что это такое и насколько опасна? Мутация Лейдена и беременность
-
Автомобили
-
Бизнес
-
Дом и семья
-
Домашний уют
-
Духовное развитие
-
Еда и напитки
-
Закон
-
Здоровье
-
Интернет
-
Искусство и развлечения
-
Карьера
-
Компьютеры
-
Красота
-
Маркетинг
-
Мода
-
Новости и общество
-
Образование
-
Отношения
-
Публикации и написание статей
-
Путешествия
-
Реклама
-
Самосовершенствование
-
Спорт и Фитнес
-
Технологии
-
Финансы
-
Хобби
Рубрики
-
О проекте -
Реклама на сайте -
Условия -
Конфиденциальность -
Вопросы и ответы
FB
Войти
Гетерозиготная мутация что это значит при беременности
Мутация Лейдена
Лейденовская мутация – это изменение одного или двух (гетеро-, гомозигота) участков в гене, кодирующем активность V фактора свертывания крови, проакцелерина. В результате F5 становится устойчивым к воздействию протеина С – естественного антикоагулянта, нарушаются противотромботические механизмы крови и организм находится в постоянной тромботической готовности.
В результате F5 становится устойчивым к воздействию протеина С – естественного антикоагулянта, нарушаются противотромботические механизмы крови и организм находится в постоянной тромботической готовности.
Мутация Лейдена – самая распространенная причина наследственной склонности к тромбозам, инфарктам, инсультам и акушерским осложнениям у людей европеоидной расы. Патология названа в честь города Лейден (Голландия), где впервые был описан механизм ее возникновения.
Почему вы узнали о мутации Leiden только сейчас
Нечувствительность к протеину С сразу у нескольких членов одной семьи впервые выявлена шведским ученым Б. Дальбеком в 1993, а детально описана голландским профессором Р. Бертиной в 1994 году. Открытие внесло коррективы в диагностику нарушений гемостаза и акушерских осложнений – теперь любой случай тромбоза или патологии беременности в анамнезе врачи связывают с возможной тромбофилией. Согласно данным последних исследований, полиморфизм гена F5 – главная причина генетической тромбофилии у 5-8% населения Земли. Его распространенность варьируется в зависимости от региона: достигает 15% у жителей Греции, Швеции, Ливана и практически не встречается в Африке, Азии, Гренландии и отдельных районах Северной Америки.
Его распространенность варьируется в зависимости от региона: достигает 15% у жителей Греции, Швеции, Ливана и практически не встречается в Африке, Азии, Гренландии и отдельных районах Северной Америки.
Что такое фактор V
F5, проакцелерин, фактор Лейдена – это молекула белка, В-глобулин, которая образуется в печени человека, циркулирует в крови и участвует в каскаде свертывания.
Благодаря F5 фактор 10 прикрепляется к тромбоциту и активирует протромбин. Также проакцелерин играет важную роль в инактивации комплекса протромбиназы: в норме молекула фактора V разрушается протеином С, после чего протромбиназный комплекс распадается.
Как мутация Лейдена влияет на тромбообразование
При Leiden-мутации в клетке ДНК, кодирующей фактор 5, происходит замена белка-нуклеотида гуанина на аденин в позиции 1691 (G1691A). Изменяется порядок аминокислот в составе «готового» F5 – в 506 положении глутамин сменяет аргинин.
В результате повреждается одно из 3 мест расщепления фактора V, и он теряет чувствительность к воздействию естественного антикоагулянта, протеина С. Действие F5 длится дольше обычного, из-за чего кровь становится излишне вязкой. Нарушается система комплекса протромбиназы, высвобождается больше тромбина и возрастает риск тромбоза.
Действие F5 длится дольше обычного, из-за чего кровь становится излишне вязкой. Нарушается система комплекса протромбиназы, высвобождается больше тромбина и возрастает риск тромбоза.
Вероятность тромбоэмболического события увеличивается с возрастом и при сочетании Лейденовской с мутациями других генов гемостаза – протромбина, протеинов С и S. В развитии тромбозов у носителей полиморфизма фактора V играет роль и ряд других факторов: беременность, прием гормонов, климактерический период, травмы, инфекционные болезни, хирургические операции.
Когда надо сдать анализ на мутацию Лейдена
Признаки и симптомы
Полиморфизм фактора 5 Leiden – генетически детерминированное заболевание. Патология присутствует у человека с рождения, но дает о себе знать только в зрелом возрасте или под воздействием «провоцирующих» факторов – травмы, длительной иммобилизации во время болезни или после операции, при наступлении беременности. До этого момента клинические проявления носительства мутации обычно отсутствуют.
Лейденская мутация – самое значимое нарушение гемостаза, приводящее организм в предтромботическое состояние. При подозрении на тромбофилию анализ на фактор V является приоритетным. В зоне особого риска находятся пациентки с рецидивирующими тромбозами и невынашиванием беременности.
Почему мутация Лейдена опасна для беременных женщин
Во время беременности в организме включается адаптивный механизм: физиологическая гиперкоагуляция, которая нарастает с каждым триместром и достигает максимума в момент родов. Так срабатывает «программа защиты» от массивной кровопотери после родоразрешения.
Но для носительницы полиморфизма гена F5 этот процесс становится патологическим и может привести к тяжелым осложнениям. Уже доказано, что мутация Лейдена – главная причина:
75% случаев невынашивания беременности, синдромов потери плода; 90% случаев ПОНРП, преждевременной отслойки плаценты; 75% случаев резкого подъема уровня артериального давления и поздних токсикозов, а также внутриутробной задержки роста плода, самопроизвольного аборта на сроках как до 12, так и до 20 недель беременности, неудач ЭКО, преждевременных родов, синдрома системного воспалительного ответа. Акушерские осложнения можно предупредить, если на этапе планирования, и даже во время беременности обратиться к квалифицированному врачу гемостазиологу, который назначит поддерживающую антикоагулянтную терапию.
Акушерские осложнения можно предупредить, если на этапе планирования, и даже во время беременности обратиться к квалифицированному врачу гемостазиологу, который назначит поддерживающую антикоагулянтную терапию.
Полиморфизм гена фактора V: лечится или нет
«Поправить» дефектный ген в молекуле ДНК невозможно, но гемостазиологи предлагают, как вариант, предупредить осложнения тромбофилии профилактическими мерами. Медикаментозная терапия при мутации Лейдена назначается, исходя из прогнозируемого по результатам анализа риска тромбозов:
- Гетерозиготная мутация (дефектный 1 из двух аллелей гена проакцелерина) имеет более благоприятный прогноз. В этом случае антикоагулянты назначаются только при беременности, перед планируемой операцией, при серьезных травмах и приеме ЗГТ. Риск тромбоза при гетерозиготной форме МLeiden повышен в 7 раз, при беременности – в 15 раз.
- Гомозиготная форма (повреждены оба аллеля) или комбинация Лейденской с мутацией гена F2, протеинов-антикоагулянтов С и S является показанием для перманентной, постоянной противотромботической терапии.
 У носителей гомозиготного полиморфизма F5 или мультигенной тромбофилии вероятность тромбоза в 20, 80, 100 раз выше (в зависимости от количества дефектных генов) по сравнению со здоровым человеком.
У носителей гомозиготного полиморфизма F5 или мультигенной тромбофилии вероятность тромбоза в 20, 80, 100 раз выше (в зависимости от количества дефектных генов) по сравнению со здоровым человеком.
Обследование и сопровождение пациентов с мутацией Лейдена проводят в МЖЦ на Таганской – профильной клинике под руководством Татьяны Владимировны Кузнецовой, профессоров Александра Давидовича Макацария и Виктории Омаровны Бицадзе. На базе нашей Научной лаборатории патологии гемостаза вы сможете сдать анализ на мутацию в гене FV Leiden, который позволит определить риск тромбофилии и подобрать оптимальную противотромботическую терапию.
акушер-гинеколог, гемостазиолог, профессор, доктор медицинских наук, эксперт международного уровня по проблемам тромбозов и нарушений свертывания крови
Мутации гемостаза при беременности
Здравствуйте, нахожусь на 5,5 неделе беременности после ЭКО, сдала анализ на мутации гемостаза и вот какие результаты: PAI-1(-675 5g/4g) в гетерозиготной форме, ITGA2 (807 С больше T) в гетерозиготной форме, F13A1(103 G больше T) в гетерозиготной форме, MTHFR (1298 A больше C) в гомозиготной форме, MTRR (66 A больше G) в гомозиготной форме.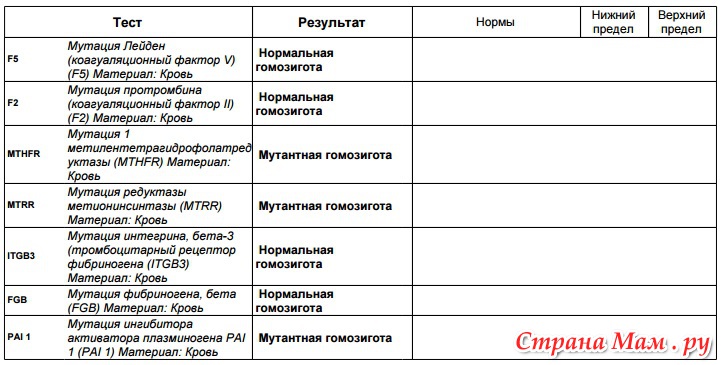 АФС нет, коагулограмма на данный момент была в норме. Гомоцистеин 7,но продолжаю снижать фолатами.Была уже одна замершая беременность на 8 неделе. Подскажите пожалуйста как быть дальше? Нужно ли колоть низкомоллекулярные гепарины и в какой дозе? В нашем городе нет гематолога, обратиться с этим вопросом не к кому (спасибо вам большое за ваш труд!
АФС нет, коагулограмма на данный момент была в норме. Гомоцистеин 7,но продолжаю снижать фолатами.Была уже одна замершая беременность на 8 неделе. Подскажите пожалуйста как быть дальше? Нужно ли колоть низкомоллекулярные гепарины и в какой дозе? В нашем городе нет гематолога, обратиться с этим вопросом не к кому (спасибо вам большое за ваш труд!
На сервисе СпросиВрача Вы можете задать вопрос гематологу по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно. Задайте свой вопрос и получите ответ сразу же!
Здравствуйте!
Согласно данным вам необходимо регулировать фолатный цикл приёмом Фолиевой кислоты.
Коагулограмму сдавали на фоне беременности?
Если да, то на данный момент нет оснований для назначения гепаринов.
Выявленные тромбофилии требуют лечения при определённых показаниях, которых у вас нет (коагулограмма в норме, тромбозов ни у кого не было).
Мутация Лейдена (гетерозиготный тип)
Девочки, кто выносил и родил или сейчас носит беременность с этой мутацией, вопрос к вам: какие препараты и в какой дозе вам назначали для профилактики тромбофилии во время беременности? Буквально 2 дня назад узнала, что у меня эта мутация, была у двух врачей, мнения разделились, пытаюсь понять, кто из врачей ближе к истине.
У меня такая мутация + гетерозиготные мутации фолатного цикла, но я об этом не знала и выносила без лечения, правда в 25 лет — у молодых часто всё прокатывает)
Татьяна, спасибо) Посту 2 года. Ту беременность доносила и родила без препаратов. Эта уже вторая))
Супер! Эт я оставила комментарий для тех, кто позже будет читать) А как у Вас было с анализами? Сдавали коагулограмму, гомоцистеин, д-димер?
Кстати, о возрасте: первую дочь родила в 33 (по акушерским меркам почти пенсия). Сейчас 35
Очень жаль, что у вас произошла такая ситуация. Я не гематолог, но судя по тем данным, которые я нашла, гетерозиготный F2 относится к низкой степени риска, остальные факторы или их сочетания вообще не рассматриваются. Вы сдавали мутации из-за изменений в коагулограмме во время беременности или по какой-то другой причине? Ключевое значение имеет уровень антифосфолипидных антител и гомоцистеина. Что касается показателей частоты антенатальной гибели плода или отслойки плаценты, принимаемая терапия никак не влияет на исход беременности.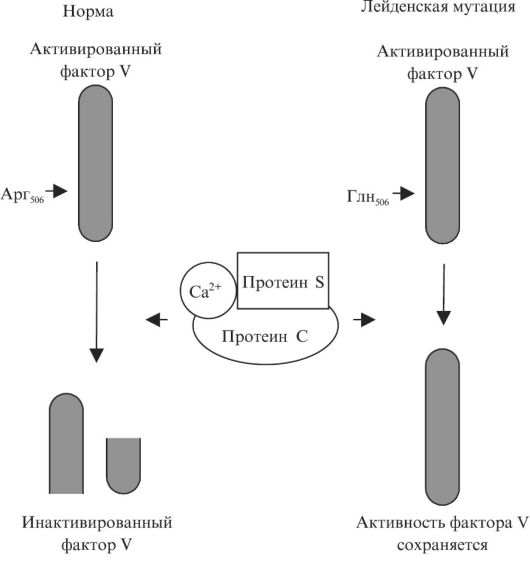 Грубо говоря, сколько бы гепарина вы не получали, это никак не отразилось бы на вероятности возникновения отслойки. Но во всех публикациях особо подчеркивается «отслойка нормально расположенной плаценты». Разумеется, врачам проще сказать: а, да у нее тромбофилия, чего тут еще ждать? Но это не значит, что ваша ситуация действительно с ней связана. По-хорошему, нужно было делать гистологическое исследование плаценты после кесарева, оценивать данные по предлежания плаценты, состоянию кровотока в маточных артериях во втором триместре, ну и ваши физиологические кондиции (был ли гестоз, преэклампсия и т.д).
Грубо говоря, сколько бы гепарина вы не получали, это никак не отразилось бы на вероятности возникновения отслойки. Но во всех публикациях особо подчеркивается «отслойка нормально расположенной плаценты». Разумеется, врачам проще сказать: а, да у нее тромбофилия, чего тут еще ждать? Но это не значит, что ваша ситуация действительно с ней связана. По-хорошему, нужно было делать гистологическое исследование плаценты после кесарева, оценивать данные по предлежания плаценты, состоянию кровотока в маточных артериях во втором триместре, ну и ваши физиологические кондиции (был ли гестоз, преэклампсия и т.д).
Гетерозиготная мутация что это значит при беременности
При гетерозиготном наследовании гены происходят от двух родительских клеток для размножения и присутствуют у животных, людей и растений. Существует несколько примеров гетерозиготных генов, включая полное доминирование, совместное доминирование и гетерозиготные мутации.
Что такое гетерозиготные гены?
Во всех диплоидных организмах, которые содержат два набора хромосом, термин гетерозиготный означает, что индивидуум, образованный из двух родительских клеток, имеет два разных аллеля для одного специфического признака. Хромосомы содержат аллели в качестве специфического признака ДНК или гена. Вы наследуете аллели от обоих родителей, в случае людей, половину от своей матери и половину от своего отца.
Хромосомы содержат аллели в качестве специфического признака ДНК или гена. Вы наследуете аллели от обоих родителей, в случае людей, половину от своей матери и половину от своего отца.
То же самое происходит у животных и растений. Клетки содержат наборы из двух гомологичных хромосом, что означает, что наборы появляются в одинаковом положении для одного и того же признака на каждой паре хромосом. Гомологичные хромосомы имеют одинаковую генетическую структуру, но аллели могут различаться, чтобы определить, какие признаки выражены в клетке.
Что такое гетерозиготная черта?
Гетерозиготный признак — это когда два ряда хромосом находятся в одной области, поскольку аллели отличаются друг от друга. Один означает черту от матери, а другой — от отца, но оба не совпадают. Например, если у матери коричневые волосы, а у отца светлые, доминирующая черта одного из родителей будет контролировать черту или цвет волос ребенка.
Какие доминантные и рецессивные черты?
Когда два аллеля отличаются по своим соответствующим хромосомам от каждого родителя, они могут иметь доминантные или рецессивные гены или признаки. Доминирующей чертой является та, которую вы можете увидеть или заметить, например, внешний вид, или это может быть черта, вызывающая привычку, например, грызть ногти. Гетерозиготный рецессивный признак в этом случае маскируется гетерозиготным доминантным признаком, поэтому он не будет рассматриваться как доминирующий признак. В случае, когда доминанта полностью маскирует рецессивную черту, это называется полным доминированием.
Доминирующей чертой является та, которую вы можете увидеть или заметить, например, внешний вид, или это может быть черта, вызывающая привычку, например, грызть ногти. Гетерозиготный рецессивный признак в этом случае маскируется гетерозиготным доминантным признаком, поэтому он не будет рассматриваться как доминирующий признак. В случае, когда доминанта полностью маскирует рецессивную черту, это называется полным доминированием.
Что такое неполное доминирование?
В случае неполного доминирования один гетерозиготный аллель является доминантным, а другой — рецессивным, однако доминирующий признак лишь частично маскирует рецессивный признак. Вместо этого создается другой фенотип, который представляет собой комбинацию фенотипов обоих аллелей. Например, если один родительский человек имеет темный оттенок кожи и темные волосы, а другой имеет очень светлую кожу и светлые волосы, случай неполного доминирования может быть, когда у ребенка средний тон кожи, который представляет собой смесь обоих родительские черты.
Что такое совместное доминирование?
В случае совместного доминирования в генетике оба гетерозиготных аллеля полностью экспрессируются в фенотипе от обоих родителей. Это можно увидеть, изучив группы крови потомства. Если один из родителей имеет группу крови A, а другой родитель имеет группу крови B, ребенок будет иметь группу крови с доминированием AB. В этом случае каждый из двух различных типов крови полностью выражен и одинаково выражен, чтобы быть доминантным.
Что такое гомозиготный?
Гомозиготный по сути является противоположностью гетерозиготного. У человека с гомозиготным признаком есть аллели, которые очень похожи друг на друга. Гомозиготы производят только гомозиготное потомство. Потомство может быть гомозиготным доминантным, выраженным как RR, или они могут быть гомозиготным рецессивным, выраженным как rr для признака.
Гомозиготные особи могут не иметь как рецессивных, так и доминантных признаков, выраженных как Rr. Как гетерозиготное, так и гомозиготное потомство могут родиться от гетерозиготы. В этом случае у потомства могут быть доминантные и рецессивные аллели, которые выражаются в полной доминантности, неполной доминантности или даже совладении.
Как гетерозиготное, так и гомозиготное потомство могут родиться от гетерозиготы. В этом случае у потомства могут быть доминантные и рецессивные аллели, которые выражаются в полной доминантности, неполной доминантности или даже совладении.
Что такое дигибридный крест в генетике?
Дигибридный крест создается, когда два родительских организма отличаются по своим двум признакам. Родительские организмы имеют разные пары аллелей для каждого признака. У одного из родителей есть гомозиготные доминантные аллели, а у другого — противоположность, как у гетерозиготных рецессивов. Это делает каждого родителя полной противоположностью от другого. Все потомство, которое вырабатывается двумя родительскими организмами, являются гетерозиготными по всем специфическим признакам. Все потомки имеют гибридный генотип и выражают доминантные фенотипы для каждого признака.
Например, рассмотрите дигибридный крест в семенах, где две изучаемые черты — форма и цвет семени. Одно растение является гомозиготным по доминирующим признакам формы и цвета, представленным как (YY) для желтого цвета семян и (RR) для круглой формы семян. Генотип (YYRR). Другое растение противоположно и имеет гомозиготные рецессивные черты, такие как зеленый цвет семян и морщины в форме семян, выраженные как (yyrr). Когда эти два растения скрещиваются, все результаты становятся гетерозиготными для желтого в качестве цвета семян и круглыми в виде формы или (YrRr). Это верно для первого потомства или поколения F1 всех гибридных скрещенных растений из тех же двух родительских растений.
Генотип (YYRR). Другое растение противоположно и имеет гомозиготные рецессивные черты, такие как зеленый цвет семян и морщины в форме семян, выраженные как (yyrr). Когда эти два растения скрещиваются, все результаты становятся гетерозиготными для желтого в качестве цвета семян и круглыми в виде формы или (YrRr). Это верно для первого потомства или поколения F1 всех гибридных скрещенных растений из тех же двух родительских растений.
Поколение F2, которое присутствует, когда растения самоопыляются, является вторым поколением, и все растения имеют вариации формы и цвета семян. В этом примере около 9/16 растений имеют желтые семена с морщинистой формой. Приблизительно 3/16 получают зеленый цвет в качестве цвета семени и округлый как форму. Приблизительно 3/16 получают семена желтого цвета и морщинистой формы, а оставшиеся 1/16 получают семена зеленого цвета с морщинистой формой. В результате поколение F2 демонстрирует четыре фенотипа и девять генотипов.
Что такое моногибридный крест в генетике?
Моногибридный генетический крест сосредоточен вокруг только одного признака, который отличается у двух родительских растений. Оба родительских растения являются гомозиготными по изучаемому признаку, хотя имеют разные аллели для этих признаков. Один из родителей является гомозиготным рецессивным, а другой — гомозиготным доминантным по той же характеристике. Так же, как в дигибридном скрещивании растений, поколение F1 будет все гетерозиготным в моногибридном скрещивании. В поколении F1 наблюдается только доминантный фенотип. Но поколение F2 будет составлять 3/4 доминирующего фенотипа и 1/4 наблюдаемого рецессивного фенотипа.
Оба родительских растения являются гомозиготными по изучаемому признаку, хотя имеют разные аллели для этих признаков. Один из родителей является гомозиготным рецессивным, а другой — гомозиготным доминантным по той же характеристике. Так же, как в дигибридном скрещивании растений, поколение F1 будет все гетерозиготным в моногибридном скрещивании. В поколении F1 наблюдается только доминантный фенотип. Но поколение F2 будет составлять 3/4 доминирующего фенотипа и 1/4 наблюдаемого рецессивного фенотипа.
Что такое гетерозиготные мутации?
Генетические мутации могут происходить в хромосомах, которые постоянно изменяют последовательность ДНК, поэтому она отличается от последовательности у большинства других людей. Мутации могут быть такими же большими, как сегмент хромосом с несколькими генами, или такими же маленькими, как одна пара аллелей. В мутации наследственности, мутация наследуется и остается с человеком в каждой клетке своего тела на протяжении всей своей жизни.
Мутации происходят, когда яйцеклетка и сперматозоид объединяются, и оплодотворенная яйцеклетка получает ДНК от обоих родителей, у которых полученная ДНК имеет генетическую мутацию. В диплоидных организмах мутация, происходящая только в одном аллеле гена, является гетерозиготной мутацией.
Генные мутации и влияние на здоровье и развитие
Каждая клетка в организме человека зависит от тысяч белков, которые должны появляться в нужных областях, чтобы выполнять свою работу и способствовать здоровому развитию. Мутация гена может помешать правильному функционированию одного или нескольких белков, а также вызвать нарушение функционирования белка или его отсутствие в клетке. Эти вещи, которые совпадают с генетическими мутациями, могут нарушить нормальное развитие или вызвать заболевание в организме. Это часто называют генетическим заболеванием.
В случае серьезных генетических мутаций эмбрион может даже не выжить достаточно долго, чтобы достичь рождения. Это происходит с генами, которые необходимы для развития. Очень серьезные генные мутации будут несовместимы с жизнью, поэтому эмбрион не доживет до рождения.
Это происходит с генами, которые необходимы для развития. Очень серьезные генные мутации будут несовместимы с жизнью, поэтому эмбрион не доживет до рождения.
Гены не вызывают заболевания, но генетическое нарушение может привести к тому, что ген не сможет функционировать должным образом. Если кто-то говорит, что у человека плохие гены, это на самом деле случай дефектного или мутировавшего гена.
Каковы различные типы генных мутаций?
Ваша последовательность ДНК может быть изменена семью различными способами, что приведет к мутации гена.
Миссенс-мутация — это изменение одной базовой пары ДНК. Это приводит к замене одной аминокислоты на другую в белке гена.
Нонсенс-мутация — это изменение пары оснований ДНК. Он не заменяет одну аминокислоту другой, но вместо этого последовательность ДНК будет преждевременно сигнализировать клетке о том, что она перестает производить белок, что приводит к укороченному белку, который может функционировать неправильно или вообще не функционировать.2009/36/11.png)
Мутации вставки изменяют количество оснований ДНК, потому что они добавляют дополнительный кусок ДНК, который не принадлежит. Это может привести к неправильной работе белка гена.
Мутации удаления являются противоположностью мутации вставки, поскольку есть часть ДНК, которая удаляется. Делеции могут быть небольшими, если затронуты только несколько пар оснований, или они могут быть большими, когда весь ген или соседние гены удалены.
Дублирующая мутация — это когда часть ДНК копирует себя один или несколько раз, что приводит к неправильному функционированию белка, полученного в результате мутации.
Мутации смены кадров происходят, когда рамка считывания гена изменяется из-за потери или добавления изменений в основе ДНК. Рамки считывания содержат группы из трех оснований с каждым кодом для одной аминокислоты. Мутация сдвига кадров смещает группы из трех и изменяет коды аминокислот. Белок в результате этого действия обычно нефункциональный.
Повторите мутации расширения, когда нуклеотиды повторяются несколько раз подряд. Это в основном увеличивает количество повторений короткой ДНК.
Это в основном увеличивает количество повторений короткой ДНК.
Что такое сложный гетерозигот?
Составная гетерозигота возникает, когда есть два мутантных аллеля, по одному от каждого родителя, в парах генов в одном и том же месте. Оба аллеля имеют генетические мутации, но каждый аллель в паре имеет разные мутации. Это называется сложным гетерозиготом или генетическим соединением, которое включает обе пары аллелей в одной области хромосомы.
Каковы некоторые примеры окраски у собак?
В качестве гетерозиготного примера, каждая собака несет набор из двух аллелей в одном месте на хромосоме по своим признакам. Чаще всего один является рецессивным, а другой — доминантным, и доминирующий цвет будет отображаться для окраса шерсти щенков как фенотип. Посмотрите на лабрадор ретриверов и их доминирующие цвета, где доминирующий цвет — черный, а рецессивный — шоколад.
Доминирующие признаки выражены заглавными буквами, а рецессивные признаки выражены строчными буквами для генотипа. Например, собака с генотипом BB имеет два доминантных аллеля, и она будет экспрессировать только B, так как оба являются доминантными. Собака с Bb в качестве генотипа будет экспрессировать B, так как B является доминантным, а b рецессивным. Генотип bb, причем оба являются рецессивными, будет единственным генотипом, который выражает цвет b.
Например, собака с генотипом BB имеет два доминантных аллеля, и она будет экспрессировать только B, так как оба являются доминантными. Собака с Bb в качестве генотипа будет экспрессировать B, так как B является доминантным, а b рецессивным. Генотип bb, причем оба являются рецессивными, будет единственным генотипом, который выражает цвет b.
Гетерозиготный ген PAI-1 и беременность
Похожие и рекомендуемые вопросы
Поиск по сайту
Что делать, если у меня похожий, но другой вопрос?
Если вы не нашли нужной информации среди ответов на этот вопрос , или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос , и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту . Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях .
Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 48 направлениям: аллерголога , анестезиолога-реаниматолога , венеролога , гастроэнтеролога , гематолога , генетика , гинеколога , гомеопата , дерматолога , детского гинеколога , детского невролога , детского уролога , детского хирурга , детского эндокринолога , диетолога , иммунолога , инфекциониста , кардиолога , косметолога , логопеда , лора , маммолога , медицинского юриста , нарколога , невропатолога , нейрохирурга , нефролога , онколога , онкоуролога , ортопеда-травматолога , офтальмолога , педиатра , пластического хирурга , проктолога , психиатра , психолога , пульмонолога , ревматолога , рентгенолога , сексолога-андролога , стоматолога , уролога , фармацевта , фитотерапевта , флеболога , хирурга , эндокринолога .
Мы отвечаем на 97% вопросов.
Фактор V Лейден — Справочник по медицине PRO7
Венозные тромбозы возникают чаще в возрасте 20 лет и старше. У женщин, носителем фактора V Лейден (L ), риск возникновения повторных выкидышей повышен. [Стр.526]
Мутация гена фактора V (фактор Лейден) оценивается как наиболее распространенная причина РАПС. Эту патологию можно выявить при проведении теста на РАПС с плазмой пациента, разбавленной 1 5 плазмой с дефицитом ф.У. Этот тест обладает высокой специфичностью и чувствительностью на выявление фактора V Лейден (табл. 28). [Стр.136]
Резистентность к протеину С может быть выявлена в различных клоттинговых тестах, в то время как присутствие генетической мутации в факторе V Лейден может быть выявлена цепной полимеразной реакцией. Данная реация может быть использована для выявления 20210 AG аномалии протромбина. [Стр.234]
Устойчивость к активированному белку С (биохимическое исследование на фактор V Лейден). Нет необходимости выполнять исследование ДНК. [Стр.195]
Нет необходимости выполнять исследование ДНК. [Стр.195]
Фактор V Лейден (исследование ДНК). Фактор II (ген протромбина). G20210A ДНК исследование. [Стр.195]
Дефммг Факторов свертывания Резистентность к активированному белку С (фактор V Лейден) Дефицит бела С, Й, антитромбина 11 Мутация гена протромбина… [Стр.253]
Фактор V Лейден(а) наследственная аномалия фактора V системы гемостаза, приводящая к нарушению свертывания крови… [Стр.443]
Фактор V Лейден (A 506 — Тли) Фактор V Кембридж (A 306 —> Тир), редкая мутация Гомозиготность по НИЗ-гаплотипу в гене фактора V, редкая мутация … [Стр.135]
ОТСЛОЙКА ПЛАЦЕНТЫ ПРИ ОДНОПЛОДНОЙ И многоплодной БЕРЕМЕННОСТИ У ДОЧЕРЕЙ И ИХ МАТЕРЕЙ НА ФОНЕ МУТАЦИИ ФАКТОРА V ЛЕЙДЕН… [Стр.137]
Целью данной работы является демонстрация роли мутации фактора V Лейден в патогенезе отслойки плаценты при одноплодной и многоплодной беременности… [Стр.137]
Недостаточное удлинение АЧТВ (патологический результат, свидетельствующий о РАПС) наблюдается у пациентов с фактором V Лейден, волчаночным антикоагулянтом, при беременности, увеличенном содержании фактора VIII и при. .. [Стр.136]
.. [Стр.136]
Смотреть другие источники с термином Фактор V Лейден:
[Стр.526]
[Стр.117]
[Стр.926]
[Стр.926]
[Стр.942]
[Стр.942]
[Стр.942]
[Стр.942]
[Стр.397]
[Стр.220]
[Стр.43]
[Стр.10]
[Стр.11]
[Стр.131]
[Стр.131]
[Стр.281]
[Стр.391]
[Стр.425]
[Стр.2866]
Фактор V Лейден — Симптомы и причины
Обзор
Фактор V Лейдена (FAK-tur five LIDE-n) — это мутация одного из факторов свертывания крови. Эта мутация может увеличить ваши шансы на развитие аномальных сгустков крови, чаще всего в ногах или легких.
У большинства людей с фактором V Лейден никогда не появляются аномальные тромбы. Но у людей эти аномальные сгустки могут привести к долгосрочным проблемам со здоровьем или стать опасными для жизни.
Но у людей эти аномальные сгустки могут привести к долгосрочным проблемам со здоровьем или стать опасными для жизни.
Лейденский фактор может быть как у мужчин, так и у женщин. Женщины с лейденской мутацией фактора V могут иметь повышенную тенденцию к образованию тромбов во время беременности или при приеме гормона эстрогена.
Если у вас есть фактор V Лейдена и у вас образовались тромбы, антикоагулянты могут снизить риск образования дополнительных тромбов и помочь избежать потенциально серьезных осложнений.
Продукты и услуги
Показать больше продуктов от Mayo Clinic
Симптомы
Лейденская мутация фактора V сама по себе не вызывает никаких симптомов.Поскольку фактор V Лейдена представляет собой риск развития тромбов в ноге или легких, первым признаком того, что у вас заболевание, может быть образование аномального тромба.
Некоторые сгустки не наносят ущерба и исчезают сами по себе.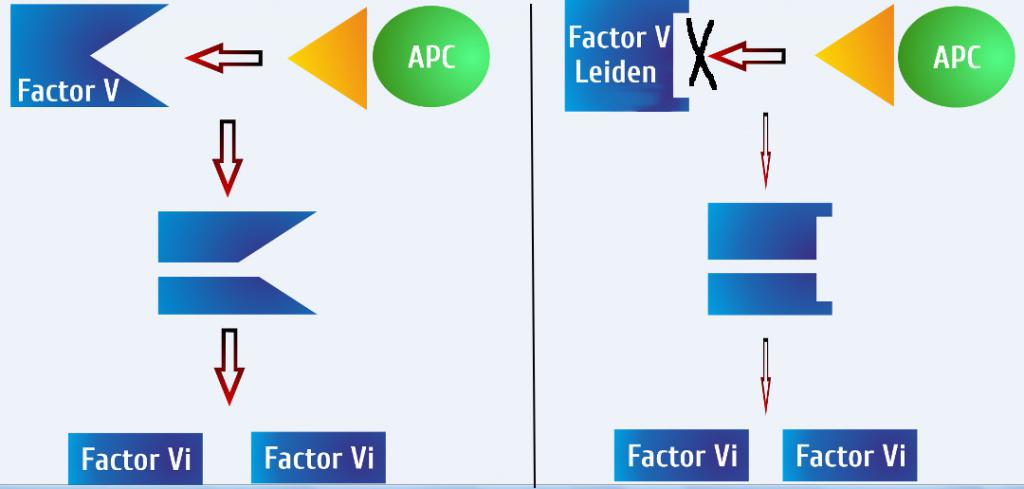 Другие могут быть опасными для жизни. Симптомы тромба зависят от того, какая часть вашего тела поражена.
Другие могут быть опасными для жизни. Симптомы тромба зависят от того, какая часть вашего тела поражена.
Сгусток в глубокой вене
Это известно как тромбоз глубоких вен (ТГВ), который чаще всего возникает в ногах.ТГВ может не вызывать никаких симптомов. Если признаки и симптомы действительно появляются, они могут включать:
- Боль
- Набухание
- Покраснение
- Тепло
Сгусток, который попадает в легкие
Известный как тромбоэмболия легочной артерии, это происходит, когда часть ТГВ отрывается и проходит через правую часть сердца в легкое, где блокирует кровоток. Это может быть опасной для жизни ситуацией. Признаки и симптомы могут включать:
- Внезапная одышка
- Боль в груди при дыхании
- Кашель с образованием мокроты с кровью или прожилками крови
- Учащенное сердцебиение
Когда обращаться к врачу
Немедленно обратитесь за медицинской помощью, если у вас есть признаки или симптомы ТГВ или тромбоэмболии легочной артерии.
Причины
Если у вас фактор V Лейден, вы унаследовали либо одну копию, либо, в редких случаях, две копии дефектного гена. Наследование одной копии немного увеличивает риск образования тромбов. Наследование двух копий — по одной от каждого родителя — значительно увеличивает риск образования тромбов.
Факторы риска
Семейный анамнез фактора V Лейдена увеличивает риск наследования заболевания.Расстройство чаще всего встречается у белых людей европейского происхождения.
У людей, унаследовавших фактор V Лейден только от одного родителя, к 65 годам вероятность развития аномального тромба составляет 5%. Факторы, увеличивающие этот риск, включают:
- Два дефектных гена. Наследование генетической мутации от обоих родителей вместо одного может значительно повысить риск образования аномальных тромбов.
- Неподвижность. Длительные периоды неподвижности, например сидение во время длительного полета в самолете, могут увеличить риск образования тромбов на ногах.
- Эстрогены. Оральные контрацептивы, заместительная гормональная терапия и беременность могут повысить вероятность образования тромбов.
- Операции или травмы. Операции или травмы, например переломы костей, могут увеличить риск образования аномальных тромбов.
- Не-O группа крови. Аномальные тромбы чаще встречаются у людей с группой крови A, B или AB по сравнению с людьми с группой крови O.
Осложнения
Фактор V Лейден может вызвать образование тромбов в ногах (тромбоз глубоких вен) и легких (тромбоэмболия легочной артерии).Эти сгустки крови могут быть опасными для жизни.
01 августа 2020 г.
Фактор V Лейден — Диагностика и лечение
Диагноз
Ваш врач может заподозрить фактор V Лейдена, если у вас был один или несколько эпизодов аномального свертывания крови или если у вас в семейном анамнезе есть сильные аномальные тромбы.Ваш врач может подтвердить, что у вас есть фактор V Лейдена, с помощью анализа крови.
Лечение
Врачи обычно прописывают разжижающие кровь препараты для лечения людей, у которых развиваются аномальные тромбы. Этот тип лекарства обычно не нужен людям, у которых есть лейденская мутация фактора V, но у которых не было аномальных тромбов.
Однако ваш врач может посоветовать вам принять дополнительные меры предосторожности для предотвращения образования тромбов, если у вас есть лейденская мутация фактора V и вы собираетесь перенести операцию.Эти меры могут включать:
- Краткий курс препаратов для разжижения крови
- Бинты для ног, которые надуваются и сдуваются, чтобы кровь продолжала движение в ногах
- Чулки компрессионные
- Гулять вскоре после операции
Образ жизни и домашние средства
Некоторые меры предосторожности, которые помогут снизить риск образования тромбов, включают:
- Держите ноги в движении. Когда ваши ноги остаются неподвижными в течение нескольких часов, ваши икроножные мышцы не сокращаются, что обычно способствует циркуляции крови. Если вы летите в долгую поездку на самолете, поднимайте и опускайте пальцы ног и вращайте лодыжки примерно каждый час. Пейте больше воды, чтобы предотвратить обезвоживание, и избегайте алкоголя. В поездке на машине делайте периодические перерывы и прогуливайтесь.
- Рассмотрим компрессионные чулки. Эти типы носков, которые обычно доходят до колен, помогают улучшить кровообращение в ногах. Спросите своего врача, могут ли они подойти в вашей ситуации.
- Будьте осторожны с эстрогеном. Оральные контрацептивы или заместительная терапия эстрогенами могут увеличивать риск образования тромбов сами по себе, поэтому обязательно обсудите с врачом риски и преимущества эстрогеносодержащих препаратов, если у вас есть фактор V Лейден.
Предотвратить чрезмерное кровотечение
Если ваш фактор V Лейден требует от вас приема антикоагулянтов, вот несколько шагов, которые могут помочь вам предотвратить травмы и избежать чрезмерного кровотечения:
- Избегайте занятий контактными видами спорта или других видов деятельности, которые могут привести к травмам.Регулярные бесконтактные упражнения, такие как ходьба или плавание, по-прежнему рекомендуются для хорошего здоровья.
- Используйте мягкую зубную щетку и вощеную нить.
- Избегайте порезов от бритья , используя электрическую бритву.
- Будьте осторожны при выполнении домашних заданий с ножами, ножницами и другими острыми инструментами.
Подготовка к приему
Ваш врач может направить вас к специалисту по генетическим заболеваниям (генетику) или к специалисту по заболеваниям крови (гематологу) для тестирования, чтобы определить, является ли причина образования тромбов генетической, и, в частности, вы имеют фактор V Лейден.
Вот некоторая информация, которая поможет вам подготовиться к встрече.
- Перечислите все симптомы, которые вы испытываете, включая те, которые могут показаться не связанными с причиной, по которой вы записались на прием.
- Укажите историю вашего здоровья, включая историю тромбов. Включите любую семейную историю сгустков крови или известных членов семьи с фактором V Лейден.
- Составьте список всех лекарств, витаминов или добавок, которые вы принимаете, вместе с дозой для каждого.
- Список вопросов, которые нужно задать своему врачу.
По фактору V Лейден некоторые основные вопросы, которые следует задать своему врачу, включают:
- Какие тесты мне нужны?
- Мне нужно обратиться к специалисту?
- Нужно ли лечить мой фактор V Лейден?
- Нужно ли мне принимать лекарства для предотвращения образования дополнительных тромбов?
- Какие побочные эффекты можно ожидать от лекарства?
- Нужно ли мне каким-либо образом ограничивать свою активность?
- Если у меня есть дети, нужно ли им сдавать анализы?
- У вас есть брошюры или другие печатные материалы, которые я могу взять с собой? Какие сайты вы рекомендуете?
Если ваш врач рекомендует генетическое тестирование, некоторые вопросы, которые вы можете задать генетическому специалисту, включают:
- Насколько точен этот тест?
- Каковы риски теста?
- Какая информация выйдет из теста?
- Что мне скажет положительный или отрицательный результат?
- Могут ли результаты теста повлиять на мою способность получить медицинскую страховку?
- Возможен ли неопределенный результат и что это будет значить?
- Какие у меня варианты лечения, если обнаружена мутация?
- Могут ли пострадать другие члены семьи?
- Нужно ли проверять моих детей?
- Какие меры принимаются для защиты моей конфиденциальности?
- Насколько опытна лаборатория при выполнении этого теста?
- Сколько времени потребуется, чтобы вернуть результаты?
Августа01, 2020
Показать ссылки
- Тромбофилия фактора V Лейдена. Информационный центр по генетическим и редким заболеваниям. https://rarediseases.info.nih.gov/diseases/6403/factor-v-leiden-thrombophilia. Доступ 4 июня 2018 г.
- Bauer KA. Фактор V Лейден и резистентность к активированному протеину С. https://www.uptodate.com/contents/search. Проверено 4 июня 2018 г.
- AskMayoExpert. Фактор V Лейден. Рочестер, Миннесота: Фонд Мейо медицинского образования и исследований; 2018.
- Венозная тромбоэмболия. Национальный институт сердца, легких и крови. https://www.nhlbi.nih.gov/health-topics/venous-thromboembolism. Проверено 4 июня 2018 г.
- Каушанский К. и др., Ред. Наследственная тромбофилия. В: Гематология Вильямса. 9 изд. Нью-Йорк, штат Нью-Йорк: образование McGraw-Hill; 2016. https://accessmedicine.mhmedical.com. Проверено 4 июня 2018 г.
- Lockwood CJ, et al. Унаследованные тромбофилии при беременности. https://www.uptodate.com/contents/search.Проверено 4 июня 2018 г.
- Прути РК (заключение эксперта). Клиника Мэйо, Рочестер, Миннесота, 17 июня 2018 г.
- Центр обучения пациентов «Барбара Вудворд Липс». Тромбоз глубоких вен и тромбоэмболия легочной артерии. Рочестер, Миннесота: Фонд Мейо медицинского образования и исследований; 2017.
Связанные
Продукты и услуги
Показать больше продуктов и услуг Mayo Clinic
Справочное руководство по лейденской болезни, фактор V
Медицинское заключение компании Drugs.com. Последнее обновление: 1 августа 2020 г.
На этой странице
Обзор
Фактор V Лейдена (FAK-tur five LIDE-n) представляет собой мутацию одного из факторов свертывания крови. Эта мутация может увеличить ваши шансы на развитие аномальных сгустков крови, чаще всего в ногах или легких.
У большинства людей с фактором V Лейден никогда не появляются аномальные тромбы. Но у людей эти аномальные сгустки могут привести к долгосрочным проблемам со здоровьем или стать опасными для жизни.
Лейденский фактор может быть как у мужчин, так и у женщин.Женщины с лейденской мутацией фактора V могут иметь повышенную тенденцию к образованию тромбов во время беременности или при приеме гормона эстрогена.
Если у вас есть фактор V Лейдена и у вас образовались тромбы, антикоагулянты могут снизить риск образования дополнительных тромбов и помочь избежать потенциально серьезных осложнений.
Симптомы
Лейденская мутация фактора V сама по себе не вызывает никаких симптомов. Поскольку фактор V Лейдена представляет собой риск развития тромбов в ноге или легких, первым признаком того, что у вас заболевание, может быть образование аномального тромба.
Некоторые сгустки не наносят ущерба и исчезают сами по себе. Другие могут быть опасными для жизни. Симптомы тромба зависят от того, какая часть вашего тела поражена.
Сгусток в глубокой вене
Это известно как тромбоз глубоких вен (ТГВ), который чаще всего возникает в ногах. ТГВ может не вызывать никаких симптомов. Если признаки и симптомы действительно появляются, они могут включать:
- Боль
- Набухание
- Покраснение
- Тепло
Сгусток, который попадает в легкие
Известный как тромбоэмболия легочной артерии, это происходит, когда часть ТГВ отрывается и проходит через правую часть сердца в легкое, где блокирует кровоток.Это может быть опасной для жизни ситуацией. Признаки и симптомы могут включать:
- Внезапная одышка
- Боль в груди при дыхании
- Кашель с образованием мокроты с кровью или прожилками крови
- Учащенное сердцебиение
Когда обращаться к врачу
Немедленно обратитесь за медицинской помощью, если у вас есть признаки или симптомы ТГВ или тромбоэмболии легочной артерии.
Причины
Если у вас фактор V Лейден, вы унаследовали либо одну, либо, в редких случаях, две копии дефектного гена.Наследование одной копии немного увеличивает риск образования тромбов. Наследование двух копий — по одной от каждого родителя — значительно увеличивает риск образования тромбов.
Факторы риска
Семейная история фактора V Лейдена увеличивает риск наследования заболевания. Расстройство чаще всего встречается у белых людей европейского происхождения.
Люди, унаследовавшие фактор V Лейдена только от одного из родителей, имеют 5-процентную вероятность развития аномального тромба к 65 годам.Факторы, увеличивающие этот риск, включают:
- Два дефектных гена. Наследование генетической мутации от обоих родителей вместо одного может значительно повысить риск образования аномальных тромбов.
- Неподвижность. Длительные периоды неподвижности, например сидение во время длительного полета в самолете, могут увеличить риск образования тромбов на ногах.
- Эстрогены. Оральные контрацептивы, заместительная гормональная терапия и беременность могут повысить вероятность образования тромбов.
- Операции или травмы. Операции или травмы, например переломы костей, могут увеличить риск образования аномальных тромбов.
- Не-O группа крови. Аномальные тромбы чаще встречаются у людей с группой крови A, B или AB по сравнению с людьми с группой крови O.
Осложнения
Фактор V Лейден может вызывать образование тромбов в ногах (тромбоз глубоких вен) и легких (тромбоэмболия легочной артерии). Эти сгустки крови могут быть опасными для жизни.
Диагностика
Ваш врач может заподозрить фактор V Лейдена, если у вас был один или несколько эпизодов аномального свертывания крови или если у вас в семье есть сильная семейная история аномальных сгустков крови. Ваш врач может подтвердить, что у вас есть фактор V Лейдена, с помощью анализа крови.
Лечение
Врачи обычно прописывают разжижающие кровь препараты для лечения людей, у которых развиваются аномальные тромбы. Этот тип лекарства обычно не нужен людям, у которых есть лейденская мутация фактора V, но у которых не было аномальных тромбов.
Однако ваш врач может посоветовать вам принять дополнительные меры предосторожности для предотвращения образования тромбов, если у вас есть лейденская мутация фактора V и вы собираетесь перенести операцию. Эти меры могут включать:
- Краткий курс препаратов для разжижения крови
- Бинты для ног, которые надуваются и сдуваются, чтобы кровь продолжала движение в ногах
- Чулки компрессионные
- Гулять вскоре после операции
Образ жизни и домашние средства
Некоторые меры предосторожности, которые помогут снизить риск образования тромбов, включают:
- Держите ноги в движении. Когда ваши ноги остаются неподвижными в течение нескольких часов, ваши икроножные мышцы не сокращаются, что обычно способствует циркуляции крови. Если вы летите в долгую поездку на самолете, поднимайте и опускайте пальцы ног и вращайте лодыжки примерно каждый час. Пейте больше воды, чтобы предотвратить обезвоживание, и избегайте алкоголя. В поездке на машине делайте периодические перерывы и прогуливайтесь.
- Рассмотрим компрессионные чулки. Эти типы носков, которые обычно доходят до колен, помогают улучшить кровообращение в ногах. Спросите своего врача, могут ли они подойти в вашей ситуации.
- Будьте осторожны с эстрогеном. Оральные контрацептивы или заместительная терапия эстрогенами могут увеличивать риск образования тромбов сами по себе, поэтому обязательно обсудите с врачом риски и преимущества эстрогеносодержащих препаратов, если у вас есть фактор V Лейден.
Предотвратить чрезмерное кровотечение
Если ваш фактор V Лейден требует от вас приема антикоагулянтов, вот несколько шагов, которые могут помочь вам предотвратить травмы и избежать чрезмерного кровотечения:
- Избегайте занятий контактными видами спорта или других видов деятельности, которые могут привести к травмам.Регулярные бесконтактные упражнения, такие как ходьба или плавание, по-прежнему рекомендуются для хорошего здоровья.
- Используйте мягкую зубную щетку и вощеную нить.
- Избегайте порезов от бритья , используя электрическую бритву.
- Будьте осторожны при выполнении домашних заданий с ножами, ножницами и другими острыми инструментами.
Подготовка к приему
Ваш врач может направить вас к специалисту по генетическим заболеваниям (генетику) или к специалисту по заболеваниям крови (гематологу) для тестирования, чтобы определить, является ли причина ваших тромбов генетической и, в частности, есть ли у вас фактор V Лейдена.
Вот некоторая информация, которая поможет вам подготовиться к встрече.
- Перечислите все симптомы, которые вы испытываете, включая те, которые могут показаться не связанными с причиной, по которой вы записались на прием.
- Укажите историю вашего здоровья, включая историю тромбов. Включите любую семейную историю сгустков крови или известных членов семьи с фактором V Лейден.
- Составьте список всех лекарств, витаминов или добавок, которые вы принимаете, вместе с дозой для каждого.
- Список вопросов, которые нужно задать своему врачу.
По фактору V Лейден некоторые основные вопросы, которые следует задать своему врачу, включают:
- Какие тесты мне нужны?
- Мне нужно обратиться к специалисту?
- Нужно ли лечить мой фактор V Лейден?
- Нужно ли мне принимать лекарства для предотвращения образования дополнительных тромбов?
- Какие побочные эффекты можно ожидать от лекарства?
- Нужно ли мне каким-либо образом ограничивать свою активность?
- Если у меня есть дети, нужно ли им сдавать анализы?
- У вас есть брошюры или другие печатные материалы, которые я могу взять с собой? Какие сайты вы рекомендуете?
Если ваш врач рекомендует генетическое тестирование, некоторые вопросы, которые вы можете задать генетическому специалисту, включают:
- Насколько точен этот тест?
- Каковы риски теста?
- Какая информация выйдет из теста?
- Что мне скажет положительный или отрицательный результат?
- Могут ли результаты теста повлиять на мою способность получить медицинскую страховку?
- Возможен ли неопределенный результат и что это будет значить?
- Какие у меня варианты лечения, если обнаружена мутация?
- Могут ли пострадать другие члены семьи?
- Нужно ли проверять моих детей?
- Какие меры принимаются для защиты моей конфиденциальности?
- Насколько опытна лаборатория при выполнении этого теста?
- Сколько времени потребуется, чтобы вернуть результаты?
© 1998-2019 Фонд медицинского образования и исследований Мэйо (MFMER).Все права защищены.
Условия эксплуатации.
Узнайте больше о Factor V Leiden
Сопутствующие препараты
Клинические коды МКБ-10 CM (внешние)
Фактор V Лейден и воспаление
Фактор V Лейден представляет собой вариант человеческого фактора V (FV), также известного как проакселерин, который приводит к состоянию гиперкоагуляции. В течение этих лет фактор V Лейдена (FVL) изучался с патофизиологической точки зрения, и исследования были сосредоточены на поиске клинических подходов для лечения FVL, связанного с тромбофилическим состоянием.Меньше внимания уделялось возможной роли FVL в воспалительных состояниях, которые, как известно, присутствуют при различных расстройствах, таких как уремия, цирроз, трансплантация печени, депрессия, а также сепсис, инфекция или воспалительное заболевание кишечника (ВЗК). Вопрос о том, будет ли FVL тромбоцитов увеличивать активацию коагуляции и / или в какой пропорции может определить окончательный результат при ранее упомянутых воспалительных состояниях, остается неясным. В этой статье будет рассмотрена связь FVL с воспалением.В частности, он будет анализировать важную роль эндотелия и вклад других воспалительных компонентов, участвующих как на иммунном, так и на сосудистом уровнях. В этой статье также делается попытка подчеркнуть важность того, чтобы быть носителем FVL в ассоциации с заболеваниями, при которых возникает хроническое воспаление, и то, как это состояние может быть определяющим в прогрессировании и исходе конкретной клинической ситуации.
1. Введение
Фактор свертывания крови V (FV), также известный как проакцелерин или лабильный фактор, синтезируется в печени и циркулирует в виде одноцепочечного полипептида в неактивной прокоагулянтной форме [1].Хотя большая часть FV присутствует в плазме, примерно 20% циркулирующего FV обнаруживается в α -гранулах [2]. FV тромбоцитов подвергается частичному протеолизу и хранится связанным с белком мультимерином внутри этих гранул [3]. Фактор V играет ключевую роль в качестве кофактора протромбиназного комплекса, который расщепляет и активирует протромбин в тромбин, что приводит к образованию тромба [4]. Фактор V Лейден (FVL) — это название специфической генной мутации, которая приводит к состоянию гиперкоагуляции с серьезными клиническими последствиями [5].Менее чем через два десятилетия после его открытия патофизиология, клинические последствия и терапевтическое лечение тромбофилического состояния, связанного с этим состоянием, остаются предметом споров [6]. Избыточное свертывание крови, возникающее при этом заболевании FV, в основном ограничивается венозной областью и, как известно, является наиболее частым фактором, вызывающим тромбоз глубоких вен (ТГВ) [7, 8].
Иногда венозные сгустки могут отрываться и проходить через сердце и легкие, блокируя сосуды, вызывая тромбоэмболию легочной артерии.С другой стороны, хотя образование тромбов в артериях кажется менее распространенным, они могут привести к инсульту или инфаркту миокарда (мини-инсульт или транзиторные ишемические атаки) [9]. Интересно, что в последние годы большое внимание уделяется тому, как венозная тромбоэмболия (ВТЭ) становится серьезной проблемой общественного здравоохранения, способствующей неуклонно растущей смертности в наших современных обществах [10, 11].
Хорошо известно, что венозный тромбоз (ЖТ) возникает в результате сочетания генетических и экологических факторов риска, таких как возраст, операция, травма, рак, беременность и использование гормональной терапии.Присутствие и взаимодействие одного или нескольких из этих факторов риска определяют относительный риск развития ЖТ. Мутация FVL еще больше повысит риск развития патологических сгустков, которые в настоящее время считаются наиболее частой причиной тромбофилии [10].
Имеется более ограниченная информация о влиянии FVL на клинические события, при которых преобладает воспаление [12, 13]. Уремия, цирроз, трансплантация печени, а также сепсис (генерализованное воспалительное состояние, также известное как системная воспалительная реакция SIR), инфекция и воспалительное заболевание кишечника (ВЗК) приводят к хроническому воспалительному состоянию.Несмотря на то, что оба механизма действия и клиническое ведение предыдущих состояний хорошо известны, не удалось достичь окончательного консенсуса относительно того, может ли FVL изменять исход этих событий.
Воспалительная реакция — сложная реакция, которая подразумевает взаимодействие сосудистых тканей, механизмов свертывания и компонентов клеток крови, в основном тромбоцитов (Plts) и лейкоцитов [14, 15]. Тромбоциты — это основной элемент «клетки» крови, участвующий в образовании сгустка [16].Присоединение к субэндотелию, активация с высвобождением его гранулярного содержимого и агрегация обеспечивают соответствующую среду для активации механизмов свертывания [17, 18]. Во время этого процесса FV, высвобождаемый при активации тромбоцитов, играет решающую роль в ранней фазе коагуляции, выраженной в его активной форме (FVa), для немедленной и устойчивой прокоагулянтной функции в местах повреждения сосудов. Лейкоциты и цитокины, которые они производят, критически вовлечены в инициирование и поддержание воспалительной реакции.Эти клетки будут рекрутироваться и привлекаться к месту повреждения посредством селектинов, которые оказались экспонированными на воспаленном эндотелии или активированных тромбоцитах.
В прошлые годы исследователи были в основном сосредоточены на изучении иммунной и коагуляционной систем во время воспалительной реакции, но меньше внимания уделялось роли поврежденного эндотелия, активированных Plts и циркулирующих микрочастиц (MP) в потенциале ненормальная функциональность FVL. Доступной литературы о возможной связи между мутациями FV, функцией тромбоцитов и повышенным количеством циркулирующих MPs относительно мало [19].
В следующем тексте мы рассмотрим связь FVL с воспалением, а также предоставим новые идеи / другие аспекты, которые могут способствовать лучшему пониманию конкретных заболеваний, которые подвержены хроническому воспалению, включая сепсис, инфекцию и / или ВЗК. . Особое внимание будет уделено вкладу эндотелия, активированных тромбоцитов и производных MPs в качестве носителей не только FV, но и тканевого фактора (TF) во время воспалительных состояний, а также его возможному влиянию на тромботические осложнения у пациентов с диагнозом FVL.
2. Патофизиология фактора V: лейденская мутация фактора V
Сгустки крови образуются в два этапа. На первом этапе активированные Plts высвобождают содержимое хранящихся гранул в плазму крови (первичный гемостаз) и объединяются, образуя начальную пробку или сгусток. На втором этапе Plts привлекает больше Plts, и активируются факторы свертывания крови [20]. В целом, Plts связаны вместе с белками свертывания крови и способствуют образованию фибрина, который стабилизирует сгусток крови [17].
Белок фактора V циркулирует в кровотоке в неактивной форме до тех пор, пока не активируется система свертывания крови из-за повреждения кровеносных сосудов. В нормальном состоянии активированный FV (FVa) действует как кофактор, который взаимодействует с активным фактором X, превращая неактивный фермент протромбин в тромбин, который расщепляет фибриноген до фибрина [4]. Затем фибрин полимеризуется, что приводит к образованию тромба (см. Рисунок 1). Участие активированного протеина C (APC) в качестве природного антикоагулянта ограничивает степень свертывания за счет расщепления и разрушения FV [21].Активированный протеин C (APC) расщепляет FV в определенных сайтах (в положении протеина 506) и подавляет его функцию, предотвращая чрезмерный рост сгустка [3, 22]. Расщепление FV также позволит этому фактору свертывания крови инактивировать фактор VIIIa, другой важный белок для нормального процесса свертывания крови [23-25]. APC не может инактивировать FV, когда происходит мутация в этом белке свертывания: однократное изменение одной аминокислоты в положении 506; аргинин (Arg) заменяется глутамином (Gln) (см. рисунок 2) [26].В результате мутация приводит к потере функции антикоагулянтного кофактора APC на FV, при этом механизмы свертывания крови остаются активными в течение более продолжительных периодов времени, и последующее увеличение образования патологических сгустков крови. Это причина, по которой заболевание FVL первоначально было описано как резистентность к APC, хотя мутация FVL обнаруживается только примерно в 80–90% случаев с диагнозом этого состояния [6, 27, 28].
Мутация FVL в настоящее время является наиболее распространенным известным фактором риска ЖТ.Фактор V Лейдена — аутосомно-доминантное заболевание, встречающееся только у европеоидов, и его распространенность колеблется от 2% до 15% [29]. Было продемонстрировано, что мутация реже встречается в других популяциях, таких как латиноамериканцы и афроамериканцы, и крайне редко у людей азиатского происхождения [30, 31]. Полиморфизм произошел из общего источника около 30 000 лет назад (эффект основателя), и от 3 до 8% людей с европейским происхождением и 5% европеоидов в Северной Америке несут одну копию мутации FVL, в то время как около 1% (примерно 5000 человек ) имеет две копии мутации [32].
Наличие мутации FVL значительно увеличивает риск развития аномального свертывания крови. Наиболее частыми клиническими проявлениями FVL являются поверхностные и ТГВ. Фактически, до 30% пациентов с ТГВ были диагностированы с этим заболеванием [10]. Риск развития тромботических эпизодов зависит от того, есть ли у человека одна или две копии мутации FVL. Наследование двух копий мутации, по одной от каждого родителя, значительно увеличивает риск развития тромботических осложнений [33].В целом, те, кто гомозиготны по мутировавшему аллелю, представляют повышенный риск развития патологических сгустков (в 50–100 раз) по сравнению с гетерозиготными по мутации (в 5–10 раз), которые на самом деле представляют довольно низкий риск венозного тромбоза [31 ]. Важно учитывать, что сочетание других приобретенных факторов риска ЖТ, таких как возраст, ожирение, курение, использование противозачаточных таблеток (гормональная контрацепция на основе эстрогена) или недавняя операция по заместительной гормональной терапии, еще больше повысит риск индивидуальный носитель мутации FVL для развития ТГВ [34].Более того, ассоциация мутации FVL с другой мутацией в другом гене, участвующем в системе свертывания, вызовет чрезвычайно высокий риск развития аномальных сгустков. В этом контексте сосуществование гетерозиготной мутации FVL и мутации G20210A в гене протромбина является наиболее частой аномалией, вызывающей ВТЭ [35, 36]. Более того, было обнаружено, что комбинации дефицита FVL, антитромбина, протеина C или протеина S и гипергомоцистиенемии приводят к 5-10-кратному увеличению относительного риска тромбоза (см. Таблицу 1, адаптированную из «Природных антикоагулянтов и тромбофилии» ) [37, 38].
| ||||||||||||||||||||||||||||||||||||||
Хотя ранее было установлено, что синтез FV имеет место в мегакариоцитах [39], Christiella et al. [25] смогли продемонстрировать, что плазма является основным источником тромбоцитов FV.Однако небольшая часть FV находится в α -гранулах тромбоцитов. Gould et al. [3] представили убедительные доказательства того, что когда-то FV, хранящийся в α -гранулах, представляет собой другой субстрат. После эндоцитоза мегакариоцитами и доставки к Plts, FV расщепляется до частично активного кофактора, который оказывается более устойчивым к инактивации APC. Этот вывод подтвердил исследование Camire et al. [40], демонстрируя, что полная инактивация тромбоцитарного FV никогда не была достигнута.Согласно предыдущим исследованиям, FVa, который экспрессируется на активированных Plts, может быть защищен от инактивации APC. Дальнейшие эксперименты также продемонстрировали, что полученные из тромбоцитов MPs приводят к повышенным уровням / скоростям инактивации кофактора, подавляя очевидную защиту, создаваемую интактными Plts [41]. Это важный момент, который следует учитывать, поскольку повышенные уровни циркулирующих МП были зарегистрированы у пациентов с диагнозом FVL [19]. Дальнейшие исследования продемонстрировали, что уровни MPs могут коррелировать с уровнями FVL в плазме, таким образом предполагая, что соотношение FVL / FV может быть параметром для прогнозирования риска тромбоза у носителей FVL [42].
3. Патофизиология воспаления: роль эндотелиальной дисфункции, тромбоцитов и MPs
Воспаление можно определить как сложную биологическую реакцию защиты на широкий спектр вредных стимулов. Этот воспалительный ответ претерпевает нарушение баланса коагуляции и изменения на нескольких уровнях, включая повреждение сосудистых тканей, реакцию лейкоцитов, выделяющих интерлейкины и цитокины, и активацию тромбоцитов [15, 43]. Воспаление бывает острым и хроническим.Острое воспаление — это первоначальная реакция организма, ведущая к каскаду биохимических явлений, основанных на взаимодействии сосудистой и иммунной систем. Стойкое или хроническое воспаление приводит к повышению уровня нескольких прокоагулянтных белков, таких как фибриноген и фактор VIII, которые считаются факторами, способствующими развитию тромбофилического состояния [38]. Хроническая воспалительная реакция может привести к нарушению гемостатического равновесия прокоагулянт / антикоагулянт вместе с другими изменениями на нескольких уровнях.Вкратце, это реакция клеток крови, в основном лейкоцитов, которые выделяют интерлейкины и цитокины, которые поддерживают воспалительный ответ [43, 44].
Эндотелиальная дисфункция практически постоянна при воспалительном процессе [45]. В результате воспалительной реакции увеличивается проницаемость кровеносных сосудов и начинается рекрутирование лейкоцитов в месте повреждения. По сути, нарушение эндотелия вызывает повышенную экспрессию новых молекул адгезии, таких как E-селектин, PECAM-1 (молекула адгезии 1 тромбоцитов к эндотелиальным клеткам), VCAM-1 (белок адгезии 1 сосудистых клеток), ICAM-1 (межклеточная адгезия молекула 1), эндотелин-1, высвобождение фактора фон Виллебранда (vWF), а также Р-селектина и L-селектина из хранящих гранул, известных как тельца Вейбеля-Палада [46, 47].Экспрессия эндотелиального селектина важна для перекатывания лейкоцитов и инфильтрации в стенку сосудов [48]. Более того, воздействие TF на эндотелиальную поверхность, которое активируется множеством воспалительных белков, активирует каскад коагуляции и способствует прокоагулянтной активности Plts [49-51]. Все эти изменения способствуют адгезии и активации Plts к поврежденному эндотелию, создавая благоприятную среду для образования тромба [18, 52, 53]. Нарушения, вызванные дисфункцией эндотелия, усугубляются тем фактом, что во время длительного воспаления также нарушаются оба механизма выработки оксида азота и простациклина, способствуя адгезии Plts к эндотелию [45].
Формирование МП также выявило важное событие для воспалительного прогрессирования [54, 55]. Микрочастицы представляют собой небольшие части мембраны, отделяемые от активированных клеток, таких как эндотелиальные клетки, моноциты и / или тромбоциты, которые поддерживают прокоагулянтную активность и вносят вклад в формирование гемостатической пробки [41, 56–58]. В 2004 году Lopez et al. [45, 59] предложили модель, основанную на микровезикулах (MV), происходящих из моноцитов / макрофагов, несущих ТФ, обладающих способностью сливаться с активированными эндотелиальными клетками за счет воспаления и способствовать инициации свертывания крови.Следовательно, адгезионные молекулы, происходящие из эндотелия, в частности P- и E-селектин, будут играть ключевую роль, взаимодействуя с тромбоцитами и циркулирующими MV / MP, несущими TF. Перенос ТФ в эндотелиальные клетки будет стимулировать прокоагулянтную активность, увеличивая образование тромбина и образование сгустка [60–62]. Вклад циркулирующих МП в воспаление был снова показан, когда Salanova et al. [63] продемонстрировали, что рецептор GPIIb-IIIa тромбоцитов приобретается нейтрофилами через производные от Plt MP, что приводит к активации сигнального каскада NF- κβ , поддерживающего воспалительный ответ [64].
В недавней публикации была рассмотрена важная роль MPs Plts и Plts не только в гемостазе и коагуляции, но и в некоторых других заболеваниях, включая атеросклероз и родственные ему заболевания, патологии центральной нервной системы (болезнь Альцгеймера, рассеянный склероз) и даже рак и / или рост опухоли [65]. Таким образом, Plts необходимы для врожденного иммунного ответа, борьбы с инфекциями (вирусами, бактериями и микроорганизмами) и играют важную роль во время воспалительных процессов [66].
4. Фактор V Лейден и воспаление: инфекция, сепсис и воспалительное заболевание кишечника
Все эти годы исследования полиморфизма FVL были сосредоточены на определении риска возможных тромботических осложнений в различных клинических ситуациях (хирургия, беременность) и оценка риска / пользы профилактического лечения. Меньше внимания уделяется возможной связи FVL с воспалением [67]. В течение последних 5 лет некоторые исследователи начали сомневаться в том, может ли FVL быть ключевым условием, определяющим исход клинических эпизодов, таких как инфекция, сепсис и / или ВЗК [68].Меньше обсуждалось возможное влияние Plts и производных тромбоцитов MP как носителей модифицированной FVL и на каком уровне они могут модулировать исход этого процесса, связанного с сепсисом, инфекцией и / или IBD [42 ].
4.1. Инфекция и сепсис
Инфекция и тяжелый сепсис подразумевают воспалительный процесс с серьезным изменением в их коагуляционной системе [49, 69]. В большинстве случаев сепсис обычно вызывается наличием известной или предполагаемой инфекции.У пациентов с сепсисом присутствуют все три из классической триады Виршоу, что приводит к нарушению кровотока к жизненно важным органам, вызывая отказ основного органа. Нарушения коагуляции у пациентов с сепсисом являются серьезными и опасными для жизни [70]. В 2004 году Weiler et al. [71] попытались продемонстрировать, что полиморфизм FVL может изменять исход сепсиса в соответствии с моделями на животных. Однако дальнейшие исследования не смогли найти значимой корреляции между FVL и некоторыми другими гемостатическими полиморфизмами как предикторами прогноза сепсиса [72–74].
В 2008 году Линдквист и Дальбек [75] указали на возможность того, что FVL является эволюционным преимуществом против определенных событий, таких как сепсис, на основании высокой распространенности среди населения в целом. В той же строке Isma et al. [76] также подтвердили, что тромботические события можно рассматривать как преимущество в выживании при определенных физиологических состояниях, особенно у женщин. В отличие от этой идеи, многочисленные публикации показали, что риск выкидыша во время беременности у женщин, несущих FVL, немного увеличивается (в два или три раза выше), а также возникают осложнения, связанные с эпизодами свертывания крови во время беременности, такими как ТГВ, тромбоэмболия легочной артерии, преэклампсия. , медленный рост плода и / или раннее отделение плаценты от стенки матки (отслойка плаценты) [77, 78].Считается, что концентраты APC имеют положительный эффект при сочетании со стандартной терапией (антибиотики, жидкости и компоненты крови) при сепсисе. Помимо своего антитромбинового действия, APC обладает противовоспалительным действием благодаря взаимодействию с лейкоцитами и эндотелиальными клетками [79–81]. Поскольку Plts и MP являются носителями модифицированного FVL, который становится устойчивым к инактивации APC, было бы интересно оценить, в какой степени лечение APC одинаково эффективно у носителей FVL или даже сможет ли оно повлиять на более ранние или отсроченный ответ на стандартное лечение.
Как и в случае сепсиса, публикации также противоречивы относительно влияния мутации FVL на исход таких инфекций, как пневмония или грипп [70]. Между тем, Schouten et al. [82] смогли найти некоторые различия в исходе пневмококковой пневмонии, дальнейшие исследования показали, что не было обнаружено значительных изменений в исходе инфекции летальным гриппом h2N1.
В различных публикациях было обнаружено, что большое количество циркулирующих МП присутствует во время острых инфекций, таких как инфекция Plasmodium vivax.Это открытие подтверждает идею о том, что не только Plts, но и производные тромбоцитов MP могут играть роль в острых воспалительных симптомах, возникающих во время инфекций [83].
4.2. Воспалительное заболевание кишечника
Воспалительное заболевание кишечника (ВЗК) известно как группа воспалительных состояний толстой и тонкой кишки и обычно относится к двум хроническим заболеваниям: язвенному колиту и болезни Крона. Состояние гиперкоагуляции обнаружено у пациентов с ВЗК. Фактически, у пациентов, страдающих ВЗК, риск ЖТ увеличивается примерно в три раза [84, 85].
Многочисленные исследования были выполнены с целью выявления взаимосвязи с наличием мутации FVL и частотой ВЗК [86]. В большинстве публикаций не обнаружено четкой связи между FVL и риском развития IBD, хотя FVL продолжает считаться фактором риска, который может влиять на клинические проявления во время IBD [84, 86–88]. Точно так же Liang et al. [89] показали, что мутация FVL не была существенно связана с риском развития ВЗК.В отличие от предыдущих отчетов, исследования Magro et al. [90] поддерживают концепцию более высокой распространенности одиночных и комбинированных тромбофильных дефектов у пациентов с ВЗК, утверждая, что эти факторы могут быть вовлечены в патогенез заболевания. Нет окончательного вывода о возможной роли мутации FVL, но кажется очевидным, что наличие мутации FVL у пациентов с ВЗК увеличивает риск развития тромботических эпизодов. Патофизиология ВЗК все еще активно исследуется. Воспалительный процесс при ВЗК, вероятно, связан с иммунной реакцией организма на собственную сосудистую ткань [91].В результате этого повреждения лейкоциты и Plts активируются и запускают цепную реакцию, вызывающую нарушение регуляции полного каскада коагуляции, способствующее образованию сгустков [92, 93].
Интересно, что повышенные уровни циркулирующих МП были обнаружены у пациентов с активной ВЗК. Более конкретно, Andoh et al. [94] смогли определить повышенную реакцию Plts у пациентов, страдающих ВЗК, что играет важную роль в ее патогенезе. Реакция иммунной системы на собственную сосудистую сеть может вызывать повышенные уровни циркулирующих MPs, которые могут играть роль в усилении коагуляции и воспалительных состояний у этих пациентов.Леонетти и др. [95] продемонстрировали, используя экспериментальную модель, что производные тромбоцитов MPs влияют и улучшают как эндотелиальную дисфункцию, так и гипореактивность сосудов, способствуя тромбофилическому состоянию, которое, вероятно, будет усилено у пациентов с диагнозом FVL [54, 96].
5. Заключительные выводы
Тромбофилическое состояние возникает из-за взаимодействия ряда различных факторов, включая наследственные дефициты, такие как FVL, приобретенный дефицит природных антикоагулянтов и дисфункциональные факторы свертывания крови с усугубляющей клинической ситуацией [97].Несмотря на то, что воспалительная реакция считается клинически отличной, она является распространенным ранним явлением, которое встречается во многих клинических ситуациях, включая упомянутые ранее. После первоначального ответа воспаление становится хроническим в большинстве рассмотренных здесь случаев, вызывая ухудшение изменений, затрагивающих стенку сосуда, иммунную систему и систему свертывания крови.
Эндотелиальная дисфункция, первоначально описанная у пациентов с уремией, также описывалась при различных клинических состояниях, таких как цирроз, диабет, трансплантация печени и даже большая депрессия [98, 99].Воспалительный ответ, возникающий во время сепсиса, инфекции и ВЗК, приводит к повреждению эндотелия, вызывая сосудистый ответ и усиление активации лейкоцитов и Plts. Высвобождение и воздействие молекул адгезии (например, P-селектина, E-селектина, ICAM-1 и VCAM-1) играют ключевую роль в обеспечении прикрепления лейкоцитов и Plts к субэндотелию [18, 100]. Предыдущие события и присутствие коллагена и ТФ на поврежденном эндотелии запускают каскад коагуляции и образование окклюзионных тромбов.
Несмотря на общепризнанную роль эндотелия и Plts в воспалении, меньше обсуждалось возможное участие MPs, производных Plts и Plt в качестве носителей TF и / или модифицированного FVL, и их значение в развитии тромботических осложнений, связанных с сепсис, инфекция и / или ВЗК [101]. Было обнаружено, что циркулирующие МП значительно увеличиваются у пациентов с диагнозом FVL [19]. Более того, повышенные циркулирующие МП были также обнаружены при сепсисе, инфекциях и ВЗК.Этот факт поддерживает идею о том, что Plts и происходящие из Plt и лейкоцитов MPs могут играть решающую роль в прогрессировании воспаления, приводя не только к образованию сгустка, но также становясь фактором прогнозирования риска развития тромбоза [42]. Было продемонстрировано, что МП усиливают сосудистую и эндотелиальную дисфункцию, подтверждая идею о том, что МП, несущие FVL, становятся усилителями протромботических событий, представленных у этих пациентов, ухудшая клиническое ведение и исход.
Предыдущие исследования показали, что MPs гетерогенны и сильно зависят от механизма активации, который запускает их производство [102]. Кроме того, сообщалось, что MP Plt являются носителями специфических рецепторов, таких как GPIIb-IIIa и других молекул, включая P-селектин и, что более важно, FV [2]. То, в какой пропорции FVL присутствует в циркулирующих MP при расстройстве FVL, а также во время сепсиса, инфекции и / или IBD, может открыть новую стратегию клинического ведения этих пациентов.Таким образом, характеристика МП у пациентов с диагнозом FVL, а также у пациентов с сепсисом, инфекцией и событиями ВЗК может предоставить ценную информацию для лучшего понимания этих расстройств, а также для оценки клинического течения этих конкретных состояний. В соответствии с более поздней концепцией, обнаружение повышенных уровней МВ, несущих ТФ, связанных с воспалительными состояниями, поможет объяснить повышенный риск тромбоза, связанный с такими инфекциями, как ВЗК [45].
Более высокое количество MPs, нагруженных провоспалительными компонентами (FV и TF), приводит к прокоагуляции
Фактор V Leiden
Чтобы отпраздновать Месяц осведомленности о ТГВ, я попросил у сказочной Элизабет Варгу интервью. У Лиз есть фактор V Лейдена, наследственное нарушение свертывания крови, и она неустанно работала над повышением осведомленности о сгустках крови и тромбофилиях, обучая как пациентов, так и медицинских работников. Лиз также является сертифицированным генетическим консультантом в Детском научно-исследовательском институте Колумбуса, где она также разрабатывает программы по укреплению здоровья для сообщества лиц, страдающих нарушениями свертывания крови.
Вот первая часть нашего интервью. Следите за новостями!
1. Можно сначала поговорить о вашей личной жизни? Как вы узнали, что у вас фактор V Лейден? Как это повлияло на вашу личную и профессиональную жизнь?
Конечно, я всегда рад поделиться своей историей. Моя история с фактором V в Лейдене началась с моей мамы. В 1999 году она путешествовала и ходила пешком, когда ее нога заболела и покраснела. Когда она почувствовала свою ногу, ей показалось, что по внутренней стороне ее бедра спускается большая веревка.Вскоре она узнала, что у нее «поверхностный тромбофлебит»; в основном это сгусток крови, проходящий по внешним венам на ноге. Ей не пришлось лечиться от этого, кроме отдыха и приема обезболивающих. Но когда ее врач опросил ее, он узнал, что у ее отца было несколько подобных эпизодов. Именно тогда он порекомендовал пройти тестирование на несколько нарушений свертывания крови. Через пару недель она узнала, что была гетерозиготной (имела 1 копию) лейденской мутации фактора V.
В то время я учился в колледже, поэтому мало что знал об этом инциденте.Однако, возвращаясь домой, я встретился со своим семейным врачом для осмотра, и она начала говорить со мной о гене, обнаруженном у моей мамы. Она сказала мне, что у ее коллеги тоже был фактор V Лейден. Эта женщина перенесла инсульт в возрасте 40 лет; Позже выяснилось, что у ее коллеги была дыра в сердце (так называемое открытое овальное отверстие или PFO) и что в венах ее ног образовался небольшой сгусток, который переместился в ее мозг.
Мой врач также рассказал мне о противозачаточных таблетках и о том, как они могут взаимодействовать с фактором V Лейдена.Она сказала, что порекомендует мне прекратить прием таблетки, если результат окажется положительным. Итак, я решил пройти генетический тест и продолжить работу.
Пару недель спустя, в субботнее утро, которое я все еще помню ясно, как день, мой врач позвонил мне домой. Она сказала мне, что тест оказался положительным; Я был гетерозиготным по фактору V Лейдена. Она также прочитала мне краткое содержание абзаца лабораторного отчета и сказала, что у меня «риск венозной тромбоэмболии увеличился в 5-7 раз», и рассказала о дополнительном риске, связанном с гормонами.Затем она сказала мне перестать принимать противозачаточные таблетки.
Я сделал то, что она предложила, и отказался от таблетки. Я был рад узнать результат своего теста, чтобы принять такое решение. Но тогда у меня осталось много вопросов. Именно тогда я начал задумываться: «Так что же такое венозная тромбоэмболия?» и «действительно ли стоит все эти хлопоты, чтобы снизить мой риск?»
Я справился с трудом, прочитав энергично… Я прочитал все, что попадалось мне в руки. Вскоре я узнал намного больше о сгустках.Но я также узнал много других вещей, некоторые из которых были пугающими. Я узнала, что когда-нибудь у меня может быть труднее с беременностью, потому что может быть более высокий риск потери беременности из-за тромбов в плаценте. Я также узнала об отслойке плаценты, когда плацента отрывается от матки во время беременности, вызывая кровотечение. Вот тогда меня осенило. У моей мамы было нечто очень похожее, когда она была беременна мной! Я всегда помню, как она рассказывала мне, что, по ее мнению, у нее «случился выкидыш», когда ей сказали, что надежды нет и что она потеряет меня.Чудом спустя несколько часов, когда у меня все еще билось сердце, они поняли, что я не уйду так легко! Фактически, ее беременность продолжалась, и хотя я родилась на 2 месяца раньше срока, у меня все было хорошо !!!
Для меня было удивительно видеть, как много фактора V объясняет Лейден! Это объясняло не только эпизод беременности у моей мамы, ее тромб и тромб у ее отца, но и в ходе исследования семейного анамнеза мы узнали, что у других членов семьи, включая двоюродных братьев моей мамы, были тромбы. Однако их никогда не обследовали на тромбофилию!
Я помню, как в этот период я испытал самые разные эмоции.Я была благодарна, потому что знала… я могу предотвратить образование тромбов и, возможно, проблемы с беременностью в будущем. Но я был немного напуган и сбит с толку. Что это на самом деле значило для меня? Что это будет значить для моих младших кузенов? Некоторые из них принимали таблетки… нужно ли их обследовать?
Волею судьбы я поступил в аспирантуру по генетическому консультированию всего через несколько месяцев после того, как узнал о своем результате. Когда я прошел классы и узнал обо всем, что связано с генетическим консультированием, включая обширное образование и поддержку, которые предлагаются до и после тестирования, я был поражен.Почему я не получил такого образования? Мне пришлось так много научиться самому! Мне пришлось самой справляться со всеми своими страхами. У меня остались вопросы о том, что сказать членам моей семьи, которые теперь обращались ко мне за советом. Я был просто расстроен и зол. Но я хотел что-то с этим сделать!
Именно этот опыт побудил меня узнать… был ли мой опыт уникальным? Проходили ли тесты другие люди, но не получали информации? Как они «справились» с результатами тестов? Их результаты беспокоили их — вызывали беспокойство, или это было только меня? Насколько хорошо они понимали значение своих результатов?
Эти вопросы стали основой моей исследовательской работы.Я опросил около 170 человек с фактором V Лейдена и спросил их об их знаниях, образовательных потребностях и о том, как тестирование повлияло на их жизнь с психологической точки зрения. Ответ, который я получил, был невероятным. Люди писали мне эссе на обратной стороне анкеты. Они поделились своими историями (в том числе той, которая написала мне из больничной койки своей матери) и своими страхами; но они также показали мне, что наделены полномочиями! Хотя многие признали, что они не получили достаточно информации при постановке диагноза, а некоторые больше беспокоились из-за их результатов, в подавляющем большинстве люди сказали мне, что они были рады узнать! Они также хотели, чтобы их медицинские работники знали больше, и они хотели сами получить образование.
Эти результаты сформировали всю мою личную жизнь и мой карьерный путь. Услышав голоса стольких людей с тромбофилией, многие из которых отчаянно нуждались в просвещении по поводу своего заболевания, я не мог не ответить. Доктор Стефан Молл, мой сотрудник по моей диссертации, пригласил меня приехать в Северную Каролину, чтобы выступить на симпозиуме для пациентов. Мы пригласили всех респондентов на мою анкету и весь вечер рассказали им о тромбофилии. После этого к нам подошли люди, чтобы выразить свою благодарность.Мне было так приятно использовать свои знания, чтобы помочь кому-то другому. Я понял, что мне есть что предложить.
С этого момента я посвятил себя обучению пациентов и их семей с тромбозами и тромбофилиями. Я хочу, чтобы люди прошли соответствующее тестирование, и когда они это сделают, я хочу, чтобы они понимали свои результаты. Я хочу, чтобы эта информация воодушевила их. Я хочу, чтобы они могли предотвратить образование тромбов. Я хочу избежать ненужных смертей.
Мне посчастливилось осуществить эту мечту, предоставляя генетические консультации, выступая на образовательных семинарах для пациентов и участвуя в таких организациях, как Национальный альянс по тромбозам и тромбофилии (NATT).Это невероятно полезно, когда я могу помочь в создании учебных материалов и поговорить с людьми, чей опыт меня удивляет и просветляет. Я также благодарен за возможность помочь компании DNA Direct, которая стремится создавать качественные образовательные материалы для пациентов с тромбофилией.
Фактор V Лейден
Генетика:
Фактор V Лейден [ F5 Arg506Gln]
Введение
Устойчивость
к активированному белку C [APCr] сначала оценивалась с использованием модифицированного анализа на основе APCr [см. Анализы APCr].Последующие исследования показали, что в большинстве случаев APCr возникает в результате миссенс-мутации G → A в нуклеотиде 1691 в гене F5 , приводящей к мутации Arg506Gln, в которой остаток аргинина в положении 506 в факторе Va заменен на глутамин. и это устраняет сайт расщепления инактивации для активированного протеина C [APC]. На диаграмме ниже показаны сайты расщепления для APC, FXa и тромбина [T] в FVa:
В очищенных реакционных смесях Gln506-FVa по сравнению с нормальным FVa показывает пониженную чувствительность к расщеплению APC, поскольку он инактивируется примерно в 10 раз медленнее, чем нормальный Arg506-FVa.Расщепление только Arg506 не инактивирует FV, но снижает скорость, с которой расщепляется Arg306.
Принципы и методы
Существует ряд методов обнаружения лейденской мутации FV. Большинство методов зависят от ПЦР для амплификации геномной ДНК, за которым следует метод для идентификации наличия или отсутствия миссенс-мутации, например переваривание рестриктазами и картирование.
Используются самые разные методы:
— Мультиплексные методы e.грамм. для мутаций FVL и протромбина G20210A
— Прямое секвенирование, однопроходное или двунаправленное
— Спектрофотометрическая оценка связывания с аллель-специфическими олигонуклеотидами в микротитровальных планшетах
— Иммуноферментный анализ продукта ПЦР
— ДНК-полимераза, опосредованная люциферазой 907 — ПЦР-независимая флуоресценция, генерируемая олигонуклеотидами
— ПЦР-анализ на основе прямого флуорогенного зонда
— ПЦР в реальном времени
— Микроэлектронные матрицы наночипов
Интерпретация
Большинство методов позволяет быстро отличить гетерозиготных особей от гомозиготных мутантов или людей дикого типа [i.

 У носителей гомозиготного полиморфизма F5 или мультигенной тромбофилии вероятность тромбоза в 20, 80, 100 раз выше (в зависимости от количества дефектных генов) по сравнению со здоровым человеком.
У носителей гомозиготного полиморфизма F5 или мультигенной тромбофилии вероятность тромбоза в 20, 80, 100 раз выше (в зависимости от количества дефектных генов) по сравнению со здоровым человеком.