Вагинальная микрофлора — Семейная Клиника
Вагинальная микрофлора (вагинальная флора) – микроорганизмы, которые населяют влагалище. Они являются частью общей человеческой микрофлоры. Количество и тип этой флоры определяет состояние здоровья женщины.
В норме в мазке на микрофлору должны преобладать бактерии рода Лактобациллы (лактобактерии), защищающие от патогенных микроорганизмов. Лактобактерии производят молочную кислоту, которая, как предполагается, препятствует развитию патогенных бактерий (золотистого стафилококка, кишечной палочки и др.). Также они вырабатывают перекись водорода, обладающую широким противомикробным спектром действия, и различные бактериоцины, которые также убивают других бактерий, но имеют более узкое направленное действие.
Правила забора материала для определения бактериальной микрофлоры
Биологический материал берется во время профилактического осмотра, а также при жалобах, таких как боль выше лобка, зуд и жжение в наружных половых органах, а также выделения, указывающие на воспалительный процесс.
Процедура забора биологического образца проходит безболезненно. Доктор вводит гинекологическое зеркало с центральным фиксатором, позволяющее расширить влагалище для осмотра поверхности шейки матки. Материал со стенки половых органов берется специальной щеточкой или ватным тампоном.
Перед походом к «женскому врачу» необходимо соблюдать определенные правила, повышающие достоверность и информативность анализа:
- за 2-3 дня не вступать в интимные отношения;
- запрещаются спринцевания;
- принимать ванную накануне визита к врачу не рекомендуется;
- при проведении гигиенических интимных процедур пользоваться специальным невысушивающим мылом;
- в период менструации посещение гинеколога не рекомендуется, лучше всего сдавать этот анализ сразу после ее прекращения;
- минимум 2-3 часа не опорожнять мочевой пузырь.
Если женщина принимает какие-либо препараты, она должна об этом сообщить лечащему врачу. Проведение терапии некоторыми препаратами (например, антибиотиками) может исказить результат исследования.
Проведение терапии некоторыми препаратами (например, антибиотиками) может исказить результат исследования.
При снижении иммунитета (к примеру, во время беременности, гормонального сбоя, после перенесенных стрессов) количество лактобактерий снижается. Это влечет за собою ослабление женского организма, что чревато усилением предрасположенности к инфекционным заболеваниям половой сферы.
В норме, кроме лактобактерий, в мазке допускается присутствие гарднерелл и кандид в малом количестве. При снижении иммунитета патогенные микроорганизмы начинают быстро размножаться, подавляя «молочные» бактерии. Это приводит к нарушению кислотности, что чревато развитием дисбактериоза влагалища, а также гарденелезом и кандидозом.
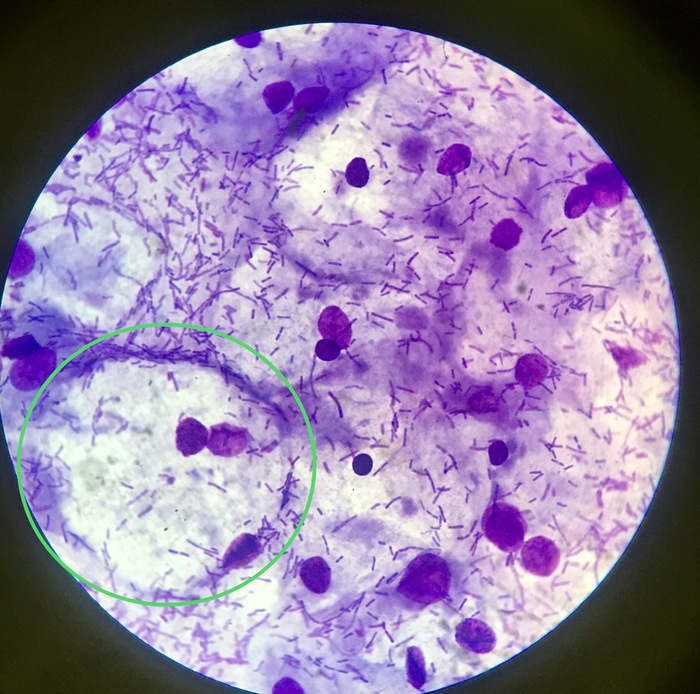
В мазке на флору оцениваются следующие показатели:
- Клетки плоского эпителия, выстилающего стенки влагалища. В норме они единичные. Большое количество может указывать на воспаление.
 Отсутствие клеток плоского эпителия может говорить об атрофии слизистой при дефиците женских половых гормонов.
Отсутствие клеток плоского эпителия может говорить об атрофии слизистой при дефиците женских половых гормонов. - Лейкоциты, функция которых обезвреживать возбудителей инфекции. Превышение их нормы (свыше 10 в поле зрения) также говорит о возможном воспалительном процессе;
- Грамположительные палочки – лактобактерии (лактобациллы) или палочки Додерлейна. Эти микроорганизмы являются основой влагалищной флоры здоровой женщины. Снижение количества лактобацилл указывает на дисбактериоз влагалища и сопровождает большинство инфекционных заболеваний половых органов;
- Слизь – секрет, выделяемый железами канала шейки матки. В стенках влагалища нет желез, вырабатывающих слизь. В норме количество слизи, выделяемое и впитываемое во влагалище, примерно равно, поэтому слизь обнаруживается лишь в небольших количествах. Увеличение количества слизи (более 5 мл в сутки) может говорить о воспалении в канале шейки матки;
- «Ключевые» клетки – это клетки плоского эпителия, которые отделились от слизистой и со всех сторон окружены бактериями.
 Преимущественно гарднереллами. Наличие этих клеток свидетельствует о влагалищном дисбактериозе;
Преимущественно гарднереллами. Наличие этих клеток свидетельствует о влагалищном дисбактериозе; - Различная флора, которая присутствует во влагалище. Указываются виды бактерий, которые были обнаружены при осмотре мазка под микроскопом. Палочковая флора считается нормой, поскольку лактобактерии имеют форму палочек. Коковая флора является тревожным признаком. Смешанная флора означает, что в мазке большое количество и палочковидных и кокковых микроорганизмов, что бывает при бактериальном вагинозе.
Микрофлора половых путей в различные периоды жизни женщины неодинакова и отражает влияния комплекса факторов внутренней и внешней среды.
Исследование мазка на микрофлору – это важная и быстрая диагностика, позволяющая на ранних стадиях выявить серьезную патологию. Своевременное и правильное лечение позволит избавиться от заболевания, не допуская его перехода в хроническую стадию. Молодым девушка и женщинам, планирующим стать мамой, следует уделить большое внимание репродуктивному здоровью, чтобы в будущем не столкнуться с проблемой зачатия или благополучного вынашивания беременности.
В СЕМЕЙНОЙ КЛИНИКЕ Вы можете сдать мазок на определение микрофлоры влагалища, а также на онкоцитологию. Наши врачи клинической лабораторной диагностики квалифицированно выполнят анализы, а врачи-гинекологи
Бактериальная флора и её устойчивость к антибиотикам при послеродовом эндометрите Текст научной статьи по специальности «Фундаментальная медицина»
Медицинские науки
№ 12. — 2016
УДК 61
БАКТЕРИАЛЬНАЯ ФЛОРА И ЕЁ УСТОЙЧИВОСТЬ К АНТИБИОТИКАМ ПРИ
ПОСЛЕРОДОВОМ ЭНДОМЕТРИТЕ
Т. Гарнизов, Университетская больница «Дом матери» Медицинского университета Софии
(София, Болгария), e-mail: teodor.garnizov@abv.bg А. Николов, Университетская больница «Дом матери» Медицинского университета Софии;
Медицинский университет Софии (София, Болгария).
В. Златков, Медицинский университет Софии (София, Болгария).
Аннотация. У 100 женщин с клиническими признаками послеродового эндометрита, из которых 70 после вагинальных родов и относятся к первой группе, а 30 родили путем кесарева сечения и относятся ко второй группе, со второго по восьмой день после рождения берутся мазки из лохий для бактериологического исследования. Из выделенных бактерий наиболее часто у обеих групп встречаются Enterococcus faecalis, Escherichia coli и Staphilococcus epidermidis. У рожениц второй группы изолированы и анаэробные бактерии — Peptococcus spp., Peptostreptococcus spp., Enterobacter aerogenes, которые не изолированы у женщин первой группы. Наиболее часто выделенные бактерии имеют значительную степень резистентности к определенным антибиотикам.
Ключевые слова: послеродовой эндометрит, бактериальная флора, устойчивость к антибиотикам.
BACTERIAL FLORA AND ITS RESISTANCE TO ANTIBIOTICS IN POSTPARTUM ENDOMETRITIS
Abstract. Swabs of 100 women with clinical signs of postpartum endometritis, of which 70 after vaginal birth and belong to the first group, and 30 gave birth by caesarean section and belong to the second group, from the second to the eighth day after birth, were taken from lochia for bacteriological examination. From the highlighted bacteria the most frequently in both groups are Enterococcus faecalis, Escherichia coli and Staphilococcus epidermidis. In the second group of women, the anaerobic bacteria — Peptococcus spp., Peptostreptococcus spp., Enterobacter aerogenes, which are not isolated in the first group of women, are also isolated. The most frequently isolated bacteria have a significant degree of resistance to certain antibiotics.
Keywords: postpartum endometritis, bacterial flora, antibiotic resistance.
Введение.
Инфекции верхних половых путей являются частыми осложнениями во время послеродового периода, что может привести к сепсису и смерти пациентки. Послеродовой эндометрит обычно получается, когда во время родов патогенная бактериальная флора из влагалища проникает в полость матки и вызывает воспаление эндометрии. Основными факторами риска при развитии послеродового эндометрита могут быть акушерские факторы, гинекологические, хирургические и демографические.
Родовые травмы, эпизиотомии, выскабливание, лапароскопические операции, лигатуры труб могут быть связаны с возникновением послеродового эндометрита [1-4]. Согласно
последним данным беременные, страдающие избыточным весом тела, подвержены повышенному риску возникновения бактериальных инфекций во время беременности [5]. Вагинит и бактериальный вагиноз, существующие во время беременности, являются серьезным фактором риска выкидыша и преждевременных родов с соответствующими социальными последствиями [6]. В послеродовой период, как осложнение, частота эндометрита после родов может достигать 16% — 25% [7].
Вагинит и бактериальный вагиноз, существующие во время беременности, являются серьезным фактором риска выкидыша и преждевременных родов с соответствующими социальными последствиями [6]. В послеродовой период, как осложнение, частота эндометрита после родов может достигать 16% — 25% [7].
Материалы и методы.
Были обследованы 100 рожениц, из которых 70 после вагинальных родов со средним возрастом 29 ± 7,1лет (первая группа) и 30 родивших с помощью кесарева сечения со средним возрастом 32,4 ± 7,8 лет (вторая группа). Все женщин с клиническими признаками послеродового эндометрита. Со второго по восьмой день после рождения были проведены бактериологические исследования лохий — сделаны микроскопические препараты и культуры аэробных и анаэробных бактерий с последующим контролем. Выделена изолированная бактериальная флора. Колонии определяются как массовые, средние и единичные. В соответствии с современными критериями определены чувствительность и сопротивляемость изолированных бактерий. Проведенное целенаправленное лечение дало очень хорошие результаты. Бактериологические исследования проводились в течение 2015 года и в первой половине 2016 года в лаборатории клинической микробиологии при Университетской больнице акушерства и гинекологии «Дом матери» г. Софии (Болгария). Для определения статистически значимой разницы между исследуемыми параметрами использовался вариационный статистический анализ. В Университетскую больницу «Дом матери», как в лечебное заведение самого высокого класса, для проведения родов направляются проблемные пациентки со всей страны, в том числе и пациентки с воспалительными осложнениями.
Проведенное целенаправленное лечение дало очень хорошие результаты. Бактериологические исследования проводились в течение 2015 года и в первой половине 2016 года в лаборатории клинической микробиологии при Университетской больнице акушерства и гинекологии «Дом матери» г. Софии (Болгария). Для определения статистически значимой разницы между исследуемыми параметрами использовался вариационный статистический анализ. В Университетскую больницу «Дом матери», как в лечебное заведение самого высокого класса, для проведения родов направляются проблемные пациентки со всей страны, в том числе и пациентки с воспалительными осложнениями.
Результаты и обсуждение.
Частота различных изолированных типов бактерий, в процентах от общего количества выделенных бактерий для первой и второй групп рожениц отражена в таблице № 1.
В первой группе у 32,8% обследованных женщин установлен один вид бактерий, у 42,9% — два вида, у 21,4% — три вида и у 2,9% — четыре различных типа бактерий. Во второй группе один тип микробного агента открыт у 70,0% (Р, менее чем 0,01 по сравнению с результатом первой группы), у 27,4% — два вида, а у 2,6% — три типа бактерий.
Во второй группе один тип микробного агента открыт у 70,0% (Р, менее чем 0,01 по сравнению с результатом первой группы), у 27,4% — два вида, а у 2,6% — три типа бактерий.
Было установлено, что проценты наиболее часто изолированных бактерий для обеих исследуемых групп Enterococcus faecalis, Escherichia coli и Staphilococcus epidermidis были сходными.
Enterococcus faecalis изолированы у 23,08% всех бактерий, изолированных у рожениц первой группы и у 22% всех бактерий, изолированных у рожениц второй группы. При проведении нашего исследования мы обнаружили значительно выраженную устойчивость Enterococcus faecalis к Cefazolin (20,13%), Cefuroxime (19.62%), Amikacin (16,82%), Cefoxitin (16,01%) и Erithromycin (13,92%). Таблица №2. В другом исследовании также указывается на то, что энтерококки, изолированные у женщин с акушерскими и гинекологическими проблемами и у новорожденных могут также иметь значительную резистентность к аминогликози-дам и к Erithromycin [8].
На втором месте по частоте изолированных бактерий в лохиях у женщин с послеродовым эндометритом находится Escherichia coli (16,02% для первой
группы и 16,0% для второй группы). В ряде публикаций акцентируется на том, что Escherichia coli часто может быть причиной акушерских инфекций [9-10].
Считается, что Escherichia coli является одним из самых распространенных микробов, обнаруживаемых в половых путях: у небеременных женщин — 28%, а у беременных — от 24% до 31% всей микробной флоры. Вагинальная Escherichia coli является резервуаром и ступенью для развития инфекций мочевых и половых путей, в том числе послеродового эндометрита. Подчеркивается, что Escherichia coli имеет значительную устойчивость к Ampicillin и Gentamycin [9, 10].
При изучении литературы по режимам антибиотиков — терапии послеродового эндометрита, можно заметить, что авторы считают наиболее адекватным лечением сочетание Clindamycin и Gentamicyn, в то же время, указывая на важность результатов бактериологических исследований [11].
В нашем исследовании показана устойчивость Escherichia coli к Ampicillin — 35,03%, Cefuroxime — 40,53%, Ciprofloxacin — 10,84%, Cefazolin — 8,20% и Gentamycin — 5,40%.
Третье место по частоте среди изолированных бактерий в культурах из лохий женщин с послеродовым эндометритом занимают Staphilococcus epidermidis — у 10,26% рожениц первой группы и у 10,0% второй группы. В других источниках указывается, что при родильных инфекциях частота Staphilococcus epidermidis составляет 5-6%. Часто эти бактерии выделяют при послеродовом сепсисе [12]. В других публикациях отмечается, что Staphilococcus epidermidis не всегда дает клиническую картину. В качестве вирулентных микроорганизмов он был замечен у пациенток с нарушениями иммунной системы и при беременности [13]. Устойчивость Staphilococcus epidermidis к используемым в настоящее время антибиотикам изменяется по сравнению с предыдущими исследованиями, и представляет особый интерес и находит свое отражение в нашем материале в таблице № 3.
На четвертом месте по частоте в культурах из лохий обследованных нами женщин с послеродовым эндометритом находятся Ureaplasma urealyticum — у 9,63% женщин из первой группы и у 14,0% из второй. Интересным фактом является то, что изолированные в нашем исследовании Ureaplasma urealyticum во всех случаях не показывают сопротивление ни к одному из тестируемых антибиотиков.
В недавних исследованиях 2016 года сообщаются результаты многофакторного анализа при изучении факторов риска для ненормальных флор влагалища. У беременных установлена корреляция между Ureaplasma urealyticum и бактериальным вагинозом / аэробным вагинитом у пациенток с несколькими половыми партнерами, мультипаритетом и низким уровнем образования [14].
В данном исследовании 61,7% выделенных бактерий являются аэробными и 38,3% -анаэробными. В большинстве случаев анаэробные
бактерии представлены единичной колонией или имеют умеренный рост при наличии других видов анаэробных бактерий.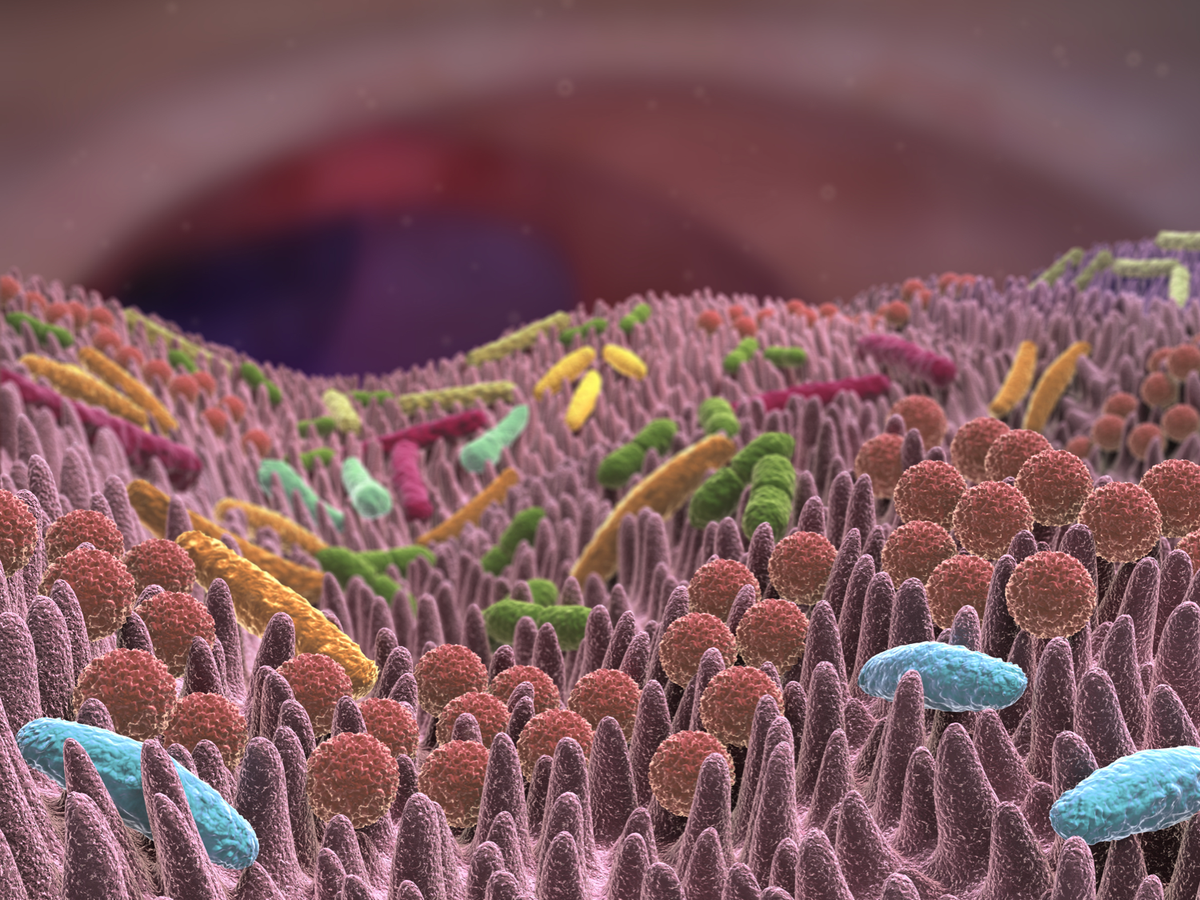 Исключение составляют два случая из второй группы, в которых наблюдается рост массовой колонии Peptostreptococcus.
Исключение составляют два случая из второй группы, в которых наблюдается рост массовой колонии Peptostreptococcus.
Таблица 1. Частота изолированных бактерий при бактериологическом исследовании -_процент всех изолированных видов_
Тип изолированных бакте- Первая группа Вторая группа
рии
Enterococcus faecalis 23,08% 22,0%
Escherichia coli 16,02% 16,0%
Staphilococcus epidermidis 10,20% 10,0%
Ureaplasma urealyticum 9,62% 14,0%
Vetastreptococcus B 4,49%
Klepsiella pneumoniae 3,85% 2,0%
Enterococcus spp 3,85%
Staphilococcus aureus 3,21%
Citobacter Kosei 3,21%
Lactobacillus spp. 2,56% 8,0%
2,56% 8,0%
Streptococcus agalacticus 1,92%
Klepsiella oxytoca 1,92%
Morgania morganii 1,92%
Streptococcus vestibularis 1,92%
Strreptococcus alpha 1,28%
Proteus vulgaris 1,28%
Micoplasma Hominis 1,28%
Corinebacterium spp. 1,28%
Micrococcus luteus 1,28%
Gardenella vaginalis 0,64%
Pseudomonas aurogenosus 0,64%
Enterococcus cloacae 0,64% 2,0%
Peptococcus spp — 10,0%
Enterobacter aerogenosus 4. 0%
0%
Staphilococcus haemolyticus 2,0%
Seratia marcesens 2,0%
is spp. 6,0%
Proteus Mirabilis 2,0%
Таблица 2. Устойчивость к антибиотикам Enterococcus fae
Cefazolin 20,13%
Cefuroxime 19,62%
Amikacin 16,82%
Cefoxitim 16,01%
Erithromycin 13,92%
Ceftazidin 4,33%
Gentamycin 3,45%
Cefepime 2,63%
calis
Ciprofloxacin 1,76%
Meropenem 1. 33%
33%
Таблица 3. Резистентность Staphilococcus epidermidis к антибиотикам
Ampicillin 21,12%
Cefuroxime 21,14%
Erithromycin 18,30%
Clindamycin 9,85%
Cefoxitin 7,05%
Amikacin 7,04%
Ciprofloxacin 4,24%
Gentamycin 4,22%
Следует отметить, что во второй группе, когда роды проходят хирургическим путем, существуют выделенные бактерии, которые не были установлены в первой группе, в том числе с большей частотой являются анаэробные бактерии Peptococcus spp. — 10,0%, Peptostreptococcus spp — 6,0%, Enterococcus aerogenes — 4,0%.
В некоторых публикациях отмечалась изменчивость бактериальной устойчивости к определенным антибиотикам в течение долгого времени [13]. Важное значение имеет частое использование определенных групп.
В исследовании, проведенном в 2015 году, отмечается, что профилактика антибиотиками во втором и третьем триместре беременности не снижает риска послеродовых инфекций, в том числе послеродового эндометрита [15]. Эти результаты можно оспорить, так как более продолжительное лечение несомненно бы дало изменения в результате, а также и адекватное лечение полового партнера.
Неразборчивость в половых партнерах, которая не учитывается в этих случаях, может обессмыслить данное исследование.
Профилактика антибиотиками послеродовых инфекционных заболеваний считается полезной в случае родов при помощи кесарева сечения, особенно для определенных рисковых пациенток [16].
Заключение.
У женщин с послеродовым эндометритом в культурах из лохий изолированной бактериальной флоры, наиболее частыми являются Enterococcus faecalis, Eschericha coli, Staphilococcus epidermidis. Вышеупомянутые бактерии имеют высокую частоту резистентности к ряду антибиотиков, используемых в настоящее время.
Заслуживают внимание результаты, появившиеся с выявлением только при рождении определенных типов бактерий, pervias naturales и других видов, которые изолированы из ло-хиальных образцов только после хирургических родов, но не изолированных после нормальных родов.
Наш опыт показывает, что лечение послеродового эндометрита дает хорошие и качественные результаты, когда оно не проходит эмпирически, как это практикуется в других школах, а основывается на результатах бактериологического исследования с учетом ме-
няющейся чувствительности и резистентности к антибиотикам выделенной микробной флоры.
Литература:
1. Chaim W., Burstein E. Postpartum infection treatments: a review // Expert Opin.Pharmacother. 2003. №4. pp.1297-1313
2. Ronghua L., Lin L., Dujuan Wand. Antimicrobial prophylaxis in caesarean section delivery // Exp.Ther.MED. 2016. №12(2). pp. 961-964
3. Ridley N. Perineal wound infections: an audit // Pract.Midwife. 2015. №18(7). pp. 28-32.
4. Clardy P. Reardon Ch.C. Critical illness during pregnancy and the perpartum period. Official reprint from UpToDate. URL: www.uptodate.com.
5. Ovalle A., Martinez M.A., Fuentes A. et al. Obesity, a risk factor for ascending bacterial infection during pregnancy // Rev. Med. Chil. 2016. №144 (4). pp. 476-482.
pp. 476-482.
6. Трухина С.И., Циркин В.И., Трухин А.Н., Хлыбова С.В. Влияние массы тела при рождении на физическое развитие и успешност обученеия детей и подростков // Вятский медицинский вестник, выпуск журнала. 2012. №1. С.39-49.
7. Newton E.R., Wallace P.A. Effects of prophylactic antibiotics on endometrial flora in women with postcaesarean endometritis // Obstet. Gynecol. 1998. №92. pp. 262-268.
8. Shopova E. The sensitivity to antibacterial preparations of enterococcial strains isolated from gynaecological patients, pregnant women, puerperae and newborn unfants // Akusg, Ginecol. 1995. №34(3). pp. 32-34.
9. Saez-Lopez E., Guiral E., Fernandez D. Et al. Vaginal versus Obstetric Infection Escherichia coli isolates among Pregnant Women: Antimicrobial Resistance and Genetic Virulence Profile // PloSOne. 2016. 11(1). e0146531. DOI:10.1371/journal.pone.0146531
2016. 11(1). e0146531. DOI:10.1371/journal.pone.0146531
10. Spaetgens R., DeBella K., Ma D. et al.. Perinatal antibiotic usage and changes in colonization and resistance rates of group B streptococcus and other pathogens // Obstet. Gynecol. 2002. №100(3). pp. 525-533.
11. Mackeen A.D., Packard R.E., Ota E., Speer L. Antibiotic regimens for postpartum endometritis // Cochrane Database Syst. Rev. 2015. №2(2). CD 001067.
12. Mohamed I.A., Mohamed A.A. and Rabie A. Puerperal Sepsis in a Rural Hospital in Sudan // Mater Sociomed. 2013. №25(1). pp. 19-22.
13. Dermendjiev T., Pehlivanov B., Hadjieva K., Stanev S. Epidemiological, clinical and microbiological findings in women with aerobic vaginitis // Akush.Ginecol (Sofia). 2015. №54(9). pp. 4-8.
14. Tibaldi C., Cappello N., Latino M.A. et al. Matrynal risk factors for abnormal vaginal flora during pregnancy // Int.J. Gynecol. Obstet. 2016. №133(1). pp. 89-93.
Tibaldi C., Cappello N., Latino M.A. et al. Matrynal risk factors for abnormal vaginal flora during pregnancy // Int.J. Gynecol. Obstet. 2016. №133(1). pp. 89-93.
15. Thinkhamrob J., Hofmeyr G.J., Adetoro O et al. Antibiotic prophilaxis during the second and third trimester to reduce adverse pregnancy outcomes and morbidity // Cochrane Database Syst. Rev. 2015. 1CD002250. DOI :10.1002/14651858.CD0022
16. Farret T.C., Dalle J., Monteiro vda S. Et al. Risk factors for surgical site infection following cesarean section in a Brazilian Women’s Hospital a case-control study // Brazilian Journal of Infectious Diseases. 2015. Mar.-Apr. 19(2). pp. 113-117. DOI:101016/J.bjid.201409.009
References:
1. Chaim W., Burstein E. Postpartum infection treatments: a review // Expert Opin.Pharmacother. 2003. №4. pp.1297-1313
2003. №4. pp.1297-1313
2. Ronghua L., Lin L., Dujuan Wand. Antimicrobial prophylaxis in caesarean section delivery // Exp.Ther.MED. 2016. №12(2). pp. 961-964
3. Ridley N. Perineal wound infections: an audit // Pract.Midwife. 2015. №18(7). pp. 28-32.
4. Clardy P. Reardon Ch.C. Critical illness during pregnancy and the perpartum period. Official reprint from UpToDate. URL: www.uptodate.com.
5. Ovalle A., Martinez M.A., Fuentes A. et al. Obesity, a risk factor for ascending bacterial infection during pregnancy // Rev. Med. Chil. 2016. №144 (4). pp. 476-482.
6. Truhina S.I., Cirkin V.l., Truhin A.N., Hlybova S.V. Vlijanie massy tela pri rozhdenii na fizicheskoe razvitie i uspeshnost obucheneija detej i podrostkov // Vjatskij medicinskij vestnik, vypusk zhurnala. 2012. №1. S.39-49.
2012. №1. S.39-49.
7. Newton E.R., Wallace P.A. Effects of prophylactic antibiotics on endometrial flora in women with postcaesarean endometritis // Obstet. Gynecol. 1998. №92. pp. 262-268.
8. Shopova E. The sensitivity to antibacterial preparations of enterococcial strains isolated from gynaecological patients, pregnant women, puerperae and newborn unfants // Akusg, Ginecol. 1995. №34(3). pp. 32-34.
9. Saez-Lopez E., Guiral E., Fernandez D. Et al. Vaginal versus Obstetric Infection Escherichia coli isolates among Pregnant Women: Antimicrobial Resistance and Genetic Virulence Profile // PloSOne. 2016. 11(1). e0146531. DOI:10.1371 /journal.pone.0146531
10. Spaetgens R., DeBella K., Ma D. et al.. Perinatal antibiotic usage and changes in colonization and resistance rates of group B streptococcus and other pathogens // Obstet. Gynecol. 2002. №100(3). pp. 525-533.
Gynecol. 2002. №100(3). pp. 525-533.
11. Mackeen A.D., Packard R.E., Ota E., Speer L. Antibiotic regimens for postpartum endometritis // Cochrane Database Syst. Rev. 2015. №2(2). CD 001067.
12. Mohamed I.A., Mohamed A.A. and Rabie A. Puerperal Sepsis in a Rural Hospital in Sudan // Mater Sociomed. 2013. №25(1). pp. 19-22.
13. Dermendjiev T., Pehlivanov B., Hadjieva K., Stanev S. Epidemiological, clinical and microbiological findings in women with aerobic vaginitis // Akush.Ginecol (Sofia). 2015. №54(9). pp. 4-8.
14. Tibaldi C., Cappello N., Latino M.A. et al. Matrynal risk factors for abnormal vaginal flora during pregnancy // Int.J. Gynecol. Obstet. 2016. №133(1). pp. 89-93.
15. Thinkhamrob J., Hofmeyr G.J., Adetoro O et al. Antibiotic prophilaxis during the second and third trimester to reduce adverse pregnancy outcomes and morbidity // Cochrane Database Syst. Rev. 2015. 1CD002250. DOI :10.1002/14651858.CD0022
Antibiotic prophilaxis during the second and third trimester to reduce adverse pregnancy outcomes and morbidity // Cochrane Database Syst. Rev. 2015. 1CD002250. DOI :10.1002/14651858.CD0022
16. Farret T.C., Dalle J., Monteiro vda S. Et al. Risk factors for surgical site infection following cesarean section in a Brazilian Women’s Hospital a case-control study // Brazilian Journal of Infectious Diseases. 2015. Mar.-Apr. 19(2). pp. 113-117. DOI:101016/J.bjid.201409.009
— • —
№ 12. — 2016
Сведения об авторах
Доктор Теодор Гарнизов, доктор медицинских наук, заведующий сектором, председатель Комитета по вопросам последипломного образования, Университетская больница «Дом матери» Медицинского университета Софии (София, Болгария).
Доктор Асен Николов, доктор медицинских наук, профессор, руководитель Родильной клиники, Заведующий стационарным блоком в Университетской больнице «Дом матери» Медицинского университета Софии; заведующий кафедрой акушерства и гинекологии, Медицинский университет Софии (София, Болгария).
Доктор Виктор Златков, доктор медицинских наук, профессор, ректор, Медицинский университет Софии (София, Болгария).
— • —
Фемофлор — 16 [реал-тайм ПЦР]
Фемофлор 16 – расширенное молекулярно-биологическое исследование качественного и количественного состава микрофлоры мочеполовых путей у женщин, включающее оценку общей бактериальной массы, состояния нормофлоры, определение широкого спектра клинически значимых условно-патогенных микроорганизмов, в том числе микоплазм и уреаплазм, а также грибов рода Candida.
Исследование информативно только для женщин репродуктивного возраста.
Синонимы русские
Исследование биоценоза влагалища методом ПЦР.
Синонимы английские
Femoflor 16 Real Time PCR.
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Соскоб урогенитальный.
Как правильно подготовиться к исследованию?
- Исследование (процедуру взятия урогенитального мазка) рекомендуется производить до менструации или через 2-3 дня после её окончания.
Общая информация об исследовании
По данным проекта Human Microbiom Project Национального института здоровья США, установлено, что в организме человека обитает около 10 000 видов микроорганизмов, преимущественными локусами распространения которых являются кожа, кишечник и урогенитальный тракт. Микрофлора мочеполовых путей у женщин в норме представлена преимущественно различными видами бактерий рода Lactobacillus, которые играют большую роль в предотвращении колонизации урогенитального тракта болезнетворными микроорганизмами. Вследствие различных причин может возникать дисбаланс микробиоты мочеполового тракта, выражающийся в нарушении её количественных и качественных характеристик, что в итоге приводит к развитию воспалительного процесса. Рядом исследований показано, что в этиологической структуре мочеполовых инфекций, обусловленных дисбалансом условно-патогенной флоры, в большинстве случаев играет роль ассоциация микроорганизмов и изменения в составе нормофлоры. Клинически такие состояния очень часто характеризуются нечеткой выраженностью симптомов, отсутствием специфических признаков и склонностью к хроническому течению, что обуславливает высокий риск присоединения инфекций, вызванных патогенными микроорганизмами, а также развития осложнений со стороны репродуктивной системы.
Микрофлора мочеполовых путей у женщин в норме представлена преимущественно различными видами бактерий рода Lactobacillus, которые играют большую роль в предотвращении колонизации урогенитального тракта болезнетворными микроорганизмами. Вследствие различных причин может возникать дисбаланс микробиоты мочеполового тракта, выражающийся в нарушении её количественных и качественных характеристик, что в итоге приводит к развитию воспалительного процесса. Рядом исследований показано, что в этиологической структуре мочеполовых инфекций, обусловленных дисбалансом условно-патогенной флоры, в большинстве случаев играет роль ассоциация микроорганизмов и изменения в составе нормофлоры. Клинически такие состояния очень часто характеризуются нечеткой выраженностью симптомов, отсутствием специфических признаков и склонностью к хроническому течению, что обуславливает высокий риск присоединения инфекций, вызванных патогенными микроорганизмами, а также развития осложнений со стороны репродуктивной системы. Это определяет первостепенную роль своевременной и качественной диагностики урогенитальных инфекций, ассоциированных с условно-патогенной микрофлорой. Традиционные лабораторные исследования, проводимые для обнаружения болезнетворных микроорганизмов, которые позволяют определить факт наличия возбудителя, малоинформативны в диагностике заболеваний, вызванных условно-патогенной флорой, так как обнаружение её представителей само по себе не свидетельствует о заболевании. Также необходимо отметить, что условно-патогенная микрофлора, наиболее часто являющаяся причиной воспалительных заболеваний мочеполовых путей у женщин, представлена преимущественно анаэробными микроорганизмами (живущими в условиях отсутствия кислорода). Культивирование таких бактерий является технически очень сложным процессом, требующим специального оборудования, и в настоящее время в большинстве лечебных учреждений затруднено.
Это определяет первостепенную роль своевременной и качественной диагностики урогенитальных инфекций, ассоциированных с условно-патогенной микрофлорой. Традиционные лабораторные исследования, проводимые для обнаружения болезнетворных микроорганизмов, которые позволяют определить факт наличия возбудителя, малоинформативны в диагностике заболеваний, вызванных условно-патогенной флорой, так как обнаружение её представителей само по себе не свидетельствует о заболевании. Также необходимо отметить, что условно-патогенная микрофлора, наиболее часто являющаяся причиной воспалительных заболеваний мочеполовых путей у женщин, представлена преимущественно анаэробными микроорганизмами (живущими в условиях отсутствия кислорода). Культивирование таких бактерий является технически очень сложным процессом, требующим специального оборудования, и в настоящее время в большинстве лечебных учреждений затруднено.
Проблему качественной диагностики урогенитальных инфекций, вызванных условно-патогенной флорой, позволило решить внедрение в практику метода полимеразной цепной реакции с детекцией результатов в режиме реального времени. Методика исследования основана на обнаружении в исследуемом материале генетического материала (ДНК) микроорганизма, его многочисленном копировании и идентификации. Так как количество полученных в конце реакции копий зависит от исходного количества исследуемой ДНК, анализ позволяет определить содержание микроорганизма в биоматериале. Отечественная разработка Фемофлор, основанная на технологии RT-ПЦР, предназначена для исследования биоценоза урогенитального тракта у женщин и позволяет выявлять ДНК условно-патогенных микроорганизмов, ДНК лактобактерий и геномной ДНК человека (в качестве контрольного параметра). Спектр выявляемых показателей позволяет получить комплексное представление о качественных и количественных изменениях состава микрофлоры урогенитального тракта, что во многом определяет адекватную тактику медикаментозной терапии. Разработано несколько вариантов комплектации тестовых систем Фемофлор, в зависимости от спектра выявляемых условно-патогенных микроорганизмов. Фемофлор 16 позволяет определять 25 показателей, включая контроль взятия материала, общую бактериальную массу и 23 группы микроорганизмов:
Методика исследования основана на обнаружении в исследуемом материале генетического материала (ДНК) микроорганизма, его многочисленном копировании и идентификации. Так как количество полученных в конце реакции копий зависит от исходного количества исследуемой ДНК, анализ позволяет определить содержание микроорганизма в биоматериале. Отечественная разработка Фемофлор, основанная на технологии RT-ПЦР, предназначена для исследования биоценоза урогенитального тракта у женщин и позволяет выявлять ДНК условно-патогенных микроорганизмов, ДНК лактобактерий и геномной ДНК человека (в качестве контрольного параметра). Спектр выявляемых показателей позволяет получить комплексное представление о качественных и количественных изменениях состава микрофлоры урогенитального тракта, что во многом определяет адекватную тактику медикаментозной терапии. Разработано несколько вариантов комплектации тестовых систем Фемофлор, в зависимости от спектра выявляемых условно-патогенных микроорганизмов. Фемофлор 16 позволяет определять 25 показателей, включая контроль взятия материала, общую бактериальную массу и 23 группы микроорганизмов:
-
Lactobacillus spp.
 – в большинстве случаев составляют основу нормальной микрофлоры влагалища у женщин репродуктивного возраста;
– в большинстве случаев составляют основу нормальной микрофлоры влагалища у женщин репродуктивного возраста; -
Семейство Enterobacteriaceae, Streptococcus spp., Staphylococcus spp. – являются компонентами нормальной флоры урогенитального тракта у женщин, могут быть причиной вагинита;
-
Gardnerella vaginalis, Prevotella bivia, Porphyromonas spp. – представители нормальной и транзиторной (Gardnerella vaginalis) флоры, этиологические агенты развития бактериального вагиноза;
-
Eubacterium spp. – бактерии этого семейства преимущественно обитают в кишечнике, условно патогенны, могут вызывать развитие бактериального вагиноза;
-
Sneathia spp.
 , Leptotrihia spp., Fusobacterium spp. – анаэробные микроорганизмы, с ними может быть ассоциировано развитие бактериального вагиноза;
, Leptotrihia spp., Fusobacterium spp. – анаэробные микроорганизмы, с ними может быть ассоциировано развитие бактериального вагиноза; -
Veilonella spp., Megasphaera spp., Dialister spp. – условно-патогенные анаэробные бактерии, участвуют в развитии бактериального вагиноза;
-
Lachnobacterium spp. – анаэробные труднокультивируемые бактерии, ассоциированы с развитием бактериального вагиноза;
-
Clostridium spp. – представитель нормальной флоры кишечника, в урогенитальном тракте условно-патогенный микроорганизм, может вызывать бактериальный вагиноз;
-
Mobiluncus spp., Corynebacterium spp.
 – анаэробные условно-патогенные микроорганизмы, могут вызывать инфекции урогенитального тракта;
– анаэробные условно-патогенные микроорганизмы, могут вызывать инфекции урогенитального тракта; -
Peptostreptococcus spp. – анаэробные кокки (шаровидные бактерии), условно-патогенны, могут вызывать бактериальный вагиноз;
-
Atopobium vaginae – анаэробный микроорганизм, может приводить к бактериальному вагинозу;
-
Mycoplasma hominis, Ureaplasma (urealyticum + parvum) – условные патогены;
-
Candida spp. – аэробные грибы, условно-патогенные микроорганизмы;
-
Mycoplasma genitalium – патогенный микроорганизм, вызывает уретрит (воспаление мочеиспускательного канала).
Для чего используется исследование?
- Для оценки качественного и количественного состава микрофлоры урогенитального тракта при наличии клинических проявлений воспаления, плановой подготовке к гинекологическим операциям, обследовании перед планированием беременности, в том числе при использовании вспомогательных репродуктивных технологий.

Когда назначается исследование?
-
При наличии клинических или лабораторных признаков воспалительного процесса урогенитального тракта.
-
При планирующихся оперативных вмешательствах на органах малого таза с высоким риском развития инфекционных осложнений.
-
Диагностический поиск при наличии отягощенного акушерского анамнеза (невынашивание беременности, перинатальные потери, бесплодие).
-
Плановое обследование перед планированием беременности, при подготовке к процедуре экстракорпорального оплодотворения.
-
Мониторинг эффективности проводимой терапии, восстановления нормоценоза.
Что означают результаты?
КВМ – контроль взятия материала. Необходимым условием качественного ПЦР-исследования считается правильное взятие биоматериала. Показателем адекватности полученного образца является достаточное количество ДНК человека, которая в процессе реакции выделяется из клеток, выстилающих слизистую оболочку и попадающих в пробу при правильном взятии мазка. Показатель КВМ менее 104 свидетельствует о недостоверных результатах ПЦР, в таких случаях рекомендуется повторное взятие биоматериала.
Показатель КВМ менее 104 свидетельствует о недостоверных результатах ПЦР, в таких случаях рекомендуется повторное взятие биоматериала.
ОБМ (общая бактериальная масса) – общее количество бактерий, имеющихся в исследуемом образце. Снижение ОБМ ниже пороговых значений свидетельствует о недостаточном заселении данного локуса бактериями, в том числе вследствие антибиотикотерапии или гормональных нарушений.
Нормальная флора — Lactobacillus spp. — их абсолютное количество в норме практически не отличается от показателя общей бактериальной массы, так как лактобактерии являются ее главной составляющей. Относительный показатель лактобактерий высчитывается автоматически путем вычисления разницы десятичных логарифмов между абсолютным значением лактобактерий и ОБМ (например, для абсолютного показателя ОБМ 107 десятичный логарифм будет равен 7). Снижение относительного показателя лактобактерий отражает дисбаланс урогенитальной микрофлоры.
Оценка условно-патогенной флоры. Количество аэробных и анаэробных бактерий также оценивается в абсолютных и относительных показателях. Относительный показатель высчитывается по разнице между десятичными логарифмами микроорганизма или их группы и ОБМ. По уровню относительной величины определяется незначительное, умеренное и значительное повышение.
Оценка микоплазм, уреаплазм и грибов рода Candida проводится только по абсолютному показателю, при превышении определенного порога (103 для Candida, 104 для микоуреаплазм) аппарат фиксирует положительный результат.
Для более удобной интерпретации результатов исследования используется специальная цветовая маркировка:
-
контрольные показатели: белый – соответствие критериям, красный – несоответствие;
-
условно-патогенные микроорганизмы и дрожжеподобные грибы: белый – соответствие критериям нормы, желтый – умеренное отклонение, красный – выраженное отклонение от нормы;
-
нормальная флора (лактобациллы): зеленый – нормоценоз (соответствие критериям нормы), желтый – умеренный дисбиоз (умеренное отклонение от нормы), красный – выраженный дисбиоз;
-
патогенные микроорганизмы: белый – не обнаружены, красный – обнаружены.

По результатам исследования автоматически дается характеристика состояния микрофлоры: нормоценоз, умеренный или выраженный дисбаланс, который по этиологической структуре может быть анаэробным, аэробным и смешанным.
Скачать пример результата
Важные замечания
- Фемофлор 16 позволяет детально оценить состав микрофлоры, однако его желательно выполнять после исключения инфекций, вызванных патогенными микроорганизмами (Chlamydia trachomatis, Neisseria gohorrhoeae, Trichomonas vaginalis). Для уменьшения времени обследования возможно одновременное взятие биоматериала для обоих исследований.
Также рекомендуется
-
Микроскопическое исследование отделяемого мочеполовых органов женщин (микрофлора), 3 локализации
-
Исследование микробиоценоза влагалища с определением чувствительности к антибиотикам
-
Chlamydia trachomatis, ДНК [реал-тайм ПЦР]
-
Neisseria gonorrhoeae, ДНК [реал-тайм ПЦР]
-
Trichomonas vaginalis, ДНК [реал-тайм ПЦР]
-
Посев на анаэробную флору
-
Планирование беременности — здоровье партнеров (для женщин)
-
Планирование беременности — здоровье партнеров (для мужчин)
Кто назначает исследование?
Гинеколог, репродуктолог, врач общей практики.
Литература
- Е. В. Рыбина. Современные методы оценки микробиоценоза влагалища. Журнал акушерства и женских болезней, том LXIV, выпуск 1/2015. С. 53-66.
- Ю. С. Шишкова, Т. В. Становая, Л. Н. Бугрова, Е. Д. Графова, Т. А. Пономарева. Молекулярно-биологический анализ содержания лактобактерий во влагалище у женщин репродуктивного возраста. Вестник Челябинского государственного университета. 2013, №7 (298). С. 44-45.
- Инструкция по применению набора реагентов для исследования биоценоза урогенитального тракта у женщин методом ПЦР в режиме реального времени Фемофлор. ООО «ДНК-Технология», 2017.
- Е. Е. Баранова, Е. И. Батенева, И. С. Галкина, А. Е. Донников, В. В. Зорина, Л. В. Тумбинская, Г. Г. Шигорина. ПЦР в реальном времени: новые возможности технологии в решении репродуктивных проблем. Пособие для врачей. ООО «ДНК-Технология».
Анализ на Бактериальный посев отделяемого половых органов
При обнаружении роста нормальной или условно-патогенной флоры в низком титре и не имеющей диагностического значения определение чувствительности к антибиотикам/бактериофагам не проводится.
Данное исследование позволяет составить целостное представление о микрофлоре урогенитального тракта. Оно состоит из 3-х бактериологических посевов взятых из 3-х точек (уретра, цервикальный канал и влагалище). Бактериологический метод– это посев материала на питательные среды и выделение чистых культур микробов с их последующей идентификацией. При обнаружении патогенных микроорганизмов определяется чувствительность выделенных микроорганизмов к антибиотикам. При высеве патогенных микроорганизмов определяется чувствительность к антибиотикам, таким образом данный анализ позволяет подобрать самое сложное и точное лечение.
Мазок из уретры берут не ранее 3-4 ч после мочеиспускания и обязательно до начала антибактериальной терапии. Аккуратно ватным тампоном забирается материал со слизистой уретры и помещается в пробирку с транспортной средой, доставляемую в лабораторию.
Бактериальная флора уретры здорового человека имеет смешанный характер: основным видом уретральных сапрофитов является негемолитический коагулазонегативный стафилококк (Staph. Epidermidis) и коринобактерии (Согуnеbacterium). Этот вид стафилококка, обычно локализующийся в передней части уретры, не являясь патогенным, участвует в антимикробной защите слизистой оболочки, выделяя вещества, подавляющие рост патогенных микроорганизмов. К патогенным микроорганизмам, вызывающим инфекцию мочевых путей, относятся: стафилококки: золотистый (S.aureus), эпидермальный (S.epidermidis) в количестве более 10*7КОЕ/мл, сапрофитный (S.saprophyticus), энтерококки (Enterococcus), кишечная палочка (E.coli), цитобактер (Citrobacter), энтеробактер (Enterobacter), протей (Proteus vulgaris), дрожжевой грибок (Candida albicans). В выдаваемом результате, указывается преобладающая микрофлора, количество патогенных микроорганизмов и чувствительность к различным группам антибиотиков. Мазок из влагалища и цервикального канала берут в течение 24 часов после спринцевания, данная процедура уменьшает количество микроорганизмов для посева. В норме флора может содержать лактобактерии до 10*7, энтерококки до 10*2, кишечную палочку до 10*2, дрожжевой грибок до 10*2КОЕ/мл.
Epidermidis) и коринобактерии (Согуnеbacterium). Этот вид стафилококка, обычно локализующийся в передней части уретры, не являясь патогенным, участвует в антимикробной защите слизистой оболочки, выделяя вещества, подавляющие рост патогенных микроорганизмов. К патогенным микроорганизмам, вызывающим инфекцию мочевых путей, относятся: стафилококки: золотистый (S.aureus), эпидермальный (S.epidermidis) в количестве более 10*7КОЕ/мл, сапрофитный (S.saprophyticus), энтерококки (Enterococcus), кишечная палочка (E.coli), цитобактер (Citrobacter), энтеробактер (Enterobacter), протей (Proteus vulgaris), дрожжевой грибок (Candida albicans). В выдаваемом результате, указывается преобладающая микрофлора, количество патогенных микроорганизмов и чувствительность к различным группам антибиотиков. Мазок из влагалища и цервикального канала берут в течение 24 часов после спринцевания, данная процедура уменьшает количество микроорганизмов для посева. В норме флора может содержать лактобактерии до 10*7, энтерококки до 10*2, кишечную палочку до 10*2, дрожжевой грибок до 10*2КОЕ/мл. При посеве могут определяться патогенные штаммы стрептококка (S. agalactinаe, S. pyogenes), стафилококка (S. Aureus), повышенное количество кишечной палочки (E. Coli). Иногда во влагалище размножаются бактерии, которые не вызывают воспаление, но потенциально опасны такие как гарднереллы (Gardnerella vaginalis), вызывающие вагиноз. Ко всем выделенным патогенным штаммам производится подбор чувствительных антибиотиков.
При посеве могут определяться патогенные штаммы стрептококка (S. agalactinаe, S. pyogenes), стафилококка (S. Aureus), повышенное количество кишечной палочки (E. Coli). Иногда во влагалище размножаются бактерии, которые не вызывают воспаление, но потенциально опасны такие как гарднереллы (Gardnerella vaginalis), вызывающие вагиноз. Ко всем выделенным патогенным штаммам производится подбор чувствительных антибиотиков.
Не пить антибиотики без назначения врача и обязательно носить маски призывают медики жителей Камчатского края
11 декабря 2020
Врачи ковидных моногоспиталей просят камчатцев не заниматься самолечением и соблюдать рекомендации, разработанные Роспотребнадзором.
Несвоевременное обращение к специалистам – основная причина тяжести течения коронавирусной инфекции у многих пациентов, поступающих на лечение в моногоспитали. И это, по оценке специалистов, характерная черта второй волны распространения новой коронавирусной инфекции и основное отличие от первой.
Заведующий ковидным госпиталем Камчатской краевой больницы Алексей Шапорев рассказал о том, как вести себя во время пандемии. Он призвал камчатцев не бояться COVID-19, соблюдать рекомендации Роспотребнадзора и не заниматься самолечением.
«Пациенты занимаются самолечением и зачастую поступают к врачу уже в тяжелом состоянии или даже в состоянии крайней степени тяжести. В таком случае что-либо сделать в плане помощи сложно. При возникновении первых симптомов не нужно затягивать с визитом к специалисту, а своевременно обращаться за медпомощью и не заниматься самолечением. Вовремя начатое лечение – залог его успешности», – поделился мнением врач-пульмонолог, заведующий ковидным госпиталем Камчатской краевой больницы Алексей Шапорев.
Также специалисты настоятельно рекомендуют не использовать при первых признаках заболевания вирусной инфекцией антибиотики. Врачи напоминают, что антибиотик — это препарат, который действует на бактерии. Вирусы не относятся к бактериальной флоре. Вирусы и бактерии — это абсолютно разные микроорганизмы. Безусловно, антибиотики используются при лечении коронавирусной инфекции, но только в том случае, когда к вирусному течению присоединяется вторичная бактериальная флора. Решение по назначению антибиотиков принимает только врач.
Вирусы не относятся к бактериальной флоре. Вирусы и бактерии — это абсолютно разные микроорганизмы. Безусловно, антибиотики используются при лечении коронавирусной инфекции, но только в том случае, когда к вирусному течению присоединяется вторичная бактериальная флора. Решение по назначению антибиотиков принимает только врач.
На сегодня в Камчатском крае развёрнуты семь моногоспиталей для пациентов с коронавирусной инфекцией. Практически все койки заняты, но есть ещё резервы, которые будут развёрнуты в случае необходимости.
«Мы начали работать с 14 ноября 2020 года. Первоначально госпиталь был развернут на 100 коек, с 9 декабря мы развернули ещё 40. Но резерв для развёртывания дополнительных мест имеется. В случае необходимости в моногоспитале при краевой больнице могут быть развернуты дополнительные 40 коек. В первую волну коронавирусной инфекции госпиталь был развернут на 180 коек. Работали тогда в течение полутора месяцев, потом, к счастью, волна пошла на спад и не довелось работать при полной загрузке», – рассказал заместитель главного врача по медицинской части Камчатской краевой больницы Максим Артамонов.
Помимо обеспеченности местами в лечебных учреждениях, специализирующихся на борьбе с коронавирусной инфекцией, Камчатка полностью обеспечена медикаментами и оборудованием, отсутствие которых остро ощущалось в первую волну весной 2020 года.
«Вторая волна характеризуется тем, что медработники не только страны, но и Камчатского края встречают эту инфекцию во всеоружии. В достаточном количестве аппараты как неинвазивной вентиляции легких, так и инвазивной. Всего хватает. Лекарственные препараты сейчас тоже есть. Да, сначала были проблемы, но сейчас все препараты закуплены в полном объеме, и мы их используем очень активно», – добавил Алексей Шапорев.
Напомним, в Камчатском крае для лечения пациентов с коронавирусной инфекцией развернуты 720 коек в 7 моногоспиталях, оборудованных на базах медучреждений Петропавловска-Камчатского и Елизова.
Урогенитальный мазок на флору, без снимка (окраска по Граму, Романовскому-Гимзе)
Описание
Урогенитальный мазок на флору является первым методом оценки состояния здоровья мочеполовых путей у женщин и мужчин.
Мазок на флору проводят для выявления воспаления и общей характеристики микрофлоры.
Как проводится исследование мазка на флору?
Суть метода сводится к тому, что взятый биоматериал тонким слоем наносят на предметное стекло, высушивают, окрашивают специальными красителями, а затем исследуют с помощью светового микроскопа.
В лаборатории «ОВУМ» исследование урогенитальных мазков мужчин и женщин проводится на микроскопах высокого качества изображения, которые оснащены цифровыми камерами с системой вывода изображения на экран компьютера. Это позволяет проводить видеорегистрацию исследований, сохранять архив изображений. При желании пациента, вместе с результатом анализа может быть предоставлен снимок препарата.
Когда нужно сдать мазок на флору?
- При признаках воспалительных заболеваний половых органов у женщин: если имеются выделения из влагалища, зуд, жжение половых органов, неприятный запах, дискомфорт, болезненность при половых контактах, нарушено мочеиспускание.

- При признаках воспалительных заболеваний половых органов у мужчин: если имеются выделения из мочеиспускательного канала, дискомфорт, нарушено мочеиспускание, зуд, отек, высыпания, покраснения на головке полового члена, неприятный запах.
- Для профилактического обследования.
- При бесплодии.
- При планировании беременности, в том числе при подготовке к ЭКО.
- При планировании операций на органах малого таза и половых органах.
- Для контроля после проведенного лечения.
Какой материал берут для анализа?
Забор материала для исследования производится у женщин из 3-х отделов (влагалище, цервикальный канал, мочеиспускательный канал).
У мужчин исследуются мазки из мочеиспускательного канала, могут проводиться исследования секрета простаты и эякулята. Исследования разных биоматериалов увеличивают вероятность обнаружения патологического процесса и точно определяют его локализацию. Какой материал взять для анализа, выбирает лечащий врач.
Мазки берутся на 2 стекла – для разных окрасок. Одно окрашивается по Романовскому-Гимзе (для характеристики лейкоцитарной реакции и клеточного состава), другое по Граму (для характеристики микрофлоры).
Трактовку результата исследования проводит лечащий врач (акушер-гинеколог, уролог или дерматовенеролог), принимая во внимание данные осмотра, проявления заболевания и результаты всех дополнительных обследований. Врач определяет необходимость и вид лечения.
Что показывает мазок на флору?
- Наличие или отсутствие воспаления.
Проводится подсчет и оценка количества клеток воспаления — лейкоцитов.
- Клетки эпителия.
Определяется тип клеток эпителия, описываются внутриклеточные изменения: отклонения в соотношении ядра и цитоплазмы, изменения ядра (дистрофия, внутриядерные включения, многоядерность), изменения цитоплазмы (наличие вакуолей, включений в цитоплазме).
Оценивается наличие маркера бактериального вагиноза — «ключевых клеток» –поверхностных эпителиальных клеток, покрытыми Грам (-) мелкими коккобациллами.
- Качественный и количественный состав микрофлоры.
Могут обнаруживаться специфические возбудители половых инфекций (гонококк, трихомонады), элементы грибов, неспецифическая палочковая и кокковая флора.
Микрофлора характеризуется по отношению к окраске по Граму (относительно свойств и строения клеточной стенки).
По количеству микрофлоры различают небольшое количество (до 10), умеренное (до 100), большое (до 1000) и массивное (более 1000) количество микробных клеток в поле зрения.
Метод световой микроскопии позволяет определять лишь морфотипы бактерий (например, лактобацилл, мобилункуса, бифидобактерий, бактероидов и тд.), а не видовой состав микрофлоры, который дифференцируется только более чувствительными методами, например методом генодиагностики — полимеразной цепной реакцией (ПЦР) или культуральным исследованием – методом бактериального посева.
Чувствительность микроскопического исследования для диагностики ИППП недостаточна, зачастую возбудители заболеваний могут быть выявлены только при остром процессе, когда в биоматериале содержатся большие количества микроорганизма. В случае хронических инфекций и при небольших концентрациях возбудителя рекомендованы более чувствительные методы исследований, например, ПЦР-анализ, культуральное исследование.
В случае хронических инфекций и при небольших концентрациях возбудителя рекомендованы более чувствительные методы исследований, например, ПЦР-анализ, культуральное исследование.
Примеры заключений по результату анализа
Нормоценоз
Бактериальный вагиноз
Микотический вагинит
Бактериальный вагинит
Трихомониаз
Гонорея
Правила подготовки
Бронхит | Сибвита
Бронхит
Бронхит – воспалительное поражение слизистой оболочки бронхов в результате воздействия на организм различных вирусов, бактерий, внутриклеточных паразитов и вредных веществ (пыль, токсины, табачный дым и другое). Своевременная терапия позволяет преодолеть болезнь легко, без возникновения каких-либо осложнений.
Опасны осложнения бронхита – воспаление легких, легочная и сердечная недостаточность, бронхоэктазы. Если лечение проводится на должном уровне, то острое заболевание может пройти без последствий, поэтому очень важно своевременно посетить хорошего ЛОР-врача.
Если лечение проводится на должном уровне, то острое заболевание может пройти без последствий, поэтому очень важно своевременно посетить хорошего ЛОР-врача.
Острым называется бронхит, который продолжается менее трех недель; хроническим – если кашель даёт о себе знать в течение трех месяцев в году на протяжении двух и более лет. Одышка – затруднение выдоха, сопровождающая заболевание, указывает на обструктивный характер бронхита.
Причины развития бронхита
- Бактериальная флора — стафилококки, пневмококки, стрептококки.
- Вирусная флора — вирус гриппа, респираторная синцитиальная инфекция, аденовирус, парагрипп и т.д.
- Атипичная (по своим биологическим характеристикам занимающая промежуточное положение между бактериями и вирусами) флора – хламидии, микоплазмы.
- Грибковая инфекция – очень редко.
- Сочетание возбудителей – самый распространенный вариант. Например, изначально причиной является вирусная инфекция, которая открывает доступ для бактерий и создает им благоприятные условия для размножения.

В осенний и зимний периоды наблюдается резкое увеличение заболеваемости в связи с сезонным распространением вирусных инфекций. Ослабление иммунитета – еще одно условие развития бронхита.
Факторы риска:
- возраст старше пятидесяти лет;
- курение;
- злоупотребление алкоголем;
- работа на вредном производстве;
- частые переохлаждения;
- хронические заболевания внутренних органов.
Симптомы заболевания
Самым главным симптомом бронхита является кашель:
- сухой – без отхождения мокроты. Наблюдается при вирусной или атипичной инфекции;
- влажный — с отхождением мокроты. Если мокрота имеет зеленый оттенок, то это признак бактериального воспаления.
Чаще всего бывает переход от сухого кашля к влажному. При остром бронхите кашель обычно приступообразный.
Симптомы острого бронхита
- кашель;
- повышение температуры тела до 38-39 градусов;
- озноб;
- повышенная потливость;
- общая слабость;
- быстрая утомляемость;
- снижение работоспособности;
- хрипы и жесткое дыхание при прослушивании;
- одышка и боли в груди – при тяжелой форме болезни.

В среднем острый бронхит длится полторы-две недели. Обострение хронического бронхита, особенно при отсутствии надлежащего лечения может продолжаться до нескольких недель.
Симптомы хронического бронхита
- кашель с отхождением скудной мокроты слизисто-, слизисто-гнойного характера;
- одышка при физической нагрузке.
Лечение бронхита
Лечение бронхита, как острого, так и хронического, должен проводить специалист. Врач назначает план обследование и лечение. Очень важно не ошибиться с диагнозом и не принять за бронхит более серьезное заболевание (туберкулез легких, рак легкого, саркоидоз).
Телефон
Позвоните по телефону, мы ответим на любые вопросы, запишем вас на прием, а также проконсультируем по поводу заболеваний.
Запись на прием
Бактериальная флора — обзор
G Разрастание бактерий
Бактериальная флора кишечника собаки увеличивается от двенадцатиперстной к толстой кишке. Факторами, поддерживающими этот аборальный градиент, являются проходимость просвета, перистальтика кишечника, ограниченная доступность субстрата, различные бактериостатические / цидные выделения и интактный илеоцекоколический клапан. Нарушения этих механизмов контроля способствуют избыточному бактериальному росту в тонком кишечнике (СИБР). СИБР обычно является вторичным по отношению к другому болезненному процессу, но сообщается как о первичной идиопатической форме.Многие клиницисты предпочитают использовать термин антибиотик-зависимая диарея вместо идиопатический SIBO (German et al. , 2003). Тем не менее, избыточный бактериальный рост может препятствовать усвоению питательных веществ и жидкости за счет снижения активности ферментов микроворсинок, увеличения клеточной или межклеточной проницаемости, деконъюгирования желчных кислот и гидроксилирования жирных кислот.
Факторами, поддерживающими этот аборальный градиент, являются проходимость просвета, перистальтика кишечника, ограниченная доступность субстрата, различные бактериостатические / цидные выделения и интактный илеоцекоколический клапан. Нарушения этих механизмов контроля способствуют избыточному бактериальному росту в тонком кишечнике (СИБР). СИБР обычно является вторичным по отношению к другому болезненному процессу, но сообщается как о первичной идиопатической форме.Многие клиницисты предпочитают использовать термин антибиотик-зависимая диарея вместо идиопатический SIBO (German et al. , 2003). Тем не менее, избыточный бактериальный рост может препятствовать усвоению питательных веществ и жидкости за счет снижения активности ферментов микроворсинок, увеличения клеточной или межклеточной проницаемости, деконъюгирования желчных кислот и гидроксилирования жирных кислот.
Ряд заболеваний (Rutgers et al., 1988, 1993, 1995; Simpson et al . , 1990; Williams et al. ., 1987) необходимо исключить, прежде чем ставить диагноз идиопатического SIBO. Сюда входят внешнесекреторная недостаточность поджелудочной железы (EPI), частичная или полная кишечная непроходимость, застой кишечника, резекция илеоцекоколического клапана и заболевания слизистой оболочки кишечника, вызывающие мальабсорбцию (например, воспалительное заболевание кишечника от умеренной до тяжелой степени), лимфому и лимфангиэктазию. Собаки и кошки с частичной кишечной непроходимостью часто имеют в анамнезе хроническую диарею и потерю веса, которая поддается лечению антибиотиками (Batt et al., 1988). Большая часть литературы относится к немецким овчаркам (GSD) с субнормальным уровнем IgA (Delles и др. ., 1993, 1994; Willard и др. ., 1994a, 1994b). Сообщалось также о SIBO у гончих с нормальным уровнем IgA (Batt et al ., 1992).
, 1990; Williams et al. ., 1987) необходимо исключить, прежде чем ставить диагноз идиопатического SIBO. Сюда входят внешнесекреторная недостаточность поджелудочной железы (EPI), частичная или полная кишечная непроходимость, застой кишечника, резекция илеоцекоколического клапана и заболевания слизистой оболочки кишечника, вызывающие мальабсорбцию (например, воспалительное заболевание кишечника от умеренной до тяжелой степени), лимфому и лимфангиэктазию. Собаки и кошки с частичной кишечной непроходимостью часто имеют в анамнезе хроническую диарею и потерю веса, которая поддается лечению антибиотиками (Batt et al., 1988). Большая часть литературы относится к немецким овчаркам (GSD) с субнормальным уровнем IgA (Delles и др. ., 1993, 1994; Willard и др. ., 1994a, 1994b). Сообщалось также о SIBO у гончих с нормальным уровнем IgA (Batt et al ., 1992).
У собак общее количество бактерий превышает 10 5 колониеобразующих единиц на миллилитр (КОЕ / мл) проксимального отдела тощей кишки или двенадцатиперстной кишки, а количество анаэробных бактерий превышает ≥10 5 КОЕ / мл (Burrows и др. ., 1994). Культура сока двенадцатиперстной кишки считается золотым стандартом для определения количества бактерий ≥10 5 КОЕ / мл; это предположение было подвергнуто сомнению из-за вариабельности подсчетов в других отчетах, которые подробно описывают количество бактерий в двенадцатиперстной кишке в диапазоне от ≤10 2 до 10 7 КОЕ / мл; количество ≥10 КОЕ / мл у клинически здоровых GSD, биглей и борзых.
., 1994). Культура сока двенадцатиперстной кишки считается золотым стандартом для определения количества бактерий ≥10 5 КОЕ / мл; это предположение было подвергнуто сомнению из-за вариабельности подсчетов в других отчетах, которые подробно описывают количество бактерий в двенадцатиперстной кишке в диапазоне от ≤10 2 до 10 7 КОЕ / мл; количество ≥10 КОЕ / мл у клинически здоровых GSD, биглей и борзых.
У здоровых кошек в тонком кишечнике больше бактериальной флоры, чем у других видов (Johnston et al ., 1993), в числах, приближенных к таковым для СИБР у собак и людей. Количество бактерий ≥10 5 КОЕ / мл все чаще регистрируется у других пород с клиническими признаками потери веса, хронической диареи, урчания в животе, кишечных спазмов или рвоты без признаков кишечной непроходимости, EPI или тяжелых инфильтратов слизистой оболочки; клинические признаки часто поддаются лечению антибиотиками.
Всесторонний обзор литературы, включая вышеупомянутые исследования, проведенный Джонстоном (1999), опроверг существующий критерий для определения избыточного бактериального роста. Она пришла к выводу, что определение SIBO выше 10 пятых КОЕ / мл в двенадцатиперстной кишке или проксимальном отделе тощей кишки не подходит для собак и кошек. Кроме того, она считала, что в будущих исследованиях необходимо отделить пациентов с СИБР от пациентов с другими антибиотико-зависимыми энтеропатиями.
Она пришла к выводу, что определение SIBO выше 10 пятых КОЕ / мл в двенадцатиперстной кишке или проксимальном отделе тощей кишки не подходит для собак и кошек. Кроме того, она считала, что в будущих исследованиях необходимо отделить пациентов с СИБР от пациентов с другими антибиотико-зависимыми энтеропатиями.
У собак идиопатический СИБР может быть субклиническим или иметь хронические желудочно-кишечные симптомы. Хронический СИБР может вызвать воспалительное заболевание кишечника. Поражения состоят из атрофии ворсинок и инфильтрации лимфоцитов и плазмоцитов в собственной пластинке.Энтероциты мембраны щеточной каймы имеют существенное, но обратимое биохимическое повреждение (Batt and McLean, 1987). Аэробные бактерии, такие как энтерококки и Escherichia coli , вызывают избирательную потерю активности щелочной фосфатазы щеточной каймы и пероксисомальной каталазы, а также изменения, которые согласуются с разрушением митохондрий. Есть исключения, но аэробный избыточный рост типичен для собак, в отличие от анаэробного чрезмерного роста у людей. Считается, что большое количество цветков в кишечнике кошек предрасполагает их к определенным недостаткам питательных веществ, таким как дефицит таурина и кишечные расстройства, связанные с деконъюгированными солями желчных кислот (Johnston et al ., 1993).
Считается, что большое количество цветков в кишечнике кошек предрасполагает их к определенным недостаткам питательных веществ, таким как дефицит таурина и кишечные расстройства, связанные с деконъюгированными солями желчных кислот (Johnston et al ., 1993).
Культивирование и количественный анализ кишечной бактериальной флоры (Simpson et al ., 1990) являются окончательными средствами диагностики SIBO. Менее инвазивные методы диагностики включают определение уровней кобаламина / фолиевой кислоты в сыворотке крови, измерение содержания водорода в дыхании или кишечной проницаемости, а также анализ мочи на нитрозонафтол (Burrows et al. ., 1995; Simpson, 2005). Деконъюгация желчных кислот кишечной флорой с последующим непропорциональным увеличением неконъюгированных желчных кислот в кровотоке наблюдается у людей с избыточным бактериальным ростом (Einarsson et al ., 1992).
Лечение SIBO направлено на исправление основных структурных аномалий, лечение EPI и контроль аномальной флоры с помощью антибиотиков. Пациентам с ВЗК часто требуется лечение СИБР и инфильтрата слизистой оболочки. У собак с подозрением на идиопатический СИБР антибактериальная терапия обычно проводится в течение 28 дней. Подходящие антибиотики включают окситетрациклин (от 10 до 20 мг / кг 3 раза в день перорально), тилозин (10 мг / кг 3 раза в день перорально) или метронидазол (15 мг / кг 2 раза в день перорально). Добавление фруктоолигосахарида в рацион немецких овчарок с дефицитом IgA привело к снижению количества бактерий в просветной жидкости и ткани слизистой оболочки кишечника (Willard et al ., 1994а, 1994б). Инфильтрация плазматических клеток в ворсинки тощей кишки снижалась при кормлении различными источниками белка (Edwards et al ., 1995). Существуют также неофициальные данные, подтверждающие использование высокоперевариваемых диет с низким содержанием жиров, которые с меньшей вероятностью метаболизируются до гидроксижирных кислот и стимулируют секрецию толстой кишки.
Пациентам с ВЗК часто требуется лечение СИБР и инфильтрата слизистой оболочки. У собак с подозрением на идиопатический СИБР антибактериальная терапия обычно проводится в течение 28 дней. Подходящие антибиотики включают окситетрациклин (от 10 до 20 мг / кг 3 раза в день перорально), тилозин (10 мг / кг 3 раза в день перорально) или метронидазол (15 мг / кг 2 раза в день перорально). Добавление фруктоолигосахарида в рацион немецких овчарок с дефицитом IgA привело к снижению количества бактерий в просветной жидкости и ткани слизистой оболочки кишечника (Willard et al ., 1994а, 1994б). Инфильтрация плазматических клеток в ворсинки тощей кишки снижалась при кормлении различными источниками белка (Edwards et al ., 1995). Существуют также неофициальные данные, подтверждающие использование высокоперевариваемых диет с низким содержанием жиров, которые с меньшей вероятностью метаболизируются до гидроксижирных кислот и стимулируют секрецию толстой кишки.
Общий прогноз при идиопатическом СИБР является осторожным, и прогноз при вторичном СИБР зависит от основного заболевания. Многие животные с подозрением на идиопатический рецидив SIBO рецидивируют после прекращения приема антибиотиков и требуют дальнейших курсов или длительного лечения.
Многие животные с подозрением на идиопатический рецидив SIBO рецидивируют после прекращения приема антибиотиков и требуют дальнейших курсов или длительного лечения.
Определение нормальной бактериальной флоры полости рта
Ротовая полость состоит из множества поверхностей, каждая из которых покрыта множеством бактерий — пресловутой бактериальной биопленкой. Некоторые из этих бактерий причастны к заболеваниям полости рта, таким как кариес и пародонтит, которые являются одними из наиболее распространенных бактериальных инфекций у людей. Например, было подсчитано, что по крайней мере 35% взрослых людей с зубками в США в возрасте от 30 до 90 лет страдают пародонтитом (1). Кроме того, определенные виды бактерий полости рта были причастны к нескольким системным заболеваниям, таким как бактериальный эндокардит (4), аспирационная пневмония (26), остеомиелит у детей (8), недоношенность при рождении с низкой массой тела (6, 20) и сердечно-сосудистые заболевания ( 2, 34).На удивление мало что известно о микрофлоре здоровой полости рта.
Используя независимые от культуры молекулярные методы, мы ранее обнаружили более 500 видов или филотипов поддесневого налета у здоровых субъектов и субъектов с заболеваниями пародонта (21), язвенно-некротического пародонтита у субъектов с вирусом иммунодефицита человека (23), зубного налета в дети с обширным кариесом (3), номой (22) и на тыльной стороне языка субъектов с галитозом и без него (15).Другие исследователи использовали аналогичные методы для определения бактериального разнообразия слюны (25), поддесневого налета пациента с гингивитом (16) и зубочелюстных абсцессов (10, 29). Более половины обнаруженных видов еще не культивируются. Данные этих исследований указывают на причастность определенных видов или филотипов к различным заболеваниям и инфекциям полости рта, но по-прежнему имеется лишь ограниченная информация о видах, связанных со здоровьем. Недавно Mager et al. (19) продемонстрировали значительные различия в бактериальных профилях 40 видов, пригодных для культивирования в полости рта, на мягких и твердых тканях у здоровых субъектов.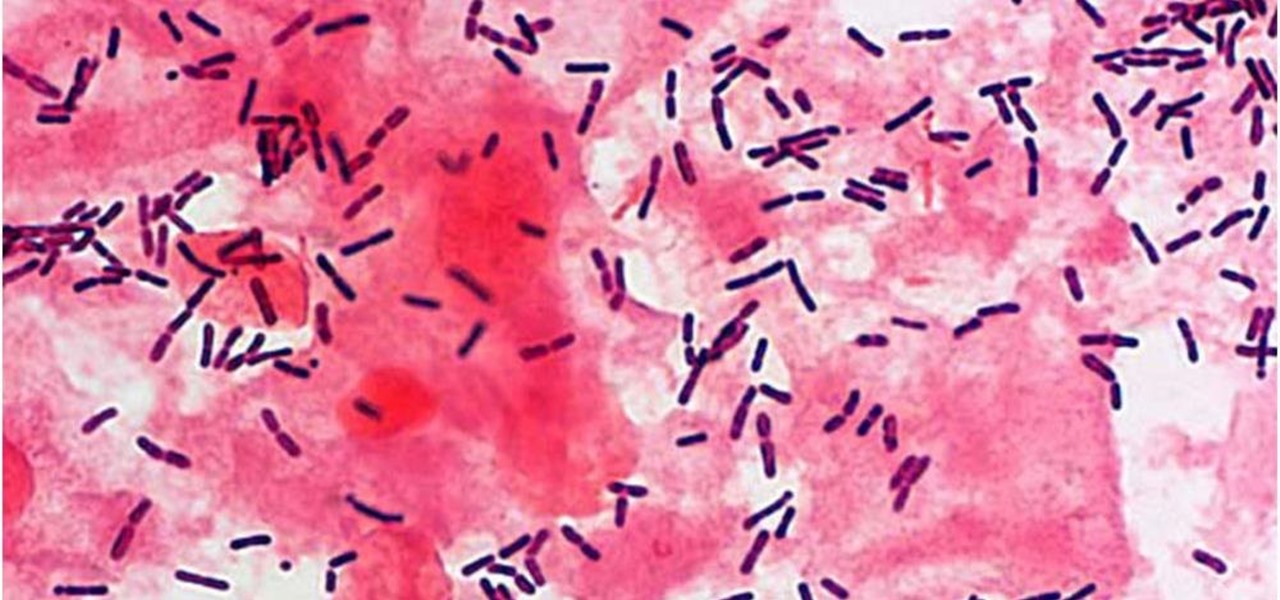 Они также обнаружили, что профили мягких тканей больше похожи друг на друга, чем профили наддесневых и поддесневых бляшек.
Они также обнаружили, что профили мягких тканей больше похожи друг на друга, чем профили наддесневых и поддесневых бляшек.
Нашими целями были следующие: (i) использовать независимые от культуры молекулярные методы для расширения наших знаний о широте бактериального разнообразия в здоровой ротовой полости человека, включая еще не культивируемые филотипы, и (ii) определить сайт и предметная специфичность бактериальной колонизации.
МАТЕРИАЛЫ И МЕТОДЫ
Тематика.В исследование были включены пять субъектов обоих полов в возрасте от 23 до 55 лет без клинических признаков заболевания слизистой оболочки полости рта. Субъекты не страдали серьезным неприятным запахом изо рта. Пародонт был здоровым, все пародонтальные карманы были менее 3 мм глубиной без покраснения или воспаления десен. У субъектов не было активных белых пятен или кариеса на зубах. Наши результаты согласуются с этими клиническими наблюдениями в том случае, если виды, которые обычно встречаются у пациентов с кариесом, не обнаруживаются (3). Испытуемые не принимали антибиотики в течение последних 6 месяцев.
Испытуемые не принимали антибиотики в течение последних 6 месяцев.
Сбор образцов. Для каждого субъекта были проанализированы образцы из следующих девяти участков: тыльная сторона языка, боковые стороны языка, щечная складка, твердое небо, мягкое небо, губная десна и миндалины поверхностей мягких тканей, а также наддесневые и поддесневые. бляшки с поверхностей зубов. Микробиологические образцы наддесневых и поддесневых бляшек были взяты с помощью стерильной кюретки Грейси. Другие образцы были собраны с помощью стерильных щеток для мазков.
Лизис образцов. Образцы пластинок непосредственно суспендировали в 50 мкл 50 мМ Трис-буфера (pH 7,6), 1 мМ EDTA, pH 8 и 0,5% Tween 20. Протеиназа K (200 мкг / мл; Roche Applied Science, Indianapolis, IN) был добавлен к смеси. Затем образцы нагревали при 55 ° C в течение 2 ч. Протеиназу К инактивировали нагреванием при 95 ° C в течение 5 мин. Обнаружение видов зависит от получения ДНК, которая может быть амплифицирована. Таким образом, трудно поддающиеся лизису бактерии не могут быть обнаружены. Однако, используя нашу технику лизиса, мы смогли обнаружить многие виды, трудно поддающиеся лизису, такие как виды Actinomyces и Streptococcus .
Амплификация генов 16S рРНК с помощью ПЦР и очистки продуктов ПЦР. Гены 16S рРНК амплифицировали в стандартизованных условиях с использованием универсального набора праймеров (прямой праймер, 5′-GAG AGT TTG ATY MTG GCT CAG-3 ‘; обратный праймер, 5’-GAA GGA GGT GWT CCA RCC GCA-3 ‘) (21). Праймеры были синтезированы коммерчески (Operon Technologies, Alameda, CA). Праймеры для ПЦР не обязательно включают все виды бактерий. Тем не менее, в этом исследовании и в наших предыдущих исследованиях был получен широкий спектр филогенетических типов с использованием этого универсального набора праймеров (3, 15, 21-23).ПЦР выполняли в тонкостенных пробирках с помощью системы GeneAmp PCR 9700 (ABI, Foster City, CA). Один микролитр лизированного образца добавляли к реакционной смеси (конечный объем, 50 мкл), содержащей 20 пмоль каждого праймера, 40 нмоль дезоксинуклеозидтрифосфатов и 1 ед. Полимеразы Platinum Taq (Invitrogen, San Diego, CA). В протоколе горячего старта образцы предварительно нагревали при 95 ° C в течение 4 мин с последующей амплификацией в следующих условиях: денатурация при 95 ° C в течение 45 с, отжиг при 60 ° C в течение 45 с и элонгация при 72 °. для 1.5 мин, с дополнительными 15 с на каждый цикл. Всего было выполнено 30 циклов; за этим следовала заключительная стадия удлинения при 72 ° C в течение 15 минут. Результаты ПЦР-амплификации исследовали электрофорезом в 1% -ном агарозном геле. ДНК окрашивали бромистым этидием и визуализировали в коротковолновом УФ-свете.
Процедуры клонирования. Клонирование ПЦР-амплифицированной ДНК выполняли с помощью набора для клонирования TOPO TA (Invitrogen) в соответствии с инструкциями производителя. Трансформацию проводили с использованием компетентных клеток Escherichia coli TOP10, предоставленных производителем.Затем трансформированные клетки высевали на чашки с агаром Луриа-Бертани, дополненным канамицином (50 мкг / мл), и планшеты инкубировали в течение ночи при 37 ° C. Каждую колонию помещали в 40 мкл 10 мМ Трис. Правильные размеры вставок определяли с помощью ПЦР с прямым праймером M13 (-20) и обратным праймером M13 (Invitrogen). Перед секвенированием фрагментов амплифицированные с помощью ПЦР фрагменты 16S рРНК очищали и концентрировали с помощью Microcon 100 (Amicon, Bedford, MA) с последующим использованием набора для очистки QIAquick PCR (QIAGEN, Valencia, CA).
Секвенирование гена 16S рРНК. Очищенные ПЦР-амплифицированные вставки 16S рРНК секвенировали с использованием набора для циклического секвенирования ABI Prism (набор для циклического секвенирования BigDye с ДНК-полимеразой Ampli Taq FS, GeneAmp PCR system 9700; ABI). Праймеры, используемые для секвенирования, были описаны ранее (21). Химический состав четверти красителя использовали с 80 мкМ праймерами и 1,5 мкл продукта ПЦР в конечном объеме 20 мкл. Цикл секвенирования выполняли с помощью системы GeneAmp PCR 9700 (ABI) с 25 циклами денатурации при 96 ° C в течение 10 с, отжига при 55 ° в течение 5 с и удлинения при 60 ° C в течение 4 мин.Реакции секвенирования проводили на секвенаторе ДНК ABI 3100 (ABI).
Секвенирование гена 16S рРНК и анализ данных нераспознанных вставок. Всего было проанализировано 2589 клонов со вставкой правильного размера примерно 1500 оснований. Количество секвенированных клонов на одного субъекта варьировалось от 42 до 69, в среднем 57,5 и стандартное отклонение 7,1. Сначала была получена последовательность из приблизительно 500 оснований для определения идентичности или приблизительного филогенетического положения.Полные последовательности примерно 1500 оснований были получены с использованием пяти-шести дополнительных праймеров для секвенирования (15) для тех видов, которые считались новыми. Для идентификации ближайших родственников последовательности нераспознанных вставок сравнивали с последовательностями 16S рРНК более 10 000 микроорганизмов в нашей базе данных и более 100 000 последовательностей в Ribosomal Database Project (7) и базах данных GenBank. Наше пороговое значение для дифференциации видов составляло 2%, или примерно 30 оснований для полной последовательности. Матрицы подобия были скорректированы на множественные изменения базы в отдельных положениях по методу Джукса и Кантора (13).Матрицы сходства были построены из выровненных последовательностей с использованием только тех положений последовательностей, для которых были доступны данные для 90% протестированных штаммов. Филогенетические деревья были построены методом объединения соседей Сайто и Неи (24). Для построения и рисования эволюционных деревьев использовался программный пакет TREECON для среды Microsoft Windows (28). Нам известно о потенциальном создании химерных молекул 16S рРНК, собранных во время ПЦР (18). Процент химерных вставок в библиотеках генов 16S рРНК составлял от 1 до 15%.Химерные последовательности были идентифицированы с использованием программы Chimera Check в проекте Ribosomal Database Project, путем древовидного анализа или анализа базовой сигнатуры. Была получена видовая идентификация химер, но последовательности не исследовались для филогенетического анализа.
Номера доступа нуклеотидных последовательностей. Полные последовательности гена 16S рРНК клонов, представляющих новые филотипы, определенные в этом исследовании, последовательности известных видов, о которых ранее не сообщалось, и опубликованные последовательности доступны для электронного поиска из баз данных нуклеотидных последовательностей EMBL, GenBank и DDBJ под инвентарными номерами, показанными на рис.С 1 по 9.
РИС. 1.
Бактериальные профили буккального эпителия здоровых людей. Распределение и уровни бактериальных видов / филотипов среди пяти субъектов показаны столбцами прямоугольников справа от дерева как не обнаруженные (пустая рамка), <15% от общего числа проанализированных клонов (заштрихованная рамка) или ≥ 15% от общего количества проанализированных клонов (затемненная рамка). 15% были выбраны произвольно. Предоставляются инвентарные номера GenBank. Маркерная полоса представляет собой 5% -ную разницу в нуклеотидных последовательностях.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Давно известно, что бактерии ротовой полости преимущественно колонизируют различные поверхности в полости рта в результате связывания специфических адгезинов на бактериальной поверхности с дополнительными специфическими рецепторами на данной поверхности полости рта (11, 12). Действительно, профили 40 культивируемых видов бактерий заметно различались на разных поверхностях мягких тканей полости рта, слюне, наддесневых и поддесневых бляшках здоровых субъектов (19). Целью этого исследования было определить преобладающую бактериальную флору здоровой полости рта путем выявления и сравнения культивируемых и еще не культивируемых видов бактерий на различных мягких тканях и над- и поддесневых бляшках.
На основании анализа 2589 клонов 16S рРНК, бактериальное разнообразие микрофлоры из девяти различных участков пяти клинически здоровых субъектов было поразительным — в общей сложности был обнаружен 141 различных бактериальных таксонов, представляющих шесть различных типов бактерий. Шесть типов включали Firmicutes (ранее называвшиеся грамположительными с низким содержанием G + C, такие как виды Streptococcus , Gemella , Eubacterium , Selenomonas , Veillonella и родственные им). , Actinobacteria (ранее называвшиеся грамположительными с высоким содержанием G + C, такие как виды Actinomyces , Atopobium , Rothia и родственные им), Proteobacteria (e.g., виды Neisseria , Eikenella , Campylobacter и родственные им), Bacteroidetes (например, виды Porphyromonas , Prevotella , Capnocytophaga и родственные ). Fusobacteria (например, виды Fusobacterium и Leptotrichia ) и тип TM7, для которых нет культивируемых представителей. Как было определено в наших предыдущих исследованиях с использованием независимых от культуры молекулярных методов (15, 21, 22), более 60% бактериальной флоры было представлено еще не культивированными филотипами.Тринадцать новых филотипов (см. Рис. 2–9) были идентифицированы впервые в этом исследовании. В сопоставимом продолжающемся исследовании кариеса постоянных зубов с использованием тех же методик мы обнаружили 224 вида при анализе 1275 клонов 16S рРНК, около 60% которых относятся к еще не культивируемым филотипам (JA Aas, SR Dardis, AL Griffen, LN Stokes, AM Lee, I. Olsen, FE Dewhirst, EJ Leys и BJ Paster. J. Dent. Res. 84: аннотация 2805, 2005). Следовательно, важно идентифицировать как культивируемую, так и еще не культивируемую бактериальную флору в данной среде, прежде чем мы сможем приписать связь со здоровьем или статусом болезни.Нет никаких доказательств того, что еще не выращенный сегмент менее важен, чем культивируемый сегмент.
РИС. 2.
Бактериальные профили переднего преддверия верхней челюсти здоровых людей. Распределение и уровни бактериальных видов / филотипов среди пяти субъектов показаны на рис. 1. Новые филотипы, идентифицированные в этом исследовании, выделены жирным шрифтом. Предоставляются инвентарные номера GenBank. Маркерная полоса представляет собой 5% -ную разницу в нуклеотидных последовательностях.
Бактериальные профили для каждого сайта, протестированного для каждого субъекта, показаны на девяти филогенетических деревьях (см.рис.С 1 по 9). На этих дендрограммах можно сразу наблюдать за распределением видов или филотипов бактерий у каждого субъекта. Например, ясно, что Streptococcus mitis , S. mitis bv. 2 и Gemella hemolysans являются преобладающими видами буккального эпителия (рис. 1). Каждый из этих видов был обнаружен у большинства или у всех субъектов и составлял ≥15% от общего числа исследованных клонов (рис. 1). Точно так же была исследована преобладающая бактериальная флора других восьми участков рта.В переднем преддверии верхней челюсти S. mitis , Granulicatella spp. И Gemella spp. преобладали (рис. 2). На спинке языка несколько видов Streptococcus , таких как S. mitis , Streptococcus australis , Streptococcus parasanguinis , Streptococcus salivarius , Streptococcus sp. clone FP015 и Streptococcus sp. clone FN051, Granulicatella adiacens и Veillonella spp.были преобладающими видами (рис. 3). На боковой поверхности языка (рис. 4) S. mitis , S. mitis bv. 2, Streptococcus sp. клон DP009, Streptococcus sp. clone FN051, S. australis , G. adiacens , G. hemolysans и Veillonella spp. преобладали. Интересно, что бактериальные профили спинки и боковой поверхности языка существенно различались. Например, S.mitis bv. 2 был хорошо представлен на боковой стороне языка, но не обнаруживался на спинке языка. Напротив, штамм 85-81 S.parasanguinis присутствовал на тыльной стороне языка, но отсутствовал на боковой стороне. Это неудивительно, поскольку известно, что эти поверхности различаются по ультраструктуре и функциям. Например, боковая сторона языка имеет гладкую некератинизированную поверхность, в отличие от спинной части языка, которая представляет собой ороговевшую, сильно папиллированную поверхность с большой площадью поверхности и лежащими под ней серозными железами.Эти анатомические различия, вероятно, влияют на экологию этих местообитаний и создают различия в микробной среде.
РИС. 3.
Бактериальные профили тыльной стороны языка здоровых людей. Распределение и уровни бактериальных видов / филотипов среди пяти субъектов показаны на рис. 1. Новые филотипы, идентифицированные в этом исследовании, выделены жирным шрифтом. Предоставляются инвентарные номера GenBank. Маркерная полоса представляет собой 5% -ную разницу в нуклеотидных последовательностях.
РИС. 4.
Бактериальные профили боковой поверхности языка здоровых людей.Распределение и уровни бактериальных видов / филотипов среди пяти субъектов показаны на рис. 1. Новые филотипы, идентифицированные в этом исследовании, выделены жирным шрифтом. Предоставляются инвентарные номера GenBank. Маркерная полоса представляет собой 5% -ную разницу в нуклеотидных последовательностях.
На твердом небе преобладающими видами бактерий были S. mitis , S. mitis biovar 2, Streptococcus sp. клон FN051, Streptococcus infantis , Granulicatella elegans , G.hemolysans и Neisseria subflava (рис.5). На мягком небе преобладали S. mitis , другие культивируемые и еще не культивируемые виды Streptococcus , G. adiacens и G. hemolysans (рис. 6). Бактериальная флора миндалин (рис. 7) была довольно разнообразной — у некоторых испытуемых было Prevotella и Porphyromonas spp. (субъекты 1 и 5), а у других было Firmicutes, видов (субъекты 2, 3 и 4).На поверхности зуба несколько видов Streptococcus , в том числе Streptococcus sp. clone EK048, S. sanguinis и S. gordonii , и Rothia dentocariosa , G. hemolysans , G. adiacens , Actinomyces sp. clone BL008 и Abiotrophia defctiva часто выявлялись (рис. 8). Наконец, в поддесневой бляшке часто обнаруживали несколько видов Streptococcus и Gemella (рис.9).
РИС. 5.
Бактериальные профили твердого неба здоровых людей. Распределение и уровни бактериальных видов / филотипов среди пяти субъектов показаны на рис. 1. Новые филотипы, идентифицированные в этом исследовании, выделены жирным шрифтом. Предоставляются инвентарные номера GenBank. Маркерная полоса представляет собой 5% -ную разницу в нуклеотидных последовательностях.
РИС. 6.
Бактериальные профили мягкого неба здоровых людей. Распределение и уровни бактериальных видов / филотипов среди пяти субъектов показаны на рис.1. Новые филотипы, выявленные в этом исследовании, выделены жирным шрифтом. Предоставляются инвентарные номера GenBank. Маркерная полоса представляет собой 5% -ную разницу в нуклеотидных последовательностях.
РИС. 7.
Бактериальные профили миндалин здоровых людей. Распределение и уровни бактериальных видов / филотипов среди пяти субъектов показаны на рис. 1. Новые филотипы, идентифицированные в этом исследовании, выделены жирным шрифтом. Предоставляются инвентарные номера GenBank. Маркерная полоса представляет собой 5% -ную разницу в нуклеотидных последовательностях.
РИС. 8.
Бактериальные профили поверхности зубов здоровых людей. Распределение и уровни бактериальных видов / филотипов среди пяти субъектов показаны на рис. 1. Новые филотипы, идентифицированные в этом исследовании, выделены жирным шрифтом. Предоставляются инвентарные номера GenBank. Маркерная полоса представляет собой 5% -ную разницу в нуклеотидных последовательностях.
РИС. 9.
Бактериальные профили поддесневого налета здоровых людей. Распределение и уровни бактериальных видов / филотипов среди пяти субъектов показаны на рис.1. Новые филотипы, выявленные в этом исследовании, выделены жирным шрифтом. Предоставляются инвентарные номера GenBank. Маркерная полоса представляет собой 5% -ную разницу в нуклеотидных последовательностях.
Количество культивируемых и еще не культивируемых видов, обнаруженных в каждом субъекте для каждого участка, также показано на рис. 1–9. Например, на рис. 1 только четыре вида ( S. mitis , S .mitis bv.2, A. defctiva и G. hemolysans ) были обнаружены на буккальном эпителии у субъекта 5.Для удобства количество видов бактерий, обнаруженных в каждом участке ротовой полости для каждого субъекта, суммировано в таблице 1. Неожиданно наибольшее количество различных видов было обнаружено на миндалинах у субъекта 1, при этом преобладали 28 видов; в совокупности на миндалинах было обнаружено 57 видов (таблица 1; рис. 7). Напротив, переднее преддверие верхней челюсти характеризовалось наименьшим разнообразием бактериальной флоры по сравнению с другими участками, среди субъектов было обнаружено всего от трех до девяти видов (таблица 1; рис.2). Часто задают вопрос, сколько видов бактерий присутствует в полости рта у одного человека. В последнем столбце таблицы 1 указано количество преобладающих видов у каждого здорового человека из всех девяти различных участков; таким образом, количество варьировалось от низкого (34) у субъекта 4 до максимального (72) у субъекта 3.
ТАБЛИЦА 1.
Количество преобладающих видов бактерий на каждый участок и субъект
Всего, культивируемых и еще не культивируемых видов Gemella , Granulicatella , Streptococcus и Veillonella обычно обнаруживались на большинстве участков. S. mitis был наиболее часто встречающимся видом практически на всех участках и у всех субъектов (рис. 1–9). У одного субъекта 79% идентифицированных клонов были S. mitis (данные не показаны на фигурах). Обратите внимание, что в этом исследовании S. mitis и Streptococcus pneumoniae были сгруппированы вместе. Некоторые члены группы mitis имеют более чем 99% сходства последовательностей 16S рРНК, хотя значения сходства ДНК-ДНК для всех хромосом оцениваются менее чем 60% (14).И S. mitis , и Streptococcus oralis были связаны с бактериальным эндокардитом, особенно у пациентов с протезами клапанов (9). Кроме того, в настоящее время они признаны частыми причинами инфекции у пациентов с ослабленным иммунитетом, особенно сразу после трансплантации тканей и у пациентов с нейтропеническим раком (30). G. adiacens , часто считающийся условно-патогенным микроорганизмом, также был обнаружен на всех участках здоровой полости рта. G. adiacens Сообщалось о изолятов бактериемии / сепсиса у пациентов с инфекционным эндокардитом / атеромой (33) и первичной бактериемии у пациентов с нейтропенической лихорадкой (33).Сообщается о высокой смертности от эндокардита от G. adiacens (5).
На рисунке 10 представлена общая информация об этом исследовании, а именно, что появляются новые бактериальные профили, которые помогают определить здоровую полость рта. Как уже обсуждалось, несколько видов, таких как S. mitis и G. adiacens , были обнаружены в большинстве или во всех участках ротовой полости, тогда как некоторые виды были весьма специфичными для участков. Например, R. dentocariosa , Actinomyces spp., S. sanguinis , S.gordonii и A. defctiva , по-видимому, преимущественно колонизировали зубы, тогда как S. salivarius был обнаружен в основном на тыльной стороне языка. Некоторые виды имели склонность к мягким тканям, например, S. sanguinis и S. australis не колонизировали зубы или поддесневую щель. S. intermediateus преимущественно колонизировал поддесневую бляшку у большинства субъектов, но не был обнаружен в большинстве других участков.С другой стороны, Neisseria spp. не были обнаружены в поддесневом налете, но присутствовали на большинстве других участков. Simonsiella muelleri колонизировала только твердое небо. Действительно, S. muelleri первоначально был выделен из твердого неба человека (32), хотя он был изолирован от новорожденного с зубной кистой и ранним прорезыванием зубов (31). Несколько видов Prevotella были обнаружены на большинстве участков, но только у одного или двух субъектов. Например, P.melaninogenica и Prevotella sp. clone BE073 были многочисленны в семи из девяти участков одного субъекта и спорадически обнаруживались у других субъектов (рис. 10). Prevotella sp. клон HF050 был обнаружен в переднем преддверии верхней челюсти у одного пациента, доминируя в бактериальной флоре как 44% клонов (рис. 2 и 10). Этот клон также был обнаружен в меньших пропорциях на мягком небе и миндалинах другого субъекта (рис. 6, 7 и 10).
РИС. 10.
Сайт-специфичность преобладающих видов бактерий в полости рта.Как правило, виды или филотипы бактерий отбирались на основе их обнаружения у нескольких субъектов для данного участка. Распределение видов бактерий в участках полости рта среди субъектов указано в столбцах прямоугольников справа от дерева следующим образом: не обнаружено ни у одного субъекта (пустое поле), <15% от общего числа проанализированных клонов (желтое поле), ≥15% от общего количества проанализированных клонов (зеленая рамка). Ограничение 15% для низкой и высокой численности было выбрано произвольно. Маркерная полоса представляет собой 10% -ную разницу в нуклеотидных последовательностях.
В заключение отметим, что в здоровой полости рта имеется особая бактериальная флора, которая отличается от флоры ротовой полости. Например, многие виды, специфически связанные с заболеваниями пародонта, такие как Porphyromonas gingivalis , Tannerella forsythia и Treponema denticola , не были обнаружены ни на одном из протестированных участков. Кроме того, обычно считается, что бактериальная флора вовлечена в кариес и глубокие полости дентина, представленная Streptococcus mutans , Lactobacillus spp., Bifidobacterium spp. И Atopobium spp., Не были обнаружены в над- и поддесневых бляшках клинически здоровых зубов. Более подробное описание видов бактерий, связанных с заболеваниями полости рта, обсуждается в другом месте (17). Как было отмечено в этом исследовании на здоровых субъектах, некоторые виды являются специфичными для одного или нескольких участков, в то время как другие виды зависят от конкретного объекта. До 60% обнаруженных видов в настоящее время непригодны для выращивания. В целом, предстоит открыть еще больше видов, хотя количество новых видов начинает достигать насыщения.
Как мы ранее утверждали (21), для тщательной оценки ассоциации конкретных видов или филотипов со здоровьем или заболеванием полости рта необходимо анализировать большее количество клинических образцов на уровни практически всех бактерий полости рта в хорошо контролируемых клинических условиях. исследования. Бактериальные комплексы, участвующие в пародонтозе, по определению Socransky et al. (27) были основаны на микробных анализах 185 субъектов, представляющих около 13000 образцов бляшек, с использованием ДНК-зондов для 40 культивируемых видов бактерий в тестах гибридизации в шахматном порядке.В настоящее время мы разрабатываем ДНК-зонды примерно для 500 известных видов бактерий и новых филотипов для использования в аналогичных исследованиях. Эти ДНК-зонды разрабатываются для использования в тесте гибридизации в шахматном порядке (3, 22, 23) и в форматах микрочипов ДНК (С. К. Бош, А. М. Ли, Б. Дж. Пастер и Ф. Э. Дьюхерст, J. Dent. Res. 83: аннотация 2263 , 2004). Нашей целью было сначала установить полное бактериальное разнообразие полости рта, а затем определить вариабельность и воспроизводимость с помощью микроматриц.Следовательно, будет относительно легко сравнить бактериальный состав статистически значимого количества образцов, чтобы более точно идентифицировать те виды, которые связаны со здоровьем и с заболеваниями полости рта из разных анатомических участков. Прежде чем мы сможем определить роль бактерий полости рта в развитии заболевания, необходимо сначала определить бактериальную флору здоровой полости рта.
22.11C: Бактериальная флора — Medicine LibreTexts
- Последнее обновление
- Сохранить как PDF
- Ключевые моменты
- Ключевые термины
- Бактериальная флора
- Бактерии и витамины
- Бактерии и антитела
Самая большая бактериальная экосистема в организме человека находится в толстой кишке, где она играет множество важных ролей .
Цели обучения
- Описать другие факторы кишечной / бактериальной флоры
Ключевые моменты
- Толстая кишка поглощает некоторые продукты, образованные бактериями, населяющими эту область, например, короткоцепочечные жирные кислоты, которые метаболизируются из непереваренных полисахаридов (клетчатки).
- К другим бактериальным продуктам ферментации непереваренного полисахарида относятся газы (газы), состоящие в основном из азота и диоксида углерода.
- Эти бактерии также производят большое количество витаминов, особенно витамин К и биотин (витамин B), для всасывания в кровь.
- Факторы, разрушающие популяцию микроорганизмов толстой кишки, включают антибиотики, стресс и паразитов.
Ключевые термины
- пассивная диффузия : Чистое перемещение материала из области высокой концентрации в область низкой концентрации без каких-либо затрат энергии.
- бактериальная флора : сообщество бактерий, которое существует на теле или в теле и имеет уникальные экологические отношения с хозяином.
- колит : воспаление толстой или толстой кишки.
Бактериальная флора
В толстой кишке обитает более 700 видов бактерий, выполняющих самые разные функции; это самая крупная бактериальная экосистема в организме человека. Толстый кишечник поглощает некоторые продукты, образованные бактериями, населяющими этот регион.
Например, непереваренные полисахариды (клетчатка) метаболизируются в короткоцепочечные жирные кислоты бактериями в толстой кишке, а затем абсорбируются путем пассивной диффузии.Бикарбонат, который выделяет толстый кишечник, помогает нейтрализовать повышенную кислотность, которая возникает в результате образования этих жирных кислот.
Бактерии и витамины
Бактериальная флора : Escherichia coli — один из многих видов бактерий, присутствующих в кишечнике человека.
Эти бактерии также производят большое количество витаминов, особенно витамин К и биотин (витамин B), для всасывания в кровь. Хотя этот источник витаминов, как правило, обеспечивает лишь небольшую часть суточной потребности, он вносит значительный вклад при низком потреблении витаминов с пищей.
Человек, который зависит только от усвоения витаминов, образованных бактериями в толстом кишечнике, может получить витаминный дефицит при лечении антибиотиками, которые подавляют другие виды бактерий, а также болезнетворные бактерии.
Другие бактериальные продукты включают газ (газы), который представляет собой смесь азота и диоксида углерода с небольшими количествами водорода, метана и сероводорода. Они образуются в результате бактериальной ферментации непереваренных полисахаридов.Нормальная флора также важна для развития определенных тканей, включая слепую кишку и лимфатические сосуды.
Бактерии и антитела
Бактериальная флора также участвует в производстве перекрестно-реактивных антител. Это антитела, вырабатываемые иммунной системой против нормальной флоры, которые также эффективны против родственных патогенов и предотвращают инфекцию или инвазию.
Наиболее распространенными бактериями являются бактероиды, которые участвуют в инициации колита и рака толстой кишки.Бифидобактерии также многочисленны, и их часто описывают как дружественные бактерии.
Слой слизи защищает толстую кишку от атак комменсальных бактерий толстой кишки. Некоторые факторы, нарушающие популяцию микроорганизмов в толстой кишке, включают антибиотики, стресс и паразиты.
Что такое вагинальная флора? Бактерии, обитающие во влагалище.
Флора влагалища — это бактерии, которые живут во влагалище. В нормальной микрофлоре влагалища преобладают различные виды лактобацилл.
Лактобациллы помогают сохранить здоровье влагалища, вырабатывая молочную кислоту, перекись водорода и другие вещества, подавляющие рост дрожжей и других нежелательных организмов. Они поддерживают уровень pH во влагалище около 4.
Эта умеренно кислая среда помогает защитить от инфекции. То же самое и с другими веществами, которые они производят. Эти бактерии являются важной частью здоровой экосистемы влагалища.
Portra / Getty Images
Почему важна флора влагалища
Отличительным признаком бактериального вагиноза (БВ) является нарушение нормальной микрофлоры влагалища и потеря лактобацилл.Это может быть неприятно не только само по себе. Это также может сделать женщину более восприимчивой к ВИЧ и другим инфекциям, передаваемым половым путем.
Бактериальный вагиноз на самом деле вызван чрезмерным ростом бактерий, которые обычно существуют в небольших количествах во влагалище. Когда популяция лактобацилл нарушается, эти бактерии вступают во владение. Взаимодействие с другими людьми
Бактерии, связанные с BV, образуют ряд летучих аминов. Эти химические вещества и вызывают характерный запах, связанный с BV.Этот запах имеет тенденцию усиливаться после секса, особенно после секса без предохранения, потому что амины становятся более пахнущими при более высоком pH, связанном со спермой.
Однако, несмотря на ассоциацию, BV не вызывается спермой. Фактически, наибольшее доказательство передачи бактериального вагиноза половым путем есть у лесбиянок.
Неясно, может ли БВ передаваться во время вагинального полового акта. БВ чаще всего диагностируется с помощью теста, называемого мокрым креплением.
Восстановление здоровой флоры влагалища
Одна из трудностей при лечении БВ и связанных с ним состояний, таких как дрожжевые инфекции, заключается в том, чтобы выяснить, как восстановить нормальную микрофлору влагалища.Иногда после лечения популяции бактерий возвращаются к нормальным размерам. В других случаях они этого не делают.
Чтобы помочь восстановить флору, в которой преобладают лактобациллы, ряд исследователей изучают пробиотические таблетки и суппозитории. Эти обработки будут содержать виды лактобацилл.
Есть надежда, что эти бактерии вырастут и заново заселят влагалище. На сегодняшний день результаты, хотя и предварительные, несколько положительны. Тем не менее, если они подтвердятся, пробиотики могут стать новым способом улучшить здоровье влагалища и восстановить здоровую микрофлору влагалища.Взаимодействие с другими людьми
Бактериальная флора рыб: обзор
Аллен Д.А., Остин Б., Колвелл Р.Р. (1983) Численная таксономия бактериальных изолятов, связанных с пресноводным промыслом. J Gen Microbiol 129: 2043–2062
Google ученый
Остин Б. (1982) Таксономия бактерий, выделенных из прибрежных морских рыбоводных хозяйств. J Appl Bacteriol 53: 253–268
Google ученый
Austin B (1983) Бактериальная микрофлора, связанная с прибрежным, морским рыбоводным хозяйством. J Mar Biol Ass UK 63: 585–592
Google ученый
Остин Б. (1985) Загрязнение антибиотиками от рыбоводных хозяйств: воздействие на водную микрофлору. Microbiol Sci 2: 113–117
PubMed
Google ученый
Остин Б., Аллен-Остин Д. (1985) Обзор: Бактериальные патогены рыб.J Appl Bacteriol 58: 483–506
PubMed
Google ученый
Остин Б., Аль-Захрани AMJ (1988) Влияние антимикробных соединений на микрофлору желудочно-кишечного тракта радужной форели, Salmo gairdneri Richardson. J Fish Biol 33: 1–14
Google ученый
Остин Б., Остин Д.А. (1987) Бактериальные патогены рыб: болезнь выращиваемых и диких рыб.Эллис Хорвуд, Лтд, Чичестер
Google ученый
Остин Б., Макинтош Д. (1988) Натуральные антибактериальные соединения на поверхности радужной форели, Salmo gairdneri Richardson. J Fish Dis 11: 275–277
Google ученый
Белл Г.Р., Хоскинс Г.Е., Ходжкисс В. (1971) Аспекты характеристики, идентификации и экологии бактериальной флоры, связанной с поверхностью инкубируемых в ручье яиц тихоокеанских лососей ( Oncorhynchus ).J Совет по рыболовству Канады 28: 1511–1525
Google ученый
Бурас Н., Дуэк Л., Нив С. (1985) Реакции рыб на микроорганизмы в сточных водах. Appl Environ Microbiol 50: 989–995.
PubMed
Google ученый
Cloete TE, Toerien DF, Pieterse AJH (1984) Бактериологическое качество воды и рыбы в прудовой системе для обработки стоков откормочных площадок крупного рогатого скота.Сельскохозяйственные отходы 9: 1–15.
Google ученый
Колвелл Р.Р. (1962) Бактериальная флора рыб Пьюджет-Саунд. J Appl Bacteriol 25: 147–158
Google ученый
Эллис А.Е. (1982) Различия между иммунными механизмами рыб и высших позвоночных. В: Робертс Р.Дж. (ред.) Микробные болезни рыб. Academic Press, Нью-Йорк, Лондон, стр. 1-29
Google ученый
Frerichs GN, Hendrie MS (1985) Бактерии, связанные с болезнями рыб. В: Collins CH, Grange JM (eds) Выделение и идентификация микроорганизмов, имеющих медицинское и ветеринарное значение. Academic Press, Орландо, Флорида, стр. 355–369
Google ученый
Гиллеспи NC, MacRae IC (1975) Бактериальная флора некоторых рыб Квинсленда и ее способность вызывать порчу. J Appl Bacteriol 39: 91–100
PubMed
Google ученый
Gilmour A, McCallum MF, Allan MC (1976) Исследование типов бактерий, встречающихся на коже и в кишечнике выращиваемой камбалы, Pleuronectes platessa . Аквакультура 7: 161–172
Google ученый
Horsley RW (1973) Бактериальная флора атлантического лосося ( Salmo salar L.) в связи с окружающей средой. J Appl Bacteriol 36: 377–386
PubMed
Google ученый
Lindsay GJH (1986) Значение хитинолитических ферментов и лизоцима в защите радужной форели ( Salmo gairdneri ). Аквакультура 51: 169–173
Google ученый
Макфарлейн Р.Д., Маклафлин Дж.Дж., Баллок Г.Л. (1986) Количественные и качественные исследования кишечной флоры полосатого окуня из устьевых и прибрежных морских сред. J Wildlife Dis 22: 344–348
Google ученый
Minami Z, Kajinta M, Hibino S (1972) Исследования по использованию петродрожжей в рационе пресноводных рыб. I. Распространение хитин-разлагающих бактерий в пищеварительном тракте. Bull Jap Soc Sci Fish 38: 1013–1019
Google ученый
Mudarris M, Austin B (1988) Количественные и качественные исследования бактериальной микрофлоры камбалы, Scophthalmus maximus L., жабры. J Fish Biol 32: 223–229
Google ученый
Munro ALS (1982) Патогенез бактериальных болезней рыб. В: Робертс Р.Дж. (ред.) Микробные болезни рыб. Academic Press, Лондон, стр. 131–149
Google ученый
Murray CK, Fletcher TC (1976) Иммуногистохимическая локализация лизоцима в тканях камбалы. J Fish Biol 9: 329–334
Google ученый
Newman JT, Jr, Cosenza BJ, Buck JD (1972) Аэробная микрофлора кишечника синей рыбы ( Pomatomus saltatrix ).J Совет по рыболовству Канады 29: 333–336
Google ученый
Ниеми М., Тайпалинен И. (1982) Фекальные индикаторные бактерии на рыбоводных фермах. Hydrobiologia 86: 171–175
Google ученый
Nieto TP, Toranzo AE, Barja JL (1984) Сравнение бактериальной флоры, связанной с молодью радужной форели, выращиваемой в двух разных инкубаториях на северо-западе Испании.Аквакультура 42: 193–206
Google ученый
Peleteiro MC, Richards RH (1985) Идентификация лимфоцитов в эпидермисе радужной форели, Salmo gairdneri Richardson. J Fish Dis 8: 161–172
Google ученый
Райс Т., Бак Д.Х., Горден Р.Н., Тазик П.П. (1984) Микробные патогены и паразиты человека в системе поликультуры животных отходов.Prog Fish-Cult 46: 230–238
Google ученый
Саката Т., Корееда Ю. (1986) Численное таксономическое исследование доминирующих бактерий, выделенных из кишечника тилапии. Bull Jap Soc Sci Fish 52: 1625–1634
Google ученый
Саката Т., Окабаяси Дж., Какимото Д. (1980) Вариации кишечной микрофлоры Tilapia , выращенных в пресной и морской воде.Bull Jap Soc Sci Fish 46: 313–317
Google ученый
Саката Т., Сугита Х., Мицуока Т., Какимото Д., Кадота Х. (1980) Выделение облигатных анаэробов из кишечных трактов пресноводных рыб. Бык Япончик Соци Фиш 46: 511
Google ученый
Саката Т, Сугита Х, Мицуока Т, Какимото Д., Кадота Х (1980) Выделение и распространение облигатных анаэробных бактерий из кишечника пресноводных рыб.Bull Jap Soc Sci Fish 46: 1249–1255
Google ученый
Sar N, Rosenberg E (1987) Бактерии кожи рыб: колониальная и клеточная гидрофобность. Microb Ecol 13: 193–202
Google ученый
Sera H, Ishida Y (1972) Бактериальная флора пищеварительного тракта морских рыб. III. Классификация изолированных бактерий. Bull Jap Soc Sci Fish 38: 853–858
Google ученый
Sera H, Ishida Y, Kadota H (1972) Бактериальная флора пищеварительного тракта морских рыб. IV. Влияние концентрации H + и желудочного сока на местные бактерии. Bull Jap Soc Sci Fish 38: 859–863
Google ученый
Шеван Дж. М. (1961) Микробиология морских рыб. В: Borgstrom G (ed) Fish as food, vol I. Academic Press, London, pp 487–560
Google ученый
Шеван Дж. М. (1971) Микробиология рыбы и рыбных продуктов — Отчет о ходе работы. J Appl Bacteriol 34: 299–315
PubMed
Google ученый
Simidu U, Kaneko E, Aiso K (1969) Микрофлора камбалы в свежем и хранящемся виде, Kareius bicoloratus . Bull Jap Soc Sci Fish 35: 77–82
Google ученый
Stickney RR, Shumway SE (1974) Возникновение активности целлюлазы в желудках рыб.J Fish Biol 6: 779–790
Google ученый
Sugita H, Ishida Y, Deguchi Y, Kadota H (1982) Бактериальная флора желудочно-кишечного тракта Tilapia nilotica адаптировалась в морской воде. Bull Jap Soc Sci Fish 48: 987–991 (на японском языке)
Google ученый
Sugita H, Oshima K, Tamura M, Deguchi Y (1983) Бактериальная флора в желудочно-кишечном тракте пресноводных рыб в реке.Bull Jap Soc Sci Fish 49: 1387–1395
Google ученый
Sugita H, Tsunohara M, Ohkoshi T., Deguchi Y (1988) Установление кишечной микрофлоры у развивающихся золотых рыбок ( Carassius auratus ) в прудах. Microb Ecol 15: 333–344
Google ученый
Sugita H, Ushioka S, Kihara D, Deguchi Y (1985) Изменения бактериального состава воды в резервуаре для выращивания карпа.Аквакультура 44: 243–247
Google ученый
Trust TJ (1975) Бактерии, связанные с жабрами лососевых рыб в пресной воде. J Appl Bacteriol 38: 225–233
PubMed
Google ученый
Trust TJ, Bull LM, Currie BR, Buckley JT (1979) Облигатные анаэробные бактерии в микрофлоре желудочно-кишечного тракта белого амура ( Ctenopharyngodon idella ), золотой рыбки ( Carassius auratus ) и Salmo gairdneri ).J Совет по рыболовству Канады 36: 1174–1179
Google ученый
Trust TJ, Sparrow RAH (1974) Бактериальная флора в пищеварительном тракте пресноводных лососевых рыб. Can J Microbiol 20: 1219–1228
PubMed
Google ученый
Yoshimizu M, Kamiyama K, Kimura T., Sakai M (1976) Исследования кишечной микрофлоры лососевых — IV. Микрофлора кишечника пресноводного лосося.Bull Jap Soc Sci Fish 42: 1281–1290 (на японском языке)
Google ученый
Йошимидзу М., Кимура Т., Сакаи М. (1976) Исследования кишечной микрофлоры лососевых — I. Кишечная микрофлора рыб, выращиваемых в пресной и морской воде. Bull Jap Soc Sci Fish 42: 91–99 (на японском языке)
Google ученый
Yoshimizu M, Kimura T, Sakai M (1976) Исследования кишечной микрофлоры лососевых — V.Микрофлора кишечника проходного лосося. Bull Jap Soc Sci Fish 42: 1291–1298 (на японском языке)
Google ученый
Йошимидзу М., Кимура Т., Сакаи М. (1980) Микрофлора эмбриона и мальков лососевых. Bull Jap Soc Sci Fish 48: 967–975
Google ученый
Микробиота кишечника (кишечная флора) | Inserm
Хроническое воспалительное заболевание кишечника (ВЗК) , такое как болезнь Крона и язвенный колит , связано с неправильной активацией иммунной системы кишечника.Его появление вызвано основными генетическими факторами и факторами окружающей среды (диета, возраст и т. Д.). В то же время улучшение симптомов у пациентов, получающих антибактериальную терапию, и разрешение воспалительных поражений кишечника у людей, стенка кишечника которых больше не контактирует с фекалиями (отведение фекалий), также указали на роль микробиоты.
Микробиота , несбалансированная с точки зрения провоспалительных и противовоспалительных видов бактерий и преобладающей природы определенных классов бактерий ( энтеробактерий, фузобактерий ) или редкой природы других видов ( клостридий) , Faecalibacterium ) были описаны у лиц, страдающих ВЗК.В настоящее время невозможно установить, является ли это причиной или следствием этих заболеваний, или определить, является ли дисбактериоз, стоящий за заболеванием, врожденным или результатом другого фактора окружающей среды (диета, лекарства и т. Д.). Была выдвинута привлекательная гипотеза: считается, что дисбактериоз развивается из-за влияния генетических факторов и факторов окружающей среды, но, по-видимому, играет роль в запуске, поддержании и степени тяжести воспаления, что приводит к порочному кругу.
Кроме того, среди десятков генов предрасположенности к ВЗК, идентифицированных в настоящее время, некоторые играют решающую роль в отношении микробиоты. Мутация гена NOD2 наиболее часто наблюдается у пациентов, страдающих болезнью Крона: этот ген кодирует рецептор врожденного иммунитета, ответственный за обнаружение компонента бактериальной стенки. После мутации он больше не может выполнять эту функцию или помогать сохранять кишечный барьер. Сообщалось о других мутациях, например, в отношении гена ATG16L1 , участвующего в аутофагии иммунных клеток в присутствии бактерий, или гена MUC2 , который играет роль в синтезе кишечной слизи.
Микробиота является одной из предпочтительных терапевтических мишеней при этих воспалительных заболеваниях. До сих пор первые клинические испытания пробиотиков или пребиотиков были безрезультатными. Однако ожидаются новые исследования, основанные на более рациональном выборе микроорганизмов или соединений для использования. В то же время некоторые команды пытаются создать генетически модифицированных пробиотиков , которые позволили бы имплантировать интересующий микроорганизм, придавая ему дополнительные свойства, такие как секреция иммуномодулирующих медиаторов.
Бактерии
Бактерии как союзники
Мы узнаем все больше и больше о преимуществах бактерий. Конечно, с помощью грибов бактерии играют жизненно важную роль в разрушении и переработке мертвых организмов. Здоровые внутренние ткани (например, кровь, мозг, мышцы и т. Д.) Не содержат микроорганизмов, но кожа и слизистые оболочки в нашем желудочно-кишечном тракте, наших дыхательных путях и мочеполовых путях контактируют с организмами в окружающей среде, и эти поверхности становятся колонизированными многими из этих видов бактерий.Эти бактерии, которые регулярно встречаются на определенном участке, называются «нормальной флорой». Нормальная флора человека состоит из> 200 видов бактерий. Их состав зависит от возраста, пола, стресса, питания и т. Д. В таблице ниже представлен частичный список некоторых наиболее распространенных бактерий, которые регулярно встречаются у людей и на них. Число плюсов указывает на их относительную численность. +/- указывает на то, что вид может присутствовать, а может и не присутствовать.
Источник: http://www.google.com / patents / WO2008049231A1? cl = en
Эта нормальная флора дает нам множество преимуществ, в том числе:
- Они предотвращают колонизацию болезнетворными микроорганизмами, конкурируя за прикрепление и питательные вещества.
- Некоторые из них синтезируют витамины, которые усваиваются организмом в качестве питательных веществ (например, K и B12).
- Некоторые производят вещества, подавляющие патогенные виды.
- Они стимулируют развитие определенных тканей, например толстая и лимфатическая ткани желудочно-кишечного тракта.
- Они стимулируют выработку перекрестно-реактивных антител. Поскольку нормальная флора ведет себя как антигены у животного, она индуцирует низкие уровни антител, которые перекрестно реагируют с аналогичными антигенами на патогены, предотвращая инфекцию или инвазию
Некоторые данные свидетельствуют о том, что ненадлежащее использование антибиотиков и предотвращение микробов путем дезинфекции самих себя и окружающей среды могут иметь неблагоприятные последствия для здоровья. Фактически, есть данные, позволяющие предположить, что чрезмерная дезинфекция у детей может увеличить риск аутоиммунных заболеваний, ожирения и астмы.Вот несколько интересных ссылок, которые дают некоторое представление об этой идее.
Блог NPR
Этот сайт дает прекрасное представление о многих преимуществах бактерий. Есть 8-минутный аудиофайл, который транслировался по NPR, и есть много других интересных ссылок.
http://www.npr.org/blogs/health/2013/07/22/203659797/staying-healthy-may-mean-learning-to-love-our-microbiomes
Кишечные бактерии могут влиять на наш мозг
Льюис Томас
Отрывок из книги Льюиса Томаса: «Жизнь клетки — заметки наблюдателя за биологией».»Bantam Books, 1974. стр.88-89.» Микробы «
Младенцы знают: немного грязи — на пользу
Из The New York Times: Личное здоровье: Джейн Э. Броуди, дата публикации: 26 января 2009 г.
Джонатан Эйзен: знакомьтесь со своими микробами
Это доклад на TED, в котором микробиолог Джонатан Эйзен обсуждает преимущества микробов и представляет некоторые идеи о том, как мы можем использовать микробы для улучшения здоровья человека. (14:23)
Экология болезней
Экология болезней — это статья Джима Роббинса из New York Times.Роббинс говорит:
«Если мы не сможем понять и позаботиться о мире природы, это может привести к выходу из строя этих систем и вернуться, чтобы преследовать нас способами, о которых мы мало знаем. Важным примером является развивающаяся модель инфекционного заболевания, которая показывает, что большинство эпидемии — СПИД, лихорадка Эбола, Западный Нил, атипичная пневмония, болезнь Лайма и сотни других, которые произошли за последние несколько десятилетий, — не происходят просто так. Они являются результатом того, что люди делают с природой.
Оказывается, болезнь — это во многом экологическая проблема.Шестьдесят процентов возникающих инфекционных заболеваний, поражающих людей, являются зоонозными — они происходят от животных. Причем более двух третей из них происходят из дикой природы ».
Грязь в нашем рационе
Это статья из New York Times от 20 июня 2012 года.

 Отсутствие клеток плоского эпителия может говорить об атрофии слизистой при дефиците женских половых гормонов.
Отсутствие клеток плоского эпителия может говорить об атрофии слизистой при дефиците женских половых гормонов.  Преимущественно гарднереллами. Наличие этих клеток свидетельствует о влагалищном дисбактериозе;
Преимущественно гарднереллами. Наличие этих клеток свидетельствует о влагалищном дисбактериозе; – в большинстве случаев составляют основу нормальной микрофлоры влагалища у женщин репродуктивного возраста;
– в большинстве случаев составляют основу нормальной микрофлоры влагалища у женщин репродуктивного возраста; , Leptotrihia spp., Fusobacterium spp. – анаэробные микроорганизмы, с ними может быть ассоциировано развитие бактериального вагиноза;
, Leptotrihia spp., Fusobacterium spp. – анаэробные микроорганизмы, с ними может быть ассоциировано развитие бактериального вагиноза; – анаэробные условно-патогенные микроорганизмы, могут вызывать инфекции урогенитального тракта;
– анаэробные условно-патогенные микроорганизмы, могут вызывать инфекции урогенитального тракта;