Фибрилляция предсердий > Клинические протоколы МЗ РК
3. длительность предсердного цикла (интервал между двумя возбуждениями предсердий), если определяется, обычно вариабелен и составляет300 в мин.)
I. ВВОДНАЯ ЧАСТЬ
Сокращения, используемые в протоколе:
EHRA European Heart Rhythm Association
NYHA New York Heart Association
ААП антиаритмические препараты
АВК антагонист витамина К
АВУ атриовентрикулярный узел
АГ артериальная гипертензия
АЛТ аланинаминотрансфераза
АС аортальный стеноз
АСТ аспартатаминотрансфераза
АТТ антитромботическая терапия
АЧТВ активированное частичное тромбопластиновое время
БРА блокаторы рецепторов ангиотензина
ВЭМ велоэргометрия
ГКС глюкокортикостероиды
ГЛЖ гипертрофия левого желудочка
ГМС голометаллический стент
ГЭРБ гастроэзофагеальнаярефлюксная болезнь
ДАТТ двойная антитромбоцитарная терапия
ИАПФ ингибиторы ангиотензин превращающего фермента
ИБС ишемическая болезнь сердца
КАГ коронарная ангиография
КТ компьютерная томография
МВ КФК МВ фракция креатинфосфокиназы
МНО международное нормализованное отношение
НМГ низкомолекулярный гепарин
НОАК новые пероральные антикоагулянты
НПВС нестероидные противовосполительные средства
НФГ нефракционированный гепарин
ОКС острый коронарный синдром
ОКСБПST острый коронарный синдром без подъема сегмента ST
ОКССПST острый коронарный синдром с подъемом сегмента ST
ОНМК острое нарушение мозгового кровообращения
ПОАК пероральные антикоагулянты
РЧА радиочастотная аблация
СД сахарный диабет
СКФ скорость клубочковой фильтрации
СН сердечная недостаточность
ССЗ сердечно-сосудистые заболевания
ТИА транзиторная ишемическая атака
ТТГ тиреотропный гормон
ТЭО тромбоэмболические осложнения
УЗИ ультразвуковое исследование
ФГДС фиброгастродуоденоскопия
ФП фибрилляция предсердий
ХЛВП холестерин липопротеидов высокой плотности
ХЛНП холестерин липопротеидов низкой плотности
ЧКВ чрескожное коронарное вмешательство
ЧП ЭхоКГ чреспищеводная эхокардиография
ЧПЭФИ чреспищеводное электрофизиологическое исследование
ЧСС частота сердечных сокращений
ЭКГ электрокардиография
Дата разработки протокола: 2014 год.
Категория пациентов: стационарные и амбулаторные пациенты.
Пользователи протокола: врачи-кардиологи, терапевты, врачи общей практики, врачи-аритмологи.
что это такое, причины, симптомы, лечение, прогноз
Фибрилляция предсердий (мерцательная аритмия) – это разновидность аритмии, которая характеризуется частыми, хаотичными подергиваниями мышечных волокон сердца.
Общая информация
Частота распространенности ФП по приблизительным подсчетам составляет 0,5-1% среди населения и с возрастом увеличивается. Популяционные исследования выявили, что распространенность заболевания составляет менее 1% у больных моложе 60 лет и более 6% у больных старше 60 лет. Распространенность с поправкой на возраст выше у мужчин.
Чаще всего ФП встречается у пациентов с хронической сердечной недостаточностью (СН) или клапанными пороками сердца, с увеличением выраженности симптомов этих заболеваний тяжесть ФП также возрастает.
Нормальный сердечный ритм
Частота сердечных сокращений (ЧСС или пульс) в норме составляет 60-100 ударов в минуту. Это означает, что Ваше сердце сокращается (бьется) в среднем около 100.000 раз в день!
Частота вашего сердцебиения контролируется электрическими импульсами, которые отвечают за сокращение сердца. Эти электрические импульсы рождаются в синоатриальном узле (этот узел также называется синусовым или СА), и обычно они постоянны и ритмичны.
Сердце состоит из двух верхних и двух нижних камер сердца (предсердий и желудочков). Когда предсердия сокращаются, кровь направляется в желудочки. Когда сокращаются желудочки, кровь выталкивается из сердца и направляется к органам нашего тела.
Ненормальный или патологический сердечный ритм
Иногда нормальный путь электрических импульсов нарушается. Синусовый узел может отправлять сигналы слишком быстро либо этих сигналов может быть слишком много.
А бывает, что электрические сигналы вместо прохождения по нормальному пути могут «закрутиться» внутри одной из камер сердца.
Результатом нарушения нормальной передачи электрических импульсов является быстрое или нерегулярное сердцебиение. Иногда это может ощущаться как трепетание, дрожание. Неправильное сокращение сердца называется аритмией.
Если Ваше сердце бьется хаотично, оно не может перекачивать кровь так же хорошо, как при регулярной его работе. Вы можете чувствовать дискомфорт и другие проявления фибрилляции предсердий, так как Ваши органы не получают через кровь кислород в должном объеме.
Фибрилляция
Частота сердечных сокращений при мерцательной аритмии достигает 350-600 в минуту. При длительном пароксизме мерцательной аритмии (превышающем 48 часов) увеличивается риск тромбообразования и ишемического инсульта. При постоянной форме мерцательной аритмии может наблюдаться резкое прогрессирование хронической недостаточности кровообращения.
Мерцательная аритмия является одним из наиболее частых вариантов нарушений ритма и составляет до 30% госпитализаций по поводу аритмий. Распространенность мерцательной аритмии увеличивается сообразно возрасту.
Классификация
По своим характеристикам наджелудочковые фибрилляции разделяются на пять форм: впервые выявленные, пароксизмальные, персистирующие, длительно персистирующие и постоянные. Также выделяются классы заболевания EHRA, с первого по четвертый.
Формы фибрилляции предсердий
Впервые выявленный эпизод ФП – впервые зарегистрированный эпизод приступа ФП, вне зависимости от того, сопровождался он какими-либо клиническими проявлениями или купировался самостоятельно.
Рецидивирующая ФП устанавливается при наличии у пациента 2-х или более приступов ФП.
Пароксизмальная форма ФП – приступы аритмии повторяются многократно, но купируются самостоятельно.
Персистирующая форма ФП – возникающие приступы аритмии продолжаются более 7 дней или купируются кардиоверсией (медикаментозной или электрической).
Длительно персистирующая (существующая) форма ФП может продолжаться более 12 мес, но предполаг
Фибрилляция предсердий — Доказательная медицина для всех
Фибрилляция предсердий
Фибрилляция предсердий (ФП, fibrillatio atriorum; син. мерцание предсердий) — аритмия сердца, характеризующаяся полной асинхронностью сокращений миофибрилл предсердий, проявляющейся прекращением их насосной функции.
мерцание предсердий) — аритмия сердца, характеризующаяся полной асинхронностью сокращений миофибрилл предсердий, проявляющейся прекращением их насосной функции.
Определение и классификация
Фибрилляция предсердий представляет собой суправентрикулярную тахиаритмию, характеризующуюся хаотической электрической активностью предсердий высокой частота (как правило, от 300 до 700 в минуту) и нерегулярным ритмом желудочков (при условии отсутствия полной АВ-блокады).
Классификация фибрилляции предсердий по электрокардиографическим и частотным признакам
- фибрилляция предсердий брадисистолическая форма (аритмия мерцательная брадисистолическая, a.fibrillaris bradysystolica; син. брадиаритмия мерцательная) — фибрилляция предсердий, протекающая с нормальной или сниженной частотой сердечных сокращений (реже 60 желудочковых сокращений в минуту) и отсутствием дефицита пульса.
- Фибрилляция предсердий тахисистолическая (Аритмия мерцательная тахисистолическая a.
 fibrillaris tachysystolica; син. тахиаритмия мерцательная) — фибрилляция предсердий, характеризующаяся учащением сердечных сокращений (более 100 в 1мин. в покое) и сопровождающаяся дефицитом пульса.
fibrillaris tachysystolica; син. тахиаритмия мерцательная) — фибрилляция предсердий, характеризующаяся учащением сердечных сокращений (более 100 в 1мин. в покое) и сопровождающаяся дефицитом пульса. - Фибрилляция предсердий нормосистолическая (Аритмия мерцательная эуритмическая a.fibrillaris eurhythmica) — при которой частота сокращений желудочков находится в нормальных для здорового человека пределах (60-100 в 1мин.).
Рис. 1. Фибрилляция предсердий. А. – нормосистолический вариант, Б. – тахисистолический вариант.В зависимости от уровня физической активности, степени эмоционального напряжения, а также под действием лекарственных препаратов и ряда других факторов, влияющих на функциональные характеристики АВ-узла, обычно наблюдаются обратимые переходы из одного варианта ФП в другой.
Классификация фибрилляции предсердий по характеру волн f
- Фибрилляция предсердий крупноволновая (Аритмия мерцательная крупно-волновая) — характеризующаяся наличием на ЭКГ сравнительно крупных и редких (300-500 в 1мин.
 ) зубцов мерцания предсердий; обычно наблюдается при пороках сердца с перегрузкой предсердий.
) зубцов мерцания предсердий; обычно наблюдается при пороках сердца с перегрузкой предсердий. - Фибрилляция предсердий мелковолновая (аритмия мерцательная мелковолновая) — характеризующаяся наличием на ЭКГ относительно мелких и частых (500-800 в 1мин.) волн мерцания предсердий; обычно наблюдается при кардиосклерозе.
Классификация ФП по длительности существования аритмии
По характеру течения и длительности аритмии выделяют 5 типов ФП: впервые выявленная, пароксизмальная, персистирующая, длительно персистирующая и постоянная или хроническая.
- Впервые выявленная фибрилляции предсердий — появившаяся впервые фибрилляция предсердий, вне зависимости от длительности аритмии или наличия и выраженности симптомов, связанных с ФП, или ее осложнений.
- Пароксизмальная форма фибрилляции предсердий — возвратная и самопрекращающаяся аритмия. Многие пациенты имеют частые симптомные пароксизмы ФП, обычно длящиеся 48 ч или менее, но менее 7 дней.
 В клинических исследованиях ФП определяется как эпизод, превышающий по длительности 30 с.
В клинических исследованиях ФП определяется как эпизод, превышающий по длительности 30 с. - Персистирующая форма фибрилляции предсердий продолжается более 7 дней (по соглашению экспертов) или купируется кардиоверсией (медикаментозной или электрической). Термин «персистирующая ФП» также предполагает стремление к восстановлению и поддержанию синусового ритма. Длительно персистирующие формы ФП могут продолжаться более 12 мес, но обозначаются как персистирующие, а не постоянные, если предполагается восстановление синусового ритма.
- Постоянная форма фибрилляции предсердий существует длительное время и определяется в случае приверженности к стратегии контроля частоты ритма, то есть наличие ФП «принимается». Вмешательства для восстановления ритма (например, антиаритмические препараты, кардиоверсия, катетерная абляция или хирургические вмешательства) не применяются у пациентов с постоянной ФП.
Обычно установлению постоянной формы предшествует период рецидивирования пароксизмов.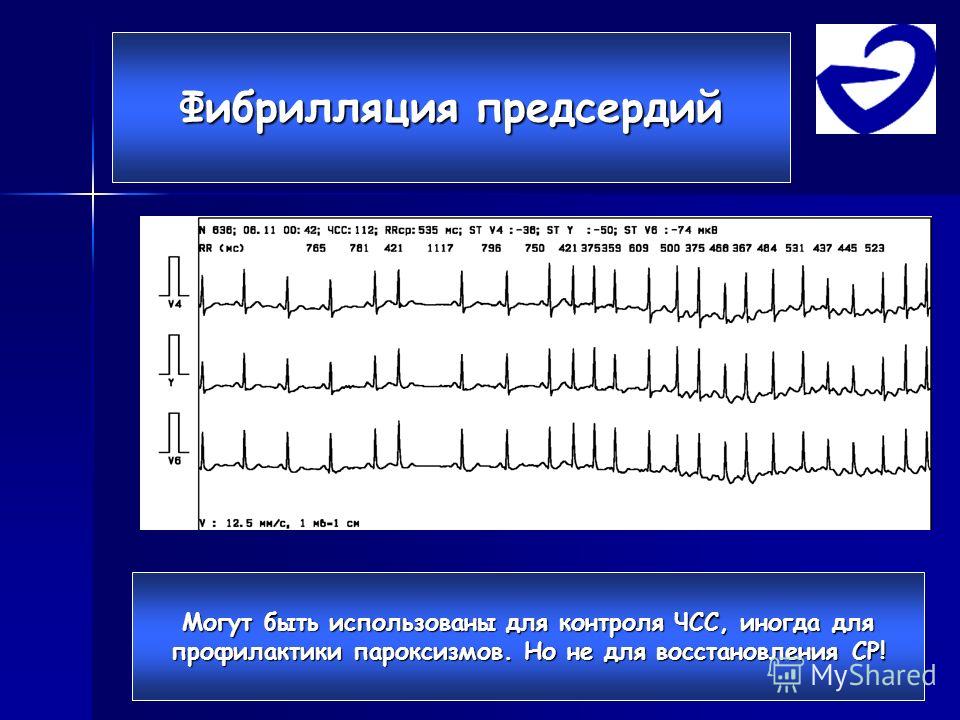 У одного и того же больного с длительным анамнезом фибрилляции предсердий на различных этапах заболевания могут наблюдаться различные типы течения аритмии, а также иметь место их сочетания. В таких случаях в диагнозе указывается только та форма ФП, которая послужила поводом для данной госпитализации или вмешательства.
У одного и того же больного с длительным анамнезом фибрилляции предсердий на различных этапах заболевания могут наблюдаться различные типы течения аритмии, а также иметь место их сочетания. В таких случаях в диагнозе указывается только та форма ФП, которая послужила поводом для данной госпитализации или вмешательства.
Данная классификация полезна для клинического ведения пациентов с ФП, особенно когда принимаются во внимание связанные с ФП симптомы.
Классификация EHRA по степени выраженности клинических проявлений (EHRA-шкала)
Шкала симптомов («EHRA-score») представляет простой клинический инструмент для оценки симптомов во время ФП. В сочетании со шкалой риска возникновения инсульта шкала симптомов и классификация ФП помогают в ведении пациентов с ФП.
- EHRA I Нет симптомов
- EHRA II Легкие симптомы, обычная ежедневная активность пациента не нарушена
- EHRA III Серьезные симптомы, обычная ежедневная активность пациента нарушена
- EHRA IV Инвалидизирующие симптомы, обычная ежедневная активность пациента прекращена
Патогенетические механизмы фибрилляции предсердий
Для возникновения устойчивой ФП необходимо наличие трёх составляющих:
- пусковых, т.
 н. триггерных факторов аритмии,
н. триггерных факторов аритмии, - аритмогенного субстрата аритмии, обеспечивающего самостоятельное поддержание ФП, а также
- индивидуальных модулирующих влияний, повышающих восприимчивость аритмогенного субстрата к триггерным факторам ФП.
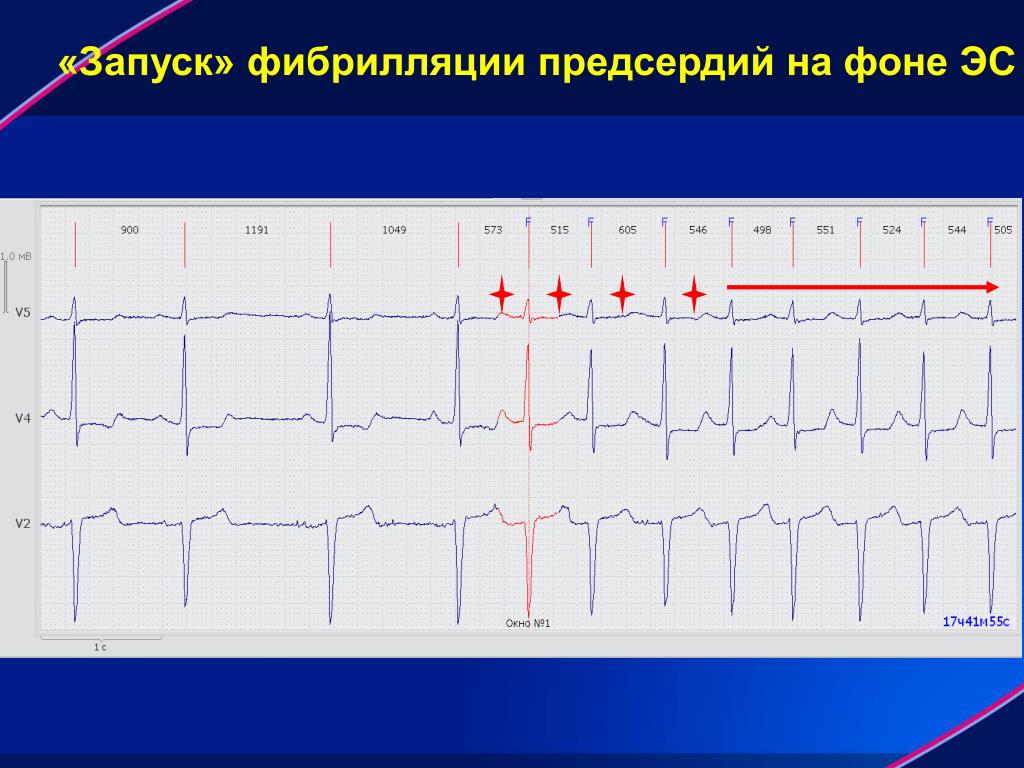
В подавляющем большинстве случаев (95%) триггерным фактором ФП является патологическая высокочастотная электрическая активность в устьях легочных вен, отражением которой на ЭКГ является частая ранняя предсердная экстрасистолия (по типу «Р на Т», см. рис. 2) и/или пробежки предсердной тахикардии (как монофокусной, так и хаотической).
Рис. 2. Возникновение приступа фибрилляции предсердий вследствие частой эктопической активности из устья левой верхней легочной вены. Обозначения: ЛВЛВ – электрограмма из устья левой верхней легочной вены; A – осцилляции предсердий. Индексом 1 обозначены электрические сигналы синусового происхождения, индексом 2 – электрические сигналы эктопии из ЛВЛВ.
Более редкими тригерными факторами фибрилляции предсердий являются экстрасистолы из полых вен, а также предсердные экстрасистолы. Электрофизиологическими механизмами очаговой активности лёгочных и полых вен является триггерная активность и повторный вход возбуждения (re-entry) в мышечных структурах, выстилающих места их впадений в предсердия. При проведении ЭФИ приступ ФП может быть вызван электростимуляцией предсердий.
Аритмогенный субстрат ФП представляет собой структурно и функционально изменённый (ремоделированный) миокард предсердий, обеспечивающий стойкое самостоятельное поддержание ФП. Под ремоделированием понимают совокупность патологических процессов, возникающих в предсердиях в ответ на возникновение ФП или/и в результате действия известных этиологических факторов ФП. Ремоделирование начинается с нарушения ионных клеточных механизмов формирования импульса и заканчивается структурно-функциональной деградацией предсердного миокарда и атриомегалией. Основными структурными изменениями миокарда предсердий, предрасполагающими к возникновению субстрата ФП, являются фиброз, воспаление, апоптоз и гипертрофия кардиомиоцитов. Функциональные нарушения в предсердном миокарде включают в себя возникновение неоднородности скоростей проведения импульсов в разных направлениях, а также дисперсию процессов реполяризации в предсердном миокарде. Прогрессирование ФП и резистентность аритмии к лекарственному и интервенционному лечению, как правило, определяется выраженностью процессов ремоделирования предсердий. В настоящее время рассматриваются две альтернативные электрофизиологические гипотезы самостоятельного поддержания ФП:
Функциональные нарушения в предсердном миокарде включают в себя возникновение неоднородности скоростей проведения импульсов в разных направлениях, а также дисперсию процессов реполяризации в предсердном миокарде. Прогрессирование ФП и резистентность аритмии к лекарственному и интервенционному лечению, как правило, определяется выраженностью процессов ремоделирования предсердий. В настоящее время рассматриваются две альтернативные электрофизиологические гипотезы самостоятельного поддержания ФП:
- наличие одного или нескольких высокочастотных роторов в предсердиях или лёгочных венах с постоянно меняющимся характером проведения импульсов на окружающий миокард предсердий;
- циркуляция множественных волн микро-реэнтри в предсердиях по неопределенному, случайному пути.
Наиболее частым модулирующим влиянием, способствующим активации «спящего» аритмогенного субстрата ФП в ответ на действие триггерного фактора, является дисбаланс вегетативных влияний на миокард предсердий.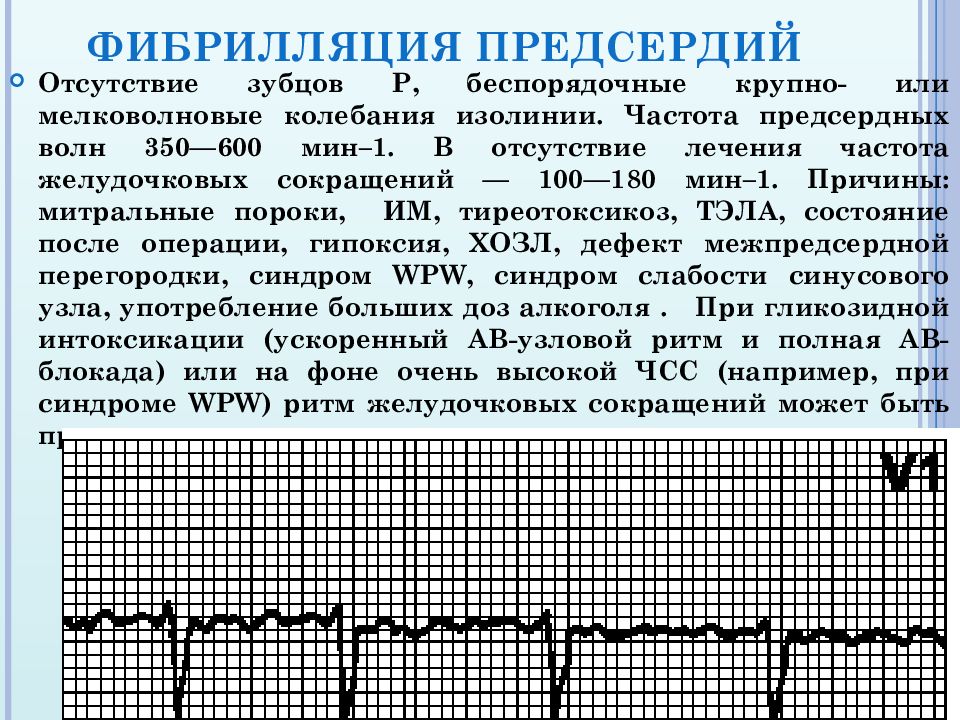 В зависимости от характера нарушений автономной регуляции работы сердца выделяют т.н. «вагусную» форму ФП (аритмия возникает преимущественно во время сна или после переедания, при резких наклонах или поворотах туловища, а также любых других факторах, усиливающих парасимпатические влияния на сердце), а также т.н. «гиперадренергическую» форму аритмии (ФП возникает преимущественно в момент физической нагрузки, при стрессе, резком испуге и других состояниях, сопровождающихся повышением симпатических влияний на сердце). В качестве модулирующего влияния могут также выступать нарушения электролитного обмена (гипокалиемия), преходящая ишемия миокарда и проаритмическое действие лекарственных препаратов.
В зависимости от характера нарушений автономной регуляции работы сердца выделяют т.н. «вагусную» форму ФП (аритмия возникает преимущественно во время сна или после переедания, при резких наклонах или поворотах туловища, а также любых других факторах, усиливающих парасимпатические влияния на сердце), а также т.н. «гиперадренергическую» форму аритмии (ФП возникает преимущественно в момент физической нагрузки, при стрессе, резком испуге и других состояниях, сопровождающихся повышением симпатических влияний на сердце). В качестве модулирующего влияния могут также выступать нарушения электролитного обмена (гипокалиемия), преходящая ишемия миокарда и проаритмическое действие лекарственных препаратов.
Диагностика, дифференциальная диагностика, клинические проявления, прогноз
Диагноз фибрилляции предсердий ставится на основании ЭКГ. Нередко для подтверждения диагноза пароксизмальной ФП требуется длительное мониторирование ЭКГ (от 24 ч до 7 дней), использование портативных ЭКГ-регистраторов с возможностью передачи ЭКГ по телефону, а также имплантируемые петлевые регистраторы ЭКГ. Программная стимуляция предсердий в условиях ЭФИ для подтверждения диагноза ФП не проводится в силу низкой чувствительности и специфичности метода в отношении воспроизводимости клинически значимой ФП.Характерными ЭКГ-признаками ФП являются: отсутствие зубцов Р, наличие разноамплитудных, полиморфных волн ff, переходящих одна в другую без чёткой изолинии между ними, а также абсолютная хаотичность и нерегулярность ритма желудочков (рис. 1). Последний признак не регистрируется в случаях сочетания ФП и АВ-блокады III степени (при т.н. феномене Фредерика).
Программная стимуляция предсердий в условиях ЭФИ для подтверждения диагноза ФП не проводится в силу низкой чувствительности и специфичности метода в отношении воспроизводимости клинически значимой ФП.Характерными ЭКГ-признаками ФП являются: отсутствие зубцов Р, наличие разноамплитудных, полиморфных волн ff, переходящих одна в другую без чёткой изолинии между ними, а также абсолютная хаотичность и нерегулярность ритма желудочков (рис. 1). Последний признак не регистрируется в случаях сочетания ФП и АВ-блокады III степени (при т.н. феномене Фредерика).
Типичными симптомами ФП являются: усиленное, как правило, неритмичное сердцебиение, перебои в работе сердца, одышка, повышенная утомляемость, плохая переносимость физических нагрузок и потливость. ФП является причиной трети всех госпитализаций по поводу нарушений ритма сердца. Основные причины госпитализаций при ФП – острый коронарный синдром, сердечная недостаточность, тромбоэмболические осложнения и необходимость неотложного купирования ФП. ФП сопряжена с двукратным возрастанием риска смерти, прежде всего кардиальной, независимо от наличия других факторов риска. Наиболее опасными осложнениями ФП являются тромбоэмболические, в том числе ишемический кардиоэмболический инсульт (возникновение ФП у больных без поражения клапанов сердца увеличивает риск инсульта в 5 раз, а при наличии клапанного порока — в 17 раз), тромбоэмболии сосудов конечностей и инфаркты внутренних органов. Кроме того, ФП может быть причиной когнитивных дисфункций, включая сосудистую деменцию. У больных с ФП ухудшается качество жизни, снижается толерантность к физическим нагрузкам, нередко появляется и/или прогрессирует дисфункция левого желудочка с развитием сердечной недостаточности. Приблизительно в четверти случаев аритмия может протекать бессимптомно и выявляется случайно при медицинском осмотре.
ФП сопряжена с двукратным возрастанием риска смерти, прежде всего кардиальной, независимо от наличия других факторов риска. Наиболее опасными осложнениями ФП являются тромбоэмболические, в том числе ишемический кардиоэмболический инсульт (возникновение ФП у больных без поражения клапанов сердца увеличивает риск инсульта в 5 раз, а при наличии клапанного порока — в 17 раз), тромбоэмболии сосудов конечностей и инфаркты внутренних органов. Кроме того, ФП может быть причиной когнитивных дисфункций, включая сосудистую деменцию. У больных с ФП ухудшается качество жизни, снижается толерантность к физическим нагрузкам, нередко появляется и/или прогрессирует дисфункция левого желудочка с развитием сердечной недостаточности. Приблизительно в четверти случаев аритмия может протекать бессимптомно и выявляется случайно при медицинском осмотре.
Все, что нужно знать об абляции при сердечных аритмиях
Автор Александр Наумов На чтение 6 мин. Опубликовано
Обновлено
Абляция в кардиохирургии — это процедура, которая устраняет или рубцует ткани в сердце, вызывающие аритмию. Существует несколько различных типов процедуры абляции. Каждый тип помогает лечить различные виды аритмии.
Виды абляции
Катетерная аблация
При таком подходе врачи вводят длинные тонкие трубки, называемые катетерами, в кровеносные сосуды, чтобы уничтожить разрушительные клетки в сердце. Используются различные методы для устранения клеток, вызывающих аритмии, в том числе:
- радиочастота, которая создает тепло
- замораживание
Хирургическая абляция
Хирургическая абляция, также известная как операция «лабиринт», направлена на устранение фибрилляции предсердий. Данный вид абляции на открытом сердце зачастую проводится по поводу дополнительных проблем с сердцем, таких как замена клапана или шунтирование сердца.
Операция «лабиринт» включает в себя выполнение небольших разрезов в верхних камерах сердца, называемых предсердиями. Это приводит к образованию рубцовой ткани, которая блокирует электрические сигналы, вызывающие фибрилляцию. Некоторым проводят менее инвазивную операцию называемую «мини-лабиринтом», при которой используют меньшие разрезы, чтобы уменьшить риск осложнений.
Гибридный подход (малоинвазивная кардиохирургическая операция и эндоваскулярнвя катетерная абляция)
Гибридная операция сочетает катетерную абляцию, которая лечит внутреннюю часть сердца, с процедурой мини-лабиринта, которая лечит внешний слой сердца.
При каких состояниях выполняют абляции при сердечных аритмиях?
Врачи обычно используют абляцию в кардиохирургии для лечения целого ряда заболеваний. К ним относятся:
Суправентрикулярная тахикардия (СВТ)
СВТ является наиболее распространенной причиной абляции при аритмиях. При этом состоянии сердце внезапно начинает биться быстро. Электрический сигнал поступает из верхних камер сердца.
Электрический сигнал поступает из верхних камер сердца.
Трепетание предсердий
Трепетание предсердий — это состояние, при котором верхние камеры сердца бьются очень быстро при нарушении электрической сигнализации в сердце, зачастую возникающей вследствие других заболеваний сердца, таких как ишемическая болезнь сердца и высокое артериальное давление.
Мерцательная аритмия
Мерцательная аритмия, или фибрилляция предсердий — это состояние, которое вызывает нерегулярное сердцебиение в верхних отделах сердца. Данное состояние увеличивает риск инсульта и сердечной недостаточности и может привести к гипертрофии сердца. Люди с фибрилляцией предсердий, которые не применяют медикаментозное лечение, зачастую прибегают к абляции.
Аритмия может привести к опасным для жизни осложнениям, таким как сердечный приступ.
Риски абляции
Абляция является процедурой низкого риска. Однако риски зависят от вида операции.
Катетерная абляция
Катетерная абляция является наименее инвазивным подходом и несет меньше рисков, чем другие процедуры. Однако существует вероятность повреждения сердца, кровеносных сосудов и близлежащих частей тела, а также дестабилизации электрической системы сердца.
Однако существует вероятность повреждения сердца, кровеносных сосудов и близлежащих частей тела, а также дестабилизации электрической системы сердца.
Гибридный подход
Операция, выполняемая одновременно с установкой катетера, не требует искусственного кровообращения. Вот почему этот тип абляции не так опасен, как другие виды, применяемые в кардиохирургии. Однако риски присутствуют.
Хирургическая абляция
Хирургическая абляция — это форма операции на открытом сердце. Процедура имеет все риски, связанные с операциями такого рода. Риски могут включать в себя:
- кровотечение
- инсульт
- инфекция
- реакция на анестетики
- смертельное повреждение сердца
Подготовка к абляции при сердечных аритмиях
Пациенту, готовящемуся к абляции, потребуется посетить больницу примерно за неделю до операции. Хирург должен провести анализы крови, мочи, выполнить электрокардиограмму и рентгенографию.
Как правило, пациенту, готовящемуся к абляции, рекомендуется выполнить следующие действия:
- воздержание от курения за 2 недели до операции
- воздержание от еды и питья, даже воды, в ночь перед процедурой
Пациент должен проконсультироваться с врачом о конкретных инструкциях по типу операции, которую он проходит.
Чего ожидать во время абляции
Катетерная абляция
Обычно катетерная абляция длится от 2 до 4 часов и проводится в стационаре. Пациент остается в сознании на протяжении всей процедуры, но получает внутривенные препараты, которые вызывают сонливость. Врач вводит катетер через пах и направляет его к сердцу, где импульсы энергии уничтожат аномальные клетки.
Гибридный подход
Этот подход включает в себя две процедуры, которые могут проходить в течение одного пребывания в стационаре. В ходе операции врач делает небольшие разрезы на боковой стороне грудной клетки, а электрофизиолог выполнит катетерную абляцию.
Хирургическая абляция
Хирургическая абляция требует общей анестезии. При этой процедуре кардиохирурги делают надрез внутренней части сердца, чтобы создать рубцовую ткань, которая восстановит баланс электрической системы сердца.
В некоторых случаях может возникнуть необходимость раздвинуть ребра и поместить сердце на аппарат искусственного кровообращения.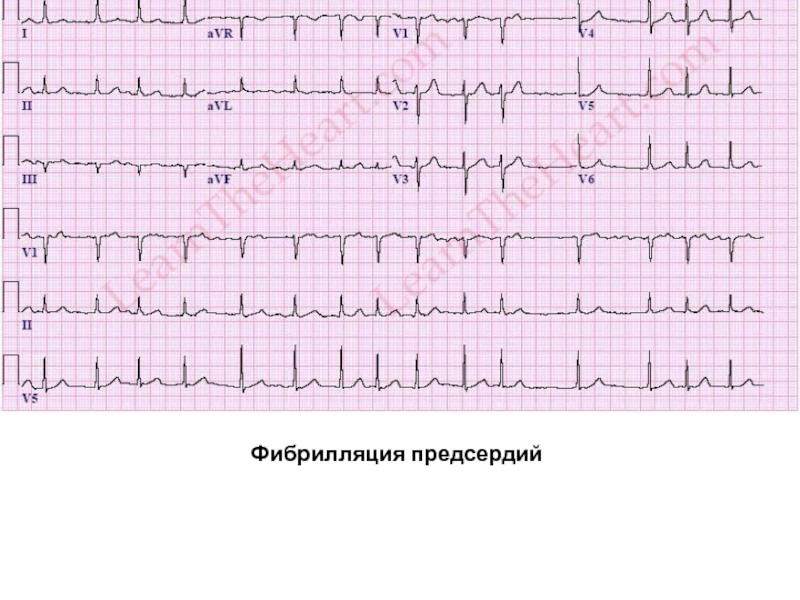 Однако не все операции настолько сложны.
Однако не все операции настолько сложны.
Восстановление после абляции при сердечных аритмиях
Характер восстановления после абляции зависит от типа процедуры.
Катетерная абляция
Обычно это амбулаторная процедура. Однако, после катетерной абляции необходимо лежать в течение 6-8 часов, поэтому большинство пациентов остаются в больнице на ночь.
Пациент может возобновить свою обычную деятельность на следующий день после возвращения из больницы. Но он не должен садиться за руль или употреблять алкоголь в течение 24 часов. Также следует избегать интенсивной физической активности в течение 3 дней.
Гибридный подход
При этой процедуре пациенты остаются в стационаре в течение 2-5 дней, а восстановление занимает около 2 недель.
Хирургическая абляция
Хирургическая абляция требует сложнейшего процесса восстановления, причем людям требуется 5-7 дней госпитализации и 4-недельный восстановительный период. Во время выздоровления пациент должен много отдыхать и избегать подъема тяжелых предметов. Необходимо также следовать инструкциям после процедуры, которые пациент получит от врача.
Во время выздоровления пациент должен много отдыхать и избегать подъема тяжелых предметов. Необходимо также следовать инструкциям после процедуры, которые пациент получит от врача.
Хирургическая абляция, как правило, эффективна. Тем не менее, люди могут иметь аритмии в течение нескольких недель после процедуры. Необходима медикаментозная терапия, чтобы контролировать симптомы.
Хирургическая абляция может успешно исправить как краткосрочные, так и долгосрочные аритмии.
Хотя люди могут вернуться к работе и многим другим видам деятельности вскоре после операции, может потребоваться до 3 месяцев после катетерной абляции, чтобы организм достаточно восстановился.
Прогноз
Прогноз для людей, перенесших операцию на сердце, в целом позитивный.
Исследование 2015 года показало 68,6% успеха через 1 год после того, как пациенты с фибрилляцией предсердий провели одну процедуру, 61,1% успеха через 3 года и 62,3% успеха через 5 лет.
Иногда симптомы фибрилляции предсердий могут вернуться. То же самое исследование показало 79% успеха через 5 лет после того, как люди прошли несколько процедур.
То же самое исследование показало 79% успеха через 5 лет после того, как люди прошли несколько процедур.
Заключение
Абляция помогает убрать симптомы аритмии, которая представляет собой нарушения ритма сердца.
Катетерная абляция, хирургическая абляция и гибридный подход (сочетающая элементы обоих подходов), являются основными методами абляции при сердечных аритмиях. Эти процедуры обычно эффективны при таких состояниях, как фибрилляция предсердий и трепетание предсердий.
Статья по теме: Учащенное сердцебиение ночью — что надо знать?
Фибрилляция предсердий — Википедия. Что такое Фибрилляция предсердий
Фибрилля́ция предсе́рдий (ФП, синоним: мерцательная аритмия) — разновидность наджелудочковой тахиаритмии с хаотической электрической активностью предсердий с частотой импульсов 350—700 в минуту, что исключает возможность их координированного сокращения[1]. Это одна из наиболее распространённых аритмий[2]. Часто ФП может быть обнаружена при определении пульса и обнаружении, что сердцебиения происходят с нерегулярным интервалом. Однако окончательный диагноз выставляется по ЭКГ-признакам: отсутствие зубцов P, которые присутствуют при нормальном ритме сердца и характеризуют электрическую активность при сокращении предсердий. Вместо них появляется множество волн f, которые характеризуют фибрилляцию (то есть мерцание, дрожание) предсердий.
Однако окончательный диагноз выставляется по ЭКГ-признакам: отсутствие зубцов P, которые присутствуют при нормальном ритме сердца и характеризуют электрическую активность при сокращении предсердий. Вместо них появляется множество волн f, которые характеризуют фибрилляцию (то есть мерцание, дрожание) предсердий.
Частота сокращений желудочков при мерцательной аритмии зависит от электрофизиологических свойств предсердно-желудочкового узла, уровня активности симпатической и парасимпатической нервной системы, а также действия лекарственных препаратов. Риск возникновения ФП увеличивается с возрастом. Данная аритмия нередко связана с органическими заболеваниями сердца. Нарушение гемодинамики и тромбоэмболические осложнения, связанные с фибрилляцией предсердий, приводят к значительному повышению заболеваемости, смертности и стоимости медицинского обслуживания. Хроническое течение ФП приводит к увеличению риска смерти примерно в 1,5—2 раза[3][4].
Эпидемиология
Видео с описанием механизма фибрилляции предсердий. Английский с русскими субтитрами.
Английский с русскими субтитрами.
Фибрилляция предсердий — одна из самых распространённых аритмий. Этим заболеванием страдают 1—2 % общей популяции, и этот показатель растёт в последние годы[5] и вероятно будет увеличиваться в ближайшие 50 лет в связи со старением населения[6]. Число больных ФП в США оценивают более чем в 2,2 миллиона человек, в странах Европейского союза — 4,5 миллиона[7][8]. По данным фрамингемского исследования, риск развития ФП у мужчин и женщин старше 40 лет составляет 26 и 23 % соответственно[9]. ФП выявляется примерно у 6—24 % пациентов с инсультом[10]. Распространённость ФП также увеличивается с возрастом, составляя около 8 % у пациентов старше 80 лет[11].
Классификация
| Формы ФП | Характеристика |
|---|---|
| Впервые выявленная | впервые возникший эпизод ФП |
| Пароксизмальная | приступ длится не более 7 дней (обычно менее 48 ч) и спонтанно восстанавливается в синусовый ритм |
| Персистирующая | приступ длится более 7 дней |
| Длительная персистирующая | приступ длится более 1 года, но принято решение о восстановлении синусового ритма |
| Постоянная | длительно сохраняющаяся ФП (например, более 1 года), при которой кардиоверсия была неэффективна или не проводилась |
| Класс EHRA | Проявления |
|---|---|
| I | Нет симптомов |
| II | Лёгкие симптомы; обычная жизнедеятельность не нарушена |
| III | Выраженные симптомы; изменена повседневная активность |
| IV | Инвалидизирующие симптомы; нормальная повседневная активность невозможна |
В рекомендациях Американского колледжа кардиологии (англ.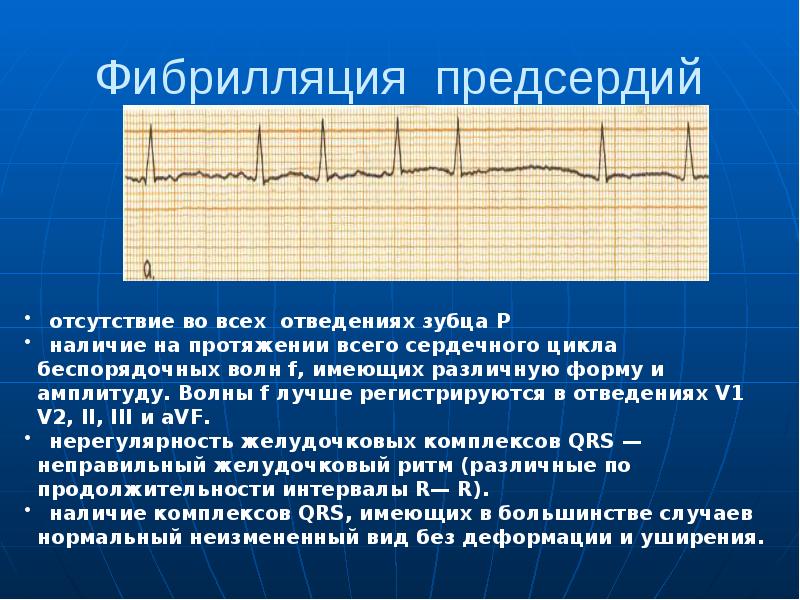 )русск., Американской кардиологической ассоциации (англ.)русск., Европейского общества кардиологов (англ.)русск. (2010 года), а также Всероссийского научного общества кардиологов (2011 года) различают 5 типов ФП[12].
)русск., Американской кардиологической ассоциации (англ.)русск., Европейского общества кардиологов (англ.)русск. (2010 года), а также Всероссийского научного общества кардиологов (2011 года) различают 5 типов ФП[12].
В зависимости от частоты сердечных сокращений различают тахи- (ЧСС > 90 в минуту), нормо- и брадисистолические (ЧСС < 60 в минуту) формы ФП[13].
Кроме того, Европейским обществом кардиологов в 2010 году предложена клиническая классификация EHRA (European Heart Rhythm Association) в зависимости от выраженности симптомов заболевания[14].
Факторы риска
Фибрилляция предсердий связана с различными сердечно-сосудистыми заболеваниями, которые способствуют развитию и поддержанию аритмии. К ним относятся[9]:
Около 30—45 % случаев пароксизмальной ФП и 20—25 % случаев персистирующей ФП возникают у молодых
Фибрилляция предсердий и трепетание предсердий
Что представляют собой фибрилляция предсердий, трепетание предсердий — на этот вопрос ответит врач.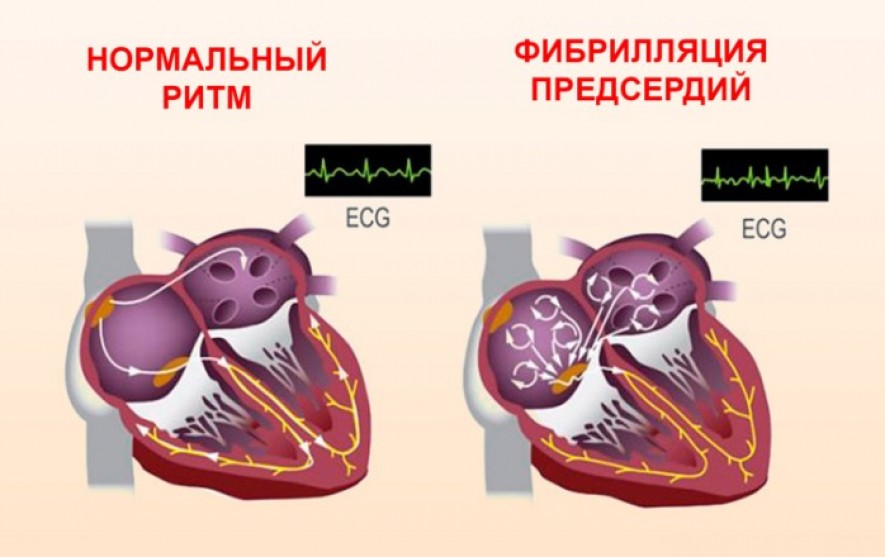
Мерцательную аритмию можно отнести к одному из наиболее типичных нарушений сердечных ритмов. Но она не несет в себе смертельную угрозу, а потому не является слишком угрожающей здоровью, как если бы это была аритмия желудочковая.
Что такое фибрилляция предсердий и трепетание предсердий?
Иначе эту патологию медики именуют фибрилляция предсердий — ФП.
Наджелудочковая тахикардия, к которой относится такой вид, как фибрилляция предсердий, заключается в том, что начинают происходить патологические сокращения предсердий, которые отличаются от обычных тем, что имеют постоянную нерегулярность, и частота сокращений, бывает, достигает 350 уд./мин. Сокращаются нерегулярно и желудочки.
Возрастные категории болезнь не выбирает, но все же в более пожилом возрасте недуг может сказаться у большинства пациентов, и это в основном зависит от сердечных патологий.
К ним относятся:
- изменения миокарда, когда нарушаются его проводимость и возбудимость;
- замещение клеток миокарда на соединительную ткань при кардиосклерозе;
- воспаление миокарда, при котором нарушается его структура;
- артериальная гипертензия;
- пороки ревматического характера, когда поражены клапаны.

Но не всегда фибрилляция зависит от сердечной деятельности.
Может сказаться заболевание какого-нибудь органа, и это чаще всего:
- недуги щитовидной железы, когда проявляется тиреотоксикоз;
- большое количество употребленных диуретиков или симпатомиметиков;
- гипокалиемия;
- интоксикация, в большинстве своем вызванная алкоголем или наркотиками;
- лечение сердечной недостаточности с помощью сердечных гликозидов;
- испуг или другая форма эмоционального напряжения;
- возрастные изменения опасны тем, что структура миокарда предсердий ухудшается, тогда появляется мелкоочаговый кардиосклероз.
Формы фибрилляций различают, опираясь на клинические проявления:
- Приступообразная, или пароксизмальная. Появляется эпизодично и может иметь продолжительность до 48 часов. Если используют кардиоверсию, то до 7 дней, в случае восстановления нормы — спонтанно.
- Персистирующая. Длится больше 7 дней, нет спонтанного восстановления. Как вариант, фибрилляция поддается кардиоверсии через двое суток.
- Хроническая. Длится непрерывно, кардиоверсии не поддается.
Учитывается и частота сердечных сокращений при следующих формах фибрилляции:
- тахисистолической — желудочки сокращаются более 100 уд./мин;
- нормосистолической — до 100 уд./мин;
- брадисистолической — не будут достигать и 60 уд./мин.
Различие между фибрилляцией и трепетанием
Мерцательная аритмия — это трепетание предсердий и фибрилляция предсердий.
Трепетание предсердий — это когда волокна миокарда сокращаются, но замедленно: 200–400 уд./мин.
Учитывая, что время рефрактерности атриовентрикулярного узла составляет такой промежуток, когда на желудочки не могут передаваться некоторые импульсы, они могут сокращаться не так быстро.
Но все равно это приводит к тому, что функция сердца в качестве насоса нарушается, и на миокард приходится излишняя нагрузка.
При фибрилляции происходит другая патология. Если учесть, что электрический импульс появляется в стенке правого предсердия, а затем идет по миокарду предсердий, желудочков и нужен для того, чтобы способствовать сокращению и впоследствии выбросу крови, значит, импульс играет важную роль при работе сердца.
При ФП импульс меняется и уже носит характер хаотичный, потому способствует тому, что предсердие начинает как бы мерцать, то есть волокна миокарда начинают вразнобой быстро сокращаться. Передавая беспорядочное возбуждение на желудочки, они начинают сокращаться также невпопад.
Если имеются фибрилляция предсердий, трепетание предсердий, и это не лечить, вовремя не обратившись к врачу, то у некоторых пациентов наблюдалось дальнейшее развитие тромбоэмболического инсульта или инфаркта миокарда.
Последствия фибрилляции
Можно проследить за механизмом развития: фибрилляция не дает предсердию сокращаться полноценно, и кровь будет стоять, что нередко приводит в пристеночном месте к образованию тромбов.
Поток крови подхватывает тромб и несет в аорту или в меньшие артерии — вот и повод для образования тромбоэмболии какой-нибудь артерии, которая должна питать один из органов.
Перекрытое кровоснабжение способствует тому, что происходит некроз — инфаркт органа. Если этим органом является мозг, к которому так легко добраться по каротидным артериям, то говорят об ишемическом инсульте.
Если уже существует недостаточность кровообращения, фибрилляция и трепетание предсердий вызывают отек легких или еще большую проблему, связанную с появлением сердечной астмы, то есть острую недостаточность левого желудочка.
Если сокращения желудочка составляют выше 90 уд./мин, и это происходит постоянно, то тогда может произойти расширение сердечных полостей, что в медицине носит название дилатационной кардиомиопатии.
Очень редко, но все же может случиться и такое, что начавшийся приступ мерцательной аритмии, если ярко выражены гемодинамические проблемы, возможно, доведет до аритмогенного шока. Это опасное состояние, так как возможна остановка сердца.
Как лечить патологию?
Врач выберет правильное лечение. Фибрилляция предсердий требует обязательного лечения. Существует кардиоверсия, когда требуется восстановление синусового ритма.
Необходима профилактика повторения пароксизмов, также понадобится контроль, чтобы частота сокращений желудочков не выходила за пределы нормы.
Для грамотного лечения понадобятся медикаменты, которые помогут избавиться от осложнений — тромбоэмболий.
Лекарства используют для следующих целей:
- Восстановление сердечного ритма, например, Пропафенон.
- Контроль ЧСС, частоты и силы сокращений, применяют в этом случае бета-адреноблокаторы, сердечные гликозиды.
- Снижение возможности образования тромбов, чтобы разжижалась кровь, если форма заболевания хроническая или персистирующая. Сюда относятся антикоагулянты как прямого, так и непрямого действия. При применении таких лекарств следует контролировать показатели свертываемости крови.
- Питание и улучшение процесса обмена в сердечной мышце. Такие препараты относят к метаболическим, они могут защитить миокард от пагубного влияния ишемии. Некоторые врачи считают, что такой метод терапии стоит на втором месте и не обязателен.
Чтобы аритмию выявить, иногда приходится использовать современную медицинскую аппаратуру. Но она имеет определенные симптомы.
В основном больные жалуются на:
- неожиданно резкое изменение количества сердечных ударов, что не соответствует норме;
- ощутимые сердечные перебои;
- болевые ощущения в районе сердца;
- необычные странные звуки в зоне сердца;
- одышку, нехватку воздуха;
- чувство паники и страха;
- слабость в теле, головокружение, обморок;
- непереносимость физической нагрузки;
Частое мочеиспускание, это вызвано тем, что в организме начинает активно вырабатываться натрийуретический пептид.
Если есть подозрение на фибрилляцию предсердий, нужно проверить пульс. Но если частота сердечных сокращений очень высокая, то есть число сокращений выше частоты пульса, то может произойти дефицит пульса.
Особый фактор риска представляют люди, у которых имеются болезни сердечно-сосудистой системы, сюда входят пороки сердца, сердечная недостаточность, опухоли и воспаления сердца.
Могут повлиять на возникновение аритмии сахарный диабет, заболевания почек, щитовидной железы, синдром сонного апноэ или хроническая обструктивная болезнь легких.
Опасны возрастные изменения, но среди молодых пациентов тоже есть тревожный процент, даже у тех, кто не испытывал проблем с сердцем.
Есть и другие важные причины возникновения аритмии. Это операции на сердце, поражение электричеством, частое употребление алкоголя, непосильная физическая нагрузка, долгое пребывание в жарких условиях, переедание.
Очень редкий случай фибрилляции предсердий может быть вызван наследственной предрасположенностью.
Что такое мерцательная аритмия (AFib или AF)?
Перейти к основному содержанию
Ресурсы по COVID-19
Симптомы сердечного приступа и инсульта
Волонтер
МАГАЗИН
ПОЖЕРТВОВАТЬ СЕЙЧАС
Пожертвовать сейчас
- Поиск
Фибрилляция предсердий | патология | Britannica
Мерцательная аритмия , нерегулярный ритм сокращения мышц предсердия, верхней камеры сердца.В некоторых случаях пациент не замечает фибрилляции, но часто хаотичные, быстрые и неглубокие удары ощущаются как сильное сердцебиение, часто сопровождающееся одышкой, головокружением и утомляемостью. Фибрилляция предсердий — наиболее распространенный тип сердечной аритмии или нарушения нормального ритма. Это не обязательно является серьезным заболеванием само по себе и не должно приводить к значительному ограничению деятельности; тем не менее, его присутствие может создавать проблемы для других сердечных функций, особенно в желудочках или нижних камерах сердца.
Британская викторина
Болезни, расстройства и многое другое: медицинская викторина
Какое состояние вызвано отложением солей мочевой кислоты? Как еще называют переломную лихорадку? Узнайте, что вы знаете о болезнях, расстройствах и многом другом.
Фибрилляция предсердий возникает, когда в мышечных клетках стенки предсердия происходят изменения, которые мешают правильному распространению электрических нервных импульсов.Известно, что это происходит чаще по мере увеличения количества фиброзной ткани в стареющем сердце; существует также значительная семейная предрасположенность к этому состоянию. Фибрилляция предсердий также может быть вызвана другими сердечными заболеваниями, которые увеличивают нагрузку на предсердие, такими как болезнь митрального клапана и хроническая застойная сердечная недостаточность. Наконец, фибрилляция предсердий может временно возникать в результате чрезмерной стимуляции (как при гипертиреозе) или раздражения (как при перикардите).
Фибрилляция предсердий нарушает нормальное функционирование синоатриального узла, массы специальной мышечной ткани в правом предсердии, которая является основным источником импульсов, которые служат естественным кардиостимулятором сердца.Таким образом, нарушается не только предсердный ритм, но и импульсы, активирующие желудочки, которые перекачивают кровь в легкие и тело. Желудочки защищены другим узлом, известным как атриовентрикулярный узел, от необычной бомбардировки импульсами, исходящими из фибриллирующего предсердия; однако у людей с фибрилляцией предсердий при физической нагрузке или стрессе часто наблюдается чрезмерное увеличение частоты сердечных сокращений, что требует лечения бета-адреноблокаторами (бета-блокаторами), блокаторами кальциевых каналов или дигиталисом.Кроме того, фибрилляция предсердий может ухудшить состояние кардиологических пациентов, функции желудочков которых уже нарушены из-за сердечной недостаточности или утолщения стенок желудочков (гипертрофия желудочков) за счет устранения вторичной энергии наполнения желудочков, обеспечиваемой нормально сокращающимся левым предсердием. Наиболее распространенное осложнение фибрилляции предсердий возникает в результате образования тромбов в стенке фибриллирующего левого предсердия. Эти сгустки часто отрываются в кровоток, где они могут образовывать эмболы, которые могут блокировать артериальные русла, вызывая тем самым существенное повреждение тканей.Подсчитано, что 25 процентов людей с хронической фибрилляцией предсердий в конечном итоге будут страдать от тяжелой эмболии и инсульта, если их не лечить антикоагулянтами, такими как варфарин (кумадин ©).
Основная стратегия лечения фибрилляции предсердий — устранить лежащую в основе аномалию. Фибрилляции можно прервать, воздействуя на желудочки электрическим током, хотя в большинстве случаев это лечение должно сопровождаться лекарственной терапией для поддержания нормального ритма. Недавний прогресс в клинической электрофизиологии дал надежду на создание техники, в которой аберрантные кардиостимуляторы могут быть удалены ультразвуком, подаваемым через катетер, чтобы обеспечить стабильную дефибрилляцию у некоторых пациентов.Однако во многих случаях фибрилляция предсердий сохраняется или повторяется, и пациентам с хронической фибрилляцией предсердий требуется лечение антикоагулянтами и антиаритмическими препаратами, упомянутыми выше. См. Также фибрилляция желудочков.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской.
Подпишитесь сегодня
К сожалению, запрошенная страница не найдена
К сожалению, запрошенная страница не найденаДля того, чтобы предоставить вам наилучшее взаимодействие с пользователем, этот сайт использует Javascript.Если вы видите это сообщение, вероятно, в вашем браузере отключена опция Javascript. Для оптимального просмотра этого сайта убедитесь, что в вашем браузере включен Javascript.
Вы знали, что ваш браузер устарел? Чтобы получить наилучшие впечатления от использования нашего веб-сайта, мы рекомендуем вам перейти на более новую версию. Учить больше.
Пожалуйста, попробуйте использовать нашу поисковую систему
Вас также может заинтересовать
Членство
Мы объединяем специалистов в области сердечно-сосудистой системы, занимающихся сердечно-сосудистыми заболеваниями, всех специальностей, ролей и уровней карьеры по всему миру.Узнайте, как присоединиться к мировому кардиологическому сообществу.
Узнать больше
Методические рекомендации
Все соответствующие доказательства, чтобы помочь врачам взвесить преимущества / риски диагностических или терапевтических процедур.
Узнать больше
Образование
Интерактивные и научно обоснованные образовательные ресурсы по общей кардиологии и специальностям для поддержки вашего непрерывного медицинского образования.
Узнать больше
Фибрилляция предсердий у детей | IntechOpen
1. Введение
Фибрилляция предсердий — это относительно редкая аритмия в детском возрасте, которая наблюдается в различных педиатрических клинических условиях и продолжает вызывать проблемы у медицинских работников.Фибрилляция предсердий может наблюдаться в детском возрасте в любом возрасте. Последние достижения позволили проводить пренатальную диагностику и лечение. Описана перинатальная фибрилляция предсердий, часто при отсутствии явных структурных или электрофизиологических сердечных аномалий. В детстве фибрилляция предсердий иногда может наблюдаться в связи с опухолями сердца, миокардитом или кардиомиопатией. Некоторые лекарства и их воздействие могут вызвать фибрилляцию предсердий у детей. Некоторые врожденные дефекты могут быть связаны с фибрилляцией предсердий в раннем взрослом возрасте, если их не вылечить, исправить или смягчить хирургическим или катетерным вмешательством.Клиническое значение фибрилляции предсердий может варьироваться от тривиального до опасного для жизни, в зависимости от клинической ситуации и лежащего в основе электрофизиологического или структурного субстрата. Недавние исследования происхождения фибрилляции предсердий, новые лекарственные препараты, интервенционный катетер и хирургические процедуры предлагают новые варианты лечения для детей или молодых людей из группы риска. В этой главе рассматриваются последние достижения в области генетических, структурных, электрофизиологических, фармакологических, медицинских и хирургических наблюдений, а также их влияние на понимание и лечение этой аритмии у детей.
2. Эмбриология предсердий
Фибрилляция предсердий — относительно редкая аритмия в детской возрастной группе. Но антецеденты фибрилляции предсердий в зрелом возрасте часто являются следствием изменений в генетике развития, анатомии, функциях и электрических свойствах развивающегося сердца. Большая часть информации о развивающейся проводящей системе предсердий получена из исследований на животных (Gourdie et al., 2003; Ho & Anderson, 1990; Jongbloed et al., 2004). Наиболее полезная модель для развивающейся проводящей системы сердца человека касается колец из специальной ткани, разделяющей пять компонентов первичной сердечной трубки (на стыке венозного синуса, примитивного предсердия, входной и выходной частей желудочкового сегмента и артериального сегмента). ).Эти кольца образуют первичную проводящую систему, концепцию, которая может быть расширена для объяснения эктопического распределения в уродливых сердцах (Gourdie et al., 2003; Ho & Anderson, 1990; Jongbloed et al., 2004). Среди предсердных структур проводящей системы синоатриальный узел распознается уже на первой стадии сердечной петли, на стыке верхней полой вены и правого предсердия (Boyett, 2009; Gourdie et al., 2003; Ho & Андерсон, 1990; Jongbloed et al., 2004).Гистологически дискретные узловые клетки расположены в матрице соединительной ткани, размер которой увеличивается к рождению. Остальная часть синоатриального перехода складывается, образуя клапаны венозного синуса (Boyett, 2009; Gourdie et al., 2003; Ho & Anderson, 1990; Jongbloed et al., 2004). Синусовый узел впервые был идентифицирован сэром Артуром Китом (подозреваемым в совершении пилтдаунского мошенничества) в 1907 году (Boyett, 2009). Хотя в учебниках синоатриальный узел показан как дискретный узел, электрофизиологические данные и новые анатомические методы предполагают более вариабельную и обширную структуру, простирающуюся от верхней полой вены к нижней полой вене (Boyett, 2009; Dobrzynski et al., 2005; Scheussler et al., 1996).
Существуют дискуссии о том, существуют ли значительные связи между тканями синоатриального узла и атриовентрикулярным узлом (Mommersteeg et al., 2009; Platanov, 2007; Sherf & James, 1979). Хотя это проиллюстрировано в предыдущих работах, окружной мышечный пучок, расположенный на передней стенке левого предсердия, соединяющий правые и левые придатки предсердия, был назван в честь Джорджа Бахмана, который описал его участие в межпредсердном распространении электрических импульсов в 1916 году (Sherf & James, 1979).Недавние эмбриологические исследования на мышах показывают, что аритмогенные области, такие как пучок Бахмана, легочные вены и венозный синус, представляют собой интранодальные структуры, которые демонстрируют экспрессию гена lacZ, характерную для специализированной проводящей ткани (Boyett, 2009; Jongbloed et al., 2004; Mommersteeg, 2009). ; Платанов 2007).
Развитие атриовентрикулярного узла довольно сложно (Boyett, 2009; Gourdie et al., 2003; Ho & Anderson, 1990; Jongbloed et al., 2004). Кольцо из специализированной ткани в атриовентрикулярном соединении образует зачаток атриовентрикулярного узла.Первоначально он зажат между предсердно-желудочковой бороздой и эндокардиальной подушечкой (Boyett, 2009; Gourdie et al., 2003; Ho & Anderson, 1990; Jongbloed et al., 2004). Проводящая ткань входного и апикального трабекулярных компонентов межжелудочковой перегородки сводится вместе, образуя непрерывную ось проводимости желудочков. Эндокардиальные подушки постепенно регрессируют, приводя проводящий пучок в прямой контакт с нижним краем межпредсердной перегородки (Boyett, 2009; Gourdie et al., 2003; Хо и Андерсон, 1990; Jongbloed et al., 2004). Ткани предсердий непосредственно вокруг области контакта становятся переходной клеточной зоной, а конец пучка становится компактным атриовентрикулярным узлом (Boyett, 2009; Gourdie et al., 2003; Ho & Anderson, 1990; Jongbloed et al., 2004). . Атриовентрикулярный узел был впервые описан в 1906 году Сунао Тавара, работавшим в лаборатории Людвига Ашоффа в Германии (Boyett, 2009). Недавние генетические исследования на животных и людях предполагают, что мутации в факторе транскрипции Nkx2.5 может быть связано с аномалиями развития проводящей системы (Gittenberger-De Groot et al., 2007; Jay et al., 2004).
Рабочие миокардиальные клетки предсердий и желудочков схожи по характеристикам, но различаются по анатомическому расположению (Boyett, 2009; Gourdie et al., 2003; Ho & Anderson, 1990). Эти клетки характеризуются большей степенью деполяризации в состоянии покоя, отсутствием спонтанной активности водителя ритма и быстрой проводимостью импульсов (Boyett, 2009; Gourdie et al., 2003; Ho & Anderson, 1990).Дифференциация элементов проводящей системы от работающих клеток миокарда предсердий включает включение и выключение контролирующих генов (Boyett, 2009). Фактор транскрипции Tbx3 экспрессируется в тканях развивающейся проводящей системы и обычно выключается в рабочих миоцитах предсердий (Boyett, 2009; Hoogaars et al., 2007). Рабочие клетки миокарда предсердий имеют более эффективное электрическое соединение из-за экспрессии генов, контролирующих соединение Cx43, в создании все более и более крупных щелевых соединений (Boyett, 2009, Chandler et al., 2009). Клетки системы сердечной проводимости имеют все меньше и меньше щелевых контактов и вместо этого экспрессируют соединение Cx45 (Boyett, 2009, Chandler et al., 2009). Исследование матричной рибонуклеиновой кислоты (мРНК) из сердца человека показывает, что синоатриальные и атриовентрикулярные узловые клетки имеют повышенную экспрессию активируемых гиперполяризацией циклических нуклеотидно-зависимых каналов HCN4 (контролирующих ток I f ) и сниженную экспрессию K ir . гены каналов, особенно K ir 2.1 (контролирующий I K, ток 1 ), что приводит к снижению потенциала покоя, более медленной проводимости и спонтанной деполяризации через другие ионные каналы (Boyett, 2009; Chandler et al., 2009; Hoogaars et al., 2007). Кардиальный натриевый канал, Na v 1.5, (контролирующий ток I Na ) обильно экспрессируется в рабочих клетках миокарда, но не в узловой ткани (Boyett, 2009). Генетические проблемы, такие как сохранение активности Tbx3 или приобретенные генетические изменения в функции ионных каналов, могут лежать в основе склонности к развитию фибрилляции предсердий в более позднем возрасте (Hoogaars et al., 2007; Робертс и Голлоб, 2010).
3. Генетика предсердий
Последние сообщения показывают, что каннелопатии играют определенную роль в развитии фибрилляции предсердий (Darbar et al., 2008; Johnson et al., 2008; Kaufman, 2009; Patel & Pavri, 2009; Thejus И Фрэнсис, 2009). Фибрилляция предсердий может быть связана с генами, вызывающими либо усиление функции ионного канала, либо потерю функции (Darbar et al., 2008; Johnson et al., 2008; Kaufman, 2009; Patel & Pavri, 2009; Thejus & Francis, 2009) и может наблюдаться у 2% пациентов с синдромом удлиненного интервала QT, у 10% пациентов с синдромом Бругада и у 30% пациентов с синдромом короткого интервала QT (Johnson et al., 2008; Патель и Паври, 2009; Робертс и Голлоб, 2010 г., Теджус и Фрэнсис, 2009 г.). Семейная фибрилляция предсердий также связана с выявленными каннелопатиями (Benito et al., 2008; Darbar et al., 2008; Johnson et al., 2008; Kaufman 2009; Patel & Pavri, 2009; Roberts & Gollub, 2010; Thejus & Francis). , 2009). Мутации, связанные с переносом ионов, связанным с фибрилляцией предсердий, включают SCN5A, KCNh3, KCNQ1, KCNJ2, KCNE2, KCNA5, HERG + MiRP1, KCNE1 и, возможно, другие (Benito et al., 2008; Дарбар и др., 2008; Джонсон и др., 2008; Кауфман 2009; Патель и Паври, 2009; Тейюс и Фрэнсис, 2009). Хотя эти мутации влияют на высоту и продолжительность потенциала действия сердечных миоцитов, продолжительность клеточной реполяризации и скорость проведения сердечного импульса, точная связь аномалий ионных каналов с развитием фибрилляции предсердий неизвестна. Тот факт, что эти генетические варианты были обнаружены в семьях пациентов с фибрилляцией предсердий, может способствовать новым подходам к диагностике, профилактике и лечению (Otway et al., 2007).
Механизмы, отличные от усиленной реполяризации потенциала действия предсердий (из-за мутаций увеличения функции) и отсроченной реполяризации потенциала действия предсердий (из-за мутаций потери функции), могут передаваться по наследству. В последнее время особое внимание уделяется гормональному контролю электрофизиологии предсердий, включая гены, контролирующие уровни предсердных натрийуретических пептидов и экспрессию минералокортикоидных рецепторов у пациентов с фибрилляцией предсердий (Hodgson-Zingman et al., 2008; Roberts & Gollob, 2010; Tsai et al., 2010). Повторная экспрессия спящих генов плода может быть одним из механизмов, связанных с развитием фибрилляции предсердий у взрослых, как было продемонстрировано появлением изоформы тропонина ssTnI плода у пациентов с фибрилляцией предсердий (Thijssen et al., 2004). Эти изменения могут быть первичными причинами фибрилляции предсердий или могут представлять вторичные изменения, связанные с другими изменениями метаболизма, функции или растяжения миокарда.
4. Мерцательная аритмия у плода
Мерцательная аритмия у плода встречается редко, но нередко.В зависимости от отчета, трепетание или фибрилляция предсердий плода составляет от 20 до 33% всех тахиаритмий плода (Azancot-Benistry et al., 1992; Belhassen et al., 1982; Silverman et al., 1985; Simpson et al. , 1998) и может быть обнаружен при обычном акушерском осмотре как нерегулярное или учащенное сердцебиение плода. Как правило, любое врожденное заболевание сердца может предрасполагать к развитию фибрилляции предсердий в этот период, но некоторые специфические заболевания обычно считаются более высокорисковыми.Синдром Вольфа-Паркинсона-Уайта (WPW) впервые был отмечен как наличие внутриутробной фибрилляции предсердий, и несколько других наблюдений были сделаны, когда эхокардиография плода стала полностью принятой клинической техникой. Дефекты межпредсердной перегородки, дефекты межжелудочковой перегородки, атриовентрикулярный канал, аномалия Эбштейна, cor triatriatum и любая анатомия отдельного желудочка (наиболее заметно гипоплазия левого сердца) — все это считается более высоким, чем средний риск развития предсердной тахиаритмии у плода. Наиболее частая аритмия, определенная в нескольких сериях исследований, — это преждевременные сокращения предсердий, которые чаще всего носят доброкачественный характер, но могут преобразоваться в предсердную тахиаритмию (Belhassen et al., 1982; Silverman et al., 1985). Обнаружение аритмии плода в основном выполняется клинически с использованием ультразвука в большинстве случаев и хорошо подтверждено в нескольких отчетах. Были продемонстрированы физиологические корреляции, наиболее серьезной из которых является водянка плода (Azancot-Benistry et al., 1992; Frohn-Mulder et al., 1995; Hajdu et al., 1997; Hansmann et al., 1991; Jaeggiet al. , 1998; Kleinman et al., 1999; Matta et al., 2010; Naumburg et al., 1997; Reed et al., 1987; Soyeur D, 1996; Szabo et al., 1997; van Engelen et al., 1994; Зилинский и др., 1998). Как обсуждалось выше, семейная фибрилляция предсердий наблюдается внутриутробно при отсутствии наследственных структурных заболеваний сердца и может быть показанием для направления на акушерский скрининг высокого риска (Aburawi et al., 2006; Bertram et al., 1996; Soyeur, 1996; Tikanoja et al., 1998).
Так как водянка плода часто приводит к разрушительному и часто фатальному диагнозу, раннее выявление трепетания предсердий плода и других наджелудочковых тахиаритмий плода имеет важное значение для профилактики.Опубликованная смертность, которую обычно связывают с трепетанием предсердий плода, находится в диапазоне 8-10%, и хотя некоторые предполагают, что ее труднее контролировать и с большей вероятностью приведет к гибели плода, вторичной по отношению к этому явлению, недавняя мета Анализ опубликованных данных показал, что общий риск трепетания предсердий схож со всеми другими типами предсердной тахиаритмии, если их принимать вместе (Krapp et al., 2003).
Поскольку УЗИ плода — это, по сути, механическое наблюдение предполагаемого электрического явления, основанное на наших знаниях о внематочной жизни, в настоящее время ведется много исследований по совершенствованию методов, которые позволят нам неинвазивно контролировать плод с подозрением на аритмию.Одним из наиболее интересных достижений стала магнитокардиография плода. По мере развития технологии магнитно-резонансной томографии (МРТ) МРТ сердца стала жизнеспособной областью для внематочной оценки сердца. На сегодняшний день артефакты движения, связанные с движениями плода, сговорились сделать тонкую детальную анатомическую оценку структур сердца плода как просто цель, но физика обнаружения магнитной сигнатуры электрических импульсов плода оказалась очень многообещающей, хотя и несколько громоздкие (Kahler et al., 2001; Wakai et al., 2003). Магнитокардиография плода (ММКГ) в последние годы продвинулась вперед семимильными шагами, и ее можно надежно проводить, начиная с 20 недель беременности в правильных условиях. Этот метод по существу использует преимущество физического факта, что электрическое движение генерирует магнитное поле, и что когда на это магнитное поле воздействует второе, сфокусированное и известное магнитное поле, такое как сканер МРТ, конечные векторы могут быть преобразованы, чтобы дать приближение, подобное на поверхностную ЭКГ, которую затем можно интерпретировать аналогичным образом.Это упрощение сложных концепций, и может создаться впечатление, что этот метод должен быть легко и широко доступен. Однако этот метод, хотя и многообещающий, в настоящее время носит только исследовательский характер. Однако это одна из немногих исследуемых областей, которая может дать нам потенциальный скачок как в обнаружении, так и в понимании аритмий плода.
Было предпринято и рекомендовано множество различных методов лечения трепетания и фибрилляции предсердий плода, и это состояние может быть наиболее точным отражением медицинского трюизма о том, что чем больше количество возможных методов лечения, тем меньше вероятность того, что какое-либо из них будет успешным.Парадигма, которой придерживаются в настоящее время, заключается в том, что за любой периодической тахикардией плода, которая проявляется менее чем в половине случаев и не оказывает очевидного воздействия на плод, внимательно следят, но в остальном не лечат. (Cuneo & Strasburger, 2000). Если лечение показано из-за сердечной или клапанной дисфункции, потенциально ведущей к водянке, в настоящее время основой терапии в США является дигоксин. Он обладает превосходной способностью проникать через плаценту и в целом продемонстрировал хорошую эффективность.По тем же показаниям в Европе предпочтительным вмешательством стал флекаинид (Strasburger & Wakai, 2010). Трепетание предсердий или фибрилляция, резистентная к дигоксину или флекаиниду при отсутствии желудочковой дисфункции, в настоящее время рекомендуется попытаться контролировать аритмию с помощью соталола и амиодарона (Cuneo & Strasburger, 2000; Srinivasan & Strasburger, 2008; Strasburger et al., 2004; Strasburger. И Вакай, 2010).
Было несколько сообщений об альтернативных методах перорального введения матери с разной степенью успеха (Hallak et al., 1991; Parilla et al., 1996; Weiner et al, 1988), но большинство из них были встречены без особого общего энтузиазма по поводу повышенного риска, когда показатель успеха традиционной терапии превышает 90% (Cuneo & Strasburger, 2000; Kleinman & Nehgme, 2004; Maeno et al. al., 2009; Srinivasan & Strasburger, 2008; Strasburger et al., 2004; Strasburger & Wakai, 2010). Недавний отчет предполагает, что исход развития нервной системы у детей с аритмией плода очень хороший (Lopriore et al., 2009).
5. Фибрилляция предсердий у новорожденных
Диагностика фибрилляции предсердий у новорожденного проще, чем у плода, благодаря удобству прямого доступа к пациенту. Можно получить электрокардиограмму в 12 отведениях и значительно повысить точность диагностики. Редко показано неонатальное инвазивное электрофизиологическое исследование, но мониторинг пищевода и стимуляция могут быть выполнены относительно легко. Кроме того, переход от кровообращения плода к кровообращению новорожденных приводит к дополнительному растяжению и нагрузке на левое предсердие (и легочные вены) из-за более низкого легочного сопротивления и увеличения легочного кровотока.(Estlin et al., 1998; Larmay & Strasberger, 2004). У новорожденных могут наблюдаться две ятрогенные причины фибрилляции или трепетания предсердий. Наиболее частые из них связаны с введением катетера пупочной вены (UVC) в правое предсердие. Нередко обнаруживается, что даже тщательно измеренная линия UVC попадет в правое предсердие и вызовет преждевременные сокращения предсердий, трепетание предсердий или фибрилляцию предсердий, которые будут прерывистыми и спонтанно разрешаются, когда катетер перемещается за пределы предсердия (da Сильва и Вайсберг, 2010 г .; Синха и др., 2005). Вторая основная причина — стресс от хирургических вмешательств в неонатальном периоде. Если у новорожденного есть структурное заболевание сердца, частота трепетания или фибрилляции предсердий значительно выше, но менее интуитивно понятно структурно нормальное сердце ребенка, которое должно пройти анестезию и хирургическую коррекцию других состояний. В нескольких описаниях клинических случаев подчеркивается вариабельность в отношении анатомического и электрофизиологического субстрата и ответа на вмешательство (Bronzetti et al., 2009; Лармей и Страсбургер, 2004 г .; Mainzer et al., 2008). Внезапные изменения объема и возможные сердечные эффекты как вдыхаемых, так и парентеральных анестетиков, связанные с хирургическим вмешательством, могут легко перегрузить даже нормальное неонатальное сердце и привести к аритмиям, включая трепетание и фибрилляцию предсердий. Внутригрудные процедуры могут увеличить этот риск, поскольку случайный механический контакт с предсердиями новорожденного вызывает аритмию (Estlin et al., 1998; Gilbert-Barness & Barness 2006; Texter et al., 2006).
Однако повышенный риск у новорожденных не ограничивается только их маленьким размером и относительной хрупкостью. Считается, что незрелый миокард, и особенно атриовентрикулярный узел, также больше подходит для быстрого поведения и, следовательно, подвергает новорожденного особенно высокому риску быстрого желудочкового ответа любой предсердной тахиаритмии, что, в свою очередь, подвергает ребенка высокому риску внезапное и резкое падение сердечного выброса. Если результирующий сердечный выброс недостаточен для доставки кислорода тканям, пострадавший младенец будет подвергаться значительному риску как развития неустранимого ритма, так и повреждения конечного органа, если ритм не будет преобразован своевременно.Крупнейшее на сегодняшний день исследование новорожденных выявило 50 детей в течение 25 лет, у которых развилось трепетание предсердий (которое наблюдается чаще, чем фибрилляция предсердий у новорожденных) без предшествующей кардиохирургической операции и только дефект межпредсердной перегородки, обнаруженный как связанный врожденный дефект (Texter et al. др., 2006). Были получены отличные результаты при электрической кардиоверсии (20 из 23, 87%), умеренный успех при чреспищеводной стимуляции (7 из 22, 32%) и только 7 из 50 (14%) нуждались в хронической антиаритмической терапии. Из тех, кто испытал рецидив трепетания предсердий (6 из 50, 12%), у всех развилась дополнительная наджелудочковая аритмия.Большая часть начального трепетания предсердий (36 из 50, 72%) возникла в течение первых 48 часов жизни, а подавляющее большинство (5 из 6, 83%) рецидивирующего трепетания предсердий произошло в течение 24 часов после начальной кардиоверсии. Еще пять младенцев, у которых не было повторного трепетания предсердий (10%), у них развился второй наджелудочковый ритм (Texter et al., 2006).
Лекарства, которые нелегко проникают через плаценту, теперь доступны для применения у новорожденных, если первичная электрическая кардиоверсия не дает результатов или у ребенка стабильная аритмия, и принято клиническое решение попробовать химическую кардиоверсию в качестве терапии первой линии.Аденозин может быть полезен для замедления желудочковой реакции (что может помочь определить основную аритмию), но может быть бесполезным для прекращения предсердной тахиаритмии. Частота желудочковых сокращений может быть снижена с помощью бета-блокады, но гипотензия и гипогликемия даже более распространены у новорожденных, чем у пожилых пациентов, и их следует тщательно контролировать в начале терапии. Независимо от первоначального выбора терапии, предсердные тахиаритмии может быть трудно контролировать, и часто может потребоваться метод проб и ошибок, прежде чем выбрать правильный терапевтический препарат или комбинацию лекарств.Как только установлен контроль аритмии, этим пациентам может быть разрешено «перерасти» свои схемы приема лекарств после тщательной корректировки веса и наблюдения в амбулаторных условиях в течение нескольких месяцев. По мере созревания и созревания проводящей системы предсердий у большого количества из них нет сообщений о рецидивах.
6. Фибрилляция предсердий у детей с миокардитом, кардиомиопатией и опухолями сердца
Младенцы и дети составляют небольшой процент пациентов с фибрилляцией предсердий (Martin, 2001).В основополагающем отчете Рэдфорда и Изукавы о фибрилляции предсердий у детей был рассмотрен спектр состояний, связанных с этой аритмией (Radford & Izukawa, 1977). В 35 зарегистрированных случаях фибрилляции предсердий у детей сопутствующие состояния включали ревматическую болезнь сердца, кардиомиопатию, опухоли предсердий, инфекционный эндокардит, синдром Марфана, эндокардиальный фиброэластоз и структурные врожденные пороки сердца (Radford & Izukawa, 1977). Кардиомиопатия (шесть пациентов), опухоли сердца (три пациента), миокардит и эндокардит (четыре пациента) составили 37% от их зарегистрированных серий.Один конкретный тип миокардита, острая ревматическая лихорадка и последующий ревматический порок сердца, снизился до очень низкого уровня в развитых странах и не будет обсуждаться в этом обзоре.
Миокардит, кардиомиопатия и опухоли сердца могут проявляться фибрилляцией предсердий. Миокардит часто бывает труднее всего диагностировать и часто требует серьезного клинического подозрения. Фульминантный миокардит может прогрессировать до потенциально фатальной сердечной недостаточности, часто предвещаемой трудно контролируемыми аритмиями, включая фибрилляцию предсердий (Ichikawa et al., 2011). Острое начало и вероятная вирусная этиология являются ключевыми в истории болезни, но часто миокардит может проявляться только внезапным началом предсердной тахиаритмии. Разрешение часто бывает столь же внезапным, если воспаление отступает и не происходит рубцевания миокарда. Это особенно актуально, если воспаленный миокард ограничен задней частью левого предсердия. У этих детей не было бы никаких других симптомов, кроме фибрилляции или трепетания предсердий, возможно, с клиническими или лабораторными доказательствами вирусного синдрома.Даже биопсия миокарда может быть отрицательной, так как они редко, если вообще когда-либо, берутся из предсердий из-за чрезвычайного риска этого маневра. На патологические образцы можно предположить миокардит (Chimenti et al., 2010; Frustaci et al., 1997). Возможно, что МРТ сердца может оказаться полезным при неинвазивной диагностике миокардита. В последнее время возникли некоторые разногласия по поводу общепринятого мнения о том, что фибрилляция предсердий на фоне миокардита вызывается воспалением, которое является отличительной чертой заболевания.Существует вероятность того, что аритмии вызваны не активным воспалением, а процессом ремоделирования и заживления, который происходит после того, как воспаление отступает (Boos et al., 2006; Boos & Lip, 2008; McCabe et al., 2008; Hoyano et al. др., 2010; Яп, 2009). Прогрессирующий характер структурного ремоделирования предсердий, по-видимому, лежит в основе прогрессирования фибрилляции предсердий в других условиях (de Vos et al, 2010; Wolf et al., 2009).
Миокардит на фоне других структурных или электрофизиологических аномалий может представлять особые проблемы.Было высказано предположение, что миокардит предсердий и предсердные тахиаритмии в условиях преждевременного возбуждения желудочков могут вызывать внезапную смерть у восприимчивых детей и молодых людей (Basso et al., 2001). Для некоторых детей с врожденными пороками сердца миокардит представляет собой более высокий риск. Дети с физиологией одного желудочка, как правило, больше полагаются на сокращение предсердий для поддержания сердечного выброса и, возможно, перенесли обширную кардиохирургическую операцию. Рубцы предсердий также характерны для тех, кто перенес процедуры переключения предсердий.Обширные линии швов, рубцы предсердий, хроническое растяжение увеличивают риск воспаления и ремоделирования, связанных с миокардитом. Лечение основного миокардита может потребоваться для контроля стойкой аритмии (Korantzopoulos et al., 2005).
Миокардит и кардиомиопатия могут быть связаны с острым воспалением, приводящим к хронической дисфункции миокарда. Однако во многих случаях кардиомиопатия не развивается после миокардита. Неконтролируемые предсердные тахиаритмии, особенно с быстрым желудочковым ответом, могут вызвать опосредованную тахикардией кардиомиопатию.Генетика кардиомиопатии и генетика фибрилляции предсердий связаны сложными способами, которые в настоящее время идентифицируются. Некоторые недавние исследования показали связь между кардиомиопатией и аритмией (Banwell et al., 1999; Karst et al., 2008; McNair et al., 2011). Все виды кардиомиопатии могут вызывать аритмию. Как и у детей с физиологией одного желудочка, у детей с кардиомиопатией сердечный выброс зависит от сокращения предсердий. Поскольку давление, растяжение и ремоделирование предсердий происходят с ухудшением функции желудочков, частота фибрилляции предсердий увеличивается.Нагрузка на предсердную камеру увеличивает вероятность воспаления предсердий и прогрессирования до неинфекционного миокардита (Hsu, 2010). Было показано, что фибрилляция предсердий является основным клиническим фактором риска заболеваемости при гипертрофической кардиомиопатии (Kubo et al., 2009).
Опухоли сердца проще понять и диагностировать. Печально известная «опухоль» может присутствовать при медицинском осмотре. Они могут затруднять кровоток в полости желудочка или попадать в атриовентрикулярный клапан, вызывая значительную регургитацию.Опухоли легко распознать с помощью эхокардиографии по их отчетливому внешнему виду. В зависимости от типа и местоположения опухоли симптомы могут быть разными. Внутрисердечные опухоли, которые являются миксоматозными, могут быть на ножке и подвижными и могут сильно колебаться вокруг пораженного предсердия, потенциально отскакивая от внутренних стенок и вызывая фибрилляцию предсердий этим контактом (Vermeulen et al., 2009; Yu et al., 2006). Лечение этих опухолей преимущественно хирургическое, и таким образом был достигнут разумный успех (Chuaratanaphong et al., 1995; Ipek et al., 2005). Сердечные рабдомиомы являются отличительной чертой туберозного склероза, и их естественная история заключается в том, что они исчезают с момента рождения.

 fibrillaris tachysystolica; син. тахиаритмия мерцательная) — фибрилляция предсердий, характеризующаяся учащением сердечных сокращений (более 100 в 1мин. в покое) и сопровождающаяся дефицитом пульса.
fibrillaris tachysystolica; син. тахиаритмия мерцательная) — фибрилляция предсердий, характеризующаяся учащением сердечных сокращений (более 100 в 1мин. в покое) и сопровождающаяся дефицитом пульса. ) зубцов мерцания предсердий; обычно наблюдается при пороках сердца с перегрузкой предсердий.
) зубцов мерцания предсердий; обычно наблюдается при пороках сердца с перегрузкой предсердий. В клинических исследованиях ФП определяется как эпизод, превышающий по длительности 30 с.
В клинических исследованиях ФП определяется как эпизод, превышающий по длительности 30 с. н. триггерных факторов аритмии,
н. триггерных факторов аритмии,