Легочные сурфактанты » Справочник ЛС
Основное клиническое значение препаратов легочного сурфактанта определяется их эффективностью при тяжелых респираторных заболеваниях, связанных с первичным или вторичным дефицитом альвеолярного сурфактанта. К ним относятся следующие заболевания и синдромы:
Респираторный дистресс-синдром недоношенных новорожденных (РДСН), возникающий в результате незрелости легких и, как следствие, выраженного дефицита сурфактанта. Недостаточный синтез сурфактанта альвеолоцитами II типа и его быстрая инактивастного натяжения в альвеолах, их спадению (ателектазам), гиповентиляции и недостаточной оксигенации крови, развитию гиперкапнии и гипоксии. Нарушения в системе легочного кровотока вызывают повреждение всех составных компонентов аэрогематического барьера (эпителий, интерстиций, эндотелий), отек легких и присоединение инфекции. В результате эти изменения приводят к развитию РДС.
Синдром аспирации мекония (САМ) у новорожденных возникает в результате попадания мекония в дыхательные пути, что приводит к нарушению синтеза сурфактанта, его инактивации компонентами мекония, спадению альвеол и развитию воспаления.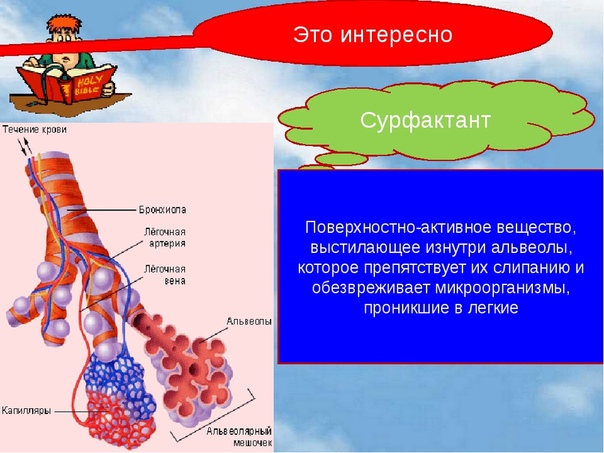 Назначение сурфактанта способствует уменьшению тяжести заболевания, предупреждает развитие острой дыхательной недостаточности (ОДН).
Назначение сурфактанта способствует уменьшению тяжести заболевания, предупреждает развитие острой дыхательной недостаточности (ОДН).
Синдром острого повреждения легких (СОПЛ) и острый респираторный дистресс-синдром (ОРДС) взрослых — как наиболее тяжелая форма проявления СОПЛ. Легкие всегда вовлекаются в патологический процесс у больных, находящихся в критическом состоянии, вне зависимости от его этиологии. СОПЛ является основным компонентом полиорганной недостаточности, развивается в результате вторичного повреждения легких, включая все компоненты аэрогематического барьера и альвеолярного сурфактанта. Важное место в патогенезе СОПЛ/ОРДС принадлежит воспалительной реакции и вторичному дефициту сурфактанта, который возникает в результате местного (пневмония, вдыхание токсических веществ) или системного (множественная травма, сепсис, длительная искусственной вентиляци легких (ИВЛ), осложнение после искусственного кровообращения и при посттрансфузионном синдроме) повреждения легких с развитием воспалительной реакции. Возникающий дефицит сурфактанта приводит к спадению альвеол, мелких дыхательных путей, отеку легких, развитию ОДН.
Возникающий дефицит сурфактанта приводит к спадению альвеол, мелких дыхательных путей, отеку легких, развитию ОДН.
Пневмония сопровождается повреждением альвеолярной паренхимы, отеком легких с выходом белков плазмы крови в альвеолы, что оказывает угнетающее действие на активность сурфактанта и к спадению альвеол. Назначение сурфактанта в этих случаях приводит к улучшению газообмена, способствуя расправлению спавшихся альвеол, т.е. разрешению ателектазов.
Туберкулез легких, особенно его распространенные формы, вызывает глубокие нарушения в сурфактантной системе легких, обширные деструктивные и ателектатические изменения альвеолярной паренхимы, особенно в участках легкого, граничащих с крупными туберкулезными фокусами (инфильтраты, каверны и др.). Применение препаратов сурфактанта в комплексном лечении туберкулеза позволяет уменьшить частоту возникновения сурфактант-зависимых изменений в легких, повысить поверхностно активные свойства легочного сурфактанта и способствует более быстрому обратному развитию воспалительных изменений.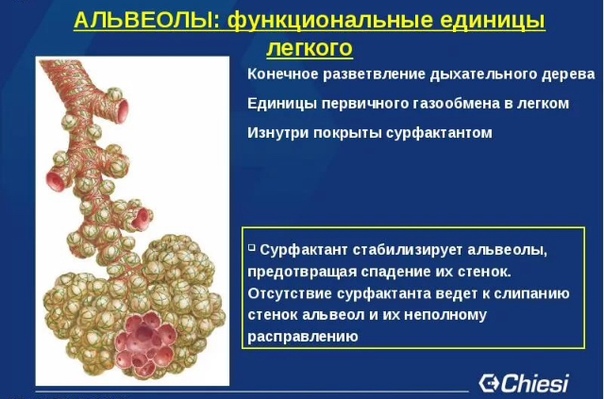
В настоящее время разработаны основные принципы сурфактантотерапии:
- исчерпывающая базовая терапия;
- использование принципов неповреждающей механической вентиляции;
- раннее начало сурфактантотерапии (первые часы, сутки с момента развития РДС), при индексе оксигенации РаО2/ FiО2 ниже 200 мм рт. ст.;
- эндобронхиальное болюсное введение препарата в оптимальной дозе и повторное введение через 6—8 ч в случае положительного ответа на первое введение;
- сурфактантотерапия при положительном ответе на первое введение должна проводиться до достижения индекса оксигенации более 300 мм рт. ст., стойкого клинико-рентгенологического улучшения.
Сурфактант-БЛ инструкция по применению: показания, противопоказания, побочное действие – описание Surfactant-BL лиофилизат д/пригот. эмульсии д/ингал. введения 25 мг: фл. 10 шт. (20810)
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Респираторный дистресс-синдром новорожденных, находящихся на ИВЛ: эндотрахеально (распылением микроструйно через эндотрахеальную трубку и боковой адаптер) и ингаляционно (в виде аэрозоля с помощью бронхоальвеолярного небулайзера). Микроструйно вводят медленно — дозу 75 мг в объеме 2.5 мл в течение 60-90 мин, в виде аэрозоля через альвеолярный небулайзер — в той же дозе в течение 2-3 ч. Препарат вводят 1-2 раза в дозе 75 мг/кг в виде 3% эмульсии (30 мг в 1 мл 0.9% раствора натрия хлорида). В случае тяжелого респираторного дистрсс-синдрома (2-го типа, обусловленного смешанной этиологией — незрелость легких и наличие инфекций) — 100 мг/кг. Повторно препарат вводят с интервалом 6-10 ч, при необходимости — через несколько суток.
Правила приготовления эмульсии
Непосредственно перед введением 75 мг лиофилизированного порошка разводят 2.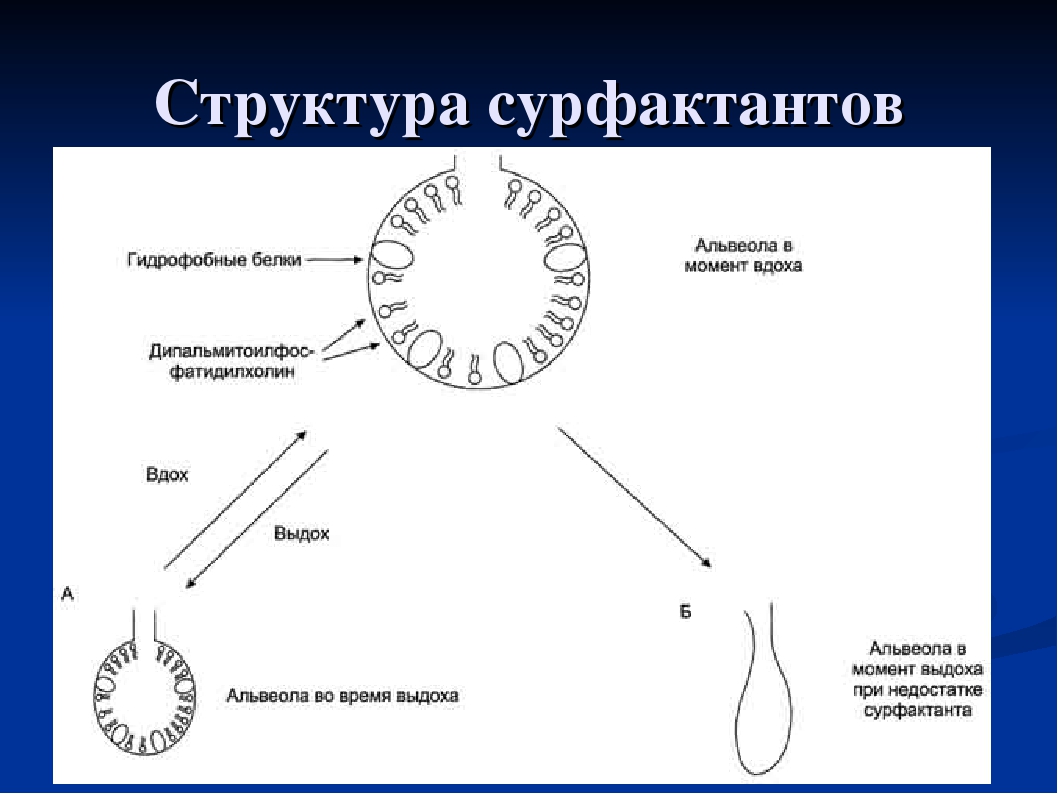 5 мл 0.9% раствора натрия хлорида д/и. Для этого вносят во флакон 2.5 мл теплого (36°С) 0.9% раствора натрия хлорида и дают флакону постоять 2-3 мин, затем суспензию осторожно перемешивают во флаконе, не встряхивая, набирают эмульсию в шприц тонкой иглой, выливают обратно во флакон по стенке несколько раз (4-5) до полного равномерного эмульгирования, избегая образования пены. Флакон нельзя встряхивать. После разведения образуется молочного цвета эмульсия, лишенная хлопьев или твердых частиц.
5 мл 0.9% раствора натрия хлорида д/и. Для этого вносят во флакон 2.5 мл теплого (36°С) 0.9% раствора натрия хлорида и дают флакону постоять 2-3 мин, затем суспензию осторожно перемешивают во флаконе, не встряхивая, набирают эмульсию в шприц тонкой иглой, выливают обратно во флакон по стенке несколько раз (4-5) до полного равномерного эмульгирования, избегая образования пены. Флакон нельзя встряхивать. После разведения образуется молочного цвета эмульсия, лишенная хлопьев или твердых частиц.
Введение препарата
Новорожденного предварительно интубируют и непосредственно перед введением Сурфактанта-БЛ аспирируют мокроту из дыхательных путей и эндотрахельной трубки. Через адаптер с дополнительным боковым входом в трахею с помощью шприцевого насоса или капельно, в течение 60-90 мин, проводят инфузию приготовленного препарата. Для равномерного распределения сурфактанта по различным отделам легких, во время инфузии препарата ребенку, если позволяет тяжесть состояния, на несколько минут осторожно меняют положение тела: поворот на правый-левый бок, подъем головного конца. Заканчивают процедуру несколькими принудительными вдохами больного. Желательно не проводить санацию трахеи в течение нескольких часов после введения сурфактанта.
Заканчивают процедуру несколькими принудительными вдохами больного. Желательно не проводить санацию трахеи в течение нескольких часов после введения сурфактанта.
Аэрозольное введение осуществляют с помощью небулайзера, включенного в контур аппарата ИВЛ максимально близко к эндотрахеальной трубке для уменьшения потерь препарата. Желательно использовать аппараты, позволяющие подавать аэрозоль сурфактанта синхронно с вдохом. Для получения аэрозоля и введения препарата необходимо использовать только не УЗ-бронхоальвеолярные небулайзеры, т.к. сурфактант разрушается при обработке эмульсии УЗ.
Синдром острого повреждения легких и респираторного дистресс-синдрома взрослых: эндобронхиально, с помощью фибробронхоскопа, в дозе 12 мг/кг массы тела в сутки, разделенной на 2 введения по 6 мг/кг, выполняемых через 12-16 ч. Препарат вводится в виде 1.5% эмульсии (15 мг в 1 мл 0.9% раствора натрия хлорида).Может потребоваться многократное введение препарата (4-6 введений) до стойкого улучшения газообмена (до увеличения индекса оксигенации более 300 мм рт.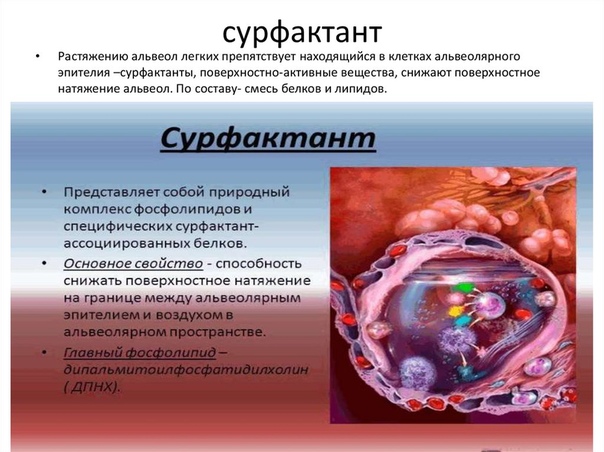 ст.), рентгенологической картины и возможности проведения ИВЛ с FiO2 менее 40%.
ст.), рентгенологической картины и возможности проведения ИВЛ с FiO2 менее 40%.
В большинстве случаев продолжительность курса применения Сурфактанта-БЛ не превышает двух суток. У 10-20% пациентов назначение препарата не сопровождается нормализацией газообмена (особенно больных с выраженной полиорганной недостаточностью). Если в течение 2 дней не происходит улучшение оксигенации, введение препарата прекращают.
Правила приготовления эмульсии
75 мг лиофилизированного порошка разводят так же, как для новорожденных, в 2.5 мл 0.9% раствора натрия хлорида. Полученную эмульсию разводят дополнительно 0.9% раствора натрия хлорида до 5 мл, получая 1.5% эмульсию препарата (15 мг в 1 мл 0.9% раствора натрия хлорида).
Введение препарата
Эндобронхиальному введению препарата предшествует тщательная санационная бронхоскопия, проводимая по стандартной методике, в конце которой в каждое легкое вводится равное количество эмульсии препарата. Наилучший эффект достигается при введении эмульсии в каждый сегментарный бронх. Объем вводимой эмульсии определяется дозой препарата.
Объем вводимой эмульсии определяется дозой препарата.
Интратрахеальная инстилляция показана в случае отсутствия возможности проведения бронхоскопии. Эмульсия готовится по описанному выше способу. До введения препарата необходимо провести тщательную санацию трахеобронхиального дерева, предварительно приняв меры для улучшения дренирования мокроты (вибромассаж, постуральная терапия, муколитики при отсутствии противопоказаний к их назначению). Эмульсию вводят через катетер, устанавливаемый в эндотрахеальную трубку так, чтобы конец катетера располагался ниже отверстия эндотрахеальной трубки, но обязательно выше киля трахеи. Эмульсию необходимо вводить в 2 приема (разделив дозу пополам), с интервалом 10 мин.
При туберкулезе (после подбора многокомпонентной антимикобактериальной терапии) — ингаляционно до или через 1.5-2 ч после приема пищи в дозе 25 мг 5 раз в неделю первые 2 нед, затем 3 раза в неделю в последующие 6 нед. Продолжительность курса — 8 нед, 28 ингаляций.
Лёгочный сурфактант — это.
 .. Что такое Лёгочный сурфактант?
.. Что такое Лёгочный сурфактант?
Сурфакта́нт (в переводе с английского — поверхностно-активное вещество[1]) — смесь поверхностно-активных веществ, находящаяся на границе воздух-жидкость в лёгочных альвеолах, то есть выстилающая альвеолы изнутри. Препятствует спадению (слипанию) альвеол за счёт снижения поверхностного натяжения жидкости. Сурфактант секретируется специальной разновидностью альвеолоцитов II типа.
Состав
Состоит из фосфолипидов, белков и полисахаридов.
Состав лёгочного сурфактанта[2]:
Фосфолипиды: 85 % | % Фосфолипидов |
|---|---|
| Фосфатидилхолин: | 7,3 |
| дипальмитоилфосфатидилхолин | 47,0 |
| ненасыщенный фосфатидилхолин | 29,3 |
| Фосфатидилглицерол | 11,6 |
| Фосфатидилинозитол | 3,9 |
| Фосфатидилэтаноламин | 3,3 |
| Сфингомиелин | 1,5 |
| Другие | 3,4 |
Нейтральные липиды: 5 % | |
| Холестерол, свободные жирные кислоты | |
Белки: 10 % | |
| Сурфактантный белок А | ++++ |
| Сурфактантный белок В | + |
| Сурфактантный белок С | + |
| Сурфактантный белок D | ++ |
| Другие | |
Точный состав белков сурфактанта пока не известен | |
Свойства
Сурфактант синтезируется и секретируется пневмоцитами (альвеолоцитами) II типа. За счёт поверхностно-активного натяжения сурфактант понижает поверхностное натяжение в альвеоле, предупреждая её «спадение». Сурфактант также имеет защитное действие. Высокие поверхностно-активные свойства сурфактанта объясняются присутствием в нём дипальмитоилфосфатидилхолина, который образуется в лёгких доношенного плода непосредственно перед родами.
За счёт поверхностно-активного натяжения сурфактант понижает поверхностное натяжение в альвеоле, предупреждая её «спадение». Сурфактант также имеет защитное действие. Высокие поверхностно-активные свойства сурфактанта объясняются присутствием в нём дипальмитоилфосфатидилхолина, который образуется в лёгких доношенного плода непосредственно перед родами.
Система сурфактантов у недоношенных детей не развита, что часто является причиной гибели недоношенных детей без лечения. Система сурфактанта может повреждаться и у взрослых при травмах, в том числе химических и термических, а также при некоторых заболеваниях.
Сурфактант помогает лёгким всасывать, усваивать кислород. В последнее время мода на безжировое питание приводит к возникновению гипоксий у людей, которые не употребляют в пищу качественные жиры. В то же время сурфактант примерно на 90% состоит из жиров.
Строение
Располагающийся на поверхности альвеолярного эпителия сурфактант включает 2 фазы:
Гипофаза
Нижняя, состоит из тубулярного миелина, имеющего решетчатый вид и сглаживающего неровности эпителия.
Апофаза
Поверхностная мономолекулярная плёнка фосфолипидов, обращённая в полость альвеолы гидрофобными участками.
Функции
- Уменьшение поверхностного натяжения плёнки тканевой жидкости, покрывающей альвеолярный эпителий, что способствует расправлению альвеол и препятствует слипанию их стенок при дыхании.
- Бактерицидная.
- Иммуномодулирующая.
- Стимуляция активности альвеолярных макрофагов.
- Формирование противоотёчного барьера, который предупреждает проникновение жидкости в просвет альвеол из интерстиция.
Примечания
См. также
Литература
- Быков В. Л. Частная гистология человека. — СПб.: СОТИС, 1999. — С. 144. — ISBN 5-85503-116-0
Ссылки
Легче легкому: российский препарат в пять раз снизил смертность от COVID-19 | Статьи
Отечественный препарат, созданный для лечения тяжелых поражений легких, оказался эффективен и против COVID-19. Больные ощущали улучшение сразу после ингаляций сурфактанта-БЛ, полученного российскими учеными из легких крупного рогатого скота. Об этом свидетельствует опыт медиков Петербурга, Москвы, Тюмени и Сыктывкара. Согласно среднемировой практике, 80% пациентов с тяжелой формой COVID умирают. Применение лекарства помогло снизить смертность в этой категории больных до 14,3%. По окончании исследования планируется включить применение сурфактанта-БЛ в рекомендации Минздрава по лечению больных коронавирусной инфекцией.
Об этом свидетельствует опыт медиков Петербурга, Москвы, Тюмени и Сыктывкара. Согласно среднемировой практике, 80% пациентов с тяжелой формой COVID умирают. Применение лекарства помогло снизить смертность в этой категории больных до 14,3%. По окончании исследования планируется включить применение сурфактанта-БЛ в рекомендации Минздрава по лечению больных коронавирусной инфекцией.
Бычье здоровье
Судя по среднемировой практике, в общей массе больных COVID-19 тяжелые случаи составляют около 5%. Почти 80% из них умирают. Опыт медицинского центра Алмазова, где пациентов с COVID-19 лечили с мая по август, подтвердил пропорцию тяжелых пациентов, а смертность в этой категории больных здесь удалось снизить до 14,3%.
— В группе из 28 пациентов с тяжелым течением инфекции COVID-19, получавших терапию сурфактантом, 24 выздоровели, — сообщил «Известиям» заведующий научно-исследовательской лабораторией анестезиологии и реаниматологии НМИЦ им. В.А. Алмазова Андрей Баутин.
А.Е. Баутин в реанимации
Фото: НМИЦ им. В.А. Алмазова
Сурфактант-БЛ — природный препарат, получаемый из легких крупного рогатого скота (сурфактант — жидкость, выстилающая легочные альвеолы изнутри, БЛ — бычье легкое. — «Известия»). Его давно применяют при поражениях легких, но, как выяснилось, сурфактант-БЛ оказался также эффективен и при лечении коронавируса.
Как рассказал Андрей Баутин, его вводили пациентам ингаляционно, процедура занимала по 30 минут дважды в сутки. Кому-то хватило двух суток лечения, в некоторых случаях препарат вводили до пяти дней. Четверо умерших пациентов стали жертвами наиболее агрессивных проявлений болезни — катастрофической гипериммунной реакции, именуемой цитокиновым штормом, и развившегося вследствие борьбы с ним сепсиса в сочетании с тромбозом.
В клинике Сеченовского университета из 32 тяжелых больных, получавших сурфактант-БЛ, выжили 30. Именно здесь главный пульмонолог Минздрава России Сергей Авдеев впервые применил ингаляционный способ введения препарата вместо бронхоскопического, что комфортнее для пациентов, удобнее и проще для персонала, а также позволяет поймать и развернуть в обратную сторону процесс на более ранних стадиях. Ранее для больных с послеоперационными поражениями легких аэрозольный путь введения считался не очень эффективным. Но COVID-19 эти представления перевернул.
В Перинатальном центре Тюмени сурфактантом пролечили 16 беременных женщин и родильниц с тяжелыми формами COVID-19. Ни одна из пациенток не была переведена на искусственную вентиляцию легких, все они выжили.
— Эффект от сурфактанта однозначно есть, он оказывает защитное действие и альвеолы не слипаются, — отметила в беседе с «Известиями» заместитель главного врача Перинатального центра Тюмени, руководитель анестезиолого-реанимационной службы Марина Швечкова.
Фото: РИА Новости/Владимир Астапкович
Всего за время борьбы с COVID-19 сурфактантом пролечили 120 больных. Эти данные в разговоре с «Известиями» привел разработчик препарата Олег Розенберг, руководитель лаборатории медицинской биотехнологии Российского научного центра радиологии и хирургических технологий им. А.М. Гранова, где и был 20 лет назад создан отечественный препарат.
— Больные, которых лечат сурфактантом, достоверно реже переводятся в реанимацию на ИВЛ, и летальность среди них в 3–5 раз ниже, — сказал Розенберг, пояснив, что обобщенные данные по всем случаям применения препарата еще в процессе сбора. Он с коллегами, работавшими с сурфактантом при лечении ковидных больных, убеждены, что выдвинутая ими в начале пандемии гипотеза о том, что препарат может помочь в борьбе с новой инфекцией, оправдалась на 100%.
В основе гипотезы лежал опыт применения сурфактанта при осложнениях гриппа A/h2N1 в 2009–2010 и 2015–2016 годах, бронхиальной астме, послеоперационных застойных пневмониях, туберкулезе и других тяжелых поражениях легких.
Тройной удар по вирусу
Попадая в легкие, вирус SARS-CoV-2 связывается с рецепторами АПФ2 (ангиотензинпревращающего фермента 2, который является входными воротами для вируса. — «Известия»), которые есть на альвеолоцитах — плоских клетках, выстилающих изнутри альвеолы легких и покрытых сверху слоем сурфактанта, вырабатываемого самими альвеолоцитами. В альвеоле — воздушном мешочке — происходит газообмен: кровь насыщается кислородом и отдает углекислый газ.
— Собственный, эндогенный сурфактант поддерживает альвеолу в расправленном состоянии. Когда вирус проникает в альвеолоцит и убивает его, выработка собственного сурфактанта прекращается, — пояснил «Известиям» Андрей Баутин, описывая механизм повреждения вирусом легочной ткани. — Мембрана между альвеолой и кровеносным сосудом повреждается, и в альвеолу поступает жидкая часть крови — плазма. Альвеола заполняется, перестает участвовать в газообмене и напоминает сдувшийся и слипшийся воздушный шарик. Дальше ненасыщенная кислородом кровь попадает в левые отделы сердца и разносится по организму. Человек ощущает нехватку кислорода, падает сатурация — насыщение крови кислородом.
В отделении ранимации
Фото: НМИЦ им. В.А. Алмазова
По словам Андрея Баутина, если при дыхании кислородом с потоком 6–8 л в минуту у пациента сатурация не поднимается выше 92%, ему показано лечение препаратом сурфактанта.
— Недостаток синтезируемого самим организмом сурфактанта компенсируется внешним препаратом. Это позволяет даже поврежденной вирусом альвеоле оставаться в расправленном состоянии и осуществлять газообмен, насыщать кровь кислородом, — добавил эксперт.
Впрочем, есть еще два способа противодействия вирусу со стороны сурфактанта. Препарат блокирует рецепторы АПФ2, «закрывая» вирусу ворота в альвеолоциты. Поэтому ученые сделали вывод, что сурфактант работает превентивно на более ранней стадии, когда вирус только пытается внедриться в альвеолы.
Третий удар по вирусу препарат наносит, участвуя в иммунной защите легких.
— Клетки макрофаги внутри альвеолы призваны бороться с вирусами и бактериями. Сурфактант их стимулирует, повышая местную иммунную защиту, — пояснил Андрей Баутин.
Центр сердца, крови и эндокринологии им. В.А. Алмазова
Фото: Наталия Михальченко
Этот тезис подтверждает опыт Марины Швечковой.
— Сурфактант препятствует присоединению вторичной бактериальной флоры, — добавила она. — Вторичная бактериальная флора опасна тем, что может привести к сепсису. Она развивается из-за ослабления иммунной системы после медикаментозного удара по ней, чтобы сбить цитокиновый шторм, который является гиперреакцией организма на SARS-CoV-2.
Ингаляционный путь введения препарата, который попадает сразу в легкие, позволил исключить антагонизм с какими-либо другими лекарствами, находящимися в кровеносном русле.
На шаг впереди
В мире существует около 10 препаратов сурфактанта. Все они, включая российский, изначально создавались для помощи недоношенным детям, которые еще не могут самостоятельно дышать из-за незрелости легких. Но только отечественный разрешен к применению у взрослых. Врачи и ученые попробовали его применить при других тяжелых болезнях легких, и это получилось. Сурфактант-БЛ помог как в свое время при свином гриппе, так и сейчас при COVID-19.
— Иностранные коллеги идут в том же направлении, что и мы. Но мы оказались на шаг впереди, — сказал главный пульмонолог Минздрава РФ, заведующий кафедрой пульмонологии лечебного факультета Первого МГМУ им. И.М. Сеченова Сергей Авдеев.
Фото: ТАСС/Сергей Бобылев
Ученый добавил, что гордиться этим времени нет, ведь, несмотря на то что найденное российскими учеными и клиницистами решение позволяет улучшить состояние многих больных, пока нельзя сказать, что все их проблемы решены.
В России с июля развернуто новое рандомизированное исследование применения препарата, сообщил Сергей Авдеев. В его рамках будут пролечены в общей сложности 90 больных, десятая часть уже прошла курс.
По итогам второго исследования планируется включить применение сурфактанта-БЛ в рекомендации Минздрава по лечению больных с COVID-19.
СУРФАКТАНТ-БЛ (СУРФАКТАНТ-BL)
Главная
Сурфактант-БЛ
Сурфактант-БЛ является единственным отечественным препаратом легочного сурфактанта. Он
создан в Центральном рентгенорадиологическом институте Минздрава РФ совместно с
компанией Биосурф. Сурфактант-БЛ — природный препарат, получаемый из легких крупного
рогатого скота.
Препарат разрабатывался для лечения респираторного дистресс-синдрома (РДС)
новорожденных. Причиной этого заболевания является недостаточность легочного
сурфактанта, связанная с незрелостью тканей легкого недоношенного новорожденного.
Респираторный дистресс-синдром взрослых также связан с повреждением сурфактантной
системы легких. Он развивается на фоне сепсиса, множественной травмы, аспирации
желудочного содержимого, ожогов дыхательных путей, тяжелых пневмоний, длительной
искусственной вентиляции легких, осложнений после операций на открытом сердце, в
частности после операций аортокоронарного шунтирования и других. Полагают, что острая
дыхательная недостаточность при атипичной пневмонии (SARS) имеет сходную природу с РДС
взрослых. Смертность от респираторного дистресс-синдрома взрослых достигает 60-90%.
Нарушения в сурфактатной системе обнаружены при туберкулезе и других заболеваний
легких.
Препараты сурфактанта различаются по составу и свойствам. В настоящее время доказано,
что наиболее эффективными являются препараты сурфактанта природного происхождения.
Максимально приближенным по составу к естественному сурфактанту легких является
отечественный препарат Сурфактант-БЛ.
К декабрю 2003 года
препарат применен более, чем у 1800 новорожденных
Препарат также эффективен при постнатальных пневмониях и аспирации мекония.
Своевременное применение Сурфактанта-БЛ при РДС новорожденных позволяет:
- быстро уходить от повреждающих режимов при искусственной вентиляции легких
- существенно (на 28-30 часов по сравнению с контролем) уменьшить время достижения
нетоксической концентрации кислорода (40%) во вдыхаемой газовой смеси - сократить время нахождения новорожденных на аппарате искусственной вентиляции легких
на 2-8 суток - существенно уменьшить частоту таких осложнений искусственной вентиляции легких и
периода новорожденности,как внутрижелудочковые кровоизлияния и бронхолегочная
дисплазия - значительно (в 2-3 раза) уменьшить летальность от респираторного дистресс-синдрома
Сурфактант-БЛ единственный препарат разрешенный для лечения РДС взрослых.
Опыт его применения у более, чем 200 больных показал, что его использование, в течение
первых суток (лучше часов) развития тяжелой гипоксемии, при проведении исчерпывающей
базовой терапии и грамотной ИВЛ позволяет:
до 6-10 суток
уменьшить время нахождения больных на аппаратной ИВЛ
Препарат чрезвычайно эффективен при прямом поражении легких: аспирации желудочного
содержимого, контузии легкого, термохимических ожогах дыхательных путей.
В рамках пилотных клинических испытаний, проведенных в ЦНИИ Туберкулеза РАМН
показано, что Сурфактант-БЛ высокоэффективен при комплексном лечении туберкулеза
легких.
В исследовании приняли участие 60 пациентов, пораженных микобактериями,
характеризующимися множественной лекарственной устойчивостью. Все больные были
бактериовыделителями, безуспешно леченными в течение 3-10 месяцев. Показано, что 8
недельный курс (600-700 мг)
Сурфактанта-БЛ
в комплексе с 4-5 противотуберкулезными препаратами,
позволяет добиться:
85,7%
больных абацилирования
(исчезновения бактерий в мокроте)94,3%
больных рассасывания инфильтратов
82,9%
больных закрытия полостей распада
Обычное лечение туберкулеза легких с множественной лекарственной устойчивостью
проводится длительно (более 2-3 лет), стоит очень дорого и дает эффект в 50-60% случаев.
Эти исследования начаты впервые в мировой практике и с большим интересом были
обсуждены на 13 ежегодном Европейском Респираторном Конгрессе в Вене в сентябре 2003
года.
Сотрудники компании Биосурф совместно с коллективом отдела медицинской
биотехнологии ЦНИРРИ МЗ РФ, и ведущих клиник и институтов Москвы, Санкт-Петербурга,
Екатеринбурга, Челябинска, Иванова, Ростова-на-Дону и многих других городов продолжают
исследования в области расширения показаний к применению российского препарата
Сурфактант-БЛ.
В Санкт-Петербурге производится лекарственный препарат для терапии основного осложнения при коронавирусе
К списку новостей
25Марта
В Санкт-Петербурге производится лекарственный препарат для терапии основного осложнения при коронавирусе
Петербургский биохимик и фармаколог, доктор медицинских наук Олег Розенберг рассказал, что лечение пневмонии, наиболее опасного осложнениякоронавируса, позволит в несколько раз сократить смертность. Ученый напомнил, что в России разработан препарат, доказавший свою эффективность в лечении тяжелой пневмонии во время эпидемий свиного гриппа в 2009-2010 гг. и 2015-2016 гг. в Москве, Санкт-Петербурге, Тюмени, Пскове, Сочи, Нижнем Новгороде и других городах России. Смертность среди больных, получавших легочный сурфактант (ТМ Сурфактант-БЛ) вместе с противовирусным препаратом, была очень низкая, а при своевременном приеме смертность была нулевой. В настоящее время препарат включен в список ЖНВЛП.
Речь идет о разработанном в Российском научном центре радиологии и хирургических технологий им. академика А.М.Гранова(директор института, доктор медицинских наук — Дмитрий Майстренко) в Санкт-Петербурге препарате легочного сурфактанта, прошедшем клинические испытания и разрешенном с 2008г. для лечения некардиогенного отека легких, от которого сегодня, в основном, и умирают больные коронавирусом.Сурфактантпредставляет собой сложный липидно-белковый комплекс,находящийся на поверхностиальвеол. Он обеспечивает вдох за счет снижения поверхностного натяжения и препятствует слипанию стенок альвеол при выдохе. Сурфактантсинтезируется специализированными клетками — альвеолоцитами II типа и выделяется на поверхность альвеолярного эпителия.
Главное осложнение, которое дает коронавирус, — это пневмония. Нередко, она развивается быстро, так как вирус поражает нижние дыхательные пути (гортань, трахею и бронхи), и далее воспаление переходит на альвеолы. Если не удается подавить воспалительный процесс, пневмония переходит внекардиогенный отек легких (медицинское название «острый респираторный дистресс-синдром»), от которого более половины больных, находящихся на ИВЛ (искусственная вентиляция легких), умирают. В группу риска тяжелого течения заболевания входят пациенты старше 60 лет, а также люди с различными хроническими заболеваниями, такими, как диабет, хроническая сердечная недостаточность, хроническая обструктивная болезнь легких и др.
Из Минздрава России в адрес РНЦ им. Гранова был направлен официальный запрос с просьбой сообщить какие препараты были разработаны, какие сейчас находятся в разработке. В ответ ведомственному органу центр направил предложение использовать препарат легочного сурфактанта для предупреждения развития вирусных пневмоний у больных коронавирусом и предотвращения смертности пожилых пациентов от его осложнений. Созданный в Лаборатории медицинской биотехнологии препарат предупреждает развитие осложнений в форме тяжелых пневмоний при респираторном дистресс синдроме. На сегодняшний день ответ от ведомства не поступал.
По словам профессора ОлегаРозенберга, этот препарат сурфактанта является единственным препаратом в мировой практике, разрешенным для применения у взрослых при тяжелых поражениях легких. Российский препарат отличается от других препаратов сурфактанта составом, он получен по оригинальной технологии и обладает высокими лечебными свойствами. «Я убежден, что широкое применениенашего препарата втерапии тяжелой коронавирусной пневмонии позволит многим больным поправить свое здоровье» — добавил эксперт.
Справочная информация:
Сурфактант-БЛ — природный нативный препарат сурфактанта, выделенный из легких крупного рогатого скота, близкий по составу и свойствам сурфактанту легкого человека.
По вопросам приобретения препарата обращаться к официальному дистрибьютеру на территории РФ – ООО «Натива». Официальный сайт компании: www.nativa.pro
СМИ сообщили о снизившем смертность от COVID-19 в пять раз препарате :: Общество :: РБК
Фото: Юрий Белинский / ТАСС
Российский препарат, созданный для лечения тяжелых поражений легких, оказался эффективен при заболевании коронавирусной инфекцией COVID-19. В результате применения этого лекарства среди тяжелых больных удалось снизить смертность в пять раз, сообщают «Известия» со ссылкой на данные медиков Санкт-Петербурга, Москвы, Тюмени и Сыктывкара.
Речь идет о препарате сурфактант-БЛ, полученном российскими учеными из легких крупного рогатого скота. Сурфактант — это жидкость, выстилающая легочные альвеолы изнутри, БЛ расшифровывается как «бычье легкое».
Как сообщают «Известия», в мире существует около десяти препаратов сурфактанта. Они создавались для помощи недоношенным детям, которые еще не могут самостоятельно дышать из-за незрелости легких. При этом только российский препарат разрешен к применению у взрослых.
В Турции выявили коронавирус у 12 туристов из России
Как передает газета, согласно среднемировой практике, в общей массе больных коронавирусной инфекцией тяжелые случаи составляют около 5%. Из них 80% пациентов умирают. Применение сурфактанта-БЛ помогло снизить смертность в этой категории больных до 14,3%.
Легочный сурфактант в здоровье и болезнях легких человека: состояние дел
Легочный сурфактант представляет собой сложный и очень поверхностно-активный материал, состоящий из липидов и белков, который содержится в жидкости, выстилающей альвеолярную поверхность легких. Поверхностно-активное вещество предотвращает коллапс альвеол при малом объеме легких и сохраняет проходимость бронхиол при нормальном и форсированном дыхании (биофизические функции). Кроме того, он участвует в защите легких от травм и инфекций, вызванных вдыхаемыми частицами и микроорганизмами (иммунологические, небиофизические функции).Легочный сурфактант может быть получен только с помощью процедур лаважа, которые могут нарушить его ранее существовавшую биофизическую и биохимическую микроорганизацию. Эти ограничения всегда следует учитывать при интерпретации исследований легочного сурфактанта ex vivo. Патофизиологическая роль сурфактанта была впервые оценена у недоношенных детей с респираторным дистресс-синдромом и заболеванием гиалиновой мембраны, состоянием, которое в настоящее время обычно лечат с помощью экзогенного замещения сурфактанта. Биохимические нарушения сурфактанта различной степени описаны при обструктивных заболеваниях легких (астма, бронхиолит, хроническая обструктивная болезнь легких и после трансплантации легких), инфекционных и гнойных заболеваниях легких (муковисцидоз, пневмония и вирус иммунодефицита человека), респираторном дистресс-синдроме у взрослых. , отек легких, другие заболевания, характерные для младенцев (хроническое заболевание легких недоношенных и дефицит сурфактанта-B), интерстициальные заболевания легких (саркоидоз, идиопатический фиброз легких и гиперчувствительный пневмонит), легочный альвеолярный протеиноз, после искусственного кровообращения и у курильщиков .При некоторых легочных заболеваниях заместительная терапия сурфактантом находится на горизонте, но для большинства необходимо узнать гораздо больше о патофизиологической роли, которую могут иметь наблюдаемые отклонения от нормы сурфактанта.
Легочный сурфактант у новорожденных и детей
Реферат
Чтобы понять состав, секреторные пути и функции легочного сурфактанта.
Рассмотреть клинические данные об использовании сурфактантов у новорожденных и детей.
Для понимания более редких нарушений метаболизма сурфактантов.
Чтобы понять последние разработки и будущие перспективы в области поверхностно-активных веществ.
Резюме Легочный сурфактант представляет собой сложную смесь определенных липидов, белков и углеводов, которая продуцируется в легких альвеолярными эпителиальными клетками II типа. Смесь является поверхностно-активной и снижает поверхностное натяжение на границе раздела воздух-жидкость альвеол.Присутствие таких молекул с поверхностной активностью подозревалось с начала 1900-х годов и было окончательно подтверждено в середине 1900-х годов. С тех пор химические, физические и биологические свойства смеси ПАВ были выявлены благодаря работе нескольких групп исследователей.
Смесь поверхностно-активных веществ является важной группой молекул, поддерживающих дыхание воздухом. Таким образом, у недоношенных детей, рожденных с незрелыми легкими и дефицитом сурфактанта, после рождения развивается респираторный дистресс-синдром.Замена естественной сурфактантной терапии очищенным сурфактантом из легких нечеловеческих видов является одним из наиболее значительных достижений в неонатологии и привела к улучшению пределов жизнеспособности недоношенных детей. Хотя недоношенные дети составляют первичную популяцию, лечение экзогенными сурфактантами также может играть роль в других респираторных заболеваниях у доношенных младенцев и детей старшего возраста.
Введение и историческая справка
Определение
Легочные сурфактанты представляют собой комплекс специфических липидов, белков и углеводов, секретируемых альвеолярными эпителиальными клетками II типа.Комплекс является амфифильным (, то есть , он содержит как гидрофобные, так и гидрофильные группы), что делает его идеально подходящим в качестве поверхностно-активного агента для снижения поверхностного натяжения на границе раздела воздух-жидкость в альвеолах во время дыхательного цикла. Для целей этого обзора сурфактант будет использоваться для обозначения легочного сурфактанта млекопитающих.
Ранняя история
В 1929 году Курт фон Нергаард выдвинул идею о том, что «ретракционные силы легких зависят от поверхностного натяжения в альвеолах, и это может быть причиной ателектаза в легких новорожденного».[1] В элегантных экспериментах, проведенных на образцах легких от мертворожденных и новорожденных младенцев, умирающих в течение 3 дней после рождения (шесть из 15 имели низкий вес при рождении), Грюнвальд [2] продемонстрировал, что ателектатические легкие труднее надуть воздухом, чем с жидкостью и требует более высокого давления. При добавлении амилацетата, поверхностно-активного агента, давление накачивания снижалось, предполагая, что поверхностное натяжение было причиной сопротивления раздуванию. Эти наблюдения были подтверждены в экспериментах на ex vivo легких недоношенных новорожденных, умирающих от болезни гиалиновых мембран (HMD; патологическое описание респираторного дистресс-синдрома, см. Ниже).Эти легкие могли расширяться в присутствии жидкости, но при расширении на воздухе развивался ателектаз с участками чрезмерного растяжения [3]. Паттл [4] предоставил доказательства наличия выстилающего слоя в альвеолах, который снижает поверхностное натяжение, проводя эксперименты по стабильности пузырьков. Он продемонстрировал, что этот слой не мог образоваться из сыворотки (или жидкости отека легких), но должен секретироваться в легких. Изучая противопенные агенты для предотвращения отека легких, Паттл [5] провел подробные эксперименты, чтобы показать физическое свойство легочной жидкости в снижении поверхностного натяжения.Он также продемонстрировал присутствие и важность белковых компонентов в легочной жидкости, которая теряла свои поверхностно-активные свойства при инкубации с панкреатином или трипсином. Используя модифицированные весы Вильгельми (модель для изучения поверхностных пленок), Эйвери [1] и его коллеги продемонстрировали, что поверхностное натяжение экстрактов легких недоношенных детей, умирающих от HMD, имеет более высокое поверхностное натяжение по сравнению с более зрелыми младенцами, детьми или взрослыми. Они предположили, что это может быть важным фактором в патогенезе HMD.
Жидкость выстилки альвеол коров была извлечена Паттлом и Томасом [6], и было отмечено, что она содержит в основном лецитин и желатин с небольшим процентным содержанием белка. Используя метод экстракции, предложенный Бондюрантом и Миллером [7], Клементс [8] и его коллеги извлекли жидкость выстилки альвеол из легких крупного рогатого скота. Они продемонстрировали более сложную смесь липидов и белков, принадлежащих к трем различным категориям: ненасыщенные фосфолипиды (поверхностно-активный компонент), нефосфорилированные липиды и белки в качестве скелета.О первой демонстрации пленки поверхностно-активного вещества с помощью электронной микроскопии сообщили Weibel и Gil [9], которые использовали отдельные методы фиксации для сохранения слоя во время обработки. С тех пор несколько других исследователей продолжили изучение состава и свойств легочного сурфактанта [10, 11].
Состав ПАВ
Экстракция ПАВ
Легочный сурфактант существует в двух основных пулах: внутриклеточном и внеклеточном. Большая часть наших знаний об этом комплексе получена в результате изучения внеклеточного пула, секретируемого альвеолярными эпителиальными клетками типа II в альвеолярное пространство.При изучении внутриклеточные пулы сурфактанта (ламеллярные тела) обнаруживают сходство с альвеолярными компонентами [12]. Поскольку этапы экстракции и очистки легочного сурфактанта могут влиять на состав смеси, процесс очистки необходимо тщательно рассматривать при интерпретации результатов исследований [13]. Предыдущие источники легочного сурфактанта (пена отека легких [3]) были заменены фракционированными гомогенатами легких и альвеолярными промывками для экстракции с последующим центрифугированием в градиенте плотности для очистки компонентов [14].
Композиция
Сурфактант млекопитающих, экстрагированный бронхоальвеолярным лаважем и очищенный центрифугированием, обнаруживает сходство химического состава у разных видов. На рисунке 1 показан состав бычьего сурфактанта, представляющего легочный сурфактант млекопитающих, содержащий 80–85% фосфолипидов, 5–10% нейтральных липидов и 5–10% поверхностно-активных апопротеинов [16]. Фосфатидилхолин (PC) является основным фосфолипидным компонентом сурфактанта млекопитающих и является основным компонентом, ответственным за снижение поверхностного натяжения в альвеолах.Большая часть PC в поверхностно-активном веществе млекопитающих присутствует в виде пальмитоил-PC либо с ацильными группами двунасыщенной пальмитиновой кислоты (дипальмитоилфосфатидилхолин (DPPC)), либо с двунасыщенным PC. Теперь ясно, что DPPC является первичной поверхностно-активной молекулой на границе раздела воздух-жидкость в альвеолах, при этом фосфатидилглицерин (PG), вероятно, играет второстепенную роль [16]. Точные функции других фосфолипидов (фосфатидилэтаноламин, фосфатидилинозитол, фосфатидилсерин и сфингомиелин) и нейтральных липидов (холестерина и диацилглицерина) еще предстоит выяснить [15].
фигура 1
Состав ПАВ. Показан типичный состав бычьего сурфактанта из жидкости лаважа легких. Компоненты выражены в процентах от веса. DPPC: дипальмитоилфосфатидилхолин; PA; фосфатидная кислота; ПЭ: фосфатидилэтаноламин; PG: фосфатидилглицерин; ИП: фосфатидилинозитол. Воспроизведено из [15] с разрешения издателя.
Состав липидных компонентов
Поскольку ПК являются основными поверхностно-активными компонентами поверхностно-активного вещества и поскольку поверхностное натяжение является результатом разницы в притяжении молекул на границе раздела, химическая структура ПК является важным определяющим фактором их функции.PC и PG состоят из трехуглеродного скелета с гидрофильной головной группой (холин или глицерин), которая взаимодействует с жидкой фазой, и сильно гидрофобными липидными боковыми цепями (ацильными группами). Боковая цепь в DPPC представляет собой полностью насыщенную (гидрированную) пальмитиновую кислоту. Насыщение ацильной цепи позволяет молекуле образовывать упорядоченные монослои и дает возможность прочно сжиматься (во время выдоха — свойство, необходимое для уменьшения поверхностного натяжения при малых объемах легких). Моно- или диненасыщенность вызывает «изгибы» в молекуле, которые делают ее менее податливой сжатию во время дыхания.Это делает DCCP идеальной молекулой для снижения поверхностного натяжения в альвеолах [15, 16].
Состав белковых компонентов
От 5 до 10% поверхностно-активного вещества (вес / вес) состоит из белковых компонентов [16], которые представляют собой смесь сывороточных и несывороточных белков. В настоящее время установлено существование четырех отдельных не связанных с сывороткой сурфактантов белков. Их называют сурфактантным белком (SP) -A, SP-B, SP-C и SP-D. Хотя генетическое происхождение и функции этих белков были выяснены, количество каждого белка в комплексе сурфактанта достоверно неизвестно [15].
SP-A представляет собой гликопротеин массой 26–35 кДа, принадлежащий к семейству лектинов С-типа млекопитающих, содержащих участки коллагена, называемые коллектинами [17]. Он синтезируется из двух генов человека, SFTPA1 и SFTPA2 , на длинном плече хромосомы 10. В зрелом гидрофильном белке амино-конец состоит из обширной коллагеноподобной области с глобулярным карбоксильным концом, содержащим домены узнавания углеводов. Олигомерная форма SP-A состоит из гексамеров, которые, возможно, остаются связанными с трансформирующим фактором роста-β в неактивном состоянии и диссоциируют в активное состояние при воспалительных стимулах [18].SP-A специфически и активно связывается с DPPC, что указывает на ключевую роль в гомеостазе сурфактанта [19]. Известно по крайней мере восемь различных рецепторов-кандидатов и связывающих белков для SP-A, некоторые из которых экспрессируются исключительно на альвеолярных клетках типа II [17], и предлагаются новые [20]. Хотя легкие являются основным местом синтеза SP-A, было показано, что белок присутствует в других тканях, включая ткани кишечника, эндокринной системы и среднего уха [17]. Это может быть связано с его ролью в качестве защитного белка хозяина у млекопитающих.
SP-D представляет собой коллектин массой 43 кДа, синтезируемый геном SFTPD на длинном плече хромосомы 10, в непосредственной близости от генов SP-A. Общая структура зрелого белка аналогична структуре SP-A, но олигомерная форма состоит из тримеров и других комплексов высокого порядка [15]. SP-D связывается с второстепенными компонентами поверхностно-активного вещества фосфатидилинозитолом и глюкозилцерамидом [21], и, таким образом, его роль в гомеостазе поверхностно-активного вещества не ясна. Описаны три рецептора-кандидата для SP-D, которые являются общими с SP-A, но ни один из них не экспрессируется на клетках альвеолярного эпителия типа II.Экспрессия SP-D широко распространена в клетках млекопитающих, вероятно, в соответствии с его ролью как молекулы иммунной защиты [17].
SP-B представляет собой гидрофобный полипептид из 79 аминокислот (а.о.), синтезируемый геном SFTPB на хромосоме 2, и всегда остается связанным с поверхностно-активными фосфолипидами. Его олигомерная форма состоит из димеров и тетрамеров [22].
SP-C — самый гидрофобный белок в сурфактанте, состоящий из 35 аминокислот, синтезируемых геном SFTPC на хромосоме 8 [15].Структура ядерного магнитного резонанса SP-C предполагает, что это трансмембранный белок, который может охватывать жидкий бислой DPPC [22].
Жизненный цикл легочного сурфактанта
Развитие эпителия
Развитие легкого во время органогенеза начинается примерно на 3-4 неделе беременности в виде зачатка из передней кишки; Дальнейшее развитие происходит в пять различных стадий, которые пересекаются по своим концам [23]. В конце второй стадии (псевдогландулярной), на 16 неделе беременности, трахеобронхиальное дерево полностью сформировано и выстлано недифференцированным эпителием, окруженным мезенхимой.Во время третьей, или канальцевой, стадии развития развиваются респираторные бронхиолы и альвеолярные протоки, а выстилающий их эпителий дифференцируется на клетки типа I и типа II. Пластинчатые тела (см. Ниже) и белок сурфактанта могут быть обнаружены в кубовидных эпителиальных клетках типа II примерно на 24 неделе беременности. Эти клетки богаты гликогеном, который, возможно, действует как предшественник поверхностно-активных фосфолипидов, и имеют все органеллы, необходимые для синтеза поверхностно-активного вещества. Дальнейшее развитие эпителия и секреция сурфактанта, а также увеличение сложности воздушных пространств происходит на заключительных стадиях развития легких, по сравнению с , саккулярной и альвеолярной стадиями.Сурфактант, секретируемый в воздушное пространство внутриутробно. может быть обнаружен в околоплодных водах на более поздних сроках беременности, и это было основой клинического теста для определения зрелости легких [24].
Синтез, секреция и переработка поверхностно-активных веществ
Этапы жизненного цикла поверхностно-активного вещества изображены на рисунке 2 [13]. Биосинтез и процессинг сурфактантных фосфолипидов и белков происходит в эндоплазматическом ретикулуме и тельцах Гольджи альвеолярных эпителиальных клеток II типа. Эти молекулы затем транспортируются и хранятся (кроме SP-A) в структурах, называемых пластинчатыми телами, вероятно, после прохождения незрелых стадий, называемых мультивезикулярными телами и составными телами [25].Пластинчатые тельца представляют собой лизосомоподобные органеллы, состоящие из ограничивающей двухслойной мембраны с фосфолипидными двухслойными листами, тонкого ободка и центрального ядра из гранулированного материала. Во время экзоцитоза ограничивающая мембрана ламеллярного тела сливается с плазматической мембраной эпителиальной клетки, в результате чего содержимое изливается в альвеолярное пространство [26]. Содержимое, богатое фосфолипидами, связывается с сурфактантными белками, особенно с SP-A, и собирается в специфичную для легких структуру, называемую тубулярным миелином, который действует как резервуар сурфактанта во время альвеолярного дыхания и усиливает введение липидов на поверхность раздела воздух-жидкость.Стадии, участвующие в образовании тубулярного миелина, до конца не изучены, но они зависят от кальция, что продемонстрировано разборкой тубулярного миелина в присутствии хелатора кальция этиленгликольтетрауксусной кислоты [25]. Во время дыхания воздухом пленка сурфактанта подвергается воздействию высокого давления при малых объемах легких, что способствует десорбции липидов сурфактанта. Часть этого десорбированного липида рециркулируется клетками типа II, где они подвергаются эндоцитозу через мультивезикулярные тельца, в конечном итоге сохраняясь в пластинчатых тельцах для секреции [25].Другие части могут рециклироваться внеклеточно в канальцевый миелин, тогда как остальная часть поглощается макрофагами для деградации. Считается, что переработка сурфактанта является частью объяснения долговременных эффектов замены экзогенного сурфактанта у недоношенных детей.
фигура 2
Биологический жизненный цикл легочного сурфактанта в альвеолярных клетках II типа. Дополнительные сведения, включая переработку поверхностно-активного вещества, см. В основном тексте. ER: эндоплазматический ретикулум; G: тела Гольджи; LB: пластинчатые тела; ТМ: трубчатый миелин; М: монослой; I: альвеолярная эпителиальная клетка I типа; II: альвеолярная эпителиальная клетка II типа.Воспроизведено из [13] с разрешения издателя.
Функции поверхностно-активного вещества
Липидные компоненты
Основная функция липидного компонента сурфактанта — снизить поверхностное натяжение в альвеолах на границе раздела воздух-жидкость. Проще говоря, поверхностное натяжение является результатом сил притяжения (разности давлений) между молекулами на поверхности. Для жидкостей, чем выше перепад давления (сила притяжения), тем выше их поверхностное натяжение. Чтобы свести к минимуму поверхностное натяжение, наиболее стабильным является состояние, когда площадь поверхности самая низкая, то есть для жидкостей это сфера.Это связано с формулой Юнга и Лапласа: Δ P = 2 γ / r , где Δ P — перепад давления, γ — поверхностное натяжение и r — радиус сфера. Поверхностное натяжение определенной жидкости можно изменить, добавив вторую жидкость, уменьшающую силы притяжения. На поверхности смеси жидкостей одни молекулы с высокими силами притяжения заменяются другими с более низкими силами притяжения, что снижает поверхностное натяжение.
Фосфолипиды в поверхностно-активном веществе, будучи амфипатическими молекулами, образуют монослой на границе раздела воздух-жидкость, где они вытесняют молекулы воды с поверхности, чтобы снизить натяжение. Чем плотнее упакован этот монослой, тем больше они вытесняют воду и тем ниже поверхностное натяжение. Это то, что происходит при малых объемах легких, например, при окончании выдоха. Фосфолипиды с насыщенными боковыми цепями, такие как DPPC, могут образовывать высокоупорядоченные и плотно упакованные пленки в течение продолжительных периодов времени, в то время как ненасыщенность предотвращает такую плотную упаковку [16].Таким образом, DPPC считается идеальной молекулой поверхностно-активного вещества для снижения поверхностного натяжения альвеол.
Белковые компоненты
Молекулы липидов могут переходить из жидкого состояния в гелевое состояние. Критическая температура, при которой происходит это фазовое изменение, называется T c . Для DPPC T c составляет 41 ° C; таким образом, чистый DPPC находится в гелеобразном состоянии ниже этой температуры, предотвращая распространение монослоя в альвеолах с образованием поверхностно-активной пленки.Клиническое значение этого свойства состоит в том, что, хотя DPPC является химически идеальным поверхностно-активным фосфолипидом, ему не хватает физических свойств для снижения поверхностного натяжения до более низких значений при температуре тела (37 ° C).
Notter et al. [27] показал, что смесь насыщенных и ненасыщенных фосфолипидов придает благоприятные адсорбционные свойства. Однако они ясно продемонстрировали важность белковых компонентов поверхностно-активного вещества для адсорбции в присутствии кальция.И SP-B, и SP-C значительно усиливают адсорбцию смесей, содержащих DPPC, при этом SP-B имеет эффект, близкий к естественному поверхностно-активному веществу [22]. В экспериментальных условиях они также придают пленкам поверхностно-активных веществ физические свойства, способствующие достижению ими низкого поверхностного натяжения при сжатии. Повторному распространению сжатой пленки поверхностно-активного вещества во время дыхания также способствуют гидрофобные белки SP-B и SP-C. SP-A принимает активное участие в образовании пленки из смесей фосфолипидов, содержащих SP-B, кальций-зависимым образом.Однако точный механизм, с помощью которого каждая из этих молекул проявляет свое действие, еще не известен.
Помимо физического воздействия на сурфактант, сборник SP-A играет критическую роль в защите хозяина [17]. Он усиливает связывание, фагоцитоз и уничтожение нескольких бактериальных, вирусных и грибковых патогенов. Точно так же SP-D имеет домен распознавания углеводов, который может связывать и агглютинировать бактерии, вирусы и грибы. Для SP-D не было продемонстрировано никакой роли гомеостаза сурфактанта. Таким образом, сурфактанты SP-A и SP-D выполняют важные защитные функции хозяина в легких.
Клиническое применение сурфактанта у новорожденных
Респираторный дистресс-синдром новорожденных
Респираторный дистресс-синдром (РДС) является прототипом дефицита сурфактанта у недоношенных новорожденных. Младенцы, рожденные на пределе жизнеспособности (гестационный возраст ≤28 недель), имеют незрелые легкие с серьезным дефицитом продукции сурфактанта. После рождения они нуждаются в респираторной поддержке и, как говорят, у них развивается RDS. Это в первую очередь характеризуется сочетанием клинических (недоношенность и респираторный дистресс) и рентгенологических (малый объем легких, помутнение «матового стекла», воздушные бронхограммы и потеря границ сердца на рентгенограммах грудной клетки; рис.3) особенности. Другие названия, используемые для этого состояния — синдром дефицита сурфактанта и HMD.
Рисунок 3
Неонатальный респираторный дистресс-синдром (РДС). Рентгенограмма грудной клетки при неонатальном респираторном дистресс-синдроме с генерализованным помутнением легочных полей «матового стекла» с обеих сторон, воздушными бронхограммами (маленькие стрелки) и потерей границ сердца (пустые стрелки). Эндотрахеальный и назогастральный зонд — in situ . Изображение любезно предоставлено С. Барром, Университетская больница Уэльса, Кардифф, Великобритания (из личной коллекции).
После открытия поверхностно-активных веществ в 1950-х годах Эйвери [1] и его коллеги отметили, что легкие недоношенных новорожденных, умирающих от HMD, имеют более высокое поверхностное натяжение по сравнению с более зрелыми младенцами и детьми. После двух десятилетий исследований физических и химических свойств сурфактанта (см. «Ранняя история») и испытаний на моделях на животных [28], экзогенная замена сурфактанта была впервые использована на недоношенных людях в Японии [29]. Хотя это было обсервационное исследование, за ним последовало несколько рандомизированных контролируемых исследований (РКИ) в следующем десятилетии, которые подтвердили клинические преимущества снижения смертности и заболеваемости у недоношенных детей [30, 31].
Большинство клинических испытаний профилактического сурфактанта у недоношенных детей проводились в эпоху, когда ни антенатальные кортикостероиды, ни современные неинвазивные режимы респираторной поддержки, такие как постоянное положительное давление в дыхательных путях (CPAP), не использовались в повседневной практике. Метаанализ испытаний показал, что у младенцев <30 недель гестации, интубированных вскоре после рождения в родильном зале или до начала клинического РДС, использование профилактического природного (легкого животного или околоплодных вод человека) сурфактанта привело к значительному снижение частоты пневмотораксов, интерстициальной эмфиземы легких, неонатальной смертности и комбинированного исхода бронхолегочной дисплазии (БЛД) в возрасте 28 дней или смерти по сравнению с контрольной группой плацебо [32].В этот метаанализ были включены в общей сложности девять РКИ, в которых приняли участие 1256 младенцев. Профилактические искусственные (безбелковые) сурфактанты у недоношенных детей с риском РДС также привели к снижению риска неонатальной смертности и синдромов утечки воздуха по сравнению с плацебо, хотя все испытания, включенные в этот обзор, проводились до широкого применения антенатальных кортикостероидов. или ранний CPAP [33]. Результаты использования протеинсодержащих искусственных поверхностно-активных веществ в качестве профилактики или лечения RDS (два испытания) были сопоставимы с натуральными поверхностно-активными веществами животного происхождения [34].Испытания, сравнивающие профилактическое (до начала клинического РДС) и селективное (после наблюдения клинических признаков РДС) использование сурфактанта (все естественного происхождения) у недоношенных новорожденных <30 недель гестационного возраста до широкого применения антенатальных кортикостероидов или CPAP сообщил о значительном снижении риска неонатальной смертности, комбинированного исхода БЛД или смерти через 28 дней и утечки воздуха из легких [35]. Однако при сравнении этих двух стратегий в исследованиях с участием детей грудного возраста, у которых было преимущество антенатальных кортикостероидов и рутинного раннего CPAP для контроля младенцев [36, 37], вышеуказанные преимущества были менее очевидными.Напротив, профилактическое использование сурфактанта было связано со значительным увеличением риска БЛД через 28 дней и комбинированным исходом БЛД или смерти через 28 дней [35]. Использование натуральных сурфактантов (животного происхождения) для лечения РДС привело к значительному снижению риска смертности и пневмоторакса [38] по сравнению с искусственными сурфактантами [39], хотя искусственные сурфактанты действительно показали клиническую пользу [40]. После начала клинического РДС испытания, сравнивающие раннее (профилактическое) использование сурфактанта (как природного, так и синтетического), продемонстрировали значительное снижение риска неонатальной смертности, ПРЛ на 36 неделе скорректированного гестационного возраста, комбинированного исхода ПРЛ или смерти на 36-й неделе. недель скорректировали гестационный возраст и синдромы утечки воздуха (пневмоторакс и интерстициальная эмфизема легких) по сравнению с поздним (спасательным) применением сурфактанта (при ухудшении RDS) [41].Многократные дозы сурфактанта приводят к значительному снижению риска пневмоторакса и смертности у недоношенных новорожденных с РДС, находящихся на ИВЛ, по сравнению с однократной дозой сурфактанта [42]. Однако у большинства младенцев, участвовавших в этом сравнении, не было преимуществ антенатальных кортикостероидов. Стратегия раннего использования сурфактанта с последующей плановой экстубацией (до неинвазивной респираторной поддержки) у недоношенных новорожденных с клиническими признаками РДС приводит к снижению риска потребности в ИВЛ, БЛД в возрасте 28 дней и синдромов утечки воздуха по сравнению с введение сурфактанта и длительная ИВЛ [43].
Таким образом, любая замена экзогенного сурфактанта в качестве профилактики или для лечения РДС дает важные клинические преимущества. Природные поверхностно-активные вещества (околоплодные воды животных или человека) клинически превосходят существующие синтетические поверхностно-активные вещества. После появления RDS чем раньше будет использовано сурфактант, тем лучше результаты. Стратегия раннего введения сурфактанта с последующей экстубацией недоношенных детей с РДС, по-видимому, дает лучшие результаты по сравнению с длительной вентиляцией после введения сурфактанта.
Синдром неонатальной аспирации мекония
Аспирация мекония у доношенных или недоношенных младенцев имеет тяжелые респираторные последствия, включая механическую обструкцию дыхательных путей [44], изменения легочного газообмена и комплаентности [44] и инактивацию сурфактанта [45] из-за химического пневмонита [46]. У младенцев с тяжелым синдромом аспирации мекония (MAS) развивается стойкая легочная гипертензия, и им может потребоваться временная поддержка с помощью стратегии обхода легких, называемой экстракорпоральной мембранной оксигенацией (ЭКМО) [47].В четырех рандомизированных контролируемых клинических испытаниях изучалась эффективность использования высоких доз легочного сурфактанта у доношенных или близких к родам детей с МАС. Метаанализ исследований показал значительное снижение риска лечения ЭКМО по сравнению со стандартным лечением, хотя другие важные исходы, такие как смертность, утечка воздуха, БЛД и внутрижелудочковое кровотечение, не различались между двумя группами [48]. В двух испытаниях для лечения MAS использовалась стратегия промывания легких разбавленными сурфактантами.Метаанализ этих двух испытаний показал, что эта стратегия значительно снижает комбинированный риск смерти или потребности в ЭКМО по сравнению с контрольной группой плацебо [49]. Однако другие важные клинические исходы существенно не различались между двумя группами, хотя общее количество младенцев, участвовавших в исследованиях, было небольшим. В недавнем сравнительном исследовании лаважа легких по сравнению с болюсной дозой сурфактанта на животной модели MAS первая группа (лаваж) продемонстрировала значительно улучшенные характеристики вентиляции и давления в легочной артерии [50].Эта терапия может принести пользу в будущем, как показывают результаты нерандомизированных исследований.
Группа B
Streptococcus Сепсис у новорожденных
Острый респираторный дистресс-синдром, вызванный стрептококковым сепсисом группы B (GBS), может вызывать дисфункцию сурфактанта по механизмам, аналогичным MAS. Кроме того, из-за воспалительного повреждения поверхности альвеолярного эпителия, приводящего к нарушению барьера между воздухом и жидкостью, происходит утечка жидкости (альвеолярный отек) и белков сыворотки в воздушное пространство.Как альвеолярный отек [51], так и белки сыворотки [52] могут способствовать инактивации сурфактанта и дисфункции. Эффективность заместительной терапии экзогенным сурфактантом при острой дыхательной недостаточности из-за сепсиса GBS изучалась в проспективном многоцентровом исследовании [53]. Лечение сурфактантом привело к быстрому снижению потребности в кислороде, хотя другие заболеваемость и смертность в целом были высокими.
Применение ПАВ у детей
Острый респираторный дистресс-синдром (ОРДС), вызванный острым повреждением легких у детей и подростков, может вызывать дисфункцию сурфактанта по тем же механизмам, которые обсуждались выше.В большом РКИ по замещению экзогенного природного сурфактанта у детей с ОРДС авторы обнаружили значительное снижение потребности в кислороде и смертности в группе лечения по сравнению с контрольной группой плацебо [54]. Улучшение вентиляционных характеристик было отмечено в нескольких нерандомизированных испытаниях терапии экзогенным сурфактантом у детей с ОРДС [55], хотя количество пациентов в каждом исследовании было небольшим. В целом, экзогенное сурфактант дает краткосрочные преимущества, хотя необходимы дальнейшие более масштабные исследования.
Бронхиолит — это распространенная респираторная респираторная инфекция младенцев и детей раннего возраста, наиболее частым патогеном которого является респираторно-синцитиальный вирус (RSV). Небольшое количество пациентов с бронхиолитом прогрессирует до дыхательной недостаточности, нуждающейся в искусственной вентиляции легких. В трех небольших РКИ изучались эффекты замены экзогенного сурфактанта у детей с дыхательной недостаточностью, вызванной бронхиолитом. Мета-анализ исследований показал, что использование сурфактанта значительно сокращает продолжительность пребывания на ИВЛ и интенсивной терапии; и улучшенные характеристики вентиляции (оксигенация и удаление углекислого газа) [56].Однако из-за небольшого числа младенцев, включенных в испытания, это остается экспериментальной терапией для лечения дыхательной недостаточности при бронхиолите.
Таким образом, наиболее распространенное и наиболее изученное применение сурфактантов — это RDS у недоношенных новорожденных. Остаются некоторые разногласия относительно использования сурфактантов в этой популяции, включая время приема первой дозы, показания для многократных доз и использование новых синтетических препаратов сурфактанта (таблица 1) [57].Поверхностно-активные вещества использовались по другим показаниям у новорожденных и детей и дали краткосрочный эффект. Однако необходимы дальнейшие исследования для выяснения роли сурфактантов при заболеваниях, не связанных с РДС.
Таблица 1
Источники и компоненты легочных сурфактантов
Генетические дефекты белков ПАВ
Из четырех известных белков сурфактанта гидрофобные SP-B и SP-C необходимы для нормальной функции сурфактанта в легких. Хотя он не участвует напрямую в снижении поверхностной активности, другой белок, который был идентифицирован на ограничивающей мембране ламеллярных телец, представляет собой аденозинтрифосфат-связывающую кассету A3 (ABCA3) [58].Считается, что ABCA3 является внутриклеточным переносчиком липидных молекул сурфактанта в ламеллярные тела. Фактор транскрипции щитовидной железы (TTF) -1 участвует в развитии легких и экспрессии сурфактантных белков в течение жизни плода [59]. Таким образом, генетические мутации гена TTF-1 NKX2.1 могут приводить к заболеваниям легких у новорожденных, имитирующих RDS.
Среди всех известных генетических заболеваний метаболизма сурфактантов дефекты SP-B изучены лучше всего. Хотя в SFTPB было идентифицировано более 30 мутаций, наиболее распространенной является замена трех оснований, GAA, на C в кодоне 121 экзона 4.Это называется 121ins2, и на его долю приходится около 70% мутаций, приводящих к дефициту SP-B [60]. Было идентифицировано несколько других мутаций, каждая из которых приводит к потере функции гена [61]. Наилучшая оценка частоты мутации 121ins2 в популяции составляет 1 на 1000–3000 [62], что позволяет предположить, что общая частота любой мутации составляет примерно 1 на 600–1800. Поскольку любой дефицит SP-B является аутосомно-рецессивным, прогнозируемая частота этого расстройства очень редка. Описаны мутации, приводящие к частичному дефициту SP-B, которые приводят к хроническим заболеваниям [61].Замена сурфактанта приводит к небольшому улучшению клинического статуса, но это кратковременное явление [61].
Хотя SP-C тесно участвует в метаболизме сурфактанта в легких, мутации SFTPC обычно не приводят к тяжелому фенотипу. Мутации обычно наследуются доминантным образом, и их частота неизвестна. Дефицит SP-C был связан с интерстициальным заболеванием легких (ILD) у детей [63].
Другой дефицит белка, приводящий к дисфункции сурфактанта, — это дефицит ABCA3.Хотя точная функция этого белка еще не установлена, мутации гена ABCA3 были идентифицированы у новорожденных с тяжелым заболеванием легких и дефицитом сурфактанта [64]. Присутствие аномальных пластинчатых тел у этих младенцев предполагает роль ABCA3 как белка-переносчика. Сообщалось о нескольких мутациях для ABCA3 , при этом замена валина на глутаминовую кислоту в кодоне 292 была идентифицирована как наиболее распространенная [65]. Тяжелая неонатальная гипоксическая дыхательная недостаточность является обычным фенотипом дефицита ABCA3 [64], хотя известно и более хроническое течение ILD [61].
Доминантно экспрессируемые мутации NKX2.1. , как сообщается, вызывают синдром, включающий хореоатетоз, гипотиреоз и хроническое поражение легких (респираторный дистресс в период новорожденности или повторные инфекции в более позднем детстве) [66]. Респираторный компонент может варьироваться от острого неонатального RDS до хронического детского ILD. Было идентифицировано несколько мутаций, приводящих к широкому разнообразию фенотипов [67].
Хотя несколько генетических дефектов, приводящих к недостаточности количества или функции сурфактантных белков, были идентифицированы, в настоящее время не существует специального лечения ни для одного из них.Недостатки SP-B являются наиболее серьезными и часто имеют плохой прогноз. Однако сообщалось о некоторых формах дефицита SP-B (сложные гетерозиготы и сплайс-мутации) с длительным выживанием [68, 69]. Проявление других генетических дефектов может быть клинически изменчивым. Трансплантация легких была выполнена при некоторых из этих заболеваний, и в результате 5-летняя выживаемость (рис. 4) составила около 50% [61, 70]. Однако трансплантация легких связана со многими осложнениями, поэтому ее следует проводить только в опытных специализированных центрах.
Рисунок 4
Трансплантация легких при дефиците белка сурфактанта. Отдаленные результаты трансплантации всего легкого у детей с наследственной недостаточностью белка сурфактанта. SP: сурфактантный белок; ABCA: кассета, связывающая аденозинтрифосфат. Воспроизведено из [70] с разрешения издателя.
Последние разработки и будущие тенденции
В настоящее время введение сурфактанта новорожденным и детям требует интубации и искусственной вентиляции легких.Поскольку это лечение чаще всего используется у недоношенных детей с риском или с установленным РДС, это становится инвазивной процедурой. Сама по себе искусственная вентиляция легких может привести к повреждению легких [71], и неинвазивные режимы вентиляции становятся все более распространенными [72]. Таким образом, апробируются менее инвазивные методы доставки сурфактанта. Впервые описанный в Германии [73], доставка сурфактанта через тонкий эндотрахеальный катетер у спонтанно дышащих младенцев, по-видимому, ограничивает потребность в ИВЛ и снижает частоту БЛД [74, 75].В одном из вариантов этого метода Dargaville et al. [76] доставлял сурфактант спонтанно дышащим младенцам в режиме CPAP (после премедикации) через сосудистый катетер. Хотя этот метод имеет теоретические преимущества, необходимы дальнейшие исследования в РКИ, чтобы прояснить клинические эффекты такой стратегии доставки сурфактанта.
Другой неинвазивный способ доставки сурфактанта — распыление. Было опубликовано несколько сообщений о применении небулайзера сурфактанта у спонтанно дышащих недоношенных детей [77].К сожалению, из-за значительных различий в используемых методах их нельзя сравнивать. Хотя распыление кажется выполнимой процедурой, необходимы дальнейшие исследования для стандартизации методов, доз, клинической эффективности и безопасности, прежде чем они станут применяться в клинической практике [78].
Заключение
Поверхностно-активные вещества представляют собой природные комплексы фосфолипидов и белков, которые присутствуют на границе раздела воздух-жидкость в легких и снижают поверхностное натяжение. Замена экзогенного сурфактанта у недоношенных детей — одно из самых значительных достижений в неонатологии.Терапия экзогенным сурфактантом также может иметь значение при других респираторных заболеваниях новорожденных и детей старшего возраста, но для определения ее места требуется дополнительная работа. Также необходимы дальнейшие исследования новых методов его доставки, оптимального состава и сроков. Однако место этого вмешательства в медицине прочно закрепилось.
Образовательные вопросы
Молекула, наиболее подходящая для поверхностной активности на границе раздела воздух-жидкость в альвеолах:
СП-Б
PG
DPPC
сфингомиелин
SP-A
Наиболее распространенное применение экзогенного сурфактанта у людей:
ARDS
RDS
MAS
стрептококковый сепсис группы В
бронхиолит
В настоящее время лучшее время для замены сурфактанта у недоношенных новорожденных с неонатальным РДС:
— до начала РДС (профилактическое)
находится в начале RDS (раннее спасение)
— только когда RDS ухудшается с увеличением требований к вентиляции (позднее спасение)
никогда, так как замена ПАВ не указана в RDS
остается спорным, и предметом исследования
Согласно текущим исследованиям, что из следующего является наиболее эффективным заместителем экзогенного сурфактанта для неонатального RDS?
Порактант альфа
Эндогенный человеческий (из околоплодных вод)
Колфосерил
Люцинактант
Ответы на учебные вопросы
с
б
e
а
Роль сурфактанта при астме | Респираторные исследования
Эйвери М.Э., Мид Дж .: Поверхностные свойства в отношении ателектаза и болезни гиалиновых мембран. Am J Dis Child. 1959, 97: 517-523.
Google Scholar
Günther A, Siebert C, Schmidt R, Ziegler S, Grimminger F, Yabut M, Temmesfeld B, Walmrath D, Morr H, Seeger W. Изменения сурфактанта при тяжелой пневмонии, остром респираторном дистресс-синдроме и кардиогенном легком отек. Am J Respir Crit Care Med. 1996, 153: 176-184.
PubMed
Статья
Google Scholar
Hohlfeld J, Fabel H, Hamm H: Роль легочного сурфактанта при обструктивной болезни дыхательных путей. Eur Respir J. 1997, 10: 482-491. 10.1183 / 0
36.97.10020482.
PubMed
Статья
Google Scholar
Симс Д.Е., Хорн М.М.: Неоднородность состава и толщины трахеальной слизи у крыс. Am J Physiol (Физиология молочных клеток легких). 1997, 273: L1036-L1041.
Google Scholar
Khoor A, Stahlman MT, Gray ME, Whitsett JA: Пространственно-временное распределение белков и мРНК SP-B и SP-C в развивающемся респираторном эпителии легких человека. J Histochem Cytochem. 1994, 42: 1187-1199.
PubMed
Статья
Google Scholar
Auten RL, Watkins RH, Shapiro DL, Horowitz S: Поверхностно-активное вещество апопротеин A (SP-A) синтезируется в клетках дыхательных путей. Am J Respir Cell Mol Biol. 1990, 3: 491-496.
PubMed
Статья
Google Scholar
Voorhout WF, Veenendaal T, Kuroki Y, Ogasawara Y, van Golde LM, Geuze HJ: Иммуноцитохимическая локализация сурфактантного белка D (SP-D) в клетках типа II, клетках Клары и альвеолярных макрофагах легкого крысы. J Histochem Cytochem. 1992, 40: 1589-1597.
PubMed
Статья
Google Scholar
Хор А., Грей М.Э., Халл В.М., Уитсетт Дж. А., Штальман М.Т.: Экспрессия мРНК SP-A и SP-A в проксимальном и дистальном отделах респираторного эпителия у плода и новорожденного человека.J Histochem Cytochem. 1993, 41: 1311-1319.
PubMed
Статья
Google Scholar
Xu P, Hashimoto S, Miyazaki H, Asabe K, Shiraishi S, Sueishi K: Морфометрический анализ иммуногистохимической экспрессии белка 10 кДа клеток Клары и сурфактантных апопротеинов A и B в развивающихся бронхах и бронхиолах человеческие зародыши и новорожденные. Арка Вирхова. 1998, 432: 17-25. 10.1007 / s004280050129.
PubMed
Статья
Google Scholar
Madsen J, Kliem A, Tornoe I., Skjodt K, Koch C, Holmskov U: Локализация легочного сурфактантного белка D на поверхности слизистой оболочки в тканях человека. J Immunol. 2000, 164: 5866-5870.
PubMed
Статья
Google Scholar
Барроу Р.Э .: Химическая структура фосфолипидов в легких и дыхательных путях овец. Respir Physiol. 1990, 79: 1-8. 10.1016 / 0034-5687 (90)
-4.
PubMed
Статья
Google Scholar
Bernhard W, Haagsman HP, Tschernig T., Poets CF, Postle AD, van Eijk ME, von der Hardt H: Проводящее сурфактант дыхательных путей: функция поверхностного натяжения, биохимический состав и возможное альвеолярное происхождение. Am J Respir Cell Mol Biol. 1997, 17: 41-50.
PubMed
Статья
Google Scholar
Wright SM, Hockey PM, Enhorning G, Strong P, Reid KBM, Holgate ST, Djukanovic R, Postle AD: Измененный состав фосфолипидов сурфактанта дыхательных путей и снижение функции легких при астме.J Appl Physiol. 2000, 89: 1283-1292.
PubMed
Google Scholar
van de Graaf EA, Jansen HM, Lutter R, Alberts C., Kobesen J, de Vries IJ, Out TA: Поверхностно-активный белок А в жидкости бронхоальвеолярного лаважа. J Lab Clin Med. 1992, 120: 252-263.
PubMed
Google Scholar
Wang JY, Shieh CC, Yu CK, Lei HY: аллерген-индуцированное бронхиальное воспаление связано со снижением уровней сурфактантных белков A и D на мышиной модели астмы.Clin Exp Allergy. 2001, 31: 652-662. 10.1046 / j.1365-2222.2001.01031.x.
PubMed
Статья
Google Scholar
Cheng G, Ueda T, Numao T., Kuroki Y, Nakajima H, Fukushima Y, Motojima S, Fukuda T: Повышенные уровни сурфактантного белка A и D в жидкостях бронхоальвеолярного лаважа у пациентов с бронхиальной астмой. Eur Respir J. 2000, 16: 831-835. 10.1183 / 0
36.00.16583100.
PubMed
Статья
Google Scholar
Гер П., Гейзер М., Им Хоф В., Шюрч С., Вабер У, Бауман М.: Поверхностно-активные вещества и вдыхаемые частицы в проводящих дыхательных путях: структурные, стереологические и биофизические аспекты. Microsc Res Tech. 1993, 26: 423-436.
PubMed
Статья
Google Scholar
Liu M, Wang L, Li E, Enhorning G: Легочный сурфактант обеспечивает свободный поток воздуха через узкую трубку. J Appl Physiol. 1991, 71: 742-748.
PubMed
Google Scholar
Enhorning G, Holm BA: Нарушение способности легочного сурфактанта поддерживать открытость узкой трубки. J Appl Physiol. 1993, 74: 2922-2927.
PubMed
Google Scholar
Enhorning G: Легочная сурфактантная функция в альвеолах и проводящих дыхательных путях. Джан Респир Дж. 1996, 3: 21-27.
Google Scholar
Enhorning G, Hohlfeld J, Krug N, Lema G, Welliver RC: На функцию поверхностно-активного вещества влияет воспаление и охлаждение дыхательных путей: возможное влияние на астму, вызванную физической нагрузкой.Eur Respir J. 2000, 15: 532-538. 10.1183 / 0
36.00.15353200.
PubMed
Статья
Google Scholar
Enhorning G, Duffy LC, Welliver RC: Легочный сурфактант поддерживает проходимость проводящих дыхательных путей у крысы. Am J Respir Crit Care Med. 1995, 151: 554-556.
PubMed
Статья
Google Scholar
De Sanctis GT, Tomkiewicz RP, Rubin BK, Schürch S, King M: экзогенный сурфактант усиливает мукоцилиарный клиренс у анестезированной собаки.Eur Respir J. 1994, 7: 1616-1621. 10.1183 / 0
36.94.07091616.
PubMed
Статья
Google Scholar
Какута Й., Сасаки Х., Такисима Т.: Влияние искусственного сурфактанта на частоту биений ресничек в трахее морской свинки. Respir Physiol. 1991, 83: 313-322. 10.1016 / 0034-5687 (91)
-С.
PubMed
Статья
Google Scholar
Widdicombe JG: Жидкость в дыхательных путях: барьер для распространения лекарств ?.Eur Respir J. 1997, 10: 2194-2197. 10.1183 / 0
36.97.10102194.
PubMed
Статья
Google Scholar
Hills BA: Астма: есть ли барьер рецепторов дыхательных путей ?. Грудная клетка. 1996, 51: 773-776.
PubMed
PubMed Central
Статья
Google Scholar
Со К.Л., Гоммерс Д., Лахманн Б.: Бронхоальвеолярный сурфактант и интратрахеальный адреналин. Ланцет.1993, 341: 120-121. 10.1016 / 0140-6736 (93) 92603-Q.
PubMed
Статья
Google Scholar
Kiekhaefer CM, Kelly EAB, Jarjour NN: Усиленная антиген-индуцированная эозинофилия с предшествующим бронхоальвеолярным лаважем [аннотация]. Am J Respir Crit Care Med. 1999, 159: A99-
Google Scholar
Hohlfeld J, Hoymann HG, Molthan J, Fabel H, Heinrich U: Аэрозольное поверхностно-активное вещество ингибирует вызванную ацетилхолином обструкцию дыхательных путей у крыс.Eur Respir J. 1997, 10: 2198-2203. 10.1183 / 0
36.97.10102198.
PubMed
Статья
Google Scholar
Hills BA, Chen Y: Подавление нервной активности рецепторов раздражителей бронхов поверхностно-активными фосфолипидами по сравнению с местными препаратами, обычно назначаемыми при астме. Clin Exp Allergy. 2000, 30: 1266-1274. 10.1046 / j.1365-2222.2000.00850.x.
PubMed
Статья
Google Scholar
Кремлев С.Г., Амстед TM, Фелпс Д.С.: Влияние сурфактантного белка А и липидов сурфактанта на пролиферацию лимфоцитов in vitro . Am J Physiol (Физиология молочных клеток легких). 1994, 267: L357-L364.
Google Scholar
Malhotra R, Haurum J, Thiel S, Jensenius JC, Sims RB: Пыльцевые зерна связываются с легочными альвеолярными клетками II типа (A549) через легочный сурфактантный белок A (SP-A). Biosci Rep. 1993, 13: 79-90.
PubMed
Статья
Google Scholar
Wang JY, Kishore U, Lim BL, Strong P, Reid KBM: Взаимодействие белков A и D сурфактанта легких человека с аллергенами клещей (Dermatophagoides pteronyssinus). Clin Exp Immunol. 1996, 106: 367-373. 10.1046 / j.1365-2249.1996.d01-838.x.
PubMed
PubMed Central
Статья
Google Scholar
Ансфилд MJ, Kaltreider HB, Benson BJ, Caldwell JL: Иммуносупрессивная активность активного материала на легочной поверхности собак.J Immunol. 1979, 122: 1062-1066.
PubMed
Google Scholar
Ситрин Р.Г., Ансфилд М.Дж., Кальтрейдер HB: Влияние легочного поверхностно-активного материала на образование и экспрессию эффекторных функций В- и Т-лимфоцитов мыши in vitro. Exp Lung Res. 1985, 9: 85-97.
PubMed
Статья
Google Scholar
Borron P, Veldhuizen RAW, Lewis JF, Possmayer F, Caveney A, Inchley K, McFadden RG, Fraher LJ: белок А, связанный с поверхностно-активным веществом, ингибирует пролиферацию лимфоцитов человека и продукцию IL-2.Am J Respir Cell Mol Biol. 1996, 15: 115-121.
PubMed
Статья
Google Scholar
Borron PJ, Crouch EC, Lewis JF, Wright JR, Possmayer F, Fraher LJ: Рекомбинантный крысиный сурфактант-ассоциированный белок D ингибирует пролиферацию Т-лимфоцитов человека и продукцию IL-2. J Immunol. 1998, 161: 4599-4603.
PubMed
Google Scholar
Wang JY, Shieh CC, You PF, Lei HY, Reid KBM: ингибирующее действие белков легочного сурфактанта A и D на индуцированную аллергеном пролиферацию лимфоцитов и высвобождение гистамина у детей с астмой.Am J Respir Crit Care Med. 1998, 158: 510-518.
PubMed
Статья
Google Scholar
Cheng G, Ueda T, Nakajima H, Kinjyo S, Motojima S, Fukuda T: Подавляющее действие SP-A на индуцированное иономицином производство и высвобождение IL-8 эозинофилами. Int Arch Allergy Immunol. 1998, 117 (приложение 1): 59-62. 10.1159 / 000053574.
Артикул
Google Scholar
Hohlfeld JM, Knöβ S, Schael M, Fabel H, Krug N: Легочный сурфактант подавляет экспрессию HLA-DR и CD69 на человеческих эозинофилах [аннотация].Am J Respir Crit Care Med. 2000, 161: A662-
Google Scholar
Окумура М., Цуруока М., Исохама Ю., Кай Х, Такахама К., Мията Т. Активированные эозинофилы стимулируют секрецию фосфатидилхолина в первичной культуре пневмоцитов крыс типа II. Biochem Mol Biol Int. 1996, 38: 569-575.
PubMed
Google Scholar
Лю М., Ван Л., Энхорнинг Г. Дисфункция сурфактанта развивается, когда иммунизированная морская свинка вводится аэрозолем овальбумина.Clin Exp Allergy. 1995, 25: 1053-1060.
PubMed
Статья
Google Scholar
Лю М., Ван Л., Ли Э, Энхорнинг Г.: Легочный сурфактант, вводимый с профилактической целью, облегчает приступ астмы у морских свинок. Clin Exp Allergy. 1996, 26: 270-275. 10.1046 / j.1365-2222.1996.d01-322.x.
PubMed
Статья
Google Scholar
Kurashima K, Fujimura M, Tsujiura M, Matsuda T: Влияние вдыхания сурфактанта на аллергическую бронхоспазм у морских свинок.Clin Exp Allergy. 1997, 27: 337-342. 10.1046 / j.1365-2222.1997.d01-501.x.
PubMed
Статья
Google Scholar
Курашима К., Фудзимура М., Мацуда Т., Кобаяши Т.: Поверхностная активность мокроты от пациентов с острой астмой. Am J Respir Crit Care Med. 1997, 155: 1254-1259.
PubMed
Статья
Google Scholar
Hohlfeld JM, Ahlf K, Enhorning G, Balke K, Erpenbeck VJ, Petschallies J, Hoymann HG, Fabel H, Krug N: Дисфункция легочного сурфактанта у астматиков после стимуляции сегментарного аллергена.Am J Respir Crit Care Med. 1999, 159: 1803-1809.
PubMed
Статья
Google Scholar
Heeley EL, Hohlfeld JM, Krug N, Postle AD: Молекулярные соединения фосфолипидов в жидкости бронхоальвеолярного лаважа после местного введения аллергена при астме. Am J Physiol (Физиология молочных клеток легких). 2000, 278: L305-L311.
Google Scholar
Fuchimukai T, Fujiwara T, Takahashi A, Enhorning G: искусственный легочный сурфактант, ингибируемый белками.J Appl Physiol. 1987, 62: 429-437. 10.1063 / 1.339816.
PubMed
Статья
Google Scholar
Seeger W, Grube C, Günther A, Schmidt R: Подавление поверхностно-активного вещества белками плазмы: дифференциальная чувствительность различных препаратов поверхностно-активного вещества. Eur Respir J. 1993, 6: 971-977.
PubMed
Google Scholar
Дэниэлс CB, Лопатко О.В., Оргейг S: Эволюция функций легочного сурфактанта позвоночных, связанных с поверхностной активностью.Clin Exp Pharmacol Physiol. 1998, 25: 716-721.
PubMed
Статья
Google Scholar
Bernhard W, Gebert A, Vieten G, Rau GA, Hohlfeld JM, Postle AD, Freihorst J: Легочный сурфактант у птиц: справляется с поверхностным натяжением в трубчатом легком. Am J Physiol (Regul Integr Comp Physiol). 2001, 281: R327-R337.
Google Scholar
Хант А.Н., Келли Ф.Дж., Постл А.Д.: Изменения в развитии молекулярных видов фосфатидилхолина в легких легких человека: сравнение с морской свинкой и крысой.Early Hum Dev. 1991, 25: 157-171.
PubMed
Статья
Google Scholar
Possmayer F, Nag K, Rodriguez Capote K, Qanbar R, Schürch S: Роль апопротеинов сурфактанта в функции сурфактанта. Appl Cardiol. 2000, 9: 283-285.
Google Scholar
Clark JC, Weaver TE, Iwamoto HS, Ikegami M, Jobe AH, Hull WM, Whitsett JA: Снижение эластичности легких и захвата воздуха у гетерозиготных мышей с дефицитом SP-B.Am J Respir Cell Mol Biol. 1997, 16: 46-52.
PubMed
Статья
Google Scholar
Крауч Э., Райт JR: Поверхностно-активные белки A и D и легочная защита хозяина. Annu Rev Physiol. 2001, 63: 521-554. 10.1146 / annurev.physiol.63.1.521.
PubMed
Статья
Google Scholar
Korfhagen TR, LeVine AM, Whitsett JA: мыши, нацеленные на ген поверхностно-активного протеина А (SP-A).Biochim Biophys Acta. 1998, 1408: 296-302. 10.1016 / S0925-4439 (98) 00075-1.
PubMed
Статья
Google Scholar
Wert SE, Yoshida M, LeVine AM, Ikegami M, Jones T, Ross GF, Fisher JH, Korfhagen TR, Whitsett JA: Повышенная активность металлопротеиназы, продукция окислителей и эмфизема у мышей с инактивированным геном сурфактантного протеина D . Proc Natl Acad Sci USA. 2000, 97: 5972-5977. 10.1073 / pnas.100448997.
PubMed
PubMed Central
Статья
Google Scholar
Nogee LM, deMello DM, Dehner LP, Colten HR: Дефицит легочного сурфактантного белка B при врожденном альвеолярном протеинозе. N Engl J Med. 1993, 328: 406-410. 10.1056 / NEJM199302113280606.
PubMed
Статья
Google Scholar
Clark JC, Wert SE, Bachurski CJ, Stahlman MT, Stripp BR, Weaver TE, Whitsett JA: Целевое нарушение гена сурфактантного белка B нарушает гомеостаз сурфактанта, вызывая дыхательную недостаточность у новорожденных мышей.Proc Natl Acad Sci USA. 1995, 92: 7794-7798.
PubMed
PubMed Central
Статья
Google Scholar
Jain-Vora S, Wert SE, Temann UA, Rankin JA, Whitsett JA: Интерлейкин-4 изменяет дифференцировку эпителиальных клеток и гомеостаз сурфактанта в постнатальном легком мыши. Am J Respir Cell Mol Biol. 1997, 17: 541-551.
PubMed
Статья
Google Scholar
Glasser SW, Burhans MS, Korfhagen TR, Na CL, Sly PD, Ross GF, Ikegami M, Whitsett JA: измененная стабильность легочного сурфактанта у мышей с дефицитом SP-C. Proc Natl Acad Sci USA. 2001, 98: 6366-6371. 10.1073 / pnas.101500298.
PubMed
PubMed Central
Статья
Google Scholar
Mishra A, Weaver TE, Beck DC, Rothenberg ME: Опосредованное интерлейкином-5 аллергическое воспаление дыхательных путей ингибирует промотор человеческого сурфактантного протеина C у трансгенных мышей.J Biol Chem. 2001, 276: 8453-8459. 10.1074 / jbc.M009481200.
PubMed
Статья
Google Scholar
Доббс Л.Г., Мейсон Р.Дж.: Легочные альвеолярные клетки типа II, выделенные от крыс. Высвобождение фосфатидилхолина в ответ на β-адренергическую стимуляцию. J Clin Invest. 1979, 63: 378-387.
PubMed
PubMed Central
Статья
Google Scholar
Экелунд Л., Бургойн Р., Браймер Д., Энхорнинг Г.: Высвобождение сурфактанта в легких у плодов кроликов под влиянием тербуталина и аминофиллина.Сканд Дж. Клин Лаб Инвест. 1981, 41: 237-245.
PubMed
Статья
Google Scholar
van Golde LMG: Синтез липидов сурфактанта в легких взрослых. Annu Rev Physiol. 1985, 47: 765-774. 10.1146 / annurev.ph.47.030185.004001.
PubMed
Статья
Google Scholar
Курашима К., Огава Х., Ока Т., Фудзимура М., Мацуда Т., Кобаяши Т.: пилотное исследование ингаляции сурфактанта при лечении приступа астмы.Аэруги (Jpn J Allergol). 1991, 40: 160-163.
Google Scholar
Oetomo SB, Dorrepaal C, Bos H, Gerritsen J, van der Mark TW, Koeter GH, van Aalderen WMC: Распыление поверхностно-активного вещества не влияет на обструкцию воздушного потока и чувствительность бронхов к гистамину у детей-астматиков. Am J Respir Crit Care Med. 1996, 153: 1148-1152.
PubMed
Статья
Google Scholar
Anzueto A, Jubran A, Ohar JA, Piquette CA, Rennard SI, Colice G, Pattishall EN, Barrett J, Engle M, Perret KA, Rubin BK: Эффекты аэрозольного сурфактанта у пациентов со стабильным хроническим бронхитом. Проспективное рандомизированное контролируемое исследование. ДЖАМА. 1997, 278: 1426-1431. 10.1001 / jama.278.17.1426.
PubMed
Статья
Google Scholar
Тибби С.М., Хатерилл М., Райт С.М., Уилсон П., Постл А.Д., Мердок И.А.: Добавки экзогенного сурфактанта младенцам с респираторно-синцитиальным вирусным бронхиолитом.Am J Respir Crit Care Med. 2000, 162: 1251-1256.
PubMed
Статья
Google Scholar
van Schaik SM, Vargas I, Welliver RC, Enhorning G: Дисфункция поверхностно-активного вещества развивается у мышей BALB / c, инфицированных респираторно-синцитиальным вирусом. Pediatr Res. 1997, 42: 169-173.
PubMed
Статья
Google Scholar
Границы | Поверхностно-активное вещество легких для восстановления легочного барьера у пациентов с пневмонией COVID-19
Введение
Вирус короны SARS-CoV-2 уже распространился по всему миру, и в настоящее время, без вакцины, остановить его невозможно.На сегодняшний день COVID-19 поражает более 3000000 подтвержденных пациентов во всем мире. Лекарства первого ряда — это противовирусные препараты, и в настоящее время проводятся многочисленные срочные клинические испытания. Однако недавнее клиническое испытание комбинации ингибиторов протеазы ВИЧ лопинавира и ритонавира не показало значительной противовирусной активности против SARS-CoV-2 у пациентов с тяжелым заболеванием (1). Пока у нас нет специфических противовирусных методов лечения SARS-CoV-2, нам необходимо обеспечить поддерживающую симптоматическую терапию для предотвращения легочной недостаточности, наиболее частой причины смертности от COVID-19.
Альвеолярные клетки типа II повреждены SARS-COV-2
Вирусная инфекция и, как следствие, разрушение альвеолярных клеток привлекают иммунные клетки с чрезмерной альвеолярной экссудативной и интерстициальной воспалительной реакцией. Бурное производство цитокинов и хемокинов приводит к разрушению легочной ткани и, в конечном итоге, к тяжелому острому респираторному дистресс-синдрому (ARDS). SARS-CoV-2, а также SARS-CoV проникают в клетки через рецептор 2 ангиотензинпревращающего фермента (ACE2). ACE2 высоко экспрессируется на апикальной поверхности эпителия дыхательных путей, эндотелия сосудов, почечной и сердечно-сосудистой ткани, а также в различных других клетках (2).Попадая через дыхательные пути, SARS-CoV и SARS-CoV-2 могут специфически разрушать клетки, которые преимущественно экспрессируют рецептор ACE2 на своей поверхности, а именно альвеолярные клетки типа II (2, 3).
Как клетки-предшественники альвеолярного эпителия, альвеолярные клетки типа II являются «защитниками альвеол» (4). Они поддерживают альвеолярный гомеостаз, особенно после микробного повреждения легких, где они контролируют воспалительную реакцию.
За счет выработки защитного сурфактанта легких альвеолярные клетки типа II снижают поверхностное натяжение легких и, таким образом, облегчают дыхание и газообмен, а также играют центральную роль в процессах восстановления после травмы (5) (Рисунок 1).Повреждение альвеолярных клеток типа II резко снижает выработку легочного сурфактанта и секрецию в альвеолярное пространство. За этим следует ателектаз из-за дисфункции сурфактанта легких, что еще больше снижает эластичность легких (6). У пациентов, инфицированных SARS-CoV-2, нарушается межфазная фаза воздух-жидкость, что приводит к повреждению легких. ACE2 сам по себе защищает от повреждения легких с помощью противовоспалительных и антифиброзных механизмов. Таким образом, использование рекомбинантного ангиотензинпревращающего фермента (АПФ) не только блокирует сайты связывания вирусных рецепторов, но также обеспечивает защиту легких.В сценарии, когда SARS-CoV-2 связывается с ACE2, защитное связывание ACE значительно снижается. Разрушение альвеолярных клеток сопровождается снижением оксигенации крови, фиброзом легких, отеком, нарушением регенерации и, в конечном итоге, приводит к дыхательной недостаточности (7).
Поверхностно-активное вещество легких в качестве защитной противовоспалительной терапии ОРДС
Дыхательная недостаточность также известна по совершенно другому происхождению, а именно у недоношенных детей с пониженной выработкой сурфактанта в легких по сравнению с доношенными детьми.Без достаточного количества сурфактанта в легких альвеолы разрушаются во время выдоха, что приводит к ухудшению оксигенации крови.
Поверхности легких представляют собой поверхность раздела воздух-жидкость и находятся в постоянном движении во время вдоха и выдоха. Последнее создает риск коллапса тканей из-за поверхностного натяжения жидкости. Легкие преодолевают эту опасность, покрывая свою поверхность легочным сурфактантом. Сурфактант легких продуцируется в специализированных клетках, обнаруженных в терминальных ветвях легких, альвеолярных клетках типа II, которые начинают продуцировать сурфактант легких сразу после рождения (8).
Поверхностно-активное вещество легких представляет собой смесь фосфолипидов и четырех поверхностно-активных белков (SP), а именно гидрофильных SP-A и SP-D, также называемых коллектинами, и липофильных SP-B и SP-C (9). Сурфактант легких снижает поверхностное натяжение и тем самым предотвращает коллапс альвеол во время выдоха. Все SP вносят вклад в врожденные иммунные ответы легких, в то время как SP-B и SP-C также влияют на консистенцию сурфактанта, богатого фосфолипидами (10). Недавно были описаны новые белки, ассоциированные с поверхностно-активными веществами (SFTA), с аналогичными свойствами по сравнению с «классическим» SP (11–13).SFTA2 является гидрофильным и обладает аналогичными свойствами по сравнению с SP-A и SP-D (13). SFTA3 усиливает фагоцитоз клеточных линий макрофагов (14) и является амфифильным белком (12). Следовательно, он, вероятно, присутствует в коммерчески доступных липофильных экстрактах легких животных и может усиливать фагоцитотическую активность макрофагов против CoV-2.
У недоношенных детей выработка сурфактанта в легких недостаточна из-за плохой оксигенации крови и высокого поверхностного натяжения альвеол, что приводит к усилению воспалительной реакции.
Начиная с конца семидесятых, экзогенный сурфактант из легких крупного рогатого скота или свиньи, полученный из бронхиального лаважа, был успешно применен в качестве терапии ОРДС у недоношенных детей. Лечение препаратами легочного сурфактанта приводит к усилению оксигенации и увеличению выживаемости (15–17). Следует отметить, что лечение естественным сурфактантом легких давало лучший результат в отношении выживаемости младенцев по сравнению с синтетическим сурфактантом легких (17). Натуральные легочные сурфактанты представляют собой смесь липидов (90%) и белков сурфактанта (10%), которые регулируют активность альвеолярных макрофагов и уменьшают воспаление.Фракция липофильного сурфактанта легких обладает противовоспалительными свойствами при интратрахеальном применении в легких (18), а также при местном применении на кожу (19). В коже сурфактант легких снижает экспрессию провоспалительных и профиброзных генов в ранах in vivo . В различных моделях воспаления раны in vitro, и in vivo, на мышах и людях, сурфактант легких снижает TNF-α, TACE и IL-6 (19), которые значительно повышены у пациентов с тяжелым заболеванием COVID-19.
Недавние результаты показывают, что SARS-CoV-2 вызывает разрушение альвеолярных клеток типа II при пневмонии, связанной с COVID-19 (2). Именно эти клетки производят сурфактант в легких и предотвращают коллапс легких. Кроме того, лимфоцитопения с массовым выбросом цитокинов является еще одним фактором, приводящим к легочной недостаточности и смерти в тяжелых случаях пациентов с COVID-19. Поэтому было предложено, чтобы противовоспалительные мишени, такие как анти-TNF и анти-IL-6, лучше контролировали тяжелую инфекцию COVID-19 (20).
Обсуждение: использование поверхностно-активного вещества легких для восстановления легочного барьера у пациентов с пневмонией COVID-19
Хотя терапия легочным сурфактантом является стандартной, очень безопасной и эффективной терапией для новорожденных с ОРДС, лечение рекомбинантным сурфактантом на основе SP-C не показало улучшения выживаемости в крупных рандомизированных контролируемых исследованиях у взрослых (18). Важно отметить, что использование натуральных поверхностно-активных веществ кажется более выгодным по сравнению с синтетическими поверхностно-активными веществами (16, 17) со значительным улучшением оксигенации крови и более коротким временем вентиляции у младенцев (16).Синдром аспирации мекония напоминает пневмонию COVID-19 с пониженной выработкой сурфактанта и разрушением альвеолярных клеток II типа (21). Раннее введение естественного сурфактанта легких сокращало время ЭКМО-терапии и вентиляции (21). Это говорит о том, что раннее введение естественного сурфактанта в легкие действительно может улучшить легочную функцию также у взрослых пациентов с тяжелым ОРДС, в то время как причиной смерти может быть не только коллапс легкого, а, скорее, полиорганная недостаточность. Кроме того, разные факторы риска развития ОРДС и разные фенотипы предполагают возможные различные эффекты, связанные с терапевтическими мерами.Таким образом, положительные эффекты терапии сурфактантами у пациентов с ОРДС, ассоциированными с COVID-19, вполне возможны, особенно при применении на ранних этапах стратегии лечения легочной недостаточности.
В связи с сильной противовоспалительной и защитной эффективностью легких и острой необходимостью сегодня в поддерживающей терапии легких, мы предлагаем адъювантное лечение пациентов с пневмонией COVID-19 в отделениях интенсивной терапии естественными сурфактантами легких в дополнение к текущим стандартам интенсивной терапии ОРДС. . Текущие данные свидетельствуют о том, что это повысит оксигенацию крови, уменьшит отек легких и уменьшит чрезмерную воспалительную реакцию, обнаруженную при вскрытии легких пациентов с COVID-19 (22).Windtree therapeutics ™ объявила о своем плане протестировать синтетическое сурфактант KL4 у пациентов с тяжелой формой заболевания COVID-19 (https://www.windtreetx.com/). В Германии Lyomark Pharma GmbH планирует протестировать свой природный многокомпонентный легочный сурфактант бовактант у взрослых пациентов с COVID-19 с пневмонией (www.lyomark.com).
Коммерчески доступное легочное сурфактант является относительно недорогим по стандартам интенсивной терапии, легкодоступным и не имеет известных побочных эффектов у детей и взрослых. Следует соблюдать осторожность у пациентов с известной аллергией на продукты из крупного рогатого скота или свиней, так как легочные сурфактанты в основном получают из легких крупного рогатого скота (бовактант, Alveofact ® ) или свиней (poractant alfa, Curosurf ® ) легких путем промывания или измельчения тканей с последующим измельчением. экстракция липидной фракции.
Введение просто путем добавления восстановленного лиофилизата в трахеальную трубку вентилируемого пациента, доставляющего лекарство непосредственно в альвеолярное пространство. Что касается бовактанта, небулайзер был недавно одобрен FDA для клинического использования в США. Покрывая внешнюю поверхность альвеол, сурфактант легких действует непосредственно на воспалительные клетки, снижая выработку цитокинов и разрушение тканей. Тем самым он восстанавливает легочный барьер и, таким образом, предотвращает коллапс легких (рис. 2).Следовательно, это сократит продолжительность вентиляции, облегчит дыхание и, таким образом, будет способствовать выздоровлению пациентов.
Рисунок 2 . Гипотетический механизм внешнего применения легочного сурфактанта для защиты легких при тяжелом ОРДС, связанном с COVID-19. Связанный с COVID-19 ОРДС характеризуется массивной инфильтрацией макрофагов, активацией тканевых альвеолярных макрофагов и потенцированием выработки цитокинов в легких (цитокиновый «шторм»), что приводит к разрушению альвеолярных клеток типа II, продуцирующих сурфактант, что ухудшает ситуацию через потеря противовоспалительного, антифиброзного сурфактанта легких.Экзогенный сурфактант может уменьшить воспаление и, таким образом, восстановить выживаемость легких. Создано с использованием медицинского искусства smart servier по адресу https://creativecommons.org/licenses/by/3.0/.
Авторские взносы
Все авторы участвовали в разработке, написании и концептуализации рукописи. UM и KM отредактировали и разработали рисунки.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить Desiree Schumann (Базельский университет) за ее проницательную поддержку при написании этой рукописи. Авторы поддерживаются Немецким исследовательским фондом (DFG) и JDRF. Мы приносим свои извинения за то, что не цитируем многие важные публикации из-за нехватки места.
Список литературы
1. Цао Б., Ван И, Вэнь Д., Лю В., Ван Дж., Фань Г. и др. Испытание применения лопинавира-ритонавира у взрослых, госпитализированных с тяжелым Covid-19. N Engl J Med. (2020) 382: 1787–99. DOI: 10.1056 / NEJMoa2001282
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Чжоу П., Ян XL, Ван XG, Ху Б., Чжан Л., Чжан В. и др. Вспышка пневмонии, связанная с новым коронавирусом, вероятно, происхождения летучих мышей. Природа . (2020) 579: 270–3. DOI: 10.1038 / s41586-020-2012-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Hoffmann M, Kleine-Weber H, Schroeder S, Kruger N, Herrler T., Erichsen S, et al.Вход в клетки SARS-CoV-2 зависит от ACE2 и TMPRSS2 и блокируется клинически доказанным ингибитором протеазы. Ячейка . (2020) 181: 271–80.e8. DOI: 10.1016 / j.cell.2020.02.052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Alcorn JL. Легочный сурфактант и гомеостаз. В: Сидхайе В.К., Коваль М., редакторы. Биология эпителия легких в патогенезе болезней легких . Филадельфия, Пенсильвания: Elsevier Academic Press (2017). п. 59–75.DOI: 10.1016 / B978-0-12-803809-3.00004-X
CrossRef Полный текст | Google Scholar
6. Гурка Д.П., Балк РА. Острая дыхательная недостаточность. В: Parrillo JE, Dellinger RP, редакторы. Реанимационная медицина. Принципы диагностики и ведения взрослых . Филадельфия, Пенсильвания: Мосби Эльзевьер (2008). п. 773–94. DOI: 10.1016 / B978-032304841-5.50040-6
CrossRef Полный текст
7. Фанг Л., Каракиулакис Г., Рот М. Имеют ли пациенты с гипертонией и сахарным диабетом повышенный риск заражения COVID-19? Ланцет Респир Мед .(2020) 8: e21. DOI: 10.1016 / S2213-2600 (20) 30116-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Райт-младший. «Мудрость» легочного сурфактанта: балансировка функций защиты организма и снижения поверхностного натяжения. Am J Physiol Lung Cell Mol Physiol . (2006) 291: L847–50. DOI: 10.1152 / ajplung.00261.2006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Schicht M, Garreis F, Hartjen N, Beileke S, Jacobi C, Sahin A, et al.SFTA3 — новый поверхностно-активный белок поверхности глаза и его роль в заживлении ран роговицы и поверхностном натяжении слезной пленки. Научная публикация (2018) 8: 9791. DOI: 10.1038 / s41598-018-28005-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Черниг Т., Вейт Н.Т., Дилер Э., Бишофф М., Мейер С., Шихт М. Важность сурфактантных белков — новые аспекты фагоцитоза макрофагов. Анн Анат. (2016) 208: 142–5. DOI: 10.1016 / j.aanat.2016.07.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13.Миттал Р.А., Хаммель М., Шварц Дж., Хешл К.М., Бретшнайдер Н., Флеммер А.В. и др. SFTA2 — новый секреторный пептид, высоко экспрессируемый в легких, — модулируется липополисахаридом, но не гипероксией. PLoS ONE. (2012) 7: e40011. DOI: 10.1371 / journal.pone.0040011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Дилер Э., Шихт М., Рабунг А., Черниг Т., Мейер С., Рауш Ф. и др. Новый поверхностно-активный белок SP-H увеличивает эффективность фагоцитоза макрофагоподобных клеточных линий U937 и MH-S. BMC Res Notes. (2014) 7: 851. DOI: 10.1186 / 1756-0500-7-851
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Раманатан Р. Сурфактантная терапия недоношенных детей с респираторным дистресс-синдромом и недоношенных новорожденных с острым РДС. Дж Перинатол . (2006) 26 (Дополнение 1): S51–6; обсуждение S63-4. DOI: 10.1038 / sj.jp.7211474
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Been JV, Zimmermann LJ.Что нового в ПАВ? Клинический взгляд на последние разработки в неонатологии и педиатрии. Europ J Pediatrics. (2007) 166: 889–99. DOI: 10.1007 / s00431-007-0501-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Эйнсворт С.Б., Бересфорд М.В., Миллиган Д.В., Шоу Нью-Джерси, Мэтьюз Дж. Н., Фентон А.С. и др. Пумактант и порактант альфа для лечения респираторного дистресс-синдрома у новорожденных, родившихся на сроке гестации 25-29 недель: рандомизированное исследование. Ланцет .(2000) 355: 1387–92. DOI: 10.1016 / S0140-6736 (00) 02136-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Spragg RG, Lewis JF, Walmrath HD, Johannigman J, Bellingan G, Laterre PF, et al. Влияние рекомбинантного сурфактанта на основе сурфактанта протеина С на острый респираторный дистресс-синдром. N Engl J Med. (2004) 351: 884–92. DOI: 10.1056 / NEJMoa033181
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Mirastschijski U, Schwab I., Coger V, Zier U, Rianna C, He W, et al.Сурфактант легких ускоряет заживление кожных ран: трансляционное исследование с рандомизированным клиническим исследованием фазы I. Научная публикация (2020) 10: 2581. DOI: 10.1038 / s41598-020-59394-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Shi Y, Wang Y, Shao C, Huang J, Gan J, Huang X и др. Инфекция COVID-19: перспективы иммунного ответа. Разница в гибели клеток . (2020) 27: 1451–4. DOI: 10.1038 / s41418-020-0530-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21.Финдли Р.Д., Тэуш Х.В., Вальтер Ф.Дж. Сурфактантная заместительная терапия при синдроме аспирации мекония. Педиатрия . (1996) 97: 48–52.
PubMed Аннотация | Google Scholar
22. Яо XH, Ли TY, He ZC, Ping YF, Liu HW, Yu SC и др. [Патологический отчет о трех случаях COVID-19 при минимально инвазивном вскрытии]. Чжунхуа Бин Ли Сюэ За Чжи . (2020) 49: E009. DOI: 10.3760 / cma.j.cn112151-20200312-00193
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Ингибирование и противодействие поверхностно-активному веществу естественного происхождения Surfacen
Abstract
Инактивация легочного сурфактанта различными компонентами, такими как сыворотка, холестерин или меконий, способствует тяжелым респираторным патологиям из-за дестабилизации и разрушения воздушного пространства.Недавние исследования подробно проанализировали, как межфазные свойства природного поверхностно-активного вещества, очищенного из легких животных, изменяются в результате воздействия на него белков сыворотки или мобилизованного меконием холестерина. Также было продемонстрировано, что предварительное воздействие на поверхностно-активное вещество полимеров, таких как гиалуроновая кислота, обеспечивает устойчивость к инактивации множественными ингибиторами. В текущей работе мы расширили эти исследования до анализа Surfacen, клинического сурфактанта, который в настоящее время используется для спасения недоношенных детей, страдающих или подверженных риску респираторного дистресса из-за врожденного недостатка сурфактанта.Этот сурфактант также сильно ингибируется как меконием, так и сывороткой при тестировании в сурфактометре с пленочными пузырьками (CBS) в условиях, имитирующих динамику дыхания. Как и в случае с нативным сурфактантом, Surfacen заметно защищен от ингибирования предварительным воздействием гиалуроновой кислоты, подтверждая, что клинические сурфактанты можно улучшить для лечения патологий, связанных с сильно дезактивирующими контекстами, например, связанных с повреждением легких и воспалением. Примечательно, что мы обнаружили, что в физиологически имитирующих условиях клиническое поверхностно-активное вещество, не содержащее холестерин, такое как Surfacen, менее подвержено ингибированию холестерин-мобилизирующей средой, чем холестеринсодержащий природный поверхностно-активный агент, как следствие заметно сниженной склонности к включению экзогенных холестерин.
Образец цитирования: Lugones Y, Blanco O, López-Rodríguez E, Echaide M, Cruz A, Pérez-Gil J (2018) Ингибирование и противодействие Surfacen, клиническому сурфактанту легких естественного происхождения. PLoS ONE 13 (9):
e0204050.
https://doi.org/10.1371/journal.pone.0204050
Редактор: Надес Паланияр, Больница для больных детей, КАНАДА
Поступила: 8 мая 2018 г .; Одобрена: 31 августа 2018 г .; Опубликован: 20 сентября 2018 г.
Авторские права: © 2018 Lugones et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе.
Финансирование: Это исследование было поддержано грантами Министерства экономики Испании (BIO2015-67930-R) и регионального правительства Мадрида (P2013 / MIT-2807).Сотрудничество между CENSA и UCM поддерживалось проектом Испанского агентства международного сотрудничества в целях развития (AECID). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, решении о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Легочный сурфактант представляет собой сложную смесь липидов и специфических белков. Он синтезируется и секретируется в альвеолярные пространства пневмоцитами II типа, и его основная функция заключается в снижении поверхностного натяжения на границе раздела дыхательного воздуха и жидкости, предотвращении коллапса альвеол и снижении работы дыхания [1].Терапевтическое применение препаратов сурфактанта у младенцев, страдающих респираторным дистресс-синдромом новорожденных (NRDS), доказало свою эффективность, факт, подтвержденный значительным количеством клинических испытаний, так что терапия экзогенным сурфактантом является рутинной практикой у пациентов с NRDS [ 2].
Адекватная активность сурфактанта остается критически важной для оптимальной функции легких на протяжении всей жизни, а вторичная дисфункция или инактивация сурфактанта может способствовать патогенезу тяжелых заболеваний легких, включая синдром острого респираторного расстройства (ARDS) [3, 4] и синдром аспирации мекония (MAS) [ 5] среди других.Заболеваемость острым повреждением легких (ОПЛ) и ОРДС у взрослых в США оценивается примерно в 200 000 пациентов в год со смертностью около 40% [6, 7]. Клинические расстройства, связанные с развитием ОРДС, включают сепсис, пневмонию, аспирацию желудочного содержимого и серьезные травмы. МАС остается важной причиной заболеваемости и смертности доношенных новорожденных, несмотря на улучшения в перинатальном ведении [8].
Ингибирование или инактивация поверхностно-активного вещества относится к процессам, которые уменьшают или отменяют нормальную межфазную активность легочного сурфактанта.Такие процессы могут препятствовать адсорбции поверхностно-активного вещества с образованием богатой фосфолипидами функциональной пленки поверхностно-активного вещества, препятствуя достижению пленкой достаточно низкого поверхностного натяжения при сжатии или влияя на повторное растекание пленки во время расширения. Сообщается, что ряд веществ ингибирует легочный сурфактант. Основными тормозящими факторами являются белки плазмы и сыворотки, лизофосфолипиды, свободные жирные кислоты, меконий (фекалии плода, выделяемые во время стресса) и супрафизиологические уровни холестерина [9].В нескольких исследованиях изучались молекулярные механизмы, лежащие в основе этих процессов инактивации, а также различные стратегии защиты и / или восстановления инактивации легочного сурфактанта [10]. На данный момент наиболее многообещающие результаты показали, что некоторые неионные или ионные полимеры (включая декстран, полиэтиленгликоль (PEG), гиалуронан (HA) или хитозан) усиливают поверхностную активность клинических поверхностно-активных веществ [11-18], нативных поверхностно-активных веществ [ 19, 20] или различные смеси синтетических фосфолипидов и поверхностно-активных белков [21] в присутствии инактивирующих веществ.
В частном случае ингибирования холестерином было проведено множество исследований для выяснения роли, которую играют естественные пропорции этого липида в системе поверхностно-активных веществ, в то время как аномально высокие пропорции холестерина вызывают вредные эффекты [22–26]. Фактически, баланс между возможными преимуществами ограниченной доли холестерина для поддержания надлежащей динамики поверхностно-активных мембран и пленок и восприимчивостью к ингибированию в патогенных условиях все еще остается предметом дискуссий.Было высказано предположение, что ингибирующие эффекты холестерина могут быть связаны с воздействием холестерина на поверхностно-активное вещество в присутствии агентов, мобилизующих холестерин, таких как соли желчных кислот или циклодекстрин [27]. Однако то, насколько природа препарата поверхностно-активного вещества (с точки зрения состава, структуры и т.д.) влияет на возможное включение холестерина и его последующее ингибирующее действие, должным образом не исследовалось.
Недавно мы оптимизировали протоколы для оценки ингибирования легочного сурфактанта сывороткой, холестерином или меконием в физиологически имитирующих условиях в сурфактометре с пленочным пузырьком (CBS) [19].В текущем исследовании мы использовали этот подход для анализа способности сыворотки и мекония влиять на биофизические свойства Surfacen, клинического поверхностно-активного вещества свиного происхождения, которое в настоящее время используется для лечения недоношенных детей, страдающих или подверженных риску RDS в кубинских больницах. Мы проанализировали, насколько восприимчивость Surfacen к ингибированию связана с включением холестерина, и действительно ли воздействие гиалуроновой кислоты на этот клинический сурфактант защищает или восстанавливает ингибирование Surfacen каким-либо веществом.
Материалы и методы
Материалы
Препараты Surfacen, клинического поверхностно-активного вещества, используемого в терапии NRDS в кубинских больницах [28], были получены из Centro Nacional de Sanidad Agropecuaria (CENSA, Mayabeque, Cuba). Surfacen получают из органических экстрактов свиных бронхоальвеолярных лаважей, которые подвергаются осаждению ацетоном для снижения содержания в них нейтральных липидов. Он предоставляется в виде стерильного белого лиофилизированного порошка, дозированного во флаконах, содержащих 50 мг фосфолипида, 0.От 3 до 0,7 мг гидрофобных белков и 2–3 мг других липидов. Каждый флакон также содержит 18 мг хлорида натрия исходного физиологического раствора, использованного для промывания [29, 30]. Чтобы восстановить водную суспензию Surfacen, необходимое количество сухого порошка поверхностно-активного вещества взвешивают и суспендируют в дистиллированной воде с 60-минутной инкубацией суспензии при 37 ° C с периодическим встряхиванием незадолго до проведения функциональных экспериментов.
Нативный сурфактант из легких свиней получали из бронхоальвеолярного лаважа свежих легких взрослых свиней, полученных с бойни, как описано ранее [31], и хранили при -70 ° C до использования.Легкие были извлечены у животных, предназначенных для употребления в пищу, и животных не приносили в жертву с единственной целью этих экспериментов. Бронхоальвеолярный лаваж (БАЛ) проводили в легких свиней с 0,9% раствором NaCl, который затем центрифугировали при 1.000g в течение 5 минут для удаления клеток и клеточного дебриса. БАЛ хранили при -20 ° C до использования. Для получения комплексов поверхностно-активных веществ мы сначала выполнили центрифугирование при 100000 g, 4 ° C, 1 час для осаждения полной мембранной фракции, а затем эти осадки центрифугировали в прерывистом градиенте плотности в течение 2 часов, 120.000xg, 4 ° C. Растворы, использованные для приготовления градиента плотности, включали NaBr 16%, NaCl 0,9% для более высокой плотности, NaBr 13%, NaCl 0,9% для промежуточной плотности и 0,9% NaCl для слоев с более низкой плотностью. В конце центрифугирования в градиенте плотности комплексы поверхностно-активных веществ, содержащие липиды и все взаимодействующие белки, концентрируются в виде компактного слоя между двумя последними растворами плотности. Этот материал состоит из 90% липидов и примерно 10% белков, хотя только 6-8% по массе составляют специфические белки, связанные с поверхностно-активными веществами (SP-A, -B и -C).Около 80–85% липидов по массе составляют фосфолипиды, включая около 75% фосфатидилхолина, 10–15% фосфатидилглицерин плюс фосфатидилинозитол и менее 5% фосфатидилсерин и сфингомиелин. Почти половина фракции ПАВ фосфатидилхолина составляет дипальмитоилфосфатидилхолин (ДПФХ). Холестерин является основным нейтральным липидом в этом препарате природного поверхностно-активного вещества, составляя 5–10% от общей массы липидов [29].
Первоначально прошедший меконий был подарком проф.H. W. Taeusch, из больницы общего профиля Сан-Франциско, и был получен из подгузников без мочи трех здоровых доношенных детей, родившихся в больнице. Перед использованием меконий охлаждали, хорошо перемешивали и лиофилизировали. Использование этого выброшенного человеческого материала для исследований было одобрено Наблюдательным советом больницы общего профиля Сан-Франциско, осуществляющим надзор за клиническими исследованиями, поскольку не предполагается коммерческое использование и не используются идентификаторы пациентов. Гиалуроновая кислота (HA, 120k) была получена от Sigma (St.Луис, Миссури). Сухую массу мекония или ГК использовали для стандартизации смесей с Surfacen. Конечная концентрация Surfacen составляла 20 мг / мл, для мекония 10 мг / мл и 0,25% для HA; Перед началом функциональных испытаний Surfacen и смеси инкубировали 30 мин при 37 ° C в термомиксере. Свиную сыворотку получали из крови и использовали при концентрации белка 100 мг / мл. Холестерин был получен от Avanti Polar Lipids (Бирмингем, Алабама), а водорастворимый холестерин (в комплексе с метил-β-циклодекстрином (MβCD)) был получен от Sigma (C4951, St.Луис, Миссури).
Органический экстракт Surfacen получали экстракцией водной суспензии Surfacen хлороформом / метанолом. Добавление холестерина в органический экстракт Surfacen было достигнуто путем добавления необходимого количества холестерина, растворенного в хлороформе, к органическому экстракту Surfacen перед сушкой. Затем смесь сушили в атмосфере азота, а затем в UNIVAP в течение 2 часов для удаления следов растворителя, а затем повторно гидратировали в физиологическом растворе в течение 60 минут при 37 ° C с периодическим перемешиванием со скоростью 550 об / мин каждые 10 минут.
Методы
Эффективность поверхностно-активного вещества оценивалась при 37 ° C и оценивалась с помощью поверхностно-активного вещества с закрытым пузырем, как описано ранее [32]. Камера содержала 5 мМ трис-HCl pH 7, 150 мМ NaCl и 10% сахарозу. После образования небольшого пузырька воздуха (0,035–0,040 см 3 ) примерно 150 нл поверхностно-активного вещества (20 мг / мл) откладывались под поверхностью пузырька. Такой небольшой объем был геометрически измерен на изображении с микроскопа CBS с учетом высоты столбика поверхностно-активного вещества, нанесенного внутри прозрачного капилляра известного диаметра.После нанесения поверхностно-активного вещества изменение поверхностного натяжения (γ) отслеживали в течение пяти минут по изменению формы пузырька (17). Затем камеру герметично закрывали, и пузырек быстро (1 с) расширялся до 0,15 см 3 для регистрации адсорбции после расширения. Через пять минут после расширения начинались квазистатические циклы, в которых размер пузырька сначала уменьшался (на 20% от его предыдущего объема), а затем увеличивался ступенчато. Между каждым из четырех квазистатических циклов была 1-минутная задержка между циклами и дополнительная 1-минутная задержка перед запуском динамических циклов, в которых размер пузырьков непрерывно изменялся со скоростью 20 циклов / мин.Данные по начальной адсорбции и адсорбции после расширения представлены в виде средних значений из нескольких экспериментов (n> 3), в то время как графики, показывающие квазистатические (Q-статические) и динамические циклы, соответствуют отдельным репрезентативным экспериментам. Чтобы изучить ингибирующий эффект сыворотки с механизмом ингибирования, который зависит от способности сурфактанта к адсорбции на границе раздела фаз, мы сначала вводили 2 мкл полной сыворотки (концентрация белка ~ 100 мг / мл), чтобы сформировать слой на границе раздела. пузырьковая граница раздела воздух-жидкость, а затем в субфазу у поверхности вводили ПАВ [19].Чтобы изучить ингибирующие эффекты мекония или холестерина, которые обычно действуют путем нарушения состава и структуры поверхностно-активных мембран, поверхностно-активное вещество сначала было предварительно смешано с холестерином или меконием, а затем смеси были введены в субфазу около пузыря. Мы использовали концентрацию ПАВ 20 мг / мл во всех функциональных экспериментах. В некоторых экспериментах ГК предварительно смешивали с поверхностно-активным веществом или смесями поверхностно-активного вещества / мекония и сразу же вводили в субфазу, как описано выше (19).
Чтобы определить процент включения холестерина в поверхностно-активные вещества, надлежащее количество поверхностно-активного вещества подвергали воздействию различных пропорций нагруженного холестерином метил-β-циклодекстрина (MβCD), инкубировали в течение 30 минут, 550 об / мин при 37 o ° C в термомиксер. После центрифугирования при 14800 об / мин осадок ресуспендировали в буфере и использовали для количественного определения содержания фосфолипидов, используя анализ фосфора, описанный в другом месте [33], и концентрацию холестерина с помощью ферментативного колориметрического метода, коммерчески предоставляемого Spinreact (Жирона, Испания).Альтернативно, количество включенного холестерина определяли в препаратах, ресуспендированных из смесей органического экстракта поверхностно-активного вещества и органических растворов хлороформа.
Большинство цифр представляют собой среднее значение ± стандартное отклонение. после усреднения данных нескольких (n> 3) независимых экспериментов. Как правило, с каждым образцом повторяли четыре различных эксперимента, за исключением экспериментов с воздействием мекония на поверхностно-активное вещество, которые были повторены 9 раз, чтобы подтвердить высокую внутреннюю изменчивость эффектов мекония.Эксперименты CBS на сжатие-расширение показаны в виде репрезентативных изотерм. Для выявления статистически значимых различий был проведен односторонний дисперсионный анализ с анализом после t-критерия Дункана (InfoStat 2018) [34]. Значения вероятности p <0,05 считались достоверными.
Результаты
На рис. 1A показано, как Surfacen в отсутствие сыворотки быстро образует поверхностную пленку, которая снижает поверхностное натяжение до 24,4 ± 1,4 мН / м после 5 минут начальной адсорбции и после расширения границы раздела пузырьков в течение 5 минут.Во время начальной адсорбции Surfacen может достичь поверхности раздела за несколько секунд. Когда Surfacen наносился под слой сыворотки, прилегающий к границе раздела воздух-жидкость, адсорбция Surfacen не происходила, потому что поверхностное натяжение оставалось на уровне 43,2 ± 2,3 мН / м, что близко к натяжению пленки чистой сыворотки, и значительно выше (p = 0,00001), чем производимый Surfacen в отсутствие сыворотки. После расширения минимальное поверхностное натяжение через 5 минут также осталось неизменным и составило 41,7 ± 2,6 мН / м, что указывает на то, что Surfacen не может эффективно конкурировать с компонентами сыворотки за достижение границы раздела.Напротив, нанесение Surfacen, предварительно подвергнутого воздействию HA, восстановило способность поверхностно-активного вещества достигать границы раздела и снизить поверхностное натяжение до значений 25,6 ± 0,6 мН / м даже в присутствии сыворотки (нет существенной разницы по сравнению с одним Surfacen в отсутствие сыворотки). В принципе, HA не влияет на состав и поведение поверхностной пленки Surfacen, поскольку равновесное натяжение, достигаемое только Surfacen, было аналогично натяжению Surfacen, предварительно смешанного с HA.
Рис. 1. Ингибирование Surfacen сывороткой и его реверсия HA.
Изотермы межфазной адсорбции (A) и сжатия-расширения (B) пленок Surfacen в отсутствие или в присутствии сыворотки и / или HA. Данные представляют собой средние значения ± стандартное отклонение на графиках IA и PEA. Репрезентативный эксперимент показан на каждой панели изотерм сжатия-расширения из различных повторений (n> 3), выполненных с каждым образцом.
https://doi.org/10.1371/journal.pone.0204050.g001
На рис. 1В приведены изотермы сжатия-расширения пленок Surfacen, сформированных в отсутствие или в присутствии сыворотки.В отсутствие сыворотки изотермы циклирования Surfacen демонстрировали оптимальное поведение, причем первые квазистатические циклы демонстрировали больший гистерезис, чем последующие циклы. В конце четвертого квазистатического цикла поверхностное натяжение упало до 3,0 ± 0,8 мН / м после уменьшения площади менее чем на 20% от исходной площади. Динамические циклы показывают нормальное функционирование Surfacen в отсутствие сыворотки с очень низким поверхностным натяжением (3,1 ± 0,7 мН / м), достигаемым при уменьшении площади менее чем на 20%. Surfacen (20 мг / мл), нанесенный чуть ниже поверхности пузырька, под предварительно сформированным слоем сыворотки, не смог снизить поверхностное натяжение ниже 20.6 ± 1,6 мН / м (Q-статические циклы) или 13,9 ± 5,8 мН / м (динамические циклы), значения, которые были значительно выше (p = 0,0001), чем те, которые были достигнуты в отсутствие сыворотки, даже после того, как 50% уменьшение площади поверхности. Однако нанесение Surfacen, предварительно смешанного с HA, смогло восстановить способность Surfacen получать минимальное поверхностное натяжение, которое было статистически неотличимо от того, которое достигается Surfacen в отсутствие сыворотки во время как Q-статического, так и динамического циклов.
На рис. 2 сравнивается кинетика межфазной адсорбции Surfacen и Surfacen, предварительно подвергнутых действию мекония, по оценке после осаждения на границе раздела воздушного пузыря в поверхностно-активном сурфактометре с закрепленным пузырем.Начальную адсорбцию и адсорбцию после расширения (рис. 2А), а также изотермы квазистатического и динамического циклирования (рис. 2В) Surfacen можно сравнить с предварительной инкубацией с меконием и без нее. Clean Surfacen адсорбируется с образованием стабильной поверхностной пленки с минимальным равновесным поверхностным натяжением 23 ± 0,5 мН / м в течение первых секунд после нанесения. Surfacen, подвергшийся воздействию мекония, адсорбируется так же быстро, как и чистый Surfacen, хотя он достигает несколько более высокого поверхностного натяжения (33,5 ± 9,4 мН / м через пять минут). Повторная адсорбция избыточного материала при расширении пузырька дала аналогичные результаты (рис. 2 A).Вариабельность изотерм, полученных для образцов, обработанных меконием, обычно очень высока, независимо от количества экспериментов и испытанных образцов, вероятно, как следствие дисперсной и неоднородной природы самого мекония.
Рис. 2. Влияние мекония на поверхностную активность Surfacen по оценке сурфактометра Captive Bubble Surfactometer.
A) Начальная адсорбция и адсорбция после расширения Surfacen в отсутствие (слева) и в присутствии (справа) мекония.Б) Квазистатические (Q-статика, верхние панели) и динамические (нижние панели) изотермы сжатия-расширения пленок Surfacen, сформированных в отсутствие (слева) или в присутствии (справа) мекония.
https://doi.org/10.1371/journal.pone.0204050.g002
Изотермы циклов, полученные из чистых пленок Surfacen, практически не показывают гистерезиса сжатия / расширения в последовательных квазистатических или динамических циклах (рис. 2B). Surfacen достигает минимального поверхностного натяжения 2,4 ± 0.15 мН / м при сжатии всего 15% во время динамических циклов. Напротив, изотермы Surfacen, подвергнутые воздействию мекония, снова показали высокую изменчивость циклических изотерм. На рис. 2В суммированы три репрезентативных эксперимента (из девяти повторов) с таким изменяющимся поведением как в квазистатических, так и в динамических циклах, в то время как эксперименты проводились в идентичных условиях. При квазистатическом циклическом сжатии / расширении гистерезис все еще был ограничен, но в некоторых экспериментах требовалось сжатие гораздо большей площади, чтобы получить значения минимального поверхностного натяжения 19.6 мН / м. Однако никакого эффекта мекония не наблюдалось в других экспериментах, где предварительное воздействие мекония по-прежнему сохраняло способность получать минимальное поверхностное натяжение, подобное (то есть в третьем и четвертом циклах) для очистки Surfacen. Напротив, Surfacen, подвергнутый воздействию мекония, всегда нуждался в сжатии большей площади и демонстрировал заметный гистерезис как в квазистатическом, так и в динамическом цикле.
С другой стороны, изотермы, полученные для пленок, образованных смесью Surfacen / HA (рис. 3), всегда демонстрировали аналогичное поведение независимо от того, подвергались ли они предварительному воздействию мекония или нет, при этом Surfacen, подвергнутый воздействию мекония, по-прежнему практически не показывает гистерезиса сжатия / расширения. и достигнув минимального натяжения 2.8 ± 0,6 мН / м при сжатии всего 20% площади. Только первый квазистатический цикл показал предельный гистерезис, который терялся в последующих циклах, вероятно, как следствие уравновешивания / реорганизации пленки во время сжатия. Таким образом, добавление HA полностью восстановило поведение Surfacen в присутствии мекония во время Q-статического и динамического цикла сжатия-расширения, что в конечном итоге привело к очень низкому поверхностному натяжению. Кроме того, обработанный ГК Surfacen показал очень стабильное межфазное поведение без различий между экспериментами с предварительным воздействием мекония или без него.
Рис. 3. Обращение HA ингибирования Surfacen меконием.
A) Адсорбция при начальном и последующем расширении Surfacen плюс HA в отсутствие (слева) или в присутствии (справа) мекония. Б) Квазистатические (Q-статические, верхние панели) и динамические (нижние панели) изотермы сжатия-расширения пленок Surfacen плюс HA, сформированных в отсутствие (левые панели) или в присутствии (правые панели) мекония.
https://doi.org/10.1371/journal.pone.0204050.g003
На рис. 4 обобщены наиболее важные параметры, определяющие поведение Surfacen, подвергнутого воздействию мекония, на CBS и реверсию, вызванную HA. Панель А иллюстрирует равновесное поверхностное натяжение, достигаемое при адсорбции, либо вначале, либо после расширения пузырьков, предварительно обработанного меконием и / или ГК Surfacen. Равновесное поверхностное натяжение, достигнутое во время начальной адсорбции предварительно экспонированным поверхностно-активным веществом ГК, статистически не отличалось от натяжения, полученного пленками, изготовленными только из Surfacen. Предварительно смешанные Surfacen с меконием привели к значительно более высокому среднему поверхностному натяжению (p = 0.005), чем чистый Surfacen или Surfacen, предварительно смешанный с меконием и ГК. Различия в минимальном натяжении во время адсорбции после расширения не были обнаружены как статистически значимые из-за большого стандартного отклонения как следствие высокой неоднородности в поведении реплик, вероятно, связанной с внутренней сложностью и неоднородностью мекония, как указано выше. Панель B на рис. 4 иллюстрирует минимальное и максимальное поверхностное натяжение в конце 4-го квазистатического или 20-го динамических циклов сжатия-расширения Surfacen, предварительно обработанного меконием и / или ГК.Surfacen, предварительно подвергнутый воздействию мекония в отсутствие HA, вызывал значительно более высокое поверхностное натяжение (p = 0,006), чем чистый Surfacen или Surfacen, подвергнутый воздействию мекония в присутствии HA во время q-статического цикла. Минимальное растяжение не отличалось статистически во время динамического цикла, что указывает на то, что пленки могут быть, по крайней мере, частично очищены от вредных компонентов во время быстрого сжатия. Однако Surfacen, подвергшийся воздействию мекония, давал значительно более высокие максимальные напряжения (p = 0,005) в конце части расширения динамических изотерм, чем чистый Surfacen или Surfacen, который подвергался воздействию мекония в присутствии HA.Это указывает на то, что, хотя быстрая циклическая обработка может способствовать непрерывной очистке менее поверхностно-активных компонентов от загрязненных меконием межфазных пленок, адсорбция все еще недостаточна для надлежащего пополнения пленок новыми поступающими компонентами во время периодов расширения. Оптимальное поведение как во время q-статического, так и во время динамического цикла полностью сохранялось в присутствии HA. На панели C показано уменьшение площади, необходимое для достижения минимального поверхностного натяжения в конце 4-го квазистатического или 20-го динамического цикла сжатия-расширения.Surfacen, подвергнутый воздействию мекония, требует уменьшения площади почти на 40%, чтобы получить поверхностное натяжение, подобное тому, которое достигается только Surfacen или Surfacen плюс HA в 4-м квазистатическом цикле (см. Рис. 2 и 3).
Рис. 4. Параметры, определяющие поведение поверхности Surfacen в отсутствие и в присутствии мекония и / или HA.
A) Минимальное поверхностное натяжение после начальной адсорбции или адсорбции после расширения только Surfacen или в присутствии мекония и / или HA. B) Минимальное и максимальное поверхностное натяжение после квазистатических (четвертый цикл) или динамических (десятый цикл) изотерм сжатия-расширения пленок, образованных одним Surfacen или Surfacen, предварительно смешанным с меконием и / или HA.C) Процент уменьшения площади, необходимый для получения минимального натяжения пленками, образованными только Surfacen или Surfacen в присутствии мекония и / или HA. Звездочка указывает на то, что среднее значение статистически отличается от сравниваемых значений (p <0,05) (см. Текст).
https://doi.org/10.1371/journal.pone.0204050.g004
Учитывая высокую вариабельность воздействия мекония на Surfacen и тот факт, что инактивация поверхностно-активного вещества меконием, как было доказано, зависит от количества холестерина перенесенный из мекония [27], мы решили сравнить инактивацию мекония с эффектом включения избытка холестерина в комплексы Surfacen.На фиг.5А показано, что добавление 20% (мас. / Мас.) Холестерина к Surfacen оказывало различные эффекты на его биофизическое поведение в зависимости от стратегии, используемой для воздействия на поверхность стерола. Когда 20% (мас. / Мас.) Холестерина было введено в смеси Surfacen, которые ранее были экстрагированы органическими растворителями, а затем снова восстановлены в виде водных суспензий, содержащих холестерин, это оказало явно пагубное влияние на изотермы Q-static и динамического сжатия-расширения. что потребовало уменьшения площади примерно на 40% для достижения минимального поверхностного натяжения всего 20 мН / м.Напротив, воздействие на Surfacen 20% (мас. / Мас.) Холестерина, солюбилизированного циклодекстрином, имело очень ограниченный ингибирующий эффект на его биофизические свойства. В этом случае Q-static циклы потребовали большего уменьшения площади (около 50% в первом цикле) в первом случае, но в четвертом цикле сжимаемость была восстановлена до тех же значений, что и в случае Surfacen без холестерина. Однако все циклы сжатия-расширения показали больший гистерезис по сравнению с таковыми на изотермах Surfacen без холестерина.На изотермах динамического сжатия-расширения только первый цикл имел больший гистерезис. Холестерин (добавленный в виде органической смеси или солюбилизированный циклодекстрином) не оказывал заметного влияния ни на начальную, ни на адсорбцию после расширения, независимо от метода включения.
Рис. 5. Поведение поверхности Surfacen, включающего холестерин в водном или органическом растворителе.
Surfacen либо подвергался действию MβCD-холестерина (водный), либо экстрагировался в органическом растворителе и смешивался с холестерином перед восстановлением смеси снова в виде водной суспензии.А. Начальная и пострасширяющая адсорбция (IA и PEA) Surfacen плюс 20% или 40% (по отношению к фосфолипидам) MβCD-холестерина (водный) или холестерин (органический), по оценке CBS при 37 ° C. . B. Типичные изотермы сжатия-расширения, полученные во время Q-статического или динамического цикла. Данные представляют собой средние значения ± стандартное отклонение на графиках IA и PEA. Репрезентативный эксперимент показан на каждой панели циклических изотерм после нескольких повторений (n> 3) для каждого образца.
https: // doi.org / 10.1371 / journal.pone.0204050.g005
Ингибирующий эффект включения холестерина в Surfacen в смесях органических растворителей, по-видимому, связан с эффективным увеличением доли холестерина до 16% по отношению к фосфолипидам (Таблица 1) после того, как смеси Surfacen / холестерин были снова восстановлены в виде водных растворов. Напротив, воздействие на Surfacen нагруженного холестерином MβCD только увеличивало долю стерола в комплексах сурфактанта до 11%.Было установлено, что физиологический уровень холестерина в эндогенном нативном сурфактанте легких может составлять около 5–10% по отношению к массе фосфолипидов. Поскольку производство Surfacen заканчивается почти полным истощением холестерина [35], скрытое включение холестерина в пропорциях, не превышающих 10%, может поддерживать физиологические пределы без видимых отрицательных эффектов на биофизическое поведение Surfacen. Поэтому мы приступили к тестированию эффекта воздействия Surfacen на гораздо более высокие уровни холестерина, которые могут увеличить фактическое включение холестерина в комплексы этого клинического сурфактанта, имитируя определенные патологические контексты.С этой целью мы инкубировали Surfacen с 40% (мас. / Мас.) Холестерина, солюбилизированного в MβCD, так как это может имитировать ситуации, в которых большое количество холестерина может быть мобилизовано на поверхностно-активное вещество, например, в случаях аспирации мекония. Фиг. 5 показывает, что поведение Surfacen при воздействии 40% холестерина, солюбилизированного циклодекстрином, не слишком отличалось от поведения Surfacen при воздействии 20% солюбилизированного холестерина. Таблица 1 показывает, что существуют важные различия в степени включения холестерина в комплексы Surfacen по сравнению с включением в нативный сурфактант легких при воздействии сравнимых количеств солюбилизированного холестерина.Surfacen, кажется, всегда содержит меньше холестерина по сравнению с мембранами из нативных поверхностно-активных веществ. Когда холестерин добавляют к смесям поверхностно-активных веществ в органическом растворителе, как фосфолипиды поверхностно-активных веществ, так и холестерин полностью смешиваются и включаются в обычные восстановленные мембраны. Когда холестерин солюбилизируется водными мобилизующими агентами, такими как желчные кислоты или циклодекстрин, и добавляется непосредственно к водным суспензиям поверхностно-активных веществ, включение холестерина может зависеть от таких факторов, как состав и структура мембран.В этом смысле кажется, что чувствительность каждого поверхностно-активного вещества к включению солюбилизированного холестерина может существенно различаться с возможным порогом, выше которого дальнейшее добавление растворимого холестерина в среду не приводит к дальнейшему увеличению содержания холестерина в комплексах поверхностно-активных веществ (таблица 1). . На рис. 6 показано различное биофизическое поведение комплексов нативных поверхностно-активных веществ и клинического поверхностно-активного вещества Surfacen после воздействия водорастворимого холестерина. Мембраны нативного поверхностно-активного вещества были более восприимчивы к включению холестерина, чем клиническое поверхностно-активное вещество (таблица 1), и, как следствие, нативное поверхностно-активное вещество, подвергнутое воздействию солюбилизированного холестерина, демонстрирует худшее биофизическое поведение, чем подвергшееся воздействию холестерина Surfacen (рис. 6) в условиях, налагаемых нашим CBS. тесты, предназначенные для имитации физиологически значимых ограничений.
Рис. 6. Поведение поверхности Surfacen или нативного свиного поверхностно-активного вещества при воздействии 20% MβCD-холестерина, по оценке CBS при 37 ° C.
Данные представляют собой средние значения ± стандартное отклонение на графиках IA и PEA. Репрезентативный эксперимент показан на каждой панели изотерм сжатия-расширения после нескольких повторений (n = 4) для каждого образца.
https://doi.org/10.1371/journal.pone.0204050.g006
Обсуждение
В этом исследовании была проанализирована чувствительность Surfacen, клинического сурфактанта, используемого в настоящее время, к ингибированию патогенными веществами, такими как сыворотка (просачивающаяся в альвеолярные пространства в случае повреждения легких, воспаления и отека) или меконий (аспирируемый младенцами, страдающими МАС).Ингибирование было протестировано in vitro в условиях, которые были недавно оптимизированы [19] для имитации истинно патогенного контекста, включая высокие концентрации сурфактанта (20 мг / мл) и сыворотки (100 мг / мл белка). Концентрация поверхностно-активного вещества, используемого для исследований ингибирования, является решающим фактором, потому что критическая концентрация требуется для клинического поверхностно-активного вещества для реорганизации из дисперсной суспензии мембранных комплексов в большие связанные с поверхностью мембранные сети, в зависимости от конкретного поверхностно-активного вещества и ионных условий [25, 36].
Ранее было проведено всего несколько исследований, в которых сравнивали различные препараты сурфактантов против инактивации белками плазмы, и было обнаружено, что разные сурфактанты обладают разной чувствительностью к ингибированию [37]. Чувствительность Surfacen к инактивации ранее не проверялась, несмотря на то, что Surfacen широко применяется в кубинских больницах для лечения детей, страдающих или подверженных риску NRDS. Предыдущие результаты также показали потенциал использования полимеров для снижения инактивации поверхностно-активных веществ [12, 16, 20].Анионные полимеры, такие как ГК или хитозан, имеют больше преимуществ, чем неионогенные, поскольку они требуют более низких концентраций для восстановления ингибирования и, следовательно, придают более низкую вязкость конечной смеси поверхностно-активное вещество-полимер [9]. Воздействие HA показало сходные эффекты по отношению к различным препаратам сурфактанта, что указывает на то, что все они повторно активируются по общему механизму. Недавно мы сообщили, что полимеры не только улучшают межфазную адсорбцию, но также восстанавливают сжимаемость пленок поверхностно-активного вещества во время циклического сжатия-расширения в присутствии ингибиторов [19].Таким образом, был сделан вывод, что механизм реверсии в некотором роде является общим для поверхностно-активных веществ, а не специфическим для тестируемых ингибиторов. Дальнейшие исследования пришли к выводу, что воздействие полимеров выше пороговых значений концентрации, при которых происходит запутывание полимерных цепей, вызывает значительные изменения в структуре мембраны поверхностно-активного вещества [38]. Эти изменения включают обширную упаковку, обезвоживание и структурную очистку, заканчивающуюся высокоактивной структурой, способной преодолевать ингибирование сывороткой или меконием. Многие из этих изменений были необратимыми, что позволяет предположить, что предварительное воздействие полимеров, таких как ГК, может быть включено в протоколы производства клинических поверхностно-активных веществ как средство доставки гораздо более эффективных терапевтических препаратов.
Результаты настоящего исследования иллюстрируют ингибирующее действие сыворотки или мекония в отношении еще одного терапевтического сурфактанта, Surfacen, и расширяют способность HA придавать этому широко используемому клиническому препарату существенную устойчивость к инактивации. Смеси Surfacen с HA, зараженные различными ингибиторами, приводили к восстановлению активности, сравнимой с активностью исходного Surfacen. ГК не влияет на поверхностную активность самого Surfacen, что позволяет предположить, что добавление или обработка Surfacen полимерами, такими как HA, может усилить его активность в сложных условиях, вызванных такими патологиями, как синдром аспирации мекония (MAS) у новорожденных или синдром острого респираторного дистресс-синдрома ( ОРДС) у детей и взрослых.
Холестерин является основным нейтральным липидом легочного сурфактанта, где он может встречаться в концентрации до 10% по массе (20 мол.%) По отношению к фосфолипидам. Присутствие холестерина в поверхностно-активном веществе известно давно; однако роль холестерина в сурфактанте остается неясной [23]. С другой стороны, избыток холестерина был связан с нарушением функции сурфактанта, связанным с тяжелыми патологиями, такими как ОРДС [39, 40]. Традиционно ингибирование холестерина изучали на стенде путем добавления холестерина, растворенного в органическом растворителе, в смеси экстрагированных органических поверхностно-активных веществ.Однако включение в поверхностно-активные комплексы холестерина из смесей органических растворителей не является физиологически значимым, поскольку холестерин доступен in vivo как часть структур, которые солюбилизируют его в воде, таких как липопротеины или мицеллы солей желчных кислот. Для моделирования мобилизации холестерина из липидных мембран и внутрь их с переменным успехом использовались различные методы. Мы применили здесь метод включения, основанный на воздействии на комплексы поверхностно-активных веществ циклодекстрина, нагруженного холестерином.Предыдущие исследования показали, что молекулы холестерина легко встраиваются из комплексов холестерин / циклодекстрин в клеточные мембраны [41] или в комплексы сурфактантов [27], причем включение хорошо воспроизводимо и требует короткого времени инкубации. Сообщалось, что для наблюдения дисфункции сурфактанта требуется не менее 20% холестерина (мас. / Мас., Холестерин / фосфолипид) [9, 22, 24, 40]. Поэтому мы оценили включение 20% холестерина, но в его солюбилизированной водной форме.Интересно, что мы обнаружили, что не весь холестерин фактически был включен в мембраны Surfacen (см. Таблицу 1), и, как следствие, его биофизическое поведение не сильно изменилось, поскольку конечная доля холестерина не намного превышала физиологические уровни. Мы сравнили это поведение с поведением нативного сурфактанта, который может каким-то образом воспроизводить in vitro и условия, которые, как считается, возникают во время аспирации мекония in vivo, когда количество холестерина в бронхоальвеолярных лавадах становится очень высоким [42].Различия между мембранами нативного и клинического сурфактанта в отношении их способности включать холестерин значительны. Похоже, что холестеринсодержащий сурфактант, такой как нативный препарат, полученный из легких свиньи, может быть каким-то образом «подготовлен» для приема большего количества стерола, доставленного из растворимых структур, таких как комплексы циклодекстрина. Gunasekara et al [22] подтвердили гипотезу, предсказанную Discher et al [43], что холестерин может ассоциироваться с участками мембраны, обогащенными DPPC, а не с более жидким матриксом, с помощью препарата экзогенного поверхностно-активного вещества BLES.Предыдущие исследования нашей группы показали, что конденсированные домены в мембранах Surfacen, предположительно обогащенные DPPC, были больше и занимали большую фракционную поверхность, чем конденсированные домены в нативном сурфактанте легких или его органическом экстракте, как видно с помощью эпифлуоресцентной микроскопии [35]. Наши текущие результаты предполагают, что более высокая доля конденсированных мембранных доменов, как показывает Surfacen, вовсе не связана с более высоким включением холестерина, а наоборот. Поэтому мы предполагаем, что перенос холестерина из растворимых структур в поверхностно-активные мембраны может начаться в наиболее жидких областях, независимо от того, где холестерин в конечном итоге распределяется в результате скрытой боковой диффузии и уравновешивания.Следствием этого является то, что Surfacen может быть менее склонен к принятию солюбилизированного холестерина, чем нативные комплексы поверхностно-активных веществ или другие клинические препараты с меньшей долей конденсированных мембран.
Основное различие в составе Surfacen и других терапевтических препаратов, таких как Alveofact, Infasurf или Survanta, по сравнению с нативным поверхностно-активным веществом — это значительное снижение содержания холестерина [29, 44, 45]. Утверждалось, что низкое содержание холестерина может позволить экзогенным поверхностно-активным веществам лучше противостоять воздействию богатых холестерином патогенных сред до достижения пороговых значений ингибирования холестерина в поверхностно-активном веществе.Наши результаты предполагают, что включение холестерина в сурфактант может быть не просто вопросом прибавления экзогенного холестерина к эндогенной пропорции. Воздействие на Surfacen более высоких количеств холестерина на самом деле не означало пропорционального увеличения включения холестерина и подтверждает, что максимальная стехиометрия холестерина кажется приемлемой в этом комплексе [22]. Следствием этого является то, что Surfacen, по-видимому, не достигает пропорций холестерина, которые могли бы поставить под угрозу сжимаемость и механическую стабильность его межфазных пленок.Это, вероятно, является следствием особого липидного состава Surfacen и сопутствующей ему фазовой структуры мембраны, хотя другие различия между Surfacen и нативными комплексами поверхностно-активных веществ, такие как уровень сложности мембранных сетей или отсутствие белков, таких как SP-A, может также вносить вклад в различные реакции на включение холестерина, что трудно предсказать. В принципе, можно было бы ожидать, что более сложные трехмерные структуры, такие как структуры в нативном поверхностно-активном веществе, поскольку они собираются и секретируются in vivo, должны быть более защищены от воздействия растворимых переносчиков холестерина и, следовательно, менее восприимчивы к переносу холестерина.Это явно не так. Также предполагается, что присутствие белка SP-A защищает от ингибирования сурфактанта, опять же как следствие того, что белок способствует сборке более компактных и сложных липидно-белковых мембранных сетей [46–48]. Наши результаты, по-видимому, указывают на то, что эти различия в сложности мембран, потенциально обусловленные SP-A, связаны не со сниженным включением холестерина, а с переносом больших количеств стерола и более высокой восприимчивостью к функциональному ингибированию.Различные физико-химические свойства с точки зрения упаковки липидов, текучести или вязкости свободных от холестерина мембран Surfacen и, возможно, других поверхностно-активных веществ, обедненных холестерином, могут создавать внутренний барьер для импорта холестерина агентами, мобилизующими холестерин, и, следовательно, обеспечивать подлинное сопротивление ингибированию холестерина. В этом смысле Surfacen может стать отличным клиническим препаратом для лечения случаев, когда ожидается, что инактивация холестерина является важным патогенным фактором, как это происходит у пациентов с MAS.В какой степени устойчивость к ингибированию холестерина является общей характеристикой любого клинического препарата, не содержащего холестерин, или является ли это комбинацией недостатка холестерина и определенной композиции / структуры, образующейся в результате процедур, применяемых во время производства сурфактанта, — это то, что нужно требует дальнейшего расследования. Остается также открытым вопрос, в какой степени эта устойчивость к включению экзогенного холестерина и, следовательно, к сопротивлению определенным ингибирующим контекстам также будет проявляться в реальных условиях воздействия in vivo и .Оптимизация состава / структуры с минимальными возможностями включения холестерина может способствовать реализации новых стратегий производства экзогенных поверхностно-активных веществ, которые все еще необходимы для лечения наиболее сложных респираторных патологий.
Ссылки
- 1.
Перес-Гил Дж. Структура легочных мембран и пленок сурфактанта: роль белков и липид-белковые взаимодействия. Biochim Biophys Acta. 2008. 1778 (7–8): 1676–95. pmid: 18515069 - 2.Sardesai S, Biniwale M, Wertheimer F, Garingo A, Ramanathan R. Эволюция сурфактантной терапии респираторного дистресс-синдрома: прошлое, настоящее и будущее. Pediatr Res. 2017; 81 (1–2): 240–8. pmid: 27706130
- 3.
Taeusch HW. Лечение острого респираторного дистресс-синдрома (взрослых). Святой Грааль сурфактантной терапии. Biol Neonate. 2000; 77 Дополнение 1: 2–8. - 4.
Dushianthan A, Grocott MP, Postle AD, Cusack R. Острый респираторный дистресс-синдром и острое повреждение легких.Postgrad Med J. 2011; 87 (1031): 612–22. pmid: 21642654 - 5.
Пак К.Х., Пэ CW, Чанг SJ. Влияние мекония на физические свойства поверхности и морфологию экзогенного легочного сурфактанта in vitro. J Korean Med Sci. 1996. 11 (5): 429–36. pmid: 8934399 - 6.
Рубенфельд Г.Д., Колдуэлл Э., Пибоди Э., Уивер Дж., Мартин Д.П., Нефф М. и др. Заболеваемость и исходы острого повреждения легких. N Engl J Med. 2005; 353 (16): 1685–93. pmid: 16236739 - 7.
Маттай М.А., Земанс Р.Л.Синдром острого респираторного дистресс-синдрома: патогенез и лечение. Анну Рев Патол. 2011; 6: 147–63. pmid: 20936936 - 8.
Видеманн Дж. Р., Саугстад А. М., Барнс-Пауэлл Л., Дюран К. Синдром аспирации мекония. Neonatal Netw. 2008. 27 (2): 81–7. pmid: 18431962 - 9.
Zuo YY, Veldhuizen RA, Neumann AW, Petersen NO, Possmayer F. Текущие перспективы легочного сурфактанта — ингибирование, усиление и оценка. Biochim Biophys Acta. 2008; 1778 (10): 1947–77. pmid: 18433715 - 10.Лопес-Родригес Э., Перес-Гил Дж. Взаимоотношения структура-функция в легочных сурфактантных мембранах: от биофизики к терапии. Biochim Biophys Acta. 2014; 1838 (6): 1568–85. pmid: 24525076
- 11.
Calkovska A, Some M, Linderholm B, Johansson J, Curstedt T., Robertson B. Биофизические и физиологические свойства свиного поверхностно-активного вещества, обогащенного полимиксином B. Biol Neonate. 2005. 88 (2): 101–8. pmid: 15860913 - 12.
Calkovska A, Some M, Linderholm B, Curstedt T, Robertson B.Терапевтические эффекты экзогенного сурфактанта, обогащенного декстраном, у новорожденных кроликов с дыхательной недостаточностью, вызванной инстилляцией альбумина в дыхательные пути. Pulm Pharmacol Ther. 2008. 21 (2): 393–400. pmid: 18032077 - 13.
Calkovska A, Mokra D, Drgova A, Zila I, Javorka K. Бронхоальвеолярный лаваж смесью легочного сурфактанта и декстрана улучшает клиренс мекония и функции легких при экспериментальном синдроме аспирации мекония. Eur J Pediatr. 2008. 167 (8): 851–7. pmid: 17952467 - 14.Лу К.В., Гёрке Дж., Клементс Дж. А., Тэуш Х.В. Гиалуронан снижает ингибирование сурфактанта и улучшает функцию легких крыс после повреждения меконием. Pediatr Res. 2005. 58 (2): 206–10. pmid: 16055934
- 15.
Лу К.В., Робертсон Б., Тэуш Х.В. Декстран или полиэтиленгликоль добавляют в curosurf для лечения мекониевого повреждения легких у крыс. Biol Neonate. 2005. 88 (1): 46–53. pmid: 15767742 - 16.
Лу К.В., Гёрке Дж., Клементс Дж. А., Тэуш Х.В. Гиалуронан снижает инактивацию сурфактанта in vitro.Pediatr Res. 2005. 57 (2): 237–41. pmid: 15585679 - 17.
Herting E, Rauprich P, Stichtenoth G, Walter G, Johansson J, Robertson B. Устойчивость различных препаратов поверхностно-активных веществ к инактивации меконием. Pediatr Res. 2001; 50 (1): 44–9. pmid: 11420417 - 18.
Лу К.В., Перес-Гил Дж., Тэуш Х. Кинематическая вязкость терапевтических легочных сурфактантов с добавленными полимерами. Biochim Biophys Acta. 2009; 1788 (3): 632–7. pmid: 19366601 - 19.
Лопес-Родригес Э., Оспина О.Л., Эхаид М., Тэуш Х.В., Перес-Гил Дж.Воздействие полимеров отменяет ингибирование легочного сурфактанта сывороткой, меконием или холестерином в сурфактометре с пленочным пузырьком. Biophys J. 2012; 103 (7): 1451–1451. pmid: 23062337 - 20.
Лу Дж.Дж., Чеунг В.В., Ю Л.М., Поликова З., Ли Д., Волосы М.Л. Действие декстрана на восстановление активности легочного сурфактанта ингибируется альбумином. Respir Physiol Neurobiol. 2002. 130 (2): 169–79. pmid: 12380007 - 21.
Лу К.В., Перес-Гил Дж., Эхаиде М., Тэуш Х.В. Белки легочного сурфактанта и комбинации полимеров снижают ингибирование сурфактанта сывороткой.Biochim Biophys Acta. 2011; 1808 (10): 2366–73. pmid: 21741354 - 22.
Gunasekara L, Schurch S, Schoel WM, Nag K, Leonenko Z, Haufs M и др. Функция легочного сурфактанта отменяется повышенным содержанием холестерина. Biochim Biophys Acta. 2005; 1737 (1): 27–35. pmid: 16216549 - 23.
Китинг Э., Рахман Л., Фрэнсис Дж., Петерсен А., Поссмайер Ф., Велдхуизен Р. и др. Влияние холестерина на биофизические и физиологические свойства клинического легочного сурфактанта.Биофиз Дж. 2007; 93 (4): 1391–401. pmid: 17526587 - 24.
Леоненко З., Гилл С., Баукина С., Монтичелли Л., Дохнер Дж., Гунасекара Л. и др. Повышенный уровень холестерина нарушает самосборку легочного сурфактанта в функциональную пленку. Биофиз Дж. 2007; 93 (2): 674–83. pmid: 17483162 - 25.
Gunasekara L, Schoel WM, Schurch S, Amrein MW. Сравнительное изучение механизмов ингибирования сурфактанта. Biochim Biophys Acta. 2008. 1778 (2): 433–44. pmid: 18036553 - 26.Бернардино де ла Серна Дж., Перес-Хиль Дж., Симонсен А.С., Багатолли Л.А. Правила холестерина: прямое наблюдение сосуществования двух жидких фаз в мембранах нативных легочных сурфактантов при физиологических температурах. J Biol Chem. 2004. 279 (39): 40715–22. pmid: 15231828
- 27.
Lopez-Rodriguez E, Echaide M, Cruz A, Taeusch HW, Perez-Gil J. Меконий ухудшает легочный сурфактант за счет комбинированного действия холестерина и желчных кислот. Biophys J. 2011; 100 (3): 646–55. pmid: 21281579 - 28.Морено О.В., Лопес М.Л., Дьеппа Ф.Д., Лопес МАП, Абад А.А., Риверо Г.Дж. и др. Estudio de la eficacia del SURFACEN en el Distres Respiratorio del recién nacido. Rev Cubana Pediatria. 1999. 71 ((2)): 60–71.
- 29.
Blanco O, Perez-Gil J. Биохимические и фармакологические различия между препаратами экзогенного природного сурфактанта, используемыми для лечения респираторного дистресс-синдрома: роль различных компонентов в эффективном легочном сурфактанте. Eur J Pharmacol. 2007. 568 (1–3): 1–15.pmid: 17543939 - 30.
Manzanares D, Diaz E, Alfonso W., Escobar A, Colome H, Muñoz MC, et al. Surfactante pulmonar porcino. República de Cuba 1995; A 61: 35–42 K. - 31.
Тэуш Х.В., Бернардино де ла Серна Дж., Перес-Хиль Дж., Алонсо К., Засадзински Дж. Инактивация легочного сурфактанта из-за ингибированной сывороткой адсорбции и обращения гидрофильными полимерами: эксперимент. Biophys J. 2005; 89 (3): 1769–79. pmid: 15923228 - 32.
Schurch S, Green FH, Bachofen H.Формирование и структура поверхностных пленок: сурфактометрия с пленочным пузырем. Biochim Biophys Acta. 1998. 1408 (2–3): 180–202. pmid: 9813315 - 33.
Rouser G, Siakotos AN, Fleischer S. Количественный анализ фосфолипидов с помощью тонкослойной хроматографии и анализа пятен на фосфор. Липиды. 1966; 1 (1): 85–6. pmid: 17805690 - 34.
ДиРиенцо Дж. А., Касановес Ф., Бальзарини М. Г., Гонсалес Л., Таблада М., Робледо С. В.. InfoStat version 2018. Grupo InfoStat, FCA. 2018; Национальный университет Кордовы, Аргентина. - 35.
Бланко О., Круз А., Оспина О.Л., Лопес-Родригес Э., Васкес Л., Перес-Гил Дж. Межфазное поведение и структурные свойства клинического легочного сурфактанта из свиного источника. Biochim Biophys Acta. 2012; 1818 (11): 2756–66. pmid: 22771553 - 36.
Холм Б.А., Ван З., Ноттер Р.Х. Множественные механизмы ингибирования сурфактанта в легких. Pediatr Res. 1999. 46 (1): 85–93. pmid: 10400140 - 37.
Seeger W, Grube C, Gunther A, Schmidt R. Ингибирование сурфактанта белками плазмы: дифференциальная чувствительность различных препаратов сурфактанта.Eur Respir J. 1993; 6 (7): 971–7. pmid: 8370446 - 38.
Lopez-Rodriguez E, Cruz A, Richter RP, Taeusch HW, Perez-Gil J. Кратковременное воздействие гиалуронана на сурфактант легких способствует структурным и композиционным преобразованиям в высокоактивное состояние. J Biol Chem. 2013. 288 (41): 29872–81. pmid: 23983120 - 39.
Маркарт П., Рупперт С., Выгрека М., Коларис Т., Дахал Б., Уолмрат Д. и др. Пациенты с ОРДС показывают улучшение, но не нормализацию альвеолярной поверхностной активности при лечении сурфактантом: предполагаемая роль нейтральных липидов.Грудная клетка. 2007. 62 (7): 588–94. pmid: 17287298 - 40.
Vockeroth D, Gunasekara L, Amrein M, Possmayer F, Lewis JF, Veldhuizen RA. Роль холестерина в биофизической дисфункции сурфактанта при повреждении легких, вызванном вентилятором. Am J Physiol Lung Cell Mol Physiol. 2010. 298 (1): L117–25. pmid: 19897745 - 41.
Hartel S, Diehl HA, Ojeda F. Метил-бета-циклодекстрины и липосомы как водорастворимые носители для включения холестерина в мембраны и его оценка с помощью анализа микроферментной флуоресценции и красителей, чувствительных к текучести мембран.Анальная биохимия. 1998. 258 (2): 277–84. pmid: 9570841 - 42.
Autilio C, Echaide M, De Luca D, Perez-Gil J. Контролируемая гипотермия может улучшить функцию сурфактанта у асфиксированных новорожденных с синдромом аспирации мекония или без него. PLoS One. 2018; 13 (2): e0192295. pmid: 29420583 - 43.
Дисчер Б.М., Мэлони К.М., Грейнджер Д.В., Холл СБ. Влияние нейтральных липидов на сосуществующие фазы в монослоях легочного сурфактанта. Biophys Chem. 2002; 101–102: 333–45. pmid: 12488012 - 44.Echaide M, Autilio C, Arroyo R, Perez-Gil J. Восстановление легочных сурфактантных мембран и пленок на респираторной поверхности. Biochim Biophys Acta. 2017; 1859 (9 Pt B): 1725–39.
- 45.
Рудигер М., Толле А., Мейер В., Рустов Б. Коммерческие поверхностно-активные вещества природного происхождения различаются по составу липидов поверхностно-активных веществ и поверхностной вязкости. Am J Physiol Lung Cell Mol Physiol. 2005. 288 (2): L379–83. pmid: 15501950 - 46.
Ференбах Х., Тьюс С., Ференбах А., Охс М., Виттвер Т., Уолерс Т. и др.Улучшенная консервация легких связана с увеличением канальцевого миелин-ассоциированного сурфактантного белка A. Respir Res. 2005; 6: 60. pmid: 15969762 - 47.
Hiansen JQ, Keating E, Aspros A, Yao LJ, Bosma KJ, Yamashita CM и др. Опосредованная холестерином дисфункция сурфактанта смягчается сурфактантным белком A. Biochim Biophys Acta. 2015; 1848 (3): 813–20. pmid: 25522687 - 48.
Родригес Капоте К., Маккормак FX, Поссмайер Ф. Легочный сурфактантный белок-A (SP-A) восстанавливает поверхностные свойства сурфактанта после окисления по механизму, который требует наличия межцепочечной дисульфидной связи Cys6 и домена связывания фосфолипидов.J Biol Chem. 2003. 278 (23): 20461–74. pmid: 12600986
Синтетические препараты легочного сурфактанта: новые разработки и будущие тенденции
Название: Синтетические препараты легочного сурфактанта: новые разработки и будущие тенденции
ОБЪЕМ: 15 ВЫПУСК: 4
Автор (ы): Исмаэль Мингарро, Дунья Лукович, Маркаль Вилар и Хесус Перес-Гил
Место работы: Отдел.Bioquimica i Biol. Molec., Университет Валенсии. Доктор Молинер, 50. E-46100 Бурхассот, Испания.
Ключевые слова: дипальмитоилфосфатидилхолин, легочный сурфактантный белок B, липополисахарид, острый респираторный дистресс-синдром, легкие
Резюме: Легочный сурфактант — это липидно-белковый комплекс, который покрывает внутреннюю часть альвеол и позволяет легким функционировать должным образом. После синтеза легочное сурфактант адсорбируется на границе раздела между воздухом и гипофазой, капиллярном водном слое, покрывающем альвеолы.Снижая и модулируя поверхностное натяжение во время дыхания, сурфактант легких снижает дыхательную работу по расширению и стабилизирует альвеолы от коллапса во время выдоха. Дефицит или дисфункция легочного сурфактанта способствует возникновению нескольких респираторных патологий, таких как детский респираторный дистресс-синдром (IRDS) у недоношенных новорожденных и острый респираторный дистресс-синдром (ARDS) у детей и взрослых. Основными клиническими экзогенными поверхностно-активными веществами, которые в настоящее время используются для лечения некоторых из этих патологий, являются в основном органические экстракты, полученные из легких животных.Хотя природные поверхностно-активные вещества очень эффективны, они имеют серьезные недостатки: i) они могут варьироваться по составу от партии к партии; ii) их производство связано с относительно высокими затратами, а источники ограничены; и iii) они несут потенциальный риск передачи инфекционных агентов животных и возможность иммунологической реакции. Все эти предостережения оправдывают необходимость в строго контролируемом синтетическом материале. В настоящем обзоре обсуждаются усилия, направленные на разработку новых поверхностно-активных веществ, включая модификацию существующих экзогенных поверхностно-активных веществ путем добавления молекул, которые могут усиливать их активность, а также прогресс, достигнутый в производстве совершенно новых препаратов.
.
