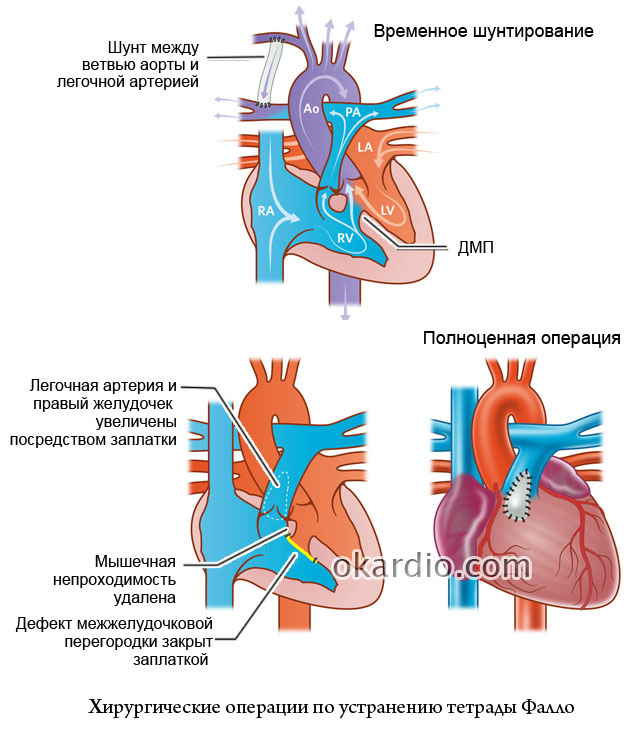
Врожденные пороки сердца — РИА Новости, 01.07.2016
Врожденный порок сердца можно диагностировать на 16-й неделе беременности с высокой долей вероятности, а на 21-22-й неделе на 100% случаев можно назвать, какой это врожденный порок.
При большом количестве разнообразных ВПС семь из них встречаются наиболее часто: дефект межжелудочковой перегородки (ДМЖП) составляет около 20% всех случаев врожденных пороков сердца, дефект межпредсердной перегородки (ДМПП), открытый артериальный порок (ОАП), коарктация аорты, стеноз аорты, стеноз легочной артерии и транспозиция крупных магистральных сосудов (ТКС) — по 10-15% каждый.
Существует более 100 различных врожденных пороков сердца. Последняя классификация, использующаяся в России, соответствует Международной классификации болезней. Часто используется разделение пороков на синие, сопровождающиеся синюшностью кожи, и белые, при которых кожные покровы бледной окраски. К порокам синего типа относится тетрада Фалло, транспозиция магистральных сосудов, атрезия легочной артерии, к порокам белого типа — ДМЖП, ДМПП и другие.
Чем раньше выявлен врожденный порок сердца, тем больше надежды на своевременное его лечение. Врач может заподозрить наличие у ребенка порока сердца по нескольким признакам: ребенок при рождении или вскоре после рождения имеет голубой или синюшный цвет кожи, губ, ушных раковин. Или синюшность появляется при кормлении грудью, крике малыша. При белых пороках сердца может возникнуть побледнение кожи и похолодание конечностей. Врач при прослушивании сердца выявляет шумы, но шум у ребенка не обязательный признак порока сердца.
Ребенок с врожденным пороком сердца может выглядеть внешне вполне здоровым в течение первых десяти лет жизни. Однако в дальнейшем порок сердца начинает проявлять себя: малыш отстает в физическом развитии, появляется одышка при физических нагрузках, бледность или синюшность кожи. Для установки истинного диагноза необходимо комплексное обследование сердца с применением современного высокотехнологичного оборудования.
По статистике 36% новорожденных, у которых есть порок сердца, умирают в течение первого месяца жизни, еще 35,5% — в течение последующих 11 месяцев. Таким образом, фактически из 100 детей, которые родились с ВПС, в течение первого года почти 72% нуждаются в операции.
Таким образом, фактически из 100 детей, которые родились с ВПС, в течение первого года почти 72% нуждаются в операции.
В настоящее время с хирургической точки зрения неоперабельных пороков сердца нет — есть различные состояния, которые возникают в результате развития порока у ребенка. Главное — вовремя прооперировать самые сложные пороки сердца. 97% вовремя прооперированных детей проживают полноценную жизнь. Большинство этих операций проводится на остановленном сердце с использованием аппарата искусственного кровообращения (АИК). Сделать такие операции максимально щадящими — самое главное направление развития сердечно-сосудистой хирургии. Некоторые большие полостные операции заменены эндоваскулярными. Теперь после эндоваскулярной операции ребенка выписывают на третий день.
В России головным учреждением страны по проблеме «Сердечно-сосудистая хирургия» является Научный центр сердечно-сосудистой хирургии имени А.Н. Бакулева. Центр осуществляет диагностику, консервативное, интервенционное и хирургическое лечение больных врожденными пороками сердца.
Отделение детской кардиохирургии и врожденных пороков сердца ведет работу в Новосибирском научно-исследовательском институте патологии кровообращения имени академика Е.Н. Мешалкина. Специалистами выполняется хирургическое лечение всех ВПС у пациентов любой возрастной группы.
Функции головного учреждения по проблемам кардиологии в Сибири и на Дальнем Востоке выполняет Научно-исследовательский институт кардиологии в Томске. В институте выполняются все виды кардиохирургической, рентгенохирургической и аритмологической помощи взрослым и детям, начиная с первых дней жизни.
Отделение кардиохирургии для детей Детской городской клинической больницы N13 имени Н.Ф. Филатова в Москве выполняет около 400 операций в год, включая рентгенохирургические процедуры по устранению врожденных пороков сердца детям.
В отделении кардиохирургии Детской городской больницы N1 Санкт-Петербурга было выполнено более шести тысяч операций на открытом сердце. Ежегодно в отделении оперируется 600 детей с врожденными пороками сердца. Отделение оказывает помощь не только жителям Санкт-Петербурга, но и принимает детей из регионов РФ и стран ближайшего зарубежья.
Отделение оказывает помощь не только жителям Санкт-Петербурга, но и принимает детей из регионов РФ и стран ближайшего зарубежья.
В ведущую тройку российских кардиохирургических центров входит Самарский областной клинический кардиологический диспансер (СОККД).
Самые современные хирургические и миниинвазивные методы лечения врожденных пороков сердца есть в крупных специализированных центрах практически во всех странах мира. Особо выдающихся результатов в лечении врожденных пороков сердца у детей достигла детская кардиохирургия в Израиле и Германии.
В Израиле на базе Института сердца МЦ «Хадасса» действует Центр детской кардиологии и кардиохирургии. Среди известных израильских клиник, занимающихся хирургическим лечением врожденных пороков сердца, — Детская больница Сафра Государственного медицинского центра им. Хаима Шиба, Детская больница Майер на базе медицинского комплекса Рамбам, клиника «Ассута» и др.
Кардиологическая клиника Шарите в Берлине (Германия) — известный во всем мире университетский клинический комплекс. Клиника специализируется на диагностике и лечении пациентов с ВПС.
Клиника специализируется на диагностике и лечении пациентов с ВПС.
Немецкий центр сердечно-сосудистой хирургии в Западном Берлине проводит более 400 операций в год при врожденных пороках сердца.
Также хирургическим лечением врожденных пороков сердца занимается Мюнхенский кардиологический центр на Изаре, отделение кардиологии клиники Ammerland, расположенное в Вестерштеде. Оперативной корректурой врожденного порока сердца занимается отделение детской сердечной хирургии кардиологического центра в Аугсбурге, а также клиника торакальной и сердечно-сосудистой хирургии Униклиники Саарланд в городе Хомбург.
Международный уровень детской кардиохирургии можно найти в клиниках Франции, Австрии, Южной Кореи, Индии, Турции. В США лечением врожденного порока сердца занимается Медицинский центр Детской больницы Цинциннати.
Среди отечественных благотворительных фондов, оказывающих помощь детям с врожденным порокам сердца, наиболее известны Русфонд, Региональный благотворительный общественный фонд «Детские сердца», интернет-фонд «Помоги. org», Благотворительный фонд «Калин фонд», Межрегиональный общественный фонд «Доброе сердце» и др.
org», Благотворительный фонд «Калин фонд», Межрегиональный общественный фонд «Доброе сердце» и др.
Частота врожденных пороков сердца
Мировая статистика показывает, что частота рождения детей с врожденными пороками составляет 6–8 на 1000 живых родов. Но, если причислить сюда заболевания сердца, которые не проявляются во младенчестве, а остаются незамеченными в течение многих лет жизни, но при этом имеют врожденную природу (например, пролапс митрального клапана, двухстворчатый клапан аорты, разнообразные нарушения ритма), то это число значительно возрастет. Кажется, что это не так уж много. Но, если пересчитать это на население многомиллионного города, области или страны, получается не так уж и мало.
Ежегодно только в России рождается более 20 тысяч детей с врожденными пороками сердца. И это значит, что проблема коснулась не только вас и не только сейчас. Многое было известно врачам давно, многое — давно излечивалось, и таких родителей, как вы — десятки тысяч.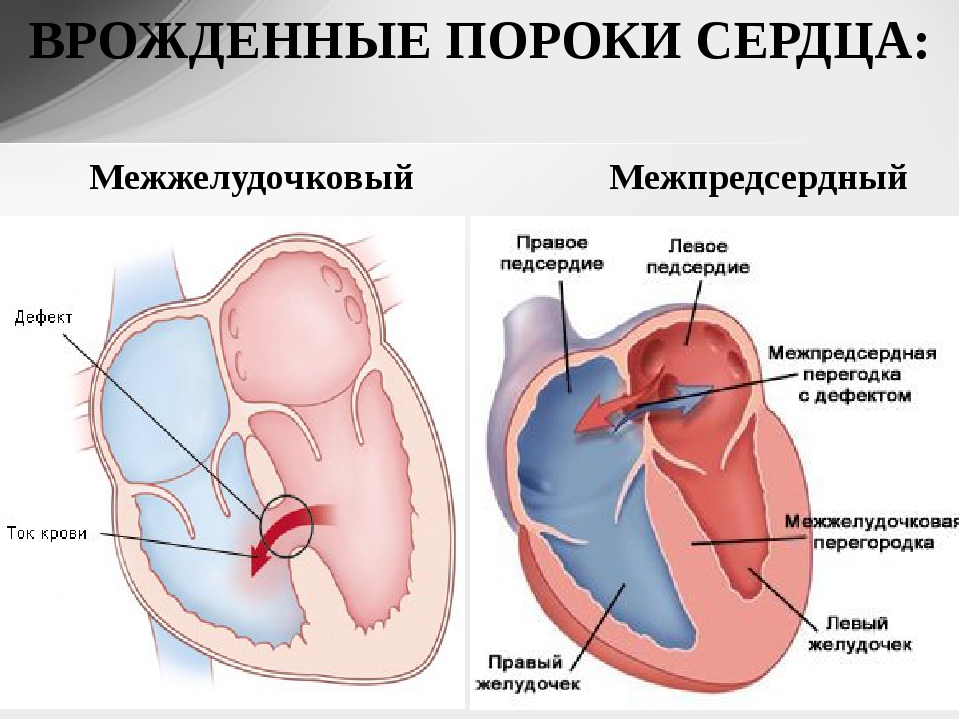 Они переживали точно то же, что и вы переживаете сегодня. Но вам сейчас гораздо легче, потому что современная детская кардиология и кардиохирургия могут узнать о врожденном пороке буквально все, помочь — всегда, а исправить — почти всегда. И запомните главное — около 97 процентов детей, оперированных по поводу ВПС в раннем возрасте, способны вести нормальный образ жизни — расти, учиться, работать, создавать семьи.
Они переживали точно то же, что и вы переживаете сегодня. Но вам сейчас гораздо легче, потому что современная детская кардиология и кардиохирургия могут узнать о врожденном пороке буквально все, помочь — всегда, а исправить — почти всегда. И запомните главное — около 97 процентов детей, оперированных по поводу ВПС в раннем возрасте, способны вести нормальный образ жизни — расти, учиться, работать, создавать семьи.
Статистические наблюдения, фиксирующие частоту врожденных пороков сердца, ведутся в течение нескольких десятилетий. Но интересно, что данные статистики постоянно меняются. Дело в том, что с появлением новейших методов исследования стало возможным выявлять некоторые пороки гораздо раньше и чаще, чем прежде. Кроме того, по мере внедрения и освоения специализированной кардиологической помощи и совершенствования знаний специалистов на местах, диагнозы ставят чаще, т.е. просто улучшается «выявляемость».
В таблице № 2 приводятся собранные в США в 1998 — 1990 годах статистические данные (Nadas’ Pediatric Cardiology, 1992), которые поступали в один реестр и обрабатывались.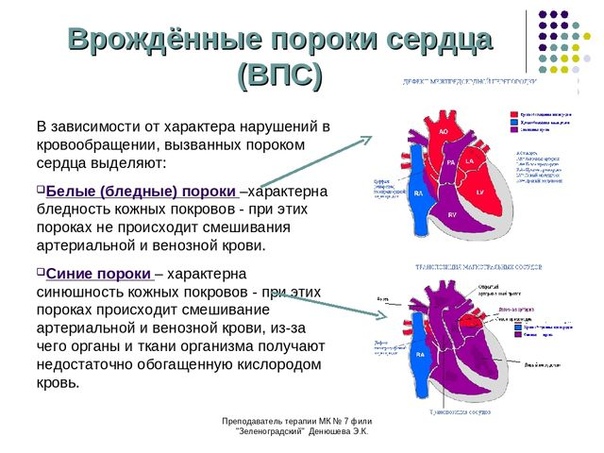 Мы приводим их, прежде всего, для того, чтобы вы почувствовали, что не одиноки в своих проблемах: за два года в реестр вошли сведения о 5 512 детях, родившихся с врожденными пороками сердца. Пороки распределились следующим образом:
Мы приводим их, прежде всего, для того, чтобы вы почувствовали, что не одиноки в своих проблемах: за два года в реестр вошли сведения о 5 512 детях, родившихся с врожденными пороками сердца. Пороки распределились следующим образом:
Таблица № 2.
Название порока | Частота в процентах |
Дефект межжелудочковой перегородки | 14,1 |
Дефект межпредсердной перегородки (вторичный) | 8,8 |
Стеноз клапана легочной артерии | 6,8 |
Миокардиопатия | 6,4 |
Открытый артериальный проток | 6,3 |
Тетрада Фалло | 6,3 |
Транспозиция магистральных сосудов * | 6,0 |
Стеноз аортального клапана * | 5,9 |
Атрио-вентрикулярный канал | 4,4 |
Порок митрального клапана | 4,0 |
Коарктация аорты * | 3,8 |
Синдром гипоплазии левого желудочка * | 3,3 |
Аномальное положение сердца | 3,3 |
| 78,5 |
* пороки, которые могут или всегда вызывают так называемое «критическое» состояние, требующее немедленной, экстренной помощи.
Отметим, что таблица включает 78,5% известных форм пороков. На оставшиеся 21,5% приходятся пороки, частота которых менее 3%. К ним относятся и те пороки, которые не требуют экстренной помощи, и те, которые приводят к критическому состоянию, например, некоторые формы аномалии Эбштейна, общий артериальный ствол, аномальное отхождение коронарных артерий.
Динамика заболеваемости населения ВПС за последние годы у нас в стране приведена в табл. 3.
Таблица 3. Врожденные аномалии сердца и сосудов в РФ (на 100 тыс. населения соответствующего возраста)
Год | Взрослые | Дети 15-17 лет | Дети до 14 лет | |||
Всего | Впервые выявлено | Всего | Впервые выявлено | Всего | Впервые выявлено | |
2003 | 65,2 | 4,4 | 576,8 | 82,0 | 763,6 | 159,1 |
2004 | 66,3 | 4,5 | 603,9 | 81,7 | 822,8 | 193,4 |
2005 | 67,6 | 4,4 | 650,8 | 91,0 | 915,2 | 218,1 |
2006 | 69,3 | 4,9 | 672,6 | 96,6 | 1006,5 | 250,7 |
В статистиках центров, где делаются операции, будут другие цифры относительной частоты. Это объясняется тем, что там концентрируются больные, нуждающиеся в хирургической помощи, часто – экстренной. Кардиохирургических клиник в нашей стране достаточно много, и в последние годы открываются все новые центры. Приводим ниже данные по количеству выполненных операций в таких клиниках на начало 2007 г.
Это объясняется тем, что там концентрируются больные, нуждающиеся в хирургической помощи, часто – экстренной. Кардиохирургических клиник в нашей стране достаточно много, и в последние годы открываются все новые центры. Приводим ниже данные по количеству выполненных операций в таких клиниках на начало 2007 г.
В статистиках центров, где делаются операции, будут другие цифры относительной частоты. Это объясняется тем, что там концентрируются больные, нуждающиеся в хирургической помощи, часто – экстренной. Кардиохирургических клиник в нашей стране достаточно много, и в последние годы открываются все новые центры. Приводим ниже данные по количеству выполненных операций в таких клиниках на начало 2007 г.
Как бы то ни было, при большинстве ВПС особой срочности в операции нет. Это не значит, что ничего не надо делать. Наоборот, ребенка необходимо показать специалистам при малейшем подозрении на ВПС, узнать точный диагноз. И тогда, когда диагноз будет ясен, можно говорить о «прогнозе», т.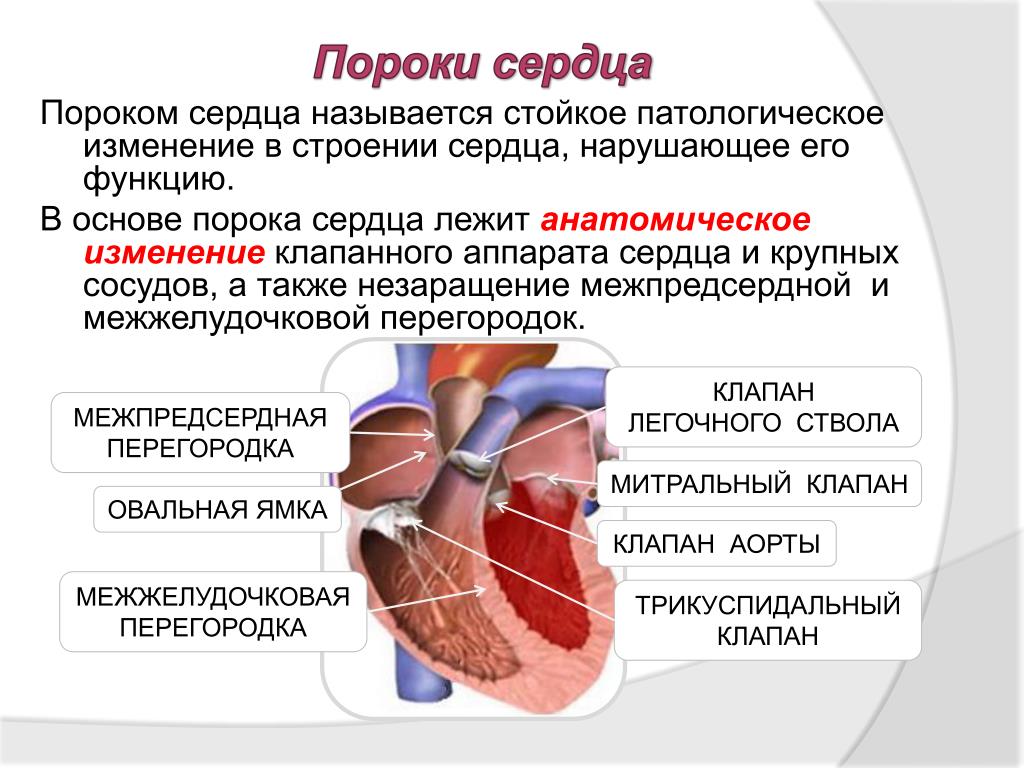 е. о том, что надо делать и когда и что ждет ребенка в будущем.
е. о том, что надо делать и когда и что ждет ребенка в будущем.
Цитируется по книге Г. Э. Фальковский, С. М. Крупянко. «Сердце ребенка. Книга для родителей о врожденных пороках сердца»
ABC-медицина
Порок сердца представляет собой ряд структурных аномалий и деформаций перегородок, клапанов и отверстий между сосудами и камерами сердечной мышцы. Заболевание нарушает циркуляцию крови по внутренним сосудам сердца и ведет к формированию хронической и острой формы недостаточной циркуляции крови.
Виды пороков сердца
Различают патологии сердца приобретенного и врожденного происхождения.
Врожденный порок сердца. При этой патологии наблюдаются дефекты стенок миокарда, отвечающего за ритмичные сокращения сердечной мышцы или стенок крупных сосудов, которые прилежат к миокарду. Некоторые разновидности врожденных пороков встречаются как в различных комбинациях, так и по одному.
Приобретенные пороки так же называются клапанными. При данной патологии подвергаются изменениям один или несколько клапанов сердечной мышцы. Чаще всего поражается аортальный клапан, который расположен между аортой и левым желудочком, а также митральный клапан, который контролирует кровоток между желудочком и левым предсердием.
При данной патологии подвергаются изменениям один или несколько клапанов сердечной мышцы. Чаще всего поражается аортальный клапан, который расположен между аортой и левым желудочком, а также митральный клапан, который контролирует кровоток между желудочком и левым предсердием.
Причины
Приобретенная патология сердца возникает вследствие:
- инфекционного эндокардита;
- сифилиса;
- атеросклероза;
- ревматизма;
- травм различного характера.
Причины большей части случаев врожденных пороков сердца медики диагностируют не в полной мере. Эти заболевания могут быть вызваны воздействием радиации на организм беременной. Опасны вирусные и прочие инфекции, которые были перенесены женщиной в первом триместре беременности (гепатит B, краснуха, грипп). Прием во время беременности наркотиков, алкоголя и некоторых лекарственных средств также может быть причиной врожденных заболеваний.
Симптомы
Внешние симптомы порока сердца проявляются у всех пациентов одинаково:
- одышка;
- слабость;
- быстрая утомляемость;
- отеки конечностей;
- нарушение сна;
- «синюшность» или бледность;
- беспокойство;
- боли в сердце или между лопатками.

Если у Вас присутствует несколько перечисленных симптомов порока сердца, обязательно обратитесь к квалифицированному специалисту.
Последствия
Врожденное заболевание сердца может привести к серьезным нарушениям движения крови по сосудам (гемодинамики). Они связанны с прогрессированием болезни и декомпенсацией сердечной системы.
Приобретенная патология приводит к развитию сердечной недостаточности, нарушению ритма сердца, тромбоэмболическим осложнениям, инвалидности и даже летальному исходу.
Диагностика
Приобретенный порок сердца. При диагностике у людей отслеживается самочувствие в состоянии покоя, переносимость физических нагрузок, уточняется анамнез.
При диагностике пороков сердца в клинике с помощью пальпации выявляют наличие пульсации вен, цианоза, отеков, одышки. Перкуторно определяют границы сердца, прослушивают легкие и сердечные тоны и шумы (чтобы выяснить вид порока). Также осуществляют пальпаторное выявление размеров печени.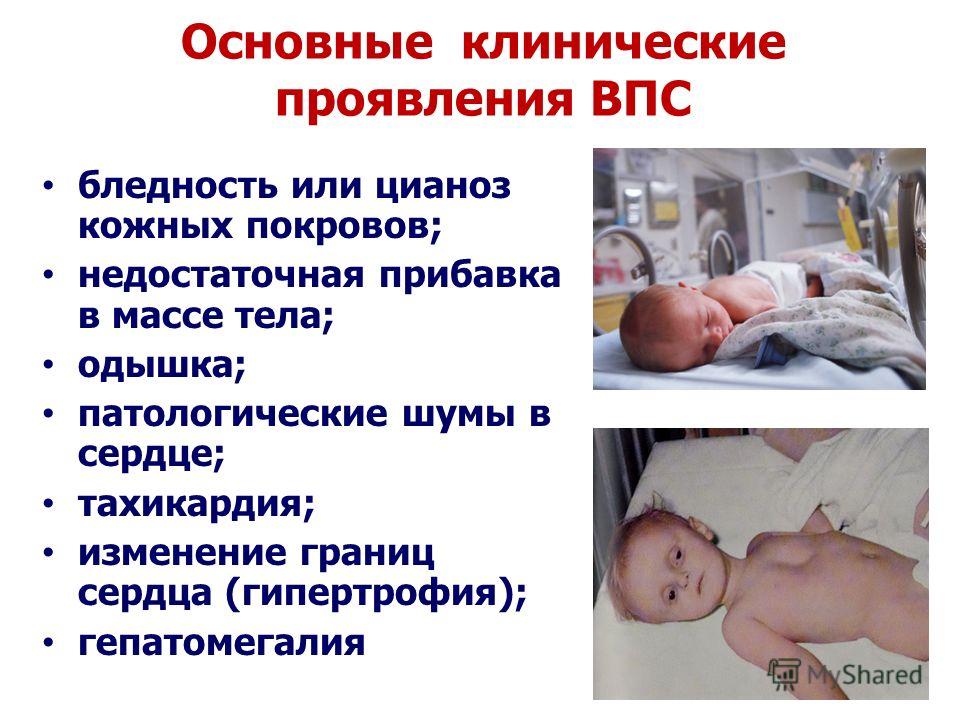
С помощью результатов фонокардиографии выявляются пороки клапанов сердца. Для уточнения вида заболевания выполняется рентгенограмма. Эхокардиография помогает диагностировать патологию, выраженность регургитации, площадь атриовентрикулярного отверстия, размеры и состояние клапанов, хорд.
к лабораторным исследованиям, имеющим наибольшее диагностическое значение, относят проведение специальных ревматоидных проб, определение холестерина, сахара, анализы мочи и крови.
Такая диагностика осуществляется не только при первичном обследовании пациентов с подозрением на заболевание, но и в диспансерных группах больных с подтвержденным диагнозом.
Врожденный. Диагноз подтверждают визуализацией порока на эхокардиографии, выявлением ЭКГ-признаков перегрузки камер сердца и гипертрофии, фиксацией шумов при помощи фонокардиографии, обнаружением нарушений газового состава артериальной крови. Также выявляют изменение конфигурации сердечной мышцы на соответствующей рентгенограмме.
После 3 лет жизни ребенка врожденные патологии сердца дифференцируют с ревматизмом, неревматическими кардитами, кардиомиопатиями, бактериальным эндокардитом, нарушениями деятельности сердечно-сосудистой системы. В основе последних довольно часто лежат врожденные малые аномалии и дисплазии соединительнотканных структур сердца. Также необходимо дифференцировать врожденные пороки между собой.
Лечение
Терапевтическое лечение пороков сердца не может устранить патологические изменения в сердце. Оно лишь облегчит течение заболевания.
Лечение пороков сердца зависит от нескольких составляющих:
- вида порока;
- общего состояния здоровья пациента;
- стадии заболевания.
Чем раньше было диагностировано заболевание и назначено лечение порока сердца или проведена хирургическая операция, тем больше будет снижен риск возникновения серьезных последствий. Сейчас многие пороки успешно устраняются. Но не стоит забывать о том, что как бы грамотно, с технической точки зрения, не была проведена операция, здоровое сердце намного надежнее, чем восстановленное. Поэтому важно предварительно снизить возможность возникновения заболевания.
Поэтому важно предварительно снизить возможность возникновения заболевания.
Профилактика
Снизить риск возникновения порока сердца можно с помощью своевременного лечения болезней, которые вызваны стрептококками, – фарингита, ангины. Именно они чаще всего являются причинами развития ревматизма. Если эта болезнь уже есть, то нужно обязательно пройти курс бициллинопрофилактики. Ее должен назначить компетентный врач.
Если же у человека был диагностирован пролапс митрального клапана или он уже перенес ревматизм, то необходимо в целях профилактики начать прием назначенных врачом антибиотиков за определенное время до медицинских вмешательств. К этим «вмешательствам» относятся удаление миндалин, зубов, аденоидов и прочие хирургические операции.
Клиника «АВС-медицина» осуществляет полное диагностирование и лечение пороков сердца разных форм. Если Вас беспокоят перечисленные симптомы, обязательно запишитесь на обследование. Высококвалифицированные специалисты в индивидуальном порядке назначат лечение заболевания.
Коррекция врожденного порока сердца
ВАМ ИЛИ ВАШЕМУ РЕБЕНКУ НАЗНАЧЕНА КОРРЕКЦИЯ ВРОЖДЕННОГО ПОРОКА СЕРДЦА. ЧТО ЭТО ЗНАЧИТ?
Сегодня врожденные пороки сердца (ВПС) занимают лидирующие позиции среди врожденных пороков развития. Выделяют критические ВПС, требующие хирургии в первые часы-дни жизни ребенка и пороки, которые можно прооперировать в плановом порядке.
ВЗРОСЛЫЕ И ДЕТИ. КОГДА ПРОВОДЯТСЯ ОПЕРАЦИИ?
Современные возможности медицины позволяют выявить и вылечить врожденный порок сердца на максимально-ранних стадиях. Чем старше становится человек с диагнозом врожденный порок сердца, тем чаще врачи сталкиваются еще и с сопутствующими, коморбидными заболеваниями, повышающими риски для оперативного вмешательства. Например, «изношенность» миокарда и наличие сопутствующих заболеваний (сахарный диабет, заболевания легких, печени, почек и пр.), как правило, осложняет, как проведение самой операции, так и течение послеоперационного периода, повышая риски присоединения осложнений, а также в целом ухудшает ближайшие и отдаленные результаты проведенной операции на сердце. Очень часто у взрослых, операции по поводу врожденных пороков — это повторные и этапные операции. Риск по поводу ВПС у взрослых, по сравнению с операцией в детстве, существенно выше. Сегодня по статистике, остаются только две причины, по которым ребенок оказался непрооперированным:
Очень часто у взрослых, операции по поводу врожденных пороков — это повторные и этапные операции. Риск по поводу ВПС у взрослых, по сравнению с операцией в детстве, существенно выше. Сегодня по статистике, остаются только две причины, по которым ребенок оказался непрооперированным:
- Не выявленный своевременно ВПС у ребенка в детском возрасте.
- Отказ родителей от операции
Существует 2 подхода к лечению врожденных пороков сердца: открытая хирургия и эндоваскулярные вмешательства. Выбор подхода зависит от анатомии пророка сердца и от нарушений гемодинамики.
КАРДИОХИРУРГИЯ НОВОРОЖДЕННЫХ (ХИРУРГИЯ КРИТИЧЕСКИХ СОСТОЯНИЙ)
Существующие в нашем отделении технологии позволяют проводить операции на открытом сердцем у новорожденных с низким весом и критическом состоянии. При этом, наши детские кардиологи, при необходимости, консультируют беременных при перинатально-диагностированных тяжелых врожденных пороках сердца. В рамках междисциплинарного сотрудничества беременные женщины с ВПС у плода, в т.ч. из других регионов России направляются (по предварительному согласованию) для родоразрешения в ГБУЗ «Областной перинатальный центр» г.Челябинска. При подтверждении показаний к операции после рождения ребенка, операция на сердце новорожденному проводится в условиях ФЦССХ.
В рамках междисциплинарного сотрудничества беременные женщины с ВПС у плода, в т.ч. из других регионов России направляются (по предварительному согласованию) для родоразрешения в ГБУЗ «Областной перинатальный центр» г.Челябинска. При подтверждении показаний к операции после рождения ребенка, операция на сердце новорожденному проводится в условиях ФЦССХ.
КАРДИОХИРУРГИЯ НА ПЕРВОМ ГОДУ ЖИЗНИ
Современная концепция коррекции врожденных пороков сердца в большинстве случаев предполагает проведение операций в течении первого года жизни ребенка для исключения прогрессирования легочной гипертонии и сердечной недостаточности.
Маленький вес и возраст ребенка при наличии показаний не препятствуют проведению операции. В этом возрасте возможны операции при ВПС: дефект межжелудочковой перегородки сердца, полный атрио-вентрикулярный канал, атрезия легочной артерии, Тетрада Фалло, двойное отхождение магистральных сосудов от правого желудочка, транспозиция магистральных сосудов и критические стенозы клапанов сердца.
В силу большого разнообразия возможных комбинаций сложных пороков для каждого ребенка подбирается индивидуальный план лечения после проведения развернутой диагностики.
ЭТАПНОЕ ЛЕЧЕНИЕ СЛОЖНЫХ ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА И ПОВТОРНЫЕ КАРДИОХИРУРГИЧЕСКИЕ ВМЕШАТЕЛЬСТВА
Одним из направлений нашей работы является диагностика, лечение и ремоделирование сердца при пороках правого желудочка сердца. В этот перечень входят пороки из группы тетрады Фалло (вплоть до атрезии легочной артерии), пороки с двойным отхождением магистральных сосудов от правого желудочка, операция Растрелли, аномалия Эбштейна и прочие, включая большие группы операций с одножелудочковой гемодинамикой.
Хорошие результаты достигаются после коррекции тяжелых пороков сердца по методу Фонтена. Такая операция проводится в детском возрасте с применением экстра кардиального кондуита.
МИНИМАЛЬНО ИНВАЗИВНАЯ ХИРУРГИЯ
В нашем Центре реализуется максимально щадящий подход в выборе метода и вида оперативного вмешательства на сердце у детей.
При наличии медицинских показаний предпочтение отдается малоинвазивным эндоваскулярным методам лечения, которые, в отличие от открытых оперативных вмешательств не требуют торакотомии, остановки сердца и подключения аппарата искусственного кровообращения. Эндоваскулярные вмешательства занимают по времени от 1 часа до 1,5 часов, хорошо переносятся детьми, при этом пребывание в стационаре не превышает 3 дней.
Маленьким детям операции проводятся под наркозом, более старшим — под местным обезболиванием.
Дефекты межпредсердной и межжелудочковой перегородок закрываются специальными устройствами — окклюдерами, сплетёнными из тонкой металлической проволоки с эффектом памяти формы. Подведённые к нужному месту по тонкой трубочке (катетеру) окклюдеры принимают необходимую конфигурацию при их выдвижении из катетера. Основное условие выбора такого способа лечения — наличие достаточных краёв у дефекта, что определяется при предварительном ультразвуковом исследовании. При наличии дефицита краев у дефекта (ДМПП, ДМЖП), необходима открытая операция.
При наличии дефицита краев у дефекта (ДМПП, ДМЖП), необходима открытая операция.
При врожденном пороке сердца: открытый артериальный проток в зависимости от размера он закрывается или окклюдером, или специальной платиновой спиралью.
ПРЕБЫВАНИЕ В ОТДЕЛЕНИИ
В детском отделении (КХО№4) созданы все условия для комфортного совместного пребывания матери и ребенка. В каждой палате есть встроенная мебель, душевая комната, функциональные кровати, централизованная система вентиляции и кондиционирования воздуха, телевизор, система видеонаблюдения, кнопка вызова медицинского персонала.
Для детей находящихся на искусственном вскармливании в отделении организована молочная комната, в которой предусмотрено приготовление и розлив детских молочных смесей, а также созданы все условия для сцеживания материнского молока.
И, кроме того, создана максимально комфортная среда пребывания, приближённая к домашней, доброжелательная и уютная обстановка. Имеется прекрасная игровая комната. В этой комнате комфортную атмосферу для детей создали 2 дизайнера, приглашенные из Лондона.
Имеется прекрасная игровая комната. В этой комнате комфортную атмосферу для детей создали 2 дизайнера, приглашенные из Лондона.
Приложение — Коммерсантъ Здравоохранение (110280)
Детская кардиохирургия — одно из самых успешных направлений в отечественном здравоохранении, и, увы, одно из самых востребованных. Ежегодно в России рождается около 20 тыс. детей с врожденными пороками сердца (ВПС). Возможности современной детской кардиохирургии позволяют эффективно помочь большинству из них, включая более чем 75% нуждающихся новорожденных с ВПС. Поэтому ее развитие необходимо, в частности для снижения неонатальной смертности, считает ВЛАДИМИР ИЛЬИН, заведующий отделением кардиохирургии и интенсивной терапии московской детской городской клинической больницы им. Н. Ф. Филатова, из числа ведущих детских кардиохирургов страны.
Город лечит
— Отделение кардиохирургии и интенсивной терапии, которое вы возглавляете, достаточно молодое: ему всего восемь лет. Какова была необходимость в создании в Филатовской больнице этой структуры?
— Отделение было открыто в сентябре 2008 года. В предшествующие годы в Москве резко возросла рождаемость. Если в 1992 году в столице родилось порядка 45 тыс. детей, то в 2008 году — уже 94 тыс. Причем рождаемость продолжает расти, и в 2015 году она превысила 143 тыс. Рост рождаемости в Москве и стране в целом привел, в частности, к увеличению количества детей с ВПС, которые нуждались в хирургическом лечении, в том числе неотложном. Федеральный Бакулевский центр, который, находясь в Москве, обслуживал не только столицу, но и всю страну, уже не справлялся с возросшими объемами помощи московским детям с ВПС.
В предшествующие годы в Москве резко возросла рождаемость. Если в 1992 году в столице родилось порядка 45 тыс. детей, то в 2008 году — уже 94 тыс. Причем рождаемость продолжает расти, и в 2015 году она превысила 143 тыс. Рост рождаемости в Москве и стране в целом привел, в частности, к увеличению количества детей с ВПС, которые нуждались в хирургическом лечении, в том числе неотложном. Федеральный Бакулевский центр, который, находясь в Москве, обслуживал не только столицу, но и всю страну, уже не справлялся с возросшими объемами помощи московским детям с ВПС.
Это почувствовало руководство Москвы — глава московского городского департамента здравоохранения Андрей Сельцовский и мэр Москвы Юрий Лужков. Нам отдали пустующий этаж шестого корпуса Филатовской больницы, оснастили необходимым оборудованием. Так было создано отделение кардиохирургии и интенсивной терапии в ДГКБ им. Н. Ф. Филатова. Так было найдено решение проблемы. За восемь лет мы прооперировали 2852 пациента, в том числе 567 новорожденных. На сегодняшний день мы являемся единственным детским кардиохирургическим отделением городского подчинения и удовлетворяем примерно половину потребностей Москвы в детской кардиохирургии. Ежегодно мы оперируем более 400 детей с врожденными пороками сердца, среди которых примерно четверть — новорожденные. При этом мы оказываем помощь не только московским детям, но и пациентам из Донецкой и Луганской самопровозглашенных республик. В прошлом году мы прооперировали 38 таких детей.
На сегодняшний день мы являемся единственным детским кардиохирургическим отделением городского подчинения и удовлетворяем примерно половину потребностей Москвы в детской кардиохирургии. Ежегодно мы оперируем более 400 детей с врожденными пороками сердца, среди которых примерно четверть — новорожденные. При этом мы оказываем помощь не только московским детям, но и пациентам из Донецкой и Луганской самопровозглашенных республик. В прошлом году мы прооперировали 38 таких детей.
Коллектив единомышленников
— Ваше отделение известно рекордно низкой операционной летальностью — около 3%, соответствующей среднеевропейским показателям. Как удалось в столь сжатый срок достичь таких результатов?
— За последние несколько лет мы продвинулись далеко вперед в понимании того, как, в каком возрасте, в какой последовательности оперировать, какие алгоритмы использовать, какой будет от этого эффект, как ребенок переживает эту операцию, полностью ли он поправится или его состояние несколько улучшится, поэтому результаты хирургических вмешательств резко улучшились.
К примеру, в нашем отделении за последние три года не погиб ни один ребенок из 35 новорожденных, которым мы исправляли сложнейший порок — транспозицию аорты и легочной артерии. При этой патологии очень высока летальность в перинатальный период и в грудном возрасте. 70% неоперированных детей умирают до месяца, а 90% — до года. Мы их оперируем примерно в возрасте 7-15 дней. Операция с искусственным кровообращением длится около четырех-пяти часов. При этом сердце не работает, потому что мы исправляем там дефекты. А лет 20 назад смертность была порядка 15%. То же вроде бы не очень большая, но прогресс налицо.
Сегодня у нас появилась новая хирургическая техника, мы осваиваем новые технологии, приходит понимание того, как лучше делать те или иные этапы операции. Операции на открытом сердце — это очень серьезная инвазия, большая операционная рана, переливание донорской крови, необходимость в искусственном кровообращении. Все это нужно учитывать, предупреждать и нивелировать новыми методами и лекарственными препаратами. Это очень многоплановый и большой процесс.
Это очень многоплановый и большой процесс.
При этом колоссальное значение имеет слаженная работа всего коллектива: хирургов, анестезиологов, интенсивных терапевтов и медсестер. Люди должны не просто все делать правильно, они должны быть мотивированы на достижение наилучшего результата и обращать внимание на любую мелочь. Не менее важен послеоперационный период. Когда выхаживаешь больного, очень важно предвидеть возможный ход событий, что позволяет избежать многих осложнений. Это постоянный контакт с ребенком, с приборами, которые мониторят его состояние. Очень часто это контакт на интуитивном уровне. А это приходит с опытом. Определяющим в нашей работе является слаженный коллектив, где все друг друга хорошо знают, доверяют и готовы помочь. Здесь все работает на то, чтобы пациент поправился.
— Как удалось создать такой сплоченный коллектив? Откуда пришли люди?
— Сформировать эффективный коллектив — это уже половина дела. Особенно в нашей стране. Очень важна мотивация людей на успех в работе, а не просто на зарабатывание денег. Когда мне предложили возглавить это отделение, я уже был известным детским хирургом, и люди, которым я как специалист был интересен, связались со мной и предложили свои услуги. Кто-то не выдержал наших требований и ушел, но большинство остались. Я рад, что смог организовать здесь, в многопрофильной детской больнице, эффективный коллектив, который представляет собой особенную структуру.
Когда мне предложили возглавить это отделение, я уже был известным детским хирургом, и люди, которым я как специалист был интересен, связались со мной и предложили свои услуги. Кто-то не выдержал наших требований и ушел, но большинство остались. Я рад, что смог организовать здесь, в многопрофильной детской больнице, эффективный коллектив, который представляет собой особенную структуру.
— В чем ее уникальность?
— В нашем отделении работают специалисты разного профиля: хирурги, кардиологи, педиатры, рентгенохирурги, анестезиологи и интенсивные терапевты, медицинские сестры разных специальностей — все мы работаем одним коллективом. Обычно такое не практикуется. По крайней мере мне неизвестно, чтобы у нас в стране было что-то похожее.
В нашем отделении работают 54 человека, среди них 17 врачей. Преобладают, конечно, медсестры и санитарки, и это очень важно, потому что мы стремимся каждому пациенту уделить максимальное внимание.
— Все ли дети с врожденным пороком сердца нуждаются в экстренных операциях и все ли своевременно их получают?
— Ежегодно в Москве рождается около 1,2 тыс. детей с диагнозом «врожденный порок сердца». Примерно 300-400 из них нуждаются в хирургическом вмешательстве в возрасте до одного года. Но при детальном анализе выясняется, что среди них есть те, кто родился с врожденным пороком сердца, но у них спустя какое-то время произошло самоизлечение. Такое бывает, если речь не идет о каких-то серьезных комплексных пороках, а, например, об артериальном протоке или небольшом межпредсердном дефекте. Но бывает и наоборот, когда порок проявляет себя лишь в старшем возрасте, а в период новорожденности не был диагностирован.
детей с диагнозом «врожденный порок сердца». Примерно 300-400 из них нуждаются в хирургическом вмешательстве в возрасте до одного года. Но при детальном анализе выясняется, что среди них есть те, кто родился с врожденным пороком сердца, но у них спустя какое-то время произошло самоизлечение. Такое бывает, если речь не идет о каких-то серьезных комплексных пороках, а, например, об артериальном протоке или небольшом межпредсердном дефекте. Но бывает и наоборот, когда порок проявляет себя лишь в старшем возрасте, а в период новорожденности не был диагностирован.
Самые тяжелые пациенты — это новорожденные и дети первых месяцев жизни, которые во многих случаях требуют неотложных, в том числе повторных, вмешательств.
При этом сама операция — это немалый риск. Если для ребенка риск умереть без операции больше, чем риск операции, то мы оперируем новорожденных. Если же ребенок может расти и развиваться с умеренными проблемами, с умеренной сердечной недостаточностью, с какими-то другими элементами, которые мы можем лечить терапевтически, мы даем ему такую возможность.
Хирургическую помощь по медицинским показаниям у нас получают все дети. Нередко у ребенка с врожденным пороком сердца присутствует целый ряд других дефектов развития и перинатального периода: порок желудочно-кишечного тракта, порок дыхательных путей и легких и др. Это пациент с множественной патологией развития, поэтому нельзя в полной мере считать, что это кардиологический пациент. Из всех больных с комплексными ВПС, которые нуждаются в хирургической помощи, примерно 7-10% имеют множественные дефекты развития. Обычно это некая синдромальная патология, которая сопровождается пороком сердца. При этом нередко встречаются и абсолютно смертельные генетически обусловленные синдромы, при которых 75-80% детей погибают до года и 100% — до достижения двух лет. Тем не менее их необходимо лечить, как и всех остальных детей.
Владимир Ильин оперирует детей и беспокоится о взрослых, потому что ВПС — диагноз пожизненный
Фото: Геннадий Гуляев, Коммерсантъ
— Это лечение просто продлевает жизнь?
— Кому-то продлевает, а кому-то, наоборот, укорачивает, поскольку кардиохирургические вмешательства — это самые инвазивные и самые травматичные хирургические вмешательства для организма ребенка, да и взрослого. Специфика детской кардиохирургии и хирургии ВПС состоит в том, что нередко врач формирует и создает нестандартные и очень сложные для исполнения алгоритмы операции, которые на протяжении 30-40 лет могут встретиться ему только дважды. И это нужно адекватно оценивать и исполнять. При лечении других патологий такого разнообразия, как правило, нет. Это очень творческая и очень сложная специальность, каждый раз требующая персонифицированного подхода к лечению пациента.
Специфика детской кардиохирургии и хирургии ВПС состоит в том, что нередко врач формирует и создает нестандартные и очень сложные для исполнения алгоритмы операции, которые на протяжении 30-40 лет могут встретиться ему только дважды. И это нужно адекватно оценивать и исполнять. При лечении других патологий такого разнообразия, как правило, нет. Это очень творческая и очень сложная специальность, каждый раз требующая персонифицированного подхода к лечению пациента.
Для помощи таким детям приходится задействовать огромный арсенал тактических подходов и хирургических приемов. Все попытки стандартизации здесь неуместны.
Кроме того, в каждой возрастной категории есть свои особенности, с которыми должна быть знакома опытная группа специалистов, чтобы быстро и целенаправленно решать проблемы, характерные для этого возраста.
— Можно ли говорить о случаях полного выздоровления после операции по поводу врожденного порока сердца?
— Врожденные пороки сердца — это огромный диапазон патологий, часть которых полностью не устранима, другая часть устранима частично, но все же значительная часть ВПС может быть устранена полностью. Если в период новорожденности или в первые годы жизни ребенку с ВПС выполняют радикальную коррекцию, то во многих случаях это не значит, что его сердце станет здоровым и он выздоровеет. Лишь самые простые пороки устраняются так, что потом ребенок может считаться совершенно здоровым. Наука озабочена проблемой лечения пациентов со сложными, комплексными ВПС, которые не всегда можно устранить в ходе одной операции. Безусловно, операция улучшает состояние пациента, но сплошь и рядом после операции сохраняются какие-то остаточные так называемые резидуальные, или неустранимые, дефекты. Предположим, окклюдером (специальной заплаткой.— «Ъ») закрывают отверстие в сердечной перегородке, но в одном уголке шов может прорезаться, и вместо большого отверстия останется маленькое. Это рутинная ситуация во всем мире.
Если в период новорожденности или в первые годы жизни ребенку с ВПС выполняют радикальную коррекцию, то во многих случаях это не значит, что его сердце станет здоровым и он выздоровеет. Лишь самые простые пороки устраняются так, что потом ребенок может считаться совершенно здоровым. Наука озабочена проблемой лечения пациентов со сложными, комплексными ВПС, которые не всегда можно устранить в ходе одной операции. Безусловно, операция улучшает состояние пациента, но сплошь и рядом после операции сохраняются какие-то остаточные так называемые резидуальные, или неустранимые, дефекты. Предположим, окклюдером (специальной заплаткой.— «Ъ») закрывают отверстие в сердечной перегородке, но в одном уголке шов может прорезаться, и вместо большого отверстия останется маленькое. Это рутинная ситуация во всем мире.
Или нужно корригировать клапан легочной артерии, который неправильно развит. Но там уродливые створки, и мы не всегда можем сделать их полноценными. Устранение порока заключается в разрушении части этих створок, чтобы выход крови из желудочка в легочную артерию был более свободным, чем до операции. Это в какой-то степени совместимо с некоей продолжительностью жизни. Мы, совершенствуя технологию, пытаемся так приоткрыть этот измененный клапан, чтобы он хоть частично исполнял свою функцию. При возможности используем искусственные клапаны. Бывает, имплантируем клапаны, скроенные из тканей самого пациента или полученные от животного и специальным образом обработанные. Некоторые из них прекрасно работают. Но со временем — через три-семь лет — они неизбежно подвергаются изменениям, становятся малоподвижными. Поскольку ребенок еще и растет, требуется еще одна или даже несколько операций.
Это в какой-то степени совместимо с некоей продолжительностью жизни. Мы, совершенствуя технологию, пытаемся так приоткрыть этот измененный клапан, чтобы он хоть частично исполнял свою функцию. При возможности используем искусственные клапаны. Бывает, имплантируем клапаны, скроенные из тканей самого пациента или полученные от животного и специальным образом обработанные. Некоторые из них прекрасно работают. Но со временем — через три-семь лет — они неизбежно подвергаются изменениям, становятся малоподвижными. Поскольку ребенок еще и растет, требуется еще одна или даже несколько операций.
Врожденный порок сердца, особенно комплексный,— это пожизненный диагноз, с которым человек идет по жизни. Сердце остается неправильно сформированным. Конечно, условия для его работы в результате операции улучшились, но на сердце появились рубчики, в него вросли заплатки, к нему подсоединены искусственные трубочки, которые исполняют, к примеру, роль легочной артерии, которой не было изначально. По мере роста ребенка эти трубочки надо менять.
Поэтому нередко даже после успешно проведенной операции пациент нуждается в лечебных манипуляциях, лекарственной поддержке, дальнейшем наблюдении, а в ряде случаев — в повторных вмешательствах. Поэтому целесообразно, чтобы один и тот же врач начинал лечение пациента в младенческом возрасте и продолжал его дальше, как это происходит в нашем подразделении.
Первый крик
— Сегодня появилась тенденция создавать кардиохирургические отделения для новорожденных в новых перинатальных центрах, которые в массовом порядке строятся сейчас в субъектах. Каково ваше отношение к этому тренду?
— На мой взгляд, это нонсенс. Устраивать кардиохирургию в роддомах — это неправильно и неэффективно. Во-первых, статус перинатального центра не позволяет привозить детей из других роддомов, поэтому полноценное кардиохирургическое отделение там организовать невозможно. Во-вторых, кардиохирургия, особенно новорожденных, требует мультидисциплинарного подхода — врачей разных профилей. Лечение детей с врожденным пороком сердца зачастую, особенно в периоде новорожденности, не завершается за один или два месяца. Это всего лишь один этап. А где потом лечить этих детей? Направлять в какую-то другую клинику? В хирургии ВПС необходима преемственность, когда один и тот же специалист наблюдает динамику в послеоперационном периоде и может непрерывно провести весь процесс лечения: от первого дня до 16-18 лет. Делать это в роддоме невозможно. В роддоме должен быть кардиолог, владеющий определенными знаниями и диагностическими методами, чтобы своевременно и правильно диагностировать порок сердца, оказать первую помощь и направить ребенка на лечение в специализированные кардиохирургические отделения. Так это организовано во всем мире.
Лечение детей с врожденным пороком сердца зачастую, особенно в периоде новорожденности, не завершается за один или два месяца. Это всего лишь один этап. А где потом лечить этих детей? Направлять в какую-то другую клинику? В хирургии ВПС необходима преемственность, когда один и тот же специалист наблюдает динамику в послеоперационном периоде и может непрерывно провести весь процесс лечения: от первого дня до 16-18 лет. Делать это в роддоме невозможно. В роддоме должен быть кардиолог, владеющий определенными знаниями и диагностическими методами, чтобы своевременно и правильно диагностировать порок сердца, оказать первую помощь и направить ребенка на лечение в специализированные кардиохирургические отделения. Так это организовано во всем мире.
Одинокое сердце взрослого
— Где сейчас получают лечение больные с ВПС по достижении ими 18-летнего возраста?
— Сегодня это большая, трудно решаемая проблема, актуальность которой нарастает год от года. Успехи кардиохирургии и кардиологии привели к тому, что все больше и больше детей с врожденными пороками сердца становятся взрослыми. Успешно оперированные дети вырастают и пополняют ряды взрослых с ВПС, которые по-прежнему нуждаются в постоянном наблюдении, периодической терапии, а иногда и в операциях. На сегодняшний день только в США с диагнозом «врожденный порок сердца» живут 1 млн детей и 1,5 млн взрослых.
Успешно оперированные дети вырастают и пополняют ряды взрослых с ВПС, которые по-прежнему нуждаются в постоянном наблюдении, периодической терапии, а иногда и в операциях. На сегодняшний день только в США с диагнозом «врожденный порок сердца» живут 1 млн детей и 1,5 млн взрослых.
Поскольку ВПС — диагноз пожизненный, не всегда возможно предсказать, как будет складываться жизнь такого пациента. У него могут появиться нарушения ритма или какие-то другие проблемы, иногда требующие повторных операций. Но взрослые кардиохирурги к этому, как правило, не готовы. Они могут не знать патофизиологии таких ВПС и никогда не выполняли такие операции. Это мировая проблема, которую необходимо решать. Поэтому сегодня, например, в Великобритании детские кардиохирургические центры начинают расширять свои полномочия, оперируя и взрослых.
В России каждый год выписываются 14-15 тыс. детей, оперированных по поводу ВПС. Они вырастают, и детские кардиолог и кардиохирург их уже не принимают, а взрослый — далеко не всегда умеет лечить. Это официально не обозначенная, очень непростая, дорогостоящая, но проблема, которую необходимо решать в ближайшее время.
Это официально не обозначенная, очень непростая, дорогостоящая, но проблема, которую необходимо решать в ближайшее время.
Несколько лет назад в департаменте здравоохранения Москвы обсуждалась возможность расширения нашего кардиохирургического отделения, которое уже имеет опыт и эффективно работает, внося значительный вклад в столичное здравоохранение. Но развития эти планы не получили. В настоящее время мы не располагаем большими площадями, а те, что есть, используем на 150%. На сегодняшний день мы сложившийся, опытный, эффективно работающий коллектив, готовый расширяться и наращивать объемы медицинской помощи больным с врожденными пороками сердца.
Беседовала Светлана Белостоцкая
12000 часов наедине с сердцем
Владимир Николаевич Ильин — советский и российский врач, один из ведущих российских детских кардиохирургов, доктор медицинских наук, профессор. Окончил Второй Московский государственный медицинский институт им. Н. И. Пирогова.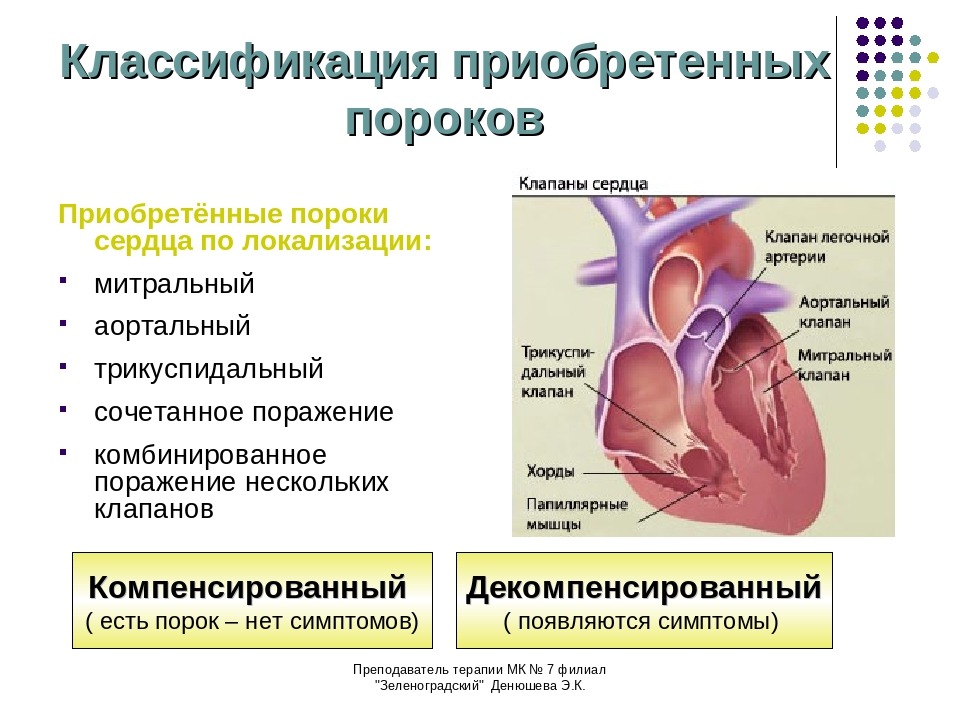 Работал в Институте сердечно-сосудистой хирургии им. А. Н. Бакулева АМН СССР, где прошел обучение в клинической ординатуре и аспирантуре. Ученик академика В. И. Бураковского. С 1990 года по сентябрь 2006 года возглавлял Отделение экстренной кардиохирургии новорожденных и детей первого года жизни НЦССХ им. А. Н. Бакулева РАМН. С января 2008 года — руководитель нового отделения кардиохирургии и интенсивной терапии ГБУЗ ДГКБ им. Н. Ф. Филатова (г. Москва). Провел более 3 тыс. операций на сердце новорожденным и детям раннего возраста, в том числе более 1,8 тыс. операций на открытом сердце. Автор более 240 научных работ, 23 из которых опубликованы в зарубежной печати. Член ряда российских и зарубежных медицинских сообществ: Ассоциации сердечно-сосудистых хирургов России, Ассоциации детских кардиологов России, Европейской ассоциации кардиоторакальных хирургов, Европейской ассоциации детских кардиохирургов, Общества торакальных хирургов (США), Всемирного общества педиатрии и хирургии врожденных пороков сердца.
Работал в Институте сердечно-сосудистой хирургии им. А. Н. Бакулева АМН СССР, где прошел обучение в клинической ординатуре и аспирантуре. Ученик академика В. И. Бураковского. С 1990 года по сентябрь 2006 года возглавлял Отделение экстренной кардиохирургии новорожденных и детей первого года жизни НЦССХ им. А. Н. Бакулева РАМН. С января 2008 года — руководитель нового отделения кардиохирургии и интенсивной терапии ГБУЗ ДГКБ им. Н. Ф. Филатова (г. Москва). Провел более 3 тыс. операций на сердце новорожденным и детям раннего возраста, в том числе более 1,8 тыс. операций на открытом сердце. Автор более 240 научных работ, 23 из которых опубликованы в зарубежной печати. Член ряда российских и зарубежных медицинских сообществ: Ассоциации сердечно-сосудистых хирургов России, Ассоциации детских кардиологов России, Европейской ассоциации кардиоторакальных хирургов, Европейской ассоциации детских кардиохирургов, Общества торакальных хирургов (США), Всемирного общества педиатрии и хирургии врожденных пороков сердца.
Лечение порока сердца в Германии
Диагноз
Врожденный порок сердца ВПС. Перемембранозный дефект межжелудочковой перегородки. Небольшое открытое овальное окно. Мизерный открытый артериальный проток (супрастернально).
Пациент:
Ребенок, 1 год, Казахстан
Врач:
Главный врач центра детской кардиохирургии Университетской клиники Бонн, профессор Булос Асфур
Ответ детского кардиохирурга профессора Булоса Асфур
В данном случае мы имеем дело с доброкачественным пороком сердца (дефект межжелудочковой перегородки ДМЖП), после корректировки которого ребенок считается здоровым. При этой сердечной патологии избыточный (большой) объем крови поступает (закачивается) в лёгочную артерию, в следствии чего происходит перегрузка малого круга кровобращения, где увеличивается давление. Мы проводим хирургическое лечение таких пациентов в возрасте до 6 месяцев.
Когда ДМЖП небольшой, легочные сосуды не страдают от повышенного давления.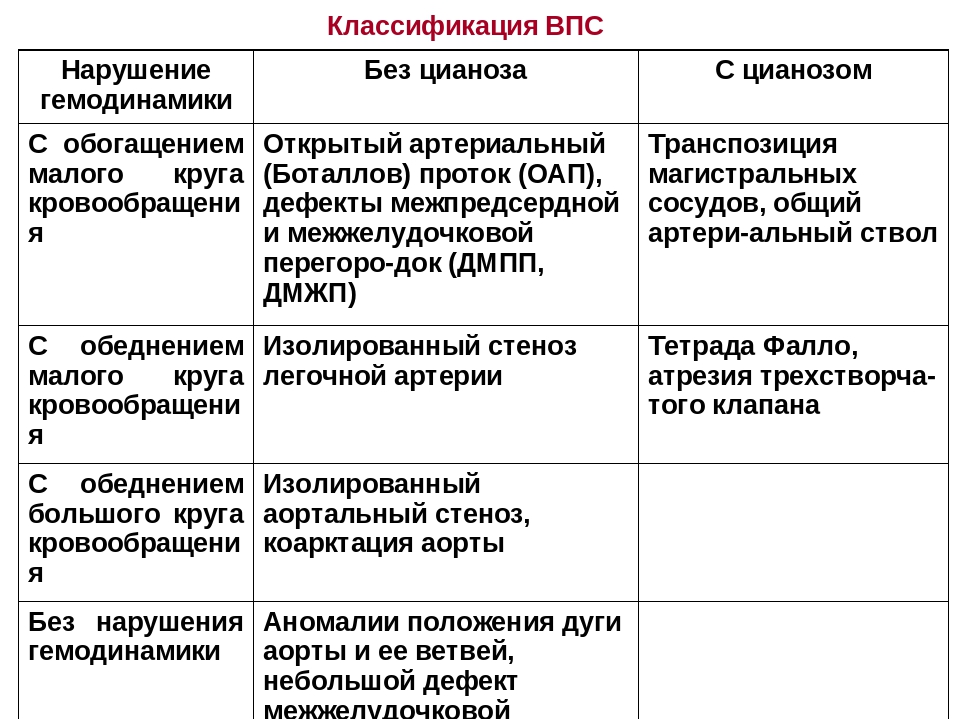 К сожалению на снимках УЗИ этого не видно, но отверстие выглядит большим. Так или иначе, это обстоятельство не является основанием для отказа от корректировки существующего порока сердца. В этом случае нельзя слишком долго медлить.
К сожалению на снимках УЗИ этого не видно, но отверстие выглядит большим. Так или иначе, это обстоятельство не является основанием для отказа от корректировки существующего порока сердца. В этом случае нельзя слишком долго медлить.
Как вы наверное знаете, в нашем специализированном центре кардиохирургии проводиться операций больше, чем в каком либо другом кардиоцентре Германии. В случае необходимости мы подготовим калькуляцию стоимости операции в нашей клинике.
Вопросы родителей пациента
1. Как будет проводится операция?
2. Какова длительность пребывания в клинике?
3. Как долго мы должны оставаться в Германии?
Ответы врача
Операционная техника для всех пороков сердца идентична и стандартизирована. Операция проводится с рассечением грудины, но в отдельных случаях доступ может осуществляться через боковой разрез с правой стороны. Госпитализация проводится за 2 дня до операции, чтобы провести необходимые обследования и разъяснить родителям ход предстоящей операции. После операции ребенок пробудет один 1 день в отделении интенсивной терапии, а затем еще неделю в стационарном отделении клиники. После выписки из клиники целесообразно оставаться в Германии еще около 2 недель, чтобы мы могли контролировать состояние ребенка.
После операции ребенок пробудет один 1 день в отделении интенсивной терапии, а затем еще неделю в стационарном отделении клиники. После выписки из клиники целесообразно оставаться в Германии еще около 2 недель, чтобы мы могли контролировать состояние ребенка.
Предварительная стоимость лечения: 46.200 Евро.
Проведенное лечение
Фактическая стоимость лечения: 22.972 Евро
Детское сердце. Сердечный маршрут
Друзья! Мы подвели итоги первого этапа реализации проекта «Сердечный маршрут», целью которого является здоровье сбережение детей, ранняя диагностика сердечно-сосудистой патологии и врожденных пороков сердца, которые стали возможными и проводятся с использованием гранта Президента Российской Федерации на развитие гражданского общества, предоставленного Фондом президентских грантов.
Детские кардиологи побывали в 4-х городах Кемеровской области и провели консультации 136 детей. 48 детям был подтвержден диагноз врожденный порок сердца, причем 14 детям этот диагноз установили впервые. По итогам диагностики 19 детей были приглашены на лечение в Кемеровский областной кардиологический диспансер, а 2-м детям предстоит в ближайшие месяцы пройти хирургическое лечение, после которого они будут здоровы и как и обычные дети будут радоваться солнцу, снегу, играть в футбол и просто обретут счастливое детство. А команда проекта в преддверии самого долгожданного праздника — Нового года — рада была оказать помощь маленьким кузбассовцам и желает всем детям быть здоровыми и радовать своих родителей новыми достижениями и победами.
По итогам диагностики 19 детей были приглашены на лечение в Кемеровский областной кардиологический диспансер, а 2-м детям предстоит в ближайшие месяцы пройти хирургическое лечение, после которого они будут здоровы и как и обычные дети будут радоваться солнцу, снегу, играть в футбол и просто обретут счастливое детство. А команда проекта в преддверии самого долгожданного праздника — Нового года — рада была оказать помощь маленьким кузбассовцам и желает всем детям быть здоровыми и радовать своих родителей новыми достижениями и победами.
В ходе реализации второго этапа проекта «Сердечный маршрут» детскими кардиологами были осмотрены и продиагностированы 140 детей в 4-х территориях Кемеровской области – Яя, Красный Брод, Зеленогорский, Тяжин. Диагноз врожденный порок сердца (ВПС) был подтвержден 31 ребенку, причем впервые такой диагноз установлен 4 детям. Для дальнейшего лечения в Кардиоцентр приглашены 29 детей, среди них 4 ребенка нуждаются в хирургической коррекции порока. С уверенностью можно сказать, что теперь жизнь и здоровье детей с установленным диагнозом ВПС вне опасности. Все намеченные задачи были выполнены. А детские кардиологи уже планируют следующие выезды, где они точно знают, ждут дети и родители, которые сами не смогут прибыть в областной центр для прохождения диагностики.
С уверенностью можно сказать, что теперь жизнь и здоровье детей с установленным диагнозом ВПС вне опасности. Все намеченные задачи были выполнены. А детские кардиологи уже планируют следующие выезды, где они точно знают, ждут дети и родители, которые сами не смогут прибыть в областной центр для прохождения диагностики.
Следующий этап реализации проекта «Сердечный маршрут» стартует в конце апреля.
За третий этап реализации проекта детские кардиологи посетили 4 отдаленные территории Кемеровской области: г. Тайга, г. Киселевск, пгт Тисульский и пгт Ижморский. В среднем до каждого места обследования дорога занимала 4 часа. Педиатры на территориях в течение 2 недель вели запись детей на УЗИ- исследование и консультацию кардиолога. Но и те дети, которые пришли без записи, не остались без внимания. Родители самостоятельно отслеживают новости о работе проекта через группы фонда в социальных сетях, некоторые звонят в фонд для уточнения возможной консультации своего ребенка у кардиолога.
Всего диагностику прошло 142 ребенка, DS «врожденный порок сердца» был установлен 42 детям, причем впервые выявлена такая патология у 9 детей. На дальнейшее лечение в Кардиоцентр приглашены 28 маленьких жителей Кузбасса.
За 4 этап реализации проекта «Сердечный маршрут» детские кардиологи побывали в Ленинск-Кузнецком районе, поселке Инской Беловского района и городе Новокузнецке. Раннюю диагностику врожденных пороков сердца и сердечно-сосудистых заболеваний прошло 116 детей. Врачи подтвердили диагноз «врожденный порок сердца» 22 детям, но среди этого числа были выявлены и впервые пороки сердца у 4 ребятишек. 20 маленьких кузбассовцев приглашены на дообследование и лечение в Кемеровский кардиоцентр уже в 2018 году. Теперь эти дети будут окружены особым вниманием врачей и совсем скоро станут абсолютно здоровыми.
Вот уже второй раз проект «Сердечный маршрут» реализуется с использованием Гранта Президента РФ на развитие гражданского общества, предоставленного Фондом президентских грантов. Мы понимаем, что это большая ответственность и поэтому, серьезно подходим к исполнению намеченных планов, зачастую перевыполняя их.
Мы понимаем, что это большая ответственность и поэтому, серьезно подходим к исполнению намеченных планов, зачастую перевыполняя их.
Наш проект показал необходимость ранней диагностики врожденных пороков сердца еще на этапе апробации, теперь же все детские кардиологи считают эффективной данную работу и помогают в лечении детских сердец – оперативно ставят на учет, записывают на дообслодование на базе стационара, проводят оперативное лечение и контролируют на этапе восстановления после хирургического лечения. Все это помогает детям выздоравливать в кратчайшие сроки.
Жители Кемеровской области – родители малышей с врожденными пороками или сердечно-сосудистой патологией – более ответственно стали относиться к обследованию своих малышей, тем более что, бригада проекта приезжает сама в районные поликлиники. За год мы запланировали провести раннюю диагностику ВПС 400 малышей в 12 городах и поселках области, где нет детских кардиологов или оборудования для проведения УЗИ-диагностики.
Подводя итоги реализации 1 этапа проекта «Сердечный маршрут» нужно отметить, что детские кардиологи осмотрели 272 ребенка в 8 городах и поселках области. Диагноз «врожденный порок сердца» подтвержден у 28% – 76 детей, причем впервые выявлено заболевание у 15 детей (5,5%) из общего числа пришедших на прием. 61 ребенок нуждается в дополнительном обследование на базе стационара, они приглашены в «Кемеровский областной клинический кардиологический диспансер им. акад. Л.С. Барбараша». 4 (>1%) детей нуждаются в срочной хирургической коррекции порока, после проведения высоко-технологичных операций эти дети станут полностью здоровы.
«Сердечный маршрут» продолжит работу в Кузбассе в ближайшее время, ведь от выявления заболевания на ранней стадии зависит Жизнь и здоровье детей региона. Команда проекта «Сердечный маршрут» желает всем детям здоровья, забыть о болезни и обрести счастливое беззаботное детство.
youtube.com/embed/VQFLMyotPD4″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»» frameborder=»0″>
Проект «Сердечный маршрут» реализуется с использованием Гранта Президента РФ на развитие гражданского общества, предоставленного Фондом президентских грантов. Это большая ответственность и поэтому мы серьезно подходим к исполнению намеченных планов, вот и в этот раз вновь кардиологи проекта осмотрели больше детей, чем изначально планировалось.
Проект показал необходимость ранней диагностики врожденных пороков сердца, все детские кардиологи считают эффективной данную работу и помогают в лечении детских сердец –ставят на учет, записывают на дообслодование на базе стационара, проводят оперативное лечение и контролируют на этапе восстановления после хирургического лечения. Все это помогает детям выздоравливать в кратчайшие сроки.
Жители Кемеровской области – родители малышей с врожденными пороками или сердечно-сосудистой патологией тоже ответственно относятся к обследованию своих малышей. А бригада проекта приезжает сама в районные поликлиники, что помогает многодетным и малообеспеченным семьям. За год мы планировали провести раннюю диагностику ВПС 400 малышей в 12 городах и поселках области, где нет детских кардиологов или оборудования для проведения эхокардиографии.
А бригада проекта приезжает сама в районные поликлиники, что помогает многодетным и малообеспеченным семьям. За год мы планировали провести раннюю диагностику ВПС 400 малышей в 12 городах и поселках области, где нет детских кардиологов или оборудования для проведения эхокардиографии.
Подводя итоги реализации проекта «Сердечный маршрут» нужно отметить, что детские кардиологи осмотрели 461 ребенка в 14 городах и поселках области. Диагноз «врожденный порок сердца» подтвержден у 148 детей, причем впервые выявлено заболевание у 21 ребенка из общего числа пришедших на прием. 113 детей нуждаются в дополнительном обследование на базе стационара, они приглашены в «Кемеровский областной клинический кардиологический диспансер им. акад. Л.С. Барбараша». 6 детей нуждаются в срочной хирургической коррекции порока, после проведения высоко-технологичных операций эти дети станут полностью здоровы.
«Сердечный маршрут» продолжит работу в Кузбассе в новом 2020 году, ведь от выявления заболевания на ранней стадии зависит Жизнь и здоровье детей региона. Команда проекта «Сердечный маршрут» желает всем детям здоровья и счастливого беззаботного детства.
Команда проекта «Сердечный маршрут» желает всем детям здоровья и счастливого беззаботного детства.
Проект «Сердечный маршрут» стал постоянным действующим проектом Кузбасского благотворительного фонда «Детское сердце». Проект реализуется при поддержке Фонда президентских грантов, уже в 3 раз становясь победителем конкурса.
В 2020 году запланировано провести раннюю диагностику врожденных пороков сердца у детей Кемеровской области в 12 городах.
За первый этап реализации проекта детские кардиологи смогли осмотреть 175 детей в 7 городах Кузбасса. И не смотря на введенные карантинные меры, выявили впервые патологии сердечно-сосудистой системы у 9 маленьких кузбассовцев, подтвержден диагноз «врожденный порок сердца» у 72 детей. На лечение в «Кемеровский областной клинический кардиологический диспансер им. Л.С. Барабараша» на дообследование и лечение было приглашено 60 детей, а 5 малышей нуждаются в срочном хирургическом лечении. С уверенностью можно сказать, что теперь здоровье сердца этих малышей под контролем высококлассных специалистов Кузбасса.
Осложнения вентрикулоперитонеального шунта: обзор
Основные моменты
- •
Обструкция является наиболее частой причиной нарушения функции вентрикулоперитонеального шунта (VPS).
- •
Инфекция — вторая по частоте причина неисправности VPS, которая чаще встречается у детей.
- •
Псевдокиста — это позднее осложнение VPS, которое может проявляться болью в животе и пальпируемым образованием.
- •
Перфорация кишечника — редкое осложнение ВПС, которое в основном возникает у недоношенных и новорожденных.
- •
Образование субдуральной гематомы может происходить при избыточном шунтировании в случаях гидроцефалии низкого давления.
Реферат
Установка вентрикулоперитонеального шунта (VPS) является одной из наиболее часто выполняемых нейрохирургических процедур и необходима для лечения большинства форм гидроцефалии. К сожалению, осложнения, связанные с установкой VPS, являются обычным явлением, и на протяжении всей жизни пациента почти ожидаются многократные ревизии шунта. Неисправность шунта может быть объяснена множеством причин, включая непроходимость, инфекцию, образование псевдокист и перфорацию кишечника.Обструкция VPS, которая чаще всего возникает в проксимальном катетере, является наиболее частой причиной нарушения функции VPS. Инфекция оборудования является второй по частоте причиной неисправности VPS, и это осложнение чаще всего наблюдается у младенцев, причем недоношенные младенцы наиболее восприимчивы. Несмотря на постоянные попытки снизить частоту осложнений VPS, такие как усовершенствованные методы стерилизации, пропитанные антибиотиками катетеры и программируемые клапаны, неисправность VPS остается серьезной проблемой, которая часто приводит к множественной и дорогостоящей госпитализации.В настоящем обзоре обсуждаются наиболее частые осложнения VPS, включая их проявление и соответствующее лечение.
К сожалению, осложнения, связанные с установкой VPS, являются обычным явлением, и на протяжении всей жизни пациента почти ожидаются многократные ревизии шунта. Неисправность шунта может быть объяснена множеством причин, включая непроходимость, инфекцию, образование псевдокист и перфорацию кишечника.Обструкция VPS, которая чаще всего возникает в проксимальном катетере, является наиболее частой причиной нарушения функции VPS. Инфекция оборудования является второй по частоте причиной неисправности VPS, и это осложнение чаще всего наблюдается у младенцев, причем недоношенные младенцы наиболее восприимчивы. Несмотря на постоянные попытки снизить частоту осложнений VPS, такие как усовершенствованные методы стерилизации, пропитанные антибиотиками катетеры и программируемые клапаны, неисправность VPS остается серьезной проблемой, которая часто приводит к множественной и дорогостоящей госпитализации.В настоящем обзоре обсуждаются наиболее частые осложнения VPS, включая их проявление и соответствующее лечение.
Ключевые слова
Вентрикулоперитонеальный шунт
Инфекция вентрикулоперитонеального шунта
Неисправность вентрикулоперитонеального шунта
Осложнения вентрикулоперитонеального шунта
Рекомендованные статьи
000
0009C
Рекомендуемые статьи 9C
Elite
Вентрикулоперитонеальный шунт: процедура, восстановление и риски
Что такое вентрикулоперитонеальный шунт?
Вентрикулоперитонеальный (ВП) шунт — это медицинское устройство, которое снижает давление на мозг, вызванное скоплением жидкости.
VP Шунтирование — это хирургическая процедура, которая в первую очередь лечит состояние, называемое гидроцефалией. Это состояние возникает, когда избыток спинномозговой жидкости накапливается в желудочках головного мозга. CSF смягчает ваш мозг и защищает его от повреждений внутри черепа. Жидкость действует как система доставки питательных веществ, в которых нуждается ваш мозг, а также выводит продукты жизнедеятельности. Обычно спинномозговая жидкость течет через эти желудочки к основанию головного мозга. Затем жидкость омывает головной и спинной мозг, прежде чем снова впитается в кровь.
Обычно спинномозговая жидкость течет через эти желудочки к основанию головного мозга. Затем жидкость омывает головной и спинной мозг, прежде чем снова впитается в кровь.
Когда этот нормальный поток нарушается, скопление жидкости может оказывать вредное давление на ткани мозга, что может привести к его повреждению. Врачи хирургическим путем помещают шунты VP в один из желудочков головного мозга, чтобы отводить жидкость от мозга и восстановить нормальный поток и всасывание спинномозговой жидкости.
У людей любого возраста может развиться гидроцефалия, поэтому требуется шунт VP. Однако, по данным клиники Майо, гидроцефалия чаще встречается у младенцев и пожилых людей.По оценкам Национального института неврологических заболеваний и инсульта (NINDS), от 1 до 2 из 1000 детей рождаются с гидроцефалией.
Избыточная жидкость может скапливаться вокруг головного мозга по ряду причин, включая:
- перепроизводство спинномозговой жидкости
- плохое всасывание спинномозговой жидкости кровеносными сосудами
- закупорки, препятствующие протеканию жидкости по всему мозгу
. самая частая причина гидроцефалии. Кисты, опухоли или воспаление в головном мозге могут препятствовать нормальному оттоку спинномозговой жидкости и создавать опасные скопления.Симптомы гидроцефалии могут включать:
самая частая причина гидроцефалии. Кисты, опухоли или воспаление в головном мозге могут препятствовать нормальному оттоку спинномозговой жидкости и создавать опасные скопления.Симптомы гидроцефалии могут включать:
Визуализирующие обследования могут подтвердить диагноз гидроцефалии. Ультразвук, компьютерная томография и магнитно-резонансная томография позволяют врачам просматривать полости и ткани в головном мозге. Тестирование покажет, содержат ли участки мозга больше жидкости, чем обычно.
Врачи обычно устанавливают шунт VP, когда пациент находится под общей анестезией. Вы будете спать во время операции и не будете испытывать боли. Вся процедура занимает около 90 минут.
Поговорите со своей медицинской бригадой о предоперационных ограничениях в еде и питье. Детям старшего возраста и взрослым может потребоваться голодание не менее восьми часов до операции. Младенцам и детям ясельного возраста может потребоваться прекратить есть детскую смесь и твердую пищу только за шесть часов до операции, но обычно они могут пить воду за четыре часа до запланированной процедуры. В любом случае эти инструкции должны быть просмотрены вашей хирургической бригадой.
В любом случае эти инструкции должны быть просмотрены вашей хирургической бригадой.
Хирургическая медсестра побреет область за ухом перед шунтированием, так как именно здесь будет установлен катетер.Катетеры — это тонкие гибкие трубки, используемые для слива лишней жидкости. Хирург сделает крошечный разрез за ухом, а также просверлит небольшое отверстие в черепе. Затем они вводят один катетер в мозг через это отверстие. Другой катетер проходит за ухом и является подкожным, то есть находится под кожей. Эта трубка проходит вниз к груди и животу, позволяя избытку спинномозговой жидкости стекать в брюшную полость, где тело поглощает ее. Ваш хирург может прикрепить к обоим катетерам крошечный насос и поместить его под кожу за ухом.Насос автоматически активируется для удаления жидкости при повышении давления в черепе. Можно даже запрограммировать насос, также называемый клапаном, на активацию, когда жидкость увеличивается до определенного объема.
Восстановление после установки шунта VP занимает от трех до четырех дней. Большинство людей могут покинуть больницу в течение семи дней после процедуры.
Большинство людей могут покинуть больницу в течение семи дней после процедуры.
Во время вашей госпитализации персонал больницы будет контролировать вашу частоту сердечных сокращений и артериальное давление, а ваш врач назначит вам профилактические антибиотики.Перед вашим отъездом врач убедится, что шунт работает нормально.
Установка шунта — очень безопасная процедура. Однако во время или после процедуры могут возникнуть осложнения. Риски, связанные с любой хирургической процедурой, включают чрезмерное кровотечение и инфекцию. У вас также могут возникнуть побочные реакции на анестезию, такие как затрудненное дыхание, изменение частоты сердечных сокращений или изменение уровня артериального давления.
Существуют редкие риски, характерные для шунтирования VP, которые могут быть серьезными и потенциально опасными для жизни, если их не лечить, в том числе:
Лихорадка, головная боль, боль в животе, усталость и скачок уровня артериального давления или наличие тех же симптомов, что и присутствовали при первоначальной установке шунта, могут указывать на инфекцию или неисправность шунта. Немедленно сообщите своему врачу, если появятся эти признаки и симптомы. По данным Чикагского университета, инфекция наиболее часто встречается в первые несколько недель после установки шунта.
Немедленно сообщите своему врачу, если появятся эти признаки и симптомы. По данным Чикагского университета, инфекция наиболее часто встречается в первые несколько недель после установки шунта.
Шунтирование помогает снизить давление в головном мозге у большинства людей. Шунты VP могут потребовать замены через несколько лет, особенно у маленьких детей. Средняя продолжительность жизни шунта младенца составляет два года. Взрослые и дети старше 2 лет могут не нуждаться в замене шунта в течение восьми и более лет.Системы шунтирования требуют частого контроля и последующего наблюдения. Осложнения, которые могут возникнуть с шунтирующими системами, включают:
- механический отказ
- препятствия
- инфекции
Неисправности могут привести к серьезным осложнениям, таким как чрезмерное или недостаточное дренирование спинномозговой жидкости. Чрезмерное дренирование происходит, когда спинномозговая жидкость выводится из желудочков быстрее, чем производится. Это может вызвать коллапс желудочков, что может привести к головным болям или кровоизлиянию в мозг. Недостаточный дренаж позволяет спинномозговой жидкости накапливаться в головном мозге и может вызвать возвращение симптомов гидроцефалии.Немедленно обратитесь за медицинской помощью, если у вас возникнут симптомы, указывающие на то, что ваша шунтирующая система не работает должным образом.
Это может вызвать коллапс желудочков, что может привести к головным болям или кровоизлиянию в мозг. Недостаточный дренаж позволяет спинномозговой жидкости накапливаться в головном мозге и может вызвать возвращение симптомов гидроцефалии.Немедленно обратитесь за медицинской помощью, если у вас возникнут симптомы, указывающие на то, что ваша шунтирующая система не работает должным образом.
Псевдокиста спинномозговой жидкости брюшной полости, возникшая через 21 год после установки вентрикулоперитонеального шунта: клинический случай | BMC Surgery
22-летний мужчина обратился в нашу больницу с прогрессирующим вздутием живота и тошнотой. VPS была установлена 21 год назад для лечения гидроцефалии, вторичной по отношению к расщеплению позвоночника. Ревизия шунта была выполнена только один раз, когда ему было 10 месяцев, и после этого никаких других операций на брюшной полости не проводилось.В анамнезе не было злокачественных новообразований, заболеваний поджелудочной железы или печени.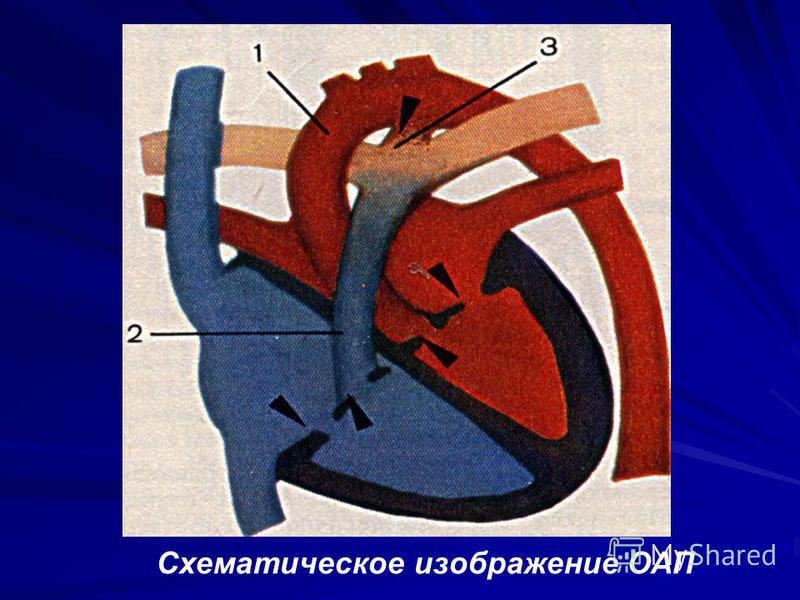 При физикальном обследовании в верхней части живота обнаружено большое эластичное пальпируемое образование. Неврологических изменений не наблюдалось. Количество лейкоцитов и уровень амилазы в сыворотке были нормальными. Пациенту была выполнена рентгенография брюшной полости в положении лежа на спине и компьютерная томография (КТ) брюшной полости без улучшения.
При физикальном обследовании в верхней части живота обнаружено большое эластичное пальпируемое образование. Неврологических изменений не наблюдалось. Количество лейкоцитов и уровень амилазы в сыворотке были нормальными. Пациенту была выполнена рентгенография брюшной полости в положении лежа на спине и компьютерная томография (КТ) брюшной полости без улучшения.
Рентгенография живота в положении лежа на спине выявила VPS в левом верхнем квадранте и образование мягких тканей в верхней части живота (рис. 1). КТ брюшной полости показала скопление однородной жидкости низкой плотности.Кончик катетера VPS находился рядом с местом сбора жидкости, что свидетельствовало о гигантском кистозном поражении вокруг шунтирующего катетера (рис. 2A, B). Кистозная масса не зависела от поджелудочной железы.
Рисунок 1
Рентгенография брюшной полости, показывающая катетер VPS и мягкую массу ткани –, расположенную в верхней части живота.
Рисунок 2
КТ брюшной полости (A: аксиальная, B: сагиттальная), показывающая скопление жидкости рядом с кончиком катетера VPS. A, B КТ брюшной полости, показывающая скопление жидкости рядом с кончиком катетера VPS.
A, B КТ брюшной полости, показывающая скопление жидкости рядом с кончиком катетера VPS.
Таким образом, была заподозрена перитонеальная псевдокиста вокруг VPS, вызывающая непроходимость желудка, и была выполнена экстренная лапаротомия. Большое образование было локализовано в левой верхней части живота между желудком и поперечной брыжейкой ободочной кишки, точно в сальниковой сумке (рис. 3). После удаления диффузных спаек брюшной полости кистозная масса вскрылась и было слито 1500 мл прозрачной жидкости. Часть стенки псевдокисты, состоящую из задней стенки желудка и брыжейки толстой кишки, была полностью резецирована, чтобы открыть псевдокисту (рис. 4).Дистальный конец VPS поместили внутрь массы. Таким образом, диагностирована псевдокиста как осложнение ВПС. После исследования спинномозговой жидкости от кончика катетера VPS мы заменили катетер VPS на другое место в брюшной полости. Гистопатологическое исследование резецированного препарата выявило фиброзную ткань с инфильтрацией воспалительных клеток. После операции аппетит восстановился, выписан на 8-е сутки после операции в хорошем состоянии. Послеоперационное течение 4 месяцев после последней операции протекало без осложнений.
После операции аппетит восстановился, выписан на 8-е сутки после операции в хорошем состоянии. Послеоперационное течение 4 месяцев после последней операции протекало без осложнений.
Рисунок 3
Интраоперационная находка с большой массой, расположенной в области сальниковой сумки.
Рисунок 4
Интраоперационная находка, представляющая внутреннюю полость псевдокисты. Стенка псевдокисты состоит из задней стенки желудка (стрелка) и брыжейки толстой кишки.
Результаты анализа жидкости были аналогичны результатам анализа спинномозговой жидкости, с отрицательными посевами и отсутствием микробной флоры.
Обсуждение
VPS — наиболее распространенная процедура лечения гидроцефалии; тем не менее, это не без осложнений. Псевдокиста спинномозговой жидкости в брюшной полости — редкое, но потенциально опасное для жизни осложнение установки VPS. Он выглядит как тонкостенная кистозная масса вокруг кончика шунта, заполненная спинномозговой жидкостью. Стенка состоит из фиброзной ткани без эпителиальной выстилки. Основные механизмы, участвующие в формировании псевдокисты спинномозговой жидкости, остаются неизвестными; однако воспаление, стерильное или инфекционное, обычно рассматривается как главный причинный фактор [1].В нашем случае имелась диффузная абдоминальная адгезия, предполагающая наличие в анамнезе абдоминальной инфекции.
Он выглядит как тонкостенная кистозная масса вокруг кончика шунта, заполненная спинномозговой жидкостью. Стенка состоит из фиброзной ткани без эпителиальной выстилки. Основные механизмы, участвующие в формировании псевдокисты спинномозговой жидкости, остаются неизвестными; однако воспаление, стерильное или инфекционное, обычно рассматривается как главный причинный фактор [1].В нашем случае имелась диффузная абдоминальная адгезия, предполагающая наличие в анамнезе абдоминальной инфекции.
Симптомами псевдокист спинномозговой жидкости брюшной полости у взрослых пациентов являются боль в животе, вздутие живота и пальпируемое образование в брюшной полости. Таким образом, у взрослых преимущественно симптомы со стороны брюшной полости. С другой стороны, у педиатрических пациентов чаще встречаются симптомы нарушения работы шунта, такие как головная боль, тошнота и рвота [9].
КТ указывает на окончательный диагноз псевдокисты спинномозговой жидкости в брюшной полости, выявляя большое скопление жидкости, ограниченное тонкой стенкой, примыкающей к кончику катетера.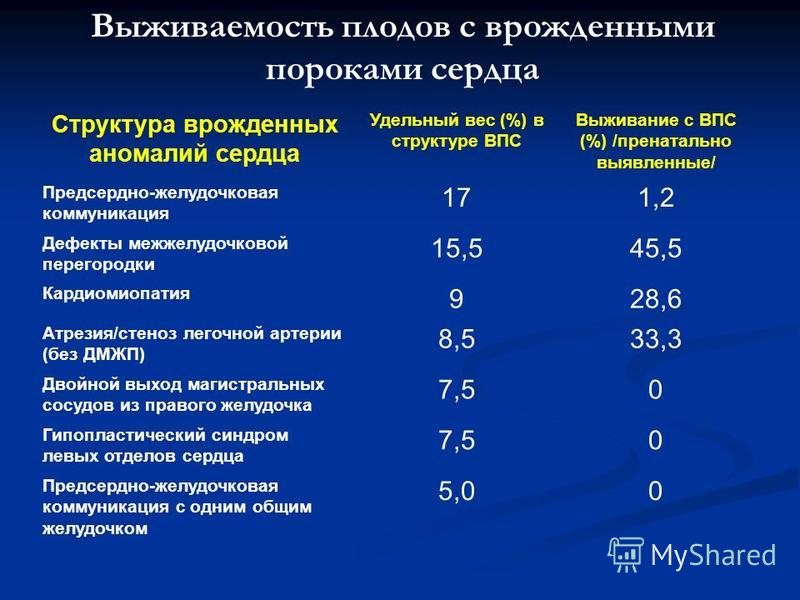 Дифференциальный диагноз кистозной массы брюшной полости включает абдоминальный абсцесс, лимфоцеле, серому, кистозную лимфангиому, кистозную мезотелиому, брыжеечную кисту, доброкачественную кистозную тератому, кистозную веретено-клеточную опухоль, псевдокисту поджелудочной железы и дупликационную кисту [2]. В нашем случае отсутствие инфекционных симптомов и отсутствие каких-либо воспалительных изменений в окружающих тканях делает диагноз абсцесса маловероятным. Кроме того, отсутствие в анамнезе заболеваний поджелудочной железы делает диагноз псевдокисты поджелудочной железы маловероятным.Предоперационный диагноз псевдокисты вокруг VPS был сделан с учетом клинических условий и связи кисты с VPS.
Дифференциальный диагноз кистозной массы брюшной полости включает абдоминальный абсцесс, лимфоцеле, серому, кистозную лимфангиому, кистозную мезотелиому, брыжеечную кисту, доброкачественную кистозную тератому, кистозную веретено-клеточную опухоль, псевдокисту поджелудочной железы и дупликационную кисту [2]. В нашем случае отсутствие инфекционных симптомов и отсутствие каких-либо воспалительных изменений в окружающих тканях делает диагноз абсцесса маловероятным. Кроме того, отсутствие в анамнезе заболеваний поджелудочной железы делает диагноз псевдокисты поджелудочной железы маловероятным.Предоперационный диагноз псевдокисты вокруг VPS был сделан с учетом клинических условий и связи кисты с VPS.
Сообщается, что время между последней операцией по VPS и забором спинномозговой жидкости из брюшной полости составляет от 3 недель до 10 лет [4]. Недавно Pernas et al . [2] и Sena et al . [1] сообщили о случае формирования абдоминальной псевдокисты через 15 лет после установки VPS, оба из которых кажутся наиболее продолжительными периодами, о которых ранее сообщалось в английской литературе . В нашем случае последняя операция по VPS была выполнена за 21 год до появления текущих симптомов, и в этот период никаких других операций на брюшной полости не проводилось. Это, по-видимому, самый длинный период, о котором сообщалось до настоящего времени в английской литературе.
В нашем случае последняя операция по VPS была выполнена за 21 год до появления текущих симптомов, и в этот период никаких других операций на брюшной полости не проводилось. Это, по-видимому, самый длинный период, о котором сообщалось до настоящего времени в английской литературе.
Лечение спинномозговой жидкости в брюшной полости кажется спорным. Поэтому описаны многие алгоритмы лечения, такие как лапаротомия с широким иссечением кистозных стенок, парацентез и аспирация кистозной жидкости, аспирация псевдокисты под контролем КТ или ультразвуком.В данном случае была выполнена диагностическая лапаротомия и иссечение кистозных стенок с дренажем жидкости. Недавно появились сообщения о лапароскопическом лечении, которое является полезным инструментом [10]; однако в нашем случае использование этого средства показалось невозможным из-за диффузного спаечного процесса в брюшной полости.
Гидроцефалия после субарахноидального кровоизлияния: патофизиология, диагностика и лечение
Гидроцефалия (HCP) — частое осложнение у пациентов с субарахноидальным кровоизлиянием. В этом обзоре мы подводим итоги передовых исследований в области HCP и обсуждаем понимание молекулярных источников HCP, а также разработку диагнозов и средств лечения HCP после САК.Сообщалось, что воспаление, апоптоз, аутофагия и окислительный стресс являются важными причинами HCP, а хорошо известные молекулы, включая трансформирующий фактор роста, матриксные металлопротеиназы и железо, в конечном итоге приводят к фиброзу и блокировке HCP. Потенциальные лекарственные средства для HCP все еще находятся в доклиническом состоянии, и хирургическое вмешательство является наиболее распространенной и эффективной терапией, несмотря на соответствующие риски различных хирургических методов, включая фенестрацию lamina terminalis, желудочково-перитонеальное шунтирование и пояснично-перитонеальное шунтирование.HCP остается недугом, который нельзя игнорировать, и даже с помощью различных решений медицинское сообщество все еще пытается понять и решить, почему и как оно развивается, и, соответственно, улучшить прогноз для этих пациентов с HCP.
В этом обзоре мы подводим итоги передовых исследований в области HCP и обсуждаем понимание молекулярных источников HCP, а также разработку диагнозов и средств лечения HCP после САК.Сообщалось, что воспаление, апоптоз, аутофагия и окислительный стресс являются важными причинами HCP, а хорошо известные молекулы, включая трансформирующий фактор роста, матриксные металлопротеиназы и железо, в конечном итоге приводят к фиброзу и блокировке HCP. Потенциальные лекарственные средства для HCP все еще находятся в доклиническом состоянии, и хирургическое вмешательство является наиболее распространенной и эффективной терапией, несмотря на соответствующие риски различных хирургических методов, включая фенестрацию lamina terminalis, желудочково-перитонеальное шунтирование и пояснично-перитонеальное шунтирование.HCP остается недугом, который нельзя игнорировать, и даже с помощью различных решений медицинское сообщество все еще пытается понять и решить, почему и как оно развивается, и, соответственно, улучшить прогноз для этих пациентов с HCP.
1. Введение
Гидроцефалия (HCP) — серьезное и частое осложнение клинического течения субарахноидального кровоизлияния (SAH), которое до сих пор остается неопределенным. В зависимости от фона и клинических обстоятельств сообщалось о широком диапазоне заболеваемости HCP у пациентов с САК от 6 до 67%; в самых последних исследованиях этот процент составляет около 20% ~ 30%.
HCP встречается примерно у одной пятой пациентов в раннем течении (острое в первые 3 дня или подострое в течение 4-14 дней) САК, в то время как хроническая гидроцефалия возникает у 10-20% пациентов позже, в ходе САК (через 2 недели). Независимо от наступившего периода, HCP ухудшает неврологическую функцию пациента и приводит к ухудшению функциональных исходов, особенно при внутрижелудочковом кровоизлиянии (ВЖК), даже если первичная САК была пролечена [1]. Напротив, лучшие результаты достигаются, если САК диагностируется на ранней стадии и проводится лечение.
Несмотря на отсутствие удовлетворительного профилактического лечения, было разработано несколько терапевтических методов для лечения гидроцефалии или минимизации необходимости постоянного шунтирования. Интраоперационно проводится фенестрация lamina terminalis (LTF) с тщательным промыванием тромбов из желудочков и цистерн с целью восстановления нормального кровотока спинномозговой жидкости (CSF), а также для устранения нарушений, вызванных сгустками крови и их побочными продуктами. . В послеоперационном периоде временный внутрижелудочковый или поясничный дренаж — это метод, используемый для переноса реабсорбции спинномозговой жидкости.Пациентам без внутрижелудочковых катетеров или люмбальных дренажей, но с постоянными симптомами, необходимы серийные люмбальные пункции. Несмотря на эти усилия по предотвращению возникновения, значительному числу пациентов требуется постоянное шунтирование спинномозговой жидкости.
Интраоперационно проводится фенестрация lamina terminalis (LTF) с тщательным промыванием тромбов из желудочков и цистерн с целью восстановления нормального кровотока спинномозговой жидкости (CSF), а также для устранения нарушений, вызванных сгустками крови и их побочными продуктами. . В послеоперационном периоде временный внутрижелудочковый или поясничный дренаж — это метод, используемый для переноса реабсорбции спинномозговой жидкости.Пациентам без внутрижелудочковых катетеров или люмбальных дренажей, но с постоянными симптомами, необходимы серийные люмбальные пункции. Несмотря на эти усилия по предотвращению возникновения, значительному числу пациентов требуется постоянное шунтирование спинномозговой жидкости.
В этом обзоре мы подводим итоги исследований HCP, вызванных САК, и обсуждаем этиологию, диагностику и лечение. С развитием этой области, благодаря усилиям многих исследователей, вопросы и проблемы лечения и профилактики остаются нерешенными и применимыми в клинической практике.
2. Этиология
Около трети пациентов, поступивших с САК, имеют постоянное отведение спинномозговой жидкости. В крупномасштабном метаанализе сообщается, что доля больных шунт-зависимыми HCP составляет 17,4% [2]. Пациенты с острым течением, госпитальными осложнениями, ВЖК, плохим статусом госпитализации, повторным кровотечением, локализацией разрыва аневризмы и возрастом ≥ 60 лет сообщили о более высоком риске шунтирующей зависимости [3-5].
Достижения и прогресс в изучении гидроцефалии неизбежно не позволяют понять весь механизм HCP после SAH.Теории, упомянутые выше, отвечают на вопросы исследователей примерно через повреждение арахноидальных грануляций (AG), а также ткани мозга. Похоже, что механизмы патогенеза острых и хронических HCP взаимосвязаны. Общепринято, что воспалительная реакция (хроническая или острая) и связанный с ней процесс фиброза препятствуют быстрому оттоку спинномозговой жидкости к пазухам окончательно из АГ. Помимо пролиферации лептоменингеальных клеток (рис. 1), исследования в настоящее время в основном нацелены на патологическую обструкцию АГ, включая механическую блокировку и фиброз АГ (Рисунок 2).Исследователи долгое время работали над ослаблением этого патогенеза, чтобы иметь дело с HCP [6, 7].
1), исследования в настоящее время в основном нацелены на патологическую обструкцию АГ, включая механическую блокировку и фиброз АГ (Рисунок 2).Исследователи долгое время работали над ослаблением этого патогенеза, чтобы иметь дело с HCP [6, 7].
Исследователи в основном сосредоточены на патофизиологии повреждения головного мозга после САК, а распространенные теории включают воспаление, апоптоз, аутофагию и окислительный стресс (рис. 3). Вазоспазм хориоидальной артерии, вероятно, возникает из-за стенозирования водопровода и повреждения эпендимных клеток после САК [8]. Деваскуляризация паренхимы головного мозга, вероятно, является результатом последовательного спазма сосудов SAH и, как подтверждено, индуцирует пролиферацию нервных стволовых клеток, направляемую клетками глии [9].Глиоциты, в отличие от других органов тела, играют деструктивную и лечебную роль и выделяют большое количество цитокинов, когда мозг страдает различными поражениями [10]. Считается, что матриксные металлопротеиназы являются решающими и универсальными участниками в разрушении гематоэнцефалического барьера (ГЭБ) [11], и было подтверждено, что тканевые ингибиторы матриксных металлопротеиназ обладают гомологичным защитным действием при вазоспазме после САК для целостности ГЭБ у пациентов с апоплексическим поражением. [12]. Кроме того, исследователи обнаружили, что вегетативная нервная система играет вспомогательную роль в воспалительной реакции и может способствовать разрушению ГЭБ, который структурно и функционально состоит из глиальных клеток [13].Уровни белка фактора роста эндотелия сосудов повышаются и ограничивают рост аномальных кровеносных сосудов [14]. Впоследствии гиперсекреция спинномозговой жидкости вызывает или усугубляет нарушение кровообращения и в конечном итоге приводит к HCP.
[12]. Кроме того, исследователи обнаружили, что вегетативная нервная система играет вспомогательную роль в воспалительной реакции и может способствовать разрушению ГЭБ, который структурно и функционально состоит из глиальных клеток [13].Уровни белка фактора роста эндотелия сосудов повышаются и ограничивают рост аномальных кровеносных сосудов [14]. Впоследствии гиперсекреция спинномозговой жидкости вызывает или усугубляет нарушение кровообращения и в конечном итоге приводит к HCP.
Острый HCP вносит свой вклад в причины ранних травм головного мозга [15], обычно считающихся некоммуникативными (или обструктивными) типами, и в значительной степени объясняется массовым эффектом или образованием тромбов в желудочках и водоводах, препятствующих оттоку спинномозговой жидкости. свода черепа.Кроме того, считается, что воспаление является решающим биомолекулярным механизмом, который вызывает острую HCP через нарушение ГЭБ [16]. Тем не менее, недавнее исследование продемонстрировало радиологически схожие характеристики между острыми и хроническими HCP, что указывает на частично схожий патогенез. Фазоконтрастная МРТ показала, что хронический HCP имеет коммуникативную форму; однако у некоторых из этих людей все еще развивается острый ГП после САК, несмотря на отсутствие ВЖК или сгустка крови в желудочках [17, 18].Параллельные параметры потока спинномозговой жидкости, обнаруженные в их исследованиях, также показали, что обструкция не может быть единственным инициатором острого HCP. Кроме того, Kanat et al. постулировали, что сгустки крови играют начальную роль в запуске гиперсекреции спинномозговой жидкости и фиброза паутинных грануляций, что приводит к долгосрочным коммуникативным HCP, а не просто к обструкции или стенозу водопровода [19]. Будь то коммуникативный, обструктивный или патофизиологический гибрид, он может напрямую повлиять на решение о лечении и соответствующий прогноз этих пациентов.Несмотря на многие открытия и достижения, необходимы дополнительные доказательства, чтобы раскрыть и объяснить этиологию острого HCP после кровотечения.
Фазоконтрастная МРТ показала, что хронический HCP имеет коммуникативную форму; однако у некоторых из этих людей все еще развивается острый ГП после САК, несмотря на отсутствие ВЖК или сгустка крови в желудочках [17, 18].Параллельные параметры потока спинномозговой жидкости, обнаруженные в их исследованиях, также показали, что обструкция не может быть единственным инициатором острого HCP. Кроме того, Kanat et al. постулировали, что сгустки крови играют начальную роль в запуске гиперсекреции спинномозговой жидкости и фиброза паутинных грануляций, что приводит к долгосрочным коммуникативным HCP, а не просто к обструкции или стенозу водопровода [19]. Будь то коммуникативный, обструктивный или патофизиологический гибрид, он может напрямую повлиять на решение о лечении и соответствующий прогноз этих пациентов.Несмотря на многие открытия и достижения, необходимы дополнительные доказательства, чтобы раскрыть и объяснить этиологию острого HCP после кровотечения.
Напротив, у значительного числа пациентов с хроническим HCP не наблюдается повышенного внутричерепного давления (ВЧД), и с многочисленными доказательствами, появляющимися в пути фиброза, существует общее мнение, что хронические HCP относятся к «коммуникативному» типу, связанному с фиброзом. и спайки лептоменингеальных и паутинных грануляций. Долгое время считалось, что продукты крови и трансформирующий фактор роста играют важную роль в патофизиологических процессах после САК, включая хронические HCP.Внутрижелудочковое введение железа (хлорида железа или хлорида железа) или лизированных эритроцитов аналогичным образом может привести к HCP у крыс [20]. Кроме того, Strahle et al. также обнаружил гибель клеток в модели новорожденных крыс через патологические секции [21], что свидетельствует об очень критических эффектах в механизмах. Кроме того, некроз клеток мозга и нарушение ГЭБ, индуцированное железом, также изображено у крыс [22], что делает это предположение более красноречивым. Учитывая все предыдущие исследования, доклинические исследования подтверждают идею о том, что окисление объясняет точные механизмы патогенеза, вызванного железом [23], первоначально названного «ферроптозом» [24].Но необходимы дополнительные доказательства для дальнейшего раскрытия процессов и связей между «ферроптозом» и HCP, и мы стремимся к убедительному клиническому испытанию, которое подтвердит, будет ли удаление сгустка крови или субарахноидальный лаваж крови на начальной стадии САК определенным положительным результатом.
и спайки лептоменингеальных и паутинных грануляций. Долгое время считалось, что продукты крови и трансформирующий фактор роста играют важную роль в патофизиологических процессах после САК, включая хронические HCP.Внутрижелудочковое введение железа (хлорида железа или хлорида железа) или лизированных эритроцитов аналогичным образом может привести к HCP у крыс [20]. Кроме того, Strahle et al. также обнаружил гибель клеток в модели новорожденных крыс через патологические секции [21], что свидетельствует об очень критических эффектах в механизмах. Кроме того, некроз клеток мозга и нарушение ГЭБ, индуцированное железом, также изображено у крыс [22], что делает это предположение более красноречивым. Учитывая все предыдущие исследования, доклинические исследования подтверждают идею о том, что окисление объясняет точные механизмы патогенеза, вызванного железом [23], первоначально названного «ферроптозом» [24].Но необходимы дополнительные доказательства для дальнейшего раскрытия процессов и связей между «ферроптозом» и HCP, и мы стремимся к убедительному клиническому испытанию, которое подтвердит, будет ли удаление сгустка крови или субарахноидальный лаваж крови на начальной стадии САК определенным положительным результатом. исход у этих пациентов.
исход у этих пациентов.
3. Диагностика
По сравнению с обнаружением хронических HCP, возникающих во время или после курса САК, клинически сложнее диагностировать острые HCP, которые могут вводить в заблуждение или скрывать САК, сопровождающиеся головной болью, тошнотой или нарушением сознания.Поскольку это связано с анатомической дилатацией желудочков, его распознавание в первую очередь основывается на рентгенологических методах, особенно на компьютерной томографии (рис. 4). Индекс бикаудата (BCI) и относительный индекс бикаудата (RBCI) (рассчитанный, соответственно, в разных возрастных группах) были общепринятыми и широко применяемыми в качестве диагностических критериев со времени исследования Gijn и его коллег в 1980-х годах (как показано на рисунке 5). ) [17, 25–28]. И коллеги пришли к выводу, что если не выявить своевременно до того, как RBCI> 1,6, попытки провести дренажную операцию могут быть напрасными из-за неулучшенных результатов [29].Тем не менее, форма и форма расширенных желудочков у пациентов сильно различаются, и авторы полагают, что точнее измерить объем желудочков и рассчитать скорость расширения [30].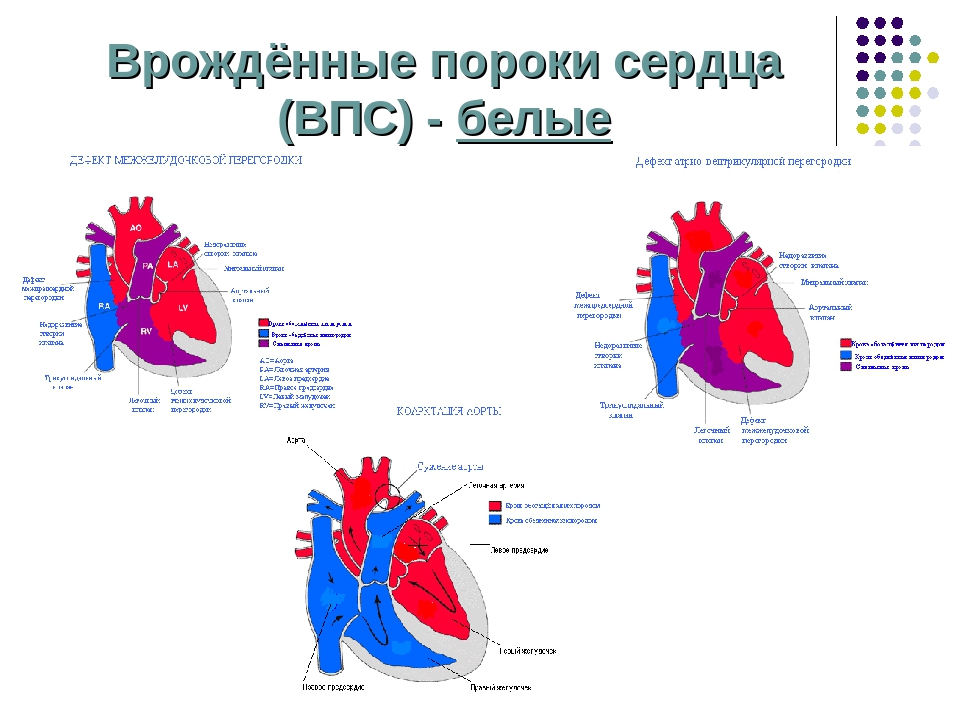
Используются достижения в области радиологической визуализации и исследований, а также полезные методы, такие как диффузионно-тензорное изображение (DTI) [31] и изображение диффузного эксцесса (DKI) [32], но КТ по-прежнему является самым быстрым и эффективным диагностическим методом. для HCP. Более того, МРТ дает гораздо больше информации о том, повреждена ли паренхима головного мозга дилатацией желудочков и каким образом.Более того, мы можем точно наблюдать морфологию водопровода и динамику спинномозговой жидкости, а затем узнать, заблокирован он или стенозирован [17, 18]. Эти расширенные обследования позволяют получить более подробную информацию о пациентах, чем компьютерная томография, что, вероятно, облегчит раскрытие этиологии и патогенеза HCP. Одно исследование продемонстрировало как измененную микроструктуру, так и движение молекул воды в нервных аксонах и внутри- или внеклеточном пространстве у пациентов с идиопатической гидроцефалией нормального давления (iNPH), вызванной DTI и DKI [33].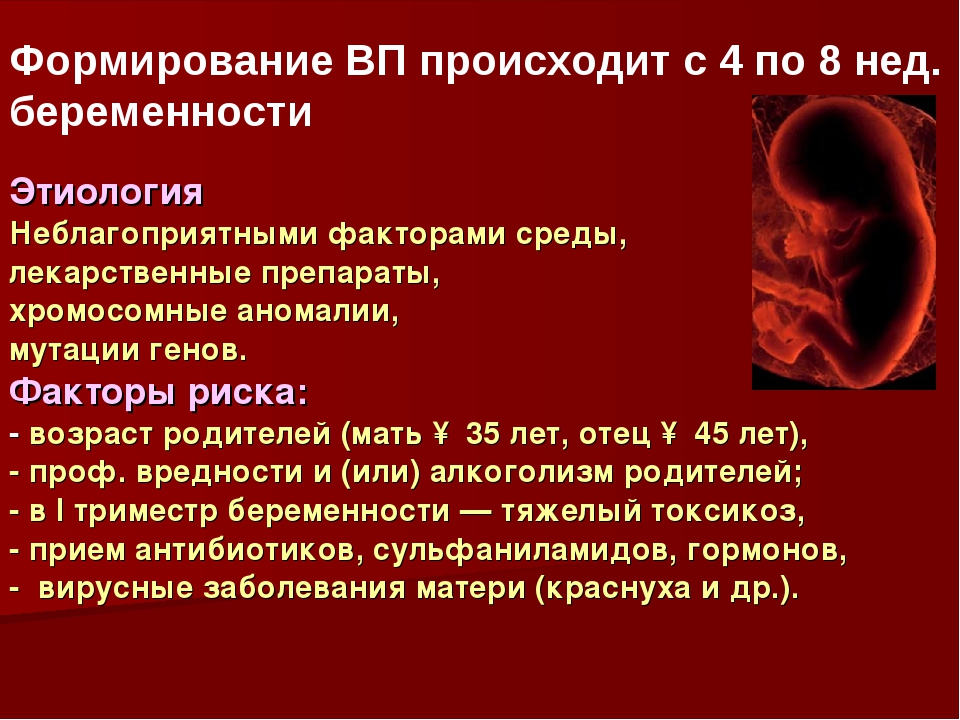 Эти данные могут быть полезны при оценке повреждения мозга после САК и HCP [34].
Эти данные могут быть полезны при оценке повреждения мозга после САК и HCP [34].
4. Прогностические факторы
Значительное число пациентов подвержено риску шунт-зависимого HCP после САК. Более раннее отведение спинномозговой жидкости приводит к меньшему повреждению паренхимы мозга. Существуют трудности при принятии решения о том, следует ли периодически запускать дренаж или выполнять операцию, чтобы отвести СМЖ, секретируемую за пределы абсорбции. Важно и полезно прогнозировать шунтирующую зависимость, выходящую за рамки клинических проявлений [35].Сообщалось о пациентах с острым течением HCP, госпитальными осложнениями, ВЖК, высоким баллом по шкале Ханта и Гесса (или низким исходным значением шкалы комы Глазго или высоким баллом Фишера), повторным кровотечением, локализацией разрыва аневризмы в задней части кровообращения и возрастом ≥ 60 лет. подвергаться более высокому риску шунтирующей зависимости [3–5]. В других исследованиях сообщалось о столь же более высоком риске HCP при аневризме заднего кровообращения, ВЖК, большем объеме кровотечения и в пожилом возрасте [4, 5, 28, 36]. Зависимость от таких факторов, как экономика, медицинское развитие и методы борьбы с разрывом аневризмы, также приводят к различным случаям шунт-зависимых HCP [5].
Зависимость от таких факторов, как экономика, медицинское развитие и методы борьбы с разрывом аневризмы, также приводят к различным случаям шунт-зависимых HCP [5].
Кроме того, некоторые исследователи пытаются найти точный и измеримый способ предвидеть необходимость постоянного шунтирования. В исследовании Hoh et al. Было обнаружено, что симптоматические аневризмы, вероятно, больше и с большей вероятностью вызывают обструктивную гидроцефалию, которая может потребовать дренирования [37]. Ямада и др. в 2012 г. представила дискриминантную функцию, необходимую для определения потребности в VPS после SAH [38]. Чувствительность и специфичность составили 85,3% и 87,2% соответственно, что достаточно высоко для прогнозирования независимости от шунта.Это способствует более раннему хирургическому вмешательству и предотвращает повреждение, вызванное вентрикуломегалией. Для разработки функциональной модели, более клинически применимой и пригодной для использования, необходимо больше доказательств и случаев.
5. Лечение
5.1. Лечебные процедуры
Обычные методы лечения медицинских работников включают, в основном, ацетазоламид и маннит. Многолетняя клиническая практика свидетельствует о том, что лекарства не снижают вероятность последующего хирургического дренирования с дополнительными побочными эффектами.Сейчас его применяют в надежде отложить операцию по установке шунта и предоперационную подготовку.
Наряду с постепенным раскрытием механизмов HCP в последние годы, некоторые экспериментальные агенты оказались потенциально эффективными в улучшении исходов пациентов [7, 39]. Сообщается, что миноциклин эффективен в уменьшении глиоза и задержке развития HCP на модели крыс [40]. Декорин может быть полезным при длительном лечении HCP [7]. С другой стороны, у новорожденных крыс с кровотечением из зародышевого матрикса дефероксамин ослабляет долгосрочные осложнения, включая постгеморрагическое расширение желудочков [41].
SAH имеет аналогичные механизмы с внутримозговым кровоизлиянием и способствует пагубным процессам, включая HCP и апоптоз мозга. В связи с этим у них могут быть похожие методы лечения. Трихостатин А (TSA), ингибитор гистондеацетилазы, который усиливает аутофагию, способствует облегчению апоптоза нейронов, улучшению неврологической функции и ослаблению травмы головного мозга после САК [42], потенциально приводя к более слабому фиброзу мозговых оболочек и лучшим результатам у пациентов с HCP. .
В связи с этим у них могут быть похожие методы лечения. Трихостатин А (TSA), ингибитор гистондеацетилазы, который усиливает аутофагию, способствует облегчению апоптоза нейронов, улучшению неврологической функции и ослаблению травмы головного мозга после САК [42], потенциально приводя к более слабому фиброзу мозговых оболочек и лучшим результатам у пациентов с HCP. .
5.2. Хирургическое лечение
Несмотря на довольно высокую частоту осложнений, около 50%, неэффективность шунтирования в течение 1 года, около 30%, и ряд пациентов, нуждающихся во вторичной операции для ревизии катетера, операция по-прежнему является предпочтительным методом лечения для HCP. . Целью хирургического лечения является улучшение нейрофункции за счет отвода спинномозговой жидкости, а не восстановление исходной структуры головного мозга. Хирургический протокол различается в зависимости от типа гидроцефального поражения и состояния отдельных пациентов.Оптимальное время для хирургического лечения остается спорным. В таблице 1 сравниваются между собой три преобладающих хирургических метода лечения HCP.
В таблице 1 сравниваются между собой три преобладающих хирургических метода лечения HCP.
| ||||||||||||||||||||||||||||||||||||||||||||||
5.
 2.1. Lamina Terminalis Fenestration (LTF)
2.1. Lamina Terminalis Fenestration (LTF)
Сообщается, что у них меньше осложнений и они благоприятны для уменьшения шунт-зависимых случаев [43–45], хирурги склонны запускать LTF во время хирургической операции при острой САК после промывания тромбов в субарахноидальном пространстве, чтобы избежать постгеморрагическая обструкция оттока ликвора. Однако некоторые другие исследователи подвергли сомнению эффективность LTF в снижении шунтирующей зависимости пациентов [46]. Как упоминалось в нашем отрывке о патогенезе острого HCP, LTF не прекращает и не задерживает фиброзный процесс лептоменингов и паутинных грануляций, следовательно, возможно, улучшая динамику CSF.Авторы по-прежнему с подозрением относятся к его эффектам и долгосрочным результатам, в основном к шунтирующей заболеваемости у пациентов с острыми заболеваниями, особенно у тех, кто страдает от общения с HCP без ранних диагностических данных.
5.2.2. Желудочно-перитонеальное шунтирование (VPS)
VPS в настоящее время является наиболее широко применяемым хирургическим методом для лечения HCP. Согласно систематическому обзору с участием 41 789 пациентов с аневризмой САК в 66 опубликованных исследованиях, общая частота внедрения VPS составила 12,7% [47]; 31.2% пациентов нуждались в VPS при остром HCP после аневризматической САК, независимо от того, было ли это после эндоваскулярного или хирургического лечения [48].
Согласно систематическому обзору с участием 41 789 пациентов с аневризмой САК в 66 опубликованных исследованиях, общая частота внедрения VPS составила 12,7% [47]; 31.2% пациентов нуждались в VPS при остром HCP после аневризматической САК, независимо от того, было ли это после эндоваскулярного или хирургического лечения [48].
Однако, несмотря на то, что это наиболее часто применяемый хирургический протокол, VPS несет неизбежно высокий риск осложнений и неудач. 10-летнее наблюдение среди 14 455 человек, перенесших VPS, показало, что 32% имели кумулятивные осложнения через 5 лет [49]. Другое клиническое исследование показало, что 51,9% пациентов, принимавших VPS, нуждались в ревизии шунта [50].Возникновение осложнений в основном связано с имплантацией катетера и сообщением между желудочками, цистернами и энтероцелией. Способ, которым хирурги имплантируют трубку, и то, как они устанавливают параметры шлюза для спинномозговой жидкости, играют важную роль в определении результатов лечения пациентов.
5.2.3. Пояснично-перитонеальное шунтирование (LPS)
LPS обычно выполняется в качестве дополнительного решения для пациентов, страдающих коммуникативными HCP, которые не подходят для VPS.По сравнению с VPS, LPS включает гораздо более короткий катетер, следовательно, более легкие осложнения, такие как чрезмерное шунтирование, колебания внутричерепного давления, щелевые желудочки и инфекция. С другой стороны, LPS имеет более узкую область применения для лечения HCP.
6. Заключение
Возникновение HCP после SAH имеет различные клинические характеристики и загадочные биомолекулярные механизмы, которые до сих пор не изучены. Несмотря на то, что некоторые исследования продемонстрировали, что патофизиология включает фиброз и обструкцию паутинной оболочки, соответствующие факторы риска, обобщенные предшественниками, по-прежнему ограниченно способствуют предотвращению HCP.Некоторые хирургические методы, включая LTF, VPS и LPS, доступны, но недостаточны для предотвращения или лечения гидроцефалии.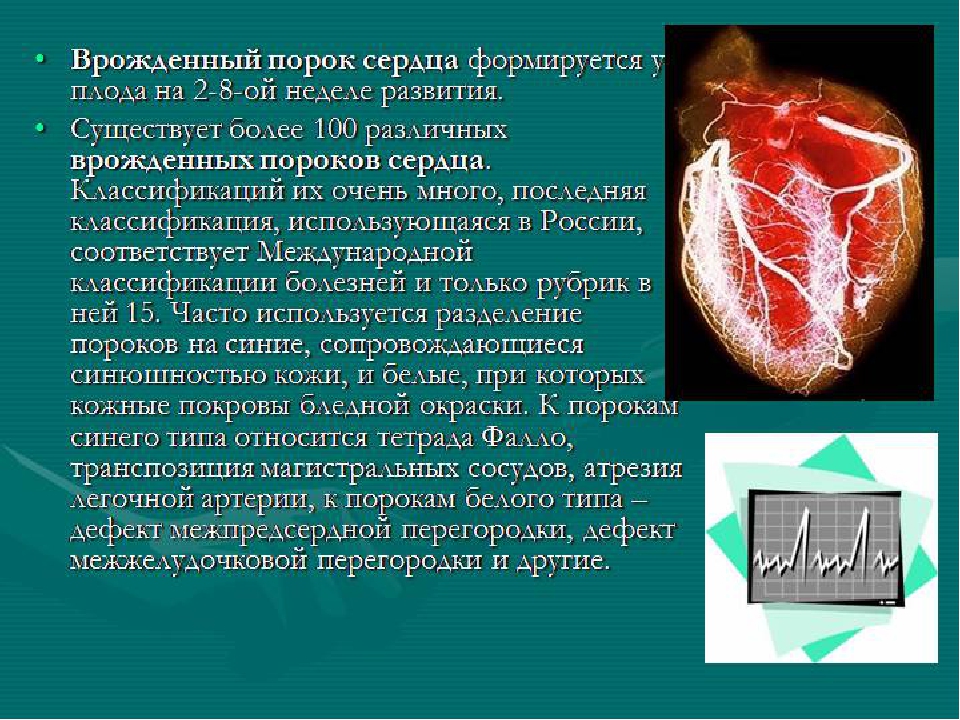 Однако сообщество медицинских исследователей продолжает открывать задействованные механизмы и более эффективные и полезные методы лечения пациентов.
Однако сообщество медицинских исследователей продолжает открывать задействованные механизмы и более эффективные и полезные методы лечения пациентов.
Конкурирующие интересы
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Вклад авторов
Д-р Шэн Чен и д-р Цзиньци Луо внесли равный вклад в работу над статьей.
Финансирование
Это исследование было поддержано грантами от Национального фонда естественных наук Китая (81500992) и Фонда естественных наук провинции Чжэцзян (LQ16H0
) и ключевого проекта медицины и здравоохранения провинции Чжэцзян (2016RCA015), предоставленного Шэн Чену.
Гидроцефалия нормального давления, шунт NPH
Обзор
Гидроцефалия с нормальным давлением (ГНД), несмотря на свое название, является ненормальным состоянием. Это происходит у пожилых людей, когда спинномозговая жидкость (СМЖ) накапливается в желудочках головного мозга. Увеличенные участки растягивают и повреждают мозг, вызывая симптомы легкой деменции, затруднения при ходьбе и проблемы с мочеиспусканием. НПХ часто не лечат, потому что он может напоминать болезнь Альцгеймера или Паркинсона. Но если диагноз поставлен на ранней стадии, NPH можно лечить с помощью шунтирующего устройства, которое выводит жидкость из желудочков и возвращает их к нормальному размеру.
Увеличенные участки растягивают и повреждают мозг, вызывая симптомы легкой деменции, затруднения при ходьбе и проблемы с мочеиспусканием. НПХ часто не лечат, потому что он может напоминать болезнь Альцгеймера или Паркинсона. Но если диагноз поставлен на ранней стадии, NPH можно лечить с помощью шунтирующего устройства, которое выводит жидкость из желудочков и возвращает их к нормальному размеру.
Что такое гидроцефалия при нормальном давлении?
Гидроцефалия с нормальным давлением (ГНД) — это прогрессирующее состояние, которое возникает, когда в головном мозге слишком много спинномозговой жидкости (ЦСЖ).Обычно спинномозговая жидкость образуется в двух больших полостях головного мозга, называемых желудочками.
Рисунок 1. Спинномозговая жидкость (синяя) вырабатывается сосудистым сплетением внутри желудочков и постоянно поглощается и пополняется. Он циркулирует из желудочков в субарахноидальные пространства, окружающие головной и спинной мозг. ЦСЖ поглощается паутинными ворсинками в верхней части мозга.
ЦСЖ поглощается паутинными ворсинками в верхней части мозга.
Жидкость течет внутри и вокруг головного и спинного мозга, чтобы смягчить и защитить их от травм (рис.1). Вены наверху головы поглощают спинномозговую жидкость в кровоток со скоростью около 30 грамм в час. НПХ возникает, когда нормальный объем спинномозговой жидкости не всасывается достаточно быстро, в результате чего жидкость собирается в желудочках.
Рис. 2. При гидроцефалии с нормальным давлением избыток спинномозговой жидкости увеличивает желудочки, растягивая головной мозг и вызывая симптомы.
По мере того, как спинномозговая жидкость медленно накапливается в желудочках, они увеличиваются и растягивают мозг (рис. 2). Это может повредить близлежащие нервные волокна, которые контролируют ноги, мочевой пузырь и память.
НПХ трудно диагностировать, потому что он может напоминать другие, более частые причины деменции или болезни Паркинсона. При ранней диагностике НПХ можно лечить шунтирующим устройством, которое сливает лишнюю жидкость и устраняет некоторые симптомы.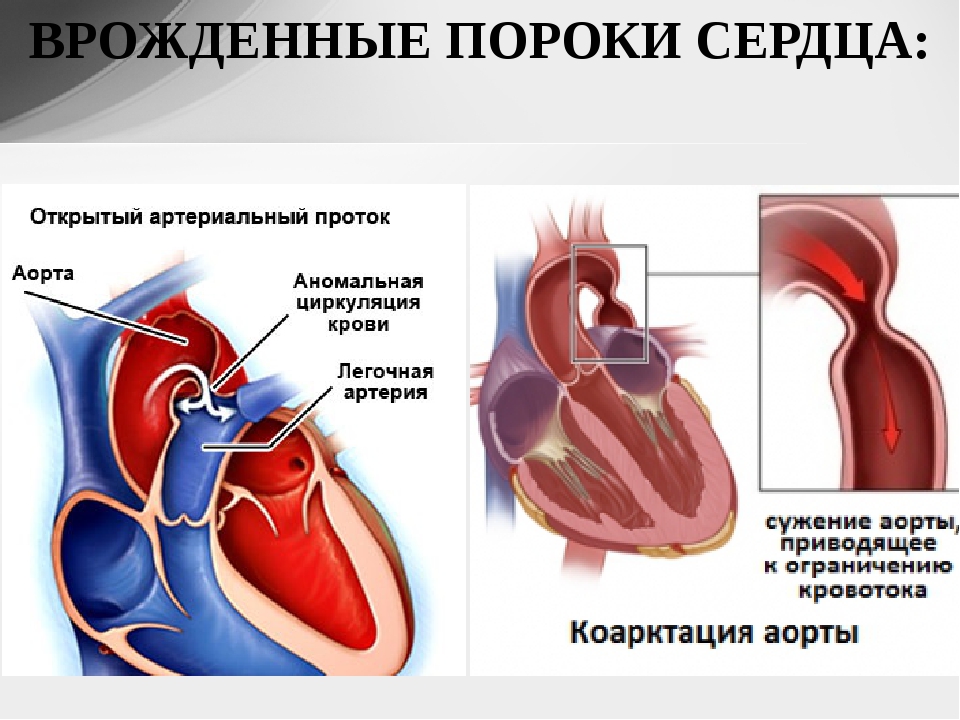
Какие симптомы?
- Трудность при ходьбе проявляется в неустойчивой или шаркающей походке, ощущении, что ноги прилипают к полу и не могут подняться.
- Легкая деменция может включать потерю памяти, забывчивость и снижение концентрации внимания.
- Проблемы с мочеиспусканием варьируются от частых и неотложных до фактического недержания мочи.
У человека с ГПН обычно больше проблем с ходьбой, чем с памятью, и симптомы проявляются в течение относительно короткого времени. Человек, который несколько лет находится в доме престарелых с тяжелой деменцией, но может достаточно хорошо ходить, вероятно, не болен НПХ.
Кто пострадал?
Считается, что на
НПХ приходится 5% всех случаев деменции.Заболевание в первую очередь поражает пожилых людей, и по мере того, как население живет дольше, заболеваемость НПХ увеличивается.
Каковы причины?
НПХ может развиться по неизвестной причине или в результате закрытой черепно-мозговой травмы, операции на головном мозге, менингита или разрыва аневризмы.
Как ставится диагноз?
Точный диагноз важен, потому что у людей с НПХ, которые не получают лечения, вероятно, будет и дальше снижаться.Они также могут потерять независимость и качество жизни неоправданно.
Диагностика НПХ затруднена, потому что симптомы и увеличенные желудочки, которые характеризуют его, также наблюдаются при многих других состояниях. НПХ может напоминать болезнь Альцгеймера, Паркинсона и сосудистую деменцию. Он также может имитировать прогрессирующий надъядерный паралич и деменцию с тельцами Леви.
Рисунок 3. МРТ нормальных и увеличенных желудочков.
Человек с подозрением на НПХ начинает консультацию нейрохирурга или невролога.Врач просматривает историю болезни пациента и проводит физический осмотр. Компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) назначается для поиска увеличенных желудочков или других признаков закупорки (рис. 3). Если сканирование в норме, у пациента нет НПХ.
Компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) назначается для поиска увеличенных желудочков или других признаков закупорки (рис. 3). Если сканирование в норме, у пациента нет НПХ.
При подозрении на болезнь Паркинсона врач может назначить курс лечения леводопой. Леводопа может помочь пациенту с болезнью Паркинсона, но не облегчит симптомы НПХ.
Тестирование походки также может использоваться, чтобы отличить болезнь Паркинсона от НПХ.Люди с ГПН обычно имеют атаксическую походку — широкую походку, похожую на пингвиновскую, при которой ноги жесткие, а ступня может тянуться и заедать, — тогда как люди с болезнью Паркинсона, как правило, ходят маленькими шаркающими шагами. Иногда походка при НПХ и болезни Паркинсона может быть не различима невооруженным глазом. В этих случаях пациент может пройти тестирование с помощью карты походки, длинного коврика, на котором записывается время и регулярность шага человека, длина шага и частота вращения педалей.
Нейропсихолог может проверить память и познавательные способности пациента.Это обследование может исключить другой диагноз, такой как болезнь Альцгеймера или деменция, не связанная с болезнью Альцгеймера.
Если ГНП остается возможным диагнозом, пациенту назначают пробу люмбального дренажа.
Испытание люмбального дренажа
Пробный дренаж — это «тест-драйв», чтобы определить, улучшит ли шунт спинномозговой жидкости состояние пациента.
Если пациент принимает антикоагулянты, он должен прекратить прием лекарства за 7–10 дней до исследования.Затем пациент поступает в больницу. При поступлении физиотерапевт оценивает походку пациента, чтобы установить базовый уровень его баланса и шага.
Рис. 4. В люмбальном дренаже полая игла вводится в заполненное жидкостью субарахноидальное пространство в нижней части позвоночника. Через полую иглу вводится гибкий катетер, и игла удаляется. Цереброспинальная жидкость (ЦСЖ) собирается в течение нескольких дней и контролируется давление ЦСЖ.
Для обезболивания нижней части спины используется местный анестетик.Хирург вводит временный катетер в позвоночный канал для дренирования спинномозговой жидкости (рис. 4). Пациент остается в больнице от 3 до 4 дней, пока спинномозговая жидкость периодически откачивается, и контролируется ваше состояние, особенно способность ходить. Семья и друзья могут навещать вас и составить вам компанию.
Через 72 часа дренаж удаляется, и физиотерапевт проводит вторую оценку походки пациента. Также проводится повторное нейропсихологическое обследование. Если память пациента и его походка заметно улучшились после дренирования, можно поставить положительный диагноз ГПН.
Любое улучшение симптомов после пробного слива продлится всего несколько дней. Симптомы вернутся к прежнему состоянию.
Если после обследования врачи определяют, что у пациента нет НПХ, его следует направить к неврологу. Невролог рассмотрит, есть ли у пациента другое заболевание, имитирующее НПХ, например болезнь Альцгеймера или атрофию мозга. Лечение будет зависеть от фактического протекания болезни.
Лечение будет зависеть от фактического протекания болезни.
Какие методы лечения доступны?
Нет лекарства от НПХ, и нет доступных лекарств.Однако шунт спинномозговой жидкости может облегчить симптомы у некоторых пациентов. Устройство, имплантированное хирургическим путем, удаляет из желудочков лишнюю жидкость. Если исследование люмбального дренажа прошло успешно, пациент может быть хорошим кандидатом на постоянное шунтирование спинномозговой жидкости. Поскольку NPH обычно является прогрессирующим заболеванием, шунтирование увеличивает качество жизни пациента, но симптомы NPH могут вернуться.
Иногда у пациента с ГНП может не быть шунта из-за других проблем со здоровьем, которые делают операцию небезопасной.Лечение этого состояния может достаточно улучшить здоровье пациента, чтобы он или она могли безопасно перенести операцию по шунтированию.
Шунтирующая хирургия
Нейрохирург и общий хирург работают вместе над имплантацией желудочкового перитонеального (ВП) шунта. Гибкое трубчатое устройство отводит избыток спинномозговой жидкости из мозга в область живота (рис. 5).
Гибкое трубчатое устройство отводит избыток спинномозговой жидкости из мозга в область живота (рис. 5).
Рис. 5. Программируемый шунт состоит из трех частей: (1) желудочковый катетер, который подключается к (2) клапанной системе, которая регулирует давление или поток спинномозговой жидкости по (3) перитонеальному катетеру в брюшную полость.
Шунт имеет клапан, который открывается для выпуска жидкости при повышении давления. Жидкость стекает в брюшную полость, а затем абсорбируется. Дренажную трубку также можно ввести в легкое или яремную вену. Операция проводится под общим наркозом и длится около 90 минут.
Шаг 1. Делается разрез на коже черепа на затылке. В черепе просверливается небольшое отверстие. Катетер проходит через головной мозг, чтобы он оставался внутри увеличенного желудочка.
Шаг 2. Делается разрез за ухом. Вставляется шунт / клапан и присоединяется желудочковый катетер.
Шаг 3. На животе делается еще один разрез. Затем создается туннель под кожей за ухом, идущий вниз по шее и груди в область живота. К шунту / клапану подключается перитонеальный катетер, чтобы переносить избыток спинномозговой жидкости в живот, где он будет абсорбирован.
Затем создается туннель под кожей за ухом, идущий вниз по шее и груди в область живота. К шунту / клапану подключается перитонеальный катетер, чтобы переносить избыток спинномозговой жидкости в живот, где он будет абсорбирован.
Что происходит после операции?
Пациент остается в больнице 2-3 дня.Сначала область над шунтом может быть приподнята, но по мере того, как опухоль уходит, шунт обычно не заметен. Спинальные головные боли вызваны утечкой спинномозговой жидкости вокруг катетера или шунта. Лягте на землю и пейте много негазированных жидкостей с кофеином (например, чая, кофе).
Пациентам следует расслабиться в течение нескольких недель после операции, не сгибать, не скручивать, не поднимать тяжести или носить плотно прилегающие шляпы. Для заживления разрезов нужно время. Пациенты могут принимать душ по указанию хирурга, но не должны принимать ванну или погружаться в воду в течение 4 недель.Надрезы следует промокнуть насухо мягким полотенцем, чтобы избежать раздражения.
Позвоните в офис хирурга, если температура пациента превышает 101 ° F, или если разрез начинает отделяться или появляются признаки инфекции, такие как покраснение, отек, боль или дренаж.
Если у пациента сильная головная боль, рвота и ригидность шеи, из-за которой подбородок не опускается к груди — это экстренная ситуация — обратитесь в больницу. Это признаки кровотечения в головном мозге.
Восстановление
Большинство пациентов с шунтом НПХ обращаются к нейрохирургу 2–3 раза в течение первого года после операции.Первое посещение происходит вскоре после операции и включает в себя проверку разреза и устранение любых проблем, которые могут возникнуть у пациента в период раннего выздоровления.
Последующие контрольные визиты будут включать оценку, чтобы убедиться, что шунт не дренирует слишком много или слишком мало. При необходимости врач может настроить программирование шунта с помощью контроллера извне тела без дополнительных операций.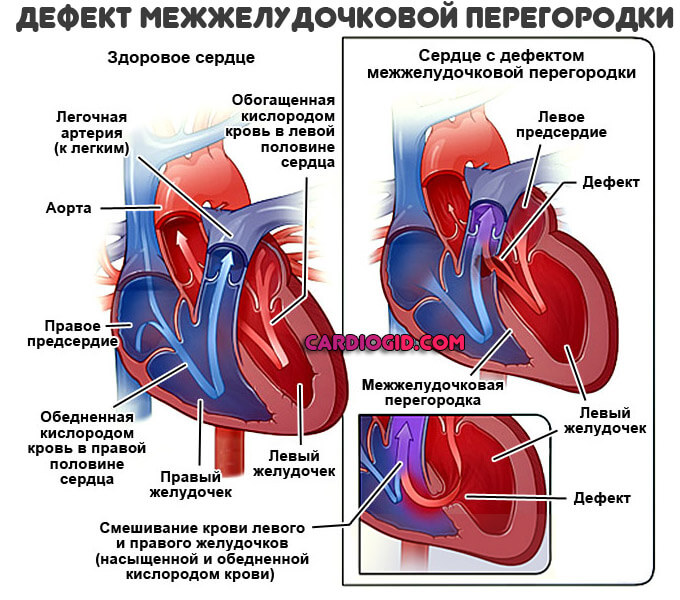 Врач также может запросить компьютерную томографию для проверки желудочков.
Врач также может запросить компьютерную томографию для проверки желудочков.
В некоторых случаях будет имплантирован непрограммируемый шунт. Размещение регулируемого шунтирующего клапана по сравнению с нерегулируемым — вопрос предпочтений и споров среди нейрохирургов. Поговорите со своим врачом о том, какое устройство лучше всего подходит для вашей ситуации.
Какие риски?
Ни одна операция не обходится без риска. Возможные осложнения самой операции включают кровотечение в головном мозге или желудочках, инфекцию, судороги и проблемы с анестезией.
Осложнения, которые могут возникнуть позже, включают нарушение работы шунта из-за закупорки или инфекции. Это вызывает накопление спинномозговой жидкости и возвращение первоначальных симптомов. При появлении ненормальных симптомов обратитесь к врачу. Часто засорения можно исправить. В редких случаях может потребоваться замена шунта.
Если желудочки уменьшаются в размере слишком быстро, мозг может оторваться от черепа и разорвать мелкие кровеносные сосуды. Это может вызвать образование тромбов вокруг головного мозга (так называемая субдуральная гематома).Программирование шунта для отвода спинномозговой жидкости с надлежащей скоростью и регулярные контрольные визиты к врачу обеспечивают оптимальную работу системы.
Это может вызвать образование тромбов вокруг головного мозга (так называемая субдуральная гематома).Программирование шунта для отвода спинномозговой жидкости с надлежащей скоростью и регулярные контрольные визиты к врачу обеспечивают оптимальную работу системы.
Некоторые признаки неисправности шунта:
- Затруднения при ходьбе / нарушения походки
- Когнитивные проблемы / слабоумие легкой степени
- Ургентное мочеиспускание или недержание мочи
- Лихорадка (признак недостаточности шунтирования или инфекции)
- Покраснение по ходу шунтирующего тракта (признак отказа шунтирования или инфекции)
Какие результаты?
У некоторых пациентов, которым установили шунт, значительно уменьшатся симптомы.Исследования показывают, что от 50 до 80% пациентов могут ожидать улучшения своих симптомов в первые 2–3 года [1]. У других пациентов результат может быть менее успешным. Результат определяется несколькими факторами, включая общее состояние здоровья пациента, причину возникновения НПХ и продолжительность НПХ.
У других пациентов результат может быть менее успешным. Результат определяется несколькими факторами, включая общее состояние здоровья пациента, причину возникновения НПХ и продолжительность НПХ.
Ранняя диагностика и лечение повышают шансы на успешное облегчение симптомов с помощью шунта. Пациенты, у которых симптомы проявлялись менее года или у которых слабоумие легкой степени или не было вовсе, чувствуют себя лучше [2].Мужчины и все пациенты пожилого возраста реже демонстрируют улучшение мышления и памяти после операции шунтирования [3]. Другое исследование показало, что, хотя может происходить значительное улучшение атаксической походки и недержания мочи, улучшение деменции происходит редко [4].
Почему у одних пациентов выздоравливает, а у других нет, это результат двух факторов. Во-первых, ученые не до конца понимают, какие факторы вызывают возникновение НПХ. Во-вторых, нейрохирурги различаются по методам диагностики, лечения и оценки успешности лечения пациентов с НПХ.
Поскольку НПХ — это пожизненное заболевание, имплантированный шунт может облегчить симптомы, но не вылечит.
Источники и ссылки
Если у вас есть дополнительные вопросы, свяжитесь с Mayfield Brain & Spine по телефону 800-325-7787 или 513-221-1100.
Источники
1. Мармару А., Бергснайдер М., Фелкин Н. и др. Разработка рекомендаций по идиопатической гидроцефалии нормального давления. Нейрохирургия 57 (Дополнение): S1-3, 2005
2.Meier U, Konig A, Miethke C. Предикторы исхода у пациентов с гидроцефалией нормального давления. Eur Neurol 51: 59-67, 2004
3. Chang s, Agarwal S, Williams MA, et al. Демографические факторы влияют на когнитивное восстановление при идиопатической гидроцефалии нормального давления после шунтирования. Cogn Behav Neurology 17: 179-184, 2004
4. Пока М.А., Матаро М., Матарин М. и др. Хороший исход у пациентов с гидроцефалией нормального давления и факторами, указывающими на плохой прогноз. J Neurosurg 103: 455-463, 2005
J Neurosurg 103: 455-463, 2005
Ссылки
Ассоциация гидроцефалии
Жизнь НПХ
обновлено> 7.Обзор
(2018):> Брэд Курт, доктор медицины и Захари Темпел, доктор медицины, клиника Мэйфилд, Цинциннати, Огайо
Медицинские информационные материалы, сертифицированные Mayfield, написаны и разработаны клиникой Mayfield Clinic. Мы соблюдаем стандарт HONcode в отношении достоверной медицинской информации. Эта информация не предназначена для замены медицинских рекомендаций вашего поставщика медицинских услуг.
(PDF) Необходима ли рентгенография с использованием шунта перед ревизией непроходимого вентрикулоперитонеального шунта?
Методы: ретроспективный обзор 64 последовательных пациентов
, перенесших ревизию обструкции VPS в хирургическом отделении нейро-
Университета Короля Сауда, Эр-Рияд, Саудовская Аравия
Аравия, в период с июня 2002 г. по декабрь 2011 г., оценка
по декабрь 2011 г., оценка
доля и влияние аномальных результатов в
POSS.
Результаты: 69 POSS были выполнены 64 пациентам
до ревизии VPS с обструкцией. Их средний возраст составлял
11,8 года, из них 25 пациентов — женщины. У Sev-
(24,6%) POSS были аномальные результаты, которые были статистически значимыми (P = 0,005), и только 10 из них
повлияли на хирургическую технику или выбор терапевтической
процедуры (P = 0,0001). ). Положительные результаты получены в виде
шт .; сломанный / отсоединенный катетер (n = 4), внутрибрюшный
миграция перитонеального катетера (n = 4), спиральный / экстраперитонеальный
тональный дистальный катетер (n = 2), короткий перитонеальный конец (n = 1) ,
и ретенционный катетер / более одного шунта (n = 6).Однако
большинство серий шунтов (75,4%) были нормальными.
Заключение: рутинная рентгенография серии шунтов сама по себе не является диагностическим инструментом
для неисправности шунта, и POSS
следует зарезервировать для пациентов с доказанным отказом шунта на КТ
или МРТ. POSS
POSS
оказал значительное влияние на оперативное решение для тех, кто подвергался ревизии
в отношении препятствия VPS.
Ключевые слова: серия предоперационных шунтов; Обструкция шунта; Шунт
ревизия; Вентрикулоперитонеальный шунт
Ó2014 Taibah University.Производство и хостинг — Elsevier
Ltd. Все права защищены.
Введение
Вентрикулоперитонеальные шунты (VPS) подвержены осложнениям.
шунтов, частота отказов достигает 40% в течение первого года
после установки и 50% в течение 2 лет.
1
Наиболее частыми
типами отказа VPS являются обструкция и инфекция. Механические причины обструкции
могут включать отсоединение, перелом или кальцификацию
, субгалеальную спираль, внутрибрюшную или экстрапериодную миграцию катетера, перфорацию внутренних органов и анальную миграцию шунтирующего катетера.
2–5
Диагностическая оценка обструкции VPS обычно включает КТ головного мозга и не включает только шунт серии
. Рентгеновские снимки серии Shunt — это набор простых рентгенограмм
всего участка шунтирующей трубки. Он состоит из
передних и боковых изображений черепа, груди и живота.
6
Используется для оценки рентгеноконтрастных катетеров и клапана
, как дополнительный диагностический инструмент для идентификации отдельных компонентов шунтирующего узла
, если исходный хирургический отчет недоступен, и
может выявить проблемы, которые упускаются из виду при клиническом обследовании.
Это также делается в качестве предоперационного исследования с целью
ограничить хирургическое вмешательство радиологически открытой проблемой
.
Шунтирующая серия может помочь в выявлении потенциальных механических
причин обструкции VPS, включая сбои в системе;
отсоединений и перегибов, эктопическое расположение катетера, как
в подгалеальной области проксимально и в пределах
внутрибрюшинного пространства или экстраперитонеально дистально.
1,3,7
Иногда
абдоминальная псевдокиста или адгезия абдоминального катетера
можно заподозрить на простых рентгенограммах.
2
Нейрохирурги, диагностирующие обструкцию VPS, обычно не могут определить
, в каком случае будет полезна серия шунтов.
8
После того, как
наблюдал это, после того, как диагноз обструкции шунта был четко установлен
и было принято решение о проведении хирургического исследования или ревизии шунта
, POSS оставался легко доступным инструментом
при оценке предполагаемых механических
причин отказа шунта.
Отделение нейрохирургии в нашем учреждении
недавно согласилось рассматривать POSS как неотъемлемую часть предоперационной
оценки, тем самым предотвращая неожиданности во время операции. В
этого исследования автор оценил важность POSS и
его роль во влиянии на хирургическое решение ревизии шунта.
Материалы и методы
Это исследование включало 64 пациента, которым была проведена ревизия или замена
VPS с обструкцией в период с июня 2002 г. по
декабря 2011 г. в отделении нейрохирургии Университета короля Сауда
, Эр-Рияд, Саудовская Аравия.Исследование было сосредоточено на результатах POSS
, которые способствовали отказу шунта, и влиянию
положительных результатов на хирургическую процедуру, выполненную для ревизии шунта
.
Для всех пациентов была собрана подробная информация с указанием возраста
пациентов, пола, причины гидроцефалии, типа шунтирующей системы
и продолжительности VPS, истории предыдущих ревизий
пациентов с оценкой доли аномальных Результаты POSS
и их влияние на лечение обструкции шунта.
Данные были проанализированы с использованием коммерческого статистического программного обеспечения
package (SPSS, версия 15.0 для Windows; SPSS, Inc., Chi-
cago, IL).
Результаты
Возраст пациентов варьировал от 3 дней до 73 лет, при этом средний возраст
составлял 11,8 года. Из 64 пациентов 25 (39%) составляли
женщин и 39 (61%) мужчин. Все пациенты были обработаны как
неотложных состояний с симптомами и признаками гидроцефалии, повторно связанными с нарушением функции шунта, и подверглись хирургической ревизии
или замене заблокированного VPS.У всех пациентов был POSS,
, но 5 были прооперированы дважды по поводу обструкции VPS в течение периода исследования
, и поэтому POSS были выполнены дважды.
Проверено 69 POSS; У 17 (24,6%) обнаружено
отклонений, 10 из них повлияли на хирургическую технику
или выбор терапевтической процедуры, что позволило избежать неожиданностей во время операции
, например отсутствие дистального катетера при исследовании шунта
из-за миграции и подготовка к лапароскопическому извлечению
перенесенного катетера.Аномальные результаты были; сломанный / отсоединенный катетер
(n = 4) (рисунок 1), внутрибрюшная миграция
перитонеального катетера (n = 4) (рисунок 2), спиральный / экстраперитонеальный
дистальный конец неальной области (n = 2) (Рисунок 3), короткий перитонеальный катетер
(n = 1) (Рисунок 4) и удерживаемый катетер / более одного шунта
(n = 6) (Рисунок 2). Однако в большинстве POSS (75,4%)
не выявило серьезных отклонений от нормы (таблица 1).
Статистический анализ
Использовался Z-тест процентных соотношений, взятых из одной выборки,
, предполагая, что существует значительная разница, если P <0.05
46 E.A. Elgamal et al.
Вентрикулоперитонеальный шунт: обзор, показания, противопоказания
Автор
Вамси Кришна Чинтапалли, MBBS, MRCP, MRCS Специализированный регистратор по неврологии, Национальная больница неврологии и нейрохирургии, Великобритания
Раскрытие: Ничего не разглашать.
Соавтор (ы)
Лоуренс Д. Уоткинс, MBChB, MA, FRCS Консультант-нейрохирург, Национальная больница неврологии и нейрохирургии, Великобритания
Раскрытие информации: выступать (d) в качестве докладчика или члена бюро докладчиков для: B Braun, Codman
Получал гонорары от Medtronic за выступления и преподавание; Получал гонорары от Б. Брауна за выступления и преподавание; Не получил от Интегры ни одного отзыва о членстве в экспертной комиссии; Не получал от Boston Scientific ни одного патента.
Специальная редакционная коллегия
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Главный редактор
Cristian Gragnaniello, MD Научный сотрудник отделения нейрохирургии позвоночника, Австралийская школа усовершенствованной медицины, Университет Маккуори, Австралия
Cristian Gragnaniello, MD является членом следующих медицинских обществ: Американской ассоциации неврологических хирургов, Конгресса неврологов. Хирурги
Раскрытие информации: раскрывать нечего.
Дополнительные участники
Эндрю К. Чанг, доктор медицины, магистр медицины Винсент Вердайл, доктор медицины, заведующий кафедрой неотложной медицины, профессор неотложной медицины, заместитель председателя по исследованиям и академическим вопросам Медицинского колледжа Олбани; Доцент кафедры неотложной клинической медицины Медицинского колледжа Альберта Эйнштейна; Лечащий врач отделения неотложной медицины, Медицинский центр Монтефиоре
Эндрю К. Чанг, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии неотложной медицины, Американской академии неврологии, Американской академии медицины боли, Американского колледжа неотложной помощи Врачи, Американское гериатрическое общество, Американское общество боли, Общество академической неотложной медицины
Раскрытие информации: нечего раскрывать.
.