Комментарий к статье В.С.Корсака «К вопросу о роли эндометрия в имплантации эмбрионов» (Проблемы репродукции. 2016;2:33-36)
Автор рассматривает случаи эктопических беременностей (в приводимом им случае — брюшных) как «противоречащие взглядам на уникальность эндометрия…, как структуры способной претерпевать прегравидную трансформацию и обеспечить условия для имплантации эмбриона». И в этом он прав. Однако есть важный аспект, оставшийся в статье без объяснения, который, на мой взгляд, разъясняет многое.
В 60−70 годы прошлого века, когда я только начинал свою деятельность на поприще ВРТ в Институте акушерства и гинекологии АМН СССР (ныне – НИИ АГ и Р им. Д.О. Отта), возглавляемая мной группа раннего эмбриогенеза человека (с 1982 г. — лаборатория того же названия) входила в состав лаборатории нормальной и патологической морфологии института. Основной практической задачей этой лаборатории были аутопсии погибших плодов и новорожденных и гистологическое изучение их органов, а также аутопсии погибших беременных и родильниц (в то время такие случаи были чаще, чем сейчас). Для точного выяснения причин их смерти проводилось гистологическое исследование всех органов. Несколько раз я просматривал эти препараты. И вот что меня поразило: участки полноценной децидуальной ткани обнаруживались не только в матке, но и в сальнике, лимфоузлах, селезенке, печени.
Сейчас бегло просмотрев литературу, я без особого труда, обнаружил подтверждение этому, прежде всего, в работах Клавдии Петровны Улезко-Строгановой, первого руководителя названной выше лаборатории того же института, носившего в то время название «Императорский клинический повивальный институт ведомства учреждений императрицы Марии». Итак, согласно работам К.П. Улезко-Строгановой и исследованиям других авторов, «децидуальному превращению» могут подвергаться: ткань лимфоузлов, эндотелий кровеносных сосудов и серозные оболочки маточных труб, соединительно-тканные структуры яичников, влагалища и мочевого пузыря, тазовая брюшина, ткань диафрагмы, даже — слизистая гортани. Необычностью этого явления объясняется то, что иногда патогистологи принимают гетеротопии децидуальной ткани за рак, туберкулез и другие подобные процессы.
Необычностью этого явления объясняется то, что иногда патогистологи принимают гетеротопии децидуальной ткани за рак, туберкулез и другие подобные процессы.
Из всего этого можно сделать вывод о том, что децидуальная (до начала имплантации эмбриона — децидуоподобная) реакция — это системная реакция клеток соединительной ткани различных органов женщины на рост продукции желтым телом прогестерона. При этом эмбрион, попавший в брюшную полость (что происходит, вероятно, много чаще, чем мы думаем) или «застрявший» в трубе, начинает получать биохимические «сигналы» от этой ткани («я тут») и сам начинает направлять ей свои «сигналы». В результате обмена сигналами (все это только в начале тщательного изучения) децидуоподобная реакция переходит в децидуальную, особенно с началом продукции трофобластом чХГ, и начинается имплантация. Таким образом, эмбрион имплантируется не в ткань органа (сальник, маточная труба, яичник и другие органы), а в «родную» децидуальную ткань, в которой как и в decidua матки естественным путем формируются «кровяные лакуны», в которые погружаются ворсины хориона и т. д. И пиноподии, и окно имплантации здесь также, вероятно, имеют место.
Возможен (более редкий, по-видимому) вариант: эмбрион «натыкается» на участки гетеротопий эндометрия, которые также претерпевают децидуоподобную и децидуальную реакции, и имплантируется в них.
Конечно, роль эмбриона в имплантации более велика, чем роль эндометрия. Но это, по-моему, связано с большим количеством дефектов, возникающих в процессе созревания половых клеток, оплодотворения и дробления зародыша, ведущих к нарушениям в его генотипе и фенотипе, от которых как раз и зависит полноценность профиля продуцируемых ими факторов, влияющих и на его жизнеспособность, и на имплантацию и на плацентацию.
57) Патология беременности
Спонтанные аборты
(самопроизвольные выкидыши)Эктопическая
беременностьТрофобластическая
болезнь
пузырный занос
хориокарцинома
Причины
спонтанных абортов
многообразны: хромосомные и генные
мутации, иммунологические факторы,
эндокринные расстройства; инфекции;
экстрагенитальные заболевания матери.
Материал, получаемый при выскабливании
полости матки после спонтанного аборта,
может быть представлен:
плодное яйцо
(редко)ворсины хориона
децидуальная
ткань.
Ворсины
хориона в зависимости от сроков гестации
имеют различное строение.
При
м и к р о с к о п и ч е с к о м исследовании
в децидуальной ткани соскоба полости
матки видны очаги некроза с инфильтрацией
лейкоцитами, очаги кровоизлияний, могут
быть тромбы в сосудах децидуальной
оболочки.
Если
в соскобе обнаруживается только
децидуальная ткань без ворсин хориона,
диагноз маточной беременности подтвердить
нельзя.
Эктопическая
беременность (внематочная)
представляет собой беременность при
локализации плодного яйца вне полости
матки.
Оплодотворенная
яйцеклетка не попадает в полость матки
и имплантируется в местах (в ложе), не
приспособленном к развитию беременности
(труба, яичник, шейка матки, брюшина).
Cреди
причин внематочной беременности стоят
воспалительные заболевания придатков
матки со спайками и с сужением просвета
маточных труб, гипоплазия желтого тела
яичника, пороки развития матки.
Морфология
трубной беременности.
Маточная труба (чаще в ампулярном отделе)
расширена; в трубе можно увидеть плодное
яйцо и свертки крови.
При
г и с т о л о г и ч е с к о м исследовании
определяются ворсины хориона. В слизистой
оболочки трубы видна децидуальная
реакция, могут быть видны клетки
вневорсинчатого трофобласта и фибриноид.
Эктопическая
беременность, как правило, прерывается
до 5 – 6 недельного срока и часто
сопровождается опасным для жизни
внутренним кровотечением. Прерывание
трубной беременности может происходить
двумя путями:
Разрыв трубы
с выходом плодного яйца в брюшную
полость, при этом возникает резкая боль
в животе, головокружение, падение АД,
коллапс.Трубный аборт,
который может быть полным и неполным.
При полном трубном аборте плодное яйцо
отслаивается от стенки трубы и изгоняется
через ампулярную часть в брюшную
полость. При
неполном трубном аборте
– зародыш
с плацентой и со сгустками крови остаются
в просвете трубы.
Кроме
трубной эктопической бывает первичная
брюшная беременность,
когда яйцеклетка не попала в трубу, а
имплантировалась в брюшине, и вторичная
брюшная беременность, возникшая
после прерывания трубной. Исход такой
беременности тяжелый – может возникнуть
смертельное кровотечение, а плод при
этом гибнет. Описаны случаи, когда
беременность прервалась, кровотечение
не вызвало катастрофы, а погибший плод
обызвествляется (литопедион).
В
диагностике эктопических беременностей
большое значение имеют определение
уровня хорионического гонадотропина,
ультразвуковое исследование и
лапароскопия.
Трофобластическая
болезнь.
Включает
в себя несколько заболеваний:
пузырный
занос,хорионкарциному,
трофобластическую
опухоль плацентарного ложа.
Источником
этих заболеваний служат ткани плаценты.
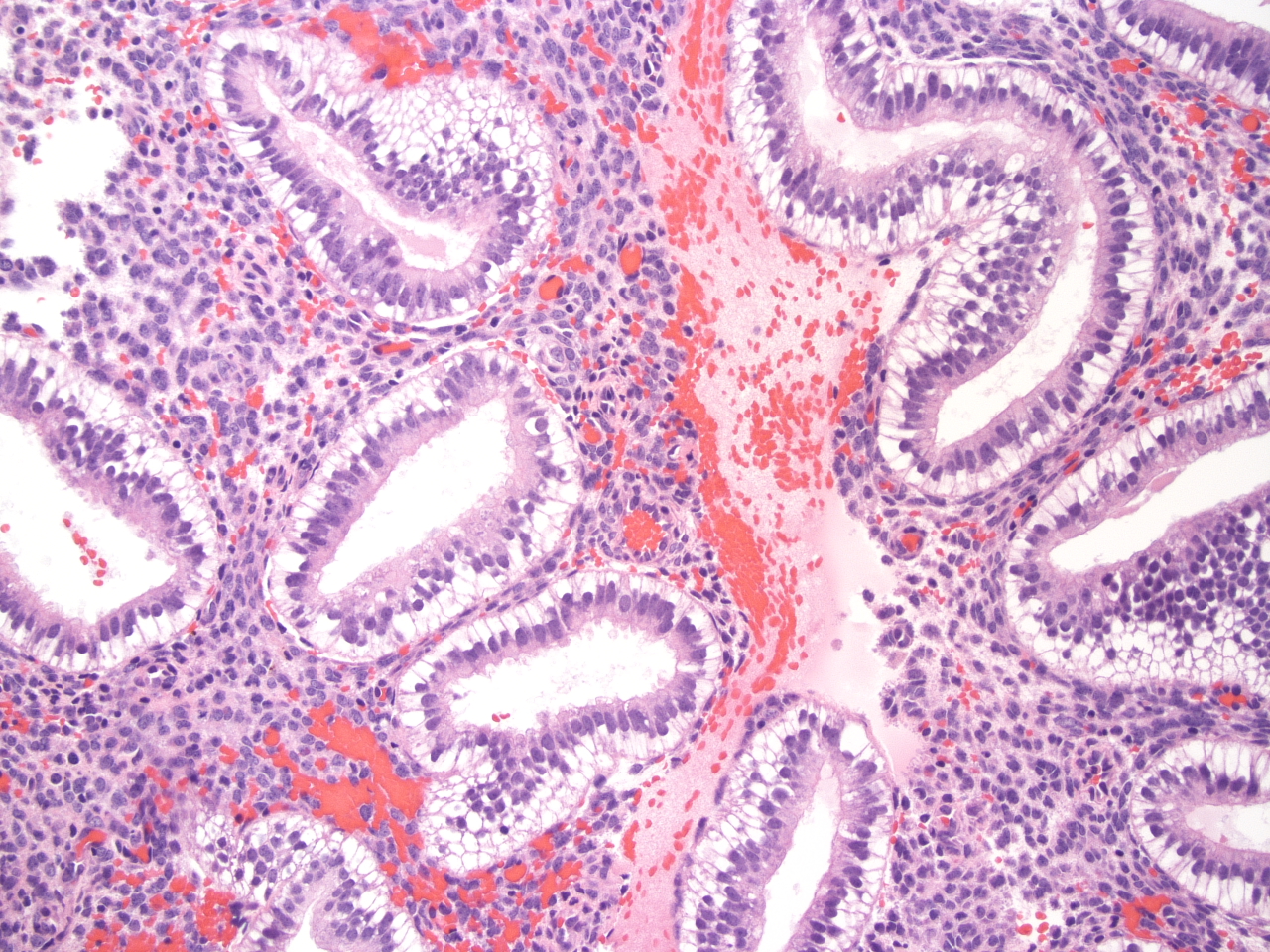
Пузырный занос
простой и инвазивный – характеризуется
увеличением размеров ворсин, которые
приобретают вид пузырьков, заполненных
прозрачной жидкостью. При простом
пузырном заносе полость матки увеличена
и содержит пузырьковидные ворсины,
скопление которых напоминает гроздь
винограда. Пузырьки могут свободно
располагаться в полости матки и
выделяться из влагалища. При инвазивном
пузырном заносе пузырьковидные ворсины
врастают в миометрий или прорастают
всю ткань матки, распространяясь на
прилежащие органы. Микроскопически
инвазивные отечные ворсины можно
обнаружить как в миометрии, так и в
сосудах. В этих случаях могут наблюдаться
MTS
в легкие и влагалище. Эти метастазы при
удалении основной опухоли исчезают
сами или при гормональном лечении.
По локализации
различают
полный
пузырный занос,
когда вся плацента поражается – плод
при этом отсутствует, и частичный
пузырный занос
– в отдельных участках нормальной
плаценты распределены пузырьковидные
ворсины. Плод при этом имеется, но он
Плод при этом имеется, но он
рано погибает.
Клинически
пузырный занос проявляется кровотечением
в первом триместре с выделением или без
выделения пузырьковидных ворсин. В
крови беременной определяется высокий
уровень хорионического гонадотропина.
Г
и с т о л о г и ч е с к и
Видны
резко отечные ворсины, нередко с
образованием в центре ворсин полостей,
так называемых цистерн, заполненных
жидкостью.
Ворсины
лишены сосудов.
Наблюдается
пролиферация трофобласта. При простом
пузырном заносе пролиферация трофобласта
выражена слабо. Очаги
пролиферации, преимущественно
клеток Лангханса, представлены тяжами
или выступами на поверхности ворсин.
При инвазивном пузырном заносе видны
пласты или поля пролиферирующего
трофобласта, преимущественно синцитиальных
клеток. По соскобу можно только заподозрить
возможность инвазии.
акушер-гинеколог, профессор. Во время месячных вышел сгусток, результат гистологии Децуальная ткань.
Во время месячных вышел сгусток, результат гистологии Децуальная ткань.
Здравствуйте,хотела бы получить разъяснения ещё от одного специалиста,моя ситуация такова: последние нормальные месячные были с 26.05.14 по 01.06.14,затем была задержка,сделала 3 теста(все отрицательные) + осмотр гинеколога-беременность не выявлена,месячные пошли 11.07.14 и перешли в кровотечение,по скорой 23.07 попала в гинекологию в стационар где сделали выскабливание,на что врач не уверенно сказал что похоже на беременность,анализ гистологии беременность не подтвердил,было написано гиперплазия матки,после выскабливания кровяные выделения ещё продлились 2 недели,после этого я сделала УЗИ где врач узист сказала что у меня эндометриоз 2-й степени…25.07.14 начинаются месячные и переходят в кровотечение,обращаюсь в больницу,выписывают кровоостанавливающее и гормон ригевидон,остановили кровотечение,пропила по схеме гормон 21 таблетка и перерыв 7 дней,месячные начались 20.07.14,перешли в обильные и на 7-й день месячных вышел огромный сгусток,ощущение как при схватках с сильными болями,испугавшись я позвонила в женскую консультацию и рассказала гинекологу что произошло,она сказала залить это хотя бы спиртом и принести,я принесла это к врачу,она направила меня сдать это на гистологию,вообщим через 2-е недели я сделала УЗИ,где врач узист сказала что в сравнении с 1-м УЗИ эндометрии в норме,с результатом УЗИ я пошла на приём к врачу где услышала результат гистологии родившегося сгустка и была в ещё большем шоке услышав что в материале децедуальная ткань.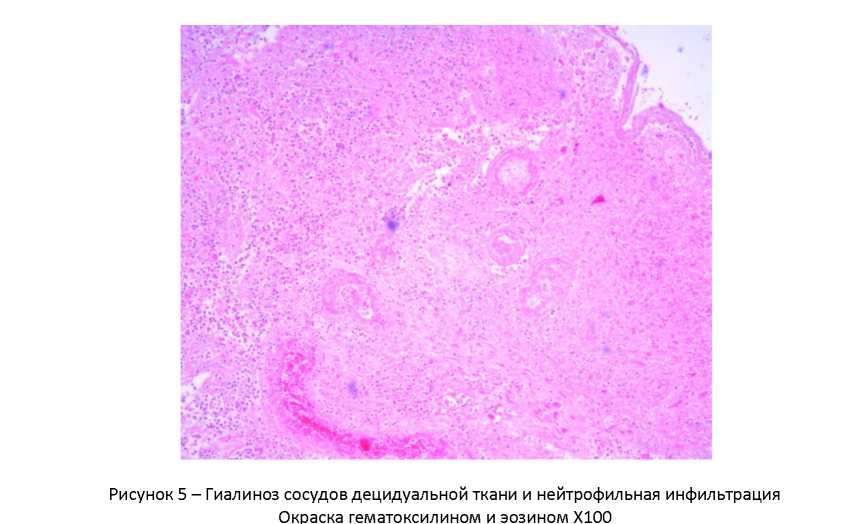 ..а как же тесты7 как же выскабливания?как же осмотр гинеколога?…гинеколог сменил гармон на регулон и сказала пить 3 месяца а после прийти на приём…. я нахожусь в шоке и не понимаю что же произошло,беременности не было а откуда эта децедуальная ткань? ….моему ребёнку 6 лет,не могло ли это остаться после родов и быть там столько времени?(наверное звучит глупо,но уже и не знаю что думать)….Буду благодарна за ответы.
..а как же тесты7 как же выскабливания?как же осмотр гинеколога?…гинеколог сменил гармон на регулон и сказала пить 3 месяца а после прийти на приём…. я нахожусь в шоке и не понимаю что же произошло,беременности не было а откуда эта децедуальная ткань? ….моему ребёнку 6 лет,не могло ли это остаться после родов и быть там столько времени?(наверное звучит глупо,но уже и не знаю что думать)….Буду благодарна за ответы.
Медведев Михаил Владимирович // 15 Октября 2014
Дело в том что между децидуальной тканью и беременностью нельзя ставить равенство. Децидуальная ткань — это эндометрий, похожий на тот, что при беременности. Без наличия ворсин хориона беременность не считается подтвержденной.
Результат гистологии. Децидуальная ткань с инвазивным трофобластом.
Елена Петровна, здравствуйте! Возник вопрос по результатам гистологии (похожих ситуаций в вопросах/ответах не нашла, поэтому решила спросить):
2 недели назад у меня случилась замершая беременность на 9 нед. (на 6 нед. по узи). Сначала началось небольшое кровотечение, отвезли в больницу,ночью случился выкидыш,а на след.день сделали выскабливание. Сегодня получила результат гистологии: В соскобе кусочки гравидарного эндометрия, кусочек децидуальной ткани с инвазивным трофоблстом.
В больнице,где делали выскабливание и гистологический анализ, сказали, что эмбрион прикрепился больше (сильнее), чем нужно. И что необходимо отвезти стекла (видимо с материалом анализа, отдали их мне) в онкологический диспансер для дополнительной проверки, а также сдать кровь на уровень ХГЧ и сделать УЗИ.
Почитала про трофобластическу болезнь ( Трофобластическая болезнь (пузырный занос, хорионэпителиома и др.)) и про ее серьезность. Как я поняла, врачи как раз её и опасаются.
В связи с этим вопрос: действительно ли по результатам гистологии может возникнуть подозрение на данное заболевание?
О себе: мне 31 год, мужу 33, планирум беременность уже около 3х лет, ничего не получалось, были перерывы в планировании (предохранялись) т. к. у меня первые 1.5 года периодически появлялась молочница (начиналась после овуляции, во 2ой половине цикла) , которая прекращалась, когда мы начинали предохраняться или после лечения. В самом начале «планирования» пролечили уреаплазму, думали что молочница возникает из-за неё, но молочница все равно появлялась.
к. у меня первые 1.5 года периодически появлялась молочница (начиналась после овуляции, во 2ой половине цикла) , которая прекращалась, когда мы начинали предохраняться или после лечения. В самом начале «планирования» пролечили уреаплазму, думали что молочница возникает из-за неё, но молочница все равно появлялась.
И еще на протяжении планирования у меня периодически происходили задержки, после которых менструация была более болезненной.
По мои анализам: гормоны были в норме, в мазке в недостаточном количестве лактобактерии. Начала ставить свечи с лактобактериями (ацилак). Параллельно с этим сделали спермограмму мужу, сначала у него были найдены лейкоциты в бОльшем количестве,чем по нормам и активность спермиев была ниже нормы, пролечили простатит и показатели улчшились.
Видимо пролеченный простатит и лактобактерии принесли результат и я заберменила, но на 9ой недели беременность замерла.
В самом начале берменности (4-5 недели) я чувствовала слабость и неповоротливость, тяжело былоходить, но через пару недель прошло и больше ничего не беспокоило.
Децидуа — Decidua — qaz.wiki
Децидуальный является модифицированной слизистой оболочки из матки (то есть, модифицированный эндометрий ) , что формы при подготовке к беременности . Он образуется в процессе децидуализации под действием прогестерона . Клетки эндометрия становятся очень характерными. Децидуальная оболочка образует материнскую часть плаценты и остается в ней на время беременности. Он выделяется во время родов — отсюда и используется термин «децидуа», имеющий значение отпадения , как в слове « листопадный» .
Структура
Часть децидуальной оболочки, которая взаимодействует с трофобластом, — это базальная децидуальная оболочка (также называемая децидуальной плацентарной ), в то время как капсульная децидуальная оболочка вырастает над эмбрионом на просветной стороне, заключая его в эндометрий. Остальная часть децидуальной оболочки называется decidua parietalis или decidua vera , и к четвертому месяцу беременности она срастется с decidua capsularis.
Остальная часть децидуальной оболочки называется decidua parietalis или decidua vera , и к четвертому месяцу беременности она срастется с decidua capsularis.
Таким образом, можно описать три морфологически различных слоя decidua basalis:
- Плотный внешний слой ( stratum compactum )
- Промежуточный слой ( stratum spongiosum )
- Пограничный слой, прилегающий к миометрию ( stratum basalis )
В децидуальной оболочке иногда образуются фибриноидные отложения в местах повреждения синцитиотрофобласта. Область отложения фибриноидов, где трофобласты встречаются с компактной частью decidua basalis, называется слоем Рора , а фибриноидные отложения, которые возникают между компактным и губчатым слоем decidua basalis, называются слоем Nitabuch . В приросшей плаценте этот слой отсутствует .
Децидуальная оболочка имеет гистологически отчетливый вид, на ней видны большие многоугольные децидуальные клетки в строме. Это увеличенные стромальные клетки эндометрия, которые напоминают эпителий (и называются «эпителиоидными»).
Децидуализация включает в себя процесс дифференцировки веретенообразных стромальных фибробластов в большие секреторные децидуальные клетки, которые создают перицеллюлярный внеклеточный матрикс, богатый фибронектином и ламинином (подобным эпителиальным клеткам).
В децидуализирующемся эндометрии повышается васкуляризация, а также проницаемость сосудов.
Его популяция лейкоцитов различна, с преобладанием крупных гранулярных лейкоцитов эндометрия, в то время как полиядерные лейкоциты и В-клетки скудны.
Большие гранулярные лимфоциты ( CD56 bright) называются « естественными клетками- киллерами матки » или «клетками uNK» у мышей и «децидуальными NK-клетками» или «клетками dNK» у людей.
Разработка
После овуляции у плацентарных млекопитающих слизистая оболочка эндометрия становится гипертрофированной и сосудистой под влиянием половых гормонов , эстрогена и прогестерона .
У животных с гемохориальной плацентой эндометрий подвергается децидуализации после имплантации . Если имплантация не происходит, секреторная слизистая оболочка абсорбируется ( эстральный цикл ) или теряется ( менструальный цикл ).
Децидуальная оболочка отделяется вместе с плацентой во время родов .
Функция
В качестве материнского интерфейса для эмбриона децидуальная оболочка участвует в обмене питательными веществами, газами и отходами во время беременности. Он также защищает беременность от материнской иммунной системы . Кроме того, децидуальная оболочка должна обеспечивать контролируемое вторжение трофобласта.
При инвазивных нарушениях плаценты, таких как приращение плаценты, децидуализация неизменно оказывается недостаточной.
Производство гормонов
Децидуальная оболочка секретирует гормоны , факторы роста и цитокины . В нем есть рецепторы к эстрогену , прогестерону , гормону роста и другим.
Среди его продуктов — гормоны, обычно связанные с другими органами, такие как кортизол , CRF , GnRH , пролактин и релаксин . Децидуальный пролактин не находится под дофаминергическим контролем.
Белок, связывающий инсулиноподобный фактор роста 1 (IGFBP1), также называемый плацентарным белком 12, и PAEP (гликоделин), по-видимому, являются специфическими продуктами секреторной и децидуальной выстилки.
Другие высвобождаемые факторы включают интерлейкин-15 и фактор роста эндотелия сосудов (VEGF). Разумного понимания роли и взаимодействия этих гормонов и факторов не получено.
Другой
Клиническое значение
Длительная инфекция децидуальной оболочки, хронический децидуит , связана с преждевременными родами .
История
Слово происходит от латинского deciduus «падение / выпадение».
Дополнительные изображения
Схема плацентарного кровообращения.

Рекомендации
внешняя ссылка
Роль рецепторов RIG-I, AIM2 и IFI16, распознающих вирусную ДНК и РНК, в патогенезе самопроизвольных выкидышей и неразвивающейся беременности ранних сроков
ФГАОУ ВО Белгородский государственный национальный исследовательский университет, Россия
Цель исследования. Установить особенности экспрессии в децидуальной ткани мРНК внутриклеточных рецепторов RIG-I, IFI16 и AIM2, распознающих ДНК и РНК вирусов, а также белков их сигнальных путей у пациенток с неразвивающейся беременностью и самопроизвольными выкидышами ранних сроков.
Материал и методы. Были обследованы 68 пациенток со спорадическими выкидышами: 34 женщины с неразвивающейся беременностью и 34 – с самопроизвольными выкидышами на сроке 6–10 недель беременности. Контрольную группу составили 57 пациенток, которым был проведен медицинский аборт на том же сроке беременности. Из исследования были исключены пациентки, имеющие тяжелые экстрагенитальные заболевания, антифосфолипидный синдром, эндокринные причины невынашивания беременности, подтвержденные хромосомные аномалии плода. Материалом являлась децидуальная ткань, которую получали во время выскабливания полости матки. Исследование экспрессии мРНК RIG-I, IFI16 и AIM2, а также белков их сигнальных путей (ASC, TBK1, STING, каспазы-1, интерлейкина-1β (IL-1β)) проводили c помощью количественной полимеразной цепной реакции.
Результаты. У пациенток с неразвивающейся беременностью в децидуальной ткани выявлено семикратное увеличение экспрессии мРНК белка AIM2, распознающего внутриклеточную ДНК вирусов и листерий. Это сопровождалось увеличением экспрессии мРНК каспазы-1 и IL-1β, способствующих индукции воспалительной реакции и клеточной гибели путем пироптоза. Достоверных изменений экспрессии мРНК RIG-I, IFI16 и белков их сигнальных путей у пациенток с неразвивающейся беременностью не наблюдалось. У пациенток с самопроизвольными выкидышами не было выявлено изменений экспрессии мРНК AIM2, RIG-I, IFI16 и белков их сигнальных путей.
Заключение. Таким образом, у пациенток с неразвивающейся беременностью в децидуальной ткани наблюдается увеличение экспреcсии рецептора AIM2, распознающего ДНК вирусов и листерий. Это сопровождается увеличением экспрессии мРНК каспазы-1 и IL-1β, приводящих к индукции провоспалительного ответа и клеточной гибели.
неразвивающаяся беременность
самопроизвольный выкидыш
невынашивание беременности
AIM2
каспаза
интерлейкин-1β
1. Kitaya K. Prevalence of chronic endometritis in recurrent miscarriages. Fertil. Steril. 2011; 95(3): 1156-8.
2. Giakoumelou S., Wheelhouse N., Cuschieri K., Entrican G., Howie S.E.M., Horne A.W. The role of infection in miscarriage. Hum. Reprod. Update. 2016; 22(1): 116-33.
3. Iwasaki A., Medzhitov R. Control of adaptive immunity by the innate immune system. Nat. Immunol. 2015; 16(4): 343-53.
4. Сухих Г.Т., Ванько Л.В. Иммунные факторы в этиологии и патогенезе осложнений беременности. Акушерство и гинекология. 2012; 1: 128-36.
5. Фрейдлин И.С. Взаимосвязи врожденного и приобретенного иммунитета при инфекциях (ревизия классических догм). Инфекция и иммунитет. 2011; 1(3): 199-206.
6. Кречетова Л.В., Тетруашвили Н.К., Вторушина В.В., Николаева М.А., Хачатрян Н.А., Агаджанова А.А., Ванько Л.В., Иванец Т.Ю., Сухих Г.Т. Особенности фенотипа лимфоцитов периферической крови женщин с идиопатическим привычным выкидышем в зависимости от исхода беременности на фоне иммуноцитотерапии. Акушерство и гинекология. 2017; 7: 52-60.
7. He M., Zhou Y., Jiang M., Li F., Yang M., Fan Y., Deng D. Increased Toll-like receptor-myeloid differentiation factor 88 expression at the maternal-fetal interface is associated with spontaneous abortion. Gynecol. Obstet. Invest. 2017; 82(6): 553-62.
8. Bao S.H., Shuai W., Tong J., Wang L., Chen P., Sun J. Increased expression of Toll-like receptor 3 in decidual natural killer cells of patients with unexplained recurrent spontaneous miscarriage.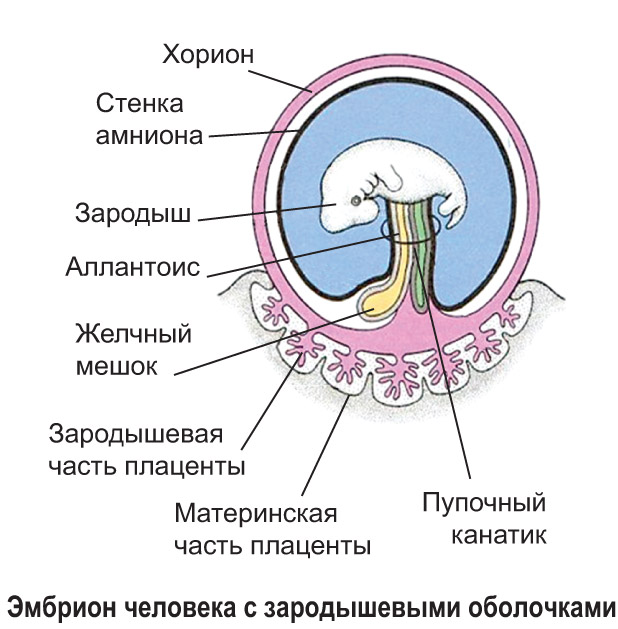 Eur. J. Obstet. Gynecol. Reprod. Biol. 2012; 165(2): 326-30.
Eur. J. Obstet. Gynecol. Reprod. Biol. 2012; 165(2): 326-30.
9. Potter J.A., Garg M., Girard S., Abrahams V.M. Viral single stranded RNA induces a trophoblast pro-inflammatory and antiviral response in a TLR8-dependent and-independent manner. Biol. Reprod. 2015; 92(1): 17.
10. Лебедева О.П., Пахомов С.П., Ивашова О.Н., Старцева Н.Ю., Чурносов М.И. Сигнальные рецепторы врожденного иммунитета в индукции апоптоза при невынашивании беременности ранних сроков. Акушерство и гинекология. 2015; 2: 39-43.
11. Pandey S., Kawai T., Akira S. Microbial sensing by Toll-like receptors and intracellular nucleic acid sensors. Cold Spring Harb. Perspect. Biol. 2015; 7(1): a016246.
12. Bustin S.A., Benes V., Garson J.A., Hellemans J., Huggett J., Kubista M. et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clin. Chem. 2009; 55(4): 611-22.
13. Pfaffl M.W. Quantification strategies in real-time PCR. In: Bustin S.A., ed. A-Z of quantitative PCR. La Jolla: Int. University Line; 2004: 87-112.
14. Kim S., Bauernfeind F., Ablasser A., Hartmann G., Fitzgerald K.A., Latz E. et al. Listeria monocytogenes is sensed by the NLRP3 and AIM2 inflammasome. Eur. J. Immunol. 2010; 40(6): 1545-51.
15. Jin T., Perry A., Jiang J., Smith P., Curry J.A., Unterholzner L. et al. Structures of the HIN domain: DNA complexes reveal ligand binding and activation mechanisms of the AIM2 inflammasome and IFI16 receptor. Immunity. 2012; 36(4): 561-71.
16. Hornung V., Ablasser A., Charrel-Dennis M., Bauernfeind F., Horvath G., Caffrey D.R. et al. AIM2 recognizes cytosolic dsDNA and forms a caspase-1-activating inflammasome with ASC. Nature. 2009; 458(7237): 514-8.
17. Хаитов Р.М., Ярилин А.А., Пинегин Б.В. Иммунология: атлас. М.: ГЭОТАР-Медиа; 2011. 624c.
18. Fernandes-Alnemri T., Yu J.W., Datta P., Wu J., Alnemri E.S. AIM2 activates the inflammasome and cell death in response to cytoplasmic DNA.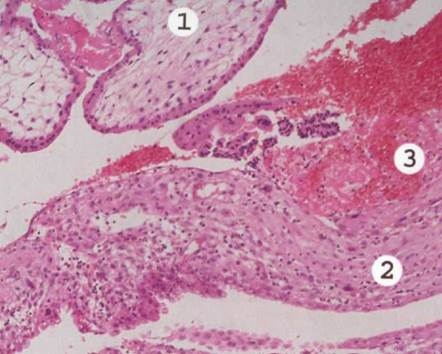 Nature. 2009; 458(7237): 509-13.
Nature. 2009; 458(7237): 509-13.
Поступила 22.11.2017
Принята в печать 22.12.2017
Лебедева Ольга Петровна, д.м.н., доцент, профессор кафедры акушерства и гинекологии ФГАОУ ВО Белгородский государственный национальный исследовательский университет. Адрес: 308015, Россия, Белгород, ул. Победы, д. 85. Телефон: 8 (4722) 26-85-91. E-mail: [email protected]. ORCID 0000-0002-7188-6780
Жукова Ирина Олеговна, ординатор кафедры акушерства и гинекологии ФГАОУ ВО Белгородский государственный национальный исследовательский университет. Адрес: 308015, Россия, Белгород, ул. Победы, д. 85. Телефон: 8 (4722) 26-85-91. E-mail: [email protected]. ORCID 0000-0002-8393-2852
Ивашова Олеся Николаевна, к.м.н., ассистент кафедры акушерства и гинекологии ФГАОУ ВО Белгородский государственный национальный исследовательский университет. Адрес: 308015, Россия, Белгород, ул. Победы, д. 85. Телефон: 8 (4722) 26-85-91. E-mail: [email protected]. ORCID 0000-0003-1480-2234
Пахомов Сергей Петрович, д.м.н., профессор, зав. кафедрой акушерства и гинекологии ФГАОУ ВО Белгородский государственный национальный исследовательский университет. Адрес: 308015, Россия, Белгород, ул. Победы, д. 85. Телефон: 8 (4722) 26-85-91. E-mail: [email protected]. ORCID 0000-0001-8113-4788
Чурносов Михаил Иванович, д.м.н., профессор, зав. кафедрой медико-биологических дисциплин ФГАОУ ВО Белгородский государственный национальный исследовательский университет.
Адрес: 308015, Россия, Белгород, ул. Победы, д. 85. Телефон: 8 (4722) 26-85-91. E-mail: [email protected]. ORCID 0000-0003-1254-6134
Для цитирования: Лебедева О.П., Жукова И.О., Ивашова О.Н., Пахомов С.П., Чурносов М.И. Роль рецепторов RIG-I, AIM2 и IFI16, распознающих вирусную ДНК и РНК, в патогенезе самопроизвольных выкидышей и неразвивающейся беременности ранних сроков. Акушерство и гинекология. 2018; 7: 57-61.
https://dx.doi.org/10.18565/aig.2018.7.57-61
Децидуальный полип: симптомы, диагностика, лечение.
Децидуальный полип – это новообразование в виде небольшого выроста, выступающее в просвет канала шейки матки или за его пределы. В период беременности гормональный фон женщины подвергается мощным изменением, в результате чего слизистая канала начинает разрастаться, то есть происходит ее децидуализация. Избыточное разрастание децидуальной (хориальной) ткани в результате приводит к ее проникновению в цервикальный канал в виде небольших наростов (полипов).
По данным научных исследований, практически 22% беременных женщин сталкиваются с доброкачественными патологическими процессами шейки матки, в частности, с полиповидными образованиями эндоцервикса (слизистой оболочки, выстилающей шейку матки изнутри).
Различают два вида полиповидных образований шейки матки:
- децидуальные псевдополипы;
- истинные полипы с децидуализацией.
Образование таких полипов сложно назвать заболеванием, поскольку в большинстве случаев они проходят самостоятельно после рождения ребенка и стабилизации гормонального фона. Однако такие образования способны вызвать беспокойство женщины, поскольку характеризуются наличием большого количества сосудов и начинают кровоточить при малейшем механическом воздействии, например, во время половой близости или медицинского обследования.
Травмированный полип представляет собой серьезную опасность, поскольку может быть инфицирован, а это способно вызвать серьезные воспалительные процессы в организме женщины. Необходимо срочно обратиться к специалисту, если обнаружили у себя любой из симптомов, указывающий на наличие полипа.
Симптомы и причины возникновения
Как уже было отмечено, поскольку тело децидуального полипа пронизано большим количеством кровеносных сосудов, он может начать кровить даже при малейшем повреждении. То есть кровянистые выделения из влагалища могут возникнуть в результате активных физических нагрузок или в процессе планового обследования в кабинете врача.
На что следует обращать внимание, если специалисты диагностировали наличие полипа:
- изменения цвета, состава и интенсивности выделений;
- возникновение болей и спазмов внизу живота;
- повышение температуры тела.
Любой из данных симптомов может свидетельствовать об инфицировании полипа и возникновении воспалительного процесса. Если новообразование постоянно кровоточит, следует пройти полное обследование, на основании которого специалист назначит адекватное лечение.
Этиология полипов до конца не изучена, но современная медицина выделяет несколько основных причин развития таких новообразований:
- гормональные нарушения;
- острые и хронические урогенитальные инфекции;
- эндокринные изменения в репродуктивной системе;
- перенесенные травмы шейки матки;
- повышенный уровень эстрогенов;
- нарушения в работе иммунной системы.
Особенно важно отслеживать децидуальный полип при беременности, и поскольку основными показателями состояния образования являются выделения, о любом изменении их состава необходимо сообщать гинекологу.
Децидуальный полип при беременности: диагностика и лечение
Децидуальные новообразования образуются из ткани плаценты или хориона и располагаются в шейке матки. Диагностика таких полипов не представляет особой сложности, поскольку они обнаруживаются при обычном исследовании шейки матки и цервикального канала – кольпоскопии. Процедура занимает всего несколько минут и является безболезненной. Обязательными являются общеклинические и бактериологические лабораторные исследования.
Обнаружив полип, врач проводит дифференциальную диагностику с паппиломой шейки матки, пролабирующими железами и травмированными кусочками ткани шейки матки, которые могут быть приняты за полип. С помощью мазка на онкоцитологию и в редких случаях биопсии определяется состояние полипа.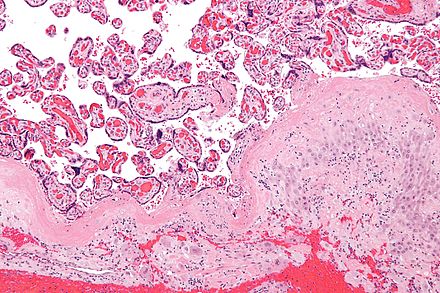 Также выполняется УЗИ органов малого таза с допплеометрическим картированием сосудов и эхоскопией полиповидного образования. После проведения полной диагностики и постановки точного диагноза назначается эффективное лечение.
Также выполняется УЗИ органов малого таза с допплеометрическим картированием сосудов и эхоскопией полиповидного образования. После проведения полной диагностики и постановки точного диагноза назначается эффективное лечение.
В большинстве случаев децидуальные образования не нуждаются в каком-либо лечении и самостоятельно проходят после нормализации гормонального фона. Естественному ходу родов такие полипы также не мешают, поэтому чаще всего после постановки диагноза специалисты просто наблюдают за развитием образования, контролируют внутреннюю флору влагалища и при необходимости могут назначить противовоспалительное лечение.
Однако децидуальный полип при беременности подлежит немедленному удалению, если наблюдаются такие симптомы:
- образование постоянно кровоточит;
- возникают изъязвления на поверхности полипа;
- наличие полипа провоцирует спазмы и повышает тонус матки;
- появляются деструктивные изменения в инфицированном полипе.
Удаляют полип методом откручивания с применением лазера, эндоскопа, с последующей термо- и криокоагуляцией образования. Данный способ оперативного вмешательства является малоинвазивным и не требует выскабливания цервикального канала, поэтому может использоваться при беременности.
Диагностика и лечение децидуального полипа в ОН КЛИНИК
Большинство женщин обращаются к гинекологу лишь при возникновении болезненных или дискомфортных ощущений. Но, чтобы сохранить собственное здоровье и выявить заболевание на самой ранней стадии развития, следует проводить регулярные гинекологические осмотры. Если у Вас возникли любые сомнения по поводу здоровья или появились тревожные симптомы, свидетельствующие о каких-либо нарушениях, рекомендуем незамедлительно обратиться к специалистам нашей клиники.
Медицинский центр ОН КЛИНИК – это команда профессионалов с огромным практическим опытом и прогрессивной диагностической базой. В своей работе наши гинекологи используют уникальные методы диагностики и лечения любых женских заболеваний, что позволит в короткий срок справиться с патологией и полностью устранить все проявления болезни на самом раннем этапе развития.
В своей работе наши гинекологи используют уникальные методы диагностики и лечения любых женских заболеваний, что позволит в короткий срок справиться с патологией и полностью устранить все проявления болезни на самом раннем этапе развития.
Ультразвуковая диагностика с объемным сканированием позволяет точно определить наличие и локализацию образований, а современные безоперационные методы позволяют проводить малоинвазивные вмешательства без риска возникновения каких-либо осложнений.
ОН КЛИНИК: тысячи женщин вернулись к здоровой жизни благодаря профессиональной работе наших врачей. Присоединяйтесь!
Децидуальная оболочка — материнское ложе, охватывающее эмбрион — поддерживает беременность
Abstract
Децидуальная оболочка известна как материнская ткань матки, которая играет важную роль в защите эмбриона от нападения материнских иммунных клеток и обеспечивает питательную поддержку для развитие эмбриона до образования плаценты. Однако есть вопросы, на которые еще предстоит ответить: (1) Как децидуальная оболочка обеспечивает питание и физическую основу для растущего эмбриона до установления связи с плацентарными сосудами? (2) Как устанавливается баланс между предотвращением иммунного ответа против эмбриона и защитой эмбриона и матери от инфекций? Чтобы понять основные особенности децидуальных тканей, мы рассмотрим структуру децидуальной оболочки, состоящую из терминально дифференцированных стромальных клеток матки, кровеносных сосудов и ряда репертуаров местных иммунных клеток матки, включая хорошо известные клетки естественных киллеров матки (uNK) и недавно открыли врожденные лимфоидные клетки (ВЛК).Децидуальные макрофаги и дендритные клетки матки (ДК) должны модулировать адаптивный иммунитет посредством балансировки цитокинов и стимулирования генерации регуляторных Т-клеток (T reg ). Во время децидуализации ремоделирование сосудов и тканей в матке обеспечивает питательную и физическую поддержку развивающегося эмбриона.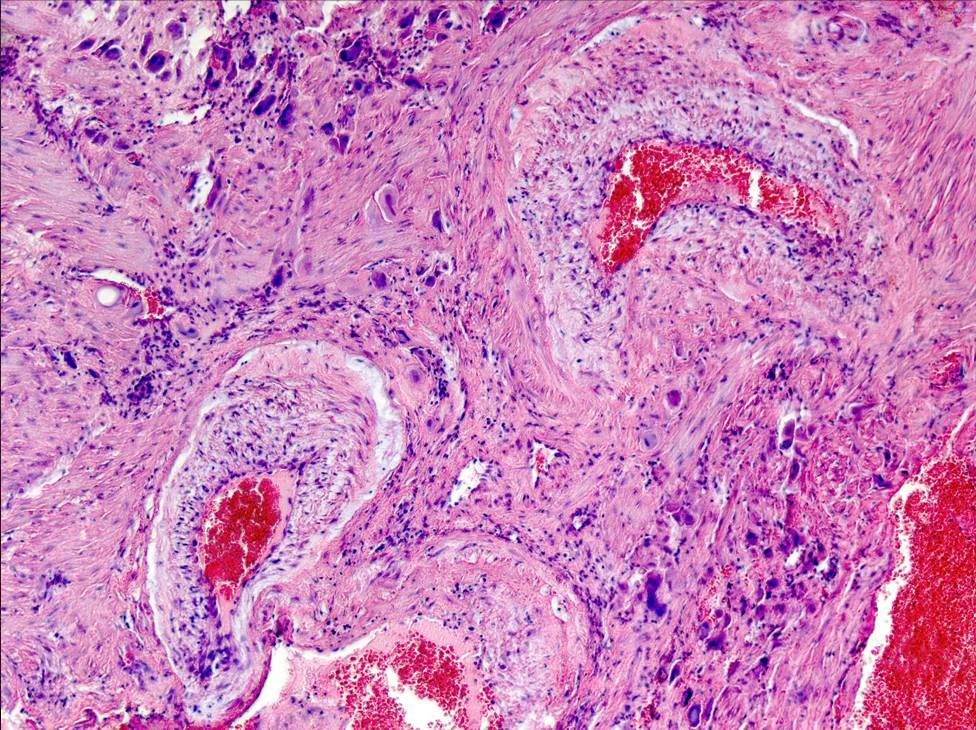 Секреция различных цитокинов и хемокинов как из эмбриона, так и из децидуальных клеток активирует множественную сигнальную сеть между матерью и эмбрионом после имплантации.Дефекты децидуального развития на ранних сроках беременности приводят к прерыванию беременности или осложнениям на более поздних сроках беременности.
Секреция различных цитокинов и хемокинов как из эмбриона, так и из децидуальных клеток активирует множественную сигнальную сеть между матерью и эмбрионом после имплантации.Дефекты децидуального развития на ранних сроках беременности приводят к прерыванию беременности или осложнениям на более поздних сроках беременности.
Ключевые слова: Децидуальная оболочка, эндометрий, беременность, бесплодие, преэклампсия, ремоделирование сосудов
Введение
Децидуальная оболочка является временной, но важной платформой в ткани матки, которая включает терминально дифференцированные стромальные клетки эндометрия, вновь образованные материнские сосудистые клетки, и клетки материнской крови внутри и снаружи сосудов.Развитие децидуальной оболочки после прикрепления бластоцисты к стенке матки — это резкое ремоделирование ткани, включающее физические и гуморальные изменения в жилых и рекрутированных иммунных клетках. На незаменимость децидуальной ткани для имплантации эмбриона и поддержания беременности до стадии формирования плаценты впервые указала ее физическая важность, когда у мышей была вызвана попытка переноса бластоцисты в брюшную полость и не удалось [1], и когда образование децидуальных маточных труб было нарушено наблюдалась в некоторых случаях эктопической имплантации человека в яичник или брюшную полость [2], а также когда наблюдалась потеря эмбриона в результате опосредованной овариэктомией отмены прогестерона из-за «коллапса» децидуальной оболочки крысы [3].Таким образом, децидуализация ткани матки необходима для успешной беременности, но как она возникает и как влияет на рост эмбриона?
Децидуальные паренхимные клетки, в дальнейшем называемые децидуальными клетками, происходят из маточных стромальных фибробластоподобных клеток эндометрия. Они представляют собой большие, круглые и многоядерные полиплоидные клетки, богатые гликогеном и липидами и продуцирующие множество функциональных маркеров, таких как пролактин и родственные ему белки семейства, а также белки, связывающие инсулиноподобный фактор роста (IGFBP). Эмбрион мыши на стадии бластоцисты прикрепляется к просвету матки на гестационный день (gd) 4.0 после полового акта, и первичная децидуальная зона (PDZ) сразу устанавливается в слое эндометрия, ближайшем к имплантированному эмбриону (рис.). Это считается первым защитным каркасом для эмбрионального роста с бессосудистым и плотным клеточным составом [9]. К gd 5.5 PDZ завершается, в то время как вторичная децидуальная зона (SDZ), окружающая эмбрион и PDZ, развивается в терминальную дифференцировку децидуальных стромальных клеток, начиная от антимезометрия к области мезометрия.Напротив, область мезометрия, видимая с gd 6.5, состоит из сильно расширенной большой сосудистой сети, и децидуальные области мезометрия и антимезометрия уменьшаются с gd 8.5 вместе с образованием плаценты [10]. Сопутствующий ангиогенез в децидуализирующемся эндометрии и ремоделирование спиральной артерии на ранних сроках беременности как у человека, так и у грызунов убедительно свидетельствует о том, что питание, обеспечиваемое материнскими кровеносными сосудами, необходимо для раннего эмбрионального роста до соединения с плацентой.
Эмбрион мыши на стадии бластоцисты прикрепляется к просвету матки на гестационный день (gd) 4.0 после полового акта, и первичная децидуальная зона (PDZ) сразу устанавливается в слое эндометрия, ближайшем к имплантированному эмбриону (рис.). Это считается первым защитным каркасом для эмбрионального роста с бессосудистым и плотным клеточным составом [9]. К gd 5.5 PDZ завершается, в то время как вторичная децидуальная зона (SDZ), окружающая эмбрион и PDZ, развивается в терминальную дифференцировку децидуальных стромальных клеток, начиная от антимезометрия к области мезометрия.Напротив, область мезометрия, видимая с gd 6.5, состоит из сильно расширенной большой сосудистой сети, и децидуальные области мезометрия и антимезометрия уменьшаются с gd 8.5 вместе с образованием плаценты [10]. Сопутствующий ангиогенез в децидуализирующемся эндометрии и ремоделирование спиральной артерии на ранних сроках беременности как у человека, так и у грызунов убедительно свидетельствует о том, что питание, обеспечиваемое материнскими кровеносными сосудами, необходимо для раннего эмбрионального роста до соединения с плацентой.
Анатомическая локализация материнских иммунных клеток децидуальной оболочки мыши.Из-за сложности получения образцов от здоровых беременных женщин на самой ранней стадии беременности показано тканевое распределение материнских иммунных клеток в матке мышей на гестационный день (gd) 5.5 и 7.5. Первичная децидуальная зона (PDZ) бессосудистая, и клетки CD45 + практически не обнаруживаются [4]. Вторичная децидуальная зона (SDZ) на gd 5.5 и антимезометриальная децидуальная зона на gd 7.5 богаты мелкими кровеносными сосудами, тогда как область мезометрия на gd 7.5 окружена латеральными расширенными крупными сосудами (не показаны).В децидуальной оболочке мезометрия наиболее часто встречаются uNK клетки [5], также см. Рис.], DCs ограничены всей децидуальной оболочкой [6]. Помимо uILC1 в децидуальной оболочке, другие uILCs обнаруживаются в области мезометрия и миометрии [7], но о взаимодействии uILCs с сосудистой сетью или другими иммунными клетками не сообщалось. За исключением сообщения о подавлении инфильтрации цитотоксических эффекторных Т-клеток в децидуальной оболочке [8], субпопуляции Т-клеток внутри децидуальной оболочки мыши не были хорошо известны. Макрофаги могут быть обнаружены в области между трофобластом и стромальными клетками матки в ассоциации с эндотелиальными клетками сосудов [4].Обратите внимание, что количество репрезентативных типов клеток не согласуется с фактическими популяциями
За исключением сообщения о подавлении инфильтрации цитотоксических эффекторных Т-клеток в децидуальной оболочке [8], субпопуляции Т-клеток внутри децидуальной оболочки мыши не были хорошо известны. Макрофаги могут быть обнаружены в области между трофобластом и стромальными клетками матки в ассоциации с эндотелиальными клетками сосудов [4].Обратите внимание, что количество репрезентативных типов клеток не согласуется с фактическими популяциями
Развитие децидуальной оболочки и ее молекулярные механизмы
Регуляторы децидуализации снаружи и внутри стромы матки
Циклические колебания клеточной дифференцировки эндометрия и последующая апоптотическая смерть в матке человека находятся под гормональным контролем. В отсутствие энтопического эмбриона в матке децидуальная оболочка человека может формироваться обычным образом, а затем опадать (как листья на лиственном дереве , откуда происходит слово «децидуальная»).У грызунов искусственная децидуализация может наблюдаться как реакция децидуомы после легкой физической стимуляции псевдобеременной матки без эмбрионов. По сравнению с беременной маткой, различные модели децидуомы у мышей показывают более увеличенные размеры матки и небольшие различия в экспрессии децидуальных маркеров, таких как щелочная фосфатаза 2 и Wnt4 [11]. Передача сигналов между эмбрионом и эпителием просвета матки, опосредованная молекулами адгезии, такими как интегрины и углеводные фрагменты гликопротеинов, приводящая к апоптозу просветного эпителия и последующему взаимодействию между эпителием и проксимальными стромальными клетками, также считается вовлеченной в начальную децидуальную дифференцировку [ 12].
При использовании искусственной децидуомы у грызунов, о которых говорилось выше, нарушение децидуализации было продемонстрировано у мышей с дефицитом рецепторов прогестерона (PR) или связанных с PR путей (Bmp2, Wnt4, Hoxa10 и Hoxa11) [13–16], что указывает на то, что эндокринная система играет основную роль в децидуализации [17]. Другие пути, участвующие в принятии бластоцист посредством местной и системной регуляции в материнском эпителии матки и эндометрии, рассмотрены в другом месте [18]. Модель на мышах с дефицитом передачи сигналов цитокина интерлейкина-11 (IL-11) (IL-11Rα — / — ) [19] демонстрирует нарушение децидуализации, сопровождающееся снижением пролиферации стромальных клеток матки [20].После того, как пролиферация и дифференцировка децидуальных клеток инициированы, они переходят к мульти-нуклеаризации, то есть репликации ДНК без деления клеток (эндо-редупликация / полиплоидия), что позволяет экспрессировать несколько генов и секрецию транслированных белков с меньшим потреблением энергии, и считается важным признаком децидуального созревания у грызунов и людей [21, 22]. На модели мышей с дефицитом белка, содержащего эффекторный домен смерти (Dedd) [23], было показано, что двунаправленные пути передачи сигналов Akt и циклина D3 / Cdk4 / Cdk6 вносят вклад в мультинуклеаризацию децидуальных клеток.В отсутствие Dedd стабильность белков комплексов Akt [23, 24] и Cyclin D3 / Cdk4 / Cdk6 снижается, что соответствует более низкому коэффициенту мульти-ядерности в децидуальных клетках. Как показано на культурах децидуальных и эндометриальных клеток человека [25], передача сигналов Akt связана с децидуальной дифференцировкой. Das SK et al. предположил, что cyclin D3, в ассоциации с Cdk4, Cdk6 и p21, является важным регулятором клеточного цикла в эндо-редупликации мульти-ядерных децидуальных клеток мыши [26].Также показано, что экспрессия циклина D3 и p21 находится ниже передачи сигналов IL-11 [27]. Любопытно, что хотя самки мышей Dedd — / — не могут производить потомства, а самки мышей IL-11Rα — / — сильно бесплодны, любой единичный нокаут Akt1, Akt2, Akt3 или циклина D3 не вызывает полного бесплодие, что свидетельствует о важности Dedd как главного регулятора в вышестоящей сети этих множественных белков. Связь между эндокринной системой и передачей сигналов цитокинов или путем Dedd не выяснена.
Другие пути, участвующие в принятии бластоцист посредством местной и системной регуляции в материнском эпителии матки и эндометрии, рассмотрены в другом месте [18]. Модель на мышах с дефицитом передачи сигналов цитокина интерлейкина-11 (IL-11) (IL-11Rα — / — ) [19] демонстрирует нарушение децидуализации, сопровождающееся снижением пролиферации стромальных клеток матки [20].После того, как пролиферация и дифференцировка децидуальных клеток инициированы, они переходят к мульти-нуклеаризации, то есть репликации ДНК без деления клеток (эндо-редупликация / полиплоидия), что позволяет экспрессировать несколько генов и секрецию транслированных белков с меньшим потреблением энергии, и считается важным признаком децидуального созревания у грызунов и людей [21, 22]. На модели мышей с дефицитом белка, содержащего эффекторный домен смерти (Dedd) [23], было показано, что двунаправленные пути передачи сигналов Akt и циклина D3 / Cdk4 / Cdk6 вносят вклад в мультинуклеаризацию децидуальных клеток.В отсутствие Dedd стабильность белков комплексов Akt [23, 24] и Cyclin D3 / Cdk4 / Cdk6 снижается, что соответствует более низкому коэффициенту мульти-ядерности в децидуальных клетках. Как показано на культурах децидуальных и эндометриальных клеток человека [25], передача сигналов Akt связана с децидуальной дифференцировкой. Das SK et al. предположил, что cyclin D3, в ассоциации с Cdk4, Cdk6 и p21, является важным регулятором клеточного цикла в эндо-редупликации мульти-ядерных децидуальных клеток мыши [26].Также показано, что экспрессия циклина D3 и p21 находится ниже передачи сигналов IL-11 [27]. Любопытно, что хотя самки мышей Dedd — / — не могут производить потомства, а самки мышей IL-11Rα — / — сильно бесплодны, любой единичный нокаут Akt1, Akt2, Akt3 или циклина D3 не вызывает полного бесплодие, что свидетельствует о важности Dedd как главного регулятора в вышестоящей сети этих множественных белков. Связь между эндокринной системой и передачей сигналов цитокинов или путем Dedd не выяснена.
Ангиогенез матки и ремоделирование тканей
Ремоделирование эндотелия сосудов, модулируемое стероидными гормонами
Во время менструального цикла и до имплантации стероидные гормоны яичников, 17β-эстрадиол (E 2 ) и прогестерон (P ) 4 модулируют развитие и функции сосудов матки, что приводит к резким изменениям объема, эластичности и транспортировки питательных веществ всей маткой. E 2 оказывает большее влияние на проницаемость сосудов за счет подавления молекул адгезии, таких как E-селектин, молекула адгезии сосудистых клеток-1 (VCAM-1) и молекула межклеточной адгезии-1 (ICAM-1) в эндотелиальных клетках пупочной вены человека. (HUVEC) [28].С другой стороны, P 4 оказывает большее ангиогенное действие на HUVEC за счет индукции пролиферативных факторов из клеток эндометрия, таких как фактор роста эндотелия сосудов A (VEGFA), ангиопоэтин-2 (ANGPT2) и фактор роста фибробластов 2 (FGF2) [ 29]. P 4 может также непосредственно подавлять экспрессию ICAM-1 в HUVEC [30]; однако этот эффект, по-видимому, минимален in vivo. VEGF также экспрессируется в строме эндометрия в секреторной фазе и в децидуальных клетках беременных как у мышей, так и у людей [31, 32].Angpt2 и другие ангиогенные факторы также регулируются внутриутробным E 2 [33]. Сам по себе быстрый ангиогенез может вызвать ослабление структуры сосудистой сети, что приведет к локальной гипер проницаемости, например, в опухолевом поражении [34]. Действие эндокринных факторов на эндотелиальные и гладкомышечные клетки сосудов может влиять на стабильность сосудов, чтобы изменить обмен веществ, таких как свободные жирные кислоты, загруженные в плазменный альбумин и клетки крови, между кровью и стромальной тканью, а также регулировать экспрессию поверхностных молекул для набора специфичных для матки. иммунные клетки.
Морфологический динамизм в ткани матки
Децидуальные клетки не только секретируют факторы роста, но также высвобождают тканевый ингибитор матриксных металлопротеиназ (ТИМП) для подавления производных от трофобластов матричных металлопротеиназ (ММП) [35, 36] и экспрессируют контактные -зависимые сигнальные молекулы, такие как коннексин 43 (Сх43) [37].
 Хотя не все матричные белки, как было показано, специфически экспрессируются в децидуальных клетках человека или мыши, α 2 -макроглобулин, один из мощных ингибиторов ММП, был показан ниже по течению от вызываемого IL-11 JAK-STAT3. у грызунов [38], который также участвует в стромальных клетках эндометрия человека (hESCs) [39].Модель на мышах с использованием условного нокаута Cx43 посредством рекомбинации PR-Cre показала важность Cx43 стромы матки для пролиферации эндотелия сосудов при gd 7.5 [37]. Матка, дефицитная по Сх43, демонстрирует недостаточный ответ децидуомы, сопровождаемый сниженным ангиогенезом сосудов матки. Этот эффект, возможно, связан с коммуникацией щелевого соединения между децидуальными клетками, которые секретируют VEGF и ангиопоэтины, но связь между децидуальной оболочкой и эндотелиальными клетками сосудов еще предстоит исследовать.
Хотя не все матричные белки, как было показано, специфически экспрессируются в децидуальных клетках человека или мыши, α 2 -макроглобулин, один из мощных ингибиторов ММП, был показан ниже по течению от вызываемого IL-11 JAK-STAT3. у грызунов [38], который также участвует в стромальных клетках эндометрия человека (hESCs) [39].Модель на мышах с использованием условного нокаута Cx43 посредством рекомбинации PR-Cre показала важность Cx43 стромы матки для пролиферации эндотелия сосудов при gd 7.5 [37]. Матка, дефицитная по Сх43, демонстрирует недостаточный ответ децидуомы, сопровождаемый сниженным ангиогенезом сосудов матки. Этот эффект, возможно, связан с коммуникацией щелевого соединения между децидуальными клетками, которые секретируют VEGF и ангиопоэтины, но связь между децидуальной оболочкой и эндотелиальными клетками сосудов еще предстоит исследовать.
Классическая иммунология децидуальной оболочки
Чтобы оспорить привилегированную иммунную функцию децидуальной оболочки в отношении эмбрионального трансплантата, была протестирована первая экспериментальная трансплантация кожного аллотрансплантата на децидуальной оболочке грызунов [40]. Аллотрансплантат просуществовал дольше, однако в конечном итоге трансплантат был отторгнут у предварительно иммунизированного беременного грызуна. В отличие от другой неудачной попытки трансплантации отцовского кожного аллотрансплантата, испытанного в хориодецидуальном соединении крысы [41], эмбрионы, окруженные предположительно отцовскими антиген-положительными трофобластами, могут быть приняты.Ранние исследования также изучали существование иммунодепрессантов из децидуальной культуры мышей in vitro [42] и гормонозависимых супрессорных клеток независимо от имплантированных эмбрионов [43]. Однако эти исследования не смогли идентифицировать подмножество клеток или молекул, происходящих из децидуальной оболочки.
В современную эпоху, с развитием технологий проточной цитометрии и визуализационного анализа, ряд исследований описал присутствие, распределение и функции материнских иммунных клеток в децидуальной ткани на ранней стадии беременности (рис. , Стол ). Децидуальная оболочка содержит большое количество материнских иммунных клеток, которые предположительно устанавливают баланс между защитой от патогенов и толерантностью эмбриона. Основные популяции включают клетки врожденного иммунитета, то есть клетки uNK и макрофаги. Однако нельзя игнорировать небольшие популяции ILC и адаптивных иммунных клеток. Более того, для здоровья матери и плода в будущем важно, чтобы децидуальная оболочка, в которой находится эмбрион, могла обеспечивать защитные реакции против патогенов без чрезмерного воспаления или повреждения эмбриона / плода.Глядя на основные функции и характеристики этих иммунных клеток, отслеживая результаты дефицита или аномалии в каждом компоненте этих иммунных подмножеств, мы можем пролить свет на их роль и важность в нормальных и патологических состояниях.
, Стол ). Децидуальная оболочка содержит большое количество материнских иммунных клеток, которые предположительно устанавливают баланс между защитой от патогенов и толерантностью эмбриона. Основные популяции включают клетки врожденного иммунитета, то есть клетки uNK и макрофаги. Однако нельзя игнорировать небольшие популяции ILC и адаптивных иммунных клеток. Более того, для здоровья матери и плода в будущем важно, чтобы децидуальная оболочка, в которой находится эмбрион, могла обеспечивать защитные реакции против патогенов без чрезмерного воспаления или повреждения эмбриона / плода.Глядя на основные функции и характеристики этих иммунных клеток, отслеживая результаты дефицита или аномалии в каждом компоненте этих иммунных подмножеств, мы можем пролить свет на их роль и важность в нормальных и патологических состояниях.
Таблица 1
Состав иммунных клеток матки на стадии постимплантации у мышей
| Virgin | gd 5.5 | gd 6.5 | gd 7.5∼9.5 | |
|---|---|---|---|---|
| uNK | DBA — 10 a ∼20% b | DBA — <5% b | DBA — 8% a | DBA — 8% a |
| DBA + 0% f | DBA + N.D. | DBA + <2% a, f | DBA + 20% a | |
| Mϕ | 8% b | 20% b | 30% f | ND |
| DC | 2∼3% b, d | 5∼6% d | 15% f | 15% e |
| T | <1% f | N.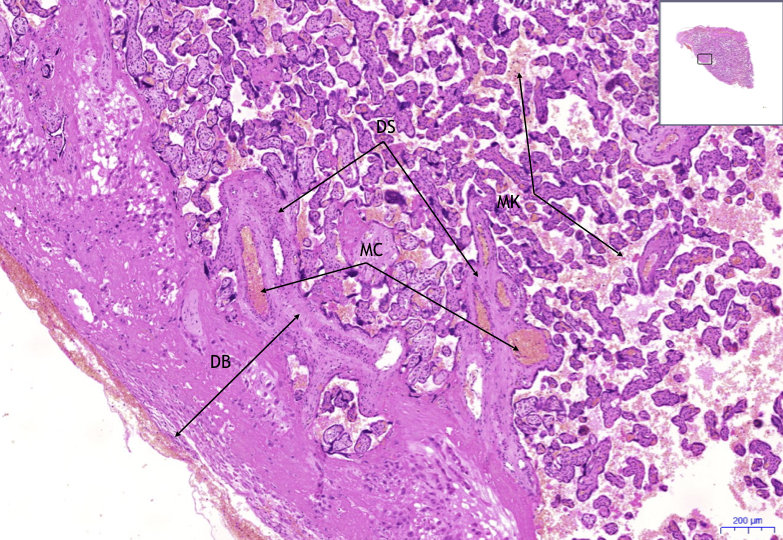 D. D. | <1% f | ND |
| uILCs | Очень мало ILC c uILC1 является доминирующим | ND | ND | Очень мало ILC c uILC3 является доминирующим |
NK-клетки матки
Природные киллерные (NK) клетки происходят из плюрипотентных гемопоэтических стволовых клеток в костном мозге и развиваются как лимфоидные, но без перестройки рецепторного гена, как в случае Т-клеток.NK-клетки опосредуют врожденный клеточный иммунитет против патогенов и раковых клеток. Зрелые NK-клетки обладают как активирующими, так и ингибирующими рецепторами для MHC класса I, такими как подтипы Ly49 у мышей и ингибирующие рецепторы киллеров (KIR) у человека [48]. У них также есть MHC-независимые рецепторы естественной цитотоксичности (NCR). У человека периферические и маточные NK-клетки представляют две фенотипически разные популяции (таблица). Большинство периферических NK-клеток человека экспрессируют низкую плотность CD56 (CD56 dim ) и высокие уровни FCγRIII (CD16 + ), что указывает на ADCC-опосредованные цитотоксические функции, в то время как остальные из них экспрессируют высокую плотность CD56 (CD56 , яркий ) и являются CD16-отрицательными, что соответствует низкой цитотоксичности.Клетки uNK составляют от 60 до 70% всех децидуальных лимфоцитов в первом триместре беременности человека [49]. В отличие от периферических подмножеств NK, большинство децидуальных NK-клеток представляют собой CD16 — CD56 светлые . Помимо фенотипических различий, маточные и периферические NK-клетки выполняют разные функции. Периферические NK-клетки CD16 + CD56 dim являются гранулярными и цитотоксическими, тогда как второстепенная подгруппа периферических NK не содержит цитоплазматических гранул и не наделена цитотоксическим потенциалом, но играет иммуно-регулирующую роль посредством продукции цитокинов [50]. Децидуальные NK-клетки содержат цитотоксические гранулы [51] и избирательно сверхэкспрессируют гены секретируемых белков с известной иммуносупрессивной активностью [49], а также перфорин и гранзимы A и B [52]. У мышей два разных подмножества uNK-клеток различаются по реактивности периодической кислоты-Шиффа (PAS) и агглютинина Dolichos biflorus (DBA). PAS + DBA — клетки продуцируют IFN-γ, который участвует в ремоделировании материнской спиральной артерии [53], тогда как популяция PAS + DBA + продуцирует ангиогенные факторы [54-56].Яди и др. [44] описывают два различных подмножества NK-клеток CD3 — CD122 + в матке мышей в середине гестации: небольшая подгруппа, аналогичная периферическим NK-клеткам, и большая подмножество DBA + , которое экспрессирует активирующий рецептор NKp46 и ингибирующий рецептор Ly49s, но не NK1.1 или DX5. Следует отметить, что через материнскую кровь, которая перфузирует плаценту, обе группы NK-клеток периферической крови могут контактировать с тканями плода. NK-клетки матки обладают низкой спонтанной цитотоксичностью, что согласуется с согласованным присутствием неклассических молекул MHC на трофобласте и экспрессией ингибирующих рецепторов на NK-клетках, что приводит к снижению дегрануляции [57].Однако в присутствии патогенов пропорции активирующих и ингибирующих рецепторов могут изменяться, что способствует цитотоксичности [58]. В настоящее время нет доказательств того, что цитотоксический потенциал NK-клеток имеет какое-либо прямое влияние на трофобласт, в то время как материнский MHC, но не отцовский MHC, как было показано, обучает uNK-клетки через соответствующие рецепторы Ly49 для производства IFN-γ в качестве фактора ремоделирования сосудов. [59]. Предшественники uNK-клеток мыши либо происходят извне матки [60], либо дифференцируются от резидентных гемопоэтических предшественников [61] в присутствии других иммунных клеток.У мышей SCID дифференцировка uNK-клеток в базальной децидуальной оболочке задерживается в течение раннего периода плацентации из-за отсутствия функциональных Т- и В-клеток [62].
Децидуальные NK-клетки содержат цитотоксические гранулы [51] и избирательно сверхэкспрессируют гены секретируемых белков с известной иммуносупрессивной активностью [49], а также перфорин и гранзимы A и B [52]. У мышей два разных подмножества uNK-клеток различаются по реактивности периодической кислоты-Шиффа (PAS) и агглютинина Dolichos biflorus (DBA). PAS + DBA — клетки продуцируют IFN-γ, который участвует в ремоделировании материнской спиральной артерии [53], тогда как популяция PAS + DBA + продуцирует ангиогенные факторы [54-56].Яди и др. [44] описывают два различных подмножества NK-клеток CD3 — CD122 + в матке мышей в середине гестации: небольшая подгруппа, аналогичная периферическим NK-клеткам, и большая подмножество DBA + , которое экспрессирует активирующий рецептор NKp46 и ингибирующий рецептор Ly49s, но не NK1.1 или DX5. Следует отметить, что через материнскую кровь, которая перфузирует плаценту, обе группы NK-клеток периферической крови могут контактировать с тканями плода. NK-клетки матки обладают низкой спонтанной цитотоксичностью, что согласуется с согласованным присутствием неклассических молекул MHC на трофобласте и экспрессией ингибирующих рецепторов на NK-клетках, что приводит к снижению дегрануляции [57].Однако в присутствии патогенов пропорции активирующих и ингибирующих рецепторов могут изменяться, что способствует цитотоксичности [58]. В настоящее время нет доказательств того, что цитотоксический потенциал NK-клеток имеет какое-либо прямое влияние на трофобласт, в то время как материнский MHC, но не отцовский MHC, как было показано, обучает uNK-клетки через соответствующие рецепторы Ly49 для производства IFN-γ в качестве фактора ремоделирования сосудов. [59]. Предшественники uNK-клеток мыши либо происходят извне матки [60], либо дифференцируются от резидентных гемопоэтических предшественников [61] в присутствии других иммунных клеток.У мышей SCID дифференцировка uNK-клеток в базальной децидуальной оболочке задерживается в течение раннего периода плацентации из-за отсутствия функциональных Т- и В-клеток [62].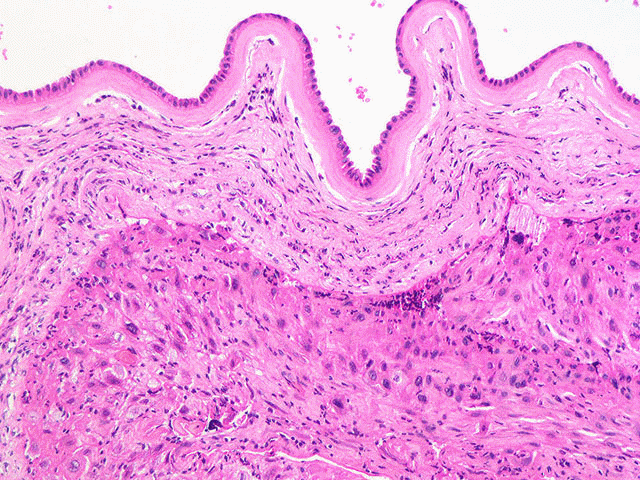 Число резидентных популяции NK-клеток снижается между gd 0,5 и 5,5 [45] и считается замещенным рекрутированными внематочными предшественниками, которые дифференцируются в клетки uNK. DBA + NK-клеток мало в децидуальной оболочке на gd 5.5, в то время как с gd 6.5 увеличивается количество NK-клеток DBA + и PAS + DBA — NK-клеток ([63], рис.).
Число резидентных популяции NK-клеток снижается между gd 0,5 и 5,5 [45] и считается замещенным рекрутированными внематочными предшественниками, которые дифференцируются в клетки uNK. DBA + NK-клеток мало в децидуальной оболочке на gd 5.5, в то время как с gd 6.5 увеличивается количество NK-клеток DBA + и PAS + DBA — NK-клеток ([63], рис.).
Таблица 2
Основные различия между периферическими NK-клетками человека и uNK-клетками
| Периферические NK-клетки | NK-клетки матки | |
|---|---|---|
| (90%) | (10%) | |
| CD56 тусклый | CD56 яркий | CD56 яркий |
| CD16 + | CD16 — | CD16 — |
| Цитотоксичный | Нетоксичный | Низкий цитотоксичность |
| Гранулированный | Негранулярный, продуцирующий цитокины | Гранулированный |
| LFA1 + | CCR7 + | |
| Перфорин + гранзим + | Перфорин + granzyme + | |
Распределение клеток uNK в e ранняя стадия беременности у мышей.Срезы матки самок мышей C57BL / 6 при gd 5.5 ( a ) и gd 6. 5 ( b — d ) окрашивали лектином DBA (A-C) или PAS (D). a В gd 5.5 NK-клетки DBA + практически не обнаруживаются. b При gd 6.5 NK-клетки DBA + все чаще обнаруживаются в мезометриальной области. c Большое увеличение b. d На непрерывном участке c обнаружено большее количество NK-ячеек PAS + . Тонкие стрелки : PAS + ячеек, толстые стрелки : DBA + ячеек. Bars , a , b 500 мкм, c , d 100 мкм
5 ( b — d ) окрашивали лектином DBA (A-C) или PAS (D). a В gd 5.5 NK-клетки DBA + практически не обнаруживаются. b При gd 6.5 NK-клетки DBA + все чаще обнаруживаются в мезометриальной области. c Большое увеличение b. d На непрерывном участке c обнаружено большее количество NK-ячеек PAS + . Тонкие стрелки : PAS + ячеек, толстые стрелки : DBA + ячеек. Bars , a , b 500 мкм, c , d 100 мкм
Интерлейкин-15 (IL-15) является критическим регулятором дифференцировки NK- и uNK-клеток [64, 65]. IL-15 — / — самки лишены uNK-клеток, а также ремоделирования спиральной артерии [66, 67]. Недавнее исследование [68], однако, сравнило профили экспрессии генов в местах имплантации матки во время децидуализации на gd 7.5 между мышами дикого типа и мышами с дефицитом uNK (IL-15 — / — ) и не обнаружил различий в экспрессии генов, участвующих в децидуализации или ангиогенезе, за исключением Adamts9, который является антиангиогенным фактором, экспрессируемым с большей скоростью в IL-15 — / — , чем у мышей дикого типа. Мышиные модели с дефицитом иммунных клеток показали важность вклада NK-клеток в имплантацию и нормальную беременность. Модель мышиного лимфоида, Rag2 — / — Δγc, в которой системно отсутствуют Т, В и NK-клетки, имеет недостаточный ранний децидуальный ангиогенез, задержку раннего эмбрионального развития и неспособность модификации спиральной артерии в середине беременности.Все эти аномалии корректируются восстановлением трансплантатами NK + T — B — перед спариванием [69]. Эффекты клеточного контакта uNK-клетки с другими лимфоцитами или другими децидуально-резидентными клетками в значительной степени неизвестны, но было показано, что растворимые факторы из uNK-клеток, такие как IFN-γ, вносят вклад в ремоделирование спиральной артерии [70] на моделях NK-дефицитных мышей. У человека клетки uNK также генерируют ряд ангиогенных факторов роста, например, VEGF, ANGPT-1, 2, трансформирующий фактор роста-β (TGF-β) [71] и фактор роста плаценты (PlGF) [72, 73] .Как следствие неадекватного ремоделирования спиральной артерии можно ожидать преэклампсии и задержки внутриутробного развития; однако данные из разных лабораторий противоречат друг другу. Это, вероятно, связано с различиями в фокусе внимания на периферических и децидуальных NK-клетках и их подмножествах, а также с разнообразием эффектов, возникающих после преэклампсии и аборта, которые могут запускать цитотоксическую активацию NK. Недавний отчет показал, что беременные женщины с высоким индексом доплеровской резистентности, указывающим на нарушение ремоделирования спиральной артерии и более высокий риск преэклампсии, обладают нецитотоксическими децидуальными NK-клетками, как и нормальные беременные женщины, но со сниженной экспрессией KIR2DL / S1, 3, 5, рецепторы против антигена С канонического локуса гистосовместимости класса I (HLA-C) и LILRB1 против HLA-G на трофобласте [74].Противоречиво, что истощение in vivo NK-клеток антителом против асиало-ганглио-N-тетраозилцерамида (asialo-GM1) снижает частоту абортов у склонных к аборту самок мышей CBA / J, спариваемых с самцами мышей DBA / 2J [75]. Считается, что это происходит из-за двойной стороны цитотоксических и ремоделирующих сосуды NK-клеток, поскольку аналогичное истощение NK у мышей CB17 SCID, лишенных эффекторных Т- и В-клеток, показало повышенную частоту абортов [76]. Вероятно, это связано с отсутствием врожденного иммунитета против местных бактерий. Таким образом, когда NK-клетки истощаются системно, следует учитывать различную цитотоксичность в двух подгруппах uNK-клеток.
У человека клетки uNK также генерируют ряд ангиогенных факторов роста, например, VEGF, ANGPT-1, 2, трансформирующий фактор роста-β (TGF-β) [71] и фактор роста плаценты (PlGF) [72, 73] .Как следствие неадекватного ремоделирования спиральной артерии можно ожидать преэклампсии и задержки внутриутробного развития; однако данные из разных лабораторий противоречат друг другу. Это, вероятно, связано с различиями в фокусе внимания на периферических и децидуальных NK-клетках и их подмножествах, а также с разнообразием эффектов, возникающих после преэклампсии и аборта, которые могут запускать цитотоксическую активацию NK. Недавний отчет показал, что беременные женщины с высоким индексом доплеровской резистентности, указывающим на нарушение ремоделирования спиральной артерии и более высокий риск преэклампсии, обладают нецитотоксическими децидуальными NK-клетками, как и нормальные беременные женщины, но со сниженной экспрессией KIR2DL / S1, 3, 5, рецепторы против антигена С канонического локуса гистосовместимости класса I (HLA-C) и LILRB1 против HLA-G на трофобласте [74].Противоречиво, что истощение in vivo NK-клеток антителом против асиало-ганглио-N-тетраозилцерамида (asialo-GM1) снижает частоту абортов у склонных к аборту самок мышей CBA / J, спариваемых с самцами мышей DBA / 2J [75]. Считается, что это происходит из-за двойной стороны цитотоксических и ремоделирующих сосуды NK-клеток, поскольку аналогичное истощение NK у мышей CB17 SCID, лишенных эффекторных Т- и В-клеток, показало повышенную частоту абортов [76]. Вероятно, это связано с отсутствием врожденного иммунитета против местных бактерий. Таким образом, когда NK-клетки истощаются системно, следует учитывать различную цитотоксичность в двух подгруппах uNK-клеток.
Здесь цитотоксические NK-клетки могут играть роль в патологиях беременности. Повышенная скорость резорбции у беременных мышей BALB / c, вызванная антителом к антипрогестерон-индуцированному блокирующему фактору (PIBF), была скорректирована обработкой мышей антителом против NK-1. 1 [77]. У людей повышенное количество клеток CD56 + было продемонстрировано в биопсиях эндометрия в середине лютеиновой фазы у пациентов с идиопатическим рецидивирующим невынашиванием (РМ) [78], но в другом исследовании (Tuckerman et al., [79]) сделан вывод, что количество uNK клетки в RM не предсказывают последующий исход беременности.Среди децидуальных лимфоцитов от неудачных беременностей было меньше перфорин-положительных клеток CD56 + , чем в децидуальных лимфоцитах от нормальных беременностей [80], что свидетельствует о повышенной скорости дегрануляции в первых случаях. У женщин с РМ пониженное сопротивление маточной артерии кровотоку было продемонстрировано допплеровской ультрасонографией вместе с повышенным процентом uNK-клеток во время средней секреторной фазы, что указывает на корреляцию между чрезмерным развитием кровеносных сосудов и неудачей беременности [81].Другие исследования показали, что не количество общих NK-клеток эндометрия, а преобладание субнабора CD16 — CD56 ярких uNK-клеток было значительно снижено в пользу CD16 + CD56 dim uNK-клеток у рецидивирующих абортёров [82] . У пациенток, у которых был выкидыш хромосомно нормальных эмбрионов, было снижено процентное содержание CD16 — CD56 ярких uNK-клеток по сравнению с таковыми при нормальной беременности [83, 84]. Эти данные предполагают, что часть RM с неизвестной этиологией может быть объяснена дефицитом CD16 — CD56 ярких uNK-клеток или, альтернативно, избыточной инфильтрацией CD16 + CD56 dim NK-клеток, полученных из перфузирующей крови [85 ].Однако причинно-следственная связь и точный механизм были неизвестны, особенно у людей. Взятые вместе, необходимы дальнейшие исследования функций uNK-клеток, а не количества или поверхностных маркеров.
1 [77]. У людей повышенное количество клеток CD56 + было продемонстрировано в биопсиях эндометрия в середине лютеиновой фазы у пациентов с идиопатическим рецидивирующим невынашиванием (РМ) [78], но в другом исследовании (Tuckerman et al., [79]) сделан вывод, что количество uNK клетки в RM не предсказывают последующий исход беременности.Среди децидуальных лимфоцитов от неудачных беременностей было меньше перфорин-положительных клеток CD56 + , чем в децидуальных лимфоцитах от нормальных беременностей [80], что свидетельствует о повышенной скорости дегрануляции в первых случаях. У женщин с РМ пониженное сопротивление маточной артерии кровотоку было продемонстрировано допплеровской ультрасонографией вместе с повышенным процентом uNK-клеток во время средней секреторной фазы, что указывает на корреляцию между чрезмерным развитием кровеносных сосудов и неудачей беременности [81].Другие исследования показали, что не количество общих NK-клеток эндометрия, а преобладание субнабора CD16 — CD56 ярких uNK-клеток было значительно снижено в пользу CD16 + CD56 dim uNK-клеток у рецидивирующих абортёров [82] . У пациенток, у которых был выкидыш хромосомно нормальных эмбрионов, было снижено процентное содержание CD16 — CD56 ярких uNK-клеток по сравнению с таковыми при нормальной беременности [83, 84]. Эти данные предполагают, что часть RM с неизвестной этиологией может быть объяснена дефицитом CD16 — CD56 ярких uNK-клеток или, альтернативно, избыточной инфильтрацией CD16 + CD56 dim NK-клеток, полученных из перфузирующей крови [85 ].Однако причинно-следственная связь и точный механизм были неизвестны, особенно у людей. Взятые вместе, необходимы дальнейшие исследования функций uNK-клеток, а не количества или поверхностных маркеров.
Врожденные лимфоидные клетки
Врожденные лимфоидные клетки (ILC) играют роль в защите от патогенов, в лимфоидном органогенезе и ремоделировании тканей.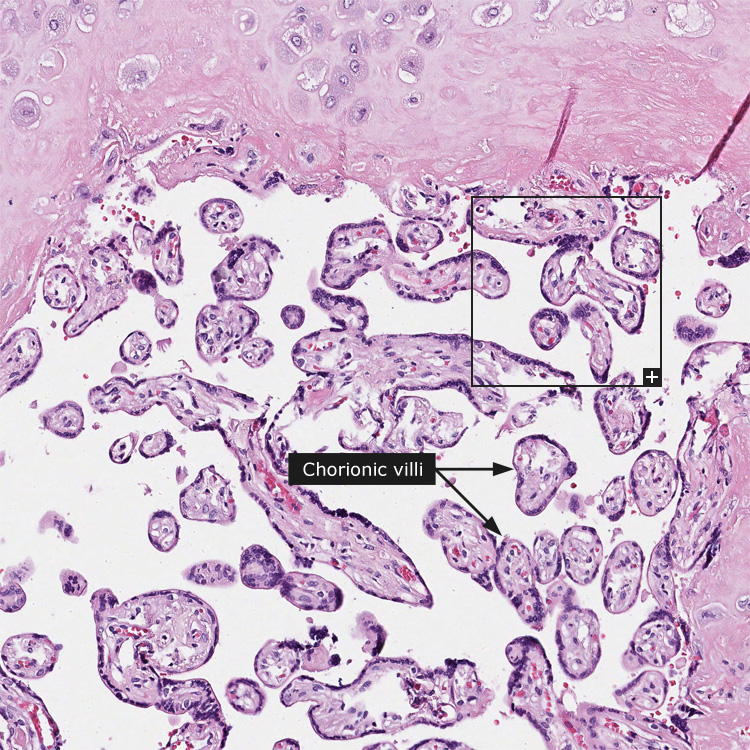 В настоящее время они разделены на три подгруппы на основе их фенотипических и функциональных характеристик [86–88].ILC группы 1 можно отличить от цитотоксических NK-клеток по отсутствию фактора транскрипции Eomes, однако они продуцируют IFN-γ через фактор транскрипции T-bet, что делает ILC1 слабо цитотоксичными. ILC группы 2 экспрессируют различительный рецептор IL-33, а также экспрессируют хемокиновые рецепторы CCR4 и CCR5 при стимуляции. В ответ на IL-25, IL-33, паразиты или повреждение тканей они продуцируют цитокины Th3, такие как IL-4, IL-5 и IL-13, действуя регуляторным образом, подобным клеткам Th3. ILC группы 3 требуют для своего образования орфанного рецептора γt, родственного ретиноевой кислоте, фактора транскрипции (RORγt).Они производят IL-22, а также при определенных обстоятельствах секретируют IL-17. Хотя они нецитотоксичны, часть ILC3 экспрессирует NK-активирующий рецептор NCR (NKp46 / 44). Все ILC имеют общего предшественника, экспрессирующего фактор транскрипции ID2. ILC играют роль во врожденной защите против патогенов и в организации лимфоидной ткани во время жизни плода [89], но их наиболее важная роль заключается в том, чтобы действовать как посредник между врожденными иммунными ответами и функциями Т-хелперов. Экспрессия обоих рецепторов NK и продукция цитокинов Th2, Th3, Th27 и Th32 ILC предполагают, что они могут играть роль в установлении баланса между иммунитетом и толерантностью как в врожденных, так и в адаптивных условиях (таблица).Во время беременности наиболее важную роль играют uNK-клетки, как описано в разделе выше. В дополнение к этому, ИЛ-22-продуцирующие не-NK ILC также присутствуют в слизистой оболочке небеременной матки, а также в децидуальной оболочке во втором триместре [91]. Недавно Doisne et al. идентифицировали подмножества ИЛЦ матки (uILC) в эндометрии человека в первом триместре и в матке мышей в начале образования плаценты [7]. Три субпопуляции, uILC2, uILC3 и специфичные для матки CD127 – uILC1 были обнаружены в матке мышей на gd 9.
В настоящее время они разделены на три подгруппы на основе их фенотипических и функциональных характеристик [86–88].ILC группы 1 можно отличить от цитотоксических NK-клеток по отсутствию фактора транскрипции Eomes, однако они продуцируют IFN-γ через фактор транскрипции T-bet, что делает ILC1 слабо цитотоксичными. ILC группы 2 экспрессируют различительный рецептор IL-33, а также экспрессируют хемокиновые рецепторы CCR4 и CCR5 при стимуляции. В ответ на IL-25, IL-33, паразиты или повреждение тканей они продуцируют цитокины Th3, такие как IL-4, IL-5 и IL-13, действуя регуляторным образом, подобным клеткам Th3. ILC группы 3 требуют для своего образования орфанного рецептора γt, родственного ретиноевой кислоте, фактора транскрипции (RORγt).Они производят IL-22, а также при определенных обстоятельствах секретируют IL-17. Хотя они нецитотоксичны, часть ILC3 экспрессирует NK-активирующий рецептор NCR (NKp46 / 44). Все ILC имеют общего предшественника, экспрессирующего фактор транскрипции ID2. ILC играют роль во врожденной защите против патогенов и в организации лимфоидной ткани во время жизни плода [89], но их наиболее важная роль заключается в том, чтобы действовать как посредник между врожденными иммунными ответами и функциями Т-хелперов. Экспрессия обоих рецепторов NK и продукция цитокинов Th2, Th3, Th27 и Th32 ILC предполагают, что они могут играть роль в установлении баланса между иммунитетом и толерантностью как в врожденных, так и в адаптивных условиях (таблица).Во время беременности наиболее важную роль играют uNK-клетки, как описано в разделе выше. В дополнение к этому, ИЛ-22-продуцирующие не-NK ILC также присутствуют в слизистой оболочке небеременной матки, а также в децидуальной оболочке во втором триместре [91]. Недавно Doisne et al. идентифицировали подмножества ИЛЦ матки (uILC) в эндометрии человека в первом триместре и в матке мышей в начале образования плаценты [7]. Три субпопуляции, uILC2, uILC3 и специфичные для матки CD127 – uILC1 были обнаружены в матке мышей на gd 9.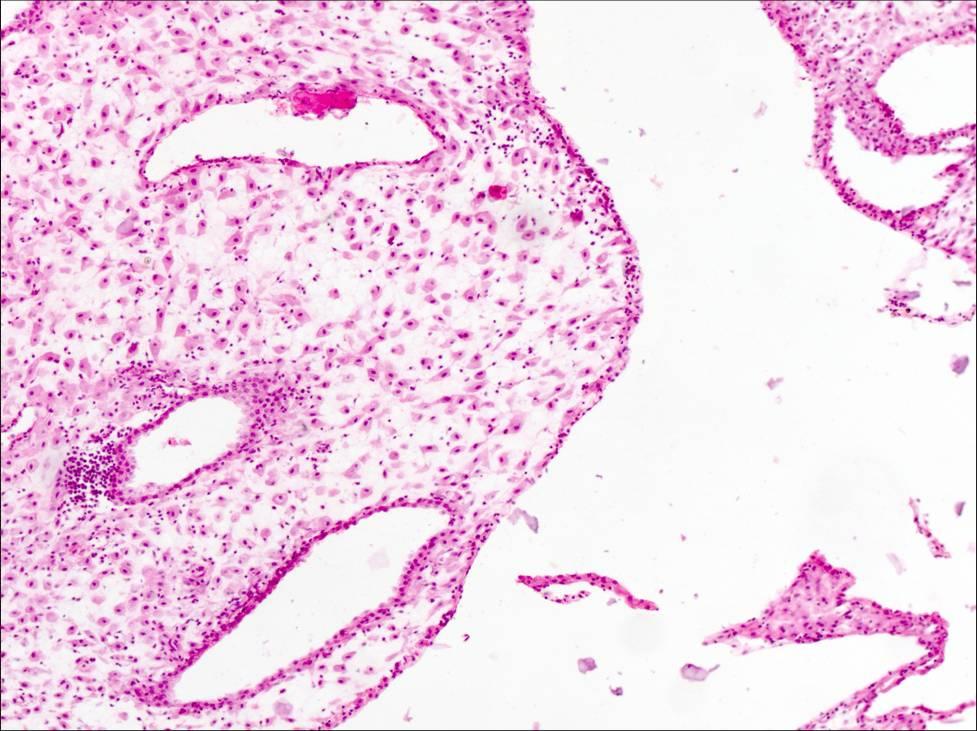 5, но с другим распределением в месте имплантации (рис. И [7]). Как в матке мыши, так и в эндометрии человека, uILC3, по-видимому, является доминирующей подгруппой во время беременности, тогда как uILC2 практически не обнаруживается, а децидуальный uILC1 состоит из клеток CD127 –, подобных интраэпителиальным лимфоцитам (IEL) в кишечнике [7] (Таблица ).
5, но с другим распределением в месте имплантации (рис. И [7]). Как в матке мыши, так и в эндометрии человека, uILC3, по-видимому, является доминирующей подгруппой во время беременности, тогда как uILC2 практически не обнаруживается, а децидуальный uILC1 состоит из клеток CD127 –, подобных интраэпителиальным лимфоцитам (IEL) в кишечнике [7] (Таблица ).
Таблица 3
Сравнение подмножеств ILC матки с Th-клетками и клетками uNK
| Подмножества uILC | Сопоставимые подмножества Th | Сопоставимые подмножества uNK |
|---|---|---|
| uILC1 (T-bet, (IFN-γ )) | Th2 | IFN-γ (DBA — uNK у мышей) |
| uILC2 (IL-33R, IL-7Rα, GATA3, IL-5) | Th3 | |
| uILC3 ( RORγt, IL-7Rα, IL-17, 22, частично NCR + CD56 + у человека) | Th27, Th32 | Некоторые DBA + IL22 + у мышей? NCR + CD16 — CD56 яркий у человека? |
Из-за их относительно недавнего открытия, роль этих клеток в воспроизводстве еще не установлена.Мышиные модели, лишенные определенных подмножеств ILC, без отмены дифференцировки клеток Th3, наблюдаемой у мышей с дефицитом ST2- (IL-33R) [46], например, облученные мыши дикого типа химеры костного мозга с мутантом staggerer (RORα sg / sg) мышей, считаются подходящей моделью для оценки внутренних ролей ILC2. RORγt-репортерные мыши в сочетании с генотипом RAG2 — / — полезны для выяснения роли ILC3 [92]. Учитывая характерное для децидуальной оболочки распределение uILC1 (рис. ), PLZF-дефицитные (лишенные всех подмножеств ILC) мыши также являются альтернативной необязательной моделью для исследования роли uILCs в децидуальной оболочке. Однако ни одна из этих моделей не была протестирована на количественную репродуктивную способность, хотя сообщений о проблемах разведения не поступало. Дальнейшие исследования с использованием моделей мышей с дефицитом ILC необходимы для выяснения специфической роли ILC в репродукции.
), PLZF-дефицитные (лишенные всех подмножеств ILC) мыши также являются альтернативной необязательной моделью для исследования роли uILCs в децидуальной оболочке. Однако ни одна из этих моделей не была протестирована на количественную репродуктивную способность, хотя сообщений о проблемах разведения не поступало. Дальнейшие исследования с использованием моделей мышей с дефицитом ILC необходимы для выяснения специфической роли ILC в репродукции.
Децидуальные макрофаги
При установлении беременности циркулирующие моноциты проникают в децидуальную оболочку и развиваются в макрофаги [93] вместе с резидентными миелоидными клетками матки, составляющими от 20 до 25% децидуальных лейкоцитов человека [94].Мыши, лишенные децидуальных макрофагов, недоступны. Даже CSF-I-дефицитные остеопетронные (op / op) мыши обнаруживают небольшое количество F4 / 80-позитивных клеток в децидуальной оболочке, хотя наблюдаются только при gd 7.5 [95]. Однако самки мышей op / op, скрещенные с самцами op / op, бесплодны на стадии имплантации, и любая другая комбинация, включающая самок op / + или самцов op / +, приводит к умеренной недостаточной фертильности [96], предполагая, что для этого необходимо достаточное количество макрофагов. выдержать беременность. У самок op / op, спарившихся с самцами op / +, частота имплантации была снижена до 60% с меньшим количеством участков имплантации и более низкой выживаемостью имплантатов до доношенной беременности, что привело к 39% фертильности по сравнению с самками op / +, спарившимися с op / + или op / op мужчины, показывающие> 92% частоты имплантации и> 85% фертильности.
На основании дифференциальной экспрессии рецептора комплемента CD11c в децидуальной оболочке человека были идентифицированы две отдельные субпопуляции (CD11c hi и CD11c lo ) [96]. В децидуальной оболочке первого триместра большинство макрофагов — это CD11c lo . Они экспрессируют гены, связанные с образованием внеклеточного матрикса, регуляцией мышц и ростом тканей [97]. Макрофаги CD11c hi , составляющие приблизительно одну треть децидуальной популяции, экспрессируют гены, связанные с антигенпрезентирующей функцией, например.g., CD1a, CD1c и CD1d, и обрабатывают антигены более эффективно, чем макрофаги CD11c lo [97].
Макрофаги CD11c hi , составляющие приблизительно одну треть децидуальной популяции, экспрессируют гены, связанные с антигенпрезентирующей функцией, например.g., CD1a, CD1c и CD1d, и обрабатывают антигены более эффективно, чем макрофаги CD11c lo [97].
Децидуальные макрофаги вносят свой вклад в «благоприятную для эмбриона» иммунологическую среду, которая сводит на нет наблюдение со стороны иммунитета и разрешает эмбриогенез, подобно тому, как микросреда опухоли способствует росту опухолей. Основываясь на их цитокиновом паттерне, они классифицируются как M1 и M2 соответственно [98, 99]. Макрофаги M1 секретируют фактор некроза опухоли-α (TNF-α) и IL-12 [100], в то время как макрофаги M2 характеризуются пониженной продукцией IL-12 и экспрессируют антагонист рецептора IL-1 [101].Кроме того, макрофаги M2 экспрессируют рецептор маннозы макрофагов (MMR), который обеспечивает защиту хозяина и играет роль в удалении побочных продуктов воспаления [102]. Децидуальные макрофаги человека ингибируют Т-клеточные ответы за счет продукции простагландина E2 [103, 104]. Кроме того, они продуцируют значительное количество иммунодепрессанта IL-10 [105, 106], который может снизить частоту абортов в модели CBA / J x DBA / 2J, и метаболитов триптофана [107–109], которые могут эффективно стимулировать T reg. поколение.Взяв все вышесказанное вместе, можно предположить, что фенотип M2 ожидается во время нормально развивающейся беременности. Однако не было доказательств того, что децидуальные макрофаги обладают иммуносупрессивным фенотипом с M2-поляризацией.
Дендритные клетки
Дендритные клетки (ДК) являются важным игроком, который связывает врожденный иммунитет с адаптивным иммунитетом. После захвата антигена на периферии они мигрируют в региональные лимфатические узлы, где они представляют пептиды наивным Т-клеткам, что приводит к антиген-специфическим иммунным ответам [110–113].В рамках адаптивного иммунитета DC также контролируют поляризацию дифференцировки Т-хелперных клеток за счет секреции цитокинов; IL-12 из лимфоидных DCs индуцирует развитие Th2 клеток, тогда как не было обнаружено убедительного фактора, индуцирующего развитие Th3, а поляризация на Th27 или Th32, по-видимому, индуцируется не только DCs [114–116]. DC как антигенпрезентирующие клетки не только важны для индукции первичного иммунного ответа, но также играют роль в индукции толерантности. Подтипы ДК децидуальной оболочки человека описаны как незрелые неактивированные (CD209 + ), незрелые активированные (DEC205 + ) и зрелые активированные (CD83 + ) клетки [117, 118].Незрелые ДК, обрабатывая антигены через рецептор DEC205, способствуют пролиферации Т-клеток CD8 + , но подавляют продукцию цитотоксического ИФН-γ, что приводит к толерантности, тогда как зрелые ДК индуцируют Т-клеточный иммунитет [117].
DC как антигенпрезентирующие клетки не только важны для индукции первичного иммунного ответа, но также играют роль в индукции толерантности. Подтипы ДК децидуальной оболочки человека описаны как незрелые неактивированные (CD209 + ), незрелые активированные (DEC205 + ) и зрелые активированные (CD83 + ) клетки [117, 118].Незрелые ДК, обрабатывая антигены через рецептор DEC205, способствуют пролиферации Т-клеток CD8 + , но подавляют продукцию цитотоксического ИФН-γ, что приводит к толерантности, тогда как зрелые ДК индуцируют Т-клеточный иммунитет [117].
Имеется очень мало CD83 + DCs на границе раздела матери и плода [118], но DC в децидуальной оболочке беременных обнаруживаются CD209 + , указывая на то, что рекрутированные полученные из моноцитов незрелые DCs остаются неактивированными. Более того, DCs, присутствующие в децидуальной оболочке мыши, не могут мигрировать из этой ткани даже после активации [119] (рис.). Было показано, что секретируемые факторы в кондиционированной среде культуры децидуальных клеток мыши блокируют презентацию антигена in vivo ДК и ингибируют их способность индуцировать IFN-γ, но не продукцию IL-10 примированными лимфоцитами, что позволяет предположить, что децидуальные факторы способствуют развитию развитие доминирования Th3 за счет модуляции функции ДК [6]. Миелоидные DC в децидуальной оболочке продуцируют более низкие уровни IL-12, чем их аналоги в периферической крови, и несколько более склонны к стимуляции ответов Th3 у человека [120].Таким образом, эти результаты предполагают, что децидуальные DC могут локально представлять антиген децидуальным Т-клеткам способами, которые минимизируют ответы Th2.
Недавние исследования показывают, что децидуальные DCs могут играть роль в ремоделировании децидуальной ткани, например, у DC-дефицитных мышей обнаружен измененный децидуальный ангиогенез [121, 122]. Данные о роли децидуальных ДК в патологии беременности человека немногочисленны. При осложнениях беременности у человека описаны лишь незначительные изменения в децидуальной плотности CD83 + DC [123, 124].Askelund et al. сообщили о значительно более высоком количестве дендритных клеток в децидуальных тканях у женщин с РМ на 8-недельной беременности по сравнению с контрольной группой, соответствующей гестационному возрасту [124].
При осложнениях беременности у человека описаны лишь незначительные изменения в децидуальной плотности CD83 + DC [123, 124].Askelund et al. сообщили о значительно более высоком количестве дендритных клеток в децидуальных тканях у женщин с РМ на 8-недельной беременности по сравнению с контрольной группой, соответствующей гестационному возрасту [124].
Регуляторные Т-клетки
CD4 + CD25 hi FoxP3 + [125] T reg клетки являются компонентом адаптивного иммунитета и действуют как супрессоры иммунного ответа. Благодаря своей способности подавлять иммунологические реакции клетки T reg участвуют в поддержании самотолерантности, ускользания от опухолей и толерантности к трансплантату, в то время как во время беременности при определенных условиях клетки T reg также могут способствовать материнской толерантности плод через продуцирование ИЛ-10 [126, 127].Aluvihare et al. впервые предположили, что клетки T reg могут опосредовать материнскую толерантность у мышей во время беременности [128]. Действительно, адоптивный перенос клеток T reg от BALB / c-спарившихся нормальных беременных мышей CBA / J предотвратил потерю плода у склонных к аборту самок мышей CBA / 2J, спарившихся с BALB / c, в то время как клетки T reg из не- у беременных мышей эффекта не было [129]. Клетки T reg участвуют в защите плода, подавляя воспалительные реакции. Клетки T reg подавляют выработку цитокинов как в Т-клетках CD4 + , так и в Т-клетках CD8 + , цитотоксическую активность NK-клеток, а также дендритную функцию и созревание, что приводит к подавлению локальной воспалительной активации [127, 130, 131] .
Отсутствие модуляции, опосредованной клетками T reg , может привести к срыву беременности или патологиям, но следует внимательно различать естественные клетки T reg (nT reg ), полученные из тимуса, и индуцированные клетки T reg (iT ). reg ) клетки, полученные из периферических Т-лимфоцитов CD4 + . Сообщалось о снижении частоты децидуальных клеток T reg при выкидышах с нормальным кариотипом эмбриона [132]. В этом исследовании клетки Helios + T reg оценивали в популяции CD4 + FoxP3 + ; однако определение клеток nT reg как Helios + CD4 + FoxP3 + не вызывает удовлетворительного консенсуса.Напротив, беременность мышей с дефицитом Helios — iT reg характеризуется повышенной скоростью резорбции и дефектным ремоделированием спиральных артерий [133]. Однако в этой мышиной модели общий уровень абортов составил всего 10%; Таким образом, непонятна незаменимость ячеек iT reg . Следует также отметить, что нет никаких доказательств того, что отсутствие клеток T reg может вызывать аборты эмбрионов, экспрессирующих отцовские аллоантигены, истощение клеток T reg у трансгенных мышей, экспрессирующих искусственный антиген, ограниченный MHC II, может вызывать резорбция плода в середине беременности.
reg ) клетки, полученные из периферических Т-лимфоцитов CD4 + . Сообщалось о снижении частоты децидуальных клеток T reg при выкидышах с нормальным кариотипом эмбриона [132]. В этом исследовании клетки Helios + T reg оценивали в популяции CD4 + FoxP3 + ; однако определение клеток nT reg как Helios + CD4 + FoxP3 + не вызывает удовлетворительного консенсуса.Напротив, беременность мышей с дефицитом Helios — iT reg характеризуется повышенной скоростью резорбции и дефектным ремоделированием спиральных артерий [133]. Однако в этой мышиной модели общий уровень абортов составил всего 10%; Таким образом, непонятна незаменимость ячеек iT reg . Следует также отметить, что нет никаких доказательств того, что отсутствие клеток T reg может вызывать аборты эмбрионов, экспрессирующих отцовские аллоантигены, истощение клеток T reg у трансгенных мышей, экспрессирующих искусственный антиген, ограниченный MHC II, может вызывать резорбция плода в середине беременности.
Выводы: к клиническим конечным точкам
Текущий диагноз бесплодия и неэффективность лечения
Дефектное формирование децидуальной оболочки на ранних сроках беременности может привести к бесплодию или к более позднему развитию осложнений, таких как преэклампсия, повторный аборт и преждевременные роды [18 , 148, 149]. Всемирная организация здравоохранения (ВОЗ) определяет бесплодие как бездетность в течение 1 года после активного полового акта [150]. Факторами риска женского бесплодия и субфертильности, включая рецидивирующие аборты, являются такие заболевания матки, как эндометриоз (10% случаев) [151] и миома матки (поражены 70-80% женщин, но лишь небольшая часть с огромными поражениями страдает бесплодием из-за физической невосприимчивости). [152], или проблемы с яичниками, e.например, синдром поликистозных яичников (СПКЯ) у 4-8% женщин репродуктивного возраста [153] и преждевременная недостаточность яичников у 0,8-3,7% женщин различных рас в возрасте от 40 до 45 лет [154].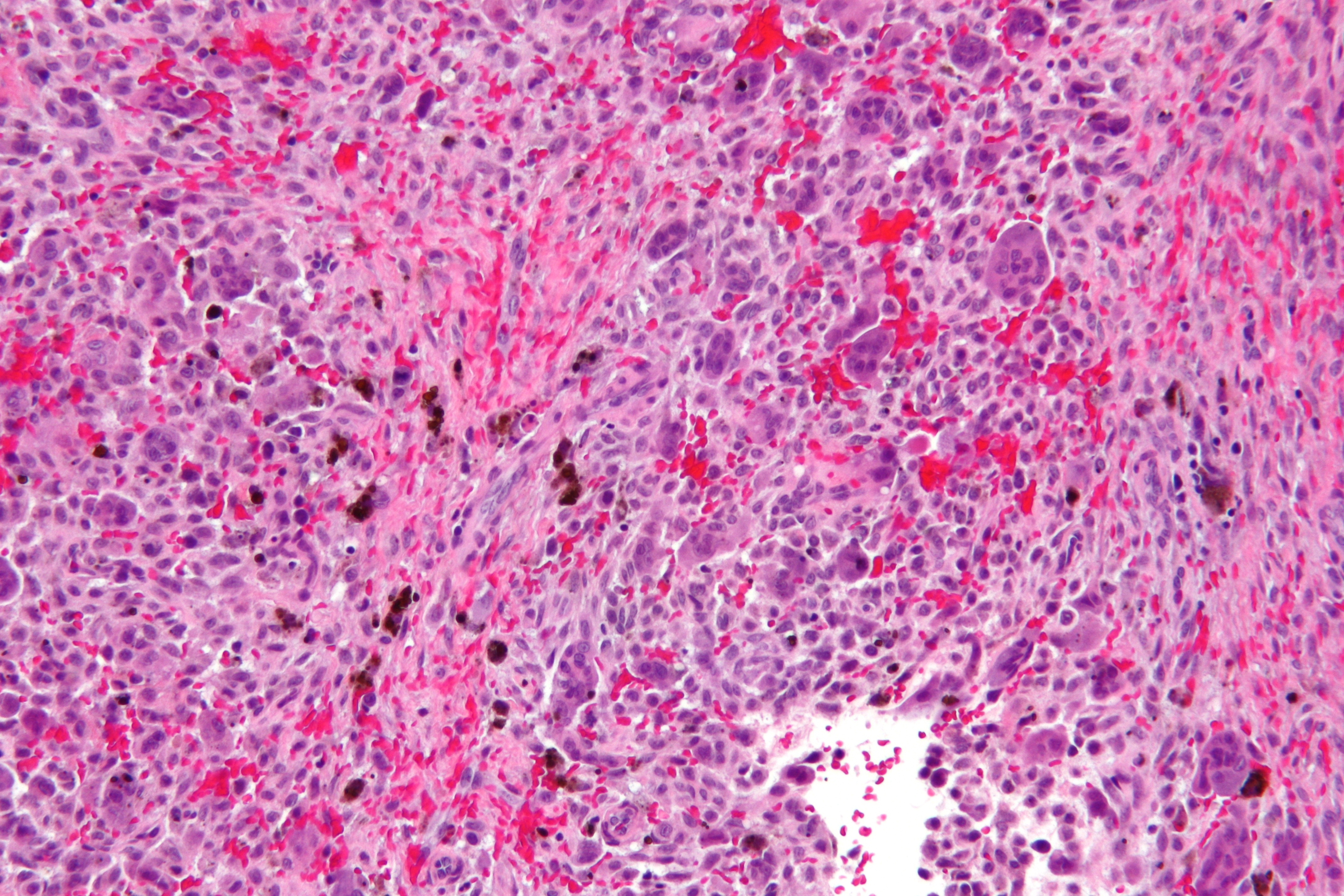 В некоторых случаях бесплодие поддается лечению, например хирургической резекцией миомы или введением метформина пациентам с СПКЯ с толерантностью к инсулину для снижения подавляющего действия андрогенов на развитие лютеиновой кислоты. Однако 42% РМ все еще не учтены (исключая 41% аномального кариотипа эмбриона и пересчитанный из оригинальной литературы [155]).Согласно отчетам правительства Японии, количество успешных случаев использования технологий вспомогательной репродукции (ВРТ) удвоилось в период с 2002 по 2012 год (15 228 случаев в 2002 году и 37 953 случая в 2012 году) [156], в то время как общее число бесплодных пациентов увеличилось в четыре раза за период с 2002 по 2012 год. за тот же период (85 664 женщины в 2002 году и 326 426 женщин в 2012 году) [156].
В некоторых случаях бесплодие поддается лечению, например хирургической резекцией миомы или введением метформина пациентам с СПКЯ с толерантностью к инсулину для снижения подавляющего действия андрогенов на развитие лютеиновой кислоты. Однако 42% РМ все еще не учтены (исключая 41% аномального кариотипа эмбриона и пересчитанный из оригинальной литературы [155]).Согласно отчетам правительства Японии, количество успешных случаев использования технологий вспомогательной репродукции (ВРТ) удвоилось в период с 2002 по 2012 год (15 228 случаев в 2002 году и 37 953 случая в 2012 году) [156], в то время как общее число бесплодных пациентов увеличилось в четыре раза за период с 2002 по 2012 год. за тот же период (85 664 женщины в 2002 году и 326 426 женщин в 2012 году) [156].
Увеличение числа АРТ можно отнести к прогрессу и достижениям в области экстракорпорального оплодотворения (ЭКО), интрацитоплазматической инъекции сперматозоидов (ИКСИ) и использования замороженных яйцеклеток.Еще одна попытка с иммунологической точки зрения была предпринята с использованием внутривенного введения иммуноглобулина (IVIg) пациентам с аутоиммунным заболеванием, представленным антифосфолипидным (aPL) синдромом, системной красной волчанкой (СКВ), аутоиммунным заболеванием щитовидной железы (AITD) и сахарным диабетом 1 типа. [157]. Однако этот подход был признан окончательным выбором для подгрупп бесплодных женщин, которые не были спасены другими способами из-за высокого риска побочных эффектов и медицинских затрат на опухоль [157].Более того, действительно, антитела против aPL обладают сродством к поверхностному фосфолипиду, экспонированному на цитотрофобластах, и действительно, лечение IVIg может спасти RM у пациентов с AITD, но в сочетании с гормонами щитовидной железы [157], механизмы, как аутоантитела влияют на имплантацию и как IVIg спасают, неясны. В большинстве случаев при аутоиммунных заболеваниях также страдают функции яичников и другой эндокринной системы. Типичное лекарство с комбинацией ИГВВ и НПВП может просто подавить цитокиновый шторм, но без понимания основы трудно выбрать подходящего пациента.
Лучшее понимание механизмов с помощью оптимальных моделей на животных
Ряд молекул, например фактор ингибирования лейкемии (LIF) и липидные медиаторы простагландины, связанные с «маточной восприимчивостью», были идентифицированы в путях PR и ER и передаче сигналов Wnt через ген -дефицитные мышиные модели [18]. Иммунологи в области репродукции использовали T, B, NK-дефицитный Rag2 — / — Δγc или T, NK-дефицитный tgε26 для выяснения роли иммунных клеток в недостаточности ремоделирования децидуальных сосудов.Однако у этих иммунодефицитных мышей не наблюдалось полного прерывания беременности, с лишь небольшими изменениями в ремоделировании сосудов матки или децидуальной клеточности, не говоря уже о высокой скорости резорбции и сокращении плаценты у мышей tgε26 [158], вероятно, из-за компенсаторных функций других второстепенных иммунных клеток. клеточных популяций и стромальных клеток матки, или к адаптивно усиленному развитию сосудов, а также к отсутствию цитотоксических иммунных клеток со стороны матери. Более того, только на более поздней стадии плацентарной беременности у этих мышей наблюдается повышенная резорбция и аномалия плаценты с существенным предупреждением о влиянии генотипа плода.Таким образом, перенос эмбрионов дикого типа в эти матки лучше проясняет роль материнских клеток. Напротив, децидуальные дефекты описаны в нескольких моделях мышей, нацеленных на гены (Hoxa10, Hoxa11, Bmp2, Wnt4, Dedd и IL11ra) [13–16, 19, 23]. Некоторые модели мышей с дефицитом передачи сигналов цитокинов, такие как Lif — / — или Stat3 — / — , демонстрируют бесплодный фенотип [159, 160], но дефекты в частоте имплантации уже обнаружены до децидуализации, что предполагает более фундаментальную и плейотропную роль для сигнализация в нисходящем направлении.Интересно, что условно-маточные Trp53 — / — мышей обнаруживают децидуальное старение, сопровождающееся чрезмерной терминальной дифференцировкой и мульти-нуклеаризацией до более позднего гестационного периода, что приводит к преждевременным родам [161].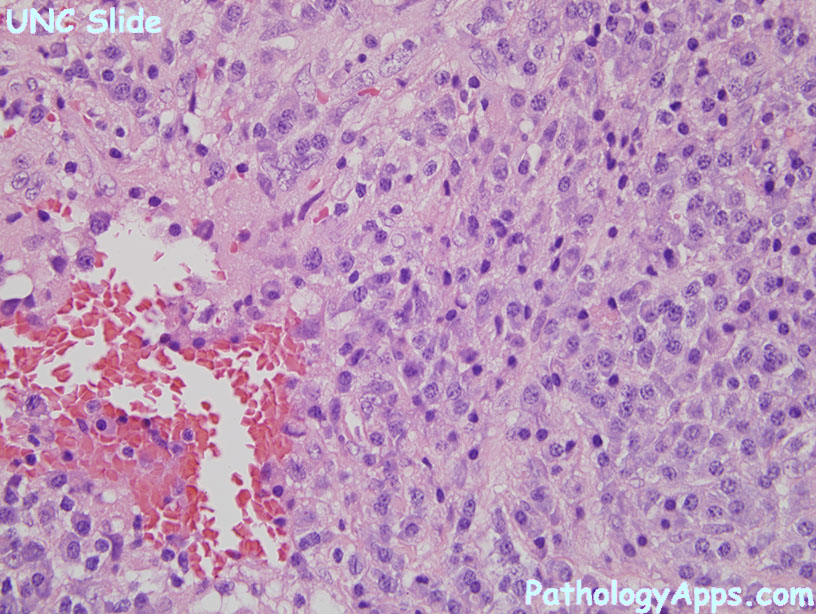 Чтобы пролить больше света на внутренние и взаимные роли материнских иммунных клеток, сосудов матки и стромальных клеток, необходимо создать новую комбинацию различных моделей мышей. Модель мышей с децидуальной недостаточностью матки, названной выше, в сочетании с моделями с дефицитом NK может более четко объяснить функции uNK-клеток в децидуальном развитии и наоборот, посредством скрещивания двух линий мышей и посредством переноса NK-клеток дикого типа.Сходным образом модели сосудистой недостаточности матки могут пролить свет на роль сосудистых факторов в функциях uNK-клеток. Однако эмбриональная или постнатальная летальность мышей Vegfa — / — , Angpt1 — / — и Angpt2 — / — требует оценки условной делеции этих генов в матке, которая не подвергалась сомнению в отношении репродуктивных функций самок. Например, PR-Cre x Vegfa flox удаляет децидуальную клеточно-специфическую делецию VEGF-A, а VE-cadherin-Cre-ER x Vegfa flox может удалять продукцию VEGF-A эндотелием сосудов посредством введения тамоксифена.
Чтобы пролить больше света на внутренние и взаимные роли материнских иммунных клеток, сосудов матки и стромальных клеток, необходимо создать новую комбинацию различных моделей мышей. Модель мышей с децидуальной недостаточностью матки, названной выше, в сочетании с моделями с дефицитом NK может более четко объяснить функции uNK-клеток в децидуальном развитии и наоборот, посредством скрещивания двух линий мышей и посредством переноса NK-клеток дикого типа.Сходным образом модели сосудистой недостаточности матки могут пролить свет на роль сосудистых факторов в функциях uNK-клеток. Однако эмбриональная или постнатальная летальность мышей Vegfa — / — , Angpt1 — / — и Angpt2 — / — требует оценки условной делеции этих генов в матке, которая не подвергалась сомнению в отношении репродуктивных функций самок. Например, PR-Cre x Vegfa flox удаляет децидуальную клеточно-специфическую делецию VEGF-A, а VE-cadherin-Cre-ER x Vegfa flox может удалять продукцию VEGF-A эндотелием сосудов посредством введения тамоксифена.
Требуются тщательные исследования основных и клинических аспектов, чтобы преодолеть противоречивые доказательства (которые частично связаны с отсутствием образцов человека на стадии периимплантации), чтобы получить молекулярный ключ к причинам бесплодия и изобрести новые методы диагностики и лечения.
Децидуализация — обзор | ScienceDirect Topics
VII Децидуализация: постимплантационный эндометрий
Децидуализация — это изменение, которое происходит в строме эндометрия во время беременности, при котором резидентные фибробласты увеличиваются, расширяют процессы для контакта с соседними клетками, приобретают повышенное соотношение цитоплазмы к ядру и производят отличительный спектр выделений.Клетки железистого эпителия становятся гипотрофическими. Внеклеточный матрикс подвергается ремоделированию с потерей пучков фибриллярного коллагена и (у человека) появлением базальной капсульной мембраны вокруг децидуализирующихся стромальных клеток. Увеличивается доля иммунных клеток; после децидуализации до 35% присутствующих клеток происходят из костного мозга, и они состоят преимущественно из макрофагов и необычного типа крупных гранулированных лимфоцитов с некоторыми свойствами, подобными естественным клеткам-киллерам.Также есть несколько Т-клеток и тучных клеток. Стероидные гормоны регулируют количество и фенотип иммунных клеток, регулируя локальный синтез цитокинов и хемокинов. От материнской иммунной системы требуется толерантность к отцовскому антигену эмбриона, но она должна продолжать обеспечивать устойчивость к патогенам. Для достижения этих целей параллельно работают несколько механизмов, но их описание выходит за рамки данной статьи.
Увеличивается доля иммунных клеток; после децидуализации до 35% присутствующих клеток происходят из костного мозга, и они состоят преимущественно из макрофагов и необычного типа крупных гранулированных лимфоцитов с некоторыми свойствами, подобными естественным клеткам-киллерам.Также есть несколько Т-клеток и тучных клеток. Стероидные гормоны регулируют количество и фенотип иммунных клеток, регулируя локальный синтез цитокинов и хемокинов. От материнской иммунной системы требуется толерантность к отцовскому антигену эмбриона, но она должна продолжать обеспечивать устойчивость к патогенам. Для достижения этих целей параллельно работают несколько механизмов, но их описание выходит за рамки данной статьи.
По большому счету, децидуализация стромы происходит только у видов, которые подвергаются интерстициальной имплантации, а время и степень изменений также зависят от вида.У человека децидуальные изменения очевидны в поздней секреторной фазе небеременных циклов, и при хронической контрацептивной стимуляции прогестероном эндометрий становится полностью децидуализированным. Таким образом, децидуализация может происходить независимо от эмбриональных сигналов. Эмбрионы имплантируются в нецидуализированную строму, и децидуализация происходит в течение следующих нескольких дней. Напротив, у мышей и крыс прикрепление эмбриона к антимезометриальному просветному эпителию матки инициирует процесс передачи сигналов в сенсибилизированном стероидом эндометрии, который запускает децидуализацию.Подобные изменения (известные как децидуомы) могут быть вызваны у гормонально сенсибилизированных мышей механическим повреждением просвета матки или инстилляцией раздражителя, такого как масло. В течение 5–8 дней беременности децидуальные изменения распространяются из субэпителиальной антимезометриальной стромы в более глубокие антимезометриальные области, а затем распространяются латерально, в конечном итоге включая строму мезометрия. Децидуальные клетки мезометрия и мезометрия имеют разные секреторные репертуары.
Вероятно, что ранние децидуальные изменения создают материнскую среду, в которой паракринная поддержка обеспечивается зачатку за счет локальной секреторной активности до того, как образуется гемохориальная плацента, способная извлекать питательные вещества непосредственно из материнской крови.Несколько материнских децидуальных секреторных компонентов — примеры пролактина (PRL) и TGF-β — обнаруживаются в околоплодных водах. Еще многое предстоит сделать, чтобы определить точную функцию децидуальной оболочки по отношению к развивающемуся понятию. Однако генетические манипуляции с мышами дали полезные сведения о сигнальных путях, посредством которых опосредуется децидуализация, а также предоставили четкие доказательства того, что децидуальная дифференцировка на ранних сроках беременности является критическим требованием для успешного исхода (Таблица 1).
Cox-2 — одна из двух циклооксигеназ, которые катализируют лимитирующую стадию производства простагландинов. Строма матки не децидуализируется у мышей, лишенных Цокс-2, и имплантация не выполняется. Этот фенотип, по-видимому, является результатом недостатка простациклина, эффекты которого опосредованы активацией рецептора ядерного гормона, активируемого пролифератором пероксисомы, рецептора-δ (PPAR-δ).
Hoxa-10 и Hoxa-11 являются соседними генами гомеобокса, которые экспрессируются в развивающихся мочеполовых путях и индуцируются прогестероном во взрослой матке на ранних сроках беременности.Дефектная имплантация и децидуализация происходят при отсутствии материнского Hoxa-10 или Hoxa-11. Экспрессия Hoxa-10 необходима для развития эпителиальных пиноподов, что указывает на раннюю роль в каскаде имплантации. Экспрессия Hoxa-11 обычно регулируется прогестероном у мышей, нулевых по Hoxa-10. Стероид-зависимая пролиферация стромальных клеток снижается при нокауте Hoxa-10 с более низким уровнем циклина D3 в строме через 1 день после инициации децидуализации. Индукция Cox-2 в строме значительно снижена у мышей, нулевых по Hoxa-10; однако децидуализация не может быть восстановлена лечением простагландинами, вероятно, потому, что два рецептора простагландина, EP3 и EP4, аномально экспрессируются и неправильно регулируются прогестероном в строме.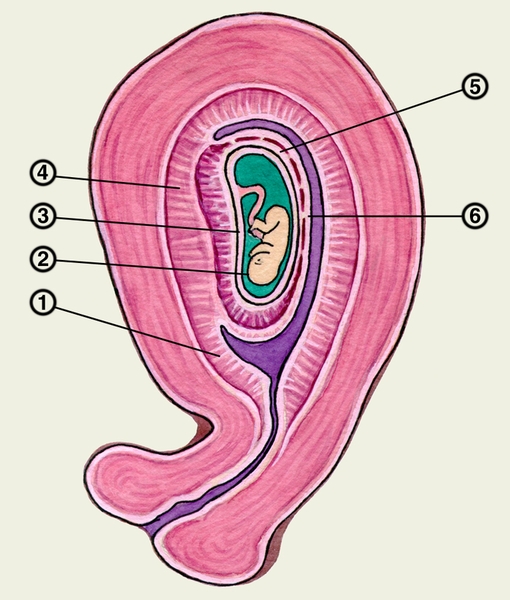 Это предполагает, что Hoxa-10 опосредует стероидную регуляцию EP3 и EP4. Однако экспрессия нескольких других продуктов гена, регулируемых прогестероном, идентична у мышей дикого типа и мутантных мышей Hoxa-10.
Это предполагает, что Hoxa-10 опосредует стероидную регуляцию EP3 и EP4. Однако экспрессия нескольких других продуктов гена, регулируемых прогестероном, идентична у мышей дикого типа и мутантных мышей Hoxa-10.
Прекращение экспрессии другого гена гомеобокса, Hmx3, приводит к нарушению децидуализации и бесплодию, несмотря на нормальную овуляцию и оплодотворение. Основное место экспрессии Hmx3 находится в миометрии, где локализация в основном антимезометриальная на 4.5 день беременности, непосредственно перед началом децидуализации в вышележащей антимезометриальной строме.Эти данные вызывают интересные предположения о возможности перекрестного взаимодействия между миометрием и эндометрием в регулировании дифференцировки.
Клетки матки у LIF-нулевых мышей не децидуализируются ни во время беременности, ни в ответ на искусственные стимулы, применяемые при псевдобеременности, а самки бесплодны. Таким образом, эмбрионы дикого типа, перенесенные LIF-нулевым самкам, не могут имплантироваться, а LIF-нулевые бластоцисты, перенесенные самкам дикого типа, прогрессируют и дают — / — взрослых особей.Повышающая регуляция LIF в железистом эпителии отменяется у мышей с нокаутом Hmx3 и Hoxa-11, что указывает на то, что LIF находится ниже по течению от этих двух генных продуктов. Экспрессия LIF, напротив, не затрагивается нулевыми значениями Hoxa-10. Пути LIF и простагландина сходятся в инициировании децидуальных изменений в стромальных клетках.
IL-11 важен на несколько более поздних этапах децидуализации мышей. Инактивация гена, кодирующего уникальную α-цепь рецептора интерлейкина-11 (IL-11), приводит к фенотипу, при котором степень децидуализации значительно снижается.На 4,5 день после полового акта IL-11 экспрессируется в первичной децидуальной зоне (область антимезометриальной стромы под местом прикрепления), а IL-11Rα находится в окружающей более глубокой строме, которая позже становится вторичной децидуальной оболочкой. И во время беременности, и при децидуоме нулевой эндометрий дифференцируется с образованием первичной децидуальной оболочки, но довольно небольшой вторичной децидуальной оболочки, вовлекая IL-11 в сигнальный путь, который усиливает и регулирует пространственно-временную экспрессию децидуального фенотипа. В результате на 6-й день происходит кровотечение в просвет матки, а на 9-й день эмбрионы некротизируются.Однако популяция вторичных гигантских клеток трофобласта расширяется, занимая область, которая обычно содержит децидуальную оболочку мезометрия. Разрастание трофобластов в отсутствие вторичной децидуальной оболочки подтверждает гипотезу о том, что децидуальная оболочка играет некоторую роль в ограничении инвазии трофобластов.
В результате на 6-й день происходит кровотечение в просвет матки, а на 9-й день эмбрионы некротизируются.Однако популяция вторичных гигантских клеток трофобласта расширяется, занимая область, которая обычно содержит децидуальную оболочку мезометрия. Разрастание трофобластов в отсутствие вторичной децидуальной оболочки подтверждает гипотезу о том, что децидуальная оболочка играет некоторую роль в ограничении инвазии трофобластов.
Эндометрий человека содержит транскрипт Hoxa-10, IL-11, LIF, PRL и простагландины, но при сравнении этих двух видов важно иметь в виду, что, хотя оба требуют прайминга прогестерона для децидуализации, у мышей это инициируется сигнал передается от бластоцисты к эпителию матки, а затем в поверхностную антимезометриальную строму, тогда как у человека децидуализация происходит по всему эндометрию даже при отсутствии концептуса.Таким образом, механизмы пространственной и временной регуляции могут быть видоспецифичными.
Decidua — обзор | ScienceDirect Topics
Децидуализация эндометрия
Децидуальная оболочка — это новая специализированная структура, которая развивается в беременной матке с функцией опосредования взаимодействий между матерью и концептусом, обеспечивая условия, необходимые для развития концептуса. Децидуализация характеризуется (1) трансдифференцировкой фибробластов эндометрия в децидуальные клетки; (2) обширное ремоделирование ECM стромы эндометрия; (3) производство большого количества молекул, которые регулируют перекрестный разговор матери и плода; (4) ангиогенез, формирующий обширную сеть кровеносных сосудов, которая служит источником питания для эмбриона; (5) обширный и избирательный приток маточных естественных киллеров (uNK), которые вносят вклад в иммунную регуляцию на границе раздела матери и плода и в ремоделирование кровеносных сосудов эндометрия во время плацентации (главы 15 и 19, глава 15, глава 19).
Известны некоторые молекулярные механизмы «материнской заботы», обеспечиваемой децидуальной оболочкой для защиты материнско-фетальной единицы и развития эмбриона. Например, децидуальные клетки экспрессируют антиоксидантные ферменты, которые придают устойчивость к окислительному стрессу. 42 Таким же образом экспрессия ароматазы децидуальными клетками позволяет им регулировать локальную концентрацию эстрогена. 27 Этот механизм способствует поддержанию развития децидуализации и, следовательно, поддержке разработки концептуальных решений.Исследования in vitro показали, что децидуальные клетки способствуют мониторингу жизнеспособности эмбрионов и поддерживают развитие жизнеспособных за счет продукции факторов, стимулирующих рост; в противном случае задержка эмбрионов подавляет экспрессию этих факторов. 43 Кроме того, децидуальная оболочка играет роль в иммунном ответе матери. Децидуальный ECM подавляет активацию макрофагов 44,45 и доступ Т-клеток к границе раздела матери и плода предотвращается эпигенетическим подавлением хемокинов на децидуальных клетках. 46 Более того, как децидуальные клетки, так и сосуды демонстрируют пространственную и временную экспрессию молекул с иммуномодулирующими свойствами во время беременности. 47,48
Например, децидуальные клетки экспрессируют антиоксидантные ферменты, которые придают устойчивость к окислительному стрессу. 42 Таким же образом экспрессия ароматазы децидуальными клетками позволяет им регулировать локальную концентрацию эстрогена. 27 Этот механизм способствует поддержанию развития децидуализации и, следовательно, поддержке разработки концептуальных решений.Исследования in vitro показали, что децидуальные клетки способствуют мониторингу жизнеспособности эмбрионов и поддерживают развитие жизнеспособных за счет продукции факторов, стимулирующих рост; в противном случае задержка эмбрионов подавляет экспрессию этих факторов. 43 Кроме того, децидуальная оболочка играет роль в иммунном ответе матери. Децидуальный ECM подавляет активацию макрофагов 44,45 и доступ Т-клеток к границе раздела матери и плода предотвращается эпигенетическим подавлением хемокинов на децидуальных клетках. 46 Более того, как децидуальные клетки, так и сосуды демонстрируют пространственную и временную экспрессию молекул с иммуномодулирующими свойствами во время беременности. 47,48
Триггер децидуализации у мышей обеспечивается взаимодействием имплантируемого эмбриона с эпителием просвета матки во время «окна имплантации». Эпителий матки участвует в передаче сигналов в строму эндометрия, поскольку удаление эпителия нарушает искусственную индукцию децидуализации. 49 Кроме того, децидуализация ограничивается стромой эндометрия, окружающей каждый эмбрион, идентифицированной как место имплантации. Участки эндометрия между имплантируемыми эмбрионами, называемые промежуточными участками имплантации, не подвергаются децидуализации и остаются обычной соединительной тканью, обеспечивая превосходный внутренний контроль, позволяющий проводить прямое сравнение с децидуализированными областями.
Децидуализация может быть экспериментально вызвана введением веществ в просвет матки псевдобеременных или гормональных самок грызунов.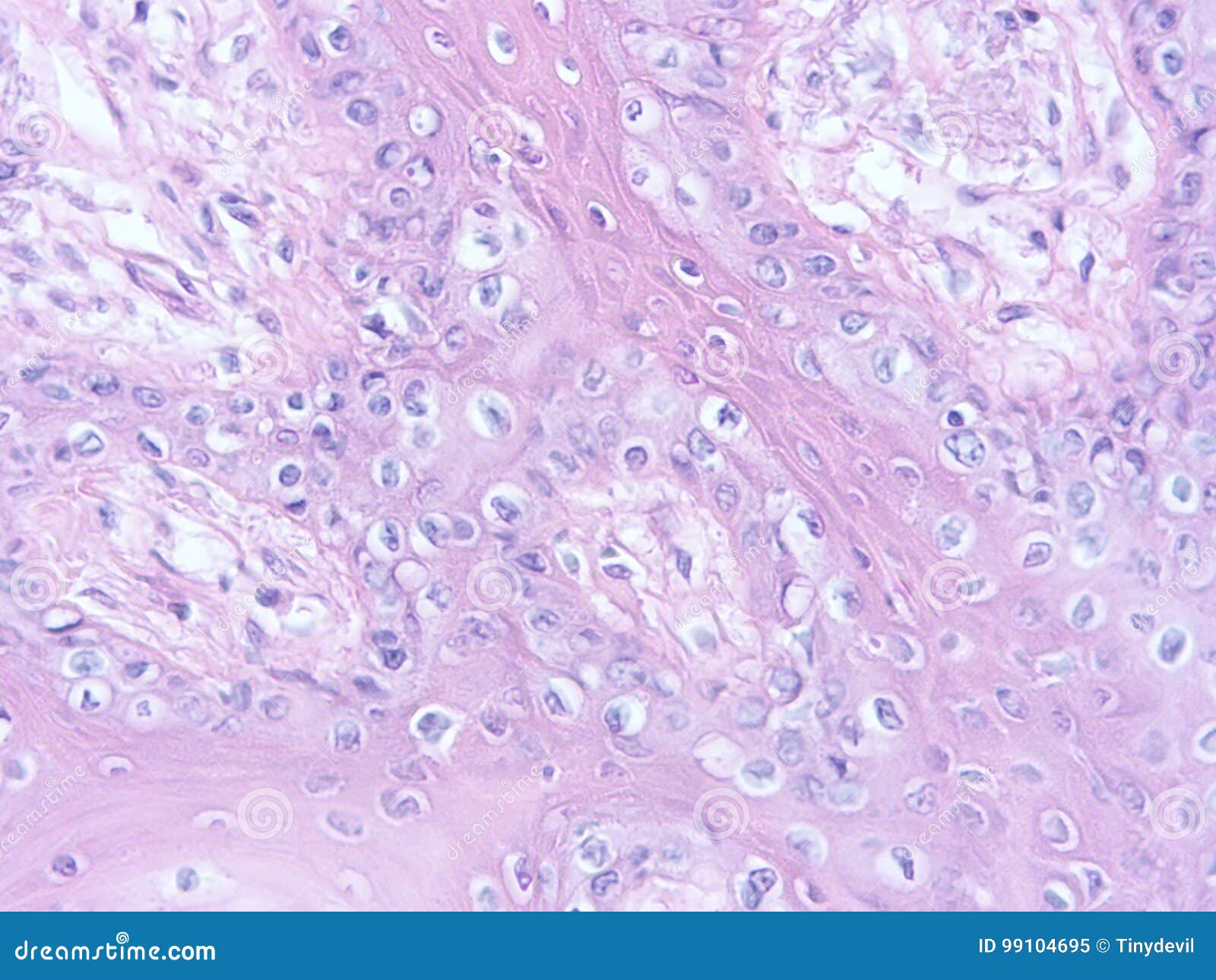 50–52 Образовавшаяся структура называется децидуома. 53 Децидуомы представляют собой ценную модель для анализа децидуализации без влияния эмбриона (Глава 25). У людей некоторая степень децидуализации уже присутствует в прогестационной фазе репродуктивного цикла 54 в ответ на повышение уровня прогестерона, секретируемого желтым телом. Полная децидуальная реакция происходит во время беременности. 55 Между децидуальной оболочкой человека и мыши есть много общего, однако результаты, полученные на одном виде, не могут быть полностью перенесены на другой.
50–52 Образовавшаяся структура называется децидуома. 53 Децидуомы представляют собой ценную модель для анализа децидуализации без влияния эмбриона (Глава 25). У людей некоторая степень децидуализации уже присутствует в прогестационной фазе репродуктивного цикла 54 в ответ на повышение уровня прогестерона, секретируемого желтым телом. Полная децидуальная реакция происходит во время беременности. 55 Между децидуальной оболочкой человека и мыши есть много общего, однако результаты, полученные на одном виде, не могут быть полностью перенесены на другой.
Цитоскелет широко реструктурирован в стромальных клетках эндометрия, подвергающихся децидуализации. Преобладающим промежуточным филаментом в фибробластах эндометрия небеременных мышей является виментин, мезенхимальный маркер. Во время децидуализации десмин, промежуточная молекула филаментов, характерная для гладкомышечных клеток, интенсивно продуцируется децидуальными клетками мыши. 56 Филаменты десмина изменяют свое положение в соответствии с прогрессивными стадиями дифференцировки децидуальных клеток антимезометрия.Первоначально этот белок находится вокруг ядер предецидуальных или децидуальных клеток и имеет форму шапочки. Позже он постепенно распространяется по цитоплазме, затем концентрируется на ее периферии и исчезает в инволютивных децидуальных клетках. 57 Функциональное значение этого динамического поведения неясно. В то время как активность щелочной фосфатазы (ЩФ) имеет долгую историю использования в качестве децидуального маркера, 58 десмин был первым молекулярным маркером, связанным с децидуализацией.В дополнение к морфологическому наблюдению, экспрессия десмина дает возможность точно локализовать децидуальные клетки in situ с помощью иммуногистохимии, что позволяет контролировать трансформацию децидуальных клеток. К списку децидуальных маркеров добавлены и другие молекулы, в том числе децидуальный протеин, связанный с пролактином (dPRP) 59 и костный морфогенетический протеин 2 (BMP2).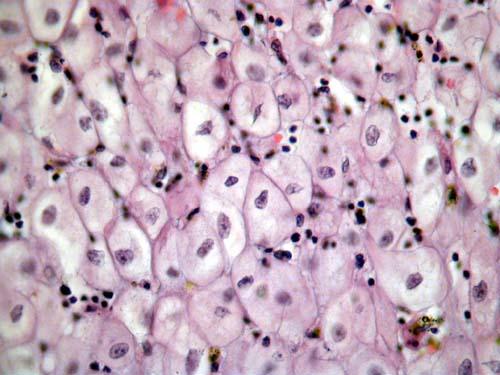 60
60
Научные публикации в Интернете
R Pingili, W Jackson
Ключевые слова
комбинированные оральные противозачаточные таблетки,
децидуальный слепок,
внематочная беременность,
эндометриальный слепок.,
перепончатая дисменорея,
маточная гипсовая повязка
Цитата
R Pingili, W. Jackson. Децидуальный слепок . Интернет-журнал гинекологии и акушерства. 2007 Том 9 Номер 1.
Аннотация
Выстилка беременной матки, кроме области, занимаемой плацентой, называется децидуальной оболочкой. Внешний вид нормальной оболочки матки под действием прогестерона может стать децидуализированным.Когда область децидуальной оболочки выпадает, это называется децидуальной гипсовой повязкой, потому что она часто выступает в форме полости матки. Децидуальные цилиндры имеют хорошо известную связь с внематочной беременностью. Децидуальный гипс также был зарегистрирован у небеременных женщин как побочный эффект при использовании менопаузального гонадотропина человека (ГМГ), хорионического гонадотропина человека (ХГЧ) и прогестагенов. Редко можно увидеть децидуальную повязку при использовании комбинированных оральных противозачаточных таблеток стандартной дозы. Мембранозная дисменорея встречается редко и вызывает сильную схваткообразную боль в результате прохождения неповрежденного эндометриального слепка через недилатированную шейку матки.Мы сообщаем об интересном случае децидуальной гипсовой повязки и перепончатой дисменореи после приема комбинированных оральных контрацептивов.
Отчет о болезни
Сообщаем об интересном случае прохождения децидуальной гипсовой ткани. В наше отделение поступила 16-летняя девочка с сильными болями в животе и вагинальным кровотечением. Ей прописали Микрогинон 30 микрограмм (комбинированные оральные противозачаточные таблетки, стандартная дозировка), чтобы принимать их вместе при сильных болезненных менструациях.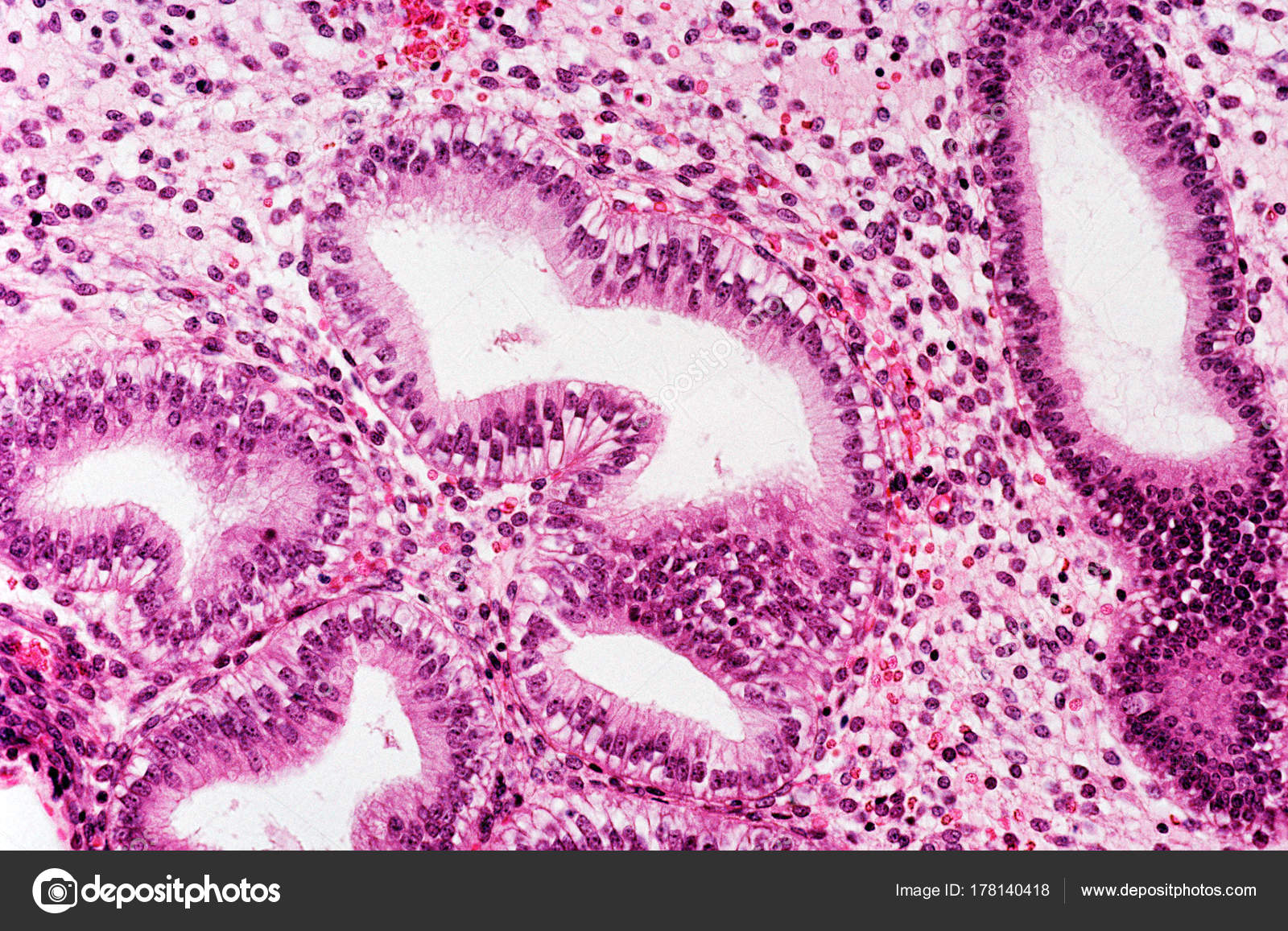 Она принимала эти таблетки 3 месяца. После 15 дней приема последней таблетки у нее началось болезненное вагинальное кровотечение, связанное с сильной спастической болью в нижней части живота, из-за чего она обратилась в больницу, и у нее прошла децидуальная гипсовая ткань, и ее симптомы исчезли после прохождения ткани. Тест на беременность отрицательный. Позже она прошла сканирование, которое показало, что матка и яичники в норме. После этого эпизода у нее возобновились нормальные регулярные месячные.
Она принимала эти таблетки 3 месяца. После 15 дней приема последней таблетки у нее началось болезненное вагинальное кровотечение, связанное с сильной спастической болью в нижней части живота, из-за чего она обратилась в больницу, и у нее прошла децидуальная гипсовая ткань, и ее симптомы исчезли после прохождения ткани. Тест на беременность отрицательный. Позже она прошла сканирование, которое показало, что матка и яичники в норме. После этого эпизода у нее возобновились нормальные регулярные месячные.
Гистопатологическое исследование подтвердило диагноз.
Гистопатологический отчет
Макроскопия: слепок полости матки 5x6x1 см.
Микроскопия: Частично некротический эндометрий показывает заметное децидуальное изменение стромы, но скорее неактивные расширенные железы.
Диагноз: Децидуальное изменение эндометрия.
Рисунок 1
Рисунок 1-3: Отдельное литье
Рисунок 2
Рисунок 3
Обсуждение
Выстилка беременной матки, кроме области, занимаемой плацентой, называется децидуальной оболочкой.Внешний вид нормальной оболочки матки под действием прогестерона становится децидуализированным. Когда область децидуальной оболочки выпадает, это называется децидуальной гипсовой повязкой, потому что она часто выступает в форме полости матки. Децидуальные цилиндры имеют хорошо известную связь с внематочной беременностью (–1). На УЗИ внематочная беременность с децидуальной гипсовой повязкой часто ошибочно принимается за внутриутробную беременность ( 2 ). Клинически удаление децидуальной гипсовой повязки может имитировать выкидыш.Децидуальный гипс также был зарегистрирован у небеременных женщин как побочный эффект при использовании менопаузального гонадотропина человека (ГМГ), хорионического гонадотропина человека (ХГЧ) и прогестагенов. Редко можно увидеть децидуальный слепок указанного размера, формы и толщины при использовании комбинированных пероральных противозачаточных таблеток стандартной дозы. Мембранозная дисменорея встречается редко и вызывает сильную схваткообразную боль в результате прохождения неповрежденного эндометриального слепка через недилатированную шейку матки ( 3 , 4 ).
Мембранозная дисменорея встречается редко и вызывает сильную схваткообразную боль в результате прохождения неповрежденного эндометриального слепка через недилатированную шейку матки ( 3 , 4 ).
Заключение
Децидуальные цилиндры и мембранозная дисменорея, хотя и редко, должны рассматриваться у небеременных женщин, принимающих ХГЧ, ГМГ, прогестагены или даже комбинированные пероральные противозачаточные таблетки, проявляющиеся сильной спастической болью в животе и кровотечением при отхождении тканей. Эти слепки могут вводить в заблуждение при недиагностированной внематочной беременности, тогда они могут быть ошибочно приняты за внутриутробный гестационный мешок на ультразвуковом сканировании, поэтому очень важно отслеживать такие случаи с помощью серийных уровней бета-ХГЧ.
Список литературы
1. Дж. П. Максвелл (1929). На цилиндрах матки. Международный журнал акушерства и гинекологии, 36 544.
2. WG Bradley, CE Fiskie и RA Filly (1982). Знак двойного мешка на ранних сроках внутриутробной беременности: использование для исключения внематочной беременности. Радиология, 143, 223-226.
3. Джозеф Л. Мэйо (1997). Здоровый менструальный цикл. Clinical Nutrition Insights, 5,9.
4. Рабинерсон Д., Каплан Б., Фиш Б., Браславски Д., Нери А. Мембранозная дисменорея: забытая сущность.Obstet Gynecol. 1995 Май; 85 (5 Pt 2): 891-2.
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.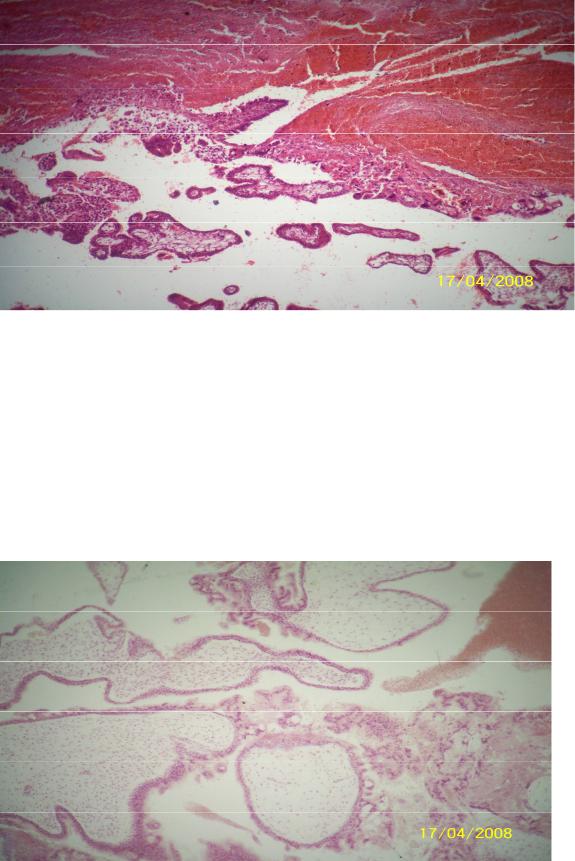
Децидуальный клеточно-специфический поверхностный антиген (ы), распознаваемый моноклональными антителами: распределение по тканям и видам.
Abstract
Децидуальные клетки являются прямыми потомками стромальных клеток эндометрия и конечным потомком предшественников, полученных из костного мозга.Принимая во внимание их генеалогию костного мозга и продемонстрированную иммунорегуляторную роль во время беременности, в этом исследовании была предпринята попытка идентифицировать маркер (ы) дифференцировки на децидуальных клетках мышей в надежде проследить путь их развития и изучить их семейные отношения с другими лимфомиелоидными клетками. Два связывающих белок A моноклональных антитела изотипа IgG2b (секретируемые клонами 16F12 и 2G4F8) были получены путем иммунизации девственных мышей CBA сингенными децидуальными клетками. Присутствие и плотность антигенного маркера (ов), распознаваемого этими антителами, исследовали с помощью радиоавтографии на различных типах клеток в суспензиях отдельных клеток децидуальной оболочки, плаценты и лимфомиелоидных органов после сэндвич-мечения супернатантами гибридомы с последующим 125I-протеином А. .Оба антитела, по-видимому, распознают антиген (ы), уникальный для линии децидуальных клеток у мышей, людей и крыс. Распространенность антиген-несущих децидуальных клеток увеличивалась с возрастом беременности у мышей CBA, C3H и CD1 между 8 и 14 днями, а у людей — между 6 и 10,5 неделями; у крыс, однако, некоторое снижение было отмечено между 8 и 14 днями. Связывание всегда было выше с 16F12, чем с супернатантами 2G4F8. Никакого значительного связывания антител с трофобластными клетками плаценты или лейкоцитами в децидуальной оболочке не было отмечено ни у одного из вышеупомянутых линий или видов мышей.На лимфомиелоидных клетках девственных или беременных мышей CBA наблюдали незначительное или полное отсутствие мечения любого типа клеток, но последовательное мечение редких клеток бластного типа в крови наблюдалось с обоими антителами, что повышает вероятность того, что эти клетки могут представлять циркулирующий предшественник линии децидуальных клеток. Остается выяснить, распознают ли эти антитела один и тот же или разные антиген (ы) дифференцировки на децидуальных клетках, и означает ли сохранение этого антигена (ов) во время видообразования его функциональное значение.
Остается выяснить, распознают ли эти антитела один и тот же или разные антиген (ы) дифференцировки на децидуальных клетках, и означает ли сохранение этого антигена (ов) во время видообразования его функциональное значение.
- Авторские права © 1985 Американской ассоциацией иммунологов
Рецидивирующая потеря беременности связана с прорастающей децидуальной реакцией во время периимплантационного окна
Abstract
Нарушение взаимодействия плода и матери на ранних сроках беременности вызывает выкидыш. Циклический эндометрий становится готовым к переходу в состояние беременности во время окна средней ягодичной имплантации, что совпадает с дифференцировкой стромальных клеток в децидуальные клетки (DC) и появлением стареющих децидуальных клеток (snDC).Новые данные свидетельствуют о том, что DC задействуют естественные клетки-киллеры матки для устранения их стареющих собратьев, тем самым обеспечивая формирование прочного децидуального матрикса во время беременности. Чтобы проверить, увеличивает ли неспособность сдерживать snDC во время периимплантационного окна риск выкидыша, мы реконструировали децидуальный путь на одноклеточном уровне in vitro и продемонстрировали, что без иммунного надзора вторичное старение быстро превращает DC в резистентные к прогестерону. клетки, которые в большом количестве экспрессируют факторы ремоделирования внеклеточного матрикса.Дополнительный одноклеточный анализ эндометрия средней ягодицы идентифицировал DIO2 и SCARA5 как маркерные гены расходящегося децидуального ответа in vivo . Наконец, мы сообщаем о заметной связи между прорастающей децидуальной реакцией эндометрия в лютеиновой фазе и повторяющимся невынашиванием беременности, предполагая, что скрининг и вмешательство до беременности могут снизить бремя выкидыша.
Введение
Примерно 15% клинических беременностей заканчиваются выкидышем 1 , чаще всего в течение первого триместра. Хромосомные аномалии плода составляют 50-60% спорадических выкидышей 2 , хотя частота повторных выкидышей ниже (RPL) 3, 4 , определяемых как две или более потери 5, 6 . Кроме того, с каждым дополнительным выкидышем частота потери эуплоидов увеличивается, тогда как вероятность успешной беременности снижается. 7 , указывая на то, что маточные факторы приводят к выкидышам более высокого порядка. К сожалению, в RPL 5 немногочисленные меры позволяют улучшить показатели живорождения, что свидетельствует о том, что в большинстве случаев лежащие в основе механизмы не до конца поняты.
Хромосомные аномалии плода составляют 50-60% спорадических выкидышей 2 , хотя частота повторных выкидышей ниже (RPL) 3, 4 , определяемых как две или более потери 5, 6 . Кроме того, с каждым дополнительным выкидышем частота потери эуплоидов увеличивается, тогда как вероятность успешной беременности снижается. 7 , указывая на то, что маточные факторы приводят к выкидышам более высокого порядка. К сожалению, в RPL 5 немногочисленные меры позволяют улучшить показатели живорождения, что свидетельствует о том, что в большинстве случаев лежащие в основе механизмы не до конца поняты.
После постовуляторного повышения уровня циркулирующего прогестерона эндометрий становится временно восприимчивым к имплантации эмбриона во время средней ягодичной фазы цикла. Это окно имплантации также знаменует начало интенсивного ремоделирования тканей 8 , которое происходит в строме за счет дифференцировки стромальных клеток эндометрия (EnSC) в специализированные децидуальные клетки (DC) и накопления клеток естественных киллеров матки (uNK) 9 . После имплантации эмбриона DC быстро инкапсулирует концептус 10 , участвует в биосенсоре эмбриона 11 и затем формирует децидуальный матрикс, который контролирует инвазию трофобластов 12 .На молекулярном уровне децидуальная трансформация EnSC включает ремоделирование ландшафта хроматина 13 по всему геному, репрограммирование множественных сигнальных путей 14–16 и активацию децидуальных генных сетей 17, 18 . Этот многоступенчатый процесс дифференцировки начинается с эволюционно консервативной реакции на острый клеточный стресс 19 , отмеченной всплеском активных форм кислорода (ROS) и высвобождением провоспалительных цитокинов 9, 20, 21 .После периода задержки в несколько дней EnSC теряют свой фибробластический вид и превращаются в секреторные DC с обильной цитоплазмой и выдающимся эндоплазматическим ретикулумом 8 . Отличительной чертой постоянного тока является устойчивость к множественным сигналам стресса. Несколько механизмов лежат в основе децидуальной устойчивости к стрессу, включая молчание пути c-Jun N-терминальной киназы (JNK) и активацию различных белков защиты от стресса и поглотителей ROS 8, 15, 22 . Кроме того, DC сильно экспрессируют 11β-гидроксистероиддегидрогеназу типа 1 23 , которая превращает неактивный кортизон в кортизол, мощный противовоспалительный глюкокортикоид.Таким образом, по сравнению с EnSC, DC прекрасно адаптированы для противодействия гипервоспалению и стрессу, связанным с глубокой гемохориальной плацентой.
Отличительной чертой постоянного тока является устойчивость к множественным сигналам стресса. Несколько механизмов лежат в основе децидуальной устойчивости к стрессу, включая молчание пути c-Jun N-терминальной киназы (JNK) и активацию различных белков защиты от стресса и поглотителей ROS 8, 15, 22 . Кроме того, DC сильно экспрессируют 11β-гидроксистероиддегидрогеназу типа 1 23 , которая превращает неактивный кортизон в кортизол, мощный противовоспалительный глюкокортикоид.Таким образом, по сравнению с EnSC, DC прекрасно адаптированы для противодействия гипервоспалению и стрессу, связанным с глубокой гемохориальной плацентой.
Недавно мы продемонстрировали, что децидуализация также приводит к появлению стареющих децидуальных клеток (snDC), как in vitro, , так и in vivo 9, 24 . В строме количество клеток, экспрессирующих p16 INK 4 , опухолевый супрессор и маркер канонического старения, временно достигает пика во время средней ягодичной фазы, прежде чем снова возрастает перед менструацией 9 .Клеточное старение определяется состоянием постоянной остановки клеточного цикла и значительной секрецией различных биоактивных молекул, включая ROS, белки ремоделирования внеклеточного матрикса (ECM), провоспалительные цитокины, хемокины и факторы роста, называемые секреторным фенотипом, связанным со старением (SASP). ) 25–27 . Различные типы стареющих клеток лежат в основе патологических и физиологических процессов. Хронические стареющие клетки прогрессивно накапливаются в ответ на различные стрессоры и вызывают постепенную потерю функции органов во время старения и при возрастных заболеваниях, опосредованных пагубными эффектами SASP на гомеостаз тканей 25, 27 .Напротив, остро стареющие клетки связаны с биологическими процессами, которые включают запрограммированное ремоделирование тканей, включая эмбриогенез и заживление ран 27–29 . Они индуцируются в ответ на специфические сигналы, продуцируют временный SASP с определенными паракринными функциями и быстро выводятся иммунными клетками 25 . Недавно мы продемонстрировали, что snDC обнаруживают признаки остро стареющих клеток 9 . Во-первых, как DC, так и snDC возникают в ответ на активацию FOXO1, основного децидуального транскрипционного фактора ниже протеинкиназы A (PKA) и путей передачи сигналов прогестерона.Во-вторых, связанный с ними SASP критически усиливает начальную децидуальную воспалительную реакцию, которая не только управляет дифференцировкой EnSC, но также связана с индукцией ключевых генов рецептивности 21 . Кроме того, мы предоставили доказательства того, что DC рекрутирует и активирует клетки uNK, которые, в свою очередь, могут устранять snDC посредством экзоцитоза гранул, содержащих перфорин и гранзимы 9, 24 .
Хотя snDC составляют относительно небольшую и изменчивую популяцию стромы в эндометрии средней ягодицы, они обладают потенциалом глубоко влиять на разворачивающуюся децидуальную реакцию таким образом, что либо способствует, либо предотвращает прогрессирование беременности.Напр., Временный SASP, связанный с остро стареющими клетками, как было показано, способствует пластичности ткани за счет увеличения популяции резидентных предшественников 9, 30 . Напротив, стареющие клетки, которые персистируют (т.е. хронические стареющие клетки), могут вызывать старение в соседних клетках посредством передачи сигналов юкстракрина (так называемого «вторичного» или «стороннего» старения), что приводит к пространственно-временному распространению фенотипа и потере функции ткани 25, 31 , 32 .
Недавно мы сообщили о потере клональных мезенхимальных стволовых подобных клеток (MSC) в эндометрии средней ягодицы у пациентов с RPL, но как это связано с последующим разрушением децидуально-плацентарного интерфейса во время беременности, неясно 33 .Мы предположили, что дефицит МСК может вызывать прогрессирующий децидуальный ответ во время периимплантационного окна, достигающий кульминации в хроническом воспалении на ранних сроках беременности, протеолизе децидуально-плацентарного интерфейса и выкидыше. Чтобы проверить это предположение, мы сначала выполнили одноклеточный транскриптомный анализ децидуализации первичных культур EnSC, картировали появление DC и snDC и идентифицировали ко-регуляторные генные сети, лежащие в основе многоступенчатого децидуального пути. Затем мы распространили одноклеточный анализ на периимплантационные биопсии эндометрия и проверили стромо-специфические маркерные гены, которые сигнализируют о дивергенции децидуальной реакции в сторону просенесцентного децидуального состояния.Затем анализировали экспрессию двух маркерных генов, DIO2 и SCARA5 , а также количество uNK-клеток в периимплантационных биопсиях эндометрия у 89 пациентов с RPL и 90 контрольных субъектов.
Результаты
Одноклеточный анализ децидуального пути
in vitro
Чтобы идентифицировать предполагаемые маркерные гены DC и snDC, мы сначала реконструировали децидуальный путь in vitro с использованием транскриптомики одноклеточных. Как схематически изображено на Фигуре 1а, первичные EnSC децидуализировали с помощью прогестина (медроксипрогестерона ацетат, MPA) и аналога циклического аденозинмонофосфата (8-бром-цАМФ, цАМФ) в течение 8 дней.Затем сигнал дифференциации был отключен на 2 дня для оценки зависимости децидуальных подмножеств прогестерона / цАМФ. Клетки собирали каждые 48 ч и подвергали одноклеточному анализу с использованием штрих-кодирования нанолитровых капель и высокопроизводительного секвенирования РНК 34 . Примерно 800 клеток секвенировали за один момент времени, что дало в среднем 1282 гена на клетку. После контроля качества вычислений (дополнительный рисунок S1) 4580 клеток были отнесены к 7 состояниям транскрипционных клеток с использованием методов общего ближайшего соседа (SNN) и t -распределенного стохастического соседнего вложения (t-SNE).На рис. 1b показаны клетки, обозначенные цветом по дням лечения, а на рис. 1с — по состоянию транскрипции (S1-7). 10 основных дифференциально экспрессируемых генов (DEG) между 7 состояниями клеток представлены в виде тепловой карты (дополнительный рисунок S2 и таблица S1). За исключением дискретной популяции пролиферативных клеток (S1), основная масса недифференцированных EnSC находилась в S2. Ко 2 дню децидуализации большинство клеток перешло в S3, который отличался от S2 на 898o (дополнительная таблица S2). Этот стремительный транскриптомный ответ соответствует острому ответу на клеточный стресс и совпал с временным повышением секреции IL-6 и IL-8 независимо от транскрипции (дополнительный рисунок S3).Децидуализованные клетки затем прогрессировали синхронно с S4 к 4 дню, после чего они разделились на два транскрипционно различных субнабора, S5 и S6 (Fig. 1c). Анализ независимых культур EnSC подтвердил, что децидуализация поляризует клетки на два подмножества (дополнительный рисунок S4). Известные гены защиты от децидуального стресса (например, CRYAB , HSD11B1 и GLRX ) 35–37 были обогащены S5 (обозначены DC), тогда как гены, участвующие в передаче сигналов окислительного стресса и клеточного старения, включая KIAA1199 , CLU и ABI3BP 38–41 , преобладали в S6 (обозначенном snDC) (рис.1d и дополнительный рисунок S5). Примечательно, что на 6 день доля DC и snDC составляла 78% и 13% соответственно (рис. 1e и дополнительная таблица S3). К 8-му дню snDC были почти такими же многочисленными, как DC (42% и 45% соответственно), что свидетельствует о безудержном вторичном старении. Прекращение сигнала децидуализации на 8 день вызывало дальнейшее изменение транскрипции (S7), которое объяснялось частичной де-дифференцировкой> 95% DC (дополнительные таблицы S2 и S3). Напротив, snDC были гораздо более устойчивы к отмене, что свидетельствует об утрате зависимости от прогестерона / цАМФ.
Рис. 1. Одноклеточная реконструкция децидуального пути в культуре.
a Схематическое изображение эксперимента in vitro с динамикой времени. b t -SNE проекция 4,580 EnSC с цветовой кодировкой в соответствии с днями децидуализации (D0-8) и после снятия (WD) сигнала дифференциации в течение 48 часов. D0 представляет собой недифференцированный EnSC. c Тот же график t -SNE теперь имеет цветовую кодировку в соответствии с состоянием транскрипции (S1-7). d Графики скрипки, показывающие логарифмически преобразованные, нормализованные уровни экспрессии для указанных генов в децидуальных клетках (DC, состояние S5) и стареющих децидуальных клетках (snDC, состояние S6). e Относительная доля всех ячеек, назначенных состояниям S5 (DC), S6 (snDC) и S7 в каждый экспериментальный момент времени. f Decidualizing EnSC были помещены в псевдовремя, чтобы реконструировать траекторию дифференциации, показывая непрерывную траекторию к старению с единственной точкой ветвления, отмечающей дивергенцию DC. g Тепловая карта, показывающая динамику гена во время перехода между состояниями клетки в точке ветвления, показанной на панели f. Столбцы представляют собой точки в псевдовремени, а строки представляют 50 наиболее динамичных генов в точке ветвления. Начало псевдовремени находится в середине тепловой карты, а траектория в направлении DC и snDC обозначена стрелками. Иерархическая кластеризация визуализирует модули генов с аналогичными зависимыми от клонов паттернами экспрессии.
Таблица 1:
Демография субъектов
Для дальнейшего изучения «переключения» DC в snDC мы заказали децидуализацию клеток (D2-8) в псевдовремя и закодировали их цветом по состоянию транскрипции.Как показано на рисунке 1f, этот анализ показал, что децидуализация EnSC продвигается по непрерывной траектории к старению. Эта траектория была прервана единственной точкой ветвления, отмечая дивергенцию DC и подмножество DC, уже переходящее к стареющему фенотипу. 50 основных генов, лежащих в основе этой точки ветвления, изображены на модифицированной тепловой карте и иерархически сгруппированы для визуализации модулей генов со сходными паттернами экспрессии (рис. 1g). DIO2 , кодирующий йодтирониндейодиназу 2, был идентифицирован как ген главной ветви в пути старения.Этот фермент катализирует превращение прогормона тироксина (Т4) в биоактивный трийодтиронин (Т3) 42 , что свидетельствует об усилении энергетического метаболизма в snDC. Множественные гены, кодирующие факторы ремоделирования ВКМ, связанные со старением, совместно регулируются с DIO2 , включая LUM (люмикан) 43 , CLU (кластерин) 41 , ADAMTS5 (металлопептидаза ADAM с тромбоспондином типа 1). мотив 5) 44 , KIAA1199 (также известный как гиалуронидаза 1, индуцирующая миграцию клеток, CEMIP) 39 и ABI3BP (связывающий белок члена 3 семейства ABI) 38 .Примечательно, что IGFBP1 , широко используемый децидуальный маркерный ген 8 , также был частью этого модуля. FTL и SCARA5 , наряду с известными децидуальными генами, такими как GLRX и IL1RL1 , были частью выдающегося модуля ветвления в не стареющем децидуальном пути (Fig. 1g). FTL кодирует легкую цепь ферритина (L-ферритин), а SCARA5 (член 5-го класса акцепторных рецепторов) — рецептор L-ферритина, что свидетельствует об увеличении накопления железа и способности к детоксикации в DC.
Взятые вместе, одноклеточный анализ подтвердил, что децидуализация — это многоступенчатый процесс, который начинается с острой аутовоспалительной реакции, которая, в свою очередь, синхронизирует переход клеток через промежуточные состояния транскрипции, прежде чем проявляться в основном в виде DC и некоторых snDC. Мы также продемонстрировали, что snDC быстро увековечивает фенотип старения в культуре, что приводит к хроническому старению и повышенной экспрессии компонентов ECM, протеаз и других компонентов SASP.
Совместно регулируемые децидуальные генные сети
Мы использовали кластерный анализ k-средних для идентификации сетей совместно регулируемых генов через децидуальный путь (дополнительная таблица S4). Анализ 1748 ° дал 7 сетей уникально совместно регулируемых генов. На рисунке 2 изображены отдельные сети, аннотированные для выбранных генов факторов транскрипции (TF) с ключевыми ролями в децидуализации. Гены сети A1 быстро подавляются в течение первых 48 часов децидуального процесса, после чего экспрессия остается в значительной степени стабильной.Наиболее заметным TF, который «сбрасывается» таким образом после децидуализации, является рецептор прогестерона (PGR). Это наблюдение согласуется с предыдущим исследованием, утверждающим, что сверхэкспрессия PGR блокирует образование мультимерных транскрипционных комплексов при децидуализации посредством подавления ключевых ко-регуляторов 45 . Гены сети A2, включая HOXA10 и , постепенно подавляются при децидуализации. Сети B1 и B2 состоят из двухфазных генов, пик которых предшествует появлению DC и snDC.Они включают несколько генов, кодирующих основные децидуальные ТФ, такие как STAT3 , MEIS1 , KLF9 , WT1 и FOXO1 8, 19 . Гены в сети C1 постепенно индуцируются после децидуализации, а затем достигают пика в DC. Выдающиеся TFs в этой сети представляют собой производные сердца и нервного гребня, экспрессируемые 2 (HAND2) и FOS like 2 (FOSL2), мощный корегулятор PGR 46 . Напротив, две различные сети послужили основой для появления snDC.Сетевые гены C2 постепенно повышаются во время начальной децидуальной фазы, но затем экспрессия быстро ускоряется, особенно в snDC. Интересно, что эта сеть обогащена терминами генной онтологии «секретируемый» (скорректированный по Бенджамини P = 3,7 × 10 -5 , модифицированный точный тест Фишера) и «путь передачи сигналов интерферона типа I» (скорректированный по Бенджамини P = 1,4 × 10 -6 , модифицированный точный тест Фишера) (дополнительная таблица S5), оба канонических признака клеточного старения 24 .Выдающимся TF в этой сети, связанной со старением, является преобразователь сигналов и активатор транскрипции 1 (STAT1), который не только активируется с помощью передачи сигналов интерферона, но также является мощным ингибитором передачи сигналов PGR в клетках эндометрия 47 . Вторая двухфазная сеть, обозначенная как сеть D, также связана с snDC. Гены в этой сети первоначально репрессируются при децидуализации, а затем повторно экспрессируются преимущественно в snDC. Интересно, что эта сеть обогащена генами, которые, как известно, подавляются PGR, включая гены TF SOX4 и FOXP1 14 .Взятые вместе, данные показывают, что сложные сети совместно регулируемых генов лежат в основе прогрессирования клеток по децидуальному пути, и предполагают, что измененные уровни экспрессии ко-регуляторов PGR, таких как FOSL2 и STAT1, могут объяснять прогестероновую зависимость DC и прогестерона. -сопротивление snDC.
Рис. 2. Кластерный анализ K-средних идентифицирует совместно регулируемые децидуальные генные сети
Анализ 1748 ° децидуального пути (D0-D8) дал семь сетей уникально совместно регулируемых генов.Сети аннотированы для выбранных генов факторов транскрипции, играющих ключевую роль в децидуализации.
Скоординированная активация генов иммунного надзора
Мы дополнительно исследовали сети для генов, кодирующих факторы, участвующие в иммунном надзоре за стареющими клетками. CXCL14 и IL-15 управляют хемотаксисом, пролиферацией и активацией uNK-клеток, соответственно 9, 48 . ТИМП-3 (ингибитор 3 ТИМП-металлопептидазы) играет важную роль в иммунном распознавании стрессированных или стареющих клеток, ингибируя протеолитическое расщепление лигандов поверхностного стресса, необходимых для распознавания NK-клеток 49 .Интересно, что CXCL14 , IL15, и TIMP3 принадлежат к одной и той же двухфазной генной сети (B2), характеризующейся пиком экспрессии непосредственно перед появлением DC и snDC (Fig. 3a). Впоследствии экспрессия этих генов заметно снижается в snDC, но гораздо меньше в DC. Для дальнейшего изучения этой концепции «запрограммированного» иммунного надзора мы контролировали секретируемые уровни CXCL14, IL-15 и TIMP-3 каждые 48 часов в течение 8-дневного курса в 4 независимых децидуализованных культурах.Как показано на рисунке 3b, секретируемые уровни всех 3 факторов быстро повышаются во время начальной децидуальной фазы. В то время как уровни CXCL14 и TIMP-3 затем, по-видимому, выходят на плато, IL-15 продолжает накапливаться в супернатанте.
Рис. 3. Скоординированная экспрессия децидуальных генов иммунного надзора.
a Децидуальная генная сеть B2 снабжена аннотациями для выделения генов, участвующих в активации uNK-клеток и иммунном надзоре за старческими клетками. b Первичные культуры EnSC децидуализировали 8-бром-цАМФ и МРА (C + M) в течение указанных дней.ELISA выполняли на отработанной среде, собранной с 48-часовыми интервалами, чтобы исследовать секретируемые уровни CXCL14, IL-15 и TIMP-3. Серые пунктирные линии показывают уровни секрета в отдельных культурах (n = 4). Черные сплошные линии указывают средний уровень секреции. c Четыре независимых первичных культуры EnSC децидуализировали 8-бром-цАМФ и MPA (C + M) в течение указанных дней. ELISA выполняли на отработанной среде, собранной с 48-часовыми интервалами, для исследования секретируемых уровней кластерина (CLU) и sST2.Культуры, полученные из одной и той же биопсии, соответствуют цвету на графиках (пунктирные линии). Черные сплошные линии указывают средний уровень секреции. d Схематическое изображение экспериментов по совместному культивированию клеток uNK. Всего 5000 первичных uNK-клеток культивировали совместно в течение 48 часов с указанной точки времени с 50000 децидуализированных клеток, высеянных в 96-луночные планшеты. Использовали четыре независимых культуры EnSC. e Активность SAβG в недифференцированных и децидуализированных (C + M) клетках, совместно культивируемых с клетками uNK или без них.Использовали четыре независимых культуры EnSC. f Секреция CLU и sST2 в децидуализированных (C + M) клетках, совместно культивируемых с клетками uNK, по сравнению с децидуализированными клетками, культивированными без клеток uNK. Использовали четыре независимых культуры EnSC, линии соединяли парные образцы.
Кластерин (CLU) и растворимый рецептор-ловушка sST2 IL-33 (кодируемый IL1RL1 ) являются предполагаемыми секретируемыми маркерами snDC и DC, соответственно (рис. 1g). Как показано на фиг. 3c, секретируемые уровни обоих маркеров заметно увеличиваются при децидуализации, хотя повышение уровней sST2 обычно предшествует секреции CLU.Мы предположили, что совместное культивирование с клетками uNK может избирательно ослаблять секрецию маркеров snDC. Чтобы проверить эту гипотезу, uNK-клетки были выделены из супернатантов свеже культивированных EnSC с использованием магнитно-активированной сортировки клеток (MACS), а чистота и жизнеспособность клеток подтверждены проточной цитометрией (дополнительный рисунок S6). Схема эксперимента изображена на рисунке 3d. Чтобы контролировать гибель стареющих клеток uNK-клетками, мы измерили активность ассоциированной со старением β-галактозидазы (SAβG), широко используемого маркера старения 26 , в недифференцированных и децидуализированных культурах с добавлением или без добавления первичные клетки uNK.Как сообщалось ранее 9 , увеличение активности SAβG при децидуализации было полностью отменено при совместном культивировании с клетками uNK (рис. 3e, правая панель). Напротив, клетки uNK не влияли на базальную активность SAβG в недифференцированных культурах. Совместное культивирование uNK-клеток с децидуализированными клетками также снижает секретируемые уровни CLU, стресс-индуцированной молекулы молекулярного шаперона, 41 , примерно на 50% (рис. 3e, средняя панель). Напротив, uNK-клетки практически не влияли на уровни секретируемого sST2 (рис.3e, правая панель), который секретируется DC (рис. 1g). Чтобы подтвердить, что клетки uNK нацелены на snDC, шесть независимых первичных культур EnSC децидуализировали в течение 8 дней в присутствии или в отсутствие дазатиниба, сильнодействующего сенолитического препарата 9 . Как показано на дополнительной фигуре S7, дазатиниб также заметно снижал активность SAβG и избирательно ингибировал CLU, тогда как влияние на секрецию sST2 было минимальным, таким образом повторяя действия клеток uNK. Взятые вместе, данные показывают, что экспрессия и секреция децидуальных факторов, участвующих в рекрутировании и активации uNK клеток, жестко запрограммированы, чтобы совпадать с появлением snDC.Если повторить in vivo , эти наблюдения дополнительно предполагают важную роль uNK-клеток в ограничении пагубного воздействия snDC на ранних сроках беременности. экспрессируется или индуцируется в железистых эпителиальных клетках после овуляции 8 . Чтобы идентифицировать стром-специфические маркерные гены дивергентного периимплантационного децидуального ответа, мы сначала подвергали свежевыделенные клетки эндометрия scRNA-seq.Биопсии были рассчитаны относительно преовуляторного выброса лютеинизирующего гормона (ЛГ), чтобы совпасть с окном средней ягодичной имплантации (LH + 8; n = 3) или началом поздней лютеиновой фазы (LH + 10; n = 3). После контроля качества (дополнительный рисунок S8) анализ t-SNE отнес 2 847 клеток к 5 кластерам, обозначенным цветом, чтобы указать день биопсии (фиг. 4a, левая панель). Дополнительный анализ уменьшения размерности был проведен на иммунных клетках (рис. 4а, правая панель). Кластеры были обозначены на основе канонических маркерных генов как эндотелиальные клетки (EC; n = 141), эпителиальные клетки (EpC; n = 395), иммунные клетки (IC; n = 352) и EnSC (n = 1943) (рис.4c и дополнительная таблица S6). Кроме того, был идентифицирован дискретный, но еще не охарактеризованный кластер пролиферирующих клеток (PC; n = 16) (рис. 4a). EpC разделен на 4 кластера с наиболее многочисленной популяцией (EpC1), экспрессирующей гены прототипической рецептивности (например, GPX3 , PAEP и DPP4 ) (рис. 4b) 50 . ЕрС2 — это мерцательные эпителиальные клетки, обнаруженные вкраплениями по железам эндометрия (дополнительный рисунок S9). EpC3 были получены преимущественно, но не исключительно, из одной биопсии, тогда как EpC4 представлял неоднозначную популяцию, экспрессирующую как эпителиальные, так и стромальные маркерные гены (рис.4б). Клетки uNK, представляющие 89% всех IC, сгруппированы в 3 субпопуляции (NK1-3; рис. 4a, правая панель). Примечательно, что различные популяции NK также недавно были описаны у беременной децидуальной оболочки 51 . На основе анализа CIBERSORT и перекрестных ссылок определяющих кластер транскриптов с каноническими маркерами, подобранными из литературы, оставшиеся иммунные популяции были идентифицированы как наивные B-клетки (IC1), моноциты (IC2) и макрофаги / дендритные клетки (IC3) ( Рис. 4c и дополнительная таблица S7).Количество различных типов и подгрупп клеток в каждой биопсии приведено в дополнительной таблице S3.
Рис. 4. Идентификация типов и подмножеств клеток эндометрия в окне имплантации.
a Левая панель: график t-SNE для 2847 клеток, выделенных из 6 биопсий с привязкой к LH, окрашенных, чтобы указать день цикла (LH + 8 или LH + 10), захватывает все основные типы клеток эндометрия, включая эпителиальные клетки (EpC). ), иммунные клетки (IC), эндотелиальные клетки (EC), стромальные клетки (EnSC) и дискретную, но транскрипционно отличную пролиферативную (PC) субпопуляцию стромы.EpC разделен на 4 субпопуляции (EpC1-4). * указывает, что EpC3 вносится преимущественно одним образцом. Правая панель: дополнительное уменьшение размерности разделенных иммунных клеток на 3 субнабора клеток uNK (NK1-3), наивные B-клетки (IC1), моноциты (IC2) и макрофаги / дендритные клетки (IC3) b Тепловая карта, показывающая относительную экспрессию (z -счет) маркеров, определяющих типы клеток и субпопуляции EpC. MYO6 , RASD1 и ALCAM включены как панэпителиальные гены. c Тепловая карта, показывающая относительную экспрессию маркеров, определяющих популяции эндометриальных IC во время окна имплантации, включая три подмножества клеток uNK.
Маркерные гены расходящихся децидуальных состояний
Затем мы сосредоточили внимание на EnSC, который заметно сгруппировался в день биопсии на графике t -SNE (рис. 4a). Прогрессирование от LH + 8 к LH + 10 было связано с изменением экспрессии 518 генов в EnSC (дополнительная таблица S8), 49% из которых также являются частью 7 совместно регулируемых генных сетей in vitro ( P <10 -1 43 , гипергеометрический тест).Хотя наш одноклеточный анализ был ограничен шестью биопсиями, полученными только в двух временных точках, мы предположили, что взаимосвязь между генами, которые управляют дивергенцией DC и snDC in vitro , будет, по крайней мере частично, сохраняться в стромальных клетках in vivo . Чтобы проверить эту гипотезу, мы выбрали 50 главных генов точки ветвления в децидуальном временном ходе и определили корреляции Пирсона для каждой пары генов в EnSC in vitro и in vivo на LH + 8 и LH + 10, соответственно. .Затем мы вычислили сумму коэффициентов в диапазоне от +2 до -2. Конгруэнтность была определена как сумма коэффициентов корреляции> 1 или <-1 для положительно и отрицательно сорегулируемых генов, соответственно (дополнительный рисунок S10). Используя этот критерий, 27% пар генов соответствовали как LH + 8, так и LH + 10, что значительно больше, чем ожидалось случайно ( P <10 -30 и P <10 -58 соответственно; гипергеометрический тест).
Мы пришли к выводу, что информативные гены-маркеры дивергентного децидуального ответа in vivo должны быть сильно обогащены стромальными клетками, не регулироваться железистым эпителием и иметь временной профиль в лютеиновой фазе, соизмеримый с ожидаемым переключением DC на snDC до к менструации.Из 50 генов-ответвлений 5 генов ( TIMP3 , IGF2 , DIO2 , SCARA5 и ABI3BP ) были сильно обогащены EnSC по сравнению с EpC, EC или IC. При перекрестной ссылке на два общедоступных набора данных [Gene Expression Omnibus (GEO) ID: GSE84169 и GEO ID: GDS2052), только SCARA5 и DIO2 соответствовали всем критериям. Примечательно, что SCARA5 принадлежит к сети C1 генов, пик экспрессии которых приходится на DC, тогда как DIO2 , ген, репрессированный активированным PGR при децидуализации EnSC 14 , принадлежит к сети D генов, связанных со старением (рис.5а). На рисунке 5b показана относительная экспрессия обоих генов в разных типах клеток эндометрия, а также их временная экспрессия в течение всего цикла. Затем мы измерили уровни транскриптов SCARA5 и DIO2 с помощью RT-qPCR в 250 образцах, полученных через окно имплантации (LH + 6-11), чтобы построить графики процентилей, основанные на статистическом распределении экспрессии генов за каждый день (рис. 5в). Чтобы определить, коэкспрессируются ли транскрипты SCARA5 и DIO2 или маркируют разные децидуальные клетки, мы выполнили мультиплексную одиночную гибридизацию in situ (smISH) на биоптатах эндометрия, полученных в один и тот же день цикла, но признанных SCARA5 HIGH / DIO2 LOW , SCARA5 LOW / DIO2 HIGH или SCARA5 AVERAGE / DIO2 AVERAGE на основе соответствующих графиков процентилей (Рис.5г). Большинство EnSC были SCARA5 + , но DIO2 — в биоптатах SCARA5 HIGH / DIO2 LOW , тогда как противоположная картина наблюдалась в образцах SCARA5 LOW / DIO2 HIGH . Однако образцы SCARA5 СРЕДНИЙ / DIO2 СРЕДНИЙ состояли из смеси клеток SCARA5 + или DIO2 + , а также промежуточных клеток, экспрессирующих оба транскрипта. Наконец, мы использовали вычислительный подход для выделения EnSC, относительно обогащенного транскриптами SCARA5 , но сниженного экспрессией DIO2 и , наоборот, .Как показано на дополнительном рисунке S11, SCARA5 , обогащенные / DIO2 , уменьшенные клеток характеризуются экспрессией нескольких децидуальных генов TF и стрессоустойчивости, тогда как сигнатура стрессового гена была заметной SCARA5 уменьшенным / DIO2 , обогащено клеток (дополнительная таблица S9).
Рис. 5. SCARA5 и DIO2 как маркерные гены для дивергентных децидуальных состояний.
a SCARA5 и DIO2 принадлежат к двум различным децидуальным генным сетям с пиком экспрессии в DC и snDC соответственно. b Пространственная и временная экспрессия SCARA5 и DIO2 в циклическом эндометрии человека. Левые панели, графики скрипки, демонстрирующие экспрессию SCARA5 и DIO2 in vivo в EnSC, EC (эндотелиальные клетки), EpC (эпителиальные клетки) и IC (иммунные клетки) (тест суммы рангов Вилкоксона с поправкой Бонферрони). Справа: экспрессия SCARA5 и DIO2 в пролиферативном эндометрии и эндометрии в ранней, средней и поздней лютеиновой фазе. Каждая полоса представляет собой индивидуальную биопсию.Данные были получены из данных микроматрицы, депонированных в Омнибусе экспрессии генов (GEO Profiles, GDS2052). c SCARA5 и Уровни транскриптов DIO2 , определенные количественно с помощью анализа RT-qPCR в 250 биоптатах эндометрия, полученных между LH + 6 и LH + 11. Вычисления центилей были выполнены для значений dCt с использованием программного обеспечения R, и графики были построены на основе распределения экспрессии на каждый день. Среднее количество образцов на каждый день составляло 43 (диапазон: от 30 до 46). d Мультиплексированная одиночная молекула in situ гибридизация (smISH) на 3 биопсиях эндометрия (LH + 10) признана SCARA5 HIGH / DIO2 LOW (95 th и 20 th процентиль, соответственно ), SCARA5 СРЕДНИЙ / DIO2 СРЕДНИЙ (60 -й и 52 -й процентиль соответственно) и SCARA5 НИЗКИЙ / DIO2 ВЫСОКИЙ (4 -й и 91 st процентиль соответственно).Вставка на левой панели показывает гибридизацию с зондом отрицательного контроля. На вставке в средней панели показаны ячейки SCARA5 + (синие, закрашенные стрелки) и DIO2 + (розовые, незакрашенные стрелки) в непосредственной близости. Шкала шкалы: 100 мкМ. Исходное увеличение: × 40.
RPL ассоциируется с аберрантной децидуальной реакцией
Чтобы изучить, связана ли аберрантная децидуальная реакция в циклическом эндометрии с повышенным риском потери беременности, мы проанализировали биопсию эндометрия с LH-синхронизацией у 90 контрольных субъектов и 89 пациенток с RPL.Демографические и клинические характеристики представлены в таблице 1. Каждая биопсия была разделена и обработана для анализа RT-qPCR и иммуногистохимии. Уровни транскриптов SCARA5, и DIO2 были измерены и нормализованы для дня цикла на основании их соответствующих графиков процентилей (рис. 5c). Иммуногистохимия использовалась для количественной оценки uNK-клеток с использованием стандартизованного и проверенного подхода, который включает измерение количества uNK-клеток CD56 + на 100 стромальных клеток в непосредственной близости от просветного эпителия 52 .Затем данные uNK-клеток были нормализованы для дня биопсии в цикле, как сообщалось ранее 9 . Как показано на рисунке 6a, более низкие процентили SCARA5 , но более высокие DIO2 процентилей в образцах RPL указывают на расходящуюся просенесцентную децидуальную реакцию. Кроме того, uNK-клетки были значительно менее многочисленны в RPL по сравнению с контрольными субъектами ( P <0,0001, двусторонний тест Велча t -тест). Мы пришли к выводу, что SCARA5, , + DC и uNK-клетки управляют успешной трансформацией стромы в децидуальную оболочку беременных.Следовательно, мы создали 4 бина на основе суммы процентилей SCARA5, и uNK и определили количество RPL и контрольных субъектов в каждой ячейке. Как показано на Рисунке 6b, 81% (25/31) субъектов, отнесенных к наименьшей ячейке, были пациентами с RPL, тогда как 79% (15/19) участников с наибольшей ячейкой были контрольными субъектами ( P <0,0001; точный критерий Фишера). Наш анализ также позволил определить предполагаемые дефекты на пути пути, включая «отказ децидуализации» ( SCARA5 : ≤30 th процентиль, DIO2 : ≤30 th процентиль), «чрезмерное децидуальное старение» ( SCARA5 : ≤ 30-й процентиль, DIO2 : ≥70 -й процентиль ) и «дефицит клеток uNK» (клетки uNK: ≤30 -й процентиль , SCARA5 и DIO2 : > 30 th — < 70 th процентиль) (рис.6в). Избыточное децидуальное старение и дефицит uNK-клеток были значительно чаще у пациентов с RPL по сравнению с контрольными субъектами ( P = 0,0016 и P = 0,02, соответственно; χ 2 тест). Взятые вместе, частота аберрантного децидуального ответа (то есть охватывающего все дефекты) была в ~ 3 раза выше у пациентов с RPL по сравнению с контрольными субъектами (44% против 14%, соответственно, P = 0,00013; точный критерий Фишера).
Рис. 6. Нарушение расхождения судьбы децидуальных клеток при RPL.
a Распределение uNK-клеток и SCARA5 и DIO2 процентилей в синхронизированных биопсиях эндометрия контрольных субъектов (n = 90) и пациентов с RPL (n = 89) (двусторонний тест Велча t ). b Количество RPL и контрольных субъектов в 4 ячейках, определяемых суммой процентилей клеток SCARA5 и uNK. c Схема, иллюстрирующая децидуальный путь. Расхождение судьбы EnSC после децидуализации связано с уровнем репликативного стресса (указывается затенением ядер), которому подвергаются отдельные клетки во время фазы пролиферации.Стрессоустойчивые децидуальные клетки привлекают и активируют клетки uNK для устранения стрессовых / стареющих децидуальных клеток посредством экзоцитоза гранул. Могут быть идентифицированы различные дефекты децидуального пути, включая «отказ децидуализации», «чрезмерное децидуальное старение» и «дефицит клеток uNK». Показана частота каждого дефекта в RPL и контрольной группе (тест χ 2 ).
Обсуждение
Децидуализация эндометрия происходит у всех эвтериальных (плацентарных) млекопитающих, у которых плацентация включает вторжение трофобластов в строму эндометрия 53 .У менструирующих видов, включая людей, децидуализация не находится под контролем имплантируемого эмбриона, а инициируется во время средней ягодичной фазы каждого цикла 54 . После запуска децидуализирующийся эндометрий становится неразрывно зависимым от устойчивой передачи сигналов прогестерона. В отсутствие имплантации компетентного эмбриона падение уровня прогестерона вызывает воспалительную децидуальную реакцию, которая при привлечении и активации лейкоцитов приводит к разрушению тканей, очаговым кровотечением и менструальным выделениям 55, 56 .Таким образом, важнейшей задачей при имплантации является одновременное предотвращение неминуемого разрушения эндометрия и преобразование циклического эндометрия в полупостоянную ткань, децидуальную оболочку, которая сохраняется на протяжении всей беременности. Недавно мы утверждали, что успешная трансформация эндометрия на ранних сроках беременности требует как успешной дифференцировки EnSC в DC, так и быстрой элиминации snDC активированными клетками uNK; и наоборот, дефекты этого процесса предрасполагают к раннему выкидышу 9 .Чтобы проверить нашу гипотезу, мы намеревались идентифицировать предполагаемые гены-маркеры аберрантного децидуального ответа с помощью одноклеточной последовательности РНК.
Сначала мы создали подробную карту транскрипции первичных децидуализированных EnSC в культуре в течение 8 дней с последующим снятием сигнала дифференцировки на 2 дня. Этот анализ выявил многоступенчатый процесс, который начинается с быстрого транскрипционного ответа при дифференцировке EnSC, за которым следует синхронный переход клеток через промежуточные состояния, а затем появление DC и некоторого количества snDC.Недавнее исследование подтвердило, что DC возникли в процессе эволюции в результате перестройки предковой клеточной реакции на стресс 19 . Этот вывод был основан на наблюдении, что фибробласты эндометрия, изолированные от сумчатых, которые произошли от эвтерианских животных 60-80 миллионов лет назад 57 , активируют те же основные регуляторные гены, что и EnSC человека, в ответ на децидуализирующий стимул, а затем вызывают реакцию острого воспалительного стресса. сродни начальной децидуальной фазе 19 .Ключевое различие состоит в том, что большинство EnSC возникают в результате этого процесса воспалительного репрограммирования как DC, экспрессирующие множественные противовоспалительные гены и гены устойчивости к стрессу. Однако некоторые EnSC не способны активировать важные децидуальные эффекторные гены и превращаются в snDC, таким образом повторяя предковую реакцию. Мы также продемонстрировали, что snDC быстро превращает DC во вторичные стареющие клетки, процесс отменяется при совместном культивировании клеток uNK. Важно отметить, что вторичное старение оказало драматическое влияние на экспрессию децидуальных генов, характеризуясь выраженной активацией генов, кодирующих белки ECM, протеазы и другие компоненты SASP.Механизмы, управляющие вторичным старением DC в культуре, требуют дальнейшего изучения, включая возможность того, что EnSC становятся сенсибилизированными к юкстракринному старению при дифференцировке в DC. Отличительной чертой snDC является устойчивость к прогестерону, примером которой является экспрессия генов, репрессированных PGR, таких как SOX4 и FOXP1 , 14 , а также отсутствие реакции на прогестерон и отмену цАМФ. Анализ совместно регулируемых генных сетей показал, что переключение ко-регуляторов PGR с FOSL2 на STAT1 может объяснить устойчивость к прогестерону snDC, хотя это предположение необходимо проверить экспериментально.Помимо создания временной карты TF и эффекторных генов, лежащих в основе прогрессирования клеток по децидуальному пути, сетевой анализ также показал, что несколько генов, участвующих в иммунном надзоре за стареющими клетками, включая CXCL14 , IL15 и TIMP3 , являются аппаратно активируется до появления snDC. Интересно, что хорионический гонадотропин человека, как было показано, непосредственно стимулирует пролиферацию uNK клеток 58 , что предполагает потенциальное сотрудничество между имплантирующим эмбрионом и DC в устранении snDC.
Наш анализ in vitro и предположил, что траектория децидуализации EnSC по умолчанию ведет к клеточному старению, которого, возможно, можно избежать только путем своевременного удаления snDC клетками uNK. Несоблюдение этого правила приводит к хроническому старению, по крайней мере, в культуре. Существует множество механизмов, с помощью которых хронические стареющие клетки способствуют тканевой дисфункции, включая возмущение стволовых клеток, нарушение ECM, индукцию тканевого воспаления и распространение старения в соседних клетках 25, 27, 32 .При экстраполяции на ситуацию in vivo это означает, что неспособность децидуализации EnSC « избежать » пути по умолчанию во время периимплантационного окна неизбежно приведет к прорастающей децидуальной реакции и формированию изначально нестабильной децидуально-плацентарной интерфейс при беременности. Чтобы проверить эту гипотезу, мы сначала намеревались идентифицировать гены-маркеры, специфичные для стромы, которые различают физиологический и патологический децидуальный ответ при циклическом движении эндометрия.Одноклеточный транскриптомный анализ эндометрия средней ягодицы дал ряд заметных результатов, включая открытие дискретной, но еще не охарактеризованной популяции пролиферативных мезенхимальных клеток, характеристику различных субпопуляций эпителиальных клеток и идентификацию состояний 3 клеток uNK, которые в целом соответствовали различным субпопуляциям децидуальных NK-клеток, недавно идентифицированным одноклеточным анализом на ранних сроках беременности 51 . Различные состояния NK-клеток частично определялись относительной численностью генов клеточного цикла.Например, популяция NK1, представляющая наиболее пролиферирующие клетки uNK, обильно экспрессирует гены, участвующие в экзоцитозе гранул (например, PRF1 , GNLY , GZMA и GZMB ). Напротив, клетки NK3 экспрессируют низкие уровни генов клеточного цикла, но определяются экспрессией CCL5 и CXCR4 . Примечательно, что CXCR4 + uNK клетки ранее участвовали в ремоделировании сосудов при беременности 59 .
Поскольку одноклеточный анализ in vivo был ограничен несколькими образцами в двух временных точках, мы ограничили наш поиск предполагаемых маркерных генов до 50 ведущих генов ветвления in vitro , которые отметили дивергенцию DC и DC, уже переходящих к старению.Из 50 генов SCARA5 и DIO2 были признаны лучшими генами-маркерами DC и snDC, соответственно, на основании их временной регуляции в течение всего цикла биопсии всего эндометрия, отсутствия регуляции в железистом эпителии и уровня обогащения биопсией эндометрия. стромальные клетки. Кроме того, мультиплексированный smISH показал, что клетки SCARA5 + отличаются от клеток DIO2 + , что дополнительно подтверждается различными транскриптомными профилями SCARA5 , обогащенными / mDIO2 , уменьшенными и SCARA5 , уменьшенными / DIO2 , обогащенными EnSC. в наборе одноклеточных данных in vivo .Чтобы проверить нашу гипотезу о том, что аберрантная децидуальная траектория предрасполагает к потере беременности, мы сначала сгенерировали процентильные графики для экспрессии SCARA5 и DIO2 с использованием 250 биопсий средней ягодицы эндометрия (LH + 6-11). Этот подход позволяет сравнивать относительный уровень экспрессии генов в биоптатах, полученных в разные дни цикла. Относительное количество uNK-клеток также определяли с использованием ранее установленного процентильного графика, основанного на анализе 1997 биоптатов 9 .Затем мы количественно оценили количество uNK-клеток и экспрессию SCARA5 и DIO2 в биоптатах эндометрия, взятых у RPL и контрольных субъектов. Выборка была основана исключительно на репродуктивном анамнезе; у всех пациенток с RPL было 3 или более выкидышей подряд, в то время как контрольными субъектами были женщины с мужским фактором, трубным бесплодием или бесплодием необъяснимого характера, ожидающие лечения ЭКО. В целом, наш анализ показал, что эндометрий до беременности при RPL характеризуется дефицитом uNK-клеток параллельно с переходом от преобладания DC к snDC.Затем мы изучили частоту различных предполагаемых дефектов децидуального пути, которые могут нарушить плаценто-децидуальный интерфейс на ранних сроках беременности. Основываясь на заранее определенных, но произвольных критериях, мы обнаружили, что RPL связана с «чрезмерным децидуальным старением» и «дефицитом клеток uNK», но не с «неудачей децидуализации». Перспективные исследования, хотя и многообещающие, необходимы для подтверждения наших наблюдений и определения прогностических критериев, которые могут быть использованы для скрининга женщин с риском RPL до беременности.
Децидуализация — это повторяющийся процесс циклирования эндометрия. В настоящее время неясно, сохраняется ли аберрантная децидуальная реакция от цикла к циклу или представляет собой прерывистый дефект, который влияет на некоторые, но не на все циклы. Относительно высокий кумулятивный коэффициент живорожденности в RPL свидетельствует в пользу последнего сценария 60 . Два различных регуляторных механизма контролируют клеточный гомеостаз в циклическом эндометрии. Помимо резидентных клеток-предшественников в базальном слое, эндометрий активно рекрутирует происходящие из костного мозга клетки (BDMC), способные дифференцироваться в стромальные, эпителиальные и эндотелиальные клетки 61 .Экспериментальные исследования показали, что BDMC усиливают регенеративную способность эндометрия небеременных 61 и, вероятно, способствуют быстрому децидуальному расширению во время беременности. С другой стороны, быстрое накопление uNK клеток во время средней ягодичной фазы порождает избирательную элиминацию snDC посредством экзоцитоза гранул, de facto омолаживая эндометрий во время имплантации эмбриона 9 . Таким образом, балансируя рекрутирование клеток BMDC и uNK, эндометрий внутренне приспособлен для тонкой настройки децидуальной реакции, чтобы гарантировать способность имплантации от одного цикла к следующему и, возможно, адаптироваться после неудачной беременности.Однако предполагается, что патологические сигналы, нарушающие эти регуляторные процессы, увеличивают частоту прорастающего децидуального ответа и, как следствие, вероятность выкидыша. Например, ожирение связано с потерей клоногенных клеток-предшественников в циклическом эндометрии 33, 62 , а также с дефицитом uNK-клеток 63, 64 . Ожирение также сильно связано с выкидышем, особенно с эуплоидной потерей беременности 65 . Таким образом, прогностическая ценность скринингового теста, основанного на анализе эндометрия, может быть увеличена за счет включения клинических переменных, таких как ИМТ матери, возраст и количество предыдущих потерь.
Таким образом, основываясь на транскриптомном анализе отдельных клеток, мы предполагаем, что децидуализация — это многоэтапный процесс, который в конечном итоге приводит к хроническому старению, клеточному состоянию, несовместимому с формированием функционального децидуально-плацентарного интерфейса. Наши данные предполагают, что DC д. Задействовать uNK клетки для устранения snDC, чтобы избежать этого пути по умолчанию, хотя необходимы дополнительные in vivo исследований, чтобы подтвердить это предположение. Тем не менее, мы идентифицировали SCARA5 и DIO2 как селективные маркерные гены для DC и резистентного к прогестерону snDC, соответственно.В сочетании с uNK-клетками эти гены-маркеры могут быть использованы для картирования предполагаемых дефектов децидуального пути в циклическом эндометрии. Наши результаты открывают возможность простого скринингового теста для выявления женщин с риском выкидыша и мониторинга эффективности вмешательств до беременности.
Материалы и методы
Этическое одобрение и сбор образцов
Исследование было одобрено Национальным комитетом по этике исследований NHS — Hammersmith и Queen Charlotte’s & Chelsea (1997/5065).Биопсии эндометрия были взяты у женщин, посещающих клинику имплантации, специализированную исследовательскую клинику при университетских больницах Ковентри и Уорикшира (UHCW) National Health Service Trust. Биопсии эндометрия по времени относительно преовуляторного выброса ЛГ были получены с использованием пробоотборника эндометрия Wallach Endocell ™ с письменного информированного согласия и в соответствии с рекомендациями Хельсинкской декларации (2000).
Культура первичных стромальных клеток эндометрия (EnSC)
Биопсии эндометрия собирали в среде DMEM-F12 с добавлением 10% покрытого декстраном FBS (DCC), покрытого углем, и обрабатывали для получения первичной культуры EnSC, как описано 9 .Для исследований децидуализации конфлюэнтные монослои стромальных клеток эндометрия человека (EnSC) инкубировали в течение ночи при 37 ° C с 5% CO2 в среде DMEM / F-12 без фенолового красного, содержащей 2% DCC, содержащей антибиотик / антимикотик и L-глутамин (2 % средства массовой информации). Для индукции дифференцировки клетки обрабатывали 0,5 мМ 8-бром-цАМФ (Sigma-Aldrich, Poole, UK) и 1 мкМ медроксипрогестерона ацетатом (MPA; Sigma-Aldrich) в указанные моменты времени. Для ингибирования старения клетки обрабатывали 250 нМ дазатинибом (CST, Лейден, Нидерланды) на протяжении всего периода дифференцировки.
Генерация капель и секвенирование отдельных клеток (Drop-Seq)
Транскриптомы отдельных клеток были захвачены в водных каплях, содержащих штрих-кодовые шарики, с использованием микрофлюидной системы (scRNAseq: Dolomite Bio, Royston, UK) в соответствии с протоколом производителя и на основе Метод Drop-Seq, описанный Macosko и коллегами 34 . Вкратце, клетки в суспензии помещали в удаленную камеру системы scRNAseq. Бусины со штрих-кодом (Barcoded Bead SeqB; Chemgenes Corp., США) в буфере для лизиса в концентрации 280 шариков / мкл загружали в петлю для образца. Растворы клеток и гранул пропускали при скорости потока 30 мкл / мин в микрофлюидный чип из фторофильного стекла с глубиной травления 100 мкм (Single Cell RNA-seq Chip, Dolomite Bio) с маслом для образования капель (Bio-Rad Laboratories, Великобритания) при скорость потока 200 мкл / мин в течение 15-18 минут. Капли собирали в пробирку Falcon на 50 мл, качество проверяли с помощью гемоцитометра C-Chip Fuchs-Rosenthal (Labtech, Heathfield, UK) и подсчитывали дублеты гранул.Разрушение капель, выделение гранул и обратная транскрипция выполнялись точно так же, как описано Macosko и Goldman (Drop-Seq Laboratory Protocol, версия 3.1) на 8000 гранул на реакцию, с двумя реакциями на образец, с получением ~ 800 транскриптомов одноклеточных, прикрепленных к микрочастицам ( STAMPS) на момент времени. Условия ПЦР были такими, как у Macosko и Goldman. Очистку гранулами Agencourt AMPure XP (Beckman Coulter, High Wycombe, UK) проводили в соответствии со стандартными протоколами Illumina RNAseq с 0.6 × соотношение бусинок к образцу. кДНК элюировали в количестве 12 мкл, а качество и размер оценивали с использованием ДНК-чипа Agilent Bioanalyzer High Sensitivity (Agilent, Stockport, UK). Для мечения 600 пг кДНК, как определено с помощью анализа Qubit High Sensitivity DNA (ThermoFisher, Пейсли, Великобритания), обрабатывали согласно Macosko и Goldman с использованием набора образцов ДНК Illumina Nextera XT и набора для индексации (Illumina, Кембридж, Великобритания). Помеченные библиотеки очищали с использованием гранул AMPure XP, как и раньше, с соотношением гранул 0,6 × с последующей повторной очисткой с использованием гранул 1 ×.Элюированные библиотеки анализировали с использованием ДНК-чипа Agilent Bioanalyzer High Sensitivity для оценки качества и определения размера библиотеки, а концентрацию определяли с помощью анализа ДНК высокой чувствительности Qubit. Разбавление и денатурация библиотеки выполняли в соответствии со стандартными протоколами Illumina и секвенировали с использованием набора NextSeq High Output 75 cycle V2.
Выравнивание и количественная оценка данных Drop-Seq
Первоначальная обработка данных Drop-Seq была выполнена с использованием Drop-Seq_tools-1.0.1 в соответствии с протоколом, описанным Nemesh (seqAlignmentCookbook_v1.2Jan2016.pdf, http://mccarrolllab.com/dropseq). Вкратце, считывания с низкокачественными основаниями в клеточном или молекулярном штрих-коде фильтровали и обрезали для загрязнения праймера или последовательности поли-А. Ошибки секвенирования в штрих-кодах были выявлены и исправлены, как это реализовано в Drop-Seq_tools-1.0.1. Считанные данные были сопоставлены с эталонным геномом hg19 (человека), сцепленным с аннотациями ERCC, с использованием STAR-2.5.3a 66 , с Gencode21 (Human) в качестве эталонного транскриптома. При количественной оценке использовались однозначно сопоставленные чтения с ≤ 1 вставкой или удалением.Наконец, инструмент DigitalExpression 34 был использован для получения цифровой матрицы экспрессии генов для каждого образца. Номера ячеек были выбраны вычислительным способом из точки перегиба в кумулятивном распределении считываний, нанесенных на график относительно штрих-кодов ячеек, упорядоченных по убыванию количества считываний 67 . Считается, что штрих-коды клеток за точкой перегиба представляют собой «окружающую РНК» (например, загрязняющую РНК из поврежденных клеток), а не клеточные транскриптомы, и поэтому исключаются из дальнейшего анализа.Это привело к ~ 800 клеткам на момент времени, что соответствует количеству, ожидаемому на основе обработанного подсчета гранул.
Анализ агрегации клеток
Анализ данных DGE был выполнен с помощью Seurat v2 68 . Чтобы выбрать высококачественные данные для анализа, клетки включались, когда было обнаружено не менее 200 генов, а гены включались, если они были обнаружены как минимум в 3 клетках. Клетки, которые имели более 4500 генов, были исключены из анализа, как и клетки с более чем 5% транскриптов митохондриальных генов, чтобы минимизировать дублеты и клетки низкого качества (сломанные или поврежденные) соответственно.После масштабирования и нормализации необработанных подсчетов в матрице DGE применялась регрессия клеточного цикла. Для агрегации клеток сначала был идентифицирован набор генов с высокой вариабельностью, со средним средним значением экспрессии от 0,0125 до 3 и отношением логарифмической вариации к среднему не менее 0,5, которые использовались для выполнения анализа главных компонентов (PC). Основываясь на статистической значимости и надежности результатов, первые 10 ПК впоследствии использовались в качестве входных данных для кластеризации через совместно используемого ближайшего соседа (SNN) и последующего представления t -распределенное стохастическое встраивание соседей ( t -SNE).Функция Сёра «FindAllMarkers» с использованием теста Вилкоксона была использована для идентификации маркерных генов для каждого кластера состояний клеток в представлении t-SNE. Для получения независимой оценки количества уникальных типов ячеек мы использовали SC3 v1.3.18 (5), применяя консенсусную стратегию и теорию Трейси-Уидома на случайных матрицах для оценки оптимального количества кластеров (k).
Корегулируемые генные сети
Кластерный анализ K-средних был выполнен в МэВ v4.8 (6) для группировки маркерных генов на основе коэкспрессии в кластерах состояний клеток.Рисунок достоинства (FoM) был запущен сначала для определения количества паттернов экспрессии (k). Прогностическая мощность алгоритма k-средних была оценена с использованием значений «Рис. Качества» (FOM) для k от 1 до 20. Кластеризация K-средних была проведена с использованием метрики корреляции Пирсона максимум для 50 итераций. Анализ онтологии генов был выполнен для кластерных генов с использованием DAVID 69 .
Анализ траектории
Анализ траектории выполнялся с помощью Monocle v2.6.1 70 .Гены точки ветвления идентифицировали с помощью функции моделирования анализа разветвленной экспрессии (BEAM).
Корреляция экспрессии генов
Чтобы проверить корреляцию экспрессии генов между парами генов, экспрессия была рассчитана для каждой клетки с использованием графической иммутации клеток на основе марковской аффинности (MAGIC) 71 . Коэффициенты корреляции Пирсона были рассчитаны для 50 основных генов, определяющих различные траектории в информативных точках ветвления. Чтобы оценить соответствие между наборами данных времени и биопсии, были добавлены коэффициенты корреляции, в результате чего получилась сумма коэффициентов от -2 до +2.Чтобы сделать вывод об экспрессии гена, связанной с прорастающим децидуальным ответом, SCARA5 обогащено / DIO2 уменьшено и SCARA5 уменьшено / DIO2 обогащено EnSC были выбраны после вменения MAGIC с использованием средней уровни экспрессии в качестве пороговых значений. Дифференциальную экспрессию генов на выбранных клетках определяли с использованием функции Сёра «FindMarkers» с использованием теста Вилкоксона, с анализом GO, выполняемым с использованием DAVID 69 .
Drop-Seq анализ синхронизированных биопсий эндометрия
Шесть биопсий эндометрия с синхронизацией по времени LH были обработаны, как подробно описано в другом месте 9 . Затем одноклеточные фракции подвергали анализу Drop-Seq. Время от биопсии в клинике до синтеза кДНК составляло менее 4 часов для всех образцов. Анонимные биопсии эндометрия были получены у женщин в возрасте от 31 до 42 лет с регулярными циклами, индексом массы тела от 23 до 32 кг / м2 и отсутствием патологии матки при трансвагинальном ультразвуковом исследовании.
Количественная ПЦР с обратной транскрипцией (RT-qPCR)
РНК была извлечена из биоптатов эндометрия, которые были мгновенно заморожены в клинике (<1 мин после сбора), с использованием STAT-60 (AMS Biotechnology, Оксфорд, Великобритания) в соответствии с инструкциями производителя. инструкции. Обратную транскрипцию выполняли с 1 мкг РНК с использованием набора для обратной транскрипции Quantitect (QIAGEN, Манчестер, Великобритания), и кДНК разводили до эквивалента 10 нг / мкл перед использованием в кПЦР. Амплификацию проводили на системе ПЦР в реальном времени 7500 (Applied Biosystems, Пейсли, Великобритания) в реакциях объемом 20 мкл с использованием 2 × PrecisionPlus Mastermix с SYBR Green и низкой ROX (PrimerDesign, Саутгемптон, Великобритания), с 300 нМ каждого из прямого и обратного грунтовки. L19 использовали в качестве контрольного образца. Последовательности праймеров были следующими: SCARA5, прямой: 5’-CAT GCG TGG GTT CAA AGG TG-3 ’, SCARA5 обратный: 5’-CCA TTC ACC AGG CGG ATC AT-3’; DIO2 вперед: 5′-ACT CGG TCA TTC TGC TCA A-3 ‘, DIO2 назад: 5′-TTC CAG ACG CAG CGC AGT-3′, L19 вперед: 5′-GCG GAA GGG TAC AGC CAA T-3 ‘, L19 обратный: 5′-GCA GCC GGC GCA AA-3’. Расчет центилей проводился для значений dCt с использованием программного обеспечения R.
Мультиплексная одномолекулярная гибридизация in situ
Фиксированные формалином образцы, залитые парафином (FFPE), разрезали на срезы 5 мкм.Гибридизацию РНК in situ проводили с помощью набора реагентов RNAscope® 2.5 HD Duplex (ACD, Калифорния, США) с зондами для SCARA5 (574781-C1) и DIO2 (562211-C2) в соответствии с инструкциями производителя. После гибридизации и амплификации предметные стекла контрастировали с 50% гематоксилином. Изображения были получены с использованием микроскопа EVOS AUTO (ThermoFisher Scientific) с объективом 40 ×.
Выделение и культивирование клеток uNK
Первичные клетки uNK выделяли из биоптатов эндометрия в лютеиновой фазе, как описано ранее 9 .Вкратце, собирали супернатант от свежепереваренных культур EnSC. Клетки uNK выделяли с помощью магнитно-активированного разделения клеток (MACS; Miltenyi Biotec, Bergisch Gladbach, Германия) с использованием конъюгированных с фикоэритрином (PE) антител к CD56 (Bio-Legend, Сан-Диего, Калифорния). , США) в соответствии с инструкциями производителя. Положительную фракцию CD56 + собирали центрифугированием и культивировали в суспензии до 5 дней в среде RPMI (Sigma-Aldrich) с добавлением 10% DCC-FBS, 1 × антибиотик-антимикотик и 2 нг / мл IL-15. (Sigma-Aldrich), чтобы способствовать созреванию клеток uNK.Для увеличения выхода uNK-клетки от 3-5 субъектов объединяли. Для экспериментов по совместному культивированию клетки uNK осаждали и ресуспендировали в среде DMEM / F-12, содержащей 2% DCC без IL-15. Всего 5000 клеток uNK добавляли к 50000 децидуализированным или нет EnSC на лунку 96-луночного планшета. Выделенные MACS uNK-клетки анализировали проточной цитометрией после мечения с помощью BD Horizon ™ Fixable Viability Stain (FVS) 660 (BD Biosciences) в 1 × PBS (1: 1000) и PE-конъюгированного CD56 (BD Biosciences; клон: B159; номер по каталогу : 555516; 1: 5) согласно инструкциям производителя.Эритроциты (RBC) удаляли из отрицательной фракции с использованием 1 × раствора для лизиса RBC (BD Biosciences, номер по каталогу: 349202) в течение 10 минут при комнатной температуре. Образцы анализировали с помощью BD FACSMelody ™ Cell Sorter (BD Biosciences), а анализ данных выполняли с помощью FlowJo v10.
Количественный анализ uNK-клеток в биоптатах эндометрия
Срезы ткани FFPE окрашивали на CD56 (uNK-клеточно-специфический поверхностный антиген) с использованием разведения 1: 200 концентрированного антитела CD56 (NCL-L-CD56-504, Novocastra, Leica BioSystems).Окрашенные слайды обезвоживали, очищали и наносили покровное стекло в автоматическом окрашивателе для слайдов Tissue-Tek ® Prisma ® , модель 6134 (Sakura Flinetek Inc., Калифорния, США), используя среду для заключения покровного стекла DPX. Изображения в светлом поле были получены на слайд-сканере Mirax Midi с использованием объектива 20 × и открыты в Panoramic Viewer v1.15.4 (3DHISTECH Ltd, Будапешт, Венгрия) для анализа. Чтобы избежать несоответствий, которые отражают снижение плотности клеток uNK на большей глубине эндометрия, клетки CD56 + количественно определяли в компартментах, непосредственно лежащих под эпителием просвета.Здесь три случайно выбранных области интереса для каждой биопсии были идентифицированы и зафиксированы в Panoramic Viewer перед анализом в программе анализа изображений ImageJ. И просветные, и железистые эпителиальные клетки удаляли вручную перед деконволюцией цвета на составляющие коричневые (окрашивание CD56 +) и синие (окрашивание гематоксилином — стромальные клетки). Площадь положительного окрашивания выше определенного вручную фонового порога использовалась для количественной оценки интенсивности окрашивания. Процент клеток uNK рассчитывали как количество клеток CD56 + на 100 стромальных клеток и усредняли по 3 изображениям 9 .
Иммуноферментный анализ (ELISA)
Супернатанты культур собирали каждые 2 дня и центрифугировали для очистки от остатков клеток перед хранением при -20 ° C. Аналиты в собранном супернатанте измеряли с помощью ELISA в соответствии с инструкциями производителя (DuoSet ELISA kits, Bio-Techne, Abingdon, UK). Стандартные кривые были подогнаны под 4-параметрическую логистическую кривую в программном обеспечении GraphPad Prism, а концентрации образцов интерполированы по этим графикам.
Количественное определение активности SAβG
Активность SAβG в культивируемых клетках количественно определяли с использованием 96-луночного набора для анализа активности клеточного старения (CBA-231, Cell Biolabs Inc; Калифорния, США), как описано ранее 9 .
Статистический анализ
Статистический анализ данных ELISA и SaβG был выполнен с использованием GraphPad Prism 8.0.1, и данные представлены как среднее значение ± стандартная ошибка среднего. Хи-квадрат и точный тест Фишера дефектов децидуального пути проводились с использованием онлайн-калькуляторов по адресу https://www.socscistatistics.com/. Все остальные анализы были выполнены в R.
Доступность данных
Данные Drop-Seq были депонированы в репозиторий GEO (номер доступа: GSE127918).
Вклад авторов
Концептуализация, Дж.J.B .; Методология, P.V., E.S.L, J.L. и S.O .; Расследование, E.S.L., P.V., J.M., M.D.C., P.J.B., C-S.K., K.F .; Письмо — оригинальный проект, J.J.B., P.V. и E.S.L .; Приобретение финансирования, S.Q., S.O. и J.J.B .; Ресурсы, J.O., L.J.E., S.Q. и J.J.B .; Надзор, С.О. и J.J.B.
Рис. S1. Контроль качества библиотек timecouse scRNA-seq.
Кумулятивное распределение чтения для основной ( a ) и дополнительной ( b ) выборок временного курса. Точки изгиба и перегиба, рассчитанные с помощью пакета DropUtils R, представлены синими и зелеными пунктирными линиями соответственно. c , Графики скрипки, показывающие распределение количества генов (nGene), количества транскриптов (nUMI) и процента митохондриальных чтений (percent.mito) на выборки временного курса.
Рис. S2. Тепловая карта 10 основных маркерных генов для каждого из 7 состояний клетки.
Каждый столбец представляет один из 4580 EnSC. Экспрессия каждого гена сосредоточена на средней экспрессии по клеткам и масштабируется по их стандартному отклонению. Желтый, черный и фиолетовый представляют соответственно высокую, среднюю и низкую экспрессию.
Рис. S3. Преходящая секреция IL-6 и IL-8 во время начальной децидуальной фазы.
Временные профили уровней транскриптов IL6, и IL8, (синяя линия) и соответствующие уровни секретирования по децидуальному пути (D0-D8) и после отмены (WD) сигналов дифференцировки. Обратите внимание, что начальное повышение секреции IL-6 или IL-8 не совпадает с соответствующим увеличением уровней мРНК. Второй рост секреции IL-8 совпадает с появлением snDC.
Фиг.S4. Одноклеточный анализ трех независимых первичных культур показывает агрегацию клеток по состоянию транскрипции.
Три независимых первичных культуры EnSC (обозначенные a, b и c) децидуализировали в разные моменты времени и затем подвергали анализу Drop-seq. Культура «а» представляет собой полный курс обучения [D0-D8 плюс абстинентный синдром (WD)]; культура «b» децидуализировалась в течение 2 и 8 дней, тогда как культура «c» децидуализировалась в течение 2 дней. график t -SNE с клетками, цветными кодами культуры и дня децидуализации. b t -SNE график с ячейками, обозначенными цветом в зависимости от состояния ячейки. График был дополнительно аннотирован, чтобы указать день децидуализации и отмены (WD) сигналов дифференцировки.
Рис. S5. Стресс-защитные механизмы при ДК.
a Множественные механизмы, лежащие в основе стрессоустойчивости DC, включая прогестерон-зависимую индукцию фосфатазы 1 двойной специфичности (DUSP1, также известной как митоген-активированный протеин (MAP) киназа фосфатаза-, MKP1), которая подавляет c-Jun NH -концевой киназный (JNK) путь передачи сигнала стресса и блокирует зависимое от стресса сумоилирование многочисленных мишеней, включая лигандированный рецептор прогестерона (PGR) 1, 2 .Прогестерон также регулирует экспрессию сывороточной и глюкокортикоид-индуцируемой киназы SGK1 3 , киназы, которая нацелена и инактивирует FOXO3, ключевой фактор транскрипции, участвующий в ответах на окислительную гибель клеток в клетках эндометрия 4 . PLCL1 , кодирующий фосфолипазу C, подобную 1 (неактивную), представляет собой индуцируемый прогестероном каркасный белок, который отделяет активацию фосфолипазы C от рецепторов, связанных с Gq-белком, от внутриклеточного высвобождения Ca 2+ за счет ослабления передачи сигнала трифосфата инозита (IP3) 5 .Прогестерон дополнительно активирует 11β-гидроксистероид дегидрогеназу типа 1 (кодируется HSD11B1 ) 6, 7 , фермент, который превращает инертный кортизон в активный кортизол, мощный противовоспалительный гормон. Высокоиндуцированный децидуальный ген — это IL1RL1 , который кодирует трансмембранный рецептор IL-33 ST2L, а также секретируемый рецептор-ловушку sST2 8 , мощный противовоспалительный медиатор, который связывает и инактивирует IL-33. Основным немитохондриальным источником активных форм кислорода в стромальных клетках эндометрия является НАДФН-оксидаза NOX4 9 .Хотя для инициации децидуального процесса требуется активация NOX4 9 , он также является медиатором клеточного старения 10 . b Log-трансформированные, нормализованные уровни экспрессии для указанных генов в стрессоустойчивых DC (S5) и snDC (S6).
Рис. S6. Проточно-цитометрический анализ клеток CD56 + после разделения MACS.
клеток uNK, выделенных с помощью MACS из супернатантов 4 независимых недавно созданных культур EnSC, подвергали проточной цитометрии для подтверждения обогащения клеток CD56 + (CD56-PE) и жизнеспособности клеток (FVS660) в положительной фракции и отсутствия CD56. + клеток в отрицательной фракции.В положительной фракции подтверждено, что приблизительно 86% клеток являются жизнеспособными клетками uNK.
Рис S7. Обработка децидуализованных клеток сокультурами дазатиниба, имитирующими uNK.
Шесть независимых культур EnSC децидуализировали с помощью цАМФ и МРА (C + M) в течение восьми дней в присутствии или в отсутствие сенолитического агента, дазатиниба (250 нМ). Левая панель: схематическое изображение экспериментов с дазатинибом. Правая панель: кратное изменение активности SAβG и секреции кластерина (CLU) и sST2 (кодируемого IL1RL1 ) в децидуализированных клетках, обработанных дазатинибом, по сравнению с децидуализированными клетками, культивированными без дазатиниба (пунктирная линия).Отдельные культуры обозначены разными цветами.
Рис. S8. Контроль качества биопсийных библиотек scRNA-seq.
a Распределение кумулятивного считывания для образцов биопсии. Точки изгиба и перегиба, рассчитанные с помощью пакета DropUtils R, представлены синими и зелеными пунктирными линиями соответственно. b Графики для скрипки, показывающие распределение количества генов (nGene), количества транскриптов (nUMI) и процента считываний митохондрий (процент. Мито) на образец биопсии.
Фиг.S9. Распределение мерцательных клеток в железистом эпителии эндометрия.
Стрелки указывают на экспрессию маркеров мерцательного эпителия, фактора сборки динеина 1 аксонемы (DNAAF1), компонента 1 головки радиальной спицы (RSPh2) и белка 157, ассоциированного с ресничками и жгутиками (CFAP157), в железистом компартменте эндометрия человека. Изображения были взяты из Human Protein Atlas v18.1 (https://www.proteinatlas.org/) 11 .
Рис. S10. Анализ in vitro генов точек ветвления в лютеиновой фазе EnSC in vivo .
Тепловые карты, изображающие сумму коэффициентов корреляции 50 взаимодействий ген-ген, участвующих в клональной дивергенции децидуализации EnSC in vitro по сравнению с in vivo экспрессией при LH + 8 ( a ) и LH + 10 ( b ). Цветовой ключ указывает уровень конгруэнтности, определяемый как сумма коэффициентов корреляции> 1 или <-1 для положительно (красный) и отрицательно (синий) совместно регулируемых генов, соответственно.
Рис. S11. Дифференциальная экспрессия гена в SCARA5 , обогащенном / DIO2 , снижена EnSC по сравнению с SCARA5 снижена / DIO2 обогащена EnSC in vivo .
Тепловая карта , показывающая относительное выражение (z-балл) 104 °, на основе критерия суммы рангов Вилкоксона с поправкой Бонферрони P -значение <0,05, между SCARA5 уменьшено / DIO2 обогащено EnSC (n = 368) и SCARA5 обогащено / DIO2 восстановлено EnSC (n = 271). Столбцы представляют отдельные EnSC, сгруппированные в соответствии с их уровнями транскриптов SCARA5 и DIO2 . SCARA5 обогащенный / DIO2 уменьшенный EnSC были обогащены генами, кодирующими несколько ключевых децидуальных ТФ, включая CEBPB 12, 13 , NR4A1 (также известный как NUR77 ) 14 и члены семейства AP-1gene ( FOS , FOSB и JUN ) 14, 15 . SCARA5 обогащен / DIO2 восстановлен EnSC также были обогащены генами, участвующими в защите от стресса, включая SOD2 (кодирующая супероксиддисмутазу 2) 16 , DUSP1 (кодирующая MKP1) 1 , TNFAIP3 (TNF-альфа-индуцированный белок 3) и NFKBIA (NFKB-ингибитор альфа, IκBα) TNFAIP3 является убиквитин-модифицирующим ферментом и мощным ингибитором активации NF-каппа B, а также TNF-опосредованного апоптоза.Он играет решающую роль в предотвращении воспаления in vivo 17 . Аналогичным образом, IκBα эффективно подавляет воспаление за счет связывания с NF-каппа B. Напротив, повышенная экспрессия генов, кодирующих различные белки теплового шока (HSP) в SCARA5 уменьшенных / DIO2 обогащенных клетках указывает на протеотоксический стресс ответ 18 . b Анализ генной онтологии выявил значительно обогащенные биологические темы, связанные с SCARA5 уменьшенным DIO2 обогащенным по сравнению с SCARA5 обогащенным / DIO2 уменьшенным EnSC.Ось X показывает долю дифференциально экспрессируемых генов, обнаруженных в каждой биологической категории. Показаны скорректированные по Бенджамини значения P (точный тест Фишера).
Дополнительные таблицы (отдельный файл)
Таблица S1. Гены-маркеры для каждого состояния клетки
Таблица S2. Дифференциально экспрессируемые гены (DEG) in vitro (S1-S7)
Таблица S3. Вклад отдельных образцов в популяции клеток эндометрия
Таблица S4. Кластерный анализ k-средних (k = 7)
Таблица S5.GO анализ со-выраженных категорий
Таблица S6. Гены-маркеры типов и субпопуляций эндометриальных клеток
Таблица S7. Гены-маркеры кластеров и подтипов иммунных клеток
Таблица S8. DEG в LH8 по сравнению с Lh20 EnSC
Таблица S9. DEG в SCARA5 , обогащенном / DIO2 уменьшенном EnSC по сравнению с SCARA5 уменьшенным / DIO2 обогащенным EnSC in vivo .
Благодарность
Мы благодарны всем женщинам, принявшим участие в этом исследовании.Эта работа была поддержана фондами Национального центра исследования выкидышей Томми и премией Wellcome Trust Investigator Award, полученной JJB и S.O.

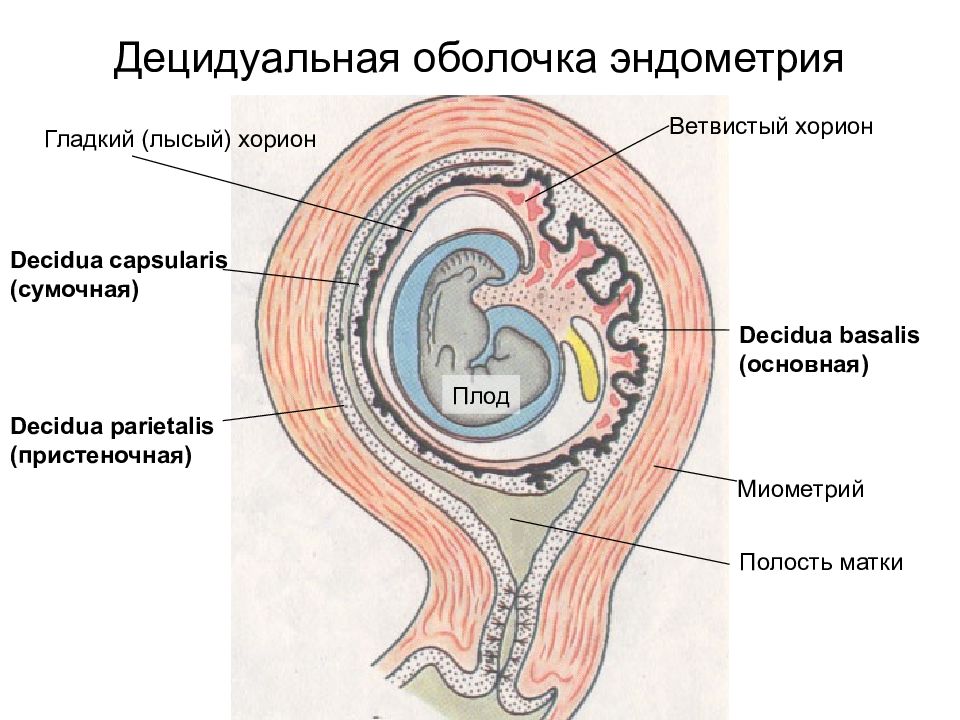

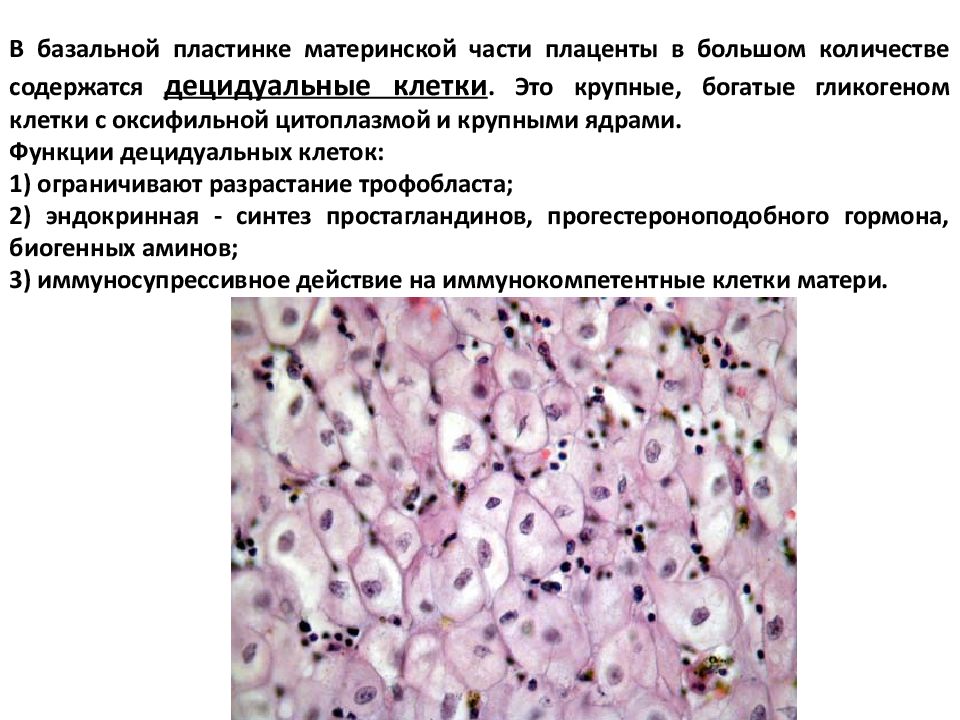 Хотя не все матричные белки, как было показано, специфически экспрессируются в децидуальных клетках человека или мыши, α 2 -макроглобулин, один из мощных ингибиторов ММП, был показан ниже по течению от вызываемого IL-11 JAK-STAT3. у грызунов [38], который также участвует в стромальных клетках эндометрия человека (hESCs) [39].Модель на мышах с использованием условного нокаута Cx43 посредством рекомбинации PR-Cre показала важность Cx43 стромы матки для пролиферации эндотелия сосудов при gd 7.5 [37]. Матка, дефицитная по Сх43, демонстрирует недостаточный ответ децидуомы, сопровождаемый сниженным ангиогенезом сосудов матки. Этот эффект, возможно, связан с коммуникацией щелевого соединения между децидуальными клетками, которые секретируют VEGF и ангиопоэтины, но связь между децидуальной оболочкой и эндотелиальными клетками сосудов еще предстоит исследовать.
Хотя не все матричные белки, как было показано, специфически экспрессируются в децидуальных клетках человека или мыши, α 2 -макроглобулин, один из мощных ингибиторов ММП, был показан ниже по течению от вызываемого IL-11 JAK-STAT3. у грызунов [38], который также участвует в стромальных клетках эндометрия человека (hESCs) [39].Модель на мышах с использованием условного нокаута Cx43 посредством рекомбинации PR-Cre показала важность Cx43 стромы матки для пролиферации эндотелия сосудов при gd 7.5 [37]. Матка, дефицитная по Сх43, демонстрирует недостаточный ответ децидуомы, сопровождаемый сниженным ангиогенезом сосудов матки. Этот эффект, возможно, связан с коммуникацией щелевого соединения между децидуальными клетками, которые секретируют VEGF и ангиопоэтины, но связь между децидуальной оболочкой и эндотелиальными клетками сосудов еще предстоит исследовать.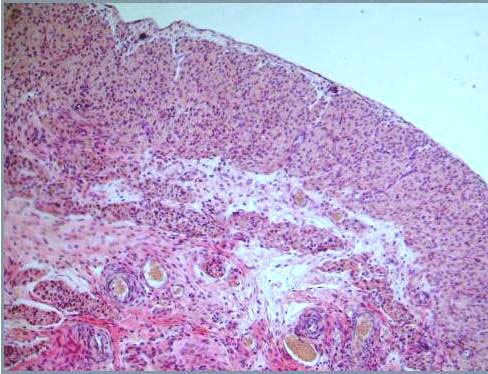 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.