Диарея бактериального генеза что это
Бактериальная (инвазивная) диарея
Инфекционный тип диареи считается одним из наиболее частых заболеваний. Ее предпосылкой может быть попадание в организм вредоносных микроорганизмов рода шигелл, сальмонелл, семейства стафилококков и прочих.
Причиной возникновения бактериальной диареи являются различные микробы, действие которых в организме нарушает естественную работу микрофлоры и органов ЖКТ. Бактериальная (инвазивная) диарея – достаточно распространенная проблема, которая имеет широкий спектр симптомов и возможных патологий. В зависимости от того каким микроорганизмом был инфицирован больной будет определяться клиническая картина его болезни.
Каждый возбудитель инвазивной диареи имеет определенные направления воздействия на организм, что и обуславливает диверсификацию симптомов и сложность постановки точного диагноза без проведения необходимого лабораторного изучения. Отдельным препятствием может стать заражение комплексом бактерий различного типа, действие которых может спровоцировать проявление широкого спектра признаков.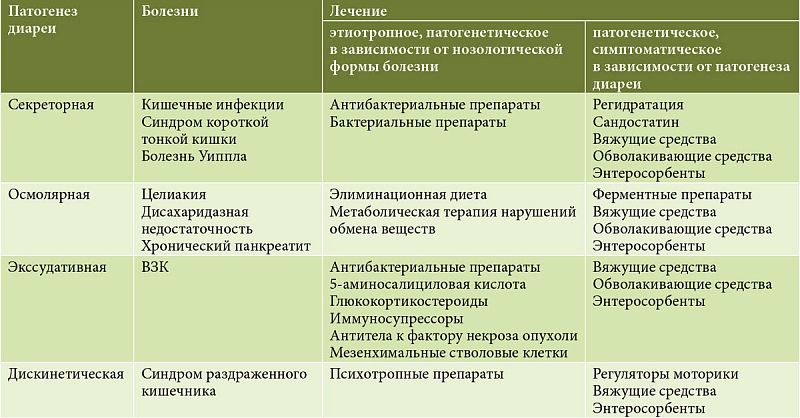
Современная статистика демонстрирует некоторые изменения в соотношении частоты заражения тем или иным возбудителем по сравнению с предыдущими годами. Так, сегодня в мире наибольшую распространенность имеет бактериальная диарея, причиной которой являются палочковидные бактерии campylobacter и escherichia coli. Последняя, больше известная как кишечная палочка, часто воспринимается как исключительно вредоносный микроорганизм. Но опасность представляют исключительно те ее серотипы, которые могут спровоцировать отравления и даже привести к летальному исходу. Безвредные штаммы этой бактерии принимают участие в формировании микрофлоры организма и выполняют определенные полезные функции, которые являются полезными для организма человека.
Изменение статистики заболевания инвазивной диареей в сторону отмеченных возбудителей можно объяснить в первую очередь большой популяризацией фаст-фуда, качество которого не всегда соответствует необходимым санитарным нормам. Вспышки данного заболевания фиксируются не только в слаборазвитых странах, но даже в США (хотя и не так часто), где питание «на ходу» имеет очень большую популярность. Бактериальную диарею могут спровоцировать недостаточная термическая обработка мясных изделий, отсутствие должных санитарных условий в точке реализации, на предприятиях по переработке мяса, фермах – на каждом из этих этапов продукция подвергается риску заражения вредоносными организмами, которые впоследствии могут привести к бактериальной диарее.
Вспышки данного заболевания фиксируются не только в слаборазвитых странах, но даже в США (хотя и не так часто), где питание «на ходу» имеет очень большую популярность. Бактериальную диарею могут спровоцировать недостаточная термическая обработка мясных изделий, отсутствие должных санитарных условий в точке реализации, на предприятиях по переработке мяса, фермах – на каждом из этих этапов продукция подвергается риску заражения вредоносными организмами, которые впоследствии могут привести к бактериальной диарее.
Также заражение часто происходит через зараженную питьевую воду, содержание в которой холерных вибрионов провоцирует возникновение холеры. Ярким симптомом данного заболевания является сильная диарея инвазивного типа. Холера являет собой эпидемиологическую опасность, поскольку содержание вибрионов в испражнениях инфицированного человека очень высоко, что дает почву для быстрого распространения инфекции.
Другими причинами заболевания такой диареей могут быть бактерии сальмонеллы и шигеллы. Бактерии этих типов опасны, прежде всего, своей способностью к длительному существованию в пище (в отдельных продуктах сальмонелла способна жить и размножаться до 6 месяцев), а заболевание, провоцируемое шигеллами – дизентерия – самое большое распространение имеет между детьми, которые очень тяжело его переносят.
Бактерии этих типов опасны, прежде всего, своей способностью к длительному существованию в пище (в отдельных продуктах сальмонелла способна жить и размножаться до 6 месяцев), а заболевание, провоцируемое шигеллами – дизентерия – самое большое распространение имеет между детьми, которые очень тяжело его переносят.
Симптомы бактериальной диареи
Картина болезни имеет существенные отличия в зависимости от микроорганизма, который спровоцировал заболевание. Основными симптомами бактериальной диареи обычно бывают:
- частый жидкий стул различной интенсивности;
- боли в различных областях живота, спазмы;
- высокая температура;
- тошнота с рвотой;
- головная боль и общее недомогание.
Очень опасным последствием бактериального поноса является обезвоживание организма. При некоторых заболеваниях, провоцирующих сильный понос, в частности холере, может возникнуть критический уровень обезвоживания, который способен привести к летальному исходу. Поэтому обязательно нужно контролировать состояние больного на предмет потери организмом жидкости и безотлагательно принимать меры по восстановлению водного баланса.
Поэтому обязательно нужно контролировать состояние больного на предмет потери организмом жидкости и безотлагательно принимать меры по восстановлению водного баланса.
Лечение бактериальной диареи
Несмотря на присутствие в организме инфекции, наиболее опасными для жизни больного являются последствия обезвоживания. Главными группами риска, естественно, являются дети, люди преклонного возраста и те, у кого по тем или иным причинам ослаблен иммунитет. Инвазивная диарея у этих групп может иметь особенно опасные последствия, поэтому ее лечение должно осуществляться под контролем специалиста.
В первую очередь необходимо провести комплекс действий по восстановлению водного баланса путем приема регидратационных препаратов или глюкозосодержащей жидкости. Диета
Диарея бактериальная — лекарства
Список применяемых лекарственных средств
Нозология: Диарея бактериальная
Синонимы нозологии:
Бактериальная диарея
Бактериальная дизентерия
Бактериальные инфекции ЖКТ
Бактериальный гастроэнтерит
Диарея бактериальная
Диарея или дизентерия амебной или смешанной этиологии
Диарея инфекционного генеза
Диарея на фоне антибактериальной терапии
Диарея путешественников
Диарея путешественников, обусловленная изменением режима питания и привычного рациона
Диарея, обусловленная антибиотикотерапией
Дизентерийное бактерионосительство
Дизентерийный энтерит
Дизентерия
Дизентерия бактериальная
Дизентерия смешанная
Желудочно-кишечная инфекция
Инфекции ЖКТ
Инфекционная диарея
Инфекционное заболевание ЖКТ
Инфекция желудочно-кишечного тракта
Инфекция желчных путей и ЖКТ
Инфекция ЖКТ
Летняя диарея
Неспецифическая острая диарея инфекционной природы
Неспецифическая хроническая диарея инфекционной природы
Острая бактериальная диарея
Острая диарея при пищевом отравлении
Острая дизентерия
Острый бактериальный гастроэнтерит
Острый гастроэнтероколит
Острый энтероколит
Подострая дизентерия
Понос хронический
Рефрактерная диарея у больных СПИДом
Стафилококковый энтерит у детей
Стафилококковый энтероколит
Токсическая диарея
Хроническая дизентерия
Энтерит
Энтерит инфекционный
Энтероколит
Лекарственные средства:
Абомин
Аллилчеп
Альфа нормикс
Аминоплазмаль Е
Амоксициллин
Амоксициллин Сандоз
Ампициллин
Ампициллин АМП-КИД
Ампициллин АМП-Форте
Ампициллин Иннотек
Ампициллин-АКОС
Ампициллина натриевая соль
Анцеф
Аципол
Бактиспорин
Бактисубтил
Бактрим
Берлоцид 240
Берлоцид 480
Бетулаир
Биомасса ацидофильных лактобактерий Наринэ сухая (БАЛБ Наринэ)
Бисептол
Бифидумбактерин
Бифидумбактерин сухой
Бифидумбактерин форте
Бифилиз (ВИГЭЛ)
Брифесептол
ВИТАБС Био с бифидобактериями
ВИТАБС Био с лактобактериями
Вицеф
Галавит
Гарамицин
Гентамицин
Гентамицина сульфат
Гросептол
Дефламон
Диара
Доксилан
Доксициклина гидрохлорид
Дуо-Септол
Дюфалак
Зетсил
Зиндолин 250
Карбактин
Квипро
Кефадим
Кипферон
Ко-тримоксазол
Ко-тримоксазол-Ривофарм
Лактобактерин в порошке
Лидаприм
Ликацин
Липрохин
Лифаксон
Лонгацеф
Макропен
Максаквин
Мегион
Метовит
Метрогил
Микрофлокс
Нагипол
Натрия нуклеинат
Небцин
Невиграмон
Неоинтестопан
Нифуроксазид
Нолицин
Норбактин
Норилет
Нормофлорин-Д биокомплекс
Ориприм
Оспамокс
Пенодил
Пентрексил
Перти
Пефлоксацин
Полибактерин
Полисорб МП
Пробифор
Рела Лайф
Ренор
Ретинола пальмитат
Реципро
РоксиГЕКСАЛ
Рондомицин
Сангвиритрин
Синерсул
Смекта
Софазин
Стандациллин
Сулотрим
Суметролим
Тиротакс
Тримезол
Трифамокс ИБЛ
Уголь активированный МС
Уголь активированный ФАС-Э
Узара
Уназин
Фортум
Форцеф
Фуразолидон
Хиконцил
Хилак форте
Цедекс
Цепрова
Цефезол
Цефосин
Цефтазидим-АКОС
Цефтидин
Цефтриабол
Цефтриаксон-АКОС
Ципринол
Ципробид
Ципробрин
Ципролет
Ципросан
Ципросол
Ципрофлоксацин
Ципрофлоксацина гидрохлорид
Цитерал
Цифлоксинал
Цифран
Цифран ОД
Цифран СТ
Элекасола сбора брикет
Энтерол
Энтеросан
Энтеросгель
Эрмицед
Эрсефурил
Ютибид
Диарея бактериального генеза
Диарея бактериального генеза: симптомы, лечение
Автор статьи:Тиронова Инна Игоревна
Гастроэнтеролог, терапевт
Стаж 15 лет
Профессиональные навыки: Гидроколонотерапия, лечение заболеваний желудочно-кишечного тракта
[adsp-pro-1]
Причин появления поноса множество.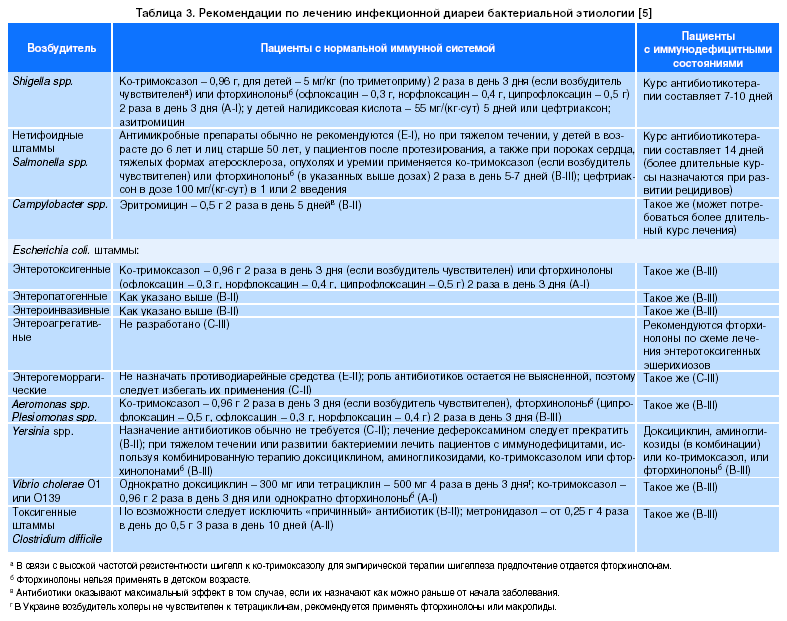 Расстройство может вызывать как элементарное переедание, так и воспаление стенок кишечника. Диарея бактериального генеза – это понос, что вызывается воздействием патогенных бактерий. В организм они попадают вместе с несвежими или с зараженными продуктами, быстро размножаются, подавляя естественную микрофлору кишечника.
Расстройство может вызывать как элементарное переедание, так и воспаление стенок кишечника. Диарея бактериального генеза – это понос, что вызывается воздействием патогенных бактерий. В организм они попадают вместе с несвежими или с зараженными продуктами, быстро размножаются, подавляя естественную микрофлору кишечника.
Основные причины и симптомы
Бактериальная диарея появляется при употреблении зараженной пищи. Возбудители инфекции попадают в кишечник, размножаются, отравляют организм токсичными продуктами своей жизнедеятельности, что вызывает понос, рвоту, обезвоживание, интоксикацию, лихорадку и другие симптомы.
Чаще всего диарею вызывают 10 наиболее известных инфекционных агентов. Ранее к самым распространенным относились возбудители холеры, сальмонеллеза, дизентерии. В настоящее время врачам чаще всего приходится сталкиваться с кишечной палочкой и кампилобактериями.
Понос носит разный характер:
- При инфицировании толстой кишки стул становится жидким, частым, но скудным.

- При заражении тонкого кишечника объем резко возрастает, но частота позывов невелика.
- При секреторной диарее стенки не всасывают воду в должной степени и она, соответственно, выводится вместе с фекалиями.
- Более тяжело протекает понос, если он обусловлен токсической дисрегуляцией кишечных клеток. При этом стенка органа воспаляется, дальнейшее действие токсинов приводит к разрушению клеток.
- Примеси крови в кале появляются при воспалении стенок кишечника. Такой симптом характерен для энтеротоксигенного штамма Escherichia Coli.
[adsp-pro-2]
Симптомы диареи бактериального происхождения определяются характером возбудителя. Однако у поноса такого рода есть и некоторые общие признаки.
- Инкубационный период. После попадания бактерий в кишечник проходит от 8-10 часов до 10 дней прежде чем появляются понос и другие симптомы заболевания.
- Обезвоживание – общий признак диареи любой этиологии. Обильный жидкий стул выводит много воды.
 При этом появляется сильная сухость во рту, уменьшается объем мочи, урина темнеет.
При этом появляется сильная сухость во рту, уменьшается объем мочи, урина темнеет. - Интоксикация. При бактериальном поносе наблюдаются все признаки интоксикации: рвота, тошнота, лихорадка, характерные боли в мышцах и суставах. Симптомы развиваются тем быстрее, чем быстрее размножаются бактерии.
[adsp-pro-3]
Важно! При появлении признаков интоксикации следует немедленно обратиться к врачу. Обычные средства при бактериальной диарее бессильны.
Особенности состояния у детей и пожилых людей
У взрослых и у детей признаки диареи бактериального генеза совпадают. Однако у малышей инфекционные заболевания протекают намного тяжелее. Иммунная система ребенка до 5 лет не сформирована и очень слаба. Справиться самостоятельно с инфекционным возбудителем детский организм не в состоянии. Признаки болезни – диарея, рвота, повышение температуры, появляются намного быстрее и намного быстрее развиваются осложнения:
- Буквально через несколько часов после заражения наблюдаются метеоризм, рези в животе.
 Малыш становится плаксивым, капризным, отказывается от еды.
Малыш становится плаксивым, капризным, отказывается от еды. - Диарея появляется в течение суток или быстрее. Кал меняет цвет, часто содержит примеси слизи, крови, пены, что выступает явственным признаком бактериального генеза диареи. Характерное изменение оттенка может указать и на возбудителя. Например, стул зеленого цвета появляется при дизентерии или сальмонеллезе.
- Характерный признак инфекционного поноса у ребенка – нежелание пить. Даже на фоне выраженного обезвоживания, ребенок не может выпить достаточного количества воды. Поить его следует маленькими порциями, но очень часто.
[adsp-pro-4]
У пожилых людей симптомы развиваю
Что такое диарея, и как ее лечить?
Автор На чтение 26 мин. Опубликовано
Клинические различия
Чтобы определить, ротавирус или отравление пищевыми продуктами послужили причиной диспепсического расстройства, исследуют особенности клинического течения нозологических единиц.
Можно отличить отравление от ротавирусной инфекции.
- Катаральные явления верхних дыхательных путей – красное горло и кашель с насморком, конъюнктивит.
- Боли в области живота и метеоризм, тошнота и рвота.
- На 3 день появляется диарея – стул становится жидким и серовато-жёлтым. Частота испражнений – до 15 раз в сутки.
- На фоне поноса и рвоты — обезвоживание, сухость слизистых оболочек. Аппетит значительно снижается. Черты лица заостряются. Ротовая полость и язык становятся сухими и шершавыми.
- Выраженный интоксикационный синдром. Повышается температура. На языке – белый налёт. Слабость и вялость.
Выздоровление наступает спустя 5-7 дней. Заболеванию в основном подвержены маленькие дети и люди с ослабленным иммунитетом.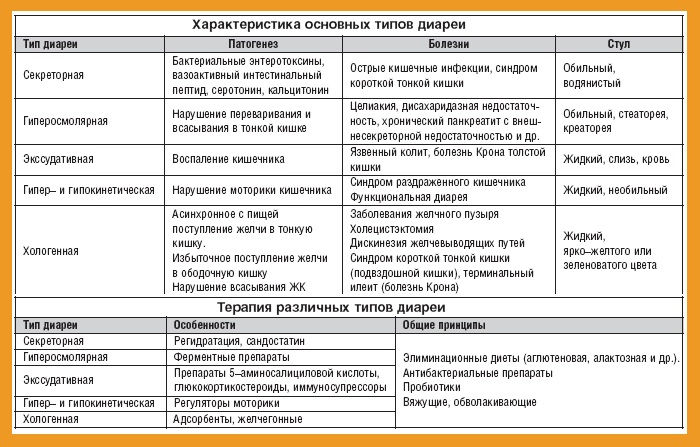
Отличить ротавирус от простого отравления у ребёнка позволят клинические проявления отравления:
- Воспалительные проявления в пищеварительном тракте: тошнота и рвота, спастическая боль в животе.
- Интоксикация – лихорадка с ознобом. Тошнота и рвота. Высокая температура сопровождается болью в мышцах и головной болью. Общая слабость и утомляемость.
- Картина обезвоживания выражается в жажде и сухости кожи и слизистых оболочек. Снижается артериальное давление.
Описанные симптомы проходят самостоятельно через 1 или 2 дня и не требуют дополнительного лечения.
Основное отличие ротавируса от отравления: сроки заболеваний и отсутствие симптомов респираторного заболевания при отравлении.
Острое пищевое отравление развивается спустя несколько часов после употребления недоброкачественной пищи.
Если спустя 1-2 дня в человека сохраняется клиническая картина обезвоживания, сухость во рту и потемнение мочи, головокружение и уменьшение количества мочеиспусканий, обращаются за медицинской помощью.
Отличие ротавируса от отравления:
- Ротавирусная инфекция имеет название кишечный грипп из-за симптомов респираторного заболевания, которыми она дебютирует. Это позволяет отличить ротавирус от пищевого отравления. Развивается сухость в носоглотке и затруднения при глотании.
- При ротавирусной инфекции поражается не только слизистая оболочка пищеварительной системы; возбудитель действует на конъюнктиву и слизистую верхних дыхательных путей. Пищевое отравление не сопровождается ангиной или конъюнктивитом.
- Характер и частота стула отличаются от таковых при ротавирусной инфекции. Вирусная диарея имеет серый цвет. При бактериальных инфекциях стул имеет прожилки крови и слизи.
- В инкубационном периоде при пищевом отравлении имеет место вздутие живота и метеоризм с резким гнилостным запахом.
- Ротавирусная инфекция влияет на цвет мочи: она имеет тёмный цвет и запах аммиака.
Опередить отличие пищевого отравления от клинических признаков при ротавирусе можно по самочувствию окружающих больного людей. Если в семье присутствует ротавирус, члены семьи заболевают поочерёдно.
Пищевое отравление отличается от ротавирусной инфекции. Диагностируют пищевое отравление у питающихся одним испорченным продуктом.
Причины, отличительные черты и факторы риска
Развивается данный тип диареи по причине попадания патогенных бактерий, которые оказывают пагубное воздействие на организм. Бактерии нарушают баланс естественной микрофлоры органов ЖКТ, а также выделяют продукты собственной жизнедеятельности (токсины), которые всасываются в кровь.
Самыми широко встречаемыми возбудителями бактериальной диареи являются:
- Сальмонеллы – эти бактерии попадают в организм вместе с несвежими продуктами, а также мясом и молоком, не прошедшими первичную тепловую обработку. Симптомами сальмонеллеза является учащенный жидкий стул зеленого цвета с пузырьками воздуха, которые по консистенции напоминают пену. Болевые ощущения проявляются в области пупка, а при дефекации возникает сильный спазм внизу живота.
- Шигеллы – бактериальные микроорганизмы провоцируют такое заболевание, как дизентерия. Для него характерны такие проявления, как:
- жидкий стул, периодичность которого более 10 раз в сутки;
- сильная, острая, спастическая боль в животе;
- примеси гноя, крови и белых прожилок в кале.
- Холера – эти бактерии провоцируют развитие одноименного заболевания, которое проявляется в виде сильного обезвоживания по причине обильного поноса. При этом воспалительного процесса в кишечнике нет. Опасность данного заболевания в том, что его стремительное течение нередко провоцирует летальный исход.
Существует несколько факторов риска, обуславливающих попадание патогенных микроорганизмов в пищеварительный тракт:
- Питание в общественных местах – не каждое заведение общепита может похвастаться наличием стерильной посуды, которая проходит через тысячи пациентов ежедневно.
- Употребление продуктов низкого качества, включая фаст-фуд – еда быстрого приготовления так же быстро портится, провоцируя активное размножение патогенных микроорганизмов.
- Сыроедение, для которого характерно употребление рыбы, мяса и молочных продуктов в свежем виде.
- Отсутствие должной гигиены рук, особенно перед едой.
- Частый контакт с больными, которые являются переносчиками бактерий.
- Посещение общественных мест и мест скопления большого количества людей.
- Работа с деньгами.
Однако, коварство данного типа диареи в том, что на первый взгляд все симптомы идентичны, хотя возбудители могут отличаться. В связи с этим лечение нельзя начинать до тех пор, пока не выявлен возбудитель.
Человек испытывает все признаки интоксикации, включая расстройство пищеварения.
- Холера – эти бактерии провоцируют развитие одноименного заболевания, которое проявляется в виде сильного обезвоживания по причине обильного поноса. При этом воспалительного процесса в кишечнике нет. Опасность данного заболевания в том, что его стремительное течение нередко провоцирует летальный исход.
Как видим, путей заражения масса.
Что делать, если понос не проходит
Кишечная ротавирусная инфекция опасна больше для детей, чем для взрослых. Диагностические признаки у детей и взрослых одинаковы. У детей короткий инкубационный период. В возрасте меньше года инкубационный период – не более 1-2 часов.
- Развивается острая схваткообразная или режущая боль в области живота.
- Снижение аппетита сопровождается тошнотой и интенсивной рвотой.
- В носоглотке и на слизистых глаз – воспалительные явления.
- В кишечнике образуются газы. Вздутие живота и острая боль напоминают по клиническому течению панкреатит. Диагностическое отличие – отсутствие признаков изменения структуры поджелудочной железы при ультразвуковом обследовании.
Понос инфекционного генеза — одно из наиболее распространенных заболеваний после простудных и респираторных болезней верхних дыхательных путей. Диарея, вызванная вирусной инфекцией занимает около 10%.
Легкое расстройство пищеварения, обычно проходящее после 3-4 эпизодов поноса, легко отличить от острой инфекции, которая сопровождается ухудшением самочувствия и может продолжаться от 48 часов до 10-12 дней. Понос при этом длится у всех по-разному, но в среднем его длительность не должна превышать 14 дней.
Симптомы, сопровождающие инфекционное кишечное расстройство, при правильном лечении проходят самостоятельно, не вызывают осложнений, угрожающих здоровью или хронических рецидивов.
Необходимо помнить, что диарея – проявление защитной функции организма, с ее помощью выводится патогенная микрофлора, токсины, бактерии. При поносе, что длится 1-2 дня с постепенным понижением интенсивности, лучше ничего не делать.
Важно соблюдать диету, исключить жирную, жареную, острую пищу. Можно принимать энтеросорбенты (активированный уголь), регидрон. Если симптомы не проходят в течение нескольких дней, самочувствие не улучшается, потребуется консультация врача.
При рецидивах кишечной инфекции, которые не проходят в течение нескольких недель, обязательно обращение к медицинским специалистам. Ведь речь может идти о хроническом поносе по причине язвенного колита, нарушения всасывания пищи, онкологическом заболевании кишечника.
Симптомы, сопровождающие состояние
Инкубационный период диареи бактериального генеза непродолжительный. Достаточно 2-3 часов, чтобы человек почувствовал первые признаки неладного. Поносы и болезненные ощущения в животе дополняются такими симптомами, как:
- повышение температуры тела, озноб и лихорадка;
- тошнота и рвота;
- учащенное сердцебиение, повышение артериального давления;
- сильная головная боль;
- слабость и отсутствие аппетита;
- симптомы обезвоживания, для которых характерны сухость кожных покровов и слизистых оболочек, пересыхании и растрескивание кожи губ.
Диарея бактериального типа – это очень коварное заболевание, поскольку его симптоматика постоянно пополняется новыми клиническими проявлениями, а при отсутствии необходимой помощи может наступить смерть.
Страшна не столько сама инфекция, как токсины, отравляющие организм. Раздраженный кишечник старается максимально удалить патоген, вместе с которым выводится вода и полезные бактерии, из-за чего стремительно падает иммунитет и снижается уровень жидкости в организме. Все обменные процессы без воды существенно притормаживаются, организм испытывает стресс.
Интоксикация усиливается, если вовремя не приняты необходимые меры. Обезвоживание провоцирует появление резкой усталости, а также снижение активности. В критических ситуациях может наступить смерть. Поэтому при поносе, независимо от его этиологии и патогенеза, всегда нужно пить много воды, что восполнит ее потери.
Общая симптоматика инфекционной диареи бактериального и вирусного происхождения одинакова:
- повышение температуры тела;
- интоксикация организма, ухудшение общего состояния, слабость;
- жидкий стул с частыми, иногда ложными позывами;
- обезвоживание, с появлением синюшности, бледности кожных покровов;
- боли, рези в животе;
- головная боль, боль в мышцах, суставах;
- рвота, тошнота;
- при острых бактериальных заражениях могут наблюдаться примеси крови, гноя в кале.
Бессимптомно может быть проявление ротавирусной инфекция в 30-40 % случаев среди взрослых и детей. Стул при ротавирусе имеет светлую окраску. Поноса может не быть (около 40 % случаев), а наблюдаться только рвота, тошнота при болезни, вызванной вирусом Норфолка.
Обильно поносить водянистым стулом, испытывать рвотные позывы можно при бактериальной диарее, вызванной шигеллой, сальмонеллой (при сальмонеллезе стул зеленого оттенка), холерой, ротавирусе. Тошнить, рвать, сильно лихорадить может при стафилококке, гонококке, калицивирусах. Цитомегаловирус обычно заражает людей, больных СПИДом, кроме поноса, проявляется увеличением лимфатических узлов (не путать с мононуклеозом).
Дифференциальная диагностика
Чтобы распознать, чем кишечная палочка или другой бактериальный возбудитель отличается от ротавирусной инфекции, проводятся диагностические исследования. Пациенты часто соглашаются на обследование в тяжёлых затянувшихся случаях.
Основное исследование, позволяющее отличить кишечный грипп от пищевого отравления у детей – посев и анализы крови.
После ротавирусной инфекции в анализе крови можно обнаружить повышенное содержание лейкоцитов. К середине заболевания количество лейкоцитов в крови падает. При кишечной инфекции уменьшается объём циркулирующей крови.
Анализ мочи
Диагностируют ротавирусную инфекцию по косвенным признакам. Отличия в анализе мочи: повышено количество белка и лейкоцитов. Моча приобретает тёмный цвет, запах аммиака. При пищевых отравлениях таких признаков не отмечается.
Анализ кала
В анализе кала можно определить, какой возбудитель вызвал пищевое отравление, какие симптомы разовьются. При дизентерии, сальмонеллёзе в анализах удаётся обнаружить примеси крови, слизи. Бактериологическое исследование позволяет идентифицировать возбудителя.
Похожую клиническую картину вызывают дизентерия, сальмонеллёз. Чтобы выявить эти заболевания, чувствительность к антибиотикам, проводят бактериологические посевы. При пищевых отравлениях в анализах обнаруживаются кишечная палочка или стафилококк.
Особенности состояния у детей и пожилых людей
Лечение при вирусных и бактериальных заболеваниях имеет различия. Общие черты лишь у симптоматической терапии и питании.
Диета при отравлениях и симптомах острого гастрита подразумевает голодание в первые сутки. Условием питания при ротавирусе является исключение из рациона молочных продуктов. Это связано с развитием лактазной недостаточности при вирусной инфекции.
Питаются при кишечной инфекции дробно и часто. Из рациона исключаются жирная и солёная пища, жареные и копчёные блюда находятся под запретом. Требование к еде при кишечных инфекциях – щадящий характер.
Лечение от гриппа ротавирусной этиологии подразумевает назначение противовирусной терапии и меры по регидратации и дезинтоксикации. Можно ли лечить антибиотиками вирусную инфекцию, зависит от течения заболевания. Назначение антибиотиков необходимо, когда происходит присоединение вторичной бактериальной инфекции.
Лечение от дизентерии и сальмонеллёза подразумевает назначение антибиотиков.
Патогенетическая терапия подразумевает назначение регидратационных средств. Для выведения из организма токсинов применяются кишечные сорбенты. С целью восстановления нормальной микрофлоры кишечника применяют пробиотики. Улучшают процесс пищеварения с помощью пищеварительных ферментов.
Диарея – это жидкий, водянистый стул, с частыми позывами, сопровождающийся болезненными ощущениями в животе, иногда рвотой, повышенной температурой.
Инфекционная диарея
Статьи по медицине » Терапия
Диарея инфекционной природы принадлежит в настоящее время к числу наиболее распространенных заболеваний и занимает по своей частоте второе место после острых воспалительных заболеваний верхних дыхательных путей. Например, в странах Африки, Азии (без учета Китая) и Латинской Америки ежегодно у детей младше 5 лет регистрируется более 750 млн случаев острой инфекционной диареи, которая более чем у 4,5 млн детей приводит к летальному исходу .
Возбудителями инфекционной диареи могут быть различные агенты, способные определять своеобразие клинической картины заболевания, особенности диагностики и лечения. Серьезность проблемы обусловлена еще и тем обстоятельством, что диагностику и лечение инфекционной диареи нередко осуществляют не инфекционисты, а врачи общего профиля .
Бактериальная диарея
Этиология и патогенез
В структуре этиологических факторов бактериальной диареи в настоящее время произошли существенные изменения. Уменьшилась частота инфекционной диареи, вызванной привычными возбудителями (шигеллами, сальмонеллами), и возросло число случаев заболеваний, обусловленных энтеропатогенными штаммами кишечной палочки и кампилобактерной инфекцией .
Патофизиологические механизмы бактериальной диареи включают в себя выработку энтеротоксина, повышающего активность аденилатциклазы и стимулирующего таким образом секрецию воды и электролитов энтероцитами (например, при инфекции, вызванной холерным вибрионом, клостридиями, энтеротоксинобразующими штаммами кишечной палочки), или же непосредственную инвазию бактерий в эпителиальные клетки слизистой оболочки кишечника с их последующим повреждением и развитием воспалительной реакции (при шигеллезной инфекции, инфекции, вызванной энтероинвазивными штаммами кишечной палочки, иерсиниозе, сальмонеллезе).
Клиническая картина
Инкубационный период при бактериальной диарее может длиться от нескольких часов (при сальмонеллезе или стафилококковой инфекции) до 10 сут (при иерсиниозе). Ведущими клиническими симптомами бактериальной диареи помимо жидкого стула служат лихорадка и схваткообразные боли в животе. При этом могут отмечаться некоторые особенности клинических проявлений, обусловленные этиологическим фактором. Например, клиническая картина при кампилобактерном илеите может напоминать острый аппендицит, а хирург, решившийся в этой ситуации на операцию, находит неизмененный червеобразный отросток и признаки мезентериального лимфаденита. Иерсиниозная инфекция протекает иногда с развитием узловой эритемы и поражением суставов. Сальмонеллезная инфекция может осложняться бактериемией с возникновением пневмонии, менингита, абсцессов внутренних органов. Инфекционная диарея, вызванная энтерогемолитическими штаммами кишечной палочки (0157:Н7), способна привести к развитию гемолитико-уремического синдрома, проявляющегося острой почечной недостаточностью, гемолитической анемией и тромбоцитопенической пурпурой.
Диагностика
Диагностика бактериальной диареи предполагает проведение клинического анализа крови (выявляется лейкоцитоз со сдвигом формулы влево) и ректороманоскопии (картина острого проктосигмоидита при шигеллезной инфекции), а также поиск этиологического фактора, послужившего причиной ее развития. Посев кала с его последующим микробиологическим исследованием дает положительный результат примерно у 4060% больных с острой диареей, протекающей с лихорадкой и появлением лейкоцитов в кале . При отрицательных результатах посевов используют иммунологические методы диагностики. Так, применение иммуноферментных методов позволяет обнаружить антитела к кампилобактеру и сальмонеллам. Энтеротоксины патогенных штаммов кишечной палочки можно выявить с помощью полимеразной цепной реакции и латексной агглютинации. При шигеллезах уже в первые дни болезни при использовании метода гемагглютинации можно определить антитела к антигену 0.
Лечение
Борьба с обезвоживанием
Лечение острой инфекционной диареи должно включать в себя в первую очередь (особенно у детей) борьбу с обезвоживанием. В легких случаях заболевания регидратационная терапия сводится к достаточному приему жидкости (чай, минеральная вода и т.д.), содержащей глюкозу и электролиты. Самый простой регидратационный раствор готовится следующим образом: в 1 стакан апельсинового сока (он содержит 1,5 г хлорида калия) добавляют 1/2 чайной ложки поваренной соли (3,5 г хлорида натрия) и 1 чайную ложку соды (2,5 г бикарбоната натрия), после чего кипяченой водой доводят общий объем раствора до 1 л .
При более выраженном обезвоживании показаны специальные регидратационные растворы, имеющие электролитный состав, рекомендованный ВОЗ (Na+ 90 ммоль/л, К+ 20 ммоль/л, CI— 80 ммоль/л, НСО—3 30 ммоль/л, глюкоза 110 ммоль/л). В педиатрической практике в целях борьбы с обезвоживанием при диарее используют препарат регидрон, содержащий в 1 пакетике 3,5 г натрия хлорида, 2,9 г натрия цитрата, 2,5 г калия хлорида и 10 г декстрозы. После растворения содержимого пакетика в 1 л теплой кипяченой воды больному дают пить полученный раствор, исходя из предполагаемой потери массы тела (при потере 57,5% массы тела объем вводимой жидкости составляет 4050 мл/кг массы тела в течение 4 ч или до 150 мл/кг массы тела в сутки). Общий объем перорально принимаемой жидкости для взрослых больных должен быть не менее 23 л в сутки. При тяжелом обезвоживании (потеря более 10% массы тела в течение 24 ч) дополнительно прибегают к внутривенному введению воды и растворов электролитов. Больным с острой инфекционной диареей рекомендуется легкая диета сроком на 23 дня с включением в нее таких продуктов, как слизистые супы, рис, подсушенный хлеб, подсоленный крекер, печеный картофель, яйца и др. Следует избегать приема продуктов, богатых растительной клетчаткой, молочных продуктов, кофе и алкоголя.
Антибактериальная терапия
Антибактериальные препараты, прежде широко применявшиеся при лечении бактериальной диареи, в настоящее время назначаются дифференцированно, с учетом вида возбудителя и тяжести течения заболевания. Следует иметь в виду, что многие формы инфекционной диареи заканчиваются самоизлечением в течение 5 дней на фоне регидратационной терапии .
При неосложненных случаях сальмонеллеза антибиотики не показаны, поскольку они не уменьшают длительность болезни и удлиняют период выделения возбудителя. К антибиотикотерапии прибегают в тех случаях, когда заболевание протекает с высокой лихорадкой, признаками выраженной интоксикации, бактериемией и поражением других органов. Препаратами выбора при этом являются ампициллин (в дозе 46 г в сутки) или хлорамфеникол (по 1 г 3 раза в день), которые применяются в течение 2 нед. При выраженной интоксикации альтернативой можно считать ко-тримоксазол (160 мг триметоприма и 800 мг сульфаметоксазола 2 раза в день в течение 12 нед).
Антибиотикотерапия, проводимая у больных с шигеллезом, способствует уменьшению длительности лихорадки и укорочению периода носительства микроорганизмов. Препаратом выбора является ко-тримоксазол, назначаемый в дозе 960 мг 2 раза в день в течение 5 дней. С учетом возможной устойчивости к данному препарату вместо него можно применять также налидиксовую кислоту (по 1 г 4 раза в день), норфлоксацин (по 400 мг 2 раза в день) или ципрофлоксацин (по 500 мг 2 раза в день). Ампициллин и доксициклин используются лишь при подтверждении чувствительности к ним высеянных штаммов бактерий. В качестве резервного метода лечения рассматривается применение цефтриаксона (по 1 г в день внутривенно в течение 5 дней).
При лечении неосложненного кампилобактериоза антибиотики обычно не играют существенной роли, поскольку клинические проявления этого заболевания часто полностью стихают в таких случаях еще до выявления возбудителя. Антибактериальные средства применяются обычно при тяжелом течении заболевания, выраженной интоксикации, наличии крови в кале. Основным препаратом для лечения кампилобактериоза служит эритромицин, который назначается в дозе 1 г в сутки (в 2 или 4 приема) на протяжении 57 дней. Эффективны также тетрациклины (например, доксициклин по 200 мг в 1-й день и далее по 100 мг в день) и фторхинолоны. При кампилобактерной септицемии применяют гентамицин (в дозе 45 мг на 1 кг массы тела), цефтриаксон (1 г в сутки) или хлорамфеникол (3 г в сутки).
При иерсиниозе антибактериальное лечение проводится только в тяжелых случаях заболевания. Препаратами выбора при этом следует считать гентамицин (5 мг на 1 кг массы тела в день внутривенно) или хлорамфеникол (50 мг на 1 кг массы тела в день внутривенно или перорально). Продолжительность лечения должна составлять не менее 2 нед.
Применение антибиотиков при холере способствует быстрому исчезновению холерного вибриона из фекалий и уменьшению длительности диареи. Препаратом выбора остается тетрациклин (250 мг каждые 6 ч в течение 4 дней). Можно использовать также фуразолидон (в дозе 5 мг на 1 кг массы тела в день, разделенной на 4 приема, в течение 3 дней), хлорамфеникол (500 мг 4 раза в день в течение 7 дней) и ко-тримоксазол (960 мг 2 раза в день в течение 1 нед).
Использование симптоматических антидиарейных средств при лечении инфекционной диареи, вызванной энтероинвазивными бактериями (шигеллами и сальмонеллами), не показано, поскольку они замедляют элиминацию микроорганизмов и удлиняют продолжительность заболевания. Их назначения следует избегать и при высокой лихорадке, выраженной интоксикации, а также при наличии лейкоцитов и крови в кале, из-за опасности развития токсической дилатации толстой кишки (токсический мегаколон).
Вирусная диарея
Среди различных вариантов вирусной диареи наибольшее клиническое значение имеют диарея ротавирусной этиологии (самая частая форма инфекционной диареи у детей), диарея, вызванная вирусом Норфолк, а также адено- и астровирусами. В клинической картине вирусной диареи обращает на себя внимание частое сочетание поносов и лихорадки с диспепсическими расстройствами, а нередко (при ротавирусной диарее) и с поражением верхних дыхательных путей. Диагноз подтверждается при обнаружении вируса в кале с помощью электронной микроскопии или при проведении специальных иммунологических исследований (например, с моноклональными антителами). Течение диареи вирусного происхождения обычно благоприятное. Продолжительность заболевания не превышает, как правило, 35 дней. Лечение является симптоматическим и сводится к устранению водно-электролитных нарушений.
Диарея паразитарного происхождения
В группе диареи паразитарного происхождения наибольшее клиническое значение имеют амебиаз и лямблиоз.
Возбудителем амебиаза является дизентерийная амеба, которая характеризуется почти повсеместной распространенностью. Полагают, что около 10% всего населения земного шара инфицированы этими простейшими. При этом у 70% инфицированных колонизация паразитами слизистой оболочки толстой кишки протекает бессимптомно, тогда как в остальных случаях развертывается классическая картина амебного колита с болями в животе, диареей и лихорадкой. Стул имеет хорошо заметную на глаз примесь крови. При тяжелом течении амебиаза возможны осложнения в виде перфорации стенки кишки с развитием перитонита, токсического мегаколона, абсцессов печени, легких, головного мозга. Диагноз амебиаза подтверждается при обнаружении трофозойтов Entamoeba histolytica или их цист в стуле. Дополнительное диагностическое значение имеет определение специфичных IgA, IgM и IgG иммуноферментным методом. Лечение включает в себя назначение метронидазола (0,75 г 3 раза в день в течение 5-10 дней) или комбинации тетрациклина (0,25 г 4 раза) с хлорохином (0,250,5 г 34 раза) в течение 15 дней.
Одной из наиболее распространенных инфекций, способных быть причиной острой или хронической диареи, является лямблиоз. При попадании лямблий в кишечник во многих случаях развивается бессимптомное носительство. Картина лямблиозного энтерита возникает лишь у 2550% инфицированных, причем заболевание часто принимает хроническое течение. Диагноз лямблиоза подтверждается при обнаружении трофозойтов или цист лямблий в кале, желчи или дуоденальном содержимом. Возможно также определение антител классов IgA, IgM и IgG к G.lamblia. Препаратом выбора в лечении больных с лямблиозом является метронидазол, применяемый в течение 7 дней в дозе 0,25 г 3 раза в сутки.
Особые формы диареи
В настоящее время выделены особые формы инфекционной диареи:
диарея путешественников;
диарея у мужчин-гомосексуалистов;
дирея у больных СПИДом;
антибиотико-ассоциированная диарея;
синдром избыточного роста бактерий.
Необходимость их отдельного рассмотрения продиктована различными обстоятельствами: широкой распространенностью (диарея путешественников), своеобразием этиологических факторов (диарея у мужчин-гомосексуалистов, диарея у больных СПИДом), нередко бесконтрольным приемом антибиотиков (антибиотико-ассоциированная диарея).
Риск развития диареи путешественников наиболее высок (3070%) при поездках в страны Азии, Африки и Латинской Америки. В большинстве случаев эта форма заболевания бывает вызвана энтеротоксигенными штаммами кишечной палочки (реже сальмонеллами, шигеллами и другими микроорганизмами). Дополнительное значение в ее развитии имеют смена характера питания, климатические особенности, нервные стрессы. Диарея путешественников обычно начинается внезапно, протекает со схваткообразными болями в животе и незначительным повышением температуры. Признаков обезвоживания организма, как правило, не наблюдается и симптомы заболевания исчезают самопроизвольно в течение 34 дней. У большинства больных достаточно симптоматического лечения. Хорошо зарекомендовал себя лоперамид (Имодиум). Противодиарейный эффект препарата связан со снижением перистальтики и увеличением времени прохождения содержимого по кишечнику. Препарт повышает тонус анального сфинктера, способствуя лучшему удержанию каловых масс и уменьшая императивные позывы к дефекации. У взрослых при остро возникшей диарее первая доза Имодиума составляет 4 мг (у детей 2 мг), в дальнейшем после каждого эпизода жидкого стула — 2 мг. К назначению антибактериальных препаратов (фуразолидон, фторхинолоны, ко-тримоксазол) прибегают лишь при высокой лихорадке и симптомах интоксикации.
Инфекционная диарея у мужчин-гомосексуалистов бывает вызвана специфичными возбудителями (гонококки, хламидии, вирус простого герпеса). Так, попадание в прямую кишку гонококков может вызвать вялотекущий гонорейный проктит со слизисто-гнойными выделениями. Диагноз подтверждается при обнаружении грамотрицательных диплококков в лейкоцитах, полученных с помощью тампона при ректороманоскопии. Лечение в таких случаях проводится пенициллинами.
Сочетание диарейного синдрома с выраженной прокталгией, затруднением мочеиспускания, увеличением паховых лимфоузлов и характерными везикулезными высыпаниями на слизистой оболочке прямой кишки в области ануса может свидетельствовать о наличии у больного инфекции, вызванной вирусом простого герпеса. Диагноз подтверждается при исследовании содержимого пузырьков (с использованием метода культуры тканей), а также определении титра соответствующих антител. Для лечения применяют ацикловир.
Диарея у больных СПИДом один из ведущих синдромов в клинической картине заболевания, встречается у 3040% пациентов. Этиологическими факторами инфекционной диареи у больных чаще всего оказываются простейшие (криптоспоридии и изоспоры), оппортунистические вирусы (цитомегаловирус, вирус простого герпеса), бактериальные агенты (чаще всего Mycobacterium avium intracellulare). Инфекционная диарея у больных СПИДом нередко принимает угрожающее для жизни течение (прежде всего вследствие значительной потери массы тела) и плохо поддается лечению.
Кроме того, диарея у больных СПИДом может быть вызвана непосредственным действием самого вируса иммунодефицита человека на слизистую оболочку кишечника с развитием ВИЧ-ассоциированной энтеропатии и синдрома мальабсорбции. Способность вируса иммунодефицита человека усиливать процессы секреции в кишечнике ведет иногда к возникновению секреторной диареи с увеличением объема кала до 1214 л в сутки. Единственный препарат, эффективный в таких случаях, октреотид. Наконец, при поиске причин развития диареи у больных СПИДом необходимо иметь в виду, что она может быть связана со злокачественным поражением желудочно-кишечного тракта (саркома Капоши, злокачественная лимфома).
Антибиотико-ассоциированная диарея приобретает важное клиническое значение в тех случаях, когда она бывает обусловлена Clostridium difficile. Частота носительства данных микроорганизмов, составляющая среди взрослого населения 315%, существенно возрастает (до 1540%) при приеме антибиотиков (в первую очередь, клиндамицина, ампициллина, цефалоспоринов), угнетающих рост штаммов кишечной флоры, в норме подавляющих жизнедеятельность Clostridium difficile.
Спектр клинических проявлений этой инфекции колеблется от легкого послабления стула до тяжело протекающего псевдомембранозного колита, связанного с повреждающим действием на колоноциты энтеротоксинов А и В, вырабатываемых данными микроорганизмами. Псевдомембранозный колит протекает, как правило, с высокой лихорадкой, схваткообразными болями в животе, жидким стулом (часто с примесью крови), высоким лейкоцитозом. Заболевание может осложняться электролитными нарушениями, развитием артериальной гипотонии и токсического мегаколона. Диагноз подтверждается при эндоскопическом исследовании (характерные налеты на слизистой оболочке толстой кишки в виде псевдомембран) и обнаружении Clostridium difficile (с помощью метода культуры тканей) или его токсинов (иммуноферментным методом). Лечение больных с псевдомембранозным колитом проводится ванкомицином (по 0,1250,5 г 4 раза в сутки) или метронидазолом (0,25 г 4 раза в сутки) в течение 714 дней.
Синдром избыточного роста бактерий специфический вариант инфекционной диареи, в основе которого лежит увеличение содержания бактерий в тонкой кишке (с 104107/мл до 1011/мл). Синдром избыточного роста бактерий возникает в тех случаях, когда замедляется пассаж содержимого по тонкой кишке (например, после операций на желудке и кишечнике, при спаечном процессе, стриктурах кишечника) или нарушается функция илеоцекального клапана (резекция слепой и подвздошной кишки), в результате чего содержимое толстой кишки попадает в просвет тонкой кишки.
Синдром избыточного роста бактерий клинически проявляется диареей с последующим развитием синдрома мальабсорбции. Диагноз основывается на результатах дыхательного теста, проводимого с меченой лактулезой, а также на обнаружении повышенного содержания микроорганизмов (>106) в дуоденальном аспирате. Лечение синдрома избыточного роста бактерий должно быть направлено на устранение заболеваний, послуживших причиной его развития (опухоль тонкой кишки, спаечный процесс, свищи и т.д.).
Таким образом, представленные данные показывают, что в клинической практике врачу общего профиля могут встретиться различные формы и варианты инфекционной диареи, часто имеющие клинические особенности, обусловленные возбудителем заболевания. Знание этих особенностей оказывается крайне необходимым для постановки правильного диагноза и назначения адекватного лечения.
Литература
1. Speelman P. Acute gastrointestinal infections and their complications. Current topics in gastroenterology and hepatology (Ed. G.N.J.Tytgat, M. van Blankenstein). Stuttgart- New York, 1990; 817.
2. Ивашкин В.Т. Инфекционная диарея в практике гастроэнтеролога. Росс. журн. гастроэнтерологии, гепатологии, колопроктологии. 1997; 5; 517.
3. Slutsker L., Ries A.A., Greene K.D. et al. Escherichia coli 0157 : H7 diarrhea in the United States: clinical and epidemiologic features. Ann. Intern Med. 1997; 126: 50513.
4. Богомолов Б.П. Диарея в дифференциальной диагностике инфекционных болезней. Клин. мед. 1997; 7: 812.
5. McQuaid K.R. Diarrhea. Current medical diagnosis & treatment (Ed.L.M.Tierney, S.J.McPhee, M.A.Papadakis). 38th Ed. Appleton & Lange. Stamford, 1999; 54652.
31.03.2010
Другие статьи в рубрике «Терапия»
Диарея; Острый — Консультант по терапии рака
I. Проблема / Состояние.
Диарея является причиной примерно 1,8 миллиона посещений кабинетов врачей в Соединенных Штатах ежегодно, а расходы на здравоохранение и снижение производительности составляют 6 миллиардов долларов в год. При примерно 1,8 млн госпитализаций в год диарея является одним из наиболее распространенных состояний, с которыми справляются госпиталисты.
Диарея определяется как снижение консистенции стула (мягкий или жидкий) с увеличением частоты стула до трех и более дефекаций в день.Тяжесть диарейного заболевания определяется необходимостью изменения регулярной повседневной деятельности, где легкое заболевание не требует изменения активности, умеренное заболевание требует некоторого изменения в деятельности, а тяжелое заболевание приводит к полной инвалидности.
Диарею можно дополнительно классифицировать по течению времени (острый или хронический), объему (большой или маленький), патофизиологии (секреторный или осмотический) и характеристикам стула (водянистый, жирный или воспалительный). Эти классификации полезны для диагностики и лечения.Острая диарея длится менее 14 дней, стойкая диарея — 14–29 дней, а хроническая диарея — более 30 дней. В этой главе особое внимание будет уделено острой диарее.
II. Диагностический подход
A. Каков дифференциальный диагноз этой проблемы?
Острая диарея возникает преимущественно по инфекционным причинам. Неинфекционная этиология включает побочные эффекты лекарств, пищевую аллергию, эндокринные нарушения, основное желудочно-кишечное расстройство, злокачественные новообразования.
Инфекционная диарея чаще всего вызывается вирусами, но также может быть вызвана бактериями или паразитами. Факторы риска бактериальных инфекций включают недавние путешествия, воздействие пищевых продуктов или сопутствующие заболевания (например, состояние с ослабленным иммунитетом). Инфекционная этиология, как показано в Таблице I, далее подразделяется на невоспалительные или воспалительные причины.
Таблица I.
Инфекционные этиологии острой диареи
Неинфекционная этиология включает основные желудочно-кишечные или эндокринные расстройства, злокачественные новообразования, диету, лекарства и другие ятрогенные причины, как показано в таблице II.
Таблица II.
Неинфекционные этиологии диареи
B. Опишите диагностический подход / метод пациенту с этой проблемой
Одна из дилемм при ведении пациента с острой диареей — определить, когда проводить дальнейшую диагностическую оценку, а когда начинать терапию. Поскольку в большинстве случаев острые диарейные заболевания проходят самостоятельно, диагностические тесты и лечение обычно не требуются. Показания к рассмотрению дополнительных анализов включают тяжелое заболевание (полная инвалидность из-за диареи), кровавый стул, лихорадка, симптомы длятся более 7 дней.
1. Историческая справка, важная в диагностике данной проблемы.
Тщательный анамнез может помочь определить этиологию острой диареи. В частности, подробные сведения о продолжительности и частоте симптомов, степени тяжести (признаки обезвоживания, такие как повышенная жажда, снижение диуреза, слабость, головокружение, изменения психического статуса) и характеристик стула (наличие крови, слизи, гноя, частиц пищи, масла капель). Эта информация может помочь определить происхождение диареи в тонкой кишке (стул большого объема без крови, сопровождающийся спазмами, вздутием живота, газами и потерей веса) или толстой кишке (частый стул небольшого объема, связанный с лихорадкой, кровавый / слизистый стул и спазмы в животе).
Повышенная температура, боль в животе и кровавый стул указывают на воспалительную инфекцию, вызванную инвазивными бактериями или патогенами, продуцирующими токсины. Тошнота и рвота могут указывать на присутствие предварительно сформированных бактериальных токсинов, а время их появления в результате приема внутрь или воздействия может дать дополнительные ключи к разгадке основной этиологии (например, Staphylococcus aureus и Bacillus cereus вызывают симптомы менее чем через 6 часов, а C. perfringens вызывает диарею. Через 8-16 часов после приема внутрь). Дополнительная историческая информация включает воздействия или факторы риска, как указано в Таблице III.
Таблица III.
Патогены, вызывающие диарею и связанные с ней факторы риска
Пациенты с иммунодефицитом (например, вирус иммунодефицита человека [ВИЧ], длительное употребление стероидов, химиотерапия, иммунодепрессанты, дефицит иммуноглобулина) подвергаются повышенному риску всех инфекций, особенно цитомегаловируса, Cryptosporidium, Microsporidium, Isospora и Cyclospora. У пациентов после трансплантации может развиться диарея из-за болезни трансплантат против хозяина. У пациентов с дефицитом IgA может развиться тяжелый рефрактерный лямблиоз.Больные циррозом имеют повышенный риск инфицирования V. parahemolyticus, а у пациентов с гемохроматозом могут развиться инфекции Yersinia.
Наконец, также необходимо тщательное расследование ятрогенных причин, таких как лекарства, антибиотики, недавняя операция или лучевая терапия, а также возможное воздействие патогенов. В частности, следует тщательно изучить место жительства, профессиональные воздействия, сексуальный анамнез, недавние поездки, домашних животных и хобби.
2. Маневры физического осмотра, которые могут быть полезны для диагностики причины этой проблемы.
Первоначальная оценка включает оценку обезвоживания (например, снижение тургора кожи, ортостатическая гипотензия, тахикардия, сухость слизистых оболочек, задержка наполнения капилляров, запавшие глаза). Наличие лихорадки предполагает воспалительную диарею. Ректальное обследование для оценки стула может помочь в диагностике. Стул следует исследовать на консистенцию и наличие крови. Также следует провести тщательное обследование брюшной полости для выявления осложнений (например, снижение или отсутствие кишечных шумов, вздутие живота, локализованная или диффузная болезненность, болезненность при отскоке и образования).
3. Лабораторные, рентгенографические и другие анализы, которые могут быть полезны при диагностике причины этой проблемы.
Поскольку в большинстве случаев острая диарея купируется самостоятельно, тестирование следует ограничить пациентами с заболеванием средней и тяжелой степени, наличием кровянистого стула, симптомами, продолжающимися более 7 дней, или пациентами с подавленным иммунитетом. У пациентов с признаками обезвоживания анализ крови может включать базовую метаболическую панель для оценки электролитных нарушений и признаков почечной недостаточности.Следует рассмотреть следующие исследования стула:
Лейкоциты, лактоферрин или кальпротектин
Микроскопия и посев на вирусы, бактерии, яйцеклетки и паразиты
Токсин Clostridium difficile (C. diff)
Иммуноферментный анализ (ELISA) для определения Giardia и Cryptosporidium
Рентгенограмма брюшной полости у токсичных пациентов для выявления признаков кишечной непроходимости или мегаколона
Применение эндоскопии ограничено, но может рассматриваться в случаях тяжелой острой диареи с неясным диагнозом, основанным на вышеуказанном обследовании и стойких симптомах.Колоноскопия обеспечивает прямую оценку слизистой оболочки кишечника, которая позволяет выявить неинфекционные причины острой диареи и предоставить средства для получения биопсий толстой и тонкой кишки.
Эзофагогастродуоденоскопия в настоящее время не рекомендуется пациентам с острой диареей из-за низкой эффективности, поскольку в большинстве случаев инфекционный агент поражает нижние отделы желудочно-кишечного тракта.
C. Критерии диагностики каждого диагноза, указанного в методе выше.
Большинство случаев острой диареи вызвано инфекциями, которые имеют самоограниченное течение и, следовательно, обычно не требуют дополнительных исследований для определения этиологии.Однако дальнейшие диагностические исследования показаны пациентам с ослабленным иммунитетом или пациентам с тяжелой диареей с симптомами токсичности (например, лихорадка, кровавый стул, перитонеальные признаки, признаки обезвоживания) или недавним приемом антибиотиков (связанным с C. diff).
Во-первых, пациента следует тщательно обследовать на предмет признаков обезвоживания и системной токсичности. Восполнение запасов жидкости имеет решающее значение на ранних этапах презентации, даже до определения основной этиологии острого диарейного заболевания пациента.После завершения первоначальной реанимации собирают подробный анамнез, чтобы определить самый высокий риск осложнений у пациента, включая пациентов с ослабленным иммунитетом (например, ВИЧ-инфицированных, реципиентов трансплантата, использование иммуносупрессивных препаратов, беременность или пожилой возраст) и пациентов с множественными заболеваниями. сопутствующие заболевания, которые могут относительно быстро декомпенсироваться (например, цирроз печени, почечная недостаточность, сердечная недостаточность).
Для сужения дифференциального диагноза необходимо провести полное исследование лекарств, социального анамнеза и истории поездок пациента.Как обсуждалось выше и указано в Таблице III, целевые вопросы могут помочь в сокращении разницы.
Пациентам, у которых этиология острой диареи имеет решающее значение для ведения, проводится диагностическая оценка. В первую очередь следует исключить инфекционные причины, как указано выше. Если инфекционное обследование не позволяет установить диагноз, для получения дополнительных данных можно использовать визуализацию и эндоскопию. Если диарея сохраняется и продолжает ухудшаться, диагностическую оценку следует расширить, включив хронические причины диареи, поскольку острая диарея пациента может быть первым проявлением более хронической проблемы.
D. Чрезмерно используемые или «потраченные впустую» диагностические тесты, связанные с оценкой этой проблемы.
По данным многочисленных исследований, культуры стула часто получают без надобности с относительно низким выходом — менее 10%. В результате стоимость посева кала на один положительный результат оценивается до 1200 долларов. Выборочное тестирование необходимо для минимизации затрат на здравоохранение во всем мире. Посев кала рекомендуется только у пациентов с ослабленным иммунитетом или у пациентов с кровавым стулом, умеренным и тяжелым заболеванием или стойкими симптомами в течение 7 дней или дольше.
III. Управление в процессе диагностики
A. Ведение острой диареи
Большинство случаев острой диареи разрешаются спонтанно, но некоторым пациентам может потребоваться поддерживающая гидратация и восполнение электролитов. Раствор для пероральной регидратации (ПРР), рекомендованный Всемирной организацией здравоохранения (ВОЗ) и Международным чрезвычайным фондом для детей Организации Объединенных Наций (ЮНИСЕФ), оказался экономически эффективным методом предотвращения госпитализаций и лечения большинства случаев инфекционной диареи.ПРС содержит воду, электролиты и поддерживающую жидкостную терапию. В состав раствора для пероральной регидратации (на литр воды) входят 60-75 миллиэквивалентов / литр (мэкв / л) натрия и 75-90 миллимоль / литр (ммоль / л) глюкозы. Подобный раствор можно приготовить дома, добавив одну чайную ложку соли и восемь чайных ложек сахара в один литр воды.
Пациенты с более легкой степенью тяжести часто могут восполнить потерю жидкости водой, супами, фруктовыми соками и солеными крекерами; Следует отметить, что важно обеспечивать как глюкозу, так и натрий, поскольку оба они необходимы для котранспорта в кишечнике.Таким образом, одних спортивных напитков (например, Gatorade (, Powerade ()) недостаточно в качестве растворов для пероральной регидратации.
Раннее начало энтерального кормления важно при лечении острых диарейных заболеваний, так как помогает снизить кишечную проницаемость, особенно в случае инвазивных патогенов. Хотя не было рандомизированных контролируемых испытаний в поддержку определенной диеты, диета BRAT (бананы, рис, яблочный соус, тосты) или вареные крахмалы и злаки (например.г., картофель, лапша, рис, пшеница и овес). Следует избегать продуктов с высоким содержанием жира, пока функция кишечника не вернется в норму. Также следует избегать молочных продуктов, поскольку может возникнуть преходящий дефицит лактазы. Могут быть добавлены поливитамины и минералы, а пробиотики могут использоваться в качестве альтернативной терапии, особенно в случаях диареи путешественников.
Симптоматическое лечение достигается с помощью антисекреторных и противовоспалительных средств. Основным антисекреторным лекарством, доступным в Соединенных Штатах, является субсалицилат висмута, который продается без рецепта в таблетках по 263 грамма.Пациентам обычно рекомендуется принимать одну или две таблетки до четырех раз в день, максимум восемь доз за 24 часа до этого. Побочные эффекты, включая черный стул и черный язык, в результате присутствия в лекарстве соли сульфида висмута.
Два широко используемых препарата против моторики — это лоперамид и дифеноксилат / атропин, последний из которых, как правило, более проблематичен при более высоких дозах из-за его центральных побочных эффектов опиатов. Агенты, снижающие моторику, противопоказаны пациентам с высокой температурой или кровавой диареей, поскольку они могут продлить болезнь или вызвать ее ухудшение.Было обнаружено, что лоперамид уменьшает продолжительность диареи на 24 часа при диарее путешественников.
Антибактериальная терапия в большинстве случаев не требуется, так как большинство случаев вызвано вирусами или самоограничивающимися бактериальными инфекциями. Фактически, использование антибиотиков не рекомендуется из-за их способности вызывать в будущем устойчивость, искоренять нормальную кишечную флору, приводить к суперинфекции, то есть инфекции C.Diff, продлевать состояние носительства или индуцировать выброс токсинов. Пациенты с высокой вероятностью бактериальной инфекции (т.е. подозрение на диарею путешественника), тяжелое заболевание, состояние с ослабленным иммунитетом, длительное заболевание или работа в общественном здравоохранении (например, разносчики еды, медицинские работники) могут рассматриваться для эмпирического лечения антибиотиками с одним из следующих режимов лечения:
Левофлоксацин 500 миллиграммов (мг) ежедневно в течение (x) 1-3 дней
Ципрофлоксацин 750 мг ежедневно х 1 день
Ципрофлоксацин 500 мг в сутки 3 дня
Офлоксацин 400 мг в сутки 1–3 дня
Азитромицин 1000 мг ежедневно x 1 день
Азитромицин 500 мг ежедневно x 3 дня
Рифаксимин 200 мг 3 раза в день x 3 дня
Таргетная терапия на основе посева кала, если таковая получена, доступна для некоторых бактериальных и паразитарных инфекций.Схемы лечения могут варьироваться в зависимости от местных панелей резистентности и чувствительности, но общие рекомендации включают:
Campylobacter: азитромицин 500 мг в день x 3-5 дней
Clostridium difficile: метронидазол 500 мг три раза в день x 10 дней, ванкомицин (в тяжелых случаях)
Escherichia coli (за исключением штамма, продуцирующего токсин Shiga): ципрофлоксацин 500 мг в день x 3 дня
Shigella: ципрофлоксацин 500 мг 2 раза в день 3 дня или 2 г 1 день
Vibrio cholerae: доксициклин 300 мг x 1 день
Лямблии: метронидазол 250-750 мг 3 раза в день в течение 7-10 дней
Cryptosporidium: нитазоксанид 500 мг два раза в день x 3 дня при иммуносупрессии
Microsporidium: альбендазол 400 мг два раза в день x 3 недели
Isospora и cyclospora: триметоприм / сульфаметоксазол DS 2 раза в день x 7-10 дней
Entamoeba histolytica: метронидазол 750 мг три раза в день и паромомицин 25-35 мг / килограмм / день x 5-10 дней
Б.Распространенные ловушки и побочные эффекты лечения этой клинической проблемы
Необходимо использовать соответствующие растворы для пероральной регидратации. Одной воды недостаточно, поскольку она не содержит необходимых электролитов, соли или сахара.
Агенты, снижающие подвижность (например, лоперамид и дифеноксилат / атропин), следует ограничивать для использования только у пациентов с невоспалительной диареей. Субсалицилат висмута является более безопасной альтернативой для таких пациентов.
Megacolon может развиться, если агенты, снижающие моторику, используются в течение длительного времени.
Субсалицилат висмута может вызывать отравление салицилатом у пациентов, принимающих препараты аспирина. Это также может вызвать потемнение языка, серовато-черный стул (который можно спутать с меленой) и закупорку, особенно у младенцев и ослабленных пациентов. У некоторых пациентов может наблюдаться потеря слуха и шум в ушах.
Следует избегать назначения антибиотиков пациентам с лихорадкой и дизентерией, если не исключена энтерогеморрагическая кишечная палочка, продуцирующая токсин Шига, поскольку антибиотики могут вызвать гемолитико-уремический синдром.
Антибиотики следует использовать с осторожностью из-за повышенного риска инфекции C.diff и развития резистентности.
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
границ | Бактериальные и грибковые изменения микробиоты различают C.difficile от других форм диареи: результаты проспективного стационарного исследования
Введение
Сообщество местных микроорганизмов (включая бактерии, вирусы и грибковые элементы), сосуществующих в желудочно-кишечном тракте хозяина, называется кишечным микробиомом . Нарушения микробиоты кишечника, особенно антибиотиками, были связаны с развитием ИКД (Peterfreund et al., 2012; Theriot et al., 2014). Предполагается, что у здоровых пациентов нормальные местные микробы предотвращают болезненные состояния с помощью предполагаемых механизмов, таких как прямое ингибирование патогенов, истощение необходимых питательных веществ патогенами и стимуляция иммунной системы хозяина (Stecher and Hardt, 2011).Однако большинство исследований, оценивающих изменения этих кишечных микробных сообществ в условиях ИКД, либо ограничивались нишевыми популяциями людей, такими как младенцы или пожилые люди, либо прибегали к моделям на мышах (Reeves et al., 2011; Rea et al., 2012; Rousseau et al., 2012; Lawley, Young, 2013; Koenigsknecht et al., 2015; Miezeiewski et al., 2015). Из этой относительно небольшой части опубликованной литературы можно прийти к согласию, что общей чертой, отличающей пациента с ИКД от здорового субъекта, является значительное уменьшение как популяционного разнообразия, так и плотности видов бактерий, характеризующееся потерей часто встречающихся комменсальных бактерий и переизбытком некоторых анаэробов ( Proteobacteria ; Skraban et al., 2013; Zhang et al., 2015).
Существуют четыре элемента текущих исследований микробиома, которые ограничивают их клиническую значимость. Во-первых, очень мало представленная особенность большинства опубликованных исследований микробиома связана с анализом альтруистических или враждебных отношений между структурами бактериального сообщества в кишечнике одного и того же пациента. Составной профиль отдельных и совокупных сообществ в кишечнике может сдвигать среду толстой кишки в сторону более или менее благоприятной среды обитания для патогенных бактерий, таких как C.difficile через ряд различных механизмов (таких как доступность источников углерода и пищи, влияние на выработку муцина и бактериальных токсинов; Perez-Cobas et al., 2014). Второй фактор, который часто не учитывается в предыдущих исследованиях ИКД, связан с ролью грибковых элементов. Виды грибов составляют значительную часть микробной среды кишечника, но их участие в развитии ИКД практически не изучено. В-третьих, существует мало исследований ИКД и микробиома, в которых используется стул от людей, из-за проблем со сбором этих образцов ткани и накоплением когорт с приемлемой степенью однородности, которая позволила бы провести надлежащее сравнение.В-четвертых, исследования микробиома при ИКД требуют C. difficile отрицательных диарейных стула в качестве надлежащего контроля. Эта особенность важна, поскольку диарея, с C. difficile или без нее, связана с изменениями микробиоты, которые отсутствуют у пациентов со сформированным стулом; Кроме того, именно пациенты с диареей будут проходить тестирование на ИКД, и для достоверных сравнений важно убедиться, что у обеих когорт схожие симптомы.
Настоящее исследование предполагает, что ИКД как заболевание кишечника связано с определенными структурами бактериального и грибкового сообщества, которые согласованы между человеческими хозяевами.Целью этого исследования было сравнение и сопоставление различных микробных таксонов и различных паттернов совместной встречаемости микробных сетей, наблюдаемых среди проспективно собранных, полученных от человека положительных и отрицательных образцов диарейного стула на C. difficile . Предполагается, что эта информация окажется полезной для лучшего понимания механизма того, как ранее сообщенные изменения в кишечных таксонах приводят к ИКД, а также потенциально может обеспечить цели для профилактики и лечения.
Материалы и методы
Дизайн исследования и сбор образцов
Это проспективное когортное исследование было проведено исключительно в Медицинском центре штата Пенсильвания в Херши с одобрения Институционального наблюдательного совета.Образцы диарейного стула, собранные у госпитализированных медицинских и хирургических пациентов, были отправлены в микробиологическую лабораторию Медицинского центра Херши для тестирования C. difficile в период с июня 2014 г. по ноябрь 2014 г. и рассматривались для включения в это исследование. Каждый пациент подписал одобренную IRB форму согласия до того, как их стул будет собран для использования в этом исследовании. В течение 12 часов после сбора стула образцы были проверены на C. difficile с использованием NAAT, разработанного для обнаружения высококонсервативной области C.difficile tcdA . Обнаружение tcdA считалось положительным для ИКД, в то время как отсутствие обнаружения tcdA считалось отрицательным для ИКД, что отражало клиническую практику в больнице старшего автора. Положительный или отрицательный результат NAAT послужил основой для формирования группы CDI и контрольной группы. Коллега в лаборатории клинической микробиологии нашего учреждения, который курировал все исследования образцов стула в стационаре на ИКД, ежедневно связывался с членами нашей команды относительно положительных и отрицательных образцов.Эти образцы, ожидающие возврата в лабораторию клинической микробиологии, будут храниться в морозильной камере -80 ° C. Член нашей команды при первой возможности попытался бы дать пациенту согласие на использование образца стула в этом исследовании, а также получить согласие на доступ к его электронной медицинской карте. После получения согласия образец кала перемещали непосредственно из морозильной камеры -80 ° C в лаборатории клинической микробиологии в морозильную камеру -80 ° C в исследовательской лаборатории старшего автора исследования. Эти образцы хранились до тех пор, пока все образцы для исследования не были собраны, что произошло в ноябре 2014 г., с использованием этого подхода, чтобы образцы можно было разморозить и обработать для секвенирования в течение одного периода.Каждую когорту составили двенадцать пациентов; Кроме того, один пациент предоставил образец стула с положительным результатом C. difficile , и после успешного лечения с помощью подтверждающего отрицательного теста NAAT, стул этого пациента был снова собран после терапии ИКД для анализа после лечения. Всего в каждой из двух когорт было по 13 выборок.
Критерии включения для обеих когорт включали пациентов в возрасте 18 лет и старше, которые отправили образец диарейного стула для тестирования ИКД в рамках обычного клинического ухода за каждым пациентом.Критерии исключения включали возраст моложе 18 лет, беременность, неспособность дать информированное согласие или введение антибиотиков, направленных на difficile, до взятия образца стула. Исследовательская группа ежедневно уведомлялась о пробах-кандидатах, что позволяло своевременно получать информированное согласие потенциальных субъектов исследования. После получения согласия образцы стула были немедленно получены из лаборатории микробиологии и хранились в лаборатории главного исследователя (DBS) при -70 ° C для использования в настоящем исследовании.
ПЦР-амплификация
ДНК
экстрагировали приблизительно из 0,25 г фекального материала с использованием набора для экстракции ДНК MoBio Powerfecal TM DNA Extraction Kit в соответствии с инструкциями производителя (MoBio, Карлсбад, Пенсильвания, США). ПЦР-реакции Illumina iTag (25 мкл) содержали ~ 5-10 нг матричной ДНК и конечную концентрацию 1x буфера для ПЦР, 0,8 мМ dNTP, 0,625 U Taq-полимеразы, 0,2 мкМ прямого праймера 515F и 0,2 мкМ праймера с обратным штрих-кодом illumina 806R, на реакция. ПЦР проводили на термоциклере MJ Research PTC-200 (Bio-Rad, Hercules, CA, США).Объединенные продукты ПЦР очищали в геле с использованием набора Qiagen Gel Purification Kit (Qiagen, Frederick, MD, USA) и количественно определяли с помощью флуорометра Qubit 2.0 (Life Technologies, Carlsbad, CA, USA). Перед отправкой на секвенирование качество библиотек проверяли с помощью чипа 2100 Bioanalyzer DNA 1000 (Agilent Technologies, Санта-Клара, Калифорния, США).
Секвенирование
Размер пулов библиотеки
проверяли с помощью Fragment Analyzer CE (Advanced Analytical Technologies Inc., Ames IA, USA) и количественно оценивали с использованием набора высокочувствительной дцДНК Qubit (Life Technologies, Carlsbad, CA, USA).После разведения до конечной концентрации 1 нМ, содержащей 10% контроль библиотеки PhiX V3 (Illumina, Сан-Диего, Калифорния, США), пулы библиотек денатурировали в течение 5 минут в равном объеме 0,1 н. NaOH, затем разбавляли до 12 пМ. в буфере HT1 (Illumina) и были секвенированы с использованием кассеты набора циклов Illumina MiSeq V2 300 с праймерами для секвенирования библиотеки 16S рРНК, установленными на 150 оснований, считывания парных концов.
Фильтрация качества / Отбор OTU
Считанные последовательности были обрезаны до длины 150 пар оснований и были отфильтрованы по качеству с ожидаемой ошибкой менее 0.5% с использованием USEARCH v7 (Эдгар, 2013). После качественной фильтрации чтения были проанализированы с помощью QIIME 1.9.0 (Caporaso et al., 2010, 2011). Химерные последовательности были идентифицированы с помощью USEARCH61 (Edgar, 2010). Всего после качественной фильтрации и проверки химер было извлечено 1 372 573 последовательности. Открытые эталонные OTU были выбраны с использованием алгоритма USEARCH7 (Edgar, 2010), а присвоение таксономии было выполнено с использованием базы данных генов 16S рРНК Greengenes (выпуск 13-5, 97%; DeSantis et al., 2006). Кластерные таксоны были собраны в таблицу OTU.Нерарифицированная таблица OTU прошла нормализацию CSS для анализа бета-разнообразия.
Подготовка библиотеки ITS и биоинформатический анализ грибковых элементов
Анализ грибкового сообщества
ITS был выполнен с использованием праймеров ITS1-F и штрих-кодов ITS2, как описано в Bellemain et al. (2010). Illumina iTag (ПЦР выполняли в общем объеме 25 мкл для каждого образца и содержали конечные концентрации буфера для 1X ПЦР, 0,8 мМ dNTP, 0,625 ед. Taq, 0,2 мкМ ITS1-F прямого праймера, 0,2 мкМ праймера ITS2 с обратным штрих-кодом и ∼10 нг матричной ДНК на реакцию.ПЦР проводили на термоциклере MJ Research PTC-200, и продукты ПЦР объединяли и очищали, как описано для библиотек генов 16S рРНК. OTU были отобраны de novo с использованием алгоритма UPARSE с отбрасыванием одноэлементных чтений, как рекомендовано Эдгаром (2013). OTU в наборе данных сравнивали с базой данных грибов ITS UNITE с помощью BLAST.
Анализ микробного сообщества
Графики анализа
основных координат и тесты ANOSIM на значимость были рассчитаны с использованием взвешенной матрицы расстояний UniFrac, созданной на основе нормализованной таблицы OTU CSS в Qiime 1.9.0. Непараметрический тест Краскела-Уоллиса на значимость использовался для идентификации обогащенных таксонов у контрольных пациентов и пациентов с ИКД. Различия считались значимыми при альфа 0,01. Графики относительной численности были построены из нормализованной таблицы OTU по CSS (Paulson et al., 2013). LEfSe также использовался для идентификации таксономических биомаркеров между контрольными пациентами и пациентами с ИКД (Segata et al., 2011). Относительная численность на уровне рода была умножена на один миллион и была отформатирована, как описано в Segata et al.(2011). Сравнения проводились с «Статусом» (контроль или CDI) в качестве главной категориальной переменной. Для тестов Краскела – Уоллиса использовались альфа-уровни 0,10, и были нанесены результаты линейного дискриминантного анализа для обогащенных таксонов внутри каждого класса. Характеристики были нанесены на график в логарифмической шкале в соответствии с экспериментальной группой, с которой они были существенно связаны. LEfse явно требует, чтобы все парные сравнения отвергали нулевую гипотезу для обнаружения таксонов биомаркеров; таким образом, не потребовалось никаких множественных исправлений тестирования (Segata et al., 2011). Индексы альфа-разнообразия, включая Chao1, равномерность Хейпа, наблюдаемые виды и PD Whole Tree, были сгенерированы из нерарифицированной таблицы OTU с максимальной глубиной выборки 1900, размером шага 190 и с 25 итерациями на каждом шаге. Анализы основного микробиома проводились на нерарифицированном столе OTU в qiime-1.9.0. Сетевые графики были созданы в Cytoscape 3.2.0 из отфильтрованной таблицы OTU, разреженной на глубине секвенирования 3218 в Qiime1.9.0. Только OTU, идентифицированные на уровне вида, были оставлены для сетевого анализа, все оставшиеся таксоны были отфильтрованы в Qiime.Для визуализации данных использовался стиль Cytoscape Biopax.
Сеть совместной встречаемости была создана в рамках плагина Cytoscape Conet из нераспределенной таблицы OTU, содержащей данные о численности бактерий от двенадцати пациентов с ИКД (Faust et al., 2012). Все таксоны, не относящиеся к таксономическому ранжированию королевства, были отброшены. Были рассчитаны корреляции Спирмена между численностью таксонов, и в сеть были включены только сильные корреляции (коэффициент Спирмена> ± 0,8). Минимальное количество OTU было установлено на 10, отбрасывая все OTU, которые не наблюдались 10 раз в каждой выборке.
Расчет объема выборки
Несмотря на то, что предыдущих публикаций, которые могли бы помочь в оценке размера выборки для исследования, сфокусированного на стационарных пациентах с диареей, относительно мало, предполагая, что количество ОТЕ составляет 1000 единиц при мощности 0,8, для 10 субъектов на когорту потребуется минимальное изменение численности В 2,5 раза по значимости. Настоящее исследование превосходит это требование.
Результаты
Описание исследуемой популяции
В этом исследовании использовались образцы стула двенадцати пациентов с ИКД и двенадцати пациентов без ИКД.В таблице 1 представлены клинические характеристики этих пациентов. У всех пациентов, включенных в это исследование, был диарейный стул, и две когорты не продемонстрировали значительных различий с точки зрения выбранных клинических характеристик. Не было различий в факторах риска ИКД или других причин диареи, выявленных между когортами.
ТАБЛИЦА 1. Характеристики пациента.
Оценка альфа- и бета-разнообразия бактериальной микробиоты
При сравнении наблюдаемой насыщенности и равномерности у контрольных субъектов и пациентов с ИКД, двухвыборочные непараметрические тесты t не продемонстрировали существенной разницы между двумя группами (насыщенность: P = 0.224; ровность: P = 0,760). Бета-разнообразие, однако, выявило различия в структуре бактериального сообщества между контрольной и CDI когортами, что продемонстрировано четкой кластеризацией, наблюдаемой между двумя когортами на PCoA (Рисунок 1). Анализ сходства подтвердил, что эта кластеризация была значительной ( P = 0,004), хотя эти различия в структурах бактериальных сообществ существенно не менялись ни в зависимости от возраста ( P = 0,644), ни пола ( P = 0.603).
РИСУНОК 1. Анализ главных координат в образцах кала без ИКД и ИКД. Взвешенные матрицы расстояний UniFrac были сгенерированы из отфильтрованной таблицы OTU, которая подверглась нормализации CSS. Контрольные образцы ( n = 13) отображаются синим цветом, а образцы CDI — красным ( n = 13). Между бактериальными сообществами этих двух групп можно наблюдать отчетливую кластеризацию. Образцы S1 (без антибиотиков) и S1A (антибиотики) представляют собой образцы фекалий одного и того же контрольного человека.Образцы CD3 (без антибиотиков) и CD3A (антибиотики) представляют собой образцы фекалий одного и того же человека с ИКД.
В
образцах фекалий из обеих когорт преобладали семейства Lachnospiraceae , Bacteroidaceae и Ruminococcaceae (Рисунок 2). Непараметрические тесты Краскела-Уоллиса выявили определенные таксоны, которые были обогащены в любой из когорт. Интересно, что три разных OTU из Peptostreptococcaceae близко (> 97%) совпадают с C.difficile , штамм 630 были значительно обогащены ( P <0,005) образцами фекалий ИКД. Кроме того, два OTU, Akkermansia muciniphila и неизвестный Enterobacteriaceae , также были более многочисленны у лиц с ИКД. Множество таксонов было значительно обогащено в контрольной когорте, включая представителей групп Bacteroidales и Clostridales .
РИСУНОК 2. Относительная численность семейств бактерий у индивидуумов с ИКД и без ИКД. Относительная численность 10 самых распространенных семейств бактерий для CDI ( n = 13) и контрольных ( n = 13) образцов фекалий. Относительную численность таксонов определяли на основе относительной численности последовательностей гена 16S рРНК, отнесенных к данному семейству бактерий, с использованием базы данных Greengenes.
Среди индивидуумов с ИКД было меньше ОТЕ по сравнению с контрольными пациентами, что позволяет предположить, что у нескольких членов основного микробиома отсутствует ИКД, а дальнейший анализ распространенности и численности конкретных семейств бактерий в когортах исследования показал, что Enterobacteriaceae и Peptostreptococcaceae были более распространены у индивидуумов с ИКД по сравнению с индивидуумами без ИКД (рис. 3).Напротив, Bacteroidales семейство S24-7 было обогащено индивидуумами без ИКД. На рисунке 4 представлена диаграмма Венна, демонстрирующая отдельные и общие OTU между состояниями CDI и не-CDI.
РИСУНОК 3. Распространенность определенных семейств бактерий в когортах с ИКД и без ИКД. График Ciros отображает относительную численность бактериальных отрядов в контрольных образцах и образцах CDI. Графики были созданы из нормализованной таблицы OTU CSS со всеми удаленными синглетонами.Численность каждого отряда прямо пропорциональна ширине каждой ленты, соединяющей таксоны бактерий с соответствующим образцом. Каждому семейству бактерий присвоен определенный цвет. Внешнее кольцо представляет совокупный процент последовательностей 16S, отнесенных к данному семейству из каждого образца, в то время как внутренний круг представляет собой количество последовательностей 16S рРНК, отнесенных к данным таксонам в данном образце.
РИСУНОК 4. Диаграмма Венна, демонстрирующая отдельные и общие OTU между состояниями без CDI и CDI.
Результаты сообщества грибов
Из девяти OTU, которые оказались значительно обогащенными в инфицированной когорте, восемь уникальных OTU были сопоставлены с неизвестными таксонами грибов, обозначенными как «некультивируемые грибы», причем эти данные предполагают, что определенное грибковое сообщество неизвестного в настоящее время филогенетического происхождения составляло значительную часть грибковое сообщество пациентов с ИКД. Единственные обогащенные таксоны в когорте CDI, которые были успешно картированы в базе данных грибов, принадлежали к роду Penicillium .Таким образом, небольшое количество часто обнаруживаемых видов было обнаружено у субъектов без ИКД, в то время как большее количество редких таксонов было распространено в группе ИКД.
Структура сообщества и анализ совпадений
Сеть совместной встречаемости (рис. 5) выявила сильные корреляции между бактериальными таксонами (сообществами) в фекальном микробиоме пациентов с ИКД. Представляющие интерес таксоны в инфицированной когорте включали неклассифицированные Peptostreptococcaceae , которые соответствовали C.difficile , штамм 630 при поиске BLAST (100% запрос) , Enterococcus и неклассифицированный Clostridiales . Взаимодействие с Peptostreptococcaceae выявило сильные отрицательные корреляции с тремя различными OTU Bacteroides , включая OTU, совпадающую с Bacteroides fragilis . Enterococcus также отрицательно коррелировал с теми же штаммами Bacteroides , а также Wolbachia, Methylophilaceae и Methylobacterium adhaesivum . Clostridiales OTU имели сильную положительную корреляцию с Parabacteroides, Bacteroides и Lachnospiraceae .
РИСУНОК 5. Сетевой график совместной встречаемости таксонов бактерий в фекальном микробиоме пациентов с ИКД. Сетевой график совместной встречаемости, созданный с помощью плагина Cytoscape Conet , выявляет сильные положительные (ро Спирмена> 0,8) и сильные отрицательные (ро Спирмена <-0,8) корреляции между ОТЕ, идентифицированными в 13 образцах стула CDI.Показаны восемнадцать уникальных OTU (обозначенных прямоугольными узлами), обладающих сильной корреляцией друг с другом. Последовательность 16S рРНК узла Peptostreptococcaceae , выделенная красным цветом, соответствует штамму 630 Clostridium difficile (охват запроса = 100%) при поиске BLAST. Дополнительные потенциальные патогенные ОТЕ показаны оранжевым цветом, включая Enterococcus и неклассифицированный Clostridiales . Края, соединяющие узлы, выделенные зеленым цветом, указывают на сильную положительную корреляцию, тогда как края, выделенные красным, указывают на сильную отрицательную корреляцию.
Влияние антибиотика на структуру сообщества
Один пациент из когорты CDI успешно прошел 10-дневное лечение антибиотиками (метронидазолом). Второй образец стула был собран через 12 дней после завершения антибактериальной терапии ИКД, и на основании тестирования амплификации нуклеиновой кислоты для tcdA был подтвержден отрицательный результат на C. difficile . Сообщество микробов после успешного лечения ИКД продемонстрировало сдвиг в сторону тех же структур микробного сообщества, которые характерны для когорты без ИКД.Наибольшие наблюдаемые сдвиги были четырехкратным увеличением неклассифицированного Acetobacteraceae в ответ на лечение антибиотиками и четырехкратным снижением Myxococcales OM27 в ответ на лечение.
Всего у 6 из 11 наиболее распространенных родов у этого пролеченного субъекта наблюдали двукратный сдвиг в ответ на лечение антибиотиками. Наиболее резкое увеличение (> 10%) в этой группе из 11 таксонов наблюдалось в пределах Bacteroidales S24-7 и Clostridiales .У Ruminococcaceae и Lachnospiraceae наблюдалось наибольшее снижение (> 7%) в ответ на антибиотики.
Обсуждение
Результаты этого исследования можно резюмировать следующим образом. В отличие от нескольких предыдущих публикаций (Antharam et al., 2013), в нашей популяции пациентов было обнаружено относительно большое количество бутирогенных бактерий (таких как Lachnospiraceae и Ruminococcaceae ) в как , так и не-CDI. когорты, хотя когорта без CDI была более изобилующей организмами.У пациентов с ИКД преобладали анаэробы семейства Peptostreptococcaceae , с относительным истощением анаэробов групп Bacteroidales и Clostridiales . Ранее не сообщалось об увеличении количества Akkermansia muciniphila у пациентов с ИКД, а также о росте нескольких неизвестных видов Enterobacteriaceae . Грибковые OTU ранее не регистрировались в популяции CDI, и это исследование идентифицировало грибковые элементы из рода Penicillium как преобладающую особенность CDI.Среди пациентов с ИКД наиболее часто встречались сети микробных сообществ: Peptostreptococcaceae и Enterococcus , за исключением Bacteroides . Наконец, после успешного лечения пациента с ИКД сравнение микробных сообществ до и после лечения показывает сдвиг в сторону увеличения численности Bacteroides и бутирогенных бактерий, аналогично микробным сообществам, встречающимся у пациентов без ИКД, что дает причинное описание для изменения микробиоты, связанные с успешным лечением антибиотиками ИКД.
Из этого исследования можно сделать несколько интересных наблюдений. Одно важное отражение в обзоре таблицы 1 показывает равное распределение часто цитируемых клинических факторов риска ИКД (Thibault et al., 1991; Bignardi, 1998; Hegarty et al., 2014; Regnault et al., 2014) между обоими инфицированные и неинфицированные когорты. В этом исследовании среди пациентов с диареей использование и тип антибиотика, использование ингибиторов протонной помпы, предыдущий диагноз ИКД, диагностика воспалительного заболевания кишечника и продолжительность пребывания существенно не различались между пациентами с ИКД и пациентами без ИКД с диареей. .Хотя эти клинические переменные являются ассоциированными факторами риска ИКД, их дискриминирующая сила для стационарных пациентов может быть ограничена, учитывая большое количество пациентов с диареей с ИКД и без них, которые разделяют эти факторы. Это наблюдение может указывать на то, что диарея среди стационарных пациентов, вероятно, должна отражать тестирование ИКД, поскольку любая попытка стратифицировать риск ИКД пациента на основе клинических факторов не обладает специфичностью, чтобы надежно обойтись без анализа кала.
Практически не проводилось исследований по изучению изменений микробиоты грибов у пациентов с диареей, с ИКД или без нее.Настоящее исследование продемонстрировало, что у пациентов с ИКД выделялись ОТЕ, связанные с родом Penicillium . Этот грибок связан с диареей у пациентов с ослабленным иммунитетом (Leung et al., 1996). Исследования, оценивающие влияние антибиотиков на микробиом кишечника хомячка, например, в условиях применения клиндамицина, используемого для индукции ИКД, показали, что преобладающим грибковым элементом был Penicillium (Peterfreund et al., 2012). Настоящее исследование является первым, описывающим такую же ассоциацию у людей, и род Penicillium может быть потенциальным биомаркером инфекции ИКД у людей с диарейными заболеваниями.Интересно, что Penicillium полезен в микробиологии окружающей среды из-за его полезности в биоремедиации, поскольку он производит ферменты, которые разлагают ряд ксенобиотических соединений, каждый из которых может предотвратить колонизацию и выживание бактерий (Leitao, 2009). Этот эффект Penicillium на окружающие бактерии может представлять собой причинный механизм, с помощью которого этот гриб может, в сочетании с нарушениями нормальной микробиоты, способствовать дальнейшему развитию дисбактериоза кишечника, а также сопротивляться сдвигам в сторону здоровой экологии кишечника.
Преобладание Akkermansia muciniphila у пациентов с ИКД является новым наблюдением у людей. Мышиные модели отметили, что изменения нормальной толщины и состава слизи толстой кишки, особенно в правой толстой кишке, влияют на колонизацию толстой кишки нормальной микробиотой (Семенюк и др., 2015). Нормальный слой слизи необходим для создания и сохранения непатогенных кишечных сообществ, соизмеримых с нормальным здоровьем. A. muciniphila является хорошо известным деградатором муцина, который может обеспечить селективное преимущество для C. difficile в создании преобладающей популяции в кишечнике (Derrien et al., 2004, 2008; van Passel et al., 2011). Недавно сообщалось, что C. difficile сам по себе может снижать выработку муцина, а также изменять состав слизи, чтобы дать дополнительное преимущество C. difficile в прилипании к измененной слизи по сравнению с другими полезными организмами (Engevik и другие., 2015). Совместное появление A. muciniphila у пациентов с ИКД может быть результатом начальных сдвигов в сторону болезненного состояния ИКД с увеличением количества патогенных бактерий, таких как A. muciniphila , что приводит к укоренению патогенных сообществ кишечника за счет изменений в слизь толстой кишки. Это может быть одной из нескольких возможных причин того, что инфекция C. difficile настолько устойчива к лечению из-за одновременного появления других бактерий, которые не чувствительны к антибиотикам, направленным на difficile , и которые способствуют созданию среды кишечника с барьерами для возвращение к здоровой экологии.
Сильная отрицательная корреляция между C. difficile и Bacteroides в этом исследовании представляет интерес, поскольку Bacteroides являются многочисленными и мутуалистическими членами микробиома кишечника человека, участвуя в ключевых метаболических процессах, участвующих в нормальном здоровье кишечника. включая ферментацию углеводов и производство полисахаридов (Wexler, 2007). Одна из причин, по которой Bacteroides преуспевают в доминировании над микробиотой кишечника, связана с их способностью модулировать поверхностные полисахариды в попытке уклониться от иммунной системы хозяина (Wexler, 2007).Кроме того, было показано, что B. fragilis способствует росту лимфоидной ткани, ассоциированной с кишечником, путем выработки полисахаридов, которые могут активировать CD4 + Т-клетки, которые помогают направлять лимфоциты в места инфекции (Round and Mazmanian, 2009). Руссо и др. (2011) наблюдали аналогичную тенденцию в когорте младенцев, где низкое соотношение Firmicutes к Bacteroides и увеличение факультативных анаэробов были связаны с наблюдаемым увеличением колонизации на C.difficile . В этом исследовании была обнаружена сильная положительная корреляция с неклассифицированными Clostridiales . Наши данные предполагают, что C. difficile может фактически подавлять рост комменсальных бактерий, таких как Bacteroides , на основе моделирования сообщества в когорте CDI.
Анализ микробиоты индивидуума с положительной реакцией на ИКД после 10 дней антибиотикотерапии с метронидазолом, направленной на difficile , выявил избирательное обогащение Bacteroidales S24-7 в образце стула после приема антибиотика.Интересно, что бактерии этого порядка, как известно, продуцируют бутират, жирную кислоту с короткой цепью, которая, как было показано, способствует укреплению барьера толстой кишки при соответствующих концентрациях за счет увеличения выработки муцина, уменьшения проницаемости толстой кишки и, таким образом, снижения восприимчивости толстой кишки к инфекциям (Hatayama и др., 2007). В предыдущих исследованиях было описано, что относительное истощение бутирогенных бактерий играет ключевую роль в преобразовании кишечного микроокружения в такое, которое способствует прорастанию и росту C.difficile (Antharam et al., 2013; Zhang et al., 2015; Gu et al., 2016). Преобладание Bacteroidales может быть биомаркером, сигнализирующим о сдвиге в кишечной среде, который совпадает с искоренением инфекции C. difficile , и влияние бутирата на улучшение здоровья кишечника может быть одним из механизмов этого эффекта. Следует отметить, что наши данные об изменениях микробиоты у пациентов с ИКД после антибактериальной терапии очень ограничены текущим исследованием, в котором анализируется только один образец от одного пациента после успешной антибактериальной терапии ИКД.
Настоящее исследование ограничено тем, что проводится в одном медицинском центре. Кроме того, хотя количество наших субъектов превышает необходимый минимум, основанный на наших расчетах размера выборки, настоящее исследование включало меньшее количество субъектов из-за расходов на исследование этого типа. Поскольку текущая популяция исследования была ограничена стационарными пациентами, многие из участников исследования были назначены на антибиотики по разным причинам, и использование антибиотиков может значительно повлиять на состав микробиоты кишечника.Текущая исследуемая популяция, как описано в таблице 1, не выявила статистически значимых различий ни по одному из показателей, перечисленных в этой таблице, включая частоту использования антибиотиков, а также тип применяемого антибиотика. Стремясь получить однородные когорты, мы ограничили наше исследование пациентами с диареей, и, как видно из таблицы 1, эти группы пациентов были довольно схожими с точки зрения демографии, хронических состояний здоровья и факторов риска ИКД. Во-вторых, это не первое исследование, описывающее изменения в OTU на основе секвенирования 16S рРНК.В нашем исследовании была предпринята попытка выйти за рамки этого, включив информацию о грибковых элементах и сосредоточив внимание на том, как сообщества бактериальной и грибковой микробиоты различаются при диарейных состояниях CDI и без CDI. Это, в сочетании с нашим вниманием к стационарным пациентам с диареей, обеспечивает не только новизну, но и исследование, которое обращается к пациентам, которые наиболее часто проходят тестирование CDI.
Заключение
Инфекция Clostridium difficile связана с воспроизводимыми и последовательными изменениями в микробиоме, включая рост патогенных анаэробных организмов ( Peptostreptococcaceae и Enterococcus ), бактерий, разлагающих муцин ( A.muciniphila ) и преобладающий грибной элемент ( Penicillium ). Эти микробы могут оказывать синергетический эффект, обеспечивая C. difficile селективное преимущество за счет создания множественных барьеров на пути обращения кишечного дисбиоза, связанного с болезненным состоянием ИКД. Эти кишечные таксоны вносят вклад в дисбактериоз кишечника, связанный с инфекцией C. difficile .
Взносы авторов
Гарант статьи: DS Концепция и дизайн исследования: WS, RL, JH и DS.Сбор и анализ данных: WS, JH, RL и DS. Интерпретация данных: все авторы. Составление рукописи: WS, RL и DS. Критический пересмотр рукописи на предмет важного интеллектуального содержания: все авторы. Научное руководство: RL и DS.
Финансирование
DS получил финансирование для этого исследования из Барсумского трастового гранта и из гранта CTSI.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Сокращения
ANOSIM, анализ сходства; BLAST, базовый инструмент поиска локального выравнивания; CDI, инфекция, вызванная Clostridium difficile, ; CSS, масштабирование кумулятивной суммы; LEfSe, размер эффекта линейного дискриминантного анализа; NAAT, тест амплификации нуклеиновых кислот; OTU, операционные таксономические единицы; PCoA, анализ главных координат; ПЦР, полимеразные цепные реакции; tcdA , ген токсина А.
Список литературы
Антарам, В. К., Ли, Э. К., Измаил, А., Шарма А., Май В., Рэнд К. Х. и др. (2013). Дисбактериоз кишечника и истощение запасов бутирогенных бактерий при инфекции Clostridium difficile и нозокомиальной диарее. J. Clin. Microbiol. 51, 2884–2892. DOI: 10.1128 / JCM.00845-13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bellemain, E., Carlsen, T., Brochmann, C., Coissac, E., Taberlet, P., and Kauserud, H. (2010). ITS как штрих-код экологической ДНК для грибов: подход in silico выявляет потенциальные ошибки ПЦР. BMC Microbiol. 10: 189. DOI: 10.1186 / 1471-2180-10-189
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бигнарди, Г. Э. (1998). Факторы риска инфицирования Clostridium difficile . J. Hosp. Заразить. 40, 1–15. DOI: 10.1016 / S0195-6701 (98)
-6
CrossRef Полный текст | Google Scholar
Caporaso, J.G., Kuczynski, J., Stombaugh, J., Bittinger, K., Bushman, F.D., Costello, E.K., et al. (2010). QIIME позволяет анализировать высокопроизводительные данные секвенирования сообщества. Nat. Методы 7, 335–336. DOI: 10.1038 / nmeth.f.303
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Капорасо, Дж. Г., Лаубер, К. Л., Уолтерс, В. А., Берг-Лайонс, Д., Лозупоне, К. А., Тернбо, П. Дж. И др. (2011). Глобальные паттерны разнообразия 16S рРНК на глубине миллионов последовательностей на образец. Proc. Natl. Акад. Sci. США 108 (Приложение 1), 4516–4522. DOI: 10.1073 / pnas.1000080107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дерриен, М., Колладо, М. К., Бен-Амор, К., Салминен, С., и де Вос, В. М. (2008). Деградатор муцина Akkermansia muciniphila является частым жителем кишечного тракта человека. Прил. Environ. Microbiol. 74, 1646–1648. DOI: 10.1128 / AEM.01226-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дерриен, М., Воган, Э. Э., Плагге, К. М., и де Вос, В. М. (2004). Akkermansia muciniphila gen. nov., sp. nov., кишечная бактерия, разрушающая муцин человека. Внутр. J. Syst. Evol. Microbiol. 54 (Pt 5), 1469–1476. DOI: 10.1099 / ijs.0.02873-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ДеСантис, Т.З., Хугенхольц, П., Ларсен, Н., Рохас, М., Броди, Э.Л., Келлер, К. и др. (2006). Greengenes, проверенная химерами база данных генов 16S рРНК и рабочая среда, совместимая с ARB. Прил. Environ. Microbiol. 72, 5069–5072. DOI: 10.1128 / AEM.03006-05
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Энгевик, М.A., Yacyshyn, M. B., Engevik, K. A., Wang, J., Darien, B., Hassett, D. J., et al. (2015). Человек Clostridium difficile Инфекция: изменение образования и состава слизи. Am. J. Physiol. Гастроинтест. Liver Physiol. 308, G510 – G524. DOI: 10.1152 / ajpgi.00091.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фауст К., Сатирапонгсасути Дж. Ф., Изард Дж., Сегата Н., Геверс Д., Раес Дж. И др. (2012). Отношения микробного сосуществования в микробиоме человека. PLoS Comput. Биол. 8: e1002606. DOI: 10.1371 / journal.pcbi.1002606
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гу, С., Чен, Ю., Чжан, X., Лу, Х., Львов, Т., Шен, П. и др. (2016). Идентификация ключевых таксонов, которые способствуют кишечной колонизации Clostridium difficile у взрослого населения Китая. Microbes Infect. 18, 30–38. DOI: 10.1016 / j.micinf.2015.09.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хатаяма, Х., Ивашита, Дж., Куваджима, А., и Абэ, Т. (2007). Короткоцепочечная жирная кислота, бутират, стимулирует выработку муцина MUC2 в клеточной линии рака толстой кишки человека. LS174T. Biochem. Биофиз. Res. Commun. 356, 599–603. DOI: 10.1016 / j.bbrc.2007.03.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хегарти, Дж. П., Сангстер, В., Харрис, Л. Р. III, и Стюарт, Д. Б. (2014). Ингибиторы протонной помпы вызывают изменения в экспрессии генов колоноцитов, которые могут повлиять на инфекцию Clostridium difficile . Хирургия 156, 972–978. DOI: 10.1016 / j.surg.2014.06.074
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кенигскнехт, М. Дж., Териот, К. М., Бергин, И. Л., Шумахер, К. А., Шлосс, П. Д., Янг, В. Б. (2015). Динамика и становление инфекции Clostridium difficile в желудочно-кишечном тракте мышей. Заражение. Иммун. 83, 934–941. DOI: 10.1128 / IAI.02768-14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леунг, Р., Сунг, Дж. Й., Чоу, Дж., И Лай, К. К. (1996). Необычная причина повышения температуры тела и диареи у больного СПИДом. Penicillium marneffei Инфекция. Dig. Dis. Sci. 41, 1212–1215. DOI: 10.1007 / BF02088239
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Miezeiewski, M., Schnaufer, T., Muravsky, M., Wang, S., Caro-Aguilar, I., Secore, S., et al. (2015). Модель культивирования in vitro для изучения динамики микробиоты толстой кишки сирийских золотых хомяков и их восприимчивости к инфекции Clostridium difficile . ISME J. 9, 321–332. DOI: 10.1038 / ismej.2014.127
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Полсон, Дж. Н., Стайн, О. К., Браво, Х. К., и Поп, М. (2013). Анализ дифференциальной численности для обзоров микробных маркеров генов. Nat. Методы 10, 1200–1202. DOI: 10.1038 / nmeth.2658
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перес-Кобас, А. Э., Артачо, А., Отт, С. Дж., Мойя, А., Госальбес, М. Дж., И Латорре, А.(2014). Структурные и функциональные изменения микробиоты кишечника, связанные с инфекцией Clostridium difficile . Фронт. Microbiol. 5: 335. DOI: 10.3389 / fmicb.2014.00335
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Peterfreund, G. L., Vandivier, L. E., Sinha, R., Marozsan, A. J., Olson, W. C., Zhu, J., et al. (2012). Последовательность в микробиоме кишечника после терапии антибиотиками и антителами для Clostridium difficile . PLoS ONE 7: e46966.DOI: 10.1371 / journal.pone.0046966
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ри, М. К., О’Салливан, О., Шанахан, Ф., О’Тул, П. У., Стэнтон, К., Росс, Р. П. и др. (2012). Носительство Clostridium difficile у пожилых людей и связанные с ним изменения микробиоты кишечника. J. Clin. Microbiol. 50, 867–875. DOI: 10.1128 / JCM.05176-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ривз, А. Э., Териот, К.М., Бергин И. Л., Хаффнагл Г. Б., Шлосс П. Д. и Янг В. Б. (2011). Взаимодействие между динамикой микробиома и динамикой патогенов в мышиной модели инфекции Clostridium difficile на мышах. Кишечные микробы 2, 145–158. DOI: 10.4161 / gmic.2.3.16333
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Regnault, H., Bourrier, A., Lalande, V., Nion-Larmurier, I., Sokol, H., Seksik, P., et al. (2014). Распространенность и факторы риска инфекции Clostridium difficile у пациентов, госпитализированных по поводу обострения воспалительного заболевания кишечника: ретроспективная оценка. Dig. Liver Dis. 46, 1086–1092. DOI: 10.1016 / j.dld.2014.09.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Руссо, К., Левенес, Ф., Фукери, К., Дор, Дж., Коллиньон, А., и Лепаж, П. (2011). Колонизация Clostridium difficile в раннем детстве сопровождается изменением состава кишечной микробиоты. J. Clin. Microbiol. 49, 858–865. DOI: 10.1128 / JCM.01507-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Руссо, К., Пойлан, И., Де Понтуаль, Л., Махеро, А. С., Ле Монье, А., и Коллиньон, А. (2012). Носительство Clostridium difficile у здоровых младенцев в сообществе: потенциальный резервуар для патогенных штаммов. Clin. Заразить. Dis. 55, 1209–1215. DOI: 10.1093 / cid / cis637
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сегата, Н., Изард, Дж., Уолдрон, Л., Геверс, Д., Миропольский, Л., Гаррет, В. С. и др. (2011). Открытие и объяснение метагеномных биомаркеров. Genome Biol. 12: R60. DOI: 10.1186 / GB-2011-12-6-r60
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Семенюк Э. Г., Поройко В. А., Джонстон П. Ф., Джонс С. Э., Найт К. Л., Гердинг Д. Н. и др. (2015). Анализ бактериальных сообществ при инфицировании Clostridium difficile у мышей. Заражение. Иммун. 83, 4383–4391. DOI: 10.1128 / IAI.00145-15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скрабан, Ю., Дзероски, С., Зенко, Б., Монгус, Д., Гангл, С., и Рупник, М. (2013). Паттерны кишечной микробиоты, связанные с колонизацией различных риботипов Clostridium difficile . PLoS ONE 8: e58005. DOI: 10.1371 / journal.pone.0058005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Териот, К. М., Кенигскнехт, М. Дж., Карлсон, П. Э. младший, Хаттон, Г. Е., Нельсон, А. М., Ли, Б. и др. (2014). Вызванные антибиотиками изменения в кишечном микробиоме и метаболоме мышей повышают восприимчивость к инфекции, вызванной Clostridium difficile . Nat. Commun. 5: 3114. DOI: 10.1038 / ncomms4114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тибо А., Миллер М. А. и Гез К. (1991). Факторы риска развития диареи, ассоциированной с Clostridium difficile, во время больничной вспышки. Заражение. Control Hosp. Эпидемиол. 12, 345–348. DOI: 10.2307 / 30145209
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ван Пассель, М. В., Кант, Р., Zoetendal, E.G., Plugge, C.M., Derrien, M., Malfatti, S.A., et al. (2011). Геном Akkermansia muciniphila, специального разрушителя кишечного муцина, и его использование для изучения кишечных метагеномов. PLoS ONE 6: e16876. DOI: 10.1371 / journal.pone.0016876
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, Л., Донг, Д., Цзян, К., Ли, З., Ван, X., и Пэн, Ю. (2015). Понимание изменения микробиоты кишечника при инфекции Clostridium difficile и бессимптомной инфекции C.difficile колонизация. Анаэроб 34, 1–7. DOI: 10.1016 / j.anaerobe.2015.03.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кокцидиоз, самая частая причина диареи у молодых коз
Кокцидиоз вызывается микроскопическими простейшими паразитами, называемыми кокцидианами (Eimeria spp.). Кокцидии проходят сложный «жизненный цикл» в клетках кишечника коз.В процессе они производят большое количество яиц (технически называемых ооцистами), которые выводятся с фекалиями. В процессе роста и размножения эпителиальных клеток кишечника коз кокцидии могут разрушать многие клетки кишечника. Это может вызвать диарею и другие признаки заболевания кокцидиозом.
Кокцидиоз — наиболее частая причина диареи у коз в возрасте от 3 недель до 5 месяцев. Это особенно верно, когда коз содержится в неволе. Кокцидиоз обычно поражает молодых коз вскоре после отъема из-за стресса от внезапной разлуки с их матерью.
Почти все (или большинство) взрослых коз переносят кокцидии в кишечнике. Очень маленькие яйца или ооцисты, попавшие в фекалии взрослых коз, вылупляются в окружающей среде, и козы подхватывают инфекционные стадии кокцидий либо непосредственно из навоза, либо с зараженными кормами и водой. Когда кокцидии присутствуют в небольших количествах, они обычно не являются проблемой. Следовательно, количество кокцидий, которые проникают в кишечник, будет определять тяжесть инфекции. Существует много различных видов кокцидий, некоторые из которых не являются патогенными, а другие являются патогенами легкой, средней или высокой степени патогенности.Фекалии могут, например, содержать большое количество яиц непатогенных кокцидий или небольшое количество яиц более патогенных кокцидий. В целом, если у животных нет никаких клинических признаков (диарея и т. Д.), Инфекция, вероятно, не является значительной.
В присутствии соответствующей температуры, влажности и кислорода яйца кокцидий (ооцисты) попадают в «вылупление» фекалий (технически называемое споруляцией), становятся заразными через два или несколько дней и могут легко заражать корм и воду.При попадании в организм других коз эти инфекционные формы (спороцисты) проходят через желудок в кишечник. Затем спороцисты проникают в клетки кишечника и претерпевают несколько изменений. Больные, молодые козы и козы, находящиеся в стрессовом состоянии (отлучение от груди очень тяжело для детей) более восприимчивы, и в этих случаях кокцидии могут размножаться. Это повреждение, разрушение клеток, выстилающих кишечник, и повреждение тканей, которые вызывают признаки кокцидиоза.
Когда начинается вспышка кокцидиоза, только хорошая санитария и изоляция больных животных предотвратят его распространение по стаду.Яйца кокцидий устойчивы ко многим дезинфицирующим средствам и могут выжить в окружающей среде более года. Они могут оставаться в живых на пастбище, пока находятся во влажной и темной среде, но умрут, когда температура упадет ниже нуля. Козы, пережившие кокцидиоз, приобретают определенный иммунитет к будущим проблемам с кокцидиозом.
Признаки кокцидиоза делятся на две категории: субклинические и клинические.Субклинические случаи приводят к снижению потребления корма и прибавки веса, и их трудно обнаружить из-за отсутствия диареи. Клинические случаи могут варьироваться от некоторой потери аппетита и снижения прибавки в весе и небольшой кратковременной диареи до тяжелых случаев, включающих большое количество диареи, жидкие фекалии, содержащие слизь и кровь, постоянное напряжение при попытках отхождения кала, потеря веса, грубые волосы. шерсть, обезвоживание и в некоторых случаях смерть всего за 24 часа. Первичная патология, связанная с кокцидиозом, включает разрушение клеток кишечника.Рубцы и повреждение слизистой оболочки кишечника после лечения или выздоровления могут привести к тому, что козы навсегда останутся небрежными и низкорослыми, потому что их способность поглощать пищу нарушена.
Диагноз ставится на основании анамнеза / признаков, микроскопического исследования кала и патологоанатомического анализа. Присутствие яиц кокцидий в кале нормальных коз указывает на то, что козы инфицированы, но не обязательно больны. Яйца кокцидий (ооцисты) можно найти в фекалиях большинства коз, включая здоровых коз.
Надлежащие методы ведения хозяйства — лучшие меры профилактики кокцидиоза. Регулярное удаление навоза и ненужных кормов, отказ от кормления на земле, проектирование кормушек и систем водоснабжения, минимизирующих фекальное загрязнение, обеспечение чистого источника воды, регулярная очистка резервуаров для воды и кормушек, обеспечение отсутствия утечек из систем полива и достаточного количества солнечного света входы в здания являются примерами такой практики ведения хозяйства.Если козы зимой содержатся на твердых полах, важно поддерживать чистоту и сухость подстилки.
На фермах, где проблемы с кокцидиозом повторяются, рекомендуется проводить профилактическую обработку стада.
В зависимости от ситуации доступны несколько вариантов:
- Использование кормов, содержащих кокцидиостат:
- Корма, содержащие декоквинат (торговая марка Deccox ® ), имеются в продаже и одобрены FDA США для профилактики кокцидиоза у нелактирующих коз .
- Другой кокцидиостат, монензин (торговая марка Rumensin ® ), также одобрен FDA США в качестве корма для профилактики кокцидиоза у нелактирующих коз.
- Ласалоцид (торговая марка Bovatec®), другой кокцидиостат, имеет разрешение US FDA для овец , но не для коз .
- Обливание коз пероральной дозой раствора ампролиума (Corid ® — 9.6%). Этот препарат не одобрен FDA США для коз. В некоторых случаях рекомендуется лечить всех взрослых коз, годовиков и, особенно, детей, потому что дети очень восприимчивы к отлучению от груди.
- В качестве альтернативы можно добавить ампролиум (Corid ® ) в питьевую воду. Во время лечения важно ограничить водоснабжение коз и убедиться, что у них нет доступа к другим источникам воды. Имейте в виду, что добавление ампролиума (Corid ® ) в питьевую воду не гарантирует, что все животные получат соответствующую дозу ампролиума.
Когда козы заболевают с признаками кокцидиоза:
- Пропитать их орально ампролиумом (Corid ® — 9,6%) в течение 5 дней подряд. Это часто считается эффективным методом лечения. Это использование не по назначению, так как amprolium не маркирован для коз, и ветеринар должен назначить его использование.
- Сульфатные препараты (сульфадиметоксин-сульфаметазин), такие как Albon ® и Sulmet ® , наиболее эффективны на ранних стадиях острых инфекций, когда кокцидии быстро размножаются.Сульфамидные препараты не могут вылечить кокцидиоз, но их часто назначают инфицированным козам для предотвращения вторичных инфекций, таких как бактериальный энтерит. Это также использование вне маркировки, поскольку сульфадиметоксин и сульфаметазин не отмечены FDA США для коз, и ветеринар должен прописать их использование .
- Независимо от того, лечит ли коз профилактически от кокцидиоза или козы с клиническими признаками кокцидиоза, всегда сначала консультируйтесь со специалистом по ветеринарии (местным ветеринаром, кооперативным консультантом и т. Д.) для конкретных указаний о том, какой продукт и дозировку использовать, способ введения (кормовой или пероральный), время выхода мяса и молока и т. д.
- Дефицит витамина B1 (тиамина) может быть вызван слишком частым употреблением ампролиума (Corid ® ). Некоторые ветеринары советуют делать животным инъекции гидрохлорида тиамина при лечении коз ампролиумом.
- Всегда приобретайте и соблюдайте соответствующие сроки хранения мяса после любого использования лекарств вне маркировки.
- Кокцидии очень специфичны для хозяина. Поэтому виды кокцидий, поражающие коз, поражают только коз. Кокцидии, обнаруженные у птиц, крупного рогатого скота, собак и кроликов, НЕ заразят коз. Для некоторых кокцидий может иметь место перекрестная инфекция между овцами и козами.
- Практически каждая коза заражена в той или иной степени, но болезнь встречается только у некоторых животных. Образцы фекалий практически любой козы любого возраста, пола, породы и физиологической стадии могут содержать яйца кокцидий.
- БОЛЕЗНЬ ЯВЛЯЕТСЯ ПОЧТИ ВСЕГДА ПРОИСХОДИТ У ЮНЫХ ЖИВОТНЫХ. ДЕТИ В ВОЗРАСТЕ МЕНЕЕ 5 МЕСЯЦЕВ ОСОБЕННО УДОБНЫ. Дети рано заразятся из окружающей среды. У взрослых будет иммунитет к паразиту, который достаточно эффективен для предотвращения болезней, но не инфекций.
- Первичный признак кокцидиоза — диарея. Обратите внимание на признаки инфекции у находящихся в стрессовом состоянии животных.Счастливые, хорошо питающиеся дети, оставшиеся со своей матерью, могут не проявлять диареи, пока их не отлучат от груди. СТРЕСС ОТ ОТНОШЕНИЯ МОЖЕТ СНИЖАТЬ ИММУНИТЕТ, ДОСТАТОЧНЫЙ ДЛЯ КОКОКИДИИ ЗАРАБОТАТЬ ВЕРНУЮ РУКУ И ВЫЗВАТЬ ИНФЕКЦИЮ.
- Надлежащие методы ведения животноводства — лучшие меры профилактики кокцидиоза. К ним относятся такие меры, как удаление навоза, отказ от кормления с земли, недопущение того, чтобы козы прыгали в кормушки (настоящая проблема), регулярная чистка кормушек и резервуаров для воды и т. Д. Лекарства, используемые для лечения кокцидий, включают ампролиум (Corid ® ), декоквинат (Deccox ® ), моненсин (Rumensin ® ), лазалоцид (Bovatec ® ) и сульфадиметоксин (Albon ® ).
На момент написания данной статьи декоквинат и монензин были одобрены для использования у нелактирующих коз. Однако ампролиум, лазалоцид и сульфадиметоксин не были одобрены для коз. Перед использованием обязательно получите актуальную информацию о допусках и соответствующих отзывах после использования. Источник: Программа по незначительному употреблению наркотиков для животных, по состоянию на 28.10.09.
- JM Luginbuhl
Специалист-консультант (козы и кормовые системы)
Науки о сельскохозяйственных культурах и почвах
- Кевин Андерсон
Профессор, ветеринария и производственная медицина жвачных животных
Ветеринария
Дополнительную информацию можно найти на следующих веб-сайтах NC State Extension:
Дата публикации: сентябрь.29, 2015
N.C. Cooperative Extension запрещает дискриминацию и домогательства независимо от возраста, цвета кожи, инвалидности, семейного и семейного положения, гендерной идентичности, национального происхождения, политических убеждений, расы, религии, пола (включая беременность), сексуальной ориентации и статуса ветерана.
Эпидемия коронавируса COVID-19 имеет естественное происхождение — ScienceDaily
Новый коронавирус SARS-CoV-2, который появился в городе Ухань, Китай, в прошлом году и с тех пор вызвал крупномасштабную эпидемию COVID-19 и распространился на другие страны. чем 70 других стран является продуктом естественной эволюции, согласно результатам, опубликованным сегодня в журнале Nature Medicine .
Анализ общедоступных данных о последовательности генома SARS-CoV-2 и родственных вирусов не обнаружил доказательств того, что вирус был создан в лаборатории или сконструирован иным образом.
«Сравнивая доступные данные о последовательности генома для известных штаммов коронавируса, мы можем твердо определить, что SARS-CoV-2 возник в результате естественных процессов», — сказал Кристиан Андерсен, доктор философии, доцент кафедры иммунологии и микробиологии Scripps Research и соответствующий автор статьи о бумага.
Помимо Андерсена, авторы статьи «Ближайшее происхождение SARS-CoV-2» включают Роберта Ф.Гарри из Тулейнского университета; Эдвард Холмс из Сиднейского университета; Эндрю Рамбо из Эдинбургского университета; В. Ян Липкин из Колумбийского университета.
Коронавирусы — это большое семейство вирусов, которые могут вызывать заболевания различной степени тяжести. Первое известное серьезное заболевание, вызванное коронавирусом, возникло в результате эпидемии тяжелого острого респираторного синдрома (SARS) в Китае в 2003 году. Вторая вспышка тяжелого заболевания началась в 2012 году в Саудовской Аравии с ближневосточным респираторным синдромом (MERS).
31 декабря прошлого года власти Китая уведомили Всемирную организацию здравоохранения о вспышке нового штамма коронавируса, вызывающего тяжелое заболевание, которое впоследствии было названо SARS-CoV-2. По состоянию на 20 февраля 2020 года было зарегистрировано почти 167 500 случаев COVID-19, хотя гораздо больше легких случаев, вероятно, остались недиагностированными. Вирус убил более 6600 человек.
Вскоре после начала эпидемии китайские ученые секвенировали геном SARS-CoV-2 и предоставили данные исследователям по всему миру.Полученные данные о геномной последовательности показали, что китайские власти быстро обнаружили эпидемию и что количество случаев COVID-19 увеличивается из-за передачи от человека человеку после однократного внедрения в человеческую популяцию. Андерсен и его сотрудники из нескольких других исследовательских институтов использовали эти данные секвенирования для изучения происхождения и эволюции SARS-CoV-2, сосредоточив внимание на нескольких характерных особенностях вируса.
Ученые проанализировали генетический шаблон для белков-шипов, каркасов на внешней стороне вируса, которые он использует для захвата и проникновения через внешние стенки клеток человека и животных.В частности, они сосредоточились на двух важных характеристиках белка-шипа: рецептор-связывающий домен (RBD), своего рода крюк для захвата, который цепляется за клетки-хозяева, и сайт расщепления, молекулярный консервный нож, который позволяет вирусу взламывать и входят в клетки-хозяева.
Свидетельства естественной эволюции
Ученые обнаружили, что RBD-часть шиповых белков SARS-CoV-2 эволюционировала, чтобы эффективно воздействовать на молекулярную особенность снаружи человеческих клеток, называемую ACE2, рецептором, участвующим в регулировании кровяного давления.Спайк-белок SARS-CoV-2 был настолько эффективен в связывании человеческих клеток, что ученые пришли к выводу, что это результат естественного отбора, а не продукт генной инженерии.
Это свидетельство естественной эволюции было подтверждено данными об основной цепи SARS-CoV-2 — его общей молекулярной структуре. Если бы кто-то пытался создать новый коронавирус в качестве патогена, он бы сконструировал его из основы вируса, который, как известно, вызывает заболевание. Но ученые обнаружили, что основа SARS-CoV-2 существенно отличалась от таковой у уже известных коронавирусов и в основном напоминала родственные вирусы, обнаруженные у летучих мышей и ящеров.
«Эти две особенности вируса, мутации в RBD-части белка-шипа и его отдельный каркас, исключают лабораторные манипуляции как потенциальное происхождение SARS-CoV-2», — сказал Андерсен.
Джози Голдинг, доктор философии, руководитель отдела эпидемий в британском Wellcome Trust, заявила, что выводы Андерсена и его коллег «крайне важны для обоснованного взгляда на слухи о происхождении вируса, которые распространяются (SARS- CoV-2), вызывающий COVID-19.«
«Они пришли к выводу, что вирус — продукт естественной эволюции, — добавляет Гулдинг, — положив конец любым предположениям о преднамеренной генной инженерии».
Возможное происхождение вируса
Основываясь на анализе геномного секвенирования, Андерсен и его сотрудники пришли к выводу, что наиболее вероятное происхождение SARS-CoV-2 происходило по одному из двух возможных сценариев.
В одном сценарии вирус эволюционировал до своего текущего патогенного состояния в результате естественного отбора у нечеловеческого хозяина, а затем перешел на человека.Так возникали предыдущие вспышки коронавируса, когда люди заражались вирусом после прямого контакта с циветтами (SARS) и верблюдами (MERS). Исследователи предложили летучих мышей как наиболее вероятный резервуар для SARS-CoV-2, поскольку он очень похож на коронавирус летучих мышей. Однако нет задокументированных случаев прямой передачи от летучих мышей к человеку, что позволяет предположить, что между летучими мышами и людьми, вероятно, был промежуточный хозяин.
В этом сценарии обе отличительные особенности шипового белка SARS-CoV-2 — часть RBD, которая связывается с клетками, и сайт расщепления, открывающий вирус, — должны были развиться до своего текущего состояния до попадания в человека.В этом случае нынешняя эпидемия, вероятно, возникла бы быстро, как только люди были инфицированы, поскольку вирус уже развил бы особенности, которые делают его патогенным и способным распространяться между людьми.
Согласно другому предложенному сценарию, непатогенная версия вируса перешла от животного-хозяина к человеку, а затем эволюционировала до своего текущего патогенного состояния в человеческой популяции. Например, некоторые коронавирусы ящеров, броненосных млекопитающих, обитающих в Азии и Африке, имеют структуру RBD, очень похожую на структуру SARS-CoV-2.Коронавирус от панголина мог быть передан человеку напрямую или через промежуточного хозяина, такого как циветты или хорьки.
Тогда другой отчетливый спайковый белок, характерный для SARS-CoV-2, сайт расщепления, мог развиться в организме человека-хозяина, возможно, через ограниченную необнаруженную циркуляцию в человеческой популяции до начала эпидемии. Исследователи обнаружили, что сайт расщепления SARS-CoV-2 похож на сайты расщепления штаммов птичьего гриппа, которые, как было показано, легко передаются между людьми.SARS-CoV-2 мог развить такой опасный сайт расщепления в человеческих клетках и вскоре вызвать нынешнюю эпидемию, поскольку коронавирус, возможно, стал бы гораздо более способным распространяться между людьми.
Соавтор исследования Эндрю Рамбо предупредил, что на данном этапе трудно, если не невозможно, узнать, какой из сценариев наиболее вероятен. Если SARS-CoV-2 проник в людей в своей нынешней патогенной форме из животного источника, это повысит вероятность будущих вспышек, поскольку вызывающий болезнь штамм вируса все еще может циркулировать в популяции животных и может снова перейти в люди.Меньше шансов, что непатогенный коронавирус попадет в человеческую популяцию, а затем приобретет свойства, аналогичные SARS-CoV-2.
Финансирование исследования было предоставлено Национальными институтами здравоохранения США, благотворительным фондом Pew Charitable Trusts, Wellcome Trust, Европейским исследовательским советом и стипендиатом австралийских лауреатов ARC.
.


 При этом появляется сильная сухость во рту, уменьшается объем мочи, урина темнеет.
При этом появляется сильная сухость во рту, уменьшается объем мочи, урина темнеет. Малыш становится плаксивым, капризным, отказывается от еды.
Малыш становится плаксивым, капризным, отказывается от еды.