Лимфома — симптомы и признаки болезни
Содержание статьи:
Лимфома (lymphoma) – злокачественная опухоль клеток иммунитета.При ней лимфоциты увеличиваются до гигантских размеров, бесконтрольно делятся и поражают лимфатическую систему: лимфоузлы, костный мозг, вилочковую железу.
От других онкологических заболеваний лимфома отличается диссеминацией по всему организму: с током лимфы переродившиесязлокачественныеклетки попадают во внутренние органы и критически нарушают их работу. Болезнь долго течет бессимптомно, а когда начинает проявляться, то часто весь организм уже поражен.
Большинстволимфомхарактеризуетсяпрогрессирующим течением и высокой злокачественностью с метастазированием. Тем не менее при раннем их выявлении благоприятный прогноз достигает ~90%.
Статистические данные о лимфомах:
- Ежегодно в России выявляют около 25 000 пациентов с раком данного типа – это 4% от всех онкобольных.
- Мужчины болеют чаще, чем женщины.

- Возрастной пик заболеваемости – 30-34 года и после 60 лет.
- В группе риска – больные с артритом двух и более суставов.
- Провоцирующий фактор – дефицит селена в организме.
- Есть предположение, что окрашивание волос чаще 1 раза в месяц темной краской увеличивают риск развития лимфомы на 26%.
- Считается что витамин Д обладает защитными свойствами против лимфомы.
- Благодаря современным методикам и препаратам за последние 10 лет смертность от лимфом в России снизилась на 27%.
Виды лимфом
Различают две основные группы заболевания – лимфому Ходжкина и неходжкинские лимфомы. Они развиваются из разного типа клеток, отличаются характером течения и по-разному реагируют на терапию.
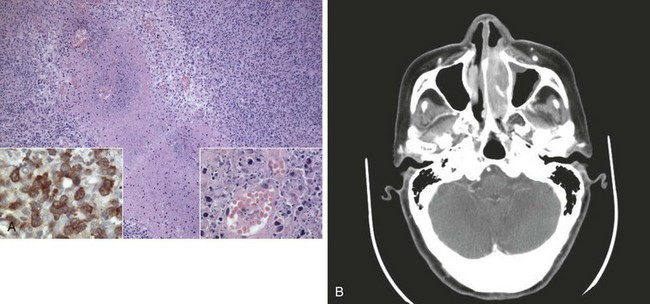
Лимфома Ходжкина (ЛГМ) – лимфогранулематоз, злокачественная гранулема.ХарактеризуетсяпоражениемВ-лимфоцитов. Отличается агрессивным течением, при этом хорошо поддается лечению. Источник:
И.И. Яковцова, В. Д. Садчиков, В.М. Садчикова, О.В. Долгая, С.В. Данилюк, А.Е. Олейник Лимфома Ходжкина: эволюция клинических классификаций // Вестник проблем биологии и медицины, 2013, №3, т.2 (103), с.62-69
Д. Садчиков, В.М. Садчикова, О.В. Долгая, С.В. Данилюк, А.Е. Олейник Лимфома Ходжкина: эволюция клинических классификаций // Вестник проблем биологии и медицины, 2013, №3, т.2 (103), с.62-69
Неходжкинские лимфомы (НХЛ)поражают не только В-, но и Т-лимфоциты. Всего выделено 30 подтипов.Большинство из них менее агрессивно, но и труднее лечится.
Классификация неходжкинских лимфом в соответствии с 4-й редакцией ВОЗ 2008 года:
- В-лимфобластная НХЛ;
- болезнь тяжелых цепей;
- В-клеточный пролимфоцитарный лейкоз;
- волосатоклеточный лейкоз;
- диффузная В-крупноклеточая НХЛ;
- лейкоз Беркитта;
- НХЛ из клеток мантийной зоны;
- лимфоплазмоцитарная НХЛ;
- медиастинальная диффузная В-крупноклеточая НХЛ;
- нодальная В-клеточная НХЛ маргинальной зоны;
- первичная экссудативная НХЛ;
- плазмоклеточная плазмоцитома/миелома;
- селезеночная НХЛ маргинальной зоны;
- фолликулярная НХЛ;
- хронический лимфолейкоз;
- экстранодальная В-клеточная НХЛ маргинальной зоны;
- Т-лимфобластная НХЛ;
- агрессивный NK-клеточный лейкоз;
- анапластическая крупноклеточная НХЛ с первичным поражением кожи;
- анапластическая крупноклеточная НХЛ с первичным системным поражением;
- ангиоиммунобластная Т-клеточная НХЛ;
- гепатолиенальная Т-клеточная НХЛ;
- грибовидный микоз Сезари;
- неуточненная периферическая Т-клеточная НХЛ;
- Т-клеточная панникулитоподобная НХЛ подкожной клетчатки;
- Т-клеточный лейкоз;
- Т-клеточный лейкоз из больших гранулярных лимфоцитов;
- Т-клеточный пролимфоцитарный лейкоз;
- экстранодальная NK/T-клеточная лимфома назального типа;
- энтеропатическая Т-клеточная НХЛ.

Самые распространенные в клинической практике лимфомы: Ходжкина, фолликулярная и диффузная В-крупноклеточная. Источник:
Г.С. Тумян Неходжкинские лимфомы // Клиническая онкогематология, 2015, 8(4), с.455-470
По характеру поражения и патогенезу все лимфомы делятся на 3 основные группы:
- агрессивные – для них характерно быстрое развитие с ярко выраженной симптоматикой;
- экстранодальные – первичное поражение формируется не в лимфатических узлах, а сразу во внутренних органах;
- индолентные – отличаются своим медленным и благоприятным течением; могут не требовать терапии, иногда достаточно регулярно наблюдаться у врача.
Для каждого вида лимфом существует особая схема лечения.
Стадии лимфом
В зависимости от распространенности опухоли определяют стадию патологического процесса. В соответствии с международной классификацией AnnArborвыделяют 4 стадии заболевания:
- На 1-й стадии в лимфомный процесс может быть вовлечена одна группа лимфатических узлов.

- На 2-й допускается вовлечение двух и более групп по одну сторону от диафрагмы.
- На 3-й стадии опускается поражение лимфатических узлов по обе стороны диафрагмы.
- На 4-й стадии в процесс вовлекаются внутренние органы – мозг, сердце, печень, селезенка, желудок, кишечник.
Каждую стадию дополнительно маркируют титрами А и Б. Титр А указывает на отсутствие ключевых симптомов – лихорадки, сильной ночной потливости и резкого снижения веса. Титр Б указывает, что такие проявления есть.
Причины возникновения лимфом
Единого причинного фактора развития заболевания не выделено. На данный момент ученые считают, что патпроцесс запускается комплексом причин. К ним относят:
- наследственную предрасположенность;
- регулярные контакты с токсинами и канцерогенами;
- вирус герпеса, гепатита, хеликобактер пилори и другие инфекционные заболевания;
- аутоиммунные и иммунодефицитные состояния;
- повторяющиеся пневмонии;
- иммуноподавляющую терапию после пересадки почек, стволовых леток и т.
 д.;
д.; - операции по вставке грудных имплантатов (предположительно).
Симптомы
Помимо основных симптомов – лихорадки, сильной ночной потливости и резкого снижения веса – для патологии характерны:
- слабость и повышенная утомляемость;
- повышение температуры;
- потеря веса;
- увеличение лимфатических узлов (часто, но не всегда; при этом они безболезненны и не уменьшаются в результате лечения антибиотиками, как при инфекционных заболеваниях).
Иногда возможен кожный зуд. При поражениях опухолью грудной клетки возможны затрудненное дыхание, одышка и кашель. При локализации новообразования в брюшной полости наблюдают расстройства пищеварения, тошноту, рвоту, распирающие боли в животе и нижней части спины. При поражении костного мозга больные жалуются на боли в костях.Если в патологию вовлечены лицевые и черепные структуры, есть жалобы на головные боли и распирающие боли в лице и шее.
Диагностика лимфом
Диагноз ставят по результатам микроскопического исследования биоптата – образца лимфоидной ткани. По результатам дифференциальной биопсии определяют тип опухоли.
По результатам дифференциальной биопсии определяют тип опухоли.
Чтобы выявить опухоли в разных частях тела, применяют методы лучевой диагностики: рентгенографию, сцинтиграфию, магниторезонансную, позитронно-эмиссионную и компьютерную томографию. При необходимости уточнить некоторые особенности патпроцесса назначают лабораторные анализы крови – иммуноферментотипирование методом проточной цитометрии, молекулярно-генетические и цитогенетические исследования. Источник:
Wang HW, Balakrishna JP, Pittaluga S, Jaffe ES Diagnosis of Hodgkin lymphoma in the modern era // Br J Haematol. 2019 Jan;184(1):45-59. doi: 10.1111/bjh.15614. Epub 2018 Nov 8
Методы лечения
Наиболее распространенные методы лечения лимфом:
- лучевая терапия;
- химиотерапия;
- радиотерапия;
- биологическая терапия;
- трансплантация стволовых клеток;
- хирургическое вмешательство.
Они применяются как в виде отдельных курсов, так и в комплексе. Выбор лечебной схемы зависит от вида опухоли и общего состояния больного.
Выбор лечебной схемы зависит от вида опухоли и общего состояния больного.
Лечебная тактика
Индолентные лимфомы могут не требовать лечения, а только наблюдения онкогематолога. Терапия показана при первых признакахпрогрессированияпатпроцесса. При локализованныхопухоляхдостаточнорадиотерапевтического облучения пораженных структур. При генерализованных формах показана химиотерапия.
При агрессивном течении заболевания одна из наиболее эффективных лечебных схем – химиотерапия по протоколу СНОР в сочетании с иммунотерапевтическимипрепаратами из группы моноклональных антител. При высокоагрессивных видах опухолей может быть назначена высокодозная химиотерапия в сочетании с трансплантацией кроветорных стволовых клеток.
Лечение отдельных типов лимфом
Основной метод лечения лимфомы Ходжкина ЛГМ– химиотерапия. Противоопухолевые цитотоксины назначают в разных лекарственных формах. Химиотерапия носит цикличный характер – медикаментозные курсы чередуются с периодами реабилитации. Источник:
Источник:
Sermer D, Pasqualucci L, Wendel HG, Melnick A, Younes A Emerging epigenetic-modulating therapies in lymphoma // Nat Rev Clin Oncol. 2019 Aug;16(8):494-507.doi: 10.1038/s41571-019-0190-8
Радиотерапия – излучение высокой мощности – в качестве самостоятельного лечения ЛГМ может быть оправдана в отдельных случаях – когда в процесс вовлечена одна, максимум две группы лимфатических узлов. Чаще ее назначают в комплексе с химиотерапией. На поздних стадиях заболевания метод показан в качестве паллиативного лечения.
Биологические препараты – моноклональные антитела – при лечении лимфомы применяют для активизации иммунной системы. Лучевую терапию проводят регионарно, в области вовлеченных в онкологический процесс лимфоузлов.
В некоторых случаях при лечении ЛГМ оправдано удаление селезенки. Если увеличенные лимфатические узлы сдавливают соседние органы,может быть показано их иссечение.
При рецидивах заболевания, а также с целью уничтожения раковых клеток, на которые не действуют стандартные дозировки лучевой и химиотерапии, назначают высокие терапевтические дозы, разрушающие вместе с опухолью ткани костного мозга. После такого курса показана трансплантация органа. Взятые заранее собственные либо донорские стволовые клетки формируют новую иммунную систему.
После такого курса показана трансплантация органа. Взятые заранее собственные либо донорские стволовые клетки формируют новую иммунную систему.
Хорошие результаты в лечении НХЛ демонстрирует также комбинация лучевой и химиотерапии. В некоторых случаях успешно применяют инновационную техникулюмбально-пункционного введения противоопухолевых антител.
НХЛ с агрессивным течением плохо поддаются лечению. Наиболее эффективный метод борьбы с этим заболеванием – пересадка костного мозга.
Прогнозы
Прогноз для пациентов с лимфомами зависит от стадии процесса, возраста и состояния больного, а также от результатов терапии. При лимфоме Ходжкина пациенты молодого возраста на ранних стадиях,как правило, полностью выздоравливают. У 8 из 10 удается добиться устойчивой ремиссии. Пятилетняя выживаемость при 1-й стадии составляет 95%, при 4-й – 65%.
При НХЛ селезенки, лимфоузлов и слизистых средняя пятилетняя выживаемость – порядка 70%. При НХЛ ЖКТ, слюнных желез, глазных орбит средняя пятилетняя выживаемость – около 60%. Менее благоприятный прогноз у агрессивных НХЛ молочных желез, яичников, ЦНС и костей – пятилетняя выживаемость в среднем меньше 30%.
Менее благоприятный прогноз у агрессивных НХЛ молочных желез, яичников, ЦНС и костей – пятилетняя выживаемость в среднем меньше 30%.
Клинические рекомендации после лечения лимфом и профилактика
Избегайте факторов риска – интоксикаций и контакта с канцерогенами. Вакцинируйтесь, а если заболели инфекционной болезнью – не занимайтесь самолечением.
При первых признаках лимфомы обращайтесь к врачу. Ежегодно проходите профилактические медосмотры, придерживайтесь правильного питания и старайтесь вести здоровый образ жизни.
Источники:
- И.И. Яковцова, В.Д. Садчиков, В.М. Садчикова, О.В. Долгая, С.В. Данилюк, А.Е. Олейник. Лимфома Ходжкина: эволюция клинических классификаций // Вестник проблем биологии и медицины, 2013, №3, т.2 (103), с.62-69.
- Г.С. Тумян. Неходжкинские лимфомы // Клиническая онкогематология, 2015, 8(4), с.455-470.
- Wang HW, Balakrishna JP, Pittaluga S, Jaffe E. Diagnosis of Hodgkin lymphoma in the modern era // Br J Haematol.
 2019 Jan;184(1):45-59. doi: 10.1111/bjh.15614. Epub 2018 Nov 8.
2019 Jan;184(1):45-59. doi: 10.1111/bjh.15614. Epub 2018 Nov 8. - Sermer D, Pasqualucci L, Wendel HG, Melnick A, Younes A. Emerging epigenetic-modulating therapies in lymphoma // Nat Rev Clin Oncol. 2019 Aug;16(8):494-507.doi: 10.1038/s41571-019-0190-8.
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
Читайте также
Диагностика экстранодальных поражений при лимфомах с помощью совмещенной пэт-кт Текст научной статьи по специальности «Клиническая медицина»
УДК: 616-006.4
диагностика экстранодальных поражений при лимфомах с помощью совмещенной пэт-кт
А.В. Важенин, н.г. Афанасьева, А.С. Субботин
ГБУЗ «Челябинский окружной клинический онкологический диспансер», г. Челябинск 454087, г. Челябинск, ул. Блюхера, 42, e-mail: [email protected]; [email protected]
Челябинск 454087, г. Челябинск, ул. Блюхера, 42, e-mail: [email protected]; [email protected]
Представлен опыт Центра позитронно-эмиссионной томографии Челябинского окружного клинического онкологического диспансера в диагностике экстранодальных поражений при лифмомах. ПЭТ-КТ исследование проведено 316 пациентам с лимфомами Ходжкина и неходжкинскими лимфомами, в 43,6 % случаев выявлены экстранодальные поражения. При их оценке учитывались стандартизованный уровень накопления (SUVmax), характер поражения (очаговое или диффузное) и наличие структурного субстрата, выявляемого с помощью КТ-компонента исследования (кроме очагов метаболической активности без четко визуализируемого морфологического субстрата).
Ключевые слова: лимфома, экстранодальная локализация, совмещенная ПЭТ-КТ, 18-F ФДГ
DETECTION OF EXTRANODAL INVOLVEMENT IN PATIENTS WITH LYMPHOMAS USING THE COMBINED PET-CT
A. V. Vazhenin, N.G. Afanasyeva, A.S. Subbotin Chelyabinsk Regional Clinical Oncology Center, Chelyabinsk 42, Blyukhera Street, 454000-Chelyabinsk, Russia, e-mail: [email protected]; [email protected]
V. Vazhenin, N.G. Afanasyeva, A.S. Subbotin Chelyabinsk Regional Clinical Oncology Center, Chelyabinsk 42, Blyukhera Street, 454000-Chelyabinsk, Russia, e-mail: [email protected]; [email protected]
The experience of the Center of Positron Emission Tomography of Chelyabinsk Regional Clinical Oncology Center in the diagnosis of extranodal involvement in patients with lymphomas has been presented. Three hundred and sixteen patients with Hodgkin’s and non-Hodgkin’s lymphomas underwent a PET-CT examination, which revealed extranodal involvement in 43.6% of cases. The standardized uptake value (SUVmax), nature of the lesion (focal or diffuse) and the presence of structural substrate detected on the CT component of the study (except metabolic activity foci without clearly visualized morphological substrate) were taken into account.
Key words: lymphoma, extranodal localization, combined 18-F-FDG-PET-CT.
Во всем мире отмечается тенденция к росту заболеваемости лимфомами [1, 19]. При этом частота встречаемости экстранодальных поражений в разных странах варьируется от 24 до 48 % [4, 14]. За последние два десятилетия отмечается увеличение доли экстранодальных лимфом в структуре заболеваемости лимфомами, превосходящее темпы роста заболеваемости лимфомами. Экстранодальные поражения встречаются чаще при агрессивных не-ходжкинских лимфомах [19].
Достижения медицинской науки позволяют считать лимфомы, в частности лимфому Ходжкина. злокачественными новообразованиями с высокой вероятностью получения благоприятного исхода. Для этого обязательным условием является точное стадирование и определение прогностической группы [2, 6, 11, 13]. Выбор оптимальной схемы химиотерапии невозможен без точной оценки объема опухолевой ткани, для назначения лучевой терапии необходимо определить локализацию очагов пора-
жения [3].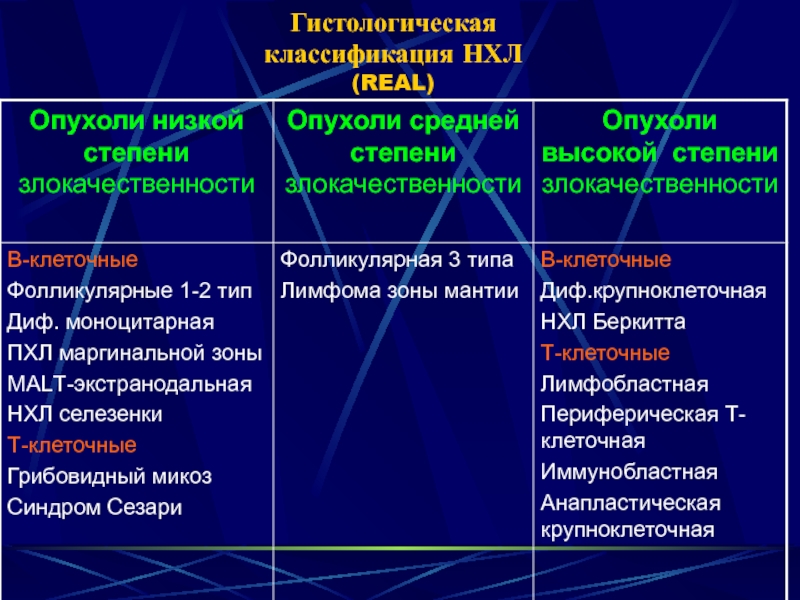 Традиционно это проводится с помощью конвенциональных методов исследования, определяющих структурные изменения (рентгенография, УЗИ, МСКТ, МРТ), диагностика при этом базируется на определении размеров очагов поражения и их денситометрических характеристиках [3, 5, 12, 16, 18]. В то же время реактивные изменения, некротические и фиброзные процессы могут ошибочно интерпретироваться как опухолевое поражение, а злокачественные процессы в структурно не измененных органах и тканях не приниматься во внимание [5, 12, 13, 17, 18].
Традиционно это проводится с помощью конвенциональных методов исследования, определяющих структурные изменения (рентгенография, УЗИ, МСКТ, МРТ), диагностика при этом базируется на определении размеров очагов поражения и их денситометрических характеристиках [3, 5, 12, 16, 18]. В то же время реактивные изменения, некротические и фиброзные процессы могут ошибочно интерпретироваться как опухолевое поражение, а злокачественные процессы в структурно не измененных органах и тканях не приниматься во внимание [5, 12, 13, 17, 18].
Применение функциональных методов диагностики, направленных на оценку метаболических процессов в тканях, позволяет оценивать наличие и объем жизнеспособной опухолевой ткани, что незаменимо как при первичном исследовании пациента, так и при оценке ответа на проведенное лечение [8-10, 15]. Реактивные воспалительные процессы, а также наличие фокусов метаболической актив-
диагностика экстранодальньх поражений при лимфомах с помощью совмещенной ПЭТ-КТ ————————————————————————————— 3?
ности в нормально функционирующих органах и тканях, таких как миокард, кишечник, бурый жир, могут имитировать злокачественное поражение или маскировать его. Кроме того, определение анатомической принадлежности очагов метаболической активности к тем или иным структурам представляет значительные затруднения при интерпретации полученных данных. Совмещение данных, полученных в процессе конвенциональных и функциональных методов исследования, потенцирует информативность этих методов, практически полностью нивелируя их недостатки [5, 14, 15].
Кроме того, определение анатомической принадлежности очагов метаболической активности к тем или иным структурам представляет значительные затруднения при интерпретации полученных данных. Совмещение данных, полученных в процессе конвенциональных и функциональных методов исследования, потенцирует информативность этих методов, практически полностью нивелируя их недостатки [5, 14, 15].
К данным методам относится поэитронно-эмиссионная томография, совмещенная с компьютерной томографией (ПЭТ-КТ). Диагностическая ценность ПЭТ-КТ для большинства злокачественных новообразований, в том числе и для лимфопролиферативных заболеваний, была доказана многочисленными исследованиями [15, 17, 18]. Большинство исследований, посвященных целесообразности ПЭТ-КТ у пациентов с лимфомами, было направлено на определение диагностической ценности ПЭТ-КТ либо для нодальных локализаций, либо без разделения на нодальные и экстра-нодальные локализации процесса [7, 18]. С учетом тенденции к увеличению частоты экстранодальных поражений при лимфомах возникает потребность в оценке информативности ПЭТ-КТ при данной патологии. Поскольку трудности в диагностике поражений селезенки при лимфомах во многом схожи с трудностями диагностики экстранодальных поражений, вовлечение в процесс селезенки также было рассмотрено в данном исследовании, несмотря на то, что фактически поражение селезенки не относится к экстранодальным поражениям при лимфомах.
С учетом тенденции к увеличению частоты экстранодальных поражений при лимфомах возникает потребность в оценке информативности ПЭТ-КТ при данной патологии. Поскольку трудности в диагностике поражений селезенки при лимфомах во многом схожи с трудностями диагностики экстранодальных поражений, вовлечение в процесс селезенки также было рассмотрено в данном исследовании, несмотря на то, что фактически поражение селезенки не относится к экстранодальным поражениям при лимфомах.
Материал и методы
В Центре позитронно-эмиссионной томографии на базе Челябинского окружного клинического онкологического диспансера было проведено исследование, в которое были включены 316 пациентов с гистологически верифицированными лимфомами. ПЭТ-КТ исследования проводились на аппаратах Biograph 40 и Biograph 64, производства фирмы Siemens. Перед исследованием пациентам рекомендовалось в течение 3 дней исключить из диеты газообразующие продукты, вечером накануне исследования — легкий ужин и очистительная клизма. Для подготовки желудочно-кишечного тракта к
Для подготовки желудочно-кишечного тракта к
исследованию пациенты принимали внутрь воду в объеме 1500 мл, полностью исключался прием пищи за 6 ч до проведения ПЭТ-КТ.
Пациентам внутривенно вводилась фтордезок-сиглюкоза, меченная 18F, в объемах, обладающих активностью 309-580 МБк. Через 60-120 мин после введения радиофармпрепарата проводилось ПЭТ-КТ исследование в режиме WholeBody (от основания черепа до средней трети бедер), которому предшествовала мультиспиральная компьютерная томография с внутривенным многофазным болюсным контрастным усилением йодсодержащими неионными мономерными рентгеноконтрастными препаратами, за исключением пациентов с противопоказаниями к введению контраста. С целью ста-дирования заболевания исследование проведено 67 % пациентам, для оценки динамики после лечения — 33 % больным.
Результаты исследования
Лимфома Xоджкина ^X) была верифицирована у 159 (50,4 %) пациентов, неходжкинская лимфома (HXЛ) — у 155 (49 %), сочетание ЛX и HXЛ — у 2 (0,6 %) больных. По результатам проведенных исследований у 58 (17,2 %) пациентов метаболически активного патологического процесса на момент исследования не было выявлено, что было характерно для индолентных форм HXЛ (n=16) и пациентов с полным метаболическим ответом на ранее проведенную терапию (n=42). Нодальные поражения были обнаружены в 96 (28,4 %) случаях, экстранодальные поражения — в 19 (5 %), сочетание экстранодальных и нодальных поражений — в 128 (38,6%) наблюдениях (таблица).
По результатам проведенных исследований у 58 (17,2 %) пациентов метаболически активного патологического процесса на момент исследования не было выявлено, что было характерно для индолентных форм HXЛ (n=16) и пациентов с полным метаболическим ответом на ранее проведенную терапию (n=42). Нодальные поражения были обнаружены в 96 (28,4 %) случаях, экстранодальные поражения — в 19 (5 %), сочетание экстранодальных и нодальных поражений — в 128 (38,6%) наблюдениях (таблица).
У 39 (12,3 %) пациентов обнаружены метаболически активные очаги без четко дифференцируемых или сомнительных сопутствующих структурных изменений: в костях (54,8 % от выявленных поражений костей), мягких тканях (42,8 %), печени (15,4 %), селезенке (31,4 %) (рис. 1). Метаболически активные очаги в костях свидетельствовали о поражении костного мозга, в том числе и при негативных результатах его биопсии, поскольку забор биопсийного материала, как правило, осуществлялся из стандартных зон (крылья подвздошных костей), а изменения при ПЭТ-КТ выявлялись в других участках скелета. У 20 (6,3 %) пациентов легочные проявления лимфомы не сопровождались изменениями метаболической активности в легких. Для дифференциального диа-
У 20 (6,3 %) пациентов легочные проявления лимфомы не сопровождались изменениями метаболической активности в легких. Для дифференциального диа-
Рис. 1. ПЭТ-КТ-сканы. Поражение органов при лимфомах без четко выраженных или при сомнительных структурных изменениях. Слева: пациент с лимфомой Ходжкина, незначительно увеличенная селезенка на МСКТ при совмещении изображения с ПЭТ показывает существенно повышенный уровень метаболической активности. Справа: пациент с лимфомой Ходжкина, в структурно не измененном теле левой подвздошной кости определяется очаг повышения метаболической активности
гноза между легочными проявлениями лимфомы и воспалительными изменениями рекомендовалось проводить ПЭТ-КТ в динамике через 8-12 нед. Экстранодальные поражения при ПЭТ-КТ
Рис. 2. ПЭТ-КТ-сканы. Пациент с неходжкинской лимфомой. Вверху: первичное стадирование, на фоне неспецифических изменений стенки антрального отдела желудка (сглаженность складок слизистой оболочки, повышенное накопление рентгеноконтрастного вещества) определяется выраженное локальное повышение метаболической активности. Внизу: состояние после 8 циклов химиотерапии, структурные изменения стенки желудка без существенной динамики по сравнению с предыдущим исследованием, однако уровень метаболической активности в области поражения опухолевым процессом снизился, достигнув нормальных значений.
Внизу: состояние после 8 циклов химиотерапии, структурные изменения стенки желудка без существенной динамики по сравнению с предыдущим исследованием, однако уровень метаболической активности в области поражения опухолевым процессом снизился, достигнув нормальных значений.
Полный метаболический ответ на проведенное лечение
были выявлены почти у половины больных —
43,6 %. Чаще всего наблюдались легочные проявления лимфомы, поражение селезенки и плоских костей.
Таблица
Частота встречаемости экстранодальных поражений по данным ПЭТ-КТ
Локализация Процентное соотношение Соотношение ЛX:HXЛ
От пациентов с лимфомами От пациентов с экстранодальными поражениями
Легкие (п=64) 20,2 % 40,7 % 1,46:1
Селезенка (п=35) 11 % 22,3 % 1,5:1
Плоские кости (п=35) 11 % 22,4 % 1,9:1
Печень (п=15) 4,7 % 9,5 % 1,5:1
ЖКТ и поджелудочная железа (п=17) 4,4 % 8,9 % 1:4,6
Миндалины (п=13) 4,1 % 8,3 % 1,6:1
Мягкие ткани (п=10) 3,1 % 6,4 % 1:1,5
Почки (п=4) 1,2 % 2,5 % 0:4
Трубчатые кости (п=4) 1,2 % 2,5 % 1:3
Прочие (п=30) 10,6 % 21,6 % 1:3,25
ДИАГНОСТИКА ЭКСТРАНОДАЛЬНЫХ ПОРАЖЕНИЙ ПРИ ЛИМФОМАХ С ПОМОЩЬЮ СОВМЕЩЕННОЙ ПЭТ-КТ
—————————————————————————————— 39
По результатам обследования тактика лечения изменена у 24 (7,6 %) пациентов. Из них у 9 был обнаружен рецидив или неизлеченность основного заболевания, у 15 пациентов изменена стадия, преимущественно за счет выявления поражения селезенки и очагов, не сопровождающихся структурными изменениями по КТ-картине.
Из них у 9 был обнаружен рецидив или неизлеченность основного заболевания, у 15 пациентов изменена стадия, преимущественно за счет выявления поражения селезенки и очагов, не сопровождающихся структурными изменениями по КТ-картине.
Таким образом, ПЭТ-КТ имеет большую диагностическую значимость для оценки опухолевого ответа на проведенную терапию. Наиболее актуальным является проведение ПЭТ-КТ для поражений без структурных изменений, но с высокой метаболической активностью (в мягких тканях, желудочно-кишечном тракте), а также для процессов со структурными изменениями, которые медленно регрессируют в ответ на лечение (поражение костей) (рис. 2). За счет обнаружения экстранодальных поражений с помощью ПЭТ-КТ у
7,6 % пациентов была изменена тактика лечения.
ЛИТЕРАТУРА
1. Каприн А. Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2012 году. М., 2013. 232 с.
Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2012 году. М., 2013. 232 с.
2. ИмянитовЕ.Н. Эпидемиология и биология лимфомы Ходжкина // Практическая онкология. 2007. Т. 8, № 2. С. 53-56.
3. Новиков С.Н., Гиршович М.М. Диагностика и стадирование лимфомы Ходжкина // Практическая онкология. 2007. Т. 8, № 2. С. 65-72.
4. Поддубная И.В., Дёмина Е.А. Диагностика и определение распространенности (стадирование) неходжкинских лимфом // Практическая онкология. 2004. Т. 5, № 3. С. 176-184.
5. Тюрин И.Е. Диагностическая онкорадиология // Практическая онкология. 2007. Т. 8, № 4. С. 188-193.
6. Хансон К.П., Имянитов Е.Н. Эпидемиология и биология неходжкинских лимфом // Практическая онкология. 2004. 80.
80.
8. Ben-Haim S., Bar-Shalom R., Israel O., Gaitini D., Haim N., Epelbaum R., Even-Sapir E., Jerushalmi J., Gips S., Kolodny GM. Liver Involvement in Lymphoma: Role of Gallium-67 Scintigraphy // J. Nucl. Med. 1995. Vol. 36 (5). P. 900-904.
9. Berkman N., Breuer R., Kramer M.R., Polliack A. Pulmonary involvement in lymphoma // Leukemia. Lymphoma. 1996. Vol. 20 (3-4). P. 229-237.
10. De Jong P.A., van UffordHM., Baarslag H.J., deHaasM.J., Witte-bol S.H., Quekel L.G., de Klerk JM. CT and 18F-FDG PET for Noninvasive Detection of Splenic Involvement in Patients with Malignant Lymphoma // AJR. 2009. Vol. 192 (3). P 745-753. doi: 10.2214/AJR.08.1160.
11. Dhanapathi H., Kumar R. F-18 FDG PET/PET-CT in the Management of Lymphoma // Ind. J. Med. Paediatr. Oncol. 2007. № 3. P 17-23.
12. Even-Sapir E., Lievshitz G., Perry C., Herishanu Y, Lerman H., Metser U. Fluorine-18 Fluorodeoxyglucose PET/CT Patterns of Extranodal Involvement in Patients with Non-Hodgkin Lymphoma and Hodgkin’s Disease // Radiol. Clin. 2007. № 45. P. 697-709.
Even-Sapir E., Lievshitz G., Perry C., Herishanu Y, Lerman H., Metser U. Fluorine-18 Fluorodeoxyglucose PET/CT Patterns of Extranodal Involvement in Patients with Non-Hodgkin Lymphoma and Hodgkin’s Disease // Radiol. Clin. 2007. № 45. P. 697-709.
13. Ilica A.T., Kocacelebi K., SavasR., AyanA. Imaging of extranodal lymphoma with PET/CT // Clin. Nucl. Med. 2011. Vol. 36 (10). P. 127-138. doi: 10.1097/RLU.0b013e31821c99cd.
14. Krol A.D., le Cessie S., Snijder S., Kluin-Nelemans J.C., Kluin P.M., NoordijkEM. Primary extranodal non-Hodgkin’s lymphoma (NHL): the impact of alternative definitions tested in the Comprehensive Cancer Centre West population-based NHL registry // Ann. Oncol. 2003. № 14. P 131-139.
15. Metser U., Goor O., LermanH., NaparstekE., Even-Sapir E. PET-CT of Extranodal Lymphoma // AJR. 2004. Vol. 182 (6). P. 1579-1586.
16. Nihashi T., Hayasaka K., Itou T., Ito K., Kato R., Okae T., Ishigaki T. Findings of fluorine-18-FDG PET in extranodal origin lymphoma. In three cases of diffuse large B cell type lymphoma // Ann. Nucl. Med. 2006. Vol. 20 (10). P. 689-693.
17. Paes F.M., Kalkanis D.G., Sideras P.A., Serafini A.N. FDG PET/ CT of Extranodal Involvement in Non-Hodgkin Lymphoma and Hodgkin Disease // RadioGraphics. 2010. № 30. P 269-291. doi: 10.1148/ rg.301095088.
18. Schwaiger M., Wieder H. Role of PET in Lymphoma // Chang Gung Med. J. 2005. № 5. P. 315-325.
19. Zucca E., Roggero E., Bertoni F, Cavalli F. Primary extranodal non-Hodgkin’s lymphomas. Part 1: gastrointestinal, cutaneous and genitourinary lymphomas // Ann. Oncol. 1997. № 8. P. 727-737.
Поступила 17. 02.14
02.14
REFERENCES
1. KaprinA.D., Starinskij V.V., Petrova G.V. Cancer care in Russia in 2012. М., 2013. 232 p. [in Russian]
2. Imjanitov E.N. Epidemiology and biology of Hodgkin’s lymphoma // Prakticheskaja onkologija. 2007. Vol. 8 (2). P. 53-56. [in Russian]
3. Novikov S.N., GirshovichMM. Diagnosis and staging of Hodgkin’s lymphoma // Prakticheskaja onkologija. 2007. Vol. 8 (2). P. 65-72. [in Russian]
4. Poddubnaja I.V, Djomina E.A. Diagnosis and staging of non-Hodgkin’s lymphoma // Prakticheskaja onkologija. 2004. Vol. 5 (3). P. С. 176-184. [in Russian]
5. Tjurin I.E. Diagnostic radiation oncology // Prakticheskaja onkologi-ja. 2007. Vol. 8 (4). P. С. 188-193. [in Russian]
6. Hanson K.P., Imjanitov E.N. Epidemiology and biology of non-Hodgkin’s lymphoma // Prakticheskaja onkologija. 2004. Vol. 5 (3). P. 163-168. [in Russian]
Hanson K.P., Imjanitov E.N. Epidemiology and biology of non-Hodgkin’s lymphoma // Prakticheskaja onkologija. 2004. Vol. 5 (3). P. 163-168. [in Russian]
7. Beal K.P., Yeung H.W., Yahalom J. FDG-PET scanning for detection and staging of extranodal marginal zone lymphomas of the MALT type: a report of 42 cases // Ann. Oncol. 2005. Vol. 16 (3). P 473-480.
8. Ben-Haim S., Bar-Shalom R., Israel O., Gaitini D., Haim N., Epelbaum R., Even-Sapir E., Jerushalmi J., Gips S., Kolodny GM. Liver Involvement in Lymphoma: Role of Gallium-67 Scintigraphy // J. Nucl. Med. 1995. Vol. 36 (5). P. 900-904.
9. Berkman N., Breuer R., Kramer M.R., Polliack A. Pulmonary involvement in lymphoma // Leukemia. Lymphoma. 1996. Vol. 20 (3-4). P. 229-237.
10. De Jong P.A., van Ufford HM., Baarslag H.J., de Haas M. J., Witte-bol S.H., Quekel L.G., de Klerk JM. CT and 18F-FDG PET for Noninvasive Detection of Splenic Involvement in Patients with Malignant Lymphoma // AJR. 2009. Vol. 192 (3). P 745-753. doi: 10.2214/AJR.08.1160.
J., Witte-bol S.H., Quekel L.G., de Klerk JM. CT and 18F-FDG PET for Noninvasive Detection of Splenic Involvement in Patients with Malignant Lymphoma // AJR. 2009. Vol. 192 (3). P 745-753. doi: 10.2214/AJR.08.1160.
11. Dhanapathi H., Kumar R. F-18 FDG PET/PET-CT in the Management of Lymphoma // Ind. J. Med. Paediatr. Oncol. 2007. № 3. P 17-23.
12. Even-Sapir E., Lievshitz G., Perry C., Herishanu Y, Lerman H., Metser U. Fluorine-18 Fluorodeoxyglucose PET/CT Patterns of Extranodal Involvement in Patients with Non-Hodgkin Lymphoma and Hodgkin’s Disease // Radiol. Clin. 2007. № 45. P 697-709.
13. Ilica A.T., Kocacelebi K., Savas R., Ayan A. Imaging of extranodal lymphoma with PET/CT // Clin. Nucl. Med. 2011. Vol. 36 (10). P 127-138. doi: 10.1097/RLU.0b013e31821c99cd.
14. Krol A. D., le Cessie S., Snijder S., Kluin-Nelemans J.C., Kluin P.M., Noordijk EM. Primary extranodal non-Hodgkin’s lymphoma (NHL): the impact of alternative definitions tested in the Comprehensive Cancer Centre West population-based NHL registry // Ann. Oncol. 2003. № 14. P. 131-139.
D., le Cessie S., Snijder S., Kluin-Nelemans J.C., Kluin P.M., Noordijk EM. Primary extranodal non-Hodgkin’s lymphoma (NHL): the impact of alternative definitions tested in the Comprehensive Cancer Centre West population-based NHL registry // Ann. Oncol. 2003. № 14. P. 131-139.
15. Metser U., Goor O., LermanH., NaparstekE., Even-SapirE. PET-CT of Extranodal Lymphoma // AJR. 2004. Vol. 182 (6). P. 1579-1586.
16. Nihashi T., Hayasaka K., Itou T., Ito K., Kato R., Okae T., Ishigaki T. Findings of fluorine-18-FDG PET in extranodal origin lymphoma. In three cases of diffuse large B cell type lymphoma // Ann. Nucl. Med. 2006. Vol. 20 (10). P. 689-693.
17. Paes F.M., Kalkanis D.G., Sideras P.A., Serafini AN. FDG PET/ CT of Extranodal Involvement in Non-Hodgkin Lymphoma and Hodg-
kin Disease // RadioGraphics. 2010. № 30. P. 269-291. doi: 10.1148/ rg.301095088.
2010. № 30. P. 269-291. doi: 10.1148/ rg.301095088.
18. Schwaiger M., Wieder H. Role of PET in Lymphoma // Chang Gung Med. J. 2005. № 5. P. 315-325.
19. Zucca E., Roggero E., Bertoni F, Cavalli F. Primary extranodal non-Hodgkin’s lymphomas. Part 1: gastrointestinal, cutaneous and genitourinary lymphomas // Ann. Oncol. 1997. № 8. P. 727-737.
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: VIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
VIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ФАКТОРЫ ПРОГНОЗА
ПРИ ДИФФУЗНОЙ КРУПНОКЛЕТОЧНОЙ В-КЛЕТОЧНОЙ ЛИМФОМЕ
И.В. Поддубная, Л.Г. Бабичева
Кафедра онкологии РМАПО, Москва
В последние годы заболеваемость неходжкинскими лимфомами (НХЛ) имеет неизменную тенденцию к росту; она выше в развитых странах, где за последние 20 лет увеличилась более чем на 50% и по темпу прироста превышает лимфогранулематоз. Наиболее часто встречающимся вариантом агрессивных НХЛ является диффузная крупноклеточная В-клеточная лимфома (ДККЛ), течение которой характеризуется склонностью к быстрой генерализации опухолевого роста, что определяет крайне неблагоприятный прогноз и высокую летальность больных: 5-летняя выживаемость составляет в среднем 38%, а медиана выживаемости не леченных больных не превышает 1 года (Gaynor E.R., 1998).
Наиболее часто встречающимся вариантом агрессивных НХЛ является диффузная крупноклеточная В-клеточная лимфома (ДККЛ), течение которой характеризуется склонностью к быстрой генерализации опухолевого роста, что определяет крайне неблагоприятный прогноз и высокую летальность больных: 5-летняя выживаемость составляет в среднем 38%, а медиана выживаемости не леченных больных не превышает 1 года (Gaynor E.R., 1998).
Разработанные в последние годы программы лечения позволили увеличить продолжительность ремиссии и жизни, но не решили проблему полного излечения больных. Повышение интенсивности терапевтических программ способствует увеличению эффективности, с одной стороны, но и развитию тяжелых осложнений на фоне миелосупрессии – с другой, и поэтому является оправданной не во всех случаях. Остаются мало разработанными критерии выбора оптимального объема и длительности лечения в каждом конкретном случае. Важным этапом решения проблемы индивидуализации лечебных программ является оценка прогностического значения ряда клинико-лабораторных характеристик заболевания у каждого больного до начала специфической терапии.
В области изучения НХЛ основное внимание уделяется прогностической ценности различных морфологических вариантов заболевания, при этом диффузная крупноклеточная В-клеточная лимфома определяется как наиболее неблагоприятный.
Не вызывает сомнений прогностическое значение клинической стадии заболевания. Результаты всех исследований отчетливо указывают на более низкую продолжительность жизни больных с III-IV стадиями в сравнении с I-II. Доказана зависимость прогноза течения лимфомы от возраста, наличия экстранодальных очагов, общего состояния больного и содержания сывороточной лактатдегидрогеназы (ЛДГ). Эти факторы легли в основу Международного прогностического индекса (МПИ). Недостаточно изученными остаются вопросы прогностической ценности симптомов интоксикации, исходного уровня гемоглобина, общего белка и альбуминов, большой опухолевой массы и т.д. Литературные сведения по этим вопросам неоднозначны и противоречивы.
В наше ретроспективное не рандомизированное исследование включены 136 больных диффузной крупноклеточной В-клеточной лимфомой, установленной в соответствие с классификацией REAL (1994 г. ) и ВОЗ (2001 г.) на основании иммуноморфологического исследования опухолевой ткани. Пациенты получали лечение и наблюдались в РОНЦ с января 1995 г. по январь 2003 г.
) и ВОЗ (2001 г.) на основании иммуноморфологического исследования опухолевой ткани. Пациенты получали лечение и наблюдались в РОНЦ с января 1995 г. по январь 2003 г.
Мужчин было 51% и женщин — 49%. Возраст больных варьировал от 14 до 87 лет, составляя в среднем 50,76±1,62 года; 54 (40%) пациента были старше 60 лет.
Определение стадии заболевания осуществлялось с помощью клинической классификации для злокачественных лимфом, предложенной в Анн-Арбор в 1971 г. I стадия заболевания была диагностирована у 10 (7,5%) больных, II стадия – у 36 (26,5%), III стадия – у 11 (8%) больных, а IV стадия – у 79 (58%) пациентов (рис. 1). Таким образом, к моменту постановки диагноза генерализованную стадию заболевания имели более половины (66%) больных.
Рис. 1. Распределение больных по стадиям.
Экстранодальные проявления лимфомы были выявлены у 115 (84,5%) больных, причем поражение более одной экстранодальной зоны изначально было обнаружено у 47 (34,6%) пациентов. Общее состояние 50 (37%) больных расценивалось как тяжелое, соответствующее 3-4 степени по шкале ECOG. Повышение уровня ЛДГ выше нормы отмечалось у 87 (64%) пациентов, причем в 31 (23%) случае уровень этого фермента составил более двух норм (?900 Ед/л). Следует отметить, что высокий уровень ЛДГ (>750 Ед./л) достоверно чаще регистрировался у больных моложе 60 лет (р=0,042).
Общее состояние 50 (37%) больных расценивалось как тяжелое, соответствующее 3-4 степени по шкале ECOG. Повышение уровня ЛДГ выше нормы отмечалось у 87 (64%) пациентов, причем в 31 (23%) случае уровень этого фермента составил более двух норм (?900 Ед/л). Следует отметить, что высокий уровень ЛДГ (>750 Ед./л) достоверно чаще регистрировался у больных моложе 60 лет (р=0,042).
Таким образом, в соответствии с МПИ, пациенты распределились следующим образом: к низкой степени риска раннего прогрессирования (0-1 фактор) были отнесены 37 (27%) больных, к промежуточной низкой (2 фактора) – 35 (26%) больных, в группу промежуточной высокой степени (3 фактора) вошел 31 (23%) больной, а высокой степени (4-5 факторов) — 33 (24%)больных. Следовательно, около половины пациентов (47%) были отнесены в неблагоприятную прогностическую группу (рис. 2).
Рис. 2. Распределение больных по количеству неблагоприятных факторов по МПИ.
Кроме основных факторов, входящих в МПИ, были отмечены симптомы интоксикации (В-симптомы), включающие снижение массы тела на 10% и более в течение 6 мес. , наличие лихорадки (>38?С) в течение не менее 3 дней подряд без признаков воспалительного процесса и ночная профузная потливость. Они сопровождали заболевание в 29 (21%) случаях. Следует отметить, что частота этого признака была прямо пропорциональна количеству неблагоприятных факторов по МПИ.
, наличие лихорадки (>38?С) в течение не менее 3 дней подряд без признаков воспалительного процесса и ночная профузная потливость. Они сопровождали заболевание в 29 (21%) случаях. Следует отметить, что частота этого признака была прямо пропорциональна количеству неблагоприятных факторов по МПИ.
В настоящее время массивным поражением (“bulky”) принято считать опухолевые образования диаметром более 10 см. К моменту постановки диагноза первичная опухоль достигала больших (более 10 см) размеров в 86 (63%) случаях, причем у 29 (21,3%) больных это было массивное поражение лимфоузлов средостения. Отмечена высоко достоверная зависимость этого признака от количества неблагоприятных факторов МПИ. Так, в группе низкого риска наличие “bulky “ зарегистрировано у 49% больных, а в группе высокого риска по МПИ– у 94% больных (р=0,001).
Снижение уровня общего белка сыворотки крови ниже нормы (минимальное значение составило 53,5 г/л) отмечалось у 15 (11%) пациентов. Уровень альбумина сыворотки крови ниже 35 г/л (до 26,1 г/л) зарегистрирован у 14 (10%) больных. Анемия (гемоглобин
Уровень альбумина сыворотки крови ниже 35 г/л (до 26,1 г/л) зарегистрирован у 14 (10%) больных. Анемия (гемоглобин
Необходимо отметить такой показатель как общее количество зон поражения: у 82 (60%) пациентов к моменту постановки диагноза было выявлено менее 4 зон поражения; в 28 (21%) случаях их было от 4 до 7; более 7 зон поражения изначально было диагностировано у 26 (19%) больных.
В общей сложности 90 (66%) пациентов на момент поступления в клинику имели генерализованную (III-IV) стадию заболевания с наличием симптомов интоксикации в 29 (21%) случаях и биологической активности в 87 (64%) случаях. Только у 46 (34%) больных лимфома была распознана в локальных (I-II) стадиях. Среди причин позднего поступления больных в специализированное отделение можно назвать низкую специфичность начальных симптомов болезни, трудность диагностики основных локализаций в ранней стадии, выраженную агрессивность опухолевого роста и недостаточную онкологическую настороженность населения и врачей общей практики.
Все больные получали антрациклинсодержащие режимы химиотерапии. Полная программа лечения (6-8 курсов) проведена 65% больным, среднее количество курсов на одного человека составило 5. Стандартную схему СНОР (циклофосфан, адриамицин, винкристин, преднизолон) получили 67,7% пациентов.
При анализе результатов лечения была использована современная классификация оценки эффективности терапии при НХЛ, разработанная Международной Рабочей группой (B. Cheson, 1999). Согласно этой классификации, в результате индукционной терапии полная ремиссия была достигнута в 85 (62%) случаях, частичная ремиссия получена у 23 (17%) больных.
Нами выявлена высоко значимая обратная зависимость распространенности заболевания и частоты полных ремиссий, которая постепенно уменьшается со 100% при I стадии до 47% при IV стадии НХЛ (р=0,001). Частичная ремиссия также оказалась в прямой зависимости от стадии лимфомы, и ее частота увеличивалась от 0% при I стадии до 24% при IV.
Из 85 пациентов, достигших полной ремиссии, более чем у 1/3 больных (37,6%) отмечено развитие рецидива лимфомы в различные сроки. Наибольшая частота появления рецидива (26 случаев — 81%) зарегистрирована в течение первого года наблюдения, причем в подавляющем большинстве случаев (21 случай — 80%) в первые 6 мес. Всего у 5 (13,5%) больных рецидив был выявлен позже 24 мес. наблюдения, и только в 1 (2,7%) случае рецидив возник в течение второго года заболевания.
Среди 23 больных с частичной ремиссией у 5 (22%) пациентов выявлены рецидивы НХЛ, причем, во всех случаях – в первые 6 мес. наблюдения.
Из 37 пациентов с возвратом заболевания лишь 4 (11%) ответили на II линию лечения: в 2 случаях ранних рецидивов проводилась химиотерапия по схеме ВАЕМ, а у 2 пациентов с поздними рецидивами было повторено предыдущее лечение: в одном случае — по схеме СНОР, в другом – CIOP.
Прогрессирование заболевания на фоне лечения отмечено у 27 (20%) больных: в 4 (11%) случаях в группе со II стадией НХЛ против 23 (29%) больных с IV стадией лимфомы; разница статистически значима (р=0,005). Ни один из этих пациентов не ответил на последующие виды лечения. У 17 из 27 (63%) больных было зарегистрировано раннее прогрессирование заболевания (после 1-3 курсов химиотерапии). Следует отметить, что подавляющее большинство этих пациентов (15-88%) имели IV стадию заболевания и относились к группам неблагоприятного прогноза (3-4 фактора по МПИ).
Ни один из этих пациентов не ответил на последующие виды лечения. У 17 из 27 (63%) больных было зарегистрировано раннее прогрессирование заболевания (после 1-3 курсов химиотерапии). Следует отметить, что подавляющее большинство этих пациентов (15-88%) имели IV стадию заболевания и относились к группам неблагоприятного прогноза (3-4 фактора по МПИ).
Нами определена эффективность комбинированной химиолучевой терапии при I-II стадиях ДККЛ. В 10 (43,5%) случаях при I-II стадиях НХЛ больные получали лучевую терапию в составе комбинированного лечения после 3 курсов химиотерапии с последующим проведением еще 3 курсов (“sandwich”). После полной программы лечения (6-8 курсов химиотерапии) лучевую терапию получили 13 (56,5%) пациентов.
Рецидивы у больных с I и II стадиями ДККЛ после химиолучевого лечения были выявлены в 11 (48%) случаях, причем в 9 (82%) из них лучевая терапия проводилась в составе “sandwich”, и лишь в 2 (18%) случаях – после полной программы химиотерапии. Таким образом, в подавляющем большинстве случаев (в 9 из 11) рецидивы лимфомы отмечены у больных, которым лучевая терапия проводилась после первых 3 курсов химиотерапии в составе “sandwich”.
Таким образом, в подавляющем большинстве случаев (в 9 из 11) рецидивы лимфомы отмечены у больных, которым лучевая терапия проводилась после первых 3 курсов химиотерапии в составе “sandwich”.
Из 136 больных, поступивших в отделение химиотерапии гемобластозов ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России за период с января 1995 г. по январь 2003 г., к моменту окончания исследования (январь 2004 г.) 73 (53,7%) пациента умерли от прогрессирования ДККЛ и/или от осложнений химиотерапии; 51 (37,5%) больной находился в состоянии полной ремиссии в течение 1 и более лет, остальные 12 (8,8%) пациентов продолжали лечение. Медиана наблюдения составила 18,5 мес.
Анализ выживаемости показывает, что более половины больных (41 человек – 56,2% от всех умерших) умерли в течение первого года заболевания. В последующем смертность снижалась: в течение второго года умерли 20 (27,4%) больных, а в течение последующих 3 лет – 12 (16,4% от всех умерших пациентов) больных. Медиана общей выживаемости составила 16 мес.
Медиана общей выживаемости составила 16 мес.
В соответствии с литературными данными общепринятым сроком оценки прогноза агрессивных НХЛ является 2-летняя выживаемость. С этой целью проведено сравнение основных клинико-лабораторных параметров, характеризующих течение диффузной крупноклеточной В-клеточной лимфомы, в двух группах: в первую вошли пациенты, пережившие 2-летний период, во вторую – больные, умершие в течение 2 лет после начала лечения.
Исходя из данных однофакторного анализа, более 1/3 пациентов в каждой группе были старше 60 лет, причем большее количество пожилых пациентов были в группе умерших (43% против 36% больных в группе с благоприятным исходом). Однако статистические различия выживаемости по всем возрастным группам не достигли статистической значимости (р>0,05). При анализе взаимосвязи возраста с другими клинико-лабораторными характеристиками диффузной В-крупноклеточной лимфомы выявлено несколько закономерностей: высокий уровень ЛДГ сыворотки крови (>750 Ед. /л) достоверно чаще встречался у молодых пациентов (р=0,042), с высокой степенью статистической значимости у пациентов моложе 60 лет чаще наблюдалось поражение средостения и легких (р<0,005).
/л) достоверно чаще встречался у молодых пациентов (р=0,042), с высокой степенью статистической значимости у пациентов моложе 60 лет чаще наблюдалось поражение средостения и легких (р<0,005).
Прослежена четкая зависимость выживаемости от стадии лимфомы, установленной в момент диагностики заболевания согласно Анн-Арборской классификации. Если при I стадии 2-летняя выживаемость составила 89%, то во II-III – 63%, а в IV – 30%. Различия статистически значимы (p<0,005) (рис. 3).
Рис. 3. Влияние стадии заболевания на общую выживаемость больных ДККЛ.
Мы предположили, что влияние на прогноз лимфомы оказывает не только стадия заболевания, но и характер распространения опухолевого процесса к моменту начала специфической терапии. Проанализировано влияние на выживаемость 22 выявленных локализаций опухолевого поражения у больных ДККЛ в исследуемой группе. Результаты позволяют заключить, что из нодальных поражений лишь изменение внутрибрюшных и забрюшинных лимфатических узлов оказывает статистически значимое влияние на прогноз диффузной В-крупноклеточной лимфомы (р=0,004). Из экстранодальных проявлений достоверные различия в 2-летней выживаемости выявлены лишь при поражении костного мозга (р=0,047).
Из экстранодальных проявлений достоверные различия в 2-летней выживаемости выявлены лишь при поражении костного мозга (р=0,047).
Высокоинформативным при однофакторном анализе и обладающим высоким диагностическим коэффициентом при многофакторном оказался признак, не упоминающийся в доступной нам отечественной и зарубежной литературе, – общее количество специфически пораженных зон. Отмечено четкое снижение 2-летней выживаемости по мере увеличения количества зон поражения. Если при наличии у пациентов менее 4 локализаций 2-летняя выживаемость составила 61,5%, то при выявлении более 7 специфически измененных зон этот показатель равнялся всего 8%; различия статистически значимы (р=0,001) (рис. 4).
1 группа — 1-3 зоны поражения; 2 группа — 4-6 зон поражения;
3 группа — >7 зон поражения.
Рис. 4. Влияние количества зон специфического поражения на общую выживаемость больных ДККЛ.
Анализ прогностической ценности симптомов интоксикации также выявил ее высокую значимость (р=0,003). Присоединение В-симптомов в 3 раза чаще отмечалось в группе больных с летальным исходом. При оценке тяжести общего состояния больных по шкале ECOG до начала специфического лечения отмечена статистически значимая корреляция IV степени ECOG с неблагоприятным исходом лимфомы. Так, среди 17 пациентов в крайне тяжелом состоянии 23% умерли и всего 6% пережили 2-летний срок (р=0,012). Проведен анализ выживаемости больных ДККЛ в зависимости от наличия или отсутствия большой опухолевой массы (“bulky”). Эта клиническая ситуация была выявлена в 74% случаях в группе с летальным исходом и в 54% среди выживших пациентов (р=0,025).
Присоединение В-симптомов в 3 раза чаще отмечалось в группе больных с летальным исходом. При оценке тяжести общего состояния больных по шкале ECOG до начала специфического лечения отмечена статистически значимая корреляция IV степени ECOG с неблагоприятным исходом лимфомы. Так, среди 17 пациентов в крайне тяжелом состоянии 23% умерли и всего 6% пережили 2-летний срок (р=0,012). Проведен анализ выживаемости больных ДККЛ в зависимости от наличия или отсутствия большой опухолевой массы (“bulky”). Эта клиническая ситуация была выявлена в 74% случаях в группе с летальным исходом и в 54% среди выживших пациентов (р=0,025).
Прогностическая роль уровня гемоглобина обсуждается во многих работах, посвященных изучению НХЛ; мнения по этому вопросу весьма разноречивы. В нашем исследовании низкое ( 50 Ед./л зарегистрирован в 48% случаев в группе больных с летальным исходом против 20% выживших пациентов.
Помимо ЛДГ, уточнить прогноз течения диффузной В-крупноклеточной лимфомы можно с помощью определения содержания в сыворотке крови больного общего белка и альбуминов. Нами выявлено статистически значимое отрицательное влияние на 2-летнюю выживаемость снижения уровня общего белка
Нами выявлено статистически значимое отрицательное влияние на 2-летнюю выживаемость снижения уровня общего белка
В исследовании было проанализировано влияние на выживаемость каждого в отдельности из 5 неблагоприятных факторов, вошедших в МПИ. Однако мы посчитали необходимым определить прогностическую значимость совокупности того или иного количества этих показателей согласно 4 группам риска раннего прогрессирования по МПИ. Так, среди выживших пациентов 40% были отнесены к группе низкого риска в сравнении с 10% в группе с летальным исходом (р=0,012). Отмечено высоко значимое (р=0,001) влияние на 2-летнюю выживаемость совокупности 4-5 факторов: среди выживших пациентов лишь 6% были отнесены к высокой степени риска против 42% в группе больных с летальным исходом (рис. 5).
Рис. 5. Влияние группы риска раннего прогрессирования по МПИ на общую выживаемость больных ДККЛ.
В особую группу прогностических факторов необходимо выделить непосредственные результаты I линии химиотерапии (достижение полной ремиссии, частичной ремиссии или прогрессирование), определяющие чувствительность опухоли к специфическому лечению. Так, в группе больных с благоприятным исходом полная ремиссия была достигнута в подавляющем большинстве случаев (94%), тогда как среди умерших пациентов полный эффект получен лишь у 28% больных (p<0,0001). Если в результате I линии химиотерапии получена частичная ремиссия, то имеет место обратная тенденция: 26% в группе с летальным исходом против 6% среди выживших пациентов (p=0,005). В случае прогрессирования заболевания во время лечения ни один больной не пережил 2-летний период (p<0,0001).
Так, в группе больных с благоприятным исходом полная ремиссия была достигнута в подавляющем большинстве случаев (94%), тогда как среди умерших пациентов полный эффект получен лишь у 28% больных (p<0,0001). Если в результате I линии химиотерапии получена частичная ремиссия, то имеет место обратная тенденция: 26% в группе с летальным исходом против 6% среди выживших пациентов (p=0,005). В случае прогрессирования заболевания во время лечения ни один больной не пережил 2-летний период (p<0,0001).
Таким образом, задачей индукционного лечения при ДККЛ является достижение полной ремиссии, а частичный эффект необходимо отнести к неудачам лечения.
С помощью многофакторного дисперсионного анализа выявлены факторы, статистически значимо влияющие на выживаемость (общую и бессобытийную):
1) МПИ, р=0,002, мощность=0,9;
2) стадия, р<0,0001, мощность=0,9;
3) уровень сывороточной ЛДГ, p=0,001, мощность=0,9;
4) уровень альбумина, p<0,0001, мощность=0,9;
5) общее количество зон поражения, p=0,007, мощность=0,9;
6) уровень общего белка, p=0,004, мощность=0,8;
7) наличие симптомов интоксикации, p=0,01, мощность=0,7;
8) поражение внутрибрюшных и забрюшинных лимфоузлов, р=0,02, мощность=0,6;
9) поражение легких, р=0,03, мощность=0,5;
10) поражение кольца Вальдейра, p=0,05, мощность=0,5;
11) поражение костного мозга, p=0,08, мощность=0,4;
Непосредственные результаты I линии химиотерапии:
12) полная ремиссия, p<0,0001, мощность=1;
13) прогрессирование, p<0,0001, мощность=0,9;
14) частичная ремиссия, p=0,005, мощность=0,8
Таким образом, тщательно собранный анамнез и клиническое обследование больного позволяют выделить критерии неблагоприятного прогноза. К ним относятся такие клинические факторы как возраст (старше 60 лет), симптомы интоксикации, локализация опухолевых очагов и их количество (более 7), наличие экстранодальных поражений, распространенная стадия заболевания, наличие большой опухолевой массы («bulky»), тяжесть общего состояния и непосредственные результаты I линии терапии, а также изменения лабораторных параметров (повышение уровня ЛДГ, анемия, гипопротеинемия и гипоальбуминемия).
К ним относятся такие клинические факторы как возраст (старше 60 лет), симптомы интоксикации, локализация опухолевых очагов и их количество (более 7), наличие экстранодальных поражений, распространенная стадия заболевания, наличие большой опухолевой массы («bulky»), тяжесть общего состояния и непосредственные результаты I линии терапии, а также изменения лабораторных параметров (повышение уровня ЛДГ, анемия, гипопротеинемия и гипоальбуминемия).
Неходжкинские лимфомы | Клиника «Оберіг»
Неходжкинские лимфомы — гетерогенная группа опухолей, возникающих из различного типа клеток лимфоидной ткани и различающихся по ряду клинических, цитоморфологических, иммунологических и молекулярно-генетических признаков. Существует более 80 различных видов неходжкинских лимфом, потому диагностический процесс достаточно сложен. В последние годы совершенствование методов диагностики и лечения неходжкинских лимфом значительно улучшило прогноз пациентов с этими заболеваниями.
СИМПТОМЫ НЕХОДЖКИНСКИХ ЛИМФОМ
Обычно неходжкинские лимфомы поражают лимфатические узлы. Однако заболевание может распространиться на другие ткани лимфатической системы – миндалины, аденоиды, селезенку, вилочковую железу. Нередко в патологический процесс вовлекаются органы, которые не входят в лимфатическую систему – желудок, кишечник, щитовидная железа, молочная железа, яички, кости, центральная нервная система и др. Такие лимфомы называются экстранодальными.
Пациенты с неходжкинскими лимфомами могут предъявлять следующие жалобы:
- Безболезненные увеличенные лимфатические узлы на шее, подмышками или в паху;
- Боль в животе;
- Боль в груди, кашель, утрудненное дыхание;
- Постоянная слабость;
- Лихорадка;
- Сильная потливость, особенно ночью;
- Необъяснимая потеря веса.
ПРИЧИНЫ НЕХОДЖКИНСКИХ ЛИМФОМ
Иммунная клетка под воздействием причинных факторов останавливается на каком-либо этапе созревания, преобразуется в злокачественную и начинает бесконтрольно делиться, что ведет к возникновению опухоли. Неходжкинские лимфомы начинаются с одиночного опухолевого очага, который чаще всего локализуется в каком-либо лимфатическом узле (нодальное поражение), реже в других органах и тканях (экстранодальное поражение). Риск развития лимфом повышен при иммунодефицитных состояниях различной природы (ВИЧ-инфекция, аутоиммунные и наследственные заболевания и др.).
Неходжкинские лимфомы начинаются с одиночного опухолевого очага, который чаще всего локализуется в каком-либо лимфатическом узле (нодальное поражение), реже в других органах и тканях (экстранодальное поражение). Риск развития лимфом повышен при иммунодефицитных состояниях различной природы (ВИЧ-инфекция, аутоиммунные и наследственные заболевания и др.).
Неходжкинские лимфомы могут происходить из B-лимфоцитов и T-лимфоцитов. Большинство случаев неходжкинских лимфом связано с нарушением жизненного цикла B-клеток. Это может быть диффузная В-крупноклеточная лимфома, фолликулярная лимфома, из клеток маргинальной зоны, мантийноклеточная лимфома, лимфома Беркитта и др. Неходжкинские лимфомы, происходящие из Т-клеток, встречаются реже. Среди них – периферическая Т-клеточная лимфома и кожная Т-клеточная лимфома. Происхождение заболевания определяет выбор тактики лечения.
Риск развития неходжкинских лимфом повышают некоторые вирусы и бактерии, такие как ВИЧ, вирус Эпштейн-Барр, Helicobacter pylori. Заболевание встречается среди всех возрастных групп.
Заболевание встречается среди всех возрастных групп.
ДИАГНОСТИКА НЕХОДЖКИНСКИХ ЗЛОКАЧЕСТВЕННЫХ ЛИМФОМ
Диагностика включает следующие исследования:
- Осмотр пациента;
- Анализы крови;
- Определение расположения опухоли с помощью КТ, МРТ и ПЭТ-КТ;
- Биопсия лимфатического узла – хирургическое иссечение и последующее гистологическое и иммуногистохимическое исследование лимфоидной ткани;
- Трепанобиопсия костного мозга подвздошной кости – забор участка костного мозга путем прокола с помощью специальной иглы и его гистологическое исследование;
- Молекулярно-генетические исследования.
Для планирования лечения необходимо определить вид лимфомы, группу риска и стадию по классификации Ann Arbor.
Стадия I. Опухоль ограничена одним лимфатическим узлом или группой близлежащих узлов.
Стадия II. Опухоль расположена в двух разных группах лимфатических узлов, или процесс распространился на орган и близлежащие лимфатические узлы. Опухоль находится по одну сторону диафрагмы.
Опухоль находится по одну сторону диафрагмы.
Стадия III. Поражение лимфатических зон с обеих сторон диафрагмы, которое может сопровождаться поражением селезенки (IIIS) или локальным поражением одного нелимфоидного органа.
Стадия IV. Множественные поражения обнаруживаются в разных органах и тканях. Могут быть поражены печень, легкие или кости.
Дополнительно используются буквы A и B для обозначения симптомов заболевания. Буква В указывает на такие симптомы как постоянная лихорадка, потеря массы тела, профузный ночной пот.
Существуют редкие формы неходжкинских лимфом, которые сложно диагностировать. Точный диагноз и стадирование – залог успешного лечения.
ЛЕЧЕНИЕ НЕХОДЖКИНСКИХ ЗЛОКАЧЕСТВЕННЫХ ЛИМФОМ
Выбор лечения зависит от вида, стадии заболевания, группы риска, общего состояния здоровья пациента. Если опухоль растет медленно (индолентная лимфома), можно отложить лечение и ограничиться регулярным наблюдением у врача.
Лечение проводится, если лимфома относится к классу агрессивных или вызывает клинические симптомы. С терапевтической целью чаще всего применяют иммунохимиотерапию – введение моноклональных антител и химиотерапевтических препаратов, которые уничтожают раковые клетки. Курс химиотерапии включает несколько циклов, чаще 6, и проводится в течение нескольких месяцев. Также может использоваться радиотерапия – прицельное облучение опухолей. Она чаще применяется с консолидирующей целью после завершения курсов иммунохимиотерапии.
В сложных случаях может понадобиться пересадка гемопоэтических стволовых клеток – собственных или донорских.
В Универсальной клинике «Оберіг» принимает врач-гематолог. Диагностика и лечение проводятся согласно рекомендациям европейских и американских онкологических сетей ESMO и NCCN. Запишитесь на консультацию по телефону:
(044) 521 30 03
Ходжкина лимфома
Лимфома Ходжкина — это первичное злокачественное новообразование лимфатической системы. Для данного заболевания характерно безболезненное увеличение лимфатических узлов, селезенки и другой лимфоидной ткани. Гистологический диагноз ставится при выявлении клеток Березовского-Штернберга.
Для данного заболевания характерно безболезненное увеличение лимфатических узлов, селезенки и другой лимфоидной ткани. Гистологический диагноз ставится при выявлении клеток Березовского-Штернберга.
Эпидемиология
Лимфома Ходжкина составляет менее 1% всех злокачественных новообразований и 14% всех злокачественных лимфом. Отмечаются два возрастных пика: первый приходится на период 15-35 лет, второй 55-75 лет. Чаше встречается у мужчин.
Общие положения
- половина пациентов с болезнью Ходжкина имеет видимое при рентгенографии увеличение лимфатических узлов
- примерно в 5-10% случаев пациенты могут иметь медиастинальную лимфоаденопатию без вовлечения любых других лимфатических узлов
- клинически, боле 90% пациентов с болезнью Ходжкина имеют увеличенные лимфатические узлы, а болезнь протекает более мягко если локализация ограничена шеей
- чаще встречаеться вариант лимфомы Ходжкина с нодулярным склерозом
различают 4 основных гистологических типа:
- лимфогистиоцитарный вариант лимфомы Ходжкина
- вариант лимфомы Ходжкина с нодулярным склерозом
- смешанноклеточный вариант лимфомы Ходжкина
- вариант лимфомы Ходжкина с подавлением лимфоидной ткани
- лимфоцит-преобладающая форма лимфомы Ходжкина (отдельная сущность с отличающейся клиникой и подходов в терапии)
Клиническая картина
- большинство пациентов с локализацией процесса выше уровня диафрагмы не имеют клинических симптомов до определенной стадии заболевания
- “B” симптомы встречаются в 40%
- потеря веса
- жар
- ночная потливость
- интермитирующая лихорадка в более чем 35% случаев
- редко, лихорадка Pel-Ebstein (лихорадочный период длительностью 1-2 недели следует за афебрильным периодом длительностью в 1-2 недели)
- крупные медиастинальные конгломераты лимфатических узлов могут провоцировать боли в грудной клетке, кашель или отдышку
- зуд
- болезненность лимфатических узлов, особенно если предшествовало употребление алкоголя, встречается менее чем у 10% пациентов, но является патогномоничным для лимфомы Ходжкина
- кровохаркание (редко)
- боли в спине и костях (редко)
Диагностика
- легочная паренхима поражается у 1/3 пациентов с лимфомой Ходжкина
- практически все пациенты имеют прикорневую или медиастинальную аденопатию
- наиболее частая форма проявления
- встречается в 90-99% случаев
- часто поражены разные группы лимфатических узлов
- часто поражаются передние медиастинальные и загрудинные лимфатические узлы (3А по IASLC 2009 г.
 )
) - в 40% локализация ограничена передним средостением
- в 20% случаев встречается сочетание поражения медиастинальных ил корневых узлов
- двустороннее поражение корневых узлов встречается в 50% случаев
- бронховаскулярная форма (наиболее частый тип поражения)
- грубый ретикуло-нодулярный паттерн распространяющийся от средостения по ходу лимфатических путей
- узловые образования в паренхиме
- милиарные узелки
- эндобронхиальное распространение
- долевой ателектаз при бронхиальной обструкции (редко)
- кавитации за счет некроза (редко)
- субплевральная форма
- отграниченные субплевральные образования
- плевральный выпот
- возникает за счет обструкции лимфатических путей
- встречается в 1/3 случаев
- обычно не содержит злокачественных клеток
- пневмоническая форма
- диффузный инфильтрат не ограниченный сегментом
- массивные инфильтраты занимающие всю долю (30%)
- гомогенные сливающиеся инфильтраты с неровными границами
- положительный признак воздушной бронхографии
- узловая форма
- множественные узлы <1 см в диаметре
- внелегочные проявления в грудной клетке
- двустороннее ассиметричное поражение корневых лимфатических узлов
- поражение передних медиастинальных узлов
- возможно наличие кальцинатов в них, на фоне лучевой терапии
Стадирование (Ann Arbor)
- I стадия поражение одной лимфатической зоны или структуры
- II стадия поражение двух или более зон лимфатических коллекторов по одну сторону диафрагмы
- III стадия поражение лимфатических узлов или структур по обе стороны диафрагмы
- IV стадия экстранодальное поражение, например легких или головного мозга
- модификаторы
- S – поражение селезенки
- B – наличие B симптомов
- A – отсутствие B симптомов
- X – массивное («bulk») поражение лимфатических узлов
- E – протяженное экстранодальное поражение
Дифференциальный диагноз
Лечение
- комбинация лучевой и химиотерапии
Прогноз
- увеличение лимфатических узлов средостения ухудшает прогноз, но в минимальной степени
- диффузное поражение легких, с другой стороны, имеет более худший прогноз
Пятилетняя выживаемость в зависимости от стадии
- I и II стадии: 90%
- III стадия: 84%
- IV стадия: 65%
Синонимы
- болезнь Ходжкина
- лимфогранулематоз
- мегакариоцитоз
Неходжкинские Лимфомы
Вам поставили диагноз: Неходжкинская лимфома?
Наверняка Вы задаётесь вопросом: что же теперь делать?
Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать». Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни.
Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать». Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни.
Мы поможем вам справиться с болезнью и будем идти с вами рука об руку через все этапы вашего лечения.
Предлагаем вашему вниманию краткий, но очень подробный обзор Неходжкинской Лимфомы.
Его подготовили высоко квалифицированные специалисты Отдела лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба и Отдела лекарственного лечения опухолей МНИОИ имени П.А. Герцена – филиалов ФГБУ «НМИЦ радиологии» Минздрава России под редакцией заведующих отделами, д.м.н. ФАЛАЛЕЕВОЙ Н.А. и д.м.н. ФЕДЕНКО А.А.
Филиалы и отделения, где лечат неходжкинские лимфома
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Неходжкинские лимфомы
– Это историческое название, обозначающее, что данный тип лимфомы не является лимфомой Ходжкина. Неходжкинские лимфомы (НХЛ) – это большая группа опухолей лимфоидной системы, внутри которой выделяют наиболее часто встречающиеся В-клеточные лимфомы, возникшие из В-лимфоцитов и Т-клеточные лимфомы- из Т-лимфоцитов. НХЛ подразделяют на агрессивные и вялотекущие основываясь на характере течения опухоли, подходы к лечению вялотекущих и агрессивных лимфом разняться. Вялотекущие (индолентные) лимфомы на сегодняшний день неизлечимы. Благодаря их медленному развитию, иногда от момента установки диагноза до начала лечения проходит длительное время, исчисляемое годами. Агрессивные лимфомы следует лечить сразу после обнаружения, целью лечения в этих случаях является достижение ремиссии. Опухолевые клетки при агрессивных лимфомах делятся очень быстро, опухоль может стремительно увеличивать свои размеры, симптомы болезни возникают быстро.
Благодаря их медленному развитию, иногда от момента установки диагноза до начала лечения проходит длительное время, исчисляемое годами. Агрессивные лимфомы следует лечить сразу после обнаружения, целью лечения в этих случаях является достижение ремиссии. Опухолевые клетки при агрессивных лимфомах делятся очень быстро, опухоль может стремительно увеличивать свои размеры, симптомы болезни возникают быстро.
К факторам, предрасполагающим развитию неходжкинских лимфом относиться:
· Вирус Эпштейн-Барр, Т-лимфотропный вирус человека, вирус герпеса 8 типа.
· ВИЧ-инфекция.
· Вирус гепатита С.
· Хроническая бактериальная инфекция: Helicobacter pylori, Borelliaburgdorferi.
· Прием лекарственных препаратов, подавляющих иммунитет.
· Аутоиммунные заболевания.
· Химические канцерогены.
Клиническая картина
Как правило, манифестация НХЛ сопровождается симптомами, которые носят общий характер, например- повышение температуры тела, общая слабость, повышенная утомляемость, потеря веса, суставные боли и т. д. Можно сказать, что злокачественное заболевание крови на начальных этапах может прятаться под «масками» других заболеваний. Не напрасно же среди гематологов существует профессиональная поговорка: «Лимфома – обезьяна любой болезни». В связи с наличием общих жалоб часто ошибочно устанавливаются неверные диагнозы, назначается симптоматическое лечение. В результате в гематологическую клинику пациент поступает лишь спустя время и уже в тяжелом состоянии, а диагноз устанавливается на поздней стадии, что ухудшает прогноз и течение заболевания, создает дополнительные терапевтические проблемы.
д. Можно сказать, что злокачественное заболевание крови на начальных этапах может прятаться под «масками» других заболеваний. Не напрасно же среди гематологов существует профессиональная поговорка: «Лимфома – обезьяна любой болезни». В связи с наличием общих жалоб часто ошибочно устанавливаются неверные диагнозы, назначается симптоматическое лечение. В результате в гематологическую клинику пациент поступает лишь спустя время и уже в тяжелом состоянии, а диагноз устанавливается на поздней стадии, что ухудшает прогноз и течение заболевания, создает дополнительные терапевтические проблемы.
В типичном случае поражаются лимфатические узлы, их локализация крайне вариабельна и в незначительной степени зависит от варианта НХЛ. Симптомы болезни будут зависеть от расположения растущих лимфатических узлов. Довольно часто в опухолевый процесс вовлекаются селезенка и костный мозг. Поражение селезёнки проявляется тяжестью и дискомфортом в левой половине живота, вовлечение в процесс костного мозга можно заподозрить на основании анализа крови. Возможно поражение органов, не относящихся к лимфатической системе, например, желудок, легкие, головной мозг, молочная железа, яички, кости, кожа и т.д. при этом симптомы болезни будут соответствовать поражению органа. В этом случае речь идет о экстранодальном (=вне лимфатической системы) варианте НХЛ.
Возможно поражение органов, не относящихся к лимфатической системе, например, желудок, легкие, головной мозг, молочная железа, яички, кости, кожа и т.д. при этом симптомы болезни будут соответствовать поражению органа. В этом случае речь идет о экстранодальном (=вне лимфатической системы) варианте НХЛ.
Диагноз
В настоящее время отличить один вариант лимфомы от другого возможно лишь при проведении комплексного иммуноморфологического исследования, подкрепленного в ряде случаев цитогенетическим и молекулярными анализами опухолевой ткани, взятой при биопсии. Выбор программы лечения, в том числе с применением новейших таргетных препаратов, также основывается на детальном изучении иммунологического и генетического портрета опухоли.
Обследование. См. раздел Лимфома Ходжкина.
Лечение неходжкинских лимфом
План лечения определяется в каждом случае индивидуально и зависит от иммуноморфологического варианта НХЛ, ее молекулярно-генетических особенностей, стадии заболевания, наличия факторов прогноза и общих симптомов.
Хирургический метод
В лечении лимфом практически не используется. С целью диагностики заболевания выполняется биопсия пораженного лимфатического узла или ткани.
«Наблюдай и жди»
При некоторых вариантах индолентных НХЛ, когда клинические проявления болезни минимальны, а состояние больного хорошее, лечение не начинается сразу после установления диагноза, пациент остается под наблюдением врача до наступления «симптомной» болезни. Такой подход возможен при фолликулярной лимфоме, лимфоме из клеток маргинальной зоны, при хроническом лимфолейкозе. Выжидательная тактика неприменима к агрессивным вариантам лимфом, когда лечение необходимо начинать сразу после установления диагноза.
Лекарственная терапия неходжкинских лимфом
Клетки лимфомы обычно обладают высокой чувствительностью к химиопрепаратам, причем тем более агрессивно ведет себя опухоль, тем, как правило, большей чувствительностью она обладает. Прогноз при НХЛ кардинально изменился за последние два десятилетия. Причиной тому стало развитие нового направления лекарственной терапии рака- таргетной, т.е. лечение с использованием препаратов направленного действия. Так, эффективность анти- CD20-антитела ритуксимаба при многих видах В-клеточных лимфом оказалась настолько высока, что время после начала применения препарата получило название «эра ритуксимаба».
Прогноз при НХЛ кардинально изменился за последние два десятилетия. Причиной тому стало развитие нового направления лекарственной терапии рака- таргетной, т.е. лечение с использованием препаратов направленного действия. Так, эффективность анти- CD20-антитела ритуксимаба при многих видах В-клеточных лимфом оказалась настолько высока, что время после начала применения препарата получило название «эра ритуксимаба».
Изучение иммунологических, биологических и функциональных свойств отдельных видов НХЛ привело к пониманию механизмов их возникновения и развития. Эти знания легли в основу создания самых современных программ лекарственного лечения каждого иммуноморфологического варианта лимфомы. Терапевтические программы сегодня – это, как правило, сочетание определенных режимов цитостатиков с новейшими таргетными препаратами. Использование указанных режимов позволяет достигать длительные и стойкие ремиссии даже при генерализованных стадиях лимфом.
Лучевая терапия неходжкинских лимфом
При лучевой терапии воздействие осуществляется непосредственно на пораженные лимфатические узлы и ткани организма, содержащие опухолевые клетки, которые чрезвычайно чувствительны к воздействию радиации. Индивидуальная программа лечения пациента обычно включает лекарственное лечение, которое проводится первым этапом и лучевую терапию обычно в качестве закрепляющего второго этапа.
Индивидуальная программа лечения пациента обычно включает лекарственное лечение, которое проводится первым этапом и лучевую терапию обычно в качестве закрепляющего второго этапа.
В ряде случаев, после завершения двух этапов лечения пациенту назначается поддерживающеелечение, включающее в себя, как правило, таргетные иммунопрепараты.
Филиалы и отделения Центра, в которых лечат неходжкинскую лимфому
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Отдел лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующая отделом, д. м.н. ФАЛАЛЕЕВА Наталья Александровна
м.н. ФАЛАЛЕЕВА Наталья Александровна
8 (484) 399 – 31-30, г. Обнинск, Калужской области
Отдел лекарственного лечения опухолей МНИОИ имени П.А. Герцена –филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
8 (494) 150 11 22
Неходжкинские лимфомы (лимфосаркомы) у взрослых
Различают два основных типа лимфом — болезнь Ходжкина, названную так по имени автора, описавшего это заболевание, и неходжкинские лимфомы.
Неходжкинские лимфомы (лимфосаркомы) (НХЛ) развиваются из лимфоидной ткани, которая выполняет защитную функцию организма. Лимфоидная ткань, представлена лимфоцитами и имеется в лимфатических узлах, селезенке, вилочковой железе, аденоидах, миндалинах, костном мозге и желудочно-кишечном тракте.
Среди лимфоцитов выделяют В-клетки и Т-клетки, из которых могут развиваться НХЛ.
При этом В-клеточные лимфомы встречаются чаще (85%) по сравнению с Т-клеточными (15%).
Классификация неходжкинских лимфом
Наиболее часто используется Европейско-американская классификация, разработанная в рамках Всемирной организации здравоохранении (ВОЗ).
По этой классификации НХЛ подразделяются в зависимости от их клеточной принадлежности.
Диффузная В-крупноклеточная лимфома составляет 31% от общего числа лимфом. Эта лимфома возникает наиболее часто после 60 лет и отличается быстрым ростом. При этом 40-50% больных удается полностью излечить.
Фолликулярная лимфома, на которую приходится 22% от общего числа НХЛ. Этот вид лимфомы диагностируется обычно в возрасте около 60 лет и характеризуется медленным ростом. Длительная (5-летняя) выживаемость больных колеблется в пределах 60-70%. Со временем фолликулярная лимфома может превратиться в быстрорастущую диффузную лимфому.
Хронический лимфоцитарный лейкоз/мелкоклеточная лимфоцитарная лимфома. На эти родственные заболевания приходится 7% от общего количества лимфом. Они отличаются медленным ростом, но плохо поддаются лечению. Тем не менее больные с этими заболеваниями могут жить в течение 10 лет. Иногда возможно превращение их в быстрорастущие лимфомы.
На эти родственные заболевания приходится 7% от общего количества лимфом. Они отличаются медленным ростом, но плохо поддаются лечению. Тем не менее больные с этими заболеваниями могут жить в течение 10 лет. Иногда возможно превращение их в быстрорастущие лимфомы.
Лимфома из клеток мантийной зоны (6%) чаще поражает мужчин в возрасте около 63 лет. Этот тип лимфомы хотя и растет не очень быстро, однако лишь 20% больных живет в течение 5 лет.
Экстранодальные В-клеточные лимфомы маргинальной зоны — MALT-лимфомы (8%). Средний возраст больных — около 60 лет. Часто выявляется в желудке, отличается медленным местным ростом. Хорошо излечивается на ранних стадиях.
Нодальная В-клеточная лимфома маргинальной зоны (2%). Характеризуется медленным ростом. Многие больные с ранними стадиями заболевания могут быть полностью излечены.
Селезеночная В-клеточная лимфома маргинальной зоны встречается у пожилых больных, чаще мужского пола.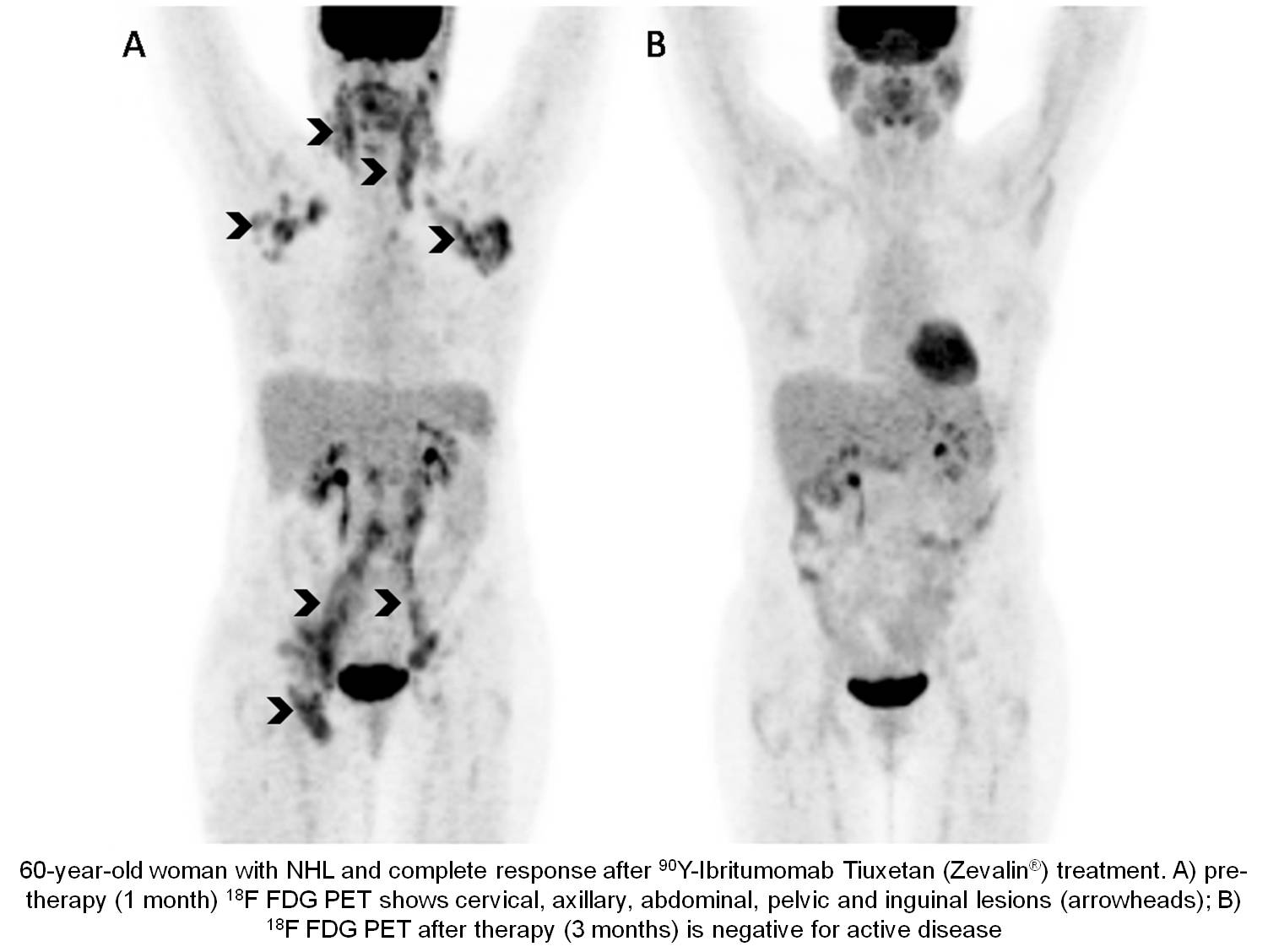 Нередко лечение не назначается до появления выраженных симптомов в результате увеличения селезенки.
Нередко лечение не назначается до появления выраженных симптомов в результате увеличения селезенки.
Первичная медиастинальная В-клеточная лимфома (2%) возникает в средостении преимущественно у женщин в возрасте 30-40 лет и характеризуется быстрым ростом. 50% больных могут быть излечены.
Лимфома Беркитта и беркиттоподобная лимфома(2%) возникает в 90% случаев у мужчин в возрасте около 30 лет. Отличается быстрым ростом. При интенсивной химиотерапии 50% больных могут быть полностью излечены.
Лимфоплазмоцитарная лимфома (макроглобулинемия Вальденстрема) составляет 1% от общего числа НХЛ. Заболевание отличается медленным течением, но полностью его излечить нельзя. Тем не менее большинство больных живут более 5 лет.
Волосатоклеточный лейкоз относится к очень редким заболеваниям и выявляется у пожилых людей. Характеризуется медленным ростом. Некоторые больные не нуждаются в лечении.
Первичная лимфома центральной нервной системы (ЦНС) может поражать как головной, так и спинной мозг. Ранее эта опухоль считалась очень редкой, однако в настоящее время она выявляется чаще у больных СПИДом. 30% больных живут 5 и более лет.
Ранее эта опухоль считалась очень редкой, однако в настоящее время она выявляется чаще у больных СПИДом. 30% больных живут 5 и более лет.
Т-лимфобластная лимфома/лейкоз из клеток-предшественников (2%). Это заболевание можно рассматривать как лимфому или лейкоз. Различие зависит от количества опухолевых клеток в костном мозге. В случае выявления менее 25% опухолевых клеток ставится диагноз лимфомы, а более 25% — лейкоза.
75% больных составляют мужчины, а остальные 25% — женщины. Средний возраст пациентов — 25 лет. Если костный мозг не поражен, то вероятность излечения высокая, а при его вовлечении в процесс вероятность излечения не превышает 20%.
Периферические Т-клеточные лимфомы (7%) подразделяются на несколько видов:
Кожная Т-клеточная лимфома (грибовидный микоз, синдром Сезари) составляет менее 1% среди всех лимфом и выявляется в возрасте 50-60 лет. Выживаемость больных в течение 5 лет колеблется от 5 до 58% в зависимости от скорости роста опухоли.
Ангиоиммунобластная Т-клеточная лимфома характеризуется быстрым ростом и неблагоприятным прогнозом.
Экстранодальная Т-клеточная лимфома из естественных киллеров, назальный тип встречается во всех возрастных группах. Исход заболевания зависит от степени распространения опухолевого процесса.
Т-клеточная лимфома с энтеропатией возникает у людей, чувствительных к клейковине — белку пшеничной муки. Прогноз (исход) заболевания неблагоприятный.
Т-клеточная панникулитоподобная лимфома подкожной клетчатки вначале растет медленно, но со временем может стать быстрорастущей опухолью. Химиотерапия дает лишь частичный эффект.
Анапластическая крупноклеточная лимфома, Т/0-клеточная (2%) чаще возникает у молодых людей. Химиотерапия позволяет излечить многих больных.
Частота возникновения неходжкинских лимфом (нхл)
Более 90% НХЛ диагностируется у взрослых больных. Чаще всего НХЛ возникают в возрасте 60-70 лет. Риск возникновения этой опухоли увеличивается с возрастом.
Чаще всего НХЛ возникают в возрасте 60-70 лет. Риск возникновения этой опухоли увеличивается с возрастом.
Персональный риск возникновения НХЛ в течение всей жизни составляет приблизительно 1 к 50.
С начала 70-х годов отмечено почти двукратное увеличение частоты НХЛ. Это явление трудно объяснить. В основном это связывают с инфекцией, вызванной вирусом иммунодефицита человека. Частично такое увеличение можно связать с улучшением диагностики.
С конца 90-х годов наблюдается стабилизация частоты возникновения НХЛ.
НХЛ чаще выявляются у мужчин по сравнению с женщинами.
В 2002 году в России было выявлено 5532 случая НХЛ у взрослых больных.
В США в 2004 году по предварительным данным ожидается 53370 случаев НХЛ у взрослых и детей.
Факторы риска возникновения неходжкинских лимфом
Факторы риска могут быть генетическими (наследственными), связанными с образом жизни и окружающей средой.
Возраст является самым важным фактором риска возникновения НХЛ. Большинство случаев НХЛ диагностируется у людей старше 60 лет.
Большинство случаев НХЛ диагностируется у людей старше 60 лет.
Врожденные нарушения иммунной системы предрасполагают не только к инфекциям, но и повышают риск развития НХЛ у детей и молодых взрослых.
Ожирение может повысить риск НХЛ.
Радиация увеличивает вероятность возникновения лейкоза, рака щитовидной железы и НХЛ. У больных, получавших лучевую терапию по поводу злокачественной опухоли, позднее повышается риск развития НХЛ. Этот риск еще более повышается при применении комбинации химиотерапии и облучения.
Бензол, гербициды и инсектициды ассоциируются с повышенным риском возникновения НХЛ.
Приобретенный иммунодефицит, вызванный применением различных препаратов у больных по поводу пересадки органов, повышает риск развития НХЛ.
Инфекции, вызванные вирусом иммунодефицита человека, сопровождаются увеличением риска возникновения некоторых типов НХЛ.
Вирус Эпштейна-Барр ассоциируется с повышенным риском развития лимфомы Беркитта и других лимфом, особенно у больных СПИДом.
Бактерия Helicobacter pylori, вызывающая язву желудка, может также привести к лимфоме той же локализации.
Устранение (по возможности) известных факторов риска может в известной степени содействовать профилактике этого заболевания.
Диагностика неходжкинских лимфом
Внимательное отношение к появившимся необычным признакам и симптомам может помочь в ранней диагностике НХЛ.
НХЛ могут сопровождаться различными симптомами в зависимости от месторасположения опухоли.
Увеличенные лимфатические узлы на шее, в подмышечной, надключичной или паховой областях могут быть легко обнаружены как врачом, так и самим больным.
При возникновении опухоли в вилочковой железе или лимфатических узлах грудной полости возможно сдавление трахеи, что приводит к кашлю, одышке и отеку верхней половины тела и лица.
Поражение лимфатических узлов живота вызывает увеличение его размеров как за счет опухолевых узлов, так и скопления жидкости. Сдавление кишки может вызывать явления частичной или полной кишечной непроходимости, что приводит к тошноте, рвоте и боли в животе.
Лимфома желудка сопровождается болью в верхних отделах живота, тошнотой, рвотой и снижением аппетита.
При НХЛ головного мозга больные отмечают головную боль, тошноту, рвоту, судороги и пр.
В случае лимфомы кожи появляется зуд, подкожное уплотнение красновато-багрового цвета.
Кроме местных симптомов могут отмечаться и общие симптомы в виде необъяснимого похудения, повышения температуры, сильных потов, особенно по ночам, и выраженного зуда кожи. Указанные симптомы указывают на наличие распространенного опухолевого процесса и ухудшают прогноз (исход) заболевания.
Следует иметь в виду, что увеличение лимфатических узлов может быть связано также с инфекцией. В связи с этим нередко назначаются антибиотики.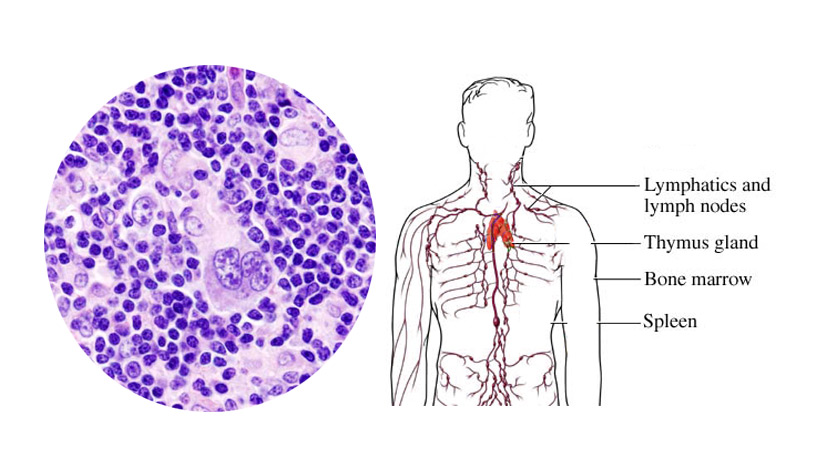 Если в течение нескольких недель не отмечается уменьшения размеров лимфатических узлов, следует провести детальное обследование: Биопсия (взятие кусочка опухоли для исследования) является окончательным методом диагностики лимфомы. При этом биопсию могут выполнять как иглой, так и с помощью небольшой операции.
Если в течение нескольких недель не отмечается уменьшения размеров лимфатических узлов, следует провести детальное обследование: Биопсия (взятие кусочка опухоли для исследования) является окончательным методом диагностики лимфомы. При этом биопсию могут выполнять как иглой, так и с помощью небольшой операции.
Пункция и биопсия костного мозга необходимы для выяснения наличия в нем опухолевых клеток.
Спинномозговая пункция дает возможность обнаружить опухолевые клетки в спинномозговой жидкости.
Кроме того, проводятся иммуногистохимические, цитометрические, цитогенетические и молекулярно-генетические исследования клеточного субстрата с целью уточнения типа лимфомы, что важно для определения прогноза заболевания и выбора тактики лечения.
Рентгенография грудной клетки дает возможность выявить увеличенные лимфатические узлы и вилочковую железу, а также жидкость в плевральных полостях.
Компьютерная томография (КТ) особенно целесообразна при лимфомах области головы, шеи, грудной полости, живота и области таза, так как позволяет детально изучить опухоль и окружающие органы и ткани.
Магнитно-резонансная томография (МРТ) особенно целесообразна при исследовании головного и спинного мозга.
Сканирование с галлием-67 позволяет обнаружить поражение лимфатических узлов, внутренних органов и костей.
Сканирование костной системы с помощью технеция-99 выявляет костные поражения, вызванные лимфомой.
Ультразвуковое исследование (УЗИ) дает возможность детально изучить лимфатические узлы, печень, селезенку и почки.
Определение стадии (степени распространения) неходжкинских лимфом
После детального обследования, включающего все вышеперечисленные методы, уточняется стадия лимфомы (сI — по IV) в зависимости от степени распространения опухолевого процесса.
При наличии у больного общих симптомов к стадии добавляется символ Б (или латинская буква В), а при их отсутствии — символ А.
Для прогнозирования скорости роста опухоли и эффективности лечения разработан международный прогностический индекс (МПИ), который учитывает 5 факторов, включая возраст больного, стадию заболевания, поражение не только лимфатических узлов, но и других органов, общее состояние больного, уровень лактатдегидрогеназы (ЛДГ) в сыворотке крови.
К благоприятным прогностическим факторам относятся: возраст менее 60 лет, стадии I-II, отсутствие поражения органов, хорошее общее состояние, нормальные уровни ЛДГ.
К неблагоприятным прогностическим факторам относятся: возраст пациента выше 60 лет, стадии III и IV, поражение лимфатических узлов и органов, неудовлетворительное общее состояние и повышение уровней ЛДГ.
Лечение неходжкинских лимфом
Оперативный метод имеет ограниченное применение у больных НХЛ. Обычно операция заключается в удалении части опухоли для исследования с целью уточнения диагноза.
Обычно операция заключается в удалении части опухоли для исследования с целью уточнения диагноза.
Лишь в случае изолированного поражения какого-либо органа, например, желудка возможно хирургическое вмешательство. Однако и в этом случае предпочтение нередко отдается лучевому методу.
У больных НХЛ обычно используется наружное облучение источниками высоких энергий. У больных с I и II стадиями НХЛ облучение может быть основным методом лечения, однако чаще всего применяется комбинация химиотерапии и облучения.
Лучевую терапию можно использовать в качестве паллиативного (временно облегчающего) метода при поражении головного и спинного мозга, а также для уменьшения боли в случае сдавления нервных окончаний.
Лучевая терапия может вызывать незначительные изменения со стороны кожи и повышенную утомляемость.
Другие побочные эффекты связаны с местом облучения.
Так, лучевая терапия на область живота может приводить к энтеропатии и поносу.
Облучение грудной клетки может вызвать повреждение легочной ткани и затруднение дыхания.
Облучение легких, особенно у курильщиков, иногда приводит к развитию рака той же локализации.
Серьезные побочные эффекты облучения головного мозга проявляются через 1-2 года и включают головную боль и нарушение памяти.
Необходимо иметь в виду, что побочные эффекты химиотерапии могут усугубляться при применении облучения.
Под химиотерапией подразумевается применение противоопухолевых препаратов для уничтожения опухолевых клеток. При этом используются многие препараты и их комбинации (сочетания).
Лечение проводится в виде курсов с интервалами 2-4 недели. Химиотерапия может проводиться как в отделении, так и в поликлинических (амбулаторных) условиях в зависимости от сложности лечения, его побочных действий, состояния больного и других факторов.
Больной может получать одну или несколько схем лечения в зависимости от эффективности терапии.
Противоопухолевая терапия уничтожает опухолевые клетки, но одновременно повреждает и нормальные быстро делящиеся клетки, к которым относится костный мозг, слизистая оболочка полости рта и желудочно-кишечного тракта, волосяные фолликулы. Выраженность побочных эффектов зависит от типа, общей и суммарной дозы препарата, а также длительности химиотерапии.
Выраженность побочных эффектов зависит от типа, общей и суммарной дозы препарата, а также длительности химиотерапии.
В результате лечения у больного могут возникнуть: облысение, появление язв во рту, повышенная восприимчивость к инфекциям за счет снижения количества лейкоцитов, кровоточивость в результате снижения числа тромбоцитов, утомляемость при снижении уровня эритроцитов, потеря аппетита.
Указанные побочные явления являются временными и проходят после прекращения лечения.
В настоящее время имеется возможность профилактики и лечения осложнений химиотерапии назначением противорвотных препаратов, антибиотиков, факторов роста, стимулирующих выработку лейкоцитов, противовирусных и противогрибковых препаратов и т.д.
Для профилактики инфекционных осложнений необходимо:
- избегать контактов с инфекцией
- носить хирургические маски больными, посетителями и персоналом
- использовать хирургические стерильные перчатки
- тщательно мыть руки
- не употреблять сырые овощи и фрукты, а также продукты, которые могут содержать микробы
- не контактировать с детьми, которые чаще взрослых являются носителями инфекций
Синдром лизиса (распада) опухоли возникает в результате быстрого эффекта химиотерапии у больных с крупными лимфомами.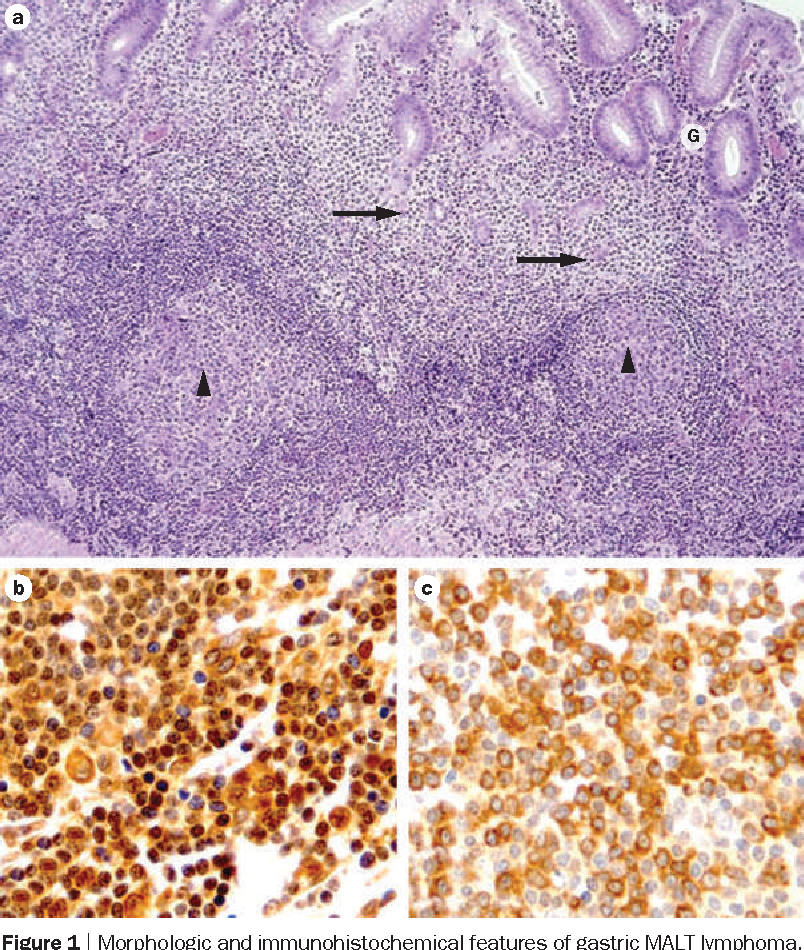 Содержимое распавшихся опухолевых клеток попадает в кровоток и нарушает функцию почек, сердца и центральной нервной системы (ЦНС). Предотвратить такое состояние можно за счет назначения большого объема жидкости и таких препаратов как сода, аллопуринол.
Содержимое распавшихся опухолевых клеток попадает в кровоток и нарушает функцию почек, сердца и центральной нервной системы (ЦНС). Предотвратить такое состояние можно за счет назначения большого объема жидкости и таких препаратов как сода, аллопуринол.
Химиотерапевтические противоопухолевые препараты способны напрямую повреждать почки, печень, яички, яичники, головной мозг, сердце и легкие. Однако применение современных средств профилактики и лечения позволяет избежать большинство таких осложнений.
Наиболее серьезным осложнением химиотерапии является возникновения второго злокачественного заболевания, в частности лейкоза. К счастью, такое осложнение у больных лимфомами встречается редко.
Для иммунотерапии используются вещества, которые в норме вырабатываются иммунной системой. Эти вещества способны уничтожить лимфомные клетки, замедлить их рост или активизировать иммунную систему больного для эффективной борьбы с лимфомой.
Интерферон является гормоноподобным веществом, который вырабатывается лейкоцитами для борьбы с инфекцией. В настоящее время имеются различные виды интерферона. Применение интерферона может вызвать приостановку роста или сокращение лимфомы. Препарат обычно используют в комбинации с химиотерапией.
В настоящее время имеются различные виды интерферона. Применение интерферона может вызвать приостановку роста или сокращение лимфомы. Препарат обычно используют в комбинации с химиотерапией.
Из побочных эффектов лечения интерфероном следует отметить повышенную утомляемость, повышение температуры, озноб, головную боль, боль в мышцах и суставах, изменение настроения.
Моноклональные антитела. Антитела вырабатываются иммунной системой для борьбы с инфекциями. Моноклональные антитела производятся в лабораторных условиях и применяются для борьбы с клетками лимфомы.
При неэффективности стандартной терапии у больных лимфомами в ряде случаев применяют трансплантацию костного мозга или периферических стволовых клеток. Это позволяет использовать высокие дозы химиопрепаратов для уничтожения резистентных опухолевых клеток.
Различают трансплантацию аутологичных (от самого больного) и аллогенных (от донора) клеток костного мозга или периферической крови. Поражение костного мозга или периферической крови лимфомными клетками исключает возможность использования аутологичной трансплантации.
Костный мозг или периферические стволовые клетки получают от больного или донора до начала интенсивной химиотерапии или облучения, а затем вновь возвращают больному после проведенного лечения для восстановления показателей крови. Через 2-3 недели начинают повышаться показатели лейкоцитов, а затем — тромбоцитов и эритроцитов.
Побочные эффекты и осложнения трансплантации костного мозга и периферических стволовых клеток подразделяются на ранние и поздние. Ранние побочные эффекты принципиально не отличаются от таковых при назначении химиотерапии высокими дозами.
Из отдаленных осложнений следует отметить:
- Лучевое повреждение легких, вызывающее одышку
- Болезнь отторжения при аллогенной трансплантации
- Повреждение яичников у женщин, приводящее к бесплодию
- Бесплодие у мужчин
- Повреждение щитовидной железы
- Развитие катаракты
- Поражение костей, вызывающее асептический (не воспалительный) некроз
- Развитие лейкоза
Понимание, где может возникнуть экстранодальная лимфома
Хотя лимфомы — это все виды рака, которые поражают лимфоциты — тип лейкоцитов, — иногда на этом сходство заканчивается. Существует множество различных типов и подтипов лимфомы. Две основные категории — лимфома Ходжкина, или HL, и неходжкинская лимфома, или NHL. Большинство как NHL, так и HL представляют собой узловые лимфомы, что означает, что они возникают в лимфатических узлах. Однако лимфомы могут возникать практически где угодно.Взаимодействие с другими людьми
Существует множество различных типов и подтипов лимфомы. Две основные категории — лимфома Ходжкина, или HL, и неходжкинская лимфома, или NHL. Большинство как NHL, так и HL представляют собой узловые лимфомы, что означает, что они возникают в лимфатических узлах. Однако лимфомы могут возникать практически где угодно.Взаимодействие с другими людьми
FatCamera / Getty Images
Первичная экстранодальная лимфома
Когда считается, что лимфома возникла вне лимфатических узлов , ее называют экстранодальной лимфомой, или, точнее, первичной экстранодальной лимфомой. Иногда бывает трудно определить, где именно в теле началась лимфома. В этих случаях врачи могут следовать более приблизительному определению: Если лимфома когда-то имела большую опухолевую массу — ее наиболее очевидную массу — в экстранодальном участке, то ее можно рассматривать как экстранодальную лимфому.
Важные отличия
Из лимфом, которые начинаются в лимфатических узлах, или узловых лимфом, почти все могут иметь экстранодальных поражений — , то есть они могут распространяться на экстранодальные участки. Лимфома, которая распространяется на другие органы из лимфатических узлов, НЕ считается первичной экстранодальной лимфомой. Чтобы лимфома была первичной экстранодальной, она должна иметь очагов вне лимфатических узлов.
Лимфома, которая распространяется на другие органы из лимфатических узлов, НЕ считается первичной экстранодальной лимфомой. Чтобы лимфома была первичной экстранодальной, она должна иметь очагов вне лимфатических узлов.
Обзор
Первичные экстранодальные лимфомы гораздо чаще встречаются при НХЛ, чем при лимфоме Ходжкина.До 33% всех NHL считается первичной экстранодальной лимфомой, тогда как при HL первичное экстранодальное заболевание считается более редким.
Наиболее частая локализация первичной экстранодальной лимфомы находится в желудочно-кишечном тракте, и почти все из них — НХЛ. Следующим по частоте участком после желудочно-кишечного тракта является кожа. Однако, когда НХЛ начинается только на коже, это называется кожной лимфомой или кожной лимфомой.
Экстранодальная лимфома также может возникать в лимфоидной ткани селезенки, костного мозга, тимуса, миндалин и аденоидов — небольших участков миндалиноподобной ткани, скрытых там, где носовые ходы встречаются с глоткой. Взаимодействие с другими людьми
Взаимодействие с другими людьми
Иммунные или лимфоидные клетки в желудке, легких, структурах вокруг глаз, в щитовидной железе, слюнных железах и тонком кишечнике также могут вызывать первичные лимфомы. Лимфомы в этих областях включают «В-клеточные лимфомы маргинальной зоны ассоциированной со слизистой оболочкой лимфоидной ткани», или для краткости MZBCL MALT.
Первичные лимфомы носа и горла включают MZBCL MALT, диффузную крупную B-клеточную лимфому или DLBCL и лимфомы естественных киллеров / T-клеток.
Первичные лимфомы могут поражать яички у мужчин и называются первичными лимфомами яичек.Лимфома головного мозга или лимфома ЦНС также могут быть первичными. Хотя первичная экстранодальная лимфома головного мозга и яичек связана с заболеванием, которое трудно поддается лечению, недавние исследования показали, что лечение, специально разработанное для этих участков, может привести к значительным улучшениям, особенно при лимфоме яичек.
Первичные экстранодальные фолликулярные лимфомы, не являющиеся лимфомами кожи, возникают довольно редко. Первичная лимфома кости — это редкое заболевание, при котором лимфома начинается в кости.
Первичная лимфома кости — это редкое заболевание, при котором лимфома начинается в кости.
Первичная лимфома сердца — одна из самых редких опухолей сердца. Считается, что первичная сердечная лимфома составляет всего 1,3% всех сердечных опухолей и лишь 0,5% всех экстранодальных лимфом. Когда это действительно происходит, наиболее распространенным типом этой опухоли является диффузная В-клеточная лимфома большого размера и, как правило, правое предсердие. и правый желудочек вовлечены.
Одним из наблюдений первичных экстранодальных лимфом в целом является то, что они резко увеличились с появлением ВИЧ и СПИДа.
Прогноз первичной экстранодальной лимфомы
Тот факт, что лимфома является первичной экстранодальной лимфомой a , может быть фактором плана лечения и прогноза, но другие факторы могут быть не менее важными или иметь большее значение. Подтип лимфомы, тип В-клеток или Т-клеток, а также первичный орган или ткань происхождения могут быть важными прогностическими факторами.
Прогноз экстранодального вовлечения
Почти все узловые лимфомы могут распространяться на экстранодальные участки, но в этих случаях они не считаются первичными экстранодальными лимфомами.
В НХЛ наиболее эффективные планы лечения зависят от ряда факторов, и одним из них может быть экстранодальное вовлечение . Иногда лимфома, ограниченная лимфатическими узлами, более поддается лечению и имеет более благоприятный прогноз, чем лимфома, которая распространилась за пределы лимфатических узлов. Однако широкий спектр возможностей экстранодальной первичной НХЛ — наряду со многими другими факторами, влияющими на лечение и исходы — означает, что план лечения и прогнозы могут быть очень индивидуальными.Взаимодействие с другими людьми
В некоторых случаях экстранодальное поражение является более признаком запущенного заболевания. Например, при болезни Ходжкина экстранодальное поражение — за исключением селезенки и тимуса — указывает на болезнь Ходжкина IV стадии. Однако даже поздняя стадия болезни Ходжкина поддается лечению, а иногда и лечению.
Однако даже поздняя стадия болезни Ходжкина поддается лечению, а иногда и лечению.
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.

- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Обнаружение экстранодальной лимфомы брюшной полости: может помочь позитронно-эмиссионная томография / компьютерная томография
Лечение лимфомы зависит от точного определения стадии лимфомы, в то время как стадии I и II рассматриваются как ограниченное заболевание с местной полевой лучевой терапией в качестве первой линии лечения и стадии III и IV считаются запущенным заболеванием при системном режиме химиотерапии плюс или минус лучевая терапия, которая является методом выбора [8].
Исследование ПЭТ / КТ дает возможность полностью оценить экстранодальную лимфоматозную инфильтрацию и позволяет правильно определить стадию лимфомы; Недавние исследования показывают, что ПЭТ / КТ превосходит КТ в обнаружении экстранодальных заболеваний брюшной полости, особенно селезенки и печени [9].
В этом исследовании для определения стадии использовалась классификация Лугано, рассматривающая поражение селезенки как узловое заболевание; среди двенадцати пациентов с поражением селезенки в этом исследовании ПЭТ / КТ изменили стадию у девяти пациентов (9/12): у шести пациентов с поражением селезенки и косточки (рис.4) и трех пациентов с поражением селезенки и печени, в то время как у трех пациентов (3/12) с поражением узлов и селезенки без влияния на исходную стадию КТ лимфомы [10], во многих других исследованиях селезенка рассматривалась как экстранодальный орган, и в других исследованиях селезенка рассматривалась как узловой орган при болезни Ходжкина и экстранодальный орган при неходжкинской лимфоме [9,10,11].
Рис. 4
У 55-летнего пациента мужского пола с поражением шейных лимфоузлов обнаружена НХЛ, и теперь у него имеется относительное изменение плотности косточки тазовых костей, особенно левой подвздошной кости с нечетко выраженными литическими мозговыми областями (стрелки на рисунке ). ). b Соответствующее аксиальное слитное изображение ПЭТ и ПЭТ / КТ ( c ), показывающее диффузное поглощение ФДГ, особенно в анатомическом месте литических областей левой подвздошной кости (стрелки на c )
). b Соответствующее аксиальное слитное изображение ПЭТ и ПЭТ / КТ ( c ), показывающее диффузное поглощение ФДГ, особенно в анатомическом месте литических областей левой подвздошной кости (стрелки на c )
Лимфома печени , проявленная в нашем исследовании гепатомегалия с множественными узелками составила 6,25% нашего исследования; Manzella et al. [12] указали на различные паттерны лимфомы печени, включая единичное очаговое поражение, множественные очаговые поражения, гепатомегалию и милиарный паттерн, составляющие 15% всех экстранодальных лимфом брюшной полости [12].
По согласованию с Manzella et al. и Ли и др. [13], лимфома желудка и лимфома тонкого кишечника наиболее частыми проявлениями были диффузная инфильтрация с диффузным утолщением стенок, а другие формы инфильтрации желудка и кишечника включали полиповидную массу, диффузную или фокальную инфильтрацию, язвенное поражение или узловатость слизистой оболочки [12,13,14].
Максимальное значение отсечки SUV среди изученных случаев составило 3,5, максимальное значение SUV max было 21 (отмечено при лимфоме желудка), самое низкое максимальное значение SUV было 4. 1 (отмечается при лимфоме надпочечников), а среднее значение SUV составляло 9. Cronin et al. [15], с другой стороны, в его исследовании в основном зависела от визуальной оценки, взяв за эталон поглощение печеночного ФДГ.
1 (отмечается при лимфоме надпочечников), а среднее значение SUV составляло 9. Cronin et al. [15], с другой стороны, в его исследовании в основном зависела от визуальной оценки, взяв за эталон поглощение печеночного ФДГ.
Соображения относительно экономической эффективности не были частью этого исследования, но они будут необходимы, так как они будут играть все возрастающую роль в ближайшем будущем, поскольку клиническая применимость ПЭТ / КТ приведет к изменению стратегии диагностики и лечения онкологические больные [16,17,18].
Диагностика и лечение лимфомы конъюнктивы
Авторы: Джулия Сейн, бакалавр медицины, Александра Стефанович, доктор медицины, и Кэрол Л. Карп, доктор медицины
Под редакцией Ингрид У. Скотт, доктор медицины, магистр здравоохранения, и Шарон Фекрат, доктор медицины
Эта статья опубликована в сентябре 2012 г. и может содержать устаревшие материалы.
Лимфома конъюнктивы — это опухоль на поверхности глаза, которая обычно выглядит как безболезненное, лососево-розовое, «мясистое» пятно. Хотя обычно он имеет гладкую поверхность, он также может проявляться как многоузловое поражение или как фолликулярный конъюнктивит (рис.1).
Хотя обычно он имеет гладкую поверхность, он также может проявляться как многоузловое поражение или как фолликулярный конъюнктивит (рис.1).
P ПРЕДВАРИТЕЛЬНАЯ ПРЕЗЕНТАЦИЯ. Фолликулярная форма лимфомы конъюнктивы. Пациенты часто имеют минимальные симптомы, что приводит к задержке постановки диагноза. |
Глазные лимфомы придатка составляют 2 процента всех неходжкинских лимфом, а конъюнктива является основной областью поражения в 30–40 процентах случаев. Лимфома конъюнктивы составляет около 1.5 процентов опухолей конъюнктивы и, как сообщается, наиболее частое приобретенное субэпителиальное поражение. 1
Эти поражения обычно представляют собой первичные экстранодальные В-клеточные новообразования, хотя от 10 до 30 процентов являются вторичными опухолями у пациентов с диссеминированной лимфомой. В-клеточная лимфома экстранодальной маргинальной зоны слизистой лимфоидной ткани (лимфома MALT-типа) является наиболее распространенным подтипом, за ней следуют фолликулярная и диффузная В-клеточная лимфома большого размера.
В-клеточная лимфома экстранодальной маргинальной зоны слизистой лимфоидной ткани (лимфома MALT-типа) является наиболее распространенным подтипом, за ней следуют фолликулярная и диффузная В-клеточная лимфома большого размера.
Заболеваемость глазными лимфомами MALT растет, с ежегодным увеличением на 6 процентов.Образования двусторонние примерно у 20–38 процентов пациентов. Лимфомы конъюнктивы обычно протекают безболезненно, а изолированное поражение конъюнктивы предвещает лучший прогноз. Однако у 20 процентов пациентов с изначально локализованной лимфомой конъюнктивы в конечном итоге разовьется диссеминированное заболевание. Системное поражение чаще встречается при двусторонних лимфоидных инфильтратах (47 процентов), чем при односторонних лимфоидных инфильтратах (17 процентов). 2
Этиологические факторы
Инфекционный. Одна из гипотез постулирует, что лимфома MALT возникает в результате соматических мутаций во время лимфоцитарного ответа на хроническую антигенную стимуляцию в результате инфекционного или воспалительного процесса с последующими генетическими мутациями, вегетативной пролиферацией и, в конечном итоге, моноклональной трансформацией в лимфому. Микробные и вирусные агенты, такие как Chlamydophila psittaci, Helicobacter pylori, Borrelia burgdorferi, и вирус гепатита С, были связаны с лимфомой MALT с предрасположенностью к различным органам и тканям. 3
Микробные и вирусные агенты, такие как Chlamydophila psittaci, Helicobacter pylori, Borrelia burgdorferi, и вирус гепатита С, были связаны с лимфомой MALT с предрасположенностью к различным органам и тканям. 3
Потенциальная роль C. psittaci (Cp) в патогенезе глазных придатков MALT лимфомы было предложено в различных исследований, проведенных в разных странах, но эта связь остается спорным в связи с различиями в методологии обнаружения и очевидной изменчивости в различных географических регионах по всему миру . 4
Аутоиммунный. Хронические воспалительные состояния, связанные с лимфомой орбиты, включают тиреоорбитопатию, тиреоидит Хашимото, синдром Шегрена и целиакию. 5
Клиническая презентация
Лимфома конъюнктивы преобладает у женщин и чаще всего возникает на пятом-седьмом десятилетии жизни в виде узелкового пятна лососево-розового цвета на конъюнктиве глазного яблока. Пациенты часто имеют минимальные симптомы, что приводит к средней задержке в восемь месяцев между клиническим началом и постановкой диагноза. Различные клинические жалобы включают покраснение конъюнктивы, раздражение и чрезмерное слезоотделение. Пациенты также могут иметь пальпируемое образование, птоз или диплопию.
Диагностика
Дифференциальный диагноз. Должны быть исключены следующие состояния: доброкачественная реактивная лимфоидная гиперплазия, доброкачественные опухоли глазной поверхности (плоскоклеточная папиллома, пиогенная гранулема и лимфангиэктазия), злокачественные опухоли (плоскоклеточный рак и амеланотическая меланома), склерит, эписклерит, эктопический гнойный лакрим. инородное тело, отложение амилоида и хронический фолликулярный конъюнктивит.
Биопсия. При подозрении на диагноз лимфома обязательно отправить свежую ткань на проточную цитометрию и исследования генной реаранжировки в дополнение к анализу фиксированной формалином ткани. Следует сделать биопсию обоих глаз. В клинически не пораженном глазу выполняется биопсия нижнего свода. Клиническое различие между доброкачественной лимфоидной гиперплазией и злокачественными лимфоидными поражениями невозможно; поэтому для установления диагноза необходимы гистопатологическая оценка и иммуногистохимические исследования.
Постановка. Хотя лимфома конъюнктивы обычно проявляется локализованным поражением, у меньшинства пациентов при обращении наблюдается диссеминированное заболевание. Правильная промежуточная оценка включает полный анамнез и физикальное обследование, общий анализ крови, метаболическую панель, уровни лактатдегидрогеназы в сыворотке, электрофорез сывороточного протеина и уровни бета 2 -микроглобулина, компьютерную томографию (шеи, груди, живота и таза), магнитно-резонансная томография (орбиты и головного мозга) и биопсия костного мозга.
Лечение
Индивидуальное лечение зависит от того, локализуется ли опухоль в конъюнктиве или распространяется на другие части тела.
Локализованное заболевание. Основным методом лечения локализованного заболевания является дистанционная лучевая терапия (ДЛТ) с дозой от 30 до 36 грей (Гр), обычно назначаемая 20 порциями по 1,8 Гр в день. Частота полной ремиссии для MALT-лимфомы превышает 90%, с отличным долгосрочным местным контролем у большинства пациентов.Возможные осложнения ДЛТ включают ксерофтальмию, кератит, образование катаракты и ретинопатию. 6
Интерферон альфа-2b представляет собой гликопротеин, продуцируемый лейкоцитами, и обладает как противовирусной, так и противоопухолевой активностью. Было описано несколько случаев полной ремиссии у пациентов после восьми недель внутриочаговых инъекций интерферона альфа-2b при локализованной лимфоме конъюнктивы. 7 Роль препарата ограничена лимфомами низкой степени злокачественности. Побочные эффекты включают гриппоподобные симптомы в течение первой недели после инъекции.
Внутриочаговые инъекции ритуксимаба антитела к CD20 в сочетании с аутологичной сывороткой привели к полной ремиссии в нескольких случаях лимфомы MALT и фолликулярной лимфомы. 8 Для определения роли этого агента в регрессе заболевания необходимо более длительное наблюдение.
Если поражение конъюнктивы относительно невелико и ограничено, может быть достаточно эксцизионной биопсии и тщательного наблюдения. Однако этот подход связан с высоким риском рецидива из-за субклинической инвазии опухоли в окружающие ткани без адъювантного лечения. 6
Системное заболевание. Не существует общепринятого золотого стандарта лечения диссеминированных болезней. Обычно используется ряд отдельных агентов (включая химиотерапию и иммунотерапию), а также режимы комбинированной химиотерапии.
Ритуксимаб показал эффективность при лечении MALT-лимфомы конъюнктивы с частотой ответа от 50 до 87 процентов. Однако среднее время рецидива было менее одного года. 9
Доксициклин считается неэффективным при лечении пациентов с MALT-лимфомой конъюнктивы.В одном проспективном исследовании фазы 2 наблюдалась частичная или полная регрессия MALT-лимфомы конъюнктивы с введением доксициклина у семи из 11 пациентов, которые были Cp -положительными, и у шести из 16, которые были Cp -отрицательными. 10 Однако в более позднем исследовании не сообщалось об обнаружении бактериальной ДНК (из Cp, H. pylori, Escherichia coli, Staphylococcus aureus, или Yersinia pestis ) в лимфомах MALT глазных придатков, что позволяет предположить, что ранее описанный эффект лечение антибиотиками может быть связано с географическими различиями, а также с различиями в методах выявления. 11
Недавнее исследование фазы 2 с использованием таргетной радиоиммунотерапии зевалином (иттриум-90 ибритумомаб тиуксетан) представляет собой многообещающую терапию первой линии для пациентов с экстранодальной B-клеточной лимфомой придатков глаза на ранней стадии. Частота полной ремиссии составила 83% для стадии ИЭ без значительных побочных эффектов или цитопении высокой степени. 12 Случаев дистального (экстраорбитального) рецидива в течение среднего периода наблюдения 20 месяцев не наблюдалось.
(щелкните, чтобы развернуть)
Продолжение
Прогноз первичной локализованной лимфомы конъюнктивы MALT в связи с ее вялотекущим характером в целом благоприятный: пятилетняя выживаемость составляет 93 процента.Поскольку почти у 20 процентов пациентов с лимфомой придаточного канала глаза в конечном итоге развивается диссеминированное заболевание, наблюдение необходимо и его следует продолжать бесконечно. Последующее наблюдение рекомендуется каждые три месяца в течение первого года и каждые шесть месяцев после этого.
История болезни
43-летняя женщина с трехнедельным анамнезом безболезненного розового новообразования на левом глазу была направлена для обследования в глазной институт им. Баскома Палмера. Ее UCVA составлял 20/20 в каждом глазу. Обследование левого глаза с помощью щелевой лампы выявило студенистое поражение лососево-розового цвета в нижнем своде носа, бульбарной конъюнктиве носа (рис. 2А) и верхней носовой части бульбарной конъюнктивы. Фолликулы нижнего свода были видны в правом глазу. Остальная часть обследования прошла нормально.Пальпируемых преаурикулярных, подчелюстных и шейных лимфатических узлов не обнаружено. Биопсия конъюнктивы была выполнена на обоих глазах. Гистологические срезы обоих образцов показали монотонную популяцию преимущественно небольших круглых лимфоцитов с небольшой популяцией цитологически атипичных лимфоцитов. Обнаружено ограничение каппа-легкой цепи, что указывает на моноклональную популяцию В-клеток с положительным CD20. Маркеры CD5, CD10 и CD23 были отрицательными. Эти данные были подтверждены анализом реаранжировки гена, который показал реаранжировку гена иммуноглобулина.Результаты были интерпретированы как лимфома экстранодальной маргинальной зоны (лимфома MALT) на обоих глазах. Наш пациент был направлен к онкологу для обширного обследования; онколог не обнаружил поражения других органов или лимфаденопатии. Она получила внешнюю лучевую терапию в дозе 30 Гр на обе орбиты в течение четырех недель; это хорошо переносилось, с легким отеком век и без жалоб на сухость. Через месяц опухоль значительно уменьшилась (рис.2Б), а зрение не изменилось. Шесть месяцев спустя не было обнаружено никаких признаков опухоли ни в одном глазу, и структура ткани конъюнктивы была нормальной. Она не болела в течение двух лет. |
Сводка
Лимфома конъюнктивы является второй по распространенности опухолью придатков глаза и обычно проявляется в виде пятна лососево-розового цвета на своде глаза. В-клеточная лимфома маргинальной зоны (лимфома MALT-типа) является наиболее частым подтипом, определяемым при биопсии и иммуногистохимических исследованиях.Предполагается, что лимфомы MALT могут быть связаны с хроническими воспалительными или аутоиммунными заболеваниями.
Хотя ДЛТ является основным методом лечения локализованных поражений, другие методы лечения показали свою эффективность в различных отчетах и сериях клинических случаев. Системное лечение химиотерапевтическими агентами предназначено для пациентов с диссеминированным или рецидивирующим заболеванием.
___________________________
Г-жа Сейн — студент-медик, Д-р Стефанович — доцент кафедры клинической медицины и Др.Карп — профессор офтальмологии; все находятся в Университете Майами. Авторы сообщают об отсутствии связанных финансовых интересов.
___________________________
1 Bardenstein DS. Офтальмол Clin North Am . 2005; 18 (1): 187-197.
2 Shields CL et al. Офтальмология . 2001; 108 (5): 979-984.
3 Стефанович А, Лосос И.С. Кровь . 2009; 114 (3): 501-510.
4 Husain A et al. Рак . 2007; 110 (4): 809-815.
5 Nutting CM et al. Глаз . 2006; 20 (6): 645-648.
6 Цай П.С., Колби К.А. Семин офтальмол . 2005; 20 (4): 239-246.
7 Lachapelle KR et al. Arch Ophthalmol . 2000; 118 (2): 284-285.
8 Ferreri AJ et al. Офтальмология . 2011; 118 (1): 24-28.
9 Coupland SE et al. Surv Ophthalmol . 2002; 47 (5): 470-490.
10 Ferreri AJ et al. J Национальный онкологический институт . 2006; 98 (19): 1375-1382.
11 Matthews JM et al. Br J Haematol . 2008; 142 (2): 246-249.
12 Esmaeli B et al. Энн Онкол . 2009; 20 (4): 709-714.
определение экстранодального по Медицинскому словарю
Иммуногистохимически сильно положительный по белку S100 и различным маркерам, особенно CD68 и CD163.2 Безболезненная шейная лимфаденопатия с дополнительными узловыми проявлениями или без них является одним из наиболее частых клинических проявлений.3 Около 40% случаев болезни Розай-Дорфмана имеют экстранодальное поражение с преобладанием головы и шеи. область, край.FDA для своего ингибитора фосфоинозитид-3-киназы (PI3K) дельта, умбралисиб (TGR-1202), для лечения пациентов со всеми тремя типами лимфомы маргинальной зоны (MZL): узловой, экстранодальной и селезеночной MZL. запишите количество исследованных узлов, количество узлов, пораженных опухолью (положительный результат), а также наличие или отсутствие экстранодального распространения (ENE) (Таблица 2). Стадия заболевания, наличие объемного заболевания, экстранодальное поражение, статус работоспособности. Были определены Восточная кооперативная онкологическая группа (ECOG), оценка международного прогностического индекса (IPI), тип применяемого лечения и ответ на лечение всех пациентов.Наиболее распространенная экстранодальная локализация лимфомы Беркитта — около подвздошной кишки или слепой кишки. Первичная экстранодальная неходжкинская лимфома (НХЛ): влияние альтернативных определений, протестированных в Общем регистре НХЛ Западного онкологического центра. КТ для экстраузального определения стадии неходжкинской лимфомы и лимфомы Ходжкина. Более высокие показатели НХЛ у мужчин наблюдаются во всех подтипах, от более распространенных внутриузловых подтипов, таких как диффузная крупноклеточная В-клеточная лимфома (Hedstrom et al., 2015), фолликулярная лимфома (Nabhan et al. al., 2016) и лимфомы из мантийных клеток (Aschebrook-Kilfoy, Caces, Ollberding, Smith, & Chiu, 2013), до самых редких форм экстранодальной НХЛ, таких как первичная лимфома центральной нервной системы (Villano, Koshy, Shaikh, Dolecek, & McCarthy , 2011) и первичной лимфомы желудка (Padhi et al., 2012). Энтеропатия-ассоциированная Т-клеточная лимфома (EATL) — это экстранодальная лимфома с неблагоприятным прогнозом, обусловленная интраэпителиальными Т-лимфоцитами кишечника. с большим прямым разбросом, экспрессирующие CD2 / CD7, CD38, CD56, CD159a, CD161 и человеческий лейкоцитарный антиген-D, но отрицательный по CD34, TDT, CD45, поверхностному CD3, CDd5, CD138, CD19 и CD20, что указывает на экстранодальный NKTCL.DLBCL — это агрессивная (быстрорастущая) лимфома высокой степени злокачественности, которая может возникать в узловых или экстранодальных участках, таких как желудочно-кишечный тракт, яички, щитовидная железа, кожа, грудь, кости или мозг. они представляют собой гетерогенную группу лимфопролиферативных злокачественных новообразований, которые имеют большую склонность к распространению на экстранодальные ткани (1).
Визуализация редкой локализации, экстраузловой лимфомы
[1]
Американское онкологическое общество.Что такое неходжкинская лимфома? www.cancer.org/docroot/CRI/content/CRI_2_4_1X_What_Is_Non_Hodgkins_Lymphoma_32 (по состоянию на 7 марта 2005 г.)
[2]
Шах, Хина Дж. И др. (2017): Диффузная В-клеточная лимфома в эпоху прецизионной онкологии: чем полезна визуализация. Корейский радиологический журнал 18.154–70. ЧВК. Интернет. 1 октября 2018 г. (PMID: 28096718)
[3]
Вивек Вирмани, MD, FRCR, Винита Сетхи, MD, Наджла Фасих, FRCR, JohnRyan, FRCP, CaniaKielar, FRCPC (2014) Шишки и выпуклости брюшной стенки: спектр поперечной визуализации.
Журнал Канадской ассоциации радиологов, том 65, выпуск 1, февраль, страницы 9-18 (PMID: 22884230)
[4]
Ю-Сян Хуан, Сачин С. Сабу, Шри Харша Тирумани, Ашиш Ханделвал (2014).
Злокачественные кожные и подкожные новообразования у взрослых: мультимодальная визуализация с помощью КТ, МРТ и 18F-FDG ПЭТ / КТ-рентгенография, май, том 202, номер 5 (PMID: 24758677)
[5]
Kalender E, Yilmaz M, Erkilic S, Yilmaz M, Celen Z (2011) Двусторонняя кожная диффузная большая B-клеточная лимфома на FDG PET / CT.Clin Nucl Med; 36: e153 – e155 (PMID: 21892030)
[6]
Сон Ын Ан, доктор медицины, Сон Джин Пак, доктор медицины, Сон Кён Мун, доктор Донг Хо, доктор медицины, Джу Вон Лим, доктор медицины (2016 г.), Корреляция опухолей брюшной стенки и массивных повреждений с помощью компьютерной томографии и магнитно-резонансной томографии. J Ultrasound Med; 35: 189–208 (PMID: 26657747)
[7]
Лорен Штайн, Халед М.Эльсайс и Николаус Вагнер-Бартак (2012) Подкожные массы брюшной стенки: радиологическое обоснование. AJR Февраль, том 198, выпуск 2
(PMID: 22268204)
[8]
Beaman FD, Kransdorf MJ, Andrews TR, Murphey MD, Arcara LK, Keeling JH (2007) Поверхностные массы мягких тканей: анализ, диагностика и дифференциальные соображения. RadioGraphics; 27: 509–523 (PMID: 17374866)
[9]
Мэтью П.




 д.;
д.; 2019 Jan;184(1):45-59. doi: 10.1111/bjh.15614. Epub 2018 Nov 8.
2019 Jan;184(1):45-59. doi: 10.1111/bjh.15614. Epub 2018 Nov 8. )
)