Применение Saccharomyces boulardii у детей
Введение
Микрофлора желудочно-кишечного тракта (ЖКТ), так называемая микробиота, представляет собой довольно сложную экосистему, которая сосуществует в равновесии с организмом хозяина. Растет количество данных, подтверждающих, что эта микробиота является основным регулятором иммунной системы, включая и ее внекишечные отделы. Слово «пробиотик» происходит из греческого языка и означает «для жизни». Пробиотики определяют как микроорганизмы (бактерии и дрожжи), устойчивые к перевариванию и достигающие живыми толстого кишечника, которые при употреблении в адекватных количествах оказывают положительное влияние на здоровье хозяина [44]. Еще недавно пробиотики обсуждались в основном в контексте нетрадиционной медицины, а уже сегодня они находят свое применение в обычной медицинской практике [85].
Дрожжи являются частью местной микробной системы, которая составляет < 0,1 % микробиоты. Основными дрожжами, изолируемыми из ЖКТ, является Candida albicans, хотя изредка обнаруживаются и другие дрожжи. Размер клеток дрожжей во много раз больше, чем таковой у бактерий (рис. 1).
Размер клеток дрожжей во много раз больше, чем таковой у бактерий (рис. 1).
Saccharomyces boulardii (S.b.) представляют собой дрожжи, изолируемые из кожуры личи, произрастающего в Индокитае, и принадлежат к тому же самому роду, что и Saccharomyces cerevisiae (S.cerevisiae), хотя перечисленные организмы имеют различные таксономические, физиологические, метаболические и генетические характеристики. Была описана уникальная и специфичная микросателлитная аллель, позволяющая отличить S.b. от штаммов S.cerevisiae [56]. В то время как большинство штаммов S.cerevisiae растет и осуществляет обмен веществ при температуре 30 °С, S.b. являются термотолерантными дрожжами и оптимально растут при температуре 37 °С [45].
Глубокое понимание механизмов действия пробиотиков важно для научного осознания их потенциальных преимуществ. К этим механизмам относят регуляцию кишечного микробного гомеостаза, препятствие способности патогенов образовывать колонии и инфицировать слизистую, модуляцию местного и системного иммунных ответов, стабилизацию барьерной функции желудка и кишечника, ингибирование прокарциногенных ферментов, стимуляцию активности ферментов, облегчающих всасывание и усвоение питательных веществ.
Фармакокинетика и фармакодинамика
В лиофилизированной форме S.b. устойчивы к действию желудочного сока и желчи и сохраняются живыми во всех отделах желудочно-кишечного тракта, если принимаются ежедневно. Лиофилизация подразумевает замораживание препарата и затем его высушивание в вакууме. S.b., кроме того, устойчивы к протеолизу. После 3 дней приема в кишечном содержимом достигается стабильная концентрация данных дрожжей. В течение 1 недели после прекращения приема S.b. они не определяются в кишечнике [11]. Как и все дрожжи, S.b. имеют природную устойчивость к антибиотикам. Одновременный прием амоксициллина и S.b. удваивает их количество, выживающее в ЖКТ [61]. Была обнаружена выраженная корреляция между количеством S.b. в кале и терапевтической активностью у пациентов с рецидивирующей инфекцией Clostridium difficile: у тех больных, у которых не наблюдались рецидивы, была более высокая концентрация S.b. в кале (1 × 106 клеток на грамм) по сравнению с теми, у которых рецидивы были (2,5 × 104 клеток на грамм) [40]. С увеличением вводимой дозы S.b. увеличивалась выживаемость мышей, инфицированных C.difficile [39].
С увеличением вводимой дозы S.b. увеличивалась выживаемость мышей, инфицированных C.difficile [39].
Влияние на кишечные патогены
S.b. оказывают выраженное влияние на желудочно-кишечную микрофлору. Был обнаружен сильный прямой антагонизм S.b. в отношении большого количества патогенов. Исследования in vitro показали, что S.b. подавляют рост C.albicans, Escherichia coli, Shigella, Salmonella typhimurium, Pseudomonas aeruginosa, Staphylococcus aureus и Entamoeba histolytica. В исследованиях in vitro было показано, что S.b. подавляют клеточную инвазию S.typhimurium и Yersinia enterocolitica [31]. S.typhimurium и E.coli серогруппы 0157 связываются с поверхностью S.b. (рис. 1, 2) [47].
В исследованиях in vivo было продемонстрировано, что S.b. у крыс значительно уменьшают количество E.histolytica и тяжесть симптомов [74]. У мышей S.b. уменьшают количество C.albicans в 20–50 раз, снижают смертность мышей, инфицированных вирулентными штаммами S.typhimurium и Shigella [76]. По результатам исследования Т84-клеток, инфицированных энтеропатогенными штаммами E.coli, был сделан вывод, что S.b. способны увеличивать трансэпителиальную резистентность к патогенам посредством поддержания целостности плотных контактов [29] Предварительные данные Brunser свидетельствуют о том, что S.b. нарушают структуру Helicobacter pylori (рис. 3) [13].
По результатам исследования Т84-клеток, инфицированных энтеропатогенными штаммами E.coli, был сделан вывод, что S.b. способны увеличивать трансэпителиальную резистентность к патогенам посредством поддержания целостности плотных контактов [29] Предварительные данные Brunser свидетельствуют о том, что S.b. нарушают структуру Helicobacter pylori (рис. 3) [13].
В ряде исследований в моделях на животных и/или клеточных моделях было выявлено два основных механизма действия S.b. против кишечных патогенов: продукция факторов, которые конкурируют с бактериальными токсинами, и модуляция сигнальных путей клеток хозяина, вовлеченных в провоспалительный ответ при бактериальной инфекции [30].
Секреция ферментных белков
S.b. продуцируют два белка: один массой 120 кДа, другой — 54 кДа. Белок весом 54 кДа является серин-протеазой и ингибирует энтеротоксическую и цитотоксическую активность C.difficile путем протеолиза токсина А и его рецепторов. Pothoulakis и соавт. показали in vivo, что этот белок тормозит секрецию воды и электролитов, но не влияет на клеточные повреждения, вызванные C.difficile [24, 72]. Тем не менее кишечная проницаемость для маннитола в присутствии S.b. снижается на 93 %. Castagliuolo и соавт. показали, что протеаза массой 54 кДа тормозит связывание токсинов А и В со своими рецепторами на мембранах кишечных ворсинок [25, 26, 74].
показали in vivo, что этот белок тормозит секрецию воды и электролитов, но не влияет на клеточные повреждения, вызванные C.difficile [24, 72]. Тем не менее кишечная проницаемость для маннитола в присутствии S.b. снижается на 93 %. Castagliuolo и соавт. показали, что протеаза массой 54 кДа тормозит связывание токсинов А и В со своими рецепторами на мембранах кишечных ворсинок [25, 26, 74].
Белок массой 120 кДа не обладает протеолитической активностью. Он специфически препятствует развитию гиперсекреции, вызванной токсинами Vibrio cholera, путем снижения концентрации циклического аденозинмонофосфата (цАМФ) в кишечных клетках. Метаболические изменения в слизистой оболочке кишечника, вызванные холерным токсином, уменьшаются в том случае, если S.b. принимаются до воздействия холерного токсина. Белок массой 120 кДа оказывает прямое воздействие на энтероциты и затрагивает пути сигнальной трансдукции, вовлеченные в регуляцию секреции [32].
Кроме вышеперечисленных белков, S.b. синтезируют фосфатазу, которая дефосфорилирует эндотоксины, такие как липополисахарид E. coli 055B5, и инактивируют их цитотоксические эффекты [22].
coli 055B5, и инактивируют их цитотоксические эффекты [22].
Влияние на кишечный тракт
Трофические эффекты
У здоровых взрослых волонтеров S.b. не влияли на толщину слизистой оболочки тонкого кишечника. Однако наблюдалось увеличение исходной энзиматической активности лактазы, альфа-глюкозидазы, щелочной фосфатазы. S.b. стимулируют экспрессию дисахаридаз — ферментов, вовлеченных в переваривание пищи (рис. 4).
S.b. столь интенсивно стимулируют секрецию сахаразы, что могут использоваться в лечении врожденной недостаточности сахаразы-изомальтазы [19]. Относительно недавно была обнаружена способность секретировать внутрь просвета кишечника лейцинаминопептидазу (принадлежит к семейству цинк-металлопротеаз), что способствует усилению протеолиза [21]. После проксимальной энтерэктомии S.b. улучшают абсорбцию D-глюкозы более чем на 50 % [20].
S.b. стимулируют продукцию гликопротеинов в щеточной кайме микроворсинок, например гидролаз, транспортеров, секреторных IgA, рецепторов для полимерных иммуноглобулинов [15].
Одним из наиболее значимых и специфичных механизмов действия является способность S.b. индуцировать и стимулировать продукцию кишечных полиаминов. Такие полиамины, как спермидин, спермин и путресцин, усиливают экспрессию ферментов щеточной каймы (гидролаз, протеаз и транспортных молекул) [18].
Противовоспалительный и иммунологический эффект
Врожденная иммунная система является первым звеном защиты против микробной агрессии. Пробиотики снижают воспаление путем оказания позитивного воздействия на дисфункцию эпителиальных клеток и иммунной системы слизистой оболочки, которая составляет основу воспалительного процесса. Пептидогликаны, липополисахариды и липотейхоевая кислота, присутствующие в бактериях, а также фосфолипоманнан, фосфопептидоманнан и гликан, присутствующие в дрожжах, являются патоген-ассоциированными антигенами и распознаются разными рецепторами, что и может обусловливать различный иммунный ответ на эти микроорганизмы [59].
S. b. снижают апоптоз энтероцитов, возможно, путем снижения синтеза TNFα [33].
b. снижают апоптоз энтероцитов, возможно, путем снижения синтеза TNFα [33].
Введение S.b. приводит к увеличению выработки регуляторных цитокинов, которые играют большую роль в реализации их протективных эффектов, что, по всей видимости, осуществляется путем взаимодействия с дендритными клетками, которые продуцируют регуляторные цитокины или стимулируют Т-клетки с подобными свойствами. Недавно было показано, что S.b. тормозят активацию Т-клеток, ранее не контактировавших с ангигеном, которая запускается дендритными клетками [6], модифицируют миграцию лимфоцитов в модели хронической ВБК [34]. S.b. модифицируют способность лимфоцитов прикрепляться к эндотелиальным клеткам, приводя к улучшению их миграции и адгезии [34].
Экспериментальные исследования, выполненные в последние годы, подтвердили противовоспалительные свойства S.b. в различных моделях воспаления (мыши, инфицированные C.albicans [60] или Citrobacter rodentium [90], клетки Т84, инфицированные S.flexneri [69]).
S. b. заметно стимулируют секрецию IgA, что подтверждается увеличением содержания данного иммуноглобулина в просвете кишечника и клетках крипт. Этот эффект может быть объяснен трофическим влиянием на слизистую оболочку или прямой иммуностимуляцией (рис. 6) [15].
b. заметно стимулируют секрецию IgA, что подтверждается увеличением содержания данного иммуноглобулина в просвете кишечника и клетках крипт. Этот эффект может быть объяснен трофическим влиянием на слизистую оболочку или прямой иммуностимуляцией (рис. 6) [15].
Клиническое применение S.b.
Все больше и больше положительных эффектов для здоровья связывают с приемом пробиотиков [1, 80]. Однако только некоторые из них подтверждены в хорошо спланированных и выполненных рандомизированных контролируемых исследованиях (РКИ). Причем в детской популяции этих исследований еще меньше.
Острая диарея
Диарея определяется как изменение подвижности кишечника с увеличением содержания воды, объема и частоты стула [73, 88]. В подавляющем большинстве случаев острая диарея является результатом кишечной инфекции — в развитых странах преимущественно вирусной этиологии. Основная терапия при дегидратирующем гастроэнтерите сводится к пероральной регидратации. Однако восполнение воды и электролитов не приводит ни к существенному укорочению эпизодов диареи, ни к уменьшению объема стула. Поэтому сегодня растет интерес к поиску дополнительных видов терапии острой диареи.
Однако восполнение воды и электролитов не приводит ни к существенному укорочению эпизодов диареи, ни к уменьшению объема стула. Поэтому сегодня растет интерес к поиску дополнительных видов терапии острой диареи.
S.boulardii в лечении острой диареи
Цель одного из метаанализов сводилась к оценке эффективности S.b. в лечении острой инфекционной диареи у детей [81]. Для поиска исследований, посвященных острой инфекционной диарее и S.b., в августе 2006 г. были просмотрены следующие электронные базы публикаций: MEDLINE, EMBASE, CINAHL и Кокрановская библиотека; дополнительные источники были взяты из обзорных статей. В результате в метаанализ были включены данные из пяти РКИ (всего 619 больных) (рис. 7) [10, 27, 54, 63, 86].
Комбинированные данные из четырех РКИ показали, что S.b. значительно снижают длительность диареи по сравнению с контролем, значительно снижали риск развития диареи на 3, 6 и 7-й день. Вдобавок риск того, что диарея будет длиться > 7 дней, был достоверно снижен в группе S. b. по сравнению с контрольной группой. Таким образом, метаанализ РКИ показал, что у детей с острым инфекционным гастроэнтеритом применение S.b. по сравнению с контролем (стандартной терапией) приводит к росту лечебного эффекта (рис. 8).
b. по сравнению с контрольной группой. Таким образом, метаанализ РКИ показал, что у детей с острым инфекционным гастроэнтеритом применение S.b. по сравнению с контролем (стандартной терапией) приводит к росту лечебного эффекта (рис. 8).
В рамках РКИ, которое было выполнено в Мьянме [58] и включало 100 детей с острой диареей, S.b. снижали длительность диареи по сравнению с плацебо (3,08 ± 0,95 против 4,68 ± 1,23 дня соответственно).
Принимая во внимание эти новые данные, вышеупомянутый метаанализ был выполнен еще раз. Исходя из обобщенных результатов шести РКИ, включавших 756 детей, было обнаружено, что S.b. снижали длительность диареи на сутки по сравнению с плацебо. Таким образом, данные свидетельствуют о том, что S.b. эффективны в лечении детей с острым гастроэнтеритом.
S.boulardii в профилактике острой диареи
В РКИ из Пакистана, включавшем 100 детей с острой водной диареей, было сообщено о достоверном различии в частоте эпизодов диареи в течение 2 месяцев наблюдения в группе, получавшей S. b., по сравнению с контрольной группой (0,32 против 0,56, р = 0,04) (рис. 9) [10].
b., по сравнению с контрольной группой (0,32 против 0,56, р = 0,04) (рис. 9) [10].
Персистирующая диарея
Большинство эпизодов диареи длятся менее 1 недели, однако у некоторых детей может развиваться персистирующая диарея. ВОЗ определяет это состояние как эпизод, который начинается остро, но длится до 14 дней или более. Основная опасность персистирующей диареи сводится к недостаточному питанию и развитию тяжелых некишечных инфекций [87]. Заболеваемость и смертность от персистирующей диареи, а также масштабы проблемы, особенно в развивающихся странах, оправдывают попытки повысить эффективность терапии данного заболевания.
В исследовании, выполненном на Кубе [26], 40 детей в возрасте от 6 до 36 месяцев с диареей длительностью 3–4 недели были рандомизированы к получению S.boulardii в дозе 500 мг/день (n = 20) или плацебо (n = 20).
Курс лечения составил 1 месяц. До начала исследования все пациенты получали либо тинидазол по поводу Giardia lamblia (87,5 %), либо триметоприм плюс сульфаметоксазол по поводу Shigella. Обе группы имели одинаковые исходные характеристики. К концу исследования процент детей с 1–3 дефекациями в день был достоверно выше в группе S.b. по сравнению с плацебо-группой (65 против 15 %). Большее число пациентов в группе S.b. имели гистологически нормальную слизистую оболочку (35 против 15 %).
Обе группы имели одинаковые исходные характеристики. К концу исследования процент детей с 1–3 дефекациями в день был достоверно выше в группе S.b. по сравнению с плацебо-группой (65 против 15 %). Большее число пациентов в группе S.b. имели гистологически нормальную слизистую оболочку (35 против 15 %).
Таким образом, результаты свидетельствуют о том, что S.b. полезны при лечении персистирующей диареи у детей. Однако необходимо провести более крупные исследования, для того чтобы определить, будет ли монотерапия S.b. достаточно эффективной для лечения персистирующей диареи у детей.
Безопасность
Ни в одном из исследований не было отмечено побочных эффектов при использовании S.boulardii. Однако следует с осторожностью использовать S.boulardii у пациентов с центральным венозным катетером [5, 75, 91]. О спорадических случаях фунгемии сообщалось, однако они наблюдались у пациентов с тяжелыми общими или кишечными заболеваниями, у которых был поставлен постоянный венозный катетер и не было точно определено, вызвана фунгемия S. boulardii или S.cerevisiae [52, 55]. Следует помнить, что S.cerevisiae также могут быть ответственными за значительную часть этих фунгемий.
boulardii или S.cerevisiae [52, 55]. Следует помнить, что S.cerevisiae также могут быть ответственными за значительную часть этих фунгемий.
Насколько известно автору, о случаях фунгемии S.boulardii не было сообщено в амбулаторной практике у пациентов с нормальным функционированием иммунной системы.
Рекомендации европейских педиатрических обществ
Экспертная рабочая группа Европейского общества детской гастроэнтерологии, гепатологии и питания (ESPGHAN) и Европейского общества детских инфекций рассмотрела вопрос о клинической эффективности пробиотиков в лечении острых гастроэнтеритов [53]. Она пришла к выводу, что отдельные пробиотики могут быть эффективной дополнительной терапией при лечении острой диареи. Однако поскольку в отношении многих препаратов нет доказательств их эффективности, в качестве дополнительной терапии к пероральной регидратации у детей с острым гастроэнтеритом рекомендуют использовать только те штаммы пробиотиков, клиническая эффективность которых доказана, при этом должен быть правильно соблюден дозовый режим. Примерами подобных пробиотиков являются L.rhamnosus GG и S.boulardii.
Примерами подобных пробиотиков являются L.rhamnosus GG и S.boulardii.
К настоящему времени накоплены данные, которые подтверждают целесообразность применения S.boulardii для лечения острых гастроэнтеритов и предотвращения антибиотик-связанной диареи у детей.
Перевод А.В. Савустьяненко
Впервые опубликовано в Eur. J. Pediatr. — 2009. — 168. — 253-65 (публикуется с сокращениями)
Инфекционный эндокардит: диагностика и лечение | Белобородов В.Б.
Кафедра инфекционных болезней РМАПО, Москва
Классическими признаками инфекционного эндокардита (ИЭ) являются: поражение клапанов сердца, бактериемия или фунгемия, эмболии и аутоиммунные поражения сосудов. Не все эти симптомы могут присутствовать одновременно, часть их может быть слабо выражена или отсутствовать вовсе, что значительно осложняет проведение диагностики и лечения заболевания [1].
Клиническая диагностика ИЭ предполагает использование алгоритма, предложенного исследователями из Duke University [2]. Основными критериями Duke являются морфологические признаки ИЭ, полученные при операции на сердце или аутопсии, достоверные микробиологические при знаки (гемокультура) и дан ные эхокардиограммы (ЭхоКГ). Шесть менее специфических признаков ИЭ составляют дополнительные критерии: длительная бактериемия, лихорадка, массивная эмболия, неэмболические поражения сосудов, предрасполагающие заболевания клапанов, внутривенная наркомания и признаки на ЭхоКГ (нетипичная картина функционирования клапанов и вегетаций на них, признаки абсцессов). Клиническая диагностика требует либо наличия 2 основных критериев, либо 1 главного и 3 дополнительных, либо 5 дополнительных.
Основными критериями Duke являются морфологические признаки ИЭ, полученные при операции на сердце или аутопсии, достоверные микробиологические при знаки (гемокультура) и дан ные эхокардиограммы (ЭхоКГ). Шесть менее специфических признаков ИЭ составляют дополнительные критерии: длительная бактериемия, лихорадка, массивная эмболия, неэмболические поражения сосудов, предрасполагающие заболевания клапанов, внутривенная наркомания и признаки на ЭхоКГ (нетипичная картина функционирования клапанов и вегетаций на них, признаки абсцессов). Клиническая диагностика требует либо наличия 2 основных критериев, либо 1 главного и 3 дополнительных, либо 5 дополнительных.
Критерии Duke при диагнозе “определенно ИЭ” имеют предсказательный уровень 98%, специфичность составляет 99%, а эффективность диагностики – 72–70% по сравнению с клинической оценкой экспертов-инфекционистов [3, 4]. Применение новых дополнительных критериев (спленомегалии, микрогематурии, СОЭ, уровня С-реактивного белка) позволило дополнительно диагностировать ИЭ в 10% случаев.
Эхокардиография (ЭхоКГ), не являясь обязательным скрининговым тестом у пациентов с лихорадкой и позитивной гемокультурой, должна проводиться при подозрении на ИЭ. Характерные вегетации, абсцессы, вновь появляющиеся изменения искусственных клапанов и признаки недостаточности клапанов являются 4 основными признаками ИЭ (см. определение терминологии).
Трансторакальная ЭхоКГ (ТЭхоКГ) является важнейшим методом диагностики и эффективно выявляет 98% вегетаций более 2 мм в диаметре. Однако чувствительность ТЭхоКГ в отношении выявления всех вегетаций составляет менее 60%. Результаты могут оказаться неадекватными у 20% взрослых больных из-за избыточной массы тела, хронических обструктивных заболеваний легких, деформации грудной клетки. При низком риске ИЭ (энтерококковая бактериемия с первичным фокусом без других признаков ИЭ) проведенная на должном уровне ТЭхоКГ позволяет исключить наличие ИЭ [5].
В отсутствие эффекта антибактериальной терапии и при подозрении на развитие осложнений показано проведение трансэзофагеальной ЭхоКГ (ТЭЭхоКГ). Преимущества ТЭЭхоКГ определяются высокой чувствительностью (76–100%) и специфичностью (94%) выявления инфекций клапанного кольца. Расположение датчика в пищеводе позволяет лучше визуализировать ИЭ искусственных клапанов с чувствительностью 86–94% и специфичностью 88–100%. Недостаточность искусственных клапанов значительно лучше выявляется из-за отсутствия интерференции их структур с допплеровским сигналом. При использовании ТЭЭхоКГ из двух проекций увеличивается выявление растущих вегетаций и их подвижности. Причинами ложноотрицательных результатов ТЭЭхоКГ могут быть вегетации и абсцессы меньше предела разрешения метода и предшествующая эмболия вегетациями.
Преимущества ТЭЭхоКГ определяются высокой чувствительностью (76–100%) и специфичностью (94%) выявления инфекций клапанного кольца. Расположение датчика в пищеводе позволяет лучше визуализировать ИЭ искусственных клапанов с чувствительностью 86–94% и специфичностью 88–100%. Недостаточность искусственных клапанов значительно лучше выявляется из-за отсутствия интерференции их структур с допплеровским сигналом. При использовании ТЭЭхоКГ из двух проекций увеличивается выявление растущих вегетаций и их подвижности. Причинами ложноотрицательных результатов ТЭЭхоКГ могут быть вегетации и абсцессы меньше предела разрешения метода и предшествующая эмболия вегетациями.
Многопозиционные комбинации ТЭЭхоКГ и ТЭхоКГ позволяют повысить достоверность исследования в сложных ситуациях. При отрицательном результате одновременного применения обоих видов исследований вероятность ИЭ составляет не более 5%. Считается, что ТЭЭхоКГ должна рассматриваться как часть раннего обследования пациентов с бактериемий S. aureus [6].
aureus [6].
Если вероятность ИЭ остается высокой, а результаты ТЭЭхоКГ оказались отрицательными, повторное исследование необходимо проводить через 7–10 дней, когда могут проявиться не видимые ранее вегетации. Повторная ЭхоКГ в процессе терапии способствует дополнительному выявлению вегетаций в 59% случаев. Увеличение размера вегетаций на фоне лечения указывает на высокую вероятность развития осложнений.
Длительная бактериемия и высокая частота выделения гемокультур являются типичными для ИЭ. В крупном исследовании было показано, что из 95% посевов крови был выделен возбудитель. Интенсивность бактериемии не всегда бывает высокой, у большинства пациентов обнаружено менее 50 колониеобразующих единиц в 1 мл крови. Наиболее частыми возбудителями ИЭ были стрептококки, энтерококки, стафилококки и грибы [7].
Бактериологического подтверждения не получено у 5% пациентов с диагнозом “определенно ИЭ” по критериям Duke. Это может быть связано с применением антибиотиков до сбора крови, нарушением правил сбора и хранения образцов, погрешностями микробиологической техники, инфицированностью бактериями, требующими необычных условий культивирования, или небактериальными возбудителями. Посев крови необходимо проводить в течение 1 ч трижды в 2 флакона (1 флакон для аэробов и 1 – для анаэробов при каждом посеве). Кровь должна быть внесена во флакон по крайней мере в отношении 1:5 (или согласно инструкции), с указанием в сопроводительном документе и предполагаемого диагноза – “ИЭ”. При указании этого диагноза необходимо удлинить период микробиологического исследования. При отсутствии роста через 48–72 ч инкубация образцов должна продолжаться не менее 2–3 нед.
Посев крови необходимо проводить в течение 1 ч трижды в 2 флакона (1 флакон для аэробов и 1 – для анаэробов при каждом посеве). Кровь должна быть внесена во флакон по крайней мере в отношении 1:5 (или согласно инструкции), с указанием в сопроводительном документе и предполагаемого диагноза – “ИЭ”. При указании этого диагноза необходимо удлинить период микробиологического исследования. При отсутствии роста через 48–72 ч инкубация образцов должна продолжаться не менее 2–3 нед.
Применение антибиотиков до взятия посевов крови снижает частоту выявления бактериемии до 35–45%. Прекращение антибактериальной терапии в первые дни лечения для проведения повторных посевов крови в течение 2–4 дней не ухудшало состояния пациентов с ИЭ и не увеличивало показателей летальности. Однако это можно рекомендовать при отсутствии тяжелой интоксикации, прогрессирующего поражения клапанов и застойной сердечной недостаточности.
Выделение некоторых возбудителей ИЭ затруднительно проводить в обычной клинической микробиологической лаборатории. Это связано с необходимостью применения специального оборудования, селективных сред, тканевых культур и методов выращивания (HACEK, Bartonella spp., Brucella spp., Coxiella burnetti). Некоторые гри бы, возбудители ИЭ, почти никогда не выделяются из крови (род Aspergillus), другие выделяются спорадически (Candida, Сryptococcus neoformans и др.). Для ряда возбудителей ИЭ (бруцеллы, бар тонеллы и хламидии) серологическая диагностика остается важнейшим методом подтверждения этиологии [8].
Это связано с необходимостью применения специального оборудования, селективных сред, тканевых культур и методов выращивания (HACEK, Bartonella spp., Brucella spp., Coxiella burnetti). Некоторые гри бы, возбудители ИЭ, почти никогда не выделяются из крови (род Aspergillus), другие выделяются спорадически (Candida, Сryptococcus neoformans и др.). Для ряда возбудителей ИЭ (бруцеллы, бар тонеллы и хламидии) серологическая диагностика остается важнейшим методом подтверждения этиологии [8].
В дополнение к микробиологическому и серологическому исследованию крови, посев тканей клапанов или эмболизированных сосудов также может помочь в выделении возбудителя. Световая и электронная микроскопия с флюоресцентными антительными метками, молекулярная диагностика специфических фрагментов ДНК и РНК являются перспективными диагностическими методами. Использование полимеразной цепной реакции (ПЦР) позволяет проводить диагностику таких возбудителей ИЭ, как Tropherema whipelli и Bartonella sp. [9].
[9].
Этиология и антибиотикотерапия
Стрептококки
Стрептококки вызывают до 55% всех случаев ИЭ. Примерно 35% из них составляет зеленящий стрептококк. Из-за низкой вирулентности зеленящий стрептококк вызывает ИЭ уже поврежденных клапанов, процесс принимает подострое или хроническое течение, разрушение клапанов происходит медленно. Учитывая высокую чувствительность стрептококков к пенициллину, уже в течение многих лет общепринятой схемой лечения является применение высоких доз пенициллина (12 000 000 – 18 000 000 ЕД/сут в виде 4 внутривенных инфузий в течение 4–6 нед). Имеются сведения о применении комбинации пенициллина с аминогликозидами (1 мг/кг гентамицина через 8 ч внутримышечно в течение 2 нед). Целесообразность такой комбинации вызывает сомнения, особенно у пациентов после 3 мес терапии пенициллином и при наличии противопоказаний к применению аминогликозидов. В случаях неосложненного течения ИЭ доказана эффективность цефтриаксона (2 г внутривенно или внутримышечно 1 раз в сутки в течение 4 нед).
Энтерококки (стрептококки группы D) являются причиной 10% ИЭ, такой же “вклад” вносят другие негемолитические стрептококки. Обычно энтерококки чувствительны к пенициллину и лечение проводится по указанной выше схеме.
Однако некоторая часть энтерококков устойчива к пенициллинам и цефалоспоринам. В этих случаях применяют ванкомицин (90-минутная внутривенная инфузия 1 г препарата через 12 ч). Длительность применения препарата определяется динамикой клинических и ЭхоКГ-данных и составляет 4–6 нед. К настоящему времени имеются сообщения об энтерококках, резистентных к ванкомицину и другим гликопептидам. Консервативная терапия таких ИЭ не имеет реальных перспектив, и пациентов необходимо оперировать.
Стафилококки
Стафилококки являются этиологической причиной 35% всех ИЭ. Острый ИЭ с генерализованным воспалением и быстрым разрушением клапанов обычно вызывают S. aureus. Стандартным лечением является применение оксациллина (по 2 г через 4 ч внутривенно в течение 4 нед). В случае резистентности к оксациллину или метициллину рекомендуется применять рифампицин (по 400–600 мг внутривенно капельно через 12 ч в течение 4 нед) или ванкомицин (по 1 г в виде 60–90-минутной внутривенной инфузии через 12 ч в течение 4 нед).
aureus. Стандартным лечением является применение оксациллина (по 2 г через 4 ч внутривенно в течение 4 нед). В случае резистентности к оксациллину или метициллину рекомендуется применять рифампицин (по 400–600 мг внутривенно капельно через 12 ч в течение 4 нед) или ванкомицин (по 1 г в виде 60–90-минутной внутривенной инфузии через 12 ч в течение 4 нед).
До недавнего времени коагулазонегативные стафилококки (CNS) считались наиболее частыми возбудителями ИЭ искусственных клапанов, однако в последнее десятилетие показано первичное поражение клапанов у пациентов с пролапсом митрального клапана. Среди CNS важную роль играет S.lugdunensis, однако его идентификация затруднительна в условиях обычной лаборатории и требует направления образцов в референтную лабораторию. Этот возбудитель способен вызывать более острые формы ИЭ с поражением клапанного кольца и метастатическими очагами в другие органы. Большинство экспертов рекомендуют лечить эти ИЭ стандартными схемами антибиотиков с учетом чувствительности штаммов in vitro. Другим частым возбудителем ИЭ из группы CNS является S.epidermidis. Учитывая результаты мониторинга, эмпирическую терапию рекомендуют проводить ванкомицином (по 1 г в виде 60-минутной внутривенной инфузии через 12 ч) до определения чувствительности к антибиотикам и выбора целенаправленной терапии.
Другим частым возбудителем ИЭ из группы CNS является S.epidermidis. Учитывая результаты мониторинга, эмпирическую терапию рекомендуют проводить ванкомицином (по 1 г в виде 60-минутной внутривенной инфузии через 12 ч) до определения чувствительности к антибиотикам и выбора целенаправленной терапии.
Синегнойная палочка
Большинство случаев ИЭ, вызываемых Pseudomonas spp., приходится на P.aeruginosa и возникает у наркоманов, при внутривенном введении наркотических средств, или при внутрибольничной инфекции. Как правило, ИЭ клапанов правого сердца не требует хирургического лечения. Обычно используют комбинации высоких доз пенициллинов с антисинегнойной активностью (например, пиперациллин 18 г/сут) с аминогликозидами (тобрамицин 5–8 мг/кг/сут) курсом до 6 нед. Однако недостаточная эффективность такой комбинации может выявляться в течение 7–10 сут лечения при отсутствии снижения активности воспаления и позитивной динамики процесса на клапанах (по данным ЭхоКГ). В этих случаях необходимо применять карбапенемы, доза которых зависит от тяжести инфекции и составляет от 500 мг 2 раза в сутки внутримышечно до 500 мг 3–4 раза в сутки внутривенно (имипенем). Применение карбапенемов особенно актуально при ИЭ клапанов левого сердца, так как именно недостаточная эффективность антибактериальной терапии приводит к быстрому разрушению клапанов и требует хирургического лечения. Карбапенемы эффективны против широкого спектра патогенных микроорганизмов (грамотрицательных аэробных бактерий, грамотрицательных анаэробных бактерий, грамположительных аэробных и анаэробных бактерий), что делает их особенно полезными при лечении полимикробных и смешанных аэробных/анаэробных инфекциях.
В этих случаях необходимо применять карбапенемы, доза которых зависит от тяжести инфекции и составляет от 500 мг 2 раза в сутки внутримышечно до 500 мг 3–4 раза в сутки внутривенно (имипенем). Применение карбапенемов особенно актуально при ИЭ клапанов левого сердца, так как именно недостаточная эффективность антибактериальной терапии приводит к быстрому разрушению клапанов и требует хирургического лечения. Карбапенемы эффективны против широкого спектра патогенных микроорганизмов (грамотрицательных аэробных бактерий, грамотрицательных анаэробных бактерий, грамположительных аэробных и анаэробных бактерий), что делает их особенно полезными при лечении полимикробных и смешанных аэробных/анаэробных инфекциях.
Грибы
Candida и Aspergillus является наиболее частыми возбудителями грибковых ИЭ. Наркоманы, принимающие наркотики внутривенно, реципиенты искусственных клапанов сердца и пациенты с длительной катетеризацией центральных вен составляют группу высокого риска в отношении развития ИЭ. Эта этиология ИЭ должна быть заподозрена при отрицательных посевах крови, наличии крупных вегетаций, инфекционных метастатических очагов, поражения клапанного кольца, эмболии крупных сосудов. Амфотерицин В является единственным препаратом фунгицидного действия, однако из-за плохого проникновения в вегетации часто требуется имплантация искусственных клапанов и одновременная терапия амфотерицином В (5 мг/кг/сут внутривенно капельно, продолжительность применения не определена). Эффективность имидазолов (флюконазол и итраконазол) в лечении ИЭ пока еще не доказана, хотя имеются описания случаев эффективной длительной терапии у взрослых пациентов при невозможности хирургического лечения.
Эта этиология ИЭ должна быть заподозрена при отрицательных посевах крови, наличии крупных вегетаций, инфекционных метастатических очагов, поражения клапанного кольца, эмболии крупных сосудов. Амфотерицин В является единственным препаратом фунгицидного действия, однако из-за плохого проникновения в вегетации часто требуется имплантация искусственных клапанов и одновременная терапия амфотерицином В (5 мг/кг/сут внутривенно капельно, продолжительность применения не определена). Эффективность имидазолов (флюконазол и итраконазол) в лечении ИЭ пока еще не доказана, хотя имеются описания случаев эффективной длительной терапии у взрослых пациентов при невозможности хирургического лечения.
Заключение
Количество больных ИЭ возрастает, ежегодно выявляют 15–20 тыс. новых случаев. ИЭ занимает 4-е место по летальности после сепсиса, пневмонии и абдоминального хирургического сепсиса. Оптимизация диагностики, антимикробной терапии и хирургической тактики позволила достигнуть некоторого снижения заболеваемости и летальности от ИЭ, тем не менее ИЭ остается жизнеугрожающим заболеванием.
Использование критериев Duke в сочетании с ЭхоКГ позволяет улучшить диагностику ИЭ и его осложнений. Эффективная антибактериальная терапия ИЭ позволяет предупреждать развитие основных осложнений этого заболевания (сердечная недостаточность, инфекции клапанного кольца и окружающих тканей, абсцессы селезенки и микотические аневризмы), играет важную роль в улучшении исходов заболевания в целом. Увеличение частоты случаев ИЭ и связанной с ними летальности делает необходимым разработку прогностических критериев, совершенствование лечения и определение финансовых затрат, связанных с ИЭ.
Список литературы Вы можете найти на сайте http://www.rmj.ru
Литература
1. Bayer A.S., Bolger A.F., Taubert K.A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation. 1998; 98: 2936–48.
2. Durack D.T., Lukes A.S., Bright D.K. New criteria for diagnosis of infective endocarditis: utilisation of specific echocardiographic findings: Duke Endocarditis Service. Am J Med 1994; 96: 200–9.
Am J Med 1994; 96: 200–9.
3. Hoen B., Selton-Suty C., Danchin N. et al. Evaluation of the Duke criteria versus the Beth Israel criteria for the diagnosis of infective endocarditis. Clin Infect Dis. 1995; 21: 905–9.
4. Heiro M., Nikoskelainen J., Hartiala J.J., et al. Diagnosis of infective endocarditis: sensitivity of the Duke vs. von Reyn criteria. Arch Intern Med. 1998; 158: 18–24.
5. Daniel W.G., Mugge A., Grote J. et al. Comparison of transthoracic and transesophageal echocardiography for detection of abnormalities of prosthetic and bioprosthetic valves in the mitral and aortic positions. Am J Cardiol. 1993; 71: 210–5.
6. Birmingham G.D., Rahko P.S., Ballantyne F. III. Improved detection of infective endocarditis with transesophageal echocardiography. Am Heart J. 1992; 123: 774–7 S 1.
7. Ali A.S., Trivedi V., Lesch M. Culture-negative endocarditis: a historical review and 1990s update. Prog Cardiovasc Dis. 1994; 37: 149–60.
8. Shapiro D.S., Kenney S.C., Johnson M. et al. Brief report: Chlamydia psittaci endocarditis diagnosed by blood culture. N Engl J Med. 1992; 326: 1192–5.
9. Hamed K.A., Dormitzer P.R., Su C.K., Relman D.A. Haemophilus parainfluenzae endocarditis: application of a molecular approach for identification of pathogenic bacterial species. Clin Infect Dis. 1994; 19: 677–83.
| Приложения к статье |
| Критерии Duke для диагностики ИЭ
Определенно ИЭ
Лабораторные критерии
Микробиологические признаки:
• позитивный посев крови
• позитивный посев внутрисердечного абсцесса
• данные гистологического исследования вегетаций
• данные гистологического исследования эмболов.
Морфологические признаки:
• вегетации или внутрисердечные абсцессы, подтвержденные гистологически картиной активного эндокардита
Клинические критерии:
• 2 основных критерия, или
• 1 основной и 3 дополнительных критерия, или
• 5 дополнительных критериев
Вероятно ИЭ
Признаки, которые не соответствуют ни “определенно ИЭ”, ни “нет ИЭ”.
Нет ИЭ
• наличие альтернативного объяснения признакам ИЭ – изменение диагноза
• разрешение проявлений ИЭ на фоне кратковременной (менее 4 дней) терапии антибиотиками
• отсутствие морфологических доказательств ИЭ во время операции или аутопсии после кратковременной (менее 4 дней) терапии антибиотиками.
|
| Определение терминологии при использовании критериев Duke
Основные критерии
1. Положительная гемокультура, характерная для ИЭ
А. Типичный для ИЭ микроорганизм, выделенный из двух флаконов
• Streptococcus viridans, Streptococcus bovis, Haemophilus spp, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella spp, Kingella kingae
• Внебольничный штамм Staphylococcus aureus или энтерококка в отсутствие определенного гнойного очага или
Б. Повторный высев культуры, способной вызывать ИЭ
• В образце крови, взятой позже 12-часового промежутка после предыдущего
• Во всех 3 или в большинстве из 4 или более образцах крови, взятой на посев после более чем часового промежутка
2.
А. Характерные данные ЭхоКГ
• Наличие вегетации на клапанах или других структурах, или по ходу потоков регургитации крови, или на имплантированных материалах в отсутствие других анатомических отклонений или
• Наличие абсцессов, или
• Наличие измененных искусственных клапанов
Б. Появление новых признаков регургитации крови через клапаны (увеличение или изменение предшествующих шумов не учитывается).
Дополнительные критерии
• Предшествующие заболевания сердца или внутривенное введение наркотиков.
• Лихорадка больше 38О С.
• Сосудистые проявления: крупные артериальные эмболы, септические инфаркты легких, микотическая аневризма, внутричерепные кровоизлияния, геморрагии в конъюнктиву.
• Иммунологические нарушения: гломерулонефрит, узелки Osler’а, пятна Roth’а, положительная проба на ревматоидный фактор.
• Микробиологические подтверждения: позитивный посев крови с выделением флоры, не соответствующей основным критериям, или серологическое подтверждение активной инфекции в отсутствие микроорганизма, обычно вызывающего ИЭ.
• ЭхоКГ: данные, напоминающие ИЭ, но не соответствующие основным критериям.
|
.
Порекомендуйте статью вашим коллегам
Полимикробность гемокультур — современная тенденция в этиологии инфекции кровотока
При посеве крови у 853 больных получили полимикробные гемокультуры у стационарных больных в 11,4% и у амбулаторных — 35,7% случаев. Больные инфекционным эндокардитом чаще других кардиологических больных имели ассоциации микроорганизмов при посеве крови. У амбулаторных пациентов при жалобах на озноб, заболевания верхних дыхательных путей и неустойчивый стул гемокультуры характеризовались аэробно-аэробными и при жалобах на повышенную температуру тела и гнойнички на коже — аэробно-анаэробными ассоциациями возбудителей.
У амбулаторных пациентов при жалобах на озноб, заболевания верхних дыхательных путей и неустойчивый стул гемокультуры характеризовались аэробно-аэробными и при жалобах на повышенную температуру тела и гнойнички на коже — аэробно-анаэробными ассоциациями возбудителей.
Polymicrobial blood cultures — current trends in etiology bloodstream infections
When blood cultures in 853 patients polymicrobic blood cultures were obtained in 11,4% hospitalized patients and in outpatients — 35,7% of cases. Patients with infective endocarditis more often than other cardiac patients were associations of microorganisms in blood cultures. In ambulatory patients with complaints of fever, upper respiratory tract and unstable stools blood cultures were characterized by aerobic-aerobic and complaints of fever and pustules on the skin — aerobic-anaerobic associations of pathogens.
В настоящее время инфекционные заболевания продолжают играть одну из ведущих ролей в патологии человека. К таким терапевтическим заболеваниям относятся: язвенная болезнь желудка, заболевания сердечно-сосудистой системы, которые в настоящее время рассматриваются как инфекционные процессы. В их диагностике обязательным является обнаружение возбудителя и проведение антимикробной терапии. В современных условиях изменился статус врача-микробиолога. Ему отведена роль клинического микробиолога. В связи с этим в его обязанности входит соединить в единую логическую цепь: больного, диагностическое исследование материала и врача-клинициста для решения главного вопроса — подбора рациональной терапии. Комплексный подход разных специалистов к индивидуальному обследованию больного с инфекционной патологией повысит качество медицинского обслуживания и эффективность работы учреждений здравоохранения.
К таким терапевтическим заболеваниям относятся: язвенная болезнь желудка, заболевания сердечно-сосудистой системы, которые в настоящее время рассматриваются как инфекционные процессы. В их диагностике обязательным является обнаружение возбудителя и проведение антимикробной терапии. В современных условиях изменился статус врача-микробиолога. Ему отведена роль клинического микробиолога. В связи с этим в его обязанности входит соединить в единую логическую цепь: больного, диагностическое исследование материала и врача-клинициста для решения главного вопроса — подбора рациональной терапии. Комплексный подход разных специалистов к индивидуальному обследованию больного с инфекционной патологией повысит качество медицинского обслуживания и эффективность работы учреждений здравоохранения.
Из 50 млн смертей, регистрируемых в мире ежегодно, 35% приходится на инфекционные заболевания. Серьезную проблему представляют внутрибольничные инфекции. Ежегодно в США бактериемия (Б) и фунгемия (Ф) развиваются у 200 000 пациентов и летальность достигает 20-50% случаев [1]. Проблема летальности при инфекции кровотока (ИК) напрямую зависит от быстроты диагностики, т.е. обнаружения возбудителя. Трехлетний анализ летальных исходов показал, что в 62% случаях микроорганизмы были выделены после смерти больных. Не были предприняты экспресс-методы при диагностике Б [2]. Проблема ИК в России озвучена как проблема госпитальной инфекции и подлежит регистрации. Ежегодно все виды внутрибольничных инфекций переносят 2 млн человек, из которых на долю амбулаторно-поликлинических учреждений приходится 8,0% случаев. Согласно мнению Г.Г. Онищенко, главного государственного санитарного врача страны, смертность при гнойно-септических заболеваниях по причине септических осложнений остается актуальной проблемой здравоохранения и свидетельствует о сохраняющихся недостатках в лабораторной диагностике [3]. Исследовательская группа Европейского общества клинических микробиологов и инфекционных заболеваний начала работу с ведущей нозокомиальной инфекцией, т.е. инфекцией кровотока. Были выделены нарастающие проблемы в стационарах стран Европы, связанные с ИК.
Проблема летальности при инфекции кровотока (ИК) напрямую зависит от быстроты диагностики, т.е. обнаружения возбудителя. Трехлетний анализ летальных исходов показал, что в 62% случаях микроорганизмы были выделены после смерти больных. Не были предприняты экспресс-методы при диагностике Б [2]. Проблема ИК в России озвучена как проблема госпитальной инфекции и подлежит регистрации. Ежегодно все виды внутрибольничных инфекций переносят 2 млн человек, из которых на долю амбулаторно-поликлинических учреждений приходится 8,0% случаев. Согласно мнению Г.Г. Онищенко, главного государственного санитарного врача страны, смертность при гнойно-септических заболеваниях по причине септических осложнений остается актуальной проблемой здравоохранения и свидетельствует о сохраняющихся недостатках в лабораторной диагностике [3]. Исследовательская группа Европейского общества клинических микробиологов и инфекционных заболеваний начала работу с ведущей нозокомиальной инфекцией, т.е. инфекцией кровотока. Были выделены нарастающие проблемы в стационарах стран Европы, связанные с ИК. Это катетер-ассоциированные ИК и фунгемии, а именно кандидемия [4].
Это катетер-ассоциированные ИК и фунгемии, а именно кандидемия [4].
Среди кардиологических больных ИК чаще встречается у пациентов с инфекционным эндокардитом и является у них одним из ведущих диагностических признаков заболевания. Дисбактериоз в настоящее время рассматривается как социальная болезнь 21-го века, так как от него страдает 90% взрослого населения. Пациенты жалуются на расстройство стула в виде запора или диареи, быструю утомляемость, появление на теле поражений гнойничкового характера, небольшое повышение температуры тела. Известно, что декомпенсированная форма дисбактериоза сопровождается неспецифической Б [5].
С термином ИК связывают пребывание в крови микроорганизмов, сопровождающееся клиническими симптомами. Это состояние может иметь частное название: бактериемия, фунгемия, паразитемия, вирусемия, т.к. название ассоциировано с типом микроорганизма, циркулирующего в кровеносном русле. В практической работе чаще случается Б и Ф. Микробиологическое исследование крови обеспечивает уточнение природы лихорадочного состояния и вооружает клинициста критериями для назначения адекватной антимикробной терапии и прогноза осложнений основного заболевания, на фоне которого развивается Б или Ф. Гемокультура признается во всем мире как «золотой стандарт» установления диагноза бактериальной или грибковой инфекции и положительные результаты посева крови влияют на выбор антимикробной терапии. Вариабельность результатов микробиологического исследования крови во многом определяется разнообразием методических приемов отбора и культивирования крови, а также применяемых питательных сред и приспособлений в лабораториях.
Гемокультура признается во всем мире как «золотой стандарт» установления диагноза бактериальной или грибковой инфекции и положительные результаты посева крови влияют на выбор антимикробной терапии. Вариабельность результатов микробиологического исследования крови во многом определяется разнообразием методических приемов отбора и культивирования крови, а также применяемых питательных сред и приспособлений в лабораториях.
Анализ опубликованных в отечественной и зарубежной литературе данных по полимикробному характеру ИК показал определенные особенности, которые были связаны, с одной стороны, с заболеванием пациента и, с другой стороны, с качеством выполненного микробиологического исследования крови. Биологические свойства микроорганизмов значимы для взаимодействия в ассоциациях [6].
Анаэробные микроорганизмы рода Clostridium вызывают Б. в 33% случаев в виде полимикробной инфекции [7]. Наиболее часто из крови выделяют сочетание Cl.perfringens и пептострептококков.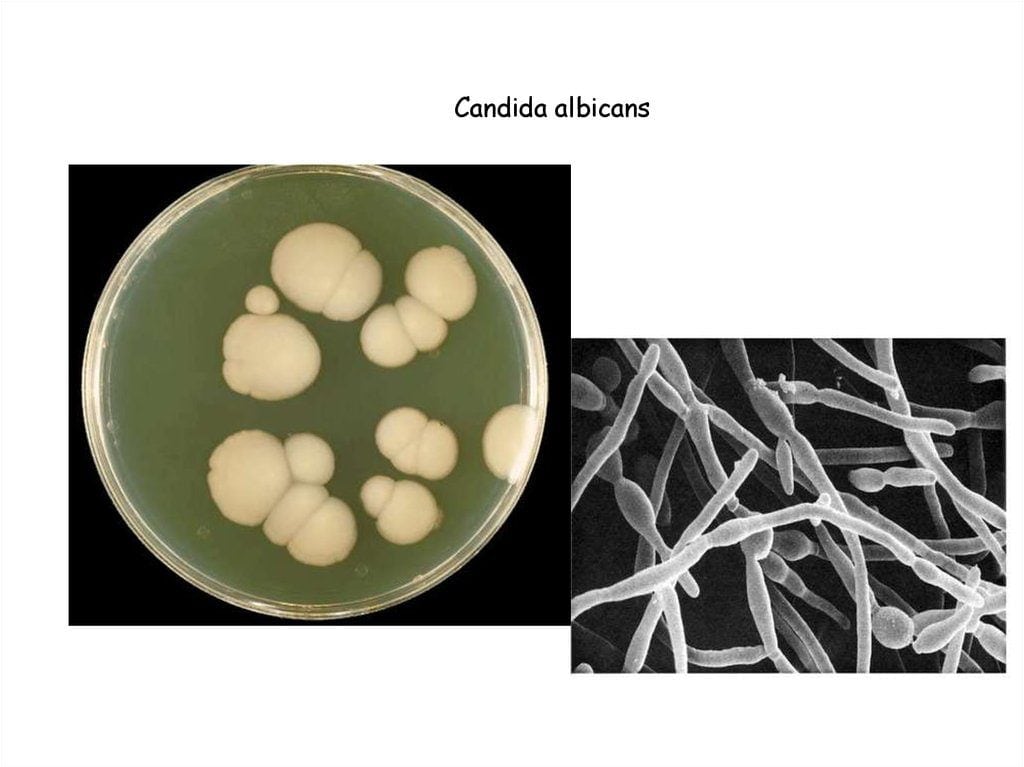 Бактериемия, вызванная микроорганизмами рода Lactobacillus, в 22% случаев была полимикробной. Проблема инфекции в крови может быть связана с микроорганизмами, находящимися в воде. Короткая аэробная грамотрицательная неферментирующая палочка из группы CDC IVс-2 впервые была выделена из загрязненной воды, которая служила источником ИК в 19% случаях. Было установлено, что этот микроорганизм контаминировал чистую воду в отделении физиотерапии и минеральную воду, разлитую по бутылкам.Anderson и соавт. описали эпизод полимикробной Б, в состав возбудителей которой входил данный микроорганизм, у 30-летнего мужчины со СПИДом и центральным венозным катетером [8].
Бактериемия, вызванная микроорганизмами рода Lactobacillus, в 22% случаев была полимикробной. Проблема инфекции в крови может быть связана с микроорганизмами, находящимися в воде. Короткая аэробная грамотрицательная неферментирующая палочка из группы CDC IVс-2 впервые была выделена из загрязненной воды, которая служила источником ИК в 19% случаях. Было установлено, что этот микроорганизм контаминировал чистую воду в отделении физиотерапии и минеральную воду, разлитую по бутылкам.Anderson и соавт. описали эпизод полимикробной Б, в состав возбудителей которой входил данный микроорганизм, у 30-летнего мужчины со СПИДом и центральным венозным катетером [8].
Грибы относятся к микроорганизмам, редко выделяемым из крови. В настоящее время грибковая инфекция рассматривается как потенциальный возбудитель инфекции кровотока. Грибы выделяют из крови больных при амбулаторных и госпитально-ассоциированных заболеваниях [9]. Несмотря на антифунгальную терапию, летальность от кандидидемии достигает 60% случаев. Грибы редко встречаются в виде моноинфекции. Они чаще выделяются в виде полиинфекции с бактериями или другими видами грибов [10]. Ретроспективный обзор данных больных с полимикробной кандидемией за 9 лет (1992-2000) показал выделение грибов рода Candida из крови у 5,2% больных. Летальность этих больных составляла 43% [11]. Особенностью изучения этиологии диссеминированного кандидоза обследованных больных 16 стационаров Санкт-Петербурга с 1998 по 2000гг. стало выявление полимикробной Ф в 9% случаев. Микст-фунгемия (Geotrichum candidum и Trichosporonasahii) была определена у 4% больных. Микст-бактериофунгемия была выявлена у 22% пациентов [12]. Анализ Ф в Японии за период с 1982 по 1993 год выявил 11,6% случаев полимикробной инфекции.
Грибы редко встречаются в виде моноинфекции. Они чаще выделяются в виде полиинфекции с бактериями или другими видами грибов [10]. Ретроспективный обзор данных больных с полимикробной кандидемией за 9 лет (1992-2000) показал выделение грибов рода Candida из крови у 5,2% больных. Летальность этих больных составляла 43% [11]. Особенностью изучения этиологии диссеминированного кандидоза обследованных больных 16 стационаров Санкт-Петербурга с 1998 по 2000гг. стало выявление полимикробной Ф в 9% случаев. Микст-фунгемия (Geotrichum candidum и Trichosporonasahii) была определена у 4% больных. Микст-бактериофунгемия была выявлена у 22% пациентов [12]. Анализ Ф в Японии за период с 1982 по 1993 год выявил 11,6% случаев полимикробной инфекции.
За трехлетний период у больных дилатационной кардиомиопатией (ДКМП) было описано 37 случаев Б. Считается, что вероятными причинами развития ДКМП является вирусная инфекция, которая приводит к повреждению сосудов и миокарда и к изменению иммунологической реактивности макроорганизма. Поэтому пациенты с иммунологической недостаточностью инфицируются низковирулентными микроорганизмами, которые в норме являются комменсалами организма человека. Описанные случаи Б у больных с ДКМП в 18% характеризовались полимикробностью, что свидетельствовало о глубоком нарушении защитных функций ретикулоэндотелиальной системы, функциональной активности клеток иммунитета у больных.
Поэтому пациенты с иммунологической недостаточностью инфицируются низковирулентными микроорганизмами, которые в норме являются комменсалами организма человека. Описанные случаи Б у больных с ДКМП в 18% характеризовались полимикробностью, что свидетельствовало о глубоком нарушении защитных функций ретикулоэндотелиальной системы, функциональной активности клеток иммунитета у больных.
В настоящее время появились публикации о полимикробных ИК у детей. Смешанная инфекция в крови случается при хронических заболеваниях, желудочно-кишечной патологии, наличии центрального венозного катетера и при парентеральном питании. Ведущим клиническим симптомом является пролонгированная лихорадка. Желудочно-кишечные заболевания у детей представляют собой особый фактор риска для развития полимикробной ИК.
Научно установлено, что бактериемия у иммунокомпромиссных пациентов вызывается коагулазо-негативными стафилококками, которые признаются истинными возбудителями. Развитие бактериемии, где причиной являются зеленящие стрептококки, есть следствие манипуляции в ротовой полости. Описан эпизод полимикробной бактериемии, вызванный Staphylococcus epidermidis и Streptococcus oralis. Результаты исследования показали, что ротовая полость являлась источником для обеих инфекций и первого эпизода бактериемии, а коагулазо-негативные стафилококки — клинически значимыми [13].
Описан эпизод полимикробной бактериемии, вызванный Staphylococcus epidermidis и Streptococcus oralis. Результаты исследования показали, что ротовая полость являлась источником для обеих инфекций и первого эпизода бактериемии, а коагулазо-негативные стафилококки — клинически значимыми [13].
В литературе обсуждается механизм прямого воздействия некоторых бактериальных токсинов на клетки скелетной мускулатуры. Клиника бактериального полимиозита (в сочетании с полирадикулоневритом) сопровождалась бактериемией и выделением из крови ассоциации микроорганизмов: Staphylococcus. epidermidis и Corynebacterium minutissimum.
В работе представлены результаты микробиологического исследования крови стационарных терапевтических больных кардиологического профиля и амбулаторных пациентов, обращавшихся за медицинской помощью с основными клиническими симптомами — повышенная температура тела или озноб при наличии разнообразных хронических заболеваний.
Всего было обследовано 853 стационарных больных. Среди обследованных больных женщин было 417 (48,9%) и мужчин — 436 (51,1%). Обследуемые больные в 84,3% случаев были в возрасте от 20 до 60 лет.
Таблица 1.
Диагнозы обследуемых терапевтических больных
Диагноз | Количество больных | % ± m |
| Инфекционный эндокардит | 280 | 32,8 ± 1.6 |
| Ревматизм | 122 | 14,3 ± 1,1 |
| Лихорадка неясной этиологии | 133 | 15,6 ± 1. |
| Врожденные пороки сердца | 54 | 6,3 ± 0,8 |
| Миокардит | 83 | 9,7 ± 1,0 |
| Кардиомиопатия | 5 | 0,6 ± 0.2 |
| Вторичный инфекционный эндокардит | 107 | 12,5 ± 1,1 |
| Ишемическая болезнь сердца | 62 | 7,3 ± 0,8 |
| Заболевания почек | 7 | 0,8 ± 0,3 |
| Всего | 853 | 100,0 |
Наибольшее число обследуемых больных имели диагноз инфекционного эндокардита (32,8%). Это объясняется тем, что при данном заболевании инфекция играет ведущую роль в развитии клинических симптомов. Реже обследовались больные с диагнозами: лихорадка неясной этиологии, ревматизм и вторичный инфекционный эндокардит (15,6%, 14,3% и 12,5%, соответственно). Причинами этих состояний также часто являются микроорганизмы. Больные с другими диагнозами (миокардит, ишемическая болезнь сердца, врожденный порок сердца, заболевания почек и кардиомиопатия) обследовались в виду наличия жалоб на повышенную температуру тела, пот и озноб.
Это объясняется тем, что при данном заболевании инфекция играет ведущую роль в развитии клинических симптомов. Реже обследовались больные с диагнозами: лихорадка неясной этиологии, ревматизм и вторичный инфекционный эндокардит (15,6%, 14,3% и 12,5%, соответственно). Причинами этих состояний также часто являются микроорганизмы. Больные с другими диагнозами (миокардит, ишемическая болезнь сердца, врожденный порок сердца, заболевания почек и кардиомиопатия) обследовались в виду наличия жалоб на повышенную температуру тела, пот и озноб.
Для культурального исследования крови применяли классический метод. Отбор пробы крови проводили шприцом путем венопункции. Кожа в области прокалывания обрабатывали последовательно с двухминутной экспозицией 70°С спиртом, 5%-ным спиртовым раствором йода и затем вновь спиртом. Кровь отбирали в объеме 10 мл и вносили во флакон с питательной средой путем прокола резиновой пробки флакона, не открывая его. Пробку флакона обрабатывали предварительно спиртом и раствором йода, также как кожу. Для получения гемокультуры использовали флаконы с 200,0 мл сердечно-мозговой среды для выдерживания соотношения крови к питательной среде 1:20. Модифицированная сердечно-мозговая среда была приготовлена в лабораторных условиях по прописи оригинальных зарубежных сред для гемокультуры. Среда разливалась по 200 мл в стандартные аптечные флаконы емкостью 250 мл с резиновыми пробками, воздушное пространство над средой замещалось инертным газом для создания анаэробных условий при первичном культивировании. Резиновая пробка завальцовывалась металлическим колпачком при помощи аппарата аптечного назначения [14]. Через 30 минут повторно забирали вторую порцию крови на гемокультуру. У всех больных были выполнены более двух отборов крови для посева.
Для получения гемокультуры использовали флаконы с 200,0 мл сердечно-мозговой среды для выдерживания соотношения крови к питательной среде 1:20. Модифицированная сердечно-мозговая среда была приготовлена в лабораторных условиях по прописи оригинальных зарубежных сред для гемокультуры. Среда разливалась по 200 мл в стандартные аптечные флаконы емкостью 250 мл с резиновыми пробками, воздушное пространство над средой замещалось инертным газом для создания анаэробных условий при первичном культивировании. Резиновая пробка завальцовывалась металлическим колпачком при помощи аппарата аптечного назначения [14]. Через 30 минут повторно забирали вторую порцию крови на гемокультуру. У всех больных были выполнены более двух отборов крови для посева.
Для амбулаторных пациентов был разработан специальный опросник, по которому были собраны клинические симптомы предполагаемой инфекцией в крови. Всего было опрошено 204 из 270 амбулаторных больных (75,5%). Большую часть обследованных были в возрасте от 30 до 60 лет. Из числа опрошенных амбулаторных пациентов женщин было 137 (67,2%) и мужчин — 67 (32,8%) человек.
Из числа опрошенных амбулаторных пациентов женщин было 137 (67,2%) и мужчин — 67 (32,8%) человек.
Таблица 2.
Характеристика жалоб амбулаторных пациентов (n=204)
Виды жалоб | Количество больных | % ± m |
| Лихорадка | 100 | 49,0 ± 3,5 |
| Озноб | 110 | 53,9 ± 3.4 |
| Заболевания рта | 87 | 42,6 ± 3,4 |
| Заболевания желудочно-кишечного тракта | 85 | 41,7 ± 3,4 |
| Нестабильность стула | 110 | 53,9 ± 3,4 |
| Заболевания верхних дыхательных путей | 130 | 63,7 ± 3,3 |
| Заболевания мочевой системы | 56 | 27,5 ± 3,1 |
| Заболевания половой системы | 85 | 41,7 ± 3,4 |
| Боли в мышцах и суставах | 83 | 40,7 ± 3,4 |
| Наличие травм | 83 | 40,7 ± 3,4 |
| Появление гнойничков | 147 | 72,1 ± 3,1 |
| Перенесенные заболевания | 20 | 9,8 ± 2,0 |
| Подверженность респираторным заболеваниям | 95 | 46,6 ± 3,4 |
| Наличие заболеваний щитовидной железы | 17 | 8,3 ± 1,9 |
| Увеличенные лимфатические узлы | 76 | 37,3 ± 3,3 |
Наибольшее число пациентов (72,1%) жаловалось на появление гнойничков и фурункулов кратковременно или постоянно в течение длительного времени. В 63,7% случаев пациенты имели хронические заболевания верхних дыхательных путей и в 46,6% были подвержены респираторным заболеваниям (грипп, ОРЗ), что значительно отягощало имеющееся заболевание. Частыми жалобами также были: наличие субфебрильной температуры тела (49,0%), озноба (53,9%) и нестабильного стула (53,9%). Повышение температуры тела и озноб чаще случались в вечернее время суток.
В 63,7% случаев пациенты имели хронические заболевания верхних дыхательных путей и в 46,6% были подвержены респираторным заболеваниям (грипп, ОРЗ), что значительно отягощало имеющееся заболевание. Частыми жалобами также были: наличие субфебрильной температуры тела (49,0%), озноба (53,9%) и нестабильного стула (53,9%). Повышение температуры тела и озноб чаще случались в вечернее время суток.
Посев крови амбулаторных пациентов проводили запатентованным экспресс-методом, включающим минимальное количество объема пробы (4,5 мл), удобный для пациента способ отбора и доставки крови в «шприц-пробирке» в виде закрытой системы с 0,5 мл лимонно-кислого натрия. В лаборатории отобранная проба центрифугировалась без переноса крови в другую емкость. В качестве посевного материала использовали лейкоцитарный слой крови, который засевали непосредственно на анаэробный 5% гемагар, приготовленный на высокопитательной основе (мозговой). Использовались аэробные и анаэробные условия культивирования. Экспрессивность данного метода при диагностике инфекции кровотока заключалась в ускоренных сроках получения информации о наличии микроорганизмов в крови, т.е. на 3–4-й день от момента отбора. Была показана разрешающая способность (95%) культуральной диагностики инфекции кровотока данным способом [15, 16].
Экспрессивность данного метода при диагностике инфекции кровотока заключалась в ускоренных сроках получения информации о наличии микроорганизмов в крови, т.е. на 3–4-й день от момента отбора. Была показана разрешающая способность (95%) культуральной диагностики инфекции кровотока данным способом [15, 16].
Результаты
У стационарных больных из 1933 флаконов с инокулированной кровью в 458 получили гемокультуру (23,7%) и 516 штаммов микроорганизмов, включая бактерии (98,6%) и грибы (1,4%). Полученные гемокультуры представляли собой моноинфекцию и ассоциацию возбудителей.
Таблица 3
Моно- и ассоциации возбудителей в гемокультурах стационарных больных
Всего гемокультур
| Число гемокультур с моновозбудителями | Число гемокультур с ассоциацией возбудителей | ||
количество | % ± m | количество | % ± m | |
| 458 | 406 | 88,6 ± 1,5 | 52 | 11,4 ± 1,5 |
В большинстве случаев причиной инфекции в крови был моновариант микроорганизмов (88,6%). Но в 11,4% случаев возбудители инфекции кровотока представляли собой ассоциацию микроорганизмов, что характерно для течения воспалительного процесса инфекционного характера.
Но в 11,4% случаев возбудители инфекции кровотока представляли собой ассоциацию микроорганизмов, что характерно для течения воспалительного процесса инфекционного характера.
Таблица 4.
Виды ассоциаций при различных диагнозах
Виды ассоциаций
| Д и а г н о з ы | ||||||||
ИЭ | Ревм. | Лихор. неуст/эт. | ВПС | Мио-кардит | Кардио- миопатия | Втор. ИЭ | ИБС | Забол. почек | |
| Два микроорг. n = 48 | 17 | 8 | 3 | 3 | 7 | — | 8 | 2 | — |
| % | 35,4 | 16,7 | 6,2 | 6,2 | 14,6 | — | 16,7 | 4,2 | — |
| Три микроорг. n = 4 | 2 | — | 1 | 1 | — | — | — | — | — |
| % | 50,0 | — | 25,0 | 25,0 | — | — | — | — | — |
| Бактерия + бактерия n = 51 | 19 | 8 | 4 | 3 | 7 | — | 8 | 2 | — |
| % | 37,3 | 15,7 | 7,8 | 5,9 | 13,7 | — | 15,7 | 3,9 | — |
Бактерия + гриб. n = 1 | — | — | — | 1 | — | — | — | — | — |
| % | — | — | — | 100,0 | — | — | — | — | — |
| Аэроб. + аэроб. n = 44 | 14 | 7 | 4 | 3 | 7 | — | 7 | 2 | — |
| % | 31,9 | 15,9 | 9,1 | 6,8 | 15,9 | — | 15,9 | 4,5 | |
Аэроб. + анаэроб. n = 8 | 4 | 1 | 1 | 1 | — | — | 1 | — | — |
| % | 50,0 | 12,5 | 12,5 | 12,5 | — | — | 12,5 | — | — |
При сопоставлении полученных данных с диагнозами больных оказалось, что ассоциации микроорганизмов в одной пробе крови чаще встречались у больных с диагнозом инфекционного эндокардита. Это были ассоциации разного вида: с двумя и тремя возбудителями (35,4 и 50,0% соответственно), состоящие из различных видов бактерий (37,3%), относящиеся к аэробным микроорганизмам (31,9%) и состоящие из аэробных и анаэробных микроорганизмов (50,0%). Среди других заболеваний, при которых были выделены ассоциации, состоящие из двух компонентов, необходимо отметить вторичный инфекционный эндокардит и ревматизм (16,7%). При этих же заболеваниях было получено наибольшее число ассоциации из различных видов бактерий, относящихся к аэробным микроорганизмам (15,7 и 15,9% соответственно). Ассоциация из бактерий и грибов получена в одном случае у больного с диагнозом врожденный порок сердца. У больного с лихорадкой неясного генеза получили гемокультуру, включающую в себя три возбудителя (25,0%) и гемокультуру из аэробных и анаэробных микроорганизмов (12,5%). Несмотря на то, что миокардит в большинстве случаев относится к заболеваниям вирусной этиологии, у обследованных больных миокардитом гемокультуры содержали ассоциации: по два ассоцианта, различные виды бактерий, относящиеся к аэробным бактериям (14,6, 13,7 и 15,9% соответственно).
Это были ассоциации разного вида: с двумя и тремя возбудителями (35,4 и 50,0% соответственно), состоящие из различных видов бактерий (37,3%), относящиеся к аэробным микроорганизмам (31,9%) и состоящие из аэробных и анаэробных микроорганизмов (50,0%). Среди других заболеваний, при которых были выделены ассоциации, состоящие из двух компонентов, необходимо отметить вторичный инфекционный эндокардит и ревматизм (16,7%). При этих же заболеваниях было получено наибольшее число ассоциации из различных видов бактерий, относящихся к аэробным микроорганизмам (15,7 и 15,9% соответственно). Ассоциация из бактерий и грибов получена в одном случае у больного с диагнозом врожденный порок сердца. У больного с лихорадкой неясного генеза получили гемокультуру, включающую в себя три возбудителя (25,0%) и гемокультуру из аэробных и анаэробных микроорганизмов (12,5%). Несмотря на то, что миокардит в большинстве случаев относится к заболеваниям вирусной этиологии, у обследованных больных миокардитом гемокультуры содержали ассоциации: по два ассоцианта, различные виды бактерий, относящиеся к аэробным бактериям (14,6, 13,7 и 15,9% соответственно). Вероятно, данные больные страдали микст-инфекцией, вирусно-бактериальной или только бактериальной этиологии.
Вероятно, данные больные страдали микст-инфекцией, вирусно-бактериальной или только бактериальной этиологии.
Культуральное исследование крови амбулаторных пациентов было выполнено экспресс-методом. Из 324 посевов крови в 168 были получены гемокультуры (51,9%), содержащие 244 штамма микроорганизмов: бактерий (97,5%) и грибов (2,5%). Из одной пробы крови часто высевали ассоциацию микроорганизмов.
Таблица 5.
Моно- и поливарианты возбудителей в гемокультурах амбулаторных пациентов
Варианты | Моно- вариант | Поливарианты, число ассоциантов | ||
2 | 3 | 4 | ||
Гемокультуры n = 168 | 108 | 48 | 8 | 4 |
% ± m | 64,3 ± 3,6 | 28,6 ± 3,4 | 4,7 ± 1,6 | 2,4 ± 1,1 |
Из 168 полученных гемокультур 108 содержали моновозбудитель (64,3%) и 60 — ассоциации микроорганизмов (35,7%). Среди выделенных 60 ассоциаций преобладали гемокультуры с двумя возбудителями (28,6%). Наличие трех или четырех ассоциантов-возбудителей (4,7 и 2,4% соответственно) в одной гемокультуре осложняло подбор адекватной антимикробной терапии. Треть полученных гемокультур амбулаторных пациентов характеризовалась полимикробностью.
Среди выделенных 60 ассоциаций преобладали гемокультуры с двумя возбудителями (28,6%). Наличие трех или четырех ассоциантов-возбудителей (4,7 и 2,4% соответственно) в одной гемокультуре осложняло подбор адекватной антимикробной терапии. Треть полученных гемокультур амбулаторных пациентов характеризовалась полимикробностью.
Таблица 6.
Частота жалоб пациентов при аэробно-аэробной ассоциации в гемокультуре (n = 30)
Субфебрилитет | Озноб | Заболевание ВДП | Неустойчивый стул | Гнойнички на коже | |||||
число | % ± m | число | % ± m | число | % ± m | число | % ± m | число | % ± m |
17 | 56,7 ± 9,0 | 18 | 60,0 ± 8,9 | 14 | 46,7 ± 9,1 | 14 | 46,7 ± 9,1 | 14 | 46,7 ± 9,1 |
Аэробно-аэробные ассоциации возбудителей в крови чаще встречались у пациентов с жалобами на озноб, чем на повышенную температуру тела (60,0 и 56,7% соответственно). Жалобы пациентов на заболевания верхних дыхательных путей, неустойчивый стул и гнойничковые заболевания кожи в равной мере могут быть маркерами инфекции кровотока с пребыванием возбудителей в виде аэробно-аэробной ассоциации (46,7%).
Таблица 7.
Частота жалоб пациентов при аэробно-анаэробной ассоциации в гемокультуре (n = 28)
Субфебрилитет | Озноб | Заболевание ВДП | Неустойчивый стул | Гнойники на коже | |||||
число | % ± m | число | % ± m | число | % ± m | число | % ± m | число | % ± m |
17 | 60,7 ± 9,2 | 16 | 57,1 ± 9,3 | 11 | 39,3 ± 9,2 | 9 | 32,1 ± 8,8 | 13 | 46,4 ± 9,4 |
Аэробно-анаэробные ассоциации чаще были связаны с жалобами пациентов на повышенную температуру тела, чем на озноб (60,7 и 57,1 соответственно). Связь аэробно-анаэробных ассоциаций возбудителей с другими жалобами показала преимущество гнойничковых заболеваний кожи перед заболеваниями ВДП и неустойчивым стулом (46,4, 39,3 и 32,1% соответственно).
Обсуждение
Сравнительный анализ полученных данных по стационарным и амбулаторным пациентам показал следующее.
Таблица 8.
Полимикробность гемокультур стационарных и амбулаторных больных (%)
Вариан-ты | 2 ассо-цианта | 3 ассо-цианта | 4 ассо-цианта | Бактерия + бактерия | Бакте-рия + гриб | Аэроб + аэроб | Аэроб + анаэроб | Анаэроб + анаэроб |
Стацио-нарные | 92,3 | 7,7 | — | 98,1 | 1,9 | 84,6 | 15,4 | — |
Амбула-торные | 28,6 | 4,7 | 2,4 | 91,7 | 8,3 | 50,0 | 46,7 | 3,3 |
Из флаконов с инокулированной кровью стационарных больных получили гемокультуру в виде полиинфекции в 11,4%, а у амбулаторных пациентов — в 35,7% случаев. У стационарных больных полимикробность более выражена при сочетании двух микроорганизмов (92,3%), а у амбулаторных пациентов полимикробность достигала до четырех микроорганизмов в одной пробе крови (2,4%). Ассоциации из различных видов бактерий были обнаружены у стационарных и амбулаторных пациентов в равной мере (98,1 и 91,7% соответственно), а ассоциации бактерий с грибами встречались чаще у амбулаторных, чем у стационарных больных (8,3% и 1,9 соответственно). Ассоциации аэробных с анаэробными бактериями также чаще обнаруживали у амбулаторных пациентов, чем у стационарных (46,7 и 15,4 соответственно). Сочетание различных видов анаэробов присутствовало только в крови амбулаторных пациентов и не было выделено у стационарных. В литературе имеются данные о выделении ассоциаций из крови: аэробно-анаэробных (21,6%) и анаэробно-анаэробных микроорганизмов (10,8%) [17]. Больные с диагнозом инфекционного эндокардита чаще других кардиологических больных имели полимикробные гемокультуры. Из одной пробы крови выделяли 2-3 разных вида микроорганизмов, ассоциации из аэробных бактерий и из аэробно-анаэробных. У больного с врожденным пороком сердца была получена гемокультура, содержавшая ассоциацию бактерии с грибами. По данным Европейской исследовательской группы, больным с инфекцией кровотока терапия назначалась слишком поздно или была неадекватной в 22,6% случаев и в 10-17% случаев в гемокультурах обнаруживали ассоциации микроорганизмов. При жалобах амбулаторных пациентов на озноб, заболевания ВДП и неустойчивый стул чаще всего следует ожидать присутствие в гемокультуре аэробно-аэробные, а при повышенной температуре тела и гнойничках на коже — аэробно-анаэробные ассоциации микроорганизмов.
Таким образом, культуральное исследование крови с целью выделения возбудителя инфекции кровотока относится к трудоемкому и дорогому виду исследования. Однако получение гемокультуры является достоверным подтверждением наличия инфекции в крови. Полимикробность гемокультур характеризовалась одновременным присутствием в пробе крови двух или трех микроорганизмов. По видовому составу большинство ассоциаций были представлены различными видами аэробных бактерий, но имело место и ассоциация бактерий с грибами и чаще это случалось у амбулаторных пациентов. Другой особенностью полученных ассоциаций было выделение аэробно-анаэробных и анаэробно-анаэробных сочетаний микроорганизмов, что в значительной степени важно для определения целевой антимикробной терапии. Этиология ведущих кардиологических заболеваний (первичный и вторичный инфекционный эндокардит, ревматизм) может быть представлена микст-инфекцией, которая проявляется наличием двух или трех возбудителей, а также сочетанием различных аэробных и анаэробных бактерий в одной гемокультуре. Миокардит может протекать как бактериальная инфекция с полимикробностью этиологии (два ассоцианта, различные виды аэробных бактерий). При диагностике лихорадок неясной этиологии в гемокультуре могут циркулировать одновременно два или три возбудителя из числа аэробных и анаэробных бактерий.
Современное течение инфекции кровотока характеризуется клинико-микробиологическими особенностями, которые выражаются в полимикробности этиологии заболевания, что в свою очередь существенно осложняет назначение адекватной антимикробной терапии на начальном этапе лечения.
Н.М. Каргальцева, В.И. Кочеровец, А.М. Иванов
Военно-медицинская академия им. С.М. Кирова, г. Санкт-Петербург
Первый государственный медицинский университет, г. Москва
Каргальцева Наталья Михайловна — кандидат медицинских наук, преподаватель кафедры клинической биохимии и лабораторной диагностики
Литература:
1. Weinstein M.P., Towns M.L., Quartey S.M. et al. The clinical significance of positive blood cultures in the 1990s: a prospective comprehensive evaluation of the microbiology, epidemiology and outcome of bacteremia and fungemia in adults, Clin. Infect. Dis., 1997, 24, 584-602.
2. Pedersen G., Schonheyder H.C. Patients with bacteremia dying before notification of positive blood cultures, 3-year clinical study, Scand.J.Inf.Dis., 1997, 29, 2, 169-173.
3. Онищенко Г.Г. О заболеваемости ВБИ в Российской Федерации, № 0100\9938-07-32 от 02.10.2007, Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека.
4. Bouza E., Perez-Molina J., Munoz P. Report of ESGNI-001 and ESGNI-002 studies. Blood stream infections inEurope. Clin.Microb.Infect., 1999, 5, 2S1-2S12.
5. Воробьев А.А., Абрамов Н.А., Бондаренко В.М., и др. Дисбактериозы — актуальная проблема медицины. — Вестн. РАМН, 1997, 3, 4-7.
6. Schonheyder H.C. Two thousands seven hundred and thirty nine episodes of bacteremia in thecountry ofNorthern Jutland1996-1998. Presentation of a regional clinical database. Ugeskr Laeger, 2000, 162 (20), 2886-2891.
7.HoddyR.I., Nadkarni D.D., Mann B.L. et all. Clostridial bacteremia in the community hospital. Scand.J.Infect.Dis., 2000, 32 (1), 27-30.
8. Anderson R.R., Warnick P., Schreckenberger P.C. Recurrent SDS Group IV C-2 bacteremia a human with AIDS. J.of Clin.Microb., 1997, 35, 3, 780-782.
9. Pfaller M., Wenzel R. Impact of the changing epidemiology of fungal infectious in the 1990s. Eur. J. Clin. Microbiol. Infect. Dis., 1992, 11, 287-292.
10. Klotz S.A., Chasin B.S., Powell B.,et al.. Polymicrobial bloodstream infections involving candida species: analysis of patients and review of the literature. Diagn. Microb. Infect. Dis., 2007, 59 (4), 401-406.
11. Pulimood S., Ganesan L., Alangaden G. et al. Polymicrobial candidemia. Diagn. Microb. Infect. Dis., 2002, 44 (4), 353-357.
12. Пестова Л.А., Колб З.К., Богомолова Т.С. Диагностика кандидемии у больных в отделениях интенсивной терапии. — Проблемы мед. микологии, 2001, Т. 3, 2, 46.
13. Kennedy H.F., Morrison D., Kaufmann M.E. et al. Origins of Staphylococcus epidermidis and Streptococcus oralis causing bacteraemia in a bone marrow transplant patient. J.Med.Microb., 2000, 49 (4), 367-370.
14. Кочеровец В.И., Каргальцева Н.М., Гуревич В.С., Бондаренко Б.Б. Принципы бактериологического исследования крови больных инфекционным эндокардитом. — Мет. реком. — РСФСР, Ленинград, 1990. — 23 с.
15. Каргальцева Н.М., Кочеровец В.И., Кафтырева Л.А., Пастушенков В.Л., Колосовская Е.Н., Кучеренко Е.В., Сатосова Н.В. Микробиологические методы диагностики инфекции кровотока. — Санкт-Петербург, 2010. — 41 с.
16. Каргальцева Н.М. Способ диагностики бактериемии. — Патент 2098486, Россия, № 95\10928\13 от 21.06.95, бюлл. № 34.
17. Окронидзе Г.Г., Петраков А.А., Арутчева А.А. Анаэробная бактериемия при гнойно-септических осложнениях у травматологических и хирургических больных. — Хирургия, 1996, 1, 70-72.
Энтерол 250 мг №10 капс.
Инструкция по медицинскому применению
лекарственного средства
ЭНТЕРОЛ® 250
Торговое название
Энтерол® 250
Международное непатентованное название
Нет
Лекарственная форма
Капсулы
Состав
Одна капсула содержит
активное вещество: сахаромицеты Буларди (Saccharomyces boulardii) штамм CNCM I-745 — 250,0 мг,
вспомогательные вещества: лактозы моногидрат, магния стеарат,
состав капсулы: желатин, титана диоксид (Е 171).
Описание
Твердые, желатиновые, непрозрачные капсулы, белого цвета, размер № 0; содержимое капсул – светло-коричневый порошок с характерным запахом дрожжей.
Фармакотерапевтическая группа
Антидиарейные микроорганизмы. Сахаромицеты Boulardii.
Код АТХ A07F A02
Фармакологические свойства
Фармакокинетика
После приема препарата быстро достигается высокая концентрация Saccharomyces boulardii (штамм CNCM I-745) в толстом кишечнике, которая поддерживается на протяжении 24 часов. Saccharomyces boulardii (штамм CNCM I-745) не проникают в системный кровоток и мезентериальные лимфатические узлы. После окончания лечения Saccharomyces boulardii (штамм CNCM I-745) полностью выводятся с калом в течение 3-5 дней.
Фармакодинамика
Энтерол® 250 – препарат биологического происхождения с противомикробным и противодиарейным действием. Saccharomyces boulardii (штамм CNCM I-745) благодаря тому, что являются непатогенными штаммами аскоспорных дрожжей и генетически устойчивыми к противобактериальным препаратам, стали широко применяться в терапии заболеваний кишечника, так как они, проходя через желудочно-кишечный тракт, не образуют в нем колоний, быстро достигают значительных концентраций в кишечнике, которые сохраняются на постоянном уровне, не влияют на нормальную резидентную микрофлору и не проникают за пределы пищеварительного тракта.
Следует отметить устойчивость Saccharomyces boulardii (штамм CNCM I-745) к антибиоткам и большинству других препаратов, а также их чувствительность к противогрибковым препаратам.
Главный механизм действия Saccharomyces boulardii (штамм CNCM I-745):
— прямой антагонизм (антимикробное действие), что характеризуется особенностью Saccharomyces boulardii (штамм CNCM I-745) подавлять, посредством усиления неспецифической иммунной защиты, а также повышения продукции IgA и секреторных компонентов остальных иммуноглобулинов, рост патогенных и условно-патогенных микроорганизмов и грибов, нарушающих микрофлору кишечника, таких как: Clostridium dificile, Staphуlococcus aureus, Pseudomonas аeruginosa, Candida krusei, Candida pseudotropical, Salmonella typhi, Ecsherichia coli, Shigella dysenteriae, Proteus, Enthamoeba hystolitica, Lambliae
— антитоксическое действие обусловлено синтезом нейтрализующего фактора, действующего на энтероциты через рецепторы, соединенные с G- протеином
— антисекреторное действие обусловлено снижением содержания цАМФ в энтероцитах, что приводит к уменьшению секреции воды и соли в просвет кишечника
— ферментативное действие обусловлено повышением активности дисахаридаз тонкого кишечника (лактазы, сахаразы, мальтазы)
— трофический эффект относительно слизистой оболочки тонкой кишки за счет высвобождения спермина и спермидина.
Генетически обусловленная стойкость Saccharomyces boulardii (штамм CNCM I-745) к антибиотикам обуславливает возможность их одновременного применения с антибиотиками для защиты нормального биоценоза кишечного тракта.
Фармакодинамика Saccharomyces boulardii (штамм CNCM I-745), живой формы дрожей, установлена в процессе различных исследований in vitro и in vivo у животных и человека. На основании полученных данных можно утверждать, что Энтерол® 250 восстанавливает микрофлору кишечника и имеет выраженное этиопатогенетическое антидиарейное действие.
Показания к применению
— острая и инфекционная диарея у детей и взрослых
— профилактика и лечение колитов и диареи, вызванных приемом антибиотиков
— синдром раздраженного кишечника
— псевдомембранозный колит и заболевания, обусловленные Clostridium difficile
— диарея, вызванная длительным энтеральным питанием
— дисбактериоз кишечника
Способ применения и дозы
Капсулу необходимо проглатывать, запивая небольшим количеством теплой жидкости.
Детям от 6 лет до 12 лет: по 1 капсуле 1-2 раза в день.
Взрослым и детям старше 12 лет: по 1-2 капсулы 2 раза в день.
Рекомендуемый курс лечения:
— острая диарея — 3-5 суток
— лечение острой и хронической бактериальной диареи, синдрома раздраженного толстого кишечника — 10-14 суток
— профилактика и лечение антибиотик-ассоциированной диареи и псевдомембранозного колита — совместно с антибиотиками, в дозе 2 капсулы 2 раза в сутки, на весь курс применения антибиотиков.
Побочные действия
Редко
— фунгемия у госпитализированных пациентов с центральным венозным катетером
Очень редко
— метеоризм
— аллергическая реакция в форме зуда, сыпи, ангионевротического отека, крапивницы из-за индивидуальной повышенной чувствительности к компонентам препарата
Противопоказания
— гиперчувствительность (аллергия) к какому-либо из компонентов препарата
— пациенты с центральным венозным катетером
— галактоземия, недостаточность лактозы, синдром мальабсорбции глюкозы и галактозы
Лекарственные взаимодействия
Не принимать одновременно вместе с противогрибковыми средствами при их пероральном или парентеральном назначении.
Особые указания
Для детей до 6 лет рекомендуется использовать более удобную для них лекарственную форму — в виде порошка в пакетиках.
Энтерол® 250 не следует смешивать с очень горячей (выше 50оС) или очень холодной пищей или жидкостью. Не принимать с алкоголем.
Если в течение 2 дней диарея не прекращается, следует проконсультироваться с врачом о дальнейшем применении препарата. Необходимо применение растворов для восстановления водно-солевого баланса. Объем регидратационного раствора должен быть эквивалентен потерянному объему, т.е. 50-100 мл на кг массы тела. В случае острой или продолжительной диареи, рвоты или воздержания от пищи необходимо выбирать способ восстановления водного баланса – пероральный или парентеральный.
При нарушении целостности капсул, в случае применения больными с центральным венозным катетером, возникает опасность фунгемии в результате колонизации последнего. Были сообщения о возникновении гематогенной грибковой инфекции у больных с центральным венозным катетером (в данном случае не применялись Saccharomyces boulardii). Довольно часто следствием этого является гипертермия, в пробах крови обнаруживается наличие Saccharomyces. Данные симптомы проходят после антигрибковой терапии и удаления катетера.
Беременность и период лактации
Энтерол® 250 не рекомендуется во время беременности.
Энтерол® 250 может применяться во время грудного вскармливания, в связи с тем, что Saccharomyces boulardii (штамм CNCM I-745) не проникают в грудное молоко.
Особенности влияния лекарственного средства на способность управлять автотранспортом и работать с движущимися механизмами
Не влияет
Передозировка
Saccharomyces boulardii (штамм CNCM I-745) не абсорбируется в системный кровоток, поэтому нет причин для возникновения передозировки.
В случае возникновения передозировки не требуется каких-либо мероприятий.
Форма выпуска и упаковка
По 10 капсул помещают в флакон из прозрачного стекла, укупоренный полиэтиленовой крышкой.
1 флакон вместе с инструкцией по применению на государственном и русском языках помещают в картонную коробку
Условия хранения
Хранить в защищенном от света месте, при температуре не выше 25ºС.
Хранить в недоступном для детей месте!
Срок хранения
3 года
Не применять по истечении срока годности.
Условия отпуска из аптек
Без рецепта
Производитель
Биокодекс,
7, авеню Гальени, 94250 Жантилли – Франция
Владелец регистрационного удостоверения
Биокодекс, Франция
Наименование, адрес и контактные данные (телефон, факс, электронная почта) организации принимающей на территории Республики Казахстан претензии (предложения) по качеству лекарственных средств от потребителей и ответственный за пострегистрационное наблюдение за безопасностью лекарственного средства:
ТОО «Pharmaline» г. Алматы, ул. Шамиевой, 11, тел: +7(727) 3384815.тел круглосуточной доступности: 87010277044 [email protected]
Противогрибковое лечение в отделении интенсивной терапии
При сниженном иммунитете пропорционально числу лиц увеличивается количество
грибковых инфекций. Большинство случаев кандидозных инфекций, наблюдаемых в
отделении интенсивной терапии (ОИТ), возникает, вероятно, из-за ятрогенных
факторов, таких как повышенная пищевая нагрузка, использование катетеров,
антибиотиков широкого спектра действия и частые осложнения, связанные с
проведением процедур. Задержка начала адекватной терапии, что нередко
наблюдается на практике, может поставить под угрозу исход лечения пациента. К
счастью, своевременное распознавание отдельных клинических синдромов в ОИТ,
требующих специализированного лечения, может улучшить клинические результаты.
Противогрибковая профилактика должна проводиться в соответствии с уровнем
резистентности возбудителя.
Ниже приведено краткое изложение опубликованного в Journal of Intensive Care
Medicine (2008; Vol. 23, № 3; 151–158) обзора Ranjan Chowdhry, William L.
Marshall «Antifungal Therapies in the Intensive Care Unit», в котором
рассмотрены действующие рекомендации по использованию противогрибковых средств
для профилактики микозов у пациентов ОИТ. Описаны несколько новых
антимикотических препаратов, действие которых направлено против резистентных
грибов, с лучшим токсикотерапевтическим соотношением. Таким образом, количество
более безопасных и более эффективных методов лечения грибковых инфекций в ОИТ
увеличивается.
Разновидности гриба рода Сandida занимают четвертое место в мире среди причин
госпитальных инфекций крови. Следствием кандидемии является увеличение
летальности, продолжительности срока госпитализации и стоимости лечения. Garey и
его коллеги показали, что время начала терапии флуконазолом достоверно связано с
уровнем летальности таких больных. Наблюдается рост числа случаев инфекций,
вызванных штаммами, отличными от C. albicans (nonalbicans). Уровень выявления
C.
glabrata и C. parapsilosis достигает 4 и 13% соответственно, при этом у 36%
пациентов сразу после госпитализации в ОИТ была выявлена кандидемия.
В недавнем исследовании Martin и соавторов показано, что частота сепсиса,
вызванного грибом, с 1979 до 2000 года увеличилась на 207%, и количество
летальных исходов, связанных с микозами, сильно возросло. Аspergillus — наиболее
часто встречающийся инфекционный агент, обусловливающий тяжелое течение
кандидоза и высокую летальность, которая составляет приблизительно 58% и
значительно выше у пациентов, перенесших трансплантацию костного мозга или
другого органа. При иммуносупрессии и подозрении на инфекцию всегда необходимо
проводить дифференциальную диагностику для исключения грибкового заболевания.
Специфические противогрибковые средства
Амфотерицин (полиены)
Амфотерицин B деоксихолат обладает более широким спектром противогрибковой
активности по сравнению со многими другими антимикотическими средствами. Однако
его использование связано с многочисленными побочными эффектами, в том числе с
почечной недостаточностью, что приводит к увеличению конечной летальности.
Липид-ассоциированные формы амфотерицина — липидный комплекс амфотерицина В
(ABLC, абелсет), коллоидная дисперсия амфотерицина B (ABCD, амфотек) и
липосомальный амфотерицин B (L-amB, амбизом) для лечения инвазивных микозов —
являются менее нефротоксичными, хотя и более дорогой альтернативой амфотерицину
B деоксихолату. В случае длительной лихорадки и нейтропении при подозрении на
грибковую инфекцию для эмпирического лечения показан липосомальный амфотерицин
B. Данные ретроспективных и проспективных исследований свидетельствуют о
безопасности и эффективности липид-ассоциированных форм амфотерицина при их
использовании у больных с сопутствующей почечной дисфункцией и у пациентов в
критическом состоянии с тенденцией к увеличению содержания креатинина. Обладая
меньшей нефротоксичностью, липидные производные амфотерицина вызывают
приблизительно наполовину меньше таких связанных с инфузиями осложнений, как
озноб и лихорадка. Три основные его формы отличаются сроками развития данных
побочных эффектов. Эффективность всех препаратов одинакова, но частота отмены
составляла 12% для L-amB, 32% для ABLC и 42% для ABCD, что наиболее приближено к
уровню, характерному для амфотерицина B деоксихолата. Так как эффективность
различных форм является аналогичной только при использовании сопоставимых доз,
при выборе препарата учреждением немаловажным фактором является его стоимость.
При фебрильной нейтропении амфотерицин продолжает применяться с тенденцией к
уменьшению. Спектр активности амфотерицина распространяется на Candida,
Aspergillus и Zygomycetes [8]. Аspergillus terreus,
Scedosporium apiospermum,
Candida lusitaniae и Candida guilliermondii к амфотерицину резистентны. Вообще,
амфотерицин B в дозе 0,7 мг/кг в комплексе с флуцитозином в дозе 100 мг/кг в
сутки является средством выбора для начальной терапии у всех пациентов с
криптококковым менингитом. После 2 недель лечения и клинического выздоровления
для закрепления полученного эффекта дозу флуконазола корректируют до 400 мг в
сутки в течение 10 недель. После этого больные со СПИДом должны получать
флуконазол в дозе 200 мг в сутки пожизненно. У больных с тяжелой криптококковой
пневмонией амфотерицин B является средством выбора для начальной терапии.
Липосомальный амфотерицин — средство выбора для лечения диссеминированного
гистоплазмоза у больных со СПИДом. При сравнении с азоловыми противогрибковыми
препаратами, которые эффективны для поддерживающей терапии гистоплазмоза,
амфотерицин B деоксихолат был определен как более эффективный, несмотря на его
токсичность. Использование L-amB в дозе 3 мг/кг сопровождалось более низкой
токсичностью и снижением летальности по сравнению с группой пациентов, в которой
лечение проводили амфотерицином B деоксихолатом.
При легочном или распространенном аспергиллезе терапевтический выбор может
изменяться. Амфотерицин B используется более длительно, чем другие препараты. С
растущим опытом использования вориконазола и установлением того, что данный
препарат связан с меньшим уровнем летальности, амфотерицин B перестает быть
средством выбора из-за своих побочных эффектов и наличия только внутривенной
формы. Амфотерицин В продолжает играть важную роль у больных с непереносимостью
вориконазола и в ситуациях, когда использование данного препарата
противопоказано, например у пациентов, получающих сиролимус.
Эхинокандины
Эхинокандины являются ингибиторами синтеза β-(1, 3)-глюкана и обладают быстрой
фунгицидной активностью против большинства разновидностей Candida, включая
C. glabrata и C. krusei (виды с частичной или полной резистентностью к
флуконазолу), и фунгистатическим действием против Аspergillus. Таким образом,
эхинокандины — превосходный выбор в случаях, когда любой из двух названных
штаммов подозревается в качестве причинного инфекционного агента. Эхинокандины
продемонстрировали in vitro сниженную активность против C. parapsilosis, но не
ясно, коррелирует ли это с меньшей их клинической эффективностью. Эхинокандины
не оказывают действия против Zygomycetes, Fusarium или Cryptococcus.
Каспофунгин одобрен FDA в январе 2001 года к применению при кандидемии и
инвазивном кандидозе (исключая пациентов с эндокардитом, остеомиелитом и
менингитом, поскольку они не были включены в выборку исследования). Это
превосходный выбор для лечения больных с фунгемией, которым в недавнем прошлом
проводилась терапия азолами. Каспофунгин рекомендуется для эмпирической терапии
до момента идентификации причинного агента. Побочные эффекты препарата —
высыпания и гепатит. Каспофунгин взаимодействует с такролимусом, циклоспорином,
дексаметазоном, карбамазепином и средствами для антиретровиральной терапии. При
идентификации C. albicans целесообразно перевести пациента на другой препарат
или проверить чувствительность в случае применения азолов в прошлом. Каспофунгин
также одобрен для терапии кандидоза пищевода, и его следует использовать у тех
больных, у которых инфекция вызвана резистентными к флуконазолу штаммами, такими
как C. krusei или C. Glabrata. По результатам сравнительного исследования
каспофунгина и L-amB сделано заключение о сопоставимой эффективности этих
препаратов в лечении лихорадки и нейтропении.
Анидулафунгин в настоящее время одобрен к применению для лечения кандидемии,
инвазивного кандидоза (исключая пациентов с эндокардитом, остеомиелитом и
менингитом) и кандидоза пищевода. Хотя первичные результаты лечения были
сопоставимы с таковыми при использовании флуконазола, частота рецидивов при
кандидозе пищевода была значительно более низкой при применении анидулафунгина.
Анидулафунгин не стимулирует и не угнетает изоферменты системы цитохрома P450 и,
таким образом, не проявляет клинически значимого взаимодействия с циклоспорином
или такролимусом.
Микафунгин в настоящее время одобрен для проведения профилактики кандидозной
инфекции у больных после трансплантации гемопоэтических клеток и для лечения
кандидоза пищевода. Препарат не проявляет клинически значимого взаимодействия с
циклоспорином или такролимусом. Пациентам, получающим сиролимус, необходимо
провести исследование по определению его токсичности, после чего дозу, возможно,
нужно будет сократить.
Триазолы
Флуконазол — одно из наиболее часто используемых противогрибковых средств. Имеет
превосходную биодоступность при приеме внутрь и очень хорошо переносится
пациентами. Единственный встречающийся побочный эффект — гепатотоксичность.
Флуконазол весьма эффективен для лечения кандидемии, так как устойчивость C. albicans к этому препарату составляет приблизительно 1%. Вследствие широкого
использования флуконазола изменилась частота встречаемости отдельных
разновидностей причинных агентов, вызывающих инфекции, с тенденцией к увеличению
числа штаммов nonalbicans. C. krusei изначально резистентна к флуконазолу,
C. glabrata может быть восприимчивой только при увеличении дозы препарата. Таким
образом, если у тяжелобольного в качестве этиологического фактора, вызвавшего
инфекцию, подозревается один из этих штаммов, флуконазол не должен быть
эмпирическим противогрибковым средством выбора. Флуконазол играет важную роль в
терапии криптококкового менингита.
Использование флуконазола как профилактического средства у больных, перенесших
пересадку костного мозга, снижает риск инвазивного кандидоза и летальность. Это
также касается пациентов с острым миелолейкозом. Однако к назначению флуконазола
с профилактической целью в ОИТ больным без нейтропении нужно подходить
индивидуально, учитывая нехватку данных об ее эффективности. Кроме того, широкое
применение данного препарата для профилактики может привести к повышению
резистентности, что уменьшит эффективность предупредительных мер.
Вориконазол стал средством выбора для лечения инвазивного аспергиллеза. Он
хорошо переносится и имеет более благоприятный профиль побочных эффектов, чем
амфотерицин. B. Herbrecht и его коллеги при сравнении вориконазола и
амфотерицина B деоксихолата в лечении инвазивного аспергиллеза получили лучшие
результаты и отметили более высокую выживаемость при использовании вориконазола.
Denning иPerfect также показали удовлетворительные результаты использования
вориконазола в качестве средства, назначаемого по жизненным показаниям. Walsh и
коллеги подтвердили целесообразность использования вориконазола в качестве
эмпирического противогрибкового средства у больных с постоянной фебрильной
нейтропенией. Препарат эффективен против А. terreus — штамма, который устойчив к
амфотерицину.
Посаконазол — средство триазолового ряда с подтвержденным in vitro расширенным
спектром активности против грибов, включая разновидности Aspergillus. В
настоящее время препарат одобрен для профилактики инвазивных аспергиллезных и
кандидозных инфекций у иммуноскомпрометированных больных после перенесенной
трансплантации гематопоэтических стволовых клеток с реакцией «трансплантат
против хозяина» или пациентов со злокачественными гематологическими
заболеваниями с длительной нейтропенией вследствие химиотерапии. По результатам
двух рандомизированных контролируемых исследований по сравнению посаконазола с
флуконазолом инфекции, вызванные Aspergillus, возникали реже при использовании
посаконазола. В большом исследовании по сравнению флуконазола или итраконазола с
посаконазолом у пациентов с лейкозом и длительной нейтропенией после
химиотерапии летальность вследствие всех причин была значительно ниже при
использовании в целях профилактики посаконазола. Что касается предотвращения
смертельных случаев в связи с микозом после трансплантации костного мозга с
реакцией «трансплантат против хозяина», посаконазол продемонстрировал большую
эффективность, чем флуконазол, но тенденции к увеличению выживаемости в группе
посаконазола достоверными не были.
Изучено применение посаконазола в качестве терапии спасения при аспергиллезе —
успех был достигнут в 42% случаев. Таким образом, были получены основания для
проведения дальнейших терапевтических исследований. Также посаконазол эффетивен
против Zygomycetes, являясь альтернативой амфотерицину В в терапии этого
заболевания. Значимое лекарственное взаимодействие наблюдается между
посаконазолом и кальциневриновыми ингибиторами. Однако в настоящее время
посаконазол доступен только в форме для перорального применения, что
ограничивает его использование в ОИТ.
Комбинированная терапия
На основании данных недавно проведенных исследований высказано предположение,
что комбинирование амфотерицина и каспофунгина является эффективным для лечения
тяжелых инфекций. Каспофунгин может использоваться для лечения аспергиллеза в
комбинации с амфотерицином или вориконазолом. Есть сведения, подтверждающие
синергию этих препаратов in vitro и в исследованиях на животных. Большинство же
данных, касающихся человеческой популяции, находится в форме описания серии
случаев у больных, получающих такую терапию по жизненным показаниям. В
исследовании, в которое были включены пациенты, перенесшие трансплантацию,
вориконазол и каспофунгин использовали в качестве первичной терапии
аспергиллеза. Сравнение было проведено по историям болезней пациентов,
проходивших лечение в прошлом. Как оказалось, при комбинированном лечении
выживаемость больных с инфекцией, вызванной Aspergillus fumigatus, была
значительно выше. Широкое же использование комбинации данных препаратов для
терапии аспергиллеза станет возможным после проведения рандомизированного
проспективного клинического испытания.
Спектр доступных противогрибковых средств резко расширился за 5 последних лет, в
настоящее время еще больше препаратов находится в разработке. Это позволяет
подобрать более специфичную терапию при конкретных микозах, встречающихся в ОИТ.
Проблемные микозы в ОИТ
Кандидоз мочевыводящих путей, грибковая пневмония и фунгемия
Микозы мочевыводящих путей трудно дифференцировать с микробной колонизацией. Это
связано с увеличением степени кандидозного обсеменения мочевого пузыря
вследствие частого назначения антибиотиков широкого спектра действия. Также
уровень кандидозной колонизации мочевого пузыря резко возрастает из-за частого
использования в ОИТ мочевых катетеров. Существуют различные стратегии
предотвращения кандидоза мочевыводящих путей в ОИТ: замена мочевого катетера
(20% вероятность успеха), двухнедельный курс лечения флуконазолом в дозе 200
мг/сут (20–60% вероятность успеха в течение 6 недель) вместо удаления катетера
(40% частота успеха). Кандидурия у больного ОИТ иногда может указывать на
распространенную грибковую инфекцию.
Лечение грибковой пневмонии в ОИТ чрезвычайно проблематично. Пневмонии,
вызванные оппортунистическими грибами, такими как Aspergillus, S. apiospermum,
S. fusarium и Zygomycetes, осложняют лечение пациентов с гематологическими
злокачественными заболеваниями, а также перенесших трансплантацию и других
иммуноскомпроментированных групп больных. Диагностика грибковой пневмонии
затруднительна, так как малоинвазивные методы, такие как бронхоальвеолярный
лаваж и исследование культуры мокроты, редко позволяют установить диагноз. Часто
подозрение на заболевание основывается на обнаружении изменений при
томографическом исследовании — связанных с плеврой клиновидных инфильтратов,
«ореола» или увеличивающихся образований, диффузных изменений в легких в виде
узелков. Иногда позитивной оказывается серологическая проба на галактоманнан,
подтверждающая аспергиллезную инфекцию.
Эмпирическая противогрибковая терапия должна быть ориентирована на наиболее
вероятных возбудителей. Например, у больных лейкозом чаще других легочных
грибковых инфекционных агентов встречается Aspergillus, у них очень эффективна
терапия вориконазолом. В случае инфекций, вызванных зигомицетами, такими как
mucor или rhizopus, использование амфотерицина B требует сопутствующего
хирургического вмешательства.
Риск развития кандидемии и распространенного кандидоза в ОИТ высок ввиду наличия
следующих факторов: проведение парентерального питания, использование
антибиотиков широкого спектра действия, колонизация Candida и недавнее
абдоминальное хирургическое вмешательство. Пациентам с положительными
результатами посевов крови на дрожжевые грибы до идентификации C. albicans и
определения чувствительности к флуконазолу должен быть назначен эхинокандин. В
случаях получения чувствительного к флуконазолу изолята или при стабильном
клиническом течении инфекции, вызванной C. albicans, показан флуконазол в дозе
800 мг/сут с последующим переходом на 400 мг/сут. Вспомогательные меры включают
удаление внутривенных катетеров практически во всех случаях и консультацию
офтальмолога для исключения эндофтальмита.
Профилактика грибковых инфекций в ОИТ
Проведение профилактических мероприятий в ОИТ пациентам без нейтропении должно
осуществляться только при высоком риске развития грибковых инфекций. Недавно
проведенный Shorr и соавторами мета-анализ рандомизированных контролируемых
плацебо исследований по изучению использования с профилактической целью
флуконазола в хирургических ОИТ показал значительное уменьшение частоты микозов,
но какая-либо связь с увеличением выживаемости пациентов при этом не обнаружена.
Кроме того, у больных исследуемой группы не было статистически достоверного
преимущества в сроках снижения уровня кандидемии, хотя дозы флуконазола,
используемые в исследованиях, подвергнутым мета-анализу, были различны, а общий
уровень кандидемии — низким. В исследовании Jacobs и соавторов показано
значительное увеличение выживаемости пациентов, получающих флуконазол, особенно
в подгруппе больных с интраабдоминальным сепсисом. Американское общество
инфекционных болезней в руководствах по лечению предполагаемого кандидоза у
пациентов с лихорадкой без нейтропении рекомендует ограничить эмпирическое
использование флуконазола в случае отсутствия любого другого источника
лихорадки, множественной колонизации Candida и наличия одного из таких факторов
риска, как: длительное использование антибактериальных средств, применение
центральных венозных катетеров, гипералиментации, недавнее хирургическое
вмешательство (особенно на пищевом канале) или длительное пребывание в ОИТ. Были
сделаны выводы, что у пациентов с самым высоким риском, например, после
хирургического вмешательства на пищевом канале с необъяснимой лихорадкой,
которая возникает на фоне антибиотикотерапии, стратегией выбора может быть
эмпирическая противогрибковая терапия. У этих больных могут протекать
бессимптомные кандидозные инфекции при отсутствии кандидемии, что затрудняет
принятие данного решения. В таких случаях должно быть проведено более тщательное
обследование, например рентгенологическое, до прекращения эмпирической
противогрибковой терапии. Широкое использование эмпирической противогрибковой
терапии у пациентов с лихорадкой без нейтропении, находящихся в ОИТ, у которых
риск возникновения грибковой инфекции более низок, вряд ли увеличит
выживаемость, но повысит устойчивость микроорганизмов и стоимость лечения.
Подготовила Ольга Денисова.
Лицо
%PDF-1.4
%
1 0 obj
>
/ExtGState > /XObject > /Font > >>
/Contents 10 0 R
/TrimBox [ 8.50394 8.50394 847.559 603.78 ]
/BleedBox [ 0 0 856.063 612.283 ]
/ArtBox [ 8.50394 8.50394 847.559 603.78 ]
/StructParents 0
/Parent 2 0 R
>>
endobj
3 0 obj
>
endobj
11 0 obj
>
stream
2019-09-24T18:22:03+04:00Adobe Illustrator CC (Windows)2019-09-24T19:32:06+03:002019-09-24T19:32:06+03:00application/pdf
xmp.did:14d47a71-d0ba-5e41-a973-b3d84a4a3ccbuuid:b2ea69d0-5e72-4d71-8cb1-207eebe30c4euuid:1d0b9a20-3e3e-4aa2-897a-4f92d7cf4f68proof:pdfuuid:0eb00027-693a-47ad-8b09-b1ee065893c0uuid:1d0b9a20-3e3e-4aa2-897a-4f92d7cf4f68uuid:1d0b9a20-3e3e-4aa2-897a-4f92d7cf4f68
1FalseFalse209.999994297.000002Millimeters
Adobe PDF library 11.00
endstream
endobj
4 0 obj
>
endobj
12 0 obj
>
stream
2019-09-24T18:22:03+04:00Adobe Illustrator CC (Windows)2019-09-24T19:32:06+03:002019-09-24T19:32:06+03:00application/pdf
xmp.did:14d47a71-d0ba-5e41-a973-b3d84a4a3ccbuuid:b2ea69d0-5e72-4d71-8cb1-207eebe30c4euuid:1d0b9a20-3e3e-4aa2-897a-4f92d7cf4f68proof:pdfuuid:0eb00027-693a-47ad-8b09-b1ee065893c0uuid:1d0b9a20-3e3e-4aa2-897a-4f92d7cf4f68uuid:1d0b9a20-3e3e-4aa2-897a-4f92d7cf4f68
1FalseFalse209.999994297.000002Millimeters
Adobe PDF library 11.00
endstream
endobj
5 0 obj
>
endobj
13 0 obj
>
stream
2019-09-24T18:20:42+04:00Adobe Illustrator CC (Windows)2019-09-24T18:20:42+03:002019-09-24T18:20:42+03:00application/pdf
xmp.did:aae1d855-bb6b-2f42-afb8-eb1b2ff61581uuid:454caa2e-8863-4c30-8375-2a29ad3be8d5uuid:1d0b9a20-3e3e-4aa2-897a-4f92d7cf4f68proof:pdfuuid:0eb00027-693a-47ad-8b09-b1ee065893c0uuid:1d0b9a20-3e3e-4aa2-897a-4f92d7cf4f68uuid:1d0b9a20-3e3e-4aa2-897a-4f92d7cf4f68
1FalseFalse209.999994297.000002Millimeters
Adobe PDF library 11.00
endstream
endobj
6 0 obj
>
endobj
14 0 obj
>
stream
2019-09-24T18:20:42+04:00Adobe Illustrator CC (Windows)2019-09-24T18:20:42+03:002019-09-24T18:20:42+03:00application/pdf
xmp.did:aae1d855-bb6b-2f42-afb8-eb1b2ff61581uuid:454caa2e-8863-4c30-8375-2a29ad3be8d5uuid:1d0b9a20-3e3e-4aa2-897a-4f92d7cf4f68proof:pdfuuid:0eb00027-693a-47ad-8b09-b1ee065893c0uuid:1d0b9a20-3e3e-4aa2-897a-4f92d7cf4f68uuid:1d0b9a20-3e3e-4aa2-897a-4f92d7cf4f68
1FalseFalse209.999994297.000002Millimeters
Adobe PDF library 11.00
endstream
endobj
7 0 obj
>
endobj
8 0 obj
> ]
/Type /XObject
/BitsPerComponent 8
/Height 2340
/Width 1648
/Subtype /Image
>>
stream
HlWْ8dt:):-:z)zA(@&O_//VQavCZ]..,w../vp~mׯ{_7NUigqr4¢;ѝ`wo#1aՅc7ϸޜ_.5X+k{wZ6~[\ή}=’Yof3_w7W558[|fX5˔q
И о что значит, фунгемия, что это?
24 февраля 2010 г.
Пандемия – это распространение нового заболевания в мировых масштабах.
Пандемия гриппа происходит, когда появляется новый вирус гриппа и распространяется по всему миру, и большинство людей не обладают иммунитетом. Вирусы, вызывавшие прежние пандемии, обычно происходили от вирусов гриппа животных.
Некоторые аспекты пандемии гриппа могут казаться сходными с сезонным гриппом, тогда как другие параметры могут значительно отличаться. Например, и сезонным и пандемическим гриппом могут заразиться все возрастные группы, и в большинстве пациент полностью выздоравливает без лечения. Однако от типичного сезонного гриппа больше всего умирает престарелых, а другие тяжелые случаи наблюдаются чаще всего среди лиц с различными медицинскими состояниями.
Напротив, пандемия h2N1 вызвала большинство тяжелых или смертельных случаев заболевания среди лиц более молодых возрастных групп, как с хроническими состояниями, так и здоровых, значительно больше случаев вирусной пневмонии, чем обычно наблюдается при сезонном гриппе.
И при сезонном и при пандемическом гриппе общее число тяжело заболевших может варьироваться. Однако последствия или тяжесть обычно более выражены при пандемии отчасти в силу того, что значительно больше людей не имеют ранее сформировавшегося иммунитета к новому вирусу. Когда заражается значительная часть населения, даже если доля заразившихся, у которых разовьется болезнь в тяжелой форме, невелика, общее число тяжелых случаев может быть весьма большим.
В случаях как сезонного, так и пандемического гриппа можно ожидать, что пик активности придется на обычный для той или иной зоны период наступления сезонного гриппа. (Например, в зонах умеренного климата это обычно зимние месяцы). Однако, как это наблюдалось в ходе текущей пандемии гриппа h2N1, пандемии могут отличаться необычной эпидемиологической динамикой и крупные вспышки возможны в летние месяцы.
19.05.2014 bracatuS (2380 articles)
Мечта модниц 30-х годов прошлого века, уникальное в своем роде изделие для изысканных дам – фильдеперсовые чулки. Они стоили баснословно дорого и при том их сложно было достать! Они появились во времена НЭПа, став альтернативой обычным грубым хлопковым чулкам и предшественниками нейлоновых чулок.
Так что же такое фильдеперсовые чулки? Как они выглядели? Из чего были сделаны? Почему каждая уважающая себя женщина считала необходимым иметь их?
Справка из Википедии
Фильдепе́рс (от фр. fil de Perse — «персидская нить», также фильдепе́рса) — особо обработанный, более шелковистый и тонкий фильдекос, изделия из фильдеперса были заметно дороже, чем из обычного фильдекоса.
Фильдеко́с (от фр. fil d’Ecosse — «шотландская нить») — тонкая хлопчатобумажная пряжа, туго скручиваемая из нескольких ниток, мерсеризированная и пропущенная через опалку газовыми горелками. Использовалась во второй половине XIX — первой половине XX веков для изготовления тонких трикотажных изделий, прежде всего, в чулочном производстве, перчаток. Производилась в основном в Шотландии (чему ткань и обязана названием).
Мерсеризация — кратковременная обработка ткани концентрированным раствором едкого натра с последующей промывкой её горячей и холодной водой. Предотвращает выцветание тканей, сохраняет первоначальный тон, гигроскопичность и прочность, придаёт материалу шелковистый блеск.
Процесс был разработан в 1844 году Джоном Мерсером (John Mercer) из Грейт Харвуд, Ланкашир, Великобритания, который обогащал хлопковые волокна гидроксидом натрия. Волокна набухали, так что разновидность процесса, использовавшаяся Мерсером, сокращала общий размер ткани и делала ткань прочнее и более легкоокрашиваемой. Процесс не стал популярен, пока в 1890 году не был доработан до современного вида: хлопок удерживался во избежание уменьшения размеров, и автор идеи, Лоу, обнаружил, что волокна получили блестящий внешний вид.
Мерсеризация изменяет химическую структуру хлопкового волокна. Структура волокон переходит из состояния альфа-целлюлозы в термодинамически более благоприятную бета-целлюлозу. Мерсеризация приводит к набуханию клеточной стенки хлопкового волокна. Это приводит к увеличению площади поверхности и придаёт волокну блестящий вид.
Мерсеризованный хлопок проходит весьма непростую обработку. Вначале пряжа обрабатывается раствором каустической соды, причем процесс полностью автоматизирован: загрузка и выгрузка пряжи и электронный контроль процесса. Этот этап собственно и называется мерсеризация.
Крашение такой пряжи осуществляется в муфтах, что значительно превосходит по качеству обычное окрашивание пряжи в бабинах.
Следующий этап обработки, которую проходит нить – это газоопалка. При газоопалке нить разматывается с бобин и проходит через газовую горелку, где полностью сгорают ворсинки, после чего вновь перематывается в бобины. Этот процесс обработки позволяет получить нить с уже качественно новыми уникальными свойствами. Нить, прошедшая газоопалку, а, соответственно и пряжа, полученная из нее, становится «цилиндрической», а значит, и более гладкой. Исчезает ворсистость, появляется блеск и высокая прочность.
Итак, мерсеризованная пряжа – это обработанная особым способом хлопковая нить. В результате подобной обработки пряжа приобретает превосходный блеск, мягкость и шелковистость, высокую устойчивость цвета и отличное поглощение влаги. Изделия из такой пряжи напоминают шелковую продукцию. Они устойчивы к свету, к стирке, к поту, трению, а также к сухому глажению. Мерсеризованный хлопок это замечательный новый материал, обладающий уникальными качествами: красив, прочен, высоко износостоек, удобен и экологичен в носке.
В советской России фильдеперсовые чулки можно было купить только за валюту в магазинах торговли с иностранцами. Носили их, как обычно, с поясом для чулок или с корсетом. Самоподдерживающиеся чулки на силиконе или резинке появились гораздо позже. Фильдеперсовые чулки изготавливались и 100%-го хлопка без каких-либо добавок эластана и полиамида – в те годы таких технологий еще не использовали. Поэтому женщинам было достаточно сложно избегать морщин на чулках. Мерсеризированная хлопковая нить придавала фильдеперсовым чулкам мягкий благородный шелковистый блеск. Эти чулки притягивали взгляды и были очень приятными на ощупь. Некоторые даже полагали, что фильдеперсовые чулки делают из шелка – настолько мягкий мерсеризированный хлопок был похож на него. Конечно зимой, в стужу, фильдеперсовые чулки отнюдь не способствовали сохранению тепла, но и нынешние модницы рискуют своим здоровьем, надевая в мороз даже не хлопковые, а более тонкие полиамидные чулки и колготки.
Наверное, вы удивитесь, но фильдеперсовые чулки, колготки и даже леггинсы можно купить и сейчас. При этом речь не идет об антикварных вещах. Некоторые современные производители продолжают выпускать изделия в ретро-стиле для любителей всего натурального и роскошного.
Посмотрите на эту модель получулок от Oroblu: если взять их в руки, то вы сразу поймете, что к вам попали те самые «бабушкины» чулки. Изготовленные из высококачественного 100%-го хлопка, полностью в стиле тех лет, такие же красивые и прочные.
Или же возьмем колготки из мерсеризированного хлопка (88% хлопка в составе). Если вы наденете эти эксклюзивные колготки, то будете выглядеть неповторимо и изысканно.
Для любительниц еще более современных вариантов чулочно-носочных изделий мы можем предложить леггинсы из мерсеризированного хлопка. Во-первых, модель, аналогичную колготкам, но без носочно-пяточной части; во-вторых – чудесные леггинсы с ажурным низом (87% хлопка в составе). Название леггинсов Nostalgia выражает желание дизайнеров дать нам ощутить дух «тех» времен – времен роскоши и женственности.
Надеемся, вы по достоинству оцените не только внешнюю красоту этих изделий, но и их функциональность. Чулки, колготки и леггинсы и высококачественного мерсеризированного хлопка прослужат очень долго и будут дарить вам незабываемые ощущения.
Что такое фильдеперсовые чулки (текст) © Bracatus. Фотоматериалы: каталоги Oroblu, сайт Антик-мода.ру. Все материалы данного сайта являются объектами авторского права (в том числе дизайн). Запрещается копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя.
Этикет — классическая вещь, и поэтому никакие вновь появившиеся колготки с отрезанными пальцами элегантная женщина носить не может. Если на ней колготки — значит пальцы тоже закрыты колготками.
— Альбина Холгóва
Fungemia — обзор | Темы ScienceDirect
Прогноз
Прогноз зависит от состояния пациента на момент постановки диагноза. Дети и взрослые, у которых произошла фунгемия и имеют поражение нескольких органов, могут хуже реагировать на терапию и нуждаться в интенсивной терапии. Уровень смертности от ПКМ постепенно снижается в результате более ранней диагностики и более эффективного лечения. В отчете, описывающем восемь смертей в когорте из 141 педиатрического случая, коэффициент летальности составил 9.5% в период 1981–2001 гг. И 2,6% в период 2002–2019 гг. (Romaneli et al ., 2019). Как указывалось ранее, уровень альбумина при поступлении может быть предиктором смерти. Другие авторы указали, что абдоминальные осложнения, особенно поражение печени, асцит и недоедание, были связаны с летальным прогнозом (Nogueira et al ., 2006; de Melo Braga et al ., 2013). В A / SAF уровень смертности ниже. Полной ремиссии следует ожидать у большинства, но не у всех пациентов с A / SAF и CF, так как могут развиваться последствия, а поражение определенных органов может быть окончательным (например,г., фиброз легких, недостаточность надпочечников, неврологические последствия). Таким образом, некоторые клиницисты считают термин лечить неуместным из-за невозможности подтвердить полное уничтожение организма; Вместо этого следует использовать термин кажущееся излечение (Shikanai-Yasuda et al ., 2017).
PCM сохраняется как болезнь с относительно низкой смертностью, но значительной заболеваемостью. Осложнения различаются, и, как и прогноз, их возникновение зависит от степени поражения грибком.При A / SAF ранними осложнениями, которые могут привести к хирургическому вмешательству, являются кишечная непроходимость и желтуха, которые возникают в результате увеличения брыжеечных лимфатических узлов, или экстренной трахеостомии из-за поражения гортани, приводящей к стенозу трахеи. Сиквелы чаще встречаются у взрослых, чем у детей. Как правило, фиброз является причиной серьезных проблем у пациентов, которые реагируют на терапию, особенно при наличии обширных легочных инфильтратов. Несмотря на новейшие, очень эффективные методы лечения, эти последствия в некоторых случаях препятствуют полному восстановлению прежнего состояния здоровья пациентов (Tobón et al ., 2003; Lopera и др. ., 2015). Рубцы и фиброз пораженных узлов и остаточный фиброз легких были отмечены в более ранних исследованиях (Londero et al ., 1996). Исследование показало, что почти у всех недавно пролеченных пациентов с МВ сохраняется хотя бы одна аномалия на КТ (Costa et al ., 2013), наиболее частыми из которых были архитектурные искажения, сетчатое и утолщение перегородки, центрилобулярная и парасептальная эмфизема и паренхиматозная ткань. группы. Эти данные, вероятно, отражают характер распространения грибов через лимфатические сосуды и последующий фиброз, ранее описанный в гистопатологических исследованиях (Tuder et al ., 1985). Функционально пациенты обычно имели легкое обструктивное расстройство и легкое снижение диффузионной способности при сохранении способности к физической нагрузке. Однако у одной трети пациентов наблюдалась значительная десатурация кислорода при нагрузке, которая была связана с респираторным дистресс-синдромом (Costa et al ., 2013). Кроме того, у большинства пациентов также наблюдались центрилобулярная и парасептальная эмфизема, что свидетельствует о высоком воздействии табака в этой популяции и подчеркивает важность прекращения воздействия табака для лучших результатов лечения.Недавнее исследование пациентов после лечения с более длительным периодом наблюдения показало стойкость фиброза и аномалий эмфиземы; все пациенты курили (Пина, 2006). Попытки уменьшить фиброз легких после лечения были протестированы только на экспериментальных моделях, но могут быть многообещающими (Lopera et al ., 2015). В редких случаях у пациента может остаться достаточно значительное фиброзное рубцевание, которое приведет к развитию легочного сердца (Campos et al ., 1986). Другими важными последствиями, которые могут присутствовать при МВ, являются охриплость голоса, стеноз трахеи, ведущий к окончательной трахеостомии, микростомия, которая требует хирургической реконструкции, надпочечниковая недостаточность, требующая длительного гормонального замещения, и неврологические последствия (do Valle et al ., 1995; Табон и др. , 1995; Londero и др. , 1996; Вебер и др. ., 2006; Francesconi et al ., 2011; де Пина и др. ., 2018).
PCM человека не имеет признанного профилактического лечения. Стратегии вакцинации разрабатываются, но все еще ограничиваются экспериментальными моделями болезни (Taborda et al ., 2015).
Fungemia — обзор | Темы ScienceDirect
Микробиологическая оценка
Стойкая бактериемия или фунгемия — наиболее полезный лабораторный результат при эндокардите.Вернер и его коллеги 63 изучили 206 взрослых с эндокардитом и обнаружили, что на стрептококки первая культура крови была положительной в 96% случаев, а вторая культура была положительной в 98%. При эндокардите, вызванном другими видами, один посев крови дал диагноз в 82% случаев, а два — в 100%. Аналогичные результаты были получены Belli & Waisbren, 64 , которые сообщили, что первая культура была положительной в 94% случаев. Однако каждый посев крови не может быть положительным на привередливые организмы, такие как микроорганизмы HACEK.Таким образом, для оптимизации выявления патогена у пациентов с подозрением на эндокардит необходимо собрать от трех до пяти образцов гемокультуры из отдельных участков венепункции. Если пациент недавно получал антибиотики и клинически стабилен, противомикробную терапию следует приостановить на время, чтобы потенциально улучшить диагностическую ценность.
В идеале, если пациенту не требуется немедленное лечение антибиотиками, посев крови может быть получен в течение 24 часов. Клиническое значение единичного положительного результата посева, особенно для возможного контаминанта (например,g., коагулазонегативные стафилококки и, иногда, стрептококки viridans) бывает трудно оценить. Таким образом, если получено несколько образцов культур и только один дает положительный результат, эндокардит маловероятен. Если для посева имеется ограниченное количество крови, весь объем следует засеять в аэробную бутыль. Целесообразно продемонстрировать стойкость бактериемии с помощью двух или трех дополнительных культур крови до начала противомикробной терапии.
Лабораторию клинической микробиологии следует попросить использовать специализированные среды, условия роста и увеличить продолжительность инкубации до 2 недель, если предыдущие результаты культивирования были отрицательными и рассматриваются необычные патогены, такие как организмы HACEK.Серологические тесты (например, Coxiella , Chlamydia, Bartonella ), тесты на антиген в моче (например, Legionella ), а также тесты генных зондов и полимеразной цепной реакции (ПЦР) образцов ткани и сыворотки (например, Bartonella ) являются важными вспомогательными средствами в сложных случаях. 1, 21 Недавнее исследование подчеркнуло полезность серологического и ПЦР-тестирования. Из 348 пациентов с культурально-отрицательным эндокардитом, Q-лихорадкой и Bartonella spp. были диагностированы серологически в 48% и 28% случаев соответственно. 65 ПЦР, проведенная на ткани клапана, выявила Coxiella burnetii, Bartonella, Tropheryma whipplei, и виды стрептококков в 12%, 14%, 0,5% и 1% соответственно. Однако, за исключением антител против C. burnetii , ни один из этих диагностических тестов не является стандартизированным или широко доступным и, следовательно, еще не является диагностическим критерием в классификации Герцога. 1, 59
% PDF-1.4
%
249 0 объект
>
эндобдж
xref
249 113
0000000016 00000 н.
0000003219 00000 н.
0000003378 00000 н.
0000005100 00000 н.
0000005127 00000 н.
0000005280 00000 н.
0000005630 00000 н.
0000005891 00000 н.
0000006400 00000 н.
0000006642 00000 п.
0000007153 00000 н.
0000007406 00000 н.
0000007457 00000 н.
0000007508 00000 н.
0000007558 00000 н.
0000007609 00000 н.
0000007660 00000 н.
0000007711 00000 н.
0000007762 00000 н.
0000007813 00000 н.
0000007927 00000 н.
0000016030 00000 п.
0000023603 00000 п.
0000031181 00000 п.
0000031293 00000 п.
0000031433 00000 п.
0000031839 00000 п.
0000032095 00000 п.
0000032702 00000 п.
0000032949 00000 п.
0000032976 00000 п.
0000033477 00000 п.
0000033608 00000 п.
0000033994 00000 п.
0000034580 00000 п.
0000034979 00000 п.
0000035290 00000 п.
0000035317 00000 п.
0000043278 00000 п.
0000050505 00000 п.
0000058845 00000 п.
0000065952 00000 п.
0000074325 00000 п.
0000074508 00000 п.
0000086356 00000 п.
0000086603 00000 п.
0000089413 00000 п.
0000096835 00000 п.
0000096921 00000 п.
0000096991 00000 п.
0000109947 00000 н.
0000110335 00000 н.
0000110596 00000 н.
0000119567 00000 н.
0000128691 00000 н.
0000128793 00000 н.
0000128863 00000 н.
0000128932 00000 н.
0000129301 00000 н.
0000129594 00000 н.
0000129829 00000 н.
0000130328 00000 н.
0000130771 00000 п.
0000131170 00000 н.
0000131647 00000 н.
0000132134 00000 н.
0000133922 00000 н.
0000134254 00000 н.
0000134649 00000 н.
0000143773 00000 н.
0000143812 00000 н.
0000180589 00000 н.
0000180628 00000 н.
0000191228 00000 н.
0000218716 00000 н.
0000235072 00000 н.
0000244902 00000 н.
0000254385 00000 н.
0000263918 00000 н.
0000275409 00000 н.
0000288642 00000 н.
0000291367 00000 н.
0000292625 00000 н.
0000293967 00000 н.
0000294970 00000 н.
0000295950 00000 н.
0000296928 00000 н.
0000297907 00000 н.
0000299955 00000 н.
0000301611 00000 н.
0000302688 00000 п.
0000303796 00000 н.
0000305019 00000 н.
0000305496 00000 н.
0000306790 00000 н.
0000308034 00000 н.
0000308992 00000 н.
0000309977 00000 н.
0000311715 00000 н.
0000312922 00000 н.
0000313452 00000 н.
0000314415 00000 н.
0000315378 00000 н.
0000316414 00000 н.
0000319729 00000 н.
0000320810 00000 н.
0000321341 00000 н.
0000321941 00000 н.
0000322448 00000 н.
0000323801 00000 н.
0000324948 00000 н.
0000003039 00000 н.
0000002556 00000 н.
трейлер
] / Назад 399112 / XRefStm 3039 >>
startxref
0
%% EOF
361 0 объект
> поток
hb«`g`g` ̀
Фунгемия Медицинское определение | Медицинский словарь Merriam-Webster
варианты:
или главным образом британская фунгемия \
fən- ˈjē- mē- ə
, fəŋ- ˈgē- mē- ə
\
Медицинское определение
фунгемии
: наличие грибков (дрожжей) в крови
Candida krusei Fungemia: эскалация серьезной инфекции у пациентов с ослабленным иммунитетом | Реанимационная медицина | JAMA Internal Medicine
Фон
Candida krusei по своей природе устойчива к флуконазолу и становится частой причиной фунгемии у пациентов с гематологическими злокачественными новообразованиями.
Объектив
Определить факторы риска и прогностические факторы, связанные с фунгемией C krusei в сравнении с фунгемией Candida albicans у больных раком.
Методы
Ретроспективное исследование 57 случаев фунгемии C krusei , имевших место в онкологическом центре MD Anderson, Хьюстон, Техас, с 1989 по 1996 год. Случаи C krusei сравнивали с 57 случаями фунгемии C albicans в отношении демографии, основной рак, оценка острой физиологии и хронического здоровья II, иммуносупрессивный статус, химиотерапия и использование центральных венозных катетеров, а также профилактика флуконазолом.
Результаты
В нашем учреждении на C krusei приходилось 5% фунгемии в период с 1989 по 1992 год и 10% в период с 1993 по 1996 год. Пациенты с фунгемией C krusei чаще болели лейкемией, чем пациенты с C albicans (77% против 11 %; P = 0,02), тогда как инфекции, связанные с катетером, чаще встречались среди пациентов с фунгемией C albicans (42% против 0%; P <0,001). Пациенты с фунгемией C krusei имели более низкий уровень ответа (51% против 69%; P =.05), в основном потому, что они чаще были нейтропеническими и имели диссеминированную инфекцию. Смертность, связанная с фунгемией, составила 49% в случаях с C krusei по сравнению с 28% у C albicans . Анализ множественной логистической регрессии показал, что стойкая нейтропения ( P = 0,02) и септический шок ( P = 0,002) были предикторами плохого прогноза.
Заключение
У пациентов с нейтропенией фунгемия C krusei связана с высокой смертностью.Его следует подозревать у пациентов с лейкемией, получающих профилактику флуконазолом, и их следует агрессивно лечить по схеме амфотерицина B.
В течение многих лет почти все случаи кандидемии были вызваны Candida albicans . В течение последнего десятилетия Candida tropicalis стал важным патогеном, особенно среди больных раком. 1 -3 Совсем недавно было доказано, что другие виды Candida ответственны за повышенную долю кандидемий, и Candida krusei стал одним из наиболее частых из этих новых патогенов, особенно среди пациентов с острым лейкозом. . 2 , 4 Candida krusei по своей природе устойчива к флуконазолу, и многие инфекции, вызываемые этим организмом, были связаны с профилактическим или терапевтическим применением этого противогрибкового средства. 5 , 6 Поскольку у большинства учреждений ограниченный опыт работы с фунгемией C krusei , мы рассмотрели все случаи, имевшие место в нашем учреждении в течение 7-летнего периода. Контрольная группа пациентов с фунгемией C albicans была выбрана для определения факторов риска, уникальных для приобретения фунгемии C krusei .
Записи микробиологической лаборатории онкологического центра им. М. Д. Андерсона Техасского университета в Хьюстоне были проанализированы за период с 1 января 1989 г. по 31 декабря 1996 г. для выявления всех случаев гематогенного кандидоза. Из 885 случаев 60 были вызваны C krusei, , и медицинские записи 57 из этих случаев были доступны для просмотра. Исследование случай-контроль было проведено путем отбора 57 пациентов с фунгемией C albicans в качестве контрольной группы.Две группы были сопоставлены по времени первого положительного посева крови на фунгемию C krusei и C albicans в течение каждого из двух периодов: с 1989 по 1992 год и с 1993 по 1996 год.
Были изучены медицинские записи всех случаев и контрольных групп, и за 30 дней до сбора первого положительного посева крови и впоследствии в ходе инфекции была определена следующая информация: возраст, пол, лежащее в основе злокачественное новообразование, острая физиология и хроническое здоровье Оценка II балла (в начале фунгемии), продолжительности госпитализации, продолжительности пребывания в отделении интенсивной терапии и продолжительности нейтропении.Кроме того, в течение этого интервала мы регистрировали прием антибиотиков, кортикостероидов надпочечников, облучение всего тела, химиотерапевтические препараты против рака, иммунодепрессанты (циклоспорин, такролимус), парентеральное питание и противогрибковые препараты.
У пациента была определена кандидемия, если C krusei или C albicans было выделено по крайней мере из одного образца культуры крови, связанного с лихорадкой или признаками инфекции органов.Фунгемии, имевшие место в период с 1989 по 1992 год, были включены в предыдущие отчеты. 2 , 7 Пациенты считались страдающими диссеминированной инфекцией, если помимо фунгемии имелись клинические или гистопатологические доказательства инфекции хотя бы в 1 внутреннем органе и был идентифицирован Candida видов, или был выделен тот же вид. из образца ткани. Инфекция также считалась распространенной, когда вид Candida был выделен из образцов культуры крови, собранных в течение 3 отдельных дней у пациента с нейтропенией, у которого катетер не был источником фунгемии.
Количество нейтрофилов
было отнесено к категории менее 0,50 × 10 9 / л и менее 0,10 × 10 9 / л. В этом исследовании нейтропения определялась как количество нейтрофилов менее 0,50 × 10 9 / л, поскольку результаты были аналогичными для 2 категорий нейтропении. Шок определялся как снижение систолического артериального давления на 40 мм рт. Ст. Или более или систолическое артериальное давление менее 90 мм рт. Ст. У ранее нормотензивного пациента, не связанное с другими возможными причинами.Инфекция считалась связанной с катетером, если кончик катетера был заметно колонизирован теми же видами Candida , что и кровоток (≥15 колониеобразующих единиц по полуколичественному методу роликового планшета) или количественный посев крови, собранный через центральный венозный катетер. количество колоний было в 10 раз больше, чем в параллельном образце количественной культуры периферической крови.
Ответ
был определен как разрешение всех клинических проявлений с отрицательными культурами крови на Candida видов в течение как минимум 1 недели после терапии.Отсутствие ответа определялось как сохранение клинических признаков и симптомов грибковой инфекции или стойкой кандидемии, вызванной тем же видом Candida после начала терапии. Смерть приписывалась инфекции Candida , если у пациента отсутствовала реакция на терапию и не было другой очевидной причины смерти, такой как обширное кровотечение или другая инфекция.
Плотность заболеваемости гематогенным кандидозом рассчитывалась как количество случаев за период на 10 000 выписок из больницы.Были выполнены частоты и описания демографических и клинических характеристик популяции пациентов. Тест χ 2 и точный критерий Фишера использовались для определения категориальных предикторов инфекций и исходов. Непрерывные переменные сравнивались с помощью теста t . Множественные предикторы были проверены на значимость с помощью множественной логистической регрессии с использованием обратного исключения по критерию Вальда. P Значения менее 0,05 считались статистически значимыми.Все статистические анализы были выполнены с помощью SPSS версии 8.0 для Windows (SPSS, Inc, Чикаго, Иллинойс). 8
ОСОБЕННОСТИ C krusei ИНФЕКЦИЯ
С 1989 по 1996 год было зарегистрировано 57 случаев фунгемии C krusei . Частота значительно увеличилась с 2.5 на 10 000 выписанных из больниц в период с 1989 по 1992 г. до 5,7 на 10 000 в период с 1993 по 1996 г. ( P = 0,004). Candida krusei составляла 5% всех кандидемий в первый период и 10% во второй период. Почти все пациенты имели гематологические злокачественные новообразования, особенно острый лейкоз (таблица 1). Только 8 инфекций (14%) были признаны внебольничными.
Сорок девять пациентов (86%) с фунгемией C krusei получали профилактику флуконазолом; эта доля увеличилась с 78% до 90% в течение 2 периодов, а средняя продолжительность профилактики увеличилась с 12 дней (диапазон 4-32 дня) до 19 дней (диапазон 6-47 дней).Частота ответа для 49 пациентов, получавших профилактику флуконазолом, была аналогична таковой для 8 пациентов, которые не получали (51% [25 пациентов] против 50% [4 пациента]). Один из 8 пациентов получил эмпирическое лечение флуконазолом и ответил на него. У одиннадцати пациентов (все с нейтропенией) развилась фунгемия C krusei при приеме амфотерицина B от постоянной лихорадки, предположительно вызванной грибковой инфекцией. Вводимая доза составляла от 0,35 до 0,5 мг / кг в день в течение от 2 до 36 дней (в среднем 13 дней).Только 3 пациента выздоровели от инфекции, что было связано с исчезновением нейтропении и увеличением дозы амфотерицина B.
У 51 пациента (89%) была нейтропения в начале инфекции, а средняя продолжительность нейтропении до начала инфекции составляла 18 дней (диапазон от 3 до 95 дней). У 21 (37%) пациентов была диссеминированная инфекция, и у 18 (86%) из этих пациентов в начале инфекции была нейтропения. Ни одна из фунгемии C krusei не считалась связанной с катетером.
Двадцать девять (51%) пациентов ответили на терапию, а остальные 28 пациентов умерли от своей инфекции (Таблица 2). Считалось, что 24 из последних 28 пациентов умерли в основном от своей инфекции. Среди умерших пациентов у 22 (79%) сохранялась нейтропения на протяжении всей инфекции, а у 18 (64%) была диссеминированная инфекция. Смертность составила 81% (17 пациентов) для пациентов со стойкой нейтропенией и 86% (18 пациентов) для пациентов с диссеминированной инфекцией.Только 11 пациентов (31%), у которых не было нейтропении или нейтропения которых разрешилась во время терапии, умерли от инфекции. Ни один из пациентов с солидными опухолями или ремиссией злокачественного новообразования не умер от инфекции.
Девять пациентов изначально лечились флуконазолом, и двое из них ответили на эту терапию. У обоих этих пациентов в начале инфекции была нейтропения, которая исчезла во время терапии. У остальных 7 пациентов терапия была изменена на амфотерицин B, обычно, когда гриб идентифицировался как C krusei .49 пациентов получали дезоксихолат амфотерицина B или липидную формулу амфотерицина B, и 25 (51%) случаев ответили на лечение. Среди 25 респондентов 21 (84%) не страдали нейтропенией или вылечились от нейтропении.
Одномерный анализ показал, что плохой ответ был связан со стойкой нейтропенией, диссеминированной инфекцией, септическим шоком, другими сопутствующими грибковыми инфекциями и иммуносупрессивной терапией (таблица 3). Анализ множественной логистической регрессии выявил стойкую нейтропению ( P =.02) и септический шок ( P = 0,002) были единственными значимыми множественными предикторами плохого прогноза.
Демографические и клинические групповые характеристики
Характеристики двух групп пациентов описаны в таблице 1. Несколько статистически значимых различий ( P ≤,05) были выявлены между пациентами с фунгемией C krusei и C albicans .Пациенты первой группы были несколько моложе и преимущественно страдали острым лейкозом. Большая часть этих пациентов прошла курс химиотерапии рака или облучение всего тела, перенесла трансплантацию костного мозга в течение предыдущего года, страдала нейтропенией и длительной нейтропенией. Доля пациентов, получавших профилактику флуконазолом, была значительно выше среди пациентов с фунгемией C krusei . Катетерная фунгемия встречалась только у пациентов с фунгемией C albicans .Распространенная инфекция чаще встречалась у пациентов с фунгемией C krusei (37% против 21%; P = 0,06). Интересно, что 18 (86%) из 21 пациента с диссеминированной инфекцией C krusei были нейтропеническими, по сравнению только с 4 (33%) из 12 пациентов с диссеминированной инфекцией C albicans . Большинство инфекций C krusei и C albicans считались внутрибольничными.
Значительно большая часть пациентов с фунгемией C krusei страдала лейкемией ( P =.02) и получали противогрибковую профилактику ( P <0,002), чаще всего флуконазолом ( P = 0,03). С другой стороны, у значительно большей доли пациентов с фунгемией C albicans были инфекции, связанные с катетером ( P <0,001).
Частота ответа была выше среди пациентов с инфекциями C albicans (69% против 51%; P = 0,05), в основном потому, что у большего числа пациентов с фунгемией C krusei была нейтропения и диссеминированная инфекция (Таблица 2).Среди умерших пациентов более высокая доля пациентов с фунгемией C albicans не имела нейтропении или вылечилась от нейтропении (11 пациентов [69%] против 11 [39%]; P = 0,06). Флуконазол и амфотерицин B были одинаково эффективны для лечения фунгемии C albicans (79% против 71%). Была обнаружена тенденция к предположению, что амфотерицин B был более эффективным для лечения инфекции C albicans , чем C krusei (71% против 51%; P =.18).
Candida krusei — нечастая причина фунгемии. В большинстве учреждений этот вид Candida составляет от 3,5% до 4,5% грибков. 2 , 9 , 10 В обзоре литературы о кандидемиях Вингард 1 обнаружил, что только 4% были вызваны C krusei . Наш анализ представляет собой самую большую серию C krusei fungemias из одного учреждения.Самый крупный предыдущий отчет представлял собой сопоставленный анализ 62 случаев. 6 Примерно 90% случаев произошли у пациентов с острым лейкозом или апластической анемией или у реципиентов трансплантата костного мозга, и очень мало случаев было зарегистрировано у пациентов, у которых не было рака. Нейтропения присутствует у 80–90% пациентов с этой инфекцией. 6 , 9 , 10 В нашем анализе парных пар острый лейкоз и нейтропения были значимыми предрасполагающими факторами для фунгемии C krusei .
Частота фунгемии C krusei значительно возросла в нескольких учреждениях, начиная с начала 1990-х годов. Candida krusei по своей природе устойчива к флуконазолу, и это увеличение числа инфекций было связано с использованием флуконазола, особенно для профилактики грибка. Wingard et al. 5 впервые сообщили об этой ассоциации среди пациентов с нейтропенией, лечившихся в 1989–1990 гг. Колонизация Candida krusei была обнаружена у 41% пациентов, получавших профилактику флуконазолом, по сравнению с 17% пациентов, не получавших профилактики.Частота диссеминированной инфекции составила 8% и 1% соответственно. Они также обнаружили, что антибактериальная профилактика норфлоксацином увеличивает риск колонизации C krusei . Однако Merz et al. 11 сообщили об увеличении колонизации и инфицирования C krusei среди пациентов с нейтропенией, лечившихся в том же учреждении с 1977 по 1985 год, до того, как стал доступен флуконазол. В то время частота колонизации составляла 12,4%, а у 1,2% развивалась фунгемия. Некоторые из этих пациентов получали профилактику миконазолом.
В нашем учреждении частота фунгемии C krusei удвоилась с 5% в 1989–1992 годах до 10% в 1993–1996 годах. В 1993 году флуконазол стал широко использоваться в качестве профилактического средства у пациентов с гематологическими злокачественными новообразованиями. Кроме того, использование флуконазола было значительным предрасполагающим фактором в нашем анализе. В обзоре Goldman et al., 6 82% пациентов получали флуконазол до заражения. Nguyen et al. 10 сообщили о 34 случаях кандидемии, возникшей во время приема флуконазола, и 7 случаев были вызваны C krusei .Они обнаружили, что использование флуконазола является важным предрасполагающим фактором для фунгемии C krusei . Однако не все исследования связывают использование флуконазола с увеличением колонизации и инфицирования этими дрожжами. Iwen et al. 12 обнаружили, что 4% инвазивных инфекций Candida были вызваны C krusei , и ни один из пациентов не получал флуконазол. В двух мультиинституциональных рандомизированных исследованиях профилактики флуконазолом у пациентов с нейтропенией частота колонизации и инфицирования C krusei была одинаковой среди пациентов, получавших флуконазол и плацебо. 13 , 14 Аналогичным образом, в рандомизированном исследовании реципиентов трансплантата костного мозга, которые получали флуконазол или плацебо в течение 75 дней после трансплантации, не было значительных различий в показателях колонизации и инфекций в обеих группах. 15 Возможно, что в некоторых больницах есть нозокомиальные источники C krusei , и что колонизации и инфицированию способствует избирательный эффект использования флуконазола.
Несколько исследований показали, что около 70% пациентов развивают колонизацию C krusei до начала инфекции. 6 , 9 , 10 Мерц и др. 11 обнаружили, что желудочно-кишечный тракт был наиболее частым местом колонизации, за ним следовали дыхательные пути. Goldman et al. 6 обнаружили повреждение слизистой оболочки желудочно-кишечного тракта у 68% инфицированных пациентов. Следовательно, последовательность событий, ведущих к инфекции C krusei , может быть колонизацией, облегченной введением флуконазола, местной инфекцией, вызванной мукозитом, и последующим гематогенным распространением, вызванным нейтропенией.Хотя у большинства пациентов внутрисосудистые катетеры были вставлены до инфицирования, наше исследование и исследование Merz et al. 11 не обнаружили, что эти катетеры являются источником фунгемии.
В нашем исследовании только 37% пациентов считались имеющими диссеминированную инфекцию, что может быть заниженной оценкой. Истинную частоту диссеминированной инфекции часто трудно установить, потому что эта инфекция обычно проявляется множеством небольших абсцессов с вовлечением нескольких органов, которые не вызывают специфических для органа симптомов.Следовательно, многие диссеминированные инфекции выявляются только при вскрытии. В 2 исследованиях среди пациентов с фунгемией C krusei , которые умерли и прошли вскрытие, у 67% и 100% была обнаружена диссеминированная инфекция. 9 , 11
Уровень смертности в нашем исследовании среди пациентов с фунгемией C krusei составлял 49% в целом, но составлял 93% среди пациентов со стойкой нейтропенией и 83% среди пациентов с диссеминированной инфекцией.Смертность была ниже среди пациентов с фунгемией C albicans (28%), что было связано с более низкой частотой нейтропении и более высокой частотой фунгемии, связанной с катетером. Предыдущие исследования кандидемии показали, что уровень смертности среди онкологических больных со стойкой нейтропенией или диссеминированной инфекцией составляет 90% и выше. 16 , 17 Другие исследования показали, что уровень смертности у пациентов с фунгемией C krusei составляет от 60% до 80%. 6 , 9 , 11
Несколько исследований продемонстрировали, что изоляты C krusei могут быть менее чувствительны к амфотерицину B in vitro, чем изоляты C albicans . 18 , 19 Berrouane et al 20 считали C krusei патогеном с множественной лекарственной устойчивостью. В нашем исследовании 19% фунгемии C krusei впервые возникли, когда пациенты получали от 0,35 до 0,5 мг амфотерицина B на килограмм в день, а Blumberg и Reboli 21 сообщили о прорывной фунгемии при введении еще более высоких доз амфотерицина B. В нашем исследовании частота ответа была выше, когда использовались суточные дозы амфотерицина B 1 мг или более на килограмм.Эти данные несколько сложно интерпретировать, потому что большинство инфекций возникает у пациентов с нейтропенией, а ответ на амфотерицин B зависит от восстановления нейтрофилов. 16 Хотя C krusei по своей природе устойчив к флуконазолу, на флуконазол реагировали случайные инфекции, в том числе у 2 пациентов с нейтропенией в нашем исследовании, у которых количество нейтрофилов восстановилось во время терапии. Итраконазол обычно активен против C krusei in vitro, но его использование для лечения серьезных инфекций ограничено из-за отсутствия внутривенного препарата и вариабельности абсорбции исходного перорального препарата. 22
Candida видов, отличных от C albicans , в настоящее время составляют почти половину случаев гематогенно-диссеминированного кандидоза во многих учреждениях. 1 , 10 Хотя на C krusei приходится лишь небольшая часть этих инфекций, он значительно увеличивается в некоторых центрах лейкемии и трансплантации костного мозга, где флуконазол широко используется для профилактики. Хотя эта связь, очевидно, вызывает беспокойство, она компенсируется общим положительным эффектом этой противогрибковой профилактики против других видов Candida . 2 , 15 У пациентов с гематологическими злокачественными новообразованиями фунгемия C krusei связана с высокой частотой распространения и смертности. Поскольку C krusei может быть менее восприимчив к амфотерицину B, чем другие виды Candida , суточная доза амфотерицина B, используемая в качестве эмпирической противогрибковой терапии, вероятно, должна составлять 1 мг / кг в учреждениях, где распространены инфекции C krusei .
Принята к публикации 1 февраля 2000 г.
Мы благодарим Джека Торнби, доктора философии, за пересмотр исследования и ценные комментарии.
Отпечатки: Хенд А. Ханна, доктор медицины, магистр здравоохранения, Онкологический центр им. М. Д. Андерсона Техасского университета, 1515 Holcombe Blvd, Houston, TX 77030.
1. Вингард
JR Значение Candida видов, отличных от C albicans , в качестве патогенов у онкологических больных. Clin Infect Dis. 1995; 20115-125Google ScholarCrossref 2.Аби-Саид
DAnaissie
EUzun
ORaad
И.Пинцковски
H Вариант
S Эпидемиология гематогенного кандидоза, вызванного различными видами Candida . Clin Infect Dis. 1997; 241122-11128Google ScholarCrossref 3. Комшян
SVUwaydah
АКСобель
JDCrane
LR фунгемия, вызванная видами Candida и Torulopsis glabrata у госпитализированного пациента: частота, характеристики и оценка факторов, влияющих на исход. Rev. Infect Dis. 1989; 11379-390Google ScholarCrossref 4.Wingard
JR Инфекции, вызванные резистентными видами Candida у больных раком, получающих химиотерапию. Clin Infect Dis. 1994; 19 (приложение 1) S49- S53Google ScholarCrossref 5.Wingard
JRMerz
ВАГРОНД
MGJohnson
ТРКарп
JESaral
R Увеличение инфекции Candida krusei среди пациентов с трансплантацией костного мозга и нейтропенией, получавших профилактическое лечение флуконазолом. N Engl J Med. 1991; 3251274-1277Google ScholarCrossref 6. Голдман
MP Коттедж
JCWeaver
DC Candida krusei фунгемия: отчет о 4 случаях и обзор литературы. Медицина. 1993; 72143-150Google ScholarCrossref 7. Anissie
EARex
JHUzun
Вариант
S Предикторы неблагоприятного исхода у онкологических больных с кандидемией. Am J Med. 1998; 104238-245Google ScholarCrossref 8.
Norusis
MJ Статистический пакет для социальных наук .Чикаго, штат Иллинойс, SPSS Inc., 1994;
9. рог
RWong
BKiehn
ТЕАрмстронг
D Фунгемия в онкологической больнице: изменение частоты, более раннее начало и результаты терапии. Rev. Infect Dis. 1985; 7646-655Google ScholarCrossref 10. Нгуен
MHPeacock
JE
Младший Моррис
AJ
и другие. Изменяющийся облик кандидемии: появление не– Candida albicans видов и устойчивость к противогрибковым препаратам. Am J Med. 1996; 100617-623Google ScholarCrossref 11.Мерц
WGKarp
JESchron
DSaral
R Повышенная частота фунгемии, вызванной Candida krusei . J Clin Microbiol. 1986; 24581-584Google Scholar12.Iwen
PCKelly
DMReed
Э.Чинрихс
SH Инвазивная инфекция, вызванная Candida krusei у пациентов с ослабленным иммунитетом, не получавших флуконазол. Clin Infect Dis. 1995; 20342-347Google ScholarCrossref 13. Уинстон
DJChandrasekar
PHLazarus
HM
и другие.Профилактика грибковой инфекции флуконазолом у пациентов с острым лейкозом: результаты рандомизированного плацебо-контролируемого двойного слепого многоцентрового исследования. Ann Intern Med. 1993; 118495-503Google ScholarCrossref 14.Goodman
JLWinston
DJGreenfield
РА
и другие. Контролируемое испытание флуконазола для профилактики грибковых инфекций у пациентов, перенесших трансплантацию костного мозга. N Engl J Med. 1992; 326845-851Google ScholarCrossref 15. Славин
МАОсборн
BAdams
р
и другие.Эффективность и безопасность флуконазола для профилактики грибковых инфекций после трансплантации костного мозга: проспективное рандомизированное двойное слепое исследование. J Infect Dis. 1995; 1711545-1552Google ScholarCrossref 16.Bodey
GP Гематогенный кандидоз и кандидоз основных органов. Bodey
GPed. Кандидоз: патогенез, диагностика и лечение 2-е изд. Нью-Йорк, NY Raven Press, 1993; 279-329.
JMReed
Эмори
M
и другие. Клинические особенности и анализ факторов риска инвазивной кандидозной инфекции после трансплантации костного мозга. J Infect Dis. 1991; 164731-740Google ScholarCrossref 18.Pfaller
MA. Чувствительность клинических дрожжевых изолятов к трем противогрибковым агентам in vitro, определенная методом микроразбавления. Mycopathologia. 1995; 1303-9Google ScholarCrossref 19.Pfaller
MARex
JH Тестирование противогрибковой чувствительности изолятов рандомизированного многоцентрового исследования флуконазола по сравнению с амфотерицином B в качестве лечения пациентов с кандидемией, не страдающих нейтропенией. Противомикробные агенты Chemother. 1995; 3940-44Google ScholarCrossref 20.Berrouane
YFHollis
RJPfaller
Различия между штаммами MA и противогрибковая чувствительность изолятов Candida krusei . J Clin Microbiol. 1996; 341856-1858Google Scholar21.Blumberg
EAReboli
AC Отказ системного эмпирического лечения амфотерицином B для предотвращения кандидемии у пациентов с нейтропенией и раком. Clin Infect Dis. 1996; 22462-466Google ScholarCrossref 22.Картледж
JMidgley
Джаззард
B. Раствор итраконазола циклодекстрина: роль тестирования чувствительности in vitro в прогнозировании успешного лечения ВИЧ-ассоциированного флуконазол-устойчивого и чувствительного к флуконазолу кандидоза полости рта. СПИД. 1997; 11163-168Google ScholarCrossref
Кандидемия — Доктор Гриб
Обзор
Кандидемия — это выделение Candida из одного или нескольких образцов крови. Хотя более убедительно наличие двух или более положительных культур, нельзя игнорировать даже одну культуру.
В течение многих лет велась важная дискуссия относительно возможности того, что кандидемия может быть незначительным открытием. Любой организм в культуре крови может представлять заражение образца во время процесса сбора, и в ранних отчетах также предполагалось, что кандидемия часто была тривиальным процессом, который можно было просто игнорировать [664]. Эта идея была постепенно опровергнута сообщениями, показывающими, что кандидемия связана со значительной заболеваемостью и смертностью. Показатели смертности от 26 до 75 процентов сообщаются в сериях, содержащих в основном пациентов, не страдающих раком [762, 993, 1212, 1446, 1790, 1904], тогда как показатели смертности от 30 до 72 процентов сообщаются для серий, содержащих в основном больных раком [762 , 1062, 1224, 2332].
Таким образом, нельзя оспаривать наличие отдельных случаев, когда кандидемия проходит удовлетворительно без лечения [664, 762]. Однако у клинициста нет готового способа узнать, у какого пациента больше не будет проблем, а у кого скоро начнется ухудшение состояния. Учитывая высокую смертность и заболеваемость кандидемией, недавняя международная консенсусная конференция пришла к выводу, что практически все пациенты с кандидемией должны получать терапию [649].
Эпидемиология
Кандидемия стала одной из самых серьезных внутрибольничных инфекций за последние два десятилетия.В течение 1980-х было отмечено увеличение его частоты более чем в 400 раз как возбудителя инфекций кровотока [168]. В течение 1990-х годов Candida spp. были четвертым по частоте агентом, вызывающим внутрибольничную инфекцию кровотока [646].
C. albicans исторически является наиболее частой причиной кандидемии. Однако частота кандидемии, вызванной не albicans, видами Candida , выросла в течение 1990-х годов [4, 1641, 1846, 2444, 2445], и недавние исследования показывают, что C.albicans вызывает лишь около половины всех случаев кандидемии [1717, 1779]. Часто встречались виды: C. tropicalis , C. glabrata и C. parapsilosis [993, 1150, 1453, 1778, 2465]. В то время как C. tropicalis и C. glabrata стали более частыми среди взрослых популяций, C. parapsilosis , по-видимому, имеет особое сродство для педиатрических (и особенно неонатальных) условий [1327, 1718, 1871].Среди пациентов с трансплантацией костного мозга также отмечалось увеличение частоты у C. krusei [2444].
Причины этого изменения в эпидемиологии не совсем ясны [2422]. Использование флуконазола в схемах профилактики у пациентов с тяжелой иммуносупрессией тесно связано с изменениями этиологии кандидемии в этой популяции [4, 2444, 2445]. Однако то же самое явление наблюдалось в популяциях, не подвергавшихся воздействию этого агента [15–25].
Клинические проявления
Клинические проявления кандидемии варьируются от не более чем лихорадки до явного и опасного для жизни сепсиса.При обнаружении кандидемии также полезно рассматривать ее в контексте одной из четырех частично совпадающих форм инвазивного кандидоза.
Кандидемия у больных ВИЧ / СПИДом
Несмотря на то, что кандидоз ротоглотки является наиболее частой грибковой инфекцией, поражающей пациентов с ВИЧ и СПИДом, инвазивные формы кандидоза в этой популяции с ослабленным иммунитетом встречаются редко. Опубликованы единичные клинические случаи и одно ретроспективное исследование кандидемии у ВИЧ-инфицированных взрослых [1282, 1303, 2263].Эти случаи произошли у пациентов с терминальной стадией СПИДа (количество CD4 + <50 клеток / мм3) и предшествующей обширной терапии флуконазолом. В остальном факторы риска для ВИЧ-инфицированных, у которых развивается кандидемия, аналогичны факторам риска у людей, не инфицированных ВИЧ: центральные венозные катетеры, парентеральное питание и предыдущее применение антибиотиков широкого спектра действия. Следовательно, это осложнение, по-видимому, представляет собой типичную внутрибольничную инфекцию, а не состояние, связанное с наличием или отсутствием ВИЧ.С терапевтической точки зрения частое использование азолов у ВИЧ-инфицированных пациентов означает, что амфотерицин B следует использовать в качестве противогрибкового средства первой линии при выявлении инвазивного кандидоза [1303].
Терапия
Лечение кандидемии состоит из двух основных элементов. Во-первых, следует определить наиболее вероятный источник фунгемии и по возможности лечить его. У пациентов, не страдающих нейтропенией, внутрисосудистый катетер является наиболее вероятным источником, и удаление таких катетеров часто бывает полезным.Мы отсылаем читателя к нашему обсуждению внутрисосудистых катетеров и кандидемии.
Другими распространенными источниками являются инфекции мочевыводящих путей и локализованные инфекции [1904]. По возможности следует лечить местные условия на этих участках (например, устранить непроходимость мочевыводящих путей, дренировать абсцесс).
Во-вторых, следует использовать противогрибковое средство. Из доступных противогрибковых средств только амфотерицин B и флуконазол доступны в парентеральных формах, необходимых для лечения пациентов в критическом состоянии.На сегодняшний день в двух крупных рандомизированных испытаниях [1790, 1904] и двух больших сериях наблюдений [71, 1642] изучалась относительная полезность этих агентов и было обнаружено, что они в целом сопоставимы, в частности, как лечение фунгемии C. albicans у других пациентов. -нейтропенические пациенты. Вне этой настройки выбор терапии менее определен и следует (A): общим правилам лечения инвазивного кандидоза. Недавно лицензированный препарат итраконазола для внутривенного введения в настоящее время изучается в качестве терапии инвазивного кандидоза, но пока нет данных о его относительной полезности.
Candida glabrata Инфекции, симптомы, лечение и кто находится в группе риска
Candida — это род дрожжевых грибков, которые естественным образом обитают в организме и на нем. Обычно он содержится в небольших количествах во рту, кишечнике и на коже.
Обычно Candida не вызывает никаких проблем, но в некоторых случаях может привести к заражению.
Читайте дальше, чтобы узнать больше о различных типах грибковых инфекций Candida , которые часто называют просто дрожжевой инфекцией, особенно вызванных Candida glabrata .
Candida glabrata ( C. glabrata ) может быть частью вашей естественной микрофлоры. Он может присутствовать в желудочно-кишечном тракте, во рту и в области гениталий.
Candida glabrata обычно хорошо контролируется или безвредна у здоровых людей. Но это может стать проблемой для людей с подавленной иммунной системой. Например, сюда входят люди, живущие с ВИЧ, люди, получающие лечение от рака, и люди, которым была сделана трансплантация органов.
Candida glabrata также обладает высокой устойчивостью к некоторым противогрибковым препаратам, что может затруднить лечение.
Грибковые инфекции Candida
Candida glabrata может быть вторым или третьим по распространенности штаммом Candida , распространенность которого растет с 1990-х годов. Candida albicans считается наиболее частой причиной дрожжевых инфекций.
Важные термины, касающиеся грибковой инфекции
Кандидоз — термин, обозначающий инфекцию, вызванную дрожжами Candida .
Инвазивный кандидоз — это инфекция внутри вашего тела. Это может повлиять на внутренние органы или другие части вашего тела.
Фунгемия — это присутствие дрожжей или грибков в кровотоке. Наиболее распространенным типом этой инфекции является Candidemia , когда в кровотоке находится Candida дрожжей. По данным CDC, это наиболее распространенный тип инвазивного кандидоза. Кандидемия — одна из наиболее частых причин инфекций кровотока у людей, находящихся в больнице.
Острый гематогенный кандидоз — это инфекция Candida , которая распространяется через кровоток в другие органы вашего тела. Например, распространение Candida через кровоток в мозг может привести к менингиту.
Далее мы рассмотрим причины, симптомы и методы лечения наиболее распространенных типов инфекции Candida . Хотя чаще всего поражается Candida albicans , вполне возможно, что Candida glabrata вызывает эти типы инфекций, поскольку его можно найти в аналогичных областях тела.
Candida glabrata инфекции наиболее вероятно затронут:
- мочевыводящие пути, которые проходят от уретры до мочевого пузыря и почек
- половые органы
- рот
- кровоток, в случае специфических группы риска
Грибковые инфекции мочевыводящих путей (ИМП) чаще всего вызываются видами дрожжей Candida . Грибковые ИМП могут поражать нижнюю часть мочевыводящих путей, включая мочевой пузырь.Это может даже повлиять на почки.
Симптомы грибковой инфекции мочевых путей
Если у вас грибковая инфекция мочевыводящих путей, у вас может не быть никаких симптомов. При наличии симптомов они могут включать:
- жжение или болезненные ощущения при мочеиспускании
- повышенную потребность в мочеиспускании
- кровь в моче
- боль в области таза или живота
Лечение грибковых ИМП
Рекомендуется только лечение для людей с симптомами. Обычно он состоит из противогрибковых препаратов, отпускаемых по рецепту.Во многих случаях первым лечением является противогрибковый препарат флуконазол.
Для Candida glabrata и других видов, которые могут быть устойчивы к флуконазолу, можно использовать препараты амфотерицин B и флуцитозин.
Candida видов могут вызывать инфекции влагалища и полового члена. Candida glabrata часто вызывает более сложные инфекции, которые трудно поддаются лечению.
Обычно количество Candida в области гениталий уравновешивается бактериями Lactobacillus.Lactobacillus также встречается в этой части тела в природе. Когда уровень Lactobacillus каким-либо образом изменяется или понижается, Candida может разрастаться, вызывая инфекцию.
У вас также может развиться генитальная инфекция Candida после определенных сексуальных действий, особенно тех, которые связаны с орально-генитальным контактом.
Симптомы грибковой инфекции половых органов
Симптомы грибковой инфекции половых органов могут включать:
- ощущение жжения во время секса
- ощущение жжения при мочеиспускании
- сыпь вокруг влагалища
- белое сырное вещество под кожными складками на коже половой член
- аномальные выделения из влагалища, которые могут быть водянистыми или густыми и белыми
- зуд или болезненное ощущение во влагалище или за его пределами или на половом члене
- сыпь, покраснение или припухлость вокруг влагалища
Однако в некоторых случаях Candida Инфекции полового члена могут не вызывать никаких симптомов.
Лечение грибковых инфекций половых органов
Использование безрецептурных или рецептурных противогрибковых препаратов может эффективно лечить легкие или средние половые грибковые инфекции.
Противогрибковые препараты, отпускаемые без рецепта, чаще всего выпускаются в следующих формах:
- крем
- порошок
- таблетка
- суппозиторий
Пероральные противогрибковые препараты также доступны по рецепту.
Врач может назначить более длительный курс лечения более сложных инфекций.Это может быть крем, таблетка или мазь.
Несмотря на то, что Candida является нормальной частью микрофлоры ротовой полости, она может вызвать инфекции, если она разрастется.
Инфекция не ограничивается только ротовой полостью. Молочница может распространиться на миндалины и заднюю стенку глотки. Тяжелые инфекции могут распространяться на пищевод.
Общие симптомы молочницы во рту могут включать:
- жжение или болезненное ощущение во рту
- ощущение хлопка во рту
- затруднение глотания или еды
- потеря вкуса
- покраснение в углах во рту или внутри рта
- кремово-белые пятна во рту или на языке, которые могут кровоточить при прикосновении
Нелеченный молочница может привести к системной грибковой инфекции, особенно у людей с ослабленной иммунной системой.
Молочницу полости рта лечат противогрибковыми препаратами, которые могут быть в форме таблеток, жидкости или леденцов. Примеры используемых лекарств включают нистатин или клотримазол. В некоторых случаях может быть назначен пероральный курс флуконазола.
Хотя здоровые люди могут заразиться дрожжевой инфекцией, следующие группы подвержены повышенному риску развития инфекции Candida glabrata :
- людей, принимающих или недавно принимавших антибиотики
- людей с диабетом, у которых уровень сахара в крови плохо контролируемый
- человек, которым установили медицинское устройство, например катетер
- человек, носящий зубные протезы
- человек с ослабленной иммунной системой, например, люди, живущие с ВИЧ, или люди, получающие лечение от рака
Заболеваемость Candida glabrata с годами растет.
Интересно, что Candida glabrata генетически более тесно связана с пекарскими дрожжами ( Saccharomyces cerevisiae ), чем с Candida albicans или Candida parapsilosis . Большинство видов дрожжей, которые тесно связаны с Candida glabrata , не связаны с людьми, а вместо этого встречаются в растениях и почве.
Candida glabrata в сравнении с Candida albicans
Candida glabrata отличается от Candida albicans во многих отношениях, в том числе:
- более высокой устойчивостью к некоторым противогрибковым препаратам, таким как флуконазол
- и неспособностью образовывать гифы, а длинная ветвящаяся структура, продуцируемая многими грибами
- способность расти и делиться после поедания иммунными клетками, называемыми макрофагами
- , имеющими много генов, которые не имеют соответствующего эквивалента в Candida albicans
Candida glabrata инфекции являются часто приобретаются в больницах, особенно у людей, получающих флуконазол, к которому он может быть более устойчивым.
Candida glabrata может вызывать те же типы грибковых инфекций, что и наиболее распространенные виды Candida .


 Доказательства вовлечения эндокарда
Доказательства вовлечения эндокарда
 2
2