Глюкокортикоиды : инструкция по применению
Механизм действия и фармакологические эффекты
Глюкокортикоиды — гормональные средства, основное действие которых реализуется на уровне ядерных структур клетки и заключается в регуляции экспрессии определенных генов. Глюкокортикоиды взаимодействуют со специфическими белковыми рецепторами клеток-мишеней в цитоплазме клетки (цитозольными рецепторами). Образовавшийся комплекс гормон-рецептор перемещается в ядро, где связывается с ко-активирующими молекулами и чувствительным элементом генов. В результате этого в клетках активируются процессы транскрипции генов (геномный эффект) и, как следствие, повышается скорость образование белков, обладающих противовоспалительным эффектом: липокортина-1 (аннексина-1), ИЛ-10, антагониста рецепторов ИЛ-1, ингибитора ядерного фактора карра, нейтральной эндопептидазы и некоторых других. Эффект действия стероидных гормонов проявляется не сразу, а спустя определенное время (несколько часов), которое необходимо для экспрессии гена и последующего синтеза специфического белка. Однако многие эффекты глюкокортикоидов проявляются достаточно быстро, чтобы их можно было бы объяснить только стимуляцией транскрипции генов. Вероятно, они являются следствием внегеномных эффектов глюкокортикоидов.
Однако многие эффекты глюкокортикоидов проявляются достаточно быстро, чтобы их можно было бы объяснить только стимуляцией транскрипции генов. Вероятно, они являются следствием внегеномных эффектов глюкокортикоидов.
Внегеномный эффект глюкокортикоидов заключается во взаимодействии с факторами транскрипции и ингибиторными белками. Последние являются регуляторами нескольких генов, принимающих участие в иммунном ответе и воспалении, включая гены цитокинов (ИЛ-1-6, -8, -11, -13, -16-18, фактор некроза опухоли а (ФНО-а), гранулоцитарно-макрофагальный колониестимулирующий фактор, эотаксин, воспалительный белок макрофагов, хемотаксический белок моноцитов и др.), а также их рецепторов, молекул адгезии, протеиназ и др. Итогом этого взаимодействия является торможение транскрипции провоспалительных и иммуномодулирующих генов.
Противовоспалительное, противоаллергическое и иммуносупрессивное действие. Глюкокортикоиды подавляют продукцию множества факторов, которые являются критическими для запуска и развития воспалительной реакции и тем самым вызывают подавление избыточных реакций организма. Действие ГКС направлено на основных участников воспалительной реакции: медиаторы воспаления, сосудистый и клеточный компоненты воспаления. Глюкокортикоиды уменьшают продукцию простаноидов и лейкотриенов, подавляя индукцию биосинтеза липокортина, который ингибирует фосфолипазу А2, а также экспрессию гена ЦОГ-2. За счет влияния на продукцию про- и противовоспалительных медиаторов глюкокортикоиды стабилизируют лизосомальные мембраны, снижают капиллярную проницаемость, что объясняет их выраженный эффект на экссудативную фазу воспаления. Стабилизация лизосомальных мембран приводит к ограничению выхода различных протеолитических ферментов за пределы лизосом и предупреждает деструктивные процессы в тканях. Сокращается накопление лейкоцитов в зоне воспаления, снижается активность макрофагов и фибробластов. Угнетая размножение фибробластов и их активность в отношении синтеза коллагена и склеротических процессов в целом, глюкокортикоиды способны подавлять пролиферативную фазу воспаления. Торможение созревания базофилов под действием глюкокортикоидов приводит к уменьшению синтеза медиаторов немедленной аллергии.
Действие ГКС направлено на основных участников воспалительной реакции: медиаторы воспаления, сосудистый и клеточный компоненты воспаления. Глюкокортикоиды уменьшают продукцию простаноидов и лейкотриенов, подавляя индукцию биосинтеза липокортина, который ингибирует фосфолипазу А2, а также экспрессию гена ЦОГ-2. За счет влияния на продукцию про- и противовоспалительных медиаторов глюкокортикоиды стабилизируют лизосомальные мембраны, снижают капиллярную проницаемость, что объясняет их выраженный эффект на экссудативную фазу воспаления. Стабилизация лизосомальных мембран приводит к ограничению выхода различных протеолитических ферментов за пределы лизосом и предупреждает деструктивные процессы в тканях. Сокращается накопление лейкоцитов в зоне воспаления, снижается активность макрофагов и фибробластов. Угнетая размножение фибробластов и их активность в отношении синтеза коллагена и склеротических процессов в целом, глюкокортикоиды способны подавлять пролиферативную фазу воспаления. Торможение созревания базофилов под действием глюкокортикоидов приводит к уменьшению синтеза медиаторов немедленной аллергии. Таким образом, глюкокортикоиды способны подавлять и ранние, и поздние проявления воспалительной реакции и тормозить реакции пролиферации при хроническом воспалении.
Таким образом, глюкокортикоиды способны подавлять и ранние, и поздние проявления воспалительной реакции и тормозить реакции пролиферации при хроническом воспалении.
Противовоспалительный эффект глюкокортикоидов неспецифичен и развивается в ответ на любые повреждающие стимулы: физические, химические, бактериальные или патологические иммунные, такие как гиперчувствительность или аутоиммунные реакции. Неспецифический характер противовоспалительного эффекта ГКС делает его пригодным для воздействия на многочисленные патологические процессы. Хотя действие ГКС не затрагивает причин, лежащих в основе воспалительного заболевания, и никогда его не излечивает, подавление клинических проявлений воспаления имеет огромное клиническое значение.
Провести четкую грань между механизмами, обеспечивающими противовоспалительный и иммуносупрессивный эффекты ГКС, невозможно, поскольку многие факторы, в том числе цитокины, играют важную роль в развитии обоих, патологических процессов.
Нарушение продукции регуляторных и эффекторных цитокинов, а также экспрессии молекул, обеспечивающих взаимодействие иммунокомпетентных клеток, приводит к разрегуляции иммунного ответа и, как следствие, к его незавершенности или полной блокаде. За счет ингибирования продукции цитокинов, регулирующих различные фазы иммунного ответа, глюкокортикоиды одинаково эффективно блокируют иммунный ответ на любой стадии его развития.
За счет ингибирования продукции цитокинов, регулирующих различные фазы иммунного ответа, глюкокортикоиды одинаково эффективно блокируют иммунный ответ на любой стадии его развития.
Глюкокортикоиды имеют огромное клиническое значение при лечении заболеваний, которые являются результатом нежелательных иммунологических реакций. Эти заболевания включают как состояния, которые преимущественно являются результатом нарушения гуморального иммунитета (такие как крапивница), так и состояния, которые опосредуются клеточными иммунными механизмами (такие как отторжение трансплантата). Подавление выработки антител развивается при введении только очень высоких доз глюкокортикоидов. Этот эффект наблюдается лишь спустя неделю после начала терапии.
Второй механизм, объясняющий иммуносупрессивное действие глюкокортикоидов, — это усиление продукции в клетках эндонуклеаз. Активация эндонуклеаз является центральным событием поздних этапов апоптоза, или физиологической запрограммированной гибели клеток.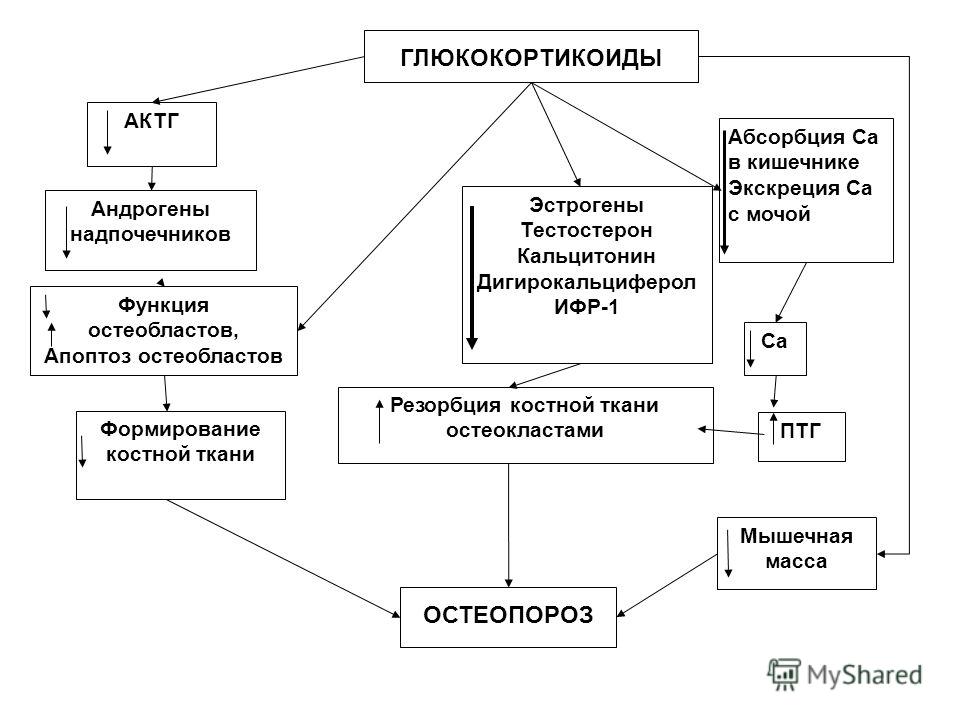 В соответствии с этим прямым следствием действия ГКС является гибель большого количества клеток и, в частности, лейкоцитов. Индуцированный глюкокортикоидами апоптоз затрагивает лимфоциты, моноциты, базофилы, эозинофилы и тучные клетки. Клинически апоптогенный эффект ГКС проявляется как соответствующие виды цитопений. Действие глюкокортикоидов на нейтрофилы имеет противоположный характер, т.е. под влиянием этих ЛС апоптоз нейтрофилов угнетается, а продолжительность их циркуляции возрастает, что является одной из причин нейтрофилии. Однако глюкокортикоиды вызывают резкое снижение функциональной активности нейтрофилов. Например, под влиянием ГКС нейтрофилы теряют способность покидать кровоток (угнетение миграции) и проникать в очаги воспаления.
В соответствии с этим прямым следствием действия ГКС является гибель большого количества клеток и, в частности, лейкоцитов. Индуцированный глюкокортикоидами апоптоз затрагивает лимфоциты, моноциты, базофилы, эозинофилы и тучные клетки. Клинически апоптогенный эффект ГКС проявляется как соответствующие виды цитопений. Действие глюкокортикоидов на нейтрофилы имеет противоположный характер, т.е. под влиянием этих ЛС апоптоз нейтрофилов угнетается, а продолжительность их циркуляции возрастает, что является одной из причин нейтрофилии. Однако глюкокортикоиды вызывают резкое снижение функциональной активности нейтрофилов. Например, под влиянием ГКС нейтрофилы теряют способность покидать кровоток (угнетение миграции) и проникать в очаги воспаления.
За счет непосредственного взаимодействия с ДНК стероиды индуцируют или ингибируют синтез ферментов, которые участвуют в регуляции обмена веществ, что является основной причиной побочных реакций ГКС. Большинство нежелательных метаболических эффектов проявляются не сразу, а только при длительной терапии ГКС.
Углеводный обмен
Одним из важных эффектов ГКС является их стимулирующее действие на глюконеогенез. Глюкокортикоиды вызывают увеличение образования гликогена и продукции глюкозы в печени, ингибируют действие инсулина и уменьшают проницаемость мембран для глюкозы в периферических тканях. В результате может развиваться гипергликемия и глюкозурия.
[10], [11], [12], [13], [14], [15], [16], [17], [18]
Белковый обмен
Глюкокортикоиды снижают синтез белка и повышают его распад, что проявляется отрицательным азотистым балансом. Особенно выражен этот эффект в мышечной ткани, коже и костной ткани. Проявлениями отрицательного азотистого баланса являются похудание, мышечная слабость, атрофия кожи и мышц, стрии, кровоизлияния. Снижение синтеза белка является одной из причин задержки регенеративных процессов. У детей нарушается формирование тканей, в том числе костной, замедляется рост.
Липидный обмен
Глюкокортикоиды вызывают перераспределение жира. Влияние на жировой обмен проявляется местным липолитическим действием в области конечностей, одновременно с этим индуцируется липогенез в области туловища. В результате при систематическом применении ЛС значительные количества жира накапливаются в области лица, дорсальной части тела, плечах при уменьшении жировой ткани конечностей. Глюкокортикоиды повышают синтез жирных кислот и триглицеридов, вызывая гиперхолестеринемию.
Влияние на жировой обмен проявляется местным липолитическим действием в области конечностей, одновременно с этим индуцируется липогенез в области туловища. В результате при систематическом применении ЛС значительные количества жира накапливаются в области лица, дорсальной части тела, плечах при уменьшении жировой ткани конечностей. Глюкокортикоиды повышают синтез жирных кислот и триглицеридов, вызывая гиперхолестеринемию.
Водно-солевой обмен
Длительное назначение ГКС приводит к реализации их минералокортикоидной активности. Наблюдается повышение реабсорбции ионов натрия из дистальных отделов почечных канальцев и повышение канальцевой секреции ионов калия. Задержка ионов натрия в организме вызывает постепенное увеличение ОЦК и повышение АД. Минералокортикоидные эффекты ГКС в большей степени присущи природным ГКС — кортизону и гидрокортизону и в меньшей степени полусинтетическим ГКС.
Глюкокортикоиды имеют тенденцию вызывать отрицательный баланс кальция в организме, снижая всасывание кальция из ЖКТ и повышая его экскрецию почками, что может вызвать гипокальциемию и гиперкальциурию. При длительном назначении нарушение обмена кальция вкупе с распадом белкового матрикса приводит к развитию остеопороза.
При длительном назначении нарушение обмена кальция вкупе с распадом белкового матрикса приводит к развитию остеопороза.
Форменные элементы крови
Глюкокортикоиды уменьшают в крови количество эозинофилов, моноцитов и лимфоцитов. Одновременно возрастает содержание эритроцитов, ретикулоцитов, нейтрофилов и тромбоцитов. Большая часть этих изменений отмечаются после приема даже одной дозы ГКС с максимальной выраженностью эффекта через 4-6 ч. Восстановление исходного состояния происходит через 24 ч. При длительном лечении ГКС изменения картины крови сохраняются в течение 1-4 недель.
По принципу обратной связи глюкокортикоидыоказывают угнетающее влияние на гипоталамо-гипофизарно-надпочечниковую систему (ГГНС), вследствие чего уменьшается продукция АКТГ. Развивающаяся при этом недостаточность функции коры надпочечников может проявиться при резкой отмене приема глюкокортикоидов. Риск развития надпочечниковой недостаточности значительно повышается при регулярном приеме глюкокортикоидов в течение более 2 недель.
[19], [20], [21], [22], [23], [24], [25], [26], [27], [28]
Противострессовое действие
Глюкокортикоиды являются адаптивными гормонами, повышающими устойчивость организма к стрессу. В условиях тяжелого стресса продукция кортизола значительно увеличивается (по крайней мере, в 10 раз). Имеются данные о связи иммунологической системы и ГГНС. Эти взаимодействия могут представлять, по крайней мере, один из механизмов противострессового действия глюкокортикоидов. Показано, что функция ГГНС регулируется многими цитокинами (ИЛ-1, -2, -6, фактор некроза опухоли ФНО-а). Все они оказывают стимулирующее действие. Многие имеют широкий круг эффектов. Например, ИЛ-1 стимулирует высвобождение кортикотропин-высвобождающего гормона гипоталамическими нейронами, прямо воздействует на гипофиз (повышает высвобождение АКТГ) и надпочечники (повышает высвобождение Глюкокортикоиды). В то же время глюкокортикоиды способны выражение ингибировать многие звенья иммунной системы, например продукцию цитокинов. Таким образом, ГГНС и иммунная система обладают двусторонними связями во время стресса и эти взаимодействия, вероятно, имеют большое значение в поддержании гомеостаза и защищают организм от потенциально жизнеугрожающих последствий развернутой воспалительной реакции.
[29], [30], [31], [32], [33], [34], [35], [36], [37]
Пермиссивное действие
Глюкокортикоиды могут оказывать влияние на действие других гормонов, в значительной мере потенцируя их эффекты. Такое действие Глюкокортикоиды на эффекты других регулирующих гормонов называется пермиссивным и отражает вызванные ГКС изменения в синтезе белков, которые изменяют ответ тканей на определенные стимулы.
Так, малые дозы глюкокортикоидов вызывают значительное потенцирование липолитического действия катехоламинов. Глюкокортикоиды также повышают чувствительность адренорецепторов к катехоламинам и усиливают прессорное действие ангиотензина II. Считается, что благодаря этому глюкокортикоиды оказывают тонизирующее действие на сердечно-сосудистую систему. В результате происходит нормализация сосудистого тонуса, повышается сократимость миокарда и уменьшается проницаемость капилляров. Напротив, недостаточность выработки естественных ГКС характеризуется низким СВ, расширением артериол и слабой реакцией на адреналин.
Показано, что глюкокортикоиды усиливают и бронходилатирующее действие катехоламинов, восстанавливая к ним чувствительность бета-адренорецепторов, что связано с повышением биосинтеза адренергических рецепторов сосудистой стенки.
Глюкокортикоиды — это… Что такое Глюкокортикоиды?
Глюкокортико́иды, или глюкокортикостеро́иды — общее собирательное название подкласса гормонов коры надпочечников, обладающих более сильным действием на углеводный, чем на водно-солевой обмен, и их синтетических аналогов. Функция: регуляция минерального, углеводного и белкового баланса.
Общие сведения
По строению все глюкокортикоиды являются стероидами. Основным и наиболее активным естественным глюкокортикоидом человека является кортизол, но это верно не для всех видов животных. Например, у крысы основным глюкокортикоидом является кортикостерон, а кортизола производится мало, и он малоактивен для тканей организма крысы. У человека наоборот: кортикостерон производится в очень малых количествах, и он малоактивен для тканей человеческого организма.
Физиологическая роль
Глюкокортикоиды обладают разносторонним действием на организм.
Антистрессовое и противошоковое действие
Глюкокортикоиды оказывают мощное антистрессовое, противошоковое действие. Их уровень в крови резко повышается при стрессе, травмах, кровопотерях, шоковых состояниях. Повышение их уровня при этих состояниях является одним из механизмов адаптации организма к стрессу, кровопотере, борьбы с шоком и последствиями травмы. Глюкокортикоиды повышают системное артериальное давление, повышают чувствительность миокарда и стенок сосудов к катехоламинам, предотвращают десенситизацию рецепторов к катехоламинам при их высоком уровне. Кроме того, глюкокортикоиды также стимулируют эритропоэз в костном мозге, что способствует более быстрому восполнению кровопотери.
Влияние на обмен веществ
Глюкокортикоиды повышают уровень глюкозы в крови, увеличивают глюконеогенез из аминокислот в печени, тормозят захват и утилизацию глюкозы клетками периферических тканей, угнетают активность ключевых ферментов гликолиза, повышают синтез гликогена в печени и скелетных мышцах, усиливают катаболизм белков и уменьшают их синтез, повышают анаболизм жиров в подкожной жировой клетчатке и других тканях.
Кроме того, глюкокортикоиды оказывают также определённое минералокортикоидное действие — способствуют задержке катиона натрия, аниона хлора и воды, усилению выведения катионов калия и кальция.
Взаимоотношения с другими гормонами
Глюкокортикоиды понижают секрецию печенью соматомедина и инсулиноподобных факторов роста в ответ на соматотропин, понижают чувствительность периферических тканей к соматомедину и соматотропину, тем самым тормозя анаболические процессы и линейный рост. Также глюкокортикоиды понижают чувствительность тканей к гормонам щитовидной железы и половым гормонам.
Глюкокортикоиды являются мощными контринсулярными гормонами, понижают чувствительность тканей к инсулину. Повышение секреции глюкокортикоидов в ответ на гипогликемию или в ответ на гиперинсулинемию при нормальном уровне глюкозы крови является одним из физиологических механизмов быстрой коррекции гипогликемии или предотвращения гипогликемии при гиперинсулинемии.
Иммунорегулирующее, противовоспалительное и противоаллергическое действие
Глюкокортикоиды обладают мощным иммунорегулирующим действием. Они угнетают активность клеток лимфоидного ряда, тормозят созревание и дифференцировку как Т-, так и B-субпопуляций лимфоцитов, вызывают апоптоз лимфоидных клеток и тем самым снижают количество лимфоцитов в крови. Глюкокортикоиды также тормозят продукцию антител B-лимфоцитами и плазматическими клетками, уменьшают продукцию лимфокинов и цитокинов разными иммунокомпетентными клетками, угнетают фагоцитарную активность лейкоцитов.
Вместе с тем эффекты глюкокортикоидов на иммунную систему неоднозначны. Проявление иммуностимулирующего или иммуносупрессивного эффекта зависит от концентрации глюкокортикоидного гормона в крови. Дело в том, что субпопуляция T-супрессоров значительно более чувствительна к угнетающему воздействию низких концентраций глюкокортикоидов, чем субпопуляции T-хелперов и T-киллеров, а также B-клетки. Таким образом, в сравнительно низких концентрациях глюкокортикоиды оказывают скорее иммуностимулирующее действие, сдвигая соотношение T-хелпер/Т-супрессор в сторону преобладания Т-хелперной активности. В более высоких концентрациях глюкокортикоиды оказывают иммуносупрессивное действие, причём интенсивность иммуносупрессии прямо пропорциональна концентрации в крови и растёт практически линейно вплоть до уровней, в 100 раз превышающих физиологические.
Глюкокортикоиды усиливают нейтрофилопоэз и повышают содержание нейтрофильных гранулоцитов в крови. Они также усиливают ответ нейтрофильного ростка костного мозга на ростовые факторы G-CSF и GM-CSF и на интерлейкины, уменьшают повреждающее действие лучевой и химиотерапии злокачественных опухолей на костный мозг и степень вызываемой этими воздействиями нейтропении. Благодаря этому эффекту глюкокортикоиды широко применяются в медицине при нейтропениях, вызванных химиотерапией и радиотерапией, и при лейкозах и лимфопролиферативных заболеваниях.
Глюкокортикоиды угнетают эозинофилопоэз и вызывают апоптоз зрелых эозинофилов крови, и тем самым снижают содержание эозинофилов в крови вплоть до полной анэозинофилии (отсутствия в пробе крови эозинофильных лейкоцитов).
Глюкокортикоиды также оказывают мощное противовоспалительное действие. Они тормозят активность различных разрушающих ткани ферментов — протеаз и нуклеаз, матриксных металлопротеиназ, гиалуронидазы, фосфолипазу А2 и др., тормозят синтез простагландинов, кининов, лейкотриенов и других медиаторов воспаления из арахидоновой кислоты. Они также понижают проницаемость тканевых барьеров и стенок сосудов, тормозят экссудацию в очаг воспаления жидкости и белка, миграцию лейкоцитов в очаг (хемотаксис) и пролиферацию соединительной ткани в очаге, стабилизируют клеточные мембраны, тормозят перекисное окисление липидов, образование в очаге воспаления свободных радикалов и многие другие процессы, играющие роль в осуществлении воспаления.
Также глюкокортикоидам свойственно мощное противоаллергическое действие. Оно также осуществляется многими разными механизмами: понижением продукции IgE-иммуноглобулинов, повышением гистамин-связывающей (гистаминопексической) способности крови, стабилизацией мембран тучных клеток и уменьшением высвобождения из них медиаторов аллергии, понижением чувствительности периферических тканей к гистамину и серотонину с одновременным повышением чувствительности к адреналину и др.
| Глюкокортикостероиды для местного назначения (D07) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Глюкокортикостероиды |
| ||||||||
| * — препарат не зарегистрирован в России | |||||||||
Глюкокортикоиды — SportWiki энциклопедия
Заместительная терапия[править | править код]
Глюкокортикоид кортизол (гидрокортизон) и минералокортикостероид альдостерон вырабатываются в коре надпочечников. Оба стероидных гормона жизненно необходимы при адаптации к стрессовым ситуациям (болезнь или операция). АКТГ гипофиза стимулирует выработку кортизола, а ангиотензин II — альдостерона. При недостаточности надпочечников (первичная недостаточность или болезнь Аддисона) необходима заместительная терапия кортизолом и альдостероном, при сниженной продукции АКТГ {вторичная недостаточность)—только кортизолом. Кортизол назначают перорально (30 мг/суг: 2/3 дозы утром, 1/3 дозы после обеда). При стрессовых ситуациях дозу повышают в 5-10 раз. Альдостерон оказывает слабое действие при пероральном приеме. Вместо него назначают минералокортикоид флудрокортизон (0,1 мг/сут).
Фармакодинамическая терапия глюкокортикоидами[править | править код]
В высоких нефизиологических концентрациях кортизол и другие глюкокортикоиды препятствуют развитию всех фаз воспаления (экссудация, пролиферация, рубцевание), т.е. реакций организма на внедрение чужеродных и токсических веществ. На механизм действия влияет множество факторов, в основе которых лежит изменение транскрипции генов. Стимулируется синтез липокортина, который блокирует реакцию воспаления. Липокортин ингибирует фермент фосфолипазу А2, в результате чего снижается синтез арахидоновой кислоты и медиаторов воспаления типа простагландинов и лейкотриенов. Глюкокортикоиды ослабляют ферментативный синтез многих других белков, играющих важную роль в воспалительной реакции, например синтез интерлейкинов и других цитокинов под действием фосфолипазы А2 и циклооксигеназы-2. При инъекциях очень высоких доз могут развиваться не связанные с генами эффекты, затрагивающие мембранные рецепторы.
Терапевтическое действие. Глюкокортикоиды находят применение при лечении «нежелательных» воспалительных реакций, таких как аллергия, ревматоидный артрит и т. п., для достижения антиаллергического, иммуносупрессорного и противовоспалительного эффекта.
Побочные действия. При кратковременном применении глюкокортикоидов даже в высоких дозах побочных эффектов практически нет.
При длительном применении развиваются изменения, схожие с синдромом Кушинга (эндогенная гиперпродукция кортизола). После снятия воспалительных реакций с помощью глюкокортикоидов у пациента обнаруживается повышенная склонность к инфекциям и ухудшение заживления ран. Последствия повышенной глюкокортикоидной активности: а) усиление глюконеогенеза и высвобождения глюкозы; под действием инсулина происходит переход глюкозы в триглицериды (отложение жира: «лунообразное» лицо, ожирение туловища), при недостаточной выработке инсулина развивается стероидный диабет; б) усиление катаболизма белка, что приводит к атрофии скелетных мышц (тонкие конечности), остеопорозу, нарушению роста у детей, атрофии кожных покровов. Последствиями повышенной минералокортикоидной активности являются удерживание NaCI и воды с повышением АД, склонность к отекам, потеря KCI с опасностью гипокалиемии.
При хроническом приеме глюкокортикоидов возможны психические отклонения: прежде всего эйфорические и маниакальные ухудшения настроения.
Ослабление или устранение медикаментозного синдрома Кушинга,
- Применение производных кортизола со сниженной (например, преднизолон) или отсутствующей минералокортикоидной активностью (например, триамцинолон, дексаметазон). Глюкокортикоидная активность этих препаратов усилена, противовоспалительная активность и ингибирующее действие на гипофиз коррелируют между собой. Не существует производных, обладающих только противовоспалительным действием. «Глюкокортикоидного» синдрома Кушинга избежать невозможно. В таблице приведено сравнение глюкокортикоидной и минералокортикоидной активности препаратов. Активность кортизола принята за единицу.
- Местное применение позволяет достичь терапевтической концентрации в месте введения препарата и избежать системного действия. Целесообразно назначение таких лекарств, которые после диффузии с места аппликации подвергаются быстрой биотрансформации и инактивации. Так, например, для ингаляции используют глюкокортикоиды с быстрым пресистемным выведением: бекло-метазона дипропионат, будезонид, флунизолид, флутиказона пропионат. Однако местные побочне эффекты тоже возможны. Например, при ингаляциях — кандидоз слизистой рта, охриплость голоса. При накожном применении — атрофия кожи, стрии, телеангиэктазии, стероидные акне, при закапывании в глаза—помутнение хрусталика (катаракта) и повышение внутриглазного давления (глаукома).
- Назначение как можно более низких доз. Для длительного применения необходимо выбрать достаточную, но при этом минимальную дозу. Следует помнить, что выработка эндогенных глюкокортикоидов по механизму обратной связи будет уменьшаться. Поэтому слишком низкая доза может оказаться недостаточной, и в результате противовоспалительный эффект не проявится.
Влияние глюкокортикоидов на продукцию кортизола в надпочечниках. АКТГ гипофиза стимулирует выработку кортизола в надпочечниках. АКТГ в свою очередь вырабатывается под влиянием кортикотропина (КРГ) гипоталамуса. В гипофизе и в гипоталамусе есть рецепторы к кортизолу. Связывание кортизола с этими рецепторами по механизму отрицательной обратной связи препятствует выработке АКТГ или КРГ. С помощью такого «датчика» контролируется концентрация кортизола (ее соответствие должной величине). Если концентрация повышена, то уменьшается высвобождение АКТГ и, соответственно, продукция кортизола, и наоборот. Организм аналогичным образом реагирует на введение синтетических глюкокортикоидов. Высвобождение КРГ и АКТГ уменьшается (блокада вышестоящих центров экзогенными глюкокортикоидами), снижается образование кортизола (подавление функции надпочечников). При введении высоких нефизиологических концентраций глюкокортикоидов надпочечники сморщиваются — атрофия надпочечников. Способность к продукции альдостерона сохраняется. При резком прекращении лечения атрофированные надпочечники не могут выработать достаточного количества кортизола, что может быть опасным для жизни. Поэтому терапию глюкокортикоидами следует заканчивать, постепенно снижая дозировку.
Профилактика атрофии надпочечников. Выработка кортизола максимальна утром и снижается к вечеру (циркадный ритм). Вечером чувствительность гипоталамуса и гипофиза повышена.
- Введение в циркадном ритме. Суточная доза глюкокортикоидов вводится утром; надпочечники начинают продуцировать гормон, регуляторные центры относительно нечувствительны к ингибированию. В ранние часы утром следующего дня произойдет стимуляция надпочечников, и выработка КТРГ и АКТГ понизится.
- Другой способ введения. Через день по уграм вводят двойную дозу. В промежутке организм сам вырабатывает кортизол.
Оба способа введения имеют тот недостаток, что между дозами глюкокортикоидов могут проявиться вновь симптомы заболевания.
Глюкокортикоиды.. Нормальная физиология
Глюкокортикоиды.
К глюкокортикоидным гормонам относятся кортизол, кортизон, кортикостерон, 11-дезоксикортизол, 11-дегидрокортикостерон. У человека наиболее важным глюкокортикоидом является кортизол.
Эти гормоны оказывают влияние на обмен углеводов, белков и жиров:
1. Глюкокортикоиды вызывают повышение содержания глюкозы в плазме крови (гипергликемия). Этот эффект обусловлен стимулированием процессов глюконеогенеза в печени, т. е. образования глюкозы из аминокислот и жирных кислот. Глюкокортикоиды угнетают активность фермента гексокиназы, что ведет к уменьшению утилизации глюкозы тканями. Глюкокортикоиды являются антагонистами инсулина в регуляции углеводного обмена.
2. Глюкокортикоиды оказывают катаболическое влияние на белковый обмен. Вместе с тем они обладают и выраженным анти-анаболическим действием, что проявляется снижением синтеза особенно мышечных белков, так как глюкокортикоиды угнетают транспорт аминокислот из плазмы крови в мышечные клетки. В результате снижается мышечная масса, может развиться остеопороз, уменьшается скорость заживления ран.
3. Действие глюкокортикоидов на жировой обмен заключается в активации липолиза, что приводит к увеличению концентрации жирных кислот в плазме крови.
4. Глюкокортикоиды угнетают все компоненты воспалительной реакции: уменьшают проницаемость капилляров, тормозят экссудацию и снижают отечность тканей, стабилизируют мембраны лизосом, что предотвращает выброс протеолитических ферментов, способствующих развитию воспалительной реакции, угнетают фагоцитоз в очаге воспаления. Глюкокортикоиды уменьшают лихорадку. Это действие связано с уменьшением выброса интерлейкина-1 из лейкоцитов, который стимулирует центр теплопродукции в гипоталамусе.
5. Глюкокортикоиды оказывают противоаллергическое действие. Это действие обусловлено эффектами, лежащими в основе противовоспалительного действия: угнетение образования факторов, усиливающих аллергическую реакцию, снижение экссудации, стабилизация лизосом. Повышение содержания глюкокортикоидов в крови приводит к уменьшению числа эозинофилов, концентрация которых обычно увеличена при аллергических реакциях.
6. Глюкокортикоиды угнетают как клеточный, так и гуморальный иммунитет. Они снижают продукцию Ти В-лимфоцитов, уменьшают образование антител, снижают иммунологический надзор. При длительном приеме глюкокортикоидов может возникнуть инволюция тимуса и лимфоидной ткани. Ослабление защитных иммунных реакций организма является серьезным побочным эффектом при длительном лечении глюкокортикоидами, так как возрастает вероятность присоединения вторичной инфекции. Кроме того, усиливается и опасность развития опухолевого процесса из-за депрессии иммунологического надзора. С другой стороны, эти эффекты глюкокортикоидов позволяют рассматривать их как активных иммунодепрессантов.
7. Глюкокортикоиды повышают чувствительность гладких мышц сосудов к катехоламинам, что может привести к возрастанию артериального давления. Этому способствует и их небольшое минералокортикоидное действие: задержка натрия и воды в организме.
8. Глюкокортикоиды стимулируют секрецию соляной кислоты.
Образование глюкокортикоидов корой надпочечников стимулируется АКТГ аденогипофиза. Избыточное содержание глюкокортикоидов в крови приводит к торможению синтеза АКТГ и кортиколиберина гипоталамусом. Таким образом, гипоталамус, аденогипофиз и кора надпочечников объединены функционально и поэтому выделяют единую гипоталамо-гипофизарно-надпочечниковую систему. При острых стрессовых ситуациях быстро повышается уровень глюкокортикоидов в крови. В связи с метаболическими эффектами они быстро обеспечивают организм энергетическим материалом.
Содержание глюкокортикоидов в крови самое высокое в 6–8 часов утра.
Гипофункция коры надпочечников проявляется снижением содержания кортикоидных гормонов и носит название Аддисоновой (бронзовой) болезни. Главными симптомами этого заболевания являются: адинамия, снижение объема циркулирующей крови, артериальная гипотония, гипогликемия, усиленная пигментация кожи, головокружение, неопределенные боли в области живота, поносы.
При опухолях надпочечников может развиться гиперфункция коры надпочечников с избыточным образованием глюкокортикоидов. Это так называемый первичный гиперкортицизм, или синдром Иценко – Кушинга. Клинические проявления этого синдрома такие же, как и при болезни Иценко – Кушинга.
Поделитесь на страничке
Следующая глава >
6. Гормоны надпочечников. Глюкокортикоиды. Нормальная физиология: конспект лекций
6. Гормоны надпочечников. Глюкокортикоиды
Надпочечники – парные железы, расположенные над верхними полюсами почек. Они имеют важное жизненное значение. Различают два типа гормонов: гормоны коркового слоя и гормоны мозгового слоя.
Гормоны коркового слоя длятся на три группы:
1) глюкокортикоиды (гидрокортизон, кортизон, кортикостерон);
2) минералокортикоиды (альдестерон, дезоксикортикостерон);
3) половые гормоны (андрогены, эстрогены, прогестерон).
Глюкокортикоиды синтезируются в пучковой зоне коры надпочечников. По химическому строению гормоны являются стероидами, образуются из холестерина, для синтеза необходима аскорбиновая кислота.
Физиологическое значение глюкокортикоидов.
Глюкокортикоиды влияют на обмен углеводов, белков и жиров, усиливают процесс образования глюкозы из белков, повышают отложение гликогена в печени, по своему действию являются антагонистами инсулина.
Глюкокортикоиды оказывают катаболическое влияние на белковый обмен, вызывают распад тканевого белка и задерживают включение аминокислот в белки.
Гормоны обладают противовоспалительным действием, что обусловлено снижением проницаемости стенок сосуда при низкой активности фермента гиалуронидазы. Уменьшение воспаления обусловлено торможением освобождения арахидоновой кислоты из фосфолипидов. Это ведет к ограничению синтеза простагландинов, которые стимулируют воспалительный процесс.
Глюкокортикоиды оказывают влияние на выработку защитных антител: гидрокортизон подавляет синтез антител, тормозит реакцию взаимодействия антитела с антигеном.
Глюкокортикоиды оказывают выраженное влияние на кроветворные органы:
1) увеличивают количество эритроцитов за счет стимуляции красного костного мозга;
2) приводят к обратному развитию вилочковой железы и лимфоидной ткани, что сопровождается уменьшением количества лимфоцитов.
Выделение из организма осуществляется двумя путями:
1) 75–90 % поступивших гормонов в кровь удаляется с мочой;
2) 10–25 % удаляется с калом и желчью.
Регуляция образования глюкокортикоидов.
Важную роль в образовании глюкокортикоидов играет кортикотропин передней доли гипофиза. Это влияние осуществляется по принципу прямых и обратных связей: кортикотропин повышает продукцию глюкокортикоидов, а избыточное их содержание в крови приводит к торможению кортикотропина в гипофизе.
В ядрах переднего отдела гипоталамуса синтезируется нейросекрет кортиколиберин, который стимулирует образование кортикотропина в передней доле гипофиза, а он, в свою очередь, стимулирует образование глюкокортикоида. Функциональное отношение «гипоталамус – передняя доля гипофиза – кора надпочечников» находится в единой гипоталамо-гипофизарно-надпочечниковой системе, которая играет ведущую роль в адаптационных реакциях организма.
Адреналин – гормон мозгового вещества надпочечников – усиливает образование глюкокортикоидов.
Данный текст является ознакомительным фрагментом.
Читать книгу целиком
Поделитесь на страничке
Гормоны надпочечников: кортикостероиды | Гормоны
Надпочечник — это парный орган, лежащий над почкой и состоящий из двух частей, которые различаются по своем происхождению, морфологии и функции – коры и мозгового вещества. Кора развивается из складки целомического эпителия, из которого образуются и гонады. Клеточные элементы из брюшных симпатических ганглиев мигрируют в область расположения коркового вещества и в дальнейшем образуют клетки мозгового вещества надпочечников, вырабатывающие катехоламины. Такое происхождение объясняет близость гормонов, выделяющихся в коре надпочечника гонад: и те, и другие являются стероидами. Понятна также синэргичность симпатической нервной системы и мозгового вещества надпочечника.
Кора надпочечника
Кора надпочечника у млекопитающих состоит из трех слоев: клубочковой зоны, лежащей снаружи, пучковой зоны и сетчатой, прилежащей к мозговому веществу. Надпочечник имеет обильное кровоснабжение.
Из коры надпочечников выделено около 50 различных стероидов. Большинство из них является промежуточными продуктами синтеза активных гормонов. Основным субстратом для синтеза стероидных гормонов является холестерин, поступающий в клетки с кровью. В клетках он хранится в виде эфиров или других соединений в липидных каплях или липосомах, представляющих собою депо холестерина. В процессе синтезов стероидов большую роль играют митохондрии, эндоплазматический ретикулум, комплекс Гольджи. Ряд этапов синтеза стероидов осуществляется в митохондриях, в связи с этим в стероидогенных тканях эти органоиды имеют везикулярные кристы.
Кортикостероиды
В коре надпочечника вырабатываются гормоны, называемые кортикостероидами или кортикоидами. Они разделяются на две основные группы: глюкокортикоиды, выделяемые пучковой и сетчатой зонами, и минералокортикоиды, образующиеся в наружной клубочковой зоне. Кроме того, в коре надпочечника, главным образом в сетчатой зоне, секретируются небольшие количества половых стероидов, главным образом андрогенов.
Состав секретируемых кортикостероидов различается у разных животных; у человека только три кортикоида секретируются в виде гормонов: кортизол (гидрокортизон), альдостерон и в меньшей степени кортикостерон. В крови гормоны находятся в связанном состоянии с белком-носителем – транскортином.
Действие кортикостероидов
Кортикостероиды обладают широким спектром действия. Удаление обоих надпочечников приводит к смерти животного. Основным действием глюкокортикоидов является влияние на углеводный обмен; минералокортикоиды (альдостерон) связаны с балансом электролитов.
Эффекты глюкокортикоидов
Влияние глюкортикоидов весьма разнообразно и выявляется весьма четко у животных после удаления надпочечников (адреналэктомии) и введения альдостерона. Так, синтез глюкозы из аминокислот – глюконеогенез – находится под регулирующим влиянием кортизола. У этого гормона несколько путей влияния, но преимущественно его воздействие осуществляется за счет увеличения активности ряда ферментов, необходимых для глюконеогенеза. Глюкоза, вырабатываемая в результате введения кортизола, восполняет запасы гликогена в печени, истощенные после удаления коры надпочечника. Таким образом, кортизол увеличивает образование и отложение гликогена в печени и мышцах и повышает уровень глюкозы в крови.
Глюкокортикоиды обладают катаболическим действием. Они тормозят синтез белков в периферических тканях и усиливают их катаболизм. Аминокислоты, поступающие в печень в результате катаболизма белков, служат субстратом для глюконеогенеза. Избыток кортизола приводит к атрофии мышц. В отсутствие глюкокортикоидов нарушаются мобилизация и выделение жирных кислот из жировой ткани, т.е. липолиз. Благодаря повышению кровотока в клубочках и усилению клубочковой фильтрации кортизол обеспечивает экскрецию воды. Он обладает также специфическим влиянием на экскрецию мочи – снижает проницаемость для воды дистального отдела канальцев. При недостаточности коры надпочечника наблюдается мышечная слабость, проявления которой снижаются при введении кортизола.
В головном мозгу обнаружены многочисленные рецепторы глюкокортикоидов, благодаря чему эти гормоны оказывают разнообразное действие на функцию ЦНС и органов чувств. При недостаточности коры надпочечников нарушается способность различать оттенки вкусовых, обонятельных и звуковых ощущений; введение глюкокортикоидов способствует нормализации функции. Глюкокортикоиды также влияют на процессы обработки информации в центрах мозга.
Глюкокортикоиды оказывают значительное влияние на клеточный и гуморальный иммунитет. При снижении активности коры надпочечников происходит увеличение тимуса и лимфатических узлов. Введение глюкокортикоидов нормализует функцию этих органов. Кортизол обладает четким противовоспалительным действием, в связи с чем его применяют при лечении ревматических заболеваний.
Концентрация глюкокортикоидов поддерживается в течение более или менее длительных периодов времени на постоянном уровне за счет специальных регуляторных механизмов, хотя существуют циркадные колебания. Например, у человека продукция кортизола максимальна в утренние часы и снижена ночью. 90 % глюкокортикоидов связано с белками крови.
Регуляция секреции глюкокортикоидов
Схема регуляции секреции глюкокортикоидов такова. Рилизинг-гормон КРГ, образованный в гипофизарной зоне гипоталамуса, поступает в гипофиз и вызывает выделение АКТГ. Последний доставляется кровью к коре надпочечника, где он стимулирует синтез и секрецию глюкокортикоидов. Введение АКТГ крысе уже через 2 мин приводит к увеличению уровня глюкокортикоидов. Образование КРГ в гипофизотропной зоне гипоталамуса находится под контролем высших отделов ЦНС, которые получают и перерабатывают сигналы, поступающие с периферии организма. На секреторной активности коры надпочечников отражаются эмоциональное состояние и поведение.
Введение глюкокортикоидов в гипофизотропную зону гипоталамуса вызывает снижение секреции АКТГ. Секреция АКТГ изменяется также при их инъекции в аденогипофиз. Очевидно, что в гипофизотропной зоне и в гипофизе располагаются рецепторы глюкокортикоидов. Возможно, АКТГ способен и непосредственно ингибировать свою собственную выработку через так называемую короткую цепь обратной связи. При этом этот гормон влияет на функцию нейросекреторных клеток, вырабатывающих КРГ.
Изменения концентрации глюкокортикоидов особенно отчетливо выступают при предъявлении к организму особых требований –стресс. Автор теории стресса Г. Селье выделяет три его фазы: тревоги, резистентности и истощения. Стресс-реакция может пройти бесследно, если воздействие не очень сильное; при его повторении возможна адаптация к этому стимулу. В некоторых случаях реакция на стресс-фактор может оказаться столь интенсивной, что произойдут опустошение всех запасов глюкокортикоидов в коре надпочечников и ее разрушение. В этом случае введение глюкокортикоидов облегчает ситуацию.
Болезни, связанные с гормонами коры надпочечников
Из анализа эффектов глюкокортикоидов следует, что как гиперфункция, так и снижение выработки этих гормонов приводят к серьезным нарушениям функций организма. В результате повышенного содержания кортизола наблюдаются ожирение, гипергликемия, усиленный распад белков (катаболическое действие), задержка воды и хлорида натрия в организме (отеки), гипертензия, пониженная резистентность. При недостаточности функции коры надпочечников, снижении выработки кортикостероидов развивается тяжелое состояние — бронзовая, или аддисонова, болезнь. Она характеризуется бронзовой окраской кожи, ослаблением сердечной мышцы, повышенной утомляемостью, восприимчивостью к инфекциям.
глюкокортикоидов — это … Что такое глюкокортикоид?
глюкокортикоид — GLUCOCORTICOÍD, glucocorticoizi, s.m. (биол.) Гормон, секретируемый кортикосупрареналовой железой, глюциделором, отвечающим за метаболизм, липиделор и протиделор, прекумтом и целым апей и электролитером. — Дин фр. глюкокортикоид. Trimis de… Dicționar Român
Глюкокортикоид — вгл. Глюкокортикоид… Das Wörterbuch medizinischer Fachausdrücke
Глюкокортикоид — Химическая структура кортизола, глюкокортикоида… Википедия
Глюкокортикоид — Глюкокортикоид, веральтет Глюкокортикоид, zählen zu den Corticosteroiden, einer Klasse von Steroidhormonen aus der Nebennierenrinde.Die natürlich vorkommenden Glucocorticoide sind Abkömmlinge des Progesterons. Zu diesen zählen Cortisol und…… Deutsch Wikipedia
Глюкокортикоид — гормон, который преимущественно влияет на метаболизм углеводов и, в меньшей степени, жиров и белков (и имеет другие эффекты). Глюкокортикоиды образуются во внешней части (коре) надпочечников и химически классифицируются как…… Медицинский словарь
глюкокортикоид — существительное Дата: 1950 любой из группы кортикостероидов (например, кортизол), которые участвуют особенно в метаболизме углеводов, белков и жиров, обладают противовоспалительным и иммунодепрессивным действием и широко используются в медицине (например, the…… New Collegiate Dictionary
глюкокортикоид — / glooh koh kawr ti koyd /, n.Biochem. любой из класса стероидных гормонов, которые синтезируются корой надпочечников позвоночных и обладают противовоспалительной активностью. [1945 50; ГЛЮКО + КОРТИКАЛЬНЫЙ + ОИД; ср. КОРТИКОСТЕРОИД] * * *… Универсалиум
глюкокортикоид — существительное Любой из группы стероидных гормонов, вырабатываемых корой надпочечников, которые участвуют в метаболизме и обладают противовоспалительными свойствами… Викисловарь
Глюкокортикоид — Glu | co | cor | ti | co | id, Glu | co | cor | ti | co | ste | ro | id [↑ Gluc] ↑ Кортикостероид… Универсал-Лексикон
Глюкокортикоид — Glu | co | cor | ti | co | id vgl.Глюкокортикоид… Das große Fremdwörterbuch
глюкокортикоид — [ˌglu: kə (ʊ) kɔ: tɪkɔɪd] существительное Биохимия любой из группы кортикостероидов, которые участвуют в метаболизме углеводов, белков и жиров и обладают противовоспалительной активностью… Словарь новых терминов английского языка
побочных эффектов глюкокортикоидов | IntechOpen
1. Введение
Термин «глюкокортикоиды» (ГК) обозначает как естественные гормоны, секретируемые корой надпочечников, так и противовоспалительные и иммунодепрессивные агенты.С момента успешного использования гидрокортизона (кортизола), основного глюкокортикоида коры надпочечников человека, для подавления клинических проявлений ревматоидного артрита были изготовлены и испытаны многие синтетические соединения с глюкокортикоидной активностью [1]. Различия между фармакологическими эффектами синтетических GC (SGC) являются результатом структурных изменений их основного стероидного ядра и его боковых групп. Эти структурные изменения могут влиять на биодоступность SGC.К ним относятся желудочно-кишечное или парентеральное всасывание, период полувыведения из плазмы и метаболизм в печени, жировой ткани или тканях-мишенях, а также их способность взаимодействовать с рецептором глюкокортикоидов и модулировать транскрипцию генов, чувствительных к глюкокортикоидам [2]. Структурные вариации снижают естественную перекрестную реактивность SGC с рецептором минералокортикоидов (MR), устраняя нежелательный эффект удержания солей. В дополнение к этому, некоторые вариации увеличивают растворимость SGC в воде для парентерального введения или снижают их растворимость в воде для улучшения местного действия [3, 4].Основные SGC, используемые в клинической практике, вместе с их относительной биологической активностью и их периодом полураспада в плазме и биологических условиях перечислены в таблице 1.
| Глюкокортикоиды | Эквивалентная доза (мг) | Глюкокортикоид активность | Подавление HPA | Эффективность минералокортикоидов | Период полувыведения из плазмы (мин) | Период полувыведения из плазмы (ч) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Короткого действия | |||||||||||||
| Кортизол | 20.0 | 1,0 | 1,0 | 1,0 | 90 | 8–12 | |||||||
| Кортизон | 25,0 | 0,8 | 0,8 | 80–118 | 898–12 действующий | ||||||||
| Преднизон | 5,0 | 4,0 | 4,0 | 0,3 | 60 | 18–36 | |||||||
| Преднизолон | 5,0 | 5,0 | 115–200 | 18–36 | |||||||||
| Триамцинолон | 4,0 | 5,0 | 4,0 | 0 | 30 | 18–36 | |||||||
| 4,0105 | 4,010преднизолон | 0 | 180 | 18–36 | |||||||||
| Долговременного действия | |||||||||||||
| Дексаметазон | 0,75 | 30 | 17 | 0 | 200 | 200 | 900 | 0.6 | 25–40 | 0 | 300 | 36–54 | |
| Минералокортикоиды | |||||||||||||
| Флюдрокортизон | 2,0 | 10 | 2,0 | 10 9010 | |||||||||
| Дезоксикортикостерона ацетат | 0 | 20 | 70 | ||||||||||
Таблица 1.
Эквивалентности глюкокортикоидов (адаптировано из [5, 6, 7]).
ГК — 21-углеродные стероидные гормоны. Конфигурация дельта-4,3-кето-11-бета, 17-альфа, 21-тригидроксила необходима для активности глюкокортикоидов и присутствует во всех природных и синтетических ГК. Примерно 90% эндогенного кортизола в сыворотке крови связано с белками, в первую очередь с кортикостероидсвязывающим глобулином (CBG) и альбумином. И наоборот, синтетические ГК, отличные от преднизолона, либо слабо связываются с альбумином, либо циркулируют в виде свободных стероидов, потому что у них мало сродства к КБГ или нет вообще. Свободная форма ГК может легко диффундировать через мембрану и может с высокой аффинностью связываться с внутрицитоплазматическими рецепторами глюкокортикоидов.ГК выполняют большую часть своих эффектов благодаря специфическим имманентно распределенным внутриклеточным рецепторам. Связывание GC с этим рецептором создает комплекс, который затем перемещается в ядро, где он может напрямую взаимодействовать со специфическими последовательностями ДНК (глюкокортикоид-чувствительными элементами [GREs]) и другими факторами транскрипции. ГК метаболизируются в печени. Почки выводят 95% конъюгированных метаболитов, а оставшаяся часть теряется в кишечнике. Экзогенные GC имеют те же метаболические процессы, что и эндогенные GC.Период полураспада синтетических ГК обычно больше, чем у кортизола, который составляет примерно 80 минут [8, 9, 10, 11, 12, 13]. Механизмы действия GC показаны на рисунке 1.
Рисунок 1.
Механизмы действия GC.
ГК используются практически во всех медицинских областях для системной терапии. ГК представляют собой стандартную терапию для уменьшения воспаления и иммунной активации при астме, а также при аллергических, ревматоидных, коллагеновых, сосудистых, гематологических, неврологических расстройствах и воспалительных заболеваниях кишечника.Также ГК используются при заболеваниях почек, кишечника, печени, глаз и кожи и для подавления реакций «хозяин-трансплантат» или «трансплантат против хозяина» после трансплантации органов. SGC назначают в качестве заместительной терапии при первичной или вторичной недостаточности надпочечников (AI), а также в качестве супрессивной терапии надпочечников при резистентности к глюкокортикоидам и врожденной гиперплазии надпочечников. Они также используются для некоторых диагностических целей, например, для установления синдрома Кушинга. Острые фармакологические дозы ГК можно использовать при небольшом количестве неэндокринных заболеваний, например, для пациентов, страдающих острым травматическим повреждением спинного мозга, с тяжелым неврологическим дефицитом и болями в костях даже после операции и критической недостаточности кортизола, связанной с заболеванием.Кроме того, все плоды на сроке от 24 до 34 недель с риском преждевременных родов должны рассматриваться как кандидаты на дородовое лечение ГК. Преимущества ГК были продемонстрированы у ряда других пациентов, включая кардиохирургические операции с высоким риском, печеночную недостаточность, посттравматическое стрессовое расстройство, внебольничную пневмонию и отказ от ИВЛ [3, 4, 6, 7, 9, 14, 15, 16, 17, 18]. Общие клинические применения системных ГК показаны в таблице 2.
| Область медицины | Нарушение (-я) | |||
|---|---|---|---|---|
| Аллергия и респирология |
Гиперчувствительный пневмонит | |||
| Дерматология | ||||
| ||||
| Гематология | 8 9008 | |||
| Иммунология | Кератоконъюнктивит | |||
| Прочие |
000 000 |
Таблица 2.
Общие клинические применения системных ГК (адаптировано из [19]).
Цель этой всеобъемлющей статьи — выделить общие побочные эффекты системных (пероральных и парентеральных) ГК. В первую очередь будут описаны механизмы действия ГК. Затем будут обсуждаться побочные эффекты ГК и патофизиологические механизмы. Во время написания этого раздела использовалась текущая литература и базы данных.
2. Механизм действия
ГК воздействуют на многие, если не на все, клетки и ткани человеческого тела, пробуждая тем самым широкий спектр изменений, которые затрагивают одновременно несколько типов клеток [20].
2.1. Транскрипция гена
Связывание рецептора с GRE может вызывать либо усиление, либо подавление транскрипции отвечающих нижестоящих генов. ГК подавляют синтез почти всех известных воспалительных цитокинов [21, 22].
2.2. Посттрансляционные события
GC также подавляют секрецию и синтез воспалительных молекул (IL-1, IL-2, IL-6, IL-8, фактор некроза опухоли, воспалительные эйкозаноиды и циклооксигеназа-2), влияя на посттрансляционные события. [23].
2.3. Влияние на распределение клеток крови
Введение глюкокортикоидов предсказуемо приводит к нейтрофильному лейкоцитозу, резкому сокращению циркулирующих эозинофилов и базофилов, временному незначительному снижению количества моноцитов и общего количества лимфоцитов. Острая лимфопения нормализуется к 24–48 часам. ГК не оказывают прямого воздействия на количество эритроцитов и тромбоцитов. Но анемия и тромбоцитоз могут излечиться с уменьшением хронического воспаления [24, 25].
3. Изменения функций и выживаемости клеток
3.1. Нейтрофилы
Наиболее важным действием ГК на нейтрофилы является подавление адгезии нейтрофилов к эндотелиальным клеткам. Этот эффект уменьшает захват нейтрофилов в воспаленной области и, вероятно, является причиной характерного гематологического изменения — нейтрофилии. ГК в фармакологических дозах лишь незначительно ухудшают функции нейтрофилов, такие как высвобождение лизосомальных ферментов, респираторный взрыв и хемотаксис в воспаленной области. Более низкие дозы не влияют на эти функции [26, 27].
3.2. Моноциты и макрофаги
ГК противодействуют дифференцировке макрофагов и подавляют многие из их функций. ГК (1) подавляют миелопоэз и ингибируют экспрессию антигенов главного комплекса гистосовместимости класса II, индуцированную интерфероном-γ; (2) блокировать высвобождение множества цитокинов, таких как интерлейкин-1, интерлейкин-6 и фактор некроза опухоли-α; (3) подавление продукции и высвобождения провоспалительных простагландинов (PG) и лейкотриенов; (4) подавлять фагоцитарную и микробицидную активность активированных макрофагов; (5) уменьшить выведение опсонизированных бактерий ретикулоэндотелиальной системой; (6) уменьшают накопление моноцитов и макрофагов в тканях [28, 29, 30, 31].
3.3. Эозинофилы, базофилы и тучные клетки
GC поддерживают апоптоз эозинофилов. В дополнение к этому, GC уменьшают накопление эозинофилов и тучных клеток в местах аллергической реакции. Кроме того, GC ингибируют IgE-зависимое высвобождение гистамина и лейкотриена C4 из базофилов, а также ингибируют дегрануляцию как продукции цитокинов, так и дегрануляции тучных клеток и эозинофилов [26, 32, 33].
3.4. Естественные киллерные клетки (NKC)
Общее количество циркулирующих NKC существенно не изменяется после введения GC.Но наблюдалась устойчивая повышающая регуляция генов активации NKC [34].
3.5. Эндотелиальные клетки
GC оказывают сильное влияние на активацию / функцию эндотелиальных клеток и, безусловно, подавляют проницаемость сосудов. ГК непосредственно подавляют экспрессию молекул адгезии как на лейкоцитах, так и на эндотелиальных клетках. ГК подавляют адгезию эндотелия, а также косвенные эффекты из-за ингибирования транскрипции цитокинов (интерлейкин-1 и фактор некроза опухоли), которые повышают экспрессию молекул эндотелиальной адгезии [25].
3.6. Т-лимфоциты
Введение ГК вызывает резкое снижение антигенной чувствительности Т-лимфоцитов in vitro. Генерация, пролиферация и функция хелперных и супрессорных Т-клеток, а также ответы цитотоксических Т-клеток ингибируются GC. Эти эффекты связаны с подавлением высвобождения определенных цитокинов. ГК также подавляют острую генерацию цитокинов, производных как Т-хелперов 1-го, так и Т-хелперных типов 2, активированными Т-клетками. Но ингибирующий эффект на экспрессию цитокинов, производных от Т-хелперов 1-го типа, больше [35, 36, 37, 38].
3,7. Уровни В-лимфоцитов и иммуноглобулина
ГК постепенно влияют на активацию, пролиферацию и дифференцировку В-клеток. В-лимфоциты относительно устойчивы к иммуносупрессивному действию ГК в отличие от Т-лимфоцитов. После активации В-клетки дифференцируются в плазматические клетки, секретирующие иммуноглобулин. Но сборщики мусора оказывают лишь минимальное влияние на этот процесс дифференциации. Наиболее важный эффект ГК на В-лимфоциты, связанный с выработкой и секрецией иммуноглобулинов.ГК также увеличивают катаболизм иммуноглобулинов. Короткий курс лечения ГК вызывает явное и стойкое снижение сывороточного IgG. Напротив, уровни иммуноглобулина E (IgE) могут увеличиваться. Неизвестно, подавляют ли ГК экспрессию гена иммуноглобулина. Следовательно, низкие дозы ГК подавляют движение лейкоцитов и клеточные иммунные ответы. Но для подавления функций лейкоцитов и гуморального иммунного ответа необходимы более высокие дозы ГК. Эта вариабельность лекарственного ответа также очевидна у разных пациентов и различных заболеваний [39, 40, 41, 42, 43].
3.8. Дендритные клетки и презентация антигена
GCs вызывают значительное сокращение циркулирующих дендритных клеток. Дендриты являются основными стимуляторами наивных Т-клеток, представляя антигены. В результате ГК нарушают развитие иммунитета к впервые обнаруженным антигенам [44].
3.9. Фибробласты
В супрафизиологических концентрациях ГК подавляют пролиферацию фибробластов и индуцированный фактором роста синтез ДНК и синтез белка, включая синтез коллагена и гликозаминогликана.Также было показано, что GC взаимодействуют с двумя медиаторами фиброплазии; трансформирующий фактор роста-β и фактор роста эндотелия сосудов. Кроме того, ГК индуцируют транскрипцию матричной РНК фибронектина, ингибируют интерлейкин-1, синтез металлопротеиназы, индуцированный фактором некроза опухоли-α, и синтез метаболитов арахидоновой кислоты [20, 28, 45, 46].
3.10. Простагландины
Подавление воспалительных простагландинов (PGs) является основным фактором противовоспалительного действия GC.Подавление активности фосфолипазы А2 с помощью ГК опосредуется активацией ингибиторов самого фермента или ингибированием синтеза фермента. Семейство белков липокортин / аннексин, связанных с глюкокортикоидами, может быть вовлечено в этот процесс. Второй этап синтеза простагландинов — образование простагландина h3 из арахидоновой кислоты ферментами, называемыми циклооксигеназами. Ген и белок COX-2 сильно активируются в эндотелиальных клетках, фибробластах и макрофагах, а также под действием таких медиаторов, как эндотоксин и интерлейкин-1.Но ГК сильно подавляют экспрессию ЦОГ-2, вызванную воспалительными стимулами. Позже D’Adamio et al. идентифицировали индуцированную глюкокортикоидами лейциновую молнию (GILZ). GILZ является членом семейства белков лейциновой молнии, которое принадлежит к семейству факторов транскрипции клона-22, стимулированному трансформирующим фактором роста. GILZ подавляет индуцированную воспалительными цитокинами экспрессию COX-2, таким образом опосредуя противовоспалительные эффекты GC [47, 48, 49, 50, 51, 52, 53].
4. Побочные эффекты системных глюкокортикоидов
Токсичность глюкокортикоидов — одна из наиболее частых причин ятрогенных заболеваний, связанных с хроническими воспалительными заболеваниями.Побочные эффекты ГК известны десятилетиями. Но точное соотношение риска и пользы является неполным и / или непостоянным, потому что обычно трудно отличить эффекты ГК от эффектов основных сопутствующих заболеваний, других сопутствующих заболеваний или других лекарств. Побочные эффекты, связанные с ГК, зависят как от средней дозы, так и от продолжительности терапии. В целом можно констатировать, что длительное применение является фактором высокого риска, тогда как общая доза имеет второстепенное значение.Даже при лечении низкими дозами ГК могут вызывать серьезные побочные эффекты. Тяжесть варьируется от косметических аспектов (например, телеангиэктазии, гипертрихоза) до серьезных инвалидизирующих и даже опасных для жизни ситуаций (например, желудочного кровотечения). Возможны одиночные или множественные побочные эффекты [12, 54, 55]. Побочные эффекты ГК являются основным ограничивающим фактором для использования этих агентов. Обзор наиболее распространенных и серьезных побочных эффектов ГК представлен в Таблице 3.
| Раннее начало терапии, практически неизбежно | ||||
| Усиливается у пациентов с основными факторами риска или одновременное употребление других лекарств | ||||
| ||||
| При продолжении супрафизиологического лечения | ||||
|
| |||
| Редкий и непредсказуемый | ||||
| ||||
| Доза | Определение |
|---|---|
| Низкая доза | ≤7.5 мг эквивалента преднизона / день |
| Средняя | > 7,5 мг, но ≤30 мг эквивалента преднизона / день |
| Высокая | > 30 мг, но ≤100 мг эквивалента преднизона / день |
| Очень высокая | > 100 мг эквивалента преднизона / день |
| Пульсная терапия | ≥250 мг эквивалента преднизона / день в течение 1 дня или нескольких дней |
Таблица 4.
Супрафизиологическое дозирование и взаимное преобразование SGC (адаптировано из [ 66, 67, 69]).
Преднизон или пренизолон 5 мг≈ / гидрокортизон 20 мг≈ / дексаметазон 0,75 мг.
Подавление надпочечников менее вероятно в следующих ситуациях: (1) схемы, имитирующие суточный ритм кортизола (более высокая доза утром, более низкая доза днем) и (2) прием стероидов через день. Возможный риск этого побочного эффекта неизвестен. В то же время индивидуальные ответы на GC могут сильно отличаться. Клинические проявления ИИ изменчивы; многие признаки и симптомы неспецифичны и могут быть ошибочно приняты за симптомы интеркуррентного заболевания или основного состояния, которое лечится с помощью ГК.Признаки и симптомы AI и надпочечникового криза перечислены в таблице 5. AI часто возникает, когда экзогенные ГК выводятся слишком быстро или, в случае стрессовых состояний (например, хирургическое вмешательство и инфекция), когда могут потребоваться более высокие уровни ГК. В дополнение к AI и надпочечниковому кризису снижение уровня АКТГ, связанное с подавлением оси HPA, приводит к снижению общей продукции стероидных гормонов. Эта ситуация способствует возникновению дополнительных побочных эффектов, таких как гипогонадизм и остеопороз [55, 65, 66, 67, 68].
| Подавление надпочечников |
0003 |
| Надпочечниковый криз |
|
Таблица 5.
Признаки и симптомы надпочечниковой недостаточности и надпочечникового криза (адаптировано из [72]).
5.1. Отмена стероидов или надпочечниковая недостаточность?
Когда ГК уменьшаются и их действие снижается, пациенты могут испытывать вялость, миалгию, тошноту, рвоту и постуральную гипотензию. В этой ситуации увеличение дозы ГК для предотвращения ИА может задержать восстановление функции надпочечников. План лечения должен быть составлен путем оценки соотношения риск / польза. На этом этапе пациентам может просто потребоваться успокоение, симптоматическое лечение или, при необходимости, кратковременное (на 1 неделю) повышение предыдущей минимальной дозы с последующим повторным обследованием.С любым конусом рекомендуется соблюдать максимальную осторожность. К счастью, кора надпочечников восстанавливает способность секретировать достаточное количество кортизола в течение некоторого периода времени. Восстановление секреции эндогенного кортизола ожидается после остановки экзогенных ГК. Но время восстановления у разных пациентов может быть разным. Ингибирование функции оси HPA, индуцированное экзогенными ГК, может сохраняться в течение 6–12 месяцев после отмены лечения. В заключение, все пациенты, использующие ГК, подвержены риску ИИ. Клиницисты должны информировать пациентов о риске, признаках и симптомах ИИ; и рассмотреть возможность тестирования пациентов после прекращения приема высоких доз или длительного лечения ГК [68].
6. Увеличение веса и липодистрофия
ГК оказывают взаимное влияние на метаболизм жировой ткани, способствуя как липолизу, так и липогенезу / адипогенезу, вызывая неравномерность распределения жировой ткани (то есть липодистрофию). Эти эффекты показаны на рисунке 2 (адаптированном из [69]). Около 60–70% пациентов, получавших ГК в течение длительного периода, отмечают прибавку в весе. Это отличается от классического набора веса. Развивается центральная гипертрофия жировой ткани. Характерными признаками являются жировая ткань лица (лунное лицо), ожирение туловища и дорсоцервикальная жировая ткань (буйволиный горб).Напротив, периферическая и подкожная жировая ткань истончается. Эти специфические изменения называются особенностями Кушингоида и связаны с липодистрофией, вызванной ГК. Увеличение веса — наиболее частый побочный эффект, о котором сообщают сами. Около двух третей пациентов проявляют кушингоидные черты в течение первых 2 месяцев терапии ГК. Эти побочные эффекты зависят как от дозы, так и от продолжительности приема ГК. Риск увеличения веса увеличивается при приеме преднизона (или его эквивалента) от 5 до 7,5 мг в день.Риск этих побочных эффектов выше у молодых пациентов, женщин, пациентов с более высоким исходным индексом массы тела, пациентов с более высоким начальным потреблением калорий (> 30 ккал / кг / день) и пациентов с исходным более высоким содержанием лептина и низким уровнем резистина. уровни. Что еще более важно, эти побочные эффекты связаны с высоким кровяным давлением, уровнями глюкозы и триглицеридов в крови и низким уровнем холестерина липопротеинов высокой плотности (факторы риска сердечно-сосудистых заболеваний). Следовательно, лечение ГК увеличивает риск ишемической болезни сердца, сердечной недостаточности и инсульта [70, 71, 72, 73, 74].
7. Сердечно-сосудистые заболевания
ГК оказывают комплексное и часто противоречивое влияние на сердечно-сосудистые заболевания (ССЗ) и сердечно-сосудистый риск. Пациенты, хронически применяющие экзогенные ГК, имеют более высокий риск сердечно-сосудистых заболеваний, таких как ишемическая болезнь сердца, сердечная недостаточность и инсульт. У пациентов с ревматоидным артритом, хронической обструктивной болезнью легких и другими состояниями, которые подвергались хроническому воздействию экзогенных глюкокортикостероидов, исследование случай-контроль обнаружило зависимость доза-ответ между суточной дозой глюкокортикоидов и риском сердечной недостаточности.Также увеличился риск ишемической болезни сердца. Пациенты, принимавшие преднизолон в дозе ≥7,5 мг в день или его эквивалент, имели значительно более высокий смешанный риск инфаркта миокарда, стенокардии, коронарной реваскуляризации, госпитализации по поводу сердечной недостаточности, транзиторной ишемической атаки и инсульта. Воздействие ГК в течение предшествующих 6 месяцев было связано с повышенным риском сердечно-сосудистых заболеваний. Риски были выше при постоянном использовании, чем при периодическом использовании. Связь между риском сердечно-сосудистых заболеваний и ГК осложняется основным воспалительным заболеванием (например,грамм. ревматоидный артрит и системная красная волчанка). Из-за хронического воспаления и лечения более высокими дозами ГК хронические воспалительные состояния могут еще больше увеличить частоту сердечно-сосудистых заболеваний. Этот повышенный риск является кумулятивным и зависит от дозы, в основном наблюдается в течение первого месяца лечения и снижается, когда лечение прерывается. У пациентов с воспалительным артритом установлена повышенная смертность от болезней сердца. Более того, связь между ГК и риском фибрилляции и трепетания предсердий была установлена в нескольких исследованиях.Импульсные ГХ дополнительно связаны с сердечно-сосудистыми заболеваниями. Сообщалось о внезапной смерти, вызванной пульсовой дозой ГК. Но это обычно происходит у пациентов с сердечно-сосудистыми заболеваниями. Таким образом, пациенты с тяжелым заболеванием сердца и почек должны находиться под тщательным наблюдением во время пульс-терапии ГК [75, 76, 77, 78].
Побочные эффекты ГК со стороны сердечно-сосудистой системы можно объяснить двумя механизмами: (1) прямым влиянием на функцию сердца и сосудистой сети и (2) увеличением факторов риска сердечно-сосудистых заболеваний.Известно, что рецептор глюкокортикоидов экспрессируется в сердце. Таким образом, ГК оказывают прямое действие на кардиомиоциты. Взаимодействие ГК со стенкой сосудов нарушено при ССЗ. Некоторые хорошо известные факторы риска сердечно-сосудистых заболеваний, такие как гипертония, инсулинорезистентность, гипергликемия и дислипидемия, чаще наблюдаются у людей, подвергшихся воздействию глюкокортикоидов. Основное влияние ГК на сердечно-сосудистый риск, вероятно, связано с взаимодействием с почками, печенью, жировой тканью и центральной нервной системой.Влияние ГК на гомеостаз предположительно связано с задержкой натрия почками и перегрузкой внутрисосудистым объемом. Есть также доказательства наличия дополнительных непочечных механизмов. Это подтверждает, что ГК могут напрямую взаимодействовать с клетками сердца и сосудистой стенки. Таким образом, сборщики мусора могут изменять свою функцию и структуру. У пациентов с хроническим воспалительным заболеванием были установлены бляшки сонной артерии и растяжимость артерий (независимо от факторов риска сердечно-сосудистых заболеваний и клинических проявлений).У пациентов с системной красной волчанкой прием ГК снижал эффективность правастатина [79, 80, 81, 82, 83].
8. Гипергликемия и диабет
ГК являются наиболее частой причиной лекарственной гипергликемии и диабета. Гипергликемия и диабет, вызванные ГК, определяют как аномальное повышение уровня глюкозы в крови, связанное с использованием ГК у пациента с или без гипергликемии или диабета в анамнезе. ГК вызывают повышенную постпрандиальную гипергликемию и нечувствительность к экзогенному инсулину.Таким образом, ГК оказывают большее влияние на уровень глюкозы после еды, чем глюкоза натощак. Постпрандиальная гипергликемия (de
Влияние глюкокортикоидов на развитие плода и плаценты
1. Введение
Глюкокортикоиды (ГК), стероидные гормоны, вырабатываемые преимущественно надпочечниками, являются ключевыми медиаторами стрессовых реакций. Хотя острые и хронические эффекты Фармакологический избыток глюкокортикоидов хорошо известен (включая индукцию гипергликемии, инсулинорезистентности, гиперлипидемии, гипертонии и дисфории с подавлением иммунных, воспалительных и когнитивных процессов), их роль в биологии реакции на стресс более тонкая, со сбалансированным гомеостатическим эффектом. эффекты для облегчения краткосрочного выживания и восстановления после заражения [1, 2].Кроме того, глюкокортикоиды играют важную роль в нормальном развитии плода и важны для развития и созревания различных тканей плода, включая печень, легкие, кишечник, скелетные мышцы и жировую ткань, при подготовке к внематочной жизни. Глюкокортикоиды, в первую очередь, действуют на поздних сроках беременности, стимулируя выработку сурфактанта легкими. Это действие имеет решающее значение для подготовки плода к внематочной жизни, и именно по этой причине лечение синтетическими глюкокортикоидами так широко используется при недоношенных беременностях, когда незрелость легких угрожает жизнеспособности новорожденных.Хотя эти методы лечения значительно улучшают выживаемость [3], они не лишены побочных эффектов.
Глюкокортикоиды регулируют многие процессы, необходимые для успешной имплантации эмбриона, а также для последующего роста и развития плода и плаценты. Внутриутробно эндометрий, плацента и эмбрион / плод подвергаются воздействию физиологических глюкокортикоидов, поступающих из надпочечников матери или плода. Было показано, что глюкокортикоиды играют несколько ролей в улучшении внутриматочной среды.Например, в матке глюкокортикоиды регулируют синтез простагландинов, которые играют решающую роль во время имплантации, увеличивая проницаемость стромальных сосудов [4] и в начале родов [5]. Периимплантационная секреция хорионического гонадотропина человека (ХГЧ) из человеческих трофобластов может быть стимулирована до 10 раз обработкой в течение 24–72 часов синтетическими глюкокортикоидами, дексаметазоном и триамцинолоном [6, 7]. Глюкокортикоиды обладают несколькими противовоспалительными действиями, необходимыми для имплантации.В цитотрофобластах человека в первом триместре кортизол может подавлять синтез провоспалительного интерлейкина (ИЛ) -1b [8]. Аналогичным образом, в плацентарных цитотрофобластах человека физиологические концентрации кортизола и многочисленных синтетических глюкокортикоидов могут ингибировать секрецию провоспалительных цитокинов, фактора некроза опухоли (TNF) -α, IL-6 и IL-8, не влияя на экспрессию противовоспалительного цитокина IL. -10 [9-11]. Глюкокортикоиды способствуют предотвращению иммунологического отторжения плодного полуаллотрансплантата в матке беременной за счет ингибирования инфильтрации эозинофилов [12].Более того, глюкокортикоиды глубоко и специфично подавляют экспрессию фибронектина и ламинина, двух белков внеклеточного матрикса, которые являются важными медиаторами маточно-плацентарной адгезии [6].
Кроме того, глюкокортикоиды активируют многие биохимические процессы в этих тканях, такие как изменение экспрессии многочисленных рецепторов, ферментов, ионных каналов, транспортеров, факторов роста, белков цитоскелета, связывающих белков, факторов свертывания крови, белков разрывов и плотных контактов и внутриклеточных сигнальных путей. компоненты, участвующие в росте.Взятые вместе, эти вызванные глюкокортикоидами изменения в физиологии клетки в совокупности вызывают функциональные изменения на системном уровне [13].
Во время беременности введение глюкокортикоидов используется в основном при ведении женщин с риском преждевременных родов и при антенатальном лечении плодов с риском врожденной гиперплазии надпочечников. Беременным женщинам, имеющим риск преждевременных родов в течение 7 дней в период между 24 и 34 неделями беременности, рекомендуется провести однократный курс приема кортикостероидов.А женщинам с преждевременным разрывом плодных оболочек до 32 недель беременности следует назначать однократный курс антенатальных кортикоидов для снижения риска респираторного дистресс-синдрома, перинатальной смертности и других заболеваний [14]. Многочисленные доказательства показывают, что повышенное воздействие глюкокортикоидов на плод в середине и на поздних сроках беременности может привести к неблагоприятным исходам, включая задержку внутриутробного развития (ЗВУР) [15-18], послеродовую гипертензию [15, 19], послеродовые сердечно-сосудистые заболевания [20], постнатальная непереносимость глюкозы [20], повышенная постнатальная активность в системе гипоталамо-гипофиз-надпочечники [21-24], влияние на развитие мозга плода [21, 25, 26].
Действие глюкокортикоидов внутри клетки регулируется глюкокортикоидным рецептором (GR) [27]. При связывании гормона активированный GR перемещается из цитоплазмы в ядро в виде димера для связывания со специфическими последовательностями ДНК, называемыми элементами ответа глюкокортикоидов (GRE), и действует как лиганд-зависимый фактор транскрипции [28]. GR-опосредованная активация транскрипции модулируется фосфорилированием [29]. GR в высокой степени экспрессируются в децидуальной оболочке, хорионе, амнионе, стромальных фибробластах, гладкомышечных клетках сосудов и эндотелиальных клетках плаценты человека, с умеренной экспрессией в цитотрофобластах и незначительной экспрессией в синцитиотрофобластах [30–34].Поскольку значение глюкокортикоидов для ранних эмбрионов млекопитающих очевидно, а действие глюкокортикоидов внутри клетки регулируется GR, мы исследовали экспрессию GR в течение эмбриогенеза крыс до 12 дня беременности. Продемонстрированный онтогенетический паттерн экспрессии GR указывает на потенциальные места биологического действия глюкокортикоидов, обеспечивая подтверждающие доказательства его критической важности в ходе эмбриогенеза у крыс [35].
Внутриклеточный фермент 11β-гидроксистероид дегидрогеназа (11β-HSD) катализирует взаимное превращение биоактивных глюкокортикоидов (кортизола и кортикостерона) и их неактивных метаболитов (кортизона и 11-дегидрокортикостерона).Таким образом, он является важным модулятором биодоступности глюкокортикоидов в органах-мишенях как глюкокортикоидов, так и минералокортикоидов [36]. На сегодняшний день идентифицированы, охарактеризованы и клонированы два изофермента 11β-HSD (известные как 11β-HSD1 и 11β-HSD2) [37]. Превращение кортизона в активный кортизол катализируется 11β-HSD1, тогда как метаболизм кортизола в кортизон опосредуется как 11β-HSD1, так и 11β-HSD2 [38]. В плаценте белок 11β-HSD1 специфически экспрессируется в эндотелиальных клетках ворсинок плаценты, амнионе, хорионических и вневорсинчатых трофобластах (EVT).Экспрессия 11β-HSD1 увеличивается на протяжении всей беременности в ответ на прогестерон [39]. По мере дифференциации плаценты происходит повышенная регуляция экспрессии фермента 11β-HSD2, который становится основным изоферментом плаценты [40]. Белок 11β-HSD2 локализован исключительно в синцитиотрофобласте и инвазивных вневорсинчатых трофобластах без экспрессии в хорионе или амнионе [41–43]. Различный паттерн локализаций 11β-HSD1 и -2 может указывать на наличие разных физиологических функций. При нормальной беременности уровни глюкокортикоидов у матери заметно выше, чем в кровотоке плода.Было заявлено, что роль плацентарного 11β-HSD заключается в защите плода от побочных эффектов материнских глюкокортикоидов. 11β-HSD2 лучше подходит для этой роли из-за своего местоположения (место обмена матери и плода) и своих ферментативных свойств (более высокое сродство к кортизолу). Этот фермент действует как «барьер» для предотвращения преждевременного или несоответствующего воздействия на ткани, чувствительные к глюкокортикоидам, во время внутриутробного развития [44]. Было высказано предположение, что снижение экспрессии или активности плацентарного 11β-HSD2, ведущее к увеличению трансплацентарного пассажа активных глюкокортикоидов, снижает рост плода.У мышей с нокаутом 11β-HSD2 (11β-HSD2 — / -) наблюдается пониженная масса тела при рождении и повышенная тревожность во взрослом возрасте [45]. Многочисленные исследования показали, что ингибирование 11β-HSD2 во время беременности приводит к снижению веса при рождении и развитию более поздней гипертонии и непереносимости глюкозы [46–48], а также к программированию повышенной активности оси HPA и поведения, связанного с тревогой [49] . Более того, в плаценте плодов мышей с нокаутом 11β-HSD2 нарушено развитие капилляров в лабиринтной зоне, что сопровождается снижением экспрессии мРНК фактора роста эндотелия сосудов (VEGF) -A и изменением транспорта питательных веществ с помощью переносчика аминокислот системы A (SNAT) [50].Кроме того, сообщалось о корреляции между снижением активности 11β-HSD2 в плаценте человека и ЗВУР [15, 51, 52]. Кроме того, мутации в гене HSD11B2 у людей, хотя и редки, заметно снижают массу тела при рождении [53]. Было обнаружено, что в то время как материнское введение глюкокортикоидов вызывало ЗВУР, введение глюкокортикоидов непосредственно в кровообращение плода не ограничивало рост плода, что позволяет предположить, что ограничивающие рост эффекты глюкокортикоидов опосредуются действием в маточно-плацентарной единице, а не воздействием на ткани плода. [54]
Развитие плаценты является критическим фактором роста плода, и глюкокортикоиды влияют на рост и развитие плода косвенно, влияя на развитие и функцию плаценты.Действие глюкокортикоидов на рост плода частично опосредуется изменениями плаценты. У овец, крыс, мышей и приматов, не являющихся людьми, введение синтетических глюкокортикоидов на поздних сроках беременности снижает массу плаценты. У большинства этих видов глюкокортикоиды действуют на плаценту сильнее, чем на плод [13]. Глюкокортикоиды участвуют в слиянии клеток цитотрофобласта с образованием синцитиотрофобласта и связаны с морфологическими (ускоренное образование апикальных микроворсинок, созревание ядер и увеличение количества клеточных органелл) и функциональными (повышенная секреция ХГЧ и повышенная экспрессия мРНК 11β-HSD2) маркерами дифференцировка синцитиотрофобластов.Эти данные свидетельствуют о том, что глюкокортикоиды стимулируют дифференцировку и созревание синцитиотрофобластов [55-57].
Анализ микроматрицы показал, что введение материнского глюкокортикоида приводит к заметным изменениям профиля экспрессии генов в плаценте. Дексаметазон (Dex) вызывал снижение экспрессии генов, участвующих в делении клеток, таких как циклины A2, B1, D2, CDK 2, CDK 4 и протеинкиназа M-фазы, наряду с генами, способствующими росту, такими как рецептор эпидермального фактора роста, морфогенетический белок 4 и белок 3, связывающий инсулиноподобный фактор роста.Кроме того, лечение Dex привело к подавлению активности генов, участвующих в биосинтезе белка, развитии скелета и метаболизме коллагена. Также была снижена экспрессия генов, участвующих в делении клеток, репликации ДНК, сегрегации хромосом, алкилировании ДНК, биосинтезе нуклеотидов и нуклеозидов, процессах на основе микротрубочек, процессах активации и дифференцировки B-клеток, врожденного иммунного ответа, обработки и презентации антигенов и комплемента. система [58]. Лечение крыс глюкокортикоидами ограничивает развитие сосудов плаценты за счет ингибирования VEGF-A и рецептора γ, активируемого пролифератором пероксисом (PPARγ), который регулируется экспрессией VEGF-A [59, 60].Кроме того, в ответ на лечение глюкокортикоидами матери или плода происходят изменения в плацентарной обработке определенных аминокислот, таких как аланин, глутамин и глутамат. Однако до настоящего времени было проведено немного исследований влияния глюкокортикоидов на переносчики аминокислот в плаценте любого вида [61, 62]. Кроме того, глюкокортикоиды изменяют выработку и метаболизм гормонов плацентой, таких как простагландины, плацентарный лактоген, лептин, кортикотропин-рилизинг-гормон (CRH), эстрогены, прогестерон и другие прогестагены [63, 64].Глюкокортикоиды также изменяют плацентарную активность различных ферментов, участвующих в синтезе и инактивации стероидов и гормонов щитовидной железы, таких как 17,20-лиаза, 17α-гидроксилаза, ароматаза, ренин и эндотелиальная синтаза оксида азота [63].
2. Влияние глюкокортикоидов на клеточный цикл плаценты
Глюкокортикоиды играют фундаментальную роль во время беременности, влияя на децидуализацию, имплантацию, развитие плаценты, развитие мозга плода, созревание легких и роды, но внутриплацентарное воздействие глюкокортикоидов, вводимых матерью, может привести к аномалиям роста плода и плаценты [15, 19, 65].Механизм действия глюкокортикоидов при подавлении роста плаценты не определен.
Развитие плаценты человека устанавливается путем инвазии трофобластов в эндометрий матки и его сосудистую сеть. Полученные в результате изменения будут способствовать увеличению межворсинчатого кровотока и, следовательно, обмену питательными веществами и молекулами между кровью матери и плода. Транспортировка, а также метаболические и эндокринные функции плаценты находятся в основном в плавающих ворсинках, покрытых синцитиотрофобластом, тканью, которая возникает в результате терминальной дифференцировки нижележащих ворсинчатых цитотрофобластов и их последующего слияния.Заякоренные ворсинки устанавливают физическую связь плаценты с децидуальной оболочкой преимущественно за счет субпопуляции цитотрофобластов, известной как EVT. Они накапливаются на концах закрепляющих ворсинок и образуют столбики клеток. Субпопуляции цитотрофобластов как ворсинок, так и вне ворсинок возникают в результате пролиферации и дифференцировки из стволовых клеток, расположенных в слое цитотрофобластов ворсинок хориона [66].
На основе иммуноокрашивания антигена Ki67, регулятора клеточного цикла с еще неизвестной ролью, EVT были отнесены к категории пролиферативного фенотипа, который преимущественно локализован в проксимальной части, и инвазивного фенотипа, который локализован в основном в дистальная часть колонок клеток [66].Текущее понимание предполагает, что EVT может дифференцироваться, приобретая тем самым инвазивный фенотип, который в конечном итоге позволяет им проникать в материнскую децидуальную оболочку и спиральные артерии. Таким образом, развитие плаценты включает пролиферацию и дифференцировку цитотрофобластов способом, который строго регулируется во времени и пространстве.
Цикл эукариотических клеток состоит из четырех фаз: G1, S, G2 и M. G1 и G2 — это подготовительные фазы для синтеза ДНК (S) и митоза (M) соответственно.Во время фаз G1 и G2 происходит рост клеток, удвоение количества белка и органелл и подготовка к следующей фазе. Если условия не подходят, клетки в фазе G1 останавливают развитие клеточного цикла и переходят в состояние покоя, известное как фаза G0, где они продолжают биологические функции, но не проходят остаток клеточного цикла. Когда получены сигналы роста, клетки в фазе G0 могут продолжить цикл через фазу G1 [67, 68].
Цикл эукариотических клеток регулируется скоординированной активностью семейства циклин-зависимых киназ (CDK).Они положительно и отрицательно регулируются семействами ингибиторов циклинов и CDK [69, 70]. В зависимости от времени их появления в клеточном цикле циклины можно разделить на две группы: митотические циклины A и B и циклины G1 семейств D и E [71]. Циклин A способствует переходам как G1 / S, так и G2 / M, тогда как циклин B1 накапливается в цитозоле во время поздней фазы S и G2 и проникает в ядро в начале митоза [72].
В клетках млекопитающих существует по крайней мере два различных семейства ингибиторов CDK: INK4 и ингибиторы Cip / Kip (p21, p27, p57).Оба семейства играют регуляторные роли во время контрольной точки клеточного цикла G1 / S [73]. Из-за более широкого набора CDK, с которыми они взаимодействуют [74], ингибиторы семейства Cip / Kip контролируют также и другие контрольные точки. p21 играет роль во время фазового перехода G2 / M [75], а также может опосредовать S-фазу [76] и задержку G2 [77]. В целом это коррелирует с остановкой клеточного цикла перед терминальной дифференцировкой [78]. Кроме того, p27 обладает способностью задерживать клетки в G2 [77]. p57 ингибирует cyclin A- и E-ассоциированные CDK и, следовательно, регулирует G1 / S переход и завершение S фазы [79] и в первую очередь экспрессируется в терминально дифференцированных клетках [80].
Несмотря на важность понимания механизмов, контролирующих пролиферацию, мало известно о том, как пролиферация цитотрофобластов координируется с дифференцировкой и какие факторы определяют, делятся ли клетки цитотрофобластов или дифференцируются и синцитиализуются. Несколько исследований локализовали регуляторы клеточного цикла, которые специфически экспрессируются во время ключевых переходов и фаз [81-83].
Гипотеза о том, что скоординированная экспрессия факторов прогрессии клеточного цикла и ингибирования будет определять, будут ли цитотрофобласты пролиферировать или подвергаться остановке клеточного цикла или выходу из клеточного цикла, позволяющему последующую дифференцировку, была проверена нашей командой.Промоторы клеточного цикла циклин A, циклин B1, ядерный антиген пролиферирующих клеток (PCNA), Ki67 и ингибиторы клеточного цикла p21, p27 и p57 были иммунолокализованы в срезах тканей беременностей в первом триместре (6 и 9-12 недели). Цитотрофобласты ворсинок были помечены иммуномечением на Ki67 и циклин A, но лишь немногие из них были окрашены антициклином B1. Синцитиотрофобласт был лишен иммунореактивности по отношению к любому из факторов прогрессирования клеточного цикла. Он особенно экспрессировал p21, тогда как p27 и p57 преимущественно обнаруживались в ворсинчатых цитотрофобластах.PCNA, Ki67, циклин A и циклин B1 были иммунолокализованы в проксимальных и дистальных EVT закрепляющих ворсинок и в EVT, которые проникли в верхние децидуальные сегменты. Все EVT сильно экспрессируют p27 и p57, но не p21. Эти данные ясно указывают на разные функции p21, p27 и p57 в развитии плаценты с разными ролями p21 и p57 в дифференцировке синцитиотрофобластов и EVT, соответственно. p27, по-видимому, участвует в обоих процессах. Результаты могут также поставить под сомнение концепцию дифференциальной митотической активности в проксимальной и дистальной частях колонки клеток цитотрофобласта первого триместра, но явно необходимы дополнительные функциональные исследования.Присутствие p27 и p57 в клетках EVT, которые глубоко проникают в децидуальные оболочки, может объяснять потерю митогенного потенциала этих клеток [84].
Хотя архитектура плаценты человека и грызунов различается, их анатомические структуры и молекулярные механизмы сравнивались [85, 86] и проводились аналогии между различными типами клеток; кроме того, считается, что молекулярные механизмы развития плаценты у этих двух видов очень похожи. Таким образом, плацента грызунов все чаще используется в качестве модели для изучения механизмов, лежащих в основе развития плаценты [85, 87].
Рисунок 1.
Схематическое изображение белков, связанных с клеточным циклом, в плаценте крыс в нашем исследовании [88].
Нас использовали для локализации циклинов G1 (D1, D3, E), которые являются основными детерминантами пролиферации, ингибиторов Cip / Kip, р53 в качестве главного регулятора и ядерного антигена пролиферирующих клеток во всех типах клеток плаценты крыс. Схематическое изображение изученных белков, связанных с клеточным циклом, показано на фиг. 1. Подсчитывали долю иммуномеченных клеток каждого типа.Циклин D1 и циклин D3 присутствовали в основном в клетках фетальной части плаценты, тогда как G1 / S циклин E присутствовал только в популяциях спонгио- и лабиринтных трофобластов. Среди ингибиторов Cip / Kip p21 присутствовал только в клетках фетального аспекта, тогда как p27 и p57 были обнаружены во всех изученных типах клеток. p53 был обнаружен только в небольшой доле клеток без совместной локализации p53 и p21 [88]. Схематическое изображение наших результатов иммуногистохимии в плаценте крысы показано на рисунке 2.Данные предполагают, что клетки фетальной стороны плаценты крысы все еще обладают некоторым потенциалом пролиферации, который контролируется экспрессией ингибиторов клеточного цикла Cip / Kip, тогда как клетки материнского аспекта потеряли этот потенциал. Апоптоз является лишь маргинальным в случае плаценты крысы. В заключение, пролиферация и апоптоз плацентарных клеток крыс, по-видимому, контролируются в основном ингибиторами Cip / Kip на поздних сроках беременности. До сих пор не известно, как на механизмы координации пролиферации и дифференцировки влияют индуцированные глюкокортикоидами IUGR в плаценте.
Рисунок 2.
Схематическое изображение наших результатов иммуногистохимии в плаценте крысы.
Мы стремились изучить влияние вводимого матерью синтетического глюкокортикоида Dex на пролиферацию клеток, остановку клеточного цикла или апоптоз развития плаценты. Мы исследовали пространственную и временную иммунолокализацию PCNA, Ki67, p27 и p57 при нормальном и Dex-индуцированном развитии плаценты IUGR у беременных крыс. Интенсивность иммуномечения PCNA в плаценте контрольной группы была статистически значимо выше, чем в плаценте группы Dex-индуцированной IUGR во все дни в соединительной и лабиринтной зонах (JZ и LZ соответственно).Мы наблюдали снижение интенсивности окрашивания Ki67 в лабиринтных трофобластах Dex-индуцированных плацент IUGR по сравнению с контролем на 21-й день. Интенсивность иммуномечения Ki67 была выше в контрольной группе, чем в плаценте группы IUGR во все дни в обеих зонах, за исключением 21-го дня. соединительная зона. Эти различия были статистически значимыми на 15, 17 и 19 сутки в зоне сочленения и на 13, 15, 17 и 21 сутки в зоне лабиринта. Интенсивность окрашивания Ki67 постепенно снижалась после 15-го дня как в контрольной зоне, так и в плаценте ЗВУР.Интенсивность иммуноокрашивания Ki67 была выше в зоне лабиринта по сравнению с зоной соединения в обеих группах. Более того, после 17-го дня практически не было получено иммуноокрашивание Ki67 в плаценте IUGR в зоне соединения. Мы обнаружили более высокую интенсивность иммуномечения p27 в Dex-индуцированных IUGR плацентах по сравнению с контрольными плацентами как в соединительной, так и в лабиринтной зонах для всех дней гестации (Таблица 1) [89]. В соответствии с этим, в другом исследовании было обнаружено, что в Dex-индуцированных клетках хориокарциномы человека JEG-3 мРНК p27 были активированы [90].Мы наблюдали, что интенсивность иммуноокрашивания p57 в Dex-индуцированных IUGR плацентах была выше по сравнению с контролем в обеих зонах для всех дней гестации. Мы обнаружили, что индукция Dex приводит к активации p57 в плацентарном развитии крыс [89]. В отличие от наших результатов, p57 не экспрессируется в Dex-индуцированных клетках JEG-3 [90]. В другом исследовании мы хотели определить Ser / Thr протеинкиназу Akt и MAPK (Mitogen-Activated Protein Kinase) ERK1 / 2, связанные с механизмами пролиферации и апоптоза, на которые влияют Dex-индуцированные IUGR плаценты.Таким образом, мы исследовали уровни экспрессии и пространственно-временную иммунолокализацию белков Akt, p-Akt, ERK1 / 2 и p-ERK1 / 2 при нормальном плацентарном развитии крыс и при лечении Dex. Мы обнаружили, что лечение Dex у матери приводило к снижению активации ERK1 / 2 и Akt во время развития плаценты у крыс вместе с потерей веса плаценты и плода. Активация Akt была значительной в зонах соединения плаценты крысы, особенно в клетках спонгиотрофобластов и гигантских клетках, и снижалась после лечения дексаметазоном.С другой стороны, активация ERK1 / 2 наблюдалась как в зоне соединения, так и в зоне лабиринта плаценты крысы и была слабее в зонах лабиринта плаценты группы IUGR. Снижение активации ERK1 / 2 и Akt может приводить к ингибированию выживания клеток или стимуляции апоптоза. Следовательно, Dex-индуцированные аномалии развития плаценты и эмбриона могут быть связаны со снижением активации Akt и ERK1 / 2 [91]. В другом исследовании наблюдалось снижение уровня фосфорилирования Akt в плаценте после внутриутробного воздействия Dex [92].
Использование Antenatal Dex связано с уменьшением веса плода и плаценты с морфологическими изменениями плаценты. Плаценты мышей, обработанных Dex, показали набухшие клетки трофобласта как в зоне соединения, так и в зоне лабиринта, а также повышенный апоптоз клеток трофобласта в зоне соединения. Более того, обработанные Dex плаценты были отечными, рыхлыми и бледными [58]. Увеличение антенатального воздействия кортикостероидов было связано с фиброзом ворсинок, минерализацией стромы и менее частым инфарктом ворсинок [93].Кроме того, лечение Dex предотвращало нормальное повышение экспрессии VEGF и связанное с этим увеличение лабиринтной васкуляризации в течение последней трети беременности. Следовательно, Dex, по-видимому, снижает рост зоны лабиринта, предотвращая нормальное развитие сосудистой сети плода в зоне лабиринта [59]. Более того, анализ микроматрицы показал, что Dex вызывает снижение экспрессии генов, участвующих в делении клеток, таких как циклины A2, B1, D2, CDK 2, CDK 4 и протеинкиназа M-фазы, наряду с генами, способствующими росту, такими как рецептор эпидермального фактора роста. , костный морфогенетический белок 4 и белок 3, связывающий инсулиноподобный фактор роста [58].Кроме того, анализ включения 3H-тимидина показал, что пролиферация клеточных линий трофобластов JEG-3 и HTR-8 / SV neo и первичных трофобластов человека в первом триместре беременности ингибируется глюкокортикоидами в зависимости от времени и дозы [94]. Нарушение роста плаценты, обработанной Dex, также характеризовалось пониженной экспрессией как пролактин-подобного протеина-B, так и инсулиноподобного фактора роста (IGF) -II, особенно в зоне соединения плаценты крысы [92]. Обработка Dex увеличивала апоптоз клеток трофобласта плаценты мышей и крыс.Dex-индуцированный апоптоз трофобластов опосредован активацией каспаз 1 и 3 [58, 95]. Апоптоз также индуцировался в первичных культурах децидуальных клеток человека в третьем триместре беременности при лечении кортизолом, кортизоном или дексаметазоном [34]. Аналогичным образом, было показано, что Dex индуцирует апоптоз и некроз в первичных культурах терминального плацентарного трофобласта человека, в модели синцитиализации in vitro и в клеточной линии SGH-PL4, полученной из вневорсинчатых трофобластов человека, путем измерения цитокинов TNF-альфа и IFN- гамма с использованием метода TUNEL, связывания аннексина V, флуоресцентной микроскопии и измерений АТФ / АДФ [96].В другом исследовании с использованием модели эксплантата плаценты человека in vitro было показано, что лечение Dex связано с морфологией (ускоренное образование апикальных микроворсинок, созревание ядер,
| Гестационные дни | Зона соединения | Зона лабиринта | Белок клеточного цикла | |
| 13 | ↓ | ↓ | PCNA | |
| ↓ 15 | ↓ | ↓ | ↓ | ↓ |
| 19 | ↓ | ↓ | ||
| 21 | ↓ | ↓ | ||
| ↓ 13 | — | ↓ | ↓ | |
| 17 | ↓ | ↓ | ||
| 19 90 105 | ↓ | — | ||
| 21 | — | ↓ | ||
| 13 | ↑ |
Glucocorticoids 9 Предупреждения и предупреждения3 лекарства имитируют то, как ваше тело контролирует воспаление.
Глюкокортикоиды — это стероиды, которые либо вырабатываются в организме естественным путем, либо создаются синтетическим путем в виде лекарств.
Как естественные, так и синтетические глюкокортикоиды выполняют две основные функции:
Глюкокортикоиды, отпускаемые по рецепту, используются для лечения воспалений, вызванных широким спектром заболеваний, включая астму, воспалительное заболевание кишечника (ВЗК), ревматоидный артрит, аутоиммунные заболевания, такие как волчанка и т. рак.
Примеры глюкокортикоидных препаратов:
Предупреждения и меры предосторожности
Избегайте приема глюкокортикоидов, если вы:
- У вас аллергия на глюкокортикоиды
- Принимаете лекарства от грибковой инфекции
- У вас есть инфекция малярии
в головном мозге
вы принимали глюкокортикоиды в течение двух или более недель, не прекращайте прием препарата внезапно, если только ваш врач не скажет вам иное.
Прекращение приема препарата «холодная индейка» может отправить ваш организм в критический режим.
Спросите своего врача о глюкокортикоидах, если вы:
- Имеете ослабленную иммунную систему или находитесь в группе повышенного риска инфекции
- У вас активная инфекция, включая корь или ветряную оспу
- У вас высокое кровяное давление, застойная сердечная недостаточность или диабет
- Недавно перенес сердечный приступ
- У вас есть заболевание, влияющее на ваш пищеварительный тракт, например, воспалительное заболевание кишечника, язвенная болезнь или отверстия в кишечнике
- Приступы
- Есть расстройство настроения
- Есть состояние, связанное с нарушением гормонального баланса , например, заболевание щитовидной железы или остеопороз
Общие побочные эффекты
Поскольку глюкокортикоиды так или иначе влияют на многие клетки, ткани и органы, прием этих препаратов может иметь множество побочных эффектов, в том числе:
- Повышение артериального давления , уровень триглицеридов, холестерина или глюкозы
- Задержка воды, включая отеки в стопах, лодыжках ноги или руки
- Повышенный аппетит и прибавка в весе
- Нежелательный рост волос
- Головная боль, головокружение и головокружение
- Перепады настроения
- Остеопороз, переломы костей
- Молочница (грибок) во рту
- Тонкая кожа
- Катаракта
- Глаукома
- Угри
- Легкое заболевание или раны, которые заживают медленнее, чем обычно (при длительном приеме наркотиков)
Взаимодействие с другими лекарствами
Не принимайте глюкокортикоиды, если вы:
Также Узнайте у врача о глюкокортикоидах, если вы в настоящее время принимаете какие-либо лекарства от:
- Высокое кровяное давление
- Застойная сердечная недостаточность
- Отек
- Диабет
- Трансплантация органов
- Вирусная инфекция
- Ревматоидный артрит
7 Глюкокортикоид 9035 | BrainImmune: тенденции в нейроэндокринной иммунологии
Отправлено: 21 августа 2010 г.
Томосигэ Кино
Гормоны и иммунитетОбзорная статья
Глюкокортикоиды, стероидные гормоны, секретируемые корой надпочечников, играют важную роль в поддержании внутреннего гомеостаза, воздействуя практически на все органы и ткани.Эти разнообразные действия глюкокортикоидов опосредуются рецептором глюкокортикоидов (GR), который принадлежит к суперсемейству ядерных рецепторов и функционирует как гормонозависимый фактор транскрипции. Белок GR человека продуцируется из 9 экзонов гена GR и состоит из 3 основных субдоменов, каждый из которых имеет определенные структурные и функциональные свойства. Поскольку глюкокортикоиды необходимы для жизни, другие клеточные сигнальные пути сильно регулируют действия GR многими различными способами, такими как физическое взаимодействие через их эффекторные факторы транскрипции и эпигенетические модификации, включая фосфорилирование и ацетилирование.Кроме того, ген GR экспрессирует вариант сплайсинга GRbeta, который не связывает глюкокортикоиды, но функционирует как доминантно-отрицательная изоформа для GRalpha. В этой главе обсуждается недавний прогресс в области исследования действий GR.
Введение
Глюкокортикоиды — это стероидные гормоны, секретируемые фасцикулярной зоной коры надпочечников, и играют важную роль в поддержании внутреннего гомеостаза, влияя на деятельность практически всех органов и тканей, таких как мозг, печень и т. Д. скелетные мышцы и связанные с иммунной системой органы и клетки [1].В дополнение к их влиянию на базальное состояние, эти гормоны важны для правильной реакции на стресс, изменения окружающей среды, происходящие внутри и снаружи [2]. Таким образом, организмы не могут выжить без действия глюкокортикоидов, как это наблюдалось на модели мышей, в которой ген глюкокортикоидного рецептора (GR) генетически удален [3]. В фармакологических дозах или дозах, связанных со стрессом, глюкокортикоиды действуют как сильнодействующие иммунодепрессанты и, как следствие, широко используются при лечении многих воспалительных, аутоиммунных и пролиферативных заболеваний [4].Поскольку глюкокортикоиды незаменимы для жизни и необходимы в ответ на стресс, сложная, но организованная система обратной связи, называемая осью гипоталамо-гипофизарно-надпочечников (HPA), регулирует выработку глюкокортикоидов в коре надпочечников для своевременного удовлетворения потребности в глюкокортикоидных действиях в организме человека. их ткани-мишени [2]. Эта регуляторная система состоит из трех компонентов: паравентрикулярного ядра гипоталамуса (ПВЯ), передней доли гипофиза и коры надпочечников.Эти компоненты соответственно секретируют кортикотропин-рилизинг-гормон, адренокортикотропный гормон и глюкокортикоиды, которые регулируют нижележащие компоненты, а также подавляют верхние центры, в конечном итоге создавая замкнутую регуляторную петлю [2]. Ось HPA в отсутствие стресса находится под сильным влиянием супрахиазматического ядра верхнего регуляторного центра (SCN) гипоталамуса, которое функционирует как ядро для организации циркадной активности организма [2, 5]. Таким образом, уровни циркулирующего кортизола у людей создают типичные колебательные колебания, которые завершаются в 24-часовом цикле, причем зенит приходится на раннее утро, а надир — в полночь [2, 5].
Глюкокортикоиды влияют на множество биологических процессов и оказывают глубокое влияние на многие физиологические функции, влияя на содержание мРНК до ~ 20% генома человека [6, 7]. Глюкокортикоиды делают это путем связывания со своей молекулой внутриклеточного рецептора, рецептором глюкокортикоидов (GR), который функционирует как активируемый гормонами фактор транскрипции для положительного и отрицательного изменения экспрессии генов, отвечающих за глюкокортикоиды [8, 9]. GR повсеместно экспрессируется почти во всех тканях и органах человека [9].Человеческий (h) GR, одна полипептидная цепь из 777 аминокислотных остатков, принадлежит к суперсемейству стероидных / стероловых / тироидных / ретиноидных / орфанных рецепторов, которое состоит из более чем 130 членов, которые в настоящее время клонированы и охарактеризованы для разных видов [10]. В этой главе будет описана структура и действия GR с упором на недавний прогресс в этой области.
Глюкокортикоидные рецепторы
Биологические действия циркулирующих глюкокортикоидов, таких как кортизол у людей и кортикостерон у грызунов, трансдуцируются в клетки повсеместно экспрессируемым внутриклеточным рецептором, GR [1].КДНК GR была выделена путем экспрессионного клонирования в 1985 г. [11]. GR, также известный как суперсемейство ядерных рецепторов 3, группа C, член 1 (NR3C1), принадлежит к суперсемейству ядерных рецепторов, которые функциональны и сохраняются от ранних многоклеточных животных до человека [8, 9]. GR образует подсемейство рецепторов стероидных гормонов вместе с рецепторами минералокортикоидов (MR), прогестерона (PR), эстрогенов (ER) и андрогенов (AR) [12]. Считается, что GR и его филогенетически ближайший рецептор MR произошли примерно 450 миллионов лет назад от предкового рецептора кортикостероидов (CR), который произошел от предкового рецептора эстрогена после двух событий дублирования генома, которые произошли на ранних этапах эволюции хордовых [13-15] .
Ген GR человека, расположенный в коротком плече хромосомы 5 (5q31.3), состоит из 9 экзонов, и его экспрессия регулируется по крайней мере тремя различными промоторами A, B и C, при этом промотор A используется альтернативно с тремя уникальные фрагменты промотора 1A1, 1A2 и 1A3 [16]. Таким образом, ген GR может продуцировать пять разных транскриптов из разных промоторов, которые кодируют одни и те же белки GR. В дополнение к альтернативным транскриптам, использующим различные 5 ’промоторы, ген GR генерирует два варианта транскрипта 3’ сплайсинга с альтернативным использованием экзона 9альфа и 9бета (рис. 1).Таким образом, ген GR генерирует 10 различных транскриптов, которые кодируют две белковые молекулы, GRalpha и GRbeta. Недавно стало очевидно, что мРНК варианта GRalpha транслируется по крайней мере из 8 сайтов инициации во множество изоформ GRalpha, обозначенных от A до D (A, B, C1-C3 и D1-D3), продуцируя различные аминоконцевые изоформы с различными транскрипционными активностями на гены, реагирующие на глюкокортикоиды [17] (рис. 1). Эти молекулы GR также по-разному экспрессируются в нескольких различных клеточных линиях и тканях [17].Учитывая, что GRalpha и GRbeta имеют общий домен мРНК, который содержит одни и те же сайты инициации трансляции [11], похоже, что мРНК варианта GRbeta также транслируется через одни и те же сайты инициации в подобный хозяин из 8 бета-изоформ [9] (Рисунок 1 ).
Рис. 1. Геномные и комплементарные структуры ДНК и белков изоформ человеческого GR. Ген человека GR состоит из 9 экзонов. Экзон 1 представляет собой нетранслируемую область, экзон 2 кодирует NTD, экзоны 3 и 4 — DBD, а экзоны 5–9 — шарнирную область (HR) и LBD.Ген GR содержит два концевых экзона 9 (9a и 9b), попеременно сплайсированных для получения классического GRa (GRalpha-A) и не связывающегося с лигандом GRb-A, который оказывает доминирующее негативное влияние на GRalpha (GRa-A). С-концевые серые домены в GRalpha-A и GRb-A показывают свои специфические части. N-концевые трансляционные изоформы GRalpha, экспрессируемые из одного транскрипта GRa, показаны в середине рисунка. Транскрипт GRb может также продуцировать аналогичные N-концевые изоформы из одних и тех же стартовых сайтов.(Изменено из ссылки 9). Сокращения: AF-1: функция активации-1; DBD: ДНК-связывающий домен; HD: шарнирная область; GR: рецептор глюкокортикоидов; LBD: лиганд-связывающий домен; NTD: N-концевой домен.
Классический рецептор GRa и его молекулярная структура
GRalpha, классический рецептор глюкокортикоидов, экспрессируется повсеместно и опосредует большинство известных действий глюкокортикоидов [1, 9]. Человеческий GRalpha состоит из 777 аминокислот и имеет 3 основных различных функциональных домена: N-концевой или иммуногенный домен (NTD), ДНК-связывающий домен (DBD) и лиганд-связывающий домен (LBD) [18] (Рисунок 2 ).
Рисунок 2. Функциональное распределение человеческого GRa в его линеаризованной молекуле. GRalpha человека состоит из 3 субдоменов, NTD, DBD и LBD, каждый из которых содержит несколько функциональных молекулярных структур, таких как сигналы ядерной локализации и домены трансактивации. GRalpha человека также содержит несколько аминокислотных остатков для фосфорилирования (серины) или ацетилирования (лизины), как указано. Сокращения: AF-1 и -2: функции активации-1 и -2; DBD: ДНК-связывающий домен; GR: рецептор глюкокортикоидов; HR: шарнирная область; HSP: белки теплового шока; LBD: лиганд-связывающий домен; NL-1 и -2: сигналы ядерной локализации 1 и 2; NTD: N-концевой домен.
Между DBD и LBD есть небольшая часть, называемая «шарнирной областью», которая влияет на специфичность рецептора к связыванию с его родственными последовательностями ДНК, элементами ответа глюкокортикоидов (GRE) [19]. LBD GRalpha, соответствующая аминокислотам 520-777, состоит из 12 альфа-спиралей и 4 бета-листов, среди которых спирали 3, 4, 11 и 12 образуют лиганд-связывающий карман для связывания с глюкокортикоидами [20-22] . DBD GRalpha соответствует аминокислотам 420–480 и содержит два мотива «цинковые пальцы», посредством которых GRalpha связывается с GRE [23, 24].DBD имеет два подобных модуля с цинковыми пальцами, каждый из которых образован координационным центром иона Zn, удерживаемым четырьмя остатками цистеина, за которым следует альфа-спираль [25]. Первая альфа-спираль N-конца расположена в большой бороздке двухцепочечной ДНК, в то время как C-концевая часть каждого модуля расположена над малой бороздкой [25]. В отличие от LBD и DBD, структура NTD еще недостаточно изучена [26].
Нуклеоцитоплазматический челночный транспорт GRalpha
GRalpha располагается в основном в цитоплазме в отсутствие глюкокортикоидного лиганда, как часть гетероолигомерных комплексов, содержащих белки теплового шока (HSP) 90, 70, 50, 20 и, возможно, другие белки также [9, 18] (рис. 3).После связывания со своим лигандом-агонистом GRalpha претерпевает конформационные изменения, диссоциирует от белков теплового шока (HSP), гомодимеризуется и перемещается в ядро через ядерную пору посредством активного АТФ-зависимого процесса, опосредованного сигналами его ядерной локализации ( NL) -1 и -2 [8, 27]. NL-1 расположен на стыке DBD и шарнирной области, тогда как NL-2 охватывает всю LBD [27] (Рисунок 2). Функция NL-1 опосредуется классическим importin альфа / бета-ядерным поровым комплексом, тогда как функция NL-2 до конца не выяснена [27].В отсутствие лиганда связывание HSP с LBD маскирует / инактивирует NL-1 и NL-2, тем самым поддерживая GRalpha в цитоплазме. Было постулировано несколько механизмов регуляции ядерного экспорта GRalpha [27]. CRM1 / экспортин и классический ядерный экспортный сигнал (NES) -опосредованный механизм ядерного экспорта не функционирует в GRalpha, что основано на доказательствах того, что GRalpha нечувствительна к лептомицину B, ингибитору этой экспортной системы, и не содержит классический NES ( s) [27-29].Скорее, Са2 +-связывающий белок кальретикулин играет роль в ядерном экспорте GRalpha, напрямую связываясь с DBD этого рецептора [29-31].
Регуляция транскрипционной активности GRalpha
Внутри ядра активированный лигандом GRalpha напрямую взаимодействует как димер с GRE, расположенными в промоторной области генов-мишеней [9] (Рисунок 3).
Рисунок 3. Циркуляция GRa между цитоплазмой и ядром и его трансактивирующая или трансрепрессивная активность.После связывания с лигандом GRalpha диссоциирует от HSP и перемещается в ядро, где он регулирует транскрипционную активность генов, реагирующих на глюкокортикоиды, положительно и отрицательно, либо путем связывания с GRE, расположенных в промоторной области генов-мишеней, либо путем физического взаимодействия с другими факторами транскрипции. . После завершения изменения транскрипционной активности генов, чувствительных к глюкокортикоидам, рецептор экспортируется в цитоплазму и включается в комплекс с HSP.Сокращения: GR: рецептор глюкокортикоидов; GRE: элемент, реагирующий на глюкокортикоиды; HSP: белки теплового шока; TF: фактор транскрипции; TFRE: элементы, реагирующие на фактор транскрипции.
Оптимальный сайт узнавания GREs — это инвертированный гексамерный палиндром, разделенный 3 парами оснований, PuGNACANNNTGTNCPy, причем каждая молекула GRalpha связывается с одним из палиндромов [32]. Взаимодействие GRalpha с GREs является динамическим, при этом GRalpha связывается с GREs и диссоциирует от них в течение секунд [33].GRalpha содержит два домена трансактивации, функцию активации (AF) -1 и -2, расположенных в ее NTD и LBD, соответственно. Через эти домены связанный с промотором GRalpha взаимодействует со многими белками и белковыми комплексами, такими как коактиватор гистонацетилтрансферазы ядерного рецептора [p160, p300 / CREB-связывающий белок (CBP) и p300 / CBP-связанный фактор (p / CAF)]. и SWI / SNF и взаимодействующий с рецептором витамина D белок / ассоциированный с рецептором гормона щитовидной железы белок (DRIP / TRAP), ремоделирующий хроматин комплексы [34].Привлекая эти комплексы кофакторов, GRalpha изменяет структуру хроматина, влияет на активность РНК-полимеразы II и ее вспомогательных факторов и, в конечном итоге, изменяет скорость транскрипции генов, чувствительных к глюкокортикоидам [9, 18, 34] (Рис. 2 и 3). GRalpha также взаимодействует с корепрессором ядерного рецептора (NCoR) и его гомологом, медиатором подавления ретиноевой кислоты и рецептором тироидного гормона (SMRT), которые являются макромолекулярными стыковочными платформами для ядерных рецепторов и многих факторов транскрипции, и подавляют транскрипционную активность GRalpha посредством привлечение комплексов HDAC / Sin3 [34].Коактиваторы типа p160 и корепрессоры типа NCoR / SMRT устанавливают равновесие в своем взаимодействии с GRalpha, чтобы соответственно способствовать или блокировать его транскрипционную активность [35]. Накопление коактиваторов и корепрессоров на связанном с промотором GRalpha зависит от типа лигандов, связанных с GRalpha: глюкокортикоиды-агонисты привлекают коактиваторные комплексы к связанной с промотором GRalpha, в то время как антагонисты, такие как RU 486, накапливают корепрессорные комплексы [36]. .
В дополнение к трансактивации генов, чувствительных к глюкокортикоидам, описанной выше, GRalpha модулирует другие каскады передачи сигналов посредством взаимного белок-белкового взаимодействия со специфическими факторами транскрипции, влияя на их способность стимулировать или ингибировать скорость транскрипции соответствующих генов-мишеней (рис. 3).Эта активность может быть более важной, чем GRE-опосредованная, при условии, что мыши, несущие мутантный GRalpha, который активен с точки зрения белок-белковых взаимодействий, но неактивен с точки зрения трансактивации через ДНК GRE, выживают и размножаются. Напротив, мыши с делецией всего гена GR умирают сразу после рождения от тяжелого респираторного дистресс-синдрома [37, 38].
Белковые взаимодействия GRalpha с другими факторами транскрипции могут иметь место на промоторах, не содержащих GRE, а также на промоторах, которые имеют как GRE (ы), так и реагирующий элемент (ы) факторов транскрипции, которые взаимодействуют с GRalpha [ 39].Подавление трансактивации других факторов транскрипции посредством белок-белковых взаимодействий может быть особенно важным для подавления иммунной функции и воспаления глюкокортикоидами [37, 40]. Существенная часть эффектов глюкокортикоидов на иммунную систему может быть объяснена взаимодействием между GRalpha с ядерным фактором-каппаB (NF-kappaB), протеином-активатором-1 (AP-1) и, возможно, преобразователями сигналов и активаторами транскрипции. (СТАТИСТИКИ) [41-44]. В дополнение к этим факторам транскрипции, GRalpha физически взаимодействует со многими другими факторами транскрипции, включая белок, связывающий элемент ответа цАМФ (CREB), трансформирующий фактор роста (TGF) бета-нисходящий Smad6, белки, связывающие CAAT / энхансер (C / EBP). , промотор куриного овальбумина перед фактором транскрипции II (COUP-TFII), ядерный фактор гепатоцитов (HNF) -6, Nur77, p53, GATA-1, Oct-1 и -2, ядерный фактор-1 и Sp-1.Посредством этих факторов транскрипции GRalpha развивает специфические биологические эффекты, например, влияющие на промежуточный метаболизм, дифференцировку адипоцитов и регуляцию экспрессии CRH в гипоталамусе [1, 45-50]. Важно отметить, что эти взаимодействующие с GRalpha транскрипционные факторы также влияют на транскрипционную активность GRalpha на гены, реагирующие на глюкокортикоиды, указывая на то, что эффект их белок-белкового взаимодействия является взаимным.
Эпигенетическая модуляция транскрипционной активности GRalpha
Фосфорилирование
Помимо ко-регуляторов и других факторов транскрипции, которые модулируют индуцированную GRalpha транскрипционную активность, несколько различных сигнальных путей регулируют транскрипционную активность GRalpha через посттрансляционную модификации рецепторного белка [9].К ним относятся метилирование, ацетилирование, нитрозилирование, сумоилирование, убиквитинирование и фосфорилирование, последнее из которых изучено больше всего. Например, дрожжевая циклин-зависимая киназа p34CDC28 фосфорилирует крысиную GRalpha по серинам 224 и 232, которые ортологичны серинам 203 и 211 человеческой GRalpha, с результирующим фосфорилированием, повышающим транскрипционную активность крысиной GRalpha в дрожжах [51]. Эти остатки также фосфорилируются после связывания GRalpha с агонистами или антагонистами, и фосфорилированный рецептор показывает уменьшенную транслокацию в ядро и / или измененную субклеточную локализацию в клетках млекопитающих [52, 53].Митоген-активированная протеинкиназа p38 (MAPK) фосфорилирует серин 211 человеческого GRalpha, усиливает его транскрипционную активность и опосредует GR-зависимый апоптоз [54]. p38 MAPK и N-терминальная киназа c-Jun (JNK) также фосфорилируют серин 226 человеческого GRalpha и подавляют его транскрипционную активность за счет усиления ядерного экспорта рецептора [28]. Недавно мы обнаружили, что аденозин-5′-монофосфат-активируемая протеинкиназа (AMPK), центральный регулятор энергетического гомеостаза, который играет важную роль в модуляции аппетита и расходе энергии, косвенно фосфорилирует человеческий GRalpha по серину 211 и усиливает его транскрипционную активность за счет фосфорилирования / активация p38 MAPK [55].Специфическая для центральной нервной системы (ЦНС) циклин-зависимая киназа 5 (CDK5) также фосфорилирует человеческий GRalpha по нескольким серинам, включая серины 203 и 211, и модулирует индуцированную GR транскрипционную активность, физически взаимодействуя с рецептором через его компонент-активатор p35. и изменяя накопление транскрипционных кофакторов на GRE-связанном GRalpha [56]. Действительно, большинство фосфорилированных сайтов расположены в домене AF-1 NTD (рис. 2), таким образом, фосфорилирование некоторых или всех из них модулирует индуцированную GRalpha транскрипционную активность, главным образом за счет изменения притяжения ко-регулятора к промоторной области гены, реагирующие на глюкокортикоиды, возможно, за счет изменения их аффинности к AF-1 домену GR [56].CDK5 и p35 экспрессируются в основном в нейрональных клетках и играют важную роль в развитии мозга эмбриона. Аберрантная активация CDK5 в центральной нервной системе также играет важную роль в патогенезе нейродегенеративных расстройств, таких как болезнь Альцгеймера и боковой амиотрофический склероз [57].
Ацетилирование: влияние на модуляцию действия глюкокортикоидов при суточных колебаниях циркулирующих глюкокортикоидов
Человеческий GRalpha ацетилируется по нескольким остаткам лизина при различных физиологических и патологических состояниях.Например, человеческий GRalpha ацетилируется по лизинам, расположенным в положениях аминокислот 494 и 495 шарнирной области, в ответ на глюкокортикоиды, и ацетилирование этих аминокислот снижает трансрепрессивное действие рецептора на транскрипционную активность, индуцированную NF-kappaB [58 ]. Интересно, что HDAC2 деацетилирует эти остатки лизина и восстанавливает репрессивный эффект глюкокортикоидов на сигнальный путь NF-kappaB [58]. Мы недавно обнаружили, что фактор транскрипции циркадного ритма Clock ацетилирует человеческий GRalpha по множеству лизиновых кластеров, расположенных в его шарнирной области, и репрессирует GR-индуцированную транскрипционную активность нескольких генов, чувствительных к глюкокортикоидам [19].Часы, «циркадный цикл локомоторного выхода капут» и его гетеродимерный партнер «мозг-мышца-arnt-подобный белок 1» (Bmal1) относятся к основной спирали-петле-спирали (bHLH) -PER-ARNT-SIM (PAS) суперсемейство факторов транскрипции [59, 60] и играет важную роль в формировании ритма циркадных колебаний как главных ЧАСОВ, расположенных в гипоталамическом SCN, так и подчиненных ЧАСОВ, несущих периферическую ткань, которые функционируют как внутренние хранители циркадного времени [61]. Clock физически взаимодействует с LBD GR через свой домен, взаимодействующий с ядерным рецептором, и ацетилирует остатки лизина, расположенные в положениях 480, 492, 494 и 495 аминокислот человеческого GRalpha в его шарнирной области [19] (Рисунок 2).Ацетилирование GRalpha дополнительно подавляет связывание этого рецептора с GRE, что подчеркивает механизм его репрессивного эффекта [19]. Вероятно, что опосредованная ацетилированием репрессия транскрипционной активности GRalpha с помощью Clock функционирует как локальный контррегуляторный механизм по отношению к суточным колебаниям циркулирующих глюкокортикоидов, что создается сильным влиянием центральных главных часов, расположенных в гипоталамических SCN [5].
Вариант сплайсинга Изоформа GRbeta
Изоформа GRbeta, которая экспрессируется из гена GR посредством альтернативного использования его специфического экзона 9beta, экспрессируется повсеместно в большинстве тканей, как и классический человеческий GRalpha.Эта изоформа была идентифицирована как у рыбок данио, так и у людей, а недавно была обнаружена у мышей [11, 62, 63]. Человеческий (h) GRbeta содержит 742 аминокислоты и разделяет первые 727 аминокислот от N-конца с hGRalpha [11, 18] (Рисунок 1). hGRbeta кодирует дополнительно 15 негомологичных аминокислот на С-конце, тогда как hGRalpha содержит дополнительные 50 аминокислот, формируя белок из 777 аминокислот [11, 18] (Рисунок 1). Следовательно, hGRbeta разделяет те же NTD и DBD с hGRalpha, но имеет уникальный «LBD».Поскольку точка расхождения (аминокислота 727) расположена на С-конце спирали 10 в hGRalpha LBD, hGRbeta «LBD» не имеет спиралей 11 и 12 hGRalpha. Поскольку эти спирали важны для формирования кармана для связывания лиганда и для создания поверхности AF-2 при связывании лиганда [20], GRbeta не может образовывать активный карман для связывания лиганда, не связывает глюкокортикоиды и, следовательно, не напрямую регулируют промоторы GRE-содержащих, чувствительных к глюкокортикоидам генов. В отсутствие hGRbeta «LBD» укороченный hGR, состоящий из NTD и DBD, транскрипционно активен на GRE-содержащих промоторах [64], таким образом, hGRbeta «LBD» каким-то образом ослабляет транскрипционную активность других субдоменов молекулы на GRE. -приводимые промоутеры.Недавно было показано, что человеческий GRbeta обладает внутренней транскрипционной активностью, независимой от его доминирующего негативного воздействия на транскрипционную активность, индуцированную GRalpha, в то время как физиологическая роль (и) этой активности еще предстоит изучить [65-67]. Внутри клеток hGRbeta может локализоваться как в цитоплазме, так и в ядре [68, 69].
Подобно гену GR человека, ген GR рыбок данио (z) состоит из 9 экзонов и продуцирует белки zGRalpha и zGRbeta, которые содержат 746 и 737 аминокислот соответственно [62] (Рисунок 4).
Рисунок 4. Геномная и комплементарная ДНК и изоформы белка GR рыбок данио Ген GR рыбок данио (z) состоит из 9 экзонов. Ген zGR экспрессирует варианты сплайсинга zGRa и zGRb посредством удерживания интронов [62]. С-концевые серые и заштрихованные домены в zGRalpha и zGRbeta показывают их специфические части. Они соответственно кодируются экзоном 9 и 3 ’частью экзона 8, которые также показаны в той же маркировке. (Из ссылки 65). Сокращения: DBD: ДНК-связывающий домен; GR: рецептор глюкокортикоидов; LBD: лиганд-связывающий домен; NTD: N-концевой домен; UTR: непереведенный регион.
zGRalpha и zGRbeta имеют общие N-концевые 697 аминокислот, тогда как они имеют специфические C-концевые части, которые содержат 47 и 40 аминокислот, соответственно. В отличие от hGRalpha и hGRbeta, которые продуцируются путем альтернативного использования специфических экзонов 9alpha и 9beta, zGRalpha и zGRbeta образуются в результате удержания интронов [62]. zGRalpha и zGRbeta используют экзон 1-экзон 8 для их общих N-концевых 697 аминокислот. zGRalpha использует экзон 9 для своей специфической C-концевой части, в то время как zGRbeta постоянно использует остальную часть экзона 8 и использует стоп-кодон, расположенный в 3 ’части этого экзона, для экспрессии своего специфического C-концевого пептида [62].Сравнение белкового выравнивания hGRbeta и zGRbeta показало, что эти две молекулы используют точно такую же точку расхождения, в то время как их специфичные для бета-изоформы С-концевые пептиды демонстрируют небольшую гомологию последовательностей [62]. Эти фрагменты молекулярной информации указывают на то, что hGRbeta и zGRbeta эволюционировали независимо. Мышиный (m) GRbeta также продуцируется тем же способом, что и zGRbeta, что указывает на то, что удерживание интронов, по-видимому, является общим механизмом для экспрессии этой изоформы рецептора в организмах, в то время как опосредованная сплайсингом экспрессия, используемая человеческим GRbeta, довольно уникальна [70].Тем не менее, GRbeta рыбок данио и мыши продемонстрировали те же функциональные свойства, что и hGRbeta, а именно, неспособность связывать глюкокортикоиды, доминирующую отрицательную активность в отношении индуцированной zGRalpha- и mGRalpha трансактивации a промоторов GRE-drive и поразительно схожего тканевого распределения, как у hGRbeta [62, 70]. Таким образом, hGRbeta, mGRbeta и zGRbeta были продуцированы в результате конвергентной эволюции, вероятнее всего, в результате сильной потребности в изоформе GR этого типа в физиологической ситуации.
Присутствие не связывающихся лигандом С-концевых вариантов не является уникальным для GR. Подобно GR человека, мыши и рыбок данио, некоторые другие человеческие стероидные и ядерные рецепторы, например рецептор эстрогена бета (ERbeta), рецептор гормона щитовидной железы альфа (TRalpha), рецептор витамина D, конститутивный рецептор андростана (CAR), зависимый от дозы рецептор изменения пола-1 (DAX-1), связанный с ядерным рецептором-2 (NURR-2), Орфанный рецептор-2, происходящий из нейронов (NOR-2), рецептор альфа, активируемый пролифераторами пероксисом (PPARalpha), и PPARgamma, все имеют изоформы рецепторов, усеченные на С-конце, которые нарушают связывание с родственными лигандами и обладают доминирующей отрицательной активностью на их соответствующих классические рецепторы [71-80].Это говорит о том, что эволюция позволила развить и сохранить такие альтернативные ядерные рецепторы, вероятно, потому, что они играют полезные биологические роли.
Выводы
GR трансдуцирует различные действия глюкокортикоидов, обнаруженных в большинстве органов и тканей, путем сильной модуляции транскрипционной активности многочисленных генов, чувствительных к глюкокортикоидам. Чтобы поддерживать такую обширную активность глюкокортикоидов, белки GR по-разному экспрессируются тканеспецифическим образом за счет альтернативного использования 5 различных промоторов, концевых 9альфа / бета-сайтов экзона и 8 сайтов инициации трансляции, а также имеют несколько доменов со специфическими функциональными мотивами в их отдельных полипептидная цепь, охватывающая ~ 800 аминокислот.К ним относятся 3 субдомена, NTD, DBD и LBD, которые содержат структуры для связывания лиганда или ДНК, ядерной локализации, трансактивации и трансрепрессии, а также части для взаимодействия с другими факторами транскрипции. Кроме того, другие клеточные сигнальные каскады регулируют активность GR посредством химических модификаций, включая фосфорилирование и ацетилирование. Важно отметить, что эти многочисленные различные активности GR регулируются путем связывания рецептора с глюкокортикоидным лигандом, что указывает на то, что GR является очень сложным внутриклеточным молекулярным переключателем, возможно, возникшим под сильным влиянием длительного эволюционного давления и биологических потребностей.
Благодарность
Литературная работа над этой статьей финансировалась Программой внутренних исследований Национального института здоровья детей и развития человека Юнис Кеннеди Шрайвер, Национальные институты здравоохранения, Бетесда, Мэриленд.
Нестандартные сокращения: AF-1 и -2: функции активации-1 и -2; AMPK: аденозин-5’-монофосфат-активируемая протеинкиназа; AP-1: белок-активатор-1; Bmal1: белок 1, подобный мозговым мышцам; CAR: конститутивный рецептор андростана; CBP: белок-связывающий белок, связывающий элемент цАМФ-ответа; C / EBP: CAAT / связывающий энхансер белок; CDK5: циклин-зависимая киназа 5; Часы: выходной цикл циркадного локомотера капут; ЦНС: центральная нервная система; COUP-TFII: промотор куриного овальбумина выше транскрипционного фактора II; CR: рецептор кортикостероидов; CREB: белок, связывающий элемент ответа цАМФ; DAX-1: изменение пола-1, зависящее от дозировки; DBD: ДНК-связывающий домен; КАПЕЛЬ: белок, взаимодействующий с рецептором витамина D; ER: рецептор эстрогена; GR: рецептор глюкокортикоидов; GRE: элемент ответа на глюкокортикоиды; HDAC: гистондеацетилаза; Ось HPA: ось гипоталамус-гипофиз-надпочечники; HNF-6: ядерный фактор гепатоцитов-6; HR: шарнирная область; HSP: белки теплового шока; JNK: N-концевая киназа cJun; LBD: лиганд-связывающий домен; MAPK: митоген-активированная протеинкиназа; MR: рецептор минералокортикоидов; NCoR: корепрессор ядерного рецептора; NES: сигнал ядерного экспорта; NF-kB: ядерный фактор-kB; NL-1 и -2: сигналы ядерной локализации-1 и -2; NOR-2: орфанный рецептор-2, полученный из нейронов; NURR-2: родственный ядерному рецептору-2; NTD: N-концевой домен; PAS: основная спираль-петля-спираль-PER-ANT-SIM; pCAF: белок, взаимодействующий с p300 / CBP; PPARg: рецептор g, активируемый пролифераторами пероксисом; PR: рецептор прогестерона; PVN: паравентрикулярное ядро; SCN: супрахиазматическое ядро; SMRT: подавляющий медиатор рецептора ретиноевой кислоты и гормона щитовидной железы; STAT: преобразователь сигнала и активатор транскрипции; TF: фактор транскрипции; TFRE: элементы ответа фактора транскрипции; TR: рецептор гормона щитовидной железы; TRAP: белок, связанный с рецептором тироидного гормона; UTR: непереведенный регион
Членство автора (-ов)
T Kino — Отдел по действию молекулярных гормонов, Программа репродуктивной и взрослой эндокринологии, Национальный институт здоровья детей и развития человека Юнис Кеннеди Шрайвер, Национальные институты здравоохранения, Бетесда MD 20892-1109, США
Каталожные номера
- T.Кино, Г. Chrousos, Влияние глюкокортикоидов на экспрессию генов, in: T. Steckler, N.H. Kalin, J.M.H.M. Reul (Eds.), Справочник по стрессу и мозгу, Elsevier BV, Амстердам, 2005 г., стр. 295-312.
- Г.П. Хрусос, Ось гипоталамус-гипофиз-надпочечники и иммуноопосредованное воспаление, N Engl J Med 332 (20) (1995) 1351-1362.
- H.M. Райхардт, К. Kaestner, O. Wessely, P. Gass, W. Schmid, G. Schutz, Анализ передачи сигналов глюкокортикоидов посредством нацеливания на гены, J Steroid Biochem Mol Biol 65 (1-6) (1998) 111-115.
- Г.П. Chrousos, Глюкокортикоидная терапия, в: P. Felig, L.A. Frohman (Eds.), Endocrinology & Metabolism, McGraw-Hill, New York, 2001. pp. 609-632.
- Н. Надер, Г.П. Хрусос, Т. Кино, Взаимодействие циркадной системы ЧАСОВ и оси HPA, Trends in Endocrinology & Metabolism 21 (5) (2010) 277-286.
- A. Munck, P.M. Гайр, Н.Дж. Холбрук, Физиологические функции глюкокортикоидов при стрессе и их связь с фармакологическим действием, Endocr Rev 5 (1) (1984) 25-44.
- J.K. Кларк, W.T. Schrader, B.W. О ”Малли, Механизм стероидных гормонов, в: J.D. Wilson, D.W. Фостер (ред.), Учебник эндокринологии Уильямса, WB Sanders Co., Филадельфия, 1992. стр. 35-90.
- Т. Кино, М.Ю. Де Мартино, Э. Чармандари, М. Мирани, Г.П. Chrousos, Синдромы тканевой глюкокортикоидной резистентности / гиперчувствительности, J Steroid Biochem Mol Biol 85 (2-5) (2003) 457-467.
- Г.П. Chrousos, T. Kino, Внутриклеточная передача сигналов глюкокортикоидов: ранее простая система становится стохастической, Sci STKE 304 (2005) pe48.
- Д.Дж. Mangelsdorf, C. Thummel, M. Beato, P. Herrlich, G. Schutz, K. Umesono, B. Blumberg, P. Kastner, M. Mark, P. Chambon и др., Суперсемейство ядерных рецепторов: второе десятилетие , Cell 83 (6) (1995) 835-839.
- С.М. Холленберг, К. Вайнбергер, Э.С. Онг, Г. Черелли, А. Оро, Р. Лебо, Э. Томпсон, М. Розенфельд, Р. Эванс, Первичная структура и экспрессия кДНК функционального человеческого рецептора глюкокортикоидов, Nature 318 (6047) (1985) 635-641.
- Т. Кино, Г.П. Chrousos, Глюкокортикоиды и синдромы резистентности / гиперчувствительности к минералокортикоидам, J Endocrinol 169 (3) (2001) 437-445.
- J.T. Бриджем, Э.А. Ортлунд, Дж. Торнтон, Эпистатический храповик ограничивает направление эволюции рецепторов глюкокортикоидов, Nature 461 (7263) (2009) 515-519.
- E.A. Ортлунд, Дж. Бриджем, М.Р. Рединбо, Дж. Торнтон, Кристаллическая структура древнего белка: эволюция путем конформационного эпистаза, Science 317 (5844) (2007) 1544-1548.
- Н.С. Николаидес, З. Галата, Т. Кино, Г.П. Chrousos, E. Charmandari, Человеческий глюкокортикоидный рецептор: молекулярная основа биологической функции, Стероиды 75 (1) 1-12.
- М.Б. Бреслин, К. Гэн, W.V. Vedeckis, В гене GR человека существует множество промоторов, один из которых активируется глюкокортикоидами, Mol Endocrinol 15 (8) (2001) 1381-1395.
- N.Z. Лу, Дж. А. Cidlowski, Трансляционные регуляторные механизмы генерируют изоформы N-концевых глюкокортикоидных рецепторов с уникальными транскрипционными генами-мишенями, Mol Cell 18 (3) (2005) 331-342.
- Т. Кино, Г.П. Chrousos, Глюкокортикоидные и минералокортикоидные рецепторы и связанные с ними заболевания, Essays Biochem 40 (2004) 137-155.
- Н. Надер, Г.П. Chrousos, T. Kino, Фактор транскрипции циркадного ритма CLOCK регулирует транскрипционную активность глюкокортикоидного рецептора путем ацетилирования его лизинового кластера шарнирной области: потенциальные физиологические последствия, FASEB J 23 (5) (2009) 1572-1583.
- R.K. Бледсо, В. Монтана, Т. Стэнли, С.Дж. Делвес, С.Дж. Аполито, Д.Д. Макки, Т. Конслер, Д.Дж. Паркс, Э. Стюарт, Т. Уилсон, М. Ламберт, Дж. Мур, К. Пирс, Х. Сюй, Кристаллическая структура лиганд-связывающего домена глюкокортикоидного рецептора раскрывает новый способ димеризации рецептора и распознавания коактиватора, Cell 110 (1) (2002) 93-105.
- Д.М. Таненбаум, Ю. Ван, С.П. Уильямс, П. Сиглер, Кристаллографическое сравнение лигандсвязывающих доменов рецептора эстрогена и прогестерона, Proc Natl Acad Sci U S. A 95 (11) (1998) 5998-6003.
- С.П. Вильямс, П. Б. Сиглер, Атомная структура прогестерона в комплексе с его рецептором, Nature 393 (6683) (1998) 392-396.
- K.J. Ховард, С.Дж. Холли, К. Ямамото, C.W. Дистелхорст, Картирование области связывания HSP90 рецептора глюкокортикоидов, J Biol Chem 265 (20) (1990) 11928-11935.
- Р. Шуле, П. Рангараджан, С. Кливер, Л.Дж. Рансоне, Дж. Боладо, Н. Ян, И.М. Верма, Р.М. Эванс, Функциональный антагонизм между онкопротеином c-Jun и рецептором глюкокортикоидов, Cell 62 (6) (1990) 1217-1226.
- B.F. Luisi, W.X. Сюй, З. Отвиновски, Л.П. Фридман, К.Р. Ямамото, П. Сиглер, Кристаллографический анализ взаимодействия рецептора глюкокортикоидов с ДНК, Nature 352 (6335) (1991) 497-505.
- R. Kumar, J.M. Serrette, S.H. Хан, А.Л.Миллер, Э. Томпсон, Влияние различных осмолитов на индуцированное сворачивание N-концевого домена активации (AF1) рецептора глюкокортикоидов, Arch Biochem Biophys 465 (2) (2007) 452-460.
- J.G. Савори, Б. Сюй, И. Laquian, W. Giffin, T. Reich, R.J. Аче, Ю.А. Лефевр, Различие между NL1- и NL2-опосредованной ядерной локализацией глюкокортикоидного рецептора, Mol Cell Biol 19 (2) (1999) 1025-1037.
- М. Ито, М. Адачи, Х. Ясуи, М. Такекава, Х. Танака, К. Имаи, Ядерный экспорт глюкокортикоидного рецептора усиливается фосфорилированием, опосредованным N-концевой киназой c-Jun, Mol Endocrinol 16 (10 ) (2002) 2382-2392.
- J.M. Holaska, B.E. Блэк, Д.С.Лав, Дж.А. Ганновер, Дж. Лешик, Б.М. Пашаль, Кальретикулин является рецептором ядерного экспорта, J Cell Biol 152 (1) (2001) 127-140.
- B.E. Black, J.M. Holaska, F. Rastinejad, B.M. Paschal, ДНК-связывающие домены в различных ядерных рецепторах функционируют как сигналы ядерного экспорта, Curr Biol 11 (22) (2001) 1749-1758.
- J.M. Holaska, B.E. Блэк, Ф. Растинежад, Б. Пасхальный, Са2 + -зависимый ядерный экспорт, опосредованный кальретикулином, Mol Cell Biol 22 (17) (2002) 6286-6297.
- Б.А. Либерман, Б.Дж. Бона, Д.П. Эдвардс, С. Nordeen, Состав элемента ответа на прогестерон, Mol Endocrinol 7 (4) (1993) 515-527.
- J.G. МакНелли, У.Г. Мюллер, Д. Уокер, Р. Вулфорд, Г.Л. Хагер, Глюкокортикоидный рецептор: быстрый обмен с регуляторными участками в живых клетках, Science 287 (5456) (2000) 1262-1265.
- M.G. Розенфельд, В. Луняк, К. Стекло, датчики и сигналы: коактиватор / корепрессор / эпигенетический код для интеграции сигнально-зависимых программ транскрипционного ответа, Genes Dev 20 (11) (2006) 1405-1428.
- Q. Wang, J.A. Блэкфорд-младший, Л. Сонг, Ю. Хуанг, С. Чо, С.С. Саймонс, младший, Равновесные взаимодействия корепрессоров и коактиваторов с агонистическими и антагонистическими комплексами глюкокортикоидных рецепторов, Mol Endocrinol 18 (6) (2004) 1376-1395.
- M. Schulz, M. Eggert, A. Baniahmad, A. Dostert, T. Heinzel, R. Renkawitz, RU486-индуцированный агонизм рецепторов глюкокортикоидов контролируется N-концом рецептора и связыванием корепрессора, J Biol Chem 277 (29 ) (2002) 26238-26243.
