Ведение пациенток с преждевременным выключением функции яичников | #10/05
Угасание функции яичников — сложный и продолжительный по времени процесс. В отношении различных вариантов этого состояния имеется своя терминология, хотя разграничение терминов в значительной степени искусственное. Некоторые исследователи считают целесообразным выделять «раннее выключение функции яичников» — симптомокомплекс, формирующийся у женщин 40–45 лет, и «преждевременное выключение функции яичников», возникающее в возрасте до 40 лет [13]. Примечательно, что две тысячи лет назад менопауза в 40 лет рассматривалась как нормальное явление (Аристотель, IV век до н. э.). С увеличением продолжительности жизни возрастает и средний возраст наступления менопаузы.
История систематизированного изучения преждевременного выключения функции яичников, или преждевременной недостаточности функции яичников (ПНЯ), началась в 30-е гг. XX столетия, когда впервые было выявлено повышение уровня гонадотропинов у молодых женщин, которые ранее регулярно менструировали. В 1950 г. Аtria [10] представил основную клиническую характеристику больных с преждевременным эстрогенным дефицитом. В начале 1960-х гг. Hertz [20] описал четырех пациенток с повышенным уровнем фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ), у которых в биоптатах яичников при последующем их гистологическом исследовании были обнаружены фолликулы на различной стадии зрелости. Подобные клинико-анатомические находки сделали в 1969 г. Jones и de Morales-Ruchsen [18], описавшие трех пациенток с вторичной аменореей, бесплодием, высоким уровнем гонадотропинов и сохраненным фолликулярным аппаратом. Подобное состояние было ими охарактеризовано как синдром резистентных яичников, или Савадж-синдром — по имени одной из этих пациенток. Согласно данным Fenichel [17], у половины женщин с ПНЯ в яичнике имеются единичные фолликулы, которые периодически функционируют, поэтому у этих пациенток изредка могут спонтанно наступать овуляции и в отдельных случаях даже возникать беременности. Подобные клинико-гормональные взаимоотношения прослеживаются на протяжении 6 и более лет после наступления гипергонадотропной аменореи.
Подобные клинико-гормональные взаимоотношения прослеживаются на протяжении 6 и более лет после наступления гипергонадотропной аменореи.
С 1967 г. под ПНЯ подразумевается нефизиологическое прекращение менструации у женщин до 40 лет. Частота данной патологии среди женской популяции репродуктивного возраста составляет приблизительно 1% [4, 7, 14, 20].
Дефицит половых гормонов в возрасте до 40 лет способствует формированию не только целой гаммы вазомоторных и эмоционально вегетативных проявлений, но также является ведущим фактором риска развития сердечно-сосудистой патологии и снижения минеральной плотности костной ткани. В связи с тем что все представленные выше метаболические нарушения сохраняются по крайней мере на протяжении 7–10 лет, предшествующих возрасту физиологической менопаузы, пациенток с ПНЯ следует выделять в особую группу риска, требующую постоянного диспансерного наблюдения и обязательного назначения заместительной гормональной терапии (ЗГТ).
Установлено, что с момента рождения и до 50 лет число примордиальных фолликулов у женщин постепенно снижается с 1–2 млн до 10 тыс. в каждом. Большинство фолликулов подвергается атрезии на стадии малых антральных [22]. Следует отметить, что в 37–38 лет помимо этого выявляется выраженная атрезия — за счет примордиальных фолликулов, что значительно ускоряет процесс их исчезновения из яичника [16]. О процессах, контролирующих эти «возрастные коридоры» жизни яичников, известно крайне мало.
Время прекращения функционирования яичников может зависеть как от величины яичникового пула, так и от скорости атрезии. Время наступления менопаузы у женщин — наследственный признак. Количество родов и факторы внешней среды, такие, как питание, социально-экономический статус, также оказывают влияние на возраст наступления менопаузы. Вредные привычки, в особенности курение, могут приблизить ее наступление.
Точная природа ПНЯ неясна. Это состояние описывается как «многофакторный синдром», в развитии которого могут принимать участие генетические, аутоиммунные, инфекционно-токсические, психогенные факторы внешней среды, а также дефекты в структурах и /или действия гонадотропинов.
В ходе последних исследований Krauss и соавторы [19] обнаружили ген (ПНЯ 1), расположенный на участке Xq21.3–q27 или Xq26.l–q27, ответственный зa преждевременное истощение яичников. Powell и соавторы открыли второй ген (ПНЯ 2) родственного происхождения, расположенный проксимальнее к локусу Хq в ql3.3–q21.1.
Преждевременное истощение яичников нередко выявляется в семьях, где имеются редкие наследственные патологии, такие, как галактоземия (лактазная недостаточность), блефарофимоз, причем механизм повреждения яичников при этих генетических расстройствах неизвестен. При галактоземии у девочек развивается первичная или вторичная аменорея, в то время как у мужчин репродуктивная функция остается интактной. При блефарофимозе только у каждой второй женщины развивается ПНЯ, при этом клиническая картина заболевания часто сходна с синдромом резистентных яичников.
К наиболее редким генетическим причинам семейных случаев ПНЯ относится дефект гена, кодирующего синтез рецептора к ФСГ. У таких женщин выявляются гипоплазия яичников, множество примордиальных фолликулов, остановившихся в развитии на ранней стадии.
Степень повреждения яичников в результате лучевого и химического воздействия зависит от величины, дозы и продолжительности воздействия, а также от возраста пациентки. Доза порядка 6 Грей обычно приводит к стойкому повреждению яичников.
Препараты, используемые в онкологической практике и обладающие антимитотическим и цитотоксическим действием, могут приводить к выраженному угнетению функции яичника у женщин [12]. Данные, опубликованные в 1998 г. [8, 23], подтверждают, что гранулезные клетки являются в яичнике главной мишенью для циклофосфана, что приводит к ПНЯ за счет истощения фолликулярного аппарата в связи с активацией процесса апоптоза, который, в свою очередь, приводит к стойкой атрезии примордиальных фолликулов, в норме протекающей в циклическом режиме. Выявленная в пубертатном возрасте устойчивость яичников к воздействию химиопрепаратов натолкнула исследователей на мысль о возможности осуществления непосредственно перед назначением химиопрепаратов медикаментозного подавления роста и созревания фолликулов. В 1995 г. Ataya и соавторы [9] доказали на женских особях резус-обезьян, что агонисты гонадотропинрелизинг-гормона (ГнРГ) защищают яичник от воздействия циклофосфамидов. Назначение агониста ГнРГ параллельно с химиопрепаратом значительно снизило скорость ежедневной гибели примордиальных фолликулов.
В 1995 г. Ataya и соавторы [9] доказали на женских особях резус-обезьян, что агонисты гонадотропинрелизинг-гормона (ГнРГ) защищают яичник от воздействия циклофосфамидов. Назначение агониста ГнРГ параллельно с химиопрепаратом значительно снизило скорость ежедневной гибели примордиальных фолликулов.
Согласно современным представлениям ПНЯ следует относить к органоспецифическим аутоиммунным заболеваниям. До настоящего времени не ясно, является ли развитие аутоиммунного процесса (срыв толерантности) первичной причиной возникновения заболевания или результатом воздействия длительной хронической патологии, как бы замыкая «порочный» круг патогенеза. Сегодня предложено около двух десятков теорий, объясняющих причины срыва толерантности и, как следствие, развитие аутоиммунитета. Наиболее доказуемыми из них в плане формирования ПНЯ являются теория «запретных» клонов, а также теория генетической предрасположенности, молекулярной мимикрии.
Механизм развития аутопроцесса в яичнике представляется в виде последовательности следующих событий. Под влиянием внешних факторов (видимо, это некоторые вирусы и ферменты ДНК, другие экзогенные вещества и соединения) лимфоциты приобретают аномальную чувствительность к различным белкам, выступающим в виде аутоантигенов, взаимодействующих с Т-лимфоцитами и образующих эпитоны с молекулами антигенов системы HLA. После такого комплексирования с молекулами II класса системы HLA антигены «представляются» Т-лимфоцитами, что является сигналом для инициации иммунного ответа.
Активирование таких аутореактивных Т-лимфоцитов становится потенциальной причиной деструкции яичника.
По данным Fenischel, у больных с идиопатической формой ПНЯ методом ELISА аутоантитела к яичнику были обнаружены в 59% случаев. Согласно нашим исследованиям, яичниковые антитела выявлены у 25% больных [5].
Частота выявления яичниковых аутоантител зависит от метода, с помощью которого они определялись, и разновидности биологического материала, в котором они идентифицировались. Более высокая чувствительность продемонстрирована при использовании метода ELISА (в сравнении с методом иммуноферментного анализа), а наиболее значимой биологической средой оказалась ткань яичника (в сравнении с сывороткой крови).
Более высокая чувствительность продемонстрирована при использовании метода ELISА (в сравнении с методом иммуноферментного анализа), а наиболее значимой биологической средой оказалась ткань яичника (в сравнении с сывороткой крови).
ПНЯ — это одна из составляющих II типа аутоиммунного полигландулярного синдрома, для которого, помимо изменений клеточного звена иммунитета, характерна ассоциация с гаплотипами HLA В8, DR3, DR4, DR5 .
Согласно проведенным нами исследованиям, для больных с преждевременной недостаточностью яичников характерно носительство аллелей DRB1*О1, DRB1*О3, DRB1*О4, DRB1*3О2, DRB1*5О1, показатель относительного риска составил 1,74; 1,78; 2,09; 2,46; 1,73 соответственно, что может указывать на значимость аутоиммунного процесса при этой патологии. Представленные аллельные варианты НLА II класса встречались у 25% больных с подтвержденным аутоиммунным генезом заболевания и у всех пациенток с промежуточным вариантом ПНЯ.
К наиболее распространенным сочетаниям ПНЯ и аутоиммунной патологии относятся поражения внутренней секреции, а также различные заболевания неэндокринного генеза; среди них следует особо выделить болезнь Аддисона, аутоиммунный тиреоидит, гипопаратиреоз, сахарный диабет, системную красную волчанку, ревматоидный артрит, витилиго, миастению, пернициозную анемию, гломерулонефрит [23]. Согласно полученным нами данным, гипофункция щитовидной железы (тиреотропный гормон (ТТГ)) — 7,34 ± 1,1 мМЕ/л выявляется у 23,3% больных с ПНЯ, т. е. в 3–4 раза чаще, чем в популяции. Манифестная форма заболевания диагностирована у 16,3% и субклиническая — у 7,0% обследованных.
На фоне прекращения менструаций ранние симптомы дефицита женских половых гормонов в виде вазомоторных и эмоциональных вегетативных проявлений отмечены у 77,5% пациенток. При этом их выраженность, согласно индексу Куппермана (15,2 ± 1,8 балла) и оценке качества жизни на основании анкеты MENQOL (вазомоторные симптомы — 8,2 ± 3,8 балла, физическое состояние — 37,5 ± 8,3 балла, сексуальная сфера — 8,1 ± 3,4 балла, психологическое состоя-ние — 25,6 ± 6,8 балла), свидетельствовала о среднетяжелом дефиците эстрогенов. Относительно незначительные клинические проявления изменения гормонального гомеостаза можно объяснить тем, что, в отличие от женщин в периоде физиологической менопаузы, у этих пациенток еще не произошло старения структур гипоталамической и лимбической систем. ПНЯ с исходом в гипергонадотропный гипогонадизм в конечном итоге приводит к изменению функционирования гипоталамической и лимбической систем и секреции нейрогормонов, в результате чего снижается допаминергический и повышается норадренергический тонус, а это, в свою очередь, ведет к снижению уровня b-эндорфиновой активности, уровней серотонина, допамина; у пациенток изменяется терморегуляция, появляются приливы, гипертензия, гипергидроз, ожирение [3].
Относительно незначительные клинические проявления изменения гормонального гомеостаза можно объяснить тем, что, в отличие от женщин в периоде физиологической менопаузы, у этих пациенток еще не произошло старения структур гипоталамической и лимбической систем. ПНЯ с исходом в гипергонадотропный гипогонадизм в конечном итоге приводит к изменению функционирования гипоталамической и лимбической систем и секреции нейрогормонов, в результате чего снижается допаминергический и повышается норадренергический тонус, а это, в свою очередь, ведет к снижению уровня b-эндорфиновой активности, уровней серотонина, допамина; у пациенток изменяется терморегуляция, появляются приливы, гипертензия, гипергидроз, ожирение [3].
Чем раньше наступает менопауза, тем более выраженный стресс она вызывает. У женщин, достигших менопаузы одновременно или раньше своих матерей, нередко возникает чувство несправедливости. Исследования показывают, что стресс, обусловленный осознанием своего отличия от сверстниц, — важнейший психологический фактор, превалирующий над всеми остальными психологическими и социальными проблемами, связанными с менопаузой, которые не зависят от семейного положения, образования и количества детей [21].
В генезе развития урогенитальных расстройств у больных с ПНЯ, безусловно, определенную роль играет наличие определенного числа эстрогеновых рецепторов в эпителии и строме влагалищной стенки, состав соединительной ткани и ее биохимические характеристики (снижение соотношения протеогликана/коллагена). Описанные изменения в парауретральной соединительной ткани обусловлены не только низким уровнем эстрадиола, но и включением возрастного механизма старения уротелия. Пациентки с ПНЯ составляют относительно молодую группу, у них еще не задействованы сложные механизмы старения уротелия, поэтому симптомы урогенитальной атрофии встречаются только в 15,6% случаев, в то время как у 1/3 женщин после 55 лет эти изменения являются ведущими среди поздних осложнений климактерия.
Оценка гормонального статуса пациенток с ПНЯ свидетельствует о достоверном повышении содержания ФСГ и ЛГ до уровня более 40 МЕ/л и снижении содержания менее 80 пмоль/л, что значительно ниже показателей, характерных для ранней фолликулярной фазы у женщин с регулярными менструациями. Особый, с нашей точки зрения, интерес представляет анализ у больных с ПНЯ секреции андрогенов как яичникового, так и надпочечникового генеза.
С одной стороны, с наступлением естественной менопаузы основная часть тестостерона образуется путем периферической конверсии из андростендиона и дегидроэпиандростерона-сульфата, при этом содержание его, в отличие от эстрогенов, резко не снижается, а наоборот, может возрастать, особенно его свободные фракции.
С другой стороны, на фоне снижения уровня эстрадиола и закономерного уменьшения продукции полового стероидсвязывающего глобулина (ПССГ), а значит и уровня связанного тестостерона отмечается повышение содержания его свободных, биологически активных фракций, вследствие чего у значительного числа женщин в менопаузе наблюдается относительная гиперандрогения. Несколько другие гормональные соотношения, касающиеся баланса андрогенов, были выявлены у женщин с ПНЯ. По данным N. Doldi и соавторов, при ПНЯ обнаружено достоверное снижение уровня 17-оксипрогестерона, андростандиона, тестостерона в сравнении с женщинами с нормальной функцией яичников.
Согласно нашим данным, у 55,7% больных с ПНЯ на фоне закономерных для данной патологии соотношений ФСГ, ЛГ и эстрадиола отмечено андрогендефицитное состояние (снижение уровня тестостерона до 0,8 ± 0,1 пмоль/л).
Мы считаем, что снижение секреции андрогенов яичниками у больных с ПНЯ является еще одним неоспоримым доказательством справедливости нашего суждения об аутоиммунном генезе ПНЯ, так как при любом аутопроцессе в конечном итоге развивается сочетанная недостаточность эндокринных желез. Со временем этот процесс охватывает не только яичник, но и надпочечник.
До настоящего времени, согласно мнению P. Fenichel и многих других авторов, эффективного специфического лечения ПНЯ (кроме ЗГТ и донации ооцитов) предложено не было [17].
Решение о проведении ЗГТ должно приниматься больной совместно с лечащим врачом. Несмотря на проявления дефицита эстрогенов, согласие на прием гормонопрепаратов нам удалось получить у 62,7% пациенток.
На первом этапе следует определиться с базовым лечением, которое должно быть направлено на патогенетическое звено заболевания. Использование препаратов женских половых стероидов, способствующих восполнению гипоэстрогенного состояния, следует рассматривать как «первую линию» лечебного воздействия. Назначение ЗГТ является универсальным средством ликвидации дефицита половых гормонов. В отличие от тактики, принятой при естественной менопаузе, режим проведения ЗГТ при ПНЯ имеет некоторые особенности. Согласно точке зрения V. Beral, у женщин репродуктивного возраста риск развития рака молочной железы низок, в связи с чем пятилетний срок, на который назначается непрерывная ЗГТ, может быть пролонгирован во времени, по крайней мере до возраста естественной менопаузы. При этом, безусловно, необходимо соблюдать все принципы и рекомендации, направленные на безопасное использование половых гормонов.
По мнению L. Giotto и соавторов, которые с 1992 по 2002 г. наблюдали 72 женщины с ПНЯ, получавшие в течение 10 лет ЗГТ, необходимо дифференцировать подходы к назначению длительной гормонотерапии с учетом противопоказаний и возрастных критериев. Так, пациентам до 35 лет при отсутствии генетических тромбофилий, эпизодов венозной тромбоэмболии или ишемической кардиомиопатии, а также сопутствующей аутоиммунной патологии (ревматоидный артрит) следует рекомендовать пероральный прием препаратов. Через 10 лет их необходимо переводить на трансдермальные формы препаратов. В возрасте после 38 лет и при наличии факторов риска целесообразно гормонотерапию начинать сразу с трансдермальных форм. Назначение селективных эстроген-рецепторных модуляторов (ралоксифен), с точки зрения этих ученых, не целесообразно, так как при ПНЯ мы имеем дело с молодыми женщинами, нуждающимися в восполнении дефицита половых гормонов натуральными эстрогенами в связи с множественными проявлениями симптомов выключения функции яичников.
Назначение селективных эстроген-рецепторных модуляторов (ралоксифен), с точки зрения этих ученых, не целесообразно, так как при ПНЯ мы имеем дело с молодыми женщинами, нуждающимися в восполнении дефицита половых гормонов натуральными эстрогенами в связи с множественными проявлениями симптомов выключения функции яичников.
Некоторые ученые полагают [2], что пациенткам с ПНЯ требуются более высокие дозы гормонов, поскольку, в отличие от естественной менопаузы, при которой наблюдается постепенное растянутое во времени уменьшение эндогенного образования женских половых гормонов и в значительном проценте случаев формируется относительная гиперандрогения, при ПНЯ этот процесс ускорен во времени, и у 55,7% больных, согласно полученным нами данным, отмечается гипоандрогенное состояние. Установлено, что эстрогены оказывают выраженное положительное влияние не только на вазомоторные проявления дефицита эстрогенов, но и на сексуальность женщины — благодаря своему центральному и периферическому воздействию.
В настоящее время для профилактики и лечения патологических состояний, обусловленных снижением эстрогенной насыщаемости организма в молодом возрасте, применяют натуральные эстрогены: конъюгированный эстроген (per os) в дозе 0,625 мг/сут, эстрадиол валерат — 2 мг/сут, 17b-эстрадиол — 2 мг/сут. Перечисленные препараты обладают системным влиянием и при использовании в указанной общепринятой дозировке применяются для коррекции ранних, средневременных и поздних обменных нарушений [3].
С целью профилактики гиперпластических процессов эндометрия женщинам с ПНЯ терапию эстрогенами необходимо назначать в сочетании с гестагенами и предпочтительно в циклическом режиме. При подборе наиболее подходящего режима ЗГТ крайне важно учитывать степень индивидуальной чувствительности к гестагенам.
Проводя ЗГТ, не следует забывать об основных принципах ее назначения. В основном избирается циклический режим назначения (сочетание эстрогена и гестагена), при этом надо стремиться обеспечить физиологическое соотношение эстрогенов (эстрадиол/эстрон) в плазме крови, характерное для данного возрастного периода жизни, и не упускать из виду необходимость индивидуального подбора препаратов для минимизации побочных эффектов ЗГТ. С целью купирования дефицита эстрогенов и коррекции выявленных метаболических нарушений могут использоваться: 2 мг 17β-эстрадиола и 10 мг дидрогестерона в циклическом непрерывном режиме (фемостон 2/10), а также 2 мг эстрадиола валерата и медроксипрогестерона ацетат.
С целью купирования дефицита эстрогенов и коррекции выявленных метаболических нарушений могут использоваться: 2 мг 17β-эстрадиола и 10 мг дидрогестерона в циклическом непрерывном режиме (фемостон 2/10), а также 2 мг эстрадиола валерата и медроксипрогестерона ацетат.
Эстрогенсодержащий компонент препарата фемостон 2/10 — 17β-эстрадиол — идентичен человеческому эстрогену, вырабатываемому яичниками. Он синтезируется из растительного сырья и не содержит составляющих животного происхождения. Микронизированный 17β-эстрадиол, в отличие от кристаллического, хорошо всасывается при приеме внутрь и активно метаболизируется в слизистой оболочке кишечника и затем при прохождении через печень. Фармакология 17β-эстрадиола хорошо изучена. Прием 17β-эстрадиола 1 раз в день обеспечивает устойчивую постоянную концентрацию препарата в крови. Эндогенный 17β-эстрадиол вырабатывается всеми млекопитающими вне зависимости от пола и возраста. Он воздействует на ряд процессов в репродуктивной и гипоталамо-гипофизарной системах, а также на другие органы. Экзогенный 17β-эстрадиол аналогично действует на те же органы-мишени. Фемостон 2/10 предупреждает потерю костной ткани, входящий в его состав дидрогестерон не снижает защитного действия эстрогена на ее метаболизм. ЗГТ намного эффективнее предупреждает потерю костной массы и переломы, если она начата вскоре после формирования ПНЯ, поскольку с течением времени губчатое вещество разрушается и уже не восстанавливается [1]. В нашем исследовании через 6 мес использования фемостона 2/10 уровень ФСГ у пациенток с ПНЯ снизился с 119,9 ± 13,8 до 53,8 ± 9,2 МЕ/л, уровень Е2 повысился с 48,3 ± 7,4 до 118,6 ± 25,6 пмоль/л (p < 0,001), что соответствует средней стадии пролиферации у женщин в репродуктивном возрасте.
Дивисек также является оптимальным препаратом для лечения женщин с ПНЯ. Это трехфазный препарат, в котором эстрогеновый компонент представлен эстрадиолом валератом, а гестагенный — медроксипрогестероном ацетатом. Эстрадиола валерат подвергается в печени биотрансформации в эстрадиол, поэтому его рассматривают как предшественника «натуральных» эстрогенов, которые образуются в организме из синтетических. Он попадает в кровоток после превращения его в печени в натуральный эстроген – эстрадиол. Медроксипрогестерона ацетат является производным естественного прогестерона — 17α-гидрокси-6-метилпрогестерона. Он обладает слабой андрогенной активностью, но может взаимодействовать с эндогенными андрогенами (так называемый синандрогенный эффект), что помогает купировать симптомы дефицита андрогенов у женщин с ПНЯ. Более того, медроксипрогестерона ацетат не снижает положительного воздействия эстрогенов на депрессивные симптомы и при этом достоверно уменьшает чувство тревоги. Трехфазный режим применения препарата позволяет избежать возобновления симптомов недостатка половых гормонов, возникающих в дни ожидаемых менструальноподобных реакций при двухфазном режиме. Дивисек также активно предупреждает потерю костной ткани.
Эстрадиола валерат подвергается в печени биотрансформации в эстрадиол, поэтому его рассматривают как предшественника «натуральных» эстрогенов, которые образуются в организме из синтетических. Он попадает в кровоток после превращения его в печени в натуральный эстроген – эстрадиол. Медроксипрогестерона ацетат является производным естественного прогестерона — 17α-гидрокси-6-метилпрогестерона. Он обладает слабой андрогенной активностью, но может взаимодействовать с эндогенными андрогенами (так называемый синандрогенный эффект), что помогает купировать симптомы дефицита андрогенов у женщин с ПНЯ. Более того, медроксипрогестерона ацетат не снижает положительного воздействия эстрогенов на депрессивные симптомы и при этом достоверно уменьшает чувство тревоги. Трехфазный режим применения препарата позволяет избежать возобновления симптомов недостатка половых гормонов, возникающих в дни ожидаемых менструальноподобных реакций при двухфазном режиме. Дивисек также активно предупреждает потерю костной ткани.
Для профилактики остеопороза и сердечно-сосудистой патологии ЗГТ в любом возрасте должна проводиться в течение не менее 5 лет в непрерывном режиме.
В последние годы появились предложения о целесообразности добавления к традиционной ЗГТ инъекции тестостерона. Подобные рекомендации были разработаны также для пациенток с двусторонней овариоэктомией, у которых в 40% случаев отмечаются также симптомы гипоандрогении, однако исследований, посвященных этой проблеме, проводилось крайне мало [11]. По сообщению S. N. Kalantaridou, в Национальном институте здоровья (США), проводится трехлетнее плацебоконтролируемое исследование, в котором наряду с традиционным ЗГТ больным с ПНЯ назначают трансдермально 150 мг тестостерона.
Многие симптомы гипотиреоза схожи с жалобами, обусловленными дефицитом половых гормонов. Поэтому провести дифференциальный диагноз при этих двух состояниях крайне сложно: необходим комплексный подход с обязательным углубленным одновременным исследованием уровней как половых, так и тиреоидных гормонов. В нашем исследовании (Г. В. Тагиева) манифестная форма гипотиреоза выявлена у 7 больных (16,3%), а субклиничес-кая — у 3 больных (7%). Основываясь на рекомендации как отечественных, так и зарубежных эндокринологов о необходимости обязательного восполнения дефицита тиреоидных гормонов L-тироксином лечение было назначено только 7 пациенткам с манифестной формой заболевания в дозе 1,6–1,8 мкг/кг массы больного. Препарат применяли в непрерывном режиме, больные находились под наблюдением общего эндокринолога, уровень ТТГ контролировали каждые 3 мес. При динамическом контроле во всех случаях нам удалось добиться нормализации уровня ТТГ и установления эутиреоидного состояния у больных с ПНЯ (ТТГ составил 3,1 ± 0,2 мМЕ/л).
В нашем исследовании (Г. В. Тагиева) манифестная форма гипотиреоза выявлена у 7 больных (16,3%), а субклиничес-кая — у 3 больных (7%). Основываясь на рекомендации как отечественных, так и зарубежных эндокринологов о необходимости обязательного восполнения дефицита тиреоидных гормонов L-тироксином лечение было назначено только 7 пациенткам с манифестной формой заболевания в дозе 1,6–1,8 мкг/кг массы больного. Препарат применяли в непрерывном режиме, больные находились под наблюдением общего эндокринолога, уровень ТТГ контролировали каждые 3 мес. При динамическом контроле во всех случаях нам удалось добиться нормализации уровня ТТГ и установления эутиреоидного состояния у больных с ПНЯ (ТТГ составил 3,1 ± 0,2 мМЕ/л).
До настоящего времени активно обсуждается проблема целесообразности проведения ЗГТ тиреоидными препаратами при субклиническом течении гипотиреоза, однако окончательно этот вопрос еще не решен. Тем не менее большинство исследователей предпочитают придерживаться выжидательной тактики. Мы ограничились у этой группы больных только контролем за уровнем тиреотропного и тиреоидных гормонов. При контрольном определении уровня тиреоидных гормонов показатель ТТГ у этих 3 больных однократно находился в пределах 4,3–4,9 мМЕ/л, т. е. был ниже 5–10 мМЕ/л, что, по мнению В. В. Фадеева и Г. А. Мельниченко, не требует назначения им заместительной терапии L-тироксином [6].
Назначение препаратов L-тироксина больным с нормальной функцией щитовидной железы и наличием только высоких диагностических титров антител к ткани щитовидной железы (последние в нашем исследовании выявлены у 30,2%) и/или ультразвуковых признаков ее аутоиммунной патологии нецелесообразно. Выдвигаемое некоторыми исследователями предположение о том, что подавление уровня ТТГ, наблюдающееся при назначении L-тироксина пациенткам с эутиреозом на фоне циркулирующих тиреоидных аутоантител, уменьшает презентацию антигенов щитовидной железы и тем самым замедляет аутоиммунный процесс, не состоятельно, так как при этом необходимо длительно применять не менее 75–100 мкг препарата, что в конечном итоге может привести к развитию медикаментозного тиреотоксикоза.
Согласно S. N. Kalantaridou, у 5–10% женщин с ПНЯ может наступить беременность даже в том случае, когда при биопсии яичников у них не обнаруживали примордиальных фолликулов.
В исследовании, проведенном в Китае, анализировались отдаленные результаты клинического течения заболевания и эффективности лечения при ПНЯ с 1988 по 2002 г. В клинике гинекологической эндокринологии г.Пекина наблюдались 245 пациенток с идиопатической формой ПНЯ. Ретроспективный анализ течения заболевания на протяжении 14 лет подтвердил наличие стойкого синдрома резистентных яичников только у 7 больных (2,9%). На фоне проводимой длительной ЗГТ у них установился регулярный ритм менструации, снизился уровень ФСГ, возросла концентрации эстрадиола и наступила беременность. Авторы делают вывод о том, что ПНЯ в ряде случаев представляет собой транзиторную патологию, при которой не всегда для наступления беременности требуется проведение донации яйцеклетки. Согласно данным Р. Fenichel и соавторов, из 26 пациенток с ПНЯ у 4 (19,23%) на фоне терапии эстрогенами наступила беременность. Согласно нашим наблюдениям, на фоне ЗГТ из 78 пациенток с ПНЯ 2 (2,6%) забеременели; у одной из них случился самопроизвольный выкидыш, у второй — завершилось своевременными самопроизвольными родами.
Таким образом, представленные нами данные позволяют несколько приблизиться к разрешению многочисленных загадок, которые таит в себе такая мультифакторная патология, как преждевременное выключение функции яичников. Однако необходимо провести еще целый ряд исследований, в которых были бы изучены процесс апоптоза и его генетические маркеры, а также дана оценка роли цитокинов (Th2 и Th3 популяции Т-лимфоцитов) и факторов роста в генезе формирования преждевременного выключения функции яичников. Решение этих задач позволит наметить дальнейшие пути разработки патогенетически обоснованных вариантов профилактики и лечения стойкого дефицита половых гормонов у пациенток репродуктивного возраста. Возможно, это станет реальным шагом на пути к восстановлению как репродуктивного здоровья, так и качества жизни у данной категории больных.
Возможно, это станет реальным шагом на пути к восстановлению как репродуктивного здоровья, так и качества жизни у данной категории больных.
Литература
- Зайдиева Я. З. Новые возможности лечения климактерических расстройств в постменопаузе//Гинекология. 2003. Т. 5. № 1. С. 10–13.
- Рубченко Т. И., Краснопольский В. И., Лукашенко С. Ю. Метаболические нарушения у женщин с хирургической менопаузой и их коррекция с помощью ЗГТ//Проблемы репродукции. 1999. Т. 5. № 3. С. 59–63.
- Сметник В. П., Кулаков В. И. Руководство по климактерию МИА. 2001. С. 345–346, 368.
- Сметник В. П., Тумилович Л. Г. Неоперативная гинекология. М.: Медицинское информационное агентство, 2003.
- Тагиева Г. В. Роль аутоиммунного процесса в генезе преждевременного выключения функции яичников: Дис. … канд. мед. наук. М., 2005.
- Фадеев В. В., Мельниченко Г. А., Герасимов Г. А. Аутоиммунный тиреоидит. Первый шаг к консенсусу//Проблемы эндокринологии. 2001. Т. 47. № 4.
- Юренева С. В. Хирургическая менопауза в репродуктивном возрасте (Патогенетические механизмы, особенности клиники, диагностика, лечение): Дис. … д-ра мед. наук. М., 2004.
- Ataya K. M., McKanna J. A., Weintraub A. M. et al. A prevention of chemotherapy-induced ovarian follicular loss in rats//Cancer Res. 1985; 45: 3651–3656.
- Ataya К. Hormone-releasing hormone agonist inhibits cyclophosphamide induced ovarian follicular depletion in rhesus monkeys//Biol Reprod. 1995; 52: 365–372.
- Atria A. La menopausia precos у tratamiento hormonal//Rev Med Chil. 1950; 78: 373–377.
- Burger H., Davis S. Should women be treated with testosterone. Clinical Endocrinology. 1998; 49: 159–160.
- Byrne J., Mulvihill J. J., Myers M. H. et al. Effects of treatment on fertility in long term-survivors of childhood cancer//N Engl J. Med. 1987; 317: 1315–1321.
- Crosignani P.
 , Alagna F. et al. Familian form of idiathic premature and early menophause. Presented at the International Symposium of Ovarian Ageing, Brussels, Belgium//Abstract in International journal of Fertility and Womens’s Medicine. 1998; 43(4): 200.
, Alagna F. et al. Familian form of idiathic premature and early menophause. Presented at the International Symposium of Ovarian Ageing, Brussels, Belgium//Abstract in International journal of Fertility and Womens’s Medicine. 1998; 43(4): 200. - Eisenhauer K. M., Chun S.-Y., Billing H. Growth hormone suppresion of apoptosis in preovulatory rat follicles and partial neutrallization by insulin-like growth factor binding protein.//Biol. Reprod. 1995; 53: 13–20.
- Epplen J. T., Buitkamp J., Bocker T., Epplen C. Indirect gene diagnoses for complex (multifactorial) diseases. a review//Gene. 1995; 159: 49-55.
- Faddy M., Gosden R. A mathematical model of follicle dynamics in the human ovary//Human Reprod. 1995; 10: 770–775.
- Fenichel P., Sosset C. et al. Premature ovarian failure: An autoimmune disease//Advances in Endocrinological Gynecoljgy. 1999; 143–149.
- Jones G. S., de Morales-Ruehsen M. A new syndrome of amenorrhea in association with hypogonadotropism and apparently normal follicular apharatus//Am. J. Obstet Gynecol. 1969; 104: 597.
- Krauss C. M., Turksoy R. N., Atkins L. et al. Familial premature ovarian failure menopause due to an interstitial deletion of the long arm of the X-chromosome//N Engl J. Med. 1987; 317: 125–131.
- Laml T., Schulz-Lobmeyr L. A Obruca Premature ovarian failure: etiology and prospects//Gynecol Endocrinol. 2000; 14: 292–302.
- Lennon M. C. The psychological consequenses of menopause: The importance of timing of a life stage event//J. of Health and Social Behaviour. 1982; 23: 353–366.
- McGee E., Hsueh A. Initial and cyclic recruitment of ovarian follicles//Endocrin Rev. 2000; 2: 200–214.
- Ramahi-Ataya A., Ataya K. M., Subramanian M. et al. The effect of ‘activated’ cyclophosphamide on rat granulosa cells in vitro//Reprod Toxicol. 1988; 2: 99–103.
А. И. Гус, доктор медицинских наук, профессор
Л. А. Марченко, доктор медицинских наук, профессор
А. Марченко, доктор медицинских наук, профессор
Н. В. Александрова
З. Т. Габибуллаева
Г. В. Тагиева, кандидат медицинских наук
НЦГАиП, Москва
Диагностика и лечение недостаточности яичников
Недостаточность яичников – это патологическое состояние, возникающее у женщин детородного возраста.
Заболевание характеризуется тем, что яичники не продуцируют необходимое количество эстрогенов, вследствие чего происходит нарушение выработки яйцеклеток и овуляторной функции. При таких условиях зачатие и наступление беременности невозможно, именно поэтому недостаточность яичников считается одной из самых распространенных причин бесплодия.
По происхождению недостаточность яичников может являться физиологической. Это значит, что угасание овариальной функции происходит вследствие естественных возрастных изменений и наступления менопаузы. В остальных случаях речь будет идти о патологической недостаточности яичников, когда нарушения происходят у женщин детородного возраста. В этом случае недостаточность яичников может протекать в следующих формах:
- синдром резистентных яичников – патология, при которой в яичниках содержится адекватное количество фолликулов, но они не развиваются полноценно из-за своей невосприимчивости к воздействию гормонов. Вследствие этого овуляции в организме женщины не происходит;
- синдром истощенных яичников – иногда у достаточно молодых женщин функция яичников может угасать преждевременно. Обычно это происходит вследствие наследственной предрасположенности, различных гинекологических заболеваний, а также перенесенных хирургических операций в области яичников.
Причины недостаточности яичников
Вы должны знать, что недостаточность яичников может развиться под воздействием довольно большого количества факторов, хотя точную причину назвать бывает непросто. Часто подобное патологическое состояние становится следствием перенесенной лучевой или химиотерапии. Первичная недостаточность яичников может развиться вследствие:
Часто подобное патологическое состояние становится следствием перенесенной лучевой или химиотерапии. Первичная недостаточность яичников может развиться вследствие:
- патологий беременности, когда плод подвергался воздействию различных негативных факторов;
- нарушения гормонального баланса в организме женщины, вынашивающей девочку;
- инфекционных заболеваний матери в период беременности;
- генетических заболеваний.
Вторичная недостаточность яичников может возникнуть по еще большему числу причин:
- анорексия, при которой менструации полностью прекращаются;
- дефицит витаминов и питательных веществ;
- нервное перенапряжение, частые стрессы;
- туберкулез половых органов;
- хронические воспалительные заболевания придатков матки;
- травмы головы, при которых произошло повреждение гипофиза или гипоталамуса;
- нарушение кровотока в мозговых артериях.
Проявления заболевания
При недостаточности яичников вы можете наблюдать у себя типичные симптомы, которые сопровождают наступление менопаузы:
- нерегулярные месячные или их отсутствие;
- приливы жара;
- повышенная потливость, особенно в ночное время суток;
- сухость во влагалище;
- повышенная раздражительность;
- перепады настроения;
- снижение либидо.
Мы рекомендуем не откладывать визит в нашу клинику, если подобные клинические проявления вы наблюдаете у себя на протяжении нескольких недель. Наш специалист назначит ряд исследований, которые позволят установить причину патологии и назначит адекватное лечение.
Возможные осложнения
Своевременное лечение недостаточности яичников действительно очень важно, ведь подобное состояние чревато целым рядом серьезных осложнений, одним из которых является бесплодие. Помимо этого у женщин с данным заболеванием возрастает риск развития остеопороза вследствие пониженного уровня эстрогенов в организме. Нехватка этого гормона также способствует депрессивным состояниям, постоянному чувству беспокойства и плохому настроению.
Нехватка этого гормона также способствует депрессивным состояниям, постоянному чувству беспокойства и плохому настроению.
Диагностика и лечение в нашей клинике
После первичного осмотра и сбора вашего подробного анамнеза, врач предложит вам пройти ряд исследований, которые позволят выявить недостаточность яичников и ее возможные причины. Список необходимых исследований может варьироваться в зависимости от индивидуальных показаний, но, как правило, он включает в себя следующие диагностические процедуры:
Так как основной причиной недостаточности яичников обычно становится дефицит в вашем организме эстрогена, лечение патологии проводится с помощью гормональной терапии. Дополнительно в качестве профилактики остеопороза наш доктор может назначить вам препараты кальция и витамина Д. В большинстве случаев своевременно начатое лечение позволяет устранить нарушения и полностью восстановить детородную функцию.
Что касается тяжелых форм бесплодия, вызванных недостаточность яичников, то оптимальным способом его преодоления являются вспомогательные репродуктивные технологии. В нашей клинике вы сможете пройти процедуру ЭКО с использованием донорских яйцеклеток и стать мамой здорового малыша, несмотря на свой пессимистичный диагноз.
Механизм регуляции функции яичника в норме и при гипоталамо-гипофизарной дисфункции.
Симптом бесплодия есть проявление истощения компенсаторных возможностей тех или иных звеньев системы регуляции репродукции. В 50 — 70% случае бесплодие определяется состоянием жены, в 20 — 25% случаев — состоянием мужа. В 10 — 30% случаев встречаются смешанные формы, а в 2 — 5% случаев причина бесплодия не ясна (2). В структуре женского бесплодия эндокринные нарушения встречаются в 35 — 40% случаев, нарушения функции маточных труб — в 30 — 40% случаев, маточные факторы — в 10%, шеечные — в 7 — 10% случаев, влагалищные — в 6%, экстрагенитальные — в 1%, психические — в 1% случаев. Такие или сходные данные приводятся в большинстве руководств по гинекологии (10).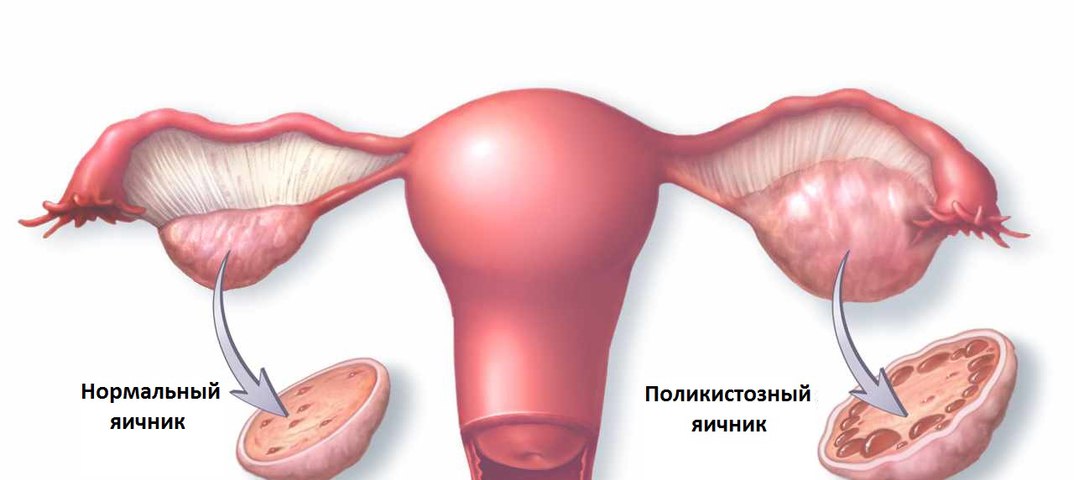
Основой репродуктивной системы женщины является ось гипоталамус — гипофиз — яичник, правильное функционирование которой обеспечивает созревание полноценной яйцеклетки, адекватную подготовку эндометрия к беременности, трубный транспорт гамет, оплодотворение, имплантацию и сохранение ранней беременности.
Высшим органом регуляции гипоталамо-гипофизарно-яичниковой оси является центральная нервная система, путем целого комплекса прямых и обратных связей обеспечивающая стабильность работы системы репродукции при изменении внутренней и внешней среды (14, 21). К настоящему времени открыто более 36 пептидов, регулирующих секрецию Гн-РГ (28). На основании того, что все основные нейроэндокринные круги прямо или косвенно связаны с иммунной системой и кроме эндокринных центров связывают участки мозга с лимфоидной тканью, в настоящее время некоторые исследователи говорят не о нейроэндокринной, а о нейро-иммунно-эндокринной системе регуляции репродукции (30, 33).
Рилизинг-фактором двух главных гонадотропинов, ЛГ и ФСГ, является Гн-РГ, декапептид, синтезированный Schally и Guillemin в 1977 году. Гн-РГ синтезируется в аркуатном ядре медиобазального гипоталамуса и поступает в систему воротного кровотока гипофиза в импульсном режиме. Для обеспечения нормальной секреции гонадотропинов достаточно поддержания стабильной частоты выброса физиологических количеств Гн-РГ. Изменение частоты выброса Гн-РГ меняет не только количество ЛГ и ФСГ, выделяемых гипофизом, но и их соотношение, в то время как даже десятикратное повышение концентрации Гн-РГ ведет только к небольшому снижению выделения ФСГ и никак не меняет секреции ЛГ.
Частота выброса Гн-РГ у человека составляет 1 выброс в 70 — 90 минут и соответствует целому ряду биоритмов (чередованию фаз сна, колебанию скорости клубочковой фильтрации и желудочной секреции, частоте приливов во время климакса и т.д., что подтверждает гипотезу Kleitmann о существовании общего ритма с периодичностью около 90 минут, имеющего связь с базальным циклом покоя — активности (20), который объясняется геофизическими причинами (22, 37). Основными факторами, регулирующими частоту выделения Гн-РГ являются опиаты и альфа-адреноблокаторы (6, 12, 13). Пульсовой генератор ритма — аркуатное ядро — не нуждается для поддержания своей нормальной работы ни в каких влияниях со стороны других отделов нервной системы (1). В физиологических условиях пульсовой генератор получает информацию о выделении гонадотропинов гипофизом по системе короткой обратной связи, так как специальные сфинктеры регулируют градиенты давлений в воротной системе кровотока, и часть крови из гипофиза поступает не в кавернозный синус, а обратно в гипоталамус, что обеспечивает очень высокую местную концентрацию гормонов гипофиза в гипоталамусе (31). Синтез и секреция ЛГ и ФСГ в гипофизе осуществляются одними и теми же клетками (7). На поверхности гонадотропов имеются рецепторы к Гн-РГ, плотность которых зависит от уровня стероидных гормонов в крови и от концентрации Гн-РГ. Соединение Гн-РГ с рецептором вызывает массивное поступление ионов кальция внутрь клетки, что через несколько минут ведет к выбросу запаса ЛГ и ФСГ в кровоток. Кроме того, Гн-РГ вызывает стимуляцию синтеза ЛГ и ФСГ и поддерживает целостность гонадотропов (40). Изменения частоты пульсового генератора меняет соотношение ЛГ и ФСГ, выделяемых гипофизом (24). Так, повышение ритма ведет к значительному повышению выброса ФСГ и к снижению выброса ЛГ. Частотная модуляция информации обеспечивает быстроту и надежность регуляции репродуктивной системы и ее устойчивость к помехам (4, 36). В лютеиновую фазу прогестерон через эндогенные опиаты урежает частоту пульсового генератора, причем данное действие определяется не концентрацией прогестерона, а длительностью его воздействия. Эстрадиол, действуя на гипоталамус и на гонадотропы (увеличение плотности рецепторов Гн-РГ), повышает амплитуду волны ЛГ /ФСГ (16, 39).
Основными факторами, регулирующими частоту выделения Гн-РГ являются опиаты и альфа-адреноблокаторы (6, 12, 13). Пульсовой генератор ритма — аркуатное ядро — не нуждается для поддержания своей нормальной работы ни в каких влияниях со стороны других отделов нервной системы (1). В физиологических условиях пульсовой генератор получает информацию о выделении гонадотропинов гипофизом по системе короткой обратной связи, так как специальные сфинктеры регулируют градиенты давлений в воротной системе кровотока, и часть крови из гипофиза поступает не в кавернозный синус, а обратно в гипоталамус, что обеспечивает очень высокую местную концентрацию гормонов гипофиза в гипоталамусе (31). Синтез и секреция ЛГ и ФСГ в гипофизе осуществляются одними и теми же клетками (7). На поверхности гонадотропов имеются рецепторы к Гн-РГ, плотность которых зависит от уровня стероидных гормонов в крови и от концентрации Гн-РГ. Соединение Гн-РГ с рецептором вызывает массивное поступление ионов кальция внутрь клетки, что через несколько минут ведет к выбросу запаса ЛГ и ФСГ в кровоток. Кроме того, Гн-РГ вызывает стимуляцию синтеза ЛГ и ФСГ и поддерживает целостность гонадотропов (40). Изменения частоты пульсового генератора меняет соотношение ЛГ и ФСГ, выделяемых гипофизом (24). Так, повышение ритма ведет к значительному повышению выброса ФСГ и к снижению выброса ЛГ. Частотная модуляция информации обеспечивает быстроту и надежность регуляции репродуктивной системы и ее устойчивость к помехам (4, 36). В лютеиновую фазу прогестерон через эндогенные опиаты урежает частоту пульсового генератора, причем данное действие определяется не концентрацией прогестерона, а длительностью его воздействия. Эстрадиол, действуя на гипоталамус и на гонадотропы (увеличение плотности рецепторов Гн-РГ), повышает амплитуду волны ЛГ /ФСГ (16, 39).
Прогестерон стимулирует образование в гипоталамусе ингибитора, устраняющего данное влияние эстрадиола (29, 35). Таким образом исключается возможность пика ЛГ в лютеиновую фазу, что могло бы нарушить созревание когорты фолликулов для следующего менструального цикла (11).
Гонадотропины являются главными регуляторами синтеза и секреции половых стероидов. Местом выработки половых стероидов в организме могут быть фолликулярный комплекс (тека интерна, тека экстерна, гранулеза и ооцит), желтое тело и строма яичника. Полноценность циклических изменений, обеспечивающих подготовку организма женщины к беременности, определяется качеством селекции и созревания доминантного фолликула. Основные закономерности фолликулогенеза были установлены рабочей группой профессора Ходжена на рубеже 1970-х и 1980-х годов (11). Ими были предложены термины рекрутирование, когорта, селекция, установление доминантности. Рекрутированием назван процесс перехода фолликулов из примордиальной стадии в антральную, так как только с этого времени процесс созревания становится зависимым от действия гонадотропинов. Процесс рекрутирования определяется внутрияичниковыми факторами и происходит постоянно, но образовать когорту — группу фолликулов, из которой выделится доминантный — смогут только те фолликулы, которые рекрутируются в последние 4 дня лютеиновой фазы предыдущего цикла (39). Число рекрутируемых фолликулов определяется скорее всего уровнем гонадотропинов в позднюю лютеиновую фазу и локальной концентрацией прогестерона в яичнике, что объясняет чередование овуляции в правом и в левом яичниках. Рост когорты фолликулов в раннюю фолликулярную фазу объясняется благоприятными условиями соотношения ЛГ и ФСГ и локальных концентраций эстрогенов и андрогенов. Действие ЛГ и ФСГ на фолликул строго специализировано: ЛГ стимулирует процесс синтеза андрогенов de novo клетками теки и практически не действует на клетки гранулезы, а ФСГ активирует ароматазную систему гранулезы, превращающую синтезированные в теке андрогены в эстрадиол (15).
Эстрогены и ФСГ тормозят атрезию преантрального фолликула и стимулируют пролиферацию клеток гранулезы, синтез рецепторов к ФСГ и индукцию рецепторов к ЛГ, начинающуюся на периферии фолликула и идущую к центру. Появление рецепторов к ЛГ в клетках гранулезы больших фолликулов является предпосылкой для синтеза прогестерона желтым телом. ЛГ через стимуляцию андрогенного синтеза ограничивает и уменьшает синтез рецепторов к ФСГ, ЛГ, эстрадиолу в клетках фолликула. Синергизм действия ЛГ и ФСГ в раннюю фолликулярную фазу вызывает значительное усиление секреции эстрогенов яичником. Это в свою очередь индуцирует повышение индекса ЛГ/ФСГ, что смещает синтез половых стероидов в фолликулах в сторону преимущественного образования андрогенов. При нормальном развитии событий к 8 дню менструального цикла заканчивается селекция доминантного фолликула, главным свойством которого является способность усиливать эстрогенную продукцию в условиях дефицита ФСГ и полностью подавлять развитие других фолликулов когорты с помощью внутрияичниковых и гипоталамо-гипофизарных связей (8, 11, 18, 42). Если по какой-либо причине доминантный фолликул гибнет, должен вновь произойти рекрутский набор, так как ни один другой фолликул данной когорты не сможет принять на себя роль доминантного. Важную роль в процессе подавления других фолликулов играет полипептидный регулятор ингибин, избирательно подавляющий секрецию ФСГ, и фолликул-регулирующий протеин, избирательно подавляющий ароматазную активность гранулезы.
ЛГ через стимуляцию андрогенного синтеза ограничивает и уменьшает синтез рецепторов к ФСГ, ЛГ, эстрадиолу в клетках фолликула. Синергизм действия ЛГ и ФСГ в раннюю фолликулярную фазу вызывает значительное усиление секреции эстрогенов яичником. Это в свою очередь индуцирует повышение индекса ЛГ/ФСГ, что смещает синтез половых стероидов в фолликулах в сторону преимущественного образования андрогенов. При нормальном развитии событий к 8 дню менструального цикла заканчивается селекция доминантного фолликула, главным свойством которого является способность усиливать эстрогенную продукцию в условиях дефицита ФСГ и полностью подавлять развитие других фолликулов когорты с помощью внутрияичниковых и гипоталамо-гипофизарных связей (8, 11, 18, 42). Если по какой-либо причине доминантный фолликул гибнет, должен вновь произойти рекрутский набор, так как ни один другой фолликул данной когорты не сможет принять на себя роль доминантного. Важную роль в процессе подавления других фолликулов играет полипептидный регулятор ингибин, избирательно подавляющий секрецию ФСГ, и фолликул-регулирующий протеин, избирательно подавляющий ароматазную активность гранулезы.
На 12 — 14 день цикла доминантный фолликул отвечает почти за всю продукцию эстрадиола в больших количествах, что вызывает пик ЛГ и ФСГ, являющийся причиной овуляции.
Важное значение для нормальной работы желтого тела имеет пик ФСГ в середине цикла, обеспечивающий индукцию синтеза рецепторов к ЛГ в клетках гранулезы преовуляторного фолликула.
У здоровых женщин правильное развитие доминантного фолликула вызывает:
- адекватную продукцию эстрадиола, обеспечивающую созревание эндометрия и накопление в его эпителии рецепторов к прогестерону и созревание шеечной слизи;
- полноценную овуляцию;
- подготовку рецепторов к ЛГ в гранулезе, долженствующей превратиться в желтое тело.
Таким образом, качество лютеиновой фазы определяется прежде всего процессами, происходящими в первую фазу цикла. По классификации ВОЗ 1976 года все нарушения эндокринной функции яичников делятся на 7 больших групп:
По классификации ВОЗ 1976 года все нарушения эндокринной функции яичников делятся на 7 больших групп:
- гипогонадотропная нормопролактинемическая недостаточность;
- нормогонадотропная нормопролактинемическая недостаточность;
- гипергонадотропная недостаточность;
- анатомическая форма аменореи;
- гиперпролактинемии;
- гиперпролактинемии;
- объемные процессы в гипоталамо-гипофизарной области, не меняющие секрецию пролактина (5).
Подавляющее большинство больных с нарушением функции яичников, обращающихся по поводу бесплодия, относятся ко 2-й группе нарушений по классификации ВОЗ — эугонадотропной гипоталамо-гипофизарной дисфункции. Клинически в данной группе можно выделить подгруппу 2а — больные со спонтанными менструальными циклами — и подгруппу 2б — больные с аменореей. Для больных подгруппы 2а характерны недостаточность лютеиновой фазы вследствие нарушения созревания доминантного фолликула, нарушения овуляции и нарушения функции желтого тела, а также ановуляторные менструальные циклы, отличающиеся тем, что доминантный фолликул созревает, но не овулирует, в период атрезии доминантного фолликула происходит лютеинизация гранулезы и теки, сопровождающиеся резко сниженной продукцией прогестерона. Базальная температура при этом или не повышается, или повышается незначительно.
Недостаточность лютеиновой фазы, ановуляция и аменорея как правило являются выражением степени эндокринных нарушений и часто выступают как стадии одной процесса (34).
Типичным выражением яичниковой недостаточности 2-го типа является повышение отношения ЛГ/ФСГ, сопровождается небольшой (в сравнении с гормон-продуцирующими опухолями) надпочечниковой и /или яичниковой гиперсекрецией андрогенов (5). Традиционно такие формы гипоталамо-гипофизарно-яичниковой дисфункции относили к синдрому поликистозных яичников. Однако данный термин оспаривается рядом авторов. С одной стороны, увеличение яичников может иметь место при синдроме Кушинга, андрено-генитальном синдроме, при гормон-продуцирующих опухолях, а иногда — у здоровых подростков. С другой стороны, у женщин с типичными проявлениями данного синдрома могут быть яичники нормальных размеров. Кроме того, при данном синдроме анатомические изменения яичников являются только следствием нарушенных гормональных взаимодействий в организме.
С одной стороны, увеличение яичников может иметь место при синдроме Кушинга, андрено-генитальном синдроме, при гормон-продуцирующих опухолях, а иногда — у здоровых подростков. С другой стороны, у женщин с типичными проявлениями данного синдрома могут быть яичники нормальных размеров. Кроме того, при данном синдроме анатомические изменения яичников являются только следствием нарушенных гормональных взаимодействий в организме.
Поэтому предлагается называть данный вид патологии синдромом гиперандрогении с хронической ановуляцией (19). Со стороны гормональных изменений самыми характерными признаками являются значение отношения ЛГ/ФСГ больше 2 и повышение уровня андрогенов (тестостерона, андростендиона и ДГЭА-С) в периферической крови (17).
По сравнению со здоровыми женщинами, у которых главным эстрогеном в циркулирующей крови является эстрадиол, у женщин с синдромом гиперандрогении значительно повышен уровень эстрона, который может превышать концентрацию эстрадиола. Главным источником повышения уровня эстрона у таких больных является периферическая ароматизация андростендиона. Постоянная и монотонная продукция эстрона сенсибилизирует гипофиз к действию Гн-РГ, следствием чего является повышение отношения ЛГ/ФСГ, секретируемых гипофизом. В свою очередь, высокий уровень ЛГ ведет к чрезмерной стимуляции стромы яичника и теки, результатом чего является чрезмерная продукция андрогенов. В этих условиях резко нарушаются как процесс селекции доминантного фолликула, так и его полноценность, что ведет к опсоменорее, ановуляции, недостаточности лютеиновой фазы и к аменорее (9, 27).
Гипоталамо-гипофизарная дисфункция при II типе яичниковой недостаточности является чисто функциональным нарушением, при котором нарушается положительная обратная связь. Этиология синдрома гиперандрогении с хронической ановуляцией до сих пор не известна. Доказано, что важную роль в развитии синдрома играют наследственность, центральные нарушения катехоламинов, психический стресс и ожирение (32).
Важную роль в развитии заболевания придают дисфункции коры надпочечников. У значительной части больных надпочечники очень чувствительны к стимуляции АКТГ. В связи с этим высказана гипотеза о секреции гипофизом специфического гормона, стимулирующего андрогены коры надпочечников с молекулярным весом около 60 000 (32). Часть больных является гетерозиготными носительницами дефекта С-21-гидроксилазы (38).
Кроме того, повышенную продукцию андрогенов клетками теки может вызвать и повышенный уровень инсулина за счет перекрытия специфичности инсулина и локальных факторов роста (3). Следовательно, гирсутизм и гиперандрогения могут быть проявлением глубоких метаболических расстройств.
Для гиперандрогенной недостаточности яичников характерно повышение амплитуды и частоты залпов ЛГ гипофиза (41).
Важную роль в патогенезе играет влияние андрогенов на уровень белка, связывающего тестостерон и эстрогены (ТЭСГ). При гиперандрогении и ожирении синтез ТЭСГ в печени снижается, что ведет к повышению активных концентраций эстрогенов и тестостерона в крови, в результате чего проявления гиперандрогении усиливаются. Есть указания на то, что важную роль в развитии синдрома играют ненаследственные внутриутробные влияния, и что гиперандрогения у матери может оказывать неблагоприятное влияние на созревание различных ферментных систем плода (25). При синдроме гиперандрогении меняется соотношение норадреналина и допамина, и возникающий дефицит допамина ведет к усилению выброса ЛГ.
Нарушение развития доминантного фолликула и овуляции при нормогонадотропной недостаточности яичников ведет к развитию НЛФ (23).
Выделяют 5 причин развития НЛФ: нарушение созревания фолликула; недостаточная стимуляция ЛГ во 2- фазу цикла; недостаточная и /или запоздалая лютеинизация преовуляторного фолликула; мягкие формы гиперпролактинемии; гиперандрогении различного происхождения (23). Гормональным проявлением НЛФ является снижение продукции прогестерона желтым телом, сопровождающееся нормальной или повышенной секрецией эстрадиола (относительная гиперэстрогения). На клеточном уровне НЛФ проявляется усилением клеточных делений (эндрометрий, молочная железа, миометрий). Клинически НЛФ проявляется предменструальным синдромом, нарушениями менструального цикла, снижением фертильности, доброкачественными опухолями молочных желез и миомой матки. Причинами бесплодия при НЛФ являются недостаточная зрелость эндометрия, затрудняющая нормальную имплантацию и недостаточный для поддержки ранней беременности уровень прогестерона (26).
На клеточном уровне НЛФ проявляется усилением клеточных делений (эндрометрий, молочная железа, миометрий). Клинически НЛФ проявляется предменструальным синдромом, нарушениями менструального цикла, снижением фертильности, доброкачественными опухолями молочных желез и миомой матки. Причинами бесплодия при НЛФ являются недостаточная зрелость эндометрия, затрудняющая нормальную имплантацию и недостаточный для поддержки ранней беременности уровень прогестерона (26).
- The arcuate nucleus and the control of gonadotropin and prolactin secretion in the female rhesus monkey (Macaca mulatta). -Plant T.M., Krey L.S., Moossy J., McCormack J.T., Hess D.L., Knobil E. //Endocrinology, 1978, v. 102, N 1, p. 52-62.
- Baltzer J., Mickan H. Kern Gynäkologie. 4. Aufl. Stuttgart: Thieme, 1985. -685 S.
- Barbieri R.L., Ryan K.J. Hyperandrogenism, insulin resistance and acanthosis nigrans syndrome: A common endocrinopathy with distinct pathophysiologic features. //American Journal of Obstetrics and Gynecology, 1983, v. 147, N 1, p. 90-101.
- Bohumil R.J. Pulsatile variations in hormone levels. //Biorythms and human reproduction. — Ferin M., Halberg F.,Richart R. M., Van de Wiele R. L. (Eds) New York: Wiley, 1974, p. 107-131.
- Breckwoldt M. Störungen der Ovarialfunktion. //Reproduktionsmedizin. -Bettendorf J., Breckwoldt M. (Hrsg.). Stuttgart; New York: Fisher, 1989, S. 258-266.
- Central electrophysiological correlates of pulsatile luteinizing hormone secretion in the rhesus monkey. -Wilson R. S., Kesner J.S., Kaufman J.M,, Uemura T., Akema T., Knobil E. //Neuroendocrinology, 1984, v. 39, N 3, p. 256-260.
- Childs G.V. Functional ultrastructure of gonadotropes: a review. //Morfology of hypothalamus and its connections. -Ganten D., Pfaff D. (Eds.). Berlin: Springer, 1986, p. 49-98.
- Correlation of human follicular fluid inhibin activity with spontaneous an
- Davis O.K., Ravnikar V. Induction of ovulation with Clomiphen Citrate. //Reproductive endocrine therapeutics. – Barbiery L., Schiff I. (Eds.). New York: A.R. Liss, Inc., 1988, p. 1-24.
- Diedrich K., Wildt L. Neue Wege in der Behandlung ovarieller Funktionsstorungen. Teil 1. //Neue Wege in der Diagnostik und Therapie der Weiblichen Sterilität. -Diedrich K., Hrsg. -Stuttgart: F. Enke, 1987, p. 26-40.
- DiZerega G.G., Hodgen G.D. Folliculogenesis in the primate ovarian cycle. //Endocrine review 1981, v. 2, N 1, p. 27-49.
- The effect of morphine on the electrophysiological activity of the hypothalamic luteinizing hormone-releasing hormone pulse generator in the rhesus monkey. -Kesner J.S., Kaufman G., Wilson R. C., Kuroda G., Knobil E. //Neuroendocrinology, 1986, v. 43, N 6, p. 486-488.
- Electrophisiological manifestation of luteinizing hormone releasing hormone pulse generator activity in the rhesus monkey: influence of a adrenergic and dopaminergic blocking agents. -Kaufman J.M., Kesner J.S., Wilson R.S., Knobil E. //Endocrinology, 1985, v. 116, N 4, p. 1327-1333.
- Everett J.W. Central neural control of reproductive functions of the adenohypophysis. //Physiology review, 1964, v. 44, p. 373-431.
- Falck B. Site of production of estrogens in rat ovary as studied by microtransplants. //Acta physiologica Scandinavica, 1959, v. 163, N 1, p. 1.
- Ferin M., van Vugt D., Wardlaw S. The hypothalamic control of the menstrual cycle and the role of endogenous opioid peptides. //Recent progress in hormone research, 1984, v. 40, p. 441-485.
- Givens J.R., Andersen R.N., Umstot E.S. Clinical findings and hormonal responses in patients with polycystic ovarian disease with normal versus elevated LH levels.
 //Obstetrics and gynecology, 1976, v. 47, N 4, p. 388-394.
//Obstetrics and gynecology, 1976, v. 47, N 4, p. 388-394. - Hoffmann F. Untersuchunden über die hormonale Regulation der Follikelreifung im Zyklus der Frau. //Geburtshilfe und Frauerheilkunde, 1961, Bd. 21, S. 554-560.
- Infertility, contraception and reproductive endocrinology. Ed. by D.R. Mishell, Jr.; V. Davaian, 2-nd edition. — Oradell: Medical Economics Books, 1986. -IX, 688 p.
- Kleitmann N. Sleep and wakefulness. — Chicago: Chicago University Press, 1963. -250 p.
- Lakoski J.M. Cellular electrophysiologycal approaches to the central regulation of female reproductive aging. //Neural control of reproductive function. -J.M. Lakoski, J.R. Perez-Polo, D.K.Rassin (Eds.). -New York: Liss, 1989, p. 209-220.
- Lavie P., Kripke D.F. Ultradian circa 1½ hour rhythms: A multioscillatory system. //Life sciences, 1981, v. 29, N 24, p. 2445-2450.
- Lobo R.A. Polycystic ovary syndrome. //Infertility, contraception and reproductive endocrinology. Ed. by D.R. Mishell, Jr. and V. Davajan, 2-nd edition. — Oradell: Medical Economics Books, 1986, p. 319-336.
- Leyendecker G., Wildt L., Plotz E.J. Die hypothamische Ovarialinsuffizienz.//Gynäkologe, 1981, Bd. 14, N 2, S. 84-103.
- Lobo R.A. Polycystic ovary syndrome. //Infertility, contraception and reproductive endocrinology. Ed. by D.R. Mishell, Jr. and V. Davajan, 2-nd edition. — Oradell: Medical Economics Books, 1986, p. 319-336.
- Mauvais-Jarvis P., Kutten F. Insuffisance gonadotrope dissociée (anovulation et dysovulation)
- The microinvironment of the human antral follicle: Interrelationships among the steroid levels in human antral fluid, the population of granulosa cells and the status of the oocyte in vivo and in vitro.
 -McNatty K.P., Smith D.M., Makris A., Osathanonolh R., Ryan K.J. //Journal of clinical endocrinology and metabolism, 1979, v. 49, N 6, p. 851-860.
-McNatty K.P., Smith D.M., Makris A., Osathanonolh R., Ryan K.J. //Journal of clinical endocrinology and metabolism, 1979, v. 49, N 6, p. 851-860. - Miller B.T. Peptide modulation of luteinizing hormone releasing hormone secretion. //Neural control of reproductive function. -J.M. Lakoski, J.R. Perez-Polo, D.K. Rassin (Eds.). New York: A.R.Liss, Inc., 1989, p. 255-271.
- Mode of action of progesterone in the blocade of gonadotropin surges in the rhesus monkey. -Pohl C.R., Richardson W.D., Marshall G., Knobil E. //Endocrinology, 1982, v. 110, N 4, p. 1454-1455.
- The Neuro-immune-endocrine connection. — Cotman C., Brinton R.E., Galaburda A., McEwen B.C. -New York: Raven Press, 1986. -150 p.
- Page R.B. Pituitary blood flow. //American journal of physiology, 1982, v. 243, N 6, p. 427-442.
- Parker L.N., Odell W.B. Control of adrenal androgen secretion. //Endocrine review, 1980, v. 1, N 4, p. 392-410.
- Perez-Polo J.R. Introduction: Neuroimmune modulation of reproductive function. //Neural control of reproductive function. -J.M. Lakoski, J.R. Perez-Polo, D.K. Rassin (Eds.). -New York: A.R. Liss, 1989, p. 307-309.
- Plotz E.J. Differentialdiagnose und Therapie ovarieller Funktionsstörungen: Richtlinien fur die Praxis. //Gynäkologe, 1981, Bd. 14, N 2, S. 145-148.
- The pulsatile pattern of gonadotropin secretion and follicular development durung the menstrual cycle and in women with hypothalamic and hyperandrogenic amenorrhea. -Wildt L., Schwilden H., Werner G., Roll C., Brensing K.A., Vuckhaus J., Böhr M., Leyendecker G. //Brain and pituitary peptides II. — G. Leyendecker, H. Stock, L. Wildt (Eds.). -Basel: Karger, 1983, p. 28-36
- Rushton W.A.H. Peripheral coding in the nervous system. //Sensory communication. -W.A. Rosenblith (Ed.). -New York: Wiley, 1961, p. 20-30.

- Shapiro S. Compass on the 90-minutes sleep-dream cycle. //Sleep and dreaming. -Hartman E. (Ed.) -Boston: Little and Brown, 1970, p. 40-49.
- An update of congenital adrenal hyperplasia. — New M.I., Dupont B., Pang S., Pollack M., Levine S.L. // Recent progress in hormone research, 1981, v. 37, p. 105-181.
- Wildt L. Die endokrine Kontrolle der Ovarialfunktion und die Pathologie endokriner Ovarialfunktionsstörungen. // Neue Wege in Diagnostik und Therapie der weiblichen Sterilität. -Hrsg. von K. Diedrich. — Stuttgart: Enke, 1987, S. 1-25.
- Wildt L. Hypothalamus. //Reproduktionsmedizin. — Hrsg. von Bettendorf G., Breckwoldt M. — Stuttgart: Fischer, 1989, S. 6-22.
- Yen S.S.C. The polycystic ovary syndrome. //Clinical endocrinology, 1980, v. 12, N 2, p. 177-207.
- Zeleznik A.J., Schuler H.M., Reichert L.C., Jr. Gonadotropin binding sites in the rhesus monkey ovary: Role of the vasculature in the selective distribution of human chorionic gonadotropin to the preovulatory follicle. //Endocrinology, 1981, v. 109, N 2, p. 356-362.
d induced follicular maturation. -Murrs R.P., Lobo J.D., Campeau J.D., Nakamura R.M., Brown J., Ujita E.L., DiZerega G.S. //Journal of Clinical Endocrinology and Metabolism, 1987, v. 64, N 1, p. 148-152.
-Murrs R.P., Lobo J.D., Campeau J.D., Nakamura R.M., Brown J., Ujita E.L., DiZerega G.S. //Journal of Clinical Endocrinology and Metabolism, 1987, v. 64, N 1, p. 148-152.
. //Médecine de la reproduction. Gynécologie endocrinienne. -Paris: Flammarion, 1982, p. 305-319.
.
Теги:
менструальный цикл
Клиники Чайка — Chaika.com
Первичная яичниковая недостаточность (ПЯН) — это состояние у женщин в возрасте до 40 лет, при котором яичники перестают функционировать нормально — останавливается выработка яйцеклеток или они формируются крайне редко, прерывается выработка гормонов эстрогена, прогестерона и тестостерона. Раньше это состояние называли «преждевременным яичниковым истощением», однако это определение неверно, поскольку у женщин с ПЯН яичники не всегда отключаются полностью.
Диагноз ПЯН не обязательно означает, что беременность совсем невозможна.
Причины заболевания
- Генетические факторы. ПЯН может наступать в результате болезней, связанных с аномальным набором хромосом или аномалиями индивидуальных генов.
 Чаще всего генетической причиной ПЯН становится синдром Тернера — 45Х, когда вместо обычных двух половых Х-хромосом, имеется одна.
Чаще всего генетической причиной ПЯН становится синдром Тернера — 45Х, когда вместо обычных двух половых Х-хромосом, имеется одна. - Токсические факторы. Химиотерапия и лучевая терапия — частые причины ПЯН.
- Аутоиммунные факторы. В норме функция иммунной системы заключается в идентификации и разрушении «чужих» или аномальных «своих» клеток, измененных под влиянием инфекций или опухолевого процесса. Но иногда в результате сбоя иммунная система начинает атаковать здоровые клетки организма. Так, в некоторых случаях она ошибочно атакует гормон-продуцирующие органы — например, надпочечники, щитовидную железу или яичники, провоцируя таким образом развитие ПЯН.
Симптомы
У большинства женщин до начала развития яичниковой недостаточности отмечался период нормального полового созревания и был регулярный менструальный цикл. Наиболее частым признаком, заставляющим женщин обратиться к врачу, является отсутствие или нерегулярные менструации. У некоторых женщин менструация прекращается или становится нерегулярной после отмены приема оральных контрацептивов, однако это не означает, что прием оральных контрацептивов стал причиной ПЯН — просто пока женщина принимала их, она не замечала признаков болезни.
Другие симптомы ПЯН включают приливы жара, ночную потливость, сухость во влагалище и вследствие нее болезненные ощущения при половом контакте.
ее виды, какие симптомы и как лечат
Содержание
Когда женщина приближается к менопаузе, происходит постепенное прекращение функции яичников, что приводит к дефициту эстрогенов и снижению фертильности. Это происходит на фоне повышения уровня гонадотропина. Средний возраст этого природного явления составляет 50 лет (стандартное отклонение 4 года). Когда менопауза возникает в возрасте до 40 лет, она считается преждевременной и известна как синдром преждевременной недостаточности яичников. Широко используемое определение преждевременная недостаточность яичников — это не менее 4 месяцев аменореи и двукратное увеличение уровня фолликулостимулирующего гормона, установленное лабораторными исследованиями с интервалом по меньшей мере в 1 месяц.
Синдром преждевременной недостаточности яичников является наиболее широко признанным термином, но были предложены несколько альтернатив, таких как первичная недостаточность яичников и преждевременный отказ яичников.
Термин первичная недостаточность яичников свидетельствует о необратимости состояния овариальной несостоятельности, что бывает не совсем верно.
Фолликулярный резерв яичников колеблется примерно у 50% женщин с синдромом преждевременной недостаточности яичников и 5-10% женщин с этим диагнозом способны рано или поздно при должной терапии зачать. Кроме того, термин «отказ» имеет отрицательное значение и вносит ощущение безнадежности, что не помогает женщине принять свой диагноз.
Фолликулярная недостаточность яичников у женщин
Что же такое недостаточность яичников? Это такое состояние репродуктивной системы женщины, при котором по тем или иным причинам железистая ткань яичника больше не способна выполнять свои функции, а именно обеспечивать цикличное созревание фолликулов и продуцировать стероидные половые гормоны.
У большинства женщин с синдромом преждевременного истощения яичников не выявлено никакой причины данного заболевания, но с достижениями прогресса в области генетики и эндокринологии наше понимание патофизиологии этого клинического состояния постоянно улучшается.
К сожалению, с каждым годом преждевременная недостаточность яичников становится все более часто встречающимся состоянием. Такую тенденцию к росту можно объяснить увеличением числа девочек, перенесших в детстве химиотерапию, и победивших онкологию. К сожалению, расплатой за долгую жизнь у таких пациенток становится ранняя менопауза и нереализованная репродуктивная функция.
Несмотря на то, что все больше женщин с каждым годом узнает на личном опыте яичниковая недостаточность, что это такое, этиология данного состояния до сих пор в полной мере неизвестна. Установить конкретную причину удается установить не чаще чем в 10-15% случаев. Основным патогенетическим звеном данного заболевания вероятнее всего является уменьшение фолликулярного пула яичников.
Основным патогенетическим звеном данного заболевания вероятнее всего является уменьшение фолликулярного пула яичников.
Основным направлением лечения недостаточности яичников является надлежащее консультирование, психологическая поддержка и заместительная гормональная терапия, которую следует рекомендовать всем женщинам.
Первичная недостаточность яичников
Первичная недостаточность яичников приводит к репродуктивным проблемам, более ранней встрече с симптомами менопаузы и постменопаузальным осложнениям. Существует три возможных механизма развития синдрома преждевременного истощения яичников, а именно: ускорение апоптоза, блокирование фолликулярного созревания и преждевременная активация фолликулов.
Первичная яичниковая недостаточность что это такое? Первичная овариальная недостаточность определяется как появление аменореи (в течение 4 месяцев и более) до 40 лет у женщин с увеличением показателя фолликулостимулирующего гормона в сыворотке крови до постменопаузального уровня, а уровень эстрадиола при этом критически низок. При данном патологическом состоянии, определяющим звеном патогенеза является нарушение на уровне яичников, в то время как регулирующие структуры работают в нормальном режиме.
Первичная недостаточность яичников не является общей причиной бесплодия, но это и не редкость. Психосоциальные и репродуктивные проблемы, а также долгосрочные риски, связанные с синдромом преждевременной недостаточности яичников, осложняют жизнь не менее 1,65-1,85% женского населения земного шара.
Нормопролактинемическая
Преждевременная недостаточность яичников представляет собой потерю функции яичников до 40 лет. Обычно определяющей триадой для диагностики является аменорея, гипергонадотропность и гипоэстрогенизм. Если у данного состояния есть генетическая причина, его можно назвать гонадальным дисгенезом, если помимо повешенного уровня гонадотропинов не происходит повышения уровня пролактина, такое состояние носит название нормопролактинемическая недостаточность яичников
Существует различная терминология в отношении концепции синдрома раннего истощения яичников, и это может создать некоторую путаницу, учитывая тот факт, что не каждый термин имеет одни и те же характеристики.
Когда менструация прекращается из-за истощения фолликулов яичников до 40 лет, или если есть недостаток ответа фолликулов яичников на гормональный стимул гонадотропинов, у нас будет преждевременная недостаточность яичников.
Редкой разновидностью преждевременной недостаточности яичников является недостаточность яичников нормогонадотропная. Это такое состояние, при котором не происходит повышения уровня фолликулостимулирующего гормона в ответ на снижение продукции эстрогенов железистой тканью яичников.
Гипергонадотропная недостаточность яичников
Гипергонадотропная недостаточность яичников характеризуется повешением уровня фолликулостимулирующего гормона, порой до очень высоких цифр, и при этом отсутствием ответа от яичников на эту стимуляцию. Данное состояние может возникать по двум ведущим причинам. Первое, фолликулярный аппарат яичников истощен вследствие оперативного вмешательства или химиотерапии, и у них не осталось резервов для ответа на стимулирующее действие гипофиза. Второе, ткань яичника по каким-то причинам утратила рецепторы к гонадотропинам и из-за этого не может функционировать должным образом.
Нормогонадотропная
Нормогонадотропная нормопролактинемическая недостаточность яичников – разновидность несостоятельности железистой ткани яичника, которой свойственен нормальный показатель фолликулостимулирующего гормона (ФСГ) в сыворотке крови. По данным Всемирной ассоциации сексуального здоровья, это заболевание встречается у 85% женщин с нарушением функции женских половых желез. К заболеваниям, чаще всего приводящим к развитию данного вида несостоятельности яичников, относят болезнь Штейна-Левенталя, аденомиоз, врожденную гипертрофию коры надпочечников, аутоиммунный сальпингоофорит, врожденный и приобретенный гипотиреоз и другую сопутствующую патологию.
Гипогонадоторпная
Гипогонадотропная недостаточность яичников или гипогонадротропный гипогонадизм – это состояние, связанная с нарушением функции гипофиза или гипоталамуса, характеризующееся снижением продукции половых гормонов яичниками.
Гипогонадотропная недостаточность яичников вызвана отсутствием гормонов, которые обычно стимулируют яичники: гонадотропин-релизинг гормон, фолликулостимулирующий гормон (ФСГ) и лютеинизирующий гормон (ЛГ). Гипогонадизм чаще всего вызван рядом патологических процессов, но может также возникать как часть различных врожденных синдромов.
Причины гипогонадизма включают следующее: опухоли головного мозга и гипофиза, инфильтративные заболевания, инфекции, травмы головы, употребление наркотиков, функциональный дефицит, системное заболевание, нарушение питания, гипотиреоз, гиперпролактинемия, сахарный диабет и болезнь Кушинга.
Гипогонадротропный гипогонадизм является редким заболеванием. Первым шагом в оценке этих пациентов должен быть тщательный физический осмотр и сбор анамнеза.
Осложнения диагноза фолликулярная недостаточность яичников у нелеченных женщин включают:
- нарушения менструального цикла
- ранняя менопауза
- бесплодие
- остеопороз
- низкое либидо
Симптомы
При диагнозе недостаточность яичников симптомы и признаки сходны с симптомами менопаузы и типичны для дефицита эстрогена.
Первым признаком недостаточности обычно является изменение нормальной картины ваших месячных. В конце концов, месячные со временем прекратятся совсем. С нарушением менструального цикла тесно связаны проблемы с фертильностью.
Около 8 из каждых 10 женщин будут иметь дополнительные симптомы в течение некоторого времени до и после прекращения месячных. Это может оказать значительное влияние на повседневную жизнь некоторых женщин.
Общие симптомы включают:
Лечение
Решение о том, использовать ли вам при диагнозе недостаточность яичников лечение или нет, зависит от того, насколько ваши симптомы мешают вашей повседневной жизни, и есть ли у вас необходимость снизить риск раннего возникновения сердечно-сосудистых заболеваний и остеопороза.
Лечение гормонозаместительной терапией (ЗГТ) рекомендуется для уменьшения тяжелых симптомов и снижения долгосрочных рисков для здоровья, связанных с недостаточностью яичников, таких как остеопороз. Тем не менее, другие методы лечения могут быть рекомендованы для купирования симптомов умеренной степени выраженности или если есть противопоказания к заместительной гормональной терапии, такие как рак молочной железы
Обсудите эти варианты с вашим врачом, чтобы вы могли выбрать подходящее именно вам лечение диагноза преждевременная недостаточность яичников.
Можно добиться уменьшения некоторых симптомов всего лишь внеся изменения в ваш образ жизни:
- придерживаться сбалансированной диеты;
- держать свое тело и разум в тонусе;
- активно использовать расслабляющие дыхательные техники;
- снизить потребление кофе, заменив его травяными чаями с фитоэстрогнами;
- отказаться от курения и крепкого алкоголя.
Недостаточность яичников и беременность
Пока женщина все еще менструирует, она может забеременеть. Даже если у нее уже есть какая-либо форма нарушения менструального цикла, беременность все еще возможна, хотя и не вероятна.
Женщины, которые испытывают недостаточность яичников и планирующие беременность, должны как можно скорее проконсультироваться со специалистом в области репродуктивного здоровья, чтобы рассмотреть все возможные варианты.
Одним из популярных подходов является использование экстракорпорального оплодотворения. Для женщин, ищущих более естественный вариант, может быть предложено использовать фитоэстрогенны, которые могут увеличить фертильность.
Видео : Преждевременная недостаточность яичников
Prezhdevremennaya nedostatochnost’ funktsii yaichnikov: patogenez, diagnostika i zamestitel’naya gormonal’naya terapiya | Marchenko
Под терминами “преждевременная недостаточность яичников” (ПНЯ),“преждевременное выключение функции яичников” (ПВФЯ), “преждевременное истощение яичников” (ПИЯ),“преждевременная менопауза” (ПМ) принято подразумевать симптомокомплекс, формирующийся у женщин моложе 40 лет и проявляющийся вторичной аменореей, симптомами выраженной гипоэстрогении и бесплодием на фоне повышенного уровня гонадотропинов (ФСГ, ЛГ) Точная природа преждевременного выключения функции яичников неясна. Это состояние описывается как “многофакторный синдром”, в развитии которого могут принимать участие генетические факторы, ферментопатии (галактоземия), аутоиммунные, инфекционно-токсические, психогенные факторы внешней среды, а также дефекты в структурах гонадотропинов и/или их действия.
Это состояние описывается как “многофакторный синдром”, в развитии которого могут принимать участие генетические факторы, ферментопатии (галактоземия), аутоиммунные, инфекционно-токсические, психогенные факторы внешней среды, а также дефекты в структурах гонадотропинов и/или их действия.
Менструация, материнство и менопауза относятся к кардинальным событиям в жизни женщины. Сдвиг хронологической рамки наступления менархе или выключения функции яичников неизбежно приводит к формированию симптомокомплексов, при которых в патологический процесс вовлекаются не только органы репродукции, но и системы, чутко реагирующие на изменение уровней половых гормонов. В настоящее время все эстроген-дефицитные состояния (уровень Е2 в крови 80 пмоль/л и менее) в зависимости от уровня поражения репродуктивной системы подразделяются на нарушения центрального и яичникового генеза (рис. 1). Яичник – уникальный орган женщины, прекращающий свое функционирование задолго до окончания ее жизни. По образному выражению Н. Woollet [1]: “Преждевременная менопауза выбивает женщину из марафонского забега задолго до ожидаемого финиша”. Под терминами “преждевременная недостаточность яичников” (ПНЯ),“преждевременное выключение функции яичников” (ПВФЯ), “преждевременное истощение яичников” (ПИЯ),“преждевременная менопауза” (ПМ) принято подразумевать симптомокомплекс, формирующийся у женщин моложе 40 лет и проявляющийся вторичной аменореей, симптомами выраженной гипоэстрогении и бесплодием на фоне повышенного уровня гонадотропинов (ФСГ, ЛГ) [2, 3]. Возраст прекращения менструаций, при котором правомерна постановка диагноза ПНЯ, является предметом дискуссии; он оценивается в пределах 35–43 лет. Сегодня частота ПНЯ, по разным данным, составляет от 1–3% [4, 5] до 10% женской популяции. На основании ранее проведенных исследований ПНЯ относили к категории необратимых состояний. В 1969 г. G.Jones и М. de Morales-Ruehsen [6] описали 3 пациенток с вторичной аменореей, бесплодием, высоким уровнем гонадотропинов и сохраненным фолликулярным аппаратом, у которых крайне редко возникали самостоятельные менструации. Подобное состояние было охарактеризовано как синдром резистентных яичников, или Савадж-синдром по имени одной из этих пациенток [3]. C.О’Herlity и соавт. [7] для этой клинической ситуации предложили термин скрытая форма ПНЯ. Согласно современным воззрениям ПНЯ может развиваться вследствие снижения фолликулярного пула; нарушенного фолликулогенеза и ускорения процесса апоптоза и атрезии фолликулов. Физиологическая менопауза наступает тогда, когда количество фолликулов в яичнике достигает определенной критической величины от 100 до 1000, и прекращается процесс их созревания. Средний возраст наступления менопаузы около 50 лет [8]. Около 1% женщин достигают менопаузы к 60 годам, и около 1–2% – до 40 лет [9]. Патогенез и клиника Точная природа преждевременного выключения функции яичников неясна. Это состояние описывается как “многофакторный синдром”, в развитии которого могут принимать участие генетические факторы (нарушения на коротком и длинном плече X хромосомы: дефект гена ZFX и генов, расположенных на участке Xq 21,3-q27; Xq-26,1-q27; Xq133-q21,1), ферментопатии (галактоземия), аутоиммунные, инфекционно-токсические, психогенные факторы внешней среды, а также дефекты в структурах гонадотропинов и/или их действия [2, 10]. Генеалогический анализ, проведенный нами у 70 пациенток с ПНЯ (средний возраст 32,8±1,5 года, продолжительность заболевания 4,71±0,48 года), показал, что в родословной по материнской линии у 20% наших пациенток отмечены различные нарушения ритма менструаций, при этом в 14,2% случаев были указания на раннее выключение функции яичников. Анализ становления менструальной функции, продолжительности менструального цикла у больных с ПНЯ не позволили выявить каких-либо особенностей, которые бы в пубертатном и юношеском возрасте настораживали наших пациенток в отношении повышенного риска возникновения в дальнейшем преждевременного выключения функции яичников. Наиболее частой причиной, приводящей к формированию яичниковой недостаточности (в 30% случаев), явились различные стрессовые ситуации. Согласно точке зрения A. Vermeulen [11] хронический стресс относится к ведущим повреждающим факторам, воздействующим на эндокринные железы. Индивидуальное восприятие повышенных физических и психических нагрузок может изменять регуляторную функцию иммунной системы и через повышение уровня кортикостероидных гормонов оказывать влияние на гипоталамо-гипофизарно-яичниковую ось. Преждевременное выключение функции яичников с исходом в гипергонадотропный гипогонадизм в конечном итоге приводит к изменению функционирования гипоталамической и лимбической систем и секреции нейрогормонов, в результате чего снижается активность допаминергических и повышается активность норадренергических структур, вследствие чего снижается уровень b-эндорфинов, серотонина, допамина и изменяется терморегуляция, появляются приливы, гипергидроз, а также развиваются гипертензия и ожирение. У подавляющего большинства (85,5%) наших пациенток начало заболевания проявлялось нарушением регулярности менструального цикла по типу олигоменореи. Внезапное прекращение менструаций отмечено у 10 (14,2%) пациенток. На фоне прекращения менструаций ранние симптомы дефицита женских половых гормонов в виде вазомоторных и эмоциональных вегетативных нарушений отмечены у 48 и 77,5% соответственно. Эти расстройства были средней степени тяжести по данным индекса Куппермана (15,2±1,8 балла) и оценки качества жизни по анкете MENQOL (вазомоторные симптомы 8,2±3,8 балла, физическое состояние 37,5±8,3 балла, сексуальная сфера 8,1±3,4 балла, психологическое состояние 25,6±6,8 балла). Отсутствие тяжелых климактерических расстройств у пациенток с ПНЯ можно объяснить тем, что в отличие от женщин в периоде физиологической менопаузы у наших пациенток еще не произошло возрастного изменения структур гипоталамической и лимбической систем. Еще одним отличием ПНЯ от своевременной менопаузы явилась низкая частота и отсутствие выраженных симптомов атрофии урогенитального тракта. Из 70 обследованных больных только у 9 (12,8%) были симптомы атрофического вагинита и у 2 (2,8%) наблюдалось нарушение мочеиспускания по типу поллакиурии. У 1/3 женщин после 55 лет отмечаются симптомы урогенитальной атрофии, и их возникновение связано с падением уровня эстрогенов ниже 50 пмоль/л [12]. В нашем исследовании уровень эстрадиола составил в среднем 69,4±20,3 пмоль/л, что, по-видимому, и объясняет низкую частоту урогенитальных расстройств у наших больных. В то же время дефицит эстрогенов, приводящий к прекращению пролиферативных процессов во влагалище и уменьшению количества коллагена, частичной элиминации лактобацилл, а также снижению кровотока в стенке влагалища с последующим уменьшением транссудации, в конечном итоге может способствовать формированию серьезной патологии урогенитального тракта. Согласно многочисленным данным литературы, при дефиците женских половых гормонов в течение более 10 лет частота развития атрофического вагинита достигает 73,7% [3]. Средняя продолжительность заболевания у наших больных составила 4,71±0,48 года. Следует подчеркнуть, что в генезе развития урогенитальных расстройств, безусловно, определенную роль играет абсолютное количество в эпителии и строме влагалищной стенки эстрогеновых рецепторов, при этом не выявлено корреляции между возрастом и количеством рецепторов [13]. Возможно, определенная роль в формировании этого процесса принадлежит составу соединительной ткани и ее биохимическим характеристикам [14, 15]. Снижение соотношения протеогликаны/коллаген влияет на формирование фибрилл коллагена, увеличение числа поперечных соединений, их диаметр и функцию. Описанные изменения в парауретральной соединительной ткани обусловлены не только низким уровнем эстрадиола, но и включением некого возрастного механизма старения уротелия [16]. Наши пациентки с ПНЯ были моложе 40 лет, составляя относительно молодую группу, у них еще не были задействованы механизмы старения уротелия. Рис. 1. Эстроген-дефицитные состояния: эстрадиол крови (Е2) < 80 пг/мл. • Центрального генеза: – гипогонадотропная аменорея – гиперпролактинемия • Яичникового генеза: – физиологическая менопауза – ятрогенная менопауза, в том числе хирургическая – ПНЯ: — резистентные яичники — преждевременное истощение яичников — дисгенезия гонад Рис. 2. Источники андрогенов у женщин. Гормональный статус Оценка гормонального статуса пациенток с ПНЯ свидетельствовала о достоверном повышении уровня ФСГ до 93,3±8,9 МЕ/л и ЛГ – 77,7±9,5 МЕ/л, что в 13,7 и 10,2 раза соответственно превышает базальную секрецию гонадотропинов. Подобные высокие уровни гонадотропинов при ПНЯ отмечены в работах В.П. Сметник [2] и многих других исследователей. У больных с гипергонадотропным гипогонадизмом представляет интерес определение индекса ЛГ/ ФСГ, так как для данной патологии характерны три типа этого индекса: ЛГ/ФСГ=1, <1 и >1. У наших больных индекс ЛГ/ФСГ=1 встречался в 7,14% случаев, >1 – в 22,8% и в 70,06% случаев этот показатель был менее 1. Таким образом, у 70,06% больных мы выявили косвенный дифференциально-диагностический признак, позволяющий предположить истощение фолликулярного пула по типу формирования синдрома истощения яичников. У 22,8% больных можно заподозрить синдром резистентных яичников [2]. Содержание эстрадиола у наших больных составило 69,4±20,3 пмоль/л, что значительно ниже его уровня в раннюю фолликулярную фазу у женщин с регулярными менструациями. Особый интерес представляет анализ у больных с ПНЯ секреции андрогенов как яичникового, так и надпочечникового генеза. В этом отношении имеются существенные различия при своевременной (физиологической) и преждевременной менопаузе. Как известно, главные предшественники эстрогенов – андрогены (андростендион и тестостерон) синтезируются как в клетках внутренней теки стромы яичников, так и в надпочечниках. Наступление физиологической менопаузы не отражается заметно на продукции андрогенов в отличие от остальных половых стероидов, в связи с чем они обнаруживаются в значительных количествах в крови, оттекающей по яичниковой вене, особенно это касается андростендиона [17]. В репродуктивном возрасте андростендион, тестостерон секретируются и надпочечниками, и яичниками, в то время как D5 андрогены – дегидроэпиандростерон (ДГЭА) и дегидроэпиандростерона сульфат (ДГЭА-С) примерно на 70–80% от их общего количества продуцируются надпочечниками (рис. 2). Затем основная их часть на периферии путем конверсии превращается в андростендион, тестостерон и дегидротестостерон (самый “сильный” андроген) и эстрогены. Таким образом, с наступлением естественной менопаузы основная часть тестостерона, с одной стороны, образуется путем периферической конверсии из андростендиона и ДГЭА-С, при этом содержание его в отличие от эстрогенов резко не снижается, а наоборот, может возрастать, особенно его свободные фракции. С другой стороны, из-за снижения уровня эстрадиола в печени уменьшается продукция глобулина, связывающего половые стероиды (ПССГ), и в крови повышается уровень свободной, биологически активной фракции тестостерона [18]. Поэтому у значительного процента женщин при своевременной менопаузе отмечается относительная гиперандрогения. Несколько другие гормональные соотношения, касающиеся баланса андрогенов, были выявлены у женщин с ПНЯ. В нашем исследовании у 39 (55,7%) из 70 больных мы также отметили колебание уровня тестостерона от 0,7 до 1,0 пмоль/л, что в среднем составило 0,8±0,1 пмоль/л и в 2–2,5 раза было ниже показателей контрольной группы. В целом по группе уровень тестостерона составил 1,0±0,2 пмоль/л, что соответствовало нижней границе нормы, принятой в лаборатории эндокринологии НЦАГиП РАМН, и в 1,8 раза было ниже показателей контрольной группы. В работе Falsetti и соавт. [19] у больных с ПНЯ обнаружено снижение уровня тестостерона. При этом 52,5% этих пациенток страдали идиопатической формой ПНЯ, а у 45% был выявлен аутоиммунный генез заболевания. Однако в противоположность нашим результатам этими авторами одновременно с падением уровня тестостерона было выявлено достоверное снижение в плазме андростендиона и дегидроэпин–андростендиона, в то время как согласно нашим результатам уровни кортизола и ДГА-S не отличались от контрольной группы. Мы считаем, что снижение секреции яичниками андрогенов у больных с ПНЯ является еще одним неоспоримым доказательством справедливости нашего суждения об аутоиммунном генезе ПНЯ, так как при любом аутопроцессе в конечном итоге развивается сочетанная недостаточность эндокринных желез. Со временем этот процесс поражает не только яичник, но и надпочечник. У больных с ПНЯ отмечается дефицит не только эстрогенов, но и андрогенов, что не свойственно механизмам физиологического выключения яичников при своевременном наступлении менопаузы, так как при этом надпочечник частично берет на себя функцию яичника. Несмотря на сходство изменений, происходящих в гипоталамо-гипофизарно-яичниковой системе при своевременном и преждевременном выключении яичников, не следует ставить знак равенства между этими эстроген-дефицитными состояниями. Соответственно, и заместительную гормональную терапию (ЗГТ) следует проводить с учетом индивидуальных изменений гормональных параметров. ЗГТ при ПНЯ Учитывая, что при ПНЯ нами выявлена абсолютная недостаточность эстрогенов, уровень эстрадиола составил 69,4±20,3 пмоль/л, использование препаратов женских половых стероидов следует рассматривать как “первую линию” лечебного воздействия, направленного на восполнение дефицита эстрогенов. Решение о ЗГТ должно приниматься совместно больной и лечащим врачом. Несмотря на клинические проявления дефицита эстрогенов, согласие на прием гормональных препаратов нам удалось получить только у 27 (62,7%) из 43 пациенток. Основными принципами ЗГТ у пациенток с ПНЯ являются: • Использование натуральных эстрогенов в минимальных эффективных дозировках, создающих концентрацию эстрадиола в плазме крови на уровне ранней фолликулярной фазы менструального цикла. • Поскольку пациентки по возрасту относятся к репродуктивному периоду, преимущественно используется циклический режим ЗГТ (двухфазные эстроген-гестагенные препараты). • Индивидуальный подбор препарата с учетом особенностей клинического течения ПНЯ и гормонального статуса пациентки. • Раннее назначение ЗГТ, обеспечивающее профилактику остеопороза и сердечно-сосудистой патологии. ЗГТ при ПНЯ имеет некоторые особенности. Согласно точке зрения V. Beral [20] у женщин репродуктивного возраста риск развития рака молочной железы ниже, чем в постменопаузе. Это дает право использовать ЗГТ по крайней мере до возраста естественной менопаузы (даже если при этом ее продолжительность превысит 5 лет), а при необходимости и больше. При этом, безусловно, необходимо соблюдать все принципы и рекомендации, направленные на безопасное использование половых гормонов, в частности уменьшение дозы эстрогена после нескольких лет использования ЗГТ (переход на препараты, содержащие 1 мг эстрадиола) и переход на непрерывную схему терапии (монофазные эстроген-гестагенные препараты) через 5 лет использования циклического режима. По мнению некоторых ученых [21, 22], пациенткам с ПНЯ требуются более высокие дозы гормонов, поскольку в отличие от естественной менопаузы, при которой наблюдается постепенное растянутое во времени уменьшение эндогенного образования женских половых гормонов, при ПНЯ этот процесс ускорен во времени. В последние годы появились предложения о целесообразности добавления к традиционной ЗГТ инъекции тестостерона. Подобные рекомендации были предложены также пациенткам с двусторонней овариэктомией, у которых в 40% случаев отмечаются симптомы дефицита андрогенов, однако исследований в этом плане проведено крайне мало [23]. Согласно сообщению S.Kalantaridou в Национальном институте здоровья США проводится трехлетнее плацебо-контролируемое исследование, в котором наряду с традиционным ЗГТ больным с ПНЯ назначают трансдермально 150 мг тестостерона [24]. Поскольку у большинства пациенток с ПНЯ в клинической картине помимо симптомов эстрогенного дефицита имеются проявления андрогенной недостаточности (апатия, депрессия, снижение работоспособности, сексуальная дисфункция и др.), предпочтительно назначение препаратов, содержащих прогестагены – производные 19-нортестостерона. К таким препаратам относится климонорм (2 мг эстрадиола валерата в течение 21 дня в сочетании с 0,15 мг левоноргестрела в последние 12 дней). Благодаря тому, что левоноргестрел является одним из наиболее сильных прогестагенов, доза 150 мкг/сут достаточна для защиты эндометрия. В такой низкой дозе левоноргестрел обладает очень незначительной остаточной андрогенностью, которая проявляется, главным образом, в антидепрессивном и антиастеническом эффекте (т.е. действие на ЦНС), а также слабом анаболическом и пластическом эффектах. При этом нет негативного влияния на липиды крови (печеночного эффекта), поскольку в печени преобладает эффект эстрогена, стимулирующего синтез белков и усиливающего утилизацию ЛПНП. Климонорм оказывает благоприятное влияние не только на соматическое состояние (купирование вазомоторных симптомов), но и на психоэмоциональную сферу пациенток с ПНЯ (снижение депрессии, тревоги, психической утомляемости и напряженности, повышение уверенности в себе, когнитивных функций, устойчивости к эмоциональным стрессам, улучшение способности справляться с ежедневными задачами и адаптивных реакций). При этом осуществляется надежная регуляция менструального цикла и защита эндометрия от нежелательных пролиферативных изменений (профилактика гиперплазии), а также костной ткани и коллагеновых структур урогенитального тракта от возможных разрушительных последствий эстрогенного дефицита, что доказано в процессе наблюдения за пациентками, получающими климонорм в перименопаузе [25, 26]. Таким образом, у пациенток с преждевременным выключением яичников климонорм обеспечивает все необходимые эффекты и является препаратом первого выбора. Климонорм соответствует современным принципам ЗГТ, содержит низкие дозы гормонов, хорошо переносится и характеризуется высокой безопасностью при длительном применении.
В 1969 г. G.Jones и М. de Morales-Ruehsen [6] описали 3 пациенток с вторичной аменореей, бесплодием, высоким уровнем гонадотропинов и сохраненным фолликулярным аппаратом, у которых крайне редко возникали самостоятельные менструации. Подобное состояние было охарактеризовано как синдром резистентных яичников, или Савадж-синдром по имени одной из этих пациенток [3]. C.О’Herlity и соавт. [7] для этой клинической ситуации предложили термин скрытая форма ПНЯ. Согласно современным воззрениям ПНЯ может развиваться вследствие снижения фолликулярного пула; нарушенного фолликулогенеза и ускорения процесса апоптоза и атрезии фолликулов. Физиологическая менопауза наступает тогда, когда количество фолликулов в яичнике достигает определенной критической величины от 100 до 1000, и прекращается процесс их созревания. Средний возраст наступления менопаузы около 50 лет [8]. Около 1% женщин достигают менопаузы к 60 годам, и около 1–2% – до 40 лет [9]. Патогенез и клиника Точная природа преждевременного выключения функции яичников неясна. Это состояние описывается как “многофакторный синдром”, в развитии которого могут принимать участие генетические факторы (нарушения на коротком и длинном плече X хромосомы: дефект гена ZFX и генов, расположенных на участке Xq 21,3-q27; Xq-26,1-q27; Xq133-q21,1), ферментопатии (галактоземия), аутоиммунные, инфекционно-токсические, психогенные факторы внешней среды, а также дефекты в структурах гонадотропинов и/или их действия [2, 10]. Генеалогический анализ, проведенный нами у 70 пациенток с ПНЯ (средний возраст 32,8±1,5 года, продолжительность заболевания 4,71±0,48 года), показал, что в родословной по материнской линии у 20% наших пациенток отмечены различные нарушения ритма менструаций, при этом в 14,2% случаев были указания на раннее выключение функции яичников. Анализ становления менструальной функции, продолжительности менструального цикла у больных с ПНЯ не позволили выявить каких-либо особенностей, которые бы в пубертатном и юношеском возрасте настораживали наших пациенток в отношении повышенного риска возникновения в дальнейшем преждевременного выключения функции яичников. Наиболее частой причиной, приводящей к формированию яичниковой недостаточности (в 30% случаев), явились различные стрессовые ситуации. Согласно точке зрения A. Vermeulen [11] хронический стресс относится к ведущим повреждающим факторам, воздействующим на эндокринные железы. Индивидуальное восприятие повышенных физических и психических нагрузок может изменять регуляторную функцию иммунной системы и через повышение уровня кортикостероидных гормонов оказывать влияние на гипоталамо-гипофизарно-яичниковую ось. Преждевременное выключение функции яичников с исходом в гипергонадотропный гипогонадизм в конечном итоге приводит к изменению функционирования гипоталамической и лимбической систем и секреции нейрогормонов, в результате чего снижается активность допаминергических и повышается активность норадренергических структур, вследствие чего снижается уровень b-эндорфинов, серотонина, допамина и изменяется терморегуляция, появляются приливы, гипергидроз, а также развиваются гипертензия и ожирение. У подавляющего большинства (85,5%) наших пациенток начало заболевания проявлялось нарушением регулярности менструального цикла по типу олигоменореи. Внезапное прекращение менструаций отмечено у 10 (14,2%) пациенток. На фоне прекращения менструаций ранние симптомы дефицита женских половых гормонов в виде вазомоторных и эмоциональных вегетативных нарушений отмечены у 48 и 77,5% соответственно. Эти расстройства были средней степени тяжести по данным индекса Куппермана (15,2±1,8 балла) и оценки качества жизни по анкете MENQOL (вазомоторные симптомы 8,2±3,8 балла, физическое состояние 37,5±8,3 балла, сексуальная сфера 8,1±3,4 балла, психологическое состояние 25,6±6,8 балла). Отсутствие тяжелых климактерических расстройств у пациенток с ПНЯ можно объяснить тем, что в отличие от женщин в периоде физиологической менопаузы у наших пациенток еще не произошло возрастного изменения структур гипоталамической и лимбической систем. Еще одним отличием ПНЯ от своевременной менопаузы явилась низкая частота и отсутствие выраженных симптомов атрофии урогенитального тракта. Из 70 обследованных больных только у 9 (12,8%) были симптомы атрофического вагинита и у 2 (2,8%) наблюдалось нарушение мочеиспускания по типу поллакиурии. У 1/3 женщин после 55 лет отмечаются симптомы урогенитальной атрофии, и их возникновение связано с падением уровня эстрогенов ниже 50 пмоль/л [12]. В нашем исследовании уровень эстрадиола составил в среднем 69,4±20,3 пмоль/л, что, по-видимому, и объясняет низкую частоту урогенитальных расстройств у наших больных. В то же время дефицит эстрогенов, приводящий к прекращению пролиферативных процессов во влагалище и уменьшению количества коллагена, частичной элиминации лактобацилл, а также снижению кровотока в стенке влагалища с последующим уменьшением транссудации, в конечном итоге может способствовать формированию серьезной патологии урогенитального тракта. Согласно многочисленным данным литературы, при дефиците женских половых гормонов в течение более 10 лет частота развития атрофического вагинита достигает 73,7% [3]. Средняя продолжительность заболевания у наших больных составила 4,71±0,48 года. Следует подчеркнуть, что в генезе развития урогенитальных расстройств, безусловно, определенную роль играет абсолютное количество в эпителии и строме влагалищной стенки эстрогеновых рецепторов, при этом не выявлено корреляции между возрастом и количеством рецепторов [13]. Возможно, определенная роль в формировании этого процесса принадлежит составу соединительной ткани и ее биохимическим характеристикам [14, 15]. Снижение соотношения протеогликаны/коллаген влияет на формирование фибрилл коллагена, увеличение числа поперечных соединений, их диаметр и функцию. Описанные изменения в парауретральной соединительной ткани обусловлены не только низким уровнем эстрадиола, но и включением некого возрастного механизма старения уротелия [16]. Наши пациентки с ПНЯ были моложе 40 лет, составляя относительно молодую группу, у них еще не были задействованы механизмы старения уротелия. Рис. 1. Эстроген-дефицитные состояния: эстрадиол крови (Е2) < 80 пг/мл. • Центрального генеза: – гипогонадотропная аменорея – гиперпролактинемия • Яичникового генеза: – физиологическая менопауза – ятрогенная менопауза, в том числе хирургическая – ПНЯ: — резистентные яичники — преждевременное истощение яичников — дисгенезия гонад Рис. 2. Источники андрогенов у женщин. Гормональный статус Оценка гормонального статуса пациенток с ПНЯ свидетельствовала о достоверном повышении уровня ФСГ до 93,3±8,9 МЕ/л и ЛГ – 77,7±9,5 МЕ/л, что в 13,7 и 10,2 раза соответственно превышает базальную секрецию гонадотропинов. Подобные высокие уровни гонадотропинов при ПНЯ отмечены в работах В.П. Сметник [2] и многих других исследователей. У больных с гипергонадотропным гипогонадизмом представляет интерес определение индекса ЛГ/ ФСГ, так как для данной патологии характерны три типа этого индекса: ЛГ/ФСГ=1, <1 и >1. У наших больных индекс ЛГ/ФСГ=1 встречался в 7,14% случаев, >1 – в 22,8% и в 70,06% случаев этот показатель был менее 1. Таким образом, у 70,06% больных мы выявили косвенный дифференциально-диагностический признак, позволяющий предположить истощение фолликулярного пула по типу формирования синдрома истощения яичников. У 22,8% больных можно заподозрить синдром резистентных яичников [2]. Содержание эстрадиола у наших больных составило 69,4±20,3 пмоль/л, что значительно ниже его уровня в раннюю фолликулярную фазу у женщин с регулярными менструациями. Особый интерес представляет анализ у больных с ПНЯ секреции андрогенов как яичникового, так и надпочечникового генеза. В этом отношении имеются существенные различия при своевременной (физиологической) и преждевременной менопаузе. Как известно, главные предшественники эстрогенов – андрогены (андростендион и тестостерон) синтезируются как в клетках внутренней теки стромы яичников, так и в надпочечниках. Наступление физиологической менопаузы не отражается заметно на продукции андрогенов в отличие от остальных половых стероидов, в связи с чем они обнаруживаются в значительных количествах в крови, оттекающей по яичниковой вене, особенно это касается андростендиона [17]. В репродуктивном возрасте андростендион, тестостерон секретируются и надпочечниками, и яичниками, в то время как D5 андрогены – дегидроэпиандростерон (ДГЭА) и дегидроэпиандростерона сульфат (ДГЭА-С) примерно на 70–80% от их общего количества продуцируются надпочечниками (рис. 2). Затем основная их часть на периферии путем конверсии превращается в андростендион, тестостерон и дегидротестостерон (самый “сильный” андроген) и эстрогены. Таким образом, с наступлением естественной менопаузы основная часть тестостерона, с одной стороны, образуется путем периферической конверсии из андростендиона и ДГЭА-С, при этом содержание его в отличие от эстрогенов резко не снижается, а наоборот, может возрастать, особенно его свободные фракции. С другой стороны, из-за снижения уровня эстрадиола в печени уменьшается продукция глобулина, связывающего половые стероиды (ПССГ), и в крови повышается уровень свободной, биологически активной фракции тестостерона [18]. Поэтому у значительного процента женщин при своевременной менопаузе отмечается относительная гиперандрогения. Несколько другие гормональные соотношения, касающиеся баланса андрогенов, были выявлены у женщин с ПНЯ. В нашем исследовании у 39 (55,7%) из 70 больных мы также отметили колебание уровня тестостерона от 0,7 до 1,0 пмоль/л, что в среднем составило 0,8±0,1 пмоль/л и в 2–2,5 раза было ниже показателей контрольной группы. В целом по группе уровень тестостерона составил 1,0±0,2 пмоль/л, что соответствовало нижней границе нормы, принятой в лаборатории эндокринологии НЦАГиП РАМН, и в 1,8 раза было ниже показателей контрольной группы. В работе Falsetti и соавт. [19] у больных с ПНЯ обнаружено снижение уровня тестостерона. При этом 52,5% этих пациенток страдали идиопатической формой ПНЯ, а у 45% был выявлен аутоиммунный генез заболевания. Однако в противоположность нашим результатам этими авторами одновременно с падением уровня тестостерона было выявлено достоверное снижение в плазме андростендиона и дегидроэпин–андростендиона, в то время как согласно нашим результатам уровни кортизола и ДГА-S не отличались от контрольной группы. Мы считаем, что снижение секреции яичниками андрогенов у больных с ПНЯ является еще одним неоспоримым доказательством справедливости нашего суждения об аутоиммунном генезе ПНЯ, так как при любом аутопроцессе в конечном итоге развивается сочетанная недостаточность эндокринных желез. Со временем этот процесс поражает не только яичник, но и надпочечник. У больных с ПНЯ отмечается дефицит не только эстрогенов, но и андрогенов, что не свойственно механизмам физиологического выключения яичников при своевременном наступлении менопаузы, так как при этом надпочечник частично берет на себя функцию яичника. Несмотря на сходство изменений, происходящих в гипоталамо-гипофизарно-яичниковой системе при своевременном и преждевременном выключении яичников, не следует ставить знак равенства между этими эстроген-дефицитными состояниями. Соответственно, и заместительную гормональную терапию (ЗГТ) следует проводить с учетом индивидуальных изменений гормональных параметров. ЗГТ при ПНЯ Учитывая, что при ПНЯ нами выявлена абсолютная недостаточность эстрогенов, уровень эстрадиола составил 69,4±20,3 пмоль/л, использование препаратов женских половых стероидов следует рассматривать как “первую линию” лечебного воздействия, направленного на восполнение дефицита эстрогенов. Решение о ЗГТ должно приниматься совместно больной и лечащим врачом. Несмотря на клинические проявления дефицита эстрогенов, согласие на прием гормональных препаратов нам удалось получить только у 27 (62,7%) из 43 пациенток. Основными принципами ЗГТ у пациенток с ПНЯ являются: • Использование натуральных эстрогенов в минимальных эффективных дозировках, создающих концентрацию эстрадиола в плазме крови на уровне ранней фолликулярной фазы менструального цикла. • Поскольку пациентки по возрасту относятся к репродуктивному периоду, преимущественно используется циклический режим ЗГТ (двухфазные эстроген-гестагенные препараты). • Индивидуальный подбор препарата с учетом особенностей клинического течения ПНЯ и гормонального статуса пациентки. • Раннее назначение ЗГТ, обеспечивающее профилактику остеопороза и сердечно-сосудистой патологии. ЗГТ при ПНЯ имеет некоторые особенности. Согласно точке зрения V. Beral [20] у женщин репродуктивного возраста риск развития рака молочной железы ниже, чем в постменопаузе. Это дает право использовать ЗГТ по крайней мере до возраста естественной менопаузы (даже если при этом ее продолжительность превысит 5 лет), а при необходимости и больше. При этом, безусловно, необходимо соблюдать все принципы и рекомендации, направленные на безопасное использование половых гормонов, в частности уменьшение дозы эстрогена после нескольких лет использования ЗГТ (переход на препараты, содержащие 1 мг эстрадиола) и переход на непрерывную схему терапии (монофазные эстроген-гестагенные препараты) через 5 лет использования циклического режима. По мнению некоторых ученых [21, 22], пациенткам с ПНЯ требуются более высокие дозы гормонов, поскольку в отличие от естественной менопаузы, при которой наблюдается постепенное растянутое во времени уменьшение эндогенного образования женских половых гормонов, при ПНЯ этот процесс ускорен во времени. В последние годы появились предложения о целесообразности добавления к традиционной ЗГТ инъекции тестостерона. Подобные рекомендации были предложены также пациенткам с двусторонней овариэктомией, у которых в 40% случаев отмечаются симптомы дефицита андрогенов, однако исследований в этом плане проведено крайне мало [23]. Согласно сообщению S.Kalantaridou в Национальном институте здоровья США проводится трехлетнее плацебо-контролируемое исследование, в котором наряду с традиционным ЗГТ больным с ПНЯ назначают трансдермально 150 мг тестостерона [24]. Поскольку у большинства пациенток с ПНЯ в клинической картине помимо симптомов эстрогенного дефицита имеются проявления андрогенной недостаточности (апатия, депрессия, снижение работоспособности, сексуальная дисфункция и др.), предпочтительно назначение препаратов, содержащих прогестагены – производные 19-нортестостерона. К таким препаратам относится климонорм (2 мг эстрадиола валерата в течение 21 дня в сочетании с 0,15 мг левоноргестрела в последние 12 дней). Благодаря тому, что левоноргестрел является одним из наиболее сильных прогестагенов, доза 150 мкг/сут достаточна для защиты эндометрия. В такой низкой дозе левоноргестрел обладает очень незначительной остаточной андрогенностью, которая проявляется, главным образом, в антидепрессивном и антиастеническом эффекте (т.е. действие на ЦНС), а также слабом анаболическом и пластическом эффектах. При этом нет негативного влияния на липиды крови (печеночного эффекта), поскольку в печени преобладает эффект эстрогена, стимулирующего синтез белков и усиливающего утилизацию ЛПНП. Климонорм оказывает благоприятное влияние не только на соматическое состояние (купирование вазомоторных симптомов), но и на психоэмоциональную сферу пациенток с ПНЯ (снижение депрессии, тревоги, психической утомляемости и напряженности, повышение уверенности в себе, когнитивных функций, устойчивости к эмоциональным стрессам, улучшение способности справляться с ежедневными задачами и адаптивных реакций). При этом осуществляется надежная регуляция менструального цикла и защита эндометрия от нежелательных пролиферативных изменений (профилактика гиперплазии), а также костной ткани и коллагеновых структур урогенитального тракта от возможных разрушительных последствий эстрогенного дефицита, что доказано в процессе наблюдения за пациентками, получающими климонорм в перименопаузе [25, 26]. Таким образом, у пациенток с преждевременным выключением яичников климонорм обеспечивает все необходимые эффекты и является препаратом первого выбора. Климонорм соответствует современным принципам ЗГТ, содержит низкие дозы гормонов, хорошо переносится и характеризуется высокой безопасностью при длительном применении.
- Wollett H. Questioning «mother hoad» as a model for womens lives and development. Paper presented at Womtn and psychology Conference, University of Leeds 1995.
- Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. М.: Медицинское информационное агентство, 2003.
- Laml T, Schulz-Lobmeyr L, A Obruca Premature ovarian failure: etiology and prospects. Gynecol Endocrinol 2000; 14; 292–302.
- Wheeler C.A. Premature Ovarian Failure: treatment strategies. Journal of Reproduct Immunol Med J 1995; 76 (5): 130–1.
- Davis S.R. Premature Ovarian Failure. Мaturitas 1996; 23: 1–18.
- Jones G.S, de Morales-Ruehsen M. A new syndrome of amenorrhea in association with hypogonadotropism and apparently normal follicular apharatus. Am J Obstet Gynecol 1969; 104: 597.
- O’Herlity C, Pepperell R.J, Evans J.H. The significance of FSH Elevations in young women with disorders of ovulation. Brit Med J 1980; 281: 1447–50.
- McKinlay S.M, Brambilla D.J, Posner J.G. The normal menopause transition. Maturitas 1992; 14: 103–15.
- Epplen J.T, Buitkamp J, Bocker T, Epplen C. Indirect gene diagnoses for complex (multifactorial) diseases. a review. Gene 1995; 159: 49–55.
- Rebair R.W, Conolly H.V, Clinical ferlutes of young women with hypeigonadotropic amenorrhea. Fertil. Stetil 1990; 53: 804–10.
- Vermeulen A. Environment, human reproduction, menopause and andropause. Environment Health Perspectives Supplements 1993; 101 (suppl 2): 91–100.
- Samsioe G, Jansson I, Mellstrom P et al. The occurrence, nature out treatment of urinary in continence in a 70 year old population. Maturitus 1985; 7: 335–42.
- Балан В.Е. Урогенитальные расстройства в климактерии (клиника, диагностика, заместительная гормонотерапия). Дис.… докт. мед. наук. М., 1998.
- Van Der Rest M, Garrone R, Collagen Family of proteins. FASTB J 1991; 5: 2814–23.
- Falkoner C, Malmstrom A, Ulmsten U, Barchan K et al. Changes in paraurethral connective trisue at mtnopause are counteracted by estrogen. Maturitas 1996; 24: 197–204.
- Yamauchi M, Woodley D, Mechanic G, Aging and crosslinking of skin collagen. Biochem. Biophis. Res. Commun 1988; 152: 898–903.
- Longcope C, Hunter R, Franz C. Steroid secretion by the postmenopausal ovary. Am J Obstet Gynecol 1980; 138: 564–8.
- Burger H.G, Dudley E.C, Cui J et al. A prospective longitudinal study of serum testosterone, dehydroepiandrosterone sulfate and sex hormone — binding globulin levels through the menopause transition. J Clin Endocrinol Metab 2000; 85: 2832–8.
- Falsetti L, Scalchi S et al. Premature Ovarian Failure. Gynecol Endocrinol 1999 Jun 13(3), 189–95.
- Beral V. Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52, 705 women with breast cancer and 108411 women without breast cancer. Collaborative Group of Hormonal Factors in Breast Cancer. Lancet 1991; 349: 1047–59.
- Рубченко Т.Н., Краснопольский В.И., Лукашенко С.Ю. Метаболические нарушения у женщин с хирургической менопаузой и их коррекция с помощью ЗГТ. Пробл. репрод. 1999; 5(3): 59–63.
- Рябцева И.Т., Шаповалова К.А. Заместительная гормональная терапия при синдроме постовариоэктомии. Вест. Рос. ассоц. акуш. — гин. 2000; 2: 92–4.
- Burger H, Davis S. Should women be treated with testosterone. Clinical Endocrinology 1998; 49: 159–60.
- Kalantaridou S.N. Premature ovarian failure – not jast a premature menopause. Материалы 11-го Всемирного конгресса во Флоренции. 2004; c.220.
- Rudolf I, Zimmermann T, Kaminsky K et al. Changes in psychic and somatic well — being and cognitive capabilities of peri — and postmenopausal women after the use of hormone replacement drug containing estradiol valerate and levonorgestrel. Methods Find Exp Clin Pharmacol 2000;22(1):51–6.
- Paoletti A.M, Pilloni M, Orru M et al. Efficacy and safety of oral and transdermal hormonal replacement treatment containing levonorgestrel. Maturitas 2002; 42: 137–47.
Cited-By
Article Metrics
Refbacks
- There are currently no refbacks.
Gonadotroph adenomas as a cause of ovarian failure | Repina
Introduction
Among the causes of amenorrhea, hypothalamic dysfunction with an undesirable inverse effect, hyperprolactinemia and ovarian failure are the most common. As a result of examinations of 262 patients, Reindollar et al (1986) revealed hypothalamic causes of amenorrhea in 35%, pituitary (mainly hyperprolactinemia) — in 17% of cases [1]. New information on the pathogenesis of hypothalamic, pituitary and other forms of amenorrhea has been presented [2, 3].
As for the pituitary causes, in addition to hyperprolactinemia, they include corticotroph and somatotroph adenomas, other tumors, genetic and other rare causes of hypopituitarism. However, pituitary incidentaloma has not, in fact, been announced as a cause of amenorrhea so far. The prevalence of pituitary adenomas is 94–77.6 per 100,000 cases [4]. They mainly include the formations noted above with the clinic of hyper production of hormones.
The remaining pituitary adenomas, as a rule, are considered to be non-functioning incidentalomas, “detected with the help of imaging technologies performed for reasons not related to the found formation.”
The incidence rate of incidentalomas among all pituitary adenomas reaches 14.7–22.2 and even 30–35% [4, 5, 7]. It is believed that 80–90% of incidentalomas come from gonadotrophs [6], while formations from somatotrophs, lactotrophs and corticotrophs are much less common [8]. The clinical “silence” of gonadotroph adenomas is associated with their ineffective hormonal production.
According to the results of a histological examination of 506 surgically removed lesions of the pituitary gland, 422 were adenomas (83.4%). Incidentalomas were 42.4%, lactotroph adenomas were 16.6%, follicle-stimulating hormone (FSH) secreting — 8.8% and luteinizing hormone (LH) secreting — 0.5% [7]. On the whole, the frequency of gonadotroph adenomas (9.3%) corresponded to that of growth hormone (GH) secreting adenomas (9.2%) and exceeded the frequency of adrenocorticotroph adenomas (5.9%) and thyrotroph adenomas (1.7%).
Despite the fact that a significant proportion of pituitary adenomas originates from gonadotrophs, their clinical manifestation is the least studied and therefore they are most commonly referred to accidentally found formations.
Material and methods
The study included seven patients between the ages of 22 to 43 years old. The reason for the treatment of one of them was primary amenorrhea, for the rest of the patients — secondary amenorrhea.
In a patient with primary amenorrhea, repeated attempts at hormonal induction of menstruation, undertaken from the age of 17, ended with the refusal of further treatment due to the development of a severe psychotic state during bleeding.
In the second case, the menarche at 17 years old, a regular cycle lasted up to 21 years old, then amenorrhea, treatment with combined oral contraceptives (COCs) — up to 25 years old, discontinuation due to varicose vein diseaseand for the next 18 years — amenorrhea.
In the third case, a regular menstrual cycle is from the age of 12. At 19 the patient suffered from psychological stress with weight loss and the development of amenorrhea. Cyclic administration of progestogens was without effect. For the next 11 years amenorrhea has persisted, and the patient hasn’t sought help.
In the fourth case, a regular menstrual cycle is from the age of 14.Two years after opsomenorrhea — amenorrhea developed. The patient was prescribed COCs. After of their cancellation amenorrhea returned.
In the fifth case, the menarche at 13 years old, the regular cycle with giving a normal birth — up to 30 years old. Then amenorrhea has developed (1.5 years).
In the sixth case, the menarche has come at the age of 15, immediately the state of opsomenorrhea — amenorrhea. Ten years after a patient sought medical assistance, observation and treatment are irregular.
In the seventh case, the menarche has come at the age of 16, immediately the state of opso-amenorrhea. In this context, a patient had one abortion and two uncomplicated childbirths. Over the past year is a persistent amenorrhea.
The patients were examined using imaging technologies and laboratory diagnostic methods.
Results
All the patients had pronounced psycho-emotional symptoms: irritability, incredulity, anxiety, depression, sometimes aggressiveness and tearfulness. Two patients, diagnosed with the psychasthenia and depressive syndrome, were receiving antipsychotic medication, one of them was observed by a psychiatrist. Three patients indicated frequent headaches (in one case — from 13 years old, in the other case — after a traumatic brain injury). A decrease in the FSH and LH secretion was noted in all the patients (Table 1).
Table 1 / Таблица 1
Results of a dynamic hormonal examination of patients with pituitary incidentalomas
Данные гормонального обследования в динамике наблюдения пациенток с аденомой гипофиза
Patients | FSH, mIU/ml | LH, mIU/ml | Prolactin, mIU/ml | AMG, ng/ml | TSH, µU/ml | Free T4, pmol/l |
1 | 162.1; 116; 95.0 | 38.1; 20.0; 33.2 | 115.8; 175.0 | 0.28; 0.1 | 3.23; 2.78 | 11.7; 13.5 |
2 | 85.9; 17.6 | 21.1; 2.05 | 83.9; 222.90 | 0.18 | 1.98; 1.64 | 14.1; 13.2 |
3 | 11.1; 0; 0 | 1.58; 0; 0 | 243.7; 195.8; 97.9 | 5.8; 0.73 | 1.64; 0.66; 0.93; 0.82 | 10.7; 10.9; 10.6; 12.1 |
4 | 2.56; 0.08; 0.03 | 0.33; 0; 0 | 162.2; 181.9 | 7.2 | 0.83; 0.73; 0.67; 0.32 | 8.16; 11.7; 6.9; 2.7; 14.2 |
5 | 0.7; 3.42 | 0.43; 0.7 | 82.2; 76.9; 74.2 | 2.2; 1.08 | 1.95; 0.48 | 13.1; 8.2 |
6 | 4.3; 0.84; 0; 0 | 3.7; 0.23; 0; 0.02 | 397; 140 | 1.8 | 1.66; 1.53; 0.92; 0.78 | 15.0; 16.1; 16.8 |
7 | 1.2; 0.81 | 0.09; 1.1 | 180.2; 138.7 | 4.52; 7.84 | 0.974; 0.824 | 5.93; 12.02 |
Two cases need some clarification. A gradual decrease in high gonadotropins between the ages of 18 to 24 years old (the first case) was observed in the patient against the background of severe estrogen and progesterone deficiency. She refused hormone replacement therapy (HRT).The same dynamics was observed in the second patient in the time period from 43 to 45 years old. The patient was undergoing hormone replacement therapy (HRT) with transdermal administration of estradiol (1 mg/day) and oral administration of progestogen (10 mg/day) in a cyclic mode.
Regardless of the absence of clinical signs of adenomas originating from other secretory cells, all the patients underwent additional examination. The concentration of prolactin remained normal or decreased due to previously prescribed cabergoline (in two cases). After the discontinuation of the drug, prolactin secretion was
restored.
In addition to the absence of symptoms of Cushing’s disease, the patients maintained normal production of corticotropin (ACTH) and total cortisol in the morning blood serum sample (2.4–3.1–3.7 pmol/L and 217–402 nmol/L, respectively). The secretion of growth hormone did not increase (0.23–0.58 μg/l).
At the same time, the secretion of free thyroxine, which is, as a rule, higher in the reproductive period, was at the lower limits of normal in most of the patients. In parallel, there was no increase in the secretion of thyroid stimulating hormone (TSH), whichis natural in such cases, as it remained in normally low limits (Table 1). In no case autoimmune damage to the thyroid gland was observed. The antibodies to thyroid peroxidase or thyroglobulin were within normal values. Ultrasound of the thyroid gland also showed no pathology.
In three cases, the first magnetic resonance imaging (MRI) scan did not reveal any pituitary adenomas. The diagnosis was made with repeated MRI 2–5 years after. It is not known whether the first study was performed with contrast enhancement or not. Repeated MRI with contrast enhancement in these patients and primary MRI in the rest revealed the presence of pituitary adenoma with a diameter of 0.35–0.5 mm. Dynamic control in the interval of one year — nine years in different patients did not show any growth in adenomas.
Discussion
Headaches, dizziness, nausea, vomiting, visual impairment in patients withgonadotropin adenomas were noted by Buurman H. et al., 2006. A high incidence of pituitary incidentalomas was detected at autopsy after suicide [10].
According to Shimon et al., 2001, gonadotroph incidentalomas contribute to the development of multiple follicular ovarian cysts due to the secretion of FSH, LH and/or their α and β subunits [11]. It is thought that this process is typical for both the period of reproduction and the period of premenopause [12]. Developing in childhood, gonadotropic adenomas induce premature puberty, early development of the mammary glands [13].
For girls with gonadotroph pituitary adenoma, the formation of ovarian cysts with abdominal pain and tension of the abdominal wall is common. In the process of regression of cysts, they experience episodes of bleeding associated with a decrease in estrogen concentration [14, 15, 16].
In women of reproductive age were noted endometrial hyperplasia, metrorrhagia, ovarian hyperstimulation syndrome with the development of massive cysts. The clinical picture can sometimes be similar to that with hyperstimulation with FSH drugs in cycles of assisted reproductive technologies [17].
However, with a low ovarian reserve observed in some patients, it is difficult to expect the development of ovarian cysts even in cases of high gonadotropin production. It seems that the formation of ovarian cysts should be more characteristic of puberty and early reproductive age, when the highest follicular consumption is noted.
Gonadotroph adenomas secrete FSH, α- and β-subunits of FSH, LH and β-subunit of LH with decreasing force [18, 19]. The ambiguous biosynthesis of gonadotropins is manifested by the diversity of their clinical picture. Given the hypoestrogenism or the fluctuating estrogen concentration, the hormonal response options may be mildly elevated, normal, or decreased levels of FSH. LH biosynthesis is also significantly reduced.
However, we did not find any information about the complete cessation of FSH and LH secretion in patients with pituitary gonadotropic adenoma. Meanwhile, the actual cessation of LH biosynthesis was noted in three cases, and FSH — in one case.
Observational analysis indicates that, in contrast to lactotroph, corticotroph and somatotroph adenomas, gonadotroph formations are more characterized by hypoproduction than hyperproduction of hormones. Even in cases of normal or high initial biosynthesis of FSH and LH, it decreases subsequently until the complete cessation. Initially high concentrations of gonadotropins associated with their overproduction by adenoma or with a reaction to ovarian insufficiency are later on reduced, despite low estrogen concentration.The concentrations of estradiol and progesterone in the patients, respectively, were 57.9–106.2 pmol/L and 2.6–3.5 nmol/L. A gradual decrease in the FSH and LH concentrations occurred both against the background of the preservation of amenorrhea, and against the background of HRT.
The impossibility to specify the time of the formation of incidentaloma does not allow us to answer the question of whether the hormonal production of gonadotroph cells changes due to the appearance of adenoma or even before its development.
By referring gonadotroph adenomas to incidentalomas, it is believed that they do not give specific clinical manifestations. This point of view does not seem entirely true. A possible increase in the biosynthesis of gonadotropins at the beginning of the formation of adenoma, inducing the constant formation of cysts at puberty and early reproductive age, depletes the ovarian reserve. This is evidenced by ultrasound data (decrease in ovarian volume and follicular expression) and by low levels of AMH in some patients aged 30–32 years or less (Table 2).
Table 2 / Таблица 2
Pelvic ultrasound data at the time of the last examination of the patients with incidentaloma of the pituitary gland
Данные ультразвукового исследования на момент осмотра пациенток с длительной аменореей
Patients | Age at the | BMI, kg/m2 | Uterine size, mm | Right ovary | Left ovary | ||
Volume, cm3 | Follicles, | Volume, cm3 | Follicles, number | ||||
1 | 22 | 20.8 | 22 × 16 × 22 | 1.15 | 1 | 2.1 | 0 |
2 | 43 | 24.3 | 28 × 14 × 29 | 1.10 | 0 | 0.13 | 0 |
3 | 30 | 18.5 | 33 × 30 × 28 | 3.57 | 7–8, d 4–5 mm | 2.74 | 7–8, d 4–5 mm |
4 | 23 | 18.6 | 34 × 29 × 30 | 2.25 | 3–4, d 4–5 mm | 3.1 | 4–5, d 5–6 mm |
5 | 32 | 20.0 | 51 × 34 × 48 | 2.6 | 8–10, d 3–4 mm | 2.4 | 9–10, d 3–4 mm |
6 | 30 | 15.7 | 50 × 41 × 35 | 5.7 | 9–10, d 6–8 mm | 4.9 | 9–10, d 6–8 mm |
7 | 33 | 20.9 | 50 × 37 × 50 | 7.43 | 10, d 4–5 mm | 6.3 | 10–11, d 4–5 mm |
The result of the decrease in the secretion of gonadotropins and/or their α and β-subunits is oligomenorrhea — amenorrhea, anovulation and infertility. Therefore, the low secretion of gonadotropins, especially the decrease in secretion in the dynamics of observation of the patients with the indicated pathology, makes us suspect the development of gonadotroph adenoma.
It is possible that with gonadotroph adenoma, the function of thyrotroph is also somewhat damaged. The inadequate response of thyrotroph to a low concentration of thyroxine in blood serum also does not exclude the influence of the total alpha α-subunit in FSH and TSH [20].
The results of the presented observation allow us to conclude that hypogonadotropic ovarian failure in patients with oligomenorrhea — amenorrhea, anovulation and infertility can be a consequence of gonadotroph adenoma.
Possible signs of gonadotroph adenoma:
- Incidences of stress, head injuries
- Signs of psychasthenia, depression
- Complaints of headaches in past medical history or at present
- Syndrome of abdominal pain, metrorrhagia during puberty
- Relapses of ovarian cysts (early reproductive age)
- Dynamic decrease in FSH, LH secretion
- A possible simultaneous decrease in TSH and free thyroxine
- When revealing pituitary adenoma (MRI with contrast enhancement):
- normal prolactin secretion
- lack of clinical signs of acromegaly, Cushing’s disease
- normal secretion of ACTH and cortisol
- normal secretion of growth hormone and insulin-like growth factor-1
There is no information about the course of pregnancy when a gonadotroph adenoma is present. However, in general, microadenomas are not a contraindication to pregnancy and in such a case there is a chance of having a baby, but this chance is gradually disappearing with the growth of adenomas. Obviously, this chance should be used as early as possible in connection with the risk of depletion of the ovarian reserve. It is clear that induction of pregnancy in such a situation is possible only with the help of assisted reproductive technologies (ART).
Such patients require replacement therapy with natural estradiol preparations in a cyclic combination with intravaginal administration of progesterone or oral administration of its agonists. We believe that the use of COCs for patients with gonadotroph adenoma is contraindicated, since the progestogen effect of these drugs is aimed at suppressing the function of gonadotropes, which in these cases is already impaired.
In a prospective study, it was shown that HRT or even a refusal of treatment is more effective in terms of normalizing the cycle than the prescription of COCs [21]. It is advisable that patients visit a psychologist.
Incidentalomas originating from gonadotroph cells often express some subtypes of somatostatin and dopamine receptors on cell membranes [8, 22]. Therefore, to control the growth of adenomas, some authors prescribe treatment with cabergoline, octreotide and GnRH agonists. The effectiveness of such treatment is not confirmed [23].
It seems that in cases of gonadotroph microadenomas, in addition to HRT, regular medical check-up (taking into account clinical symptoms, laboratory data) with dynamic MRI of the pituitary gland is sufficient.
Conclusion
With the accumulation of data, we have come to understanding that pituitary incidentalomas represent a heterogeneous group in which gonadotroph adenomas occupy a significant place. The clinical manifestation of these adenomas, depending on the secretory effectiveness of gonadotropins and their subunits, is diverse and includes the development of recurrent ovarian cysts, abdominal pain syndrome and metrorrhagia (puberty and the beginning of the reproductive period), the development of persistent amenorrhea with psychosomatic disorders and an asymptomatic course (incidentaloma). A sign of gonadotroph adenoma is hypogonadotropic amenorrhea with a dynamic decrease in the secretion of FSH and LH. In view of this, if was exclusion other probable causes of amenorrhea, pituitary MRI with contrast enhancement is indicated.
Первичная недостаточность яичников — гинекология и акушерство
Уровни фолликулостимулирующего гормона (ФСГ) и эстрадиола
Функциональные пробы щитовидной железы, глюкоза натощак, электролиты и креатинин
Иногда генетическое тестирование
Первичная недостаточность яичников подозревается у женщин <40 лет с необъяснимым бесплодием, нарушениями менструального цикла или симптомами дефицита эстрогена.
Делается тест на беременность, и уровни сывороточного ФСГ и эстрадиола измеряются еженедельно в течение 2–4 недель; если уровень ФСГ высокий (> 20 мМЕ / мл, но обычно> 30 мМЕ / мл), а уровень эстрадиола низкий (обычно <20 пг / мл), недостаточность яичников подтверждается. Затем проводятся дальнейшие тесты в зависимости от предполагаемой причины.
Поскольку антимуллеров гормон вырабатывается только в небольших фолликулах яичников, уровни этого гормона в крови были использованы для попытки диагностировать снижение резерва яичников.Нормальные уровни составляют от 1,5 до 4,0 нг / мл. Очень низкий уровень предполагает снижение резерва яичников. Эндокринологи-репродуктологи используют уровни антимюллерова гормона, чтобы помочь предсказать, какие женщины могут плохо реагировать на препараты для лечения бесплодия и в целом, какие пары с меньшей вероятностью добьются успеха при лечении бесплодия. Антимуллеров гормон можно принимать в любое время менструального цикла.
Генетическое консультирование и тестирование на предварительную мутацию FMR1 показано, если у женщин в семейном анамнезе имеется первичная недостаточность яичников или имеется умственная отсталость, тремор или атаксия.Кариотип определяют, если у женщины с подтвержденной недостаточностью или недостаточностью яичников <35 лет или если есть подозрение на предварительную мутацию FMR1 .
При нормальном кариотипе или подозрении на аутоиммунную причину проводятся анализы сывороточных антител к надпочечникам и анти-21-гидроксилазы (аутоантитела надпочечников).
Если подозревается аутоиммунная причина, также проводятся тесты для проверки на аутоиммунный гипотиреоз; они включают измерение тиреотропного гормона (ТТГ), тироксина (Т4), а также антител к тиреоид-пероксидазе и тиреоглобулину.
При подозрении на надпочечниковую недостаточность диагноз может подтвердить измерение утреннего уровня кортизола или тест на стимуляцию адренокортикотропного гормона (АКТГ).
Необходимо провести другие тесты на аутоиммунную дисфункцию; они включают полный анализ крови с дифференциалом, скорость оседания эритроцитов и измерение антинуклеарных антител и ревматоидного фактора.
Плотность костей измеряется, если у женщины есть симптомы или признаки дефицита эстрогена.
Биопсия яичника не показана.
Первичную недостаточность яичников можно классифицировать на основании клинических данных и уровней ФСГ в сыворотке:
Скрытая первичная недостаточность яичников (снижение резерва яичников): необъяснимое бесплодие и нормальный базальный уровень ФСГ в сыворотке
Биохимическая первичная недостаточность яичников: необъяснимое бесплодие и повышенный базальный уровень ФСГ в сыворотке
Открытая первичная недостаточность яичников: нерегулярные менструальные циклы и повышенный базальный уровень ФСГ в сыворотке
Преждевременная недостаточность яичников: нерегулярные или периодические периоды в течение многих лет, возможность беременности и повышенный базальный уровень ФСГ в сыворотке
Преждевременная менопауза: аменорея, стойкое бесплодие и полное истощение примордиальных фолликулов
Предпосылки, Патофизиология, Спонтанная первичная недостаточность яичников
Hewlett M, Mahalingaiah S.Обновленная информация о первичной недостаточности яичников. Curr Opin Endocrinol Диабет Ожирение . 2015 22 декабря (6): 483-9. [Медлайн].
Buijsen RA, Visser JA, Kramer P, Severijnen EA, Gearing M, Charlet-Berguerand N, et al. Присутствие включений, положительных по полиглицинсодержащему белку, FMRpolyG, указывает на то, что связанная с повторами трансляция, не связанная с AUG, играет роль в хрупкой Х-ассоциированной первичной недостаточности яичников. Репродукция Человека . 2015 3 ноября [Medline].
Bardoni B, Mandel JL, Fisch GS.Ген FMR1 и синдром ломкой Х-хромосомы. Ам Дж. Мед Генет . 2000 Лето. 97 (2): 153-63. [Медлайн].
Мюррей А., Шумейкер М.Дж., Беннет С.Е., Эннис С., Макферсон Дж. Н., Джонс М. и др. Популяционные оценки распространенности мутаций экспансии FMR1 у женщин с ранней менопаузой и первичной недостаточностью яичников. Генет Мед . 2013 г. 23 мая. [Medline].
Kim TJ, Anasti JN, Flack MR, Kimzey LM, Defensor RA, Nelson LM.Регулярный эндокринный скрининг пациентов с нормальным кариотипом спонтанной преждевременной недостаточности яичников. Акушерский гинекол . 1997 Май. 89 (5 Пет 1): 777-9. [Медлайн].
Rebar RW, Connolly HV. Клинические особенности молодых женщин с гипергонадотропной аменореей. Фертил Стерил . 1990 Май. 53 (5): 804-10. [Медлайн].
Заключение комитета № 502: первичная недостаточность яичников у подростков. Акушерский гинекол .2011 Сентябрь 118 (3): 741-5. [Медлайн].
Сноудон Д.А., Кейн Р.Л., Бисон В.Л. и др. Является ли ранняя естественная менопауза биологическим маркером здоровья и старения? Am J Общественное здравоохранение . 1989 июн.79 (6): 709-14. [Медлайн].
Luborsky JL, Meyer P, Sowers MF, Gold EB, Santoro N. Преждевременная менопауза в многонациональном популяционном исследовании перехода к менопаузе. Репродукция Человека . 2003 18 января (1): 199-206. [Медлайн].
Попат В.Б., Калис К.А., Вандерхоф В.Х. и др.Минеральная плотность костей у молодых женщин с дефицитом эстрогена. Дж Клин Эндокринол Метаб . 2009 Июль 94 (7): 2277-83. [Медлайн]. [Полный текст].
Нельсон Л.М., Анасти Дж. Н., Кимзи Л. М. и др. Развитие лютеинизированных граафовых фолликулов у пациентов с нормальным кариотипом спонтанной преждевременной недостаточности яичников. Дж Клин Эндокринол Метаб . 1994 Ноябрь 79 (5): 1470-5. [Медлайн].
Калантариду С.Н., Калис К.А., Вандерхоф В.Х. и др.Дефицит тестостерона у молодых женщин с 46, XX спонтанной преждевременной недостаточностью яичников. Фертил Стерил . 2006 ноябрь 86 (5): 1475-82. [Медлайн].
Чжай Дж, Яо Дж, Донг Ф, Бу Зи, Ченг Й, Сато Й и др. Активация фолликулов in vitro и аутотрансплантация свежих тканей у пациентов с первичной недостаточностью яичников. Дж Клин Эндокринол Метаб . 2016 ноябрь 101 (11): 4405-4412. [Медлайн].
Дуглас Д. Активация фолликулов in vitro при первичной недостаточности яичников может способствовать рождению живых детей.Reuters Health Infomation. Доступно на http://www.medscape.com/viewarticle/868836. 16 сентября 2016 г .; Дата обращения: 17 ноября 2016 г.
Адамс Хиллард П.Дж., Нельсон Л.М. Девочки-подростки, менструальный цикл и здоровье костей. Дж. Педиатр Эндокринол Метаб . 2003 май. 16 Дополнение 3: 673-81. [Медлайн].
Adashi EY, Hennebold JD. Мутации одного гена, приводящие к нарушению репродуктивной функции у женщин. N Engl J Med . 1999 4 марта.340 (9): 709-18. [Медлайн].
Alzubaidi NH, Chapin HL, Vanderhoof VH, Calis KA, Nelson LM. Удовлетворение потребностей молодых женщин со вторичной аменореей и спонтанной преждевременной недостаточностью яичников. Акушерский гинекол . 2002 май. 99 (5 Пт 1): 720-5. [Медлайн].
Анасти JN. Преждевременная недостаточность яичников: обновленная информация. Фертил Стерил . 1998 июл.70 (1): 1-15. [Медлайн].
Анасти Дж., Адамс С., Кимзи Л. М., Дефенсор Р. А., Захари А. А., Нельсон Л. М..Кариотипически нормальная спонтанная преждевременная недостаточность яичников: оценка ассоциации с основным комплексом гистосовместимости класса II. Дж Клин Эндокринол Метаб . 1994 марта 78 (3): 722-3. [Медлайн].
Анасти Дж. Н., Калантариду С. Н., Кимзи Л. М., Дефенсор Р. А., Нельсон Л. М.. Потеря костной массы у молодых женщин с нормальным кариотипом спонтанной преждевременной недостаточностью яичников. Акушерский гинекол . 1998, январь, 91 (1): 12-5. [Медлайн].
Армстронг А.Ю., Калис К.А., Нельсон Л.М.Увеличивается ли частота первичной недостаточности яичников у лиц, переживших рак в детстве? Нат Клин Практик Эндокринол Метаб . 2007 апр. 3 (4): 326-7. [Медлайн].
Бакалов В.К., Анасти Ю.Н., Чалис К.А. и др. Аутоиммунный оофорит как механизм фолликулярной дисфункции у женщин с 46, XX спонтанной преждевременной недостаточностью яичников. Фертил Стерил . 2005 Октябрь 84 (4): 958-65. [Медлайн].
Бакалов В.К., Вандерхоф В.Х., Бонди КА, Нельсон Л.М.Антитела надпочечников обнаруживают бессимптомную аутоиммунную недостаточность надпочечников у молодых женщин со спонтанной преждевременной недостаточностью яичников. Репродукция Человека . 2002 17 августа (8): 2096-100. [Медлайн].
Bannatyne P, Russell P, Shearman RP. Аутоиммунный оофорит: клинико-патологическая оценка 12 случаев. Инт Дж. Гинеколь Патол . 1990. 9 (3): 191-207. [Медлайн].
Belvisi L, Bombelli F, Sironi L, Doldi N. Органоспецифический аутоиммунитет у пациентов с преждевременной недостаточностью яичников. Дж Эндокринол Инвест . 1993 16 (11): 889-92. [Медлайн].
Беттерле С., Росси А., Далла Приа С. и др. Преждевременная недостаточность яичников: аутоиммунитет и естественное течение. Клин Эндокринол (Oxf) . 1993 июл. 39 (1): 35-43. [Медлайн].
Betterle C, Volpato M. Аутоиммунитет надпочечников и яичников. евро J Эндокринол . 1998, январь 138 (1): 16-25. [Медлайн].
Бискотти CV, Харт В.Р., Лукас Дж.Кистозное увеличение яичников в результате аутоиммунного оофорита. Акушерский гинекол . 1989 сентябрь 74 (3, часть 2): 492-5. [Медлайн].
Bondy CA, Nelson LM, Kalantaridou SN. Генетические причины нарушения функции яичников. J Здоровье женщин . 1998 Декабрь 7 (10): 1225-9. [Медлайн].
Бирн Дж. Бесплодие и преждевременная менопауза у детей, переживших рак. Медицинский педиатр онкол . 1999 Июль 33 (1): 24-8. [Медлайн].
Cameron IT, O’Shea FC, Rolland JM, Hughes EG, de Kretser DM, Healy DL.Скрытая недостаточность яичников: синдром бесплодия, регулярных менструаций и повышенной концентрации фолликулостимулирующего гормона. Дж Клин Эндокринол Метаб . 1988 Декабрь 67 (6): 1190-4. [Медлайн].
Check JH, Nowroozi K, Chase JS, Nazari A, Shapse D, Vaze M. Вызвание овуляции и беременность у 100 последовательных женщин с гипергонадотропной аменореей. Фертил Стерил . 1990 Май. 53 (5): 811-6. [Медлайн].
Чен С., Савика Дж., Беттерле С. и др.Аутоантитела к стероидогенным ферментам при аутоиммунном полигландулярном синдроме, болезни Аддисона и преждевременной недостаточности яичников. Дж Клин Эндокринол Метаб . 1996 май. 81 (5): 1871-6. [Медлайн].
Кристин-Мэтр С., Вассер С., Портной М.Ф., Бушар П. Гены и преждевременная недостаточность яичников. Молекулярный эндокринол . 1998 25 октября. 145 (1-2): 75-80. [Медлайн].
Conway GS, Kaltsas G, Patel A, Davies MC, Jacobs HS. Характеристика идиопатической преждевременной недостаточности яичников. Фертил Стерил . 1996 Февраль 65 (2): 337-41. [Медлайн].
Coope J. Гормональные и негормональные вмешательства при симптомах менопаузы. Maturitas . 1996 23 марта (2): 159-68. [Медлайн].
Corrigan EC, Raygada MJ, Vanderhoof VH, Nelson LM. Женщина со спонтанной преждевременной недостаточностью яичников рожает ребенка с синдромом ломкой Х-хромосомы. Фертил Стерил . 2005 ноябрь 84 (5): 1508. [Медлайн].
Coulam CB, Adamson SC, Annegers JF.Частота преждевременной недостаточности яичников. Акушерский гинекол . 1986 апр. 67 (4): 604-6. [Медлайн].
Дэвис SR. Преждевременная недостаточность яичников. Maturitas . 1996 23 февраля (1): 1-8. [Медлайн].
Fanchin R, de Ziegler D, Olivennes F, Taieb J, Dzik A, Frydman R. Тест на экзогенный фолликулостимулирующий гормон яичникового резерва (EFORT): простой и надежный скрининговый тест для выявления «плохих ответов» при экстракорпоральном оплодотворении. Репродукция Человека . 1994 9 (9): 1607-11. [Медлайн].
Фархи Дж., Хомбург Р., Фербер А., Орвието Р., Бен Рафаэль З. Отсутствие реакции на стимуляцию яичников у нормогонадотропных, нормогонадных женщин: клинический признак надвигающегося начала недостаточности яичников, предваряющий повышение уровня базальных фолликулостимулирующих гормонов . Репродукция Человека . 1997 12 февраля (2): 241-3. [Медлайн].
Фенихель П., Соссет С., Барбарино-Монье П. и др. Распространенность, специфичность и значение антител к яичникам при спонтанной преждевременной недостаточности яичников. Репродукция Человека . 1997 12 декабря (12): 2623-8. [Медлайн].
Финер Н., Фогельман И., Боттаццо Г. Беременность у женщины с преждевременной недостаточностью яичников. Постградская медицина J . 1985 декабрь 61 (722): 1079-80. [Медлайн]. [Полный текст].
Fiumara A, Sorge G, Toscano A, Parano E, Pavone L, Opitz JM. Синдром Перро: данные о прогрессирующем поражении нервной системы. Ам Дж. Мед Генет А . 30 июля 2004 г. 128A (3): 246-9. [Медлайн].
Garguillo AR, Hill JA. Аутоиммунные эндокринопатии при женской репродуктивной дисфункции. Volpe R, ed. Современная эндокринология: аутоиммунные эндокринопатии . Тотова, Нью-Джерси: Humana Press; 1999. 365-91.
Гордон К.М., Нельсон Л.М. Аменорея и здоровье костей у подростков и молодых женщин. Curr Opin Акушерский гинекол . 2003 15 октября (5): 377-84. [Медлайн].
Хагерман Р.Дж., Хагерман П.Дж.Премутация ломкой X: в фенотипическую складку. Curr Opin Genet Dev . 2002 июн. 12 (3): 278-83. [Медлайн].
Хагерман Р.Дж., Ливитт Б.Р., Фарзин Ф. и др. Синдром тремора / атаксии, связанный с ломкой Х-хромосомой (FXTAS) у женщин с премутацией FMR1. Ам Джам Генет . 2004 Май. 74 (5): 1051-6. [Медлайн].
Hoek A, Schoemaker J, Drexhage HA. Преждевременная недостаточность яичников и аутоиммунитет яичников. Endocr Ред. .1997 18 февраля (1): 107-34. [Медлайн].
Джонсон Дж., Каннинг Дж., Канеко Т., Пру Дж. К., Тилли Дж. Л. Стволовые клетки зародышевой линии и обновление фолликулов в постнатальном яичнике млекопитающих. Природа . 2004 г. 11 марта. 428 (6979): 145-50. [Медлайн].
Kalantaridou SN, Braddock DT, Patronas NJ, Nelson LM. Лечение аутоиммунной преждевременной недостаточности яичников. Репродукция Человека . 14 июля 1999 г. (7): 1777-82. [Медлайн].
Калантариду С.Н., Калис К.А., Вандерхоф В.Х. и др.Дефицит тестостерона у молодых женщин с 46, XX спонтанной преждевременной недостаточностью яичников. Фертил Стерил . 2006 ноябрь 86 (5): 1475-82. [Медлайн].
Калантариду С.Н., Дэвис С.Р., Нельсон Л.М. Преждевременная недостаточность яичников. Endocrinol Metab Clin North Am . 1998 27 декабря (4): 989-1006. [Медлайн].
Калантариду С.Н., Нака К.К., Папаниколау Э. и др. Нарушение функции эндотелия у молодых женщин с преждевременной недостаточностью яичников: нормализация гормональной терапией. Дж Клин Эндокринол Метаб . 2004 августа 89 (8): 3907-13. [Медлайн].
Koh JM, Kim CH, Hong SK, et al. Первичная недостаточность яичников, вызванная растворителем, содержащим 2-бромпропан. евро J Эндокринол . 1998 Май. 138 (5): 554-6. [Медлайн].
LaBarbera AR, Miller MM, Ober C, Rebar RW. Аутоиммунная этиология при преждевременной недостаточности яичников. Am J Reprod Immunol Microbiol . 1988 марта 16 (3): 115-22. [Медлайн].
Лонсдейл Р.Н., Робертс П.Ф., Троуэлл Дж.Аутоиммунный оофорит, связанный с поликистозом яичников. Гистопатология . 1991 июля 19 (1): 77-81. [Медлайн].
Luborsky JL, Visintin I, Boyers S, Asari T, Caldwell B, DeCherney A. Антитела к яичникам, обнаруживаемые иммуноанализом на иммобилизованный антиген у пациентов с преждевременной недостаточностью яичников. Дж Клин Эндокринол Метаб . 1990, январь 70 (1): 69-75. [Медлайн].
МакКонки-Розелл А., Абрамс Л., Финукейн Б. и др. Рекомендации мультидисциплинарных фокус-групп по каскадному тестированию и генетическому консультированию при хрупких Х-ассоциированных расстройствах. Дж. Генет Коунс . 2007 октября, 16 (5): 593-606. [Медлайн].
Мейерс К.М., Бафман Дж. А., Ривас М., Уилрой Р. С., Симпсон Дж. Л.. Дисгенезия гонад (яичников) у 46, XX человек: частота аутосомно-рецессивной формы. Ам Дж. Мед Генет . 1996, 28 июня. 63 (4): 518-24. [Медлайн].
Миллер М.Э., Чаттен Дж. Изменения яичников при атаксии и телеангиэктазии. Акта Педиатр Сканд . 1967 Сентябрь 56 (5): 559-61. [Медлайн].
Мюнстер К., Хельм П., Шмидт Л.Вторичная аменорея: распространенность и медицинский контакт — перекрестное исследование, проведенное в датском округе. Br J Obstet Gynaecol . 1992 Май. 99 (5): 430-3. [Медлайн].
Намнум А.Б., Мерриам Г.Р., Моисей А.М., Левин Массачусетс. Репродуктивная дисфункция у женщин с наследственной остеодистрофией Олбрайт. Дж Клин Эндокринол Метаб . 1998 марта 83 (3): 824-9. [Медлайн].
Navot D, Rosenwaks Z, Margalioth EJ. Прогностическая оценка женской плодовитости. Ланцет . 1987 19 сентября. 2 (8560): 645-7. [Медлайн].
Нельсон Л.М., Анасти Дж. Н., Флэк МР. Преждевременная недостаточность яичников. Adashi EY, Rock JA, Rosenwaks Z, ред. Репродуктивная эндокринология, хирургия и технологии . Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс; 1995. 2: 1393-410.
Нельсон Л.М., Анасти Дж. Н., Флэк МР. Преждевременная недостаточность яичников. Адаши Э, изд. Репродуктивная эндокринология, хирургия и технологии .Филадельфия, Пенсильвания: Raven Press; 1996. 1394-410.
Нельсон Л.М., Анасти Дж. Н., Кимзи Л. М. и др. Развитие лютеинизированных граафовых фолликулов у пациентов с нормальным кариотипом спонтанной преждевременной недостаточности яичников. Дж Клин Эндокринол Метаб . 1994 Ноябрь 79 (5): 1470-5. [Медлайн].
Нельсон Л.М., Бакалов В.К. Механизмы фолликулярной дисфункции у 46, XX спонтанной преждевременной недостаточности яичников. Endocrinol Metab Clin North Am .2003 Сентябрь 32 (3): 613-37. [Медлайн].
Нельсон Л.М., Бакалов В.К. Механизмы фолликулярной дисфункции у 46, XX спонтанной преждевременной недостаточности яичников. Endocrinol Metab Clin North Am . 2003 Сентябрь 32 (3): 613-37. [Медлайн].
Нельсон Л.М., Ковингтон С.Н., Арматура RW. Обновление: спонтанная преждевременная недостаточность яичников — это не ранняя менопауза. Фертил Стерил . 2005 г., май. 83 (5): 1327-32. [Медлайн].
Нельсон Л.М., Кимзи Л.М., Уайт Б.Дж., Мерриам Г.Р.Подавление гонадотропинов для лечения кариотипически нормальной спонтанной преждевременной недостаточности яичников: контролируемое исследование. Фертил Стерил . 1992 Январь 57 (1): 50-5. [Медлайн].
Новосад Дж. А., Калантариду С. Н., Тонг З. Б., Нельсон Л. М.. Антитела к яичникам, обнаруженные с помощью непрямой иммунофлуоресценции, ненадежны при диагностике аутоиммунной преждевременной недостаточности яичников: контролируемая оценка. BMC Женское Здоровье . 17 марта 2003 г. 3 (1): 2. [Медлайн].
Новосад Дж. А., Калантариду С. Н., Тонг З. Б., Нельсон Л. М..Антитела к яичникам, обнаруженные с помощью непрямой иммунофлуоресценции, ненадежны при диагностике аутоиммунной преждевременной недостаточности яичников: контролируемая оценка. BMC Женское Здоровье . 17 марта 2003 г. 3 (1): 2. [Медлайн].
Prior JC, Vigna YM, Schechter MT, Burgess AE. Потеря костной массы позвоночника и нарушения овуляции. N Engl J Med . 1990 г., 1. 323 (18): 1221-7. [Медлайн].
Prueitt RL, Zinn AR. Развилка на пути к плодородию. Нат Генет . 2001 27 февраля (2): 132-4. [Медлайн].
Арматура RW, Cedars MI. Гипергонадотропные формы аменореи у молодых женщин. Endocrinol Metab Clin North Am . 1992 21 марта (1): 173-91. [Медлайн].
Rebar RW, Morandini IC, Erickson GF, Petze JE. Гормональная основа репродуктивных дефектов у бестимусных мышей: снижение концентрации гонадотропина у самок препубертатного возраста. Эндокринология . 1981, январь, 108 (1): 120-6.[Медлайн].
Rosen GF, Stone SC, Yee B. Индукция овуляции у женщин с преждевременной недостаточностью яичников: проспективное перекрестное исследование. Фертил Стерил . 1992 г., 57 (2): 448-9. [Медлайн].
Schwartz CE, Dean J, Howard-Peebles PN, et al. Акушерские и гинекологические осложнения у хрупких носителей Х-хромосомы: многоцентровое исследование. Ам Дж. Мед Генет . 1994 15 июля. 51 (4): 400-2. [Медлайн].
Sedmak DD, Hart WR, Tubbs RR.Аутоиммунный оофорит: гистопатологическое исследование пораженных яичников с иммунологической характеристикой инфильтрата мононуклеарных клеток. Инт Дж. Гинеколь Патол . 1987. 6 (1): 73-81. [Медлайн].
Шарф М., Израильский И., Графф Г. Значение биопсии яичников в диагностике и лечении бесплодия, связанного с аменореей. Акушерский гинекол . 1972, январь, 39 (1): 89-94. [Медлайн].
Симпсон Дж. Л., Райкович А. Дифференцировка яичников и гонадная недостаточность. Ам Дж. Мед Генет . 1999, 29 декабря. 89 (4): 186-200. [Медлайн].
Sklar C. Репродуктивная физиология и потеря выработки половых гормонов, связанная с лечением. Медицинский педиатр онкол . 1999 Июль 33 (1): 2-8. [Медлайн].
Смит Дж. А., Витале С., Рид Г. Ф. и др. Признаки и симптомы сухого глаза у женщин с преждевременной недостаточностью яичников. Арочный офтальмол . 2004 Февраль 122 (2): 151-6. [Медлайн].
Смит Дж. А., Витале С., Рид Г. Ф. и др.Признаки и симптомы сухого глаза у женщин с преждевременной недостаточностью яичников. Арочный офтальмол . 2004 Февраль 122 (2): 151-6. [Медлайн].
Taylor AE, Adams JM, Mulder JE, Martin KA, Sluss PM, Crowley WF Jr. Рандомизированное контролируемое испытание заместительной терапии эстрадиолом у женщин с гипергонадотропной аменореей. Дж Клин Эндокринол Метаб . 1996 Октябрь 81 (10): 3615-21. [Медлайн].
Thomas MA, Rebar RW. Задержка полового созревания у девочек и первичная аменорея. Курр Тер эндокринол Метаб . 1997. 6: 223-6. [Медлайн].
Тонг З.Б., Нельсон Л.М. Ген мыши, кодирующий антиген ооцита, связанный с аутоиммунной преждевременной недостаточностью яичников. Эндокринология . 1999 августа 140 (8): 3720-6. [Медлайн].
Tung KS, Lu CY. Иммунологические основы репродуктивной недостаточности. Моногр Патол . 1991. 308-33. [Медлайн].
van Kasteren YM, Schoemaker J. Преждевременная недостаточность яичников: систематический обзор терапевтических вмешательств для восстановления функции яичников и достижения беременности. Обновление Hum Reprod . 1999 сентябрь-октябрь. 5 (5): 483-92. [Медлайн].
Ventura JL, Fitzgerald OR, Koziol DE, et al. Функциональное благополучие положительно коррелирует с духовным благополучием у женщин со спонтанной преждевременной недостаточностью яичников. Фертил Стерил . 2007 Март 87 (3): 584-90. [Медлайн].
Wittenberger MD, Hagerman RJ, Sherman SL, et al. Премутация и воспроизведение FMR1. Фертил Стерил . 2007 Март.87 (3): 456-65. [Медлайн].
Ян Г., Шенфельд Д., Пенни С., Хурксталь К., Тейлор А. Э., Фаустман Д. Идентификация пациентов с преждевременной яичниковой недостаточностью с основным аутоиммунным заболеванием. J Womens Health Gend Based Med . 2000 Апрель, 9 (3): 275-87. [Медлайн].
Zarate A, Karchmer S, Gomez E, Castelazo-Ayala L. Преждевременная менопауза. Клиническое, гистологическое и цитогенетическое исследование. Am J Obstet Gynecol . 1970 января 1. 106 (1): 110-4.[Медлайн].
Little DT, Ward HR. Недостаточность яичников у подростков после вакцинации против вируса папилломы человека: серия случаев, наблюдаемых в общей практике. J Investig Med High Impact Case Rep . 2014 окт-дек. 2 (4): 2324709614556129. [Медлайн].
Преждевременная недостаточность яичников | Orphanet Journal of Rare Diseases
Santoro N: Механизмы преждевременной недостаточности яичников. Ann Endocrinol. 2003, 64: 87-92.
CAS
Google Scholar
Timmreck LS, Reindollar RH: Современные проблемы первичной аменореи. Obstet Gynecol Clin North Am. 2003, 30: 287-302. 10.1016 / S0889-8545 (03) 00027-5.
Артикул
PubMed
Google Scholar
Coulam CB, Adamson SC, Annegers JF: Частота преждевременной недостаточности яичников. Obstet Gynecol. 1986, 67: 604-606.
CAS
PubMed
Google Scholar
Conway GS, Kaltsas G, Patel A, Davies MC, Jacobs HS: Характеристика идиопатической преждевременной недостаточности яичников.Fertil Steril. 1996, 64: 337-341.
Google Scholar
Cramer DW, Xu H, Harlow BL: Семейный анамнез как предиктор ранней менопаузы. Fertil Steril. 1995, 64: 740-745.
CAS
PubMed
Google Scholar
Torgerson DJ, Thomas RE, Reid DM: Возраст матери и дочери в период менопаузы: есть ли связь ?. Eur J Obstet Gynecol Reprod Biol. 1997, 74: 63-66.10.1016 / S0301-2115 (97) 00085-7.
CAS
Статья
PubMed
Google Scholar
Симпсон Дж. Л., Райкович А: Дифференцировка яичников и гонадная недостаточность. Am J Med Genet. 1999, 89: 186-200. 10.1002 / (SICI) 1096-8628 (199
CAS
Статья
PubMed
Google Scholar
Шерман С.Л.: Преждевременная недостаточность яичников при синдроме ломкой Х-хромосомы.Am J Med Genet. 2000, 97: 189-194. 10.1002 / 1096-8628 (200023) 97: 3 <189 :: AID-AJMG1036> 3.0.CO; 2-J.
CAS
Статья
PubMed
Google Scholar
Sybert PV, McCauley E: Синдром Тернера. N Engl J Med. 2004, 351: 1227-1238. 10.1056 / NEJMra030360.
CAS
Статья
PubMed
Google Scholar
Госвами Д., Конвей Г.С.: Преждевременная недостаточность яичников.Обновление Hum Reprod. 2005, 11: 391-410. 10.1093 / humupd / dmi012.
CAS
Статья
PubMed
Google Scholar
Achermann JC, Ozisik G, Meeks JJ, Jameson JL: Перспектива: генетические причины репродуктивных заболеваний человека. J Clin Endocrinol Metab. 2002, 87: 2447-2454. 10.1210 / jc.87.6.2447.
CAS
Статья
PubMed
Google Scholar
Aittomaki K, Lucena JL, Pakarinen P, Sistonen P, Tapanainen J, Gromoll J, Kaskikari R, Sankila EM, Lehvaslaiho H, Engel AR, Nieschlag E, Huhtaniemi I, de la Chapelle A: Мутация в Ген рецептора фолликулостимулирующего гормона вызывает наследственную гипергонадотропную недостаточность яичников.Клетка. 1995, 82: 959-568. 10.1016 / 0092-8674 (95)
-9.
CAS
Статья
PubMed
Google Scholar
Beau I, Touraine P, Meduri G, Gougeon A, Desroches A, Matuchansky C., Milgrom E, Kuttenn F, Misrahi M: новый фенотип, связанный с мутациями частичной потери функции рецептора фолликулостимулирующего гормона. J Clin Invest. 1998, 102: 1352-1359.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Де Баэре Э, Бейсен Д., Олей К., Лоренц Б., Кокке Дж., Де Саттер П., Девриндт К., Диксон М., Феллоус М., Фринс Дж. П., Гарза А., Йонсруд К., Койвисто П. А., Краузе А., Лерой Б. П., Мейре Ф. , Plomp A, Van Maldergem L, De Paepe A, Veitia R, Messiaen L: FOXL2 и BPES: горячие точки мутаций, фенотипическая изменчивость и пересмотр корреляции генотип-фенотип. Am J Hum Genet. 2003, 72: 478-487. 10.1086 / 346118.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Ди Паскуале Э, Бек-Пекко П., Персани Л.: Гипергонадотропная недостаточность яичников, связанная с наследственной мутацией гена морфогенетического белка-15 костей человека (BMP15). Am J Hum Genet. 2004, 75: 106-111. 10.1086 / 422103.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Шимасаки С., Мур Р.К., Оцука Ф., Эриксон Г.Ф .: Система костных морфогенетических белков в репродукции млекопитающих. Endocr Rev.2004, 25: 72-101.10.1210 / er.2003-0007.
CAS
Статья
PubMed
Google Scholar
Харрис С.Е., Чанд А.Л., Виншип И.М., Герсак К., Айттомаки К., Шеллинг А.Н.: Идентификация новых мутаций в FOXL2, связанных с преждевременной недостаточностью яичников. Мол Хум Репрод. 2002, 8: 729-733. 10,1093 / мольхр / 8.8.729.
CAS
Статья
PubMed
Google Scholar
Bodega B, Porta C, Crosignani PG, Ginelli E, Marozzi A: Мутации в кодирующей области гена FOXL2 не являются основной причиной идиопатической преждевременной недостаточности яичников.Мол Хум Репрод. 2004, 10: 555-557. 10,1093 / мольхр / gah078.
CAS
Статья
PubMed
Google Scholar
Touraine P, Beau I, Gougeon A, Meduri G, Desroches A, Pichard C, Detoeuf M, Paniel B, Prieur M, Zorn JR, Milgrom E, Kuttenn F, Misrahi M: новые естественные инактивирующие мутации рецептор фолликулостимулирующего гормона: корреляция между функцией рецептора и фенотипом. Мол Эндокринол. 1999, 13: 1844-1854. 10.1210 / me.13.11.1844.
CAS
Статья
PubMed
Google Scholar
Arnhold IJ, Latronico AC, Batista MC, Izzo CR, Mendonca BB: Клинические особенности женщин с резистентностью к лютеинизирующему гормону. Клин Эндокринол (Oxf). 1999, 51: 701-707. 10.1046 / j.1365-2265.1999.00863.x.
CAS
Статья
Google Scholar
Хики М., Бален А: Нарушения менструального цикла в подростковом возрасте: исследование и лечение.Обновление Hum Reprod. 2003, 9: 493-504. 10.1093 / humupd / dmg038.
Артикул
PubMed
Google Scholar
Meduri G, Touraine P, Beau I, Lahuna O, Desroches A, Vacher-Lavenu MC, Kuttenn F, Misrahi M: задержка полового созревания и первичная аменорея, связанные с новой мутацией рецептора фолликулостимулирующего гормона человека : клинические, гистологические и молекулярные исследования. J Clin Endocrinol Metab. 2003, 88: 3491-3498. 10.1210 / jc.2003-030217.
CAS
Статья
PubMed
Google Scholar
Вайнштейн Л.С., Лю Дж., Сакамото А., Се Т., Чен М: Мини-обзор: GNAS: нормальные и ненормальные функции. Эндокринология. 2004, 145: 5459-5464. 10.1210 / en.2004-0865.
CAS
Статья
PubMed
Google Scholar
Чиауцци В.А., Буссманн Л., Кальво Дж. К., Сундблад В., Шарро Э. Х .: Циркулирующие иммуноглобулины, которые ингибируют связывание рецептора фолликулостимулирующего гормона: предполагаемая диагностическая роль при синдроме резистентных яичников.Клин Эндокринол (Oxf). 2004, 61: 46-54. 10.1111 / j.1365-2265.2004.02054.x.
CAS
Статья
Google Scholar
Обновление при гипер- и гипогонадотропной аменорее | Журнал клинической эндокринологии и метаболизма
Аннотация
Справочная информация:
Аменорея — это относительно обычное заболевание, которое в любое время присутствует у 5% взрослых женщин. Клиническое значение отсутствия регулярных менструальных циклов выходит за рамки репродуктивных проблем.Эпизоды аменореи продолжительностью 90 дней могут иметь последствия для здоровья костей и сердечно-сосудистой системы. Длительная аменорея, в зависимости от ее первопричины, может быть предвестником значительного сердечно-сосудистого риска.
Материалы и методы:
Это последняя версия медицинской литературы по этой теме.
Результаты:
Последние несколько лет были отмечены большим вниманием к ранним проявлениям общих нарушений овуляции, таких как синдром поликистозных яичников, и менее распространенных заболеваний, таких как преждевременная недостаточность / недостаточность яичников.Также выясняются долгосрочные последствия функциональной гипоталамической аменореи и ее генетическое происхождение. Наконец, последствия для здоровья этих и других нарушений менструального цикла становятся все более четко определенными с более твердыми клиническими конечными точками, а не просто оценкой факторов риска.
Аменорея продолжительностью не менее 3 месяцев присутствует примерно у 3–5% взрослых женщин, при этом больший процент (примерно 11%) сообщают об олигоменорее меньшей продолжительности (1). Менструальный цикл считается «жизненно важным признаком» репродуктивного здоровья женщины (2), и уделяется повышенное внимание постановке диагноза относительно ранней стадии аменореи.Это связано с тем, что общие последствия аменореи для здоровья нарастают относительно быстро после того, как женщина становится гипогонадальной (3), тогда как раннее выявление синдрома поликистозных яичников (СПКЯ) может помочь избежать чрезмерного увеличения веса и гирсутизма (4) и снизить риски гиперплазия эндометрия и рак.
Среди гипергонадотропных состояний ранняя менопауза (прекращение менструаций в возрасте до 45 лет) встречается примерно у 5% женщин, при этом у 1% наступает менопауза до 40 лет (5).У большей доли женщин, оцениваемой в 14%, наблюдается снижение резерва яичников (DOR) и снижение фертильности, сопровождающееся биохимическими маркерами ранней менопаузы (6). В какой степени эта клиническая сущность предсказывает раннюю менопаузу, остается спорным. Олигоаменорея с селективной гиперсекрецией ЛГ наблюдается у женщин с СПКЯ и присутствует у 6–8% взрослого женского населения (7). Считается, что гипогонадотропный гипогонадизм или гипоталамическая аменорея (ГА) присутствует у 2–5% взрослых женщин, но существует немного действительно популяционных обследований, и заболевание, по-видимому, варьируется в зависимости от исследуемой популяции (1).Общее описание относительных биохимических показателей при различных типах аменореи, описанных в этом обзоре, представлено в таблице 1.
Таблица 1
Общее направление ожидаемых лабораторных исследований у женщин с аменореей разных типов
| Параметр . | FHA (стресс, упражнения) . | FHA (анорексия) . | FHA + СПКЯ . | СПКЯ . | POF / POI . | Ожирение . | |
|---|---|---|---|---|---|---|---|
| LH | От низкого до нормального | От низкого до необнаружимого | от нормального до низкого | от нормального до высокого | от нормального до высокого | от нормального до низкого | |
| от низкого до низкого | от низкого до низкого | от нормального до низкого | от нормального до низкого | высокого | от нормального до низкого | ||
| E2 | низкого | от самого низкого | от нормального до низкого | от нормального до низкого | от нормального до низкого | от нормального до низкого | |
| Тестостерон | От низкого до нормального | От низкого | от нормального до высокого | высокого | от нормального до низкого | от нормального до высокого | |
| DHEAS | от нормального до низкого | низкого нормального 908 высокий | от нормального до низкого | от нормального до низкого | |||
| AMH (MIS) | Нормальный | Нормальный | Нормальный к высокому | От нормального к высокому | Низкий | Нормальный к низкому |
| Параметр . | FHA (стресс, упражнения) . | FHA (анорексия) . | FHA + СПКЯ . | СПКЯ . | POF / POI . | Ожирение . | |
|---|---|---|---|---|---|---|---|
| LH | От низкого до нормального | От низкого до необнаружимого | от нормального до низкого | от нормального до высокого | от нормального до высокого | от нормального до низкого | |
| от низкого до низкого | от низкого до низкого | от нормального до низкого | от нормального до низкого | высокого | от нормального до низкого | ||
| E2 | низкого | от самого низкого | от нормального до низкого | от нормального до низкого | от нормального до низкого | от нормального до низкого | |
| Тестостерон | От низкого до нормального | От низкого | от нормального до высокого | высокого | от нормального до низкого | от нормального до высокого | |
| DHEAS | от нормального до низкого | низкого нормального 908 высокий | от нормального до низкого | от нормального до низкого | |||
| AMH (MIS) | Нормальный | Нормальный | От нормального к высокому | От нормального к высокому | Низкий | От нормального к низкому |
Таблица 1
Общее направление ожидаемых лабораторных исследований у женщин с аменореей разных типов
| FHA (стресс, упражнения) . | FHA (анорексия) . | FHA + СПКЯ . | СПКЯ . | POF / POI . | Ожирение . | ||
|---|---|---|---|---|---|---|---|
| LH | От низкого до нормального | От низкого до необнаружимого | от нормального до низкого | от нормального до высокого | от нормального до высокого | от нормального до низкого | |
| от низкого до низкого | от низкого до низкого | от нормального до низкого | от нормального до низкого | высокого | от нормального до низкого | ||
| E2 | низкого | от самого низкого | от нормального до низкого | от нормального до низкого | от нормального до низкого | от нормального до низкого | |
| Тестостерон | От низкого до нормального | От низкого | от нормального до высокого | высокого | от нормального до низкого | от нормального до высокого | |
| DHEAS | от нормального до низкого | низкого нормального 908 высокий | от нормального до низкого | от нормального до низкого | |||
| AMH (MIS) | Нормальный | Нормальный | Нормальный к высокому | От нормального к высокому | Низкий | Нормальный к низкому |
| Параметр . | FHA (стресс, упражнения) . | FHA (анорексия) . | FHA + СПКЯ . | СПКЯ . | POF / POI . | Ожирение . | |
|---|---|---|---|---|---|---|---|
| LH | От низкого до нормального | От низкого до необнаружимого | от нормального до низкого | от нормального до высокого | от нормального до высокого | от нормального до низкого | |
| от низкого до низкого | от низкого до низкого | от нормального до низкого | от нормального до низкого | высокого | от нормального до низкого | ||
| E2 | низкого | от самого низкого | от нормального до низкого | от нормального до низкого | от нормального до низкого | от нормального до низкого | |
| Тестостерон | От низкого до нормального | От низкого | от нормального до высокого | высокого | от нормального до низкого | от нормального до высокого | |
| DHEAS | от нормального до низкого | низкого нормального 908 высокий | от нормального до низкого | от нормального до низкого | |||
| AMH (MIS) | Нормальный | Нормальный | От нормального к высокому | От нормального к высокому | Низкий | От нормального к низкому |
За последние 2 года мы получили некоторые научные данные обо всех этих состояниях.В этом обзоре основное внимание будет уделено новейшим открытиям и сдвигам в парадигме в отношении аменореи. Подтверждены опасения по поводу возможных осложнений ранней менопаузы, описана природа ранней менопаузы и ее сходство или отсутствие таковой с естественной менопаузой, соответствующей возрасту. Особое внимание уделяется раннему выявлению СПКЯ и его дифференциации от репродуктивной дисфункции, связанной с ожирением, а также более пристальному вниманию к его долгосрочным последствиям.Наконец, целостные и генетические модели вторичной ГА поставили под сомнение наши представления об этом заболевании.
Гипергонадотропные условия
Ранняя и преждевременная менопауза
Менопауза до 45 лет встречается примерно у 5% женщин и поэтому определяется как аномально ранняя, тогда как менопауза до 40 лет определяется как преждевременная. Премутация ломкой Х-хромосомы является наиболее распространенной генетической аномалией, связанной с преждевременной недостаточностью яичников у взрослых женщин, за которой следуют аномалии, связанные с Х-хромосомой, не связанные с синдромом Тернера (8).Генетические причины преждевременной и ранней менопаузы, помимо синдрома Тернера, были изучены совсем недавно с использованием высокопроизводительных технологий. Изучение 18 862 генотипированных и условно рассчитанных однонуклеотидных полиморфизмов в 278 генах у 24 341 женщины в рамках исследования здоровья медсестер (n = 2287) и исследования здоровья женского генома (n = 22054) показало, что полиморфизмы в метаболизме стероидных гормонов и пути биосинтеза связаны со временем наступления менархе и менопаузы (9).Исследование «Прорыв поколений» выявило четыре генетических локуса, связанных с возрастом при естественной менопаузе, и выявило важные семейные ассоциации (10). Когда эти исследователи продолжили сравнение 4,5% людей с наименьшим числом аллелей риска (два или три) с 3,0% с наибольшим числом (восемь аллелей риска), скорректированное отношение шансов (OR) составило 4,1 [95% доверительный интервал (ДИ) 2,4–7,1; P = 4,0 × 10 −7 ] был обнаружен для ранней менопаузы (11).
Новые мутации генов были идентифицированы в связи с преждевременной и ранней менопаузой и могут дать новые ключи к разгадке патофизиологии этого заболевания. Мутации гена гомолога фосфата и тензина связаны с преждевременной активацией пула ооцитов и, возможно, преждевременной менопаузой (12). Гетерозиготные мутации и полиморфизмы костного морфогенетического белка-15 (13) и генов фактора роста / дифференцировки-9 также могут быть связаны с преждевременной менопаузой, но ни один из них не особенно распространен в популяции (14).
Ранняя менопауза связана с учащением сердечно-сосудистых заболеваний (ССЗ), но причинная природа этой связи остается неясной. Было высказано предположение, что женщины с ранее существовавшими сердечно-сосудистыми заболеваниями более склонны к ранней менопаузе. Есть также эпидемиологические данные, позволяющие предположить, что ранняя менопауза является независимым фактором риска сердечно-сосудистых заболеваний (15, 16). Более того, есть данные, позволяющие предположить, что сердечно-сосудистые заболевания, когда они становятся клинически очевидными, более серьезны у женщин с ранней менопаузой. Последние данные проспективного регистра инфаркта миокарда у 493 женщин указывают на усиление стенокардии (скорректированный OR, 2.09; 95% ДИ, 1,38–3,17) и более тяжелая стенокардия (скорректированный ОШ, 2,65; 95% ДИ, 1,34–5,22) наблюдались при 1-летнем наблюдении у женщин с ранней менопаузой в анамнезе, перенесших инфаркт миокарда, когда по сравнению с женщинами с менопаузой, соответствующей возрасту (17). Примечательно, что в этом исследовании женщины с менопаузой до 40 лет чаще курили, но у них не было других сопутствующих заболеваний, которые отличались бы от группы менопаузы, соответствующей возрасту. У женщин, перенесших двустороннюю овариэктомию в пременопаузе и не получавших эстроген, смертность от сердечно-сосудистых заболеваний почти удвоилась в когорте, наблюдаемой в округе Олмстед, штат Миннесота [отношение рисков (HR), 1.84; 95% ДИ 1,27–2,68; P = 0,001] (18). Исследование SWAN, продольное когортное исследование более 3000 женщин среднего возраста на исходном уровне, сообщило о своих 10-летних результатах, оценив женщин по факторам и маркерам сердечно-сосудистого риска и сосредоточив данные на заключительном менструальном периоде. Общий холестерин, холестерин липопротеинов низкой плотности и аполипопротеин B продемонстрировали существенное повышение в течение 1-летнего интервала до и после последней менструации. Эти изменения наиболее соответствовали изменениям, вызванным менопаузой (19).Взятые вместе, эти исследования предполагают, что при оценке риска сердечно-сосудистых заболеваний стоит оценить возраст женщины в период менопаузы и рассматривать раннюю менопаузу как независимый фактор риска сердечно-сосудистых заболеваний.
Дополнительные доказательства того, что потеря функции яичников в возрасте до наступления естественной менопаузы пагубно сказывается на здоровье женщины, получены в обсервационных исследованиях женщин, подвергшихся овариэктомии. У женщин, перенесших двустороннюю овариэктомию в предменопаузе (n = 1091) и сравнивавших с теми, кто перенес одностороннюю овариэктомию (n = 1274) или естественную менопаузу (n = 2383), была повышена смертность от нейродегенеративных заболеваний (в первую очередь паркинсонизма и деменции; HR 5.24; 95% ДИ 2,02–13,6; P <0,001) и более депрессивные и тревожные расстройства (скорректированный HR, 1,54; 95% ДИ, 1,04–2,26; и HR, 2,29; 95% ДИ, 1,33–3,95, соответственно) (20).
Переход к менопаузе продолжает оставаться темой исследовательского интереса, и появляются новые парадигмы, объясняющие нарушения менструального цикла и симптоматику. Менопаузальный переход характеризуется «нерегулярными» менструальными циклами и сопутствующим непредсказуемым гормональным режимом.В частности, описаны дисфункциональное маточное кровотечение, резкие колебания секреции эстрогена и снижение уровня прогестерона. Hale et al. (21) три раза в неделю наблюдали гормоны в сыворотке крови у 77 женщин: 17 из них находились в стадии ранней менопаузы, а 23 — в поздней стадии менопаузы. Из 29 наблюдаемых овуляторных циклов 11 продемонстрировали паттерн с лютеиновым повышением эстрадиола, предположительно из-за несоответствующего раннего набора фолликулов, сопровождаемого повышенным уровнем ФСГ в последующей фолликулярной фазе и снижением секреции лютеинового прогестерона, когда наступила овуляция.Эти исследователи назвали этот цикл типом LOOP (лютеиновый вне фазы) и обнаружили, что они обычно были менее 21 или более 40 дней по продолжительности. Циклы LOOP не наблюдались у женщин, у которых не было менопаузального перехода. Тенденция к аномальному повышению уровня эстрогена у женщин во время раннего менопаузального перехода была оценена O’Connor et al. (22, 23) в исследовании биодемографических моделей репродуктивного старения (BIMORA). В этом исследовании 108 женщин в возрасте от 25 до 58 лет собирали ежедневные пробы мочи в течение 6-месячных периодов времени.Женщины были сгруппированы по репродуктивной стадии (24) с размерами групп от 17 до 134 человек. Сообщалось об увеличении общего воздействия эстрогена, измеряемого с помощью глюкуронида эстрона в моче, а также о беспрепятственном воздействии эстрогена у женщин в раннем переходном периоде менопаузы. Эти исследования важны, потому что они обеспечивают большую ясность процесса менопаузального перехода, исследуя гормоны в течение более чем одного менструального цикла, тем самым обеспечивая понимание предшествующих гормональных событий.
Женщины с DOR еще не находятся в периоде менопаузы, но имеют признаки повышенного ФСГ и / или пониженного уровня антимюллеровского гормона / вещества, ингибирующего мюллериан, с регулярными менструальными циклами или без них. Хотя у некоторых из этих женщин может продолжаться ранняя менопауза, у других может быть другой репродуктивный фенотип. Pal et al. (25) недавно сообщил о подробном анализе менструального цикла женщин с DOR. Эти исследователи сравнили репродуктивные гормональные паттерны восьми женщин с DOR с 14 женщинами соответствующего возраста, обычно ездящими на велосипеде, а также с исторической группой женщин в перименопаузе.У женщин с DOR наблюдался длительный всплеск ЛГ (3,3 ± 0,4 дня) по сравнению с женщинами того же возраста (1,9 ± 0,2 дня; P <0,01) и женщинами в перименопаузе (1,5 ± 0,2 дня; P <0,001). Величина выброса ЛГ была выше, чем у женщин в перименопаузе (64 ± 13 против 31 ± 8 мМЕ / мл; P = 0,048). Женщины с DOR также продемонстрировали в целом более высокий уровень ФСГ в моче, чем контрольные женщины того же возраста и женщины в перименопаузе, и меньше выделяли глюкуронида прегнандиола с мочой по сравнению с контрольной группой того же возраста.Эти данные свидетельствуют о том, что DOR может отличаться от ранней менопаузы по клинической картине и может свидетельствовать о нарушении секреции или действия гонадотропинов.
Синдром поликистозных яичников
Повышенное внимание было уделено ранней диагностике и отдаленным последствиям СПКЯ, определяемым как хроническая ановуляция с клиническими или биохимическими признаками гиперандрогении с морфологией поликистозных яичников или без нее, а не по другим причинам, которые могут имитировать заболевание [ e.грамм. врожденная гиперплазия надпочечников (ВГК)] (26). Недавняя клиническая выборка сообщила об исходных характеристиках группы из 70 девочек из Висконсина, которым был поставлен диагноз в среднем 16,2 года (диапазон от 11 до 22 лет). Полностью 70% молодых женщин имели индекс массы тела (ИМТ) выше 95-го центиля на момент постановки диагноза, более 50% имели гирсутизм, а у трех был сахарный диабет (СД) 2 типа (27). Эти данные подчеркивают важность раннего выявления СПКЯ, потому что предотвращение всех этих последствий намного эффективнее, чем их лечение после того, как они проявятся.Лечение метформином маленьких для гестационного возраста девочек с признаками преждевременного полового созревания оказалось эффективным в отсрочке наступления ожидаемого фенотипа СПКЯ (28).
Клинические проявления СПКЯ, сосуществующие с лежащей в основе ГК, оценивались клиницистами в течение многих лет, но были официально описаны недавно (29). При сравнении с женщинами с HA было обнаружено, что женщины с СПКЯ имели более высокий ИМТ и имели клинические признаки гиперандрогенемии и нерегулярных менструаций при увеличении веса, но у них был аналогичный риск низкой плотности костной ткани из-за хронического подавления гипоталамуса. -гипофизарно-яичниковая ось.Эта клиническая проблема может быть эффективно решена, если врачи не предполагают, что у всех женщин с ГА восстановится нормальная менструальная цикличность после улучшения основной энергетической / стрессовой диссинергии, которая лежит в основе расстройства. В настоящее время нет четких клинических критериев, которые позволили бы сделать очевидным, что у женщины с функциональной ГА (FHA) разовьется СПКЯ, когда ее гипоталамус оправится от стрессоров, которые привели к FHA. Однако клиницисты могут быть внимательны, чтобы рассмотреть эту возможность, когда женщина с FHA предприняла шаги, необходимые для снижения своего физиологического стресса ( e.грамм. уменьшила количество физических упражнений, увеличила массу тела до нормы, прошла когнитивно-поведенческую терапию) и не восстанавливает менструальную функцию.
Помимо опасений по поводу раннего выявления, все больше данных собирается о потенциальных долгосрочных последствиях СПКЯ. Shaw et al. (30), сообщающий о 104 женщинах из Оценки женского ишемического синдрома (WISE), которые сообщили о нерегулярных менструациях и превалирующей гиперандрогенемии, обнаружил, что выживаемость без сердечно-сосудистых событий составила 78.9% у женщин с СПКЯ по сравнению с 88,7% бессобытийной выживаемостью у женщин без СПКЯ. Этот результат привел к нескорректированному HR 3,3 для женщин с СПКЯ, который был снижен до 1,6 после корректировки на ИМТ. Это исследование предполагает, что повышенные факторы риска сердечно-сосудистых заболеваний, наблюдаемые у женщин с СПКЯ в пременопаузе, приводят к повышенному риску сердечно-сосудистых заболеваний после менопаузы. Однако определение СПКЯ, используемое в этом исследовании, могло быть слишком широким, а критерий текущей гиперандрогенемии (определяемый как верхний квартиль для андростендиона, общего или свободного тестостерона) мог быть слишком всеобъемлющим, поскольку известно, что индекс свободных андрогенов возрастают с прогрессом в период менопаузы и могут влиять на риск других женщин с нерегулярными менструациями, но без СПКЯ (31).Более того, контроль ИМТ имеет решающее значение для установления соответствующего уровня риска (31), который может различаться у худых и полных женщин с СПКЯ. Второе недавнее исследование подтвердило мнение о том, что СД 2 типа и стойкая дислипидемия более вероятны у женщин с СПКЯ (32). Это исследование включало 18-летнее наблюдение за 1127 женщинами в возрасте от 20 до 32 лет на исходном уровне. Было использовано определение СПКЯ Национального института здравоохранения (олигоановуляция с гиперандрогенизмом, другие потенциальные причины исключены; см. Синдром поликистозных яичников ), и были выполнены стандартизированные измерения гормонов.Из первоначальных 1127 женщин 746 прошли повторное обследование на СПКЯ. Из начальной когорты 53 (4,7%) женщины соответствовали диагностическим критериям СПКЯ. У этих женщин риск развития СД 2 типа удвоился (скорректированный OR, 2,4; 95% ДИ, 1,2–4,9) и дислипидемии (скорректированный OR, 1,9; 95% ДИ, 1,0-3,6). Интересно, что риск СД 2 типа был в 3 раза выше у женщин с нормальным весом с СПКЯ, указывая на тот факт, что даже женщины с нормальным весом с СПКЯ склонны к диабету 2 типа.
Генетические исследования когорт СПКЯ и их семей продолжают давать ключи к разгадке генетического происхождения этого синдрома.Мутации гена белка фактора транскрипции 7, подобного 2, создают риск восприимчивости СД 2 типа. Недавнее исследование ассоциации этого генного локуса с СПКЯ показало ранее не обнаруженные ассоциации с однонуклеотидными полиморфизмами в близлежащих регионах. Интерес к гену фибриллина продолжается, и один из его полиморфных маркеров, D19S884, был связан с СПКЯ (33). Ген, родственный фибриллину 3, ламин а / с, не был связан с СПКЯ (34).
Благодаря Pall et al. Мы также продвинулись немного дальше в нашей способности отличать женщин с СПКЯ от женщин с неклассическим дефицитом 21-гидроксилазы. (35). Эти исследователи изучили клиническую выборку из 52 волосатых худощавых женщин с СПКЯ; 54 женщины с толстым волосами, ожирением и СПКЯ; 23 женщины с волосяным покровом с неклассическим дефицитом 21-гидроксилазы; и 27 нормальных элементов управления. В то время как 71–88% женщин с СПКЯ имели поликистоз яичников на УЗИ, только 24% женщин с ХАГ имели. Ни у одной из женщин с СПКЯ не было регулярных менструальных циклов, но у 74% женщин с ХАГ были. Интересно, что у женщин с ХАГ был такой же ответ глюкозы и инсулина на пероральный прием глюкозы, как и у худых женщин с СПКЯ, но обе группы отличались от полных женщин с СПКЯ, как и нормальные контрольные.У женщин с ХАГ было меньше шансов иметь повышенное соотношение ЛГ / ФСГ, но средние отношения ЛГ / ФСГ среди всех групп были в некоторой степени схожими. Таким образом, в условиях, когда гирсутизм является главной клинической проблемой, наличие регулярных менструальных циклов может помочь дифференцировать СПКЯ от женщин с ХАГ; однако, если клинические проявления связаны с нерегулярными менструациями, не представляется возможным проводить выборочный скрининг пациентов, и диагностический алгоритм СПКЯ все же должен сопровождаться исключением ХАГ.
Гипогонадотропная аменорея
Функциональный HA
Клинические представления о происхождении и лечении вторичного гипогонадотропного гипогонадизма, или FHA, претерпели изменения в последние годы. Основное исследование Williams et al. (36) предоставил исключительно значимую информацию о патофизиологии этого расстройства. Это также примечательно как прекрасный пример синергизма, который может быть достигнут при эффективном сотрудничестве фундаментальных и клинических ученых.Эти исследователи намеревались воспроизвести физиологические стрессоры, обычно наблюдаемые у женщин с FHA, на модели обезьяны, чтобы проверить эффективность каждого отдельного стрессора или их комбинаций в возникновении состояния. Обезьяны подвергались стрессу питания (умеренное ограничение калорийности) и физической нагрузке (ежедневный бег на беговой дорожке) или психосоциальному стрессу (частая смена соседей по клетке). Каждый отдельный стрессорный фактор не был в значительной степени способен индуцировать FHA у исследованных животных; однако комбинация всех трех стрессоров вызвала аномальные циклы у семи из 10 животных (определяемые как циклы, которые были короче 25 дней или длиннее 44 дней, или ановуляторные на основе уровней прогестерона через день).Эти данные важны тем, что они поддерживают стратегии изменения образа жизни для лечения FHA и указывают на ценность когнитивно-поведенческой терапии в помощи пациентам в осознании взаимодействия их привычек образа жизни и реакции с их репродуктивным здоровьем (37).
Роль лептиновой недостаточности как фундаментального механизма НА была четко установлена в результате наблюдения, что введение лептина восьми женщинам со стойкой FHA (хотя и близкой к нормальному или нормальному весу тела для роста) приводило к овуляторным менструациям у трех из восьми и свидетельства роста фолликулов еще у двух (38).Тонкая природа недостаточного питания, которая способствует FHA, стала предметом дальнейшего научного исследования. Исследователи из Детской больницы Шнайдера сообщили о своем опыте работы с подростками с расстройствами пищевого поведения, которые имели нормальный вес (39). Они правильно предположили, что расход энергии в покое, измеренный с помощью непрямой калориметрии, был ниже у якобы выздоровевших подростков с аменореей по сравнению с теми, у кого менструация была регулярной (1103 против 1217 ккал / 24 ч; P = 0.001). Подростки с аменореей имели немного меньшую массу тела и ИМТ (ИМТ 20,5 ± 1,7 против 21,5 ± 2,2 кг / м 2 ; P = 0,002). Гипометаболизм подростков с аменореей, по-видимому, является фактором, способствующим их длительному аменорейному состоянию. Важность этого исследования заключается в том, что оно предоставляет доказательства стойкого гипометаболизма и возможной гиполептинемии на фоне ИМТ в нормальном диапазоне, что затрудняет, если не делает невозможным определение, что представляет собой «выздоровление» при ограничительных расстройствах пищевого поведения.В поддержку этого мнения другие исследователи обнаружили несколько различий между якобы «выздоровевшими» женщинами с нервной анорексией, у которых ИМТ был менее 18,5 кг / м 2 , по сравнению с женщинами с ИМТ выше этого порогового значения (40).
Эти исследования дополнительно подчеркивают то, что долгое время считалось верным в отношении ограничительных расстройств пищевого поведения — что симптомы и физиологические проявления сохраняются в течение очень длительных периодов времени, и следует рассмотреть возможность длительного лечения (41, 42).
Как и женщины с расстройствами пищевого поведения, тренирующиеся женщины более склонны к FHA.De Souza et al. (43) исследовали гормональные параметры, используя длительную экскрецию гормонов с мочой у женщин, которые выполняли в среднем 457,1 ± 30,5 минут упражнений в неделю, по сравнению с сидячими женщинами, которые сообщали о 96,7 ± 39,1 минут в неделю физической активности. Все сообщили о регулярных менструациях каждые 26–35 дней при наборе. Хотя возраст, ИМТ, менархеальный и гинекологический возраст были одинаковыми в этих двух группах, между группами наблюдались большие различия в характере экскреции гормонов.У одной из 20 женщин, ведущих малоподвижный образ жизни, экскреция метаболита лютеинового прогестерона была ниже нормы, тогда как у 13 из 48 женщин, занимающихся физическими упражнениями, наблюдалась такая картина. Ни у одной из женщин, ведущих малоподвижный образ жизни, не было ановуляторного цикла, по сравнению с 12 из 48 женщин, занимающихся физическими упражнениями. Наконец, ни у одной из женщин, ведущих малоподвижный образ жизни, не было аменореи при последующем наблюдении, в то время как у 29 из 86 женщин, занимающихся физическими упражнениями, не было. Интересным в этом исследовании был тот факт, что физическая активность исследуемых женщин представляла собой различные виды легкой атлетики, а не участников какого-либо одного вида спорта.Поразительным открытием этого исследования было то, что все женщины сообщили о нормальном межменструальном интервале.
Клиническое мышление в течение нескольких лет было сфокусировано на психосоциальной модели и модели образа жизни в качестве объяснения FHA; однако недавно была опубликована генетическая основа FHA, которая во многом объясняет, почему некоторые женщины или группы женщин кажутся более уязвимыми к этому расстройству, чем другие (44). Генотипирование 55 женщин с FHA выявило семь гетерозиготных мутаций в генах, ранее идентифицированных этой группой как ответственные за идиопатический гипогонадотропный гипогонадизм или синдром Каллмана, выраженный у женщин с FHA, что указывает на вариабельность экспрессии этих генетических вариантов как основную причину как первичной, так и вторичной аменореи. у женщин.Ни одна из этих мутаций не была обнаружена у 422 человек из контрольной группы с нормальным циклом. Поскольку многие из мутировавших генов ответственны за миграцию нейронов и установку нейронов GnRH в гипоталамус во время развития, можно ожидать, что относительная экспрессия этих вариантов приведет к спектру дисфункции. Таким образом, женщины с более полной экспрессией могут иметь так мало нейронов гипоталамического ГнРГ, что они неспособны инициировать пубертатный процесс. И наоборот, люди с меньшей пенетрантностью генотипа могут иметь только частичное нарушение и быть способны завершить половое созревание по расписанию, но они могут быть более уязвимы к стрессовым факторам образа жизни, которые, как известно, вызывают FHA.
Ожирение и гипогонадотропный гипогонадизм
Из-за нынешней эпидемии ожирения в последние годы усилилось внимание к влиянию ожирения на репродуктивную ось. Ожирение связано с бесплодием и повышенным риском нарушения менструального цикла и аменореи (45). Не всякая аменорея, связанная с ожирением, может быть связана с СПКЯ. СПКЯ присутствует у 6-8% населения (7), а ожирение в настоящее время присутствует у более чем 35% взрослых женщин в США (46).Женщины с ожирением из исследования SWAN чаще сообщали о нерождении в течение всей жизни и имели гораздо более высокий уровень аменореи (30,9% среди женщин с ИМТ> 30 кг / м 2 против 15,4% в группе с нормальным ИМТ) ( 47). В этом исследовании количество самопроизвольных абортов не увеличивалось в группе с ожирением по сравнению с женщинами с нормальным весом.
Относительный гипогонадотропный гипогонадизм ожирения также становится все более очевидным как модификатор пубертатного процесса. Было обнаружено, что дети с ожирением прогрессируют медленнее в период полового созревания, хотя они склонны к более раннему началу полового созревания (48).Источник относительного гипоталамо-гипофизарного подавления, наблюдаемого при ожирении на всех этапах жизни, исследуется. Было высказано предположение, что различные жировые продукты (лептин, адипонектин, глюкагоноподобный пептид-1 и грелин, среди других) действуют центрально или периферически, нарушая секрецию гипоталамуса или гипофиза соответственно. Одна молекула-кандидат представляет собой 17β-гидроксистероиддегидрогеназу типа V, которая, как известно, продуцируется в подкожно жировой ткани и транскрипционно регулируется Kruppel-подобным фактором 15 (49).Поскольку п / к жировая ткань, по-видимому, менее метаболически активна, эта гипотеза повышает вероятность того, что как метаболически здоровые, так и метаболически нездоровые женщины с ожирением подвержены дисфункции менструального цикла — первая связана с гипогонадизмом, индуцированным подкожным жиром, а вторая — с висцеральным ожирением и приобретением фенотип поликистозных яичников. Другие обнаружили, что повышенная инсулинорезистентность у женщин с очень ожирением (ИМТ> 40 кг / м 2 ) служила клиническим маркером нарушения менструального цикла, определяемого как продолжительность цикла более 35 дней (50).У 57 обследованных женщин, 36 из которых имели нерегулярные менструации, модель оценки гомеостаза инсулинорезистентности была почти удвоена у женщин с ненормальной продолжительностью менструального цикла при отсутствии межгрупповых различий в гонадотропинах или андрогенах. В таблице 1 представлена относительная парадигма, позволяющая клиницисту отличить связанный с ожирением гипогонадотропный гипогонадизм от СПКЯ у полных женщин. Лучшее развитие клинически полезных фенотипических различий между этими двумя группами женщин будет иметь клиническую пользу.
Обсуждение и выводы
Исследования в области репродукции продолжают обеспечивать критическое понимание наших знаний о механизмах, ответственных за аменорею у женщин. Диагностика и лечение аменореи приобретают все большее клиническое значение, поскольку известно, что нарушения менструального цикла в течение всей жизни являются прогностическими факторами последующих ССЗ у женщин (51). Предполагается, что преждевременный вывод эндогенного эстрогена является провоцирующим фактором, хотя на самом деле не известно, имеет ли стойкое нарушение овуляции и выработки прогестерона последствия для здоровья женщины.Помимо этого важного долгосрочного последствия аменореи, другие проблемы, такие как преждевременная деминерализация костей или недостаточное образование костной ткани, могут подвергать женщин с аменореей высокому риску остеопороза и переломов. Таким образом, текущие исследования, посвященные срокам естественной менопаузы, показывают, что это полезный клинический вопрос по ряду причин. Риск не ограничивается только женщинами с очень ранней менопаузой; скорее, он представляет собой континуум риска и должен учитываться при принятии клинических решений о лечении в постменопаузе.
Поскольку мы беспокоимся о конце репродуктивной жизни, нам также необходимо сохранять высокий уровень усердия в диагностике молодых женщин и подростков, у которых может быть аменорея по разным причинам. Раннее выявление и лечение расстройств пищевого поведения и надлежащий мониторинг менструальной цикличности у спортивных женщин очень важны. Раннее выявление ожирения и определение того, является ли это «простым ожирением» или СПКЯ, одинаково важно для предотвращения долгосрочных последствий СД 2 типа, а также сердечно-сосудистых заболеваний.Дальнейшее изучение этих расстройств приведет к более совершенным стратегиям профилактики и лечения.
Сокращения:
ИМТ
CAH
врожденная гиперплазия надпочечников
CI
CVD
arian DM
000
0004
0004 DOR4
HR
OR
СПКЯ
Синдром поликистозных яичников.
Благодарности
Сводка раскрытия информации: Н.С. владеет опционами на акции Menogenix.
Список литературы
1.
Харлоу
SD
2000
Менструация и нарушения менструального цикла: эпидемиология менструации и нарушения менструального цикла
. В: ,
Goldman
МБ
,
Люк
М
ред.
Женщины и здоровье
.
Сан-Диего
:
Academic Press
;
99
—
113
2.
Адамс Хиллард
PJ
2008
Менструация у подростков: что нормально?
Medscape J Med
10
:
295
3.
Анасти
JN
,
Калантариду
SN
,
Kimzey
LM
,
Дефенсор
РА
,
Нельсон
LM
1998
Потеря костной массы у молодых женщин с нормальным кариотипом спонтанной преждевременной недостаточностью яичников.
Акушер-гинеколь
91
:
12
—
15
4.
Джеффри Чанг
рэнд
,
Коффлер
MS
2007
Синдром поликистозных яичников: раннее выявление у подростков.
Clin Obstet Gynecol
50
:
178
—
187
5.
Люборский
JL
,
Мейер
П
,
Сеятели
МФ
,
Золото
EB
,
Санторо
N
2003
Преждевременная менопауза в мультиэтническом популяционном исследовании переходного периода менопаузы.
Hum Reprod
18
:
199
—
206
6.
Скотт
РТ
,
Opsahl
MS
,
Леонарди
MR
,
Neall
GS
,
Иллионы
EH
,
Навот
Д
1995
Анализ таблицы дожития по частоте наступления беременности в общей популяции бесплодия относительно овариального резерва и возраста пациентки.
Hum Reprod
10
:
1706
—
1710
7.
Кармина
E
,
Аззиз
рэнд
2006
Диагностика, фенотип и распространенность синдрома поликистозных яичников.
Fertil Steril
86
(
Suppl 1
):
S7
—
S8
8.
Холостяк
А
,
Rouxel
A
,
Массин
N
,
Дулон
Дж
,
Куртильо
C
,
Матучанский
C
,
Бадачи
Y
,
Фортин
A
,
Паниель
Б
,
Lecuru
F
,
Lefrère-Belda
MA
,
Констанцис
E
,
Тибо
E
,
Медури
G
,
Guiochon-Mantel
A
,
Мисрахи
M
,
Куттенн
Ф
,
Турень
P
;
Исследовательская группа POF-GIS
2009
Фенотипирование и генетические исследования 357 последовательных пациентов с преждевременной недостаточностью яичников.
Eur J Эндокринол
161
:
179
—
187
9.
He
C
,
Крафт
П
,
Chasman
DI
,
Бьюринг
JE
,
Чен
К
,
Хэнкинсон
SE
,
Паре
G
,
Чанок
S
,
Ридкер
PM
,
Хантер
DJ
2010
Крупномасштабное исследование ассоциации генов-кандидатов возраста начала менархе и возраста естественной менопаузы.
Hum Genet
128
:
515
—
527
10.
Моррис
DH
,
Джонс
ME
,
Schoemaker
MJ
,
Эшворт
A
,
Swerdlow
AJ
2011
Семейное соответствие возраста наступления менархе: анализ из исследования «Прорыв поколений».
Педиатр Perinat Epidemiol
25
:
306
—
311
11.
Мюррей
А
,
Беннет
CE
,
Perry
JR
,
Weedon
MN
,
Джейкобс
PA
,
Моррис
DH
,
Orr
N
,
Schoemaker
MJ
,
Джонс
M
,
Эшворт
A
,
Swerdlow
AJ
2011
Общие генетические варианты являются значительными факторами риска ранней менопаузы: результаты исследования Breakthrough Generations Study.
Hum Mol Genet
20
:
186
—
192
12.
Редди
П
,
Лю
L
,
Адхикари
D
,
Джагарламуди
К
,
Раджаредди
S
,
Шэнь
Y
,
Ду
С
,
Тан
Вт
,
Hämäläinen
T
,
Пэн
SL
,
Лан
ZJ
,
Куни
AJ
,
Хухтаниеми
I
,
Лю
К
2008
Ооцит-специфическая делеция Pten вызывает преждевременную активацию пула примордиальных фолликулов.
Наука
319
:
611
—
613
13.
Мендоса
N
,
Санчес-Боррего
R
,
Галиано
D
,
Саламанка
A
,
Mozas
J
,
Quereda
F
,
Васкес
F
,
Мартинес-Асторкиса
T
,
Морон
Ф
2009
Мультигенная комбинация генов, связанных с эстрогеном, связана с возрастом естественной менопаузы у населения Испании.
Менопауза Инт
15
:
150
—
156
14.
Laissue
P
,
Кристен-Мэтр
S
,
Турень
P
,
Куттенн
Ф
,
Ритвос
О
,
Айттомаки
К
,
Bourcigaux
N
,
Жакессон
L
,
Bouchard
P
,
Фридман
Р
,
Dewailly
D
,
Reyss
AC
,
Джеффри
л
,
Холостяк
А
,
Массин
N
,
Феллоус
M
,
Veitia
RA
2006
Мутации и варианты последовательности в GDF9 и BMP15 у пациентов с преждевременной недостаточностью яичников.
Eur J Эндокринол
154
:
739
—
744
15.
van der Schouw
YT
,
ван дер Грааф
Y
,
Steyerberg
EW
,
Eijkemans
JC
,
Banga
JD
1996
Возраст в период менопаузы как фактор риска сердечно-сосудистой смертности.
Ланцет
347
:
714
—
718
16.
Йоакимсен
O
,
Bønaa
KH
,
Стенсланд-Бугге
E
,
Якобсен
BK
2000
Популяционное исследование возраста наступления менопаузы и ультразвуковое исследование атеросклероза сонных артерий: исследование Tromso.
J Clin Epidemiol
53
:
525
—
530
17.
Парашар
S
,
Рейд
кДж
,
Spertus
JA
,
Шоу
LJ
,
Vaccarino
В
2010
Ранняя менопауза позволяет прогнозировать стенокардию после инфаркта миокарда.
Менопауза
17
:
938
—
945
18.
Ривера
CM
,
Гроссардт
BR
,
Родос
DJ
,
Коричневый
RD
,
Роджер
VL
,
Мелтон
LJ
,
Рокка
WA
2009
Повышенная смертность от сердечно-сосудистых заболеваний после ранней двусторонней овариэктомии.
Менопауза
16
:
15
—
23
19.
Мэтьюз
KA
,
Кроуфорд
SL
,
Чаэ
У.е.
,
Эверсон-Роуз
SA
,
Сеятели
МФ
,
Штернфельд
B
,
Саттон-Тиррелл
К
2009
Связаны ли изменения факторов риска сердечно-сосудистых заболеваний у женщин среднего возраста с хронологическим старением или с переходным периодом в менопаузе?
J Am Coll Cardiol
54
:
2366
—
2373
20.
Рокка
WA
,
Гроссардт
BR
,
Геда
YE
,
Гостоут
BS
,
Беседка
JH
,
Мараганор
DM
,
де Андраде
M
,
Мелтон
LJ
2008
Долгосрочный риск депрессивных и тревожных симптомов после ранней двусторонней овариэктомии.
Менопауза
15
:
1050
—
1059
21.
Хейл
GE
,
Hughes
CL
,
Бургер
HG
,
Робертсон
DM
,
Фрейзер
IS
2009
Атипичные паттерны секреции эстрадиола и овуляции, вызванные лютеиновой несинфазностью (LOOP), лежащей в основе нерегулярных овуляторных менструальных циклов в период менопаузы.
Менопауза
16
:
50
—
59
22.
О’Коннор
KA
,
Феррелл
Р
,
тигровый
E
,
Трамбл
B
,
Шофер
Дж
,
Холман
DJ
,
Вайнштейн
М
2009
Прогестерон и овуляция на разных этапах перехода к менопаузе.
Менопауза
16
:
1178
—
1187
23.
О’Коннор
KA
,
Феррелл
RJ
,
тигровый
E
,
Шофер
Дж
,
Холман
DJ
,
Миллер
RC
,
Schechter
DE
,
Певица
Б
,
Вайнштейн
М
2009
Общее и беспрепятственное воздействие эстрогена на всех этапах перехода к менопаузе.
Биомаркеры эпидемиологии рака Предыдущее
18
:
828
—
836
24.
Соул
MR
,
Шерман
S
,
Parrott
E
,
Арматура
R
,
Санторо
N
,
Утян
Вт
,
Вудс
N
2001
Резюме: Этапы семинара по репродуктивному старению (STRAW).
Климактерический
4
:
267
—
272
25.
Pal
L
,
Чжан
К
,
Zeitlian
G
,
Санторо
N
2010
Характеристика среды репродуктивных гормонов у бесплодных женщин со сниженным овариальным резервом.
Fertil Steril
93
:
1074
—
1079
26.
Франков
S
2006
Противоречие в клинической эндокринологии: диагностика синдрома поликистозных яичников: в защиту критериев Роттердама.
J Clin Endocrinol Metab
91
:
786
—
789
27.
Bekx
MT
,
Коннор
EC
,
Шестигранник
DB
2010
Характеристика подростков, поступающих в многопрофильную клинику по поводу синдрома поликистозных яичников.
J Педиатр Adolesc Gynecol
23
:
7
—
10
28.
Ибаньес
L
,
Лопес-Бермехо
A
,
Диас
M
,
Маркос
МВ
,
de Zegher
F
2011
Ранняя терапия метформином (возраст 8–12 лет) у девочек с преждевременным ранним лобком для уменьшения гирсутизма, избытка андрогенов и олигоменореи в подростковом возрасте.
J Clin Endocrinol Metab
96
:
E1262
—
E1267
29.
Сумма
М
,
Уоррен
MP
2009
Гипоталамическая аменорея у молодых женщин с синдромом поликистозных яичников.
Fertil Steril
92
:
2106
—
2108
30.
Шоу
LJ
,
Байрей Мерц
CN
,
Аззиз
рэнд
,
Станчик
FZ
,
Сопко
Г
,
Браунштейн
GD
,
Келси
SF
,
Kip
KE
,
Купер-Дехофф
RM
,
Джонсон
BD
,
Vaccarino
В
,
Рейс
SE
,
Биттнер
В
,
Ходжсон
TK
,
Роджерс
Вт
,
Пепин
CJ
2008
Женщины в постменопаузе с нерегулярными менструациями и повышенным уровнем андрогенов в анамнезе с высоким риском ухудшения сердечно-сосудистой выживаемости без событий: результаты оценки женского синдрома ишемии, спонсируемой Национальным институтом здоровья, легкими и кровью.
J Clin Endocrinol Metab
93
:
1276
—
1284
31.
Ван
ET
,
Чирилло
PM
,
Vittinghoff
E
,
Биббинс-Доминго
К
,
Кон
BA
,
Кедр
MI
2011
Нарушение менструального цикла и смертность от сердечно-сосудистых заболеваний.
J Clin Endocrinol Metab
96
:
E114
—
E118
32.
Ван
ET
,
Кальдерон-Маргалит
R
,
Кедр
MI
,
Давиглус
ML
,
Меркин
SS
,
Шрайнер
PJ
,
Штернфельд
B
,
Веллонс
M
,
Шварц
SM
,
Льюис
CE
,
Уильямс
OD
,
Сисковик
DS
,
Биббинс-Доминго
К
2011
Синдром поликистозных яичников и риск длительного диабета и дислипидемии.
Акушер-гинеколь
117
:
6
—
13
33.
Ewens
кг
,
Стюарт
DR
,
Анкенер
Вт
,
Урбанек
М
,
Макаллистер
JM
,
Чен
К
,
Baig
км
,
Паркер
SC
,
Маргулиес
EH
,
Легро
RS
,
Дунаиф
А
,
Штраус
JF
,
Spielman
RS
2010
Семейный анализ генов-кандидатов на синдром поликистозных яичников.
J Clin Endocrinol Metab
95
:
2306
—
2315
34.
Урбанек
М
,
Нампиапарампил
G
,
D’Souza
J
,
Сефтон
E
,
Акерман
К
,
Легро
RS
,
Дунаиф
А
2009
Роль генетической изменчивости гена ламина а / с в этиологии синдрома поликистозных яичников.
J Clin Endocrinol Metab
94
:
2665
—
2669
35.
Палл
М
,
Аззиз
рэнд
,
Бейрес
Дж
,
Пигнателли
D
2010
Фенотип женщин с гирсутами: сравнение синдрома поликистозных яичников и неклассической гиперплазии надпочечников с дефицитом 21-гидроксилазы.
Fertil Steril
94
:
684
—
689
36.
Уильямс
NI
,
Берга
SL
,
Кэмерон
JL
2007
Синергизм психосоциальных и метаболических стрессоров: влияние на репродуктивную функцию у яванских макак.
Am J Physiol Endocrinol Metab
293
:
E270
—
E276
37.
Берга
SL
,
Loucks
TL
2006
Использование когнитивно-поведенческой терапии при функциональной гипоталамической аменорее.
Ann NY Acad Sci
1092
:
114
—
129
38.
Welt
CK
,
Чан
JL
,
Bullen
J
,
Мерфи
R
,
Смит
П
,
DePaoli
AM
,
Каралис
А
,
Манцорос
CS
2004
Рекомбинантный человеческий лептин у женщин с гипоталамической аменореей.
N Engl J Med
351
:
987
—
997
39.
фунтов стерлингов
WM
,
Золотой
NH
,
Якобсон
MS
,
Орнштейн
RM
,
Гц
SM
2009
Оценка метаболизма у менструирующих и не менструирующих подростков с нормальным весом.
Инт J Нарушение питания
42
:
658
—
663
40.
Мегердичский
С
,
Самуэлиан-Массат
C
,
Валеро
Р
,
Begu-Le Corroller
А
,
Fromont
I
,
Манчини
Дж
,
Воробей
JD
,
Поинсо
Ф
,
Vialettes
B
2009
Влияние нормализации веса на качество восстановления при нервной анорексии.
J Am Coll Nutr
28
:
397
—
404
41.
Приолетта
А
,
Мускоджиури
G
,
Sorice
GP
,
Лассандро
AP
,
Mezza
T
,
Policola
C
,
Саломоне
E
,
Чиполла
К
,
Della Casa
S
,
Понтекорви
А
,
Джаккари
A
2011
Нервная анорексия, даже небольшое увеличение брюшного жира является причиной появления инсулинорезистентности.
Клин Эндокринол (Oxf)
75
:
202
—
206
42.
Haas
VK
,
Гаскин
кДж
,
Кон
MR
,
Кларк
SD
,
Мюллер
МДж
2010
Различные термические эффекты лептина у девочек-подростков с различным содержанием жира в организме.
Clin Nutr
29
:
639
—
645
43.
Де Соуза
МДж
,
Toombs
RJ
,
Scheid
JL
,
О’Доннелл
E
,
Запад
SL
,
Уильямс
NI
2010
Высокая распространенность незначительных и серьезных нарушений менструального цикла у женщин, занимающихся физическими упражнениями: телосложение с использованием ежедневных гормональных мер.
Hum Reprod
25
:
491
—
503
44.
Карония
LM
,
Мартин
К
,
Welt
CK
,
Sykiotis
GP
,
Quinton
R
,
Тамбундит
A
,
Авбель
М
,
Дхрувакумар
S
,
Plummer
L
,
Hughes
VA
,
Семинара
SB
,
Boepple
PA
,
Сидис
Y
,
Кроули
WF
,
Мартин
KA
,
Холл
JE
,
Pitteloud
N
2011
Генетическая основа функциональной гипоталамической аменореи.
N Engl J Med
364
:
215
—
225
45.
Санторо
N
,
Нил-Перри
G
2010
Роль веса тела в нарушениях менструального цикла и аменорее
.
Нью-Йорк
:
Springer
46.
Flegal
км
,
Кэрролл
MD
,
Огден
класс
,
Куртин
LR
2010
Распространенность и тенденции ожирения среди взрослого населения США, 1999–2008 гг.
JAMA
303
:
235
—
241
47.
Полоцкий
AJ
,
Hailpern
SM
,
Скурник
JH
,
Lo
JC
,
Штернфельд
B
,
Санторо
N
2010
Ассоциация подросткового ожирения и пожизненного отсутствия деторождения — Исследование женского здоровья в разных странах (SWAN).
Fertil Steril
93
:
2004
—
2011
48.
Бордини
В
,
Литтлджон
E
,
Розенфилд
RL
19
Сентябрь
2010
Динамика ЛГ у девочек с избыточной массой тела с преждевременным адренархе и медленно прогрессирующим половым ростом
.
Int J Педиатр эндокринол
49.
Ду
Х
,
Розенфилд
RL
,
Цинь
К
2009
KLF15 является регулятором транскрипции гена 17β-гидроксистероиддегидрогеназы человека 5 типа. Потенциальная связь между регулированием выработки тестостерона и запасами жира у женщин.
J Clin Endocrinol Metab
94
:
2594
—
2601
50.
Souza
FA
,
Dias
R
,
Фернандес
CE
,
Пиментел
Ф
,
Диас
Д
2010
Нарушение менструального цикла: возможный клинический маркер метаболической дисфункции у женщин с ожирением III класса.
Гинекол Эндокринол
26
:
768
—
772
51.
Соломон
CG
,
Hu
FB
,
Дунаиф
А
,
Рич-Эдвардс
JE
,
Stampfer
MJ
,
Willett
WC
,
Speizer
FE
,
Мэнсон
JE
2002
Нарушения менструального цикла и риск сердечно-сосудистых заболеваний в будущем.
J Clin Endocrinol Metab
87
:
2013
—
2017
Авторские права © 2011 Общества эндокринологов
Primary яичников Недостаточность. — обзор
1. Аутоиммунные Причины POF
Роль аутоиммунитета в патогенезе POF остается спорным [9] Некоторые считают аутоиммунные механизмы основной причиной ПОЯ, в то время как другие утверждают, что аутоиммунные механизмы не установлены, за исключением нескольких конкретных условий.Есть несколько доказательств, указывающих на аутоиммунный механизм. Во-первых, существует четкая связь между некоторыми формами аутоиммунных эндокринопатий и ПНЯ. Во-вторых, у женщин с ПНЯ часто встречаются аутоантитела. В-третьих, есть изменения в субпопуляциях лимфоцитов у женщин с ПНЯ. И, наконец, биопсия яичников иногда показывает инфильтрацию лимфоцитов и плазматических клеток вокруг развивающихся фолликулов у женщин с ПНЯ. [11] Гистологическое обнаружение инфильтрата хронических воспалительных мононуклеарных клеток обычно локализовано вокруг развивающихся и атретических фолликулов с сохранением примордиальных фолликулов.В ранних случаях инфильтрат обнаруживается в основном вокруг клеток теки, в то время как в поздних случаях наблюдается инфильтрация слоя клеток гранулезы с дегенерацией некоторых клеток гранулезы. Инфильтрат не распространяется на строму, но может присутствовать вокруг клеток корня. С помощью иммуноцитохимического окрашивания можно показать, что инфильтрат состоит из поликлональных В-клеток, Т4- и Т8-положительных лимфоцитов, макрофагов и естественных клеток-киллеров, что свидетельствует о антителозависимой клеточно-опосредованной цитотоксичности.[9]
Преждевременная недостаточность яичников явно связана с другими синдромами аутоиммунной эндокринной недостаточности. Синдром аутоиммунной полигландулярной недостаточности I типа характеризуется гипопаратиреозом, надпочечниковой недостаточностью и кожно-слизистым кандидозом и обычно проявляется в детстве. Шестьдесят процентов пораженных женщин имеют ПОЯ. Синдром аутоиммунной полигландулярной недостаточности II типа характеризуется надпочечниковой недостаточностью и гипотиреозом и обычно проявляется в возрастной группе 20–40 лет. POF также часто встречается в этой группе.[6] Многие пациенты с аутоиммунной надпочечниковой недостаточностью имеют циркулирующие антитела IgG, направленные против стероид-синтезирующих клеток надпочечников. Эти антитела перекрестно реагируют со стероид-синтезирующими клетками яичника и могут быть обнаружены в прикорневых клетках, развивающихся фолликулах и клетках теки желтого тела [9]. Эти стероид-синтезирующие клеточные антитела (SCA) представляют собой органоспецифические аутоантитела, которые реагируют против микросомального антигена, общего для стероид-продуцирующих клеток различных тканей.Они обнаруживаются у 60% женщин с болезнью Аддисона и вторичной аменореей и у 95% женщин с болезнью Аддисона и первичной аменореей. У 40% женщин с SCA и болезнью Аддисона через 10–15 лет разовьется ПОЯ [6]. Они редко встречаются у женщин с ПНЯ без болезни Аддисона или у нормальных женщин.
Существование аутоантитела, направленного против яичника, отличного от SCA, вызывает сомнения. [26] Аутоантитела к 3β-гидроксистероиддегидрогеназе при ПНЯ встречаются редко.[27] В то время как некоторые пациенты с ПНЯ и надпочечниковой недостаточностью имеют антитела, направленные против 21-гидроксилазы, 17α-гидроксилазы или фермента расщепления боковой цепи Р450, пациенты с идиопатической ПНЯ не имеют этих антиферментных антител. [6] Аналогичным образом, антитела к блестящей оболочке были описаны у женщин с необъяснимым бесплодием, и прививка белков блестящей оболочки у некоторых видов животных может привести к дисфункции и истощению фолликулов. Это антитело, по-видимому, не играет роли в POF человека.[6] Специфические IgG-антитела, которые блокируют рецептор GnRH, были описаны у двух пациентов с POF и миастенией. Кроме того, IgG от некоторых пациентов с ПНЯ ингибируют ФСГ-индуцированный синтез ДНК в клетках гранулезы. В этих последних двух примерах в экспериментальной модели использовались нечеловеческие рецепторы гонадотропина. Используя рекомбинантный рецептор гонадотропина человека, Анасти не удалось продемонстрировать IgG, способный ингибировать активность рецептора у 38 женщин с ПНЯ. [6]
У десяти процентов пациентов с болезнью Аддисона разовьется недостаточность яичников.Обычно у этих женщин присутствуют антитела SCA. Приблизительно у 3% женщин с ПНЯ обнаруживается полигландулярная аутоиммунная недостаточность. При полигландулярной аутоиммунной недостаточности I типа ПОЯ обычно диагностируется после начала болезни Аддисона. При типе II ПНЯ часто диагностируется до болезни Аддисона. [26] Это имеет важное значение для долгосрочного наблюдения за женщинами с ПНЯ.
Другая четко выраженная аутоиммунная этиология ПНЯ связана с хроническим кандидозом слизистых оболочек.Антитела против кандиды перекрестно реагируют с фолликулярными клетками яичников и могут вызвать аутоиммунный оофорит. [9]
Некоторые предполагают, что у женщин с несколькими неудачными попытками ЭКО из-за «плохой реакции» может быть скрытая ПНЯ. В одном исследовании у 10 из 131 такой женщины был повышен уровень ФСГ в ранней фолликулярной сыворотке. Примерно у 50% также были аутоантитела к надпочечникам, щитовидной железе или яичникам. В том же исследовании у 1 из 13 здоровых женщин были обнаружены сывороточные антитела, которые реагировали с тека, тироидными и микросомальными антигенами.[28]
У женщин с явно идиопатической ПНЯ (без хирургического вмешательства на яичниках, химиотерапии или лучевой терапии в анамнезе) 10 из 24 с нормальным кариотипом имели положительный тест на антинуклеарные антитела (ANA), а 0 из 8 с аномальным кариотипом имели положительный результат. АНА. Десять из 13 женщин, у которых была ПНЯ до 30 лет, имели положительную АНА, в то время как ни у одной из 11 женщин, имевших ПОЯ после 30 лет, не было положительной АНА. Никаких других аутоантител у этих женщин обнаружено не было. [29] Многие небольшие ретроспективные или наблюдательные исследования продемонстрировали высокую распространенность других аутоиммунных заболеваний у женщин с ПНЯ, включая, в частности, гипотиреоз, а также миастению, болезнь Крона, витилиго, пернициозную анемию, системную волчанку и ревматоидный артрит.Кроме того, сообщалось о ремиссии ПНЯ после лечения кортикостероидами при надпочечниковой недостаточности, миастении, системной волчанке и полигландулярной аутоиммунной недостаточности [6]. Плазмаферез и тимэктомия у пациентов с миастенией и внутривенная терапия иммуноглобулинами у пациентов с аутоиммунной полигландулярной недостаточностью также были связаны с ремиссиями при ПНЯ [6].
Антиоварианские антитела продемонстрированы различными методами. Некоторые исследователи использовали яичники человека для демонстрации антител с помощью непрямой иммунофлуоресценции.В одном исследовании сыворотка различных женщин была протестирована против нормальной ткани яичников человека. Четырнадцать из 27 женщин с ПНЯ показали иммунофлуоресценцию по сравнению с 0 из 24 контрольных женщин того же возраста ( p <0,001) и у 1 из 22 женщин в постменопаузе (p <0,01). У пяти из 17 женщин с аутоиммунными заболеваниями была иммунофлуоресценция ( p <0,01 по сравнению с контрольной группой) [30]. Этот метод громоздкий. Совсем недавно анализы ELISA были использованы для демонстрации антител с использованием яичниковых антигенов или белков в качестве субстрата.При использовании этих методов антиовариальные антитела были продемонстрированы у 10–69% женщин с ПНЯ, но также и у значительного числа здоровых женщин. [6, 31] Корреляция между наличием антител и тяжестью или хронологией недостаточности функции яичников. бедный. Антиовариальные антитела могут быть патогенными или представлять собой эпифеномены, вторичные по отношению к высвобождению антигена после клеточного повреждения. С другой стороны, присутствие антител может быть временным, присутствовать на ранней стадии и отсутствовать на более поздних стадиях недостаточности яичников.Из 215 биопсий яичников, сделанных за 30 лет и рассмотренных Анасти [6], 11% имели доказательства лимфоцитарного оофорита. Семьдесят восемь процентов из тех, у кого были гистологические доказательства оофорита, имели SCA.
Наличие антиовариальных антител не доказывает, что они вызывают аутоиммунный оофорит. Они могут присутствовать при болезни Аддисона из-за туберкулеза, а также связаны с неоплазией эндометрия, почек, мочевого пузыря или яичников. Не было показано, что они связывают комплемент или цитотоксичны.[9]
Обобщая запутанную литературу, можно сказать, что существует четкая взаимосвязь между ВСС, часто присутствующей при болезни Аддисона, и ПНЯ. Кроме того, было показано, что антитела против кандида вызывают оофорит. В других клинических ситуациях взаимосвязь аутоиммунного состояния и недостаточности функции яичников не столь ясна. Многие женщины с ПНЯ имеют ассоциированные аутоиммунные состояния, и у многих есть циркулирующие аутоантитела, но неясно, как очевидное нарушение регуляции их иммунной системы влияет на их функцию яичников.Связь с аутоиммунными заболеваниями имеет значение для долгосрочного наблюдения за этими женщинами.
Преждевременная недостаточность яичников: обзор
ВВЕДЕНИЕ
Преждевременная недостаточность яичников (ПНЯ) — это состояние гипергонадотропного гипогонадизма, которое характеризуется непрерывным ухудшением функции яичников в возрасте до 40 лет. Этот возрастной предел в 40 лет был принят в качестве порогового возраста для ПНЯ, поскольку этот возраст примерно на два стандартных отклонения ниже естественного возраста менопаузы.Однако, в отличие от менопаузы, при ПНЯ не происходит полного прекращения фолликулярной функции, и периодическая овуляция все еще может происходить. Следовательно, термин «преждевременная недостаточность яичников» более приемлем и с научной точки зрения верен, чем «недостаточность яичников». Заболеваемость ПНЯ составляет 1,0% к 40 годам, 0,1% к 30 годам и 1:10 000 к 20 годам. 1
ПНЯ носит спонтанный или ятрогенный характер (хирургическое вмешательство / лучевая терапия / химиотерапия). Пациенты с недостаточностью яичников обращаются либо с жалобами на нарушения менструального цикла, либо с гипоэстрогенными симптомами.ПНЯ является причиной у 10–28% женщин с первичной аменореей и у 4–18% женщин с вторичной аменореей. 2,3 Психологическое воздействие POI намного больше, чем его физический аналог, и его необходимо учитывать при ведении таких пациентов.
Несмотря на то, что об этой сущности имеется обширная литература, этот обзор всесторонне охватывает концепцию POI вместе с ее причинами, последствиями и доступными вариантами лечения с целью предоставления актуальной и актуальной информации поставщику медицинских услуг для таких пациентов.
МЕТОД
Литература была найдена по ключевым словам «преждевременная недостаточность яичников», «преждевременная недостаточность яичников», «преждевременная менопауза» и другие слова, относящиеся к текущему обзору. Авторы не проводили обширного поиска, чтобы найти все представляющие интерес статьи, признавая наличие обширной литературы по этой теме. Исследования были отобраны на основе их соответствия повествованию в обзоре.
ПАТОФИЗИОЛОГИЯ
Число примордиальных фолликулов достигает максимума в 6–7 миллионов к 20 неделям беременности у человеческого плода женского пола.После этого фолликулы быстро подвергаются атрезии, в результате чего при рождении остается 1-2 миллиона ооцитов, и только 400-500 из них овулируются до наступления физиологической менопаузы. 4 Эта атрезия фолликулов регулируется взаимодействием различных молекул, которые либо стимулируют атретический процесс (андрогены, TNF-альфа и лиганд Fas), либо уменьшают его (эстроген, гонадотропины и оксид азота). Таким образом, истощение фолликулов в ПНЯ может происходить по любому из трех механизмов: меньшее количество фолликулов с самого начала, более высокая скорость атретизации или нарушение рекрутирования фолликулов. 5
ЭТИОЛОГИЯ
Различные причины POI суммированы на Рисунке 1. Несмотря на десятилетия исследований, направленных на определение причины POI, более половины случаев все еще остаются идиопатическими. Около 20–25% случаев имеют генетическую причину, из которых примерно 9% случаев связаны с аберрациями в Х-хромосоме. 6 Синдром Тернера — наиболее частая аномалия хромосомной аберрации у пациентов с ПНЯ. У этих пациенток первичная аменорея и недостаточное развитие груди, в то время как у пациенток с мозаикой Тернера менструация может начаться спонтанно.Среди других генетических причин премутация ломкой X наиболее хорошо изучена и возникает из-за изменения FMR1 (Xq27.3). В этой премутации количество тринуклеотидных повторов CGG увеличивается и колеблется от 55 до 200. 7 Пораженные люди подвергаются повышенному риску ПНЯ, от 3% в спорадических случаях до 15%, если в семейном анамнезе присутствует ПНЯ. 1 Любая делеция или перестройка вблизи центра инактивации X (расположенного в Xq13) приводит к легким проявлениям у пациентов, которые похожи на пациентов с синдромом Тернера.Другой ген, расположенный на коротком плече Х-хромосомы, который может привести к ПНЯ, — это BMP15 . 8 Вырабатываемый им белок играет важную роль в созревании ооцитов. Также были идентифицированы некоторые аутосомные гены, мутации которых приводят к снижению активности яичников ( FSHR / LHCGR ). 9
Различные синдромы, связанные с ПНЯ, также перечислены на рисунке 1. Если повреждение происходит во время ранней дифференцировки гонад, это приводит к наиболее тяжелой форме дисгенезии гонад.Например, при синдроме Дениса Драша, который вызван мутацией WT1 , и надпочечниковой недостаточностью, вызванной мутацией SF1 . 5 Другой важной причиной ПНЯ является аутоиммунитет яичников. Он диагностируется при наличии антител против яичников наряду с гистологическими признаками лимфоцитарного оофорита и других аутоиммунных заболеваний. 10 Антитела к стероидным клеткам (SCA) нацелены на фермент 17-гидроксилазу и фермент расщепления боковой цепи цитохрома p450 и разрушают стероид-продуцирующие клетки в коре надпочечников, семенниках (клетки Лейдига), яичниках (клетки тека) и плаценте (синцитиотрофобласте). ), что приводит к аутоиммунному полиэндокринному синдрому 1 и 2 типа, болезни Аддисона и ПНЯ.SCA выявляются у 60–87% пациентов с поражением надпочечников, ассоциированным с ПНЯ. 11 Однако основным ограничением в диагностике аутоиммунного поражения является высокая частота ложноположительных результатов и низкая специфичность этих антител. 12
Инфекционный оофорит (вирусный / бактериальный) считается одной из причин ПНЯ. 13 Ятрогенные причины включают хирургическую овариэктомию / лучевую терапию / химиотерапию. Полное прекращение активности яичников происходит при кумулятивной дозе лучевой терапии 20 Гр для женщин <40 лет и 5 Гр для пожилых женщин. 14 Химиотерапия с алкилирующими агентами, антрациклином и замещенным гидразином увеличивает риск ПНЯ в 9 раз, особенно у подростков и молодых людей. 15
КЛИНИЧЕСКАЯ ОЦЕНКА
Женщин с ПНЯ следует подробно расспросить о личном, менструальном, медицинском и семейном анамнезе. Анамнез, который необходимо задать в анкете, и пункты обследования описаны во вставке 1. Положительный семейный анамнез присутствует в 30% случаев ПНЯ; поэтому следует искать подробный семейный анамнез ПОИ. 16 У этих пациентов следует спросить о клинических симптомах, которые могут быть следствием либо ПНЯ, либо ассоциированных аутоиммунных / генетических синдромов. Пациенты с ПНЯ испытывают симптомы менопаузы, такие как вазомоторные симптомы (наиболее частые), 17 измененное настроение, усталость, сухость влагалища, диспареуния, частое мочеиспускание, недержание мочи и снижение либидо. Около 12–14% пациенток не испытывают никаких симптомов менопаузы, 18 особенно пациентов, у которых ПНЯ возникла до менархе, потому что эти симптомы в основном связаны с отменой эстрогена, а не с дефицитом.
ИССЛЕДОВАНИЯ
Диагностическое обследование таких пациентов должно включать подтверждение диагноза и исключение других сопутствующих заболеваний. Хотя в качестве порогового значения были приняты разные уровни фолликулостимулирующего гормона (ФСГ), стойкое повышение уровня ФСГ в сыворотке> 30 МЕ / л в двух разных случаях с интервалом не менее 4-6 недель подтверждает диагноз ПНЯ у установка нарушения менструального цикла. 19-23 Следует исключить другие частые причины аменореи, такие как беременность, гиперпролактинемия, хронические заболевания и синдром поликистозных яичников.Обследования, которые следует проводить во всех случаях, кратко изложены во вставке 2. Тест на отмену прогестерона не следует проводить, поскольку он дает ложное чувство уверенности и, таким образом, задерживает постановку диагноза. 24
После подтверждения диагноза POI следует искать причину этого состояния. Хромосомный анализ, предварительная мутация ломкой Х-хромосомы, скрининг на антитела к щитовидной железе и измерение уровней антител к 21-гидроксилазе могут быть выполнены для подтверждения этиологии у пациентов с ПНЯ, где это необходимо. 25-27 Тестирование на мутацию аутосомного гена и тестирование на антитела против яичников обычно не рекомендуется. Биопсия яичников — это золотой стандарт диагностики аутоиммунных заболеваний яичников. Однако, поскольку это инвазивный тест, он обычно не проводится. Сканирование плотности костной ткани (DEXA-сканирование) должно быть выполнено для измерения базовой минеральной плотности костной ткани (BMD), и если плотность костной ткани находится в нормальном диапазоне, и пациент соответствует требованиям заместительной гормональной терапии (HRT), этот тест можно повторять каждые 2 раза. -3 года. 18
ДОЛГОСРОЧНЫЕ ПОСЛЕДСТВИЯ
Преждевременный вывод эстрогена приводит к преждевременному старению различных систем органов, которые являются основной целью действия эстрогенов, и это может проявляться в виде различных заболеваний / нарушений в организме. Эти эффекты кратко описаны выше.
Сердечно-сосудистая система
Сердечно-сосудистые заболевания являются основной причиной сокращения продолжительности жизни пациентов с нелеченными ПНЯ. В метаанализе была обнаружена значительная связь между сердечно-сосудистыми заболеваниями и ранней менопаузой. 28 Rocca et al. 29 показали, что смертность значительно увеличилась у женщин, перенесших двустороннюю овариэктомию в возрасте до 45 лет, по сравнению с женщинами, которым не производилась овариэктомия. В другом исследовании, проведенном Гордоном и соавторами, было обнаружено, что 30 женщин в постменопаузе четвертого десятилетия имеют повышенную частоту сердечно-сосудистых заболеваний по сравнению с контрольной группой того же возраста в пременопаузе.
Здоровье костей
Недостаток эстрогена увеличивает ремоделирование кости, но резорбция кости превышает образование кости.Чистым эффектом является потеря костной массы, и вдобавок медленная минерализация новой кости приводит к низкой МПК. Почти у 50% пострадавших женщин МПК значительно снизилась в течение 18 месяцев после постановки диагноза, а 2/3 имеют низкий уровень МПК, что подвергает их высокому риску переломов бедра. 31,32 Через 2–9 лет после постановки диагноза МПК позвоночника и бедра снижается на 2–3%. 18
Влияние на познание
Женщины с ПНЯ подвергаются повышенному риску когнитивных нарушений.Повышенный риск когнитивных нарушений или деменции наблюдался у женщин, перенесших овариэктомию (одностороннюю / двустороннюю) до наступления менопаузы. 33 Bove et al. 34 сообщили, что преждевременная хирургическая менопауза связана с более быстрым снижением общего познания и памяти. Также было изучено, что продолжительность ЗГТ не менее 10 лет (если она была начата в течение 5 лет после перименопаузального периода) имела защитный эффект на общее познание.
Дисфункция половых органов
Женщины с ПНЯ могут иметь плохую сексуальную активность из-за боли и сухости влагалища из-за недостатка эстрогена.Дефицит андрогенов является причиной низкого либидо, плохого полового возбуждения и оргазма, а также притупления мотивации и ухудшения самочувствия. 35,36 Потеря фолликулярной функции приведет к бесплодию.
Психологический эффект
Внезапный диагноз потери фертильности и менструации может быть неожиданным, и женщины часто выражают беспокойство, депрессию или гнев, которые обычно недооцениваются клиницистами. Это может быть связано с повышенным риском серьезной депрессии и тревоги на протяжении всей жизни. 37,38 Женщины с ПНЯ имеют более низкую социальную поддержку и меньшую самооценку, что, в свою очередь, влияет на качество их жизни. 39,40
УПРАВЛЕНИЕ
В идеале
POI должна управляться многопрофильной командой, состоящей из гинеколога, эндокринолога и психолога. Лечение ПНЯ включает следующие компоненты:
- HRT.
- Регулирование фертильности.
- Психологическая поддержка.
Заместительная гормональная терапия
Замена эстрогена — это лечение первой линии при ПНЯ с целью облегчения симптомов менопаузы и улучшения здоровья сердечно-сосудистой системы, сексуальности и костей.Он может вызывать вторичные половые признаки у подростков с ПНЯ. Если развитие груди неполное или отсутствует, терапию эстрогенами следует начинать в низких дозах и следует медленно увеличивать до начала прогестерона, чтобы избежать образования канальцев в груди. 23
Преимущества заместительной гормональной терапии
HRT улучшает липидный профиль за счет увеличения содержания липопротеинов высокой плотности в сыворотке и снижения общего холестерина и липопротеинов низкой плотности. В целом после начала ЗГТ риск ишемической болезни сердца снижается на 24%. 41 Улучшает МПК и, таким образом, значительно снижает риск переломов. 42 Он также обращает вспять урогенитальную атрофию, вызванную недостатком эстрогена, а также снимает вазомоторные симптомы. Таким образом, улучшается общее качество жизни пациента.
Пути администрирования
Эстроген можно вводить перорально или трансдермально. Трансдермальный путь является предпочтительным, поскольку устраняется эффект первого прохождения через печень, что снижает риск венозной тромбоэмболии (ВТЭ). 43 Исследование Langrish et al. 44 показали лучшие результаты в отношении сердечно-сосудистой системы у женщин с ПНЯ, получавших трансдермальный эстрадиол и норэтистерон. Эстроген можно вводить в виде 1–2 мг 17-β-эстрадиола перорально в день, 100 мкг трансдермального эстрадиола или 0,625–1,250 мг конъюгированного конского эстрогена. Прогестерон можно вводить пероральным / трансдермальным / маточным путем для предотвращения гиперплазии эндометрия, которая может быть результатом беспрепятственного действия эстрогена у пациентов с интактной маткой (непрерывно / последовательно).Женщины могут выбрать внутриматочную спираль на основе левоноргестрела, если им также нужна эффективная контрацепция. ЗГТ следует начинать вскоре после постановки диагноза ПНЯ и продолжать до достижения возраста естественной менопаузы.
Потеря активности яичников может снизить общее производство андрогенов на 50%, что может повлиять на сексуальное здоровье. Поэтому при необходимости андрогены можно заменить в виде крема / геля / имплантата / пластыря с тестостероном.
Комбинированная пероральная контрацепция в сравнении с заместительной гормональной терапией
Нет крупных, хорошо контролируемых исследований по сравнению комбинированных пероральных контрацептивов (КОК) и ЗГТ для лечения ПНЯ.Поскольку КОК гораздо более эффективен, чем ЗГТ, такое сильное действие не требуется для лечения ПНЯ. Однако его легко принять, и он вызывает меньше стигматизации. Существует всего несколько исследований, сравнивающих эффект ЗГТ и КОК, но эти исследования явно не позволяют сделать сколько-нибудь значимый вывод. Langrish et al. 44 сравнили ЗГТ (трансдермальный эстрадиол 100–150 мкг / день и вагинальный прогестерон 400 мг / день) с КОК (30 мкг этинилэстрадиола с 1,5 мг норэтистерона) в рандомизированном контролируемом перекрестном исследовании и обнаружили, что лечение ЗГТ привело к более низкое среднее 24-часовое систолическое и диастолическое артериальное давление в течение 1 года по сравнению с КОК.У женщин, которые принимали ЗГТ, было повышено МПК и маркеры костеобразования по сравнению с женщинами, которым давали КОК. 45 Картрайт и др. 46 также обнаружили, что прием ЗГТ (2 мг 17-β-эстрадиола и 75 мкг левоноргестрела) значительно увеличивал МПК поясничного отдела позвоночника через 2 года по сравнению с приемом КОК (30 мкг этинилэстрадиола с 150 мкг левоноргестрела) у пациентов с ПНЯ. Лечение эстрогеном и прогестероном можно назначать либо в виде ЗГТ, либо в виде КОК до тех пор, пока не будут получены результаты более крупных рандомизированных исследований.
Побочные эффекты заместительной гормональной терапии
У женщин в менопаузе пероральные эстрогены увеличивают риск ВТЭ, причем этот риск является самым высоким в первый год их применения. Однако вопрос о том, можно ли экстраполировать эти данные, полученные от пожилых женщин, на молодых женщин, пока нет. Тем не менее, чтобы снизить риск ВТЭ, трансдермальный путь предпочтительнее перорального. 43,47
Недостаточно данных для оценки связи между терапией эстрогенами, назначаемой женщинам с ПНЯ, и риском развития рака груди.Крупное популяционное исследование, включающее данные Датского онкологического реестра, показывает, что риск рака груди был повышен у женщин, получающих ЗГТ, в возрасте ≥50 лет, тогда как риск не увеличивался у женщин <50 лет. 48 Чтобы предотвратить риск гиперплазии эндометрия и карциномы, прогестерон всегда следует включать в ЗГТ, чтобы избежать беспрепятственного действия эстрогенов.
Другие меры для здоровья костей
Бисфосфонаты действуют, подавляя активность остеокластов и, таким образом, уменьшая резорбцию костей.Однако он не рекомендуется женщинам репродуктивного возраста, желающим забеременеть в будущем. Более того, при длительном приеме он связан с остеонекрозом челюсти и подвертельным переломом бедренной кости. Упражнения с весовой нагрузкой следует выполнять, избегая курения табака и алкоголя. Также следует измерить статус витамина D и восполнить его, если он <30 МЕ / л. Кальций также следует дополнять в дозе 800–1000 мг / день. 18
Постановление о фертильности
Существуют различные варианты лечения для улучшения фертильности у этих женщин.У 5–10% этих женщин происходит спонтанное возобновление овуляции, что может привести к беременности. 49 Таким образом, женщинам, не желающим забеременеть в будущем, следует предложить определенные средства контрацепции.
Лечение бесплодия
Подход «подожди и посмотри» не подходит для лечения бесплодия у пациентов с ПНЯ, поскольку овуляция у этих пациенток носит прерывистый и непредсказуемый характер. Однако самопроизвольная беременность с идиопатическим ПНЯ не связана с повышенным риском выкидыша и акушерских осложнений. 18 Смешанное ретроспективное и проспективное исследование показало, что у 24% женщин с идиопатическим ПНЯ функция яичников возобновилась, а у большинства пациенток возобновилось в течение 1 года после постановки диагноза. 50
Предварительная обработка эстрогеном снижает уровень ФСГ и позволяет восстановить рецепторы ФСГ в оставшихся фолликулах. Предварительное лечение эстрогеном с последующей стимуляцией экзогенными гонадотропинами приводило к овуляции в 32% случаев и к беременности в 16% случаев. 51 Оплодотворение in vitro донорскими ооцитами имеет самый высокий шанс на беременность.В этом случае эндометрий можно подготовить к имплантации, увеличив дозу эстрадиола валерата вместе с естественным прогестероном. Беременность с донорскими ооцитами связана с такими осложнениями, как гипертоническое расстройство, ограничение роста и преждевременные роды. 52 Было высказано предположение, что иммунологическая непереносимость между матерью и плодом ответственна за осложнения. Дегидроэпиандростерон способствует активации ооцитов и подавляет их атрезию. Более высокая частота наступления беременности при приеме добавок дегидроэпиандростерона была отмечена у пациентов с пониженной функцией яичников. 53
Другие новые возможности — это трансплантация коры яичника и трансплантация всего яичника. 54,55 Самостоятельная трансплантация у онкологических больных может быть связана с риском распространения. Таким образом, некоторые авторы пробовали трансплантацию монозиготным близнецам, дискордантным по яичниковой недостаточности. 54 Созревание in vitro ооцитов, происходящих из преантральных фолликулов, которые сохраняются при ПНЯ, может использоваться как один из вариантов лечения. 1
Сохранение яичников
56,57
Чтобы избежать повреждения фолликулов у молодых женщин, которым требуется химиотерапия или лучевая терапия по поводу рака, могут быть приняты следующие меры:
- Экранирование гонад
- Транспозиция яичников
В этом методе яичники выводятся из поля облучения путем перерезания маточно-яичниковых связок и их мобилизации у пациентов, проходящих лучевую терапию для лечения рака.У процедуры есть определенные осложнения, в том числе хроническая тазовая боль и послеоперационные спаечные процессы. Иногда сама процедура может вызвать преждевременную недостаточность яичников. Транспозиция яичников предотвращает только радиационное поражение яичников. Следовательно, если пациенту требуется как химиотерапия, так и лучевая терапия, этого следует избегать.
- Подавление яичников аналогами ГнРГ
Агонизм GnRH подавляет уровни ФСГ и лютеинизирующего гормона и защищает фолликулы яичников от разрушения химиотерапией, временно приостанавливая функцию яичников.Поэтому женщины репродуктивного возраста должны получать агонист гонадолиберина вместе с химиотерапией.
- Криоконсервация ооцита / эмбриона / ткани яичника
(i) Криоконсервация эмбрионов / ооцитов:
Криоконсервация как эмбрионов, так и ооцитов требует контролируемой гиперстимуляции яичников и последующего извлечения ооцитов. Эта процедура требует отсрочки как минимум 14 дней до начала химиотерапии. Чтобы сохранить эмбрионы, необходимо оплодотворение in vitro и либо мужским партнером, либо донорской спермой.Криоконсервация эмбрионов имеет хорошие показатели успешности с точки зрения совокупной частоты наступления беременности. Криоконсервация ооцитов более полезна, когда у пациента нет партнера. Ооциты извлекаются после стимуляции яичников и сохраняются для будущих целей. Недостаток криоконсервации эмбрионов и ооцитов состоит в том, что за один раз можно хранить только ограниченное их количество, что ограничивает количество попыток будущих беременностей.
(ii) Криоконсервация ткани яичника:
Этот метод требует забор ткани яичников лапароскопической процедурой и хранения ткани для будущих целей.Преимущество этого метода заключается в том, что он не требует гормональной стимуляции яичников и не вызывает значительной задержки в начале химиотерапии.
Контрацепция
Поскольку у 5–10% женщин с ПНЯ может произойти спонтанное возобновление овуляции, женщинам, не желающим зачатия в будущем, следует предоставлять контрацептивы. Хотя комбинированные оральные противозачаточные таблетки являются одним из наиболее часто используемых методов контрацепции, они могут не подавлять высокие уровни ФСГ, наблюдаемые при ПНЯ, и, таким образом, могут привести к беременности.Были отдельные сообщения о женщинах с ПНЯ, которые забеременели после приема оральных противозачаточных таблеток. 58 Барьерная контрацепция или внутриматочные средства — лучшие варианты для этих женщин. 20
Социально-психологическая поддержка
Многие женщины с ПНЯ недовольны объемом информации, которую им предоставляют врачи. 59 Семья должна быть вовлечена во время сообщения плохих новостей. Психологическая поддержка должна быть предоставлена в виде консультирования пациентам и соответствующего лечения тем, кто страдает от тревоги или депрессии.Диагноз ПНЯ и его последствия могут повлиять на качество их жизни. Для таких женщин доступны большие группы поддержки, такие как Группа поддержки преждевременной менопаузы Daisy Network и Международная ассоциация преждевременной недостаточности яичников. Учитывая деликатный характер диагнозов, а также культурную значимость, пациентов следует осторожно информировать о диагнозе, обеспечивая доступность семейной поддержки. Родители подростков с ПНЯ также должны быть проинформированы о последствиях и должны быть готовы оказать эмоциональную поддержку своим дочерям. 23
БУДУЩИЕ ИССЛЕДОВАНИЯ
Международный исследовательский консорциум и регистр болезней должны быть сформированы для предоставления клинических данных о патогенезе и лечении ПНЯ. 60 Трансплантация коры яичников и активация спящих фолликулов с использованием ингибитора PTEN в повторно имплантированной ткани требует дальнейших исследований. Требуются крупные рандомизированные контролируемые испытания для сравнения различных вариантов ЗГТ на предмет их безопасности и эффективности. А до тех пор междисциплинарный подход является потребностью эпохи для выявления таких пациентов и оказания им оптимальной помощи с максимальной психологической поддержкой.
Аменорея: оценка и лечение — Американский семейный врач
1. Практический комитет Американского общества репродуктивной медицины. Текущая оценка аменореи. Fertil Steril .
2004; 82 (приложение 1): S33–9 ….
2. Американский колледж акушеров и гинекологов. Аменорея (Технический бюллетень ACOG 128). Вашингтон, округ Колумбия: ACOG, 1989.
3. Сперофф Л., Фриц М.А. Аменорея. В кн .: Клиническая гинекологическая эндокринология и бесплодие.7-е изд. Филадельфия, Пенсильвания: Lippincott Williams & Wilkins, 2005; 401–64.
4. Маршалл, Вашингтон,
Таннер Дж. М..
Вариации паттернов пубертатных изменений у девочек. Арк Дис Детский .
1969; 44: 291–303.
5. Speroff L, Glass RH, Kase NG. Нормальное и ненормальное половое развитие. В кн .: Клиническая гинекологическая эндокринология и бесплодие. 6-е изд. Балтимор, Мэриленд: Липпинкотт Уильямс и Уилкинс, 1999: 339–79.
6. Кинингем РБ,
Апгар Б.С.,
Schwenk TL.Оценка аменореи. Врач Фам .
1996; 53: 1185–94.
7. Плетчер Дж. Р.,
Пощечину ГБ.
Нарушения менструального цикла. Педиатрическая клиника North Am .
1999; 46: 505–18.
8. Рейндоллар Р.Х.,
Берд младший,
Макдонаф PG.
Задержка полового развития: исследование 252 пациентов. Am J Obstet Gynecol .
1981; 140: 371–80.
9. Макивер Б.,
Романский С.А.,
Ниппольдт ТБ.
Оценка и лечение аменореи. Mayo Clin Proc .
1997; 72: 1161–9.
10. Альбанезе А,
Стэнхоуп Р.
Исследование задержки полового созревания. Клин Эндокринол (Oxf) .
1995; 43: 105–10.
11. Arojoki M,
Йокимаа V,
Джуути А,
Кошинен П,
Ираджала К.,
Анттила Л.
Гипотиреоз среди бесплодных женщин в Финляндии. Гинекол Эндокринол .
2000. 14: 127–31.
12. Калро Б.
Нарушение фертильности, вызванное эндокринной дисфункцией у женщин. Endocrinol Metab Clin North Am .
2003. 32: 573–92.
13. Лауфер М.Р.,
Этаж AE,
Парсонс К.Э.,
Кунц К.М.,
Barbieri RL.
Гормональное тестирование у женщин с аменореей в начале взрослой жизни. Гинекол Обстет Инвест .
1995; 40: 200–3.
14. Уоррен MP,
Биллер БМ,
Шангольд ММ.
Новый клинический вариант заместительной гормональной терапии у женщин с вторичной аменореей: влияние циклического введения прогестерона из вагинального геля Crinone с замедленным высвобождением (4% и 8%) на морфологические особенности эндометрия и кровотечение отмены. Am J Obstet Gynecol .
1999. 180 (pt 1): 42–8.
15. Пикетт, Калифорния.
Диагностика и лечение опухолей гипофиза: последние достижения. Prim Care .
2003. 30: 765–89.
16. Фольч М,
Пигема I,
Konje JC.
Мюллерова агенезия: этиология, диагностика и лечение. Obstet Gynecol Surv .
2000; 55: 644–9.
17. Селдмейер Иллинойс,
Palmert MR.
Задержка полового созревания: анализ большой серии случаев из академического центра. Дж. Клин Эндо Метаб .
2002; 87: 1613–20.
18. Traggiai C,
Стэнхоуп Р.
Задержка полового созревания. Best Practices Clin Endocrinol Metab .
2002; 16: 139–51.
19. Симпсон Дж.,
Райкович А.
Дифференцировка яичников и гонадная недостаточность. Ам Дж. Мед Генет .
1999; 89: 186–200.
20. Вебстер Дж.,
Писцителли Г,
Полли А,
Феррари CI,
Исмаил I,
Scanlon MF,
и другие.Сравнение каберголина и бромокриптина при лечении гиперпролактинемической аменореи. N Engl J Med .
1994; 331: 904–9.
21. Американский колледж акушеров и гинекологов. Бюллетень практики ACOG. Руководство по клиническому ведению акушеров-гинекологов: № 41, декабрь 2002 г. Obstet Gynecol .
2002; 100: 1389–402.
22. Соломон К.Г.
Эпидемиология синдрома поликистозных яичников. Распространенность и сопутствующие риски заболеваний. Endocrinol Metab Clin North Am .
1999; 28: 247–63.
23. Чанг Р.Дж.,
Katz SE.
Диагностика синдрома поликистозных яичников. Endocrinol Metab Clin North Am .
1999; 28: 397–408, vii.
24. Мазер К.Дж.,
Кван Ф,
Коренблюм Б.
Гиперинсулинемия при синдроме поликистозных яичников коррелирует с повышенным риском сердечно-сосудистых заболеваний независимо от ожирения. Fertil Steril .
2000. 73: 150–6.
25. Velazquez E,
Акоста А,
Мендоса С.Г.Цикличность менструального цикла после терапии метформином при синдроме поликистозных яичников. Акушерский гинекол .
1997; 90: 392–5.
26. Колодзейчик Б,
Дулеба А.Дж.,
Спачинский Р.З.,
Павельчик Л.
Терапия метформином снижает гиперандрогенизм и гиперинсулинемию у женщин с синдромом поликистозных яичников. Fertil Steril .
2000. 73: 1149–54.
27. Анасти JN.
Преждевременная недостаточность яичников: обновленная информация. Fertil Steril .1998; 70: 1–15.
28. Kalantaridou S,
Нака К.К.,
Папаниколау Э,
Казакос Н,
Краварити М,
Калис К.А.,
и другие.
Нарушение функции эндотелия у молодых женщин с преждевременной недостаточностью яичников: нормализация гормональной терапией. Дж Клин Эндокринол Метаб .
2004; 89: 3907–13.
29. Kalantaridou S,
Дэвис С.Р.,
Нельсон Л.М.
Преждевременная недостаточность яичников. Endocrinol Metab Clin North Am .1998. 27: 989–1006.
30. van der Schouw Y,
ван дер Грааф Y,
Steyerberg EW,
Эйкеманс JC,
Banga JD.
Возраст в период менопаузы как фактор риска смерти от сердечно-сосудистых заболеваний. Ланцет .
1996; 347: 714–8.
31. Якобсен Б.К.,
Нильссен С,
Эй, я,
Квале Г.
Влияет ли возраст естественной менопаузы на смертность от ишемической болезни сердца? Дж. Клин Эпидемиол .
1997; 50: 475–9.
32.Ким TJ,
Анасти JN,
Флэк MR,
Кимзей Л.М.,
Дефенсор РА,
Нельсон Л.М.
Регулярный эндокринный скрининг пациентов с нормальным кариотипом спонтанной преждевременной недостаточности яичников. Акушерский гинекол .
1997. 89 (5 pt 1): 777–9.
33. Миллер К.К.,
Парулекар М.С.,
Шенфельд Э,
Андерсон Э,
Хаббард Дж.
Клибански А,
и другие.
Снижение уровня лептина у женщин с нормальным весом и гипоталамической аменореей: влияние состава тела и приема пищи. Дж Клин Эндокринол Метаб .
1998; 83: 2309–12.
34. Велт СК,
Чан JL,
Буллен Дж.

 , Alagna F. et al. Familian form of idiathic premature and early menophause. Presented at the International Symposium of Ovarian Ageing, Brussels, Belgium//Abstract in International journal of Fertility and Womens’s Medicine. 1998; 43(4): 200.
, Alagna F. et al. Familian form of idiathic premature and early menophause. Presented at the International Symposium of Ovarian Ageing, Brussels, Belgium//Abstract in International journal of Fertility and Womens’s Medicine. 1998; 43(4): 200. //Obstetrics and gynecology, 1976, v. 47, N 4, p. 388-394.
//Obstetrics and gynecology, 1976, v. 47, N 4, p. 388-394. -McNatty K.P., Smith D.M., Makris A., Osathanonolh R., Ryan K.J. //Journal of clinical endocrinology and metabolism, 1979, v. 49, N 6, p. 851-860.
-McNatty K.P., Smith D.M., Makris A., Osathanonolh R., Ryan K.J. //Journal of clinical endocrinology and metabolism, 1979, v. 49, N 6, p. 851-860.
 Чаще всего генетической причиной ПЯН становится синдром Тернера — 45Х, когда вместо обычных двух половых Х-хромосом, имеется одна.
Чаще всего генетической причиной ПЯН становится синдром Тернера — 45Х, когда вместо обычных двух половых Х-хромосом, имеется одна.