| ИП | – | интерстициальная пневмония |
| НсИП | – | неспецифическая интерстициальная пневмония |
| КОП | – | криптогенная организующаяся пневмония |
| ЛИП | – | лимфоидная интерстициальная пневмония |
| ДИП | – | десквамативная интерстициальная пневмония |
| ЛАМ | – | лимфангиолейомиоматоз |
| ГЦ-Х | – | гистиоцитох Х |
| ЛАП | – | легочный альвеолярный протеиноз |
| РБ ИЗЛ | – | респираторныйбронхиолит, ассоциированный с интерстициальным заболеванием легких |
| ОИП | – | обычная интерстициальная пневмония |
| ИППФЭ | – | идиопатический плевропаренхиамтозныйфиброэластоз |
| КТВР | – | компьютерная томография высокого разрешения |
| HRCT | – | компьютерная томография высокого разрешения |
| ИЛФ | – | идиопатический легочный фиброз |
| ФВД | – | функция внешнего дыхания |
| ИЗЛ | – | интерстициальные заболевания легких |
| ИБЛ | – | интерстициальные болезни легких |
| ИФА | – | идиопатический фиброзирующийальвеолит |
| ЭКГ | – | электрокардиограмма |
| ДЭхоКГ | – | Допплер-эхокардиография |
| НИП | – | неспецифическая интерстициальная пневмония |
| ВТСБЛ | – | видеоторакоскопическая биопсия легких |
| ТБПБЛ | – | трансбронхиальная пункционная биопсия легких |
| ТТПБЛ | – | трансторакальная биопсия легких |
| ФБС | – | фибробронхоскопия |
| ФР | – | факторы риска |
| ММП | – | матриксные металлопротеиназы |
| ЛАГ | – | легочная артериальная гипертензия |
| ФЖЕЛ | – | форсированная жизненная емкость легких |
| РсрЛА | – | среднее давление в легочной артерии |
| ДКТ | – | длительная кислородная терапия |
| АТО | – | Американское торакальное общество |
| ATS | – | AmericanThoracicSociety |
| ЕРО | – | Европейское респираторное общество |
| ERS | – | EuropeanRespiratorySociety |
| 6MWT | – | тестс 6-минутнойходьбой |
Другие интерстициальные легочные болезни с упоминанием о фиброзе (J84.1)
Значимые проспективные исследования эффективности терапии при идиопатическом легочном фиброзе в настоящее время отсутствуют.
Эмпирически назначают следующую терапию:
1. Оксигенотерапия.
2. Методы легочной реабилитации.
3. Медикаментозная терапия.
Кортикостероиды. На ранней стадии заболевания назначают преднизолон 0,5 мг/кг в сутки идеальной массы тела, в течение 4 недель. Затем дозу снижают до 0,25 мг/кг в сутки, в течение 8 недель с постепенным уменьшением дозы до 0,125 мг/кг в сутки, через день.
Цитостатики. В поздний период болезни и при быстро прогрессирующем течении показаны кортикостероиды в комбинации с иммунодепрессантами (азатиоприн 2-3 мг/кг в сутки, максимальная доза — 150 мг/день). Обычно начинают с 25-50 мг/сутки с постепенным повышением дозы каждые 1-2 недели до достижения расчетной. Терапию продолжают в течение 2 месяцев, затем дозу снижают до 1,5 мг/кг в сутки, в течение 1 года и более).
Альтернативой является циклофосфамид (без комбинации с кортикостероидами) в дозе 2 мг/кг (максимум 150 мг/сутки). Начальная суточная доза в 25-50 мг увеличивается еженедельно до достижения расчетной целевой дозы.
Российские авторы рекомендуют в дополнение к терапии преднизолоном и азатиоприном использовать и пеницилламин, или купренил (300 мг/сутки, затем постепенно дозу увеличивают до 1,8 г/сутки с последующим уменьшением до поддерживающей — 300 мг/сутки).
Мониторинг эффективности терапии проводят через 6, 12, 18 месяцев (при отсутствии осложнений на применяемые препараты). В него входят клиническая и функциональная оценка, КТВР. Терапию продолжают только тем пациентам, у которых имеется стабилизация состояния или улучшение. Если ответ на терапию отсутствует или состояние ухудшается, лечение прекращают и рассматривают вопрос о трансплантации легких.
Идиопатический легочный фиброз: симптомы и лечение
Автор Руслан Хусаинов На чтение 6 мин. Опубликовано
Обновлено
Идиопатический легочный фиброз (ИЛФ) — это хроническое и прогрессирующее заболевание легких. ИЛФ вызывает образование рубцовой ткани в легких, что приводит к одышке и постоянному кашлю. На сегодняшний день ИЛФ не имеет известного лечения. Однако врачи могут помочь справиться с этим заболеванием и улучшить качество жизни.
Что такое ИЛФ?
Легочный фиброз — это рубцевание легочной ткани. ИЛФ возникает, когда легочная ткань, окружающая воздушные мешочки, утолщается и становится жесткой, что приводит к рубцеванию легочной ткани. Рубцевание влияет на функцию легких, затрудняя дыхание.
В прошлом другие названия ИЛФ включали криптогенный фиброзирующий альвеолит, идиопатический диффузный интерстициальный фиброз легких и идиопатический фиброзирующий альвеолит. В настоящее время врачи могут называть ИЛФ обычной интерстициальной пневмонией.
Идиопатический легочный фиброз — симптомы
Симптомы ИЛФ могут развиваться постепенно у одних людей и быстрее у других. Симптомы ИЛФ включают в себя:
- чувство одышки, которое обычно возникает при физической нагрузке, но может усилиться со временем и привести к тому, что человек будет задыхаться во время покоя
- сухой кашель, который усиливается и может сопровождаться приступами неконтролируемого кашля
- ноющие мышцы и суставы
- кончики пальцев рук или ног становятся шире и круглее
- усталость
- непреднамеренная потеря веса
- плохое самочувствие
- потеря аппетита
- боль или стеснение в груди
Варианты течения
Официальных стадий ИЛФ не существует, но врачи используют такие термины, как легкая, умеренная или тяжелая стадия.
Легкая стадия
На этой стадии у людей могут проявляться легкие симптомы ИЛФ и ставиться первоначальный диагноз. В некоторых случаях люди могут не иметь никаких симптомов.
Умеренная стадия
На этом этапе в легких образуется большое количество рубцов, и может потребоваться кислородная терапия.
Тяжелая стадия
Симптомы на этой стадии тяжелые, и может потребоваться пересадка легких.
Идиопатический легочный фиброз — причины
Большинство случаев ИЛФ происходит в результате повреждения эпителиальных клеток, которые выстилают альвеолы и дыхательные пути.
Организм пытается восстановить поврежденные клетки, но реакция нарушена, что приводит к прогрессирующему повреждению и образованию рубцов на легочной ткани и альвеолах. Однако не известно, почему происходит первоначальное повреждение, которое вызывает реакцию восстановления.
Хотя нет известной причины ИЛФ, специалисты считают, что сочетание окружающей среды, образа жизни и генетических факторов играет определенную роль в этом заболевании. Наиболее значимым фактором риска, по-видимому, является вариация гена MUC5B, что приводит к высокой продукции слизи в дыхательных бронхиолах.
Другие факторы риска ИЛФ:
- Генетика: люди с семейным анамнезом ИЛФ имеют более высокий риск развития заболевания, особенно если у родственника первой степени, такого как родитель или брат, есть ИЛФ. Однако ИЛФ также может возникать спорадически.
- Курение сигарет: около 75% людей с ИЛФ являются курильщиками или ранее курили.
- Гастроэзофагеальная рефлюксная болезнь (ГЭРБ): примерно 75% людей с ИЛФ имеют симптомы кислотного рефлюкса и изжоги.
- Мужской пол: приблизительно 75% людей с ИЛФ — мужчины.
- Возраст: Большинство людей с ИЛФ старше 50 лет.
Идиопатический легочный фиброз — диагностика
Для диагностики ИЛФ врач оценит симптомы, изучит историю болезни и проведет общее обследование. Во время осмотра он проверит, есть ли у человека:
- посиневшие руки и ноги
- деформация пальцев ног или рук
- пронзительные крепитации, исходящие из легких
Идиопатический легочный фиброз — тесты
Сочетание тестов может помочь врачу подтвердить диагноз ИЛФ. Эти тесты могут включать в себя:
- Дыхательный тест: чтобы проверить, насколько хорошо легкие вдыхают и выдыхают воздух и насколько хорошо они насыщают кровь кислородом.
- Рентгенография грудной клетки: выявляет признаки заболевания и прогрессирования.
- Анализы крови: для выявления других причин образования рубцов на легких.
- Компьютерная томография: чтобы найти рубцы в легких.
- Биопсия легких: для подтверждения диагноза, если это невозможно, на основе компьютерной томографии.
Лечение
Хотя в настоящее время нет лекарственных средств против ИЛФ, можно замедлить прогрессирование ИЛФ и улучшить качество жизни.
Методы лечения зависят от стадии ИЛФ и могут включать в себя:
- Ингибиторы киназы: этот тип лекарственных средств помогает замедлить потерю функции легких и предотвратить внезапное ухудшение ИЛФ.
- Антациды: они помогают лечить ГЭРБ, если у людей также есть это состояние.
- Кислородотерапия: первоначально человек может нуждаться в этой терапии после физической нагрузки. На более поздних стадиях ИЛФ он может нуждаться в ней постоянно.
- Трансплантация легких: эта операция может быть необходима людям с прогрессирующим ИЛФ.
Другие формы лечения зависят от симптомов заболевания. Например, если у человека развилась легочная инфекция, то могут потребоваться антибиотики. При хроническом кашле назначают кодеин.
Легочная реабилитация может быть частью плана лечения.
Легочная реабилитация — это программа, которая может включать в себя:
- дыхательную гимнастику
- физическую активность для укрепления организма
- консультирование
- рекомендации по питанию
Управление симптомами
Соблюдение плана лечения может помочь людям с ИЛФ справиться с этим заболеванием и улучшить качество их жизни. Шаги, которые люди могут предпринять для управления ИЛФ:
- отслеживание симптомов и информирование медицинского работника, если они ухудшаются
- регулярные посещения врача для осмотров
- воздержание от курения сигарет и пассивного курения
- избегайте веществ, которые могут раздражать легкие, такие как химикаты и пыль
- оставайтесь физически активными и выполняйте регулярные умеренные физические упражнения, такие как ходьба или использование велотренажера
- поддержание умеренного веса
- прием небольших порций пищи, чтобы облегчить дыхание
- избегайте мест или ситуаций, которые могут затруднить дыхание, например, находясь на большой высоте
Осложнения
ИЛФ может вызвать у человека беспокойство, стресс и депрессию. Врач может порекомендовать:
- когнитивно-поведенческая терапия (КПТ)
- препараты, например, антидепрессанты
- группа поддержки пациентов
Возможные осложнения ИЛФ могут включать в себя:
- рак легких
- легочная гипертензия, которая представляет собой повышение артериального давления в кровеносных сосудах легких
- дыхательная недостаточность, при которой легкие не могут обеспечить достаточное количество кислорода в крови
- трудности со сном
Виды легочного фиброза
Существует более 200 видов легочного фиброза, и наиболее распространенным из них является ИЛФ. Существует пять основных категорий легочного фиброза, основанных на их причинах:
- Лекарственно-индуцированный: причиной является применение препаратов, влияющих на легкие, таких как химиотерапия, Амиодарон (Пейсерон) или Нитрофурантоин (Макробид).
- Радиационно-индуцированный: вследствие лучевой терапии грудной клетки.
- Легочный фиброз окружающей среды: из-за воздействия раздражителей легких, таких как плесень.
- Аутоиммунный: вследствие аутоиммунных заболеваний, таких как ревматоидный артрит или синдром Шегрена.
- Профессиональный: вследствие воздействия пыли или паров, таких как асбест или кремнезем.
ИЛФ отличается от других форм легочного фиброза тем, что у него нет известной причины.
Когда нужно обратиться к врачу
Люди должны обратиться к врачу, если у них появились какие-либо симптомы ИЛФ. Врач может направить человека к специалисту, называемому пульмонологом.
Заключение
ИЛФ — это тип легочного фиброза без известной причины. К факторам риска относятся факторы окружающей среды, образ жизни и генетические факторы. Если у человека имеются какие-либо симптомы ИЛФ, он должен обратиться к врачу для обследования и постановки диагноза. Хотя лекарственных средств для лечения ИЛФ не существует, люди могут справиться с этим заболеванием и улучшить качество своей жизни.
Научная статья по теме: Высокий уровень железа в легких связан с повышенной тяжестью астмы.
Диффузные паренхиматозные заболевания легких: что нового мы узнали в 2011 году? | Авдеев С.Н., Чикина С.Ю., Капустина В.А., Самсонова М.В., Бродская О.Н.
Эффективность ингибитора тирозинкиназы при идиопатическом легочном фиброзе
[Richeldi L., Costabel U., Selman M. et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. New Engl J Med. 2011. Vol. 365. Р. 1079–1087]
Идиопатический легочный фиброз (ИЛФ) – прогрессирующее заболевание легких, характеризующееся неблагоприятным прогнозом и высоким уровнем летальности. В патогенезе заболевания играет значимую роль активация рецепторов тирозинкиназы, поэтому определенные надежды возлагаются на использование ингибиторов этих рецепторов в терапии ИЛФ. Целью настоящего исследования было сравнение эффективности и безопасности 4 различных доз препарата BIBF 1120 − внутриклеточного ингибитора тирозинкиназы − у пациентов с ИЛФ.
В 12–месячное многоцентровое рандомизированное двойное слепое плацебо–контролируемое исследование (II фаза) было отобрано 428 пациентов с ИЛФ (320 мужчин, средний возраст – 65 лет, средняя форсированная жизненная емкость легких (ФЖЕЛ) – 80,2%, средняя диффузионная способность по окиси углерода (DLCO) – 3,6 ммоль/мин./кПа). Включенных в исследование больных рандомизировали на получавших плацебо или BIBF 1120 в одной из следующих дозировок: 50 мг 1 раз/сут., 50 мг 2 раза/сут., 100 мг 2 раза/сут. или 150 мг 2 раза /сут. в течение 52 нед.
Лечение пациентов BIBF 1120 в максимальной дозе 150 мг 2 раза/сут. сопровождалось снижением уровня ежегодного падения ФЖЕЛ 68,4% по сравнению с плацебо (0,06 л vs 0,19 л, p=0,01). После повторного статистического анализа с разбивкой на группы по дозировкам BIBF 1120 на момент окончания исследования уровень ежегодного снижения ФЖЕЛ был по–прежнему более низким в группе пациентов, принимавших 150 мг 2 раза/сут., по сравнению с группой получавших плацебо (0,04 л vs 0,19 л) (рис. 1). Изменение общего объема легких (ОЕЛ) при сравнении с исходными значениями было более выраженным среди получавших плацебо, чем при лечении BIBF 1120 в дозе 150 мг 2 раза/сут. (−0,24 л vs 0,12 л, p < 0,001). Изменение SpO2 в покое от исходного уровня для групп пациентов, получавших препарат 100 мг 2 раза/сут. (+0,1%) и 150 мг 2 раза/сут. (−0,2%), достоверно отличалось от динамики SpO2 в группе плацебо (−1,3%). Ни один из режимов терапии не сопровождался достоверным изменением DLCO и пройденной дистанцией в тесте с 6–минутной ходьбой (6–МХ).
Доля пациентов с клинически значимым изменением оценки качества жизни по Респираторному опроснику Св. Георгия (SGRQ) (≥ 4 балла) была достоверно выше среди принимавших исследуемый препарат в дозе 100 мг 2 раза/сут. и 150 мг 2 раза/сут., по сравнению с группой получавших плацебо (32,6 и 29,1% vs 16,1% соответственно). Число обострений ИЛФ было наименьшим в группе получавших BIBF 1120 в дозе 150 мг 2 раза/сут., и наибольшим – в группе получавших плацебо (2,4 vs 15,7 на 100 пациентов–лет, p=0,02) (рис. 2). Различий в общей смертности среди сравниваемых групп выявлено не было.
Общее число неблагоприятных событий существенно не различалось между группами. Доля пациентов с серьезными нежелательными явлениями была ниже среди принимавших исследуемый препарат в дозе 150 мг 2 раза/сут. по сравнению с принимавшими плацебо (27,1 vs 36,0%), однако в этой же группе была и наиболее высокая частота прекращения приема препарата в связи с развитием неблагоприятных явлений, нежели в группе плацебо (30,6 vs 25,9%).
Таким образом, проведенная II фаза исследования продемонстрировала приемлемую эффективность и безопасность нового ингибитора тирозинкиназы BIBF 1120 в лечении пациентов с ИЛФ. Так, применение максимальных доз препарата (150 мг 2 раза/сут.) сопровождалось уменьшением уровня ежегодного падения ФЖЕЛ наряду с улучшением ряда других показателей: уменьшением числа обострений ИЛФ и связанным с этим улучшением качества жизни больных по опроснику SGRQ. Среди побочных эффектов чаще всего встречались гастроинтестинальные, тяжесть их была небольшой или умеренной.
Терапия гастроэзофагеального рефлюкса
ассоциирована с увеличением выживаемости при идиопатическом легочном фиброзе
[Lee J.S., Ryu J.H., Elicker B.M. et al. Gastroesophageal reflux therapy is associated with longer survival in idiopathic pulmonary fibrosis // Am J Respir Crit Care Med. 2011. Vol. 184. Р. 1390–1394]
У пациентов с ИЛФ наблюдается высокая распространенность гастроэзофагеального рефлюкса (ГЭР). Распространенность проксимального и дистального ГЭР, оцененного при помощи пищеводной рH–метрии, составляет 67–88 и 30–71% соответственно. Патофизиологическое значение ГЭР при ИЛФ остается окончательно невыясненным. В настоящем исследовании изучены взаимоотношения между ГЭР и ИЛФ в большой когорте пациентов с четко определенным диагнозом.
В исследование было включено 204 пациента с ИЛФ (69% мужчин, средний возраст – 70 лет, средний индекс массы тела – 29 кг/м2, 71% участников исследования были активными или бывшими курильщиками, средняя ФЖЕЛ – 69%, средняя DLCO – 47%).
Симптомы ГЭР были выявлены у 34% пациентов, ГЭР в анамнезе имелся у 45% пациентов. К моменту установления диагноза ИЛФ примерно половина пациентов принимала препараты для лечения ГЭР (86 человек − ингибиторы протонной помпы, 12 человек − Н2–гистаминоблокаторы), 11 пациентам в связи с ГЭР была проведена операция фундопликации по Ниссену.
Медиана выживаемости в данной когорте составила 1079 дней. В монофакторном анализе предикторами лучшей выживаемости были: женский пол (отношение шансов (ОШ) 0,64), более высокие показатели ФЖЕЛ (ОШ 0,97), ОЕЛ (ОШ 0,97), DLCO (ОШ 0,97), наличие симптомов ГЭР (ОШ 0,62), установленный диагноз ГЭР (ОШ 0,57), прием лекарств по поводу ГЭР (ОШ 0,51), фундопликация по Ниссену (ОШ 0,29).
В обеих скорректированных моделях с лучшей выживаемостью были ассоциированы большие значения ФЖЕЛ (ОШ 0,98), DLCO (ОШ 0,98) и прием препаратов для лечения ГЭР (ОШ 0,47). Среди пациентов, получавших терапию по поводу ГЭР, было больше женщин (39% против 23%), наблюдалась большая распространенность кашля (92% против 81%), была меньшая выраженность фиброза (14% против 19%).
Таким образом, в настоящем исследовании продемонстрировано, что прием лекарств для лечения ГЭР пациентами с ИЛФ ассоциирован с меньшей выраженностью легочного фиброза и лучшей выживаемостью. Данное наблюдение подтверждает гипотезу о том, что ГЭР и хроническая микроаспирация могут играть важную роль в патофизиологии ИЛФ.
Прогрессирование идиопатического легочного фиброза: асимметричное поражение
[Tcherakian C., Cottin V., Brillet P.Y. et al. Progression of idiopathic pulmonary fibrosis: lessons from asymmetrical disease // Thorax. 2011. Vol. 66. Р. 226–231]
При ИЛФ распределение фиброзных изменений между правым и левым легкими и распространение этих изменений в легочной ткани с течением времени неизвестны. Асимметричный ИЛФ (аИЛФ) предоставляет уникальную возможность более глубокого изучения патогенеза и течения ИЛФ. В данной статье представлены результаты исследования «случай–контроль», в котором описаны клиническая характеристика аИЛФ, особенно связь заболевания с ГЭР; рентгенологические и функциональные особенности, исходы заболевания, включая прогрессирование по данным компьютерной томографии высокого разрешения (КТВР), обострения и летальность, и дано сравнение асимметричного и симметричного ИЛФ. 32 больных с аИЛФ сравнивали с 64 контрольными пациентами с симметричным ИЛФ.
Группа аИЛФ состояла из 26 мужчин и 6 женщин, средний возраст в момент диагностики ИЛФ − 69 лет. ИЛФ был асимметричным уже при первом обследовании у 29 (90,6%) больных и изначально симметричным у 3 (9,4%) больных. При включении в исследование легочный фиброз был более выражен в правом легком у 20 (62,5%), в левом − у 12 (37,5%) больных. ГЭР диагностирован у 20 (62,5%) больных. По сравнению с контрольными пациентами больные с аИЛФ были достоверно старше (69±7 по сравнению с 63±12 лет), чаще страдали ГЭР (62,5 по сравнению с 31,3%) и имели более сохранную DLCO (52±19 по сравнению с 43±13%).
У больных с аИЛФ средний индекс асимметричности по КТВР составил 0,50, то есть процент фиброза в наиболее пораженном легком был в 3 раза выше, чем во втором легком. Легочный фиброз был четко односторонним у 2 больных. Эмфизема выявлена у 9 (28%) больных. Четверо больных имели особую форму аИЛФ с выраженным фиброзом в одном легком и эмфиземой в другом.
Выявлена достоверная корреляция между общим процентом фиброза и ФЖЕЛ (% от должного): r=–0,52. При повторном выполнении КТВР (через 32±26 мес.) отмечено, что общий процент фиброза достоверно нарастал у всех больных в среднем на 13,3%. Легочный фиброз остался четко асимметричным у 20 (86,9%) больных и превратился в симметричный у 3 (13,1%) больных после двухсторонних обострений.
Выживаемость больных с аИЛФ и симметричным ИЛФ была одинаковой с вероятностью выживаемости через 1, 3 и 5 лет: 75% по сравнению с 87%, 53% по сравнению с 63,3% и 50% по сравнению с 51,4% соответственно.
Таким образом, аИЛФ может быть вызван несколькими фоновыми состояниями, включая ГЭР. ГЭР может способствовать как прогрессированию ИЛФ, так и развитию обострений.
Вирусная инфекция при остром обострении идиопатического легочного фиброза
[Wootton S.C., Kim D.S., Kondoh Y. et al. Viral infection in acute exacerbation of idiopathic pulmonary fibrosis // Am J Respir Crit Care Med. 2011. Vol. 183. Р. 1698–1702]
ИЛФ – прогрессирующее заболевание неизвестной этиологии, связанное с развитием фиброза легких, плохо поддающееся лечению. Несмотря на постоянное прогрессирование функциональных показателей, клиническая картина характеризуется относительно стабильным течением и эпизодами резкого ухудшения, которые зачастую фатальны. Такие эпизоды получили название «обострение». Цель настоящего исследования – показать, связано ли обострение ИЛФ с вирусной инфекцией.
В исследование были включены 43 пациента с обострением ИЛФ. Медиана времени от начала заболевания до развития обострения составила 85 дней. У 28% пациентов при развитии обострения имели место вирусоподобные симптомы − лихорадка и миалгия. У 4 пациентов (9%) с обострением методом ПЦР были выявлены респираторные вирусы (у 2 – риновирус, у 1 – коронавирус–ОС43 и у 1 – вирус парагриппа–1). Вирусы не были обнаружены ни у одного из пациентов с ИЛФ стабильного течения. С помощью ДНК–микрочипов выявлено наличие трансфузионно–передающегося вируса (TTV) и вирусов герпеса человека. При выполнении геномно–специфичного анализа методом ПЦР были обнаружены еще 15 положительных проб БАЛ. Среди этих вирусов только TTV достоверно чаще встречался в группе с обострением ИФЛ по сравнению с контролем (28% против 0%, p=0,0003). В четырех образцах было обнаружено по 2 вируса (в 2 – TTV и риновирус, в 1 – TTV и вирус парагриппа–1 и в 1 – TTV и вирус простого герпеса). Таким образом, в 33% при обострении обнаружены вирусы, тогда как при стабильном течении заболевания вирусы не были выявлены ни в одном из образцов (p<0,0001). Достоверных различий в частоте лихорадки и миалгии у вирус–положительных и вирус–отрицательных пациентов выявлено не было.
При сравнении TTV–положительных и TTV–отрицательных пациентов было выявлено, что у первых заболевание протекало более тяжело, из них 58% было необходимо проведение механической вентиляции, тогда как в группе TTV–отрицательных таких имелось лишь 29% (p=0,09). Кроме того, в группе TTV–положительных пациентов 75% умерли в течение 60 дней, а в группе TTV–отрицательных пациентов доля умерших составила 42% (p=0,06). Медиана выживаемости среди TTV–положительных пациентов составила 29 дней (против 88 дней среди TTV–отрицательных пациентов (p=0,19)), однако наличие TTV–положительного теста не являлось предиктором выживаемости в описанной группе пациентов. У 27% пациентов с обострением ИЛФ и у 16% пациентов со стабильным течением ИФЛ был положителен ПЦР–тест на TTV в сыворотке крови, однако корреляции между этим показателем в сыворотке крови и БАЛ не выявлено. TTV–инфекция выявлена в БАЛ у 24% пациентов с ОПЛ, причем достоверных различий между частотой выявления TTV у пациентов с ОПЛ и обострением ИЛФ не обнаружено.
Таким образом, патогенетическая роль TTV при обострении ИЛФ неясна. Возможно, что развитие TTV–инфекции приводит к острому альвеолярному повреждению и развитию обострения. Если так, то данный процесс не является уникальным для ИЛФ, поскольку этот вирус обнаружен с приблизительно равной частотой и среди пациентов с ОПЛ. Хотя роль TTV в патогенезе обострения при ИЛФ и не исключена, возможно также, что острое альвеолярное повреждение является пусковым триггером локальной репликации вируса или может приводить к повышению проницаемости микрососудистого русла и проникновению инфекции в легкие. В таком случае наличие TTV в легочном пространстве является скорее следствием воспаления в легких, нежели его причиной.
Экзогенный аллергический альвеолит
Морфологическое разнообразие хронической болезни голубеводов: клиника и выживаемость
[Gaxiola M., Buendıa–Roldan I., Mejıa M. et al. Morphologic diversity of chronic pigeon breeder’s disease: Clinical features and survival // Respir Med. 2011. Vol. 105. Р. 608–614]
Экзогенный аллергический альвеолит (ЭАА) – диффузное паренхиматозное заболевание легких, связанное с развитием иммунного ответа на ингаляцию различных органических частиц. В Мексике одним из наиболее частых антигенов, вызывающих развитие ЭАА, являются белки птиц, которые провоцируют развитие так называемой «болезни голубеводов» (БГ). Наиболее частым гистопатологическим изменением, наблюдаемым при ЭАА, являются гранулематозный интерстициальный бронхиолоцентрический пневмонит, характеризующийся выраженной интерстициальной мононуклеарной инфильтрацией с наличием не некротических нечетко очерченных гранулем. В хронической стадии может иметь место фиброз различной степени выраженности. Однако описаны и другие морфологические изменения, включая относительно гомогенное интерстициальное воспаление и фиброз, напоминающие неспецифическую интерстициальную пневмонию (НСИП), а также периферический фиброз с образованием фибробластических фокусов, напоминающий обычную интерстициальную пневмонию (ОИП).
В настоящем исследовании у 110 пациентов с диагнозом БГ была описана клиническая картина и оценена выживаемость при разных морфологических типах ЭАА: организующейся пневмонии (ОП), бронхоцентрическом фиброзе (БЦФ) и неклассифицируемом ЭАА.
Средний возраст пациентов составил 45±12 лет, средняя продолжительность симптомов – 25±32 мес. Все пациенты отмечали наличие одышки и кашля, изменения концевых фаланг пальцев по типу «барабанных палочек» были выявлены у 56% пациентов. У всех пациентов имели место рестриктивные функциональные изменения (ФЖЕЛ 54,5±17% от должного), гипоксемия в покое (SpO2 85,7±6,7% пациентов), ухудшающаяся при физической нагрузке (SpO2 72±8%).
Типичный гистологический вариант ЭАА был выявлен у 58 пациентов, НСИП–подобный – у 22, ОИП–подобный – у 10, смешанный – у 9, организующаяся пневмония – у 3, БЦФ – у 3 и неклассифицируемый – у 5. Фибробластические фокусы обнаружены в 20% при типичном ЭАА, в 30% − при НСИП–подобном варианте и во всех наблюдениях с ОИП–подобным ЭАА. При КТВР выявлено, что воспалительный характер изменений преобладал у 75% пациентов с типичным ЭАА, 69% − с НСИП–подобным, 14% − с ОИП–подобным вариантами БГ (p<0,05).
При анализе выживаемости выявлены различия между морфологическими группами БГ (рис. 3). Так, ОШ летальности для группы пациентов с ОИП–подобным вариантом по сравнению с типичным ЭАА составило 4,19 (p<0,004). Напротив, выживаемость в группе с НСИП–подобным вариантом по сравнению с типичным ЭАА была выше – ОШ 0,18 (p<0,03). Таким образом, в настоящем исследовании показано, что при ЭАА имеет место разнообразие гистологических изменений, их оценка важна для определения прогноза выживаемости пациентов.
Гиперчувствительный пневмонит
и контаминация микобактериями
металлообрабатывающих жидкостей
[Tillie–Leblond I., Grenouillet F., Reboux G. et al. Hypersensitivity pneumonitis and metalworking fluids contaminated by mycobacteria // Eur Respir J. 2011. Vol. 37. Р. 640–647]
ЭАА может быть вызван действием различных антигенов, включая бактериальные. В литературе имеются данные о возможном возникновении ЭАА при контакте с металлообрабатывающими жидкостями (МОЖ). Быстрорастущие микобактерии (БРМ) являются одним из этиологических факторов развития ЭАА, вызванного контактом с МОЖ. Цель настоящего исследования – определить антиген, который может быть связан с развитием ЭАА, вызванного контактом с МОЖ.
В исследование были включены 13 пациентов с МОЖ–ассоциированным ЭАА, подтвержденным согласно клиническим, биологическим и рентгенологическим критериям, 12 лиц, имевших контакт с МОЖ (работающих на тех же заводах и выполняющих такую же работу, как и пациенты с ЭАА) при отсутствии клинических симптомов, 18 здоровых добровольцев.
Средний возраст пациентов ЭАА составил 46,3 года. У всех 13 пациентов имело место улучшение клинических симптомов спустя год после прекращения контакта с МОЖ. Проведен серологический анализ для выявления антигенов против Aspergillus fumigatus и Pseudomonas, результаты были отрицательны. M. immunogenum был изолирован из 40% проб МОЖ, Bacillus spp. – из 42%, грамотрицательные бактерии (исключая Pseudomonas spp.) – менее чем из 12% проб, грибы − из 11% проб. В образцах жидкостей был проведен анализ электросинерезиса для выявления преципитинов против M. immunogenum, F. solani, B. simplex. Для антигена M. immunogenum число преципитиновых арок было достоверно выше у пациентов с МОЖ–ассоциированным ЭАА, чем у лиц контрольной группы, имевших контакт с МОЖ. При пороге в 5 арок преципитации чувствительность теста составила 77%, а специфичность – 92%. M. immunogenum–специфичный IgG также был достоверно повышен в этой группе пациентов.
Таким образом, наличие M. immunogenum в более чем 40% проб МОЖ, а также выявление специфических преципитинов к M. immunogenum в сыворотке крови пациентов с МОЖ–ассоциированным ЭАА свидетельствует о том, что контакт с контаминированными МОЖ может быть причиной развития ЭАА. Регулярные исследования проб МОЖ, адекватная защита рабочих, имеющих контакт с МОЖ, позволит предотвратить развитие ЭАА в этой популяции.
Кистозные заболевания легких
Эффективность и безопасность сиролимуса
при лимфангиолейомиоматозе
[McCormack F.X., Inoue Y., Moss J. et al. Efficacy and safety of sirolimus in lymphangioleiomyomatosis // N Engl J Med. 2011. Vol. 364. Р. 1595–1606]
Лимфангиолейомиоматоз (ЛАМ) – редкое системное заболевание, характеризующееся кистозной деструкцией легочной ткани, хилезным плевральным выпотом и абдоминальными опухолями (ангиомиолипомами почек). У большинства больных в течение 10 лет от начала заболевания развиваются респираторные нарушения, рецидивирующие пневмотораксы и гипоксемия. Гладкомышечные клетки, инфильтрирующие легочную ткань, также циркулируют в крови и содержат биаллельные мутации, инактивирующие ген TSC. Утрата функции гена TSC запускает сигнальный путь mTOR, который регулирует многочисленные клеточные функции, в том числе рост, подвижность и выживаемость клеток. Препарат сиролимус блокирует активацию mTOR и восстанавливает функционирование дефектного гена TSC.
В данной статье приведены результаты международного многоцентрового рандомизированного двойного слепого плацебо–контролируемого исследования, в котором изучали влияние годичной терапии mTOR–ингибитором сиролимусом на легочную функцию у больных ЛАМ.
Больные для участия в исследовании отбирались с помощью Фонда ЛАМ. Исследование включало скрининговый визит, 12–месячный период лечения и 12–месячный период пассивного наблюдения, во время которого пациенты не получали изучаемый препарат. Пациенты в рандомизированном порядке и соотношении 1:1 были разделены на группы, получавшие сиролимус перорально в начальной дозе 2 мг/сут. или плацебо. Во время каждого визита измеряли концентрацию сиролимуса в крови и меняли дозу препарата для поддержания его концентрации в пределах 5–15 пг/мл.
Всего было рандомизировано 89 больных: 43 – в группу плацебо и 46 – в группу сиролимуса. В группе плацебо ОФВ1 снижался в течение 12 мес. на 12±2 мл/мес. от исходного уровня. В группе сиролимуса снижение ОФВ1 составило 1±2 мл/мес., что означало стабилизацию легочной функции на фоне лечения. Абсолютная разница в среднем изменении ОФВ1 за период лечения между группами составила 153 мл (различия достоверны) (рис. 4). Снижение ФЖЕЛ во время лечения составило −11±3 мл/мес. в группе плацебо и +8±3 мл/мес. в группе сиролимуса, что означало существенное улучшение легочной функции на фоне активной терапии. Абсолютная разница в среднем изменении ФЖЕЛ во время терапии между группами составила 226 мл (рис. 4).
Качество жизни по вопросникам Functional Performance Inventory и визуально–аналоговой шкале EuroQOL в группе сиролимуса достоверно улучшилось за 12 мес. лечения в отличие от группы плацебо. Средние уровни специфичного для ЛАМ лимфогенного фактора vascular endothelial growth factor D (VEGF–D) исходно были одинаковыми в обеих группах, но через 6 и 12 мес. в группе сиролимуса стали значительно ниже, чем в группе плацебо.
За последующий год пассивного наблюдения ОФВ1 снизился в обеих группах (на 8±2 мл/мес. в группе плацебо и на 14±3 мл/мес. в группе сиролимуса, различия недостоверны). Аналогичным образом не получено достоверных различий в динамике ФЖЕЛ за 24 мес. Средний уровень VEGF–D через 24 мес. оставался повышенным в группе плацебо (2107±2146 пг/мл) и снизился в группе сиролимуса (930±461 пг/мл).
Наиболее частые побочные эффекты в период лечения включали воспаление слизистых оболочек желудочно–кишечного тракта, диарею, тошноту, гиперхолестеринемию, кожную сыпь и отеки нижних конечностей. В группе сиролимуса достоверно чаще встречались побочные эффекты, связанные с состоянием костного мозга и крови, желудочно–кишечные явления, дерматологические проблемы, метаболические нарушения или изменения лабораторных показателей, мышечно–скелетные нарушения и побочные эффекты, связанные с мягкими тканями; болевые и неврологические синдромы, нарушения зрения или другие офтальмологические проблемы.
Таким образом, лечение пациентов с ЛАМ сиролимусом в течение 1 года позволило стабилизировать ОФВ1, улучшить качество жизни и некоторые функциональные характеристики. Положительное влияние на бронхиальную проходимость исчезло после отмены препарата. Лечение сиролимусом было связано с более частым, чем в группе плацебо, развитием побочных эффектов, хотя серьезные побочные эффекты возникали с одинаковой частотой в обеих группах.
Легочные проявления при синдроме
Бёрта–Хогга–Дюбе’: кистозные изменения
и легочная гистиоцитома
[Tomassetti S., Carloni A., Chilosi M. et al. Pulmonary features of Birt–Hogg–Dubе’ syndrome: cystic lesions and pulmonary histiocytoma // Respir Med. 2011. Vol. 105. Р. 768–774]
Синдром Бёрта–Хогга–Дюбе’ (БХД) – аутосомно–доминантный генодерматоз, предрасполагающий к развитию фолликулярных гамартом кожи, кистозных изменений легких, пневмотораксов и новообразований почек. Синдром БХД вызывается мутацией в гене БХД (FLCN), который локализован в коротком плече 17 хромосомы (17р11.2) и кодирует синтез опухолевого супрессора белка фолликулина. Типичными для синдрома БХД поражениями кожи являются фиброфолликулома (ФФ) и триходискома (ТД), представляющие собой множественные мелкие папулы на коже лица, шеи и верхней части туловища. У большинства больных развивается кистозное поражение легких, нередко с рецидивирующими пневмотораксами. Поражение почек проявляется различными гистологическими вариантами почечно–клеточного рака. В данной статье описано поражение легких при синдроме БХД у 12 больных с синдромом БХД в трех семьях, проживающих в Великобритании и Италии.
Поражение кожи диагностировано у 7 больных, почек – у 2 больных, кистозное поражение легких – у 9 (75%) больных. Средний возраст в момент постановки диагноза составлял 44,6 года; 8 (66%) больных принадлежали к мужскому полу. У 4 (33%) больных (возраст 47–57 лет) развивались рецидивирующие пневмотораксы (от одного до трех эпизодов). Легочные тонкостенные кисты круглой или овальной формы, размером 3–57 мм (более крупные располагались в нижних отделах легких), окруженные неизмененной легочной тканью, с толщиной стенки от невидимой до 2 мм обнаружены при КТВР в небольшом количестве по всем легочным полям у 9 (75%) больных в возрасте 24–85 лет (рис. 5).
Гистологическое исследование выявило кистозную дилатацию альвеолярных ходов от микроскопической до нескольких миллиметров в диаметре. Тонкостенные кисты были выстланы кубическим эпителием при отсутствии в их стенках фиброзной или гладкомышечной ткани. У одного пациента в нижней доле левого легкого выявлен одиночный узел 12 мм в диаметре, который был резецирован; морфологически и иммунофенотипически диагностирована гистиоцитома.
Таким образом, синдром БХД является одним из кистозных поражений легких, что необходимо учитывать при проведении дифференциального диагноза кистозных заболеваний легких (куда также входят ЛАМ, гистиоцитоз Х, пневмония, вызванная Pneumocystis, лимфоцитарная интерстициальная пневмония и метастатическое поражение легких при аденокарциномах и низкодифференцированных саркомах).
Бронхиолиты
Тяжелый хронический бронхиолит
как начальное проявление первичного
синдрома Шегрена
[Borie R., Schneider S., Debray M.–P. et al. Severe chronic bronchiolitis as the presenting feature of primary Sjo..gren’s syndrome // Respir Med. 2011. Vol.105. Р. 130–136]
Синдром Шегрена – аутоиммунное заболевание, характеризующееся лимфоидной инфильтрацией экзокринных желез. Различают первичный синдром Шегрена – системное заболевание неизвестной этиологии и вторичный синдром Шегрена, сопутствующий другим аутоиммунным заболеваниям. Манифестирует болезнь чаще всего развитием астении и «сухого» синдрома (ксеростомии и ксерофтальмии), реже – системными проявлениями, в том числе поражением органов дыхания.
Известно, что почти у половины больных можно обнаружить лимфоплазмоцитарную инфильтрацию стенки воздухоносных путей при биопсии и гиперреактивность бронхов при проведении ФВД. Клинически выраженное поражение органов дыхания возникает, по мнению некоторых авторов, лишь у 9% больных с первичным синдромом Шегрена.
В данной работе описываются 5 клинических случаев пациентов с тяжелым бронхиолитом и хронической дыхательной недостаточностью, ассоциированными с первичным синдромом Шегрена. Среди больных были 4 женщины и 1 мужчина, средний возраст на момент постановки диагноза составлял от 38 до 70 лет (58 лет в среднем). У всех пациентов доминирующими жалобами были одышка продолжительностью от 1 до 144 мес. (10 мес. в среднем), хронический кашель и отделение мокроты. Четверым больным требовалось проведение длительной кислородотерапии в связи с тяжелой гипоксемией. У троих в анамнезе были указания на повторяющиеся инфекции верхних дыхательных путей.
При анализе КТВР органов грудной клетки у всех пациентов визуализировались умеренно выраженные бронхоэктазы на фоне множественного диффузного мелкоузелкового поражения легких. У 3 больных на момент постановки диагноза обнаруживались признаки альвеолита, которые исчезали после проведения антибиотикотерапии и физиотерапии. По данным ФВД у всех больных диагностирована бронхиальная обструкция. Микробиологическое исследование аспирата бронхиального дерева выявило рост Pseudomonas aeruginosa у 1 пациента и Staphylococcus aureus еще у 1 пациента. В 4 случаях был проведен бронхоальвеолярный лаваж (БАЛ), в ходе которого выявлен повышенный цитоз, преимущественно за счет нейтрофилов (80%). У всех больных были выявлены антиядерные антитела, у 2 пациентов – анти–SSA антитела. Все пациенты получали ингаляционные глюкокортикостероиды (ИГКС) и длительно действующие β2–агонисты, а также физиотерапию с целью улучшения дренажа бронхов. За все время наблюдения значительное улучшение было отмечено у 3 больных, рецидивирующая респираторная инфекция выявлена у 3 пациентов, из которых 1 скончался от пневмонии.
Таким образом, практическим врачам не стоит забывать о риске развития поражения органов дыхания на фоне системных заболеваний. Назначение макролидов, ИГКС и бронходилататоров способно существенно улучшить течение тяжелого облитерирующего бронхиолита.
Интерстициальные заболевания
легких и курение
Объемы легких и эмфизема у курильщиков с интерстициальными изменениями
[Washko G.R., Hunninghake G.M., Fernandez I.E. et al. Lung volumes and emphysema in smokers with interstitial lung abnormalities // N Engl J Med. 2011. Vol. 364. Р. 897–906]
В настоящее время накапливается все больше информации о том, что табакокурение помимо ХОБЛ может вызывать формирование областей повышенной плотности легких − интерстициальных изменений (ИИ), обнаруживаемых при КТВР. В какой степени эти нарушения связаны с меньшей выраженностью эмфиземы и меньшим снижением общей емкости легких (ОЕЛ) при продолжающемся курении, неизвестно. Целью настоящего исследование стало изучение взаимосвязи между признаками ИИ, ОЕЛ и эмфиземой, определяемыми при КТВР в когорте курильщиков со стажем более 10 пачек–лет.
В исследование было включено 2508 курильщиков со стажем курения не менее 10 пачек–лет в возрасте 45–80 лет из 21 центра США. В исследование не включались лица с легочными заболеваниями за исключением астмы, ХОБЛ и эмфиземы.
КТВР была выполнена 2416 пациентам, из них 1171 были женщинами, 613 − чернокожими, 1060 − активными курильщиками, 1002 − страдали ХОБЛ. У 1361 (56%) пациента на КТВР не было выявлено ИИ, у 861 (36%) имелись неопределенные (менее 5% зоны легкого) ИИ, и у 194 (8%) были выявлены ИИ. По сравнению с лицами без ИИ пациенты с ИИ были старше (64 года против 60), имели больший индекс массы тела (28 против 27) и больший стаж курения (44 пачка–лет против 40). Пациенты с ИИ реже страдали ХОБЛ (32% против 41%), имели меньший ОЕЛ (5,02 л против 5,7 л) и меньший объем при спокойном выдохе (2,67 л против 3,13 л).
В скорректированной модели общий легочный объем и объем при спокойном выдохе были снижены у пациентов с ИИ по сравнению с группой без подобных изменений. Выраженность эмфиземы также была меньшей у лиц с ИИ. Шансы иметь ХОБЛ у пациентов с ИИ были на 47% ниже, чем у лиц без ИИ.
Стратификация пациентов по факту наличия или отсутствия ХОБЛ выявила, что ИИ ассоциированы со снижением ОЕЛ как у пациентов с ХОБЛ (−12% от должного), так и без ХОБЛ (−7% от должного). Выраженность эмфиземы также была меньше при наличии ИИ у пациентов с ХОБЛ (−7%) и без ХОБЛ (−0,6%). После коррекции данных по распространенности эмфиземы снижение ОЕЛ было практически одинаковым в группе с ХОБЛ (−7%) и без ХОБЛ (−6%). Это означает, что снижение ОЕЛ при ХОБЛ с ИИ связано как с рестриктивным дефектом, так и с меньшей выраженностью эмфиземы.
Из 194 пациентов с ИИ у 37 (19%) отмечались центрилобулярные изменения, у 107 (55%) – субплевральные, 38 (20%) имели смешанные − центрилобулярные и субплевральные изменения и 12 (6%) имели рентгенологические признаки интерстициального заболевания легких. Наибольшее снижение ОЕЛ наблюдалось при субплевральном варианте ИИ (−0,481), смешанном варианте (−0,416), наименьшее снижение – при центрилобулярном расположении ИИ (−0,133). Активное курение было ассоциировано с образованием центрилобулярных узелков (отношение шансов 4,82).
Таким образом, в настоящем исследовании было продемонстрировано, что КТВР позволяет выявить интерстициальные изменения у 8% курильщиков. ИИ ассоциированы с уменьшением ОЕЛ и меньшей выраженностью эмфиземы, амплитуда этого снижения максимальна у пациентов с ХОБЛ. Авторы исследования предполагают, что курение может вызвать два различных варианта поражения легких − эмфизему и ИИ.
![Рис. 1. Скорость снижения ФЖЕЛ за 1 год у пациентов ИЛФ, принимавших плацебо и различные дозы BIBF 1120 [Richeldi et al., New Engl J Med. 2011]](/800/600/https//data/articles/Image/t20/n6/265-1.gif)
![Рис. 2. Частота обострений ИЛФ у пациентов, принимавших плацебо и различные дозы BIBF 1120 [Richeldi et al., New Engl J Med. 2011]](/800/600/https//data/articles/Image/t20/n6/265-2.gif)
![Рис. 3. Выживаемость больных ЭАА с «типичным» паттерном, НСИП и ОИП–подобными паттернами [Gaxiola et al., Respir Med. 2011]](/800/600/https//data/articles/Image/t20/n6/265-3.gif)
![Рис. 4. Изменения ОФВ1 и ФЖЕЛ за 12 мес. терапии сиролимусом [McCormack et al., N Engl J Med. 2011]](/800/600/https//data/articles/Image/t20/n6/265-4.gif)
![Рис. 5. Кистозные изменения в легких больного с болезнью БХД (мужчина 52 лет) [Tomassetti et al., Respir Med. 2011]](/800/600/https//data/articles/Image/t20/n6/265-5.gif)
.
Фиброз легких: что это такое, продолжительность жизни и фиброзные изменения на флюорограмме
Фиброзом легких называется болезнь, при которой в легких образуется фиброзная ткань и нарушается дыхательная функция этого органа. При данном заболевании наблюдается уменьшение эластичности ткани легких и усложненное проникновение через альвеолы кислорода и углекислого газа.
Эта болезнь может привести к очень серьезным последствиям, поэтому каждый человек должен знать, что такое фиброз, каковы его симптомы и способы лечения.
Основная симптоматика и методы диагностики
Самым первым и основным симптомом является одышка. Первым делом она начинает проявляться только во время физического труда, а потом может возникать и в покое.
Затем, по мере развития болезни, пациент начинает жаловаться на сухой кашель. Кожа больного приобретает синеватый оттенок. В тяжелых случаях у пациента может замечаться изменения формы пальцев.
Также, если болезнь длится уже длительное время, то у больного фиброзом легких симптомы могут проявляться и со стороны сердечно-сосудистой системы. К ним относятся:
 отеки ног,
отеки ног,- усиленное сердцебиение,
- вздутие вен на шее,
- боли в груди,
- быстрая утомляемость и общая слабость.
При обращении в больницу, врач, для того чтобы поставить этот диагноз, первым делом изучает анамнез больного, опрашивает его о симптомах и общем состоянии, а также проводит осмотр. Для этого он прослушивает и простукивает область грудной клетки, проверяет, как работают органы дыхания, и определяет объем легких. Также врачу нужно проверить и то, какой уровень кислорода содержится в крови. Сделать это можно с помощью такой процедуры как оксигенометрия.
Сделать картину развития заболевания более четкой могут современные способы диагностики. Больному, у которого подозревают наличие фиброза легкого, могут назначить:
- рентгенографию,
- магнитно-резонансную томографию,
- биопсию легкого,
- компьютерную томографию.
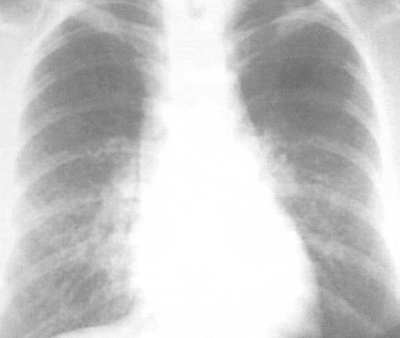 На рентгеновском снимке грудной клетке специалист может обнаружить усиление рисунка легких очагового или диффузного характера в верхней или нижней зоне органа. Иногда это исследование может показать и наличие кистозных просветлений небольшого размера. КТ дает возможность выявить различные виды затемненностей в легких и больше сказать о процессе образования фиброзных изменений.
На рентгеновском снимке грудной клетке специалист может обнаружить усиление рисунка легких очагового или диффузного характера в верхней или нижней зоне органа. Иногда это исследование может показать и наличие кистозных просветлений небольшого размера. КТ дает возможность выявить различные виды затемненностей в легких и больше сказать о процессе образования фиброзных изменений.
Если врач подозревает наличие осложнений фиброза, то может назначаться эхокардиограмма. Она дает возможность выявить легочную гипертензию. Также, в ряде случаев, специалист может назначить пациенту бронхоскопию, которая позволит точно определить масштаб изменений в легочной ткани.
Классификация фиброза легких
Фиброз классифицируется по нескольким признакам. По характеру распространения болезни он бывает:
 односторонним, то есть поражается лишь одно легкое,
односторонним, то есть поражается лишь одно легкое,- двухсторонним, поражающим оба легких,
- очаговым (изменяется только небольшой участок органа),
- диффузным (поражается все легкое).
По причинам образования патологии выделяют интерстициальный и идиопатический фиброз. Идиопатическая форма имеет неустановленную причину развития. Она является самой диагностируемой, среди других видов фиброза. Чаще всего она встречается у мужчин 50-60 лет. Точные причины развития данной патологии не выявлены, но ученые доказали, что она может возникнуть из-за негативного влияния генетических и экологических факторов.
Интерстициальный фиброз – заболевание, вызванное воздействием негативных факторов.
Он в свою очередь делится на:
- постлучевой фиброз легких, который возникает как последствие лучевой терапии,
- пылевой, возникающий из-за вдыхания пыли,
- соединительнотканный фиброз, причинами которого являются патологии соединительной ткани,
- инфекционный, являющийся осложнением инфекционных заболеваний,
- лекарственный, возникший из-за длительного приема медикаментов,
- перибронхиальный фиброз, являющийся следствием хронического воспаления,
Также фиброз классифицируют и по выраженности образования соединительной ткани. В этой классификации выделяются:
- Пневмофиброз. Представляет собой разрастание фиброзной ткани умеренной тяжести, которая чередуется с нормальной тканью.
- Пневмосклероз. При пневмосклерозе наблюдается грубое замещение хорошей ткани измененной и уплотнение легких.
- Цирроз легких. Характеризуется полной заменой легочной ткани и повреждением бронхов и легочных сосудов.
По локализации фиброз легких делится на:
- Апикальный, который затрагивает верхнюю часть органа.
- Прикорневой фиброз, который поражает участки около корней легких.
- Корневой фиброз, который возникает в корне легкого.
Причины возникновения, методы профилактики и возможные осложнения
Такие паталогические изменения в легких часто возникают при наличии у пациента инфекционных заболеваний, аллергии, а также из-за лучевой терапии и длительном вдыхании пыли. В группе риска находятся люди, работающие с мукой, плесенью, песком и другой органической и неорганической пылью.
Также причинами развития легочного фиброза могут являться болезни соединительной ткани, васкулиты и курение.
Ученые выявили, что у злостных курильщиков риск возникновения патологии намного больше, чем у некурящих людей.
Для того чтобы избежать этого заболевания, нужно избегать факторов, которые вызывают данную болезнь. Самыми основными методами профилактики являются:
- правильное питание,
- проведение дыхательной гимнастики,
- избегание долгого контакта с любой пылью,
- соблюдение правил безопасности при работе с вредными веществами,
- строгий отказ от курения.
Также очень важно ежегодно проверять состояние легких и своевременно выявлять признаки заболеваний легких.
Фиброз легких является очень серьезным заболеванием и имеет ряд осложнений. Самыми распространенными из них считаются:
- дыхательная недостаточность,
- кома гипоксимического типа,
- пневмоторакс,
- плеврит.
Кроме того у больных могут наблюдаться тромбоэмболия легочной артерии и хроническое легочное сердце. Также специалисты установили, что у больных данным заболеванием риск возникновения рака в 14 раз больше, чем у людей без этого диагноза. Эти заболевания очень тяжелые, поэтому если фиброзные изменения легких не лечить, это может привести и к летальному исходу.
Лечение заболевания
Пациенту с данным диагнозом назначают комплексное лечение, в которое входят медикаментозная терапия и немедикаментозное лечение с реабилитационными мероприятиями. В тяжелых случаях применяется и трансплантация легкого. Основная цель лечебных мероприятий – улучшить качество жизни больного.
В медикаментозную терапию при фиброзе обязательно входят глюкокортикостероиды, цитостатики и антифиброзные препараты. Самым назначаемым глюкокортикостероидным препаратом является Преднизолон. Лечебный курс этим лекарством обычно составляет 12 недель. Но данный препарат применяется и для поддерживающей терапии, длительность которой составляет минимум 2 года.
Если Преднизолон не дает должного эффекта, то в комплекс к нему включают цитостатики. В их качестве врачи могут назначить Азатиоприн и Циклофосфамид. Комбинированный прием Преднизолона и цитостатиков обычно длится около полугода.
Нужно принимать во внимание тот факт, что длительный прием глюкокортикостероидов может нанести вред организму, например, вызвать остеопороз, язву желудка, нарушения нервной системы, миопатию. Поэтому в течение всего времени приема лекарств, больному необходимо регулярно посещать врача и соблюдать диету №9.
 В качестве антифиброзного препарата в большинстве случаев прописывается Колхицин. Вещества, содержащиеся в данном препарате, не дают образовываться амилоидным фибриллам. Также эффективным лекарством является Верошпирон. Он имеет свойство снижать скорость образования соединительной ткани. Такой препарат нужно принимать в течение длительного времени.
В качестве антифиброзного препарата в большинстве случаев прописывается Колхицин. Вещества, содержащиеся в данном препарате, не дают образовываться амилоидным фибриллам. Также эффективным лекарством является Верошпирон. Он имеет свойство снижать скорость образования соединительной ткани. Такой препарат нужно принимать в течение длительного времени.
Фиброз корней легких и других участков органа лечится и при помощи немедикаментозной терапии. Она включается в себя лечение кислородом, помогающее бороться с одышкой и улучшить состояние во время физических нагрузок. Если болезнь находится в тяжелой стадии, то пациенту следует пройти такие процедуры как плазмаферез и гемосорбция.
Положительный эффект оказывают и реабилитационные программы с физическими упражнениями. Подбираются они, каждому человеку индивидуально, учитывая общее состояние и особенности организма.
В некоторых случаях больному может требоваться пересадка легких. Показаниями к такой операции являются:
 гипоксия при физической нагрузке,
гипоксия при физической нагрузке,- уменьшение жизненного объема легких,
- тяжелая дыхательная недостаточность,
- сильное снижение диффузной способности легких.
По статистике выживаемость в течение 5 лет после данной операции составляет около 60%. Полностью фиброз легких вылечить нельзя, но можно постараться приостановить процесс образования фиброзной ткани. Для этого нужно постоянно посещать специалистов и выполнять все их рекомендации.
 Загрузка…
Загрузка…
Легочные проявления системных аутоиммунных заболеваний | #07/14
В основе поражения легких (ПЛ) при системных аутоиммунных заболеваниях (САЗ) лежат расстройства механизмов иммунорегуляции и гиперреактивность организма. Макрофаги и лимфоциты являются ключевыми клетками, участвующими в инициации и сохранении иммунного ответа в легких. Альвеолярные макрофаги — резиденты легочной ткани — поглощают чужеродные агенты, проникшие через слизистые поверхности легких и бронхов. Кроме того, эти клетки служат в качестве антигенпредставляющих клеток для Т-лимфоцитов. Относительно небольшое число лимфоцитов присутствуют в нормальной паренхиме легких. Однако после стимуляции соответствующим антигеном окружающей лимфоидной ткани лимфоциты мигрируют в легкие и принимают участие в воспалительной реакции.
По существу, все САЗ оказываются зависимыми от неадекватной активации аутореактивных CD4+ Т-клеток и В-клеток. От аутоиммунных процессов могут «пострадать» дыхательные пути, плевра, легочная паренхима. Хотя патология легких обычно диагностируется у пациентов с установившимся заболеванием, иногда ПЛ является первым проявлением САЗ [1–3].
Проведение специальных исследований, включавших компьютерную томографию высокого разрешения (КТВР) и биопсию легкого, выявило, что при САЗ встречаются различные гистологические формы поражения интерстиция легких (табл.).
_575.gif)
Системная красная волчанка
Системная красная волчанка (СКВ) — системное аутоиммунное заболевание неизвестной этиологии, характеризующееся гиперпродукцией органоспецифических аутоантител к различным компонентам клеточного ядра с развитием иммуновоспалительного повреждения тканей и внутренних органов.
С точки зрения гистологии СКВ характеризуется определенной комбинацией воспаления и фиброза, а клинический фенотип диктуется относительным «вкладом» каждого пораженного органа. Поражение тканей, по-видимому, опосредовано характерной выработкой аутоантител, формированием иммунных комплексов и их органоспецифическим отложением. Поражение дыхательной системы при СКВ включает патологию плевры, сосудистой системы легких и паренхимы. Наиболее распространенным проявлением является односторонний или двусторонний плеврит, который часто связан с перикардиальным выпотом. Ведущую роль в патогенезе бактериальной пневмонии больных СКВ играет оппортунистическая инфекция. Легочное кровотечение у пациентов СКВ является еще одним проявлением ПЛ, хотя и наблюдается реже. Интерстициальное поражение легких (ИПЛ) при СКВ встречается реже, чем при ревматоидном артрите (РА) или системной склеродермии (ССД). Легочный фиброз (ЛФ) затрагивает в основном базальные отделы нижних сегментов легкого. Острый волчаночный пневмонит (люпус-пневмонит) является редким проявлением СКВ. Легочная гипертензия (ЛГ) при СКВ встречаются реже, чем при других САЗ. Необычный синдром, который называют синдромом «сморщенного легкого», был описан у больных СКВ, при этом отмечается подъем половины купола диафрагмы, обусловленный первичным поражением ее мышц и сохранной иннервацией. В результате развивается ателектаз и фиброз легкого на пораженной стороне. Все это сопровождается значительным дыхательным нарушением по рестриктивному типу [1–5].
Ревматоидный артрит
Ревматоидный артрит (РА) — системное аутоиммунное заболевание соединительной ткани с преимущественным поражением суставов по типу хронического прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями.
ПЛ при РА было впервые описано в 1948 г., когда Эллман и Болл установили диффузный фиброз легких у трех пациентов. Легочные проявления при РА включают поражение плевры, образование ревматоидных узелков в легких, ИПЛ, легочный васкулит, альвеолярные кровоизлияния, бронхообструктивные изменения. Почти у половины больных РА при вскрытии выявляется плеврит. Экссудативный плеврит может быть односторонним или двусторонним и сохраняться в течение многих месяцев. Наличие плеврального выпота вызывает нарушение легочной функции. Как правило, плевральная жидкость бывает экссудативной с низким содержанием глюкозы и низким уровнем комплемента. Чаще у пациентов с РА встречается сухой плеврит и является находкой при рентгенологическом исследовании.
Ревматоидные узелки (РУ), как единичные, так и множественные, могут быть обнаружены в легочной паренхиме больных РА. РУ легких у пациентов с РА были впервые описаны Каплан в 1953 г. РУ могут появиться до, во время или после начала РА. ИПЛ характеризуется хроническим воспалением стенок альвеол и скоплением больших мононуклеарных клеток в альвеолах. Довольно часто у больных РА встречается сочетание ИПЛ и подкожных ревматоидных узелков. Прогноз для пациентов с РА с ИПЛ неблагоприятен. Легочный васкулит является одним из редких легочных проявлений РА. Альвеолярные кровоизлияния, не часто встречающиеся у больных РА, приводят к кровохарканью и анемии. У пациентов с РА отмечается высокая частота поражения бронхов. ПЛ может быть результатом токсического воздействия препаратов, используемых в терапии РА. Для того чтобы обеспечить оптимальный эффект от лечения, врач всегда должен учитывать возможную легочную патологию при оценке состояния пациентов с РА [1–3].
Системная склеродермия
Системная склеродермия (ССД) — диффузное заболевание соединительной ткани с прогрессирующим фиброзом, распространенными вазоспастическими нарушениями и характерными изменениями кожи, опорно-двигательного аппарата и внутренних органов. Среди висцеральных проявлений ССД ПЛ занимает важное место.
Плеврит при ССД наблюдается реже, чем при РА и СКВ. В то же время у больных ССД значительно выше частота ИПЛ, при этом морфологическое исследование показывает выраженный фиброз интерстициальной ткани и утолщение межальвеолярных перегородок. Исследование функции внешнего дыхания (ФВД) демонстрирует снижение диффузионной способности легких (ДСЛ) даже при отсутствии каких-либо клинических симптомов и рентгенологических изменений.
У пациентов с ССД выявляется рестриктивный тип нарушения вентиляции легких. У большинства больных ССД с ЛФ наблюдается гистологическая картина обычной интерстициальной пневмонии (ОИП), однако во многих случаях встречается гистопатологический тип неспецифиче
Хроническая обструктивная болезнь легких (ХОБЛ)
Хроническая обструктивная болезнь легких (ХОБЛ) — это название группы заболеваний легких, вызывающих затруднения дыхания.
Сюда входят:
- эмфизема — повреждение воздушных мешков в легких
- хронический бронхит — длительное воспаление дыхательных путей
ХОБЛ — распространенное заболевание, которое в основном встречается у курящих людей среднего и старшего возраста. . Многие люди не осознают, что у них это есть.
Проблемы с дыханием, как правило, постепенно ухудшаются со временем и могут ограничивать вашу обычную деятельность, хотя лечение может помочь держать это состояние под контролем.
Сделайте прививку от гриппа
Грипп может быть очень серьезным заболеванием, если у вас ХОБЛ. Попросите бесплатную прививку от гриппа по телефону:
- в приемной терапевта
- в местной аптеке, где есть служба вакцинации против гриппа
Узнайте больше о вакцине против гриппа
Информация:
Консультации по коронавирусу
Получите консультацию по коронавирусу и ХОБЛ от Британского фонда легких
Симптомы ХОБЛ
Основными симптомами ХОБЛ являются:
- усиление одышки, особенно когда вы активны
- постоянный грудной кашель с мокротой — некоторые люди могут отклонить это как просто «кашель курильщика»
- частый грудной клетки инфекции
- постоянное свистящее дыхание
Без лечения симптомы обычно прогрессируют.Также могут быть периоды, когда они внезапно ухудшаются, что называется обострением или обострением.
Узнайте больше о симптомах ХОБЛ.
Когда обращаться за медицинской помощью
Обратитесь к терапевту, если у вас стойкие симптомы ХОБЛ, особенно если вы старше 35 лет и курите или привыкли курить.
Не игнорируйте симптомы. Если они вызваны ХОБЛ, лучше начать лечение как можно скорее, прежде чем ваши легкие серьезно повредятся.
Лечащий врач спросит о ваших симптомах, а также о том, курили ли вы в прошлом. Они могут организовать тест на дыхание, чтобы помочь диагностировать ХОБЛ и исключить другие заболевания легких, такие как астма.
Узнайте больше о том, как диагностируется ХОБЛ.
Причины ХОБЛ
ХОБЛ возникает, когда легкие воспаляются, повреждаются и сужаются. Основная причина — курение, хотя иногда это заболевание может поражать людей, которые никогда не курили.
Вероятность развития ХОБЛ увеличивается, чем больше вы курите и дольше курите.
Некоторые случаи ХОБЛ вызваны длительным воздействием вредных паров или пыли. Другие являются результатом редкой генетической проблемы, которая означает, что легкие более уязвимы для повреждений.
Узнайте больше о причинах ХОБЛ.
Лечение ХОБЛ
Повреждение легких, вызванное ХОБЛ, необратимо, но лечение может помочь замедлить прогрессирование заболевания.
Лечение включает:
- отказ от курения — если у вас ХОБЛ и вы курите, это самое важное, что вы можете сделать
- ингаляторы и лекарства — облегчить дыхание
- легочная реабилитация — специализированная программа упражнений и образование
- Операция или трансплантация легких — хотя это вариант только для очень небольшого числа людей
Узнайте больше о том, как лечат ХОБЛ и как жить с ХОБЛ.
Перспективы ХОБЛ
Перспективы ХОБЛ варьируются от человека к человеку.Состояние невозможно вылечить или обратить вспять, но для многих людей лечение может помочь держать его под контролем, чтобы оно не сильно ограничивало их повседневную деятельность.
Но у некоторых людей ХОБЛ может продолжать ухудшаться, несмотря на лечение, что в конечном итоге оказывает значительное влияние на качество их жизни и приводит к опасным для жизни проблемам.
Информация:
Руководство по социальной помощи и поддержке
Если вам:
- нужна помощь в повседневной жизни из-за болезни или инвалидности
- Регулярный уход за кем-то из-за болезни, пожилого возраста или инвалида, включая членов семьи
В руководстве по уходу и поддержке объясняются ваши варианты и где вы можете получить поддержку.
Предотвращение ХОБЛ
ХОБЛ в значительной степени можно предотвратить. Вы можете значительно снизить свои шансы на его развитие, если откажетесь от курения.
Если вы уже курите, прекращение курения может помочь предотвратить дальнейшее повреждение легких до того, как оно начнет вызывать неприятные симптомы.
Если вы считаете, что вам нужна помощь, чтобы бросить курить, вы можете обратиться в NHS Smokefree за бесплатными советами и поддержкой. Вы также можете поговорить с терапевтом о доступных методах лечения от курения.
Узнайте больше о том, как бросить курить, и где найти ближайший к вам пункт службы помощи.
ХОБЛ
В этом видео рассказывается больше о ХОБЛ (бронхите и эмфиземе).
Последний раз просмотр СМИ: 9 мая 2018 г.
Срок сдачи обзора СМИ: 9 мая 2021 г.
Последняя проверка страницы: 20 сентября 2019 г.
Срок следующей проверки: 20 сентября 2022 г.
интерстициальных болезней легких | Краткие медицинские знания

- COVID-19
- Ресурсы по COVID-19
- Концептуальная карта COVID-19
- Осложнения COVID-19
- Видеокурс по COVID-19
- Интерактивные файлы дела по COVID-19
- Студенты: Советы для Домашнее обучение
- Студенты: советы преподавателей по сложным темам
- Учреждения: обеспечение непрерывности медицинского обучения
- Студенты
- Lecturio Medical
- Lecturio Nursing
- Медицинские экзамены
- Step 1 USMLE
- USM
- Предметные экзамены NBME
- COMLEX, уровень 1
- COMLEX, уровень 2
- MCAT
- Дополнительные экзамены
- AMC CAT
- ENARM
- FMGE
- MCCQE Часть 1
- NEET-UG
09 NEET-UG
- PNA
09 NEET-UG
- Медицинские курсы
- Pre-Medical
- Pre-Clinical by Subject
- Клинические знания
900 09 Доклинические по системам
- Медицинские учебные заведения
- Непрерывность медицинского обучения
- Переосмысление медицинского образования
- Инициатива развития (MEDI)
- О нас
- Педагоги
- Успех обучения
- Истории успеха
- Обзоры
- Пресса
Меню
- COVID-19
- COVID
- COVID
- COVID Ресурсы -19 Карточка с концепцией
- Осложнения COVID-19
- Видеокурс COVID-19
- Интерактивные файлы дел по COVID-19
- Студенты: Советы по обучению дома
- Студенты: Советы преподавателей по сложным темам
- Учреждения: Обеспечьте Непрерывность медицинского обучения
- Студенты 9 0008
- Lecturio Medical
- Lecturio Nursing
- Медицинские экзамены
- USMLE Step 1
- USMLE Step 2
- Предметные экзамены NBME
- COMLEX, уровень 1
- COMLEX Level 2
- MCAT
- Другие экзамены ENARM
- FMGE
- MCCQE Part 1
- NEET-UG
- NEET-PG
- PLAB
- PNA
- Медицинские учебные заведения
- Непрерывность медицинского обучения
- Переосмысление медицинского образования
- Инициатива развития (MEDI)
- О нас
- Успешное обучение
- Истории успеха
- Обзоры
9100009
Заболевания легких, являющиеся основной причиной смерти, большинство людей не знают
Несмотря на то, что от болезней легких ежегодно умирают 4 миллиона человек , Форум международных респираторных обществ (FIRS) обнаружил тревожные данные, показывающие, что большинство людей не знают о них. болезнь легких , от которой умирает больше людей, чем от любой другой болезни во всем мире.Данные были обнародованы в связи со Всемирным днем спирометрии.
Маркетинговое агентство YouGov, проведенное на четырех континентах, показало, что, несмотря на высокую распространенность заболеваний легких, людей гораздо больше беспокоят рак, болезни сердца и инсульт.
Сприометрия — это разновидность легочного теста (легочной функции). Он измеряет объем всасываемого и выдыхаемого воздуха в зависимости от времени. После глубокого вдоха пациент дует изо всех сил в мундштук.
Спирометрия измеряет, сколько воздуха человек может выдохнуть из легких (FVC — форсированная жизненная емкость легких) и сколько он может выдохнуть за одну секунду (FEV1 — объем форсированного выдоха).

Современный портативный настольный спирометр
Учитывая, что исследования показывают, что уровень смертности от ХОБЛ (хронической обструктивной болезни легких) почти удвоился за последние тридцать лет, отсутствие беспокойства еще более драматично, поскольку уровень смертности от большинства других серьезных болезней за тот же период снизился.
Согласно опросу населения, люди недооценивают влияние заболеваний легких и не знают, как с ними бороться. 57% респондентов никогда не проверяли свои легкие, хотя простые легочные тесты, такие как спирометрия, помогают врачам выявлять ХОБЛ, астму и другие проблемы с легкими на ранней стадии, когда лечение наиболее эффективно.
70% респондентов считают, что люди с заболеваниями легких не должны заниматься какими-либо упражнениями, даже легким плаванием или целенаправленной работой в тренажерном зале. Физическая активность может быть полезной для лечения, а также для облегчения симптомов заболевания легких, например одышки.Даже пациенты с тяжелыми симптомами могут получить пользу от упражнений.
У реципиентов трансплантата легких, которые участвовали в трехмесячном режиме структурированных физических упражнений после выписки из больницы, было обнаружено значительно более высокое качество жизни и более низкий шанс развития сердечно-сосудистых проблем по сравнению с теми, кто этого не делал, сообщили бельгийские исследователи в Американский журнал трансплантологии . (Ссылка на статью)
По мере того, как мы приближаемся к Олимпийским играм, FIRS стремится использовать эти последние данные, чтобы рассказать людям о важности тестирования легких и повышения физической активности — и то, и другое имеет жизненно важное значение для хорошего респираторного здоровья.
FIRS призывает пациентов с заболеваниями легких поговорить со своими врачами и другими медицинскими работниками о вариантах физической активности. Данные показывают, что только 41% пациентов когда-либо обсуждают это со своими врачами.
Астма среди спортсменов неуклонно растет в течение последних 20 лет. На Олимпийских играх 2004 года 21% британской сборной страдали астмой по сравнению с 8% британского населения. Отчет, опубликованный в BMJ (Британский медицинский журнал) , показал, что многие спортсмены, страдающие астмой, вероятно, не используют лучшую терапию для своего состояния и могут поставить под угрозу свое здоровье в долгосрочной перспективе.(Ссылка на статью)
Медицинские работники во всем мире будут на улицах, чтобы проводить публичные мероприятия по тестированию легких во Всемирный день спирометрии и в преддверии Олимпийских игр, чтобы повысить осведомленность о спирометрическом тестировании, которое обычно занимает менее 10 минут и является наиболее эффективным способом проверки здоровья органов дыхания.
Клаус Рабе, председатель FIRS и президент Европейского респираторного общества (ERS), сказал:
«Хроническое заболевание легких — серьезная проблема для здоровья, но, как показывает опрос FIRS, его бремя продолжает недооцениваться.Широко распространено игнорирование не только серьезности заболевания легких, но и того, что можно сделать для его предотвращения.
По мере того, как страны по всему миру празднуют достижения лучших спортсменов мира, мы чувствуем, что настало время сосредоточиться на том, как мы все можем улучшить здоровье легких. Врачи-респираторы все больше и больше понимают важность упражнений, но наши исследования подтверждают, что невежество все еще существует. Даже легкая ходьба для людей с тяжелым заболеванием может помочь улучшить емкость легких и общее самочувствие, и мы должны донести эту мысль до пациентов.
Председатель Европейского фонда легких, Моника Флетчер, которая координировала глобальную инициативу WSD, добавила: «Всемирный день спирометрии дает людям возможность понять важность тестирования своих легких. Ранняя диагностика заболеваний легких может привести к более эффективным вмешательствам, которые, в свою очередь, могут помочь облегчить симптомы и замедлить прогрессирование заболевания ».
Несколько известных спортсменов присоединились к ним, чтобы рассказать людям о заболеваниях легких и о том, чего они могут достичь с помощью упражнений.Среди них норвежский олимпийский гребец Олаф Туфте, завоевавший два золота и одну серебряную медаль — он страдает тяжелой аллергической астмой.
Туфте сказал:
«Я настроен не позволять своей астме ограничивать меня или ограничивать мои амбиции. Вместо этого я рассматриваю это как одну из многих проблем, которые мне нужно преодолеть, чтобы стать лидером в моем виде спорта. Люди с заболеваниями легких могут вести здоровый и активный образ жизни, если они предпримут шаги для того, чтобы их состояние было выявлено на достаточно ранней стадии и было хорошо лечиться.”
Существует три основных вида заболеваний легких:
- Болезни легочного кровообращения — кровеносные сосуды в легких поражаются из-за тромба, воспаления кровеносных сосудов или рубцевания кровеносных сосудов . Нарушается способность легких поглощать кислород и выделять углекислый газ. Заболевания легочного кровообращения иногда вызывают проблемы с сердцем.
- Заболевания дыхательных путей — поражаются дыхательные пути (трубки), по которым кислород и другие газы попадают в легкие и из них.В большинстве случаев дыхательные пути либо становятся слишком узкими, либо возникает закупорка. Примеры включают хронический бронхит, эмфизему и астму. Дыхание может стать затрудненным и затрудненным, некоторые говорят, что это как дыхание через соломинку .
- Болезни легочной ткани — поражается структура легочной ткани. Воспаление тканей или рубцевание вызывает ограничительное заболевание легких — легкие не могут полностью расширяться, что затрудняет вдыхание кислорода и избавление от углекислого газа (выдох).Примеры включают саркоидоз и фиброз легких.
Некоторые заболевания легких включают сочетание двух или трех типов.
По данным Национального института здоровья США (NIH), наиболее распространенными заболеваниями легких в США являются:
- Отек легких
- Пневмония
- Рак легких
- Эмфизема
- ХОБЛ (хроническая обструктивная болезнь легких)
- Бронхит
- Ателектаз — коллапс части, а иногда и всего легкого
- Астма
К другим легочным заболеваниям относятся — асбестоз, аспергиллома, аспергиллез — острая инвазивная пневмония, бронхоэктатическая болезнь, облитерирующий бронхиолит (организуемый бронхиолит) , Эозинофильная пневмония, метастатический рак легких, некротизирующая пневмония, плевральный выпот, пневмокониоз, пневмония у пациентов с иммунодефицитом, пневмоторакс, легочный актиномикоз, легочный альвеолярный протеиноз, легочная форма сибирской язвы, легочная артериовенозная мальформация, легочная эмболия эмболии, легочная эмболия , Легочная гипертензия, Pu нокардиоз легких, туберкулез легких, веноокклюзионная болезнь легких, ревматоидное заболевание легких и саркоидоз.
Написано Петрой Ратту
Ученые озадачены исчезновением гриппа … но действительно ли он исчез или просто замаскирован Covid-19? — RT Op-ed
Автор Питер Эндрюс , ирландский научный журналист и писатель из Лондона. Он имеет опыт работы в области наук о жизни и окончил Университет Глазго по специальности генетик.
В этом году число случаев заражения гриппом сократилось на 98%, что развеяло опасения по поводу коронавируса и гриппа, «двойного демика», о которых многие предупреждали.Эксперты говорят, что мы можем благодарить маски и социальное дистанцирование. Но действительно ли это складывается?
Хотя массового тестирования на грипп в отличие от Covid не существует, ВОЗ утверждает, что эпиднадзор за данными со всего мира показывает, что заболеваемость гриппом падает повсюду. Австралия фактически «пропустила» сезон гриппа в этом году, и с июля (пик) не было зарегистрировано ни одного случая заболевания. Фактически, грипп более или менее исчез во всем Южном полушарии, и первые индикаторы предполагают, что он последует этому примеру к северу от экватора.Чем можно объяснить этот беспрецедентный спад?
Также на rt.com
Система здравоохранения не интересуется ничем, кроме Covid … даже раком легких
Куда это делось?
На мой взгляд, есть три возможности.
Во-первых, кажется, что грипп исчез, потому что врачи и ученые ошибочно классифицируют другие респираторные заболевания как Covid. Обратите внимание, что ученые уже рассматривают это предложение как нечто сродни теории плоской Земли.
Во-вторых, Covid «вытеснил» грипп. Кажется, что сразу двумя вирусами нельзя заболеть. Недавнее исследование Йельского университета показало, что из 13000 пациентов, поступивших в крупную больницу с респираторными заболеваниями, практически никто никогда не болел простудой и гриппом одновременно. Фактически, легочная ткань, ранее подвергавшаяся воздействию вируса простуды, была невосприимчивой к вирусу гриппа.
Но ученые говорят, что это решение не работает: не более одной пятой населения заразились Covid, и поэтому все остальные должны стать благодатной почвой для гриппа.Но если они ошибаются, а Covid на самом деле гораздо более распространен, чем думают ученые, «скопление вирусов» может способствовать падению гриппа. (Вопрос в том, почему Covid так окончательно выиграл бы эту битву, чтобы не было практически ни одного случая гриппа и миллионы случаев Covid — наверняка грипп заразил бы некоторых людей раньше, чем Covid?)
Третья возможность — это ученые объяснение. Прежде чем я его приведу, обратите внимание, что любая из первых двух возможностей, если она верна, сделала бы весь ответ Covid смешным, не в последнюю очередь потому, что это означало бы, что Covid гораздо менее опасен, чем это широко утверждалось.
Также на rt.com
Лечить хуже болезни? Исследование говорит, что изоляция в Великобритании связана с тысячами дополнительных смертей
Вердикт —
Научный истеблишмент быстро формирует ряды, стоящие за теорией о том, что грипп ушел из-за ограничений Covid, особенно масок, социального дистанцирования и изоляции. Они «в подавляющем большинстве согласны» с этим; их уверенность примечательна на этой ранней стадии.
Но почему эти меры так непреднамеренно сработали при гриппе, который существует с нами на протяжении тысячелетий, но число случаев Covid по-прежнему стремительно растет? Пропускают ли маски одну частицу и останавливают ли другую?
У сторонников этой теории есть объяснение.Они утверждают, что люди с Covid более заразны, чем больные гриппом. У него более длительный «инкубационный период», чем у гриппа, и его «коэффициент R» в три раза выше, чем у гриппа. Но даже если бы все эти оценки были верными, все еще остается без ответа вопрос, почему грипп удалось бы полностью искоренить.
Также на rt.com
Буллезная болезнь легких (включая эмфизему, связанную с ВИЧ)
Что нужно знать каждому врачу:
Буллезная болезнь легких характеризуется развитием булл в паренхиме легких.Булла — это постоянное, заполненное воздухом пространство в паренхиме легкого размером не менее 1 см с тонкой или плохо выраженной стенкой; он окаймлен только остатками альвеолярных перегородок и / или плевры. Буллы следует отличать от других заполненных воздухом пространств в легких:
Пузырьки представляют собой заполненные воздухом скопления в слоях висцеральной плевры и имеют диаметр <1 см.
Кисты представляют собой круглые, хорошо очерченные скопления, имеющие эпителиальную или фиброзную выстилку.
Полости обычно представляют собой скопления с толстыми стенками, образованные очаговым некрозом внутри уплотнения, массы или узелка.
Пневматоцеле — это временные палатки в паренхиме легких, которые обычно возникают в результате тупой травмы или чрезмерного растяжения легкого.
Хотя буллы обычно наблюдаются в контексте ХОБЛ, иногда они могут быть отмечены как отдельные находки в нормальной паренхиме легких и не всегда связаны с обструкцией воздушного потока.
Буллы обычно со временем увеличиваются в размерах, но скорость и степень роста сильно различаются. Если пузыри вырастают достаточно большими, они могут ограничивать расширение паренхимы соседнего легкого и в тяжелых случаях могут вызвать явный ателектаз соседних сегментов легкого.
При отсутствии неуправляемых симптомов буллы не обязательно требуют вмешательства. Однако у пациентов с тяжелыми нарушениями, несмотря на агрессивную медикаментозную терапию, хирургическая булэктомия может быть полезной.
Классификация:
Буллезную болезнь легких можно разделить на несколько основных категорий в зависимости от состояния окружающей паренхимы легких:
Буллезная эмфизема относится к образованию булл в эмфизематозной паренхиме легких.В этом контексте множественные соседние буллы часто образуются как области сильного слияния эмфиземы, что происходит из-за прогрессирующей потери альвеолярных прикреплений. Пациенты обычно обнаруживают обструкцию воздушного потока при спирометрии.
Буллы внутри нормальных легких часто бывают единичными и окружены морфологически нормальной легочной тканью. Эта категория встречается гораздо реже, чем буллезная эмфизема. Патогенез четко не установлен, но, вероятно, он связан с очаговым анатомическим дефектом, который приводит к прогрессирующему захвату воздуха.Даже при наличии симптомов пациенты с этой формой заболевания могут демонстрировать нормальные показатели функции легких.
Буллы на поздней стадии фиброза легких, такой как поздняя стадия саркоидоза или пневмокониоза.
Синдром исчезающего легкого или идиопатический гигантский эмфизематозный булла — это редкий синдром, при котором буллы занимают> 30% пораженного гемиторакса без установленной основной этиологии. Чаще поражаются верхние доли, преобладающим признаком является наличие субплевральных булл.Это, как правило, затрагивает молодых курильщиков (4 -е года). Прогрессирование заболевания, как и любой буллезной эмфиземы, варьирует, и для окончательного лечения обычно требуется хирургическая булэктомия.
Были предложены более подробные схемы классификации (например, классификация Рейда) на основе количества булл, их расположения и состояния окружающей паренхимы легких. Эти классификации обычно не используются, и их клиническая применимость недостаточно изучена.
Вы уверены, что у вашего пациента буллезная болезнь легких? Что вы должны ожидать найти?
Буллы вызывают симптомы посредством двух различных механизмов:
Буллы могут мешать вентиляции прилегающих участков консервированного легкого, препятствуя их полному расширению при вдохе или, в тяжелых случаях, вызывая явный ателектаз.
Буллы — это объемные образования, которые занимают относительно большие объемы грудной полости, не способствуя функциональному газообмену. Поскольку они могут увеличиваться при выполнении упражнений в результате захвата воздуха, пузыри могут способствовать динамической гиперинфляции, изменяя механику грудной клетки (например, уплощение диафрагмы и цилиндрическую грудную клетку) и увеличивая работу дыхания.
Хотя буллезное заболевание легких иногда протекает бессимптомно и редко обнаруживается при визуализации, обычно оно проявляется симптомами.Обычно это симптомы ХОБЛ:
.
Одышка или стеснение в груди, особенно при физической нагрузке
Кашель
Производство мокроты
Иногда ощущение переполнения или вздутия живота, обычно связанное с тяжелой обструкцией и заметным захватом воздуха при тестировании функции легких.
Редко боль в груди из-за захвата воздуха внутри буллы, вызывающего расширение висцеральной плевры
Симптомы обычно коварны, но внезапная и сильная одышка или боль в груди у пациента с буллезным заболеванием легких должны вызывать подозрение на пневмоторакс из-за разрыва пузыря или пузыря.Редко лихорадка и недомогание +/- увеличение выделения мокроты могут сигнализировать о инфицированном пузыре.
Визуализация грудной клетки выявляет большие, заполненные воздухом пространства в паренхиме легких размером ≥1 см с тонкими или плохо очерченными стенками. Буллы обычно обнаруживаются в областях эмфизематозных легких, но реже они возникают изолированно от нормальной окружающей паренхимы легких.
Тестирование функции легких может быть нормальным, особенно у пациентов, чьи пузыри окружены нормальной паренхимой легких.Однако обычно они демонстрируют обструктивную болезнь легких. Общие нарушения включают обструкцию воздушного потока, гиперинфляцию (то есть повышенную общую емкость легких), захват воздуха (то есть повышенный остаточный объем) и снижение диффузионной способности. Другие признаки буллезной болезни легких могут включать гипоксемию, особенно при физической нагрузке; гиперкапноэ; и сниженная физическая нагрузка.
Осторожно: существуют другие заболевания, которые могут имитировать буллезную болезнь легких:
Дифференциальный диагноз буллезной болезни легких является относительно широким, так как он включает любое заболевание, которое может образовывать заполненные воздухом пространства в паренхиме легких:
Пузырьки: фактически «пузыри», которые возникают внутри слоев висцеральной плевры, а не внутри самой паренхимы легких.Они обычно имеют диаметр менее 1 см, расположены на вершине и часто встречаются у пациентов со спонтанным пневмотораксом. Блебы могут сосуществовать с буллезным заболеванием легких.
Кистозная болезнь легких: отличается от булл по их округлому значению
.

 отеки ног,
отеки ног, односторонним, то есть поражается лишь одно легкое,
односторонним, то есть поражается лишь одно легкое, гипоксия при физической нагрузке,
гипоксия при физической нагрузке,