Плоский эпителий в мазке на цитологию: что значит, норма
Увеличение или уменьшение плоского эпителия в мазке как симптом болезни
Итак, анализ мазка на цитологию может показывать нормальное (в передах 5-15 единиц), повышенное или пониженное содержание эпителиальных клеток в материале, взятом на исследование из уретрального канала или внутренних половых органов. Если количество плоских клеток в пределах нормы, беспокоиться не о чем. В правильно взятом мазке должны присутствовать плоский, цилиндрический и железистый эпителий, который выстилает слизистую оболочку внутренних органов, но в пределах нормы.
А вот показатели выше или ниже границ нормы должны уже насторожить врача и пациента, ведь они могут указывать на некоторые патологические процессы, происходящие в организме мужчины или женщины. И чем раньше будут выявлены эти процессы, тем меньше вреда они принесут.
Плоский эпителий в мазке у женщин
Чаще всего эпителий в большом количестве указывает на воспалительный процесс с локализацией в области внутренних половых органов:
- Вагинит (воспаление тканей влагалища),
Это довольно частое заболевание обычно не протекает бессимптомно, поэтому плоский эпителий в мазке в больших количествах является не единственным проявлением болезни. Обычно мазок с такими показателями берут тогда, когда женщина обращается к врачу с жалобами на:
Обычно мазок с такими показателями берут тогда, когда женщина обращается к врачу с жалобами на:
- неприятные ощущения в области внутренних половых органов, болезненность во время полового акта,
- зуд в области гениталий и влагалища,
- раздражение наружных половых органов, в результате чего отмечается покраснение и отек половых губ, жжение, усиливающееся во время мочеиспускания,
- появление обильных выделений, имеющих белый или желтоватый цвет, причем выделяемого так много, что женщина чувствует постоянную влажность трусиков, что является причиной раздражения наружных половых органов.
Основной причиной вагинитов является патогенная и условно патогенная микрофлора, которая попала внутрь влагалища и начала активно размножаться вследствие дисбаланса микрофлоры внутренних половых органов, механических повреждений, гормональных нарушений и т.д. Что касается выделений, то их характер (цвет, запах и другие показатели) будет зависеть от вида болезнетворных микроорганизмов, населяющих влагалище (гоннококковая или трихомонадная инфекции, активизировавшаяся условно-патогенная микрофлора, грибки и т.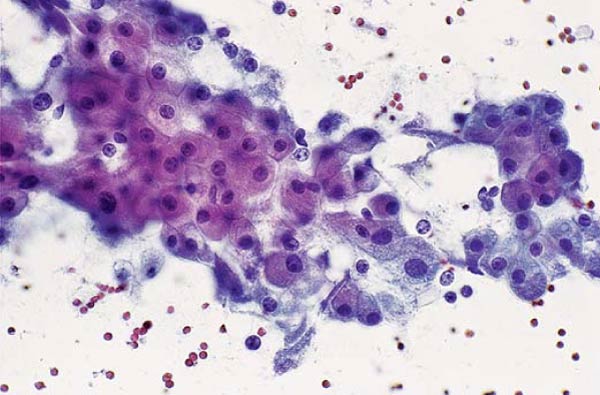 д.). Если причиной болезни стали гарднереллы, помимо плоского эпителия в мазке будут выявлены ключевые клетки. Поскольку вагинит – это заболевание воспалительного плана повышенным окажется и количество лейкоцитов.
д.). Если причиной болезни стали гарднереллы, помимо плоского эпителия в мазке будут выявлены ключевые клетки. Поскольку вагинит – это заболевание воспалительного плана повышенным окажется и количество лейкоцитов.
- Цервицит (воспаление с локализацией в цервикальном канале шейки матки),
Это воспалительное заболевание может протекать явно или в скрытой форме, поэтому обнаружить повышенный поверхностный плоский эпителий в мазке врач может случайно, во время планового профосмотра. Если патология протекает в острой форме, то женщина будет указывать на такие симптомы:
- довольно обильные слизистые или гнойные выделения из влагалища (их характер опять же зависит от возбудителя болезни, которыми могут быть как бактерии или вирусы, так и грибки, например, актиномицеты),
- тупые боли в низу живота, которые не являются постоянными.
Осмотр на гинекологическом кресле покажет покраснение и отек тканей около входа в цервикальный канал. Если причиной болезни стали гоноккоки воспалительный процесс и его симптомы будут особенно выраженными, в то время как хламидии провоцируют вялотекущее воспаление с менее заметными симптомами.
Трихомонады сильно повреждают слизистую оболочку, в результате чего на ней появляются микроскопические кровоизлияния. Они также способствуют появлению в мазках видоизмененных клеток. Поэтому когда в мазке обнаруживается плоский эпителий без атипии трихомонадную инфекцию можно исключить. Но нужно помнить, что важно опять же не столько качество эпителиальных клеток, сколько их количество, хотя наличие атипичных клеток может помочь врачу-диагносту заподозрить трихомонад в развитии заболевание, что впоследствии должен будет подтвердить бактериальный анализ.
Но если неизмененный плоский эпителий в мазке и то вызывает настороженность, появись он в превышающих норму количествах, то что уж говорить о клетках, имеющих нетипичное строение. Наличие атипичных клеток не обязательно свидетельствует о трихомонадной инфекции, но это не повод расслабляться. Ведь видоизмененные клетки эпителия могут также свидетельствовать о развитии онкологического процесса, поэтому требуется более детальное их изучение. Если выявлены атипичные цилиндрические клетки эпителия, то речь может идти о раке шейки матки.
Если выявлены атипичные цилиндрические клетки эпителия, то речь может идти о раке шейки матки.
При вирусной природе цервицита обычно прежде всего подозревают вирус герпеса или палилломы человека. Герпевирус делает поверхность шейки матки ярко-красной и рыхлой на вид, на ней могут появляться прозрачные пузырьки, которые, лопаясь, оставляют после себя небольшие красные ранки (язвочки). При папилломатозе на тканях шейки матки также можно заметить изъязвления, а иногда на ней образуются патологические наросты (кондиломы).
Если причиной воспаления тканей шейки матки стали лучистые грибки (актиномицеты), на месте поражения обнаруживается желтоватый зернистый налет, а грибки Кандида оставляют после себя белую массу, напоминающую творог (зернистая и с кисловатым запахом), которая очень легко удаляется с покрасневшей поверхности.
Сходный налет наблюдается при лейкоплакии (гиперкератоз) – заболевании, при котором происходит ороговение слизистой оболочки (в норме процессы ороговения слизистой не свойственны). Но в этом случае, в отличие от грибковой инфекции, беловатый или сероватый налет (он может образовываться и на шейке матки, и на слизистой влагалища) снимается с трудом, а в мазке обнаруживаются чешуйки плоского эпителия, представляющие собой цитоплазму клетки без ядра.
Но в этом случае, в отличие от грибковой инфекции, беловатый или сероватый налет (он может образовываться и на шейке матки, и на слизистой влагалища) снимается с трудом, а в мазке обнаруживаются чешуйки плоского эпителия, представляющие собой цитоплазму клетки без ядра.
Кстати, иногда в мазке врачи обнаруживают не отдельные клетки, а пласты плоского эпителия. Если это единичные образования, особо беспокоиться не стоит, ведь клетки эпителия матки и влагалища располагаются слоями, поэтому неудивительно, если от общей массы при обновлении клеток они отойдут целым участком. Но вот если таких пластов будет много, это может стать свидетельством диспластических процессов в матке (дисплазия, эрозия, эндометриоз, лейкоплакия шейки матки, предраковые состояния и рак шейки матки), поэтому обязательны дальнейшие исследования и консультация гинеколога, а возможно и онколога.
Острый цервицит характеризуется тем, что в мазке присутствует большое количество лейкоцитов (лейкоцитоз), появляются лимфоциты и гистиоциты, обнаруживаются цилиндрический и плоский эпителий. При этом клетки цилиндрического эпителия (базального слоя) имеют увеличенное ядро, а плоский эпителий поверхностного слоя в мазке имеет дистрофические изменения (например, появляются чешуйки, не содержащие ядер).
При этом клетки цилиндрического эпителия (базального слоя) имеют увеличенное ядро, а плоский эпителий поверхностного слоя в мазке имеет дистрофические изменения (например, появляются чешуйки, не содержащие ядер).
Если болезнь протекает в вялой форме длительное время, в мазках в большом количестве будут выявлены клетки цилиндрического эпителия, имеющие разные размеры и признаки разрушения клеточных структур.
- уретрит (воспалительный процесс в тканях мочеиспускательного канала – уретры, который может быть диагностирован у пациентов обоих полов).
Уретрит – это заболевание, которое может иметь различную природу. Инфекционная форма болезни представляет собой воспаление стенок уретры, вызванное бактериями. О неспецифическом уретрите говорят, если болезнь спровоцирована размножением условно-патогенной микрофлоры. Речь идет о стафилококках, стрептококках, кишечной палочке и прочих представителях этой группы.
Специфический уретрит – заболевание, вызванное бактериями, которые передаются половым путем (гонококки, трихомонады, хламидии, микоплазма, гарднереллы и т.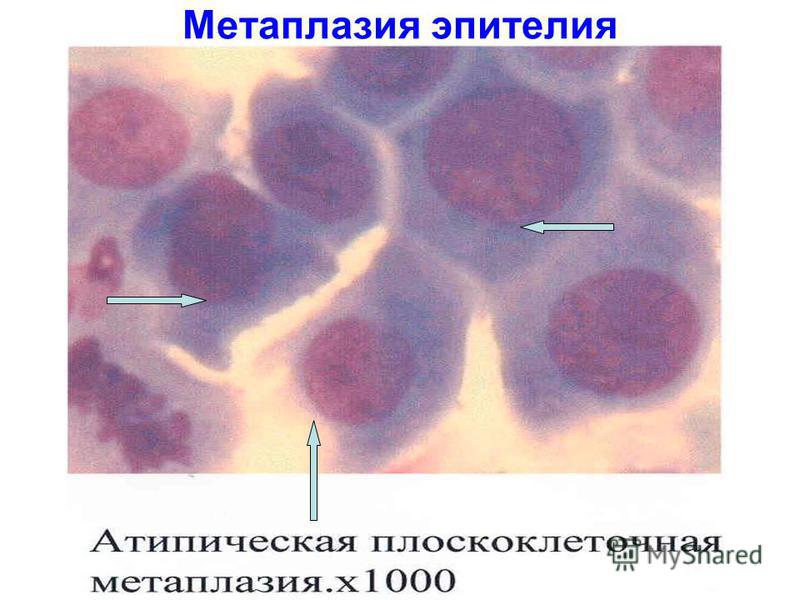 д.), или грибками из рода Кандида. Иногда причиной воспаления внутренних тканей мочеиспускательного канала становятся вирусы герпеса и папилломы человека (вирусный уретрит).
д.), или грибками из рода Кандида. Иногда причиной воспаления внутренних тканей мочеиспускательного канала становятся вирусы герпеса и папилломы человека (вирусный уретрит).
Неинфекционная форма уретрита обычно является осложнением уже имеющихся заболеваний: цистит, мочекаменная болезнь, опухоли по ходу мочеиспускательного канала, травмы (часто такое случается при постановке катетера, при проведении цистоскопии и т.д.), застойные процессы в кровеносных сосудах тазовой области, болезни аллергического или гинекологического плана. Неинфекционный уретрит может быть спровоцирован даже первым сексуальным опытом.
Хронический уретрит в 50% случаев протекает без появления каких либо беспокоящих женщину симптомов, и выявить его можно лишь при помощи мазка, взятого из уретры. Чаще всего уретрит у женщин протекает на фоне цистита, по поводу которого они и обращаются к врачу. Зачастую цистит как раз и становится осложнением уретрита, протекающего в затяжной форме, особенно если речь идет об инфекционном характере патологии.
Для острого уретрита характерны:
- дискомфорт при осуществлении акта мочеиспускания (женщина может испытывать зуд, жжение, чувство сжимания или стягивания тканей урерального канала),
- нерегулярные ноющие боли в самом низу живота,
- выделения из мочеиспускательного канала (не влагалищные!), которые в зависимости от возбудителя болезни могут иметь различный характер (слизистые или гнойные, из-за чего в утреннее время возникает неприятное ощущение, будто ткани уретры слиплись),
- появление в моче частиц крови, как следствие сильного раздражения и изъязвления воспаленных тканей,
Особенностью уретрита является и то, что пациент не испытывает симптомов общего недомогания. Присутствуют в основном местные симптомы. А выявить болезнь можно случайно, обнаружив плоский эпителий в моче, где его по идее не должно быть либо может наблюдаться незначительное количество отделившихся эпителиальных клеток, ранее выстилавших органы мочевыделительной системы (не более 3-4 единиц).
Плоский эпителий в моче довольно часто обнаруживается при беременности, когда организм женщины, и особенно мочевыделительная система, испытывает чрезмерные нагрузки. Появление большого количества отделившихся эпителиоцитов говорит в первую очередь о воспалительном процессе, протекающем в настоящем или прошедшем времени.
Если исключить гинекологические проблемы (а близость уретры и влагалища приводят к тому, что секрет обоих органов может смешиваться, поэтому очень важно правильно подготавливаться к анализу мочи и мазкам), причиной увеличенного количества эпителиальных клеток в моче могут стать:
- цистит (воспаление стенок мочевого пузыря, который также внутри имеет поверхностный слой из эпителиальных клеток, который в результате воспалительных процессов может слущиваться со стенок органа),
- уретрит (воспаление слизистой уретры, о котором мы уже писали),
- нефропатия беременных — проявление позднего токсикоза с повышением артериального давления, отечным синдромом и появлением в моче белка, эпителиальных клеток различных слоев почек, эритроцитов и т.
 д.
д.
Как при беременности, так и в иное время появление в моче несвойственных ей компонентов могут провоцировать нефропатии, вызванные некорректной работой иммунной системы, приемом лекарственных средств, некоторых заболеваний эндокринной природы (например, сахарный диабет) и т.д., при которых в моче обнаруживается большое количество плоского эпителия.
Нужно сказать, что по причине воспалительных процессов в почках и мочевом пузыре, плоский эпителий в моче может обнаруживаться не только у женщин, но и у мужчин. Понятно, что в мазках из уретры врач опять же может обнаружить такие клетки.
[9], [10], [11], [12], [13], [14], [15], [16]
Плоский эпителий в мазке у мужчин
У мужчин, обращающихся к урологу обычно по поводу различных выделений из полового члена, а также таких неприятных симптомов как зуд, жжение и воспаление тканей в области мочеиспускательного канала, мазок на микрофлору берется из уретры. В слизистом, беловатом или гнойном выделяемом помимо бактерий, вирусов, грибков и других микроорганизмов можно обнаружить также слущившиеся клетки плоского и цилиндрического эпителия.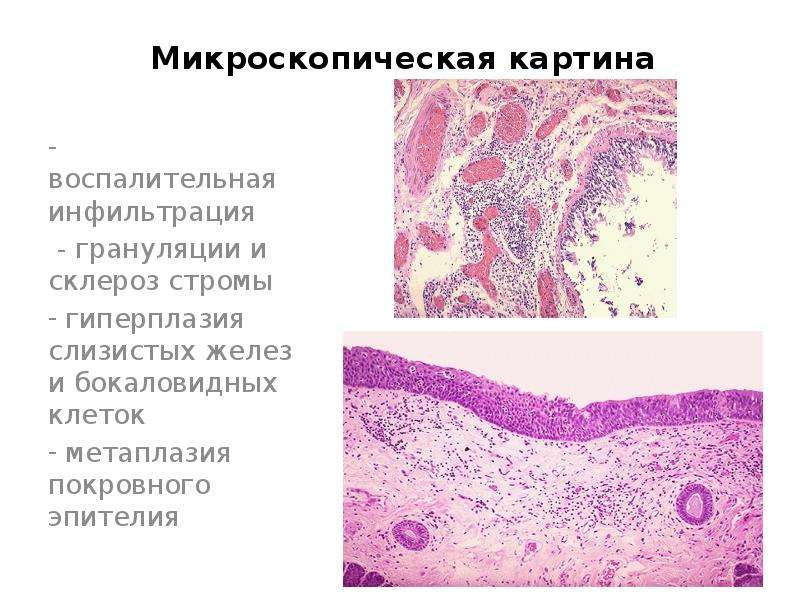 Слизистая уретры имеет немного иную конструкцию, поэтому небольшое количество базальных клеток не является патологией.
Слизистая уретры имеет немного иную конструкцию, поэтому небольшое количество базальных клеток не является патологией.
Если же количество эпителиальных клеток в мазке выше нормы, речь идет о разрушении тканей. Так большое количество плоского эпителия, как и в случае с женщинами, чаще всего говорит о воспалительном процессе в мочеполовой системе. При этом нужно брать в учет не только органы мочевыделения (почки, мочевой пузырь, уретра).
Воспалительный процесс может также локализоваться в семенных мешочках (воспаление яичка или орхит) или предстательной железе (воспаление простаты или простатит), которые относят к половым органам. А поскольку органы мочевыделительной и половой систем имеют общий выход (мочеиспускательный канал или уретра), то причин выделений из полового члена у мужчин может быть больше, чем у женщин, у которых выходы хоть и расположены поблизости, но все же разделены, что облегчает диагностику при правильном взятии мазка.
Если речь идет о воспалительном процессе, в мазках обязательно будет отмечаться также повышение уровня лейкоцитов (более 5 единиц в поле зрения), которые выбрасываются иммунной системой на борьбу с инфекцией.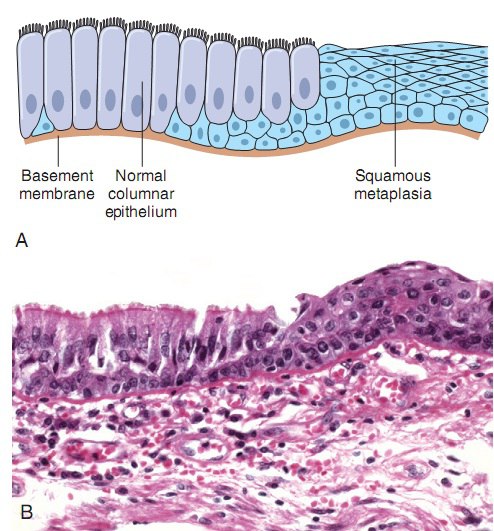 Бактериологические исследования при этом выявляют также возбудителей болезни, что еще раз говорит о том, что появление плоского эпителия в мазке не случайно.
Бактериологические исследования при этом выявляют также возбудителей болезни, что еще раз говорит о том, что появление плоского эпителия в мазке не случайно.
Если же в мазках не обнаружено ни инфекции, ни лейкоцитов, значит, речь идет о гиперкератических процессах (лейкоплакии и т.д.), которые могут локализоваться на различных участках слизистой по всему организму. Но нужно понимать, что количество плоского эпителия может немного возрастать по сравнению с нормой по мере старения организма человека. Пусть у мужчин этот процесс выражен не так явно, но все же некоторые изменения в анализах мазков, не связанные с заболеваниями мочеполовой сферы, врачи все же отмечают.
И у женщин, и у мужчин увеличение количества эпителиальных клеток в мазке может оказаться временно повышен в связи с применением местных средств. В этом случае ситуацию можно рассматривать как необычное проявление аллергической реакции на лекарство. По аналогии, на коже может появляться зуд, покраснение и шелушение, которое также объясняется отторжением поверхностных эпителиальных клеток.
Что касается пониженного количества эпителиальных клеток в мазке, то для женщин молодого возраста это считается тревожным симптомом. При наступлении климакса к уменьшению таких клеток в анализах приводит снижение выработки женского гормона эстрогена, что считается физиологически обусловленным возрастным процессом. Нарушение гормонального баланса в сторону снижения выработки эстрогенов у молодых женщин до наступления менопаузы чревато большими неприятностями в виде нарушения внутренней среды влагалища и активизации болезнетворной микрофлоры.
При дефиците эстрогенов происходит постепенная атрофия клеток влагалища, которая проявляется в отсутствии естественных овуляционных выделений, сухости влагалища во время полового акта, небольших вагинальных мажущих кровотечений, появлении жжения и зуда во влагалище, частых позывах к мочеиспусканию. Все это довольно опасные симптомы, которые могут иметь печальные последствия и стать причиной бесплодия женщины детородного возраста. Поэтому оставлять такие симптомы без внимания нежелательно.
Последствия и осложнения
В мазке на микрофлору можно обнаружить различные виды эпителия: плоский поверхностный, переходный, цилиндрический, который выстилает цервикальный канал и периодически вытесняется клетками плоского эпителия. В том, что эти клетки присутствуют в биологическом материале, нет ничего патологического. Это результат физиологических процессов, происходящих в организме. У женщин таких клеток может быть меньше, у женщин больше, но это также обусловлено лишь строением их половых органов. И если количество клеток конкретного вида при изучении биоматериала под микроскопом не превышает 15 единиц в поле зрения, беспокоиться особо нечего.
А вот если показатели завышены или ниже нормы – это уже повод конкретно заняться своим здоровьем. Особенно если речь идет о женщинах репродуктивного возраста.
Повышенное количество в мазке плоского эпителия чаще всего говорит все же о воспалительных процессах в уретре или влагалище – органах, поверхность которых покрыта нежной слизистой оболочкой. А как мы знает, ни один воспалительный процесс, и тем более длительно протекающий не проходит бесследно. Своевременное лечение острого воспалительного процесса, на который может указывать большое число клеток отслоившегося плоского эпителия, помогает предупредить возможные осложнения.
А как мы знает, ни один воспалительный процесс, и тем более длительно протекающий не проходит бесследно. Своевременное лечение острого воспалительного процесса, на который может указывать большое число клеток отслоившегося плоского эпителия, помогает предупредить возможные осложнения.
Например, переход в хроническую форму вагинита, грозит в будущем воспалительными процессами наружных половых органов, эрозией шейки матки, воспалением эндометрия, которые в свою очередь могут со временем привести к диспластическим процессам (дисплазия тканей матки, эндометриоз, рак шейки матки). В детском возрасте вагинит чреват сращиванием малых и больших половых губ у девочек.
Воспалительный процесс может приводить к уплотнению тканей слизистой. В ней нарушаются обменные процессы, клеточное дыхание, ткани слизистой атрофируются. На слизистой могут появляться трещинки и эрозии, которые не только становятся препятствием для получения удовольствия во время полового контакта, но и становятся питательной средой для размножения инфекции.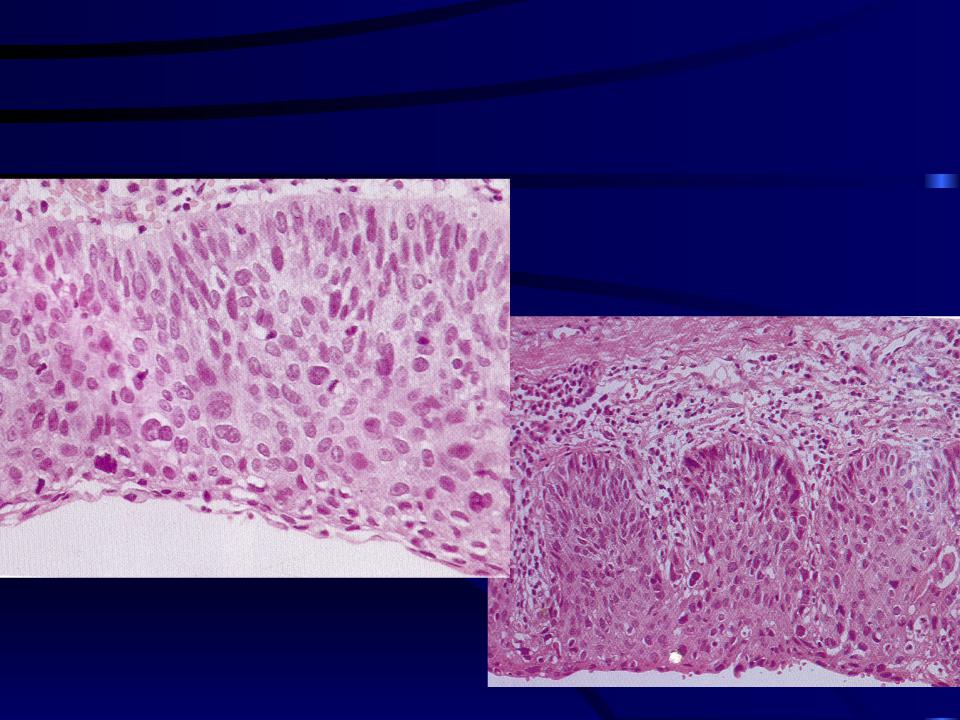 Если сам по себе вагинит не всегда вызван инфекцией, то появлением на слизистой различных повреждений будет провоцировать ее присоединение.
Если сам по себе вагинит не всегда вызван инфекцией, то появлением на слизистой различных повреждений будет провоцировать ее присоединение.
Инфекция, особенно бактериального характера, имеет свойства охватывать все большие площади, т.е. она будет продвигаться вверх, поражая органы мочевыделительной системы.
Идентичные последствия может иметь и хронический цервицит. Инфекция будет постепенно распространяться на другие органы, вызывая воспаление придатков, мочевого пузыря, брюшины. Его результатом может стать появление спаек на внутренних органах и развитие онкологических заболеваний (рак шейки матки на фоне воспаления развивается не так часто, но все же такая опасность существует). К тому же само по себе появление большого количества цилиндрических и плоских эпителиальных клеток в мазке может свидетельствовать о начальной стадии рака и без симптомов цервицита.
Уретрит у женщин, в подавляющем большинстве случаев вызванный инфекционным фактором, хотя повреждения уретры могут быть спровоцированы и мочекаменной болезнью, может вызывать нарушение микрофлоры влагалища, воспаление мочевого пузыря и даже почек, если инфекция поднимется к ним.
У мужчин несвоевременное или некачественное лечение уретрита (а те более его каких-либо лечебных мер) вызывает множество неприятных последствий, которые будут отражаться и на половой жизни:
- развитие простатита, и как следствие аденомы простаты,
- появление везикулита, орхита и колликулита (воспалительные процессы в семенных пузырьках, яичках или семенном бугорке),
- развитие баланопостита (воспаление полового члена в области крайней плоти) и т.д.
Длительно протекающее воспалением в уретре может приводить к появлению стриктур, т.е. к сужению мочеиспускательного канала, что создает проблемы с выведением мочи из организма и зачастую требует хирургического вмешательства.
У пациентов с воспалительными заболеваниями мочеполовой системы начинаются проблемы сексуального и психологического характера. Боли во время сексуального контакта становятся причиной отказа в половой близости, постоянной неудовлетворенности половых партнеров. Начинаются ссоры и скандалы в семье, что также можно считать отдаленным последствием беспечного отношения к появлению в мазке большого количества эпителиальных клеток.
Хотя не меньшие проблемы сексуального плана можно наблюдать и у женщин с недостаточным количеством эпителия в мазках, у которых недостаток смазки во влагалище приводит к появлению болей и раздражению слизистых во время полового акта.
Но патологии, при которых изменяется состав мазка, имеют и гораздо более неприятные последствия, если учесть, что они иногда становятся препятствием к зачатию ребенка. А бесплодие одного из супругов нередко приводит к распаду семьи.
Как видим, обнаружение в мазке клеток плоского эпителия в количествах, отличных от нормы, можно считать не только показателем патологических процессов в организме, но также возможностью своевременно начать эффективное лечение и предупредить развитие опасных осложнений.
[17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [27], [28]
Неопухолевые изменения клеток эпителия
Плоскоклеточная метаплазия
Процесс, который характеризуется нераковыми изменениями в эпителиальных клетках шейки матки. Плоскоклеточная метаплазия возникает в результате совокупности общих и местных факторов, которые негативно влияют на организм, вызывая обратимый процесс, в ходе которого дифференцированные эпителиальные клетки преобразуются в более выносливые клетки многослойного плоского эпителия, с ороговением или без. Плоскоклеточная метаплазия цервикального канала также возникает как результат слияния с находящимся рядом эндоцервиксом. Изменение типа клеток может приводить к снижению функции эпителия. Когда патологические раздражители устраняются, метапластические клетки приобретают свою первоначальную форму и функцию. Сохранение физиологических стрессоров в областях, подверженных метаплазии, может приводить к дисплазии или предраковым клеточным изменениям. Развитие метаплазированных клеток происходит под влиянием герпеса или бактериальных инфекций (хламидиоз, токсоплазмоз, уреаплазмоз), протекающих на фоне ослабленного иммунитета и имеющих хроническую форму.
Плоскоклеточная метаплазия возникает в результате совокупности общих и местных факторов, которые негативно влияют на организм, вызывая обратимый процесс, в ходе которого дифференцированные эпителиальные клетки преобразуются в более выносливые клетки многослойного плоского эпителия, с ороговением или без. Плоскоклеточная метаплазия цервикального канала также возникает как результат слияния с находящимся рядом эндоцервиксом. Изменение типа клеток может приводить к снижению функции эпителия. Когда патологические раздражители устраняются, метапластические клетки приобретают свою первоначальную форму и функцию. Сохранение физиологических стрессоров в областях, подверженных метаплазии, может приводить к дисплазии или предраковым клеточным изменениям. Развитие метаплазированных клеток происходит под влиянием герпеса или бактериальных инфекций (хламидиоз, токсоплазмоз, уреаплазмоз), протекающих на фоне ослабленного иммунитета и имеющих хроническую форму.
Кератоз
Представляет собой патологический процесс, который характеризуется пролиферацией и ороговением клеток плоского эпителия, выстилающего влагалищную часть шейки матки.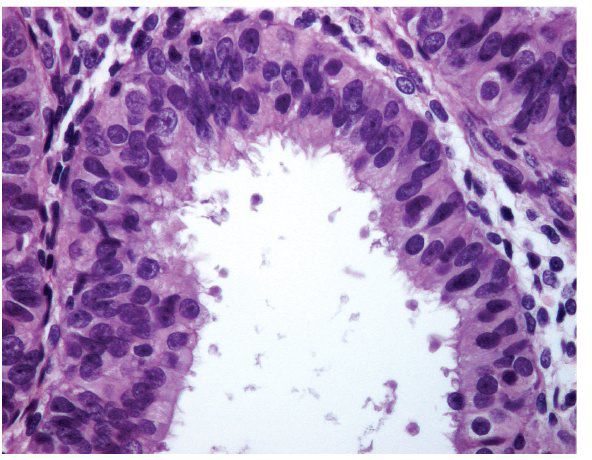 При этом образуются утолщения или бляшки белого цвета с четкими границами, выступающие над поверхностью слизистых оболочек и могут быть видимы невооруженным глазом до любой обработки растворами.
При этом образуются утолщения или бляшки белого цвета с четкими границами, выступающие над поверхностью слизистых оболочек и могут быть видимы невооруженным глазом до любой обработки растворами.
Гиперкератоз
Это усиленное ороговение верхнего слоя многослойного плоского эпителия шейки матки. Считается, что причиной может быть недостаток эстрогена в организме женщины. В процессе ороговения слизистая покрывается плотными белесоватыми структурами, слегка выступающими над поверхностью здоровой ткани.
Паракератоз
Нарушения Ороговения эпителиального слоя эпидермиса (неполное ороговение). Характеризуется ороговением слизистых оболочек, потерей эпидермисом способности синтезировать кератогиалин (предшественник кератина) и нарушением морфологии слизистой оболочки. При данном процессе пораженный участок цервикального канала выглядит сморщенным из-за нарушения эластичности ткани. Такие островки более грубые.
Опасность представляет лейкоплакия, возникшая в результате активизации вируса папилломы человека высокого канцерогенного риска.
Трубная метаплазия
Характеризуется наличием в строме шейки матки нормальных по строению желез, выстланных клетками, напоминающими эпителий маточной трубы. Данная патология обычно представлена одиночной железой или группой желез и может быть реснитчатая либо секреторная. Трубная метаплазия часто встречается в неупорядоченном пролиферативном эндометрии
Атрофические изменения.
Атрофия матки и шейки в большинстве случаев диагностируется у женщин в климактерическом периоде. Результатом данной патологии становится регресс эпителиальной ткани. Однако женщины детородного возраста также не застрахованы от атрофии шейки матки. Заболевание может развиться при дефиците эстрогенов, после оперативных вмешательств на шейке матки, при системных патологиях соединительной ткани. Атрофия шейки матки – один из факторов, вызывающих женское бесплодие.
В основном атрофические изменения происходят в период менопаузы. Снижение выработки гормонов приводит к исчезновению слизистой секреции, изменению бактериальной флоры. В результате происходит поэтапное сокращение толщины эпителия, что приводит ткани к раздражениям, травмам.
В результате происходит поэтапное сокращение толщины эпителия, что приводит ткани к раздражениям, травмам.
Изменения при беременности
В течение беременности устанавливается типичная для данного процесса картина мазка. Эти изменения связаны с продукцией гормонов плацентой и могут быть неверно трактованы как предопухолевые или опухолевые. Реактивные изменения шейки матки связаны с нарушением клеток ее эпителия. Возникают при: воспалениях, гиперкератозе, паракератозе, дискератозе, плоскоклеточной метаплазии, железистой гиперплазии, полипах, лимфоцитарном (фолликулярном) цервиците.
Внутриэпителияальные изменения клеток и рекомендуемые алгоритмы ведения пациенток
ASC-US (ASC of undetermined significance) – клетки плоского эпителия с атипией неясного значения.*ASCCP, 2013
(Цитология жидкостная и традиционная при заболеваниях шейки матки. Цитологический атлас / Под ред. И.П.Шабаловой, К.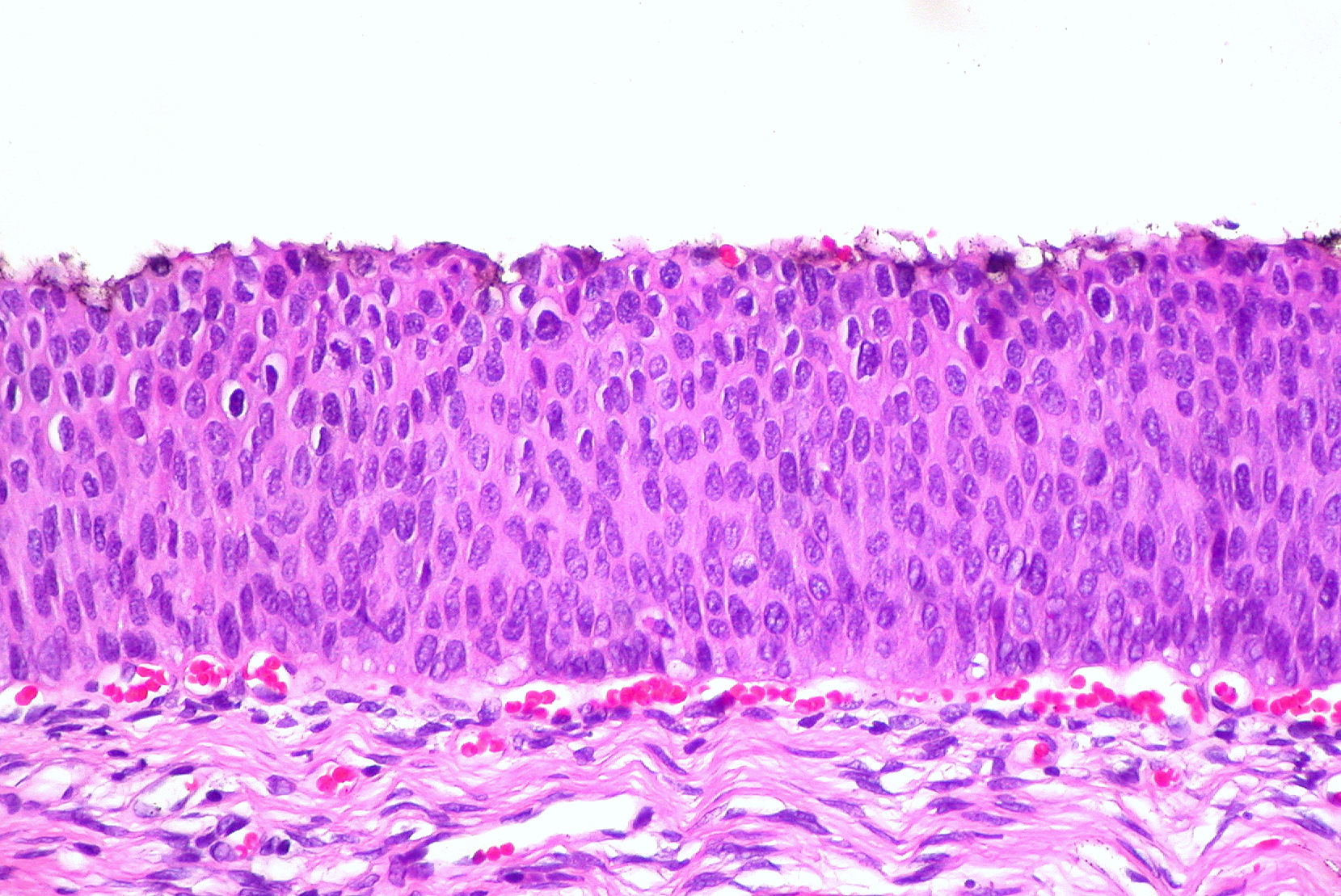 Т.Касоян. 4-е издание, исправленной и ополненное. М. –Тверь: ООО«Издательство «Триада»», 22016. – 320 с.: 1122 ил.)LSIL (Low-grade squamous intraepithelial lesion) внутриэпителиальное поражение клеток плоского эпителия низкой степени
Т.Касоян. 4-е издание, исправленной и ополненное. М. –Тверь: ООО«Издательство «Триада»», 22016. – 320 с.: 1122 ил.)LSIL (Low-grade squamous intraepithelial lesion) внутриэпителиальное поражение клеток плоского эпителия низкой степени
ASCCP, 2013ASC-H (ASC, cannot exclude high-grade squamous intraepithelial lesion) клетки плоского эпителия с атипией, не позволяющие исключить HSIL
(Цитология жидкостная и традиционная при заболеваниях шейки матки. Цитологический атлас / Под ред. И.П.Шабаловой, К.Т.Касоян. 4-е издание, исправленной и ополненное. М. –Тверь: ООО«Издательство «Триада»», 22016. – 320 с.: 1122 ил.)HSIL (High-grade squamous intraepithelial lesion) — внутриэпителиальное поражение клеток плоского эпителия высокой степени, включают CIN II и CIN III, рак in situ
(Цитология жидкостная и традиционная при заболеваниях шейки матки. Цитологический атлас / Под ред. И.П.Шабаловой, К.Т.Касоян. 4-е издание, исправленной и ополненное. М. –Тверь: ООО«Издательство «Триада»», 22016. – 320 с.: 1122 ил.)
М. –Тверь: ООО«Издательство «Триада»», 22016. – 320 с.: 1122 ил.)
Атипичные железистые клетки (AGC):
- эндоцервикальные
- эндометриальные
- неопределенные
Просмотреть(Цитология жидкостная и традиционная при заболеваниях шейки матки. Цитологический атлас / Под ред. И.П.Шабаловой, К.Т.Касоян. 4-е издание, исправленной и ополненное. М. –Тверь: ООО«Издательство «Триада»», 22016. – 320 с.: 1122 ил.)
Опасная дисплазия железистого эпителия шейки матки лечится только методом ФДТ
Афанасьев Максим Станиславович.
Д.м.н., профессор Сеченовского университета, онколог, хирург, онкогинеколог, гинеколог-иммунолог, эксперт по лечению дисплазии, предраковых и опухолевых заболеваний шейки матки.
Если говорить совсем коротко, то железистая дисплазия – это предраковое заболевание шейки матки. Из-за особенности своего расположения оно практически не поддается лечению классическими хирургическими методами. Фотодинамическая терапия в этом случае – пожалуй, единственный эффективный способ лечения, который защищает от рецидивов и раковой трансформации.
Фотодинамическая терапия в этом случае – пожалуй, единственный эффективный способ лечения, который защищает от рецидивов и раковой трансформации.
А теперь обо всем по порядку.
Чтобы лучше понять, что такое железистая дисплазия шейки матки, мы немного погрузимся в теорию и изучим строение шейки матки.
Строение шейки матки: эктоцервикс, эндоцервикс. зона трансформации.
Участок шейки матки, который погружен во влагалище (синий прямоугольник) называется эктоцервиксом. Он покрыт многослойным плоским эпителием.
Участок шейки матки от наружного зева по направлению к матке называется цервикальным каналом шейки матки (оранжевый прямоугольник). Он покрыт эндоцервиксом, или железистым (цилиндрическим) эпителием.
Цервикальный канал не ровный, а складчатый. На медицинском языке эти складки называются криптами. Железы цилиндрического эпителия секретирует слизь, которая составляет основной объём нормальных выделений.
Так выглядят крипты шейки матки. Всю поверхность крипты выстилает цилиндрический эпителий.
Зона, в которой многослойный плоский эпителий переходит в железистый эпителий называется переходной зоной, или зоной трансформации. Обычно дисплазия начинает свое развитие в зоне трансформации – в ней идет непрерывное клеточное деление, и вирусу папилломы легче всего проникнуть сквозь слабую защиту незрелых клеток в необходимые для его выживания базальные клетки.
Переходная зона или зона трансформации.
Дисплазия представляет собой скопление измененных вирусом клеток. Такие клетки называются атипическими, а само заболевание чаще всего относится к предраковым.
Что такое «дисплазия метаплазированного эпителия»?
Мы уже выяснили: зона, в которой сходится плоский и цилиндрический эпителий, называется зоной трансформации. Втрое ее название – переходная зона.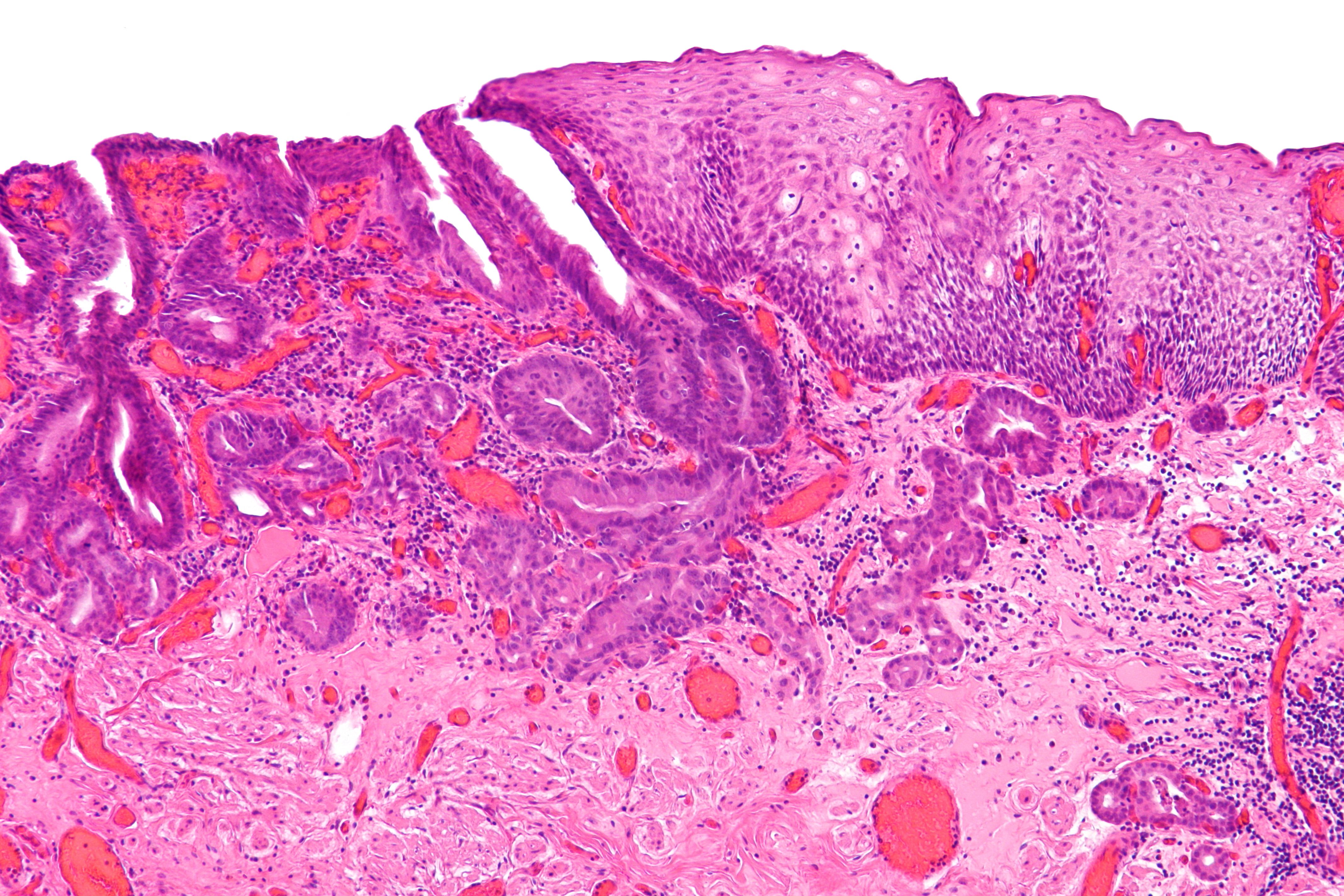
Но это только на схеме она представляет собой ровную линию. На самом деле, в этой зоне один эпителий заходит на другой, как морские волны на песчаный берег. Молодой плоский эпителий перекрывает молодой цилиндрический. Такой незрелый плоский эпителий и называется метаплазированным.
Незрелый метаплазированный эпителий.
Само словосочетание «метаплазированный эпителий» вызывает много вопросов. Не скрывается ли за этой формулировкой рак? – Нет, не скрывается.
Хуже, если в вашей цитологии ничего про метаплазированный эпителий не написано. Это значит, что он отсутствует в мазке, и анализ взят неправильно (помните, я писал о том, что правильная цитология начинается в кабинете врача, а не в лаборатории?).
А теперь давайте обратим внимание на то, что написано в заключении. Если в заключении написано «на фоне метаплазии очаги дисплазии», перед нами дисплазия переходного эпителия. Так как в зоне трансформации идет непрерывный процесс интенсивного деления клеток, незрелые клетки менее защищены от заражения, и вирусу папилломы (причина дисплазии) как раз в области метаплазированного эпителия легче проникнуть в глубокий базальный слой и встроиться в ДНК клетки.
Именно поэтому шейку матку так тщательно осматривают и берут с нее анализ на цитологию – дисплазия обычно начинается в переходной зоне.
А теперь поговорим о том, что означает диагноз «интраэпителиальная дисплазия железистого эпителия шейки матки».
Что такое дисплазия цервикального канала и чем она опасна
«Интраэпителиальная дисплазия железистого эпителия шейки матки» – это так называемый «цитологический» или «гистологический» диагноз. Такое заключение пишет специалист в лаборатории после изучения вашего цитологического мазка или биопсии.
Он видит в микроскоп, что в клетках железистого эпителия происходит предраковая трансформация клеток.
Формулируя таким образом свое заключение, врач-морфолог подчеркивает, что процесс происходит не в зоне трансформации, а В ЦЕРВИКАЛЬНОМ КАНАЛЕ ШЕЙКИ МАТКИ.
Поэтому заболевание еще называют «цервикальная дисплазия», или «дисплазия канала».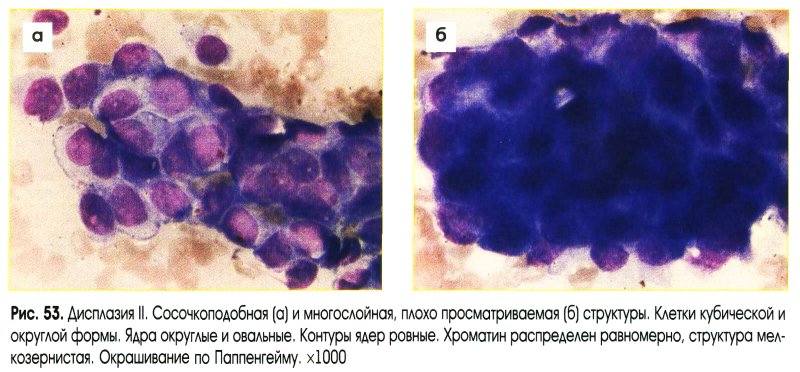
Такой диагноз говорит о том, что при лечении его классическими методами вероятность рецидива заболевания приближается к 80%.
Классический метод лечения дисплазии называется конизацией шейки матки. Это операция, в ходе которой хирург удаляет кусочек эктоцервикса и эндоцервикса в форме конуса. Задача хирурга – удалить участок вместе с дисплазией.
Низкая (слева) и высокая (справа) конизация шейки матки.
Но такой способ лечения для диагноза «дисплазии цилиндрического эпителия» изначально порочен.
Дело в том, что при работе с цервикальным каналом хирург действует фактически вслепую. Он не видит зоны поражения, не может оценить ее размера, глубины и по факту удаляет ткани «на ощупь». Практика показывает, что после такого лечения частота рецидива дисплазии приближается к 80%.
Фактически, когда врач-морфолог в заключении описывает наличие проблемы в области железистого эпителия, он таким образом подчеркивает сложный характер расположения дисплазии и бесперспективность хирургической тактики лечения.
Этим недостатки хирургического метода не ограничиваются.
Во-первых, радикальность и как следствие, эффективность конизации – всегда сомнительна. Объясню почему. Крипты эндоцервикса достигают глубины 5 мм. У всех разная физиология, и хирург никак не может проверить, убрал ли он достаточно цилиндрического эпителия.
У нерожавших женщин глубокое удаление тканей чревато развитием осложнений, которые могут препятствовать зачатию, вынашиванию и родам (на эту тему читайте мою статью «Беременность после конизации шейки матки»). Хирурги знают об этом, и стараются проводить операцию максимально щадящим образом.
Определение границ изменённого дисплазией эпителия носит всегда субъективный характер. А при проведении конизации глубина конуса определяется хирургом «на глазок», здесь доказательная медицина не подсказывает хирургу как действовать. Глубина обычно определяется длиной электрода – «паруса», а не тяжестью диспластического процесса.
Недостаточно радикальная конизация, как следствие, вызывает закономерный рецидив.
Во-вторых, любое лечебное воздействие само по себе является для вируса провоцирующим фактором.
После лечения вирус начинает вести себя более агрессивно и приводит к быстрому рецидиву, который развивается по негативному сценарию: дисплазия 2 степени переходит в 3, а дисплазия 3 степени и рака ин ситу могут трансформироваться в инвазивный рак шейки матки.
В-третьих, хирургия делает вирус резистентным (устойчивым) К ЛЮБОМУ лечению, даже к фотодинамической терапии. Увы, и я, и коллеги часто наблюдаем это в своей практике.
При таком развитии событий рано или поздно возникнет необходимость в удалении матки. Именно поэтому при диагнозе «дисплазия эндоцервикса» я настоятельно не рекомендую делать конизацию, так как она не устраняет причину болезни.
Как избежать рецидива?
Избежать рецидива можно единственным способом – устранить измененные клетки вместе с причиной заболевания – вирусом папилломы человека.
К сожалению, механическое удаление в процессе конизации атипических клеток не приводит к выздоровлению. ВПЧ остается в цервикальном канале. В теории, вместе с очагами дисплазии удаляются и все зараженные ВПЧ клетки. Но на практике так не происходит.
Единственный метод, который позволяет убрать из цервикального канала ВПЧ и атипичные клетки, – это правильно и в полном объеме выполненная фотодинамическая терапия с соблюдением протокола проведения.
Цервикальная дисплазия шейки матки хорошо лечится методом фотодинамической терапии
Я не буду рассказывать о самой: фотодинамической терапии – об этом очень хорошо рассказывает это видео:
Фундаментальные исследования доказали, что лазерный свет глубоко проникает в ткани и запускает фотохимические реакции на глубине минимум 7 мм. Крипты (складки) цервикального канала имеют максимальную глубину 5 мм, поэтому даже самые глубоко залегающие атипические клетки попадают под лечебное воздействие.
При соблюдении протокола проведения ФДТ в ходе фотохимических реакций образуются активные токсичные формы кислорода, которые увеличивают реальную глубину лечебного воздействия до 1,5 см! Соответственно, фотодинамическое воздействие в полной мере оказывает необходимый лечебный эффект, и даже с запасом.
Положительный терапевтический результат процедуры достигается только при неукоснительном соблюдении протокола ФДТ, который включает в себя обязательное облучение и зоны эктоцервикса, и цервикального канала специальным цилиндрическим диффузором.
Этот диффузор вводится в полость цервикального канала на всю его глубину, и по периметру облучает все поле железистого эпителия.
Только такой подход позволяет полностью уничтожить патологические клетки и содержащийся в них вирус папилломы человека (ВПЧ) на всех участках шейки матки и говорить о качественно выполненном лечении.
При такой адекватно проведённой ФДТ ВПЧ уничтожаются в 93% случаев.
Хочу отметить, что до сих пор даже очень уважаемые мои коллеги допускают ошибки в обучении специалистов-гинекологов и не показывают им необходимость облучения цервикального канала при лечении дисплазии шейки матки.
В этом случае ФДТ не оказывает нужного лечебного воздействия. Воздействие осуществляется только в области эктоцервикса, а вся полость цервикального канала шейки матки остается не задействованной в лечении. Такой «урезанный» протокол ФДТ зачастую приводит к тем же печальным последствиям, что и конизация.
Я горжусь, что могу менять медицинскую практику вокруг себя в лучшую сторону. Так, методическое пособие для врачей ГНЦ лазерной медицины МЗ РФ «Фотодинамическая терапия фоновых и предраковых заболеваний шейки матки» от 2004 года не включало в себя важный этап обработки цервикального канала.
После моего выступления на конференции StatusPraesens «Перинатальная медицина: от прегравидарной подготовки к здоровому материнству и детству», 18–20 февраля 2016 года, отель «Санкт-Петербург», методические рекомендации подверглись пересмотру и теперь включают в себя обработку цервикального при лечении дисплазии канала шейки матки как обязательный этап.
Многие теперь стали использовать диффузор для облучения цервикального канала. Однако даже после этой революции многие используют его, не понимая, какая интенсивность света выходит из этого диффузора. А это важный параметр, от которого зависит эффективность проведённой фотодинамической терапии.
Многие также используют диффузоры многократно, хотя уже после одного облучения мощность инструмента падает, и необходимое лечебное воздействие не достигается. Но никто об этом не задумывается!
Чтобы получить консультацию, показана ли вам фотодинамическая терапия, и рассчитать стоимость процедуры, высылайте свою историю болезни и анализы на e-mail [email protected]. Или звоните по бесплатному телефону 8-800-555-77-26.
Прием ведет Афанасьев Максим Станиславович, акушер-гинеколог, онкогинеколог, онколог, иммунолог, доктор медицинских наук, профессор и член ученого совета Первого МГМУ им. И.М. Сеченова МЗ РФ, эксперт по лечению дисплазии шейки матки.
Прием проводится в двух клиниках в Москве, а также в Санкт-Петербурге, Махачкале, Ставрополе, Барнауле, Воронеже, Самаре, Набережных Челнах, Саратове, Челябинске, Майкопе и других регионах России. Уточнить дату, место приема в вашем городе и записаться на консультацию вы можете у администратора по телефону 8-800-555-77-26.
После лечения я поддерживаю обратную связь со всеми пациентками и решаю все возникающие вопросы. Гепатит и положительный ВИЧ статус не является противопоказаниями для лечения методом ФДТ.
Обсуждение в настоящее время закрыто, но вы можете послать
с Вашего собственного сайта.
Клетки метаплазированного эпителия желудка
Взаимодействие неблагоприятных факторов, состоящих из сбоев в питании, злоупотребления алкоголем или лекарствами, вызывающие частые воспалительные процессы, со временем приводят к видоизменению слизистой оболочки желудка с постепенной утратой функции.
Патология носит название «метаплазия желудка». Основную группу пациентов с этим диагнозом составляют люди среднего и пожилого возраста.
В основе болезни лежит постепенная атрофия, затем гибель эпителия слизистой оболочки желудка и замещение клетками других органов пищеварения – тонкого или толстого кишечника. Вновь образованные участки ткани обладают свойствами тех органов, к которым они принадлежат. Желудок постепенно перестаёт выполнять свойственные ему функции.
При этом желудочный эпителий заменяется кишечным на отдельных участках некоторых желёз, групп, ямок или валиков.
Появление на участках метаплазии реснитчатых или панкреатических клеток сигнализирует о начале перехода доброкачественной стадии процесса в злокачественную форму.
Метаплазия – достаточно редкая, но опасная патология, не считается самостоятельным заболеванием. Возникает на фоне других длительных хронических процессов и без своевременного лечения возможны серьёзные осложнения и смертельные исходы. При правильном подходе к лечению и соблюдении рекомендаций возможно полное выздоровление.
Известно 2 типа желудочной метаплазии:
- Полная зрелая или тонкокишечная. Имеет доброкачественное течение.
- Неполная незрелая или толстокишечная. Опаснее предыдущей формы, часто переходит в злокачественную опухоль.
Но может быть и смешанная форма, когда в эпителии желудка обнаруживают клетки тонкого и толстого кишечника одновременно.
По размеру площади, занятой изменёнными клетками, метаплазию разделяют на несколько форм:
- слабую – изменёнными клетками занято 5 % площади слизистой оболочки желудка;
- умеренную – поражено 20 % поверхности;
- выраженную – поражено больше чем 20 % поверхности слизистой.
По степени атрофии желёз различают:
- незначительную степень – тип А;
- промежуточную степень – тип В;
- полная степень – тип С.
Также по характеру распространения выделяются:
- Очаговая метаплазия — характеризуется частичным, небольшим по площади, замещением клеток, чаще обнаруживается в пилорической и антральной зоне, на фоне воспалительных изменений слизистой оболочки и при нарушении процессов обновления клеток.
- Диффузная форма – кишечная метаплазия обнаруживается в пилорическом и антральном отделе, может продвигаться дальше, занимать обширную площадь и захватывать слизистую оболочку фундального отдела.
Полная тонкокишечная метаплазия
Зрелая форма метаплазии характеризуется тем, что в структуре слизистой оболочки желудка появляются все клетки, характерные для тонкого кишечника. Но самый достоверный признак – появление клеток Панета с характерной апикальной зернистостью. Обнаруживаются они в ямках вместе с бескаёмчатыми энтероцитами.
Слизистая желудка по структуре и функционально-морфологическим свойствам напоминает тонкий кишечник.
Полная, зрелая форма метаплазии обнаруживается намного чаще, чем неполная. Её считают переходной формой в незрелый толстокишечный тип. Но они могут совмещаться в пределах одной железы или обнаруживаются в разных железах.
Этот тип заболевания часто сопутствует хроническому гастриту.
Неполная толстокишечная метаплазия
При заболевании толстокишечной метаплазией для измененных участков характерно наличие клеток, в норме выстилающих внутреннюю поверхность толстого кишечника. При этой форме клетки Панета в желудке не обнаруживаются. При неполной толстокишечной метаплазии происходит нарушение созревания и дифференциации клеток, это признак предракового состояния.
При этой форме метаплазии слизистая желудка по строению и функциональным свойствам приобретает черты, свойственные толстому кишечнику.
Этот тип метаплазии считают более опасным и менее предсказуемым при прогнозировании исхода заболевания.
При доброкачественных заболеваниях признаки толстокишечной метаплазии находятся у 11 % больных, при раке желудка — у 94 %.
Причины
Причины, вызывающие кишечную метаплазию слизистой поверхности в желудке, изучены не полностью и однозначного ответа нет. Но установлены провоцирующие факторы, сочетание которых или длительное воздействие одного из них может дать толчок к развитию заболевания. Среди общих неблагоприятных факторов негативно влияют длительные отрицательные психоэмоциональные нагрузки, стресс или депрессивные состояния.
Другие причины возникновения метаплазии:
- частые употребления в пищу алкоголя, острых, жирных, жареных блюд, вызывающих раздражение внутренней поверхности стенок желудка;
- хронические воспаления и изъязвления эпителия;
- забрасывание кишечного содержимого в полость желудка;
- понижение уровня кислотности желудочного сока;
- проникновение в желудок бактерии хеликобактер пилори.
Во время обследования у больных обнаруживается пониженная кислотность желудочного сока, в такой среде необходимая для нормальной функции желудка микрофлора гибнет. Бактерицидные свойства сока снижаются и создаются благоприятные условия для развития бактерий патогенной кишечной группы, в том числе и опасного микроба – хеликобактер пилори. Его жизнедеятельность сопровождается выделением ферментов, которые в результате сложных химических преобразований, образуют нитросоединения с канцерогенными свойствами.
Нитросоединения в совокупности с другими канцерогенами, поступающими с пищей, разрушают слизистую желудка, способствуя возникновению метаплазии и создавая предпосылки для развития раковой опухоли.
Симптомы
Характерных признаков, указывающих на метаплазию, нет. Жалобы предъявляются в соответствии с причинными факторами, вызвавшими заболевание.
При гастрите с повышенной кислотностью больной чувствует:
- частое жжение в эпигастрии;
- голодные боли;
- голод во время ночного сна.
Основные жалобы при рефлюксной болезни с частыми забросами в желудок желчи:
- на разлитые боли;
- горечь во рту;
- рвоту.
Диагностика обнаруживает дисбаланс моторики антральной зоны желудка и обратную перистальтику.
Гистология укажет на очаговую метаплазию антрального отдела органа.
Если процесс провоцирует язвенная болезнь:
- интенсивные, локальные боли;
- голодные боли, утихающие после приёма пищи.
Регулярные периоды весеннее-осенних обострений.
Эндоскопия показывает характерные для язвы изменения на слизистой – эрозии, рубцы.
Хелибактериоз имеет симптоматику, подобную хроническому гастриту. Подтверждает диагноз исследование биоматериала, взятого со слизистой, в котором обнаруживаются продукты жизнедеятельности микроорганизма и респираторный тест, то есть исследование выдыхаемого больным воздуха, анализ кала.
Общая симптоматика, присущая всем больным метаплазией:
- отрыжка с горьким или кислым привкусом;
- появление периодической болезненности в верхней части живота;
- частые приступы тошноты, иногда рвота;
- снижение аппетита.
Диагностика
Стадию, локализацию, степень, форму и вид патологии можно определить только при инструментальном обследовании.
Самый достоверный способ обследования, позволяющий точно выявить метаплазию желудка — фиброгастродуоденоскопия. Прибор имеет встроенную подсветку и видеокамеру, с его помощью можно детально осмотреть внутреннюю поверхность стенок пищевода, желудка и 12-перстной кишки, одновременно взять на гистологическое исследование небольшую часть слизистой оболочки органов и в лабораторных условиях выявить изменение тканей на клеточном уровне.
Для более точной диагностики пользуются методом хромогастроскопии. В этом случае через гастроскоп на слизистую желудка подаётся краситель – метиленовая синь. Если имеются кишечные клетки, они абсорбируют краситель и приобретают синее окрашивание, которое хорошо видно на экране и даёт возможность прицельно взять материал на биопсию.
Лечение
Терапия включает медикаментозное и хирургическое лечение, диету, средства народной медицины.
Схему лечения разрабатывает врач, учитывая клиническую картину, полученные результаты диагностики, индивидуальные особенности организма больного и его возраст.
Медикаментозное лечение
Обычно врачи назначают:
- антибиотики для уничтожения патогенной микрофлоры;
- одновременно назначаются пробиотики для восстановления нормальной бактериальной флоры желудка – Линекс, Бифиформ;
- при повышенной кислотности желудочного сока – Омепразол;
- при изжоге – Фосфалюгель, Маалокс;
- для снижения секреторной активности – Ранитидин;
- гастропротекторы – для защиты слизистой от разрушения.
Если при повторных обследованиях положительной динамики не наблюдается, рекомендуется оперативное вмешательство.
Хирургическое лечение
Полостная операция – используется при обширных поражениях. При этом полностью удаляются пораженные метаплазией участки желудка.
Лапароскопия – щадящий метод. На практике используется чаще.
Диета
Залогом успеха лечения является соблюдение диеты. Питание должно быть дробным. Идеально, если пища свежая и приготовлена на домашней кухне из доброкачественных продуктов. Из рациона стоит исключить все фастфуды и полуфабрикаты. Пища подаётся тёплой, горячие и холодные блюда запрещены.
Должно быть исключено или ограничено:
- все жареные, жирные, солёные, копчёные, маринованные, перчёные, пряные продукты и блюда из них;
- из напитков требуется полный отказ от алкоголя, газировки, крепкого чёрного чая и кофе, магазинных соков;
- запрещается курение – дым табака, попадая в желудок, действует раздражающе на слизистую.
Разрешённые продукты:
- приготовленные отварным, паровым или методом запекания диетические сорта мяса (филе кур, индейка, крольчатина) или рыба — можно употреблять как самостоятельные блюда или вместе с бульоном;
- каши из любых круп;
- орехи, зелень, фрукты, овощи в свежем и термически обработанном виде;
- минеральная вода, зелёный чай, кисель, компот, отвары.
Ежедневное меню должно составляться в соответствии с рекомендациями врача. После употребления продуктов и напитков пациент должен анализировать свои внутренние чувства и отдавать предпочтение тем из них, которые не вызывают неприятных ощущений.
Народная медицина
Среди средств народной медицины имеются проверенные временем рецепты, которые эффективны при гастритах, язвенной болезни и других патологиях:
- Настоянные в течение получаса в кипятке (1 чайная ложка на 200 мл воды) травы – тысячелистник, ромашка, зверобой. Принимать по 30 мл за полчаса до приёма пищи. Заваривать травы можно по отдельности или смешать их и сделать сбор.
- Если нет противопоказаний к применению мёда, можно приготовить смесь из мёда и листьев алоэ. Для этого срезанные листья алоэ выдерживаются в холодильнике, затем с них убирают колючки и измельчают блендером или на мясорубке, соединяют в равных пропорциях с мёдом. Смесь выдерживают в прохладном тёмном месте 2 недели, затем принимают натощак по столовой ложке.
- Вместо отваров можно использовать спиртовые настойки трав или прополиса. Их дозируют в каплях, разводят в воде.
Нужно знать, что лечение травами и другими народными средствами должно проводиться тоже после консультации с врачом. Отсутствие знаний об их действии может усугубить ситуацию, например, усилить секрецию соляной кислоты, когда она и так высока или повысить/понизить давление.
Меры профилактики
В основе профилактических мер лежат постоянные медицинские обследования, не реже одного раза в год. Людям пожилого возраста рекомендуется делать это каждые полгода.
Следует обращать внимание на свои внутренние ощущения и если со стороны желудка есть неприятные сигналы — не ждать, когда само пройдёт, а обращаться к врачу.
Очень важна и личная гигиена.
Заключение
Метаплазия желудка – длительно текущее, вялое заболевание. Симптоматика не имеет определённых симптомов и часто маскируется под другие патологии ЖКТ. Кроме того, что болезнь нарушает процесс пищеварения, она опасна переходом в злокачественную стадию. Ранняя диагностика и своевременное лечение может полностью избавить от страданий и спасти жизнь.
Загрузка…
Плоскоклеточная метаплазия и врожденная зона трансформации
Плоскоклеточная метаплазия (сквамозная метаплазия) — нормальный физиологический процесс, при котором цилиндрический эпителий покрывается или замещается многослойным плоским эпителием. Обычно он происходит в зоне эктопии, однако может иметь место и в цервикальном канале, и на поверхности полипов. Течение и характер этого процесса зависят от ряда факторов, таких как гормональная стимуляция, рН влагалищной среды, инфекции и др.
Структура шейки матки (ШМ) при наличии зоны трансформации
Плоскоклеточная метаплазия начинается с появления под ЦЭ слоя субцилиндрических резервных клеток, способных к пролиферации и гиперплазии, которые в последние годы называют стволовыми. Происхождение этих клеток до сих пор неясно. Имеется версия о том, что метаплазия может возникнуть и в результате активности мононуклеарных клеток — производных стромы.
Формирование МПЭ происходит в результате роста и дифференцировки резервных клеток. Пролиферация последних сопровождается развитием незрелой, а в дальнейшем и зрелой плоскоклеточной метаплазии.
Метапластический эпителий (МЭ) гистологически представляет собой не полностью дифференцированный плоский эпителий разной степени зрелости, иногда располагающийся прямо на цилиндрическом эпителии, клетки которого постепенно дегенерируют.
Незрелая метаплазия
Клетки при незрелой плоскоклеточной метаплазии более мелкие, не содержат гликогена и в иммуногистохимическом отношении характеризуются особенностями эндоцервикального (наличие муцина) и плоского (кератины промежуточных филаментов) эпителия. На наружной поверхности незрелого метапластического эпителия иногда сохраняются клетки эндоцервикального типа.
Незрелая метаплазия. Окраска гематоксилином и эозином
Зрелая метаплазия
Дифференцировка клеток незрелой плоскоклеточной метаплазии приводит к появлению зрелого метапластического эпителия, мало отличающегося от клеток многослойного плоского эпителия.
Зрелая метаплазия. Окраска гематоксилином и эозином
Вместе с тем гистологи отмечают, что выделение слоев, свойственных многослойному плоскому эпителию, в участке плоскоклеточной метаплазии на экзоцервиксе нередко представляет определенные трудности. В отличие от многослойного плоского эпителия в участках зрелой плоскоклеточной метаплазии отсутствует полярность клеток, они содержат меньшее количество гликогена.
Промежуточные этапы метаплазии
Необходимо отметить, что между началом формирования зрелого многослойного плоского эпителия и завершением процесса плоскоклеточной метаплазии можно наблюдать множество различных морфологических картин. Поэтому не удивительно, что для названия различных этапов этого процесса предложено много наименований.
Наряду с термином «незрелая» и «зрелая» плоскоклеточная метаплазия используется термин «атипический метапластический эпителий» (плоскоклеточная метаплазия с атипией клеток), клеточные элементы которого характеризуются вариабельностью формы и величины ядер, содержанием в них хроматина, наличием ядрышек.
Интенсивная пролиферация резервных клеток, локализация последних в криптах эндоцервикального типа иногда может вызвать подозрение в отношении ранней стадии плоскоклеточной карциномы. Однако отсутствие полиморфизма, гиперхромных ядер клеток и единичные митозы позволяют исключить диагностику злокачественного поражения.
Процесс метаплазии может привести к возникновению эпителиев разных типов, в том числе атипического. Трактовка эпителия на различных этапах его формирования сложна и неоднозначна даже для гистологов. Тем более сложным представляется процесс идентификации такого эпителия кольпоскопически.
Метапластический эпителий — основной субстрат для кольпоскопического понятия «зона трансформации».
Кольпоскопическим проявлением нормальной метаплазии является нормальная зона трансформации (ЗТ). Метапластический эпителий разной степени зрелости перекрывает псевдожелезы, которые некоторое время остаются открытыми. Когда отверстие псевдожелезы оказывается закрытым, внутри нее начинает скапливаться секрет (закрытые железы). Со временем этот секрет растягивает железу, вызывая расширение сосудов и перифокальное воспаление, возникают наботовы, или, Другими словами, ретенционные кисты. Весь процесс стимулирует сосудистую пролиферацию. Метапластический эпителий представляет основной морфологический субстрат для зоны трансформации на ШМ. ЗТ в сочетании с эктопией встречается у многих молодых женщин репродуктивного возраста.
Как правило, ЗТ — физиологический доброкачественный процесс. Однако, по мнению ряда исследователей, МПЭ, сформированный после трансформации, по биологическим свойствам отличается от первичного МПЭ и в определенных условиях может служить почвой для развития злокачественного процесса. В любом случае ЗТ — это участок, уязвимый для любого внешнего влияния, особенно для ВПЧ, поэтому в 90% случаев именно в зоне трансформации, особенно при наличии незрелого эпителия, развивается цервикальная неоплазия. Незрелую метаплазию врач-кольпоскопист легко может принять за CIN. Полностью зрелый метапластический эпителий внешне практически неотличим от оригинального (естественного) многослойного плоского эпителия.
Врожденная зона трансформации (Congenital transformation zone)
Этот термин широко используется во всей иностранной литературе и мало применяется в РФ. Гистологически врожденная зона трансформации (ВЗТ) представляет собой зону, где эндоцервикальный эпителий подвергся метаплазии еще во внутриутробном периоде жизни и раннем периоде новорожденности, когда под влиянием материнских эстрогенов поддерживались процессы метаплазии. Возможно, определенную роль в формировании ВЗТ играет прием матерью гормональных средств, в частности диэтилстилбэстрола. Гистологические признаки ВЗТ следующие: тонкий плоский эпителий с нежными эпителиальными прорастаниями в строму, небольшое количество или полное отсутствие гликогена в эпителии, тонкий слой поверхностной кератинизации.
Гистологически во ВЗТ могут определяться утолщения стромальных папилл, подразделяющихся и ветвящихся внутри, поэтому кольпоскопически эти участки-поля могут проявляться в виде мозаики.
В слое кератинизированных клеток при гиперкератозе и паракератозе могут сохраняться ядра, хотя они становятся пикнотичными, могут давать картину лейкоплакии, с утолщенными участками. Подобные состояния обнаруживают у девственниц и даже новорожденных.
Граница, или стык, ВЗТ с нормальным МПЭ четкая, часто распространяется с экзоцервикса на своды влагалища. Отсутствие гликогена делает этот участок йоднегативным. В практике его принимают за лейкоплакию или CIN и нередко подвергают неоднократным аблациям, которые, надо отметить, бывают малоэффективными.
С.И. Роговская
Опубликовал Константин Моканов
Клетки метаплазированного эпителия
Клетки
незрелого метаплазированного эпителия
напоминают парабазальные, располагаются
преимущественно разрозненно, реже в
неплотных скоплениях (рис.18). Ядра
несколько гиперхромные, хроматин
распределен равномерно. Размер ядер
составляет более половины диаметра
клеток. Цитоплазма окрашена интенсивно.
По мере созревания клеток (созревающая
плоскоклеточная метаплазия) появляются
клетки с отростками цитоплазмы (клетки
– «паучки»). Иногда в цитоплазме
определяется зона просветления вокруг
ядра или вакуоли. Границы клеток четкие,
иногда ровные с одной из сторон.
| ||
Рис. | ||
По
мере созревания цитоплазма становится
все более светлой, иногда вакуолизированной.
Форма клеток приближается к овальной.
Отмечается деление цитоплазмы на более
светлую внутреннюю и более интенсивно
окрашенную наружную часть. Зрелые
метаплазированные клетки практически
неотличимы от естественного плоского
эпителия (рис.19)
| ||
Рис. | ||
Цитологическая
диагностика вируса папилломы человека
Инвазивный
рак матки до сих пор является вторым по
частоте злокачественным заболеванием
в мире: ежегодно регистрируется свыше
600 000 новых случаев. В России в настоящее
время ежегодная заболеваемость раком
шейки матки составляет 14.9 на 100 000 женщин
(1). Если рак шейки матки диагностируется
на начальной бессимптомной стадии, он
практически излечим хирургическими
или лучевыми методами. Крайне важно в
связи с этим раннее выявление предраковых
поражений при цитологическом скрининге.
Эпидемиологические
исследования показали, что наиболее
важными факторами риска рака шейки
матки являются раннее начало половой
жизни, число половых партнеров, курение.
В последнее время папилломавирусная
инфекция (Human papiloma
virus —
HPV) признается как фактор, способствующий
развитию рака шейки матки (2).
Вирус
HPV типа 16 и 18 считают канцерогенным для
человека, типа 31 и 33 — вероятно канцерогенным,
остальные типы — возможно канцерогенными,
в связи с чем некоторые исследователи
называют рак шейки матки заболеванием,
передающимся половым путем.
Классическим
проявлением инфекции являются кондиломы,
множественные папиллярные выросты,
основой которых является фиброзная
ткань, покрытая многослойным плоским
эпителием. Кондиломы могут быть
остроконечными, плоскими, гигантскими,
эндофитными (инвертирующими). Эквивалентами
кондилом на слизистых оболочках могут
быть различные плоские поражения:
патологическое ороговение, дисплазия,
внутриэпителиальный рак. Поражение
иногда протекает клинически латентно,
встречается бессимптомное носительство.
Характерным
цитологическим признаком папилломавирусного
поражения является так называемая
койлоцитарная атипия (рис. 1, 2).
Папилломавирусная инфекция может
сопровождаться паракератозом,
гиперкератозом. Встречаются двухъядерные,
иногда и многоядерные клетки. В некоторых
случаях при кондиломатозных поражениях
обнаруживают атипичные плоские клетки,
формирующие «жемчужины» с ороговением
в центре, напоминающие «жемчужины»
при раке.
Койлоциты
— клетки плоского эпителия неправильной
формы с четкими границами (рис. 1, 2).
Размер
их может быть разным: но обычно они
крупнее, чем клетки соответствующего
им слоя. Располагаются преимущественно
разрозненно или небольшими группами.
Цитоплазма обильная, характерно наличие
обширной околоядерной зоны просветления,
полости или нескольких полостей, четко
отграниченных от периферических отделов
цитоплазмы, которые окрашиваются более
равномерно и интенсивно.
Околоядерную
зону просветления обнаруживают не
только при папилломавирусной инфекции,
но и при других изменениях эпителия, в
частности, при плоскоклеточной метаплазии.
Для
койлоцитов, в отличие от других клеток
с околоядерной зоной просветления,
характерны изменения ядер: они увеличены
в разной степени, мембрана неровная
складчатая, отмечается гиперхромия,
хроматин часто смазанный. В части клеток
может отмечаться кариорексис. В
двухъядерных и многоядерных клетках,
в отличие от герпетической инфекции,
ядра нагромождаются друг на друга или
располагаются рядом, при этом сохраняется
их округлая форма.
Появление
околоядерной зоны просветления связано
с дегенеративными изменениями, некрозом
цитоплазмы, который начинается с ядра
и постепенно распространяется на
периферию.
Четкое
отграничение перинуклеарной зоны
связано с конденсацией по периферии
некроза фибрилл цитоплазмы. При
электронной микроскопии в койлоцитах
обнаруживают кристаллические стрелки
вирусных частиц, характерные для
семейства Паповавирусов, иногда
некристаллические скопления вокруг
хроматина или в цитоплазме. Вирусные
частицы обнаруживают преимущественно
в ядре, иногда в околоядерной зоне
просветления.
При
доброкачественных поражениях вирусные
частицы располагаются эписомально, при
раке — встроены в геном клеток.
Развитие
дисплазии и рака при папилломавирусной
инфекции является сложным процессом,
зависящим от множества случайных
биологических событий. В отдельных
случаях может появиться «злокачественный»
клон клеток, способный сохраниться и
привести к раку. К факторам, усиливающим
неоплстическую роль вируса папилломы,
относят множество инфекций, генетические
особенности и состояние иммунного
статуса. Женщин с признаками
папилломавирусной инфекции нужно
тщательно обследовать, при отсутствии
данных о злокачественном поражении
проводится динамическое наблюдение,
по показаниям больным выполняется
электрокоагуляция, криодеструкция или
лазерное удаление очага поражения и
тщательное наблюдение в течение
длительного времени.
Литература
В.
В. Двойрин, Е. М. Аксель, Н. Н. Трапезников
— Заболеваемость и смертность от
злокачественных новообразований
населения России и некоторых других
стран СНГ в 1993 г, Москва, 1995.Papillimaviruses
and human desease K.
Syrjanen, L. Gissmann, L. Ci.
Koss
(edit.) Springer-Verlag, Berlin, 1987Diagnostic Cyroparholugy,
под редакцией. W.Gray, 1995, 672
Оценка
качества мазка
Материал
полноценный – полноценным материалом
считается мазок хорошего качества,
содержащий клетки плоского эпителия,
клетки эндоцервикса и метаплазированные
клетки.
Материал
неполноценный – неполноценным считается
материал, по которому нельзя судить о
наличии или отсутствии патологических
изменений шейки матки. Причины получения
неполноценного материала различны,
желательно описать клеточный состав
мазка, и если это возможно, указать
причину, по которой материал признан
неполноценным.
Возможные
причины получения неполноценного
материала
Небрежность
при выполнении различных ступеней
приготовления мазкаШейка
плохо выведена в зеркалахНе
соблюдены условия получения материала
(рис.10)Недостаточное
усиление при надавливании на слизистую
оболочку при получении материалаМатериал
из зоны трансформации и цервикального
канала получен не со всей поверхностиМатериал
плохо распределен на стеклеСлишком
тонкий или слишком толстый мазокВысушивание
мазков, предназначенных для влажной
фиксации, до фиксацииПлохое
окрашивание мазковМазки
представлены преимущественно элементами
крови и\или воспаления (рис.11)Загрязнение
мазков спермицидными и антибактериальными
кремами, смазкой с презервативов, гелем
для ультразвукового исследованияМазки,
взятые во время менструации, представлены
большим числом клеток эндометрия,
крови.
|
Frontiers | Метапластические клетки Панета в нише слизистой оболочки вне кишечника указывают на связь с микробиомом и воспалением
Введение
Клетки Панета представляют собой группу зрелых эпителиальных клеток кишечника, присутствующих у людей и других млекопитающих. Они преимущественно локализуются в основании крипт Либеркюн в тонкой кишке. Эти клетки были впервые описаны Швальбе (1872 г.), а затем полностью охарактеризованы Йозефом Панетом (1888 г.). Нормальные клетки Панета дифференцируются от стволовых клеток кишечника и живут около 60 дней (Ireland et al., 2005). Клетки Панета можно найти в слепой кишке и восходящей ободочной кишке человека, но они крайне редко встречаются в дистальном отделе толстой кишки человека и отсутствуют в эпителии толстой кишки грызунов (Tanaka et al., 2001). При обычном гистологическом исследовании клетки Панета определяются как крупные столбчатые эпителиальные клетки с характерными эозинофильными секреторными гранулами, плотно упакованными в цитоплазму. Помимо секреции факторов роста (например, лигандов Wnt и EGF) (Clevers and Bevins, 2013) для поддержания ниши кишечных стволовых клеток (Clevers and Bevins, 2013), клетки Панета секретируют многочисленные антимикробные пептиды (например,g., α-дефенсины, лизоцим, Reg3A и др.) (Bevins and Salzman, 2011) для регулирования иммунного ответа слизистых оболочек.
Утрата или уменьшение клеток Панета обнаруживается при болезни Крона подвздошной кишки (Wehkamp et al., 2005; Perminow et al., 2010; Adolph et al., 2013), кишечной ишемии (Grootjans et al., 2011), некротическом энтероколите ( McElroy et al., 2013), патогенная бактериальная инфекция (Zhang et al., 2012; Conway et al., 2013; White et al., 2017) и болезнь трансплантат против хозяина (Fishbein et al., 2008; Levine et al. al., 2013; Kroemer et al., 2016). Напротив, аномальное появление клеток Панета в других частях желудочно-кишечного тракта и вне желудочно-кишечного тракта называется метаплазией клеток Панета (ПКМ). Обильное появление клеток Панета в дистальных отделах толстой кишки человека подробно описано в литературе, посвященной язвенному колиту (Tanaka et al., 2001; Bedini et al., 2014; Simmonds et al., 2014), болезни Крона (Tanaka et al. , 2001; Simmonds et al., 2014) и аденомы канальцев толстой кишки (Symonds, 1974; Wada et al., 2005; Ши, 2007; Wehkamp и Stange, 2010; Wang et al., 2011a; Mahon et al., 2016). Хотя эти изменения клеток Панета часто связаны с хроническим воспалением, молекулярный механизм и значение патологий, связанных с клетками Панета, плохо изучены.
Кишечная метаплазия (IM) представляет собой патологическое состояние желудочно-кишечного тракта и определяется как аномальное присутствие эпителиальных клеток кишечника в некишечных тканях. Хотя не все IM содержат клетки Панета, о метапластических клетках Панета широко сообщалось в пораженных верхних пищеварительных тканях, таких как пищевод Барретта (ПБ) (Chen et al., 2015), хронический гастрит (Montero, Loizaga, 1971; Lewin et al., 1976; Rubio et al., 1987; Deveci, Deveci, 2004; Shen et al., 2005) и железа Бруннера (Coutinho et al., 1996). Удивительно, но редкие метапластические клетки Панета даже наблюдались в других тканях желудочно-кишечного тракта и не желудочно-кишечного тракта (Symonds, 1974; Tanaka et al., 2001; Mitsuhashi et al., 2005; Puiman et al., 2011; Gassler, 2017). Помимо краткого обзора хорошо изученного PCM в левой толстой кишке, который представляет собой характерное изменение при идиопатическом воспалительном заболевании кишечника (IBD), в этом обзоре будет проанализирована литература о метапластических клетках Панета в тканях верхних отделов желудочно-кишечного тракта или не-желудочно-кишечного тракта, области исследования, которым уделялось мало внимания.Мы отметили потенциальную корреляцию между бактериальной активностью и этиологическим развитием метапластических клеток Панета в этих внекишечных нишах слизистой оболочки.
Релевантность метапластических клеток Панета в толстой кишке и их заболевание
Клетки Панета обычно присутствуют в проксимальных (правой и поперечной) ободочной кишке человека, но крайне редко встречаются в дистальной (левой) ободочной кишке. Обнаружение клеток Панета в левой ободочной кишке было названо PCM и задокументировано во многих исследованиях IBD (Lewin, 1969; Bansal et al., 1984; Аджиока и др., 2005; Simmonds et al., 2014). Кроме того, сообщалось о PCM при других состояниях воспаления толстой кишки, таких как дивертикулит (Sandow and Whitehead, 1979) и лучевой колит (Watanabe, 1978). Однако гистогенез PCM толстой кишки до конца не изучен. Метапластические клетки Панета в IBD толстой кишке обычно обнаруживаются в областях крипт и морфологически идентичны нормальным клеткам Панета, которые располагаются в тонком кишечнике (Cunliffe et al., 2001). Иммуно-гистохимические исследования показали, что метапластические клетки Панета в толстой кишке экспрессируют антимикробные пептиды: лизоцим (Klockars et al., 1977), sPLA2 (Haapamaki et al., 1997) и α-дефенсины (Cunliffe et al., 2001). Нормальная слизистая оболочка толстой кишки не экспрессирует человеческий альфа-дефенсин 5 (HD5; антимикробный белок, продуцируемый клетками Панета). Однако HD5 был обнаружен в криптах толстой кишки образцов пациентов с ВЗК, что согласуется с возникновением PCM (Cunliffe et al., 2001).
Сообщая о значительно более высоких частотах ПКМ в дистальном отделе толстой кишки у пациентов с ВЗК по сравнению с пациентами без ВЗК и контрольной группой, Tanaka et al. (2001) предложили ассоциацию клеток Панета толстой кишки с ВЗК.Регрессионный анализ показал, что восстановление и регенерация могут быть наиболее мощными стимулами, вызывающими ПКМ (Tanaka et al., 2001). Более того, клетки Панета могут улавливать комменсальную микробиоту (Vaishnava et al., 2008) и формировать микробиом (Salzman et al., 2010) для поддержания гомеостаза кишечника. Следовательно, присутствие PCM может быть адаптивной реакцией для защиты поврежденного эпителия толстой кишки от бактериальной инвазии. Кроме того, Wehkamp et al. (2007) предположили, что антибактериальные пептиды, продуцируемые клетками Панета, могут противодействовать бактериальной атаке как механизм «по требованию».
Об обнаружении клеток Панета в колоректальных аденомах сообщалось еще в 1967 году (Gibbs, 1967), и сообщаемые частоты такого обнаружения варьировались от 0,2 до 39% в различных исследованиях (Bansal et al., 1984; Wada et al., 1994. , 2005; Joo et al., 2009; Pai et al., 2013; Mahon et al., 2016). Кроме того, клетки Панета не только продуцируют антимикробные компоненты, но также составляют важную эпителиальную нишу для стволовых клеток тонкого кишечника, продуцируя фактор роста эпителия (EGF), трансформирующий фактор роста (TGF-α), Wnt3 и лиганды Notch (Sato et al., 2011). Пациенты с ВЗК имеют повышенный риск развития рака толстой кишки, связанного с воспалением. Кроме того, во время репарации и регенерации поврежденного эпителия у пациентов с ВЗК может быть повышенная вероятность накопления мутаций (модель циклического удара, описанная в последующих параграфах), а метапластические клетки Панета могут способствовать ускоренному эпителиальному онкогенезу, обеспечивая фактор роста стволовых клеток. в опухолевые клетки (Chen and Huang, 2014).
Метапластические клетки Панета в слизистой оболочке желудка и их значение для заболевания
Кишечная метаплазия в желудке человека была впервые описана Морсоном (1955) и позже признана предшественником рака желудка в различных исследованиях (Морсон, 1955; Ming et al., 1967; Мацукура и др., 1979; Сегура и Монтеро, 1983; Шимада и др., 1987). Кавачи и др. (1976) использовали метод Tes Tape для характеристики IM посредством визуализации дисахаридазы и классифицировали поражения на два типа. В IM типа I, также известном как полный IM, присутствовали бокаловидные клетки, клетки Панета, а также энтероцитарные ферменты, включая сахарозу, мальтазу, треалазу и щелочную фосфатазу. При типе II неполная форма IM, трегалаза, щелочная фосфатаза и клетки Панета отсутствовали. Таким образом, полная метаплазия частично напоминает эпителий тонкой кишки, содержащий клетки Панета, тогда как неполная метаплазия напоминает эпителий толстой кишки, в котором отсутствуют клетки Панета.В их исследовании из 96 образцов IM 57% показали IM типа I с присутствием клеток Панета, в то время как 43% были типом II без клеток Панета (Kawachi et al., 1976).
Используя различные процедуры окрашивания (таблица 1), Albedi et al. (1984) сообщили, что незрелые клетки Панета присутствовали в менее дифференцированном IM. Другие авторы также подтвердили наличие PCM путем иммуноокрашивания на PSTI (ингибитор панкреатического секреторного трипсина) (Kazal et al., 1948; Bohe et al., 1986, 1987), лизоцим (Heitz and Wegmann, 1980) и человеческий дефенсин 5 ( Шен и др., 2005). Кроме того, Панет-подобные клетки были обнаружены в аденомах и карциномах желудка (Heitz and Wegmann, 1980; Ito et al., 1986; Caruso et al., 1989; Rubio, 1989). Хотя некоторые из этих опухолей проявляли агрессивность (Ohtani and Sasano, 1988), прогностическое значение этих панет-подобных клеток для рака желудка остается неясным.
Таблица 1. Методы, использованные для идентификации метапластических клеток Панета.
Inada et al. (1997) далее классифицировали желудочный IM на основе статуса дифференциации на два основных класса (i) желудочный и кишечный (GI) смешанный тип; и (ii) исключительно кишечного (I) типа.Далее было установлено шесть подклассов для смешанного типа GI. В этом исследовании они наблюдали присутствие и отсутствие клеток Панета в IM почти с одинаковой частотой, то есть 15 и 17% соответственно в слизистой оболочке фундального отдела. Частота кишечных подтипов с клетками Панета составляла 17% в фундальной полости и 19% в слизистой оболочке привратника, соответственно. Частота подтипов GI (Su-Pa +), которые характеризуются наличием клеток Панета (Pa) и отсутствием поверхностных слизистых клеток (Su), составляла 11% в фундальной и 14% в слизистой оболочке привратника (Inada et al., 1997). Внутри этих метапластических повреждений присутствие клеток Панета вблизи пролиферативной зоны и больших внутриклеточных гранул указывает на то, что эти клетки не были ни главными клетками, ни клетками пилорических желез (Inada et al., 1997).
Мацубара выполнил морфологические характеристики клеток Панета и сообщил, что клетки Панета в нормальном эпителии тонкого кишечника содержат больше фаголизосом в нижних отделах цитоплазмы по сравнению с клетками Панета, обнаруженными в IM (Matsubara, 1977). Это была одна из самых ранних попыток отличить резидентные клетки кишечника от клеток.метапластические клетки Панета. Гасслер и др. (2002) позже сообщили, что экспрессия калнексина была обратно пропорциональна секреторному лизоциму в клетках Панета нормальной слизистой оболочки кишечника, но стала прямо коррелированной с лизоцимом в метапластических клетках Панета в слизистой оболочке желудка. Далее они идентифицировали экспрессию пролиферативного маркера Ki67 в метапластических клетках Панета, но не в клетках Панета нормального тонкого кишечника. Эти исследования показали, что метапластические клетки Панета могут вести себя иначе, чем нормальные клетки Панета (Gassler et al., 2002). Однако подробная информация на молекулярном уровне в настоящее время отсутствует, чтобы отличить нормальные клетки Панета от метапластических.
Большинство случаев рака желудка у человека возникает после длительной инфекции Helicobacter pylori в результате прогрессирования метапластических изменений, впервые названных Корреа (Correa, 1992; Correa and Shiao, 1994; Uemura et al., 2001) с первым увеличивающимся метапластическим изменением. риск прогрессирования рака — атрофический гастрит, включающий потерю секретирующих кислоту париетальных клеток с сопутствующей псевдопилорической метаплазией (также называемой SPEM, обсуждаемой ниже) оставшихся клеток.Некоторые авторы считают, что IM является обязательным этапом после атрофии (гипотеза Корреа), тогда как другие, такие как Дэвид Грэм (Graham et al., 2019), предполагают, что IM является скорее репаративным поражением, не напрямую связанным с канцерогенезом, а атрофия является более диагностическим фактор риска (El-Zimaity et al., 2002). При атрофии желудка, вызванной длительной колонизацией H. pylori , зрелые главные клетки, присутствующие в основании желез, заменяются (метапластическими) типами клеток, которые коэкспрессируют как главный клеточный маркер, так и маркеры нормальной слизи. секретирующие клетки, находящиеся в шейке железы, такие как Trefoil Factor 2, TFF2 (спазмолитический полипептид).Этот тип метаплазии также известен как метаплазия, экспрессирующая спазмолитический полипептид (SPEM) или псевдопилорическая метаплазия из-за отсутствия зрелых главных и париетальных клеток, напоминающих антральный или пилорический эпителий (Goldenring et al., 2011; Saenz and Mills, 2018). Во время SPEM дифференцированные клетки меняют свою судьбу на регенеративное состояние, сначала отключая передачу сигналов mTORC1, а затем экспрессию маркеров-предшественников для реактивации mTORC1. Этот процесс был назван палигенозом (Jin, Mills, 2018; Willet et al., 2018). В моделях мышей SPEM возникала в хронически воспаленном желудке и явно приводила к развитию рака желудка (Fox et al., 1996). Воспаление из-за инфекции или других инсультов увеличивает палигенотические события. Этот непрерывный процесс палигеноза увеличивает риск накопления мутаций, ведущих к появлению неопластического или диспластического клона. Это явление было названо «моделью циклических ударов» (Burclaff and Mills, 2018; Saenz and Mills, 2018; Jin and Mills, 2019). Хотя не существует исследования, которое бы точно изучало, как клетки Панета возникли в процессе метаплазии, недавнее исследование Leushacke et al.(2017) показали, что субпопуляция главных клеток LGR5 + коэкспрессирует кишечные стволовые клетки и маркеры Wnt в продвинутых опухолях кишечного типа в теле. Следовательно, метапластические клетки Панета могут быть частью программы IM, происхождение которой может быть связано с инфекцией и воспалением, но остается малоизученным.
Хотя значение метапластических клеток Панета в патогенезе слизистой оболочки желудка неясно, характерная продукция антимикробных пептидов клетками Панета предполагает, что метаплазия может быть адаптивной реакцией на бактериальную инфекцию.Клетки Панета секретируют дефенсины и лизоцим, которые, как было показано, снижают колонизацию H. pylori в желудке (Tanabe et al., 2008). Интересно, что области слизистой оболочки с IM или псевдопилорической метаплазией показали отсутствие H. pylori , предполагая, что присутствие клеток Панета в метапластической слизистой оболочке может быть адаптацией против бактериальной инфекции (Rubio, 2015). Атрофия желудка характеризуется потерей главных и париетальных клеток, и во время инфекции эта атрофия прогрессирует от антрального отдела до тела (Kimura et al., 1996; Shichijo et al., 2015). Поскольку инфекция H. pylori связана с IM и более высоким риском рака, были предприняты попытки уменьшить инфекцию (Fukase et al., 2008; Ogura et al., 2008; Sakitani et al., 2011; Shichijo et al. ., 2016). В некоторых исследованиях сообщалось, что IM не выглядело облегченным даже после ликвидации инфекции H. pylori , что свидетельствует о потенциально необратимом характере IM (Wang et al., 2011b; Kodama et al., 2012; Mera et al., 2018). Однако другие исследования показали, что искоренение H.pylori несколько снижал IM (Correa et al., 2000; Zullo et al., 2000; Kong et al., 2014). Кроме того, недавно было обнаружено, что антимикробные пептиды клеток Панета, особенно человеческий дефенсин 5 и 6, активируются в слизистой оболочке желудка у лиц, злоупотребляющих алкоголем (Ostaff et al., 2015). Таким образом, ИМ в слизистой оболочке желудка также может быть вызвано небактериальными факторами, такими как чрезмерное употребление алкоголя, ретроградный желчный рефлюкс, аспирин и противовоспалительные препараты (Webb et al., 1996; Bresalier, 1998). Однако эти изменения могут также косвенно повлиять на колонизацию желудка H.pylori или другие виды бактерий. Для выяснения этих причинно-следственных связей необходимы дополнительные исследования.
Метапластические клетки Панета в слизистой оболочке пищевода и актуальность заболевания
Присутствие клеток Панета в BE было впервые описано Schreiber et al. (1978), когда метапластические клетки Панета, подобные резидентным в кишечнике клеткам Панета, были обнаружены в образцах биопсии БЭ от 4 пациентов. БЭ характеризуется тем, что однослойный столбчатый эпителий заменяет естественный многослойный многослойный плоский эпителий дистального отдела пищевода.БЭ рассматривается как форма защитной адаптации от хронических инсультов, вторичных по отношению к гастроэзофагеальной рефлюксной болезни (Burgess et al., 1971; Naef et al., 1975; Ozzello et al., 1977), и предшественник большинства аденокарцином пищевода. Это заболевание пищевода патологически проявляется наличием множественных клонов эпителиальных клеток кишечника, включая клетки Панета и энтероэндокринные клетки, а также клетки желудка (Boulton et al., 2003).
Позже Томпсон и др. (1983) продемонстрировали присутствие клеток Панета в 50% образцов эзофагогастрэктомии с метаплазией Барретта и образцах с аденокарциномой в гастроэзофагеальном соединении.Никаких различий в соотношении полов или возрастном диапазоне не наблюдалось среди выборок, связанных с метаплазией или без нее. По сравнению с более ранними исследованиями с использованием образцов биопсии, в этом исследовании ошибка отбора образцов была минимизирована с помощью эзофагогастрэктомии. Более того, в этом исследовании использовались различные экспериментальные подходы, включая сканирующую электронную микроскопию, рентгенографию образцов и рассечение микроскопии, а также обычные гистохимические методы по сравнению с более ранними исследованиями, которые в основном полагались на гистологический анализ.
В последнее десятилетие иммуноокрашивание на различные антимикробные пептиды использовалось для идентификации клеток Панета. Шен и др. (2005) сообщили об иммуноокрашивании человеческого дефенсина 5 как инструменте для идентификации IM при БЭ, а также при желудочном IM. В нормальных условиях человеческий дефенсин 5 присутствует в клетках Панета кишечника и обычно ограничен эпителием тонкого кишечника. Однако экспрессия дефенсина 5 наблюдалась и в IM. Частота окрашивания человеческого дефенсина 5 была выше в желудочном IM по сравнению с BE.Это различие было связано с более высокой инфекцией H. pyloric в желудке по сравнению с пищеводом (Shen et al., 2005).
Rubio также сообщил о присутствии PCM в BE, обнаружив экспрессию лизоцима и других антимикробных белков, специфичных для клеток Панета (Rubio, 2012). В недавнем исследовании Chen et al. (2015) провели большое исследование 757 образцов биопсии пищевода и сообщили, что 31% этой когорты с IM содержали метапластические клетки Панета. Эти результаты соответствуют предыдущим отчетам, показывающим аналогичную частоту PCM при BE (Schreiber et al., 1978; Томпсон и др., 1983; Takubo et al., 1995). Более того, самая высокая частота ПКМ при БЭ наблюдалась в образцах с неопределенной дисплазией и дисплазией низкой степени. Кроме того, в своем последующем исследовании они показали, что ПКМ связан со снижением регрессии заболевания, и предложили его в качестве потенциального маркера для выявления тяжелого заболевания (Chen et al., 2015). Более того, присутствие продуктов метапластических клеток Панета, таких как антимикробные пептиды, может ускорить каскад БЭ, изменяя экспрессию Е-кадгерина, тем самым уменьшая межклеточное взаимодействие (Nomura et al., 2013).
Подобно желудочному IM, BE также рассматривалось как адаптация после хронического воспаления или повреждения эпителия пищевода. Сообщалось, что желчная кислота является одним из основных факторов развития БЭ на животных моделях (Clark et al., 1994; Quante et al., 2012). Пациенты с гастроэзофагеальной рефлюксной болезнью часто получали ингибиторы протонной помпы, которые могли вызывать снижение секреции кислоты желудочного сока, что приводило к избыточному бактериальному росту при БЭ. Кроме того, сообщалось, что биопсия БЭ сильно ассоциировалась с присутствием бактерий по сравнению с биопсией пищевода без БЭ (Osias et al., 2004). При биопсии пищевода наблюдали два разных типа микробиома: тип I преобладает из рода Streptococcus и присутствует с фенотипически нормальным пищеводом; а тип II содержал грамотрицательные анаэробы, которые коррелировали с БЭ (Yang et al., 2009). В других исследованиях также сообщалось о наличии бактериальной популяции, живущей в условиях гастроэзофагеальной рефлюксной болезни и БЭ. Одно исследование показало присутствие Bacteroidetes, Firmicutes, Proteobacteria и Actinobacteria (Pei et al., 2005), в то время как другие сообщили о 46 видах бактерий, включая высокие уровни Campylobacter consisus и Campylobacter rectus (Macfarlane et al., 2007). Лю и др. (2013) также наблюдали Firmicutes, Proteobacteria, Bacteroides , Fusobacterium и Actinobacter в 6 случаях БЭ. Эти исследования предложили потенциальный рациональный механизм самозащиты от патогенных бактерий. Следовательно, присутствие метапластических панет-подобных клеток в этих поражениях может представлять собой адаптивный антибактериальный ответ инфицированной слизистой оболочки.Однако, помимо антибактериальной роли, дефенсины также были предложены для снижения E-кадгерина в эпителии пищевода, чтобы, возможно, ускорить патогенез БЭ (Nomura et al., 2013).
Появление клеток Панета в других органах желудочно-кишечного тракта и не-желудочно-кишечного тракта
Кишечная метаплазия также наблюдалась в некоторых других тканях желудочно-кишечного тракта. Хотя ИМ в желчном пузыре встречается очень редко, полный ИМ в желчном пузыре был зарегистрирован еще в 1967 г. (Jarvi and Lauren, 1967).Laitio и Nevalainen (1975) изучили 100 желчных пузырей после холецистэктомий с целью удаления желчных камней. Один образец показал наличие клеток Панета. Электронная микроскопия этого образца показала клетки Панета столбчатой формы с апикальной цитоплазмой, занятой секреторными гранулами, и хорошо развитым аппаратом Гольджи. Позднее Albores-Saavedra et al. (1986) сообщили, что 3 из 49 образцов желчного пузыря показали присутствие клеток Панета. Наличие сходной морфологии в IM в желчном пузыре с таковыми в желудке предполагает, что эпителий желудка и желчного пузыря имеет одинаковый потенциал дифференцироваться в сходные клеточные клоны.Хотя предполагалось, что IM желчного пузыря, содержащего клетки Панета, связано с развитием карциномы, наличие более высокой иммунореактивности лизоцима в недиспластической слизистой оболочке, чем в карциноме, не подтверждает эту гипотезу. Более того, частота наблюдения клеток Панета оказалась самой низкой в тканях рака желчного пузыря по сравнению с неопухолевой слизистой оболочкой, что указывает на обратную корреляцию ПКМ с раком желчного пузыря (Yamamoto et al., 1989). Это наблюдение согласуется с недавним всесторонним исследованием 1900 колоректальных аденом, показывающим, что метапластические клетки Панета в дистальных колоректальных аденомах обратно связаны с синхронно развитой аденомой и карциномой (Mahon et al., 2016). Сакаки и др. (2000) наблюдали случай аденокарциномы желчного пузыря с обширным PCM.
Более того, PCM также наблюдался при холангиокарциноме кишечного типа, связанной с гепатолитиазом в большом желчном протоке печени (Bae et al., 2002). Аномальный метаболизм и секреция холестерина и желчных кислот являются частыми патофизиологическими дефектами при заболеваниях желчного пузыря. Присутствие метапластических клеток Панета при этих заболеваниях можно объяснить наличием бактериального сообщества.Сообщалось, что метаболизм желчных кислот регулируется микробиомом кишечника, поэтому роль микробиоты в заболевании невозможно переопределить (Abeysuriya et al., 2008; Wang et al., 2009; Sayin et al., 2013). Точно так же присутствие микробиоты в литогенной желчи может также способствовать воспалению и образованию желчных камней (White et al., 2006; Capoor et al., 2008; Sekirov et al., 2010), а связь микробиоты с желчными камнями хорошо известна (Kaufman et al. ., 1989; Lee et al., 1999; Maurer et al., 2005; Салтыкова и др., 2016). Кроме того, различные микробы были выделены из желчи у пациентов с холестериновыми камнями (Stewart et al., 1987; Cull and Beck, 1988; Darko and Archampong, 1994). Хотя ни одно исследование не установило прямой корреляции ПКМ и присутствия бактерий в заболеваниях желчного пузыря, существующие исследования показали наличие бактериальных сообществ в литогенной желчи (Abeysuriya et al., 2008) и метапластических клеток Панета в желчном пузыре с желчными камнями (Laitio и Невалайнен, 1975).Следовательно, присутствие клеток Панета может быть защитным механизмом против патогенных бактерий в литогенной желчи.
Alrajban et al. (2018) сообщили о первом ПКМ в опухолях Крукенберга, которые составляют 1-2% опухолей яичников и характеризуются наличием метастатических клеток аденокарциномы. Было обнаружено, что низкодифференцированная карцинома содержит смесь злокачественных клеток с печатным кольцом и эозинофильной цитоплазмой, характерной для ПКМ. PCM также наблюдался в выстилке дивертикула уретры (Niemiec et al., 1989), состояние, при котором формируется мешочек переменного размера. E. coli был наиболее распространенным организмом среди других кишечных грамотрицательных бактерий, выделенных от пациентов с дивертикулом уретры (Ljungqvist et al., 2007; Greiman et al., 2019). Поскольку дивертикул уретры соединяется с уретрой и заполняется во время мочеиспускания, метапластические изменения выстилки уретры могут быть вызваны воздействием таких раздражителей, как бактериальная колонизация и задержанная моча. Таким образом, в этом сценарии метапластические клетки Панета снова могут быть антибактериальным ответом.Сообщаемое присутствие клеток Панета при неовагините (van der Sluis et al., 2016) может указывать на аналогичный адаптивный ответ на борьбу с присутствием бактерий.
Кишечная метаплазия была описана как в доброкачественной, так и в злокачественной предстательной железе после терапии эстрогенами (Bainborough, 1952; Maung et al., 1988). Клеточно-подобная метаплазия предстательной железы Панета впервые была описана Frydman et al. (1992). Adlakha и Bostwick позже сообщили, что эти изменения, подобные клеткам Панета, при световой микроскопии напоминают кишечные клетки Панета.Однако им не хватало иммунореактивности лизоцима, и они сохраняли многие маркеры простаты. Поскольку эти Панетподобные клетки были положительными по нейроэндокринным маркерам, их назвали «нейроэндокринными клетками с большими эозинофильными гранулами» (Adlakha and Bostwick, 1994). PCM также был обнаружен при заболеваниях придатка яичка (Nevalainen et al., 2001; Nistal et al., 2007). Вместе эти Paneth-подобные клетки могут представлять трансформированные нормальные или неопластические клетки простаты.
Связь инфекции и воспаления изучалась во многих исследованиях рака простаты.В недавнем исследовании Shrestha et al. (2018) показали, что в образцах мочи пациентов с подтвержденным биопсией раком простаты увеличились бактериальные кластеры, часто связанные с другими урогенитальными инфекциями, такими как простатит и бактериальный вагиноз (Massari et al., 2019). Кроме того, недавнее исследование, посвященное тестированию жидкости предстательной железы у пациентов с раком простаты и без рака простаты, показало присутствие микробов в обоих образцах, но выявило разницу в видах микробов (Ma et al., 2019). Аналогичным образом также сообщалось о наличии микробиоты в опухолевой, перитуморальной и неопухолевой ткани простаты (Cavarretta et al., 2017). Таким образом, вопрос о том, является ли появление панетоподобных клеток при патологии простаты другой формой защитного механизма против бактерий, может потребовать дальнейшего исследования.
Заключительное слово
Слизистая оболочка желудочно-кишечного тракта постоянно подвергается воздействию различных факторов окружающей среды, начиная от патогенных и условно-патогенных бактерий и их продуктов, до резких выделений с пищеварительными свойствами. В свою очередь, человеческий организм развил защитные механизмы, такие как перистальтика, постоянное восстановление выстилающего эпителия и выработка антимикробных пептидов, таких как те, которые секретируются клетками Панета.Эктопическая экспрессия и секреция этих антимикробных пептидов в слизистой оболочке вне кишечника, где они обычно отсутствуют, демонстрируют устойчивую тканевую пластичность при адаптации к инфекции и травмам. Будущие исследования необходимы, чтобы очертить ответственные микробные сигнальные пути, которые вызывают такую необычную клеточную метаплазию. Влияние этих широко распространенных метапластических клеток Панета на прогрессирование воспалительных заболеваний и рака требует глубоких исследований, таких как использование подходов отслеживания клонов клеток Панета (Yu et al., 2018).
Авторские взносы
RS, IB, LZ и NG концептуализировали рукопись. РС и Н.Г. составили рукопись. И.Б. и Л.З. редактировали рукопись.
Финансирование
Эта работа была поддержана грантами Национальных институтов здравоохранения (NIH) (DK102934, AT010243 и DK119198), грантами Национального научного фонда (NSF / BIO / IDBR 1353890 и 1952823) и стипендией ACS (RSG-15-060). -01-TBE) в NG.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Абейсурия, В., Дин, К. И., Виджесурия, Т., и Сальгадо, С. С. (2008). Микробиология желчного пузыря при неосложненной симптоматической желчнокаменной болезни. Гепатобилиарный панкреат. Dis. Int. 7, 633–637.
Google Scholar
Абрахам, С. К., Парк, С. Дж., Ли, Дж. Х., Мугартеги, Л., и Ву, Т. Т. (2003). Генетические изменения аденом желудка кишечного и фовеолярного фенотипов. Мод. Патол. 16, 786–795. DOI: 10.1097 / 01.mp.0000080349.37658.5e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Адлаха, Х., Боствик, Д. Г. (1994). Подобное клеткам Панета изменение при аденокарциноме предстательной железы представляет собой нейроэндокринную дифференциацию: отчет о 30 случаях. Гм. Патол. 25, 135–139. DOI: 10.1016 / 0046-8177 (94)
-2
CrossRef Полный текст | Google Scholar
Адольф Т. Э., Томчак М. Ф., Нидеррейтер Л., Ко, Х. Дж., Бок Дж. И Мартинес-Навес Э.(2013). Клетки Панета как источник воспаления кишечника. Природа 503, 272–276.
Google Scholar
Аджиока, Ю., Нисикура, К., и Ватанабэ, Г. (2005). [Патоморфология язвенного колита]. Нихон Риншо 63, 763–769.
Google Scholar
Альбеди, Ф. М., Лоренцетти, Э., Контини, М., и Нарди, Ф. (1984). Незрелые клетки Панета в кишечной метаплазии слизистой оболочки желудка. Заявл. Патол. 2, 43–48.
Google Scholar
Альборес-Сааведра, Дж., Наджи, М., Хенсон, Д. Э., Зигельс-Вайсман, Дж., И Монс, Дж. М. (1986). Кишечная метаплазия желчного пузыря: морфологическое и иммуноцитохимическое исследование. Гм. Патол. 17, 614–620. DOI: 10.1016 / s0046-8177 (86) 80134-4
CrossRef Полный текст | Google Scholar
Альраджбан, В. А., Хубрани, Р. А., Алмалки, М. С., Альмассри, А., и Альрикаби, А. С. (2018). Обширная метаплазия клеток Панета в опухоли Крукенберга яичников: отчет о необычном случае и обзор литературы. J. Surg. Дело Rep. 2018: rjy323.
Google Scholar
Бэ, Дж. Й., Парк, Ю. Н., Наканума, Ю., Ли, У. Дж., Ким, Дж. Й. и Парк, К. (2002). Холангиокарцинома кишечного типа большого внутрипеченочного желчного протока, ассоциированная с гепатолитиазом — новый гистологический подтип для дальнейшего исследования. Гепатогастроэнтерология 49, 628–630.
Google Scholar
Бейнборо, А. Р. (1952). Плоская метаплазия простаты после терапии эстрогенами. J. Urol. 68, 329–336. DOI: 10.1016 / s0022-5347 (17) 68202-8
CrossRef Полный текст | Google Scholar
Бансал М., Феноглио К. М., Роббой С. Дж. И Кинг Д. В. (1984). Действительно ли метаплазии при колоректальных аденомах метаплазии? Am. J. Pathol. 115, 253–265.
Google Scholar
Бедини, О. А., Навес, А., Сан-Мигель, П., Киспе, А., и Гуида, К. (2014). [Метаплазические клетки Панета при язвенном колите]. Acta Gastroenterol.Латиноам. 44, 285–289.
Google Scholar
Бевинс, К. Л., Зальцман, Н. Х. (2011). Клетки Панета, антимикробные пептиды и поддержание гомеостаза кишечника. Nat. Rev. Microbiol. 9, 356–368. DOI: 10.1038 / nrmicro2546
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bohe, M., Borgstrom, A., Lindstrom, C., and Ohlsson, K. (1986). Панкреатические эндопротеазы и иммунореактивность ингибитора секреторного трипсина поджелудочной железы в клетках Панета человека. J. Clin. Патол. 39, 786–793. DOI: 10.1136 / jcp.39.7.786
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bohe, M., Lindstrom, C.G., and Ohlsson, K. (1987). Различная встречаемость гастродуоденального иммунореактивного ингибитора секреторного трипсина поджелудочной железы. J. Clin. Патол. 40, 1345–1348. DOI: 10.1136 / jcp.40.11.1345
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боултон, Р. А., Уссельманн, Б., Мохаммед, И., и Янковски, Дж.(2003). Пищевод Барретта: влияние окружающей среды на прогрессирование дисплазии. Мир J. Surg. 27, 1014–1017. DOI: 10.1007 / s00268-003-7054-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бресальер Р. С. (1998). Helicobacter pylori и рак желудка: непростая ассоциация. Гастроэнтерология 114, 408–409. DOI: 10.1016 / s0016-5085 (98) 70495-0
CrossRef Полный текст | Google Scholar
Burclaff, J., и Миллс, Дж. К. (2018). Пластичность дифференцированных клеток в заживлении ран и онкогенезе, часть II: кожа и кишечник. Dis. Модель Mech. 11: dmm035071. DOI: 10.1242 / dmm.035071
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Берджесс, Дж. Н., Пейн, В. С., Андерсен, Х. А., Вейланд, Л. Х., и Карлсон, Х. С. (1971). Пищевод Барретта: нижняя часть пищевода, выстланная столбчатым эпителием. Mayo Clin. Proc. 46, 728–734.
Google Scholar
Капур, М.Р., Раджни, Д. Н., Кханна, Г., Кришна, С. В., Чинтамани, М. С., и Аггарвал, П. (2008). Микрофлора аспиратов желчи у пациентов с острым холециститом с желчнокаменной болезнью или без: опыт тропиков. Braz. J. Infect. Dis. 12, 222–225.
Google Scholar
Каварретта И., Феррарезе Р., Каззанига В., Сайта Д., Лучано Р., Серезола Е. Р. и др. (2017). Микробиом микросреды опухоли простаты. Eur. Урол. 72, 625–631.
Google Scholar
Чен С. и Хуанг Э. Х. (2014). Микросреда стволовых клеток рака толстой кишки является ключом к будущей терапии рака. J. Gastrointest. Surg. 18, 1040–1048. DOI: 10.1007 / s11605-014-2497-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, В., Франкель, В. Л., Кронли, К. М., Ю, Л., Чжоу, X. и Йирсли, М. М. (2015). Значение метаплазии клеток Панета в пищеводе Барретта: морфологическое и клинико-патологическое исследование. Am. J. Clin. Патол. 143, 665–671. DOI: 10.1309 / ajcpvujmcvbc9pkm
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кларк, Г. В., Смирк, Т. К., Мирвиш, С. С., Ансельмино, М., Ямашита, Ю., Хиндер, Р. А. и др. (1994). Влияние гастродуоденального сока и пищевых жиров на развитие пищевода Барретта и неоплазии пищевода: экспериментальная модель на крысах. Ann. Surg. Онкол. 1, 252–261. DOI: 10.1007 / bf02303531
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Конвей, К.Л., Кубалла, П., Сонг, Дж. Х., Патель, К. К., Касторено, А. Б., Йилмаз, О. Х. и др. (2013). Atg16l1 необходим для аутофагии в эпителиальных клетках кишечника и защиты мышей от инфекции Salmonella . Гастроэнтерология 145, 1347–1357. DOI: 10.1053 / j.gastro.2013.08.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корреа, П. (1992). Канцерогенез желудка у человека: многоэтапный и многофакторный процесс — первая награда Американского общества рака по эпидемиологии и профилактике рака. Cancer Res. 52, 6735–6740.
Google Scholar
Correa, P., Fontham, E. T., Bravo, J. C., Bravo, L.E., Ruiz, B., Zarama, G., et al. (2000). Химиопрофилактика дисплазии желудка: рандомизированное испытание антиоксидантных добавок и терапии против Helicobacter pylori . J. Natl. Cancer Inst. 92, 1881–1888. DOI: 10.1093 / jnci / 92.23.1881
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корреа П. и Шиао Ю.Х. (1994). Фенотипические и генотипические события в канцерогенезе желудка. Cancer Res. 54, 1941–1943 гг.
Google Scholar
Коутиньо, Х. Б., Робалиньо, Т. И., Коутиньо, В. Б., Аморин, А. М., Алмейда, Дж. Р., Филью, Дж. Т. и др. (1996). Иммуноцитохимическая демонстрация того, что дуоденальные железы Бруннера человека могут участвовать в защите кишечника. J. Anat. 189 (Pt 1), 193–197.
Google Scholar
Калл Д. Л. и Бек Д. Э. (1988).Стандартный посев желчи при плановой холецистэктомии. South Med. J. 81, 1358–1360. DOI: 10.1097 / 00007611-198811000-00006
CrossRef Полный текст | Google Scholar
Канлифф, Р. Н., Роуз, Ф. Р., Кейт, Дж., Абберли, Л., Чан, В. К., и Махида, Ю. Р. (2001). Человеческий дефенсин 5 хранится в форме предшественника в нормальных клетках Панета и экспрессируется некоторыми эпителиальными клетками ворсинок и метапластическими клетками Панета в толстой кишке при воспалительном заболевании кишечника. Кишечник 48, 176–185.DOI: 10.1136 / gut.48.2.176
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дарко Р. и Аршампонг Э. К. (1994). Микрофлора желчи у ганцев. West Afr. J. Med. 13, 113–115.
Google Scholar
Девечи, М. С., Девечи, Г. (2004). Измененное распределение метапластических клеток Панета, гастрина и ацинарных клеток поджелудочной железы в атрофической слизистой оболочке желудка с поражением эндокринных клеток. Tohoku J. Exp. Med. 202, 13–22. DOI: 10.1620 / tjem.202.13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эль-Зимайти, Х. М., Ота, Х., Грэм, Д. Ю., Акамацу, Т., и Кацуяма, Т. (2002). Особенности атрофии желудка при карциноме желудка кишечного типа. Рак 94, 1428–1436. DOI: 10.1002 / cncr.10375
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фишбейн Т., Новицкий Г., Мишра Л., Мацумото К., Кауфман С., Гоял С. и др. (2008). Экспрессирующие NOD2 клетки костного мозга, по-видимому, регулируют врожденный эпителиальный иммунитет пересаженного тонкого кишечника человека. Кишечник 57, 323–330. DOI: 10.1136 / gut.2007.133322
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фокс, Дж. Г., Ли, X., Кэхилл, Р. Дж., Андрутис, К., Растджи, А. К., Одзе, Р. и др. (1996). Гипертрофическая гастропатия у мышей дикого типа C57BL / 6, инфицированных Helicobacter felis , и гемизиготных трансгенных мышей p53. Гастроэнтерология 110, 155–166. DOI: 10.1053 / gast.1996.v110.pm8536852
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фридман, К.П., Блейвейс, И. Дж., Унгер, П. Д., Гордон, Р. Э., и Бразенас, Н. В. (1992). Панетоклеточная метаплазия предстательной железы. Arch. Патол. Lab Med. 116, 274–276.
Google Scholar
Фукасе, К., Като, М., Кикучи, С., Иноуэ, К., Уэмура, Н., Окамото, С. и др. (2008). Влияние ликвидации Helicobacter pylori на частоту метахронной карциномы желудка после эндоскопической резекции раннего рака желудка: открытое рандомизированное контролируемое исследование. Ланцет 372, 392–397. DOI: 10.1016 / s0140-6736 (08) 61159-9
CrossRef Полный текст | Google Scholar
Gassler, N., Schnolzer, M., Rohr, C., Helmke, B., Kartenbeck, J., Grunewald, S., et al. (2002). Экспрессия калнексина отражает дифференцировку и функцию клеток Панета. Lab. Вкладывать деньги. 82, 1647–1659. DOI: 10.1097 / 01.lab.0000041709.42598.4a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Голденринг, Дж. Р., Нам, К.Т., и Миллс, Дж. К. (2011). Происхождение предопухолевой метаплазии в желудке: главные клетки выходят из тумана. Exp. Cell Res. 317, 2759–2764. DOI: 10.1016 / j.yexcr.2011.08.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грэм, Д. Ю., Рагге, М., и Гента, Р. М. (2019). Диагноз: кишечная метаплазия желудка — что делать дальше? Curr. Мнение. Гастроэнтерол. 35, 535–543. DOI: 10.1097 / mog.0000000000000576
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грутянс, Дж., Hodin, C.M., De Haan, J.J., Derikx, J.P., Rouschop, K.M., Verheyen, F.K. и др. (2011). Уровень активации реакции развернутого белка коррелирует с апоптозом клеток Панета в тонком кишечнике человека, подвергающемся ишемии / реперфузии. Гастроэнтерология 140, 529–539.e3. DOI: 10.1053 / j.gastro.2010.10.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хаапамаки, М. М., Гронроос, Дж. М., Нурми, Х., Аланен, К., Каллайоки, М., и Невалайнен, Т.Дж. (1997). Экспрессия гена фосфолипазы A2 группы II в кишечнике при язвенном колите. Кишечник 40, 95–101. DOI: 10.1136 / gut.40.1.95
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Heitz, P.U., and Wegmann, W. (1980). Идентификация неопластических клеток Панета в аденокарциноме желудка с использованием лизоцима в качестве маркера и электронной микроскопии. Арка Вирхова. Патол. Анат. Histol. 386, 107–116. DOI: 10.1007 / bf00432648
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Инада, К., Наканиси, Х., Фудзимицу, Ю., Симидзу, Н., Ичиносе, М., Мики, К. и др. (1997). Желудочно-кишечные смешанные и исключительно кишечные типы кишечной метаплазии в желудке человека. Pathol. Int. 47, 831–841. DOI: 10.1111 / j.1440-1827.1997.tb03714.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ирландия, Х., Хоутон, К., Ховард, Л., и Винтон, Д. Дж. (2005). Клеточное наследование Cre-активированного репортерного гена для определения продолжительности жизни клеток Панета в тонком кишечнике мышей. Dev. Дин. 233, 1332–1336. DOI: 10.1002 / dvdy.20446
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ито, Х., Хата, Дж., Йокодзаки, Х., Накатани, Х., Ода, Н., и Тахара, Э. (1986). Тубулярная аденома желудка человека. Иммуногистохимический анализ гормонов кишечника, серотонина, карциноэмбрионального антигена, секреторного компонента и лизоцима. Рак 58, 2264–2272. DOI: 10.1002 / 1097-0142 (19861115) 58:10 <2264 :: aid-cncr2820581018> 3.0.co; 2-f
CrossRef Полный текст | Google Scholar
Ярви, О.и Лорен П.К. (1967). Кишечная метаплазия слизистой оболочки желчного пузыря и общего желчного протока с дополнительными наблюдениями за гетеротопией поджелудочной железы. Ann. Med. Exp. Биол. Фенн. 45, 213–223.
Google Scholar
Джин, Р. У., и Миллс, Дж. К. (2018). Родственны ли желудочная и пищеводная метаплазия? Дело в том, что Барретт проистекает из СПЭМ. Dig. Dis. Sci. 63, 2028–2041. DOI: 10.1007 / s10620-018-5150-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джин, Р.У., Миллс Дж. К. (2019). Модель циклического удара: как палигеноз может установить мутационный ландшафт в пищеводе Барретта и аденокарциноме пищевода. Curr. Мнение. Гастроэнтерол. [Epub перед печатью].
Google Scholar
Джу М., Шахсафаэй А. и Одзе Р. Д. (2009). Дифференцировка клеток Панета в новообразованиях эпителия толстой кишки: доказательства роли пути Apc / бета-катенин / Tcf. Гм. Патол. 40, 872–880. DOI: 10.1016 / j.humpath.2008.12.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кауфман, Х. С., Магнусон, Т. Х., Лиллемо, К. Д., Фраска, П., и Питт, Х. А. (1989). Роль бактерий в камнеобразовании желчного пузыря и общего протока. Ann. Surg. 209, 584–591; обсуждение 591–582.
Google Scholar
Кавачи, Т., Курису, М., Нуманю, Н., Сасадзима, К., и Сано, Т. (1976). Предраковые изменения желудка. Cancer Res. 36, 2673–2677.
Google Scholar
Казал, Л.А., Спайсер, Д.С., и Брахинский, Р.А. (1948). Выделение кристаллического белка-ингибитора-антикоагулянта трипсина из поджелудочной железы. J. Am. Chem. Soc. 70, 3034–3040. DOI: 10.1021 / ja01189a060
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кимура, К., Сато, К., Идо, К., Танигучи, Ю., Такимото, Т., и Такемото, Т. (1996). Гастрит японского желудка. Сканд. J. Gastroenterol. Дополнение 214, 17–20; обсуждение 21–23.
Google Scholar
Klockars, M., Reitamo, S., Reitamo, J. J., and Moller, C. (1977). Иммуногистохимическая идентификация лизоцима в поражениях кишечника при язвенном колите и болезни Крона. Кишечник 18, 377–381. DOI: 10.1136 / gut.18.5.377
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кодама, М., Мураками, К., Окимото, Т., Сато, Р., Утида, М., Абэ, Т. и др. (2012). Десятилетнее проспективное наблюдение за гистологическими изменениями в пяти точках слизистой оболочки желудка в соответствии с рекомендациями обновленной Сиднейской системы после эрадикации Helicobacter pylori . J. Gastroenterol. 47, 394–403. DOI: 10.1007 / s00535-011-0504-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Конг, Ю. Дж., Йи, Х. Г., Дай, Дж. К., и Вэй, М. X. (2014). Гистологические изменения слизистой оболочки желудка после эрадикации Helicobacter pylori : систематический обзор и метаанализ. World J. Gastroenterol. 20, 5903–5911.
Google Scholar
Кремер, А., Эльсаббаг, А. М., Мацумото, К. С., Заслофф, М., и Фишбейн, Т. М. (2016). Микробиом и его значение при трансплантации кишечника. Curr. Мнение. Трансплантация органа. 21, 135–139. DOI: 10.1097 / mot.0000000000000278
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Laitio, M., and Nevalainen, J. (1975). Электронно-микроскопическое исследование кишечной метаплазии желчного пузыря человека. Beitr. Патол. 155, 297–308. DOI: 10,1016 / s0005-8165 (75) 80123-5
CrossRef Полный текст | Google Scholar
Ли, Д.К., Тарр П. И., Хей В. Г. и Ли С. П. (1999). Бактериальная ДНК в желчных камнях со смешанным холестерином. Am. J. Gastroenterol. 94, 3502–3506. DOI: 10.1111 / j.1572-0241.1999.01614.x
Определение
Альтернативные / исторические названия
Критерии диагностики
Ричард Л. Кемпсон, доктор медицины Роберт В. Роуз, доктор медицины Исходная публикация: 1 мая 2006 г. Дополнительные исследованияИммуногистология
Плоские и мезенхимальные элементы и в большинстве случаев протоковые элементы окрашиваются Дифференциальная диагностика
Другие метапластические карциномы с немезенхимальной дифференцировкой не следует путать с карциномами с гигантскими клетками, подобными остеокластам.
Клинический
Оценка / Постановка / ОтчетОценка
Стадия
Отчет
СпискиПроникающая карцинома грудиБиблиография
|
Типы, результаты тестов, причины и многое другое
Что такое эпителиальные клетки?
Эпителиальные клетки — это клетки, которые поступают с поверхностей вашего тела, таких как кожа, кровеносные сосуды, мочевыводящие пути или органы.Они служат барьером между внутренней и внешней частью вашего тела и защищают его от вирусов.
Небольшое количество эпителиальных клеток в моче — это нормально. Большое количество может быть признаком инфекции, заболевания почек или другого серьезного заболевания. По этой причине ваш врач может назначить анализ мочи или общий анализ мочи, чтобы просмотреть вашу мочу под микроскопом.
Эпителиальные клетки различаются по размеру, форме и внешнему виду. В зависимости от происхождения в моче можно обнаружить три типа эпителиальных клеток:
- Почечные канальцы. Это самые важные эпителиальные клетки. Повышенное количество может означать заболевание почек. Их также называют почечными клетками.
- Плоский. Это самый крупный тип. Они исходят из влагалища и уретры. Этот тип чаще всего обнаруживается в женской моче.
- Переходный. Они могут исходить из любого места между мужской уретрой и почечной лоханкой. Иногда их называют клетками мочевого пузыря, и они чаще встречаются у пожилых людей.
Анализ мочи может показать, что в моче «мало», «умеренно» или «много» эпителиальных клеток.
Эпителиальные клетки естественным образом отслаиваются от вашего тела. Нормальным является наличие от одной до пяти клеток плоского эпителия на поле высокого разрешения (HPF) в моче. Наличие умеренного количества или большого количества клеток может указывать на:
Тип эпителиальных клеток в моче также может сигнализировать об определенных условиях. Например, эпителиальные клетки, содержащие большое количество гемоглобина или частицы крови, могут означать, что у вас недавно были эритроциты или гемоглобин в моче, даже если их не было во время анализа мочи.
Более 15 эпителиальных клеток почечных канальцев на HPF могут означать, что ваша почка не работает должным образом.
Клетки плоского эпителия в моче могут означать, что образец загрязнен.
Анализ мочи, который обнаруживает плоские эпителиальные клетки в моче, не является нормой, сказал Healthline Уильям Винтер, доктор медицины, клинический химик из больницы Шэндс и профессор патологии и педиатрии Университета Флориды.
Это потому, что метод «чистого улова» при взятии образца мочи обычно предотвращает появление плоских эпителиальных клеток в моче.При использовании метода чистого улова вам дадут стерилизующую ткань, чтобы вытереть область вокруг влагалища или пениса перед сдачей анализа мочи. Это предотвращает появление загрязнений с вашей кожи, таких как эпителиальные клетки, в вашем образце.
Ваш врач может помочь вам понять результаты ваших анализов и узнать, есть ли у вас заболевание, требующее лечения. Чтобы найти причину, врач может также назначить дальнейшее обследование.
Вы можете подвергаться повышенному риску высокого количества эпителиальных клеток, если:
- имеете камни в почках
- имеете ослабленную иммунную систему
- имеете диабет
- имеете высокое кровяное давление
- имеете семейный анамнез хронического заболевания почек
- имеют увеличенную простату
- беременны
- имеют африканское, испаноязычное, азиатское и американское индейское происхождение
Лечение будет зависеть от причины аномального количества эпителиальных клеток.Большинство ИМП являются бактериальными, и их можно лечить антибиотиками. Питье большего количества воды также может ускорить заживление. При вирусных ИМП врачи могут назначить противовирусные препараты.
Лечение болезни почек означает устранение основной причины заболевания, включая артериальное давление, уровень сахара в крови и холестерина. Ваш врач может назначить лекарство от кровяного давления, чтобы замедлить прогрессирование заболевания или сохранить функцию почек, даже если у вас нет высокого кровяного давления. Также важны изменения в здоровом питании и образе жизни.
Ваш врач может посоветовать вам:
Поддержание водного баланса — один из самых простых способов предотвратить инфекции мочевыводящих путей и заболевания почек. Вы должны выпивать несколько стаканов воды в день, но ваш врач может посоветовать, что лучше для вас.
Употребление клюквенного сока или употребление в пищу клюквы может помочь снизить риск развития ИМП. Клюква содержит химическое вещество, которое может защитить от бактерий, прикрепляющихся к слизистой оболочке мочевого пузыря. Однако в медицинском сообществе до сих пор ведутся споры об эффективности этого средства.
Если анализ мочи обнаруживает в моче эпителиальные клетки, это обычно не повод для беспокойства. Это может быть результат загрязненного образца. Эпителиальные клетки могут также выявлять основные заболевания, такие как ИМП или заболевание почек.
Только ваш врач может интерпретировать результаты ваших анализов и выбрать наилучший курс действий. Даже в этом случае может потребоваться дальнейшее тестирование.
Интерфаза между иммунными и эпителиальными клетками шейки матки
Шейка матки разделена на две морфологически и иммунологически различные области, а именно: (1) микробная эктоцервикс, которая проксимальнее влагалища, и (2) «стерильный» эндоцервикс. , которая находится дистальнее матки.Две шейные области граничат с зоной трансформации шейки матки (CTZ), областью изменяющихся клеток, и преимущественно состоят из эпителиальных клеток шейки матки. Известно, что эпителиальные клетки играют решающую роль в инициации, поддержании и регуляции врожденного и адаптивного ответа в сотрудничестве с иммунными клетками в нескольких типах тканей, включая шейку матки, и их дисфункция может приводить к спектру клинических синдромов. Например, эпителиальные клетки блокируют развитие и нейтрализуют или убивают микроорганизмы множеством способов.Эти (способы) включают создание физических (межклеточные соединения, секреция слизи) и иммунных барьеров (пути, опосредованные рецептором распознавания патогенов), которые в совокупности и в конечном итоге приводят к высвобождению определенных хемокинов и / или цитокинов. Цитокины впоследствии привлекают подмножества иммунных клеток, соответствующих конкретному иммунному контексту и ответу, такие как дендритные клетки (DC), T, B и естественные клетки-киллеры (NK). Иммунный ответ, как и большинство биологических процессов в женском репродуктивном тракте (FRT), в основном регулируется эстрогеном и прогестероном, и их (иммунные клетки) ответы различаются во время различных физиологических фаз репродукции, таких как менструальный цикл, беременность и постменопауза.Цель настоящего обзора — сравнить иммунологический профиль слизистых оболочек и иммунных клеток экто- и эндоцервикса и их интерфазы на разных фазах репродукции самок.
1. Введение
Женский репродуктивный тракт (FRT) можно разделить на две иммунологические области, а именно: верхнюю (эндоцервикс, матка и яйцевод) и нижнюю (влагалище и эктоцервикс) FRT [1]. В то время как нижняя FRT связана с большим количеством микробов, верхняя область считается «стерильной», хотя эта теория недавно подверглась сомнению [2] (рисунки 1 и 2).Таким образом, каждая из двух областей обладает уникальными тканеспецифическими иммунологическими особенностями, и обе они претерпевают определенные изменения во время различных физиологических состояний (менструальный цикл, беременность, послеродовой период и возраст), и вместе они создают спектр иммунного ответа с двумя «противоположными» концами. [3]. С одной стороны, возникает иммунный ответ, необходимый для защиты от инфекций и других вредных воздействий окружающей среды. На другом конце спектра, и одновременно, во время беременности поддерживается симбиотический мутуализм с комменсальными микробами и иммунологическая толерантность к аллогенным сперматозоидам, а также полуаллогенному плоду [3].Эти сложные иммунные ответы в значительной степени организуются и регулируются половыми стероидными гормонами, и нарушение регуляции этих иммунных ответов может привести к различным клиническим осложнениям, таким как бактериальный вагиноз, вагинальный кандидоз, рак шейки матки, инфекции мочевыводящих путей и преждевременные роды [4, 5 ]. В настоящем обзоре основное внимание уделяется тканеспецифическим иммунологическим изменениям, которые происходят в экто- и эндоцервиксе в различных физиологических условиях.
Шейка матки человека представляет собой бочкообразную структуру с центральным каналом и имеет длину примерно 2 см.Проксимальный конец шейки матки называется внутренним зевом os и открывается в матку без каких-либо явных особенностей, позволяющих обозначить границы двух тканей, тогда как дистальный конец называется внешним зевом и открывается во влагалище [6]. Ткань шейки матки имеет два доминирующих типа клеток как в эндо-, так и в эктоцервиксе, состоящих из (а) стромальных и (б) эпителиальных клеток. Эти два типа клеток разделены базальной мембраной [7]. Стромальная ткань преимущественно состоит из фибробластов с гладкими мышцами и рассеянных иммунных клеток, встроенных в богатый коллагеном внеклеточный матрикс, содержащий гиалуронан и протеогликаны [8].В настоящем обзоре основное внимание уделяется двум типам клеток, которые играют доминирующую роль в местных иммунных ответах, а именно клеткам шейного эпителия и иммунным клеткам. В целом как эпителиальные клетки шейки матки, так и иммунные клетки экто- и эндоцервикса защищают верхнюю часть передней передней поверхности матки от бактериальной инфильтрации с помощью различных механизмов. (а) Цервикальные эпителиальные клетки создают физический барьер через слизь и эпителиальные слои. Эти клетки (эпителиальные) также генерируют специфические иммунные ответы и взаимодействуют с обычными иммунными клетками.(б) Иммунные клетки (резидентные и нерезидентные) управляют как врожденными, так и адаптивными иммунными ответами [3, 9, 10].
2. Мультииммунные аспекты эпителиальных клеток шейки матки
2.1. Общий обзор
Эпителиальные клетки являются «первыми респондентами», которые вступают в прямой контакт с потенциальными патогенами, которые проникают в FRT. По сути, они должны быть гибкими, проворными и адаптивными. Кроме того, эффективная связь между эпителиальными и иммунными клетками имеет решающее значение для создания эффективной защиты от инфекции.Например, эпителий FRT, включая эпителий шейки матки, способен поддерживать различные врожденные и адаптивные иммунные функции. По сути, эпителиальные клетки шейки матки обладают несколькими иммунными способностями, которые используются для блокирования восхождения патогенов к верхнему FRT. Примечательно, что они включают (1) создание физического иммунного барьера, (2) секрецию антимикробных, цитокиновых и хемокиновых факторов и (3) проявление некоторых из более специализированных врожденных и адаптивных иммунных функций, таких как презентация антигена.
2.2. Эпителиальные клетки шейки матки создают физический барьер против патогенов
Верхняя FRT выстлана одинарным слоем столбчатых клеток, в то время как эктоцервикс имеет многослойный слой клеток, покрытый плоскими эпителиальными клетками. Два типа эпителия (экто и эндо) разделены стыком с плоскостолбчатыми клетками. Барьерные свойства эпителия слизистой оболочки частично регулируются молекулами адгезии, которые закрывают межклеточное пространство между соседними клетками [11].Таким образом, целостность эпителиального барьера поддерживается межклеточными соединениями, предотвращающими вторжение микробов. Межклеточные соединения, присутствующие в боковой мембране эпителиальных клеток, можно разделить на три основных типа, а именно: плотные или закрывающие соединения, адгезивные соединения (включая десмосомы и гемидесмосомы) и щелевые соединения (сообщающиеся соединения). Второй физический барьер, установленный эпителием шейки матки, — это секретируемая слизь [12].
2.2.1. Соединения клеток в эпителии шейки матки
Исследование с помощью электронной микроскопии продемонстрировало, что классические плотные соединения представляют собой основные межклеточные соединения между простыми столбчатыми эпителиальными клетками в эндоцервиксе [13, 14].Напротив, самые верхние слои многослойного плоского эктоцервикального эпителия лишены организованных межклеточных соединений [13, 14]. Более того, соединительные молекулы, которые, как считается, являются ключевыми регуляторами проницаемости эпителия, целостности соединений и инфильтрации лейкоцитов, такие как F11R (или JAM-A), E-кадгерин, окклюдин, клаудин-1 и TJP1 (или ZO-1), являются распространены в эндоцервиксе человека [13]. Отсутствие плотных контактов в нижнем FRT не только позволяет перемещению небольших молекул и патогенов между эпителиальными клетками, но также позволяет иммунным клеткам, таким как эпителиальные цервиковагинальные клетки Лангерганса или дендритные клетки (DC), делать то же самое.Неудивительным является тот факт, что эктоцервикс и влагалище имеют сплошной морфологически идентичный слой слизистой оболочки, и поэтому распределение соединительных молекул одинаково в обеих тканях. Согласно Blaskewicz et al., Наиболее надежные соединения в многослойном плоском эпителии эктоцервикса и влагалища лежат в парабазальном эпителии, чуть выше базального слоя, контактирующего с базальной мембраной [13]. В этих клетках особенно много спаек. Целостность соединений прогрессивно ухудшается по направлению к апикальной поверхности, где эпителиальные клетки становятся ороговевшими, теряют все клеточные контакты и выпадают в просвет [13].На структуру плотных контактов влияют гормоны [15], а также цитокины [11]. Например, наша группа продемонстрировала, что экзогенный фактор роста эндотелия сосудов (VEGF), мощный ангиогенный фактор, способствует параклеточной проницаемости в эпителиальных клетках шейки матки во время беременности [16]. Кроме того, фактор некроза опухоли- α (TNF- α ), сигнальная молекула, снижает трансэпителиальную резистентность эпителиальных клеток матки [17]. Наличие щелевых контактов в эпителиальных клетках шейки матки практически не изучено [18, 19] (рис. 1 и 3).
2.2.2. Слизь как второй физический барьер с антимикробной активностью
Цервикальная слизь продуцируется бокаловидными клетками псевдогландов и претерпевает заметные модификации, которые приводят к характерным биохимическим и биофизическим характеристикам на разных этапах цикла [12, 20]. Слизь представляет собой смесь различных факторов, состав и концентрация которых варьируются в зависимости от цикла и во время беременности. Эти факторы включают воду, липиды, холестерин, углеводы, неорганические ионы и белки (иммуноглобулины, белки плазмы, муцины и ферменты) [12].Изменения консистенции слизи во время менструального цикла или беременности изменяют способность слизи физически блокировать рост бактерий, одновременно позволяя сперматозоидам проникать в верхнюю часть передней передней стенки желудка. Например, верхняя FRT уязвима для инфекции во время менструации и родов, когда шейка матки открывается, чтобы обеспечить прохождение менструальных выделений и ребенка. Следовательно, иммунный ответ, генерируемый шейкой матки, должен быть гибким и гибким в различных физиологических репродуктивных условиях, позволяя шейке матки играть различные ключевые роли в воспроизводстве самок, в частности, являясь ключевым иммунным «хранителем ворот» «стерильной» верхней FRT (Рисунок 4).
Муцины — это большие гликопротеины, которые служат гелем или клеем слизи и, следовательно, способны улавливать и иммобилизовать патогены, среди прочего, в зависимости от толщины слизи [20]. Существует более 20 различных муцинов, которые по-разному экспрессируются бокаловидными клетками в зависимости от местоположения и менструального статуса [20]. MUC4 и MUC5 (5AC, 5B) и MUC6 являются основными белками муцина слизи эндоцервикального канала, и их количество изменяется в течение цикла [21].В целом, цервикальная слизь действует как полупроницаемый и противомикробный барьер, предотвращая доступ патогенов к верхним половым путям, одновременно обеспечивая проникновение сперматозоидов до овуляции [20, 21] (Рисунок 4).
Антимикробные и иммунные составляющие слизи дополняют физический барьер, создаваемый цервикальной слизью. Эти упомянутые ранее компоненты включают иммуноглобулины, комплемент, антитела, цитокины, антимикробные белки и иммунные клетки [22], и их концентрации или уровни демонстрируют циклические колебания [22, 23], тогда как другие молекулы, такие как IL-6, IL-4 , IL-12, IFN-, γ и активность Т-клеток не имеют циклических вариаций [23, 24].Хотя эти циклические изменения в составе слизи повышают уязвимость верхней передней передней части желудка, поскольку они могут привести к появлению патогенов, разжижение слизи во время овуляции также способствует более легкому прохождению спермы [12]. Комбинация физического и иммунного барьера, установленного слизью и эпителиальным слоем, возможно, является компенсаторной и усиливает иммунную функцию, например, замедляя диффузию частиц, оставляя время для биологической защиты [12].
2.3. Эпителиальные клетки шейки матки секретируют противомикробные препараты, цитокины и хемокины
Известно, что эпителиальные клетки секретируют смесь или коктейль регуляторных факторов, которые либо синергизируют, либо дополняют друг друга, такие как цитокины и хемокины, а также ряд противомикробных препаратов, включая лактофермерин , и дефенсины, наряду с иммуноглобулинами A (IgA) и IgG, которые обеспечивают защиту от патогенов [25–27].Например, секреция антимикробных молекул в цервикальной слизи представляет собой интересный пример синергизма или взаимозависимости между врожденными и адаптивными иммунными функциями. Несколько видов бактерий в просвете матки мыши связывают комплемент C3, продуцируемый эпителиальными клетками, который (комплемент C3), в свою очередь, способствует связыванию антител IgA и IgG с бактериями, что в конечном итоге приводит к более эффективному фагоцитозу бактерий нейтрофилами [ 28]. Следовательно, в то время как производство компонентов комплемента является врожденным процессом, антитела являются частью адаптивного процесса, который ведет к защите [9].Было показано, что экспрессия IgA и IgG в ткани матки регулируется гормонально [27]. Распределение рецептора комплемента 3 (CR3) на эпителии женских половых путей человека было описано ранее, а также продуцирование альтернативных компонентов комплемента в первичных экто- и эндоцервикальных клетках человека, что впоследствии обеспечивает отложение C3b и его быстрое преобразование. к iC3b [29–32].
В целом, по-видимому, существует различие в составе противомикробного средства нижней FRT по сравнению с верхней FRT, что, вероятно, отражает уникальные функции двух трактов [4].Например, верхние эпителиальные клетки FRT секретируют батарею антимикробных пептидов, таких как β -дефенсины человека (hBD), ингибитор секреторной лейкоцитарной протеазы (SLPI), лизоцим, антимикробный пептид трахеи, воспалительный белок макрофагов-3 (MIP3 α / CCL20), траппин-2 / элафин и кателицидин [14], тогда как протеомный профиль нагруженного патогенами нижнего FRT включает SLPI, hBD-2, нейтрофильный пептид 1 человека (HNP1), HNP2, HNP3, лизоцим, лактоферрин. , сурфактант А и элафин (также известный как ингибитор пептидазы 3) [4, 33] (рис. 5).Другие распространенные цервикальные секреции включают цитокины, такие как IL-1 β , IL-6, IL-10, IL-18, CC-хемокиновый лиганд 2 (CCL2) и фактор роста эндотелия сосудов (VEGF), уровни которых значительно ниже. выше в нижнем FRT, в то время как уровни IL-12, IL-15, фактора ингибирования миграции макрофагов (MIF) и гомолога 1 dickkopf (DKK1) очень низкие в цервикальном секрете по сравнению с секретом эндометрия [25]. Цитокины модулируют различные физиологические, воспалительные и невоспалительные процессы и развитие, но они также модулируют параклеточную проницаемость, реструктурируя плотные контакты через множество различных сигнальных путей.Например, провоспалительный цитокин, фактор некроза опухоли альфа (TNF- α ), трансформирующий фактор роста бета (TGF- β ) и фактор роста гепатоцитов (HGF) непосредственно нарушают плотные контакты в ряде линий эпителиальных и эндотелиальных клеток. [11], включая эпителий матки [17]. В последнее время современная теория иммунной специфичности и различий между двумя компартментами FRT подверглась сомнению [34], поскольку многие белки по-разному секретируются в верхнем и нижнем FRT, такие как CCL2, IL-6, IL-10, IL-15 и IL-1 β также участвуют в миграции иммунных клеток и развитии фенотипа [25].Следовательно, наблюдаемые различия в секреции конкретных белков могут регулировать вариации популяций иммунных клеток в FRT [4] (Рисунки 6 и 7).
2.4. Эпителиальная клетка шейки матки как антигенпредставляющая клетка
Типичная антигенпрезентирующая клетка (APC) имеет молекулу класса II главного комплекса гистосовместимости (MHC), расположенную на ее поверхности и экспонирует процессированный антиген CD4 + T-клетке, которая является основа для активации, пролиферации и дифференцировки Т-клеток в эффекторные клетки [35].APC происходят из костного мозга и включают дендритные клетки, макрофаги и моноциты [36]. Однако другие типы клеток с продемонстрированной антигенпрезентирующей способностью включают клетки Лангерганса кожи, клетки Купфера печени и дендритные клетки селезенки [36]. Презентация антигена эпителиальными клетками была продемонстрирована на нескольких поверхностях слизистых оболочек, включая эпителиальные клетки матки [37], а также в строме матки и влагалище [35]. Внутри FRT эпителиальные клетки экспрессируют молекулы MHC класса II [37, 38].Половые гормоны могут играть роль в регуляции презентации антигена [38], которая также регулируется цитокином эпителиальных клеток, о чем свидетельствует тот факт, что эпителиальные клетки матки продуцируют трансформирующий фактор роста- β (TGF- β ), который подавляет базовые APC в строме матки в ответ на эстрадиол (E 2 ) [39].
2,5. Эпителиальные клетки шейки матки экспрессируют различные рецепторы распознавания образов
Ранее мы описали, как эпителий FRT играет роль против патогенов, (а) создавая физический барьер, образованный межклеточными соединениями и секретируя слизь, содержащую специфические белки, (б) секретируя цитокины, хемокины и противомикробные средства и (c) в качестве антигенпрезентирующих клеток.Эпителиальные клетки шейки матки также распознают ассоциированные с патогенами молекулярные паттерны (PAMP) на микробах (бактерии, паразиты и вирусы) через рецепторы распознавания паттернов (PRR), такие как семейство толл-подобных рецепторов (TLR), ген 1, индуцируемый ретиноевой кислотой (RIG- I) -подобные рецепторы (RLR) и NOD-подобные рецепторы (NLR) [40–42]. TLR2 и TLR4 обнаруживают сигналы от грамположительных и грамотрицательных бактерий соответственно [40–42], в то время как NOD1 и NOD2 опосредуют сигналы от пептидогликановых фрагментов, полученных от грамположительных и грамотрицательных бактерий, а также от небактериальных патогенов, таких как как вирусы и простейшие паразиты [43].RLR опосредуют сигналы от различных вирусов, что приводит к продукции IFN-1 и индукции противовирусных ответов [44]. Уровень экспрессии этих рецепторов выше в верхней FRT, считающейся «стерильной», по сравнению с нижней FRT, которая нагружена патогенами [4, 40]. Конкретные бактериальные лиганды (пептидогликан, липополисахарид), связанные с TLR, увеличивают экспрессию медиаторов воспаления, таких как цитокины и хемокины (упомянутые ранее) [40]. Кроме того, было показано, что E 2 изменяет профиль секреции цитокинов в культивируемых эпителиальных клетках шейки матки, когда активируются сигнальные пути TLR2 и TLR4 [40, 42], и природа ответа варьируется в зависимости от типа цитокина и продолжительность совпадения клеток с лигандами E 2 и TLR [40].Авторы приходят к выводу, что комплексная иммуномодулирующая роль E 2 существует на поверхности эпителия и что такая роль, вероятно, позволяет слизистому слою нижней FRT различать комменсалы и патогены и обеспечивать соответствующую защиту хозяина от восходящей инфекции [40 ]. Напротив, TLR7, TLR8 и TLR9 равномерно экспрессируются в верхнем и нижнем FRT. Эти рецепторы обнаруживают одноцепочечную РНК (TLR7 и TLR8) и ДНК (TLR9). Однако точные механизмы передачи сигналов еще предстоит выяснить.
2.6. Микробиом влагалища
Влагалище сравнивали с камерой, богатой питательными веществами для микробов [45]. Эти микробы, состоящие из разных видов (бактерии, вирусы, грибы и простейшие), играют решающую роль в поддержании общего состояния влагалища и предотвращении инфекций [45–47]. Нарушение этого микробного сообщества может привести, в частности, к вагинальным инфекциям, а также к другим урогенитальным осложнениям и неблагоприятным исходам беременности [45, 48]. Факторы, которые могут изменить состав микробиоты влагалища, разнообразны и включают возраст, гормональный фон, генитальные инфекции и гигиену [45, 49].На сегодняшний день в вагинальном тракте описано более 50 видов микробов, среди которых преобладают виды Lactobacillus (70% от общего числа) [50]. Ключевые представители видов лактобацилл включают L. crispatus , L. gasseri , L. inners и L. jensenii [46]. Этот вид ( Lactobacillus ) привлек значительное внимание из-за их защитных и пробиотических свойств [51], которые частично вызваны продуцирующими факторами, снижающими pH ниже 4.5 и подавляют чрезмерный рост нормальных факультативных анаэробов, а именно молочной кислоты [52–55]. Другие ключевые виды, обнаруженные во влагалище, включают анаэробы ( Gardnerella , Atopobium , Mobiluncus , Prevotella , Streptococcus , Staphylococcus , Ureaplasma , и Megasphaera microorganisms и Megasphaera ). условно-патогенный гриб, Candida albicans [56]. Необходимы дальнейшие исследования, чтобы понять основной механизм взаимозависимости между микробиотой FRT и хозяином, что будет иметь решающее значение для улучшения репродуктивного здоровья женщин.
3. Региональное распределение и функция иммунных клеток в слизистой оболочке шейки матки
3.1. Общий обзор
Как указывалось ранее, влагалище и эктоцервикс, составляющие нижнюю FRT, обычно сильно загружены микробами, потому что они непосредственно подвергаются воздействию внешней среды, в отличие от «стерильной» верхней FRT. Таким образом, следует ожидать, что эти две области будут иметь разные иммунологические профили. Кроме того, считается, что иммунные клетки в этих двух областях в основном регулируются половыми гормонами во время менструального цикла [4], беременности и послеродового периода [10] локально-специфическим образом, который зависит от типа факторов, присутствующих в местное тканевое микроокружение, такое как факторы роста, цитокины и хемокины [4, 10].Как правило, в слизистых оболочках шейки матки человека Т-лимфоцитов гораздо больше, чем В-клеток [57, 58], и примерно 40% цервикальных Т-клеток составляют CD4 + Т-клетки. остальные 60% составляют Т-клетки CD8 + [58]. Среди CD4 + Т-клеток, расположенных в шейке матки, большинство (70%) проявляют эффекторную память или эффекторный фенотип, по сравнению с примерно 60% CD8 + , экспрессирующих фенотип эффекторных клеток, что согласуется с шейкой матки. являясь эффекторным сайтом для клеточно-опосредованного иммунитета и тканевой резидентности CD4 + и CD8 + Т-клеток шейки матки [10, 58].Напротив, естественные киллеры (NK) составляют лишь 2,7% от общего числа CD45 + иммунных клеток [3], а В-клетки CD19 + составляют только 0,9% иммунных клеток [3, 58]. Однако пока Трифонова и соавт. свидетельствуют о том, что Т-клетки CD8 + более многочисленны, чем Т-клетки CD4 + , конкретное локальное распределение Т-клеток CD4 + и CD8 + все еще остается спорным [58]. Расхождения между некоторыми исследованиями в отношении конкретной доли каждой популяции лейкоцитов могут отчасти объясняться различиями в экспериментальных планах исследований [57, 58], таких как репродуктивная фаза (менструальный цикл vs.менопауза или беременность) и размер выборки [3].
Макрофаги, дендритные клетки (ДК) и другие лимфоцитарные клетки с отрицательным происхождением (CD3, CD20, CD56 и CD16) являются основными иммунными клетками шейки матки, составляющими от 37 до 55% мононуклеарных клеток CD45 + [ 58]. Макрофаги CD11 + являются доминирующими клетками примерно на 30% от CD14 + клеток шейки матки. Цервикальные ДК несколько более распространены, чем ДК периферической крови, которые составляют менее 1% клеток CD45 + [58].
3.2. Иммунные клетки слизистой оболочки Ectocervix
Т-клетки (CD3 + ) являются наиболее многочисленными лейкоцитами в FRT и сконцентрированы больше в нижнем FRT, чем в верхнем FRT [4]. В нижнем FRT большинство Т-клеток, как полагают, обладают фенотипом эффекторной памяти [58], и 35% мононуклеарных клеток CD45 + являются CD3 + Т-клетками. Кроме того, незрелые DC CD4 + T и CD1a + значительно более распространены в эктоцервиксе, чем во влагалище [58].С другой стороны, CD4 + и CD8 + T-клетки одинаково многочисленны в эктоцервиксе, в отличие от эндометрия, где преобладают CD8 + T-клетки [4]. Хотя NK- и B-клетки также присутствуют в эктоцервиксе, они гораздо менее распространены, чем T-клетки [4]. NK и гранулоциты (CD66b + ) более многочисленны в верхнем FRT, чем в нижнем FRT [4]. Как Т-, так и В-лимфоцитов больше в эктоцервиксе, чем в эндоцервиксе, что положительно коррелирует с микробной нагрузкой [10, 58] (рис. 8).
Поскольку количество CD8 + T, B и NK-клеток уменьшается после менопаузы, иммунные клетки шейки матки человека, вероятно, регулируются гормонами [59]. Миелоидные APC также распространены как в экто-, так и в эндоцервиксе человека [10]. В компартменте APC наиболее многочисленны клетки CD14 + , при этом наибольшие популяции составляют макрофаги CD11c — , за которыми следуют клетки CD11c + , которые включают тканевые DC и / или моноциты, которые еще не полностью дифференцировались в макрофаги. [58].Обычные подмножества DC также обнаруживаются в подмножестве APC CD14 –; однако их количество, хотя и больше, чем в периферической крови, намного ниже, чем у клеток CD14 + [58]. Несмотря на характеристику этих иммунных клеток шейки матки человека, лежащие в основе регуляторные механизмы их дифференциации и функций с помощью системных и местных иммунных сигналов еще предстоит изучить. Тот факт, что Pudney et al. смогли обнаружить более высокие концентрации CD8 + и TIA1 + Т-лимфоцитов в эктоцервиксе и зоне трансформации шейки матки (CTZ), что позволяет предположить, что они могут быть основными эффекторными участками ответа цитотоксических Т-лимфоцитов [60].Кроме того, поскольку эктоцервикс и CTZ содержат наибольшее количество антигенпрезентирующих клеток, они, вероятно, также могут быть лучшим местом для индукции клеточно-опосредованных иммунных ответов в нижних FRT [60]. Хотя В-клетки представляют собой незначительную популяцию клеток во всем женском репродуктивном тракте, плазматические клетки, продуцирующие IgG и IgA, преимущественно локализуются в шейке матки и, в меньшей степени, во влагалище. В частности, цервиковагинальный секрет характеризуется большим количеством IgG, чем IgA, и оба они регулируются гормонально [14].
ДК являются наиболее мощными антигенпрезентирующими клетками и, как таковые, играют важную роль в защите матки [61], активируя наивные Т-клетки, что является важным шагом в инициации адаптивного иммунного ответа [61]. DCs преимущественно наблюдались в базальных и супрабазальных областях, и их дендритная природа была более заметной в базальных слоях многослойного плоского эпителия эктоцервикса и CTZ [61]. DC также были описаны в промежуточном слое без типичных дендритных процессов [62].Хотя конкретная функция этих клеток остается неизвестной, Rabi et al. предположили, что они могут быть недендритными дополнительными антигенпрезентирующими клетками [62]. Распределение DCs в субэпителии неоднородно, и они (DCs) мигрируют из этого места в эпителий, где встречаются с антигенами [62].
3.3. Иммунные клетки в зоне трансформации шейки матки (CTZ)
CTZ представляет собой резкий переход между иммунологически различными областями нижней и верхней FRT, а именно экто- и эндоцервиксом [60, 63].Это (CTZ), по-видимому, область с ослабленным иммунитетом, поскольку она является участком множества патогенных состояний, включая ВИЧ и метапластический плоский эпителий, которые развиваются в плоскоколончатом соединении. Поэтому довольно удивительно, что несколько исследований специально изучали клетки из этого иммунологически стратегического региона. Действительно, это было показано как предпочтительная локализация лимфоцитов и APC в CTZ шейки матки, в сущности, устанавливая «последнюю» линию защиты и «проводя линию» между эктоцервиксом, нагруженным патогенами (внизу) и «стерильным». эндоцервикс (верхний FRT) [60].В частности, было показано, что CD8 + и TIA1 + Т-клетки накапливаются в CTZ, подразумевая, что CTZ функционирует как «последний» иммунологический барьер для восходящих микробов. Однако, как ни удивительно, этот сайт с более высокой концентрацией CD4 + является предпочтительным местом заражения ВИЧ-1 [60], и более 90% случаев рака шейки матки происходят от него [64]. До сих пор неясно, почему такая богатая иммунными клетками область и стратегическая иммунологическая «граница» или ориентир очень чувствительны к заболеваниям и злокачественной опухоли (рис. 8).
3.4. Иммунные клетки в слизистой оболочке эндоцервикса
Плотность популяции Т-клеток и макрофагов в эндоцервиксе намного ниже, чем у эктоцервикса, где преобладает CD8 + [4, 60]. Эндоцервикс содержит многочисленные плазматические клетки IgA + и IgM + , которые опосредуют гуморальный иммунный ответ [60]. Более того, дендритные клетки CD1A + не наблюдаются или не локализуются в эпителии, железах или собственной пластинке эндоцервикса [60].Также, что интересно, никаких различий не наблюдалось в количестве и характере локализации лейкоцитов во время пролиферативной и секреторной фаз менструального цикла или у женщин в постменопаузе [60]. Тем не менее считается, что половые гормоны влияют на функции иммунных клеток [60] (рис. 8).
Как указывалось ранее, экто- (или нижний FRT) и эндоцервикс (или верхний FRT) представляют собой две иммунологически разные области с некоторыми вариациями в профиле субпопуляций иммунных клеток.Например, CD3 + и В-клеток в эктоцервиксе вдвое больше, чем в эндоцервиксе [58], и, кроме того, как CD4 + , так и CD8 + Т-клетки более распространены в эктоцервиксе, чем эндоцервикс [58]. 58]. Однако между двумя регионами есть и некоторые сходства. Например, количество подмножеств NK-клеток CD56 bright CD16 — и CD56 dim CD16 + существенно не различается между эндо- и эктоцервиксом и, как правило, NK-клетками, продуцирующими IL-22, известно, что они играют ключевую роль в иммунитете слизистых оболочек, очень редко обнаруживаются в шейке матки [58].Краткое содержание обзора представлено на Рисунке 8.
4. Иммунный профиль экто- и эндоцервикса во время различных репродуктивных фаз
4.1. Общий обзор
Эстрадиол (E 2 ) и прогестерон (P), которые секретируются яичниками во время менструального цикла и беременности, являются основными регуляторами клеточной функции (эпителиальной, фибробластной, миометриальной и иммунной) FRT. [57, 65]. Иммунные клетки, в состав которых входят естественные киллеры (NK), макрофаги, дендритные клетки и Т-клетки, являются основными клетками, ответственными за борьбу с инфекциями, одновременно обеспечивая успешное зачатие и последующее развитие и рождение плода [4, 40, 66].В частности, иммунологические эффекты двух гормонов (E 2 и P) противоречивы, т. Е. В то время как P оказывает противовоспалительное действие, индуцируя транскрипцию белков и факторов роста, которые смягчают воспаление и способствуют восстановлению слизистых оболочек [66], E 2 , с другой стороны, регулирует активность различных воспалительных факторов транскрипции, таких как AP-1, SP1, STAT и рецептор витамина D в клетках матки человека [44], а также изменяет иммунный ответ шейки матки. эпителиальные клетки [40].
4.2. Менструальный цикл
Менструальный цикл делится на две основные фазы: (1) пролиферативная (FRT) или фолликулярная фаза (яичниковая) и (2) секреторная (FRT) или лютеиновая фаза (яичниковая) [67]. Как указывалось ранее, изменения и колебания гормонального фона во время менструального цикла оказывают сильное регионально-специфическое влияние на функциональный статус иммунной системы FRT, включая шейку матки [4].
Например, в середине цикла (овуляция), когда уровни E 2 высоки, продукция антимикробных пептидов ингибируется в нижнем FRT, создавая таким образом окно уязвимости для инфекции [68].С другой стороны, активность цитотоксических клеток в верхнем FRT снижается в то время, когда увеличивается продукция антимикробных пептидов, что оптимизирует условия для успешной имплантации [58, 68]. Кроме того, во время пролиферативной стадии менструального цикла (перед овуляцией) цервикальные / вагинальные выделения содержат более высокие уровни антимикробных пептидов по сравнению с другими фазами цикла [68], таким образом дополняя и усиливая их защитные барьерные возможности против микроорганизмов, помимо иммуномодулирующие эффекты.
Пролиферативная фаза также характеризуется ангиогенезом и регенерацией тканей эндометрия и шейки матки, при этом концентрация иммунных клеток в эндометрии в это время снижается [65]. Напротив, при более низкой FRT колебания уровней половых гормонов не влияют на количество иммунных клеток, которые остаются постоянными на протяжении всего цикла [60]. Примерно в середине цикла, когда маточный ангиогенез достигает пика, в матке облегчается набор врожденных иммунных клеток, таких как NK-клетки, нейтрофилы и макрофаги [4].Этот набор опосредуется цитокинами, хемокинами и факторами роста, которые в основном продуцируются клетками эндометрия и фибробластами матки под влиянием обоих половых стероидов [65]. В целом, 40-50% лейкоцитов в FRT — это Т-клетки [57, 58, 69], и во время фазы пролиферации большинство Т-клеток в эндометрии диспергированы или сконцентрированы в небольших агрегатах в строме или в виде эпителиальных лимфоцитов [ 4]. Лимфоидные агрегаты (LA) структурно имеют ядро В-клеток в центре, окруженное CD8 + Т-лимфоцитами и инкапсулированное макрофагами [70].Эти иммуноагрегаты образуются в эндометрии, но не в эктоцервиксе или нижнем FRT, в отсутствие инфекции [70]. Однако они (МА) имеют максимальный размер в середине цикла и сохраняются во время секреторной фазы и могут обеспечивать защиту от вторичных инфекций или могут играть роль в поддержании репертуара Т-клеток и предотвращении потери резидентных клеток памяти во время менструации [4, 70] .
Во время поздней секреторной фазы и менструации, что связано со снижением уровня половых стероидов и последующим инициированием воспалительной реакции, количество иммунных клеток в эндометрии увеличивается [57, 65, 71].Эти воспалительные реакции включают снижение метаболизма простагландинов, потерю защиты от активных форм кислорода (АФК) и повышенный синтез провоспалительных простагландинов, цитокинов, хемокинов и матриксных металлопротеиназ (ММП), что приводит к привлечению лейкоцитов. В совокупности эти действия приводят к разрушению тканей и характерным кровотечениям, связанным с менструацией [71].
Макрофаги , с другой стороны, составляют только около 10-20% лейкоцитов FRT [4, 57, 58].Однако их больше в строме эндометрия, чем в эндоцервиксе или эктоцервиксе, и их количество остается стабильным во время фазы пролиферации [4]. NK матки клетки составляют около 30% лейкоцитов во время периода имплантации и увеличиваются в количестве во время секреторной фазы и заселяют эндометрий до беременности [65, 72]. До сих пор неясно, как именно увеличивается количество NK-клеток [4]. В целом, множество иммунных клеток, включая нейтрофилы, NK-клетки, макрофаги, эозинофилы и DC, мигрируют в матку в ответ на гормональные изменения [71, 73].Например, абстиненция фосфора вызывает менструацию и воспалительную реакцию в эндометрии, что приводит к притоку лейкоцитов, которые опосредуют разрушение и восстановление тканей [4].
4.3. Постменструальный цикл
Во время менопаузы колебания половых гормонов снижаются, а их уровни остаются низкими и постоянными [74]. Эти гормональные изменения приводят к различным изменениям, в частности, к прогрессирующему нарушению регуляции системной иммунной системы, что приводит к повышенной восприимчивости к инфекциям и злокачественным новообразованиям, снижению ответов на вакцинацию и усилению общего воспаления [75].Более того, женщины, по-видимому, теряют свое иммунологическое преимущество после менопаузы, поскольку с возрастом они становятся более восприимчивыми к инфекциям и развитию воспалительных заболеваний [68]. Специфические изменения в системной иммунной системе включают снижение соотношения клеток CD4 + : CD8 + , увеличение количества дифференцированных эффекторных Т-клеток и Т-клеток памяти, истощение наивных Т-клеток и снижение частоты В-клеток [75]. Естественные киллеры (NK), которые борются с вирусными патогенами и опухолями, увеличиваются с возрастом [75].Однако они (NK-клетки) демонстрируют снижение цитотоксичности и способности продуцировать цитокины [75, 76]. Старение также связано с повышением уровня провоспалительных цитокинов, что, как следствие, приводит к усилению воспалительного состояния [75]. В частности, у женщин в постменопаузе наблюдаются более высокие уровни провоспалительных цитокинов в сыворотке крови, таких как моноцитарный хемоаттрактантный белок 1 (MCP1 / CCL2), фактор некроза опухоли альфа (TNF α ) и IL-6 и свободные радикалы [59]. С другой стороны, CD4 + T- и B-лимфоцитов и цитотоксическая активность NK-клеток обычно снижаются [59] (Таблица 1).
Множество иммунных факторов, зависящих от эстрогена, снижает во время менопаузы.К ним относятся потеря функции толл-подобных рецепторов (TLR), снижение секреторных антимикробных компонентов, отсутствие образования цервикальной слизи, изменения в комменсальных лактобацилл и кислотности вагинального микроокружения [75], а также общее старение иммунных клеток [77]. Специфические изменения шейки матки, связанные со старением иммунных клеток, включают потерю дендритных клеток и резидентных Т-клеток памяти [77]. Необходимы дальнейшие исследования для оценки иммунного ответа шейки матки у женщины в постменопаузе. 5. ВыводыШейка матки играет сложный балансирующий акт в женском воспроизводстве под влиянием половых стероидных гормонов, действуя как патоген и «привратник» зародыша / плода, т. Е. С одной стороны, он блокирует распространение патогенов. верхний FRT, обеспечивая при этом сперму и устранение менструальной жидкости и прохождения плода при рождении. Дисфункция этой сложной роли может привести к серьезным гинекологическим и акушерским осложнениям, таким как развитие полипов и кист, дисплазия, рак и цервикальная недостаточность, инфекции мочевыводящих путей, бактериальный вагиноз, кандидоз и вирусные инфекции.Разработка эффективных методов лечения этих расстройств будет зависеть от всестороннего понимания основных молекулярных механизмов, управляющих иммунным ответом местных слизистых и иммунных клеток во время различных женских репродуктивных фаз. Новые технологии, такие как метагеномика, метаболомика и транскриптомика, должны помочь разобраться в этих сложностях. Конфликт интересовАвторы заявляют об отсутствии конфликта интересов относительно публикации этой статьи. Регулирование свойств и функций кишечных эпителиальных клеток с помощью аминокислотКишечные эпителиальные клетки (IEC) выстилают поверхность кишечного эпителия, где они играют важную роль в переваривании пищи, всасывании питательных веществ и защите человеческого тела от микробные инфекции и другие. Дисфункция IEC может вызвать заболевания. На развитие, поддержание и функции IEC сильно влияет внешнее питание, такое как аминокислоты.Аминокислоты играют важную роль в регулировании свойств и функций IEC. В этой статье мы кратко рассмотрели текущее понимание роли аминокислот в регуляции свойств и функций IEC в физиологическом состоянии, в том числе в гомеостазе IEC (дифференциация, пролиферация и обновление), в структуре и функциях кишечного эпителиального барьера. и в иммунных ответах. Мы также обобщили некоторые важные данные о влиянии добавок аминокислот (например,g., глутамин и аргинин) для восстановления функций IEC и кишечника при некоторых патологических состояниях. Эти результаты будут способствовать нашему пониманию важной роли аминокислот в гомеостазе IEC и потенциально могут помочь в выявлении новых мишеней и реагентов для терапевтического вмешательства при заболеваниях, связанных с дисфункциональными IEC. 1. Введение1.1. Пищеварительная система, структура и функции кишечникаЧеловеческое тело имеет несколько уровней организации: клетки, ткани, органы и системы органов.Работая вместе, системы органов человека снабжают клетки организма основными биологическими материалами, которые им необходимы для функционирования, а также способствуют удалению отходов. Они также работают согласованно, чтобы поддерживать температуру, pH и другие условия на оптимальном уровне для поддержки клеточных процессов. Пищеварительная система выполняет три основные функции: переваривание пищи, усвоение питательных веществ и удаление твердых пищевых отходов. К органам пищеварительной системы относятся те, которые составляют желудочно-кишечный тракт (ЖКТ) (например,g., пищевод, желудок, тонкий и толстый кишечник) и вспомогательные органы (например, печень, желчный пузырь и поджелудочная железа). Тонкий и толстый кишечник составляют основную часть желудочно-кишечного тракта. Расположенные в брюшной полости, они являются основным местом переваривания и всасывания питательных веществ из принятой пищи [1]. Тонкая кишка состоит из трех отделов: двенадцатиперстной кишки, тощей кишки и подвздошной кишки [2]. Двенадцатиперстная кишка — это первый и самый короткий сегмент тонкой кишки. Получает частично переваренную пищу из секрета желудка и поджелудочной железы, содержащую пищеварительные ферменты; он играет важную роль в переваривании пищи.Тощая кишка находится в средней части кишечника, соединяя двенадцатиперстную кишку и подвздошную кишку. Он содержит круглые складки и ворсинки для увеличения площади поверхности для поглощения мелких частиц питательных веществ, которые ферментативно перевариваются в двенадцатиперстной кишке. Поглощенные питательные вещества затем попадают в печень через энтерогепатический кровоток. Подвздошная кишка является третьей частью тонкой кишки и содержит ворсинки, похожие на ворсинки тощей кишки. Подвздошная кишка поглощает витамин B12, желчные кислоты и другие питательные вещества, не усваиваемые тощей кишкой [2].В слепой и толстой кишке (толстой кишке) ворсинки отсутствуют. Структура поперечного сечения тонкой кишки состоит из четырех слоев: слизистой оболочки, подслизистой основы, мышечного слоя и адвентиции [3] (рис. 1). Слизистая оболочка состоит из эпителиальных клеток, которые выделяют слизь в виде густой защитной жидкости. Основные функции слизистой оболочки — поглощение и транспортировка питательных веществ, поддержание влажности тканей и защита организма от патогенов и посторонних частиц [4]. Подслизистая основа представляет собой относительно тонкий внеклеточный матрикс, богатый коллагеном, который поддерживает слизистую оболочку и соединяет ее с мышечным слоем.Мышечный слой состоит из мышечной ткани; он отвечает за движения кишечника, такие как перистальтика [3]. Адвентиция — это гладкая тканевая мембрана, состоящая из двух слоев мезотелия, висцеральной мембраны и париетального слоя. Адвентиция выделяет серозную жидкость [3].
1.2. Свойства и функции эпителиальных клеток кишечника (IEC)IEC существуют как слой клеток, выстилающих просветную поверхность кишечного эпителия. IEC постоянно заменяются каждые 4-5 дней в процессе обновления и миграции.Новые IEC производятся стволовыми клетками, расположенными в криптах у основания кишечных желез. Эти стволовые клетки дают начало предшественникам, которые дифференцируются в типы зрелых IECs, поскольку они (за исключением клеток Панета) мигрируют вверх по оси крипта-ворсинка [5]. Престарелые ИЭК подвергаются апоптозу и выводятся в просвет кишечника. В эпителии кишечника присутствует несколько типов клеток, включая энтероциты, клетки Панета, бокаловидные клетки и нейроэндокринные клетки (рис. 1). Энтероциты являются основным типом клеток кишечного эпителия.Они представляют собой простые столбчатые эпителиальные клетки и играют важную роль в абсорбции питательных веществ (например, ионов, воды, сахара, пептидов и липидов) и в секреции иммуноглобулинов. Бокаловидные клетки составляют около 10% всех IEC. Бокаловидные клетки выделяют слизь, которая смазывает прохождение пищи по кишечнику и защищает стенку кишечника от пищеварительных ферментов [6]. Клетки Панета обнаруживаются только в тонком кишечнике, особенно в подвздошной кишке [7]. Клетки Панета синтезируют и секретируют антимикробные пептиды и белки.Сообщалось, что клетки Панета могут непосредственно ощущать кишечные бактерии через клеточно-автономную активацию MyD88-зависимого toll-подобного рецептора (TLR), запускающего экспрессию множества антимикробных факторов [8]. Клетки Панета — долгоживущие клетки; они мигрируют вниз к основанию крипт после дифференциации от стволовых клеток. Нейроэндокринные клетки могут выделять кишечные гормоны или пептиды в кровоток при стимуляции, чтобы активировать нервные реакции [9]. Также известно, что нейроэндокринные клетки действуют как хеморецепторы, инициируя пищеварительные процессы, обнаруживая вредные вещества и инициируя защитные реакции [10]. Другие типы клеток, о которых сообщается, включают экзокринные клетки и эндокринные клетки. Экзокринные клетки расположены в слизистой оболочке тонкой кишки; они секретируют слизь, пептидазу, сахарозу, мальтазу, лактазу, липазу и энтеропептидазу [9]. Эндокринные клетки секретируют холецистокинин и секретин. Их секреция в основном регулируется химусом: чем больше химуса присутствует, тем больше секреция [11]. 2. Аминокислоты регулируют свойства и функции IEC2.1. Поглощение аминокислот в кишечникеПо данным Национальной академии наук инженерной медицины, рекомендуемая диета составляет 0,8 грамма белка на килограмм веса тела [12]. Большинство этих белков не могут быть поглощены человеческим организмом в их предварительно переваренном состоянии и должны быть преобразованы в аминокислоты перед поглощением [13]. Пищеварение описывает процесс, с помощью которого сложные пищевые вещества превращаются в простые формы, которые могут усваиваться организмом.Переваривание белков начинается в желудке и заканчивается в кишечнике. Для переваривания белков важны три фермента: пепсин, трипсин и химотрипсин [14]. Кислая среда в желудке денатурирует белки и делает их доступными для протеолитического переваривания. Пепсин является основным протеолитическим ферментом в желудке, где он превращает большие белки в более мелкие пептиды. Частично переваренные пептиды попадают в тонкий кишечник, где они далее разлагаются активированным трипсином и химотрипсином. Трипсин и химотрипсин секретируются поджелудочной железой в виде неактивных форм и превращаются в активные формы, когда секретируются в тонкий кишечник [14].Переваривание белков может быть дополнительно усилено протеазами, такими как аминопептидаза N. Аминопептидазы могут переваривать белки от аминоконца и образовывать отдельные аминокислоты или ди- и трипептиды [15]. Поглощение аминокислот в основном осуществляется IEC посредством активного транспорта [16]. Эти IECs сильно поляризованы, причем апикальная плазматическая мембрана обращена к просвету кишечника. Поскольку существуют разные типы транспортеров, локализованных либо в апикальной, либо в базолатеральной мембранах, IECs могут транспортировать вещества в одном направлении через эпителий.На апикальной поверхности МЭК насчитывается более 7 типов переносчиков аминокислот [17, 18]. Один тип — это Na + / транспортная система аминокислот; он переносит аминокислоты из просвета кишечника в клетки. По крайней мере, 5 переносчиков аминокислот присутствуют на серозной (базолатеральной) поверхности, которые могут транспортировать аминокислоты из клеток в интерстициальную жидкость [17] (Рисунок 2). Затем аминокислоты могут поступать в кровеносные сосуды для циркуляции. Непереваренные и неабсорбированные вещества попадают в толстую кишку.
2.2. Аминокислоты регулируют пролиферацию и дифференциацию IECПоддержание и рост кишечника определяется количеством питательных веществ в просвете. Высокое содержание питательных веществ приводит к увеличению количества клеток, длины ворсинок и глубины крипт [13, 19, 20]. Кроме того, тип питательных веществ, по-видимому, способствует изменениям морфологии и функций IEC. Недавнее исследование показало, что L-глутамин усиливает рост кишечных энтероцитов за счет активации у млекопитающих пути передачи сигнала рапамицина (mTOR), независимо от AMP-активируемой киназы (AMPK) [21].В другом исследовании было обнаружено, что добавление глютамина в рацион (1% L-глутамина, вес: вес) у поросят увеличивает экспрессию в кишечнике генов, необходимых для роста клеток и удаления оксидантов (120–124%), и снижает экспрессию генов, способствующих оксидативный стресс и активация иммунной системы (34–75%) [22]. Было обнаружено, что диета с высоким содержанием белка стимулирует экспрессию генов, связанных с пролиферацией клеток и функцией химического барьера в толстой кишке крысы [23]. Это исследование показало, что диета с высоким содержанием белка увеличивает количество непереваренных пептидов, попадающих в толстую кишку, изменяет состав микробиоты кишечника и увеличивает ферментацию белка бактериями, что приводит к выработке многочисленных метаболитов, полученных из аминокислот [23]. Также было обнаружено, что обработка раствором аминокислот (1,0 г / л треонина, 1,2 г / л валина, 1,1 г / л серина, 0,2 г / л тирозина и 1,6 г / л триптофана) увеличивала скорость пролиферации IECs в мыши, подвергшиеся воздействию радиации. Обработка увеличила маркеры пролиферации (например, Ki-67, p-Erk, p-Akt и PCNA) и маркеры стволовых клеток (Lgr5 +), снизила маркеры апоптоза (например, расщепленную каспазу-3) и повысила уровень белка натрия. –Водородообменник 3 (NHE3) и натрийзависимые переносчики глюкозы (SGLT1) в мембране щеточной каймы [24].Мыши, получавшие этот раствор аминокислоты, демонстрировали пониженную межклеточную проницаемость (сужение слизистого барьера), повышенную абсорбцию Na + и улучшенную выживаемость при воздействии смертельной дозы облучения всего тела. Результаты показали, что лучшее всасывание электролитов и питательных веществ может быть, по крайней мере частично, связано с увеличением высоты ворсинок, индуцированным раствором аминокислоты, и что путь внеклеточной киназы, регулируемой сигналом (ERK), в IECs был активирован аминокислотой. решение [24]. Было обнаружено, что пероральное введение L-глутамина (0,5%) поросятам-отъемышам увеличивает высоту ворсинок и глубину крипт, снижает окислительный стресс, увеличивает скорость пролиферации IEC и снижает скорость апоптоза IEC [25]. В культивируемых эпителиальных клетках кишечника свиней (IPEC-1) L-аргинин стимулировал скорость пролиферации и ослаблял гибель клеток, индуцированную липополисахаридом (LPS) [26]. В механистическом исследовании авторы обнаружили, что обработка L-аргинином увеличивает относительные уровни белка фосфорилированного mTOR и фосфорилированного рибосомного белка S6 киназы-1 и снижает относительные уровни белка TLR4 и фосфорилированного ядерного фактора, усилителя легкой каппа-цепи активированных В-клеток ( NF-B) в клетках IPEC-1, обработанных LPS. 2.3. Аминокислоты регулируют барьерные функции кишечного эпителияIEC плотно связаны в монослой межклеточными соединительными комплексами. Эти межклеточные связи позволяют эпителию образовывать барьер, который отделяет внеклеточную жидкость на просветной стороне клетки от жидкости на серозной стороне, а также предотвращает микробную инвазию в интерстициальные ткани [27]. Плотные соединения являются основным фактором, определяющим свойства и функции кишечного эпителиального барьера.Плотные соединения предотвращают прямую диффузию малых молекул из просвета кишечника в интерстициальные пространства, а затем в кровеносные сосуды [28]. Нарушение структур плотных соединений из-за специфических мутаций белков или из-за аберрантной передачи сигналов может быть как причиной, так и следствием заболеваний [27]. В последние годы исследования установили важную роль глутамина в регуляции функций белков плотных контактов (рис. 2). В человеческих клетках Caco-2, классической модели для изучения барьерной функции кишечника, было обнаружено, что депривация глутамина или ингибирование глутаминсинтетазы значительно снижает трансэпителиальную резистентность и снижает экспрессию белков плотных контактов.Добавление глутамина спасало фенотип барьерной дисфункции [29]. В другом исследовании авторы обнаружили, что депривация глутамина активирует путь фосфатидилинозитол-3-киназы (PI3-K) / Akt и снижает экспрессию белка плотного соединения клаудин-1, что приводит к нарушению барьерной функции (со снижением трансэпителиального электрического сопротивления и повышенная проницаемость) [30]. Другие соединительные белки, такие как ZO-1, occludin и claudins, были описаны как важные эффекторы перифункциональной регуляции плотных соединений, опосредованной актомиозиновым кольцом [31].На модели желудочно-кишечной инфекции поросят, связанной с отъемом, было обнаружено, что добавление глутамина (4,4%, мас. / Мас.) Сохраняет барьерную функцию кишечного эпителия в дистальном отделе подвздошной кишки поросят во время инфекции [32]. При воздействии E.coli уровни экспрессии клаудина-1 и окклюдина снижались у животных, получавших контрольный корм, но не у поросят, получавших глутамин. Исследование показало, что добавление глютамина было полезным для уменьшения тяжести инфекции, вероятно, за счет снижения цитокиновых ответов слизистой оболочки и сохранения барьерной функции кишечника [32].Пероральный прием глутамина у крыс с повреждением кишечной ишемии-реперфузии (IR) показал значительное увеличение веса тощей и подвздошной кишки и слизистой оболочки, а также высоты ворсинок и глубины крипт по сравнению с крысами, не получавшими IR [33]. Добавка глутамата (2%) продемонстрировала положительное влияние на показатели роста свиней, которых кормили зараженными плесенью кормами, улучшила несбалансированную антиоксидантную систему и уменьшила вызванные микотоксинами нарушения в структуре кишечника [34]. Сообщалось, что дефицит пищевого глутамина нарушает передачу сигналов клеток и приводит к атрофии кишечника как у поросят, так и у младенцев [35]. Добавка L-аргинина в дозе 0,5% или 1% для свиней-отъемышей защищает и усиливает иммунную функцию слизистой оболочки кишечника и поддерживает целостность кишечного барьера после заражения LPS E. coli [36]. В модели мышей с воспалительным заболеванием кишечника (ВЗК) добавление L-аргинина подавляло индуцированное декстрансульфатом натрия (DSS-) повреждение слизистой оболочки кишечника и улучшало клинические параметры ВЗК (например, выживаемость и потерю массы тела) [37]. Добавка L-аргинина с пищей также уменьшала вызванное метотрексатом повреждение слизистой оболочки кишечника и улучшала восстановление кишечника после травмы у крыс [38].Сообщается, что кормление L-аргинином in ovo улучшает развитие и барьерные функции тонкой кишки у вылупившихся бройлеров, что связывают с активацией пути mTOR [39]. 2.4. Аминокислоты регулируют иммунитет кишечникаIEC играют важную роль в защите человеческого организма от микробных инфекций. Кишечник содержит наибольшее количество иммунных клеток в организме [40] и постоянно подвергается воздействию широкого спектра антигенов и потенциальных иммунных стимулов [27].IEC могут ощущать микробные стимуляции и реагировать на них, чтобы усилить свою барьерную функцию и участвовать в координации соответствующих иммунных ответов, от толерантности до иммунитета к антипатогенам. Поскольку IEC функционируют как барьер между кишечной микробиотой и хозяином, они важны для поддержания симбиотических отношений между кишечной микробиотой и хозяином, создавая слизистые барьеры, секретируя иммунологические медиаторы и доставляя бактериальные антигены.Инфламмасома, экспрессируемая IEC, играет важную роль в иммунной защите и воспалении слизистой оболочки [41]. Дисфункция кишечного эпителия может вызывать заболевания, а некоторые заболевания вызывают аномалии в кишечном эпителии, которые могут усугубить осложнения. Большинство иммунологических процессов происходит в слизистой оболочке [42]. Пятна Пейера являются важными компонентами кишечной лимфоидной ткани (GALT) в тонком кишечнике (рис. 1). В-клетки обычно доминируют в зародышевых центрах фолликулов, а Т-клетки разбросаны между фолликулами.В-клетки в GALT играют центральную роль в иммунных ответах кишечника. Нарушения функций В-клеток могут вызывать развитие аутоиммунитета [43]. Клетки B-1 производят большую часть циркулирующих естественных антител. Они могут дифференцироваться в клетки, секретирующие иммуноглобулин M- (IgM-) или IgA, и влиять на гомеостаз тканей и поддержание симбиотической микробиоты слизистой оболочки с помощью BCR-зависимых и независимых средств [43]. Отсутствие в кишечнике IgA-продуцирующих B-1 клеток может увеличить риск пищевой аллергии [44].Регуляторные Т-клетки (Treg) представляют собой субпопуляцию Т-клеток. Их функция заключается в подавлении дисрегулируемых иммунных ответов других иммунных клеток для поддержания гомеостаза кишечника [45]. Предполагается, что Treg играют важную роль в других физиологических и патофизиологических процессах, включая патогенез ВЗК, контролируя микробное разнообразие кишечника и способствуя изменению формы / репарации кишечной ткани в ответ на повреждение [45]. Адекватное питание необходимо для развития и поддержания иммунной системы.Обширные исследования пролили свет на гомеостатическую регуляцию аминокислот в кишечном иммунитете. Было обнаружено, что глутамин снижает продукцию провоспалительных ИЛ-6 и ИЛ-8 в биоптатах кишечника и повышает уровень противовоспалительного ИЛ-10 в кишечнике [46]. IL-10 в основном продуцируется лейкоцитами (например, Т-клетками и В-клетками), а также эпителиальными клетками. IL-10 играет важную роль в поддержании гомеостаза слизистой оболочки кишечника и в подавлении провоспалительных реакций клеток врожденного и адаптивного иммунитета [47].Ока и его коллеги обнаружили, что по сравнению с регуляторными B-клетками (Bregs) от здоровых контролей, у Breg от пациентов с болезнью Крона нарушена продукция IL-10, и что у мышей с истощенными Breg развивалось более тяжелое воспаление кишечника по сравнению с контролем. Результаты показали, что уменьшение или потеря функции Breg усугубляет воспаление кишечника [48]. Было показано, что продуцирующие IL-10 регуляторные клетки B10 ингибируют DSS-индуцированное воспаление / повреждение кишечника на модели колита на мышах [49]. Было показано, что аминокислоты влияют на развитие, созревание и функции В-клеток и Т-клеток в кишечнике. Было показано, что дефицит аргинина нарушает раннее созревание B-клеток у трансгенных мышей F / A -2 + / + , что приводит к резкому снижению количества B-клеток в тонком кишечнике и снижению уровня IgM в сыворотке [50]. Исследования с использованием аминокислотного транспортера ASCT2-дефицитных мышей ( Slc1a5 — / — мышей) продемонстрировали, что ASCT2 играет важную роль в развитии ответов Т-хелперов 1 (Th2) и Th27, а также в регуляции функции Т-хелперных клеток CD4. [51].Было обнаружено, что из-за снижения импорта глутамина передача сигналов mTORC1 в Т-клетках была снижена, а провоспалительные ответы CD4 + Т-клеток были ослаблены [51]. Cobbold и его коллеги обнаружили, что истощение незаменимых аминокислот ингибирует активацию и пролиферацию Т-клеток и передачу сигналов mTOR в дендритных клетках [52]. Было обнаружено, что глутамин необходим для активации Т-клеток. Истощение запасов глутамина блокирует пролиферацию и секрецию цитокинов Т-клетками. А активация Т-клеток индуцировала поглощение и метаболизм глутамина, регулируемые передачей сигналов ERK / MAPK [53].Икеда и его коллеги обнаружили, что аминокислоты с разветвленной цепью (BCAA, например, изолейцин) регулируют поддержание Treg через Slc3a2-зависимое метаболическое перепрограммирование. Мыши, получавшие диету с пониженным содержанием BCAA, имели пониженное количество Treg Foxp3 + , а Foxp3 + Tregs у мышей на диете с пониженным содержанием лейцина демонстрировали дефектную пролиферацию [54]. Было показано, что пероральный прием L-аргинина улучшает иммунную функцию кишечника и снижает транслокацию бактерий и эндотоксинов у экспериментальных крыс с тяжелым острым панкреатитом [55].Лечение увеличило количество CD3 + и CD4 + Т-лимфоцитов и соотношение CD4 + / CD8 + в собственной пластинке слизистой оболочки кишечника [55]. Эти данные могут помочь понять положительный эффект глутамина на снижение заболеваемости и проницаемости кишечника у пациентов с травмой полиорганной системы [56]. На крысиной модели пункционной травмы мозга введение глутамина уменьшало повреждение кишечника и снижало активность кишечного NF-B и экспрессию кишечных провоспалительных цитокинов [57]. Исследования орального и парентерального питания показали, что, помимо общего потребления белка, наличие определенных пищевых аминокислот (особенно глутамина, глутамата и аргинина) также имеет важное значение для оптимизации иммунных функций кишечника [42].Дефицит таких аминокислот, как триптофан, аргинин, глутамин и цистеин, может снизить активацию иммунных клеток [58]. Было показано, что эти аминокислоты играют уникальную роль в поддержании целостности, роста и функции кишечника, в нормализации секреции воспалительных цитокинов, в улучшении количества Т-лимфоцитов, специфических функций Т-клеток и секреции IgA [59]. На модели крыс с язвой, вызванной 2,4,6-тринитробензолсульфоновой кислотой (TNBS), по сравнению с крысами, получавшими контрольную диету, у крыс, получавших глицин, наблюдались легкие язвы и локализованные воспалительные клетки на слизистой оболочке и подслизистой области. , снижение активности миелопероксидазы толстой кишки (70%) и снижение TNBS-индуцированной мРНК IL-1 β и TNF- α [60]. Исследования на мышах продемонстрировали, что стимуляция диетическими аминокислотами регулирует гомеостаз макрофагов в тонком кишечнике. Например, когда мышам давали полное парентеральное питание, которое лишало животных энтеральных питательных веществ, наблюдалось значительное снижение количества макрофагов, продуцирующих IL-10 (например, макрофагов F4 / 80 + CD11b +) в тонком кишечнике, тогда как IL-10 -продуцирующие CD4 + Т-клетки остались без изменений [61]. Производство IL-10 в тонком кишечнике зависит как от диеты, так и от микробиоты.Эти данные продемонстрировали сильную связь между аминокислотной депривацией и нарушением восстановления функции кишечного иммунитета; длительный дефицит белка (аминокислот) нарушает важные иммунные функции [61]. Было показано, что L-аргинин участвует в синтезе белка и в регуляции многих основных клеточных функций, включая иммунный ответ, секрецию гормонов и заживление ран [62]. Добавление L-аргинина (0,5%) свиньям увеличивало количество IgA-секретирующих клеток и CD8 + и CD4 + Т-клеток в подвздошной кишке [36].В человеческих клетках Caco-2 было обнаружено, что L-аргинин уменьшает воспаление кишечника за счет ослабления активации NF-B, вызванной интерлейкином-1 β — (IL-1 β -) [63]. L-аргинин и его метаболит орнитин способствуют заживлению эпителиальной раны толстой кишки за счет увеличения пролиферации клеток и отложения коллагена за счет активации сигнального пути mTOR [64]. Было показано, что пищевые добавки с глицином и L-глутамином защищают стенку толстой кишки облученных крыс [65, 66]. Хотя длительный дефицит белка может нарушить критические иммунные функции, было показано, что кратковременное ограничение белка повышает иммунитет к патогенам [67] и регулирует воспаление [68].Интегрированный стресс-ответ (ISR) — это скоординированная клеточная программа, которая позволяет эукариотическим клеткам воспринимать и реагировать на вызванные стрессом сигналы, включая недостаток питательных веществ (например, аминокислотное голодание) и стресс эндоплазматического ретикулума [69, 70]. General control nonderepressible 2 (GCN2) — сенсор ISR, который может определять истощение аминокислот [69]. Недавнее исследование показало, что острое аминокислотное голодание (с использованием диеты с 2% белками или диеты с дефицитом лейцина) подавляло воспаление кишечника и уменьшало тяжесть заболевания на модели колита, индуцированного DSS, через GCN2-зависимый механизм [69].Авторы продемонстрировали, что аминокислотное голодание активировало ISR, а GCN2 подавляло воспаление кишечника и ответы Th27 посредством механизма, зависящего от аутофагии, снижения окислительного стресса и снижения активации инфламмасом и продукции IL-1 β [69]. В предыдущем исследовании Сандруд и его коллеги обнаружили, что селективная депривация аминокислот ингибирует дифференцировку клеток Th27 и что небольшая молекула галофугинона избирательно ингибирует дифференцировку Th27, активируя путь ответа аминокислотного голодания.Авторы также обнаружили, что галофугинон подавляет связанное с Th27 аутоиммунное воспаление в двух экспериментальных моделях аутоиммунного энцефаломиелита на мышах [71]. Эти результаты иллюстрируют способность Т-клеток определять уровни аминокислот в локальной среде, а не использовать аминокислоту исключительно в качестве источника топлива, раскрывают механизм, связывающий восприятие аминокислот с воспалением кишечника через GCN2, и потенциально помогают идентифицировать новые цели для терапевтическое вмешательство при ВЗК и других воспалительных заболеваниях. Помимо мономерных единиц для синтеза белков, аминокислоты участвуют в различных клеточных функциях. Обширные исследования показали, что (1) аминокислоты играют важную роль в поддержании роста, структуры, гомеостаза и функций IECs; (2) аминокислоты регулируют структуру и функции кишечного эпителиального барьера; (3) аминокислоты регулируют функции кишечного иммунитета; и (4) добавление аминокислот имеет потенциал для улучшения патологий / фенотипов, связанных с дисфункциональными IEC, за счет восстановления свойств (и функций) IEC (Таблица 1).Эти результаты помогают нам глубже понять важную роль аминокислот в гомеостазе ИЭК и в поддержании физиологии кишечника, пищеварительной системы и человеческого организма, а также потенциально могут помочь в выявлении новых мишеней и реагентов для терапевтических вмешательств при заболеваниях, связанных с дисфункциональными ИЭК. .
| |||||||||||||||||||||||||||||||

 д.
д.