Удаление доброкачественных новообразований | Медицинский центр SHiFA
Содержание
Опухолевые новообразования являются одной из самых распространенных патологий нашего времени. Причиной роста заболеваемости называют неправильное питание, стрессы, плохую экологию, нарушение гормонального баланса. Все эти провоцирующие факторы действительно оказывают негативное влияние на здоровье населения. Однако даже здоровый образ жизни не позволяет исключить риск развития опухоли. Поэтому необходимо знать о том, что представляет собой новообразование, чем оно опасно и как от него избавиться.
Что такое доброкачественная опухоль?
Опухоль – это патологическое образование, которое образуется в результате дифференцировки и неконтролируемого деления клеток. Последовательные мутации приводят к неопластической (опухолевой) трансформации клеток. В результате здоровые ткани утрачивают специфическую структуру, но чаще полностью или частично сохраняют функции. Процесс разрастания новообразования может сопровождаться повреждением окружающих здоровых тканей – опухоль сдавливает их, нарушая кровообращение, питание, регенерацию и другие естественные процессы.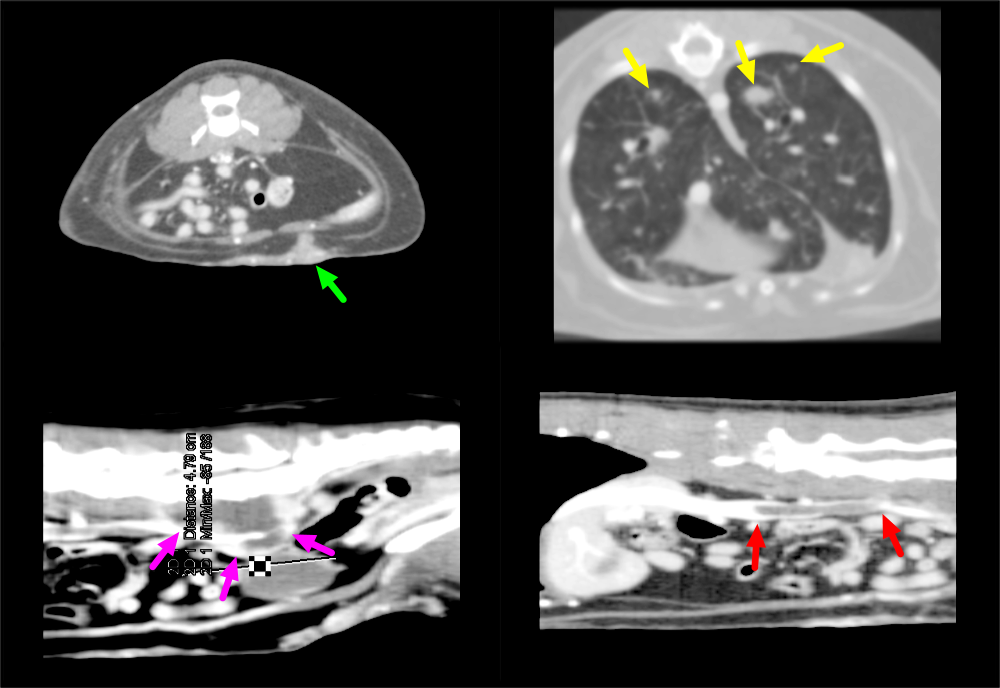
Виды доброкачественных опухолей
Опухоль – общее название множества новообразований, которые произрастают из различных тканей организма. Например, по типу тканей различают виды:
- Плоский и цилиндрический эпителий — Эпителиома;
- Железистый эпителий — Аденома;
- Соединительная ткань — Фиброма;
- Жировая ткань — Липома;
- Гладкомышечная ткань — Лейомиома;
- Костная ткань — Остеома;
- Хрящева ткань — Хондрома;
- Лимфоидная ткань — Лимфома;
- Поперечно-полосатая мышечная ткань — Рабдомиома;
- Нервная ткань — Невринома.
Методы лечения доброкачественных опухолей
Наиболее надежным методом лечения опухолей является оперативное удаление патологически измененных тканей. Так как доброкачественные новообразования не произрастают в окружающие ткани и не метастазируют, то удаление обычно не представляет особой сложности. Исключение составляют опухоли большого размера. Например, при некоторых формах миомы матки рекомендована гистерэктомия – ампутация органа вместе с опухолевым новообразованием.
Для удаления доброкачественного новообразования используют различные методы:
1. Хирургическое удаление опухолевых новообразований
Радикальное удаление опухоли путем иссечения в пределах здоровых тканей – самый надежный метод лечения. Он позволяет полностью удалить участок атипичных тканей и остановить рост опухоли, исключить риск малигнизации (озлокачествления). Удаленные оперативным путем ткани можно отправить на гистологическое следование для определения вида опухоли и уточнения диагноза (доброкачественная или злокачественная).
При хирургическом методе лечения опухоль иссекают – вырезают, удаляя все измененные ткани и клетки. При удалении небольших новообразований ткани эпитализуются, полностью или частично замещая повреждение. При удалении опухолей большого размера позже проводят дополнительно второй этап лечения – косметическое исправление дефекта.
Оперативное хирургическое лечение может использоваться в качестве основного метода или в комплексе с противоопухолевой терапией, иммунотерапией, химиотерапией, гормональной терапией и др.
При своевременно проведенном лечении в большинстве случаев удается добиться полного выздоровления и исключить риск рецидива.
Хирургическим методом удаляют следующие виды доброкачественных опухолей: фибромы, атеромы, жировики, миомы и др.
2. Криодеструкция
Криодеструкция – еще один метод лечения опухолевых новообразований. В настоящее время для криодеструкции используют жидкий азот. Локальное замораживание позволяет разрушать пораженные участки тканей, вызывая отторжение опухолевого новообразования. Причем криовоздействие может быть применено как для поверхностных тканей, так и для более глубоких слоев.
При локальном воздействии на пораженный участок не повреждаются окружающие здоровые ткани. Крионекроз является наиболее щадящим и практически безболезненным методом разрушения опухоли, не требующим анестезии. Воздействие холодом блокирует сосуды, делая удаление бескровным, то есть не возникает кровотечение.
Криохирургический метод очагового лечения жидким азотом дает противовоспалительный и антисептический эффект, ускоряет процесс регенерации, не вызывает обширных дефектов и грубых послеоперационных рубцов, требующих последующего косметического этапа.
Методом криодеструкции удаляют папилломы, аденомы, остроконечные кондиломы, истинные эрозии, бородавки, лечат паппиломотоз гортани, актинический кератоз и др.
3. Электрокоагуляция
Электрокоагуляция – метод удаления атипичных участков тканей с помощью высокочастотных электрических токов. В ограниченном участке, локально с помощью активного электрода создает операционное поле и методом теплового воздействия опухолевые ткани разрушают – подвергают деструкции. Применение высокочастотных токов исключает риск заражения и кровотечения. Однако возможно ожоговое поражение окружающих тканей.
Методом электрокоагуляции удаляют папилломы вирусной этиологии, родинки.
Обязательно ли удалять доброкачественные новообразования?
Не все доброкачественные новообразования потенциально опасны. Самые распространенные из них – родинки – возникают на протяжении жизни у каждого человека. Плоские безболезненные пигментированне невусы представляют собой скопление сосудов или клеток эпидермиса и дермы. Немеланомоопасные родинки запрещено пытаться самостоятельно удалять народными методами (например, прижигать чистотелом, делать примочки и припарки) и нужно стараться не повреждать.
Другие доброкачественные опухоли могут появляться, например, при нарушении гормонального баланса, и самостоятельно исчезать. Однако во многих случаях при визуальном исследовании невозможно точно определить вид опухоли (доброкачественная или злокачественная), нельзя исключить последующую малигнизацию. Например, когда с помощью УЗИ или МРТ у пациента обнаруживают новообразование, то установить его характер зачастую невозможно. Его удаляют хирургическим путем, а затем образцы тканей отправляют на гистологическое исследование для уточнения диагноза.
Показания к оперативному удалению новообразования
1. Показанием к удалению родинки служит оценка по тесту ABCDE:
- A – асимметричность новообразования, неравномерное разрастание.
- B – нечеткие, смазанные, изрезанные края.
- C – неоднородный цвет с синими, черными, красными вкраплениями.
- D – большой размер, ориентировочно это диаметр более 5-6 мм.
- E – изменение любой из характеристик (рост, пигментация, рельеф поверхности).
Если родинка начала изменяться внешне, появился зуд, припухлость, ощущается болезненность при пальпации, то необходимо немедленно показаться врачу.
2. Папиллома имеет вирусную этиологию и является результатом заражения ВПЧ. Если иммунитет не справляется с вирусом, то в результате проникновения и активизации хронической инфекции на слизистой или коже разрастается эпителий. Не весь паппиломотоз потенциально опасен, но существуют штаммы ВПЧ, которые вызывают малигнизацию клеток.
Онкогенный риск несут в себе новообразования, которые:
- Растут, увеличиваются в размерах, «расползаются», увеличивается их количество.
- Темнеют, светлеют, изменяют окрас.
- Становятся более плотными, имеют неоднородную структуру.
- Вызывают дискомфорт, боль.
Рекомендуется удалять любые новообразования, которые легко травмировать из-за их локализации. Это могут быть папилломы (или родинки), расположенные на шее, руках (особенно на локте), у женщин под резинками бюстгальтера. Также травмоопасными считаются крупные новообразования на пояснице. При повреждении кожных покровов через открытую рану легко проникает любая инфекция, создавая благоприятнее условия для воспалительных процессов, нагноения. Поэтому потенциально травмоопасные папилломы и невусы рекомендуется удалять даже в том случае, если они не беспокоят и не несут онкогенного риска.
3. Доброкачественные опухоли имеют различный этиопатогенез. Некоторые гормонально зависимые формы (миомы и др.) требуют наблюдения и лечатся медикаментозными методами (гормональной терапией), другие считаются относительно безобидными (фибромы), третьи причисляют к предраку (например, полипоз желудка и толстой кишки). Поэтому метод лечения всегда выбирается индивидуально после тщательного обследования и уточнения диагноза.
При обнаружении доброкачественных опухолей, характер которых выявить не удается, рекомендуется удалять их оперативным путем с проведением гистологического исследования иссеченных тканей. К таким новообразованиям относятся опухоли лимфатических узлов, внутренних органов и кожи, которые бывают внешне схожи с кистозными образованиями или, например, воспаленными лимфатическими узлами крупных размеров.
Что делать при обнаружении доброкачественной опухоли?
При обнаружении любых уплотнений, воспалений, «шариков» под кожей рекомендуется показаться врачу-онкологу для постановки диагноза.
Рак шейки матки – поиск специалистов и врачей
Определение: Что такое рак шейки матки (цервикальная карцинома)?
Рак шейки матки, известный также как цервикальная карцинома, представляет собой малигнизацию клеток шейки матки. В зависимости от происхождения опухоли в шейке матки выделяют плоскоклеточный рак и аденокарциномы.
При плоскоклеточной форме рак возникает в верхнем клеточном слое плоского эпителия и составляет 70% – 80% всех случаев. Аденокарцинома встречается гораздо реже, 10% – 20%, и развивается из железистой ткани цервикса.
Перерождение нормальных клеток в раковые занимает нескольких лет. Злокачественным опухолям предшествует предраковые изменения, которые могут быть легко выявлены на ежегодном гинекологическом скрининге рака с помощью мазка.
На стадии предрака или раннего развития заболевание почти всегда излечимо. Поэтому крайне важно проходить ежегодные проверки в возрасте от 20 лет у гинеколога.
Рак шейки матки или рак матки? В чем разница?
Матка состоит из тела и шейки матки. Рак шейки матки более распространен, чем рак тела матки. В зависимости от течения заболевания и терапии медицина также различает следующие опухоли матки:
• Рак шейки матки
•
Рак матки (рак эндометрия)
• Рак мышц матки (саркома мягких тканей)
Причины и факторы риска развития рака шейки матки
С течением времени были выявлены различные факторы риска развития рака шейки матки. Общим фактором здесь является в основном половые контакты. Так что риск возрастает при ранних и частых половых сношениях, а также зависит от количества сексуальных партнеров.
В частности, у женщин с хорошей интимной гигиеной и/или при половых контактах с обрезанными мужчинами (под крайней плотью, во влажной, теплой среде, микроорганизмы особенно хорошо размножаются) рак шейки матки встречается гораздо реже.
В данной связи также был подробно изучен вирус папилломы человека (ВПЧ). Оказалось, что вирус передается половым путем и часто приводит к злокачественной трансформации клеток шейки матки. При этом определенные типы вируса могут оставаться в вагинальной области в течение многих лет. Но даже вирусные инфекции, вызываемые вирусом простого герпеса или ВИЧ, а также курение, увеличивают риск.
Симптомы рака шейки матки
Лишь около 5% инфекций вызывают перерождение клеток в предрак или рак шейки матки. Заболевание, как правило, остается совершенно бессимптомным. Иногда могут наблюдаться мажущие кровотечения или на более поздних стадиях кровотечения во время полового акта или сладковатые выделения.
На очень поздних стадиях опухоль может сдавливать органы таза и тем самым привести к различным нарушениям работы мочевого пузыря и кишечника, а также боли различной интенсивности и продолжительности. Беременность не влияет на развитие рака.
Диагностика и стадии рака шейки матки
В рамках борьбы с раком раз в год гинеколог берет мазок из шейки матки у пациенток в возрасте от 20 лет. Полученные клетки исследуют под микроскопом на предмет их изменений. Результаты могут быть следующими:
• класс I: Цитограмма без особенностей
• класс II: Отдельные клетки меняются, но причин для беспокойства нет!
• класс III: Необходима дальнейшая оценка и уточнение
• класс IV: Весьма вероятен предрак (дисплазия) или ранняя стадия рака
• класс V: Весьма вероятен рак
Дальнейшая диагностика
Результат III не означает наличие рака. Тем не менее, через регулярные промежутки времени должен осуществляться контроль. Кроме того, также может быть выполнен анализ на ВПЧ. Клеточные изменения при результате III могут исчезать сами собой, без необходимости дальнейшей терапии. В данной ситуации лечащий врач-гинеколог предоставит пациенту все необходимые рекомендации.
Дальнейшая диагностика при результате IV или V
При результатах IV и V медлить нельзя, поэтому сразу проводят дальнейшую диагностику. Для оценки изменений клеток шейки матки используют кольпоскопию. Лечащий врач-гинеколог осматривает цервикс с помощью осветительного прибора, окрашивает подозрительные участки уксусной кислотой или йодом и проводит забор образца ткани. Кольпоскопия несильно отличается от обычного гинекологического осмотра и, как правило, безболезненна. Забор ткани, как правило, также в большинстве случаев не вызывает никакого дискомфорта.
Образец отправляется в лабораторию для гистологического исследования. Получение результатов может занять несколько дней. Если злокачественные клеточные изменения подтверждаются, проводится определение стадии заболевания в зависимости от степени распространения аномальных клеток.
Можно выделить следующие стадии:
• Предрак
• Рак шейки матки на ранней стадии
• Инвазивный рак (рак шейки матки)
Более подробная классификация предраковых поражений согласно CIN и SIL, а также рака шейки матки по FIGO или TNM представлена здесь:
https://www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/krebsarten/andere-krebsarten/gebaermutterhalskrebs/erkrankungsverlauf.html
Дальнейшая диагностика при раке шейки матки
Выбор других диагностических мероприятий после биопсии во многом зависит от конкретного случая. Для подготовки к терапии происходит сбор всех данных с помощью рентгеновских и ультразвуковых исследований, на определенных стадиях также МРТ (магнитно-резонансная томография) или ПЭТ-КТ, и определяется стратегия лечения. (Распространение, вовлечение соседних органов, метастазирование).
Лечение рака шейки матки
Лечение рака шейки матки зависит от стадии заболевания, возраста и общего состояния пациента и по возможности должно проводиться опытными
специалистами в области онкогинекологии
. При предраковых поражениях и ранней стадии рака для полного излечения достаточно операции.
Если опухоль распространилась только на шейку матки и не поразила другую часть влагалища или таза, операция является в данном случае лучшим методом лечения. Здесь также можно добавить химиорадиотерапию. Кроме того, возможна неоадъювантная химиотерапия (химиотерапия до операции) с целью уменьшения риска рецидива (повторного возникновения заболевания).
При распространении рака за пределы шейки матки в каждом отдельном случае решается, будет ли проводиться еще одна операция или же химиолучевая, химио- или лучевая терапия, что является более щадящим для пациента и, соответственно, не ухудшающим качество его жизни.
Лечение предраковых поражений
За предраком шейки матки (CIN) регулярно наблюдает гинеколог в течение 24 месяцев. Клетки могут как исчезнуть, так и малигнизироваться, в последнем случае их удаляют хирургическим путем. Операция выполняется путем локального иссечения пораженной ткани (в случае планирования беременности) или путем удаления всей матки (
гистерэктомия
). Опять же, каждый отдельный случай следует рассматривать индивидуально. Во время консультации с опытными специалистами онкогинекологического центра или клиники лечения рака все пожелания пациента тщательно взвешиваются с индивидуальными возможностями и рисками.
Лечение рака шейки матки на ранней стадии
На ранних стадиях хирургического иссечения может быть достаточно, как и в случае с предраком (конизация). При этом пораженные ткани удаляются с помощью ножа или электрической петли и исследуются патологом. Если разрез края не содержит клетки опухоли, можно предположить выздоровление в 98% случаях.
При планировании беременности в исключительных случаях возможно сохранение матки. Данный вопрос следует обсудить в индивидуальном порядке с лечащим гинекологом. Врач расскажет обо всех возможностях органосохраняющей хирургии и соответствующих рисках.
Лечение рака шейки матки на поздних стадиях
На более поздних стадиях рака шейки матки одной конизации недостаточно (хирургия шейки матки проводится в основном в амбулаторных условиях). В зависимости от степени распространения опухоли может удаляться вся матка, часть влагалища, яичники и пораженные участки мочевого пузыря, а также кишечника. Данный вопрос всегда решается в индивидуальном порядке. Часто рекомендуется и безоперационное лечение, а именно химиолучевая, лучевая, химио- или брахитерапия.
Какое безоперационное лечение рака шейки матки на поздних стадиях назначить и как улучшить качество жизни пациента, решает консилиум врачей конкретного медицинского центра.
Каковы шансы на выздоровление при раке шейки матки?
Наилучший прогноз наблюдается при раке шейки матки на ранней стадии. После удаления матки можно ожидать выздоровление в 95-100%. На более поздних стадиях шанс излечения значительно снижается.
После терапии важно проходить регулярные осмотры, чтобы своевременно обнаружить рецидив и принять соответствующие меры.
Большую роль играет первоначальная профилактика. Здесь важны регулярные осмотры, соответствующая интимная гигиена половых партнеров, обрезание и использование презервативов.
Скрининг рака способствует раннему выявлению, и вакцинация защищает от развития заболевания
Любая женщина, которая регулярно ходит к гинекологу, знакома с такой процедурой, как мазок Папаниколау, который берется при помощи тампона из шейки матки, а затем отправляется на лабораторное исследование. Благодаря данному тесту количество заболеваний раком шейки матки неуклонно снижается в последние годы.
Хороший скрининг позволяет обнаружить также множественные формы рака шейки матки на ранней стадии. Пик заболеваемости раком шейки матки приходится на 35-40 и 60-65 лет.
Путем выявления различных факторов риска в последние годы удалось вывести на рынок вакцину, предназначенную для предотвращения заражения вирусом ВПЧ (вируса папилломы человека). Данный вирус является причинным фактором в 70% случаев рака шейки матки. Вакцинация рекомендуется для девочек в возрасте от 12 до 17 лет, которые в лучшем случае не имели половых контактов.
Источники:
http://www.awmf.org/leitlinien/detail/ll/032-033OL.html
http://www.awmf.org/leitlinien/detail/ll/015-027.html
http://www.nds-krebsgesellschaft.de/bilder/pdf/123.pdf
http://www.aerzteblatt.de/pdf/105/47/a2541.pdf
https://www.krebsinformationsdienst.de/tumorarten/gebaermutterhalskrebs/was-ist-gebaermutterhalskrebs.php
Штаубер, Манфред; Вейер сталь, Томас (2007): акушерство и гинекология. Третьих, обновленные издания. Штутгарт: Georg Thieme (Duale Reihe).
Кек, Кристоф; Деншлаг, Доминик; Темпфер, Клеменз (2004): Экзамены по акушерству и гинекологии. 1000 вопросов с комментариями; 6 таблиц. Штутгарт: Thieme.
Колоректальный рак. Рак толстой кишки
Факторы риска развития колоректального рака
Основным фактором риска развития рака толстой кишки у формально здорового человека является возраст.
Так, заболеваемость РТК у пациентов в возрасте 40 лет и меньше составляет 8 на 100 000 населения, а у людей 60 лет и старше — 150 на 100 000 населения, причем это относится и к мужчинам и к женщинам.
95 % заболевших колоректальным раком в Великобритании — пациенты старше 50 лет.
Lynch H.T. et. аl. подсчитали, что риск развития колоректального рака:
- у формально здорового человека составляет 1-3 %;
- если родственник I порядка родства болел РТК, то риск повышается до 5 %;
- среди больных язвенным колитом риск развития колоректального рака составляет 15-30 %;
- среди пациентов с болезнью Крона — 15 %;
- с неполипозным наследственным колоректальным раком — 15-20 %;
- с наследственным семейным полипозом — 30-100 %
К факторам риска развития колоректального рака относятся полипы толстой кишки, которые сами по себе почти никогда не представляют угрозы для жизни. Однако, чрезвычайно важное клиническое и социальное значение определяется возможностью их малигнизации. По данным многих исследователей именно из полипов, в большинстве случаев развивается рак ТК. Исследования, проведенные в разных клиниках, свидетельствуют, что с увеличением размеров полипов возрастает пролиферативная активность в них, вплоть до злокачественной трансформации.
В аденоматозных полипах размером менее 10 мм фокусы аденокарциномы обнаруживаются редко, в 0,5-1% случаев, с увеличением размера полипа до 20 мм возрастает и риск малигнизации до 5-10 %.
Большие полипы малигнизируются в 20-30 % случаев. В результате проведенных нами исследований, было определено, что частота малигнизации ворсинчатых опухолей прямой кишки четко зависит от площади ее основания.
Если площадь основания опухоли менее 16 см2, то риск озлокачествления ее составляет 18,2 %, если же площадь основания более 16 см2, то риск малигнизации составляет 56.3 % (И.М.Русейкин, 2002). Множественные полипы более опасны, так как каждый из них имеет шанс малигнизироваться.
Хронические воспалительные заболевания толстой кишки, особенно длительно существующий неспецифический язвенный колит, представляют реальную угрозу развития РТК. У больных с неспецифическим язвенным колитом, длительность заболевания которого более 20 лет, риск развития рака достигает 50 %. У пациентов с болезнью Крона, также существует риск развития колоректального рака, который достигает 15-20 %, в зависимости от длительности заболевания.
Больные, которые были оперированы по поводу колоректального рака, тоже составляют группу риска развития рака в оставшихся отделах толстой кишки, так как злокачественные новообразования этого органа часто развиваются метахронно (последовательно). У 50 % больных вновь могут образоваться полипы, которые в 5 % случаев малигнизируются.
Безусловно, к группе риска относятся пациенты с диффузным семейным полипозом толстой кишки. При этом заболевании, как известно, появляются тысячи полипов во всех отделах толстой кишки, часть из которых малигнизируется в 100 % случаев. За развитие этого заболевания ответственен ген АРС (аденоматозный полипоз кишки), идентифицированный в длинном плече 5-ой хромосомы.
Пациенты с наследственным неполипозным колоректальным раком, как правило, имеют родственников с такой же патологией не менее чем в двух генерациях. При этом заболевании наиболее часто встречаются мутации hMLh2 и hMSh3 генов, затем hMSH6, hPMS1 и hPMS2 генов. У 70 % пациентов с наследственным неполипозным колоректальным раком злокачественное новообразование развивается в возрасте 45-65 лет. При этом заболевании могут образоваться так же неопластические процессы в других органах: мозге, (синдром Тюрко), матке, яичниках, желудке, почках, щитовидной железе и др. (синдром Гарднера). У 60 % таких пациентов раковая опухоль развивается в проксимальных отделах толстой кишки.
Диета и её влияние на развитие колоректального рака
В связи с тем, что толстая кишка является составляющей единой системы пищеварительного тракта, то роль этиологического фактора питания на развитие неопластических процессов в этом органе велика. О влиянии диеты на развитие колоректального рака можно судить по тем фактам, что мигранты, переехавшие из регионов с исходно низкой заболеваемостью раком толстой кишки в страны Северной Америки и Европы, употребляя пищу местного населения, заболевают колоректальным раком так же часто, как жители этих стран. Следует отметить, что у вегетарианцев весьма низкий уровень заболеваемости колоректальным раком. В современной литературе, в связи с этим обсуждаются в основном три гипотезы влияния факторов питания на развитие колоректального рака:
- Повышенное употребление животных белков
- Повышенное употребление животных жиров
- Повышенное употребление рафинированных углеводов
Многие исследователи придают важное значение в развитии колоректального рака употреблению в пищу большого количества животных белков. В конце прошлого века Gregor et. al. проанализировали сведения из 28 стран и определили, что там, где на душу населения употребляли большое количество мяса, возрастала заболеваемость КРР и, повышался уровень смертности от рака толстой кишки. Это связывали с распадом животных белков и внутрикишечным синтезом канцерогенных и коканцерогенных веществ, таких как метаболиты триптофана, нитрозамины и гетероциклические амины, содержащиеся в жареном мясе. Однако, более поздние исследования показали, что само употребление протеинов достоверно не способствует развитию колоректального рака, тогда как, процесс приготовления мяса (или плохо перевариваемая пища) может генерировать образование гетероциклических аминов, обладающих выраженной канцерогенной активностью.
Во многих статьях отмечается, что увеличение доли насыщенных жирных кислот способствует развитию колоректального рака. Так, изучение состава кала у населения разных стран показало, что у американцев, не соблюдающих диету, в среднем, в кале содержится около 800 мг стеролов, а у вегетарианцев — около 300 мг. Содержание желчных кислот (потенциальных канцерогенов) в кале американцев в 2.5 — 5 раз выше, чем у людей, не употребляющих в пищу животные жиры. Заболеваемость колоректальным раком у вегетарианцев значительно ниже. Высказывается предположение, что на развитие рака толстой кишки оказывает влияние изменение секреции желчи, метаболизм желчных кислот и состав микрофлоры толстой кишки. Процессы выделения и превращения желчных кислот во вторичные желчные кислоты зависят от количества клетчатки в пище, синтеза витаминов, уровня эстрогенов крови, от концентрации и соотношения микроорганизмов в толстой кишке. В современных статьях, посвященных этой проблеме, обсуждается вопрос о влиянии холецистэктомии на развитие колоректального рака, в связи с повышением уровня желчных кислот в кале. Мнения высказываются различные. Однако, проведенные специальные исследования не определили достоверную связь развития рака толстой кишки с удалением желчного пузыря.
Известно, что на образование канцерогенных соединений значительное влияние оказывает микрофлора толстой кишки и соотношение анаэробных и аэробных бактерий в ней. В странах с низкой заболеваемостью колоректальным раком такое соотношение микроорганизмов в кале составляет 0.5-1.5, а в регионах с высокой частотой развития рака толстой кишки 2.1-2.7 Лидирующее значение в этом отводится анаэробу clostridium paraputrificum, который способен разрушать желчные кислоты с образованием канцерогенных или коканцерогенных соединений.
На развитие колоректального рака оказывает влияние дефицит витаминов, особенно А и С, недостаток в пище такого элемента, как селениум и влияние химически вредны веществ, таких как асбест, афлотоксин и др. Рак ободочной кишки ассоциируется с многолетним курением, а развитие рака прямой кишки у мужчин связывают с злоупотреблением пива и другого алкоголя.
Некоторым протективным действием обладает кофе, за счет снижения секреции желчи, а так же употребление овощей, фруктов и морепродуктов.
Обобщая влияние факторов питания на развитие колоректального рака, можно представить следующую схему развития неопластических процессов в толстой кишке: повышенное потребление животных жиров, белков и рафинированных углеводов при малом количестве растительной клетчатки, создают условия для поступления в кишку химуса содержащего высокие концентрации желчных и жирных кислот. Это приводит к нарушению микробного пейзажа слизистой и изменению состава ферментов микробного происхождения, что способствует разрушению стероидов, желчных кислот с образованием канцерогенных или коканцерогенных соединений. Замедление пассажа по кишке создаёт лучшие условия для более длительного контакта канцерогенов со слизистой оболочкой толстой кишки.
Скрининг рака толстой кишки
Раннее выявление рака толстой кишки среди населения имеет 2 направления:
А. Обнаружение РТК у формально здоровых людей
Б. Обнаружение РТК в группах высокого риска.
Возраст — основной фактор риска развития колоректального рака у формально здоровых людей. Заболеваемость раком толстой кишки у пациентов разного возраста. 40 лет — 8 на 100 000 населения; 60 лет — 150 на 100 000 населения. Лица старше 50 лет составляют 37 % населения Великобритании. Именно на эту группу приходится 95 % от общего числа заболевших раком толстой кишки.
Риск развития колоректального рака
Лица без предрасполагающих обстоятельств -1 — 3 %
Рак толстой кишки у родственника 1 порядка — 5 %
Пациенты с НЯК и болезнью Крона — 15 — 30 %
Пациенты, перенесшие ранее операции по поводу рака толстой кишки, молочной железы,
яичника — 8 — 10 %
Пациенты с одиночными и групповыми полипами — 20 %
Пациенты с семейным полипозом — 30 — 100 %
Тесты на скрытую кровь в кале, проводимые в качестве скрининговых программ у здорового населения старше 40 лет, привели к противоречивым результатам из-за большого числа ложноположительных и ложноотрицательных ответов, а также из-за влияния диеты на результаты. Кроме того, сбор кала у формально здорового населения эстетически многими не воспринимается. Лишь 38% людей откликается на приглашение выполнить тест. После скрининга 2-6% формально здоровых людей имеют положительную реакцию на скрытую кровь в кале и в этой группе в 5-10% случаев выявляется РТК, железистые аденомы в 20-40% случаев. Вместе с тем многие исследователи считают, что сигмоскопия, проведенная у лиц с положительной реакцией на скрытую кровь, + пальцевое исследование прямой кишки, приводят к снижению смертности от РТК на 30%, за счет диагностики болезни на ранней стадии ее развития.
Пальцевое исследование прямой кишки позволяет выявить до 10% рака толстой кишки;
Ректороманоскопия — до 40% РТК;
Сигмоскопия проведенная до 60 см от анального края, позволяет выявить до 70% всех видов РТК.
На основании сказанного Американское Раковое Общество рекомендует лицам старше 50 лет пройти тестирование на скрытую кровь и раз в год подвергаться сигмоскопии.
Маркеры рака толстой кишки
Наиболее известный маркер рака толстой кишки — карциноэмбриональный антиген (СЕА) был открыт в 1965 году Gold end Freedman.
Опухоли толстой кишки получают потенциал метастазирования после прорастания подслизистого слоя кишки, богатого лимфатическими сосудами. Если опухоль не прорастает все слои кишки, метастазы в лимфоузлы обнаруживаются лишь в 10%, если пенетрируется серозная оболочка — в 60%. Если в лимфоузлах обнаруживается реактивная гиперплазия — это хороший прогностический признак. Рак толстой кишки после метастазирования в печень, может широко диссеминироваться по органам и тканям — легкие, кости и т.д. Метастазы в печени обнаруживаются на секции в 40% случаев.
Английский патолог Dukes еще в тридцатых годах ХХ века описал очередность этапов диссеминации рака прямой кишки. После возникновения опухоли в слизистой ее инвазия осуществляется в поперечном направлении (не по длиннику), т.е. опухоль растет преимущественно в сторону просвета кишки. Эта же закономерность характерна и для ободочной кишки.
Лимфатическая диссеминация колоректального рака может быть и при опухолях не прорастающих все слои толстой кишки. При хирургических манипуляциях по поводу рака толстой кишки возможна имплантация раковых клеток на новое место.
Классификация колоректального рака
Главным прогностическим фактором является стадия рака толстой кишки в момент первичной диагностики. От четкости и единого отношения к классификации рака ободочной кишки (РОК) во многом зависят показания к назначению адъювантного метода лечения и возможность сравнивать результаты предпринимавшихся оперативных вмешательств и способов комбинированного лечения. В настоящее время приняты и широко используются на практике несколько классификаций рака ободочной кишки.
В России, как и во всем мире, принято стадировать раковые опухоли по Международной TNM классификации злокачественных опухолей, разработанной Международным Противораковым Союзом. В 2002 г. вышло в свет 6 издание этой классификации. Предложено различать 5 стадий (O, I, II, III и IV).
Система TNM принята для описания анатомического распространения поражения всех отделов и изгибов ободочной кишки, от слепой, включая аппендикс, до сигмовидной включительно (ректосигмоидный выделяют отдельно). Во всех случаях необходимо иметь гистологическое подтверждение диагноза. До начала лечения используется клиническая классификация, основанная на данных различных исследований (рентгенологических, эндоскопических, ультразвуковых, биопсионных и др.). Эта классификация позволяет определиться в выборе того или иного метода лечения. После исследования операционного материала описывается патологическая классификация с оценкой первичной опухоли (рТ), состояния регионарных лимфоузлов (рN) и отдаленных метастазов (рМ). Эта классификация позволяет определиться с необходимостью выбора адъювантного метода лечения, высказаться о прогнозе результатов лечения.
Т — первичная опухоль
- Тх — Недостаточно данных для оценки первичной опухоли
- Т0 — Первичная опухоль не определяется
- Тis — Интраэпителиальная или с инвазией слизистой оболочки
- Т1 — Опухоль прорастает слизистую и подслизистую оболочки
- Т2 — Опухоль прорастает мышечный слой стенки кишки
- Т3 — Опухоль прорастает субсерозу или неперитонизированные участки ободочной кишки
- Т4 — Опухоль прорастает висцеральную брюшину, или непосредственно распространяется на соседние органы и структуры.
N — Регионарные лимфатические узлы
- NХ — Недостаточно данных для оценки регионарных лимфатических узлов
- N0 — Нет признаков метастатического поражения лимфатических узлов
- N1 — Метастазы в 1 — 3 регионарных лимфатических узлах
- N2 — Метастазы в 4 и более регионарных лимфатических узлах
При гистологическом анализе должны быть исследованы не менее 12 регионарных лимфатических узлов. Метастазы в лимфоузлах расположенных по ходу аорты и в зоне наружных подвздошных сосудов расценивают как М1.
М — Отдаленные метастазы
- МХ — Недостаточно данных для определения отдаленных метастазов
- М0 — Нет признаков отдаленных метастазов
- М1 — Имеются отдаленные метастазы
G — Гистопатологическая дифференцировка
- GХ — Степень дифференцировки не может быть установлена
- G1 — Высокая степень дифференцировки
- G2 — Средняя степень дифференцировки
- G3 — Низкая степень дифференцировки
- G4 — Недифференцированные опухоли
R — резидуальные опухоли
- RХ — Недостаточно данных для определения резидуальной опухоли
- R0 — Резидуальная опухоль отсутствует
- R1 — Резидуальная опухоль определяется микроскопически
- R2 — Резидуальная опухоль определяется макроскопически
Группировка по стадиям
- Стадия 0 — Тis, N0 M0
- Стадия I — Т1, Т2 N0 M0
- Стадия IIА — Т3 N0 М0
- Стадия IIВ — Т4 N0 M0
- Стадия IIIА — Т1, Т2, N1 М0
- Стадия IIIВ — Т3, Т4, N1 М0
- Стадия IIIC — Любая Т, N2 M0
- Стадия IV — Любая Т, Любая N, М1
В особых случаях используются дополнительные дескрипторы m, y, r, a. Символ mуказывает на первичную множественность опухоли, r — о рецидиве опухоли после полной ремиссии. Префикс a свидетельствует, что стадия заболевания установлена после аутопсии, а символ y используется, когда классификация определяется во время и после применения различных методов лечения.
Морфологический тип опухоли
Наиболее часто встречается аденокарцинома (более 80 % всех раковых опухолей толстой кишки), а так же слизистый рак, коллоидный, перстневидноклеточный, аденосквамозный, недифференцированный.
Приводим так же Международную морфологическую классификацию рака ободочной кишки:
- Аденокарцинома:
- высокодифференцированная;
- умеренно дифференцированная;
- низкодифференцированная.
- Слизистая аденокарцинома:
- мукоидный;
- слизистый;
- коллоидный рак.
- Перстневидно-клеточный рак — мукоцеллюлярный.
- Недифференцированный рак (carcinoma simplex, медуллярный, трабекулярный).
- Неклассифицируемый рак.
В России используется классификация рака толстой кишки, утвержденная ещё Минздравом СССР в 1980 году, которая подразделяет опухоль в зависимости от распространенности по кишке на IV стадии.
- I стадия — опухоль занимает менее половины окружности кишки локализуется в слизистой оболочке и подслизистом слое кишки, без регионарных метастазов.
- IIа стадия — опухоль занимает не более полуокружности кишки, не выходит за пределы кишечной стенки, без регионарных метастазов в лимфатических узлах.
- IIб стадия — опухоль занимает не более полуокружности кишки, прорастает всю ее стенку, но не выходит за пределы кишки, с наличием метастазов в ближайших регионарных лимфатических узлах.
- IIIa стадия — опухоль занимает более полуокружности кишки, прорастает всю ее стенку, поражения лимфатических узлов нет.
- IIIб стадия — опухоль любого размера при наличии множественных метастазов в регионарных лимфатических узлах.
- IVа стадия — обширная опухоль, прорастающая в соседние анатомические структуры и органы с множественными регионарными метастазами,
- IVб стадия — опухоль любого размера с наличием отдаленных метастазов.
Классификация колоректального рака по С.Е.Dukes
Широкое распространение во многих странах мира получила классификация колоректального рака по С.Е.Dukes.
В 1929 г. английский патолог С.Е.Dukes предложил выделять три стадии при КРР в зависимости от степени распространенности онкологического процесса в кишке:
- А — инвазия опухоли ограничивается подслизистым слоем,
- В — распространение опухолевой инвазии на мышечный слой
- С — прорастание всей стенки кишки и распространение онкологического процесса в околокишечную клетчатку (С1 — без метастазов в лимфоузлы и С2 — с метастазами в лимфоузлы).
Эта классификация оказалась простой и практически очень удобной.
В 1932 г. С.Е.Dukes сообщил о втором варианте своей классификации, при которой:
- стадия А предусматривает поражение всей толщи стенки, но без поражения лимфоузлов;
- при стадии В — прорастание всей стенки и периректальных тканей, но без поражения лимфоузлов;
- стадия С — метастазы в лимфоузлах при любом размере опухоли.
В 1947 г. С.Е.Dukes ввел IV стадию, при которой обнаруживаются отдаленные метастазы стадия D. Во многих работах настоящего времени приводятся данные в соответствии с классификацией С.Е.Dukes
Потенциал многопрофильного стационара и возможность участия на операции специалистов различного профиля, позволяет проводить резекции смежных органов и удалять значительные по распространенности рецидивы заболевания в пределах здоровых тканей.
Профессор И.А.Нечай
НМИЦ онкологии им. Н.Н. Блохина
Хирургическое лечение — самый древний и до сих пор основной радикальный метод борьбы со злокачественными заболеваниями. Операцией как единственным методом лечения рака можно обойтись в отдельных случаях на ранних стадиях, когда нет метастазов в близлежащие лимфоузлы и другие органы.
В других случаях к хирургическому вмешательству добавляют лучевую терапию или химиопрепараты или другое современное лечение.
Комбинацию методов лечения, разработку схемы первичного и последующего лечения, выбор оперативного доступа, объема операции, необходимость реконструкции органа хирург-онколог обсуждает с анестезиологом, лучевым терапевтом, химиотерапевтом и другими специалистами. Особенности хирургического лечения очень индивидуальны и зависят как от общего состояния пациента, там и от особенностей роста опухоли и ее стадии.
Виды хирургического лечения рака
Выбор объема хирургического вмешательства зависит от стадии опухолевого процесса и его распространенности, наличия метастазов, прорастания в соседние ткани и органы и сопутствующих заболеваний у пациента.
Существуют следующие виды хирургического лечения рака:
Профилактическая операция
При наличии предраковых новообразований с высоким риском малигнизации, или злокачественного перерождения, их удаляют хирургически в пределах здоровых тканей во избежание развития рака в дальнейшем.
Радикальная операция
Целью данного вмешательства является тщательное удаление опухоли в пределах здоровых тканей, перевязка артерий и вен, питающих ее, и а также удаление близлежащих лимфоузлов во избежание дальнейшего распространения опухолевых клеток с током крови или лимфы.
В зависимости от объема и расположения опухоли выполняют:
- резекцию, или частичное удаление органа;
- ампутацию, или удаление дистально расположенной части органа;
- экстирпацию, или полное удаление органа.
Паллиативная операция
Цель паллиативного лечения — облегчить состояние пациента при поздних стадиях рака, когда опухоль невозможно иссечь полностью или присутствуют множественные метастазы. Например, если опухоль проросла в соседние жизненно важные органы и полное ее удаление несовместимо с жизнью пациента, то ее удаляют частично — для уменьшения интоксикации организма, болевого синдрома, борьбы с осложнениями и улучшения общего состояния пациента.
Паллиативная хирургия помогает снизить дозу противоопухолевых препаратов или лучевой терапии для неоперабельных пациентов.
Диагностическая операция
Обычно проводят с помощью малоинвазивных методов: лапароскопии, эндоскопии и другого инструментария. Показана, когда инструментальные и лабораторные методы не позволяют точно поставить диагноз, определить тип опухолевых клеток и стадию заболевания. Во время диагностического вмешательства берут биопсию (кусочки ткани из разных мест опухоли для гистологического исследования).
Реконструктивная операция
Часто после объемных оперативных вмешательств с полным удалением пораженного органа требуется последующая реконструкция. Например, молочной железы, частей лица при их иссечении, или части кишечника, мочевого пузыря для восстановления жизнедеятельности организма. Современные методики и производство синтетических тканей для пластики обеспечивают быстрое и успешное развитие реконструктивной хирургии и реабилитации онкобольных.
Принципы абластики и антиабластики
Хирургия рака не обходится без строгого соблюдения принципов абластики и антибластики, вне зависимости от типа раковых клеток, стадии опухоли и зоны роста.
Абластика — профилактика рецидива и распространения опухоли путем ее осторожного удаления (без сдавливания и травмирования) единым блоком в пределах здоровых тканей вместе с лимфоузлами. В случае, когда регионарные лимфоузлы расположены на некотором расстоянии от первичной опухоли, операцию осуществляют в два этапа: на первом удаляют первичную опухоль, а на втором регионарные лимфатические узлы.
Антибластика подразумевает максимальную обработку послеоперационной раны от возможных остатков раковых клеток с помощью облучения, противоопухолевых препаратов, спирта и других способов.
В онкохирургии соблюдают следующие правила:
- однократное использования хирургических инструментов, марлевого материала; замена операционного белья, перчаток в процессе выполнения ключевых этапов операции;
- тщательное отгораживание опухоли с лимфоузлами от здоровых тканей;
- аккуратные манипуляции с опухолевым узлом для предотвращения выдавливания и попадания раковых клеток в кровь;
- раннее перевязывание магистральных вен во избежание попадания опухолевых клеток в кровоток
- промывание операционной раны цитотоксическими средствами;
- использование электроинструментария.
Осложнения после хирургического удаления рака
Такие же, как и при обычных хирургических вмешательствах, но могут быть более тяжелыми и длительными, учитывая общую интоксикацию организма опухолевым процессом, слабость, нарушение иммунитета и кроветворения у онкологических пациентов:
- инфекционные осложнения;
- кровопотеря;
- повреждение близлежащих тканей;
- послеоперационные боли.
Онкохирурги — высококвалифицированные врачи, которые обладают расширенным опытом и знаниями, необходимыми для ведения сложных операций. Учитывая длительный наркоз при обширных вмешательствах, высокий риск осложнений, потребность в дополнительных методах обработки раны и грамотной последующей противораковой терапии, проведение операции онкологическому пациенту рекомендуется в крупном специализированном онкоцентре с помощью команды врачей-специалистов.
Причины возникновения доброкачественных опухолей гортани
Врач оториноларинголог (ЛОР) клинико-диагностического центра Медпомощь 24 (пр. Заневский, д.71) Ботфириб Ульяна Азеровна специализируется на патологических изменениях гортани и поделилась с нами своим опытом, рассказала на какие симптомы стоит обратить внимание пациентам.
Опухоли гортани могут иметь злокачественный и доброкачественный характер. В структуре опухолевых заболеваний гортани доминируют доброкачественные образования (они встречаются в 10 раз чаще, чем злокачественные). По данным медицинской статистики, самая высокая заболеваемость регистрируется среди мужчин молодого и среднего возраста (от 20 до 45 лет).
Доброкачественные опухоли горла не несут в себе такой серьезной опасности для жизни и здоровья пациента, как злокачественные. Тем не менее, даже доброкачественные опухоли обязательно нужно своевременно лечить. Во-первых, всегда есть риск перерождения доброкачественных образований в злокачественные (например, папиллома горла перерождается в рак в 7-20% случаев, что является достаточно высоким показателем).
Доброкачественные опухоли гортани — локализующиеся в гортани опухолевые образования, отличающиеся медленным ростом, отсутствием изъязвлений и метастазирования. Доброкачественные опухоли гортани могут протекать бессимптомно. В других случаях они проявляются осиплостью и охриплостью голоса, кашлем, нарушением дыхания. При значительных размерах опухоли возможна полная афония и возникновение асфиксии. Диагностика доброкачественных опухолей гортани проводится отоларингологом и включает ларингоскопию, эндоскопическую биопсию и гистологическое исследование. Лечение доброкачественных опухолей гортани осуществляется хирургическим путем. Его методика зависит от вида опухоли и характера ее роста.
Причины возникновения доброкачественных опухолей гортани
Возникновение врожденных доброкачественных опухолей гортани связано с генетической предрасположенностью и воздействием на плод различных тератогенных факторов. К последним относятся инфекционные заболевания матери в период беременности (краснуха, корь, вирусный гепатит, хламидиоз, микоплазмоз, сифилис, ВИЧ), радиационное воздействие, прием беременной женщиной эмбриотоксичных медикаментов.
Причинами развития доброкачественных опухолей гортани приобретенного характера являются нарушения в иммунной системе, некоторые вирусные заболевания (ВПЧ, аденовирусная и герпетическая инфекция, грипп, корь), хронические воспалительные заболевания (хронический ларингит и фарингит, тонзиллит, аденоиды), длительное воздействие раздражающих веществ (вдыхание мелкодисперсной пыли, табачного дыма, работа в задымленном помещении), изменения в работе эндокринной системы, тяжелые голосовые нагрузки.
Симптомы доброкачественных опухолей гортани
Основная жалоба пациентов с доброкачественными опухолями гортани — это изменение голоса. Голос становиться охриплым или осиплым. Для доброкачественных опухолей гортани, имеющих длинную ножку, характерны перемежающиеся изменения в голосе и частое покашливание. Если опухоль локализуется в области голосовых связок и мешает их смыканию, то может наблюдаться полное отсутствие голоса (афония). Доброкачественные опухоли гортани большого размера вызывают затруднение дыхания и могут стать причиной асфиксии, что чаще отмечается у маленьких детей.
Фибромы — доброкачественные опухоли гортани соединительнотканного происхождения. Обычно это одиночные образования сферической формы, располагающиеся на свободном крае или верхней поверхности голосовой складки. Их размер варьирует от 0,5 до 1,5 см. Фибромы гортани имеют серую окраску и гладкую поверхность, могут быть на ножке. В случае, когда в структуре фибромы содержится большое количество кровеносных сосудов, она имеет красную окраску (ангиофиброма). Клинически эти доброкачественные опухоли гортани проявляются различными изменениями голоса. При достижении больших размеров могут приводить к нарушению дыхания.
Полипы гортани являются отдельным видом фибром, в структуру которых кроме соединительнотканных волокон входят клеточные элементы и большое количество жидкости. Эти доброкачественные опухоли гортани имеют менее плотную консистенцию, чем фибромы, имеют толстую ножку или широкое основание, могут достигать размеров горошины. Локализуются чаще в передней части одной из голосовых складок. Как правило, единственным проявлением полипа является охриплость голоса. Изменения дыхания или кашель обычно не наблюдаются.
Папилломы гортани у взрослых представляют собой одиночные, реже множественные, плотные выросты грибовидной формы с широким основанием. Они имеют белесоватую или розоватую окраску, при интенсивном кровоснабжении могут быть темно-красными. В отдельных случаях наблюдается распространение папиллом на слизистую трахеи. У детей наблюдаются ювенильные папилломы, которые чаще всего появляются в период от 1 до 5 лет. Этот вид доброкачественных образований гортани склонен к спонтанному исчезновению в период полового созревания ребенка. В детском возрасте чаще развиваются множественные папилломы, занимающие целые участки слизистой. В таких случаях говорят о папилломатозе. Внешне такие доброкачественные опухоли гортани отличаются мелкодольчатым строением и напоминают цветную капусту. Поражение обычно локализуется на голосовых складках, однако процесс может распространяться на надгортанник, подскладочную область, черпалонадгортанные складки, трахею. Клинически папилломатоз гортани проявляется переходящей в афонию охриплостью. При значительном разрастании папиллом возникает хронический стеноз гортани.
Ангиомы — доброкачественные опухоли гортани сосудистого происхождения. Как правило, имеют врожденный характер и представляют собой единичные образования. Гемангиомы (опухоли из кровеносных сосудов) имеют красную окраску, могут разрастаться в окружающие ткани и сильно кровоточат при травмировании. Лимфангиомы (опухоли из лимфатических сосудов) имеют желтоватый цвет и не склонны разрастаться.
Кисты гортани могут развиться из зародышевых жаберных щелей в результате нарушений эмбриогенеза. У детей также наблюдаются ретенционные кисты, образующиеся из желез слизистой оболочки гортани при закупорке их выводных протоков. Они редко бывают большой величины и поэтому практически не вызывают никаких симптомов.
Хондромы — плотные доброкачественные опухоли гортани, берущие свое начало из хрящевой ткани. С течением времени могут претерпевать злокачественное перерождение с развитием хондросаркомы.
Липомы — доброкачественные опухоли гортани желтой окраски и овоидной формы, часто имеющие ножку. Как и липомы других локализаций, липомы гортани состоят из жировой ткани.
Диагностика доброкачественных опухолей гортани
Доброкачественные опухоли гортани малых размеров, не препятствующие смыканию голосовых связок, протекают бессимптомно и могут быть случайно обнаружены отоларингологом при обследовании пациента по поводу другого заболевания. Клинически проявляющиеся доброкачественные опухоли гортани имеют довольно типичные симптомы, позволяющие их диагностировать. Однако при этом следует проводить дифференциацию доброкачественных опухолей гортани от инородных тел, склеромы и злокачественных процессов, которые могут давать подобную симптоматику.
Подтверждение диагноза доброкачественной опухоли гортани проводится по данным микроларингоскопии, позволяющей детально рассмотреть его внешний вид. Точно установить вид образования возможно после проведения его гистологического исследования. Гистология доброкачественной опухоли гортани чаще производится после ее удаления. В некоторых случаях показана эндоскопическая биопсия образования. Исследование голосовой функции, степени смыкания и подвижности голосовых связок проводится при помощи фонетографии, стробоскопии, определения времени максимальнойфонации и электроглоттографии. Для диагностики распространенности доброкачественных опухолей гортани может применяться рентгенография черепа, УЗИ, КТ или МРТ.
Диагностика новообразования гортани
- Консультация оториноларинголога, онколога.
- Непрямая ларингоскопия. КТ гортани.
- Рентгенография шеи в 2-х проекциях.
- Фиброларингоскопия.
- Биопсия гортани, гистологическое исследование.
Лечение доброкачественных опухолей гортани
Ввиду развития осложнений (нарушения голоса и дыхания), а также из-за вероятности малигнизации доброкачественные опухоли гортани подлежат хирургическому удалению. При небольших размерах фибром и полипов производится их эндоскопическое удалениеспециальной петлей или гортанными щипцами. Таким же образом удаляют изолированные папилломы гортани. Небольшие кисты гортани иссекают вместе с их оболочкой. При большой величине кист гортани предварительно производят их прокол и отсасывание находящейся в них жидкости, затем кисту вскрывают и удаляют ее стенки. Для предупреждения рецидива кисты после ее удаления производят криообработку основания.
Метод удаления доброкачественных опухолей гортани сосудистого генеза зависит от распространенности опухоли и характера ее роста. Локальные гемангиомы, характеризующиеся экзофитным ростом, иссекают, после чего проводят антирецидивную обработку пораженного участка путем диатермокоагуляции, криовоздействия или лазерного облучения. При распространенном характере и эндофитном росте этого вида доброкачественных опухолей глотки применяют их склерозирование или окклюзию питающих их сосудов.
Наиболее сложную задачу представляет лечение папилломатоза гортани. Операция заключается в иссечении измененных участков слизистой. Она проводится с использованием хирургического микроскопа для более точного определения границы здоровых тканей. Ограниченные участки папилломатоза могут быть удалены путем диатермокоагуляции, лазеро- или криодеструкции. Для профилактики рецидивов проведение хирургического вмешательства должно сопровождаться противовирусной и иммуномодулирующей терапией. С целью повышения иммунитета у детей с папилломатозом применяют аутовакцинацию, проводят дезинтоксикационное лечение. Рецидивирование папилломатоза после проведенной операции и значительное увеличение папилломных разрастаний является показанием к химиотерапии цитостатическими препаратами.
Папилломы гортани имеют вид сосочкового разрастания, с различной степенью ороговения и склонностью к рецидивированию после их удаления. Проявления папиллом зависят, прежде всего, от их локализации. При локализации в области голосовой щели появляется охриплость, продолжительное изменение голоса, иногда голос вообще пропадает. При развитии папиллом в надскладочном отделе больные отмечают ощущение инородного тела. Поражение, локализующееся под голосовыми складками, вызывает легкое першение, щекотание и покашливание, в дальнейшем могут наблюдаться затруднения при дыхании. Предложено много способов лечения папиллом. В настоящее время эффективными являются эндоларингеальное удаление опухоли.
Так как вовремя не леченные заболевания уха, горла, носа довольно часто приводят к грозным осложнениям поражающим и другие органы и системы (сердце, суставы, желудок, почки). Отоларинголог не только выявит причину заболевания, но и проведет лечение, профилактику, реабилитацию!
Особенности оперативного лечения злокачественных новообразований
Оперативное удаление опухоли — является основным лечебным методом в ветеринарной онкологии. Оно выполняется практически в любой ветеринарной клинике в нашей стране. Однако результаты операции зависят от многих факторов, часть из которых не всегда учитывается при подготовке к онкологической операции. Онкологическая хирургия имеет ряд особенностей на которых хотелось бы остановиться подробнее. Анализируя собственные неудачи и видя рецидивы после хирургической операции коллег, очевидным становится , что залог успеха хирургического лечения онкологических пациентов заключается в правильном планирование оперативного вмешательства и скрупулезном соблюдении принципов онкологической хирургии. Невозможно правильно спланировать операцию по удалению опухоли без предварительной морфологической диагностики удаляемого новообразования. Необходимо четко понимать какой объём удаляемых тканей необходимо иссечь при операции и какие хирургические границы резекции будут оптимальными. Особенно это важно, если опухоль находится в области головы или конечностей животного, так как в этих областях всегда существуют риски повреждения важных анатомических структур , что может привести к инвалидизации животного. Тем не менее, при удалении злокачественных опухолей уменьшение границы резекции опухоли приводит к возникновению рецидивов и стимуляции метастазирования. Визуально не возможно точно определить с какой именно опухолью имеет дело хирург. Существует ошибочное мнение среди некоторых коллег, что есть «достоверные» признаки по которым внешне можно определить злокачественная опухоль или нет. Например: злокачественная опухоль не имеет четких границ, а доброкачественная всегда окружена капсулой. Это не верно. Доброкачественная опухоль жировой ткани — липома, может не иметь чётких контуров, прорастает между фасциями мышц, особенно в области конечностей, и при этом её хирургическое удаление обычно не представляет сложностей. А злокачественные саркомы мягких тканей, очень часто образуют хорошо видимую капсулу, которая появляется в результате сдавления опухолью окружающих тканей и не является преградой для распространения опухолевых клеток вокруг видимой границы новообразования. Второй миф касается скорости роста опухоли. Считается , что злокачественная опухоль растёт быстро, а доброкачественная медленно. Это утверждение не всегда верно. При доброкачественных кистозных эпителиомах кожи внутри опухоли образуется полость , которая заполняется жидкостью. Этот процесс может идти достаточно быстро и опухоль увеличивается в размерах в 2-3 раза за короткое время. Такой же процесс может происходить при доброкачественных опухолях молочных желёз у собак. Но и злокачественные опухоли растут не всегда быстро. Например: тучноклеточные злокачественные опухоли кожи — мастоцитомы, долгое время, в течении месяцев, а иногда и лет, могут не увеличиваться в размерах, при этом метастазируя, в регионарные лимфатические узлы. Внешне такая опухоль кожи выглядит безобидно, но при не радикальном хирургическом удалении даёт быстрый рецидив в области операции и бурный рост метастазов по ходу лимфатических сосудов. Ещё одно заблуждение связано с мнением о том, что образование язвы в области опухоли говорит о её злокачественности. Мы много раз наблюдали животных, которые разгрызали и расчесывали кожный покров в области доброкачественного новообразования по причинам не онкологического характера. Особенно часто это бывает , если новообразование покрыто слизистой оболочкой в ротовой полости или в области влагалища. Многие годы работы с онкологическими пациентами убедили нас, что без морфологического уточнения диагноза нельзя приступать к планированию лечения онкологического больного. Для определения вида опухоли, хирург перед оперативным вмешательством производит взятие материала для цитологического или гистологического исследования. При этом ткани, которые были повреждены при взятии материала должны быть обязательно удалены при последующей операции. Когда опухоль находится в полости тела, предоперационная биопсия может привести к фрагментации новообразования и стимуляции имплантационного метастазирования. Поэтому решение о проведении предоперационной биопсии в таких случаях нужно принимать, только тщательно взвесив все факторы и риски. В остальных случаях предоперационная биопсия или цитология не увеличивает риски рецидива или метастазирования опухоли. Результат цитологии не является окончательным морфологическим диагнозом, но он позволяет спланировать объем операции и если опухоль злокачественная провести предоперационное обследование для определения стадии процесса. В онкологической хирургии существуют рекомендуемые границы хирургической резекции, в зависимости от гистологического типа опухоли. Доброкачественные опухоли могут быть удалены с захватом не значительного количества окружающих тканей. Достаточно отступить 0,5 — 1 см от края новообразования. Плоскоклеточный рак кожи требует отступать не менее 2 см здоровой ткани от видимой границы опухоли. При мастоцитомах разрез должен проходить не ближе 3 см от видимого края опухоли, а в глубину удаляются все ткани подкожной клетчатки до мышечных фасций. Если мастоцитома проросла до фасции, то мышца должна быть удалена полностью. После хирургического удаления необходимо провести гистологическое исследование. Определяют степень дифференцировки клеток и по возможности проводят иммуногистохимическое исследование, определяя уровень Ki 67. Эти данные помогают врачу принять решение о проведении адьювантной химиотерапии. Для злокачественной меланомы кроме гистологического типа, большое прогностическое значение имеет место локализации. Если меланома находится на коже, то достаточно будет отступить от края опухоли 1,5 — 2 см, прогноз при такой локализации, как правило благоприятный. Если же меланома находится на слизистой ротовой полости, то операция должна быть более радикальной. Необходимо отступить от края новообразования не менее 3 см и руководствуясь принципом блочности удалять опухоль вместе с окружающими тканями и костью черепа единым блоком. Это связано с данными статистики, которые показывают, что при диаметре опухоли более 2 см, более 50 % животных имели инвазию опухоли в прилежащую кость и метастазы в регионарный лимфатический узел. При этом в 40% случаев лимфатические узлы не были увеличены. Исходя из этих данных мы рекомендуем при злокачественной меланоме в ротовой полости и размере опухоли более 2 см всегда удалять региональные лимфатические узлы. Клетки меланомы имеют очень слабые связи друг с другом, поэтому при хирургическом удалении данной опухоли врачу необходимо неукоснительно соблюдать правила проведения онкологических операций. Во время операции опухоль нельзя брать руками, сжимать и травмировать инструментами, перед манипуляциями с опухолевой тканью хирург должен лигировать все крупные сосуды, питающие опухоль. После удаления новообразования реконструкцию раны следует проводить, используя новые перчатки и другой набор инструментов. О важности соблюдения этих правил свидетельствует статистика гуманной медицины. Процент рецидивов после удаления злокачественных меланом в обычном лечебном учреждении выше почти в 3 раза по сравнению с специализированным онкологическим центром. Ещё один вид опухоли, который требует всего арсенала онкологической хирургии — это саркомы мягких тканей.
Злокачественные опухоли молочных желез у собак и кошек являются одной из наиболее частых причин обращения к ветеринарному онкологу. Мне бы хотелось выделить две основные ошибки в лечебном подходе к новообразованиям этой локализации. Во -первых, это бездействие врача, связанное с недостатком квалификации. Очень часто встречается ошибочное мнение, что «маленькую» опухоль лучше не трогать, пока она не растет. Между тем следует напомнить, что злокачественная опухоль имеет возможность метастазировать с началом формирования ангиогенеза в опухоли, то есть при диаметре опухоли 0,5 мм! С этого момента раковые клетки уже могут попадать в кровяное русло. При этом следует помнить, что опухоли молочных желез склонны к малигнизации и с течением времени их злокачественный потенциал только усиливается. У кошек малигнизация опухолей молочных желез происходит особенно быстро. Скорость метастазирования злокачественной опухоли молочной железы не всегда коррелирует со скоростью роста первичного очага. Мы наблюдали наличие метастазов в легкие при опухоли молочной железы у кошки диаметром 1,5 — 1,8 см. (Т 2 М1) и у собак при размерах опухоли 3-5 см (Т 2), мы наблюдали отдаленные метастазы несколько раз. Поэтому рекомендацию наблюдение — при опухоли молочной железы (без цитологической диагностики и при отсутствии противопоказаний к хирургической операции) мы считаем профессиональной ошибкой, которая может перевести излечимое заболевание в неизлечимое. Однако у пациентов с большим коэффициентом наркозного риска, после проведения предварительной цитологической диагностики, при доброкачественном течении процесса, наблюдение может быть оправдано.
Вторая группа ошибок при лечении опухоли молочной железы связана с проведением не радикальной хирургической операции. При злокачественных опухолях молочных желез у собак радикальными следует считать регионарную или унилатеральную мастэктомию. Если врач не проводил предварительного цитологического исследования, то любую опухоль молочной железы следует считать потенциально злокачественной. У кошек мы рекомендуем проводить только унилатеральную мастэктомию. Это связано с особенностями лимфооттока от молочной железы у кошек и с более агрессивным ростом и развитием у них рака молочных желез . У собак регионарную мастэктомию возможно проводить двумя способами в зависимости от локализации опухоли. При локализации новообразования в паховых пакетах молочных желез удаляют обе паховые и грудную молочную железу единым блоком ( 3,4 и 5 молочные железы) вместе с регионарным лимфатическим узлом . При локализации опухоли в 1 или 2 грудной молочной железы, удаляют первые 3 молочные железы единым блоком. При поражении опухолью центральной молочной железы (3 -ей молочной железы) радикальной будет считаться только унилатеральная мастэктомия — это связано с особенностью лимфооттока от молочных желез. Отток лимфы от 1-2 пары грудных молочных желез осуществляется в подмышечные лимфоузлы, от 4 — 5 паховых молочных желез в паховые лимфатические узлы, а лимфоотток от 3 пары осуществляется как в грудные, так и в паховые лимфоузлы. Если при пальпации врач обнаруживает даже не значительное уплотнение в тканях молочных желез со стороны поражения опухолью, то такие железы считаются пораженными и нуждаются в удалении единым блоком вместе с молочными железами на которых опухоль определяется явно (принцип блочности в онкологической хирургии). Кроме того у кошек мы регулярно встречаем рецидивы в области 1-2 пары грудных молочных желез и поражение подмышечного лимфоузла после не радикальных операций проведенных в других лечебных учреждениях. Это показывает небрежное отношение некоторых хирургов к технике удаления ткани молочной железы. У кошек грудные молочные железы не имеют явно выраженного апоневроза в области глубокой грудной мышцы, поэтому она должна быть удалена единым блоком вместе с лимфоузлами. Не радикальная операция в этой области ведет к рецидиву, а рецидивная опухоль всегда является более злокачественной и активно метастазирующей, чем первичная.
Однако, существуют и случаи, когда хирургическое удаление опухоли является лечебной ошибкой. Во- первых, при наличии метастатического поражения внутренних органов, поскольку тогда операция не повлияет на продолжительность жизни животного, более того , есть данные, что удаление первичной опухоли может ускорять развитие метастазов. Во -вторых, хирургическое удаление воспалительно — инфильтративной формы рака молочной железы без предварительного применения лучевой или (и) химиотерапии заканчивается бурным рецидивом в течении 2 — 4 недель.
Целесообразность стерилизации при наличии опухоли молочной железы. Уже давно доказано, что злокачественные опухоли молочных желез у собак и кошек не эстрогенозависимые. Поэтому стерилизация животного не замедляет рост новообразования и не профилактирует возникновения новых опухолей, если животное имеет сформировавшийся гормональный фон. Профилактическим противоопухолевым эффектом обладает только стерилизация до первой течки и, в некоторой степени, до второй течки у сук.
Несколько слов следует сказать об особенностях хирургического удаления злокачественных новообразований, находящихся на органах брюшной полости. Чаще всего они поражают паренхиматозные органы: селезёнку, яичники, печень, не опустившиеся семенники в мошонку. Рост опухоли начинается в толще паренхимы и далее новообразование прорастает капсулу органа. Даже микроскопическое повреждение капсулы может привести к проникновению опухолевых клеток в брюшную полость и развитию имплантационного метастазирования в большом сальнике. В гуманной онкологии было доказано, что микрометастазы в большом сальнике обнаруживались даже у 17% онкологических больных с 1-2 стадией онкологического процесса, а у больных с 3-5 стадией метастазы обнаруживались у 70% больных. Мы в своей практике, много раз наблюдали имплантационное метастазирование в большой сальник у животных при злокачественных опухолях яичника, селезёнки и других локализаций. Поэтому для повышения радикальности операций , мы рекомендуем экстирпацию больного сальника при новообразованиях яичника и опухолей других локализаций в брюшной полости с повреждением капсулы органа или с вовлечением сальника в опухолевый конгломерат.
В заключении, хотелось бы пожелать коллегам, постоянно совершенствовать хирургическую технику, профессионально подходить к лечению онкологических пациентов, тщательно планировать оперативные вмешательства и как можно реже встречаться с рецидивом опухоли после проведения онкологической операции.
Автор статьи:
Брюшковский Константин Юрьевич
кандидат ветеринарных наук
Рак ободочной кишки | Онкологический диспансер Санкт-Петербурга
Общая информация
Выделяют наследственный и спорадический (возникший случайным образом) рак ободочной кишки. Развитие наследственного рака генетически связано с некоторыми полипозными или неполипозными синдромами. Такие наследственные болезни как семейный диффузный полипоз, синдром Гарднера и синдром Тюрко сопровождаются крайне высоким риском развития рака толстой кишки. Наследственный неполипозный рак ассоциирован с мутациями генов, отвечающих за репарацию ДНК. К 70 годам рак толстой кишки диагностируется примерно у 80% носителей данных мутаций. Кроме того, лица первой степени родства с больными раком толстой кишки имеют высокую степень риска возникновения этого заболевания.
Наиболее важными экзогенными факторами, влияющими на возникновение спорадического рака толстой кишки, являются диета, ожирение и гиподинамия (малоподвижный образ жизни) являются. Частота рака ободочной кишки выше в тех странах, где в рационе основной массы населения преобладает мясо и ограничено потребление растительной клетчатки. Мясная пища вызывает увеличение концентрации жирных кислот, которые в процессе пищеварения превращаются в канцерогенные агенты. Меньшая частота рака толстой кишки отмечается в сельской местности и странах с традиционной растительной диетой (Китай, Индия, страны Средней Азии и Центральной Африки). Согласно химической теории происхождения рака толстой кишки злокачественный процесс обусловлен мутагенным действием ряда экзо- и эндогенных химических веществ (канцерогенов) на клетки кишечного эпителия. Наиболее канцерогенными считаются полициклические ароматические углеводороды, ароматические амины и амиды, нитросоединения, а также метаболиты триптофана и тирозина. Канцерогенные вещества (бензпирен) могут образовываться при неправильной термической обработке пищевых продуктов, копчении мяса и рыбы. В результате воздействия канцерогенов на геном клетки происходят точечные мутации, приводящие к трансформации клеточных протоонкогенов в активные онкогены. Последние превращают нормальную клетку в опухолевую.
Ещё одним доказанным фактором риска возникновения рака толстой кишки являются воспалительные заболевания кишечника (ВЗК). Установлено, что у пациентов с болезнью Крона рак ободочной кишки возникает в 2,5 раза чаще, чем у здоровых людей. Также доказана высокая корреляция между неспецифическим язвенным колитом и колоректальным раком, особенно в случаях распространенного поражения язвенным процессом толстой кишки с анамнезом заболевания более 10 лет. Рак ободочной кишки у таких пациентов диагностируется в 5,2-30% наблюдений.
Полипы толстой кишки также достоверно увеличивают риск возникновения злокачественной опухоли. Индекс малигнизации одиночных полипов составляет 2-4 %, множественных (которые можно сосчитать) – 20 %, ворсинчатых образований – до 40 %. Полипы толстой кишки редко встречаются в молодом возрасте, а у лиц старших возрастных групп наблюдаются часто. По литературным данным, частота выявления полипов при аутопсиях составляет около 30 %.
Рак ободочной кишки развивается в соответствии с основными законами роста и распространения злокачественных опухолей: относительная автономность и нерегулируемость роста опухолевых клеток, снижение их дифференцировки, утрата органо- и гистотипического строения. Вместе с тем, имеются и свои особенности. Так, рост и распространение рака ободочной кишки происходят достоверно медленнее, чем аналогичные процессы, например, при раке желудка и поджелудочной железы. Опухоль толстой кишки длительное время не распространяется за пределы ее стенки.
Стадии рака ободочной кишки
Можно выделить три этапа развития опухолевого процесса:
- I и II стадии – опухоль ограничена самой толстой кишкой (возможно с подрастанием к соседним органам)
- III стадия – появляются метастазы опухоли в регионарные лимфатические узлы
- IV стадия – появляются отдалённые метастазы опухоли (печень, лёгкие, брюшина, отдалённые лимфатические узлы, головной мозг и др.)
I – III стадии можно считать потенциально излечимыми. IV стадия подлежит паллиативному лечению (расценивается как хроническое, неизлечимое заболевание). Следует отметить, что даже при IV стадии возможно длительное продление жизни. В настоящее время имеется определённый процент пациентов, переживающих 10-летний рубеж от момента выявления IV стадии рака ободочной кишки.
Чем ниже дифференцировка опухоли, тем выше ее степень злокачественности (более быстрый рост опухоли и более раннее метастазирование). Метастазирование рака ободочной кишки происходит лимфогенным (наиболее часто), гематогенным и имплантационным путями. Лимфогенное метастазирование идет по ходу питающих кишку сосудов, а также в лимфатические узлы брыжейки. Гематогенные метастазы наиболее часто обнаруживаются в печени, легких, головном мозге. Имплантационные метастазы возникают вследствие прорастания опухолью всех слоев кишечной стенки и распространения опухолевых клеток по брюшине (карциноматоз брюшины).
Клиническая картина рака ободочной кишки
Рак ободочной кишки является полисимптомным заболеванием. Его клинические проявления зависят от локализации опухоли (в правой или левой половине ободочной кишки), характера ее роста, размеров опухоли, стадии злокачественного процесса, наличия осложнений. Ранние формы рака практически всегда протекают бессимптомно и выявляются при колоноскопии по поводу других заболеваний или при диспансерном обследовании.
Большинство пациентов обращаются к врачу по поводу появления крови или слизи в каловых массах, нарушения стула в виде появившихся запоров или, наоборот, поносов, а также изменения формы каловых масс, в связи с кишечным дискомфортом, болевыми ощущениями в животе, ухудшением общего состояния.
При опухолях правой половины толстой кишки,которые более длительное время могут протекать бессимптомно, первыми признаками заболевания часто являются недомогание, слабость, снижение трудоспособности, ухудшение аппетита, похудание, анемия, субфебрильная температура тела (до +37,90С). В некоторых случаях одним из первых симптомов оказывается плотное образование в животе справа, которое обнаружил сам пациент.
Для опухолей левой половины ободочной кишки характерны запоры, которые появились без видимых причин и со временем участились, непостоянная примесь слизи и темной крови в стуле, испражнения в виде овечьего кала, необъяснимый метеоризм и эпизоды внезапных спастических или схваткообразных болей в животе без четкой локализации.
Возможные осложнения рака ободочной кишки:
- кровотечение из опухоли;
- острая обтурационная толстокишечная непроходимость;
- перфорация опухоли;
- параканкрозный абсцесс;
- местное распространение опухоли на соседние органы и ткани с нарушением их функций.
Диагностика рака ободочной кишки
«Diagnosis bona – curatio bona»
«Bene diagnoscitur, bene curatur»
Набор диагностических исследований при раке ободочной кишки имеет свои принципиальные особенности. Недостаточно просто выявить опухоль. Чрезвычайно важным является выполнение комплексного обследования с оценкой гистологического варианта и распространённости опухолевого процесса. От результатов правильно сформулированного диагноза зависит объём лечения и последовательность различных его этапов.
ВАЖНО! Если Вам говорят что-то вроде: «У вас рак! Надо срочно оперировать! Идти к онкологу и обследоваться – бесполезная трата сил и средств!» — ОБРАТИТЕСЬ К СПЕЦИАЛИСТУ-ОНКОЛОГУ!
Оперировать пациента, которому следует начинать лечение с лекарственной или лучевой терапии – неверно! Ошибочный диагноз ведёт к ошибочной лечебной тактике, а это, в свою очередь, ведёт к худшим прогнозам на выздоровление и дальнейшую жизнь!
Примерным минимумом обследований пациента с опухолью ободочной кишки следует считать:
- Комплекс клинических лабораторных исследований: клинический анализ крови, общий анализ мочи, глюкоза, АлТ, АсТ, билирубин общий, белок общий, креатинин, амилаза, С-реактивный белок, ПТВ+МНО, HBsAg, HCV-AT, AT HIV-1,2, антитела к Trep. Pallidum, СА 19-9, РЭА
- Электрокардиография
- Осмотр терапевта с заключением о наличии и выраженности сопутствующей патологии
- КТ грудной клетки и брюшной полости с контрастированием
- Фиброгастроскопия + фиброколоноскопия
- Исследование гистологического материала (биоптатов опухоли)
- Ирригоскопия при наличии стенозирующей опухоли, за которую невозможно зайти эндоскопом
- Женщинам дополнительно: УЗИ малого таза + осмотр гинеколога
По результатам первичного осмотра врача-онколога могут потребоваться дополнительные исследования и консультации (МРТ головного мозга, внутривенная урография, фибробронхоскопия, осмотр невролога, осмотр эндокринолога и т.д.). Их спектр строго индивидуален и зависит от распространённости опухолевого процесса и наличия сопутствующей патологии.
Хирургическое лечение рака ободочной кишки
Хирургия является основным методом лечения рака ободочной кишки при отсутствии отдалённых метастазов. Показания к операции всегда являются абсолютными. Выбор варианта хирургического вмешательства зависит от локализации опухоли, клинической стадии заболевания, наличия или отсутствия осложнений, а также общего состояния больного.
Операция должна выполняться обученными хирургами-онкологами с соблюдением основ онкохирургии – футлярности вмешательства, соблюдения мероприятий абластики и антибластики. Кроме того, для выбора правильной лечебной тактики в дальнейшем, необходимо удалить и исследовать не менее 12 лимфатических узлов.
ВАЖНО! К сожалению, мы регулярно сталкиваемся с негативными последствиями плохо выполненных хирургических вмешательств в неонкологических стационарах города! Тщательно взвешивайте выбор места прохождения планового хирургического лечения.
Лекарственное лечение
Адъювантная (профилактическая) полихимиотерапия (АПХТ) проводится после радикального удаления опухоли при отсутствии видимых опухолевых очагов в организме. Её цель – воздействие на нераспознанные и неопределяемые микрометастазы опухоли, которые теоретически могут иметься у пациента. АПХТ начинается в срок до 60 суток после операции. После 60 суток профилактическая химиотерапия считается неэффективной и необоснованной.
ВАЖНО! Своевременное начало профилактического и других видов лечения – ещё один веский повод проходить лечение в специализированных онкологических учреждениях!
Паллиативная химиотерапия проводится в случае наличия неудалимых очагов опухоли при метастатическом раке ободочной кишки. Её задачами являются увеличение продолжительности и улучшение качества жизни за счет замедления прогрессирования опухолевого процесса.
Наблюдение после окончания лечения
Согласно Приказу Минздрава РФ №915н от 15 ноября 2012 года «Об утверждении Порядка оказания медицинской помощи населению по профилю «онкология»», все пациенты после проведения специального лечения по поводу злокачественных опухолей подлежат пожизненному диспансерному наблюдению районным онкологом (находится в поликлинике по месту жительства). В первый год после окончания лечения пациенты должны осматриваться 1 раз в 3 месяца, второй год – 1 раз в 6 месяцев и начиная с третьего года наблюдения – 1 раз в год. Кроме осмотра пациентам показано выполнение соответствующих лабораторных и инструментальных исследований (зависит от вида и локализации опухолевого процесса).
Чтобы записаться на консультацию и осмотр у врача, обращайтесь к специалисту контактного центра:
Единый колл-центр: +7 (812) 607-03-03
Оценка края опухоли с увеличением лупы обеспечивает лучшее гистологическое удаление базальноклеточных карцином лица по сравнению с одним только клиническим обследованием
Фон:
Хирургическое удаление базальноклеточного рака лица (BCC) — это баланс между онкологическим клиренсом и сохранением косметических и функционально чувствительных тканей.
Задача:
Оценить, может ли увеличение с помощью лупы (LM) улучшить визуальную оценку краев опухоли BCC, что приведет к большему гистологическому клиренсу.
Материалы и методы:
В этом проспективном исследовании пациенты с первичными ОЦК на лице были рандомизированы на предоперационную оценку края опухоли с помощью LM (исследуемая группа) или только клиническое обследование (контрольная группа). Базальноклеточные карциномы иссекали с заранее определенным хирургическим краем в 2, 3 или 4 мм. Средняя гистологическая граница, частота неполного иссечения и метод закрытия были записаны и сравнены между LM и контрольной группами по диапазону хирургических полей.
Полученные результаты:
У 93 пациентов было удалено 94 BCC, по 47 BCC в каждой группе. Средняя гистологическая граница была больше в исследовании по сравнению с контрольной группой для каждой группы (2-миллиметровая граница, 1,8 против 1,4, 3-миллиметровая граница, 2,4 против 2,3, 4-миллиметровая граница и 3,1 против 2,7), но статистически значимо только в группа 4 мм (p = 0,032). Не было различий в способах закрытия между LM и контрольной группами.
Заключение:
Увеличение лупы улучшило оценку края опухоли для лицевого BCC, что позволило увеличить диаметр гистологического клиренса. Использование LM должно стать стандартной практикой при удалении BCC на лице.
Конфокальная микроскопия опухолевого ангиогенеза при низком увеличении
Благодарности
GM благодарит Боба Цукера (Агентство по охране окружающей среды США, Research Triangle Park, Северная Каролина) за вдохновение и обсуждения с малым увеличением, а также Томаса Д.Коутс (CHLA) для направления. Мы благодарим Shinya Yamada (CHLA и больница Hachioji при университете Токай, Токио, Япония) за метод латексной сосудистой гипсовой повязки. Мы благодарим Кларка Тома и Клауса Шрека (Leica Microsystems, Экстон, Пенсильвания) за конфокальное обслуживание на месте, Колю Вавровски (Cedars-Sinai Medical Center, Лос-Анджелес, ранее с Leica) за конфокальное обучение, Фрэнка Ли, Скотта Янга, Роба Дунакина, Дэвиду Земо, Бобу Фогелю и Крису Киеру за техническую поддержку и поддержку приложений. Мы благодарны Бобу Фогелю и Мартину Хоппе из Leica Microsystems за разрешение включить программное обеспечение LCS Lite в Paddock 2.0 книга CD-ROM. LCS Lite можно бесплатно загрузить с веб-сайта Leica Microsystems, а также у продавцов и дилеров Leica. Эксперименты с многофотонным возбуждением Hoechst 33342 были проведены на микроскопе Zeiss LSM 510 META NLO в Национальном медицинском центре города Надежды (http://www.cityofhope.org/LMC/LSM510.asp) в центре световой микроскопии в сотрудничестве с Доктор Кристин Браун, Ренат Старр и профессор Майкл Дженсен.
Мы благодарны Сэму Гамбиру за предоставленную трибридную конструкцию репортерного гена hrLuc-DsRed2-TK перед публикацией (Ray et al.[20]). Мы благодарим Дениз Петерсен, Карен Пеппер и Дона Кон, CHLA Gene Vector Core, за встраивание трибридного репортерного гена в лентивирусный вектор и трансдукцию клеток U87MG. Мы благодарим доктора Игнасио Гонсалеса за подготовку слайдов для гистологии и диагностику тканей. Мы благодарим Игнасио Гонсалеса, доктора Рекса Моатса, доктора Майка Росола, Майю Отто-Дюссель и доктора Шона Чена за обсуждения.
Эта работа была поддержана грантами Национальных институтов здравоохранения (CA 82989, W.E. Laug), T.Фонд Дж. Мартелла (Нью-Йорк) (У. Э. Лаугу) и грант на капитальное оборудование HRSA США (Я. ДеКлерку). Конфокальная и стандартная флуоресцентная микроскопия была проведена в Центре клеточной визуализации конгрессмена Джулиана Диксона детской больницы Лос-Анджелеса. Мультифотонная визуализация Hoechst 33342 в Национальном медицинском центре «Город надежды» была проведена в сотрудничестве с докторами Кристин Браун и Ренат Старр и финансировалась за счет грантов NIH профессору Майклу Дженсену.
Конфокальные микроскопы Leica SP5 и MP-NDD4 / SP5 / FCS / FLIM Университета Майами были приобретены на средства Фонда Исследовательского института диабета.Ронг Вэнь и Ивен Ли получают поддержку от Национального института глаз и Института глаз Баскома Палмера.
Использование наноплазмона-усиленного рассеяния и микроскопии с малым увеличением для количественной оценки полученных из опухоли экзосом
Экзосомы высвобождаются из большинства типов клеток и играют ключевую роль в межклеточной коммуникации, включая патофизиологические процессы, связанные с различными заболеваниями, поскольку они могут быть домом для определенных тканей или типов клеток и содержать множество нуклеиновых кислот, белков и липидов, которые отражают их клеточное происхождение и могут оказывать регулирующее воздействие на клетки-реципиенты 1 , 2 , 3 , 4 .Экзосомы часто секретируются на повышенных уровнях при болезненных состояниях, могут взаимодействовать как с соседними, так и с удаленными клетками и обнаруживаются в относительно высоких концентрациях в кровотоке, а также в большинстве других жидкостей организма, включая слюну, мочу, сок поджелудочной железы и желчи, а также бронхоальвеолярный отросток. промывная жидкость 5 , 6 , 7 , 8 , 9 , 10 , 11 .Изобилие и стабильность экзосом в жидкостях человеческого тела в сочетании с их богатой информацией природой делают их идеальными биомаркерами для диагностики заболеваний и мониторинга лечения.
Сюда входят экзосомы, происходящие из опухоли (TDE), которые содержат опухолеспецифические или селективные факторы, которые могут служить биомаркерами заболевания, включая связанные с опухолью мутантные аллели. TDE могут участвовать в ремоделировании микросреды опухоли, чтобы способствовать развитию опухоли и метастазированию, а также регулировать противоопухолевые ответы 12 .Повышенная секреция TDE является общим фенотипом большинства видов рака, и известно, что некоторые особенности микросреды опухоли, включая гипоксию, кислый pH и воспаление, способствуют секреции экзосом. Удивительно, но учитывая количество клеток, секретирующих экзосомы, повышение общего уровня экзосом может само по себе функционировать как биомаркер рака. Например, недавнее исследование показало, что общая концентрация EV в желчном соке позволяет различать злокачественные и доброкачественные у пациентов со стенозом общего желчного протока со 100% точностью 7 .Аналогичные результаты были получены при исследованиях с использованием других жидкостей организма, включая плазму. Тем не менее, из-за возможности вариации субъекта и других мешающих факторов, большинство исследований, изучающих экзосомы как биомаркеры болезни, были сосредоточены на обнаружении биомаркеров, которые выборочно связаны с TDE, а не на общем количестве экзосом.
Однако внедрение биомаркеров экзосом в клиническую практику остается сложной задачей, поскольку большинство известных подходов к анализу экзосом требует длительных и трудоемких процедур выделения. 13 .Популярные в настоящее время методы выделения экзосом включают ультрацентрифугирование, градиенты плотности, исключение по размеру, соосаждение, аффинный захват и микрофлюидную изоляцию. Ультрацентрифугирование является методом «золотого стандарта» и чаще всего используется для выделения экзосом, но эта процедура занимает много времени и приводит к повреждению экзосом и кластеризации мембран экзосом, а также дает образцы экзосом, загрязненные белками, липопротеинами и другими факторами, которые может повлиять на последующий анализ 14 .Большинство методов выделения экзосом, включая ультрацентрифугирование, не могут отделить экзосомы (30–150 нм) от микровезикул (100–1000 нм) и апоптотических телец (100–5000 нм), которые возникают через разные механизмы и выполняют разные функции из-за размеры перекрываются среди этих групп и разнообразие популяций экзосом 15 . Необходимы новые подходы для повышения чувствительности и воспроизводимости анализов экзосом за счет улучшения восстановления экзосом при одновременном снижении повреждения и загрязнения экзосом, хотя любые анализы, основанные на таких методах, также необходимо будет оптимизировать, чтобы сделать их пригодными для перевода в приложения в клинических условиях.
В нескольких недавних исследованиях было предложено использовать интегрированные платформы для захвата и анализа экзосом непосредственно из жидкостей организма. В этих методах используются микрофлюидный, электрокинетический, аффинный захват и различные другие методы выделения экзосом, а также электрохимия, поверхностный плазмонный резонанс и другие методы для обнаружения захваченных экзосом. Неясно, насколько осуществимы многие из этих подходов в клинических условиях из-за их сложности, стоимости, низкой пропускной способности или других проблем.
Мы разработали быстрый и недорогой анализ, который можно использовать для чувствительной и специфической количественной оценки общего количества экзосом и конкретных подтипов экзосом, включая связанные с заболеванием экзосомы, такие как TDE, для которого требуется только небольшое количество образца и который использует оптимизированный рабочий процесс. подходит для клинических условий. В этом анализе предметное стекло покрывают антителами, которые связывают либо специфичный для экзосомы, либо специфический для заболевания маркер, экспрессируемый на поверхности экзосомы, для непосредственного захвата экзосом-мишеней, присутствующих в образцах плазмы или сыворотки небольшого объема, нанесенных в лунки на предметном стекле.Захваченные экзосомы затем гибридизируются с наночастицей, конъюгированной с антителом, которая распознает интересующий биомаркер на этих экзосомах, который может быть либо общим маркером экзосом, либо фактором, специфичным для интересующего подтипа экзосом. Изображения этих лунок с образцами затем фиксируются с помощью микроскопа темного поля (DFM) и анализируются для измерения света, рассеянного от наночастиц, связанных с интересующими экзосомами, захваченного в каждой лунке с образцом 6 , 16 , 17 .Примечательно, что визуализация всего образца с помощью DFM с малым увеличением (LMDFM) позволяет избежать систематической ошибки выбора, возникающей при анализе DFM с большим увеличением, когда пользователи должны напрямую выбирать, какие поля захватывать для последующего анализа изображения. Анализ изображений LMDFM подвержен артефактам рассеяния света из-за неровностей поверхности, включая царапины и обломки образцов, но этот фон можно уменьшить с помощью простого алгоритма шумоподавления, который мы разработали для работы в программе анализа изображений NIH ImageJ (https: // imagej .nih.gov/ij/). Этот алгоритм сначала применяет пороговое значение входного контура, которое используется для обнаружения границ лунки с образцом, чтобы определить область изображения для последующего анализа. Область, определяемая этой контурной областью, затем разделяется для разделения сигнала, присутствующего в красном, синем и зеленом каналах изображения, и синий канал вычитается из красного канала, чтобы удалить сигнал, возникающий из-за поверхностных артефактов и неравномерного освещения из сигнала наностержней.
В этой статье описывается, как использовать этот анализ для быстрого количественного определения общего или специфического уровня экзосом в образцах плазмы или сыворотки.
Новая технология может обнаруживать крошечные опухоли яичников | MIT News
Большинство случаев рака яичников диагностируется на таких поздних стадиях, что выживаемость пациентов оставляет желать лучшего. Однако, если рак обнаружен раньше, пятилетняя выживаемость может превышать 90 процентов.
Теперь инженеры Массачусетского технологического института разработали гораздо более чувствительный способ выявления опухолей яичников: в тестах на мышах они смогли обнаружить опухоли, состоящие из узелков диаметром менее 2 миллиметров.Исследователи говорят, что у людей это может привести к обнаружению опухоли примерно на пять месяцев раньше, чем это возможно при существующих анализах крови.
В новом тесте используется «синтетический биомаркер» — наночастица, которая взаимодействует с опухолевыми белками и высвобождает фрагменты, которые можно обнаружить в образце мочи пациента. Этот вид теста может генерировать гораздо более четкий сигнал, чем естественные биомаркеры, обнаруживаемые в очень малых количествах в кровотоке пациента.
«В этой статье мы разработали наш датчик примерно в 15 раз лучше, чем в предыдущей версии, а затем сравнили его с биомаркером крови в мышиной модели рака яичников, чтобы показать, что мы можем победить его», — говорит Сангита Бхатия. , Джон и Дороти Уилсон, профессор медицинских наук и технологий, электротехники и информатики, член Института интегративных исследований рака при Массачусетском технологическом институте и Института медицинской инженерии и науки при Массачусетском технологическом институте и старший автор исследования.
Этот подход также может быть адаптирован для работы с другими видами рака. В этой статье, опубликованной 10 апреля в выпуске Nature Biomedical Engineering , исследователи показали, что они могут обнаруживать колоректальные опухоли, метастазирующие в печень.
Ведущие авторы статьи — постдок Эстер Квон и аспирант Джайдип Дудани.
Синтетические биомаркеры
Бхатия впервые сообщил о стратегии диагностики рака с помощью синтетических биомаркеров в 2012 году.Этот метод измеряет активность ферментов, расщепляющих белок, называемых эндопротеазами, которые вырабатываются опухолями, чтобы помочь задействовать кровеносные сосуды и проникнуть в окружающие ткани, чтобы рак мог расти и распространяться.
Чтобы обнаружить этот вид ферментов, исследователи разработали наночастицы, покрытые небольшими фрагментами белка, называемыми пептидами, которые могут расщепляться определенными протеазами, называемыми ММП. После инъекции мыши эти частицы пассивно собираются на участке опухоли. ММП расщепляют пептиды, высвобождая крошечные репортерные фрагменты, которые затем отфильтровываются почками и концентрируются в моче, где их можно обнаружить с помощью различных методов, включая простой бумажный тест.
В статье, опубликованной в 2015 году, исследователи создали математическую модель этой системы, чтобы понять несколько факторов, таких как то, как частицы циркулируют в организме, насколько эффективно они взаимодействуют с протеазой и с какой скоростью протеаза расщепляет пептиды. Эта модель показала, что для обнаружения опухолей диаметром 5 миллиметров или меньше у людей исследователям необходимо повысить чувствительность системы по крайней мере на один порядок.
В текущем исследовании исследователи использовали две новые стратегии для повышения чувствительности своего детектора.Первый заключался в оптимизации длины полимера, который связывает пептиды с наночастицей. По причинам, еще не полностью понятным, когда связка имеет определенную длину, определенные протеазы расщепляют пептиды с большей скоростью. Эта оптимизация также снижает количество фонового расщепления нецелевым ферментом.
Во-вторых, исследователи добавили к наночастицам целевую молекулу, известную как проникающий в опухоль пептид, которая заставляет их накапливаться в опухоли в большем количестве и приводит к увеличению количества расщепленных пептидов, которые в конечном итоге секретируются с мочой.
Объединив эти два усовершенствования, исследователи смогли повысить чувствительность датчика в 15 раз, что, как они показали, было достаточно для обнаружения рака яичников, состоящего из небольших опухолей (2 миллиметра в диаметре) у мышей. Они также протестировали этот подход на печени, где смогли обнаружить опухоли, возникшие в толстой кишке. У людей рак толстой кишки часто распространяется на печень и образует небольшие опухоли, которые трудно обнаружить, похожие на опухоли яичников.
«Это важная работа для проверки новых стратегий раннего выявления рака, которые не зависят от биомаркеров, производимых раковыми клетками.[Метод] вместо этого вынуждает генерировать искусственные биомаркеры в месте опухоли, если какая-либо опухоль действительно существует в теле », — говорит Санджив Сэм Гамбхир, заведующий кафедрой радиологии Медицинской школы Стэнфордского университета, который не принимал участия в исследовании. учиться. «Такие подходы в конечном итоге должны помочь изменить способ обнаружения рака».
Ранняя диагностика
В настоящее время врачи могут искать биомаркеры крови, продуцируемые опухолями яичников, но эти маркеры не накапливаются в достаточно высоких концентрациях, чтобы их можно было обнаружить до тех пор, пока опухоли не станут около 1 сантиметра в диаметре, примерно через восемь-десять лет после их образования.Другой диагностический инструмент, ультразвуковая визуализация, также ограничен опухолями яичников диаметром 1 сантиметр и более.
Возможность обнаружить опухоль пятью месяцами ранее, что, по мнению исследователей Массачусетского технологического института, может сделать их новая методика, может иметь большое значение для некоторых пациентов.
В этой статье исследователи также показали, что они могут обнаруживать протеазы болезней в микромассивах многих опухолевых клеток, взятых у разных онкологических больных. Эта стратегия может в конечном итоге помочь исследователям определить, какие пептиды использовать при различных типах рака и даже для отдельных пациентов.
«Опухоли у каждого пациента разные, и не все опухоли поддаются нацеливанию с помощью одной и той же молекулы», — говорит Бхатия. «Это инструмент, который поможет нам использовать модульность технологии и персонализировать рецептуры».
В настоящее время исследователи продолжают изучать возможность использования этого подхода для лечения других видов рака, включая рак простаты, где его можно использовать для отделения более агрессивных опухолей от опухолей, которые растут намного медленнее, говорит Бхатиа.
Исследование финансировалось Мраморным центром онкологической наномедицины Института Коха, Центром молекулярной онкологии Людвига, грантом поддержки Института Коха из Национального института рака, грантом основного центра Национального института гигиены окружающей среды, Рут Л. Премия Национальной исследовательской службы Киршштейна, Медицинский институт Говарда Хьюза и научная стипендия Национального научного фонда.
Бронховидеоскопия с большим увеличением в сочетании с узкополосной визуализацией может обнаружить капиллярные петли ангиогенной плоскоклеточной дисплазии у заядлых курильщиков с высоким риском рака легких
Использование флуоресцентной бронхоскопии у заядлых курильщиков с высоким риском рака легких увеличило выявление случаев плоскоклеточной дисплазии бронхов. 1– 4 Считается, что повышенное утолщение эпителия бронхов, усиление роста сосудов и снижение концентрации флуорофора связаны с появлением областей аномальной флуоресценции. Это может объяснить, почему многие наблюдатели обнаружили воспаление слизистой оболочки с аномальной флуоресценцией. 5 Недавно с помощью флуоресцентной бронхоскопии в крупных центральных дыхательных путях была идентифицирована новая морфологическая форма, называемая ангиогенной плоскоклеточной дисплазией (РАС), при которой скопления капиллярных кровеносных сосудов тесно сопоставлялись с диспластическим бронхиальным эпителием и проецировались на него. 6, 7 Повышенная плотность сосудов в подслизистой оболочке часто присутствует при плоскоклеточной дисплазии бронхов, 8, 9 , указывая на то, что ангиогенез является относительно ранним событием во время патогенеза рака легких. 10 Капиллярные кровеносные сосуды диспластического эпителия при РАС также демонстрируют признаки ангиогенеза по гистопатологическим данным, так что трудно отличить РАС от обычной плоскоклеточной дисплазии (то есть без капиллярных кровеносных сосудов при плоскоклеточной дисплазии бронхов) с помощью бронхоскопии в белом свете, а также флуоресцентная бронхоскопия.Однако еще предстоит определить, подвержены ли РАС большему риску прогрессирования, чем обычная плоскоклеточная дисплазия. 10
Недавно мы разработали систему бронховидеоскопии с большим увеличением для прямого просмотра с целью детального исследования дисплазии слизистой оболочки бронхов у пациентов с аномальной флуоресценцией слизистой оболочки. 11 Бронховидеоскоп с большим увеличением имеет внешний диаметр всего 6 мм, поэтому его легко вставить в трахеобронхиальное дерево.Микрососуды в подслизистой оболочке бронхов можно наблюдать на 14-дюймовом телевизионном мониторе при большом увеличении до 110 ×. Наш предыдущий отчет показал, что во многих случаях плоскоклеточной дисплазии наблюдаются сосудистые паттерны увеличения роста сосудов и сложные сети извитых сосудов в субэпителии бронхов. 11 Таким образом, используя технику исследования in vivo бронховидеоскопии с большим увеличением, можно было продемонстрировать ангиогенез в подслизистой оболочке пациентов с дисплазией бронхов, который не мог быть распознан при обычной бронхоскопии в белом свете.
В настоящем исследовании мы исследовали способность системы бронховидеоскопии с большим увеличением в сочетании с узкополосной визуализацией (NBI) обнаруживать капиллярные кровеносные сосуды в диспластическом эпителии бронхов у заядлых курильщиков с высоким риском рака легких. Мы изменили спектральные характеристики системы последовательного видеоскопа RGB с обычного широкополосного фильтра RGB (красный / зеленый / синий) на новый фильтр NBI, чтобы обеспечить сфокусированное и детальное наблюдение за паттернами бронхиальных сосудов.Диапазоны длин волн нового фильтра NBI включали фильтр NBI-Blue 1 (NBI-B1) на 400–430 нм, который перекрывал длины волн поглощения 410 нм для гемоглобина и, следовательно, предполагал возможность более точного обнаружения сосудистых структур.
МЕТОДЫ
Узкополосная визуализация
Обычная система последовательного видеоскопа RGB имеет ксеноновую лампу и вращающийся диск с 3 оптическими фильтрами RGB. Диск вращения и монохромный ПЗС синхронизируются, и последовательно генерируются 3-полосные изображения.Цветные изображения могут быть синтезированы видеопроцессором с использованием трехполосных изображений (рис. 1A). Узкополосная визуализация, разработанная совместно с Olympus Optical Corp., Токио, Япония, представляет собой новую систему, которая может использоваться для наблюдения за структурой микрососудов с использованием нового узкополосного фильтра в системе последовательного видеоскопа RGB вместо обычного широкополосного фильтра RGB. Диапазоны длин волн нового фильтра NBI были: B1: 400–430 нм, B2: 420–470 нм и G: 560–590 нм. Напротив, диапазон длин волн в обычном широкополосном фильтре RGB был B: 400–500 нм, G: 500–600 нм и R: 600–700 нм (рис. 1B).Свойства оптического поглощения и рассеяния тканей сильно зависят от длины волны, 12 , так что синий свет, который имеет более короткую длину волны, чем видимый свет, обычно достигает мелких поверхностей. 13 Основным хромофором в тканях бронхов в видимом диапазоне длин волн является гемоглобин, который имеет максимальную длину волны поглощения около 415 нм, 14, 15 и находится в диапазоне длин волн NBI-B1. Таким образом, ожидалось, что фильтр NBI-B1 будет обнаруживать структуры кровеносных сосудов более точно, чем другие фильтры.Когда обычный широкополосный свет RGB доставляется через эндоскоп на поверхность ткани, часть света отражается от ткани, часть рассеивается или поглощается тканью, и на телевизионных мониторах обнаруживается небольшое количество света для формирования изображения. Однако узкополосный свет, попадающий на ту же поверхность, имеет меньшее рассеяние и позволяет отображать более четкие изображения на телевизионном мониторе.
Рисунок 1
Обычная система RGB и новая система NBI (узкополосная визуализация).Обычная система последовательного видеоскопа RGB имеет ксеноновую лампу и вращающийся диск с 3 оптическими фильтрами RGB. Диск вращения и монохромный ПЗС синхронизируются, и последовательно генерируются 3-полосные изображения. Цветные изображения могут быть синтезированы видеопроцессором с использованием трехполосных изображений (рис. 1A). Узкополосная визуализация (NBI) — это новая система, которая может использоваться для наблюдения за структурой микрососудов с использованием нового узкополосного фильтра в системе последовательного видеоскопа RGB вместо обычного широкополосного фильтра RGB.Диапазоны длин волн нового фильтра NBI: B1 = 400–430 нм, B2 = 420–470 нм и G = 560–590 нм. Напротив, диапазон длин волн в обычном широкополосном фильтре RGB был: B = 400–500 нм, G = 500–600 нм и R = 600–700 нм. X = длина волны, Y = сила света (рис. 1B).
Бронховидеокопия с большим увеличением
Бронховидеоскоп с большим увеличением (XBF 200HM2) представляет собой комбинацию двух систем: системы видеонаблюдения для наблюдения с большим увеличением и волоконной системы наблюдения для ориентации наконечника бронхоскопа, как подробно описано ранее. 11 В то время как обычная бронховидеоскопия в белом свете выявила только усиление покраснения и местного отека, бронховидеоскоп с большим увеличением позволил визуализировать сосудистые сети с увеличенным ростом сосудов и сложные сети извилистых сосудов различного размера в слизистой оболочке бронхов (рис. 2).
Рисунок 2
Обычная бронховидеоскопия в белом свете и бронховидеоскопия с большим увеличением слизистой оболочки бронхов.В то время как обычная бронховидеоскопия в белом свете выявила только покраснение и отек, бронховидеоскопия с большим увеличением облегчила наблюдение сложных сосудистых сетей различного размера в слизистой оболочке бронхов.
Исследуемая популяция и бронхоскопическая процедура
Комитеты по этике Высшей школы медицины Университета Чиба одобрили все протоколы и процедуры. В исследование были включены 48 пациентов с цитологическими образцами мокроты, подозрительными или положительными на злокачественные новообразования, которые наблюдались в отделении торакальной хирургии Высшей школы медицины Университета Чиба в Чибе с декабря 2000 по апрель 2002 года.Был проведен массовый скрининг цитологических исследований мокроты для выявления больных с высоким риском рака легких. В группу высокого риска входили люди 50 лет и старше, у которых было 30 или более лет упаковки, и те 40 лет и старше, у которых была кровавая мокрота в течение последних 6 месяцев. Пациенты состояли из 46 мужчин и 2 женщин в возрасте от 42 до 77 лет (в среднем 66 лет). История курения в пачках колебалась от 25 до 155 (в среднем 54). Сорок один из пациентов был курильщиком в настоящее время, а 7 — бывшими курильщиками.Обычная бронхоскопия в белом свете (BF-240, Olympus Optical Corp, Токио, Япония) сначала была выполнена под местной анестезией с седативным эффектом путем внутривенной инъекции мидазолама и ингаляции O 2 . Исследование флуоресцентной бронхоскопии выполняли с использованием системы легких LIFE (Xillix LIFE-Lung Fluorescence Endoscopy System, Xillix Technologies Corp, Ричмонд, Британская Колумбия, Канада). Наблюдения с помощью бронховидеоскопии с большим увеличением в обычном белом свете проводились в основном в местах аномальной флуоресценции, установленной флуоресцентной бронхоскопией, а затем повторялись с помощью света NBI для исследования микрососудистых сетей в слизистой оболочке бронхов.Образцы бронхиальной биопсии для патологического исследования были взяты из всех исследованных аномальных участков. Изображения, полученные с помощью бронховидеоскопии с большим увеличением, были изучены и сопоставлены с патологическими диагнозами, полученными при биопсии бронхов. Все участники предоставили письменное информированное согласие перед включением в исследование.
Бронховидеоскопия с большим увеличением в сочетании с NBI слизистой оболочки бронхов
Бронховидеоскопия с большим увеличением в сочетании с NBI позволила более точно визуализировать микрососудистые структуры слизистой оболочки бронхов.Показаны типичные результаты бронхоскопии с большим увеличением при обычном RGB и NBI (рис. 3). По сравнению с обычными изображениями RGB, изображения NBI-B1 / NBI-B2 / NBI-G обеспечивали более точные изображения различных классов микрососудов, особенно с использованием NBI-B1. Таким образом, с помощью нашей новой системы NBI стало возможным различать структуры микрососудов, которые нельзя было увидеть с помощью обычных широкополосных систем, особенно при использовании изображений B1. На изображениях NBI-B1 сосуды были четко видны как точки среди сложной сети извилистых сосудов разного размера, которые мы назвали «точечными сосудами».Наблюдение за сосудами, независимо от того, были ли они точечными или нет, проводилось без знания о наличии или отсутствии патологического диагноза ангиогенной плоской дисплазии.
Рисунок 3
Бронховидеокопия с большим увеличением при обычном RGB и NBI слизистой оболочки бронхов. Показаны типичные результаты бронхоскопии с большим увеличением и обычным RGB или NBI. По сравнению с обычными изображениями RGB, изображения NBI-B1 / B2 / G могут точно определять различные классы микрососудов, особенно изображения NBI-B1.
Гистопатологический анализ
Образцы биопсии фиксировали в 10% нейтральном формалине, заливали парафином и окрашивали гематоксилин-эозином для гистологического исследования. Слайды биопсии сначала были оценены патологом нашего отделения, а затем все слайды были просмотрены двумя экспертами-легочными патологами нашего отделения (KH и HO). Плоскоклеточная бронхиальная дисплазия была диагностирована в соответствии с недавними критериями Всемирной организации здравоохранения. 16 Ангиогенная плоскоклеточная дисплазия (рис. 4) характеризовалась микроскопическими проекциями на поверхность просвета бронхов плоскоклеточным бронхиальным эпителием, проявляющим плоскоклеточную дисплазию различной степени. 6 Бронхит был определен как состояние, при котором стенка дыхательных путей инфильтрована лимфоцитами и кровеносные сосуды переполнены.
Рисунок 4
Микрофотография плоской ангиогенной дисплазии. Скопления кровеносных сосудов размером с капилляр, близко расположенные и выступающие в диспластический бронхиальный эпителий.
Конфокальный лазерный сканирующий микроскоп для наблюдения
Образцы бронхиальной биопсии, фиксированные в течение ночи в 10% нейтральном формалине, промывали в PBS и применяли для непрямой иммунофлуоресценции. Образцы инкубировали в течение ночи при 4 ° C с мышиным моноклональным антителом IgG против CD34 (Immunotech, Марсель, Франция) (разведение 1:10) в качестве первичного антитела. После нескольких промывок образцы инкубировали с меченными флуоресцентным красителем козьими антимышиными IgG, Alexa Fluor488® (Molecular Probes, Inc.Юджин, Орегон, США) (разведение 1: 500) в качестве вторичного антитела в течение 60 мин при комнатной температуре в темноте. Ядерное контрастное окрашивание проводили в течение 15 мин при комнатной температуре иодидом пропидия. Затем образцы бронхов исследовали с помощью конфокального лазерного сканирующего микроскопа (BioRad; MRC-600), оснащенного источниками аргон-криптона (488 нм) и аргона (514 нм). На полученных изображениях зеленая флуоресценция представляет CD34, а ядра клеток имеют оранжевый цвет.
Расчет диаметра точечных сосудов среди микрососудов различных сортов, видимых с помощью бронховидеоскопии с большим увеличением в сочетании с NBI
11
По известным графикам рассчитано увеличение на 14-дюймовом телевизионном мониторе.Когда L = фактический размер целевого судна, K (коэффициент преобразования) = 9,1 × 10 2 мкм / пиксель, D (расстояние между двумя точками в Adobe Photoshop 6.0) пиксель = √ {(X1 − X2) 2 + (Y1-Y2) 2 }, а M = увеличение, L выражается как равное K × D / M.
Расчет диаметра капиллярных кровеносных сосудов в ASD
11
Используя систему анализа клеток для цитометрии изображений (CAS 200) (Becton Dickenson, Сан-Хосе, Калифорния, США), микрометрическую программу, мы рассчитали диаметр капиллярных кровеносных сосудов в ASD, идентифицированных гистологически, с использованием предметного стекла для биопсии, окрашенного гематоксилином / эозином.
Статистический анализ
Частотный анализ проводился с использованием точного вероятностного критерия Фишера, при этом значения p менее 0,05 считались статистически значимыми. Расчеты проводились с использованием пакета статистических программ Stat View (SAS Inc, Кэри, Северная Каролина, США).
РЕЗУЛЬТАТЫ
Патологические диагнозы на биоптатах
Биоптаты из 67 участков аномальной флуоресценции были диагностированы как 39 бронхит и 28 плоскоклеточная бронхиальная дисплазия.Из 28 образцов плоскоклеточной дисплазии бронхов в 15 поражениях наблюдались морфологические изменения, характерные для РАС.
Бронховидеоскопия с большим увеличением в сочетании с NBI слизистой оболочки бронхов
На рис. 5 показаны четыре различных результата бронхоскопии (бронхоскопия в белом свете, флуоресцентная бронхоскопия, бронховидеоскопия с большим увеличением и бронховидеоскопия с большим увеличением с помощью NBI-B1) правого базального бронха пациента с цитологией мокроты, подозрительной на злокачественное новообразование.Покраснение и припухлость на разветвлении RT B8 и B9 + 10 наблюдались при исследовании в белом свете, а аномальная красновато-коричневая область была идентифицирована флуоресцентным исследованием. Увеличенный рост сосудов и сложные сети извитых сосудов наблюдались в местах аномальной флуоресценции с помощью бронховидеоскопии с большим увеличением с обычным широкополосным фильтром RGB. На изображениях NBI-B1 сосуды были четко обозначены точками среди сложной сети извилистых сосудов, которые мы назвали «точечными сосудами».Патологический диагноз биоптата показал РАС.
Рисунок 5
Бронховидеоскопия с большим увеличением в сочетании с NBI слизистой оболочки бронхов в местах аномальной флуоресценции. Некоторые пунктирные сосуды, помимо увеличенного роста сосудов и сложной сети извилистых сосудов, видны на изображении NBI-B1. Патологический диагноз биоптата — плоская ангиогенная дисплазия.
Сравнение точечных сосудов, наблюдаемых при бронховидеоскопии с большим увеличением с использованием NBI-B1, и кровеносных сосудов размером с капилляр, выступающих в диспластический эпителий (ASD), наблюдаемых под микроскопом
Использование Adobe Photoshop 6.0 сосуды, наблюдаемые в виде точек при бронховидеоскопии с большим увеличением с использованием NBI-B1, были рассчитаны как L1 = 53 мкм, L2 = 40 мкм, L3 = 25 мкм и L4 = 48 мкм. Диаметр капиллярных кровеносных сосудов при ASD рассчитывали с помощью системы анализа клеток Image Cytometry (CAS 200) как C1 = 62,5 мкм, C2 = 50 мкм и C3 = 35 мкм. Таким образом, фактические диаметры, как видно из гистопатологических образцов, соответствовали диаметрам сосудов, наблюдаемым при бронховидеоскопии с большим увеличением (рис. 6).
Рисунок 6
Сравнение точечных сосудов, наблюдаемых при бронховидеоскопии с большим увеличением в сочетании с NBI и микроскопическим наблюдением кровеносных сосудов размером с капилляр, выступающих в диспластический эпителий (ASD).
Двойная иммуномарка для конфокальной лазерной сканирующей микроскопии
С помощью конфокального лазерного сканирующего микроскопа капиллярные кровеносные сосуды были четко визуализированы в виде зеленой флуоресценции, а ядра диспластического эпителия приобрели оранжевый цвет. Мы оценили капиллярные петли в диспластическом эпителии, чтобы определить достоверность точечных сосудов, обнаруженных с помощью бронховидеоскопии с большим увеличением в сочетании с визуализацией NBI-B1 (рис. 7).
Рисунок 7
Двойная иммунная мечение с помощью конфокальной лазерной сканирующей микроскопии.Капиллярные кровеносные сосуды были четко визуализированы как зеленая флуоресценция, в то время как ядра диспластического эпителия выглядели оранжевыми при конфокальной лазерной сканирующей микроскопии.
Сравнение изображений NBI-B1 и плоскоклеточной дисплазии с ДМПП (рис. 8)
Рисунок 8
Сравнение изображений NBI-Blue1 (NBI-B1) и плоскоклеточной дисплазии с РАС. Пунктирные сосуды наблюдались на 18 участках аномальной флуоресценции с изображениями NBI-B1, из которых 14 (78%) демонстрировали ASD.Отрицательные пунктирные сосуды среди сосудистых сетей находились на 49 участках аномальной флуоресценции, из которых 48 (98%) не имели ДМПП. Обнаружилась значимая связь между частотой точечных сосудов по данным визуализации NBI-B1 и патологически подтвержденным РАС (p = 0,002 по точному вероятностному тесту Фишера).
Мы исследовали 67 участков аномальной флуоресценции с помощью бронховидеоскопии с большим увеличением в сочетании с NBI. Пунктирные сосуды среди увеличенного роста сосудов и сложной сети извилистых сосудов наблюдались на 18 участках аномальной флуоресценции с изображениями NBI-B1, из которых 14 (78%) демонстрировали ДМПП.Отрицательные пунктирные сосуды среди сосудистых сетей находились на 49 участках аномальной флуоресценции, из которых 48 (98%) не имели ДМПП. Обнаружилась значимая связь между частотой точечных сосудов по данным визуализации NBI-B1 и патологически подтвержденным РАС (p = 0,002 по точному вероятностному тесту Фишера).
ОБСУЖДЕНИЕ
В этом исследовании мы использовали метод бронховидеоскопии с большим увеличением в сочетании с NBI на группе заядлых курильщиков с высоким риском рака легких.Микрососуды, сосудистые сети разной степени тяжести и пунктирные сосуды четко наблюдались на изображениях ДМПП NBI-B1. В предыдущем исследовании мы показали, что бронховидеоскопия с большим увеличением с использованием обычного широкополосного фильтра RGB на системе последовательного видеоскопа RGB облегчила наблюдение микрососудистых сетей в слизистой оболочке бронхов. 11 Наше настоящее исследование показало, что микрососудистые сети слизистой оболочки бронхов можно отчетливо наблюдать на изображениях NBI-B1, полученных с помощью нового фильтра NBI, которые нельзя было наблюдать с помощью обычных широкополосных фильтров RGB, включая обычные B-изображения.Из трех фильтров NBI (NBI-B1, NBI-B2 и NBI-G) микрососудистые сети, включая точечные сосуды, наиболее четко обнаруживались в длинах волн NBI-B1. Свойства оптического поглощения и рассеяния тканей сильно зависят от длины волны, поэтому синий свет, который имеет относительно короткую длину волны, обычно достигает неглубоких поверхностей. 13 Основным хромофором в тканях бронхов в видимом диапазоне длин волн является гемоглобин, максимальная длина волны поглощения которого составляет приблизительно 415 нм.Поскольку это находится в пределах диапазона нового фильтра NBI-B1, наш новый прибор NBI более точно обнаруживает структуры кровеносных сосудов, чем фильтры с другими длинами волн.
Ранее мы сообщали, что некоторые из сосудов, обнаруженных как разбросанные красные точки, которые могут иметь возможность бронховидеоскопии с большим увеличением и обычным белым светом, были кровеносными сосудами размером с капилляр при ДМПП. 11 Однако диаметр точечных сосудов, наблюдаемых с помощью визуализации NBI-B1, соответствовал значениям диаметра капиллярных кровеносных сосудов ASD, полученным при патологическом исследовании.Поскольку капиллярные кровеносные сосуды в ASD проецируются в диспластический бронхиальный эпителий, точечные сосуды на изображениях NBI-B1 представляют капиллярные кровеносные сосуды ASD. Таким образом, бронховидеоскопия с большим увеличением в сочетании с NBI представляет собой новый исследовательский инструмент для обнаружения капиллярных кровеносных сосудов в поражениях ASD и может продемонстрировать начало ангиогенеза во время многоступенчатого канцерогенеза легких у заядлых курильщиков с высоким риском рака легких.
Флуоресцентная бронхоскопия
LIFE улучшила распознавание дисплазии бронхов у пациентов с высоким риском рака легких.Hirsch et al сообщили, что флуоресцентная бронхоскопия выявила 75% случаев РАС. 4 Однако флуоресцентная бронхоскопия LIFE не может отличить РАС от обычной плоскоклеточной дисплазии (без РАС). Используя нашу новую технику визуализации, мы смогли отличить РАС от другого предопухолевого поражения. До внедрения флюоресцентной бронхоскопии не было никаких средств для определения областей плоской дисплазии в нижних дыхательных путях, за исключением случайной биопсии бронхов.Результаты нашего настоящего исследования показали, что наш новый метод успешно обнаружил РАС в дополнение к обычной плоскоклеточной дисплазии. В будущем количественная флуоресцентная визуализация в сочетании с флуоресцентной отражательной томографией и спектрофлуорометрией также может быть полезна для улучшения распознавания РАС. 5, 17
Все участники с цитологическим анализом мокроты, подозрительные или положительные на злокачественные новообразования, включенные в это исследование, были идентифицированы с помощью программы массового скрининга на предмет высокого риска рака легких.История курения в пачках в нашей группе исследования варьировалась от 25 до 155, в среднем 54. Все поражения РАС, обнаруженные в нашем исследовании, были у пациентов, которые сильно курили, в то время как РАС не было обнаружено у некурящих ни нашим исследованием, ни исследователями. Кейт и др. , 6 указывают на то, что РАС и курение могут быть связаны. 10, 18 Никотин от курения сигарет привел к значительному увеличению экспрессии фактора роста эндотелия сосудов (VEGF) эндотелиальных клеток, как показали анализы ОТ-ПЦР и вестерн-блоттинга, 19 и вызвал значительное повышение уровней VEGF в сыворотке и индукцию ангиогенеза в модели мыши. 20 В нашем исследовании открытие того, что РАС был обнаружен у заядлых курильщиков, но не у некурящих, предполагает, что никотин может стимулировать ангиогенез в бронхиальном эпителии больших дыхательных путей человека.
Технология конфокальной лазерной сканирующей микроскопии позволила визуализировать структуры капиллярной сети различных тканей, включая ткани опухоли. 21– 23 В экспериментальных животных моделях ангиогенеза опухоли многофотонная лазерная сканирующая микроскопия количественно оценивала ангиогенез в отношении различных типов сосудов на разной глубине опухоли. 24 Однако, что касается предопухолевых поражений, таких как плоскоклеточная дисплазия бронхиального эпителия, не было сообщений об анализе ангиогенных явлений с использованием конфокальной лазерной сканирующей микроскопии. В нашем исследовании с использованием флуоресцентного зонда капиллярные петли в диспластическом эпителии гистопатологически подтвержденного ДМПП были обнаружены по зеленой флуоресценции. Таким образом, технология конфокальной лазерной сканирующей микроскопии является подходящим методом для демонстрации ангиогенеза в предзлокачественном бронхиальном эпителии.
То, что ангиогенез необходим для роста опухоли, был впервые признан Фолкманом. 25, 26 Чтобы прогрессировать до больших размеров, зарождающиеся новообразования должны развить ангиогенные способности. Несколько исследований, посвященных многоступенчатой модели канцерогенеза в эпителиальных опухолях, показали, что ангиогенез необходим в дополнение к молекулярным изменениям. 27 Ангиогенный переключатель, по-видимому, происходит в преинвазивных поражениях до образования инвазивной опухоли в моделях трансгенных мышей и исследованиях патогенеза рака человека. 28, 29 Неоваскуляризация была очевидна в интраэпителиальных новообразованиях II-III цервикального эпителия и поражениях карциномы молочной железы с помощью иммунохимии in situ, а также были подробно задокументированы другие преинвазивные ангиогенные поражения. 28, 30 Было высказано предположение, что флуоресцентная бронхоскопия может применяться для исследования прединвазивных поражений бронхов и многоступенчатого канцерогенеза. В этом исследовании мы использовали начало ангиогенеза при плоскоклеточной дисплазии бронхов in vivo с использованием бронховидеоскопии с большим увеличением в сочетании с системой NBI.
Можно разделить плоскоклеточную дисплазию бронхов в соответствии с риском развития плоскоклеточного рака. Остается неясным, является ли РАС индикатором прогрессирования плоскоклеточного рака. В настоящее время продолжающееся лонгитюдное последующее исследование наличия РАС позволит решить этот вопрос. 4 Нам необходимо задокументировать молекулярный патогенез плоской дисплазии с ангиогенезом и без него, а также исследования химиопрофилактики с использованием антиангиогенной терапии у заядлых курильщиков.Возможно, что в ближайшем будущем ингибиторы ангиогенеза, вводимые вместе или добавленные к химиотерапии, радиотерапии или другим методам, станут частью стандартных и эффективных методов противоопухолевой терапии.
В заключение, бронховидеоскопия с большим увеличением в сочетании с NBI является новым исследовательским инструментом для обнаружения капиллярных кровеносных сосудов в поражениях ASD и может позволить различить ASD и другое преинвазивное поражение бронхов.
Благодарности
Мы хотим поблагодарить K Gono, Y Morizane, S Takehana (Olympus Optical Corp, Токио, Япония) и M Maekawa (Департамент анатомии и биологии развития, Высшая школа медицины, Университет Тиба) за их техническую помощь.
ССЫЛКИ
- ↵
Лам С. , Кеннеди Т., Унгер М., и др. Локализация внутриэпителиальных неопластических поражений бронхов методом флуоресцентной бронхоскопии. Chest1998; 113: 696–702.
Джордж П.Дж. . Флуоресцентная бронхоскопия для раннего выявления рака легких. Thorax1999; 54: 180–183.
Shibuya K , Fujisawa T, Hoshino H, et al. Флуоресцентная бронхоскопия для выявления преинвазивных поражений бронхов у пациентов с цитологическим анализом мокроты, подозрительным или положительным на злокачественные новообразования. Рак легких, 2001; 32: 19-25.
- ↵
Hirsch FR , Prindiville SA, Miller YE, et al. Сравнение флуоресценции и бронхоскопии в белом свете для выявления предопухолевых поражений: рандомизированное исследование. J Natl Cancer Inst, 2001; 93: 1385–1391.
- ↵
Kennedy TC , Lam S, Hirsch FR.Обзор последних достижений в области флуоресцентной бронхоскопии для ранней локализации рака легких в центральных дыхательных путях. Онколог 2001; 6: 257–262.
- ↵
Кейт Р.Л. , Миллер Ю.Е., Геммилл Р.М., и др. Ангиогенная плоскоклеточная дисплазия бронхов у лиц с высоким риском рака легких. Clin Cancer Res2000; 6: 1616–1625.
- ↵
Франклин WA . Диагностика рака легких: патология инвазивной и преинвазивной неоплазии.Chest2000; 117: 80S – 89S.
- ↵
Fisseler-Eckhoff A , Rothstein D, Muller KM. Неоваскуляризация при гиперпластических, метапластических и потенциально предопухолевых поражениях слизистой оболочки бронхов. Арка Вирхова, 2996; 429: 95–100.
- ↵
Fontanini G , Calcinai A, Boldrini L, et al. Модуляция неоангиогенеза при пренеопластических поражениях бронхов. Онкол Реп, 1999; 6: 813–817.
- ↵
Газдар AF , Минна Дж. Д. Ангиогенез и многоэтапное развитие рака легких. Clin Cancer Res2000; 6: 1611–1612.
- ↵
Сибуя К. , Хосино Х., Чиё М., и др. Субэпителиальные сосудистые паттерны при дисплазии бронхов с помощью бронховидеоскопа с большим увеличением. Thorax2002; 57: 902–907.
- ↵
Cheong W , Prahl S, Welch A.Обзор оптических свойств биологических тканей. IEEE J. Quantum Electron. 1990; 26: 2166–2185.
- ↵
DaCosta RS , Wilson BC, Marcon NE. Светоиндуцированная флуоресцентная эндоскопия желудочно-кишечного тракта. Gastrointest Endosc Clin N Am2000; 10: 37–69.
- ↵
Smith M , Denninghoff K, Lompado A, et al. Влияние множественных световых путей на оксиметрию сосудов сетчатки.Прикладная оптика 2000; 39: 1183–1193.
- ↵
- ↵
Трэвис В.Д. К Т , Коррин Б., Шимосато Y, и др. Гистологическое типирование опухолей легких и плевры. В: Всемирная организация здравоохранения, Международная гистологическая классификация опухолей. 3-е изд. Нью-Йорк: Springer-Verlag, 1999.
.
- ↵
Kusunoki Y , Imamura F, Uda H, et al. Раннее обнаружение рака легких с помощью лазерно-флуоресцентной эндоскопии и спектрофлуорометрии. Chest2000; 118: 1776–1782.
- ↵
Hiroshima K , Iyoda A, Shibuya K, et al. Доказательства неоангиогенеза и увеличения количества пролиферирующих клеток в эпителии бронхов курильщиков. Рак, 2002; 95: 1539–1545.
- ↵
Conklin BS , Zhao W, Zhong DS, et al. Никотин и котинин повышают экспрессию фактора роста эндотелия сосудов в эндотелиальных клетках. Am J Pathol, 2002; 160: 413–418.
- ↵
Heeschen C , Jang JJ, Weis M, et al. Никотин стимулирует ангиогенез и способствует росту опухолей и атеросклерозу. Нат Мед, 2001; 7: 833–839.
- ↵
Хансен-Смит FM . Формирование паттерна капиллярной сети во время ангиогенеза.Clin Exp Pharmacol Physiol2000; 27: 830-835.
Ито Дж. , Ясумура К., Такешита Т., и др. Трехмерное изображение ангиогенеза опухоли. Anal Quant Cytol Histol2000; 22: 85–90.
- ↵
Jin E , Ghazizadeh M, Fujiwara M, et al. Ангиогенез и фенотипические изменения эндотелия альвеолярных капилляров в областях распространения неопластических клеток при первичной аденокарциноме легкого.Патол Int2001; 51: 691–700.
- ↵
Коричневый EB , Кэмпбелл РБ, Цузуки Y, и др. Измерение in vivo экспрессии генов, ангиогенеза и физиологической функции в опухолях с использованием многофотонной лазерной сканирующей микроскопии. Нат Мед, 2001; 7: 864–868.
- ↵
Фолькман Дж. . Каковы доказательства того, что опухоли зависят от ангиогенеза? J Natl Cancer Inst, 1990; 82: 4–6.
- ↵
Фолькман Дж. . Семинары по медицине больницы Бет Исраэль, Бостон. Клинические применения исследований ангиогенеза. N Engl J Med1995; 333: 1757–1763.
- ↵
Хирш FR , Франклин В.А., Газдар А.Ф., и др. Раннее обнаружение рака легких: клинические перспективы последних достижений биологии и радиологии. Clin Cancer Res2001; 7: 5–22.
- ↵
Ханахан Д. , Фолкман Дж.Паттерны и новые механизмы ангиогенного переключения во время туморогенеза. Cell1996; 86: 353–364.
- ↵
Hanahan D , Weinberg RA. Признаки рака. Cell2000; 100: 57–70.
- ↵
Smith-McCune KK , Weidner N. Демонстрация и характеристика ангиогенных свойств дисплазии шейки матки. Cancer Res1994; 54: 800–804.
Обнаружение и классификация рака по изображениям микроскопической биопсии с использованием клинически значимых и биологически интерпретируемых признаков
Предложена и исследована основа для автоматического обнаружения и классификации рака по изображениям микроскопической биопсии с использованием клинически значимых и биологически интерпретируемых признаков.Различные этапы, включенные в предлагаемую методологию, включают улучшение микроскопических изображений, сегментацию фоновых ячеек, выделение признаков и, наконец, классификацию. Соответствующий и эффективный метод используется на каждом этапе проектирования предлагаемой структуры после проведения сравнительного анализа обычно используемых методов в каждой категории. Для выделения деталей тканей и структур используется подход выравнивания адаптивной гистограммы с ограничением контраста. Для сегментации фоновых ячеек используется алгоритм сегментации, потому что он работает лучше по сравнению с другими обычно используемыми методами сегментации.На этапе извлечения признаков предлагается извлекать различные биологически интерпретируемые и клинически значимые формы, а также особенности на основе морфологии из сегментированных изображений. К ним относятся функции текстуры уровня серого, функции на основе цвета, функции текстуры уровня серого цвета, функции, основанные на энергии текстуры закона, функции Тамуры и функции вейвлетов. Наконец, метод ближайшего соседства используется для классификации изображений на нормальные и злокачественные категории, потому что он работает лучше по сравнению с другими широко используемыми методами для этого приложения.Эффективность предлагаемой структуры оценивается с использованием хорошо известных параметров для четырех основных тканей (соединительной, эпителиальной, мышечной и нервной) из 1000 случайно выбранных изображений микроскопической биопсии.
1. Введение
Обнаружение рака всегда было основной проблемой для патологов и практикующих врачей при диагностике и планировании лечения. Ручная идентификация рака по изображениям микроскопической биопсии носит субъективный характер и может варьироваться от эксперта к эксперту в зависимости от их опыта и других факторов, включая отсутствие конкретных и точных количественных показателей для классификации изображений биопсии как нормальных или злокачественных.Автоматическая идентификация раковых клеток по изображениям микроскопической биопсии помогает облегчить вышеупомянутые проблемы и дает лучшие результаты, если для идентификации заболевания используются подходы, основанные на биологически интерпретируемых и клинически значимых признаках.
Около 32% населения Индии в какой-то момент своей жизни заболевает раком. Рак — одно из распространенных заболеваний в Индии, которое приводит к максимальной смертности — около 0,3 миллиона смертей в год [1].Шансы заболеть этим заболеванием увеличиваются из-за изменения привычек людей, таких как увеличение употребления табака, ухудшение пищевых привычек, отсутствие активности и многое другое. Возможность излечения от рака увеличена благодаря недавним достижениям медицины и инженерии. Шансы на излечение от рака в первую очередь заключаются в его обнаружении и диагностике. Выбор лечения рака полностью зависит от уровня его злокачественности. Медицинские работники используют несколько методов для обнаружения рака.Эти методы могут включать в себя различные методы визуализации, такие как рентген, компьютерная томография (КТ), позитронно-эмиссионная томография (ПЭТ), ультразвук и магнитно-резонансная томография (МРТ), а также патологические тесты, такие как анализ мочи и анализ крови.
Для точного выявления онкологических заболеваний патологоанатомы используют изображения гистопатологической биопсии, то есть исследования микроскопической структуры ткани пациента. Таким образом, анализ изображений биопсии является жизненно важным методом обнаружения рака [2, 3]. Гистопатология — это изучение симптомов и признаков заболевания с использованием изображений микроскопической биопсии.Чтобы визуализировать различные части ткани под микроскопом, срезы окрашивают одним или несколькими окрашивающими компонентами. Основная цель окрашивания — выявить компоненты на клеточном уровне, а контрастные пятна используются для обеспечения цвета, видимости и контраста. Гематоксилин-эозин (H&E) — окрашивающий компонент, который патологи используют уже несколько десятилетий. Гематоксилин окрашивает ядра клеток синего цвета, а эозин окрашивает цитоплазму и соединительные ткани розового цвета.Гистология [4] связана с изучением клеток с точки зрения структуры, функции и интерпретации ткани и клеток. Микроскопическая биопсия чаще всего используется для обследования обоих заболеваний из-за менее инвазивной природы. Характеристика микроскопических изображений биопсии — наличие изолированных клеток и кластеров клеток. Образцы микроскопической биопсии легче анализировать по сравнению с гистопатологией из-за отсутствия неосложненных структур [5]. Точная идентификация рака вручную по изображениям микроскопической биопсии всегда была серьезной проблемой для патологов и практикующих врачей, наблюдающих структуру клеток или тканей под микроскопом.
В гистопатологии процесс обнаружения рака обычно состоит из классификации биопсии изображения на злокачественную или доброкачественную [6]. При анализе изображений микроскопической биопсии врачи и патологи наблюдают многие аномалии и классифицируют образец на основе различных характеристик ядер клеток, таких как цвет, форма, размер и пропорция цитоплазмы. Микроскопическая биопсия с высоким разрешением дает надежную информацию для дифференциации аномальных и нормальных тканей.Разница между нормальными и раковыми клетками показана в таблице 1 [7].
| |||||||||||||||||||||||
Для обнаружения и диагностики рака по изображениям микроскопической биопсии гистопатологи обычно изучают специфические особенности клеток и тканевых структур.Различные общие признаки, используемые для обнаружения и диагностики рака по изображениям микроскопической биопсии, включают форму и размер клеток, форму и размер ядер клеток и распределение клеток. Краткое описание этих функций приводится ниже.
(A) Форма и размер ячеек. Было замечено, что общая форма и размер клеток в тканях в основном нормальные. Клеточные структуры раковых клеток могут быть больше или короче нормальных клеток.Нормальные клетки имеют ровную форму и функциональность. Раковые клетки обычно не функционируют должным образом, и их форма часто бывает неправильной.
(B) Размер и форма ядра клетки. Форма и размер ядра раковой клетки часто не соответствуют норме. Ядро в раковых клетках децентрализовано. Изображение клетки выглядит как омлет, в котором центральный желток является ядром, а окружающий белый цвет — цитоплазмой. Ядра раковых клеток больше, чем у нормальных клеток, и отклонены от центра масс.Ядро раковой клетки более темное. Этап сегментации в основном фокусируется на отделении областей интересов (клеток) от фоновых тканей, а также на отделении ядер от цитоплазмы.
(C) Распределение клеток в тканях . Функция каждой ткани зависит от распределения и расположения нормальных клеток. Количество здоровых клеток на единицу площади меньше в раковых тканях. Эти прилагательные к изображениям микроскопической биопсии были включены в функции, основанные на форме и морфологии, особенности текстуры, особенности на основе цвета, матрицу сочетания уровней серого цвета (GLCM), энергию текстуры по Закону (LTE), особенности Тамуры и особенности вейвлетов, которые более поддаются биологической интерпретации. и клинически значимо.
Основная цель данной статьи — спроектировать и разработать структуру и программный инструмент для автоматического обнаружения и классификации рака по изображениям микроскопической биопсии с использованием вышеупомянутых клинически значимых и биологически интерпретируемых признаков. В этом документе основное внимание уделяется выбору подходящего метода для каждого этапа проектирования структуры после проведения сравнительного анализа различных часто используемых методов в каждой категории. Различные этапы, включенные в предлагаемую методологию, включают улучшение микроскопических изображений, сегментацию фоновых ячеек, выделение признаков и, наконец, классификацию.
Остальная часть статьи построена следующим образом. Раздел 2 описывает связанные работы, Раздел 3 представляет методы и модели, Раздел 4 описывает результаты и обсуждения, и, наконец, Раздел 5 подводит итоги работы, представленной в этой статье.
2. Связанные работы
В последние годы в литературе было опубликовано мало работ по проектированию и разработке инструментов для автоматического обнаружения рака по изображениям микроскопической биопсии. Кумар и Шривастава [9] представили подробные обзоры компьютерной диагностики (CAD) для обнаружения рака по изображениям микроскопической биопсии.Демир и Йенер [10] также представили метод автоматической диагностики изображения биопсии. Они представили систему диагностики клеточного уровня с использованием методов обработки изображений. Bhattacharjee et al. [11] представили обзор компьютерной системы диагностики для обнаружения рака по изображениям микроскопической биопсии с использованием методов обработки изображений.
Bergmeir et al. [12] предложили модель для извлечения текстурных особенностей с использованием локальных гистограмм и GLCM. Алгоритм квазиуправляемого обучения работает с двумя наборами данных: в первом из которых нормальные ткани помечены только косвенно, а во втором — немеченая коллекция смешанных образцов нормальных и раковых тканей.Этот метод был применен к набору данных из 22 080 векторов с уменьшенной размерностью, 119 из 132. Области, имеющие раковые ткани, были точно идентифицированы с истинно положительной частотой 88% и ложноположительной частотой 19%, соответственно, с использованием ручного набора наземных данных.
Mouelhi et al. [13] использовали функции текстур Харалика [14], гистограмму ориентированных градиентов (HOG) и статистические моменты на основе цветовых компонентов (CCSM), чтобы классифицировать раковые клетки по изображениям микроскопической биопсии.В этой статье используются различные функции: контраст, корреляция, энергия, однородность, особенности текстуры GLCM [14], RGB, уровень серого и HSV.
Хуанг и Лай [15] представили методологию сегментации и классификации гистологических изображений на основе особенностей текстуры, и при использовании SVM максимальная полученная точность классификации составляет 92,8%.
Landini et al. [16] представили метод морфологической характеристики клеточных окрестностей в неопластической и пренеопластической ткани на изображениях микроскопической биопсии.В этой статье авторы представили преобразования водораздела для вычисления площади клеток и ядер и других параметров. Мера расстояния значения окрестности использовалась для вычисления сложности окрестности со ссылкой на v-ячейки. Наилучшая классификация, полученная классификатором NN, составляет 83% для диспластических и неопластических классов и 58% правильной классификации.
Синха и Рамкришан [17] извлекли некоторые особенности изображений микроскопической биопсии, которые включают эксцентриситет, соотношение площадей, компактность, средние значения цветовых компонентов, энергетическую энтропию, корреляцию, а также площадь клеток и ядра.Точность классификации, полученная с помощью байесовского метода ближайшего соседа, нейронных сетей и машины опорных векторов, составила 82,3%, 70,60%, 94,1% и 94,1% соответственно.
Kasmin et al. [18] извлекли особенности микроскопических изображений биопсии, включая площадь, периметр, выпуклую область, плотность, длину главной оси, область, заполненную ориентацией, эксцентриситет, соотношение площади клетки и ядра, округлость и среднюю интенсивность цитоплазмы. Классификатор NN и нейронной сети используются для точности классификации 86% и 92% соответственно.
В этой статье предлагается и исследуется структура для автоматического обнаружения и классификации рака по изображениям микроскопической биопсии с использованием клинически значимых и биологически интерпретируемых признаков. Для сегментации изображений используется метод цветных средств. Различные гибридные функции, которые извлекаются из сегментированных изображений, включают форму и морфологические особенности, особенности текстуры GLCM, особенности Тамуры, функции, основанные на энергии текстуры по закону, гистограмму ориентированных градиентов, особенности вейвлетов и цветовые особенности.Для целей классификации предлагается использовать метод «ближайшего соседа». Также исследуется эффективность других классификаторов, таких как SVM, случайный лес и нечеткие средние. Для тестирования используются 2828 изображений микроскопической биопсии, доступные из гистологической базы данных [8]. Из полученных результатов было замечено, что предложенный метод работает лучше по сравнению с другими методами, описанными выше. Общее резюме и сравнение предлагаемого метода и других методов представлены в таблице 6 в разделе 4 результатов и анализа.
3. Методы и модели
Обнаружение и классификация рака по изображениям микроскопической биопсии — сложная задача, потому что изображение обычно содержит много кластеров и перекрывающихся объектов. Различные этапы, включенные в предлагаемую методологию, включают улучшение микроскопических изображений, сегментацию фоновых ячеек, выделение признаков и, наконец, классификацию. Для улучшения изображений микроскопической биопсии используется подход адаптивного выравнивания гистограмм с ограничением контраста [19, 20], а для сегментации фоновых клеток используется алгоритм сегментации средних.На этапе извлечения признаков из сегментированных изображений извлекаются различные биологически интерпретируемые и клинически значимые особенности, основанные на форме и морфологии, которые включают особенности текстуры на уровне серого, особенности на основе цвета, особенности текстуры на уровне серого цвета, особенности на основе энергии текстуры по закону (LTE), особенности Тамуры. , и вейвлет-функции. Наконец, классификаторы на основе ближайшего соседства (NN), нечеткой NN и опорной векторной машины (SVM) исследуются для классификации нормальных и злокачественных изображений биопсии.Эти подходы тестируются на четырех основных тканях (соединительной, эпителиальной, мышечной и нервной) из 1000 случайно выбранных изображений микроскопической биопсии. Наконец, характеристики классификаторов оцениваются с использованием хорошо известных параметров, и из результатов и анализа видно, что классификатор на основе нечеткой NN работает лучше для выбранного набора функций. Схема предлагаемой работы представлена на рисунке 1.
3.1. Улучшения
Основная цель предварительной обработки — удалить конкретное ухудшение, такое как уменьшение шума и усиление контраста интересующей области.Изображения биопсии, полученные с помощью микроскопа, могут быть дефектными и неполноценными в некоторых отношениях, таких как плохой контраст и неравномерное окрашивание, и их необходимо улучшить с помощью процесса улучшения изображения, которое увеличивает контраст между передним планом (интересующие объекты) и фоном [21] . Подход адаптивного выравнивания гистограммы с ограничением контраста (CLAHE) [20] используется для улучшения изображений микроскопической биопсии. На рисунке 2 показано исходное и улучшенное изображение с использованием адаптивного выравнивания гистограммы с ограничением контраста.
3.2. Сегментация
Несколько методов сегментации были адаптированы для сегментации цитоплазмы, клеток и ядер [22] из изображений микроскопической биопсии, например, алгоритмы на основе пороговых значений, областей и кластеризации. Однако выбор методов сегментации зависит от типа функций, которые необходимо сохранить и извлечь. Для сегментации ROI (области интереса) основная истина (GT) изображений вручную обрезается и создается из набора данных гистологии [8]. Алгоритмы сегментации, основанные на кластеризации, используются из-за сохранения желаемой информации.Из полученных результатов путем экспериментов следует, что алгоритмы, основанные на кластеризации, а именно метод на основе средств, лучше всего подходят для изображений микроскопической биопсии. На рисунке 3 показано исходное и среднее сегментированное изображение микроскопической биопсии. Для целей тестирования и экспериментов использовались двадцать изображений микроскопической биопсии, доступные из набора гистологических данных [8]. Эти изображения были случайным образом выбраны для сегментации. Изображения наземной истины (GT) создаются вручную путем обрезки области интереса (ROI).Визуальные результаты сегментации на основе текстуры, сегментации FCM, сегментации -средств и сегментации на основе цвета [20, 23–26] представлены на рисунках с 3 (a) по 3 (d). Таким образом, из визуальных результатов, полученных и представленных на рисунках с 3 (a) по 3 (d), видно, что метод сегментации на основе кластеризации -средний работает лучше в большинстве случаев по сравнению с другими подходами к сегментации, рассматриваемыми для микроскопических изображений биопсии. сегментация.
Наконец, сегментированное изображение ROI микроскопической биопсии сравнивается с наземными истинными изображениями для количественной оценки различных подходов к сегментации для всех 20 образцов изображений из набора гистологических данных.Эффективность различных подходов к сегментации, таких как -средние [27], нечеткие -средства [28], сегментация на основе текстуры [29] и сегментация на основе цвета [30], оценивалась с точки зрения различных популярных параметров мер сегментации. Эти параметры включают точность, чувствительность, специфичность, частоту ложных срабатываний (FPR), случайный индекс вероятности (RI), глобальную ошибку согласованности (GCE) и дисперсию информации (VOI).
Ниже приводится краткое описание некоторых из этих показателей эффективности, используемых в этой статье.
(i) Индекс случайной вероятности (PRI) . Случайный индекс вероятности — это непараметрическая мера качества алгоритмов сегментации. Случайный индекс между test () и наземной истиной () оценивается путем суммирования количества пар пикселей с одинаковой меткой и количества пар пикселей, имеющих разные метки в обоих, и последующего деления его на общее количество пар пикселей. Учитывая набор наземных сегментов истинности, PRI оценивается с использованием (1), так что это событие, которое описывает пару пикселей (), имеющую одинаковую или другую метку в тестовом изображении
(ii) Дисперсия информации (VOI) .Вариация информации — это мера расстояния между двумя кластерами (разделами элементов) [31]. Кластеризация с кластерами представлена случайной величиной, такой как, и представляет собой вариацию информации между двумя кластерами и.
Таким образом, представлено с использованием где — энтропия, а — взаимная информация между и. измеряет, насколько кластерное назначение для элемента в кластеризации снижает неопределенность относительно кластера элемента в кластеризации.
(iii) Глобальная ошибка согласованности (GCE) .GCE оценивается следующим образом: предположим, что сегменты содержат пиксель, скажем, такой, что, где обозначает набор сегментов, которые генерируются оцениваемым алгоритмом сегментации, и обозначает набор опорных сегментов. Для начала мера локальной ошибки уточнения оценивается с использованием (3), а затем она используется для вычисления локальных и глобальных ошибок согласованности, где обозначает набор операций разности и представляет набор пикселей, соответствующих области, которая включает в себя пиксель.Используя (3) [31], вычисляется глобальная ошибка согласованности (GCE) с использованием (4), где обозначает общее количество пикселей изображения. GCE определяет количество ошибок при сегментации (0 означает отсутствие ошибки, а 1 означает отсутствие согласия):
В таблице 2 и на рисунке 4 показано сравнение различных алгоритмов сегментации на основе средней точности, чувствительности, специфичности, FPR, PRI, GCE. , и VOI для 20 образцов изображений, взятых из набора данных гистологии [8]. Из таблицы 2 и рисунка 4 видно, что методы -средства, цветовые -средства, нечеткие-средние и методы на основе текстуры работают лучше по номиналу с точки зрения точности, специфичности и показателей сегментации PRI, но за исключением методов сегментации на основе средних значений. другие методы не работают лучше по другим важным параметрам.Только алгоритм сегментации на основе средних значений связан с большим значением точности, чувствительности, специфичности и случайного индекса (RI) и меньшим значением FPR, GCE и VOI по сравнению с другими методами и, следовательно, лучше по сравнению с другими. Следовательно, сегментация на основе -средств — единственный метод, который лучше работает по всем параметрам, и именно поэтому он выбран в качестве метода сегментации в предлагаемой структуре для обнаружения рака по изображениям микроскопической биопсии.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3. Извлечение признаков
После сегментации изображения из интересующих областей извлекаются особенности для выявления и оценки потенциальных раковых образований.Извлечение признаков — один из важных шагов в анализе изображений биопсии. Характеристики извлекаются на уровне ткани и на уровне клеток из изображений микроскопической биопсии для лучшего прогноза. Чтобы лучше фиксировать информацию о форме, мы используем методы на основе областей и контуров, чтобы выделить антициркулярность, неравномерность площади и неправильность контура ядер в качестве трех характеристик формы, отражающих нерегулярность ядер на изображениях биопсии. Функция клеточного уровня фокусируется на количественной оценке свойств отдельных ячеек без учета пространственной зависимости между ними.На изображениях биопсии отдельной клетки извлекаются форма и морфологические, текстурные, гистограммы ориентированных градиентов и вейвлет-характеристики. Характеристики тканевого уровня позволяют количественно оценить распределение клеток по ткани; для этого он в первую очередь использует либо пространственную зависимость ячеек, либо зависимость пикселей от уровня серого.
На основе этих характеристик некоторые важные формы и морфологические особенности объясняются следующим образом.
(i) Площадь ядра (A) .Область ядра может быть представлена областью ядра, содержащей общее количество пикселей; Здесь показано, где — площадь ядра и сегментированное изображение строк и столбцов.
(ii) Яркость ядра . Среднее значение интенсивности пикселей, принадлежащих области ядра, известно как яркость ядра.
(iii) Самый длинный диаметр ядра (NLD) . Диаметр наибольшего круга, описывающего область ядра, известен как наибольший диаметр ядра; это показано, где, и, являются конечными точками на большой оси.
(iv) Наименьший диаметр ядра (NSD). Это представлено через наименьший диаметр круга, описывающего область ядра. Он представлен в виде, где, и являются конечными точками на малой оси.
(v) Удлинение ядра. Это представлено отношением наименьшего диаметра к наибольшему диаметру области ядра, как показано в
(vi) Периметр ядра (P) . Длина периметра области ядра представлена с использованием
(vii) Круглость ядра ( ) .Отношение площади ядра к площади круга, соответствующего наибольшему диаметру ядра, известно как компактность ядра, как показано в
(viii) Solidity . Твердость — это отношение реальной площади клетки / ядра к площади выпуклой оболочки, показанное в
(ix) Эксцентриситет . Отношение длины главной оси к длине малой оси известно как эксцентриситет и определено в
(x) Компактность . Компактность — это соотношение площади и площади периметра.Он сформулирован как
Существует семь наборов функций, используемых для вычисления вектора признаков микроскопических изображений биопсии, которые объясняются следующим образом.
(i) Элементы текстуры (F1 – F22) . [32–34] Автокорреляция, контраст, корреляция, видимость кластера, оттенок кластера, дисперсия разницы, несходство, энергия, энтропия, однородность, максимальная вероятность, сумма квадратов, среднее значение суммы, дисперсия суммы, суммарная энтропия, энтропия разности, информационная мера корреляция 1, информационная мера корреляции 2, обратная разность (INV), нормализованная обратная разность (INN) и нормализованный обратный разностный момент являются основными характеристиками текстуры, которые могут быть вычислены с использованием уравнений свойств текстуры.
(ii) Характеристика морфологии и формы (F23 – F32) . В статьях [35, 36] авторы описывают особенности формы и морфологии. Рассматриваемые форма и морфологические особенности в этой статье — это площадь, периметр, длина большой оси, длина малой оси, эквивалентный диаметр, ориентация, выпуклая область, заполненная область, твердость и эксцентриситет.
(iii) Гистограмма ориентированного градиента (HOG) (F33 – F68) . Гистограмма ориентированного градиента — одна из хороших функций для обожествления объектов [32].В наше наблюдение он будет включен для лучшей и точной идентификации объектов, присутствующих на изображениях микроскопической биопсии.
(iv) Функции вейвлетов (F69–100) . Вейвлеты — это небольшие волны, которые используются для преобразования сигналов для эффективной обработки [3]. Вейвлеты полезны при анализе изображений микроскопической биопсии с несколькими разрешениями, поскольку они быстрые и обеспечивают лучшее сжатие по сравнению с другими преобразованиями. Преобразование Фурье преобразует сигнал в непрерывную серию синусоидальных волн, но вейвлет предшествует ему как по времени, так и по частоте.Этим объясняется эффективность вейвлет-преобразований [37]. Вейвлеты Добеши использовались, потому что они имеют фрактальную структуру и полезны в случае микроскопических изображений биопсии. В этой статье учитываются энтропия, энергия, однородность контраста и сумма вейвлет-коэффициентов.
(v) Цветовые характеристики (F101 – F106). Компонентами этих моделей являются оттенок, насыщенность и значение (HSV) [34]. Это представлено шестигранными пирамидами, вертикальная ось ведет себя как яркость, горизонтальное расстояние от оси представляет собой насыщенность, а угол представляет собой оттенок.Здесь среднее значение и стандартное отклонение компонентов HSV принимаются как характеристики.
(vi) Функции Тамуры (F107 – F109). Характеристики Тамуры вычисляются на основе трех основных характеристик текстуры: контраста, грубости и направленности [3]. Контрастность — это мера разнообразия фактурного рисунка. Следовательно, большие блоки, составляющие изображение, имеют больший контраст. На это влияет использование различной интенсивности черного и белого [32]. Грубость — это мера детализации изображения [32]; таким образом, грубость может быть представлена с использованием среднего размера областей с одинаковой интенсивностью [38].Направленность — это мера направления значений серого в изображении [32].
(vii) Энергия текстуры по закону (LTE) (F110 – F115) . Эти функции представляют собой функции описания текстуры, которые в основном используют средний уровень серого, края, пятна, рябь и волны для создания векторов масок. Маска Ло представлена особенностями изображения без использования частотной области [39]. Законы значительно определили, что несколько масок подходящего размера были очень полезны для различения различных типов текстурных особенностей, присутствующих на изображениях микроскопической биопсии.Таким образом, его классифицированные выборки основаны на ожидаемых значениях дисперсионных квадратных мер этих сверток, называемых мерами энергии текстуры. Метод маски LTE основан на преобразовании энергии текстуры, применяемом к классификации изображения, используемой для оценки энергии в области пропускания фильтров [40].
В таблице 3 представлено распределение названий типов признаков и количество признаков, выбранных для классификации изображений микроскопической биопсии.
Предлагаемая методология обнаружения стадий на основе изображений биопсии и диагностики рака состоит из изображений биопсии и диагностики. улучшение, сегментация, выделение признаков и классификация. Адаптивное выравнивание гистограммы с ограничением контраста (CLAHE) используется для улучшения изображений микроскопической биопсии, поскольку оно позволяет лучше выделить интересующие области на изображениях, что было проверено экспериментально. Чтобы лучше сохранить желаемую информацию на изображениях микроскопической биопсии во время процесса сегментации, были исследованы различные подходы к сегментации на основе кластеризации и текстуры. Для получения изображений микроскопической биопсии необходимо получить как можно больше информации о ядрах, чтобы сделать надежное и точное обнаружение и диагностику на основе параметров клеток и ядер.На основании результатов и анализа, представленных в разделе 4, для сегментации изображений микроскопической биопсии использовался алгоритм сегментации -средний [40], поскольку он работает лучше по сравнению с другими методами. В процессе сегментации метода кластеризации -средств количество кластеров было установлено равным. Кроме того, чтобы найти центр кластеров, в качестве меры сходства используются меры евклидова расстояния в квадрате. На этапе выделения признаков из сегментированных изображений были извлечены различные биологически интерпретируемые и клинически значимые признаки, основанные на форме и морфологии, которые включают признаки текстуры на уровне серого (F1 – F22), признаки на основе формы и морфологии (F23 – F32), гистограмму ориентированных градиенты (F33 – F68), вейвлет-функции (F69 – F100), особенности на основе цвета (F101 – F106), особенности Тамуры (F107 – F119) и функции на основе энергии текстуры по закону (F110 – F115).Наконец, была сформирована 2D-матрица размером 2828 × 115 с использованием всех наборов функций, где 2828 — это количество микроскопических изображений в наборе данных, а 115 — общее количество извлеченных функций. Произвольно выбранные 1000 данных / выборок были использованы для тестирования различных алгоритмов классификации. Для разделения данных на обучающие и тестовые наборы использовался 10-кратный подход перекрестной проверки. Таким образом, 900 данных / выборок были использованы для целей обучения и 100 данных / выборок были использованы для целей тестирования.Ближайший сосед (NN) — это простой классификатор, в котором назначается вектор признаков. Для классификации NN числа ближайшего соседа () были установлены на 5, и были использованы матрица евклидова расстояния и правило «ближайшего», чтобы решить, как классифицировать выборку. Предлагаемый метод был также протестирован с использованием классификатора на основе опорных векторов (SVM) для линейной функции ядра с 10-кратными методами перекрестной проверки. В модели классификации SVM параметры ядра и параметр soft margin играют жизненно важную роль в процессе классификации; лучшая комбинация и была выбрана поиском по сетке с экспоненциально растущими последовательностями и.Каждая комбинация выбора параметров была проверена с помощью перекрестной проверки (10-кратной), и были выбраны параметры с наилучшей точностью перекрестной проверки. Для линейной функции ядра SVM использовался параметр оптимизации квадратичного программирования (QP), чтобы найти разделяющую гиперплоскость. В случае случайного леса значение по умолчанию составляет 500 деревьев и mtry = 10. Производительность классификаторов рассчитывалась с использованием матрицы неточностей размером 2 × 2 и вычислялись значения TP, TN, FP и FN.Точность, чувствительность и специфичность рабочих параметров рассчитывались с использованием (14) — (19). Основные определения этих показателей эффективности можно проиллюстрировать следующим образом. Точность . Точность классификации метода зависит от количества правильно классифицированных образцов (т.е. истинно отрицательных и истинно положительных) [40] и рассчитывается следующим образом: где — общее количество образцов, присутствующих на изображениях микроскопической биопсии. Чувствительность .Чувствительность — это мера доли положительных образцов, которые правильно классифицированы [41]. Его можно рассчитать, используя диапазон значений чувствительности от 0 до 1, где 0 и 1 соответственно означают худшую и лучшую классификацию. Специфичность . Специфичность — это мера доли отрицательных образцов, которые правильно классифицированы [42]. Значение чувствительности рассчитывается с использованием диапазона значений от 0 до 1, где 0 и 1 соответственно означают худшую и лучшую классификацию. Сбалансированная классификационная ставка (BCR) . Среднее геометрическое значение чувствительности и специфичности считается коэффициентом классификации баланса [43, 44]. Он представлен F-Measure . -меры — это гармоничное средство точности и отзывчивости. Он определяется с помощью диапазона значений -measure от 0 до 1, где 0 означает худшую классификацию, а 1 означает лучшую классификацию. Коэффициент корреляции Мэтьюза (MCC) . MCC — это мера известности бинарных классификаций [43].Его можно рассчитать по следующей формуле: его значение находится в диапазоне от -1 до +1, где -1, +1 и 0, соответственно, соответствуют худшему, лучшему, произвольному предсказанию. Обсуждение результатов . В таблице 5 показаны результаты классификации предложенной структуры для четырех различных тканей микроскопических изображений биопсии, содержащих раковые и нераковые случаи, проверенных с использованием четырех популярных классификаторов, таких как -ближайший сосед, SVM, нечеткий NN и случайный лес.
Из таблицы 5 и рисунка 5 (a) для образцов соединительной ткани, содержащих тестовые примеры, сделаны следующие наблюдения . (i) Для идентификации рака по изображениям биопсии соединительной ткани в случае NN среднее значение точности, специфичности, чувствительности, BCR, -measure и MCC составляет 0,921909, 0,940164, 0.819922, 0,880263, 0,759395 и 0,717455 соответственно. (Ii) Для идентификации рака по биопсии соединительной ткани в случае SVM среднее значение точности, специфичности, чувствительности, BCR, -мера и MCC составляет 0,89245, 0,888438, 0,948297, 0, 6, 0,538314 и 0,55879, соответственно. (Iii) Для идентификации рака на основе биопсии соединительной ткани в случае нечеткого NN среднее значение точности, специфичности, чувствительности, BCR, -мера и MCC. равно 0,787879, 0,867476, 0.370074, 0,618789, 0,356613 и 0,231013 соответственно. (Iv) Для идентификации рака по биопсии соединительной ткани, в случае случайного лесного классификатора, среднее значение точности, специфичности, чувствительности, BCR, -мера и MCC составляет 0, 5, 0,993668, 0,493996, 0,743832, 0,647373 и 0,642137 соответственно. Из таблицы 5 и рисунка 5 (b) для образцов тестовых случаев, содержащих эпителиальные ткани, сделаны следующие наблюдения: (i) для идентификации рака по изображениям биопсии эпителиальных тканей в случае NN среднее значение точности, специфичность, чувствительность, BCR, -мера и MCC равны 0.884727, 0, 6, 0,801733, 0,859435, 0,795319 и 0,71626 соответственно. (Ii) Для идентификации рака по биопсии эпителиальных тканей в случае SVM среднее значение точности, специфичности, чувствительности, BCR, -мера и MCC составляет 0,796998, 0,7851, 0,898525, 0,842279, 0,472804 и 0,4587, соответственно. (Iii) Для идентификации рака по биопсии эпителиальных тканей в случае нечеткого NN среднее значение точности, специфичности, чувствительности, BCR, — мера, а MCC равен 0.665834, 0,76465, 0,407057, 0,585984, 0,401181 и 0,17053 соответственно. (Iv) Для идентификации рака по биопсии эпителиальных тканей, в случае случайного лесного классификатора, среднее значение точности, специфичности, чувствительности, BCR, — measure, а MCC — 0,849306, 0,966243, 0,555332, 0,760788, 0,675868 и 0,609494 соответственно. | Из таблицы 5 и рисунка 5 (c) для образцов тестовых случаев, содержащих мышечные ткани, сделаны следующие наблюдения: (i) для идентификации рака по изображениям биопсии мышечной ткани в случае NN среднее значение точности, специфичность, чувствительность, BCR, -мера и MCC равны 0.897321, 0,923277, 0,650761, 0,787092, 0,543009 и 0,49783 соответственно. (Ii) Для идентификации рака по биопсии мышечной ткани в случае SVM среднее значение точности, специфичности, чувствительности, BCR, -мера и MCC составляет 0,884379, 0,886718, 0,786303, 0,83681, 0,263764 и 0,320547, соответственно. (Iii) Для идентификации рака по биопсии мышечной ткани в случае нечеткой NN среднее значение точности, специфичности, чувствительности, BCR, — мера, а MCC равен 0.614958, 0,672503, 0,535894, 0,604364, 0,538571 и 0,208941 соответственно. (Iv) Для идентификации рака по биопсии мышечной ткани, в случае случайного лесного классификатора, точность, специфичность, чувствительность, BCR, -меры и MCC равны 0,889878, 0,995023, 0,193145, 0,594084, 0,313309 и 0,37318 соответственно. Из таблицы 5 и рисунка 5 (d) для образцов тестовых случаев, содержащих нервные ткани, сделаны следующие наблюдения: (i) для идентификации рака по изображениям биопсии нервных тканей в случае NN среднее значение точности, специфичность, чувствительность, BCR, -мера и MCC равны 0.861763, 0,880866, 0,835733, 0,858482, 0,834116 и 0,716492 соответственно. (Ii) Для идентификации рака по биопсии нервных тканей в случае SVM среднее значение точности, специфичности, чувствительности, BCR, -мера и MCC составляет 0,769545, 0,723056, 0,946068, 0,834923, 0,630126 и 0,552038 соответственно. (Iii) Для идентификации рака по биопсии нервных тканей в случае нечеткого NN точность, специфичность, чувствительность, BCR, -меры и MCC равны 0.808453, 0.882722, 0.242776, 0,562835, 0,225886 и 0,11837 соответственно. (Iv) Для идентификации рака по биопсии нервных тканей, в случае случайного лесного классификатора, среднее значение точности, специфичности, чувствительности, BCR, -мера и MCC. составляет 0,843102, 0,92827, 0,723262, 0,825766, 0,792403 и 0,676888 соответственно. Из приведенных выше обсуждений для всех четырех категорий тестовых случаев видно, что NN работает лучше по сравнению с другими классификаторами для идентификации рака по изображениям биопсии нервных тканей. Из всех вышеперечисленных наблюдений можно сделать вывод, что классификатор NN дает лучшие результаты по сравнению с другими методами в случае биопсийных изображений соединительной ткани. Максимальные значения точности, чувствительности и специфичности составляют 0,9552, 0,9615 и 0,9543 соответственно. Классификатор ближайшего соседа также работает лучше во всех случаях, как это обсуждалось выше. В таблице 6 представлен сравнительный анализ предложенной структуры с другими стандартными методами, доступными в литературе.Из таблицы 6 видно, что предлагаемый метод работает лучше по сравнению со всеми другими методами. 5. ВыводыБыла представлена автоматизированная процедура обнаружения и классификации рака по изображениям микроскопической биопсии с использованием клинически значимого и биологически интерпретируемого набора признаков. Предлагаемый анализ был основан на микроскопических наблюдениях клеток и ядер на уровне тканей для выявления и классификации рака. Для улучшения изображения при микроскопической биопсии использовался метод на основе ограниченного контраста адаптивного выравнивания гистограммы.Для сегментации изображений использовался метод кластеризации средств. После сегментации изображений было извлечено в общей сложности 115 гибридных наборов признаков для 2828 образцов гистологических изображений, взятых из базы данных гистологии [8]. После выделения признаков для целей классификации случайным образом было отобрано 1000 образцов. Из 1000 образцов 115 функций 900 образцов были отобраны для целей обучения и 100 образцов были отобраны для целей тестирования. Были протестированы различные подходы к классификации: ближайшая окрестность (NN), нечеткая NN, машина опорных векторов (SVM) и классификаторы на основе случайного леса.Из Таблицы 5 мы можем сделать вывод, что NN является наиболее подходящим алгоритмом классификации для обнаружения доброкачественных и злокачественных микроскопических изображений биопсии, содержащих все четыре основные ткани. SVM дает средние результаты для всех типов тканей, но не лучше, чем NN. Нечеткая NN — сравнительно менее хороший классификатор. Радиочастотный классификатор обеспечивает очень низкую чувствительность и пониженную точность по сравнению с классификатором NN для этого набора данных. Следовательно, из экспериментальных результатов было замечено, что классификатор NN работает лучше для всех категорий тестовых случаев, присутствующих в выбранных тестовых данных.Этими категориями тестовых данных являются соединительные ткани, эпителиальные ткани, мышечные ткани и нервные ткани. Кроме того, среди всех категорий тестовых случаев было отмечено, что предложенный метод лучше работает для тестовых случаев типа соединительной ткани. Показатели производительности для набора данных о соединительной ткани с точки зрения средней точности, специфичности, чувствительности, BCR, -мера и MCC составляют 0,921909, 0,940164, 0,819922, 0,880263, 0,759395 и 0,717455 соответственно. Конфликт интересовАвторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи. Тесты, используемые на биопсийных и цитологических образцах для диагностики ракаТип и степень рака обычно ясны, когда клетки просматриваются под микроскопом после стандартной обработки и окрашивания, но это не всегда так. Иногда патологу необходимо использовать другие процедуры для постановки диагноза. Гистохимические пятнаВ этих тестах используются различные химические красители, которые привлекают определенные вещества, обнаруженные в некоторых типах раковых клеток. Например, слизь притягивает пятно муцикармина.Капли слизи внутри клетки, подвергшиеся воздействию этого пятна, под микроскопом будут выглядеть розово-красными. Это окрашивание полезно, если патолог подозревает, например, аденокарциному (железистый тип рака) при биопсии легкого. Аденокарциномы могут выделять слизь, поэтому обнаружение розово-красных пятен в клетках рака легких скажет патологу, что диагноз — аденокарцинома. Помимо того, что они помогают при сортировке различных видов опухолей, в лаборатории используются другие типы специальных красителей для выявления в тканях микроорганизмов (микробов), таких как бактерии и грибки.Это важно, потому что у людей с раком могут развиться инфекции как побочный эффект лечения или даже из-за самого рака. Это также важно при диагностике рака, потому что некоторые инфекционные заболевания вызывают образование шишек, которые можно принять за рак, пока гистохимические исследования не докажут, что у пациента инфекция, а не рак. Иммуногистохимические красителиИммуногистохимические (ИГХ) или иммунопероксидазные пятна — еще одна очень полезная категория специальных тестов.Основной принцип этого метода заключается в том, что иммунный белок, называемый антителом , будет прикрепляться к определенным веществам, называемым антигенами , которые находятся на клетке или в ней. Каждый тип антител распознает и прикрепляется к антигенам, которые ему точно подходят. Определенные типы нормальных клеток и раковых клеток имеют уникальные антигены. Если у клеток есть специфический антиген, они будут привлекать антитело, соответствующее этому антигену. Чтобы определить, были ли антитела привлечены к клеткам, добавляются химические вещества, которые заставляют клетки менять цвет только при наличии определенного антитела (и, следовательно, антигена). Наши тела обычно вырабатывают антитела, которые распознают антигены микробов и помогают защитить нас от инфекций. Антитела, используемые при окрашивании ИГХ, разные. Они созданы в лаборатории для распознавания антигенов, связанных с раком и другими заболеваниями. Пятна ИГХ очень полезны при идентификации определенных типов рака. Например, рутинно обрабатываемая биопсия лимфатического узла может содержать клетки, которые явно выглядят как рак, но патолог может быть не в состоянии определить, начался ли рак в лимфатическом узле или он начался в другом месте тела и распространился на лимфатический узел.Если рак начался в лимфатическом узле, диагноз — лимфома. Если рак начался в другой части тела и распространился на лимфатический узел, это может быть метастатический рак. Это различие очень важно, потому что лечение зависит от типа рака (а также от некоторых других факторов). Для тестов ИГХ используются сотни антител. Некоторые из них довольно специфичны, что означает, что они реагируют только с одним типом рака. Другие могут реагировать с несколькими типами рака, поэтому можно проверить несколько антител, чтобы решить, какой это тип рака.Глядя на эти результаты вместе с внешним видом рака после обработки образца биопсии, его местонахождением и другой информацией о пациенте (возраст, пол и т. Д.), Часто можно классифицировать рак таким образом, чтобы помочь в выборе лучшее лечение. Хотя красители ИГХ чаще всего используются для классификации клеток, их также можно использовать для обнаружения или распознавания раковых клеток. Когда большое количество раковых клеток распространилось на соседний лимфатический узел, эти клетки обычно легко распознаются, когда патолог смотрит на лимфатическую ткань под микроскопом, используя обычные красители.Но если в узле всего несколько раковых клеток, может быть трудно распознать клетки, используя только обычные красители. Здесь могут помочь пятна IHC. Как только патолог знает, какой вид рака следует искать, он или она может выбрать одно или несколько антител, которые, как известно, реагируют с этими клетками. Добавляется больше химикатов, чтобы раковые клетки меняли цвет и четко выделялись из окружающих их нормальных клеток. Окрашивание IHC обычно не используется для изучения ткани из лимфатических узлов (которые удаляют большое количество узлов), но иногда они используются при биопсии сторожевых лимфатических узлов.(См. Картирование и биопсию Sentinel лимфатических узлов в нашем обзоре типов биопсии.) Еще одно специальное использование этих красителей — помочь отличить лимфатические узлы, содержащие лимфому, от узлов, увеличенных в результате увеличения количества нормальных лейкоцитов (обычно в ответ на инфекцию). Определенные антигены присутствуют на поверхности белых кровяных телец, называемых лимфоцитами . Доброкачественная (незлокачественная) ткань лимфатических узлов содержит множество различных типов лимфоцитов с множеством антигенов на их поверхности.Напротив, такие виды рака, как лимфома, начинаются с одной аномальной клетки, поэтому раковые клетки, которые растут из этой клетки, обычно имеют химические свойства первой аномальной клетки. Это особенно полезно при диагностике лимфомы. Если большинство клеток при биопсии лимфатического узла имеют одинаковые антигены на своей поверхности, этот результат подтверждает диагноз лимфомы. Некоторые красители ИГХ могут помочь распознать в раковых клетках определенные вещества, которые влияют на прогноз пациента и / или на то, могут ли они получить пользу от определенных лекарств.Например, ИГХ обычно используется для проверки рецепторов эстрогена на клетках рака груди. Пациенты, клетки которых имеют эти рецепторы, вероятно, получат пользу от препаратов гормональной терапии, которые блокируют выработку или действие эстрогенов. IHC также может помочь определить, каким женщинам с раком груди могут быть полезны препараты, которые блокируют стимулирующие рост эффекты аномально высоких уровней белка HER2. Электронная микроскопияВ типичном медицинском лабораторном микроскопе для исследования образцов используется луч обычного света.Более крупный и более сложный прибор, называемый электронным микроскопом , использует пучки электронов. Увеличивающая сила электронного микроскопа примерно в 1000 раз больше, чем у обычного светового микроскопа. Такая степень увеличения редко требуется для определения того, является ли клетка раком. Но иногда это помогает найти очень крошечные детали структуры раковой клетки, которые дают ключ к разгадке точного типа рака. Например, некоторые случаи меланомы, очень агрессивного рака кожи, могут выглядеть как другие виды рака под обычным световым микроскопом.В большинстве случаев эти меланомы можно распознать по определенным пятнам ИГХ. Но если эти тесты не дадут однозначного ответа, можно использовать электронный микроскоп для выявления крошечных структур внутри клеток меланомы, называемых меланосомами . Это помогает установить тип рака и выбрать лучший план лечения. Проточная цитометрияПроточная цитометрия часто используется для тестирования клеток костного мозга, лимфатических узлов и образцов крови. Он очень точно определяет, какой у человека тип лейкемии или лимфомы.Это также помогает отличить лимфомы от нераковых заболеваний лимфатических узлов. Образец клеток из биопсии, цитологического образца или образца крови обрабатывают специальными антителами. Каждое антитело прикрепляется только к определенным типам клеток, которые имеют соответствующие антигены. Затем клетки проходят перед лазерным лучом. Если теперь в клетках есть эти антитела, лазер заставит их излучать свет, который затем измеряется и анализируется компьютером. При анализе случаев подозрения на лейкоз или лимфому с помощью проточной цитометрии используются те же принципы, которые описаны в разделе по иммуногистохимии:
Проточная цитометрия также может использоваться для измерения количества ДНК в раковых клетках (называемая плоидностью ). Вместо использования антител для обнаружения белковых антигенов клетки можно обрабатывать специальными красителями, которые вступают в реакцию с ДНК.
Другое использование проточной цитометрии — измерение фракции S-фазы, которая представляет собой процент клеток в образце, которые находятся на определенной стадии деления клеток, называемой синтезом или S-фазой . Чем больше клеток находится в S-фазе, тем быстрее растет ткань и тем более агрессивным может быть рак. Изображение цитометрииКак и проточная цитометрия, в этом тесте используются красители, вступающие в реакцию с ДНК. Но вместо того, чтобы суспендировать клетки в потоке жидкости и анализировать их с помощью лазера, цитометрия изображений использует цифровую камеру и компьютер для измерения количества ДНК в клетках на предметном стекле микроскопа. Как и проточная цитометрия, визуальная цитометрия также может определять плоидность раковых клеток. Генетические тестыЦитогенетикаНормальные клетки человека имеют 46 хромосом (фрагменты ДНК и белка, которые контролируют рост и функцию клеток).Некоторые виды рака имеют одну или несколько аномальных хромосом. Распознавание аномальных хромосом помогает идентифицировать эти типы рака. Это особенно полезно при диагностике некоторых лимфом, лейкозов и сарком. Даже если тип рака известен, цитогенетические тесты могут помочь предсказать состояние пациента. Иногда тесты могут даже помочь предсказать, на какие химиотерапевтические препараты может подействовать рак. В раковых клетках можно обнаружить несколько типов хромосомных изменений:
Иногда раковые клетки могут получить или потерять целую хромосому. Для цитогенетического тестирования раковые клетки выращивают в лабораторных чашках в течение примерно 2 недель, прежде чем их хромосомы можно будет рассмотреть под микроскопом.Из-за этого на получение результатов обычно уходит около 3 недель. Флуоресцентная гибридизация in situФлуоресцентная гибридизация in situ (FISH) во многом похожа на цитогенетическое тестирование. Он может обнаружить большинство хромосомных изменений, которые можно увидеть под микроскопом в стандартных цитогенетических тестах. Он также может обнаружить некоторые изменения, которые слишком малы, чтобы их можно было увидеть при обычном цитогенетическом исследовании. FISH использует специальные флуоресцентные красители, связанные с частями ДНК, которые прикрепляются только к определенным частям определенных хромосом.FISH может обнаруживать хромосомные изменения, такие как транслокации, которые важны для классификации некоторых видов лейкемии. Обнаружение определенных хромосомных изменений также важно для определения того, могут ли определенные лекарственные препараты помочь пациентам с некоторыми типами рака. Например, FISH может показать, когда имеется слишком много копий (так называемая амплификация ) гена HER2, что может помочь врачам выбрать лучшее лечение для некоторых женщин с раком груди. В отличие от стандартных цитогенетических тестов, для FISH нет необходимости выращивать клетки в лабораторных чашках.Это означает, что результаты FISH доступны гораздо раньше, обычно в течение нескольких дней. Молекулярно-генетические тестыДругие тесты ДНК и РНК могут использоваться для обнаружения большинства транслокаций, обнаруживаемых цитогенетическими тестами. Они также могут обнаружить некоторые транслокации, затрагивающие части хромосом, слишком маленькие, чтобы их можно было увидеть под микроскопом с помощью обычного цитогенетического тестирования. Этот тип расширенного тестирования может помочь классифицировать некоторые лейкемии и, реже, некоторые саркомы и карциномы. Эти тесты также полезны после лечения, чтобы найти небольшое количество оставшихся раковых клеток лейкемии, которые можно пропустить под микроскопом. Молекулярно-генетические тесты также могут определять мутации (аномальные изменения) в определенных областях ДНК, которые контролируют рост клеток. Некоторые из этих мутаций могут повышать вероятность роста и распространения рака. В некоторых случаях выявление определенных мутаций может помочь врачам выбрать наиболее эффективные методы лечения. Определенные вещества, называемые рецепторами антигенов , находятся на поверхности клеток иммунной системы, называемых лимфоцитами. Нормальная ткань лимфатических узлов содержит лимфоциты с множеством различных рецепторов антигена, которые помогают организму реагировать на инфекцию.Но некоторые типы лимфомы и лейкемии начинаются с одного аномального лимфоцита. Это означает, что все эти раковые клетки имеют один и тот же рецептор антигена. Лабораторные тесты ДНК генов рецепторов антигенов каждой клетки являются очень чувствительным способом диагностики и классификации этих видов рака. Полимеразная цепная реакция (ПЦР): Это очень чувствительный молекулярно-генетический тест для обнаружения конкретных последовательностей ДНК, например, при некоторых раковых заболеваниях. ПЦР с обратной транскриптазой (или ОТ-ПЦР) — это метод, используемый для обнаружения очень малых количеств РНК.РНК — это вещество, связанное с ДНК, которое необходимо клеткам для производства белков. Для каждого белка в нашем организме существуют определенные РНК. ОТ-ПЦР можно использовать для поиска и классификации раковых клеток. Преимущество ОТ-ПЦР заключается в том, что она может обнаруживать очень небольшое количество раковых клеток в образцах крови или тканей, которые могут быть пропущены другими тестами. ОТ-ПЦР обычно используется для обнаружения определенных видов лейкозных клеток, которые остаются после лечения, но ее ценность для более распространенных типов рака менее очевидна.Недостатком является то, что врачи не всегда уверены, что наличие нескольких раковых клеток в кровотоке или лимфатических узлах означает, что у пациента действительно разовьются отдаленные метастазы, которые вырастут достаточно, чтобы вызвать симптомы или повлиять на выживаемость. При лечении пациентов с наиболее распространенными типами рака до сих пор неясно, должно ли обнаружение нескольких раковых клеток с помощью этого теста быть фактором при выборе вариантов лечения. ОТ-ПЦР также может использоваться для подклассификации раковых клеток. Некоторые тесты RT-PCR измеряют уровни одной или даже нескольких РНК одновременно.Сравнивая уровни важных РНК, врачи иногда могут предсказать, будет ли рак более или менее агрессивным (вероятно, будет расти и распространяться), чем можно было бы ожидать, исходя из того, как он выглядит под микроскопом. Иногда эти тесты могут помочь предсказать, подействует ли рак на определенные методы лечения. Микромассивы экспрессии генов: Эти крошечные устройства в некотором смысле похожи на компьютерные чипы. Преимущество этой технологии состоит в том, что относительные уровни сотен или даже тысяч различных РНК из одного образца можно сравнивать одновременно.Результаты показывают, какие гены активны в опухоли. Эта информация иногда может помочь предсказать прогноз (перспективы) пациента или реакцию на определенные виды лечения. Этот тест иногда используют, когда рак распространился на несколько частей тела, но врачи не знают, где он начался. (Это называется раком неизвестной первичной). РНК-паттерн этих злокачественных новообразований можно сравнить с паттернами известных типов рака, чтобы увидеть, совпадают ли они. При выборе лечения полезно знать, где начался рак.Эти тесты могут помочь сузить тип рака, но они не всегда могут с уверенностью определить тип рака. (Чтобы узнать больше об этом типе рака, см. Неизвестный первичный рак.) Секвенирование ДНК: В течение последних нескольких десятилетий секвенирование ДНК использовалось для выявления людей, унаследовавших генетические мутации, которые значительно увеличивают риск развития определенных типов рака. В этом случае при тестировании обычно используется ДНК из клеток крови либо пациентов, у которых уже есть определенные виды рака (например, рака молочной железы или рака толстой кишки), либо из крови их родственников, которые не болеют каким-либо известным раком, но могут подвергаться повышенному риску. Врачи начали использовать секвенирование ДНК некоторых видов рака, чтобы помочь предсказать, какие целевые препараты с наибольшей вероятностью подействуют на отдельных пациентов. Эту практику иногда называют «персонализированной онкологией» или «точной онкологией». Сначала секвенирование ДНК проводилось только для одного гена или нескольких генов, которые, как было известно, наиболее часто поражались определенными типами рака. Недавний прогресс позволил секвенировать гораздо больше генов или даже все гены рака (хотя это до сих пор не делается в повседневной практике).Эта информация о последовательности иногда показывает неожиданные мутации в генах, которые затрагиваются реже, и может помочь врачу выбрать лекарство, которое в противном случае не было бы рассмотрено, и избегать других лекарств, которые вряд ли будут полезны. . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
