Множественные эндокринные неоплазии у детей и подростков | #03/18
Под синдромом множественной эндокринной неоплазии (МЭН) понимают формирование в двух или более органах эндокринной системы наследственных доброкачественных или злокачественных опухолей и других (диффузных, узловых) гиперпластических процессов с повышенной продукцией гормонов.
Несмотря на относительную редкость сочетания множественных опухолей в разных эндокринных железах, в последнее десятилетие возросло количество публикаций, посвященных этой проблеме. Разработка и внедрение в клиническую практику широкого набора современных методов исследований (молекулярно-генетических, иммуноморфологических, мониторирования уровня гормонов и др.) способствовали значительному нарастанию выявления больных с синдромом множественной эндокринной неоплазии. Признание важности семейного генетического скрининга привело к более тщательному описанию этого синдрома, ранней диагностике и своевременному лечению.
Количество нозологических форм МЭН-синдрома постоянно расширяется. В настоящее время в него включают четыре генетически различных семейных заболевания, Карни-комплекс, синдром Пейтца–Йегерса, нейрофиброматоз 1-го типа, синдром Гиппеля–Линдау, синдром Мак-Кьюна–Олбрайта–Брайцева [1].
Каждый из этих синдромов наследуется по аутосомно-доминантному типу, а фенотипические признаки характеризуются высокой пенетрантностью, разной степенью экспрессивности и внешне не всегда связаны с последствиями мутации отдельного гена. В отдельных случаях точная локализация мутации не известна.
Синдром множественной эндокринной неоплазии 1-го типа (МЭН 1-го типа)
Синдром МЭН 1-го типа (синдром Вермера) — включает в себя гетерогенные наследственные заболевания, в патогенезе которых лежит гиперплазия или опухолевая трансформация нескольких эндокринных желез, в основном нейроэктодермального происхождения.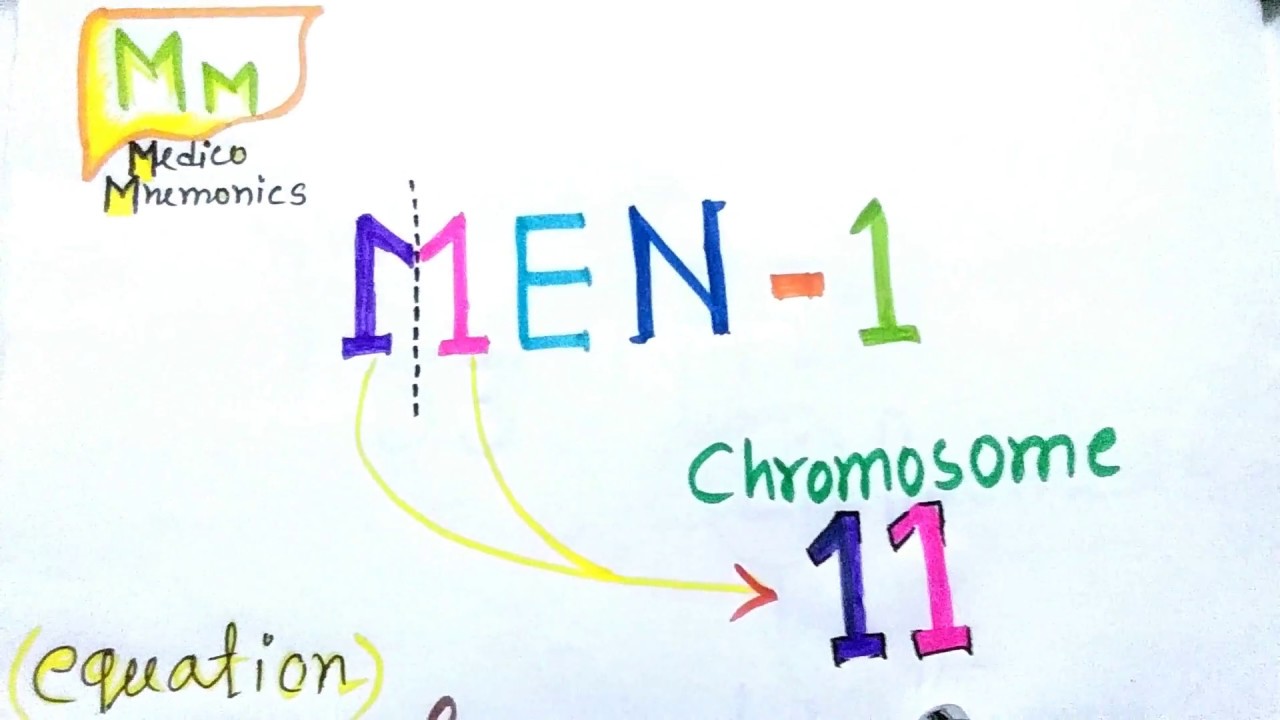 Синдром характеризуется опухолями околощитовидных желез, гипофиза и островков Лангерганса поджелудочной железы. Возможно также появление дуоденальных гастрином, карциноидных опухолей (производных передней эмбриональной кишки), доброкачественных аденом надпочечников и липом.
Синдром характеризуется опухолями околощитовидных желез, гипофиза и островков Лангерганса поджелудочной железы. Возможно также появление дуоденальных гастрином, карциноидных опухолей (производных передней эмбриональной кишки), доброкачественных аденом надпочечников и липом.
Причиной МЭН 1-го типа являются мутации в гене менина, который расположен в длинном плече хромосомы 11 (11q13). Эти изменения в гене идентифицируются у 70–95% пациентов с данным синдромом. Менин является классическим опухолевым супрессором, регулирующим клеточный цикл и транскрипцию. Недостаточность менина приводит к гиперплазии клеток, а отсутствие менина — к их опухолевой трансформации. Частота МЭН 1-го типа составляет 1 случай на 30 000 населения. Среди больных с первичным гиперпаратиреозом синдром МЭН 1-го типа встречается в 2–4% [2].
Синдром Вермера характеризуется высокой пенетрантностью. Первые клинические симптомы у 50% пациентов появляются к 20 годам, а в возрасте старше 40 лет — почти у 95%. Возраст начала заболевания колеблется от 4 до 80 лет, но пик манифестации приходится на возраст от 20 до 40 лет [3].
Вышеизложенные статистические данные говорят о том, что примерно в 50% случаев МЭН 1-го типа может встретиться в детском возрасте, что в свою очередь требует бдительности и более тщательного генетического скринингового контроля детей в семьях с выявленными мутациями гена менина.
МЭН 1-го типа отличается вариабельностью сочетания клинических проявлений. В литературе описано более 20 различных комбинаций эндокринных и метаболических нарушений в рамках данного синдрома. Примерно в 40% случаев МЭН 1-го типа поражаются три эндокринные железы — околощитовидные, поджелудочная железа и гипофиз. У больных с мутацией гена менина и поражением хотя бы одной из этих трех характерных для МЭН 1-го типа опухолей существует риск последующего развития любой из двух других. Чаще синхронно или последовательно развиваются опухоли паращитовидных желез (в 95% случаев), желудочно-кишечного тракта (в 30–80%), аденогипофиза (в 15–90%) [4].
Наиболее характерными новообразованиями для синдрома МЭН 1-го типа являются гиперплазия или опухоли паращитовидных желез, приводящие к развитию у пациента первичного гиперпаратиреоза (ПГПТ). Клинические симптомы обнаруживаются обычно в молодом возрасте (20–25 лет). Поражаются либо три, либо все четыре околощитовидные железы. Из-за нарушения кальциевого обмена больные испытывают постоянное чувство жажды, развиваются полидипсия, полиурия, мочекаменная болезнь или нефрокальциноз, а впоследствии почечная недостаточность. У половины больных с гиперпаратиреозом отмечаются симптомы со стороны пищеварительной системы — потеря аппетита, тошнота, рвота, метеоризм, нарушения стула, снижение массы тела, у 10% — возникают пептические язвы желудка и двенадцатиперстной кишки.
Островково-клеточные новообразования поджелудочной железы, входящие в синдром МЭН 1-го типа, — это чаще всего гастринома и инсулинома (до 60% случаев), реже — глюкагонома, соматостатинома, опухоли из РР-клеток, а также случайно обнаруженные опухоли, не имеющие функциональной активности, и карциномы (медленно растущие гормонально-активные образования). Опухоли в поджелудочной железе при синдроме МЭН 1-го типа диагностируются обычно в возрасте 40 и более лет. Для них характерен мультицентрический (одновременное появление сразу нескольких опухолей) рост. Помимо поджелудочной железы они могут располагаться и в подслизистой оболочке — это множественные мелкие гастриномы двенадцатиперстной кишки [5].
Опухоли аденогипофиза наблюдаются у 60% пациентов. Из гормонально-активных опухолей аденогипофиза наиболее часто обнаруживают пролактиномы. Однако нередки случаи сочетания их с соматотропиномой, кортикотропиномой, тиреотропиномой. В детском возрасте чаще выявляются гормонально-неактивные микроаденомы. В большом обзоре (2230 пациентов с аденомой гипофиза) синдром МЭН 1-го типа диагностирован у 1,4% детей в возрасте до 11 лет, из них лишь у 16% были гормонально-активные опухоли [6].
Карциноидные новообразования (из группы нейроэндокринных опухолей) встречаются преимущественно у мужчин. Это карциноидная опухоль тимуса, рост которой не проявляется никакими клиническими признаками. Для женщин более характерно наличие подобных опухолей в бронхиальном дереве, продуцирующих кортикотропин-релизинг-гормон, адренокортикотропный гормон (АКТГ). При синдроме МЭН 1-го типа также обнаруживаются множественные карциноидные опухоли в желудке и других отделах пищеварительной системы (гастриномы и др.).
Это карциноидная опухоль тимуса, рост которой не проявляется никакими клиническими признаками. Для женщин более характерно наличие подобных опухолей в бронхиальном дереве, продуцирующих кортикотропин-релизинг-гормон, адренокортикотропный гормон (АКТГ). При синдроме МЭН 1-го типа также обнаруживаются множественные карциноидные опухоли в желудке и других отделах пищеварительной системы (гастриномы и др.).
Надпочечники при синдроме Вермера поражаются часто. Это обычно гормонально-неактивные опухоли (инциденталома), которые являются случайной находкой при визуализации компьютерной томографией.
Характерными для синдрома МЭН 1-го типа являются новообразования на коже: липомы, ангиофибромы, коллагеномы (невусы), которые являются своеобразными предвестниками развития синдрома до формирования очевидной клинической картины заболевания.
Синдром множественных эндокринных неоплазий 4-го типа (МЭН 4-го типа)
У 10–30% пациентов с фенотипическим проявлением, характерным для синдрома МЭН 1-го типа, не выявляют мутации в гене МЭН 1-го типа. В менее чем у 3% таких больных обнаруживаются мутации гена CDK1B, который кодирует ингибитор циклин-зависимой киназы (p27). Последний регулирует клеточную пролиферацию и дифференциацию. В эксперименте на животных мутация в этом гене вызывает опухолевый рост в эндокринных органах, схожих при МЭН 1-го типа. Такой вариант выделили в МЭН 4-го типа [7].
Диагностика синдрома МЭН 1-го типа складывается из сбора анамнеза, физикального обследования, лабораторных, генетических и инструментальных методов исследования. При наличии отягощенного семейного анамнеза, что подтверждается при проведении генетических исследований, а также при манифестном поражении двух эндокринных желез необходимо исследовать и другие органы, которые подвержены частому поражению, с целью раннего выявления и своевременной терапии.
Лабораторные исследования — один из важных этапов диагностики синдрома МЭН 1-го типа. Диагностическими критериями гиперпаратиреоза являются повышение концентрации ионизированного кальция и снижение уровня фосфора и щелочной фосфатазы в плазме, повышение уровня интактного паратгормона в крови, гиперкальциурия и гиперфосфатурия. Для обнаружения нейроэндокринных опухолей рекомендуется определение уровня гастрина и инсулина в крови натощак, а также оценка содержания хромогранина А. С целью визуализации новообразований, а также размеров и характера опухолевого процесса используют ультразвуковое исследование паращитовидных желез, органов брюшной полости и забрюшинного пространства, магнитно-резонансную томографию головного мозга.
Для обнаружения нейроэндокринных опухолей рекомендуется определение уровня гастрина и инсулина в крови натощак, а также оценка содержания хромогранина А. С целью визуализации новообразований, а также размеров и характера опухолевого процесса используют ультразвуковое исследование паращитовидных желез, органов брюшной полости и забрюшинного пространства, магнитно-резонансную томографию головного мозга.
Показаниями для проведения генетического исследования для выявления мутаций гена МЭН 1-го типа служит обнаружение у пациентов двух и более новообразований, характерных для синдрома МЭН 1-го типа, выявление множественных опухолей паращитовидных желез у пациентов младше 30 лет, рецидивы гиперпаратиреоза после оперативного вмешательства у больных с множественными гастриномами и опухолями поджелудочной железы. Кроме того, генетическое обследование рекомендовано родственникам пациентов с выявленной генетической мутацией.
У детей с обнаруженными мутациями, характерными для МЭН 1-го типа, после 8 лет назначают ежегодные исследования концентрации ионизированного кальция, фосфора, паратгормона, гастрина, пролактина, кортизола, АКТГ, а также глюкозы и иммунореактивного инсулина натощак.
После 5 лет один раз в 3 года проводят магнитно-резонансную томографию гипоталамо-гипофизарной области, УЗИ паращитовидных, поджелудочной желез, органов брюшной полости [1].
Основной целью лечения больных с МЭН 1-го типа является удаление новообразований и последующая коррекция гормонального дисбаланса.
Учитывая, что наиболее распространенным является поражение паращитовидных желез, хирургическое лечение является методом выбора. Однако оптимальные сроки не определены, и решение об оперативном вмешательстве принимается, основываясь на данных инструментально-лабораторных исследований. Рекомендуется субтотальная паратиреоидэктомия (не менее 3,5 желез) или тотальная паратиреоидэктомия.
Однако результаты лечения опухолей, ассоциированных с MЭН 1-го типа, не всегда успешны в связи с частым обширным местным распространением опухоли, высокой вероятностью рецидивов [5].
Синдром множественной эндокринной неоплазии 2-го типа
Синдром множественной эндокринной неоплазии 2-го типа (МЭН 2-го типа) объединяет группу патологических состояний, для которых характерно наличие новообразования или гиперпластического процесса из клеток нейроэктодермы, поражающего два и более органов эндокринной системы.
В популяции этот синдром встречается с частотой 1:30 000, является аутосомно-доминантным заболеванием с высоким риском развития нейроэндокринных опухолей, сопровождающихся возникновением и накоплением в семьях медуллярного рака щитовидной железы (МРЩЖ), феохромоцитомы и гиперплазии паращитовидных желез [8].
Характеризуется высокой пенетрантностью и вариабельностью проявлений. Встречается чаще у молодых людей и в детском возрасте. Несмотря на то, что механизм развития синдрома до конца не изучен, он напрямую связан с развитием дефектов в протоонкогене RET. Ген RET (Rearranged during transfection) локализуется в 10-й хромосоме и состоит из 20 экзонов. Он кодирует клеточно-поверхностный гликопротеин, относящийся к классу рецепторов тирозинкиназы, играющей роль в развитии ганглионарной пластинки и ее производных. Ген функционирует в тканях человека, являющихся производным нервного гребешка (парафолликулярные клетки щитовидной железы, медуллярная часть надпочечников и симпатические ганглии). В фолликуллярных клетках щитовидной железы и в корковом слое надпочечников этот ген не передает информацию.
МЭН 2-го типа подразделяют на три подтипа: МЭН 2A (синдром Сиппла), МЭН 2Б (синдром Горлина) и медуллярный рак щитовидной железы. Практически во всех случаях МЭН 2-го типа обнаруживают МРЩЖ.
Мутации внеклеточного домена протоонкогена RET, локализующиеся в 10-м и 11-м экзонах, в большинстве случаев выявляются при синдромах МЭН 2А и МРЩЖ. Развитие синдрома МЭН 2Б ассоциировано с мутациями внутриклеточного домена (14–16 экзоны).
В соответствии с последней информацией, представленной ARUP Online Scientific Resourse, зарегистрировано 155 герминальных мутаций гена RET. Cогласно базе данных этой организации и данным Американской тиреоидологической ассоциации (American Thyroid Association, ATA) пациенты, страдающие только синдромом МРЩЖ, имеют относительно низкий риск развития агрессивных форм опухоли. В этих случаях чаще всего выявляются мутации в 13-м экзоне (кодоны 768, 790), 14-м экзоне (кодон 804) и 15-м экзоне (кодон 891) протоонкогена RET [9].
Cогласно базе данных этой организации и данным Американской тиреоидологической ассоциации (American Thyroid Association, ATA) пациенты, страдающие только синдромом МРЩЖ, имеют относительно низкий риск развития агрессивных форм опухоли. В этих случаях чаще всего выявляются мутации в 13-м экзоне (кодоны 768, 790), 14-м экзоне (кодон 804) и 15-м экзоне (кодон 891) протоонкогена RET [9].
У пациентов с синдромом МЭН 2А сохраняется промежуточный риск развития прогностически неблагоприятных форм МРЩЖ и мутации чаще локализуются в 10-м экзоне (кодоны 609, 611, 618, 620) и в 630-м кодоне 11-го экзона гена RET. К группе высокого риска относятся пациенты с классическим синдромом МЭН 2А. Мутации в данном случае обнаруживаются в 634-м кодоне 11-го экзона протоонкогена RET.
К самой неблагоприятной группе прогноза с ранним возрастом манифестации МРЩЖ, ранним отдаленным метастазированием и агрессивным характером роста опухоли относятся пациенты с синдромом МЭН 2Б, при котором чаще всего мутации выявляются в 883-м кодоне 15-го экзона (3%) и 918-м кодоне 16-го экзона (95%) протоонкогена RET [9, 10].
Синдром МЭН 2А подтипа составляет 70–80% от всех случаев, который сочетает в себе МРЩЖ, феохромоцитому и поражение паращитовидных желез. МРЩЖ является главным проявлением заболевания и встречается в 70–90% случаев. Диагностируется обычно в возрасте до 35 лет, при этом у 70% пациентов уже на стадии регионального лимфогенного метастазирования. Второй по частоте опухолью при синдроме Сиппла является феохромоцитома, которая выявляется у 60–75% больных, причем в 50–80% случаев она является двусторонней. Ей сопутствует общая слабость, умеренная транзиторная или постоянная артериальная гипертензия, гипергидроз, гиперсаливация, полиурия. При кризовом течении феохромоцитомы высока вероятность фибрилляции желудочков, острой сердечной недостаточности, отека легких. Гиперплазия паращитовидных желез при МЭН 2А подтипа имеет место в 20% случаев и характеризуется мягким течением [11].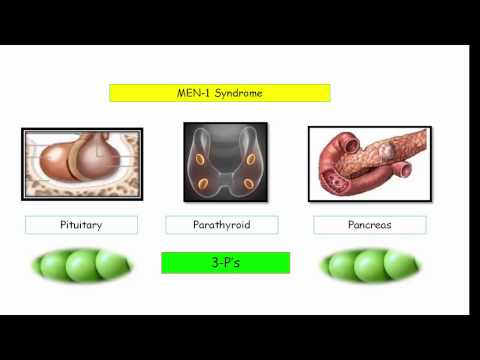
Синдром МЭН 2Б подтипа составляет около 5% от всех случаев синдрома МЭН 2-го типа. В отличие от двух других подтипов синдром Горлина характеризуется наличием специфических фенотипических проявлений, ранней манифестацией и агрессивным течением МРЩЖ [12]. Приблизительно 75% пациентов имеют марфаноподобный фенотип, страдают кифосколиозом или лордозом, у части больных отмечают гипермобильность суставов и снижение подкожно-жировой клетчатки. Уже в раннем детском возрасте обращают на себя внимание выступающие губы, подслизистые узелки на пограничной линии губ. Невриномы век вызывают утолщение и выворачивание наружу края верхнего века [12].
У некоторых пациентов возможно образование неврином на поверхности языка, твердого неба, задней поверхности слизистой глотки. У 40% пациентов с синдромом МЭН 2Б при плановом обследовании диагностируется диффузный ганглионейроматоз желудочно-кишечного тракта, ассоциированный с развитием таких симптомов, как мегаколон и диарея.
В исследовании 19 человек с МЭН 2B у 84% авторами обнаружено поражение желудочно-кишечного тракта уже в раннем детстве [13]. Изменения околощитовидных желез при этом варианте синдрома МЭН 2В не типично.
Наследственный (семейный) МРЩЖ составляет 10–20% всех случаев синдрома МЭН 2-го типа и является, как правило, единственным проявлением заболевания с более поздним возрастом манифестации болезни. При этом подтипе МРЩЖ наследуется во многих поколениях. У членов семьи отсутствуют феохромоцитома и ПГПТ. Поскольку мутация RET встречается при всех клинических подтипах МЭН 2-го типа, МРЖЩ может рассматриваться как МЭН 2A с пониженной специфичностью. В связи с этим молекулярно-генетическое тестирование является практически обязательным и чаще всего используется для выделения спорадических случаев МРЖЩ [14].
Каждый из подтипов МЭН 2-го типа может быть заподозрен на основе клинических признаков. Для МЭН 2A типично появление двух или более специфичных эндокринных опухолей (МРЩЖ, феохромоцитома или паращитовидная аденома/гиперплазия) у одного человека или у близких родственников. МЭН 2B можно предположить при наличии марфаноподобной внешности, поражения слизистых, а также МРЖЩ [10]. В отличие от МЭН 2А при МЭН 2В отсутствует ПГПТ. МРЖЩ следует иметь в виду в семьях при обнаружении этого заболевания в нескольких поколениях при отсутствии феохромоцитомы и аденомы паращитовидной железы.
МЭН 2B можно предположить при наличии марфаноподобной внешности, поражения слизистых, а также МРЖЩ [10]. В отличие от МЭН 2А при МЭН 2В отсутствует ПГПТ. МРЖЩ следует иметь в виду в семьях при обнаружении этого заболевания в нескольких поколениях при отсутствии феохромоцитомы и аденомы паращитовидной железы.
При подозрении на МРЩЖ обязательно следует проводить определение базального и стимулированного (глюконатом кальция) уровня кальцитонина, который в этих случаях резко повышается. Для подтверждения феохромоцитомы определяют содержание метанефрина и норметанефрина в суточной моче. А увеличение секреции паратгормона подтверждается определением его концентрации, а также содержания ионов кальция и фосфора в сыворотке крови.
Для визуализации новообразований, составляющих основу синдрома множественных эндокринных неоплазий, применяют ультразвуковое исследование, компьютерную и магнитно-резонансную томографию. При нетипичной локализации феохромоцитомы одними из наиболее информативных методов является сцинтиграфия с метайодбензилгуанидином (МИБГ).
При обнаружении генетической основы синдрома даже при отсутствии клинических признаков ежегодно проводят анализы гормонов — кальцитонина, паратгормона и катехоламинов — с целью раннего распознавания синдрома МЭН 2-го типа. Основной целью лечения при МЭН 2-го типа является избавление от опухолевых очагов и последующая коррекция гормональных нарушений.
Такая тактика лечения и профилактика МРЩЖ предполагает исключительно оперативный путь, который включает радикальную тиреоидэктомию с центральной шейной лимфаденэктомией. Даже при опухолях размером менее 1 мм узловые метастазы описаны в 50% случаев [15].
У детей с мутацией гена RET могут применяться две стратегии лечения. Первая основана на постоянном контроле уровня кальцитонина в сыворотке крови, перед тем как выполнить оперативное лечение и тем самым отдалить срок его проведения. Однако необходим постоянный скрининг, который может учесть отсутствие достоверной корреляции роста лабораторных показателей от распространенности опухолевого процесса. В связи с этим появляется риск образования инвазивных и местно распространяемых форм рака, что в свою очередь будет влиять на объем хирургического вмешательства и ухудшение в дальнейшем прогноза заболевания [16].
В связи с этим появляется риск образования инвазивных и местно распространяемых форм рака, что в свою очередь будет влиять на объем хирургического вмешательства и ухудшение в дальнейшем прогноза заболевания [16].
Вторая стратегия заключается в проведении профилактических тиреоидэктомий на ранней стадии, основанная только на мутации гена RЕТ. То есть этим детям рекомендуют проводить превентивную тиреоидэктомию в раннем возрасте, когда существует низкая вероятность инвазивного МРЩЖ. Профилактическая тиреоидэктомия при мутации RET-гена является предпочтительнее длительного лабораторного скрининга. Уровень лимфаденэктомии может быть ограничен паратрахеальными и центральной группой лимфоузлов. При наличии верифицированных метастазов других групп лимфоузлов оперативное вмешательство проводится в соответствии с онкологическими стандартами.
Если МРЩЖ сочетается с феохромоцитомой, лечение начинают с удаления опухоли надпочечников, а именно с проведения адреналэктомии при одностороннем поражении и удалении обоих надпочечников при двустороннем поражении. С профилактической целью удаление обоих надпочечников не предусмотрено.
При гиперплазии паращитовидных желез поражение всех четырех желез одновременно наблюдается крайне редко, однако целесообразно проведение их полноценной ревизии. Увеличенные железы удаляют полностью либо частично. Удаление паращитовидных желез при хирургическом вмешательстве на щитовидной железе возможно лишь после подтверждения гиперпаратиреоза на основании биохимических данных. Так как агрессивность гиперпаратиреоза в общем течении синдрома МЭН 2-го типа невысока, удаление паращитовидных желез с профилактической целью не рекомендуется [14].
Медуллярный рак щитовидной железы нечувствителен к лучевой терапии и химиотерапии, однако в эпоху таргетной терапии крайне перспективным является изучение влияния препарата вандетаниб.
Вандетаниб, являясь селективным ингибитором тирозинкиназы, подавляет активность тирозинкиназы рецептора-2 фактора роста сосудистого эндотелия. Этот препарат уменьшал ангиогенез, индуцированный опухолевыми клетками, проницаемость сосудов опухоли, подавлял рост опухоли и метастазов на моделях гетеротрансплантата рака легкого человека у бестимусных мышей. В ходе клинического исследования с участием 331 пациента с неоперабельными местно-распространенным или метастатическим МРЩЖ показано статистически значимое улучшение выживаемости без прогрессирования при приеме вандетаниба по сравнению с плацебо [17].
Этот препарат уменьшал ангиогенез, индуцированный опухолевыми клетками, проницаемость сосудов опухоли, подавлял рост опухоли и метастазов на моделях гетеротрансплантата рака легкого человека у бестимусных мышей. В ходе клинического исследования с участием 331 пациента с неоперабельными местно-распространенным или метастатическим МРЩЖ показано статистически значимое улучшение выживаемости без прогрессирования при приеме вандетаниба по сравнению с плацебо [17].
Имеются данные, что применение данного препарата у детей с синдромом МЭН 2-го типа дает хороший ответ при метастатических формах МРЩЖ, существенно увеличивая продолжительность жизни [17].
Карни-комплекс
Карни-комплекс — редкий преимущественно наследственный аутосомно-доминантный синдром, характеризирующийся наличием лентигиноза кожи, миксом сердца, кожи, молочных желез и эндокринными опухолями [18].
У 70% пациентов выявлена гетерозиготная мутация в гене PRKAR1A, который располагается на 17-й хромосоме в области 17q22–24.5. Это ген-супрессор опухоли, который кодирует протеинкиназу А (ПКА). Эта мутация может возникнуть de novo у 20% пациентов. В ряде случаев обнаружены мутации гена CNC2, в локусе 2p16, отвечающем за поддержание стабильности генома клеток. Изменение этого гена активизирует клеточную пролиферацию и дифференцировку, лежащую в основе канцерогенеза [19].
К классическим проявлениям комплекса Карни можно отнести пятнистую пигментацию (лентиго) на лице, конъюнктивах, груди и плечах, кайме губ, тыльной поверхности кистей и стоп, вульвы, перианальной области и головке полового члена. Пигментация может иметь цвет загара от темно-коричневого до черного. Эти элементы клинически не отличаются от веснушек, но имеют другое гистологическое строение и, как правило, менее 5 мм в размере. Кроме того, на коже при данном синдроме могут выявляться голубые невусы, подкожные нейрофибромы и реже меланотические шванномы.
Лентиго у пациентов с Карни-комплексом похожи на те, которые характерны для синдрома Пейтца–Егерса и синдрома Мак-Кьюна–Олбрайта–Брайцева, но гены, в которых происходит мутация, разные.
Миксомы сердца обычно возникают преимущественно в возрасте 20–30 лет, у 9–22% пациентов имеют склонность к эмболизации сосудов, приводя к ишемическим инсультам, сердечной недостаточности и внезапной сердечной смерти. Они могут сопровождаться лихорадкой, болью в суставах, одышкой и диастолическим шумом. В литературе описан случай возникновения ишемического инсульта у 6-летней девочки с Карни-комплексом, вследствие эмболизации частицами миксомы левого предсердия [20].
Кожные миксомы чаще всего развиваются на веках, в наружном канале уха, хотя могут поражать любую часть кожи, редко превышают размеры более 1 см. Это, как правило, мелкие темно-розовые опалесцирующие папулы. У 80% пациентов с миксомой сердца сопутствуют аналогичные изменения на коже. Необычным проявлением Карни-комплекса можно считать множественные двусторонние миксоидные фиброаденомы молочных желез [21].
Среди поражений эндокринной системы Карни-комплекса чаще выявляется АКТГ-независимый синдром Кушинга, обусловленный первичной микроузелковой гиперплазией коркового слоя обоих надпочечников. Подтверждает особенность морфологической структуры надпочечников проба с дексаметазоном — уровень кортизола повышается более чем наполовину [21]. Синдром гиперкортицизма может протекать волнообразно с разной степенью выраженности.
Кожные миксомы чаще всего развиваются на веках, в наружном канале уха, хотя могут поражать любую часть кожи, редко превышают размеры более 1 см. Это, как правило, мелкие темно-розовые опалесцирующие папулы. У 80% пациентов с миксомой сердца сопутствуют аналогичные изменения на коже. Реже встречаются у молодых людей крупноклеточные кальцифицированные опухоли клеток Сертоли в тестикулах. Для них в клинике характерна гинекомастия, обусловленная избыточной ароматазной активностью. Описаны единичные случаи овариальных кист у пациенток, а у мужчин лейдигом.
Комплекс Карни также может включать в себя клинические проявления аденомы гипофиза (гиперпролактинемии и соматотропинемии), гиперпаратиреоз, доброкачественные узловые образования щитовидной железы, двустороннюю протоковую аденому молочной железы.
Генетический скрининг рекомендуется делать при наличии отягощенного семейного анамнеза. При подтверждении генетических аномалий проводят лабораторную и инструментальную диагностику, что позволяет диагностировать заболевание на ранней стадии и предотвратить возникновение жизнеугрожающих последствий [22].
Синдром Пейтца–Егерса
Это редкий аутосомно-доминантный наследственный синдром с мутацией в гене серин-треонинкиназы (STK11), который действует как ингибитор опухоли. Его избыточная экспрессия может вызвать нарушение клеточного цикла клетки в фазе G1. Роль гена STK11, расположенного на хромосоме 19p13.3, в жизнедеятельности клетки еще изучается. Синдром Пейтца–Егерса относится к наследственным гамартомным полипозам. Каждый родственник первой линии родства человека с синдромом Пейтца–Егерса имеет 50% вероятность того, что этот синдром проявится на любом возрастном этапе жизни. Но у 45% пациентов с синдромом Пейтца–Егерса не наблюдается отягощенного семейного анамнеза.
Мутация в этом гене вызывает у человека целый спектр фенотипических проявлений.
С этим синдромом ассоциируется повышенная частота опухоли в яичниках и в тестикулах. В последних они представлены доброкачественными опухолями клеток Сертоли с кальцификатами. У юношей развивается препубертатная гинекомастия. Это объясняется потерей гетерозиготности в локусе STK11 в клетках Сертоли и клетках молочной железы, что приводит к увеличению экспрессии ароматазы. У некоторых больных выявляют опухоли молочных желез и щитовидной железы [23].
Меланиновая пигментация кожи и слизистых оболочек является типичным симптомом заболевания. Она характеризуется меланиновыми пятнами (лентиго), круглой или овальной формы, диаметром от 1 до 5 мм, вокруг рта и глаз, на носу, реже на конечностях, на слизистой оболочке полости рта, прямой кишке и гениталий. Пятна на красной кайме губ отличаются большей плотностью, чем на коже. Они не вызывают болезненных ощущений, имеют небольшой размер, овальную форму, коричневый цвет, не темнеют при длительном пребывании на солнце, не малигнизируются. Пятна появляются в раннем возрасте, иногда у грудных детей. Наличие подобных элементов может указывать на повышенный риск развития рака органов пищеварительной и репродуктивной системы.
Пятна появляются в раннем возрасте, иногда у грудных детей. Наличие подобных элементов может указывать на повышенный риск развития рака органов пищеварительной и репродуктивной системы.
Синдрому сопутствует гамартоматозный полипоз. Крупные полипы кишечника обычно располагаются в тощей кишке (93%) от 5 см и больше в размере, на ножке или широком основании, а мелкие чаще встречаются в желудке и толстой кишке. Полипы преимущественно доброкачественные аденоматозного типа. При гистологическом исследовании определяются гиперхромные ядра, в перестроенных железах мышечные волокна прорастают в мышечную пластику слизистой оболочки, что позволяет считать их предраковыми клетками. Множественный полипоз желудочно-кишечного тракта долгое время ничем себя не проявляет и манифестирует в зрелом возрасте. У детей пигментация на слизистых и семейный анамнез требуют проведения генетических исследований [24].
Нейрофиброматоз 1-го типа
Нейрофиброматоз представляет собой гетерогенную группу наследственных синдромов, приводящих к развитию опухолей центральной и периферической нервной системы. На сегодняшний день наиболее распространенной формой является нейрофиброматоз типа 1 (НФ1), известный как болезнь фон Реклингхаузена или периферический нейрофиброматоз. Это аутосомно-доминантное заболевание, причиной которого является мутация супрессорного гена НФ1 с образованием нейрофибром периферических нервов.
В гене НФ1 содержится информация, ответственная за синтез белка нейрофибромина. Из-за повреждения гена в одной из пар 17 хромосом половина синтезируемого нейрофибромина становится дефектной, что ведет к усиленной пролиферации клетки [25].
Частота встречаемости НФ1 приблизительно 1:2500 до 3000. Если аллельный ген в парной хромосоме не подвергается мутации и синтез белка не прекращается, то усиливается рост доброкачественных образований. Если повреждается и аллельный ген нейрофибромина, развивается злокачественная опухоль. Примерно 50% мутаций появляются de novo у пациентов, не имеющих семейного анамнеза НФ1 [26].
Клиническая картина нейрофиброматоза Реклингхаузена отличается значительным многообразием симптомов. Самым ранним признаком, позволяющим заподозрить заболевание, является наличие у новорожденного или ребенка более 5 молочно-кофейных пигментных пятен диаметром от 0,5 до 15 мм и больше. Обычно они расположены на туловище и шее, но могут быть на лице и конечностях. Хотя кофейные пятна являются специфической находкой при нейрофиброматозе, они могут встречаются у 10% здорового населения, а также при синдромах Рассела–Сильвера, МЭН 2В, Легиуса, Мак-Кьюна–Олбрайта–Брайцева.
Нейрофибромы диагностируются примерно у 60% пациентов. Они могут появляться как на коже, так и во внутренних органах. Кожные формы могут быть на ножке, в форме узелков или бляшек, чаще развиваются в позднем детстве, и частота их нарастает в зрелом возрасте. Внутриорганные нейрофибромы могут возникать по всему телу, в том числе периорбитально, в забрюшинном пространстве, на протяжении желудочно-кишечного тракта, в средостении [27].
Патогномоничным для внутренних нейрофибром при НФ1 является плексиформный (гроздевидный) рост нейрофибромы. Переплетенные нейрофибромы часто развиваются в детстве и быстро растут, оказывая интенсивное давление на прилегающие ткани. В отличие от кожной формы, плексиформная нейрофиброма имеет повышенный риск трансформации в злокачественную опухоль оболочки периферического нерва [27].
Пациенты с НФ1 также имеют значительную предрасположенность к злокачественным опухолям вне нервной системы. Дети имеют высокий риск, в 7 раз большую вероятность появления системного онкологического злокачественного новообразования кроветворения, особенно миелоидного лейкоза, по сравнению с детьми их возрастной группы. У пациентов с НФ1 высокий риск развития рака молочной железы, особенно у женщин в возрасте 50 лет.
Наконец, хотя это и редкое явление, возможно появление феохромоцитомы надпочечников у пациентов с НФ1 до 5%, у населения в целом — менее 1%. Кроме того, многие пациенты с НФ1 маленького роста, хотя их пропорции тела остаются нормальными. Механизм возникновения скелетных деформаций еще неизвестен, однако у таких пациентов отмечается низкая костная минеральная плотность и низкая концентрация витамина D и, как следствие, высокая статистика повторных переломов у детей [28].
Кроме того, многие пациенты с НФ1 маленького роста, хотя их пропорции тела остаются нормальными. Механизм возникновения скелетных деформаций еще неизвестен, однако у таких пациентов отмечается низкая костная минеральная плотность и низкая концентрация витамина D и, как следствие, высокая статистика повторных переломов у детей [28].
Болезнь фон Гиппеля–Линдау
Болезнь Гиппеля–Линдау (БГЛ) является наследственным заболеванием с доминантным типом наследования. Причина этого фанкоматоза — мутация гена-супрессора опухолевого роста VHL, локализующегося на коротком плече 3-й хромосомы 3p25.3. В 20% случаев мутации возникают de novo. При болезни происходит аномальное производство белка «фон Гиппеля–Линдау» или полное отсутствие его, тем самым нарушается регуляция деления клеток и процесса их регенерации. Этот протеин имеет несколько функций, основная из них — контроль ангиогенеза путем регулирования деградации гипокси-регулирующих транскрипционных факторов. Частота встречаемости в популяции 1:36 000. Средний возраст заболеваемости 26 лет, а самому молодому известному пациенту было 5 лет [29].
Заболевание характеризуется развитием множественных новообразований и кист в различных органах и системах: гемангиобластома в сетчатке и центральной нервной системе, феохромоцитома, почечно-клеточная карцинома, кисты поджелудочной железы, яичек и почек, панкреатические нейроэндокринные опухоли, цистоаденомы мочеполовой системы, опухоли эндолимфатического мешка и параганглиомы.
Наиболее распространенным признаком является ретинальный ангиоматоз, который сопровождает до 75% случаев заболевания. Зачастую он выступает диагностическим маркером данной патологии.
В детском возрасте болезнь фон Гиппеля–Линдау отличается появлением неврологической симптоматики на фоне уже существующих зрительных расстройств. В ряде случаев заболевание у детей манифестирует субарахноидальным кровоизлиянием [30].
Феохромоцитомы встречаются у 10–20% больных. Поражение надпочечников чаще двустороннее. Изменения в поджелудочной железе носят доброкачественный характер в виде мелкокистозного перерождения. У некоторых больных выявляется нарушение толерантности к глюкозе. Поражение почек представлено кистами, во взрослом возрасте может развиться ренальноклеточная карцинома. В детском возрасте при семейном типе заболевания поликистоз почек зачастую является его единственным проявлением.
Поражение надпочечников чаще двустороннее. Изменения в поджелудочной железе носят доброкачественный характер в виде мелкокистозного перерождения. У некоторых больных выявляется нарушение толерантности к глюкозе. Поражение почек представлено кистами, во взрослом возрасте может развиться ренальноклеточная карцинома. В детском возрасте при семейном типе заболевания поликистоз почек зачастую является его единственным проявлением.
Большинство периферических опухолей сетчатки можно лечить лазерной фотокоагуляцией (небольшие периферические опухоли) или криотерапией (большие опухоли), но эти современные методы лечения не могут быть использованы при опухолях вблизи зрительного нерва. Недавно были опубликованы данные о положительных результатах использования пропранолола (синтетического блокатора β-адренорецепторов) у больных с пролиферативными сосудистыми опухолями. Этот препарат уменьшал рост этих гемангиобластом сетчатки. Пропранолол вызывал остановку деления опухолевых клеток и запускал апоптоз через активацию каскада каспаз, индуцирование антиангиогенеза и повышение вазоконстрикции [31].
Итак, клинические критерии для диагностики болезни Гиппеля–Линдау основаны на отягощенном семейном анамнезе и/или возникновении регионарной/центральной гемангиобластомы, феохромоцитомы, карциномы, кист почечной и поджелудочной паренхимы. Предполагать и исключать болезнь фон Гиппеля–Линдау следует в каждом случае выявления ангиоматоза сетчатки в ходе офтальмоскопии, особенно при наличии отягощенного семейного анамнеза.
Синдром Мак-Кьюна–Олбрайта–Брайцева
Это редкое врожденное заболевание, характеризующееся полиоссальной фиброзной дисплазией костей, кофейной пигментацией кожи и преждевременным половым развитием (ППР) и другими эндокринопатиями. Генетический дефект обусловлен мутацией в гене GNAS1, который кодирует α-субъединицу G-белка, являющегося мессенджером в превращении цАМФ, регулирующего всю гормональную систему. GNAS1 находится на длинном плече 20-й хромосомы (область 20ql3.2). Молекулярные изменения в белке приводят к пролиферации эндокринных клеток и повышенной их функции. Предполагают, что данная клеточная мутация происходит на ранних стадиях эмбриогенеза. В результате образуются клоны клеток, несущих мутантные белки [32].
Фиброзная дисплазия, приводящая к переломам, деформациям, системным болям в костях, является наиболее тяжелым проявлением этой болезни. Процесс захватывает многие кости, начиная с тазовых и бедренных. В костной ткани мутантный G-белок нарушает дифференцировку остеобластов. В очагах поражения измененные остеобласты вызывают истончение костной ткани, а костные трабекулы рассасываются. Фиброзная дисплазия, как правило, не проявляется с самого рождения, а становится клинически явной в течение первых нескольких лет жизни
Укороченный скелет, переломы, чаще проксимального отдела бедренной кости, ее форма в виде «пастушьего посоха» и сколиоз приводят к изменению походки по типу «утиной», дыхательной недостаточности. Нарушение фосфорно-кальциевого обмена является причиной гипофосфатемии, витамин D резистентного рахита, остеомаляции у пациентов с уже выраженными изменениями костной системы.
Из эндокринной патологии для этого синдрома типично ППР преимущественно у девочек (80%), чаще после первого года жизни. Как правило, первым проявлением оказываются маточные кровотечения. Они обнаруживаются задолго до наступления телархе и адренархе. Кровотечения вызваны автономным функционированием фолликулярных кист яичников, приводящих эпизодически к избыточным выбросам эстрогенов. Яичники имеют обычный размер, но в них можно обнаружить крупные персистирующие фолликулярные кисты. Считают, что мутантный белок активирует аденилатциклазу в рецепторах лютеинизирующего гормона и фолликулостимулирующего гормона в клетках яичников, тем самым стимулируя секрецию эстрогенов в отсутствие гонадотропных гормонов. Характерным является увеличение молочных желез и ускорение роста в длину. У некоторых больных повышены уровни гонадотропных гормонов. В таких случаях можно говорить об истинном ППР [33].
Из других эндокринных нарушений встречаются аномалии щитовидной железы, половина из которых протекает с гипертиреозом, реже с гипотиреозом. Избыток гормона роста встречается реже, поражая лишь 15–20% пациентов. У некоторых пациентов соматотропинома сочеталась c гиперсекрецией пролактина. Гиперадренокортицизм, являющийся редкой патологией, встречается в неонатальный период вследствие первичной пигментной мелкоузелковой дисплазии или аденомы надпочечников плода [34].
Мутация GNAS была выявлена у больных с внутрипротоковым папиллярным муцинозным новообразованиям (IPMNs) поджелудочной железы. Редкие случаи рака поджелудочной железы были выявлены у пациентов с синдромом Мак-Кьюна–Олбрайта–Брайцева [32].
Этиотропного лечения пока нет, но широко используются ингибиторы ароматазы (тамоксифен), кетоназол, бисфосфонаты в качестве комплексной коррекции клинических проявлений.
Итак, диагностика синдрома МЭН представляет значительные трудности для диагностики, что, прежде всего, связано с многоорганным поражением, а вовлечение эндокринной ткани приводит к разнообразным метаболическим нарушениям. Первые признаки синдрома МЭН часто возникают в детском возрасте, поэтому важно, чтобы педиатры были знакомы с основными симптомами этих синдромов.
Пациентов с синдромом МЭН необходимо наблюдать в специализированной клинике, имеющей опыт работы с этой патологией, для определения тактики ведения и лечения.
Литература
- Дедов И. И., Петеркова В. А., Ширяева Т. Ю. и др. Справочник педиатра-эндокринолога. М.: Литтерра, 2014. 528 с.
- White M. L., Doherty G. M. Multiple endocrine neoplasia // Surgical Oncology Clinics of North America. 2008; 17: 439–459.
- Skarulis M. C. Clinical expression of MEN1 at NIH // Ann Intern Med. 1998; 129: 484–494.
- Gibril F., Schumann M., Pace A., Jensen R. T. Multiple endocrine neoplasia type 1 and Zollinger-Ellison syndrome: a prospective study of 107 cases and comparison with 1009 cases from the literature // Medicine (Baltimore). 2004; 83 (1): 43–83.
- Brandi M. L., Gagel R. F., Angeli A., Bilezikian J. P., Beck-Peccoz P., Bordi C., ConteDevolx, Falchetti B. A., Gheri R. G., Libroia A., Lips C. J., Lombardi G., Mannelli M., Pacini F., Ponder B. A., Raue F., Skogseid B., Tamburrano G., Thakker R. V., Thompson N. W., Tomassetti P., Tonelli F., Wells S. A. Jr., Marx S. J. Guidelines for diagnosis and therapy of MEN type 1 and type 2 // J Clin. Endocrinol Metab. 2001; 86: 5658–5671.
- Mindermann T., Wilson C. B. 1995 Pediatric pituitary adenomas // Neurosurgery. 36: 259–269.
- Эндокринология: Национальное руководство / Под. ред. И. И. Дедова, Г. А. Мельниченко. 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2016. 1112 с.
- Allgayer H., Render H., Fulda S. Hereditary Tumors: From genes to clinical consequences. Wiley-VCH, 2009. 530 p.
- ARUP Online Scientific Resourse. www. arup. utah. edu.
- Moline J., Eng C. Multiple endocrine neoplasia type 2: an overview // Genet Med. 2011, Sep; 13 (9): 755–764.
- Cohen M. S., Moley J. F. Surgical treatment of medullary thyroid carcinoma // J Intern Med. 2003, Jun; 253 (6): 616–626.
- Skinner M. A., DeBenedetti M. K., Moley J. F. et al. Medullary thyroid carcinoma in children with multiple endocrine neoplasia types 2 A and 2 B // J Pediatr Surg. 1996, Jan; 31 (1): 177–81; discussion 181–182.
- Wray C. J., Rich T. A., Waguespack S. G., Lee J. E., Perrier N. D., Evans D. B. Failure to recognize multiple endocrine neoplasia 2B: more common than we think? // Ann Surg Oncol. 2008; 15: 293–301.
- Kloos R. T., Eng C., Evans D. B. et al. Medullary thyroid cancer: management guidelines of the American Thyroid Association // Thyroid. 2009; 19: 565– 612.
- Melvin K. E. W., Miller H. H., Tashjian A. M. Early diagnosis of medullary carcinoma of the thyroid gland by means of calcitonin assay // N Engl J Med. 1971; 285: 115–120.
- Telander R. L., Zimmerman D., van Heerden J. A., Sizemore G. W. Results of early thyroidectomy for medullary thyroid carcinoma in children with multiple endocrine neoplasia type 2 // J Pediatr Surg. 1986; 12: 1190–1194.
- Fox E., Widemann B. C., Chuk M. K. et al. Vandetanib in Children and Adolescents with Multiple Endocrine Neoplasia Type 2 B Associated Medullary Thyroid Carcinoma // Clin Cancer Res. 2013; 19: 4239–4248.
- Casey M., Vaughan C. J., He J., Hatcher C. J., Winter J. M., Weremowicz S. et al. Mutations in the protein kinase A R1 alpha regulatory subunit cause familial cardiac myxomas and Carney complex // J Clin Invest. 2000, Sep; 106 (5): R31–38.
- Briassoulis G., Kuburovic V., Xekouki P., Patronas N., Keil M. F., Lyssikatos C. et al. Recurrent left atrial myxomas in Carney complex: a genetic cause of multiple strokes that can be prevented // J Stroke Cerebrovasc Dis Off J Natl Stroke Assoc. 2012, Nov; 21 (8): 914. e1–8.
- Turhan S., Tulunay C., Altin T., Dincer I. Second recurrence of familial cardiac myxomas in atypical locations // Can. J. Cardiol. 2008; 24: 715–716.
- Орлова Е. М., Карева М. А. Карни-комплекс — синдром множественных эндокринных неоплазий // Проблемы эндокринологии. 2012, т. 58, № 3, с. 22–30.
- Bertherat J. Carney complex (CNC) // Orphanet J Rare Dis. 2006; 1: 21.
- Wang Z. J., Churchman M., Avizienyte E. et al. Germline mutationsof the LKB1 (STK11) gene in Peutz–Jeghers patients // J Med Genet. 1999; 36: 365–368.
- Giardiello F. M., Brensinger J. D., Tersmette A. C. et al. Very high risk of cancer in familial Peutz–Jeghers syndrome // Gastroenterology. 2000; 119: 1447–1453.
- Weiss S. et al. Enzinger and Weiss’s Soft Tissue Tumors. Philadelphia, PA. Elsevier Saunders; 2014.
- Boyd K. P., Korf B. R., Theos A. Neurofibromatosis type 1 // J Am Acad Dermatol. 2009; 61 (1): 1–14, quiz 15–16.
- Rosai J. et al. Rosai and Ackerman’s Surgical Pathology. 10 th ed. Philadelphia, PA: Elsevier Saunders; 2011.
- Hirbe A. C., Gutmann D. H. Neurofibromatosis type 1: a multidisciplinary approach to care // Lancet Neurol. 2014; 13 (8): 834–843.
- Huynh T. T., Pacak K., Brouwers F. M., Abu-Asab M. S., Worrell R. A., Walther M. M. et al. Different expression of catecholamine transporters in phaeochromocytomas from patients with von Hippel-Lindau syndrome and multiple endocrine neoplasia type 2 // Eur J Endocrinol. 2005; 153: 551–563.
- Chung S. Y., Jeun S. S., Park J. H. Disseminated Hemangioblastoma of the Central Nervous System without Von Hippel-Lindau Disease // Brain tumor research and treatment. 2014, Vol. 2, p. 96–101.
- Von Hippel E. Vorstellung eine patienten mit einer sehr ungewohnlieben Netzhant // Ber Ophthalmol Ges. 1985, Vol. 24, p. 269.
- Happle R. The McCune-Albright syndrome: a lethal gene surviving by mosaicism // Clin Genet. 1986; 29 (4): 321–324.
- Parvanescu A. et al. Lessons from McCune-Albright syndrome-associated intraductal papillary mucinous neoplasms: GNASactivating mutations in pancreatic carcinogenesis // JAMA Surg. 2014; 149 (8): 858–862.
- Brown R. J., Kelly M. H., Collins M. T. Cushing syndrome in the McCune-Albright syndrome // J Clin Endocrinol Metab. 2010; 95 (4): 1508–5115.
В. В. Смирнов1, доктор медицинских наук, профессор
С. А. Мирошниченко
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
1 Контактная информация: [email protected]
Множественные эндокринные неоплазии у детей и подростков/ В. В. Смирнов, С. А. Мирошниченко
Для цитирования: Лечащий врач № 3/2018; Номера страниц в выпуске: 25-31
Теги: инсулинома, лентиго, миксома, ангиоматоз
Синдром множественной эндокринной неоплазии 2-го типа Текст научной статьи по специальности «Клиническая медицина»
СТАТТ1
Н.1. Бойко, В.В. Хом’як, М.П. Павловський, Ю.П. Довгань, Я.1. Гавриш, Р.В. Кемiнь СИНДРОМ МНОЖИННО1 ЕНДОКРИННО1 НЕОПЛАЗП 2-го ТИПУ
Львгвський нацюнальний медичний ушверситет гмеш Данила Галицького, Львгв
ВСТУП
Синдроми множинноТ ендокринноТ неоплазм (МЕН) — це спадков\ захворювання, що успад-ковуються за автосомно-дом\нантним типом та характеризуються синхронним або метахрон-ним виникненням доброяк\сних (аденома, г\пер-плаз\я) або злояк\сних пухлин у функц\онально та анатом\чно р\зних ендокринних органах, або неендокринних тканинах нервовоТ системи, або у тканинах мезенх\мального походження. Синдроми МЕН под\ляють на два п\дтипи -МЕН 1 та МЕН 2 — залежно в\д того, як\ ендо-кринн\ залози уражено [1, 2].
1959 року й.В. Иа2агЬ I сп\вавтори вперше описали медулярний рак щитопод\бноТ залози (МРЩЗ) як окрему хворобу, а вже через два роки и.И. Б1рр!е пов\домив про те, що МРЩЗ часто поеднуеться з феохромоцитомою [3]. П\з-н\ше поеднання МРЩЗ \ феохромоцитоми з первинним г\перпаратиреозом (ПГПТ) в\днес-ли до синдрому МЕН 2а (синдрому С\ппла), а наявн\сть множинних гангл\оневром слизовоТ травного каналу, вроджених аномал\й скелета, очей, товстоТ кишки (хвороба Г\ршпрунга) — до синдрому МЕН 2Ь (синдрому Горл\на) [1, 3, 4].
Через генетичну обумовлен\сть виникнення цих синдром\в пухлини часто мультифокальн\ у непарних органах та двоб\чн\ у парних органах, що впливае на тактику х\рург\чного л\кування таких хворих. А у родич\в цих пац\ент\в ретель-ний скрин\нг маркер\в хвороби (визначення вм\сту кальцитон\ну, УСГ) \ генетичн\ досл\джен-ня дозволяють вчасно проводити х\рург\чн\ втру-чання та отримувати добр\ в\ддален\ результа-ти [1, 3, 5].
Метою роботи був анал\з кл\н\чних особли-востей, результат\в лабораторних та \нструмен-тальних метод\в досл\дження для вчасноТ д\аг-ностики та добору оптимальноТ х\рург\чноТ тактики у хворих на синдром МЕН 2.
МАТЕР1АЛ I МЕТОДИ
Протягом останн\х 10 рок\в у кл\н\ц\ кафед-ри х\рург\Т №1 д\агностували синдром МЕН 2 у
5 хворих: у чотирьох — МЕН 2а, в одн\еТ -МЕН 2Ь синдром. Серед пац\ент\в були 4 ж\нки та 1 чолов\к, середн\й в\к хворих складав 36,5±6,1 року. У пац\ент\в визначали спадковий анамнез, наявн\сть супров\дноТ патологи, базаль-ний \ стимульований (пентагастрином або каль-ц\ем) р\вн\ кальцитон\ну, катехолам\ни, р\вн\ \он\-зованого та загального кальц\ю, паратгормону, проводили УСГ та/або комп’ютерну томограф\ю (КТ) шиТ та заочеревинного простору.
РЕЗУЛЬТАТИ ТА ОБГОВОРЕННЯ
В ус\х пац\ент\в д\агноз синдрому МЕН 2 фун-тувався на поеднанн\ МРЩЗ \ феохромоцитоми. Якщо у хворого \з синдромом МЕН 2 були в\дсутн\ множинн\ гангл\оневроми та \нш\ врод-жен\ аномал\Т розвитку та/або було виявлено ПГПТ, захворювання в\дносили до синдрому МЕН 2а, якщо виявляли типов\ аномал\Т розвит-ку — д\агностували синдром МЕН 2Ь.
Р\вень кальцитон\ну перед х\рург\чним втру-чанням визначали у 4 пац\ент\в. Базальний р\-вень кальцитон\ну був п\двищеним \ становив в\д 85 пг/мл до 420 пг/мл (норма — до 14 пг/мл), а п\сля стимуляц\Т в\н зростав до 240-1200 пг/мл. За допомогою ультрасонограф\чного досл\джен-ня в одн\еТ хвороТ виявили патолог\чно зм\нен\ шийн\ л\мфатичн\ вузли.M npoTaroM 5 poêiâ — KoHTpoëb AT, Bè3HaHeHHa piBHa KaëbUèToHiHy, YCT wèï Ta 3aoHepeBèHHoro npocTopy; câiflHeHb peuèflèBy XBopoôè HeMae. 3riflHo 3 noâifloMëeHHaMè ëiTe-
paTypè, MPÙ3 Mae arpecèBHiwèé nepeôir y xbopmx Ha cèHflpoM MEH 2b [2, 5], xoHa y HarnoMy BènaflKy HeMae flaHèx ùoflo peuèflèBy MPÙ.3 nicëa nepBèHHoro xipypriHHoro ëiêyâaHHa.
Mè oÔcTeXèëè BciX 6ëè3bKèX poflèHiâ xbopmx Ha MEH 2 cèHflpoM: KoHTpoëb AT, Bè3HaHeHHa ôa3aëbHoro piBHa KaëbUèToHiHy, ioHi3oâaHoro Kaëbuira, YCT 0èï Ta 3aoHepeBèHHoro npocTopy. Y cecTpè oflHieï 3 nauieHToK BèaBèëè niflBèùeHi piBHi ôa3aëbHoro KaëbUèToHiHy (450 nr/Më), ioHi-3oBaHoro Kaëbuira (1,41 MMoëb/ë) i napaTropMoHy (121 nr/Më), œoflHèX KëiHiHHèX Bèaâiâ nTÏT He ôyëo. nifl Hac YCT Bi3yaëi3oBaHo By3oë y npaâié HacTui ùèTonofliÔHoï 3aëo3è Ta yTBopeHHa po3Mi-poM 14 mm y npoeêuiï ëiâoï HèXHboï npèùèTono-fliÔHoï 3aëo3è. Xâopié BèKoHaHo TèpeoïfleKToMira, ueHTpaëbHy ëiMôafleHeKToMira 3 npèBofly MPÙ3 i BèflaëeHo afleHoMy npèùèTonofliÔHoï 3aëo3è.
BÈCHOBKÈ
1. nauieHTè, y aKèx fliarHocToâaHo ôyflb-aêèé KoMnoHeHT cèHflpoMy MEH 2, HaflTo MPÙ3 aôo ÔeoxpoMouèToMy, niflëararaTb BceôiHHoMy oôcTe-xeHHra 3 MeTora BèaBëeHHa uboro cèHflpoMy.
2. Y poflèHiâ xbopmx, y aKèx fliarHocTyâaëè MEH 2 cèHflpoM, cëifl Bè3HaHaTè piBHi KaëbUèTo-HiHy, KaTexoëaMiHiâ, Kaëbuira, BèKoHyBaTè YCT wèï Ta 3aoHepeBèHHoro npocTopy 3 MeTora fliarHoc-tmkm MEH cèHflpoMiâ.
ËITEPATyPA
1. Bordi C. Multiple endocrine neoplasia (MEN)-as-sociated tumours / Bordi C. // Digestive and Liver Disease. — 2004. — Vol. 36, №1. — P. 31-34.
2. Lee N.C. Multiple endocrine neoplasia type 2B: genetic basis and clinical expression / Lee N.C., Norton J.A. // Surgical Oncology. — 2000. — №9. -P. 111-118.
3. Iler M.A. Multiple Endocrine Neoplasia Type 2A: A 25-Year Review / Iler M.A., King D.R., Ginn-Pease M.E., O’Dorisio T.M., Sotos J.F. // Journal of Pediatric Surgery. — 1999. — Vol.34, №1. — P. 92-97.
4. Raue F. Multiple endocrine neoplasia type 2: clinical features and screening / Raue F., Frank-Raue K., Grauer A. // Endocrinology and Metabolism Clin of North Am. — 1994. — Vol. 23, №1. — P. 137-156.
5. Norton J.A. Multiple endocrine neoplasia type lib the most aggressive form of medullary thyroid carcinoma / Norton J.A., Froome L.C., Farrell R.E., Wells S.A. // Surgical Clinics of North America. -1979. — Vol. 59, №1. — P. 109-18.
20
KëiHiHHa eHfloKpèHoëoria Ta eHfloêpèHHa xipypria 1(34) 2011
РЕЗЮМЕ
Синдром множественной эндокринной неоплазии 2-го типа
Н.И. Бойко, М.П. Павловский, В.В. Хомяк, Ю.П. Довгань, Я.И. Гаврыш, Р.В. Кеминь
Синдром множественной эндокринной неоплазии (МЭН) — наследственное заболевание, которое характеризируется синхронным или метахронным возникновением доброкачественных (аденома, гиперплазия) или злокачественных опухолей в эндокринных органах. Наличие медуллярного рака щитовидной железы и феохромоцитомы — обязательное условие диагностики МЭН 2 синдрома. Целью исследования была своевременная диагностика и оптимальное хирургическое лечение больных с МЭН 2 синдромом. На протяжении последних 10 лет (19992009 гг.) в клинике диагностировали синдром МЭН 2 у 5 больных, из них две женщины были родными сестрами. У всех пациентов выявляли медуллярный рак щитовидной железы и феохромоцитому. У двух больных феохромоцитома была двусторонней, а клиническое течение характеризировалось бескризовой умеренной артериальной гипертензией. Первичный гиперпаратиреоз наблюдали у 2 больных. Сделан вывод, что у ближних родственников больных синдромом МЭН 2 необходимо определять уровни каль-цитонина, катехоламинов, кальция, проводить ульт-расонографию шеи и забрюшинного пространства с целью диагностики МЭН синдромов.
Ключевые слова: синдром множественной эндокринной неоплазии, медуллярный рак щитовидной железы, феохромоцитома, первичный гиперпа-ратиреоз.
SUMMARY
Type 2 multiple endocrine neoplasia N. Boiko, M. Pavlovsky, V. Khomyak, Ju. Dovgan, Ja. Gavrysh, R. Kemin
Multiple endocrine neoplasia (MEN) syndrome — is a hereditary disease which is characterized by synchronous or metachronous development of benign (adenoma, hyperplasia) or malignant tumors in the endocrine organs. The presence of medullary thyroid carcinoma and pheochromocytoma are mandatory requirements of MEN 2 syndrome. The purpose of our study was to perform timely diagnosis and optimal surgical treatment of patients with MEN 2 syndrome. Over the past 10 years (1999-2009 years) in the clinic of Surgical Department №1, we have diagnosed the syndrome of MEN type 2 in 5 patients, of whom two women were sisters. In all cases we observed medullary thyroid carcinoma and pheochromocytoma. Two patients had bilateral phe-ochromocytoma, and the clinical course was characterized with mild arterial hypertension. Primary hyperparathyroidism was observed in 2 patients. Conclusion: in the near relatives of patients with syndrome of MEN 2, you must measure calcitonin, catecholamines, calcium, conduct ultrasound examination of the neck and retroperitoneal space for diagnosis of MEN syndrome.
Key words: multiple endocrine neoplasia syndrome, medullary thyroid carcinoma, pheochromocytoma, primary hyperparathyroidism.
Дата надходження до редакцП 10.01.2011 p. KëiHiHHa ендокринолопя та ендокринна х1рурпя
1(34) 2011
21
Синдром множественной эндокринной неоплазии 2A типа
Метод определения
Секвенирование.
Выдаётся описание результатов врачом-генетиком!
Исследуемый материал
Цельная кровь (с ЭДТА)
Доступен выезд на дом
Исследование мутаций в экзонах 10, 11 гена RET при МЭН 2А.
Тип наследования.
Аутосомно-доминантный.
Гены, ответственные за развитие заболевания.
Ген RET (REARRANGED DURING TRANSFECTION PROTOONCOGENE) расположен на хромосоме 10 в регионе 10q11.21 . Содержит 19 экзонов. Продуцирует три изоформы белков.
Мутации в данном гене приводят также к развитию синдрома врожденной центральной гиповентиляции, медуллярному раку щитовидной железы, синдрома множественной эндокринной неоплазии тип 2Б, феохромоцитомы, агенезии почек, предрасположенности к болезни Гиршпрунга тип 1.
Определение заболевания.
Семейные раковые синдромы ассоциированы со специфическими мутациями протоонкогена RET (10q11.2), кодирующего тирозиновую протеинкиназу рецепторного типа. Мутации превращают нормальный ген RET в доминантный трансформирующий онкоген.
Патогенез и клиническая картина .
Для МЭН 2А характерно наличие семейного медуллярного рака щитовидной железы (МРЩЖ) (92-100 %). Также характерно наличие феохромоцитомы (встречается ~ в 50 % случаев) и гиперплазии/аденомы паращитовидных желез (обнаруживают у 20-30 % больных). Заболевание протекает менее агрессивно , чем МЭН 2Б.
При синдроме МЭН 2А МРЩЖ чаще формируется в раннем школьном возрасте, а риск развития МРЩЖ составляет 100%.
Частота встречаемости: 1: 30 000 (суммарная частота).
Перечень исследуемых мутаций может быть предоставлен по запросу.
Литература
- Амосенко Ф.А., Калинин В.Н., Любченко Л.Н., Козлова В.М., Бржезовский В.Ж., Ванушко В.Э., Трубникова И.С., Гарькавцева Р.Ф. Синдром множественной эндокринной неоплазии типа 2 (МЭН2): молекулярная диагностика и профилактическая тиреоидэктомия.// Медицинская генетика, 2005, т.4, № 4, с.147.
- Brandi, M. L., Gagel, R. F., Angeli, A., Bilezikian, J. P., Beck-Peccoz, P., Bordi, C., Conte-Devolx, B., Falchetti, A., Gheri, R. G., Libroia, A., Lips, C. J. M., Lombardi, G., and 12 others. Guidelines for diagnosis and therapy of MEN type 1 and type 2. J. Clin. Endocr. Metab. 86: 5658-5671, 2001.
- OMIM.
Диагностика семейного медуллярного рака щитовидной железы и синдромов МЭН 1 и 2
Описание
Синонимы (rus): Множественная эндокринная неоплазия (МЭН), МЭН 1, синдром Вермера, МЭН 2A, синдром Сиппла, МЭН 2B, синдром Горлина, семейный медуллярный рак щитовидной железы, ген RET, ген MEN1
Синонимы (eng): Multiple Endocrine Neoplasia type 1, 2A, 2B, MEN1, Wermer Syndrome, MEN2A, MEN2B, familial medullary thyroid carcinoma, RET gene, MEN1 gene.
Биоматериал: Венозная кровь
Показатель(и): Мутации в гене MEN и в гене RET
Метод(и): Секвенирование
Тип контейнера и особенности преаналитики: Пробирка для гематологических исследований с EDTA, 2 мл (фиолетовая крышечка)
Синдром множественной эндокринной неоплазии (МЭН) относится к редким причинам формирования избыточной концентрации гормонов в крови. Синдром МЭН включает гиперплазии, аденомы и карциномы нескольких эндокринных желез. Синдром МЭН относится к заболеваниям с аутосомно-доминантным типом наследования.
МЭН 1, или синдром Вермера, характеризуется гиперплазией и/или аденомами паращитовидных желез, нейроэндокринными опухолями поджелудочной железы, двенадцатиперстной кишки, желудка, аденомами передней доли гипофиза, опухолями надпочечника. Данное заболевание обусловлено инактивирующими мутациями в гене-супрессоре опухолевого роста MEN1. Наиболее часто мутации обнаруживаются во 2 и 10 экзонах этого гена.
МЭН 2 типа включает 3 группы заболеваний: МЭН2а, МЭН2b и семейный медуллярный рак щитовидной железы. Причиной развития этого синдрома являются активирующие мутации в протоонкогене RET, наиболее часто встречающиеся в 10, 11 и 13-16 экзонах.
Медуллярный рак щитовидной железы развивается при обоих типах МЭН2. По сравнению со спорадическим раком ЩЖ, данный тип рака характеризуется более молодым возрастом возникновения.
МЭН2а, или синдром Сиппла, характеризуется сочетанием медуллярной карциномы щитовидной железы, феохромоцитому и гиперплазию/аденому паращитовидных желез.
МЭН2b, или синдром Горлина, характеризуется развитием тех же опухолей, что при МЭН2а, однако также присутствуют нейриномы слизистых оболочек и расстройства опорно-двигательного аппарата.
Когда назначается
Диагностика семейного медуллярного рака щитовидной железы и синдромов множественной эндокринной неоплазии 1 и 2 типов
Подготовка к анализу
Специальной подготовки не требуется. Исследование проводится натощак (не принимать пищу 3 часа до исследования, можно пить воду).
Интерпретация
В норме мутации в гене MEN и гене RET отсутствуют.
При обнаружении указанных мутаций отмечается повышенный риск развития опухолей, характерных соответственно для МЭН 1 и 2 типов.
Список литературы
- Лапин С.В. Тотолян А.А. Иммунологическая лабораторная диагностика аутоиммунных заболеваний. Издательство «Человек», СПб- 2010
- Tietz Clinical guide to laboratory tests. 4-th ed. Ed. Wu A.N.B.- USA,W.B Sounders Company, 2006,1798 p.
- De Herder, W. W. Multiple Endocrine Neoplasia (MEN) / Reference Module in Biomedical Sciences — 2019
- Инструкция производителя тест-системы
Лечение множественной эндокринной неоплазии в Израиле: цены, отзывы
Множественная эндокринная неоплазия (МЭН) – это наследственный синдром, при котором имеется тенденция к возникновению опухолей в нескольких эндокринных железах. Существует два типа МЭН-синдрома.
МЭН-синдром I типа, также известный как синдром Вернера, передается как доминантный признак (если один из родителей страдает данным заболеванием, вероятность появления ребенка с дефектным геном составляет 50 %).
Наиболее частые сопутствующие заболевания:
- Гиперпаратериоз
- Инсулома (опухоли островковой ткани поджелудочной железы)
- Опухоли гипофиза
Наиболее распространенным клиническим проявлением синдрома Вернера является повышенная активность щитовидной железы (гиперпаратиреоз). Существуют четыре паращитовидных железы, которые расположены на задней поверхности щитовидной железы. Эти железы секретируют паратироидный гормон (ПТГ), который отвечает за регуляцию уровня кальция в организм
Увеличение количества ПТГ, как правило, связано с увеличением числа клеток, продуцирующих этот гормон, во всех четырех паращитовидных железах (гиперплазия). Доброкачественная опухоль (аденома), которая образуется в нескольких паращитовидных железах – менее распространенная причина гиперсекреции ПТГ.
Гиперсекреция ПТГ приводит к повышению уровня кальция в крови и моче (как правило, наблюдается у пациентов в возрасте от 20 до 30 лет), что может привести к мочекаменной болезни, остеопорозу, болям в животе, запорам, мышечной слабости, а также расстройствам нервной системы и поведения.
Инсуломы (опухоли островковой ткани поджелудочной железы) – это второе наиболее частое проявление синдрома Вернера. Они возникают, как правило, в том же возрасте, что и опухоли паращитовидных желез. В отличие от других проявлений синдрома Вернера, 30 % новообразований поджелудочной железы являются злокачественными и дают метастазы, главным образом, в печень. Опухоли данного типа могут вырабатывать различные гормоны и вызывать, соответственно различные симптомы. Например, чрезмерная выработка инулина приводит к гипоглицемии, а гиперсекреция гастрина – к повышению кислотности желудочного сока и, как следствие, язвенной болезни желудка.
Гипофиз расположен в области турецкого седла головного мозга, непосредственно под гипоталамусом. Секретируемые им гормоны взаимодействуют с рецепторами многих эндокринных желез, регулируя тем самым их работу. Примерно у 50 % пациентов с синдромом МЭН I типа обнаруживают доброкачественные опухоли гипофиза.
Наиболее распространенной опухолью гипофиза является пролактинома, секретирующая гормон пролактин, который отвечает за работу молочных желез. Опухоли других типов могут нарушать секрецию гормона роста и кортизола (повышение уровня которого приводит к развитию синдрома Иценко-Кушинга).
МЭН-синдром II типа можно разделить на 2 группы:
- МЭН IIa: К данной группе относится медуллярная карцинома щитовидной железы, гиперпаратиреоз и феохромоцитома, секретирующая адреналин. Еще одной разновидностью МЭН IIa является семейная медуллярная карцинома щитовидной железы (МКЩЖ).
- МЭН IIb: Данный синдром характеризуется сочетанием МКЩЖ, феохромоцитомы, кожных опухолей и невромы (опухоль нервной ткани).
МЭН IIa и IIb типов
Медуллярная карцинома щитовидной железы – наиболее распространенное проявление синдрома МЭН IIa. Опухоли данного типа развиваются из клеток щитовидной железы, которые продуцируют гормон кальцитонин. Роль данного гормона в организме до сих пор не выяснена до конца. МКЩЖ возникает, как правило, у детей. Опухоли с диаметром более 1 см обычно дают метастазы. Измерение уровня кальцитонина после введения кальция внутривенно помогает в ранней диагностике данного заболевания.
Феохромоцитома развивается примерно у 50 % пациентов с синдромом МЭН IIа типа. Опухоль вызывает повышение кровяного давления, что сопровождается головными болями, потоотделением и тахикардией.
Для пациентов с опухолями МЭН II тип характерны внешние признаки, подобные тем, что проявляются при синдроме Марфара, включая непропорционально длинные конечности и удлиненные тонкие пальцы. Также для таких больных характерны нейромы – опухоли, которые локализуются на кончике языка, веках и в органах системы пищеварения. Все эти признаки МКЩЖ проявляются в молодом возрасте. Примерно у 50 % пациентов также развивается феохромоцитома, как и у пациентов с синдромом МЭН II типа.
Генетика
МЭН-синдром может быть наследственным. Ответственный за его проявление ген RET находится в 10-й хромосоме. Этот ген кодирует белок, который также является рецептором тирозинкиназы. Мутации в данном гене вызывает сбои в непрерывной работе рецепторов и он начинает функционировать спорадически. У 80 % пациентов с синдромом МЭН II типа имеется мутация в триплете 634. Также мутации могут затрагивать триплеты 609, 611, 618, 620. У 10-15 % пациентов имеется мутация в триплете 918.
Лечение
Превентивной мерой, позволяющей воспрепятствовать появлению МКЩЖ, является тиреоидектомия (удаление щитовидной железы). Генетические анализы позволяют выявлять различные мутации и корректировать их в юном возрасте. Детям с мутациями в триплетах 883, 918 или 922 удаляют щитовидную железу в возрасте до одного года.
Детям с мутациями в триплетах 611, 618, 620, 630, 634 или 891, показана тиреоидектомия в возрасте до 6-ти лет.
Для детей с мутациями в триплетах 609, 768, 791, 790, 804 или 902 существует два варианта лечения:
- Тиреоидектомия с удалением основных лимфатических узлов или без, в возрасте от 6-ти до 10-ти лет
- Ежегодные анализы на содержание кальцитонина. Высокий уровень кальцитонина может являться показанием к тиреоидектомии с удалением лимфотических узлов или без.
Пациентам с мутациями в гене RET рекомендуется каждый год проходить сканирование на наличие феохромоцитомы. Другие анализы включают: определение уровня кальция в крови и исследования на паратгормон (ПТГ).
У взрослых пациентов с МКЩЖ при размере опухоли более 1 проводится проверка на участие лимфоузлов в патологическом процессе.
Если болезнь распространилась в область шеи, можно уменьшить массу опухоли и избежать появления локальных рецидивов. Эффективность химиотерапии и препаратов, проходящих клинические испытания, еще не доказана.
Диагностика и лечение в Израиле – почему в клинике “Хадасса”?
- Более 100 лет организация “Хадасса” и основанные ею медицинские центры являются лидерами в области оказания медицинских услуг в Израиле.
- Более 50% исследований в области новейших медицинских технологий и методов лечения в Израиле проводятся врачами “Хадассы”.
Диагностика и лечение множественной эндокринной неоплазии проводятся врачами-специалистами отделений эндокринологии и онкологии.
Клиника VIVA
Множественная эндокринная эндоплазия (или неоплазия, сокращенно МЭН) — это группа наследственных патологий (болезней), которые обусловлены появлением множественных опухолей или новообразований на эндокринных железах, в том числе щитовидке, гипофизе, поджелудочной, надпочечниках и т.д.
В зависимости от локализации выделяют три основные вида МЭН: синдром Вермера (1 тип), синдром Сиппла (2А) и синдром Горлина (2В).
Симптоматика
Множественная эндокринная эндоплазия имеет следующую клиническую картину:
- развитие гиперпаратиреоза (избыточная продукция паратгормона околощитовидной железой)
- снижение аппетита, запоры, похудение
- почечные колики
- карцинома щитовидной железы (характерно для синдрома Сиппла и Горлина)
- патологии со стороны опорно-двигательного аппарата (свойственно для МЭН 2В)
- новообразования на слизистых оболочках
Диагностика множественной эндокринной неоплазии
Для точной постановки диагноза и определения типа эндоплазии необходимо лабораторным способом выявить как минимум два характерных для синдрома компонента. Специалисты клиники Viva для этих целей назначают различные виды исследований, в том числе УЗИ, томографию, ультрасонографию, ЭКГ, сцинтиграфию. Дополнительно проводятся анализы на уровень гормонов и кальция в крови, а подтвердить мутацию гормонов позволяет генетический скрининг.
Лечение множественной эндокринной эндоплазии
Разные виды множественной неоплазии предполагают свой подход к терапии с учетом различных индивидуальных особенностей. В большинстве случаев для лечения МЭН показано хирургическое вмешательство с послеоперационной химиотерапией при злокачественном характере новообразований. В качестве альтернативного (если опухоль неоперабельная) или дополнительного лечения множественной эндокринной эндоплазии назначается лучевая или медикаментозная терапия.
При удалении желез (частичном или полном) предполагается обязательная заместительная терапия или аутологичная трансплантация тканей для обеспечения нормальной выработки гормонов, необходимых для жизнедеятельности человека.
Эндокринологи
Подразделения, где проводится процедура
Остались вопросы?
Синдром множественной эндокринной неоплазии 2A типа (экзоны 10, 11 гена RET) (Multiple Endocrine Neoplasia Type 2A (Exons 10, 11 Gene RET))
Исследуемый материал
Цельная кровь (с ЭДТА)
Метод определения
Секвенирование.
Выдаётся описание результатов врачом-генетиком!
Исследование мутаций в экзонах 10, 11 гена RET при МЭН 2А.
Тип наследования.
Аутосомно-доминантный.
Гены, ответственные за развитие заболевания.
Ген RET (REARRANGED DURING TRANSFECTION PROTOONCOGENE) расположен на хромосоме 10 в регионе 10q11.21 . Содержит 19 экзонов. Продуцирует три изоформы белков.
Мутации в данном гене приводят также к развитию синдрома врожденной центральной гиповентиляции, медуллярному раку щитовидной железы, синдрома множественной эндокринной неоплазии тип 2Б, феохромоцитомы, агенезии почек, предрасположенности к болезни Гиршпрунга тип 1.
Определение заболевания.
Семейные раковые синдромы ассоциированы со специфическими мутациями протоонкогена RET (10q11.2), кодирующего тирозиновую протеинкиназу рецепторного типа. Мутации превращают нормальный ген RET в доминантный трансформирующий онкоген.
Патогенез и клиническая картина.
Для МЭН 2А характерно наличие семейного медуллярного рака щитовидной железы (МРЩЖ) (92-100 %). Также характерно наличие феохромоцитомы (встречается ~ в 50 % случаев) и гиперплазии/аденомы паращитовидных желез (обнаруживают у 20-30 % больных). Заболевание протекает менее агрессивно , чем МЭН 2Б.
При синдроме МЭН 2А МРЩЖ чаще формируется в раннем школьном возрасте, а риск развития МРЩЖ составляет 100%.
Частота встречаемости: 1: 30 000 (суммарная частота).
Перечень исследуемых мутаций может быть предоставлен по запросу.
Литература
- Амосенко Ф.А., Калинин В.Н., Любченко Л.Н., Козлова В.М., Бржезовский В.Ж., Ванушко В.Э., Трубникова И.С., Гарькавцева Р.Ф. Синдром множественной эндокринной неоплазии типа 2 (МЭН2): молекулярная диагностика и профилактическая тиреоидэктомия.// Медицинская генетика, 2005, т.4, № 4, с.147.
- Brandi, M. L., Gagel, R. F., Angeli, A., Bilezikian, J. P., Beck-Peccoz, P., Bordi, C., Conte-Devolx, B., Falchetti, A., Gheri, R. G., Libroia, A., Lips, C. J. M., Lombardi, G., and 12 others. Guidelines for diagnosis and therapy of MEN type 1 and type 2. J. Clin. Endocr. Metab. 86: 5658-5671, 2001.
- OMIM.
Синдром МакКьюна-Олбрайта: MedlinePlus Genetics
Синдром МакКьюна-Олбрайта — это заболевание, поражающее кости, кожу и некоторые гормональные (эндокринные) ткани.
У людей с синдромом МакКьюна-Олбрайта в костях появляются участки аномальной рубцовой (фиброзной) ткани, состояние, называемое полиостотической фиброзной дисплазией. Полиостотический означает, что аномальные области (поражения) могут возникать во многих костях; часто они ограничиваются одной стороной тела. Замена кости фиброзной тканью может привести к переломам, неравномерному росту и деформации.Когда возникают поражения костей черепа и челюсти, это может привести к неравномерному (асимметричному) росту лица. Асимметрия также может возникать в длинных костях; неравномерный рост костей ног может стать причиной хромоты. Также может возникнуть аномальное искривление позвоночника (сколиоз). Поражения костей могут стать злокачественными, но это происходит менее чем у 1 процента людей с синдромом МакКьюна-Олбрайта.
Помимо аномалий костей, у пораженных людей обычно есть светло-коричневые пятна на коже, называемые пятнами кофе с молоком, которые могут присутствовать с рождения.Неправильные границы пятен с молоком при синдроме МакКьюна-Олбрайта часто сравнивают с картой побережья штата Мэн. Напротив, пятна кофе с молоком при других расстройствах имеют плавные границы, которые можно сравнить с побережьем Калифорнии. Как и поражения костей, пятна с молоком при синдроме МакКьюна-Олбрайта могут появляться только на одной стороне тела.
Девочки с синдромом МакКьюн-Олбрайт могут рано достигать половой зрелости. У этих девочек часто случаются менструальные кровотечения к 2 годам. Считается, что это раннее начало менструации вызвано избытком эстрогена, женского полового гормона, вырабатываемого кистами, развивающимися в одном из яичников.Реже у мальчиков с синдромом МакКьюна-Олбрайта может быть раннее половое созревание.
Другие эндокринные проблемы также могут возникать у людей с синдромом МакКьюна-Олбрайта. Щитовидная железа, орган в форме бабочки у основания шеи, может увеличиваться (состояние, называемое зобом) или образовывать массы, называемые узелками. Около 50 процентов пораженных людей вырабатывают чрезмерное количество гормонов щитовидной железы (гипертиреоз), что приводит к учащенному сердцебиению, высокому кровяному давлению, потере веса, тремору, потоотделению и другим симптомам.Гипофиз (структура в основании мозга, вырабатывающая несколько гормонов) может производить слишком много гормона роста. Избыток гормона роста может привести к акромегалии — состоянию, характеризующемуся большими руками и ногами, артритом и характерными чертами лица, которые часто называют «грубыми». Избыточная секреция гормона роста также может привести к увеличению фиброзной дисплазии в костях, наиболее заметно в черепе. Редко у пораженных людей развивается синдром Кушинга, избыток гормона кортизола, вырабатываемого надпочечниками, которые представляют собой небольшие железы, расположенные на верхней части каждой почки.Синдром Кушинга вызывает увеличение веса лица и верхней части тела, замедление роста у детей, хрупкую кожу, усталость и другие проблемы со здоровьем. У людей с синдромом МакКьюна-Олбрайта синдром Кушинга возникает только в возрасте до 2 лет.
Проблемы в других органах и системах, такие как доброкачественные (доброкачественные) желудочно-кишечные новообразования, называемые полипами, и другие аномалии также могут возникать при синдроме МакКьюн-Олбрайт.
| 1 | Прыгающие французы штата Мэн. 57 61 | Сен-Илер MH … Granger L | 3528919 | 1986 | |
| 2 | Болезнь вздрагивания или гиперэкплексия: дальнейшее определение синдрома. 61 57 | Андерманн Ф. Кесни Л. Ф. | 6777025 | 1980 | |
| 3 | «Прыгающие французы из мэйн.«МИРИАХИТ. | Стивенс Х | 14247390 | 1965 | |
| 4 | В знак признательности прыгающим французам. 57 | Карп ЛЕ | 7282768 | 1981 | |
| 5 | Мутация болезни страха α1S270T предсказывает сокращение глицинергических синаптических токов. 61 | У З … Сивилотти LG | 32445491 | 2020 | |
| 6 | Мембранная холестериновая зависимость каннабиноидной модуляции рецептора глицина. 61 | Яо L … Xiong W | 32608538 | 2020 | |
| 7 | Новый вариант рецептора глицина с возбудителем болезни влияет на синдапин I и глицинергическое ингибирование. 61 | Langlhofer G … Villmann C | 32354853 | 2020 | |
| 8 | Захват рецепторов GABAA мутантными рецепторами глицина. 61 | Харви Р.Дж. | 31521561 | 2019 | |
| 9 | Распознавание неотложных состояний двигательного расстройства — практический обзор для не неврологов. 61 | Хаким Х … Бхатти DE | 31535526 | 2019 | |
| 10 | Мутация сдвига рамки считывания носителя глицина SLC6A5 вызывает у испанских борзых пугающую болезнь. 61 | Мерфи СК … Кларк Л.А. | 30847549 | 2019 | |
| 11 | Клинические особенности и генетический анализ двух братьев и сестер с пугающей болезнью в итальянской семье: отчет о болезни. 61 | Sprovieri T … Battaglia D | 30866851 | 2019 | |
| 12 | Мутации, связанные с гиперекплексией в нейрональном транспортере глицина 2. 61 | Лопес-Коркуера Б … Арагон С | 29859229 | 2019 | |
| 13 | Странный смех при гиперекплексии: новый фенотип, связанный с новой мутацией в гене GLRA1? | Хуан З… Чжан Х | 29602144 | 2018 | |
| 14 | Миссенс-мутация A384P, связанная с гиперэкплексией человека, выявляет сайт десенсибилизации рецепторов глицина. | Ван Ч…Wu DC | 29440552 | 2018 | |
| 15 | Функциональные последствия постнатального перехода от неонатальных к мутантным взрослым субъединицам рецептора глицина α1 в мышиной модели пугающей болезни. | Шефер Н…Villmann C | 29 1 | 2018 | |
| 16 | Нарушение торговли рецепторами глицина при неврологических заболеваниях. | Шефер Н…Villmann C | 30186111 | 2018 | |
| 17 | Исследования структуры / функций субъединицы α4 выявляют эволюционную потерю подтипа GlyR, участвующего в ответах на испуг и бегство. | Ликок С…Harvey RJ | 29445326 | 2018 | |
| 18 | Нарушение структурно важного внеклеточного элемента в рецепторе глицина приводит к снижению синаптической интеграции и передачи сигналов, что приводит к тяжелому поражению. 61 | Шефер Н … Вилльманн К | 28724750 | 2017 | |
| 19 | Мутация Startle Disease E103K нарушает активацию гомомерных α1-глициновых рецепторов человека, разрушая межсубъединичный солевой мостик через сайт связывания агониста. 61 | Safar F … Сивилотти LG | 28174298 | 2017 | |
| 20 | [Клинико-генетический анализ гиперэкплексии у китайского ребенка и обзор литературы]. 61 | Ли Х … Лю XY | 28173650 | 2017 | |
| 21 | Глицинергическая передача: переносчик глицина GlyT2 при нейрональных патологиях. 61 | Зафра Ф … Хименес К | 32714574 | 2017 | |
| 22 | Внеклеточная петля β8-β9 GlyR — функциональный фактор, определяющий эффективность агонистов. 61 | Янцен Д. … Вилльманн К. | 270 | 2017 | |
| 23 | Знакомая гиперекплексия, потенциальная причина осторожной походки: новый корейский случай и систематический обзор фенотипов. 61 | Ли Й … Сон Й. | 28122427 | 2017 | |
| 24 | Синаптопатии: синаптическая дисфункция при неврологических расстройствах — обзор студентов студентам. 61 | Лепета К … Зайденбехер К | 27333343 | 2016 | |
| 25 | Мутант по испуганному мышиному Nmf11 влияет на структурную стабильность рецептора глицина и увеличивает дезактивацию. 61 | Уилкинс МЭ … Смарт ТГ | 27028707 | 2016 | |
| 26 | Нонсенс-мутация de novo CTNNB1, связанная с синдромальной атипичной гиперэкплексией, микроцефалией и умственной отсталостью: отчет о клиническом случае. 61 | Winczewska-Wiktor A … Деньги D | 26968164 | 2016 | |
| 27 | Связанная с геном TSEN54 понтоцеребеллярная гипоплазия 2 типа, проявляющаяся чрезмерно выраженной испуганной реакцией: сообщение о двух случаях в семье. 61 | Марас-Генч Х … Кара Б | 26701950 | 2015 | |
| 28 | «Прыгающие французы Мэна». 61 | Стивенс Х | 25734750 | 2015 | |
| 29 | Молекулярная основа доминирующего негативного эффекта мутации переносчика глицина 2, связанной с гиперэкплексией. 61 | Аррибас-Гонсалес Э … Лопес-Коркуера Б | 25480793 | 2015 | |
| 30 | Отличительные фенотипы в моделях данио-рерио, вызывающих испуг человека. 61 | Гансер Л.Р. … Даллман Дж. Э. | 24029548 | 2013 | |
| 31 | Переносчики глицина как новые терапевтические мишени при шизофрении, алкогольной зависимости и боли. 61 | Харви Р.Дж. … Йи Б.К. | 24172334 | 2013 | |
| 32 | Новые миссенс-мутации в гене β-субъединицы глицинового рецептора (GLRB) при болезни испуга. 61 | Джеймс ВМ … Харви Р.Дж. | 23238346 | 2013 | |
| 33 | Биогенез нейронального транспортера глицина 2 (GlyT2) с помощью калнексина. 61 | Аррибас-Гонсалес Э … Лопес-Коркуера Б | 23650557 | 2013 | |
| 34 | 4-Хлорпропофол усиливает потоки хлоридов в гиперэксплексических и искусственно мутированных рецепторах глицина человека. 61 | де ла Рош Ж … Аренс Дж. | 23006332 | 2012 | |
| 35 | Мутации в гене GlyT2 (SLC6A5) — вторая основная причина болезни испуга. 61 | Carta E … Харви RJ | 22700964 | 2012 | |
| 36 | Новая доминантная мутация гиперэкплексии Y705C изменяет транспорт и биохимические свойства пресинаптического транспортера глицина GlyT2. 61 | Хименес К … Лопес-Коркуера Б | 22753417 | 2012 | |
| 37 | Молекулярные механизмы мутаций переносчика глицина GlyT2 при болезни испуга. 61 | Джеймс ВМ … Харви Р.Дж. | 22114948 | 2012 | |
| 38 | Мутация α1K276E «испуганная болезнь» выявляет множественные промежуточные состояния в стробировании рецепторов глицина. 61 | Отворот R … Sivilotti LG | 22279218 | 2012 | |
| 39 | Вклад консервативных остатков в стробирующий интерфейс рецепторов глицина. 61 | Pless SA … Ахерн CA | 21835920 | 2011 | |
| 40 | Болезнь испуга у ирландских волкодавов, связанная с микроделецией в гене переносчика глицина GlyT2. 61 | Джилл Дж. Л. … Харви Р. Дж. | 21420493 | 2011 | |
| 41 | Конформационные изменения петли М2-М3 субъединицы β не связаны с закрытием канала рецептора α1 β глицина: последствия для наследственной гиперэкплексии человека. 61 | Шан Кью … Линч ДжВ | 22132222 | 2011 | |
| 42 | Молекулярные сайты для положительной аллостерической модуляции рецепторов глицина эндоканнабиноидами. 61 | Yevenes GE … Zeilhofer HU | 21 | 2 | 2011 |
| 43 | Синдромы испуга. 61 | Бхидаясири Р … Чыонг Д.Д. | 21496599 | 2011 | |
| 44 | Глава 33: история двигательных расстройств. 61 | Lanska DJ | 19892136 | 2010 | |
| 45 | Глицинергическая система при испуганной болезни человека: подход к генетическому скринингу. 61 | Дэвис Дж. С. … Риз М. И. | 20407582 | 2010 | |
| 46 | Дефектная глицинергическая синаптическая передача у мутантов по подвижности рыбок данио. 61 | Хирата Х … Кувада Дж. | 20161699 | 2009 | |
| 47 | Идентификация de novo мутации Lys304Gln в гене субъединицы альфа-1 рецептора глицина у корейского младенца с гиперэкплексией. 61 | Кан ХК … Ки CS | 18175347 | 2008 | |
| 48 | Анестезиологические последствия гиперекплексии — «болезнь испуга». 61 | Гарг Р … Шарма П | 18361020 | 2008 | |
| 49 | Новый аллель гиперэкплексии GLRA1 (S267N) влияет на этанольный сайт рецептора глицина. 61 | Беккер К … Беккер СМ | 18043720 | 2008 | |
| 50 | Клеточные и нейрофизиологические эффекты высокого давления окружающей среды. 61 | Дэниэлс С | 18351122 | 2008 |
Редкие болезни штата Мэн
Жители Оленьего острова проявляют особый интерес к редкой болезни под названием SPG4. Десятки из них несут мутантный ген, делающий их восприимчивыми, хотя во всем мире он встречается только у двух-четырех из 100000.
И исследователи продолжают искать случаи другого редкого заболевания, синдрома Альстрома, с группой жертв в близлежащих морских провинциях Канады.
SPG4, что означает походка со спастической параплегией, влияет на ходьбу или «походку». Он прибыл на Дир-Айл с одним из первых поселенцев из Франции. Предполагается, что он влияет только на членов и потомков семейств Харди или Хаскелл. Дети носителей имеют 50-процентный шанс унаследовать мутацию. Это не укорачивает жизнь, но может ослабить мышцы ног и вызвать потерю равновесия.
Доктор Роберт Бикман из Эллсворта, специалист по этой болезни, связывает его концентрацию на Оленьем острове с длительной изоляцией местного населения. Он консультируется с жителями Оленьих островов, которые болеют или опасаются заразиться.
Синдром Альстрома гораздо серьезнее. Он может поразить в младенчестве и часто приводит к ожирению, прогрессирующей потере зрения и слуха, проблемам с сердцем и часто к ранней смерти. Ян Д. Маршалл, генетик из лаборатории Джексона, специалист по этой болезни, знает о трех случаях заболевания в Нью-Брансуике и пяти или шести в Новой Шотландии.Подозреваемый случай в штате Мэн оказался чем-то другим, но акадское население в штате Мэн и приморских провинциях считается уязвимым. По ее словам, зарегистрировано 657 случаев заболевания в 48 странах.
И то, и другое внимательно изучается специалистами, но ни для одного из них пока нет ни профилактики, ни лечения. И то, и другое настолько редки, что крупные генетические компании не видят рентабельности в проведении дорогостоящих исследований их причин и возможных способов лечения.
И доктор Бикман, и мисс Маршалл предвидят возможность прогресса в возможно отдаленном будущем.Тем временем они направляют заинтересованных людей на веб-сайты и в организации, объединяющие пациентов и исследователей. А коллега г-жи Маршалл из лаборатории Джексона вывела две модели мышей Альстрома, которые, как они надеются, могут привести к пониманию функционирования мутации гена Альстрома как первого шага к борьбе с этим заболеванием у людей.
Тем временем специалисты по таким редким заболеваниям надеются, что губернатор Джон Балдаччи присоединится к другим штатам и объявит 28 февраля Днем редких заболеваний, чтобы распространять информацию и давать надежду.
Множественных вспышек COVID-19, связанных со свадебным приемом в сельской местности штата Мэн — 7 августа — 14 сентября 2020 г.
Расследование и результаты
12 августа 2020 года MeCDC получил лабораторные отчеты о двух людях, которые получили положительные результаты теста полимеразной цепной реакции (ПЦР) SARS-CoV-2 из образцов мазков из носоглотки. Оба человека сообщили, что посетили свадебный прием 7 августа, и у обоих начались жар, кашель и боль в горле 11 августа. Еще три человека, которые сообщили о том, что посетили тот же прием, на следующий день получили положительные результаты теста на SARS-CoV-2, что побудило их начало расследования эпидемии MeCDC 14 августа.
MeCDC использовала определения случаев COVID-19, разработанные Советом государственных и территориальных эпидемиологов ( 4 ). Подтвержденные случаи заболевания определялись получением положительного результата ПЦР-теста на SARS-CoV-2, а вероятные случаи определялись на основании сообщения о наличии симптомов, совместимых с COVID-19, и эпидемиологической связи с подтвержденным случаем без лабораторных исследований ( 4 ) . Тесный контакт определялся как нахождение в пределах 6 футов от человека с COVID-19 в течение не менее 15 минут ( 4 ).MeCDC определяет вспышку COVID-19 как возникновение трех или более подтвержденных случаев заболевания в течение 14 дней у лиц из разных домохозяйств с эпидемиологической связью с одним учреждением или событием. Исследователи MeCDC опросили пациентов с помощью стандартизированной анкеты *; ввел данные о демографических характеристиках, дате начала, симптомах и соответствующем воздействии в Базовую систему Национальной системы электронного надзора за заболеваниями; и зарегистрировал тесные контакты в Sara Alert, † , автоматизированном веб-инструменте для мониторинга симптомов ( 5 ).
Первичные случаи определялись как подтвержденные или вероятные случаи у лиц, присутствующих на приеме. Путем отслеживания контактов MeCDC выявила вторичные и третичные случаи (тесные контакты первичных и вторичных пациентов соответственно). MeCDC разработала цепочки передачи с использованием MicrobeTrace (версия 0.6.1; CDC) § и выполнила описательную статистику с помощью программного обеспечения SAS (версия 9.4; SAS Institute). Эта деятельность была проверена CDC и проводилась в соответствии с действующим федеральным законодательством и политикой CDC. ¶
Прием, на котором присутствовало 55 человек, состоялся 7 августа в сельском городке штата Мэн, расположенном в округе А. В городе проживало около 4500 человек, и ранее не сообщалось о случаях COVID-19. Заболеваемость COVID-19 в округе А до приема составила 97 случаев на 100000 человек. Семья невесты, жениха и жениха (семь человек) отправилась из Калифорнии в Мэн 6 августа. В соответствии с распоряжением губернатора штата Мэн **, поскольку вскоре после прибытия они получили отрицательные результаты теста на SARS-CoV-2, они 14 дней не подвергались карантину.Индексным пациентом был житель штата Мэн и гость на свадебном приеме, который сообщил о появлении лихорадки, насморка, кашля и усталости 8 августа и получил положительный результат теста на SARS-CoV-2 13 августа. В период с 8 по 14 августа 24 августа. Лица, получившие положительные результаты ПЦР-теста на SARS-CoV-2 в округе А, сообщили о том, что они посетили мероприятие, что побудило медицинскую инспекцию учреждения проверить соответствие рекомендациям штата Мэн по COVID-19. ††
Прием проходил в общежитии в графстве А, к которому был пристроен ресторан и четыре обеденные зоны, включая зал для мероприятий, зал для завтраков, бар и открытую террасу.Гости рассаживались в помещении для мероприятий, в котором было 10 столов, по 4–6 гостей за каждым столом. Общее количество приглашенных на свадьбу (55) превысило установленный в штате Мэн лимит в 50 человек для собраний в помещении в общем помещении. Персонал объекта проверил температуру для всех гостей на входе в объект; они были зарегистрированы как нормальные. Несмотря на то, что у входа в учреждение были вывешены знаки, инструктирующие посетителей носить маски, гости не соблюдали это требование и не поддерживали физическое расстояние ≥6 футов, и сотрудники не применяли эти меры; все сотрудники были в масках.Объект не собирал контактную информацию от гостей. Участник свадебной вечеринки сообщил MeCDC общее количество гостей, но не предоставил их контактную информацию. Следователи MeCDC связали случаи с событием с помощью обратного отслеживания, §§ , в котором люди с подтвержденным или вероятным COVID-19 были опрошены, чтобы определить, присутствовали ли они на мероприятии или были в тесном контакте с человеком, которому поставили диагноз COVID. -19 ≤14 дней до появления симптомов или даты тестирования.
Dry Eyes Портленд, штат Мэн | Синдром сухого глаза Мэн
Терапия сухого глаза: восстановление здоровых слез
Благодарим вас за то, что вы выбрали Центр сухих глаз и эстетики Eyecare Medical Group для ухода за сухими глазами. Мы с нетерпением ждем возможности работать с вами над созданием индивидуального плана лечения для облегчения ваших симптомов. На этой странице представлена общая информация о болезни сухого глаза и о том, как мы можем изменить окружающую среду и образ жизни, чтобы поддерживать здоровые слезы и минимизировать симптомы сухого глаза.
О болезни сухих глаз:
Болезнь сухих глаз — одно из наиболее распространенных состояний, поражающих глаза. По оценкам, 50 миллионов американцев страдают от синдрома сухого глаза, и он становится все более распространенным, поскольку мы живем дольше и наша окружающая среда становится более склонной к сухости. Хотя сухость глаз может показаться простой, это сложное и часто плохо изученное состояние.
«Болезнь сухого глаза» — это общий термин, включающий множество состояний, которые приводят к образованию нестабильной слезной пленки, которая не может адекватно и постоянно защищать, питать и увлажнять поверхность глаза.Это хроническое, часто прогрессирующее заболевание, которое влияет на зрение, комфорт для глаз и, в конечном итоге, на качество жизни. Общие названия, используемые для болезни сухого глаза, включают:
- Сухой кератит
- Сухой кератоконъюнктивит
- Заболевание глазной поверхности
- Дефицит липидов
- Дисфункциональная слезная пленка
- Глаза с дефицитом воды
в худшем случае может вызвать значительный дискомфорт и плохое зрение.Люди могут испытывать симптомы сухого глаза по-разному, и симптомы не всегда коррелируют с серьезностью. Интересно, что около 40% пациентов с синдромом сухого глаза не сообщают о симптомах.
До недавнего времени мы упускали из виду важность здоровых слез и влияние синдрома сухого глаза. Это сложное воспалительное состояние с различными проявлениями и причинами. Как и во многих других хронических состояниях, изменения могут происходить в течение многих лет и ухудшаться в любое время, прежде чем появятся серьезные симптомы.Прогресс в исследованиях и технологиях должен привести к улучшению лечения и облегчению симптомов. Эффективная терапия направлена на минимизацию воспаления и поддержание здоровых слез.
Теперь мы знаем, что лучшее время для решения проблемы синдрома сухого глаза — это ранняя стадия процесса, до того, как произойдут существенные изменения. Существует множество модификаций образа жизни и окружающей среды, которые помогут поддержать здоровые слезы и минимизировать симптомы. Успешная терапия сухого глаза начинается с понимания того, что происходит и что мы можем сделать, чтобы помочь.
Общие симптомы сухости глаз включают:
- Жжение или покалывание
- красные глаза
- Ощущение песка или инородного тела
- светочувствительность
- колеблющееся зрение с миганием
- плохое зрение при чтении
- чувствительность к холоду и / или ветру окружающая среда
- боль или болезненность глаз
- зуд век
- снижение толерантности к контактным линзам
- липкие глаза
- слезящиеся глаза
- усталые глаза
Важность здоровых слез
Сухие глаза возникают, когда слезная пленка не срабатывает и глаз подвергается чрезмерному воздействию окружающей среды, вызывая дискомфорт и воспаление.Поверхность глаза (роговица) представляет собой слизистую оболочку и должна оставаться увлажненной, чтобы оставаться здоровой и комфортной. Если кто-то не производит достаточно слез, не производит качественных слез и / или не может равномерно расплескивать слезы по глазам, он / она подвергается риску развития болезни сухого глаза.
Когда мы моргаем, наши веки закрываются, как ракли, от внешнего к внутреннему уголку глаза, выводя старые слезы в слезные протоки и равномерно распределяя свежие слезы по глазу.
Слезная пленка выполняет несколько функций:
- Поддерживает увлажнение поверхности глаза.
- Удаляет мусор, аллергены и другие частицы, чтобы избежать раздражения и повреждения глаз.
- Обеспечивает сильную иммунную систему, защищающую глаза от инфекций.
- Обеспечивает питательными веществами поверхность глаза, наиболее метаболически активную и быстро заживающую ткань нашего тела.
- Он обеспечивает гладкую преломляющую поверхность для четкого зрения, фокусируя ~ 80% света, попадающего в глаз.
- Слезная пленка представляет собой удивительно сложную структуру, состоящую из эфирных жирных масел, белков, витаминов, электролитов, антител и воды, взвешенных в тонком балансе.
Слезная пленка состоит из трех уникальных интерактивных слоев:
Липидный слой («мейбум») — это самый внешний слой слезной пленки. Он утолщает слезы, создает гладкую поверхность для фокусировки света и замедляет испарение слез. Этот слой происходит от мейбомиевых желез, расположенных внутри век. Когда наши веки закрываются во время полного моргания, мышцы век выдавливают масло через слезы.
Водный слой — это поливной средний слой слезной пленки.Он составляет большую часть того, что мы видим как слезы, и смывает частицы, которые не попадают в глаз. Этот слой происходит от слезной железы, расположенной за верхним веком.
Муциновый слой — это внутренний слой слезной пленки. Это создает основу, которая помогает равномерно распределить слезы по всей поверхности глаза. Без муцина слезы не прилипли бы к глазу и не распространились бы по нему. Муцин производится из бокаловидных клеток конъюнктивы.
Наши слезы производятся и регулируются функциональным блоком слезной жидкости (LFU), полностью интегрированной системой, включающей все структуры и нервные пути, активные в производстве слезы.В здоровой функционирующей слезной системе глаза постоянно производят сбалансированные слезы, которые меняют состав в зависимости от изменений в окружающей среде. Сухие глаза возникают, когда эта система нарушает функции и слезы становятся все более несбалансированными и нестабильными. Все, что влияет на способность организма производить достаточное количество слез, качественные слезы и / или равномерно распределять слезы по глазам, увеличивает риск заболевания сухим глазом. Если слезы находятся в состоянии хронического дисбаланса, может возникнуть воспалительный цикл, что может ухудшить здоровье глаз и качество зрения.
Подтипы болезни сухих глаз
Исторически болезнь сухих глаз классифицировалась как один из двух типов: 1) водная недостаточность, в первую очередь из-за низкого производства слезы, и 2) липидная недостаточность, в первую очередь из-за дисфункции мейбомиевых желез и / или блефарит. Поскольку слезы находятся в постоянном контакте с краями век, здоровье слез и здоровье век напрямую влияют друг на друга. Теперь мы знаем, что большинство случаев синдрома сухого глаза представляют собой смесь дефицита липидов и недостатка воды, а также могут быть связаны с механическими факторами.
Дефицит липидов или дисфункция мейбомиевых желез:
Дефицит липидов, то есть слишком мало масла в слезах, вызывает быстрое испарение слезы и является очень частой причиной синдрома сухого глаза. Плохое производство масла, когда мейбомиевые железы век не функционируют должным образом. Это может произойти по многим причинам, включая прием определенных лекарств, блефарит (см. Ниже), усиление воспаления в организме и плохое моргание. Лечение направлено на улучшение качества масла и продвижение в слезы.
Блефарит:
Воспаление по краю века является обычным явлением среди населения в целом и приводит к раздражению век, покраснению и зуду. Это чаще встречается у людей со светлой кожей или с такими кожными заболеваниями, как розацеа, экзема и псориаз. Косметические и гигиенические привычки могут сильно повлиять на блефарит. Лечение направлено на правильную очистку век и изменение привычек, чтобы минимизировать воспаление.
Водный дефицит:
Низкое слезоотделение слезной железой или водный дефицит в основном связан с приемом некоторых лекарств, пожилым возрастом, обезвоживанием и аутоиммунными заболеваниями.Лечение направлено на увеличение выработки слез с помощью отпускаемых по рецепту глазных капель, увеличение гидратации и изменение окружающей среды для повышения влажности.
Механические факторы:
Все, что нарушает правильную функцию моргания, может повлиять на устойчивость к разрыву и привести к сухости. Предыдущие операции на веках, паралич Bells, неполное закрытие век, неполное и / или нечастое моргание, увеличенное время экрана и дряблость век — все это может повлиять на функцию моргания. Лечение часто включает в себя улучшение привычки моргать, смазывание на ночь, использование защитных очков, изменение окружающей среды и хирургические процедуры на веках, если это необходимо.
Общие факторы риска, связанные с сухостью глаз
Факторы, связанные со здоровьем
- Использование CPAP
- Аллергия
- Повышенное воспаление
- Дефицит витамина A
- Плохое питание (с низким содержанием незаменимых жирных кислот, витаминов и / или анти- воспалительные продукты)
- Гормональные изменения, включая менопаузу и заместительную терапию
- История трансплантации стволовых клеток
- История системной химиотерапии
Факторы, связанные с пациентом:
- Возраст (снижение выработки слез)
- Женский пол
- Светлый цвет лица
- Плохой сон
- Обезвоживание
- Потребление алкоголя
- Потребление кофеина
- Курение
- Частые полеты
- Длительное использование контактных линз
- Плохие привычки контактных линз
- Рефракционная хирургия (т.е.LASIK, PRK, RK и т. Д.)
- Регулярные и продолжительные действия, связанные с уменьшением мигания (например, чтение, использование компьютера или планшета, вождение автомобиля, просмотр телевизора и т. Д.).
Факторы окружающей среды:
Проживание, работа или длительное пребывание в сушильной среде, например:
- Плохое качество воздуха увеличивает загрязнение воздуха
- Воздействие химикатов, чистящих средств или других раздражителей и аллергенов
- Низкая влажность
- Потолочные вентиляторы во время сна
- Кондиционер
- Холодная и / или ветреная среда
- Запыленная среда
- Отопление дровяной печью
- Вентиляторы или вентиляционные отверстия, направленные к лицу во время работы
Медицинские условия, связанные с сухостью глаз:
- Синдром Шегрена
- Розацеа
- Волчанка
- Ревматоидный артрит
- Болезнь Паркинсона
- Паралич Белла
- Диабет
- Гепатит C
- Диграфия
- Диграфия
- Саркоидоз
- Дигрогенез
- Недостаточность яичников
- Угри
Тыр оидная дисфункция
Обычные лекарства, связанные с сухим глазом:
- Лекарства от кровяного давления (диуретики)
- Лекарства от аллергии (антигистаминные препараты)
- Лекарства от простуды (противоотечные)
- Антидепрессанты (SSRI, трициклические антидепрессанты) 90-987 лекарства от тревожности
- Эстроген или другая заместительная гормональная терапия
- Лекарства от угрей (например,грамм. Accutane)
- Гормональные противозачаточные средства (например, «таблетки»), «пластырь»
- Пероральные кортикостероиды
- Капли от глаукомы
Модификации окружающей среды и образа жизни для улучшения симптомов сухости глаз
Гигиенические соображения 909
Соображения по окружающей среде:
- Сведите к минимуму воздействие сухой, сквозняковой, задымленной и / или пыльной окружающей среды.
- Носите закрывающиеся очки на улице, чтобы не сушить от ветра. При необходимости наденьте очки с камерой влажности для повышения влажности. Рекомендуется защита от UVA / UVB в солнцезащитных очках.
- Избегайте направлять обогреватели, кондиционеры, вентиляторы и т. Д. В лицо, особенно в машине, в офисе и во время сна.
- Повысьте влажность в помещениях, где вы проводите много времени, например в офисе, гостиной и спальне. Используйте увлажнители или поддоны с большой площадью поверхности, заполненные водой.
- Уменьшите температуру зимой. Повышение температуры внутри, когда на улице морозы, снижает влажность в вашем доме.
- Если вы используете печь на гранулах или дровах, подумайте об использовании увлажнителя воздуха или поставьте на плиту пароварку или кастрюлю с водой, чтобы добавить влаги в воздух.
Соображения об образе жизни:
- Делайте частые перерывы, когда работаете в пределах досягаемости рук, особенно за компьютером:
- • Гигиена зрения 20/20/20 • каждые 20 минут, смотрите на 20+ футов в течение 20+ секунд и сделайте несколько медленных, долгих, полных миганий
- Во время работы на компьютере смотрите слегка опущенными вниз.Ваши глаза должны находиться на одном уровне с верхней частью монитора.
- Спите 7+ часов
- Ограничьте потребление кофеина и алкоголя
- Увеличьте потребление воды (стремитесь к 64 унциям в день) по мере возможности
- Соблюдайте сбалансированную диету, богатую витаминами (особенно A, C и E) и незаменимые омега-жирные кислоты (холодноводная жирная рыба, такая как лосось, скумбрия и треска, семена льна, семена чиа, грецкие орехи, соевые бобы и т. д.). Ограничьте потребление обработанных пищевых продуктов, рафинированного сахара и красного мяса.
- При необходимости обсудите с врачом сокращение или замену лекарств, которые, как известно, ухудшают симптомы сухого глаза.
Питание и сухость глаз
Здоровые глаза принадлежат здоровому телу.Вести здоровый образ жизни, оставаться активным и придерживаться сбалансированной и здоровой диеты очень важно для здоровья глаз. При сухости глаз важна диета, сводящая к минимуму воспаление и обеспечивающая необходимые питательные вещества.
Если вы чувствуете, что в вашем рационе не хватает питательных веществ, вы можете подумать о приеме добавок:
- Ежедневный поливитамин
- Лютеин + зеаксантин
- каротиноидные пигменты, важные для общего здоровья глаз
- особенно полезны при приеме статинов или метформина
Добавки Омега-3/6/9:
- 1000-2000 мг Омега-3/6/9 (DHA + EPA + GLA) каждое утро с полным стаканом воды и завтраком с высоким содержанием жиров (авокадо, яйца, смузи с арахисовым маслом и т. д.) для максимального поглощения. Если вы не можете перенести полную дозу сразу, разделите дозу на завтрак / ужин.
- можно удваивать дозу в течение 15-30 дней при начале приема добавок или каждые 6-12 месяцев по мере необходимости для контроля симптомов
- вегетарианские варианты:
- 1-2 столовые ложки льняного масла холодного отжима (хранить в холодильнике)
- 1-2 столовые ложки свежемолотых семян льна, добавленные в пищу (горячие или холодные хлопья, йогурт, коктейли, соки и т. Д.)
- Добавки омега-3 могут способствовать разжижению крови.Проконсультируйтесь с врачом перед началом приема добавок, если вы беременны или принимаете рецептурные препараты для разжижения крови, такие как Lasix, Coumadin, Xarelto или ежедневный аспирин.
- рассмотрите возможность приема фермента липазы , если желчный пузырь плохо функционирует или отсутствует.
Важность моргания
Подавляющее большинство из нас не моргает часто или недостаточно полно в течение дня. Мы моргаем вдвое медленнее обычного при концентрации внимания (например, при чтении или за рулем) и в пятой части обычного при использовании электронных устройств (например,компьютеры, телевизоры и смартфоны), и многие из нас в таких условиях прибегают к быстрому и быстрому миганию. При этом образуется слезная пленка, которая не пополняется полностью или равномерно по глазу, что часто усугубляет симптомы сухого глаза. Есть также ряд лекарств и состояний, которые могут способствовать неполному и / или нечастому морганию.
Во время полного моргания верхнее и нижнее веки сходятся вместе, как ракель, очищая слезы и создавая свежие слезы.
Когда веки полностью закрываются, мышцы век сжимают мейбомиевые железы и выделяют масло в слезы, а веки слегка растирают взад и вперед и очищают ресницы.Когда веки открываются, слезная пленка равномерно распространяется по глазу.
Важно делать частые перерывы при концентрации, особенно при работе в пределах досягаемости рук или с электронными устройствами, чтобы избежать сухости и утомления глаз:
• Гигиена зрения 20/20/20 • каждые 20 минут, смотреть на расстояние 20+ футов в течение 20+ секунд и сделайте 20 медленных, длинных миганий
«Сознательное мигание» так же просто, как несколько медленных, долгих, преднамеренных миганий и удерживание в середине мигания в течение 2 секунд.Попробуйте связать это с вещами, которые часто происходят в течение дня, например, между письмами, телефонными звонками, приемами пищи или перерывами. Сделайте несколько долгих морганий после теплых компрессов и гигиены век.
- Закрыть, чтобы научить крышки касаться
- Пауза на счет до 2, чтобы усилить прикосновение крышек
- Открыть на счет до 2, чтобы завершить мигающую последовательность
Компьютерные программы для напоминания о мигающих перерывах:
ПК совместимый:
БЕСПЛАТНО
- www.workrave.org | www.trisunsoft.com/pc-work-break
- www.eyeleo.com | www.regularbreaks.com
НА ПЛАТЕЖНОЙ ОСНОВЕ
- www.paratec.com | www.eyeprotectorpro.com
Совместимость с iOS (Apple):
БЕСПЛАТНО
- www.regularbreaks.com, Тайм-аут (Mac только в магазине приложений)
Lid Hygiene
Регулярная чистка крышки маржа важна. Без регулярной очистки век и ресниц скопление омертвевших клеток кожи, масел, макияжа и мусора скапливается вдоль век и прилипает к основанию ресниц.Это накопление увеличивает воспаление вместе с веками и блокирует сальные железы. Цель чистки век — очистить край века от мусора, не удаляя полезные масла и флору, открывая сальные железы у основания ресниц и ограничивая общее воспаление век и слезы.
Мы рекомендуем выполнять те гигиенические процедуры, которые наиболее удобны и удобны для вас. Некоторые люди предпочитают использовать пенящиеся очищающие средства в душе и салфетки для крышек, в противном случае. Некоторые предпочитают чередовать продукты на основе бамии и чайного дерева.И некоторые предпочитают использовать спрей для крышек после очищающих средств каждый раз, каждые несколько раз или вообще не использовать, в то время как другие предпочитают использовать только спрей для крышек без каких-либо других очищающих средств. Не существует правильного или неправильного способа чистки крышек, просто соблюдайте какой-то распорядок. И, как и гигиена полости рта, все лучше, чем ничего.
Искусственные слезы
Искусственные слезы полезны при лечении синдрома сухого глаза, но они не улучшают качество естественных слез.
Преимущества искусственной слезы:
- Успокаивает и увлажняет поверхность глаза
- Стабилизирует и уравновешивает слезную пленку
- Способствует распространению слезы по глазу
- Смывает с глаз токсины, раздражители и мусор
- Уменьшает трение моргания между веком и поверхностью глаза
Не все искусственные слезы сделаны одинаково.Мы предоставим вам список рекомендуемых вариантов. Важно выбирать качественные капли с мягкими консервантами. Избегайте дженериков, так как они часто используют жесткие консерванты, такие как хлорид бензалкония (БАК), которые могут ухудшить симптомы.
Бренды включают:
- Обновить
- Systane
- Oasis
- Blink
- Genteal
- TheraTears
- Успокаивающий
- Некоторые другие рекомендуемые капли, кроме
.Используйте то, что вам больше нравится.
Советы и уловки по поводу искусственных слез:
- Используйте слезы перед действиями, которые беспокоят глаза, такими как работа за компьютером, чтение, вождение, деятельность на свежем воздухе и т. Д.
- Храните капли в холодильнике, чтобы они охлаждали и при необходимости успокаивали. .
- Искусственные слезы — это не то же самое, что «средства от покраснения» или «средства от зуда», которые содержат дополнительные лекарства, которые не всегда помогают.
- Не делитесь глазными каплями с другими людьми.
- Не касайтесь кончиком пипетки глаз, ресниц или век.
- Снимите контактные линзы перед использованием любых глазных капель, не предназначенных для использования с контактами.
- Если вы принимаете более одного типа глазных капель одновременно, подождите 3-5 минут между каплями.
КОНСЕРВИРОВАННЫЕ СЛЕЗЫ
- универсальный флакон
- не использовать более 4 раз в день
- выберите капли с мягкими консервантами
- выбросьте 2-3 месяца
PRESERVATIVE -FREE 98 СЛЕЗЫ можно использовать 4 раза в день, но не чаще, чем каждые 1-2 часа В Как правило, не рекомендуется использование средств для снятия покраснения.При частом использовании возникает «обратное покраснение», что означает, что глаза будут красными, если вы не используете каплю. Кроме того, в этих каплях используются жесткие консерванты. Их следует использовать очень экономно, если они вообще используются. Гипертрофическая кардиомиопатия у кошек мейн-кун обычно не проявляется, пока они не станут взрослыми, хотя генетическая мутация присутствует при рождении. У большинства мейн-кунов болезнь развивается после 3 лет, но у некоторых она развивается гораздо позже (6-8 лет).Мутация ДНК мейн-куна — это изменение одной пары оснований в ДНК. Несколько исследований показывают, что генетическая мутация довольно часто встречается у кошек мейн-кунов, и около 30% мейн-кунов являются носителями этой мутации. Заболевание называется «неполной пенетрантностью». Это означает, что даже если у кошки есть генетическая мутация, она может не «проникнуть» или привести к развитию полного заболевания у этой кошки. Результаты теста ДНК покажут, есть ли у кошки мутация в 1 копии из 2 копий гена (гетерозиготная) или обеих копиях гена (гомозиготная).Большинство кошек, гетерозиготных по мутации, НЕ заболеют. Однако у большинства кошек, гомозиготных (имеющих 2 копии гена), со временем разовьется болезнь, и они могут заболеть. Гипертрофическая кардиомиопатия у кошек мейн-кун (HCM) Стоимость тестирования: 35 долларов США за кошку Скидка на помет распространяется на пометы ДВУХ ИЛИ БОЛЕЕ. Скидка НЕ распространяется на родителей или братьев и сестер из других пометов. Образцы от каждого котенка в помете должны подаваться вместе. Форма помета После того, как вы запустите ДНК-тест, мы отправим вам результаты, в которых будет указано, что результаты вашей кошки: Рекомендации по разведению: Поскольку, по оценкам, около 30% популяции мейн-кунов имеют мутацию, мы не рекомендуем исключать всех положительных гетерозиготных кошек из программы разведения.Поскольку большинство кошек, которые являются положительными гетерозиготными, не заболевают этим заболеванием, может быть разумным рассмотреть возможность скрещивания этих кошек с кошкой с отрицательным результатом, обследовать котят и попытаться выбрать котенка с отрицательным результатом, чтобы оставить его в качестве воспроизводящего животного в следующем помете или так. Мы никогда не рекомендуем скрещивать положительную гетерозиготную кошку с положительной гетерозиготной кошкой, поскольку это может привести к появлению гомозиготных кошек, которые с большей вероятностью заболеют этим заболеванием. §1642. Синдром Дауна Департамент должен создать, поддерживать и управлять информационной службой по синдрому Дауна.Для целей этого раздела «синдром Дауна» означает хромосомное состояние, вызванное ошибкой в делении клеток, которое приводит к наличию дополнительной полной или частичной копии хромосомы 21. [2015, c. 269, §1 (НОВОЕ).] 1. Будущий или новый родитель; другие. Больница, врач, поставщик медицинских услуг или сертифицированная медсестра-акушерка, оказывающая дородовую или послеродовую помощь, или генетический консультант, который оказывает дородовое или послеродовое генетическое консультирование, должны после получения положительного результата пренатального или послеродового теста на синдром Дауна предложить информация о будущих или новых родителях, предоставленная департаментом в соответствии с подразделом 2.Отделение также должно предоставить такую информацию любому другому лицу, получившему положительный результат пренатального или послеродового теста на синдром Дауна. [2015, c. 269, §1 (НОВОЕ).] 2. Информация предоставлена. Отделение должно предоставить лицу, оказывающему дородовую помощь, послеродовую помощь или генетическое консультирование будущим или молодым родителям, получившим пренатальный или послеродовой диагноз синдрома Дауна, следующую информацию: A. Актуальная письменная информация, основанная на доказательствах. о синдроме Дауна, который включает в себя физические, связанные с развитием, образовательные и психосоциальные результаты, ожидаемую продолжительность жизни, клиническое течение, а также интеллектуальное и функциональное развитие и варианты лечения.Информация должна быть проверена авторитетными медицинскими экспертами в данной области и национальными организациями по синдрому Дауна; и [2015, c. 269, §1 (NEW).] B. Контактная информация о программах и услугах поддержки, включая информационные горячие линии, относящиеся к синдрому Дауна, информационные центры и информационные центры, национальные, общегосударственные и местные организации, занимающиеся синдромом Дауна, и другие образовательные и вспомогательные программы. Государственная ветеринарная больница штата Северная Каролина: Мелкие животные: Ветеринарная генетика — Гипертрофическая кардиомиопатия кошек мейн-кун (HCM)
Форма для подачи У нас действует скидка на помет!
: Закон штата Мэн в новой редакции 2016 года :: Кодексы и законы США :: Законодательство США :: Justia
