Нейробиологи научились измерять содержание миелина в мозге плода в утробе матери
Нервные волокна периферической и центральной нервной системы окружены защитной оболочкой из миелина – многослойной клеточной мембраной, состоящей из жиров и белков. Ионные токи не могут проходить через миелин, поэтому нервный импульс проходит по миелинизированным волокнам крупными «перескоками» – только по областям разрыва миелиновой оболочки, такие области встречаются через равные промежутки длиной примерно 1 миллиметр. В результате такой скачкообразной передачи сигнала, нервный импульс распространяется по миелинизированным волокнам в несколько раз быстрее, чем по волокнам без миелина. Повреждение миелиновой оболочки приводит к серьезным нарушениям работы нервной системы.
Процесс миелинизации начинается приблизительно на пятом месяце развития плода и интенсивно продолжается после рождения, когда человек учится держать голову, ходить, говорить, мыслить и так далее. Нарушение этого процесса, а также некоторые заболевания (например, рассеянный склероз) могут повредить миелиновую оболочку нервных волокон и таким образом вывести из строя центральную нервную систему. Ученые из Томского государственного университета и Института «Международный топографический центр» Сибирского отделения РАН разработали метод количественной оценки процесса миелинизации мозга плода в клиничесских условиях с помощью магнитнорезонансной томографии (МРТ).
«Нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также являются возможным механизмом формирования ряда неврологических и психиатрических заболеваний. Наше исследование открывает возможность неинвазивного изучения формирования миелина в мозге плода на самой ранней стадии и последующего применения полученных знаний в клинической диагностике и фундаментальных нейронауках», — рассказал Василий Ярных, руководитель проекта, профессор Томского государственного университета и университета Вашингтона (США).

Современные методы МРТ позволяют на качественном уровне оценить выраженные нарушения миелинизации, но не дают возможности измерить точное количество миелина в нервной ткани. Более ранние технологии МРТ также недостаточно чувствительны к малым количествам миелина, которые присутствуют в мозге плода или новорожденного ребенка. Авторы исследования предлагают использовать для этих целей новый метод – картирование макромолекулярной протонной фракции (МПФ). При обычной МРТ источником сигнала являются протоны, содержащиеся в воде, тогда как метод картирования МПФ измеряет количество протонов, входящих в состав клеточных мембран. Благодаря специальному алгоритму математической обработки изображений и протоколу сбора данных, новый метод позволяет выделить сигнал протонов, относящихся к миелиновей оболочке. В предыдущих исследованиях ученые доказали эффективность этого метода для количественной оценки миелинизации, а в новой работе продемонстрировали применение картирования МПФ для визуализации тонких различий в миелинизации анатомических структур мозга плода.
«Наше исследование стало возможным благодаря тесному сотрудничеству с клиницистами из отделения «МРТ Технологии» Института «Международный топографический центр» Сибирского отделения РАН под руководством доктора медицинских наук Александры Коростышевской и их значительному опыту в диагностике патологий развития плода. В результате нашей работы предложен новый метод построения карт миелинизации мозга человека в процессе пренатального развития. Впервые показана возможность неинвазивной количественной оценки содержания миелина в мозге плода с использованием широкодоступного клинического оборудования для МРТ», — добавил ученый.
В исследовании приняло участие более сорока беременных женщин на сроке беременности от 18 до 38 недель. Ученые показали способность их метода надежно оценивать пространственно-временные траектории развития миелина в различных анатомических структурах мозга плода.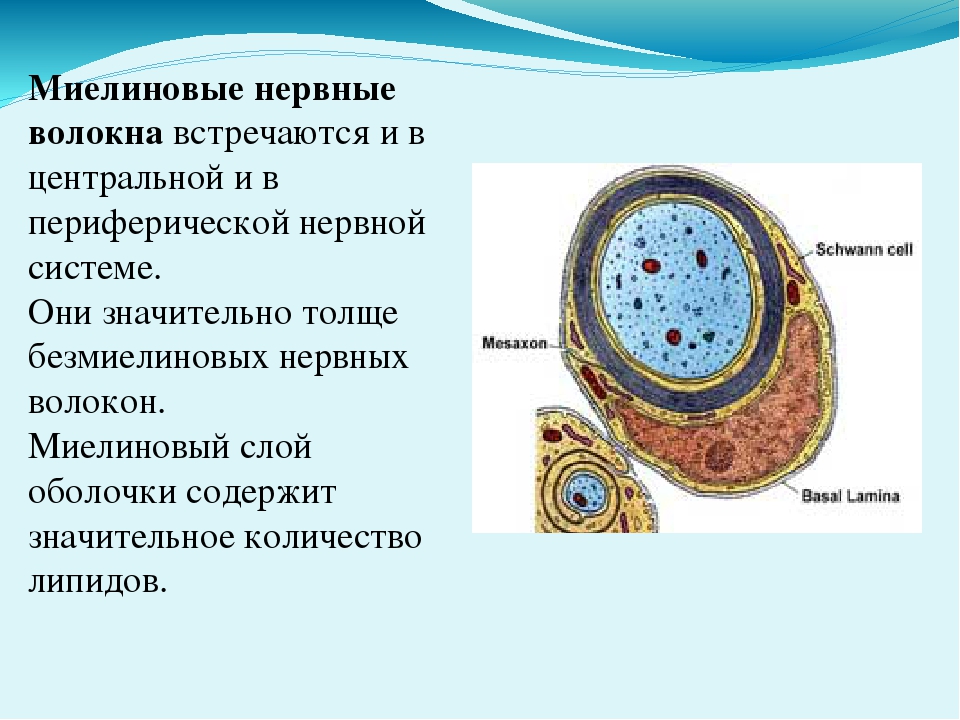 Новая технология позволяет выявлять очень малые количества миелина на ранних стадиях его формирования с высоким пространственным разрешением и коротким временем сканирования (менее 5 минут). Авторы сравнили данные, полученные для мозга взрослого человека и мозга плода и выяснили, что картирование МПФ являтся наиболее чувствительным к содержанию миелина среди всех известных методов МРТ.
Новая технология позволяет выявлять очень малые количества миелина на ранних стадиях его формирования с высоким пространственным разрешением и коротким временем сканирования (менее 5 минут). Авторы сравнили данные, полученные для мозга взрослого человека и мозга плода и выяснили, что картирование МПФ являтся наиболее чувствительным к содержанию миелина среди всех известных методов МРТ.
Фото: Примеры карт МПФ головного мозга плодов различного гестационного возраста. Источник: Василий Ярных
Найден способ восстановления защиты нервных волокон, повреждающейся при рассеянном склерозе
Рассеянный склероз (РС) – заболевание, при котором иммунная система по ошибке атакует миелин, вещество из которой строится оболочка нервных волокон. Эта оболочка защищает нейроны в нервной системе.
Подобно короткому замыканию оголённых электрических проводов потеря миелина приводит к «короткому замыканию» нервов, что в итоге оборачивается потерей связи между мозгом и телом. В результате у человека с РС ухудшаются двигательные навыки и когнитивные способности.
Согласно статистике, более двух миллионов человек во всём мире страдают от такого недуга. Большинство случаев диагностируется в возрасте 20-40 лет, между тем специалисты отмечают, что заболевание может затронуть совсем юных и пожилых людей. Также РС в три раза чаще диагностируется у женщин, чем у мужчин (специалисты объяснили, чем это может быть вызвано).
Исследователи из Мельбурнского университета разработали синтетический пептид, помогающий миелину регенерировать. Такой пептид потенциально может замедлить прогрессирование заболевания и ухудшение состояния больных.
Если говорить о возможном лечении РС, то у исследователей есть несколько мишеней. Одно из направлений заключается в попытке остановить столь агрессивную реакцию иммунной системы на миелин. Другая цель учёных — замедлить ход заболевания. По этой причине они и ищут способ восстановить повреждённый миелин. Специалисты надеются сделать это при помощи лекарств, стволовых клеток и генной терапии.
По этой причине они и ищут способ восстановить повреждённый миелин. Специалисты надеются сделать это при помощи лекарств, стволовых клеток и генной терапии.
Исследование австралийских учёных можно условно отнести ко второму лагерю.
Учёные сосредоточились на факторе роста под названием нейротрофический фактор из тканей мозга (BDNF). Дело в том, что он обладает нейрозащитными свойствами. Он также способствует образованию миелинового слоя (процесс называется миелинизацией).
В случае с миелинизацией BDNF действует через посредника (рецепторного белка на поверхности клеток, продуцирующих миелин). Рецепторный белок называется TrkB.
Как говорят учёные, специалисты могут улучшить восстановление миелина после его разрушения в головном мозге за счёт стимулирования TrkB на олигодендроцитах. Последние клетки продуцируют миелин.
Чтобы сделать это, необходимо нацелиться конкретно на TrkB. И сделать это можно за счёт имеющихся знаний о молекулярной структуре фактора BDNF. Последний взаимодействует с TrkB через специфическую последовательность аминокислот, собранные в петлеобразные структуры.
Отмечается, что ранее учёные уже пытались разработать способ лечения РС при помощи этого фактора роста, но оказалось, что с ним достаточно трудно работать. Причина в том, что BDNF — это относительно большая молекула, которая взаимодействует с несколькими рецепторами и довольно быстро разрушается в организме.
Новый пептид меньше и более эффективен в восстановлении миелина, чем природный фактор роста BDNF.
Чтобы устранить возникшие препятствия, учёные разработали синтетический пептид под названием TDP6. Он имитирует петлеобразные структуры BDNF. По сути пептид действует как уменьшенная, более управляемая версия природного фактора роста.
Во время испытаний на мышах учёные выяснили, что TDP6 лучше повышал регенерацию миелина, чем естественный BDNF. Он увеличивал количество олигодендроцитов — клеток, продуцирующих миелин.
Выяснилось к тому же, что вновь сформированные слои миелина были толще, чем миелин, восстановленный после разрушительного действия иммунной системы. В своей работе исследователи делают вывод, что TDP6 даже более эффективен в вопросе регенерации миелина, чем BDNF.
Также исследователи установили, что TDP6 не разрушается в организме грызунов даже спустя семь дней. То есть он может действовать достаточно долго.
Как отмечается в пресс-релизе исследования, стимулирование производства миелина в мозге может помочь людям с разными дегенеративными и неврологическими заболеваниями, не только с рассеянным склерозом.
Добавим, что, хотя результаты являются достаточно многообещающими, исследование находится на ранней стадии. Специалисты говорят, что в будущих работах они будут изучать, как именно синтетический пептид восстанавливает миелин. Также они намерены разработать улучшенные версии TDP6.
Результаты исследования представлены в издании Journal of Neuroscience.
Миелиновая защита нейрона: всё начинается до рождения
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации.
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом — миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Аксон — главный «кабель» нейрона, покрытый миелиновой оболочкой. Он отдаленно напоминает линию электропередач с цепочкой изоляторов. Цель оболочки, которую формируют специальные обслуживающие клетки (олигодендроциты либо клетки Шванна), — обеспечить передачу электрических импульсов без потерь и с максимальной скоростью. © Servier Medical Art. Слева — аксоны седалищных нервов мыши (красные), обернутые клетками Шванна (зеленые, ядра — синие). Фото A. Alvarez-Prats и T. Balla. © Eunice Kennedy Shriver / National Institute of Child Health and Human Development / NIH
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз — хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей — через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
В головном мозге миелиновую оболочку создают олигодендроциты, в периферической нервной системе — клетки Шванна. Каждый олигодендроцит образует несколько «ножек», которые неоднократно «оборачиваются» вокруг части какого-нибудь аксона (внизу). В результате один олигодендроцит оказывается связан с несколькими нейронами. © Servier Medical Art. Вверху — олигодедроциты в культуре (красные, ядра — сиреневые). © jakeyoung64
Каждый олигодендроцит образует несколько «ножек», которые неоднократно «оборачиваются» вокруг части какого-нибудь аксона (внизу). В результате один олигодендроцит оказывается связан с несколькими нейронами. © Servier Medical Art. Вверху — олигодедроциты в культуре (красные, ядра — сиреневые). © jakeyoung64
Не все знают, что миелин — это множество слоев клеточной мембраны, много раз «намотанных» на аксон. Формируется миелин плоскими выростами «служебных» глиальных клеток, цитоплазма в которых практически отсутствует. Миелиновая оболочка не непрерывна, а дискретна, с промежутками (перехватами Ранвье). Поэтому аксон обладает более быстрой скачкообразной проводимостью: скорость прохождения сигнала по волокнам с миелином и без него может отличаться в сотни раз. Что касается молекулярного состава «изолятора», то он, как и все клеточные мембраны, состоит преимущественно из липидов и белков.
Дефекты нервной «изоляции»
Развитие мозга плода — сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18–20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Дело в том, что количество миелина и размеры отдельных структур головного мозга у эмбриона настолько малы, что любые измерения очень сложны и трудоемки. К тому же плод постоянно шевелится, что очень затрудняет получение качественных изображений и достоверных количественных данных. Поэтому нужна технология, позволяющая получать изображения быстро и с высокой разрешающей способностью даже на маленьких объектах.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) — биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
Метод макромолекулярной протонной фракции (МПФ) основан на эффекте переноса намагниченности, когда протоны свободной воды «обмениваются» намагниченностью с протонами малоподвижных макромолекул, таких как белки. Скорость этого процесса влияет на величину детектируемого сигнала МРТ и зависит от площади взаимодействия макромолекулярной фракции и воды
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин — в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
Карта МПФ (д) реконструируется с помощью специальной математической программы из четырех видов исходных изображений: в режиме переноса намагниченности (а) и протонной плотности (б), референсного (в) и анатомического (г), которые можно получить на обычном томографе
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы — врожденной злокачественной опухоли мозжечка.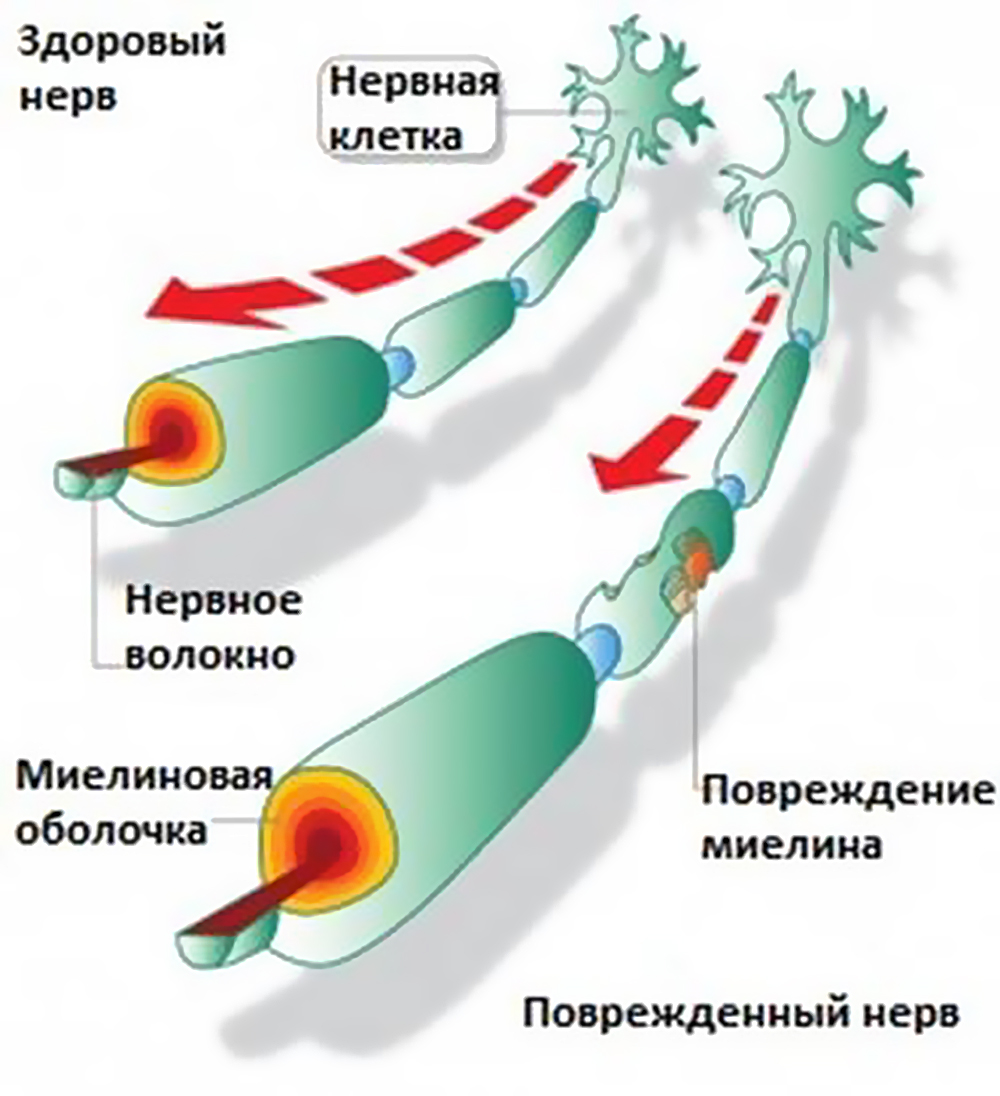 У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Наиболее высокие значения МФП и, соответственно, степени миелинизации выявлены в стволовых структурах головного мозга плода. Меньшие значения МПФ обнаружены в таламусе и мозжечке, а минимальные — в полушариях головного мозга. При этом количество миелина в центральных мозговых структурах стабильно увеличивается с эмбриональным возрастом
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
Медуллобластома — злокачественная опухоль центральной нервной системы, развивающаяся из эмбриональных клеток и локализующаяся преимущественно в мозжечке. Она составляет пятую часть всех опухолей головного мозга у детей. Формирование у ребенка врожденной медуллобластомы удалось проследить с внутриутробного периода. На традиционных МРТ-изображениях головного мозга (карте коэффициента диффузии воды — а и анатомических изображениях с различным контрастом — б, в) опухоль можно диагностировать после рождения: например, она хорошо видна в возрасте 4 месяцев. Однако в последнем семестре беременности опухоль не выделяется на фоне окружающей ткани, но ее можно увидеть на МПФ-карте, потому что медуллобластома содержит большое количество коллагена, влияющего на величину детектируемого сигнала МРТ. Справа — МРТ-изображение нервной системы больного в возрасте 4 месяцев, полученное при обычном сканировании с контрастным усилением. В возрасте 5,5 месяцев ребенку была сделана оперативная резекция опухоли. Внизу — гистологические срезы опухолевых фрагментов, окрашенных гематоксилин-эозином (а) и импрегнированных серебром (б), на которых видны множественные слившиеся опухолевые узлы, окруженные фиброзными волокнами, в состав которых входит коллаген. Фото из архива НМИЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева (Москва)
На традиционных МРТ-изображениях головного мозга (карте коэффициента диффузии воды — а и анатомических изображениях с различным контрастом — б, в) опухоль можно диагностировать после рождения: например, она хорошо видна в возрасте 4 месяцев. Однако в последнем семестре беременности опухоль не выделяется на фоне окружающей ткани, но ее можно увидеть на МПФ-карте, потому что медуллобластома содержит большое количество коллагена, влияющего на величину детектируемого сигнала МРТ. Справа — МРТ-изображение нервной системы больного в возрасте 4 месяцев, полученное при обычном сканировании с контрастным усилением. В возрасте 5,5 месяцев ребенку была сделана оперативная резекция опухоли. Внизу — гистологические срезы опухолевых фрагментов, окрашенных гематоксилин-эозином (а) и импрегнированных серебром (б), на которых видны множественные слившиеся опухолевые узлы, окруженные фиброзными волокнами, в состав которых входит коллаген. Фото из архива НМИЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева (Москва)
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH).
Литература
1. Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест.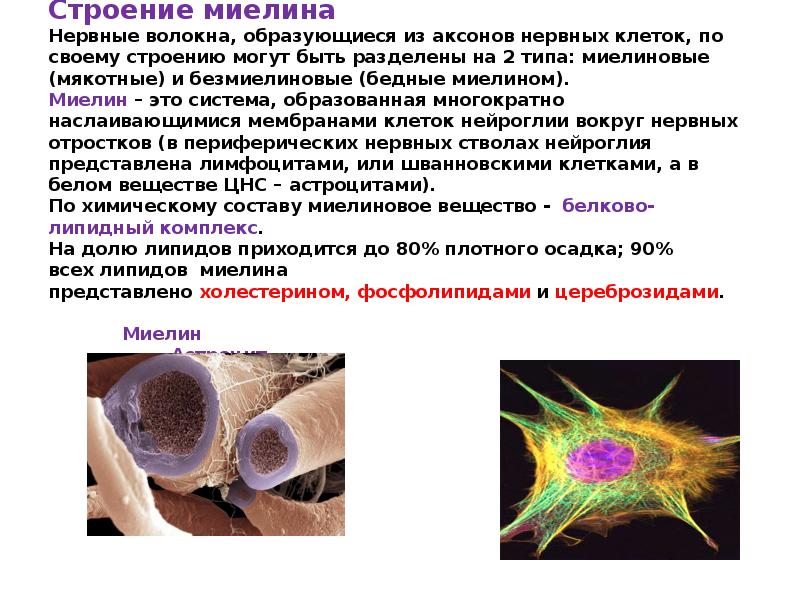 Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
2. Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
3. Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635.
4. Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
5. Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
6. Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
Автор: Александра Коростышевская, Андрей Савелов, Ирина Приходько, Яна Исаева, Василий Ярных.
Ученые создали технологию для определения аутизма на стадии эмбриона
Фото: depositphotos/pressmaster
Российские ученые создали технологию внутриутробного наблюдения за развитием миелина в мозге плода. Это позволяет судить об аномалиях развития мозга на начальных этапах формирования ЦНС. Итоги работы опубликованы в журнале American Journal of Neuroradiology.
Нервные волокна периферической и центральной нервной системы окружены защитной оболочкой из миелина. Из-за ее повреждений нарушается работа нервной системы.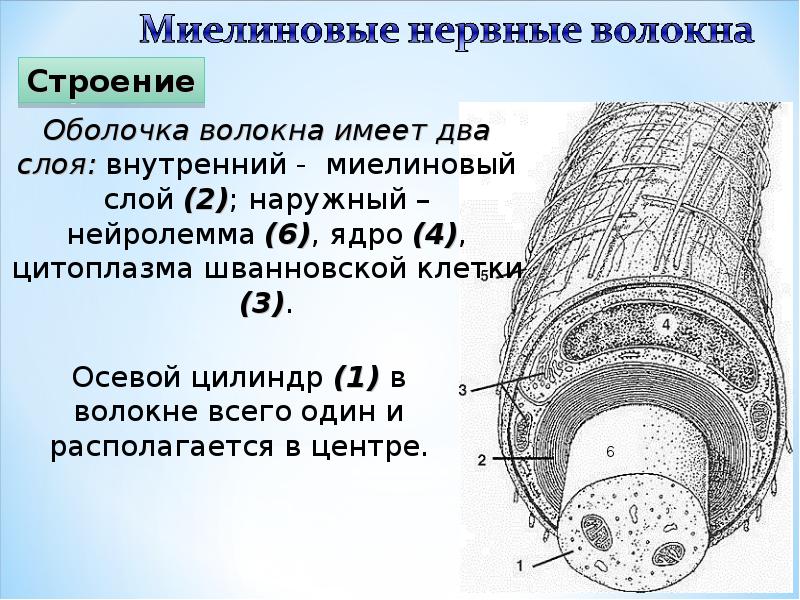
Процесс миелинизации начинается примерно на пятом месяце развития плода и продолжается после рождения. Нарушения этого процесса могут повредить миелиновую оболочку нервных волокон. Из-за этого из строя выводится центральная нервная система. Ученые из Томского государственного университета и Института «Международный топографический центр» Сибирского отделения РАН разработали метод количественной оценки процесса миелинизации мозга плода с помощью МРТ.
Авторы исследования предлагают использовать для этих целей новый метод – картирование макромолекулярной протонной фракции (МПФ). При обычной МРТ источником сигнала являются протоны в воде, а метод картирования МПФ измеряет число протонов, входящих в состав клеточных мембран. Новый метод позволяет выделить сигнал протонов, относящихся к миелиновей оболочке.
Участницами исследования стали более сорока беременных женщин на сроке беременности от 18 до 38 недель. Оказалось, что новая технология позволяет выявлять очень малые количества миелина на ранних стадиях его формирования с высоким пространственным разрешением и коротким временем сканирования – менее пяти минут.
Ранее британские ученые разработали анализ крови и мочи на аутизм. Они выявили связь между расстройствами аутистического спектра и повреждением белков в плазме крови из-за окисления и процессов, при которых активные формы кислорода или восстанавливающие углеводы, такие как глюкоза и фруктоза, спонтанно изменяют белки. Сейчас диагностика по крови и моче – самый надежный способ, чтобы обнаружить заболевание.
В прошлом году специалисты выяснили, что дети с аутизмом чаще рождаются у мужчин с высоким интеллектом. Ученые проанализировали медкарты 309 803 детей, отцов которых призвали в армию Швеции из-за высоких баллов в технической части теста на коэффициент интеллекта. У мужчин с IQ от 111 и выше дети с аутизмом рождались на треть чаще, чем у тех, чей IQ достигал около 100.
Продукты компании
Согласие на обработку персональных данных
Настоящим, отправляя данную форму, Вы, в соответствии с требованиями статьи 9 Федерального закона от 27. 07.2006 № 152-ФЗ «О персональных данных», свободно, своей волей и в своем интересе, даете согласие Обществу с ограниченной ответственностью «Юнифарм» (ООО «Юнифарм», ОГРН 1177746443005, ИНН 7725371608, далее также «Оператор»), адрес местонахождения: 115162, Москва, ул. Шаболовка, д. 31, стр.б, 5 подъезд, 3 этаж
07.2006 № 152-ФЗ «О персональных данных», свободно, своей волей и в своем интересе, даете согласие Обществу с ограниченной ответственностью «Юнифарм» (ООО «Юнифарм», ОГРН 1177746443005, ИНН 7725371608, далее также «Оператор»), адрес местонахождения: 115162, Москва, ул. Шаболовка, д. 31, стр.б, 5 подъезд, 3 этаж
на обработку своих персональных данных, а именно: имя, отчество; номер телефона; адрес электронной почты;
в целях:
- получения информации о реализуемой Оператором продукции;
- реагирования на обращения по вопросам качества реализуемой Оператором продукции;
- Вашего участия в проводимых Оператором акциях, опросах, исследованиях.
с использованием средств автоматизации и без использования средств автоматизации, а также смешанную обработку, путем совершения действий (операций) или совокупности действий (операций), предусмотренных п. 3 ст. 3 Федерального закона от 27.07.2006 N 152-ФЗ «О персональных данных», включая: сбор, запись, систематизацию, накопление, хранение, уточнение (обновление, изменение), извлечение, использование, обезличивание, передача, блокирование, удаление, уничтожение персональных данных, на условиях, предусмотренных в настоящем Согласии.
Настоящее согласие действует до достижения целей обработки персональных данных.
Оператор вправе передавать полученные по настоящему Согласию персональные данные следующим третьим лицам, осуществляющим обработку персональных данных по поручению Оператора в указанных в настоящем Согласии целях:
Общество с ограниченной ответственностью «Ит-софт», ИНН 7709383684 , адрес местонахождения: Россия, г. Москва, шоссе Коровинское, вл. 41,
или поручить их обработку иным третьим лицам при условии, что:
- такие передача или поручение разумно необходимы для достижения целей, указанных в настоящем Согласии на обработку персональных данных;
- персональные данные передаются в объеме, минимально необходимом для достижения целей обработки персональных данных такими третьими лицами;
- третьи лица, получающие персональные данные, соответствуют всем требованиям, установленным для обработки персональных данных, в том числе обеспечивают их конфиденциальность и защиту, если иное не предусмотрено федеральным законом.

Настоящее согласие действует до достижения целей обработки персональных данных или до его отзыва.
Настоящее согласие на обработку персональных данных может быть отозвано полностью или частично посредством предоставления Оператору письменного отзыва согласия на обработку персональных данных с личной подписью на бумажном носителе лично или направления по почте заказным письмом с уведомлением о вручении на адрес: 115162, г. Москва, ул. Шаболовка, д. 31, стр. Б, подъезд 5 или по электронной почте:
[email protected] с указанием в теме электронного письма «Отзыв согласия на обработку персональных данных».
Я осознаю, что, нажимая кнопку «Согласен», я подтверждаю что:
- условия данного Согласия мне ясны, и я обладаю достаточной информацией для выражения сознательного согласия с ними;
- предоставленная мной информация является полной, точной и достоверной;
- вся предоставленная информация заполнена мной лично, все действия совершены непосредственно мной;
- при заполнении настоящего Согласия я не использовал(а) чужие контактные данные, включая телефон, адрес электронной почты и т.п.
- ознакомлен(а) с Политикой в отношении обработки и защиты персональных данных, размещенной на сайте Оператора www.unipharm.ru и соглашаюсь с ее условиями,
- даю ООО «Юнифарм» свое согласие на обработку моих персональных данных на условиях, изложенных выше.
Нейроуридин №20 капс.
Компоненты нейроуридин способствуют восстановлению периферических нервных волокон и укреплению нервной системы нейроуридин – специально подобранная комбинация нейротропных веществ: витаминов группы В (В1, В6, В9, В12), нуклеотида (уридинмонофосфат) и холина, необходимых для восстановления нервных волокон, улучшения нервной проводимости, укрепления нервной системы и общего состояния организма.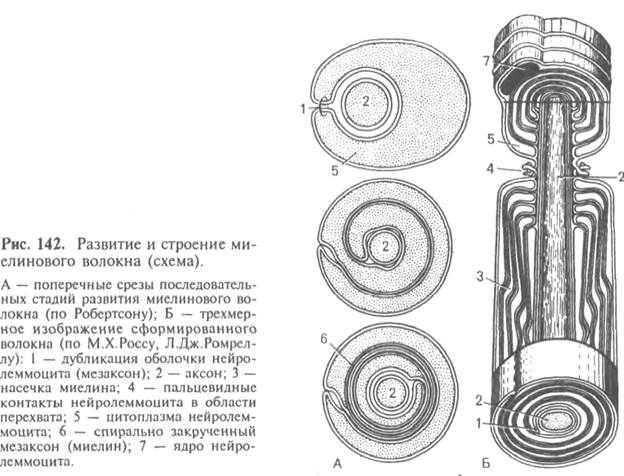
свойства продукта обусловлены свойствами компонентов, входящих в его состав:
Уридинмонофосфат – важнейший нуклеотид, необходимый для поддержания обменных процессов (метаболизма) в нервной ткани и образования миелиновых оболочек нервов. Поддерживает адекватную поставку ферментов в нервные клетки, стимулирует деление клеток, жизнедеятельность и регенерацию периферических нервов. Нервные клетки не имеют собственных энергетических ресурсов для синтеза нуклеотидов, обеспечение нервных клеток уридином осуществляется через ток крови от других клеток, а также с пищей и добавками, содержащими уридин-5-монофосфат. Уридинмонофосфат имеет особое значение для ускорения восстановления поврежденных нервов. При поражениях периферических нервов повышается потребность в пиримидиновых нуклеотидах, таких как уридинмонофосфат. Поэтому его поступление в организм извне имеет важнейшее значение в ходе процессов восстановления и регенерации нервов.
Витамины группы В принимают активное участие в биохимических процессах, обеспечивающих нормальную жизнедеятельность различных структур нервной системы.
Витамин В1 (тиамин) играет фундаментальную роль в выработке энергии в организме, необходим для роста, развития и функционирования клеток. Участвует в построении мембран нервных клеток. Необходим для биосинтеза ацетилхолина, является важнейшим компонентом системы проведения возбуждения в нервных волокнах (за счет активации хлоридных ионных каналов в мембранах нервных клеток). Защищает клетки нервных тканей от токсического воздействия продуктов перекисного окисления. Помогает в процессе регенерации нервной ткани.
Витамин В6 (пиридоксин) необходим для нормального функционирования центральной и периферической нервной систем. Участвует в процессах усвоения нервными клетками глюкозы. Необходим для белкового обмена и трансаминирования аминокислот. Участвует в синтезе и метаболизме ряда нейромедиаторов (допамина, норадреналина, адреналина, гистамина и GABA) и обеспечивает нормальную работу нервной системы, улучшает функцию мозга. Ускоряет регенеративные процессы в нервной ткани.
Ускоряет регенеративные процессы в нервной ткани.
Витамин В12 (цианокобаламин) играет важную роль в клеточном метаболизме, нервной функции и продукции ДНК. Витамин B12 необходим для сохранения миелиновой оболочки нейронов и для синтеза нейромедиаторов. Способствует миелинизации нервных волокон, в том числе в пораженных участках нервов. Снижает токсические эффекты глутамата в отношении нервных клеток.
Фолиевая кислота (витамин B9) имеет решающее значение для правильной функции мозга и играет важную роль в психическом и эмоциональном здоровье. Она участвует в производстве ДНК и РНК, генетического материала организма. Фолиевая кислота также участвует в синтезе аминокислот, миелина и необходима для синтеза нейротрансмиттеров допамина, эпинефрина, норадреналина и серотонина. Совместно с витаминами B6 и B12 осуществляет контроль уровня в крови аминокислоты гомоцистеина.
Холин является одним из основных компонентов мембран клеток головного мозга и миелиновых оболочек нервов. Участвует в осуществлении функции возбудимости и передачи нервных импульсов. Улучшает передачу нервно-мышечных сигналов, повышает скорость передачи импульсов по нервным волокнам.
Важная дополнительная информация
Целостность и здоровая функция нервных волокон – основа двигательной активности.
Обычно в медицине нервную систему подразделяют на два вида – центральную и периферическую. Головной и спинной мозг относятся к центральной нервной системе, а все нервы и нервные окончания относятся к периферической нервной системе. При поражении нервов, развивающихся при нарушении в них обменных процессов, что бывает при дефиците витаминов группы В, или в случае их механической травматизации, возможно развитие неприятных и болезненных ощущений. Так, при дегенеративных процессах в шейном и поясничном отделах позвоночника сдавление или ущемление нервных корешков грыжей межпозвонкового диска или костными выростами может проявляться неприятными ощущениями в области шеи, спины и конечностей.
Организм человека устроен так, что может восстанавливать поврежденные ткани, в том числе, и периферические нервы. Но для их восстановления требуется достаточно много времени. Дополнительное поступление в организм определенных веществ (витаминов группы В, нуклеотидов) может ускорить процесс восстановления и способствует более быстрому исчезновению неприятных ощущений.
Компоненты нейроуридин способствуют:
улучшению восстановительных процессов в поврежденных нервных волокнах
улучшению нервной проводимости
снижению мышечного дискомфорта в шейном, грудном и поясничном отделах позвоночника
повышению двигательной активности
улучшению метаболических процессов в мозговой ткани и периферических нервах
укреплению нервной системы и улучшению общего состояния организма
снижению стрессовых реакций
улучшению когнитивной функции головного мозга (память, внимание)
Область применения: Нейроуридин рекомендуется в качестве биологически активной добавки к пище – дополнительного источника витаминов В1, В6, В12, фолиевой кислоты, холина, содержащей уридинмонофосфат.
Рекомендации по применению: взрослым принимать по 1 капсуле в день, запивая достаточным количеством воды. Продолжительность приема – 2-3 недели. При необходимости прием можно повторить через месяц.
Состав: DL-холина битартрат, уридин-5-монофосфат, желатин, микрокристаллическая целлюлоза (носитель), витамин В6 (пиридоксина гидрохлорид), магниевые соли стеариновой кислоты (антислеживающий агент), витамин В1 (тиамина гидрохлорид), кремния диоксид (антислеживающий агент), титана диоксид (краситель), фолиевая кислота, витамин В12 (цианокобаламин), железа оксид желтый (краситель), железа оксид красный (краситель).
Противопоказания: индивидуальная непереносимость компонентов, беременность, кормление грудью. Перед применением рекомендуется проконсультироваться с врачом.
Срок годности: 3 года
Условия хранения: хранить в недоступном для детей месте, при температуре от 15 ºС до 25 ºС и при относительной влажности не более 75 %.
Условия реализации: через аптечную сеть и специализированные магазины, отделы торговой сети.
Форма выпуска: капсулы массой 547 мг по 10 капсул в блистере, по 1, 2, 4, 6 или 8 блистеров в пачку картонную; по 30, 60, 90, 120 капсул во флаконе, по 1 флакону в пачку картонную.
Биологически активная добавка к пище.
Не является лекарственным средством.
Свидетельство о государственной регистрации №: RU.77.99.11.003.E.005816.12.18
Дата выдачи: 25.12.2018 г.
Создан метод измерения миелина в мозге плода в утробе матери
Процесс миелинизации начинается приблизительно на пятом месяце развития плода и интенсивно продолжается после рождения, когда человек учится держать голову, ходить, говорить, мыслить и так далее. Нарушение этого процесса, а также некоторые заболевания (например, рассеянный склероз) могут повредить миелиновую оболочку нервных волокон и таким образом вывести из строя центральную нервную систему. Ученые из Томского государственного университета и Института «Международный топографический центр» Сибирского отделения РАН разработали метод количественной оценки процесса миелинизации мозга плода в клинических условиях с помощью магнитнорезонансной томографии (МРТ).
«Нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также являются возможным механизмом формирования ряда неврологических и психиатрических заболеваний. Наше исследование открывает возможность неинвазивного изучения формирования миелина в мозге плода на самой ранней стадии и последующего применения полученных знаний в клинической диагностике и фундаментальных нейронауках», — рассказал Василий Ярных, руководитель проекта, профессор Томского государственного университета и университета Вашингтона (США).
Современные методы МРТ позволяют на качественном уровне оценить выраженные нарушения миелинизации, но не дают возможности измерить точное количество миелина в нервной ткани. Более ранние технологии МРТ также недостаточно чувствительны к малым количествам миелина, которые присутствуют в мозге плода или новорожденного ребенка. Авторы исследования предлагают использовать для этих целей новый метод – картирование макромолекулярной протонной фракции (МПФ). При обычной МРТ источником сигнала становятся протоны, содержащиеся в воде, тогда как метод картирования МПФ измеряет количество протонов, входящих в состав клеточных мембран. Благодаря специальному алгоритму математической обработки изображений и протоколу сбора данных, новый метод позволяет выделить сигнал протонов, относящихся к миелиновей оболочке. В предыдущих исследованиях ученые доказали эффективность этого метода для количественной оценки миелинизации, а в новой работе продемонстрировали применение картирования МПФ для визуализации тонких различий в миелинизации анатомических структур мозга плода.
Авторы исследования предлагают использовать для этих целей новый метод – картирование макромолекулярной протонной фракции (МПФ). При обычной МРТ источником сигнала становятся протоны, содержащиеся в воде, тогда как метод картирования МПФ измеряет количество протонов, входящих в состав клеточных мембран. Благодаря специальному алгоритму математической обработки изображений и протоколу сбора данных, новый метод позволяет выделить сигнал протонов, относящихся к миелиновей оболочке. В предыдущих исследованиях ученые доказали эффективность этого метода для количественной оценки миелинизации, а в новой работе продемонстрировали применение картирования МПФ для визуализации тонких различий в миелинизации анатомических структур мозга плода.
Миелинизированное нервное волокно — обзор
Миелинизированное (сердцевинное) нервное волокно
Миелинизация афферентных зрительных путей начинается на латеральном коленчатом теле на 5-м месяце беременности и заканчивается на решетчатой пластинке примерно в срок. 168 Олигодендроциты, ответственные за миелинизацию ЦНС, обычно не присутствуют в сетчатке глаза человека. 168 Гистологические исследования подтвердили наличие предполагаемых олигодендроцитов и миелина в областях миелинизированных нервных волокон и их отсутствие в других областях. 169 Миелинизированные нервные волокна сетчатки обнаруживаются примерно в 1% вскрытых глаз и у 0,3–0,6% обычных офтальмологических пациентов. 168
Миелинизированные нервные волокна обычно выглядят как белые полосатые пятна на верхнем и нижнем полюсах диска (рис. 51.25). Они могут имитировать отек диска зрительного нерва, как за счет приподнимания пораженных участков диска, так и за счет затемнения края диска и находящихся под ним сосудов сетчатки. 168,170 Дистально они имеют неправильный веерообразный вид.Небольшие щели или пятна нормального цвета глазного дна иногда видны в области миелинизации. 168 Миелинизированные нервные волокна в 17–20% случаев двусторонние.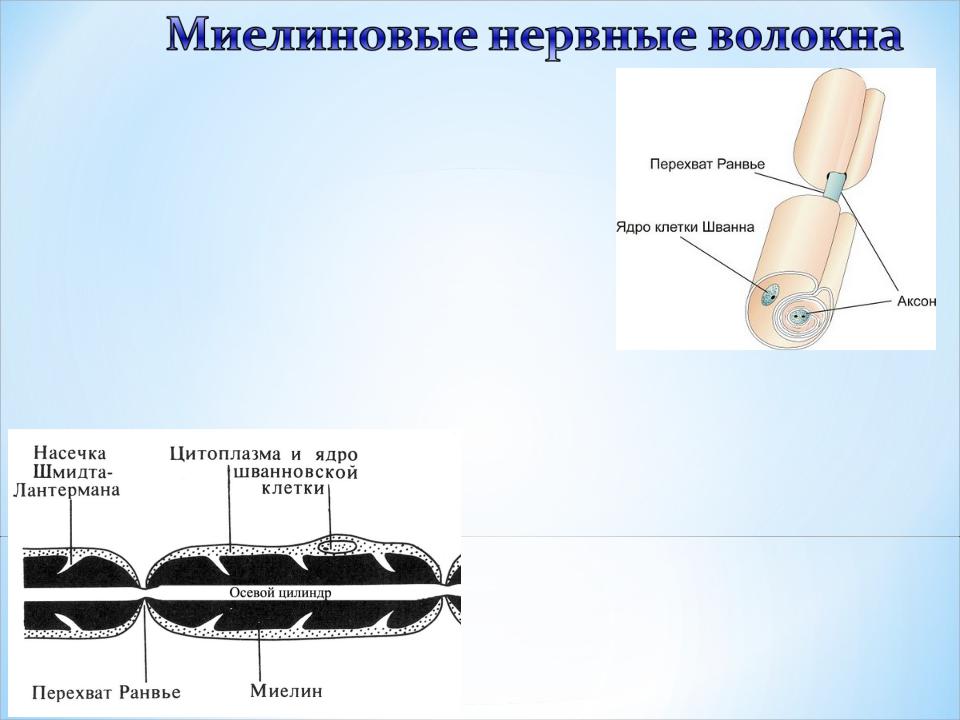 В 19% они прерываются с головкой зрительного нерва. Изолированные участки миелинизированных нервных волокон в периферической сетчатке редко обнаруживаются в носу по отношению к диску зрительного нерва. 170
В 19% они прерываются с головкой зрительного нерва. Изолированные участки миелинизированных нервных волокон в периферической сетчатке редко обнаруживаются в носу по отношению к диску зрительного нерва. 170
Патогенез миелинизированных нервных волокон остается спекулятивным, 170 , но животные с небольшой или отсутствующей решетчатой пластинкой, как правило, имеют глубокие физиологические чашечки и обширную миелинизацию нервных волокон сетчатки, в то время как животные с хорошо развитой решетчатой пластинкой демонстрируют достаточно плоские нервные головки и отсутствие миелинизации сетчатки, что предполагает несколько возможных механизмов: 170
- 1
Дефект в решетчатой пластинке может позволить олигодендроцитам проникать в сетчатку и производить там миелин.
- 2
Аксонов может быть меньше по сравнению с размером склерального канала, что дает достаточно места для прохождения миелинизации в глаз. В глазах с удаленными изолированными периферическими участками миелинизированных нервных волокон аномалия времени или формирования решетчатой пластинки обеспечивает доступ олигодендроцитов к сетчатке, которые мигрируют через слой нервных волокон, пока не обнаруживают область с относительно низкой плотностью слоя нервных волокон. где протекает миелинизация.
- 3
Позднее развитие решетчатой пластинки может позволить олигодендроцитам мигрировать в глаз.
Обширная односторонняя (или редко двусторонняя) миелинизация нервных волокон может быть связана с миопией высокой степени и рефрактерной амблиопией 171 (рис. 51.26). У таких пациентов миелин покрывает большую часть, если не всю окружность диска. Макула (хотя и немиелинизированная) обычно выглядит ненормальной, показывая притупленный рефлекс или дисперсию пигмента. 172 Внешний вид макулы может быть лучшим прямым коррелятом ответа на окклюзионную терапию. 172
Миелинизированные нервные волокна возникают в связи с синдромом Горлина (множественные базально-клеточные невусы), 173 и аутосомно-доминантной витреоретинопатией, характеризующейся врожденным плохим зрением, двусторонней обширной миелинизацией слоя нервных волокон сетчатки, тяжелой дегенерацией стекловидного тела, миопия высокой степени, дистрофия сетчатки с куриной слепотой и деформации конечностей. 174
174
Миелинизированные нервные волокна могут передаваться по аутосомно-доминантному типу. 175 Описаны единичные случаи миелинизированных нервных волокон в связи с аномальной длиной зрительного нерва (оксицефалия), 176 эффекты в lamina cribrosa (наклонный диск), 177 дисгенезия переднего сегмента, 170 и NF -2 (нейрофиброматоз 2). 178 Хотя миелинизированные нервные волокна могут быть связаны с нейрофиброматозом, 178 многие считают это сомнительным. 168
В редких случаях участки миелинизированных нервных волокон могут быть приобретены в младенчестве и даже во взрослом возрасте. 179,180 Травма глаза (удар по глазу у одного пациента и фенестрация оболочки зрительного нерва у другого), по-видимому, является общим знаменателем в этих случаях. Возможно, имеется достаточное повреждение решетчатой пластинки, чтобы олигодендроциты могли проникнуть в сетчатку. 170 Миелинизированные нервные волокна могут исчезнуть в результате повреждения аксонов. 168
Миелинизированный слой нервных волокон сетчатки
Принять участие в конкурсе резидентов и стипендиатов
Принять участие в Международном конкурсе офтальмологов
Хема Л.Рамкумар, доктор медицины, Дженнифер И Лим, доктор медицины, К. Дэвид Эпли, доктор медицины, Кушик Трипати, доктор медицины (AIIMS), FRCS (Глазго), Мэри Элизабет Хартнетт, доктор медицины, Рэйчел Патель, доктор медицины и Теодор Ленг, доктор медицины, магистр медицины
Присвоенный статус Актуально
Мэри Элизабет Хартнетт, доктор медицины, 4 января 2021 года.
Фотография глазного дна девочки 7 лет с миелинизированной СНВС, зрением 20/20 и легкой дальнозоркостью.
Миелинизированные слои нервных волокон сетчатки (MRNF) — это нервные волокна сетчатки, расположенные перед решетчатой пластинкой сетчатки, которые, в отличие от нормальных нервных волокон сетчатки, имеют миелиновую оболочку. Клинически они представляют собой хорошо разграниченные серо-белые пятна с потрепанными краями на передней поверхности нейросенсорной сетчатки. [1] [2] MNFL присутствует у 0,57–1% населения и может возникать двусторонне примерно у 7% больных. [3] [4] У большинства пациентов с MRNF симптомы отсутствуют; однако у некоторых пациентов наблюдаются сопутствующие офтальмологические изменения, включая осевую миопию, амблиопию и косоглазие. [3] [4] Семейные случаи MRNF, хотя и редкие, описаны как изолированно, так и в сочетании с глазными и системными синдромами. [5] MRNF обычно присутствуют при рождении и представляют собой статические поражения, но было описано несколько случаев приобретенных и прогрессирующих поражений как в детстве, так и во взрослом возрасте. Сообщалось также об исчезновении MRNF после операций и повреждений зрительного нерва.
Клинически они представляют собой хорошо разграниченные серо-белые пятна с потрепанными краями на передней поверхности нейросенсорной сетчатки. [1] [2] MNFL присутствует у 0,57–1% населения и может возникать двусторонне примерно у 7% больных. [3] [4] У большинства пациентов с MRNF симптомы отсутствуют; однако у некоторых пациентов наблюдаются сопутствующие офтальмологические изменения, включая осевую миопию, амблиопию и косоглазие. [3] [4] Семейные случаи MRNF, хотя и редкие, описаны как изолированно, так и в сочетании с глазными и системными синдромами. [5] MRNF обычно присутствуют при рождении и представляют собой статические поражения, но было описано несколько случаев приобретенных и прогрессирующих поражений как в детстве, так и во взрослом возрасте. Сообщалось также об исчезновении MRNF после операций и повреждений зрительного нерва.
Международная классификация болезней
МКБ-9 377.49 Другие поражения зрительного нерва
МКБ-10 h45.89 Дефект, дефект волокон пучка нервов сетчатки
История
Немецкий патолог Рудольф Вирхов был первым, кто описал миелинизированные нервные волокна сетчатки, написав в 1856 году, что «сетчатка была белой, очень толстой и морщинистой.Макула была нормальной и около диска зрительного нерва, хотя и располагалась более глубоко, представляла собой толстые, непрозрачные, мелово-белые пятна, которые распространялись вокруг диска в форме звезды, так что когда я хотел провести линию между диском и макулой с каждой стороны у двух было одинаковое расхождение. В другом глазу я без особого удивления обнаружил в том же месте кольцо вокруг диска шириной 2–2,5 мм, регрессирующее наружу ». [1]
Миелинизация аксонов в центральной нервной системе человека — сложный, упорядоченный процесс, осуществляемый клетками-предшественниками олигодендроцитов, которые мигрируют под влиянием нейрогормональных сигналов с образованием олигодендроцитов, продуцирующих миелин.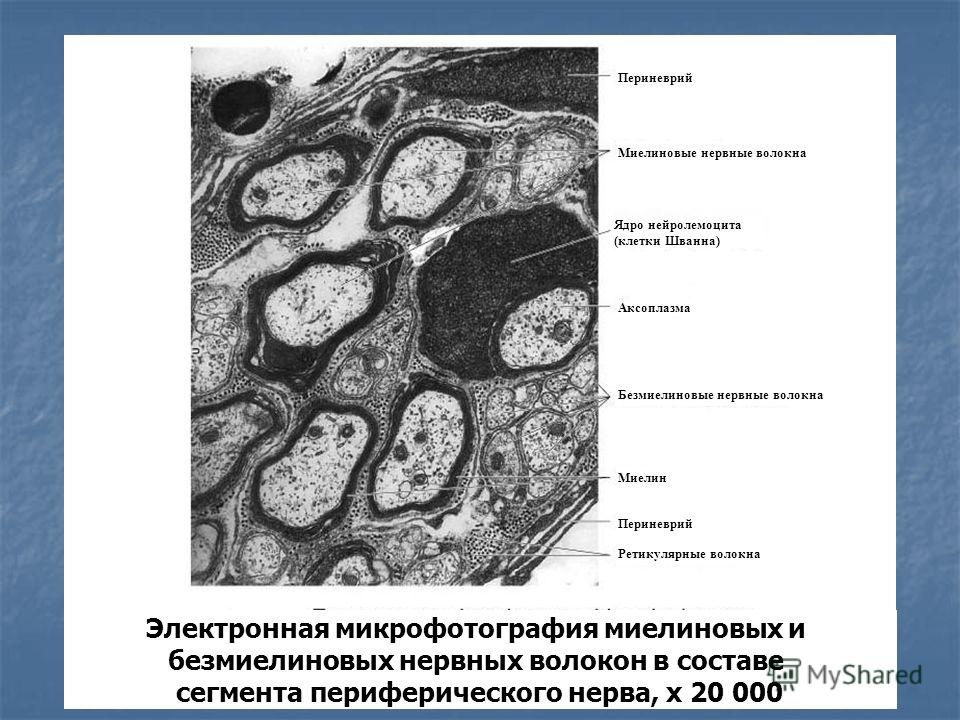 Миелинизация ганглиозных клеток сетчатки происходит от латерального коленчатого ядра кпереди по направлению к глазному яблоку. [6] Миелинизация вдоль зрительного пути впервые наблюдается на восьмом месяце беременности и обычно достигает задней части глазного яблока примерно во время рождения, при этом практически все волокна достигают полной миелинизации к возрасту 7 месяцев. [6] Обычно процесс миелинизации останавливается на этом уровне; Некоторыми постулируемыми объяснениями этого наблюдения являются наличие структуры cribrosa пластинки, утечка белков плазмы из хориоидального кровотока, вызывающая дифференцировку олигодендроцитов, и факторы астроцитов типа 1, блокирующие миграцию олигодендроцитов. [7] [8] Хотя точные причины остаются неизвестными, MRNF возникает, когда процесс миелинизации распространяется за пределы решетчатой пластинки и виден при осмотре глазного дна.
Миелинизация ганглиозных клеток сетчатки происходит от латерального коленчатого ядра кпереди по направлению к глазному яблоку. [6] Миелинизация вдоль зрительного пути впервые наблюдается на восьмом месяце беременности и обычно достигает задней части глазного яблока примерно во время рождения, при этом практически все волокна достигают полной миелинизации к возрасту 7 месяцев. [6] Обычно процесс миелинизации останавливается на этом уровне; Некоторыми постулируемыми объяснениями этого наблюдения являются наличие структуры cribrosa пластинки, утечка белков плазмы из хориоидального кровотока, вызывающая дифференцировку олигодендроцитов, и факторы астроцитов типа 1, блокирующие миграцию олигодендроцитов. [7] [8] Хотя точные причины остаются неизвестными, MRNF возникает, когда процесс миелинизации распространяется за пределы решетчатой пластинки и виден при осмотре глазного дна.
Гистопатологический анализ показывает, что миелинизированные волокна не ограничены участком или пучком, а отдельные миелинизированные волокна могут быть обнаружены между пучками немиелинизированных волокон. [7] Было показано, что как миелинизированные, так и немиелинизированные волокна в области MRNF имеют больший диаметр, чем волокна в нормальной сетчатке.Кроме того, примечательно, что уменьшенная популяция ганглиозных клеток сетчатки присутствует в MRNF наряду с уменьшенной шириной нижележащих внутреннего и внешнего плексиформных слоев сетчатки. [7] Относительно мало клеточных ядер и нет микроскопических доказательств воспаления в области MRNF. Хотя некоторые MRNF могут выглядеть макроскопически смежными с диском зрительного нерва, одно гистологическое исследование показало, что область миелинизации не прилегает к области зрительного нерва. [7] Не было описано аномалий решетчатой пластинки на глазах с MRNF.
Генетический контроль миелинизации зрелых ганглиозных клеток сетчатки в значительной степени неизвестен и является активной областью исследований. [9] [10]
[9] [10]
Сообщалось о семейных случаях изолированного MRNF, в том числе в семье с двумя поколениями из 10 случаев и у матери и дочери с двусторонним MRNF. [5] [11]
Также описаны семейные случаи, связанные с другими расстройствами.Аутосомно-рецессивный синдром, состоящий из задержки роста, алопеции, псевдоанодонтии и атрофии зрительного нерва (синдром ГАПО), также может включать MRNF, гипертелоризм и глаукому. [12] Также был описан наследственный синдром витреоретинальной дегенерации, задней субкапсулярной катаракты, скелетных аномалий и MRNF. [13]
Клиническая презентация
Большинство случаев MRNF диагностируется случайно у бессимптомных здоровых людей с помощью офтальмоскопии.Внешний вид обычно представляет собой отчетливое перипапиллярное белое полосатое пятно с зазубренными краями размером примерно один диаметр диска или больше (Рисунок 1).
Рисунок 1. Многоцветное изображение миелинизации ЛВСЯ .
Характеристики офтальмологической визуализации
На инфракрасных изображениях и изображениях без красного цвета MRNF выглядит белым, что, вероятно, связано с высоким содержанием липидов в миелине. [14] Миелин блокирует обнаружение нижележащего флуоресцентного материала, поэтому он выглядит темным на аутофлуоресценции глазного дна.На оптической когерентной томографии (ОКТ) MRNF выглядит как утолщенный и гиперотражающий слой нервных волокон сетчатки (RNFL) (, рис. 2, ).
Рис. 2. ОКТ, на котором красные стрелки указывают гиперрефлективный вид миелинизированного слоя нервных волокон сетчатки.
MRNF часто изолированы, но могут быть связаны с ипсилатеральной миопией, амблиопией, косоглазием и другими глазными заболеваниями (Таблица 1). В одном обзоре косоглазие было обнаружено у 66% пациентов с MRNF. [15] Острота зрения обычно не снижается; однако, если присутствует достаточное количество миелинизированных волокон, может развиться относительная скотома, соответствующая локализации MRNF.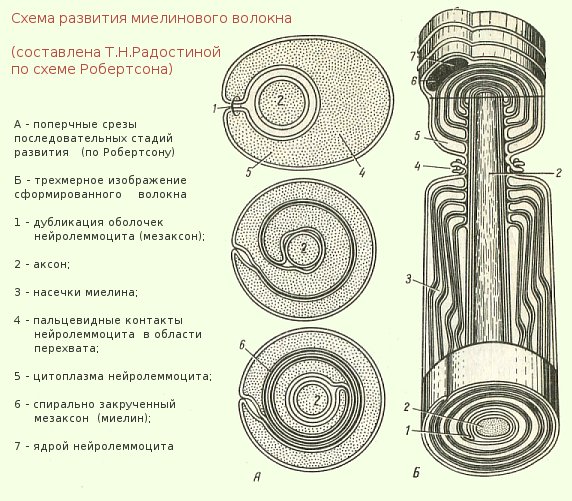 Эти скотомы обычно меньше, чем можно было бы предположить по размеру пластыря MRNF. [4] [16] Острота зрения и прогноз зависят от тяжести глазных осложнений или связанных синдромов.
Эти скотомы обычно меньше, чем можно было бы предположить по размеру пластыря MRNF. [4] [16] Острота зрения и прогноз зависят от тяжести глазных осложнений или связанных синдромов.
Глазные ассоциации с миелинизацией СНВС
| Передний сегмент: |
|---|
|
| Рефракционная и сенсомоторная: |
|
| Связанный зрительный нерв: |
|
| Увеал и сетчатка: |
|
Системные ассоциации с миелинизацией RNFL
Системные синдромы, которые были связаны с MRNF, включают синдром Тернера, [35] эпилепсию, [19] трисомию 21 и краниосиностоз.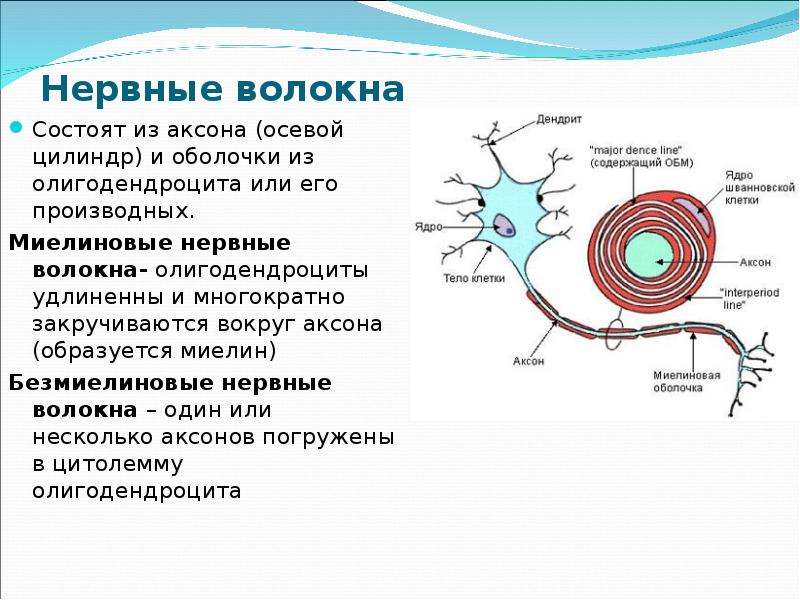 [4]
[4]
Заболевания, связанные с приобретенной и прогрессирующей миелинизацией RNFL
Имеется несколько сообщений о случаях приобретенной и прогрессирующей миелинизации в детском, подростковом и взрослом возрасте. [25] Эти случаи связаны с тупой травмой, фенестрацией оболочки зрительного нерва, друзами зрительного нерва, семейным анамнезом гипоплазии зрительного нерва у здорового ребенка, мальформацией Арнольда-Киари, связанной с гидроцефалией, нейрофиброматозом I типа и Горлина-Гольца ( базально-клеточный невус) синдром. [23] [25] [35] [36] [37] [38] [39]
Состояния, связанные с потерей миелинизации RNFL
Сообщалось также об исчезновении MRNFL, связанном с несколькими неврологическими, воспалительными заболеваниями и заболеваниями сетчатки. Предполагается, что исчезновение MRNF сигнализирует о патологической дегенерации аксонов нервов сетчатки. Связи с неврологическими заболеваниями включают аденому гипофиза, неврит зрительного нерва, острую оптическую невропатию и первичную открытоугольную глаукому. [40] [41] [42] [43] [44] Описана очевидная демиелинизация MRNF у пациента с болезнью Бехчета после повторных эпизодов папиллита и витрита, а также MRNF у пациента, перенесшего лучевую терапию бляшками по поводу меланомы хориоидеи. [45] [46] Кроме того, с исчезновением MRNFL были связаны такие состояния сетчатки, как окклюзия ветви сетчатки, окклюзия центральной артерии сетчатки, диабетическая ретинопатия и витрэктомия pars plana для эпиретинальной мембраны. [47] [48] [49] [50]
MRNF обычно доброкачественны, но их можно принять за другие потенциально серьезные состояния. При рассмотрении неопластического инфильтрата может быть полезен общий анализ крови. Гиперрефлективность на ОКТ может имитировать результаты окклюзии сосудов сетчатки или пятна ваты, поэтому офтальмоскопия и флюоресцентная ангиография могут помочь в распознавании явления эмболии. У маленьких детей обширный MRFL может быть ошибочно принят за ретинобластому, которую следует отличать с помощью тщательной офтальмоскопии (часто под анестезией) и возможных дополнительных изображений, таких как ультразвуковое исследование глаз.При наличии грубых дефектов зрения необходимо формальное тестирование поля зрения, чтобы исключить сопутствующую нейроофтальмологическую проблему, поскольку дефекты зрения в MRNF обычно легкие.
У маленьких детей обширный MRFL может быть ошибочно принят за ретинобластому, которую следует отличать с помощью тщательной офтальмоскопии (часто под анестезией) и возможных дополнительных изображений, таких как ультразвуковое исследование глаз.При наличии грубых дефектов зрения необходимо формальное тестирование поля зрения, чтобы исключить сопутствующую нейроофтальмологическую проблему, поскольку дефекты зрения в MRNF обычно легкие.
Управление MRNF сосредоточено на серийных обследованиях глаз для оценки и лечения сопутствующих состояний. Близорукость следует лечить с помощью коррекции рефракции. При наличии значительной анизометропии коррекция очками может быть непереносимой на фоне анизейконии, и следует назначать контактные линзы.Детскую амблиопию необходимо лечить, чтобы оптимизировать зрительное развитие. [3] [48] Косоглазие следует лечить с помощью обычных протоколов, и пациенты часто хорошо поддаются хирургической коррекции. [51]
Важно осознавать в целом доброкачественный характер MRNF, чтобы избежать излишнего медицинского обследования. Полезно задокументировать MRNF с помощью визуализации, поскольку определенные условия могут быть связаны с потерей миелинизации, как описано выше.
- ↑ 1.0 1,1 Вирхов VR. Zur patologischen anatomic der netzaut und des scherven. Вирхов Арка Патол Анат. 1856; 10: 170–193.
- ↑ Gradle HS. Мертвая зона: III. Связь слепого пятна с медуллированными нервными волокнами сетчатки. Журнал Американской медицинской ассоциации. 1921; 77 (19): 1483–147.
- ↑ 3,0 3,1 3,2 Кодама Т., Хаясака С., Сетогава Т. Миелинизированные нервные волокна сетчатки: распространенность, расположение и влияние на остроту зрения.Ophthalmologica. Журнал международная офтальмология. Международный журнал офтальмологии. Zeitschrift für Augenheilkunde. 1990. 200 (2): 77–83. Доступно по адресу: http://www.ncbi.nlm.
 nih.gov/pubmed/2338989. Доступ 20 июля 2013 г.
nih.gov/pubmed/2338989. Доступ 20 июля 2013 г. - ↑ 4,0 4,1 4,2 4,3 4,4 Straatsma BR, Foos RY, Heckenlively JR, Taylor GN. Миелинизированные нервные волокна сетчатки. Американский журнал офтальмологии. 1981. 91 (1): 25–38. Доступно по адресу: http: //www.ncbi.nlm.nih.gov/pubmed/7234927. Доступ 20 июля 2013 г.
- ↑ 5.0 5.1 Funnell CL, George NDL, Pai V. Семейные миелинизированные нервные волокна сетчатки. Глаз (Лондон, Англия). 2003. 17 (1): 96–7. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12579180. Доступ 20 июля 2013 г.
- ↑ 6.0 6.1 Magoon EH, Робб Р.М. Развитие миелина в зрительном нерве и тракте человека: световое и электронное микроскопическое исследование. Архив офтальмологии. 1981. 99 (4): 655–659.Доступно по адресу: http://archopht.jamanetwork.com/article.aspx?articleid=633760. Проверено 22 июля 2013 г.
- ↑ 7,0 7,1 7,2 7,3 ФитцГиббон Т., Несторовски З. Морфологические последствия миелинизации сетчатки глаза человека. Экспериментальное глазное исследование. 1997. 65 (6): 809–19. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/9441705. Доступ 20 июля 2013 г.
- ↑ Perry VH, Lund RD. Доказательства того, что решетчатая пластинка предотвращает интраретинальную миелинизацию аксонов ганглиозных клеток сетчатки.Журнал нейроцитологии. 1990. 19 (2): 265–72. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2358833. Проверено 22 июля 2013 г.
- ↑ Wegner M. Вопрос идентичности: контроль транскрипции в олигодендроцитах. Журнал молекулярной нейробиологии: МН. 2008; 35 (1): 3–12. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/18401762. По состоянию на 28 мая 2013 г.
- ↑ Howng SYB, Авила Р.Л., Эмери Б. и др. ZFP191 необходим олигодендроцитам для миелинизации ЦНС. Гены и развитие. 2010. 24 (3): 301–11.Доступно по адресу: http://genesdev.cshlp.org/content/24/3/301.long. По состоянию на 22 мая 2013 г.
- ↑ Франсуа Ж. Миелинизированные нервные волокна. В кн .: Наследственность в офтальмологии. Сент-Луис, Миссури: Мосби; 1961: 494–496.
- ↑ Бозкурт Б., Йилдирим М.С., Окка М., Битирген Г. Синдром ГАПО: четыре новых пациента с врожденной глаукомой и миелинизированным слоем нервных волокон сетчатки. Американский журнал медицинской генетики. Часть A. 2013; 161 (4): 829–34. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23494824. Доступ 20 июля 2013 г.
- ↑ Traboulsi EI, Lim JI, Pyeritz R, Goldberg HK, Haller JA. Новый синдром миелинизированных нервных волокон, витреоретинопатия и пороки развития скелета. Архив офтальмологии. 1993. 111 (11): 1543–5. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/8240111. Доступ 20 июля 2013 г.
- ↑ Shelton JB, Digre KB, Gilman J, Warner JEA, Katz BJ. Характеристики миелинизированного слоя нервных волокон сетчатки при офтальмологической визуализации: результаты автофлуоресценции, флуоресцентной ангиографии, инфракрасной, оптической когерентной томографии и бескрасных изображений.Офтальмология JAMA. 2013. 131 (1): 107–9. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23307221. Доступ 30 июня 2013 г.
- ↑ Tarabishy AB, Alexandrou TJ, Traboulsi EI. Синдром миелинизированных нервных волокон сетчатки, миопия и амблиопия: обзор. Обзор офтальмологии. 52 (6): 588–96. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/18029268. По состоянию на 18 июня 2013 г.
- ↑ 16,0 16,1 Миллер Н.Р. Клиническая нейроофтальмология. 4-е изд. (Wilkins W and, ed.). Балтимор; 1982: 367–9.
- ↑ Williams TD. Медуллированные нервные волокна сетчатки: предположения об их причинах и клинических проявлениях. Американский журнал оптометрии и физиологической оптики. 1986. 63 (2): 142–51. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/3953757. Проверено 22 июля 2013 г.
- ↑ Герцог-старший С. Врожденные уродства. В: Duke-Elder S, ed. Сент-Луис: Мосби, резюме; 1963: 646–651.
- ↑ 19,0 19,1 19,2 Kiso K. Beitrage zur Kenntis von der Vererbung der markhaltigen Sehnervenfasern der netzhaut.Graefes Arch Clin Exp Ophthalmol. 1928; 120: 154–174.
- ↑ 20.0 20.1 20.2 Straatsma BR, Heckenlively JR, Foos RY, Shahinian JK. Миелинизированные нервные волокна сетчатки, связанные с ипсилатеральной миопией, амблиопией и косоглазием. Американский журнал офтальмологии. 1979; 88 (3 Pt 1): 506–10. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/484678. Доступ 21 июля 2013 г.
- ↑ Шмидт Д., Мейер Дж., Брэнди-Дорн Дж. Широко распространенные миелинизированные нервные волокна диска зрительного нерва: влияют ли они на развитие миопии? Международная офтальмология.20 (5): 263–8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/
97. Доступ 21 июля 2013 г.
- ↑ Merritt JC. Миелинизированные нервные волокна, связанные с дефектом афферентного зрачка и амблиопией. Журнал детской офтальмологии. 14 (3): 139–40. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/
- ↑ 23,0 23,1 Али Б.Х., Логани С., Козлов К.Л., Арнольд А.С., Бейтман Б. Прогрессирование миелинизации нервных волокон сетчатки в детстве.Американский журнал офтальмологии. 1994; 118: 515–517.
- ↑ Gharai S, Prakash G, Kumar D, Jacob S, Agarwal A, Arora V. Спектральные оптические когерентные томографические характеристики односторонних перипапиллярных миелинизированных нервных волокон сетчатки с вовлечением макулы. Журнал AAPOS. 2010. 14 (5): 432–434.
- ↑ 25,0 25,1 25,2 Жан-Луи Дж., Кац Б.Дж., Дигре КБ, Уорнер Дж. Э., Крегер Д.Д. Приобретенная и прогрессирующая миелинизация слоя нервных волокон сетчатки у подростка.Американский журнал офтальмологии. 2000. 130 (3): 361–2. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/11020421. Доступ 20 июля 2013 г.
- ↑ Эйде Н. Разрыв сетчатки в области с мозговыми волокнами. Acta ophthalmologica. 1986. 64 (3): 271–3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/3751515. Доступ 21 июля 2013 г.
- ↑ Хаббард Г.Б., Томас М.А., Гроссниклаус Х.Э. Синдром витреомакулярной тракции с сильно миелинизированными нервными волокнами. Архив офтальмологии. 2002. 120 (5): 670–1.Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12003629 Проверено 21 июля 2013 г.
- ↑ Карадимас П, Капетаниос А, Панайотидху Э, Бузас Э. Эпиретинальная мембрана, образованная миелинизированными нервными волокнами сетчатки и сосудистыми аномалиями. Сетчатка (Филадельфия, Пенсильвания). 2003. 23 (6): 880–1. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/14707848. Доступ 21 июля 2013 г.
- ↑ 29,0 29,1 Берлинер М.Л. Медуллированные нервные волокна, связанные с хориоидитом: отчет о случае с предварительными исследованиями причин появления мозговых нервных волокон в сетчатке.Архив офтальмологии. 1931; 6 (3): 404–413. Доступно по адресу: http://archopht.jamanetwork.com/article.aspx?articleid=609280. Проверено 23 июля 2013 г.
- ↑ Джексон Э. Увеит с непрозрачными волокнами зрительного нерва. Являюсь. J. Ophthal. 1918; 1 (448).
- ↑ 31,0 31,1 Розен Б., Барри С., Констебль И.Дж. Развитие миелинизированных нервных волокон сетчатки. Американский журнал офтальмологии. 1999. 127 (4): 471–473. Доступно по адресу: http://dx.doi.org/10.1016/S0002-9394(98)00377-8. Проверено 24 июля 2013 г.
- ↑ Mehta JS, Raman J, Gupta N, Sinha A. Сосудистые аномалии сетчатки в приобретенных миелинизированных нервных волокнах. Acta ophthalmologica Scandinavica. 2003. 81 (3): 311–2. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12780415. Доступ 21 июля 2013 г.
- ↑ 33,0 33,1 Leys AM, Leys MJ, Hooymans JM, et al. Миелинизированные нервные волокна и сосудистые аномалии сетчатки. Сетчатка (Филадельфия, Пенсильвания). 1996. 16 (2): 89–96. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/8724950.Доступ 20 июля 2013 г.
- ↑ 34,0 34,1 Сильвестри Г., Сехми К., Гамильтон П. Патологии сосудов сетчатки. Редкое осложнение миелинизированных нервных волокон? Сетчатка (Филадельфия, Пенсильвания). 1996. 16 (3): 214–8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/8789859. Доступ 21 июля 2013 г.
- ↑ 35,0 35,1 Ааби А.А., Кушнер Б.Дж. Приобретенные и прогрессирующие миелинизированные нервные волокна. Архив офтальмологии. 1985. 103: 542–544.
- ↑ Парулекар М. В., Эльстон Дж. С..Приобретенная миелинизация сетчатки при нейрофиброматозе 1. Архив офтальмологии. 2002. 120 (5): 659–5. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12003622. Доступ 21 июля 2013 г.
- ↑ Baarsma GS. Приобретенные мозговидные нервные волокна. Британский офтальмологический журнал. 1980; 64 (9): 651. Доступно по адресу: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1043786&tool=pmcentrez&rendertype=abstract. Доступ 21 июля 2013 г.
- ↑ Kushner BJ. Декомпрессия зрительного нерва.Arch Ophthalmol. 1979; 97: 1459–1461.
- ↑ De Jong PT, Bistervels B, Cosgrove J, de Grip G, Leys A, Goffin M. Медуллированные нервные волокна. Признак синдрома множественных базальноклеточных невусов (Горлина). Архив офтальмологии. 1985. 103 (12): 1833–6. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/4074174. Доступ 21 июля 2013 г.
- ↑ A. S. Schwund Markhaltiger Nervenfasern in der Netzhaut bei intzundlicher Atrophie des Sehnervern in Folges eines Tumor oerebri. Z. Augenheilkd. 1905; 13: 739–50.
- ↑ Гупта А., Кхандалавала Б., Бансал РК, Джайн И.С., Гревал СП. Атрофия миелинизированных нервных волокон при аденоме гипофиза. Журнал клинической нейроофтальмологии. 1990. 10 (2): 100–2. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2141848. Доступ 21 июля 2013 г.
- ↑ Sharpe JA, Sanders MD. Атрофия миелинизированных нервных волокон сетчатки при неврите зрительного нерва. Британский офтальмологический журнал. 1975. 59 (4): 229–32. Доступно по адресу: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1042599&tool=pmcentrez&rendertype=abstract.Доступ 20 июля 2013 г.
- ↑ Schachat AP, Miller NR. Атрофия миелинизированных нервных волокон сетчатки после острой нейропатии зрительного нерва. Американский журнал офтальмологии. 1981. 92 (6): 854–6. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/7315937. Доступ 20 июля 2013 г.
- ↑ Katz SE, Weber PA. Фотодокументация потери мозговых нервных волокон сетчатки при неконтролируемой первичной открытоугольной глаукоме. Журнал глаукомы. 1996. 5 (6): 406–409. Доступно по адресу: http: // www.ncbi.nlm.nih.gov/pubmed/8946297. Проверено 22 июля 2013 г.
- ↑ Чавис П.С., Таббара К.Ф. Демиелинизация миелинизированных нервных волокон сетчатки при болезни Бехчета. Documenta ophthalmologica. Успехи офтальмологии. 1998. 95 (2): 157–64. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/10431799. Доступ 21 июля 2013 г.
- ↑ Машаехи А., Шилдс К.Л., Шилдс Дж.А. Исчезновение миелинизированных нервных волокон сетчатки после лучевой терапии хориоидальной меланомы. Retina (Филадельфия, Пенсильвания.). 2003. 23 (4): 572–3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12972781. Доступ 20 июля 2013 г.
- ↑ Teich SA. Исчезновение миелинизированных нервных волокон сетчатки после окклюзии ветви артерии сетчатки. Американский журнал офтальмологии. 1987. 103 (6): 835–7. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/35. Доступ 20 июля 2013 г.
- ↑ 48,0 48,1 R. B. Schwund markhaltiger Nervenfasern in der Netzhaut nach Embolie der Art. Централизованные сетчатки.Альбрехт фон Грейфес Арка. Офтальмол. 1922; 107 (10).
- ↑ Gentile RC, Torqueti-Costa L, Bertolucci A. Потеря миелинизированных нервных волокон сетчатки при диабетической ретинопатии. Британский офтальмологический журнал. 2002; 86 (12): 1447. Доступно по адресу: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1771408&tool=pmcentrez&rendertype=abstract. Доступ 20 июля 2013 г.
- ↑ Williams AJ, Fekrat S. Исчезновение миелинизированных нервных волокон сетчатки после витрэктомии pars plana.Американский журнал офтальмологии. 2006. 142 (3): 521–3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/16935613. Доступ 20 июля 2013 г.
- ↑ Rootman DB, Gonzalez E, Mallipatna A, et al. Переносная оптическая когерентная томография спектральной области высокого разрешения при ретинобластоме: клинические и морфологические соображения. Британский офтальмологический журнал. 2013. 97 (1): 59–65. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23104902. Проверено 24 июля 2013 г.
1. По состоянию на 27 июля 2013 г.
Авторы благодарят Пенни Коппернолл-Блах и сотрудников библиотеки UCSD за их помощь в проведении обзора литературы, необходимой для этой статьи.Особая благодарность Джулио Бартеселли и Габриэлю Балеа за офтальмологические фотографии, представленные здесь. Мы благодарим Кристофера Ругабера, OD, Факультет оптометрии, Университет Рангсит, Патум Тани, Таиланд, за его ценные предложения по улучшению этой вики-страницы.
Слой миелинизированных нервных волокон сетчатки
Принять участие в конкурсе резидентов и стипендиатов
Принять участие в Международном конкурсе офтальмологов
Хема Л. Рамкумар, доктор медицины, Дженнифер И Лим, доктор медицины, К.Дэвид Эпли, доктор медицины, Кушик Трипати, доктор медицины (AIIMS), FRCS (Глазго), Мэри Элизабет Хартнетт, доктор медицины, Рэйчел Патель, доктор медицины и Теодор Ленг, доктор медицины, магистр медицины
Присвоенный статус Актуально
Мэри Элизабет Хартнетт, доктор медицины, 4 января 2021 года.
Фотография глазного дна девочки 7 лет с миелинизированной СНВС, зрением 20/20 и легкой дальнозоркостью.
Миелинизированные слои нервных волокон сетчатки (MRNF) — это нервные волокна сетчатки, расположенные перед решетчатой пластинкой сетчатки, которые, в отличие от нормальных нервных волокон сетчатки, имеют миелиновую оболочку.Клинически они представляют собой хорошо разграниченные серо-белые пятна с потрепанными краями на передней поверхности нейросенсорной сетчатки. [1] [2] MNFL присутствует у 0,57–1% населения и может возникать двусторонне примерно у 7% больных. [3] [4] У большинства пациентов с MRNF симптомы отсутствуют; однако у некоторых пациентов наблюдаются сопутствующие офтальмологические изменения, включая осевую миопию, амблиопию и косоглазие. [3] [4] Семейные случаи MRNF, хотя и редкие, описаны как изолированно, так и в сочетании с глазными и системными синдромами. [5] MRNF обычно присутствуют при рождении и представляют собой статические поражения, но было описано несколько случаев приобретенных и прогрессирующих поражений как в детстве, так и во взрослом возрасте. Сообщалось также об исчезновении MRNF после операций и повреждений зрительного нерва.
Международная классификация болезней
МКБ-9 377.49 Другие поражения зрительного нерва
МКБ-10 h45.89 Дефект, дефект волокон пучка нервов сетчатки
История
Немецкий патолог Рудольф Вирхов был первым, кто описал миелинизированные нервные волокна сетчатки, написав в 1856 году, что «сетчатка была белой, очень толстой и морщинистой.Макула была нормальной и около диска зрительного нерва, хотя и располагалась более глубоко, представляла собой толстые, непрозрачные, мелово-белые пятна, которые распространялись вокруг диска в форме звезды, так что когда я хотел провести линию между диском и макулой с каждой стороны у двух было одинаковое расхождение. В другом глазу я без особого удивления обнаружил в том же месте кольцо вокруг диска шириной 2–2,5 мм, регрессирующее наружу ». [1]
Миелинизация аксонов в центральной нервной системе человека — сложный, упорядоченный процесс, осуществляемый клетками-предшественниками олигодендроцитов, которые мигрируют под влиянием нейрогормональных сигналов с образованием олигодендроцитов, продуцирующих миелин.Миелинизация ганглиозных клеток сетчатки происходит от латерального коленчатого ядра кпереди по направлению к глазному яблоку. [6] Миелинизация вдоль зрительного пути впервые наблюдается на восьмом месяце беременности и обычно достигает задней части глазного яблока примерно во время рождения, при этом практически все волокна достигают полной миелинизации к возрасту 7 месяцев. [6] Обычно процесс миелинизации останавливается на этом уровне; Некоторыми постулируемыми объяснениями этого наблюдения являются наличие структуры cribrosa пластинки, утечка белков плазмы из хориоидального кровотока, вызывающая дифференцировку олигодендроцитов, и факторы астроцитов типа 1, блокирующие миграцию олигодендроцитов. [7] [8] Хотя точные причины остаются неизвестными, MRNF возникает, когда процесс миелинизации распространяется за пределы решетчатой пластинки и виден при осмотре глазного дна.
Гистопатологический анализ показывает, что миелинизированные волокна не ограничены участком или пучком, а отдельные миелинизированные волокна могут быть обнаружены между пучками немиелинизированных волокон. [7] Было показано, что как миелинизированные, так и немиелинизированные волокна в области MRNF имеют больший диаметр, чем волокна в нормальной сетчатке.Кроме того, примечательно, что уменьшенная популяция ганглиозных клеток сетчатки присутствует в MRNF наряду с уменьшенной шириной нижележащих внутреннего и внешнего плексиформных слоев сетчатки. [7] Относительно мало клеточных ядер и нет микроскопических доказательств воспаления в области MRNF. Хотя некоторые MRNF могут выглядеть макроскопически смежными с диском зрительного нерва, одно гистологическое исследование показало, что область миелинизации не прилегает к области зрительного нерва. [7] Не было описано аномалий решетчатой пластинки на глазах с MRNF.
Генетический контроль миелинизации зрелых ганглиозных клеток сетчатки в значительной степени неизвестен и является активной областью исследований. [9] [10]
Сообщалось о семейных случаях изолированного MRNF, в том числе в семье с двумя поколениями из 10 случаев и у матери и дочери с двусторонним MRNF. [5] [11]
Также описаны семейные случаи, связанные с другими расстройствами.Аутосомно-рецессивный синдром, состоящий из задержки роста, алопеции, псевдоанодонтии и атрофии зрительного нерва (синдром ГАПО), также может включать MRNF, гипертелоризм и глаукому. [12] Также был описан наследственный синдром витреоретинальной дегенерации, задней субкапсулярной катаракты, скелетных аномалий и MRNF. [13]
Клиническая презентация
Большинство случаев MRNF диагностируется случайно у бессимптомных здоровых людей с помощью офтальмоскопии.Внешний вид обычно представляет собой отчетливое перипапиллярное белое полосатое пятно с зазубренными краями размером примерно один диаметр диска или больше (Рисунок 1).
Рисунок 1. Многоцветное изображение миелинизации ЛВСЯ .
Характеристики офтальмологической визуализации
На инфракрасных изображениях и изображениях без красного цвета MRNF выглядит белым, что, вероятно, связано с высоким содержанием липидов в миелине. [14] Миелин блокирует обнаружение нижележащего флуоресцентного материала, поэтому он выглядит темным на аутофлуоресценции глазного дна.На оптической когерентной томографии (ОКТ) MRNF выглядит как утолщенный и гиперотражающий слой нервных волокон сетчатки (RNFL) (, рис. 2, ).
Рис. 2. ОКТ, на котором красные стрелки указывают гиперрефлективный вид миелинизированного слоя нервных волокон сетчатки.
MRNF часто изолированы, но могут быть связаны с ипсилатеральной миопией, амблиопией, косоглазием и другими глазными заболеваниями (Таблица 1). В одном обзоре косоглазие было обнаружено у 66% пациентов с MRNF. [15] Острота зрения обычно не снижается; однако, если присутствует достаточное количество миелинизированных волокон, может развиться относительная скотома, соответствующая локализации MRNF. Эти скотомы обычно меньше, чем можно было бы предположить по размеру пластыря MRNF. [4] [16] Острота зрения и прогноз зависят от тяжести глазных осложнений или связанных синдромов.
Глазные ассоциации с миелинизацией СНВС
| Передний сегмент: |
|---|
|
| Рефракционная и сенсомоторная: |
|
| Связанный зрительный нерв: |
|
| Увеал и сетчатка: |
|
Системные ассоциации с миелинизацией RNFL
Системные синдромы, которые были связаны с MRNF, включают синдром Тернера, [35] эпилепсию, [19] трисомию 21 и краниосиностоз. [4]
Заболевания, связанные с приобретенной и прогрессирующей миелинизацией RNFL
Имеется несколько сообщений о случаях приобретенной и прогрессирующей миелинизации в детском, подростковом и взрослом возрасте. [25] Эти случаи связаны с тупой травмой, фенестрацией оболочки зрительного нерва, друзами зрительного нерва, семейным анамнезом гипоплазии зрительного нерва у здорового ребенка, мальформацией Арнольда-Киари, связанной с гидроцефалией, нейрофиброматозом I типа и Горлина-Гольца ( базально-клеточный невус) синдром. [23] [25] [35] [36] [37] [38] [39]
Состояния, связанные с потерей миелинизации RNFL
Сообщалось также об исчезновении MRNFL, связанном с несколькими неврологическими, воспалительными заболеваниями и заболеваниями сетчатки. Предполагается, что исчезновение MRNF сигнализирует о патологической дегенерации аксонов нервов сетчатки. Связи с неврологическими заболеваниями включают аденому гипофиза, неврит зрительного нерва, острую оптическую невропатию и первичную открытоугольную глаукому. [40] [41] [42] [43] [44] Описана очевидная демиелинизация MRNF у пациента с болезнью Бехчета после повторных эпизодов папиллита и витрита, а также MRNF у пациента, перенесшего лучевую терапию бляшками по поводу меланомы хориоидеи. [45] [46] Кроме того, с исчезновением MRNFL были связаны такие состояния сетчатки, как окклюзия ветви сетчатки, окклюзия центральной артерии сетчатки, диабетическая ретинопатия и витрэктомия pars plana для эпиретинальной мембраны. [47] [48] [49] [50]
MRNF обычно доброкачественны, но их можно принять за другие потенциально серьезные состояния. При рассмотрении неопластического инфильтрата может быть полезен общий анализ крови. Гиперрефлективность на ОКТ может имитировать результаты окклюзии сосудов сетчатки или пятна ваты, поэтому офтальмоскопия и флюоресцентная ангиография могут помочь в распознавании явления эмболии. У маленьких детей обширный MRFL может быть ошибочно принят за ретинобластому, которую следует отличать с помощью тщательной офтальмоскопии (часто под анестезией) и возможных дополнительных изображений, таких как ультразвуковое исследование глаз.При наличии грубых дефектов зрения необходимо формальное тестирование поля зрения, чтобы исключить сопутствующую нейроофтальмологическую проблему, поскольку дефекты зрения в MRNF обычно легкие.
Управление MRNF сосредоточено на серийных обследованиях глаз для оценки и лечения сопутствующих состояний. Близорукость следует лечить с помощью коррекции рефракции. При наличии значительной анизометропии коррекция очками может быть непереносимой на фоне анизейконии, и следует назначать контактные линзы.Детскую амблиопию необходимо лечить, чтобы оптимизировать зрительное развитие. [3] [48] Косоглазие следует лечить с помощью обычных протоколов, и пациенты часто хорошо поддаются хирургической коррекции. [51]
Важно осознавать в целом доброкачественный характер MRNF, чтобы избежать излишнего медицинского обследования. Полезно задокументировать MRNF с помощью визуализации, поскольку определенные условия могут быть связаны с потерей миелинизации, как описано выше.
- ↑ 1.0 1,1 Вирхов VR. Zur patologischen anatomic der netzaut und des scherven. Вирхов Арка Патол Анат. 1856; 10: 170–193.
- ↑ Gradle HS. Мертвая зона: III. Связь слепого пятна с медуллированными нервными волокнами сетчатки. Журнал Американской медицинской ассоциации. 1921; 77 (19): 1483–147.
- ↑ 3,0 3,1 3,2 Кодама Т., Хаясака С., Сетогава Т. Миелинизированные нервные волокна сетчатки: распространенность, расположение и влияние на остроту зрения.Ophthalmologica. Журнал международная офтальмология. Международный журнал офтальмологии. Zeitschrift für Augenheilkunde. 1990. 200 (2): 77–83. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2338989. Доступ 20 июля 2013 г.
- ↑ 4,0 4,1 4,2 4,3 4,4 Straatsma BR, Foos RY, Heckenlively JR, Taylor GN. Миелинизированные нервные волокна сетчатки. Американский журнал офтальмологии. 1981. 91 (1): 25–38. Доступно по адресу: http: //www.ncbi.nlm.nih.gov/pubmed/7234927. Доступ 20 июля 2013 г.
- ↑ 5.0 5.1 Funnell CL, George NDL, Pai V. Семейные миелинизированные нервные волокна сетчатки. Глаз (Лондон, Англия). 2003. 17 (1): 96–7. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12579180. Доступ 20 июля 2013 г.
- ↑ 6.0 6.1 Magoon EH, Робб Р.М. Развитие миелина в зрительном нерве и тракте человека: световое и электронное микроскопическое исследование. Архив офтальмологии. 1981. 99 (4): 655–659.Доступно по адресу: http://archopht.jamanetwork.com/article.aspx?articleid=633760. Проверено 22 июля 2013 г.
- ↑ 7,0 7,1 7,2 7,3 ФитцГиббон Т., Несторовски З. Морфологические последствия миелинизации сетчатки глаза человека. Экспериментальное глазное исследование. 1997. 65 (6): 809–19. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/9441705. Доступ 20 июля 2013 г.
- ↑ Perry VH, Lund RD. Доказательства того, что решетчатая пластинка предотвращает интраретинальную миелинизацию аксонов ганглиозных клеток сетчатки.Журнал нейроцитологии. 1990. 19 (2): 265–72. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2358833. Проверено 22 июля 2013 г.
- ↑ Wegner M. Вопрос идентичности: контроль транскрипции в олигодендроцитах. Журнал молекулярной нейробиологии: МН. 2008; 35 (1): 3–12. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/18401762. По состоянию на 28 мая 2013 г.
- ↑ Howng SYB, Авила Р.Л., Эмери Б. и др. ZFP191 необходим олигодендроцитам для миелинизации ЦНС. Гены и развитие. 2010. 24 (3): 301–11.Доступно по адресу: http://genesdev.cshlp.org/content/24/3/301.long. По состоянию на 22 мая 2013 г.
- ↑ Франсуа Ж. Миелинизированные нервные волокна. В кн .: Наследственность в офтальмологии. Сент-Луис, Миссури: Мосби; 1961: 494–496.
- ↑ Бозкурт Б., Йилдирим М.С., Окка М., Битирген Г. Синдром ГАПО: четыре новых пациента с врожденной глаукомой и миелинизированным слоем нервных волокон сетчатки. Американский журнал медицинской генетики. Часть A. 2013; 161 (4): 829–34. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23494824. Доступ 20 июля 2013 г.
- ↑ Traboulsi EI, Lim JI, Pyeritz R, Goldberg HK, Haller JA. Новый синдром миелинизированных нервных волокон, витреоретинопатия и пороки развития скелета. Архив офтальмологии. 1993. 111 (11): 1543–5. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/8240111. Доступ 20 июля 2013 г.
- ↑ Shelton JB, Digre KB, Gilman J, Warner JEA, Katz BJ. Характеристики миелинизированного слоя нервных волокон сетчатки при офтальмологической визуализации: результаты автофлуоресценции, флуоресцентной ангиографии, инфракрасной, оптической когерентной томографии и бескрасных изображений.Офтальмология JAMA. 2013. 131 (1): 107–9. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23307221. Доступ 30 июня 2013 г.
- ↑ Tarabishy AB, Alexandrou TJ, Traboulsi EI. Синдром миелинизированных нервных волокон сетчатки, миопия и амблиопия: обзор. Обзор офтальмологии. 52 (6): 588–96. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/18029268. По состоянию на 18 июня 2013 г.
- ↑ 16,0 16,1 Миллер Н.Р. Клиническая нейроофтальмология. 4-е изд. (Wilkins W and, ed.). Балтимор; 1982: 367–9.
- ↑ Williams TD. Медуллированные нервные волокна сетчатки: предположения об их причинах и клинических проявлениях. Американский журнал оптометрии и физиологической оптики. 1986. 63 (2): 142–51. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/3953757. Проверено 22 июля 2013 г.
- ↑ Герцог-старший С. Врожденные уродства. В: Duke-Elder S, ed. Сент-Луис: Мосби, резюме; 1963: 646–651.
- ↑ 19,0 19,1 19,2 Kiso K. Beitrage zur Kenntis von der Vererbung der markhaltigen Sehnervenfasern der netzhaut.Graefes Arch Clin Exp Ophthalmol. 1928; 120: 154–174.
- ↑ 20.0 20.1 20.2 Straatsma BR, Heckenlively JR, Foos RY, Shahinian JK. Миелинизированные нервные волокна сетчатки, связанные с ипсилатеральной миопией, амблиопией и косоглазием. Американский журнал офтальмологии. 1979; 88 (3 Pt 1): 506–10. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/484678. Доступ 21 июля 2013 г.
- ↑ Шмидт Д., Мейер Дж., Брэнди-Дорн Дж. Широко распространенные миелинизированные нервные волокна диска зрительного нерва: влияют ли они на развитие миопии? Международная офтальмология.20 (5): 263–8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/
97. Доступ 21 июля 2013 г.
- ↑ Merritt JC. Миелинизированные нервные волокна, связанные с дефектом афферентного зрачка и амблиопией. Журнал детской офтальмологии. 14 (3): 139–40. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/
- ↑ 23,0 23,1 Али Б.Х., Логани С., Козлов К.Л., Арнольд А.С., Бейтман Б. Прогрессирование миелинизации нервных волокон сетчатки в детстве.Американский журнал офтальмологии. 1994; 118: 515–517.
- ↑ Gharai S, Prakash G, Kumar D, Jacob S, Agarwal A, Arora V. Спектральные оптические когерентные томографические характеристики односторонних перипапиллярных миелинизированных нервных волокон сетчатки с вовлечением макулы. Журнал AAPOS. 2010. 14 (5): 432–434.
- ↑ 25,0 25,1 25,2 Жан-Луи Дж., Кац Б.Дж., Дигре КБ, Уорнер Дж. Э., Крегер Д.Д. Приобретенная и прогрессирующая миелинизация слоя нервных волокон сетчатки у подростка.Американский журнал офтальмологии. 2000. 130 (3): 361–2. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/11020421. Доступ 20 июля 2013 г.
- ↑ Эйде Н. Разрыв сетчатки в области с мозговыми волокнами. Acta ophthalmologica. 1986. 64 (3): 271–3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/3751515. Доступ 21 июля 2013 г.
- ↑ Хаббард Г.Б., Томас М.А., Гроссниклаус Х.Э. Синдром витреомакулярной тракции с сильно миелинизированными нервными волокнами. Архив офтальмологии. 2002. 120 (5): 670–1.Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12003629 Проверено 21 июля 2013 г.
- ↑ Карадимас П, Капетаниос А, Панайотидху Э, Бузас Э. Эпиретинальная мембрана, образованная миелинизированными нервными волокнами сетчатки и сосудистыми аномалиями. Сетчатка (Филадельфия, Пенсильвания). 2003. 23 (6): 880–1. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/14707848. Доступ 21 июля 2013 г.
- ↑ 29,0 29,1 Берлинер М.Л. Медуллированные нервные волокна, связанные с хориоидитом: отчет о случае с предварительными исследованиями причин появления мозговых нервных волокон в сетчатке.Архив офтальмологии. 1931; 6 (3): 404–413. Доступно по адресу: http://archopht.jamanetwork.com/article.aspx?articleid=609280. Проверено 23 июля 2013 г.
- ↑ Джексон Э. Увеит с непрозрачными волокнами зрительного нерва. Являюсь. J. Ophthal. 1918; 1 (448).
- ↑ 31,0 31,1 Розен Б., Барри С., Констебль И.Дж. Развитие миелинизированных нервных волокон сетчатки. Американский журнал офтальмологии. 1999. 127 (4): 471–473. Доступно по адресу: http://dx.doi.org/10.1016/S0002-9394(98)00377-8. Проверено 24 июля 2013 г.
- ↑ Mehta JS, Raman J, Gupta N, Sinha A. Сосудистые аномалии сетчатки в приобретенных миелинизированных нервных волокнах. Acta ophthalmologica Scandinavica. 2003. 81 (3): 311–2. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12780415. Доступ 21 июля 2013 г.
- ↑ 33,0 33,1 Leys AM, Leys MJ, Hooymans JM, et al. Миелинизированные нервные волокна и сосудистые аномалии сетчатки. Сетчатка (Филадельфия, Пенсильвания). 1996. 16 (2): 89–96. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/8724950.Доступ 20 июля 2013 г.
- ↑ 34,0 34,1 Сильвестри Г., Сехми К., Гамильтон П. Патологии сосудов сетчатки. Редкое осложнение миелинизированных нервных волокон? Сетчатка (Филадельфия, Пенсильвания). 1996. 16 (3): 214–8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/8789859. Доступ 21 июля 2013 г.
- ↑ 35,0 35,1 Ааби А.А., Кушнер Б.Дж. Приобретенные и прогрессирующие миелинизированные нервные волокна. Архив офтальмологии. 1985. 103: 542–544.
- ↑ Парулекар М. В., Эльстон Дж. С..Приобретенная миелинизация сетчатки при нейрофиброматозе 1. Архив офтальмологии. 2002. 120 (5): 659–5. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12003622. Доступ 21 июля 2013 г.
- ↑ Baarsma GS. Приобретенные мозговидные нервные волокна. Британский офтальмологический журнал. 1980; 64 (9): 651. Доступно по адресу: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1043786&tool=pmcentrez&rendertype=abstract. Доступ 21 июля 2013 г.
- ↑ Kushner BJ. Декомпрессия зрительного нерва.Arch Ophthalmol. 1979; 97: 1459–1461.
- ↑ De Jong PT, Bistervels B, Cosgrove J, de Grip G, Leys A, Goffin M. Медуллированные нервные волокна. Признак синдрома множественных базальноклеточных невусов (Горлина). Архив офтальмологии. 1985. 103 (12): 1833–6. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/4074174. Доступ 21 июля 2013 г.
- ↑ A. S. Schwund Markhaltiger Nervenfasern in der Netzhaut bei intzundlicher Atrophie des Sehnervern in Folges eines Tumor oerebri. Z. Augenheilkd. 1905; 13: 739–50.
- ↑ Гупта А., Кхандалавала Б., Бансал РК, Джайн И.С., Гревал СП. Атрофия миелинизированных нервных волокон при аденоме гипофиза. Журнал клинической нейроофтальмологии. 1990. 10 (2): 100–2. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2141848. Доступ 21 июля 2013 г.
- ↑ Sharpe JA, Sanders MD. Атрофия миелинизированных нервных волокон сетчатки при неврите зрительного нерва. Британский офтальмологический журнал. 1975. 59 (4): 229–32. Доступно по адресу: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1042599&tool=pmcentrez&rendertype=abstract.Доступ 20 июля 2013 г.
- ↑ Schachat AP, Miller NR. Атрофия миелинизированных нервных волокон сетчатки после острой нейропатии зрительного нерва. Американский журнал офтальмологии. 1981. 92 (6): 854–6. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/7315937. Доступ 20 июля 2013 г.
- ↑ Katz SE, Weber PA. Фотодокументация потери мозговых нервных волокон сетчатки при неконтролируемой первичной открытоугольной глаукоме. Журнал глаукомы. 1996. 5 (6): 406–409. Доступно по адресу: http: // www.ncbi.nlm.nih.gov/pubmed/8946297. Проверено 22 июля 2013 г.
- ↑ Чавис П.С., Таббара К.Ф. Демиелинизация миелинизированных нервных волокон сетчатки при болезни Бехчета. Documenta ophthalmologica. Успехи офтальмологии. 1998. 95 (2): 157–64. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/10431799. Доступ 21 июля 2013 г.
- ↑ Машаехи А., Шилдс К.Л., Шилдс Дж.А. Исчезновение миелинизированных нервных волокон сетчатки после лучевой терапии хориоидальной меланомы. Retina (Филадельфия, Пенсильвания.). 2003. 23 (4): 572–3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12972781. Доступ 20 июля 2013 г.
- ↑ Teich SA. Исчезновение миелинизированных нервных волокон сетчатки после окклюзии ветви артерии сетчатки. Американский журнал офтальмологии. 1987. 103 (6): 835–7. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/35. Доступ 20 июля 2013 г.
- ↑ 48,0 48,1 R. B. Schwund markhaltiger Nervenfasern in der Netzhaut nach Embolie der Art. Централизованные сетчатки.Альбрехт фон Грейфес Арка. Офтальмол. 1922; 107 (10).
- ↑ Gentile RC, Torqueti-Costa L, Bertolucci A. Потеря миелинизированных нервных волокон сетчатки при диабетической ретинопатии. Британский офтальмологический журнал. 2002; 86 (12): 1447. Доступно по адресу: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1771408&tool=pmcentrez&rendertype=abstract. Доступ 20 июля 2013 г.
- ↑ Williams AJ, Fekrat S. Исчезновение миелинизированных нервных волокон сетчатки после витрэктомии pars plana.Американский журнал офтальмологии. 2006. 142 (3): 521–3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/16935613. Доступ 20 июля 2013 г.
- ↑ Rootman DB, Gonzalez E, Mallipatna A, et al. Переносная оптическая когерентная томография спектральной области высокого разрешения при ретинобластоме: клинические и морфологические соображения. Британский офтальмологический журнал. 2013. 97 (1): 59–65. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23104902. Проверено 24 июля 2013 г.
1. По состоянию на 27 июля 2013 г.
Авторы благодарят Пенни Коппернолл-Блах и сотрудников библиотеки UCSD за их помощь в проведении обзора литературы, необходимой для этой статьи.Особая благодарность Джулио Бартеселли и Габриэлю Балеа за офтальмологические фотографии, представленные здесь. Мы благодарим Кристофера Ругабера, OD, Факультет оптометрии, Университет Рангсит, Патум Тани, Таиланд, за его ценные предложения по улучшению этой вики-страницы.
Слой миелинизированных нервных волокон сетчатки
Принять участие в конкурсе резидентов и стипендиатов
Принять участие в Международном конкурсе офтальмологов
Хема Л. Рамкумар, доктор медицины, Дженнифер И Лим, доктор медицины, К.Дэвид Эпли, доктор медицины, Кушик Трипати, доктор медицины (AIIMS), FRCS (Глазго), Мэри Элизабет Хартнетт, доктор медицины, Рэйчел Патель, доктор медицины и Теодор Ленг, доктор медицины, магистр медицины
Присвоенный статус Актуально
Мэри Элизабет Хартнетт, доктор медицины, 4 января 2021 года.
Фотография глазного дна девочки 7 лет с миелинизированной СНВС, зрением 20/20 и легкой дальнозоркостью.
Миелинизированные слои нервных волокон сетчатки (MRNF) — это нервные волокна сетчатки, расположенные перед решетчатой пластинкой сетчатки, которые, в отличие от нормальных нервных волокон сетчатки, имеют миелиновую оболочку.Клинически они представляют собой хорошо разграниченные серо-белые пятна с потрепанными краями на передней поверхности нейросенсорной сетчатки. [1] [2] MNFL присутствует у 0,57–1% населения и может возникать двусторонне примерно у 7% больных. [3] [4] У большинства пациентов с MRNF симптомы отсутствуют; однако у некоторых пациентов наблюдаются сопутствующие офтальмологические изменения, включая осевую миопию, амблиопию и косоглазие. [3] [4] Семейные случаи MRNF, хотя и редкие, описаны как изолированно, так и в сочетании с глазными и системными синдромами. [5] MRNF обычно присутствуют при рождении и представляют собой статические поражения, но было описано несколько случаев приобретенных и прогрессирующих поражений как в детстве, так и во взрослом возрасте. Сообщалось также об исчезновении MRNF после операций и повреждений зрительного нерва.
Международная классификация болезней
МКБ-9 377.49 Другие поражения зрительного нерва
МКБ-10 h45.89 Дефект, дефект волокон пучка нервов сетчатки
История
Немецкий патолог Рудольф Вирхов был первым, кто описал миелинизированные нервные волокна сетчатки, написав в 1856 году, что «сетчатка была белой, очень толстой и морщинистой.Макула была нормальной и около диска зрительного нерва, хотя и располагалась более глубоко, представляла собой толстые, непрозрачные, мелово-белые пятна, которые распространялись вокруг диска в форме звезды, так что когда я хотел провести линию между диском и макулой с каждой стороны у двух было одинаковое расхождение. В другом глазу я без особого удивления обнаружил в том же месте кольцо вокруг диска шириной 2–2,5 мм, регрессирующее наружу ». [1]
Миелинизация аксонов в центральной нервной системе человека — сложный, упорядоченный процесс, осуществляемый клетками-предшественниками олигодендроцитов, которые мигрируют под влиянием нейрогормональных сигналов с образованием олигодендроцитов, продуцирующих миелин.Миелинизация ганглиозных клеток сетчатки происходит от латерального коленчатого ядра кпереди по направлению к глазному яблоку. [6] Миелинизация вдоль зрительного пути впервые наблюдается на восьмом месяце беременности и обычно достигает задней части глазного яблока примерно во время рождения, при этом практически все волокна достигают полной миелинизации к возрасту 7 месяцев. [6] Обычно процесс миелинизации останавливается на этом уровне; Некоторыми постулируемыми объяснениями этого наблюдения являются наличие структуры cribrosa пластинки, утечка белков плазмы из хориоидального кровотока, вызывающая дифференцировку олигодендроцитов, и факторы астроцитов типа 1, блокирующие миграцию олигодендроцитов. [7] [8] Хотя точные причины остаются неизвестными, MRNF возникает, когда процесс миелинизации распространяется за пределы решетчатой пластинки и виден при осмотре глазного дна.
Гистопатологический анализ показывает, что миелинизированные волокна не ограничены участком или пучком, а отдельные миелинизированные волокна могут быть обнаружены между пучками немиелинизированных волокон. [7] Было показано, что как миелинизированные, так и немиелинизированные волокна в области MRNF имеют больший диаметр, чем волокна в нормальной сетчатке.Кроме того, примечательно, что уменьшенная популяция ганглиозных клеток сетчатки присутствует в MRNF наряду с уменьшенной шириной нижележащих внутреннего и внешнего плексиформных слоев сетчатки. [7] Относительно мало клеточных ядер и нет микроскопических доказательств воспаления в области MRNF. Хотя некоторые MRNF могут выглядеть макроскопически смежными с диском зрительного нерва, одно гистологическое исследование показало, что область миелинизации не прилегает к области зрительного нерва. [7] Не было описано аномалий решетчатой пластинки на глазах с MRNF.
Генетический контроль миелинизации зрелых ганглиозных клеток сетчатки в значительной степени неизвестен и является активной областью исследований. [9] [10]
Сообщалось о семейных случаях изолированного MRNF, в том числе в семье с двумя поколениями из 10 случаев и у матери и дочери с двусторонним MRNF. [5] [11]
Также описаны семейные случаи, связанные с другими расстройствами.Аутосомно-рецессивный синдром, состоящий из задержки роста, алопеции, псевдоанодонтии и атрофии зрительного нерва (синдром ГАПО), также может включать MRNF, гипертелоризм и глаукому. [12] Также был описан наследственный синдром витреоретинальной дегенерации, задней субкапсулярной катаракты, скелетных аномалий и MRNF. [13]
Клиническая презентация
Большинство случаев MRNF диагностируется случайно у бессимптомных здоровых людей с помощью офтальмоскопии.Внешний вид обычно представляет собой отчетливое перипапиллярное белое полосатое пятно с зазубренными краями размером примерно один диаметр диска или больше (Рисунок 1).
Рисунок 1. Многоцветное изображение миелинизации ЛВСЯ .
Характеристики офтальмологической визуализации
На инфракрасных изображениях и изображениях без красного цвета MRNF выглядит белым, что, вероятно, связано с высоким содержанием липидов в миелине. [14] Миелин блокирует обнаружение нижележащего флуоресцентного материала, поэтому он выглядит темным на аутофлуоресценции глазного дна.На оптической когерентной томографии (ОКТ) MRNF выглядит как утолщенный и гиперотражающий слой нервных волокон сетчатки (RNFL) (, рис. 2, ).
Рис. 2. ОКТ, на котором красные стрелки указывают гиперрефлективный вид миелинизированного слоя нервных волокон сетчатки.
MRNF часто изолированы, но могут быть связаны с ипсилатеральной миопией, амблиопией, косоглазием и другими глазными заболеваниями (Таблица 1). В одном обзоре косоглазие было обнаружено у 66% пациентов с MRNF. [15] Острота зрения обычно не снижается; однако, если присутствует достаточное количество миелинизированных волокон, может развиться относительная скотома, соответствующая локализации MRNF. Эти скотомы обычно меньше, чем можно было бы предположить по размеру пластыря MRNF. [4] [16] Острота зрения и прогноз зависят от тяжести глазных осложнений или связанных синдромов.
Глазные ассоциации с миелинизацией СНВС
| Передний сегмент: |
|---|
|
| Рефракционная и сенсомоторная: |
|
| Связанный зрительный нерв: |
|
| Увеал и сетчатка: |
|
Системные ассоциации с миелинизацией RNFL
Системные синдромы, которые были связаны с MRNF, включают синдром Тернера, [35] эпилепсию, [19] трисомию 21 и краниосиностоз. [4]
Заболевания, связанные с приобретенной и прогрессирующей миелинизацией RNFL
Имеется несколько сообщений о случаях приобретенной и прогрессирующей миелинизации в детском, подростковом и взрослом возрасте. [25] Эти случаи связаны с тупой травмой, фенестрацией оболочки зрительного нерва, друзами зрительного нерва, семейным анамнезом гипоплазии зрительного нерва у здорового ребенка, мальформацией Арнольда-Киари, связанной с гидроцефалией, нейрофиброматозом I типа и Горлина-Гольца ( базально-клеточный невус) синдром. [23] [25] [35] [36] [37] [38] [39]
Состояния, связанные с потерей миелинизации RNFL
Сообщалось также об исчезновении MRNFL, связанном с несколькими неврологическими, воспалительными заболеваниями и заболеваниями сетчатки. Предполагается, что исчезновение MRNF сигнализирует о патологической дегенерации аксонов нервов сетчатки. Связи с неврологическими заболеваниями включают аденому гипофиза, неврит зрительного нерва, острую оптическую невропатию и первичную открытоугольную глаукому. [40] [41] [42] [43] [44] Описана очевидная демиелинизация MRNF у пациента с болезнью Бехчета после повторных эпизодов папиллита и витрита, а также MRNF у пациента, перенесшего лучевую терапию бляшками по поводу меланомы хориоидеи. [45] [46] Кроме того, с исчезновением MRNFL были связаны такие состояния сетчатки, как окклюзия ветви сетчатки, окклюзия центральной артерии сетчатки, диабетическая ретинопатия и витрэктомия pars plana для эпиретинальной мембраны. [47] [48] [49] [50]
MRNF обычно доброкачественны, но их можно принять за другие потенциально серьезные состояния. При рассмотрении неопластического инфильтрата может быть полезен общий анализ крови. Гиперрефлективность на ОКТ может имитировать результаты окклюзии сосудов сетчатки или пятна ваты, поэтому офтальмоскопия и флюоресцентная ангиография могут помочь в распознавании явления эмболии. У маленьких детей обширный MRFL может быть ошибочно принят за ретинобластому, которую следует отличать с помощью тщательной офтальмоскопии (часто под анестезией) и возможных дополнительных изображений, таких как ультразвуковое исследование глаз.При наличии грубых дефектов зрения необходимо формальное тестирование поля зрения, чтобы исключить сопутствующую нейроофтальмологическую проблему, поскольку дефекты зрения в MRNF обычно легкие.
Управление MRNF сосредоточено на серийных обследованиях глаз для оценки и лечения сопутствующих состояний. Близорукость следует лечить с помощью коррекции рефракции. При наличии значительной анизометропии коррекция очками может быть непереносимой на фоне анизейконии, и следует назначать контактные линзы.Детскую амблиопию необходимо лечить, чтобы оптимизировать зрительное развитие. [3] [48] Косоглазие следует лечить с помощью обычных протоколов, и пациенты часто хорошо поддаются хирургической коррекции. [51]
Важно осознавать в целом доброкачественный характер MRNF, чтобы избежать излишнего медицинского обследования. Полезно задокументировать MRNF с помощью визуализации, поскольку определенные условия могут быть связаны с потерей миелинизации, как описано выше.
- ↑ 1.0 1,1 Вирхов VR. Zur patologischen anatomic der netzaut und des scherven. Вирхов Арка Патол Анат. 1856; 10: 170–193.
- ↑ Gradle HS. Мертвая зона: III. Связь слепого пятна с медуллированными нервными волокнами сетчатки. Журнал Американской медицинской ассоциации. 1921; 77 (19): 1483–147.
- ↑ 3,0 3,1 3,2 Кодама Т., Хаясака С., Сетогава Т. Миелинизированные нервные волокна сетчатки: распространенность, расположение и влияние на остроту зрения.Ophthalmologica. Журнал международная офтальмология. Международный журнал офтальмологии. Zeitschrift für Augenheilkunde. 1990. 200 (2): 77–83. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2338989. Доступ 20 июля 2013 г.
- ↑ 4,0 4,1 4,2 4,3 4,4 Straatsma BR, Foos RY, Heckenlively JR, Taylor GN. Миелинизированные нервные волокна сетчатки. Американский журнал офтальмологии. 1981. 91 (1): 25–38. Доступно по адресу: http: //www.ncbi.nlm.nih.gov/pubmed/7234927. Доступ 20 июля 2013 г.
- ↑ 5.0 5.1 Funnell CL, George NDL, Pai V. Семейные миелинизированные нервные волокна сетчатки. Глаз (Лондон, Англия). 2003. 17 (1): 96–7. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12579180. Доступ 20 июля 2013 г.
- ↑ 6.0 6.1 Magoon EH, Робб Р.М. Развитие миелина в зрительном нерве и тракте человека: световое и электронное микроскопическое исследование. Архив офтальмологии. 1981. 99 (4): 655–659.Доступно по адресу: http://archopht.jamanetwork.com/article.aspx?articleid=633760. Проверено 22 июля 2013 г.
- ↑ 7,0 7,1 7,2 7,3 ФитцГиббон Т., Несторовски З. Морфологические последствия миелинизации сетчатки глаза человека. Экспериментальное глазное исследование. 1997. 65 (6): 809–19. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/9441705. Доступ 20 июля 2013 г.
- ↑ Perry VH, Lund RD. Доказательства того, что решетчатая пластинка предотвращает интраретинальную миелинизацию аксонов ганглиозных клеток сетчатки.Журнал нейроцитологии. 1990. 19 (2): 265–72. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2358833. Проверено 22 июля 2013 г.
- ↑ Wegner M. Вопрос идентичности: контроль транскрипции в олигодендроцитах. Журнал молекулярной нейробиологии: МН. 2008; 35 (1): 3–12. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/18401762. По состоянию на 28 мая 2013 г.
- ↑ Howng SYB, Авила Р.Л., Эмери Б. и др. ZFP191 необходим олигодендроцитам для миелинизации ЦНС. Гены и развитие. 2010. 24 (3): 301–11.Доступно по адресу: http://genesdev.cshlp.org/content/24/3/301.long. По состоянию на 22 мая 2013 г.
- ↑ Франсуа Ж. Миелинизированные нервные волокна. В кн .: Наследственность в офтальмологии. Сент-Луис, Миссури: Мосби; 1961: 494–496.
- ↑ Бозкурт Б., Йилдирим М.С., Окка М., Битирген Г. Синдром ГАПО: четыре новых пациента с врожденной глаукомой и миелинизированным слоем нервных волокон сетчатки. Американский журнал медицинской генетики. Часть A. 2013; 161 (4): 829–34. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23494824. Доступ 20 июля 2013 г.
- ↑ Traboulsi EI, Lim JI, Pyeritz R, Goldberg HK, Haller JA. Новый синдром миелинизированных нервных волокон, витреоретинопатия и пороки развития скелета. Архив офтальмологии. 1993. 111 (11): 1543–5. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/8240111. Доступ 20 июля 2013 г.
- ↑ Shelton JB, Digre KB, Gilman J, Warner JEA, Katz BJ. Характеристики миелинизированного слоя нервных волокон сетчатки при офтальмологической визуализации: результаты автофлуоресценции, флуоресцентной ангиографии, инфракрасной, оптической когерентной томографии и бескрасных изображений.Офтальмология JAMA. 2013. 131 (1): 107–9. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23307221. Доступ 30 июня 2013 г.
- ↑ Tarabishy AB, Alexandrou TJ, Traboulsi EI. Синдром миелинизированных нервных волокон сетчатки, миопия и амблиопия: обзор. Обзор офтальмологии. 52 (6): 588–96. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/18029268. По состоянию на 18 июня 2013 г.
- ↑ 16,0 16,1 Миллер Н.Р. Клиническая нейроофтальмология. 4-е изд. (Wilkins W and, ed.). Балтимор; 1982: 367–9.
- ↑ Williams TD. Медуллированные нервные волокна сетчатки: предположения об их причинах и клинических проявлениях. Американский журнал оптометрии и физиологической оптики. 1986. 63 (2): 142–51. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/3953757. Проверено 22 июля 2013 г.
- ↑ Герцог-старший С. Врожденные уродства. В: Duke-Elder S, ed. Сент-Луис: Мосби, резюме; 1963: 646–651.
- ↑ 19,0 19,1 19,2 Kiso K. Beitrage zur Kenntis von der Vererbung der markhaltigen Sehnervenfasern der netzhaut.Graefes Arch Clin Exp Ophthalmol. 1928; 120: 154–174.
- ↑ 20.0 20.1 20.2 Straatsma BR, Heckenlively JR, Foos RY, Shahinian JK. Миелинизированные нервные волокна сетчатки, связанные с ипсилатеральной миопией, амблиопией и косоглазием. Американский журнал офтальмологии. 1979; 88 (3 Pt 1): 506–10. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/484678. Доступ 21 июля 2013 г.
- ↑ Шмидт Д., Мейер Дж., Брэнди-Дорн Дж. Широко распространенные миелинизированные нервные волокна диска зрительного нерва: влияют ли они на развитие миопии? Международная офтальмология.20 (5): 263–8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/
97. Доступ 21 июля 2013 г.
- ↑ Merritt JC. Миелинизированные нервные волокна, связанные с дефектом афферентного зрачка и амблиопией. Журнал детской офтальмологии. 14 (3): 139–40. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/
- ↑ 23,0 23,1 Али Б.Х., Логани С., Козлов К.Л., Арнольд А.С., Бейтман Б. Прогрессирование миелинизации нервных волокон сетчатки в детстве.Американский журнал офтальмологии. 1994; 118: 515–517.
- ↑ Gharai S, Prakash G, Kumar D, Jacob S, Agarwal A, Arora V. Спектральные оптические когерентные томографические характеристики односторонних перипапиллярных миелинизированных нервных волокон сетчатки с вовлечением макулы. Журнал AAPOS. 2010. 14 (5): 432–434.
- ↑ 25,0 25,1 25,2 Жан-Луи Дж., Кац Б.Дж., Дигре КБ, Уорнер Дж. Э., Крегер Д.Д. Приобретенная и прогрессирующая миелинизация слоя нервных волокон сетчатки у подростка.Американский журнал офтальмологии. 2000. 130 (3): 361–2. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/11020421. Доступ 20 июля 2013 г.
- ↑ Эйде Н. Разрыв сетчатки в области с мозговыми волокнами. Acta ophthalmologica. 1986. 64 (3): 271–3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/3751515. Доступ 21 июля 2013 г.
- ↑ Хаббард Г.Б., Томас М.А., Гроссниклаус Х.Э. Синдром витреомакулярной тракции с сильно миелинизированными нервными волокнами. Архив офтальмологии. 2002. 120 (5): 670–1.Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12003629 Проверено 21 июля 2013 г.
- ↑ Карадимас П, Капетаниос А, Панайотидху Э, Бузас Э. Эпиретинальная мембрана, образованная миелинизированными нервными волокнами сетчатки и сосудистыми аномалиями. Сетчатка (Филадельфия, Пенсильвания). 2003. 23 (6): 880–1. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/14707848. Доступ 21 июля 2013 г.
- ↑ 29,0 29,1 Берлинер М.Л. Медуллированные нервные волокна, связанные с хориоидитом: отчет о случае с предварительными исследованиями причин появления мозговых нервных волокон в сетчатке.Архив офтальмологии. 1931; 6 (3): 404–413. Доступно по адресу: http://archopht.jamanetwork.com/article.aspx?articleid=609280. Проверено 23 июля 2013 г.
- ↑ Джексон Э. Увеит с непрозрачными волокнами зрительного нерва. Являюсь. J. Ophthal. 1918; 1 (448).
- ↑ 31,0 31,1 Розен Б., Барри С., Констебль И.Дж. Развитие миелинизированных нервных волокон сетчатки. Американский журнал офтальмологии. 1999. 127 (4): 471–473. Доступно по адресу: http://dx.doi.org/10.1016/S0002-9394(98)00377-8. Проверено 24 июля 2013 г.
- ↑ Mehta JS, Raman J, Gupta N, Sinha A. Сосудистые аномалии сетчатки в приобретенных миелинизированных нервных волокнах. Acta ophthalmologica Scandinavica. 2003. 81 (3): 311–2. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12780415. Доступ 21 июля 2013 г.
- ↑ 33,0 33,1 Leys AM, Leys MJ, Hooymans JM, et al. Миелинизированные нервные волокна и сосудистые аномалии сетчатки. Сетчатка (Филадельфия, Пенсильвания). 1996. 16 (2): 89–96. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/8724950.Доступ 20 июля 2013 г.
- ↑ 34,0 34,1 Сильвестри Г., Сехми К., Гамильтон П. Патологии сосудов сетчатки. Редкое осложнение миелинизированных нервных волокон? Сетчатка (Филадельфия, Пенсильвания). 1996. 16 (3): 214–8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/8789859. Доступ 21 июля 2013 г.
- ↑ 35,0 35,1 Ааби А.А., Кушнер Б.Дж. Приобретенные и прогрессирующие миелинизированные нервные волокна. Архив офтальмологии. 1985. 103: 542–544.
- ↑ Парулекар М. В., Эльстон Дж. С..Приобретенная миелинизация сетчатки при нейрофиброматозе 1. Архив офтальмологии. 2002. 120 (5): 659–5. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12003622. Доступ 21 июля 2013 г.
- ↑ Baarsma GS. Приобретенные мозговидные нервные волокна. Британский офтальмологический журнал. 1980; 64 (9): 651. Доступно по адресу: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1043786&tool=pmcentrez&rendertype=abstract. Доступ 21 июля 2013 г.
- ↑ Kushner BJ. Декомпрессия зрительного нерва.Arch Ophthalmol. 1979; 97: 1459–1461.
- ↑ De Jong PT, Bistervels B, Cosgrove J, de Grip G, Leys A, Goffin M. Медуллированные нервные волокна. Признак синдрома множественных базальноклеточных невусов (Горлина). Архив офтальмологии. 1985. 103 (12): 1833–6. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/4074174. Доступ 21 июля 2013 г.
- ↑ A. S. Schwund Markhaltiger Nervenfasern in der Netzhaut bei intzundlicher Atrophie des Sehnervern in Folges eines Tumor oerebri. Z. Augenheilkd. 1905; 13: 739–50.
- ↑ Гупта А., Кхандалавала Б., Бансал РК, Джайн И.С., Гревал СП. Атрофия миелинизированных нервных волокон при аденоме гипофиза. Журнал клинической нейроофтальмологии. 1990. 10 (2): 100–2. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2141848. Доступ 21 июля 2013 г.
- ↑ Sharpe JA, Sanders MD. Атрофия миелинизированных нервных волокон сетчатки при неврите зрительного нерва. Британский офтальмологический журнал. 1975. 59 (4): 229–32. Доступно по адресу: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1042599&tool=pmcentrez&rendertype=abstract.Доступ 20 июля 2013 г.
- ↑ Schachat AP, Miller NR. Атрофия миелинизированных нервных волокон сетчатки после острой нейропатии зрительного нерва. Американский журнал офтальмологии. 1981. 92 (6): 854–6. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/7315937. Доступ 20 июля 2013 г.
- ↑ Katz SE, Weber PA. Фотодокументация потери мозговых нервных волокон сетчатки при неконтролируемой первичной открытоугольной глаукоме. Журнал глаукомы. 1996. 5 (6): 406–409. Доступно по адресу: http: // www.ncbi.nlm.nih.gov/pubmed/8946297. Проверено 22 июля 2013 г.
- ↑ Чавис П.С., Таббара К.Ф. Демиелинизация миелинизированных нервных волокон сетчатки при болезни Бехчета. Documenta ophthalmologica. Успехи офтальмологии. 1998. 95 (2): 157–64. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/10431799. Доступ 21 июля 2013 г.
- ↑ Машаехи А., Шилдс К.Л., Шилдс Дж.А. Исчезновение миелинизированных нервных волокон сетчатки после лучевой терапии хориоидальной меланомы. Retina (Филадельфия, Пенсильвания.). 2003. 23 (4): 572–3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12972781. Доступ 20 июля 2013 г.
- ↑ Teich SA. Исчезновение миелинизированных нервных волокон сетчатки после окклюзии ветви артерии сетчатки. Американский журнал офтальмологии. 1987. 103 (6): 835–7. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/35. Доступ 20 июля 2013 г.
- ↑ 48,0 48,1 R. B. Schwund markhaltiger Nervenfasern in der Netzhaut nach Embolie der Art. Централизованные сетчатки.Альбрехт фон Грейфес Арка. Офтальмол. 1922; 107 (10).
- ↑ Gentile RC, Torqueti-Costa L, Bertolucci A. Потеря миелинизированных нервных волокон сетчатки при диабетической ретинопатии. Британский офтальмологический журнал. 2002; 86 (12): 1447. Доступно по адресу: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1771408&tool=pmcentrez&rendertype=abstract. Доступ 20 июля 2013 г.
- ↑ Williams AJ, Fekrat S. Исчезновение миелинизированных нервных волокон сетчатки после витрэктомии pars plana.Американский журнал офтальмологии. 2006. 142 (3): 521–3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/16935613. Доступ 20 июля 2013 г.
- ↑ Rootman DB, Gonzalez E, Mallipatna A, et al. Переносная оптическая когерентная томография спектральной области высокого разрешения при ретинобластоме: клинические и морфологические соображения. Британский офтальмологический журнал. 2013. 97 (1): 59–65. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23104902. Проверено 24 июля 2013 г.
1. По состоянию на 27 июля 2013 г.
Авторы благодарят Пенни Коппернолл-Блах и сотрудников библиотеки UCSD за их помощь в проведении обзора литературы, необходимой для этой статьи.Особая благодарность Джулио Бартеселли и Габриэлю Балеа за офтальмологические фотографии, представленные здесь. Мы благодарим Кристофера Ругабера, OD, Факультет оптометрии, Университет Рангсит, Патум Тани, Таиланд, за его ценные предложения по улучшению этой вики-страницы.
Слой миелинизированных нервных волокон сетчатки
Принять участие в конкурсе резидентов и стипендиатов
Принять участие в Международном конкурсе офтальмологов
Хема Л. Рамкумар, доктор медицины, Дженнифер И Лим, доктор медицины, К.Дэвид Эпли, доктор медицины, Кушик Трипати, доктор медицины (AIIMS), FRCS (Глазго), Мэри Элизабет Хартнетт, доктор медицины, Рэйчел Патель, доктор медицины и Теодор Ленг, доктор медицины, магистр медицины
Присвоенный статус Актуально
Мэри Элизабет Хартнетт, доктор медицины, 4 января 2021 года.
Фотография глазного дна девочки 7 лет с миелинизированной СНВС, зрением 20/20 и легкой дальнозоркостью.
Миелинизированные слои нервных волокон сетчатки (MRNF) — это нервные волокна сетчатки, расположенные перед решетчатой пластинкой сетчатки, которые, в отличие от нормальных нервных волокон сетчатки, имеют миелиновую оболочку.Клинически они представляют собой хорошо разграниченные серо-белые пятна с потрепанными краями на передней поверхности нейросенсорной сетчатки. [1] [2] MNFL присутствует у 0,57–1% населения и может возникать двусторонне примерно у 7% больных. [3] [4] У большинства пациентов с MRNF симптомы отсутствуют; однако у некоторых пациентов наблюдаются сопутствующие офтальмологические изменения, включая осевую миопию, амблиопию и косоглазие. [3] [4] Семейные случаи MRNF, хотя и редкие, описаны как изолированно, так и в сочетании с глазными и системными синдромами. [5] MRNF обычно присутствуют при рождении и представляют собой статические поражения, но было описано несколько случаев приобретенных и прогрессирующих поражений как в детстве, так и во взрослом возрасте. Сообщалось также об исчезновении MRNF после операций и повреждений зрительного нерва.
Международная классификация болезней
МКБ-9 377.49 Другие поражения зрительного нерва
МКБ-10 h45.89 Дефект, дефект волокон пучка нервов сетчатки
История
Немецкий патолог Рудольф Вирхов был первым, кто описал миелинизированные нервные волокна сетчатки, написав в 1856 году, что «сетчатка была белой, очень толстой и морщинистой.Макула была нормальной и около диска зрительного нерва, хотя и располагалась более глубоко, представляла собой толстые, непрозрачные, мелово-белые пятна, которые распространялись вокруг диска в форме звезды, так что когда я хотел провести линию между диском и макулой с каждой стороны у двух было одинаковое расхождение. В другом глазу я без особого удивления обнаружил в том же месте кольцо вокруг диска шириной 2–2,5 мм, регрессирующее наружу ». [1]
Миелинизация аксонов в центральной нервной системе человека — сложный, упорядоченный процесс, осуществляемый клетками-предшественниками олигодендроцитов, которые мигрируют под влиянием нейрогормональных сигналов с образованием олигодендроцитов, продуцирующих миелин.Миелинизация ганглиозных клеток сетчатки происходит от латерального коленчатого ядра кпереди по направлению к глазному яблоку. [6] Миелинизация вдоль зрительного пути впервые наблюдается на восьмом месяце беременности и обычно достигает задней части глазного яблока примерно во время рождения, при этом практически все волокна достигают полной миелинизации к возрасту 7 месяцев. [6] Обычно процесс миелинизации останавливается на этом уровне; Некоторыми постулируемыми объяснениями этого наблюдения являются наличие структуры cribrosa пластинки, утечка белков плазмы из хориоидального кровотока, вызывающая дифференцировку олигодендроцитов, и факторы астроцитов типа 1, блокирующие миграцию олигодендроцитов. [7] [8] Хотя точные причины остаются неизвестными, MRNF возникает, когда процесс миелинизации распространяется за пределы решетчатой пластинки и виден при осмотре глазного дна.
Гистопатологический анализ показывает, что миелинизированные волокна не ограничены участком или пучком, а отдельные миелинизированные волокна могут быть обнаружены между пучками немиелинизированных волокон. [7] Было показано, что как миелинизированные, так и немиелинизированные волокна в области MRNF имеют больший диаметр, чем волокна в нормальной сетчатке.Кроме того, примечательно, что уменьшенная популяция ганглиозных клеток сетчатки присутствует в MRNF наряду с уменьшенной шириной нижележащих внутреннего и внешнего плексиформных слоев сетчатки. [7] Относительно мало клеточных ядер и нет микроскопических доказательств воспаления в области MRNF. Хотя некоторые MRNF могут выглядеть макроскопически смежными с диском зрительного нерва, одно гистологическое исследование показало, что область миелинизации не прилегает к области зрительного нерва. [7] Не было описано аномалий решетчатой пластинки на глазах с MRNF.
Генетический контроль миелинизации зрелых ганглиозных клеток сетчатки в значительной степени неизвестен и является активной областью исследований. [9] [10]
Сообщалось о семейных случаях изолированного MRNF, в том числе в семье с двумя поколениями из 10 случаев и у матери и дочери с двусторонним MRNF. [5] [11]
Также описаны семейные случаи, связанные с другими расстройствами.Аутосомно-рецессивный синдром, состоящий из задержки роста, алопеции, псевдоанодонтии и атрофии зрительного нерва (синдром ГАПО), также может включать MRNF, гипертелоризм и глаукому. [12] Также был описан наследственный синдром витреоретинальной дегенерации, задней субкапсулярной катаракты, скелетных аномалий и MRNF. [13]
Клиническая презентация
Большинство случаев MRNF диагностируется случайно у бессимптомных здоровых людей с помощью офтальмоскопии.Внешний вид обычно представляет собой отчетливое перипапиллярное белое полосатое пятно с зазубренными краями размером примерно один диаметр диска или больше (Рисунок 1).
Рисунок 1. Многоцветное изображение миелинизации ЛВСЯ .
Характеристики офтальмологической визуализации
На инфракрасных изображениях и изображениях без красного цвета MRNF выглядит белым, что, вероятно, связано с высоким содержанием липидов в миелине. [14] Миелин блокирует обнаружение нижележащего флуоресцентного материала, поэтому он выглядит темным на аутофлуоресценции глазного дна.На оптической когерентной томографии (ОКТ) MRNF выглядит как утолщенный и гиперотражающий слой нервных волокон сетчатки (RNFL) (, рис. 2, ).
Рис. 2. ОКТ, на котором красные стрелки указывают гиперрефлективный вид миелинизированного слоя нервных волокон сетчатки.
MRNF часто изолированы, но могут быть связаны с ипсилатеральной миопией, амблиопией, косоглазием и другими глазными заболеваниями (Таблица 1). В одном обзоре косоглазие было обнаружено у 66% пациентов с MRNF. [15] Острота зрения обычно не снижается; однако, если присутствует достаточное количество миелинизированных волокон, может развиться относительная скотома, соответствующая локализации MRNF. Эти скотомы обычно меньше, чем можно было бы предположить по размеру пластыря MRNF. [4] [16] Острота зрения и прогноз зависят от тяжести глазных осложнений или связанных синдромов.
Глазные ассоциации с миелинизацией СНВС
| Передний сегмент: |
|---|
|
| Рефракционная и сенсомоторная: |
|
| Связанный зрительный нерв: |
|
| Увеал и сетчатка: |
|
Системные ассоциации с миелинизацией RNFL
Системные синдромы, которые были связаны с MRNF, включают синдром Тернера, [35] эпилепсию, [19] трисомию 21 и краниосиностоз. [4]
Заболевания, связанные с приобретенной и прогрессирующей миелинизацией RNFL
Имеется несколько сообщений о случаях приобретенной и прогрессирующей миелинизации в детском, подростковом и взрослом возрасте. [25] Эти случаи связаны с тупой травмой, фенестрацией оболочки зрительного нерва, друзами зрительного нерва, семейным анамнезом гипоплазии зрительного нерва у здорового ребенка, мальформацией Арнольда-Киари, связанной с гидроцефалией, нейрофиброматозом I типа и Горлина-Гольца ( базально-клеточный невус) синдром. [23] [25] [35] [36] [37] [38] [39]
Состояния, связанные с потерей миелинизации RNFL
Сообщалось также об исчезновении MRNFL, связанном с несколькими неврологическими, воспалительными заболеваниями и заболеваниями сетчатки. Предполагается, что исчезновение MRNF сигнализирует о патологической дегенерации аксонов нервов сетчатки. Связи с неврологическими заболеваниями включают аденому гипофиза, неврит зрительного нерва, острую оптическую невропатию и первичную открытоугольную глаукому. [40] [41] [42] [43] [44] Описана очевидная демиелинизация MRNF у пациента с болезнью Бехчета после повторных эпизодов папиллита и витрита, а также MRNF у пациента, перенесшего лучевую терапию бляшками по поводу меланомы хориоидеи. [45] [46] Кроме того, с исчезновением MRNFL были связаны такие состояния сетчатки, как окклюзия ветви сетчатки, окклюзия центральной артерии сетчатки, диабетическая ретинопатия и витрэктомия pars plana для эпиретинальной мембраны. [47] [48] [49] [50]
MRNF обычно доброкачественны, но их можно принять за другие потенциально серьезные состояния. При рассмотрении неопластического инфильтрата может быть полезен общий анализ крови. Гиперрефлективность на ОКТ может имитировать результаты окклюзии сосудов сетчатки или пятна ваты, поэтому офтальмоскопия и флюоресцентная ангиография могут помочь в распознавании явления эмболии. У маленьких детей обширный MRFL может быть ошибочно принят за ретинобластому, которую следует отличать с помощью тщательной офтальмоскопии (часто под анестезией) и возможных дополнительных изображений, таких как ультразвуковое исследование глаз.При наличии грубых дефектов зрения необходимо формальное тестирование поля зрения, чтобы исключить сопутствующую нейроофтальмологическую проблему, поскольку дефекты зрения в MRNF обычно легкие.
Управление MRNF сосредоточено на серийных обследованиях глаз для оценки и лечения сопутствующих состояний. Близорукость следует лечить с помощью коррекции рефракции. При наличии значительной анизометропии коррекция очками может быть непереносимой на фоне анизейконии, и следует назначать контактные линзы.Детскую амблиопию необходимо лечить, чтобы оптимизировать зрительное развитие. [3] [48] Косоглазие следует лечить с помощью обычных протоколов, и пациенты часто хорошо поддаются хирургической коррекции. [51]
Важно осознавать в целом доброкачественный характер MRNF, чтобы избежать излишнего медицинского обследования. Полезно задокументировать MRNF с помощью визуализации, поскольку определенные условия могут быть связаны с потерей миелинизации, как описано выше.
- ↑ 1.0 1,1 Вирхов VR. Zur patologischen anatomic der netzaut und des scherven. Вирхов Арка Патол Анат. 1856; 10: 170–193.
- ↑ Gradle HS. Мертвая зона: III. Связь слепого пятна с медуллированными нервными волокнами сетчатки. Журнал Американской медицинской ассоциации. 1921; 77 (19): 1483–147.
- ↑ 3,0 3,1 3,2 Кодама Т., Хаясака С., Сетогава Т. Миелинизированные нервные волокна сетчатки: распространенность, расположение и влияние на остроту зрения.Ophthalmologica. Журнал международная офтальмология. Международный журнал офтальмологии. Zeitschrift für Augenheilkunde. 1990. 200 (2): 77–83. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2338989. Доступ 20 июля 2013 г.
- ↑ 4,0 4,1 4,2 4,3 4,4 Straatsma BR, Foos RY, Heckenlively JR, Taylor GN. Миелинизированные нервные волокна сетчатки. Американский журнал офтальмологии. 1981. 91 (1): 25–38. Доступно по адресу: http: //www.ncbi.nlm.nih.gov/pubmed/7234927. Доступ 20 июля 2013 г.
- ↑ 5.0 5.1 Funnell CL, George NDL, Pai V. Семейные миелинизированные нервные волокна сетчатки. Глаз (Лондон, Англия). 2003. 17 (1): 96–7. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12579180. Доступ 20 июля 2013 г.
- ↑ 6.0 6.1 Magoon EH, Робб Р.М. Развитие миелина в зрительном нерве и тракте человека: световое и электронное микроскопическое исследование. Архив офтальмологии. 1981. 99 (4): 655–659.Доступно по адресу: http://archopht.jamanetwork.com/article.aspx?articleid=633760. Проверено 22 июля 2013 г.
- ↑ 7,0 7,1 7,2 7,3 ФитцГиббон Т., Несторовски З. Морфологические последствия миелинизации сетчатки глаза человека. Экспериментальное глазное исследование. 1997. 65 (6): 809–19. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/9441705. Доступ 20 июля 2013 г.
- ↑ Perry VH, Lund RD. Доказательства того, что решетчатая пластинка предотвращает интраретинальную миелинизацию аксонов ганглиозных клеток сетчатки.Журнал нейроцитологии. 1990. 19 (2): 265–72. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2358833. Проверено 22 июля 2013 г.
- ↑ Wegner M. Вопрос идентичности: контроль транскрипции в олигодендроцитах. Журнал молекулярной нейробиологии: МН. 2008; 35 (1): 3–12. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/18401762. По состоянию на 28 мая 2013 г.
- ↑ Howng SYB, Авила Р.Л., Эмери Б. и др. ZFP191 необходим олигодендроцитам для миелинизации ЦНС. Гены и развитие. 2010. 24 (3): 301–11.Доступно по адресу: http://genesdev.cshlp.org/content/24/3/301.long. По состоянию на 22 мая 2013 г.
- ↑ Франсуа Ж. Миелинизированные нервные волокна. В кн .: Наследственность в офтальмологии. Сент-Луис, Миссури: Мосби; 1961: 494–496.
- ↑ Бозкурт Б., Йилдирим М.С., Окка М., Битирген Г. Синдром ГАПО: четыре новых пациента с врожденной глаукомой и миелинизированным слоем нервных волокон сетчатки. Американский журнал медицинской генетики. Часть A. 2013; 161 (4): 829–34. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23494824. Доступ 20 июля 2013 г.
- ↑ Traboulsi EI, Lim JI, Pyeritz R, Goldberg HK, Haller JA. Новый синдром миелинизированных нервных волокон, витреоретинопатия и пороки развития скелета. Архив офтальмологии. 1993. 111 (11): 1543–5. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/8240111. Доступ 20 июля 2013 г.
- ↑ Shelton JB, Digre KB, Gilman J, Warner JEA, Katz BJ. Характеристики миелинизированного слоя нервных волокон сетчатки при офтальмологической визуализации: результаты автофлуоресценции, флуоресцентной ангиографии, инфракрасной, оптической когерентной томографии и бескрасных изображений.Офтальмология JAMA. 2013. 131 (1): 107–9. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23307221. Доступ 30 июня 2013 г.
- ↑ Tarabishy AB, Alexandrou TJ, Traboulsi EI. Синдром миелинизированных нервных волокон сетчатки, миопия и амблиопия: обзор. Обзор офтальмологии. 52 (6): 588–96. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/18029268. По состоянию на 18 июня 2013 г.
- ↑ 16,0 16,1 Миллер Н.Р. Клиническая нейроофтальмология. 4-е изд. (Wilkins W and, ed.). Балтимор; 1982: 367–9.
- ↑ Williams TD. Медуллированные нервные волокна сетчатки: предположения об их причинах и клинических проявлениях. Американский журнал оптометрии и физиологической оптики. 1986. 63 (2): 142–51. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/3953757. Проверено 22 июля 2013 г.
- ↑ Герцог-старший С. Врожденные уродства. В: Duke-Elder S, ed. Сент-Луис: Мосби, резюме; 1963: 646–651.
- ↑ 19,0 19,1 19,2 Kiso K. Beitrage zur Kenntis von der Vererbung der markhaltigen Sehnervenfasern der netzhaut.Graefes Arch Clin Exp Ophthalmol. 1928; 120: 154–174.
- ↑ 20.0 20.1 20.2 Straatsma BR, Heckenlively JR, Foos RY, Shahinian JK. Миелинизированные нервные волокна сетчатки, связанные с ипсилатеральной миопией, амблиопией и косоглазием. Американский журнал офтальмологии. 1979; 88 (3 Pt 1): 506–10. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/484678. Доступ 21 июля 2013 г.
- ↑ Шмидт Д., Мейер Дж., Брэнди-Дорн Дж. Широко распространенные миелинизированные нервные волокна диска зрительного нерва: влияют ли они на развитие миопии? Международная офтальмология.20 (5): 263–8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/
97. Доступ 21 июля 2013 г.
- ↑ Merritt JC. Миелинизированные нервные волокна, связанные с дефектом афферентного зрачка и амблиопией. Журнал детской офтальмологии. 14 (3): 139–40. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/
- ↑ 23,0 23,1 Али Б.Х., Логани С., Козлов К.Л., Арнольд А.С., Бейтман Б. Прогрессирование миелинизации нервных волокон сетчатки в детстве.Американский журнал офтальмологии. 1994; 118: 515–517.
- ↑ Gharai S, Prakash G, Kumar D, Jacob S, Agarwal A, Arora V. Спектральные оптические когерентные томографические характеристики односторонних перипапиллярных миелинизированных нервных волокон сетчатки с вовлечением макулы. Журнал AAPOS. 2010. 14 (5): 432–434.
- ↑ 25,0 25,1 25,2 Жан-Луи Дж., Кац Б.Дж., Дигре КБ, Уорнер Дж. Э., Крегер Д.Д. Приобретенная и прогрессирующая миелинизация слоя нервных волокон сетчатки у подростка.Американский журнал офтальмологии. 2000. 130 (3): 361–2. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/11020421. Доступ 20 июля 2013 г.
- ↑ Эйде Н. Разрыв сетчатки в области с мозговыми волокнами. Acta ophthalmologica. 1986. 64 (3): 271–3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/3751515. Доступ 21 июля 2013 г.
- ↑ Хаббард Г.Б., Томас М.А., Гроссниклаус Х.Э. Синдром витреомакулярной тракции с сильно миелинизированными нервными волокнами. Архив офтальмологии. 2002. 120 (5): 670–1.Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12003629 Проверено 21 июля 2013 г.
- ↑ Карадимас П, Капетаниос А, Панайотидху Э, Бузас Э. Эпиретинальная мембрана, образованная миелинизированными нервными волокнами сетчатки и сосудистыми аномалиями. Сетчатка (Филадельфия, Пенсильвания). 2003. 23 (6): 880–1. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/14707848. Доступ 21 июля 2013 г.
- ↑ 29,0 29,1 Берлинер М.Л. Медуллированные нервные волокна, связанные с хориоидитом: отчет о случае с предварительными исследованиями причин появления мозговых нервных волокон в сетчатке.Архив офтальмологии. 1931; 6 (3): 404–413. Доступно по адресу: http://archopht.jamanetwork.com/article.aspx?articleid=609280. Проверено 23 июля 2013 г.
- ↑ Джексон Э. Увеит с непрозрачными волокнами зрительного нерва. Являюсь. J. Ophthal. 1918; 1 (448).
- ↑ 31,0 31,1 Розен Б., Барри С., Констебль И.Дж. Развитие миелинизированных нервных волокон сетчатки. Американский журнал офтальмологии. 1999. 127 (4): 471–473. Доступно по адресу: http://dx.doi.org/10.1016/S0002-9394(98)00377-8. Проверено 24 июля 2013 г.
- ↑ Mehta JS, Raman J, Gupta N, Sinha A. Сосудистые аномалии сетчатки в приобретенных миелинизированных нервных волокнах. Acta ophthalmologica Scandinavica. 2003. 81 (3): 311–2. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12780415. Доступ 21 июля 2013 г.
- ↑ 33,0 33,1 Leys AM, Leys MJ, Hooymans JM, et al. Миелинизированные нервные волокна и сосудистые аномалии сетчатки. Сетчатка (Филадельфия, Пенсильвания). 1996. 16 (2): 89–96. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/8724950.Доступ 20 июля 2013 г.
- ↑ 34,0 34,1 Сильвестри Г., Сехми К., Гамильтон П. Патологии сосудов сетчатки. Редкое осложнение миелинизированных нервных волокон? Сетчатка (Филадельфия, Пенсильвания). 1996. 16 (3): 214–8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/8789859. Доступ 21 июля 2013 г.
- ↑ 35,0 35,1 Ааби А.А., Кушнер Б.Дж. Приобретенные и прогрессирующие миелинизированные нервные волокна. Архив офтальмологии. 1985. 103: 542–544.
- ↑ Парулекар М. В., Эльстон Дж. С..Приобретенная миелинизация сетчатки при нейрофиброматозе 1. Архив офтальмологии. 2002. 120 (5): 659–5. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12003622. Доступ 21 июля 2013 г.
- ↑ Baarsma GS. Приобретенные мозговидные нервные волокна. Британский офтальмологический журнал. 1980; 64 (9): 651. Доступно по адресу: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1043786&tool=pmcentrez&rendertype=abstract. Доступ 21 июля 2013 г.
- ↑ Kushner BJ. Декомпрессия зрительного нерва.Arch Ophthalmol. 1979; 97: 1459–1461.
- ↑ De Jong PT, Bistervels B, Cosgrove J, de Grip G, Leys A, Goffin M. Медуллированные нервные волокна. Признак синдрома множественных базальноклеточных невусов (Горлина). Архив офтальмологии. 1985. 103 (12): 1833–6. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/4074174. Доступ 21 июля 2013 г.
- ↑ A. S. Schwund Markhaltiger Nervenfasern in der Netzhaut bei intzundlicher Atrophie des Sehnervern in Folges eines Tumor oerebri. Z. Augenheilkd. 1905; 13: 739–50.
- ↑ Гупта А., Кхандалавала Б., Бансал РК, Джайн И.С., Гревал СП. Атрофия миелинизированных нервных волокон при аденоме гипофиза. Журнал клинической нейроофтальмологии. 1990. 10 (2): 100–2. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2141848. Доступ 21 июля 2013 г.
- ↑ Sharpe JA, Sanders MD. Атрофия миелинизированных нервных волокон сетчатки при неврите зрительного нерва. Британский офтальмологический журнал. 1975. 59 (4): 229–32. Доступно по адресу: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1042599&tool=pmcentrez&rendertype=abstract.Доступ 20 июля 2013 г.
- ↑ Schachat AP, Miller NR. Атрофия миелинизированных нервных волокон сетчатки после острой нейропатии зрительного нерва. Американский журнал офтальмологии. 1981. 92 (6): 854–6. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/7315937. Доступ 20 июля 2013 г.
- ↑ Katz SE, Weber PA. Фотодокументация потери мозговых нервных волокон сетчатки при неконтролируемой первичной открытоугольной глаукоме. Журнал глаукомы. 1996. 5 (6): 406–409. Доступно по адресу: http: // www.ncbi.nlm.nih.gov/pubmed/8946297. Проверено 22 июля 2013 г.
- ↑ Чавис П.С., Таббара К.Ф. Демиелинизация миелинизированных нервных волокон сетчатки при болезни Бехчета. Documenta ophthalmologica. Успехи офтальмологии. 1998. 95 (2): 157–64. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/10431799. Доступ 21 июля 2013 г.
- ↑ Машаехи А., Шилдс К.Л., Шилдс Дж.А. Исчезновение миелинизированных нервных волокон сетчатки после лучевой терапии хориоидальной меланомы. Retina (Филадельфия, Пенсильвания.). 2003. 23 (4): 572–3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/12972781. Доступ 20 июля 2013 г.
- ↑ Teich SA. Исчезновение миелинизированных нервных волокон сетчатки после окклюзии ветви артерии сетчатки. Американский журнал офтальмологии. 1987. 103 (6): 835–7. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/35. Доступ 20 июля 2013 г.
- ↑ 48,0 48,1 R. B. Schwund markhaltiger Nervenfasern in der Netzhaut nach Embolie der Art. Централизованные сетчатки.Альбрехт фон Грейфес Арка. Офтальмол. 1922; 107 (10).
- ↑ Gentile RC, Torqueti-Costa L, Bertolucci A. Потеря миелинизированных нервных волокон сетчатки при диабетической ретинопатии. Британский офтальмологический журнал. 2002; 86 (12): 1447. Доступно по адресу: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1771408&tool=pmcentrez&rendertype=abstract. Доступ 20 июля 2013 г.
- ↑ Williams AJ, Fekrat S. Исчезновение миелинизированных нервных волокон сетчатки после витрэктомии pars plana.Американский журнал офтальмологии. 2006. 142 (3): 521–3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/16935613. Доступ 20 июля 2013 г.
- ↑ Rootman DB, Gonzalez E, Mallipatna A, et al. Переносная оптическая когерентная томография спектральной области высокого разрешения при ретинобластоме: клинические и морфологические соображения. Британский офтальмологический журнал. 2013. 97 (1): 59–65. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23104902. Проверено 24 июля 2013 г.
1. По состоянию на 27 июля 2013 г.
Авторы благодарят Пенни Коппернолл-Блах и сотрудников библиотеки UCSD за их помощь в проведении обзора литературы, необходимой для этой статьи.Особая благодарность Джулио Бартеселли и Габриэлю Балеа за офтальмологические фотографии, представленные здесь. Мы благодарим Кристофера Ругабера, OD, Факультет оптометрии, Университет Рангсит, Патум Тани, Таиланд, за его ценные предложения по улучшению этой вики-страницы.
границ | Влияние нормального старения на миелинизированные нервные волокна в центральной нервной системе обезьян
В центральной нервной системе есть два типа нервных волокон: миелинизированные и немиелинизированные. Миелинизированные нервные волокна представляют собой аксоны нейронов, которые окружены межузловыми участками миелина, образованными олигодендроцитами.В процессе развития межузловые отрезки миелина образуются на концах отростков олигодендроцитов, и каждое междоузлие генерируется путем спирального обертывания парного слоя плазматической мембраны олигодендроцитов. Первоначально последовательные витки спирали парных мембранных листов разделены цитоплазмой, но в конечном итоге цитоплазма вытесняется между витками. В результате образуется зрелый компактный миелин. На концах каждой межузловой длины миелина находятся области, называемые параузлами, и здесь последовательно заканчиваются витки спиральных оберток миелиновой мембраны, причем самый внутренний заканчивается первым (рис.
).По мере того как витки миелина заканчиваются, оболочка постепенно становится тоньше и в конечном итоге заканчивается на узлах Ранвье, которые разделяют последовательные межузловые отрезки миелина. В узлах аксон голый, но с густым подшерстком.
Рис. 1. Продольный разрез миелинизированного нервного волокна в первичной зрительной коре головного мозга макаки-резуса. Срез проходит через узел Ранвье (N), где аксолемма имеет характерную грунтовку.По обе стороны от узла расположены пара узлы (p). Оболочка справа имеет 8 ламелей, в то время как левая более толстая, с 15 ламелями, так что у нее более длинный паранод. Шкала шкалы = 1 микрон. (Из Peters and Sethares, 2003 г.
).
Олигодендроцит образует несколько межузловых участков миелина, каждая на своем аксоне, и, как правило, чем больше диаметр аксона, тем толще его миелиновая оболочка и тем длиннее его междоузлия и паранозы (см. Рис.
). И поскольку кажется, что существует некоторый предел количества миелина, который индивидуальный олигодендроцит может продуцировать и поддерживать, олигодендроциты, которые миелинизируют аксоны малого диаметра, образуют более межузловые участки миелина, чем те, которые миелинизируют аксоны большего диаметра.Миелин содержит липопротеины, поэтому в незафиксированном мозге миелиновые оболочки имеют белый блеск. Следовательно, участки центральной нервной системы, которые содержат в основном миелинизированные нервные волокна и несколько нейронов, называются белым веществом. Напротив, серое вещество содержит тела клеток и дендриты нейронов и меньшее количество миелинизированных нервных волокон.
Наши исследования были связаны с влиянием возраста на миелинизированные нервные волокна в центральной нервной системе приматов, не относящихся к человеку, макаки-резус ( Macaca mulatta ).Обезьяна-резус представляет собой отличную модель для изучения воздействия нормального старения на мозг, поскольку, в отличие от людей, макаки-резус не имеют нейрофибриллярных клубков и не подвержены деменции, характерной для болезни Альцгеймера. У людей наличие этого заболевания затрудняет изучение эффектов нормального старения, потому что часто бывает проблема определить, действительно ли пожилые люди нормальны, поскольку у них может быть начало болезни Альцгеймера, которая морфологически характеризуется наличием как старческих бляшек, так и нейрофибриллярных клубков, вызывающих гибель нейронов.Действительно, недавние исследования показали, что у некоторых когнитивно неповрежденных людей в мозгу может быть значительное количество бляшек и клубков (например, Bennett, 2006
; Сильвер и др., 2002
). Дополнительные трудности в определении того, какие из морфологических изменений старения, которые происходят в мозге человека, ответственны за нормальное снижение когнитивных функций, заключается в том, что большинство пожилых людей не проходили поведенческое тестирование до того, как их мозг станет доступным для исследования, поэтому их реальный когнитивный статус обычно не соответствует действительности. известен.И даже когда мозг становится доступным для исследования, задержка с фиксацией ткани обычно оставляет структурную сохранность менее оптимальной.
Макаки-резусы живут максимум 35 лет (Tigges et al., 1988
), а преимущество их использования в качестве модели нормального старения состоит в том, что они не подвержены болезни Альцгеймера и в целом не теряют значительного количества нейронов коры головного мозга с возрастом (см. Merrill et al., 2000
; Моррисон и Хоф, 1997
; Peters et al., 1998
), Однако Smith et al.(2004)
недавно заявили, что может быть очаговая потеря нейронов кортикальной области 8A префронтальной коры. Ни один из нейронов в коре головного мозга стареющих обезьян не имеет нейрофибриллярных клубков, и, хотя могут присутствовать некоторые старческие бляшки, особенно в лобной и первичной соматосенсорной коре головного мозга старых обезьян, их немного (Heilbroner and Kemper, 1990
; Struble et al., 1985
). Небольшое количество бляшек увеличивается с возрастом у обезьян, но нет корреляции между бляшками и когнитивным снижением (Sloane et al., 1997 г.
). Другое преимущество использования обезьян для изучения нормального когнитивного снижения состоит в том, что на протяжении всего периода их жизни обезьян можно тестировать на поведенческом уровне, чтобы определить их когнитивный статус, а в наших исследованиях их когнитивный статус определяется индексом когнитивных нарушений (CII). . Затем их мозг можно должным образом подготовить к морфологическому, физиологическому или биохимическому анализу.
Первый намек на возрастные изменения миелинизированных нервных волокон пришел из наблюдения, что у старых людей и обезьян наблюдается снижение интенсивности окрашивания белого вещества гемотоксилином (например,г., Кемпер, 1994
; Линтл и Браак, 1983 г.
). Основная причина этой повышенной бледности при окрашивании миелином все еще не ясна, но теперь известно, что существует ряд возрастных изменений миелинизированных нервных волокон в центральной нервной системе приматов, таких как потеря некоторых миелинизированных нервных волокон и изменения в морфологии и составе миелиновых оболочек, которые могут объяснить снижение интенсивности окрашивания. Некоторые из этих изменений будут рассмотрены в следующих разделах, в которых основное внимание будет уделено возрастным изменениям, которые наблюдались у нечеловеческих приматов.Также будут рассмотрены корреляции, возникающие между возрастными морфологическими изменениями миелинизированных нервных волокон и когнитивным снижением.
Потеря миелинизированных нервных волокон
Магнитно-резонансная томография (МРТ) обоих людей (например, Альберт, 1993 г.
; Guttmann et al., 1998
) и обезьяны (Lai et al., 1995
; Виско и др., 2008 г.
) мозг показал, что с возрастом происходит потеря белого вещества полушариями головного мозга. Например, Wisco et al. (2008)
подсчитайте, что у макак-резусов 11.5% потеря белого вещества из переднего мозга с возрастом, в отличие от потери только 2% серого вещества. Однако следует отметить, что другие исследования на людях (например, Pfefferbaum et al., 1994
; Резник и др., 2003 г.
; Салливан и др., 2004 г.
) и обезьяны (Andersen et al., 1999
) предполагают, что потеря объема полушарий в основном происходит из-за истончения коры головного мозга. Тем не менее, похоже, есть общее согласие с тем, что с возрастом происходит некоторая потеря белого вещества, и это подтверждается стереологическими исследованиями когнитивно нормального человеческого мозга.Первым из этих исследований было исследование Паккенберга и Гундерсена (1997).
которые исследовали мозг людей в возрасте от 20 до 95 лет и использовали принцип Кавальери для определения изменений объема, они пришли к выводу, что объем белого вещества полушарий головного мозга уменьшается на 28%. В другом исследовании той же лаборатории Tang et al. (1997)
с помощью световой и электронной микроскопии пришли к выводу, что эта потеря связана с 27% общей потерей длины миелинизированных нервных волокон из белого вещества.Позже Марнер и др. (2003)
расширили эти исследования, изучив образцы, которые были взяты систематически и случайным образом из белого вещества 36 нормальных мозгов мужчин и женщин в возрасте от 18 до 93 лет. Они пришли к выводу, что, хотя общая потеря белого вещества полушариями головного мозга человека составляет 23%, общее уменьшение общей длины миелинизированных нервных волокон еще больше и составляет 45%. О подобной потере миелинизированных нервных волокон из головного мозга человека сообщили Meier-Ruge et al.(1992)
, которые исследовали мозг когнитивно нормальных людей и пришли к выводу, что потеря миелинизированных нервных волокон из белого вещества прецентральной извилины составляет 16%, а из мозолистого тела — 11%.
Исследования влияния возраста на мозг обезьяны подтверждают утверждение о том, что с возрастом происходит потеря миелинизированных нервных волокон. В каждом из исследованных нами трактов белого вещества была обнаружена некоторая потеря миелинизированных нервных волокон. В течение жизни обезьяны среднее количество миелинизированных нервных волокон, теряемых из зрительного нерва (Sandell and Peters, 2001
) и от передней комиссуры (Sandell, Peters, 2003
) составляет около 45%, в то время как от свода и звездочки мозолистого тела (неопубликованные данные) потеря составляет около 25%.Во всех четырех структурах корреляция между уменьшением количества миелинизированных нервных волокон и возрастом значительна.
Напротив, нет измеримой потери миелинизированных нервных волокон из зрительной коры (Nielsen and Peters, 2000).
), но неспособность обнаружить потерю может быть из-за относительно небольшого количества миелинизированных нервных волокон, присутствующих в коре головного мозга, потому что в коре было замечено несколько миелинизированных нервных волокон с дегенерирующими аксонами (рис.
). Действительно, миелинизированные нервные волокна с дегенерирующими аксонами, на что указывает в электронном микроскопе наличие плотной аксоплазмы с утраченными органеллами или наличие пустых миелиновых оболочек (рис.
), были обнаружены во всех исследованных нами частях стареющего мозга обезьяны, что позволяет предположить, что потеря миелинизированных нервных волокон является повсеместным явлением.И, основываясь на более ранних исследованиях дегенерации нервных волокон Валлера, нет никаких сомнений в том, что после дегенерации аксона неумолимо следует разрушение и дегенерация его миелиновой оболочки (например, Guillery, 1970
).
Рис. 2. В поле находится нормальное нервное волокно (N) и другое нервное волокно (E), в котором аксон дегенерировал, оставив пустую оболочку. Слой 4 из области 46 27-летней макаки-резуса. Шкала шкалы = 1 микрон.
Потеря миелинизированных нервных волокон из белого вещества в проводящих путях должна привести к некоторому разъединению между различными частями центральной нервной системы.Но что интересно, хотя нет никаких существенных корреляций между степенью потери миелинизированных нервных волокон из звездочки мозолистого тела и когнитивным снижением, наблюдаемым у обезьян (Peters and Sethares, 2002
), существует корреляция между снижением когнитивных функций и потерей миелинизированных нервных волокон из передней комиссуры (Sandell and Peters, 2003
) и свод (не опубликовано). В этом контексте интересно, что перерезание звездочки мозолистого тела, которое является основным волокнистым путем, соединяющим затылочную кору, мало влияет на познавательные способности (Innocenti, 1986
).Передняя комиссура обеспечивает межполушарную связь между всей височной долей, а также частями препириформной коры орбитофронтальной коры и миндалевидного тела (Demeter et al., 1990
; Жуанде и Газзанига, 1979 г.
; Салливан и Гамильтон, 1973a
, б
), и многочисленные исследования показали, что передняя комиссура обеспечивает путь, по которому визуальная информация может достигать противоположного полушария и способствовать поведенческим реакциям, таким как дискриминация двух вариантов (Doty et al., 1994 г.
; Гросс и др., 1977 г.
; Соботка и Ринго, 1996 г.
). Свод, с другой стороны, несет основную продукцию гиппокампа, и исследования эффектов повреждения свода у обеих обезьян (Fletcher et al., 2006
; Гаффан и др., 2001 г.
; Оуэн и Батлер, 1981
; Уилсон и др., 2007 г.
) и людей (например, D’Esposito et al., 1995
; Гаффан и др., 1991
) раскрыли роль свода в памяти и описали амнезию как главное последствие возникновения таких повреждений.
Можно предположить, что, поскольку миелинизированные нервные волокна теряются из белого вещества с возрастом, должна быть сопутствующая потеря нейронов, из которых возникают нервные волокна.Что касается зрительного нерва, то это может быть так, поскольку ганглиозные клетки сетчатки подвержены повреждению в результате глазных изменений и системных заболеваний, которые часто возникают у пожилых людей (Garner et al., 1994
). Но для других путей центральной нервной системы, в которых миелинизированные нервные волокна возникают из кортикальных нейронов, следует искать другую причину, потому что, как указано выше, недавние исследования показали, что при нормальном старении несколько нейронов теряются из коры головного мозга. обезьян или людей (например,г., Hof et al., 2000
; Merrill et al., 2000
; Моррисон и Хоф, 1997
; Паккенберг и Гундерсен, 1997 г.
; Peters et al., 1998
), и Freeman et al. (2008)
недавно показали, что у нормально стареющих людей количество корковых нейронов сохраняется даже при корковой атрофии. Чтобы объяснить возрастную потерю миелинизированных нервных волокон из белого вещества, мы предположили, что только часть аксонального сплетения пирамидной клетки, которая входит в белое вещество, дегенерирует в результате отмирания, оставляя более обширные локальные аксональные клетки. сплетение коры головного мозга неповреждено (Peters and Rosene, 2003
).Этот сценарий объясняет как потерю некоторых миелинизированных нервных волокон из белого вещества, так и неспособность обнаружить потерю миелинизированных нервных волокон из самой коры головного мозга.
Дегенеративные изменения миелиновых оболочек
Очевидно, что при нормальном старении некоторые миелиновые оболочки дегенерируют в результате дегенерации их аксонов, но в других случаях миелиновые оболочки дегенерируют, даже если аксон не поврежден. В последней категории есть два вида изменений миелиновой оболочки. Наиболее частым возрастным дегенеративным изменением является накопление темной цитоплазмы в карманах, возникающих в результате расщепления основной плотной линии (например,грамм. Peters et al., 1994
; Питерс и Сетхарес, 2002
; Peters et al., 2000
; Санделл и Питерс, 2003 г.
). Примеры того, что будет называться плотными оболочками, показаны на рисунке 3.
. Расположение плотной цитоплазмы в разрывах основной плотной линии подразумевает, что цитоплазма должна происходить от родительского олигодендроцита, потому что основная плотная линия миелиновой оболочки образуется путем сопоставления цитоплазматических поверхностей плазматической мембраны олигодендроцита, образующего миелиновая оболочка.Количество плотной цитоплазмы может варьироваться от небольшого количества, содержащегося в локальном разрезе оболочки, до обширного скопления, вызывающего выпячивание оболочки в окружающее межклеточное пространство. Продольные срезы пораженных влагалищ показывают, что скопления плотной цитоплазмы локализованы, хотя может быть несколько таких локусов вдоль междоузлия миелина. Доказательство того факта, что накопление плотной цитоплазмы при нормальном старении является дегенеративным изменением, получено из исследований токсичности курпризона, которая приводит к гибели олигодендроцитов, что приводит к образованию плотной цитоплазмы в цитоплазматическом процессе на внутренней стороне миелиновой оболочки ( Людвин, 1978
).Подобная плотная цитоплазма также встречается в оболочках мышей с миелин-ассоциированным дефицитом гликопротеинов (например, Lassmann et al., 1997
).
Рис. 3. Поперечный разрез пучка нервных волокон в первичной зрительной коре 29-летней макаки-резус. В этом пучке одни нервные волокна (N) имеют нормальную оболочку и разделены междоузлиями, а другие (P) — параузлами. Три нервных волокна (D) имеют дегенерирующие оболочки, о чем свидетельствует скопление плотной цитоплазмы в промежутках между пластинками.Шкала шкалы = 1 микрон.
Другое, но менее распространенное изменение миелина, связанное со старением, — это образование миелиновых шаров (например, Feldman and Peters, 1998
; Питерс и Сетхарес, 2003
). Эти воздушные шары могут достигать 10 мкм в диаметре, так что даже при световой микроскопии более крупные воздушные шары видны как дыры в нейропиле стареющей коры. Электронно-микроскопический анализ показывает, что эти отверстия на самом деле являются локализованными полостями, заполненными жидкостью, которые размещены за счет расщеплений во внутрипериодной линии пораженных оболочек, и, поскольку внутрипериодная линия образуется путем наложения внешних поверхностей цитоплазматической мембраны олигодендроцита, заполненные жидкостью мешочки потенциально контактируют с внеклеточным пространством.В более крупных баллонах аксон нервного волокна отодвигается к одной стороне оболочки, что позволяет предположить, что жидкость в мешочке оказывает некоторое давление. Но, несмотря на это, оболочка по всему баллону имеет одинаковую толщину, и нет явного изменения периодичности миелиновых пластинок. Следовательно, миелиновая оболочка не кажется эластичной, и поэтому образование баллона должно повлечь за собой производство избыточного миелина родительским олигодендроцитом. Следует подчеркнуть, что плотные оболочки и баллоны не являются полностью отдельными объектами, поскольку нередко баллон имеет плотную цитоплазму в его основании или оболочку с баллоном имеет плотную цитоплазму между пластинками.Опять же, есть свидетельства того, что образование воздушных шаров является дегенеративным процессом, поскольку миелиновые шары могут быть произведены купризоном (Ludwin, 1978
) и тетраэтилолово (Маламуд, Хирано, 1973
) токсичность и хроническое отравление медью (Hull and Blakemore, 1974
). Воздушные шары могут также возникать на ранних этапах валлеровской дегенерации (Franson and Ronnevi, 1989).
), а также при тяжелом диабете (Tamura and Parry, 1994.
).
Когда исследуется процент миелинизированных нервных волокон, показывающих наличие плотной цитоплазмы или баллонов, обнаруживается, что частота таких профилей значительно увеличивается с возрастом (например,грамм. Фельдман и Петерс, 1998 г.
). Что еще более важно, существует значительная корреляция между когнитивным снижением и частотой профилей дегенерирующих оболочек в области коры 46 (Peters and Sethares, 2002
), звездочка мозолистого тела (Peters, Sethares, 2002
), передняя комиссура (Sandell and Peters, 2003
) и fornix (неопубликованные данные). Исключением является первичная зрительная кора, в которой нет корреляции между когнитивным снижением и дегенерацией миелиновой оболочки (Peters et al., 2000 г.
). Это может быть связано с тем, что первичная зрительная кора не играет большой роли в познании. Предполагается, что корреляция между дегенерацией миелина и когнитивными функциями обусловлена дегенеративным замедлением скорости проводимости и, таким образом, влияет на синхронизацию в нейронных цепях.
Duce et al. (2007)
идентифицировали ряд генов, которые могут вызывать цитотоксичность в белом веществе. Эти гены варьируются от генов, которые могут влиять на продолжительность жизни, до генов, которые могут влиять на реорганизацию глиального цитоскелета, других, которые могут вызывать окислительное и протеолитическое повреждение, а также других, которые являются ингибиторами клеточного цикла.Но эти авторы обращают особое внимание на ген под названием Klotho, многофункциональный ген, который, как известно, защищает от окислительного стресса, и предполагают, что со снижением активности Klotho происходит потеря этой защиты, что может привести к смерти олигодендроциты.
Продолжение образования миелина
Существуют и другие возрастные изменения миелиновых оболочек, которые указывают на то, что миелин продолжает формироваться с возрастом. Первый — это увеличение общей толщины нормальных миелиновых оболочек с возрастом.Так, в первичной зрительной коре головного мозга обезьяны среднее количество ламелей в оболочках миелинизированных нервных волокон в слое 4Cβ молодых обезьян составляет 5,6, а у старых обезьян — 7,0 (Peters et al., 2001
). Однако увеличение толщины ножен не является равномерным, потому что среднее увеличение количества ламелей происходит в основном из-за того, что толстые ножны, состоящие более чем из 10 ламелей, становятся все более распространенными у старых обезьян. Это увеличение количества ламелей на нервных волокнах с более толстыми миелиновыми оболочками часто влияет на их паранозы, так что в то время как на продольных участках молодых нервных волокон видны оканчивающиеся паранодальные карманы цитоплазмы, это обычная последовательность, и все они находятся в контакте с подлежащей аксолеммой. (см. рисунок 1
), в нервных волокнах старых обезьян с более толстыми оболочками паранозы могут быть нарушены.Они могут быть наложены друг на друга, так что только некоторые из паранодальных петель контактируют с аксолеммой (Hinman et al., 2006
). Похожая ситуация наблюдалась в миелинизированных нервных волокнах старых крыс (Sugiyama et al., 2002
), и кажется вероятным, что такое нарушение паранодальной области может повлиять на скорость проводимости. На данный момент, по-видимому, не установлено, становятся ли миелиновые оболочки белого вещества с возрастом толще.
Другое изменение, которое, как считается, указывает на продолжающееся образование миелина, — это образование оболочек, которые содержат избыточный миелин, так что оболочки слишком велики для заключенных в них аксонов.Когда такие оболочки подвергаются поперечному сечению и исследуются с помощью электронной микроскопии, можно видеть, что аксон расположен на одном конце чрезмерно большой оболочки, которая петлей входит в окружающий нейропиль. Такие ножны впервые были описаны Розенблютом (1966).
в мозжечке жабы. Старрок (1976)
описали такие влагалища в передних спайках старых мышей, а позже Каллен и Вебстер (1979)
обнаружили, что они часто встречаются в зрительных нервах метаморфизирующихся жаб. Во время метаморфоза зрительные нервы становятся короче, а миелиновые оболочки подвергаются обширному ремоделированию, образуя избыточные оболочки, которые исчезают позже в процессе развития.Эти события привели Каллена и Вебстера к предположению, что избыточное производство миелина должно позволить оболочкам увеличиваться, чтобы они могли приспособиться к последующему увеличению диаметра заключенных аксонов. Однако роль избыточных оболочек в процессе старения еще не очевидна, хотя аксоны в этих оболочках обычно имеют небольшой диаметр.
При количественной оценке частот различных профилей миелинизированных нервных волокон в вертикальных пучках нервных волокон в коре головного мозга становится очевидным, что частота профилей паранозов увеличивается с возрастом (Peters and Sethares, 2003
).Как указывалось ранее, для настоящих целей паранозы определяются как те области на концах междоузлий, где спиральные миелиновые ламели постепенно заканчиваются по мере приближения оболочки к узлу Ранвье. По мере того как миелиновые ламели заканчиваются, основная плотная линия открывается, чтобы вмещать спираль цитоплазмы, которая на продольных срезах через парано-узлы выглядит как серия карманов цитоплазмы на каждой стороне аксона (см. Рисунок 1).
). Там, где плазматическая мембрана на внутренних поверхностях этих карманов встречается с аксолеммой, две мембраны становятся очень близко друг к другу и образуют соединительный комплекс.Это наложение мембран позволяет довольно легко идентифицировать профили миелинизированных нервных волокон, разрезанных через пара узлы (рис.
), и оказывается, что частота паранодальных профилей в стареющей зрительной коре увеличивается на 57%, а площадь 46 префронтальной коры увеличивается на 90% (Peters and Sethares, 2003
) и увеличение передней спайки на 60% (Sandell and Peters, 2003
).
У такого возрастного увеличения паранодальных профилей может быть две причины. Один из них — это увеличение длины паранодей с возрастом.Во-вторых, общее увеличение числа паранозов. Паранозы действительно становятся немного длиннее, так как количество ламелей в миелиновых оболочках увеличивается с возрастом, но этого недостаточно, чтобы объяснить 60% или более увеличение частоты паранодальных профилей. Следовательно, увеличение частоты должно быть связано с увеличением общего количества межузловых отрезков миелина. Это могло бы произойти, если бы имела место ремиелинизация, так что некоторые из исходных межузловых участков миелина дегенерируют и заменяются более короткими междоузлиями.Общепринятыми отличительными признаками ремиелинизации являются наличие коротких междоузлий и оболочек, несоответствующей тонкости размеру включенных аксонов (например, Brück et al., 2003
; Хирано, 1989 г.
; Кройцеберг и др., 1997 г.
; Людвин, 1995
; Принес и Макдональд, 1997 г.
). Такие междоузлия были обнаружены в стареющей центральной нервной системе. У старых обезьян присутствуют междоузлия миелина длиной от 3 до 8 мкм, а также оболочки, несоответствующие тонкости размера замкнутого аксона (см. Peters and Sethares, 2003
).Нам не удалось идентифицировать демиелинизированные нервные волокна в мозге обезьяны, но это не должно вызывать удивления, поскольку можно ожидать, что такие демиелинизированные нервные волокна будут напоминать немиелинизированные нервные волокна. Однако в подтверждение того факта, что имеет место демиелинизация, мы наблюдали фрагменты дегенерирующего миелина в цитоплазме как микроглии, так и, чаще, в астроцитах мозга стареющих обезьян. Также часть аморфного фагоцитированного материала в цитоплазме астроцитов в коре головного мозга старых обезьян маркирует антитела к основному белку миелина (Peters and Sethares, 2003
).Недавняя статья о ремиелинизации спинномозговых нервных волокон, которые ремиелинизируются после ушиба спинного мозга мышей, проливает свет на то, что происходит во время старения. Lasiene et al. (2008)
показали, что ремиелинизированные нервные волокна в руброспинальном тракте мышей имеют гораздо меньшую длину междоузлий, чем у контрольных мышей, и что эти ремиелинизированные аксоны проводят с меньшей скоростью, чем контрольные. Есть также свидетельства того, что скорость проводимости в нервных волокнах стареющих кошек снижается (Morales et al., 1987 г.
; Си и др., 1999 г.
). Снижение скорости проводимости также происходит при демиелинизирующих заболеваниях (например, Felts et al., 1997
; Ваксман и др., 1995 г.
).
Следовательно, можно предположить, что ремиелинизированные нервные волокна с более короткими междоузлиями у стареющей обезьяны также имеют более медленную скорость проводимости, чем нервные волокна, на которые не влияет возраст, и что это может повлиять на синхронизацию в нейронных цепях (например, см. Wang et al. , 2005 г.
). Однако, когда исследуются корреляции между частотой встречаемости профилей паранозов и общим когнитивным статусом отдельных обезьян, измеряемым с помощью индекса когнитивных нарушений, CII, значимой корреляции между двумя показателями для зрительной коры и передней части мозга не наблюдается. комиссура, но есть корреляция для области 46 префронтальной коры ( p Peters and Sethares, 2002
).Причина этой корреляции между CII и паранодальной частотой может быть связана с уникальной ролью префронтальной коры в познании.
Влияние возраста на олигодендроциты
В коре головного мозга обезьян, окрашенной реакцией Perl на трехвалентное железо, отростки некоторых олигодендроцитов у старых обезьян показывают вздутие по всей длине (рис.
; вставка), а при исследовании этих вздутий в электронном микроскопе видно, что они содержат плотные включения (рис.
). Подобные плотные включения встречаются и в перикариях старых олигодендроцитов (Peters, 1996
; Питерс и Сетхарес, 2004
; Peters et al., 1991 г.
), а поскольку плотный материал не связан с мембраной, маловероятно, что он будет произведен в результате фагоцитоза. Подобные набухания вдоль отростков олигодендроцитов были зарегистрированы у мышей twitcher, которые являются моделью глобоидной лейкодистрофии, и Levine and Torres (1992).
предполагают, что материал в опухолях происходит из компонентов обновляемых миелиновых оболочек. Скорее всего, этот материал образуется в результате дегенерации некоторых компонентов миелиновых оболочек, принадлежащих олигодендроцитам, и есть соблазн предположить, что этот материал связан с плотной цитоплазмой, которая накапливается между пластинками некоторых оболочек у старых обезьян.
Рис. 4. Электронная микрофотография олигодендроцита в слое 6 области 17 у 35-летней обезьяны-резуса. Три отростка p1 – p3 отходят от тела клетки. Один из отростков, p1, имеет набухание, содержащее плотные включения, похожие на плотные включения в теле клетки. Шкала шкалы = 1 микрон. Вставка показывает изображение под световым микроскопом олигодендроцита, окрашенного реакцией Перла на соединения железа. Обратите внимание на большую припухлость (стрелка) на одном из отростков.Он аналогичен процессу p1 на прилагаемой электронной микрофотографии. Площадь 46 28-летней обезьяны. Шкала шкалы = 10 мкм.
У старых обезьян также часто встречаются олигодендроциты парами, рядами и группами, что позволяет предположить, что олигодендроциты могут размножаться с возрастом (Peters and Sethares, 2004
; Peters et al., 1991
), и когда сравниваются количества олигодендроцитов в молодой и старой первичной зрительной коре, становится очевидным, что количество олигодендроцитов увеличивается с возрастом (Peters et al., 1991 г.
). Так, например, в слое 4Cβ, в котором олигодендроциты составляют около 55% от общей популяции нейроглиальных клеток, с возрастом количество олигодендроцитов увеличивается на 50% (Peters and Sethares, 2004
). В более позднем исследовании была проведена оценка влияния возраста на популяции нейроглиальных клеток по всей глубине первичной зрительной коры головного мозга обезьян (Peters et al., 2008
). Было видно, что количество олигодендроглиальных клеток в различных слоях по существу отражает частоту миелинизированных нервных волокон внутри них, причем наибольшее количество олигодендроцитов находится в более глубоких слоях.Опять же, с возрастом было обнаружено, что количество олигодендроцитов во всех слоях увеличивается примерно на 50%. Напротив, частота встречаемости астроцитов или микроглиальных клеток с возрастом не меняется. Также с возрастом увеличивается частота олигодендроцитов в зрительном нерве обезьян (Sandell and Peters, 2002).
), а также в своде (неопубликованные данные), но не в передней комиссуре (Sandell, Peters, 2003
). Причина этой разницы пока не ясна.
Какова причина увеличения количества образующихся олигодендроцитов и почему они необходимы? Формирование групп и рядов олигодендроцитов во время старения можно рассматривать как предположение, что олигодендроциты делятся, но преобладает мнение, что зрелые олигодендроциты не делятся (см. Keirstead and Blakemore, 1997
; Людвин, 1995
; Нортон, 1996 г.
), а при исследовании генерации новых клеток во взрослой зубчатой извилине гиппокампа у старых обезьян с использованием мечения BrdU меченых олигодендроцитов обнаружено не было (Ngwenya et al., 2008 г.
). Более вероятно, что новые олигодендроциты происходят из клеток-предшественников олигодендроглии, которые экспрессируют хондроитинсульфат NG2. Эти клетки разбросаны по центральной нервной системе, и у взрослых грызунов они составляют около 5% всех нейроглиальных клеток (например, Levine et al. 2001 г.
).
Исследования, подобные исследованию Cerghet et al. (2006)
показали, что у взрослых мышей происходит оборот олигодендроглиальных клеток, так что некоторые олигодендроциты подвергаются апоптозу и умирают, в то время как образуются новые олигодендроциты.И что интересно, Cerghet et al. (2006)
обнаружили, что оборот олигодендроцитов в мозолистом теле у самок мышей выше, чем у самцов, что указывает на то, что продолжительность жизни олигодендроцитов у самок короче, чем у самцов. Более того, Rivers et al. (2008)
недавно показали, что у взрослых мышей многие из вновь образованных олигодендроцитов, которые возникают из клеток-предшественников олигодендроцитов во взрослом возрасте, участвуют в миелинизации. Они подсчитали, что около 20% всех олигодендроцитов в мозолистом теле взрослого человека генерируются в зрелом возрасте, и что многие из этих клеток образуют миелин.Напротив, та же группа подсчитала, что только около 5% олигодендроцитов, рожденных взрослыми в коре головного мозга, по-видимому, участвуют в формировании миелиновых оболочек, но Rivers et al. (2008)
не смогли определить функцию других взрослых олигодендроцитов, присутствующих в коре головного мозга.
К сожалению, информации о скорости оборота олигодендроцитов у взрослой обезьяны нет, но нет оснований сомневаться в том, что она принципиально отличается от скорости у грызунов.
Предполагается, что следующий сценарий может объяснить имеющиеся данные о влиянии возраста на миелинизированные нервные волокна в центральной нервной системе обезьяны. Во время старения некоторые нейроны теряют свои длинные выступающие миелинизированные аксоны, которые входят в белое вещество, сохраняя при этом свои локальные сплетения, так что родительский нейрон не умирает. Следствием этого является то, что, как было продемонстрировано, некоторые миелинизированные нервные волокна теряются из белого вещества, даже если не происходит значительной потери нейронов из коры головного мозга.Для других нейронов эффекты старения менее серьезны (см. Рис. 5).
), поскольку их аксоны остаются неповрежденными, даже несмотря на то, что некоторые из межузловых участков миелина, покрывающего их, дегенерируют (рис.
Б). Процесс демиелинизации, вероятно, начинается, когда олигодендроцит испытывает стресс и начинает накапливать плотные включения в опухолях своих отростков и в перикарионе, а также в промежутках между пластинками миелиновых оболочек, за которые отвечает олигодендроцит. В конечном итоге олигодендроцит умирает, что приводит к дегенерации и потере межузловой длины миелина, принадлежащего этому олигодендроциту (рис.
C).Затем клетки-предшественники олигодендроцитов активируются и генерируют новые олигодендроциты, которые восстанавливают повреждение путем ремиелинизации голых участков аксонов. В процессе ремиелинизации несколько новых олигодендроцитов вовлекаются в замену исходного междоузлия миелина. Эти олигодендроциты производят более короткие межузловые промежутки, чем исходные, а новые оболочки тоньше (рис.
D). Таким образом, когда исследуются профили секционированных миелиновых оболочек у старых обезьян, обнаруживается увеличение числа профилей паранодей, и это сопровождается увеличением общего числа олигодендроцитов.Это разрушение миелиновых оболочек вместе с образованием более коротких межузловых участков миелина и последующим увеличением числа узлов Ранвье приведет к замедлению скорости проводимости по пораженным миелинизированным нервным волокнам. Следовательно, это повлияет на синхронизацию в нейронных цепях и будет способствовать когнитивным нарушениям, которые возникают с возрастом.
Рис. 5. Схематическое изображение дегенерации оболочек с возрастом и последующей ремиелинизации аксонов. (A) Нормальное состояние. (B) Некоторые оболочки изменяются из-за наличия плотной цитоплазмы и образования баллонов. Считается, что это происходит, когда олигодендроцит накапливает плотные включения внутри своего тела клетки и внутри опухолей вдоль своих отростков. (C) Дегенерация миелиновых оболочек оставляет аксоны обнаженными. (D) Голые аксоны ремиелинизируются вновь образованными олигодендроцитами, которые образуют короткие межузловые участки с тонкими оболочками.
Заявление о конфликте интересов
Автор заявляет, что это исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Автор хотел бы поблагодарить Клэр Фолджер за ее постоянную помощь и квалифицированную техническую помощь во время проведения этих исследований стареющего мозга. Я также благодарен ей за то, что она показала изменения, которые влияют на миелиновые оболочки во время старения.Эта работа финансировалась Национальными институтами здравоохранения, Национальным институтом старения, грант программного проекта 1P0 AG000001.
Альберт, М. (1993). Нейропсихологические и нейрофизиологические изменения у здоровых взрослых людей в любом возрасте. Neurobiol. Старение 14, 623–625.
Андерсен А. Х., Чжан З., Гаш Д. М. и Ависон М. Дж. (1999). Возрастные изменения в составе ЦНС, выявленные с помощью МРТ. Brain Res. 829, 90–98.
Беннетт, Д. А. (2006). Посмертные индексы, связывающие факторы риска с познанием: результаты исследований религиозного порядка и проекта «Память и старение». Alzheimer Dis. Доц. Disord. 20, S63 – S68.
Брюк В., Кульман Т. и Штадельманн К. (2003). Ремиелинизация при рассеянном склерозе. J. Neurol. Sci. 206, 181–185.
Cerghet, M., Skoff, R.P., Bessert, D., Zhang, Z., Mullins, C., and Ghandour. М. С. (2006). Пролиферация и гибель олигодендроцитов и белков миелина по-разному регулируются у самцов и самок грызунов. J. Neurosci. 26, 1439–1447.
Каллен, М. Дж., И Вебстер, Г. Д. (1979). Ремоделирование оболочек и аксонов зрительных нервов во время метаморфоза у Xenopus laevis . J. Comp. Neurol. 184, 353–362.
Деметер, С., Розен, Д. Л., и Ван Хусен, Г. У. (1990). Поля происхождения и пути межполушарных комиссур в височной доле макак. J. Comp. Neurol. 302, 29–53.
Д’Эспозито М., Верфали М., Александер М. П. и Кац Д. И. (1995). Амнезия после травматического двустороннего рассечения свода. Неврология 45, 1546–1550.
Доти, Р. В., Ринго, Дж. Л. и Левин, Дж. Д. (1994). Межполушарное разделение зрительной памяти у макак. Behav. Brain Res. 64Z, 79–84.
Дуче, Дж. А., Подви, С., Холландер, В., Киплинг, Д., Розен, Д. Л., и Абрахам, К. Р. (2007). Анализ генного профиля предполагает, что Klotho является важным фактором старения в белом веществе мозга макаки-резуса. Glia 56, 106–117.
Фельдман М. Л. и Петерс А. (1998). Раздувание миелиновых оболочек у макак нормального возраста. J. Neurocytol. 27, 605–614.
Фелтс П. А., Бейкер Р. А. и Смит К. Дж. (1997). Проведение по сегментарно демиелинизированным центральным аксонам млекопитающих. J. Neurosci. 17, 7267–7277.
Флетчер Б. Р., Калхун М. Э., Рапп П. Р. и Шапиро М. Л. (2006). Поражения свода отделяют индукцию транскрипции дуги гиппокампа от поведения, но не от пластичности. J. Neurosci. 26, 1507–1515.
Франсон П., Ронневи Л.-О. (1989). Распад миелина в заднем канатике котенка после дорсальной ризотомии: качественное световое и электронно-микроскопическое исследование. Анат. Эмбриол. 180, 273–280.
Фриман, С.Х., Кандел, Р., Круз, Л., Розкаин, А., Ньюэлл, К., Фрош, М. П., Хедли-Уайт, Т., Локацио, Дж. Дж., И Хайман, Б. Т. (2008). Сохранение числа нейронов, несмотря на возрастную атрофию коркового слоя головного мозга у пожилых людей без болезни Альцгеймера. J. Neuropathol. Exp. Neurol. 67, 1205–1212.
Гаффан, Э.А., Гаффан, Д., и Ходжес, Дж. Р. (1991). Амнезия после повреждения левого свода и других участков. Сравнительное исследование. Мозг 114, 1297–1313.
Гаффан, Э.А., Паркер, А., и Истон, А. (2001). Плотная амнезия у обезьяны после рассечения свода, миндалины и передней височной ножки. Neuropsychologica 39, 51–70.
Гарнер А., Саркс С. и Сракс Дж. П. (1994). Дегенеративные и связанные с ними нарушения сетчатки и сосудистой оболочки. В патобиологии глазных болезней; Динамический подход, А. Гарнер и Г. К. Клинтворт, редакторы (Нью-Йорк, Марсель Декер), стр. 631–674.
Гросс, К. Г., Бендер, Д. Б., и Мишкин, М. (1977). Вклад мозолистого тела и передней комиссуры в визуальную активацию нижних височных нейронов. Brain Res. 131, 227–239.
Гильери, Р. У. (1970). Свето- и электронно-микроскопические исследования нормальных и дегенерирующих аксонов. В «Современные методы исследования в нейроанатомии», У. Дж. Х. Наута и С. О. Эббессон, редакторы (Нью-Йорк, Спрингер), стр. 77–105.
Гуттманн, К. Р. Г., Джолес, Ф. А., Кикинис, Р., Киллиани, Р. Дж., Мосс, М. Б., Сандор, Т., и Альберт, М. С. (1998). Белое вещество изменяется при нормальном старении. Неврология 50, 972–978.
Хейльбронер, П. Л., и Кемпер, Т.Л. (1990). Цитоархитектоническое распределение сенильных бляшек у трех старых обезьян. Acta Neuropathol. 81, 60–65.
Хинман, Дж. Д., Петерс, А., Кабрал, Х., Розен, Д. Л., Холландер, В., Расбанд, М. Н., и Абрахам, К. Р. (2006). Возрастная молекулярная реорганизация в узле Ранвье. J. Comp. Neurol . 495, 351–362.
Хирано, А. (1989). Обзор морфологических аспектов ремиелинизации. Dev. Neurosci. 11, 112–117.
Хоф, Р.П., Нимчинский, Э.А., Toung, W.G., и Morrison, J.H. (2000). Число нейронов Мейнерта и слоя IVB в области V1: стереологический анализ у молодых и старых обезьян-макак. J. Comp. Neurol. 420, 113–126.
Халл, Дж. М., и Блейкмор, У. Ф. (1974). Хроническое отравление медью и изменения центральной нервной системы овец. Acta Neuropathol. 29, 9.
Инноченти, Г. М. (1986). Общая организация мозолистых связей в коре больших полушарий. В сенсорно-моторных областях и аспектах корковой связи.Кора головного мозга, Vol. 5, E. G. Jones и A. Peters, ред. (New York, Plenum Press), стр. 291–354.
Жуанде, М. Л., и Газзанига, М. С. (1979). Корковые поля происхождения передней спайки макаки-резус. Exp. Neurol. 66, 381–397.
Кейрстед, Х. С., и Блейкмор, У. Ф. (1997). Идентификация постмитотических олигодендроцитов, неспособных к ремиелинизации, в демиелинизированном спинном мозге взрослого человека. J. Neuropathol. Exp. Neurol. 56, 1191–1201.
Кемпер, Т. Л. (1994).Нейроанатомические и невропатологические изменения при старении и деменции. В клинической неврологии старения, М. Альберт и Дж. Э. Кнофель, ред. (Нью-Йорк: Oxford University Press), стр. 3–67.
Кройцеберг, Г., Блейкмор, В. Ф., и Грэбер, М. Б. (1997). Клеточная патология центральной нервной системы. В нейрофологии Гринфилда. Шестое издание, Д. И. Грэм и П. Л. Лантос, ред. (Лондон, Арнольд), стр. 85–156.
Лай, З. К., Розен, Д. Л., Киллиани, Р. Дж., Пульезе, Д., Альберт, М. С., и Мосс, М. Б. (1995). Abstr. — Soc. Neurosci. 21, 1564.
Ласиене, Дж., Шу, Л., Перлмуттер, С., и Хорнер, П. (2008). Нет доказательств хронической демиелинизации в сохранившихся аксонах после повреждения спинного мозга у мышей. J. Neurosci. 28, 3887–3896.
Лассманн, Х., Бартч, У., Монтаг, Д., и Шахнер, М. (1997). Умирающая олигодендроглиопатия; позднее последствие миелин-ассоциированного дефицита гликопротеинов. Glia 19, 104–110.
Левин, Дж. М., Рейнольдс, Р., Фосетт, Дж. У.(2001). Клетка-предшественник олигодендроцитов в здоровье и болезни. Trends Neurosci. 24, 39–47.
Левин, С. М., и Торрес, М. В. (1992). Морфологические особенности дегенерирующих олигодендроцитов у мышей twitcher. Brain Res. 587, 348–352.
Линтл П. и Браак Х. (1983). Потеря интракортикальных миелинизированных волокон: характерное возрастное изменение в полосатой области человека. Acta Neuropathol. 61, 178–182.
Людвин, С. К. (1978). Демиелинизация и ремиелинизация центральной нервной системы у мышей.Ультраструктурное исследование токсичности купризона. Lab. Вкладывать деньги. 39, 597–612.
Людвин, С. К. (1995). Патология миелиновой оболочки. В «Аксон: структура, функция и патофизиология», С. Г. Ваксман, Дж. Д. Кочис и П. К. Стис, ред. (Нью-Йорк, Oxford University Press), стр. 412–437.
Маламуд, Н., Хирано, А. (1973). Атлас невропатологии. Беркли, Калифорнийский университет Press.
Марнер Л., Ньенгаард Дж. Р., Танг Ю. и Паккенберг. Б. (2003). Заметная потеря миелинизированных нервных волокон в мозге человека с возрастом. J. Comp. Neurol. 462, 144–152.
Мейер-Руге, А., Ульрих, Дж., Брюльманн, М., и Мейер, Э. (1992). Возрастная атрофия белого вещества в головном мозге человека. Ann. N.Y. Acad. Sci. 673, 260–269.
Меррилл Д. А., Робертс Дж. А. С. и Тушиски М. Х. (2000). Сохранение числа и размеров нейронов в энторинальных слоях коры II, III и V / VI старых приматов. J. Comp. Neurol. 422, 396–401.
Моралес, Ф. Р., Боксер, П. А., Фунг, С. Дж., И Чейз, М. Х. (1987).Основные электрофизиологические свойства мотонейронов спинного мозга в пожилом возрасте у кошек. J. Neurophysiol. 58, 180–195.
Моррисон, Дж. Х., и Хоф, П. Р. (1997). Жизнь и смерть нейронов стареющего мозга. Природа 278, 412–419.
Нгвенья, Л. Б., Розен, Д. Л., и Петерс, А. (2008). Ультраструктурное исследование вновь образованных клеток в зубчатой извилине взрослой обезьяны. Гиппокамп 18, 210–220.
Нильсен, К., и Петерс, А. (2000). Влияние старения на частоту нервных волокон в полосатом коре головного мозга макаки-резуса. Neurobiol. Старение 21, 621–628.
Нортон, В. Т. (1996). Делятся ли олигодендроциты? Neurochem. Res. 21, 495–503.
Оуэн, Н. Дж., И Батлер, С. Р. (1981). Амнезия после рассечения свода у обезьян; долговременная память нарушена, кратковременная память сохранена. Behav. Brain Res. 3, 495–503.
Паккенберг Б. и Гундерсен Х. Дж. Г. (1997). Число нейронов неокортекса у человека: влияние пола и возраста. J. Comp. Neurol. 384, 312–320.
Петерс, А.(1996). Возрастные изменения олигодендроцитов в коре головного мозга обезьян. J. Comp. Neurol. 371, 153–163.
Петерс А., Джозефсон К. и Винсент С. Л. (1991). Влияние старения на нейроглиальные клетки и перициты в области 17 коры головного мозга макаки-резуса. J. Comp. Neurol. 229, 384–398.
Петерс, А., Лиху, Д., Мосс, М. Б., и МакНалли, К. Дж. (1994). Влияние старения на область 46 лобной коры обезьяны резус. Cereb. Cortex 6, 621–635.Петерс А., Моррисон Дж. Х., Розен Д. Л. и Хайман Б. Т. (1998). Теряются ли нейроны коры головного мозга приматов при старении? Cereb. Cortex 8, 295–300.
Питерс А., Мосс М. Б. и Сетарес К. (2000). Влияние старения на миелинизированные нервные волокна в первичной зрительной коре головного мозга обезьян. J. Comp. Neurol. 419, 364–376.
Петерс А. и Розен Д. Л. (2003). При старении он серый или белый? J. Comp. Neurol. 462, 139–143.
Питерс, А., Сетарес, К.(2002). Старение и миелинизированные волокна в префронтальной коре и мозолистом теле обезьяны. J. Comp. Neurol. 442, 277–291.
Петерс А. и Сетарес К. (2003). Происходит ли ремиелинизация центральной нервной системы приматов при старении? J. Comp. Neurol. 460, 238–254.
Петерс А. и Сетарес К. (2004). Олигодендроциты, их предшественники и другие нейроглиальные клетки в коре головного мозга стареющих приматов. Cereb. Cortex 14, 995–1007.
Питерс, А., Сетхарес, К.и Киллиани Р. Дж. (2001). Влияние возраста на толщину миелиновых оболочек первичной зрительной коры головного мозга обезьян. J. Comp. Neurol. 435, 241–248.
Петерс А., Вердероза А. и Сетарес К. (2008). Население нейроглии в первичной зрительной коре стареющей макаки-резус. Glia 56, 1151–1161.
Пфеффербаум А., Маталон Д. Х., Роулз Дж. М., Зипурский Р. Б., Лим К. О. (1994). Количественное магнитно-резонансное исследование изменений морфологии мозга от младенчества до позднего взросления. Arch. Neurol. 51, 874–887.
Принас, Дж. У., и Макдональд, У. И. (1997). Демиелинизирующие заболевания. В невропатологии Гринфилда, 6-е издание, Д. И. Грэм и П. И. Лантос, ред. (Лондон, Арнольд), стр. 813–896.
Резник, С. М., Фам, Д. Л., Краут, М. А., Зондерман, А. Б., и Давацокос, К. (2003). Исследования продольной магнитно-резонансной томографии пожилых людей: сокращающийся мозг. J. Neurosci. 23, 3295–3301.
Риверс, Л. Э., Янг, К. М., Рицци, М., Джамен, Ф., Псахулия, К., Уэйд А., Кессарис Н. и Ричардсон В. Д. (2008). Глия PDGFRA / NG2 генерирует миелинизирующие олигодендроциты и грушевидные проекционные нейроны у взрослых мышей. Nat. Neurosci. 11, 1392–1401.
Розенблют, Дж. (1966). Избыточные миелиновые оболочки и другие ультраструктурные особенности мозжечка жабы. J. Cell Biol. 28, 73–93.
Санделл, Дж. Х., и Питерс, А. (2001). Влияние возраста на нервные волокна зрительного нерва макаки-резуса. J. Comp. Neurol. 429, 541–553.Санделл, Дж. Х., и Питерс, А. (2002). Влияние возраста на глиальные клетки зрительного нерва макаки-резуса. J. Comp. Neurol. 445, 13–28.
Санделл Дж. Х. и Питерс А. (2003). Нарушение потери миелина и аксонов в передней комиссуре у пожилых макак-резусов. J. Comp. Neurol. 466, 14–30.
Сильвер М. Х., Ньюэлл К., Брэди К., Хедли-Уайт Э. Т. и Перлз Т. Т. (2002). Различие между нейродегенеративными заболеваниями и старением без болезней: корреляция нейропсихологических оценок и невропатологических исследований у долгожителей. Психосом. Med. 64, 493–501.
Слоан, Дж. С., Пьетропаола, Х. Ф., Розен, Д. Л., Мосс, М. Б., Кемпер, Т. и Абрахам, К. Р. (1997). Отсутствие корреляции между бляшками и когнитивными способностями у пожилых обезьян. Acta Neuropathol. 94, 471–478.
Смит Д. Э., Рапп П. Р., Маккей Х. М., Робертс Л. А. и Тушински М. Х. (2004). Нарушение памяти у пожилых приматов связано с очаговой гибелью корковых нейронов и атрофией подкорковых нейронов. J. Neurosci. 24, 4373–4381.Соботка, С., Ринго, Дж. Л. (1996). Мнемонические ответы отдельных единиц, записанные из нижневисочной коры головного мозга обезьяны, доступ к которым осуществляется через транскомиссуральные пути по сравнению с прямыми: диссоциация между активностью единицы и поведением. J. Neurosci. 16, 4222–4230.
Струбл, Р. Г., Прайс, Д. Л., мл., Корк. Л. К. и Прайс Д. Л. (1985). Старческие бляшки в коре головного мозга здоровых старых обезьян. Brain Res. 361, 267–275.
Старрок, Р. Р. (1976). Изменения нейроглии и миелинизации в белом веществе стареющих мышей. J. Gerontol. 31, 513–522.
Сугияма И., Танака К., Акита М., Йошида К., Кавасе Т. и Асу Х. (2002). Ультраструктурный анализ паранодального соединения миелинизированных волокон у 31-месячных крыс. J. Neurosci. Res. 7, 309–317.
Салливан, Э. В., Розенблум, М., Сервенти, К. Л., и Пфеффербаум, А. (2004). Влияние возраста и пола на объем таламуса, моста и коры. Neurobiol. Старение 25, 185–192.
Салливан, М. В., и Гамильтон, К. Р. (1973a).Установление памяти через переднюю комиссуру обезьян. Physiol. Behav. 11, 873–879.
Салливан, М. В., и Гамильтон, К. Р. (1973b). Межглазная передача обратной и необратимой дискриминации через переднюю комиссуру у обезьян. Physiol. Behav. 10, 355–359.
Тамура, Э., и Парри, Дж. Дж. (1994). Тяжелая корешковая патология у крыс с длительным диабетом. J. Neurol. Sci. 127, 29–35.
Тан Й., Ньенгард Дж. Р., Паккенберг Б. и Гундерсен Х.Дж. Г. (1997). Возрастные изменения белого вещества в человеческом мозге: стереологическое исследование. Neurobiol. Старение 18, 609–615.
Тиггес, Дж., Гордон, Т. П., Холл. Х. М. и Петерс А. (1988). Выживаемость и продолжительность жизни макаки-резуса. Am. J. Primatol. 15, 263–272.
Ван, Ю., Чжоу, Т., Ма. Й., Левенталь А. Г. (2005). Ухудшение синхронизации сигналов в кортикальных областях V1 и V2 стареющих обезьян. Cereb. Cortex 15, 403–408.
Ваксман, С.Г., Кочиш, Дж.Д. и Блэк Дж. А. (1995). Патофизиология демиелинизированных аксонов. В «Аксон: структура, функция и патофизиология», С. Г. Ваксман, Дж. Д. Кочис и П. К. Стис, ред. (Нью-Йорк, Oxford University Press), стр. 438–461.
Уилсон, К. Р. Э., Чарльз, Д. П., Бакли, Н. Дж., И Гаффан, Д. (2007). Перерезка Форникса ухудшает обучение произвольно изменяющимся различениям объектов. J. Neurosci. 21, 12868–12873.
Виско, Дж. Дж., Киллиани, Р. Дж., Гутманн, К. Р., Варфилд, С. К., и Розен, Д.Л. (2008). МРТ-исследование возрастных изменений объема белого и серого вещества у макаки-резуса. Neurobiol. Старение 29, 1563–1575.
Си, М.-К., Лю, Р.-Х., Энгельгардт, К.К., Моралес, Р.Р., и Чейз, (1999). Изменение скорости аксональной проводимости нейронов пирамидного тракта у пожилой кошки. Неврология 92, 219–225.
Структура миелинизированного нервного волокна
Структура миелинизированного нервного волокна
(A) Иллюстрация миелинизированного нервного волокна и скачкообразной проводимости потенциала действия.Показан пример миелинизированного нервного волокна ПНС. (B) Иллюстрация поперечного сечения миелинизированного аксона в междоузлиях. (C) Световая микроскопия седалищного нерва мыши при меньшем увеличении. Окрашивание толуидиновым синим. Миелин окрашен в синий цвет. Нервный тракт заполнен кольцевидными структурами, указывающими на поперечный разрез миелинизированных нервных волокон. (D) Электронная микроскопия миелинизированного аксона зрительного нерва мыши при большем увеличении. Аксон окружен многослойной структурой миелина.(E) Миелинизированное нервное волокно, воспроизводимое in vitro путем совместного культивирования нейронов ганглиев задних корешков крысы и шванновских клеток. Сегменты миелина окрашиваются в красный цвет антителом к основному белку миелина, молекуле, специфически экспрессируемой в миелине. Узлы Ранвье (стрелки) окрашены в зеленый цвет антителом к узловой молекуле бета-IV спектрина.
Это изображение связано со следующими Scitable страницами:
Миелин: специализированная мембрана для клеточной коммуникации
Как наша нервная система работает так быстро и эффективно? Ответ кроется в мембранной структуре, называемой миелином.

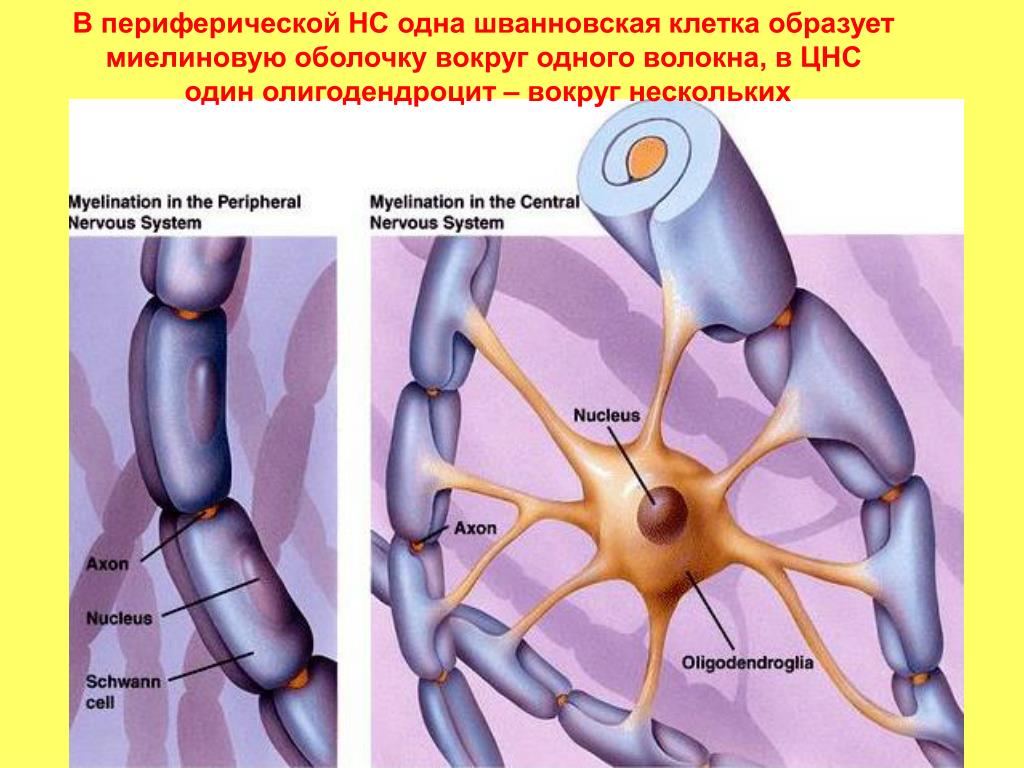

 nih.gov/pubmed/2338989. Доступ 20 июля 2013 г.
nih.gov/pubmed/2338989. Доступ 20 июля 2013 г.