Нарушение вентиляционной функции легких по рестриктивному типу
Нарушение вентиляции легких приводит к тому, что дыхательная функция не обеспечивается за счет организма человека. При рестриктивном типе причина заключается в низкой эластичности. Орган теряет способности к расширению при вдохе и спадению при выдохе. Проблема обнаруживается при спирометрии — исследование, при котором определяют объем и скорость дыхания.
Причины возникновения болезни
Причинами нарушения вентиляции легких по рестриктивному типу могут быть следующие заболевания:
- фиброз легких;
- пневмосклероз;
- воспаления альвеол и опухоли;
- эмфизема;
- плеврит;
- удаление части легкого хирургическим путем.
Признаками наличия проблемы чаще всего бывают отдышка при нагрузке, частое поверхностное дыхание. При этом в работу включается дополнительная мускулатура. Основной признак вне зависимости от причины возникновения — уменьшение легких в объеме.
Эффективное лечение нарушения вентиляционной функции в санатории
Лечение болезни преследует две цели:
- поддержание и восстановление вентиляции легких;
- устранение причины появления нарушения.
Заболевания легких чаще всего требуют длительной терапии с помощью медикаментозных средств. Справиться с признаками кислородного голодания помогают ингаляции. Отличной поддержкой станет курс санаторно-курортного лечения.
Сеть курортов АМАКС позволит одновременно отдохнуть от повседневных забот и восстановить здоровье. Здесь специализируются на лечении органов дыхания и предлагают грамотную программу терапии, которая включает в себя кислородотерапию, ингаляции, дыхательную гимнастику и лечебную физкультуру.
Оздоровительные процедуры позволяют укрепить иммунитет и улучшить работу органов дыхания. В санатории удается облегчить состояние больного и ускорить выздоровление.
В санатории удается облегчить состояние больного и ускорить выздоровление.
Последствия отсутствия лечения
Важно выявить проблему и начать терапию как можно раньше. Легочная недостаточность различной степени тяжести может привести к печальным последствиям, вплоть до летального исхода.
Не стоит ждать!
Забронируйте путевку в санатории АМАКС уже сегодня! Наши курорты находятся в живописных и экологически чистых уголках с благоприятным при легочных заболеваниях климатом. Это позволяет добиваться положительных результатов в 98% случаев.
НАРУШЕНИЕ РЕГУЛЯЦИИ РИТМА ДЫХАНИЯ ВО ВРЕМЯ ИСКУССТВЕННОЙ ВЕНТИЛЯЦИИ ЛЕГКИХ ПРИ ПОРАЖЕНИИ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | Чеченин
Литература
1.
Maas A.I., Marmarou A., Murray G.D., Teasdale S.G., Steyerberg E.W.//J. Neurotrauma. 2007. № 24. Р. 232-240.
2.
Lee K., Rincon F. Critical Care Research and Practice. 2012.
3.
Kiphuth I.C., Schellinger P.D., Khrmann M. et al.//Critical Care. 2010. № 14. Р. 136
4.
Berney S., Bragge P., Granger C. et al.//Spinal Cord. 2011. V. 49. № 1. Р. 17-29.
5.
Howard R.S., Rudd A.G., Wolfe C.D., Williams A.J.//Postgrad. Med. J. 2001. № 77. Р. 700-702.
6.
Неговский В.А., Гурвич А.М., Золотокрылина Е.С. Постреанимационная болезнь. М., 1987.
7.
Марини Д.Д., Уиллер А.П. Медицина критических состояний. М., 2002.
8.
Benditt J.O.//Respir. Care. 2006. V. 51. № 8. P. 829-837.
9.
Чеченин М.Г., Раткин И.К., Денисов Э.Н. и др.//Анестезиология и реаниматология. 2007. № 4. С. 38-42.
10.
Чеченин М.Г., Ломиворотов В.В., Полукаров А.Н. и др.//Патология кровообращения и кардиохирургия. 2013. № 3. С. 35-39.
11.
Чеченин М.Г., Мартыненков В.Я., Денисов Э.Н.//Анестезиология и реаниматология. 2004. № 4. С. 56-59.
12.
Weinhouse G., Watson P.//Crit. Care Clin. 2009. V. 25. Р. 539-549.
13.
Spahija J., de Marchie M., Albert M. et al.//Crit. Care Med. 2010. V. 38. № 2. Р. 518-526.
14.
Predicting outcome after traumatic brain injury: practical prognostic models based on large cohort of international patients MRC CRASH Trial Collaborators//BMJ | ONLINE FIRST | bmj.com.
15.
Kondili E., Prinianakis G., Georgopoulos D.//British J. Anaesthesia. 2003. № 91. Р. 106-125.
НАРУШЕНИЯ ФУНКЦИИ ВНЕШНЕГО ДЫХАНИЯ И ИХ ВЛИЯНИЕ НА КЛИНИЧЕСКИЙ ИСХОД У КАРДИОХИРУРГИЧЕСКИХ ПАЦИЕНТОВ | Пономарев
1. Пономарев Д. Н., Каменская О. В., Клинкова А. С. и др. Влияние синдрома бронхиальной обструкции на периоперационные характеристики у пациентов при аортокоронарном шунтировании: промежуточные результаты проспективного когортного исследования // Патология кровообращ. и кардиохирур. – 2015. – Т. 19, № 4. – С. 72–78.
2. Adabag A. S., Wassif H. S., Rice K. et al. Preoperative pulmonary function and mortality after cardiac surgery // Am. Heart J. – 2010. – № 159. – P. 691–697.
3. Ad N., Henry L., Halpin L. et al. The use of spirometry testing prior to cardiac surgery may impact the Society of Thoracic Surgeons risk prediction score: a prospective study in a cohort of patients at high risk for chronic lung disease // J. Thorac. Cardiovasc. Surg. – 2010. – № 139. – P. 686–691.
Ad N., Henry L., Halpin L. et al. The use of spirometry testing prior to cardiac surgery may impact the Society of Thoracic Surgeons risk prediction score: a prospective study in a cohort of patients at high risk for chronic lung disease // J. Thorac. Cardiovasc. Surg. – 2010. – № 139. – P. 686–691.
4. American Thoracic Society. Lung function testing: selection of reference values and interpretative strategies // Am. Rev. Respir. Dis. – 1991. – № 144 (5). – P. 1202–1218.
5. Anthonisen N. R., Connett J. E., Enright P. L. et al. Hospitalizations and mortality in the lung health study // Am. J. Respir. Crit. Care Med. – 2002. – № 166. – P. 333–339.
6. Body Plethysmography. 2001 Revision & Update. AARC Clinical Practice Guideline // Respir. Care. – 2001. – Vol. 5, № 46. – P. 506–513.
7. Buch P., Friberg J., Scharling H. et al. Reduced lung function and risk of atrial fibrillation in the Copenhagen City Heart Study // Eur. Respir. J. – 2003. – № 21. – P. 1012–1016.
8. Calkins H., Kuck K. H., Cappato R. et al. 2012 HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design // Europace. – 2012. – № 14. – P. 528–606.
9. Calverley P. M. A., Anderson J. A., Celli B. et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease // N. Engl. J. Med. – 2007. – № 356. – P. 775–789.
10. Clough R. A., Leavitt B. J., Morton J. R. et al. The effect of comorbid illness on mortality outcomes in cardiac surgery // Arch. Surg. – 2002. – № 137. – P. 428–433.
Clough R. A., Leavitt B. J., Morton J. R. et al. The effect of comorbid illness on mortality outcomes in cardiac surgery // Arch. Surg. – 2002. – № 137. – P. 428–433.
11. Cooper B. G. An update on contraindications for lung function testing // Thorax. – 2011. – № 66. – P. 714–723.
12. Engström G., Lind P., Hedblad B. et al. Lung function and cardiovascular risk relationship with inflammation-sensitive plasma proteins // Circulation. – 2002. – № 106. – P. 2555–2560.
13. Eriksson B., Lindberg A., Mullerova H. et al. Association of heart diseases with COPD and restrictive lung function – Results from a population survey // Respir. Med. – 2013. – № 107. – P. 98–106.
14. Fabbri L. M., Luppi F., Beghe B. et al. Complex chronic comorbidities of COPD // Eur. Respir. J. – 2008. – № 31. – P. 204–212.
15. Gan W. Q., Man S. F. P., Senthilselvan A. et al. Association between chronic obstructive pulmonary disease and systemic inflammation: a systematic review and a meta-analysis // Thorax. – 2004. – № 59. – P. 574–580.
16. Gao D., Grunwald G. K., Rumsfeld J. S. et al. Variation in mortality risk factors with time after coronary artery bypass graft operation // Ann. Thorac. Surg. – 2003. – № 75. – P. 74–81.
17. Gracey D. R., Divertie M. B., Didier E. P. Preoperative pulmonary preparation of patients with chronic obstructive pulmonary disease: a prospective study // Chest. – 1979. – № 76. – P. 123–129.
18. Hawkins N. M., Virani S., Ceconi C. Heart failure and chronic obstructive pulmonary disease: the challenges facing physicians and health services // Eur. Heart. J. – 2013. – № 34. – P. 2795–2803.
Hawkins N. M., Virani S., Ceconi C. Heart failure and chronic obstructive pulmonary disease: the challenges facing physicians and health services // Eur. Heart. J. – 2013. – № 34. – P. 2795–2803.
19. Johnson R. L. J. Gas exchange efficiency in congestive heart failure // Circulation. – 2000. – Vol. 24, № 101. – P. 2774–2776.
20. Johnson R. L J. Gas exchange efficiency in congestive heart failure II // Circulation. – 2001. – Vol. 7, № 103. – P. 916–918.
21. Jones P. W., Harding G., Berry P. et al. Development and first validation of the COPD Assessment Test // Eur. Respir. J. – 2009. – № 34. – P. 648–654.
22. Kang H., Bae B. S., Kim J. H. et al. The relationship between chronic atrial fibrillation and reduced pulmonary function in cases of preserved left ventricular systolic function // Korean Circ. J. – 2009. – № 39. – P. 372–377.
23. Kuralay E., Cingöz F., Kiliç S. et al. Supraventricular tachyarrythmia prophylaxis after coronary artery surgery in chronic obstructive pulmonary disease patients (early amiodarone prophylaxis trial) // Eur. J. Cardiothorac. Surg. – 2004. – № 25. – P. 224–230.
24. Leavitt B. J., Ross C. S., Spence B. et al. Long-term survival of patients with chronic obstructive pulmonary disease undergoing coronary artery bypass surgery // Circulation. – 2006. – № 114. – P. 430–435.
25. Légaré J. F., Hirsch G. M., Buth K. J. et al. Preoperative prediction of prolonged mechanical ventilation following coronary artery bypass grafting // Eur. J. Cardiothorac. Surg. – 2001. – № 20. – P. 930–936.
J. Cardiothorac. Surg. – 2001. – № 20. – P. 930–936.
26. Levey A. S., Stevens L. A., Schmid C. H. et al. A new equation to estimate glomerular filtration rate // Ann. Intern. Medt. – 2009. – № 150. – P. 604–612.
27. Lomivorotov V. V., Efremov S. M., Pokushalov E. A. et al. New-onset atrial fibrillation after cardiac surgery: pathophysiology, prophylaxis, and treatment // J. Cardiothorac. Vasc. Anesth. – 2016. – Vol. 1, № 30. – P. 200–216.
28. MacLay J. D., MacNee W. Cardiovascular disease in COPD: mechanisms // Chest. – 2013. – № 143. – P. 798–807.
29. Mahler D. A., Wells C. K. Evaluation of clinical methods for rating dyspnea // Chest. – 1988. – № 93. – P. 580–586.
30. Manganas H., Lacasse Y., Bourgeois S. et al. Postoperative outcome after coronary artery bypass grafting in chronic obstructive pulmonary disease // Can. Respir. J. – 2007. – № 14. – P. 19–24.
31. Mannino D. M., Thorn D., Swensen A. et al. Prevalence and outcomes of diabetes, hypertension and cardiovascular disease in COPD // Eur. Respir. J. – 2008. – № 32. – P. 962–969.
32. McAllister D. A., Wild S. H., MacLay J. D. et al. Forced expiratory volume in one second predicts length of stay and in-hospital mortality in patients undergoing cardiac surgery: a retrospective cohort study // PLoS One. – 2013. – № 8. – Р. e64565.
33. Medalion B., Katz M. G., Cohen A. J. et al. Long-term beneficial effect of coronary artery bypass grafting in patients with COPD // Chest. – 2004. – № 125. – P. 56–62.
– 2004. – № 125. – P. 56–62.
34. Mehra R., Benjamin E. J., Shahar E. et al. Association of nocturnal arrhythmias with sleep-disordered breathing: The sleep heart health study // Am. J. Respir. Crit. Care Med. – 2006. – № 173. – P. 910–916.
35. Michalopoulos A., Geroulanos S., Papadimitriou L. et al. Mild or moderate chronic obstructive pulmonary disease risk in elective coronary artery bypass grafting surgery // World J. Surg. – 2001. – № 25. – P. 1507–1511.
36. Miller M. R., Hankinson J., Brusasco V. et al. Standardisation of spirometry // Eur. Respir. J. – 2005. – № 26. – P. 319–338.
37. Montnemery P., Bengtsson P., Elliot A. et al. Prevalence of obstructive lung diseases and respiratory symptoms in relation to living environment and socio-economic group // Respir. Med. – 2001. – № 95. – P. 744–752.
38. Mullerova H., Agusti A., Erqou S. et al. Cardiovascular comorbidity in COPD: systematic literature review // Chest. – 2013. – № 44. – P. 1163–1178.
39. O’Boyle F., Mediratta N., Chalmers J. et al. Long-term survival of patients with pulmonary disease undergoing coronary artery bypass surgery // Eur. J. Cardiothoracic. Surg. – 2013. – № 43. – P. 697–703.
40. Pellegrino R., Viegi G., Brusasco V. et al. Interpretative strategies for lung function tests // Eur. Respir. J. – 2005. – № 26. – P. 948–968.
41. Roques F., Nashef S. A., Michel P. et al. Risk factors and outcome in European cardiac surgery: analysis of the EuroSCORE multinational database of 19030 patients // Eur. J. Cardiothorac. Surg. – 1999. – № 15. – P. 813–816.
Risk factors and outcome in European cardiac surgery: analysis of the EuroSCORE multinational database of 19030 patients // Eur. J. Cardiothorac. Surg. – 1999. – № 15. – P. 813–816.
42. Saleh H. Z., Mohan K., Shaw M. et al. Impact of chronic obstructive pulmonary disease severity on surgical outcomes in patients undergoing non-emergent coronary artery bypass grafting // Eur. J. Cardiothorac. Surg. – 2012. – № 42. – P. 108–113; discussion 113.
43. Samuels L. E., Kaufman M. S., Morris R. J. et al. Coronary artery bypass grafting in patients with COPD // Chest. – 1998. – № 113. – P. 878–882.
44. Spivack S. D., Shinozaki T., Albertini J. J. et al. Preoperative prediction of postoperative respiratory outcome. Coronary artery bypass grafting // Chest. – 1996. – № 109. – P. 1222–1230.
45. Standardization of Spirometry, 1994 Update. American Thoracic Society // Am. J. Respir. Crit. Care Med. – 1995. – № 152. – P. 1107–1136.
46. Stein M., Cassara E. L. Preoperative pulmonary evaluation and therapy for surgery patients // JAMA. – 1970. – № 211. – P. 787–790.
47. Terzano C., Romani S., Conti V. et al. Atrial fibrillation in the acute, hypercapnic exacerbations of COPD // Eur. Rev. Med. Pharmacol. Sci. – 2014. – № 18. – P. 2908–2917.
48. Terzano C., Conti V., Di Stefano F. et al. Comorbidity, hospitalization, and mortality in COPD: Results from a longitudinal study // Lung. – 2010. – № 188. – P. 321–329.
49. Thygesen K., Alpert J. S., Jaffe A. S. et al. Third universal definition of myocardial infarction // J. Am. Coll. Cardiol. – 2012. – № 60. – P. 1581–1598.
Thygesen K., Alpert J. S., Jaffe A. S. et al. Third universal definition of myocardial infarction // J. Am. Coll. Cardiol. – 2012. – № 60. – P. 1581–1598.
50. Vestbo J., Hurd S. S., Agusti A. G. et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary // Am. J. Respir. Crit. Care Med. – 2013. – № 187. – P. 347–365.
51. Wannamethee S. G., Shaper A. G., Papacosta O. et al. Lung function and airway obstruction: associations with circulating markers of cardiac function and incident heart failure in older men-the British Regional Heart Study // Thorax. – 2016. – № 71. – P. 526–534.
52. Witte K. K., Clark A. L. Why does chronic heart failure cause breathlessness and fatigue? // Prog. Cardiovasc. Dis. – 2007. – № 49. – P. 366–384.
НИВЛ при рестриктивных заболеваниях грудной клетки
Рестриктивное заболевание грудной клетки — это патология для которой характерно уменьшение жизненной емкости легких, а также объема легочной паренхимы. В этой группе находятся и интерстициальные болезни легких.
Нарушение дыхания при рестриктивных заболеваниях грудной клетки.
В основе патологий данного типа находится развитие фиброза, а также воспаление. Они, чаще всего, носят иммунную природу.
Рестриктивные заболевания грудной клетки:
- плевральный выпот;
- кифосколиоз;
- повышенное внутрибрюшное давление;
- пневмоторакс;
- опухолевидное образование в средостении.
Данные патологии могут быть как приобретенными, так и врожденными. У больного часто происходит сбой в полноценной деятельности и развитии дыхательной и сердечно-сосудистой систем. Человеку становится тяжело дышать при рестриктивных заболеваниях грудной клетки.
Причины, которые способны спровоцировать данные болезни:
- генетическая предрасположенность;
- сколиоз;
- сифилис костей;
- туберкулез.
Как проводится лечение рестриктивных заболеваний грудной клетки?
В подобных случаях такие методы как массаж и ЛФК не обладают особой эффективностью. Специалисты рекомендуют использовать неинвазивную вентиляцию легких при рестриктивных заболеваниях грудной клетки.
Этот способ широко практикуется людьми, страдающими болезнями, которые могут спровоцировать хроническую гиповентиляцию. Врачи утверждают, что НИВЛ при рестриктивном заболевании грудной клетки способна стабилизировать состояние пациента уже в течение нескольких суток.
Данная методика представляет собой механическую поддержку дыхания, при этом не используется трахеальная канюля или трахеостомическая трубка. У НИВЛ при рестриктивной болезни грудной клетки существуют многие преимущества перед инвазивной вентиляцией. И самым веским из них является отсутствие повреждений гортани, глотки и трахеи.
Также плюсом является сохранение естественных защитных механизмов верхних дыхательных путей, глотания и кашля.
Перед лечением, чтобы максимально прояснить общую картину, следует провести диагностику. Она проводится нашими специалистами с помощью кардио-респираторного комплекса SOMNOcheck micro CARDIO.
Данная система сохраняет, а затем анализирует полученные ею результаты. С ее помощью врач получает все данные о нарушении дыхания во сне.
Для получения общей картины специалисту также важно знать результаты полисомнографии и газового состава крови.
Важным условием для диагностирования является проведение процедуры в ночное время, когда пациент спит. Именно тогда первоначально начинаются нарушения дыхания.
Неинвазивная вентиляция легких при заболеваниях грудной клетки является хорошим вариантом, так как она безопасна и хорошо переносится.
Не знаете в какую клинику следует обратиться? Свое здоровье необходимо отдавать только в надежные руки профессионалов.
«Насколько эффективно лечить методом неинвазивной вентиляции легких рестриктивные заболевания грудной клетки» — спросите Вы? В медицинском центре «УкрТелеМед» добились больших успехов по лечению нарушения дыхания, которое является одним из главных симптомов патологии. Все наши приборы обладают необходимыми сертификатами качества, что говорит об их безопасности.
Здоровье — это самое ценное, что есть у человека, оно не терпит пренебрежительного отношения к себе. И цена, которую придется заплатить за оплошность порой бывает слишком высока.
Функциональная диагностика
В Центре физиологии и патологии дыхания Вы можете пройти функциональную диагностику бронхо-легочной системы, сердечно-сосудистой системы и нервной системы.
Функциональная диагностика в пульмонологии:
Специалисты Центра физиологии и патологии дыхания имеют уникальный многолетний опыт работы в диагностике состояния дыхательной системы.
- Спирометрия (спирография) – применяется для оценки функции внешнего дыхания. Данный метод позволяет оценить объем легких, проходимость дыхательных путей, емкость входа и выхода.
Наши специалисты проводят спирометрию в нескольких режимах: во время спокойного дыхания, при резком и ускоренном выдохе, после физической нагрузки, а также после использования лекарственных препаратов, таких как беродуал, беротек, сальбутамол и атровент.
Спирометрия является одним из обязательных пунктов программы диагностики и лечения таких заболеваний органов дыхания как: бронхиальной астма, хронический бронхит, хроническая обструктивная болезнь легких и т.д.
- Бодиплетизмография – экспертный метод оценки вентиляционной функции легких путем сопоставления показателей спирографии с показателями механического колебания грудной клетки во время дыхательного цикла.
На сегодняшний день это наиболее информативный метод определения общей емкости легких, позволяющий оценить все легочные объемы (включая остаточный объем), сопротивление дыхательных путей, а также состояние мембраны легочных альвеол.
Бодиплетизмография выполняется в специальной закрытой герметичной кабине с постоянным объемом воздуха. Пациент дышит через мундштук, соединенный с открытой в атмосферу дыхательной трубкой. Открытие и закрытие дыхательной трубки производится автоматически с помощью электронного устройства. Во время исследования вдыхаемый и выдыхаемый поток воздуха пациента измеряют с помощью спирографа.
Показания к проведению бодиплетизмографии:
- Ранняя диагностика заболевания легких и определение степени тяжести
- Подозрение на интерстициальные заболевания легких, эмфизему легких
- Дифференциальная диагностика обструктивного и рестриктивного типа вентиляционных нарушений
- Выявление смешанного типа нарушений вентиляционной функции легких при ХОБЛ, бронхиальной астме.
- Пульсоксиметрия – измеряет степень насыщения кислородом капиллярной крови.
Функциональная диагностика сердечно-сосудистой системы:
1. Велоэргометрия – это электрокардиографическое обследование (ЭКГ) с применением дозированной физической нагрузки.
Позволяет определить:
- Состояние сердечно-сосудистой системы
- Степень тяжести ишемической болезни сердца
- Уровень эффективности лечения ишемической болезни сердца
- Реакцию артериального давления на физическую нагрузку
- Нарушения ритма
- Уровень выносливости
2.ЭКГ (электрокардиограмма) –один из самых простых, доступных и информативных методов диагностики заболеваний сердца. Он основан на регистрации электрических импульсов, возникающих в сердце, и их графической записи в виде зубцов на специальную бумажную пленку.
 д.).
д.).3. ЭКГ с физической нагрузкой – информативный метод диагностики патологии сердечно-сосудистой системы до и после активного состояния. Такое обследования назначают при перебоях в работе сердца, боли за грудиной, дискомфорте и сдавлении за грудиной, одышке. Первый раз ЭКГ проводится в покое, затем пациент делает 20 приседаний, и ЭКГ снимается повторно.
4. Суточное мониторирование ЭКГ по холтеру — дает возможность отслеживать изменения в работе сердца и контролировать артериальное давление пациента в течение суток в условиях его естественной активности, расширяя диагностические возможности электрокардиографии.
Метод незаменим для:
- Локализации ишемической болезни сердца
- Определения взаимосвязи проявления стенокардии, а также бессимптомной ишемической болезни сердца с изменениями показателей ЭКГ и условиями возникновения патологий;
- Оценки нарушений ритма
- Выявления показаний к установке электрокардиостимулятора
Функциональная диагностика нервной системы:
1. Реоэнцефалография (РЭГ) –
метод, позволяющий осуществлять длительное наблюдение за состоянием мозгового кровообращения. Исследование заключается в регистрации колебаний электрического сопротивления тканей при прохождении через них слабого электрического тока высокой частоты.
Показанием для реоэнцефалографии являются головные боли и головокружения, черепно-мозговые травмы, внутричерепная гипертензия, нарушения кровообращения в связи с сужением или деформацией сосудов головного мозга.
2. Электроэнцефалография (ЭЭГ) — позволяет регистрировать спонтанную электрическую активность головного мозга с помощью размещенных на поверхности головы электродов, в результате чего можно оценить функциональное состояние коры головного мозга, а также степень имеющегося поражения и локализацию очага.
Основные показания к УЗДГ:
- Шум в голове
- Головные боли, мигрени, головокружения
- Артериальная гипертензия
- Выраженный остеохондроз
- Эпизоды внезапной потери сознания
- Эпизоды внезапной слабости, онемения руки или ноги, нарушения речи
- Длительное повышение уровня холестерина в крови
- Ишемическая болезнь сердца, стенокардия, инфаркт миокарда
4. Полисомнография – метод длительной регистрации различных параметров жизнедеятельности организма во сне в режиме реального времени.
Данное исследование позволяет определить стадии сна, их длительность, а также соотношение различных физиологических показателей со стадиями сна. Благодаря этому можно понять является ли нарушение сна первичным, или же, наоборот, сон страдает вторично вследствие соматических проблем, например, нарушения дыхания или болевого синдрома.
Определение точного механизма нарушения сна позволяет выбрать успешную тактику лечения и предупредить дальнейшее неблагоприятное течение заболевания.
Основные показания для проведения исследования:
- Нарушения сна: трудности с засыпанием, снижение общей продолжительности сна и его качества
- Храп или остановки дыхания во время сна
- Избыточная двигательная активность во сне (частая смена положения тела, непроизвольные движения конечностей и т.п.)
- Избыточная дневная сонливость, пониженная концентрация внимания, быстрая утомляемость
Данное исследование производится в амбулаторных условиях. Врач закрепляет электроды на теле обследуемого, после чего пациент отправляется домой, где ему необходимо уснуть
Врач закрепляет электроды на теле обследуемого, после чего пациент отправляется домой, где ему необходимо уснуть
Приборы регистрируют такие параметры, как храп, дыхание, насыщение крови кислородом, активность мозга (энцефалограмма), движения глаз (электроокулограмма), тонус мышц (электромиограмма), движения ног, изменения положения тела. Полученная информация обрабатывается и в зависимости от установленной причины нарушения сна назначается либо дополнительное обследование, либо лечение.
Врач-функциональной диагностики
Функциональная диагностика
Цена
Электрокардиография (ЭКГ)
350
ЭКГ с применением медикаментозных проб
500
ЭКГ с физическими упражнениями
650
ЭКГ с применением нагрузки на велоэргометре для выявления скрытой коронарной недостаточности
1500
Суточное мониторирование ЭКГ+реопульмонография (определение апноэ сна)
800
Суточное мониторирование ЭКГ+АД+реопульмонография
1000
Пульсоксиметрия
150
Пульсоксиметрия с диагностикой апноэ сна
900
Полисомнография
4900
Подбор режимов CPАР-терапии (для коррекции ночного апноэ и храпа)
1800
Спирометрия с определением кривой поток-объем
500
Спирометрия с определением кривой поток-объем с физическими упражнениями на определение постнагрузочного бронхоспазма
750
Исследование реактивности дыхательных путей: бронходилатационная проба с симпатомиметиком
600
Исследование реактивности дыхательных путей: бронходилатационная проба с холинолитиком
600
Исследование реактивности дыхательных путей: бронходилатационная проба с применением комбинированного бронхолитика (беродуал)
650
Исследование реактивности дыхательных путей: проба изокапнической гипервентиляцией холодным воздухом для диагностики холодовой гиперреактивности дыхательных путей
1500
Исследование реактивности дыхательных путей: ингаляционная провокационная проба с дистиллированной водой
1500
Исследование реактивности дыхательных путей: провокационная проба с дозированной физической нагрузкой для оценки постнагрузочного бронхоспазма
1500
Эргоспирометрия
3000
Бодиплетизмография
1200
Определение бронхиального сопротивления методом перекрытия + спирометрия
500
Определение диффузионной способности лёгких
1200
Суточный мониторинг бронхиальной проходимости методом пикфлоуметрии
300
Измерение температуры выдыхаемого воздуха
150
Риноманометрия
500
Выписка дубликатов
100
Электроэнцефалография (ЭЭГ)
600
Реоэнцефалография (РЭГ)
400
Ультразвуковая допплерография сосудов шеи и головного мозга (УЗДГ)
600
Страница не найдена |
Страница не найдена |
404. Страница не найдена
Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
22232425262728
293031
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Дыхательная недостаточность | Медицинский центр «Президент-Мед»
Дыхательная недостаточность – патология, при которой диагностируется нарушение процесса газообмена в артериальной крови легких. При прогрессировании заболевания повышается уровень углекислого газа, а количество кислорода уменьшается, в результате чего развивается кислородное голодание органов или гипоксия.
Возможные первопричины дыхательной недостаточности:
- Мышечная слабость, развивающаяся при полиомиелите, мышечной дистрофии, миастении и других болезнях.
- Патологии позвоночника или реберного каркаса.
- Ослабление дыхания.
- Кровопотери, анемии.
- Воспаление бронхов, пневмония.
- Врожденные пороки сердца.
- Передозировка наркотиков.
- Ожирение и другие.
Исходя из механизма возникновения, дыхательная недостаточность бывает гиперкапнической или гипоксемической формы. Первый тип (гиперкапническая форма ДН) развивается, если происходит избыточное накопление в артериальной крови углекислого газа. Состояние хорошо поддается кислородной терапии.
Гипоксемическая недостаточность прогрессирует при недостаточном содержании в крови парциального давления кислорода.
В зависимости от причин прогрессирования патология бывает нескольких видов: рестриктивная, обструктивная, гемодинамическая, диффузная, а также комбинированная дыхательная недостаточность.
Симптомы дыхательной недостаточности
Признаки нарушения газообмена в легких зависят от характера течения (хроническая или острая дыхательная недостаточность), вида и степени тяжести патологии.
Классическая симптоматика недомогания:
- Синюшность кожных покровов.
- Учащение пульса.
- Одышка.
- Снижение артериального давления.
- Головные боли.
- Потеря сознания.
- Бессонница ночью и сонливость днем.
- Нарушения памяти.
- Общая слабость.
На поздних стадиях развития к дыхательной патологии может присоединиться сердечная недостаточность, в результате чего появляются отеки.
Нарушение нормального газообмена в легких очень опасно для функционирования и жизнедеятельности человека. Без правильного лечения болезни могут развиться такие осложнения, как гипертрофия правого желудочка сердца, легочная гипертензия, а также остановка дыхания вплоть до летального исхода.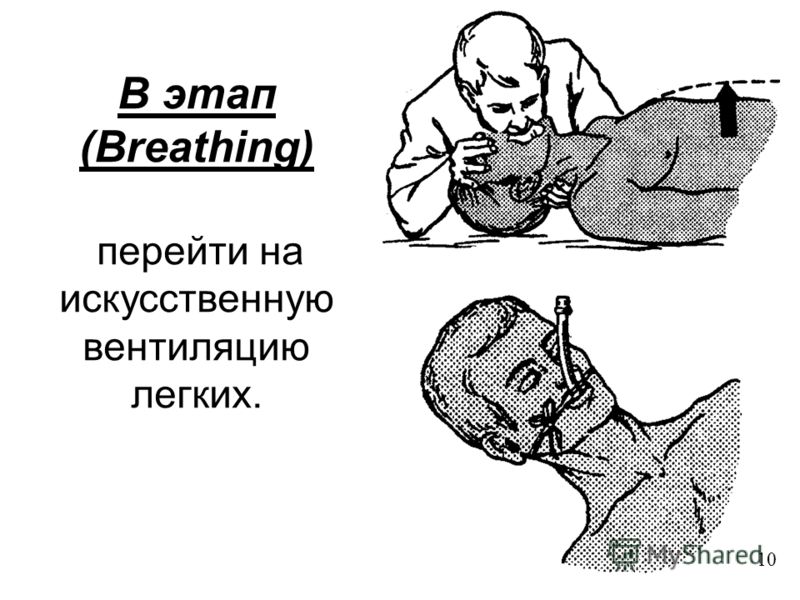
Диагностика и лечение дыхательной недостаточности
Диагностика включает в себя физикальный осмотр пациента, при этом особое внимание обращается на цианоз кожных покровов. Во время осмотра больного врач также выполняет подсчет частоты дыхательных движений и оценку работы вспомогательных групп мышц во время дыхания.
Кроме того, пациентам проводят различные инструментальные обследования и диагностические тесты. Обязательно исследуется газовый состав крови, поскольку результаты анализа позволяют определить уровень насыщения углекислым газом и кислородом, а также кислотно-щелочное состояние артериальной крови. Больным может назначаться спирометрия, эта методика помогает определить емкость легких, объем выдоха и другие показатели. С помощью рентгенографии выявляют поражения органов дыхательных путей.
Терапия дыхательной недостаточности направлена на устранение первопричины развития патологии и восстановление нормальной оксигенации крови, а также поддержание оптимальной для функционирования вентиляции легких.
Если у пациента наблюдаются выраженные симптомы гипоксии, то в срочном порядке проводят оксигенотерапию. Носовой катетер или маска применяется, когда больной дышит самостоятельно, при коматозном же состоянии выполняют интубацию, а также искусственную вентиляцию легких.
Медикаментозное лечение проводится одновременно с оксигенотеропией. Пациентам с дыхательной недостаточностью могут назначаться бронхолитики, антибиотики и муколитики. Больным также показаны ингаляции, ЛФК и массаж грудной клетки.
Для диагностики и лечения дыхательной недостаточности обращайтесь в медицинские центры «Президент-Мед» на Коломенской и ВДНХ, а также в городе Видное
Автор: Лаврова Нина Авенировна
Заместитель генерального директора по медицинской части
Окончила Ярославский государственный медицинский институт по специальности «Лечебное дело»
Медицинский опыт работы — 25 лет
Записаться к врачу
ОТЗЫВЫ КЛИЕНТОВ
Татьяна
Роман Евгеньевич хороший,грамотный специалист. Я разбираюсь в медицине и могу полностью доверять доктору.Спасибо.[…]
Я разбираюсь в медицине и могу полностью доверять доктору.Спасибо.[…]
Светлана
Выражаю благодарность Роману Евгеньевичу Бачурину. Доктор провел УЗИ брюшной полости на высшем уровне, проконсультировал по всем беспокоившим меня вопросам, показал на мониторе проблемные области и порекомендовал дальнейшие действия. Осталась очень довольна и отношением врача, и его работой. При необходимости буду вновь к нему обращаться.[…]
Газообмен и взаимосвязь вентиляции и перфузии в легком
Реферат
В этом обзоре представлен обзор взаимосвязи между соотношениями вентиляция / перфузия и газообменом в легких, подчеркивая основные концепции и соотнося их с клиническими сценариями. Для каждого газообменного блока парциальное давление кислорода и углекислого газа в альвеолярной и исходящей крови ( P O 2 и P CO 2 ) определяется соотношением альвеолярной вентиляции и кровотока. ( В ′ A / Q ′) для каждого блока.Шунтирующая и низкая V ′ A / Q ′ области являются двумя примерами несоответствия V ′ A / Q ′ и являются наиболее частыми причинами гипоксемии. Ограничение диффузии, гиповентиляция и низкий уровень вдоха P O 2 вызывают гипоксемию, даже при отсутствии несоответствия V ′ A / Q ′. В отличие от других причин, гипоксемия из-за шунтирования плохо реагирует на дополнительный кислород. Газообменные устройства с небольшим кровотоком или без него (высокий V ‘ A / Q ‘ области) приводят к альвеолярному мертвому пространству и увеличению неэффективной вентиляции, i.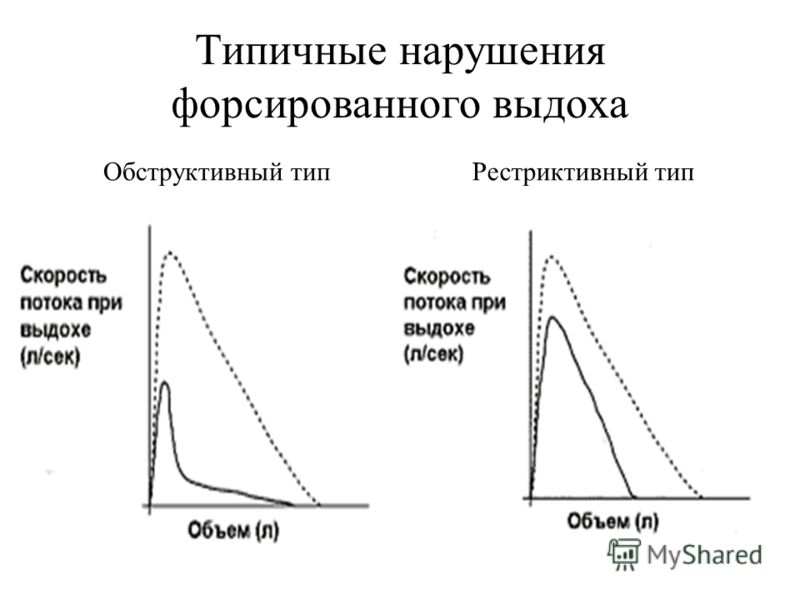 е. менее эффективное удаление углекислого газа. Из-за респираторного стремления поддерживать нормальный артериальный P CO 2 , наиболее частым результатом неэффективной вентиляции является усиление минутной вентиляции и работа дыхания, а не гиперкапния. Расчеты разницы альвеолярно-артериального давления кислорода, венозной примеси и потери вентиляции позволяют количественно оценить влияние несоответствия V ′ A / Q ′ на газообмен.Типы несоответствия V ′ A / Q ′, вызывающего нарушение газообмена, характерно для различных заболеваний легких.
е. менее эффективное удаление углекислого газа. Из-за респираторного стремления поддерживать нормальный артериальный P CO 2 , наиболее частым результатом неэффективной вентиляции является усиление минутной вентиляции и работа дыхания, а не гиперкапния. Расчеты разницы альвеолярно-артериального давления кислорода, венозной примеси и потери вентиляции позволяют количественно оценить влияние несоответствия V ′ A / Q ′ на газообмен.Типы несоответствия V ′ A / Q ′, вызывающего нарушение газообмена, характерно для различных заболеваний легких.
Аннотация
Обзор взаимосвязи вентиляции и перфузии и газообмена, основные концепции и их связь с клиническими случаями http://ow.ly/wMUwq
Введение
В то время как здоровое легкое эффективно обменивается дыхательными газами, гипоксемия и гиперкапния указывают на патофизиологию и неспособность легкого обеспечить адекватный газообмен.Понимание того, как переносятся газы, и причин неэффективного газообмена является центральным элементом ухода за пациентами с заболеваниями легких. В этой статье мы рассмотрим нормальные и патологические механизмы газообмена. Начиная с простого и заканчивая более сложным, мы подчеркнем основные концепции и свяжем их со сценариями случаев, знакомыми клиницистам.
Структура легкого
Структура легкого хорошо подходит для эффективного обмена дыхательных газов.Через дыхательные пути и сосудистые деревья свежие газы и венозная кровь доставляются и удаляются из большой площади поверхности альвеолярных капилляров. У взрослого вдыхаемый воздух попадает в трахею с площадью поперечного сечения ∼3 см 2 и доставляется в альвеолы с площадью поверхности ∼140 м 2 , размером примерно с теннисный корт [1] . Точно так же легочное сосудистое дерево начинается как основная легочная артерия и многократно разветвляется на артериолы и капилляры, которые покрывают 85–95% альвеолярной поверхности [1]. Исключительно тонкая мембрана толщиной всего 1 мкм [2, 3] разделяет альвеолярные газовые и кровяные компартменты, позволяя газам быстро диффундировать между ними. Из-за относительно большого объема крови в альвеолярных капиллярах кровоток замедляется, а время прохождения крови увеличивается, обычно до 0,25–0,75 с, что дает больше времени для газообмена. Замечательная конструкция, позволяющая построить эту систему газообмена внутри грудной полости, была подчеркнута путем сравнения этого инженерного подвига со сложением буквы так, чтобы она поместилась в наперсток [3].
Исключительно тонкая мембрана толщиной всего 1 мкм [2, 3] разделяет альвеолярные газовые и кровяные компартменты, позволяя газам быстро диффундировать между ними. Из-за относительно большого объема крови в альвеолярных капиллярах кровоток замедляется, а время прохождения крови увеличивается, обычно до 0,25–0,75 с, что дает больше времени для газообмена. Замечательная конструкция, позволяющая построить эту систему газообмена внутри грудной полости, была подчеркнута путем сравнения этого инженерного подвига со сложением буквы так, чтобы она поместилась в наперсток [3].
Единица легкого
Начнем с простой модели легкого, состоящей всего из одного газообменного блока (рис. 1а). Капилляры аппарата доставляют смешанную венозную кровь с низким парциальным давлением O 2 ( P v¯O 2 ). Парциальное давление O 2 ( P O 2 ) в альвеолярном газе ( P AO 2 ) намного выше, чем в капиллярной крови, и O 2 пассивно диффундирует из альвеолярное пространство в кровь при прохождении по капиллярам (рис.2а). Мембрана, разделяющая компартменты альвеолярного газа и крови, вызывает небольшое сопротивление диффузии, поэтому P O 2 в концевой капиллярной крови ( P ecO 2 ) уравновешивается P AO 2 задолго до того, как кровь покинет отделение. Следовательно, оксигенация артериальной крови в первую очередь зависит от P AO 2 . Обратите внимание, что в этой идеализированной легочной единице нет разницы между P AO 2 и P O 2 в артериальной крови ( P aO 2 ).По причинам, которые будут объяснены ниже, разница в натяжении альвеолярно-артериального O 2 ( P A – aO 2 ) очень полезна при оценке причин проблем газообмена в клинической медицине, и мы будем использовать ее в этом обзоре. . Хотя термин «градиент» также широко используется, мы предпочитаем использовать термин «разница», чтобы подчеркнуть, что разница между P AO 2 и P aO 2 не связана с давлением. градиент между ними.Парциальное давление CO 2 ( P CO 2 ) больше в смешанной венозной крови ( P v¯CO 2 ), чем в альвеолярном газе ( P ACO ). 2 ) и диффузия через альвеолярно-капиллярную мембрану, следовательно, приводит к чистому потоку в направлении, противоположном направлению O 2 , от крови к альвеолярному газу (рис. 2b). Результат снова равен P CO 2 в альвеолярном газе и концевой капиллярной крови ( P ecCO 2 ), потому что сопротивление диффузии даже меньше для CO 2 , чем для O 2 .Из-за различий в соотношении парциальных давлений и содержания в крови для O 2 и CO 2 примерно столько же CO 2 обменивается на разницу парциального давления между смешанной венозной и артериальной кровью 5 мм рт. ), поскольку имеется обмен O 2 с разницей в 60 мм рт. ст. (6,7 кПа). Количество O 2 , переносимое в крови, определяется концентрацией гемоглобина, долей связывания гемоглобина O 2 и P aO 2 (рис.1б). Когда мы обсуждаем несколько моделей легких ниже, важно понимать, что содержание концевых капилляров крови O 2 ( C ecO 2 ), а не P ecO 2 , от разных агрегатов складываются.
. Хотя термин «градиент» также широко используется, мы предпочитаем использовать термин «разница», чтобы подчеркнуть, что разница между P AO 2 и P aO 2 не связана с давлением. градиент между ними.Парциальное давление CO 2 ( P CO 2 ) больше в смешанной венозной крови ( P v¯CO 2 ), чем в альвеолярном газе ( P ACO ). 2 ) и диффузия через альвеолярно-капиллярную мембрану, следовательно, приводит к чистому потоку в направлении, противоположном направлению O 2 , от крови к альвеолярному газу (рис. 2b). Результат снова равен P CO 2 в альвеолярном газе и концевой капиллярной крови ( P ecCO 2 ), потому что сопротивление диффузии даже меньше для CO 2 , чем для O 2 .Из-за различий в соотношении парциальных давлений и содержания в крови для O 2 и CO 2 примерно столько же CO 2 обменивается на разницу парциального давления между смешанной венозной и артериальной кровью 5 мм рт. ), поскольку имеется обмен O 2 с разницей в 60 мм рт. ст. (6,7 кПа). Количество O 2 , переносимое в крови, определяется концентрацией гемоглобина, долей связывания гемоглобина O 2 и P aO 2 (рис.1б). Когда мы обсуждаем несколько моделей легких ниже, важно понимать, что содержание концевых капилляров крови O 2 ( C ecO 2 ), а не P ecO 2 , от разных агрегатов складываются.
Рисунок 1-
a) Иллюстрация обозначений, используемых для парциальных давлений, долей газа и содержания O 2 для различных отделов в одной единице легкого, как определено в таблице 1. Обратите внимание, что для модели легкого одной единицы, артериальной и конечной -капиллярные значения равны. б) Кривая диссоциации гемоглобина и кислорода (Hb – O 2 ) для парциального давления O 2 ( P O 2 ), насыщения O 2 и содержания O 2 в венозном и артериальные компартменты для концентрации гемоглобина 15 г · дл -1 .
б) Кривая диссоциации гемоглобина и кислорода (Hb – O 2 ) для парциального давления O 2 ( P O 2 ), насыщения O 2 и содержания O 2 в венозном и артериальные компартменты для концентрации гемоглобина 15 г · дл -1 .
Фигура 2-
a) P O 2 в разных отсеках и как диффузия O 2 по капилляру позволяет P ecO 2 равняться P AO 2 задолго до кровь покидает блок.Обратите внимание, что результатом является нулевое значение P A – aO 2 . б) P CO 2 показано аналогичным образом. Шкала времени на диаграммах на обеих панелях относится к времени прохождения эритроцитов через альвеолярные капилляры, обычно 0,25–0,75 с. Словарь терминов см. В таблице 1.
Таблица 1-
Глоссарий газовых переменных и другие обозначения
Пять причин артериальной гипоксемии
Моноблочная модель (рис.1а) используется, чтобы начать обсуждение пяти потенциальных причин гипоксемии, а также гиперкапнии. Наш первый пример — это ограничение распространения.
Ограничение диффузии
В случае 1 у 25-летнего элитного велосипедиста мужского пола, который проходит исследование сердечно-легочной нагрузки, отмечается прогрессирующее ухудшение артериальной гипоксемии с увеличением нагрузки (реакция не наблюдается у нормальных людей). Газы артериальной крови (ГАК) в конце упражнения составляют: pH 7,18, P CO 2 в артериальной крови ( P aCO 2 ) 30 мм рт.0 кПа), P aO 2 81 мм рт. Ст. (10,8 кПа) и артериальный гемоглобин O 2 насыщение 88%.
Физические упражнения увеличивают количество O 2 , извлекаемого из артериальной крови в большой круг кровообращения, что имеет тенденцию к снижению P v¯O 2 . Следовательно, для достижения нормальной оксигенации артериальной крови в легкие должно поступать больше O 2 . Физические упражнения также увеличивают легочный кровоток, что сокращает время, в течение которого кровь подвергается воздействию альвеолярного газа.Комбинированный эффект заключается в том, что необходимо поглощать больше O 2 за меньшее время (рис. 3). При очень высоких сердечных выбросах время прохождения может быть слишком коротким для полного уравновешивания между P AO 2 и P ecO 2 . Это представляет собой ограничение диффузии как причину гипоксемии у спортсменов, достигающих чрезвычайно высокого сердечного выброса [4–6]. Гипоксемия из-за ограничения диффузии также может наблюдаться у здоровых людей во время тренировок на высоте.В этой настройке управляющее давление для диффузии O 2 уменьшается из-за более низкого значения P O 2 во вдыхаемом воздухе ( P IO 2 ) на высоте и времени прохождения крови. через альвеолярные капилляры короче из-за более высокого сердечного выброса. Ограничение диффузии также может возникать у пациентов с интерстициальными заболеваниями легких. Пациенты с этими заболеваниями могут иметь нормальный P aO 2 в покое, но у них развивается гипоксемия во время упражнений, что можно объяснить комбинированным эффектом повышенного сопротивления диффузии через утолщенную альвеолярно-капиллярную мембрану, сниженного P v¯O 2 и сокращенное время прохождения [7].
Следовательно, для достижения нормальной оксигенации артериальной крови в легкие должно поступать больше O 2 . Физические упражнения также увеличивают легочный кровоток, что сокращает время, в течение которого кровь подвергается воздействию альвеолярного газа.Комбинированный эффект заключается в том, что необходимо поглощать больше O 2 за меньшее время (рис. 3). При очень высоких сердечных выбросах время прохождения может быть слишком коротким для полного уравновешивания между P AO 2 и P ecO 2 . Это представляет собой ограничение диффузии как причину гипоксемии у спортсменов, достигающих чрезвычайно высокого сердечного выброса [4–6]. Гипоксемия из-за ограничения диффузии также может наблюдаться у здоровых людей во время тренировок на высоте.В этой настройке управляющее давление для диффузии O 2 уменьшается из-за более низкого значения P O 2 во вдыхаемом воздухе ( P IO 2 ) на высоте и времени прохождения крови. через альвеолярные капилляры короче из-за более высокого сердечного выброса. Ограничение диффузии также может возникать у пациентов с интерстициальными заболеваниями легких. Пациенты с этими заболеваниями могут иметь нормальный P aO 2 в покое, но у них развивается гипоксемия во время упражнений, что можно объяснить комбинированным эффектом повышенного сопротивления диффузии через утолщенную альвеолярно-капиллярную мембрану, сниженного P v¯O 2 и сокращенное время прохождения [7].
Рисунок 3–
Оксигенация капиллярной крови как функция времени в различных условиях. На панели показано, как P ecO 2 и, следовательно, P aO 2 не достигают P AO 2 из-за низкого значения P v 2 и короткое время прохождения во время экстремальных упражнений на уровне моря (сплошная кривая) и умеренных упражнений на высоте (пунктирная кривая). Сравните с нормальной скоростью оксигенации на рисунке 2а.Словарь терминов см. В таблице 1.
Сравните с нормальной скоростью оксигенации на рисунке 2а.Словарь терминов см. В таблице 1.
Ограничение диффузии — одна из пяти причин гипоксемии (таблица 2). Отсутствие уравновешивания между P AO 2 и P ecO 2 создает повышенное значение P A – aO 2 . Гипоксемия у этих пациентов, как правило, хорошо поддается дополнительному лечению O 2 . Хотя это не устраняет ограничение диффузии, оно увеличивает P AO 2 и движущее давление для диффузии O 2 в кровь.Из-за низкого сопротивления диффузии CO 2 , P aCO 2 является нормальным для пациентов с диффузионными ограничениями O 2 . Хотя ограничение диффузии является нашей первой причиной гипоксемии в таблице 2, с клинической точки зрения это нечастая причина низкого значения P aO 2 .
Таблица 2-
Пять причин гипоксемии
Гиповентиляция
В случае 2, 82-летняя женщина с хронической почечной недостаточностью, находящаяся на непрерывном амбулаторном перитонеальном диализе (CAPD), недавно заразилась коклюшем от своих внуков.Ее врач прописал противокашлевое средство, содержащее опиоиды, чтобы уменьшить кашель. Теперь она сонная и не может справляться с процедурами CAPD. Анализ ABG показывает pH 7,17, P aO 2 45 мм рт. Ст. (6,0 кПа) и P aCO 2 77 мм рт.
Этот случай подчеркивает, что гиповентиляция является причиной гипоксемии. Хотя количественная взаимосвязь сложна [8, 9], интуитивно понятно, что P AO 2 в нашей единственной альвеолярной единице (рис.1a) зависит от соотношения между доставкой O 2 (вентиляция, V ′ A ) и удалением O 2 (кровоток, Q ′). Следовательно, одним из определяющих факторов P AO 2 является баланс или соотношение между вентиляцией и кровотоком ( V ′ A / Q ′). У пациента из случая 2 гиповентиляция и нормальный кровоток приводят к низкому соотношению V ′ A / Q ′ (без доставки и неизменного удаления O 2 ), что снижает P AO . 2 и, следовательно, P ecO 2 .И наоборот, гипервентиляция (усиление вентиляции относительно кровотока) увеличивает P AO 2 и P ecO 2 . P ACO 2 также определяется соотношением V ′ A / Q ′, но CO 2 доставляется через кровоток, а CO 2 удаляется через вентиляцию, обратное О 2 . Следовательно, уменьшение соотношения V ′ A / Q ′ приводит к более высокому соотношению P ACO 2 и P aCO 2 , отличительному признаку гиповентиляции, в то время как повышенное соотношение снижает П АКО 2 .Эти отношения проиллюстрированы на рисунке 4. Баланс между доставкой и удалением O 2 дает P AO 2 , который можно количественно определить с помощью уравнения альвеолярного газа (вставка 1).
У пациента из случая 2 гиповентиляция и нормальный кровоток приводят к низкому соотношению V ′ A / Q ′ (без доставки и неизменного удаления O 2 ), что снижает P AO . 2 и, следовательно, P ecO 2 .И наоборот, гипервентиляция (усиление вентиляции относительно кровотока) увеличивает P AO 2 и P ecO 2 . P ACO 2 также определяется соотношением V ′ A / Q ′, но CO 2 доставляется через кровоток, а CO 2 удаляется через вентиляцию, обратное О 2 . Следовательно, уменьшение соотношения V ′ A / Q ′ приводит к более высокому соотношению P ACO 2 и P aCO 2 , отличительному признаку гиповентиляции, в то время как повышенное соотношение снижает П АКО 2 .Эти отношения проиллюстрированы на рисунке 4. Баланс между доставкой и удалением O 2 дает P AO 2 , который можно количественно определить с помощью уравнения альвеолярного газа (вставка 1).
Рисунок 4–
Влияние гипер- и гиповентиляции на P AO 2 (красный) и P ACO 2 (синий) и, следовательно, также на P aO 2 и P aCO 2 , если нет другого несоответствия V ′ A / Q ′.Пунктирными линиями показаны нормальные значения для В ′ A , P AO 2 и P ACO 2 . Диаграмма получена при неизменном сердечном выбросе, потреблении O 2 и производстве CO 2 со смешанными венозными значениями, изменяющимися с изменениями в P aO 2 и P aCO 2 . При гиповентиляции P v¯O 2 и P v¯CO 2 ниже и выше нормы, соответственно.Обратите внимание, что изменения в V ‘ A соответствуют изменениям в соотношении V ‘ A / Q ‘, поскольку кровоток (сердечный выброс) поддерживается постоянным. Таким образом, пониженная вентиляция (низкое соотношение V ′ A / Q ′) приводит к перемещению P AO 2 и P ACO 2 в сторону смешанных венозных значений при сдвиге гипервентиляции. P AO 2 и P ACO 2 в сторону их вдохновенных ценностей.Таким образом, гиповентиляция приводит как к гипоксемии, так и к гиперкапнии. Увеличение F IO 2 приводит к смещению вверх кривой P O 2 , в то время как кривая P CO 2 остается фиксированной. В этой ситуации P aCO 2 может быть высоким даже при отсутствии гипоксемии. Словарь терминов см. В таблице 1. Адаптировано из [10].
При гиповентиляции P v¯O 2 и P v¯CO 2 ниже и выше нормы, соответственно.Обратите внимание, что изменения в V ‘ A соответствуют изменениям в соотношении V ‘ A / Q ‘, поскольку кровоток (сердечный выброс) поддерживается постоянным. Таким образом, пониженная вентиляция (низкое соотношение V ′ A / Q ′) приводит к перемещению P AO 2 и P ACO 2 в сторону смешанных венозных значений при сдвиге гипервентиляции. P AO 2 и P ACO 2 в сторону их вдохновенных ценностей.Таким образом, гиповентиляция приводит как к гипоксемии, так и к гиперкапнии. Увеличение F IO 2 приводит к смещению вверх кривой P O 2 , в то время как кривая P CO 2 остается фиксированной. В этой ситуации P aCO 2 может быть высоким даже при отсутствии гипоксемии. Словарь терминов см. В таблице 1. Адаптировано из [10].
ВСТАВКА 1–
Две версии уравнения альвеолярного газа
Гипоксемия, вторичная по отношению к гиповентиляции, таким образом, обусловлена низким значением P AO 2 и является второй причиной низкого значения P aO 2 , указанного в таблице 2.Поскольку нет нарушения газообмена через альвеолярно-капиллярную мембрану, P AO 2 и P aO 2 уменьшаются аналогичным образом, а P A – aO 2 является нормальным при гипоксемии, вызванной только гиповентиляцией. В случае 2 уравнение альвеолярного газа (поле 1) приводит к оценкам P AO 2 , равным 53 мм рт. Ст. (7,1 кПа) и P A – aO 2 ∼7 мм рт.9 кПа), нормальное значение. Гипоксемия, вызванная гиповентиляцией, может быть устранена добавлением O 2 , увеличивая P AO 2 , даже если гиповентиляция остается нескорректированной. Одним из важных аспектов лечения O 2 в этой ситуации является то, что гиповентиляция при вдыхании воздуха приведет к тяжелой гипоксемии до того, как P aCO 2 повысится до опасно высокого уровня. Напротив, добавление O 2 может привести к тому, что P AO 2 и P aO 2 будут поддерживаться выше 90 мм рт. Ст. (12 кПа) даже при гиповентиляции, вызывающей тяжелую гиперкапнию.Клинически важным выводом является то, что нормальные показания пульсоксиметрии у пациента, дышащего воздухом, являются хорошим показателем адекватной вентиляции (нормальная P aCO 2 ). Однако, когда пациент получает дополнительный O 2 , нормальное насыщение O 2 не может использоваться для оценки адекватности вентиляции.
Ст. (7,1 кПа) и P A – aO 2 ∼7 мм рт.9 кПа), нормальное значение. Гипоксемия, вызванная гиповентиляцией, может быть устранена добавлением O 2 , увеличивая P AO 2 , даже если гиповентиляция остается нескорректированной. Одним из важных аспектов лечения O 2 в этой ситуации является то, что гиповентиляция при вдыхании воздуха приведет к тяжелой гипоксемии до того, как P aCO 2 повысится до опасно высокого уровня. Напротив, добавление O 2 может привести к тому, что P AO 2 и P aO 2 будут поддерживаться выше 90 мм рт. Ст. (12 кПа) даже при гиповентиляции, вызывающей тяжелую гиперкапнию.Клинически важным выводом является то, что нормальные показания пульсоксиметрии у пациента, дышащего воздухом, являются хорошим показателем адекватной вентиляции (нормальная P aCO 2 ). Однако, когда пациент получает дополнительный O 2 , нормальное насыщение O 2 не может использоваться для оценки адекватности вентиляции.
Низкое давление кислорода на вдохе
В случае 3 21-летняя альпинистка в хорошей форме замечает во время восхождения на Монблан (4810 м), что ее пальцы синие и что ее уровень гемоглобина O 2 составляет 65%.
Хотя доля O 2 в воздухе всегда равна 0,21, снижение барометрического давления на большой высоте вызывает пропорциональное уменьшение P IO 2 . Используя уравнение альвеолярного газа (вставка 1), соответствующее атмосферное давление для ее высоты (420 мм рт. 0,8 приводит к ожидаемому значению P AO 2 на вершине Монблана ∼28 мм рт.7 кПа) и тяжелой гипоксемии. Низкий P IO 2 , на большой высоте или при вдохе O 2 фракция ( F IO 2 ) <0,21, следовательно, является одной дополнительной причиной гипоксемии. Опять же, газообмен на альвеолярно-капиллярной мембране в норме. Причина гипоксемии снижается. P AO 2 и, следовательно, P A – aO 2 является нормальным. Как тогда можно подняться на Монблан? Гипоксемия увеличивает дыхательный драйв, тем самым увеличивая общее соотношение V ′ A / Q ′ и доставку O 2 в альвеолы, что частично корректирует P AO 2 и P aO 2 (рис.3). Повышенная вентиляция приводит к гипокапнии, определяемой как P aCO 2 <40 мм рт. Ст. (<5,3 кПа). Недавние пробы ABG от альпинистов, дышащих воздухом на вершине Эвереста, показали, что среднее значение P aO 2 составляет 25 мм рт. Ст. (3,3 кПа) и P aCO 2 составляет 13 мм рт. 11]. Второй метод повышения P AO 2 и улучшения P aO 2 — это дополнительное дыхание O 2 .Большинство альпинистов, достигающих вершины Эвереста, используют дополнительный O 2 .
Опять же, газообмен на альвеолярно-капиллярной мембране в норме. Причина гипоксемии снижается. P AO 2 и, следовательно, P A – aO 2 является нормальным. Как тогда можно подняться на Монблан? Гипоксемия увеличивает дыхательный драйв, тем самым увеличивая общее соотношение V ′ A / Q ′ и доставку O 2 в альвеолы, что частично корректирует P AO 2 и P aO 2 (рис.3). Повышенная вентиляция приводит к гипокапнии, определяемой как P aCO 2 <40 мм рт. Ст. (<5,3 кПа). Недавние пробы ABG от альпинистов, дышащих воздухом на вершине Эвереста, показали, что среднее значение P aO 2 составляет 25 мм рт. Ст. (3,3 кПа) и P aCO 2 составляет 13 мм рт. 11]. Второй метод повышения P AO 2 и улучшения P aO 2 — это дополнительное дыхание O 2 .Большинство альпинистов, достигающих вершины Эвереста, используют дополнительный O 2 .
Двухэлементные модели легких
Для двух оставшихся причин гипоксемии, оба примера несоответствия V ′ A / Q ′, мы должны перейти к многоэлементным моделям легких. Анатомическая структура легкого с несколькими параллельными газообменными узлами, поражающая своей конструкцией и способностью к газообмену, создает основу для неравномерного и различного распределения регионарной вентиляции и кровотока.Если региональная вентиляция и перфузия не идеально согласованы, , т. Е. , каждая единица не получает равных пропорций общего кровотока и общей вентиляции, соотношение V ′ A / Q ′ будет варьироваться между областями легких, каждая из них будут иметь разные P AO 2 и P ACO 2 и газообмен будет менее эффективным. На рисунке 5 показан диапазон значений P AO 2 и P ACO 2 в единицах в зависимости от их отношения V ′ A / Q ′.Чтобы продемонстрировать, как газообмен становится менее эффективным с единицами с различным соотношением V ′ / Q ′, мы начнем с простой модели легких с двумя единицами.
На рисунке 5 показан диапазон значений P AO 2 и P ACO 2 в единицах в зависимости от их отношения V ′ A / Q ′.Чтобы продемонстрировать, как газообмен становится менее эффективным с единицами с различным соотношением V ′ / Q ′, мы начнем с простой модели легких с двумя единицами.
Рисунок 5–
Диаграмма, показывающая, как P AO 2 и P ACO 2 изменяются в зависимости от отношения V ′ A / Q ′ при допущении нормальных значений для P IO 2 (150 мм рт. Ст. (20 кПа)), P v¯O 2 (40 мм рт.3 кПа)) и P v¯CO 2 (45 мм рт. Ст. (6 кПа)). Эти предположения нереалистичны для всего легкого, поскольку изменения в P aO 2 и P aCO 2 вызовут вторичные изменения в смешанных венозных значениях (рис.4 более реалистичен в этом отношении) , но диаграмма иллюстрирует влияние соотношения V ′ A / Q ′ на альвеолярное и концевое капиллярное парциальное давление для региональных отделений легких в ситуации, когда общая вентиляция для кровотока достаточна для поддержания нормального смешанного венозного значения.Обратите внимание, что уменьшение отношения V ′ A / Q ′ ниже нормального значения ∼1 приводит к резкому падению P AO 2 и меньшему увеличению P ACO 2 , где оба приближаются к смешанным венозным значениям, показанным крайним слева. Увеличение соотношения V ′ A / Q ′ приводит к увеличению P AO 2 и уменьшению P ACO 2 , приближаясь к вдохновенным значениям, показанным крайним справа. Словарь терминов см. В таблице 1. Адаптировано из [10].
Словарь терминов см. В таблице 1. Адаптировано из [10].
Низкий
В ′ A / Q ′ единиц
В случае 4 67-летняя женщина с тяжелой эмфиземой имеет ГКД pH 7,35, P aO 2 55 мм рт. Ст. (7,3 кПа) и P aCO 2 55 мм рт. 7,3 кПа) при вдыхании воздуха. При добавлении O 2 при 3 л · мин -1 , насыщение гемоглобина O 2 улучшается с 87% до 93% по данным пульсовой оксиметрии.
На рисунке 6 показано равномерное распределение кровотока, но неравномерное распределение вентиляции по двум блокам, так что один блок имеет отношение V ′ A / Q ′, равное 2,0, а другой блок имеет отношение 0,1. Низкое соотношение V ′ A / Q ′ приводит к низкому P AO 2 в этом блоке и, таким образом, к более низкому содержанию O 2 и P ecO 2 на кровь, покидающую это устройство.Обратите внимание, что эффект аналогичен эффекту у пациента, у которого была гиповентиляция в случае 2, но в этом случае он касается только части легкого. Почти полная оксигенация гемоглобина при нормальном соотношении V ′ A / Q ′ означает, что относительная избыточная вентиляция (высокое соотношение V ′ A / Q ′) результатов другого блока только в немного повышенном содержании O 2 крови, покидающей этот блок. Также помните, что содержание O 2 в артериальной крови ( C aO 2 ) определяется взвешенным по потоку средним содержанием O 2 , а не парциальными давлениями, для крови из разных единиц.Таким образом, общий эффект от единиц V ′ A / Q ′ будет уменьшенным P aO 2 и увеличенным P A – aO 2 . Low V ′ A / Q ′ единиц являются, таким образом, четвертой причиной гипоксемии (таблица 2). Влияние низких V ′ A / Q ′ на P aCO 2 меньше по сравнению с эффектом на P aO 2 , потому что устранение CO 2 увеличивается в установке с высоким соотношением V ′ A / Q ′.У пациентов с низким уровнем V ′ A / Q ′ гиперкапния также предотвращается за счет респираторной реакции на повышенное значение P aCO 2 . Поскольку области с низким V ′ A / Q ′ фактически вентилируются, отрицательное влияние на артериальную оксигенацию можно нейтрализовать, увеличив F IO 2 , что увеличивает P AO 2 , даже в регионах с низким V ′ A / Q ′.Низкое В ′ A / Q ′ единиц, следовательно, не может быть единственной причиной гипоксемии у пациентов, которые не реагируют на повышенный F IO 2 .
Рисунок 6–
Низкое В ′ A / Q ′, представленное двухступенчатой моделью, в которой кровоток в обоих блоках одинаковый, но вентиляция разная, в результате чего блоки с В ′ A / Q ′, равные 2,0 и 0,1. Обратите внимание, что разные соотношения V ′ A / Q ′ приводят к тому, что P AO 2 и P ACO 2 сильно различаются между двумя устройствами. C aO 2 — это средневзвешенное значение расхода двух блоков, в данном случае идентичное среднему арифметическому, поскольку поток между блоками равен. Кривая P aO 2 определяется исходя из нормального гемоглобина O 2 насыщения по сравнению с P O 2 при концентрации гемоглобина 15 г · дл −1 (рис. 1б). Словарь терминов см. В таблице 1. ec и ec * обозначают концевую капиллярную кровь из двух разных единиц.
Шунт
В случае 5, 32-летний мужчина с тяжелым острым респираторным дистресс-синдромом (ОРДС), вторичным по отношению к бактериальной пневмонии, имеет ГВГ на ИВЛ с F IO 2 0,80, что показывает pH 7,28, P aO 2 67 мм рт. Ст. (8,9 кПа) и P aCO 2 61 мм рт. Ст. (8,1 кПа).
На рис. 7 показана ситуация, в которой один блок не имеет вентиляции, следовательно, он не может участвовать в газообмене.Следовательно, кровоток через это устройство представляет собой внутрилегочный шунт. Шунт можно рассматривать как крайний предел диапазона соотношений V ′ A / Q ′ с соотношением 0. Конечный капиллярный кровоток из этого устройства имеет то же самое P ecO 2 и C ecO 2 в виде смешанной венозной крови и в сочетании с кровью из другого блока снижает оксигенацию артериальной крови. Таким образом, шунт является пятой и последней причиной гипоксемии (таблица 2). C aO 2 снова является средневзвешенным по потоку для содержания O 2 из газообменного блока ( C ecO 2 ) и шунтированной крови ( C ec ′ О 2 ) (рис.7). Количество шунта количественно определяется как доля сердечного выброса ( Q ′ s / Q ′ t ), распределенная по невентилируемым блокам (поле 2). Влияние на оксигенацию артериальной крови зависит от этой фракции и содержания O 2 в смешанной венозной крови ( C v¯O 2 ).Для шунта определенной величины меньшее значение C v¯O 2 приведет к ухудшению оксигенации артериальной крови. Вмешательства, направленные на увеличение сатурации смешанных вен O 2 ( S v¯O 2 ) (и, следовательно, C v¯O 2 ), такие как повышение C aO 2 за счет увеличения концентрации гемоглобина, снижения потребления O 2 или увеличения сердечного выброса, следовательно, может улучшить гипоксемию, вызванную большим шунтом.Однако было показано, что фракция шунта увеличивается с увеличением сердечного выброса [13, 14]; поэтому такие вмешательства могут быть менее эффективными, чем ожидалось. Повышенное P v¯O 2 и повышенное давление в легочной артерии, которое может снижать и противодействовать гипоксической вазоконстрикции (обсуждается позже), являются предположительными объяснениями этого влияния сердечного выброса на шунт.
Рисунок 7–
Шунт представлен моделью из двух блоков, в которой кровоток одинаков для обоих блоков, но нет вентиляции в одном блоке.Обратите внимание, что альвеолярные и концевые капилляры P O 2 и P CO 2 в невентилируемой установке равны смешанным венозным значениям, поскольку в этом устройстве нет газообмена. C aO 2 — это средневзвешенное значение потока C ecO 2 и C ec * O 2 от двух блоков, или среднее арифметическое, когда расход равны между единицами, как в этом примере.Кривая P aO 2 определяется исходя из нормального гемоглобина O 2 насыщения по сравнению с P O 2 при концентрации гемоглобина 15 г · дл −1 (рис. 1б). Вертикальная черта справа представляет собой визуальное представление уравнения шунта (см. Вставку 2 и последующий раздел о венозной примеси). Словарь терминов см. В таблице 1. ec и ec * обозначают концевую капиллярную кровь из двух разных единиц.
ВСТАВКА 2–
Уравнение шунта
В отличие от ситуации с низким V ′ A / Q ′ областей, с увеличением шунта F IO 2 гораздо менее эффективен в улучшении артериальной оксигенации. С увеличением доли шунта эффект от повышения F IO 2 постепенно уменьшается, а для очень больших шунтов даже F IO 2 1.0 мало влияет на P aO 2 .Причины небольшого эффекта заключаются в том, что повышение F IO 2 не улучшает P AO 2 в непроветриваемых установках и что небольшой дополнительный O 2 , который может быть добавлен к кровотоку через вентиляции недостаточно, чтобы компенсировать воздействие шунтированной крови. Взаимосвязи между переменными размером шунта, F IO 2 и P aO 2 показаны на изошунтовой диаграмме (рис.8). Примерами клинических состояний с гипоксемией из-за больших внутрилегочных шунтов являются обширный ателектаз, тяжелая пневмония и ОРДС. В этих условиях шунт может превышать 50% от общего легочного кровотока [13, 16–19]. Внутрисердечный шунт справа налево оказывает такое же влияние на P aO 2 , что и внутрилегочный шунт. Даже у нормальных субъектов P aO 2 меньше, чем P AO 2 , главным образом из-за шунта справа налево, составляющего 2–3% сердечного выброса.Большая часть этого не является строгим внутрилегочным шунтом, а представляет собой венозную кровь, добавленную к артериальной крови из бронхиальных вен и фивесских вен левого желудочка [12]. Влияние шунтирования на обмен CO 2 обсуждается во вставке 3.
Рисунок 8–
Изошунтовая диаграмма, иллюстрирующая взаимосвязь между P aO 2 и F IO 2 при наличии шунта, соответствующего разным процентам от общего легочного кровотока.Обратите внимание на почти линейную зависимость между P aO 2 и F IO 2 при отсутствии шунта. При увеличении доли шунта изменение P aO 2 с увеличением F IO 2 становится гораздо более плоским. Следовательно, большое увеличение F IO 2 приводит к небольшому изменению P aO 2 . Для шунта> 30% сердечного выброса даже F IO 2 из 1.0 не приводит к P aO 2 , равному 100 мм рт. Ст. (13,3 кПа). Моделирование основано на концентрации гемоглобина 14 г · дл -1 , P aCO 2 40 мм рт. ¯O 2 ) 5 мл · дл -1 . Словарь терминов см. В таблице 1. Адаптировано из [15].
ВСТАВКА 3–
Уравнение физиологического мертвого пространства (Бора)
Мертвое пространство
В продолжение случая 4 67-летняя женщина с тяжелой эмфиземой госпитализирована с обострением хронической обструктивной болезни легких (ХОБЛ).ABG показывает pH 7,21, P aO 2 67 мм рт. Ст. (8,9 кПа) и P aCO 2 85 мм рт. Измерения показывают, что она дышит 12 л · мин -1 .
Несмотря на минутную вентиляцию ( V ′ E ), которая примерно вдвое превышает норму в покое, у этого пациента наблюдается повышенное P aCO 2 , что указывает на гиповентиляцию. Как это можно объяснить? При каждом вдохе у всех испытуемых часть дыхательного объема ( V T ) остается в проводящих дыхательных путях и, следовательно, не способствует газообмену.Этот объем соответствует анатомическому мертвому пространству и составляет ∼150 мл (2–3 мл · кг –1 ) или треть нормального V T [12, 21]. Следовательно, нормальная доля мертвого пространства дыхательного объема ( V D / V T ) составляет ∼0,3. На рисунке 9 показаны два блока с одинаковой вентиляцией, но один из блоков не имеет кровотока и, следовательно, представляет собой альвеолярное мертвое пространство. Одной из клинических причин может быть тромбоэмболия легочной артерии. Альвеолярное мертвое пространство относится к газообменным узлам, которые вентилируются, но без кровотока, и соотношение V ′ A / Q ′ бесконечно.Мертвое пространство аппарата относится к объему любой лицевой маски, трубки, и т. Д. , который функционирует как расширение анатомического мертвого пространства. Таким образом, полное мертвое пространство ( V D ) состоит из суммированного анатомического мертвого пространства, альвеолярного мертвого пространства и мертвого пространства любого аппарата.
Рисунок 9–
Альвеолярное мертвое пространство, проиллюстрированное на модели из двух блоков, в которой кровоток поступает только в один блок, а вентиляция — в оба блока. Поскольку в установке без кровотока не происходит газообмена, P AO 2 и P ACO 2 в этом устройстве равны вдыхаемому давлению.Блок мертвого пространства не влияет на газы артериальной крови, поскольку этот блок не влияет на кровоток. Отсутствие CO 2 , истекшего из зоны мертвого пространства, разбавляет концентрацию CO 2 , истекшего из другого блока и просроченного P CO 2 , таким образом, ниже, чем из перфузированных единиц. Степень уменьшения истекшего P CO 2 по сравнению с P aCO 2 пропорциональна доле легкого, представляющей собой мертвое пространство.Вертикальная полоса справа — это визуальное представление уравнения мертвого пространства (вставка 3). Он аналогичен изображенному на рисунке 7 и объяснен в разделе, посвященном отработанной вентиляции. Словарь терминов см. В таблице 1.
Минутная вентиляция относится к общему объему выдыхаемого газа в минуту, в то время как эффективная альвеолярная вентиляция относится к объему газа в минуту, который участвует в газообмене. Напротив, вентиляция мертвого пространства или бесполезная вентиляция — это часть общей вентиляции, которая не способствует газообмену.Эта доля потраченной впустую вентиляции часто выражается как отношение V D / V T . Эффективная альвеолярная вентиляция может быть рассчитана как В ′ A = RR × ( V T — V D ), где RR — частота дыхания, или как V ′ A = . V ′ E × (1– V D / V T ). Обратите внимание, что эффективная альвеолярная вентиляция определяется как минутной вентиляцией, так и В D / В T .Повышенное значение В D по сути означает, что необходима более продолжительная минутная вентиляция для поддержания эффективной альвеолярной вентиляции, достаточной для удаления CO 2 . Увеличение V D / V T без компенсирующего увеличения минутной вентиляции приводит к уменьшению P aO 2 и увеличению P aCO 2 . У пациента в случае 4 высокой минутной вентиляции недостаточно для компенсации увеличения V D / V T , что приводит к гиперкапнии.Повышенное значение P aCO 2 может также наблюдаться у пациентов с седативной и механической вентиляцией легких, которые не увеличивают минутную вентиляцию легких в условиях новой тромбоэмболии легочной артерии.
Высокая
В ′ A / Q ′ единиц
High V ′ A / Q ′ — это устройства, вентиляция которых происходит пропорционально кровотоку, например, устройство, которое получает вентиляцию 1 л · мин. -1 , но кровоток только 0.1 л · мин -1 , что приводит к соотношению В ′ A / Q ′, равному 10. Хотя эта единица не представляет альвеолярное мертвое пространство, вентиляция с превышением кровотока вызывает «эффект мертвого пространства». , потому что меньше CO 2 будет удалено за счет вентиляции блока с высоким V ′ A / Q ′, чем за счет вентиляции области с лучшей перфузией. Таким образом, аналогично альвеолярному мертвому пространству, добавление единиц с высоким В ′ A / Q ′ означает, что необходима более продолжительная минутная вентиляция для поддержания адекватного газообмена.Высокое V ′ A / Q ′ области в основном связаны с областями нормальной вентиляции с низким кровотоком. Влияние этих областей на ABG невелико, потому что вклад любой области в состав ABG взвешивается по потоку.
Более двухкомпонентные модели легких
До сих пор мы сосредоточились на моделях с одним или двумя легочными модулями. На самом деле газообмен во всем легком и образующиеся P aO 2 и P aCO 2 определяются потоком исходящей крови из тысяч единиц с различными V ′ A Отношения / Q ′ (рис.10). Райли и Курнанд [9] предположили, что влияние несоответствия V ′ A / Q ′ на газообмен можно более просто представить и количественно оценить как легкое, состоящее всего из трех отделений с разными V ′ . Соотношения A / Q ′: один отсек с идеальным согласованием V ′ A / Q ′ ( V ′ A / Q ′ = 1.0), один полностью без вентиляции ( V ′ A / Q ′ = 0, шунт) и один без кровотока ( V ′ A / Q ′ = ∞, мертвое пространство).
Рисунок 10–
a) Процент легочных единиц (вертикальная ось) с различными соотношениями V ′ A / Q ′ (горизонтальная ось) в легком, который имеет общее V ′ A / Q ′ 1,0 (минутная вентиляция соответствует сердечному выбросу). Общая эффективность газообмена определяется распределением единиц по разным соотношениям, при этом оптимальная эффективность соответствует очень узкому распределению со всеми единицами, имеющими коэффициент 1,0. Кривая иллюстрирует нормальную ситуацию с большинством агрегатов, имеющих коэффициент, близкий к оптимальному.Единицы слева от пунктирной линии имеют низкое отношение и, следовательно, способствуют увеличению P A – aO 2 и венозной примеси; эффект увеличивается с увеличением отклонения от коэффициента 1,0. Установки справа от пунктирной линии имеют высокий коэффициент пропорциональности и, следовательно, способствуют потере вентиляции; снова эффект увеличивается с увеличением отклонения от коэффициента 1,0. Единицы измерения шунта и мертвого пространства нанесены на двух крайних точках горизонтальной оси. б) Иллюстрация трехкомпонентной модели, предложенной Райли и Курнаном [9] для количественной оценки несоответствия V ′ A / Q ′ как венозной примеси и потери вентиляции.Словарь терминов см. В таблице 1.
Модель практична, потому что относительно легко получить измерения, необходимые для количественной оценки шунтирующего кровотока и вентиляции мертвого пространства (обсуждается ниже). Важно понимать, что в расчетах предполагается, что влияние несоответствия V ′ A / Q ′ на P aO 2 и P aCO 2 полностью связано с шунтирующая вентиляция и вентиляция мертвого пространства, и что весь газообмен происходит в установках с идеальным согласованием В ′ A / Q ′.Модель не отражает истинную ситуацию, поскольку игнорирует газообмен в установках с другими соотношениями V ′ A / Q ′.
Венозная примесь
В трехкамерной модели шунтирующий кровоток рассчитывается с использованием уравнения шунта (вставка 2). Вычисленный шунт, альтернативно и более точно описываемый как венозная примесь, соответствует количеству шунта смешанной венозной крови справа налево, которое привело бы к наблюдаемой артериальной оксигенации в отсутствие низкого V ′ A / Q ′ регионов.Следовательно, венозная примесь может увеличиваться даже при отсутствии истинного шунта.
Используя значения, полученные при дыхании 100% O 2 , можно отличить гипоксемию из-за низких областей V ′ A / Q ′ от эффекта истинного шунта, потому что венозная примесь от низкого уровня V ′ Регионы A / Q ′ в этой ситуации упраздняются [12]. Одна из проблем этого подхода заключается в том, что дыхание 100% O 2 имеет тенденцию к увеличению количества шунта из-за абсорбционного ателектаза, поэтому степень шунтирования при более низком дыхании F IO 2 может быть завышена.Шунт также можно измерить с помощью инертных газов с низкой растворимостью в крови [17, 22]. Следует отметить, что эта методика также отличается от расчета венозной примеси, поскольку она исключает шунтирующий эффект венозной крови, добавляемой к артериальной крови после прохождения через легкие, из фивийских и бронхиальных вен.
Отработанная вентиляция (физиологическое мертвое пространство)
Согласно трехкомпонентной модели Райли и Курнана [9], физиологическое мертвое пространство или потраченная впустую вентиляция соответствует общему мертвому пространству, которое может вызвать наблюдаемое нарушение элиминации CO 2 (вставка 3).Мы предпочитаем термин «потраченная впустую вентиляция», поскольку он лучше описывает значение этой величины. В нормальных легких потеря вентиляции близко соответствует анатомическому мертвому пространству. Помимо анатомического мертвого пространства, неэффективная вентиляция также возникает из-за любого аппарата, альвеолярного мертвого пространства и аппаратов с высоким В ′ A / Q ′. Кровь из областей шунтирования будет иметь значение P ecCO 2 , равное смешанному венозному значению, которое увеличивает P aCO 2 и, следовательно, вычисляет потерянную вентиляцию; это было названо шунтирующим мертвым пространством [21].Это результат использования P aCO 2 в качестве суррогата для P ACO 2 ; следовательно, хотя и не является эффектом увеличенного мертвого пространства или областей с высоким значением V ‘ A / Q ‘, он представляет собой нарушение элиминации CO 2 [23]. Как обсуждалось выше, эффективная альвеолярная вентиляция равна минутной вентиляции за вычетом излишней вентиляции. Минутная вентиляция 7,5 л · мин −1 и нормальная В D / В T из 0.3 дает эффективную альвеолярную вентиляцию 5,25 л · мин -1 . Хроническая болезнь легких может увеличиваться V D / V T до ≥0,8; в этом случае требуется минутная вентиляция ≥25 л · мин -1 для эффективной альвеолярной вентиляции 5 л · мин -1 . Таким образом, измерения неэффективной вентиляции позволяют оценить влияние несоответствия V ′ A / Q ′ на минутную вентиляцию, необходимую для поддержания адекватного газообмена.Хотя это и не измерено, для пациента в случае 4 повышение P aCO 2 , несмотря на высокую минутную вентиляцию, скорее всего, объясняется более значительным компонентом неэффективной вентиляции.
Поскольку контроль дыхания направлен на поддержание нормального значения P aCO 2 , увеличение неэффективной вентиляции требует увеличения минутной вентиляции для поддержания неизменной эффективной альвеолярной вентиляции. Таким образом, первым следствием увеличения неэффективной вентиляции в большинстве ситуаций является не увеличение P aCO 2 , а изменение минутной вентиляции и, следовательно, работы дыхания.Хроническую гиперкапнию можно рассматривать как адаптивную реакцию, поскольку это означает, что удаление CO 2 может поддерживаться при более низкой минутной вентиляции и, таким образом, снижает работу дыхания.
От артерии до конца выдоха
P CO 2 разница
Уравнение физиологического мертвого пространства (вставка 3) использует разницу между P aCO 2 и P CO 2 смешанного выдыхаемого газа ( P ĒCO 2 ), чтобы рассчитать общую долю потраченной впустую вентиляции.Напротив, разница между P aCO 2 и P CO 2 смешанного выдыхаемого альвеолярного газа исключает влияние анатомической мертвой зоны и мертвого пространства аппарата и, следовательно, оценивает степень высокой V ′ A / Q ′ и альвеолярные зоны мертвого пространства. Поскольку последняя часть выдыхаемого газа V T состоит из альвеолярного газа (прямоугольник 4), конечный выдох P CO 2 ( P ETCO 2 ) может использоваться в качестве суррогата. мера смешанная P ACO 2 .Таким образом, разница P aCO 2 — P ETCO 2 коррелирует с мертвым пространством и потерянной вентиляцией [28–30]. Примечательно, что, учитывая физиологическое уравнение мертвого пространства, модельные исследования показали, что ( P aCO 2 — P ETCO 2 ) / P aCO 2 имеет более линейная корреляция с долей мертвого пространства альвеол, чем у более простого P aCO 2 — P ETCO 2 [29, 30].Хотя это зависит, например, от возраста, объема вдыхаемого / выдыхаемого газа и режима вентиляции, нормальным считается значение P aCO 2 — P ETCO 2 <5 мм рт. [31, 32] и подтверждается P ETCO 2 , близким к 36 мм рт. Ст. (4,8 кПа) у небольшого числа нормальных субъектов [33]. P aCO 2 — P ETCO 2 , как было показано, коррелирует с фракцией мертвого пространства альвеол и рекрутингом альвеол на животных моделях ОРДС [34]. P ETCO 2 показано на рисунке 11 и дополнительно обсуждается во вставке 4.
Рисунок 11–
Капнограмма, показывающая P CO 2 выдыхаемого газа (вертикальная ось), построенная на графике против времени (горизонтальная ось) во время одного выдоха. Кривая A соответствует теоретической кривой модели одного легочного блока, в которой первая часть выдоха состоит исключительно из анатомического газа мертвого пространства без CO 2 , а остальная часть выдыхаемого альвеолярного газа имеет однородную форму P CO 2 , что равно P ACO 2 .В этой однокомпонентной модели P ETCO 2 = P ACO 2 = P aCO 2 . Кривая B соответствует капнограмме здорового человека с нормальным несоответствием V ′ A / Q ′. Обратите внимание, что будет небольшая разница между P ETCO 2 (отмечена белым кружком) и P aCO 2 .Кривая C показывает, как увеличение V ′ A / Q ′ вызывает увеличение P CO 2 выдыхаемого газа на протяжении выдоха. В этом случае P ETCO 2 даже превышает P ACO 2 и, возможно, P aCO 2 . Хотя это нечасто, это может произойти при медленном выдохе большого объема V T или при максимальной нагрузке.Кривая D иллюстрирует ситуацию с увеличенным мертвым пространством альвеол, что приводит к увеличению разницы между P aCO 2 и P ETCO 2 , что может наблюдаться у пациента с тромбоэмболией легочной артерии. Словарь терминов см. В таблице 1.
ВСТАВКА 4–
В конце выдоха P CO 2 ( P ETCO 2 )
Комбинированный эффект низкого и высокого
V ′ A / Q ′ регионов
По сравнению с оптимальным соответствием V ′ A / Q ′, перераспределение региональной вентиляции или кровотока должно приводить как к низкому, так и к высокому V ′ A / Q ′ регионам.Например, смещение кровотока от одного блока к другому приведет к тому, что перфузия одного блока будет меньше пропорционально вентиляции (высокое В ′ A / Q ′), а перфузия другого блока будет пропорционально большей. к вентиляции (низкая В ′ A / Q ′). По сравнению с влиянием на P aCO 2 , влияние несоответствия V ′ A / Q ′ на P aO 2 часто более очевидно, потому что 1) числовой изменения в P aO 2 больше, чем в P aCO 2 и 2) устранению нарушенного CO 2 часто противодействует увеличенная минутная вентиляция, которая компенсирует эффект V ′ A / Q ′ несоответствие на P aCO 2 в гораздо большей степени, чем влияние на P aO 2 .Чистый эффект несоответствия В ′ A / Q ′ всегда приводит к снижению эффективности газообмена, и для данного F IO 2 и минутной вентиляции приводит к снижению P aO 2 и выше P aCO 2 , чем было бы, если бы соответствие V ′ A / Q ′ было оптимальным.
V ′ A / Q ′ несоответствие в нормальном легком
Регионарная вентиляция и кровоток в нормальном легком неоднородны.Неоднородность вентиляции и перфузии объясняется влиянием геометрии дыхательных путей и сосудов, а также региональными различиями кровотока и податливости легких из-за силы тяжести [35–39]. Традиционная зональная модель перфузии и вентиляции [38] предсказывает, что и перфузия, и вентиляция увеличиваются в гравитационном направлении, от верхушки к основанию легкого в вертикальном положении. Однако они не увеличиваются с той же скоростью, и V ‘ / Q ‘ имеет тенденцию уменьшаться от вершины к основанию.Исследования на животных с использованием измерений с более высоким пространственным разрешением предложили фрактальную модель [40, 41], в которой асимметрия сосудистого дерева приводит к неоднородности перфузии, которую нельзя объяснить гидростатическим градиентом из-за силы тяжести. На региональную вентиляцию и кровоток дополнительно влияют поза, объем легких и положительное давление в дыхательных путях [36, 37, 42], и это лишь несколько факторов. Несмотря на эти неоднородности, эффективный газообмен возможен благодаря тесному согласованию вентиляции и кровотока, что объясняется общими влияниями структуры и силы тяжести [35].Однако корреляция не идеальна, что приводит к изменению соотношений V ′ A / Q ′ и, следовательно, P AO 2 и P ACO 2 . между разными областями легкого [35].
У молодых здоровых людей большая часть вентиляции и кровотока распределяется по установкам с соотношением V ′ A / Q ′ между 0,3 и 2,0 [22], что обычно приводит к диапазону P AO. 2 примерно от 90 до 130 мм рт. Ст. (Рис.5) [43]. С возрастом вентиляция и кровоток распределяются по отделениям с более широким диапазоном соотношений V ′ A / Q ′, при этом кровоток в регионах с низким V ′ A / Q ′ объясняется снижением вентиляции зависимых областей легких из-за закрытия дыхательных путей [12, 44]. Следовательно, P A – aO 2 увеличивается с возрастом [12, 44].
Оценка артериальной оксигенации
Несколько индексов используются для оценки P aO 2 по отношению к F IO 2 .При вдыхании воздуха P A – aO 2 обеспечивает чувствительную меру эффективности газообмена, но зависит от возраста. В ряде различных исследований было отобрано относительно небольшое количество людей в разных популяциях, чтобы определить распределение P A – aO 2 у нормальных людей [45–48]. Во всех исследованиях среднее значение P A – aO 2 увеличивается с возрастом, как и доверительные интервалы вокруг среднего.Таблица 3 включает данные из двух крупных популяций [45, 46]. Упрощенная формула для нормального P A – aO 2 при вдыхании воздуха составляет (возраст в годах / 4) +4 мм рт. Ст. (Результат разделите на 7,5 для кПа). Поскольку нормальное значение P A – aO 2 в первую очередь связано с венозной примесью, увеличение F IO 2 повышает P AO 2 aO более P и нормальное значение для P A – aO 2 увеличивается с увеличением F IO 2 .Соотношение P aO 2 / F IO 2 чаще используется в клинической практике и при определении ОРДС. Нижний предел для нормального P aO 2 при вдыхании воздуха 80 мм рт. 400 мм рт. P aO 2 / F IO 2 также зависит от F IO 2 , уровня положительного давления в конце выдоха (PEEP) и артериального венозного O 2 извлечения [49, 50] и, следовательно, трудна для интерпретации. P aO 2 / F IO 2 не помогает дифференцировать разные причины гипоксемии.
Таблица 3–
P aO 2 и P A – aO 2 в разном возрасте
V ′ A / Q ′ несоответствие и сосудистый тонус
Гипоксическое сужение сосудов легких
Гипоксическая вазоконстрикция легких (ВПЧ) вызывает прекапиллярную вазоконстрикцию в единицах с низким P AO 2 (<60 мм рт. ′ или шунт [51–54].Эффект ВПЧ заключается в том, чтобы отводить кровоток от гипоксических единиц к более вентилируемым, улучшая согласование V ′ A / Q ′ и артериальную оксигенацию (рис. 12). Например, у людей ВПЧ снижает приток крови к ателектатическим областям примерно на 50% [55, 56]; положительный эффект на оксигенацию артериальной крови можно вывести из перехода от одной линии изошунта к другой при фиксированном F IO 2 на диаграмме изошунта (рис. 8). Эффективность ВПЧ в коррекции несоответствия V ‘ A / Q ‘ уменьшается с увеличением области гипоксического легкого [53, 57].Одним из примеров является низкий P AO 2 во всем легком (, например, из-за сильной гиповентиляции или большой высоты). В этом случае генерализованная вазоконстрикция повышает давление в легочной артерии без улучшения согласования V ′ A / Q ′. Эксперименты на животных и людях показывают, что HPV не имеет большого значения для соответствия V ‘ A / Q ‘ в нормальных легких [53, 58, 59]. Напротив, ВПЧ может иметь решающее значение для пациентов с заболеванием, вызывающим региональную альвеолярную гипоксию [53], улучшая P aO 2 до 20 мм рт.7 кПа) у пациентов с ХОБЛ или ОРДС [54]. Иллюстрацией важности ВПЧ является то, что системно вводимые вазодилататоры, ингибирующие ВПЧ, могут снижать P aO 2 у таких пациентов [60].
Рисунок 12–
Гипоксическая вазоконстрикция легких (ВПЧ) возникает в областях легких с низким значением P AO 2 , эффективно перераспределяя кровоток от гипоксических областей в сторону более насыщенных кислородом областей. Распределение вентиляции такое же, как на рисунке 6, но поток крови к узлу V ′ A / Q ′ уменьшается вдвое из-за HPV.Сравните с рисунком 6, чтобы увидеть влияние этого перераспределения кровотока на газообмен. Поскольку вентиляция не изменяется, соотношение V ′ A / Q ′ изменяется таким образом, что в гипоксической области увеличивается соотношение V ′ A / Q ′, увеличивая P AO. 2 в этом регионе. При большем кровотоке, поступающем из хорошо вентилируемой области, при более высоком значении P AO 2 , C aO 2 и P aO 2 заметно улучшаются.Словарь терминов см. В таблице 1. ec и ec * обозначают концевую капиллярную кровь из двух разных единиц.
Дополнительная задержка кислорода и углекислого газа у пациентов с ХОБЛ
Еще одной иллюстрацией клинического значения ВПЧ является его роль в гиперкапнии, индуцированной O 2 , у пациентов с ХОБЛ. Хотя это часто связывают со снижением тяги к дыханию, было показано, что введение дополнительных O 2 этим пациентам может увеличить P aCO 2 , несмотря на постоянную минутную вентиляцию [61, 62].Основное объяснение состоит в том, что дополнительный O 2 повышает P AO 2 в низких единицах V ′ A / Q ′, подавляя региональный HPV и увеличивая приток крови к этим единицам. Следовательно, кровь отводится от лучше вентилируемых областей, превращая их в единицы с высоким значением V ′ A / Q ′, что увеличивает потерю вентиляции [61, 62]. Это иллюстрация того, как увеличенная неэффективная вентиляция снижает эффективную альвеолярную вентиляцию (обсуждалось выше), несмотря на неизменную минутную вентиляцию.Кроме того, поскольку единицы с низким V ′ A / Q ′ имеют более высокое значение P ACO 2 , восстановленный кровоток в этих единицах приводит к тому, что больше CO 2 доставляется в артериальная кровь. Повышенное несоответствие V ′ A / Q ′ как доминирующий механизм, вызывающий гиперкапнию, индуцированную O 2 , остается спорным: другие исследования показали, что снижение минутной вентиляции может способствовать увеличению P aCO 2 [63].Еще одним объяснением является эффект Холдейна, в котором увеличение P aO 2 снижает связывание как H + , так и CO 2 с гемоглобином, тем самым увеличивая количество физически растворенного CO 2 и, таким образом, , P CO 2 [12, 64]. Другими словами, для любого данного содержания CO 2 значение P CO 2 будет выше с большим насыщением гемоглобина O 2 .По оценкам, эффект Холдейна объясняет 6–78% увеличения P aCO 2 у пациентов с ХОБЛ после введения дополнительного O 2 [61, 65, 66].
Сосудорасширяющие ингаляторы
Ингаляционные вазодилататоры могут быть использованы для улучшения несоответствия V ′ A / Q ′. Идея заключается в том, что ингаляционные сосудорасширяющие средства распределяются в каждой области пропорционально региональной вентиляции, и поэтому хорошо вентилируемые области более вазодилатированы.Локально сниженный тонус сосудов вызывает смещение кровотока из непроветриваемых областей в сторону лучше вентилируемых областей, улучшая согласование и газообмен V ‘ A / Q ‘. Было показано, что вдыхаемый оксид азота снижает шунт [60, 67] и улучшает оксигенацию артериальной крови у пациентов с ОРДС [60, 68, 69]. Аналогичный эффект был продемонстрирован с ингаляционным простациклином [70, 71]. Интересно, что эффект менее устойчив у пациентов с ХОБЛ. В этом случае вдыхание оксида азота может привести как к улучшению, так и к ухудшению газообмена; последнее можно объяснить тем, что вазодилататор также достигает низких областей V ‘ A / Q ‘.Ингибирование HPV увеличивает кровоток в этих областях с низким уровнем V ‘ A / Q ‘, что вызывает дальнейшую десатурацию артерий [67, 72]. Следовательно, положительный эффект вдыхаемого оксида азота может быть менее устойчивым при гипоксемии, вызванной областями с низким V ‘ A / Q ‘, чем в условиях, характеризующихся шунтирующими областями.
V ′ A / Q ′ несоответствие при заболеваниях легких
ХОБЛ
Пациенты с ХОБЛ могут иметь гипоксемию, гиперкапнию или и то, и другое.Гипоксемия в первую очередь объясняется перфузией недостаточно вентилируемых (низкий V ′ A / Q ′) регионов, что связывают с заболеванием дыхательных путей [73–76]. Шунтирование не имеет большого значения при отсутствии осложняющих состояний, таких как пневмония или ателектаз [7, 74], и поэтому ожидается, что гипоксемия будет реагировать на усиление F IO 2 . Гиперкапния объясняется снижением эффективной альвеолярной вентиляции из-за увеличения потерь вентиляции, вторичной по отношению к областям с высоким V ′ A / Q ′ и мертвому пространству альвеол, вызванным эмфизематозным разрушением паренхимы легких [73–75].Гиперкапния становится очевидной только тогда, когда пациент не может поддерживать дополнительную работу дыхания, необходимую для адекватной альвеолярной вентиляции. Было показано, что изменения сердечного выброса, потребления O 2 и минутной вентиляции модулируют эффект повышенного несоответствия V ′ A / Q ′ у пациентов с обострениями ХОБЛ [74].
ARDS
Газообмен у пациентов с ОРДС, часто вызванным пневмонией или сепсисом, характеризуется тяжелой гипоксемией из-за потери аэрации больших участков легких.Несколько исследований показали, что артериальная гипоксемия у этих пациентов в основном вызвана шунтирующим кровотоком, который может превышать 50% сердечного выброса [13, 16–19]. Низкое В ′ A / Q ′ области либо отсутствуют, либо являются меньшей причиной низкого P aO 2 [16, 17]. Нарушение диффузии, по-видимому, не способствует артериальной гипоксемии [16]. Особенно интересно влияние ПДКВ на несоответствие V ′ A / Q ′ у этих пациентов.Было показано, что PEEP снижает количество неаэрированной легочной ткани за счет рекрутирования альвеол и улучшает оксигенацию артериальной крови за счет уменьшения шунтирующего кровотока [13, 16, 17, 19, 77, 78]. Повышенное ПДКВ также увеличивает общее мертвое пространство, что интерпретируется как увеличение количества неперфузированных альвеол вследствие повышения давления в дыхательных путях с компрессией альвеолярных капилляров в независимых областях легких [16, 77–79]. Влияние ПДКВ на мертвое пространство ослабляется, если отрицательное влияние ПДКВ на сердечный выброс нейтрализуется жидкой нагрузкой для увеличения преднагрузки сердца, что также показывает, что снижение сердечного выброса может увеличиваться В D / В T [79].Напротив, было показано, что ПДКВ в сочетании с рекрутированием альвеол снижает потерю вентиляции [80]. Таким образом, при использовании ПДКВ для оптимизации газообмена у этих пациентов необходимо сбалансировать потенциальные положительные и отрицательные эффекты на оксигенацию, потерю вентиляции и сердечный выброс. Еще одним средством улучшения газообмена у пациентов с ОРДС является лечение в положении лежа. Эксперименты на животных и клинические исследования показали, что поза на животе снижает шунт и несоответствие V ′ A / Q ′, улучшая оксигенацию артерий [81–83].Недавнее клиническое исследование продемонстрировало, что использование положения лежа на животе на ранних этапах развития ОРДС было связано с улучшением выживаемости [84]. Основным механизмом увеличения выживаемости является не улучшение газообмена, а более равномерное распределение региональной вентиляции, приводящее к меньшему повреждению легких, вызванному вентилятором [83, 85].
Тромбоэмболия легочной артерии
Легочная эмболия приводит к участкам легких, в которых кровоток отсутствует или снижен (области с высоким V ‘ A / Q ‘) и, таким образом, увеличиваются потери вентиляции.Менее очевидно, что перераспределение кровотока в другие области легких приводит к тому, что эти области становятся относительно избыточными и трансформируются в области с низким V ′ A / Q ′, вызывая гипоксемию и повышенное P A – aO 2 . Таким образом, причиной гипоксемии является увеличенное несоответствие V ′ A / Q ′, но не увеличение шунта [86, 87]. Воздействие на ABG модифицируется респираторным ответом на повышенное значение P aCO 2 , конечным результатом часто является одышка у пациента с гипоксемией и нормальным или даже низким P aCO 2 .Гипоксемия может усугубляться недостаточностью кровообращения, вызывающей низкий уровень C v¯O 2 , или внутрисердечным шунтированием справа налево, оба из которых спровоцированы острой легочной гипертензией. Важно отметить, что отсутствие гипоксемии или повышенного уровня P A – aO 2 не исключает тромбоэмболии легочной артерии [88, 89]. Аналогично, использование P aCO 2 — P ETCO 2 для измерения излишней вентиляции информативно, но изолированно не является окончательным для диагностики тромбоэмболии легочной артерии [90].В то время как измерение P ETCO 2 , указывающее на повышенную потерю вентиляции, увеличивает вероятность тромбоэмболии легочной артерии [91], а нормальное количество неэффективной вентиляции снижает вероятность [33, 92], полезность этих мер очень зависит от a priori клиническая вероятность тромбоэмболии легочной артерии у отдельного пациента [90] и вовлеченная фракция легочного сосудистого дерева [91].
Сводка
1) Существует пять причин гипоксемии.Пониженное значение P aO 2 может быть вызвано гиповентиляцией, низким P IO 2 , ограничением диффузии, низким V ′ A / Q ′ или шунтом. В отличие от других причин, гипоксемия, вызванная шунтированием, обычно плохо реагирует на увеличение F IO 2 . Низкое V ′ A / Q ′ области и шунт на сегодняшний день являются наиболее частыми причинами клинически встречающейся гипоксемии.
2) Гиповентиляция и области с низким V ′ A / Q ′ также ухудшают удаление CO 2 , но величина воздействия на P aCO 2 меньше и изменяется вентиляцией. ответ на гиперкапнию.
3) Высокое В ′ A / Q ′ области и альвеолярное пространство и мертвое пространство аппарата вызывают повышенную потерю вентиляции и, таким образом, ухудшают выведение CO 2 . Первичной реакцией на повышенную потерю вентиляции в большинстве ситуаций является усиленная минутная вентиляция и работа дыхания, а не повышенная P aCO 2 .
4) Влияние несоответствия V ′ A / Q ′ на эффективность газообмена можно количественно оценить с помощью расчетов P A – aO 2 , венозной примеси и отработанной вентиляции.
5) Низкое и высокое V ′ A / Q ′ области вызывают гипоксемию, нарушение выведения CO 2 и усиление работы дыхания у пациентов с ХОБЛ.
6) Шунт является наиболее важной причиной гипоксемии у пациентов с ОРДС и пневмонией.
Сноски
Предыдущие статьи в этой серии: № 1: Naeije R, Vachiery J-L, Yerly P, et al . Градиент транспульмонального давления для диагностики заболеваний сосудов легких. евро Respir J 2013; 41: 217–223. № 2: Hughes JMB, van der Lee I. Соотношение T L, NO / T L, CO в интерпретации теста функции легких. евро Respir J 2013; 41: 453–461. № 3: Vonk-Noordegraaf A, Westerhof N.Описание функции правого желудочка. евро Respir J 2013; 41: 1419–1423. No. 4: Hamzaoui O, Monnet X, Teboul J-L. Парадоксальный пульс. евро Respir J 2013; 42: 1696–1705. № 5: Приск ГК. Микрогравитация и дыхательная система. евро Respir J 2014; 43: 1459–1471. No. 6: Dempsey JA, Smith CA. Патофизиология дыхательного контроля человека. евро Respir J 2014; 44: 495–512.
Конфликт интересов: не заявлен
- Получено 24 февраля 2014 г.
- Принято 4 мая 2014 г.
Microsoft PowerPoint — 03 -GAS EXCHANGE_2012-comp doc [Режим совместимости]
% PDF-1.6
%
202 0 объект
/ M (D: 201001220-05’00 ‘) / Имя (ARE Acrobat Product v8.0 P23 0002337) / ByteRange [0 102 9636 460992] / Ссылка [> / Data 202 0 R / TransformMethod / UR3 / Type / SigRef> >] / Prop_Build> / App> / PubSec >>> / Type / Sig >>>> / Metadata 332 0 R / AcroForm 328 0 R / Pages 192 0 R / Type / Catalog / PageLabels 190 0 R >>
эндобдж
332 0 объект
> поток
PScript5.dll Версия 5.22010-01-22T09: 17: 30-05: 002010-01-22T09: 17: 07-05: 002010-01-22T09: 17: 30-05: 00application / pdf
Acrobat Distiller 8.0.0 (Windows) uuid: 3a9339d0-c5a5-4239-bcaa-294551562d9duuid: 52e3766f-37a4-4a86-8e1e-8f95a6445f02
конечный поток
эндобдж
328 0 объект
> / Кодировка >>> / SigFlags 2 >>
эндобдж
192 0 объект
>
эндобдж
190 0 объект
>
эндобдж
191 0 объект
>
эндобдж
193 0 объект
>
эндобдж
194 0 объект
>
эндобдж
195 0 объект
>
эндобдж
196 0 объект
>
эндобдж
197 0 объект
>
эндобдж
198 0 объект
>
эндобдж
141 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
эндобдж
143 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
эндобдж
144 0 объект
> поток
HWn7} W # 2_C $> 8E!; KY.IivV / KJvDYsEd% 4 \ G8 @ ShZ $ a & Bhd. ݷ X $] mD4٦6DaM6WT \ cd2y] * ŵ.) _ X ~ Cn31? G
«f: h3CBU2ʆIY1, P`rs9 * ( Q} / HkIiyzeZVWr8» 7
(PDF) Нарушение вентиляции не связано независимо с 28-дневной смертностью при COVID-19 ARDS
Нарушение вентиляции не связано с 28 —
-дневная смертность при COVID-19 ARDS
Авторский комитет: Луис Моралес-Кинтерос1,2,3, Ари Серпа Нето4,5,6,7, Антонио
Артигас2,3,8,9, Луис Бланш3,3, 8,9, Микела Ботта4, Дэвид А.Kaufman10, Marcus J.
Schultz4,11,12, Anissa Tsonas4, Frederick Paulus4, Lieuwe D. Bos4.
От имени исследовательской группы PRoVENT-COVID.
1 Отделение интенсивной терапии, Больница Universitari Sagrat Cor, Grupo Quironsalud, Барселона,
Испания.
2 Автономный университет Барселоны, Барселона, Испания.
3Institut d’Investigació i Innovació Parc Taulí I3PT, Sabadell, Spain
4 Отделение интенсивной терапии и лаборатория экспериментальной интенсивной терапии и
анестезиологии (L · E · I · C · A), Амстердам, Амстердам, Амстердам,
Нидерланды.
5 Отделение интенсивной терапии, больница Исраэлита Альберта Эйнштейна, Сан-Паулу,
Бразилия
6 Австралийско-новозеландский исследовательский центр интенсивной терапии (ANZIC-RC), Университет Монаш
, Мельбурн, Австралия.
7 Центр исследований и оценки данных (DARE), больница и университет Остина
из Мельбурна, Мельбурн, Австралия
8 Центр интенсивной терапии, Corporation Sanitaria Universitaria Parc Taulí, Сабадель, Испания.
9CIBER Enfermedades Respiratorias (ISCiii), Мадрид, Испания
10 Отделение легочной медицины, интенсивной терапии и медицины сна, Медицинская школа Нью-Йоркского университета,
Нью-Йорк, Нью-Йорк, США.
11 Медицинский факультет Наффилда, Оксфордский университет, Оксфорд, Великобритания.
12Махидол-Оксфордский исследовательский отдел тропической медицины (MORU), Университет Махидол,
Бангкок, Таиланд.
Информация об авторе: Приведен полный список членов совместной группы PRoVENT-COVID
:
РУКОВОДИТЕЛЬНЫЙ КОМИТЕТ: (в алфавитном порядке) A.Г. Алгера, Л.С. Буров; L.D.J. Бос; М.
Ботта; Дж. Пиллэй, Д.А. Донгельманс, М.В. Холлманн; Дж. Хорн; Ф. Паулюс; А. Серпа Нето;
M.J. Schultz; ЯВЛЯЮСЬ. Цонас, А.П.Влаар.
КООРДИНАТОРЫ ИССЛЕДОВАНИЯ: (в алфавитном порядке) М. Ботта; ЯВЛЯЮСЬ. Цонас.
Следователи: (в алфавитном порядке): И. П. ван Аккерен; А.Г. Альгера; C.K. Algoe; Р. Б. фургон
Амстел; Артигас А; О.Л. Баур; П. ван де Берг; А.Э. ван ден Берг; D.C.J.J. Бергманс; Д.И.
ван ден Берселаар; Ф.А. Бертенс; A.J.G.H. Биндельс; М.М. де Бур; С. ден Бур; Л.С.
буров; М. Богерд; L.D.J. Бос; М. Ботта; J.S. Брил; Х. де Брюэн; С. де Брюэн; C.L. Бруна;
L.A. Buiteman – Kruizinga; О. Кремер; R.M. Детерманн; В. Диперинк; Д.А. Донгельманы;
H.S. Франке; РС. Галек – Олдридж; М.Дж. де Грааф; L.A. Hagens; J.J. Харингман; S.T. van
Сердечно-сосудистые функции при эмфиземе легких
Хроническая обструктивная болезнь легких (ХОБЛ) и хронические сердечно-сосудистые заболевания, такие как ишемическая болезнь сердца, застойная сердечная недостаточность и сердечные аритмии, оказывают сильное влияние друг на друга, и было рассмотрено системное воспаление как основное звено между ними.С другой стороны, ограничение воздушного потока может заметно повлиять на механику легких с точки зрения статической и динамической гиперинфляции, особенно при эмфиземе легких, и они, в свою очередь, могут также повлиять на работу сердца. Истощение скелетной массы, которое является общим признаком ХОБЛ, особенно у пациентов с эмфиземой легких, также может иметь значение для сердечно-сосудистой функции этих пациентов, независимо от повреждения легких. Мы рассмотрели новые данные, которые подчеркивают роль механики легких и нарушения мышечной массы в объеме желудочков, ударном объеме и ударной работе в состоянии покоя и при физической нагрузке при наличии эмфиземы легких.Пациенты с эмфиземой могут различаться среди популяции ХОБЛ даже с точки зрения сердечно-сосудистой функции.
1. Введение
Эмфизема легких, фенотип хронической обструктивной болезни легких (ХОБЛ), представляет собой патологическое состояние, характеризующееся ненормальным и постоянным увеличением воздушных пространств дистальнее конечных бронхиол, что приводит к разрушению стенок воздушного пространства и, как правило, к прогрессирующему потоку воздуха. ограничение [1]. При эмфиземе легких потеря упругой отдачи приводит не только к необратимой бронхиальной обструкции, но также к гиперинфляции легких, что подразумевает увеличение объема по сравнению с нормальным диапазоном приливного дыхания и увеличение функциональной остаточной емкости (FRC).Кроме того, чем сильнее нарушена функция легких, тем сильнее сжимаемость дыхательных путей влияет на механику легких, что приводит к высокому внутреннему положительному давлению в конце выдоха (PEEPi), которое увеличивает внутриплевральное давление.
Фенотип эмфиземы определяет преобладающих симптомов пациентов с ХОБЛ, которые жалуются на одышку и снижение физической нагрузки. Истощение скелетных мышц и недоедание также могут характеризовать пациентов с эмфиземой. Была обнаружена обратная корреляция между индексом массы тела (ИМТ) и степенью эмфиземы, оцененной с помощью компьютерной томографии высокого разрешения [2].
Появляется все больше доказательств того, что у пациентов с ХОБЛ хроническое сердечно-сосудистое заболевание, такое как ишемическая болезнь сердца или застойная сердечная недостаточность, может быть частой сопутствующей патологией из-за привычки к курению, которая является распространенным фактором риска, и что воспаление, связанное с ХОБЛ, не ограничивается легкими, но оно также может поражать нелегочные органы, такие как сердечно-сосудистая система [3–5]. Интересно, что при эмфиземе легких изменения как в механике легких, так и в насосе скелетных мышц могут нарушать per se сердечно-сосудистую функцию.Таким образом, этот обзор специально адресован функции сердечно-сосудистой системы у пациентов с эмфиземой легких.
2. Сердце и легочная гиперинфляция
Легочная гиперинфляция может существенно повлиять на размер сердца и его функцию. С помощью метода магнитного резонанса Jörgensen et al. [6] изучали пациентов с тяжелой эмфиземой и обнаружили уменьшение внутригрудного объема крови, конечных диастолических объемов левого и правого желудочков, а также нарушение ударного объема и ударной работы в гиперинфлированных легких по сравнению с контролем.Авторы утверждали, что есть как минимум два основных объяснения этих результатов. При гиперинфляции легких высокое значение PEEPi может вызвать внутригрудную гиповолемию и небольшие конечные диастолические размеры камер как левого, так и правого желудочка. Перераспределение легочного кровообращения при эмфиземе может происходить не только из-за прямой деструкции паренхимы или гипоксии вазоконстрикции, но также из-за снижения эластичности легочного сосудистого русла, которое имеет тенденцию выталкивать кровь на периферию за счет высокого PEEPi.Во-вторых, камеры правого и левого желудочка могут быть механически сдавлены гиперинфляцией легких, что может ухудшить конечную диастолическую жесткость. Согласно закону Франка-Старлинга, низкая предварительная нагрузка в конечном итоге снижает производительность желудочков с точки зрения ударного объема (SV) и ударной работы.
В большой выборке пациентов с ХОБЛ от GOLD I до IV класса Watz et al. [7] обнаружили, что степень тяжести ХОБЛ напрямую коррелировала с сердечной дисфункцией. Интересно отметить, что в этом исследовании размеры камеры сердца и нарушение диастолического наполнения левого желудочка больше коррелировали со степенью статической гиперинфляции, оцениваемой по соотношению емкости вдоха к общей емкости легких (IC / TLC), чем к степени проходимости дыхательных путей. обструкция, выраженная в виде объема форсированного выдоха за 1-ю секунду (ОФВ 1 )% от прогнозируемого, или способности к диффузии монооксида углерода.Кроме того, IC / TLC был независимым предсказателем размеров сердечной камеры после корректировки на площадь поверхности тела [7].
В соответствии с выводами Watz et al. [7], Malerba et al. [8] сообщили о частом субклиническом нарушении наполнения левого желудочка у пациентов с ХОБЛ на ранней стадии заболевания, даже при отсутствии каких-либо других сердечно-сосудистых заболеваний. Кроме того, Smith et al. [9] недавно показали уменьшение размера легочной вены при ХОБЛ, что связано с процентом эмфиземы, тем самым подтверждая механизм нижних легочных причин недостаточного заполнения левого желудочка.
Интересно, что легочная гиперинфляция может иметь отрицательные эффекты, поэтому легочная дефляция может улучшить сердечную функцию у пациентов с эмфиземой легких. У пациентов с тяжелой гиперинфляцией Come и соавторы [10] недавно обнаружили, что снижение гиперинфляции в результате хирургического вмешательства по уменьшению объема легких (LVRS) было значительно связано с улучшением пульса кислорода, что можно рассматривать как неинвазивный маркер эффективности сердечно-сосудистой системы и показатель SV.
Следует отметить, что степень эмфиземы, обнаруженная на компьютерной томографии (КТ), может быть связана с нарушением сердечной функции даже у пациентов без очень тяжелого заболевания легких [11]. В недавнем популяционном исследовании большая степень эмфиземы при КТ была линейно связана с нарушением наполнения левого желудочка, уменьшением ударного объема и более низким сердечным выбросом без изменений фракции выброса [11]. Статус курения значительно ухудшил эти ассоциации.Соответственно, авторы [11] предположили, что механизмом нарушения наполнения левого желудочка при ранней легкой эмфиземе может быть субклиническая потеря капиллярного русла из-за апоптотического эффекта курения на легочный эндотелий.
3. Сердечно-сосудистая реакция на упражнения и динамическую гиперинфляцию
У здоровых людей в состоянии покоя FRC физиологически равняется объему расслабления (), при котором все дыхательные мышцы расслаблены, а упругая отдача грудной стенки наружу точно уравновешивает внутреннюю отдачу легкие.Напротив, у пациентов с ограничением потока выдоха изменения вентиляции, такие как увеличение потока и / или частоты дыхания, могут поднять FRC выше. Состояние, характеризующееся FRC, который не равен, но превышает его, называется «динамической гиперинфляцией» и обычно может возникать во время физических упражнений у пациентов с ХОБЛ. Помимо статической гиперинфляции легких, динамическая гиперинфляция ответственна за ограничение физических упражнений у пациентов с ХОБЛ и за появление одышки при физической нагрузке [12].Соответственно, возможно, что во время физических упражнений динамическая гиперинфляция может еще больше ухудшить сердечную функцию в состоянии покоя у пациентов с эмфиземой легких.
И вентиляционные, и сердечные реакции на физическую нагрузку могут быть хорошо изучены с помощью сердечно-легочного теста с нагрузкой (CPET). CPET — это относительно неинвазивный метод проверки толерантности к максимальным нагрузкам и дает несколько сведений о том, как сердечно-сосудистые, дыхательные и мышечные аппараты реагируют на упражнения. Примечательно, что оценка динамической гиперинфляции основана на сравнении ИК, выполненных в состоянии покоя и во время упражнений, и положительная разница между ними предполагает динамическую гиперинфляцию, предполагая, что ТСХ остается постоянной во время упражнений.
Динамическая гиперинфляция, которая ухудшает сердечно-сосудистую функцию у пациентов с ХОБЛ, может быть задокументирована во время быстрого нарастания CPET. Vassaux et al. [13] впервые заметили, что динамическая гиперинфляция отрицательно связана с пульсом кислорода на пике нагрузки у пациентов с тяжелой ХОБЛ. Эти результаты были подтверждены и расширены нашей группой у пациентов с ХОБЛ разной степени тяжести, показывая значительную взаимосвязь между динамической гиперинфляцией и набором неинвазивных показателей сердечно-сосудистой функции во время упражнений [14].Примечательно, что у этих пациентов мы обнаружили, что степень динамической гиперинфляции была обратно пропорциональна не только пульсу кислорода, но и произведению систолического артериального давления и частоты сердечных сокращений, так называемому двойному произведению (ДП). Интересно, что DP отражает потребление кислорода миокардом во время упражнений, потому что тремя основными детерминантами поглощения кислорода миокардом являются напряжение стенки желудочка, сократительное состояние сердца и частота сердечных сокращений [15]. Во-вторых, мы наблюдали, что наклон эффективности поглощения кислорода (OUES), параметр, который объединяет функциональные возможности нескольких систем органов (сердечно-сосудистой, скелетно-мышечной и легочной), и который представляет скорость увеличения потребления O 2 в ответ на заданное значение. вентиляция во время дополнительных упражнений [16] была отрицательно связана с динамической гиперинфляцией.
Важно отметить, что недавно было показано, что у пациентов с тяжелой эмфиземой легких снижение динамической гиперинфляции после LVRS было значительно связано с улучшением сердечной реакции на нагрузку, как с точки зрения пульса кислорода, так и пульсового давления, что является разницей между систолическое и диастолическое артериальное давление [17]. Следует отметить, что легочная реабилитация может снизить потребность в вентиляции во время упражнений, что приведет к увеличению времени выдоха и, в свою очередь, к снижению динамической гиперинфляции [18].Соответственно, можно предположить, что у пациентов с ХОБЛ легочная реабилитация может улучшить сердечно-сосудистую реакцию на упражнения за счет усиления вентиляционной функции. В соответствии с этим предположением наша группа недавно сообщила об улучшении сердечно-сосудистой реакции во время упражнений при субмаксимальных упражнениях, независимо от внешней работы, после стандартной программы легочной реабилитации [19]. Это изменение было значительно связано с улучшением дыхательной функции во время упражнений.
4. Насос скелетных мышц и сердечно-сосудистая функция
Насос скелетных мышц имеет основополагающее значение как для местного, так и для системного кровообращения, поскольку он может увеличивать венозный возврат, центральное венозное давление, конечный диастолический объем и, следовательно, сток-объем и сердечный выброс путем изгнания объема периферической венозной крови во время упражнений [20]. Таким образом, мышечный насос делает доступным больший кровоток, который направляется к активным мышцам и тем самым косвенно вызывает гиперемию мышц [20].С другой стороны, истощение скелетных мышц может негативно повлиять на сердечно-сосудистую реакцию на упражнения.
У пациентов с ХОБЛ истощение скелетных мышц может обычно происходить в результате нескольких факторов, таких как атрофия неиспользования, плохое питание, системные медиаторы воспаления и хроническое введение пероральных кортикостероидов [21]. Важно отметить, что когда в популяции ХОБЛ характеристика фенотипов основывалась на наличии и тяжести эмфиземы, пациенты с фенотипом, в котором преобладает эмфизема, имеют значительно более низкий ИМТ [22].
Недавно наша группа показала, что истощение мышечной массы играет роль per se в снижении переносимости физических упражнений у пациентов с ХОБЛ, независимо от нарушения функции легких, и строго связано с плохой сердечно-сосудистой реакцией на упражнения и с утомляемостью ног. [23]. Примечательно, что в нашем исследовании значения пульса как в состоянии покоя, так и в пиковом состоянии кислорода были значительно ниже у истощенных пациентов по сравнению с пациентами без истощения, в то время как значение максимального пульса кислорода было тесно связано с массой без жира во всей популяции.Мы также обнаружили, что истощенные и не истощенные пациенты различались по НОЭС, что является объективной мерой кардиореспираторной и мышечной подготовленности [24]. Наконец, у наших пациентов мы обнаружили, что восстановление частоты сердечных сокращений после максимальной нагрузки, маркер вегетативной функции сердца и мощный предиктор смертности в общей популяции [25], было значительно ниже у истощенных пациентов.
5. Выводы
Растет понимание того, что ХОБЛ и хронические сердечные заболевания, по-видимому, связаны лежащим в основе системным воспалительным статусом.В то же время механика легких и работа сердца в значительной степени зависят друг от друга, и оба могут быть ответственными за ограничение физических упражнений, одышку при физической нагрузке и плохое качество жизни в присутствии необратимого ограничения воздушного потока и гиперинфляции легких. Кроме того, истощение мышечной массы, которое особенно характерно для пациентов с эмфиземой легких среди популяции ХОБЛ, также может способствовать сердечно-сосудистой реакции на упражнения.
Клиницисты должны учитывать, что любой терапевтический подход, такой как ингаляционные бронходилататоры, операция по уменьшению объема легких и легочная реабилитация, направленный на улучшение механики легких, может, в свою очередь, улучшить работу сердца также и у пациентов с ХОБЛ.Кроме того, все, что может увеличить мышечную массу у истощенных пациентов с ХОБЛ, может, в свою очередь, улучшить их сердечно-сосудистую функцию.
В заключение, эмфизема и хронический бронхит — это два разных фенотипа ХОБЛ не только с клинической и функциональной точки зрения, но и с точки зрения сердечно-сосудистой функции. Примечательно, что системное воспаление, нарушение механики легких и истощение мышечной массы могут играть различную роль в кондиционировании сердечно-сосудистой функции у пациентов с эмфиземой и у пациентов с хроническим бронхитом.Требуются дальнейшие исследования для решения этого вопроса и поиска решений.
Аббревиатуры
| ИМТ: | Индекс массы тела | |
| ХОБЛ: | Хроническая обструктивная болезнь легких | |
| CPET: | ||
| DP: | Двойной продукт | |
| FEV 1 : | Объем форсированного выдоха за 1-ю секунду | |
| GOLD: | Глобальная инициатива по борьбе с хронической обструктивной болезнью легких | |
| LVRS: | Операция по уменьшению объема легких | |
| OUES: | Наклонная характеристика эффективности поглощения кислорода | |
| PEEPi: | Внутреннее положительное давление в конце выдоха 33 | 33 |
| ТСХ: | Общая емкость легких у. |
Роль периодических дыхательных упражнений (EPB) в нарушении регуляции вентиляции у пациентов с сердечной недостаточностью — полный текст V CO 2slope), который продемонстрировал нарушение регуляции дыхания при данной категории заболеваний. У некоторых из этих пациентов развивается дальнейшая картина нарушения регуляции вентиляции с вентиляционными колебаниями, состоящими из периодического дыхания с физической нагрузкой (EPB) и апноэ во сне.Предыдущие исследования показали, что вентиляционные колебания связаны с циклическими изменениями напряжений артериального кислорода (PO2) и углекислого газа (PCO2), а также связаны с серьезным нарушением толерантности к физической нагрузке, резким наклоном VE -V CO 2 и низким пиковым потреблением O 2. коррелировал с более тяжелой сердечной недостаточностью и неблагоприятным прогнозом. Причиной вентиляционной осцилляции может быть нестабильность системы управления вентилятором, которая включает длительную задержку кровообращения, аномальную активацию периферической эргорезы и периферическую химио- и барочувствительность, даже из-за аномальных вегетативных реакций на измененную центральную команду.Однако в большинстве исследований изучались эти реакции через апноэ во сне в состоянии покоя, особенно в отношении мозга. Изменение реакции на упражнения в реальном времени ограничивалось параметрами вентиляции, такими как потребление кислорода, выработка углекислого газа. Остается неясным, является ли реакция периодического дыхания с физической нагрузкой на физическую нагрузку, которая приводит к аномальным ответам церебральной гемодинамики на упражнения при СН.
Нарушение мозгового кровотока было продемонстрировано во время эпизода апнетика и связано с нейропсихологическим дефицитом у пациента с апноэ во сне.Можно предположить, что нарушение мозгового кровотока во время упражнений у пациентов с EPB контролируется с помощью того же ключевого механизма обратной связи. Более того, церебральная гипоперфузия на упражнения может способствовать ухудшению функциональных возможностей у пациентов с сердечной недостаточностью. Соответственно, мы предполагаем, что нарушение церебральной гемодинамики в результате периодического дыхания при физических нагрузках связано со снижением функциональных возможностей у пациентов с сердечной недостаточностью. Кроме того, физическая подготовка может иметь положительные эффекты, которые могут эффективно противодействовать развитию вредных компенсаторных механизмов при сердечной недостаточности.Неясно, оказывают ли упражнения такое же положительное влияние на колебания и неэффективность вентиляции.
Мы будем наблюдать в режиме реального времени изменения сердца и гемодинамики в ответ на упражнения с периодическим изменением дыхания. Мы ожидаем, что эти результаты, полученные в этом исследовании, могут помочь в выборе подходящих упражнений для улучшения аэробной формы, а также одновременно улучшить гемодинамический контроль у пациентов с сердечной недостаточностью. В этом исследовании будет использоваться квазиэкспериментальный план.Шестьдесят пациентов с сердечной недостаточностью будут набраны из Медицинского фонда Чанг Гунга, отделения Килунг, после того, как они дадут информированное согласие. Эти субъекты будут разделены на группы PB (n = 30) и не-PB (n = 30) по выражению CPET. Пациенты из каждой группы получали одинаковую терапию и курс обследования в течение 2 лет, включая клиники сердечно-сосудистых заболеваний, CPET и полисомнографию. Мы будем измерять физическую подготовку субъектов, транспорт кислорода и использование задействованных скелетных мышц, сердечно-сосудистые функции и гемодинамику, параметры клеток крови, деформацию и агрегацию эритроцитов, плазменные биомаркеры повреждения миокарда, кислородный стресс и качество жизни на этапе подготовки к тренировке и после нее. 6-й, 12-й, 18-й, 24-й месяцы программы розыска.Результаты экспериментов анализировали с помощью описательной статистики (процентное, среднее и стандартное отклонение), независимого t-критерия и ANOVA с повторными измерениями. Мы изучаем вышеуказанный параметр, чтобы понять физиологическую реакцию этих пациентов на упражнения и найти подходящую интенсивность упражнений для назначения EPB.
В этом исследовании одновременно использовалось неинвазивное устройство с биологической реакцией (то есть неинвазивная система непрерывного мониторинга CO, NICOM) для оценки сердечной гемодинамики и спектроскопия в ближнем инфракрасном диапазоне (NIRS) для мониторинга изменений церебральной и мышечной перфузии / оксигенации.Мы также выяснили адаптацию в реальном времени между параметрами вентилятора и гемодинамическими параметрами во время вентиляционных колебаний у пациентов с сердечной недостаточностью.
Качество жизни и удовлетворенность жизнью серьезно ухудшаются у пациентов с длительной инвазивной вентиляцией легких после лечения в ОИТ и безуспешного отлучения от груди | Annals of Intensive Care
Блок-схема исследуемой когорты представлена на рис. 1.
Рис. 1
Блок-схема исследования. НИВ неинвазивная вентиляция
В общей сложности 25 пациентов (10 женщин, средний возраст 64 года, мин. / Макс. 20; 82 года, 14 в основном с ХОБЛ, 11 с НПЗ) были посещены в их домашних условиях и интенсивно изучены, как описано в разделе «Методы».Дополнительные демографические данные, классификации заболеваний, сопутствующие заболевания, а также семейное положение и образование пациентов перечислены в Дополнительном файле 1: Таблицы S1 и S2, соответственно. Самооценка соответствующих аспектов повседневной жизни проиллюстрирована на рис. 2.
Рис. 2
Субъективная оценка удовлетворенности жизнью по отношению к 23 конкретным аспектам жизни в порядке возрастания. iHMV инвазивная домашняя механическая вентиляция
В целом пациенты оценили 23 различных темы.Данные также предоставляются по категориям заболеваний, показывая, что пациенты с ХОБЛ чаще, чем пациенты с нервно-мышечными заболеваниями, недовольны 23 перечисленными аспектами (дополнительный файл 1: таблица S3). В дополнение к этому, подробная информация об основных обстоятельствах для каждой из 23 тем приведена в Дополнительном файле 1: Таблица S4.
В качестве примера две из 23 тем (№ 10, рис. 3 и № 1, рис. 4) проиллюстрированы в соответствии с основным заболеванием.
Фиг.3
Степень удовлетворенности историей трахеостомии в зависимости от основного заболевания — вопрос: оглядываясь назад, вы бы снова выбрали трахеостомию для долгосрочной инвазивной HMV? NMD нервно-мышечное заболевание, ХОБЛ хроническая обструктивная болезнь легких, HMW ИВЛ в домашних условиях
Рис. 4
Степень удовлетворенности мобилизацией в зависимости от основного заболевания — вопрос: Удовлетворены ли вы своим уровнем мобильности? NMD нервно-мышечная болезнь, ХОБЛ хроническая обструктивная болезнь легких
С этой целью наиболее часто неудовлетворительной темой была мобильность.В частности, гораздо большая часть пациентов с ХОБЛ (85,7%) была неудовлетворена своей мобильностью по сравнению с пациентами с NMD (45,5%) (дополнительный файл 1: таблица S3). Только один пациент (4%) смог встать с постели без посторонней помощи, 23 пациента (92%) зависели от технических средств и / или личной помощи, а один пациент (4%) вообще не мог встать с кровати. Однако всем пациентам были индивидуально прописаны технические средства передвижения, такие как инвалидные коляски, роляторы и подъемники (дополнительный файл 1: таблица S4).Кроме того, выйти из дома с помощью или без посторонней помощи смогли только 16 пациентов (64%). Экскурсии и путешествия были возможны для 13 (52%) и 2 пациентов (8%) соответственно.
Что касается вопроса о «повторном выборе трахеостомии, задним числом», 42,9% пациентов с ХОБЛ ( N = 6) и 18,2% пациентов с NMD ( N = 2; один с боковым амиотрофическим склерозом, один со спинным мозгом травма) указали, что они отказались бы от трахеотомии, если бы им пришлось выбирать снова.Важно отметить, что этот вопрос был поднят в предположении, что альтернативой трахеотомии была смерть, о чем сообщалось всем пациентам во время интервью. К сожалению, остается неясным, попросили ли некоторые из этих пациентов прекратить ИВЛ. Следует отметить, что средний срок трахеотомии составил 23 месяца (минимум 6; максимум 145 месяцев), без разницы между пациентами, которые отказались, и теми, кто этого не сделал. Семь из восьми и 8/8 пациентов, которые отказались бы от трахеотомии, указали на неудовлетворенность МК и подвижностью соответственно.Наконец, 18 пациентов (72%) имели внеплановую госпитализацию для лечения острого ухудшения состояния до исследования.
Еще одним важным вопросом, затронутым в интервью, было общение. Для общения 21 (84%) пациенту потребовались технические средства (дополнительный файл 1: таблица S4). Несмотря на это, способность говорить была нарушена у 48% пациентов, писать от руки — у 24% и писать с помощью компьютера — у 48%. Примечательно, что трое пациентов с NMD могли общаться только с помощью движений глаз.
У большинства пациентов были члены семьи и / или близкие друзья (дополнительный файл 1: таблица S4). Пятнадцать пациентов (60%) жили с членами семьи. Напротив, после того, как инвазивный HMV был установлен, шесть (24%) и 14 пациентов (56%) потеряли контакт с близкими членами семьи и близкими друзьями, соответственно. Пациенты также сильно зависели от ухода за больными: купание (100%), одевание (96%), пользование туалетом (92%), уход (76%), кормление (44%).
Что касается амбулаторной помощи, 23 пациента (92%) посещали на дому терапевт, а четырех пациентов (16%) посещал специализированный врач-респиратор.Тем не менее, все пациенты были распределены в специализированный центр вентиляции со средним (мин. / Макс.) Расстоянием 15 км (0,1 / 104 км). Амбулаторно-медсестринская помощь оказана 92% пациентов. Кроме того, члены семей участвовали в медсестринском уходе за 48% пациентов: в основном, в базовом уходе и в меньшей степени в лечении респираторных заболеваний. Восемнадцать пациентов (72%) жили в частном доме и семь пациентов (28%) в учреждении сестринского ухода (дополнительный файл 1: таблица S4). 9 пациентов (36%) получали питание посредством чрескожной эндоскопической гастростомии.
Распорядок дня 25 пациентов, перенесших инвазивную HMV, проиллюстрирован в Дополнительном файле 1: Рисунок S1 и Таблица S4. Важно отметить, что пациенты большую часть времени смотрели телевизор, когда не спали (8 часов в день). Одиннадцать пациентов (44%) получали непрерывную вентиляцию легких в течение 24 часов в сутки. Напротив, 14 пациентов (66%) периодически могли дышать спонтанно, со средним периодом спонтанного дыхания 8,5 ± 5,7 ч в день.
Информация о подшкалах и сводной шкале SRI представлена в таблице 1, с акцентом на различиях между двумя группами пациентов, а также между теми, кто пожалел о трахеостомии, и теми, кто этого не сделал.С этой целью пациенты, которые сожалели о трахеостомии, имели значительно более низкие результаты SRI как по подшкале тревожности, так и по итоговой шкале, в то время как большинство остальных шкал также имели тенденцию быть ниже.
Таблица 1 Промежуточные и сводные шкалы SRI в зависимости от основного заболевания (NMD против ХОБЛ) и индивидуального отношения к трахеостомии и инвазивному HMV
Результаты открытого интервью на темы жизни и смерти и загробной жизни суммированы в Таблица 2. Поскольку интервью было слишком утомительным для одного пациента, страдающего ХОБЛ и гиповентиляционным синдромом ожирения, подробные интервью доступны для 24 пациентов.Что касается этих результатов, 21 пациент (84%) имел религиозную принадлежность: католик ( N = 13), протестант ( N = 5), мусульманин ( N = 2) и индуист ( N = 1). Однако только 17 из этих пациентов (68%) сообщили об активной вере.
Таблица 2 Резюме открытого интервью ( N = 24)
Апноэ оксигенация при однолегочной вентиляции у пациентов с функциональными нарушениями во время рукавной лобэктомии | Европейский журнал кардио-торакальной хирургии
Аннотация
Мы описываем полезный метод спасения от гипоксемии во время однолегочной вентиляции (OLV) у пациентов с функциональными нарушениями во время реконструкции рукавного бронха.Когда стратегии зависимого легочного OLV при гипоксемии терпят неудачу во время бронхиального анастомоза (увеличение подачи кислорода до фракции вдыхаемого кислорода (FiO 2 ) 1 и положительного давления в конце выдоха (PEEP), стратегия набора и модуляция перфузии), очень простой и может быть легко использован эффективный метод введения кислорода в независимое легкое. Поток кислорода 5–10 л мин. –1 , вводимый с помощью детского внутриполевого катетера, помещенного в дистальный отдел бронхов во время бронхиального анастомоза защищенной доли (долей), в соответствии с принципами апноэ (гипер) оксигенированной вентиляции, успешно улучшает оксигенацию без значительного ухудшения рабочего поля.
1 Введение
Современные тенденции к снижению смертности и частоты осложнений после операции по лечению немелкоклеточного рака легкого (НМРЛ) открывают двери для хирургического лечения пожилых пациентов с сопутствующими состояниями и более серьезными функциональными нарушениями. На качество жизни [1], а также на краткосрочную и долгосрочную выживаемость в решающей степени влияет степень резекции паренхимы [2], и использование бронхо-сосудистых реконструкций во избежание пневмонэктомии имеет важное значение у пациентов с центральными опухолями.Однако интраоперационная вентиляция одного легкого (OLV) у этих пациентов с нарушением дыхания затруднена, и гипоксемия чаще возникает у пациентов, получающих OLV. Помимо увеличения фракции введения кислорода, варианты анестезиолога включают оптимизацию вентиляции зависимого легкого, постоянное положительное давление в дыхательных путях (CPAP) или высокочастотную струйную вентиляцию в независимом легком, а также модуляцию перфузии в обоих легких [3] . Другие возможные методы включают маневры рекрутинга [4], бронхоскопическое введение кислорода непосредственно в не подвергнутые манипуляции доли, если дыхательные пути не повреждены [5], и, наконец, двойная вентиляция легких (DLV), если гипоксемия становится тяжелой и неизлечимой.Однако все эти варианты мешают нормальной хирургической стратегии, увеличивая время операции и потенциальные послеоперационные осложнения из-за ушиба легких и постоянной утечки воздуха. Кроме того, когда требуется циркулярный бронхиальный анастомоз, гипоксемия на OLV может спровоцировать тяжелую ситуацию, если пациент не переносит временную функциональную пневмонэктомию, то есть когда дыхательные пути открываются и эффект шунта увеличивается за счет сохраненной доли (s). ).
2 Техника
Менее чем в 10% этих случаев гипоксемия становится неизлечимой и требуется DLV.Во время бронхиального анастомоза при рукавной лобэктомии OLV может быть затруднено из-за усиленного шунтирующего эффекта независимого легкого, и DLV не может быть повторно введен до тех пор, пока анастомоз не будет завершен. Другие стратегии в отношении независимого легкого в лучшем случае очень ограничены или непригодны при бронхиальном разрезе из-за целостности дыхательных путей, необходимой для их успеха.
Двухпросветная трубка устанавливалась при бронхоскопии во всех наших случаях, чтобы исключить смещение за пределы бокового положения пролежня.Во время регулярной диссекции для лобэктомии рукава, когда гипоксемия OLV тяжелая и фракция вдыхаемого кислорода (FiO 2 ) увеличена до 100%, положительное давление в конце выдоха (PEEP) и стратегия набора были выполнены с частичным успехом и даже DLV не обеспечивает эффективной оксигенации, вероятность дыхательной недостаточности и неизлечимой гипоксемии во время бронхиального отдела очень предсказуема. В нашей процедуре перед разделением дыхательных путей пациенту проводят предварительную оксигенацию обоих легких (хотя целевые доли не могут быть оксигенированы) с использованием только 100% кислорода, чтобы максимизировать денитрогенизацию оставшихся 2500–3000 мл функциональной емкости и гарантировать, что любое увлечение азота прекращается.Перед перезапуском OLV необходимо усилить оксигенацию, отсоединив сосудистую долю, и легко достичь P O 2 > 200–250. Нормальное потребление кислорода составляет 200–250 мл мин. –1 ; Таким образом, внутрилегочный запас кислорода объемом 2500–3000 мл обеспечивает адекватную оксигенацию в течение 10–12 минут в случае полного апноэ и 25–30 минут при OLV, несмотря на плохой газообмен у пациентов с функциональными нарушениями. Теперь дыхательные пути можно открыть и правильно подготовить для бронхиального анастомоза, если образец должен быть удален [6].Во время наложения бронхиального анастомоза детский катетер помещается внутри поля под анастомозом для доставки небольшого потока кислорода (10–15 л мин. –1 ) в статически свободную долю (доли) (рис. 1). Это позволяет завершить анастомоз без проблем с оксигенацией или дополнительных осложнений. Гипоксемия у этих ограниченных пациентов часто вызывается внутрилегочным шунтом, и, если этот метод не помогает, зажим легочной артерии может стать отличным вариантом, не исключающим осложнений.
Рис. 1
(A) Схема двухпросветной интубации во время анастомоза, выполненного при лобэктомии верхнего левого рукава: катетер для введения O 2 обычно помещается под линией шва, пытаясь восстановить оксигенацию архива простой диффузией. (B) Изображение операционного поля в случае 3, выполнение анастомоза с детским катетером в дыхательные пути. Этот метод позволяет по крайней мере 45 минут апноэ оксигенации при тяжелой гипоксемии на OLV.
Рис. 1
(A) Схема двухпросветной интубации во время анастомоза, выполненного при лобэктомии верхнего левого рукава: катетер для введения O 2 обычно помещается под линией шва, пытаясь восстановить оксигенацию архива простой диффузией. (B) Изображение операционного поля в случае 3, выполнение анастомоза с детским катетером в дыхательные пути. Этот метод позволяет по крайней мере 45 минут апноэ оксигенации при тяжелой гипоксемии на OLV.
С 2006 г. этот метод использовался у 4 из 13 пациентов (таблица 1), которым была назначена только рукавная лобэктомия из-за очень низкого резерва дыхания, исключающего пневмонэктомию.Все четверо были выписаны без осложнений, хотя одному требовалась кислородная поддержка в течение 3 месяцев после выписки.
Таблица 1
Пациенты, получавшие лечение апноэ с использованием вентиляции одного легкого при циркулярном бронхиальном анастомозе.
Таблица 1
Пациенты, получавшие лечение апноэ с использованием вентиляции одного легкого при циркулярном бронхиальном анастомозе.
3 Комментарий
Возрастающие кандидаты на хирургические вмешательства и связанные с ними состояния здоровья ставят под угрозу как интраоперационное, так и послеоперационное ведение пациентов.У этих пациентов из группы высокого риска могут оказаться необходимыми методы легочной хирургии, чтобы избежать пневмонэктомии, хотя пациенты с функциональными нарушениями могут страдать от гипоксемии во время анастомоза на OLV. Гипоксемия на OLV, которая встречается в 5–10% случаев, может быть определена как сатурация артериального гемоглобина кислородом (SaO 2 ) ниже 90%, FiO 2 0,5 или выше [3].
После увеличения FiO 2 и дыхательного объема, если SaO 2 остается ниже 90%, следует выполнить маневры PEEP и набора.В этой ситуации высокочастотная струйная вентиляция может предложить подходящую оксигенацию при минимальном вмешательстве в операционное поле [7], хотя для этого требуется специальное оборудование, которое не всегда доступно и будет непригодным, если дыхательные пути прерваны.
Следующим шагом в рамках традиционных методов лечения и последним средством в случае неизлечимой тяжелой гипоксемии является начало DLV, что приведет к ухудшению состояния хирурга. В частности, в случае трахеобронхиальной реконструкции методы лечения независящего легкого (повышение ПДКВ, рекрутмент альвеол или DLV) не подходят, когда бронх открыт для циркулярного бронхиального анастомоза и его препарирования.
Мы пропагандируем эту простую, полезную и полезную технику, которая не требует дополнительного оборудования и не имеет побочных эффектов, чтобы спасти гипоксемию на OLV без целостности дыхательных путей при реконструкциях трахеобронхиальной артерии. Еще одним преимуществом этого метода является отличное и удобное управление операционным полем, так как он практически не влияет на бронхиальный анастомоз.
Список литературы
[1],,,.
Качество жизни после хирургического вмешательства при раке легкого: проспективное пилотное исследование, сравнивающее лобэктомию бронхиального рукава с пневмонэктомией
,
J Thorac Oncol
,
2008
, vol.
3
(стр.
604
—
608
) [2],,,,.
Степень резекции паренхимы легкого значительно влияет на качество жизни в долгосрочной перспективе у пациентов с немелкоклеточным раком легкого
,
Chest
,
2009
, vol.
135
(стр.
322
—
329
) [3],.
Гипоксемия при однолегочной вентиляции: прогноз, профилактика и лечение
,
Анестезиология
,
2009
, т.
110
(стр.
1402
—
1411
) [4],,,,,,.
Стратегия рекрутирования альвеол увеличивает оксигенацию артериальной крови во время однолегочной вентиляции
,
Ann Thorac Surg
,
2002
, vol.
73
(стр.
1204
—
1209
) [5],,.
Новый метод лечения гипоксемии во время вентиляции одного легкого для торакоскопической хирургии
,
J Cardiothorac Vasc Anesth
,
2009
, vol.
23
(стр.
850
—
852
) [6],,,.
Альтернатива дыханию
,
J Thorac Cardiovasc Surg
,
1978
, vol.
75
(стр.
261
—
266
) [7],,,,,,,,,.
Высокочастотная перкуссионная вентиляция улучшает периоперационную клиническую эволюцию резекции легкого.
,
Crit Care Med
,
2009
, vol.
37
(стр.
1663
—
1669
)
© 2010 Европейская ассоциация кардио-торакальной хирургии
.
