Июнь – месяц борьбы с болезнью двигательного нейрона
Неврологи ставропольской краевой клинической больницы принимают активное участие в диагностике пациентов с болезнью двигательного нейрона. Для таких пациентов в крае насчитыватся порядка 40. Специально для них создана в 2019 году «Школа БАС»
Что такое болезнь двигательного нейрона
Болезнь двигательного нейрона (БДН) — это прогрессирующее нейродегенеративное заболевание, которое поражает двигательные нейроны в головном и спинном мозге. Постепенная гибель клеток нервной системы приводит к неуклонно нарастающей мышечной слабости, охватывающей все группы мышц.
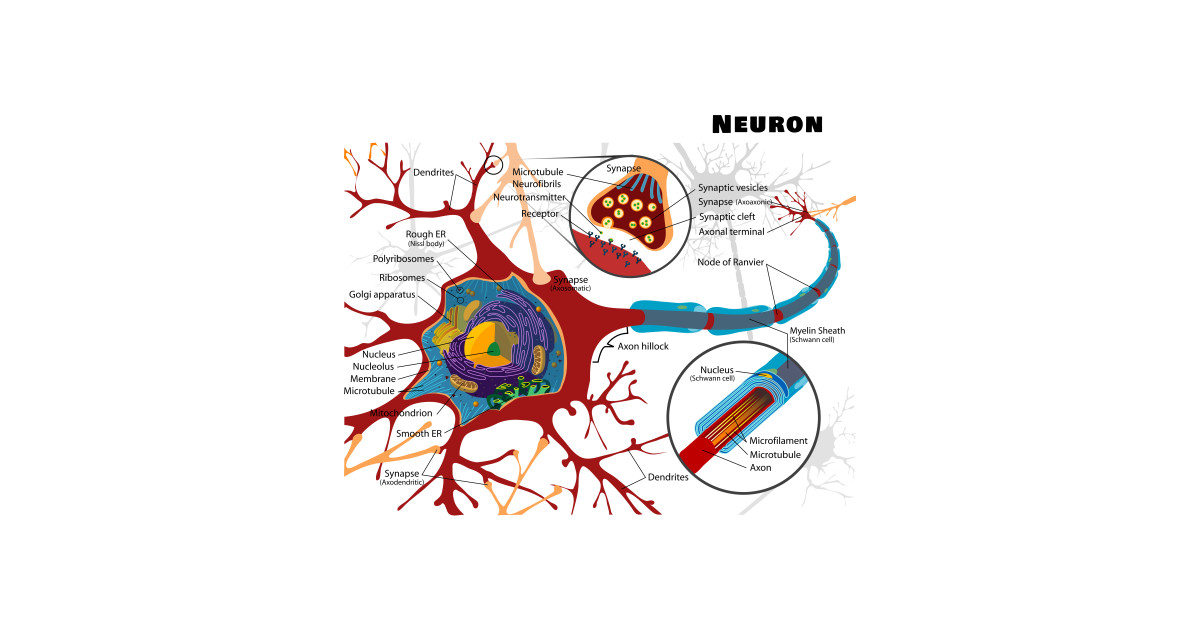
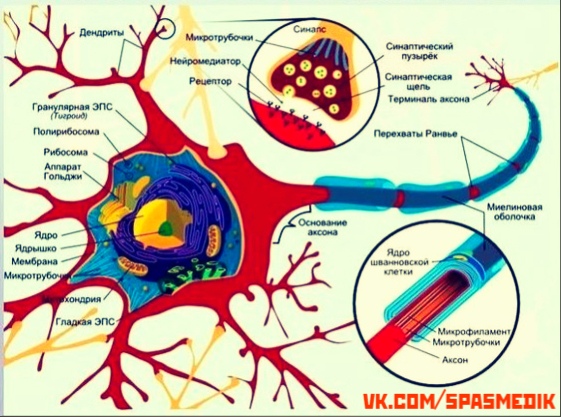
Нейроны головного мозга, которые отвечают за движения (верхние двигательные нейроны), находятся в коре полушарий. Их отростки (аксоны) спускаются в спинной мозг, где происходит контакт с нейроном спинного мозга. Этот контакт называется синапс. В области синапса нейрон головного мозга выделяет из своего отростка химическое вещество (медиатор), которое передает сигнал нейрону спинного мозга.
Нейроны спинного мозга (нижние двигательные нейроны) располагаются в нижних отделах головного мозга (бульбарный отдел), а также шейном, грудном или поясничном отделах спинного мозга в зависимости от того, к каким мышцам они направляют свои сигналы. Эти сигналы по отросткам нейронов спинного мозга (аксонам) доходят до мышц и управляют их сокращениями. Нейроны бульбарного отдела отвечают за сокращение мышц, связанных с речью, жеванием и глотанием; шейного отдела — за сокращение диафрагмы, движения рук; грудного отдела — за движения туловища; поясничного отдела —за движения ног.
Проявления поражения двигательных нейронов
При поражении нейронов спинного мозга нарастает мышечная слабость, мышцы худеют (атрофия), в них появляются непроизвольные подергивания (фасцикуляции). Фасцикуляции не просто ощущаются как подергивания, их также можно увидеть. Это похоже на подкожное трепетание мышц.
Если затронуты нейроны головного мозга, мышцы становятся слабыми, но при этом появляется скованность (спастичность), то есть повышается тонус мышц, их становится трудно расслабить.
При поражении одновременно нейронов головного и спинного мозга эти признаки могут встречаться в разных сочетаниях. То есть мышечная слабость может сопровождаться как фасцикуляциями и похудением мышц, так и скованностью.
Смотря какие отделы головного и спинного мозга оказываются пораженными, данные признаки могут появляться в мышцах, ответственных за движения рук, ног, дыхание или глотание.
Разные виды болезни двигательного нейрона БАС
Это самая распространенная форма заболевания, когда в патологический процесс вовлечены двигательные нейроны и головного, и спинного мозга.
БАС характеризуется слабостью и чувством сильной усталости в конечностях. Некоторые люди отмечают слабость в ногах при ходьбе и настолько сильную слабость в руках, что не могут удержать вещи и роняют их.
Факторы риска при БАС
В последние годы возрастает количество людей, страдающих болезнью двигательного нейрона. Возможно, это обусловлено развитием диагностических методик. Также число случаев этого заболевания, которое чаще встречается у пожилых людей, будет продолжать увеличиваться, поскольку растет средняя продолжительность жизни.
Также число случаев этого заболевания, которое чаще встречается у пожилых людей, будет продолжать увеличиваться, поскольку растет средняя продолжительность жизни.
Ученые полагают, что недуг вызывается множеством факторов как наследственных, так и средовых, которые по отдельности незначительно увеличивают риск болезни, но вместе могут склонить чашу весов в ее пользу.
В последнее время активно изучается вопрос вклада окружающей среды в риск заболевания спорадической формой БАС. Считается, что к факторам риска можно отнести тяжелый физический труд, участие в военных конфликтах, курение, интоксикацию свинцом и контакт с химическими удобрениями.Но с имеющимся ограниченным количеством информации невозможно составить какие-либо четкие рекомендации по снижению риска развития БАС.
Цифры и факты о БАС
Болезнь двигательного нейрона не является инфекционной и не заразна.
БАС может поразить любого взрослого человека, но большинство людей, которым диагностировали эту болезнь, старше 40 лет, а чаще всего заболевание встречается в возрасте между 50 и 70 годами.
Мужчины подвергаются этому заболеванию в два раза чаще, чем женщины.
Заболеваемость БАС составляет 2 новых случая болезни на 100 000 населения в год.
Распространенность БАС составляет приблизительно 5−7 человек на
100 000 населения.
Подергивания мышц (фасцикуляции)
Что происходит? Подергивания и ощущения сокращений мышц под кожей (фасцикуляции) часто являются первыми и самыми раздражающими из симптомов БАС. У некоторых людей они локализованы в отдельных мышцах, однако со временем могут распространяться.
Что можно сделать? По вопросам медикаментозного облегчения данных симптомов нужно обращаться к лечащему врачу. Во многих случаях подергивания со временем исчезают сами по себе.
Мышечная слабость и скованность в суставах
Что происходит? Когда количество сигналов от двигательных нейронов к мышцам снижается, последние используются все меньше и со временем теряют массу. Это приводит к ощущению слабости и может стать причиной нарушения равновесия и походки, что увеличивает риск падения. Что можно сделать? Снижение мышечной массы невозможно остановить физическими упражнениями, т.к. заболевание прогрессирует необратимо. Однако упражнения позволяют сохранить гибкости и подвижности суставов, что способствует поддержанию функции мышц, чувства равновесия и положения тела. Чтобы получить направление к физическому терапевту, который сможет составить подходящую программу упражнений, необходимо обратиться к лечащему врачу. Также помочь может диетолог, который проконсультирует, как правильно питаться для поддержания массы тела и дальнейшего замедления темпов снижения мышечной массы.
Что можно сделать? Снижение мышечной массы невозможно остановить физическими упражнениями, т.к. заболевание прогрессирует необратимо. Однако упражнения позволяют сохранить гибкости и подвижности суставов, что способствует поддержанию функции мышц, чувства равновесия и положения тела. Чтобы получить направление к физическому терапевту, который сможет составить подходящую программу упражнений, необходимо обратиться к лечащему врачу. Также помочь может диетолог, который проконсультирует, как правильно питаться для поддержания массы тела и дальнейшего замедления темпов снижения мышечной массы.
Мышечные судороги и спазмы
Что происходит? Из-за ухудшения проведения сигнала от двигательных нейронов развивается мышечное напряжение или спазмы. Это приводит к нарушению двигательной активности и координации движений, а также повышению риска падений. Внезапные мышечные спазмы могут быть крайне болезненны.
Что можно сделать? Чтобы устранить данный симптом, как правило, достаточно изменить положение тела во время отдыха в кровати или кресле. Частично проблему решают физические упражнения. Кроме того, лечащий врач может выписать лекарственные препараты для расслабления
Частично проблему решают физические упражнения. Кроме того, лечащий врач может выписать лекарственные препараты для расслабления
Утомляемость
Что происходит? Снижение физической функциональности мышц требует больших энергетических затрат на поддержание ежедневной активности. К другим причинам утомляемости относят проблемы с дыханием, одышку, уменьшение поступления пищи и обезвоживание.
Что можно сделать? Составляйте план выполнения дел на день. Это поможет поддерживать баланс между активностью и адекватным отдыхом. Более подробные методики решения проблемы утомляемости может предложить физический терапевт. Важно также проконсультироваться с диетологом по поводу увеличения калорийности пищи и объемов потребляемой жидкости.
Боль
Что происходит? Непосредственно БАС не вызывает боль и дискомфорт. Но они могут быть следствием ряда других причин. Например, боль появляется в результате спазмов мышц, общей спастичности, напряжения мышц, сдавливания кожи или запора. Поэтому важно выяснить причину симптома.
Поэтому важно выяснить причину симптома.
Что можно сделать? Существуют рекомендации по принятию оптимальных положений тела, поддержке, профилактике локального сдавливания и лекарственной терапии. В случае продолжительной боли необходимо обратиться в лечебное учреждение. Врач может подобрать подходящее обезболивающее.
Проблемы с глотанием
Что происходит? При поражении мышц лица, ротовой полости и гортани происходит затруднение глотания. Нарушение нормального процесса приема пищи и глотания называется дисфагия. В результате человек получает меньше питательных веществ и жидкости, что может привести к снижению массы тела.
Что можно сделать? Необходимо обратиться к логопеду и диетологу, которые проведут оценку степени нарушения глотания и изменения массы тела, а также расскажут о возможных решениях проблемы. В том числе, чтобы повысить поступление с пищей белков и углеводов, нужно скорректировать диету. Существуют также альтернативные методы, которые могут служить поддержкой или полной заменой питания.
Слюна и мокрота
Что происходит? При нарушении глотания в ротовой полости скапливается избыточное количество слюны, что приводит к слюнотечению и связанному с ним ощущению дискомфорта. Консистенция секрета может быть как водянистой, так и густой. Повышенная вязкость связана с уменьшением количества жидкости, поступающей в организм. В этом случае слюна удаляется с большим трудном. Также из-за приема лекарств, обезвоживания, дыхания через рот или кандидоза слизистой оболочки может развиться сухость во рту.
Что можно сделать? Среди вариантов решения данной проблемы —корректировка питания, лекарственная терапия и использование аспирационных аппаратов для очистки полости рта (отсосов).
Кашель и чувство удушья
Что происходит? Эти явления могут возникнуть в результате попадания еды или слюны в дыхательные пути.
Что можно сделать? В настоящий момент есть действенные приемы, которые помогают бороться с данными проблемами.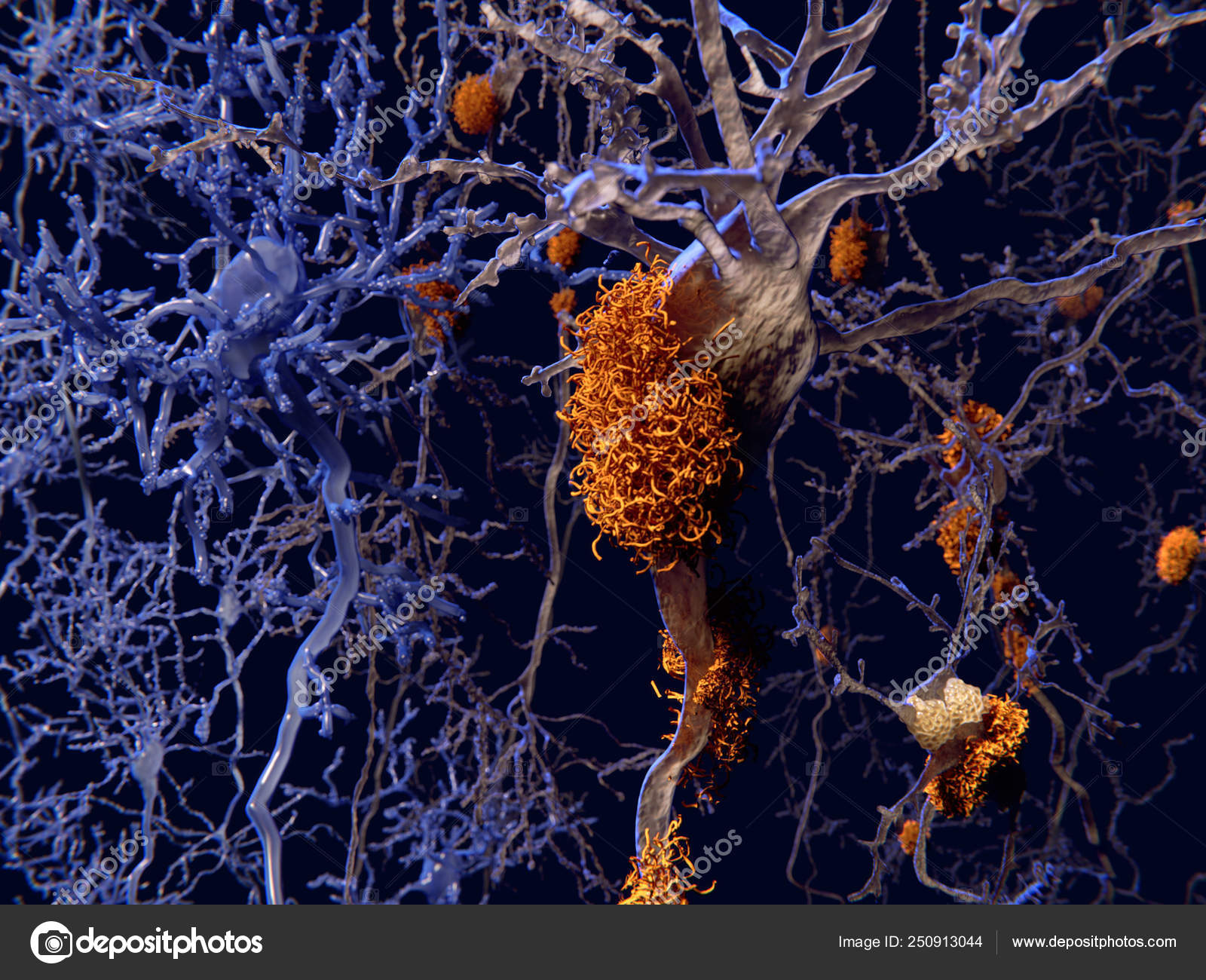 Об это расскажет лечащий врач
Об это расскажет лечащий врач
Проблемы с дыханием
Что происходит? При БАС рано или поздно поражаются дыхательные мышцы. По мере прогрессирования заболевания — особенно на последних стадиях —развиваются проблемы с дыханием. Когда это произойдет, больному понадобятся дыхательные приспособления и консультация специалиста.
Что можно сделать? Если человек испытывает одышку, слабость, нарушения сна, утренние головные боли или сонливость в течение дня, лечащий врач может направить его к пульмонологу. Методы коррекции проблемы могут включать дыхательные и физические упражнения, рекомендации по созданию удобного положения тела, техники эффективного кашля, лекарственную терапию и специальное оборудование для вентиляции легких.
Проблемы с речью и общением
Что происходит? По мере ослабления мышц лица и гортани, а также дальнейшего снижения вентиляции легких человеку становится все сложнее говорить. Такое затруднение речи называется дизартрия.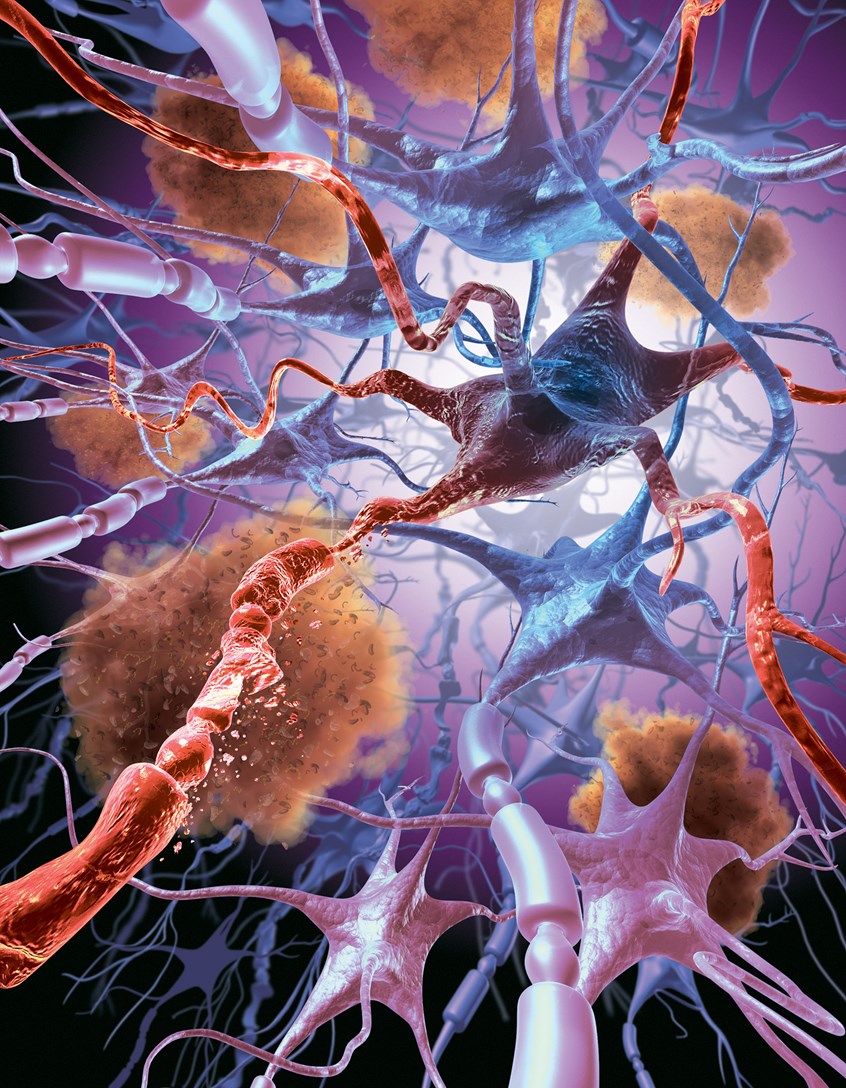
Что можно сделать? Оценить проблему и подобрать техники ее решения поможет лечащий врач. Также рекомендуем проконсультироваться с физиотерапевтом, который посоветует оборудование или вспомогательные средства в зависимости от того, на какие манипуляции способен человек с БАС. Средства для речи и общения (их еще называют «средствами альтернативной и вспомогательной коммуникации») включают как простые методики (жестикуляция, письмо, алфавитные таблицы и пр.), так и технически более сложные (с использованием компьютера)
Эмоциональная лабильность (псевдо-бульбарный эффект)
Что происходит? У некоторых людей, страдающих БАС, бывают приступы неконтролируемого смеха и/или плача, которые трудно сдержать. Данные реакции бывают не у всех болеющих, и они непроизвольны.
Что можно сделать? Для облегчения симптомов можно обратиться к лекарственной терапии. Подобные реакции могут вызывать некоторое беспокойство у окружающих, однако если они будут знать, что данные проявления являются частью симптоматики БАС, им будет легче с этим справиться.
Эмоциональные реакции
Что происходит? Часть больных БАС переживают целый спектр эмоциональных состояний, включая беспокойство, страх, гнев, печаль, депрессию и отрицание. Эти реакции нормальны.
Что можно сделать? Осознание своих эмоциональных состояний является первым шагом к решению проблем, связанных с переживаниями. Если данные состояния слишком ярко выражены и сохраняются достаточно долго, настоятельно рекомендуем обратиться за помощью к врачу. В отдельных случаях эффективна лекарственная терапия и/или психотерапия.
Нарушение высших психических функций
Что делать? Проблемы с памятью, обучением, подбором слов или снижением концентрации внимания известны как нарушение высших психических функций. По некоторым данным эти состояния встречаются у 35% пациентов с БАС, но протекают довольно незаметно. Лишь у единиц они крайне выражены. В этом случае говорят о лобно-височной деменции, которая сопровождается выраженным нарушением когнитивных функций.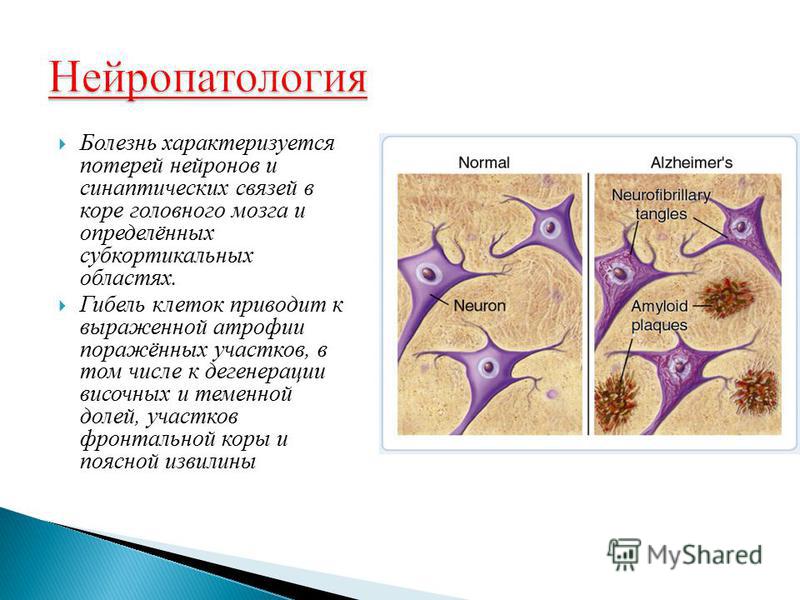
Что можно сделать? Необходимо участие многопрофильной команды специалистов, в том числе психологов и психиатров.
Что не затрагивает БАС?
Как правило, при БАС не происходит заметных изменений в перечисленных ниже системах и органах чувств. Однако течение болезни у каждого человека индивидуальны. При наличии подозрений обязательно проконсультируйтесь со своим лечащим врачом.
Вкус, зрение, осязание, тактильные ощущения и слух
В большинстве случаев упомянутые органы чувств не страдают при БАС, тем не менее, у некоторых болеющих встречаются изменения вкуса, гиперчувствительность кожи или проблемы с терморегуляцией.
Нарушений функций кишечника и недержание
Нарушения функций кишечника и мочевого пузыря обычно не встречаются при БАС, однако нарушения двигательной активности способствуют созданию дополнительных сложностей в пользовании туалетом. На фоне изменений питания, обезвоживания, беспокойства, лекарственной терапии или снижения подвижности может появиться запор. Стойкий запор может смениться диареей. Любые изменения функций мочевого пузыря и кишечника следует проверить, поскольку они могут быть симптомами других заболеваний.
Стойкий запор может смениться диареей. Любые изменения функций мочевого пузыря и кишечника следует проверить, поскольку они могут быть симптомами других заболеваний.
Сексуальная функция
БАС, как правило, не влияет на сексуальную функцию, однако у больного может измениться восприятие собственной сексуальности. Физические изменения могут наложить отпечаток на все этапы интимного процесса. Открытое обсуждение возникающих проблем с партнером и врачами поможет поддержанию интимных отношений.
Мышцы глаз
Движения глазных яблок у большинства людей с БАС сохранены. При поражении мышц шеи поможет использование соответствующей поддержки.
Сердечная мышца
БАС не затрагивает сердце напрямую.
Лечение БАС
На сегодняшний день не разработано способов победить само заболевание. Поэтому существующее лечение решает две задачи: продление жизни и улучшение ее качества. К первому направлению относятся применение препарата рилузол, дыхательная поддержка и обеспечение питания. Второе сфокусировано на минимизации избыточного слюнотечения, судорог и спастичности мышц, эмоциональной нестабильности, боли.
Второе сфокусировано на минимизации избыточного слюнотечения, судорог и спастичности мышц, эмоциональной нестабильности, боли.
Терапия нарушений дыхания
Для болеющих с проблемами дыхания существует ряд методов терапии и лекарственных препаратов. За рекомендациями по этому поводу следует обратиться к пульмонологу.
Как правило, существует два варианта действий:
неинвазивная вентиляция легких (НИВЛ), при которой специальный аппарат нагнетает воздух в лицевую маску, которая помогаем больному дышать самостоятельно;
инвазивная вентиляция легких (трахеостомия, ИВЛ), при которой производится установка воздуховода через трахеостомическую канюлю.
Гастростомия
Питание через гастростому является самым предпочтительным методом для больных БАС. Это единственный способ кормить людей сколько угодно долго по времени, в нужном количестве и без дискомфорта для самого человека.
При проведении гастростомии в желудок через переднюю брюшную стенку вводят трубку для питания. Трубка компактная, толщиной с шариковую ручку и очень гибкая. Ее не видно под одеждой.
Трубка компактная, толщиной с шариковую ручку и очень гибкая. Ее не видно под одеждой.
Есть два способа наложения гастростомической трубки: чрескожная эндоскопическая гастростомия (ЧЭГ) и рентгенологическая гастростомия (РГ). В нашей стране накоплен опыт установки гастростом методом ЧЭГ
Комплементарная терапия
Методы комплементарной терапии облегчают симптомы и снижают уровень стресса у некоторых людей с БАС. Но следует помнить, что данные методы не являются лечением заболевания.
Комплементарная терапия не входит в понятие традиционной медицины, однако способствует повышению эффективности стандартного лечения.
К методам комплементарной терапии при БАС относятся массаж, иглоукалывание, ароматерапия и рефлексотерапия.
Нутриционная поддержка (обеспечение полноценного питания)
По мере развития заболевания мышцы человека, отвечающие за жевание и глотание, становятся медлительными, вялыми и слабыми. В результате процесс приема пищи может сильно растягиваться, человек начинает поперхиваться. Если глотание затруднено, то для уменьшения собственного дискомфорта больной часто начинает сокращать рацион. В свою очередь недостаток воды и пищи приводит к обезвоживанию, потере веса, снижению иммунитета.
Если глотание затруднено, то для уменьшения собственного дискомфорта больной часто начинает сокращать рацион. В свою очередь недостаток воды и пищи приводит к обезвоживанию, потере веса, снижению иммунитета.
Специальное лечебное питание способно восполнить недостаток калорий. В России можно купить питание трех основных производителей — Nutricia, Nestle и Fresenius. При уменьшении количества потребляемой пищи в результате снижения аппетита или нарушений глотания очень желательно ежедневно добавлять в рацион такие продукты. При определенных видах БАС могут быть ограничения на ту или иную форму питания, поэтому необходимо проконсультироваться с врачом-неврологом.
Своевременное обеспечение доступа пищи в организм путем установки назогастрального зонда или гастростомы позволяет кормить и поить человека, который теряет способность самостоятельно глотать по мере развития заболевания.
Антиоксиданты
Антиоксиданты — это класс питательных веществ, которые помогают организму предотвращать повреждения клеток свободными радикалами.
Считается что люди, страдающие БАС, могут быть более восприимчивы к вредоносным эффектам свободных радикалов, и в настоящее время ведутся исследования, направленные на выявление полезного воздействия на организм добавок, богатых антиоксидантами.
Некоторые средства, содержащие антиоксиданты, которые уже прошли клинические испытания в целях выявления влияния на БАС, не доказали своей эффективности.
Альтернативное лечение
В настоящее время единственные средства, которые замедляют прогрессирование БАС, — это рилузол и эдаравон. Эффективность дорогостоящих препаратов невысокая, поэтому понятно, почему люди с БАС хотят попробовать другие способы терапии.
Что такое стволовые клетки?
Стволовые клетки — это клетки, которые еще не сформировались для того, чтобы выполнять конкретные функции. Они могут самообновляться и давать начало различным типам клеток таким, как, например, клетки крови, мышечные и нервные клетки.
Внимание СМИ и общий интерес к стволовым клеткам связаны с тем, что в будущем их, вероятно, можно будет использовать при восстановлении или для замены нормальных клеток, погибших в связи с каким-то заболеванием.
Стволовые клетки стали ценным инструментом для исследователей. Ученые интересуются ими в связи с возможностью получения мотонейронов в лабораторных условиях, что позволит изучить скрытые механизмы развития БАС.
Неврологи ставропольской краевой клинической больницы принимают активное участие в диагностике пациентов с болезнью двигательного нейрона. Для таких пациентов в крае насчитыватся порядка 40. Специально для них создана в 2019 году «Школа БАС».
Болезнь моторных нейронов: современный взгляд на проблему
Представляем вашему вниманию краткое изложение материалов обзора Catherine
Lomen-Hoerth, M.D., Ph.D. «Amyotrophic Lateral Sclerosis from Bench to Bedside»,
опубликованного в журнале Seminars in Neurology (2008, 28 (2): 205-211). Обзор
является обобщением современных данных об этиологии, нейрохимических основах
патогенеза, а также клинических вариантах и подходах к лечению хронического
неуклонно прогрессирующего заболевания – бокового амиотрофического склероза
(болезнь моторных нейронов, болезнь Шарко).
Авторы широко осветили лабораторную диагностику заболевания и основные аспекты,
играющие определяющую роль в дифференциации и выборе лечебной тактики. Надеемся,
что представленные данные о его генетически детерминированных вариантах и
подходах к дифференцированной терапии помогут на качественно новом уровне
принять верное решение в диагностических и клинических задачах, связанных с
данным заболеванием.
Боковой амиотрофический склероз (БАС) – хроническое медленно прогрессирующее
заболевание, при котором ведущими клиничеcкими синдромами являются
спастико-атрофические парезы конечностей и бульбарные расстройства,
обусловленные сочетанным поражением центрального и периферического двигательного
нейрона.
БАС впервые описан во Франции в XIX веке. Он является относительно редким
заболеванием (независимо от географических и этнических факторов составляет
приблизительно 1 случай на 100 тыс. человек) и сложным для диагностики (из-за
большого разно-образия БАС-плюс синдромов). Среди пациентов преобладают лица
Среди пациентов преобладают лица
мужского пола, средний возраст которых 56 лет. Пределы дебюта довольно широкие
и, по данным литературы, составляют от 20 до 80 лет. Случаи БАС возникают
спорадически, и только 10% из них являются генетически детерминированными с
аутосомно-доминантным типом наследования. Несмотря на идентификацию многих
генетических нарушений, а также предположение о связи БАС с прионовыми
инфекциями, его точные этиологичес-кие факторы в настоящее время не определены.
БАС редко дебютирует бульбарными нарушениями, однако его прогноз остается
неблагоприятным, поскольку после появления первых признаков дыхательных
нарушений продолжительность жизни пациентов составляет в среднем 3-5 лет.
Как известно, в настоящее время перечень эффективных лечебных мероприятий
БАС, также как и возможность существенно влиять на исход данного заболевания,
весьма ограничены.
Этиология и патогенез
В настоящее время этиология спорадического БАС до конца не выяснена. Однако у
Однако у
10-20% больных выявлены специфические генетические нарушения, позволившие
выделить более 8 наследственных форм БАС. Большинство из них выявляются
достаточно редко, за исключением формы БАС-1, связанной, согласно последним
данным, с мутацией гена, кодирующего супероксиддисмутазу (СОД-1). В результате
исследований молекулярно-генетических механизмов развития заболевания также были
определены и генетические субстраты синдромов БАС-деменция и
БАС-деменция-паркинсонизм.
БАС, по мнению большинства исследователей, является мультифакторным
заболеванием. Определенную роль в его развитии играет глутаматная
эксайтотоксичность. Поэтому в качестве патогенетической терапии у больных БАС
успешно применяют рилузол – антагонист глутаматных рецепторов. Существует
теория, связывающая развитие этого заболевания с дефицитом инсулиноподобного
фактора роста. Однако препараты на его основе в настоящий момент находятся в
стадии клинических испытаний.
Кроме того, выявлено, что определенную роль в патогенезе БАС может играть
активация каспаз и увеличение проницаемости митохондриальных мембран, что
инициирует запуск каскада протеолитических реакций, ведущих к гибели клетки. В
В
последние время для исследования патологических процессов при БАС и для
возможной целенаправленной терапии особое внимание ученых привлекают астроглии и
микроглии.
Кроме классического БАС, выделяют несколько вариантов заболевания, имеющих
характерные клинические особенности, – БАС-деменцию и БАС-деменцию-паркинсонизм.
Так, БАС-деменция, наблюдающаяся в 5-12% случаев, представляет собой сочетание
БАС с фронтотемпоральной дегенерацией и сопровождается широким спектром
поведенческих и когнитивных нарушений, что, как правило, значительно снижает
эффективность терапии.
О наличии общего механизма развития БАС и БАС-плюс синдромов свидетельствует
и цитологическое выявление специфического белка TDP-43 (transactive
response-DNA-binding protein 43) как у пациентов с БАС, так и при сочетании БАС
с фронтотемпоральной деменцией. Это, по мнению экспертов, может означать
появление новых перспектив в лечении болезни мотонейрона.
Диагностические критерии
Клинические проявления БАС включают признаки поражения центрального и
периферического мотонейрона:
• замедленную речь;
• высокие сухожильные рефлексы;
• повышение мышечного тонуса по спастическому типу;
• мышечные атрофии, фасцикуляции и периферические парезы.
Сложность диагностики может заключаться в исподволь развивающейся
неврологической симптоматике, отсутствии изменений на электромиограмме (на
начальной стадии), преобладании симптомов изолированного поражения центрального
(первичный БАС) или периферического мотонейрона (прогрессирующая мышечная
атрофия) с возможным переходом в БАС.
При преимущественном поражении центрального мотонейрона дифференциальный
диагноз необходимо проводить с:
• рассеянным склерозом;
• опухолью мозга;
• недостаточностью витамина В12;
• мультифокальной моторной невропатией;
• паранеопластическим синдромом;
• моноклональной гаммапатией;
• токсическими поражениями ЦНС и полиомиелитом.
Поскольку заболевания позвоночного столба, опухоли головного и спинного мозга
встречаются гораздо чаще БАС, первое исследование в оценке потенциального
пациента – магнитно-резонансная томография (МРТ). Дифференцировать БАС от
очаговых поражений спинного мозга, в том числе компрессионных, а также опухолей
спинного мозга позволяет отсутствие четкого уровня поражения.:quality(85)/cloudfront-us-east-1.images.arcpublishing.com/infobae/LIH6VIBRBRFLHMQFJV7M27QRLA.jpg?resize=877.5%2C586&ssl=1) Кроме того, МРТ
Кроме того, МРТ
спинного мозга позволяет визуализировать изменения характерных для него
заболеваний, наиболее часто дифференцируемых с БАС.
Лабораторная диагностика при постановке диагноза БАС, по мнению авторов,
включает:
• развернутый анализ крови с подсчетом количества тромбоцитов;
• определение электролитов крови (в том числе кальция и магния), азота мочевины,
креатинина, креа-тинфосфокиназы, АСТ, АЛТ, цианокобаламина, белка сыворотки
крови (методом электрофореза и иммунофиксации), белка мочи, концентрации свинца
в сыворотке крови и уровня тиреотропного гормона.
При преобладании симптомов поражения периферического мотонейрона необходимо
определить уровень анти-GM1-антител, повышение которых характерно для
мультифокальной моторной нейропатии, проводить ДНК-диагностику мутации гена
рецептора андрогенов для исключения Х-сцепленной бульбарной спинальной мышечной
атрофии (болезнь Кеннеди), а также иммуноферментный анализ для выявления антител
к боррелиям (если заболевание выявлено в эндемичном для болезни Лайма регионе).
У лиц молодого возраста в спектр исследований целесообразно включить определение
антител к ВИЧ и уровень гексозаминидазы А (для выявления возможного ее
дефицита).
В отличие от мультифокальной моторной невропатии при БАС анти-GM1-антитела
либо отсутствуют, либо наблюдается их незначительный подъем. Кроме этого, для
мультифокальной моторной невропатии характерно наличие блоков проведения на
периферических нервах при отсутствии сенсорных расстройств.
Заподозрить болезнь Кеннеди можно на основании семейного анамнеза, наличия
эндокринных нарушений (гинекомастии), отсутствия или снижения сухожильных
рефлексов и наличия сенсорных расстройств (преимущественно в нижних
конечностях). Укус клеща в анамнезе, наличие сыпи или вовлечение в
патологический процесс черепных нервов с большой вероятностью указывают на
наличие болезни Лайма.
Ликворологические и цитологические исследования информативны для исключения
Т-клеточной лейкемии и рассеянного склероза (при преобладании симптомов
поражения центрального мотонейрона) и лимфом (при наличии симптомов
изолированного поражения периферического мотонейрона).
Электромиография (ЭМГ) – неотъемлемый метод в процессе дифференцирования БАС
и БАС-плюс синдромов с рядом нейродегенеративных заболеваний, особенно при
преимущественном поражении периферического мотонейрона. Так, ЭМГ позволяет
выявить блок проводимости, типичный для мультифокальной моторной невропатии,
обычно хорошо поддающейся терапии иммуноглобулином.
При болезни Кеннеди может отмечаться снижение амплитуды сенсорного потенциала
действия.
В процессе дифференцирования бульбарной формы БАС и миастении, наряду с
выявлением антител к рецептору ацетилхолина, большое диагностическое значение
имеет выявление нарушений нервно-
мышечной синаптической передачи при повторной стимуляции нерва. Характерные для
миопатий изменения электромиографических показателей, в частности снижение
средней длительности потенциала двигательных единиц (ПДЕ), позволяют успешно
дифференцировать их от БАС, при котором, напротив, наблюдается повышение
параметров ПДЕ. Проведение ЭМГ при БАС, по мнению авторов, имеет как
диагностическое (в частности, при субклинических формах), так и определенное
прогностическое (определение скорости прогрессирования денервации) значение.
Учитывая тяжесть и прогноз заболевания, а также доступность информации в
Интернете, этические и практические вопросы информирования о диагнозе БАС должны
быть тщательно проработаны. Согласно рекомендациям ряда специалистов, для
уменьшения числа нозогенных реакций необходимо сообщать о диагнозе БАС лишь при
наличии четкой клинической, лабораторной, электронейрофизиологической и
нейровизуализационной (отсутствие других заболеваний) объективизации данного
заболевания. Сообщение диагноза производится в спокойной форме. Следует выбирать
простые и осторожные слова, быть откровенным, избегать перенасыщенности
медицинской терминологией.
Информацию о заболевании, представленную в письменной форме, рекомендуется
давать позже. Кроме того, пациенту необходимо предоставить полную информацию о
методах лечения БАС, сообщить о продолжающихся клинических испытаниях, в которых
при желании он может участвовать, иными словами, человек должен быть убежден,
что не оставлен один на один со своим диагнозом.![]() Необходимо сделать все
Необходимо сделать все
возможное для того, чтобы больной ушел с надеждой на успешное симптоматическое
лечение и с уверенностью в поддержке лечащего врача.
Принципы лечения
Лечение БАС включает несколько направлений:
• уменьшение прогрессирования;
• симптоматическое лечение;
• оптимизацию ухода за больным.
Одним из препаратов, эффективность которого при БАС доказана клиническими
испытаниями, является рилузол, тормозящий прогрессирование заболевания и
позволяющий увеличить продолжительность жизни больных. Эффективность других
препаратов, в частности кофермента Q10, витаминов C и E, бета-каротина, и
a-липоевой кислоты, в настоящее время активно
исследуется в рамках широкомасштабных клинических испытаний.
Симптоматическое лечение при БАС направлено на улучшение качества жизни
пациента, что более доступно в многопрофильной клинике. Особое место в лечении
занимает сбалансированное, высококалорийное, богатое белком питание, поскольку у
пациентов с БАС алиментарная недостаточность может быть следствием наличия
дисфагии или невозможности самостоятельного приема пищи из-за выраженной
слабости в руках. В этом случае для обеспечения адекватного питания и гидратации
В этом случае для обеспечения адекватного питания и гидратации
проводят зондовое кормление.
В терапии БАС одной из самых сложных задач является борьба с дыхательной
недостаточностью. Применение периодической неинвазивной вентиляции легких (НВЛ,
режимы CiPAP, BiPAP) рекомендуется:
• в случаях, если форсированная жизненная емкость легких при спирографии
снижается более чем на 50%;
• при значительном снижении максимальной объемной скорости потока форсированного
вдоха;
• при наличии выраженных ночных дыхательных расстройств (частых апноэ во сне).
При прогрессировании дыхательной недостаточности и неэффективности НВЛ
проводят трахеостомию, ИВЛ. Вопрос о целесообразности проведения длительной ИВЛ
остается дискутабельным в связи с большим количеством этических, экономических,
технических и юридических аспектов данной проблемы.
Однако наличие бульбарных и псевдобульбарных расстройств, повышение мышечного
тонуса, гиперсаливация, дизурия, нарушение функции кишечника и сна, крампи,
депрессия также требуют паллиативной терапии. При наличии признаков
При наличии признаков
псевдобульбарного синдрома чаще всего применяют низкие дозы амитриптилина. Кроме
того, в настоящее время изучается эффективность комбинации декстрометорфана и
хинидина при псевдобульбарных расстройствах. Назначение хинина сульфата и
баклофена, снижающего спастичность, позволяет в значительной степени уменьшить
выраженность крампи. С этой же целью применяют и тегретол, который требует
избирательного назначения, что продиктовано стремлением избежать ряда побочных
эффектов.
Одним из симптомов, вызывающих у больных негативную эмоциональную реакцию,
является гиперсаливация. Назначение робинула (1 мг каждые 4 часа с последующим
увеличением дозы до 2 мг) или капель 1% раствора атропина, как правило,
позволяет уменьшить выраженность слюноотделения. Для разжижения слюны применяют
робитуссин в дозе не более 400 мг каждые 4 часа. В случае неэффективности
применяемой терапии действенным методом борьбы с гиперсаливацией является
введение ботулотоксина в слюнные железы.
Комплекс двигательных нарушений при БАС включает и повышение мышечного
тонуса, затрудняющее ходьбу и часто приводящее к развитию суставных контрактур.
Применение валиума (10-20 мг на ночь) и баклофена (по схеме с постепенным
увеличением дозы до 100 мг/сут) или комбинаций баклофена с тизанидином
способствует уменьшению спастичности и сопряженных с ней осложнений со стороны
двигательной сферы. При неадекватном эффекте лечения спастичности возможно
интратекальное введение баклофена при помощи баклофенового насоса. Непрерывная
инфузия препарата в спинномозговую жидкость после получения дозозависимого
эффекта позволяет пациентам отказаться от перорального приема.
Дизурические явления у пациентов с БАС хорошо поддаются медикаментозной
коррекции препаратами, снижающими тонус гладкой мускулатуры мочевыводящих путей
(детрол, дитропан). Применение кондомного катетера у мужчин также позволяет
минимизировать негативные эффекты нарушений мочеиспускания, в частности при
необходимости длительных поездок.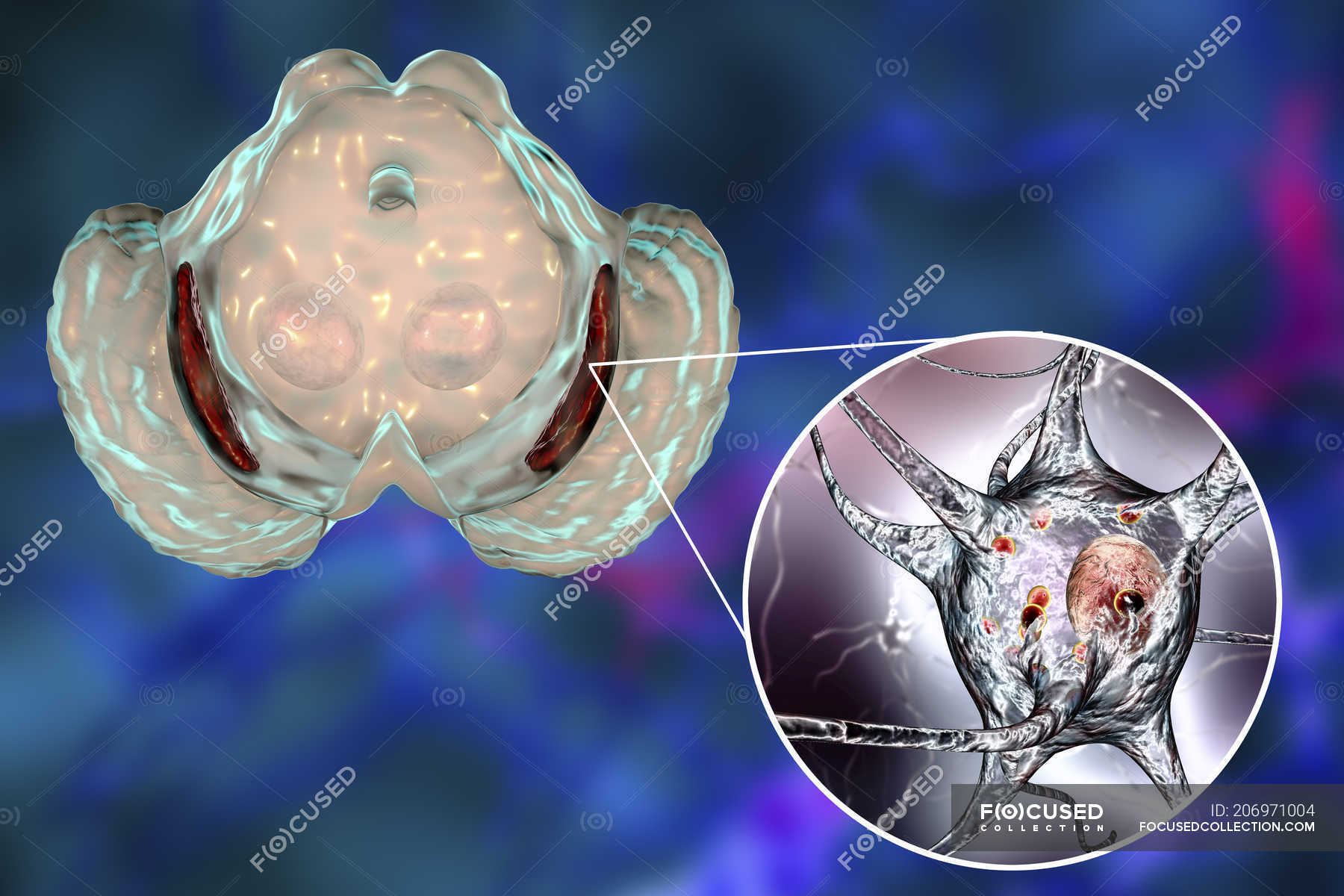
Нарушения сна у больных БАС чаще всего связаны с асфиксическими ночными
расстройствами и двигательными нарушениями. Проведение оксиметрии во время сна
позволяет выявить связь дыхательных нарушений с расстройствами сна, что
способствует своевременному назначению НВЛ.
При наличии стойких диссомнических расстройств рекомендовано применение
золпидема, а в случае сочетания нарушений сна и депрессии часто эффективны
антидепрессанты (миртазапин, тразодон). Лечение тревожных расстройств, по мнению
ряда авторов, менее успешно. Однако необходимость медикаментозной коррекции
тревожных и поведенческих расстройств, сопряженных с прогрессированием деменции
лобного типа, очевидна.
Нарушения моторно-эвакуаторной функции кишечника возникают, как правило, за
счет ограниченного двигательного режима либо недостаточного потребления
жидкости. Профилактические меры при этом включают адекватное потребление
клетчатки и жидкости, а также применение препаратов, стимулирующих перистальтику
(лактулоза).
Использование бензодиазепинов для уменьшения фасцикуляций у пациентов с БАС
является в определенной мере допустимым, однако эффективные дозы этих
препаратов, согласно ряду наблюдений, вызывали сонливость.
Симптоматическое лечение БАС
Гиперсаливация: атропин, робинул, скополамин; радиационные методы
или введение ботокса в слюнные железы
Крампи: хинина сульфат, тегретол
Спастичность: баклофен, валиум, тизанидин, баклофеновый насос
Дизурия: дитропан, детрол
Псевдобульбарный синдром: амитриптилин в низких дозах или комбинация
декстрометорфана и хинидина
Нарушения моторно-эвакуаторной функции кишечника: слабительные препараты,
жидкость, клетчатка, лактулоза
Нарушения сна: НВЛ; миртазапин, тразодон, амбиен, амбиен CR, валиум
Депрессия: СИОЗС, миртазапин, тразодон
Тревожные расстройства: лоразепам, буспирон, СИОЗС
Новые научно-технические достижения, такие как: электронные инвалидные
кресла, портативные скаты и даже возможность общаться при помощи компьютера,
благодаря специальным сенсорным датчикам, безусловно, изменили жизнь пациентов с
БАС в качественно лучшую сторону. Кроме того, в США лица с БАС имеют право не
Кроме того, в США лица с БАС имеют право не
только на высококвалифицированную медицинскую помощь, обеспечиваемую
мультидисциплинарными бригадами, но и весомую поддержку медико-социальных служб
и Ассоциации больных БАС.
Подводя итог, можно сделать вывод о том, что усилия неврологов должны быть
сфокусированы не только на поиск новых стратегий и направлений в лечении больных
БАС, но и на всестороннее улучшение их качества жизни с учетом широкого спектра
проблем, связанных с данным заболеванием.
Подготовила Евгения Соловьева
Боковой амиотрофический склероз (БАС) и другие заболевания двигательных нейронов (ЗДН) — Заболевания головного и спинного мозга и нервной системы
Прогрессирование болезни начинается с возникновения слабости, часто кистей рук, реже стоп или мышц рта и горла. Слабость может быстрее нарастать с одной стороны тела, чем с другой. Обычно слабость распространяется от конца конечностей вверх. Мышцы начинают усыхать (атрофия), обычно в кистях и стопах. Часто возникают мышечные спазмы, они могут предшествовать слабости, но чувствительность не меняется. Больной теряет вес и чувствует необычную усталость.
Часто возникают мышечные спазмы, они могут предшествовать слабости, но чувствительность не меняется. Больной теряет вес и чувствует необычную усталость.
Со временем слабость нарастает.
Мышцы подергиваются (фасцикуляции). Мышечный тонус обычно повышается, мышцы становятся ригидными и напряженными, что приводит к мышечным спазмам (спастичность). Движения скованные и неуклюжие. У некоторых больных мышечный тонус понижается, конечности становятся вялыми и слабыми.
Больному становится трудно управлять выражением лица. Ослабление мышц горла может стать причиной невнятной речи и затрудненного глотания (дисфагия). Поскольку глотание затруднено, у больных начинается слюнотечение, они могут подавиться жидкостью. Пациенты могут вдыхать пищу и слюну (аспирация) в легкие, что повышает риск пневмонии (аспирационная пневмония). Голос обычно звучит гнусаво, иногда становится хриплым.
По мере прогрессирования симптомов больной теряет возможность контролировать проявления эмоций и может не к месту смеяться или плакать.
Позднее происходит ослабление мышц, участвующих в дыхании, больному становится трудно дышать. Некоторым больным требуется аппарат искусственного дыхания.
Боковой амиотрофический склероз может прогрессировать с разной скоростью:
-
Около 50% пациентов с этим заболеванием умирают в течение 3 лет после появления первых симптомов.
-
Приблизительно 20% живут в течение 5 лет.
-
Около 10% живут 10 лет и больше.
-
Незначительное количество людей живут более 30 лет.
Диагностика болезней моторных нейронов и миопатий
Боковой амиотрофический склероз (БАС) – тяжелое нейродегенеративное заболевание с поражением верхних и нижних моторных нейронов неясной этиологии. Чувствительность и специфичность критериев El Escorial (1994) и Awaji-Shima (2008) на начальных этапах развития бокового амиотрофического склероза (БАС) крайне низка. Использование тяжелых цепей нейрофиламентов в ликворе, в качестве биомаркера нейродегенерации при БАС, позволяет не только объективизировать диагноз БАС, но и спрогнозировать течение болезни. Помимо исследования фрагментов нейрофиламентов (НФ) в ликворе, важным этапом диагностики БАС является проведение дифференциальной диагностики с рядом генетических патологий, а также проведение семейного консультирования и генотипирования на наследственные формы БАС. Упрощенным алгоритмом лабораторного обследования пациентов с симптомами болезни моторных нейронов является: 1. Исследование НФ в ликворе; 2. Генотипирование на болезни, имитирующих БАС – болезнь Кеннеди, спинальная мышечная атрофия, болезнь Штрюмпеля; 3. Исследование на мутации в генах SOD1 и C9orf72 для определения семейных форм БАС.
Использование тяжелых цепей нейрофиламентов в ликворе, в качестве биомаркера нейродегенерации при БАС, позволяет не только объективизировать диагноз БАС, но и спрогнозировать течение болезни. Помимо исследования фрагментов нейрофиламентов (НФ) в ликворе, важным этапом диагностики БАС является проведение дифференциальной диагностики с рядом генетических патологий, а также проведение семейного консультирования и генотипирования на наследственные формы БАС. Упрощенным алгоритмом лабораторного обследования пациентов с симптомами болезни моторных нейронов является: 1. Исследование НФ в ликворе; 2. Генотипирование на болезни, имитирующих БАС – болезнь Кеннеди, спинальная мышечная атрофия, болезнь Штрюмпеля; 3. Исследование на мутации в генах SOD1 и C9orf72 для определения семейных форм БАС.
Поражение нервно-мышечного аппарата может наблюдаться при ряде аутоиммунных заболеваний, воспалительных миопатиях, генетических нарушениях, а также метаболических и инфекционных заболеваниях. Важным этапом диагностики мышечной патологии является биопсия мышцы с гистологической и гистохимической окраской полученных биоптатов. Данное исследование позволяет не только описать основные паттерны поражения, но также исключить и подтвердить основные группы заболеваний нервно-мышечной системы.
Данное исследование позволяет не только описать основные паттерны поражения, но также исключить и подтвердить основные группы заболеваний нервно-мышечной системы.
Воспалительные миопатии представляют собой группу заболеваний, родственных системным заболеваниям соединительной ткани. Наиболее распространенными формами являются миозиты при системных заболеваниях соединительной ткани, дерматомиозит, миозит с тельцами включений, некротизирующая миопатия. АНФ отмечается у 50-70% пациентов с воспалительными миопатиями, а выявление специфических антинуклеарных антител играет большое значение в диагностике и дифференциальной диагностике этих заболеваний У пациентов с подозрением на воспалительные миопатии рекомендуется проведения исследования на антинуклеарные антитела и антитела к антигенам Мi-2, Ku, PM-Scl 75, PM-Scl 100 и антисинтетазные антитела.
Наследственные миопатии являются генетически гетерогенной группой заболеваний, диагностика которых значительно затруднена сходством клинических проявлений разных генетических форм. Дистрофинопатии, обусловленные мутациями в гене дистрофина (DMD), являются сравнительно распространённой Х-сцепленной наследственной патологией, которая клинически проявляется дистрофией Дюшенна и Беккера, а также кардиомиопатией. Исследование делеций и дупликаций гена DMD следует включать в обследование пациентов с симптомами поражения проксимальных отделов мышечной системы (сходными с полимиозитом) и высоким уровнем КФК в сыворотке крови. При этом, выявление поражения проксимальных или дистальных отделов мышечной системы с миотонией и системными нарушениями, такими как нарушение сердечной проводимости, сахарный диабет 2 типа, катаракта, является показанием к проведению у пациента исследования на миотоническую дистрофию 1 и 2 типов.
Дистрофинопатии, обусловленные мутациями в гене дистрофина (DMD), являются сравнительно распространённой Х-сцепленной наследственной патологией, которая клинически проявляется дистрофией Дюшенна и Беккера, а также кардиомиопатией. Исследование делеций и дупликаций гена DMD следует включать в обследование пациентов с симптомами поражения проксимальных отделов мышечной системы (сходными с полимиозитом) и высоким уровнем КФК в сыворотке крови. При этом, выявление поражения проксимальных или дистальных отделов мышечной системы с миотонией и системными нарушениями, такими как нарушение сердечной проводимости, сахарный диабет 2 типа, катаракта, является показанием к проведению у пациента исследования на миотоническую дистрофию 1 и 2 типов.
При миастении и миастеноподобных синдромах нарушение нервно-мышечной передачи обусловлено аутоантителами, которые связываются с рецепторами нейромедиаторов, в частности, с рецептором ацетилхолина и мышечно-специфической киназой (MuSK). При миастении и тимоме перекрестная реакция с миоэпителиальными клетками тимуса приводит к появлению антител к скелетным мышцам.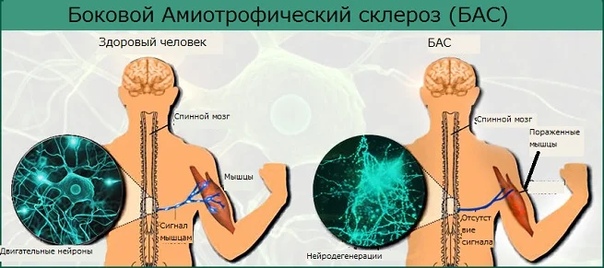 У пациентов с поздним птозом и миастеноподобным синдромом, у которых не было выявлено антител к ацетилхолиновому рецептору и MuSK, следует проводить исследование на окулофарингеальную миодистрофию и миотоническую дистрофию 1 и 2 типов в связи со схожестью их проявлений с миастенией. Заболевания щитовидной железы также часто требуют дифференциальной диагностики с миопатиями и миастенией, поскольку вызывают выраженную мышечную слабость и утомляемость, которые часто являются первым проявлением гипо- или гиперфункции щитовидной железы.
У пациентов с поздним птозом и миастеноподобным синдромом, у которых не было выявлено антител к ацетилхолиновому рецептору и MuSK, следует проводить исследование на окулофарингеальную миодистрофию и миотоническую дистрофию 1 и 2 типов в связи со схожестью их проявлений с миастенией. Заболевания щитовидной железы также часто требуют дифференциальной диагностики с миопатиями и миастенией, поскольку вызывают выраженную мышечную слабость и утомляемость, которые часто являются первым проявлением гипо- или гиперфункции щитовидной железы.
Редкая патология болезнь двигательного нейрона — приговор или… | Нервы в порядке
Человеческий мозг представляет собой сложную систему, которая так же как и остальной организм подвержена различным патологиям, одной из которых является болезнь двигательного нейрона (БДН). Данный недуг является сравнительно редким, но в то же время опасным заболеванием и в большинстве случаев приводит к печальным последствиям, но обо всем по порядку…
Что такое БДН?
Строение двигательного нейронаВ головном и спинном мозге каждого человека имеются нейроны (мотонейроны), которые отвечают за двигательную функцию того или иного участка тела. В результате поражения данных нейронов происходит своеобразная цепная реакция, которая приводит к постепенному параличу человека. В частности, больной утрачивает глотательные рефлексы, у него пропадает речь, его позвоночник перестает нормально функционировать и в итоге полностью выключается из нормальной жизнедеятельности. Кроме того, у пациента может возникнуть тетрапарез (паралич всех четырех конечностей). В совокупности данных симптомов происходит невозможность поддержания жизненно важных функций, в результате чего наступает смерть человека.
В результате поражения данных нейронов происходит своеобразная цепная реакция, которая приводит к постепенному параличу человека. В частности, больной утрачивает глотательные рефлексы, у него пропадает речь, его позвоночник перестает нормально функционировать и в итоге полностью выключается из нормальной жизнедеятельности. Кроме того, у пациента может возникнуть тетрапарез (паралич всех четырех конечностей). В совокупности данных симптомов происходит невозможность поддержания жизненно важных функций, в результате чего наступает смерть человека.
Болезнь двигательного нейрона поражает людей пожилого возраста в основном 50–70 лет, и встречается данное заболевание у каждого 2–5 человека из 100 тысяч. Средняя продолжительность жизни у такого больного не превышает 4 лет.
Основные формы болезни
Для болезни двигательного нейрона характерно 4 основные формы, в том числе:
- Боковой амиотрофический склероз (БАС).
- Прогрессирующий бульбарный паралич.
- Мышечная прогрессирующая атрофия.

- Первичный боковой склероз.
Боковой склероз
Поражения центрального двигательного нейрона вызывает возникновение данного типа болезни. БАС представляет собой хроническое заболевание, которое вызывает смерть больного, как правило, в результате отказа дыхательной системы. БАС является наиболее распространенным видом болезни двигательного нейрона. Примерно 80% случаев БДН относят именно к БАС.
Что происходит с нейроном при БАСБульбарный паралич
Данной болезни подвергаются 10–15% людей, страдающих от БДН. Бульбарный паралич характеризуется постепенным параличом мышц ротовой полости, который в конце концов приводит к отказу глотательного рефлекса и летальному итогу.
Мышечная атрофия
Встречается у 5–8% больных БДН. Данное заболевание характеризуется истончением и перерождением мышц человека, в результате чего они атрофируются и утрачивают свои основные функции.
Первичный боковой склероз
Наиболее редкая форма болезни двигательного нейрона, которая составляет 2–3% от общего числа. Болезнь характеризуется затруднением речи, ухудшение двигательных функций организма, вплоть до полного отказа ног и возникновением связанных с этим осложнений.
Болезнь характеризуется затруднением речи, ухудшение двигательных функций организма, вплоть до полного отказа ног и возникновением связанных с этим осложнений.
Помимо вышеперечисленных болезней, происхождение БДН можно связать с такими заболеваниями, как детский церебральный паралич и спастическая параплегия.
В обоих случаях поражению подвержены нижние нейроны, однако, в первом случае причин возникновения может быть несколько, когда во втором основная причина – генетическая мутация.
Отличие больного нейрона от здоровогоСимптомы
Несмотря на различие форм БДН, проявление симптомов лучше рассматривать с точки зрения расположения конечностей человека и некоторых участков человеческого тела. Так, при данном недуге возможны следующие проявления:
Руки – для больного характерны проявления слабости в руках при проведении элементарных действий (нажатие клавиш на компьютере, использование шариковой ручки для письма). Постепенно, подобные процедуры могут стать недоступны для заболевшего.
Ноги – постепенно больной не сможет передвигаться без посторонней помощи.
Проявление чувств – неконтролируемый смех или плач.
Шея и плечевые суставы – мышцы шеи и плеч постепенно ослабевают, что приводит к ухудшению дыхательных функций организма.
Речь, глотательные функции – развиваются проблемы с приемом пищи, так как человек перестает нормально ее глотать также, возможно, ухудшение речи, вплоть до полной потери возможности говорить.
Помимо вышеперечисленных симптомов, больной может испытывать сложности с запоминанием больших объемов информации, причем поражения центрального двигательного нейрона характеризуется постепенным нарастанием симптоматики. К примеру, с каждым днем человеку будет сложней запоминать все меньше и меньше информации. Дополнительно к этому может добавиться невозможность концентрировать внимание и низкую способность к обучению.
Наличие такого симптома, как невозможность вспомнить или подобрать правильное слова при разговоре также может быть связано с БДН.
Причины возникновения заболевания
В настоящее время причины БДН не изучены полностью и результаты исследований, следующие:
в 10% случаев отмечается наследственная связь.
в оставшихся 90% случаев имеет место внешнее воздействие, в том числе:
- накопление в организме больного тяжелых металлов;
- преклонный возраст;
- сильнейшее психоэмоциональное напряжение;
- чрезмерные спортивные нагрузки;
- травмы.
Кроме того, в качестве причины прогрессирования такого заболевания, как синдром поражения двигательного нейрона стоит отметить внутриклеточные процессы. Данные процессы сложны в изучении, так как проходят на уровне клеток и внешне никак себя не проявляют.
К примеру, окружение мононейрона глиальными клетками способствует его дегенерации. Изменение в процессах, связанных с доставкой питательных веществ и продуктов метаболизма также, несут угрозу для нормального функционирования мононейронов.
Диагностика
Для такого сложного заболевания недостаточно обычного опроса врачом, так как некоторые симптомы болезни имеют общую направленность. Поэтому для точной постановки диагноза применяют электронейромиографию.
Данное исследование позволяет диагностировать замедление двигательных процессов у нейронов.
Кроме этого, пациент проходит магнитно-резонансную томографию ()МРТ, необходимую для исключения ряда заболеваний с похожей симптоматикой.
Лечение
Как правило, синдром поражения двигательных нейронов является неизлечимым заболеванием, и все усилия врачей направлены на продление жизни пациенту и устранение симптомов недуга.
Лекарства, которые назначаются больному:
- креатин;
- карнитин;
- рилутек;
- комплекс витаминов.
Основное лекарственное средство – Рилутек. Данный препарат сокращает объем глутамата при передаче нервных импульсов. Его аналогом является иностранное лекарство, недоступное для граждан РФ – Рилузол. По эффективности данное лекарство, несомненно, лучше Рилутека, но принцип действия у лекарств практически одинаков.
По эффективности данное лекарство, несомненно, лучше Рилутека, но принцип действия у лекарств практически одинаков.
К устранению симптоматики БДН относят лечение мышечных спазмов, устранение нарушений в работе ЖКТ, дыхательной системы и т. п.
Так, в качестве профилактики дыхательной системы используют препарат для искусственной вентиляции легких, а при проблемах с глотанием и употреблением пищи – кормление больного происходит с помощью специального зонда.
Прогноз
Так как болезнь двигательного нейрона имеет несколько форм проявления то и продолжительность жизни у той или иной болезни различны.
В некоторых случаях пациент может прожить несколько десятков лет (боковой склероз), а в некоторых, возможно его угасание за несколько месяцев (бульбарный паралич).
В среднем продолжительность жизни людей с диагнозом БДН – от двух до пяти лет при своевременном и интенсивном лечении.
Известные личности с диагнозом БДН
Самые известные люди, в той или иной степени страдающие от БДН заграницей – Стивен Хокинг, а в РФ – Юлия Самойлова.
Стивен Хокинг страдает боковым амиотрофическим склерозом, а болезнь Юлии Самойловой носит название спинальная мышечная амиотрофия (амиотрофия Верднига —Гофмана).
Итак, БДН серьезное и смертельно опасное заболевание от которого, не застрахован никто, и по этой причине крайне важно прислушиваться к сигналам, которые посылает вам ваш организм и ни в коем случае не пренебрегать походами к врачу. Берегите себя и своих близких!
Источник: https://nervivporyadke.ru/
5 редких болезней в неврологии
* By submitting the completed data in the registration form, I confirm that I am a healthcare worker of the Russian Federation and give specific, informed and conscious consent to the processing of personal data to the Personal Data Operator Pfizer Innovations LLC (hereinafter referred to as the “Operator”) registered at the address: St. Moscow, Presnenskaya embankment, house 10, 22nd floor.
I grant the Operator the right to carry out the following actions with my personal data, as well as information about my hobbies and interests (including by analyzing my profiles on social networks): collecting, recording, systematizing, accumulating, storing, updating (updating, changing) , extraction, use, transfer (access, provision), deletion and destruction, by automated and (or) partially automated (mixed) processing of personal data.
Consent is granted with the right to transfer personal data to affiliated persons of Pfizer Innovations LLC, including Pfizer LLC (Moscow, Presnenskaya naberezhnaya, 10, 22nd floor), and with the right to order the processing of personal data, incl. h. LLC «Redox» (Moscow, Volgogradskiy prospect, house 42, building 42A, floor 3, room 3) and LLC «Supernova» (Moscow, Varshavskoe shosse, house 132), which processes and stores personal data.
The processing of my personal data is carried out for the purpose of registering on the Operator’s website www.pfizerprofi.ru to provide me with access to information resources of the Pfizer company, as well as to interact with me by providing information through any communication channels, including mail, SMS, e-mail, telephone and other communication channels.
This consent is valid for 10 (ten) years.
I have been informed about the right to receive information regarding the processing of my personal data, in accordance with the Federal Law of July 27, 2006 No. 152-FZ «On Personal Data».
152-FZ «On Personal Data».
This consent can be revoked by me at any time by contacting the address of the Operator-Pfizer Innovations LLC or by phone. 8 495 287 5000.
*Отправляя заполненные данные в регистрационной форме, я подтверждаю, что являюсь работником здравоохранения Российской Федерации и даю конкретное, информированное и сознательное согласие на обработку персональных данных Оператору персональных данных ООО «Пфайзер Инновации» (далее «Оператор»), зарегистрированному по адресу: г. Москва, Пресненская набережная, дом 10, 22 этаж.
Я предоставляю Оператору право осуществлять с моими персональными данными, а также сведениями о моих хобби и увлечениях (в том числе с помощью анализа моих профилей в социальных сетях) следующие действия: сбор, запись, систематизация, накопление, хранение, уточнение (обновление, изменение), извлечение, использование, передача (доступ, предоставление), удаление и уничтожение, путем автоматизированной и (или) частично автоматизированной (смешанной) обработки персональных данных.
Согласие предоставляется с правом передачи персональных данных аффилированным лицам ООО «Пфайзер Инновации», в т. ч. ООО «Пфайзер» (г. Москва, Пресненская набережная, дом 10, 22 этаж), и с правом поручения обработки персональных данных, в т.ч. ООО «Редокс», (г. Москва, Волгоградский проспект, дом 42, корпус 42А, этаж 3, ком. 3) и ООО «Супернова» (г. Москва, Варшавское шоссе, дом 132), осуществляющим обработку и хранение персональных данных.
Обработка моих персональных данных осуществляется с целью регистрации на сайте Оператора www.pfizerprofi.ru для предоставления мне доступа к информационным ресурсам компании Пфайзер, а также для взаимодействия со мной путем предоставления информации через любые каналы коммуникации, включая почту, SMS, электронную почту, телефон и иные каналы коммуникации.
Срок действия данного согласия — 10 (десять)лет.
Я проинформирован (-а) о праве на получение информации, касающейся обработки моих персональных данных, в соответствии с Федеральным законом от 27. 07.2006 г. №152-ФЗ «О персональных данных».
07.2006 г. №152-ФЗ «О персональных данных».
Данное согласие может быть отозвано мною в любой момент посредством обращения по адресу нахождения Оператора-ООО «Пфайзер Инновации» или по тел. 8 495 287 5000.
Дегенеративные заболевания нервной системы
Неврологическое отделение
Дегенеративные заболевания нервной системы Дегенеративные состояния возникают по неустановленным причинам и характеризуются поражением определенных нейрональных систем из-за прогрессирующей гибели нейронов. Патологические изменения распределяются двусторонне и симметрично (но на ранней стадии могут затрагивать одну половину туловища или одну конечность).
Заболевание сопровождается ограничением произвольных движений, появлением тремора, хореи, дистонии, миоклонуса, тиков и других аномальных движений, возможно развитие слабоумия и других когнитивных расстройств.
Причины возникновения заболевания:
Заболевание вызывается изменением генетической информации. Из-за мутации генов нарушается синтез определенного полипептида – характер нарушений определяется ролью в метаболизме этого полипептида (дефицит фермента, деструкция тканей, тезаурисмозы). Дегенеративные заболевания развиваются в течение многих лет и по отношению к терапии устойчивы.
Из-за мутации генов нарушается синтез определенного полипептида – характер нарушений определяется ролью в метаболизме этого полипептида (дефицит фермента, деструкция тканей, тезаурисмозы). Дегенеративные заболевания развиваются в течение многих лет и по отношению к терапии устойчивы.
Виды дегенеративных болезней:
К дегенеративным заболеваниям относится болезнь Альцгеймера, хорея Гентингтона, болезнь Паркинсона, боковой амиотрофический склероз, болезни мотонейрона, ломбальная атрофия Пика. Дегенеративные заболевания нервной системы относятся к широко распространенным – болезнь Паркинсона или Альцгеймера диагностируется у 1 человека из 1000. Причем нейродегенеративные заболевания не являются характерными только для старшей возрастной группы, например дистонические синдромы чаще всего отмечаются в продуктивном возрасте.
Диагностика и лечение дегенеративных болезней:
Проводится диагностика с использованием комплексного диагностического оборудования (лаборатория клинической неврофизиологии, невропсихологическая лаборатория, видеомониторирование).
Кроме того, проводится высокоточная диагностика сложных состояний и редких нарушений и высокоспециализированное амбулаторное лечение. Центры являются мультидисциплинарными, здесь представлен ряд клинических направлений (неврология, нейрофизиология, нейрохирургия, нейропсихология, психиатрия), применяются морфологические методы (невропатология) и методы функциональной диагностики.
Информация для пациентов и их родственников
Правила госпитализации в стационар
Услуги и цены отделения
7 Типы, причины, симптомы и лечение
Когда вы гуляете, разговариваете с другом или жуете пищу, за этими движениями стоят двигательные нейроны.
Как и другие части вашего тела, они могут быть повреждены. Возможно, вы слышали о БАС, широко известном как болезнь Лу Герига. Это один из видов заболевания двигательных нейронов, и есть несколько других, менее известных типов.
Что такое двигательные нейроны?
Это разновидность нервных клеток, и их задача — посылать сообщения по вашему телу, чтобы вы могли двигаться. У вас есть два основных вида:
У вас есть два основных вида:
- Верхние двигательные нейроны находятся в вашем мозгу. Оттуда они отправляют сообщения в ваш спинной мозг.
- Нижние двигательные нейроны находятся в спинном мозге. Они передают сообщения, посылаемые вашим мозгом вашим мышцам.
Поскольку нервные клетки умирают при заболевании двигательных нейронов, электрические сообщения не могут передаваться из мозга в мышцы. Со временем ваши мышцы истощаются. Вы можете услышать, как врач или медсестра называют это «атрофией».”
Когда это происходит, вы теряете контроль над движениями. Становится труднее ходить, говорить, глотать и дышать.
Каждый вид болезни двигательных нейронов поражает разные типы нервных клеток или имеет разные причины. БАС — наиболее распространенное из этих заболеваний у взрослых.
Вот некоторые виды заболеваний двигательных нейронов.
Боковой амиотрофический склероз (БАС)
БАС поражает как верхние, так и нижние двигательные нейроны. При БАС вы постепенно теряете контроль над мышцами, которые помогают вам ходить, говорить, жевать, глотать и дышать.Со временем они ослабевают и исчезают. У вас также может быть скованность и подергивание мышц.
При БАС вы постепенно теряете контроль над мышцами, которые помогают вам ходить, говорить, жевать, глотать и дышать.Со временем они ослабевают и исчезают. У вас также может быть скованность и подергивание мышц.
В большинстве случаев БАС — это то, что врачи называют «спорадическим». Это значит, что получить его может каждый. Только от 5% до 10% случаев в Соединенных Штатах протекает в семьях.
БАС обычно начинается в возрасте от 40 до 60 лет. Большинство людей с этим заболеванием живут от 3 до 5 лет после появления симптомов, но некоторые люди могут жить 10 лет или дольше.
Первичный боковой склероз (PLS)
PLS похож на ALS, но поражает только верхние двигательные нейроны.
Это вызывает слабость и скованность в руках и ногах, замедленную ходьбу, плохую координацию и равновесие. Речь также становится медленной и невнятной.
Как и БАС, он обычно начинается у людей в возрасте от 40 до 60 лет. Мышцы со временем становятся жестче и слабее. Но в отличие от БАС, люди не умирают от него.
Но в отличие от БАС, люди не умирают от него.
Прогрессирующий бульбарный паралич (ПБП)
Это форма БАС. У многих людей с этим заболеванием в конечном итоге разовьется БАС.
PBP повреждает двигательные нейроны в стволе головного мозга, который находится в основании вашего мозга.
В стволе есть двигательные нейроны, которые помогают жевать, глотать и говорить. С PBP вы можете невнятно произносить слова и испытывать проблемы с жеванием и глотанием. Это также мешает контролировать эмоции. Вы можете смеяться или плакать, не желая этого.
Псевдобульбарный паралич
Это похоже на прогрессирующий бульбарный паралич. Он влияет на двигательные нейроны, которые контролируют способность говорить, жевать и глотать. Псевдобульбарный паралич заставляет людей бесконтрольно смеяться или плакать.
Прогрессирующая мышечная атрофия
Эта форма встречается гораздо реже, чем БАС или ПБП.Это может быть наследственным или спорадическим. Прогрессирующая мышечная атрофия в основном поражает нижние двигательные нейроны. Слабость обычно начинается с рук, а затем распространяется на другие части тела. Ваши мышцы слабеют и могут сводиться судороги. Это заболевание может перерасти в БАС.
Слабость обычно начинается с рук, а затем распространяется на другие части тела. Ваши мышцы слабеют и могут сводиться судороги. Это заболевание может перерасти в БАС.
Спинальная мышечная атрофия
Это наследственное заболевание, поражающее нижние двигательные нейроны. Дефект гена SMN1 вызывает мышечную атрофию позвоночника. Этот ген вырабатывает белок, который защищает ваши двигательные нейроны. Без этого они умирают.Это вызывает слабость в верхних конечностях и руках, а также в туловище.
СМА бывает разных типов, в зависимости от того, когда впервые появляются симптомы:
Тип 1 (также называемый болезнью Верднига-Гофмана). Начинается примерно в возрасте 6 месяцев. Дети с этим типом не могут сидеть самостоятельно или держать голову вверх. У них слабый мышечный тонус, плохие рефлексы и проблемы с глотанием и дыханием.
Тип 2. Срок действия — от 6 до 12 месяцев. Дети с этой формой могут сидеть, но они не могут стоять или ходить в одиночку.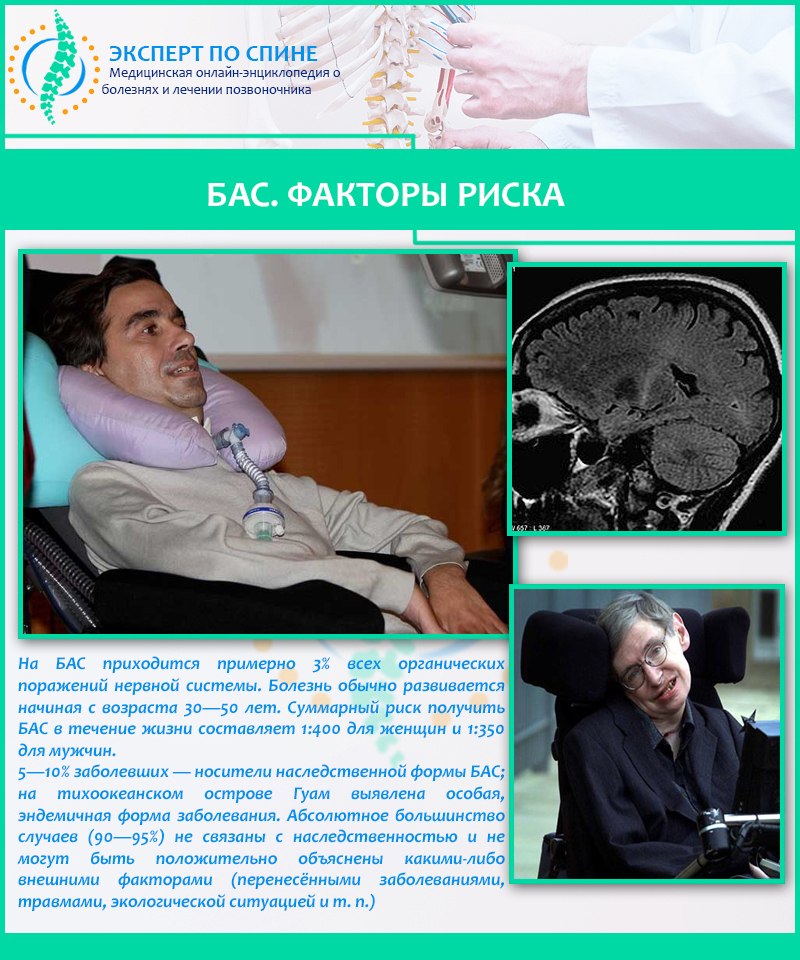 У них также могут быть проблемы с дыханием.
У них также могут быть проблемы с дыханием.
Тип 3 (также называемый болезнью Кугельберга-Веландера). Он начинается в возрасте от 2 до 17 лет. Он влияет на то, как ребенок может ходить, бегать, вставать и подниматься по лестнице. У детей с этим типом также может быть искривленный позвоночник или укороченные мышцы или сухожилия вокруг суставов.
Тип 4. Обычно начинается после 30 лет . Люди с этим типом могут иметь мышечную слабость, дрожь, подергивание или проблемы с дыханием. В основном он поражает мышцы рук и ног.
Болезнь Кеннеди
Она также передается по наследству и поражает только мужчин. Самки могут быть носителями, но не болеют от этого. Женщина с геном болезни Кеннеди имеет 50% шанс передать его сыну.
У мужчин с болезнью Кеннеди трясущиеся руки, мышечные судороги и подергивания, а также слабость в лице, руках и ногах. У них могут быть проблемы с глотанием и речью. У мужчин может быть увеличенная грудь и низкое количество сперматозоидов.
Жизнь с заболеванием двигательных нейронов
Прогноз для каждого типа заболевания двигательных нейронов разный.Некоторые из них более мягкие и прогрессируют медленнее, чем другие.
Хотя нет лекарства от болезней двигательных нейронов, лекарства и терапия могут облегчить симптомы и улучшить качество вашей жизни.
Неврологические расстройства, связанные с поражением нейронной сети: функция и механизм
Структурные и функциональные нейронные сети обеспечивают физиологическую основу для обработки информации и ментальных представлений. Сложные неврологические расстройства характеризуются структурными и функциональными аномалиями в нескольких областях мозга, включая несколько различных систем мозга.Последние достижения в биологии и медицине указывают на изменение связи мозга как на ключевую особенность их патофизиологии. Знание и понимание этого дефицита нейронных сетей привело к разработке моделей на животных, успешных методов лечения и новых инструментов для характеристики этих клинических состояний и обеспечения лучшего ухода за пациентами.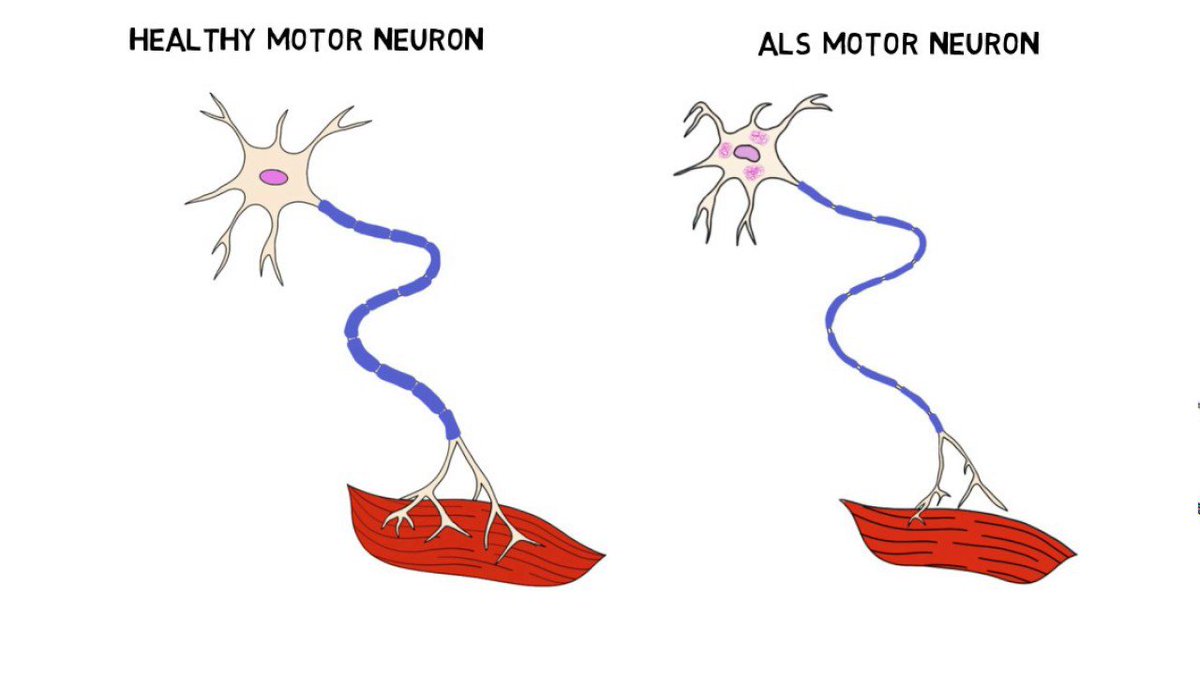 Вдохновленный заметным ростом научных исследований в этих областях, в этом специальном выпуске делается попытка своевременно собрать статьи о неврологических расстройствах, начиная с недавних открытий о различных нарушениях нейронных сетей и связанных с ними сигнальных путей при неврологических расстройствах, и проливает свет на существующие и новые концепции лечения.Отобранные статьи не только предоставляют обзор текущих открытых проблем, но также определяют потенциальные направления дальнейших исследований в области неврологических расстройств, связанных с функциями нейронных сетей.
Вдохновленный заметным ростом научных исследований в этих областях, в этом специальном выпуске делается попытка своевременно собрать статьи о неврологических расстройствах, начиная с недавних открытий о различных нарушениях нейронных сетей и связанных с ними сигнальных путей при неврологических расстройствах, и проливает свет на существующие и новые концепции лечения.Отобранные статьи не только предоставляют обзор текущих открытых проблем, но также определяют потенциальные направления дальнейших исследований в области неврологических расстройств, связанных с функциями нейронных сетей.
Эпилепсия, особенно височная эпилепсия (ВДВ), является распространенным неврологическим заболеванием во всем мире; однако основной механизм все еще неизвестен. TLE является наиболее тяжелым типом эпилепсии и с большой долей вероятности становится неизлечимым приступом в клинике. В текущем выпуске у нас есть три статьи, посвященные исследованию эпилепсии с точки зрения возникновения припадка в нейронной сети и функциональных аномалий после припадка. Работы Ю.-Х. Ли и его коллеги и Ю.-Дж. Ши и его коллеги, используя электрофизиологическую запись и математическое моделирование, изучили взаимосвязь структур мозга при возникновении эпилептиформной активности во время начала припадка. Они предоставляют доказательства того, что в период инициации припадка эпилептиформная активность имеет тенденцию распространяться от таламуса к гиппокампу; Кроме того, энторинальная кора головного мозга является не только структурой, передающей эпилептиформную активность гиппокампу, но и более важной структурой мозга в генерации иктальных разрядов, чем сам гиппокамп, в возникновении эпилептического припадка.Статья С. Конга и др. далее рассматривается роль ГАМКергической тормозной системы в хронической фазе припадка. В статье описывается феномен, заключающийся в том, что после длительного периода молчания о судороге ГАМК-синтетаза, транспортеры ГАМК и рецепторы ГАМК значительно подавляются в гиппокампе, что свидетельствует о том, что снижение ГАМКергической функции напрямую способствует возникновению повторных приступов.
Работы Ю.-Х. Ли и его коллеги и Ю.-Дж. Ши и его коллеги, используя электрофизиологическую запись и математическое моделирование, изучили взаимосвязь структур мозга при возникновении эпилептиформной активности во время начала припадка. Они предоставляют доказательства того, что в период инициации припадка эпилептиформная активность имеет тенденцию распространяться от таламуса к гиппокампу; Кроме того, энторинальная кора головного мозга является не только структурой, передающей эпилептиформную активность гиппокампу, но и более важной структурой мозга в генерации иктальных разрядов, чем сам гиппокамп, в возникновении эпилептического припадка.Статья С. Конга и др. далее рассматривается роль ГАМКергической тормозной системы в хронической фазе припадка. В статье описывается феномен, заключающийся в том, что после длительного периода молчания о судороге ГАМК-синтетаза, транспортеры ГАМК и рецепторы ГАМК значительно подавляются в гиппокампе, что свидетельствует о том, что снижение ГАМКергической функции напрямую способствует возникновению повторных приступов.
Когнитивные способности резко возрастают от младенчества до юношеского возраста, а затем либо сохраняются, либо снижаются в более старшем возрасте.Исследования активности мозга показали, что у здоровых молодых людей развиваются лучшие нейрокогнитивные способности, включая рабочую память и внимание. Оценка рабочей памяти и внимания у пациентов с шизофренией обычно основана на традиционных задачах и суждении интервьюера. Статья W. Song et al., Озаглавленная « Простой тест на пространственную рабочую память и внимание на парных символах, показывает дефицит развития у пациентов с шизофренией ». сообщил о простом тесте пространственной рабочей памяти и внимания на парных символах (SWAPS).Тест SWAPS показал правдоподобную закономерность развития у здоровых людей из контрольной группы, особенно в группе трудностей три и четыре, которая хорошо развивалась в группе 20-летних по сравнению с группой 10-летних, а затем снижалась с возрастом.
В спинном мозге рекуррентная тормозная цепь, образованная клетками Реншоу и мотонейронами, играет важную стробируемую роль в петле движения позвоночника. Было обнаружено, что дисфункция торможения Реншоу является причиной дегенерации двигательных нейронов при различных патологических состояниях.В статье, озаглавленной « Снижение рецидивирующего торможения по Реншоу после раздавливания седалищного нерва у крыс », L. Shu et al. призвана обеспечить взаимосвязь между повреждением периферических нервов и повреждением тормозной цепи спинного мозга, в частности, пути рекуррентного ингибирования Реншоу, в период раннего развития новорожденных, и обсуждает возможность пути рецидивирующего ингибирования Реншоу, являющегося мишенью для терапии нейрорегенерации.
Было обнаружено, что дисфункция торможения Реншоу является причиной дегенерации двигательных нейронов при различных патологических состояниях.В статье, озаглавленной « Снижение рецидивирующего торможения по Реншоу после раздавливания седалищного нерва у крыс », L. Shu et al. призвана обеспечить взаимосвязь между повреждением периферических нервов и повреждением тормозной цепи спинного мозга, в частности, пути рекуррентного ингибирования Реншоу, в период раннего развития новорожденных, и обсуждает возможность пути рецидивирующего ингибирования Реншоу, являющегося мишенью для терапии нейрорегенерации.
После инсульта со временем часто возникает патологическая нейрональная пластичность, называемая постишемической долговременной потенциацией (i-LTP), и новые данные, полученные на животных моделях, предполагают, что такой i-LTP играет важную роль в ишемии.В своей статье « Активная кальций / кальмодулин-зависимая протеинкиназа II (CaMKII) регулирует опосредованную рецептором NMDA постишемическую долгосрочную потенциацию (i-LTP), способствуя взаимодействию между CaMKII и рецепторами NMDA при ишемии, » N. Wang et al. . попытаться изучить механизмы, опосредующие i-LTP после инсульта, особенно в отношении активности CaMKII и усиления постсинаптических потенциалов, опосредованных рецептором NMDA.
Wang et al. . попытаться изучить механизмы, опосредующие i-LTP после инсульта, особенно в отношении активности CaMKII и усиления постсинаптических потенциалов, опосредованных рецептором NMDA.
Статья под названием « Повышенная экспрессия субъединиц NR2B рецепторов NMDA в унаследованной глаукомной сетчатке мыши DBA / 2J, », автор L.-D. Донг и др. Основываясь на их наблюдении за взаимосвязью между повышенной экспрессией субъединицы рецептора NMDA NR2B и дегенерацией ганглиозных клеток сетчатки у мышей DBA / 2J, модель спонтанной вторичной глаукомы предположила, что прогрессирующее повышение внутриглазного давления, вызванное увеличением экспрессии NR2B, может быть связано с сетчаткой дегенерация ганглиозных клеток.
Витамин B12 обычно рассматривался как спортивное питание, которое в прошлые годы использовалось для предотвращения анемии у пожилых людей.Недавние исследования показали, что витамин B12 играет ключевую роль в нормальном функционировании мозга, нервной системы и кроветворении. В своей статье, озаглавленной «Метилкобаламин : потенциальный витамин , снимающий боль», M. Zhang et al. обобщены недавние открытия об анальгетических эффектах и механизмах действия метилкобаламина, активированной формы витамина B12, при клинической боли в пояснице, шее и у пациентов с диабетической невропатической болью.
В своей статье, озаглавленной «Метилкобаламин : потенциальный витамин , снимающий боль», M. Zhang et al. обобщены недавние открытия об анальгетических эффектах и механизмах действия метилкобаламина, активированной формы витамина B12, при клинической боли в пояснице, шее и у пациентов с диабетической невропатической болью.
Детские эмоциональные травмы в значительной степени способствуют возникновению определенных психопатологий, таких как посттравматическое стрессовое расстройство (ПТСР).Статья под названием « Влияние стресса хищников в раннем возрасте на тревожное и депрессивное поведение взрослых крыс, » предоставлена L.-J. Чен и др. Исследовали взаимосвязь между стрессом хищников в раннем возрасте и поведением, похожим на тревогу или депрессию, во взрослом возрасте. Они показали, что как у крыс Wistar, так и у крыс WKY с генетической депрессией стресс хищника в раннем возрасте не усиливал тревожное или депрессивное поведение во взрослом возрасте. Они предполагают, что стресс хищников в раннем возрасте, по крайней мере у крыс, не вызывает посттравматического стресса.
В выбранных статьях отражены некоторые актуальные вопросы исследований в области сигнальных путей и сетевых функций, связанных с неврологическими расстройствами, и они помогают расширить наше понимание механизмов заболевания. Редакция надеется, что этот выпуск послужит иллюстрацией и поможет будущим исследователям в этой теме.
Благодарности
Редакция выражает искреннюю признательность всем тем, кто так или иначе помогал в этом проекте. Особая благодарность нашим анонимным рецензентам за их профессиональные и своевременные обзоры.Редакция выражает благодарность всем авторам за научный вклад в этот тематический выпуск.
Sheng-tian Li
Yun Wang
Masayuki Matsushita
Авторские права
Авторские права © 2014 Sheng-tian Li et al. Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Цероидный липофусциноз нейронов взрослых — NORD (Национальная организация по редким заболеваниям)
СТАТЬИ В ЖУРНАЛЕ
Mole SE, Anderson G, Band HA, et al.Клинические проблемы и будущие терапевтические подходы к нейрональному цероидному липофусцинозу. Lancet Neurol 2018; 18: 107–16. https://www.thelancet.com/journals/laneur/article/PIIS1474-4422(18)30368-5/fulltext
Geraets RD, Koh S, Hastings ML, et al. Переход к эффективным терапевтическим стратегиям нейронального цероидного липофусциноза. Orphanet J Rare Dis. 2016; 11:40. https://ojrd.biomedcentral.com/articles/10.1186/s13023-016-0414
Беркович С.Ф., Старополи Дж. Ф., Карпентер С. и др. Диагностика и неправильный диагноз нейронального цероидного липофусциноза взрослых (болезнь Куфса).Неврология. 2016; 87: 579-584. https://www.ncbi.nlm.nih.gov/pubmed/27412140
Di Fabio R, Colonnese C, Santorelli FM, Pestillo L, Pierelli F. Визуализация мозга при болезни Куфса типа B: отчеты о случаях. BMC Neurol. 2015; 15: 102. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4491254/
2015; 15: 102. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4491254/
Mink JW, Augustine EF, Adams HR, Marshall FJ, Kwon JM. Классификация и естественное течение нейрональных цероидных липофускинозов. J Child Neurol. 2013; 28: 1101-1105. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3979348/
Smith KR, Dahl HH, Canafoglia L, et al.Мутации катепсина F вызывают болезнь Куфа типа B, нейрональный цероидный липофусциноз с началом у взрослых. Hum Mol Genet. 2013; 22: 1417-1423. https://www.ncbi.nlm.nih.gov/pubmed/23297359
Cotman SL, Karaa A, Staropoli JF, Sims KB. Цероидный липофусциноз нейронов: влияние последних генетических достижений и расширение клинико-патологического спектра. Curr Neurol Neurosci Rep.2013; 13: 366. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3774306/
Arsov T, Smith KR, Damiano J, et al. Болезнь Куфа, основная форма взрослого нейронального цероид липофусциноза, вызываемая мутациями в CLN6.Am J Hum Genet. 2011; 88: 566-573. https://www. ncbi.nlm.nih.gov/pmc/articles/PMC3146726/
ncbi.nlm.nih.gov/pmc/articles/PMC3146726/
ИНТЕРНЕТ
Mole SE, Williams RE. Нейрональные цероид-липофусцинозы. 10 октября 2001 г. [Обновлено 1 августа 2013 г.]. В: Pagon RA, Bird TD, Dolan CR и др., GeneReviews. Интернет. Сиэтл, Вашингтон: Вашингтонский университет, Сиэтл; 1993-. Доступно по адресу: https://www.ncbi.nlm.nih.gov/books/NBK1428/ По состоянию на 18 декабря 2019 г.
Kohlschutter A. Липофусциноз нейронов нейронов взрослых. Энциклопедия Orphanet, февраль 2010 г.Доступно по адресу: https://www.orpha.net/consor/cgi-bin/OC_Exp.php?lng=EN&Expert=79262 По состоянию на 18 декабря 2019 г.
Болезнь CLN4. Домашний справочник по генетике. Проверено: январь 2017 г. Доступно по адресу: https://ghr.nlm.nih.gov/condition/cln4-disease# Проверено 18 декабря 2019 г.
Липофусциноз нейронов нейронов взрослых. Информационный центр по генетическим и редким заболеваниям (GARD). Последнее обновление: 31.08.2015. Доступно по адресу:
https://rarediseases.info. nih.gov/diseases/10973/adult-neuronal-ceroid-lipofuscinosis По состоянию на 18 декабря 2019 г.
nih.gov/diseases/10973/adult-neuronal-ceroid-lipofuscinosis По состоянию на 18 декабря 2019 г.
МакКусик В.А., изд. Интернет-Менделирующее наследование в человеке (OMIM). Балтимор. MD: Университет Джона Хопкинса; Запись №: 204300; Последнее обновление: 20.02.2019. Доступно по адресу: https://omim.org/entry/204300 По состоянию на 18 декабря 2019 г.
McKusick VA., Ed. Интернет-Менделирующее наследование в человеке (OMIM). Балтимор. MD: Университет Джона Хопкинса; Запись №: 162350; Последнее обновление: 02.05.2017. Доступно по адресу: https://omim.org/entry/162350 По состоянию на 18 декабря 2019 г.
Распад нейронной сети: общие пути, связывающие нейродегенеративные заболевания
Поведенческие фенотипы при нейродегенерации
Поведенческие изменения были связаны с рядом клинико-патологических диагнозов , но наиболее характерны для bvFTD, что отражено в текущих диагностических критериях.Пациенты с bvFTD обычно проявляют изменения в поведении, начиная от апатии — со сниженной мотивацией, инерцией и отсутствием интереса к предыдущим увлечениям — до растормаживания, проявляющегося в импульсивных и часто социально неприемлемых действиях, таких как чрезмерные траты, азартные игры или сексуально неприемлемые замечания. Воспитатели также часто сообщают о психической ригидности и стереотипном поведении, что ведет к изменению пищевых предпочтений и пищевого поведения. Подобные выраженные поведенческие симптомы были зарегистрированы при других нейродегенеративных расстройствах, включая БАС и ряд синдромов паркинсонизма плюс, которые в значительной степени совпадают с ЛТД.2 У пациентов с БАС могут развиваться заметные поведенческие особенности, включая апатию, потерю сочувствия, эмоциональную лабильность и, реже, обжорство, поведенческие стереотипы и компульсии. У пациентов с БАС могут иногда развиваться нейропсихиатрические и поведенческие симптомы до появления классических моторных симптомов.10 В ряде синдромов паркинсонизма плюс, таких как PSP и CBS, появляется все больше данных о заметных поведенческих изменениях, включая апатию, 11, 12 нарушения социальная активность, 12 и нарушение эмоционального самовыражения.13 Недавно было высказано предположение, что поведенческие изменения могут присутствовать почти у 30% пациентов с PSP.
Воспитатели также часто сообщают о психической ригидности и стереотипном поведении, что ведет к изменению пищевых предпочтений и пищевого поведения. Подобные выраженные поведенческие симптомы были зарегистрированы при других нейродегенеративных расстройствах, включая БАС и ряд синдромов паркинсонизма плюс, которые в значительной степени совпадают с ЛТД.2 У пациентов с БАС могут развиваться заметные поведенческие особенности, включая апатию, потерю сочувствия, эмоциональную лабильность и, реже, обжорство, поведенческие стереотипы и компульсии. У пациентов с БАС могут иногда развиваться нейропсихиатрические и поведенческие симптомы до появления классических моторных симптомов.10 В ряде синдромов паркинсонизма плюс, таких как PSP и CBS, появляется все больше данных о заметных поведенческих изменениях, включая апатию, 11, 12 нарушения социальная активность, 12 и нарушение эмоционального самовыражения.13 Недавно было высказано предположение, что поведенческие изменения могут присутствовать почти у 30% пациентов с PSP. 3 Пациенты с CBS и языковыми вариантами FTD (семантическая деменция) также испытывают трудности с поведением и обработкой эмоций.14 Учитывая клиническое совпадение Наблюдаемые в поведении и обработке эмоций при этих расстройствах, вполне вероятно, что общие черты существуют в нарушении или дисфункции сетей, контролирующих это фенотипическое поведение.
3 Пациенты с CBS и языковыми вариантами FTD (семантическая деменция) также испытывают трудности с поведением и обработкой эмоций.14 Учитывая клиническое совпадение Наблюдаемые в поведении и обработке эмоций при этих расстройствах, вполне вероятно, что общие черты существуют в нарушении или дисфункции сетей, контролирующих это фенотипическое поведение.
Нейронные сети и поведение
Последнее десятилетие стало свидетелем всплеска свидетельств, указывающих на дисфункцию в крупномасштабных нейронных сетях; они относятся к исследованиям МРТ (фМРТ), ЭЭГ и МЭГ в состоянии покоя и внутренней связности, которые коррелируют с клиническими проявлениями аномального поведения при нейродегенеративных заболеваниях.Три основные сети были связаны с аберрантным поведением при нейродегенеративных заболеваниях — сеть значимости (SN), сеть режима по умолчанию (DMN) и сеть исполнительного контроля (ECN).
SN центрируется на дорсальной передней поясной коре (dACC) и лобно-островковой коре с обширными связями как с кортикальными, так и с подкорковыми областями, включая верхний височный полюс, дорсолатеральную префронтальную кору, миндалину, таламус, гипоталамус и черную субстанцию. / вентральная тегментальная область.15 С точки зрения поведения ЧС участвует в обнаружении, анализе и интеграции эмоционально значимых стимулов по отношению к внутренней среде.15 Внутри сети передняя островковая часть участвует в обнаружении заметности, тогда как передняя поясная извилина функционирует как модулятор поведение. Передняя островковая часть вместе с расширенной SN и входом от задней островковой доли интегрирует внутренние сенсорные стимулы для создания социально приемлемого поведения, например, ношение подходящей по сезону одежды.Островок не только активируется во время внутренних сенсорных стимулов, он также демонстрирует активацию внешних эмоционально значимых стимулов, таких как любовь, сострадание, сочувствие, отвращение, гнев и счастье.16
/ вентральная тегментальная область.15 С точки зрения поведения ЧС участвует в обнаружении, анализе и интеграции эмоционально значимых стимулов по отношению к внутренней среде.15 Внутри сети передняя островковая часть участвует в обнаружении заметности, тогда как передняя поясная извилина функционирует как модулятор поведение. Передняя островковая часть вместе с расширенной SN и входом от задней островковой доли интегрирует внутренние сенсорные стимулы для создания социально приемлемого поведения, например, ношение подходящей по сезону одежды.Островок не только активируется во время внутренних сенсорных стимулов, он также демонстрирует активацию внешних эмоционально значимых стимулов, таких как любовь, сострадание, сочувствие, отвращение, гнев и счастье.16
Хотя SN имеет решающее значение для самосознания, самосознания контроль и регулирование эмоций, он также оказывает модулирующее влияние на DMN — еще одну крупномасштабную сеть, участвующую в поведении и познании (включая автобиографическую память, поиск и теорию разума) и внутренне связанную с ECN. 17 DMN включает сеть областей мозга с центральными регионами задней поясной коры (PCC), латеральной теменной корой и медиальной префронтальной корой (mPFC), а также заметными соединениями с узлами в медиальной височной доле (MTL) и угловой извилине. DMN взаимно деактивируется во время задач, требующих внимания, которые активируют SN. Напротив, ряд специфических когнитивных функций, не управляемых стимулами, активируют DMN; автобиографическая память и эпизодическая память связаны с активацией узлов в PCC, в то время как теория разума и моральное рассуждение связаны с активацией определенных узлов в mPFC.18, 19 Взаимодействие активации DMN и SN в моральных рассуждениях иллюстрирует роль переднего островка в модуляции поведения путем переключения между крупномасштабными сетями.20 Как уже упоминалось, DMN активируется у здоровых участников во время задач морального рассуждения; тем не менее, во время выполнения этих задач существует также направленная функциональная связь с узлами в пределах SN.
17 DMN включает сеть областей мозга с центральными регионами задней поясной коры (PCC), латеральной теменной корой и медиальной префронтальной корой (mPFC), а также заметными соединениями с узлами в медиальной височной доле (MTL) и угловой извилине. DMN взаимно деактивируется во время задач, требующих внимания, которые активируют SN. Напротив, ряд специфических когнитивных функций, не управляемых стимулами, активируют DMN; автобиографическая память и эпизодическая память связаны с активацией узлов в PCC, в то время как теория разума и моральное рассуждение связаны с активацией определенных узлов в mPFC.18, 19 Взаимодействие активации DMN и SN в моральных рассуждениях иллюстрирует роль переднего островка в модуляции поведения путем переключения между крупномасштабными сетями.20 Как уже упоминалось, DMN активируется у здоровых участников во время задач морального рассуждения; тем не менее, во время выполнения этих задач существует также направленная функциональная связь с узлами в пределах SN. Эта функциональная связь между DMN и SN снижается, когда пациенты с FTD проявляют слабое моральное мышление.21 Наконец, ECN связывает дорсолатеральные лобные и теменные неокортексы, а также дорсальный хвостовой и передний островок, и в первую очередь участвует в манипулировании и сохранении информации. в рабочей памяти, устойчивом внимании, выборе реакции на целенаправленное поведение и торможение.15, 22 В зависимости от задачи ECN и DMN показывают антагонистические ответы. Например, когда участник вовлечен в задачу, требующую внимания, в которой нет необходимости в самореференциальной и эпизодической памяти, тогда задействуется ECN, а DMN отключается, 23 изменения в сети, которым способствует SN и, в частности, передний островок.
Эта функциональная связь между DMN и SN снижается, когда пациенты с FTD проявляют слабое моральное мышление.21 Наконец, ECN связывает дорсолатеральные лобные и теменные неокортексы, а также дорсальный хвостовой и передний островок, и в первую очередь участвует в манипулировании и сохранении информации. в рабочей памяти, устойчивом внимании, выборе реакции на целенаправленное поведение и торможение.15, 22 В зависимости от задачи ECN и DMN показывают антагонистические ответы. Например, когда участник вовлечен в задачу, требующую внимания, в которой нет необходимости в самореференциальной и эпизодической памяти, тогда задействуется ECN, а DMN отключается, 23 изменения в сети, которым способствует SN и, в частности, передний островок.
Общие нейронные сети для поведенческого фенотипа при нейродегенерации
Как упоминалось ранее, многие аномальные поведения (включая апатию и плохое социальное взаимодействие) распространены среди множества нейродегенеративных состояний (включая БАС, ЛТД, ПСП, КБД и БА). Хотя эти состояния демонстрируют множество клинических фенотипов с отличительными нейроанатомическими, нейровизуализационными и генетическими признаками, их общие поведенческие дефициты могут быть объяснены с точки зрения нарушения сети.
Хотя эти состояния демонстрируют множество клинических фенотипов с отличительными нейроанатомическими, нейровизуализационными и генетическими признаками, их общие поведенческие дефициты могут быть объяснены с точки зрения нарушения сети.
Существует все больше свидетельств участия SN в ЛВД, особенно в отношении bvFTD.24 Эти результаты сходятся с результатами исследований структурной визуализации, которые демонстрируют атрофию ключевых областей SN, включая переднюю часть поясной извилины, островок и подкорковые структуры ( включая миндалевидное тело, полосатое тело и таламус), все области, которые участвуют в сложной социальной и эмоциональной обработке.25 Более того, сниженная связь с SN коррелирует с тяжестью заболевания.26, 27 Учитывая роль SN и, в частности, передней поясной извилины с точки зрения модуляции поведения, неудивительно, что пациенты с аномалиями в этой сети, и особенно пациенты с FTD , демонстрируют глубокое расторможенное поведение с потерей социальной грации и сниженным сочувствием. Напротив, исследования возможности соединения DMN в FTD показали противоречивые результаты, которые, возможно, можно согласовать в свете нисходящего влияния SN на DMN, как обсуждалось выше.8 Теория дефицита разума неразрывно связана с автобиографической памятью и перспективами через связь в mPFC DMN у здоровых участников 28. Недостатки в «теории разума (ToM)» часто бывают глубокими при FTD; эти пациенты неспособны представить мысли и переживания других и часто не сочувствуют вопросам, которые их не касаются, что, в свою очередь, может вызвать конфликт в личных отношениях.29, 30 Дефицит ToM также был выявлен у пациентов с ALS и PSP, таким образом подтверждая гипотезу о слиянии этих состояний в терминах аномалий в DMN.31, 32 При БА DMN постоянно демонстрирует пониженную связность, и это снова соответствует паттернам атрофии при БА и, как было показано, предсказывает тяжесть и прогрессирование заболевания.33, 34 Точно так же относительное сохранение или усиление активации SN параллельно с сохранение манер и социального приличия до поздней стадии AD, но было показано, что это связано с аберрантным двигательным поведением, тревогой и раздражительностью.
Напротив, исследования возможности соединения DMN в FTD показали противоречивые результаты, которые, возможно, можно согласовать в свете нисходящего влияния SN на DMN, как обсуждалось выше.8 Теория дефицита разума неразрывно связана с автобиографической памятью и перспективами через связь в mPFC DMN у здоровых участников 28. Недостатки в «теории разума (ToM)» часто бывают глубокими при FTD; эти пациенты неспособны представить мысли и переживания других и часто не сочувствуют вопросам, которые их не касаются, что, в свою очередь, может вызвать конфликт в личных отношениях.29, 30 Дефицит ToM также был выявлен у пациентов с ALS и PSP, таким образом подтверждая гипотезу о слиянии этих состояний в терминах аномалий в DMN.31, 32 При БА DMN постоянно демонстрирует пониженную связность, и это снова соответствует паттернам атрофии при БА и, как было показано, предсказывает тяжесть и прогрессирование заболевания.33, 34 Точно так же относительное сохранение или усиление активации SN параллельно с сохранение манер и социального приличия до поздней стадии AD, но было показано, что это связано с аберрантным двигательным поведением, тревогой и раздражительностью. 35
35
Для сравнения, пациенты с ALS показали противоречивые результаты с точки зрения подключения к сети.24, 36, 37 Возникает ряд теорий о разрешении конфликта между исследованиями. Первая повышенная связность может возникать при БАС из-за потери коркового торможения и согласуется с выводами одного исследования, которое обнаружило более высокую скорость прогрессирования заболевания у лиц с наиболее функциональной связностью; 38, 39 второе, что усиление функционального набора может возникают в одной области, чтобы компенсировать потерю функции в другой, компенсаторный механизм, который действует рано и может быть утерян по мере распада сети и увеличения когнитивных дефицитов.40 Наконец, неоднородность фенотипа БАС, особенно с точки зрения когнитивных и поведенческих особенностей, может влиять и находиться под влиянием паттерна сетевой дегенерации.
Дальнейшее понимание может быть получено путем изучения сложных взаимодействий внутри и между крупномасштабными нейронными сетями в PSP и CBS, которые демонстрируют перекрывающиеся поведенческие аномалии и структурные изменения с FTD. Теория сетевой дегенерации была подтверждена в CBS, 41 но до сих пор не существует опубликованных данных о природе внутренних аномалий связности при этих расстройствах в связи с изменениями поведения.
Теория сетевой дегенерации была подтверждена в CBS, 41 но до сих пор не существует опубликованных данных о природе внутренних аномалий связности при этих расстройствах в связи с изменениями поведения.
Когнитивный фенотип при нейродегенерации
Эпизодическая дисфункция памяти представляет собой отличительную черту БА, поскольку пациенты обычно испытывают трудности с кодированием и воспроизведением недавно пережитых событий. Независимо от области тестирования, пациенты с БА демонстрируют значительные нарушения в стандартных нейропсихологических тестах визуального и вербального воспоминания, а также серьезные нарушения при извлечении лично актуальных автобиографических воспоминаний из своего прошлого и адаптивных форм памяти, таких как предполагаемая память.MTL представляет собой одно из самых ранних участков патологии при AD, что приводит к распространенному предположению, что эпизодическое ухудшение памяти отражает дисфункцию MTL.42 Очевидно, однако, что области за пределами MTL, такие как PCC / ретроспленальная кора, также играют роль критическая роль в происхождении дисфункции памяти при AD. 43 Утверждалось, что нарушение функциональной связи между гиппокампом и задними теменными областями представляет собой ключевой модулятор эпизодического нарушения памяти при AD.44
43 Утверждалось, что нарушение функциональной связи между гиппокампом и задними теменными областями представляет собой ключевой модулятор эпизодического нарушения памяти при AD.44
В то время как дисфункция памяти рассматривается как фенотип. В связи с особенностями БА, все больше данных указывает на значительные эпизодические нарушения памяти при других нейродегенеративных расстройствах, таким образом предполагая, что диагностическая ценность традиционных задач нейропсихологической памяти может быть более ограниченной.Например, серьезная амнезиальная презентация остается критерием исключения для диагностики bvFTD; тем не менее, ряд исследований сходятся, чтобы выявить поразительные нарушения памяти, эквивалентные подобным случаям AD.18 Эти нарушения возникают независимо от области тестирования стандартизированных тестов для вербальных и визуальных, немедленных и отсроченных тестов, воспоминаний, автобиографической памяти45 и перспективной памяти .46 Дальнейшие нарушения очевидны для исходной памяти, когда случаи bvFTD не могут правильно восстановить пространственный или временной контекст ранее представленных элементов. 47 Учитывая, что локус атрофии при FTD обычно поражает лобно-островную кору, изначально предполагалось, что эпизодические проблемы с памятью при bvFTD отражают префронтальную корковую дегенерацию. Недавние исследования недвусмысленно указывают на участие MTL, в частности гиппокампа, в возникновении эпизодических дефицитов памяти при bvFTD.43, 48 Соответственно, очевидно, что существует значительное перекрытие в нейронных цепях, опосредующих эпизодические дефициты памяти при bvFTD и AD, с гиппокампом. представляя критически важную связь в этой системе.
47 Учитывая, что локус атрофии при FTD обычно поражает лобно-островную кору, изначально предполагалось, что эпизодические проблемы с памятью при bvFTD отражают префронтальную корковую дегенерацию. Недавние исследования недвусмысленно указывают на участие MTL, в частности гиппокампа, в возникновении эпизодических дефицитов памяти при bvFTD.43, 48 Соответственно, очевидно, что существует значительное перекрытие в нейронных цепях, опосредующих эпизодические дефициты памяти при bvFTD и AD, с гиппокампом. представляя критически важную связь в этой системе.
Общие нейронные сети для когнитивного фенотипа при нейродегенерации
Появление сложных методов нейровизуализации помогло прояснить сложность нейронной схемы, которая поддерживает эпизодическую память у людей, подтвердив, что участие распределенной сети корковых областей, демонстрирующих сильные связи с MTL важен для восстановления эпизодической памяти.49 Ключевые области коры в этой сети включают лобные области, такие как медиальная префронтальная кора, а также задние теменные структуры, включая ретроспленальную / PCC и угловую извилину. 50 Гиппокамп кажется особенно подходящим для поддержки эпизодического восстановления памяти, учитывая его плотные выступы с префронтальными51 и срединными задними кортикальными структурами.44 Кроме того, подкорковые структуры, такие как таламус и свод, все чаще признаются за их роль в поддержке эпизодического восстановления. еще больше подчеркивая сложность этой системы. Повреждение любого узла этой крупномасштабной сети или изменения в функциональной связности в нем приведут к снижению производительности памяти, что очевидно в крупномасштабной сетевой дисфункции, наблюдаемой при деменции.18
50 Гиппокамп кажется особенно подходящим для поддержки эпизодического восстановления памяти, учитывая его плотные выступы с префронтальными51 и срединными задними кортикальными структурами.44 Кроме того, подкорковые структуры, такие как таламус и свод, все чаще признаются за их роль в поддержке эпизодического восстановления. еще больше подчеркивая сложность этой системы. Повреждение любого узла этой крупномасштабной сети или изменения в функциональной связности в нем приведут к снижению производительности памяти, что очевидно в крупномасштабной сетевой дисфункции, наблюдаемой при деменции.18
Первичный моторный / экстрапирамидный фенотип и когнитивные способности при нейродегенерации
Архетипический синдром перекрытия между потерей первичной моторной функции и когнитивной функцией — это синдром ЛТД и БАС. Симптомы когнитивной дисфункции и ЛТД могут возникать при БАС, а у пациентов с ЛВД могут развиться слабость конечностей и дисфункция бульбара. Также растет понимание того, что в клиническом фенотипировании встречаются экстрапирамидные симптомы, включая паркинсонизм, брадикинезию, ригидность и аномалии походки, а также когнитивные изменения в рамках синдромов паркинсонизм плюс; Другими словами, часто бывает трудно отделить диагноз ЛВД (поведенческие и языковые варианты) от CBS и PSP. Пациенты часто могут иметь любое из этих двигательных расстройств и у них могут развиваться когнитивные симптомы, чаще всего в виде изменения поведения. Представление может быть связано с когнитивным дефицитом, а также включать другие области, 4 включая афазию, апраксию речи, апраксию конечностей 52 и зрительно-конструктивный дефицит.4 Еще больше усложняет проблему то, что пациенты с различными генетическими причинами ЛТД, включая расширение C9orf72 , Мутации тау-белка, ассоциированного с микротрубочками (MAPT) и програнулина (GRN), могут развить признаки паркинсонизма, при этом мутации как MAPT, так и програнулина, в частности, связаны с CBS и PSP.
Пациенты часто могут иметь любое из этих двигательных расстройств и у них могут развиваться когнитивные симптомы, чаще всего в виде изменения поведения. Представление может быть связано с когнитивным дефицитом, а также включать другие области, 4 включая афазию, апраксию речи, апраксию конечностей 52 и зрительно-конструктивный дефицит.4 Еще больше усложняет проблему то, что пациенты с различными генетическими причинами ЛТД, включая расширение C9orf72 , Мутации тау-белка, ассоциированного с микротрубочками (MAPT) и програнулина (GRN), могут развить признаки паркинсонизма, при этом мутации как MAPT, так и програнулина, в частности, связаны с CBS и PSP.
Общие нейронные сети для первичного моторного / экстрапирамидного фенотипа при нейродегенерации
Исследования структурной и функциональной визуализации показали, что сети, вовлеченные в первичный моторный дефицит БАС, функционально и анатомически включают области, связанные с моторной корой.53 При визуализации тензора диффузии было обнаружено, что мозолистое тело постоянно поражается при БАС; гипотеза состоит в том, что он является неотъемлемой частью патологического распространения в головном мозге. 54 Морфометрия на основе вокселей показывает, что атрофия моторной коры возникает в первичных моторных фенотипах как FTD, так и ALS, с дополнительной атрофией также обнаруживается в левой средней и нижней лобных извилинах. , передняя часть верхней лобной извилины, верхняя височная извилина, височные полюса и левый задний таламус, а также немоторные области, которые, как известно, участвуют в чистом bvFTD.55, 56 Этот более широкий паттерн атрофии потенциально объясняет спектр моторных и когнитивных изменений, наблюдаемых при ЛВД и БАС.
54 Морфометрия на основе вокселей показывает, что атрофия моторной коры возникает в первичных моторных фенотипах как FTD, так и ALS, с дополнительной атрофией также обнаруживается в левой средней и нижней лобных извилинах. , передняя часть верхней лобной извилины, верхняя височная извилина, височные полюса и левый задний таламус, а также немоторные области, которые, как известно, участвуют в чистом bvFTD.55, 56 Этот более широкий паттерн атрофии потенциально объясняет спектр моторных и когнитивных изменений, наблюдаемых при ЛВД и БАС.
Экстрапирамидные симптомы, связанные с синдромами паркинсонизма плюс, различаются в зависимости от клинического синдрома. Атрофия при PSP локализуется в среднем мозге, мостах, таламусе и полосатом теле; при CBS происходит двусторонняя атрофия премоторной коры, верхних теменных долей и полосатого тела.57 Было высказано предположение, что участники PSP с экстрапирамидным синдромом имеют более выраженную атрофию ствола мозга и меньшую атрофию коры, чем участники CBS. 58 Исследования, посвященные изучению сетевых связей в PSP, с использованием визуализации тензора диффузии путей белого вещества и функциональной МРТ, обнаружили нарушение сетевых соединений между мозжечком, средним мозгом, таламусом и премоторной корой.59 Было высказано предположение, что PSP связан с нарушением таламокортикальных связей и дентатор-суброталамический тракт.60 Альтернативное исследование предложило участие сети, закрепленной в дорсальном среднем мозге, и со связями, включающими ствол мозга, базальные ганглии, диэнцефальные, мозжечковые и корковые области.61 Такая сеть потенциально могла бы объяснить смешанные моторные, поведенческие и когнитивные особенности, наблюдаемые при PSP. Дальнейшие исследования показали, что дегенерация следов белого вещества различается между PSP, болезнью Паркинсона, мультисистемной атрофией и CBS.62, 63 Исследования перекрытия сетей, ответственных за экстрапирамидные симптомы при PSP, CBD и FTD, были ограничены, но такое перекрытие сетей существует вероятно, учитывая сильное совпадение клинических данных между этими состояниями.
58 Исследования, посвященные изучению сетевых связей в PSP, с использованием визуализации тензора диффузии путей белого вещества и функциональной МРТ, обнаружили нарушение сетевых соединений между мозжечком, средним мозгом, таламусом и премоторной корой.59 Было высказано предположение, что PSP связан с нарушением таламокортикальных связей и дентатор-суброталамический тракт.60 Альтернативное исследование предложило участие сети, закрепленной в дорсальном среднем мозге, и со связями, включающими ствол мозга, базальные ганглии, диэнцефальные, мозжечковые и корковые области.61 Такая сеть потенциально могла бы объяснить смешанные моторные, поведенческие и когнитивные особенности, наблюдаемые при PSP. Дальнейшие исследования показали, что дегенерация следов белого вещества различается между PSP, болезнью Паркинсона, мультисистемной атрофией и CBS.62, 63 Исследования перекрытия сетей, ответственных за экстрапирамидные симптомы при PSP, CBD и FTD, были ограничены, но такое перекрытие сетей существует вероятно, учитывая сильное совпадение клинических данных между этими состояниями. Дальнейшие исследования, включающие структурную и функциональную визуализацию этих нарушений, окажутся плодотворными.
Дальнейшие исследования, включающие структурную и функциональную визуализацию этих нарушений, окажутся плодотворными.
Метаболический фенотип при нейродегенерации
Недавно было высказано предположение, что перекрытие нейродегенеративных заболеваний может выходить за рамки моторных и когнитивных функций и включать более системные функции организма, такие как метаболизм. Инсулинорезистентность и диабет 2 типа, по-видимому, играют важную роль в модуляции нейродегенеративных заболеваний; повышенная частота периферической инсулинорезистентности и диабета выявляется при ряде нейродегенеративных состояний, включая AD, болезнь Паркинсона, болезнь Хантингтона, ALS и FTD.64–68 Как инсулин способствует нейродегенерации, остается неясным, но он может оказывать периферическое и центральное влияние. Предлагаемые механизмы включают стимулирование окислительного стресса, воспаления, сосудистой дисфункции и нарушение нейрогенеза и восстановления нейронов.69 Как правило, резистентность к инсулину и метаболические изменения рассматриваются как последствия ожирения.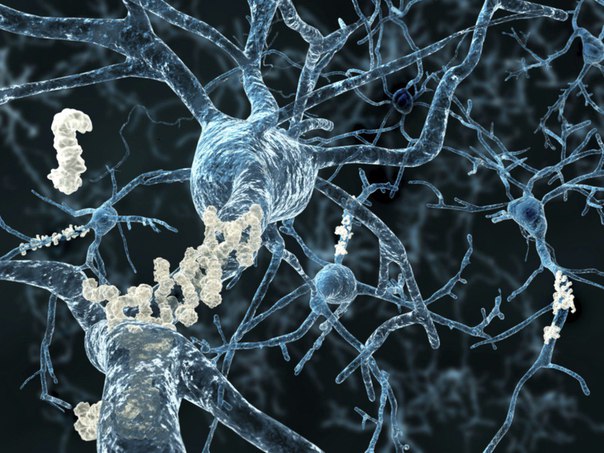 Однако растущее количество данных указывает на то, что несколько нейродегенеративных состояний, в том числе БА, болезнь Хантингтона и БАС, связаны со значительной потерей веса, часто до постановки диагноза 70, подразумевая, что эти метаболические изменения могут быть частью нейродегенеративного процесса, а не следствием ожирения .Кроме того, метаболические изменения могут лежать в основе фенотипических изменений в поведении, таких как bvFTD, когда у пациентов развиваются заметные изменения пищевого поведения с гиперфагией и изменениями в предпочтениях в еде.71 Это может иметь последующее влияние на уровни инсулина и холестерина.
Однако растущее количество данных указывает на то, что несколько нейродегенеративных состояний, в том числе БА, болезнь Хантингтона и БАС, связаны со значительной потерей веса, часто до постановки диагноза 70, подразумевая, что эти метаболические изменения могут быть частью нейродегенеративного процесса, а не следствием ожирения .Кроме того, метаболические изменения могут лежать в основе фенотипических изменений в поведении, таких как bvFTD, когда у пациентов развиваются заметные изменения пищевого поведения с гиперфагией и изменениями в предпочтениях в еде.71 Это может иметь последующее влияние на уровни инсулина и холестерина.
Общие нейронные сети для метаболического фенотипа при нейродегенерации
Появляется все больше доказательств существования сетей, контролирующих пищевое поведение, нейроэндокринного контроля и метаболизма в таких условиях, как bvFTD, 72 с участием сетей вознаграждения, гипоталамуса и изменений нейроэндокринных пептидов.72 На уровне патологии и визуализации другие нейродегенеративные состояния показывают изменения в нейроэндокринной системе, включая ALS73 и болезнь Хантингтона; 68 это состояния, демонстрирующие атрофию гипоталамуса.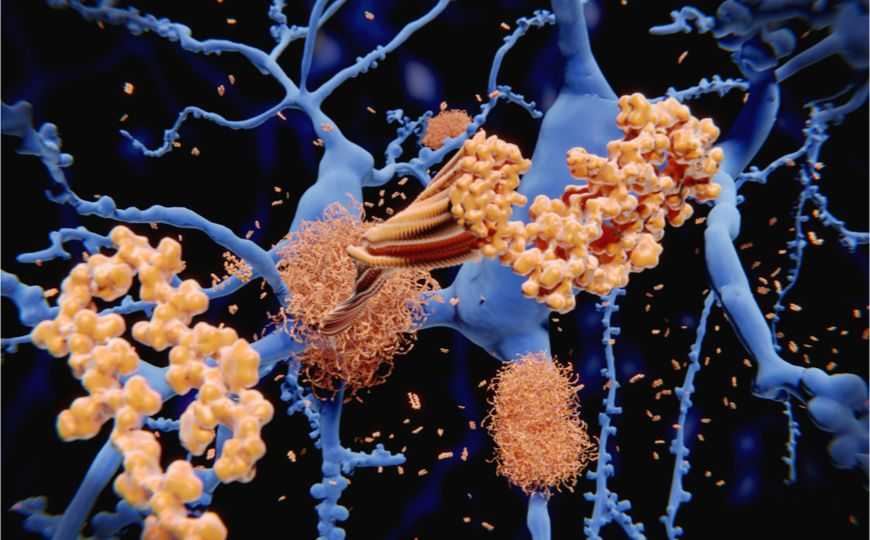 Необходима дальнейшая работа для картирования нейронных сетей в нейродегенерации, которые напрямую влияют на изменение поведения и метаболизм.
Необходима дальнейшая работа для картирования нейронных сетей в нейродегенерации, которые напрямую влияют на изменение поведения и метаболизм.
Заболевания нервной системы | Определение, обследование, патология и типы
История болезни
Старая поговорка в медицине: «Слушайте пациента; он сообщает вам диагноз », — особенно верно в неврологии.Описание симптомов пациентом — ценный инструмент, который позволяет врачу узнать о природе и локализации возможного неврологического заболевания. Изучая историю болезни пациента, невролог отмечает уровень осведомленности пациента, потерю памяти, осанку и походку, манеру поведения и выражения, речь и, в некоторой степени, личность. Невролог также отмечает такие симптомы, как боль, головная боль, потеря чувствительности, слабость, нарушение координации, истощение определенных групп мышц и аномальные движения.
Способность замечать окружающую среду и реагировать на нее — это не временное явление, а континуум. Из состояния полной бдительности человек может перейти через сонливость в ступор, состояние, при котором осознанность сильно снижается, и наилучшим двигательным ответом на стимуляцию является стон или другая голосовая (но не вербальная) реакция. Более глубокие уровни бессознательности проходят через легкую кому, при которой сильная стимуляция вызывает только неуклюжий двигательный ответ, до глубокой комы, в которой есть только рефлекторное движение или нет никакой реакции.Такое угнетение сознания возникает при нарушении функций ствола мозга или коры головного мозга. Заболевания ствола мозга могут вызвать кому, если ствол мозга сдавлен другими частями мозга, опухшими из-за болезни, или если он поражен местной болезнью, такой как энцефалит, инсульт или сотрясение мозга. Заболевания коры головного мозга, вызывающие кому, включают отравление седативными препаратами, недостаток глюкозы или кислорода в крови, кровоизлияние в мозг и некоторые редкие инфильтративные расстройства, при которых снижение уровня сознания происходит в течение недель или месяцев.Кратковременные периоды потери сознания, о которых пациент может не подозревать, возникают при многих формах эпилепсии, нарколепсии, повторяющихся приступах низкого уровня сахара в крови и снижении кровоснабжения мозга, особенно ствола мозга.
Более глубокие уровни бессознательности проходят через легкую кому, при которой сильная стимуляция вызывает только неуклюжий двигательный ответ, до глубокой комы, в которой есть только рефлекторное движение или нет никакой реакции.Такое угнетение сознания возникает при нарушении функций ствола мозга или коры головного мозга. Заболевания ствола мозга могут вызвать кому, если ствол мозга сдавлен другими частями мозга, опухшими из-за болезни, или если он поражен местной болезнью, такой как энцефалит, инсульт или сотрясение мозга. Заболевания коры головного мозга, вызывающие кому, включают отравление седативными препаратами, недостаток глюкозы или кислорода в крови, кровоизлияние в мозг и некоторые редкие инфильтративные расстройства, при которых снижение уровня сознания происходит в течение недель или месяцев.Кратковременные периоды потери сознания, о которых пациент может не подозревать, возникают при многих формах эпилепсии, нарколепсии, повторяющихся приступах низкого уровня сахара в крови и снижении кровоснабжения мозга, особенно ствола мозга.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Головная боль
Когда давление внутри черепа увеличивается, чувствительные к боли структуры в головном мозге и вокруг него искажаются и вызывают боль в плохо локализованной области, но часто идентифицируемой в передней или задней части головы, что называется тракционной головной болью.Тяговые головные боли могут быть вызваны отеком мозга, инфекцией, кровотечением, опухолью, стрессом или затрудненным потоком спинномозговой жидкости. Также боль может ощущаться в области головы, хотя заболевание, вызывающее боль, находится в другом месте; Примером может служить лицевая боль, иногда ощущаемая при недостатке крови к сердцу. Местное заболевание таких структур черепа, как челюстные суставы, придаточные пазухи носа и зубы, среднее ухо и сами кости черепа, также может вызывать боль.
Головные боли напряжения вызваны длительным чрезмерным сокращением мышц, которые проходят по черепу спереди назад; эти головные боли часто вызваны стрессом. Обычно описывается постоянная давящая или тянущая боль, часто с пульсирующей составляющей. Мигрень может возникать одновременно с головной болью напряжения и характеризуется пульсирующей болью с болезненностью кожи головы, тошнотой, рвотой и чувствительностью к шуму и свету.
Обычно описывается постоянная давящая или тянущая боль, часто с пульсирующей составляющей. Мигрень может возникать одновременно с головной болью напряжения и характеризуется пульсирующей болью с болезненностью кожи головы, тошнотой, рвотой и чувствительностью к шуму и свету.
Когнитивные изменения
Плохая концентрация, вызванная озабоченностью, усталостью или депрессией, является наиболее частой причиной потери памяти, но также являются причинами широко распространенных заболеваний мозга, авитаминоза, эпилепсии и деменции (потери умственных способностей).Когда период потери памяти четко определен, основными причинами являются травма головы, судороги, отравление (например, алкоголем) и короткие эпизоды недостаточного кровоснабжения мозга. Нарушение понимания, рассуждения, логического мышления и способности планировать наперед также могут быть симптомами неврологического расстройства.
Языковой и речевой дефицит
Пациенты с афазией могут точно знать, что они хотят сказать, но они не могут выразить свои мысли устными (и часто письменными) словами. Они также могут быть не в состоянии понять значение устной или письменной речи, поэтому нормальная речь звучит как иностранный. Инсульт — наиболее частая причина афазии, но причиной может быть любое очаговое заболевание головного мозга.
Они также могут быть не в состоянии понять значение устной или письменной речи, поэтому нормальная речь звучит как иностранный. Инсульт — наиболее частая причина афазии, но причиной может быть любое очаговое заболевание головного мозга.
Сходными проблемами языка и понимания речи являются апраксия и агнозия. Апраксия — это неспособность выполнять полезные или умелые действия; Пациенты с апраксией могут назвать такой предмет, как гребень или ключ, но они могут не знать, как им пользоваться. Агнозия — это неспособность понять значение неязыкового стимула; больной агнозом может быть не в состоянии распознать источник звука музыкального инструмента.
Дизартрия, или затруднение артикуляции, обычно вызывается аномалией нервов и мышц во рту и вокруг рта или в их соединениях. Проблемы с воспроизведением речевых звуков, называемые дисфонией, часто указывают на проблему, затрагивающую гортань или нервы и мышцы этой структуры. Поскольку черепные нервы, кровоснабжающие эти области, берут начало в стволе мозга, неврологические заболевания этой области также могут быть причиной.
Что такое нейродегенеративные заболевания и как они влияют на мозг? · Границы для молодых умов
Аннотация
Как мозг управляет движением? Какие проблемы возникают при заболевании мозга? Нейродегенеративные расстройства — это заболевания, при которых погибают определенные части мозга.Это, безусловно, одни из самых сложных заболеваний, которые можно вылечить с тяжелыми последствиями. Болезни Паркинсона и Хантингтона относятся к числу наиболее серьезных и распространенных двигательных расстройств. Хотя было найдено много информации о том, как и почему возникают эти заболевания, нейродегенеративные расстройства остаются в высшей степени загадочными и сложными. В этой статье дается более простое объяснение, позволяющее большему количеству людей узнать об этих заболеваниях.
Мозг — чрезвычайно сложный орган с огромным количеством путей, которые позволяют нам делать удивительные вещи, которые мы делаем.Мозг состоит из миллиардов клеток, от которых мы зависим каждую секунду каждого дня для правильного функционирования. Некоторые из наиболее важных клеток головного мозга называются нейронами . Нейроны общаются друг с другом, чтобы выполнять все функции мозга, будь то передвижение, обдумывание тем, изучаемых в школе, общение с друзьями или запоминание списка вещей, которые мы хотим купить в продуктовом магазине. Из-за сложности мозга его расстройства могут возникать из-за очень небольшого недопонимания между клетками.
Некоторые из наиболее важных клеток головного мозга называются нейронами . Нейроны общаются друг с другом, чтобы выполнять все функции мозга, будь то передвижение, обдумывание тем, изучаемых в школе, общение с друзьями или запоминание списка вещей, которые мы хотим купить в продуктовом магазине. Из-за сложности мозга его расстройства могут возникать из-за очень небольшого недопонимания между клетками.
Клетки мозга тесно связаны, и недопонимание в одной области может нарушить другие мозговые действия, а это означает, что расстройства мозга могут привести к широко распространенным проблемам. Хотя существует множество болезней и недомоганий, которые могут повлиять на мозг, самые сложные из этих заболеваний называются нейродегенеративными заболеваниями .
Нейродегенеративные заболевания приводят к гибели нейронов. Слово нейродегенеративный можно разделить на нейро, что означает мозг, и дегенеративный, что означает разрушение или смерть. Нейродегенеративные заболевания — отличный пример разрушительных последствий недопонимания между клетками мозга. Эти заболевания могут влиять на движения, речь, память, интеллект человека и многое другое [1, 2]. Поскольку нейродегенеративные заболевания настолько сложны, причина многих из них остается загадкой.
Нейродегенеративные заболевания — отличный пример разрушительных последствий недопонимания между клетками мозга. Эти заболевания могут влиять на движения, речь, память, интеллект человека и многое другое [1, 2]. Поскольку нейродегенеративные заболевания настолько сложны, причина многих из них остается загадкой.
Есть много хорошо известных типов нейродегенеративных заболеваний, которые возникают в разных областях мозга. Возможно, вы слышали о некоторых из этих болезней. В оставшейся части статьи мы рассмотрим несколько нейродегенеративных заболеваний и их влияние на людей, страдающих от них.
Болезнь Паркинсона
Болезнь Паркинсона — это один из типов нейродегенеративных заболеваний. Когда нейроны умирают в части мозга, называемой черной субстанцией , возникают проблемы с движением (рис. 1). Черная субстанция (лат. «Черное вещество») — это область мозга, которая содержит большое количество нейронов, выделяющих вещество, называемое дофамином.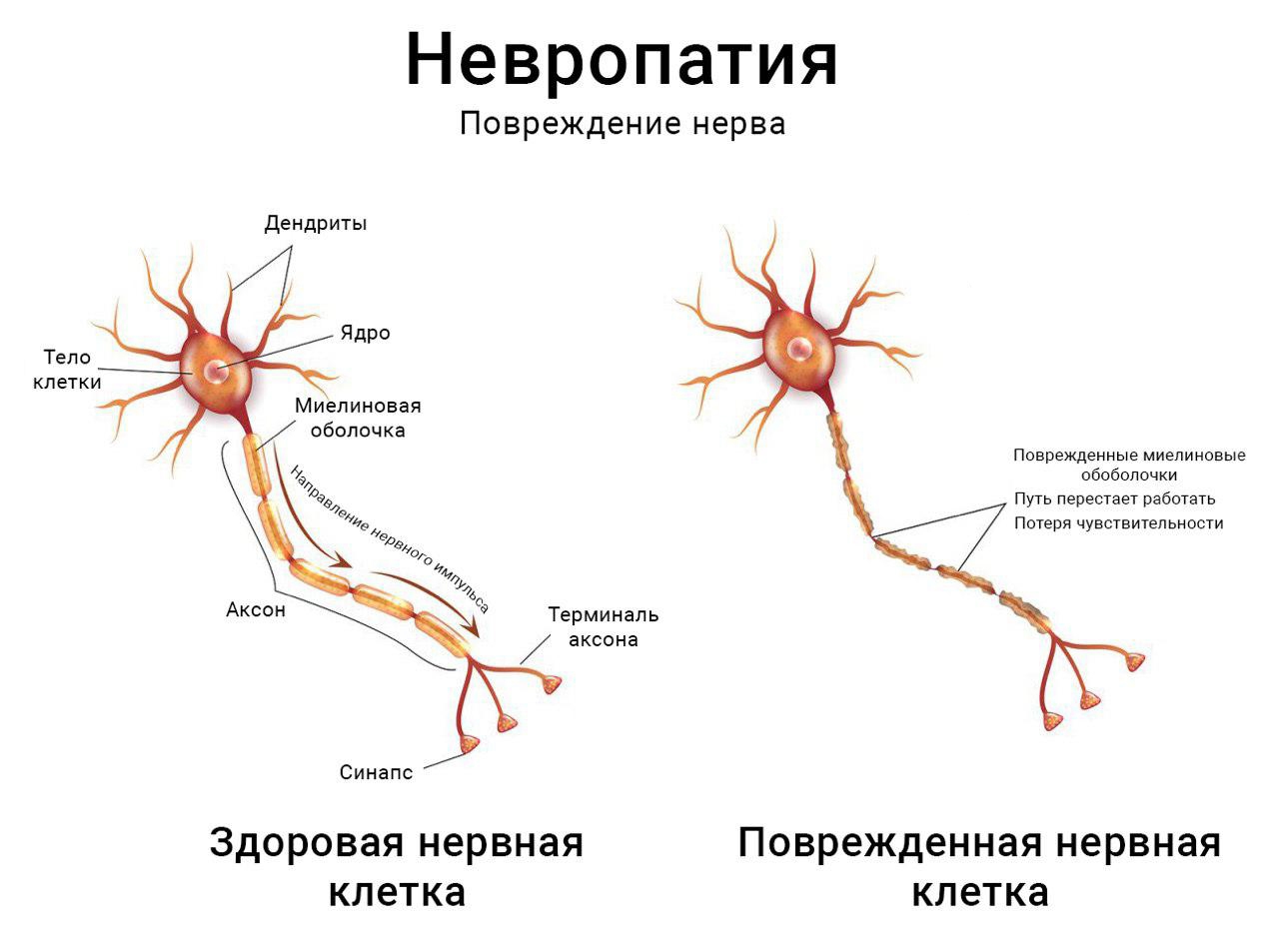 Высвобождая дофамин, нейроны черной субстанции взаимодействуют с движущимися частями мозга, такими как лобная доля и базальные ганглии .Слово ганглии означает скопления нейронов. Базальные ганглии расположены глубоко в центре мозга и состоят из нескольких разных групп нейронов. Смерть нейронов в черной субстанции означает, что эти группы нейронов больше не могут работать должным образом, вызывая спотыкание и тряску у людей, страдающих этим заболеванием [3]. Эти люди также испытывают проблемы с началом и поддержанием движения.
Высвобождая дофамин, нейроны черной субстанции взаимодействуют с движущимися частями мозга, такими как лобная доля и базальные ганглии .Слово ганглии означает скопления нейронов. Базальные ганглии расположены глубоко в центре мозга и состоят из нескольких разных групп нейронов. Смерть нейронов в черной субстанции означает, что эти группы нейронов больше не могут работать должным образом, вызывая спотыкание и тряску у людей, страдающих этим заболеванием [3]. Эти люди также испытывают проблемы с началом и поддержанием движения.
- Рис. 1. Вид сбоку мозга, разрезанный пополам, показаны базальные ганглии (красный) и черная субстанция (черный).
Болезнь Хантингтона
Как и болезнь Паркинсона, Болезнь Хантингтона также является нейродегенеративным заболеванием, которое вызывает проблемы с движением и поражает базальные ганглии. В отличие от болезни Паркинсона, болезнь Хантингтона — это генетическое заболевание . Это означает, что если один из родителей болен, очень вероятно, что заболеют и дети. Болезнь Хантингтона является результатом аномального накопления белка в головном мозге, что приводит к гибели нейронов, вызывая двигательное расстройство.В основном люди с этим заболеванием демонстрируют чрезмерное движение, которое, как правило, является нежелательным и ненужным. Например, у них часто постоянно трясутся конечности, что находится вне их контроля. По мере прогрессирования болезни людям с болезнью Хантингтона становится все труднее двигаться так, как они хотят.
Это означает, что если один из родителей болен, очень вероятно, что заболеют и дети. Болезнь Хантингтона является результатом аномального накопления белка в головном мозге, что приводит к гибели нейронов, вызывая двигательное расстройство.В основном люди с этим заболеванием демонстрируют чрезмерное движение, которое, как правило, является нежелательным и ненужным. Например, у них часто постоянно трясутся конечности, что находится вне их контроля. По мере прогрессирования болезни людям с болезнью Хантингтона становится все труднее двигаться так, как они хотят.
При любом нейродегенеративном заболевании, если нейроны умирают, мозг становится меньше! Это серьезная проблема, вызывающая у человека проблемы с памятью и мышлением.Эти проблемы являются общей чертой всех нейродегенеративных заболеваний [2].
Деменция
Воспоминания хранятся в мозгу. Хотя конкретный способ хранения воспоминаний неизвестен, нейроны определенно несут ответственность за процесс хранения. Мы знаем это, потому что болезни, вызывающие гибель нейронов, также вызывают потерю памяти. Деменция — это общий термин для обозначения потери памяти. Два распространенных типа деменции — это болезнь Альцгеймера и деменция с тельцами Леви . Каждый тип деменции является результатом нейродегенерации (сокращения мозга).Сокращение вызвано гибелью множества нейронов, происходящих по всему мозгу. Из-за гибели большого количества нейронов люди с деменцией не только начинают терять память, но и в конечном итоге теряют способность двигаться, общаться и даже правильно думать [4].
Мы знаем это, потому что болезни, вызывающие гибель нейронов, также вызывают потерю памяти. Деменция — это общий термин для обозначения потери памяти. Два распространенных типа деменции — это болезнь Альцгеймера и деменция с тельцами Леви . Каждый тип деменции является результатом нейродегенерации (сокращения мозга).Сокращение вызвано гибелью множества нейронов, происходящих по всему мозгу. Из-за гибели большого количества нейронов люди с деменцией не только начинают терять память, но и в конечном итоге теряют способность двигаться, общаться и даже правильно думать [4].
Как вылечить нейродегенеративные заболевания?
Нейродегенеративные заболевания, о которых мы говорили, являются одними из самых страшных болезней, которые только могут быть у человека. Одна из причин этого в том, что мы до сих пор не знаем, как лечить людей с нейродегенеративными заболеваниями.Исследователи и ученые всего мира в настоящее время прилагают все усилия, чтобы найти способ помочь людям с этими заболеваниями. Лечение пока не найдено, но ученые выдвинули несколько идей, у которых есть большой потенциал. Одна из самых захватывающих идей, над которыми в настоящее время работают ученые, — заменить мертвые нейроны в мозге новыми [5]. Заменить мертвые нейроны можно с помощью особого типа клеток, называемых стволовых клеток . Стволовые клетки — это незрелые клетки, которые могут стать клетками любого типа в организме, поэтому они могут действовать как замена мертвых нейронов в головном мозге.У каждого человека есть небольшое количество стволовых клеток в организме, но эти клетки не всегда работают, чтобы заменить недавно умершие клетки. Ученые обнаружили, что лучший способ заставить стволовые клетки заменить мертвые нейроны в головном мозге — это взять стволовые клетки у человека, заставить их размножаться в пробирках в лаборатории, а затем вернуть клетки туда, где они нужны. Эту идею даже опробовали на лабораторных животных, таких как мыши, и она сработала [5]! Из-за различий между людьми и другими животными ученые считают, что подобные эксперименты слишком рискованны, чтобы проводить их на людях с нейродегенеративными заболеваниями.
Лечение пока не найдено, но ученые выдвинули несколько идей, у которых есть большой потенциал. Одна из самых захватывающих идей, над которыми в настоящее время работают ученые, — заменить мертвые нейроны в мозге новыми [5]. Заменить мертвые нейроны можно с помощью особого типа клеток, называемых стволовых клеток . Стволовые клетки — это незрелые клетки, которые могут стать клетками любого типа в организме, поэтому они могут действовать как замена мертвых нейронов в головном мозге.У каждого человека есть небольшое количество стволовых клеток в организме, но эти клетки не всегда работают, чтобы заменить недавно умершие клетки. Ученые обнаружили, что лучший способ заставить стволовые клетки заменить мертвые нейроны в головном мозге — это взять стволовые клетки у человека, заставить их размножаться в пробирках в лаборатории, а затем вернуть клетки туда, где они нужны. Эту идею даже опробовали на лабораторных животных, таких как мыши, и она сработала [5]! Из-за различий между людьми и другими животными ученые считают, что подобные эксперименты слишком рискованны, чтобы проводить их на людях с нейродегенеративными заболеваниями.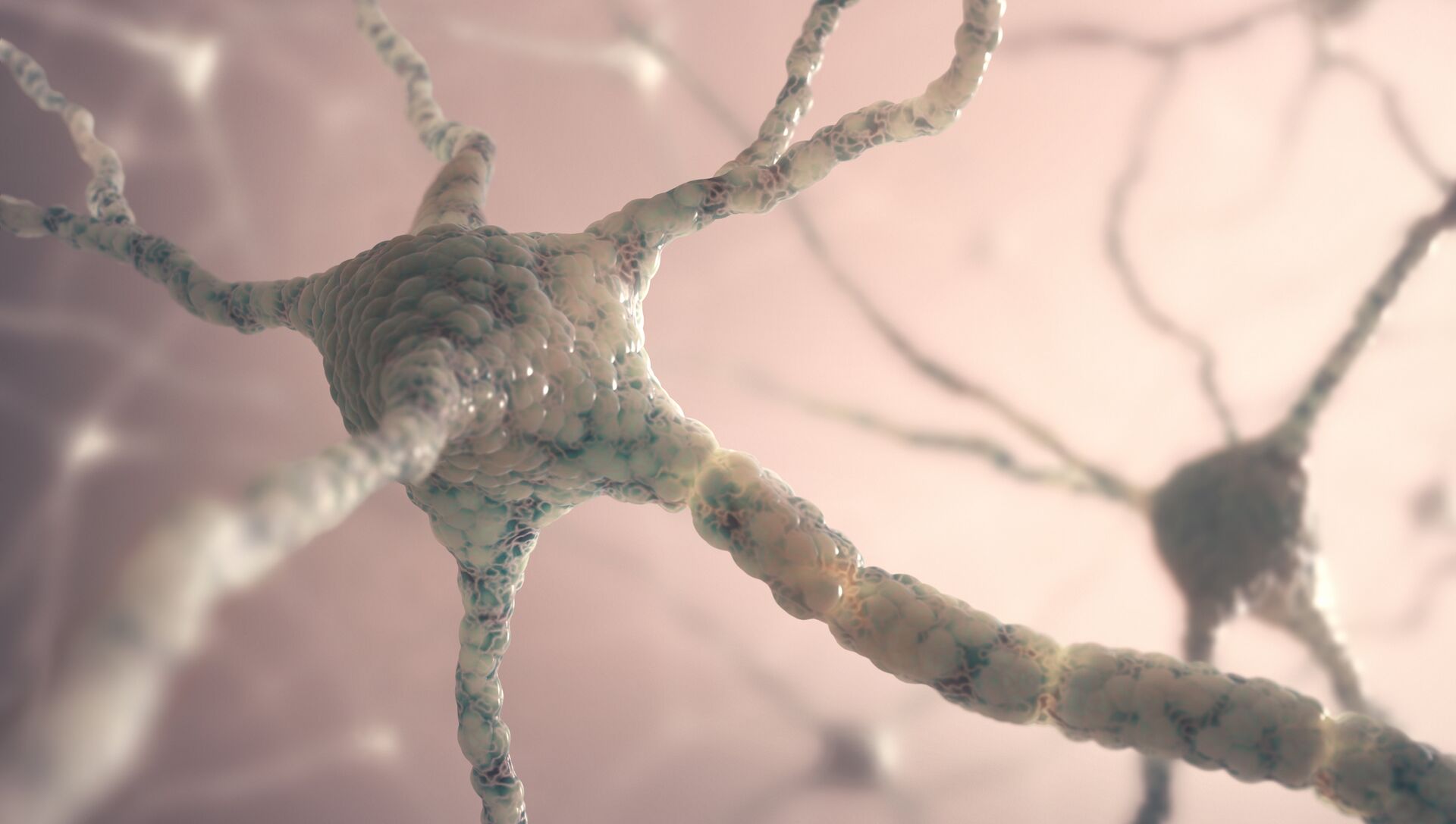 Вот почему ученые всего мира работают над разработкой более безопасного и менее рискованного способа замены нейронов в головном мозге стволовыми клетками. Когда стволовые клетки попадают в мозг, этим клеткам требуются соответствующие поддерживающие структуры, чтобы прикрепиться к ним и расти. Эти конструкции называются каркасами. Создание каркасов, которые могут поддерживать рост стволовых клеток в головном мозге, и внедрение этих каркасов в мозг — одна из серьезных проблем, с которыми в настоящее время сталкиваются нейробиологи. Тем не менее, лечение стволовыми клетками нейродегенеративных заболеваний многообещающе, и, надеюсь, приложив еще немного усилий, ученые найдут способ использовать это лечение, чтобы помочь людям, страдающим от этих заболеваний.
Вот почему ученые всего мира работают над разработкой более безопасного и менее рискованного способа замены нейронов в головном мозге стволовыми клетками. Когда стволовые клетки попадают в мозг, этим клеткам требуются соответствующие поддерживающие структуры, чтобы прикрепиться к ним и расти. Эти конструкции называются каркасами. Создание каркасов, которые могут поддерживать рост стволовых клеток в головном мозге, и внедрение этих каркасов в мозг — одна из серьезных проблем, с которыми в настоящее время сталкиваются нейробиологи. Тем не менее, лечение стволовыми клетками нейродегенеративных заболеваний многообещающе, и, надеюсь, приложив еще немного усилий, ученые найдут способ использовать это лечение, чтобы помочь людям, страдающим от этих заболеваний.
Заключение
Люди во всем мире страдают от нейродегенеративных заболеваний, которые приводят к гибели клеток мозга. Некоторые нейродегенеративные заболевания, такие как болезнь Паркинсона и болезнь Хантингтона, поражают базальные ганглии и приводят к затруднениям движений. Другие заболевания вызывают более широкую гибель клеток и приводят к потере памяти, что наблюдается при болезни Альцгеймера и деменции с тельцами Леви. Также существуют более редкие типы нейродегенеративных заболеваний, которые не были рассмотрены в этой статье.Нейродегенеративные заболевания — это ужасные болезни, от которых в настоящее время нет лекарства; однако исследователи во всем мире ищут способы помочь людям с этими заболеваниями. В одном из самых интересных методов лечения стволовые клетки заменяют отмершие нейроны. Мы надеемся, что благодаря такому количеству блестящих умов, работающих над лекарством, вскоре люди с этими заболеваниями смогут получить помощь!
Другие заболевания вызывают более широкую гибель клеток и приводят к потере памяти, что наблюдается при болезни Альцгеймера и деменции с тельцами Леви. Также существуют более редкие типы нейродегенеративных заболеваний, которые не были рассмотрены в этой статье.Нейродегенеративные заболевания — это ужасные болезни, от которых в настоящее время нет лекарства; однако исследователи во всем мире ищут способы помочь людям с этими заболеваниями. В одном из самых интересных методов лечения стволовые клетки заменяют отмершие нейроны. Мы надеемся, что благодаря такому количеству блестящих умов, работающих над лекарством, вскоре люди с этими заболеваниями смогут получить помощь!
Глоссарий
Нейроны : ↑ Клетки, которые образуют мозг и общаются друг с другом, чтобы мы могли говорить, думать, двигаться и выполнять все остальное, что мы делаем.
Нейродегенеративные заболевания : ↑ Заболевание мозга, при котором нейроны умирают, а мозг сокращается.
Болезнь Паркинсона : ↑ Нейродегенеративное заболевание, основные симптомы которого связаны с проблемами с движением из-за гибели нейронов в черной субстанции.
Черная субстанция : ↑ Область мозга, которая сообщается с базальными ганглиями, чтобы мы могли двигаться.
Basal Ganglia : ↑ Группа нейронов, составляющих основную область мозга, необходимую для управления движением.
Болезнь Хантингтона : ↑ Нейродегенеративное заболевание, которое может передаваться от родителей к ребенку и поражает базальные ганглии, что приводит к проблемам с чрезмерным движением.
Генетический : ↑ Может передаваться от родителей к детям.
Болезнь Альцгеймера и деменция с тельцами Леви : ↑ Нейродегенеративные заболевания, которые в основном приводят к проблемам с памятью.
Стволовые клетки : ↑ Незрелые клетки, которые могут стать клетками любого типа в организме, даже нейронами.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
[1] ↑ Бак, Т. Х., и Чандран, С. 2012. То, что соединяется вместе, умирает вместе: глаголы, действия и нейродегенерация при заболевании двигательных нейронов. Cortex 48: 936–44. DOI: 10.1016 / j.cortex.2011.07.008
[2] ↑ Финкбейнер, С.2011. Болезнь Хантингтона. Cold Spring Harb. Перспектива. в Биол . 3: 1–24. DOI: 10.1101 / cshperspect.a007476
[3] ↑ Калиа, Л. В., и Ланг, А. Э. 2015. Болезнь Паркинсона. Ланцет 386: 896–912. DOI: 10.1016 / S0140-6736 (14) 61393-3
[4] ↑ Холмс, К. , Амин, Дж. 2016. Деменция. Медицина (Балтимор) 44: 687–90. DOI: 10.1016 / j.mpmed.2016.08.006
, Амин, Дж. 2016. Деменция. Медицина (Балтимор) 44: 687–90. DOI: 10.1016 / j.mpmed.2016.08.006
[5] ↑ Джайсвал, М. 2017.Терапевтические возможности и проблемы с индуцированными плюрипотентными стволовыми клетками мотонейронов для лечения бокового амиотрофического склероза и болезни моторных нейронов. Neural. Regen. Res. 12: 723–36. DOI: 10.4103 / 1673-5374.206635
Молекулярная характеристика избирательно уязвимых нейронов при болезни Альцгеймера.
Браак, Х. и Браак, Э. Невропатологическая стадия изменений, связанных с болезнью Альцгеймера. Acta Neuropathol. 82 , 239–259 (1991).
CAS
PubMed
Google ученый
Scholl, M. et al. ПЭТ-изображение отложения тау в стареющем мозге человека.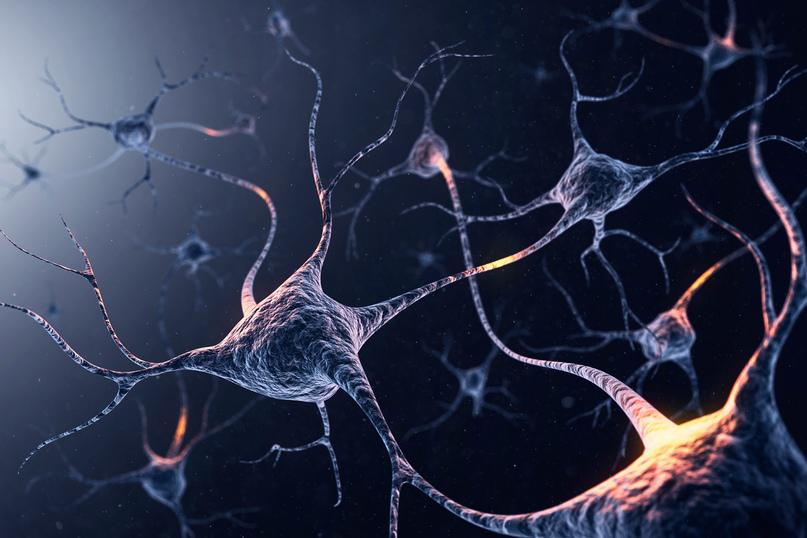 Нейрон 89 , 971–982 (2016).
Нейрон 89 , 971–982 (2016).
CAS
PubMed
PubMed Central
Google ученый
Сили, В. В., Кроуфорд, Р. К., Чжоу, Дж., Миллер, Б. Л. и Грейсиус, М. Д. Нейродегенеративные заболевания нацелены на крупномасштабные сети человеческого мозга. Нейрон 62 , 42–52 (2009).
CAS
PubMed
PubMed Central
Google ученый
Браак Х. и Браак Э. Стадии нейрофибриллярных изменений, связанных с болезнью Альцгеймера. Neurobiol. Старение 16 , 271–278 (1995).
CAS
PubMed
Google ученый

Price, J. L. et al. Число нейронов в энторинальной коре и СА1 при доклинической болезни Альцгеймера. Arch. Neurol. 58 , 1395–1402 (2001).
CAS
PubMed
Google ученый
Странахэн А. М. и Маттсон М. П. Избирательная уязвимость нейронов в слое II энторинальной коры во время старения и болезни Альцгеймера. Neural Plast. 2010 , 108190 (2010).
PubMed
PubMed Central
Google ученый
Ван Хусен, Г. В., Хайман, Б. Т., Дамасио, А. Р. Патология энторинальной коры при болезни Альцгеймера. Гиппокамп 1 , 1–8 (1991).
PubMed
Google ученый
Gomez-Isla, T. et al. Глубокая потеря нейронов энторинальной коры второго слоя происходит при очень легкой форме болезни Альцгеймера. J. Neurosci. 16 , 4491–4500 (1996).
CAS
PubMed
PubMed Central
Google ученый
Браак Х. и Браак Э. Энторинальная кора человека: нормальная морфология и пластинчатая патология при различных заболеваниях. Neurosci. Res. 15 , 6–31 (1992).
CAS
PubMed
Google ученый
Kordower, J. H. et al. Потеря и атрофия нейронов энторинальной коры II слоя у пожилых людей с легкими когнитивными нарушениями. Ann. Neurol. 49 , 202–213 (2001).
CAS
PubMed
Google ученый
Драммонд, Э. и Вишневски, Т. Болезнь Альцгеймера: экспериментальные модели и реальность. Acta Neuropathol. 133 , 155–175 (2017).
CAS
PubMed
Google ученый
Lake, B. B. et al. Подтипы и разнообразие нейронов, выявленное с помощью одноядерного секвенирования РНК человеческого мозга. Наука 352 , 1586–1590 (2016).
CAS
PubMed
PubMed Central
Google ученый
Hodge, R.D. et al. Консервативные типы клеток с разными характеристиками в коре головного мозга человека и мыши. Nature 573 , 61–68 (2019).
CAS
PubMed
PubMed Central
Google ученый
Mathys, H. et al. Транскриптомный анализ отдельных клеток болезни Альцгеймера. Nature 570 , 332–337 (2019).
CAS
PubMed
PubMed Central
Google ученый
Grubman, A. et al. Одноклеточный атлас энторинальной коры людей с болезнью Альцгеймера показывает регуляцию экспрессии генов, специфичную для клеточного типа. Nat. Neurosci. 22 , 2087–2097 (2019).
CAS
PubMed
Google ученый
Nelson, P. T. et al. Корреляция невропатологических изменений болезни Альцгеймера с когнитивным статусом: обзор литературы. J. Neuropathol. Exp.Neurol. 71 , 362–381 (2012).
PubMed
PubMed Central
Google ученый
Hof, P. R. et al. Парвальбумин-иммунореактивные нейроны неокортекса устойчивы к дегенерации при болезни Альцгеймера. J. Neuropathol. Exp. Neurol. 50 , 451–462 (1991).
CAS
PubMed
Google ученый
Fu, H.и другие. Сигнатура гомеостаза тау связана с клеточной и региональной уязвимостью возбуждающих нейронов к патологии тау. Nat. Neurosci. 22 , 47–56 (2019).
CAS
PubMed
Google ученый
Heinsen, H. et al. Количественные исследования энторинальной области человека: лево-правая асимметрия и возрастные изменения. Анат. Эмбриол. (Berl.) 190 , 181–194 (1994).
CAS
Google ученый
Кобро-Флатмоен, А. и Виттер, М. П. Нейрональная химио-архитектура энторинальной коры: сравнительный обзор. Eur. J. Neurosci. 50 , 3627–3662 (2019).
PubMed
Google ученый
Науманн, Р. К. и др. Сохранение размера и периодичности пирамидных пятен в слое 2 медиальной / каудальной энторинальной коры. J. Comp. Neurol. 524 , 783–806 (2016).
CAS
PubMed
Google ученый
Ramsden, H. L., Surmeli, G., McDonagh, S. G. & Nolan, M. F. Ламинарная и дорсовентральная молекулярная организация медиальной энторинальной коры, выявленная с помощью крупномасштабного анатомического анализа экспрессии генов. PLoS Comput. Биол. 11 , e1004032 (2015).
PubMed
PubMed Central
Google ученый
Jabaudon, D., Shnider, S.J., Tischfield, D.J., Galazo, M.J. и Macklis, J.D. RORbeta индуцирует бочкообразные нейрональные кластеры в развивающемся неокортексе. Cereb. Cortex 22 , 996–1006 (2012).
PubMed
Google ученый
Oishi, K., Aramaki, M. & Nakajima, K. Взаимно репрессивные взаимодействия между Brn1 / 2 и Rorb вносят вклад в формирование неокортикального слоя 2/3 и слоя 4. Proc. Natl Acad. Sci. США 113 , 3371–3376 (2016).
CAS
PubMed
Google ученый
Накагава Ю. и О’Лири Д. Д. Динамическая паттерн-экспрессия генов орфанных ядерных рецепторов RORalpha и RORbeta в развивающемся переднем мозге мыши. Dev. Neurosci. 25 , 234–244 (2003).
CAS
PubMed
Google ученый
Marinaro, F., et al. Молекулярная и клеточная патология моногенной болезни Альцгеймера при разрешении отдельных клеток. Препринт на bioRxiv https://doi.org/10.1101/2020.07.14.202317 (2020).
Liang, W. S. et al. Измененная экспрессия нейронных генов в областях мозга, дифференциально пораженных болезнью Альцгеймера: набор справочных данных. Physiol. Геномика 33 , 240–256 (2008).
CAS
PubMed
PubMed Central
Google ученый
Franjic, D., et al. Молекулярное разнообразие гиппокампа и энторинальных клеток взрослого человека. Препринт на bioRxiv https://doi.org/10.1101/2019.12.31.889139 (2019).
Ehrenberg, A. J., et al. Ручной мультиплексный иммунофлуоресцентный метод для исследования нейродегенеративных заболеваний. J. Neurosci. Meth. https://doi.org/10.1016/j.jneumeth.2020.108708. (2020).
Keren-Shaul, H. et al. Уникальный тип микроглии, связанный с ограничением развития болезни Альцгеймера. Cell 169 , 1276–1290 e1217 (2017).
CAS
PubMed
PubMed Central
Google ученый
Srinivasan, K., et al. Миелоидные клетки мозга пациента с болезнью Альцгеймера демонстрируют ускоренное старение и уникальную активацию транскрипции. Препринт на bioRxiv https://doi.org/10.1101/610345 (2019).
Thrupp, N., et al. Одноядерное секвенирование не позволяет обнаружить активацию микроглии в тканях человека.Препринт на bioRxiv https://doi.org/10.1101/2020.04.13.035386 (2020).
Chen, W. T. et al. Пространственная транскриптомика и секвенирование in situ для изучения болезни Альцгеймера. Cell 182 , 976–991 (2020).
CAS
PubMed
Google ученый
Перес-Ниевас Б.Г. и Серрано-Позо А. Расшифровка реакции астроцитов при болезни Альцгеймера. Front Aging Neurosci. 10 , 114 (2018).
PubMed
PubMed Central
Google ученый
Simpson, J. E. et al. Микроматричный анализ транскриптома астроцитов в стареющем мозге: связь с патологией Альцгеймера и генотипом APOE. Neurobiol. Старение 32 , 1795–1807 (2011).
CAS
PubMed
Google ученый
Секарь, С.и другие. Болезнь Альцгеймера связана с измененной экспрессией генов, участвующих в иммунном ответе и митохондриальных процессах в астроцитах. Neurobiol. Старение 36 , 583–591 (2015).
CAS
PubMed
Google ученый
Liddelow, S.A. et al. Нейротоксические реактивные астроциты индуцируются активированной микроглией. Nature 541 , 481–487 (2017).
CAS
PubMed
PubMed Central
Google ученый
Laywell, E. D. et al. Повышенная экспрессия регулируемой в процессе развития молекулы тенасцина внеклеточного матрикса после травмы головного мозга у взрослых. Proc. Natl Acad. Sci. США 89 , 2634–2638 (1992).
CAS
PubMed
Google ученый
Zamanian, J. L. et al. Геномный анализ реактивного астроглиоза. J. Neurosci. 32 , 6391–6410 (2012).
CAS
PubMed
PubMed Central
Google ученый
Андерсон М.А. и др. Образование рубцов астроцитов способствует регенерации аксонов центральной нервной системы. Nature 532 , 195–200 (2016).
CAS
PubMed
PubMed Central
Google ученый
Кампманн М. Подход CRISPR к нейродегенеративным заболеваниям. Trends Mol. Med. 23 , 483–485 (2017).
CAS
PubMed
PubMed Central
Google ученый
Кампманн, М. Функциональная геномика неврологических заболеваний на основе CRISPR. Nat. Rev. Neurol. 16 , 465–480 (2020).
PubMed
Google ученый
Tian, R. et al. Платформа на основе CRISPR-интерференции для мультимодального генетического скрининга нейронов, полученных из ИПСК человека. Нейрон 104 , 239–255.e212 (2019).
CAS
PubMed
PubMed Central
Google ученый
Hof, P.R. и Morrison, J.H. Субпопуляции нейронов неокортекса, меченные моноклональными антителами к кальбиндину, проявляют дифференциальную уязвимость при болезни Альцгеймера. Exp. Neurol. 111 , 293–301 (1991).
CAS
PubMed
Google ученый
Хоф П. Р., Кокс К. и Моррисон Дж. Х. Количественный анализ уязвимой подгруппы пирамидных нейронов при болезни Альцгеймера: I. Верхняя лобная и нижняя височная кора. J. Comp. Neurol. 301 , 44–54 (1990).
CAS
PubMed
Google ученый
Mikkonen, M., Alafuzoff, I., Tapiola, T., Soininen, H. & Miettinen, R. Подполевые и послойные изменения иммунореактивности парвальбумина, кальретинина и кальбиндина-D28K в энторинальной коре головного мозга при болезни Альцгеймера. Neuroscience 92 , 515–532 (1999).
CAS
PubMed
Google ученый
Montine, T. J. et al. Руководство ассоциации Национального института старения и болезни Альцгеймера по невропатологической оценке болезни Альцгеймера: практический подход. Acta Neuropathol. 123 , 1–11 (2012).
CAS
PubMed
Google ученый
Хьюз, К. П., Берг, Л., Данцигер, В. Л., Кобен, Л. А. и Мартин, Р. Л. Новая клиническая шкала для определения стадии деменции. Br. J. Psychiatry 140 , 566–572 (1982).
CAS
PubMed
Google ученый
Grinberg, L. T. et al. Банк мозга бразильской группы по изучению старения мозга — веха достигнута и собрано более 1600 мозгов. Банк клеточных тканей 8 , 151–162 (2007).
PubMed
Google ученый
Hyman, B.T. et al. Руководство Национального института по проблемам старения и болезни Альцгеймера по невропатологической оценке болезни Альцгеймера. Демент Альцгеймера. 8 , 1–13 (2012).
PubMed
PubMed Central
Google ученый
Suemoto, C. K. et al. Невропатологические диагнозы и клинические корреляты у пожилых людей в Бразилии: перекрестное исследование. PLoS Med. 14 , e1002267 (2017).
PubMed
PubMed Central
Google ученый
Кэрнс, Н.J. et al. Невропатологические диагностические и нозологические критерии лобно-височной долевой дегенерации: консенсус консорциума по лобно-височной долевой дегенерации. Acta Neuropathol. 114 , 5–22 (2007).
PubMed
PubMed Central
Google ученый
Феррер И., Сантпере Г. и ван Леувен Ф. В. Аргирофильная болезнь зерна. Мозг 131 , 1416–1432 (2008).
PubMed
Google ученый
Родригес Р. Д. и Гринберг Л. Т. Аргирофильная болезнь зерна: недооцененная таупатия. Демент. Neuropsychol. 9 , 2–8 (2015).
PubMed
PubMed Central
Google ученый
Rodriguez, R.D. et al. Аргирофильная болезнь зерна: демографические, клинические и невропатологические особенности по результатам большого аутопсического исследования. J. Neuropathol. Exp. Neurol. 75 , 628–635 (2016).
CAS
PubMed
PubMed Central
Google ученый
Браак, Х., Тал, Д. Р., Гебремедин, Э. и Дель Тредичи, К. Стадии патологического процесса при болезни Альцгеймера: возрастные категории от 1 до 100 лет. J. Neuropathol. Exp. Neurol. 70 , 960–969 (2011).
CAS
PubMed
Google ученый
Mo, A. et al.Эпигеномные признаки нейронального разнообразия в мозге млекопитающих. Нейрон 86 , 1369–1384 (2015).
CAS
PubMed
PubMed Central
Google ученый
Tabula Muris, C. et al. Одноклеточная транскриптомика 20 органов мыши создает Tabula Muris. Nature 562 , 367–372 (2018).
Google ученый
Lun, A. T. L. et al. EmptyDrops: различение клеток от пустых капель в данных секвенирования одноклеточной РНК на основе капель. Genome Biol. 20 , 63 (2019).
PubMed
PubMed Central
Google ученый
Lun, A. T., Bach, K. & Marioni, J. C. Объединение клеток для нормализации данных секвенирования одноклеточной РНК со многими нулевыми счетчиками. Genome Biol. 17 , 75 (2016).
PubMed
Google ученый
Лун, А. Т., Маккарти, Д. Дж. И Мариони, Дж. С. Пошаговый рабочий процесс для низкоуровневого анализа данных РНК-секвенирования отдельных клеток с помощью Bioconductor. F1000Res 5 , 2122 (2016).
PubMed
PubMed Central
Google ученый
Маккарти, Д. Дж., Кэмпбелл, К. Р., Лун, А. Т. и Уиллс, К. Ф. Скатер: предварительная обработка, контроль качества, нормализация и визуализация данных последовательностей РНК одиночных клеток в R. Биоинформатика 33 , 1179–1186 (2017).
CAS
PubMed
PubMed Central
Google ученый
Stuart, T. et al. Комплексная интеграция одноклеточных данных. Cell 177 , 1888–1902 e1821 (2019).
CAS
PubMed
PubMed Central
Google ученый
Johansen, N. & Quon, G. scAlign: инструмент для выравнивания, интеграции и идентификации редких клеток по данным scRNA-seq. Genome Biol. 20 , 166 (2019).
PubMed
PubMed Central
Google ученый
Робинсон, М. Д., Маккарти, Д. Дж. И Смит, Г. К. edgeR: пакет Bioconductor для анализа дифференциальной экспрессии цифровых данных экспрессии генов. Биоинформатика 26 , 139–140 (2010).
CAS
PubMed
Google ученый
Amezquita, R.A. et al. Управление одноклеточным анализом с помощью биопроводника. Nat. Методы 17 , 137–145 (2020).
CAS
PubMed
Google ученый
Szklarczyk, D. et al. STRING v11: сети белковых ассоциаций с расширенным охватом, поддерживающие функциональные открытия в общегеномных экспериментальных наборах данных. Nucleic Acids Res. 47 , D607 – D613 (2019).
CAS
PubMed
PubMed Central
Google ученый
Shannon, P. et al. Cytoscape: программная среда для интегрированных моделей сетей биомолекулярного взаимодействия. Genome Res 13 , 2498–2504 (2003).
CAS
PubMed
PubMed Central
Google ученый
Stelzer, G. et al. Набор GeneCards: от сбора данных о генах до анализа последовательности генома болезни. Curr. Protoc. Биоинформа. 54 , 13031–313033 (2016).
Google ученый
Arriza, J. L. et al. Функциональные сравнения трех подтипов транспортеров глутамата, клонированных из моторной коры головного мозга человека. J. Neurosci. 14 , 5559–5569 (1994).
CAS
PubMed
PubMed Central
Google ученый
Borden, L.A. et al. Клонирование человеческого гомолога транспортера ГАМК GAT-3 и идентификация нового ингибитора с селективностью по этому сайту. Рецепторы Каналы 2 , 207–213 (1994).
CAS
PubMed
Google ученый
Gendreau, S. et al. Тримерная четвертичная структура сохраняется в переносчиках глутамата бактерий и человека. J. Biol. Chem. 279 , 39505–39512 (2004).
CAS
PubMed
Google ученый
Häberle, J. et al. Врожденный дефицит глутамина с мутациями глютаминсинтетазы. N. Engl. J. Med. 353 , 1926–1933 (2005).
PubMed
Google ученый
Каваками Х., Танака К., Накаяма Т., Иноуэ К. и Накамура С. Клонирование и экспрессия переносчика глутамата человека. Biochem. Биофиз. Res. Commun. 199 , 171–176 (1994).
CAS
PubMed
Google ученый
Мельцер, Н., Biela, A. & Fahlke, C. Глутамат модифицирует ионную проводимость и зависимое от напряжения стробирование анионных каналов, связанных с переносчиком возбуждающих аминокислот. J. Biol. Chem. 278 , 50112–50119 (2003).
CAS
PubMed
Google ученый
Зюдхоф, Т. С. Синаптические нейрексиновые комплексы: молекулярный код для логики нейронных цепей. Cell 171 , 745–769 (2017).
PubMed
PubMed Central
Google ученый
Pellissier, F., Gerber, A., Bauer, C., Ballivet, M. и Ossipow, V. Молекула адгезии Necl-3 / SynCAM-2 локализуется в миелинизированных аксонах, связывается с олигодендроцитами и способствует клеточной адгезии. BMC Neurosci. 8 , 90 (2007).
PubMed
PubMed Central
Google ученый
González-Castillo, C., Ortuño-Sahagún, D., Guzmán-Brambila, C., Pallàs, M. & Rojas-Mayorquín, A.E. Плейотрофин как нейромодулятор центральной нервной системы, данные из гиппокампа. Фронт. Cell Neurosci. 8 , 443 (2014).
PubMed
Google ученый
Siddiqui, T. J. et al. Комплекс LRRTM4-HSPG опосредует развитие возбуждающих синапсов на клетках гранул зубчатой извилины. Нейрон 79 , 680–695 (2013).
CAS
PubMed
Google ученый
Heinsen, H., Arzberger, T. & Schmitz, C.Установка целлоидина (заливка без инфильтрации) — новый, простой и надежный метод получения серийных срезов большой толщины через полный мозг человека и его применение для стереологических и иммуногистохимических исследований. J. Chem. Нейроанат. 20 , 49–59 (2000).
CAS
PubMed
Google ученый
Insausti, R. & Amaral, D. G. Энторинальная кора головного мозга обезьяны: IV. Топографическая и ламинарная организация корковых афферентов. J. Comp. Neurol. 509 , 608–641 (2008).
PubMed
PubMed Central
Google ученый
Инсаусти, Р., Муньос-Лопес, М., Инсаусти, А. М. и Артачо-Перула, Э. Периаллокортекс человека: структура слоев в предубикуле, парапубикулуме и энторинальной коре. Обзор. Фронт. Нейроанат. 11 , 84 (2017).
PubMed
PubMed Central
Google ученый
Rose, S. Vergleichende messungen im allocortex bei tier und mensch. J. Psychol. Neurol. 34 , 250–255 (1927).
Google ученый
Fu, H. et al. Патология тау-белка вызывает потерю возбуждающих нейронов, дисфункцию решетчатых клеток и дефицит пространственной памяти, напоминающий раннюю болезнь Альцгеймера. Нейрон 93 , 533–541.e535 (2017).
CAS
PubMed
PubMed Central
Google ученый