Инфаркт миокарда — симптомы и лечение, как происходит, что наблюдается в сердечной мышце при первых признаках заболевания
Содержание статьи
- Инфаркт миокарда: что это такое
- Обширный инфаркт
- От чего может быть инфаркт миокарда: причины
- Классификация
- Симптомы инфаркта миокарда
- Признаки и симптомы при типичной форме инфаркта миокарда
- Атипичные формы
- Первая помощь при симптомах инфаркта сердца
- Как происходит инфаркт миокарда: механизм развития
- Последующие осложнения
- Диагностика
- Лечение при инфаркте миокарда
- Прогноз
- Профилактика
- Реабилитация
- Диета во время реабилитации
- Реабилитационная фитотерапия и рецепты народной медицины
По статистике, инфаркт миокарда – это одна из самых частых причин смертности человека.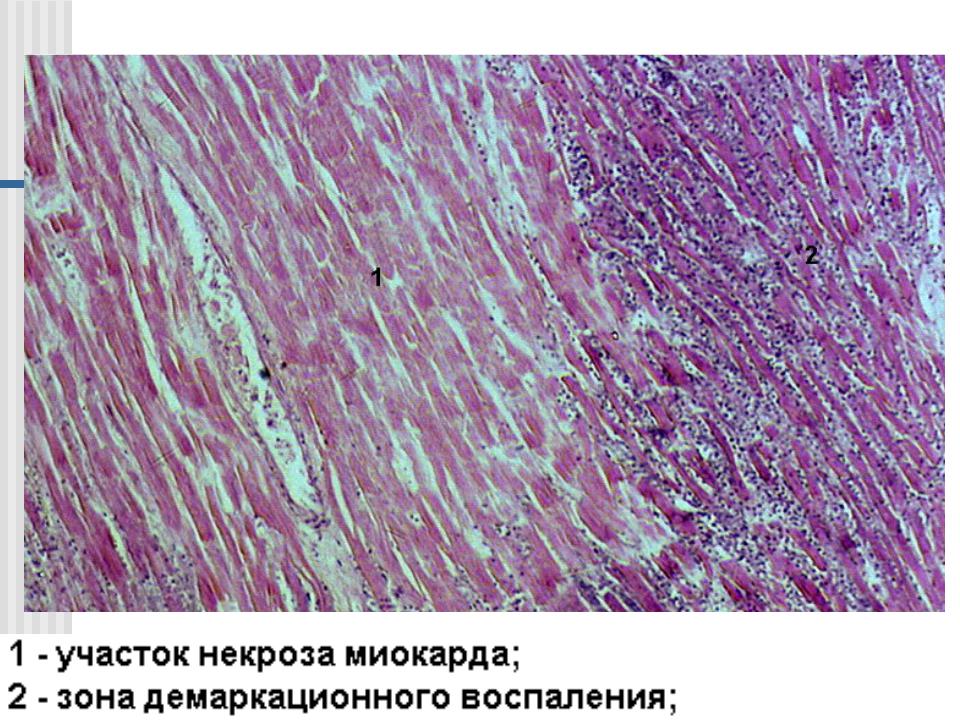 Однако его симптомы-предвестники можно распознать и в некоторых ситуациях предотвратить беду. На сегодняшний день также есть много профилактических и терапевтических подходов к этой коварной болезни сердечно-сосудистой системы. Во многих случаях они помогают спасти жизнь и предотвратить тяжелые последствия, например, инвалидность. Важно помнить, что здесь действует принцип «чем быстрее, тем лучше», поэтому необходимо оказать профессиональную помощь больному в течение часа от появления первых симптомов. О том, какие они бывают и что нужно делать, если случился приступ, мы расскажем далее.
Однако его симптомы-предвестники можно распознать и в некоторых ситуациях предотвратить беду. На сегодняшний день также есть много профилактических и терапевтических подходов к этой коварной болезни сердечно-сосудистой системы. Во многих случаях они помогают спасти жизнь и предотвратить тяжелые последствия, например, инвалидность. Важно помнить, что здесь действует принцип «чем быстрее, тем лучше», поэтому необходимо оказать профессиональную помощь больному в течение часа от появления первых симптомов. О том, какие они бывают и что нужно делать, если случился приступ, мы расскажем далее.
Инфаркт миокарда: что это такое
Это одна из форм ишемической болезни сердца (ИБС), которая возникает из-за нарушения притока крови по коронарным артериям к тканям сердечной мышцы. Из-за этого начинается некроз (отмирание) участков одного из главнейших органов нашего организма, его атрофия.
Миокард – это средний мышечный слой сердца, составляющий его основную массу. Поэтому его поражение так опасно, и если не обратиться вовремя к врачу, последствия могут быть самыми печальными.
Поэтому его поражение так опасно, и если не обратиться вовремя к врачу, последствия могут быть самыми печальными.
Обширный инфаркт
Самый опасный тип данной патологии, так как в большинстве случаев его результатом является летальный исход. При нем из-за нарушения кровоснабжения и недостатка кислорода поражаются не локальные участки ткани, а обширные площади сердечной мышцы.
Как правило, он бывает вызван тромбозом – закупоркой сгустком крови сосудов и их повреждением вследствие этого. В таких случаях пациент уже не сможет полностью оправиться, и качество его жизни заметно ухудшится. Однако при быстром диагностировании и скором лечении шансы на более благоприятный исход возрастают.
От чего может быть инфаркт миокарда: причины
Во время этого острого заболевания происходит нарушение работы кровеносных сосудов, проход которых оказываются сужен из-за спазма или закупорен кровяными сгустками (тромбами), холестериновыми или жировыми бляшками. Все это является следствием различных причин – от заболеваний и наследственности, до образа жизни:
Все это является следствием различных причин – от заболеваний и наследственности, до образа жизни:
- Атеросклероз – сама болезнь предполагает образование тромбов.
- Гипертония – частое высокое давление неблагоприятно воздействует на работу сердца, и из-за большой нагрузки может возникнуть нехватка кислорода и последующее отмирание клеток тканей.
- Пороки или наследственные заболевания.
- Сахарный диабет – характеризуется загустением крови и холестериновых отложений на стенках сосудов.
- Избыточная масса тела, которая повышает риск появления атеросклероза.
- Недостаток физических нагрузок и сидячий образ жизни – также способствуют застаиванию крови.
- Постоянное нервное напряжение и стрессы.
- Курение, нарушающее доставку кислорода к миокарду из-за интоксикации органов.
- Злоупотребление алкоголем, которое приводит к дистрофии сердечной мышцы.
Стоит отметить, что в зоне риска чаще всего оказываются люди старше 45 лет.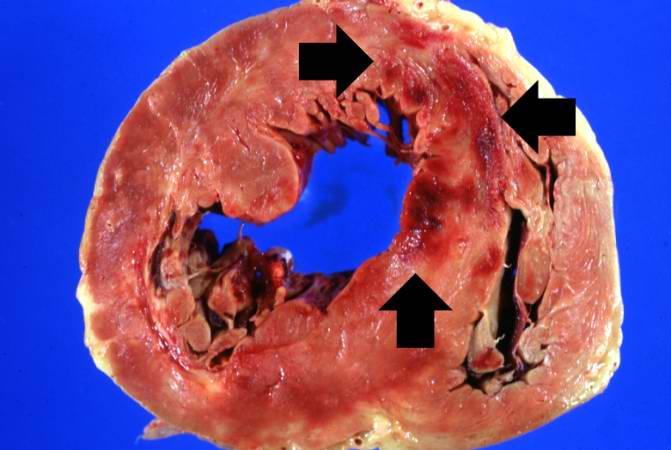
Оставьте заявку на подбор пансионата
для пожилого человека с инфарктом
Классификация
Исходя из понимания, что это такое – инфаркт сердца и симптомы миокарда, специалисты группируют его по размеру, глубине, месту поражения, изменениями на ЭКГ, наличию осложнений и др.
Выделяются крупно- и мелкоочаговые поражения. Конечно, меньшие последствия влечет за собой малая зона некроза, которая не провоцирует, например, разрыв сердца или аневризму. Однако исследователи отмечают, что около 30% пациентов, имевших ее, могут перейти в группу риска крупноочагового омертвения тканей.
Исходя из глубины расположения очага, выделяются:
- субэпикардиальный – близко к наружной оболочке сердечной мышцы;
- субэндокардиальный – располагается во внутреннем слое оболочки стенки желудочков;
- интрамуральный – непосредственно внутри мышечных волокон;
- трансмуральный – поражение стенки по всей толщине.

Симптомы инфаркта миокарда
Обычно во многих СМИ говорят о том, что главный признак надвигающейся беды – острая боль в районе груди, а также навязчивые и неконтролируемые мысли о смерти. Как правило, это действительно характерная картина, но очень многое зависит от типичности протекания процесса и его стадии. В связи с индивидуальными особенностями организма каждого пациента симптоматика будет различной. Что при неправильном понимании болезни может привести к неправильно и не вовремя оказанной помощи. Рассмотрим подробнее все нюансы. См. Также:Ишемическая болезнь сердца (ИБС): что это такое, симптомы, признаки и лечение
Признаки и симптомы при типичной форме инфаркта миокарда
Такой вид заболевания диагностируется врачами в 25% случаев.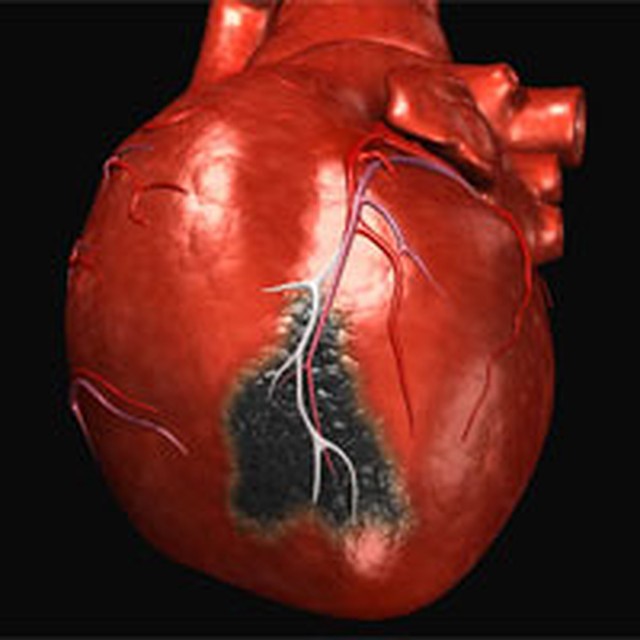 Его особенность в том, что он имеет четкие признаки, которые позволяют обнаружить проблему даже без медицинской диагностики. Это картина с ярко выраженным типичным болевым ощущением и зачастую сопутствует трансмуральному типу. Также возникает слабость, тахикардия, одышка проступает холодный липкий пот. Наблюдаются скачки артериального давления, а температура поднимается выше 38 градусов.
Его особенность в том, что он имеет четкие признаки, которые позволяют обнаружить проблему даже без медицинской диагностики. Это картина с ярко выраженным типичным болевым ощущением и зачастую сопутствует трансмуральному типу. Также возникает слабость, тахикардия, одышка проступает холодный липкий пот. Наблюдаются скачки артериального давления, а температура поднимается выше 38 градусов.
Само протекание болезни делится на периоды по определенным характеристиками.
Прединфарктный (продромальный)
Почти у половины больных он отсутствует, потому что, как правило, ИБС начинается внезапно. Многие инфарктники замечают частые приступы стенокардии, жалуются на усиливающиеся болезненные ощущения за грудиной. Заметно изменяется их эмоциональный фон: понижается настроение, возникает тревожность, беспричинный страх. Если человек принимает антиангинальные средства, их эффективность заметно снижена.
Острейший
Длится от тридцати минут до нескольких часов. Боль за грудиной становится нестерпимой, с прострелами в левые плечо, руку, часть нижней челюсти, ключицу и даже лопатку или бедро. Пациенты отмечают также возможность ломоты или распирания в груди. После наступления первых симптомов инфаркта миокарда в этом периоде за несколько минут болевые ощущения достигнут максимальной точки и будут сохраняться в течение часа с периодическими усилениями или ослаблениями.
Боль за грудиной становится нестерпимой, с прострелами в левые плечо, руку, часть нижней челюсти, ключицу и даже лопатку или бедро. Пациенты отмечают также возможность ломоты или распирания в груди. После наступления первых симптомов инфаркта миокарда в этом периоде за несколько минут болевые ощущения достигнут максимальной точки и будут сохраняться в течение часа с периодическими усилениями или ослаблениями.
Острый
В среднем его продолжительность до двух дней, однако, при повторном возникновении он может длиться и до десяти суток. Давящая и сжимающая в груди боль у большинства заболевших проходит. Если нет, это свидетельствует о длительном протекании некроза. Сохраняется нарушенный сердечный ритм и артериальная гипотензия (давление снижается более, чем на 20% от обычных показателей).
Подострый
Продолжается в рамках одного месяца. Во время него общее состояние человека постепенно нормализуется: проходит одышка, температура тела возвращается в привычное состояние, восстанавливается ритм.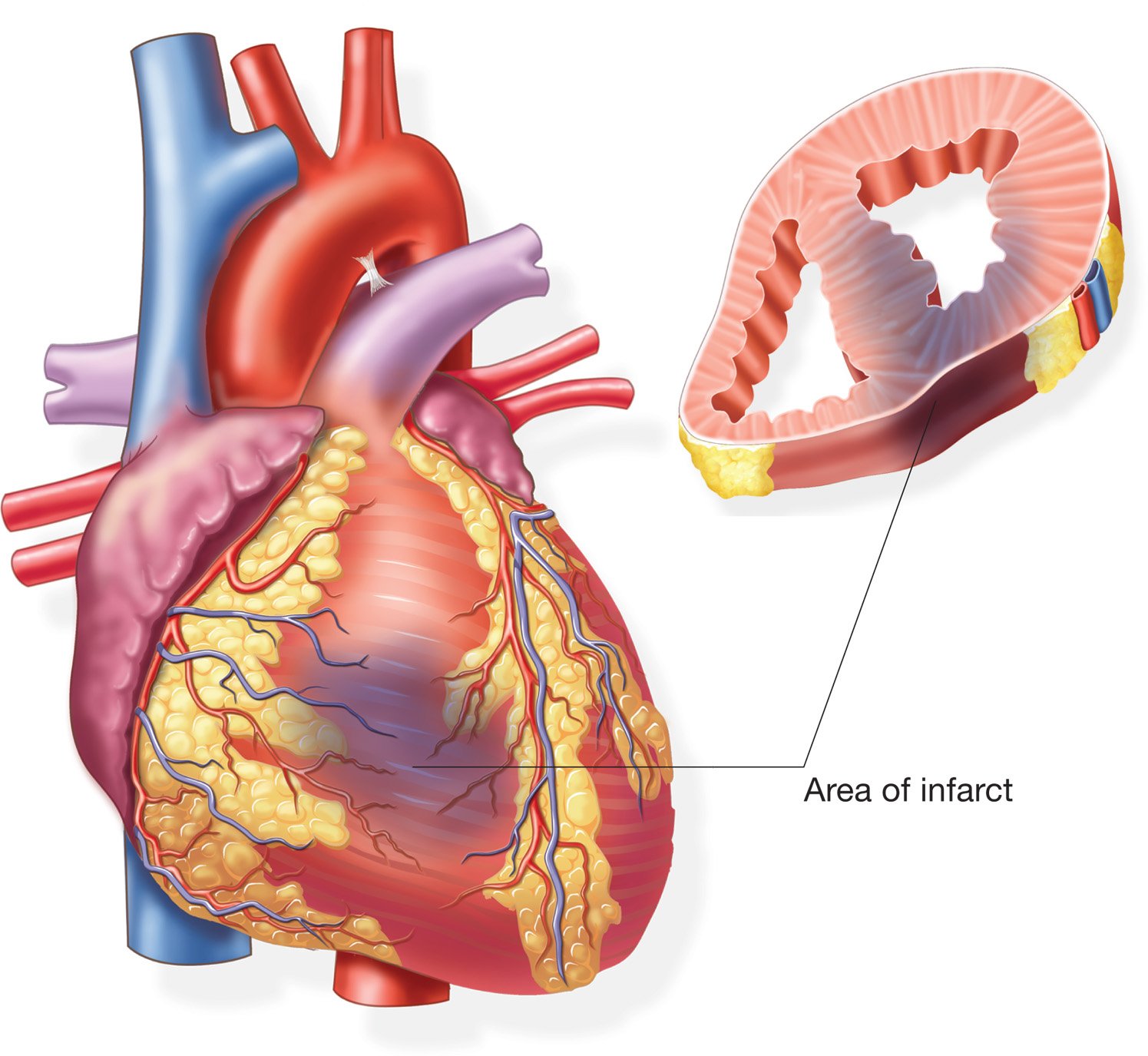
Постинфарктный
Его также называют завершающим. Он длится до полугода. Поврежденная некрозом ткань полностью зарубцовывается. При небольших размерах площади поражения устраняется сердечная недостаточность. Если же наоборот, участок омертвения был обширен, полное восстановление невозможно и синдром будет только прогрессировать.
В этот период также важно проявлять внимание и заботу к больному, особенно если это человек в возрасте. Чтобы избежать рецидивов, необходимо постоянное наблюдение и контроль его состояния.
Атипичные формы
Как видно из названия, здесь при инфаркте миокарда наблюдается нетипичность симптоматики и местоположения болевых очагов. Из-за этого крайне затрудняется его своевременная диагностика. Типология синдромов в целом основана на локализации болезненных ощущений.
Признаки атипичных форм
- Абдоминальная – боли в районе желудка или пищевода, сопровождающиеся тошнотой и рвотой.

- Отечная – является маркером большого очага омертвения ткани, которое сопровождается сильной сердечной недостаточностью, отеками конечностей, одышкой.
- Церебральная – является характерной для пожилых людей, особенно с атеросклерозом как сосудов сердца, так и мозга. При ней отмечаются головокружения потеря сознания, звон или шум в ушах.
- Аритмическая. Единственный ее признак – внезапные приступы учащенного сердцебиения.
- Периферическая – характеризуется разными локализациями боли. Это могут быть только кисть руки, нижняя челюсть или лопатка. В некоторых случаях болезненность похожа с симптомами межреберной невралгии.
Первая помощь при симптомах инфаркта сердца
Как только были замечены первые признаки, необходимо сразу же вызвать бригаду скорой помощи. Очень важно в первый час после проявления заболевания получить лечение от специалиста. Во время ожидания доктора больному нужно принять лежачее или полусидячее положение.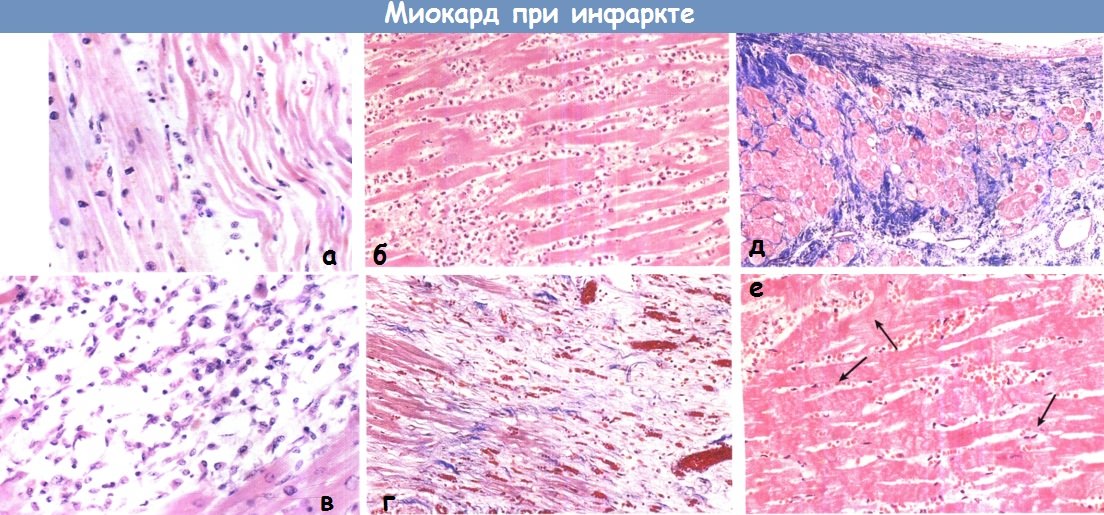 С интервалом в 15 минут под язык надо положить до полного рассасывания три таблетки нитроглицерина.
С интервалом в 15 минут под язык надо положить до полного рассасывания три таблетки нитроглицерина.
Чтобы увеличить доступ кислорода к клеткам и избежать удушья, расстегните одежду, особенно если она стесняет дыхание, и откройте окна для проветривания помещения.
В тяжелых случаях, когда не наблюдаются пульс и дыхание, нужно немедля приступить к непрямому массажу сердца и искусственному дыханию.
Очень важно не бездействовать тем, кто оказался рядом. Только так можно спасти жизнь больного.
Как происходит инфаркт миокарда: механизм развития
Пагубные изменения состояния организма происходят в следующей последовательности:
- По ряду причин образуется будущая пробка. К примеру, из-за нарушения цельности атеросклеротического отложения появляется небольшой сгусток крови, который забивает проход в сосуде.
- Происходит тромбоз или закупорка сосудистого просвета.
 Кислород и питательные вещества не могут поступать в сердце.
Кислород и питательные вещества не могут поступать в сердце. - Происходит рефлекторный спазм забитого сосуда, пытающегося протолкнуть сгусток. При большой форме последнего возможен даже разрыв с кровоизлиянием в сердечную полость, что обычно заканчивается летальным исходом.
Последующие осложнения
Даже при вовремя обнаруженных проявлениях, что происходят при инфаркте, и оказанной помощи невозможно избежать последствий для организма. Особо часто наблюдаются:
- Желудочно-кишечные заболевания (эрозивный гастрит, острый панкреатит, парез кишечника, колит, желудочное кровотечение).
- Прогрессирование сердечной недостаточности.
- Кардиогенный шок и аневризмы.
- Отеки легких.
- Психоневрологические расстройства.
Поэтому для больного важно следить за своим состоянием в восстановительный период, чтобы избежать всего перечисленного.
Диагностика
При инфаркте миокарда в сердечной мышце развивается некроз, который нужно обнаружить как можно скорее. Ведь от этого будет зависеть жизнь больного.
Ведь от этого будет зависеть жизнь больного.
Помимо описанной ранее визуальной диагностики, специалисты проводят электрокардиографические мероприятия (ЭКГ), берут на анализ кровь для обнаружения ферментативных активностей, что помогает диагностировать болезнь при нетипичной форме.
Лабораторная
Ее главная цель, проанализировав кровяной состав, выявить определенные элементы, которые служат маркерами заболевания. Например, в течение первых шести часов острого периода выявляется повышение уровня миоглобина, который незаменим в транспортировке кислорода. Также в рамках 8-10 часов обнаруживается увеличенная вдвое креатинфосфокиназа. Ее показатель приходит в норму после двух дней. Такой анализ повторяется для потенциального больного через каждые 8 часов. Если после трех заборов показания отрицательные – ИБС не подтверждается.
Инструментальная
Обследование пациента производится при помощи медицинских приборов. В большинстве случаев подразумевает электрокардиографию.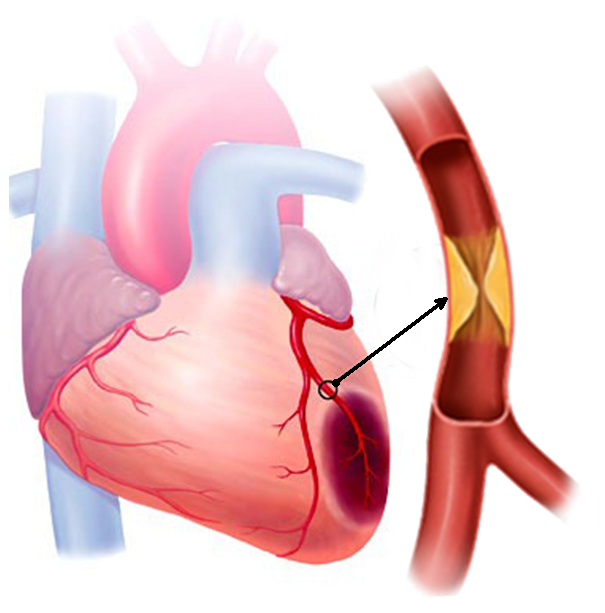 Она помогает определить обширность некротического поражения, его расположение, оценивает способность сердца сокращаться, выявляет осложнения.
Она помогает определить обширность некротического поражения, его расположение, оценивает способность сердца сокращаться, выявляет осложнения.
Иногда прописывается коронарография, которая помогает обнаружить место и обозначить степень сужения коронарной артерии.
Лечение при инфаркте миокарда
В медицинском учреждении все мероприятия направлены то, чтобы:
- купировать болевой синдром с помощью анальгетиков;
- ограничить зону некроза путем тромболитической и антикоагулянтной терапии;
- предотвратить осложнения, как, например, аритмия или острая сердечная недостаточность при помощи антиаритмических препаратов, анаболиков, гликозидов и диуретиков.
Прогноз
Он зависит от многих факторов, начиная от площади повреждений, заканчивая особенностями текущего периода. Так, если пациент вышел из острой стадии, но врачи ставят хорошие прогнозы на выздоровление. Если же течение болезни сопряжено с осложнениями, перспектива на полное восстановление неблагоприятная.
Если же течение болезни сопряжено с осложнениями, перспектива на полное восстановление неблагоприятная.
Профилактика
Здесь все достаточно просто – следует вести здоровый образ жизни, исключающий вредные привычки (курение, алкоголь), а также:
- сбалансированно питаться, избегая жирную и жареную пищу;
- обеспечивать себе достаточную физическую нагрузку, чтобы избежать малоподвижности;
- исключить нервное и физическое перенапряжение;
- контролировать уровень сахара и холестерина.
Реабилитация
Ее нюансы связаны с тяжестью перенесенного приступа, возрастом пациента, присутствием осложнений. Она подразумевает:
- постепенное увеличение физнагрузок;
- специально подобранную диету;
- избавление от лишнего веса;
- предупреждение стрессов;
- процедуры для восстановления организма;
- медикаментозное профилактическое лечение и наблюдение у врача.

Пожилым людям лучше проводить ее дома, под присмотром родственников, либо в специализированных учреждениях, как, например, в пансионатах «Забота», под надзором персонала с медицинским образованием.
Диета во время реабилитации
Главное правило – питание небольшими порциями по семь раз в сутки. Сначала в рационе только низкокалорийные продукты (овощи, фрукты, легкие супы, каши и натуральные соки). На этой стадии исключается соль. После двух недель меню пополняется рыбой и молочной продукцией. Однако под запретом останутся: соленое, копченое, кофе и алкоголь.
Реабилитационная фитотерапия и рецепты народной медицины
Нужно понимать, что это скорее дополнение к общим мероприятиям реабилитации. Ни в коем случае отвары трав не должны полностью заменять медикаментозные препараты. Однако при совмещенном применении фитотерапия поможет привести в норму давление, понизить вероятность отечности, нормализовать клеточное питание сердечной мышцы.
Рецепты для реабилитационного лечения инфаркта миокарда и симптомов возможных осложнений.
| Состав | Рецептура | |
| 1. | 20 гр сырых плодов валерианы | Залить кипятком и настоять полчаса. Принимать по стакану два раза в сутки. |
| 2. | Валериана, шалфей, бессмертник, лаванда, календула, корень ангелики. | Травы измельчить. 20 гр смеси залить 500 граммами кипятка. После того как отвар настоялся, употреблять три раза в сутки. |
| 3. | Валериана, боярышник, горицвет – по 20 гр каждый. | Заливаем 0,2 л кипятка. Пить по два раза в день. |
| 4. | По 50 г шиповника и листьев земляники. | Ошпарить 500 г кипятка и поставить на водяную баню на 20 минут. Употреблять дважды в день. Употреблять дважды в день.
|
| 5. | По 20 г валерианы, тмина, пустырника. | Залить 500 гр кипятка. Принимать по стакану перед сном. |
Дата создания статьи:
19 Сентября 2019
Дата обновления статьи:
25 Сентября 2020
Оставьте заявку на подбор пансионата
для пожилого человека с инфарктом
Инфаркт миокарда – симптомы, лечение, диагностика и признаки заболевания
Внимание!
Вы можете бесплатно вылечить это заболевание и получить медицинскую помощь в АО «Медицина» (клиника академика Ройтберга) по программе Государственных гарантий ОМС (Обязательного медицинского страхования) и ВМП (выскокотехнологичной медицинской помощи).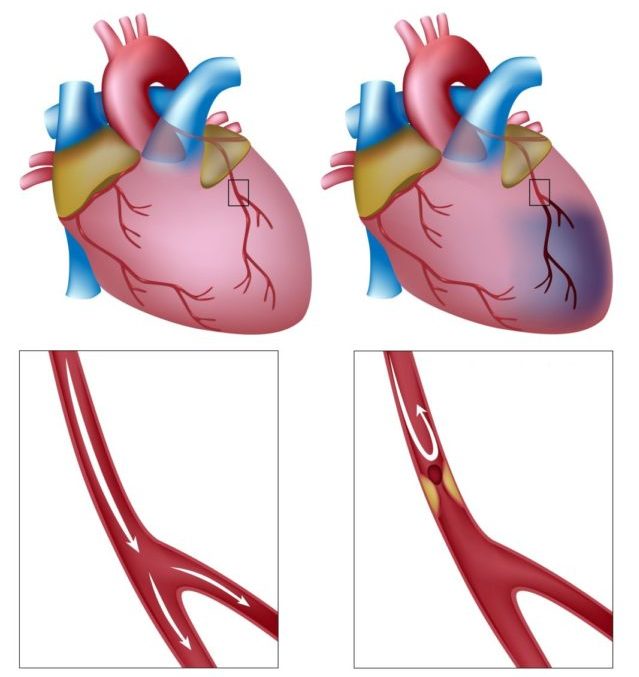
Чтобы узнать подробности, позвоните, пожалуйста, по телефону +7(495) 775-73-60, или на странице ВМП по ОМС
Заболевания сосудов и сердца – наиболее частая причина смерти. Среди этих патологий одну из первых строк занимает инфаркт миокарда. Несмотря на то, что болезнь достаточно хорошо изучена, и медики в целом умеют с ней справляться, основная сложность заключается в быстром развитии необратимых повреждений сердечной мышцы. Счет, как правило, идет даже не на часы, а на минуты от появления первых признаков инфаркта миокарда. Поэтому каждый должен знать особенности этого состояния и представлять, как необходимо вести себя во время приступа.
Что собой представляет заболевание
Инфарктом миокарда принято называть тяжелейшую форму ишемии сердца, при которой у больного быстро развивается состояние, непосредственно угрожающее его жизни. Нарушается кровоснабжение тканей сердечной мышцы, из-за чего в ней быстро формируется область некроза – отмирания клеток. Спазматическое сужение либо закупорка просвета сосудов создает препятствие для кровотока. Поскольку миокард, т.е. средний слой мышечной ткани сердца, составляет основную часть этого органа, то его поражение представляет огромную опасность. Чем быстрее будет оказана медицинская помощь, тем больше шансов на благополучный исход приступа.
Спазматическое сужение либо закупорка просвета сосудов создает препятствие для кровотока. Поскольку миокард, т.е. средний слой мышечной ткани сердца, составляет основную часть этого органа, то его поражение представляет огромную опасность. Чем быстрее будет оказана медицинская помощь, тем больше шансов на благополучный исход приступа.
Почему может случиться приступ?
Ни одно заболевание, тем более столь тяжелое, не развивается внезапно у абсолютно здорового человека. К основным причинам инфаркта миокарда медики относят:
- атеросклеротическое поражение сосудов, следствием которого становится ишемия миокарда, приводящая к длительному нарушению кровоснабжения его тканей из-за критического сужения артериального просвета;
- тромбоз, т.е. полное или частичное закупоривание сосудов сгустком крови либо атеросклеротической бляшкой;
- эмболия артерий, которая приводит к образованию некротического очага в тканях сердечной мышцы;
- пороки либо наследственные заболевания сердца.

У многих пациентов к приступу приводит сочетание нескольких причин: инфаркт миокарда развивается из-за тромбирования суженного спазмом просвета артерии при наличии атеросклеротических бляшек либо кровоизлияния в стенку сосуда.
Факторы риска
Существует ряд объективных факторов, которые существенно повышают риск развития заболевания. К ним относят:
- возрастные показатели: после 40 лет частота инфарктов миокарда заметно увеличивается;
- пол больного: в период между 40 и 65 годами инфаркт миокарда встречается гораздо чаще у мужчин, чем у женщин, после этого возраста статистика выравнивается для обоих полов;
- наличие стенокардии, артериальной гипертонии, эндокардита, ревмокардита, других сердечных заболеваний;
- увеличенная масса тела, ожирение;
- психологический стресс либо физическое перенапряжение на фоне ишемии сердца, атеросклероза;
- наличие сахарного диабета;
- малоподвижный образ жизни;
- курение, употребление алкоголя.

Сочетание нескольких основных факторов риска инфаркта миокарда особенно опасно, поэтому людям, у которых они присутствуют, необходимо быть максимально осторожными и тщательно следить за своим здоровьем.
Формы заболевания
Существует медицинская классификация инфарктов миокарда, при помощи которой кардиологи выделяют варианты течения болезни в зависимости от локализации пораженного участка, его размеров, глубины и других признаков.
В соответствии с размерами участка некротизированной ткани инфаркт миокарда может быть:
- мелкоочаговым, когда в сердечной мышце образуется несколько разрозненных пораженных зон небольших размеров;
- крупноочаговым, для которого характерна обширная зона поражения тканей.
В зависимости от глубины некроза различают:
- трансмуральное поражение по всей толщине мышечной ткани;
- субэпикардиальное, когда зона поражения прилегает к эпикардиальной ткани;
- субэндокардиальное, с пораженным участком, прилегающим к эндокардиальной ткани;
- интрамуральное, находящееся в мышечной толще.

По частоте развития различают первичный, повторный и рецидивирующий инфаркт миокарда.
В зависимости от показателей электрокардиографии выделяют следующие формы инфаркта миокарда:
- Q-инфаркт, наиболее характерный для крупноочаговых приступов;
- не Q-инфаркт, чаще встречающийся при мелкоочаговом поражении тканей.
Кроме того, заболевание проявляется:
- типично, с болями в загрудинной или прекардиальной области;
- атипично, с болями, локализованными в других участках либо вовсе без болевых ощущений.
Определение вида инфаркта миокарда по его признакам и симптоматике позволяет выбрать оптимальную схему лечения, которая наилучшим образом подходит конкретному пациенту.
Как распознать сердечный приступ
Перечислить симптомы инфаркта миокарда довольно сложно, поскольку они различны для разных периодов развития патологического состояния.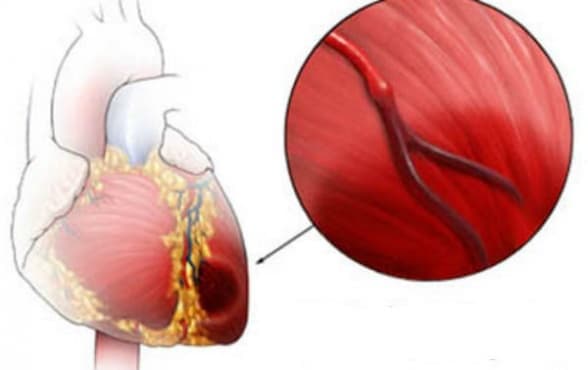 У многих пациентов присутствует собственный набор клинических проявлений, что наиболее характерно для атипичной формы протекания процесса.
У многих пациентов присутствует собственный набор клинических проявлений, что наиболее характерно для атипичной формы протекания процесса.
Типичная форма
При типичной форме приступ протекает следующим образом.
- Продромальная стадия инфаркта миокарда. Примерно у 45% пациентов приступ начинается внезапно, и этот этап у них отсутствует. У остальных больных учащаются и усиливаются загрудинные боли, появляется чувство страха, ухудшается общий тонус. Антиангинальные препараты почти не помогают.
- Острейшая стадия. Она длится от 30 минут до нескольких часов и сопровождается сильнейшими болями, локализованными за грудиной. Боль может иррадиировать в левую руку, ключицу или левую сторону нижней челюсти, а также в спину между лопатками. Характер болей, как правило, режущий, жгучий либо сдавливающий, ощущения волнообразно усиливаются и ослабевают.
- Острый период. Его продолжительность составляет от 2 до 10 дней (при рецидивах).
 Как правило, в это время давящие боли прекращаются. Если они продолжаются, это означает, что некроз еще не остановлен. Артериальное давление снижается примерно на 20% от обычной величины. Ритмичность сердцебиений нарушена.
Как правило, в это время давящие боли прекращаются. Если они продолжаются, это означает, что некроз еще не остановлен. Артериальное давление снижается примерно на 20% от обычной величины. Ритмичность сердцебиений нарушена. - Подострая стадия инфаркта миокарда. Длится примерно месяц, в течение которого пациент постепенно возвращается к своему обычному состоянию: нормализуется температура тела, проходит одышка, стабилизируется ритм сердцебиений.
- Постинфарктный период. В течение полугода формируется рубец на месте некротического повреждения. Если зона некроза была небольшой, сердечная недостаточность полностью устраняется. При обширном участке поражения формируется прогрессирующая сердечная недостаточность.
Симптомы инфаркта миокарда у мужчин и женщин практически одинаковы.
Атипичное протекание болезни
При атипичном течении заболевания сложно распознать признаки инфаркта миокарда, поскольку локализация болей может указывать и на другие недомогания.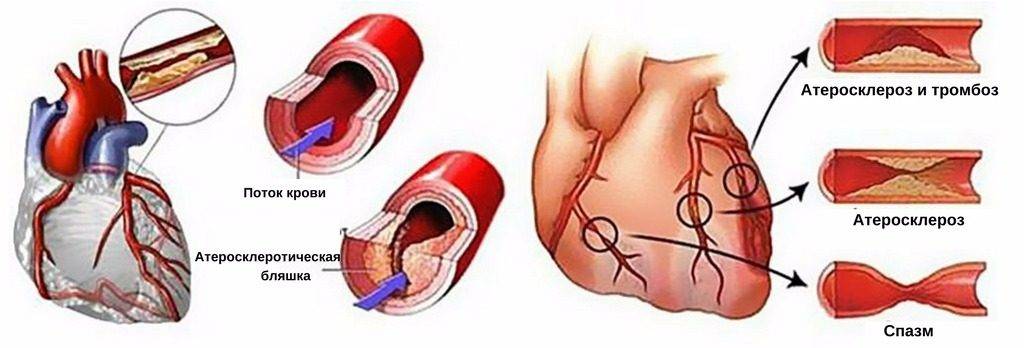 Различают следующие формы заболевания:
Различают следующие формы заболевания:
- абдоминальную, для которой характерны боли, локализующиеся в области желудка либо пищевода, а также тошнота и иногда рвота;
- отечную, признаком которой служат сильные отеки конечностей, сердечная недостаточность и одышка – свидетельство обширного очага некротизации тканей;
- церебральную, сопровождаемую шумом в ушах, головокружениями, потерей сознания, наиболее часто встречающуюся у пожилых людей;
- аритмическую, характеризующуюся приступами учащенного биения сердца;
- астматическую, с проявлениями в виде приступов удушья, кашлем, обильным холодным потом;
- периферическую, по симптоматике иногда напоминающую межреберную невралгию, с локализацией болевых ощущений в разных местах – в лопатке, нижней челюсти, кисти руки и т.д.
Кроме перечисленных, медики выделяют так называемую стертую форму, когда жалобы при инфаркте миокарда практически полностью отсутствуют.
Постановка диагноза
Помимо физикального обследования, изучения анамнеза и жалоб пациента, важную роль в диагностике инфаркта миокарда играют лабораторные и инструментальные исследования. В их число обычно входят:
- ЭКГ и ЭхоКГ;
- сцинтиграфия сердечной мышцы;
- коронарографическое исследование;
- МРТ пораженного органа;
- общий анализ крови;
- биохимические анализы крови для выявления маркеров некроза.
Эти исследования проводят как в первые часы после начала лечения, так и при наступлении последующих стадий процесса.
Проблемы и сложности лечения
Для успеха выздоровления чрезвычайно важна первая помощь при инфаркте миокарда, которую больной получает сразу после начала приступа. Желательно, чтобы рядом оказались люди, которые:
- помогут принять удобную полусидячую позу с ногами, согнутыми в коленях;
- расстегнут сдавливающую одежду, высвобождая грудь и шею для доступа воздуха;
- положат под язык больного таблетки нитроглицерина и аспирина, предварительно растертые в порошок для быстрого усвоения;
- вызовут бригаду неотложной помощи при инфаркте миокарда.
При этом заболевании важно без промедления доставить больного в специализированное медицинское учреждение, в котором есть условия для полноценной кардиологической реанимации. Чем быстрее будут предприняты усилия, тем более благоприятны перспективы восстановления здоровья и тем ниже риски развития осложнений инфаркта миокарда.
Внимание!
Вы можете бесплатно вылечить это заболевание и получить медицинскую помощь в АО «Медицина» (клиника академика Ройтберга) по программе Государственных гарантий ОМС (Обязательного медицинского страхования) и ВМП (выскокотехнологичной медицинской помощи).
Чтобы узнать подробности, позвоните, пожалуйста, по телефону +7(495) 775-73-60, или на странице ВМП по ОМС
Лечение
Лечебный процесс включает несколько этапов, каждый из которых проходит в особых условиях.
- Догоспитальный. Бригада скорой помощи выполняет первичные реанимационные действия и доставляет пациента в стационар.
- Госпитальный. Врачи специализированного отделения сосудистой хирургии проводят непосредственное лечение инфаркта миокарда в острейшей и острой стадии болезни.
- Реабилитационный. В специальном отделении больницы или кардиосанатории больной проходит реабилитацию после инфаркта миокарда, позволяющую максимально восстановить функции организма под наблюдением врачей.
- Амбулаторный. В постинфарктном периоде пациент возвращается к обычной жизни, периодически посещая специалиста в поликлинике по месту жительства.
Лечение инфаркта миокарда в стационаре решает три основные задачи.
- Первая – купирование болей, возникающих при некрозе мышечной ткани.
- Вторая – ограничение зоны некроза введением антикоагулянтных препаратов и тромболитиков.
- Третья – предотвращение развития тяжелых осложнений (острой сердечной недостаточности, аритмии и т.д.) при помощи специальных лекарственных препаратов.
При несвоевременном оказании медицинской помощи либо при попытках лечения инфаркта миокарда дома так называемыми народными средствами, существенно повышается риск развития осложнений и даже становится возможным летальный исход.
Возможные осложнения
Основная проблема заключается в том, что осложнения при инфаркте миокарда могут развиваться уже в первые часы или первые дни. К ранним проявлениям относят различные виды аритмий, наиболее опасным из которых является мерцание желудочков, создающее высокий риск летального исхода. Кроме того, возможны расстройства кровообращения, травмы сердца, тромбоэмболии, перикардиты и др. Наиболее опасными из поздних осложнений инфаркта миокарда являются синдром Дресслера, эндокардит, нарушения иннервации, хроническая недостаточность сердечной функции.
Профилактические меры
Приложив определенные усилия, каждый человек может существенно понизить риск развития столь серьезного заболевания. Меры по профилактике инфаркта миокарда достаточно просты: нужно ограничить количество жирных продуктов и жареной пищи в рационе, отказаться от курения и минимизировать количество спиртных напитков, контролировать уровень холестерина и сахара в крови. Не следует забывать о физической активности, которая должна быть посильной и регулярной. Кроме того, следует избегать чрезмерного напряжения, как физического, так и эмоционального. Поддержание здоровья до глубокой старости всецело находится в наших руках.
Вопросы и ответы
Как избежать повторного заболевания?
В реабилитационном периоде и далее до конца жизни инфарктнику придется придерживаться определенных правил:
- исключить тяжелые физические нагрузки, но не отказываться от умеренной активности;
- соблюдать специальную диету с пониженным количеством животных жиров, соли и острых приправ;
- регулярно посещать лечащего врача.
В целом, следует избегать ситуаций, создающих резкую нагрузку на сердечную мышцу.
Какое давление оптимально после инфаркта миокарда?
Успешность реабилитации подтверждается:
- Отсутствием либо снижением загрудинных болей;
- Поддержанием давления в пределах 130/80 мм рт. ст.;
- Уровнем холестерина не выше 4-4,5 ммоль/л;
- Уровнем глюкозы не выше 6 ммоль/л.
При поддержании этих показателей в течение дальнейшей жизни риск повторного инфаркта миокарда снижается до минимума.
Бывает ли инфаркт правого желудочка?
Да, бывает, хотя и намного реже, чем инфаркт левого желудочка. Среди его симптомов следует назвать:
- одышку, недостаток воздуха для дыхания;
- загрудинные боли;
- головокружения, обморок;
- спутанное сознание;
- уменьшение выделения мочи;
- посинение конечностей из-за застоя венозной крови;
- вздутые вены на шее.
Основной задачей лечения становится восстановление кровообращения, особенно в поврежденных коронарных сосудах.
Инфаркт миокарда — причины, симптомы, диагностика и лечение
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
Общие сведения
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
В возрасте 40-60 лет инфаркт миокарда в 3–5 раз чаще наблюдается у мужчин в связи с более ранним (на 10 лет раньше, чем у женщин) развитием атеросклероза. После 55-60 лет заболеваемость среди лиц обоего пола приблизительно одинакова. Показатель летальности при инфаркте миокарда составляет 30—35%. Статистически 15—20% внезапных смертей обусловлены инфарктом миокарда.
Нарушение кровоснабжения миокарда на 15-20 и более минут приводит к развитию необратимых изменений в сердечной мышце и расстройству сердечной деятельности. Острая ишемия вызывает гибель части функциональных мышечных клеток (некроз) и последующее их замещение волокнами соединительной ткани, т. е. формирование постинфарктного рубца.
В клиническом течении инфаркта миокарда выделяют пять периодов:
- 1 период – предынфарктный (продромальный): учащение и усиление приступов стенокардии, может продолжаться несколько часов, суток, недель;
- 2 период – острейший: от развития ишемии до появления некроза миокарда, продолжается от 20 минут до 2 часов;
- 3 период – острый: от образования некроза до миомаляции (ферментативного расплавления некротизированной мышечной ткани), длительность от 2 до 14 суток;
- 4 период – подострый: начальные процессы организации рубца, развитие грануляционной ткани на месте некротической, продолжительность 4-8 недель;
- 5 период – постинфарктный: созревание рубца, адаптация миокарда к новым условиям функционирования.
Инфаркт миокарда
Причины инфаркта миокарда
Инфаркт миокарда является острой формой ИБС. В 97—98% случаев основой для развития инфаркта миокарда служит атеросклеротическое поражение венечных артерий, вызывающее сужение их просвета. Нередко к атеросклерозу артерий присоединяется острый тромбоз пораженного участка сосуда, вызывающий полное или частичное прекращение кровоснабжения соответствующей области сердечной мышцы. Тромбообразованию способствует повышенная вязкость крови, наблюдаемая у пациентов с ИБС. В ряде случаев инфаркт миокарда возникает на фоне спазма ветвей венечных артерий.
Развитию инфаркта миокарда способствуют сахарный диабет, гипертоничесая болезнь, ожирение, нервно-психическое напряжение, увлечение алкоголем, курение. Резкое физическое или эмоциональное напряжение на фоне ИБС и стенокардии может спровоцировать развитие инфаркта миокарда. Чаще развивается инфаркт миокарда левого желудочка.
Классификация инфаркта миокарда
В соответствии с размерами очагового поражения сердечной мышцы выделяют инфаркт миокарда:
- крупноочаговый
- мелкоочаговый
На долю мелкоочаговых инфарктов миокарда приходится около 20% клинических случаев, однако нередко мелкие очаги некроза в сердечной мышце могут трансформироваться в крупноочаговый инфаркт миокарда (у 30% пациентов). В отличие от крупноочаговых, при мелкоочаговых инфарктах не возникают аневризма и разрыв сердца, течение последних реже осложняется сердечной недостаточностью, фибрилляцией желудочков, тромбоэмболией.
В зависимости от глубины некротического поражения сердечной мышцы выделяют инфаркт миокарда:
- трансмуральный — с некрозом всей толщи мышечной стенки сердца (чаще крупноочаговый)
- интрамуральный – с некрозом в толще миокарда
- субэндокардиальный – с некрозом миокарда в зоне прилегания к эндокарду
- субэпикардиальный — с некрозом миокарда в зоне прилегания к эпикарду
По изменениям, фиксируемым на ЭКГ, различают:
- «Q-инфаркт» — с формированием патологического зубца Q, иногда желудочкового комплекса QS (чаще крупноочаговый трансмуральный инфаркт миокарда)
- «не Q-инфаркт» – не сопровождается появлением зубца Q, проявляется отрицательными Т-зубцами (чаще мелкоочаговый инфаркт миокарда)
По топографии и в зависимости от поражения определенных ветвей коронарных артерий инфаркт миокарда делится на:
- правожелудочковый
- левожелудочковый: передней, боковой и задней стенок, межжелудочковой перегородки
По кратности возникновения различают инфаркт миокарда:
- первичный
- рецидивирующий (развивается в срок 8 недель после первичного)
- повторный (развивается спустя 8 недель после предыдущего)
По развитию осложнений инфаркт миокарда подразделяется на:
- осложненный
- неосложненный
По наличию и локализации болевого синдрома выделяют формы инфаркта миокарда:
- типичную – с локализацией боли за грудиной или в прекардиальной области
- атипичные — с атипичными болевыми проявлениями:
- периферические: леволопаточная, леворучная, гортанно-глоточная, нижнечелюстная, верхнепозвоночная, гастралгическая (абдоминальная)
- безболевые: коллаптоидная, астматическая, отечная, аритмическая, церебральная
- малосимптомную (стертую)
- комбинированную
В соответствии с периодом и динамикой развития инфаркта миокарда выделяют:
- стадию ишемии (острейший период)
- стадию некроза (острый период)
- стадию организации (подострый период)
- стадию рубцевания (постинфарктный период)
Симптомы инфаркта миокарда
Предынфарктный (продромальный) период
Около 43% пациентов отмечают внезапное развитие инфаркта миокарда, у большей же части больных наблюдается различный по продолжительности период нестабильной прогрессирующей стенокардии.
Острейший период
Типичные случаи инфаркта миокарда характеризуются чрезвычайно интенсивным болевым синдромом с локализацией болей в грудной клетке и иррадиацией в левое плечо, шею, зубы, ухо, ключицу, нижнюю челюсть, межлопаточную зону. Характер болей может быть сжимающим, распирающим, жгучим, давящим, острым («кинжальным»). Чем больше зона поражения миокарда, тем более выражена боль.
Болевой приступ протекает волнообразно (то усиливаясь, то ослабевая), продолжается от 30 минут до нескольких часов, а иногда и суток, не купируется повторным приемом нитроглицерина. Боль сопряжена с резкой слабостью, возбуждением, чувством страха, одышкой.
Возможно атипичное течение острейшего периода инфаркта миокарда.
У пациентов отмечается резкая бледность кожных покровов, липкий холодный пот, акроцианоз, беспокойство. Артериальное давление в период приступа повышено, затем умеренно или резко снижается по сравнению с исходным (систолическое < 80 рт. ст., пульсовое < 30 мм мм рт. ст.), отмечается тахикардия, аритмия.
В этот период может развиться острая левожелудочковая недостаточность (сердечная астма, отек легких).
Острый период
В остром периоде инфаркта миокарда болевой синдром, как правило, исчезает. Сохранение болей бывает вызвано выраженной степенью ишемии околоинфарктной зоны или присоединением перикардита.
В результате процессов некроза, миомаляции и перифокального воспаления развивается лихорадка (от 3-5 до 10 и более дней). Длительность и высота подъема температуры при лихорадке зависят от площади некроза. Артериальная гипотензия и признаки сердечной недостаточности сохраняются и нарастают.
Подострый период
Болевые ощущения отсутствуют, состояние пациента улучшается, нормализуется температура тела. Симптомы острой сердечной недостаточности становятся менее выраженными. Исчезает тахикардия, систолический шум.
Постинфарктный период
В постинфарктном периоде клинические проявления отсутствуют, лабораторные и физикальные данные практически без отклонений.
Атипичные формы инфаркта миокарда
Иногда встречается атипичное течение инфаркта миокарда с локализацией болей в нетипичных местах (в области горла, пальцах левой руки, в зоне левой лопатки или шейно-грудного отдела позвоночника, в эпигастрии, в нижней челюсти) или безболевые формы, ведущими симптомами которых могут быть кашель и тяжелое удушье, коллапс, отеки, аритмии, головокружение и помрачение сознания.
Атипичные формы инфаркта миокарда чаще встречаются у пожилых пациентов с выраженными признаками кардиосклероза, недостаточностью кровообращения, на фоне повторного инфаркта миокарда.
Однако атипично протекает обычно только острейший период, дальнейшее развитие инфаркта миокарда становится типичным.
Стертое течение инфаркта миокарда бывает безболевым и случайно обнаруживается на ЭКГ.
Осложнения
Нередко осложнения возникают уже в первые часы и дни инфаркта миокарда, утяжеляя его течение. У большинства пациентов в первые трое суток наблюдаются различные виды аритмий: экстрасистолия, синусовая или пароксизмальная тахикардия, мерцательная аритмия, полная внутрижелудочковая блокада. Наиболее опасно мерцание желудочков, которое может перейти в фибрилляцию и привести к гибели пациента.
Левожелудочковая сердечная недостаточность характеризуется застойными хрипами, явлениями сердечной астмы, отека легких и нередко развивается в острейший период инфаркта миокарда. Крайне тяжелой степенью левожелудочковой недостаточности является кардиогенный шок, развивающийся при обширном инфаркте и обычно приводящий к летальному исходу. Признаками кардиогенного шока служит падение систолического АД ниже 80 мм рт. ст., нарушение сознания, тахикардия, цианоз, уменьшение диуреза.
Разрыв мышечных волокон в зоне некроза может вызывать тампонаду сердца — кровоизлияние в полость перикарда. У 2-3% пациентов инфаркт миокарда осложняется тромбоэмболиями системы легочной артерии (могут стать причиной инфаркта легких или внезапной смерти) или большого круга кровообращения.
Пациенты с обширным трансмуральным инфарктом миокарда в первые 10 суток могут погибнуть от разрыва желудочка вследствие острого прекращения кровообращения. При обширном инфаркте миокарда может возникать несостоятельность рубцовой ткани, ее выбухание с развитием острой аневризмы сердца. Острая аневризма может трансформироваться в хроническую, приводящую к сердечной недостаточности.
Отложение фибрина на стенках эндокарда приводит к развитию пристеночного тромбоэндокардита, опасного возможностью эмболии сосудов легких, мозга, почек оторвавшимися тромботическими массами. В более позднем периоде может развиться постинфарктный синдром, проявляющийся перикардитом, плевритом, артралгиями, эозинофилией.
Диагностика инфаркта миокарда
Среди диагностических критериев инфаркта миокарда важнейшими являются анамнез заболевания, характерные изменения на ЭКГ, показатели активности ферментов сыворотки крови. Жалобы пациента при инфаркте миокарда зависят от формы (типичной или атипичной) заболевания и обширности поражение сердечной мышца. Инфаркт миокарда следует заподозрить при тяжелом и продолжительном (дольше 30-60 минут) приступе загрудинных болей, нарушении проводимости и ритма сердца, острой сердечной недостаточности.
К характерным изменениям ЭКГ относятся формирование отрицательного зубца Т (при мелкоочаговом субэндокардиальном или интрамуральном инфаркте миокарда), патологического комплекса QRS или зубца Q (при крупноочаговом трансмуральном инфаркте миокарда). При ЭхоКГ выявляется нарушение локально сократимости желудочка, истончение его стенки.
В первые 4-6 часов после болевого приступа в крови определяется повышение миоглобина — белка, осуществляющего транспорт кислорода внутрь клеток.Повышение активности креатинфосфокиназы (КФК) в крови более чем на 50% наблюдается спустя 8—10 ч от развития инфаркта миокарда и снижается до нормы через двое суток. Определение уровня КФК проводят через каждые 6-8 часов. Инфаркт миокарда исключается при трех отрицательных результатах.
Для диагностики инфаркта миокарда на более поздних сроках прибегают к определению фермента лактатдегидрогеназы (ЛДГ), активность которой повышается позже КФК – спустя 1-2 суток после формирования некроза и приходит к нормальным значениям через 7-14 дней. Высокоспецифичным для инфаркта миокарда является повышение изоформ миокардиального сократительного белка тропонина — тропонина-Т и тропонина-1, увеличивающихся также при нестабильной стенокардии. В крови определяется увеличение СОЭ, лейкоцитов, активности аспартатаминотрансферазы (АсАт) и аланинаминотрансферазы (АлАт).
Коронарная ангиография (коронарография) позволяет установить тромботическую окклюзию коронарной артерии и снижение желудочковой сократимости, а также оценить возможности проведения аортокоронарного шунтирования или ангиопластики — операций, способствующих восстановлению кровотока в сердце.
Лечение инфаркта миокарда
При инфаркте миокарда показана экстренная госпитализация в кардиологическую реанимацию. В остром периоде пациенту предписывается постельный режим и психический покой, дробное, ограниченное по объему и калорийности питание. В подостром периоде больной переводится из реанимации в отделение кардиологии, где продолжается лечение инфаркта миокарда и осуществляется постепенное расширение режима.
Купирование болевого синдрома проводится сочетанием наркотических анальгетиков (фентанила) с нейролептиками (дроперидолом), внутривенным введением нитроглицерина.
Терапия при инфаркте миокарда направлена на предупреждение и устранение аритмий, сердечной недостаточности, кардиогенного шока. Назначают антиаритмические средства (лидокаин), ß-адреноблокаторы (атенолол), тромболитики (гепарин, ацетилсалициловая к-та), антогонисты Са (верапамил), магнезию, нитраты, спазмолитики и т. д.
В первые 24 часа после развития инфаркта миокарда можно произвести восстановление перфузии путем тромболизиса или экстренной баллонной коронарной ангиопластики.
Прогноз при инфаркте миокарда
Инфаркт миокарда является тяжелым, сопряженным с опасными осложнениями заболеванием. Большая часть летальных исходов развивается в первые сутки после инфаркта миокарда. Насосная способность сердца связана с локализацией и объемом зоны инфаркта. При повреждении более 50% миокарда, как правило, сердце функционировать не может, что вызывает кардиогенный шок и гибель пациента. Даже при менее обширном повреждении сердце не всегда справляется нагрузками, в результате чего развивается сердечная недостаточность.
По истечении острого периода прогноз на выздоровление хороший. Неблагоприятные перспективы у пациентов с осложненным течением инфаркта миокарда.
Профилактика инфаркта миокарда
Необходимыми условиями профилактики инфаркта миокарда являются ведение здорового и активного образа жизни, отказ от алкоголя и курения, сбалансированное питание, исключение физического и нервного перенапряжения, контроль АД и уровня холестерина крови.
Трансмуральный инфаркт миокарда — причины, симптомы, диагностика и лечение
Трансмуральный инфаркт миокарда — это наиболее тяжелая форма некроза кардиальной мышцы, при которой поражаются все слои сердца. Проявляется выраженным болевым синдромом, беспокойным поведением, лихорадкой. Главный этиологический фактор состояния — атеросклероз. Выявление патологии производится с помощью электрокардиографии, лабораторных анализов крови, ангиографии с контрастом. Лечение включает в себя методы консервативной терапии, но приоритетным, наиболее эффективным является хирургическое вмешательство в виде коронарного стентирования, шунтирования, трансмиокардиальной лазерной реваскуляризации.
Общие сведения
Трансмуральный инфаркт миокарда — одна из самых тяжелых, жизнеугрожающих патологий сердца, уже многие годы остающаяся ведущей причиной смерти больных с сердечно-сосудистыми заболеваниями. Госпитальная смертность достигает 10%, а в некоторых регионах России 15%. В течение года после интенсивной терапии умирает еще около 10%. Половина больных с тяжелой формой кардиального некроза погибает на догоспитальном этапе. Мужчины 40-60 лет болеют чаще женщин, пик заболеваемости отмечается после 50 лет. Основная группа пациентов — люди с сопутствующим сахарным диабетом, гиперлипидемией, отягощенным семейным анамнезом.
Трансмуральный инфаркт миокарда
Причины
Подавляющее большинство случаев инфаркта миокарда является следствием окклюзии главного ствола или ветви коронарной артерии. Процесс сопровождается значительным ухудшением снабжения кровью сердечной мышцы. При увеличении нагрузки на кардиальную мышцу она начинает испытывать гипоксию, ее функции снижаются, что приводит к последующему некрозу. В рамках современной медицины выделяют несколько причин сужения просвета венечных сосудов:
- Атеросклероз. Ведущий фактор развития инфаркта, обнаруживаемый у 95% людей, умерших от крупноочаговых процессов. Частый признак — высокий уровень липидов крови. Перекрытие диаметра артерии более чем на 75% вызывает отмирание тканей.
- Тромбоз. Флотирующие образования в кровотоке могут попадать в коронарные сосуды двумя путями: из левого желудочка, в котором образуются в результате фибрилляции предсердий и клапанных патологий, либо при незакрытом овальном окне.
К факторам риска развития инфаркта относят отягощенную наследственность (сердечно-сосудистые заболевания у ближайших родственников), возраст старше 50 лет, многолетний стаж курения. Провоцировать отложение липидов в стенках сосудов может ожирение, недостаточная физическая активность. Группу риска составляют пациенты с установленной артериальной гипертензией, сахарным диабетом, системными заболеваниями (особенно васкулитами).
Патогенез
Трансмуральный инфаркт развивается вследствие нарушения кровоснабжения сердечной мышцы. Адекватность коронарного кровотока запросам миокарда определяется наполненностью венечных артерий, которое зависит от аортального давления и сосудистого сопротивления, насыщенности кислородом, колеблющейся в зависимости от нагрузки на сердце и частоты его сокращений, а также составом плазмы и форменных элементов, меняющемся при гипогидратации, анемиях, токсических отравлениях. Любое нарушение баланса приводит сначала к ишемии, затем к омертвлению кардиальных клеток.
Крупноочаговый характер патологии практически всегда находит отражение в интенсивном болевом синдроме. Это связано с массивным поражением кардиальной мышцы, активацией большого количества болевых рецепторов, значительным снижением ее функции. Массивный очаг некроза может стать причиной попадания в кровь большого количества продуктов распада (миоглобин, тропонины) с развитием системного воспалительного ответа — резорбционно-некротического синдрома.
Симптомы
Трансмуральный инфаркт миокарда обычно имеет выраженную клиническую картину. Наиболее характерным симптомом является интенсивная боль, способная иррадиировать в левую сторону тела — руку, шею, спину, челюсть. Кардиалгия при данной патологии напоминает хорошо знакомый пациентам с заболеваниями сердечно-сосудистой системы приступ стенокардии, но, в отличие от него, крайне сложно купируется, длится более 20 минут.
Применение нитроглицерина, оправданное в большинстве случаев, не дает должного эффекта даже после трех таблеток. Также малоэффективно изменение положения тела, подача свежего воздуха, холодное питье. Помимо боли пациенты могут ощущать головокружение, тошноту вплоть до рвоты. При выраженной сердечной недостаточности на фоне инфаркта появляется одышка, особенно выраженная у женщин. Поражение массивного участка миокарда приводит к нарушению проведения импульса, тахикардии, экстрасистолии, различным блокадам. К общим признакам относят холодный пот, угнетение сознания или эмоциональное возбуждение, выраженную слабость.
Ретроспективно диагностируется около 50% случаев патологии, особенно у пожилых людей или больных сахарным диабетом на фоне развившейся нейропатии, в состоянии после трансплантации сердца. В подобных случаях инфаркт начинается без боли в грудной клетке, поэтому второстепенные признаки приобретают ведущую роль. Нетипичная манифестация может включать в себя инсульт, острый психоз, расстройства пищеварения, периферические эмболии.
Если к общему состоянию присоединяется резорбционно-некротический синдром, к прочим симптомам добавляется повышение температуры тела до 38-39° С на протяжении более 5-7 дней, лейкоцитоз до 15х109/л с преобладанием нейтрофильной фракции. В анализе крови обнаруживается высокая скорость оседания эритроцитов в течение нескольких недель, анэозинофилия. Больные отмечают озноб, сменяющийся жаром, потливость, выраженную слабость.
Осложнения
Трансмуральный инфаркт миокарда способен привести к целому ряду жизнеугрожающих состояний. Самое частое осложнение — нарушения ритма сердца вплоть до фибрилляции желудочков. Нередко наблюдается сердечная недостаточность, обычно – левожелудочковая, сопровождающаяся хрипами, сердечной астмой, отеком легких. Специфическим именно для массивного некроза сердечной мышцы является кардиогенный шок, для которого характерно критическое уменьшение сердечного выброса, падение давления.
К менее частым последствиям относят эмболии в системе легочной артерии, аневризму и разрыв стенки сердца с тампонадой. При затрагивании инфарктом сосочковых мышц может возникнуть недостаточность митрального клапана с острой кардиальной недостаточностью. Описаны случаи так называемого постинфарктного синдрома, появляющегося через одну или несколько недель после болезни как иммунологическая реакция на некротическую ткань. Протекает как перикардит или плеврит с выраженной эозинофилией.
Диагностика
Физикальное обследование не позволяет выявить каких-то надежных диагностических признаков, подтверждающих либо опровергающих инфаркт миокарда, однако имеет большое значение в процессе оценки тяжести состояния больного. Визуально пациент обычно беспокоен, бледен, кожа покрыта холодным потом. Артериальное давление может повышаться на пике болевого приступа, сочетаться с тахикардией. Нередко нарастают признаки левожелудочковой недостаточности. Из инструментальных методик врачи-кардиологи используют:
- Электрокардиографию. Базовый метод диагностики. Изменения на ЭКГ появляются уже во время стенокардии и проходят ряд характерных стадий. Трансмуральный инфаркт характеризуется глубоким и широким зубцом Q, снижением амплитуды R, сегмент ST поднимается над изолинией. Через несколько дней формируется отрицательный зубец Т, сегмент ST снижается. Локализацию процесса определяют по грудным отведениям.
- Лабораторные методы. Массивный некроз мышечной ткани находит свое отражение в общем анализе крови. У пациентов обнаруживается выраженный лейкоцитоз на фоне лихорадки, лейкоцитарный сдвиг влево, увеличение СОЭ. В биохимическом анализе повышается значение внутриклеточных ферментов (АЛТ, АСТ, ЛДГ), отмечается высокий уровень креатининфосфокиназы, тропонинов.
- Коронарная ангиография. Рентгенологический метод, помогающий установить окклюзию коронарной артерии тромбом, оценить функцию желудочков, риск аневризм или разрыва стенок. Является обязательным компонентом предоперационной подготовки перед аортокоронарным шунтированием, ангиопластикой.
Лечение трансмурального инфаркта миокарда
Все больные с подозрением на данную патологию подлежат скорейшей госпитализации в специализированные отделения — реанимации, неотложной кардиологии, сосудистые центры. Терапию начинают на этапе до госпитализации, особенно при активном вызове скорой медицинской помощи, и продолжают стационарно. Больному прописывается строгий постельный режим, психический и эмоциональный покой, диета.
Консервативная терапия
Важнейшей начальной целью лечения является адекватное обезболивание, предотвращение шоковых состояний, жизнеугрожающих аритмий. Применяют сильные обезболивающие средства (морфин, промедол, трамадол), комбинируемые с атропином, кордароном. Назначают ингаляции кислорода, при угрозе фибрилляции желудочков используют дефибрилляцию либо внутривенное введение лидокаина. При подозрении на тромбоз показаны антикоагулянты прямого действия, преимущественно гепарин или стрептокиназа в больших дозировках.
Хирургическое лечение
Непосредственная цель инвазивных методов — восстановление адекватного кровоснабжения миокарда (реваскуляризация). Своевременно сделанная операция может значительно уменьшить зону некроза, снизить риск осложнений, предупредить рецидивы патологии. В настоящее время хирургическое лечение является приоритетным методом в терапии ишемической болезни сердца и инфаркта миокарда, позволяет добиться тех результатов, которые недоступны при медикаментозном воздействии. Применяются:
- Чрескожная коронаропластика. Расширение просвета сосуда достигается путем введения в него сетчатой металлической трубочки. Манипуляция провидится под рентген-контролем, чаще с доступом из бедренной или подключичной артерии. Результат вмешательства по многом зависит от материала, из которого изготовлен стент. В последующем от пациента требуется долгосрочный прием лекарственных средств (гиполипидемических, антитромбоцитарных).
- Аортокоронарное шунтирование. Суть операции заключается в создании обходного пути для тока крови в обход склерозированного или тромбированного участка сосуда. Это более серьезная манипуляция, приводимая на открытом сердце с использованием аппарата искусственного кровообращения. В качестве шунта может применяться как эндогенный материал (части дистальных артерий), так и искусственные импланты.
- Трансмиокардиальная лазерная реваскуляризация. Перспективный хирургический метод лечения, появившийся в последние годы. С помощью специальной лазерной установки в миокарде проделывается несколько десятков тонких сквозных ходов глубиной плоть до желудочковых полостей. По этим ходам кровь поступает непосредственно из камер к мышечным клеткам, минуя коронарные сосуды.
Прогноз и профилактика
Трансмуральный инфаркт наиболее неблагоприятен по прогнозу вследствие высокой вероятности летального исхода еще до момента оказания медицинской помощи, 20% вероятности гибели в первый месяц после приступа. Полноценная своевременная помощь минимизирует эти риски. Профилактика состояния, главным образом, сводится к предупреждению или коррекции атеросклероза. Важна нормализация массы тела, уровня липидов крови, контроль артериального давления, отказ от вредных привычек. Эти мероприятия особенно необходимы лицам с неблагоприятным семейным анамнезом.
Коронарный синдром. Причины, симптомы, признаки, диагностика и лечение патологии :: Polismed.com
Сайт предоставляет справочную информацию. Адекватная диагностика и лечение болезни возможны под наблюдением добросовестного врача. У любых препаратов есть противопоказания. Необходима консультация специалиста, а также подробное изучение инструкции!
Острый коронарный синдром (ОКС) – это один из вариантов предварительного диагноза, который используется в тех случаях, когда нет возможности точно определить характер заболевания (поставить окончательный диагноз). Как правило, этот термин используется в отношении острых клинических проявлений ишемической болезни сердца (ИБС). Ишемическая болезнь, в свою очередь, представляет собой недостаточность питания сердечной мышцы кислородом. Обычно это связано с проблемами на уровне сосудов, питающих сердце. ИБС может развиваться годами, не приводя к серьезным нарушениям работы сердца. Как только нехватка кислорода становится более выраженной, и появляется угроза инфаркта миокарда, болезнь диагностируется как острый коронарный синдром.
Термин ОКС обычно используется в отношении трех основных патологий, которые имеют общий механизм развития и общую причину:
В целом ишемическая болезнь сердца является одной из самых распространенных в мире патологий. По данным Всемирной Организации Здравоохранения (ВОЗ), например, в 2011 году именно эта болезнь унесла жизни более чем 7 млн. человек, став самой распространенной причиной смерти. Эта цифра вполне применима и к ОКС, так как именно он является стадией обострения ИБС. В настоящее время эта патология встречается у мужчин несколько чаще, чем у женщин. Соотношение составляет 1 к 1,5 или 1 к 2 (по различным данным). Проводится множество исследований, которые направлены на изучение причин и факторов, способствующих развитию ОКС. Риск стенокардии и инфарктов сильно увеличивается с возрастом. У детей и подростков при отсутствии врожденных патологий ОКС практически не встречается.
Инфаркт миокарда. Виды, причины и лечение инфаркта миокарда. Кардиогенный шок.
Инфаркт Миокарда (ИМ) — это очаговый некроз (омертвение) сердечной мышцы (миокарда), обусловленный более или менее длительным прекращением доступа крови к миокарду.
В основе этого процесса лежит нарушение проходимости одной из коронарных (венечных) артерий сердца, пораженных атеросклерозом, которая приводит к коронарной недостаточности сердца. Атеросклероз — это длительный процесс, который постепенно ведет к сужению сосудов, замедлению тока крови.
Инфаркт — самое тяжелое проявление ишемической болезни сердца.
Нарушение проходимости коронарных артерий может произойти в результате закупорки артерии тромбом или из-за резкого его сужения — спазма.
Чаще всего в происхождении Инфаркта миокарда одновременно участвуют оба этих фактора.
Возникший в результате нервных влияний (переутомление, волнение, психическая травма и пр) длительный и сильный спазм коронарной артерии, замедлению тока крови в нем и образованию вследствие этого тромба.
В механизме возникновения инфаркта большое значение имеет нарушение процесса свертывания крови: увеличение в крови протромбина и других веществ, повышаюших свертывание крови, что и создает условия для образования тромба в артерии.
При инфарктах миокарда, в благоприятных случаях после расплавления омертвевшей ткани происходит ее рассасывание и замена молодой соединительной тканью (рубцевание). Прочный рубец формируется в течение 1,5 — 6 месяцев.
Реже, при неблагоприятном, тяжелом течении инфаркта, когда сердечная мышца подверглась омертвению на большую глубину, она резко истончается, и под влиянием внутрисердечного давления в этом месте образуется выбухание участка сердечной мышцы — аневризма сердца. На этом месте может произойти разрыв, что может привести к немедленной смерти, но это происходит довольно редко.
Причины инфаркта.
- Тромбоз, тромбоэмболия +атеросклероз.
- Атеросклероз + нервно-психическое напряжение, физическая нагрузка.
- Стресс.
В результате стресса происходит выброс катехоламинов, которые усиливают и учащают сердечные сокращения, вызывающих сужение сосудов, в результате возникает хроническая гипоксия тканей и органов. - Курение.
- Злоупотребление алкоголем.
Инфаркт чаще возникает у мужчин в возрасте 40-60 лет, а иногда и у более молодых. Заболевают чаще лица ведущие малоподвижный образ жизни, склонные к атеросклерозу, гипертонической болезни, ожирению, диабету и другим нарушениям обмена веществ. Около половины случаев инфаркт миокарда возникает на фоне стенокардии, и наоборот — у многих больных стенокардия наступает после перенесенного инфаркта.
Стенокардия и инфаркт миокарда представляют собой разные проявления одного и того же болезненного процесса.
Виды инфарктов миокарда.
Наиболее часто развиваются инфаркты в передней стенке левого желудочка, задней стенке левого желудочка, межжелудочковой перегородке и боковой стенке левого желудочка. Инфаркты правого желудочка встречаются очень редко.
По локализация очага некроза:
1. Инфаркт миокарда левого желудка (передний, боковой, нижний, задний),
2. Изолированный инфаркт миокарда верхушки сердца,
3. Инфаркт миокарда межжелудочковой перегородки,
4. Инфаркт миокарда правого желудочока,
5. Сочетанные локализации: задне-передний, передне-боковой, нижне-боковой и др.
По ширине поражения, определяется по ЭКГ:
1. Крупноочаговый (обширный) инфаркт миокарда (Q-инфаркт),
2. Мелкоочаговый инфаркт миокарда.
По глубине (в зависимости от того, какой слой сердца охвачен):
1. Субэндокардиальные,
2. Субэпикардиальные,
3. Интрамуральные
4. Трансмуральные (охватывает все слои сердца).
По течению:
1. Моноциклический ИМ
2. Затяжной ИМ
3. Рецидивирующий ИМ (развивается новый очаг некроза в течение 3-7 дней)
4. Повторный ИМ (новый очаг развивается через 1месяц)
Электрически немые зоны на ЭКГ— это инфаркт.
На ЭКГ лучше диагностируется трансмуральный инфаркт, инфаркт передней стенки. Трудно определить по ЭКГ инфаркт, который сочетается с аритмией, пароксизмальной тахикардией, блокадами и ЭКГ-негативные формы. По ЭКГ инфаркт определяется в 80% случаев.
Стадии развития инфаркта.
- Период предвестников, продромальный (от нескольких часов до нескольких дней).
Проявляется кратковременными болями в области сердца или за грудиной. В этот период уменьшается кровоснабжение сердца. - Острейший период, болевого приступа (от нескольких часов до 1 суток).
- Острый период, лихорадочный (8-10 дней).
Во 2-ой и 3-ий периоды происходит некроз и размягчение пораженного участка миокарда. - Подострый период (от 10 дней до 4-8 недель). Начинается период выздоровления.
- Период Рубцевания (от 1,5-2 мес. до 6 мес).
Клиника включает 2 синдрома:
1. Болевой синдром (условно)
2. Резапционно-некротический синдром (условно).
- Болевой синдром — это клиническое проявление развивающегося очага некроза. (1-ая стадия некроза).
- Типичный болевой с-м.
Это боль в области сердца, жгучая, давящая, иррадиирующая шире, чем при стенокардии в левую руку, правую, челюсть. Нет положения, успокаивающего боль. Боль нарастающая, больной бледный, появление липкого холодного пота, цвет кожных покровов серо-бледный, потом восковидный, может быть одутловатое лицо, аритмия. Систолическое давление падает, диастолическое остается на одном уровне или поднимается. Уменьшение расстояния АД между систолическим и диастолическим — признак инфаркта. Пульс слабый, нитевидный. Тоны глухие.
- Атипичный болевой с-м.
1-ая группа — Гастралгическая боль, изжога, слабость, рвота через 5-10 мин после еды, как правило сопровождается нарушением стула, вздутием живота.
2-ая группа — Безболевой синдром, по типу приступа сердечной астмы (status astmaticus), удушье, клокочущее дыхание. Но вводить эуфиллин при инфаркте, острой лево-желудочковой недостаточности нельзя.
Аритмическая форма — пока аритмия не купирована, больного надо лечить как при инфаркте.
Преходящие мозговые нарушения.- Бессимптомная форма — жалоб нет.
- Резапционно-некротический синдром — клинические проявления уже развившегося очага некроза, развившегося в очаге асептического воспаления. (2-ая стадия инфаркта).
- Резапционно-некротический синдром — это уже к концу первых суток и к началу вторых поднимается температура до 37,5—38,5 С. Температура должна в течение 7 дней нормализоваться. Но если длится более 7 дней , значит появились осложнения.
Лабораторные данные.
К концу первых суток появляется лейкоцитоз — 10-12000 (умеренно-нейтрофильный), стессовый — до 20000 лейкоцитов. В моче появляется белок, моча окрашена в красный цвет(миоглобинурия, миоглобин выходит). Миоглобин выходит при травмах мышц, в большом количестве может забить почечные фильтры и привести к почечной недостаточности. Ускорение СОЭ происходит в конце первых суток. А через 3-4 недели нормализуется.
К концу первых суток поднимается фибриноген А. В крови появляется патологический фибриноген В ( до ++++). Фибриноген В должен нормализоваться на 3-4 день. Фибриноген В повышается, если больному вводят фибринолитические вещества. С-реактивный белок появляется в острую стадию воспаления.
Повышение внутриклеточных трансаминаз при инфаркте описал Врублевский. Трансаминазы – это катализаторные ферменты в клетках. Клетки стареют, разрушаются, трансаминазы выходят в в кровь. Когда много клеток погибает, трансаминазы в большом количестве смываются кровью, миокард работает более активно — метаболическая гипертрофия. При инфаркте увеличивается количество трансаминаз АЛАТ, АСАТ, креатинфосфатазы, креатинфосфогеназы, лактатдегидрогеназы.
Увеличение ферментов — хороший метод диагностики, но только в острой фазе.
Эхокардиограмма — определяет очаги на любой стадии, но не определяет время развития инфаркта.
Лечение проводят в стационаре под мониторным наблюдением. Необходимо состояние покоя, небольшие движения, обязательное купирование боли.
- Можно грелку на сердце, теплый чай, подержать во рту водку или коньяк, анальгин, обезболивающие.
Морфий, Промедол и др. в/в с малыми дозами Атропина 0,3-0,5мл сочетать с Антигистаминными препаратами.
Таламанал 1 мл = 1мл Дроперидола + 1 мл Фентанал - Больной не должен спать, должен говорить. Нужно управлать дыханием (вдох — задержать — выдох).
Давать кислород через подушку, но через маску, давать увлажненный кислород через спирт.
Закись Азота 50% + Кислород 50%. Закись азота давать через наркозный аппарат. - Если есть тахикардия нужно давать в/в капельно поляризующую смесь ГИК (Глюкоза + Инсулин + Калий), KCl 1500–4500 + 5% Глюкозы + 4 ед. Инсулина на 200 мл. Затем 6 ед. Инсулина на 200 мл.
Нельзя вместо KCl давать NaCl. Диабетикам вместо глюкозы можно давать р-р Рингера или увеличить дозу Инсулина - Больному вводится 5-10 тыс. Гепарина, струйно, капельно, в эту же капельницу, что и смесь ГИК.
Лидокаин 1мл. струйно, затем капельно, B-блокаторы, Нитроглицерин в/в - Если развивается брадикардия, больному через каждые 2 часа вводится Атропин.
- При дефибрилляции желудочка — массаж сердца, дефибрилляторы.
- Если давление падает, в капельницу добавляем Кордиамин.
Лечение Кардиогенного Шока.
Применяют все методы, как при остром инфаркте + остальное. Обязательно обезболивание.
Кардиогенный шок связан с падением AD, с резким снижением сократительной способности миокарда.
- Даем Мезатон, если не помогает, то Адреналин, Норадреналин кап, в/в, если падает AD.
Норадреналин 0,2 п/к, в каждую руку. Допамин – кап, под контролем AD. - Можно давать Сердечные гликозиды в/в кап. Строфантин может дать остановку сердца. Корглюкон 0,06% до 2,0 мл — лучший сердечный гликозид, не кумулирует в организме.
- При кардиогенном шоке развивается ацидоз, можно давать капельно раствор Соды, Кокарбоксилаза — капельно можно до 200 мг (4 ампулы), в/м больше 50 мг нельзя.
- При кардиогенном шоке первое введение Гепарина — до 20 тыс. ед, суточная доза доходит до 100 тыс.ед.
В некоторых случаях применяют методы наружной и внутренней контрпульсации.
Резапционно-некротический — клинические проявления уже развившегося очага некроза, развившегося в очаге асептического воспаления. (2-ая стадия инфаркта).
Некроз миокарда | Определение некроза миокарда по Медицинскому словарю
относится к мышечной ткани сердца (миокарду).
инфаркт миокарда (MI) гибель клеток области сердечной мышцы (миокарда) в результате кислородного голодания, которое, в свою очередь, вызвано нарушением кровоснабжения; обычно называют «сердечным приступом».
Миокард получает кровоснабжение от двух крупных коронарных артерий и их ветвей.Окклюзия одного или нескольких из этих кровеносных сосудов (коронарная окклюзия) является одной из основных причин инфаркта миокарда. Окклюзия может возникать в результате образования сгустка, который внезапно развивается, когда атероматозная бляшка прорывается через подслои кровеносного сосуда или когда узкая шероховатая внутренняя оболочка склерозированной артерии приводит к полному тромбозу. Ишемическая болезнь сердца — самый распространенный вид сердечных заболеваний в США и многих других странах. Риск быстро возрастает с возрастом, у женщин заболевание развивается на 15-20 лет позже, чем у мужчин.
Другие причины инфаркта миокарда могут быть связаны с внезапным увеличением неудовлетворенной потребности в кровоснабжении сердца, например, при шоке, кровотечении и тяжелых физических нагрузках, а также с ограничением кровотока через аорту, как при стенозе аорты.
Патология. Наиболее частые очаги инфаркта миокарда находятся в левом желудочке, той камере сердца, которая имеет наибольшую нагрузку. Тканевые изменения, происходящие в миокарде, связаны с тем, насколько клетки лишены кислорода.Полная депривация приводит к очагу инфаркта, в котором клетки погибают, а ткань некротизируется. Некроз в этой области проявляется в течение 5-6 часов после окклюзии. В ответ на этот некроз организм увеличивает выработку лейкоцитов, которые помогают удалять мертвые клетки. По мере увеличения коллатерального кровообращения он приносит фибробласты, которые образуют соединительнотканный рубец в области инфаркта. Обычно формирование фиброзной рубцовой ткани завершается в течение 2–3 месяцев.
Непосредственно вокруг области инфаркта находится менее серьезно поврежденная область травмы. Он может ухудшиться и таким образом расширить область инфаркта или, при адекватном коллатеральном кровообращении, он может восстановить свою функцию в течение 2–3 недель.
Самая удаленная зона повреждения — это зона ишемии , граничащая с зоной повреждения . Клетки в этой области ослаблены из-за снижения поступления кислорода, но функция может вернуться обычно в течение двух-трех недель после начала окклюзии.
Все описанные выше патологические изменения можно идентифицировать с помощью электрокардиографии. Полученная таким образом информация используется для назначения той или иной степени физической активности, разрешенной пациенту во время выздоровления.
Факторы риска. Неизбежные черты, которые увеличивают шансы человека на ишемическую болезнь сердца, включают генетическую предрасположенность, пол, возраст и сахарный диабет. Факторы, которые можно до некоторой степени контролировать, чтобы снизить риск, включают гипертонию, курение сигарет и повышенный уровень липидов в сыворотке крови.Почти половина людей, перенесших сердечные приступы, имеют в анамнезе один или несколько из этих последних трех факторов риска. Сведение к минимуму или устранение этих факторов, которых можно избежать, может снизить частоту и тяжесть ишемической болезни сердца. Профилактические меры подробно рассматриваются в разделе «Симптомы». Наиболее ярким симптомом острого инфаркта миокарда является внезапное болезненное ощущение давления, часто описываемое как «давящая боль» в груди, иногда иррадирующая в руки, горло и спину и сохраняющаяся в течение нескольких часов.Присутствуют бледность, обильное потоотделение и другие признаки шока. Могут возникать тошнота и рвота, приводящие к ошибочному впечатлению, что пострадавший страдает острым несварением желудка. Почти во всех случаях тяжелого инфаркта миокарда пациент испытывает крайние опасения и чувство неминуемой смерти.
Тяжесть симптомов может зависеть от размера артерии в месте окклюзии и количества миокардиальной ткани, обслуживаемой артерией. В некоторых случаях артерия может быть маленькой, а симптомы слабыми.В других случаях степень повреждения довольно велика, и нападение заканчивается смертельным исходом.
В течение 24 часов после первого приступа наблюдается повышение температуры и увеличение количества лейкоцитов в ответ на воспалительный процесс, возникающий в результате некроза ткани миокарда. Гибель клеток также вызывает высвобождение определенных ферментов, которые попадают в общую циркуляцию. Уровни этих ферментов в крови можно определить с помощью клинических лабораторных исследований. В течение 2–4 часов после инфаркта уровень креатинкиназы (КК) повышается; он достигает своего пика в течение 24 часов и спадает до нормального уровня в течение 48 часов.Уровень сывороточной аспартаттрансаминазы (AST) быстро увеличивается за 4-6 часов, достигает пика через 24-48 часов и возвращается к норме через пять дней. В отличие от быстрого повышения и снижения этих двух уровней ферментов, уровни лактатдегидрогеназы (ЛД) начинают увеличиваться в первый день после приступа и сохраняются на высоком уровне в течение 10-20 дней. тропонин — еще один фермент, который является чувствительным маркером инфаркта миокарда. Тесты можно сделать более конкретными, измерив изоферменты LD 1 и CK 2 , которые обнаружены в сердце.Диагноз ИМ основан на имеющихся симптомах и признаках нарушения функции сердца, обнаруженных при физикальном обследовании и электрокардиографии, а также на аномальных уровнях ферментов в сыворотке.
Лечение и уход за пациентами. Немедленное лечение острого инфаркта миокарда связано с борьбой с шоком, облегчением респираторной недостаточности и предотвращением дальнейшего кровообращения. Пострадавшего следует держать в лежачем положении, а вся тесная одежда должна быть расстегнута, чтобы уменьшить одышку и обеспечить комфорт. Следует подавать дополнительный кислород, а потребление кислорода следует снижать за счет снятия тревоги и боли и поддержки дыхания.Без промедления, но спокойно, пациента доставят в медицинское учреждение. Если у пострадавшего появляются признаки остановки сердца, немедленно приступают к сердечно-легочной реанимации.
Медикаментозное лечение включает назначение тромболитической терапии и анальгетиков, таких как сульфат морфина или меперидин (демерол). Иногда врач может назначить сульфат атропина с морфином для противодействия серьезной брадикардии. Почти во всех случаях кислород вводят в течение как минимум первых 24 часов.
Внутривенная тромболитическая терапия с использованием тканевого активатора плазминогена или стрептокиназы должна рассматриваться для всех пациентов, поступивших в течение 12 часов с момента появления боли. Максимальный потенциальный эффект достигается, когда эти препараты вводятся в течение 4-6 часов. Соображения по уходу включают раннюю точную оценку потенциальных кандидатов на тромболитическую терапию, быстрое введение лекарств и тщательный мониторинг осложнений, таких как аритмия, гипотензия, аллергические реакции, повторная окклюзия и кровотечение.Ранняя катетеризация и ангиопластика с помощью стента также могут быть выполнены, и это может быть лучше, чем внутривенная тромболитическая терапия.
Отдых необходим для восстановления поврежденных клеток миокарда, но это не обязательно означает абсолютный постельный режим. Будет ли пациенту обеспечен постельный режим или разрешено лечь в кресло, зависит от симптомов и суждений медсестры. Во время острой стадии некоторые врачи могут предпочесть, чтобы пациент отдыхал в кресле у постели больного. Пациенту разрешают встать с постели с помощью и сидеть в кресле до тех пор, пока он не почувствует усталость.Время, в течение которого пациенту позволяют сесть и стать более физически активным, постепенно увеличивается.
Достаточного отдыха легче достичь, если уменьшить психическое беспокойство; Считается, что спокойная обстановка улучшает способность к отдыху. Количество необходимого отдыха и допустимая степень физической активности зависят от предполагаемой обширной области инфаркта, развития сердечных аритмий и других осложнений и реакции пациента на повышенную физическую активность.Тщательный мониторинг частоты пульса и артериального давления до и после каждого занятия может предоставить информацию, с помощью которой можно оценить переносимость пациентом физических упражнений и действий по уходу за собой.
Большинство пациентов с инфарктом миокарда находятся на лечении в коронарном отделении во время острой стадии. Важно, чтобы пациенту и его семье было дано краткое объяснение различных типов используемого оборудования для мониторинга и чтобы они были уверены в том, что каждый сотрудник заботится о благополучии пациента.
По мере улучшения состояния пациента его постепенно отлучают от интенсивной терапии и поощряют к более активному участию в уходе за собой. Для некоторых это травмирующий опыт, и они очень опасаются оставить безопасность мониторов и внимание персонала. Кардиологическая реабилитация также является важным аспектом лечения. В некоторых больницах переход из отделения коронарной терапии в дом упрощается за счет перевода в отделение «понижения» или промежуточного ухода, где отслеживается реакция пациента на действия и даются инструкции относительно ухода за собой после выписки.Информацию о местных коронарных клубах, помощи в обучении пациентов и наличии отделения оценки кардиологической работы для определения готовности пациента вернуться к работе можно получить, связавшись с местным отделением Американской кардиологической ассоциации.
Инфаркт миокарда. Из Frazier et al., 2000.
Энциклопедия и словарь Миллера-Кина по медицине, сестринскому делу и смежным вопросам здравоохранения, седьмое издание. © 2003 Saunders, принадлежность Elsevier, Inc. Все права защищены.
Ишемический некроз миокарда | определение ишемического некроза миокарда Медицинским словарем
, относящимся к мышечной ткани сердца (миокарду).
инфаркт миокарда (MI) гибель клеток области сердечной мышцы (миокарда) в результате кислородного голодания, которое, в свою очередь, вызвано нарушением кровоснабжения; обычно называют «сердечным приступом».
Миокард получает кровоснабжение от двух крупных коронарных артерий и их ветвей.Окклюзия одного или нескольких из этих кровеносных сосудов (коронарная окклюзия) является одной из основных причин инфаркта миокарда. Окклюзия может возникать в результате образования сгустка, который внезапно развивается, когда атероматозная бляшка прорывается через подслои кровеносного сосуда или когда узкая шероховатая внутренняя оболочка склерозированной артерии приводит к полному тромбозу. Ишемическая болезнь сердца — самый распространенный вид сердечных заболеваний в США и многих других странах. Риск быстро возрастает с возрастом, у женщин заболевание развивается на 15-20 лет позже, чем у мужчин.
Другие причины инфаркта миокарда могут быть связаны с внезапным увеличением неудовлетворенной потребности в кровоснабжении сердца, например, при шоке, кровотечении и тяжелых физических нагрузках, а также с ограничением кровотока через аорту, как при стенозе аорты.
Патология. Наиболее частые очаги инфаркта миокарда находятся в левом желудочке, той камере сердца, которая имеет наибольшую нагрузку. Тканевые изменения, происходящие в миокарде, связаны с тем, насколько клетки лишены кислорода.Полная депривация приводит к очагу инфаркта, в котором клетки погибают, а ткань некротизируется. Некроз в этой области проявляется в течение 5-6 часов после окклюзии. В ответ на этот некроз организм увеличивает выработку лейкоцитов, которые помогают удалять мертвые клетки. По мере увеличения коллатерального кровообращения он приносит фибробласты, которые образуют соединительнотканный рубец в области инфаркта. Обычно формирование фиброзной рубцовой ткани завершается в течение 2–3 месяцев.
Непосредственно вокруг области инфаркта находится менее серьезно поврежденная область травмы. Он может ухудшиться и таким образом расширить область инфаркта или, при адекватном коллатеральном кровообращении, он может восстановить свою функцию в течение 2–3 недель.
Самая удаленная зона повреждения — это зона ишемии , граничащая с зоной повреждения . Клетки в этой области ослаблены из-за снижения поступления кислорода, но функция может вернуться обычно в течение двух-трех недель после начала окклюзии.
Все описанные выше патологические изменения можно идентифицировать с помощью электрокардиографии. Полученная таким образом информация используется для назначения той или иной степени физической активности, разрешенной пациенту во время выздоровления.
Факторы риска. Неизбежные черты, которые увеличивают шансы человека на ишемическую болезнь сердца, включают генетическую предрасположенность, пол, возраст и сахарный диабет. Факторы, которые можно до некоторой степени контролировать, чтобы снизить риск, включают гипертонию, курение сигарет и повышенный уровень липидов в сыворотке крови.Почти половина людей, перенесших сердечные приступы, имеют в анамнезе один или несколько из этих последних трех факторов риска. Сведение к минимуму или устранение этих факторов, которых можно избежать, может снизить частоту и тяжесть ишемической болезни сердца. Профилактические меры подробно рассматриваются в разделе «Симптомы». Наиболее ярким симптомом острого инфаркта миокарда является внезапное болезненное ощущение давления, часто описываемое как «давящая боль» в груди, иногда иррадирующая в руки, горло и спину и сохраняющаяся в течение нескольких часов.Присутствуют бледность, обильное потоотделение и другие признаки шока. Могут возникать тошнота и рвота, приводящие к ошибочному впечатлению, что пострадавший страдает острым несварением желудка. Почти во всех случаях тяжелого инфаркта миокарда пациент испытывает крайние опасения и чувство неминуемой смерти.
Тяжесть симптомов может зависеть от размера артерии в месте окклюзии и количества миокардиальной ткани, обслуживаемой артерией. В некоторых случаях артерия может быть маленькой, а симптомы слабыми.В других случаях степень повреждения довольно велика, и нападение заканчивается смертельным исходом.
В течение 24 часов после первого приступа наблюдается повышение температуры и увеличение количества лейкоцитов в ответ на воспалительный процесс, возникающий в результате некроза ткани миокарда. Гибель клеток также вызывает высвобождение определенных ферментов, которые попадают в общую циркуляцию. Уровни этих ферментов в крови можно определить с помощью клинических лабораторных исследований. В течение 2–4 часов после инфаркта уровень креатинкиназы (КК) повышается; он достигает своего пика в течение 24 часов и спадает до нормального уровня в течение 48 часов.Уровень сывороточной аспартаттрансаминазы (AST) быстро увеличивается за 4-6 часов, достигает пика через 24-48 часов и возвращается к норме через пять дней. В отличие от быстрого повышения и снижения этих двух уровней ферментов, уровни лактатдегидрогеназы (ЛД) начинают увеличиваться в первый день после приступа и сохраняются на высоком уровне в течение 10-20 дней. тропонин — еще один фермент, который является чувствительным маркером инфаркта миокарда. Тесты можно сделать более конкретными, измерив изоферменты LD 1 и CK 2 , которые обнаружены в сердце.Диагноз ИМ основан на имеющихся симптомах и признаках нарушения функции сердца, обнаруженных при физикальном обследовании и электрокардиографии, а также на аномальных уровнях ферментов в сыворотке.
Лечение и уход за пациентами. Немедленное лечение острого инфаркта миокарда связано с борьбой с шоком, облегчением респираторной недостаточности и предотвращением дальнейшего кровообращения. Пострадавшего следует держать в лежачем положении, а вся тесная одежда должна быть расстегнута, чтобы уменьшить одышку и обеспечить комфорт. Следует подавать дополнительный кислород, а потребление кислорода следует снижать за счет снятия тревоги и боли и поддержки дыхания.Без промедления, но спокойно, пациента доставят в медицинское учреждение. Если у пострадавшего появляются признаки остановки сердца, немедленно приступают к сердечно-легочной реанимации.
Медикаментозное лечение включает назначение тромболитической терапии и анальгетиков, таких как сульфат морфина или меперидин (демерол). Иногда врач может назначить сульфат атропина с морфином для противодействия серьезной брадикардии. Почти во всех случаях кислород вводят в течение как минимум первых 24 часов.
Внутривенная тромболитическая терапия с использованием тканевого активатора плазминогена или стрептокиназы должна рассматриваться для всех пациентов, поступивших в течение 12 часов с момента появления боли. Максимальный потенциальный эффект достигается, когда эти препараты вводятся в течение 4-6 часов. Соображения по уходу включают раннюю точную оценку потенциальных кандидатов на тромболитическую терапию, быстрое введение лекарств и тщательный мониторинг осложнений, таких как аритмия, гипотензия, аллергические реакции, повторная окклюзия и кровотечение.Ранняя катетеризация и ангиопластика с помощью стента также могут быть выполнены, и это может быть лучше, чем внутривенная тромболитическая терапия.
Отдых необходим для восстановления поврежденных клеток миокарда, но это не обязательно означает абсолютный постельный режим. Будет ли пациенту обеспечен постельный режим или разрешено лечь в кресло, зависит от симптомов и суждений медсестры. Во время острой стадии некоторые врачи могут предпочесть, чтобы пациент отдыхал в кресле у постели больного. Пациенту разрешают встать с постели с помощью и сидеть в кресле до тех пор, пока он не почувствует усталость.Время, в течение которого пациенту позволяют сесть и стать более физически активным, постепенно увеличивается.
Достаточного отдыха легче достичь, если уменьшить психическое беспокойство; Считается, что спокойная обстановка улучшает способность к отдыху. Количество необходимого отдыха и допустимая степень физической активности зависят от предполагаемой обширной области инфаркта, развития сердечных аритмий и других осложнений и реакции пациента на повышенную физическую активность.Тщательный мониторинг частоты пульса и артериального давления до и после каждого занятия может предоставить информацию, с помощью которой можно оценить переносимость пациентом физических упражнений и действий по уходу за собой.
Большинство пациентов с инфарктом миокарда находятся на лечении в коронарном отделении во время острой стадии. Важно, чтобы пациенту и его семье было дано краткое объяснение различных типов используемого оборудования для мониторинга и чтобы они были уверены в том, что каждый сотрудник заботится о благополучии пациента.
По мере улучшения состояния пациента его постепенно отлучают от интенсивной терапии и поощряют к более активному участию в уходе за собой. Для некоторых это травмирующий опыт, и они очень опасаются оставить безопасность мониторов и внимание персонала. Кардиологическая реабилитация также является важным аспектом лечения. В некоторых больницах переход из отделения коронарной терапии в дом упрощается за счет перевода в отделение «понижения» или промежуточного ухода, где отслеживается реакция пациента на действия и даются инструкции относительно ухода за собой после выписки.Информацию о местных коронарных клубах, помощи в обучении пациентов и наличии отделения оценки кардиологической работы для определения готовности пациента вернуться к работе можно получить, связавшись с местным отделением Американской кардиологической ассоциации.
Инфаркт миокарда. Из Frazier et al., 2000.
Энциклопедия и словарь Миллера-Кина по медицине, сестринскому делу и смежным вопросам здравоохранения, седьмое издание. © 2003 Saunders, принадлежность Elsevier, Inc. Все права защищены.
Некроз миокарда — это … Что такое некроз миокарда?
Лечение инфаркта миокарда — Основная статья: Инфаркт миокарда Лечение инфаркта миокарда включает в себя спасение как можно большего количества миокарда и предотвращение дальнейших осложнений, поэтому время фразы — мышцы. [1] Кислород, аспирин и нитроглицерин обычно…… Википедия
инфаркт миокарда — инфаркт миокарда * * * смерть сегмента сердечной мышцы, вызванная прерыванием ее кровоснабжения (см. Коронарный тромбоз).Инфаркт миокарда обычно ограничивается левым желудочком. Пациент переживает сердечный приступ: внезапно…… Медицинский словарь
Диагностика инфаркта миокарда — Основная статья: Инфаркт миокарда Диагностика инфаркта миокарда ставится путем объединения истории болезни и физического обследования с результатами электрокардиограммы и сердечными маркерами (анализы крови на клетки сердечной мышцы…… Википедия
Инфаркт миокарда — Сердечный приступ перенаправляется сюда.Для использования в других целях, см Сердечный приступ (значения). Инфаркт миокарда Классификация и внешние ресурсы Схема инфаркта миокарда (2) верхушки передней стенки сердца (апикальный инфаркт)…… Wikipedia
Некроз — Чтобы посмотреть фильм, см. Некроз (фильм). Некротическая рана ноги, вызванная укусом коричневого паука-отшельника Некроз (от греч. Νεκρός, мертвый, νέκρωσις, смерть, стадия умирания, акт убийства) — это преждевременная смерть… Википедия
Инфаркт миокарда, острый — Острый инфаркт миокарда (ОИМ) — это сердечный приступ.Термин «инфаркт миокарда» относится к сердечной мышце (миокарду) и изменениям, которые происходят в ней из-за внезапной (острой) депривации циркулирующей крови. Главное изменение — смерть…… Медицинский словарь
инфаркт миокарда — существительное Некроз сердечной мышцы, вызванный нарушением кровоснабжения сердца, часто в результате коронарного тромбоза. Синоним: инфаркт миокарда, инфаркт… Викисловарь
Некроз сокращенной полосы — Микрофотография с большим увеличением, показывающая некроз и кариолизис сокращающейся полосы.H E пятно. Некроз полосы сокращения — это тип неконтролируемой гибели клеток (некроза), характерный только для сердечных миоцитов и, как полагают, возникает при реперфузии из…… Википедия
Хронология патологии инфаркта миокарда — Эта таблица дает обзор патологии, наблюдаемой при инфаркте миокарда, по времени после обструкции. В течение первых 30 минут при макроскопическом исследовании или световой микроскопии в гистопатологии не видно никаких изменений. Однако в электронном…… Википедия
Острый инфаркт миокарда — Острый инфаркт миокарда (ОИМ) — это сердечный приступ.Термин «инфаркт миокарда» относится к сердечной мышце (миокарду) и изменениям, которые происходят в ней из-за внезапной (острой) депривации циркулирующей крови. Главное изменение — смерть…… Медицинский словарь
Коагуляционный некроз — это тип случайной гибели клеток, обычно вызываемой ишемией или инфарктом. Для него характерно призрачное появление клеток под световой микроскопией в пораженном участке ткани. При коагуляционном некрозе архитектура мертвой ткани…… Wikipedia
Инфаркт миокарда
Инфаркт миокарда ( MI ) или острый инфаркт миокарда ( AMI ), широко известный как сердечный приступ , возникает в результате прерывания кровоснабжения части сердца, в результате чего клетки сердца умирают .Чаще всего это происходит из-за окклюзии (закупорки) коронарной артерии после разрыва уязвимой атеросклеротической бляшки, которая представляет собой нестабильный скопление липидов (холестерина и жирных кислот) и лейкоцитов (особенно макрофагов) в стенке артерии. . Возникающая в результате ишемия (ограничение кровоснабжения) и связанная с этим нехватка кислорода, если ее не лечить в течение достаточного периода времени, могут вызвать повреждение или смерть ( инфаркт ) ткани сердечной мышцы ( миокард ).
Классические симптомы острого инфаркта миокарда включают внезапную боль в груди (обычно иррадиирующую в левую руку или левую сторону шеи), одышку, тошноту, рвоту, учащенное сердцебиение, потливость и беспокойство (часто описываемое как чувство надвигающейся гибели) . [1] Женщины могут испытывать меньше типичных симптомов, чем мужчины, чаще всего — одышка, слабость, чувство несварения желудка и усталость. [2] Примерно четверть всех инфарктов миокарда протекает «тихо», то есть без боли в груди или других симптомов.
Среди диагностических тестов, доступных для обнаружения повреждения сердечной мышцы, есть электрокардиограмма (ЭКГ), эхокардиография, МРТ сердца и различные анализы крови. Наиболее часто используемые маркеры крови — это фракция креатинкиназы-MB (CK-MB) и уровни тропонина. Немедленное лечение при подозрении на острый инфаркт миокарда включает кислород, аспирин и нитроглицерин сублингвально. [3]
В большинстве случаев ИМпST (ИМ с подъемом сегмента ST) лечат тромболизисом или чрескожным коронарным вмешательством (ЧКВ).ИМбпST (ИМ без подъема сегмента ST) следует лечить с помощью лекарств, хотя ЧКВ часто выполняется при госпитализации. У людей, у которых есть множественные закупорки и которые относительно стабильны, или в нескольких экстренных случаях, операция шунтирования может быть вариантом, особенно у диабетиков.
Сердечные приступы являются основной причиной смерти как мужчин, так и женщин во всем мире. [4] Важными факторами риска являются перенесенные ранее сердечно-сосудистые заболевания, пожилой возраст, курение табака, высокий уровень некоторых липидов (триглицеридов, липопротеинов низкой плотности) и низкий уровень липопротеинов высокой плотности (ЛПВП) в крови, диабет, высокое кровяное давление, ожирение, хроническое заболевание почек, сердечная недостаточность, чрезмерное употребление алкоголя, злоупотребление некоторыми наркотиками (такими как кокаин и метамфетамин) и хронический высокий уровень стресса. [5] [6]
Классификация
Существует два основных типа острого инфаркта миокарда:
- Трансмуральный: ассоциирован с атеросклерозом, затрагивающим главную коронарную артерию. Его можно подразделить на передний, задний, нижний, боковой или перегородочный. Трансмуральные инфаркты распространяются на всю толщину сердечной мышцы и обычно являются результатом полной закупорки кровоснабжения области. [7]
- Субэндокардиальный: поражается небольшой участок субэндокардиальной стенки левого желудочка, межжелудочковой перегородки или сосочковых мышц.Считается, что субэндокардиальные инфаркты являются результатом местного снижения кровоснабжения, возможно, из-за сужения коронарных артерий. Субэндокардиальная область наиболее удалена от кровоснабжения сердца и более восприимчива к этому виду патологии. [7]
Клинически инфаркт миокарда может быть дополнительно подразделен на ИМ с подъемом сегмента ST (ИМпST) по сравнению с ИМ без подъема сегмента ST (ИМ с подъемом сегмента ST) на основании изменений ЭКГ. [8]
Фраза «сердечный приступ» иногда неправильно используется для описания внезапной сердечной смерти, которая может быть или не быть результатом острого инфаркта миокарда.Сердечный приступ отличается, но может быть причиной остановки сердца, то есть остановки сердцебиения, и сердечной аритмии, ненормального сердцебиения. Он также отличается от сердечной недостаточности, при которой нарушается насосное действие сердца; тяжелый инфаркт миокарда может привести к сердечной недостаточности, но не обязательно. [необходима ссылка ]
Согласованный документ 2007 года классифицирует инфаркт миокарда на пять основных типов: [9]
- Тип 1 — Спонтанный инфаркт миокарда, связанный с ишемией, вызванной первичным коронарным событием, таким как эрозия и / или разрыв бляшки, трещина или расслоение
- Тип 2 — Инфаркт миокарда, вторичный по отношению к ишемии, вызванный либо повышенным потреблением кислорода, либо уменьшением его поступления, e.грамм. спазм коронарной артерии, коронарная эмболия, анемия, аритмия, гипертония или гипотония
- Тип 3 — Внезапная неожиданная сердечная смерть, включая остановку сердца, часто с симптомами, указывающими на ишемию миокарда, сопровождающимися предположительно новой элевацией ST или новой БЛНПГ или свидетельством свежего тромба в коронарной артерии по данным ангиографии и / или вскрытия, но смерть наступила до того, как были получены образцы крови, или до появления сердечных биомаркеров в крови
- Тип 4 — Связанный с коронарной ангиопластикой или стентами:
- Тип 4a — Инфаркт миокарда, связанный с PCI
- Тип 4b — Инфаркт миокарда, связанный с тромбозом стента, подтвержденный ангиографией или вскрытием
- Тип 5 — Инфаркт миокарда, связанный с АКШ
Признаки и симптомы
Примерная диаграмма зон боли при инфаркте миокарда (темно-красный = наиболее типичная область, светло-красный = другие возможные области, вид на грудную клетку).Вид сзади.
Симптомы инфаркта миокарда (ИМ) появляются постепенно, в течение нескольких минут и редко мгновенно. [10] Боль в груди является наиболее частым симптомом острого инфаркта миокарда и часто описывается как ощущение стеснения, давления или сдавливания. Боль в груди из-за ишемии (недостаток крови и, следовательно, снабжения кислородом) сердечной мышцы называется стенокардией. Боль чаще всего излучается в левую руку, но может также передаваться в нижнюю челюсть, шею, правую руку, [ не цитируется ] назад и эпигастрий, где может имитировать изжогу.Признак Левина, при котором пациент локализует боль в груди, сжимая кулак над грудиной, классически считался прогностическим признаком сердечной боли в груди, хотя проспективное обсервационное исследование показало, что он имел плохую положительную прогностическую ценность. [11]
Одышка (одышка) возникает, когда повреждение сердца ограничивает выброс левого желудочка, вызывая левожелудочковую недостаточность и, как следствие, отек легких. Другие симптомы включают потоотделение (чрезмерное потоотделение), слабость, головокружение, тошноту, рвоту и сердцебиение.Эти симптомы, вероятно, вызваны массивным выбросом катехоламинов из симпатической нервной системы [12] , который возникает в ответ на боль и гемодинамические нарушения, возникающие в результате сердечной дисфункции. Потеря сознания (из-за недостаточной церебральной перфузии и кардиогенного шока) и внезапная смерть (часто из-за развития фибрилляции желудочков) могут возникать при инфаркте миокарда. [необходима ссылка ]
Женщины и пациенты старшего возраста сообщают об атипичных симптомах чаще, чем их коллеги-мужчины и более молодые. [13] Женщины также сообщают о более многочисленных симптомах по сравнению с мужчинами (в среднем 2,6 против 1,8 симптомов у мужчин). [13] Наиболее частые симптомы ИМ у женщин включают одышку (одышку), слабость и утомляемость. Сообщалось, что утомляемость, нарушения сна и одышка являются часто встречающимися симптомами, которые могут проявляться за месяц до фактического клинически проявляющегося ишемического события. У женщин боль в груди может быть менее признаком коронарной ишемии, чем у мужчин. [14]
Примерно четверть всех инфарктов миокарда протекает бессимптомно, без боли в груди или других симптомов. [15] Эти случаи могут быть обнаружены позже на электрокардиограмме, с использованием тестов на ферменты крови или при вскрытии без предшествующих жалоб, связанных с этим. Тихое течение чаще встречается у пожилых людей, у пациентов с сахарным диабетом [16] и после трансплантации сердца, вероятно, потому, что донорское сердце не полностью иннервируется нервной системой реципиента. [17] У диабетиков различия в болевом пороге, вегетативной невропатии и психологических факторах приводятся в качестве возможных объяснений отсутствия симптомов. [16]
Любая группа симптомов, совместимая с внезапным прерыванием кровотока к сердцу, называется острым коронарным синдромом. [18]
Дифференциальный диагноз включает другие катастрофические причины боли в груди, такие как тромбоэмболия легочной артерии, расслоение аорты, выпот в перикард, вызывающий тампонаду сердца, напряженный пневмоторакс и разрыв пищевода.Другие некатастрофические различия включают гастроэзофагеальный рефлюкс и синдром Титце. [19]
Причины
Частота сердечных приступов выше при интенсивной нагрузке, будь то психологический стресс или физическая нагрузка, особенно если нагрузка более интенсивная, чем обычно выполняется человеком. [20] Количественно период интенсивных упражнений и последующее восстановление связаны примерно с 6-кратным увеличением частоты инфаркта миокарда (по сравнению с другими более расслабленными временными рамками) у людей, которые находятся в хорошей физической форме. [20] Для людей в плохой физической форме разница в скорости более чем в 35 раз выше. [20] Одним из наблюдаемых механизмов этого явления является увеличение артериального пульсового давления, растяжение и расслабление артерий с каждым ударом сердца, что, как наблюдалось с внутрисосудистым ультразвуком, увеличивает механическое «напряжение сдвига» на атеромах и вероятность разрыва бляшки. . [20]
Острая тяжелая инфекция, например пневмония, может вызвать инфаркт миокарда.Более спорно ссылка является то, что между Chlamydophila пневмонии инфекции и атеросклероза. [21] Хотя этот внутриклеточный организм был продемонстрирован в атеросклеротических бляшках, данные неубедительны в отношении того, можно ли его рассматривать как причинный фактор. [21] Лечение антибиотиками пациентов с доказанным атеросклерозом не продемонстрировало снижения риска сердечных приступов или других заболеваний коронарных сосудов. [22]
Существует ассоциация увеличения частоты сердечных приступов в утренние часы, а именно около 9 часов утра.м. [23] [24] [25] Некоторые исследователи заметили, что способность тромбоцитов к агрегации варьируется в зависимости от циркадного ритма, хотя они не доказали причинно-следственную связь. [26]
Факторы риска
Факторы риска атеросклероза, как правило, являются факторами риска инфаркта миокарда: [необходима ссылка ]
- Диабет (с инсулинорезистентностью или без нее) — самый важный фактор риска ишемической болезни сердца (ИБС)
- Курение табака
- Загрязнение воздуха [27]
- Гиперхолестеринемия (точнее гиперлипопротеинемия, особенно липопротеины высокой низкой плотности и липопротеины низкой высокой плотности)
- Низкий HDL
- Высокие триглицериды
- Высокое кровяное давление
- Семейный анамнез ишемической болезни сердца (ИБС)
- Ожирение [28] (определяется по индексу массы тела более 30 кг / м² или, альтернативно, по окружности талии или соотношению талии и бедер).
- Возраст — мужчины приобретают независимый фактор риска в возрасте 45 лет, женщины приобретают независимый фактор риска в возрасте 55 лет; кроме того, люди приобретают еще один независимый фактор риска, если у них есть родственник первой степени родства мужского пола (брат, отец), перенесший сердечно-сосудистое событие в возрасте 55 лет или до него. Другой независимый фактор риска приобретается, если у человека есть родственница первой степени родства женского пола ( мать, сестра), перенесшая коронарное сосудистое событие в возрасте 65 лет или младше.
- Гипергомоцистеинемия (высокий уровень гомоцистеина, токсичной аминокислоты в крови, уровень которой повышается при недостаточном потреблении витаминов B 2 , B 6 , B 12 и фолиевой кислоты)
- Стресс — Известно, что профессии с высоким индексом стресса подвержены атеросклерозу
- Алкоголь — Исследования показывают, что продолжительное употребление большого количества алкоголя может увеличить риск сердечного приступа
- Мужчины более подвержены риску, чем женщины. [20]
Многие из этих факторов риска можно изменить, поэтому многие сердечные приступы можно предотвратить, поддерживая более здоровый образ жизни. Например, физическая активность связана с более низким профилем риска. [29] Немодифицируемые факторы риска включают возраст, пол и семейный анамнез раннего сердечного приступа (до 60 лет), который, как считается, отражает генетическую предрасположенность. [20]
Социально-экономические факторы, такие как более короткое образование и более низкий доход (особенно у женщин), а также совместное проживание без брака, также коррелируют с более высоким риском ИМ. [30] Чтобы понять результаты эпидемиологического исследования, важно отметить, что многие факторы, связанные с ИМ, опосредуют свой риск через другие факторы. Например, влияние образования частично основано на его влиянии на доход и семейное положение. [30]
Женщины, принимающие комбинированные пероральные противозачаточные таблетки, имеют умеренно повышенный риск инфаркта миокарда, особенно при наличии других факторов риска, таких как курение. [31]
Известно, что воспаление является важным этапом в процессе образования атеросклеротических бляшек. [32] C-реактивный белок (CRP) является чувствительным, но неспецифическим маркером воспаления. Повышенные уровни СРБ в крови, особенно измеренные с помощью тестов с высокой чувствительностью, могут прогнозировать риск ИМ, а также инсульта и развития диабета. [32] Более того, некоторые лекарства от инфаркта миокарда также могут снижать уровень СРБ. [32] Использование высокочувствительных анализов CRP в качестве средства скрининга населения в целом не рекомендуется, но его можно использовать, по желанию врача, у пациентов, у которых уже есть другие факторы риска или известное заболевание коронарной артерии. [33] Остается неясным, играет ли CRP прямую роль в развитии атеросклероза. [32]
Воспаление при пародонтозе может быть связано с ишемической болезнью сердца, а поскольку пародонтит очень распространен, это может иметь серьезные последствия для общественного здравоохранения. [34] Серологические исследования, измеряющие уровни антител против типичных бактерий, вызывающих пародонтит, показали, что такие антитела больше присутствуют у пациентов с ишемической болезнью сердца. [35] Пародонтит имеет тенденцию повышать уровень СРБ, фибриногена и цитокинов в крови; [36] Таким образом, пародонтит может опосредовать свое влияние на риск ИМ через другие факторы риска. [37] Доклинические исследования показывают, что пародонтальные бактерии могут способствовать агрегации тромбоцитов и способствовать образованию пенистых клеток. [38] [39] Роль определенных пародонтальных бактерий была высказана, но еще предстоит установить. [40] Есть некоторые свидетельства того, что грипп может вызвать острый инфаркт миокарда. [41]
Облысение, поседение волос, диагональная складка на мочке уха (признак Франка [42] ) и, возможно, другие особенности кожи были предложены как независимые факторы риска ИМ. [43] Их роль остается спорным; предполагается общий знаменатель этих признаков и риска ИМ, возможно, генетический. [44]
Отложение кальция — еще одна часть образования атеросклеротических бляшек. Отложения кальция в коронарных артериях можно обнаружить с помощью компьютерной томографии. Несколько исследований показали, что коронарный кальций может предоставить прогностическую информацию, выходящую за рамки классических факторов риска. [45] [46] [47]
Европейское общество кардиологов и Европейская ассоциация сердечно-сосудистой профилактики и реабилитации разработали интерактивный инструмент для прогнозирования и управления риском сердечного приступа и инсульта в Европе.HeartScore нацелен на поддержку врачей в оптимизации снижения индивидуального сердечно-сосудистого риска. Программа Heartscore доступна на 12 языках и предлагает веб-версию или версию для ПК. [48]
Патофизиология
Инфаркт миокарда возникает, когда атеросклеротическая бляшка медленно накапливается во внутренней выстилке коронарной артерии, а затем внезапно разрывается, вызывая катастрофическое образование тромба, полностью перекрывая артерию и препятствуя току крови вниз по течению.Рисунок сердца, показывающий инфаркт передней стенки левого желудочка
Острый инфаркт миокарда относится к двум подтипам острого коронарного синдрома, а именно инфаркту миокарда без подъема сегмента ST и инфаркту миокарда с подъемом сегмента ST, которые наиболее часто (но не всегда) являются проявлением ишемической болезни сердца. [8] Наиболее частым запускающим событием является разрушение атеросклеротической бляшки в эпикардиальной коронарной артерии, что приводит к каскаду свертывания крови, иногда приводящему к полной окклюзии артерии. [49] [50] Атеросклероз — это постепенное накопление холестерина и фиброзной ткани в бляшках на стенке артерий (в данном случае коронарных артерий), обычно в течение десятилетий. [51] Нарушения столба кровотока, видимые на ангиографии, отражают сужение просвета артерии в результате десятилетий прогрессирующего атеросклероза. [52] Бляшки могут стать нестабильными, разорваться и дополнительно вызвать тромб (сгусток крови), который закупоривает артерию; это может произойти за считанные минуты.Когда в коронарной сосудистой сети происходит достаточно серьезный разрыв бляшки, это приводит к инфаркту миокарда (некрозу нижнего миокарда). [49] [50]
Если нарушение притока крови к сердцу продолжается достаточно долго, это запускает процесс, называемый ишемическим каскадом; сердечные клетки на территории закупоренной коронарной артерии погибают (в основном в результате некроза) и больше не растут. На его месте образуется коллагеновый рубец. Недавние исследования показывают, что другая форма гибели клеток, называемая апоптозом, также играет роль в процессе повреждения тканей после инфаркта миокарда. [53] В результате сердце пациента будет необратимо повреждено. Это рубцевание миокарда также подвергает пациента риску развития потенциально опасных для жизни аритмий и может привести к образованию аневризмы желудочков, которая может разорваться с катастрофическими последствиями.
Поврежденная ткань сердца проводит электрические импульсы медленнее, чем нормальная ткань сердца. Разница в скорости проведения между поврежденной и неповрежденной тканью может вызвать повторный вход или петлю обратной связи, которая, как полагают, является причиной многих летальных аритмий.Наиболее серьезной из этих аритмий является фибрилляция желудочков ( V-Fib / VF), чрезвычайно быстрый и хаотичный сердечный ритм, который является основной причиной внезапной сердечной смерти. Другой опасной для жизни аритмией является желудочковая тахикардия ( V-Tach / VT), которая может вызывать или не вызывать внезапную сердечную смерть. Однако желудочковая тахикардия обычно вызывает учащенное сердцебиение, которое мешает сердцу эффективно перекачивать кровь. Сердечный выброс и артериальное давление могут упасть до опасного уровня, что может привести к дальнейшей коронарной ишемии и распространению инфаркта.
Дефибриллятор сердца — это устройство, специально разработанное для устранения этих потенциально смертельных аритмий. Устройство работает, передавая пациенту электрический шок, чтобы деполяризовать критическую массу сердечной мышцы, фактически «перезагружая» сердце. Эта терапия зависит от времени, и шансы на успешную дефибрилляцию быстро снижаются после начала сердечно-легочной остановки.
Диагноз
Основная статья: Диагностика инфаркта миокарда
Диагноз инфаркта миокарда может быть поставлен после оценки жалоб и физического состояния пациента.Изменения ЭКГ, коронарная ангиограмма и уровни сердечных маркеров помогают подтвердить диагноз. ЭКГ дает ценные подсказки для определения места повреждения миокарда, в то время как коронарная ангиограмма позволяет визуализировать сужение или обструкцию сердечных сосудов. [54] При вскрытии патолог может диагностировать инфаркт миокарда на основании анатомических данных.
Рентгенограмма грудной клетки и обычные анализы крови могут указать на осложнения или провоцирующие причины и часто выполняются по прибытии в отделение неотложной помощи.Новые аномалии движения регионарной стенки на эхокардиограмме также указывают на инфаркт миокарда. Эхо может быть выполнено в сомнительных случаях дежурным кардиологом. [55] У стабильных пациентов, у которых симптомы исчезли к моменту обследования, в ядерной медицине можно использовать технеций (99mTc) сестамиби (то есть «MIBI-сканирование») или хлорид таллия-201 для визуализации участков пониженного кровотока в в сочетании с физиологическим или фармакологическим стрессом. [55] [56] Таллий также можно использовать для определения жизнеспособности ткани, различая, действительно ли нефункциональный миокард мертв или просто находится в состоянии гибернации или оглушен. [57]
Критерии ВОЗ [58] , сформулированные в 1979 г., классически использовались для диагностики ИМ; У пациента диагностирован инфаркт миокарда при соблюдении двух (вероятных) или трех (определенных) из следующих критериев:
- Клинический анамнез боли в груди ишемического типа продолжительностью более 20 минут
- Изменения в серийных записях ЭКГ
- Повышение и снижение сывороточных сердечных биомаркеров, таких как фракция креатинкиназы-MB и тропонин
Критерии ВОЗ были уточнены в 2000 г., чтобы уделить больше внимания сердечным биомаркерам. [59] Согласно новым рекомендациям, повышение сердечного тропонина, сопровождающееся либо типичными симптомами, патологическими зубцами Q, подъемом сегмента ST или депрессией, либо коронарным вмешательством, является диагностическим признаком ИМ.
Профилактика
Риск повторного инфаркта миокарда снижается при строгом контроле артериального давления и изменении образа жизни, в основном отказе от курения, регулярных физических упражнениях, разумной диете для людей с сердечными заболеваниями и ограничении потребления алкоголя. Пациентам после ИМ обычно назначают несколько долгосрочных лекарств с целью предотвращения вторичных сердечно-сосудистых событий, таких как дальнейший инфаркт миокарда, застойная сердечная недостаточность или нарушение мозгового кровообращения (ЦВА).При отсутствии противопоказаний к таким лекарствам могут относиться: [60] [61]
- Следует продолжать терапию антитромбоцитарными препаратами, такими как аспирин и / или клопидогрель, для снижения риска разрыва бляшек и повторного инфаркта миокарда. Аспирин является препаратом первого ряда из-за его низкой стоимости и сопоставимой эффективности, а клопидогрель предназначен для пациентов с непереносимостью аспирина. Комбинация клопидогрела и аспирина может дополнительно снизить риск сердечно-сосудистых событий, однако риск кровотечения увеличивается. [62]
- Следует начать терапию бета-блокаторами, такими как метопролол или карведилол. [63] Они были особенно полезны для пациентов из группы высокого риска, например, с дисфункцией левого желудочка и / или продолжающейся ишемией сердца. [64] β-Блокаторы снижают смертность и заболеваемость. Они также улучшают симптомы ишемии сердца при ИМбпST.
- Терапию ингибиторами АПФ следует начинать через 24–48 часов после инфаркта миокарда у гемодинамически стабильных пациентов, особенно у пациентов с инфарктом миокарда в анамнезе, сахарным диабетом, артериальной гипертензией, передним расположением инфаркта (по оценке ЭКГ) и / или свидетельствами дисфункция левого желудочка.Ингибиторы АПФ снижают смертность, развитие сердечной недостаточности и уменьшают ремоделирование желудочков после ИМ. [65]
- Было показано, что терапия статинами снижает смертность и заболеваемость после ИМ. [66] [67] Эффекты статинов могут быть больше, чем их эффекты снижения ЛПНП. По общему мнению, статины обладают стабилизацией бляшек и множеством других («плейотропных») эффектов, которые могут предотвратить инфаркт миокарда в дополнение к их влиянию на липиды крови. [68]
- Было показано, что агент-антагонист альдостерона эплеренон дополнительно снижает риск смерти от сердечно-сосудистых заболеваний после ИМ у пациентов с сердечной недостаточностью и дисфункцией левого желудочка при использовании в сочетании со стандартными методами лечения, описанными выше. [69] Спиронолактон — еще один вариант, который иногда предпочтительнее эплеренона из-за стоимости.
- Доказательства поддерживают потребление полиненасыщенных жиров вместо насыщенных в качестве меры снижения ишемической болезни сердца. [70] Омега-3 жирные кислоты, обычно содержащиеся в рыбе, снижают смертность после ИМ. [71] Хотя механизм, с помощью которого эти жирные кислоты снижают смертность, неизвестен, было высказано предположение, что улучшение выживаемости обусловлено электрической стабилизацией и предотвращением фибрилляции желудочков. [72] Однако дальнейшие исследования в подгруппе высокого риска не показали явного снижения потенциально смертельных аритмий, вызванных омега-3 жирными кислотами. [73] [74]
Донорство крови может снизить риск сердечно-сосудистых заболеваний у мужчин, [75] , но связь между ними еще не установлена.
Кокрановский обзор показал, что введение гепарина людям с сердечными заболеваниями, такими как нестабильная стенокардия и некоторые формы сердечных приступов, снижает риск повторного сердечного приступа. Однако гепарин также увеличивает вероятность незначительного кровотечения. [76]
Менеджмент
Основная статья: Ведение инфаркта миокарда
ИМ — это неотложная медицинская помощь, которая требует немедленной медицинской помощи. Лечение пытается спасти как можно больше миокарда и предотвратить дальнейшие осложнения, поэтому фраза «время — мускулы». [77] Можно вводить кислород, аспирин и нитроглицерин. Если нитроглицерин неэффективен, обычно применяли морфин; однако это может увеличить смертность при ИМбпST. [78] Обзор высокопоточного кислорода при инфаркте миокарда в 2009 и 2010 годах выявил повышенную смертность и размер инфаркта, что ставит под сомнение рекомендацию о его повседневном использовании. [79] [80] Польза от других анальгетиков, таких как закись азота, неизвестна. [81] Пациентам с ИМпST рекомендуется чрескожное коронарное вмешательство (ЧКВ) или фибринолиз.
Прогноз
Прогноз после инфаркта миокарда сильно различается в зависимости от здоровья человека, степени поражения сердца и проводимого лечения. В период 2005–2008 гг. В США средняя смертность через 30 дней составляла 16,6% с диапазоном от 10,9% до 24,9% в зависимости от больницы. [82] Используя переменные, доступные в отделении неотложной помощи, можно идентифицировать людей с более высоким риском неблагоприятного исхода. Одно исследование показало, что 0,4% пациентов с низким профилем риска умерли через 90 дней, тогда как у людей с высоким риском — 21.1%. [83]
Некоторые из наиболее воспроизводимых факторов стратификации риска включают: возраст, гемодинамические параметры (такие как сердечная недостаточность, остановка сердца при поступлении, систолическое артериальное давление или класс Киллипа два или выше), отклонение сегмента ST, диабет, креатинин сыворотки сосудистые заболевания и повышение сердечных маркеров. [83] [84] [85] Оценка фракции выброса левого желудочка может повысить предсказательную силу. [86] Прогностическая важность зубцов Q обсуждается. [87] Прогноз значительно ухудшается, если возникает механическое осложнение, такое как разрыв сосочковой мышцы или разрыв свободной стенки миокарда. [88] Заболеваемость и смертность от инфаркта миокарда снизились с годами благодаря более эффективному лечению. [89]
Осложнения
Основная статья: Осложнения инфаркта миокарда
Осложнения могут возникнуть сразу после сердечного приступа (в острой фазе) или для их развития может потребоваться время (хроническая проблема).Острые осложнения могут включать сердечную недостаточность, если поврежденное сердце больше не может адекватно перекачивать кровь по телу; аневризма или разрыв миокарда; митральная регургитация, особенно если инфаркт вызывает дисфункцию сосочковой мышцы; и аритмии, такие как фибрилляция желудочков, желудочковая тахикардия, фибрилляция предсердий и блокада сердца. К более отдаленным осложнениям относятся сердечная недостаточность, фибрилляция предсердий и повышенный риск повторного инфаркта миокарда.
Эпидемиология
Инфаркт миокарда — частое проявление ишемической болезни сердца. По оценкам ВОЗ в 2002 году, 12,6% смертей во всем мире были вызваны ишемической болезнью сердца [4] , при этом она является основной причиной смерти в развитых странах, а третья — СПИДом и инфекциями нижних дыхательных путей в развивающихся странах. [90] Ежегодно во всем мире более 3 миллионов человек страдают ИМпST, а 4 миллиона — ИМпST. [91]
Ишемическая болезнь сердца является причиной каждой пятой смерти в Соединенных Штатах.Это становится все более распространенным в развивающихся странах, где в Индии сердечно-сосудистые заболевания (ССЗ) являются основной причиной смерти. [92] Смертность от сердечно-сосудистых заболеваний в Индии составила 32% от всех смертей в 2007 году и, как ожидается, вырастет с 1,17 миллиона в 1990 году и 1,59 миллиона в 2000 году до 2,03 миллиона в 2010 году. [93] Хотя относительно новый эпидемии в Индии, она быстро превратилась в серьезную проблему для здоровья, поскольку ожидается, что смертность от сердечно-сосудистых заболеваний удвоится в течение 1985–2015 годов. [94] [95] Оценки смертности от сердечно-сосудистых заболеваний сильно различаются в зависимости от штата: от 10% в Мегхалае до 49% в Пенджабе (процент всех смертей).Пенджаб (49%), Гоа (42%), Тамил Наду (36%) и Андхра-Прадеш (31%) имеют самые высокие оценки смертности от ССЗ. [96] Различия между штатами коррелируют с преобладанием конкретных диетических факторов риска в штатах. Умеренные физические упражнения связаны со снижением заболеваемости сердечно-сосудистыми заболеваниями в Индии (у тех, кто занимается спортом, риск вдвое меньше, чем у тех, кто этого не делает). [94]
Правовые последствия
По общему праву, инфаркт миокарда обычно является заболеванием, но иногда может быть травмой.Это имеет значение для схем страхования без вины, таких как компенсация работникам. Сердечный приступ обычно не покрывается; [97] однако это может быть производственная травма, если она возникла, например, в результате необычного эмоционального стресса или необычного напряжения. [98] Кроме того, в некоторых юрисдикциях сердечные приступы, перенесенные людьми определенной профессии, такими как сотрудники полиции, могут быть классифицированы как травмы при исполнении служебных обязанностей в соответствии с законом или политикой. В некоторых странах или штатах человеку, пострадавшему от инфаркта миокарда, может быть запрещено участвовать в деятельности, которая ставит под угрозу жизни других людей, например, в управлении автомобилем или самолетом. [99]
Исследования
Пациенты, которые получают лечение стволовыми клетками с помощью инъекций стволовых клеток, полученных из их собственного костного мозга, после инфаркта миокарда (ИМ), демонстрируют улучшения фракции выброса левого желудочка и конечного диастолического объема, не наблюдаемые при приеме плацебо. Чем больше начальный размер инфаркта, тем сильнее эффект от инфузии. Клинические испытания инфузии клеток-предшественников как метода лечения ИМ с подъемом сегмента ST продолжаются. [100]
В настоящее время существует 3 подхода к лечению инфаркта миокарда с использованием биоматериалов и тканевой инженерии, но они находятся на еще более ранней стадии медицинских исследований, поэтому необходимо решить множество вопросов и проблем, прежде чем их можно будет применить к пациентам. a b c d e 14 Среди всех клинических форм ишемической болезни сердца особое внимание уделяется инфаркту миокарда. Именно это заболевание часто помогает вывести из строя, а в тяжелых случаях приводит к летальному исходу.Сегодняшнее внимание сосредоточено не только на диагностике, но и на профилактике патологии, ведь от этого зависит не только жизнь отдельных людей, но и качество общества в целом. Инфаркт миокарда (ИМ) тесно связан с исчезновением (некрозом) большей или меньшей части сердечной мышцы. В основе патологии лежит нарушение коронарного кровообращения, в результате чего возникает кислородное голодание на фоне физического и эмоционального напряжения клеток миокарда. Мужчины в возрасте от 35 до 50 лет чаще страдают от инфаркта миокарда, и риск развития этого заболевания заметно возрастает, когда женщины достигают 50-летнего возраста. При определении ИМ важна своевременная диагностика, для которой в первую очередь необходимо правильно интерпретировать клиническую картину. В частности, всем будет полезна информация о нормальной работе сердца и первых признаках инфаркта миокарда. В некоторых случаях это может спасти чью-то жизнь, ведь скорая помощь будет вызвана вовремя. Видео: Как устроено сердце человека — первые признаки инфаркта миокарда Инфаркт миокарда
Классификация
Помимо создания клинической классификации инфаркта миокарда, было много специалистов, которые были собраны в рабочие группы. В частности, определение болезни в 2007 году способствовало кардиологическому сообществу Европы, Америки и Всемирной организации. В результате были выявлены следующие клинические формы инфаркта миокарда:
- Первый тип (спонтанный ИМ) — нарушение коронарного кровообращения, развивающееся на фоне изменения структуры атеросклеротической бляшки из-за ее растрескивания, эрозии или пучка.
- Второй тип (вторичный ИМ) — недостаток кислорода связан с нарушением его поступления или повышенным потреблением, что часто наблюдается при анемии, гипертонической болезни, гипотонии, эмболии, спазме коронарных артерий.
- Третий тип (внезапная коронарная смерть) — может быть следствием смерти пациента или с повышенным риском внезапной остановки сердца. В патологическом процессе часто определяется блокада левой ножки пучка Гизы, коронарный тромбоз.
- Четвертый тип А (ЧКВ-ассоциированный ИМ) — ишемия развивается на фоне чрескожного коронарного вмешательства.
- Четвертый тип В (ИМ вследствие тромбоза стента) — нарушение должно быть подтверждено аутопсией или ангиографией.
- Пятый тип (ОКС-ассоциированный ИМ) — ишемия возникает в результате аортокоронарного шунтирования.
В некоторых случаях у одного и того же пациента есть несколько типов ИМ. Следует отметить, что термины «инфаркт миокарда» и «некроз кардиомиоцитов» — не одно и то же.Последнее патологическое состояние в основном связано с аортокоронарным шунтированием, которое проводилось на фоне недостаточности почек или сердца, электростимуляции сердечной деятельности, воспаления миокарда или электрофизиологической абляции.
Общей в клинической практике является клиническая классификация инфаркта миокарда:
- По срокам развития: самый резкий (развивается в первые шесть часов от начала приступа), острый (до 14 дней), подострый (до двух месяцев), рубцовый (два месяца и более).
- По объему поражения: мелкоочаговое (не считается Q-инфарктом) и крупноочаговое (еще известное как трансмуральное), при котором появляется патологический зубец Q.
- Анатомически участок поражения субэндокардиальный, субэпикардиальный, интрамуральный и трансмуральный.
- По локализации некротического очага: ИМ правого желудочка, ИМ перегородки (или межжелудочковой перегородки), ИМ изолированного (или верхних конечностей сердца), ИМ левого желудочка (может быть на передней стенке, задней, боковой и нижний).
- Течение инфаркта миокарда бывает продолжительным, моноциклическим, рецидивирующим и повторяющимся.
Причины
Сердечная мышца снабжается кровеносными сосудами коронарных артерий, которые питаются кислородом и питательными веществами. При закупорке (обтурации) просвета сосуда большая или меньшая часть миокарда перестает снабжать кровоток, что приводит сначала к ишемии, а затем к отмиранию (некрозу) ткани.
Основные причины облитерации коронарных артерий:
- До 98% случаев связаны с атеросклерозом коронарных сосудов.
- Облитерирование в результате хирургического вмешательства.
- Ограждение сосудистого эмбола (жировое, тромботическое и т.п.).
- Спазм коронарных сосудов.
В некоторых случаях наблюдается аномалия развития коронарных артерий, затем из-за аналогичной злокачественности миокард также не имеет достаточного кровоснабжения.
Некроз мышечной ткани может возникнуть в любой другой части тела, но сердце имеет жизненно важное значение, поэтому высок риск смерти пациента при его травме.
Факторы развития
Атеросклероз стоит на первом месте среди причин развития инфаркта миокарда, поэтому этот фактор возникновения патологии следует рассматривать отдельно.
При благоприятных обстоятельствах на внутренней поверхности коронарных артерий начинает формироваться атеросклеротическая бляшка. Это образование имеет фиброзную покрышку, которая может порваться, и затем субэндотелиальная соединительная ткань вступает в контакт с клетками крови и другими элементами формы.В дальнейшем на месте повреждения накапливаются тромбоциты, постепенно образуется тромбин, что приводит к тромбозу сосуда.
Процесс окклюзии сосуда занимает определенное время, при этом он динамически меняется, поскольку периодически возникают окклюзия, стеноз и восстановление местной системы кровообращения.
На фоне неразвитых коллатеральных артерий может образоваться тромботическая окклюзия сосуда, в результате чего диагностируется ИМ с приподнятым сегментом ST.Если такой подъем отсутствует, это вовсе не означает, что площадь поражения меньше, чем при наличии аналогичного признака ЭКГ. И все же ИМ с подъемом сегмента ST выделяют отдельно, поскольку при этой форме патологии применяется особая тактика лечения, чаще всего с применением тромболизиса и коронарной ангиопластики.
В процессе обучения МИ можно выделить четыре этапа:
- Ишемия
- Некробиоз (повреждение)
- Некроз.
- Очистка.
Ишемия может продолжаться остро и длительно. Этот этап условно называют компенсаторным, так как большая часть просвета сосуда не полностью закрыта. Если окклюзия артерии составила 70% и более, то наступает довольно быстрая стадия повреждения, при которой нарушается обмен веществ и миокард не выполняет свою функцию. Продолжительность этапа повреждения составляет примерно 4-7 часов.
Во время ишемии и повреждения еще можно вернуть патолог к исходным изменениям.В начале стадии некроза восстановление тканей невозможно.
Некрозу подвержены те участки миокарда, которые больше всего страдают из-за нарушения метаболизма. Кардиомиоциты погибают, и вместо них начинает формироваться соединительная ткань. Это происходит в конце второй недели после сердечного приступа. Весь процесс рубцевания занимает 1-2 месяца.
Факторы риска
Представленные факторы риска (ФК) тесно связаны с факторами риска ишемической болезни сердца, которые, в свою очередь, называются атеросклерозом ФК.Именно последняя причина чаще всего приводит к формированию атеросклероза коронарных сосудов, за которым следуют ИБС и ИМ.
К основным факторам риска относятся:
- возраст
- ;
- этаж;
- генетическая предрасположенность;
- недоедание;
- дислипидемия;
- артериальная гипертензия;
- сахарный диабет;
- гемостатических факторов;
- повышенная масса тела и ожирение;
- гиподинамия;
- курение и употребление алкоголя.
Кроме того, формирование атеросклероза и, соответственно, инфаркта миокарда может быть связано с психологическими факторами и стоматологическими заболеваниями.
В бюллетене ВОЗ, октябрь 2017 г., говорится: «Применение обширного законодательства о курении в Чили привело к резкому, почти мгновенному снижению заболеваемости инфарктом миокарда».
Важно отметить, что чем больше факторов риска определяется у пациента, тем выше вероятность развития инфаркта миокарда со всеми вытекающими последствиями.Кроме того, если инфаркт миокарда считался заболеванием в возрасте 55-60 лет, то теперь, спустя 35 лет, у каждого десятого американца развивается ишемическая болезнь сердца.
В патогенезе заболевания большую роль играет не столько возраст, сколько пол. Нет сомнений в том, что есть мужчины, которые чаще страдают от ИМ, чем им 50 лет. Наибольшая заболеваемость атеросклерозом у мужчин, чем у женщин, наблюдается в возрасте 30-39 лет, так как в первом случае частота встречаемости патологии составляет 5%, а во втором — 0.5%. Только к 70 годам заболеваемость атеросклерозом и ишемической болезнью сердца у обоих полов сопоставима.
Есть признаки, которые считаются «первыми приступами» сердечного приступа в будущем. В первую очередь это заболевания, связанные с сердечно-сосудистой системой — аритмии, отеки ног и рук, одышка, возникающая после физической работы. Также наличие предпосылок к возникновению ИМ свидетельствует о кровоточивости десен, заболеваниях пародонта, частом мочеиспускании в ночное время и частых головных болях, храпе и болезненных ощущениях в левом плече.
Виды
Инфаркт миокарда разделяют на формы по клинической картине. Если наблюдаются признаки, характерные для болезни, значит, речь идет о типичной форме инфаркта. В противном случае отмечается атипичное течение болезни.
Типовая форма MI
Гневная боль — характерный симптом этой клинической формы ИМ. Характеризуется высокой интенсивностью, располагается за грудиной. Боль часто распространяется по нервным волокнам на другие части тела — лопатку, горло, живот, руку.Боль не проходит быстро. Ее продолжительность может составлять от 15 минут до часа и более. Перед лицом сильной боли пациенты часто испытывают страх смерти, появляется липкий пот.
Инфаркт миокарда большого размера в 30% случаев сопровождается сердечной недостаточностью, поэтому возникает одышка и непродуктивный кашель.
До развития инфаркта миокарда может быть гипертонический криз, физическое или эмоциональное перенапряжение и сильная усталость.Кроме того, пациент может заметить перебои в работе сердца, что укажет на фибрилляцию предсердий / желудочков или экстрасистолию.
Атипичные формы MI
Диагностика инфаркта затруднена, если клинические симптомы проявляются на фоне атипичной формы. Выделяют следующие возможные проявления:
- Абдоминальный синдром — патологические проявления больше касаются желудочно-кишечного тракта. Соответственно боль локализуется в верхней части живота, кроме больных беспокоит икота, тяжесть живота, вздутие, тошнота и рвота.Эти симптомы чаще всего придумываются с представлением об остром панкреатите.
- Астматический синдром — тяжелая одышка постепенно нарастает, поэтому на первый взгляд бронхиальная астма, а не им.
- Церебральный синдром — среди симптомов центральной нервной системы преобладают такие симптомы, как головокружение, нарушения восприятия и т. Д.
- Аритмический синдром — тяжелое нарушение сердечного ритма по типу пароксизма.
- Коллаптоидный синдром — у больного резко снижается артериальное давление, появляется головокружение, появляется холодный пот, может отмечаться потемнение в глазах.
В некоторых случаях пациенты отмечают локализацию болевых ощущений в горле, руках, позвоночнике, нижней челюсти, затем говорят о периферической форме ИМ. Также может развиться безболезненная ишемия, когда вместо боли наблюдается сильная боль (как у пациентов с сахарным диабетом). В некоторых случаях у одного пациента возникают проявления нескольких атипичных форм, тогда диагностируется комбинированная форма ИМ.
Диагностика
В зависимости от стадии развития заболевания различают ранний и поздний диагноз ИМ.В первую группу входят электрокардиография, эхокардиография, лабораторные исследования. Второй — коронарография и сцинтиграфия сердечной мышцы.
Важную роль в определении ИМ играет электрокардиография. В зависимости от стадии патологического процесса различают следующие изменения:
- Во время развития ИМ на ЭКГ куполообразное увеличение сегмента ST, которое сливается с зубцом T, увеличение зубца R и появление неглубокого Q.
- Острая стадия ИМ характеризуется появлением отрицательного зубца Т, уменьшением высоты зубца R, бороздки Q.
- Процесс заживления ИМ определяется на ЭКГ по отрицательному тону Т и сегменту ST, приближающемуся к изолинии.
- Заживший ИМ проявляется на электрокардиограмме в виде стабильного патологического зубца Q, который дополняется волной R. с пониженной амплитудой.Отрезок ST и зубец Т соответствуют норме.
Течение инфаркта миокарда в некоторых случаях аналогично клинике других заболеваний. Например, ЭКГ-признаки ИМ схожи с перикардитом, миокардитом. Иррадиационная боль часто наблюдается при аневризме слабительного аорты, но часто она появляется не только при инфаркте миокарда, но и при тромбоэмболии легочной артерии. Поэтому для определения точного диагноза используются дополнительные методы исследования:
- Эхокардиография — в случае ИМ наблюдается увеличение сегмента ST на 1 мВ или более, это следует отметить как минимум в двух соседних отведениях.
- Лабораторная диагностика (тропонины, миоглобин, креатинфосфокиназа).
- Коронография — видны суженные или резко прерванные сосуды.
Осложнения
Заболевание может вызвать тяжелые осложнения, которые не всегда проявляются сразу. Поэтому в зависимости от срока развития определяют ранние и поздние осложнения инфаркта миокарда.
- Раннее осложнение — тромбоэмболия, кардиогенный шок, разрыв сердца, кардиогенный шок и острая сердечная недостаточность.Также могут развиваться нарушения проводимости, аллергические и геморрагические поражения.
- Поздние осложнения — развиваются через две-три недели от начала ИМ. Они могут выражаться в тромбоэмболии, аневризме сердца, хронической сердечной недостаточности и постинфарктном синдроме.
Лечение ИБС
Помощь при инфаркте миокарда можно разделить на две большие группы: первая помощь и медикаментозное лечение. В задачи специалистов, оказывающих первую помощь, входит спасение жизни пациента.В процессе лечения пациентам помогают восстановить работу сердца, одновременно реабилитируясь после потери некоторых физических возможностей.
Первая помощь
Она начинает проявляться еще на догоспитальном этапе, когда человек только сильно болел, а скорая помощь еще не прибыла.
Порядок оказания первой помощи:
- Пациент должен сидеть или лежать, пытаясь его успокоить. Оптимальное положение — сидя или пополам.
- Если у пациента тесная одежда, то ее следует снять или расстегнуть.
- Ранее прописанное лекарство следует давать в указанной врачом дозировке. Если у вас есть под рукой нитроглицерин, вы также можете дать его пациенту. Хотя препарат полностью не снимает боль, он может несколько ослабить приступ.
- Скорую помощь следует вызывать, если по истечении трех минут с начала ИМ состояние пациента не улучшилось или даже не ухудшилось.
- В некоторых случаях скорая помощь не может приехать быстро, тогда пациента следует доставить в больницу попутным транспортом. Желательно, чтобы в машине с пациентом был сопровождающий.
- На догоспитальном этапе аспирин доступен в дозе 300 мг, но при этом у пациента не должно быть известной аллергической реакции.
- При потере сознания и недостаточной сердечной деятельности проводится сердечно-легочная реанимация.
Если раньше только при отсутствии пульса начинали выполнять СЛР, то сегодня показаниями к ее проведению является отсутствие ритмичного дыхания и потеря сознания.
Видео: Инфаркт миокарда. Первая помощь и алгоритм действий
Лечебная терапия
В больничных условиях работают в ситуации. Если пациент был без сознания или ранее перенес сердечно-легочную реанимацию, то СЛР продолжается.При сохранении сознания у пациента врачи придерживаются следующей лечебной тактики:
- Устранение боли, одышки, чрезмерного беспокойства . Гидрохлорид морфина чаще всего используется для обезболивания. В некоторых случаях препарат может способствовать ранней смерти пациента, особенно при отсутствии подъема сегмента ST. Иногда предпочтение отдается нейролептикам (дроперидол, фентанил). При повышенной тревожности применяют транквилизатор (в основном диазепам).
- Кислородная терапия . Помогает справиться с кардиогенным шоком, отеком легких. Для этого пациентка носит на лице канюлю, через которую проводится ингаляция кислорода.
- Реперфузия миокарда . Его проводят при наличии подъема сегмента ST и перехода от начала приступа не более 12 часов. Наибольшая польза от реперфузии наблюдается, когда она проводится в первые часы ИМ. В качестве процедуры реперфузии выступает тромболизис или ангиопластика.Второй вариант считается более эффективным, так как согласно исследованиям можно снизить риск смерти при ИМ на 22%. При отсутствии противопоказаний к тромболизису и невозможности проведения ангиопластики проводится тромболитическая терапия. Но чаще всего тромболизис начинают проводить без промедления, а уже после, по возможности, проводят коронарную ангиопластику.
Применяется при лечении инфаркта миокарда из группы лекарственных средств:
- Антикоагулянты — это обширная группа, включая гепарин без тромболизиса и с тромболизисом, а также прямые ингибиторы тромбина.
- Бета-адреноблокаторы — препараты обязательны для всех пациентов, особенно при наличии острого бронхоспазма.
- Ингибиторы АПФ назначают в табличной форме, показаны всем пациентам, особенно со сниженной систолической емкостью левого желудочка.
- Антагонисты кальция назначают только в тех случаях, когда у пациента диагностирована суправентрикулярная тахикардия и кокаиновые инфаркты.
Препараты из групп антиаритмических и инотропных препаратов назначают только в крайних случаях, так как без очевидных доказательств они могут повысить риск смерти.
Реабилитация после инфаркта миокарда
После лечения инфаркта миокарда и назначения пациенту основных препаратов для их приема на дому должна быть организована реабилитация пациента. Это поможет:
- избежать инвалидности;
- снижает вероятность развития повторного ИМ и внезапной остановки сердца;
- снизить артериальное давление;
- уменьшить чувство смерти;
- замедляют прогрессирование атеросклероза;
- для улучшения состояния сердечно-сосудистой системы;
- улучшить эмоционально-психологическое состояние;
- улучшить физическую и двигательную активность.
Оптимальные условия для прохождения реабилитации созданы на базе санаториев, которые могут принимать поездки на 14-16 и 18-21 день.
Во время реабилитации могут проводиться следующие процедуры: ходьба с дозатором, ходьба по Скандинавии, лечебная гимнастика, плавание, массаж по типу, ручной, вакуумный или подводный. Также полезно проводить жемчужно-хвойные и йодобромные ванны, круговой душ, внешнюю контрпульсацию, психотерапию.Обязательно соблюдайте правила питания.
При необходимости пациенту предоставляется консультация физиотерапевта, врача ЛФК, диетолога, психолога, кардиолога. Реабилитация в санатории не может пройти при наличии сердечной недостаточности IIB-III стадии, тяжелых форм экстрасистолии, аневризм сердца с CH II и III стадии, гипертонического давления с тяжелыми осложнениями, цереброваскулярных нарушений и сахарного диабета с тяжелым или декомпенсированным течением.
Видео: Реабилитация после инфаркта миокарда
Профилактика
Важно помнить, что чем раньше была начата антитромботическая терапия, тем ниже риск повторного развития инфаркта миокарда. Для этого при отсутствии показаний применяют аспирин. Если этот препарат нельзя назначить, то принимают клопидогрель.
Некоторые пациенты имеют высокий риск повторного инфаркта. Для его профилактики используется подходящий препарат из группы бета-адреноблокаторов.Это может быть карведилол, метопролол, бисопролол.
Смертность среди пациентов с инфарктом миокарда способствует сокращению использования статинов.
Омега-3-полиненасыщенные жирные кислоты при приеме в больших дозах позволяют значительно снизить риск развития осложнений на фоне развившегося ИМ.
При первичной нестабильной стенокардии повышается риск инфаркта миокарда. Для его уменьшения используется низкомолекулярный или нефракционный гепарин.
При уменьшении фракции выброса левого желудочка до 40% и ниже риск развития ИМ значительно увеличивается.С целью улучшения прогноза заболевания назначают ингибиторы АПФ.
Прогноз
Инфаркт миокарда может осложняться заболеваниями разной степени тяжести, поэтому при ИМ чаще всего дают условно неблагоприятный прогноз. Наихудшие эффекты ожидаются в случае обширных сердечных приступов, когда поражаются большие участки сердечной мышцы. На ноги можно пересаживать так называемые микроинфекции, но это не значит, что это не угрожает пациенту.Скорее всего, со временем могут появиться аритмии. Поэтому крайне важно своевременно проводить лечение ИМ, особенно в виде тромболитической терапии, после которой прогноз заболевания значительно улучшается.
Видео: Каковы шансы на выживание после обширного инфаркта миокарда?
Инфаркт миокарда: статистика
- В 13% случаев это заканчивается смертью, а в 50% случаев приводит к инвалидности.
- Только 50% пациентов с острым инфарктом миокарда доживают до больницы в случае экстренной доставки.
- До 35% пациентов умирают в условиях стационара из-за возникновения постинфарктных осложнений.
- У 25% пациентов с диагнозом «инфаркт миокарда» определяется «немая» форма, внешне не проявляющаяся, следовательно, отсутствие симптоматики не свидетельствует об отсутствии инфаркта миокарда.
- Инфаркт миокарда может возникнуть уже в 17-19 лет и этот риск намного выше у тех людей, чьи родители болели сердечно-сосудистыми заболеваниями до 60 лет.
- Примерно 41% всех случаев заболевания приходится на возраст от 50 до 59 лет.
- В 95% случаев инфаркт миокарда развивается из-за окклюзии коронарного сосуда.
- Ежегодно на Западе от инфаркта миокарда умирает 5% пациентов, а в Украине — 30%.
- В Польше начала активно внедряться программа интервенционной кардиологии, позволившая снизить смертность от ИМ с 35% до 4%.
- Примерно каждые 25 секунд в США кто-то умирает от инфаркта миокарда.
3,86 ср. рейтинг ( 78 % баллов) — 7 голосов — голосов
<НАЗАД: CD-ROM Основное содержание | Показано содержание ресурса: ГЛАВА Джон В. К.Entwistle III и Эндрю С. Векслер
Ссылки Вернуться к быстрым ссылкам
|

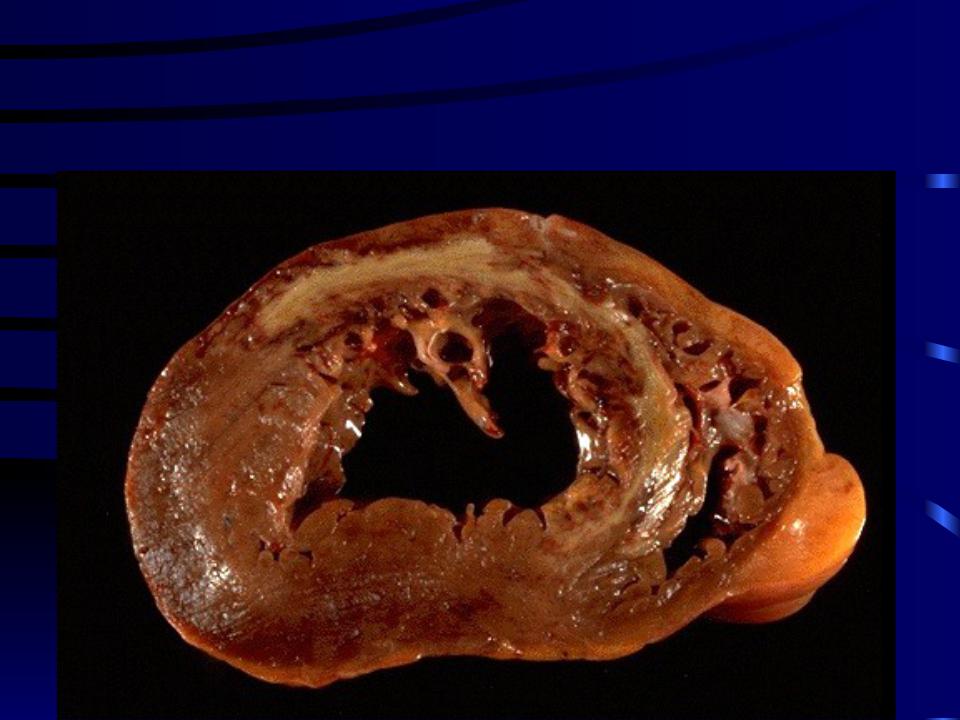

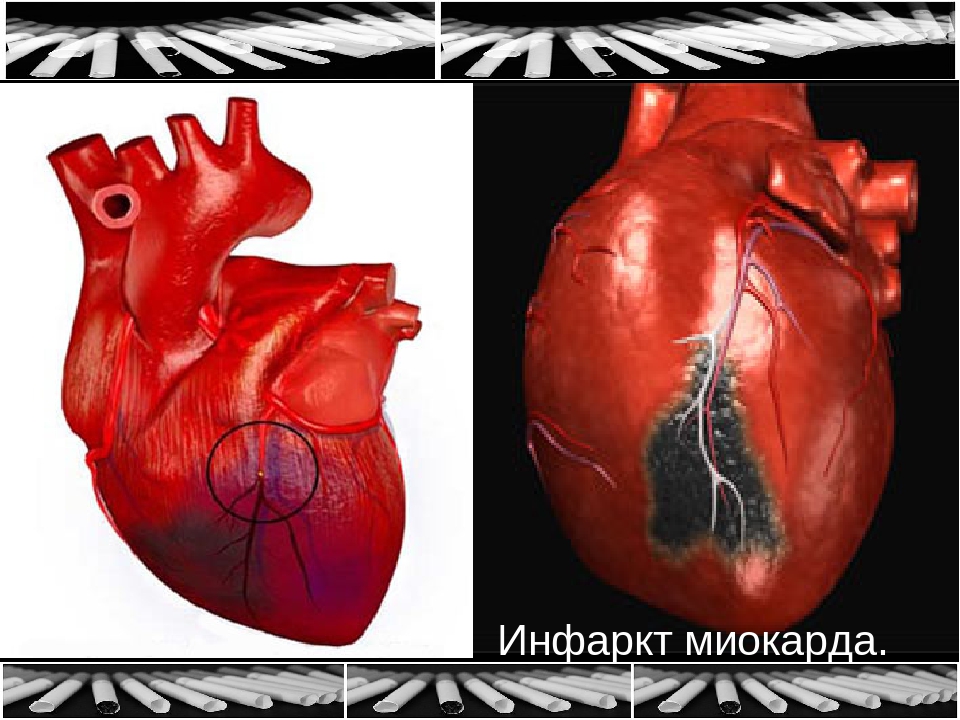 Кислород и питательные вещества не могут поступать в сердце.
Кислород и питательные вещества не могут поступать в сердце.


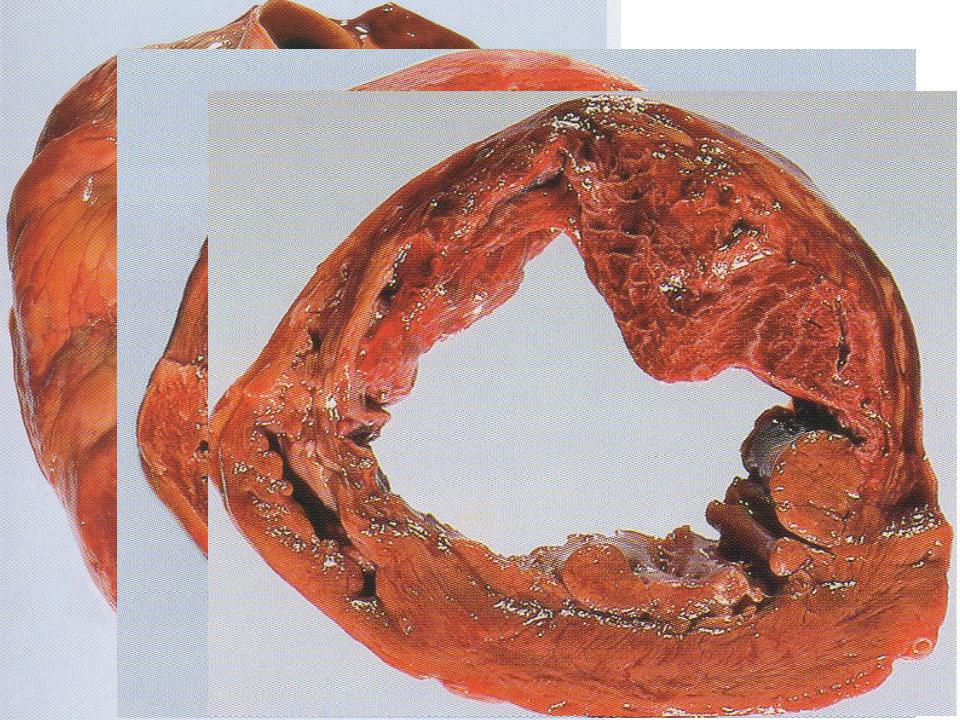
 Как правило, в это время давящие боли прекращаются. Если они продолжаются, это означает, что некроз еще не остановлен. Артериальное давление снижается примерно на 20% от обычной величины. Ритмичность сердцебиений нарушена.
Как правило, в это время давящие боли прекращаются. Если они продолжаются, это означает, что некроз еще не остановлен. Артериальное давление снижается примерно на 20% от обычной величины. Ритмичность сердцебиений нарушена.