Неонатальный менингит — Neonatal meningitis
Неонатальный менингит — серьезное заболевание младенцев, которое при отсутствии лечения приводит к быстрому летальному исходу. Менингит — это воспаление мозговых оболочек , защитных оболочек центральной нервной системы , чаще встречается в неонатальном периоде (младенцы до 44 дней), чем в любое другое время жизни, и является важной причиной заболеваемости и смертности во всем мире. Смертность составляет примерно половину в развивающихся странах и колеблется от 8% до 12,5% в развитых странах.
Симптомы неонатального менингита часто неспецифичны и могут указывать на несколько состояний, таких как сепсис ( воспаление всего тела ). Они могут включать жар , раздражительность и одышку . Единственный способ определить, является ли менингит причиной этих симптомов, — это люмбальная пункция (исследование спинномозговой жидкости ).
Наиболее частой причиной неонатального менингита является бактериальная инфекция крови, известная как бактериемия . Организмы, ответственные за это, разные; чаще всего стрептококки группы B (например, Streptococcus agalactiae ), Escherichia coli и Listeria monocytogenes . Несмотря на низкий уровень смертности в развитых странах, распространенность нарушений неврологического развития после менингита, вызванного E. coli и Streptococcus agalactiae , составляет 50% , а после менингита, вызванного грамотрицательными палочками, кроме E. coli , — 79%. . Несвоевременное лечение неонатального менингита может вызвать церебральный паралич, слепоту, глухоту, судорожные расстройства и проблемы с обучением.
Признаки и симптомы
Ниже приводится список общих признаков и симптомов неонатального менингита.
Эти симптомы неспецифичны и могут указывать на множество различных состояний.
Осложнения
Нейровизуализация ( рентгенография головного мозга) рекомендуется для выявления осложнений менингита. Осложнения следует подозревать , когда клиническое течение характеризуется шоком , дыхательной недостаточностью, очаговыми неврологическими дефицитами, положительной спинномозговой жидкости культура после 48 до 72 часов соответствующей терапии антибиотиков, или инфекции с определенными организмами, такие как Citrobacter koseri и Cronobacter sakazakii , например , . Ультразвук полезен для ранней визуализации, чтобы определить размер желудочка и кровотечение. КТ- сканирование на более поздних этапах терапии следует использовать для продления лечения.
Осложнения следует подозревать , когда клиническое течение характеризуется шоком , дыхательной недостаточностью, очаговыми неврологическими дефицитами, положительной спинномозговой жидкости культура после 48 до 72 часов соответствующей терапии антибиотиков, или инфекции с определенными организмами, такие как Citrobacter koseri и Cronobacter sakazakii , например , . Ультразвук полезен для ранней визуализации, чтобы определить размер желудочка и кровотечение. КТ- сканирование на более поздних этапах терапии следует использовать для продления лечения.
Если обнаружены внутричерепные абсцессы (скопление гноя в головном мозге), рекомендуется лечение, состоящее из комбинации хирургического дренирования абсцесса и антимикробной терапии в течение 4-6 недель. После окончания лечения антибиотиками необходимо выполнить дополнительную визуализацию, поскольку через несколько недель после начала лечения были обнаружены абсцессы .
Рецидивы также случались после соответствующего лечения при заражении грамотрицательными кишечными палочками .
Потеря слуха
Менингит — одна из основных причин приобретенной глухоты. Около 8% больных менингитом имеют стойкую нейросенсорную тугоухость. Чем дольше менингит остается без лечения, тем выше риск судорог и необратимых неврологических нарушений, таких как потеря слуха, проблемы с памятью, нарушения обучаемости, повреждение мозга, проблемы с походкой, почечная недостаточность, шок и даже смерть. Потеря слуха у людей с менингитом может возникнуть, когда организм борется с инфекцией и клетки достигают внутреннего уха, где повреждаются волосковые клетки и нервные волокна. Потеря слуха также может возникнуть после исчезновения менингита из-за повышенного риска окостенения улитки. Оссификация улитки может затруднить установку кохлеарного имплантата при потерях слуха, которые не удается лечить с помощью слуховых аппаратов. Бактериальный менингит может привести к потере слуха. Важно как можно скорее пройти проверку слуха. Лучше всего пройти проверку слуха перед выпиской из больницы или в течение четырех недель после улучшения симптомов. Колеблющаяся потеря слуха наблюдалась у большого числа пациентов, поэтому для контроля потери слуха лучше всего пройти плановые проверки слуха. Вирусный менингит с меньшей вероятностью вызывает потерю слуха, и рекомендуется выполнить проверку слуха, если пациент испытывает какие-либо проблемы со слухом. Все потери слуха различны, поэтому нет никаких прогнозов потери слуха для менингита. Детей оценивают с помощью поведенческого тестирования (если они достаточно взрослые), отоакустической эмиссии (OAE) и слуховой реакции ствола мозга (ABR).
Важно как можно скорее пройти проверку слуха. Лучше всего пройти проверку слуха перед выпиской из больницы или в течение четырех недель после улучшения симптомов. Колеблющаяся потеря слуха наблюдалась у большого числа пациентов, поэтому для контроля потери слуха лучше всего пройти плановые проверки слуха. Вирусный менингит с меньшей вероятностью вызывает потерю слуха, и рекомендуется выполнить проверку слуха, если пациент испытывает какие-либо проблемы со слухом. Все потери слуха различны, поэтому нет никаких прогнозов потери слуха для менингита. Детей оценивают с помощью поведенческого тестирования (если они достаточно взрослые), отоакустической эмиссии (OAE) и слуховой реакции ствола мозга (ABR).
Воздействие на детей на общение
Если потерю слуха не выявить и / или не лечить, это может привести к более позднему овладению речью и задержке навыков чтения. Поскольку невылеченный менингит может вызвать повреждение мозга и нарушение обучаемости, дети с менингитом в анамнезе могут отставать в развитии по сравнению с их обычно развивающимися сверстниками.
Особенности лаборатории
Лабораторные особенности, характерные для бактериального менингита новорожденных, включают:
- Выделение бактериального патогена из спинномозговой жидкости путем посева и / или визуализации с помощью окрашивания по Граму
- Повышенное количество лейкоцитов в спинномозговой жидкости (обычно> 1000 лейкоцитов / мкл, но может быть ниже, особенно у грамположительных бактерий), обычно с преобладанием нейтрофилов
- Повышенный уровень спинномозговой жидкости]] концентрация белка (> 150 мг / дл у недоношенных (преждевременных родов) и> 100 мг / дл у доношенных детей)
- Снижение концентрации глюкозы в спинномозговой жидкости (<20 мг / дл [1,1 ммоль / л] у недоношенных (преждевременных родов) и <30 мг / дл [1,7 ммоль / л] у доношенных (своевременных) младенцев)
Причины
Неонатальный менингит вызывается стрептококками группы B Streptococcus agalactiae (39–48% случаев), Escherichia coli (30–35%), другими грамотрицательными палочками (8–12%), Streptococcus pneumoniae (около 6%). и Listeria monocytogenes (5-7%). Менингит обычно вызывается бактериальной или вирусной инфекцией, однако он также может быть вызван грибковыми, паразитарными или амебными инфекциями. Еще реже, менингит может быть вызван некоторыми видами рака, волчанкой, конкретными лекарствами, травмами головы и операциями на головном мозге. В большинстве случаев неонатальный менингит возникает в результате бактериемии (бактериальной инфекции крови) с гематогенным распространением в центральную нервную систему (ЦНС).
и Listeria monocytogenes (5-7%). Менингит обычно вызывается бактериальной или вирусной инфекцией, однако он также может быть вызван грибковыми, паразитарными или амебными инфекциями. Еще реже, менингит может быть вызван некоторыми видами рака, волчанкой, конкретными лекарствами, травмами головы и операциями на головном мозге. В большинстве случаев неонатальный менингит возникает в результате бактериемии (бактериальной инфекции крови) с гематогенным распространением в центральную нервную систему (ЦНС).
Раннее начало
При раннем неонатальном менингите бактерии передаются от матери либо до рождения ребенка, либо во время родов. Наиболее частыми бактериями, обнаруживаемыми с ранним началом, являются Streptococcus agalactiae , Escherichia coli и Listeria monocytogenes . В развивающихся странах грамотрицательные кишечные (кишечные) бактерии являются причиной большинства менингитов с ранним началом.
Позднее начало
Поздний менингит может быть вызван другими грамотрицательными бактериями и стафилококками . В развивающихся странах Streptococcus pneumoniae вызывает большинство случаев позднего начала.
Вирус простого герпеса
Вирус простого герпеса — редкая причина менингита: он встречается только у 0,165 на 10 000 живорождений в Великобритании и 0,2-5 на 10 000 живорождений в США. И ВПГ-1, и ВПГ-2 могут вызывать неонатальный менингит, однако, по данным HSV-2 в 70% случаев.
Вирус простого герпеса передается новорожденным в основном во время родов (когда инфицированные материнские выделения попадают в контакт с ребенком, что составляет 85% случаев), но также происходит внутриутробно (когда плод еще находится в утробе матери, 5% случаев) или даже после родов, получив инфекцию от сообщества (10% случаев). Наиболее важными факторами, влияющими на передачу вируса, являются стадия инфицирования матери (симптоматическая или несимптоматическая) и повреждение любых материнских оболочек во время родов (чем дольше повреждены ткани, тем выше вероятность инфицирования новорожденных).
Патогенез
Как правило, развитие менингита новорожденных начинается с заселения бактериями желудочно-кишечного тракта . Затем бактерии проникают через слой слизистой оболочки кишечника в кровь, вызывая бактериемию с последующим проникновением в спинномозговую жидкость. Менее эффективная иммунная система новорожденных (особенно альтернативная система комплемента ) снижает их защиту от вторжения бактерий. Колонизация матери играет важную роль в передаче инфекции новорожденному, вызывая ранний менингит.
Стрептококк группы B
Инфекция неонатального Streptococcus agalactiae передается внутриутробно или при прохождении через влагалище. Данные свидетельствуют о том, что колонизация влагалища Streptococcus agalactiae во время беременности увеличивает риск вертикальной передачи и раннего начала заболевания у новорожденных.
E. coli, вызывающая неонатальный менингит
Некоторые штаммы кишечной палочки имеют капсулу под названием K1, которая защищает бактерии от врожденной иммунной системы и позволяет им проникать в центральную нервную систему. Капсула содержит сиаловую кислоту , которая широко встречается в организме человека и поэтому не влияет на защитные силы организма. Сиаловая кислота также играет роль в способности бактерий проникать через гематоэнцефалический барьер . Капсула может быть различным образом O-ацетилирована.
Диагностика
Бактериальная инфекция
Спинномозговая пункция (спинномозговая пункция) необходимо диагностировать менингит. Посев спинномозговой жидкости является наиболее важным исследованием для диагностики бактериального менингита новорожденных, поскольку клинические признаки неспецифичны и ненадежны. Посев крови может быть отрицательным в 15-55% случаев, что также делает их недостоверными. Однако отношение цереброспинальной жидкости к глюкозе в крови ниже двух третей тесно связано с бактериальным менингитом. Спинномозговую пункцию следует делать всем новорожденным с подозрением на менингит, с подозрением или доказанным сепсисом (воспалением всего тела) и его следует рассматривать у всех новорожденных, у которых возможен сепсис. Роль спинномозговой пункции у новорожденных , которые являются здоровыми появляясь , но имеют материнские факторы риска для сепсиса является более спорным; его диагностическая ценность у этих пациентов может быть низкой.
Спинномозговую пункцию следует делать всем новорожденным с подозрением на менингит, с подозрением или доказанным сепсисом (воспалением всего тела) и его следует рассматривать у всех новорожденных, у которых возможен сепсис. Роль спинномозговой пункции у новорожденных , которые являются здоровыми появляясь , но имеют материнские факторы риска для сепсиса является более спорным; его диагностическая ценность у этих пациентов может быть низкой.
Ранним началом считается инфицирование в течение недели после рождения. Поздним началом считается после первой недели.
Вирусная инфекция
Младенцы, рожденные от матерей с симптомами вируса простого герпеса, должны быть проверены на вирусную инфекцию. Тесты печени, полный анализ крови , анализ спинномозговой жидкости и грудная клетка Рентгеновская все должны быть завершены , чтобы диагностировать менингит. Образцы должны быть взяты из кожи, конъюнктивы (глаза), рта и горла, прямой кишки , мочи и спинномозговой жидкости для культивирования вирусов и полимеразной цепной реакции .
Профилактика
Бактериальный
Профилактика неонатального менингита в первую очередь интранатально (во время родов) антибиотическая профилактика (профилактика) беременных матерей , чтобы уменьшить вероятность раннего начала менингита на стрептококки группах в . В случае менингита с поздним началом профилактика передается лицам, осуществляющим уход, чтобы остановить распространение инфекционных микроорганизмов . Правильные гигиенические привычки — это прежде всего отказ от неправильного использования антибиотиков ; такие как чрезмерное количество рецептов, использование антибиотиков широкого спектра действия и увеличенное время дозирования помогут предотвратить поздний неонатальный менингит. Возможной профилактикой может быть вакцинация матерей против Streptococcus agalactiae и E. coli , однако она все еще находится в стадии разработки.
Популярный
Единственная форма профилактики вирусного заражения новорожденного — это родоразрешение путем кесарева сечения, если у матери проявляются симптомы инфекции.
Уход
Лечение менингита — антибиотики . Конкретные используемые препараты основаны на результатах культур, которые идентифицируют инфекционные бактерии, но смесь ампициллина , гентамицина и цефотаксима используется для раннего менингита до их идентификации. При позднем неонатальном менингите рекомендуется прием антистафилококковых антибиотиков , таких как нафциллин или ванкомицин , плюс цефотаксим или цефтазидим с аминогликозидами или без них . Целью этих методов лечения является стерилизация спинномозговой жидкости от всех патогенов . Для подтверждения стерилизации необходимо повторить спинномозговую пункцию через 24–48 часов после начала лечения.
Ограниченные данные свидетельствуют о том, что адъювантные кортикостероиды могут снизить краткосрочный риск потери слуха у новорожденных с менингитом, но неясно, помогают ли кортикостероиды снизить риск смерти или долгосрочной потери слуха.
Стрептококки группы B
При подозрении на менингит, вызванный Streptococcus agalactiae , Американская академия педиатрии рекомендует следующее лечение : дозы пенициллина до 450000 Ед / кг в сутки (270 мг / кг / сутки), разделенные на 8 часов, если возраст младше 7 дней. и делится на 6 часов, если возраст> 7 дней. Для пенициллина [рекомендуемая доза составляет до 300 мг / кг / день, разделенная на 8 часов, если возраст <7 дней, или 4-6 часов, если возраст> 7 дней. После подтверждения наличия Streptococcus agalactiae посевом, только пенициллин следует использовать до конца курса лечения, включая 14-дневную терапию после стерилизации.
Грамотрицательные кишечные вещества
При подозрении на грамотрицательный кишечный (включая кишечную палочку ) менингит рекомендуется комбинация цефотаксима и аминогликозида , обычно гентамицина . Это лечение должно продолжаться в течение 14 дней после стерилизации, а затем только цефотаксимом в течение следующих 7 дней, что составляет минимум 21 день терапии после стерилизации.
Это лечение должно продолжаться в течение 14 дней после стерилизации, а затем только цефотаксимом в течение следующих 7 дней, что составляет минимум 21 день терапии после стерилизации.
Listeria monocytogenes
Менингит, вызванный Listeria monocytogenes, следует лечить комбинацией ампициллина и гентамицина, поскольку он синергетичен in vitro и обеспечивает более быстрое удаление бактерий в моделях инфекции на животных.
Пневмококк
Streptococcus pneumoniae можно лечить пенициллином или ампициллином.
Вирус простого герпеса
В случае менингита, вызванного вирусом простого герпеса, для благоприятного исхода необходимо немедленно начать противовирусную терапию ( ацикловир или видарабин ). Ацикловир — лучший противовирусный препарат, поскольку он оказывает такое же действие на инфекцию, как и видарабин, и его безопаснее применять у новорожденных. Рекомендуемая дозировка составляет 20 мг / кг каждые шесть часов в течение 21 дня.
Эпидемиология
В промышленно развитых странах заболеваемость бактериальным менингитом составляет примерно 3 случая на 10 000 живорождений. Заболеваемость менингитом, вызванным вирусом простого герпеса, оценивается в 0,2-5,0 случая на 10 000 живорождений. Неонатальный менингит гораздо чаще встречается в развивающихся странах. Неонатальный менингит колеблется от 4,8 на 10 000 живорождений в Гонконге до 24 на 10 000 живорождений в Кувейте . В Африке и Южной Азии встречаются цифры от 8,0 до 61 на 10 000 живорождений. Ожидается, что эти цифры ниже реальности из-за сложности диагностики и доступности здравоохранения в слаборазвитых странах Азии и Африки .
Рекомендации
Лечение бактериофагами неонатального менингита
Исследования на клеточной модели показали большой потенциал фаготерапии в лечении менингита, вызванного патогенной кишечной палочкой с капсульным антигеном К1
При бактериальном менингите имеет место воспаление мозговых оболочек, вызванное инвазией менингококков, пневмококков, стрептококков группы В, патогенной кишечной палочки (Escherichia coli) и других микроорганизмов. Это тяжелая болезнь, которая требует скорейших диагностики и проведения антибактериальной и противовоспалительной терапии. Особенно часто бактериальный менингит возникает у новорожденных (чаще всего – недоношенных) и детей раннего возраста, ведь их иммунная система еще очень незрелая. Смертность при неонатальном менингите составляет 5-20%, а 25-50% выживших имеют пожизненные неврологические расстройства, среди которых когнитивные нарушения, глухота, слепота, судорожный синдром.
Это тяжелая болезнь, которая требует скорейших диагностики и проведения антибактериальной и противовоспалительной терапии. Особенно часто бактериальный менингит возникает у новорожденных (чаще всего – недоношенных) и детей раннего возраста, ведь их иммунная система еще очень незрелая. Смертность при неонатальном менингите составляет 5-20%, а 25-50% выживших имеют пожизненные неврологические расстройства, среди которых когнитивные нарушения, глухота, слепота, судорожный синдром.
Один из распространенных возбудителей бактериального неонатального менингита – E. coli, в первую очередь, штаммы, имеющие так называемый капсульный антиген К1 (это полимер сиаловой кислоты, который покрывает поверхность бактерии и скрывает многие из ее антигенов). Считается, что эта капсула помогает кишечной палочке избегать уничтожения иммунной системой человека и проникать через гематоэнцефалический барьер в мозг.
Одна из важных задач в лечении неонатального менингита – преодоление устойчивости кишечной палочки и других возбудителей к антибиотикам. С этой целью ученые из Университета Варвика (Великобритания) исследовали эффекты бактериофагов при данной патологии. Они создали модель для изучения неонатального менингита, в которой использовали эндотелиальные клетки церебральных микрососудов (hCMECs), штамм кишечной палочки E. coli EV36 и бактериофаг K1F, специфический к данному штамму E. coli.
Читайте также: Даже низкие дозы антибиотиков вредны для детей
Авторы обнаружили, что бактериофаги способны поражать кишечную палочку внутри клеток hCMECs. Сами бактериофаги не вызывают ни иммунного ответа, ни воспалительной реакции. При этом бактериофаги временно повышают проницаемость эндотелиальных клеток hCMECs, что in vivo (в живом организме) может способствовать проникновению иммунных клеток сквозь стенки сосудов в мозг.
Исследование, по мнению авторов, демонстрирует большой потенциал фаготерапии при неонатальном менингите и в целом является важным шагом в разработке методов лечения антибиотикорезистентных бактериальных инфекций.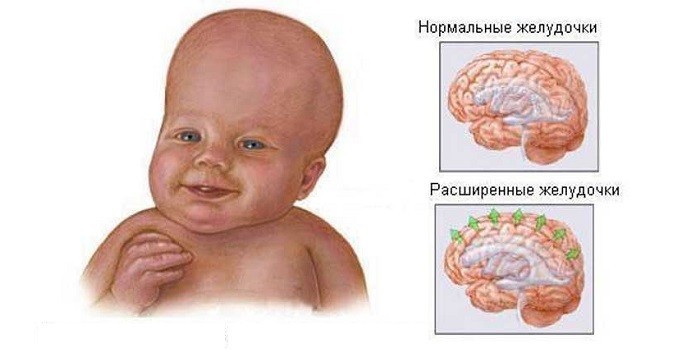
* Møller-Olsen C, Ross T, Leppard KN et al. Bacteriophage K1F targets Escherichia coli K1 in cerebral endothelial cells and influences the barrier function. Scientific Reports, 2020, 10: 8903. https://doi.org/10.1038/s41598-020-65867-4
Non-Invasive Model of Neuropathogenic Escherichia coli Infection in the Neonatal Rat
Е. палочка K1 системная инфекция модель описана здесь повторяет многие черты естественного заражения в организме человека. Бактерии внутрь, колонизировать желудочно-кишечный тракт, перемещать в отсек крови через брыжеечных лимфатических узлов, прежде чем создать орган по конкретным заболеванием с соответствующим воспаление мозга 24. Важно отметить, что эта модель показывает сильную зависимость возраста; как показано на рисунке 3, два-дневные (P2) крысята сильно подвержены инвазивных заболеваний, но в течение семидневного периода животные становятся все более невосприимчивой к инфекции, но не Г.И. колонизации тракта 17. После транзита от места GI колонизации в отсеке крови, бактерии могут быть визуализированы в образцах крови с помощью флуоресцентной микроскопии (рис 4) перед входом в ЦНС преимущественно в сосудистое сплетение 25. У некоторых животных, существует обширное вторжение в других основных органов, таких каклегких, селезенки и почек 25.
Количество бактерий в ткани может существенно варьироваться в зависимости от индивидуальных щенков 25, но при бионагрузка оценивается как наличие или отсутствие таких существует высокая степень воспроизводимости в отношении органов вторжения. С помете 12 щенков, как одной тестовой группе, расчеты электростанции, использующие G * Питание Программное обеспечение установлено, что это размер выборки равняется 98,6% вероятности нахождения эффект, основанный на выживание, используя шесть животных из когорты и> 99% вероятностью, если все в двенадцать учтены. Модель поэтому подходит для оценки новых препаратов, специально разработанных для лечения бактериальных инфекций у новорожденных и был использован в процедуре оценки терапевтического потенциала капсулы depolymerase EndoE, которые селективно удал ет капсулу K1 от бактериальной поверхности 24-26. Он также может быть использован для исследования хозяин-бактерии взаимодействий, которые влияют на похлопываниеhogenesis Е. палочки neuropathogens; в этом контексте она была использована для исследований Е. палочка A192PP колонизация и распространение. Было показано, что E. палочка A192PP клетки сохраняются в желудочно-кишечном тракте P2, P5 и Р9 щенков в больших количествах; временные аспекты колонизации в этих трех группах были очень похожи (Рисунок 5) и отражает способность бактерий к размножению и поддерживать плотность населения в пределах кишечнике.
Он также может быть использован для исследования хозяин-бактерии взаимодействий, которые влияют на похлопываниеhogenesis Е. палочки neuropathogens; в этом контексте она была использована для исследований Е. палочка A192PP колонизация и распространение. Было показано, что E. палочка A192PP клетки сохраняются в желудочно-кишечном тракте P2, P5 и Р9 щенков в больших количествах; временные аспекты колонизации в этих трех группах были очень похожи (Рисунок 5) и отражает способность бактерий к размножению и поддерживать плотность населения в пределах кишечнике.
Вирулентность клинических изол A192 была повышена путем серийного пассажа в новорожденных крыс с тем чтобы обеспечить мало или вообще не избыточность использования животных. Е. палочка A192 колонизировали P2 новорожденных крыс с 100% эффективностью, вызвало бактериемию в 35% животных и произвел смертельный эффект в 25% 27. Пассировать производная A192PP колонизирует желудочно-кишечный тракт, вызывает бактериемии и вызывает летальность во всех P2 щенков. Таким образом, модель может быть использована, чтобы исследовать вирулентность диразличны х К1 напрягает по отношению к их способности, чтобы вторгнуться в ЦНС и других органов и систем с сайта колонизации. В этом контексте, Pluschke и сотрудники 23 использовали новорожденных модель крысы инфекции для определения потенциала 95 E. палочка K1 напрягает человеческого происхождения, чтобы вызвать бактериемию после кишечной колонизации; они наблюдали значительные различия в эффективности обоих колонизации и инвазивного потенциала, лежащие в основе клонального природу E. палочка K1 neuropathogens.
Рисунок 1. Материалы для коллекции тканей: (A) весы, (B) предварительно взвешивают трубы, содержащие необходимые носители, (C) операционный стол, линейка и иглы придавить животное, (D) 70% (v / v) этанол и PBS стерилизовать сбора ткани оборудования, (F) со льдом, чтобы сохранить ткани, (G), 70% (об / об) этанола для стерилизации Таблица операции и окружает. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 2. Разделение желудочно-кишечного тракта и брыжеечных лимфатической системы. (A) Возьмитесь за центральную масса брыжеечной лимфатической системы с мелкими рассечение щипцов. (B) Возьмитесь за проксимальная часть тонкой кишки, и тянуть в разные стороны. (C) желудочно-кишечного тракта и брыжеечных лимфатическая система будет полностью separatе. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 3. Выживаемость новорожденных крысят в возрасте от двух дней (Р2) на девять дней (P9) после перорального введения E. палочка A192PP, иллюстрирующий сильный возраста зависимость системной инфекции. Каждая группа представляет 24 новорожденных.
Рисунок 4. Флуоресцентные изображения из E. палочка A192PP клетки в мазке крови от P2 щенка инфицированных после перорального введения бактерий. Антиген липополисахаридный O на поверхности бактерий была улained с кроличьей анти-O18 поликлональных антител и Alexa546-конъюгированного козьего анти-кроличьего второго антитела. Капсула K1 визуализировали с EndoE-GFP реагента. Практически все бактерии, обнаруженные в пробах крови отображается защитный K1 капсулу. Изображения были получены доктором Андреа Zelmer. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 5. Е. палочка A192PP кишечного колонизации после введения бактериального инокулята. ДНК экстрагируют из цельной кишечника и Е. палочка К1 колониеобразующих единиц / г (КОЕ / г) ткани определяется количественной полимеразной цепной реакции (КПЦР) ориентированные на polysialyltransferase (Neus) ген, как описано в другом месте 17р>. LOD: предел обнаружения.
LOD: предел обнаружения.
| Особенность | Здоровый | Нездоровый |
| Цвет кожи | Розовый | Бледный / Желтый |
| Ловкость (рефлекса) | Щенок сразу сменить на обратной размещения | Сложность в изменении обратную размещение (> 3 сек) или не может достичь |
| Нежный давление на живот | Нет звука | Звук агитации |
| Желудок / молокопровод | Видимое и белый | Не видно |
| Температура | Теплый | Относительно холодно * |
| Вес | Прирост 1,5-2 г в день | Нет увеличение веса или потеря веса |
| Поведение при размещении в клетке | Шаги в направлении матери и начинает пeeding | Не можете двигаться к матери и показывает трудности кормления |
Таблица 1. Семь-точка система подсчета очков: Первые три оценки, перечисленные, как правило, первые признаки, наблюдаемые. * Новорожденные с системной инфекции опыт повышенной температуре тела (> 2 ° C). Тем не менее, из-за отсутствия ловкостью животных, чтобы достичь своей матери для поддержания температуры тела, нездоровые животные могут отделиться от помета и холодно к голой рукой.
Страница статьи : Эпидемиология и инфекционные болезни
Деконенко Е.П., Куприянова Л.В., Головатенко-Абрамов К.В. и др. Листериозный менингит и его осложнения. Неврологический журнал. 2001; 2: 23-6.
Покровский В.И., Годованный Б.А. Листериоз В кн.: Покровский В.И. (ред.) Инфекционные болезни. М.; Медицина; 1996, 291-6.
Практическое руководство по антиинфекционной хемиотерапии. Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н.Козлова. Смоленск, МАКМАХ, 2007.
Родина Л.В., Маненкова Г.М., Тимошков В.В. Факторы и пути заражения листериозом населения Москвы. Эпидемиология и инфекционные болезни. 2002; 4: 48-50.
Эпидемиология и инфекционные болезни. 2002; 4: 48-50.
Середа А.Д., Котляров В.М., Воробьев А.А., Бакулов И.А. Иммунитет при листериозе. Журнал микробиологии. 2000; 5: 98-102.
Тартаковский И.С., Малеев В.В., Ермолаева С.А. Листерии: роль в инфекционной патологии человека и лабораторная диагностика. М.; Медицина для всех; 2002.
Честнова Т.В. Диагностика листериоза у новорожденных. Эпидемиология и инфекционные болезни. 2001; 3: 45-47.
Эпидемиология и профилактика листериоза. Методические указания. М.; Федеральный ЦГСЭН МЗ России, 2002.
Ющук Н.Д., Кареткина Г.Н., Климова Е.А. и др. Листериоз: варианты клинического течения. Терапевтический архив. 2001; 11: 48-51.
Ющук Н. Д., Кареткина Г. Н., Деконенко Е. П. и др. Листериоз с поражением нервной системы. Терапевтический архив. 2007; 11: 57-60.
Под ред. Г.М. Савельевой, Г.Т. Сухих, В.Н. Серова и др. Акушерство. Национальное руководство. 2015.
Приказ Министерства здравоохранения РФ от 01.11.2012 № 572н. «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология» (за исключением использования вспомогательных репродуктивных технологий)».
Doganay M. Listeriosis: сlinical presentation. Immunol. Med. Microbiol. 2003; 31 (3): 173-5.
Girmenia C., Iori A. P., Bernasconi S., Testy A. M. et al. Listeriosis in recipientof allogeneic bone marron transplants from unrelated donors. Eur. J. Clin. Microbiol. Infect. Dis. 2000; 19 (9):711-4.
Temple M.E., Nahata M.C. Treatment of listeriosis. Ann. Pharmacoter. 2000; 34 (5): 656-61.
Madjunkov M; Chaudhry S; Ito S.Listeriosis during pregnancy. Arch Gynecol Obstet. 2017; 296(2): 143-52.
Larraín de la C D, Abarzúa C F, Jourdan H Fd, Merino O P, Belmar J C, García C P. Listeria monocytogenes infection in pregnancy: experience of Pontificia Universidad Católica de Chile University Hospital. Rev Chilena Infectol. 2008 Oct; 25(5): 336-41. Epub 2008 Oct 1.
Стрептококковая инфекция группы В у новорожденных и грудных детей | #01/12
Стрептококк группы В (S. agalactiae) является наиболее частой причиной заболеваемости и смертности новорожденных детей от менингита, сепсиса и пневмонии в развитых странах [1]. В США ежегодно заболевают тяжелой стрептококковой инфекцией группы В 8000 новорожденных, около 800 этих детей умирает. В Великобритании частота ранних неонатальных инфекций, вызванных стрептококком группы В (СГБ), составляет 3,6 случая на 1000 новорожденных [2]. Регистрация и профилактика СГБ-инфекции у беременных и новорожденных проводится во многих странах (США, Канада, Австралия, Бельгия, Франция и др.), что позволило радикально снизить частоту заболеваемости и летальность от данной инфекции у новорожденных. С введением в развитых странах антибиотикопрофилактики СГБ-инфекции в родах, частота развития менингита у детей в период с 1993 по 2008 год сократилась на 80 процентов [1]. В России мероприятия по регистрации и профилактике инфекций, вызванных СГБ, не проводятся.
agalactiae) является наиболее частой причиной заболеваемости и смертности новорожденных детей от менингита, сепсиса и пневмонии в развитых странах [1]. В США ежегодно заболевают тяжелой стрептококковой инфекцией группы В 8000 новорожденных, около 800 этих детей умирает. В Великобритании частота ранних неонатальных инфекций, вызванных стрептококком группы В (СГБ), составляет 3,6 случая на 1000 новорожденных [2]. Регистрация и профилактика СГБ-инфекции у беременных и новорожденных проводится во многих странах (США, Канада, Австралия, Бельгия, Франция и др.), что позволило радикально снизить частоту заболеваемости и летальность от данной инфекции у новорожденных. С введением в развитых странах антибиотикопрофилактики СГБ-инфекции в родах, частота развития менингита у детей в период с 1993 по 2008 год сократилась на 80 процентов [1]. В России мероприятия по регистрации и профилактике инфекций, вызванных СГБ, не проводятся.
Клинический случай. Ребенок (девочка) от первой беременности, протекавшей на фоне гестоза с 4-кратной угрозой прерывания. У матери во время беременности было обострение хронического пиелонефрита. Роды преждевременные на сроке 35–36 недель путем кесарева сечения. Масса тела при рождении 2650 г. Заболела в возрасте 24 дня: вялость, субфебрилитет, отказ от еды, срыгивания, жидкий стул 3–5 раз в день. На 4-й день болезни состояние резко ухудшилось, и девочка госпитализирована в инфекционный стационар. При поступлении состояние крайне тяжелое: среднемозговая кома, выбухание и пульсация большого родничка, частые приступы тонических судорог, дыхание аритимичное, ослабление дыхания в нижних отделах легких, мраморность кожи, акроцианоз, тахикардия до 190 уд./мин, «кофейная гуща» из желудка, олигурия. В общем анализе крови: Ley 21400, Tr 36000, п — 4%, с — 56%, э — 0%, б — 6%, л — 24%, м — 13%, t сверт. 9 мин, СОЭ 23 мм/ч. Результаты исследования ликвора: ликвор желтый, мутный, pH = 7,0, реакция Панди ++++, реакция Нонне-Апельта ++++, цитоз 34 тыс. клеток в 1 мкл (нейтрофилы 89%, лимфоциты 11%), белок 2,98 г/л, глюкоза 3,8 ммоль/л. В биохимическом анализе крови выявлена умеренная гипербилирубинемия и гиперферментемия, снижение протромбинового индекса (ПТИ) до 40%, декомпенсированный метаболический ацидоз (рН 6,8; ВЕ — 27,3 ммоль/л). Результаты бактериологического исследования крови и ликвора отрицательные. Положительный латекс-тест на антиген S. agalactiaе в ликворе. Исследования фекалий на ротавирус, патогенные и условно-патогенные микроорганизмы отрицательные. Заключительный диагноз: поздний неонатальный сепсис, вызванный S. agalactiae (менингоэнцефалит, кардит, энтероколит, пневмония, гепатит). Осложнения: полиорганная недостаточность. Септический шок II–III стадии. Отек-набухание головного мозга. Диссеминированное внутрисосудистое свертывание (ДВС-синдром) III стадии. Ребенок получил 4 курса антибактериальной терапии (ампициллин, цефтриаксон, меронем, амикацин, ванкомицин), посиндромную терапию. Выписана в удовлетворительном состоянии на 27-й день болезни.
клеток в 1 мкл (нейтрофилы 89%, лимфоциты 11%), белок 2,98 г/л, глюкоза 3,8 ммоль/л. В биохимическом анализе крови выявлена умеренная гипербилирубинемия и гиперферментемия, снижение протромбинового индекса (ПТИ) до 40%, декомпенсированный метаболический ацидоз (рН 6,8; ВЕ — 27,3 ммоль/л). Результаты бактериологического исследования крови и ликвора отрицательные. Положительный латекс-тест на антиген S. agalactiaе в ликворе. Исследования фекалий на ротавирус, патогенные и условно-патогенные микроорганизмы отрицательные. Заключительный диагноз: поздний неонатальный сепсис, вызванный S. agalactiae (менингоэнцефалит, кардит, энтероколит, пневмония, гепатит). Осложнения: полиорганная недостаточность. Септический шок II–III стадии. Отек-набухание головного мозга. Диссеминированное внутрисосудистое свертывание (ДВС-синдром) III стадии. Ребенок получил 4 курса антибактериальной терапии (ампициллин, цефтриаксон, меронем, амикацин, ванкомицин), посиндромную терапию. Выписана в удовлетворительном состоянии на 27-й день болезни.
Источник СГБ-инфекции и риск заболевания у ребенка
СГБ являются представителями нормальной микрофлоры урогенитального, кишечного тракта и верхних дыхательных путей человека. СГБ обнаруживаются в составе микрофлоры влагалища у 15–45% женщин [3]. Преобладает бессимптомная колонизация (носительство), но СГБ может стать причиной развития у женщины инфекции мочевых путей, сепсиса, хориоамнионита, эндометрита, тромбофлебита и эндокардита. Наиболее высок уровень колонизации у женщин моложе 20 лет, ведущих активную половую жизнь, использующих ВМС-контрацепцию [4]. Беременность не влияет на частоту носительства СГБ.
По нашим данным частота носительства S. agalactiaе в урогенитальном тракте у женщин репродуктивного возраста г. Казани составляет 12,7%. Результаты получены при бактериологическом исследовании мазков из цервикального канала, слизистой влагалища, мочи 172 женщин с использованием полихромогенной среды с последующей идентификацией микроорганизмов на анализаторе VITEK. Не исключается, что частота носительства СГБ выше, поскольку не проводилось бактериологическое исследование ректальных мазков.
Не исключается, что частота носительства СГБ выше, поскольку не проводилось бактериологическое исследование ректальных мазков.
Основным источником инфицирования новорожденных детей СГБ является мать [4]. Инфицирование ребенка может произойти внутриутробно, а также в родах. Родоразрешение путем кесарева сечения не снижает риск инфицирования ребенка СГБ. Вертикальный путь передачи СГБ в основном приводит к развитию ранней стрептококковой инфекции (срок развития до 7-го дня жизни). Основными факторами риска развития СГБ-инфекции у новорожденных являются: бактериурия S. agalactiae у матери во время беременности, неонатальные СГБ-инфекции у ранее рожденных детей, недоношенность (< 37 недель), лихорадка в родах, безводный период более 18 часов [6, 7]. Однако возможно развитие СГБ-инфекции у детей, рожденных матерями, не имеющими факторов риска. Риск инфицирования новорожденных при колонизации СГБ матери составляет 50%, при отсутствии стрептококков у матери — 8% [3]. Недоношенные дети со сроком гестации менее 35–37 недель имеют более высокий риск развития заболевания в связи с отсутствием у них специфических материнских антител. Риск заболевания у доношенных детей в общей популяции составляет около 0,2%, у недоношенных детей — 0,3% [8]. Частота клинической стрептококковой инфекции у новорожденных первых 7 дней жизни составляет 1,3–3:1000, родившихся живыми, после 7 дней жизни — 1–1,7:1000. На каждые 100 инфицированных новорожденных приходится 1 случай клинически явной инфекции. Возможно постнатальное инфицирование детей СГБ от матери, а также от медицинского персонала родильных отделений (частота носительства 16–47%) или от других новорожденных, что приводит к формированию поздней СГБ-инфекции (сроки развития 8 дней — 12 недель жизни [8]. Нозокомиальный риск инфицирования новорожденных СГБ при отсутствии инфекции у матери составляет 13–43% [8].
Исходя из когорты 16 000 новорожденных детей в год в Казани, установленного нами уровня колонизации беременных в 12,7%, установленного (по данным литературы) риска колонизации детей в 0,2% и частоты развития сепсиса 0,5/1000 можно ожидать развития от 8 до 15 случаев сепсиса в Казани в год. В 2010–2011 гг. в детских стационарах г. Казани диагностировано 4 случая СГБ-сепсиса и менингита у новорожденных и детей первых трех месяцев жизни, на фоне значительно более высокого числа случаев неонатального сепсиса и гнойных менингитов невыясненной этиологии.
В 2010–2011 гг. в детских стационарах г. Казани диагностировано 4 случая СГБ-сепсиса и менингита у новорожденных и детей первых трех месяцев жизни, на фоне значительно более высокого числа случаев неонатального сепсиса и гнойных менингитов невыясненной этиологии.
Клинические проявления и исходы стрептококковой инфекции у новорожденных
У большинства новорожденных (99%), колонизированных СГБ, инфекционный процесс не развивается. У заболевших детей СГБ-инфекция в основном протекает в инвазивных формах: бактериемия, пневмония, менингит, сепсис. Инвазивная инфекция развивается только у той части новорожденных, которая постнатально колонизируется СГБ [8]. Имеются особенности течения и исходов ранней и поздней СГБ-инфекции новорожденных. Сепсис с ранним началом в 90% случаев развивается в течение 24 часов после рождения и в основном проявляется сепсисом (69%), пневмонией (26%), респираторным дистресс-синдромом (13%), реже — менингитом (11%) [9]. Ранние симптомы сепсиса неспецифичны и проявляются нарушением дыхания (апноэ, постанывание, тахи- и диспноэ) и нарушением перфузии кожи (сероватая бледность, мраморность), а также тахикардией и др. симптомами. Возможно развитие молниеносной формы инфекции с клиникой септического шока, респираторного дистресса и летальным исходом через несколько часов от начала заболевания. Сепсис с поздним началом (1–12 недель) в большинстве случаев проявляется менингитом (60%). В 20–30% случаев развитию менингита предшествуют симптомы поражения верхних дыхательных путей [9, 10]. Редкими проявлениями поздней СГБ-инфекции являются: отит, конъюнктивит, артрит, поражения кожи и остеомиелит [11]. Летальность от ранней СГБ инвазивной инфекции у доношенных составляет 2–10%, у недоношенных и маловесных при рождении детей — 30% [12]. У детей с поздней манифестацией СГБ-сепсиса летальность составляет 4–6% [9, 10, 13]. До 26% доношенных новорожденных с СГБ-менингитом умирают или имеют неврологические нарушения при выписке из стационара. В 50% случаев у выживших развивается глухота, гидроцефалия, судорожный синдром, моторные и сенсорные нарушения, задержка развития [14]. У недоношенных детей, переживших септический шок, может развиться перивентрикулярная лейкомаляция [15]. Рецидивы стрептококковой инфекции регистрируются даже после завершенного лечения в 1% случаев [8]. Риск неблагоприятного исхода стрептококкового менингита выше у детей, имевших: судороги, нарушение сознания, септический шок, содержание белка в спинномозговой жидкости ≥ 300 мг, содержание глюкозы < 20 мг/дл [15]. Риск неблагоприятного исхода у детей с ранним развитием менингита выше, чем у детей с поздним началом менингита (50% и 17%). Ученые предполагают, что частота неблагоприятных исходов стрептококкового менингита значительно выше, чем по данным литературы, поскольку выжившие дети могут иметь задержку в развитии или трудности в обучении в более старшем возрасте [14]. Фульминантность раннего сепсиса, а также незаметное постепенное начало позднего сепсиса делают жизненно необходимым умение быстрой постановки диагноза и диагноза-подозрения, а также проведения адекватной терапии [8].
В 50% случаев у выживших развивается глухота, гидроцефалия, судорожный синдром, моторные и сенсорные нарушения, задержка развития [14]. У недоношенных детей, переживших септический шок, может развиться перивентрикулярная лейкомаляция [15]. Рецидивы стрептококковой инфекции регистрируются даже после завершенного лечения в 1% случаев [8]. Риск неблагоприятного исхода стрептококкового менингита выше у детей, имевших: судороги, нарушение сознания, септический шок, содержание белка в спинномозговой жидкости ≥ 300 мг, содержание глюкозы < 20 мг/дл [15]. Риск неблагоприятного исхода у детей с ранним развитием менингита выше, чем у детей с поздним началом менингита (50% и 17%). Ученые предполагают, что частота неблагоприятных исходов стрептококкового менингита значительно выше, чем по данным литературы, поскольку выжившие дети могут иметь задержку в развитии или трудности в обучении в более старшем возрасте [14]. Фульминантность раннего сепсиса, а также незаметное постепенное начало позднего сепсиса делают жизненно необходимым умение быстрой постановки диагноза и диагноза-подозрения, а также проведения адекватной терапии [8].
Методы диагностики СГБ-инфекции
«Золотым» стандартом диагностики СГБ-инфекции является культуральный метод с использованием селективных сред (Тодда–Хевитта: бульон с кровью овец с добавлением налидиксовой кислоты и гентамицина). Диагностика инвазивных форм СГБ (сепсиса, менингита, пневмонии) основывается на выделении возбудителя из крови или ликвора или из других первично стерильных жидкостей организма. Однако диагностика заболевания, основанная только на культурах крови, не отражает истинную частоту встречаемости СГБ-сепсиса. Низкая (70%) чувствительность бактериологического метода исследования в диагностике инвазивных форм СГБ-инфекции у новорожденных детей связана с забором материала на фоне антибактериальной терапии, непостоянством бактериемии, низкой концентрацией возбудителя, небольшим объемом крови для исследования [8]. Так, чувствительность культурального метода при заборе крови на фоне антибактериальной терапии составляет всего 20–30%. Чувствительность бактериологического метода в диагностике СГБ-инфекции можно повысить на 20–30% при использовании селективных хромогенных сред.
Чувствительность бактериологического метода в диагностике СГБ-инфекции можно повысить на 20–30% при использовании селективных хромогенных сред.
Для диагностики СГБ-инфекции в настоящее время широко применяют экспресс-методы (полимеразная цепная реакция (ПЦР), латекс-агглютинация). Метод латекс-агглютинации имеет невысокую чувствительность (70%), поскольку минимально определяемая данным методом концентрация бактерий в спинномозговой жидкости составляет от 105 до 5 × 106 бактерий/мл [16]. ПЦР является незаменимым методом верификации инфекционных заболеваний в неонатологической практике [17]. Чувствительность, специфичность и прогностическая ценность (положительная и отрицательная) ПЦР по отношению к культуральному методу в диагностике СГБ-инфекции составляют соответственно 71%, 90%, 61%, 94% [8]. Женщинам, необследованным на сроке 35–37 недель и поступающим в клинику непосредственно перед родами, рекомендуется экспресс-диагностика (ПЦР или Strep-B-test). Иммунохроматографические полоски Strep B позволяют выявить возбудитель за 5–10 минут [18].
Лечение. СГБ сохраняют высокую чувствительностью к бета-лактамным антибиотикам. По результатам наших исследований, все штаммы S. agalactiae, выделенные из мочи и со слизистой влагалища женщин репродуктивного возраста, были чувствительны к пенициллину и другим бета-лактамам, ванкомицину. Устойчивость к тетрациклину выявлена в 20%, к эритромицину — в 18% случаев. Лечение СГБ-инфекции у новорожденных проводится пенициллином (300 000 МЕ/кг в сутки) или ампициллином (200 000 МЕ/кг в сутки), в комбинации с аминогликозидами (гентамицин, нетилмицин, амикацин). При менингите пенициллин следует назначать в дозе 500 000 МЕ/кг в сутки, ампициллин — 300 МЕ/кг в сутки. Цефалоспорины могут применяться, но они не обладают никакими преимуществами в сравнении с пенициллином или ампициллином. Рекомендуемая длительность терапии сепсиса 7–10 дней. При неинвазивных СГБ-инфекциях продолжительность монотерапии составляет не менее 10 суток, при СГБ-неосложненных менингитах — не менее 14 суток, при СГБ-артритах и остеомиелитах — 3–4 недели, при СГБ-эндокартите и СГБ-вентрикулите — не менее 4 недель. Лечение менингита должно продолжаться еще в течение 14 дней после санации ликвора в связи с возможностью рецидивов [19, 20].
Профилактика. Профилактика развития СГБ-инфекции у новорожденных основана на двух подходах — на учете факторов риска и скрининге беременных на инфекцию. При стратегии, «основанной на рисках», матери в родах получают антибиотики, когда присутствует один или несколько факторов: предыдущий ребенок с инвазивной инфекцией, вызванной СГБ, бактериурия при беременности, угроза преждевременных родов до 37 недель, высокая концентрация СГБ в урогенитальном тракте матери ко времени родоразрешения, промежуток времени между разрывом околоплодных оболочек и родоразрешением больше или равен 12 часам, лихорадка в родах более 38 °C [19, 21]. В основе стратегии профилактики, основанной на проведении скрининга, лежит положительная бактериальная культура ректовагинального мазка женщины, обследованной на сроке 35–37 недель беременности. Профилактика СГБ-инфекции, основанная на положительных результатах бактериологического обследования беременных женщин, более эффективна, чем профилактика, базирующаяся на факторах риска [1, 8]. Независимо от результата скрининга антибиотики назначаются, если имеется один из следующих факторов риска: предыдущий ребенок с инвазивной СГБ-инфекцией; бактериурия S. agalactiae; угроза преждевременных родов до 37 недель беременности. Химиопрофилактика женщине во время родов проводится путем в/в введения пенициллина: первая доза — 5 млн МЕ, затем по 2,5 млн МЕ каждые 4 часа до рождения ребенка. Можно применять ампициллин — стартовая доза 2 млн МЕ, затем по 1 млн МЕ каждые 4 часа до рождения ребенка. При аллергии на пенициллин применяют клиндамицин по 900 мг каждые 8 ч в/в до рождения или эритромицин 500 мг в/в каждые 6 ч до рождения.
Детям, рожденным инфицированными матерями, проводят бактериологическое исследование смывов из наружного слухового канала, слизистой зева, пупочной культи, паховых складок, а также мекония. Антибиотикотерапию проводят только детям с положительными результатами бактериологического обследования [22, 23]. Однако, по мнению немецких ученых, антибиотикопрофилактика у колонизированных новорожденных без клинических симптомов с целью предупреждения развития инвазивной инфекции не целесообразна [8]. Профилактическое назначение антибиотиков асимптоматичным детям (в том числе недоношенным), относящимся к группе риска по развитию СГБ-инфекции, также не показано, поскольку это не снижает риск заболевания и смерти по сравнению с детьми, получающими селективную антибиотикотерапию при выделении возбудителя [24, 25]. Следует отметить, что превентивное назначение антибиотиков матери не влияет на риск развития СГБ-менингита с поздним дебютом [14].
В настоящее время идет разработка иммуногенных поливалентных вакцин против полисахарид-белка СГБ. Конъюгированные вакцины завершили первую и вторую фазу испытаний у здоровых небеременных женщин, и результаты являются весьма перспективными [8].
Таким образом, несмотря на эффективные профилактические мероприятия, СГБ-инфекция у новорожденных и детей первых месяцев жизни остается заболеванием с высокой морбидностью. Имеются проблемы клинической и лабораторной диагностики СГБ-инфекции, в связи с чем этиологическую расшифровку данного заболевания необходимо проводить комплексно с использованием всех существующих на сегодняшний день методов исследования (бактериология, ПЦР, латекс-тест). В связи с высокой частотой колонизации S. agalactiae женщин репродуктивного возраста, продолжающейся регистрацией тяжелых случаев заболевания у новорожденных и детей первых месяцев жизни необходима разработка и внедрение национальной и региональных программ по регистрации и профилактике СГБ-инфекции у беременных и новорожденных.
Литература
- Apgar B. S., Greenberg G., Yen G. Prevention of group B streptococcal disease in the newborn. B // Am Fam Physician. 2005; 71 (5): 903–910.
- Luck S., Torny M., d’Agapeyeff K., Pitt A., Heath P., Breathnach A., Russell A. B. Estimated early-onset group B streptococcal neonatal disease // Lancet. 2003; 361: 1953–1954.
- Nandyal R. R. Update on group B streptococcal infections: perinatal and neonatal periods // J Perinat Neonatal Nurs. 2008; 22 (3): 230–237.
- Schuchat A., Zywicki S. S., Dinsmoor M. J. et al. Risk factors and opportunities for prevention of early-onset neonatal sepsis: a multicenter case-control study // Pediatrics. 2000; 105: 21–26.
- Law M. R., Palomaki G., Alfirevic Z. et al. The prevention of neonatal group B streptococcal disease: a report by a working group of the Medical Screening Society // J Med Screen. 2005; 12: 60–68.
- Zaleznik D. F., Rench M. A., Hillier S. et al. Invasive disease due to group B streptococcus in pregnant women and neonates from diverse population groups // Clin Infect Dis. 2000; 30: 276–281.
- Benitz W. E., Gould J. B., Druzin M. L. Risk factors for early-onset group B streptococcal sepsis: estimation of odds ratios by critical literature review // Pediatrics. 1999; 103: e77.
- Berner R. Infektionen durch Gruppe-B-Streptokokken In der Neonata lperiode // Monatsschr Kinderheild. 2003; 151: 373–383.
- Chung M. Y., Ko D. J., Chen C. C. et al. Neonatal group B streptococcal infection: a 7-year experience // Chang Gung Med J. 2004; 27: 501–508.
- Ho M. Y., Wu C. T., Huang F. Y. et al. Group B streptococcal infections in neonates: an 11-year review // Acta Paediatr Taiwan. 1999; 40: 83–86.
- Beal S., Dancer S. Antenatal prevention of neonatal group B streptococcal infection // Rev Gynaecol Perinatal Practice. 2006; 6: 218–225.
- Carlough M. C., Crowell K. How should we manage infants at risk for group B streptococcal disease? // J Fam Pract. 2003; 52: 406–409.
- Heath P. T., Balfour G., Weisner A. M. et al. Group B streptococcal disease in UK and Irish infants younger than 90 days // Lancet. 2004; 363: 292–294.
- Levent F., Baker C. J., Rench M. A., Edwards M. S. Early Outcomes of Group B Streptococcal Meningitis in the 21 st Century // Pediatr Infect Dis J. 2010; 29 (11): 1009–1012.
- Morven S. Edwards Prevention of Group B Streptococcal Disease: Answers to Questions Often Asked // Clinical Update in pediatric infectious diseases. 2000; Vol. 3, Issue 2.
- Платонов А. Е., Шипулин Г. А., Тютюнник Е. Н., Платонова О. В. Генодиагностика бактериальных менингитов и генотипирование их возбудителей: пособие для врачей. М., 2001. 29 с.
- Садова Н. В., Заплатников А. Л., Шипулина О. Ю. и др. Перинатальная инфекция, вызванная стрептококками группы В // РМЖ. 2010, № 1, с. 25–29.
- Cezarino B. N., Yamamoto L., Barbaro Del Negro G. M., Rocha D., Okay T. S. Diagnosis of neonatal group B Streptococcus sepsis by nested-PCR of residual urine samples // Brazilian Journal of Microbiology. 2008; 39: 21–24.
- Centers for Disease Control and prevention (CDC). Prevention of perinatal group В streptococcal disease: Revised Guidelines from CDC // Morb. Mortal. Wkly Rep. 2002; Vol. 51: 10–22.
- Red Book: Report of the Committee on Infectious Diseases. 27 h ed. Elk Grove Village, IL: American Academy of Pediatrics, 2006; 992.
- Schrag S., Gorwitz R., Fultz-Butts K., Schuchat A. Prevention of Perinatal Group B Streptococcal Disease. Revised Guidelines from CDC, 2002.
- Wiswell T. E., Baumgart S., Gannon C. M., Spitzer A. R. No lumbar puncture in the evaluation for early neonatal sepsis: will meningitis be missed? // P ediatrics, 1995, 95, 803–806.
- Шуляк Б. Ф. Инфекция стрептококка группы В, методы ее лабораторной диагностики и профилактики // Медицинский алфавит. 2010, № 2, с. 47–53.
- Ungerer R. L. S., Lincetto O., McGuire W. et al. Prophylactic versus selective antibiotics for term newborn infants of mothers with risk factors for neonatal infection. In: The Cochrane Library, Issue 2, 2010.
- Gerard P., Vergote-D’Hulst M., Bachy A. et al. Group B streptococcal colonization of pregnant women and their neonates. Epidemiological study and controlled trial of prophylactic treatment of the newborn // Acta Paediatr Scand. 1979; 68: 819–823.
И. В. Николаева, кандидат медицинских наук, доцент
Казанский государственный медицинский университет, Казань
Контактная информация об авторе для переписки: [email protected]
В Москве открылся центр лечения «тяжелых» новорожденных — Российская газета
Столичные медики открыли новый центр, где будут выводить в жизнь самых «тяжелых» младенцев. Пациентами нового подразделения при детской инфекционной больнице N 6 становятся малыши, родившиеся раньше срока и с серьезными патологиями.
Деток, масса которых при рождении не превышала 500 граммов, до открытия центра выхаживали и в других крупных медучреждениях столицы: Филатовской и Морозовской больницах. Но профильный центр лечения врожденных инфекций до этого работал только в Санкт-Петербурге. Теперь еще одна технологическая клиника открылась и в столице. Как рассказала корреспонденту «РГ» главный врач 6-й детской инфекционной больницы Елена Дегтярева, недавно по программе модернизации клинику полностью обновили: появились новые неонатальные отделения, все подразделения оснастили современным оборудованием, и вот теперь появился уникальный Центр внутриутробных и постнатальных инфекций. Чаще всего сюда поступают совсем крошечные малыши весом меньше килограмма: у медсестер и врачей они в буквальном смысле помещаются на ладонях. Эти крохи-пациенты появились на свет раньше положенного срока из-за тяжелых инфекционных заболеваний. Сейчас, как отметила Елена Дегтярева, в Центре восстанавливают здоровье 126 новорожденных. Они лежат в специальных инкубаторах, где автоматика поддерживает нужную температуру и влажность.
— Есть у нас и 12 деток, которые весят даже меньше 500 граммов, — рассказала «РГ» главный неонатолог Москвы Антонина Чубарова. — Еще несколько лет назад таких новорожденных просто нельзя было спасти. Сегодня возможности московской медицины таковы, что 90% младенцев с экстремально низкой массой тела могут жить и развиваться, как и другие малыши.
Довольно часто у недоношенных детей выявляются серьезные инфекционные болезни: пневмония, менингит, воспалительные поражения сердечной мышцы. Вылечить их можно только с помощью такого современного оборудования, как в новом Центре 6-й инфекционной больницы. В ряде случаев за 3-4 месяца организму больного крохи удается справиться с болезнью. Пациенты и в дальнейшем остаются под пристальным наблюдением врачей, но уже могут жить самостоятельно, без помощи аппаратуры.
Часто у недоношенных детей бывают серьезные инфекционные болезни: пневмония и менингит
— Вот этому малышу на вид, кажется, недели 34, — показывает главный неонатолог на пациента одной из палат. — Видите, он активно шевелится, скоро сможет самостоятельно питаться. А ведь малыши с экстремально низкой массой тела не могут есть материнское молоко даже из бутылочки. Сначала деток кормят через зонд, потом их приучают к пустышке и к материнской груди.
Кстати, мамы находятся здесь же, с малышами. Но постоянно следят за состоянием крошечных пациентов прежде всего врачи и медсестры: их посты расположены так, что все палаты прекрасно просматриваются. При необходимости к малышам на помощь приходят тут же не только неонатологи, но и пульмонологи, неврологи, кардиологи… Многим малышам, кроме того, проводят фототерапию с помощью новейшего аппарата. Он борется с детской желтухой, препятствует билирубиновому поражению мозга.
Полиморфизм генов врожденного иммунитета у детей с неонатальным сепсисом
Цель работы – выявление полиморфизма генов, кодирующих молекулы врожденного иммунитета, у детей с неонатальным сепсисом (НС).
Материалы и методы исследования: обследованы 70 новорожденных детей, которые были разделены на 2 группы. 1-ю составили 44 ребенка с НС, 17 из которых (39%) родились недоношенными. Основными очагами НС были пневмония (13 случаев, 29%), менингит (12 детей, 27%), энтероколит (10 случаев, 23%), пневмония в сочетании с энтероколитом (2 детей, 5%) и пузырчатка (2 ребенка, 5%). У 5 детей (10%) заболевание протекало в форме септицемии. 2-ю, контрольную, группу составили 26 детей, не имевших признаков инфекционного заболевания, 11 из которых родились недоношенными.
Результаты: риск развития НС ассоциируется с мутантным генотипом G/A по полиморфизму TLR4 Asp299Gly (OR=9,4; p=0,03) и мутациями в кодирующей и регулирующей частях гена ИЛ1β, в частности с генотипами СТ и ТТ полиморфизма C3953T гена ИЛ1β (OR=3,6; p=0,03). Для полиморфизма гена TLR4 Asp299Gly частота мутантного аллеля Gly в контрольной группе составила 1,9%, в группе детей с НС – 13,6% (р=0,03). Для гена ИЛ1β C3953T частота мутаций аллеля Т в контрольной группе составила 11,5%, у детей с НС – 28,4% (р=0,02). Доля гетеро- и гомозигот по данному аллелю в группе детей с НС составила 48 и 4% соответственно.
Заключение: мутантные генотипы гена TLR4 по полиморфизму Asp299Gly и провоспалительного цитокина ИЛ1β по полиморфизму C3953T ассоциируются с высоким риском развития НС.
Источник: https://pediatriajournal.ru/hot?section=5492
Х.С. Хаертынов, В.А. Анохин, Г.Р. Хасанова, А.А. Ризванов, Ю.Н. Давидюк, С.А. Любин, Л.Л. Панкратьева, В.Е. Мухин, Н.Н. Володин. Полиморфизм генов врожденного иммунитета у детей с неонатальным сепсисом. Педиатрия. 2019; 98 (2): 69-74.
Неонатальный менингит: история болезни, патофизиология, этиология
Автор
Гаурав Гупта, доктор медицинских наук, FAANS, FACS Доцент нейрохирургии, директор цереброваскулярной и эндоваскулярной нейрохирургии, научный руководитель стипендии по эндоваскулярной нейрохирургии (сайт), отделение хирургии, отделение нейрохирургии, Рутгерс, Роберт Вуд 9000, Медицинская школа Гора
. Гупта, доктор медицины, FAANS, FACS является членом следующих медицинских обществ: Американской академии неврологии, Американской ассоциации развития науки, Американской ассоциации неврологических хирургов, Американского колледжа хирургов, Американской кардиологической ассоциации, Американской медицинской ассоциации, Конгресса Неврологические хирурги, Ассоциация лицевых болей, Общество нейробиологов, Общество нейроинтервенционной хирургии
Раскрытие: Ничего не говорится.
Соавтор (ы)
Лав Роа, BS Менеджер по клинической информации, Envision Health
Лав Роа, BS является членом следующих медицинских обществ: Golden Key International Honor Society
Раскрытие информации: раскрывать нечего.
Фаваз Аль-Муфти, доктор медицины Доцент кафедры неврологии, нейрохирургии и радиологии, Медицинская школа Рутгерса Роберта Вуда Джонсона; Лечащий врач отделения нейроэндоваскулярной хирургии и нейрокритической помощи, Университетская больница Рутгерса Роберта Вуда Джонсона
Фаваз Аль-Муфти, доктор медицинских наук, является членом следующих медицинских обществ: Американская академия неврологии, Американская кардиологическая ассоциация, Американская ассоциация инсульта, Общество нейрокритических врачей, Общество of Critical Care Medicine
Раскрытие информации: раскрывать нечего.
Судипта Ройчоудхури, доктор медицины Клинический адъюнкт-профессор радиологии, отделение радиологии, Медицинская школа Рутгерса Роберта Вуда Джонсона; Лечащий радиолог / нейрорадиолог, Университетская группа радиологии, PC
Судипта Ройчоудхури, доктор медицины, является членом следующих медицинских обществ: Американского колледжа радиологии, Американской медицинской ассоциации, Американского общества нейрорадиологов, Медицинского общества Нью-Джерси, Радиологического общества Нью-Джерси , Радиологическое общество Северной Америки, Общество нейроинтервенционной хирургии
Раскрытие: Ничего не разглашать.
Главный редактор
Эми Као, доктор медицины Лечащий невролог, Детский национальный медицинский центр
Эми Као, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии, Американского общества эпилепсии, Общества детской неврологии
Раскрытие информации: иметь запас (под управлением компания финансовых услуг) в медицинских компаниях, включая Allergan, Cellectar Biosciences, CVS Health, Danaher Corp, Johnson & Johnson.
Дополнительные участники
Калпати С. Кришнамурти, доктор медицины Доцент кафедры педиатрии и неврологии Гарвардской медицинской школы; Персонал-консультант, Отделение детской неврологии, Массачусетская больница общего профиля
Раскрытие информации: Ничего не говорится.
Дэвид С. Дредж, доктор медицины Лечащий врач, детская неврология, Детская больница Бэйстейт; Доцент педиатрии, Медицинская школа Университета Тафтса
Дэвид С. Дредж, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии неврологии, Американской медицинской ассоциации, Общества детской неврологии, Массачусетского медицинского общества
Раскрытие информации: не раскрывать.
Благодарности
Сара М. Барнетт, доктор медицины, магистр здравоохранения Научный сотрудник по неонатальной неврологии, отделение детской неврологии, Массачусетская больница общего профиля
Сара М. Барнетт, доктор медицины, магистр здравоохранения является членом следующих медицинских обществ: Американской академии неврологии, Американской академии педиатрии, Американской ассоциации общественного здравоохранения, Общества детской неврологии и Массачусетского медицинского общества
Раскрытие: Ничего не нужно раскрывать.
Дэвид А. Гриземер, доктор медицины Профессор, кафедра неврологии и педиатрии, Медицинский университет Южной Каролины
Дэвид А. Гриземер, доктор медицины, является членом следующих медицинских обществ: Американской академии церебрального паралича и медицины развития, Американской академии неврологии, Американского общества эпилепсии, Общества детской неврологии и Общества неврологии
Раскрытие: Ничего не нужно раскрывать.
Дж. Стивен Хафф, доктор медицины Доцент кафедры неотложной медицины и неврологии, факультет неотложной медицины, Медицинский факультет Университета Вирджинии
Дж. Стивен Хафф, доктор медицины, является членом следующих медицинских обществ: Американской академии неотложной медицины, Американской академии неврологии, Американского колледжа врачей неотложной помощи и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Неонатальный менингит — обзор
Лечение неонатального менингита
Поскольку патогены, вызывающие неонатальный менингит, в основном те же, что и патогены, вызывающие неонатальный сепсис, начальная терапия и последующая терапия аналогичны.Менингит, вызванный грамотрицательными кишечными палочками, может создавать особые проблемы при лечении. Ликвидация патогена часто откладывается, и могут возникнуть серьезные осложнения [23,119,348,632]. Сохранение грамотрицательных бацилл в спинномозговой жидкости, несмотря на бактерицидные уровни противомикробного агента, привело к оценке поясничного интратекального [646] и внутрижелудочкового [647] гентамицина. Смертность и заболеваемость существенно не различались у младенцев, получавших только парентеральное лекарственное средство или парентерально плюс интратекальную терапию [646].Изучение внутрижелудочкового гентамицина было прекращено досрочно из-за высокой смертности в группе парентеральной и внутрижелудочковой терапии [647].
Feigin и его коллеги [629] рассмотрели методы лечения менингита у детей, в том числе новорожденных. Ампициллин и пенициллин G, первоначально с аминогликозидами, являются подходящими противомикробными средствами для лечения инфекции, вызванной GBS. Цефотаксим обладает превосходной бактерицидной активностью in vitro и in vivo в отношении многих микроорганизмов, ответственных за менингит новорожденных [621].Лечение кишечного грамотрицательного бациллярного менингита должно включать цефотаксим и аминогликозиды до тех пор, пока не станут известны результаты теста на чувствительность.
Если менингит развивается у ребенка с низкой массой тела при рождении, который находился в яслях в течение длительного периода времени, или у новорожденного, прошедшего предыдущие курсы противомикробной терапии по поводу предполагаемого сепсиса, следует рассмотреть альтернативные эмпирические схемы приема антибиотиков. Энтерококки и устойчивые к антибиотикам грамотрицательные кишечные палочки являются потенциальными патогенами в этих условиях.Может оказаться целесообразным сочетание ванкомицина, аминогликозида и цефотаксима. Цефтазидим или меропенем в дополнение к аминогликозиду следует рассматривать при менингите P. aeruginosa .
Для лечения высокорезистентных организмов могут потребоваться другие антибиотики. Меропенем [648], ципрофлоксацин [649–651] или триметоприм-сульфаметоксазол [652 653] могут быть единственными противомикробными средствами, активными in vitro против бактерий, которые обладают высокой устойчивостью к β-лактамным антибиотикам или аминогликозидам широкого спектра действия.Некоторые из этих препаратов требуют тщательного наблюдения из-за токсичности для новорожденных (см. Главу 37), а ципрофлоксацин не был одобрен для использования в США у младенцев. Окончательное лечение менингита, вызванного грамотрицательными кишечными палочками, должно определяться тестами на чувствительность in vitro; Может быть полезна консультация со специалистом-инфекционистом.
Использование дексаметазона в качестве дополнительного лечения бактериального менингита у детей было рекомендовано на основании уменьшения неврологических последствий у младенцев и детей, в частности потери слуха и особенно в случаях H.influenzae менингит типа B. Существует только одно рандомизированное контролируемое исследование новорожденных; у 52 доношенных новорожденных смертность (22% дексаметазона по сравнению с 28% в контрольной группе) и заболеваемость через 24 месяца (30% против 39%) существенно не различались между группами [654]. Если посев крови и спинномозговой жидкости на бактериальные патогены обычными лабораторными методами дает отрицательный результат у новорожденного с менингитом, необходимо пересмотреть дифференциальный диагноз асептического менингита, особенно с точки зрения диагностики излечимых инфекций (Таблица 6–18).
Менингит новорожденных | МедЛинк Неврология
Бетси Е.П. Острандер, доктор медицины (
Доктор Острандер из Медицинской школы Университета штата Юта не имеет финансовых отношений для раскрытия информации.
)
Джон Э. Гринли, доктор медицины , редактор. (
Доктор Гринли из Медицинской школы Университета штата Юта получил консультационные услуги от Соммерса Шварца за просмотр медицинских записей.
)
Первоначально выпущено 21 сентября 1993 года; последнее обновление 9 января 2021 г .; истекает 9 января 2024 г.
Обзор
Неонатальный менингит представляет собой серьезную клиническую проблему как для детского невролога, так и для педиатра.Клинические проявления менингита у новорожденных часто неспецифичны, и аномалии спинномозговой жидкости трудно отличить от значений, обычно наблюдаемых у новорожденных. По этой причине следует подозревать менингит у новорожденного, у которого развивается плохое питание, раздражительность, жар или переохлаждение; это часто, но не всегда, сопровождается количеством лейкоцитов в СМЖ более 30 клеток / мм3 и соотношением глюкозы в СМЖ к сыворотке менее 0,5. Судороги также могут указывать на наличие менингита, хотя клинические приступы у новорожденных могут быть более тонкими или атипичными, чем у детей старшего возраста или взрослых.Эмпирическая противомикробная терапия включает комбинацию ампициллина и цефалоспоринов третьего или четвертого поколения (обычно цефотаксим или цефтазидим). Хотя дополнительная терапия дексаметазоном рекомендуется детям и взрослым, на сегодняшний день недостаточно данных, чтобы рекомендовать терапию дексаметазоном при неонатальном менингите.
Ключевые точки
• Неонатальный менингит включает инфекции, возникающие в ближайшем послеродовом периоде, а также инфекции, возникающие в течение первых нескольких недель жизни.Состояние обычно делится на случаи, возникающие в течение 72 часов после родов (раннее начало), и случаи, возникающие через 72 часа после родов (позднее начало) до 28-дневного возраста. | |
• Основными причинами неонатального менингита являются Streptococcus agalactiae (стрептококки группы B, GBS) и грамотрицательные микроорганизмы, в частности Escherichia coli . | |
• Диагностика неонатального менингита часто бывает сложной.Типичные признаки менингеального воспаления часто отсутствуют, а у новорожденных может проявляться неспецифическая раздражительность. Новорожденный может иметь лихорадку, эутермию или гипотермию, а также тахипноэ, приступы апноэ или чрезмерную сонливость. Могут возникать судороги, но они могут не напоминать судороги, наблюдаемые у детей старшего возраста или взрослых. | |
• Данные по ЦСЖ при неонатальном менингите нелегко отличить от значений ЦСЖ, обычно наблюдаемых у новорожденных.Однако следует серьезно подозревать менингит, если количество лейкоцитов в спинномозговой жидкости превышает 30 клеток / мм3, а соотношение глюкозы в спинномозговой жидкости и сыворотке меньше 0,5. | |
• Эмпирическое лечение неонатального менингита включает использование цефалоспоринов третьего или четвертого поколения для лечения S agalactiae и грамотрицательных организмов, плюс ампициллин для лечения Listeria monocytogenes . | |
• Аминогликозиды, такие как гентамицин, ненадежно достигают терапевтических концентраций в спинномозговой жидкости, и интратекальное введение этих агентов не было эффективным.Было обнаружено, что внутрижелудочковое введение увеличивает смертность и противопоказано. | |
• Введение антибиотиков во время родов матерям, инфицированным S agalactia e, оказалось решающим для профилактики менингита у новорожденных. |
Историческая справка и терминология
Хотя первое описание бактериального менингита было зарегистрировано Гаспаром Вье в 1806 г. (Vieusseux 1806), о менингите как о состоянии новорожденных не сообщалось до 1873 г., и Фленсборг в одном из первых обзоров этого состояния смог идентифицировать только 131 случай из мировой литературы (Flensborg 1943; Ziai and Haggerty 1958).То, что неонатальный менингит был важным заболеванием в период новорожденности, не было общепризнанным до 1950-х годов (Ziai and Haggerty 1958). Первая рукопись, посвященная невропатологии бактериального менингита новорожденных у новорожденных, была опубликована в 1966 г. (Berman and Banker 1966).
Текущее понимание неонатального менингита было достигнуто благодаря работе в трех основных областях. Первым из них было понимание самого заболевания: осознание того, что неонатальный менингит не редкость, что его этиологические организмы и патогенез отличаются от тех, которые связаны с менингитом у детей и взрослых, и что его проявления обычно не похожи на те, что наблюдаются у пожилых людей. частные лица.Второе направление — это прогресс в лечении неонатального менингита. Ранние клинические испытания показали, что системный ампициллин и аминогликозид по-прежнему приводят к 50% смертности и длительной заболеваемости, что добавление интратекального гентамицина не улучшает исход, а использование внутрижелудочкового гентамицина приводит к повышению смертности (McCracken 2006). Прогнозируемое эффективное лечение антибиотиками неонатального грамотрицательного менингита было достигнуто только после появления цефалоспоринов третьего поколения.Третьей темой, имеющей большое значение в последние два десятилетия, было осознание того, что заболеваемость менингитом, вызываемым S agalactiae , может быть снижена за счет послеродового лечения матерей с положительными результатами тестов на организм. Однако, несмотря на эти достижения, неонатальный менингит остается опасным заболеванием: хотя смертность снизилась примерно до 10%, неблагоприятный исход все же будет обнаружен у 20–70% пациентов (Harvey et al 1999; Bedford et al 2001; Berardi et al. al 2010; Ku et al 2015; Ouchenir 2017).
Контент, который вы пытаетесь просмотреть, доступен только зарегистрированным, текущим подписчикам MedLink Neurology .
Если вы являетесь подписчиком, пожалуйста, авторизуйтесь.
Если вы являетесь бывшим подписчиком или регистрировались ранее, пожалуйста, сначала войдите в систему, а затем нажмите выберите план обслуживания или обратитесь в службу поддержки подписчиков. Пользователи лицензии на сайт, щелкните ссылку «Доступ к лицензии сайта» на главной странице авторизованного компьютера.
Если вы никогда раньше не регистрировались, щелкните Подробнее о MedLink Neurology или , чтобы просмотреть доступные планы обслуживания.
% PDF-1.4
%
665 0 объект
>
эндобдж
xref
665 251
0000000016 00000 н.
0000006170 00000 н.
0000006327 00000 н.
0000007149 00000 н.
0000007227 00000 н.
0000007391 00000 н.
0000011659 00000 п.
0000011798 00000 п.
0000011934 00000 п.
0000012385 00000 п.
0000012963 00000 п.
0000013126 00000 п.
0000017412 00000 п.
0000021382 00000 п.
0000024917 00000 п.
0000028671 00000 п.
0000033646 00000 п.
0000036102 00000 п.
0000038622 00000 п.
0000038877 00000 п.
0000038960 00000 п.
0000039015 00000 н.
0000039129 00000 п.
0000039152 00000 п.
0000039230 00000 п.
0000039344 00000 п.
0000039421 00000 п.
0000039652 00000 п.
0000039735 00000 п.
0000039790 00000 н.
0000039853 00000 п.
0000039888 00000 п.
0000039966 00000 н.
0000040050 00000 п.
0000040134 00000 п.
0000040255 00000 п.
0000040404 00000 п.
0000040779 00000 п.
0000040845 00000 п.
0000040962 00000 п.
0000041041 00000 п.
0000041120 00000 н.
0000041241 00000 п.
0000041387 00000 п.
0000041934 00000 п.
0000042217 00000 п.
0000042360 00000 п.
0000042437 00000 п.
0000042554 00000 п.
0000042632 00000 п.
0000042707 00000 п.
0000042804 00000 п.
0000042953 00000 п.
0000043261 00000 п.
0000043316 00000 п.
0000043432 00000 п.
0000043510 00000 п.
0000043808 00000 п.
0000043863 00000 п.
0000043979 00000 п.
0000044002 00000 п.
0000044080 00000 п.
0000044157 00000 п.
0000044192 00000 п.
0000044270 00000 п.
0000044349 00000 п.
0000044446 00000 п.
0000044595 00000 п.
0000044967 00000 п.
0000045033 00000 п.
0000045150 00000 п.
0000045185 00000 п.
0000045263 00000 п.
0000045338 00000 п.
0000045417 00000 п.
0000045533 00000 п.
0000045682 00000 п.
0000046025 00000 п.
0000046091 00000 п.
0000046208 00000 п.
0000046287 00000 п.
0000046384 00000 п.
0000046530 00000 п.
0000046676 00000 п.
0000047322 00000 п.
0000047605 00000 п.
0000047748 00000 п.
0000047825 00000 п.
0000047942 00000 п.
0000047965 00000 п.
0000048043 00000 п.
0000048120 00000 н.
0000048155 00000 п.
0000048233 00000 п.
0000048317 00000 п.
0000048401 00000 п.
0000048548 00000 н.
0000048697 00000 п.
0000049066 00000 н.
0000049132 00000 п.
0000049249 00000 п.
0000049324 00000 п.
0000049403 00000 п.
0000049482 00000 н.
0000049629 00000 п.
0000049775 00000 п.
0000050321 00000 п.
0000050604 00000 п.
0000050747 00000 п.
0000050824 00000 п.
0000050941 00000 п.
0000050964 00000 п.
0000051042 00000 п.
0000051119 00000 п.
0000051154 00000 п.
0000051232 00000 п.
0000051316 00000 п.
0000051400 00000 п.
0000051521 00000 п.
0000051670 00000 п.
0000052015 00000 п.
0000052081 00000 п.
0000052198 00000 п.
0000052277 00000 п.
0000052356 00000 п.
0000052477 00000 п.
0000052623 00000 п.
0000053057 00000 п.
0000053340 00000 п.
0000053483 00000 п.
0000053560 00000 п.
0000053677 00000 п.
0000053700 00000 п.
0000053778 00000 п.
0000053855 00000 п.
0000053890 00000 п.
0000053968 00000 п.
0000054052 00000 п.
0000054173 00000 п.
0000054322 00000 п.
0000054668 00000 п.
0000054734 00000 п.
0000054851 00000 п.
0000054930 00000 п.
0000055051 00000 п.
0000055197 00000 п.
0000055636 00000 п.
0000055919 00000 п.
0000056062 00000 п.
0000056139 00000 п.
0000056256 00000 п.
0000056279 00000 п.
0000056357 00000 п.
0000056434 00000 п.
0000056469 00000 п.
0000056547 00000 п.
0000056631 00000 п.
0000056752 00000 п.
0000056901 00000 п.
0000057247 00000 п.
0000057313 00000 п.
0000057430 00000 п.
0000057509 00000 п.
0000057630 00000 п.
0000057776 00000 п.
0000058267 00000 п.
0000058550 00000 п.
0000058693 00000 п.
0000058770 00000 п.
0000058887 00000 п.
0000058910 00000 п.
0000058988 00000 п.
0000059065 00000 п.
0000059100 00000 п.
0000059178 00000 п.
0000059262 00000 п.
0000059346 00000 п.
0000059466 00000 п.
0000059615 00000 п.
0000059986 00000 н.
0000060052 00000 п.
0000060169 00000 п.
0000060248 00000 п.
0000060327 00000 п.
0000060447 00000 п.
0000060593 00000 п.
0000061141 00000 п.
0000061424 00000 п.
0000061567 00000 п.
0000061644 00000 п.
0000061761 00000 п.
0000061873 00000 п.
0000061951 00000 п.
0000062252 00000 п.
0000062307 00000 п.
0000062423 00000 п.
0000062493 00000 п.
0000062597 00000 п.
0000073201 00000 п.
0000073472 00000 п.
0000073942 00000 п.
0000073969 00000 п.
0000074588 00000 п.
0000074658 00000 п.
0000074758 00000 п.
0000084523 00000 п.
0000084792 00000 п.
0000085221 00000 п.
0000085248 00000 п.
0000085827 00000 п.
0000096226 00000 п.
0000096481 00000 п.
0000096997 00000 н.
0000109536 00000 н.
0000109793 00000 п.
0000110440 00000 н.
0000116032 00000 н.
0000116293 00000 н.
0000135848 00000 н.
0000135887 00000 н.
0000135980 00000 н.
0000136075 00000 н.
0000136198 00000 п.
0000136344 00000 п.
0000136419 00000 н.
0000136540 00000 н.
0000136686 00000 н.
0000136764 00000 н.
0000137230 00000 н.
0000137308 00000 н.
0000137711 00000 н.
0000137789 00000 н.
0000138257 00000 н.
0000138335 00000 н.
0000138703 00000 н.
0000138781 00000 н.
0000139159 00000 н.
0000139237 00000 н.
0000139658 00000 н.
0000139736 00000 н.
0000140211 00000 н.
0000140289 00000 н.
0000140402 00000 н.
0000140771 00000 п.
0000140849 00000 н.
0000140960 00000 н.
0000142670 00000 н.
0000142748 00000 н.
0000144673 00000 н.
0000005974 00000 п.
0000005423 00000 н.
трейлер
] / Назад 157155 / XRefStm 5974 >>
startxref
0
%% EOF
915 0 объект
> поток
h ބ kQ} LfgC0; Kv @@ $ kbWGK HL ٌ (nbJA-, AHg «E
I $ ~ 9y
Неонатальный менингит (причины, симптомы и прогноз)
Менингит — очень серьезная и часто опасная для жизни инфекция, которая включает воспаление оболочек, окружающих головной и спинной мозг.Это особенно вероятно в неонатальном периоде (т. Е. В первый месяц жизни ребенка). Наиболее частыми причинами менингита в США являются Streptococcus группы B (GBS) и Escheria coli ( E. coli ), но есть много других патогенов, которые могут вызывать это состояние. Менингит представляет собой настолько серьезную угрозу для здоровья новорожденных, что медицинские работники начинают лечение в подозреваемых случаях до того, как будет поставлен официальный диагноз (1). При быстром и надлежащем лечении младенцы с менингитом должны полностью выздороветь.Однако, если лечение откладывается или проводится неправильно, неонатальный менингит может привести к серьезным нарушениям, таким как церебральный паралич, судорожные расстройства и проблемы развития, такие как нарушения зрения и слуха (2).
Перейти к:
Стрептококковые инфекции группы B являются наиболее частой причиной неонатального менингита
Причины менингита в основном бактериальные, хотя бывают случаи вирусного и грибкового менингита (1). В США 50% всех случаев бактериального менингита новорожденных вызваны Streptococcus группы B (GBS).Другие бактериальные причины включают E. coli (что составляет около 20% случаев) и Listeria monocytogenes (что составляет 5-10% случаев) (2).
Возможно, причиной того, что так много случаев менингита приписывают СГБ, является распространенность этой инфекции. По данным Центров США по контролю и профилактике заболеваний, около 1 из 4 беременных женщин переносят СГБ в прямой кишке или влагалище. Если матери не поставить диагноз пренатально и не лечить должным образом, существует гораздо более высокий риск передачи СГБ — и, в конечном итоге, менингита — ребенку в процессе родов.По этой причине все беременные женщины должны пройти тестирование на СГБ в третьем триместре. Если тесты окажутся положительными, медицинские работники должны назначить антибиотики во время родов, чтобы минимизировать риск передачи (3).
Симптомы и лечение менингита у новорожденных
Следующие признаки указывают на то, что у новорожденного может быть менингит:
- Признаки сепсиса (сходные клинические признаки)
- Плохое кормление или отказ от кормления
- Выпуклый родничок (мягкое место в верхней части головы ребенка)
- Аномальный мышечный тонус, e.грамм. ригидность затылка (невозможность согнуть шею вперед) (1)
- Проблемы с дыханием / респираторный дистресс
- Диарея или рвота
- Температурная нестабильность (лихорадка или переохлаждение)
- Изъятия
- Раздражительность или вялость
- Апноэ или брадикардия
- Гипотония
- Плохая перфузия
- Желтуха
- Гипогликемия (низкий уровень сахара в крови) или гипергликемия (высокий уровень сахара в крови) (2)
Поскольку менингит может быть смертельным, при подозрении на него врачи должны немедленно начать лечение антибиотиками широкого спектра действия.Если впоследствии менингит приписывают необычному типу бактерий, вируса или другого патогена, может потребоваться другое лечение. Несвоевременное лечение может вызвать серьезное необратимое повреждение головного мозга.
Люмбальная пункция (спинномозговая пункция) и посев спинномозговой жидкости (ЦСЖ) обычно выполняются для подтверждения менингита (1).
Помимо антибиотиков и других лекарств, младенцам с менингитом требуется поддерживающая терапия в отделении интенсивной терапии новорожденных (ОИТН) и тщательное наблюдение со стороны медицинских специалистов.Их также нужно будет лечить от любых сопутствующих осложнений. Например, если у ребенка появляются признаки неонатальных судорог, ему могут потребоваться противосудорожные препараты.
Магнитно-резонансная томография (МРТ) должна быть выполнена до прекращения приема антибиотиков (4).
Прогноз
Результаты заражения менингитом сильно различаются в зависимости от времени и качества лечения. Примерно 7-18 процентов новорожденных с менингитом не выживают. Примерно у 20 процентов выживших развиваются тяжелые формы инвалидности, а у 35 процентов — легкие и средние инвалидности.
Следует тщательно наблюдать за выжившими после неонатального менингита, чтобы видеть, достигают ли они вех в развитии или проявляют ли признаки осложнений со здоровьем (4). Если лечение своевременное и соответствующее, большинство новорожденных чувствуют себя хорошо.
Юридическая помощь при менингите новорожденных и родовых травмах
Если СГБ — или любая другая инфекция — не диагностируется и должным образом не лечится у беременной женщины, она может передаваться младенцу. Затем он может прогрессировать до неонатального менингита и различных связанных с этим осложнений, таких как церебральный паралич и судорожные расстройства.Если беременным женщинам вовремя поставить диагноз и провести надлежащее лечение, инфекция, скорее всего, не передается новорожденным.
Если у вашего ребенка был диагностирован менингит при рождении, адвокаты юридического центра ABC могут помочь. У нас есть знания и профессиональный опыт, чтобы тщательно изучить сложные медицинские записи о случае вашего ребенка, определить, была ли допущена ошибка или халатность, и помочь вам получить денежную компенсацию, которой заслуживает ваш ребенок. Бесплатно и без обязательств мы ответим на ваши вопросы и проинформируем вас о ваших юридических вариантах.Фактически, вы ничего не платите на протяжении всего судебного процесса, если мы не выиграем или не сделаем расчет в вашу пользу. Наша команда готова поговорить с вами, чтобы назначить встречу любым из следующих способов:
Бесплатный обзор корпуса | Доступно 24/7 | Никаких комиссий, пока мы не выиграем
Телефон (бесплатный): 866-691-2089
Нажмите кнопку Live Chat в своем браузере
Заполните нашу онлайн-форму для связи
Источники
- (нет данных). Получено 8 января 2019 г. с сайта https: // www.uptodate.com/contents/bacterial-meningitis-in-the-neonate-clinical-features-and-diagnosis
- Неонатальный менингит. (2018, 09 августа). Получено 8 января 2019 г. с https://emedicine.medscape.com/article/1176960-overview#a7
- GBS | Факты и статистика | Стрептококк группы B | CDC. (нет данных). Получено 8 января 2019 г. с сайта https://www.cdc.gov/groupbstrep/about/fast-facts.html
- (нет данных). Получено 8 января 2019 г. с сайта https://www.uptodate.com/contents/bacterial-meningitis-in-the-neonate-treatment-and-outcome
.
.
.
Роль белка спинномозговой жидкости
Abstract
Новорожденные подвержены высокому риску менингита и связанных с ним неврологических осложнений.Раннее распознавание новорожденных с риском плохого прогноза может помочь в обеспечении своевременного лечения. С января 2008 г. по июнь 2014 г. мы набрали 232 доношенных новорожденных с бактериальным менингитом, поступивших в 3 отделения неонатологии в Шанхае, Китай. Клинический статус в день выписки из этих больниц или в послеродовом возрасте от 2,5 до 3 месяцев оценивался с использованием шкалы результатов Глазго (GOS). Пациенты были разделены на две группы результатов: хорошие (167 случаев, 72,0%, GOS = 5) и плохие (65 случаев, 28.0%, GOS = 1–4). У новорожденных с хорошим исходом реже наблюдались апноэ, сонливость, плохое питание, выпуклый родничок, раздражительность и более тяжелая желтуха по сравнению с новорожденными с плохим исходом. В группе с хорошим исходом также было меньше пневмонии, чем в группе с плохим исходом. Кроме того, наблюдались статистически значимые различия в гемоглобине, среднем объеме тромбоцитов, ширине распределения тромбоцитов, белке С-реакции, прокальцитонине, глюкозе в спинномозговой жидкости (ЦСЖ) и белке ЦСЖ. Анализ многомерной логистической регрессии показал, что плохое питание, пневмония и белок спинномозговой жидкости были предикторами плохого исхода.Содержание белка в спинномозговой жидкости было значительно выше у пациентов с плохим исходом. Наилучшие пороговые значения для прогнозирования неблагоприятного исхода составляли 1880 мг / л по концентрации белка в спинномозговой жидкости (чувствительность 70,8%, специфичность 86,2%). После 2 недель лечения содержание белка в спинномозговой жидкости оставалось выше в группе с плохим исходом. Высокая концентрация белка в спинномозговой жидкости может прогнозировать неблагоприятный исход у новорожденных с бактериальным менингитом.
Образец цитирования: Tan J, Kan J, Qiu G, Zhao D, Ren F, Luo Z, et al. (2015) Клинический прогноз при бактериальном менингите новорожденных: роль белка спинномозговой жидкости.PLoS ONE 10 (10):
e0141620.
https://doi.org/10.1371/journal.pone.0141620
Редактор: Эшлеш К. Мурти, Университет Среднего Запада, США
Поступила: 23 июля 2015 г .; Принята к печати: 9 октября 2015 г .; Опубликовано: 28 октября 2015 г.
Авторские права: © 2015 Tan et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника
Доступность данных: Все соответствующие данные находятся в пределах бумага.
Финансирование: У авторов нет поддержки или финансирования, чтобы сообщить.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Новорожденные подвержены высокому риску менингита и связанных с ним неврологических осложнений [1]. Несмотря на доступность новых и более эффективных антибиотиков, исход бактериального менингита новорожденных остается неудовлетворительным. Неонатальный бактериальный менингит связан со значительной смертностью и разрушительными неврологическими последствиями, включая нейросенсорную потерю слуха, судороги, двигательные расстройства, умственную отсталость и поведенческие проблемы [2].Признаки бактериального менингита у новорожденных часто незаметны; Таким образом, диагноз менингита необходимо ставить на основании исследования спинномозговой жидкости (ЦСЖ). В настоящее время положительный посев спинномозговой жидкости остается золотым стандартом диагностики неонатального бактериального менингита в клинической практике. Однако он может стать отрицательным в течение нескольких часов после приема антибиотика. Кроме того, было показано, что культура спинномозговой жидкости имеет низкую чувствительность для диагностики бактериального менингита. Поэтому клиницисты также должны полагаться на глюкозу в спинномозговой жидкости, количество лейкоцитов (WBC) и белок для определения наличия менингита [3,4].
Раннее распознавание новорожденных с риском плохого прогноза может помочь в обеспечении своевременного ведения и лечения для улучшения исхода [5], а также для выявления лиц, которые требуют раннего наблюдения и вмешательства. В предыдущих исследованиях было выявлено несколько факторов риска, связанных с плохим клиническим исходом бактериального менингита у детей и взрослых, в том числе наличие судорог, комы, гипотонии, респираторного дистресса, гипогликоррахии, лейкопении или тромбоцитопении, а также задержки начала приема антибиотиков. терапия [6–10].Однако данных о прогностических факторах бактериального менингита у новорожденных недостаточно.
Целью настоящего исследования было выявить возможные факторы риска, которые могут предсказать прогноз у новорожденных с бактериальным менингитом. Более того, мы хотели выяснить, связаны ли параметры CSF независимо с плохим прогнозом.
Методы
Пациенты и данные
С января 2008 г. по июнь 2014 г. мы набрали 232 доношенных новорожденных с бактериальным менингитом, поступивших в 3 отделения неонатологии в Шанхае, Китай, включая больницу Синьхуа, Девятую народную больницу и Детскую больницу Шанхая.Неонатальный бактериальный менингит определялся как клинические симптомы и признаки менингита плюс либо положительный посев в спинномозговой жидкости (CSF), либо CSF WBC> 20 × 10 6 / л в сочетании с положительным посевом крови [11,12] . Критерии включения: 1) диагноз бактериального менингита; 2) срок беременности (GA) ≥ 37 недель; 3) возраст постановки диагноза ≤ 28 дней. Критериями исключения были сосуществующая асфиксия во время родов, серьезные врожденные аномалии, генетическое состояние или хромосомная аномалия.Исследование было одобрено комитетами по этике исследований больницы Синьхуа, Девятой народной больницы и Детской больницы Шанхая. Все родители или законные опекуны набранных младенцев подписали соглашение после того, как им была предоставлена необходимая информация об этом исследовании, и дали письменное информированное согласие.
Данные по исходу были определены в день выписки из больницы или в послеродовом возрасте от 2,5 до 3 месяцев. Клинический статус оценивался по шкале результатов Глазго (GOS), которая варьируется от 1 до 5: 1 = смерть; 2 = стойкое вегетативное состояние; 3 = тяжелая инвалидность; 4 = умеренная инвалидность; 5 = хорошее восстановление [13].Умеренная или тяжелая инвалидность определялась как любое из следующих состояний: спастичность, мышечная слабость и неподвижность одной или нескольких конечностей; микроцефалия; гидроцефалия; Эпилепсия; потеря слуха. Для целей этого анализа пациенты с оценкой 5 были определены как пациенты с хорошим результатом, а пациенты с оценкой от 1 до 4 были определены как пациенты с плохим результатом.
Статистический анализ
Все статистические анализы были выполнены с использованием SPSS 16.0 (SPSS Inc., Чикаго, Иллинойс, США).Для сравнения категориальных переменных использовался критерий хи-квадрат или точный критерий Фишера. Для сравнения непрерывных переменных использовался t-критерий Стьюдента или критерий Манна-Уитни. Для оценки предикторов неблагоприятного исхода (прогноза) неонатального менингита использовалась многомерная логистическая регрессия. Пороговая точка для белка спинномозговой жидкости для прогнозирования прогноза бактериального менингита новорожденных рассчитывалась в соответствии с рабочей характеристикой приемника (ROC). Рассчитывали площадь под кривой (AUC) и значения, зависящие от чувствительности, с 95% доверительным интервалом.Результаты представлены как среднее ± стандартное отклонение или n и процент. Значения P <0,05 считались статистически значимыми.
Результаты
Клинические характеристики
Среди 232 больных менингитом 88 пациентов были мужчинами и 144 женщины, все родились в срок. Средний возраст начала менингита составил 13,0 ± 7,7 дня. 92 (39,7%) новорожденных родились путем кесарева сечения (КС), а 140 (60,3%) новорожденных родились через естественные родовые пути. Средний вес при рождении составил 3072 ± 422 г.Было 10 новорожденных с низкой массой тела при рождении (<2500 г) и 2 новорожденных с высокой массой тела при рождении (> 4000 г). Инфекция наблюдалась у 29 (12,5%) новорожденных в течение 3 дней жизни (раннее начало инфекции), в том числе у 9 (3,9%) в первые сутки жизни. Средняя продолжительность пребывания в стационаре составила 28,6 ± 14,3 дня (от 1 до 93 дней). Общая летальность составила 3,0% (7 из 232 пациентов).
Факторы, предрасполагающие к развитию бактериального менингита новорожденных, включали лихорадку матери выше 38 ° C у 38 (16.4%) случаев и длительный разрыв плодных оболочек более 12 ч в 45 (19,4%) случаях. В одном случае пуповину перерезали с помощью загрязненных ножниц. Отмечено 30 (12,9%) случаев колонизации влагалища стрептококком группы В. Кроме того, 17 случаев имели другие гнойные инфекции (4 — септический артрит, 2 — гнойный паротит и 11 — омфалит).
Бактериологическое подтверждение менингита получено в 232 случаях. Положительные посевы крови и спинномозговой жидкости получены у 95 (40.9%) случаев и 169 (72,8%) случаев соответственно, в том числе 32 (13,7%) случая с положительной культурой как в крови, так и в спинномозговой жидкости. Бактериями, определенными в качестве возбудителя менингита, были: E. coli, 73 случая; Стрептококк группы В — 65 случаев; Коагулазонегативные стафилококки — 24 случая; Streptococcus pneumoniae — 18 случаев; Pseudomonas Aeruginosa — 16 случаев; Коринебактерии — 12 случаев; Listeria Monocytogenes — 10 случаев; Haemophilus influenzae — 8 случаев; Менингококк, 2 случая; Proteusbacillus vulgaris — 2 случая; и Enterococcus кал, 2 случай.
Шкала исходов по Глазго и неврологические осложнения
Согласно определению GOS, пациенты были разделены на две группы результатов: хорошие (167 случаев, 72,0%, GOS = 5) и плохие (65 случаев, 28,0%, GOS = 1–4). Группа с плохим исходом включала летальность у 7 пациентов, тяжелую инвалидность у 23 пациентов и умеренную инвалидность у 35 пациентов.
Неонатальный менингит связан с множеством неврологических осложнений [14]. В нашем исследовании неврологические осложнения у пациентов с плохим исходом включали субдуральный выпот (15, 23.1%), эпендимит (17, 26,2%) и абсцесс головного мозга (4, 6,2%). Однако было только 8 (4,8%) случаев субдурального выпота и ни одного случая эпендимита или абсцесса мозга у пациентов с хорошим исходом. Кажется, что у пациентов с плохим исходом было больше осложнений, чем у пациентов с хорошим исходом. (р <0,05)
Клинические особенности, результаты анализа крови и спинномозговой жидкости
Клинические особенности новорожденных с бактериальным менингитом обобщены в таблице 1. В целом лихорадка без учета факторов окружающей среды (195, 84.1%) и желтуха с уровнем билирубина более 85 мкмоль / л (91, 39,2%) были двумя ведущими проявлениями, за которыми следовали плохое питание (87, 37,5%) и сонливость (79, 34,1%). Распространенными предшествующими заболеваниями были пневмония (102, 44,0%), сепсис (95, 40,9%) и диарея (30, 12,9%).
Цитобиохимические данные периферической крови и спинномозговой жидкости также суммированы в таблице 1. Количество лейкоцитов варьировало от 2,45 до 35,98 × 10 9 / л со средним значением 16,28 × 10 9 / л, включая 67 случаев лейкоцитоза более 20.0 × 10 9 / л и 2 случая с лейкопенией менее 4,0 × 10 9 / л. Анемия с гемоглобином менее 145 г / л в 151 случае. В 72,0% случаев уровень белка С-реакции (СРБ) превышал 8 мг / дл. Прокальцитонин (ПКТ) составлял 0,05 мкг / л и более в 77,2% случаев.
Количество клеток CSF варьировалось от 11 до 17870 × 10 6 / л со средним значением 80 × 10 6 / л, включая 105 случаев с количеством клеток более 100 × 10 6 / л. Поликариоциты ЦСЖ (%)> 50% наблюдались у 65.9% случаев. Концентрация белка варьировала от 438 до 4750 мг / л, в среднем 1400 мг / л. Глюкоза в спинномозговой жидкости <1,5 ммоль / л в 25,0% случаев и соотношение глюкоза / глюкоза в крови <0,5 в 62,1% случаев.
Сравнение между двумя группами показало, что между двумя группами не было статистически значимых различий по полу, возрасту начала заболевания, массе тела при рождении и времени пребывания в больнице. Однако у новорожденных с хорошим исходом реже наблюдались апноэ, сонливость, плохое питание, выпуклый родничок, раздражительность и более тяжелая желтуха по сравнению с новорожденными с плохим исходом ( p <0.05). В группе с хорошим исходом также было меньше пневмонии и больше диареи, чем в группе с плохим исходом. Кроме того, наблюдались статистически значимые различия в гемоглобине, среднем объеме тромбоцитов, ширине распределения тромбоцитов, белке С-реакции, прокальцитонине, глюкозе в спинномозговой жидкости и белке спинномозговой жидкости. (Таблица 1)
Факторы-предикторы неблагоприятного исхода бактериального менингита новорожденных
Был проведен многомерный логистический регрессионный анализ, включая переменные, которые с помощью одномерного анализа были определены как связанные с плохим исходом с p <0.05. Плохое питание (OR 3,83, 95% CI = 1,22–12,05, p = 0,02), пневмония (OR 3,37, 95% CI = 1,15–9,84, p = 0,03) и белок ЦСЖ (OR of 4,07, 95% ДИ = 2,33–7,11, p <0,001) были предикторами плохого исхода. (Таблица 1)
Затем мы провели анализ кривой ROC для прогнозирования тяжести бактериального менингита по белку спинномозговой жидкости. AUC, предсказывающая неблагоприятный исход, составила 0,842. Лучшее пороговое значение для прогнозирования неблагоприятного исхода составляло 1880 мг / л для белка спинномозговой жидкости (чувствительность 70.8%, специфичность 86,2%). (Рис.1)
Рис. 1. Кривые рабочих характеристик приемника для белка CSF при прогнозировании исходов (плохих, хороших) у новорожденных с бактериальным менингитом.
Чувствительность (частота истинных положительных результатов) отложена в зависимости от специфичности 1 (частота ложных положительных результатов). Площадь под кривой составила 0,842 для лучшего значения отсечки при 1880 (специфичность = 70,8%, чувствительность = 86,2%).
https://doi.org/10.1371/journal.pone.0141620.g001
Изменение показателей ликвора после лечения
Несмотря на доступность планового эффективного лечения, к сожалению, 7 пациентов умерли от инфекции в течение семи дней после госпитализации.Остальные пациенты получали антибиотики не менее 2 недель. Мы сравнили параметры спинномозговой жидкости до и после 2 недель лечения. Содержание белка в спинномозговой жидкости оставалось более высоким, а содержание глюкозы в спинномозговой жидкости оставалось более низким в группах с плохим и хорошим исходом ( p <0,001). (Таблица 2)
Обсуждение
Новорожденные особенно уязвимы к инфекции. Клеточная и гуморальная иммунные системы незрелы, включая фагоцитарную функцию. Заболеваемость менингитом колеблется от 0.От 2 до 6,1 случаев на 1000 живорожденных [15,16]. Клинические признаки и симптомы неонатального менингита в значительной степени незаметны. В нашем исследовании частыми симптомами, как и в предыдущих исследованиях неонатального менингита, были жар (84,1%), желтуха (39,2%), плохое питание (37,5%) и сонливость (34,1%) [17,18]. Однако эти особенности не могли помочь установить ранний диагноз менингита.
Заболеваемость менингитом, подтвержденная посевом в ЦСЖ, была невысокой. Но существует сильная связь менингита и сепсиса с положительными культурами крови [19].Поэтому во многих исследованиях менингит определялся по положительному посеву крови и аномальным параметрам спинномозговой жидкости [2,6,20]. Мы также использовали эти определения для критериев включения пациентов в наше исследование. Более того, колиформные бактерии и стрептококки группы B являются частыми возбудителями менингита у новорожденных, что подтверждается в нашем исследовании [21,22].
Раннее распознавание младенцев с менингитом с риском неблагоприятного прогноза может помочь в обеспечении быстрого лечения и выявлении тех, кто требует долгосрочного наблюдения и раннего вмешательства [23–25].Предыдущие исследования показали ряд возможных ранних маркеров плохого прогноза неонатального менингита. Например, Гримвуд обнаружил, что симптомы> 24 часов, судороги после 72 часов пребывания в больнице и очаговые неврологические признаки являются независимыми факторами риска бактериального менингита [20]. Два ретроспективных исследования показали, что судороги, тромбоцитопения, высокий уровень белка в спинномозговой жидкости и низкая концентрация глюкозы в спинномозговой жидкости были важными прогностическими факторами осложнений при неонатальном менингите [5,26]. Мы обнаружили, что в группе с плохим исходом было больше неврологических симптомов и последствий, чем в группе с хорошим исходом, включая выпуклый родничок, раздражительность, субдуральный выпот, эпендимит и абсцесс мозга.
Кроме того, мы обнаружили, что плохое питание, пневмония и белок спинномозговой жидкости были предикторами плохого исхода в нашем исследовании. Вебер и др. Обнаружили, что снижение способности к кормлению может быть независимым предиктором тяжелого заболевания [27]. Однако у него была ограниченная специфичность в отличие от других тяжелых заболеваний, таких как сепсис, менингит, гипоксемия или пневмония, подтвержденная рентгенологически. Ben et al. Обнаружили, что респираторный дистресс был одним из основных факторов неблагоприятного прогноза бактериального менингита новорожденных [28].Мы обнаружили, что пневмония связана с неблагоприятным исходом неонатального менингита.
Следует подчеркнуть, что белок ЦСЖ в группе с плохим исходом был чрезвычайно высоким в нашем исследовании. Уровень содержания белка в спинномозговой жидкости существенно повлиял на прогноз пациента. Хотя предыдущее исследование показало, что высокий уровень белка в спинномозговой жидкости был связан с плохим прогнозом при детском бактериальном менингите [29], ни одно исследование не показало, что именно уровень белка спинномозговой жидкости является предиктором неблагоприятного исхода при неонатальном менингите.Однако мы обнаружили, что содержание белка в спинномозговой жидкости составляло 438–4750 мг / л (в среднем 1400 мг / л), аналогично исследованию Гарджес HP, в котором сообщалось, что белок спинномозговой жидкости у новорожденных с бактериальным менингитом колебался в пределах 410–19640 мг / л (медиана: 2730 мг / л). мг / л) [4]. Кроме того, мы обнаружили, что наилучшее пороговое значение составляло 1880 мг / л (специфичность = 70,8% и специфичность = 86,2%) для прогнозирования плохого прогноза при неонатальном менингите.
Было установлено, что лейкоциты, иммуноглобулины и комплементы обычно редки или отсутствуют в спинномозговой жидкости.На начальной стадии неонатального менингита микроорганизмы могут пересекать гематоэнцефалический барьер посредством микробных взаимодействий с рецепторами хозяина и одновременно размножаться в субарахноидальном пространстве. Позже бактерии выделяют эндотоксины, тейхоевую кислоту и другие вещества, которые вызывают воспалительную реакцию с помощью медиаторов, таких как лейкоциты и TNF, что приводит к увеличению уровня белка в спинномозговой жидкости. Кроме того, производство цитокинов приводит к привлечению и активации полиморфно-ядерных лейкоцитов и производству большого количества активных форм кислорода.Эти свободные радикалы обладают высокой реакционной способностью и могут вызывать нарушение липидов, белков, углеводов или нуклеиновых кислот, что увеличивает риск неблагоприятных последствий. Из-за высокого содержания липидов в головном мозге и низкой церебральной антиоксидантной защиты центральная нервная система особенно восприимчива к пагубным свойствам окислительного стресса [30,31]. Поэтому мы предположили, что высокое содержание белка в спинномозговой жидкости связано с интенсивностью воспалительной реакции. Воспалительный каскад менингита может привести к тяжелым неврологическим заболеваниям.Кроме того, наше исследование продемонстрировало, что после 2 недель терапии группа с плохим исходом все еще имела более высокий уровень белка в спинномозговой жидкости, что указывает на то, что высокое содержание белка в спинномозговой жидкости может иметь значение при отборе пациентов для более интенсивной терапии и при определении кандидатов для новых стратегий лечения.
Таким образом, белок ЦСЖ может быть биомаркером тяжелой инфекции ЦНС с плохим прогнозом для выявления пациентов для своевременного и интенсивного лечения.
Вклад авторов
Задумал и спроектировал эксперименты: YZ.Проведены эксперименты: JT JK GQ DZ. Проанализированы данные: JT DZ FR. Предоставленные реагенты / материалы / инструменты анализа: JT JK GQ DZ. Написал статью: YZ DZ ZL JT.
Список литературы
- 1.
Furyk JS, Swann O, Molyneux E. Систематический обзор: неонатальный менингит в развивающихся странах. Trop Med Int Health. 2011; 16: 672–679. pmid: 21395927 - 2.
Гашиньяр Дж., Леви С., Ромен О, Коэн Р., Бинген Э., Оджард Ю. и др. Бактериальный менингит новорожденных: 444 случая за 7 лет.Pediatr Infect Dis J. 2011; 30: 212–217. pmid: 21416693 - 3.
Раджеш Н.Т., Датта С., Прасад Р., Наранг А. Влияние задержки анализа на параметры спинномозговой жидкости новорожденных. Arch Dis Child Fetal Neonatal Ed. 2009; 95: F25–29. pmid: 19671531 - 4.
Гарджес HP, Moody MA, Cotten CM, Smith PB, Tiffany KF, Lenfestey R, et al. Неонатальный менингит: какова взаимосвязь между культурами спинномозговой жидкости, культурами крови и параметрами спинномозговой жидкости? Педиатрия.2006; 117: 1094–1100. pmid: 16585303 - 5.
Klinger G, Chin CN, Beyene J, Perlman M. Прогнозирование исхода бактериального менингита новорожденных. Педиатрия. 2000; 106: 477–482. pmid: 10969090 - 6.
Bargui F, D’Agostino I, Mariani-Kurkdjian P, Alberti C, Doit C, Bellier N, et al. Факторы, влияющие на неврологический исход детей с бактериальным менингитом в отделении неотложной помощи. Eur J Pediatr. 2012; 171: 1365–1371. pmid: 22527566 - 7.
Обуртин М., Порчер Р., Брюнель Ф., Сканвик А., Труйе Дж. Л., Бедос Дж. П. и др.Пневмококковый менингит в отделении интенсивной терапии: факторы прогноза клинического исхода в серии из 80 случаев. Am J Respir Crit Care Med. 2002; 165: 713–717. pmid: 11874820 - 8.
Ostergaard C, Konradsen HB, Samuelsson S. Клинические проявления и прогностические факторы менингита Streptococcus pneumoniae в зависимости от очага инфекции. BMC Infect Dis. 2005; 5: 93. pmid: 16253143 - 9.
de Jonge RC, van Furth AM, Wassenaar M, Gemke RJ, Terwee CB.Прогнозирование последствий и смерти после бактериального менингита в детстве: систематический обзор прогностических исследований. BMC Infect Dis. 2010; 10: 232. pmid: 20684796 - 10.
Kastenbauer S, Pfister HW. Пневмококковый менингит у взрослых: спектр осложнений и факторы прогноза в 87 случаях. Мозг. 2003; 126: 1015–1025. pmid: 126 - 11.
Хит П.Т., Ник Юсофф Н.К., Бейкер СиДжей. Неонатальный менингит. Arch Dis Child Fetal Neonatal Ed. 2003; 88: F173–178.pmid: 12719388 - 12.
Гримвуд К., Нолан TM, Бонд Л., Андерсон В.А., Катроппа С., Кейр Э. Факторы риска неблагоприятных исходов бактериального менингита. J Paediatr Child Health. 1996; 32: 457–462. pmid: 8933410 - 13.
Koster-Rasmussen R, Korshin A, Meyer CN. Отсрочка и исход лечения антибиотиками при остром бактериальном менингите. J Infect. 2008; 57: 449–454. pmid: 139 - 14.
Chu SM, Hsu JF, Lee CW, Lien R, Huang HR, Chiang MC и др. Неврологические осложнения после бактериемии новорожденных: клиническая характеристика, факторы риска и исходы.PLoS One. 2014; 9: e105294. pmid: 25364821 - 15.
Тавер Д., Заиди А.К. Бремя неонатальных инфекций в развивающихся странах: обзор данных исследований на уровне сообществ. Pediatr Infect Dis J. 2009; 28: S3–9. pmid: 19106760 - 16.
Окике И.О., Джонсон А.П., Хендерсон К.Л., Блэкберн Р.М., Мюллер-Пебоди Б., Ладхани С.Н. и др. Заболеваемость, этиология и исход бактериального менингита у младенцев в возрасте <90 дней в Соединенном Королевстве и Ирландии: проспективное усиленное национальное популяционное наблюдение.Clin Infect Dis. 2014; 59: e150–157. pmid: 24997051 - 17.
Palazzi DL, Klein JO, Baker CJ. Глава 6 — Бактериальный сепсис и менингит. В: Baker JSROKBWJ, редактор. Инфекционные болезни плода и новорожденного (шестое издание). Филадельфия: W.B. Сондерс. 2006; с.247–295. - 18.
Кребс В.Л., Коста Г.А. Клинические исходы бактериального менингита новорожденных в зависимости от массы тела при рождении. Arq Neuropsiquiatr. 2007; 65: 1149–1153. pmid: 18345420 - 19.
Bentlin MR, Ferreira GL, Rugolo LM, Silva GH, Mondelli AL, Rugolo Júnior A.Неонатальный менингит по микробиологическому диагнозу: десятилетний опыт работы в специализированном центре. Arq Neuropsiquiatr. 2010; 68: 882–887. pmid: 21243246 - 20.
Молинье Э., Низами С.К., Саха С., Хуу К.Т., Азам М., Бхутта З.А. и др. 5 дней против 10 дней лечения цефтриаксоном бактериального менингита у детей: двойное слепое рандомизированное исследование эквивалентности. Ланцет. 2011; 377: 1837–1845. pmid: 21620467 - 21.
Чанг С.Дж., Чанг В.Н., Хуанг Л.Т., Хуанг С.К., Чанг Ю.С., Хунг П.Л. и др.Бактериальный менингит новорожденных на юге Тайваня. Pediatr Neurol. 2003; 29: 288–294. pmid: 14643389 - 22.
Paap CM, Bosso JA. Варианты лечения фармакологической терапии неонатального менингита. Наркотики. 1992; 43: 700–712. pmid: 1379148 - 23.
Стивенс Дж. П., Имс М., Кент А., Халкет С., Холт Д., Харви Д. Долгосрочный исход неонатального менингита. Arch Dis Child Fetal Neonatal Ed. 2003; 88: F179–184. pmid: 12719389 - 24.
де Лувуа Дж., Халкет С., Харви Д.Неонатальный менингит в Англии и Уэльсе: последствия в возрасте 5 лет. Eur J Pediatr. 2005; 164: 730–734. pmid: 16136294 - 25.
Tarvij Eslami S, Nassirian H, Mojgan BM, Bahieh ZZ, Elham H, Alimohamad N и др. Сравнение спинномозговой жидкости у новорожденных и младенцев младше 2 месяцев с менингитом или без него. Pediatr Int. 2012; 54: 336–340. pmid: 22192569 - 26.
Андерсон С.Г., Гилберт Г.Л. Неонатальный грамотрицательный менингит: 10-летний обзор со ссылкой на исход и рецидив инфекции.J Paediatr Child Health. 1990; 26: 212–216. pmid: 2257183 - 27.
Weber MW, Carlin JB, Gatchalian S, Lehmann D, Muhe L., Mulholland EK, et al. Предикторы неонатального сепсиса в развивающихся странах. Pediatr Infect Dis J. 2003; 22: 711–717. pmid: 12913772 - 28.
Бен Хамуда Х., Бен Хадж Халифа А, Хамза М.А., Аяди А, Суа Х., Кхедер М. и др. Клинический исход и прогноз бактериального менингита новорожденных. Arch Pediatr. 2013; 20: 938–944. pmid: 23829970 - 29.Линь MC, Чи Х, Чиу NC, Хуанг Ф.Й., Хо CS. Факторы неблагоприятного прогноза бактериального менингита новорожденных в медицинском центре на севере Тайваня. J Microbiol Immunol Infect. 2012; 45: 442–447. pmid: 22571998
- 30.
Баричелло Т., Фагундес Г.Д., Дженеросо Дж.С., Элиас С.Г., Симоэс Л.Р., Тейшейра А.Л. Патофизиология острого бактериального менингита новорожденных. J Med Microbiol. 2013; 62: 1781–1789. pmid: 23946474 - 31.
Ким К.С. Острый бактериальный менингит у младенцев и детей.Lancet Infect Dis. 2010; 10: 32–42. pmid: 20129147
Helicobacter pylori [38] |
|
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Legionella pneumophila |
| |||||||||||||||||
Campylobacter jejuni |
| |||||||||||||||||
Pseudomonas 906 [Pseudomonas aeruginosa] [42] |
| |||||||||||||||||
| Burkholderia cepacia |
| |||||||||||||||||
| Vibrio vulnificus [46] Сырые или недоваренные морепродукты (например,g., сырые моллюски, кишки рыб) | ||||||||||||||||||
| Vibrio parahaemolyticus [47] | ||||||||||||||||||
Fusobacteriaceae [48] |
| |||||||||||||||||
Bacteroides (e.g., Bacteroides fragilis) |
| |||||||||||||||||
Bartonella henselae [50] |
| |||||||||||||||||
Bartonella quintana [51] | [54] |
.
