Метаболизм костной ткани и остеопороз | #10/15
Остеопороз (ОП) — прогрессирующее системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники (качества) костной ткани, что приводит к хрупкости костей и повышению риска переломов. ОП — самое распространенное заболевание костной ткани: остеопоротические переломы отмечается у половины всех женщин, находящихся в периоде постменопаузы, а также у мужчин старших возрастных групп [1]. Очевидно, что рано начатые активные профилактические мероприятия у значительной части населения могут существенно повлиять на распространенность, прогрессирование и исходы заболевания, а также снизить риск переломов. В связи с этим изучение различных лекарственных препаратов и методов, применяемых для профилактики ОП, приобретает особый смысл.
Кость — специализированная разновидность соединительной ткани, состоящая из клеток и межклеточного вещества. В течение всей жизни основные функции костной ткани, такие как жесткость и гибкость, снижаются, поскольку с возрастом наблюдаются повреждение матрикса и потеря минералов. В противовес указанным проявлениям, в кости осуществляется ремоделирование — процесс, направленный на самостоятельное обновление и сохранение скелета как структурного и функционального органа.
В течение всей жизни основные функции костной ткани, такие как жесткость и гибкость, снижаются, поскольку с возрастом наблюдаются повреждение матрикса и потеря минералов. В противовес указанным проявлениям, в кости осуществляется ремоделирование — процесс, направленный на самостоятельное обновление и сохранение скелета как структурного и функционального органа.
Основными клетками костной ткани, функциями которой регулируется гомеостаз кости, являются остеобласты, остеокласты и остеоциты. Основной функцией остеобластов является создание органического межклеточного матрикса кости, остеоида. Остеобласты синтезируют и выделяют в окружающую среду фибриллы коллагена, протеогликаны и гликозаминогликаны. Наряду с этим остеобласты активно синтезируют и выделяют во внеклеточное пространство значительное количество глицерофосфолипидов, способствующих связыванию Ca2+ и участвующих в процессах минерализации. Клетки сообщаются между собой через десмосомы, которые позволяют проходить Ca2+ и цАМФ.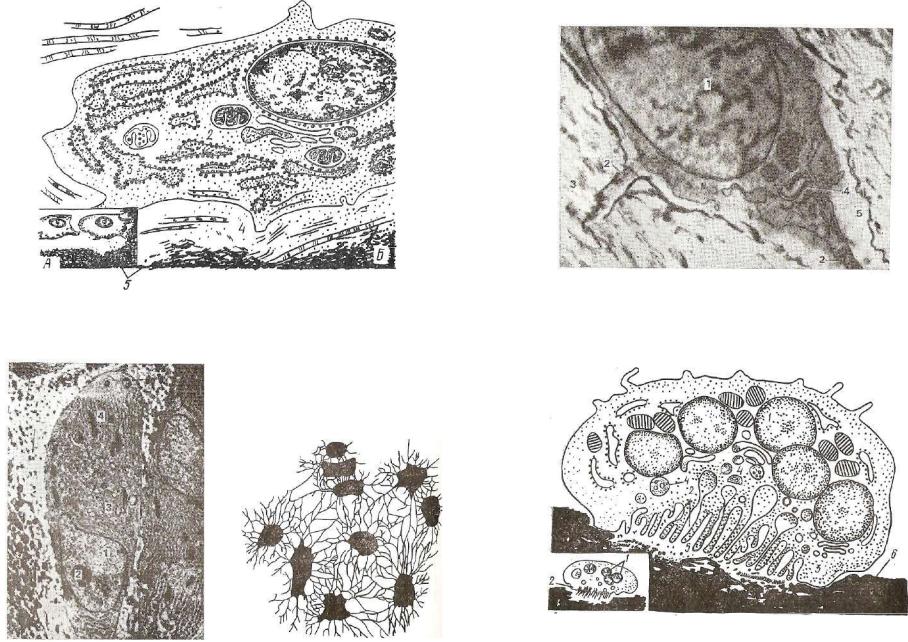 Они также обеспечивают непрерывный рост кристаллов гидроксиапатитов и выступают в качестве посредников при связывании минеральных кристаллов с белковой матрицей.
Они также обеспечивают непрерывный рост кристаллов гидроксиапатитов и выступают в качестве посредников при связывании минеральных кристаллов с белковой матрицей.
В ходе формирования кости некоторые остеобласты оказываются замурованными в толщу матрикса и становятся остеоцитами. Остеоциты контактируют друг с другом через отростки, являются основными компонентами в сформировавшейся костной ткани. Основная функция остеоцитов — поддержание нормального состояния костного матрикса и баланса кальция и фосфора в организме.
Остеокласты — клетки, выполняющие функцию разрушения кости; развиваются из стволовой кроветворной клетки и являются специализированными макрофагами. В процессе ремоделирования кости резорбтивный стимул запускает процесс привлечения остеокластов к участку кости. Прикрепившись к кости, остеокласты продуцируют множество протеолитических ферментов и формируют полость в кальцинированном матриксе. Таким образом, они осуществляют непрерывный процесс резорбции и обновления костной ткани, обеспечивая необходимый рост и развитие скелета, структуру, прочность и упругость.
Важнейшим компонентом костной ткани является межклеточное вещество — уникальный комплекс органических и неорганических компонентов, заполняющих пространство между клетками. Минерализованный матрикс костной ткани поддерживает структуру скелета и под координирующим влиянием остеобластов и остеокластов обеспечивает резервуар как ионов, так и факторов роста, которые высвобождаются в процессе метаболизма.
Органический межклеточный матрикс костной ткани представлен семейством коллагеновых белков. Состав кости необычен тем, что фактически в ней представлен только коллаген I типа (90%), хотя наряду с коллагеном I типа в кости все же присутствуют следы других типов коллагена, таких как V, XI, XII. Скорее всего, что эти типы коллагена принадлежат другим тканям, которые и находятся в костной ткани, но не входят в состав костного матрикса. Например, коллаген V типа обычно обнаруживается в сосудах, которые пронизывают кость. Коллаген XI типа находится в хрящевой ткани и может соответствовать остаткам кальцифицированного хряща.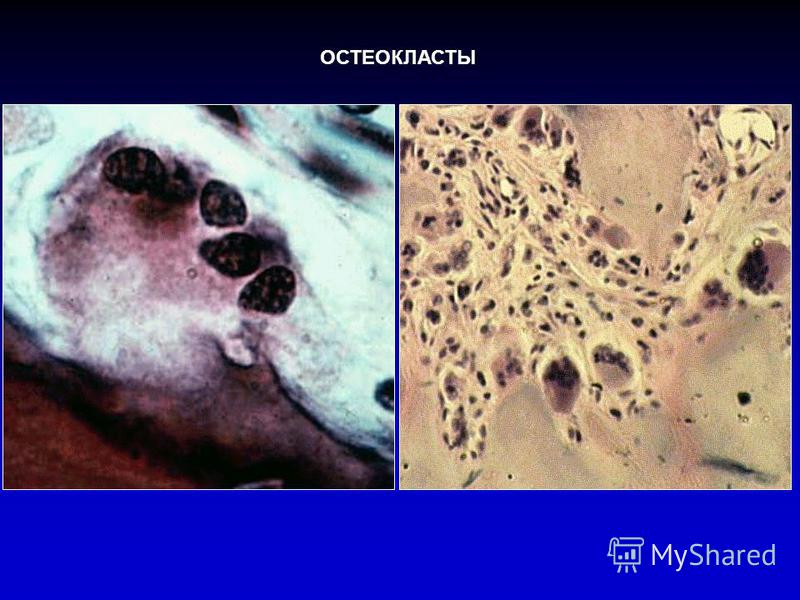 Коллагеновые фибриллы в кости строго ориентированы в соответствии с распределенной функциональной нагрузкой на кость, что обеспечивает упругость и эластичность кости. Веретенообразные и пластинчатые кристаллы гидроксиапатита находятся на коллагеновых волокнах, в их пределах и в окружающем пространстве. Как правило, они ориентированы в том же направлении, что и коллагеновые волокна.
Коллагеновые фибриллы в кости строго ориентированы в соответствии с распределенной функциональной нагрузкой на кость, что обеспечивает упругость и эластичность кости. Веретенообразные и пластинчатые кристаллы гидроксиапатита находятся на коллагеновых волокнах, в их пределах и в окружающем пространстве. Как правило, они ориентированы в том же направлении, что и коллагеновые волокна.
Неколлагеновая часть матрикса (10%) представлена основным веществом (витамин К-зависимыми глютамилпротеинами (остеокальцином), матричными протеинами, остеопонтином, остеонектином, фибронектином, фосфопротеидами, сиалопротеидами, а также протеогликанами).
Минеральные вещества, которыми пропитан органический матрикс, представлены главным образом кристаллами гидроксиапатита Ca10(PO4)6(OH)2. Кроме того, в кости обнаружены ионы Mg2+, Na+, K+, SO42-, HCO3-, гидроксильные и другие ионы, которые могут принимать участие в образовании кристаллов.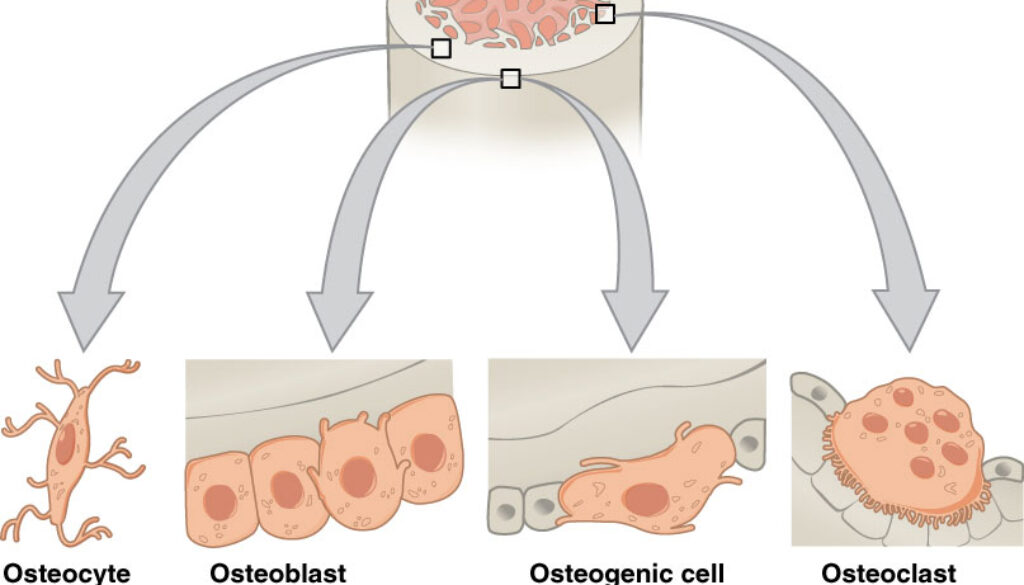
Важно подчеркнуть, что ОП является результатом уменьшения органического матрикса кости, а вовсе не плохой кальцификацией костной ткани. При ОП существенно снижается скорость образования остеоида, необходимого для формирования кости. Поэтому при планировании профилактических мероприятий чрезвычайно важно учитывать потенциальную возможность препаратов, наряду с адекватной минерализацией, оказывать влияние на синтез органического матрикса.
Разумеется, качественная структура и прочность кости, ее эффективное функционирование и своевременное самообновление возможны лишь при адекватной обеспеченности макро- и микроэлементами, которые, подобно кальцию и витамину D, принимают непосредственное участие в биохимических процессах костной ткани [2–5]. Магний, медь, цинк, марганец, бор, являясь кофакторами ферментов, регулируют синтез костного матрикса, его минерализацию, а также равномерный рост, гибкость и прочность костной ткани. Известно, что дефицит этих веществ замедляет формирование костной массы в детстве и подростковом возрасте, способствует ее ускоренной потере в пожилом возрасте. Соответственно, дефицит любого из известных минеральных веществ в организме препятствует успешной терапии и профилактике нарушений структуры кости [6, 7].
Соответственно, дефицит любого из известных минеральных веществ в организме препятствует успешной терапии и профилактике нарушений структуры кости [6, 7].
Одним из основных минералов, играющих важную роль в формировании и поддержании структуры костной ткани, является кальций. Поскольку кальций не производится в организме, то для поддержания оптимальной концентрации он должен регулярно поступать извне. Причем желательно, чтобы его поступление в организм обеспечивалось за счет натуральных молочных продуктов, молока и его производных (кефира, простокваши, ряженки, йогурта, творога, сыра). Вместе с тем биодоступность кальция из пищи составляет порядка 30%, причем с высокой индивидуальной вариабельностью. Более того, у лиц пожилого возраста нередко имеет место непереносимость молочных продуктов, связанная со снижением концентрации лактазы в желудочном соке, что приводит к низкому потреблению кальция.
Согласно эпидемиологическим исследованиям, среди женщин в возрасте старше 45 лет, проживающих в мегаполисах, непереносимость молока встречается с частотой 25,0–34,0%. При этом достаточное потребление кальция с продуктами питания имеет место менее чем у 5% женщин [8]. Фактически содержание кальция в пищевом рационе постменопаузальных женщин не соответствует рекомендованным нормам. Очевидно, что обеспечение должного уровня потребления кальция возможно лишь при условии дополнительного регулярного назначения медикаментозных препаратов.
При этом достаточное потребление кальция с продуктами питания имеет место менее чем у 5% женщин [8]. Фактически содержание кальция в пищевом рационе постменопаузальных женщин не соответствует рекомендованным нормам. Очевидно, что обеспечение должного уровня потребления кальция возможно лишь при условии дополнительного регулярного назначения медикаментозных препаратов.
Витамин D — основной регулятор активной абсорбции кальция в организме. Витамин D относят к группе жирорастворимых витаминов. Хотя в отличие от всех других витаминов он биологически не активен. В активную, гормональную, форму он превращается за счет двухступенчатой метаболизации в организме и оказывает многообразные биологические эффекты за счет взаимодействия со специфическими рецепторами, локализованными в ядрах клеток тканей и органов. Другое дело — активный метаболит витамина D. Он действует как истинный гормон, хотя в научной литературе его традиционно называют витамином D [9, 10].
Природная форма витамина D — витамин D2 (эргокальциферол) поступает в организм человека в относительно небольших количествах — не более 20–30% от потребности.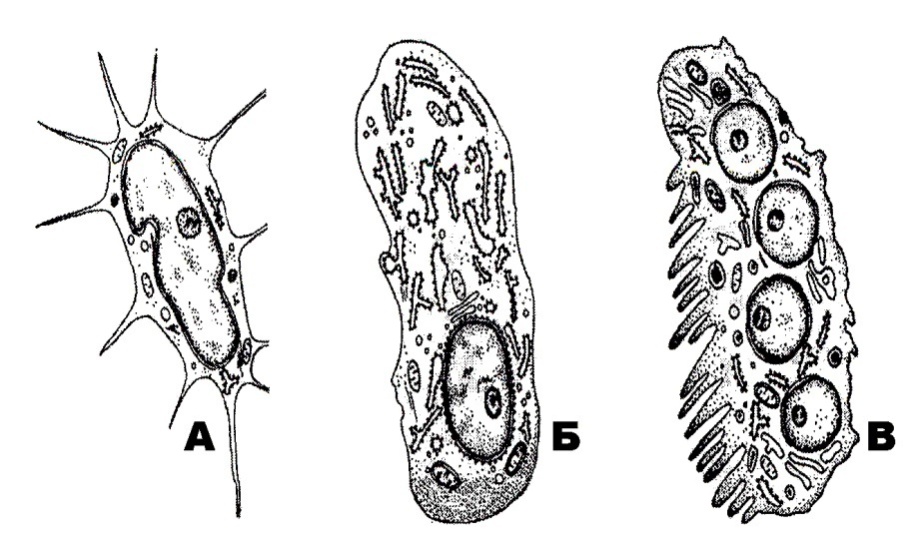 В основном из злаковых растений, рыбьего жира, сливочного масла, маргарина, молока, яичного желтка и др. В организме витамин D2 метаболизируется с образованием производных, обладающих сходным с метаболитами витамина D3 действием.
В основном из злаковых растений, рыбьего жира, сливочного масла, маргарина, молока, яичного желтка и др. В организме витамин D2 метаболизируется с образованием производных, обладающих сходным с метаболитами витамина D3 действием.
Еще одна природная форма витамина D — витамин D3, или холекальциферол, является ближайшим аналогом витамина D2, но его синтез мало зависит от поступления извне. Холекальциферол образуется в организме позвоночных животных, в том числе амфибий, рептилий, птиц и млекопитающих, в связи с чем играет значительно бóльшую роль в процессах жизнедеятельности человека, чем поступающий в небольших количествах с пищей витамин D2. В организме витамин D3 образуется из находящегося в дермальном слое кожи предшественника (7-дегидрохолестерина) под влиянием коротковолнового ультрафиолетового облучения спектра В (УФ–В/солнечного света, длина волны 290–315 нм) при температуре тела в результате фотохимической реакции раскрытия В-кольца стероидного ядра и термоизомеризации, характерной для секостероидов [9, 10].
В последующем поступивший с пищей и/или образовавшийся в организме в процессе эндогенного синтеза витамин D подвергается реакции 25-гидроксилирования в печени. Важно, что гидроксилирование витамина D3 в печени представляет собой полностью субстратзависимый процесс, который протекает весьма быстро и ведет к повышению уровня 25(ОН)D в сыворотке крови. Уровень этого вещества отражает как образование витамина D в коже, так и его поступление с пищей, в связи с чем может использоваться как маркер статуса витамина D [9, 10].
Вторая реакция гидроксилирования 25(ОН)D, с образованием наиболее важной, качественно и количественно значимой активной гормональной формы — 1a,25-дигидроксивитамина D3 (1α,25(ОН)2D3), называемой также D-гормоном, кальцитриолом, протекает уже в основном в почках, в клетках проксимальных отделов канальцев коры почек при участии фермента 1α-гидроксилазы (CYP27В1). Этот процесс строго регулируется рядом эндогенных и экзогенных факторов.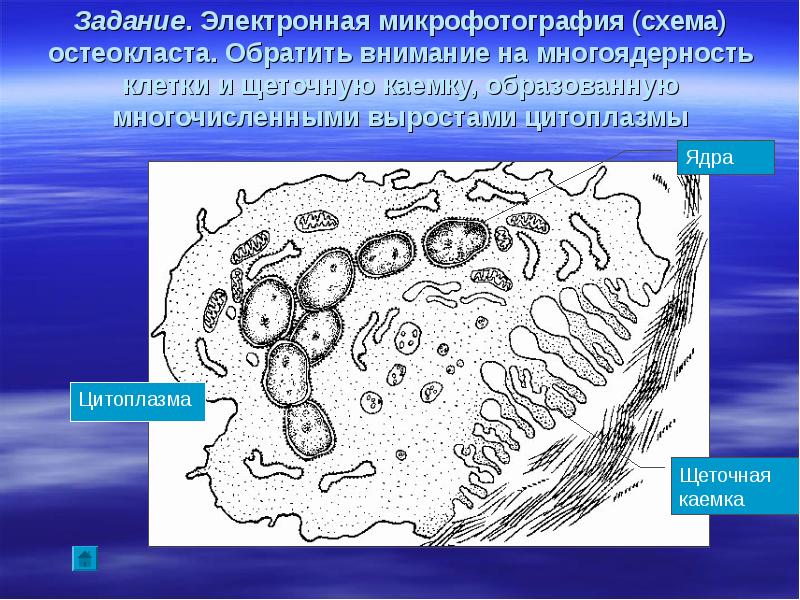 Во-первых, регуляция синтеза 1a,25(ОН)2D3 в почках является непосредственной функцией паратиреоидного гормона (ПТГ), на концентрацию которого в крови, в свою очередь, по механизму обратной связи оказывают влияние как уровень самого активного метаболита витамина D3, так и концентрация кальция и фосфора в плазме крови. Во-вторых, активация синтеза 1a-гидроксилазы и реакции 1a-гидроксилирования зависит от половых гормонов (эстрогенов и андрогенов), кальцитонина, пролактина, гормона роста (через ИПФР-1) и др. В-третьих, ингибирующее влияние на активность 1a-гидроксилазы оказывают глюкокортикостероидные гормоны, 1α,25(ОН)2D3 и ряд его синтетических аналогов. Фактор роста из фибробластов (FGF23), секретируемый в клетках кости, вызывает образование натрий-фосфат-котранспортера, который действует в клетках почек и тонкого кишечника, оказывает тормозящее влияние на синтез 1,25-дигидроксивитамина D3. На метаболизм витамина D оказывают влияние и некоторые лекарственные средства, например, противоэпилептические препараты.
Во-первых, регуляция синтеза 1a,25(ОН)2D3 в почках является непосредственной функцией паратиреоидного гормона (ПТГ), на концентрацию которого в крови, в свою очередь, по механизму обратной связи оказывают влияние как уровень самого активного метаболита витамина D3, так и концентрация кальция и фосфора в плазме крови. Во-вторых, активация синтеза 1a-гидроксилазы и реакции 1a-гидроксилирования зависит от половых гормонов (эстрогенов и андрогенов), кальцитонина, пролактина, гормона роста (через ИПФР-1) и др. В-третьих, ингибирующее влияние на активность 1a-гидроксилазы оказывают глюкокортикостероидные гормоны, 1α,25(ОН)2D3 и ряд его синтетических аналогов. Фактор роста из фибробластов (FGF23), секретируемый в клетках кости, вызывает образование натрий-фосфат-котранспортера, который действует в клетках почек и тонкого кишечника, оказывает тормозящее влияние на синтез 1,25-дигидроксивитамина D3. На метаболизм витамина D оказывают влияние и некоторые лекарственные средства, например, противоэпилептические препараты.
Основными реакциями, в которых участвует D-гормон, являются абсорбция кальция в желудочно-кишечном тракте и его реабсорбция в почках. D-гормон усиливает кишечную абсорбцию кальция в тонком кишечнике за счет взаимодействия со специфическими РВD. Об эффективности данного механизма свидетельствует тот факт, что без участия витамина D лишь 10–15% пищевого кальция и 60% фосфора абсорбируются в кишечнике. Взаимодействие между 1a,25-дигидроксивитамином D3 и РВD повышает эффективность кишечной абсорбции Са2+ до 30–40%, т. е. в 2–4 раза, а фосфора — до 80%. Сходные механизмы действия D-гормона лежат в основе осуществляемой под его влиянием реабсорбции Са2+ в почках.
В костях 1α,25(ОН)2D3 связывается с рецепторами на кость-формирующих клетках — остеобластах, вызывая повышение экспрессии ими лиганда рецептора активатора ядерного фактора кВ (RANKL). Рецептор-активатор ядерного фактора кВ (RANK), являющийся рецептором для RANKL, локализованным на преостеокластах, связывает RANKL, что вызывает быстрое созревание преостеокластов и их превращение в зрелые остеокласты. В процессах костного ремоделирования зрелые остеокласты резорбируют кость, что сопровождается выделением кальция и фосфора из минерального компонента (гидроксиапатита) и обеспечивает поддержание уровня кальция и фосфора в крови. В свою очередь, адекватный уровень кальция (Са2+) и фосфора необходим для нормальной минерализации скелета [11–13].
В процессах костного ремоделирования зрелые остеокласты резорбируют кость, что сопровождается выделением кальция и фосфора из минерального компонента (гидроксиапатита) и обеспечивает поддержание уровня кальция и фосфора в крови. В свою очередь, адекватный уровень кальция (Са2+) и фосфора необходим для нормальной минерализации скелета [11–13].
Многочисленные исследования показали, что назначение препаратов кальция и/или витамина D способствует уменьшению потери костной ткани [14–19]. У женщин в поздней постменопаузе с низким употреблением пищевого кальция прием кальция предотвращает потерю костной ткани в позвоночнике [20, 21]. В свою очередь, назначение добавок кальция лицам старше 60 лет приводит к снижению потери костной массы в области бедра среди белых мужчин и женщин в возрасте моложе 72 лет [22]. Эффект назначения цитрата кальция на минеральную плотность кости (МПК) у женщин в раннем (до 5 лет) и среднем (от 5 до 10 лет) постменопаузальном периоде в течение двух лет проявлялся в виде прироста МПК в поясничном отделе на 1%, наряду со значимым снижением МПК на 2,4% в группе, получавшей плацебо [23]. Метаанализ 9 рандомизированных клинических исследований с общей выборкой более 50 тыс. человек, в 6 из которых сравнивалось комбинированное лечение витамином D (400 или 700–800 МЕ/сут) и кальцием с группами плацебо или без лечения, продемонстрировал достоверное снижение риска перелома бедра на 18% (RR 0,82 [95% ДИ 0,71–0,94], р = 0,0005) и риска внепозвоночных переломов на 12% (RR 0,88 [95% ДИ 0,78–0,99], р = 0,036) в группах, получавших комбинированную терапию, по сравнению с группами без добавок [24]. В исследованиях, где применялся витамин D в дозе 700–800 МЕ/сут, эффект на риск перелома бедра был выше, чем при приеме 400 МЕ (21% и 18% соответственно). Соответственно, в исследованиях, в которых пациенты получали только витамин D или плацебо (4 РКИ с общей численностью 9083 пациента), не было получено снижения риска внепозвоночных переломов как при применении дозы 400 МЕ (RR 1,14 [95% ДИ 0,87–1,49]), так при использовании 700–800 МЕ (RR 1,04 [95% ДИ 0,75–1,46]), что подтверждает ранее представленные данные о том, что витамин D без добавления кальция не снижает риск переломов [24].
Метаанализ 9 рандомизированных клинических исследований с общей выборкой более 50 тыс. человек, в 6 из которых сравнивалось комбинированное лечение витамином D (400 или 700–800 МЕ/сут) и кальцием с группами плацебо или без лечения, продемонстрировал достоверное снижение риска перелома бедра на 18% (RR 0,82 [95% ДИ 0,71–0,94], р = 0,0005) и риска внепозвоночных переломов на 12% (RR 0,88 [95% ДИ 0,78–0,99], р = 0,036) в группах, получавших комбинированную терапию, по сравнению с группами без добавок [24]. В исследованиях, где применялся витамин D в дозе 700–800 МЕ/сут, эффект на риск перелома бедра был выше, чем при приеме 400 МЕ (21% и 18% соответственно). Соответственно, в исследованиях, в которых пациенты получали только витамин D или плацебо (4 РКИ с общей численностью 9083 пациента), не было получено снижения риска внепозвоночных переломов как при применении дозы 400 МЕ (RR 1,14 [95% ДИ 0,87–1,49]), так при использовании 700–800 МЕ (RR 1,04 [95% ДИ 0,75–1,46]), что подтверждает ранее представленные данные о том, что витамин D без добавления кальция не снижает риск переломов [24].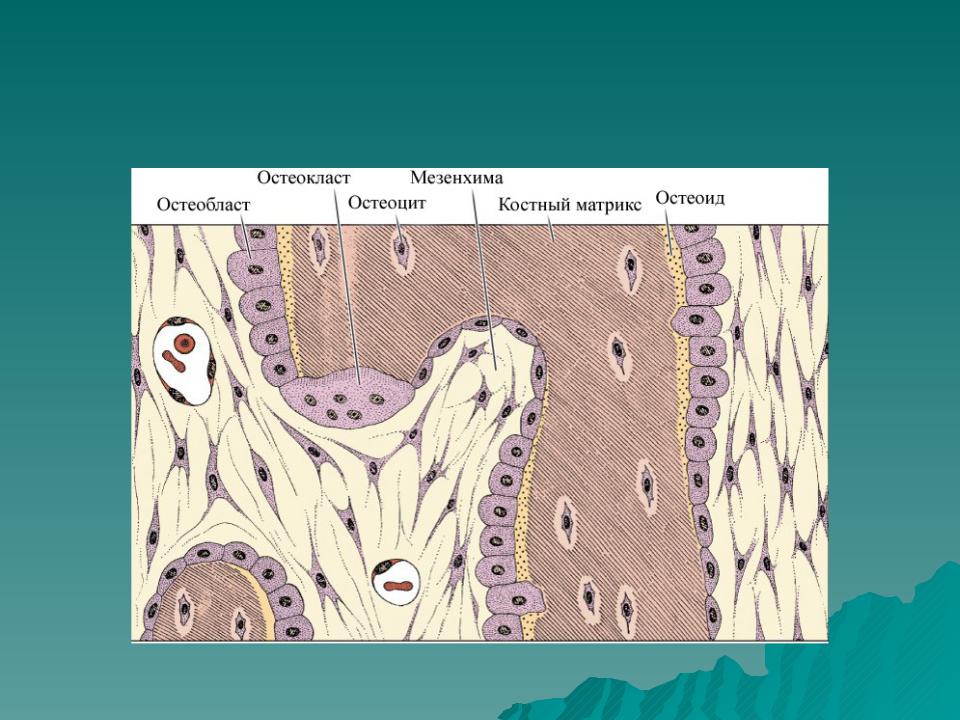
Магний
Известно, что 60–65% магния находится именно в скелете и от обеспеченности костей магнием зависит обмен кальция и витамина D. Являясь структурным компонентом значительного числа ферментов, магний образует кристаллы с фосфатами, принимает участие в росте и стабилизации кристалла гидроксиапатита — структурной единицы минерального компонента костной ткани [25, 26]. Магний регулирует секрецию паратгормона (ПГ), повышает чувствительность клеток-мишеней к ПГ и витамину D, стимулирует действие кальцитонина. Длительное во времени нарушение соотношения Mg/Ca в сторону дефицита магния сопровождается замедлением обменных процессов в кости. Специальные магний-дефицитные диеты, сопровождающиеся уменьшением сывороточной концентрации магния, способствуют системной потере костной массы, снижению толщины надкостницы, характерным изменениям провоспалительных маркеров и маркеров резорбции кости. Уже по истечении достаточно короткого срока (4 недели), магний-дефицитная диета приводит к значимому снижению содержания минеральных веществ кости (р < 0,001).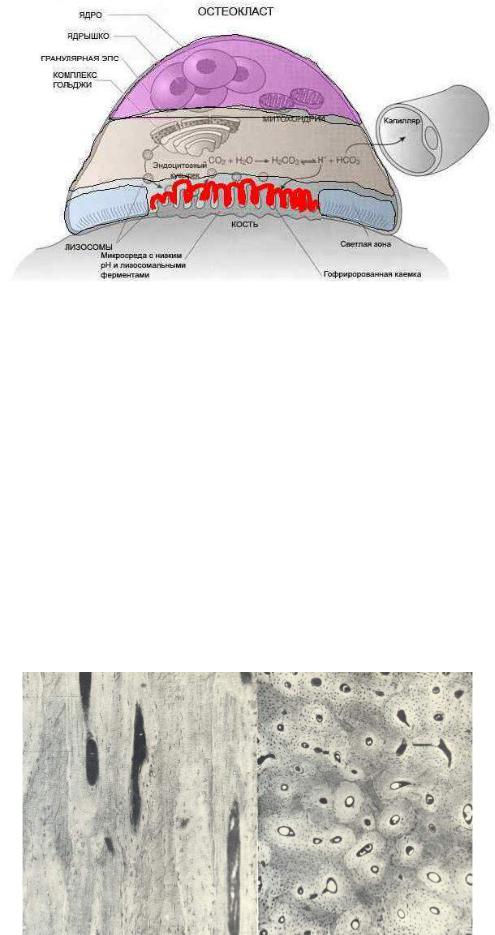 Даже слабо выраженный диетарный дефицит магния (например, 50% от рекомендованного суточного потребления магния) в течение нескольких месяцев приводит к формированию начальных стадий ОП. Более высокое значение отношения Mg/Ca в питании, соответственно, сопровождается замедлением возрастных потерь костной массы у пожилых женщин [27], меньшей частотой ОП [28]. У женщин в постменопаузе дополнительный прием магния в течение 12 месяцев способствует как минимум стабилизации или даже некоторому увеличению МПК, чего не наблюдается у лиц, не компенсирующих диетарный дефицит магния [29]. Обогащение пищевого рациона магнием сопряжено с повышенной МПК не только у женщин, но и у мужчин. Так, при исследовании когорты из 2038 человек после поправок на возраст, калорийность диеты, потребление кальция и витамина D, индекс массы тела, курение, алкоголь, физическую активность, использование тиазидных диуретиков и эстроген-содержащих препаратов, потребление магния с пищей положительно ассоциировалась с более высокой МПК [30].
Даже слабо выраженный диетарный дефицит магния (например, 50% от рекомендованного суточного потребления магния) в течение нескольких месяцев приводит к формированию начальных стадий ОП. Более высокое значение отношения Mg/Ca в питании, соответственно, сопровождается замедлением возрастных потерь костной массы у пожилых женщин [27], меньшей частотой ОП [28]. У женщин в постменопаузе дополнительный прием магния в течение 12 месяцев способствует как минимум стабилизации или даже некоторому увеличению МПК, чего не наблюдается у лиц, не компенсирующих диетарный дефицит магния [29]. Обогащение пищевого рациона магнием сопряжено с повышенной МПК не только у женщин, но и у мужчин. Так, при исследовании когорты из 2038 человек после поправок на возраст, калорийность диеты, потребление кальция и витамина D, индекс массы тела, курение, алкоголь, физическую активность, использование тиазидных диуретиков и эстроген-содержащих препаратов, потребление магния с пищей положительно ассоциировалась с более высокой МПК [30].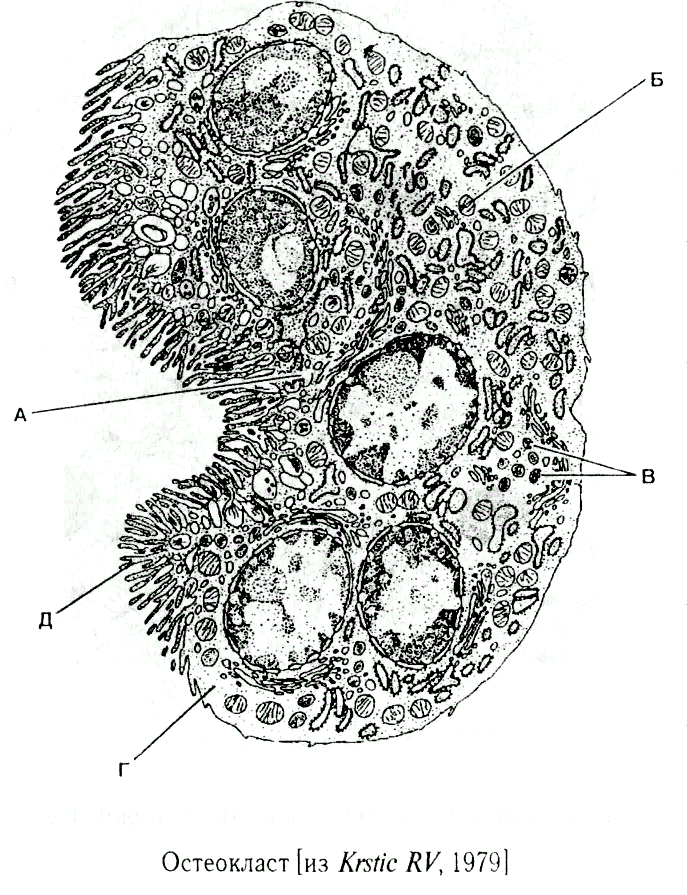 Несомненным достоинством магния является профилактика депонирования металлов, оказывающих токсическое воздействие на кость (кадмия, свинца).
Несомненным достоинством магния является профилактика депонирования металлов, оказывающих токсическое воздействие на кость (кадмия, свинца).
Медь
Являясь кофактором лизилоксидазы — ключевого фермента, ответственного за образование внутри- и межмолекулярных поперечных связей (сшивок) в волокнах костного коллагена, медь обеспечивает механическую прочность кости. Соответственно, именно дефицит меди и связанное с этим нарушение формирования сшивок коллагена способствует нарушению роста, остеогистогенеза и хрупкости костей [31], а также тяжелой патологии легких и сердечно-сосудистой системы [32]. Дефицит меди способствует нарушению такого механического свойства кости, как устойчивость к скручиванию и угловой деформации [31–33]. Сниженная концентрация меди в сыворотке крови у пожилых женщин коррелирует с низкой МПК [33].
Марганец
К эффектам долгосрочного дефицита марганца в рационе питания относят увеличение резорбции, снижение плотности и массы костей. Марганец активирует многие ферменты, в том числе марганец-зависимые гликозилтрансферазы и костную щелочную фосфатазу, что служит указанием на его участие в оссификации. Восстановление марганца в диете способствует восстановлению нормальной структуры кости и увеличению МПК [34].
Марганец активирует многие ферменты, в том числе марганец-зависимые гликозилтрансферазы и костную щелочную фосфатазу, что служит указанием на его участие в оссификации. Восстановление марганца в диете способствует восстановлению нормальной структуры кости и увеличению МПК [34].
Бор
Основными эффектами бора являются экскреция кальция с мочой, повышение уровня витамина D в крови, улучшение ассимиляции кальция костной тканью посредством нормализации гормонального фона [35, 36]. Известно, что бор дозозависимо влияет на процессы дифференцировки стромальных клеток костного мозга, способствует синтезу коллагена и костного матрикса, белков остеогенеза — остеокальцина (р < 0,05) [37–39], остеопонтина, сиалопротеина кости (ген BSP), белка Runx2 и других [40].
Цинк
Цинк — непосредственный участник синтеза органического матрикса. Являясь структурным компонентом значительного числа ферментов (более 400), участвует в дифференцировке остеобластов, контролирует синтез инсулиноподобного фактора роста (ИФР-1), коллагена [41–44]. Соответственно, длительный дефицит Zn приводит к нарушению синтеза ДНК и метаболизма белка, что ведет к нарушению синтеза органического матрикса.
Соответственно, длительный дефицит Zn приводит к нарушению синтеза ДНК и метаболизма белка, что ведет к нарушению синтеза органического матрикса.
Связь между обеспеченностью остеотропными микроэлементами, характеристикой костной ткани и возможностью коррекции дефицита потребления с помощью лекарственных средств, в состав которых входят соли кальция и микроэлементы, продемонстрирована в многочисленных исследованиях последних лет, выполненных в разных возрастных группах. Одним из наиболее изученных препаратов, рекомендованных для профилактики метаболических нарушений костной ткани, связанных с дефицитом микроэлементов, является Кальцемин Адванс [45–49].
Так, при обследовании подростков недостаточное содержание бора, меди, марганца и цинка в волосах положительно ассоциировалось со снижением МПК. При этом назначение подросткам препарата Кальцемин Адванс по 1 таблетке 2 раза в сут (соответственно 1000 мг кальция, 400 МЕ холекальциферола, 80 мг магния, 15 мг цинка, 2 мг меди, 3,6 мг марганца и 500 мкг бората натрия в сутки) на протяжении 8–12 мес привело к существенной динамике не только концентрации микроэлементов, но и МПК [45].
В исследовании продолжительностью 24 месяца показано повышение МПК в постменопаузе у женщин, принимавших Са в сочетании с цинком, медью и марганцем, в то время как у женщин, принимавших только Са, или только микроэлементы, или только плацебо, показано уменьшение МПК, при этом уменьшения риска переломов выявлено не было [46].
Применение Кальцемина Адванс у постменопаузальных женщин с остеопенией (Т-критерий в Л1–Л4 и/или шейке бедра от –1,5 до –2,5 SD) в дозировке по 1 таблетке 2 раза в сут (соответственно 1000 мг кальция, 400 МЕ холекальциферола, 80 мг магния, 15 мг цинка, 2 мг меди, 3,6 мг марганца и 500 мкг бората натрия в сутки) по сравнению с группой, получившей только рекомендации по питанию, обнаружило отсутствие снижения МПК в течение года, тогда как в контрольной группе она уменьшилась во всех исследуемых зонах [47].
Применение Кальцемина Адванс постменопаузальными женщинами, имеющими два и более факторов риска развития ОП на протяжении 52 недель, сопровождалось сохранением исходной МПК или ее повышением (прирост костной массы составил в среднем 3,55%) [48].
Эффективность препарата Кальцемин Адванс сравнивалась с различными видами лечебно-профилактических вмешательств у женщин с остеопенией в проспективном 3-летнем многоцентровом клиническом исследовании, выполненном в трех российских центрах профилактики ОП из Москвы, Ярославля, Иркутска. В группе пациенток, получавших Кальцемин Адванс (по 1 таблетке 2 раза в сут), по сравнению с группой, получившей только рекомендации по коррекции питания, уже через 12 мес наблюдалось уменьшение болевых ощущений и улучшение ежедневной активности. Наряду с этим МПК в основной группе оставалась стабильной [49].
Таким образом, при выборе средств для профилактики и лечения потерь костной ткани, восстановления ее структуры и качества необходимо использовать препараты, которые наряду с восполнением дефицита потребления остеотропных микроэлементов, участвующих в жизненно важных метаболических процессах организма, способствуют синтезу коллагена, формированию костного матрикса, его минерализации и, соответственно, увеличению плотности и прочности кости.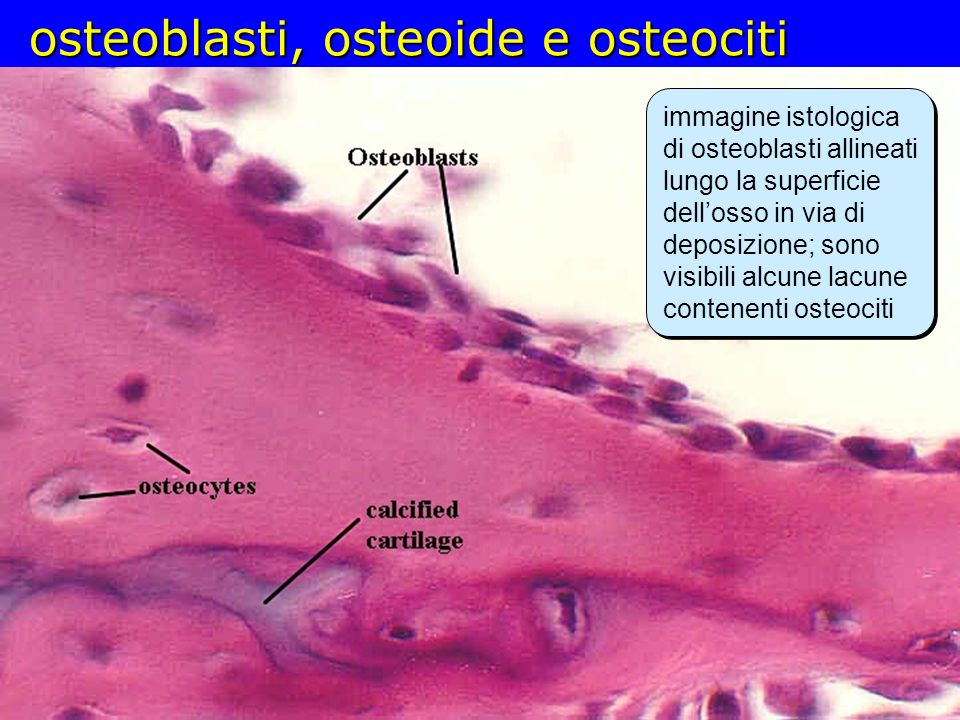
Литература
- Institute for Clinical Systems Improvement (ICSI) Health Care Guideline: Diagnosis and Treatment of Osteoporosis. 3 rd edition, July 2004. www.icsi.org.
- De Francisco A. L., Rodriguez M. Magnesium — its role in CKD // Nefrologia. 2013; 33 (3): 389–399 doi.
- Swaminathan R. Nutritional factors in osteoporosis // Int J Clin Pract. 1999; 53 (7): 540.
- Parlier R., Hioco D., Leblanc R. Metabolism of magnesium and its relation to that of calcium. I. Apropos of a study of magnesium balance in the normal man, in osteopathies and nephropathies // Rev Fr Endocrinol Clin. 1963; 4: 93–135.
- Ryder K. M., Shorr R. I., Bush A. J., Kritchevsky S. B., Harris T., Stone K., Cauley J., Tylavsky F. A. Magnesium intake from food and supplements is associated with bone mineral density in healthy older white subjects // J Am Geriatr Soc. 2005, 53: 1875–1880.
- Schaafsma A.
 , de Vries P. J, Saris W. H. Delay of natural bone loss by higher intakes of specific minerals and vitamins // Crit Rev Food Sci Nutr. 2001. Vol. 41 (4). Р. 225–249.
, de Vries P. J, Saris W. H. Delay of natural bone loss by higher intakes of specific minerals and vitamins // Crit Rev Food Sci Nutr. 2001. Vol. 41 (4). Р. 225–249. - Lakhkar N. J., Lee I. H., Kim H. W., Salih V., Wall I. B., Knowles J. C. Bone formation controlled by biologically relevant inorganic ions: role and controlled delivery from phosphate-based glasses // Adv Drug Deliv Rev. 2013. Vol. 65 (4). Р. 405–420.
- Торопцова Н. В., Никитинская О. А., Беневоленская Л. И. Профилактика первичного остеопороза с помощью различных препаратов кальция // Научно-практическая ревматология. 2005; 1: 36–39.
- Дамбахер М. А., Шахт Е. Остеопороз и активные метаболиты витамина D: мысли, которые приходят в голову. Basel: Eular Publishers, 1996. 139 p.
- Шварц Г. Я. Витамин D, D-гормон и альфакальцидол: молекулярно-биологические и фармакологические аспекты // Остеопороз и остеопатии. 1998. № 3. С. 2–7.
- Holik M.
 F. Vitamin D deficiency // New. Engl. J. Med. 2007. Vol. 357. P. 266–281.
F. Vitamin D deficiency // New. Engl. J. Med. 2007. Vol. 357. P. 266–281. - Forman J. P., Giovannucci E., Holmes M. D. et al. Plasma 25-hydroxyvitamin D level and risk of incidents hypertension // Hypertension. 2007. Vol. 49. P. 1063–1069.
- Vervloet M. G., Twisk J. W. Mortality reduction by vitamin D receptor activation in end–stage renal disease: a commentary on the robustness of current data // Nephrol. Dial. Transplant. 2009. Vol. 24. № 3. P. 703–706.
- Shea B., Wells G. et al. Calcium supplementation on bone loss in postmenopausal women (Cochrane review) // Cochrane Library, 2004.
- Cumming R. G., Nevitt M. C. Calcium for prevention of osteoporotic fractures in postmenopausal women // J. Bone Mineral. Res. 1997, V. 12: 1321–1329.
- Nordin B. E. C. Calcium and Osteoporosis // Nutrition. 1997, V. 13: 664–686.
- Baksgaard L., Andersen K. P., Hyldstrup L.
 Calcium and vitamin D supplementation increases spinal BMD in healthy, postmenopausal women // Osteoporosis Int. 1998, 8, 225–260.
Calcium and vitamin D supplementation increases spinal BMD in healthy, postmenopausal women // Osteoporosis Int. 1998, 8, 225–260. - Devine A., Prince R. L., Dhalival S. S. et al. Results of a 5 Yaer Doudle Blinde, Placebo Controlled Trial of Calcium Supplementation (CAIFOS): Bone Density Outcomes // J. Bone Miner. Res. 2004, SA 416.
- Gillespie W. J., Avenell A., Henry D. A. et al. Vitamin D and vitamin D analogues for preventing fractures associated with involutional and postmenopausal osteoporosis (Cochrane Review). The Cochrane Library, Issue I, 2004.
- Dauson-Hughes B., Dallal G. E., Krall E. A. et al. A controlled trial of the effect of calcium supplementation on bone density in postmenopausal women // N. Engl. J. Med. 1990; 323 (13): 878–883.
- Dauson-Hughes B., Harris S. S., Krall E. A. et al. Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older // N.
 Engl. J. Med. 1997; 337 (10): 670–676.
Engl. J. Med. 1997; 337 (10): 670–676. - McCabe L. D., Martin B. R., McCabe G. P. et al. Dairy intakes affect bone density in the elderly // Am. J. Clin. Nutr. 2004; 80 (4): 1066–1074.
- Ruml L. A., Sakhaee K., Peterson R. et al. The effect of calcium citrate on bone density in the early and mid–postmenopausal period: a randomized placebo-controlled study // Am J Ther. 1999. V. 6. P. 303–311.
- Boonen S., Lips P., Bouillon R. et al. Need for additional calcium to reduce the risk of hip fracture with Vitamin D supplementation: evidence from a comparative meta–analysis of randomized controlled trials // J Clin Endocrinol Metab. 2007; 92: 1415–1423.
- Lakhkar N. J., Lee I. H., Kim H. W., Salih V., Wall I. B., Knowles J. C. Bone formation controlled by biologically relevant inorganic ions: role and controlled delivery from phosphate-based glasses // Adv Drug Deliv Rev. 2013; 65 (4): 405–420 doi.
- Baksgaard L.
 , Andersen K. P., Hyldstrup L. Calcium and vitamin D supplementation increases spinal BMD in healthy, postmenopausal women // Osteoporosis Int. 1998, 8, 225–260.
, Andersen K. P., Hyldstrup L. Calcium and vitamin D supplementation increases spinal BMD in healthy, postmenopausal women // Osteoporosis Int. 1998, 8, 225–260. - Rude R. R. Magnesium deficiency; a possible risk factors for osteoporosis. In: Burckhard P., Dowson-Hughes B., Heaney R. P., eds. Nutritional aspects of osteoporosis. San Diego: Academic Press, 2001. 263–271.
- Swaminathan R. Nutritional factors in osteoporosis // Int J Clin Pract. 1999; 53 (7): 540.
- Sojka J. E., Weaver C. M. Magnesium supplementation and osteoporosis // Nutr. Rev. 1995; 53: 71–74.
- Ryder K. M., Shorr R. I., Bush A. J., Kritchevsky S. B., Harris T., Stone K., Cauley J., Tylavsky F. A. Magnesium intake from food and supplements is associated with bone mineral density in healthy older white subjects // J Am Geriatr Soc. 2005, 53: 1875–1880.
- Jorgensen L., Skjelbakken T., Lochen M. L., Ahmed L., Bjornerem A.
 , Joakimsen R., Jacobsen B. K. Anemia and the risk of non-vertebral fractures: the Tromso Study // Osteoporos Int. 2010; 21 (10): 1761–1768.
, Joakimsen R., Jacobsen B. K. Anemia and the risk of non-vertebral fractures: the Tromso Study // Osteoporos Int. 2010; 21 (10): 1761–1768. - Smoliar V. I., Biniashevskii E. V. Effect of copper deficiency on growth and bone tissue formation // Vopr Pitan. 1988; (6): 28–32.
- Opsahl W., Zeronian H., Ellison M., Lewis D., Rucker R. B., Riggins R. S. Role of copper in collagen cross-linking and its influence on selected mechanical properties of chick bone and tendon // J Nutr. 1982; 112 (4): 708–771.
- Lowe N. M., Fraser W. D., Jackson M. J. Is there a potential therapeutic value of cooper and zinc for osteoporosis? // Proceedings of the Nutrition Siciety. 2002; 61: 181–185.
- Strause L. G., Hegenauer J., Saltman P., Cone R., Resnick D. Effects of long-term dietary manganese and copper deficiency on rat skeleton // J Nutr. 1986; 116 (1): 135–141.
- Sheng M. H., Taper L. J., Veit H.
 , Qian H., Ritchey S. J., Lau K. H. Dietary boron supplementation enhanced the action of estrogen, but not that of parathyroid hormone, to improve trabecular bone quality in ovariectomized rats // Biol Trace Elem Res. 2001; 82 (1–3): 109–123.
, Qian H., Ritchey S. J., Lau K. H. Dietary boron supplementation enhanced the action of estrogen, but not that of parathyroid hormone, to improve trabecular bone quality in ovariectomized rats // Biol Trace Elem Res. 2001; 82 (1–3): 109–123. - Liao S. F., Monegue J. S., Lindemann M. D., Cromwell G. L., Matthews J. C. Dietary supplementation of boron differentially alters expression of borate transporter (NaBCl) mRNA by jejunum and kidney of growing pigs // Biol Trace Elem Res. 2011; 143 (2): 901–912.
- Tasli P. N., Dogan A., Demirci S., Sahin F. Boron enhances odontogenic and osteogenic differentiation of human tooth germ stem cells (hTGSCs) in vitro // Biol Trace Elem Res. 2013; 153 (1–3): 419–427 doi.
- Ying X., Cheng S., Wang W., Lin Z., Chen Q., Zhang W., Kou D., Shen Y., Cheng X., Rompis F. A., Peng L., Zhu Lu C. Effect of boron on osteogenic differentiation of human bone marrow stromal cells // Biol Trace Elem Res.
 2011; 144 (1–3): 306–315.
2011; 144 (1–3): 306–315. - Hakki S. S., Bozkurt B. S., Hakki E. E. Boron regulates mineralized tissue-associated proteins in osteoblasts (MC3 T3-E1) // J Trace Elem Med Biol. 2010; 24 (4): 243–250 doi.
- Yamaguchi M., Fukagawa M. Role of zinc in regulation of protein tyrosine phosphatase activity in osteoblastic MC3 T3-E1. 2005.
- Lai Y. L., Yamaguchi M. Effects of copper on bone component in the femoral tissues of rats: anabolic effect of zinc is weakened by copper // Biol Pharm Bull. 2005; 28: 2296–2301.
- Yamaguchi M., Osishi H., Suketa Y. Stimulatory effect of zinc on bone formation in tissue culture // Biochem Pharmacol. 1987; 36: 4007–4012.
- Yamaguchi M., Oishi H., Suketa Y. Zinc stimulation of bone protein synthesis in tissue culture. Activation of aminoacyl-tRNA synthetase // Biochem Pharmacol. 1988; 37: 4075–4080.
- Захарова И. Н., Творогова Т.
 М., Воробьева А. С., Кузнецова О. А. Микроэлементоз как фактор формирования остеопении у подростков // Педиатрия. 2012. Т. 91. № 1. С. 68–75.
М., Воробьева А. С., Кузнецова О. А. Микроэлементоз как фактор формирования остеопении у подростков // Педиатрия. 2012. Т. 91. № 1. С. 68–75. - Saltman P. D., Strause L. G. The role of trace minerals in osteoporosis // J. Am. Coll. Nutr. 1993. Vol. 12. № 4. P. 384–389.
- Никитинская О. А., Торопцова Н. В., Беневоленская О. А. Фармакологическая профилактика первичного остеопороза // РМЖ. 2008. Т. 16. № 6. С. 3–8.
- Лила А. М., Мазуров В. И. Роль Кальцемина адванс в профилактике постменопаузального остеопороза (результаты 12-месячного клинического исследования) // РМЖ. 2007. Т. 15. № 26. С. 1991–1996.
М. И. Шупина, кандидат медицинских наук
Г. И. Нечаева1, доктор медицинских наук, профессор
Д. В. Шупин
Е. В. Надей
А. А. Семенкин, доктор медицинских наук, профессор
ГБОУ ВПО ОмГМУ МЗ РФ, Омск
1 Контактная информация: profnechaeva@yandex.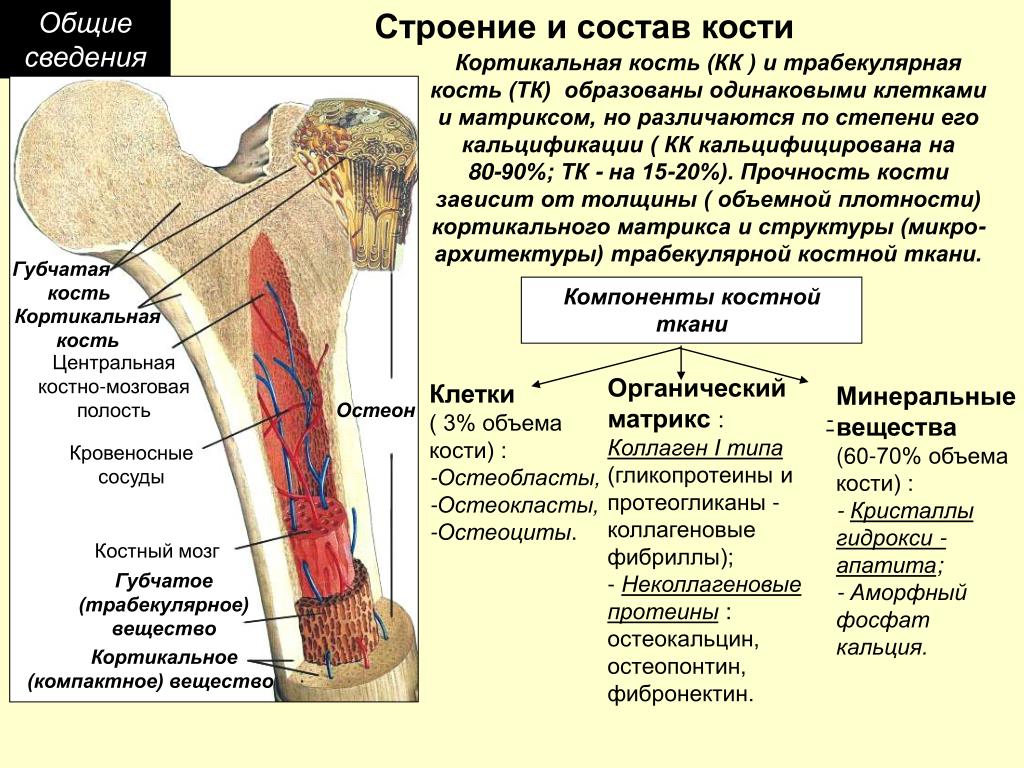 ru
ru
Дифференциация и активация остеокластов
Авторы:
W.J. Boyle, W. S. Simonet, D. L. Lacey, США
Статья в формате PDF
Остеокласты – это специализированные клетки, образующиеся из гематопоэтической линии моноцитов/макрофагов, которые развиваются и прикрепляются к матрице кости, выделяя далее кислоты и литические ферменты, разрушающие кость. Открытие в системе остеокластов сигнального пути RANK обеспечило понимание механизмов остеокластогенеза и активации резорбции кости, а также путей гормонального влияния на структуру и массу костной ткани. Дальнейшее изучение этого сигнального пути способно создать молекулярную основу с целью разработки медикаментов для лечения остеопороза и других заболеваний, сопровождающихся потерей костной массы.
Кость является ригидным, однако динамичным органом, который постоянно формируется, обновляется и восстанавливается. Микроструктура кости построена таким образом, чтобы обеспечить максимальную прочность на фоне минимальной массы соответственно физиологическим потребностям организма. Как же поддерживаются структура кости и ее функции? Как индуцируются изменения в метаболизме костной ткани? После формирования кость подлежит процессу под названием ремоделирование, который включает разрушение (резорбцию) и образование (синтез) костной ткани. Эти процессы в микромасштабе происходят во всем скелете. Ремоделирование кости – основной метаболический процесс, регулирующий ее структуру и функции на протяжении взрослой жизни. Ключевыми участниками ремоделирования являются остеокласты [1, 2]. Дисбаланс в ремоделировании способен привести к значительным нарушениям структуры и функции скелета, а потенциально – к увеличению смертности и сокращению длительности жизни.
Микроструктура кости построена таким образом, чтобы обеспечить максимальную прочность на фоне минимальной массы соответственно физиологическим потребностям организма. Как же поддерживаются структура кости и ее функции? Как индуцируются изменения в метаболизме костной ткани? После формирования кость подлежит процессу под названием ремоделирование, который включает разрушение (резорбцию) и образование (синтез) костной ткани. Эти процессы в микромасштабе происходят во всем скелете. Ремоделирование кости – основной метаболический процесс, регулирующий ее структуру и функции на протяжении взрослой жизни. Ключевыми участниками ремоделирования являются остеокласты [1, 2]. Дисбаланс в ремоделировании способен привести к значительным нарушениям структуры и функции скелета, а потенциально – к увеличению смертности и сокращению длительности жизни.
Большинство заболеваний скелета у взрослых являются следствием чрезмерной активности остеокластов, ведущей к дисбалансу ремоделирования с преобладанием резорбции [3]. Подобные болезни включают остеопороз, заболевания периодонта, ревматоидный артрит, множественную миелому, метастазы раковых опухолей. Для лиц с остеопорозом переломы костей непосредственно угрожают жизни. На данный момент в группе риска подобных переломов находятся более 70 млн людей во всем мире. Недавние открытия, касающиеся понимания дифференциации и активации остеокластов, основываются на анализе семейства биологически связанных протеинов, подобных фактору некроза опухолей (ФНО) и его рецепторам (ФНОР): остеопротегерина (OPG), рецептораактиватора ядерного фактора кB (RANK) и его лиганда (RANKL), которые регулируют функцию остеокластов [4]. Исследование этих сигнальных путей обеспечивает глубокое понимание того, как различные физиологические и патофизиологические сигналы осуществляют свое действие, индуцируя остеокластогенез, рассасывание кости и ремоделирование скелета, таким образом контролируя массу костной ткани.
Остеокластогенез
Остеокласт является тканеспецифической макрофагальной многоядерной клеткой (поликарионом), образующейся в процессе дифференциации клетокпредшественников моноцитов/макрофагов на поверхности кости или поблизости от нее (рис. 1). Существенный прогресс в понимании остеокластогенеза произошел тогда, когда в клеточных системах на основе клеток костного мозга или селезенки и стромальных клеток были получены остеокласты [5]. Тогда был сделан вывод, что для остеокластогенеза требуется тесный контакт между стромальными клетками и клетками костного мозга. Для остеокластогенеза необходимы два гемопоэтических фактора: ФНОродственный цитокин RANKL и полипептидный фактор роста CSF‑1 (колониестимулирующий фактор‑1) [6, 7], а далее происходит активация RANK на поверхности клетокпредшественников [8, 9]. Для экспрессии генов, типизирующих линию остеокластов, необходимо присутствие и CSF‑1, и RANKL.
Рис. 1. Остеокластогенез
Схема развития и дифференциации гемопоэтической клетки-предшественника в зрелые остеокласты – поликарионы (многоядерные клетки), образовавшиеся в результате слияния 10-20 отдельных клеток. Созревание происходит в костной ткани из одноядерных клеток с некоторыми чертами макрофагов, роисходящих из периферической крови. Для остеокластогенеза необходимы колониестимулирующий фактор-1 (CSF-1) и RANKL, действие которых также показано на рисунке. OPG способен связывать и нейтрализовать RANKL, что негативно влияет и на остеокластогенез, и на активацию зрелых остеокластов. В нижней части рисунка показаны одногенные мутации, блокирующие остеокластогенез и активацию остеокластов. Курсивом выделены естественные мутации грызунов и человека, обычным шрифтом представлены результаты прицельного мутагенеза. В верхней части показаны одногенные мутантные аллели, усиливающие остеокластогенез, активирующие функции остеокластов и увеличивающие их выживаемость, что приводит к остеопорозу. Все эти мутации являются нулевыми, кроме OPG [22] и sRANKL [77], представленных в моделях чрезмерной экспрессии у трансгенных мышей (выделены голубыми рамками).
Зрелый многоядерный остеокласт активируется специфическими сигналами, ведущими к инициации ремоделирования кости (рис. 2). Вследствие этого тело остеокласта поляризируется, и в ответ на активацию RANK его лигандом [10] подлежит внутренним структурным изменениям. Эти изменения – перестройка актинового цитоскелета и образование тесной связи между поверхностью кости и базальной мембраной остеокласта – подготавливают условия для резорбции костной ткани, создавая своеобразный герметично закрытый отсек. Далее эта внешняя вакуоль закисляется путем экспорта ионов водорода [11], в нее поступают литические ферменты (тартратрезистентная кислая фосфатаза, прокатепсин К) и формируется т. н. резорбционная впадина (лакуна Хоушипа). Так остеокласт приводит к рассасыванию прилежащей костной ткани. Продукты деградации (фрагменты коллагена, растворенные кальций и фосфаты) попадают в циркуляторное русло. RANKL активирует зрелые остеокласты in vitro и ведет к быстрому рассасыванию кости in vivo [10, 12]. Жизнедеятельность остеокластов и их участие в последующих циклах резорбции костной ткани частично регулируется гормонами и цитокинами [13]. RANKL и интерлейкин (ИЛ) 1 увеличивают продолжительность жизни зрелого остеокласта in vitro и in vivo [14, 15].
Рис. 2. Активация резорбции костной ткани
Поликарионы под воздействием CSF-1 и RANKL прикрепляются к кости и дифференциируются в зрелый остеокласт (a). RANKL стимулирует активацию остеокластов, индуцируя секрецию протонов и литических ферментов в закрытую резорбционную вакуоль между базальной поверхностью остеокласта и поверхностью кости. Секреция протонов приводит к повышению кислотности в этом закрытом пространстве, что, в свою очередь, вызывает активацию ферментов TRAP и CATK, ответственных за деградацию минеральной и коллагеновой составляющих кости (b). Фотография трансмиссионной электронной микроскопии активированного остеокласта мыши с видимой неровной границей лакуны резорбции на поверхности бедренной кости (красный «пропеллер» – остеокласт, черная стрелка – резорбционное углубление) (c). Фотография сканирующей электронной микроскопии человеческих остеокластов, полученных in vitro на срезах кортикальной кости из мононуклеаров периферической крови, подвергавшихся действию CSF-1 и RANKL (красный «пропеллер» – остеокласт; черная стрелка – впадина резорбции, в которой обычно ровная поверхность кости рассосалась, обнажив коллагеновые пучки; желтые звездочки – нерезорбированная поверхность кости; голубые треугольники – мононуклеары (потенциальные предшественники остеокластов) (d).
Остеокластогенез и активацию остеокластов регулируют как минимум 24 гена или генных локуса [16, 17]. Нарушение функции этих генов блокирует развитие и/или функции остеокластов, приводя к аномально высоким уровням минерализации кости и хряща (т. н. остеопетроз), или, наоборот, к усиленному остеокластогенезу и активации этих клеток, ассоциируемых с остеопенией [17, 18, 19, 20]. Такие гены осуществляют свое действие на разных стадиях жизни остеокласта, влияя на образование и выживание клетокпредшественников, их способность к дифференциации, прикрепление к кости и выделение литических ферментов (рис. 1).
Регуляторная ось RANKL/RANK/OPG
Важным моментом в изучении регуляции остеокластогенеза стало обнаружение OPG – растворимого белка, блокирующего образование остеокластов in vitro и резорбцию кости in vivo [22, 23, 24]. Поскольку OPG – это ФНОродственный протеин, неудивительно, что другой ФНОродственный поверхностный белок RANKL является ключевым цитокином, регулирующим остеокластогенез и резорбцию костной ткани [6, 7, 25, 26]. RANKL связывает и активирует белок RANK – трансмембранный сигнальный рецептор [26]. Экспрессия RANK на гемопоэтических клеткахпредшественниках является необходимым условием дифференциации и активации остеокластов, а также рассасывания кости и гормональной регуляции гомеостаза кальция [27, 28].
Полипептид RANKL – трансмембранный протеин типа II, размещенный на поверхности клеток в виде растворимой формы [7, 25, 26]. Гормоны и другие стимуляторы резорбции костной ткани in vivo индуцируют экспрессию RANKL на остеогенных стромальных клетках [30, 31]. Экспрессия RANKL остеобластами координирует ремоделирование кости путем стимуляции ее рассасывания остеокластами, что, в свою очередь, активирует остеосинтез прилежащими остеобластами. Это сочетание противоположных процессов носит название «сопряжение» (coupling) [32]. В таком случае OPG действует в качестве рецептораловушки, блокируя связывание RANKL с RANK. OPG также вырабатывается остеобластами в ответ на действие анаболических агентов (эстрогены, некоторые костные морфогенетические белки) [32, 33]. Чрезмерная экспрессия OPG блокирует продукцию остеокластов, что вызывает остеопетроз у мышей, в то время как его делеция сопровождается усиленным ремоделированием и остеопорозом [21, 22]. Таким образом, координация экспрессии RANKL и OPG необходима как для позитивной, так и для негативной регуляции костной плотности путем контроля активности RANK в остеокластах.
Активация RANK его лигандом ведет к экспрессии остеокластспецифических генов во время дифференциации, активации резорбции кости и дальнейшего жизненного цикла остеокластов. Сигнальная система RANK опосредована разнообразными цитоплазматическими факторами. Во время остеокластогенеза и активации остеокластов «включаются» как минимум пять отдельных сигнальных каскадов, опосредованных протеинкиназами – ингибитором киназы ядерного фактора кВ, cJunNтерминальной киназой, стрессактивируемой протеинкиназой p38, внеклеточной сигналрегулируемой киназой и протеинами Src (рис. 3).
Рис. 3. Сигнальный путь RANK в остеокластах
Белки с установленными эффектами, задействованные в передаче сигналов RANK во время развития и активации остеокластов, составляют сигнальный каскад от цитоплазматической мембраны до ядерных эффекторов. RANK и OPG являются ФНОР-опосредованными белками, а RANKL – ФНО-опосредованным цитокином, специфически взаимодействующим с RANK или OPG. Представленные на рисунке белки связаны стрелками или линиями, демонстрирующими их взаимодействие и функциональные ассоциации согласно данным литературы. Красные прямоугольники показывают точки приложения известных ингибиторов малых молекул.
Ключевым предварительным шагом RANKсигнализации является связывание ФНОРассоциированных цитоплазматических факторов (ФАЦФ) со специфическими доменами RANK [9, 34, 35]. Показано, что ФАЦФ‑2, 5 и 6 связываются с RANK, а мутации ФАЦФ‑6 ведут к остеопетрозу вследствие деактивации остеокластов [36, 37].
Модуляция RANKиндуцированного остеокластогенеза
Существует несколько уровней контроля сигнального пути RANK, способных усилить или затормозить остеокластогенез и активацию этих клеток. Активация находящихся на поверхности остеокластов рецепторов к ИЛ‑1, колониестимулирующему фактору‑1, простагландину Е2, ФНО потенцирует остеокластогенез in vitro и стимулирует резорбцию кости in vivo.
Сигнальный путь RANK негативно контролируется OPG in vitro и in vivo [22, 23]. Есть также доказательства существования механизмов обратной связи, которые прекращают функционирование сигнального пути RANK после его активации. Индукция остеокластогенеза RANKL ведет к усилению секреции интерферона (ИФ) β, который снижает экспрессию белка c-Fos – важного фактора развития остеокластов [63, 64]. ИФ-γ также обладает негативным действием на этот сигнальный путь. Связывание ИФ-γ с его рецепторами ведет к разрушению ФАЦФ‑6 и угнетению остеокластогенеза in vitro [65]. Эти данные являются противоречивыми, поскольку ИФ-γ применяется в лечении остеопетроза, увеличивая резорбцию кости. ИЛ‑4 также продемонстрировал негативное влияние на остеокластогенез [60]. Наконец, давно известно, что связывание кальцитонина с его рецепторами угнетает активацию остеокластов, что обусловливает его терапевтическое использование.
Гормональный контроль резорбции кости
Некоторые гормоны, цитокины и гуморальные факторы также влияют на плотность костной ткани и гомеостаз кальция путем индукции экспрессии RANKL в клетках кости (рис. 4). Большинство гормонов, регулирующих обмен кальция, и пререзорбтивных цитокинов усиливают экспрессию матричной РНК RANKL в клеточных линиях и культурах остеобластов [32, 33]. OPG, блокирующий RANKLиндуцированный остеокластогенез, способен угнетать образование остеокластов и рассасывание кости, возникающие в ответ на действие кальцитропных факторов. Данное явление свидетельствует о том, что сигнальный путь RANK интегрирует различные гуморальные сигналы, регулирующие гомеостаз кальция и резорбцию кости. Вышесказанное подтверждает тот факт, что мыши с отсутствием RANK резистентны к индукции рассасывания костной ткани вследствие действия ФНО, ИЛ‑1β и паратгормонродственного пептида [27].
Важным источником RANKL в кости выступают также Tклетки [29]. Их активация in vitro и in vivo сопровождается усилением остеокластогенеза и резорбции кости. Это позволяет предположить, что воспалительные состояния и некоторые лейкемии стимулируют патологическую потерю костной массы [66].
Гуморальные факторы, снижающие резорбцию кости и увеличивающие ее плотность, например эстрогены, обладают противоположным действием на систему остеобласт/остеокласт: экспрессия OPG усиливается, а экспрессия RANKL снижается, что ведет к сниженной активации RANK и меньшему количеству активных остеокластов в кости соответственно. Были также отмечены экспрессия OPG и аномальное возрастание плотности кости под действием тромбопоэтина [67] (рис. 4).
Рис. 4. Гормональная регуляция резорбции кости
Схематическое представление механизма действия прорезорбтивных и кальцитропных факторов (a), анаболических и антиостеокластических факторов (b). RANKL экспрессируется в остеобластах, активированных Т-клетках, синовиальных фибробластах, стромальных клетках костного мозга и далее связывается со специфическим мембранным рецептором RANK, запуская каскад ФАЦФ-опосредованных киназных реакций, стимулирующих дифференциацию, активацию и выживание остеокластов. Напротив, экспрессия OPG вызывается факторами, блокирующими катаболизм кости и обеспечивающими анаболические реакции. OPG связывает и нейтрализует RANKL, что ведет к блокаде остеокластогенеза и снижению выживаемости уже существующих остеокластов.
От исследований к клинике
Существующие методы лечения остеопороза в основном замедляют снижение минеральной плотности кости, уменьшая риск переломов. Рекомендуемые препараты должны быть направлены на остеокластопосредованную резорбцию кости и включают эстрогены, бифосфонаты и селективные модуляторы эстрогеновых рецепторов. Другими потенциальными мишенями противоостеопоротических препаратов являются остеокластспецифическая протеаза CATK, интегрин αvβ3, и c-Src-тирозинкиназа [7, 9].
Ключевая роль сигнального пути RANKL/RANK/OPG в регуляции костного метаболизма подтверждается открытием, что генетические мутации, сопровождающиеся активацией RANK или угнетением RANKL-связывающих свойств OPG, ассоциируются с семейной гиперфосфатазией и аномалиями костей [6872]. Некоторые мутации гена, кодирующего OPG, ассоциируются с идиопатической гиперфосфатазией (т. н. ювенильная болезнь Педжета) – аутосомным рецессивным заболеванием, характеризующимся деформациями длинных костей и кифозом [6971].
Данные, что мутации генов, кодирующих RANK и OPG, ведут к тяжелым заболеваниям костей у человека, свидетельствуют о том, что угнетение сигнальной системы RANKL может выступать действенной терапевтической стратегией при болезнях, сопровождающихся чрезмерной резорбцией кости. Считается, что блокада RANKL способна предупредить потерю костной массы вследствие менопаузы, рака, воспаления и др. Полностью человеческие моноклональные антитела, направленные против RANKL, являются возможным решением проблемы остеопороза (Bekker P. J. et al., неопубликованная информация). Привлекательным аспектом применения антител является избежание перекрестных реакций нейтрализации OPG и RANKактивирующих эндогенных антител. Клинические преимущества блокады RANKL требуют дальнейших исследований.
Список литературы находится в редакции.
Boyle W. J., Simonet W. S., Lacey W. S. Osteoclast differentiation and activation. Nature. Vol. 423. 15 May 2003. P. 337342.
Перевела с англ. Лариса Стрильчук
Медична газета «Здоров’я України 21 сторіччя» № 22 (419), листопад 2017 р.
СТАТТІ ЗА ТЕМОЮ Терапія та сімейна медицина
13.03.2021
Терапія та сімейна медицина
Ренгалін: застосування інноваційних технологій у лікуванні кашлю
Кашель – частий і неприємний симптом низки захворювань (насамперед застуди), що являє собою, з одного боку, складний захисний рефлекс, який формується з декількох ланок, з іншого – пристосувальну реакцію організму, спрямовану на самоочищення дихальних шляхів, яка змінюється протягом часу. Отже, терапія кашлю потребує патогенетичного підходу та гнучкої лікувальної тактики залежно від його характеру, терміну виникнення, інтенсивності й динаміки. Саме тому часто в прагненні обрати оптимальну протикашльову терапію лікарі змушені комбінувати різні препарати та корегувати схеми лікування з урахуванням стадії розвитку захворювання й поточного характеру кашлю. …
13.03.2021
Терапія та сімейна медицина
Рецепти весняної бадьорості від «Здоров’я»
Весна – мабуть, найочікуваніша пора року, адже краса природи, котра прокидається після тривалого зимового сну, милує око й тішить серце. Утім, самих лише приємних емоцій замало, щоб підтримати виснажений гіповітамінозом організм у період хисткого міжсезоння.
Додати бадьорості та життєвих сил допоможуть вітаміни й вітамінні комплекси Групи компаній «Здоров’я»….
09.03.2021
Терапія та сімейна медицина
Німесулід при гострих респіраторних захворюваннях: безпека й ефективність
Гострі респіраторні захворювання (ГРЗ) є одними з найпоширеніших патологічних станів у світі. Втім, незважаючи на значну розповсюдженість, постає багато запитань під час їх лікування, крім того, з’являється чимало помилок, які насамперед пов’язані з невиправданим призначенням антибактеріальних препаратів. Оскільки переважна більшість ГРЗ мають вірусну природу (ГРВІ), вони не потребують проведення антибактеріальної терапії. Це положення виправдане в разі як патології верхніх відділів респіраторного тракту, так і гострих бронхітів. За допомогою численних досліджень доведено, що призначення системних антибіотиків при ГРВІ не спричиняє зменшення тривалості захворювання й частоти ускладнень….
24.02.2021
Терапія та сімейна медицина
Холіну альфосцерат: сучасне підтвердження ефективності традиційної терапії
Терапія холінергічними попередниками є традиційним підходом до лікування холінергічної дисфункції та когнітивного дефіциту при розвитку деменції. Це стосується, зокрема, й холіну альфосцерату. До вашої уваги представлено огляд статті F. De Negri, опублікованої у виданні Rivista Società Italiana di Medicina Generale (2020; 5 (27): 64‑69), в якій проаналізовано отримані нещодавно дані на підтримку клінічної ефективності та сприятливої переносимості ГФХ….
КОСТНАЯ ТКАНЬ. «БИОЛОГИЧЕСКАЯ ХИМИЯ», Березов Т.Т., Коровкин Б.Ф.
Костная ткань
– особый вид соединительной ткани. Необходимо различать понятия «кость как
орган» и «костная ткань».
Кость как
орган – это сложное структурное образование, в которое наряду со специфической
костной тканью входят надкостница, костный мозг, кровеносные и лимфатические
сосуды, нервы и в ряде случаев хрящевая ткань.
Костная ткань
является главной составной частью кости. Она образует костные пластинки. В
зависимости от плотности и расположения пластинок различают компактное и
губчатое костное вещество. В телах длинных (трубчатых) костей в основном
содержится компактное костное вещество. В эпифизах длинных костей, а также в
коротких и широких костях преобладает губчатое костное вещество.
Клеточными
элементами костной ткани являются остеобласты, остео-циты и остеокласты.
Остеобласт –
клетка костной ткани, участвующая в образовании межклеточного вещества.
Отличительной чертой остеобластов является наличие сильно развитого
эндоплазматического ретикулума и мощного аппарата белкового синтеза. В
остеобластах синтезируется проколлаген, который затем перемещается из
эндоплазматического ретикулума в комплекс Гольджи, включается в секретируемые
гранулы (везикулы). В результате действия группы специальных пептидаз от
проколлагена отщепляются сначала N-концевой, а затем С-концевой домены и
формируется тропо-коллаген. Последний в межклеточном пространстве образует
фибриллы. В дальнейшем после образования поперечных сшивок формируется зрелый
коллаген (см. гл. 21).
В
остеобластах синтезируются также гликозаминогликаны, белковые компоненты
протеогликанов, ферменты и другие соединения, многие из которых затем быстро
переходят в межклеточное вещество.
Остеоцит (костная
клетка) – зрелая отростчатая клетка костной ткани, вырабатывающая компоненты
межклеточного вещества и обычно замурованная в нем.
Как известно,
остеоциты образуются из остеобластов при формировании костной ткани.
Остеокласт –
гигантская многоядерная клетка костной ткани, способная резорбировать
обызвествленный хрящ и межклеточное вещество костной ткани в процессе развития
и перестройки кости. Это основная функция остеокласта. Следует отметить, что
остеокласты, так же как и остеобласты, синтезируют РНК, белки. Однако в
остеокластах этот процесс протекает
менее
интенсивно, так как у них слабо развит эндоплазматический ре-тикулум и имеется
небольшое число рибосом, но содержится много лизосом и митохондрий.
Предыдущая страница |
Следующая страница
СОДЕРЖАНИЕ
Drug Treatment and In Vivo Imaging of Osteoblast-Osteoclast Interactions in a Medaka Fish Osteoporosis Model
Позвоночный каркас обеспечивает структурную поддержку и защиту органов, обеспечивающие мобильность, и служит в качестве источника кальция. На протяжении всей жизни, внеклеточный матрикс кости непрерывно перевернулась, чтобы поддерживать стабильность костной ткани и жесткость. Этот процесс требует сильно скоординированную деятельность и взаимодействие формирования костной остеобластов и костной резорбции остеокластов. Остеобласты получены из мезенхимальных стволовых клеток — предшественников и производят коллаген , чтобы сформировать остеоид белковый часть костной матрицы 10. Остеобласты взаимодействуют с остеокластов для обеспечения сбалансированного активность обоих типов клеток, который необходим для контроля гомеостаза кости 7. Из — за этих запутанных регуляторных взаимодействий, реакция на медикаментозное лечение и поддержании гомеостаза кости не может быть полностью изучены с помощью в пробирке исследования. Следовательно, существует большой спрос на животных моделях. По сравнению с установками для культивирования клеток, в естественных условиях модели могут обеспечитьценную информацию в многоклеточных сети в пределах окружающей среды кости.
Существует множество мышиные модели для различных заболеваний костей человека , включая остеопороз 16. Тем не менее, размер и доступность эмбрионов мыши представляют собой существенные ограничения для живого изображения скелетных процессов. Малый костистых рыб, с другой стороны, служит в качестве привлекательной альтернативы для визуализации в естественных условиях. Рерио (Danio rerio) и оризии (Oryzias latipes) стали популярными моделями на животных для исследования скелета в течение последних двух десятилетий 17, 19, 22, 24. Кости в костистых рыб и у млекопитающих очень похожи, как по структурным и на физиологическом уровне, и многие из ключевых регуляторных генов и сигнальных путей сохраняется 3. Как и у млекопитающих, костистых рыб тщательно регулируют активность остеобластов и остеокластов , чтобы сбалансировать образование костной ткани и резорбции 26. Самое главное, что оптическая прозрачность фиш Личинки позволяет использовать флуоресцентные репортеры маркировать костные клетки и кальцинированный скелетную матрицу 8, 9, 12, 21, 23, что облегчает наблюдение клеточных процессов в живом организме животного. Кроме того, ряд генетических инструментов сгенерирована для облегчения биомедицины соответствующих исследований в рыбе. Для оризии , в частности, методов направленной мутации генов с помощью CrispR / cas9 2, клеточной линии прослеживания 6 и сайт-специфической трансгенез 14 были недавно созданы и в настоящее время широко используется 15.
Малые личинки костистых были успешно использованы для химических экранов, которые привели к открытию нескольких фармакологически соответствующих препаратов 1, 18.
Личинки рыб терпимы к низкой концентрации ДМСО и способны поглощать соединений из их водной среды, либо через кожу или через желудочно — кишечный тракт 1, 5. Наша лаборатория ранее представительorted трансгенные линии оризии, которые выражают флуоресцентных репортерам в костных клеток под контролем различных osteoblast- и остеокластов конкретных промоутеров. К ним относятся преждевременные остеобласты (коллаген 10À1, col10a1; Osterix, OSX) 20, 21, зрелые остеобласты (остеокальцина, OSC) 27 и остеокластов (катепсина K, ctsk) 24. Мы также генерироваться трансгенной линии, выражающую остеокластов индуцирующие рецептор фактора активатором ядерного фактора кВ лиганд (RANKL) под контролем теплового шока-индуцируемого промотора 24.
Индукция RANKL в этой системе приводит к внематочной образованию активных остеокластов. Это приводит к увеличению костной резорбции и тяжелой остеопорозом, как фенотипа, с резко сниженной минерализацией в телах позвонков. Недавно мы показали, что активность остеокластов в этой модели может быть блокирован этидронатом и алендроната бисфосфонаты, ТВтO препараты , обычно используемые в терапии остеопороза человека, что подтверждает Оризии в качестве подходящей модельной системы для лечения остеопороза 27.
Из — за их большого размера выводка, быстрое развитие, и небольшого размера эмбрионов, трансгенная личинки оризия уникально подходят для крупномасштабного скрининга остеопороза препаратов и для анализа в естественных условиях поведения костных клеток. Исследования, проведенные в оризии, таким образом, могут эффективно дополнять эксперименты на клеточных культурах и у мышей, которые направлены на выявление новых терапевтических целей и новых методов лечения для костных заболеваний человека.
В настоящем исследовании мы опишем протокол для лечения Оризии личинок костного репортера с общим остеопорозом препарата, алендроната. Мы также подробно описывают, как личинки очищенная смонтированы и подготовлены для живого изображения костной матрицы и костных клеток. Эти протоколы могут быть легко адаптированы к другим небольших химических соединений, которые либо работают в качестве костного анаболического или антирезорбтивными препаратами. </ Р>
Subscription Required. Please recommend JoVE to your librarian.
чем можно ей помочь – Наука – Коммерсантъ
Кости составляют основу опорно-двигательного аппарата. Под прочной защитой костей находятся ценные структуры организма — костный мозг, в котором в течение всей жизни идет образование всех клеток крови и иммунитета, а также головной и спинной мозг, осуществляющие регуляцию всех функций организма.
Долгая эволюция создала совершенный механизм образования костной ткани в нашем организме — механизм остеогенеза. Он обеспечивает как ее постоянное обновление (физиологическую регенерацию или так называемое ремоделирование), так и восстановление после травм (репаративную регенерацию).
Кость формально можно назвать композиционным материалом, в состав которого входят органические вещества (основной белок-коллаген) и неорганические вещества (основные соли — кальция и фосфора). Два главных вида клеток — разрушающие кость (остеокласты) и формирующие кость (остеобласты) — трудятся в течение всей нашей жизни, обеспечивая обновление костной ткани и ее восстановление после травм.
Биоминерализацию белков могли осуществлять организмы уже более 600 млн лет назад. Раковины моллюсков, иглы морского ежа, наружный скелет членистоногих — результат этого процесса. Процесс биоминерализации коллагена при образовании костной ткани (то есть инкрустация его солями кальция, фосфора и некоторыми микроэлементами) эволюционно древний, с одной стороны, а с другой — находящийся под контролем нервной и гуморальной (через кровь с помощью биологически активных веществ и гормонов) систем. Кроме того, в костной ткани и костном мозге находится глубокий резерв организма — центральное депо стволовых клеток, замещающих в течение жизни состарившиеся или погибшие клетки во многих органах и тканях.
Изучение механизмов и процессов остеогенеза постепенно привело к пониманию того, какие материалы и конструкты на их основе нужно разрабатывать, чтобы осуществлять органотипическое (то есть с формированием типичного для этого органа структур) замещение костных дефектов. Этот подход называется биомиметическим.
Когда же может понадобиться помощь регенерационным процессам в костной ткани, если они такие совершенные, эволюционно древние? Есть такие ситуации. Во-первых, это так называемые костные дефекты, превосходящие по размерам критические, костные дефекты у пожилых людей с нарушениями кальциевого обмена и, наконец, костные дефекты у онкологических больных после химио- или лучевой терапии, когда регенерация затруднена.
То есть такие материалы востребованы при реконструктивно-пластических операциях в травматологии, челюстно-лицевой хирургии, стоматологии и, конечно, в онкологии.
Сегодня опухоли костей и метастазы в костную ткань не приговор. Их удаляют, замещая дефекты остеопластическими материалами. Полнота реабилитации у этой категории больных напрямую зависит от успехов в медицинском материаловедении.
История создания остеопластических биоматериалов насчитывает более 60 лет. Первое поколение таких материалов составляли биоинертные материалы, второе — биоактивные, биодеградируемые, третье — материалы для стимулирования специфических клеточных ответов на молекулярном уровне.
Золотым стандартом, тем не менее, остается использование аутологичной (собственной) костной ткани. Однако необходимость дополнительного оперативного вмешательства и недостаточное количество материала для закрытия крупных дефектов привели к идее использовать аллогенную (другого организма) костную ткань. Но при этом появилась опасность переноса от донора неидентифицированных инфекционных, а также аллергизирующих агентов. Материаловеды предложили использовать для этих целей синтетические кальций-фосфатные материалы, близкие по составу к неорганической составляющей костной ткани. Они широко применяются и сегодня, так как биосовместимы, обладают остеоиндуктивными (стимулирующими остеогенез) свойствами и используются клетками для построения новой кости. Однако оказалось, что они растворяются медленнее, чем образуется кость.
Неожиданный толчок в развитии биоматериалов дало изучение скелета кораллов. Он состоит из карбоната кальция, имеет особо прочную кристаллическую решетку-арагонит, сквозную пористость (что обеспечивает поток питательных веществ, газов, прорастание сосудов) и скорость биорезорбции сходную со скоростью остеогенеза. Он оказался блестящим материалом природного происхождения для замещения костных дефектов. Однако добыча кораллов ограниченна, и трудно стандартизировать их микроэлементный состав. Это привело к идее трехмерной печати для создания конструктов с целью замещения костных дефектов заданной формы, пористости и архитектоники поверхности, используя в качестве «чернил» кальций-фосфатные материалы.
Следующим этапом развития этого направления стала 3D-печать композиционных конструктов, содержащих как натуральную кость, так и органическую составляющую. В качестве таковой используют полимеры как природного (коллаген, альгинат, хитозан), так и синтетического происхождения. Еще более стимулировать остеогенез удалось при насыщении таких конструктов собственными стволовыми клетками из костного мозга, что открыло возможности изготовления персонализированных имплантатов заданной геометрии, пористости и архитектоники.
И, наконец, современные исследования в этой области посвящены разработке технологий функционализации таких 3D-конструктов биологически активными веществами (например, для пожилых людей или при крупных дефектах), антибиотиками (при открытых костных травмах, опасности инфицирования и развития воспалительных процессов) или противоопухолевыми препаратами. В последнем случае предполагается с помощью конструктов осуществлять адресную доставку химиопрепаратов с пролонгированным действием, что позволит снизить нагрузку системной (внутривенной) химиотерапии у онкологических больных.
Наталья Сергеева, доктор биологических наук, профессор, завлабораторией МНИОИ им. П. А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России
РЕГУЛЯЦИЯ ВИТАМИНОМ D МЕТАБОЛИЗМА КОСТНОЙ ТКАНИ | Майлян
1. Zerwekh J.E. Blood biomarkers of vitamin D status. // Am. J. Clin. Nutr. – 2008. – V.87(4). – P.1087–1091.
2. Holick M.F., Chen T.C. Vitamin D deficiency: a worldwide problem with health consequences. // Am. J. Clin. Nutr. – 2008. – V.87(4). – P.1080–1086.
3. Holick M.F. Vitamin D: evolutionary, physiological and health perspectives. // Curr. Drug Targets. – 2011. – V.12(1). – P.4–18.
4. Wacker M., Holick M.F. Vitamin D — effects on skeletal and extraskeletal health and the need for supplementation. // Nutrients. – 2013. V.5(1). – P.111–148. doi: 10.3390/nu5010111
5. Поворознюк В.В., Резниченко Н.А., Майлян Э.А. Внескелетные эффекты витамина D // Боль. Суставы. Позвоночник.– 2014.– №1–2.– С.19–25.
6. Мальцев С.В., Рылова Н.В. Витамин D и иммунитет // Практическая медицина.– 2015.– №1.– С.114–120.
7. Поворознюк В.В., Снежицкий В.А., Янковская Л.В., Майлян Э.А., Резниченко Н.А., Майлян Д.Э. Значение витамина D в патогенезе сердечно-сосудистых заболеваний // Журнал Гродненского государственного медицинского университета.– 2015.– №2.– С.6–14.
8. Драпкина О.М., Шепель Р.Н.. Плейотропные эффекты витамина D // Рациональная фармакотерапия в кардиологии.– 2016.– №2.– С.227–233. doi: 10.20996/1819-6446-2016-12-2-227-233
9. Bouillon R., Carmeliet G., Verlinden L., van Etten E., Verstuyf A., Luderer H.F. et al. Vitamin D and Human Health: Lessons from Vitamin D Receptor Null Mice. // Endocrine Reviews. – 2008. – V.29(6). – P.726–776. doi: 10.1210/er.2008-0004
10. Wolf G. The discovery of vitamin D: the contribution of Adolf Windaus. // J. Nutr. – 2004. – V.134(6). – P.1299–1302.
11. Tang J.Y., Fu T., Lau C., Oh D.H., Bikle D.D., Asgari M.M. Vitamin D in cutaneous carcinogenesis: Part I. // J. Am. Acad. Dermatol. – 2012. – V.67(5). – P.803–816. doi: 10.1016/j.jaad.2012.05.044
12. Мальцев С.В., Мансурова Г.Ш. Метаболизм витамина D и пути реализации его основных функций // Практическая медицина.– 2014.– №9.– С.12–18.
13. Bikle D.D., Gee E., Halloran B., Haddad J.G. Free 1,25-dihydroxyvitamin D levels in serum from normal subjects, pregnant subjects, and subjects with liver disease. // J. Clin. Invest. – 1984. – V.74. – P.1966–1971.
14. Bikle D.D. Vitamin D and bone. // Curr. Osteoporos. Rep. – 2012. V.10(2). – P.151–159. doi: 10.1007/s11914-012-0098-z
15. Holick M.F. Vitamin D Deficiency. // N. Engl. J. Med. – 2007. – V.357. – P.266–281. doi: 10.1056/NEJMra070553
16. Razzaque M.S. The FGF23-Klotho axis: endocrine regulation of phosphate homeostasis. // Nat. Rev. Endocrinol. – 2009. – V.5(11). – P.611–619. doi: 10.1038/nrendo.2009.196
17. Van Driel M., Koedam M., Buurman C.J., Hewison M., Chiba H., Uitterlinden A.G. et al. Evidence for auto/paracrine actions of vitamin D in bone: 1alpha-hydroxylase expression and activity in human bone cells. // FASEB J. – 2006. – V.20(13). –P.2417–2419.
18. Atkins G.J., Anderson P.H., Findlay D.M., Welldon K.J., Vincent C., Zannettino A.C. et al. Metabolism of vitamin D3 in human osteoblasts: evidence for autocrine and paracrine activities of 1 alpha,25-dihydroxyvitamin D3. //Bone. – 2007. – V.40(6). – P.1517–1528.
19. Binkley N., Ramamurthy R., Krueger D. Low vitamin D status: definition, prevalence, consequences, and correction. // Endocrinol. Metab. Clin. North. Am. – 2010. – V.39(2). – P.287– 301. doi: 10.1016/j.ecl.2010.02.008
20. Blomberg J.M. Vitamin D metabolism, sex hormones, and male reproductive function. // Reproduction. – 2012. – V.144(2). – P.135–152. doi: 10.1530/REP-12-0064
21. Захарова Н., Васильева С.В., Дмитриева Ю А., Мозжухина М.В., Евсеева Е. А. Коррекция недостаточности витамина D // Эффективная фармакотерапия. Педиатрия.– 2014.– №1.– С.38–44.
22. Tripkovic L., Lambert H., Hart K., Smith C.P., Bucca G., Penson S. et al. Comparison of vitamin D2 and vitamin D3 supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis. // Am. J. Clin. Nutr. – 2012. – V.95(6). – P.1357–1364. doi: 10.3945/ajcn.111.031070
23. Fleet J.C., Schoch R.D. Molecular mechanisms for regulation of intestinal calcium absorption by vitamin D and other factors. // Crit. Rev. Clin. Lab. Sci. – 2010. – V.47(4). – P.181–195. doi: 10.3109/10408363.2010.536429
24. Xue Y., Fleet J.C. Intestinal vitamin D receptor is required for normal calcium and bone metabolism in mice. // Gastroenterology. – 2009. – V.136(4). – P.1317–1327. doi: 10.1053/j.gastro.2008.12.051
25. Nordin B.E., Need A.G., Morris H.A., O’Loughlin P.D., Horowitz M. Effect of age on calcium absorption in postmenopausal women. // Am. J. Clin. Nutr. – 2004. – V.80(4). – P.998–1002.
26. Heaney R.P., Dowell M.S., Hale C.A., Bendich A. Calcium absorption varies within the reference range for serum 25-hydroxyvitamin D. // J. Am. Coll. Nutr. – 2003. – V.22(2). – P.142–146.
27. Aloia J.F., Chen D.G., Yeh J.K., Chen H. Serum vitamin D metabolites and intestinal calcium absorption efficiency in women. // Am. J. Clin. Nutr. – 2010. – V.92(4). – P.835–840. doi: 10.3945/ajcn.2010.29553
28. Ten Bolscher M., Netelenbos J.C., Barto R., Van Buuren L.M., Van Der Vijgh W.J. Estrogen regulation of intestinal calcium absorption in the intact and ovariectomized adult rat. // J. Bone Miner. Res. – 1999. – V.14(7). – P.1197–1202.
29. Van Abel M., Hoenderop J.G., van der Kemp A.W., van Leeuwen J.P., Bindels R.J. Regulation of the epithelial Ca2+ channels in small intestine as studied by quantitative mRNA detection. // Am. J. Physiol. Gastrointest. Liver Physiol. – 2003. – V.285(1). – P.78–85.
30. Boivin G., Mesguich P., Pike J.W., Bouillon R., Meunier P.J., Haussler M.R. et al. Ultrastructural immunocytochemical localization of endogenous 1,25-dihydroxyvitamin D3 and its receptors in osteoblasts and osteocytes from neonatal mouse and rat calvaria. // Bone Miner. – 1987. – V.3(2). – P.125–136.
31. Biswas P., Zanello L.P. 1alpha,25(OH)(2) vitamin D(3) induction of ATP secretion in osteoblasts.// J. Bone Miner. Res. – 2009. – V.24(8). – P.1450-1460. doi: 10.1359/jbmr.090306
32. Min B. Effects of Vitamin D on Blood Pressure and Endothelial Function. // Korean J. Physiol. Pharmacol. – 2013. – V.17(5). – P.385–392.
33. Haussler M.R., Haussler C.A., Jurutka P.W., Thompson P.D., Hsieh J.C., Remus L.S. et al. The vitamin D hormone and its nuclear receptor: molecular actions and disease states. // J. Endocrinol. – 1997. – V.154(Suppl). – P.57–73.
34. Whitfield G.K., Hsieh J.C., Jurutka P.W., Selznick S.H., Haussler C.A., MacDonald P.N. et al. Genomic actions of 1,25-dihydroxyvitamin D3. // J. Nutr. – 1995. – V.125(6 Suppl). – P.1690–1694.
35. Haussler M.R., Whitfield G.K., Kaneko I., Forster R., Saini R., Hsieh J.C. et al. The role of vitamin D in the FGF23, klotho, and phosphate bone-kidney endocrine axis. // Rev. Endocr. Metab. Disord. – 2012. – V.13(1). – P.57–69. doi: 10.1007/s11154-011-9199-8
36. Suda T., Takahashi N., Abe E. Role of vitamin D in bone resorption. // J. Cell. Biochem. – 1992. – V.49(1). – P.53–58.
37. Nordin B.E. Evolution of the calcium paradigm: the relation between vitamin D, serum calcium and calcium absorption. // Nutrients. – 2010. – V.2(9). – P. 997–1004. doi: 10.3390/nu2090997
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: VII РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
VII РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
БИСФОСФОНАТЫ В СИСТЕМЕ ПАЛЛИАТИВНОГО ЛЕЧЕНИЯ
КОСТНЫХ МЕТАСТАЗОВ
Орлова Р.В., Н.В. Тюкавина
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Костная ткань является разновидностью соединительной ткани, которая вместе с хрящевой образует скелетную систему и характеризуется динамичностью и постоянной перестройкой, не являясь «мертвой», как было принято считать раньше. На протяжении всей жизни скелет подвергается ремоделированию. Этот процесс представляет собой упорядоченный цикл событий, в котором фаза костной резорбции предшествует фазе костеобразования, и подразумевает наличие дискретных клеточных и метаболических явлений в пространстве и, следовательно, во времени (Frost, 1973; Parfitt, 1983). Коротко рассмотрим основные механизмы.
- Резорбция. Стимулированные клетки, отвечающие за целостность кости, (предшественники остеобластов) продуцируют факторы, связывающиеся с рецепторами остеокластов, что приводит к размножению остеокластов и их активации. Остеокласты разрушают минеральный скелет кости, приводя к возникновению эрозивного дефекта.
- Инверсия. Moнонуклеарные клетки подготавливают поверхность кости для “работы” новых остеобластов, восстанавливающих структуру кости.
- Восстановление. Остеобласты синтезируют органический матрикс кости для восстановления повреждения.
- Состояние покоя. Поверхность кости покрыта “распластанными” покровными клетками. Период состояния покоя сменяется периодом незначительной клеточной активности до тех пор, пока не начнется новый цикл ремоделирования (Mundy, 1999).
Злокачественные опухоли нередко сопровождаются поражением костей. В основе патогенеза костной резорбции при опухолях лежит нарушение нормального костеобразования. Опухолевые клетки продуцируют вещества, стимулирующие как остеокласты, так и остеобласты, основным из которых является PTHrP (белок, ассоциированный с паратиреоидным гормоном). Этот белок способен прямо или косвенно стимулировать остеокласты к деградации кости и высвобождению факторов роста, включая ИЛ-6, трансформирующий фактор роста (TGF-β), и других, стимулирующих рост опухолевых клеток, одновременно поддерживающих цикл резорбции кости и аномальный рост кости (Goltzman, 1997; Mundy, 1997; Boyce с соавт., 1999).
Чаше всего в кости метастазируют раки молочной железы (Lipton A., 2003) и простаты (Eaton C.L., 2003), что может отражать как высокую частоту этой патологии, так и длительность течения этих заболеваний (Yoneda T., 1995). Вероятно, существуют и другие причины такой предрасположенности опухолей определенной локализации к метастазированию в кости (Mundy G.R., 2002). Из других опухолей, часто метастазирующих в кости, следует отметить рак почки (Jung S.T. с соавт., 2003), рак щитовидной железы, рак легкого и множественную миелому.
Таблица 1.
Оценка прогностической значимости костных метастазов при некоторых опухолях.
| Локализация опухоли | Частота встречаемости костных метастазов | 5-летняя выживае- мость | Медиана выживае- мости |
|---|---|---|---|
| Множественная миелома | 95-100% | 10-30% | 20-36 мес. |
| Рак молочной железы | 65-75% | 20% | 24 мес. |
| Рак предстательной железы | 65-75% | 25% | 40 мес. |
| Рак легкого | 30-40% |
В табл. 1 представлены сводные данные некоторых исследователей (Mundy, 1997; Coleman, 1997; Ginsberg с соавт., 2001), касающиеся прогностической значимости костных метастазов при некоторых опухолях.
Основные клинические проявления костных метастазов характеризуются тетрадой симптомов: боль, патологические переломы, компрессия спинного мозга и гиперкальциемия, что в значительной степени определяет тяжесть состояния больного, а в ряде случаев является причиной смерти. Раннее выявление и лечение метастазов в костях обеспечивает максимальное повышение качества жизни пациента и его функциональную активность.
Современный подход к противоопухолевому лечению метастазов в костях отличается мультидисциплинарностью, которая включает в себя системную противоопухолевую терапию (химиотерапию, гормональную терапию), облучение и паллиативные хирургические методы лечения (Mohla S. с соавт., 2003).
Однако установление основных этапов патогенеза костных метастазов послужило основанием для создания препаратов, обладающих способностью оказывать влияние не столько на метаболизм самой опухоли, сколько на костный обмен, нарушенный опухолевым процессом (Beghe, Luzzani, 1993). Подобными свойствами обладают бисфосфонаты. Они явились первыми специфическими средствами для лечения метастазов в кости, представляя собой стабильные аналоги природных неорганических фосфатов.
Механизм их действия сложен и до конца не ясен. С одной стороны, бисфосфонаты проникают в костную ткань, концентрируются вокруг остеокластов, создавая при этом высокую концентрацию в лакунах резорбции, захватываются остеокластами, где они нарушают формирование цитоскелета, необходимого для прикрепления остеокласта к костной ткани со снижением секреции лизосомальных ферментов (Sato с соавт., 1991; Zimolo с соавт., 1995; Fleisch, 1997; Rogers с соавт., 1997).
Другой эффект бисфосфонатов заключается в апоптозе остеокластов, что подтверждается появлением особых изменений в клетке и структуре ядра (Hughes с соавт., 1995). Одновременно отмечается потеря клетками-предшественниками остеокластов способности дифференцировки и созревания, что приводит к уменьшению числа остеокластов. Кроме того, бисфосфонаты действуют на остеобласты и макрофаги в зоне костной резорбции, ингибируя синтез остеокласт-стимулирующих факторов (Shipman с соавт., 1997).
Как показали последние исследования, бисфосфонаты не только снижают потерю костной ткани, но и уменьшают объем опухолевых масс (Clark с соавт., 1991; Diel с соавт., 1997; Vinholes с соавт., 1997). Вероятно, это происходит за счет блокирования функции остеокластов, что ведет к разрыву порочного круга и прекращению подпитки опухолевых клеток факторами роста и цитокинами, вырабатываемыми костной тканью. Но это может также быть результатом прямого действия бисфосфонатов (или возможно токсических продуктов остеокластов) на опухолевые клетки (Mundy, 1999). Поднимался в литературе и вопрос о возможном влиянии бисфосфонатов на висцеральные метастазы, но подтверждения этому получено не было (Michigami T. с соавт., 2002).
Все бисфосфонаты являются производными пирофосфата, однако в отличие от него, характеризуются наличием Р-С-Р структуры (рис. 1), которая обеспечивает их активность и связывание с костным матриксом, а также боковой цепи, определяющей их антирезорбционную активность, побочные эффекты и механизм действия (Fleish, 1995).
| пирофосфат | клодронат | памидронат |
| ибандронат | золедронат |
Рис 1. Структурные формулы пирофосфата и бисфосфонатов (клодронат, памидронат, ибандронат, золедронат).
В настоящее время существует три поколения бисфосфонатов. В табл. 2 представлены эти группы со сравнительной характеристикой их активности.
Таблица 2.
Антирезорбционная активность различных бисфосфонатов (in vitro).
| Препараты | Антирезорбционная активность |
|---|---|
| Первое поколение:
клодронат тилудронат | 1 10 10 |
| Второе поколение:
алендронат |
100 1 000 |
| Третье поколение:
ибандронат золедронат |
10 000 20 000 |
Антирезорбционная активность бисфосфонатов, указанная в табл. 2, определялась in vitro. Однако в клинических исследованиях эти данные не подтверждаются. Так Diel с соавт. представили результаты рандомизированного исследования трех групп больных с метастатическим поражением скелета при раке молочной железы. Пациенты первой группы получали 60 мг памидроната, второй группы – 900 мг клодроната в/в каждые 3 недели, третьей группы – клодронат 2400 мг в сутки, внутрь. Курс лечения составил 18 мес. Снижение болевого синдрома в костях наблюдалось у 30% больных в I группе; у 25% во второй и у 15% в третьей. Вертебральные переломы наблюдались у 13%, 12% и 20% пациентов соответственно. Таким образом, в клинических исследованиях отмечены различия в эффективности некоторых бисфосфонатов, но они не так существенны, как при исследованиях in vitro.
Бисфосфонаты не являются альтернативой противоопухолевому лечению и применяются независимо от него. Однако, по сравнению с другими препаратами, оказывающими влияние на костную резорбцию, они обладают рядом преимуществ (высокая эффективность, низкая токсичность, наличие пероральной формы). Это делает их препаратами выбора при наличии костных метастазов (Taube с соавт., 1993; Kanis с соавт., 1994), так как бисфосфонаты, обладая уникальной способностью ингибировать костную резорбцию при метастазах солидных опухолей, оказывают лечебное и профилактическое действие при гиперкальциемии, болевом синдроме, существенно снижают риск развития патологических деформаций и переломов. Таким образом, несмотря на различную антирезорбционную активность in vitro, использование любого из представителей группы бисфосфонатов при костных метастазах обеспечивает снижение риска патологических переломов, уменьшение выраженности болевого синдрома, нормализацию уровня кальция крови.
В табл. 3 представлены рандомизированные исследования по изучению наиболее широко используемых бисфосфонатов с точки зрения их влияния на основные клинические симптомы костных метастазов при разных солидных опухолях.
Таблица 3.
Эффективность бисфосфонатов у больных солидными опухолями c метастазами в костях (плацебо-контролируемые исследования).
| Автор | Препарат | Локализация опухоли | Колич. больных (препарат/ плацебо) | Выводы |
|---|---|---|---|---|
| McCloskey, 1998 | Клодронат 1600 мг/день внутрь | Множествен- ная миелома | 536 (264/272) | Снижение частоты невертебральных переломов на 50% (6,8%/13,2%), вертебральных переломов на 17% (38%/55%),
других патологических переломов на 23% (45%/68%), тяжелой гиперкальциемии на 50% (5,1%/10,1%) |
| Vorreuther, 1992 | Клодронат 300 мг в/в 8 дней→ 1600 мг внутрь ежедневно | Рак предстательной железы (гормоно-резистентный) | 60 (35/25) | Снижение болевого синдрома у 71% пациентов, полное исчезновение болевого синдрома у 26% больных |
| Kanis, 1996 | Клодронат 1600 мг/день внутрь | Рак молочной железы | 133 (66/67) | Снижение числа скелетных метастазов на 50% (32/63), числа пациентов с развившимися костными метастазами на 26% (15/19), числа вертебральных переломов на 29% (35/54), невертебральных переломов на 75% (2/8) |
| Conte, 1996 | Памидронат 45 мг в/в каждые 3-4 нед. | Рак молочной железы | 295 | Увеличение времени до прогрессирования костных метастазов на 48% |
| Hortobagy, 1996 | Памидронат 90 мг в/в каждые 4 нед. | Рак молочной железы | 382 (185/197) | Увеличение времени до первого клинического симптома на 47%. Непозвоночные переломы развились у 23% пациентов в группе памидроната и у 38% пациентов в группе плацебо, гиперкальциемия – у 7% и 15% пациентов, потребность в лучевой терапии – 28% и 45% соответственно. |
| Jean-Jacques Body | Бондронат 2 мг, 6 мг в/в | Рак молочной железы | 462 | Снижение числа новых костных осложнений на одного пациента за год с 1,29 в группе плацебо до 0,93 в группе пациентов, получавших бондронат 6 мг (р<0,05). Снижение числа костных осложнений на одного пациента в течение года снизилось с 2,18 в группе плацебо до 1,83 в группе больных, получавших 2 мг бондроната, и до 1,61 в группе больных, получавших 6 мг бондроната (р<0,05). Выявлено достоверное снижение выраженности боли у пациентов, получавших 6 мг бондроната |
| Rosen, 2001, 2002 | Золедронат 4 мг в/в 15 мин. каждые 3 недели | Рак легкого и другие cолидные опухоли | 507 (257/250) | Снижение числа пациентов с возникшими костными осложнениями (38% против 47%, р=0,047), частоты регистрации костных осложнений (1,82 против 2,88 осложнения в год; р=0,049). Медиана времени до возникновения первого костного осложнения при использовании золедроната 4 мг увеличилась более чем на 2 мес. |
Бисфосфонаты хорошо переносятся большинством пациентов. Самыми частыми нежелательными явлениями являются гриппоподобные симптомы (лихорадка, артралгии, миалгии и боли в костях), повышенная утомляемость, желудочно-кишечные реакции, слабость, одышка и отеки. Эти симптомы обычно слабо выражены, быстро купируются и не требуют медикаментозного лечения.
Следует соблюдать осторожность при одновременном применении бисфосфонатов и аминогликозидов, поскольку оба препарата могут оказывать аддитивное влияние на концентрацию кальция в сыворотке крови, в результате чего уровень кальция в сыворотке может оставаться сниженным более длительно, чем это требуется.
Бисфосфонаты практически не метаболизируются в организме: 40-50% введенного препарата экскретируется с мочой в течение 48 ч. Остаток абсорбируется костной тканью и в последующем медленно элиминируется почками.
Рассмотрим подробнее основных представителей бисфосфонатов, наиболее часто используемых в повседневной практике.
Представителем первой генерации является клодронат (Бонефос) (рис. 1). Препарат зарегистрирован в Российской Федерации 20.07.1993 г., производится в виде пероральной (в капсулах) и внутривенной (ампулах) лекарственных формах. Следует отметить, что это единственный препарат для пероральной терапии, который в настоящее время зарегистрирован в России. Недостатком является плохая абсорбция из желудочно-кишечного тракта. Не более 1-5% от введенной пероральной дозы клодроната попадает в кровяное русло. Основная проблема – это взаимодействие с препаратами или продуктами с высоким содержанием кальция (антациды) или другими двухвалентными ионами металлов. Эти вещества, связываясь с клодронатом в желудочно-кишечном тракте, значительно снижают его эффективность, в ряде случаев даже нейтрализуя его. Поэтому при назначении пероральной формы следует рекомендовать прием клодроната за 1 ч до приема пищи, напитков или любых других препаратов. Часто сообщается о желудочно-кишечных осложнениях (дискомфорт, боли в области желудка, диарея, запоры) при приеме препарата внутрь в дозе 1600 мг в сутки. Однако в контролируемых исследованиях частота этих побочных эффектов оказалась такой же, как и в группе больных плацебо (Lahtinen с соавт., 1992).
Клодронат назначают в дозах от 300 до 1500 мг/сут. в течение 1-10 дней. Этот бисфосфонат был изучен в плацебо-контролируемом исследовании для оценки эффективности в отношении индуцированной опухолью гиперкальциемии: назначение клодроната привело к снижению уровня кальция в крови у 17 из 21 больного, в то время как в группе плацебо это удалось сделать только у 4 из 19 (Rostein с соавт., 1992). Повторяющиеся ежедневные инфузии 300 мг переносятся хорошо и позволяют добиться нормализации уровня кальция у 80-90% пациентов (Paterson с соавт., 1983; Bonjour с соавт., 1988). O’Rourke с соавт. (1993) показали, что однократная инфузия 1500 мг клодроната по своей эффективности не уступает инфузии этого же препарата в дозе 300 мг/сут. в течение 5 дней. Клодронат необходимо вводить медленно (в течение не менее 2-3 ч), так как быстрая инфузия сопровождается внутрисосудистым связыванием кальция, что сопряжено с образованием нефротоксических комплексов и может привести к развитию острой почечной недостаточности.
Памидронат (Аредиа) — представитель второго поколения бисфосфонатов, содержащий в своей молекуле один атом азота (рис. 1). Присутствие атома азота в боковой цепи объясняет уникальный механизм действия, связанный со способностью ингибировать процесс модификации белков в остеокластах, что приводит к их апоптозу (Luckman с соавт., 1998). Бисфосфонаты, не содержащие азот, такие как клодронат, являются менее мощными ингибиторами остеокласт-опосредованной костной резорбции, так как имеют несколько иной механизм действия. Памидронат является эффективным средством терапии больных множественной миеломой и раком молочной железы с метастазами в кости, т.е. опухолями, характеризующимися развитием, прежде всего, остеолитических метастазов.
Памидронат рекомендуется применять в дозе 60-90 мг внутривенно в виде 4-часовой инфузии с интервалом в 3 недели. Многочисленные исследования показали, что доза в 90 мг позволяет достичь нормокальциемии более чем у 90% пациентов. Несмотря на подтвержденный дозозависимый эффект памидроната, высокие дозы его практически не используются из-за побочных эффектов со стороны желудочно-кишечного тракта.
Эффективность лечения зависит от ряда факторов. Оказывается, что циркулирующий в крови PTHrP влияет на величину ответа бисфосфонатов, так как стимулирует почечную тубулярную реабсорбцию кальция. Вот почему больные с повышенным уровнем PTHrP отвечали на введение памидроната в меньшей степени, чем пациенты, у которых этот белок не был обнаружен (Coleman R.E. с соавт., 1997). Последние рандомизированные исследования показали некоторые преимущества памидроната перед клодронатом у больных с индуцированной опухолью гиперкальциемией, прежде всего в продолжительности нормокальциемии, так как средняя продолжительность эффекта клодроната составила 14 дней в сравнении с 28 днями для памидроната (Purohit с соавт., 1995). Показана возможность использования бисфосфонатов с целью предупреждения осложнений костного метастазирования. Результаты исследований с клодронатом и памидронатом выявили достоверное снижение частоты проявлений осложнений при пролонгированном применении памидроната и клодроната (табл. 3).
Бондронат (Ибандронат) является одним из представителей третьего поколения и относится к азотсодержащим бисфосфонатам (рис. 1). Применяется в дозе 2-4 мг в сутки в виде 15-минутных внутривенных инфузий 1 раз в 4 недели. В дозах, превышающих терапевтические, ибандронат, в отличие от памидроната, не вызывает нарушения минерализации костной ткани и не приводит к увеличению частоты побочных эффектов. Кроме того, препарат не обладает нефротоксичностью и не вызывает местных побочных эффектов в месте инфузии, что свойственно бисфосфонатам первого и второго поколений. Он показан для лечения гиперкальциемии у больных со злокачественными образованиями с повышенным уровнем PTHrP. При мета-анализе нескольких рандомизированных исследований было показано, что применение ибандроната вызвало статистически значимое снижение скелетных осложнений в среднем на 30% (Pavlis, Stokeler., 2002).
Золедронат (Зомета) – гетероциклический бисфосфонат третьего поколения, содержащий в имидазольном кольце боковой цепочки два атома азота, расположенных в противоположных позициях (рис. 1). Особенность молекулярного строения определяет более высокий потенциал золедроновой кислоты. В исследованиях in vitro и in vivo установлена способность препарата ингибировать рост клеток эндотелия, с чем связывают возможный антиангиогенный эффект (Boisser с соавт., 2000; Senaratue с соавт., 2000).
Рекомендуемая доза золедроната составляет 4 мг; эту дозу инфузируют в течение 15 мин. один раз в 3-4 недели. В период терапии пациентам следует назначать кальций (500 мг) и Витами D (400 МЕ). Кальций назначают для предотвращения транзиторной гипокальциемии и повышения уровня паратиреоидного гормона, являющегося следствием гипокальциемии.
Золедронат был зарегистрирован на основании результатов трех крупных клинических исследований III фазы у пациентов со следующими распространенными злокачественными новообразованиями: миеломная болезнь, рак молочной железы, рак предстательной железы, немелкоклеточный рак легкого и другие солидные опухоли. У больных раком молочной железы и у пациентов с миеломной болезнью эффективность золедроната и памидроната с точки зрения снижения частоты костных осложнений была сходной, но пациенты, которые получали золедронат, значимо реже нуждались в лучевой терапии костей. Кроме того, дополнительная 12-месячная фаза клинического исследования показала, что среди больных раком молочной железы риск развития костных осложнений был на 18% ниже при лечении золедронатом, чем при лечении памидронатом (Rosen с соавт., 2001, 2002).
У больных раком предстательной железы с костными метастазами золедронат значимо эффективнее, чем плацебо, снижал частоту костных осложнений, особенно патологических переломов. Кроме того, в группе, получавшей 4 мг золедроната, по сравнению с группой плацебо, была значимо ниже суммарная частота лучевой терапии на область метастазов в кости и хирургического вмешательства на кости, в том числе по поводу сдавления спинного мозга, а также необходимости изменения проводимой противоопухолевой терапии вследствие болей в костях. Это исследование стало первым рандомизированным клиническим исследованием, где бисфосфонат существенно снизил частоту костных осложнений у больных метастазирующим раком предстательной железы, который характеризуется остеобластными метастазами. Следует, отметить, что золедронат не влиял на такие показатели как прогрессирование костных метастазов, время до прогрессирования рака и выживаемость (Saad с соавт., 2002).
В заключение можно сказать, что бисфосфонаты являются эффективным и обязательным средством паллиативного лечения больных с костными метастазами, позволяющим значительно улучшить качество жизни этих больных.
Список литературы:
1. Модников О.П., Новиков Г.А., Родионов В.В. Костные метастазы рака молочной железы (патогенез. Клиника, диагностика и лечение) // Москва – 2001.
2. Моисеенко В.М., Семиглазов В.Ф., Тюляндин С.А. Современное лекарственное лечение местно-распространенного и метастатического рака молочной железы // «Грифон». – 1997.
3. Beghe F., Luzzani M. A new schedule for clodronate treatment in patient with breast cancer and bone metastases // Ann. NY Acad Science. 1993.`698: 367-431.
4. Boissier S, Ferrers M, Peyruchaud O. et al. Cancer Res 2000; 60: 2949—54.
5. Bonjour J.P., Philippe J., Guela G., et al. Bone and renal components in hypercalciemia of malignancy and responses to a single infusion of clodronate // Bone. – 1988. – V.9. – P. 123-130.
6. Boyce BF, Yoneda T, Guise TA. Factors regulating the growth of metastatic cancer in bone // Endocr Relat Cancer. 1999; 6: 333-347.
7. Clark N.V., Holbrook I.B., McClure J. et al. Osteoclast inhibition by pamidronate in metastatic prostate cancer: a preliminary study // Br. J. Cancer. – 1991. – V.63. — P. 420-423.
8. Coleman R.E., Purohit O.P., Vinholes J.J., Zekri J. High dose pamidronate: clinical and biochemical effects in metastatic bone disease // Cancer. – 1997. – V. 80 (Suppl.8). – P. 1686-1690.
9. Conte FF, Mauriac L, Calabresi F et al. Delay in progression of bone metastases treated with intravenous pamidronate: Results from a multicentre randomized controlled trial // J Clin Oncol 1996; 14; 2552-2559.
10. Conte PF, Latreille J, Mauriac L et al. Delay in progression of bone metastases in breast cancer patients treated with intravenous pamidronate: results from a multinational randomized controlled trial. The Aredia Multinational Cooperative Group // J Clin Oncol 1996; 14:2552-2559.
11. Diel I, Solomayer F.-F, Costa SI et al. Reduction in new metastases in breast cancer with adjuvant clodronate treatment // N Engl J Med 339: 357-363, 1998.
12. Eaton C.L., Coleman R.E. Pathophysiology of bone metastases from prostate cancer and the role of bisphosphonates in treatment // Cancer Treat Rev – 2003 – 29(3) – p. 189-98.
13. Fleisch H. Bisphosphonates in Bone Disease-From the laboratory to the Patient // New York: The Parthenon Publishing Group. – 1997.
14. Fleish H. Bisphosphonates – preclinical // In: Bisphosphonates in Bone Disease-From the laboratory to the Patient. 2d ed. Carnforth, England: Parthenon. – 1995. – P. 38-56.
15. Frost H.M. Bone remodeling and its relationship to metabolic bone disease // Springfield: Thomas. – 1973.
16. Ginsberg R.J., Vokes E.E., Rosenzweig K. // Non-small cell lung cancer. In: DeVita V.T., Jr Hellman S., Rosenberg S.A., eds. // Cancer: Principles and Practice of Oncology. Philadelphia: Lippincott Williams and Wilkins; 6th ed. 2001: 925-983.
17. Goltzman D. Mechanisms of the development of osteoblastic metastases // Cancer.1997; 80: 1581-1587.
18. Goltzman D., Stewart A.F., Broadus A.E. Malignancy-associated hypercalcemia: evaluation with a cytochemical bioassay for parathyroid hormone // J. Clin. Endocrinol. Metab. – 1981. – V. 53. – P. 899-904.
19. Hortobagyi GN, Theriault RL, Porter L, et al. Efficacy of pamidronate in reducing skeletal complications in patients with breast cancer and lytic bone metastases // New Engl J Med 335: 1785-1791, 1996.
20. Jung S.T., Ghert M.A., Harrelson J.M., Scully S.P. Treatment of osseous metastases in patients with renal cell carcinoma // Clin Orthop. – 2003 – (409) – p. 223-31.
21. Kanis J.A., O’Rourke N., McCloskey E.: Consequences of neoplasia induced resorption and the use of clodronate (Review) // Int J Oncol 5: 713-731, 1994.
22. Lahtinen R, Laakso M, Palva I et al. Randomized, placebo-controlled multicentre trial of clodronate in multiple myeloma // Lancet 340:1049-52, 1992.
23. Lipton A, Small E, Saad F, et al. The new bisphosphonate, ZOMETA® (zoledronic acid), decreases skeletal complications in both lytic and blastic lesions: a comparison to pamidronate. Presented at the Chemotherapy Foundation Symposium XIX. November 7–10, 2001. New York, NY. Abstract number 34.
24. Lipton A, Theriault 1, Leff R, et al. Long term reduction of skeletal complications in breast cancer patients with osteolytic bone metastases receiving hormone therapy, by monthly 90 mg pamidronate {Aredia™) infusions. ASCO Proceedings16: 152, 1997.
25. Lipton A. Bisphosphonates and metastatic breast carcinoma // Cancer – 2003 – 97(3 Suppl) – p. 848-53.
26. Lipton A. Bone metastases in breast cancer // Curr Treat Options Oncol. – 2003 – 4(2) – p. 151-8.
27. Michigami T., Hiraga T., Williams P.J., Niewolna M., Nishimura R., Mundy G.R., Yoneda T. The effect of the bisphosphonate ibandronate on breast cancer metastasis to visceral organs // Breast Cancer Res Treat. – 2002 – 75(3) – p. 249-58.
28. Mohla S., Weilbacher K.N., Cher M.L., Oyajobi B.O., Poznak C.V., Clohisy D.R. Third North American Symposium on Skeletal Complications of Malignancy: summary of the scientific sessions // Cancer – 2003 – 1 – 97(3 Suppl) – p. 719-25.
29. Mundy G.R. Mechanisms of bone metastasis // Cancer. – 1997. – V. 80(Suppl.8). – P.1546-1556.
30. Mundy G.R. Metastasis to bone: causes, consequences and therapeutic opportunities // Nat Rev Cancer – 2002 – 2(8) – p. 584-93.
31. Mundy G.R. Preclinical studies of metastasis: experimental models and novel techniques to detect micrometastases // Program and abstracts of 22nd San Antonio Brest Cancer Symposium; Desember 8-11, 1999; San Antonio, Texas.
32. Mundy GR. Bisphosphonates as cancer drugs // Hospital Practice. 1999; 34: 81-94.
33. O’Rourke N.P., McCloskey E.V., Vasikaran S. et al. Effective treatment of malignant hypercalcaemia with a single intravenous infusion of clodronate // Br. J. Cancer. – 1993. – V. 67. – P. 560-563.
34. Parfitt A.M. The physiologic and clinical significance of bone histomorphometric data // In: Bone histomorphometric techniques. Ed. Recker R. – Boca Raton: CRC Press. – 1983. – P. 143-223.
35. Purohit OP, Radstone CR, Anthony C, et al. A randomized double-blind comparison of intravenous pamidronate and clodronate in the hypercalcaemia of malignancy // Br J Cancer 72: 1289-1293, 1995.
36. Rogers MJ, Xiong X, Ji X et al. Inhibition of growth of Dictyostelium discoideum amoeboe by bisphosphonates is dependent on cellular uptake // Pharmacol Res. 14: 625-630, 1997.
37. Rosen LS, Gordon D, Kaminski M, et al. Zoledronic acid versus pamidronate in the treatment of skeletal metastases in patients with breast cancer or osteolytic lesions of multiple myeloma: A phase III, double-blind, comparative trial // Cancer J. 2001; 7: 377-387.
38. Rostein S., Glas U., Eriksson M., Pfeiffer P., Hansen J., et al: Intravenouse clodronate for the treatment of hypercalcemia in breast cancer patient with bone metastases – a prospective randomized placebo-controlled multicentre study // Eur J Cancer 28A: 890-893, 1992.
39. Saad F, Gleason D, Murray R, et al. Zometa is effective in the treatment of bone metastases from prostate cancer: Results of a large phase III, double-blind randomized trial. Presented at the SUO meeting Abstract 2002.
40. Sato M, Crasser W, Endo N et al. Bisphosphonate action: alendronate localization in rat bone and effects on osteoclast ultrastructure // J Clin Invest 1991:88:2095-2105.
41. Senaratue SG, Pirianov G, Mansi JL. et al // Br J Cancer 2000; 82: 1459-68.
42. Shipman CM, Rogers MJ, Apperiey JF et al. Bisphosphonates induce apoptosis in human myeloma cell lines: a novel anti-tumour activity // Br J Haematol 1997:98:665-672.
43. Taube T., Elomaa I., Blomqvist C., Beneton MNC, Kanis J.A: Comparative effects of clodronate and calcitonin in metastatic breast cancer // Eur J Oncol 29:1677-1681, 1993.
44. Vinholes JJ, Purohit OP, Abbey ME et al. Evaluation of new bone resorption markers in a randomized comparison of pamidronate or clodronate for hypercalcaemia of malignancy // J Clin Oncol 15: 131-138, 1997.
45. Vinholes JJ, Purohit OP, Abbey ME et al. Relationships between biochemical and symptomatic response in a double-blind randomized trial of pamidronate for metastatic bone disease // Ann Oncol 1997; 8: 1243-1250.
46. Yoneda T, Williams P, Dunstan С et al. Growth of metastatic cancer cells in bone is enhanced by bone derived insulin-like growth factors (IGFs) // J Bone Miner Res 1995; 10 (suppl 1):P 269.
47. Zimolo Z., Wesolowski G., Rodan G.A. Acid extrusion in produced by osteoclast attachment to bone. Inhibition by alendronate and calcitonin // J. Clin. Invest. – 1995. — V.96. – P.2277-2283.
Взаимодействие остеобластов и остеокластов
Abstract
Гомеостаз кости зависит от резорбции кости остеокластами и образования кости остеобластами. Дисбаланс этого тесно связанного процесса может вызвать такие заболевания, как остеопороз. Таким образом, механизмы, регулирующие связь между остеокластами и остеобластами, имеют решающее значение для биологии костных клеток. Было показано, что остеобласты и остеокласты могут связываться друг с другом посредством прямого межклеточного контакта, цитокинов и взаимодействия внеклеточного матрикса.Остеобласты могут влиять на формирование, дифференцировку или апоптоз остеокластов несколькими путями, такими как OPG / RANKL / RANK, LGR4 / RANKL / RANK, Ephrin2 / ephB4 и пути Fas / FasL. Напротив, остеокласты также влияют на формирование кости остеобластами через изоформу d2 вакуолярной (H +) АТФазы (v-АТФаза) домена V0 (Atp6v0d2), компонент комплемента 3a, семафорин 4D или микроРНК. Кроме того, цитокины, высвобождаемые из резорбированного костного матрикса, такие как TGF-β и IGF-1, также влияют на активность остеобластов.Было выполнено несколько обзоров связи остеобластов и остеокластов. Однако немногие обзоры показывают успехи исследований за последние годы. В этом обзоре мы обобщили текущие знания о коммуникации остеобластов и остеокластов.
Ключевые слова: ремоделирование кости, остеобласт, остеокласт, коммуникация
Кость находится в постоянном состоянии ремоделирования, что важно для поддержания нормальной структуры и функции скелета. Таким образом, дисбаланс может привести к такому заболеванию, как остеопороз.В процесс ремоделирования кости вовлечены многие типы клеток и факторов. Остеобласт и остеокласт — две основные клетки, участвующие в этом прогрессе (Matsuo and Irie, 2008). Остеокласты ответственны за резорбцию стареющей кости, а остеобласты ответственны за формирование новой кости (Matsuoka et al., 2014). Резорбция и формирование стабильны при физиологических условиях. Однако при нарушении баланса архитектура или функция костей будут ненормальными. Возникают заболевания костного метаболизма, такие как остеопороз или остеопетроз (Zaidi, 2007).
Многие цитокины, гормоны и сигнальные пути участвуют в ремоделировании костей (Matsuo and Irie, 2008). Было показано, что остеобласты и остеокласты могут связываться друг с другом посредством прямого межклеточного контакта, цитокинов или клеточно-костного матрикса (Tamma and Zallone, 2012). Молекулярные механизмы клеточной коммуникации между остеобластами и остеокластами являются одной из центральных проблем в биологии костных клеток (Mundy and Elefteriou, 2006). Связь между остеобластами и остеокластами происходит на разных стадиях дифференцировки (Matsuo and Irie, 2008).Более ранние исследования показали, что остеобласты могут регулировать образование остеокластов (Rodan and Martin, 1981). Впоследствии все больше и больше исследований показали, что остеокласты также могут влиять на активность остеобластов (Matsuoka et al., 2014; Wang et al., 2015).
Было выполнено несколько обзоров взаимодействия остеобластов и остеокластов (Matsuo and Irie, 2008; Tamma and Zallone, 2012). Однако в последние годы было опубликовано мало обзоров. В этом кратком обзоре мы освещаем основные достижения в исследованиях связи между остеобластами и остеокластами.
Роль остеобластов в образовании остеокластов
Межклеточный контакт
Было показано, что остеобласты могут связываться с остеокластами посредством прямого контакта. Когда эти две клетки контактируют, они могут образовывать щелевые контакты, и небольшие водорастворимые молекулы могут проходить между двумя типами клеток. Everts et al. (2002) показали, что клетки выстилки кости, субпопуляция остеобластов, находятся в тесном контакте с остеокластами, прикрепленными к кости. Инициирование остеокластогенеза в основном зависит от взаимодействия между этими двумя клетками (Everts et al., 2002; Мацуо и Ирие, 2008 г.). Просвечивающая электронная микрофотография также показала, что существует прямой контакт между зрелыми остеокластами и остеобластами, а основная многоклеточная единица является местом межклеточного контакта (Matsuo and Irie, 2008).
Ephrin2 / ephB4
Костные клетки и их предшественники экспрессируют ephs и ephrins (Tamma and Zallone, 2012). Zhao et al. (2006) показали, что существуют другие двунаправленные регуляции между остеобластами и остеокластами. Эта регуляция опосредована трансмембранным лигландом, ephrin2, на остеокласте и рецепторной тирозинкиназой, ephB4, на остеобласте и остеоцитах.Остеобласты могут ингибировать образование остеокластов с помощью ephb4, а остеокласты могут стимулировать дифференцировку остеобластов с помощью эфрина2. Прямая передача сигналов, опосредованная EPH (OC-OB), стимулирует дифференцировку остеобластов и индуцирует образование кости; обратная передача сигналов, опосредованная эфрином (OB-OC), ингибирует резорбцию кости. Кроме того, Zhao et al. (2006) показали, что передача сигналов ephrinB2 ингибирует остеокластогенез путем блокирования индукции Fos и его транскрипционной мишени Nfatc1, которая индуцируется RANKL. Кроме того, известно, что передача сигналов EphB4 индуцирует остеогенные регуляторные факторы, такие как Dlx5, Osx и Runx2.
MSF / MCP-1
Остеобласты могут секретировать колониестимулирующие макрофаги (M-CSF) (Lacey et al., 1994), которые связываются с его рецептором c-Fms, экспрессируемым на макрофагах и остеокластах (Wiktor-Jedrzejczak et al. , 1990). Количество остеокластов у мышей с нокаутом M-CSF было очевидно уменьшено по сравнению с мышами дикого типа. M-CSF является важным цитокином для выживания, дифференцировки, миграции клеток и активности макрофагов и остеокластов (Wiktor-Jedrzejczak et al., 1990; Kim and Kim, 2016).M-CSF также усиливает дифференцировку предшественников костного мозга в предшественники остеокластов и активирует экспрессию рецептора-активатора ядерного фактора κB (RANK) в предшественниках костного мозга (Sambandam et al., 2010).
Остеобласты также могут продуцировать хемоаттрактантный белок-1 моноцитов (MCP-1 или CCL2) (Graves et al., 1999), который является кандидатом в рекрутеры предшественников остеокластов (Li et al., 2007). МСР-1 связывается с рецептором, экспрессируемым в предшественниках остеокластов, а затем циркулирующий предшественник остеокластов позиционирует поверхность кости, чтобы дифференцироваться в активный остеокласт.Однако в нормальной кости MCP-1 не экспрессируется. Воспаление может стимулировать экспрессию MCP-1 в остеобластах.
OPG / RANKL / RANK
До открытия RANKL, OPG и RANK многие группы наблюдали, что остеобласты продуцируют цитокины для регулирования дифференцировки и образования остеокластов.
В 1990-х четыре группы независимо обнаружили, что OPG / RANKL играет критическую роль во время образования остеокластов (Boyce and Xing, 2008). Во-первых, они обнаружили, что OPG защищает от потери костной массы (Simonet et al., 1997; Yasuda et al., 1998a), а затем они открыли его лиганд (OPGL), используя OPG в качестве зонда (Lacey et al., 1998; Yasuda et al., 1998b). Кроме того, OPGL был идентифицирован как член суперсемейства TNF, которое называется активатором рецептора лигланда ядерного фактора-kb (RANKL) (Anderson et al., 1997) или цитокином, вызванным активацией TNF (TRANCE) (Wong et al. ., 1997). RANK был обнаружен другой группой, когда они секвенировали кДНК из библиотеки кДНК миелоидных дендритных клеток, полученных из костного мозга человека, и было обнаружено, что это рецептор для OPGL (Dougall et al., 1999).
OPG также называют фактором ингибирования остеокластогенеза (OCIF). OPG продуцируется многими типами клеток, помимо остеобластов, такими как клетки сердца, печени и селезенки. Было показано, что B-клетки являются основным источником OPG в костном мозге мышей, на долю которых приходится 64% всей продукции OPG костным мозгом (Li et al., 2007). Остеопетроз наблюдается у трансгенных мышей, сверхэкспрессирующих OPG из-за отсутствия остеокластов (Simonet et al., 1997), у мышей с нокаутом OPG наблюдается остеопороз из-за нерегулируемых остеокластов (Bucay et al., 1998). OPG, как рецептор-ловушка, может связываться с RANKL и блокировать его связывание и активацию с помощью RANK (Boyle et al., 2003). Следовательно, основной сигнальный путь дифференцировки и активации остеокластов был заблокирован. Экспрессия OPG в остеобластах регулируется количеством гормонов, цитокинов и факторов роста (Theoleyre et al., 2004), таких как эстроген, 1,25 (OH) 2 D 3 и TNF.
RANKL также называют фактором дифференцировки остеокластов (ODF), TNF-зависимым цитокином, индуцированным активацией (TRANCE) и лигландом остеопротегерина (OPGL) (Lacey et al.1998). Общепринятая номенклатура, RANKL, была учреждена Американским обществом исследования костных минералов в 2000 году (Комитет по номенклатуре при президенте Американского общества исследований костей и минералов). RANKL высоко экспрессируется в остеобластах, активированных Т-клетках, лимфатических узлах, тимусе, молочных железах и легких и слабо экспрессируется в костном мозге (Kearns et al., 2008). RANKL обычно связан с мембраной остеобластов (Kearns et al., 2008). Секретируемый белок происходит из мембранной формы в результате протеолитического расщепления или альтернативного сплайсинга (Ikeda et al.2001). RANKL может связываться со своим рецептором RANK, который экспрессируется на остеокластических клетках-предшественниках, и активирует нисходящие сигнальные пути, связанные с ростом и дифференцировкой клеток (Boyle et al., 2003). Различные цитокины, гормоны и факторы роста могут регулировать экспрессию RANKL, включая ПТГ, эстроген и воспалительные цитокины. Соотношение OPG / RANKL критически влияет на формирование остеокластов.
RANK представляет собой трансмембранный белок типа I, входящий в суперсемейство рецепторов TNF. Он высоко экспрессируется на мембране предшественника остеокластов, зрелых остеокластах, дендритных клетках и молочных железах (Fata et al., 2000). Раковые опухоли с высоким метастатическим потенциалом в кости также выражают RANK, например, рак груди и простаты (Kim et al. 2006). RANK связывается со своим лигандом RANKL, а затем активирует семейство факторов, связанных с рецептором TNF (TRAF), включая TRAF 2,5 и 6. Однако TRAF6 сам по себе может индуцировать остеокластогенез (Kadono 2001) и необходим для активации путей передачи внутриклеточного сигнала. (Ким и др., 1999). RANK / TRAF регулирует образование, активацию и выживание остеокластов посредством различных сигнальных путей (Boyle et al., 2003), включая JNK / AP-1, IκK / NF-κB, c-myc и кальциневрин / NFATc1 для образования остеокластов; src и MKK6 / p38 / MITF для активации.
LGR4 / RANKL / RANK
Недавнее исследование показало, что рецептор 4, связанный с G-белком, содержащий богатые лейцином повторы (LGR4, также называемый GPR48), также является рецептором для RANKL (Luo et al., 2016). RANKL может напрямую взаимодействовать с человеческим LGR4. Они также подтвердили, что LGR4 экспрессируется в остеокластах. Исследование in vivo показало, что низкая костная масса и гиперактивация остеокластов наблюдались у мышей с дефицитом Lgr4 .Количество, площадь поверхности и размер остеокластов были заметно выше у мышей с дефицитом Lgr4 по сравнению с таковыми у контрольных мышей. Исследования in vitro показали, что дефицит Lgr4 способствует образованию остеокластов и ингибирует их апоптоз. Дополнительные данные показали, что индуцированный потерей Lgr4 остеокластогенез не зависел от лиганда LGR4, R-спондина1 или норрина. Однако LGR4 ингибировал связывание RANKL с RANK дозозависимым образом, что указывает на то, что LGR4 конкурирует с RANK за связывание с RANKL.Нижестоящие сигнальные пути дифференцировки и выживания остеокластов были ослаблены. LGR4 может действовать как еще один рецептор-ловушка для RANKL.
Sema3A / Nrp
Семафорины представляют собой молекулы, направляющие конус роста аксонов, которые участвуют во взаимодействии между остеобластами и остеокластами (Negishi-Koga et al., 2011). Hayashi et al. (Hayashi et al., 2012) идентифицировали некоторые белки, секретируемые остеобластами, которые ингибируют дифференцировку остеокластов. Они обнаружили, что молекула управления аксоном Sema3A может играть важную роль.Они также показали, что рекомбинантный Sema3A может ингибировать дифференцировку остеокластов дозозависимым образом. МРНК Sema3A может быть обнаружена в изолированных остеобластах и остеоцитах. Они показали, что ингибирующие эффекты Sema3A на дифференцировку остеокластов отменяются, когда экспрессия NRP1 подавляется короткой shРНК. Более того, они наблюдали, что Sema3A не может ингибировать дифференцировку остеокластов, если у гена Nrp1 и отсутствует сайт связывания Sema. Впоследствии они продемонстрировали, что Sema3A ингибирует остеокластогенез, связываясь с Nrp1.Индуцированное Sema3A ингибирование дифференцировки остеокластов может быть опосредовано регуляцией индуцированной DAP12 передачи сигналов ITAM. Nrp1 может конкурировать с TREM2 за PlxnA1 и действует как супрессор сигнала, индуцированного PlxnA1-TREM2-DAP12.
Лизофосфатидная кислота (LPA)
LPA — это мощный биоактивный фосфолипид (Hosogaya et al., 2008). LPA продуцируется несколькими типами клеток, включая активированные тромбоциты и остеобласты (Sims et al., 2013). LPA, происходящая из остеобластов, может регулировать активность опухолевых клеток в микроокружении скелета и остеокластах (Panupinthu et al., 2008). Рецептор LPA, LPA1, LPA2, LPA4 и LPA5 экспрессируется на высоком или низком уровне в остеокластах (Del Fattore et al., 2008). McMichael et al. показали, что LPA усиливает слияние клеток-предшественников остеокластов (McMichael et al., 2010), и LPA необходим для остеокластогенеза (David et al., 2010). LPA может регулировать передачу сигналов кальция и индуцировать накопление в ядрах NFATc1 в остеокластах (Lapierre et al., 2010), который является важными путями передачи сигналов для образования остеокластов (Boyle et al., 2003). Кроме того, Lapierre et al.(2010) также показали, что LPA может подавлять апоптоз остеокластов и вызывать изменение морфологии зрелых остеокластов. Дальнейшие исследования показали, что лечение LPA приводит к увеличению размера остеокластов, сопровождающемуся увеличением числа ядер (McMichael et al., 2010).
Апоптоз остеокластов, индуцированный остеобластами
Эстроген может вызывать апоптоз остеокластов (Kousteni et al., 2002). Накамура и др. (Nakamura et al., 2007) показали, что эстроген-индуцированный апоптоз остеокластов связан с индукцией ассоциированного с фактором суицидного лиганда (FasL) в этих же клетках.Однако Крам и его коллеги (Krum et al., 2008) обнаружили, что эстроген влияет на выживаемость остеокластов за счет активации FasL в остеобластах, что приводит к апоптозу преостеокластов. Кроме того, они обнаружили, что тамоксифен и ралоксифен также индуцируют преостеокласты с помощью того же остеобласт-зависимого механизма. Гарсия и др. (Garcia et al., 2013) также показали, что индуцированный 17b-эстрадиолом (E2) апоптоз остеокластов опосредуется расщеплением и солюбилизацией экспрессируемого остеобластами FasL. E2 может активировать экспрессию матриксной металлопротеиназы-3 (MMP3), а затем MMP3 расщепляет полноразмерный FasL на растворимый FasL.В присутствии специфического ингибитора MMP3 происходило снижение обширного расщепления и концентрации растворимого FasL. Недавно Wang et al. (2015) также показали, что остеобласты индуцируют апоптоз остеокластов с помощью передачи сигналов лиганда FAS (FASL) / FAS. Условный нокаут FasL в остеобластах вызывал увеличение количества и активности остеокластов. Более того, они указали, что экспрессия FasL была подавлена в остеобластах мышей с остеопорозом после овариэктомии по сравнению с фиктивной контрольной группой. Затем они обнаружили, что остеобласты с нокаутом FasL из фиктивного контроля показали слабую способность индуцировать апоптоз остеокластов, а сверхэкспрессия FasL в остеобластах, полученных из OVX, показала повышенную способность индуцировать апоптоз остеокластов.Остеобласт-индуцированный апоптоз остеокластов с помощью FasL играет важную роль в остеопорозе OVX. Кроме того, с использованием мышей с FASL-дефицитом (FasL cKO), предшественников остеобластов / остеобластов, они обнаружили, что блокирование RANKL показало ограниченную роль в снижении активности остеокластов у мышей FasL cKO. Wang et al. (Wang et al., 2015) также показали, что предшественники остеокластов имеют более низкую экспрессию FAS по сравнению со зрелыми остеокластами. Предшественники остеокластов могут иметь низкую чувствительность к апоптозу, индуцированному остеобластами по пути FASL / FAS.
Роль остеокластов в формировании кости
Atp6v0d2
Atp6v0d2 — это аббревиатура d2 изоформы вакуолярной (H +) АТФазы (v-ATPase) V0 домена. Он высоко экспрессируется в остеокластах (Rho et al., 2002). Однако мало что известно о функциональной важности Atp6v0d2 (Rho et al., 2002). Ли и др. (2006) показали, что у мышей Atp6v0d2 — / — наблюдалось заметное увеличение костной массы и уменьшение объема костно-мозговой полости. Между тем, площадь поверхности остеокластов и количество многоядерных TRAP-положительных клеток были уменьшены.Однако количество мононуклеарных TRAP + -клеток было немного увеличено. Эти данные показали, что Atp6v0d2 — / — может влиять на созревание остеокластов, но не на дифференцировку. Кроме того, они обнаружили, что Atp6v0d2 был связан со слиянием клеток. Образование зрелых гигантских остеокластов снижалось в отсутствие Atp6v0d2. Кроме того, заметное увеличение количества остеобластов и образования костей также наблюдалось у мышей Atp6v0d2 — / -. Однако дифференцировка остеобластов и экспрессия генов, связанных с дифференцировкой, не изменилась.Авт. Предположили, что повышенная активность остеобластов у Atp6v0d2 — / — мышей может быть связана с внешними факторами остеобластов, продуцируемыми мутантными остеокластами или их предшественниками. Atp6v0d2 может иметь большой потенциал в качестве мишени для лечения остеопороза из-за его роли в остеокластах и формировании костей.
Компонент комплемента 3a
Matsuoka et al. (2014) установили систему совместного культивирования остеобластов и зрелых остеокластов для влияния остеокластов на остеобластогенез.Они очистили пептид, последовательность которого соответствует компоненту 3 комплемента (C3), из условной среды (CM) зрелых остеокластов. C3 прогрессивно увеличивался во время дифференцировки остеокластов. Они обнаружили, что биоактивный фрагмент C3 3a может стимулировать дифференцировку остеобластов и что рецептор C3a экспрессируется в линиях стромальных клеток, а также в первичных остеобластах свода черепа. Когда экспрессия гена C3 была подавлена в остеокластах, CM остеокласта не стимулировала дифференцировку остеобластов.Однако активность остеобластов в отношении щелочной фосфатазы (ЩФ) ингибировалась СМ в присутствии антагониста C3aR, и один антагонист C3aR не влиял на активность ЩФ. Все эти данные предполагают, что C3a в CM ответственен за усиление активности ALP. Кроме того, они показали, что активность ЩФ увеличивалась, если агонист C3aR был добавлен к культуре остеобластов. Впоследствии они обнаружили, что экспрессия C3a в кости увеличивается у мышей, получавших OVX, с чрезмерной активацией остеокластов.Антагонист C3aR ингибировал стимуляцию образования кости у мышей OVX. Потеря костной массы и повреждение трабекулярной архитектуры также усугублялись. Эти результаты предполагают, что C3a может обеспечивать связь резорбции кости с образованием в модели с высоким оборотом.
Семафорин 4D
Семафорин 4D (Sema4D) представляет собой молекулу, направляющую аксоны. Негиши-Кога и др. (2011) показали, что остеокласты в высокой степени экспрессируют Sema4D, а Sema4D сильно ингибирует образование костей через свой рецептор плексин-B1, экспрессируемый остеобластами.Масса кости, толщина трабекул и прочность костей, очевидно, были увеличены у мышей Sema4D — / — по сравнению с мышами дикого типа. Кроме того, заметно увеличивалась поверхность остеобластов и скорость образования кости. Однако резорбция костной ткани остеокластом была нормальной. Эти данные предполагают, что высокая костная масса у мышей Sema4D — / — была связана с увеличением образования остеобластической кости. Дальнейшее исследование показало, что добавление Sema4D ингибировало образование костных узелков, активность ЩФ и экспрессию остеобластных генов.Плексин-B1 высоко экспрессируется во время дифференцировки остеобластов. Плексин-B1 образует рецепторный комплекс с гомологом 2 вирусного онкогена эритробластного лейкоза (ErbB2) в остеобластах. Связывание Smea4d с Plexin-B1 индуцировало фосфорилирование ErB2, который играет роль киназы в остеобластах. Однако добавление Sema4D все еще немного подавляло образование костей в Plxnb1 — / — клетках, это указывает на то, что др. Рецепторы могут частично участвовать в эффектах Sema4D на остеобласты. Впоследствии они обнаружили, что связывание Sema4D с рецепторным комплексом Plexin-b1-ErbB2 может индуцировать активацию RhoA, которая опосредует фосфорилирование IRS-1.Эффекты Sema4D на остеобласты частично могут быть связаны с ослаблением передачи сигналов IGF-1. Кроме того, Sema4D может индуцировать подвижность остеобластов за счет активации RhoA и влиять на локализацию остеобластов в нужном месте. Исследования in vivo также продемонстрировали, что Sema4D-специфические антитела могут защищать от потери костной массы у мышей OVX, способствуя образованию костной ткани. Недавние исследования также показали, что siRNA-Sema4D значительно увеличивает объем кости, объемную минеральную плотность кости и количество остеобластов в модели на крысах (Zhang et al., 2015, 2016).
Склеростин
Склеростин — это белок, который у человека кодируется геном SOST (Balemans et al., 2001). Склеростин экспрессируется в длинных костях и хрящах человека, а также в остеоцитах и оказывает антианаболическое действие на формирование костной ткани (Winkler et al. 2003). Kusu et al. (2003) обнаружили, что склеростин также экспрессируется в остеокластах мышей. Они также показали, что склеростин связывается с BMP6 и BMP7 с высокой аффинностью и ингибирует их активность в мышиных клетках MC3T3-E1.Однако Винклер и др. (2003) показали, что экспрессия SOST РНК не наблюдалась в человеческих остеокластах или клетках-предшественниках остеокластов человека. Ота и др. (2013) указали, что склеростин экспрессируется в остеокластах у старых мышей. Концентрированные условные среды (CCM) из остеокластов от 6-недельных или 12-месячных мышей усиливали остеогенез. Однако CCM мышей в возрасте от 18 до 24 месяцев ингибировали минерализацию. Кроме того, они наблюдали, что уровни мРНК и белка склеростина в остеокластах у 24-месячных мышей были значительно выше, чем у 6-недельных мышей.Если в CCM добавляли антитело против склеростина, подавление минерализации с помощью CCM отменялось. Остеокласты старых мышей могут иметь несколько иной фенотип по сравнению с молодыми мышами.
MicroRNA / exsomes
Было показано, что MicroRNAs также регулируют остеогенную активность и образование остеобластов костей (Lian et al., 2012). Доказано, что MiR-214-3p играет решающую роль в заболеваниях скелета, включая подавление остеогенной дифференцировки клеток миобластов (Shi et al.2013) и формирование кости (Wang et al., 2013). Недавнее исследование показало, что экзосомальный miR-214-3p, продуцируемый остеокластами, может влиять на формирование остеобластической кости (Li et al., 2016). Обильные miR-214-3P и экзосомальные miR-214-3p были обнаружены в зрелых остеокластах мыши, но не в зрелых остеобластах. Они обнаружили, что остеокластический miR-214-3P связан со сниженным образованием костной ткани у пожилых женщин с переломами и у мышей OVX. Используя специфичную для остеокластов модель мышей miR-214-3P с нокаутом, они также обнаружили, что костная масса была уменьшена, а трабекулярная архитектура была плохо организована по сравнению с мышами дикого типа.Гистологический анализ показал, что маркеры образования костной ткани, такие как скорость присоединения минералов и Ob.S / BS, у мышей с нокаутом miR-214-3P и (OC-miR-214-3p) были значительно ниже, чем у мышей в дикой природе. типа мышки. Когда остеобласты совместно культивировали с остеокластами OC-miR-214-3p, экспрессия генов, связанных с активностью остеобластов, была значительно снижена по сравнению с таковой в остеобластах, совместно культивируемых с остеокластами дикого типа. Кроме того, они показали, что активность остеобластов подавлялась, если специфическая для остеокластов miR-214-3P была перенесена в.Более того, они продемонстрировали, что экзосомальный miR-214-3p может переноситься от остеокластов к остеобластам. Они также показали, что происходящая из остеокластов экзосомальная miR-214-3p может захватываться остеобластами in vivo . Уровни мРНК генов формирования кости, таких как Alp , Opn и Bsp , были значительно ниже на и у мышей, которым вводили экзосомы OC-miR-214-3p. Формирование кости также было заметно подавлено. Наконец, они показали, что ингибирование специфической для остеокластов miR-214-3P усиливает образование кости у стареющих мышей OVX.Недавнее исследование также показало, что остеокласты продуцируют экзосомы, обогащенные miRNA, а экзосомы переносят miR-214 в остеобласты, чтобы ингибировать их активность (Sun et al., 2016). Активность остеобластов подавлялась у остеокласт-специфичных трансгенных мышей miR-214. Высокие уровни miR-214 наблюдались у пациентов с остеопорозом и мышей OVX. Это исследование также показало, что экссомы, полученные из остеокластов, распознают остеобласты через эфринA2 / EphA2. Эти два исследования показывают, что остеокласты могут влиять на остеобласты через экзосомы.
Кроме того, двунаправленная регуляция эфрин-EphB4 (Zhao et al., 2006), повтор тройной спирали коллагена, содержащий 1 (Cthrc 1) (Takeshita et al., 2013), и сфингозин-1-фосфат (S1P) (Ryu et al. ., 2006; Pederson et al., 2008) также играют важную роль в развитии перекрестного взаимодействия остеокластов и остеобластов. Для Ephrin-EphB4 прямая передача сигналов, опосредованная EPH (OC-OB), стимулирует дифференцировку остеобластов и индуцирует образование кости. Такешита и др. (Takeshita et al., 2013) обнаружили, что Cthrc1, белок, секретируемый зрелыми резорбирующими кость остеокластами, может стимулировать остеогенез.Остеокласт-специфическая делеция Cthrc1 вызвала остеопению из-за снижения костеобразования. Мыши с нокаутом Cthrc1 показали низкую костную массу, низкую скорость образования костной ткани и микроструктурные аномалии. Кроме того, зрелые остеокласты продуцируют и секретируют многие факторы, такие как WNT10B, BMP6, липид S1P, фактор роста гепатоцитов (Grano et al., 1996), Катпсин K (Kiviranta et al., 2001; Lotinun et al., 2013) и тартрат-резистентная кислая фосфатаза (TRAcP) (Teti, 2013) для стимуляции рекрутирования и выживания остеобластов.TGF-b и IGF-1, высвобождаемые из костного матрикса во время остеокластической резорбции кости, также играют важную роль в активности остеобластов (Tang et al., 2009; Xian et al., 2012), такой как экспрессия RANKL и миграция клеток.
Таким образом, гомеостаз кости имеет решающее значение для нормального функционирования и структуры кости. Гомеостаз зависит от взаимодействия остеобластов и остеокластов. В этом прогрессе участвуют многие цитокины, гормоны и сигнальные пути. Путь OPG / RANKL / RANK — одно из важных достижений в биологии костных клеток, которое свидетельствует о том, что остеобласты могут регулировать остеокласты.Последующие исследования также показали, что остеокласты также влияют на активность остеобластов или формирование кости. Схематическое изображение взаимодействия остеобластов и остеокластов было показано на рис. Понимание взаимосвязи между остеобластами и остеокластами важно для открытия и разработки новых препаратов против остеопороза. Мы полагаем, что дополнительные исследования выявят все больше и больше новых молекул, которые обеспечивают связь между этими двумя клетками. Между тем, необходимы дальнейшие исследования для выяснения известных путей передачи сигнала.
Схематическое изображение взаимодействий остеобластов и остеокластов. Остеобласты могут усиливать пролиферацию, дифференцировку, выживаемость, апоптоз или слияние за счет фактора колонистимуляции макрофагов (M-CSF) / C-Fms, активатора рецептора лиганда ядерного фактора-κB (RANKL), рецептора лизофосфатидной кислоты / лизофосфатидной кислоты (LPA / LPAR) и Fas / FasL (FADD, домен смерти, связанный с Fas). Остеобласты также ингибируют () дифференцировку, пролиферацию или выживание остеокластов под действием остеопротегерина (OPG), RANKL / LGR4 и Sema3A / Nrp1.Остеокласты могут способствовать дифференцировке остеобластов с помощью Компонента 3а комплемента (CC3) / рецептора CC3 (CC3R) и эфринаB2. Изоформа D2 вакуолярной (H +) АТФазы (v-АТФаза) домена V0 (Atp6v0d2), семафорин 4D, склеростин, микроРНК (miR-214 и miR-214-3p) или экзосомы из остеокластов могут ингибировать (⊥) дифференцировку или активность остеобласт. Также существуют двунаправленные взаимодействия (EphB4-ephrinB2) между остеобластами и остеокластами.
Взаимодействие остеобластов и остеокластов
Abstract
Гомеостаз кости зависит от резорбции кости остеокластами и образования кости остеобластами.Дисбаланс этого тесно связанного процесса может вызвать такие заболевания, как остеопороз. Таким образом, механизмы, регулирующие связь между остеокластами и остеобластами, имеют решающее значение для биологии костных клеток. Было показано, что остеобласты и остеокласты могут связываться друг с другом посредством прямого межклеточного контакта, цитокинов и взаимодействия внеклеточного матрикса. Остеобласты могут влиять на формирование, дифференцировку или апоптоз остеокластов несколькими путями, такими как OPG / RANKL / RANK, LGR4 / RANKL / RANK, Ephrin2 / ephB4 и пути Fas / FasL.Напротив, остеокласты также влияют на формирование кости остеобластами через изоформу d2 вакуолярной (H +) АТФазы (v-АТФаза) домена V0 (Atp6v0d2), компонент комплемента 3a, семафорин 4D или микроРНК. Кроме того, цитокины, высвобождаемые из резорбированного костного матрикса, такие как TGF-β и IGF-1, также влияют на активность остеобластов. Было выполнено несколько обзоров связи остеобластов и остеокластов. Однако немногие обзоры показывают успехи исследований за последние годы. В этом обзоре мы обобщили текущие знания о коммуникации остеобластов и остеокластов.
Ключевые слова: ремоделирование кости, остеобласт, остеокласт, коммуникация
Кость находится в постоянном состоянии ремоделирования, что важно для поддержания нормальной структуры и функции скелета. Таким образом, дисбаланс может привести к такому заболеванию, как остеопороз. В процесс ремоделирования кости вовлечены многие типы клеток и факторов. Остеобласт и остеокласт — две основные клетки, участвующие в этом прогрессе (Matsuo and Irie, 2008). Остеокласты отвечают за резорбцию старой кости, а остеобласты отвечают за образование новой кости (Matsuoka et al., 2014). Резорбция и формирование стабильны при физиологических условиях. Однако при нарушении баланса архитектура или функция костей будут ненормальными. Возникают заболевания костного метаболизма, такие как остеопороз или остеопетроз (Zaidi, 2007).
Многие цитокины, гормоны и сигнальные пути участвуют в ремоделировании костей (Matsuo and Irie, 2008). Было показано, что остеобласты и остеокласты могут связываться друг с другом посредством прямого межклеточного контакта, цитокинов или клеточно-костного матрикса (Tamma and Zallone, 2012).Молекулярные механизмы клеточной коммуникации между остеобластами и остеокластами являются одной из центральных проблем в биологии костных клеток (Mundy and Elefteriou, 2006). Связь между остеобластами и остеокластами происходит на разных стадиях дифференцировки (Matsuo and Irie, 2008). Более ранние исследования показали, что остеобласты могут регулировать образование остеокластов (Rodan and Martin, 1981). Впоследствии все больше и больше исследований показали, что остеокласты также могут влиять на активность остеобластов (Matsuoka et al., 2014; Wang et al., 2015).
Было выполнено несколько обзоров взаимодействия остеобластов и остеокластов (Matsuo and Irie, 2008; Tamma and Zallone, 2012). Однако в последние годы было опубликовано мало обзоров. В этом кратком обзоре мы освещаем основные достижения в исследованиях связи между остеобластами и остеокластами.
Роль остеобластов в образовании остеокластов
Межклеточный контакт
Было показано, что остеобласты могут связываться с остеокластами посредством прямого контакта.Когда эти две клетки контактируют, они могут образовывать щелевые контакты, и небольшие водорастворимые молекулы могут проходить между двумя типами клеток. Everts et al. (2002) показали, что клетки выстилки кости, субпопуляция остеобластов, находятся в тесном контакте с остеокластами, прикрепленными к кости. Инициирование остеокластогенеза в основном зависит от взаимодействия между этими двумя клетками (Everts et al., 2002; Matsuo and Irie, 2008). Просвечивающая электронная микрофотография также показала, что существует прямой контакт между зрелыми остеокластами и остеобластами, а основная многоклеточная единица является местом межклеточного контакта (Matsuo and Irie, 2008).
Ephrin2 / ephB4
Костные клетки и их предшественники экспрессируют ephs и ephrins (Tamma and Zallone, 2012). Zhao et al. (2006) показали, что существуют другие двунаправленные регуляции между остеобластами и остеокластами. Эта регуляция опосредована трансмембранным лигландом, ephrin2, на остеокласте и рецепторной тирозинкиназой, ephB4, на остеобласте и остеоцитах. Остеобласты могут ингибировать образование остеокластов с помощью ephb4, а остеокласты могут стимулировать дифференцировку остеобластов с помощью эфрина2.Прямая передача сигналов, опосредованная EPH (OC-OB), стимулирует дифференцировку остеобластов и индуцирует образование кости; обратная передача сигналов, опосредованная эфрином (OB-OC), ингибирует резорбцию кости. Кроме того, Zhao et al. (2006) показали, что передача сигналов ephrinB2 ингибирует остеокластогенез путем блокирования индукции Fos и его транскрипционной мишени Nfatc1, которая индуцируется RANKL. Кроме того, известно, что передача сигналов EphB4 индуцирует остеогенные регуляторные факторы, такие как Dlx5, Osx и Runx2.
MSF / MCP-1
Остеобласты могут секретировать колониестимулирующие макрофаги (M-CSF) (Lacey et al., 1994), который связывается со своим рецептором c-Fms, экспрессируемым на макрофагах и остеокластах (Wiktor-Jedrzejczak et al., 1990). Количество остеокластов у мышей с нокаутом M-CSF было очевидно уменьшено по сравнению с мышами дикого типа. M-CSF является важным цитокином для выживания, дифференцировки, миграции клеток и активности макрофагов и остеокластов (Wiktor-Jedrzejczak et al., 1990; Kim and Kim, 2016). M-CSF также усиливал дифференцировку предшественников костного мозга в предшественники остеокластов и активировал экспрессию рецептора-активатора ядерного фактора κB (RANK) в предшественниках костного мозга (Sambandam et al., 2010).
Остеобласты также могут продуцировать хемоаттрактантный белок-1 моноцитов (MCP-1 или CCL2) (Graves et al., 1999), который является кандидатом в рекрутеры предшественников остеокластов (Li et al., 2007). МСР-1 связывается с рецептором, экспрессируемым в предшественниках остеокластов, а затем циркулирующий предшественник остеокластов позиционирует поверхность кости, чтобы дифференцироваться в активный остеокласт. Однако в нормальной кости MCP-1 не экспрессируется. Воспаление может стимулировать экспрессию MCP-1 в остеобластах.
OPG / RANKL / RANK
До открытия RANKL, OPG и RANK многие группы наблюдали, что остеобласты продуцируют цитокины для регулирования дифференцировки и образования остеокластов.
В 1990-х четыре группы независимо обнаружили, что OPG / RANKL играет критическую роль во время образования остеокластов (Boyce and Xing, 2008). Сначала они обнаружили, что OPG защищает от потери костной массы (Simonet et al., 1997; Yasuda et al., 1998a), а затем они обнаружили его лиганд (OPGL), используя OPG в качестве зонда (Lacey et al., 1998; Yasuda et al., др., 1998b). Кроме того, OPGL был идентифицирован как член суперсемейства TNF, который называется активатором рецептора лигланда ядерного фактора-kb (RANKL) (Anderson et al., 1997), или цитокин, индуцированный активацией, связанной с TNF (TRANCE) (Wong et al., 1997). RANK был обнаружен другой группой, когда они секвенировали кДНК из библиотеки кДНК миелоидных дендритных клеток, полученных из костного мозга человека, и было обнаружено, что это рецептор для OPGL (Dougall et al., 1999).
OPG также называют фактором ингибирования остеокластогенеза (OCIF). OPG продуцируется многими типами клеток, помимо остеобластов, такими как клетки сердца, печени и селезенки. Было показано, что B-клетки являются основным источником OPG в костном мозге мышей, на долю которых приходится 64% всей продукции OPG костным мозгом (Li et al., 2007). Остеопетроз наблюдается у трансгенных мышей, сверхэкспрессирующих OPG из-за отсутствия остеокластов (Simonet et al., 1997), у мышей с нокаутом OPG наблюдается остеопороз из-за нерегулируемых остеокластов (Bucay et al., 1998). OPG, как рецептор-ловушка, может связываться с RANKL и блокировать его связывание и активацию с помощью RANK (Boyle et al., 2003). Следовательно, основной сигнальный путь дифференцировки и активации остеокластов был заблокирован. Экспрессия OPG в остеобластах регулируется количеством гормонов, цитокинов и факторов роста (Theoleyre et al., 2004), такие как эстроген, 1,25 (OH) 2 D 3 и TNF.
RANKL также называют фактором дифференцировки остеокластов (ODF), цитокином, вызванным активацией TNF (TRANCE) и лигландом остеопротегерина (OPGL) (Lacey et al. 1998). Общепринятая номенклатура, RANKL, была учреждена Американским обществом исследования костных минералов в 2000 году (Комитет по номенклатуре при президенте Американского общества исследований костей и минералов). RANKL высоко экспрессируется в остеобластах, активированных Т-клетках, лимфатических узлах, тимусе, молочных железах и легких и слабо экспрессируется в костном мозге (Kearns et al., 2008). RANKL обычно связан с мембраной остеобластов (Kearns et al., 2008). Секретируемый белок происходит из мембранной формы в результате протеолитического расщепления или альтернативного сплайсинга (Ikeda et al. 2001). RANKL может связываться со своим рецептором RANK, который экспрессируется на остеокластических клетках-предшественниках, и активирует нисходящие сигнальные пути, связанные с ростом и дифференцировкой клеток (Boyle et al., 2003). Различные цитокины, гормоны и факторы роста могут регулировать экспрессию RANKL, включая ПТГ, эстроген и воспалительные цитокины.Соотношение OPG / RANKL критически влияет на формирование остеокластов.
RANK представляет собой трансмембранный белок типа I, входящий в суперсемейство рецепторов TNF. Он высоко экспрессируется на мембранах предшественников остеокластов, зрелых остеокластах, дендритных клетках и молочных железах (Fata et al., 2000). Раковые опухоли с высоким метастатическим потенциалом в кости также выражают RANK, например, рак груди и простаты (Kim et al. 2006). RANK связывается со своим лигандом RANKL, а затем активирует семейство факторов, связанных с рецептором TNF (TRAF), включая TRAF 2,5 и 6.Однако сам по себе TRAF6 может индуцировать остеокластогенез (Kadono 2001) и необходим для активации путей внутриклеточной передачи сигналов (Kim et al., 1999). RANK / TRAF регулирует образование, активацию и выживание остеокластов посредством различных сигнальных путей (Boyle et al., 2003), включая JNK / AP-1, IκK / NF-κB, c-myc и кальциневрин / NFATc1 для образования остеокластов; src и MKK6 / p38 / MITF для активации.
LGR4 / RANKL / RANK
Недавнее исследование показало, что рецептор 4, связанный с G-белком, содержащий богатые лейцином повторы (LGR4, также называемый GPR48), также является рецептором для RANKL (Luo et al., 2016). RANKL может напрямую взаимодействовать с человеческим LGR4. Они также подтвердили, что LGR4 экспрессируется в остеокластах. Исследование in vivo показало, что низкая костная масса и гиперактивация остеокластов наблюдались у мышей с дефицитом Lgr4 . Количество, площадь поверхности и размер остеокластов были заметно выше у мышей с дефицитом Lgr4 по сравнению с таковыми у контрольных мышей. Исследования in vitro показали, что дефицит Lgr4 способствует образованию остеокластов и ингибирует их апоптоз.Дополнительные данные показали, что индуцированный потерей Lgr4 остеокластогенез не зависел от лиганда LGR4, R-спондина1 или норрина. Однако LGR4 ингибировал связывание RANKL с RANK дозозависимым образом, что указывает на то, что LGR4 конкурирует с RANK за связывание с RANKL. Нижестоящие сигнальные пути дифференцировки и выживания остеокластов были ослаблены. LGR4 может действовать как еще один рецептор-ловушка для RANKL.
Sema3A / Nrp
Семафорины представляют собой молекулы, направляющие конус роста аксонов, которые участвуют во взаимодействии между остеобластами и остеокластами (Negishi-Koga et al., 2011). Hayashi et al. (Hayashi et al., 2012) идентифицировали некоторые белки, секретируемые остеобластами, которые ингибируют дифференцировку остеокластов. Они обнаружили, что молекула управления аксоном Sema3A может играть важную роль. Они также показали, что рекомбинантный Sema3A может ингибировать дифференцировку остеокластов дозозависимым образом. МРНК Sema3A может быть обнаружена в изолированных остеобластах и остеоцитах. Они показали, что ингибирующие эффекты Sema3A на дифференцировку остеокластов отменяются, когда экспрессия NRP1 подавляется короткой shРНК.Более того, они наблюдали, что Sema3A не может ингибировать дифференцировку остеокластов, если у гена Nrp1 и отсутствует сайт связывания Sema. Впоследствии они продемонстрировали, что Sema3A ингибирует остеокластогенез, связываясь с Nrp1. Индуцированное Sema3A ингибирование дифференцировки остеокластов может быть опосредовано регуляцией индуцированной DAP12 передачи сигналов ITAM. Nrp1 может конкурировать с TREM2 за PlxnA1 и действует как супрессор сигнала, индуцированного PlxnA1-TREM2-DAP12.
Лизофосфатидная кислота (LPA)
LPA — это мощный биоактивный фосфолипид (Hosogaya et al., 2008). LPA продуцируется несколькими типами клеток, включая активированные тромбоциты и остеобласты (Sims et al., 2013). LPA, происходящая из остеобластов, может регулировать активность опухолевых клеток в скелетной микроокружении и остеокластах (Panupinthu et al., 2008). Рецептор LPA, LPA1, LPA2, LPA4 и LPA5 экспрессируется на высоком или низком уровне в остеокластах (Del Fattore et al., 2008). McMichael et al. показали, что LPA усиливает слияние клеток-предшественников остеокластов (McMichael et al., 2010), и LPA требуется для остеокластогенеза (David et al., 2010). LPA может регулировать передачу сигналов кальция и индуцировать накопление в ядрах NFATc1 в остеокластах (Lapierre et al., 2010), который является важными путями передачи сигналов для образования остеокластов (Boyle et al., 2003). Кроме того, Lapierre et al. (2010) также показали, что LPA может подавлять апоптоз остеокластов и вызывать изменение морфологии зрелых остеокластов. Дальнейшие исследования показали, что лечение LPA приводит к увеличению размера остеокластов, сопровождающемуся увеличением числа ядер (McMichael et al., 2010).
Апоптоз остеокластов, индуцированный остеобластами
Эстроген может вызывать апоптоз остеокластов (Kousteni et al., 2002). Накамура и др. (Nakamura et al., 2007) показали, что эстроген-индуцированный апоптоз остеокластов связан с индукцией ассоциированного с фактором суицидного лиганда (FasL) в этих же клетках. Однако Крам и его коллеги (Krum et al., 2008) обнаружили, что эстроген влияет на выживаемость остеокластов за счет активации FasL в остеобластах, что приводит к апоптозу преостеокластов.Кроме того, они обнаружили, что тамоксифен и ралоксифен также индуцируют преостеокласты с помощью того же остеобласт-зависимого механизма. Гарсия и др. (Garcia et al., 2013) также показали, что индуцированный 17b-эстрадиолом (E2) апоптоз остеокластов опосредуется расщеплением и солюбилизацией экспрессируемого остеобластами FasL. E2 может активировать экспрессию матриксной металлопротеиназы-3 (MMP3), а затем MMP3 расщепляет полноразмерный FasL на растворимый FasL. В присутствии специфического ингибитора MMP3 происходило снижение обширного расщепления и концентрации растворимого FasL.Недавно Wang et al. (2015) также показали, что остеобласты индуцируют апоптоз остеокластов с помощью передачи сигналов лиганда FAS (FASL) / FAS. Условный нокаут FasL в остеобластах вызывал увеличение количества и активности остеокластов. Более того, они указали, что экспрессия FasL была подавлена в остеобластах мышей с остеопорозом после овариэктомии по сравнению с фиктивной контрольной группой. Затем они обнаружили, что остеобласты с нокаутом FasL из фиктивного контроля показали слабую способность индуцировать апоптоз остеокластов, а сверхэкспрессия FasL в остеобластах, полученных из OVX, показала повышенную способность индуцировать апоптоз остеокластов.Остеобласт-индуцированный апоптоз остеокластов с помощью FasL играет важную роль в остеопорозе OVX. Кроме того, с использованием мышей с FASL-дефицитом (FasL cKO), предшественников остеобластов / остеобластов, они обнаружили, что блокирование RANKL показало ограниченную роль в снижении активности остеокластов у мышей FasL cKO. Wang et al. (Wang et al., 2015) также показали, что предшественники остеокластов имеют более низкую экспрессию FAS по сравнению со зрелыми остеокластами. Предшественники остеокластов могут иметь низкую чувствительность к апоптозу, индуцированному остеобластами по пути FASL / FAS.
Роль остеокластов в формировании кости
Atp6v0d2
Atp6v0d2 — это аббревиатура d2 изоформы вакуолярной (H +) АТФазы (v-ATPase) V0 домена. Он высоко экспрессируется в остеокластах (Rho et al., 2002). Однако мало что известно о функциональной важности Atp6v0d2 (Rho et al., 2002). Ли и др. (2006) показали, что у мышей Atp6v0d2 — / — наблюдалось заметное увеличение костной массы и уменьшение объема костно-мозговой полости. Между тем, площадь поверхности остеокластов и количество многоядерных TRAP-положительных клеток были уменьшены.Однако количество мононуклеарных TRAP + -клеток было немного увеличено. Эти данные показали, что Atp6v0d2 — / — может влиять на созревание остеокластов, но не на дифференцировку. Кроме того, они обнаружили, что Atp6v0d2 был связан со слиянием клеток. Образование зрелых гигантских остеокластов снижалось в отсутствие Atp6v0d2. Кроме того, заметное увеличение количества остеобластов и образования костей также наблюдалось у мышей Atp6v0d2 — / -. Однако дифференцировка остеобластов и экспрессия генов, связанных с дифференцировкой, не изменилась.Авт. Предположили, что повышенная активность остеобластов у Atp6v0d2 — / — мышей может быть связана с внешними факторами остеобластов, продуцируемыми мутантными остеокластами или их предшественниками. Atp6v0d2 может иметь большой потенциал в качестве мишени для лечения остеопороза из-за его роли в остеокластах и формировании костей.
Компонент комплемента 3a
Matsuoka et al. (2014) установили систему совместного культивирования остеобластов и зрелых остеокластов для влияния остеокластов на остеобластогенез.Они очистили пептид, последовательность которого соответствует компоненту 3 комплемента (C3), из условной среды (CM) зрелых остеокластов. C3 прогрессивно увеличивался во время дифференцировки остеокластов. Они обнаружили, что биоактивный фрагмент C3 3a может стимулировать дифференцировку остеобластов и что рецептор C3a экспрессируется в линиях стромальных клеток, а также в первичных остеобластах свода черепа. Когда экспрессия гена C3 была подавлена в остеокластах, CM остеокласта не стимулировала дифференцировку остеобластов.Однако активность остеобластов в отношении щелочной фосфатазы (ЩФ) ингибировалась СМ в присутствии антагониста C3aR, и один антагонист C3aR не влиял на активность ЩФ. Все эти данные предполагают, что C3a в CM ответственен за усиление активности ALP. Кроме того, они показали, что активность ЩФ увеличивалась, если агонист C3aR был добавлен к культуре остеобластов. Впоследствии они обнаружили, что экспрессия C3a в кости увеличивается у мышей, получавших OVX, с чрезмерной активацией остеокластов.Антагонист C3aR ингибировал стимуляцию образования кости у мышей OVX. Потеря костной массы и повреждение трабекулярной архитектуры также усугублялись. Эти результаты предполагают, что C3a может обеспечивать связь резорбции кости с образованием в модели с высоким оборотом.
Семафорин 4D
Семафорин 4D (Sema4D) представляет собой молекулу, направляющую аксоны. Негиши-Кога и др. (2011) показали, что остеокласты в высокой степени экспрессируют Sema4D, а Sema4D сильно ингибирует образование костей через свой рецептор плексин-B1, экспрессируемый остеобластами.Масса кости, толщина трабекул и прочность костей, очевидно, были увеличены у мышей Sema4D — / — по сравнению с мышами дикого типа. Кроме того, заметно увеличивалась поверхность остеобластов и скорость образования кости. Однако резорбция костной ткани остеокластом была нормальной. Эти данные предполагают, что высокая костная масса у мышей Sema4D — / — была связана с увеличением образования остеобластической кости. Дальнейшее исследование показало, что добавление Sema4D ингибировало образование костных узелков, активность ЩФ и экспрессию остеобластных генов.Плексин-B1 высоко экспрессируется во время дифференцировки остеобластов. Плексин-B1 образует рецепторный комплекс с гомологом 2 вирусного онкогена эритробластного лейкоза (ErbB2) в остеобластах. Связывание Smea4d с Plexin-B1 индуцировало фосфорилирование ErB2, который играет роль киназы в остеобластах. Однако добавление Sema4D все еще немного подавляло образование костей в Plxnb1 — / — клетках, это указывает на то, что др. Рецепторы могут частично участвовать в эффектах Sema4D на остеобласты. Впоследствии они обнаружили, что связывание Sema4D с рецепторным комплексом Plexin-b1-ErbB2 может индуцировать активацию RhoA, которая опосредует фосфорилирование IRS-1.Эффекты Sema4D на остеобласты частично могут быть связаны с ослаблением передачи сигналов IGF-1. Кроме того, Sema4D может индуцировать подвижность остеобластов за счет активации RhoA и влиять на локализацию остеобластов в нужном месте. Исследования in vivo также продемонстрировали, что Sema4D-специфические антитела могут защищать от потери костной массы у мышей OVX, способствуя образованию костной ткани. Недавние исследования также показали, что siRNA-Sema4D значительно увеличивает объем кости, объемную минеральную плотность кости и количество остеобластов в модели на крысах (Zhang et al., 2015, 2016).
Склеростин
Склеростин — это белок, который у человека кодируется геном SOST (Balemans et al., 2001). Склеростин экспрессируется в длинных костях и хрящах человека, а также в остеоцитах и оказывает антианаболическое действие на формирование костной ткани (Winkler et al. 2003). Kusu et al. (2003) обнаружили, что склеростин также экспрессируется в остеокластах мышей. Они также показали, что склеростин связывается с BMP6 и BMP7 с высокой аффинностью и ингибирует их активность в мышиных клетках MC3T3-E1.Однако Винклер и др. (2003) показали, что экспрессия SOST РНК не наблюдалась в человеческих остеокластах или клетках-предшественниках остеокластов человека. Ота и др. (2013) указали, что склеростин экспрессируется в остеокластах у старых мышей. Концентрированные условные среды (CCM) из остеокластов от 6-недельных или 12-месячных мышей усиливали остеогенез. Однако CCM мышей в возрасте от 18 до 24 месяцев ингибировали минерализацию. Кроме того, они наблюдали, что уровни мРНК и белка склеростина в остеокластах у 24-месячных мышей были значительно выше, чем у 6-недельных мышей.Если в CCM добавляли антитело против склеростина, подавление минерализации с помощью CCM отменялось. Остеокласты старых мышей могут иметь несколько иной фенотип по сравнению с молодыми мышами.
MicroRNA / exsomes
Было показано, что MicroRNAs также регулируют остеогенную активность и образование остеобластов костей (Lian et al., 2012). Доказано, что MiR-214-3p играет решающую роль в заболеваниях скелета, включая подавление остеогенной дифференцировки клеток миобластов (Shi et al.2013) и формирование кости (Wang et al., 2013). Недавнее исследование показало, что экзосомальный miR-214-3p, продуцируемый остеокластами, может влиять на формирование остеобластической кости (Li et al., 2016). Обильные miR-214-3P и экзосомальные miR-214-3p были обнаружены в зрелых остеокластах мыши, но не в зрелых остеобластах. Они обнаружили, что остеокластический miR-214-3P связан со сниженным образованием костной ткани у пожилых женщин с переломами и у мышей OVX. Используя специфичную для остеокластов модель мышей miR-214-3P с нокаутом, они также обнаружили, что костная масса была уменьшена, а трабекулярная архитектура была плохо организована по сравнению с мышами дикого типа.Гистологический анализ показал, что маркеры образования костной ткани, такие как скорость присоединения минералов и Ob.S / BS, у мышей с нокаутом miR-214-3P и (OC-miR-214-3p) были значительно ниже, чем у мышей в дикой природе. типа мышки. Когда остеобласты совместно культивировали с остеокластами OC-miR-214-3p, экспрессия генов, связанных с активностью остеобластов, была значительно снижена по сравнению с таковой в остеобластах, совместно культивируемых с остеокластами дикого типа. Кроме того, они показали, что активность остеобластов подавлялась, если специфическая для остеокластов miR-214-3P была перенесена в.Более того, они продемонстрировали, что экзосомальный miR-214-3p может переноситься от остеокластов к остеобластам. Они также показали, что происходящая из остеокластов экзосомальная miR-214-3p может захватываться остеобластами in vivo . Уровни мРНК генов формирования кости, таких как Alp , Opn и Bsp , были значительно ниже на и у мышей, которым вводили экзосомы OC-miR-214-3p. Формирование кости также было заметно подавлено. Наконец, они показали, что ингибирование специфической для остеокластов miR-214-3P усиливает образование кости у стареющих мышей OVX.Недавнее исследование также показало, что остеокласты продуцируют экзосомы, обогащенные miRNA, а экзосомы переносят miR-214 в остеобласты, чтобы ингибировать их активность (Sun et al., 2016). Активность остеобластов подавлялась у остеокласт-специфичных трансгенных мышей miR-214. Высокие уровни miR-214 наблюдались у пациентов с остеопорозом и мышей OVX. Это исследование также показало, что экссомы, полученные из остеокластов, распознают остеобласты через эфринA2 / EphA2. Эти два исследования показывают, что остеокласты могут влиять на остеобласты через экзосомы.
Кроме того, двунаправленная регуляция эфрин-EphB4 (Zhao et al., 2006), повтор тройной спирали коллагена, содержащий 1 (Cthrc 1) (Takeshita et al., 2013), и сфингозин-1-фосфат (S1P) (Ryu et al. ., 2006; Pederson et al., 2008) также играют важную роль в развитии перекрестного взаимодействия остеокластов и остеобластов. Для Ephrin-EphB4 прямая передача сигналов, опосредованная EPH (OC-OB), стимулирует дифференцировку остеобластов и индуцирует образование кости. Такешита и др. (Takeshita et al., 2013) обнаружили, что Cthrc1, белок, секретируемый зрелыми резорбирующими кость остеокластами, может стимулировать остеогенез.Остеокласт-специфическая делеция Cthrc1 вызвала остеопению из-за снижения костеобразования. Мыши с нокаутом Cthrc1 показали низкую костную массу, низкую скорость образования костной ткани и микроструктурные аномалии. Кроме того, зрелые остеокласты продуцируют и секретируют многие факторы, такие как WNT10B, BMP6, липид S1P, фактор роста гепатоцитов (Grano et al., 1996), Катпсин K (Kiviranta et al., 2001; Lotinun et al., 2013) и тартрат-резистентная кислая фосфатаза (TRAcP) (Teti, 2013) для стимуляции рекрутирования и выживания остеобластов.TGF-b и IGF-1, высвобождаемые из костного матрикса во время остеокластической резорбции кости, также играют важную роль в активности остеобластов (Tang et al., 2009; Xian et al., 2012), такой как экспрессия RANKL и миграция клеток.
Таким образом, гомеостаз кости имеет решающее значение для нормального функционирования и структуры кости. Гомеостаз зависит от взаимодействия остеобластов и остеокластов. В этом прогрессе участвуют многие цитокины, гормоны и сигнальные пути. Путь OPG / RANKL / RANK — одно из важных достижений в биологии костных клеток, которое свидетельствует о том, что остеобласты могут регулировать остеокласты.Последующие исследования также показали, что остеокласты также влияют на активность остеобластов или формирование кости. Схематическое изображение взаимодействия остеобластов и остеокластов было показано на рис. Понимание взаимосвязи между остеобластами и остеокластами важно для открытия и разработки новых препаратов против остеопороза. Мы полагаем, что дополнительные исследования выявят все больше и больше новых молекул, которые обеспечивают связь между этими двумя клетками. Между тем, необходимы дальнейшие исследования для выяснения известных путей передачи сигнала.
Схематическое изображение взаимодействий остеобластов и остеокластов. Остеобласты могут усиливать пролиферацию, дифференцировку, выживаемость, апоптоз или слияние за счет фактора колонистимуляции макрофагов (M-CSF) / C-Fms, активатора рецептора лиганда ядерного фактора-κB (RANKL), рецептора лизофосфатидной кислоты / лизофосфатидной кислоты (LPA / LPAR) и Fas / FasL (FADD, домен смерти, связанный с Fas). Остеобласты также ингибируют () дифференцировку, пролиферацию или выживание остеокластов под действием остеопротегерина (OPG), RANKL / LGR4 и Sema3A / Nrp1.Остеокласты могут способствовать дифференцировке остеобластов с помощью Компонента 3а комплемента (CC3) / рецептора CC3 (CC3R) и эфринаB2. Изоформа D2 вакуолярной (H +) АТФазы (v-АТФаза) домена V0 (Atp6v0d2), семафорин 4D, склеростин, микроРНК (miR-214 и miR-214-3p) или экзосомы из остеокластов могут ингибировать (⊥) дифференцировку или активность остеобласт. Также существуют двунаправленные взаимодействия (EphB4-ephrinB2) между остеобластами и остеокластами.
Взаимодействие остеобластов и остеокластов
Abstract
Гомеостаз кости зависит от резорбции кости остеокластами и образования кости остеобластами.Дисбаланс этого тесно связанного процесса может вызвать такие заболевания, как остеопороз. Таким образом, механизмы, регулирующие связь между остеокластами и остеобластами, имеют решающее значение для биологии костных клеток. Было показано, что остеобласты и остеокласты могут связываться друг с другом посредством прямого межклеточного контакта, цитокинов и взаимодействия внеклеточного матрикса. Остеобласты могут влиять на формирование, дифференцировку или апоптоз остеокластов несколькими путями, такими как OPG / RANKL / RANK, LGR4 / RANKL / RANK, Ephrin2 / ephB4 и пути Fas / FasL.Напротив, остеокласты также влияют на формирование кости остеобластами через изоформу d2 вакуолярной (H +) АТФазы (v-АТФаза) домена V0 (Atp6v0d2), компонент комплемента 3a, семафорин 4D или микроРНК. Кроме того, цитокины, высвобождаемые из резорбированного костного матрикса, такие как TGF-β и IGF-1, также влияют на активность остеобластов. Было выполнено несколько обзоров связи остеобластов и остеокластов. Однако немногие обзоры показывают успехи исследований за последние годы. В этом обзоре мы обобщили текущие знания о коммуникации остеобластов и остеокластов.
Ключевые слова: ремоделирование кости, остеобласт, остеокласт, коммуникация
Кость находится в постоянном состоянии ремоделирования, что важно для поддержания нормальной структуры и функции скелета. Таким образом, дисбаланс может привести к такому заболеванию, как остеопороз. В процесс ремоделирования кости вовлечены многие типы клеток и факторов. Остеобласт и остеокласт — две основные клетки, участвующие в этом прогрессе (Matsuo and Irie, 2008). Остеокласты отвечают за резорбцию старой кости, а остеобласты отвечают за образование новой кости (Matsuoka et al., 2014). Резорбция и формирование стабильны при физиологических условиях. Однако при нарушении баланса архитектура или функция костей будут ненормальными. Возникают заболевания костного метаболизма, такие как остеопороз или остеопетроз (Zaidi, 2007).
Многие цитокины, гормоны и сигнальные пути участвуют в ремоделировании костей (Matsuo and Irie, 2008). Было показано, что остеобласты и остеокласты могут связываться друг с другом посредством прямого межклеточного контакта, цитокинов или клеточно-костного матрикса (Tamma and Zallone, 2012).Молекулярные механизмы клеточной коммуникации между остеобластами и остеокластами являются одной из центральных проблем в биологии костных клеток (Mundy and Elefteriou, 2006). Связь между остеобластами и остеокластами происходит на разных стадиях дифференцировки (Matsuo and Irie, 2008). Более ранние исследования показали, что остеобласты могут регулировать образование остеокластов (Rodan and Martin, 1981). Впоследствии все больше и больше исследований показали, что остеокласты также могут влиять на активность остеобластов (Matsuoka et al., 2014; Wang et al., 2015).
Было выполнено несколько обзоров взаимодействия остеобластов и остеокластов (Matsuo and Irie, 2008; Tamma and Zallone, 2012). Однако в последние годы было опубликовано мало обзоров. В этом кратком обзоре мы освещаем основные достижения в исследованиях связи между остеобластами и остеокластами.
Роль остеобластов в образовании остеокластов
Межклеточный контакт
Было показано, что остеобласты могут связываться с остеокластами посредством прямого контакта.Когда эти две клетки контактируют, они могут образовывать щелевые контакты, и небольшие водорастворимые молекулы могут проходить между двумя типами клеток. Everts et al. (2002) показали, что клетки выстилки кости, субпопуляция остеобластов, находятся в тесном контакте с остеокластами, прикрепленными к кости. Инициирование остеокластогенеза в основном зависит от взаимодействия между этими двумя клетками (Everts et al., 2002; Matsuo and Irie, 2008). Просвечивающая электронная микрофотография также показала, что существует прямой контакт между зрелыми остеокластами и остеобластами, а основная многоклеточная единица является местом межклеточного контакта (Matsuo and Irie, 2008).
Ephrin2 / ephB4
Костные клетки и их предшественники экспрессируют ephs и ephrins (Tamma and Zallone, 2012). Zhao et al. (2006) показали, что существуют другие двунаправленные регуляции между остеобластами и остеокластами. Эта регуляция опосредована трансмембранным лигландом, ephrin2, на остеокласте и рецепторной тирозинкиназой, ephB4, на остеобласте и остеоцитах. Остеобласты могут ингибировать образование остеокластов с помощью ephb4, а остеокласты могут стимулировать дифференцировку остеобластов с помощью эфрина2.Прямая передача сигналов, опосредованная EPH (OC-OB), стимулирует дифференцировку остеобластов и индуцирует образование кости; обратная передача сигналов, опосредованная эфрином (OB-OC), ингибирует резорбцию кости. Кроме того, Zhao et al. (2006) показали, что передача сигналов ephrinB2 ингибирует остеокластогенез путем блокирования индукции Fos и его транскрипционной мишени Nfatc1, которая индуцируется RANKL. Кроме того, известно, что передача сигналов EphB4 индуцирует остеогенные регуляторные факторы, такие как Dlx5, Osx и Runx2.
MSF / MCP-1
Остеобласты могут секретировать колониестимулирующие макрофаги (M-CSF) (Lacey et al., 1994), который связывается со своим рецептором c-Fms, экспрессируемым на макрофагах и остеокластах (Wiktor-Jedrzejczak et al., 1990). Количество остеокластов у мышей с нокаутом M-CSF было очевидно уменьшено по сравнению с мышами дикого типа. M-CSF является важным цитокином для выживания, дифференцировки, миграции клеток и активности макрофагов и остеокластов (Wiktor-Jedrzejczak et al., 1990; Kim and Kim, 2016). M-CSF также усиливал дифференцировку предшественников костного мозга в предшественники остеокластов и активировал экспрессию рецептора-активатора ядерного фактора κB (RANK) в предшественниках костного мозга (Sambandam et al., 2010).
Остеобласты также могут продуцировать хемоаттрактантный белок-1 моноцитов (MCP-1 или CCL2) (Graves et al., 1999), который является кандидатом в рекрутеры предшественников остеокластов (Li et al., 2007). МСР-1 связывается с рецептором, экспрессируемым в предшественниках остеокластов, а затем циркулирующий предшественник остеокластов позиционирует поверхность кости, чтобы дифференцироваться в активный остеокласт. Однако в нормальной кости MCP-1 не экспрессируется. Воспаление может стимулировать экспрессию MCP-1 в остеобластах.
OPG / RANKL / RANK
До открытия RANKL, OPG и RANK многие группы наблюдали, что остеобласты продуцируют цитокины для регулирования дифференцировки и образования остеокластов.
В 1990-х четыре группы независимо обнаружили, что OPG / RANKL играет критическую роль во время образования остеокластов (Boyce and Xing, 2008). Сначала они обнаружили, что OPG защищает от потери костной массы (Simonet et al., 1997; Yasuda et al., 1998a), а затем они обнаружили его лиганд (OPGL), используя OPG в качестве зонда (Lacey et al., 1998; Yasuda et al., др., 1998b). Кроме того, OPGL был идентифицирован как член суперсемейства TNF, который называется активатором рецептора лигланда ядерного фактора-kb (RANKL) (Anderson et al., 1997), или цитокин, индуцированный активацией, связанной с TNF (TRANCE) (Wong et al., 1997). RANK был обнаружен другой группой, когда они секвенировали кДНК из библиотеки кДНК миелоидных дендритных клеток, полученных из костного мозга человека, и было обнаружено, что это рецептор для OPGL (Dougall et al., 1999).
OPG также называют фактором ингибирования остеокластогенеза (OCIF). OPG продуцируется многими типами клеток, помимо остеобластов, такими как клетки сердца, печени и селезенки. Было показано, что B-клетки являются основным источником OPG в костном мозге мышей, на долю которых приходится 64% всей продукции OPG костным мозгом (Li et al., 2007). Остеопетроз наблюдается у трансгенных мышей, сверхэкспрессирующих OPG из-за отсутствия остеокластов (Simonet et al., 1997), у мышей с нокаутом OPG наблюдается остеопороз из-за нерегулируемых остеокластов (Bucay et al., 1998). OPG, как рецептор-ловушка, может связываться с RANKL и блокировать его связывание и активацию с помощью RANK (Boyle et al., 2003). Следовательно, основной сигнальный путь дифференцировки и активации остеокластов был заблокирован. Экспрессия OPG в остеобластах регулируется количеством гормонов, цитокинов и факторов роста (Theoleyre et al., 2004), такие как эстроген, 1,25 (OH) 2 D 3 и TNF.
RANKL также называют фактором дифференцировки остеокластов (ODF), цитокином, вызванным активацией TNF (TRANCE) и лигландом остеопротегерина (OPGL) (Lacey et al. 1998). Общепринятая номенклатура, RANKL, была учреждена Американским обществом исследования костных минералов в 2000 году (Комитет по номенклатуре при президенте Американского общества исследований костей и минералов). RANKL высоко экспрессируется в остеобластах, активированных Т-клетках, лимфатических узлах, тимусе, молочных железах и легких и слабо экспрессируется в костном мозге (Kearns et al., 2008). RANKL обычно связан с мембраной остеобластов (Kearns et al., 2008). Секретируемый белок происходит из мембранной формы в результате протеолитического расщепления или альтернативного сплайсинга (Ikeda et al. 2001). RANKL может связываться со своим рецептором RANK, который экспрессируется на остеокластических клетках-предшественниках, и активирует нисходящие сигнальные пути, связанные с ростом и дифференцировкой клеток (Boyle et al., 2003). Различные цитокины, гормоны и факторы роста могут регулировать экспрессию RANKL, включая ПТГ, эстроген и воспалительные цитокины.Соотношение OPG / RANKL критически влияет на формирование остеокластов.
RANK представляет собой трансмембранный белок типа I, входящий в суперсемейство рецепторов TNF. Он высоко экспрессируется на мембранах предшественников остеокластов, зрелых остеокластах, дендритных клетках и молочных железах (Fata et al., 2000). Раковые опухоли с высоким метастатическим потенциалом в кости также выражают RANK, например, рак груди и простаты (Kim et al. 2006). RANK связывается со своим лигандом RANKL, а затем активирует семейство факторов, связанных с рецептором TNF (TRAF), включая TRAF 2,5 и 6.Однако сам по себе TRAF6 может индуцировать остеокластогенез (Kadono 2001) и необходим для активации путей внутриклеточной передачи сигналов (Kim et al., 1999). RANK / TRAF регулирует образование, активацию и выживание остеокластов посредством различных сигнальных путей (Boyle et al., 2003), включая JNK / AP-1, IκK / NF-κB, c-myc и кальциневрин / NFATc1 для образования остеокластов; src и MKK6 / p38 / MITF для активации.
LGR4 / RANKL / RANK
Недавнее исследование показало, что рецептор 4, связанный с G-белком, содержащий богатые лейцином повторы (LGR4, также называемый GPR48), также является рецептором для RANKL (Luo et al., 2016). RANKL может напрямую взаимодействовать с человеческим LGR4. Они также подтвердили, что LGR4 экспрессируется в остеокластах. Исследование in vivo показало, что низкая костная масса и гиперактивация остеокластов наблюдались у мышей с дефицитом Lgr4 . Количество, площадь поверхности и размер остеокластов были заметно выше у мышей с дефицитом Lgr4 по сравнению с таковыми у контрольных мышей. Исследования in vitro показали, что дефицит Lgr4 способствует образованию остеокластов и ингибирует их апоптоз.Дополнительные данные показали, что индуцированный потерей Lgr4 остеокластогенез не зависел от лиганда LGR4, R-спондина1 или норрина. Однако LGR4 ингибировал связывание RANKL с RANK дозозависимым образом, что указывает на то, что LGR4 конкурирует с RANK за связывание с RANKL. Нижестоящие сигнальные пути дифференцировки и выживания остеокластов были ослаблены. LGR4 может действовать как еще один рецептор-ловушка для RANKL.
Sema3A / Nrp
Семафорины представляют собой молекулы, направляющие конус роста аксонов, которые участвуют во взаимодействии между остеобластами и остеокластами (Negishi-Koga et al., 2011). Hayashi et al. (Hayashi et al., 2012) идентифицировали некоторые белки, секретируемые остеобластами, которые ингибируют дифференцировку остеокластов. Они обнаружили, что молекула управления аксоном Sema3A может играть важную роль. Они также показали, что рекомбинантный Sema3A может ингибировать дифференцировку остеокластов дозозависимым образом. МРНК Sema3A может быть обнаружена в изолированных остеобластах и остеоцитах. Они показали, что ингибирующие эффекты Sema3A на дифференцировку остеокластов отменяются, когда экспрессия NRP1 подавляется короткой shРНК.Более того, они наблюдали, что Sema3A не может ингибировать дифференцировку остеокластов, если у гена Nrp1 и отсутствует сайт связывания Sema. Впоследствии они продемонстрировали, что Sema3A ингибирует остеокластогенез, связываясь с Nrp1. Индуцированное Sema3A ингибирование дифференцировки остеокластов может быть опосредовано регуляцией индуцированной DAP12 передачи сигналов ITAM. Nrp1 может конкурировать с TREM2 за PlxnA1 и действует как супрессор сигнала, индуцированного PlxnA1-TREM2-DAP12.
Лизофосфатидная кислота (LPA)
LPA — это мощный биоактивный фосфолипид (Hosogaya et al., 2008). LPA продуцируется несколькими типами клеток, включая активированные тромбоциты и остеобласты (Sims et al., 2013). LPA, происходящая из остеобластов, может регулировать активность опухолевых клеток в скелетной микроокружении и остеокластах (Panupinthu et al., 2008). Рецептор LPA, LPA1, LPA2, LPA4 и LPA5 экспрессируется на высоком или низком уровне в остеокластах (Del Fattore et al., 2008). McMichael et al. показали, что LPA усиливает слияние клеток-предшественников остеокластов (McMichael et al., 2010), и LPA требуется для остеокластогенеза (David et al., 2010). LPA может регулировать передачу сигналов кальция и индуцировать накопление в ядрах NFATc1 в остеокластах (Lapierre et al., 2010), который является важными путями передачи сигналов для образования остеокластов (Boyle et al., 2003). Кроме того, Lapierre et al. (2010) также показали, что LPA может подавлять апоптоз остеокластов и вызывать изменение морфологии зрелых остеокластов. Дальнейшие исследования показали, что лечение LPA приводит к увеличению размера остеокластов, сопровождающемуся увеличением числа ядер (McMichael et al., 2010).
Апоптоз остеокластов, индуцированный остеобластами
Эстроген может вызывать апоптоз остеокластов (Kousteni et al., 2002). Накамура и др. (Nakamura et al., 2007) показали, что эстроген-индуцированный апоптоз остеокластов связан с индукцией ассоциированного с фактором суицидного лиганда (FasL) в этих же клетках. Однако Крам и его коллеги (Krum et al., 2008) обнаружили, что эстроген влияет на выживаемость остеокластов за счет активации FasL в остеобластах, что приводит к апоптозу преостеокластов.Кроме того, они обнаружили, что тамоксифен и ралоксифен также индуцируют преостеокласты с помощью того же остеобласт-зависимого механизма. Гарсия и др. (Garcia et al., 2013) также показали, что индуцированный 17b-эстрадиолом (E2) апоптоз остеокластов опосредуется расщеплением и солюбилизацией экспрессируемого остеобластами FasL. E2 может активировать экспрессию матриксной металлопротеиназы-3 (MMP3), а затем MMP3 расщепляет полноразмерный FasL на растворимый FasL. В присутствии специфического ингибитора MMP3 происходило снижение обширного расщепления и концентрации растворимого FasL.Недавно Wang et al. (2015) также показали, что остеобласты индуцируют апоптоз остеокластов с помощью передачи сигналов лиганда FAS (FASL) / FAS. Условный нокаут FasL в остеобластах вызывал увеличение количества и активности остеокластов. Более того, они указали, что экспрессия FasL была подавлена в остеобластах мышей с остеопорозом после овариэктомии по сравнению с фиктивной контрольной группой. Затем они обнаружили, что остеобласты с нокаутом FasL из фиктивного контроля показали слабую способность индуцировать апоптоз остеокластов, а сверхэкспрессия FasL в остеобластах, полученных из OVX, показала повышенную способность индуцировать апоптоз остеокластов.Остеобласт-индуцированный апоптоз остеокластов с помощью FasL играет важную роль в остеопорозе OVX. Кроме того, с использованием мышей с FASL-дефицитом (FasL cKO), предшественников остеобластов / остеобластов, они обнаружили, что блокирование RANKL показало ограниченную роль в снижении активности остеокластов у мышей FasL cKO. Wang et al. (Wang et al., 2015) также показали, что предшественники остеокластов имеют более низкую экспрессию FAS по сравнению со зрелыми остеокластами. Предшественники остеокластов могут иметь низкую чувствительность к апоптозу, индуцированному остеобластами по пути FASL / FAS.
Роль остеокластов в формировании кости
Atp6v0d2
Atp6v0d2 — это аббревиатура d2 изоформы вакуолярной (H +) АТФазы (v-ATPase) V0 домена. Он высоко экспрессируется в остеокластах (Rho et al., 2002). Однако мало что известно о функциональной важности Atp6v0d2 (Rho et al., 2002). Ли и др. (2006) показали, что у мышей Atp6v0d2 — / — наблюдалось заметное увеличение костной массы и уменьшение объема костно-мозговой полости. Между тем, площадь поверхности остеокластов и количество многоядерных TRAP-положительных клеток были уменьшены.Однако количество мононуклеарных TRAP + -клеток было немного увеличено. Эти данные показали, что Atp6v0d2 — / — может влиять на созревание остеокластов, но не на дифференцировку. Кроме того, они обнаружили, что Atp6v0d2 был связан со слиянием клеток. Образование зрелых гигантских остеокластов снижалось в отсутствие Atp6v0d2. Кроме того, заметное увеличение количества остеобластов и образования костей также наблюдалось у мышей Atp6v0d2 — / -. Однако дифференцировка остеобластов и экспрессия генов, связанных с дифференцировкой, не изменилась.Авт. Предположили, что повышенная активность остеобластов у Atp6v0d2 — / — мышей может быть связана с внешними факторами остеобластов, продуцируемыми мутантными остеокластами или их предшественниками. Atp6v0d2 может иметь большой потенциал в качестве мишени для лечения остеопороза из-за его роли в остеокластах и формировании костей.
Компонент комплемента 3a
Matsuoka et al. (2014) установили систему совместного культивирования остеобластов и зрелых остеокластов для влияния остеокластов на остеобластогенез.Они очистили пептид, последовательность которого соответствует компоненту 3 комплемента (C3), из условной среды (CM) зрелых остеокластов. C3 прогрессивно увеличивался во время дифференцировки остеокластов. Они обнаружили, что биоактивный фрагмент C3 3a может стимулировать дифференцировку остеобластов и что рецептор C3a экспрессируется в линиях стромальных клеток, а также в первичных остеобластах свода черепа. Когда экспрессия гена C3 была подавлена в остеокластах, CM остеокласта не стимулировала дифференцировку остеобластов.Однако активность остеобластов в отношении щелочной фосфатазы (ЩФ) ингибировалась СМ в присутствии антагониста C3aR, и один антагонист C3aR не влиял на активность ЩФ. Все эти данные предполагают, что C3a в CM ответственен за усиление активности ALP. Кроме того, они показали, что активность ЩФ увеличивалась, если агонист C3aR был добавлен к культуре остеобластов. Впоследствии они обнаружили, что экспрессия C3a в кости увеличивается у мышей, получавших OVX, с чрезмерной активацией остеокластов.Антагонист C3aR ингибировал стимуляцию образования кости у мышей OVX. Потеря костной массы и повреждение трабекулярной архитектуры также усугублялись. Эти результаты предполагают, что C3a может обеспечивать связь резорбции кости с образованием в модели с высоким оборотом.
Семафорин 4D
Семафорин 4D (Sema4D) представляет собой молекулу, направляющую аксоны. Негиши-Кога и др. (2011) показали, что остеокласты в высокой степени экспрессируют Sema4D, а Sema4D сильно ингибирует образование костей через свой рецептор плексин-B1, экспрессируемый остеобластами.Масса кости, толщина трабекул и прочность костей, очевидно, были увеличены у мышей Sema4D — / — по сравнению с мышами дикого типа. Кроме того, заметно увеличивалась поверхность остеобластов и скорость образования кости. Однако резорбция костной ткани остеокластом была нормальной. Эти данные предполагают, что высокая костная масса у мышей Sema4D — / — была связана с увеличением образования остеобластической кости. Дальнейшее исследование показало, что добавление Sema4D ингибировало образование костных узелков, активность ЩФ и экспрессию остеобластных генов.Плексин-B1 высоко экспрессируется во время дифференцировки остеобластов. Плексин-B1 образует рецепторный комплекс с гомологом 2 вирусного онкогена эритробластного лейкоза (ErbB2) в остеобластах. Связывание Smea4d с Plexin-B1 индуцировало фосфорилирование ErB2, который играет роль киназы в остеобластах. Однако добавление Sema4D все еще немного подавляло образование костей в Plxnb1 — / — клетках, это указывает на то, что др. Рецепторы могут частично участвовать в эффектах Sema4D на остеобласты. Впоследствии они обнаружили, что связывание Sema4D с рецепторным комплексом Plexin-b1-ErbB2 может индуцировать активацию RhoA, которая опосредует фосфорилирование IRS-1.Эффекты Sema4D на остеобласты частично могут быть связаны с ослаблением передачи сигналов IGF-1. Кроме того, Sema4D может индуцировать подвижность остеобластов за счет активации RhoA и влиять на локализацию остеобластов в нужном месте. Исследования in vivo также продемонстрировали, что Sema4D-специфические антитела могут защищать от потери костной массы у мышей OVX, способствуя образованию костной ткани. Недавние исследования также показали, что siRNA-Sema4D значительно увеличивает объем кости, объемную минеральную плотность кости и количество остеобластов в модели на крысах (Zhang et al., 2015, 2016).
Склеростин
Склеростин — это белок, который у человека кодируется геном SOST (Balemans et al., 2001). Склеростин экспрессируется в длинных костях и хрящах человека, а также в остеоцитах и оказывает антианаболическое действие на формирование костной ткани (Winkler et al. 2003). Kusu et al. (2003) обнаружили, что склеростин также экспрессируется в остеокластах мышей. Они также показали, что склеростин связывается с BMP6 и BMP7 с высокой аффинностью и ингибирует их активность в мышиных клетках MC3T3-E1.Однако Винклер и др. (2003) показали, что экспрессия SOST РНК не наблюдалась в человеческих остеокластах или клетках-предшественниках остеокластов человека. Ота и др. (2013) указали, что склеростин экспрессируется в остеокластах у старых мышей. Концентрированные условные среды (CCM) из остеокластов от 6-недельных или 12-месячных мышей усиливали остеогенез. Однако CCM мышей в возрасте от 18 до 24 месяцев ингибировали минерализацию. Кроме того, они наблюдали, что уровни мРНК и белка склеростина в остеокластах у 24-месячных мышей были значительно выше, чем у 6-недельных мышей.Если в CCM добавляли антитело против склеростина, подавление минерализации с помощью CCM отменялось. Остеокласты старых мышей могут иметь несколько иной фенотип по сравнению с молодыми мышами.
MicroRNA / exsomes
Было показано, что MicroRNAs также регулируют остеогенную активность и образование остеобластов костей (Lian et al., 2012). Доказано, что MiR-214-3p играет решающую роль в заболеваниях скелета, включая подавление остеогенной дифференцировки клеток миобластов (Shi et al.2013) и формирование кости (Wang et al., 2013). Недавнее исследование показало, что экзосомальный miR-214-3p, продуцируемый остеокластами, может влиять на формирование остеобластической кости (Li et al., 2016). Обильные miR-214-3P и экзосомальные miR-214-3p были обнаружены в зрелых остеокластах мыши, но не в зрелых остеобластах. Они обнаружили, что остеокластический miR-214-3P связан со сниженным образованием костной ткани у пожилых женщин с переломами и у мышей OVX. Используя специфичную для остеокластов модель мышей miR-214-3P с нокаутом, они также обнаружили, что костная масса была уменьшена, а трабекулярная архитектура была плохо организована по сравнению с мышами дикого типа.Гистологический анализ показал, что маркеры образования костной ткани, такие как скорость присоединения минералов и Ob.S / BS, у мышей с нокаутом miR-214-3P и (OC-miR-214-3p) были значительно ниже, чем у мышей в дикой природе. типа мышки. Когда остеобласты совместно культивировали с остеокластами OC-miR-214-3p, экспрессия генов, связанных с активностью остеобластов, была значительно снижена по сравнению с таковой в остеобластах, совместно культивируемых с остеокластами дикого типа. Кроме того, они показали, что активность остеобластов подавлялась, если специфическая для остеокластов miR-214-3P была перенесена в.Более того, они продемонстрировали, что экзосомальный miR-214-3p может переноситься от остеокластов к остеобластам. Они также показали, что происходящая из остеокластов экзосомальная miR-214-3p может захватываться остеобластами in vivo . Уровни мРНК генов формирования кости, таких как Alp , Opn и Bsp , были значительно ниже на и у мышей, которым вводили экзосомы OC-miR-214-3p. Формирование кости также было заметно подавлено. Наконец, они показали, что ингибирование специфической для остеокластов miR-214-3P усиливает образование кости у стареющих мышей OVX.Недавнее исследование также показало, что остеокласты продуцируют экзосомы, обогащенные miRNA, а экзосомы переносят miR-214 в остеобласты, чтобы ингибировать их активность (Sun et al., 2016). Активность остеобластов подавлялась у остеокласт-специфичных трансгенных мышей miR-214. Высокие уровни miR-214 наблюдались у пациентов с остеопорозом и мышей OVX. Это исследование также показало, что экссомы, полученные из остеокластов, распознают остеобласты через эфринA2 / EphA2. Эти два исследования показывают, что остеокласты могут влиять на остеобласты через экзосомы.
Кроме того, двунаправленная регуляция эфрин-EphB4 (Zhao et al., 2006), повтор тройной спирали коллагена, содержащий 1 (Cthrc 1) (Takeshita et al., 2013), и сфингозин-1-фосфат (S1P) (Ryu et al. ., 2006; Pederson et al., 2008) также играют важную роль в развитии перекрестного взаимодействия остеокластов и остеобластов. Для Ephrin-EphB4 прямая передача сигналов, опосредованная EPH (OC-OB), стимулирует дифференцировку остеобластов и индуцирует образование кости. Такешита и др. (Takeshita et al., 2013) обнаружили, что Cthrc1, белок, секретируемый зрелыми резорбирующими кость остеокластами, может стимулировать остеогенез.Остеокласт-специфическая делеция Cthrc1 вызвала остеопению из-за снижения костеобразования. Мыши с нокаутом Cthrc1 показали низкую костную массу, низкую скорость образования костной ткани и микроструктурные аномалии. Кроме того, зрелые остеокласты продуцируют и секретируют многие факторы, такие как WNT10B, BMP6, липид S1P, фактор роста гепатоцитов (Grano et al., 1996), Катпсин K (Kiviranta et al., 2001; Lotinun et al., 2013) и тартрат-резистентная кислая фосфатаза (TRAcP) (Teti, 2013) для стимуляции рекрутирования и выживания остеобластов.TGF-b и IGF-1, высвобождаемые из костного матрикса во время остеокластической резорбции кости, также играют важную роль в активности остеобластов (Tang et al., 2009; Xian et al., 2012), такой как экспрессия RANKL и миграция клеток.
Таким образом, гомеостаз кости имеет решающее значение для нормального функционирования и структуры кости. Гомеостаз зависит от взаимодействия остеобластов и остеокластов. В этом прогрессе участвуют многие цитокины, гормоны и сигнальные пути. Путь OPG / RANKL / RANK — одно из важных достижений в биологии костных клеток, которое свидетельствует о том, что остеобласты могут регулировать остеокласты.Последующие исследования также показали, что остеокласты также влияют на активность остеобластов или формирование кости. Схематическое изображение взаимодействия остеобластов и остеокластов было показано на рис. Понимание взаимосвязи между остеобластами и остеокластами важно для открытия и разработки новых препаратов против остеопороза. Мы полагаем, что дополнительные исследования выявят все больше и больше новых молекул, которые обеспечивают связь между этими двумя клетками. Между тем, необходимы дальнейшие исследования для выяснения известных путей передачи сигнала.
Схематическое изображение взаимодействий остеобластов и остеокластов. Остеобласты могут усиливать пролиферацию, дифференцировку, выживаемость, апоптоз или слияние за счет фактора колонистимуляции макрофагов (M-CSF) / C-Fms, активатора рецептора лиганда ядерного фактора-κB (RANKL), рецептора лизофосфатидной кислоты / лизофосфатидной кислоты (LPA / LPAR) и Fas / FasL (FADD, домен смерти, связанный с Fas). Остеобласты также ингибируют () дифференцировку, пролиферацию или выживание остеокластов под действием остеопротегерина (OPG), RANKL / LGR4 и Sema3A / Nrp1.Остеокласты могут способствовать дифференцировке остеобластов с помощью Компонента 3а комплемента (CC3) / рецептора CC3 (CC3R) и эфринаB2. Изоформа D2 вакуолярной (H +) АТФазы (v-АТФаза) домена V0 (Atp6v0d2), семафорин 4D, склеростин, микроРНК (miR-214 и miR-214-3p) или экзосомы из остеокластов могут ингибировать (⊥) дифференцировку или активность остеобласт. Также существуют двунаправленные взаимодействия (EphB4-ephrinB2) между остеобластами и остеокластами.
Структура, функции и факторы, влияющие на костные клетки
Костная ткань непрерывно ремоделируется за счет согласованных действий костных клеток, которые включают резорбцию кости остеокластами и формирование кости остеобластами, тогда как остеоциты действуют как механосенсоры и организаторы ремоделирования кости процесс.Этот процесс находится под контролем местных (например, факторы роста и цитокины) и системных (например, кальцитонин и эстрогены) факторов, которые все вместе способствуют гомеостазу костей. Дисбаланс между резорбцией и формированием кости может привести к заболеваниям костей, включая остеопороз. Недавно было обнаружено, что во время ремоделирования кости между костными клетками существует сложная связь. Например, связь резорбции кости с образованием кости достигается за счет взаимодействия между остеокластами и остеобластами.Более того, остеоциты продуцируют факторы, которые влияют на активность остеобластов и остеокластов, тогда как за апоптозом остеоцитов следует резорбция остеокластов кости. Растущие знания о структуре и функциях костных клеток способствовали лучшему пониманию биологии костей. Было высказано предположение, что существует сложная связь между костными клетками и другими органами, что указывает на динамический характер костной ткани. В этом обзоре мы обсуждаем текущие данные о структуре и функциях костных клеток и факторах, влияющих на ремоделирование кости.
1. Введение
Кость — это минерализованная соединительная ткань, в которой представлены четыре типа клеток: остеобласты, клетки выстилки кости, остеоциты и остеокласты [1, 2]. Кость выполняет важные функции в организме, такие как движение, поддержка и защита мягких тканей, хранение кальция и фосфата и укрытие костного мозга [3, 4]. Несмотря на свой инертный вид, кость представляет собой очень динамичный орган, который постоянно резорбируется остеокластами и вновь формируется остеобластами. Есть данные, что остеоциты действуют как механосенсоры и организаторы этого процесса ремоделирования кости [5–8].Функция клеток выстилки кости не совсем ясна, но эти клетки, по-видимому, играют важную роль в соединении резорбции кости с формированием кости [9].
Ремоделирование кости — это очень сложный процесс, при котором старая кость заменяется новой, в цикле, состоящем из трех фаз: (1) инициирование резорбции кости остеокластами, (2) переход (или период обращения) от резорбции к образование новой кости и (3) образование кости остеобластами [10, 11]. Этот процесс происходит из-за скоординированных действий остеокластов, остеобластов, остеоцитов и клеток выстилки кости, которые вместе образуют временную анатомическую структуру, называемую базовой многоклеточной единицей (BMU) [12–14].
Нормальное ремоделирование кости необходимо для заживления переломов и адаптации скелета к механическому использованию, а также для гомеостаза кальция [15]. С другой стороны, дисбаланс резорбции и образования костной ткани приводит к нескольким заболеваниям костей. Например, чрезмерная резорбция остеокластами без соответствующего количества нервно-сформированной кости остеобластами способствует потере костной массы и остеопорозу [16], тогда как наоборот может привести к остеопетрозу [17]. Таким образом, равновесие между образованием и резорбцией кости необходимо и зависит от действия нескольких местных и системных факторов, включая гормоны, цитокины, хемокины и биомеханическую стимуляцию [18–20].
Недавние исследования показали, что кость влияет на деятельность других органов, а на кость также влияют другие органы и системы тела [21], что дает новое понимание и доказывает сложность и динамическую природу костной ткани.
В этом обзоре мы обратимся к текущим данным о биологии костных клеток, костном матриксе и факторах, которые влияют на процесс ремоделирования кости. Кроме того, мы кратко обсудим роль эстрогена в костной ткани при физиологических и патологических условиях.
2. Костные клетки
2.1. Остеобласты
Остеобласты — это клетки кубовидной формы, расположенные вдоль поверхности кости, составляющие 4–6% от общего числа резидентных костных клеток, и широко известны своей функцией формирования кости [22]. Эти клетки демонстрируют морфологические характеристики клеток, синтезирующих белок, включая обильный грубый эндоплазматический ретикулум и выдающийся аппарат Гольджи, а также различные секреторные везикулы [22, 23]. Как поляризованные клетки, остеобласты секретируют остеоид в направлении костного матрикса [24] (Рисунки 1 (a), 1 (b) и 2 (a)).
Остеобласты происходят из мезенхимальных стволовых клеток (МСК). Обязательство MSC по отношению к клону остеопрогениторов требует экспрессии специфических генов после своевременных запрограммированных шагов, включая синтез костных морфогенетических белков (BMPs) и членов путей Wingless (Wnt) [25]. Экспрессия связанных с Runt факторов транскрипции 2, Distal-less homeobox 5 (Dlx5) и osterix (Osx) является критическим для дифференцировки остеобластов [22, 26]. Кроме того, Runx2 является главным геном дифференцировки остеобластов, о чем свидетельствует тот факт, что Runx2-нулевые мыши лишены остеобластов [26, 27]. Runx2 продемонстрировал активацию генов, связанных с остеобластами, таких как ColIA1 , ALP , BSP , BGLAP и OCN [28].
Когда пул предшественников остеобластов, экспрессирующих Runx2 и ColIA1 , образуется во время дифференцировки остеобластов, наступает фаза пролиферации. На этой фазе предшественники остеобластов проявляют активность щелочной фосфатазы (ЩФ) и считаются преостеобластами [22].Переход преостеобластов в зрелые остеобласты характеризуется увеличением экспрессии Osx и секреции белков костного матрикса, таких как остеокальцин (OCN), костный сиалопротеин (BSP) I / II и коллаген I типа. претерпевают морфологические изменения, становясь крупными и кубовидными клетками [26, 29–31].
Имеются доказательства, что др. Факторы, такие как фактор роста фибробластов (FGF), микроРНК и коннексин 43, играют важную роль в дифференцировке остеобластов [32–35].Мыши с нокаутом FGF-2 показали снижение костной массы, связанное с увеличением адипоцитов в костном мозге, что указывает на участие FGF в дифференцировке остеобластов [34]. Также было продемонстрировано, что FGF-18 активирует дифференцировку остеобластов по аутокринному механизму [36]. МикроРНК участвуют в регуляции экспрессии генов во многих типах клеток, включая остеобласты, в которых одни микроРНК стимулируют, а другие ингибируют дифференцировку остеобластов [37, 38]. Коннексин 43, как известно, является основным коннексином в кости [35].Мутация в гене, кодирующем коннексин 43, нарушает дифференцировку остеобластов и вызывает пороки развития скелета у мышей [39].
Синтез костного матрикса остеобластами происходит в два основных этапа: отложение органического матрикса и его последующая минерализация (Рисунки 1 (b) –1 (d)). На первом этапе остеобласты секретируют белки коллагена, в основном коллаген I типа, неколлагеновые белки (OCN, остеонектин, BSP II и остеопонтин) и протеогликан, включая декорин и бигликан, которые образуют органический матрикс.После этого минерализация костного матрикса проходит в две фазы: везикулярную и фибриллярную фазы [40, 41]. Везикулярная фаза возникает, когда части с переменным диаметром от 30 до 200 нм, называемые везикулами матрикса, высвобождаются из домена апикальной мембраны остеобластов во вновь образованный костный матрикс, в котором они связываются с протеогликанами и другими органическими компонентами. Из-за своего отрицательного заряда сульфатированные протеогликаны иммобилизуют ионы кальция, которые хранятся в везикулах матрикса [41, 42].Когда остеобласты секретируют ферменты, разрушающие протеогликаны, ионы кальция высвобождаются из протеогликанов и пересекают кальциевые каналы, представленные в мембране матричных везикул. Эти каналы образованы белками, называемыми аннексинами [40].
С другой стороны, фосфатсодержащие соединения расщепляются ALP, секретируемой остеобластами, высвобождая ионы фосфата внутри везикул матрикса. Затем ионы фосфата и кальция внутри пузырьков зарождаются, образуя кристаллы гидроксиапатита [43].Фибриллярная фаза возникает, когда перенасыщение ионов кальция и фосфата внутри матричных везикул приводит к разрыву этих структур и кристаллы гидроксиапатита распространяются на окружающую матрицу [44, 45].
Зрелые остеобласты выглядят как единственный слой кубовидных клеток, содержащих обильный грубый эндоплазматический ретикулум и большой комплекс Гольджи (Рисунки 2 (а) и 3 (а)). Некоторые из этих остеобластов демонстрируют цитоплазматические отростки в направлении костного матрикса и достигают отростков остеоцитов [46].На этой стадии зрелые остеобласты могут подвергнуться апоптозу или стать остеоцитами или клетками выстилки кости [47, 48]. Интересно, что внутри вакуолей остеобластов наблюдались круглые / яйцевидные структуры, содержащие плотные тела и TUNEL-положительные структуры. Эти данные предполагают, что помимо профессиональных фагоцитов, остеобласты также способны поглощать и разрушать апоптотические тела во время формирования альвеолярной кости [49].
2.2. Клетки выстилки кости
Клетки выстилки кости представляют собой покоящиеся остеобласты плоской формы, которые покрывают костные поверхности, где не происходит ни резорбции кости, ни образования кости [50].Эти клетки имеют тонкий и плоский профиль ядра; его цитоплазма простирается вдоль поверхности кости и отображает несколько цитоплазматических органелл, таких как профили шероховатого эндоплазматического ретикулума и аппарата Гольджи [50] (Рисунок 2 (b)). Некоторые из этих клеток обнаруживают отростки, простирающиеся в канальцы, а также наблюдаются щелевые соединения между соседними клетками выстилки кости и между этими клетками и остеоцитами [50, 51].
Секреторная активность клеток выстилки костей зависит от физиологического статуса костей, в результате чего эти клетки могут вновь приобретать свою секреторную активность, увеличивая свой размер и принимая кубовидную форму [52].Функции клеток выстилки костной ткани до конца не изучены, но было показано, что эти клетки предотвращают прямое взаимодействие между остеокластами и костным матриксом, когда резорбция кости не должна происходить, а также участвуют в дифференцировке остеокластов, продуцируя остеопротегерин (OPG) и активатор рецептора. лиганда ядерного фактора каппа-B (RANKL) [14, 53]. Более того, клетки выстилки кости вместе с другими костными клетками являются важным компонентом BMU, анатомической структуры, которая присутствует во время цикла ремоделирования кости [9].
2.3. Остеоциты
Остеоциты, которые составляют 90–95% всех костных клеток, являются наиболее многочисленными и долгоживущими клетками, продолжительность жизни которых составляет до 25 лет [54]. В отличие от остеобластов и остеокластов, которые были определены их соответствующими функциями во время образования кости и резорбции кости, остеоциты ранее определялись по их морфологии и расположению. В течение десятилетий из-за трудностей с выделением остеоцитов из костного матрикса приводилось ошибочное представление о том, что эти клетки будут пассивными клетками, а их функции неверно интерпретировались [55].Развитие новых технологий, таких как идентификация маркеров, специфичных для остеоцитов, новых моделей на животных, разработка методов выделения и культивирования костных клеток, а также создание фенотипически стабильных клеточных линий привело к улучшению понимания биологии остеоцитов. Фактически, было признано, что эти клетки выполняют множество важных функций в кости [8].
Остеоциты расположены в лакунах, окруженных минерализованным костным матриксом, при этом они имеют дендритную морфологию [15, 55, 56] (Рисунки 3 (a) –3 (d)).Морфология внедренных остеоцитов различается в зависимости от типа кости. Например, остеоциты губчатой кости более округлые, чем остеоциты кортикальной кости, которые имеют удлиненную морфологию [57].
Остеоциты происходят от линии МСК посредством дифференцировки остеобластов. В этом процессе были предложены четыре распознаваемых стадии: остеоид-остеоцит, преостеоцит, молодой остеоцит и зрелый остеоцит [54]. В конце цикла формирования кости субпопуляция остеобластов становится остеоцитами, включенными в костный матрикс.Этот процесс сопровождается заметными морфологическими и ультраструктурными изменениями, включая уменьшение размеров круглых остеобластов. Количество органелл, таких как шероховатый эндоплазматический ретикулум и аппарат Гольджи, уменьшается, а соотношение ядра и цитоплазмы увеличивается, что соответствует снижению синтеза и секреции белка [58].
Во время перехода остеобласт / остеоцит цитоплазматический процесс начинает проявляться до того, как остеоциты будут заключены в костный матрикс [22].Механизмы, участвующие в развитии цитоплазматических процессов остеоцитов, до конца не изучены. Однако белок E11 / gp38, также называемый подопланином, может играть важную роль. E11 / gp38 высоко экспрессируется во встроенных или недавно встроенных остеоцитах, подобно другим типам клеток с дендритной морфологией, таким как подоциты, альвеолярные клетки легких типа II и клетки сосудистого сплетения [59]. Было высказано предположение, что E11 / gp38 использует энергию активности GTPase для взаимодействия с компонентами цитоскелета и молекулами, участвующими в подвижности клеток, посредством чего регулирует динамику актинового цитоскелета [60, 61].Соответственно, ингибирование экспрессии E11 / gp38 в остеоцитоподобных клетках MLO-Y4, как было показано, блокирует удлинение дендритов, подтверждая, что E11 / gp38 участвует в образовании дендритов в остеоцитах [59].
По завершении стадии зрелого остеоцита, полностью заключенного в минерализованный костный матрикс, происходит подавление экспрессии некоторых ранее экспрессированных маркеров остеобластов, таких как OCN, BSPII, коллаген типа I и ЩФ. С другой стороны, маркеры остеоцитов, включая белок 1 дентинового матрикса (DMP1) и склеростин, высоко экспрессируются [8, 62–64].
В то время как тело клетки остеоцита расположено внутри лакуны, его цитоплазматические отростки (до 50 на каждую клетку) пересекают крошечные туннели, берущие начало в пространстве лакуны, называемые канальцами, образуя лакуно-канальцевую систему остеоцитов [65] (Рис. –3 (г)). Эти цитоплазматические процессы связаны с другими процессами соседних остеоцитов щелевыми соединениями, а также с цитоплазматическими процессами остеобластов и выстилающих костную ткань клеток на поверхности кости, облегчая межклеточный транспорт малых сигнальных молекул, таких как простагландины и оксид азота, между этими клетками [66 ].Кроме того, лакуно-каналическая система остеоцитов находится в непосредственной близости от сосудов, через которые кислород и питательные вещества попадают в остеоциты [15].
Было подсчитано, что поверхность остеоцитов в 400 раз больше, чем у всех систем Гаверса и Фолькмана, и более чем в 100 раз больше, чем поверхность губчатой кости [67, 68]. Связь между клетками также обеспечивается интерстициальной жидкостью, которая течет между отростками остеоцитов и канальцами [68]. С помощью лакуно-канальцевой системы (Рис. 3 (b)) остеоциты действуют как механосенсоры, поскольку их взаимосвязанная сеть обладает способностью обнаруживать механическое давление и нагрузки, тем самым помогая адаптации кости к ежедневным механическим силам [55].Таким образом, остеоциты, по-видимому, действуют как организаторы ремоделирования кости, регулируя активность остеобластов и остеокластов [15, 69]. Более того, апоптоз остеоцитов был признан хемотаксическим сигналом к резорбции остеокластической кости [70–73]. В соответствии с этим было показано, что во время резорбции кости апоптотические остеоциты поглощаются остеокластами [74–76].
Механическая чувствительность остеоцитов достигается благодаря стратегическому расположению этих клеток в костном матриксе.Таким образом, форма и пространственное расположение остеоцитов согласуются с их функциями восприятия и передачи сигналов, способствуя преобразованию механических стимулов в биохимические сигналы, явление, которое называется пьезоэлектрическим эффектом [77]. Механизмы и компоненты, с помощью которых остеоциты преобразуют механические стимулы в биохимические сигналы, не очень хорошо известны. Однако было предложено два механизма. Одним из них является то, что существует белковый комплекс, образованный ресничками и ассоциированными с ней белками PolyCystins 1 и 2, который, как предполагается, является критическим для механочувствительности остеоцитов и для опосредованного остеобластами / остеоцитами образования кости [78].Второй механизм включает компоненты цитоскелета остеоцитов, включая белковый комплекс фокальной адгезии и его множественные актин-ассоциированные белки, такие как паксиллин, винкулин, талин и циксин [79]. При механической стимуляции остеоциты производят несколько вторичных мессенджеров, например, АТФ, оксид азота (NO), Ca 2+ и простагландины (PGE 2 и PGI 2 ), которые влияют на физиологию костей [8, 80] . Независимо от задействованного механизма, важно отметить, что механочувствительная функция остеоцитов возможна благодаря сложной канальцевой сети, которая обеспечивает связь между костными клетками.
2.4. Остеокласты
Остеокласты — это терминально дифференцированные многоядерные клетки (Рисунки 4 (a) –4 (d)), которые происходят из мононуклеарных клеток линии гемопоэтических стволовых клеток под влиянием нескольких факторов. В число этих факторов входят макрофагальный колониестимулирующий фактор (M-CSF), секретируемый мезенхимальными клетками и остеобластами остеопрогениторов [81], и лиганд RANK, секретируемый остеобластами, остеоцитами и стромальными клетками [20]. Вместе эти факторы способствуют активации факторов транскрипции [81, 82] и экспрессии генов в остеокластах [83, 84].
M-CSF связывается со своим рецептором (cFMS), присутствующим в предшественниках остеокластов, что стимулирует их пролиферацию и ингибирует их апоптоз [82, 85]. RANKL является решающим фактором остеокластогенеза и экспрессируется остеобластами, остеоцитами и стромальными клетками. Когда он связывается со своим рецептором RANK в предшественниках остеокластов, индуцируется образование остеокластов [86]. С другой стороны, другой фактор, называемый остеопротегерином (OPG), который продуцируется широким спектром клеток, включая остеобласты, стромальные клетки, фибробласты десен и пародонта [87–89], связывается с RANKL, предотвращая взаимодействие RANK / RANKL и , следовательно, ингибирование остеокластогенеза [87] (Рисунок 5).Таким образом, система RANKL / RANK / OPG является ключевым медиатором остеокластогенеза [19, 86, 89].
Взаимодействие RANKL / RANK также способствует экспрессии других остеокластогенных факторов, таких как NFATc1 и DC-STAMP. Взаимодействуя с факторами транскрипции PU.1, cFos и MITF, NFATc1 регулирует гены, специфичные для остеокластов, включая TRAP и катепсин K , которые имеют решающее значение для активности остеокластов [90]. Под влиянием взаимодействия RANKL / RANK NFATc1 также индуцирует экспрессию DC-STAMP, которая имеет решающее значение для слияния предшественников остеокластов [91, 92].
Несмотря на то, что эти остеокластогенные факторы были хорошо определены, недавно было продемонстрировано, что остеокластогенный потенциал может различаться в зависимости от рассматриваемого участка кости. Сообщалось, что остеокласты из длинного костного мозга формируются быстрее, чем в челюсти. Эта различная динамика остеокластогенеза, возможно, может быть связана с клеточным составом костного мозга, специфичным для костной ткани [93].
Во время ремоделирования кости остеокласты поляризуются; затем можно наблюдать четыре типа мембранных доменов остеокластов: зону уплотнения и волнистую границу, которые находятся в контакте с костным матриксом (рисунки 4 (b) и 4 (d)), а также базолатеральные и функциональные секреторные домены, которые не контактируют с костным матриксом [94, 95].Поляризация остеокластов во время резорбции кости включает перестройку актинового цитоскелета, в которой образуется кольцо F-актина, которое включает плотную непрерывную зону высокодинамичных подосом, и, следовательно, область мембраны, которая развивается в взъерошенную границу, изолирована. Важно отметить, что эти домены образуются только тогда, когда остеокласты находятся в контакте с внеклеточным минерализованным матриксом, в процессе, в котором -интегрин, а также CD44, опосредуют прикрепление подосом остеокластов к поверхности кости [96–99] .Ультраструктурно волнистая граница представляет собой мембранный домен, образованный микроворсинками, который изолирован от окружающей ткани прозрачной зоной, также известной как зона уплотнения. Светлая зона — это область, лишенная органелл, расположенная на периферии остеокласта рядом с костным матриксом [98]. Эта запечатывающая зона образована актиновым кольцом и несколькими другими белками, включая актин, талин, винкулин, паксиллин, тензин и связанные с актином белки, такие как α -актинин, фимбрин, гельсолин и динамин [95].-Интегрин связывается с неколлагеновым костным матриксом, содержащим -RGD-последовательность, такую как костный сиалопротеин, остеопонтин и витронектин, создавая периферическое уплотнение, ограничивающее центральную область, где расположена взъерошенная граница [98] (рисунки 4 (b) -4 ( г)).
Поддержание взъерошенной границы также важно для активности остеокластов; эта структура формируется за счет интенсивного движения лизосомальных и эндосомных компонентов. В волнистой кайме находится H + -АТФаза вакуолярного типа (V-АТФаза), которая помогает подкислять лакуну резорбции и, следовательно, способствует растворению кристаллов гидроксиапатита [20, 100, 101].В этой области протоны и ферменты, такие как устойчивая к тартрату кислотная фосфатаза (TRAP), катепсин K и матриксная металлопротеиназа-9 (MMP-9), транспортируются в отсек, называемый лакуной Howship, что приводит к деградации кости [94, 101–104 ] (Рисунок 5). Продукты этой деградации затем подвергаются эндоцитозу через взъерошенную границу и трансцитозируются в функциональный секреторный домен на плазматической мембране [7, 95].
Аномальное увеличение образования и активности остеокластов приводит к некоторым заболеваниям костей, таким как остеопороз, когда резорбция превышает образование, вызывая снижение плотности костей и увеличение числа переломов костей [105].При некоторых патологических состояниях, включая метастазы в кости и воспалительный артрит, аномальная активация остеокластов приводит к околосуставным эрозиям и болезненным остеолитическим повреждениям соответственно [83, 105, 106]. При пародонтите заболевание пародонта, вызванное размножением бактерий [107, 108], вызывает миграцию воспалительных клеток. Эти клетки продуцируют химические медиаторы, такие как IL-6 и RANKL, которые стимулируют миграцию остеокластов [89, 109, 110]. В результате в альвеолярной кости происходит аномальное усиление резорбции костной ткани, что способствует потере прикрепления зубов и прогрессированию пародонтита [89, 111].
С другой стороны, при остеопетрозе, который является редким заболеванием костей, генетические мутации, которые влияют на функции образования и резорбции в остеокластах, приводят к снижению резорбции кости, что приводит к непропорциональному накоплению костной массы [17]. Эти заболевания демонстрируют важность нормального процесса ремоделирования кости для поддержания гомеостаза кости.
Кроме того, есть свидетельства того, что остеокласты выполняют несколько других функций. Например, было показано, что остеокласты продуцируют факторы, называемые кластокинами, которые контролируют остеобласты во время цикла ремоделирования кости, который будет обсуждаться ниже.Другие недавние данные свидетельствуют о том, что остеокласты также могут напрямую регулировать нишу гемопоэтических стволовых клеток [112]. Эти данные указывают на то, что остеокласты являются не только клетками, резорбирующими кости, но также источником цитокинов, влияющих на активность других клеток.
2,5. Внеклеточный костный матрикс
Кость состоит из неорганических солей и органического матрикса [113]. Органический матрикс содержит коллагеновые белки (90%), преимущественно коллаген I типа и неколлагеновые белки, включая остеокальцин, остеонектин, остеопонтин, фибронектин и костный сиалопротеин II, костные морфогенетические белки (BMP) и факторы роста [114].Существуют также небольшие протеогликаны, богатые лейцином, включая декорин, бигликан, люмикан, остеоадерин и сериновые белки [114–116].
Неорганический материал кости состоит преимущественно из ионов фосфата и кальция; однако также присутствуют значительные количества бикарбоната, натрия, калия, цитрата, магния, карбоната, флюорита, цинка, бария и стронция [1, 2]. Ионы кальция и фосфата образуют зародыши с образованием кристаллов гидроксиапатита, которые представлены химической формулой Ca 10 (PO 4 ) 6 (OH) 2 .Вместе с коллагеном неколлагеновые матричные белки образуют каркас для отложения гидроксиапатита, и такая ассоциация отвечает за типичную жесткость и сопротивление костной ткани [4].
Костный матрикс представляет собой сложный и организованный каркас, который обеспечивает механическую поддержку и играет важную роль в гомеостазе кости. Костный матрикс может высвобождать несколько молекул, которые мешают активности костных клеток и, следовательно, участвует в ремоделировании кости [117].Поскольку одной только потери костной массы недостаточно, чтобы вызвать переломы костей [118], предполагается, что другие факторы, включая изменения белков костного матрикса и их модификации, имеют решающее значение для понимания и прогнозирования переломов костей [119]. Фактически, известно, что коллаген играет решающую роль в структуре и функции костной ткани [120].
Соответственно, было продемонстрировано, что существует вариация в концентрации белков костного матрикса с возрастом, питанием, заболеванием и антиостеопоротическим лечением [119, 121, 122], что может способствовать деформации после растяжения и переломам кости [119] .Например, исследования in vivo, и in vitro, сообщили, что увеличение синтеза гиалуроновой кислоты после лечения паратироидным гормоном (ПТГ) было связано с последующей резорбцией кости [123–127], что указывает на возможную связь между синтезом гиалуроновой кислоты и повышение активности остеокластов.
2.6. Взаимодействия между костными клетками и костным матриксом
Как обсуждалось ранее, костный матрикс не только обеспечивает поддержку костных клеток, но также играет ключевую роль в регулировании активности костных клеток посредством нескольких молекул адгезии [117, 128].Интегрины являются наиболее распространенными молекулами адгезии, участвующими во взаимодействии между костными клетками и костным матриксом [129]. Остеобласты взаимодействуют с костным матриксом с помощью интегринов, которые распознают и связываются с RGD и другими последовательностями, присутствующими в белках костного матрикса, включая остеопонтин, фибронектин, коллаген, остеопонтин и костный сиалопротеин [130, 131]. Наиболее распространенными интегринами, присутствующими в остеобластах, являются, и [132]. Эти белки также играют важную роль в организации остеобластов на поверхности кости во время синтеза остеоидов [129].
С другой стороны, взаимодействие между остеокластами и костным матриксом важно для функции остеокластов, поскольку, как упоминалось ранее, резорбция кости происходит только тогда, когда остеокласты связываются с минерализованной поверхностью кости [97]. Таким образом, во время резорбции кости остеокласты экспрессируют интегрины и взаимодействуют с внеклеточным матриксом, в котором первые связываются с обогащенными костями RGD-содержащими белками, такими как костный сиалопротеин и остеопонтин, тогда как интегрины связываются с фибриллами коллагена [133, 134].Несмотря на эти связывания, остеокласты обладают высокой подвижностью, даже при активной резорбции, и, как мигрирующие клетки, остеокласты не экспрессируют кадгерины. Однако было продемонстрировано, что кадгерины обеспечивают тесный контакт между предшественниками остеокластов и стромальными клетками, которые экспрессируют важные факторы роста для дифференцировки остеокластов [135].
Интегрины играют посредническую роль во взаимодействиях остеоцитов с костным матриксом. Эти взаимодействия важны для механочувствительной функции этих клеток, посредством чего сигналы, индуцированные деформацией ткани, генерируются и усиливаются [136].До сих пор неясно, какие интегрины участвуют, но было высказано предположение, что интегрины и интегрины участвуют во взаимодействии остеоцитов с костным матриксом [137, 138]. Эти взаимодействия происходят между телом остеоцитов и костным матриксом стенки лакуны, а также между стенкой канальца с отростками остеоцитов [137].
Только узкое перицеллюлярное пространство, заполненное жидкостью, отделяет тело клетки остеоцита и отростки от минерализованного костного матрикса [58]. Расстояние между телом клетки остеоцита и лакунарной стенкой составляет примерно 0.5–1,0 мкм шириной м, тогда как расстояние между мембранами отростков остеоцитов и стенкой канальца колеблется от 50 до 100 нм [139]. Химический состав перицеллюлярной жидкости точно не определен. Однако присутствует разнообразный набор макромолекул, продуцируемых остеоцитами, таких как остеопонтин, остеокальцин, белок матрикса дентина, протеогликаны и гиалуроновая кислота [136, 140, 141].
Остеоциты и их отростки окружены неорганизованным перицеллюлярным матриксом; внутри канальцевой сети наблюдались тонкие фиброзные связи, получившие название «тросы» [139].Было высказано предположение, что одним из возможных соединений этих связок является перлекан [141]. Отростки остеоцитов также могут прикрепляться непосредственно к «бугоркам», которые представляют собой выступающие структуры, исходящие из стенок канальцев. Эти структуры образуют тесные контакты, возможно, посредством -интегринов, с мембраной отростков остеоцитов [137, 142]. Таким образом, эти структуры, по-видимому, играют ключевую роль в механочувствительной функции остеоцитов, воспринимая движения потока жидкости вместе с перицеллюлярным пространством, вызванные силами механической нагрузки [143].Кроме того, движение потока жидкости также важно для двунаправленного транспорта растворенных веществ в перицеллюлярном пространстве, который влияет на сигнальные пути остеоцитов и связь между костными клетками [144, 145].
2.7. Местные и системные факторы, регулирующие гомеостаз кости
Ремоделирование кости — это очень сложный цикл, который достигается согласованными действиями остеобластов, остеоцитов, остеокластов и клеток выстилки кости [3]. Формирование, пролиферация, дифференцировка и активность этих клеток контролируются местными и системными факторами [18, 19].К местным факторам относятся аутокринные и паракринные молекулы, такие как факторы роста, цитокины и простагландины, продуцируемые костными клетками, помимо факторов костного матрикса, которые высвобождаются во время резорбции кости [46, 146]. Системные факторы, которые важны для поддержания гомеостаза костей, включают паратироидный гормон (ПТГ), кальцитонин, 1,25-дигидроксивитамин D 3 (кальцитриол), глюкокортикоиды, андрогены и эстрогены [16, 147–150]. Сообщалось, что, как и PTH, родственный PTH белок (PTHrP), который также связывается с рецептором PTH, влияет на ремоделирование кости [147].
Эстроген играет решающую роль в гомеостазе костной ткани; снижение уровня эстрогенов в период менопаузы является основной причиной потери костной массы и остеопороза [16]. Механизмы действия эстрогена на костную ткань до конца не изучены. Тем не менее, несколько исследований показали, что эстроген поддерживает гомеостаз костей, ингибируя апоптоз остеобластов и остеоцитов [151–153] и предотвращая чрезмерную резорбцию кости. Эстроген подавляет образование и активность остеокластов, а также вызывает апоптоз остеокластов [16, 76, 104, 154].Было высказано предположение, что эстроген снижает образование остеокластов, ингибируя синтез остеокластогенного цитокина RANKL остеобластами и остеоцитами. Более того, эстроген стимулирует эти костные клетки продуцировать остеопротегерин (OPG), рецептор-ловушку RANK в остеокласте, тем самым подавляя остеокластогенез [19, 155–159]. Кроме того, эстроген подавляет образование остеокластов за счет снижения уровней других остеокластогенных цитокинов, таких как IL-1, IL-6, IL-11, TNF- α , TNF- β и M-CSF [160, 161] .
Эстроген действует непосредственно на костные клетки посредством своих рецепторов эстрогена α и β , присутствующих на этих клетках [162]. Более того, было показано, что остеокласт является прямой мишенью для эстрогена [163, 164]. Соответственно, иммуноэкспрессия рецептора эстрогена β была продемонстрирована в клетках альвеолярной кости самок крыс, получавших эстрадиол. Более того, усиленная иммуноэкспрессия, наблюдаемая в TUNEL-положительных остеокластах, указывает на то, что эстроген участвует в контроле продолжительности жизни остеокластов непосредственно с помощью рецепторов эстрогена [163].Эти данные демонстрируют важность эстрогена для поддержания гомеостаза костей.
2,8. Процесс ремоделирования кости
Цикл ремоделирования кости происходит в костных полостях, которые необходимо реконструировать [165]. В этих полостях образуются временные анатомические структуры, называемые базовыми многоклеточными единицами (BMU), которые состоят из группы остеокластов впереди, образующих режущий конус, и группы остеобластов позади, образующих замыкающий конус, связанных с кровеносными сосудами и кровеносными сосудами. периферическая иннервация [11, 166].Было высказано предположение, что BMU покрыт покровом клеток (возможно, выстилающими костями клетками), которые формируют компартмент ремоделирования кости (BRC) [13]. BRC, по-видимому, связан с клетками выстилки кости на поверхности кости, которые, в свою очередь, сообщаются с остеоцитами, заключенными в костном матриксе [13, 14].
Цикл ремоделирования кости начинается с фазы инициации, которая состоит из резорбции кости остеокластами, за которой следует фаза формирования кости остеобластами, но между этими двумя фазами существует переходная (или обратная) фаза.Цикл завершается скоординированными действиями остеоцитов и клеток выстилки кости [10, 11]. В фазе инициации под действием остеокластогенных факторов, включая RANKL и M-CSF, гемопоэтические стволовые клетки рекрутируются в определенные участки поверхности кости и дифференцируются в зрелые остеокласты, которые инициируют резорбцию кости [167, 168].
Известно, что во время цикла ремоделирования кости существуют прямые и непрямые связи между костными клетками в процессе, называемом механизмом сцепления, который включает растворимые факторы сцепления, хранящиеся в костном матриксе, которые будут высвобождаться после резорбции кости остеокластами [169].Например, такие факторы, как инсулиноподобные факторы роста (IGF), трансформирующий фактор роста β (TGF- β ), BMP, FGF и фактор роста тромбоцитов (PDGF), по-видимому, действуют как факторы связывания, поскольку они хранятся в костном матриксе и высвобождаются во время резорбции кости [170]. Эта идея подтверждается генетическими исследованиями на людях и мышах, а также фармакологическими исследованиями [105, 171].
Недавно было высказано предположение, что другая категория молекул, называемых семафоринами, участвует в коммуникации костных клеток во время ремоделирования кости [146].На начальном этапе необходимо подавить дифференцировку и активность остеобластов, чтобы полностью удалить поврежденную или старую кость. Остеокласты экспрессируют фактор, называемый семафорин4D (Sema4D), который ингибирует образование кости во время резорбции кости [172]. Семафорины включают большое семейство гликопротеинов, которые не только связаны с мембраной, но также существуют в виде растворимых форм, которые обнаруживаются в широком диапазоне тканей и, как было показано, участвуют в различных биологических процессах, таких как иммунный ответ, органогенез, развитие сердечно-сосудистой системы и опухоли. прогрессия [172, 173].В костях было высказано предположение, что семафорины также участвуют в межклеточной коммуникации между остеокластами и остеобластами во время цикла ремоделирования кости [174–176].
Sema4D, экспрессируемый в остеокластах, связывается со своим рецептором (Plexin-B1), присутствующим в остеобластах, и ингибирует путь IGF-1, необходимый для дифференцировки остеобластов [172], что позволяет предположить, что остеокласты подавляют образование костей, экспрессируя Sema4D. Напротив, другой член семейства семафоринов (Sema3A) был обнаружен в остеобластах и считается ингибитором остеокластогенеза [177].Таким образом, во время цикла ремоделирования кости остеокласты ингибируют образование кости, экспрессируя Sema4D, чтобы инициировать резорбцию кости, тогда как остеобласты экспрессируют Sema3A, который подавляет резорбцию кости, до образования кости [146] (Рис. 5).
Недавние исследования также предполагают существование других факторов, участвующих в механизме сцепления во время цикла ремоделирования кости. Одним из этих факторов является эфринB2, мембраносвязанная молекула, экспрессирующаяся в зрелых остеокластах, которая связывается с ephrinB4, обнаруженным в плазматической мембране остеобластов.Связывание ephrinB2 / ephrinB4 передает двунаправленные сигналы, которые способствуют дифференцировке остеобластов, тогда как обратная передача сигналов (ephrinB4 / ephrinB2) ингибирует остеокластогенез [178] (Рисунок 5). Эти находки предполагают, что путь ephrinB2 / ephrinB4 может быть вовлечен в прекращение резорбции кости и индуцирует дифференцировку остеобластов в переходной фазе [178].
Кроме того, было показано, что эфринB2 также экспрессируется в остеобластах [179]. Более того, зрелые остеокласты секретируют ряд факторов, которые стимулируют дифференцировку остеобластов, таких как секретируемые сигнальные молекулы Wnt10b, BMP6 и сигнальный сфинголипид, сфингозин-1-фосфат [180].Эти находки указывают на очень сложный механизм эфринов и участие других факторов в коммуникации остеокластов / остеобластов во время цикла ремоделирования кости. С другой стороны, несмотря на исследования, в которых сообщается об участии семафоринов и эфринов в коммуникации остеокластов / остеобластов, прямой контакт между зрелыми остеобластами и остеокластами не был продемонстрирован in vivo и до сих пор остается спорным.
Помимо остеокластов и остеобластов, было продемонстрировано, что остеоциты играют ключевую роль во время цикла ремоделирования кости [8].Фактически, под влиянием нескольких факторов остеоциты действуют как организаторы процесса ремоделирования кости, производя факторы, которые влияют на активность остеобластов и остеокластов [55] (Рисунок 5). Например, механическая нагрузка стимулирует остеоциты производить факторы, которые оказывают анаболическое действие на кость, такие как PGE 2 , простациклин (PGI 2 ), NO и IGF-1 [181–184]. С другой стороны, механическая разгрузка подавляет анаболические факторы и стимулирует остеоциты продуцировать склеростин и DKK-1, которые являются ингибиторами активности остеобластов [185–188], а также специфических факторов, стимулирующих местный остеокластогенез [189].Склеростин является продуктом гена SOST и, как известно, является негативным регулятором образования кости, подавляя в остеобластах действие Lrp5, ключевого рецептора сигнального пути Wnt / β -катенин [63].
Апоптоз остеоцитов, как было показано, действует как хемотаксический сигнал для локального рекрутирования остеокластов [70, 150, 152, 190, 191]. Соответственно, сообщалось, что остеокласты поглощают апоптотические остеоциты [74, 75, 192], предполагая, что остеокласты способны удалять умирающие остеоциты и / или остеобласты из участка ремоделирования (Рисунки 4 (c) и 4 (d)).Более того, сообщается, что остеокластогенные факторы также продуцируются жизнеспособными остеоцитами рядом с умирающими остеоцитами [193]. Имеются данные о том, что остеоциты действуют как основной источник RANKL, способствуя остеокластогенезу [167, 168], хотя было продемонстрировано, что этот фактор также продуцируется другими типами клеток, такими как стромальные клетки [194], остеобласты и фибробласты [88, 89].
Таким образом, все еще существует неопределенность в отношении точных факторов, стимулирующих остеокластогенез, продуцируемых остеоцитами.Недавние обзоры сосредоточены на некоторых молекулах, которые могут быть кандидатами на передачу сигналов между апоптозом остеоцитов и остеокластогенезом [72, 73]. Например, в костях, подвергнутых усталостной нагрузке, жизнеспособные остеоциты вблизи апоптотических, помимо высокого отношения RANKL / OPG, экспрессируют повышенные уровни фактора роста эндотелия сосудов (VEGF) и хемоаттрактантного протеина-1 моноцитов (CCL2), способствуя усилению местного остеокластогенеза. [194, 195]. Было высказано предположение, что остеоциты действуют как основной источник RANKL, способствуя остеокластогенезу [166, 167].Кроме того, увеличение отношения RANKL / OPG, экспрессируемого остеоцитами, также наблюдалось у крыс с дефицитом коннексина 43, что позволяет предположить, что нарушение межклеточной коммуникации между остеоцитами может индуцировать высвобождение местных проостеокластогенных цитокинов [33, 196, 197] . Белок-бокс группы с высокой подвижностью 1 (HMGB1) [198–200] и M-CSF [201], как предполагается, также продуцируются остеоцитами, которые стимулируют рекрутирование остеокластов во время ремоделирования кости [72, 73]. Таким образом, для решения этой проблемы необходимы дальнейшие исследования.
2.9. Эндокринные функции костной ткани
Классические функции костной ткани, помимо передвижения, включают поддержку и защиту мягких тканей, хранение кальция и фосфатов и укрытие костного мозга. Кроме того, недавние исследования были сосредоточены на эндокринных функциях костей, которые могут влиять на другие органы [202]. Например, было показано, что остеокальцин, продуцируемый остеобластами, действует на другие органы [203]. Остеокальцин можно найти в двух различных формах: карбоксилированном и недкарбоксилированном.Карбоксилированная форма имеет высокое сродство к кристаллам гидроксиапатита, оставаясь в костном матриксе во время его минерализации. Андеркарбоксилированная форма проявляет более низкое сродство к минералам из-за подкисления костного матрикса во время резорбции остеокластов кости, а затем она транспортируется кровотоком, достигая других органов [204, 205]. Было показано, что недокарбоксилированный остеокальцин оказывает некоторое действие на поджелудочную железу, жировую ткань, яички и нервную систему. В поджелудочной железе остеокальцин действует как положительный регулятор секреции и чувствительности инсулина поджелудочной железы, а также пролиферации β -клеток поджелудочной железы [110].В жировой ткани остеокальцин стимулирует экспрессию гена адипонектина, что, в свою очередь, увеличивает чувствительность к инсулину [204]. В яичках остеокальцин может связываться со специфическим рецептором в клетках Лейдига и усиливать синтез тестостерона и, как следствие, увеличивать фертильность [206]. Остеокальцин также стимулирует синтез моноаминовых нейромедиаторов в гиппокампе и ингибирует синтез гамма-аминомасляной кислоты (ГАМК), улучшая обучаемость и навыки памяти [207].
Остеоциты способствуют другой эндокринной функции костной ткани.Эти клетки способны регулировать метаболизм фосфатов за счет продукции FGF23, который действует на другие органы, включая паращитовидную железу и почки, снижая уровень циркулирующих фосфатов [208, 209]. Остеоциты также действуют на иммунную систему, изменяя микроокружение в первичных лимфоидных органах и тем самым влияя на лимфопоэз [210]. Известно, что активность не только остеоцитов, но также остеобластов и остеокластов влияет на иммунную систему, в основном при воспалительном разрушении костей.Действительно, открытие коммуникативного взаимодействия между скелетной и иммунной системами привело к появлению новой области исследований, называемой остеоиммунологией [211].
3. Выводы
Знание структурной, молекулярной и функциональной биологии кости имеет важное значение для лучшего понимания этой ткани как многоклеточной единицы и динамической структуры, которая также может действовать как эндокринная ткань, функция все еще плохо понял. In vitro и in vivo Исследования продемонстрировали, что костные клетки реагируют на различные факторы и молекулы, что способствует лучшему пониманию пластичности костных клеток.Кроме того, взаимодействия костных клеток, зависимые от интегринов матрикса, необходимы для образования и резорбции кости. Исследования обращали внимание на важность лакуноканаликулярной системы и перицеллюлярной жидкости, с помощью которой остеоциты действуют как механосенсоры, для адаптации кости к механическим силам. Гормоны, цитокины и факторы, регулирующие активность костных клеток, такие как склеростин, эфринB2 и семафоринг, играют значительную роль в гистофизиологии кости в нормальных и патологических условиях.Таким образом, такое более глубокое понимание динамической природы костной ткани, безусловно, поможет управлять новыми терапевтическими подходами к заболеваниям костей.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарности
Это исследование было поддержано Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP-2010 / 10391-9; 2012 / 19428-8 и 2012 / 22666-8), Conselho Nacional de Desenvolvimento Cientnífico ecientnífico ecientnífico (CNPq) и Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), Бразилия.
Что такое остеобласты?
Остеобласты — это клетки, необходимые для синтеза и минерализации кости, как во время начального формирования кости, так и во время ремоделирования кости.
Эти клетки присутствуют на поверхности кости в виде плотно упакованного слоя, от которого от тела остеобласта отходят отростки через развивающуюся кость.
Остеобласты и остеокласты. Процесс ремоделирования кости. В здоровом организме остеокласты и остеобласты работают вместе, чтобы поддерживать баланс между потерей костной массы и ее формированием.Кредит изображения: Designua / Shutterstock
Эти костеобразующие клетки образуются, когда остеогенные клетки дифференцируются в ткани, покрывающей внешнюю поверхность кости, называемую надкостницей. Они также возникают в результате дифференцировки остеогенных клеток, происходящей в эндосте, структуре, обнаруженной в середине кости и в костном мозге.
Остеобласты продуцируют множество веществ, включая факторы роста, коллагеназу, остеокальцин, щелочную фосфатазу и коллаген.
Костный матрикс со временем разрастается и окружает остеобласты, и костный материал кальцинируется.После окружения и захвата остеобласт становится зрелой костной клеткой, называемой остеоцитом.
Формирование кости
Развитие и рост кости называют остеогенезом или окостенением. Некоторые скелетные кости начинают формироваться в течение первых нескольких недель после зачатия, а через восемь недель в хрящах и соединительной ткани формируется скелетный узор, после чего начинается окостенение.
Кость продолжает развиваться на протяжении всей взрослой жизни, восстанавливая переломы и реконструируя кость.
Существует два типа костеобразования или окостенения, а именно внутримембранозное окостенение и эндохондральное окостенение.
Внутримембранозное окостенение
В этом процессе мембраны соединительной ткани заменяются костной тканью с образованием костей, называемых внутримембранозными костями. Примерами образованной таким образом кости являются череп, нижняя челюсть и ключицы.
Остеобласты мигрируют к мембранам соединительной ткани, где откладывают костный матрикс, который затем окружает их, после чего они становятся остеоцитами.
Здесь гиалиновый хрящ заменяется костной тканью, из которой формируется большинство костей скелета. Кости, образующиеся таким образом, называются эндохондральными костями.
В конце первого триместра остеобласты и кровеносные сосуды инфильтрируют надхрящницу, окружающую гиалиновый хрящ, после чего надхрящница становится надкостницей.
Остеобласты образуют полосу компактной кости, которая окружает среднюю часть кости, называемую диафизом, в то время как хрящ в середине этой структуры начинает разрушаться и через него проникают остеобласты, которые заменяют хрящ губчатой костью, чтобы создать первичный центр окостенения.
Это окостенение распространяется наружу от центра и продолжается до концов кости, называемых эпифизами.
В концевых костях хрящ продолжает расти, что увеличивает длину кости по мере ее развития. После рождения на этих костных концах начинают формироваться вторичные центры окостенения.
После формирования центров кость заменяет гиалиновый хрящ во всех областях, кроме двух — поверхность конца кости остается покрытой гиалиновым хрящом и суставным хрящом и остается на месте между концом кости и диафизом.
В эпифизарной пластинке роста кости увеличиваются в длину аналогично тому, как происходит эндохондральная оссификация.
Хрящ в части пластинки, прилегающей к концу кости, подвергается митозу и продолжает расти. В области, прилегающей к диафизу, клетки хряща, называемые хондроцитами, начинают стареть и разрушаться.
Остеобласты мигрируют в эту область, и матрикс окостеняет, образуя кость. Это постоянный процесс в детстве и в раннем взрослом возрасте, когда рост хряща замедляется и в конечном итоге прекращается.
Обычно это происходит в начале двадцатых годов, когда эпифизарная пластинка роста подвергается полной оссификации и дальнейшего роста кости не происходит.
Хотя кости перестают увеличиваться в длине в раннем взрослом возрасте, кость все же может утолщаться в ответ на такие факторы, как увеличение веса или повышенная мышечная активность, процесс, называемый аппозиционным ростом.
Диаметр кости увеличивается, так как остеобласты создают компактную кость, которая окружает внешнюю поверхность кости, а остеокласты разрушают кость на внутренней поверхности.Это позволяет кости утолщаться, не становясь слишком большой и тяжелой.
Дополнительная информация
Разница между остеобластами и остеокластами
Остеобласты и остеокласты — это два типа костных клеток, которые составляют костную ткань или костную ткань. Кость представляет собой метаболически активную ткань, состоящую из нескольких типов клеток, среди которых остеобластов и остеокластов являются наиболее важными. Остеобласты отвечают за образование костей, тогда как остеокласты отвечают за разрушение костей.
Согласованные действия этих двух клеток необходимы для образования и резорбции (разрушения) костей. Это скоординированное действие между остеобластами и остеокластами известно как костное ремоделирование . Ремоделирование костей также обеспечивает поддержание костей и регулирование уровня минералов, особенно кальция и фосфора, в организме.
Сходства между остеобластами и остеокластами
Ø И остеобласты, и остеокласты являются костными клетками.
Ø Оба они участвуют в ремоделировании кости.
Ø Оба участвуют в восстановлении костей.
Ø Обе клетки являются живыми с ядром.
Ø Оба являются метаболически очень активными клетками.
Ø Обе клетки расположены на поверхности остеонного шва.
Ø Оба соединительнотканные.
Разница между остеобластами и остеокластами
| Sl. № | Остеобласты | Остеокласты |
|---|---|---|
| 1 | Остеобласты способствуют образованию кости. | Остеокласты способствуют разрушению костей. |
| 2 | Ячейки сравнительно меньше по размеру. | Ячейки сравнительно большие. |
| 3 | Остеобласты одноядерные. | Остеокласты многоядерные. |
| 4 | Клетки обладают сравнительно меньшим количеством митохондрий, вакуолей и лизосом. | Клетки обладают сравнительно большим количеством митохондрий, вакуолей и лизосом. |
| 5 | Клетки образуют белок-остеоид. | Не производят остеоидный белок. |
| 6 | Ячейки не имеют зон уплотнения и взъерошенных границ. | Ячейки имеют зоны уплотнения и волнистые края. |
| 7 | Остеоциты вырабатывают гормон — простагландины. | Остеобласты не производят никаких гормонов. |
| 8 | Клетки обладают рецепторами паратироидного (ПТГ) гормона. | Рецепторы паратироидного гормона в остеокластах отсутствуют. |
| 9 | Клетки вырабатывают большое количество фермента щелочной фосфатазы. | Клетки продуцируют большое количество фермента кислой фосфатазы, устойчивого к тартрату. |
| 10 | Остеобласты происходят из плюрипотентных мезенхимальных стволовых клеток. | Остеокласты происходят из кроветворных клеток линии гранулоцитов-макрофагов. |
| 11 | Остеобласты не имеют фагоцитарного механизма. | Остеокласты оснащены фагоцитарным механизмом. |
| 12 | Остеобласты становятся остеоцитами в конце формирования кости. | Остеокласты не превращаются в остеоциты. |
<< Вернуться к лекциям по физиологии человека
Если вам нравится этот пост… пожалуйста, добавьте свои лайки в виде КОММЕНТАРИИ (внизу ↓)
Больше примечаний к лекциям по физиологии…
Совместное использование — это забота… Пожалуйста, поделитесь с друзьями …
Какова роль остеокластов в патогенезе остеопороза?
Портер Дж. Л., Варакалло М. Остеопороз. 2020 Январь [Medline]. [Полный текст].
Джонстон CB, Дагар М. Остеопороз у пожилых людей. Мед Клин Норт Ам . 2020 Сентябрь 104 (5): 873-884. [Медлайн].
Lynn SG, Sinaki M, Westerlind KC. Характеристики баланса лиц с остеопорозом. Arch Phys Med Rehabil .1997 г., 78 (3): 273-7. [Медлайн].
[Рекомендации] Cosman F, de Beur SJ, LeBoff MS, Lewiecki EM, Tanner B, Randall S, et al. Руководство клинициста по профилактике и лечению остеопороза. Остеопорос Инт . 2014 25 октября (10): 2359-81. [Медлайн]. [Полный текст].
[Рекомендации] Шоусбоу Дж. Т., Шеперд Дж. А., Билезикян Дж. П., Баим С. Краткое изложение конференции Международного общества клинической денситометрии 2013 г. по разработке позиции по денситометрии костей. Дж. Клин Денситом . 2013 окт-дек. 16 (4): 455-66. [Медлайн].
Gosfield E 3rd, Bonner FJ Jr. Оценка минеральной плотности костной ткани при остеопорозе. Am J Phys Med Rehabil . 2000 май-июнь. 79 (3): 283-91. [Медлайн].
Kanis JA, McCloskey EV, Johansson H, Oden A, Melton LJ 3rd, Khaltaev N. Справочный стандарт для описания остеопороза. Кость . 2008 г., 42 (3): 467-75. [Медлайн].
Сильверман SL.Отбор пациентов для лечения остеопороза. Энн Н. Ю. Акад. Наук . 2007 ноябрь 1117: 264-72. [Медлайн].
Czerwinski E, Badurski JE, Marcinowska-Suchowierska E, Osieleniec J. Текущее понимание остеопороза в соответствии с позицией Всемирной организации здравоохранения (ВОЗ) и Международного фонда остеопороза. Ortop Traumatol Rehabil . 2007 июль-август. 9 (4): 337-56. [Медлайн].
Канис Я. Оценка риска переломов и ее применение для скрининга постменопаузального остеопороза: синопсис отчета ВОЗ.Исследовательская группа ВОЗ. Остеопорос Инт . 1994 4 ноября (6): 368-81. [Медлайн].
[Рекомендации] Камачо П.М., Петак С.М., Бинкли Н., Диаб Д.Л., Элдейри Л.С., Фаруки А. и др. АМЕРИКАНСКАЯ АССОЦИАЦИЯ КЛИНИЧЕСКИХ ЭНДОКРИНОЛОГОВ / АМЕРИКАНСКИЙ КОЛЛЕДЖ ЭНДОКРИНОЛОГИИ ОБНОВЛЕНИЕ КЛИНИЧЕСКОЙ ПРАКТИКИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ ПОСТМЕНОПАУЗНОГО ОСТЕОПОРОЗА-2020 Эндокр Практик . 2020 май. 26 (Дополнение 1): 1-46. [Медлайн]. [Полный текст].
[Рекомендации] Бакли Л., Гайатт Г., Финк Х.А., Кэннон М., Гроссман Дж., Хансен К.Э. и др.Руководство Американского колледжа ревматологии по профилактике и лечению остеопороза, вызванного глюкокортикоидами, 2017 г. Центр лечения артрита (Хобокен) . 2017 Август 69 (8): 1095-1110. [Медлайн]. [Полный текст].
Аль Саеди А., Ступка Н., Дуке Г. Патогенез остеопороза. Handb Exp Pharmacol . 2020 16 апреля. 115 (12): 3318-25. [Медлайн].
Majumdar SR, Lier DA, Beaupre LA, Hanley DA, Maksymowych WP, Juby AG и др.Специалист по лечению остеопороза у пациентов с переломом шейки бедра: результаты анализа экономической эффективности, проведенного в рамках рандомизированного исследования. Arch Intern Med . 2009 12 января. 169 (1): 25-31. [Медлайн].
Cosman F, de Beur SJ, LeBoff MS, Lewiecki EM, Tanner B, Randall S, et al. Руководство клинициста по профилактике и лечению остеопороза. Остеопорос Инт . 2014 25 октября (10): 2359-81. [Медлайн].
Мэйбери К. Укрепление коммуникации о здоровье костей.Гэллап. Доступно по адресу http://www.gallup.com/poll/5851/Strengtning-Communication-Bone-Health.aspx?g_source=osteoporosis&g_medium=search&g_campaign=tiles. 23 апреля 2002 г .; Дата обращения: 21 января 2021 г.
Хаас А.В., ЛеБофф М.С. Остеоанаболические агенты при остеопорозе. J Endocr Soc . 1 августа 2018 г. 2 (8): 922-932. [Медлайн].
Всемирная организация здравоохранения. Научная группа ВОЗ по оценке остеопороза на уровне первичной медико-санитарной помощи: итоговый отчет о совещании.Доступно на http://www.who.int/chp/topics/Osteoporosis.pdf. 2007; Дата обращения: 21 января 2021 г.
Кларк Б. Анатомия и физиология нормальной кости. Clin J Am Soc Nephrol . 2008 г., 3 ноября, приложение 3: S131-9. [Медлайн].
Bono CM, Einhorn TA. Обзор остеопороза: патофизиология и факторы, определяющие прочность костей. Eur Spine J . 12 октября 2003 г., приложение 2: S90-6. [Медлайн].
Seeman E, Delmas PD.Качество костей — материальная и структурная основа прочности и хрупкости костей. N Engl J Med . 2006 25 мая. 354 (21): 2250-61. [Медлайн].
С. Танака, К. Накамура, Н. Такахас. Роль RANKL в физиологической и патологической резорбции кости и терапевтических действиях, направленных на сигнальную систему RANKL-RANK. Иммунол Ред. . 2005. 208: 30-49. [Полный текст].
Mora S, Gilsanz V. Установление максимальной костной массы. Endocrinol Metab Clin North Am .2003 марта 32 (1): 39-63. [Медлайн].
Föger-Samwald U, Dovjak P, Azizi-Semrad U, Kerschan-Schindl K, Pietschmann P. Остеопороз: патофизиология и варианты лечения. ИСКЛЮЧИТЕЛЬНО J . 2020.19: 1017-1037. [Медлайн].
Raisz LG. Патогенез остеопороза: концепции, конфликты, перспективы. Дж. Клин Инвест . 2005 декабрь 115 (12): 3318-25. [Медлайн].
Jilka RL, Hangoc G, Girasole G, Passeri G, Williams DC, Abrams JS и др.Повышенное развитие остеокластов после потери эстрогена: посредничество интерлейкина-6. Наука . 1992 г. 3 июля. 257 (5066): 88-91. [Медлайн].
Föger-Samwald U, Dovjak P, Azizi-Semrad U, Kerschan-Schindl K, Pietschmann P. Остеопороз: патофизиология и варианты лечения. ИСКЛЮЧИТЕЛЬНО J . 2020.19: 1017-1037. [Медлайн].
Клайн-Смит А., Аксельбаум А., Шашкова Е., Чакраборти М., Сэнфорд Дж., Панесар П. и др. Овариэктомия активирует хроническое воспаление низкой степени, опосредованное Т-клетками памяти, что способствует остеопорозу у мышей. Дж Боун Минер Рес . 2020 июн. 35 (6): 1174-1187. [Медлайн].
Demontiero O, Vidal C, Duque G. Старение и потеря костной массы: новые идеи для клинициста. Мышечно-скелетный дисфункция . 2012 Апрель 4 (2): 61-76. [Медлайн].
Уорринер А.Х., Паткар Н.М., Кертис Дж. Р., Делзелл Э., Гэри Л., Килгор М. и др. Какие переломы чаще всего связаны с остеопорозом ?. Дж. Клин Эпидемиол . 2011 Январь 64 (1): 46-53. [Медлайн].
Каммингс С.Р., Мелтон Л.Дж.Эпидемиология и исходы остеопоротических переломов. Ланцет . 2002 18 мая. 359 (9319): 1761-7. [Медлайн].
Розен CJ, Тененхаус А. Биохимические маркеры обмена костной ткани. Взгляните на лабораторные тесты, которые отражают состояние костей. Постградская медицина . Октябрь 1998. 104 (4): 101-2, 107-10.
Nusse R. Передача сигналов Wnt при заболевании и развитии. Ячейка Res . 2005 15 января (1): 28-32. [Медлайн].
Ling L, Nurcombe V, Cool SM.Передача сигналов Wnt контролирует судьбу мезенхимальных стволовых клеток. Ген . 2009 15 марта. 433 (1-2): 1-7. [Медлайн].
Питтенгер М.Ф., Маккей А.М., Бек С.К., Джайсвал Р.К., Дуглас Р., Моска Д.Д. и др. Многолинейный потенциал мезенхимальных стволовых клеток взрослого человека. Наука . 1999, 2 апреля. 284 (5411): 143-7. [Медлайн].
Рао Т.П., Кюль М. Обновленный обзор сигнальных путей Wnt: прелюдия к большему. Circ Res . 25 июня 2010 г.106 (12): 1798-806. [Медлайн].
Clevers H, Nusse R. Передача сигналов Wnt / ß-катенина и заболевание. Ячейка . 2012 июн 8. 149 (6): 1192-205. [Медлайн].
Кришнан В., Брайант Х.Ю., Макдугалд О.А. Регулирование костной массы с помощью передачи сигналов Wnt. Дж. Клин Инвест . 2006 май. 116 (5): 1202-9. [Медлайн]. [Полный текст].
Бойден Л.М., Мао Дж., Бельски Дж., Мицнер Л., Фархи А., Митник М.А. и др. Высокая плотность костной ткани из-за мутации белка, связанного с рецепторами ЛПНП 5. N Engl J Med . 2002 16 мая. 346 (20): 1513-21. [Медлайн].
Van Wesenbeeck L, Cleiren E, Gram J, Beals RK, Bénichou O, Scopelliti D, et al. Шесть новых миссенс-мутаций в гене белка 5, связанного с рецептором ЛПНП (LRP5), в различных условиях с повышенной плотностью костей. Ам Джам Генет . 2003 Mar.72 (3): 763-71. [Медлайн]. [Полный текст].
Levasseur R, Lacombe D, de Vernejoul MC. Мутации LRP5 при синдроме остеопороза-псевдоглиомы и нарушениях с высокой костной массой. Костный сустав позвоночника . 2005 г., май. 72 (3): 207-14. [Медлайн].
Zhu Y, Sun Z, Han Q, Liao L, Wang J, Bian C и др. Мезенхимальные стволовые клетки человека подавляют пролиферацию раковых клеток, секретируя DKK-1. Лейкемия . 2009 Май. 23 (5): 925-33. [Медлайн].
Kawano Y, Kypta R. Секретные антагонисты сигнального пути Wnt. J Cell Sci . 1 июля 2003 г., 116: 2627-34. [Медлайн].
Кайзер М., Мит М., Либиш П., Оберлендер Р., Радемахер Дж., Якоб С. и др.Концентрация DKK-1 в сыворотке крови коррелирует со степенью заболевания костей у пациентов с множественной миеломой. евро J Haematol . 2008 июн. 80 (6): 490-4. [Медлайн].
Tai N, Inoue D. [Антитело против Dickkopf1 (Dkk1) как костный анаболический агент для лечения остеопороза]. Клин Кальций . 2014 24 января (1): 75-83. [Медлайн].
Bonewald LF. Удивительный остеоцит. Дж Боун Минер Рес . 2011 26 февраля (2): 229-38.[Медлайн]. [Полный текст].
Li X, Zhang Y, Kang H, Liu W, Liu P, Zhang J и др. Склеростин связывается с LRP5 / 6 и противодействует канонической передаче сигналов Wnt. Дж. Биол. Хим. . 2005 г. 20 мая. 280 (20): 19883-7. [Медлайн].
FDA одобрило новое лечение остеопороза у женщин в постменопаузе с высоким риском переломов. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно по адресу https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-osteoporosis-postmenopausal-women-high-risk-fracture.09 апреля 2019 г .; Дата обращения: 21 января 2021 г.
Ringe JD, Farahmand P. Достижения в лечении индуцированного кортикостероидами остеопороза с помощью бисфосфонатов. Клин Ревматол . 2007 Апрель, 26 (4): 474-84. [Медлайн].
Dennison EM, Syddall HE, Sayer AA, Gilbody HJ, Cooper C. Вес при рождении и вес в 1 год являются независимыми детерминантами костной массы в седьмом десятилетии: когортное исследование в Хартфордшире. Педиатр Res .2005 апр. 57 (4): 582-6. [Медлайн].
Fall C, Hindmarsh P, Dennison E, Kellingray S, Barker D, Cooper C. Программирование секреции гормона роста и минеральной плотности костей у пожилых мужчин: гипотеза. Дж. Клин Эндокринол Метаб . 1998, январь, 83 (1): 135-9. [Медлайн].
Марини Ф, Чианферотти Л, Брэнди МЛ. Эпигенетические механизмы в биологии костей и остеопорозе: могут ли они определять терапевтический выбор ?. Int J Mol Sci . 2016 12 августа.17 (8): [Medline].
Коланджело Л., Биамонте Ф., Пепе Дж., Чиприани С., Минисола С. Понимание и лечение вторичного остеопороза. Эксперт Рев эндокринол Метаб . 2019 14 марта (2): 111-122. [Медлайн].
Kelman A, Lane NE. Ведение вторичного остеопороза. Лучший Практик Res Clin Rheumatol . 2005 Декабрь 19 (6): 1021-37. [Медлайн].
Адамс Дж. С., Сонг К. Ф., Канторович В. Быстрое восстановление костной массы у мужчин с гиперкальциурией и остеопорозом, получавших гидрохлоротиазид. Энн Интерн Мед. 1999 20 апреля. 130 (8): 658-60. [Медлайн].
Манн ГБ, Канг Ю.С., Бренд C, Эбелинг ПР, Миллер Дж. Вторичные причины низкой костной массы у пациентов с раком груди: необходимость большей бдительности. Дж. Клин Онкол . 2009, 1. 27 (22): 3605-10. [Медлайн].
Холик MF. Дефицит витамина D. N Engl J Med . 2007 июля 19, 357 (3): 266-81. [Медлайн].
di Munno O, Mazzantini M, Sinigaglia L, Bianchi G, Minisola G, Muratore M и др.Влияние низких доз метотрексата на плотность костей у женщин с ревматоидным артритом: результаты многоцентрового поперечного исследования. Дж. Ревматол. . 2004 июля 31 (7): 1305-9. [Медлайн].
Migliaccio S, Brama M, Malavolta N. Управление остеопорозом, вызванным глюкокортикоидами: роль терипаратида. Центр управления рисками в клинике . 2009 Апрель, 5 (2): 305-10. [Медлайн]. [Полный текст].
van Staa TP, Leufkens HG, Cooper C. Эпидемиология остеопороза, вызванного кортикостероидами: метаанализ. Остеопорос Инт . 2002 13 октября (10): 777-87. [Медлайн].
Licata AA. Проблемы оценки риска переломов с помощью DXA: изменение представлений о прочности и плотности костей. Aerosp Med Hum Perform . 2015 Июль 86 (7): 628-32. [Медлайн].
Оценка риска переломов и ее применение для скрининга постменопаузального остеопороза. Отчет исследовательской группы ВОЗ. Представитель Мировой службы здравоохранения по органам, сер. . 1994 г.843: 1-129. [Медлайн].
Lyles KW, Schenck AP, Colón-Emeric CS. Переломы бедра и другие остеопоротические переломы увеличивают риск последующих переломов у жителей домов престарелых. Остеопорос Инт . 2008 19 августа (8): 1225-33. [Медлайн]. [Полный текст].
Финк Х.А., Кусковски М.А., Тейлор Б.К., Шоусбой Д.Т., Орволл Э.С., Энсруд К.Э. Связь болезни Паркинсона с ускоренной потерей костной массы, переломами и смертностью у пожилых мужчин: исследование остеопоротических переломов у мужчин (MrOS). Остеопорос Инт . 2008 сентября 19 (9): 1277-82. [Медлайн].
Синаки М. Физические упражнения и остеопороз. Arch Phys Med Rehabil . 1989 марта 70 (3): 220-9. [Медлайн].
Yaturu S, DjeDjos S, Alferos G, Deprisco C. Изменения минеральной плотности костной ткани при андрогенной депривационной терапии рака простаты и ответ на антирезорбтивную терапию. Рак предстательной железы Простатический диск . 2006. 9 (1): 35-8. [Медлайн].
Буско М.Химическое вещество в зубной пасте связано с остеопорозом у женщин. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/8. 26 июня 2019 г .; Дата обращения: 27 июня 2019 г.
Hansen D, Bazell C, Pelizzari P, Pyenson B. Стоимость программы Medicare при остеопоротических переломах: клиническое и финансовое бремя важного последствия остеопороза. Доступно по адресу https://static1.squarespace.com/static/5c0860aff793924efe2230f3/t/5d76b949deb7e9086ee3d7dd/1568061771769/Medicare+Cost+of+Osteoporotic+Fractures+201.pdf. Август 2019; Дата обращения: 21 января 2021 г.
Купер С., Кэмпион Дж., Мелтон Л.Дж. 3-й. Переломы бедра у пожилых людей: мировая проекция. Остеопорос Инт . 1992 ноябрь 2 (6): 285-9. [Медлайн].
Кто кандидаты для профилактики и лечения остеопороза ?. Остеопорос Инт . 1997. 7 (1): 1-6. [Медлайн].
Jensen GF, Christiansen C, Boesen J, Hegedüs V, Transbøl I. Эпидемиология переломов позвоночника и длинных костей в постменопаузе.Единый подход к постменопаузальному остеопорозу. Клин Ортоп Релат Рес . 1982 июн. 75–81. [Медлайн].
Мелтон Л.Дж., 3-й, Кан Ш., Фрай М.А., Ванер Х.В., О’Фаллон В.М., Риггс Б.Л. Эпидемиология переломов позвонков у женщин. Am J Epidemiol . 1989 Май. 129 (5): 1000-11. [Медлайн].
Смит Р., Вордсворт П. Остеопороз. Клинические и биохимические заболевания скелета . 2005. 123.
.
Chon KS, Sartoris DJ, Brown SA, Clopton P.Связанная с алкоголизмом потеря костной массы позвоночника и бедра у воздерживающихся от алкоголя мужчин, измеренная с помощью двойной рентгеновской абсорбциометрии. Скелетная радиология . 1992. 21 (7): 431-6. [Медлайн].
Роббинс Дж., Арагаки А. К., Куперберг С., Уоттс Н., Вактавски-Венде Дж., Джексон Р. Д. и др. Факторы, связанные с 5-летним риском перелома шейки бедра у женщин в постменопаузе. ЯМА . 2007 28 ноября. 298 (20): 2389-98. [Медлайн].
Bass MA, Sharma A, Nahar VK, Chelf S, Zeller B, Pham L, et al.Минеральная плотность костной ткани у мужчин и женщин в возрасте от 35 до 50 лет. Дж. Ам Остеопат Асс . 1 июня 2019 г. 119 (6): 357-363. [Медлайн]. [Полный текст].
Вулф Д., Pfleger B. Бремя основных условий опорно-двигательного аппарата. Орган здоровья Bull World . 2003. 81 (9): 646-56. [Медлайн]. [Полный текст].
Бальфур Ф. Китайское «Демографическое цунами». Bloomberg Businessweek. 5 января 2012 г. Доступно по адресу http://www.businessweek.com/magazine/chinas-demographic-tsunami-01052012.html. Доступ: 16 февраля 2012 г.
Морин С.Н., Ликс Л.М., Маджумдар С.Р., Лесли В.Д. Временные тенденции в частоте остеопоротических переломов. Curr Osteoporos Rep . 2013 декабрь 11 (4): 263-9. [Медлайн].
Melton LJ 3rd, Sampson JM, Morrey BF, Ilstrup DM. Эпидемиологические особенности переломов костей таза. Клин Ортоп Релат Рес . 1981 март-апрель. 43-7. [Медлайн].
Cauley JA, Lui LY, Ensrud KE, Zmuda JM, Stone KL, Hochberg MC, et al.Минеральная плотность костной ткани и риск возникновения нестандартных переломов у чернокожих и белых женщин. ЯМА . 2005 4 мая. 293 (17): 2102-8. [Медлайн].
Здоровье костей и остеопороз: отчет главного хирурга. Вашингтон, округ Колумбия: Министерство здравоохранения и социальных служб; 2004. [Полный текст].
Бердж Р., Доусон-Хьюз Б., Соломон Д.Х. и др. Заболеваемость и экономическое бремя переломов, связанных с остеопорозом, в США, 2005-2025 гг. Дж Боун Минер Рес . 2007 марта 22 (3): 465-75. [Медлайн].
Hackethal V. Препараты от остеопороза могут помочь самым пожилым и больным женщинам. Медицинские новости Medscape . 18 июня 2019 г. Доступно по адресу https://www.medscape.com/viewarticle/
3#vp_2.
Ensrud KE, Kats AM, Boyd CM, Diem SJ, Schousboe JT, Taylor BC, et al. Связь определения заболевания, бремени коморбидности и прогноза с вероятностью перелома бедра среди женщин позднего возраста. JAMA Intern Med . 17 июня 2019 г. [Medline].
Шарон Чоу, доктор медицины, Анджали Гровер, доктор медицины, и Мерил С. ЛеБофф, доктор медицины. Новые остеопоротические / компрессионные переломы позвонков. Доступно на https://www.ncbi.nlm.nih.gov/books/NBK279035/. 19.09.18; Дата обращения: 27.12.20.
Купер С., Аткинсон Э.Дж., Якобсен С.Дж. и др. Популяционное исследование выживаемости после остеопоротических переломов. Am J Epidemiol . 1 мая 1993 г., 137 (9): 1001-5. [Медлайн].
Кадо Д.М., Браунер В.С., Палермо Л., Невитт М.С., Генант Г.К., Каммингс С.Р. Переломы позвонков и смертность у пожилых женщин: проспективное исследование. Исследование группы исследования остеопоротических переломов. Arch Intern Med . 1999, 14 июня. 159 (11): 1215-20. [Медлайн].
Вестергаард П., Рейнмарк Л., Мосекилде Л. Повышенная смертность пациентов с переломом бедра — эффект преморбидных состояний и осложнений после перелома. Остеопорос Инт .2007 декабря 18 (12): 1583-93. [Медлайн].
Trombetti A, Herrmann F, Hoffmeyer P, Schurch MA, Bonjour JP, Rizzoli R. Выживаемость и потенциальные годы жизни, потерянные после перелома бедра у мужчин и женщин того же возраста. Остеопорос Инт . 2002 Сентябрь 13 (9): 731-7. [Медлайн].
Michel JP, Hoffmeyer P, Klopfenstein C, et al. Прогноз функционального восстановления через 1 год после перелома шейки бедра: типичные профили пациентов с помощью кластерного анализа. Дж. Геронтол А Биол Науки и Медицины .2000 Сентябрь 55 (9): M508-15. [Медлайн].
Линдси Р., Сильверман С.Л., Купер С. и др. Риск нового перелома позвонка через год после перелома. ЯМА . 2001 17 января. 285 (3): 320-3. [Медлайн].
Klotzbuecher CM, Ross PD, Landsman PB, et al. Пациенты с предыдущими переломами имеют повышенный риск будущих переломов: краткое изложение литературы и статистический анализ. Дж Боун Минер Рес . 2000 Апрель, 15 (4): 721-39.[Медлайн].
Морин С.Н., Ликс Л.М., Лесли В.Д. Важность предыдущего места перелома для диагностики остеопороза и случайных переломов у женщин. Дж Боун Минер Рес . 2014 июл.29 (7): 1675-80. [Медлайн].
Инструмент Всемирной организации здравоохранения по оценке риска переломов. Доступно на http://www.shef.ac.uk/FRAX/. Доступ: 5 мая 2008 г.
Лесли В.Д., Морен С., Ликс Л.М. Изучение отчетов о рисках переломов и начала лечения остеопороза до и после. Энн Интерн Мед. 2 ноября 2010 г. 153 (9): 580-6.
Шварц А.В., Виттингхофф Э., Бауэр Д.К. и др. Связь показателей МПК и FRAX с риском перелома у пожилых людей с диабетом 2 типа. ЯМА . 1 июня 2011 г. 305 (21): 2184-92. [Медлайн].
Tremollieres FA, Pouilles JM, Drewniak N, Laparra J, Ribot CA, Dargent-Molina P. Прогнозирование риска перелома с использованием МПК и клинических факторов риска у женщин в раннем постменопаузе: чувствительность инструмента FRAX ВОЗ. Дж Боун Минер Рес . 2010 май. 25 (5): 1002-9. [Медлайн]. [Полный текст].
Grisso JA, Kelsey JL, Strom BL, Chiu GY, Maislin G, O’Brien LA, et al. Факторы риска падений как причины перелома бедра у женщин. Группа изучения перелома северо-восточного бедра. N Engl J Med . 1991, 9 мая. 324 (19): 1326-31. [Медлайн].
Nellans KW, Kowalski E, Chung KC. Эпидемиология переломов дистального отдела лучевой кости. Ручная клиника . 2012 май.28 (2): 113-25. [Медлайн]. [Полный текст].
Sandhu SK, Nguyen ND, Center JR, Pocock NA, Eisman JA, Nguyen TV. Прогноз перелома: оценка точности прогноза алгоритма FRAX и номограммы Гарвана. Остеопорос Инт . 2010 май. 21 (5): 863-71. [Медлайн].
Канис JA, Харви NC, Йоханссон H, Odén A, McCloskey EV, Leslie WD. Обзор инструментов прогнозирования разрушения. Дж. Клин Денситом . 2017 июль — 20 сентября (3): 444-450.[Медлайн].
Cooper C, Atkinson EJ, O’Fallon WM, et al. Частота клинически диагностированных переломов позвонков: популяционное исследование в Рочестере, Миннесота, 1985–1989 годы. Дж Боун Минер Рес . 1992 7 февраля (2): 221-7. [Медлайн].
Cook DJ, Guyatt GH, Adachi JD, Clifton J, Griffith LE, Epstein RS и др. Проблемы качества жизни у женщин с переломами позвонков из-за остеопороза. Революционный артрит . 1993 июн. 36 (6): 750-6.[Медлайн].
Schnatz PF, Marakovits KA, Dubois M, O’Sullivan DM. Рекомендации по скринингу и лечению остеопороза: соблюдаются ли они ?. Менопауза . 2011 октября 18 (10): 1072-8. [Медлайн].
Geusens P, Dumitrescu B, van Geel T, van Helden S, Vanhoof J, Dinant GJ. Влияние систематической реализации стратегии выявления клинических случаев на диагностику и терапию постменопаузального остеопороза. Дж Боун Минер Рес .23 июня 2008 г. (6): 812-8. [Медлайн].
[Рекомендации] Скрининг на остеопороз: рекомендация рабочей группы США по профилактическим услугам. Энн Интерн Мед. 2011 г. 1. 154 (5): 356-64. [Медлайн].
Здоровье костей и остеопороз: отчет главного хирурга . [Полный текст].
Zhu K, Devine A, Lewis JR, Dhaliwal SS, Prince RL. Тестирование по времени и измерение минеральной плотности костной ткани для прогнозирования переломов. Arch Intern Med . 2011 Октябрь 10, 171 (18): 1655-61. [Медлайн].
Наяк С., Робертс М.С., Гринспен С.Л. Экономическая эффективность различных стратегий скрининга остеопороза у женщин в постменопаузе. Энн Интерн Мед. 2011 декабрь 6. 155 (11): 751-61. [Медлайн].
[Рекомендации] Лю Х., Пейдж Н.М., Голдцвейг К.Л., Вонг Э., Чжоу А., Сутторп М.Дж. и др. Скрининг на остеопороз у мужчин: систематический обзор рекомендаций Американского колледжа врачей. Энн Интерн Мед. 2008 6 мая. 148 (9): 685-701. [Медлайн]. [Полный текст].
Spiegel R, Nawroth PP, Kasperk C. Влияние золедроновой кислоты на риск переломов у мужчин с остеопорозом. Дж Эндокринол Инвест . 2014 марта 37 (3): 229-32. [Медлайн].
Диттмер Д.К., Тизелл Р. Осложнения иммобилизации и постельного режима. Часть 1: Скелетно-мышечные и сердечно-сосудистые осложнения. Кан Фам Врач . 1993 июн.39: 1428-32, 1435-7. [Медлайн].
Guglielmi G, Muscarella S, Bazzocchi A. Интегрированный подход к визуализации остеопороза: современный обзор и обновление. Рентгенография . 2011 сен-окт. 31 (5): 1343-64. [Медлайн].
Khoo BC, Brown K, Cann C и др. Сравнение минеральной плотности костной ткани, полученной с помощью QCT и DXA, и показателей T. Остеопорос Инт . 2009 Сентябрь 20 (9): 1539-45. [Медлайн].
Ссылка TM.Осевая и периферическая ККТ. Гульельми Г, изд. Измерения остеопороза и костной денситометрии . Нью-Йорк, штат Нью-Йорк: Springer Heidelberg; 2013. 123-32.
Beaudoin C, Moore L, Gagné M, Bessette L, Ste-Marie LG, Brown JP, et al. Использование инструментов прогнозирования для выявления лиц с риском нетравматических переломов: систематический обзор, метаанализ и мета-регрессия. Остеопорос Инт . 2019 30 апреля (4): 721-740. [Медлайн].
Paunier L.Влияние магния на обмен фосфора и кальция. Monatsschr Kinderheilkd . 1992 сентябрь 140 (9 приложение 1): S17-20. [Медлайн].
Ли В.Й., О К.В., Ри Э.Дж., Юнг Ч., Ким С.В., Юн Э.Д. и др. Связь между субклинической дисфункцией щитовидной железы и минеральной плотностью кости шейки бедра у женщин. Arch Med Res . 2006 май. 37 (4): 511-6. [Медлайн].
Танненбаум К., Кларк Дж., Шварцман К., Валленштейн С., Лапински Р., Мейер Д.Результаты лабораторных исследований для выявления вторичных факторов остеопороза у здоровых в остальном женщин. Дж. Клин Эндокринол Метаб . 2002 Октябрь 87 (10): 4431-7. [Медлайн].
Лю JM, Zhao HY, Ning G, Chen Y, Zhang LZ, Sun LH и др. IGF-1 как ранний маркер низкой костной массы или остеопороза у женщин в пременопаузе и постменопаузе. Дж. Костяной Шахтер Метаб . 2008. 26 (2): 159-64. [Медлайн].
Васикаран С., Купер С., Истелл Р., Грисмахер А., Моррис Х.А., Тренти Т. и др.Позиция Международного фонда остеопороза и Международной федерации клинической химии и лабораторной медицины в отношении стандартов костных маркеров при остеопорозе. Clin Chem Lab Med . 2011 августа 49 (8): 1271-4. [Медлайн].
Резник Д., Крансдорф М. Остеопороз. Визуализация костей и суставов . Третье издание. 2005. 551.
Hillier TA, Stone KL, Bauer DC, Rizzo JH, Pedula KL, Cauley JA и др. Оценка ценности повторных измерений минеральной плотности костной ткани и прогнозирование переломов у пожилых женщин: исследование остеопоротических переломов. Arch Intern Med . 2007, 22 января. 167 (2): 155-60. [Медлайн].
Наяк С., Робертс М.С., Гринспен С.Л. Экономическая эффективность различных стратегий скрининга остеопороза у женщин в постменопаузе. Энн Интерн Мед. 2011 декабрь 6. 155 (11): 751-61. [Медлайн]. [Полный текст].
Lin JT, Lane JM. Бисфосфонаты. Дж. Ам Акад Ортоп Сург . 2003 янв-фев. 11 (1): 1-4. [Медлайн].
Faulkner KG, Wacker WK, Barden HS, Simonelli C, Burke PK, Ragi S, et al.Индекс силы бедра позволяет прогнозировать перелом бедра независимо от плотности кости и длины оси бедра. Остеопорос Инт . 2006. 17 (4): 593-9. [Медлайн].
Prevrhal S, Shepherd JA, Faulkner KG, Gaither KW, Black DM, Lang TF. Сравнение структурного анализа тазобедренного сустава методом ДРА с объемной ККТ. Дж. Клин Денситом . 2008 апр-июн. 11 (2): 232-6. [Медлайн].
Kaptoge S, Beck TJ, Reeve J, Stone KL, Hillier TA, Cauley JA и др. Прогнозирование риска перелома бедра с помощью переменных геометрии бедра, измеренных с помощью структурного анализа бедра при исследовании остеопоротических переломов. Дж Боун Минер Рес . 2008 г., 23 (12): 1892-904. [Медлайн]. [Полный текст].
Beck TJ. Расширение DXA за пределы минеральной плотности кости: понимание анализа структуры бедра. Curr Osteoporos Rep . 2007 июн. 5 (2): 49-55. [Медлайн].
Hans D, Barthe N, Boutroy S, Pothuaud L, Winzenrieth R, Krieg MA. Корреляция между оценкой трабекулярной кости, измеренной с помощью переднезадней двухэнергетической рентгеновской абсорбциометрии, и трехмерными параметрами костной микроархитектуры: экспериментальное исследование на трупных позвонках человека. Дж. Клин Денситом . 2011 июль-сен. 14 (3): 302-12. [Медлайн].
Pothuaud L, Barthe N, Krieg MA, Mehsen N, Carceller P, Hans D. Оценка потенциального использования шкалы губчатой кости для дополнения минеральной плотности кости при диагностике остеопороза: предварительное сопоставление МПК позвоночника, случай-контроль изучать. Дж. Клин Денситом . 2009 Апрель-июнь. 12 (2): 170-6. [Медлайн].
Силва BC, Лесли В.Д., Реш Х., Лами О., Лесняк О., Бинкли Н. и др.Оценка губчатой кости: неинвазивный аналитический метод, основанный на изображении DXA. Дж Боун Минер Рес . 2014 29 марта (3): 518-30. [Медлайн].
Schuit SC, van der Klift M, Weel AE, de Laet CE, Burger H, Seeman E, et al. Частота переломов и связь с минеральной плотностью костей у пожилых мужчин и женщин: Роттердамское исследование. Кость . 2004 г., 34 (1): 195-202. [Медлайн].
Имаи К. Современные методы оценки остеопороза и риска переломов. Последние исследования Pat Endocr Metab Immune Drug Discov . 2014 8 (1): 48-59. [Медлайн].
Ян Л., Палермо Л., Блэк Д.М., Истелл Р. Прогнозирование перелома бедра с расчетной силой бедренной кости с помощью анализа конечных элементов DXA-сканирований при изучении остеопоротических переломов. Дж Боун Минер Рес . 2014 29 декабря (12): 2594-600. [Медлайн].
Torres-del-Pliego E, Vilaplana L, Güerri-Fernández R, Diez-Pérez A. Измерение качества кости. Curr Rheumatol Rep . 2013 15 ноября (11): 373. [Медлайн].
Prior JC, Vigna YM, Wark JD и др. Потеря костной массы, связанная с пременопаузальной овариэктомией: рандомизированное двойное слепое однолетнее исследование конъюгированного эстрогена или медроксипрогестерона ацетата. Дж Боун Минер Рес . 1997 12 ноября (11): 1851-63. [Медлайн].
Henzell S, Dhaliwal S, Pontifex R и др. Погрешность точности двух веерных рентгеновских абсорбциометров позвоночника, бедра и предплечья. Дж. Клин Денситом . 2000 Зима. 3 (4): 359-64. [Медлайн].
White J, Harris SS, Dallal GE, Dawson-Hughes B. Прецизионное сканирование минеральной плотности тазобедренной кости при одном сканировании по сравнению с двусторонним. Дж. Клин Денситом . 2003 Лето. 6 (2): 159-62. [Медлайн].
Bauer JS, Henning TD, Müeller D, Lu Y, Majumdar S, Link TM. Объемная количественная КТ позвоночника и бедра, полученная с помощью МДКТ с контрастным усилением: коэффициенты пересчета. AJR Ам Дж. Рентгенол .2007 май. 188 (5): 1294-301. [Медлайн].
Энгельке К., Адамс Дж. Э., Армбрехт Дж. И др. Клиническое использование количественной компьютерной томографии и периферической количественной компьютерной томографии в лечении остеопороза у взрослых: официальные положения ISCD 2007 г. Дж. Клин Денситом . 2008 Янв-март. 11 (1): 123-62. [Медлайн].
Лю Джи, Павлин М., Эйлам О, Дорулла Дж., Браунштейн Е., Джонстон С.К. Влияние остеоартроза поясничного отдела позвоночника и бедра на минеральную плотность костей и диагностика остеопороза у мужчин и женщин пожилого возраста. Остеопорос Инт . 1997. 7 (6): 564-9. [Медлайн].
[Рекомендации] Qaseem A, Forciea MA, McLean RM, Denberg TD, для Комитета по клиническим рекомендациям Американского колледжа врачей. Лечение низкой плотности костей или остеопороза для предотвращения переломов у мужчин и женщин: обновленное руководство по клинической практике Американского колледжа врачей. Энн Интерн Мед. 9 мая 2017 г. [Полный текст].
Фрибург Д., Тан С, Сра П, Деламартер Р., Бэ Х.Частота последующих переломов позвонков после кифопластики. Позвоночник (Phila Pa 1976) . 2004 15 октября. 29 (20): 2270-6; обсуждение 2277. [Medline].
Моврин И., Венгуст Р., Комадина Р. Переломы смежных позвонков после чрескожной аугментации позвонков при остеопоротическом компрессионном переломе позвоночника: сравнение баллонной кифопластики и вертебропластики. Хирургическая хирургия для лечения травм ортопедической дуги . 2010 сентябрь 130 (9): 1157-66. [Медлайн].
Кастнер М., Straus SE.Инструменты поддержки клинических решений для лечения остеопороза: систематический обзор рандомизированных контролируемых исследований. J Gen Intern Med . 2008 г., 23 (12): 2095-105. [Медлайн]. [Полный текст].
Кнопп JA, Diner BM, Blitz M, Lyritis GP, Rowe BH. Кальцитонин для лечения острой боли при остеопоротических компрессионных переломах позвонков: систематический обзор рандомизированных контролируемых исследований. Остеопорос Инт . 2005 16 октября (10): 1281-90. [Медлайн].
Kirshblum SC.Реабилитационная медицина: принципы и практика. DeLisa JA, Gans BM. Ортезы для позвоночника и верхних конечностей . 3-й. Филадельфия, Пенсильвания: Липпинкотт-Рэйвен; 1998. 635-50.
Stillo СП. Ортезы поясницы. Phys Med Rehab Clin North Am . 1992. 3: 57-94.
[Рекомендации] Eastell R, Rosen CJ, Black DM, Cheung AM, Murad MH, Shoback D. Фармакологическое лечение остеопороза у женщин в постменопаузе: Руководство по клинической практике эндокринного общества *. Дж. Клин Эндокринол Метаб . 2019 1 мая. 104 (5): 1595-1622. [Медлайн].
Герц Б.Дж., Голландия С.Д., Клайн В.Ф., Матушевский Б.К., Фриман А., Куан Х. и др. Исследования пероральной биодоступности алендроната. Clin Pharmacol Ther . 1995 Сентябрь 58 (3): 288-98. [Медлайн].
Абрахамсен Б., Эйкен П., Истелл Р. Использование ингибиторов протонной помпы и эффективность алендроната против переломов. Arch Intern Med . 2011, 13 июня. 171 (11): 998-1004.[Медлайн].
Harris ST, Watts NB, Genant HK, McKeever CD, Hangartner T, Keller M, et al. Эффекты лечения ризедронатом на переломы позвонков и позвоночника у женщин с постменопаузальным остеопорозом: рандомизированное контролируемое исследование. Группа исследования эффективности вертебральной терапии ризедронатом (VERT). ЯМА . 1999 Октябрь 13, 282 (14): 1344-52. [Медлайн]. [Полный текст].
Black DM, Delmas PD, Eastell R, et al. Золедроновая кислота для лечения постменопаузального остеопороза один раз в год. N Engl J Med . 2007 3 мая. 356 (18): 1809-22. [Медлайн].
Boonen S, Reginster JY, Kaufman JM, Lippuner K, Zanchetta J, Langdahl B, et al. Риск перелома и терапия золедроновой кислотой у мужчин с остеопорозом. N Engl J Med . 2012 ноябрь 367 (18): 1714-23. [Медлайн].
Boonen S, Orwoll E, Magaziner J, Colón-Emeric CS, Adachi JD, Bucci-Rechtweg C, et al. Золедроновая кислота один раз в год у пожилых мужчин по сравнению с женщинами с недавним переломом шейки бедра. Дж. Ам Гериатр Соц . 2011 ноябрь 59 (11): 2084-90. [Медлайн].
Odvina CV, Zerwekh JE, Rao DS, Maalouf N, Gottschalk FA, Pak CY. Сильно подавленный метаболизм костной ткани: потенциальное осложнение терапии алендронатом. Дж. Клин Эндокринол Метаб . 2005 Март 90 (3): 1294-301. [Медлайн].
Halasy-Nagy JM, Rodan GA, Reszka AA. Подавление резорбции костей алендронатом и ризедронатом не требует апоптоза остеокластов. Кость . 2001 29 декабря (6): 553-9. [Медлайн].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Сообщение FDA по безопасности лекарств: новое противопоказание и обновленное предупреждение о почечной недостаточности для Рекласта (золедроновой кислоты). Доступно на http://www.fda.gov/Drugs/DrugSafety/ucm270199.htm. 1 сентября 2011 г .; Дата обращения: 19 июня 2019 г.
Информация о безопасности: Зомета (золедроновая кислота) для инъекций. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно по адресу https: // www.accessdata.fda.gov/drugsatfda_docs/label/2016/021817s022lbl.pdf. Апрель 2016 г .; Дата обращения: 15 июня 2019 г.
Хан А.А., Моррисон А., Хэнли Д.А., Фелзенберг Д., МакКоли Л.К. и др. И др. Диагностика и лечение остеонекроза челюсти: систематический обзор и международный консенсус. Дж Боун Минер Рес . 2015 30 января (1): 3-23. [Медлайн].
Strampel W, Emkey R, Civitelli R. Меры безопасности с бисфосфонатами для лечения остеопороза. Сейф с наркотиками . 2007. 30 (9): 755-63. [Медлайн].
Зебич Л., Патель В. Профилактика медикаментозного остеонекроза челюсти. BMJ . 2019 8 мая. 365: l1733. [Медлайн].
Park-Wyllie LY, Mamdani MM, Juurlink DN, Hawker GA, Gunraj N, Austin PC, et al. Использование бисфосфонатов и риск переломов челюстно-лицевой области или диафиза бедренной кости у пожилых женщин. ЯМА . 2011 г. 23 февраля. 305 (8): 783-9. [Медлайн].
Lo JC, Neugebauer RS, Ettinger B, Chandra M, Hui RL, Ott SM, et al.Риск полного атипичного перелома бедренной кости при пероральном приеме бисфосфонатов более трех лет. BMC Musculoskelet Disord . 2020 3 декабря. 21 (1): 801. [Медлайн].
Geusens P. Бисфосфонаты для лечения постменопаузального остеопороза: определение продолжительности лечения. Curr Osteoporos Rep . 2009 Март 7 (1): 12-7. [Медлайн].
[Руководство] Адлер Р.А., Эль-Хадж Фулейхан Г., Бауэр Д.К., Камачо П.М., Кларк Б.Л., Клинес Г.А. и др. Управление остеопорозом у пациентов, получающих длительное лечение бисфосфонатами: отчет рабочей группы Американского общества исследований костей и минералов. Дж Боун Минер Рес . 2016 31 января (1): 16-35. [Медлайн]. [Полный текст].
Grady D, Cauley JA, Stock JL, Cox DA, Mitlak BH, Song J и др. Влияние ралоксифена на общую смертность. Am J Med . 2010 май. 123 (5): 469.e1-7. [Медлайн].
Линдси Р., Галлахер Дж. К., Каган Р., Пикар Дж. Х., Константин Г. Эффективность тканеселективного комплекса эстрогенов базедоксифена / конъюгированных эстрогенов для профилактики остеопороза у женщин в постменопаузе из группы риска. Фертил Стерил . 2009 Сентябрь 92 (3): 1045-52. [Медлайн].
Гилсенан А., Харрис Д., Рейнольдс М., МакСорли Д., Мидкифф К., Джексон Л. и др. Долгосрочное наблюдение за раком: результаты исследования по надзору в реестре пациентов Forteo. Остеопорос Инт . 2020 5 ноября. [Medline].
Quattrocchi E, Kourlas H. Teriparatide: обзор. Clin Ther . 2004 июня 26 (6): 841-54. [Медлайн].
Koski AM, Sikiö A, Forslund T.Лечение терипаратидом, осложненное злокачественной миеломой. BMJ Case Rep . 2010 13 августа 2010: [Medline]. [Полный текст].
Body JJ, Gaich GA, Scheele WH, Kulkarni PM, Miller PD, Peretz A. Рандомизированное двойное слепое испытание для сравнения эффективности терипаратида [рекомбинантного паратиреоидного гормона человека (1-34)] с алендронатом у женщин в постменопаузе с остеопорозом . Дж. Клин Эндокринол Метаб . 2002 Октябрь 87 (10): 4528-35. [Медлайн].
Dempster DW, Cosman F, Kurland ES, Zhou H, Nieves J, Woelfert L, et al.Влияние ежедневного лечения паратироидным гормоном на микроархитектуру и метаболизм костей у пациентов с остеопорозом: исследование парной биопсии. Дж Боун Минер Рес . 2001 16 октября (10): 1846-53. [Медлайн].
Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, et al. Влияние паратиреоидного гормона (1-34) на переломы и минеральную плотность костей у женщин в постменопаузе с остеопорозом. N Engl J Med . 2001 May 10. 344 (19): 1434-41.[Медлайн].
Курланд ES, Heller SL, Diamond B, McMahon DJ, Cosman F, Bilezikian JP. Важность терапии бисфосфонатами в поддержании костной массы у мужчин после терапии терипаратидом [гормоном паращитовидной железы человека (1-34)]. Остеопорос Инт . 2004 15 декабря (12): 992-7. [Медлайн].
Финкельштейн JS, Hayes A, Hunzelman JL, Wyland JJ, Lee H, Neer RM. Эффекты паратиреоидного гормона, алендроната или их обоих у мужчин с остеопорозом. N Engl J Med . 2003 25 сентября. 349 (13): 1216-26. [Медлайн].
Cosman F, Nieves J, Zion M, Woelfert L, Luckey M, Lindsay R. Daily и циклический паратиреоидный гормон у женщин, получающих алендронат. N Engl J Med . 2005 11 августа. 353 (6): 566-75. [Медлайн].
Deal C, Omizo M, Schwartz EN, Eriksen EF, Cantor P, Wang J и др. Комбинированная терапия терипаратидом и ралоксифеном при постменопаузальном остеопорозе: результаты 6-месячного двойного слепого плацебо-контролируемого исследования. Дж Боун Минер Рес . 2005 20 ноября (11): 1905-11. [Медлайн].
Ste-Marie LG, Schwartz SL, Hossain A, Desaiah D, Gaich GA. Влияние терипаратида [rhPTH (1-34)] на МПК при назначении женщинам в постменопаузе, получающим заместительную гормональную терапию. Дж Боун Минер Рес . 2006 21 февраля (2): 283-91. [Медлайн].
Tsai JN, Uihlein AV, Lee H, Kumbhani R, Siwila-Sackman E, McKay EA, et al. Терипаратид и деносумаб, по отдельности или в комбинации, у женщин с постменопаузальным остеопорозом: рандомизированное исследование DATA. Ланцет . 2013 июл 6. 382 (9886): 50-6. [Медлайн].
Leder BZ, Tsai JN, Uihlein AV, Wallace PM, Lee H, Neer RM и др. Переходы деносумаба и терипаратида при постменопаузальном остеопорозе (исследование DATA-Switch): продолжение рандомизированного контролируемого исследования. Ланцет . 2015 19 сентября. 386 (9999): 1147-55. [Медлайн].
Bouxsein ML, Chen P, Glass EV, Kallmes DF, Delmas PD, Mitlak BH. Терипаратид и ралоксифен снижают риск новых переломов соседних позвонков у женщин в постменопаузе с остеопорозом.Результаты двух рандомизированных контролируемых исследований. J Bone Joint Surg Am . 2009 июн.91 (6): 1329-38. [Медлайн].
Кендлер Д.Л., Марин Ф., Зербини КАФ, Руссо Л.А., Гринспен С.Л., Зикан В. и др. Влияние терипаратида и ризедроната на новые переломы у женщин в постменопаузе с тяжелым остеопорозом (VERO): многоцентровое двойное слепое рандомизированное контролируемое исследование с двойной фиксацией. Ланцет . 2017 9 ноября. [Medline].
Gomberg SJ, Wustrack RL, Napoli N, Arnaud CD, Black DM.Терипаратид, витамин D и кальций вылечили двусторонние подвертельные стрессовые переломы у женщины в постменопаузе с 13-летней историей непрерывной терапии алендронатом. Дж. Клин Эндокринол Метаб . 2011 Июнь 96 (6): 1627-32. [Медлайн].
Салех А., Хегде В.В., Потти АГ, Шнайдер Р., Корнелл С.Н., Лейн Дж. М.. Стратегия ведения симптоматических неполных атипичных переломов бедренной кости, связанных с бисфосфонатами. HSS J . 2012 июл.8 (2): 103-10. [Медлайн].[Полный текст].
Лау А.Н., Адачи Д.Д. Разрешение остеонекроза челюсти после терапии терипаратидом [рекомбинантный человеческий ПТГ- (1-34)]. Дж. Ревматол. . 2009 августа, 36 (8): 1835-7. [Медлайн].
Cheung A, Seeman E. Терипаратидная терапия алендронат-ассоциированного остеонекроза челюсти. N Engl J Med . 2010 16 декабря. 363 (25): 2473-4. [Медлайн].
Наронгроекнавин П., Данила М.И., Хамфрис Л.Г. мл., Бараш А., Кертис-мл.Бисфосфонат-ассоциированный остеонекроз челюсти с заживлением после терипаратида: обзор литературы и описание случая. Специалист по уходу за стоматологом . 2010 март-апрель. 30 (2): 77-82. [Медлайн]. [Полный текст].
Миллер П.Д., Хаттерсли Г., Риис Б.Дж., Уильямс Г.К., Лау Э., Руссо Л.А. и др. Эффект абалопаратида по сравнению с плацебо на новые переломы позвонков у женщин в постменопаузе с остеопорозом: рандомизированное клиническое испытание. ЯМА . 2016 16 августа. 316 (7): 722-33.[Медлайн]. [Полный текст].
Cosman F, Miller PD, Williams GC, Hattersley G, Hu MY, Valter I, et al. Восемнадцать месяцев лечения подкожным абалопаратидом с последующим 6-месячным курсом лечения алендронатом у женщин в постменопаузе с остеопорозом: результаты исследования ACTIVExtend. Mayo Clin Proc . 2017 Февраль 92 (2): 200-210. [Медлайн]. [Полный текст].
Пайхл П., Хольцер Л.А., Майер Р., Хольцер Г. Паратироидный гормон 1-84 ускоряет заживление переломов лонных костей у пожилых женщин с остеопорозом. J Bone Joint Surg Am . 2011 7 сентября. 93 (17): 1583-7. [Медлайн].
Cosman F, Crittenden DB, Adachi JD, Binkley N, Czerwinski E, Ferrari S и др. Лечение ромосозумабом у женщин в постменопаузе с остеопорозом. N Engl J Med . 2016 18 сентября [Medline]. [Полный текст].
Сааг К.Г., Петерсен Дж., Брэнди М.Л., Караплис А.С., Лоренцон М., Томас Т. и др. Ромосозумаб или алендронат для профилактики переломов у женщин с остеопорозом. N Engl J Med . 2017 Октябрь 12, 377 (15): 1417-1427. [Медлайн]. [Полный текст].
Lewiecki EM, Dinavahi RV, Lazaretti-Castro M, Ebeling PR, Adachi JD, Miyauchi A, et al. Один год приема ромосозумаба, а затем два года приема деносумаба способствует снижению риска переломов: результаты расширенного исследования FRAME. Дж Боун Минер Рес . 2019 марта 34 (3): 419-428. [Медлайн].
Lewiecki EM, Blicharski T, Goemaere S, Lippuner K, Meisner PD, Miller PD, et al.Рандомизированное плацебо-контролируемое исследование фазы III для оценки эффективности и безопасности ромосозумаба у мужчин с остеопорозом. Дж. Клин Эндокринол Метаб . 2018 сен 1. 103 (9): 3183-3193. [Медлайн].
Сааг К.Г., Петерсен Дж., Брэнди М.Л., Караплис А.С., Лоренцон М., Томас Т. и др. Ромосозумаб или алендронат для профилактики переломов у женщин с остеопорозом. N Engl J Med . 2017 Октябрь 12, 377 (15): 1417-1427. [Медлайн].
Body JJ, Facon T, Coleman RE, Lipton A, Geurs F, Fan M и др.Исследование биологического активатора рецептора ядерного фактора — ингибитора лиганда каппаВ, деносумаба, у пациентов с множественной миеломой или метастазами в кости от рака груди. Clin Cancer Res . 2006 15 февраля. 12 (4): 1221-8. [Медлайн].
McClung MR, Lewiecki EM, Cohen SB, Bolognese MA, Woodson GC, Moffett AH, et al. Деносумаб у женщин в постменопаузе с низкой минеральной плотностью костей. N Engl J Med . 2006 23 февраля. 354 (8): 821-31. [Медлайн].
Orwoll E, Teglbjrg CS, Langdahl BL, Chapurlat R, Czerwinski E, Kendler DL, et al.Рандомизированное плацебо-контролируемое исследование эффектов деносумаба при лечении мужчин с низкой минеральной плотностью костей. Дж. Клин Эндокринол Метаб . 2012 сентябрь 97 (9): 3161-9. [Медлайн].
Block GA, Bone HG, Fang L, Lee E, Padhi D. Исследование однократной дозы деносумаба у пациентов с различной степенью почечной недостаточности. Дж Боун Минер Рес . 2012 июля. 27 (7): 1471-9. [Медлайн]. [Полный текст].
Saag KG, Wagman RB, Geusens P, Adachi JD, Messina OD, Emkey R, et al.Сравнение деносумаба и ризедроната при остеопорозе, индуцированном глюкокортикоидами: многоцентровое рандомизированное двойное слепое активно-контролируемое двойное исследование не меньшей эффективности. Ланцет Диабет Эндокринол . 6 апреля 2018 г. [Medline].
Cummings SR, San Martin J, McClung MR, Siris ES, Eastell R, Reid IR, et al. Деносумаб для профилактики переломов у женщин в постменопаузе с остеопорозом. N Engl J Med . 2009 20 августа. 361 (8): 756-65. [Медлайн].
Смит М.Р., Эгерди Б., Эрнандес Торис Н., Фельдман Р., Таммела Т.Л., Саад Ф. и др.Деносумаб у мужчин, получающих андроген-депривационную терапию рака простаты. N Engl J Med . 2009 20 августа. 361 (8): 745-55. [Медлайн].
Лю Х., Джунди Б., Сюй С., Тедески С.К., Йошида К., Чжао С. и др. Сравнение деносумаба и бисфосфонатов у пациентов с остеопорозом: метаанализ рандомизированных контролируемых исследований. Дж. Клин Эндокринол Метаб . 2019 1 мая. 104 (5): 1753-1765. [Медлайн].
Шварц EM, Ритчлин Коннектикут.Клиническая разработка анти-RANKL терапии. Лечение артрита . 2007. 9 Приложение 1: S7. [Медлайн]. [Полный текст].
Tsai JN, Uihlein AV, Lee H, Kumbhani R, Siwila-Sackman E, McKay EA, et al. Терипаратид и деносумаб, по отдельности или в комбинации, у женщин с постменопаузальным остеопорозом: рандомизированное исследование DATA. Ланцет . 2013 14 мая. [Medline].
Анастасилакис А.Д., Полизос С.А., Макрас П., Обри-Розье Б., Каури С., Лами О.Клинические особенности 24 пациентов с рикошет-ассоциированными переломами позвонков после отмены деносумаба: систематический обзор и дополнительные случаи. Дж Боун Минер Рес . 2017 июн.32 (6): 1291-1296. [Медлайн].
Постмаркетинговая информация о безопасности лекарств для пациентов и поставщиков медицинских услуг — Вопросы и ответы: изменения в группе пациентов, принимающих миакальцин (кальцитонин-лосось). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно по адресу http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm388641.htm. 1 сентября 2015 г .; Дата обращения: 21 января 2021 г.
Россоу Дж. Э., Андерсон Г. Л., Прентис Р. Л. и др. Риски и преимущества эстрогена и прогестина у здоровых женщин в постменопаузе: основные результаты Рандомизированного контролируемого исследования Инициативы по охране здоровья женщин. ЯМА . 2002, 17 июля. 288 (3): 321-33. [Медлайн].
Блейк Г.М., Фогельман И. Долгосрочный эффект лечения стронция ранелатом на МПК. Дж Боун Минер Рес . 2005 ноя.20 (11): 1901-4. [Медлайн].
Burlet N, Reginster JY. Стронция ранелат: первое средство двойного действия для лечения постменопаузального остеопороза. Клин Ортоп Релат Рес . 2006 февраль 443: 55-60. [Медлайн].
Bischoff-Ferrari HA, Dawson-Hughes B, Willett WC, Staehelin HB, Bazemore MG, Zee RY, et al. Влияние витамина D на падения: метаанализ. ЯМА . 2004, 28 апреля. 291 (16): 1999-2006. [Медлайн].
Росс А.С., Мэнсон Дж. Э., Абрамс С. А., Алоя Дж. Ф., Браннон П. М., Клинтон С. К. и др.Отчет Института медицины о рекомендуемом потреблении кальция и витамина D с пищей за 2011 год: что необходимо знать клиницистам. Дж. Клин Эндокринол Метаб . 2011 Январь 96 (1): 53-8. [Медлайн]. [Полный текст].
Bruni V, Dei M, Filicetti MF, Balzi D, Pasqua A. Предикторы потери костной массы у молодых женщин с ограничительными расстройствами пищевого поведения. Педиатр эндокринол Ред. . 2006, 3 января, приложение 1: 219-21. [Медлайн].
Тан Б.М., Эслик Г.Д., Ноусон С., Смит К., Бенсуссан А.Использование кальция или кальция в сочетании с добавкой витамина D для предотвращения переломов и потери костной массы у людей в возрасте 50 лет и старше: метаанализ. Ланцет . 2007, 25 августа. 370 (9588): 657-66. [Медлайн].
Bischoff-Ferrari HA, Willett WC, Wong JB, Stuck AE, Staehelin HB, Orav EJ, et al. Профилактика непозвоночных переломов пероральным приемом витамина D и зависимостью от дозы: метаанализ рандомизированных контролируемых исследований. Arch Intern Med . 2009 23 марта.169 (6): 551-61. [Медлайн].
Warensjö E, Byberg L, Melhus H, et al. Потребление кальция с пищей и риск переломов и остеопороза: проспективное продольное когортное исследование. BMJ . 2011 24 мая. 342: d1473. [Медлайн]. [Полный текст].
Группа DIPART (индивидуальный анализ пациентов с витамином D в рандомизированных исследованиях). Общий анализ на уровне пациентов 68 500 пациентов из семи крупных исследований переломов витамина D в США и Европе. BMJ .12 января 2010 г. 340: b5463. [Медлайн]. [Полный текст].
Li K, Kaaks R, Linseisen J, Rohrmann S. Связи потребления кальция с пищей и добавок кальция с инфарктом миокарда и риском инсульта и общей сердечно-сосудистой смертностью в Гейдельбергской когорте исследования Европейского проспективного исследования рака и питания (EPIC-Heidelberg ). Сердце . 2012 июн. 98 (12): 920-5. [Медлайн].
Curhan GC, Willett WC, Speizer FE, Spiegelman D, Stampfer MJ.Сравнение диетического кальция с дополнительным кальцием и другими питательными веществами как факторов, влияющих на риск образования камней в почках у женщин. Энн Интерн Мед. 1997 г., 1. 126 (7): 497-504. [Медлайн].
Candelas G, Martinez-Lopez JA, Rosario MP, Carmona L, Loza E. Добавки кальция и риск образования камней в почках при остеопорозе: систематический обзор литературы. Clin Exp Rheumatol . 2012 ноябрь-декабрь. 30 (6): 954-61. [Медлайн].
Favus MJ.Риск образования камней в почках: имеет значение форма кальция. Ам Дж. Клин Нутр . 2011 Июль 94 (1): 5-6. [Медлайн].
Синаки М. Постменопаузальный остеопороз позвоночника: физиотерапия и принципы реабилитации. Mayo Clin Proc . 1982, ноябрь 57 (11): 699-703. [Медлайн].
Тинетти М.Э., Спичли М. Профилактика падений среди пожилых людей. N Engl J Med . 1989 20 апреля. 320 (16): 1055-9. [Медлайн].
Sinaki M, Mikkelsen BA.Постменопаузальный остеопороз позвоночника: упражнения на сгибание и разгибание. Arch Phys Med Rehabil . 1984 Октябрь 65 (10): 593-6. [Медлайн].
Sinaki M, Itoi E, Wahner HW, Wollan P, Gelzcer R, Mullan BP и др. Более сильные мышцы спины снижают частоту переломов позвонков: проспективное 10-летнее наблюдение за женщинами в постменопаузе. Кость . 2002 июн.30 (6): 836-41. [Медлайн].
Sinaki M, Itoi E, Rogers JW, Bergstralh EJ, Wahner HW.Корреляция силы разгибателей спины с грудным кифозом и поясничным лордозом у женщин с дефицитом эстрогена. Am J Phys Med Rehabil . 1996 сентябрь-октябрь. 75 (5): 370-4. [Медлайн].
Chien MY, Wu YT, Hsu AT, Yang RS, Lai JS. Эффективность 24-недельной программы аэробных упражнений для женщин с остеопенией в постменопаузе. Calcif Tissue Int . 2000 Декабрь 67 (6): 443-8. [Медлайн].
Snow CM, Shaw JM, Winters KM, Witzke KA. Длительные упражнения с утяжеленными жилетами предотвращают потерю тазобедренной кости у женщин в постменопаузе. Дж. Геронтол А Биол Науки и Медицины . 2000 Сентябрь 55 (9): M489-91. [Медлайн].
Howe TE, Shea B., Dawson LJ, et al. Упражнения для профилактики и лечения остеопороза у женщин в постменопаузе. Кокрановская база данных Syst Rev . 2011 6 июля. CD000333. [Медлайн].
Ивамото Дж, Такеда Т., Ичимура С. Влияние физических упражнений и детренировки на минеральную плотность костной ткани у женщин в постменопаузе с остеопорозом. Дж. Ортоп Сци .2001. 6 (2): 128-32. [Медлайн].
Kerschan-Shindl K, Uher E, Kainberger F, Kaider A, Ghanem AH, Preisinger E. Долгосрочная программа домашних упражнений: эффект у женщин с высоким риском переломов. Arch Phys Med Rehabil . 2000 Мар. 81 (3): 319-23. [Медлайн].
Робертсон М.С., Девлин Н., Гарднер М.М., Кэмпбелл А.Дж. Эффективность и экономическая оценка программы домашних упражнений, проводимых медсестрой для предотвращения падений. 1: Рандомизированное контролируемое исследование. BMJ . 2001 24 марта. 322 (7288): 697-701. [Медлайн]. [Полный текст].
Walker M, Klentrou P, Chow R, Plyley M. Продольная оценка контролируемых и неконтролируемых программ упражнений для лечения остеопороза. Eur J Appl Physiol . 2000 ноябрь 83 (4-5): 349-55. [Медлайн].
Вольф С.Л., Барнхарт Х.Х., Катнер Н.Г., Макнили Э., Куглер С., Сюй Т. Снижение дряхлости и падений у пожилых людей: исследование тайцзи и компьютеризированной тренировки равновесия.Атланта Группа ФИКСИТ. Хрупкость и травмы: совместные исследования методов вмешательства. Дж. Ам Гериатр Соц . 1996 май. 44 (5): 489-97. [Медлайн].
Картер Н.Д., Хан К.М., Пети М.А., Хейнонен А., Уотерман С., Дональдсон М.Г. и др. Результаты 10-недельной программы тренировки силы и равновесия для снижения факторов риска падений: рандомизированное контролируемое исследование с участием женщин 65-75 лет с остеопорозом. Br J Sports Med . 2001 Октябрь, 35 (5): 348-51.[Медлайн]. [Полный текст].
Риггс Б.Л., Мелтон Л.Дж., 3-й. Профилактика и лечение остеопороза. N Engl J Med . 1992 27 августа. 327 (9): 620-7. [Медлайн].
Iwamoto J, Sato Y, Uzawa M, Takeda T., Matsumoto H. Сравнение эффектов алендроната и ралоксифена на минеральную плотность поясничной кости, обмен костной ткани и липидный обмен у пожилых женщин с остеопорозом. Йонсей Мед Дж. . 2008 29 февраля, 49 (1): 119-28. [Медлайн].[Полный текст].
Gourlay ML, Fine JP, Preisser JS, May RC, Li C, Lui LY, et al. Интервал измерения плотности костной ткани и переход к остеопорозу у пожилых женщин. N Engl J Med . 2012 19 января. 366 (3): 225-33. [Медлайн]. [Полный текст].
Schwab P, Кляйн РФ. Нефармакологические подходы для улучшения здоровья костей и уменьшения остеопороза. Curr Opin Rheumatol . 2008 20 марта (2): 213-7. [Медлайн].
Lin JT, Lane JM.Немедицинское лечение остеопороза. Curr Opin Rheumatol . 14 июля 2002 г. (4): 441-6. [Медлайн].
Gourlay ML, Fine JP, Preisser JS, May RC, Li C, Lui LY, et al. Интервал измерения плотности костной ткани и переход к остеопорозу у пожилых женщин. N Engl J Med . 2012 19 января. 366 (3): 225-33. [Медлайн]. [Полный текст].
[Рекомендации] Вишванатан М., Редди С., Беркман Н., Каллен К., Миддлтон Дж. К., Николсон В. К. и др. Скрининг для предотвращения остеопоротических переломов: обновленный отчет о доказательствах и систематический обзор для Целевой группы профилактических служб США. ЯМА . 26 июня 2018 г. 319 (24): 2532-2551. [Медлайн]. [Полный текст].
[Руководство] Обновления Руководства для врача по профилактике и лечению остеопороза. Национальный фонд остеопороза. Доступно по адресу https://my.nof.org/bone-source/Incorporation-of-diagnostic-criteria-to-be-used-to-establish-a-clinical-diagnosis-of-osteoporosis. 11 ноября 2015 г .; Дата обращения: 21 января 2021 г.
[Рекомендации] Eastell R, Rosen CJ, Black DM, Cheung AM, Murad MH, Shoback D.Фармакологическое лечение остеопороза у женщин в постменопаузе: эндокринное общество * Руководство по клинической практике. Дж. Клин Эндокринол Метаб . 2019 25 марта. [Medline]. [Полный текст].
Конференция NIH Consensus. Оптимальное потребление кальция. Группа разработки консенсуса NIH по оптимальному потреблению кальция. ЯМА . 1994 28 декабря. 272 (24): 1942-8. [Медлайн].
Bauer DC. Увеличение позвонков по сравнению с нехирургической терапией: улучшение симптомов, улучшение выживаемости или ни то, ни другое? JAMA Intern Med . 2013 9 сентября. 173 (16): 1522-3. [Медлайн].
Bolland MJ, Gray A, Avenell A, Gamble GD, Reid IR. Добавки кальция с витамином D или без него и риск сердечно-сосудистых событий: повторный анализ набора данных с ограниченным доступом и метаанализа Инициативы по охране здоровья женщин. BMJ . 2011, 19 апреля. 342: d2040. [Медлайн]. [Полный текст].
Hsia J, Heiss G, Ren H, Allison M, Dolan NC, Greenland P, et al. Добавки кальция / витамина D и сердечно-сосудистые заболевания. Тираж . 2007 г. 20 февраля. 115 (7): 846-54. [Медлайн].
Ван Л., Мэнсон Дж. Э., Сонг Y, Sesso HD. Систематический обзор: добавление витамина D и кальция в профилактику сердечно-сосудистых событий. Энн Интерн Мед. 2 марта 2010 г. 152 (5): 315-23. [Медлайн].
Компстон Дж., Боуринг С., Купер А., Купер С., Дэвис С., Фрэнсис Р. и др. Диагностика и лечение остеопороза у женщин в постменопаузе и пожилых мужчин в Великобритании: обновление Национальной группы рекомендаций по остеопорозу (NOGG) 2013. Матуритас . 2013 Август 75 (4): 392-6. [Медлайн].
Лю Дж., Кертис Э.М., Купер С., Харви, Северная Каролина. Современное состояние в оценке риска и лечении остеопороза. Дж Эндокринол Инвест . 2019 Октябрь 42 (10): 1149-1164. [Медлайн].
.

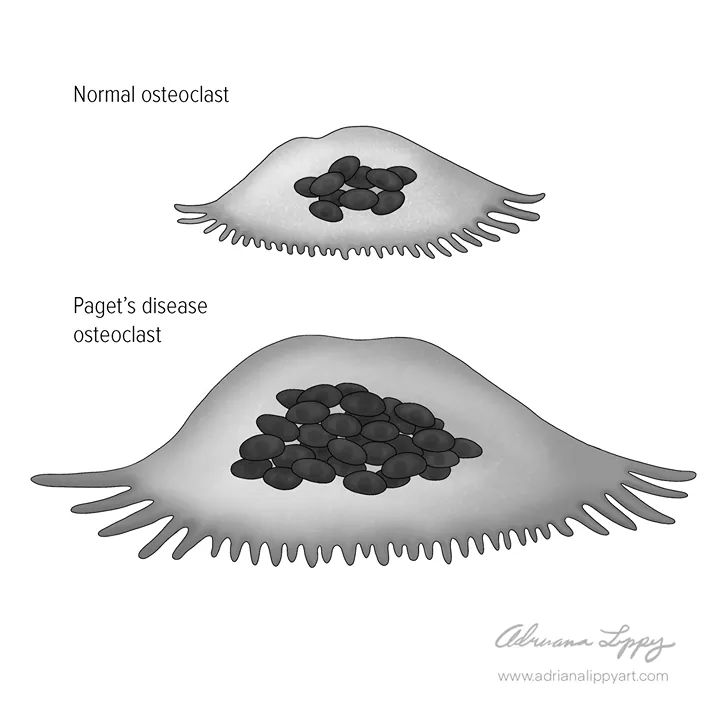 , de Vries P. J, Saris W. H. Delay of natural bone loss by higher intakes of specific minerals and vitamins // Crit Rev Food Sci Nutr. 2001. Vol. 41 (4). Р. 225–249.
, de Vries P. J, Saris W. H. Delay of natural bone loss by higher intakes of specific minerals and vitamins // Crit Rev Food Sci Nutr. 2001. Vol. 41 (4). Р. 225–249.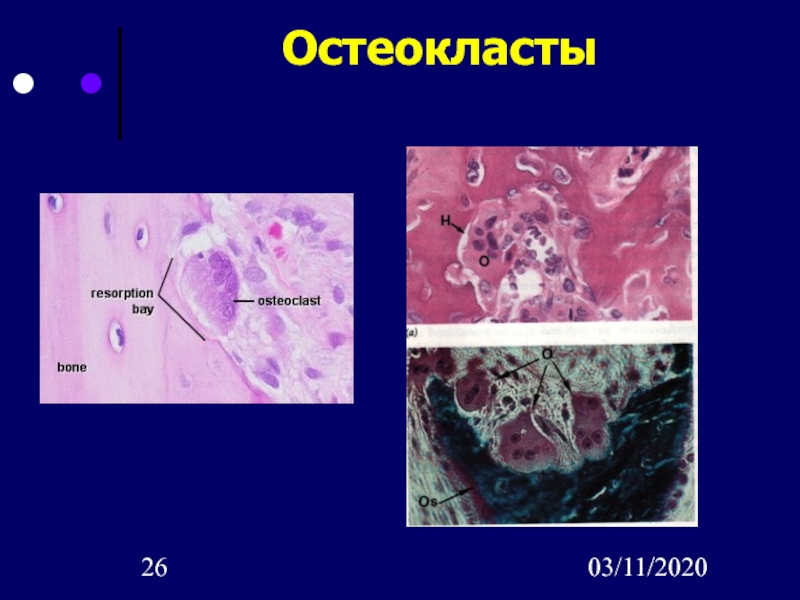 F. Vitamin D deficiency // New. Engl. J. Med. 2007. Vol. 357. P. 266–281.
F. Vitamin D deficiency // New. Engl. J. Med. 2007. Vol. 357. P. 266–281.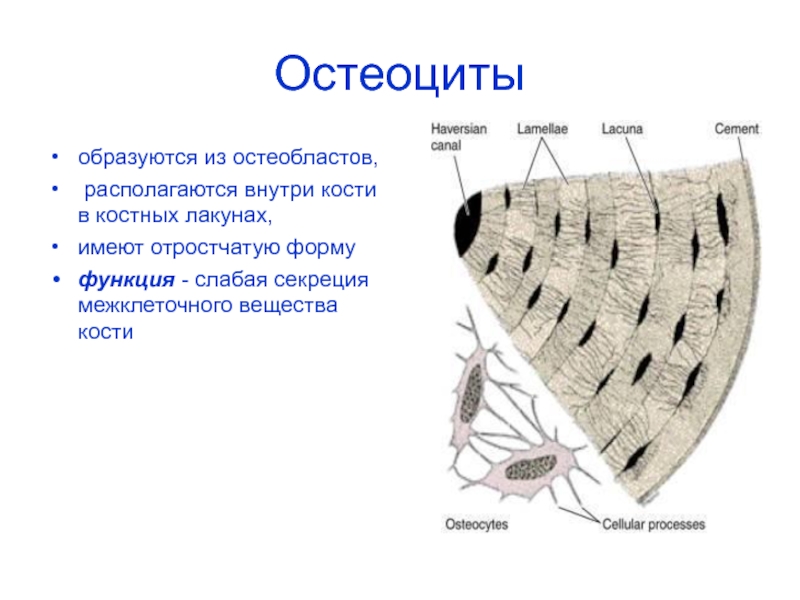 Calcium and vitamin D supplementation increases spinal BMD in healthy, postmenopausal women // Osteoporosis Int. 1998, 8, 225–260.
Calcium and vitamin D supplementation increases spinal BMD in healthy, postmenopausal women // Osteoporosis Int. 1998, 8, 225–260.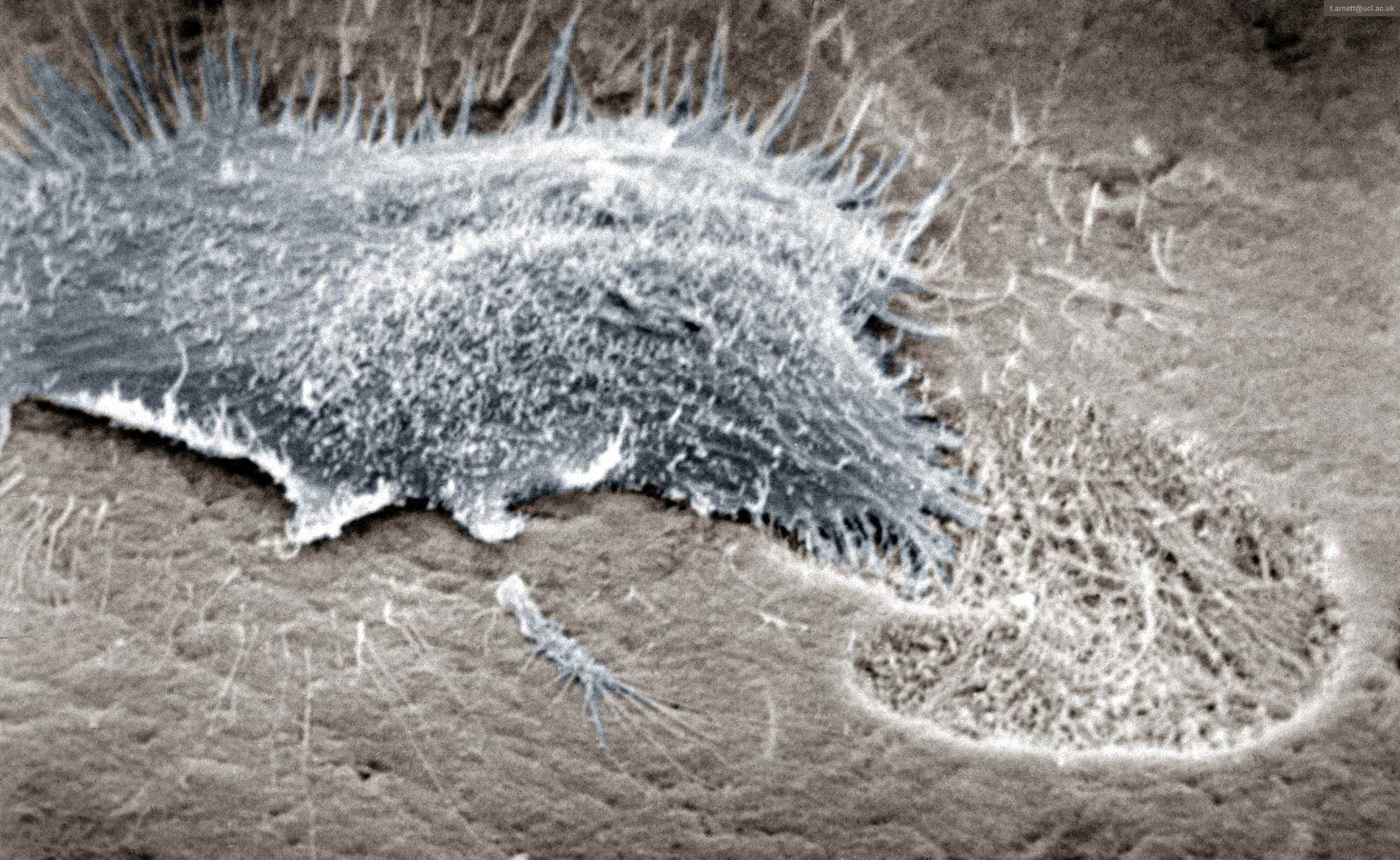 Engl. J. Med. 1997; 337 (10): 670–676.
Engl. J. Med. 1997; 337 (10): 670–676.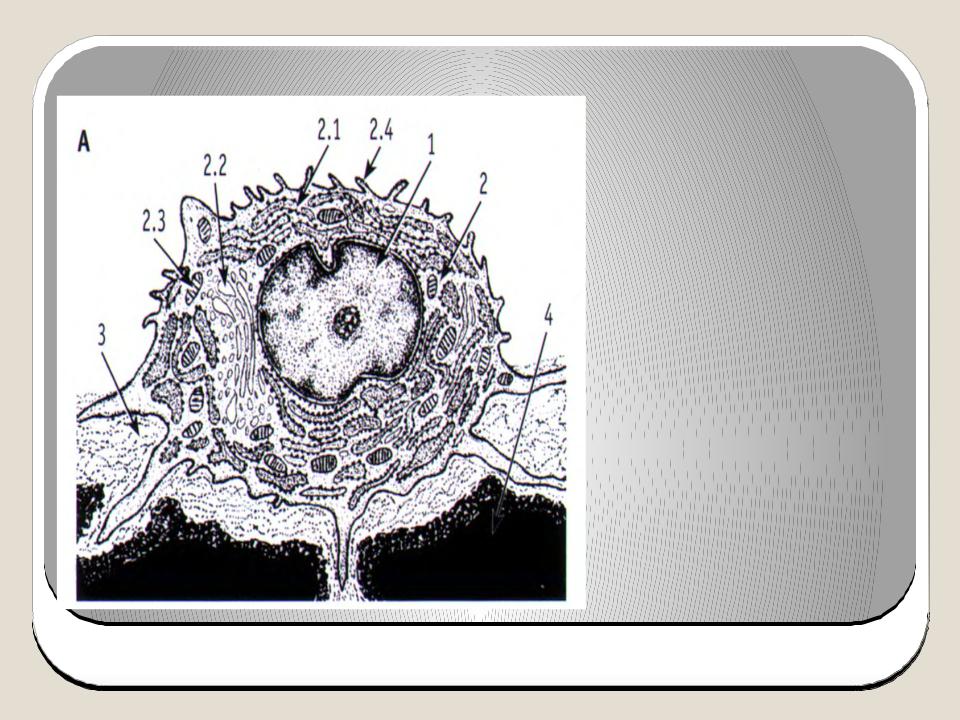 , Andersen K. P., Hyldstrup L. Calcium and vitamin D supplementation increases spinal BMD in healthy, postmenopausal women // Osteoporosis Int. 1998, 8, 225–260.
, Andersen K. P., Hyldstrup L. Calcium and vitamin D supplementation increases spinal BMD in healthy, postmenopausal women // Osteoporosis Int. 1998, 8, 225–260.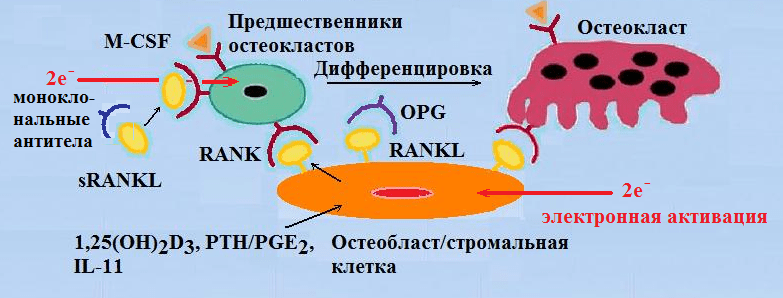 , Joakimsen R., Jacobsen B. K. Anemia and the risk of non-vertebral fractures: the Tromso Study // Osteoporos Int. 2010; 21 (10): 1761–1768.
, Joakimsen R., Jacobsen B. K. Anemia and the risk of non-vertebral fractures: the Tromso Study // Osteoporos Int. 2010; 21 (10): 1761–1768. , Qian H., Ritchey S. J., Lau K. H. Dietary boron supplementation enhanced the action of estrogen, but not that of parathyroid hormone, to improve trabecular bone quality in ovariectomized rats // Biol Trace Elem Res. 2001; 82 (1–3): 109–123.
, Qian H., Ritchey S. J., Lau K. H. Dietary boron supplementation enhanced the action of estrogen, but not that of parathyroid hormone, to improve trabecular bone quality in ovariectomized rats // Biol Trace Elem Res. 2001; 82 (1–3): 109–123./5_CB_Osteoblasts_40x_a.jpg) 2011; 144 (1–3): 306–315.
2011; 144 (1–3): 306–315. М., Воробьева А. С., Кузнецова О. А. Микроэлементоз как фактор формирования остеопении у подростков // Педиатрия. 2012. Т. 91. № 1. С. 68–75.
М., Воробьева А. С., Кузнецова О. А. Микроэлементоз как фактор формирования остеопении у подростков // Педиатрия. 2012. Т. 91. № 1. С. 68–75.