ПЕРВАЯ ПОМОЩЬ при острой сердечной недостаточности — МАУЗ ГКБ 2
ПЕРВАЯ ПОМОЩЬ при острой сердечной недостаточности
Острая сердечная недостаточность (ОСН) – это тяжелое патологическое состояние, которое развивается у больных с различными заболеваниями сердца и гипертонической болезнью. Это одна из наиболее частых причин вызова скорой помощи и госпитализации больных, а также смертности населения нашей страны и всего мира.
Основными проявлениями (симптомами) острой сердечной недостаточности являются:
- тяжелое, частое (более 24 в мин) шумное дыхание – одышка, иногда достигающая степени удушья, с преимущественным затруднением вдоха и явным усилением одышки и кашля в горизонтальном положении. Сидячее положение или лежачее положение с высоко поднятым изголовьем облегчает состояние больного;
- часто при дыхании становятся слышны влажные хлюпающие хрипы/звуки, прерываемые кашлем; в терминальной стадии дыхание приобретает характер клокочущего с появлением пены у рта больного;
- характерная сидячая поза больного, упирающегося прямыми руками в колени или в сидение (для облегчения дыхания)
Острая сердечная недостаточность может развивается очень быстро и в течение 30-60 мин привести к смерти больного. В большинстве случаев от первых клинических признаков до тяжелых проявлений ОСН проходит 6-12 и более часов, однако без медицинской помощи абсолютное большинство больные с ОСН погибает.
В большинстве случаев от первых клинических признаков до тяжелых проявлений ОСН проходит 6-12 и более часов, однако без медицинской помощи абсолютное большинство больные с ОСН погибает.
Алгоритм неотложных действий при острой сердечной недостаточности (советы пациенту) – памятка для пациента
При появлении у больных гипертонической болезнью, или болезнью сердца, (но не легких или бронхов) вышеуказанных симптомов ОСН необходимо:
- вызвать скорую медицинскую помощь • придать больному сидячее положение, лучше в кресле с подлокотниками, на которые он может опираться и включать межреберные мышцы в акт дыхания
- обеспечить физический и психоэмоциональный покой и свежий воздух, путем проветривания помещения
- ноги опустить в большую емкость (таз, бак, ведро и др.) с горячей водой
- в крайне тяжелых случаях на ноги в области паха накладываются жгуты, передавливающие поверхностные вены, но не глубокие артерии, что уменьшает приток крови к сердцу и тем самым облегчает его работу
При наличии опыта у больного или у лица, оказывающего первую помощь по применению нитроглицерина его назначают в дозе 0,4(0,5) мг (ингаляцию в полость рта производят под корень языка, таблетку/капсулу кладут под язык, капсулу необходимо предварительно раскусить, не глотать).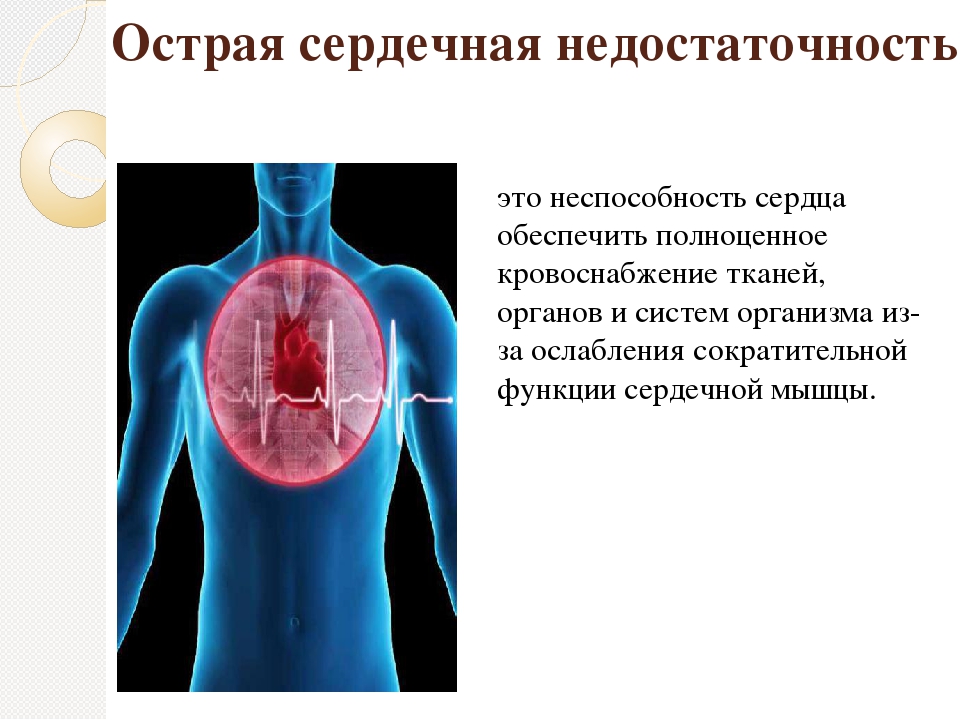 При улучшении самочувствия больного после применения нитроглицерина, его применяют повторно, через каждые 10-15 мин до прибытия бригады скорой медицинской помощи. При отсутствии улучшения самочувствия больного после очередного приема нитроглицерина, его больше не применяют.
При улучшении самочувствия больного после применения нитроглицерина, его применяют повторно, через каждые 10-15 мин до прибытия бригады скорой медицинской помощи. При отсутствии улучшения самочувствия больного после очередного приема нитроглицерина, его больше не применяют.
Внимание! Больному с ОСН необходимо исключить все физические нагрузки, категорически запрещается ходить, курить, пить воду и принимать жидкую пищу до особого разрешения врача; нельзя принимать нитроглицерин при артериальном давлении менее 100 мм рт.ст. при выраженной головной боли, головокружении, остром нарушении зрения, речи или координации движений.
Всем больным гипертонической болезнью, или болезнью сердца с наличием одышки и отеков на ногах необходимо обсудить с лечащим врачом какие препараты необходимо принимать при развитии ОСН, четко записать их наименования, дозировку и временную последовательность (алгоритм) их приема, а также уточнить у врача при каких проявлениях болезни необходимо срочно вызывать скорую медицинскую помощь.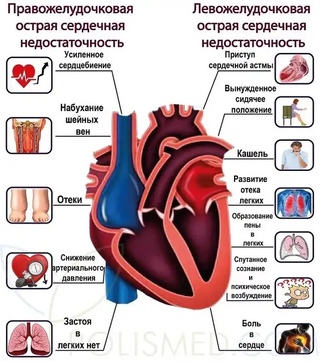 Каждому такому больному необходимо сформировать индивидуальную аптечку первой помощи при ОСН и постоянно иметь ее при себе.
Каждому такому больному необходимо сформировать индивидуальную аптечку первой помощи при ОСН и постоянно иметь ее при себе.
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ОССН — РКО — РНМОТ. СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ: ХРОНИЧЕСКАЯ (ХСН) И ОСТРАЯ ДЕКОМПЕНСИРОВАННАЯ (ОДСН). ДИАГНОСТИКА, ПРОФИЛАКТИКА И ЛЕЧЕНИЕ | Мареев
Для цитирования:
Мареев В.Ю., Фомин И.В., Агеев Ф.Т., Беграмбекова Ю.Л., Васюк Ю.А., Гарганеева А.А., Гендлин Г.Е., Глезер М.Г., Готье С.В., Довженко Т.В., Кобалава Ж.Д., Козиолова Н.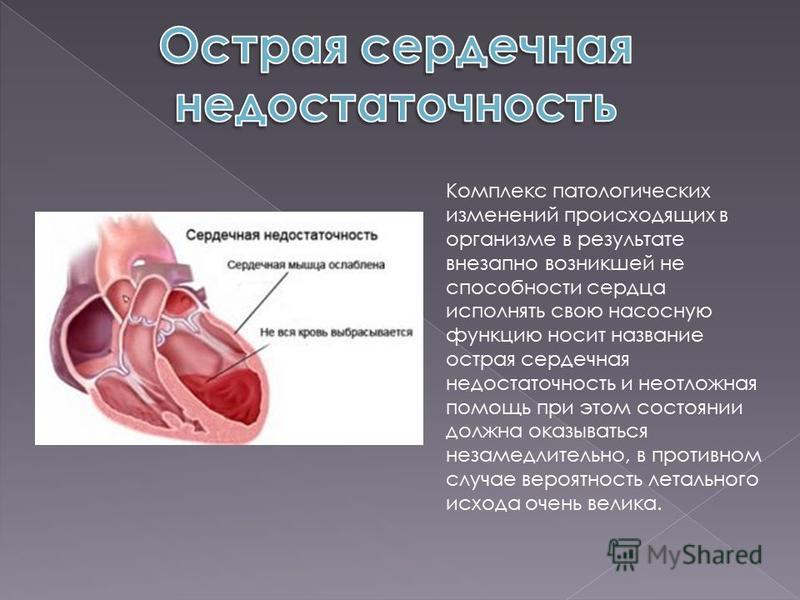 А., Коротеев А.В., Мареев Ю.В., Овчинников А.Г., Перепеч Н.Б., Тарловская Е.И., Чесникова А.И., Шевченко А.О., Арутюнов Г.П., Беленков Ю.Н., Галявич А.С., Гиляревский С.Р., Драпкина О.М., Дупляков Д.В., Лопатин Ю.М., Ситникова М.Ю., Скибицкий В.В., Шляхто Е.
А., Коротеев А.В., Мареев Ю.В., Овчинников А.Г., Перепеч Н.Б., Тарловская Е.И., Чесникова А.И., Шевченко А.О., Арутюнов Г.П., Беленков Ю.Н., Галявич А.С., Гиляревский С.Р., Драпкина О.М., Дупляков Д.В., Лопатин Ю.М., Ситникова М.Ю., Скибицкий В.В., Шляхто Е. В. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ОССН — РКО — РНМОТ. СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ: ХРОНИЧЕСКАЯ (ХСН) И ОСТРАЯ ДЕКОМПЕНСИРОВАННАЯ (ОДСН). ДИАГНОСТИКА, ПРОФИЛАКТИКА И ЛЕЧЕНИЕ. Кардиология. 2018;58(6S):8-158.
В. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ОССН — РКО — РНМОТ. СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ: ХРОНИЧЕСКАЯ (ХСН) И ОСТРАЯ ДЕКОМПЕНСИРОВАННАЯ (ОДСН). ДИАГНОСТИКА, ПРОФИЛАКТИКА И ЛЕЧЕНИЕ. Кардиология. 2018;58(6S):8-158.
https://doi.org/10.18087/cardio.2475
For citation:
Mareev V.Yu., Fomin I.V., Ageev F.T., Begrambekova Yu.L., Vasyuk Yu.A., Garganeeva A.A., Gendlin G.E., Glezer M.G., Gautier S.V., Dovzhenko T.V., Kobalava Z.D., Koziolova N.A., Koroteev A.V., Mareev Yu.V. , Ovchinnikov A.G., Perepech N.B., Tarlovskaya E.I., Chesnikova A.I., Shevchenko A.O., Arutyunov G.P., Belenkov Yu.N., Galyavich A.S., Gilyarevsky S.R., Drapkina O.M., Duplyakov D.V., Lopatin Yu.M., Sitnikova M.Yu., Skibitsky V.V., Shlyakhto E.V. Russian Heart Failure Society, Russian Society of Cardiology. Russian Scientific Medical Society of Internal Medicine Guidelines for Heart failure: chronic (CHF) and acute decompensated (ADHF). Diagnosis, prevention and treatment. Kardiologiia. 2018;58(6S):8-158.
, Ovchinnikov A.G., Perepech N.B., Tarlovskaya E.I., Chesnikova A.I., Shevchenko A.O., Arutyunov G.P., Belenkov Yu.N., Galyavich A.S., Gilyarevsky S.R., Drapkina O.M., Duplyakov D.V., Lopatin Yu.M., Sitnikova M.Yu., Skibitsky V.V., Shlyakhto E.V. Russian Heart Failure Society, Russian Society of Cardiology. Russian Scientific Medical Society of Internal Medicine Guidelines for Heart failure: chronic (CHF) and acute decompensated (ADHF). Diagnosis, prevention and treatment. Kardiologiia. 2018;58(6S):8-158.
(In Russ.) https://doi.org/10.18087/cardio.2475
Острая сердечная недостаточность | Regionaalhaigla
Сердечная недостаточность – это состояние, при котором насосная способность сердца снижается и не может обеспечить организм достаточным количеством обогащённой кислородом крови.
Острая сердечная недостаточность – это состояние, при котором резко возникает сердечная недостаточность (при хронической сердечной недостаточности обостряется).
Причины возникновения
Основными причинами возникновения острой сердечной недостаточности являются нерегулярное использование лечения, острый инфаркт миокарда и аритмии. Кроме того, состояние может быть вызвано очень высоким кровяным давлением, воспалением сердечной мышцы, острым заболеванием клапанов сердца и тромбоэмболией легочной артерии.
Симптомы
Наиболее распространенной жалобой на острую сердечную недостаточность является нехватка воздуха, которая может возникнуть уже при низких нагрузках или в состоянии покоя. Кроме того, об острой сердечной недостаточности свидетельствует быстрый набор веса (более 1-2 кг в неделю), вызванный избытком жидкости в организме. Также могут присутствовать отек и усталость.
Кроме того, об острой сердечной недостаточности свидетельствует быстрый набор веса (более 1-2 кг в неделю), вызванный избытком жидкости в организме. Также могут присутствовать отек и усталость.
Исследования и диагностика
Острая сердечная недостаточность обычно диагностируется в дополнение к оценке жалоб на основании ультразвукового исследования сердца (эхокардиографии) и образцов крови. В зависимости от состояния, вызывающего острую сердечную недостаточность, могут проводиться другие исследования, такие как зондирование коронарной артерии (коронарография) и компьютерная томография.
Лечение
При тяжелой сердечной недостаточности необходима срочная медицинская помощь. Часто требуется также госпитализация.
Основной целью лечения обострения сердечной недостаточности является лечение болезни, которая ее вызывает. При инфаркте миокарда проводится расширение и стентирование вызвавшей сердечный приступ суженной коронарной артерии, При обширном повреждении коронарных артерий и остром клапанном заболевании может потребоваться операция на сердце. При аритмиях сердечный ритм может быть восстановлен с помощью лекарств или электрошока через грудь под наркозом (электрическая кардиоверсия). Для облегчения ощущения нехватки воздуха может потребоваться введение кислорода через специальную герметичную маску (см. рисунок) или интубацией трахеи. Снижение функции сердечного насоса и артериального давления может поддерживаться некоторыми внутривенными лекарственными препаратами. При тяжелом заболевании может потребоваться установка аппарата искусственного кровообращения (ECMO).
При аритмиях сердечный ритм может быть восстановлен с помощью лекарств или электрошока через грудь под наркозом (электрическая кардиоверсия). Для облегчения ощущения нехватки воздуха может потребоваться введение кислорода через специальную герметичную маску (см. рисунок) или интубацией трахеи. Снижение функции сердечного насоса и артериального давления может поддерживаться некоторыми внутривенными лекарственными препаратами. При тяжелом заболевании может потребоваться установка аппарата искусственного кровообращения (ECMO).
Профилактика
Пациент играет важную роль в профилактике обострения сердечной недостаточности. Несмотря на возможности лечения, смертность пациентов с острой сердечной недостаточностью высока, поэтому необходимо предотвратить возникновения этого состояния (см. таблицу).
Маска неинвазивной вентиляции и дыхательный аппарат
Если у вас хроническая сердечная недостаточность: Если у вас возникают жалобы на сердечную недостаточность в течение короткого периода времени, вам требуется срочная медицинская помощь. |
Медикаментозное лечение острой сердечной недостаточности: что есть и что нас ждет | Еременко
1. Бабаев М. А., Еременко А. А., Дымова О. В. и др. Применение левосимендана при подготовке пациенток с хронической сердечной недостаточностью к кардиохирургическим операциям // Российский кардиологический журнал. ‒ 2017. ‒ № 3 (143). ‒ С. 59–62.
2. Баутин А. А., Ксендикова А. В., Белолипецкий С. С. и др. О возможности использования фармакологических индексов для прогнозирования течения послеоперационного периода кардиохирургических вмешательств // Вестник интенсивной терапии им. А. И. Салтанова. ‒ 2019. ‒ № 2. ‒ С. 66-74. DOI: 10.21320/1818-474X-2019-2-66-74.
В., Белолипецкий С. С. и др. О возможности использования фармакологических индексов для прогнозирования течения послеоперационного периода кардиохирургических вмешательств // Вестник интенсивной терапии им. А. И. Салтанова. ‒ 2019. ‒ № 2. ‒ С. 66-74. DOI: 10.21320/1818-474X-2019-2-66-74.
3. Козлов И. А., Кричевский Л. А. Оценка эффективности левосимендана в кардиохирургии // Вестник анестезиологии и реаниматологии. ‒ 2017. ‒ Т. 14, № 4. ‒ С. 81‒82. //doi.org/10.21292/2078-5658-2017-14-4-81-82.
4. Мареев В. Ю., Фомин И. В., Агеев Ф. Т. и др. Клинические рекомендации ОССН – РКО – РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение // Кардиология. ‒ 2018. ‒ № 58 (S6). DOI: 10.18087/cardio.2475.
5. Поляков Д. С., Фомин И. В., Валикулова Ф. Ю. и др. Эпидемиологическая программа ЭПОХА – ХСН: декомпенсация хронической сердечной недостаточности в реальной клинической практике (ЭПОХА – Д – ХСН) // Журнал Сердечная недостаточность. ‒ 2016. ‒ Т. 17, № 5. ‒ С. 299–305. DOI:10.18087/rhfj. 2016.5.22.
Поляков Д. С., Фомин И. В., Валикулова Ф. Ю. и др. Эпидемиологическая программа ЭПОХА – ХСН: декомпенсация хронической сердечной недостаточности в реальной клинической практике (ЭПОХА – Д – ХСН) // Журнал Сердечная недостаточность. ‒ 2016. ‒ Т. 17, № 5. ‒ С. 299–305. DOI:10.18087/rhfj. 2016.5.22.
6. Agostoni P., Farmakis D. T., García-Pinilla J. M. et al. Haemodynamic balance in acute and advanced heart failure: an expert perspective on the role of Levosimendan // Card Fail Rev. ‒ 2019. ‒ Vol. 5, № 3. ‒ Р. 155‒161. doi: 10.15420/cfr.2019.01.R1. eCollection 2019 Nov.
7. Bistola V., Simitsis P., Farmakis D. et al. Association of mineralocorticoid receptor antagonist use and in-hospital outcomes in patients with acute heart failure // Clin. Res. Cardiol. ‒ 2018. ‒ Vol. 107, № 1. ‒ Р. 76‒86. doi: 10.1007/s00392-017-1161-7. Epub 2017 Sep 18.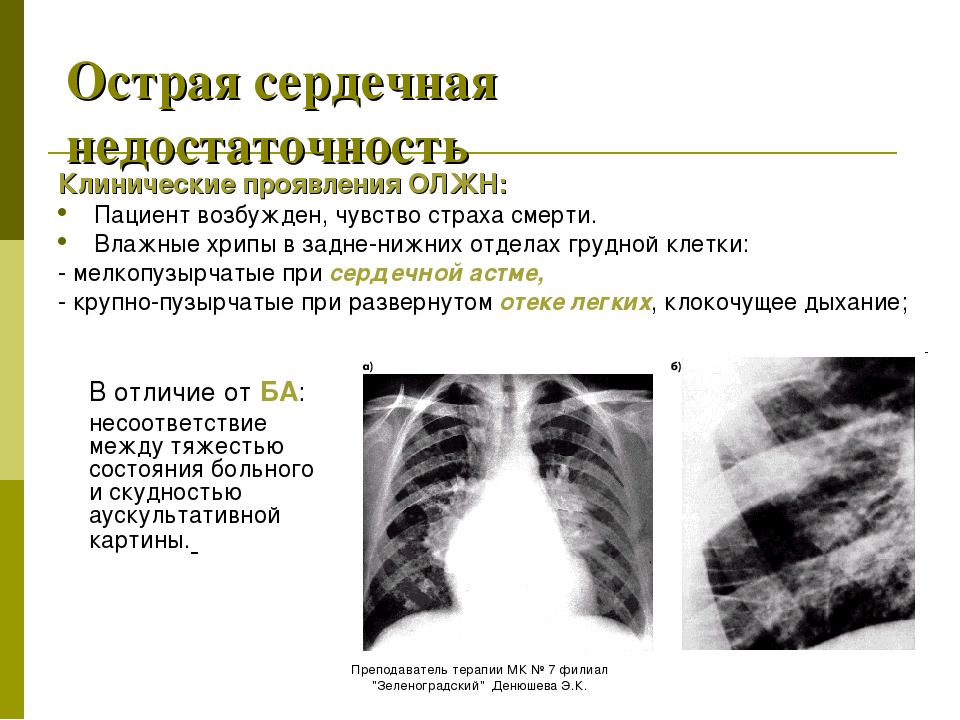
8. Chen Q. H., Zheng R. Q., Lin H. et al. Effect of levosimendan on prognosis in adult patients undergoing cardiac surgery: a meta-analysis of randomized controlled trials // Crit. Care. ‒ 2017. ‒ Vol. 21, № 1. ‒ Р. 253. doi: 10.1186/s13054-017-1848-1.
9. Cholley B., Levy B., Fellahi J. L. et al. Levosimendan in the light of the results of the recent randomized controlled trials: an expert opinion paper // Crit. Care. ‒ 2019. ‒ Vol. 23, № 1. ‒ Р. 385. doi: 10.1186/s13054-019-2674-4.
10. De Backer D., Biston P., Devriendt J. et al. SOAP II Investigators. Comparison of dopamine and norepinephrine in the treatment of shock // N. Engl. J. Med. ‒ 2010. ‒ Vol. 362, № 9. ‒ Р. 779‒789. doi: 10.1056/NEJMoa0907118.
11. Farmakis D., Agostoni P., Baholli L. et al. A pragmatic approach to the use of inotropes for the management of acute and advanced heart failure: An expert panel consensus // Int. J. Cardiol. ‒ 2019. ‒ Vol. 297. ‒ Р. 83‒90. doi: 10.1016/j.ijcard.2019.09.005. Epub 2019 Sep 6.
Farmakis D., Agostoni P., Baholli L. et al. A pragmatic approach to the use of inotropes for the management of acute and advanced heart failure: An expert panel consensus // Int. J. Cardiol. ‒ 2019. ‒ Vol. 297. ‒ Р. 83‒90. doi: 10.1016/j.ijcard.2019.09.005. Epub 2019 Sep 6.
12. Fedele F., Severino P., Calcagno S. et al. Heart failure: TNM-like classification // J. Am. Coll Cardiol. ‒ 2014. ‒ Vol. 63, № 19. ‒ Р. 1959‒1960. doi: 10.1016/j.jacc.2014.02.552. Epub 2014 Mar 19.
13. Forssmann W., Meyer M., Forssmann K. The renal urodilatin system: clinical implications // Cardiovasc. Res. 2001. ‒ Vol. 51, № 3. ‒ Р. 450‒462. DOI: 10.1016/s0008-6363(01)00331-5.
14. Gheorghiade M., Gattis W. A., O’Connor C. M. et al. Acute and chronic therapeutic impact of a vasopressin antagonist in congestive heart failure (ACTIV in CHF) investigators. Effects of tolvaptan, a vasopressin antagonist, in patients hospitalized with worsening heart failure: a randomized controlled trial // JAMA. ‒ 2004. ‒ Vol. 291, № 16. ‒ Р. 1963‒1971. DOI: 10.1001/jama.291.16.1963.
Effects of tolvaptan, a vasopressin antagonist, in patients hospitalized with worsening heart failure: a randomized controlled trial // JAMA. ‒ 2004. ‒ Vol. 291, № 16. ‒ Р. 1963‒1971. DOI: 10.1001/jama.291.16.1963.
15. Iyengar S., Feldman D. S., Trupp R. et al. Nesiritide for the treatment of congestive heart failure // Expert Opin Pharmacother. ‒ 2004. ‒ Vol. 5, № 4. ‒ Р. 901‒907. DOI: 10.1517/14656566.5.4.901.
16. Jacky A., Rudiger A., Krüger B. et al. Comparison of Levosimendan and Milrinone for ECLS weaning in patients after cardiac surgery-a retrospective before-and-after study // J. Cardiothorac. Vasc. Anesth. ‒ 2018. ‒ Vol. 32, № 5. ‒ Р. 2112‒2119. doi: 10.1053/j.jvca.2018.04.019. Epub 2018 Apr 6.
17. Keating G. M., Goa K. L. Nesiritide: a review of its use in acute decompensated heart failure // Drugs. ‒ 2003. ‒ Vol. 63, № 1. ‒ Р. 47‒70. DOI: 10.2165/00003495-200363010-00004.
‒ 2003. ‒ Vol. 63, № 1. ‒ Р. 47‒70. DOI: 10.2165/00003495-200363010-00004.
18. Konstam M. A., Gheorghiade M., Burnett J. C. Jr. et al. Efficacy of vasopressin antagonism in heart failure outcome study with tolvaptan (EVEREST) investigators. Effects of oral tolvaptan in patients hospitalized for worsening heart failure: the EVEREST Outcome Trial // JAMA. ‒ 2007. ‒ Vol. 297, № 12. ‒ Р. 1319‒1331. Epub 2007 Mar 25. DOI: 10.1001/jama.297.12.1319.
19. Léopold V., Gayat E., Pirracchio R. et al. Epinephrine and short-term survival in cardiogenic shock: an individual data meta-analysis of 2583 patients // Intens. Care Med. ‒ 2018. ‒ Vol. 44, № 6. ‒ Р. 847‒856. doi: 10.1007/s00134-018-5222-9. Epub 2018 Jun 1.
20. Levy B., Clere-Jehl R., Legras A. et al. Collaborators. Epinephrine versus norepinephrine for cardiogenic shock after acute myocardial infarction // J. Am. Coll. Cardiol. ‒ 2018. ‒ Vol. 72, № 2. ‒ Р. 173‒182. doi: 10.1016/j.jacc.2018.04.051.
Epinephrine versus norepinephrine for cardiogenic shock after acute myocardial infarction // J. Am. Coll. Cardiol. ‒ 2018. ‒ Vol. 72, № 2. ‒ Р. 173‒182. doi: 10.1016/j.jacc.2018.04.051.
21. Mebazaa A., Parissis J., Porcher R. et al. Short-term survival by treatment among patients hospitalized with acute heart failure: the global ALARM-HF registry using propensity scoring methods // Intens. Care Med. ‒ 2011. ‒ Vol. 37, № 2. ‒ Р. 290‒301. doi: 10.1007/s00134-010-2073-4. Epub 2010 Nov 18.
22. Mebazaa A., Tolppanen H., Mueller C. et al. Acute heart failure and cardiogenic shock: a multidisciplinary practical guidance // Intens. Care Med. ‒ 2016. ‒ Vol. 42, № 2. ‒ Р. 147‒163. doi: 10.1007/s00134-015-4041-5. Epub 2015 Sep 14.
23. Mosterd A., Hoes A. W. Clinical epidemiology of heart failure // Heart. ‒ 2007. ‒ Vol. 93, № 9. ‒ Р. 1137‒1146. DOI: 10.1136/hrt.2003.025270.
‒ 2007. ‒ Vol. 93, № 9. ‒ Р. 1137‒1146. DOI: 10.1136/hrt.2003.025270.
24. Pirracchio R., Parenica J., Resche Rigon M. et al. GREAT network. The effectiveness of inodilators in reducing short term mortality among patient with severe cardiogenic shock: a propensity-based analysis // PLoS One. ‒ 2013. ‒ Vol. 8, № 8. ‒ Р. e71659. doi: 10.1371/journal.pone.0071659. eCollection 2013.
25. Pollesello P., Ben Gal T., Bettex D. et al. Short-term therapies for treatment of acute and advanced heart failure-why so few drugs available in clinical use, why even fewer in the pipeline? // J. Clin. Med. ‒ 2019. ‒ Vol. 8, № 11. pii: E1834. doi: 10.3390/jcm8111834.
26. Pollesello P., Parissis J., Kivikko M. et al. Levosimendan meta-analyses: Is there a pattern in the effect on mortality? // Int. J. Cardiol. ‒ 2016. ‒ Vol. 209. ‒ Р. 77‒83. doi: 10.1016/j.ijcard.2016.02.014. Epub 2016 Feb 3.
J. Cardiol. ‒ 2016. ‒ Vol. 209. ‒ Р. 77‒83. doi: 10.1016/j.ijcard.2016.02.014. Epub 2016 Feb 3.
27. Schumann J., Henrich E. C., Strobl H. et al. Inotropic agents and vasodilator strategies for the treatment of cardiogenic shock or low cardiac output syndrome // Cochrane Database Syst Rev. ‒ 2018. ‒ Vol. 1. CD009669. doi: 10.1002/14651858.CD009669.pub3.
28. Teerlink J. R., Metra M., Zacà V. et al. Agents with inotropic properties for the management of acute heart failure syndromes. Traditional agents and beyond // Heart Fail Rev. ‒ 2009. ‒ Vol. 14, № 4. ‒ Р. 243‒253. doi: 10.1007/s10741-009-9153-y.
29. Teerlink J. R. A novel approach to improve cardiac performance: cardiac myosin activators // Heart Fail Rev. ‒ 2009. ‒ Vol. 14, № 4. ‒ Р. 289‒298. doi: 10. 1007/s10741-009-9135-0.
1007/s10741-009-9135-0.
30. Zangrillo A., Biondi-Zoccai G., Ponschab M. et al. Milrinone and mortality in adult cardiac surgery: a meta-analysis // J. Cardiothorac. Vasc. Anesth. ‒ 2012. ‒ Vol. 26, № 1. ‒ Р. 70‒77. doi:10.1053/j.jvca.2011.06.022. Epub 2011 Sep 22.
31. Zhai Y., Luo Y., Wu P., Li D. New insights into SERCA2a gene therapy in heart failure: pay attention to the negative effects of B-type natriuretic peptides // J. Med. Genet. ‒ 2018. ‒ Vol. 5. ‒ Р. 287‒296. doi: 10.1136/jmedgenet-2017-105120. Epub 2018 Feb 24.
(PDF) ОСТРАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ. ЕВРОПЕЙСКИЙ КОНСЕНСУС: ПЕРЕВОД РЕКОМЕНДАЦИИ
РЕКОМЕНДАЦИИ
Архивъ внутренней медицины
• №
4(24)
•
2015
9
• Для повышения сердечного выброса может приме-
няться добутамин; с этой целью может использо-
ваться и левосимендан, особенно у больных с ХСН,
принимающих β-адреноблокаторы.
• Вазопрессоры должны использоваться лишь при
невозможности достижения целевых цифр САД
и устранения симптомов гипоперфузии на фоне
терапии инфузионными растворами и добутами-
ном/левосименданом; при этом предпочтение сто-
ит отдавать норадреналину.
• Все больные с КШ должны быть транспортирова-
ны в центры, где работает круглосуточная интер-
венционная служба с возможностью применения
аппаратов вспомогательного кровообращения.
• Рутинное применение внутриаортальной баллон-
ной контрпульсации при КШ не рекомендовано.
• Методы вспомогательного кровообращения у па-
циентов с КШ могут быть использованы кратко-
временно, а показания к их применению опреде-
ляются возрастом больного, его неврологическим
статусом и наличием сопутствующей патологии.
• Преимущества одного метода вспомогательного
кровообращения над другими на сегодняшний
день не установлены.
Пробелы в имеющихся знаниях
и перспективы
Сегодня остается множество нерешенных задач,
связанных с патогенезом, тактикой лечения и про-
гнозом ОСН. Требует дальнейшего изучения вопрос
Требует дальнейшего изучения вопрос
определения различных биомаркеров с целью стра-
тификации риска и оценки эффективности лече-
ния. Остаются неизученными факторы, влияющие
на риск смертности при ОСН. Нуждается в доработ-
ке концепция выездных кардиологических бригад,
качественное оказание помощи которыми позво-
лило бы избежать необоснованных госпитализаций
больных в специализированные центры.
В настоящее время ожидаются результаты клиниче-
ских исследований RELAX-AHF [5], ATOMIC-AHF
[6], PRONTO [7], TRUE-AHF [14], ARTS-HF [15], ко-
торые дают надежду на прорыв в лечении пациентов
с ОСН.
Список литературы:
1. Mebazaa A ., Yilmaz M.B., Levy P. et al. Recommendations on pre-
hospital & hospital management of acute heart failure: a consensus
paper from the Heart Failure Association of the European Society
of Cardiology, the European Society of Emergency Medicine and
the Society of Academic Emergency Medicine. Eur. Heart J. 2015;
Eur. Heart J. 2015;
doi: 10.1002/ejhf.289 [published online ahead of print May 22,
2015].
2. McMurray J.J., Adamopoulos S., Anker S.D. et al. ESC Committee
for Practice Guidelines. ESC Guidelines for the diagnosis and
treatment of acute and chronic heart failure 2012: The Task Force
for the Diagnosis and Treatment of Acute and Chronic Heart
Failure 2012 of the European Society of Cardiology. Developed in
collaboration with the Heart Failure Association (HFA) of the ESC.
Eur. Heart J. 2012; 33: 1787–1847.
3. Follath F., Yilmaz M.B., Delgado J.F. et al. Clinical presentation,
management and outcomes in the Acute Heart Failure Global
Survey of Standard Treatment (ALARM-HF). Intensive Care Med.
2011; 37: 619–626.
4. Lee D.S., Stukel T.A., Austin P.C. Et al. Improved outcomes with
early collaborative care of ambulatory heart failure patients
discharged from the emergency department. Circulation. 2010;
Circulation. 2010;
122: 1806–1814.
5. Teerlink J.R., Cotter G., Davison B.A. et al. RELAXin in Acute Heart
Failure (RELAX-AHF) Investigators. Serelaxin, recombinant human
relaxin-2, for treatment of acute heart failure (RELAX-AHF): a
randomised, placebo-controlled trial. Lancet. 2013; 381: 29–39.
6. Cleland J.G., Teerlink J.R., Senior R. et al. The effects of the cardiac
myosin activator, omecamtiv mecarbil, on cardiac function in
systolic heart failure: a double-blind, placebo-controlled, cross-
over, dose-ranging phase 2 trial. Lancet. 2011; 378: 676–683.
7. Peacock WF, Chandra A, Char D. et al. Clevidipine in acute heart
failure: results of the a study of blood pressure control in acute
heart failure — a pilot study (PRONTO). Am. Heart J. 2014; 167:
529–536.
8. Nieminen M.S., Brutsaert D., Dickstein K. et al. EuroHeart Failure
Survey II (EHFS II): a survey on hospitalized acute heart failure
patients: description of population. Eur. Heart J. 2006; 27:
Eur. Heart J. 2006; 27:
2725–2736.
9. Zannad F., Mebazaa A., Juilliere Y. et al. Clinical profile,
contemporary management and one-year mortality in patients
with severe acute heart failure syndromes: the EFICA study. Eur. J.
Heart Fail. 2006; 8: 697–705.
10. Fonarow G.C., Heywood J.T., Heidenreich P.A. et al. Temporal
trends in clinical characteristics, treatments, and outcomes for
heart failure hospitalizations, 2002 to 2004: findings from Acute
Decompensated Heart Failure National Registry (ADHERE). Am.
Heart J. 2007; 153: 1021–1028.
11. Sato N., Kajimoto K., Asai K. et al. Acute decompensated heart
failure syndromes (ATTEND) registry. A prospective observational
multicenter cohort study: rationale, design, and preliminary data.
Am. Heart J. 2010; 159: 949–955 e1.
12. Ducros L., Logeart D., Vicaut E. et al. CPAP for acute cardiogenic
pulmonary oedema from out-of-hospital to cardiac intensive care
unit: a randomised multicentre study. Intensive Care Med. 2011; 37:
Intensive Care Med. 2011; 37:
1501–1509.
13. Sporer K.A., Tabas J.A., Tam RK et al. Do medications affect vital
signs in the prehospital treatment of acute decompensated heart
failure? Prehosp. Emerg. Care. 2006; 10: 41–45.
14. Anker S.D., Ponikowski P., Mitrovic V. et al. Ularitide for the
treatment of acute decompensated heart failure: from preclinical
to clinical studies. Eur. Heart J. 2015; 36: 715–723.
15. Pitt B., Anker S.D., Bohm M. et al. Rationale and design of
MinerAlocorticoid Receptor antagonist Tolerability Study-
Heart Failure (ARTS-HF): a randomized study of finerenone vs.
eplerenone in patients who have worsening chronic heart failure
with diabetes and/or chronic kidney disease. Eur. J. Heart Fail. 2015;
17: 224–232.
Авторы заявляют, что данная работа, её тема, предмет
и содержание не затрагивают конкурирующих интересов.
Острая сердечная недостаточность : руководство (Моисеев, В.
 …
…
Моисеев, В. С.
В книге рассмотрены современные представления об острой сердечной недостаточности, которая является важнейшей причиной снижения качества жизни, частой госпитализации и летальности больных. Приведены классификация, этиология, некоторые патогенетические механизмы этой патологии. Достаточно подробно описаны различные клинические варианты острой сердечной недостаточности при разных патологических состояниях.
Полная информация о книге
- Вид товара:Книги
- Рубрика:Кардиология. Ангиология
- Целевое назначение:Производств.
 -практич.изд.,практич.рук-во
-практич.изд.,практич.рук-во - ISBN:978-5-9986-0078-4
- Серия:Несерийное издание
- Издательство:
МИА - Год издания:2012
- Количество страниц:324
- Тираж:1000
- Формат:70х100/16
- УДК:616.
 12-008.46
12-008.46 - Штрихкод:9785998600784
- Переплет:в пер.
- Сведения об ответственности:В. С. Моисеев, Ж. Д. Кобалава
- Код товара:732406
Острая и хроническая сердечная недостаточность собак и кошек (ОСН и ХСН)
Также как и человек, наши домашние компаньоны собаки и кошки имеют четырехкамерное сердце и похожую систему сосудов, соединенных с ним. В связи с этим, все клинические симптомы сердечной недостаточности у животных и человека похожи (за небольшим исключением). Также все физические принципы кровотока в сосудах и камерах сердца одинаковы.
Также все физические принципы кровотока в сосудах и камерах сердца одинаковы.
Хочется отметить, что все заболевания органов и систем у млекопитающих имеют определенные стадии развития. Это также касается болезней сердца и сосудов. На каждой стадии развиваются свои симптомы, и лечение может отличаться.
В большинстве случаев, ветеринарным кардиологам нашей ветеринарной клиники приходится сталкиваться с серьезными запущенными стадиями ХСН. Многие владельцы долго не обращаются к специалистам, наблюдая какие-либо симптомы дома, и лишь при тяжелом состоянии животного обращаются в вет клинику (чаще это ОСН).
Болезни сердца собаки делят на врожденные и приобретенные (в процессе жизни, в результате заболеваний других органов, а также генетически наследуемые по породе). Это поможет установить ветврач в процессе обследования молодняка собак и кошек и взрослых животных с клиническими симптомами, а также при диспансеризации внешне здоровых животных.
Самыми яркими симптомами ХСН собак и кошек являются:
- кашель (только у собак!!!)
- одышка (учащенное дыхание, как с малой физической нагрузкой, так и без нее)
- появление утомляемости, вялости на прогулке и дома (которую владелец ранее не замечал)
- обмороки
- снижение аппетита
- увеличение объема живота (сердечный асцит)
- исхудание (кахексия)
Будьте внимательны — частое дыхание кошки с высунутым языком (как у собаки) является ненормальным и требует обязательного обследования сердца и респираторной системы животного!!! Тут нужен осмотр у ветеринарного врача кардиолога.
Все перечисленные симптомы могут возникать по отдельности и в комбинации друг с другом, Владельцу необходимо запомнить время их возникновения и длительность течения, об этом обязательно будет спрашивать кардиолог.
Как правило, кашель у собак может длиться долго, без других симптомов, иногда не сильно беспокоя владельцев. Помните, при некоторых заболеваниях сердца, кашель у собак является первым «звоночком» серьезной проблемы и требует тщательного обследования питомца. Огромное значение имеет и то, как часто животное кашляет в течение дня. Это может указать ветеринарному врачу на развитие следующей стадии ХСН. Иногда сильный приступ закашливания вашего четвероногого питомца может привести к обмороку (кашлевой обморок) после которого животному становится легче на некоторое время. Кашель, который беспокоил владельцев долгое время, может внезапно прекратиться (независимо получало ли животное кардиотерапию или нет), что обычно радует владельцев, но не врача. К сожалению, такое развитие событий говорит о прогрессировании патологии, а не излечении и требует более интенсивной терапии и исследований.
Для кошек кашель — респираторный симптом, НЕ ЯВЛЯЕТСЯ кардиологическим симптомом!
Для начала развития определенных патологий сердца у собак первым симптомом может быть только одышка, без присутствия кашля, что также является поводом для обращения к специалисту.
Важно помнить, что такой симптом как обморок собаки, кошки чаще проявляется при значимых нарушениях ритма работы сердца (аритмиях) и может привести к летальному исходу.
Потеря аппетита, вялость, исхудание и увеличение живота (асцит) чаще всего сопутствуют друг другу и указывают на более тяжелое течение ХСН.
ОСН (острая сердечная недостаточность) у собак и кошек может возникнуть довольно быстро. ОСН может развиться на фоне сочетанных травм, кровопотери, инфекционных заболеваний и др, а также сопровождать некоторые стадии ХСН. У животных с тяжелыми стадиями ХСН стресс может спровоцировать ОСН.
Основными симптомами ОСН являются:
- выраженная одышка (частое и более поверхностное дыхание, преимущественно животом, а не грудной клеткой).
 Чаще всего хорошо проявляется одышка у кошек.
Чаще всего хорошо проявляется одышка у кошек. - состояние шока (отсутствующая или сниженная реакция на внешние раздражители, холодные конечности, сниженное давление, учащенный пульс)
- отек легких (резко учащенный кашель (для собак), влажные хрипы в легких, иногда слышимые без фонендоскопа)
- выраженная бледность слизистых оболочек (рта, языка), может быть с синеватым оттенком.
Такое состояние является неотложным и требует экстренных мероприятий в условиях ветклиники и стационара. Гибель у таких животных, не получающих своевременную терапию, наступает от отека легких. В большинстве случаев, купировать приступ удается, и животное должно обязательно находиться под наблюдением ветеринарного врача еще несколько дней.
К сожалению, в домашних условиях вовремя сложно помочь такому животному, т к требуется время для транспортировки любимца, или время для приезда врача-кардиолога. Поэтому важно, имея животное определенной породы (генетически склонной к развитию патологии сердца), при начальном возникновении каких-либо симптомов, ранее не известных владельцу, а также в качестве диспансеризации здорового животного провести полное кардиообследование.
В современной ветеринарной кардиологии уже известны некоторые породы животных, у которых есть вероятность развития генетически наследуемой патологии сердца. Ее можно установить на ранних сроках развития (в разном возрасте у собак и кошек) и задержать развитие, с помощью терапии, иногда на несколько лет!
Ниже приведены породы собак и кошек, которых желательно показать кардиологу:
Наиболее распространенные породы собак в нашей полосе: доберманы, доги, кинг чарльз спаниель, спрингер-спаниели, боксеры, ирландские сеттеры, немецкие овчарки, ирландские волкодавы, йоркширские терьеры, черные терьеры, чи хуа хуа, пинчеры, таксы и др.
Наиболее распространенные в нашей полосе породы кошек: сфинксы, британские, шотландские, девон-рексы, корниш-рексы, мейнкуны и др.
В кардиологическое обследование входит: полный осмотр животного, эхокардиографическое исследование (ЭХОКГ) с доплерографией (более детальное исследование потоков крови в сосудах и камерах сердца), электрокардиографическое исследование (ЭКГ), а также при необходимости рентгенографическое исследование грудной полости собаки и кошки.
В нашей ветклинике вы сможете все это сделать, уточнив график работы кардиологов.
Приходите к нам прием с профилактической целью. Болезнь легче предупредить, чем потом её лечить.
Берегите ваших четвероногих друзей, и они ответят вам любовью.
Ветеринарная клиника «Бемби»
Ветеринарный врач визуальной
диагностики, кардиолог.
Блинова Елена Владимировна
Вы можете задать свои вопросы специалисту на форуме
Острый коронарный синдром Информация | Гора Синай
Амстердам Э.А., Венгер Н.К., Бриндис Р.Г. и др. Руководство AHA / ACC от 2014 г. по ведению пациентов с острыми коронарными синдромами без подъема сегмента ST: отчет Целевой группы Американского колледжа кардиологов / Американской кардиологической ассоциации по практическим рекомендациям. Джам Колл Кардиол . 2014; 64 (24): e139-e228. PMID: 25260718 pubmed.ncbi.nlm.nih. gov/25260718/.
gov/25260718/.
Богула Е.А., Морроу Д.А.Инфаркт миокарда с подъемом сегмента ST: ведение. В: Zipes DP, Libby P, Bonow RO, Mann DL, Tomaselli GF, Braunwald E, ред. Болезнь Браунвальда: Учебник сердечно-сосудистой медицины . 11 изд. Филадельфия, Пенсильвания: Эльзевьер; 2019: глава 59.
Eckel RH, Jakicic JM, Ard JD, et al. Руководство AHA / ACC 2013 г. по управлению образом жизни для снижения риска сердечно-сосудистых заболеваний: отчет Рабочей группы Американского колледжа кардиологов / Американской кардиологической ассоциации по практическим рекомендациям. Тираж .2014; 129 (25 Приложение 2): S76-S99. PMID: 24222015 pubmed.ncbi.nlm.nih.gov/24222015/.
Джульяно Р.П., Браунвальд Э. Острые коронарные синдромы без подъема сегмента ST. В: Zipes DP, Libby P, Bonow RO, Mann DL, Tomaselli GF, Braunwald E, ред. Болезнь Браунвальда: Учебник сердечно-сосудистой медицины . 11 изд. Филадельфия, Пенсильвания: Эльзевьер; 2019: глава 60.
О’Гара П. Т., Кушнер Ф.Г., Ашейм Д.Д. и др. Руководство ACCF / AHA 2013 г. по ведению инфаркта миокарда с подъемом сегмента ST: краткое содержание: отчет Фонда Американского колледжа кардиологов / Целевой группы Американской кардиологической ассоциации по практическим рекомендациям. Тираж . 2013; 127 (4): 529-555. PMID: 23247303 pubmed.ncbi.nlm.nih.gov/23247303/.
Т., Кушнер Ф.Г., Ашейм Д.Д. и др. Руководство ACCF / AHA 2013 г. по ведению инфаркта миокарда с подъемом сегмента ST: краткое содержание: отчет Фонда Американского колледжа кардиологов / Целевой группы Американской кардиологической ассоциации по практическим рекомендациям. Тираж . 2013; 127 (4): 529-555. PMID: 23247303 pubmed.ncbi.nlm.nih.gov/23247303/.
Scirica BM, Libby P, Morrow DA. Инфаркт миокарда с подъемом сегмента ST: патофизиология и клиническая эволюция. В: Zipes DP, Libby P, Bonow RO, Mann DL, Tomaselli GF, Braunwald E, ред. Болезнь Браунвальда: Учебник сердечно-сосудистой медицины . 11 изд. Филадельфия, Пенсильвания: Эльзевьер; 2019: глава 58.
Smith SC Jr, Benjamin EJ, Bonow RO и др. Вторичная профилактика AHA / ACCF и терапия для снижения риска для пациентов с коронарной болезнью и другими атеросклеротическими сосудистыми заболеваниями: обновление 2011 г .: рекомендации Американской кардиологической ассоциации и Фонда Американского колледжа кардиологов. Тираж . 2011; 124 (22): 2458-2473. PMID: 22052934 pubmed.ncbi.nlm.nih.gov/22052934/.
Тираж . 2011; 124 (22): 2458-2473. PMID: 22052934 pubmed.ncbi.nlm.nih.gov/22052934/.
Последнее обновление: 07.07.2020
Рецензент: Томас С. Меткус, доктор медицины, доцент кафедры медицины и хирургии, Медицинский факультет Университета Джона Хопкинса, Балтимор, доктор медицины. Также проверены Дэвидом Зивом, доктором медицины, MHA, медицинским директором, Брендой Конавей, редакционным директором, и A.D.A.M. Редакционная коллегия.
Острый коронарный синдром | Доктор
Острый коронарный синдром (ОКС) требует неотложной медицинской помощи и требует немедленной госпитализации. ACS в настоящее время классифицируется в основном на основании данных ЭКГ при поступлении и результатов серийных уровней сердечного тропонина [1] . ОКС относится к ряду острых ишемических состояний миокарда, которые включают [2] :
- ОКС с подъемом сегмента ST (ОКС с подъемом сегмента ST): пациенты с острой болью в груди и стойким (> 20 минут) подъемом сегмента ST.
 У большинства этих пациентов разовьется инфаркт миокарда с подъемом сегмента ST (ИМпST).
У большинства этих пациентов разовьется инфаркт миокарда с подъемом сегмента ST (ИМпST). - ОКС без подъема сегмента ST (ОКС без подъема сегмента ST): пациенты жалуются на острую боль в груди, но без стойкого подъема сегмента ST. ЭКГ показывает стойкую или преходящую депрессию сегмента ST или инверсию зубца T, плоские зубцы T, псевдонормализацию зубцов T или отсутствие изменений на ЭКГ при предъявлении. NSTE-ACS подразделяется на:
- Нестабильная стенокардия: нормальный уровень тропонина.
- Инфаркт миокарда без подъема сегмента ST (ИМбпST): повышение уровня тропонина.
Эта статья в основном касается нестабильной стенокардии и ИМбпST. ИМпST обсуждается в отдельных статьях «Острый инфаркт миокарда», «Ведение острого инфаркта миокарда», «Осложнения острого инфаркта миокарда» и «Задний инфаркт миокарда». Также есть отдельная статья «Стабильная стенокардия».
Эпидемиология
См. Также отдельную статью «Эпидемиология коронарной болезни сердца».
- Диагноз ИМбпST сложнее установить, чем ИМпST, и поэтому его распространенность труднее оценить [2] .
- В 2014/2015 гг. Национальный регистр Великобритании зарегистрировал 83 842 госпитализации в больницы NHS в Англии и Уэльсе, Северной Ирландии и на острове Мэн с острым инфарктом миокарда. Из них ИМпST и ИМпST составили 40,5% и 59,5% соответственно. Эти пропорции не изменились за предыдущие пять лет [3] .
- Ишемическая болезнь сердца — самая частая причина смерти в Великобритании, а также основная причина преждевременной смертности. [4] .
Факторы риска
- Немодифицируемые факторы риска атеросклероза: возраст, мужской пол, преждевременная ишемическая болезнь сердца в семейном анамнезе, преждевременная менопауза.
- Модифицируемые факторы риска атеросклероза: курение, сахарный диабет (и нарушение толерантности к глюкозе), гипертония, дислипидемия (повышенный уровень холестерина липопротеинов низкой плотности (ЛПНП), пониженный уровень холестерина липопротеинов высокой плотности (ЛПВП)), ожирение, гиподинамия.

- Рассмотреть неатеросклеротические причины у более молодых пациентов или при отсутствии признаков атеросклероза: коронарная эмболия из таких источников, как инфицированный сердечный клапан, коронарная окклюзия, вызванная васкулитом, спазм коронарной артерии, употребление кокаина, врожденные коронарные аномалии, коронарная травма, повышенная потребность в кислороде (например, гипертиреоз) или снижение доставки кислорода (например, тяжелая анемия).
Презентация
- Нестабильная стенокардия и ИМбпST могут быть неотличимы, а также неотличимы от острого ИМпST. NSTE-ACS может проявляться различными способами, включая [2] :
- Продолжительную (более 20 минут) ангинозную боль в покое.
- Новообразованная стенокардия с ограничением повседневной активности.
- Недавняя дестабилизация ранее стабильной стенокардии с умеренным или сильным ограничением повседневной активности.
- Стенокардия после инфаркта миокарда.
- Боль в груди может быть связана с потоотделением, тошнотой, рвотой, утомляемостью, одышкой и сердцебиением.

- Некоторые пациенты, особенно пожилые люди и пациенты с диабетом, могут не испытывать боли в груди. Пациенты из некоторых этнических групп также могут иметь атипичные боли.
- Физикальное обследование направлено на оценку сердечной функции и стабильности кровообращения, а также на исключение важных дифференциальных диагнозов.
Оценка возможного острого коронарного синдрома
[5]
См. Также отдельную статью о боли в груди сердечного типа, присутствующей в первичной медицинской помощи.
- Рассмотрите анамнез боли, любые факторы риска сердечно-сосудистых заболеваний, историю ишемической болезни сердца и любое предыдущее лечение, а также предыдущие исследования боли в груди.
- Симптомы, которые могут указывать на ОКС, включают:
- Боль в груди и / или других областях (например, в руках, спине или челюсти) продолжительностью более 15 минут.
- Боль в груди с тошнотой и рвотой, выраженным потоотделением и / или одышкой или гемодинамической нестабильностью.

- Новое начало боли в груди или резкое ухудшение стабильной стенокардии с повторяющейся болью, часто возникающей при незначительной физической нагрузке или без нее и часто продолжающейся более 15 минут.
- Реакция на тринитрат глицерина (GTN) не должна использоваться для постановки диагноза, а симптомы не следует оценивать по-разному у мужчин и женщин или среди разных этнических групп.
Дифференциальный диагноз
См. Также отдельную статью о боли в груди.
Исследования
Важно исключить инфаркт миокарда с подъемом сегмента ST, при котором показан немедленный тромболизис.
- ЭКГ в 12 отведениях:
- Для подтверждения сердечной основы для представления и может показать уже существующую структурную или ишемическую болезнь сердца (например, гипертрофию левого желудочка, зубцы Q).
- Нормальная или неизмененная ЭКГ не исключает возможности того, что боль в груди имеет ишемическую природу.
- Изменения, которые могут наблюдаться во время приступов стенокардии, включают преходящее повышение сегмента ST (фиксированные изменения предполагают острый инфаркт).

- При нестабильной стенокардии (и инфаркте без зубца Q) ЭКГ обычно показывает инверсию зубца Т или депрессию сегмента ST; однако ЭКГ может быть нормальной, если с момента последнего приступа боли прошло некоторое время.
- Сердечные ферменты:
- В течение первых шести часов чувствительность тропонинов выше, чем у CK-MB для выявления инфаркта миокарда.
- Тропонины I и T обнаруживаются в сыворотке крови через 3–6 часов после инфаркта, достигают пика через 12–24 часа и остаются повышенными до 14 дней.
- Поэтому тропонины обычно исследуют через шесть и 12 часов после появления боли.
- У пациентов с нестабильной стенокардией небольшое повышение тропонина может идентифицировать пациентов с риском последующих сердечных событий и смерти. Повышенный уровень тропонина указывает на повышенный риск смерти как в краткосрочной, так и в долгосрочной перспективе. Пациенты с болью в груди и повышенным уровнем тропонина должны оставаться в больнице для дальнейшего обследования, включая стационарную коронарную ангиограмму.

- Предложите немедленную коронарную ангиографию пациентам с нестабильной стенокардией или ИМбпST, если их клиническое состояние нестабильно.
- FBC может быть полезен у пациентов с подозрением на анемию и в качестве исходного уровня с точки зрения использования антикоагулянтов; уровень глюкозы в крови, функция почек и электролиты, а также TFT. СРБ как маркер острого воспаления.
- Уровень глюкозы в крови: гипергликемия часто встречается у людей, госпитализированных с ОКС. Гипергликемия во время госпитализации с ОКС является мощным предиктором снижения выживаемости и повышенного риска осложнений во время пребывания в больнице, независимо от того, страдает ли пациент диабетом [6] .
- Эхокардиография часто демонстрирует аномалии движения стенок из-за ишемии. Может быть полезно для выявления факторов, вызывающих ишемию, например гипертрофию желудочков и порок клапанов.
- CXR может показать осложнения ишемии (например, отек легких) или изучить альтернативные диагнозы — например, пневмоторакс, аневризму аорты.

- Кардиомагнитно-резонансная томография (CMR) может быть полезна для оценки функции и перфузии, а также для обнаружения рубцовой ткани. CMR также может быть полезен для исключения или выявления ACS, оценки жизнеспособности миокарда и выявления миокардита [2] .
- Коронарная ангиография дает информацию о наличии и степени тяжести ишемической болезни сердца и, следовательно, остается золотым стандартом [2] .
Оценка риска
[6]
Как только будет поставлен диагноз нестабильная стенокардия или ИМбпST и будет предложена терапия аспирином и антитромбином, следует оценить индивидуальный риск будущих неблагоприятных сердечно-сосудистых событий с использованием установленной системы оценки риска, которая включает прогнозирует шестимесячную смертность.Риск определяется как:
- Низкий: до 3%.
- Промежуточное: от 3% до 6%.
- Высокая: более 6%.
Национальный институт здравоохранения и передового опыта (NICE) рекомендует Глобальный регистр острых сердечных событий (GRACE) с оценкой риска [7] .
Шкала риска тромболизиса при инфаркте миокарда (TIMI) — еще один метод, используемый для оценки риска у пациентов с ACS [8] . Другие оценки риска могут быть потенциально полезными [9] .
Факторы, которые следует использовать при оценке риска с помощью установленной системы баллов, включают:
- Полный клинический анамнез, включая возраст, перенесенный инфаркт миокарда, предыдущее чрескожное коронарное вмешательство (ЧКВ) или коронарное шунтирование (АКШ).
- Физикальное обследование, включая кровяное давление и частоту сердечных сокращений.
- ЭКГ покоя в 12 отведениях.
- Анализы крови (например, тропонин I или Т, креатинин, глюкоза и гемоглобин).
Риск кровотечения, а также соответствующую сопутствующую патологию следует оценивать до рассмотрения лечения и на каждом этапе ведения.Факторы, связанные с высоким риском кровотечения, включают пожилой возраст, известные кровотечения, почечную недостаточность и низкую массу тела.
Управление
[6]
Лечение включает антитромботическое лечение, а также коронарную ангиографию с последующей реваскуляризацией, если это необходимо. Лечение пациентов с ОКСбпST направлено на облегчение боли и беспокойства, предотвращение рецидивов ишемии и предотвращение или ограничение прогрессирования острого инфаркта миокарда [1] .
- По сравнению с консервативной стратегией, инвазивная стратегия (ЧКВ или АКШ) связана со снижением частоты рефрактерной стенокардии и повторной госпитализации в краткосрочной перспективе и инфаркта миокарда в долгосрочной перспективе. Инвазивная стратегия связана с удвоением риска сердечного приступа, связанного с процедурой, и повышенным риском кровотечения и утечки процедурных биомаркеров [10] .
- Имеющиеся данные свидетельствуют о том, что инвазивная стратегия может быть особенно полезной у пациентов с высоким риском повторных событий [10] .
- У пациентов из группы низкого риска рассмотрите возможность консервативного лечения без ранней коронарной ангиографии для людей с нестабильной стенокардией или ИМбпST, которые имеют низкий риск неблагоприятных сердечно-сосудистых событий (прогнозируемая шестимесячная смертность 3,0% или менее).

Немедленное ведение подозреваемого в ACS
[5]
- Организовать экстренную госпитализацию (телефон 999/112/911).
- Реанимация по мере необходимости.
- Обезболивание: GTN и / или опиоид для внутривенного введения (используйте противорвотное средство с опиоидами).
- Однократная ударная доза аспирина 300 мг, если у человека нет аллергии.
- ЭКГ в 12 отведениях в покое — но не откладывайте перевод в больницу.
- Оцените сатурацию кислородом с помощью пульсоксиметрии, если возможно, перед госпитализацией. Дайте кислород, если сатурация кислорода (SpO 2 ) менее 94% без риска гиперкапнической дыхательной недостаточности; стремитесь к SpO 2 от 94-98% (стремитесь к 88-92% для людей с хронической обструктивной болезнью легких).
- Антиагрегантная и антикоагулянтная терапия:
- При наличии ишемических изменений ЭКГ или повышения сердечного тропонина пациентам с ОКС следует немедленно лечить аспирин (ударная доза 300 мг) и тикагрелор (ударная доза 180 мг) [4] .

- Не предлагайте двойную антитромбоцитарную терапию пациентам с болью в груди до постановки диагноза нестабильная стенокардия или ИМбпST.
- Рассмотреть возможность монотерапии клопидогрелем у пациентов с гиперчувствительностью к аспирину.
- Рассмотрите возможность применения клопидогрела для пациентов с нестабильной стенокардией или ИМбпST как часть двойной антитромбоцитарной терапии с аспирином, если у них есть отдельное показание для продолжающейся пероральной антикоагуляции. Эту комбинацию можно использовать до 12 месяцев. Продолжение тройной терапии (клопидогрель плюс аспирин плюс антикоагулянт) более 12 месяцев значительно увеличивает риск кровотечения.
- Прасугрел в комбинации с аспирином рекомендован NICE в качестве альтернативы для предотвращения атеротромботических событий у взрослых с ОКС с первичной или отсроченной PCI [11] .
- Тикагрелор в сочетании с низкими дозами аспирина рекомендуется на срок до 12 месяцев в качестве варианта лечения у взрослых с ОКС с [4, 12] :
- ИМпST, который кардиологи намерены лечить с помощью первичного ЧКВ; или
- NSTEMI; или
- Поступление в стационар с нестабильной стенокардией.

- Ингибиторы гликопротеина IIb / IIIa следует рассматривать в качестве дополнения к ЧКВ для пациентов с промежуточным или высоким риском, которые еще не получают ингибитор гликопротеина (GPI).
- Антитромбиновая терапия: антикоагулянты используются при лечении NSTE-ACS для подавления образования и / или активности тромбина, тем самым уменьшая количество тромбозависимых явлений [2] :
- Предлагайте фондапаринукс пациентам без высокого риска кровотечения, если только ангиография не помогает. планируется в течение 24 часов с момента поступления.Предложите нефракционированный гепарин в качестве альтернативы фондапаринуксу, если ангиография вероятна в течение 24 часов после госпитализации.
- Тщательно продумайте выбор и дозу антитромбина у пациентов с высоким риском кровотечения.
- Рассмотрите вариант нефракционированного гепарина с дозой, скорректированной с учетом функции свертывания, для пациентов с креатинином выше 265 мкмоль / л.

- Предложите системный нефракционированный гепарин (50-100 единиц / кг) в лаборатории сердечного катетера пациентам, принимающим фондапаринукс, которые подвергаются ЧКВ.
- В качестве альтернативы комбинации гепарина и GPI рассмотрите возможность применения бивалирудина для пациентов с промежуточным или более высоким риском, которые еще не получают GPI или фондапаринукс и которым назначена ангиография в течение 24 часов после госпитализации.
- В качестве альтернативы комбинации гепарина и GPI рассмотрите возможность применения бивалирудина для пациентов, подвергающихся ЧКВ, которые относятся к группе среднего или высокого риска и еще не получают GPI или фондапаринукс.
- При наличии ишемических изменений ЭКГ или повышения сердечного тропонина пациентам с ОКС следует немедленно лечить аспирин (ударная доза 300 мг) и тикагрелор (ударная доза 180 мг) [4] .
- Реваскуляризация:
- Рассмотрите возможность проведения коронарной ангиографии (с последующим ЧКВ, если показано) в течение 72 часов после первой госпитализации для людей с нестабильной стенокардией или ИМбпST, которые имеют средний или более высокий риск неблагоприятных сердечно-сосудистых событий (прогнозируется шесть Смертность в месяц выше 3.
 0%) и отсутствие противопоказаний к ангиографии (например, активное кровотечение или сопутствующие заболевания). Следует учитывать риски и преимущества раннего вмешательства. NICE предлагает подробные советы по этому поводу.
0%) и отсутствие противопоказаний к ангиографии (например, активное кровотечение или сопутствующие заболевания). Следует учитывать риски и преимущества раннего вмешательства. NICE предлагает подробные советы по этому поводу. - Коронарная ангиография (с последующим ЧКВ, если показано) должна рассматриваться для людей с нестабильной стенокардией или ИМбпST, которые изначально оцениваются как имеющие низкий риск неблагоприятных сердечно-сосудистых событий (прогнозируемая шестимесячная смертность 3,0% или меньше), если имеется ишемия. впоследствии испытанный или продемонстрированный тестом на ишемию.
- Молодые люди с низкими показателями риска смертности в течение шести месяцев могут по-прежнему подвергаться риску сердечно-сосудистых событий и могут получить пользу от ранней ангиографии.
- Если рассматривается возможность стентирования, пациентам с ОКСбпST следует предложить стент с лекарственным покрытием.
- Доля пациентов с ОКСбпST, перенесших операцию АКШ во время первичной госпитализации, составляет около 10%.
 Польза от операции шунтирования наиболее велика, когда пациентов можно прооперировать после нескольких дней медицинской стабилизации, в зависимости от индивидуального риска [2] .
Польза от операции шунтирования наиболее велика, когда пациентов можно прооперировать после нескольких дней медицинской стабилизации, в зависимости от индивидуального риска [2] . - Людям, у которых ранее был инфаркт миокарда, но не проводилась реваскуляризация, подумайте, уместна ли сейчас реваскуляризация с учетом сопутствующих заболеваний.
- Другие методы лечения:
- Нитраты (сублингвальные, пероральные или внутривенные): при продолжающейся боли в ожидании более окончательных процедур и могут преодолеть наложенный спазм коронарной артерии.
- Бета-блокаторы улучшают результат и могут снизить серьезность и частоту атак. Если не выявлено снижение фракции левого желудочка, рассмотрите возможность продолжения приема бета-адреноблокаторов в течение 12 месяцев после инфаркта миокарда.Нет убедительных доказательств в поддержку продолжения приема бета-блокаторов после 12 месяцев, и на этом этапе следует обсудить с пациентом риски, преимущества и побочные эффекты.

- Используются антагонисты кальция (например, дилтиазем, верапамил) для пациентов, которые не переносят бета-адреноблокаторы, без застойных явлений в легких или снижения фракции выброса левого желудочка.
- Блокаторы кальциевых каналов могут использоваться у людей, состояние которых стабильно после инфаркта миокарда, для лечения гипертонии и / или стенокардии.Людям с сердечной недостаточностью и сниженной фракцией выброса следует применять амлодипин и избегать верапамила, дилтиазема и дигидропиридиновых препаратов короткого действия.
- Ингибиторы ангиотензин-превращающего фермента (АПФ) снижают смертность, и их следует начинать, когда пациент находится в стационаре, если нет противопоказаний.
- Кокрановский обзор показал, что начало терапии статинами в течение 14 дней после ОКС не снижает смертность, инфаркт миокарда или инсульт до четырех месяцев; тем не менее, это снижает частоту возникновения нестабильной стенокардии через четыре месяца после ACS [13] .

- Гипергликемия [6] :
- Гипергликемию у пациентов, поступающих в больницу с ОКС, следует лечить, поддерживая уровень глюкозы в крови ниже 11,0 ммоль / л, избегая при этом гипогликемии. Следует рассмотреть возможность инфузии инсулина с коррекцией дозы с регулярным контролем уровня глюкозы в крови.
- Все пациенты с гипергликемией после ОКС и без известного диабета должны быть проверены на уровень HbA1c перед выпиской и уровень глюкозы в крови натощак не ранее, чем через четыре дня после начала ОКС.
- После стабилизации следует принять вторичные меры по снижению риска. Эти меры включают отказ от курения, продолжение терапии аспирином, лечение гипертонии, если таковая имеется, статины, ингибиторы АПФ и бета-блокаторы [14] . Если состояние пациента стабилизировалось с помощью медикаментозного лечения, вполне вероятно, что он будет проходить тестирование с физической нагрузкой на беговой дорожке.
Дальнейшее лечение
- Для выявления и количественной оценки индуцируемой ишемии рассмотрите возможность тестирования на ишемию перед выпиской пациентов, состояние которых лечилось консервативно и которым не проводилась коронарография.

- Оценить функцию левого желудочка у всех пациентов, перенесших инфаркт миокарда, и рассмотреть возможность оценки функции левого желудочка у всех пациентов с нестабильной стенокардией.
- Кардиологическая реабилитация: реабилитация и планирование выписки.
- Вторичная профилактика: управление факторами риска сердечно-сосудистых заболеваний с изменением образа жизни и лекарственной терапией по показаниям.
Осложнения
Прогноз
Люди с ОКСбпST имеют высокую частоту рецидивов ишемии миокарда, долгосрочный исход такой же, как у пациентов с ИМпST, и худший исход, чем у людей с нестабильной стенокардией [6] .
Смерть в стационаре и повторный инфаркт поражают 5-10% пациентов. Несмотря на оптимальное лечение противоишемическими и антитромботическими препаратами, смерть и повторный инфаркт миокарда наступают еще у 5-10% пациентов в течение месяца после острого приступа. Факторы, связанные с худшим прогнозом, включают [6] :
- Пожилой возраст.

- Наличие и выраженность изменений ЭКГ при ишемии.
- Величина повышения биомаркеров повреждения миокарда (например, сывороточного тропонина).
- Дисфункция левого желудочка, кардиогенный шок.
- Учащение пульса, аритмии (фибрилляция желудочков, фибрилляция предсердий).
- Почечная недостаточность.
- Сахарный диабет.
- Анемия.
- Цереброваскулярная болезнь, заболевание периферических артерий.
Любая задержка с организацией ангиографии для пациентов из группы высокого риска связана с повышенной смертностью и неблагоприятными исходами [15] .
Профилактика
Первичная профилактика сердечно-сосудистых заболеваний и оценка риска сердечно-сосудистых заболеваний:
- Отказ от курения.
- Диета и советы по упражнениям.
- Артериальное давление, гиперлипидемия и контроль диабета.
- Соблюдение приема лекарств, в частности аспирина.
- Комплексная оценка риска, включая тест на толерантность к физической нагрузке для лиц из группы высокого риска и выявление структурных заболеваний сердца (например, гипертрофия левого желудочка, стеноз аорты).

диагностика сердечного приступа — NHS
Если есть подозрение на сердечный приступ, вас следует немедленно госпитализировать.Обычно вас госпитализируют в отделение неотложной кардиологической помощи (ACCU) или непосредственно в отделение катетеризации сердца, чтобы подтвердить диагноз и начать лечение.
Электрокардиограмма
Электрокардиограмма (ЭКГ) — важный тест при подозрении на сердечный приступ. Это необходимо сделать в течение 10 минут после поступления в больницу.
ЭКГ измеряет электрическую активность вашего сердца. Каждый раз, когда ваше сердце бьется, оно производит крошечные электрические импульсы.Аппарат ЭКГ записывает эти сигналы на бумагу, позволяя врачу видеть, насколько хорошо работает ваше сердце.
ЭКГ безболезненна и занимает около 5 минут. Во время теста к вашим рукам, ногам и груди прикрепляют плоские металлические диски (электроды). Провода от электродов подключаются к аппарату ЭКГ, который регистрирует электрические импульсы.
Провода от электродов подключаются к аппарату ЭКГ, который регистрирует электрические импульсы.
ЭКГ важна, потому что:
- помогает подтвердить диагноз сердечного приступа
- помогает определить, какой у вас инфаркт, и определить наиболее эффективное лечение.
Виды инфаркта
Сердечные приступы можно классифицировать по измерению ЭКГ, известному как сегмент ST.Это соответствует области повреждения сердца.
Острый коронарный синдром
Инфаркт — это форма острого коронарного синдрома (ОКС), при которой происходит значительная закупорка коронарных артерий.
К 3 основным типам СКУД относятся:
- Инфаркт миокарда с подъемом сегмента ST (ИМпST)
- Инфаркт миокарда без подъема сегмента ST (ИМбпST)
- Стенокардия нестабильная
Инфаркт миокарда с подъемом сегмента ST (ИМпST)
ИМпST — это самый серьезный тип сердечного приступа, при котором наблюдается длительное нарушение кровоснабжения. Это вызвано полной закупоркой коронарной артерии, которая может вызвать обширное повреждение большой области сердца. ИМпST — это то, о чем думает большинство людей, когда слышат термин «сердечный приступ».
Это вызвано полной закупоркой коронарной артерии, которая может вызвать обширное повреждение большой области сердца. ИМпST — это то, о чем думает большинство людей, когда слышат термин «сердечный приступ».
Инфаркт миокарда без подъема сегмента ST (ИМбпST)
ИМбпST может быть менее серьезным, чем ИМпST, потому что приток крови к сердцу может быть только частично, а не полностью заблокирован. В результате может быть поврежден меньший участок сердца. Тем не менее, ИМпST по-прежнему считается серьезной неотложной медицинской помощью.Без лечения он может прогрессировать до серьезного повреждения сердца или ИМпST.
Нестабильная стенокардия
Нестабильная стенокардия — наименее серьезный тип ОКС. Однако, как и ИМбпST, это все еще требует неотложной медицинской помощи, поскольку оно также может прогрессировать до серьезного повреждения сердца или ИМпST. При нестабильной стенокардии кровоснабжение сердца все еще серьезно ограничено, но необратимого повреждения нет, поэтому сердечная мышца сохраняется.
Прочие испытания
Другие тесты могут использоваться для оценки состояния вашего сердца и выявления связанных с ним осложнений.Однако, поскольку сердечные приступы являются неотложной медицинской помощью, некоторые из этих анализов обычно проводятся после того, как ваше первоначальное лечение началось и ваше состояние стабилизировалось.
Анализы крови
При повреждении сердца в результате сердечного приступа определенные белки медленно попадают в кровь. Ферменты — это особые белки, которые помогают регулировать химические реакции, происходящие в вашем теле.
Если врачи подозревают, что у вас есть подозрение на сердечный приступ, у вас будет взят образец крови, чтобы его можно было проверить на эти сердечные белки (известные как сердечные маркеры).
Самый распространенный метод измерения белка — это сердечный тропонин. Ваш уровень тропонина будет измеряться с помощью серии анализов крови, сделанных в течение нескольких дней.
Это позволит оценить повреждение вашего сердца, а также поможет определить, насколько хорошо вы реагируете на лечение.
Рентген грудной клетки
Рентген грудной клетки может быть полезен, если диагноз сердечного приступа неясен и есть другие возможные причины ваших симптомов, например, воздушный карман между слоями легких (пневмоторакс).
Рентген грудной клетки также можно использовать, чтобы проверить, не возникли ли осложнения из-за сердечного приступа, например, скопление жидкости в легких (отек легких).
Эхокардиограмма
Эхокардиограмма — это вид сканирования, при котором используются звуковые волны для построения изображения внутренней части вашего сердца.
Это может быть полезно, чтобы точно определить, какие области сердца были повреждены и как это повреждение повлияло на работу вашего сердца.
Коронарная ангиография
Коронарная ангиография может помочь определить, есть ли закупорка или сужение коронарных артерий, и, если да, определить точное место закупорки или сужения.
Тест включает введение тонкой трубки (катетера) в один из кровеносных сосудов в паху или руке. Катетер вводят в коронарные артерии с помощью рентгеновских лучей.
Через катетер прокачивается специальная жидкость, называемая контрастным веществом. Эту жидкость можно увидеть на рентгеновских снимках, и изучение того, как она течет вокруг и через ваше сердце, может помочь найти место закупорки или сужения. Это помогает врачу, специализирующемуся на сердечных заболеваниях (кардиологу), выбрать лучшее лечение для вас.
Узнайте больше о лечении сердечного приступа.
Последняя проверка страницы: 28 ноября 2019 г.
Срок следующего рассмотрения: 28 ноября 2022 г.
Острый коронарный синдром — AMBOSS
Резюме
Острый коронарный синдром (ОКС) — это клиническое проявление инфаркта миокарда и обычно рабочий диагноз по умолчанию у пациентов с впервые возникшей болью в груди, предположительно имеющей ишемическое происхождение сердца. Клинические данные (например,, начало и характеристики боли, история болезни) в сочетании с ЭКГ и тропонином являются основой диагностики. На основании результатов ЭКГ пациенты делятся на пациентов с подъемом сегмента ST (ОКС с подъемом сегмента ST) или ОКС без подъема сегмента ST (ОКС без подъема сегмента ST). В зависимости от уровней сердечного тропонина (cTn) в сыворотке, NSTE-ACS можно разделить на NSTEMI или нестабильную стенокардию (UA). Пациентам с STE-ACS требуется немедленная реваскуляризационная терапия. Время и необходимость реваскуляризационной терапии при ОКСбпST определяется на основании множества факторов риска.Все пациенты с ОКС получают двойную антитромбоцитарную терапию и исходную антикоагулянтную терапию. Дополнительная терапия (например, бета-адреноблокаторы, кислород) помогает уменьшить симптомы и может иметь положительное влияние на смертность.
Клинические данные (например,, начало и характеристики боли, история болезни) в сочетании с ЭКГ и тропонином являются основой диагностики. На основании результатов ЭКГ пациенты делятся на пациентов с подъемом сегмента ST (ОКС с подъемом сегмента ST) или ОКС без подъема сегмента ST (ОКС без подъема сегмента ST). В зависимости от уровней сердечного тропонина (cTn) в сыворотке, NSTE-ACS можно разделить на NSTEMI или нестабильную стенокардию (UA). Пациентам с STE-ACS требуется немедленная реваскуляризационная терапия. Время и необходимость реваскуляризационной терапии при ОКСбпST определяется на основании множества факторов риска.Все пациенты с ОКС получают двойную антитромбоцитарную терапию и исходную антикоагулянтную терапию. Дополнительная терапия (например, бета-адреноблокаторы, кислород) помогает уменьшить симптомы и может иметь положительное влияние на смертность.
Эта статья касается первичного ведения пациентов с ОКС. См. «Инфаркт миокарда» для более подробной информации, например, о гистопатологии и долгосрочном лечении.
Определение
- Острый коронарный синдром (ОКС): подозрение или подтвержденное наличие острой ишемии миокарда [1] [2]
- Острый коронарный синдром можно разделить на следующие категории:
- См. «Миокард» инфаркт »для получения дополнительных определений.
Обзор
| Обзор острого коронарного синдрома (ACS) [1] [2] | |||
|---|---|---|---|
| NSTE-ACS | STE-ACS | ||
| Нестабильная стенокардия (UA) | |||
| Инфаркт миокарда без подъема сегмента ST (ИМбпST) | Инфаркт миокарда с подъемом сегмента ST (ИМпST) | ||
| Описание | |||
Клинические проявления не воспроизводятся
 | |||
| Патофизиология |
| ||
| Сердечный тропонин | |||
| Результаты ЭКГ | Лечение | ||
Подтипы ACS не могут быть дифференцированы только на основании клинических проявлений.
Клинические особенности
- Классическая презентация [4] [5]
- Острая загрудинная боль в груди
- Типичное: затупление, давление сжатия и / или герметичность
- Обычно иррадиирует в левую часть грудной клетки, руки, плеча, шеи, челюсти и / или эпигастрия.
- Осаждается при физической нагрузке или стрессе.
- Облегчение симптомов после введения нитратов не является диагностическим критерием сердечной ишемии. [2]
- Пиковое время наступления обычно приходится на утро.
- См. Также «Стенокардия».
- Одышка (особенно при физической нагрузке)
- Бледность
- Тошнота, рвота
- Потоотделение, беспокойство
- Головокружение, дурнота, обморок
- Острая загрудинная боль в груди
- Прочие выводы
- Атипичные проявления: чаще у пожилых людей, лиц с диабетом и женщин [2] [6]
- Чаще встречается при инфаркте нижней стенки
Традиционно считалось, что ИМпST проявляется более серьезными симптомами, чем ИМбпST, но это не всегда так.
Диагностика
Подход
[1] [2] [6] [7]
- ЭКГ: следует проводить сразу же после подозрения на ОКС или при проведении дифференциальной диагностики.
- Уровни сердечного тропонина: Измерьте как можно скорее и повторите через 1–6 часов.
- Рассмотрите возможность прикроватной ТТЭ, если диагноз неясен.
Пациенты с подозрением на ОКС с подъемом сегмента ST должны быть немедленно обследованы для проведения реваскуляризационной терапии.
ЭКГ в 12 отведениях
[1] [2]
- Показан каждому пациенту с подозрением на ОКС (лучший начальный тест) в течение 10 минут с момента обращения [2]
- Результаты: всегда следует интерпретировать в контексте клинических данных и истории болезни
- Повторять каждые 15–30 минут в течение первого часа (особенно если первая ЭКГ неубедительна или симптомы повторяются или меняются в качестве)
- Сравнить с предыдущими ЭКГ (при наличии).

Результаты ЭКГ могут измениться в течение нескольких минут, а подъем сегмента ST может появиться или исчезнуть.
- Показания: назначать тропонин T / I каждому пациенту с подозрением на ACS [2] [8]
- Время
- По прибытии и через 1–6 часов
- Повторите, если появляются симптомы или изменения ЭКГ.
- Считайте повторение через 72 часа маркером размера инфаркта.
- Результаты: всегда следует интерпретировать в сочетании с клиническими данными.
TTE обычно не требуется и не следует откладывать реперфузионную терапию. Тем не менее, это исследование может быть полезным для пациентов с атипичными симптомами или если диагноз неясен.
- Показания включают:
- Результаты
Визуализация не должна задерживать лечение ОКС.
Стратификация риска
- Доступно несколько систем оценки для помощи в выявлении пациентов с низким уровнем риска, облегчения их решения (например, необходимость госпитализации в ОИТ) и определения времени проведения ЧКВ у пациентов с болью в груди.

- Инструменты стратификации риска не заменяют клиническую оценку.
- Не следует использовать у пациентов с подозрением на ИМпST.
Инструменты стратификации риска не подходят для лечения ИМпST; Пациенты с подозрением на ИМпST должны быть немедленно обследованы для реваскуляризации.
Оценка риска смерти при ACS по шкале GRACE
[2] [9] [10]
- На основе Глобального реестра острых коронарных событий (GRACE)
- Может использоваться для информирования руководства и решения (е.г., поступление в реанимацию, сроки вмешательства при ОКСбпST).
- Включает различные критерии для оценки риска смерти пациентов с ОКС, в том числе:
Оценка СЕРДЦА
[11]
| Оценка HEART для риска MACE [11] | ||
|---|---|---|
| Компонент | Характеристика | Очки |
| История | Немного подозрительно | 0 |
| Умеренно подозрительно | 1 | |
| Сильно подозрительно | 2 | |
| ЭКГ | ||
| Значительная депрессия ST | 2 | |
| Возраст | 0 | |
| 45–65 лет | 1 | |
| ≥ 65 лет | 2 | |
| Факторы риска | Нет | 0 |
| 1-2 | 1 | |
| ≥ 3 или наличие атеросклеротического заболевания в анамнезе | 2 | |
| Тропонин (начальный) [12] [13] | нормальный | 0 |
| 1-2 x верхний предел | 1 | |
| > 2 x верхний предел | 2 | |
Интерпретация
| ||
- Оценивает риск смерти, нового или повторного инфаркта миокарда или необходимости срочной реваскуляризации у пациентов с ОКСбпST
- Может помочь определить терапевтический режим и время реваскуляризации.

| Оценка TIMI для NSTE-ACS [16] | |
|---|---|
| Характеристики | Очки |
| Возраст ≥ 65 лет | 1 |
| 1 | |
| Известные ИБС (стеноз> 50%) | 1 |
| ≥ 2 эпизода тяжелой стенокардии за последние 24 часа | 1 |
| Использование ASA за последние 7 дней | 1 |
| Отклонение ST (≥ 0.5 мм) | 1 |
| Повышенные сердечные биомаркеры | 1 |
Интерпретация
| |
ИМпST
Пациентам с ИМпST требуется немедленная реваскуляризация, и их следует идентифицировать как можно скорее. ; Результаты ЭКГ могут меняться со временем и с колебаниями симптомов, поэтому не следует исключать диагноз ИМпST на основании одной ЭКГ. Чрескожное коронарное вмешательство (ЧКВ) в течение 90 минут после первого медицинского контакта (ЧМВ) является методом выбора. Альтернативой являются внутривенные фибринолитики, если ЧКВ невозможно провести в течение 120 минут и нет противопоказаний.
; Результаты ЭКГ могут меняться со временем и с колебаниями симптомов, поэтому не следует исключать диагноз ИМпST на основании одной ЭКГ. Чрескожное коронарное вмешательство (ЧКВ) в течение 90 минут после первого медицинского контакта (ЧМВ) является методом выбора. Альтернативой являются внутривенные фибринолитики, если ЧКВ невозможно провести в течение 120 минут и нет противопоказаний.
Изменения ЭКГ при ИМпST
Изменения ЭКГ при ИМпST
[1] [6] [8] [17]
- Определение: значительная элевация ST в двух смежных отведениях
- Конкретные критерии: высота измерена в точке J относительно начала зубца Q
- Во всех отведениях, кроме V 2 и V 3 : ≥ 1 мм (≥ 0.
 1 мВ)
1 мВ) - In V 2 и V 3 : зависит от пола и возраста пациента
- Мужчины: ≥ 2,5 мм (≥ 0,25 мВ)
- Мужчины ≥ 40 лет: ≥ 2,0 мм (≥ 0,2 мВ)
- Женщины любого возраста: ≥ 1,5 мм (≥ 0,15 мВ)
- Критерии действительны только при отсутствии гипертрофии левого желудочка и БЛНПГ.
- Во всех отведениях, кроме V 2 и V 3 : ≥ 1 мм (≥ 0.
- Дополнительные соображения
Любому пациенту с подъемом сегмента ST на ЭКГ требуется немедленная оценка для срочной реваскуляризации.Назначение других методов лечения не должно откладывать лечение.
Классический график изменений ЭКГ при ИМпST
- Острая стадия: продолжается повреждение миокарда
- Промежуточная стадия: некроз миокарда присутствует
- Отсутствие зубца R
- Инверсии зубца Т
- Патологические зубцы Q
- Продолжительность ≥ 0,04 секунды
- Амплитуда ≥ ¼ зубца R или ≥ 0,1 мВ
- Любой зубец Q в отведениях V1–3
- Хроническая стадия: постоянное рубцевание
- Стойкие, широкие и глубокие зубцы Q
- Часто неполное восстановление зубцов R
- Постоянная инверсия зубцов T.

Последовательность ЭКГ изменяется от нескольких часов до дней: острейший зубец T → элевация ST → патологический зубец Q → инверсия зубца T → нормализация ST → нормализация зубца T
Эквивалентные данные ЭКГ с ИМпST
[1] [6] [17]
Наличие любого из следующих результатов требует немедленной оценки для реваскуляризационной терапии (т. Е. Ведение такое же, как и при ИМпST).
Модифицированные критерии Сгарбосса для подозрения на ИМпST у пациентов с БЛНПГ
[6] [21] [22]
- Могут помочь оценить необходимость экстренной реваскуляризации у пациентов с ОКС и БЛНПГ.

- Критерии также могут использоваться при стимуляции правого желудочка с конфигурацией БЛНПГ, но в этом сценарии они менее специфичны.
- Наличие любого из следующих признаков указывает на высокий риск острой ишемии миокарда, требующей немедленной реваскуляризации:
Оценка подъема сегмента ST при наличии блокады левой ножки пучка Гиса (БЛНПГ) может быть затруднена. Если клиническое подозрение на ишемию миокарда велико, пациентов с этой комбинацией следует лечить так же, как пациентов с ИМпST.
Управление
Следующие ниже рекомендации в целом соответствуют рекомендациям AHA / ACC 2013 года по ведению STE-ACS. [1]
«Время — мускулы»: у пациентов с ИМпST следует как можно скорее провести реваскуляризацию! Все другие вмешательства могут подождать!
Подъезд
[1]
- Для пациентов отделение с возможностью ЧКВ
- Для пациентов, находящихся на расстоянии более 120 минут от отделения, поддерживающего ЧКВ, и появления симптомов
- Для всех пациентов с ИМпST
Немедленная реваскуляризация
[1]
Экстренная коронарная ангиография с ЧКВ
[1]
- Показания: предпочтительный метод реваскуляризации у пациентов с подозрением на ИМпST.

- Процедура: баллонная дилатация с имплантацией стента (см. «Катетеризация сердца»)
- Время первого медицинского контакта (FMC) с PCI
- В идеале ≤ 90 минут.
- Не более 120 минут
Фибринолитическая терапия при ИМпST
[1]
- Показания (для эквивалентов ИМпST и ИМпST, если применимо все следующее):
- ЧКВ не может быть выполнено ≤ 120 минут после FMC.
- Начало симптома
- ≤ 12 часов
- ИЛИ 12–24 часа с клиническими признаками продолжающейся ишемии (в этом контексте ЧКВ даже более предпочтительно)
- Противопоказаний к фибринолизу нет
- Время: до прибытия пациента в больницу
- Противопоказания
- Схемы (одна из следующих)
- Постфибринолиз: проверьте коронарный кровоток TIMI и переведите его в учреждение с возможностями ЧКВ.
ЧКВ следует выполнять даже в случае успешного лизиса.
Стрептокиназа нефибринспецифична и обладает высокой антигенностью. Противопоказан в течение 6 месяцев после предыдущего контакта со стрептокиназой.
Прочие
- Аортокоронарное шунтирование: обычно не рекомендуется при остром ИМпST [1]
- Учитывать в следующих случаях:
- Анатомия коронарной артерии плохо подходит для ЧКВ
- После неудачного PCI
- ИМпST, возникший во время хирургического ремонта механического дефекта
- Учитывать в следующих случаях:
Антитромбоцитарная терапия и антикоагулянты при ИМпST
[1]
- Время: терапию следует начинать, не откладывая реваскуляризацию.
Контрольный список для ведения неотложной помощи
Для пациентов, находящихся вне учреждения, поддерживающего ЧКВ,
Для пациентов, находящихся на расстоянии более 120 минут от учреждения, поддерживающего ЧКВ, и появления симптомов
Для всех пациентов с ИМпST
NSTEMI / UA
Пациенты с NSTE-ACS классифицируются на основе наличия (NSTEMI) или отсутствия (UA) значительно повышенных уровней сердечного тропонина (cTn).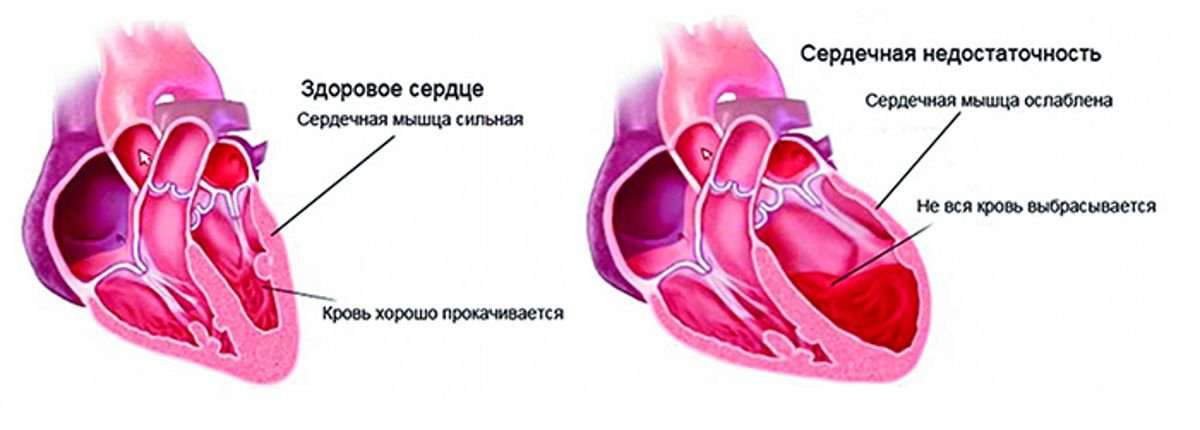 Ключевым элементом лечения является оценка необходимости и времени проведения ЧКВ (фибринолитики не указаны в NSTE-ACS).Гемодинамически нестабильным пациентам и пациентам с неизлечимой стенокардией требуется немедленное ЧКВ (т. Е. Лечение проводится как пациентов с ИМпST). Множественные оценки риска (например, HEART, TIMI, GRACE) могут помочь определить адекватную стратегию, но не заменяют индивидуальную клиническую оценку. Первоначально показана двойная антиагрегантная терапия и антикоагулянт, а предпочтительные схемы варьируются в зависимости от факторов риска пациента и времени реваскуляризации. Некоторых пациентов с ОКСбпST из группы низкого риска можно лечить консервативно.
Ключевым элементом лечения является оценка необходимости и времени проведения ЧКВ (фибринолитики не указаны в NSTE-ACS).Гемодинамически нестабильным пациентам и пациентам с неизлечимой стенокардией требуется немедленное ЧКВ (т. Е. Лечение проводится как пациентов с ИМпST). Множественные оценки риска (например, HEART, TIMI, GRACE) могут помочь определить адекватную стратегию, но не заменяют индивидуальную клиническую оценку. Первоначально показана двойная антиагрегантная терапия и антикоагулянт, а предпочтительные схемы варьируются в зависимости от факторов риска пациента и времени реваскуляризации. Некоторых пациентов с ОКСбпST из группы низкого риска можно лечить консервативно.
Изменения ЭКГ при NSTEMI / UA
- Результаты [2]
- Нет отметок ST
- Могут присутствовать неспецифические признаки ишемии, в том числе:
- Депрессия ST, особенно горизонтальная или нисходящая
- Преходящие отклонения ST ≥ 0,5 мм (≥ 0,05 мВ) у пациентов с симптомами в состоянии покоя
- Инверсия зубца T ≥ 2 мм (≥ 0,2 мВ) в В 1 –В 6
- Дополнительные соображения
Чтобы определить результаты ЭКГ, эквивалентные ИМпST или ИМпST, повторите ЭКГ, если первоначальная не дает результатов или происходят какие-либо изменения в симптомах.
Управление
Следующие ниже рекомендации в целом соответствуют рекомендациям 2014 AHA / ACC по управлению NSTE-ACS. [2]
Риск-зависимые сроки реваскуляризации
[2] [7]
Пациентам с ИМбпST с нестабильной гемодинамикой, трудноизлечимой стенокардией, подозрением на задний инфаркт и / или окклюзию левого главного сосуда требуется срочное ЧКВ (), даже если нет подъема сегмента ST. [1] [2] [6]
Фибринолитическая терапия не показана пациентам с нестабильной стенокардией или ИМбпST.
Антитромбоцитарная терапия и антикоагуляция при NSTE-ACS
[2]
- Время [2]
- Как можно скорее запустить DAPT; продолжительность зависит от того, проводится ЧКВ или нет.

- Как можно скорее начать антикоагуляцию; продолжать на время госпитализации или пока не будет выполнено ЧКВ.
- GPI следует начинать только у пациентов с высоким риском, подвергающихся ЧКВ и после консультации с кардиологом.
- Как можно скорее запустить DAPT; продолжительность зависит от того, проводится ЧКВ или нет.
Контрольный список неотложной помощи для NSTE-ACS
Мониторинг и дополнительная медикаментозная терапия
Мониторинг
- Непрерывный мониторинг сердца
- Последовательная ЭКГ в 12 отведениях каждые 15–30 минут в течение первого часа
- Последовательное измерение тропонина в сыворотке (каждые 1–6 часов)
Дополнительная медицинская терапия в ACS
[1] [2]
Неотложная медицинская помощь в ACS включает «MONA»: морфин, кислород, нитроглицерин и аспирин.Но помните: морфин, кислород и нитроглицерин не обязательно показаны каждому пациенту (см. «Показания»).
«Показания»).
Поддерживающие меры
Последующие меры
Дифференциальный диагноз
См. «Дифференциальный диагноз боли в груди».
Дифференциальная диагностика повышенного тропонина
[7]
- Сердечно-сосудистые причины
- Несердечно-сосудистые причины
Дифференциальный диагноз подъема сегмента ST на ЭКГ
[1]
Перечисленные здесь дифференциальные диагнозы не являются исчерпывающими.
Связанная минутная телеграмма
Заинтересованы в новейших медицинских исследованиях, сокращенных до одной минуты? Подпишитесь на One-Minute Telegram в разделе «Советы и ссылки» ниже.
Патофизиология острого коронарного синдрома и сердечной недостаточности
Сердечная недостаточность (СН) — изнурительное состояние, которое характеризуется одышкой, утомляемостью и непереносимостью физических упражнений. СН — это клинический синдром, который может возникать в результате любого структурного или функционального сердечного расстройства, которое нарушает способность желудочка наполняться или выбрасывать кровь в покое или во время физической активности.Изменения ткани и функции сердечной мышцы, нейрогормональные изменения, а также изменения функции сосудов и скелетных мышц часто называют «порочным кругом» сердечной недостаточности, как показано на рисунке ниже.
СН — это клинический синдром, который может возникать в результате любого структурного или функционального сердечного расстройства, которое нарушает способность желудочка наполняться или выбрасывать кровь в покое или во время физической активности.Изменения ткани и функции сердечной мышцы, нейрогормональные изменения, а также изменения функции сосудов и скелетных мышц часто называют «порочным кругом» сердечной недостаточности, как показано на рисунке ниже.
Рис. 2: «Порочный круг» патофизиологии сердечной недостаточности
(Воспроизведено с разрешения Национального фонда сердца Австралии)
Цикл начинается с поражения миокарда. Нейрогормональная компенсаторная активность активируется при снижении сердечного выброса.
Сердечная недостаточность с пониженной фракцией выброса (HFrEF)
Сердечная недостаточность со сниженной систолической функцией левого желудочка, приводящей к снижению сердечного выброса, активирует нейрогормональные реакции, которые в долгосрочной перспективе могут быть дезадаптивными или неэффективными. Многие лекарства от сердечной недостаточности изменяют нейрогормональные реакции, чтобы разорвать порочный круг сердечной недостаточности. См. Борьба с нейрогормональным циклом при сердечной недостаточности.
Многие лекарства от сердечной недостаточности изменяют нейрогормональные реакции, чтобы разорвать порочный круг сердечной недостаточности. См. Борьба с нейрогормональным циклом при сердечной недостаточности.
Нейрогормональные системы, вовлеченные в цикл сердечной недостаточности, включают симпатическую нервную систему (СНС), ренин-ангиотензин-альдостероновую систему (РААС) и систему натрийуретических пептидов (НПС).
SNS и RAAS увеличивают объем циркулирующей крови за счет сужения сосудов и задержки натрия и воды. В долгосрочной перспективе чрезмерная активация SNS и RAAS может привести к:
- Контрпродуктивная нейрогормональная адаптация, поскольку попытки поддерживать артериальное давление приводят к ухудшению функции сердца.
- Повышение уровней норадреналина, ангиотензина II и альдостерона, приводящее к хронической системной и легочной вазоконстрикции, гипертрофии и ишемии сердца, отекам, гипонатриемии и предрасположенности к сердечной аритмии.

- Системные изменения функции почек, сосудов и скелетных мышц, которые еще больше ухудшают работу сердца. Почечная недостаточность, вызванная снижением сердечной деятельности и серьезным изменением регионального кровотока, приводящим к изменению функции скелетных мышц, что проявляется в общей мышечной слабости.
- Ухудшение кровотока и нарушение мышечной функции, которые вызывают такие признаки и симптомы, как задержка соли и жидкости, жажда и усталость.
- Ремоделирование сердца (изменение структуры и формы), которое дополнительно снижает сердечный выброс.
NPS играет важную роль в гомеостазе воды и соли, увеличивая выведение натрия с мочой. Когда сердце находится в состоянии стресса из-за повышенного давления наполнения, высвобождаются B-натрийуретический пептид (BNP) и предсердный натрийуретический пептид (ANP). NPS уравновешивает вазоконстрикцию, вызванную SNS и RAAS, способствуя расширению сосудов и диурезу, и может быть эффективным на ранних этапах сердечной недостаточности. Однако в долгосрочной перспективе активация НПВ не может эффективно противодействовать неблагоприятным последствиям чрезмерной активации этих систем.
Сердечная недостаточность с сохраненной фракцией выброса (HFpEF)
Патофизиология HFpEF менее ясна, чем HFrEF. При HFpEF наблюдается перегрузка жидкостью и другие симптомы без явного снижения функции левого желудочка. Текущие патофизиологические теории, относящиеся к HFpEF, включают: коронарное микрососудистое воспаление, повышение жесткости центральной артерии, нарушения сократительного и хронотропного резерва и нарушения доставки кислорода в скелетные мышцы.
Симптомы и диагностика острого коронарного синдрома (ОКС)
Если вы или ваш близкий человек страдаете ишемической болезнью сердца (ИБС), возможно, вы слышали термин «острый коронарный синдром», также называемый ОКС. ОКС — относительно новый термин, используемый кардиологами, и он может немного сбивать с толку. Однако, поскольку он представляет собой новый взгляд на CAD, может быть полезно потратить несколько минут, чтобы понять его.
Острый коронарный синдром — это примерно то, на что это похоже.Это неотложное заболевание, поражающее коронарные артерии; чрезвычайная ситуация. Это указывает на то, что ИБС человека внезапно стала нестабильной, и что необратимое повреждение сердца либо происходит прямо сейчас, либо может произойти в любое время.
Причины
ASC возникает, когда в коронарной артерии внезапно образуется сгусток крови, обычно из-за острого разрыва атеросклеротической бляшки. Разрыв налета может произойти в любое время, часто совершенно без предупреждения. Сгусток крови может вызвать частичную или полную блокировку артерии, в любом случае подвергая сердечную мышцу, снабжаемую этой артерией, непосредственной угрозой.
Любая бляшка в любой коронарной артерии может быть разорвана, даже небольшие бляшки, которые кардиологи обычно игнорируют во время катетеризации сердца. Вот почему вы часто слышите о людях, перенесших инфаркт миокарда (ИМ или сердечный приступ), вскоре после того, как им сказали, что их ИБС «незначительна».
Три типа ACS
Кардиологи делят ОКС на три отдельные клинические модели. Два из них представляют собой разные формы ИМ, а один представляет собой особенно тяжелую форму стенокардии, называемую «нестабильной стенокардией».«Все три вызваны острыми тромбами в коронарных артериях.
Если сгусток крови достаточно велик и сохраняется более нескольких минут, некоторые клетки сердечной мышцы начинают умирать. Гибель сердечной мышцы — вот что определяет ИМ. Два типа МИ, которые может производить САУ.
- Инфаркт миокарда с подъемом сегмента ST (ИМпST), названный так потому, что «сегмент ST» на ЭКГ кажется «повышенным», возникает, когда коронарная артерия полностью заблокирована, так что начинается большая часть сердечной мышцы, снабжаемой этой артерией. умереть.ИМпST — самая тяжелая форма ОКС.
- Инфаркт миокарда без подъема сегмента ST (ИМбпST), при котором сегмент ST не повышен, возникает, когда закупорка коронарной артерии является «только» частичной. Происходит достаточная блокада, чтобы повредить некоторые клетки сердечной мышцы, снабжаемые больной артерией, но повреждение, как правило, менее обширное, чем при ИМпST. Однако одна проблема с NSTEMI заключается в том, что при неадекватном лечении блокада, вероятно, станет полной, и NSTEMI превратится в STEMI.
- Иногда ACS производит еще недостаточно большой тромб. или не сохраняется достаточно долго, чтобы вызвать необратимое повреждение сердечной мышцы. (Защитные механизмы организма пытаются растворить сгустки крови, которые образуются в кровеносных сосудах.) Когда ОКС вызывает симптомы, не вызывая при этом смерти сердечной мышцы, это называется нестабильной стенокардией. Люди с нестабильной стенокардией имеют высокий риск развития ИМбпST или ИМпST.
И ИМбпST, и нестабильная стенокардия можно рассматривать как «неполные» сердечные приступы.Эти две формы ACS нуждаются в аналогичном агрессивном медицинском лечении, чтобы снизить вероятность их прогрессирования в ИМпST, который кардиологи часто называют «завершенным» ИМ.
Симптомы
Наиболее частый симптом ОКС — боль в груди или дискомфорт в груди. Дискомфорт в груди при ОКС в целом аналогичен дискомфорту в груди при стабильной стенокардии, но часто бывает гораздо более интенсивным, частым и стойким. Наряду с дискомфортом в груди у людей с ОКС часто наблюдаются другие беспокоящие симптомы, такие как потливость, головокружение, тошнота, сильное беспокойство и то, что часто описывается как «чувство надвигающейся гибели».«Нитроглицерин (который обычно облегчает стабильную стенокардию) может не тронуть боль в груди. С другой стороны, у некоторых людей с ОКС будут только легкие симптомы, они могут даже не заметить никаких симптомов — по крайней мере, на начальном этапе.
К сожалению, независимо от того, вызывает ли ACS значительные симптомы, если его не лечить, ACS часто вызывает необратимое повреждение сердца, которое рано или поздно вызовет симптомы.
Как сделать правильный диагноз
Подводя итог, можно сказать, что если сгусток крови образуется в коронарной артерии, если обширное повреждение сердечной мышцы уже произошло, диагностируется ИМпST.Если происходит «небольшое» повреждение сердечной мышцы, диагностируется ИМпST. Если не происходит заметного повреждения сердечной мышцы, диагностируется нестабильная стенокардия.
Если у вас ОКС, как правило, ваши симптомы, физикальное обследование, история болезни и факторы риска сердечных заболеваний сразу же заставят врача серьезно заподозрить диагноз. С этого момента он или она быстро проверит вашу ЭКГ и измерит ваши сердечные ферменты. Сердечные ферменты попадают в кровоток умирающими клетками сердечной мышцы, поэтому повышение уровня сердечных ферментов означает, что происходит повреждение сердечных клеток.
Вот суть в диагностике типа ACS, с которым вы имеете дело: внешний вид ЭКГ (то есть наличие или отсутствие «подъема» в сегментах ST) позволит различить ИМпST и ИМбпST. А наличие или отсутствие повышенных сердечных ферментов позволит отличить ИМбпST от нестабильной стенокардии.
Три типа ACS представляют собой спектр клинических состояний, которые могут возникнуть при разрыве бляшки в коронарной артерии. Фактически, на самом деле нет четкой границы, которая по своей сути разделяет ИМпST, ИМпST и нестабильную стенокардию.Если кардиологи проводят грань между ИМпST и ИМбпST или между ИМбпST и нестабильной стенокардией, это относительно произвольное решение. Действительно, определения этих трех типов ACS существенно изменились с годами, поскольку наши знания, в частности наша способность интерпретировать ЭКГ и обнаруживать повреждение клеток сердца с помощью ферментных тестов, улучшились.
Лечение
По сути, лечение ОКС направлено на то, чтобы как можно быстрее снять активную закупорку пораженной коронарной артерии, чтобы предотвратить или ограничить повреждение сердечной мышцы.Конкретный терапевтический подход, который обычно используется, зависит от того, с какой из трех форм ACS вы имеете дело.
Лечение нестабильной стенокардии часто начинается с агрессивной медикаментозной терапии (использование нитратов для снятия дискомфорта в груди, бета-блокаторов для уменьшения сердечной ишемии и антитромбоцитарной терапии для прекращения дальнейшего распространения сгустка крови). Как только состояние пациента стабилизируется с помощью лекарств, потребность в инвазивной терапии (обычно в установке стента) может быть оценена в течение следующих нескольких дней.Лечение ИМбпST очень похоже на лечение нестабильной стенокардии.
Лечение ИМпST требует немедленной агрессивной терапии, направленной на как можно более быстрое открытие полностью заблокированной артерии. Сегодня предпочтительным методом вскрытия артерии у человека с ИМпST является немедленная ангиопластика и стентирование, но если такой подход невозможен, могут быть назначены препараты, разрушающие сгустки, чтобы попытаться растворить сгусток, вызывающий нарушение.
Какая бы форма ни присутствовала, ключ к успешному исходу — как можно скорее получить эффективную терапию.Даже небольшая задержка может означать разницу между полным выздоровлением и пожизненной инвалидностью или того хуже.
Вот почему любому, кто испытывает симптомы, соответствующие ОКС, необходимо немедленно обратиться за медицинской помощью.
Слово Verywell
Важным моментом, касающимся ACS, является то, что в любом случае, независимо от того, как он классифицируется, ACS является неотложной медицинской помощью и требует немедленной медицинской помощи. Лечение предназначено для достижения двух целей: 1) ограничить повреждение сердечной мышцы, вызванное острым сгустком крови в коронарной артерии, и 2) ограничить возможность того, что бляшка, которая теперь оказалась нестабильной и склонной к разрыв — снова разорвется.
Факторы, влияющие на оценку врачом риска острых сердечных приступов у пациентов с подозрением на острый коронарный синдром
Ключевые сообщения
То, что уже известно по этому вопросу
Врачи склонны переоценивать риск, разделяя пациентов с болью в груди на группы низкого риска или категории высокого риска.
Полезность конкретных элементов оценки, таких как симптомы и традиционные факторы риска сердечно-сосудистых заболеваний, подвергалась сомнению при прогнозировании индивидуального риска.
Что добавляет это исследование
В двух проспективных исследованиях мы попросили врачей оценить риск острого сердечного приступа (ACE) для пациентов и обнаружили, что врачи систематически переоценивают риск. Например, доля пациентов с АПФ составляла 2%, 4%, 9% и 25% при оценках риска врача в 5–10%, 25–30%, 50–55% и 70–75%, соответственно.
Увеличение возраста и мужского пола ассоциировалось с повышением оценки врачом риска для ACE, при этом оценки для женщин постоянно были ниже по сравнению с мужчинами.
Оценка риска врача также связана с факторами, которые оказались ненадежными предикторами АПФ в условиях ЭД, такими как типичность боли и факторы риска.
Предпосылки
Пациенты, поступающие в отделение неотложной помощи с недифференцированной болью в груди, представляют собой диагностическую проблему, поскольку менее чем у 20% таких пациентов в конечном итоге диагностируется острое сердечное событие (ОАПФ) .1 Оценка пациентов с потенциальным ОАПФ остается трудным, поскольку пациенты имеют разнообразные симптомы и могут не иметь четких диагностических результатов.По этой причине определение предтестовой вероятности заболевания для пациентов, у которых врач исследует потенциальный АПФ, является важным компонентом оценки, который облегчает проведение дополнительных исследований и планирование лечения.
Одним из методов определения риска для пациента является неструктурированная оценка риска врачом (или гештальт). Гештальт — привлекательный метод стратификации риска из-за его гибкости и неотъемлемой доступности2. Существующие исследования показали, что оценки риска врачами имеют умеренную или высокую чувствительность для исключения АПФ, но, как правило, консервативны и переоценивают риск.3–5 В таких исследованиях оценки риска разделились на низкий и высокий риск при проверке точности. В ограниченных исследованиях изучалась точность оценок врачей риска при сохранении их в качестве непрерывной переменной. Это означает, что точность оценки риска врачом по всему спектру рисков неизвестна.
Еще один аспект врачебного риска, который остается малоизученным, — это факторы, используемые врачами для предварительной оценки вероятности риска. Одно исследование показало, что врачи неотложной помощи использовали типичность симптомов как наиболее важный инструмент для определения подозрений на АПФ, а результаты ЭКГ и тропонина играли лишь второстепенную роль.6 Этот результат контрастирует с исследованиями, показывающими, что симптомы являются плохими предикторами АПФ.7 8 Также неясно, появится ли такая же картина результатов при изучении прогнозируемого риска у пациентов, которых врачи выбрали для исследования на наличие АПФ.
В этом исследовании будут изучены оценки риска врачей ED. Основная цель состояла в том, чтобы определить точность оценки риска врача отделения неотложной помощи у пациентов, обследованных на предмет возможной сердечной боли в груди. Вторичной целью было выявить факторы, используемые врачами неотложной помощи при оценке риска АПФ.
Методы
Дизайн исследования
Были проанализированы данные двух исследований пациентов, поступающих в отделение неотложной помощи с подозрением на ОКС. Первое исследование представляло собой проспективное обсервационное исследование пациентов (n = 983), поступивших в отделение неотложной помощи австралийской больницы третичного уровня в период с ноября 2007 года по январь 2011 года.9 Второе исследование было нерандомизированным интервенционным исследованием (n = 1366), проведенным в том же месте. с февраля 2011 г. по март 2014 г. 10 Подробное описание исследований было опубликовано ранее.9 10 Изучение оценок риска врачами было включено в качестве запланированного анализа в оба исследования. Информированное согласие было получено от всех участников.
Участники
В обоих исследованиях были идентичные процессы набора пациентов с одинаковыми критериями включения и исключения. Подходящими пациентами были пациенты в возрасте 18 лет и старше, которые обратились в отделение неотложной помощи с болью в груди не менее 5 минут, предполагающей ОКС, и были обследованы на предмет подозрения на ОКС. Пациенты были исключены, если у них была явная причина, не связанная с ОКС, они не хотели или не могли дать информированное согласие (например, языковой барьер), считались персоналом не подходящими для набора (например, неизлечимая болезнь), были переведены из другая больница, были беременны, были набраны для исследования в течение предыдущих 45 дней или не могли или не хотели связываться после выписки.В исследовательском центре пациенты с явным инфарктом миокарда сегмента ST при поступлении направляются непосредственно в интервенционную кардиологию при распознавании. Таким образом, эти пациенты не будут включены в первичную когорту, так как клиницисты неотложной помощи не будут управлять ими для оценки риска.
Все пациенты в обсервационном исследовании получали стандартную помощь, которая включала ЭКГ и измерение сердечного тропонина I (cTnI) при поступлении с последующими измерениями cTnI через 6 часов.9 Интервенционное исследование включало ускоренный диагностический протокол (протокол улучшенной оценки боли в груди [IMPACT]), в котором подгруппа пациентов с «низким» и «промежуточным» риском проходила 2-часовое, а не 6-часовое тестирование тропонина. .10 В когорте пациентов, использованных в текущем анализе, было 369 пациентов с IMPACT, которые прошли 2-часовое тестирование без дополнительного тестирования через 6 часов. Все наблюдались через 30 дней, чтобы убедиться, что не было пропущено ни одного события. Это вмешательство не повлияло на уход за пациентом в течение первых 2 часов в отделении неотложной помощи.Протокол IMPACT применялся только после того, как врач оценил риск.10
Сбор данных
В обоих исследованиях научный персонал первоначально идентифицировал пациентов, используя базу данных о приеме в отделение неотложной помощи, электронную запись, показывающую жалобу пациента. Затем медсестры обследовали всех пациентов, у которых были симптомы, подозрительные на ОКС, включая дискомфорт в груди; боль в плече, руке, челюсти или верхней части живота; одышка; тошнота; рвота; и потливость, чтобы определить право на участие в исследовании.В рабочее время (08: 00–17: 00) набирали последовательно подходящих пациентов. Демографические данные, подробные сведения и история болезни собирались непосредственно у каждого пациента. Если пациент не был уверен в ответе, записывался ответ «нет». Тот же персонал также контролировал тестирование ЭКГ и брал образцы крови для измерения cTnI. Пациенты находились под наблюдением в течение 30 дней с момента первого обращения с использованием истории болезни и телефонного разговора. Только события во время индексного приема рассматривались для первичного результата этого исследования, и все они считались индексными событиями.
Оценки врача ED были получены для удобной выборки из всей когорты. В эту удобную выборку вошли все подходящие пациенты при наличии (1) исследовательского персонала; (2) лечащий врач был доступен для оценки риска; и (3) оценки риска были получены до получения результатов cTnI. Врачам с повышенным уровнем подготовки в области неотложной медицины (старшим регистраторам или консультантам) было предложено оценить вероятность (с использованием визуальной аналоговой шкалы 100 мм) каждого пациента, испытывающего ОАП во время индексной госпитализации.Это было записано после того, как стали известны результаты ЭКГ, но до представления результатов cTnI. Оценки риска не были получены, если либо результат cTnI был известен до того, как научный персонал смог собрать данные, либо если врач или исследовательский персонал отсутствовали.
Исходы
Первичной конечной точкой были ОАП, определяемые как смерть от сердечной причины, диагностика острого инфаркта миокарда (тип I или II), экстренная реваскуляризация, незапланированная реваскуляризация или нестабильная стенокардия во время первичной госпитализации (онлайн-приложение) Таблица 1).11 Конечные точки оценивались в соответствии с третьим универсальным определением инфаркта миокарда (ИМ), 12 за исключением того, что 369 пациентов с IMPACT без 6-часовых образцов были оценены на основе 2-часовых, а не 3-часовых или 6-часовых образцов . Один кардиолог назначил конечные точки, используя историю болезни, ЭКГ, результаты исследований тропонина и стандартные исследования. Второй кардиолог провел слепой обзор всех пациентов с конечной точкой сердечно-сосудистой системы и 10% случаев с конечной точкой, не связанной с сердечно-сосудистыми заболеваниями.Этот процесс вынесения решения был предпринят кардиологами, входившими в исследовательскую группу. В случае разногласий конечные точки согласовывались на основе консенсуса между двумя кардиологами и врачом неотложной помощи. Вторичной конечной точкой была оценка риска врачом. Это использовалось в качестве конечной точки для определения пациентов, предикторов оценки риска врачами.
Статистический анализ
Статистический анализ проводился в R V.3.5.1. В когорту исследования вошли все пациенты, у которых была сделана оценка риска (рисунок 1).Оценка риска врачами не была доступна в 1223 случаях.
Рисунок 1
Поток участников.
Исходные характеристики и результаты исследуемой когорты были представлены для первичной когорты. Эти данные также были представлены для тех пациентов, у которых не было данных о врачебных оценках риска, чтобы определить, были ли систематические различия между когортой пациентов с оценками риска и без них. Логистическая регрессия была проведена для изучения взаимосвязи между оценкой врачом ACE и индексом ACE.Оценки риска врача были смоделированы с использованием ограниченных кубических сплайнов, чтобы учесть нелинейную взаимосвязь между индексами ACE и оценками риска врача. Для определения наилучшего соответствия модели были подогнаны с тремя, четырьмя и пятью узлами, при этом расположение узла основывалось на рекомендациях Харрелла.13 Окончательное количество узлов было выбрано на основе информационного критерия Акаике (
) .13
Был проведен линейный регрессионный анализ для определения предикторов оценок риска врачом. Эта модель включала возраст пациента, пол, факторы риска, сердечно-сосудистый анамнез, ЭКГ при предъявлении и характеристики боли.11 Эти переменные были выбраны априори, поскольку они отражают информацию, доступную клиницистам при оценке риска. Они также были переменными, которые, вероятно, будут использоваться врачами на основе предыдущих исследований.
Также был проведен анализ чувствительности, при котором был повторен первичный логистический регрессионный анализ, но для недостающих данных использовалось множественное вменение. Этот анализ был проведен, чтобы определить, были ли взаимосвязи, указанные в первичных анализах, неясными из-за использования удобной выборки.Оценки пропавших без вести врачей были вменены в 50 выборок с использованием возраста, пола, факторов риска, сердечно-сосудистого анамнеза, ЭКГ, характеристик боли и индексных ACE. Мы также провели анализ чувствительности, изучающий взаимосвязь между оценками риска врача и ACE до 30 дней (включая индексные ACE). Этот анализ был направлен на определение точности оценок риска как для индексов, так и для краткосрочных событий.
Результаты
Исходные демографические данные и исходы пациентов с оценкой риска и без нее были схожими (таблица 1).Во время представления индекса у 130 (12%) пациентов был диагностирован хотя бы один АПФ. Для пациентов с АПФ средняя оценка риска врачом составила 75 (IQR 50–70). Медианные оценки риска (рис. 2) для АПФ были аналогичны для пациентов с диагнозом ИМ I типа (75, IQR 60–90), ИМ II типа (75, IQR 50–90) и нестабильной грудной ангиной (UAP) (76,5, IQR 40–90). Однако разброс оценок для ИМ и НБП типа II был немного выше, чем для ИМ типа I (рис. 2). По сравнению с пациентами с АПФ оценка риска была ниже для пациентов с другими сердечными заболеваниями (50, IQR 20–65) или несердечным диагнозом (26, IQR 15–50).
Таблица 1
Исходные характеристики когорты
Рисунок 2
Оценка риска врачом по исходам для пациентов. T1MI, инфаркт миокарда 1 типа; T2MI, инфаркт миокарда 2 типа; UAP, нестабильная стенокардия.
Для анализа, регрессирующего ACE по оценке риска, оптимальная модель включала кубические сплайны с тремя узлами. Эти узлы были расположены при оценках риска врача в 10, 40 и 80. Повышение оценок риска было связано с увеличением вероятности индекса ACE.На рис. 3А показана доля пациентов, у которых был индекс АПФ, по диапазону оценок риска врачом (сгруппированных по пяти пунктам). На рисунке 3B представлены те же данные по отдельным оценкам риска, сглаженным с помощью логистической регрессии. Оценки риска врачами были постоянно выше, чем у пациентов с АПФ. Например, доля пациентов с АПФ составляла 2%, 4%, 9% и 25% при оценках риска врача в 5–10%, 25–30%, 50–55% и 70–75%. , соответственно.Чувствительность и специфичность различных оценок риска врача для индексных ACE представлены в дополнительных онлайн-таблицах 2 и 3. Для дальнейшего изучения данных мы выполнили второй (незапланированный) регрессионный анализ, включающий оценки риска, пола и их взаимодействия. Это предоставило данные об оценке врачами риска для участников мужского и женского пола (дополнительный рисунок 1 в Интернете). Оценки риска для участников мужского и женского пола имели одинаковую точность; обе кривые показали относительную переоценку врачами АПФ.
Рисунок 3
Прогнозируемая вероятность ACE. (A) Предоставляет калибровочный график сравнения предсказанных и наблюдаемых ACE. Пациенты были сгруппированы в 20 групп прогнозируемого риска (категории включают пять точек риска). Точки отражают долю пациентов с АПФ, а горизонтальные линии соответствуют 95% доверительному интервалу. Если точки попадают на линию под углом 45 градусов, доля пациентов с АПФ равна риску, предсказанному клиницистами. Точки под линией указывают на то, что фактическая доля АПФ ниже, чем прогнозируется клиницистами.(B) Предоставляет ожидаемую долю ACE от регрессии ACE по оценкам риска врача. ACE, острый сердечный приступ.
Также был проведен ряд анализов чувствительности. Во-первых, регрессионный анализ был повторен, но использовалось множественное вменение для вменения оценок риска для этих пациентов без пропущенных данных (n = 1223). Результаты этого анализа дали те же результаты, что и результаты основного анализа. Сравнение результатов с множественным вменением и без него представлено на дополнительном онлайн-рисунке 2.Во-вторых, регрессионный анализ был повторен, но конечной точкой были ACE до 30 дней (включая индексные события). Для этой конечной точки наблюдается такая же переоценка риска, что и при использовании индексных ACE в качестве конечной точки (онлайн-дополнительный рисунок 3).
Результаты множественной линейной регрессии оценок риска врача представлены на рисунке 4. Оценки риска врача увеличиваются с увеличением возраста до 60 лет, но начинают выходить на плато после 60 лет. Оценки риска для женщин были ниже, чем для мужчин.Пациенты с какими-либо отклонениями на ЭКГ имели более высокие оценки риска врача по сравнению с пациентами с нормальной ЭКГ; увеличение оценок риска составило от 4 до 30 пунктов выше, в зависимости от категоризации ЭКГ. Аномалии в порядке увеличения оценок риска включали (1) неспецифические изменения ST-T, (2) аномальную ЭКГ, но не диагностику ишемии, (3) ишемию или инфаркт, известные как старые, (4) инфаркт или ишемию, неизвестные быть старым и (5) изменения ЭКГ в соответствии с ОИМ. Наличие боли в груди было связано с более высокой оценкой риска (на 4–15 баллов выше), в то время как принадлежность к женщине была связана с более низкой оценкой риска (на 2–8 баллов ниже).Характеристики боли, такие как тупая, жгучая или колющая, не были связаны с оценкой риска врачом, но боль, которая усиливалась при нагрузке, была связана с повышенными оценками риска. Факторы риска и предшествующий ОИМ были связаны с небольшим увеличением оценок риска.
Рисунок 4
Предикторы оценки риска врача. (A) Обеспечивает связь между возрастом пациента и неструктурированными оценками риска врача. (B) Предоставляет коэффициенты из регрессии оценок риска врача.Коэффициенты представляют собой среднее увеличение оценки риска, присвоенного пациентам с каждой особенностью. ОИМ, острый инфаркт миокарда.
Обсуждение
Это исследование показало, что оценка врачом риска для АПФ была консервативной и переоценкой риска по всему спектру. Было установлено, что ряд факторов связан с более высокими рейтингами риска. К ним относятся факторы, позволяющие прогнозировать АПФ, такие как мужской пол, возраст и результаты ЭКГ. Они также включали другие факторы, которые оказались ненадежными предикторами АПФ в условиях ЭД, такие как типичность боли и факторы риска.
В целом, неструктурированные оценки риска были связаны с переоценкой риска ACE. Этот результат согласуется с предыдущими исследованиями, изучающими, является ли клинический гештальт точным для исключения ОИМ2–5. В таких исследованиях сообщается о умеренной или высокой чувствительности для исключения пациентов, но специфичность очень низкая, обычно около 20–30% .3 5 Это неудивительно, поскольку значимые последствия отсутствия диагноза ОИМ означают, что клиницисты, работающие с ЭД, обязательно консервативны и не склонны к риску.В сочетании с объективными тестами, такими как тропонин, гештальт врача, вероятно, будет безопасным методом стратификации риска АПФ. Однако это может привести к ненужным обследованиям и госпитализации, повышая вероятность причинения вреда пациенту и перенаселенность системы здравоохранения.
Если врач гештальт переоценивает риск, врачей можно рекомендовать вместо этого использовать проверенную структурированную оценку риска. Для оценки риска АПФ у пациентов с ЭД использовались несколько инструментов, в том числе история болезни, ЭКГ, возраст, факторы риска, оценка тропонина (СЕРДЦЕ), 14 оценка тромболизиса при инфаркте миокарда (TIMI), 15 Оценка состояния грудной клетки в отделении неотложной помощи. Оценка боли (EDACS), оценка 16 Глобального реестра острых коронарных событий (GRACE) 17 и правила Манчестерского ACS (MACS) (MACS и T-MACS18 19).Из них GRACE и MACS / T-MACS предоставляют наиболее подробную информацию с точки зрения прогнозируемой вероятности сердечных событий. Однако на сегодняшний день существует ограниченное количество исследований, сравнивающих точность клинического гештальта с такими клиническими правилами принятия решений. В существующей литературе нет однозначного подтверждения преимущества валидированных оценок над оценками врачей.20 Кроме того, было проведено ограниченное исследование, посвященное тому, насколько хорошо структурированные оценки риска откалиброваны для прогнозирования риска. Известные исключения включают многоцентровое исследование, показывающее, что правило T-MACS было точным для определения риска.19 Другое исследование обнаружило переоценку риска при использовании шкалы T-MACS в когорте с очень низким риском, но это исследование ретроспективно подтвердило T-MACS с использованием нескольких косвенных показателей.21 Необходимы дальнейшие исследования для определения полезности гештальта врача по сравнению с правила принятия клинических решений.
Известно, что мужской пол является предиктором АПФ у пациентов неотложной помощи с острой недифференцированной болью в груди, 22 и наше исследование показало, что пол играет важную роль в неструктурированном прогнозировании риска АПФ.В клинической практике необходимо проявлять осторожность при оценке пола при определении риска АПФ, поскольку ранее сообщалось о предвзятом отношении к признанию риска АПФ у женщин с АПФ, 23 и это может привести к недостаточному лечению. В этом исследовании также была обнаружена сильная связь между возрастом и прогнозом риска для АПФ, причем у пожилых пациентов был повышенный риск. Возраст является сильным предиктором основного заболевания коронарной артерии, 24 и, следовательно, это неудивительно, но влияние возраста на оценку риска врачом ранее не описывалось.
Характеристики сердечной боли не являются надежными предикторами ACE7 8, но были включены как компонент некоторых инструментов оценки риска. Боль, традиционно рассматриваемая как типичная, включая боль в груди, которая является тяжелой или давящей по своей природе, не имеет сильной связи с АПФ в недифференцированных когортах боли в груди.22 Несмотря на это, мы обнаружили, что наличие боли в груди и боли, которая является тяжелый или сокрушительный характер был предиктором оценок риска. Это указывает на то, что врачи все еще могут неявно использовать болевые характеристики, несмотря на то, что они бесполезны для прогнозирования риска.
Традиционные предикторы риска ишемической болезни сердца слабо связаны с неструктурированными оценками врачей. Эти факторы риска полезны на популяционной основе для выявления когорт с повышенным риском ишемической болезни сердца, но их полезность для прогнозирования риска индивидуального пациента ограничена, за исключением потенциально более молодых пациентов7, 22, 24 Чрезмерная зависимость от таких факторов риска может снизить точность. при выявлении пациентов с АПФ.
Из результатов исторического обследования и исследования наибольшее влияние оказали изменения ЭКГ, особенно изменения, соответствующие ОИМ или ишемическим изменениям.Это неудивительно, поскольку изменения ЭКГ являются объективной мерой, связанной с более высоким риском 30-дневной смерти, ОИМ и реваскуляризации.25 Этот результат противоречит предыдущим исследованиям, показывающим, что данные ЭКГ играли лишь незначительную роль в определении подозрения на АПФ. 6
Ограничения исследования
У нашего исследования есть несколько ограничений. В первичную когорту была включена только часть исходных пациентов из-за отсутствия оценок риска. Однако не было обнаружено различий в базовых характеристиках в не включенной подгруппе, и вменение отсутствующих данных не изменило структуру результатов.Исследование проведено в едином центре, поэтому его нельзя распространить на разные сайты. Оценки риска широко варьировались, что указывало на высокую неопределенность оценок врачей. В этом исследовании использовались ранее собранные данные. Таким образом, в исследовании не были оценены все возможные предикторы показателей врачебного риска. В нашем исследовании оценивалась неструктурированная оценка риска без доступа к вспомогательным исследованиям, включая тропонин, который, как было показано, улучшает точность стратификации риска врачами и может позволить снизить количество госпитализаций после подозрения на АПФ.

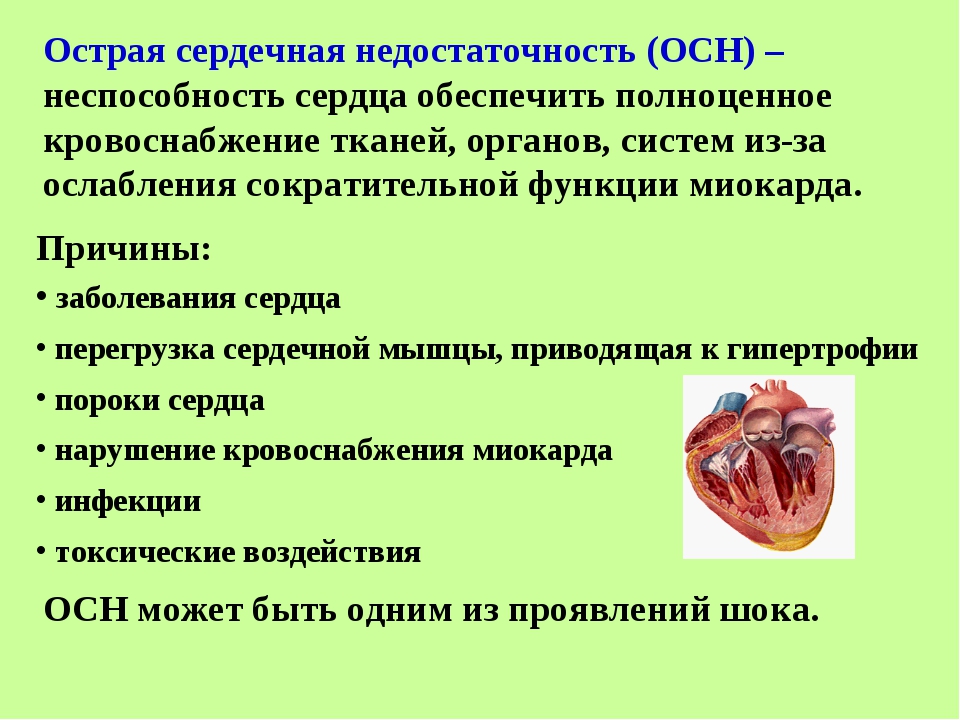 На острую сердечную недостаточность указывает увеличение веса более чем на 1-2 кг в неделю;
На острую сердечную недостаточность указывает увеличение веса более чем на 1-2 кг в неделю; -практич.изд.,практич.рук-во
-практич.изд.,практич.рук-во 12-008.46
12-008.46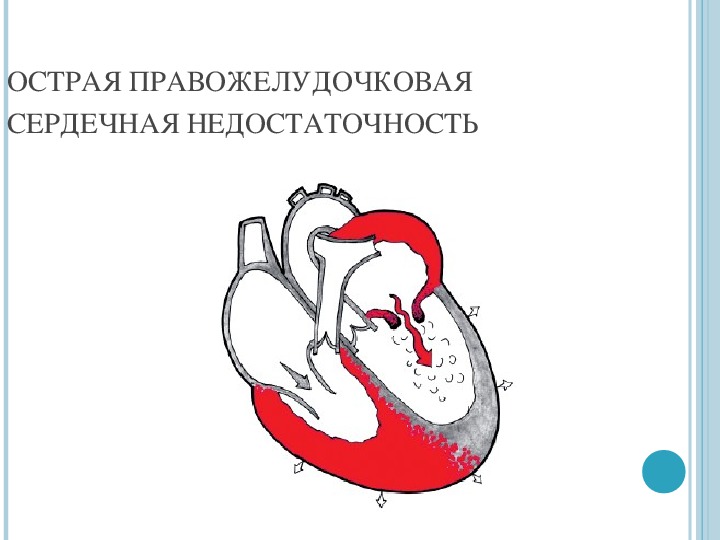 Чаще всего хорошо проявляется одышка у кошек.
Чаще всего хорошо проявляется одышка у кошек. У большинства этих пациентов разовьется инфаркт миокарда с подъемом сегмента ST (ИМпST).
У большинства этих пациентов разовьется инфаркт миокарда с подъемом сегмента ST (ИМпST).








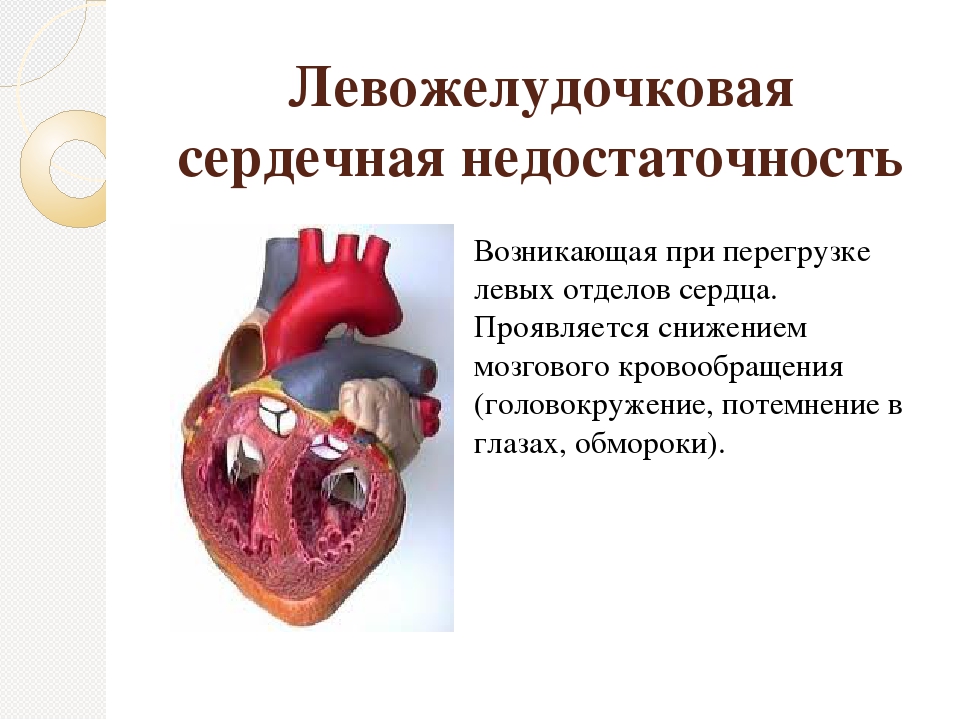
 0%) и отсутствие противопоказаний к ангиографии (например, активное кровотечение или сопутствующие заболевания). Следует учитывать риски и преимущества раннего вмешательства. NICE предлагает подробные советы по этому поводу.
0%) и отсутствие противопоказаний к ангиографии (например, активное кровотечение или сопутствующие заболевания). Следует учитывать риски и преимущества раннего вмешательства. NICE предлагает подробные советы по этому поводу.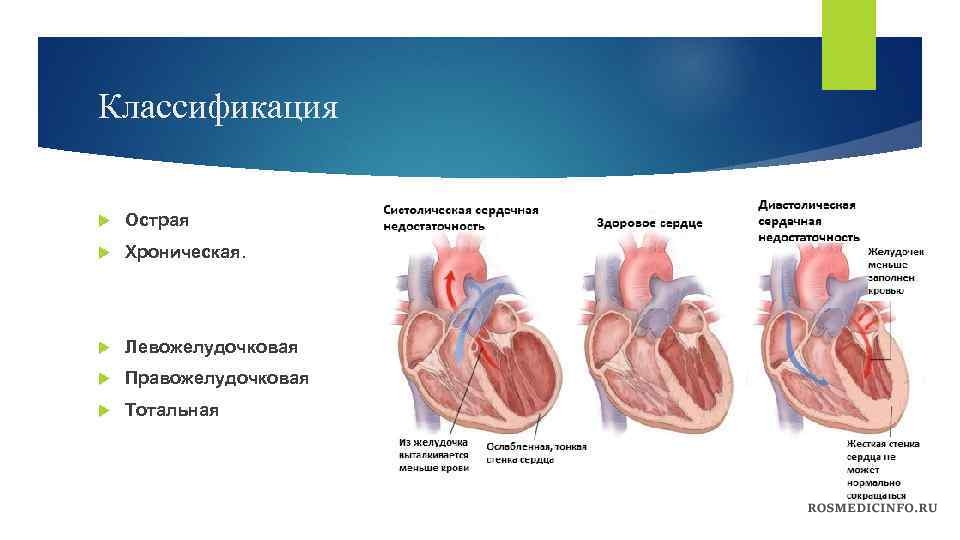 Польза от операции шунтирования наиболее велика, когда пациентов можно прооперировать после нескольких дней медицинской стабилизации, в зависимости от индивидуального риска [2] .
Польза от операции шунтирования наиболее велика, когда пациентов можно прооперировать после нескольких дней медицинской стабилизации, в зависимости от индивидуального риска [2] .







 1 мВ)
1 мВ)



