Сосудистая хирургия и Флебологический Центр им. Н.И. Пирогова
О болезни
Параганглиома шеи – весьма редкий вид опухоли из ряда нейроэндокринных образований, исходящая из параганглиев (скопление гормонально активных клеток). В настоящее время данные нейроэндокринные опухоли классифицируются по локализации их «обитания» — каротидная параганглиома (или хемодектома), вагальная параганглиома, атипичная параганглиома, югулярная параганглиома, феохромацитома и т.п. Всех их можно подразделить, в том числе, и по тому, синтезируют ли они гормоны (являются ли гормоноактивными опухолями) или нет. Следовательно, выделяют симпатические и парасимпатические опухоли; синтетические параганглиомы продуцируют выработку катехоламинов (к которым, к примеру, относят такие нейромедиаторы, как адреналин, дофамин, норадреналин; к слову, симпатические параганглиомы будут отличаться от феохромацитом, так как вторые синтезируют только адреналин). Обычно параганглиомы располагаются вблизи крупных артериальных стволов, типичные места локализации – область черепа, шеи, грудной клетки, живота, таза, мочевого пузыря – чрезвычайно
неприхотливые в расположении опухоли, не считая близости к сосудам, обеспечивающим их питание.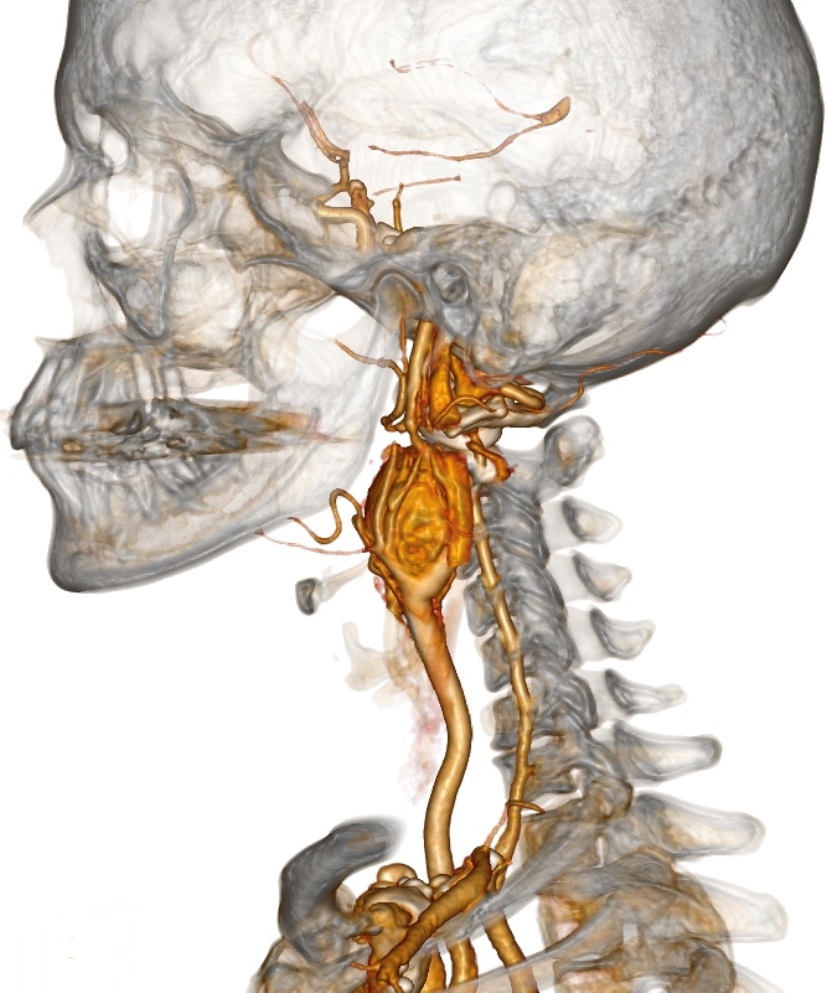 В области головы и шеи они произрастают из каротидного тельца (отсюда и одно из названий – гломусные опухоли), блуждающего нерва, расположенного вблизи сонных артерий, а так же из вагальных клеток, чаще всего их обнаруживают в области бифуркации (разветвления общей сонной артерии на наружнюю и внутреннюю артерии). Характеризуется данный вид опухоли медленным ростом, как у многих доброкачественных опухолей (однако, быстрый рост так же не будет говорить об озлокачествлении), а так же, зачастую, бессимптмным лечением, поэтому наиболее часто это случайные находки. Единственным проявлением может быть пальпаторное обнаружение самими пациентами безболезненного образования в области шеи, часто принимаемое за увеличенный лимфоузел, поэтому часто ему не придают значения. В случаях сдавления опухолью сонных артерий будет наблюдаться симптоматика, сходная с симптомами при стенозирующем атерослерозе брахиоцефальных артерий: головные боли, головокружения, снижение памяти, нарушение зрения и координации движения.
В области головы и шеи они произрастают из каротидного тельца (отсюда и одно из названий – гломусные опухоли), блуждающего нерва, расположенного вблизи сонных артерий, а так же из вагальных клеток, чаще всего их обнаруживают в области бифуркации (разветвления общей сонной артерии на наружнюю и внутреннюю артерии). Характеризуется данный вид опухоли медленным ростом, как у многих доброкачественных опухолей (однако, быстрый рост так же не будет говорить об озлокачествлении), а так же, зачастую, бессимптмным лечением, поэтому наиболее часто это случайные находки. Единственным проявлением может быть пальпаторное обнаружение самими пациентами безболезненного образования в области шеи, часто принимаемое за увеличенный лимфоузел, поэтому часто ему не придают значения. В случаях сдавления опухолью сонных артерий будет наблюдаться симптоматика, сходная с симптомами при стенозирующем атерослерозе брахиоцефальных артерий: головные боли, головокружения, снижение памяти, нарушение зрения и координации движения. При сдавлении нервных окончаний могут появляться дисфагия (ощущение инородного тела при глотании), а так же боли в области расположения самой опухоли.
При сдавлении нервных окончаний могут появляться дисфагия (ощущение инородного тела при глотании), а так же боли в области расположения самой опухоли.
Методы лечения
В данном случае консервативное лечение является малоэффективным, если не сказать, что вовсе неэффективным. Как правило, пациентам выполняется радикальное удаление опухоли, в ряде случаев перед ее выполнением осуществляют рентгенэндоваскулярную эмболизацию параганглиомы, а затем уже приступают к ее непосредственной резекции, так как опухоль является крайне высоко васкуляризированной (обильно кровоснабжаемой). В зависимости от типа ее отношения к сонным артериям существуют два типа оперативного вмешательства – с пластикой артерии, в случае ее интимной спаянности с сонной артерией, и без, когда операция заключается исключительно в удалении самой опухоли. Доступ осуществляется так же, как и при лечения атеросклероза сонных артерий, по переднему краю грудино-ключично сосцевидной мышцы, производят выделение сосудисто-нервного пучка шеи (яремная вена, сонная артерия, внутренняя сонная артерия, наружная сонная артерия, подъязычный нерв, блуждающий нерв, одна из ветвей шейного сплетения — anza cervicalis), а затем производят удаление самой опухоли, в случае плотной спаянности с сонной артерией – выполняют резекцию опухоли с часть артерии, которую в последующем протезируют.
Хирургическое лечение параганглиом шеи
Параганглиома (хемодектома) шеи является редкой опухолью. Частота этих опухолей среди всех онкологических заболеваний головы и шеи не превышает 0,01% [1, 2], а из общего числа внеорганных опухолей шеи на долю параганглиом приходится 0,5—0,9% [3]. В связи с большой редкостью этого заболевания в литературе в основном встречаются описания единичных случаев хирургического лечения пациентов с параганглиомами шеи [4—7]. Наибольшее количество наблюдений представлено в работах Л.А. Атанасяна (102 наблюдения), Е.Г. Матякина (198 наблюдений) и исследователей из Клиники Мейо (США; 153 случая, собранные за 50-летний период) [8, 9]. По данным литературы, эту опухоль чаще выявляют в 40—50-летнем возрасте с одинаковой частотой у мужчин и женщин. По сводным данным, двусторонняя локализация параганглиом шеи отмечается в 5—20% всех наблюдений [8].
Параганглионарная система широко представлена в различных органах и тканях человека в виде рассеянных и собранных в клубочки клеток, связанных с ганглиями [8].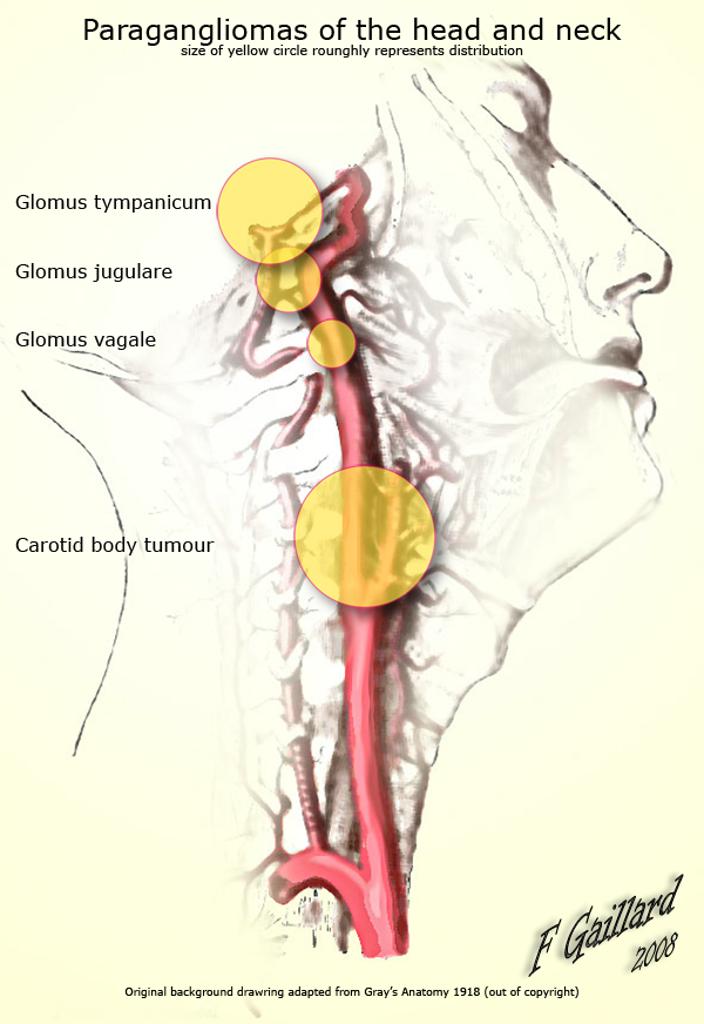 Среди параганглиом шеи чаще встречаются каротидные и реже вагальные [8—10]. Каротидная параганглиома развивается из хеморецепторного гломуса, расположенного на адвентициальном слое бифуркации общей сонной артерии. Вагальные параганглиомы исходят из узлового или яремного ганглия блуждающего нерва, преимущественно локализуются в заднебоковом окологлоточном пространстве, нередко интимно связаны с сонной артерией, внутренней яремной веной, подъязычным и языкоглоточным нервами [8, 11, 12]. Кровоснабжение опухоли осуществляется из сонных артерий и щитошейного ствола [10, 11, 13]. Размер вагальных параганглиом обычно значительно больше, чем размер каротидных опухолей [8]. По данным ряда авторов, частота вагальных параганглиом примерно в 3,5 раза меньше, чем каротидных [14].
Среди параганглиом шеи чаще встречаются каротидные и реже вагальные [8—10]. Каротидная параганглиома развивается из хеморецепторного гломуса, расположенного на адвентициальном слое бифуркации общей сонной артерии. Вагальные параганглиомы исходят из узлового или яремного ганглия блуждающего нерва, преимущественно локализуются в заднебоковом окологлоточном пространстве, нередко интимно связаны с сонной артерией, внутренней яремной веной, подъязычным и языкоглоточным нервами [8, 11, 12]. Кровоснабжение опухоли осуществляется из сонных артерий и щитошейного ствола [10, 11, 13]. Размер вагальных параганглиом обычно значительно больше, чем размер каротидных опухолей [8]. По данным ряда авторов, частота вагальных параганглиом примерно в 3,5 раза меньше, чем каротидных [14].
В большинстве наблюдений опухоли имеют доброкачественный характер, малигнизация отмечается у 4—10% пациентов. Критериями малигнизации наряду с морфологическими признаками являются быстрый рост и инфильтрация окружающих тканей.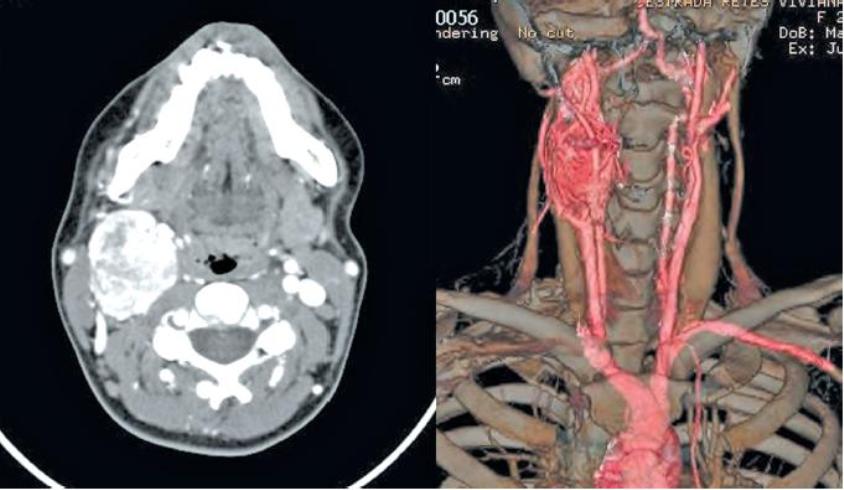 Важная особенность параганглиомы — экспансивный ее рост с инфильтрацией атипичными клетками не только капсулы новообразования, но и адвентиции магистральных сосудов [8, 15].
Важная особенность параганглиомы — экспансивный ее рост с инфильтрацией атипичными клетками не только капсулы новообразования, но и адвентиции магистральных сосудов [8, 15].
При вагальных параганглиомах чаще наблюдается злокачественный вариант их роста с развитием пареза одного или нескольких черепных нервов — ЧН (IX—XII ЧН) и симптомов сдавления глотки [8, 14].
В связи с редкостью заболевания и скудностью клинической картины первичная диагностика параганглиом шеи затруднена. Ошибки первичной диагностики составляют от 25 до 90% [8, 10]. Применение современных методов инструментальной диагностики (ультразвуковое дуплексное сканирование брахицефальных сосудов, мультиспиральная компьютерная томография — МСКТ, магнитно-резонансная томография — МРТ, рентгеноконтрастная ангиография) позволяет установить правильный диагноз и в большинстве наблюдений спланировать рациональный объем оперативного вмешательства [8].
В настоящее время большинство хирургов придерживаются в отношении параганглиом активной хирургической тактики, заключающейся в радикальном удалении опухоли в связи с возможным ее озлокачествлением и нарушением функции близлежащих органов при продолженном росте [4, 5, 7, 8]. Методом выбора является радикальное удаление опухоли с сохранением проходимости внутренней сонной артерии (ВСА) [4, 8, 11]. С целью уменьшения интраоперационной кровопотери первым этапом вмешательства проводят рентгеноэндоваскулярную эмболизацию кровоснабжающего опухоль сосуда и сосудов стромы опухоли [4, 8, 16]. В связи с этим оперативные вмешательства при параганглиоме шеи рекомендуется выполнять в специализированных лечебных учреждениях с обязательным привлечением онколога и сосудистого хирурга [8, 16, 17]. В статье представлен наш опыт хирургического лечения больных с параганглиомой шеи.
Методом выбора является радикальное удаление опухоли с сохранением проходимости внутренней сонной артерии (ВСА) [4, 8, 11]. С целью уменьшения интраоперационной кровопотери первым этапом вмешательства проводят рентгеноэндоваскулярную эмболизацию кровоснабжающего опухоль сосуда и сосудов стромы опухоли [4, 8, 16]. В связи с этим оперативные вмешательства при параганглиоме шеи рекомендуется выполнять в специализированных лечебных учреждениях с обязательным привлечением онколога и сосудистого хирурга [8, 16, 17]. В статье представлен наш опыт хирургического лечения больных с параганглиомой шеи.
Материал и методы
С июля 2013 г. по ноябрь 2016 г. в ФЦН Новосибирска проведено оперативное лечение 9 пациентов с параганглиомой шеи. Среди них были 7 женщин и 2 мужчин. Возраст больных составил от 36 до 75 лет (средний возраст 50,8 года). У всех пациентов была односторонняя локализация опухоли (у 5 — слева, у 4 — справа).
Следует отметить, что одна пациентка была ранее оперирована по поводу параганглиомы и поступила для оперативного лечения опухоли контралатеральной половины шеи. Трое больных исходно были оперированы в различных стационарах по месту жительства. Им было выполнено ревизионное вмешательство и забор биопсийного материала. Удаление образования не проводилось из-за вовлечения сонных артерий в опухолевый процесс. В одном наблюдении имелось сочетание параганглиомы шеи с атеросклеротическим симптомным стенозом ВСА.
В представленных наблюдениях время от появления первых жалоб до обращения в наш стационар составило от 6 мес до 7 лет. Основные клинические проявления, имеющиеся у описываемых больных, представлены в таблице. Клинические проявления параганглиомы шеи у 9 пациентов при поступлении
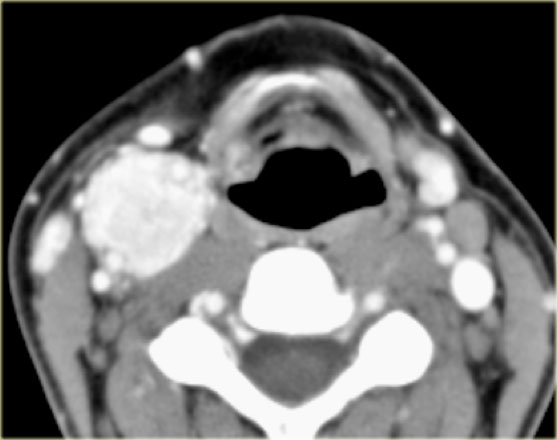
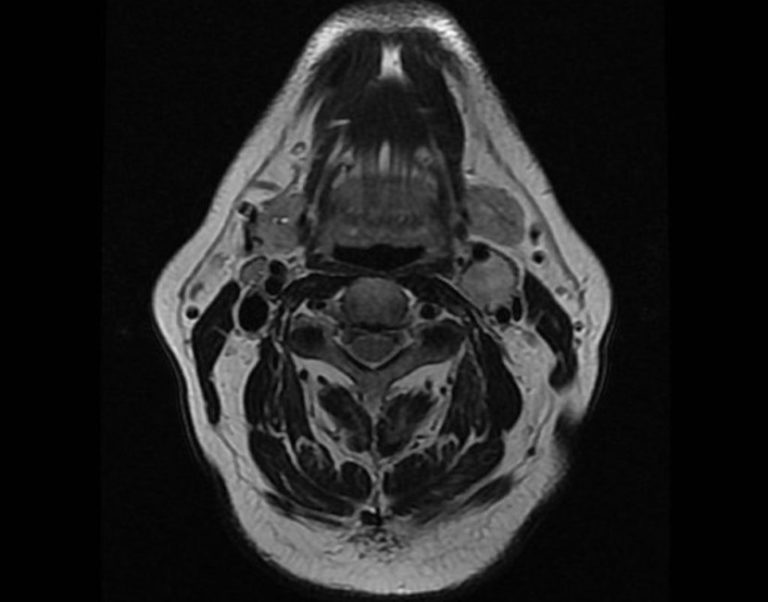
Во всех наблюдениях, помимо общеклинических обследований, использован комплекс неинвазивных (дуплексное сканирование с цветовым допплеровским картированием) и рентгенологических (МСКТ с контрастным усилением, МРТ) методов диагностики (рис. 1 и 2). Рис. 2. Мультиспиральная компьютерная ангиограмма. Параганглиома шеи. Рис. 1. Ультразвуковое дуплексное сканирование. Поперечная сканограмма параганглиомы шеи и сонных артерий. а — параганглиома охватывающая сонные артерии; б — наружная сонная артерия; в — внутренняя сонная артерия.
1 и 2). Рис. 2. Мультиспиральная компьютерная ангиограмма. Параганглиома шеи. Рис. 1. Ультразвуковое дуплексное сканирование. Поперечная сканограмма параганглиомы шеи и сонных артерий. а — параганглиома охватывающая сонные артерии; б — наружная сонная артерия; в — внутренняя сонная артерия.
На основании проведенных исследований определяли локализацию, размер, границы опухоли, ее связь с сонной артерией и прилегающими органами и тканями.
При проведении обследования каротидная параганглиома выявлена у 7 больных, вагальная — у 2. Размер опухоли в двух наибольших измерениях составил от 32×25 до 88×52 мм. В 2 наблюдениях параганглиома распространялась до основания черепа, в 1 из них было отмечено значимое смещение трахеи влево.
В своей работе мы использовали классификацию параганглиом, предложенную Л.А. Атанасяном. В соответствии с этой классификацией больные распределились следующим образом:
I тип: параганглиома рыхло соприкасается с адвентицией артерий и не обволакивает их — 1 больной;
II тип: отмечается муфтообразное обрастание опухолью наружной сонной артерии (НСА) — 3 больных;
III тип: новообразование циркулярно обрастает ствол ВСА — 1 больной;
IV тип: в процесс вовлекается бифуркация общей сонной (ОСА), внутренней и наружной сонных артерий — 4 больных.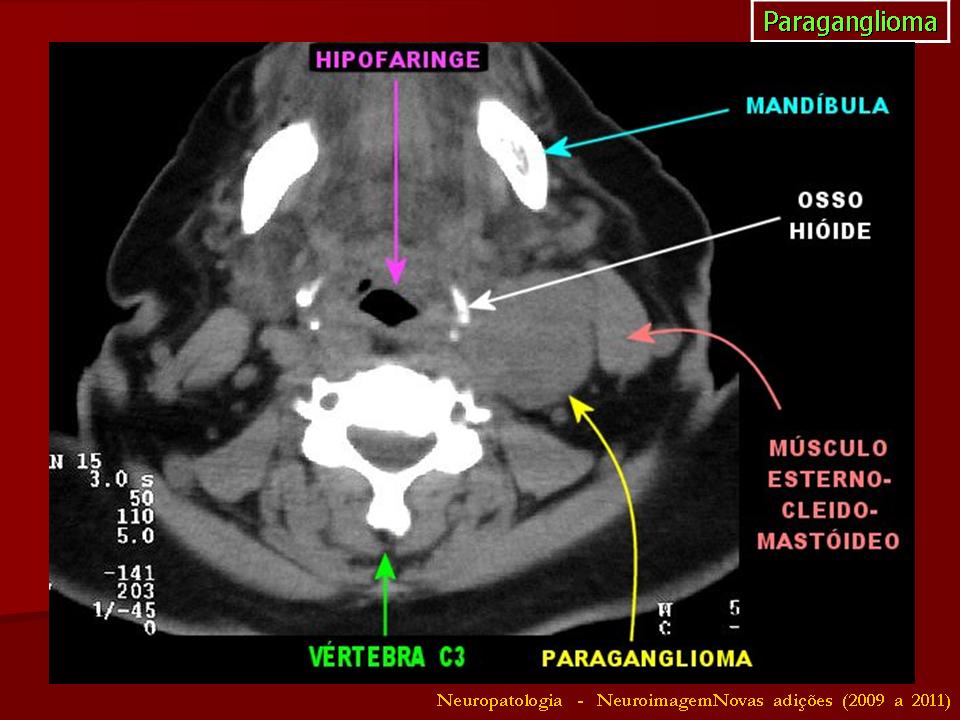
Тактику хирургического вмешательства выбирали с учетом данных инструментальных исследований. В 3 наблюдениях при размере параганглиомы более 5 см и III—IV типе по классификации Л.А. Атанасяна первым этапом производили эндоваскулярную эмболизацию приводящих сосудов и сосудов стромы опухоли с применением неадгезивной композиции (Onyx-18 фирмы «Covidien»; рис. 3). Рис. 3. Ангиограммы. Параганглиома до (а) и после (б) эмболизации сосудов, питающих опухоль.
Открытое вмешательство по удалению опухоли выполняли через сутки. Всего предпринято 9 оперативных вмешательств по удалению параганглиомы шеи.
В послеоперационном периоде проводили МСКТ для уточнения радикальности вмешательства.
Техника операций
Операции проводили под эндотрахеальным наркозом. Доступ вдоль переднего края грудиноключично-сосцевидной мышцы от верхушки сосцевидного отростка височной кости до рукоятки грудины.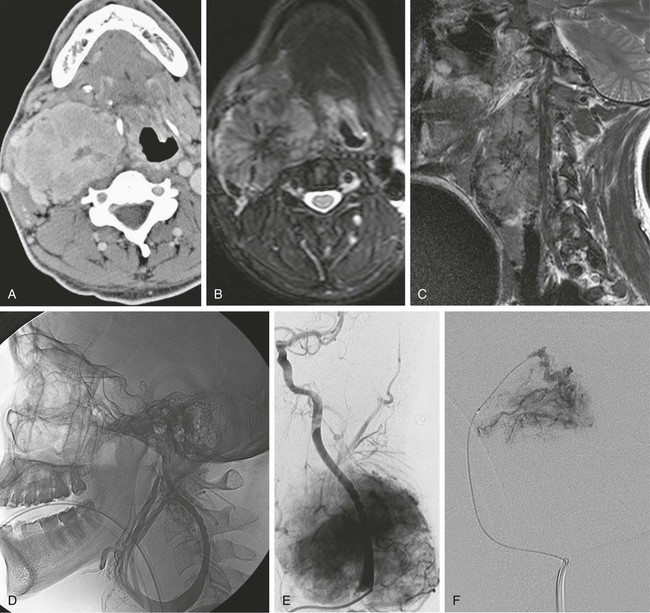 При необходимости пересекали заднее брюшко двубрюшной мышцы и удаляли часть шиловидного отростка. При всех вариантах локализации параганглиомы первоначально поэтапно выделяли ОСА, ВСА и НСА соответственно ниже и выше опухоли и брали их на держалки. Вторым этапом выделяли опухоль по передней и боковым поверхностям, начиная с проксимального отдела (рис. 4). Рис. 4. Интраоперационная фотография. Выделение параганглиомы и сонных артерий. а — выделена параганглиома единым блоком с наружной сонной артерией; б — резецирована наружная сонная артерия; в — внутренняя сонная артерия выделена и взята на держалку; г — общая сонная артерия выделена и взята на держалку.
При необходимости пересекали заднее брюшко двубрюшной мышцы и удаляли часть шиловидного отростка. При всех вариантах локализации параганглиомы первоначально поэтапно выделяли ОСА, ВСА и НСА соответственно ниже и выше опухоли и брали их на держалки. Вторым этапом выделяли опухоль по передней и боковым поверхностям, начиная с проксимального отдела (рис. 4). Рис. 4. Интраоперационная фотография. Выделение параганглиомы и сонных артерий. а — выделена параганглиома единым блоком с наружной сонной артерией; б — резецирована наружная сонная артерия; в — внутренняя сонная артерия выделена и взята на держалку; г — общая сонная артерия выделена и взята на держалку.
Одновременно выделяли ЧН этой области. Дальнейший ход операции определялся типом опухоли и наличием вовлечения в опухолевый процесс сонных артерий. При I типе выделяли на протяжении ВСА и НСА, выполняли резекцию образования. При II типе выделяли ВСА на протяжении от устья до участка артерии, расположенного выше верхнего полюса опухоли. Параганглиому удаляли единым блоком с участком НСА, дистальный и проксимальный концы которой ушивали (рис. 5). Рис. 5. Интраоперационная фотография после удаления параганглиомы шеи с резекцией наружной сонной артерии.
Параганглиому удаляли единым блоком с участком НСА, дистальный и проксимальный концы которой ушивали (рис. 5). Рис. 5. Интраоперационная фотография после удаления параганглиомы шеи с резекцией наружной сонной артерии.
При III и IV типах резецировали опухоль единым блоком с вовлеченными в нее сонными артериями и нервами. Резекцию артерий выполняли выше и ниже границ опухоли с последующим протезированием ВСА синтетическим сосудистым протезом (Carboflo ePTFE Graft). В одном наблюдении при сочетании каротидной параганглиомы и гемодинамически значимого симптомного стеноза ВСА были произведены эверсионная эндартерэктомия ВСА и удаление опухоли.
В послеоперационном периоде пациентам после реконструкции ВСА назначали двойную антиагрегантную терапию в течение 3 мес. После оперативного вмешательства пациенты были осмотрены невропатологом, онкологом и оториноларингологом для выявления возможных осложнений вмешательства и определения дальнейшей тактики лечения и реабилитации.
У 8 из 9 оперированных больных удалось радикально удалить опухоль. В одном наблюдении вагальная параганглиома распространялась до каменистого отдела ВСА — опухоль удалена до основания черепа. Оставлен участок образования объемом до 1 см, уходящий в канал височной кости.
В одном наблюдении вагальная параганглиома распространялась до каменистого отдела ВСА — опухоль удалена до основания черепа. Оставлен участок образования объемом до 1 см, уходящий в канал височной кости.
Радикальность удаления у пациентов была подтверждена данными МСКТ (рис. 6). Рис. 6. Мультиспиральная компьютерная ангиограмма. Состояние после удаления параганглиомы шеи с резекцией наружной сонной артерии.
При гистологическом исследовании диагноз параганглиомы шеи был верифицирован во всех наблюдениях. Реконструкция ВСА выполнена в 5 наблюдениях (4 протезирования и 1 эверсионная эндартерэктомия ВСА). Интраоперационная кровопотеря составила от 100 до 500 мл (в среднем 200 мл). При проведении операции и в ближайшем послеоперационном периоде случаев летального исхода и ишемического инсульта не было.
Клинические проявления повреждений различных ЧН каудальной группы после проведения операции наблюдали у 3 (33,3%) больных, что было неизбежным осложнением хирургического вмешательства. С учетом 4 наблюдений пареза гортани и мягкого неба, отмечавшихся при поступлении в стационар после ранее проведенной ревизии или вследствие компрессии нервов опухолью, общее количество нарушений функции ЧН составило 77,8%. У всех больных послеоперационный период протекал удовлетворительно. Пациенты выписаны под наблюдение онколога. Адъювантных методов лечения (лучевая терапия, химиотерапия) на амбулаторном этапе не проводили. При симптомах поражения IX—XII ЧН пациентам проводили восстановительное лечение под наблюдением невролога и афазиолога.
С учетом 4 наблюдений пареза гортани и мягкого неба, отмечавшихся при поступлении в стационар после ранее проведенной ревизии или вследствие компрессии нервов опухолью, общее количество нарушений функции ЧН составило 77,8%. У всех больных послеоперационный период протекал удовлетворительно. Пациенты выписаны под наблюдение онколога. Адъювантных методов лечения (лучевая терапия, химиотерапия) на амбулаторном этапе не проводили. При симптомах поражения IX—XII ЧН пациентам проводили восстановительное лечение под наблюдением невролога и афазиолога.
В отдаленном периоде прослежена судьба 7 пациентов, катамнез составил от 6 до 24 мес. По данным ультразвукового контроля и компьютерной томографии рецидивов опухоли не выявлено. Проходимость ВСА сохранена во всех наблюдениях, данных о стенозе анастомоза и синтетических сосудистых протезов на протяжении не выявлено. Клинических проявлений ишемии головного мозга не отмечалось. У 6 пациентов с повреждением каудальной группы ЧН сохранялись незначительные нарушения глотания или фонации, не препятствующие трудовой деятельности и повседневной жизни.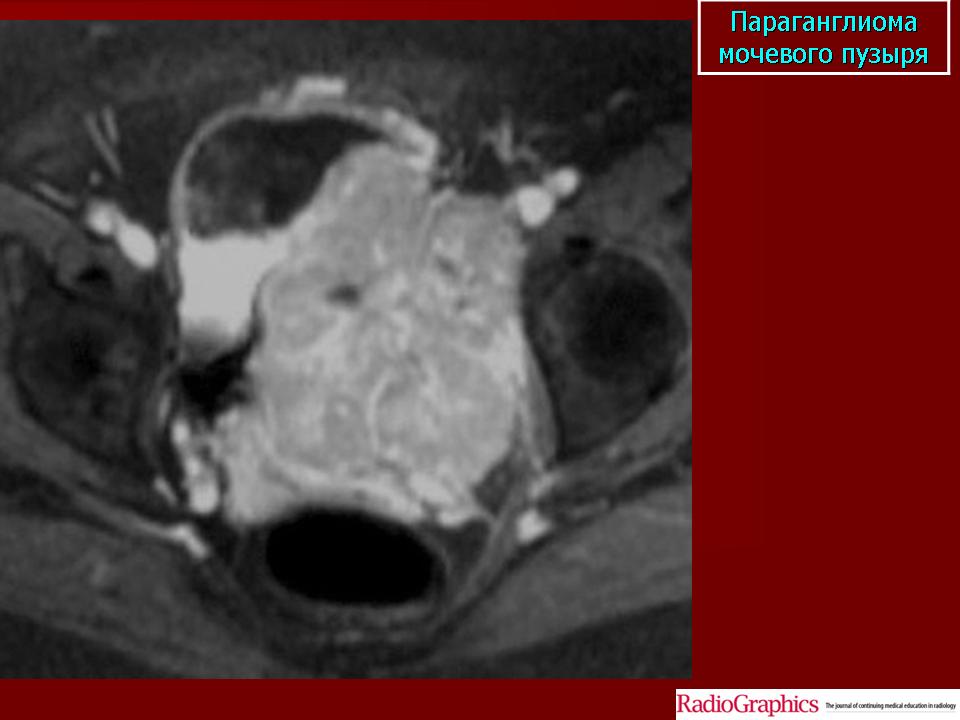
Вследствие большой редкости параганглиом шеи и ошибок при их диагностике более 50% больных первоначально оперируют в неспециализированных учреждениях [8, 18]. У 66% из них попытка удаления параганглиомы заканчивается только ревизией [8], у 7,7—9,4% хирургическое вмешательство имеет нерадикальный характер [8]. Как правило, операции в таких ситуациях сопровождаются серьезными осложнениями и усложняют повторное хирургическое вмешательство [8]. Частота осложнений обусловлена в первую очередь числом повреждений и перевязки магистральных сосудов при выделении опухоли [8, 12]. Мы наблюдали 4 подобных больных, что составило 44,4%. У всех имелись осложнения первичного вмешательства в виде остаточных проявлений ишемического инсульта или повреждения Ч.Н. Возникающий рубцовый процесс при этом значительно осложнял выделение магистральных сосудов шеи, ЧН и самой опухоли при последующей операции. Мы поддерживаем следующие выводы Е.Г. Матякина и соавт.: «…максимальная радикальность и безопасность иссечения параганглиом шеи возможны лишь при бескомпромиссной резекции с последующим восстановлением вовлеченных в опухоль сосудов, а реконструктивные вмешательства на сонных артериях расширяют возможности радикального удаления параганглиомы».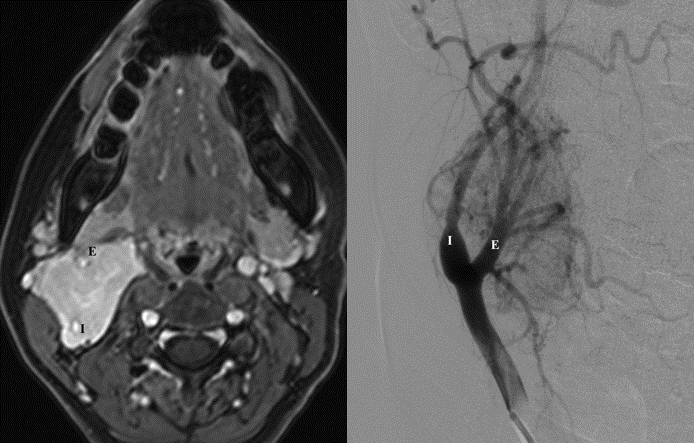
При проведении оперативных вмешательств при параганглиомах шеи III и IV типов мы не пытались выделять сонные артерии из стромы опухоли: артерии выделяли проксимальнее и дистальнее образования. Опухоль удаляли единым блоком, выполняя резекцию развилки ОСА с последующим протезированием ВСА. Подобные операции всегда влекут за собой пересечение ЧН каудальной группы с развитием пареза гортани, мягкого неба, нарушением фонации и дизартрией [8]. В связи с этим при выделении опухоли мы всегда максимально бережно выделяем нервы этой зоны и стараемся сохранить все ЧН, не вовлеченные в опухолевый процесс. Режим максимального сбережения этих структур в сочетании с комплексным лечением под наблюдением невропатолога и логопеда в послеоперационном периоде позволяет максимально нивелировать последствия операции и привести пациента к полноценной социальной адаптации.
Мы разделяем мнение ряда авторов о необходимости выполнения первым этапом эмболизации питающих параганглиому сосудов [4, 6, 8, 16]. По нашим данным, эндоваскулярная эмболизация приводящих сосудов и сосудов стромы опухоли с применением неадгезивной композиции (Onyx-18 фирмы «Covidien») значительно уменьшает кровоточивость из тканей параганглиомы при ее выделении, что дает возможность уменьшить интраоперационную кровопотерю и максимально сохранить анатомическую целостность окружающих органов и тканей. При этом мы не считаем целесообразным проведение эмболизации при небольшом размере (до 40 мм) параганглиомы I и II типов по классификации Л.А. Атанасяна. По нашему опыту, радикальное удаление таких образований не сопряжено с техническими трудностями.
По нашим данным, эндоваскулярная эмболизация приводящих сосудов и сосудов стромы опухоли с применением неадгезивной композиции (Onyx-18 фирмы «Covidien») значительно уменьшает кровоточивость из тканей параганглиомы при ее выделении, что дает возможность уменьшить интраоперационную кровопотерю и максимально сохранить анатомическую целостность окружающих органов и тканей. При этом мы не считаем целесообразным проведение эмболизации при небольшом размере (до 40 мм) параганглиомы I и II типов по классификации Л.А. Атанасяна. По нашему опыту, радикальное удаление таких образований не сопряжено с техническими трудностями.
Учитывая специфические особенности хирургической техники, требующей навыков сосудистой реконструкции, хороших знаний анатомии ЧН этой зоны, навыков работы с периферическими нервами, а также наличие возможности эндоваскулярных вмешательств, мы поддерживаем мнение ряда авторов [8, 16, 17] о целесообразности проведения оперативного удаления параганглиом шеи только в специализированных стационарах.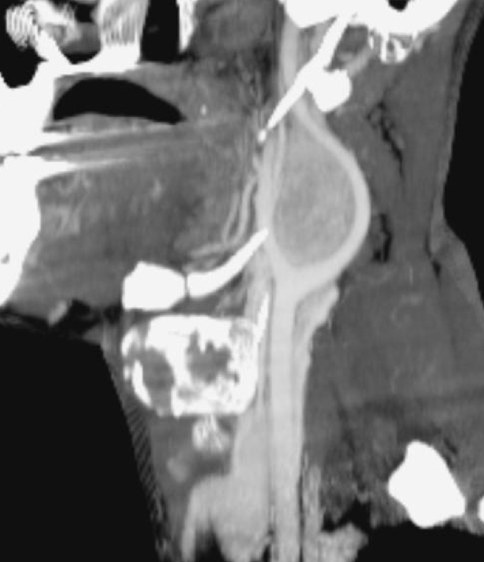 Принимая во внимание бурное развитие в нашей стране сосудистой нейрохирургии, мы считаем оправданным проведение хирургического лечения больных с параганглиомами шеи на базе крупных нейрососудистых отделений. Наш опыт показывает, что сочетание ангио- и нейрохирургических навыков позволяет достичь хороших результатов в лечении больных с этим редким и сложным заболеванием.
Принимая во внимание бурное развитие в нашей стране сосудистой нейрохирургии, мы считаем оправданным проведение хирургического лечения больных с параганглиомами шеи на базе крупных нейрососудистых отделений. Наш опыт показывает, что сочетание ангио- и нейрохирургических навыков позволяет достичь хороших результатов в лечении больных с этим редким и сложным заболеванием.
Таким образом, параганглиома шеи — редкое заболевание, с которым могут столкнуться врачи разных специальностей. При использовании современных методов диагностики установление диагноза не представляет большой сложности. При выявлении параганглиомы показано ее хирургическое удаление. Предварительная эмболизация сосудов стромы новообразования и афферентного сосуда уменьшает интраоперационную кровопотерю и показана при большом размере параганглиомы и анатомически неблагоприятном ее расположении. Для обеспечения максимальной радикальности и абластичности при хирургических вмешательствах по поводу распространенных параганглиом необходимо удалять опухоль единым блоком с вовлеченными в нее сосудами с последующим протезированием внутренней сонной артерии. Максимально бережное отношение к каудальной группе черепных нервов, прилежащих к новообразованию или вовлеченных в него, позволяет в послеоперационном периоде свести к минимуму неврологические осложнения. Целесообразно проводить оперативное вмешательство при параганглиоме шеи только в специализированных стационарах, располагающих опытом ангио- и нейрохирургических вмешательств.
Максимально бережное отношение к каудальной группе черепных нервов, прилежащих к новообразованию или вовлеченных в него, позволяет в послеоперационном периоде свести к минимуму неврологические осложнения. Целесообразно проводить оперативное вмешательство при параганглиоме шеи только в специализированных стационарах, располагающих опытом ангио- и нейрохирургических вмешательств.
Авторы заявляют об отсутствии конфликта интересов.
*e-mail: [email protected]
Параганглиомы головы и шеи: эпидемиология, лучевая диагностика, лечение | Каштанова
1. Meli G.A., Chiaramonte R., Cavallaro T., Puglisi C., Pero G. Carotid body paraganglioma. Diagnosis and treatment by angiography. Neuroradiol. J. 2006; 19: 645–648.
2. Chapman D.B., Lippert D., Geer C.P., Edwards H.D., Russell G.B., Rees C.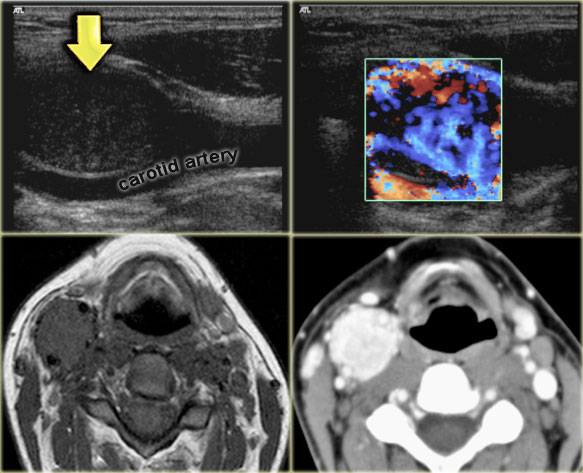 J., Browne J.D. Clinical, histopathologic, and radiographic indicators of malignancy in head and neck paragangliomas. Otolaryngol. Head Neck Surg. 2010; 143: 531–537. DOI:10.1016/j.otohns.2010.05.031.
J., Browne J.D. Clinical, histopathologic, and radiographic indicators of malignancy in head and neck paragangliomas. Otolaryngol. Head Neck Surg. 2010; 143: 531–537. DOI:10.1016/j.otohns.2010.05.031.
3. Boedeker C.C., Ridder G.J., Schipper J. Paragangliomas of the head and neck: diagnosis and treatment. Familial Cancer. 2005; 4: 55–59. DOI:10.1007/s10689-004-2154-z.
4. Mediouni A., Ammari S., Wassef M., GimenezRoqueplo A.P., Laredo J.D., Duet M., Tran Ba Huy P., Oker N. Malignant head/neck paragangliomas. Comparative study. Eur. Ann. Otorhinolaryngol. Head Neck Dis. 2014; 131(3): 159–166. DOI: 10.1016/j.anorl.2013.05.003.
5. Kaklikkaya I., Imamoglu M., Isik A.U., Ozcan F. Carotid body tumors. Turk. J. Thorac. Cardiovasc. Surg. 1998; 6: 323–329.
6. Шубин А.А. Ангиохирургические аспекты лечения хемо дектом шеи: Дисс. … д-ра мед. наук. М., 2003. 314 с. Shubin A.A. Angiosurgical aspects of treatment chemodectomas neck: Diss. … Doct. of Med. Sci. Moscow, 2003. 314 p. (In Russian)
Шубин А.А. Ангиохирургические аспекты лечения хемо дектом шеи: Дисс. … д-ра мед. наук. М., 2003. 314 с. Shubin A.A. Angiosurgical aspects of treatment chemodectomas neck: Diss. … Doct. of Med. Sci. Moscow, 2003. 314 p. (In Russian)
7. Sajid M.S., Hamilton G., Baker D.M.; Joint Vascular Research Group. A Multicenter review of carotid body tumour management. Eur. J. Vasc. Endovasc. Surg. 2007; 34 (2): 127–130.DOI:10.1016/j.ejvs.2007.01.015.
8. Welander J., Andreasson A., Brauckhoff M., Backdahl M., Larsson C., Gimm O., Söderkvist P. Frequent EPAS1/ HIF2α exons 9 and 12 mutations in non-familial pheochromocytoma. Endocr. Relat. Cancer. 2014; 21 (3): 495–504. DOI: 10.1530/ERC-13-0384.
9. Von Haller. Cited by Gratiot J.H. Carotid tumors: A collective review.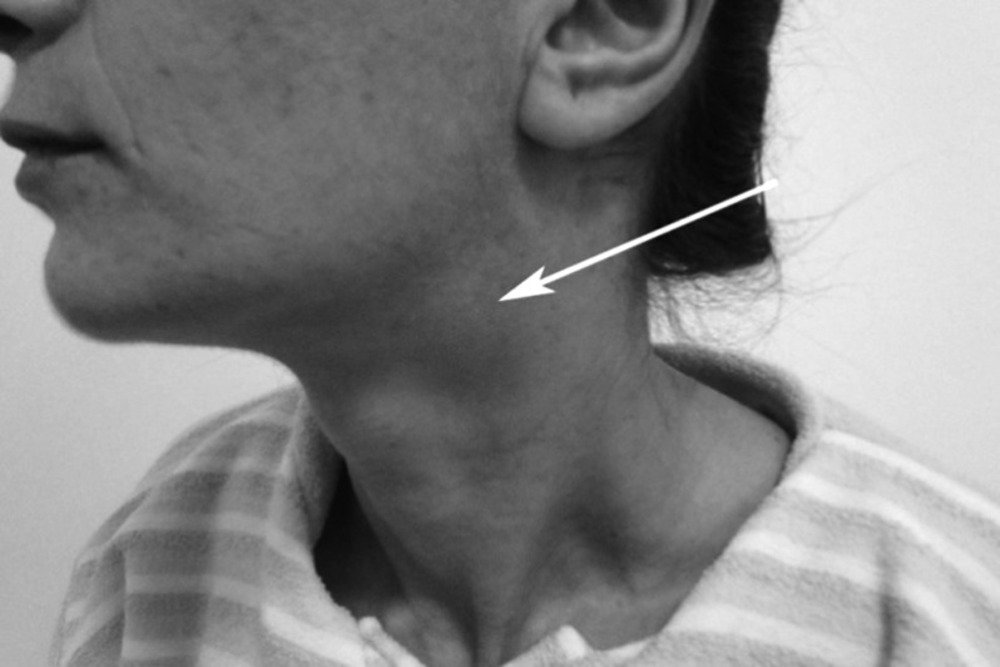 Abstr. Surg. 1943; 7: 117–186.
Abstr. Surg. 1943; 7: 117–186.
10. Glenner G.G., Grimley P. M. Tumors of the extraadrenal paraganglion system, including chemoreceptors // Atlas of Tumor Pathology. Washington, DC: U.S. Armed Forces Institute of Pathology, 1974: 13–33.
11. Zak F.G., Lawson W. Anatomy and topography in the paraganglionic chemoreceptor system. 1st ed. New York: Springer-Verlag, 1982: 15–49.
12. Persky M.S., Setton A., Niimi Y., Hartman J., Frank D., Berenstein A. Combined endovascular and surgical treatment of head and neck paragangliomas. A team approach. Head Neck. 2002; 24: 423–431. DOI:10.1002/hed.10068.
13. Lee J.H., Barich F., Karnell L.H., Robinson R.A., Zhen W.K., Gantz B.J., Hoffman H. T.; American College of Surgeons Commission on Cancer; American Cancer Society. National Cancer Data Base report on malignant paragangliomas of the head and neck. Cancer. 2002; 94 (3): 730–737. DOI 10.1002/cncr.10252.
T.; American College of Surgeons Commission on Cancer; American Cancer Society. National Cancer Data Base report on malignant paragangliomas of the head and neck. Cancer. 2002; 94 (3): 730–737. DOI 10.1002/cncr.10252.
14. Del Guercio L., Narese D., Ferrara D., Butrico L., Padricelli A., Porcellini M. Carotid and vagal body paragangliomas. Transl. Med. UniSa. 2013; 6 (6): 11–15.
15. Szymanska A., Szymanski M., Czekajska-Chehab E., Gołąbek W., Szczerbo-Trojanowska M. Diagnosis and management of multiple paragangliomas of the head and neck. Eur. Arch. Otorhinolaryngol. 2015; 272 (8): 1991–1999. DOI: 10.1007/s00405-014-3126-z.
16. Williams M.D., Tischler A.S. Update from the 4th Edition of the World Health Organization Classification of Head and Neck Tumours: Paragangliomas. Head Neck Pathol. 2017; 11 (1): 88–95. DOI: 10.1007/s12105-017-0786-1.
Head Neck Pathol. 2017; 11 (1): 88–95. DOI: 10.1007/s12105-017-0786-1.
17. Davila V.J., Chang J.M., Stone W.M., Fowl R.J., Bower T.C., Hinni M.L., Money S.R. Current surgical management of carotid body tumors. J. Vasc. Surg. 2016; 64 (6): 1703–1710. DOI: 10.1016/j.jvs.2016.05.076.
18. Langerman A., Athavale S.M., Rangarajan S.V., Sinard R.J., Netterville J.L. Natural history of cervical paragangliomas: outcomes of observation of 43 patients. Arch Otolaryngol. Head Neck Surg. 2012; 1383 (4): 341–345. DOI: 10.1001/archoto.2012.37.
19. Papaspyrou K., Mewes T., Rossmann H., Fottner C., Schneider-Raetzke B., Bartsch O., Schreckenberger M., Lackner K.J., Amedee R.G., Mann W.J. Head and neck paragangliomas: Report of 175 patients (1989–2010). Head Neck. 2012; 34 (5): 632–637. DOI:10.1002/hed.21790.
DOI:10.1002/hed.21790.
20. Mhatre A.N., Li Y., Gasperin A., Lalwani A.K. SDHB, SDHC, and SDHD mutation screen in sporadic and familial head and neck paragangliomas. Clin. Genet. 2004; 66: 461–466. DOI: 10.1111/j.1399-0004.2004.00328.x.
21. Burnichon N., Brière J.J., Libè R., Vescovo L., Rivière J., Tissier F., Jouanno E., Jeunemaitre X., Bénit P., Tzagoloff A., Rustin P., Bertherat J., Favier J., GimenezRoqueplo A.P. SDHA is a tumor suppressor gene causing paraganglioma. Hum. Mol. Genet. 2010; 19: 3011–3020. DOI: 10.1093/hmg/ddq206.
22. Martucci V., Pacak K. Pheochromocytoma and paraganglioma: diagnosis, genetics, management, and treatment. Curr. Probl. Cancer. 2014; 38 (1): 7–41. DOI:10.1016/j.currproblcancer.2014.01.001.
23. Thabet M.H., Kotob H. Cervical paragangliomas: diagnosis, management and complications. J. Laryngol. Otol. 2001; 115: 467–474.
Thabet M.H., Kotob H. Cervical paragangliomas: diagnosis, management and complications. J. Laryngol. Otol. 2001; 115: 467–474.
24. Lee K.Y., Oh Y.W., Noh H.J., Lee Y.J., Yong H.S., Kang E.U., Kim K.A., Lee N.J. Extraadrenal paragangliomas of the body: imaging features. Am. J. Roentgenol. 2006; 187 (2): 492–504. DOI: 10.2214/AJR.05.0370.
25. Myssiorek D., Ferlito A., Silver C.E., Rodrigo J.P., Baysal B.E., Fagan J.J., Suarez C., Rinaldo A. Screening for familial paragangliomas. Oral. Oncol. 2008; 44: 532–537. DOI: 10.1016/j.oraloncology.2007.06.010.
26. Jansen J.C., van den Berg R., Kuiper A., van der Mey A.G., Zwinderman A.H., Cornelisse C.J. Estimation of growth rate in patients with head and neck paragangliomas influences the treatment proposal. Cancer. 2000; 88: 2811–2816.
2000; 88: 2811–2816.
27. Атанасян Л.А. Хемодектома. М.: Медицина,1969. 62 с. Atanasyan L. A. Chemodectoma. M.: Meditsina, 1969. 62 p. (In Russian)
28. O’Neill S., O’Donnell M., Harkin D., Loughrey M., Lee B., Blair P. A 22-year northern Irish experience of carotid body tumours. Ulster Med. J. 2011; 80 (3): 133–140.
29. Кармазановский Г.Г., Никитаев Н.С., Дан В.Н., Яшина Н.И., Шубин А.А., Щеголев А.И. Спиральная КТ в диагностике опухолей и других объемных образований в развилке сонных артерий. Медицинская визуализация. 2002; 1: 39–46. Karmazanovsky G.G., NikitaevN.S., Dan V.N., Yashina N.I., Shubin A.A., Shchegolev A.I. Spiral CT in Diagnosis of Tumors and Volume Neoplasms in Bifurcation of Carotid Arteries. Medical Visualization. 2002; 1: 39–46. (In Russian)
30. Назимок Е.В., Сафронов С.Н., Крутова Т.В. Дифференциальная ультразвуковая диагностика каротидных хемо дектом и других опухолевых образований шеи. Здравоохранение Таджикистана. 2013; 3: 61–66. Nazimok E.V., Safronov S.N., Krutova T.V. Differential diagnosis of carotid chemodectоmа and other tumors of the neck by ultrasound. Zdravoohranenie Tadzhikistana. 2013; 3: 61–66. (In Russian)
Назимок Е.В., Сафронов С.Н., Крутова Т.В. Дифференциальная ультразвуковая диагностика каротидных хемо дектом и других опухолевых образований шеи. Здравоохранение Таджикистана. 2013; 3: 61–66. Nazimok E.V., Safronov S.N., Krutova T.V. Differential diagnosis of carotid chemodectоmа and other tumors of the neck by ultrasound. Zdravoohranenie Tadzhikistana. 2013; 3: 61–66. (In Russian)
31. Jianu D.C., Jianu S.N., Motoc A.G., Dan T.F., Poenaru M., Tăban S., Cretu O.M. An evaluation on multidisciplinary management of carotid body paragangliomas: a report of seven cases. Rom. J. Morphol. Embryol. 2016; 57 (2): 853–859.
32. Berk M. Chemodektoma of the glomus intervagale: case report and review. Clin. Radial. 1961; 12: 219–226.
33. Аракелян В.С., Газимагомедов З. И., Абдулгасанов Р.А. Диагностика и результаты хирургического лечения каротидных хемодектом. Креативная кардиология. 2015; 2: 72–80. DOI: 10.15275/kreatkard.2015.02.07. Arakelyan V.S., Gazimagomedov Z.I., Abdulgasanov R.A. The results of diagnosis and surgical treatment of carotid chemodectomas. Kreativnaya kardiologiya. 2015; 2: 72–80. (In Russian). DOI: 10.15275/kreatkard.2015.02.07.
И., Абдулгасанов Р.А. Диагностика и результаты хирургического лечения каротидных хемодектом. Креативная кардиология. 2015; 2: 72–80. DOI: 10.15275/kreatkard.2015.02.07. Arakelyan V.S., Gazimagomedov Z.I., Abdulgasanov R.A. The results of diagnosis and surgical treatment of carotid chemodectomas. Kreativnaya kardiologiya. 2015; 2: 72–80. (In Russian). DOI: 10.15275/kreatkard.2015.02.07.
34. Белоцерковский И.В., Акинфеев В.В., Жуковец А.Г., Тризна Н.М. Хирургическое лечение параганглиом шеи. Опухоли головы и шеи. 2011; 3: 26–31. Belotserkovsky I.V., Akinfeev V.V., Zhukovec A.G, Trizna N.M. Surgical treatment of the paragangliomas of the neck. Opukholi golovy i shei. 2011; 3: 26–31. (In Russian)
35. Газимагомедов З.И. Параганглиомы шеи. Креативная кардиология. 2015; 1: 56–65. DOI: 10.15275/kreatkard.2015.01.06. Gazimagomedov Z.I. Paragangliomas of the neck. Kreativnaya kardiologiya. 2015; 1: 56–65. (In Russian) DOI: 10.15275/kreatkard.2015.01.06.
Kreativnaya kardiologiya. 2015; 1: 56–65. (In Russian) DOI: 10.15275/kreatkard.2015.01.06.
36. Lim J.Y., Kim J., Kim S.H., Lee S., Lim Y.C., Kim J.W., Choi E.C. Surgical treatment of carotid body paragangliomas: outcomes and complications according to the Shamblin classification. Clin. Exp. Otorhinolaryngol. 2010; 3: 91–95. DOI: 10.3342/ceo.2010.3.2.91.
37. Olsen W.L., Dillon W.P., Kelly W.M., Norman D., BrantZawadzki M., Newton T.H. MR imaging of paragangliomas. Am. J. Roentgenol. 1987; 148: 201–204. DOI:10.2214/ajr.148.1.201.
38. Wieneke J.A., Smith A. Paraganglioma: carotid body tumor. Head Neck Pathol. 2009; 3 (4): 303–306. DOI: 10.1007/s12105-009-0130-5.
39. Gravel G.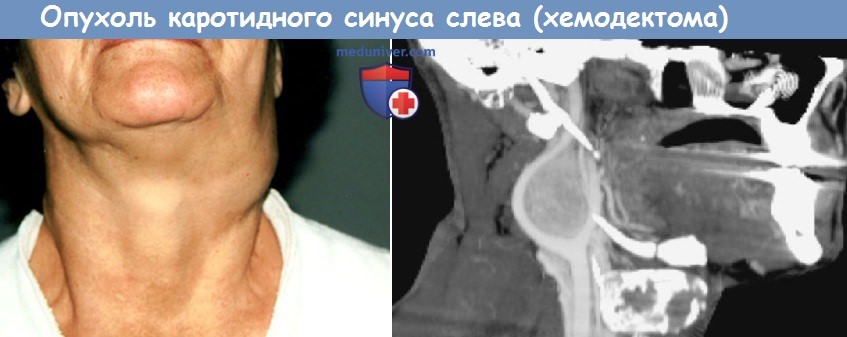 , Niccoli P., Rohmer V., Moulin G., BorsonChazot F., Rousset P., Pasco-Papon A., Marcus C., Dubrulle F., Gouya H., Bidault F., Dupas B., Gabrillargues J., Caumont-Prim A., Hernigou A., Gimenez-Roqueplo A., Halimi P. The value of a rapid contrast-enhanced angioMRI protocol in the detection of head and neck paragangliomas in SDHx mutations carriers: a retrospective study on behalf of the PGL.EVA investigators. Eur. Radiol. 2016; 26 (6): 1696–1704. DOI 10.1007/s00330-015-4024-5.
, Niccoli P., Rohmer V., Moulin G., BorsonChazot F., Rousset P., Pasco-Papon A., Marcus C., Dubrulle F., Gouya H., Bidault F., Dupas B., Gabrillargues J., Caumont-Prim A., Hernigou A., Gimenez-Roqueplo A., Halimi P. The value of a rapid contrast-enhanced angioMRI protocol in the detection of head and neck paragangliomas in SDHx mutations carriers: a retrospective study on behalf of the PGL.EVA investigators. Eur. Radiol. 2016; 26 (6): 1696–1704. DOI 10.1007/s00330-015-4024-5.
40. van den Berg R., Verbist B.M., Mertens B.J., van der Mey A.G., van Buchem M.A. Head and neck paragangliomas: improved tumor detection using contrast-enhanced 3D time-of-flight MR angiography as compared with fatsuppressed MR imaging techniques. Am. J. Neuro radiol. 2004; 25 (5): 863–870.
41. Capatina C., Ntali G., Karavitaki N., Grossman A.B. The management of head-and neck paragangliomas. Endocr. Relat. Cancer. 2013; 20: 291–305. DOI: 10.1530/ERC-13-0223.
Endocr. Relat. Cancer. 2013; 20: 291–305. DOI: 10.1530/ERC-13-0223.
42. Hamersley E.R., Barrows A., Perez A., Schroeder A., Castle J.T. Malignant Vagal Paraganglioma. Head Neck. Pathol. 2016; 10 (2): 201–205. DOI: 10.1007/s12105-015-0621-5.
43. Tong Y. Role of duplex ultrasound in the diagnosis and assessment of carotid body tumour: A literature review. Intractable Rare Dis. Res. 2012; 1 (3): 129–133. DOI: 10.5582/irdr.v1.3.129.
44. White G., Forbes M., Busch K., Harris J.P., Makeham V. Carotid body tumour or not. Ultrasound diagnostic features. Vascular 2007 Conference Handbook & Book of Abstracts. Melbourne, Australia, 2007. 72.
45. Offergeld C., Brase C., Yaremchuk S. , Mader I., Rischke H.C., Gläsker S., Schmid K.W., Wiech T., Preuss S.F., Suárez C., Kopec T., Patocs A., Wohllk N., Malekpour M., Boedeker C.C., Neumann H.P. Head and neck paragangliomas: clinical and molecular genetic classification. Clinics (Sao Paulo). 2012; 67: 19–28.
, Mader I., Rischke H.C., Gläsker S., Schmid K.W., Wiech T., Preuss S.F., Suárez C., Kopec T., Patocs A., Wohllk N., Malekpour M., Boedeker C.C., Neumann H.P. Head and neck paragangliomas: clinical and molecular genetic classification. Clinics (Sao Paulo). 2012; 67: 19–28.
46. Dickens W.J., Million R.R., Cassisi N.J., Singleton G.T. Chemodectomas arising in temporal bone structures. Laryngoscope. 1982; 92 (2): 188–191.
47. Gulya A.J. The glomus tumor and its biology. Laryngoscope. 1993; 103 (11, Pt 2, Suppl. 60): 7–15.
48. Brown J.S. Glomus jugulare tumors. Methods and difficulties of diagnosis and surgical treatment. Laryngoscope. 1967; 77 (1): 26–67. DOI: 10.1288/00005537-196701000-00004.
49. Mohan S., Hoeffner E., Bigelow D.C., Loevner L.A. Applications of magnetic resonance imaging in adult temporal bone disorders. Magn. Reson. Imaging Clin. N. Am. 2012; 20 (3): 545–572. DOI: 10.1016/j.mric.2012.06.001.
Mohan S., Hoeffner E., Bigelow D.C., Loevner L.A. Applications of magnetic resonance imaging in adult temporal bone disorders. Magn. Reson. Imaging Clin. N. Am. 2012; 20 (3): 545–572. DOI: 10.1016/j.mric.2012.06.001.
50. Subedi N., Prestwich R., Chowdhury F., Patel C., Scarsbrook A. Neuroendocrine tumours of the head and neck: anatomical, functional and molecular imaging and contemporary management. Cancer Imaging. 2013; 13 (3): 407–422. DOI:10.1102/1470-7330.2013.0034.
51. Devuyst L., Defreyne L., Praet M., Geukens S., Dhooge I. Treatment of glomus tympanicum tumors by preoperative embolization and total surgical resection. Am. J. Otolaryngol. 2016; 37 (6): 544–551. DOI: 10.1016/j.amjoto.2016.08.011.
52. Neves F., Huwart L., Jourdan G., Reizine D., Herman P.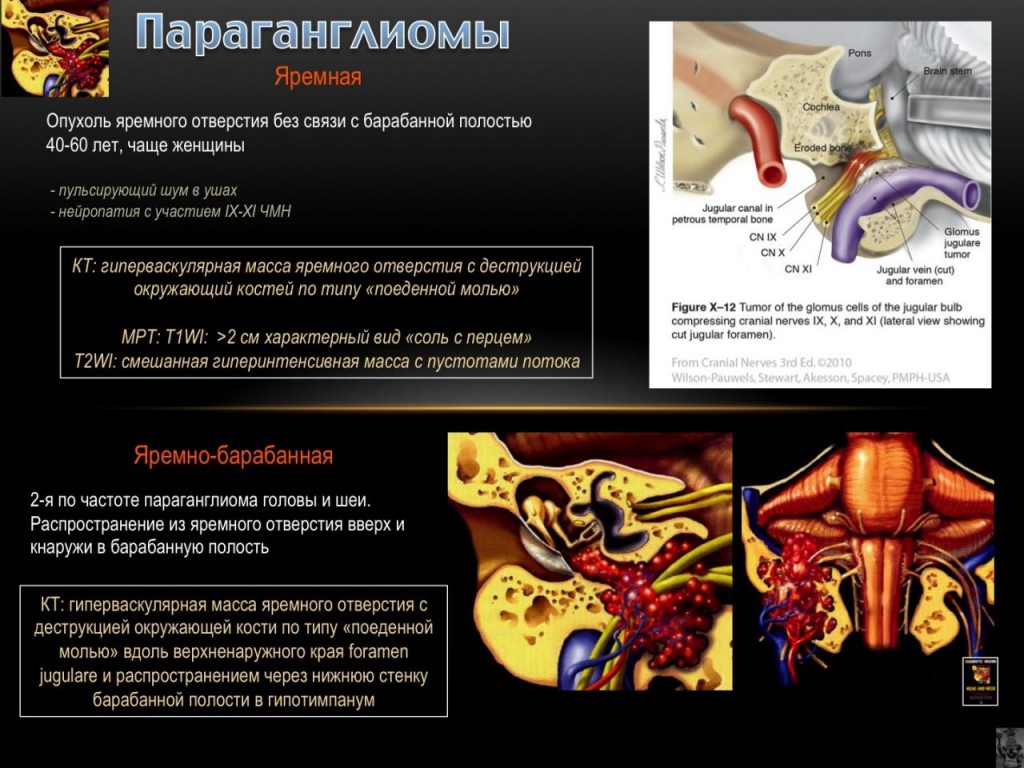 , Vicaut E., Guichard J.P. Head and neck paragangliomas: value of contrast-enhanced 3D MR angiography. Am. J. Neuroradiol. 2008; 29: 883–889. DOI: 10.3174/ajnr.A0948.
, Vicaut E., Guichard J.P. Head and neck paragangliomas: value of contrast-enhanced 3D MR angiography. Am. J. Neuroradiol. 2008; 29: 883–889. DOI: 10.3174/ajnr.A0948.
53. Luna-Ortiz K., Rason-Ortiz M., Villavicencio-Valencia V., Herrera-Gomez A. Does Shamblin’s classification predict postoperative morbidity in carotid body tumors? A proposal to modify Shamblin’s classification? Eur. Arch. Otorhinolaryngol. 2006; 2: 171–175. DOI: 10.1007/s00405-005-0968-4.
54. Reigner. Cited by Lahey F.H., Warren K.W. A long-term appraisal of carotid tumors with remarks on their removal. Surg. Gynecol. Obstet. 1951; 92: 481–491.
55. Maydl. Cited by Byme J.J. Carotid body and allied tumors. Am. J. Surg. 1958; 95: 371–384.
56. Muhm M., Polterauer P., Gstottner W., Temmel A., Richling B., Undt G.,Niederle B., Staudacher M., Ehringer H. Diagnostic and therapeutic approaches to carotid body tumors: review of 24 patients. Arch. Surg. 1997; 132 (3): 279–284.
Muhm M., Polterauer P., Gstottner W., Temmel A., Richling B., Undt G.,Niederle B., Staudacher M., Ehringer H. Diagnostic and therapeutic approaches to carotid body tumors: review of 24 patients. Arch. Surg. 1997; 132 (3): 279–284.
57. Gordon-Taylor G. On carotid tumours. Br. J. Surg. 1940; 28 (110): 163–172.
58. Shamblin W.R., Remine W.H., Sheps S.G., Harrison E.G. Carotid body tumor (chemodectoma). Clinicophatologic analysis of 90 cases. Am. J. Surg. 1971; 122 (6): 732–739.
59. Ma Y., Huang D., Liu L., Xiang M., Oghagbon E.K., Zhai S. Surgical treatment of carotid body tumour: a report of 39 cases and a new classification of carotid body tumour: our experience. Clin. Otolaryngol. 2014; 39 (4): 254–257. DOI: 10.1111/coa.12267.
60. Дан В.Н., Матякин Е.Г., Коков Л.С., Кармазановский Г.Г. Предварительная эмболизация при хирургическом лечении хемодектом шеи. Ангиология и сосудистая хирургия. 2000; 6 (2): 109–115. Dan V.N., Matjakin E.G., Kokov L.S., Karmazanovsky G.G. Preliminary embolization during surgical treatment with chemodectoma of the neck. Angiologiya i sosudistaya khirurgiya. 2000; 6 (2): 109–115. (In Russian)
Дан В.Н., Матякин Е.Г., Коков Л.С., Кармазановский Г.Г. Предварительная эмболизация при хирургическом лечении хемодектом шеи. Ангиология и сосудистая хирургия. 2000; 6 (2): 109–115. Dan V.N., Matjakin E.G., Kokov L.S., Karmazanovsky G.G. Preliminary embolization during surgical treatment with chemodectoma of the neck. Angiologiya i sosudistaya khirurgiya. 2000; 6 (2): 109–115. (In Russian)
61. Jackson R.S., Myhill J.A., Padhya T.A., McCaffrey J.C., McCaffrey T.V., Mhaskar R.S. The effects of preoperative embolization on carotid body paragangliomas surgery: a systematic review and meta-analysis. Otolaryngol. Head. Neck. Surg. 2015; 153 (6): 943–50. DOI: 10.1177/0194599815605323.
62. Dixon J.L., Atkins M.D., Bohannon W.T., Buckley C.J., Lairmore T.C. Surgical management of carotid body tumors: a 15-year single institution experience employing an interdisciplinary approach.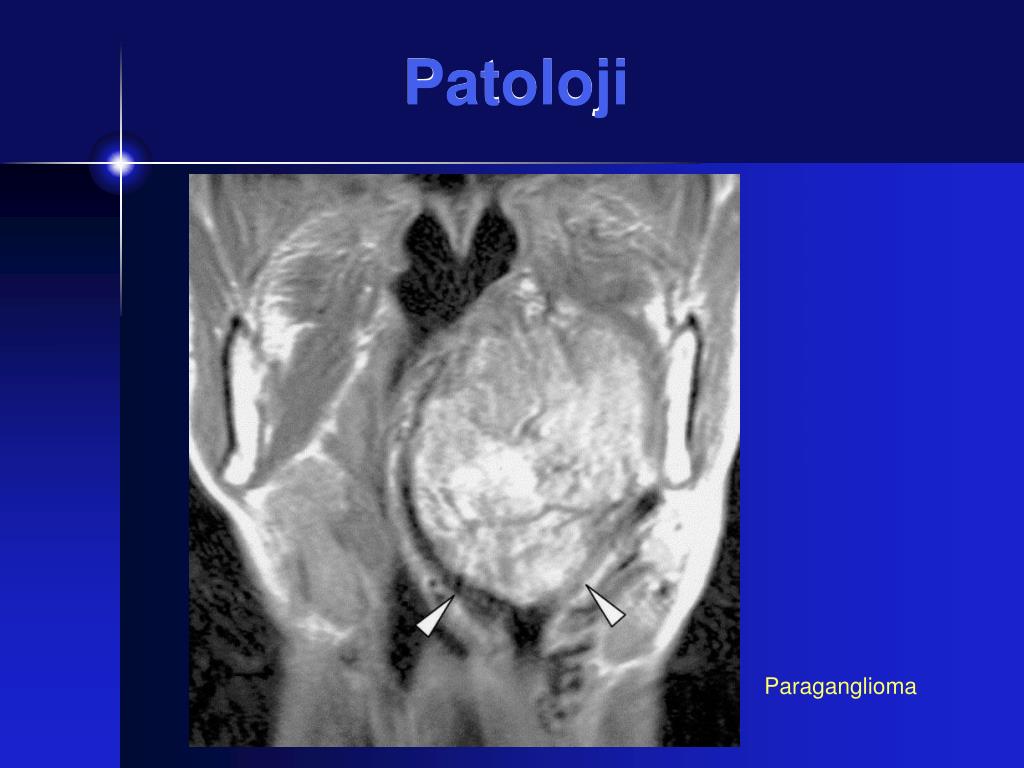 Proc (Bayl. Univ. Med. Cent). 2016; 29 (1): 16–20.
Proc (Bayl. Univ. Med. Cent). 2016; 29 (1): 16–20.
63. Power A.H., Bower T.C., Kasperbauer J., Link M.J., Oderich G., Cloft H., Young WF.Jr., Gloviczki P. Impact of preoperative embolization on outcomes of carotid body tumor resections. J. Vasc. Surg. 2012; 56: 979–989. DOI: 10.1016/j.jvs.2012.03.037.
64. Bercin S., Muderris T., Sevil E., Gul F., Kilicarslan A., Kiris M. Efficiency of preoperative embolization of carotid body tumor. Auris Nasus Larynx. 2015; 42 (3): 226–230. DOI: 10.1016/j.anl.2014.10.013.
65. Bianchi L.C., Marchetti M., Brait L., Bergantin A., Milanesi I., Broggi G., Fariselli L. Paragangliomas of head and neck: a treatment option with CyberKnife radiosurgery. Neurol. Sci. 2009; 30: 479 – 485. DOI: 10.1007/s10072-009-0138-3.
66. Galland-Girodet S., Maire J.P., De-Mones E., Benech J., Bouhoreira K., Protat B., Demeaux H., Darrouzet V., Huchet A. The role of radiation therapy in the management of head and neck paragangliomas: Impact of quality of life versus treatment response. Radiother. Oncol. 2014; 111 (3): 463–467. DOI: 10.1016/j.radonc.2014.06.002.
Galland-Girodet S., Maire J.P., De-Mones E., Benech J., Bouhoreira K., Protat B., Demeaux H., Darrouzet V., Huchet A. The role of radiation therapy in the management of head and neck paragangliomas: Impact of quality of life versus treatment response. Radiother. Oncol. 2014; 111 (3): 463–467. DOI: 10.1016/j.radonc.2014.06.002.
67. Guss Z.D., Batra S., Limb C.J., Li G., Sughrue M.E., Redmond K., Rigamonti D., Parsa A.T., Chang S., Kleinberg L., Lim M. Radiosurgery of glomus jugulare tumors: a meta-analysis. Int. J. Radiation. Oncol. Biol. Phys. 2011; 81: 497–502. DOI: 10.1016/j.ijrobp.2011.05.006.
Параганглиома | Медицинские Диагностические Центры Эксперт
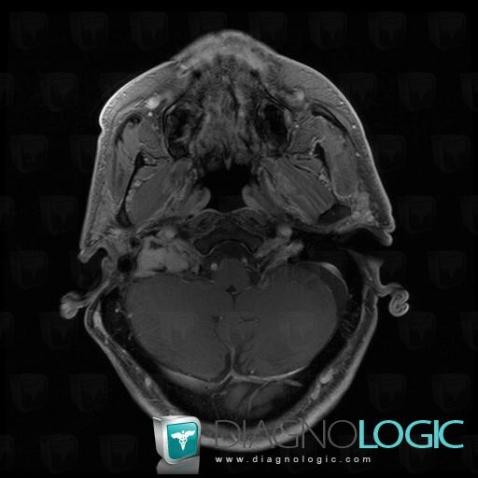
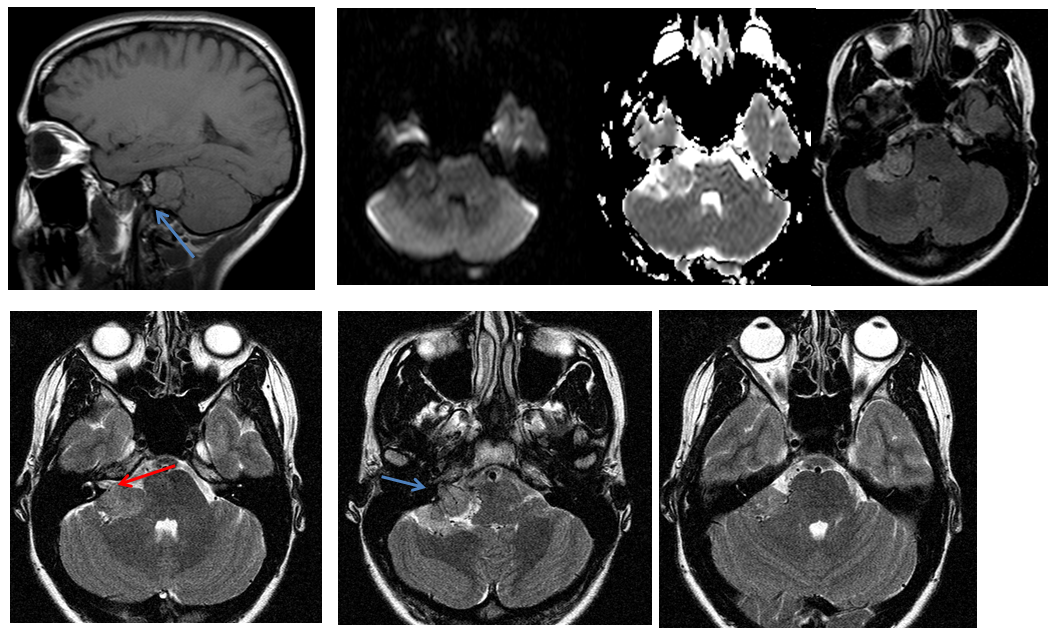
При проведении исследования шейного отдела позвоночника, было выявлено в области яремного отверстия справа образование, с признаками масс-эффекта, вызывающее деформацию внутренней сонной артерии и луковицы яремной вены; имеющего гиперинтенсивный сигнал в режиме Т2 ВИ и Flair изоинтенсивный сигнал на Т1 ВИ, в режиме DWI ограничения диффузии не определялось. Размеры образования 15,2х17,4х18,6 мм. После внутривенного введения контрастирующего вещества («Гадовист» — 15 мл) отмечалось его интенсивное накопление.
Размеры образования 15,2х17,4х18,6 мм. После внутривенного введения контрастирующего вещества («Гадовист» — 15 мл) отмечалось его интенсивное накопление.
Также отмечалась правосторонняя асимметрия гортани, ее деформирование, за счет пластинки перстневидного хряща и голосовой мышцы.
Заключение: Объемное образование краниобазальной области справа параганглиома.
В дальнейшем, при проведении оперативного лечения и гистологического исследования, диагноз был подтвержден.
Параганглиома — это достаточно редкая опухоль, преимущественно доброкачественная, развивающаяся из клеток параганглиев, ассоциированных с симпатическими и парасимпатическими ганглиями, привязанными к таким анатомическим образованиям как аурикулярная ветвь блуждающего нерва (нерв Арнольда), барабанный нерв (ветвь языкоглоточного нерва, нерв Якобсона), луковица яремной вены.
Известная также под названием гломусная опухоль (glomus tumor) Гломусные опухоли как правило, носят спорадический характер, впрочем, вероятность генетической предрасположенности параганглиом достигает 30% у членов семьи заболевшего. Чаще гломусные опухоли образуются в области яремной луковицы (опухоль яремного гломуса) или около барабанного нерва вдоль мыса (опухоль барабанного гломуса). Изредка такие опухоли могут располагаться вдоль барабанных канальцев или части лицевого канала.
Чаще гломусные опухоли образуются в области яремной луковицы (опухоль яремного гломуса) или около барабанного нерва вдоль мыса (опухоль барабанного гломуса). Изредка такие опухоли могут располагаться вдоль барабанных канальцев или части лицевого канала.
В литературе существуют разноречивые данные о частоте злокачественного роста параганглиом шеи. По данным одних авторов, злокачественные опухоли из каротидных телец составляют до 10% . Другие авторы отметили до 20% больных со злокачественной формой параганглиомы. По мнению большинства авторов, при злокачественной параганглиоме метастазы наблюдаются преимущественно в регионарных лимфатических узлах шеи, и значительно реже встречаются отдаленные метастазы – в легких, печени, костях. Распределение по полу отчетливо показывает, что женщины болеют чаще мужчин — 3:1, а дебют заболевания обычно выпадает на пятую и шестую декады жизни.
Частота выявления этих поражений составляет от 2,8 до 10%, причем чаще всего наблюдаются семейные случаи (Ван-Баррз).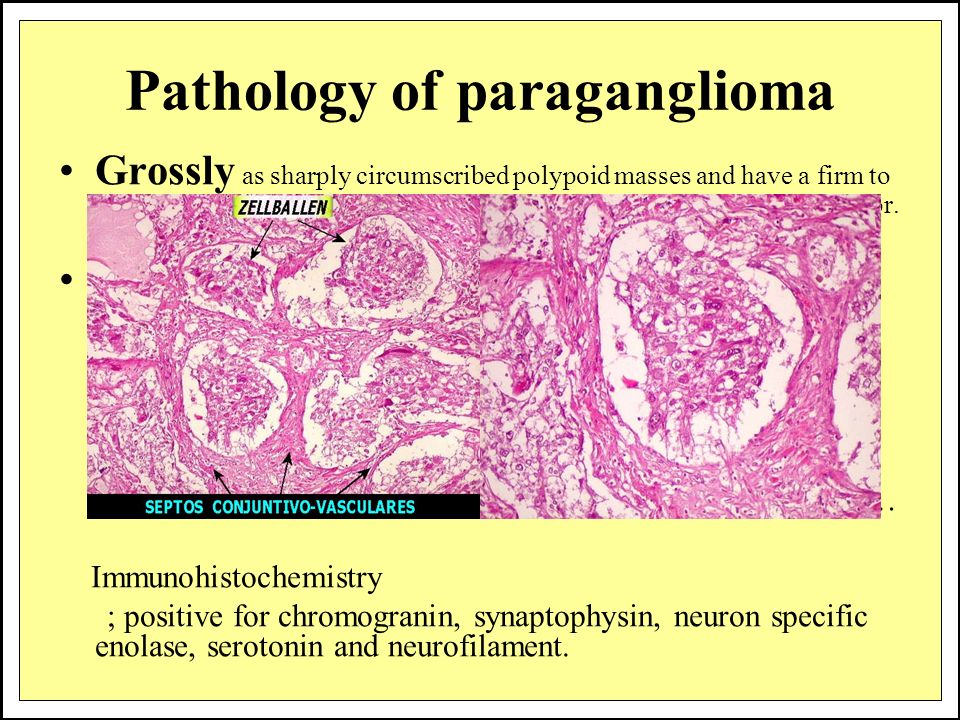 Сообщалось также о выявлении злокачественных опухолей. Смертность больных вследствие развития гломусных опухолей составляет 6%, причем больные погибают вследствие местного прогрессирования этой патологии. Кроме того, доказано, что у 8% пациентов с гломусными опухолями существуют сопутствующие злокачественные образования в других системах органов.
Сообщалось также о выявлении злокачественных опухолей. Смертность больных вследствие развития гломусных опухолей составляет 6%, причем больные погибают вследствие местного прогрессирования этой патологии. Кроме того, доказано, что у 8% пациентов с гломусными опухолями существуют сопутствующие злокачественные образования в других системах органов.
Диагностика параганглиом шеи представляет трудную задачу. До настоящего времени ошибки первичной диагностики параганглиом шеи составляют 25–90% . Трудности диагностики связаны с редкостью заболевания, неосведомленностью врачей об этой патологии, скудностью клинических проявлений, наличием большого количества сходных по клиническим проявлениям заболеваний.
Лечение: Стандартом лечения параганглиомы является ее хирургическое удаление или лучевая терапия. Выбор способов лечения параганглиомы зависит от размера и расположения опухоли, возраста пациента, наличия аномалий в работе нервов и учёта прочих особенностей организма пациента. На первом месте по безопасности лечения и его результатам стоит радиохирургия. Так, стереотаксическая радиохирургия системы «Кибер-нож» позволяет обойтись вообще без открытой операции и привычных для других методов лечения побочных эффектов.
На первом месте по безопасности лечения и его результатам стоит радиохирургия. Так, стереотаксическая радиохирургия системы «Кибер-нож» позволяет обойтись вообще без открытой операции и привычных для других методов лечения побочных эффектов.
Для всех опухолей, которым согласно диагнозу предстоит операция, обычно требуется ангиография. Оперативное лечение противопоказано при обширной диссеминации опухоли и наличии отдаленных метастазов. При проведении оперативного вмешательства проводится блокирование кровоснабжения опухоли (метод эмболизации). Это облегчает хирургическую процедуру. Если возможно, опухоли сонной артерии (carotid body tumors) и маленькие опухоли среднего уха (glomus tympanicum tumors) подлежат лечению посредством хирургии. Хирургия также рекомендуется для других локализаций параганглиомы (например, glomus jugulare, glomus vagale), при которых прослеживается поражение множества нервов.
Лучевая терапия (облучение) используется во всех случаях при условии, что все нервы функционируют нормально.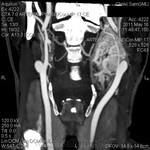 Более крупные опухоли с обширным поражением основания черепа и/или головного мозга подлежат лечению посредством лучевой терапии, которая также применяется для пациентов пожилого возраста с различными нарушениями работы организма.
Более крупные опухоли с обширным поражением основания черепа и/или головного мозга подлежат лечению посредством лучевой терапии, которая также применяется для пациентов пожилого возраста с различными нарушениями работы организма.
Гломусные опухоли (параганглиомы) — Вопросы и ответы
Элементы 1—10 из 27.
Скажите, пожалуйста, можно ли лечить гломусную опухоль среднего уха (небольших размеров) на кибер-ноже. Каковы шансы выздоровления (возможен ли рецидив). Сколько это будет стоить? Или лучше делать обычную операцию? Просто уже все мозги набекрень от этих мыслей.
Подскажите пожалуйста, у меня заключение; КТ картина параганглиомы каротидного гломуса справа(шеи) размеры опухоли 55х30х30. Есть ли возможность сделать лечение кибер ножом?
Здравствуйте! Возможно ли в вашем центре удалить хемодектому? Диагноз поставлен по результатам КТ с внутривенным контрастированием. Прилагаю все имеющиеся результаты обследования.
Добрый день! 2007 году меня прооперировали (гломусная опухоль среднего уха), возник рецидив,постоянно делали МРТ, чтобы наблюдать за изменениями.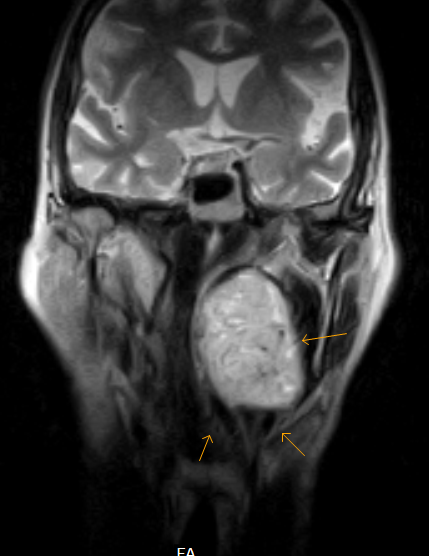 Но в последний год — сентябрь 2013 (снимок МРТ), картина меняется. Опухоль \»вылезает\» в наружный слуховой проход\».Оформила квоту. Сразу вопрос- Ваша клиника использует федеральную квоту? Если нет, то смогу ли я записавшись на консультацию, прооперироваться в ближайшее время, т.е.в декабре. Уточните стоимость: 180,0 или больше?
Но в последний год — сентябрь 2013 (снимок МРТ), картина меняется. Опухоль \»вылезает\» в наружный слуховой проход\».Оформила квоту. Сразу вопрос- Ваша клиника использует федеральную квоту? Если нет, то смогу ли я записавшись на консультацию, прооперироваться в ближайшее время, т.е.в декабре. Уточните стоимость: 180,0 или больше?
Добрый день! Мне 28 лет. По результатам МРТ-исследования (31 августа 2013 г.) обнаружена параганглиома яремного гломуса размерами 1,5 * 0,7 см. В анамнезе: антифосфолипидный синдром. Подскажите пожалуйста, могу ли я платно пройти у Вас в клинике лечение системой Кибер Нож? Если да, то как я могу это сделать? Возможно ли это в ближайшее время или есть лист ожидания, то каков срок ожидания? Какова стоимость процедуры, включая консультации доктора, дополнительных исследований, день пребывания в Центре и т.д.? Насколько эффективно лечение данной системой? Страховка по ДМС покрывает расходы на эту процедуру у Вас в Центре или нет?
Заранее большое спасибо за ответ.
параганглиома пирамиды височной кости слева. показано проведение стериотоксического облучения. Можно ли на основании этого заключения провести у вас радиохирургии кибер-ножом. Заранее благодарна
Здравствуйте! моей маме 70 лет в прошлом году ей провели операцию по удалению хамедектомы среднего уха, сегодня ей снова проводили операцию на тоже ухо. вскрывали барабанную перепонку и от туда пошла кровь. врач взял пробы на анализ и сказал что результаты через две недели но скорее всего хамедектома вновь выросла. Мама отказывается вновь оперироваться . можно ли с помощью гамма ножа удалить данную опухоль
Здравствуйте. В данный момент я оформляю квоту на получение высокотехнологичной мед.помощи. Диагноз: опухоль яремного гломуса справа. оформление занимает уже достаточно долгий срок (1 год). Мое состояние все хуже. Скажите, пожалуйста, мне еще можно помочь? Или. как мне ответил один \»добрый\» доктор — идите домой и тихо умирайте?
можно ли у вас провести процедуру Кибер-нож при кровоточащей гломусной опухоли. Могу ли я приехать к Вам внезапно примите ли Вы меня или только заранее договариваться.
Могу ли я приехать к Вам внезапно примите ли Вы меня или только заранее договариваться.
Добрый день! Скажите,пожалуйста, возможно ли сейчас лечение на аппарате Кибер-нож? Сколько будет стоить в среднем лечение? Как записаться на консультацию? Мы живем в Санкт-Петербурге. У моего мужа (51 год) гломусная опухоль в области шеи (приличных размеров). Сейчас нет перед глазами заключений, поэтому извините за неточность. С уважением, Марина валентиновна.
Параганглиома — Paraganglioma — qaz.wiki
Параганглиома является редким нейроэндокринные опухоли , которые могут развиваться на различных участках тела ( в том числе головы, шеи, грудной клетки и живота). Когда в надпочечнике обнаруживается опухоль того же типа, их называют феохромоцитомой . Это редкие опухоли с общей оценочной заболеваемостью 1/300 000. В отличие от других видов рака , не существует теста, позволяющего определить доброкачественные от злокачественных опухолей ; Поэтому всем пациентам с параганглиомой рекомендуется долгосрочное наблюдение.
Признаки и симптомы
Большинство параганглиом либо бессимптомны, либо представляют собой безболезненное образование. Хотя все они содержат нейросекреторные гранулы, только в 1–3% случаев секреция гормонов, таких как катехоламины, достаточно высока, чтобы быть клинически значимой; в этом случае проявления часто напоминают феохромоцитомы (интрамедуллярная параганглиома).
Генетика
Около 75% параганглиом являются спорадическими; остальные 25% являются наследственными (и имеют повышенную вероятность быть множественными и развиваться в более раннем возрасте). Мутации генов сукцинатдегидрогеназы , SDHD (ранее известного как PGL1), SDHA , SDHC (ранее PGL3) и SDHB были идентифицированы как вызывающие семейные параганглиомы головы и шеи. Мутации SDHB играют важную роль в семейной феохромоцитоме надпочечников и экстра-надпочечниковой параганглиоме (брюшной полости и грудной клетки), хотя есть значительное совпадение типов опухолей, связанных с мутациями генов SDHB и SDHD..png) Параганглиомы также могут возникать при МЭН 2А и 2В. Другие гены, связанные с семейной параганглиомой, — это SDHAF2 , VHL , NF1 , TMEM127 , MAX и SLC25A11 .
Параганглиомы также могут возникать при МЭН 2А и 2В. Другие гены, связанные с семейной параганглиомой, — это SDHAF2 , VHL , NF1 , TMEM127 , MAX и SLC25A11 .
Патология
Параганглиома средостения. Поверхность среза опухоли 3,9 × 3,5 × 2,5 см имеет треугольную форму, с выпуклым периферическим участком и несколько фиброзным центром. Он был окружен сердцем, левой нижней долей легкого, аортой, пищеводом и диафрагмой и 7 лет назад был диаметром 1,8 см.
Параганглиомы выглядят крупно как резко очерченные полиповидные образования и имеют консистенцию от твердой до эластичной. Это сильно сосудистые опухоли, которые могут иметь темно-красный цвет.
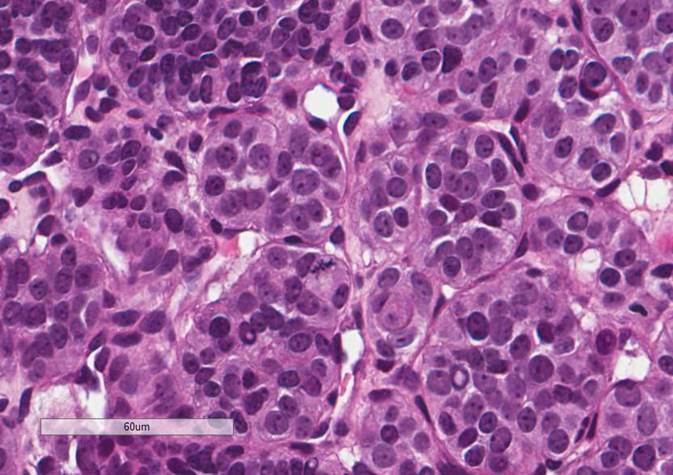
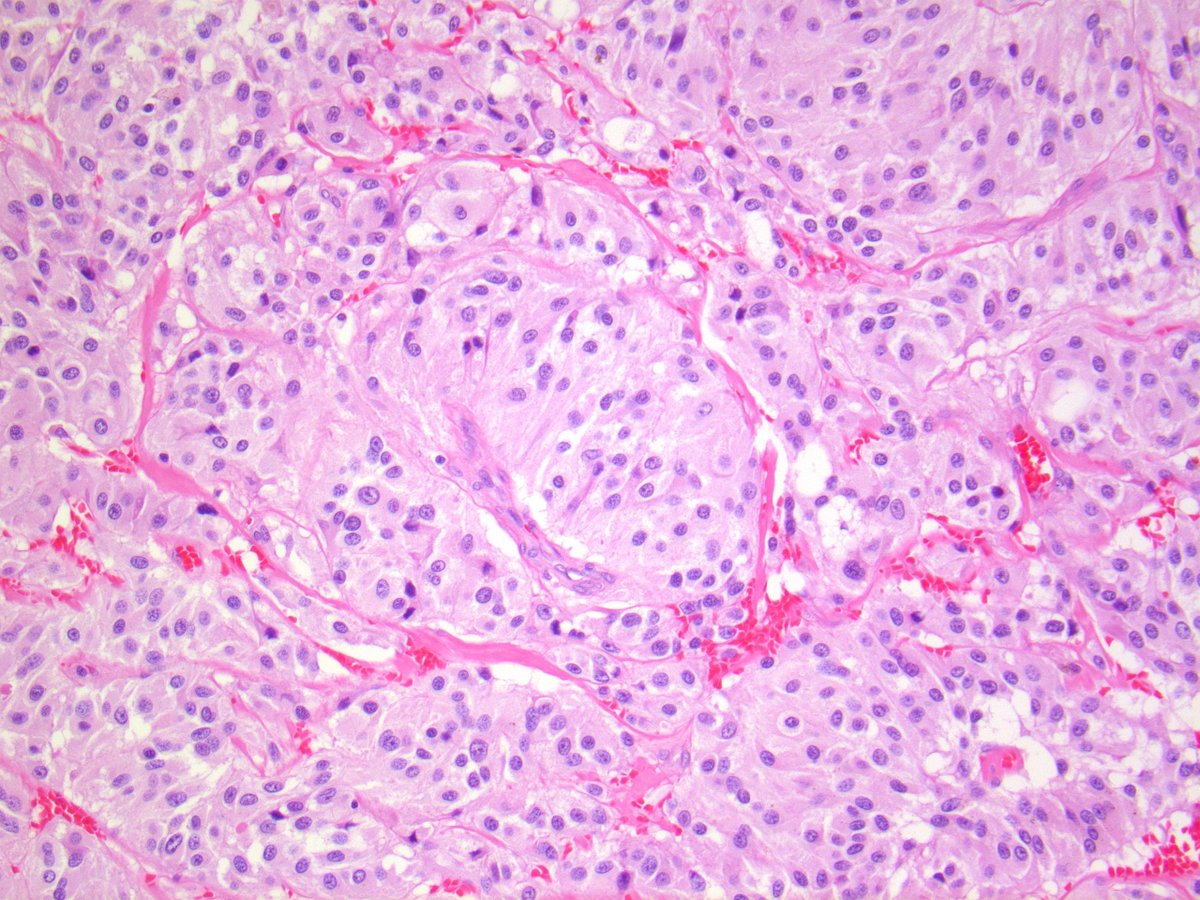
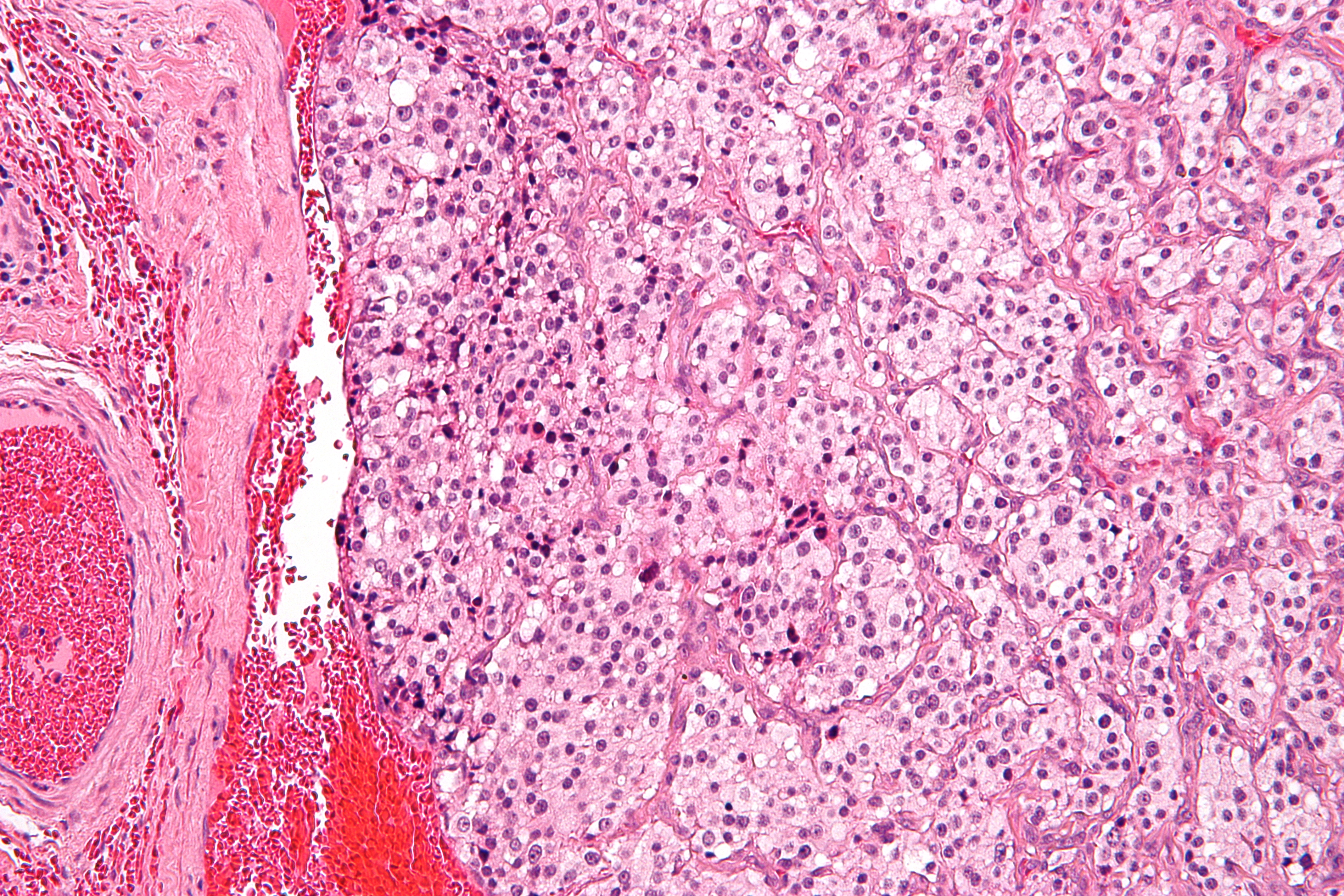
При микроскопическом исследовании опухолевые клетки легко распознаются. Отдельные опухолевые клетки имеют форму от многоугольника до овала и расположены в характерных клеточных шарах, называемых Зеллбалленом . Эти клеточные шары разделены фиброваскулярной стромой и окружены стентакулярными клетками .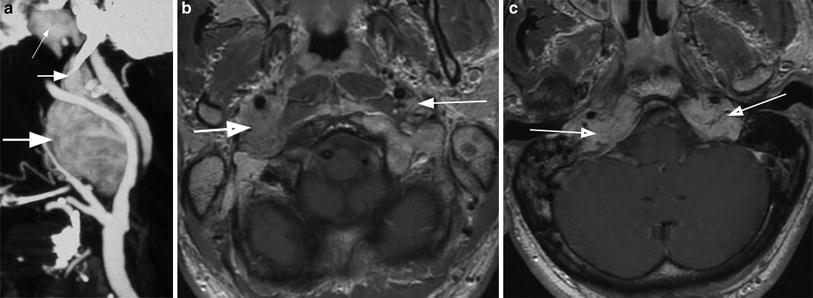
С помощью световой микроскопии дифференциальный диагноз включает связанные нейроэндокринные опухоли, такие как карциноидная опухоль , нейроэндокринная карцинома и медуллярная карцинома щитовидной железы .
С помощью иммуногистохимии главные клетки, расположенные в клеточных клубках, являются положительными по хромогранину , синаптофизину , нейрон-специфической энолазе , серотонину , нейрофиламентам и молекуле адгезии нервных клеток ; они отрицательны по белку S-100 . Сустентакулярные клетки являются S-100-положительными и фокально-положительными в отношении глиального фибриллярного кислого белка . По гистохимическому анализу клетки параганглиомы являются аргирофильными, отрицательными по Шиффу периодической кислоты, отрицательными по муцикарму и отрицательному аргентаффину .
Сайты происхождения
Около 85% параганглиом развиваются в брюшной полости; только 12% развиваются в области грудной клетки и 3% — в области головы и шеи (последние чаще всего являются симптоматическими). Хотя большинство из них являются единичными, встречаются редко — множественные случаи (обычно при наследственном синдроме). Параганглиомы описываются по месту их происхождения и часто получают специальные названия:
Хотя большинство из них являются единичными, встречаются редко — множественные случаи (обычно при наследственном синдроме). Параганглиомы описываются по месту их происхождения и часто получают специальные названия:
- Параганглиома головы и шеи (HNPGL): Существуют различные типы параганглиомы головы и шеи; они могут иметь специальные названия в зависимости от точного местоположения.
- Каротидная параганглиома ( опухоль каротидного тела ): наиболее распространенная из параганглиом головы и шеи. Обычно он проявляется в виде безболезненного новообразования на шее, но более крупные опухоли могут вызывать паралич черепных нервов, обычно блуждающего нерва и подъязычного нерва .
- Glomus tympanicum и Glomus jugulare , также известные как югулотимпанальная параганглиома : оба обычно представляют собой образование в среднем ухе, приводящее к
шуму в ушах (у 80%) и потере слуха (у 60%).
 В черепных нервы этих яремного отверстия может быть сжаты, результате глотания трудности, или ипсилатеральную слабости верхних трапециевидного и sternocleiodomastoid мышцы (от сжатия спинного добавочного нерва ). У этих пациентов наблюдается красноватая выпуклость позади неповрежденной барабанной перепонки. Это состояние также известно как «Красный барабан». При надавливании на наружный слуховой проход с помощью пневматического ушного зеркала можно было увидеть, что масса побледнела. Этот знак известен как «знак Брауна». Недостаточная костная пластинка вдоль барабанной части внутренней сонной артерии (аберрантная ВСА) является нормальным вариантом и может быть ошибочно принята за glomus jugulare.
В черепных нервы этих яремного отверстия может быть сжаты, результате глотания трудности, или ипсилатеральную слабости верхних трапециевидного и sternocleiodomastoid мышцы (от сжатия спинного добавочного нерва ). У этих пациентов наблюдается красноватая выпуклость позади неповрежденной барабанной перепонки. Это состояние также известно как «Красный барабан». При надавливании на наружный слуховой проход с помощью пневматического ушного зеркала можно было увидеть, что масса побледнела. Этот знак известен как «знак Брауна». Недостаточная костная пластинка вдоль барабанной части внутренней сонной артерии (аберрантная ВСА) является нормальным вариантом и может быть ошибочно принята за glomus jugulare.
 Обычно они проявляются в виде безболезненного образования на шее, но могут вызывать дисфагию и охриплость голоса.
Обычно они проявляются в виде безболезненного образования на шее, но могут вызывать дисфагию и охриплость голоса.Диагностика
Классификация
Параганглиомы происходят из параганглии в хромаффин-отрицательных клетках гломуса, происходящих из нервного гребня эмбриона , функционирующих как часть симпатической нервной системы (ветвь вегетативной нервной системы ). Эти клетки обычно действуют как особые хеморецепторы, расположенные вдоль кровеносных сосудов, особенно в каротидных телах (в месте бифуркации общей сонной артерии на шее) и в телах аорты (возле дуги аорты ).
Соответственно, параганглиомы классифицируются как происходящие из линии нервных клеток в классификации нейроэндокринных опухолей Всемирной организации здравоохранения . В классификации, предложенной Виком, параганглиомы относятся ко II группе. Учитывая тот факт, что они происходят из клеток ортосимпатической системы, параганглиомы тесно связаны с феохромоцитомами , которые, однако, являются хромаффин-положительными.
В классификации, предложенной Виком, параганглиомы относятся ко II группе. Учитывая тот факт, что они происходят из клеток ортосимпатической системы, параганглиомы тесно связаны с феохромоцитомами , которые, однако, являются хромаффин-положительными.
лечение
Основными методами лечения являются хирургическое вмешательство , эмболизация и лучевая терапия .
Дополнительные изображения
Эктопическая функциональная параганглиома (glomus jugulare) у пациента с ВХЛ. Т2-взвешенная МРТ в том же месте демонстрирует высокую массу сигнала, соответствующую параганглиоме. В ВХЛ можно найти дополнительные параганглиомы надпочечников (стрелка).
S100 immunostain выделяя клетки в поддерживающих в параганглиомы
Цифровая субтракционная артериограмма опухоли каротидного тела и яремной параганглиомы
Смотрите также
Рекомендации
внешние ссылки
| Классификация |
|
|---|---|
| Внешние ресурсы |
<img src=»https://en.wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
Протоны эффективны и безопасны при параганглиомах
Назад к списку
17
февраля 2020
Пациентов с параганглиомами головы и шеи можно безопасно и эффективно лечить протонной терапией, при этом результаты будут сравнимы с результатами традиционной лучевой (фотонной) радиотерапии, говорится в научной статье, опубликованной в журнале Head & Neck.
Параганглимомы головы и шеи встречаются довольно редко. Обычно это доброкачественные нейроэндокринные опухоли, образующиеся в группе клеток-параганглиев различной локализации, формирующиеся из парасимпатической и симпатической ткани нервной системы. Существуют два типа параганглиом: хромафинные и нехромафинные.
Обычно это доброкачественные нейроэндокринные опухоли, образующиеся в группе клеток-параганглиев различной локализации, формирующиеся из парасимпатической и симпатической ткани нервной системы. Существуют два типа параганглиом: хромафинные и нехромафинные.
По локализации они различаются на такие подвиды как параганглиомы височной кости, яремного отверстия, каротидного тельца и вагальные параганглиомы.
В настоящее время стандартными методами лечения этого заболевания являются хирургическая операция и радиотерапия, при этом лучевая терапия становится более популярной из-за негативных последствий хирургического вмешательства, связанных с удалением параганглиом из области яремного отверстия.
«Основная цель терапии – это остановка роста опухоли с минимизацией негативных последствий, — пишут исследователи. — … При этом радиотерапия также может уменьшить объем опухоли и облегчить симптомы, вызываемые параганглиомами головы и шеи».
С ростом популярности радиотерапии возникает необходимость принятия решения в пользу протонной или фотонной лучевой терапией.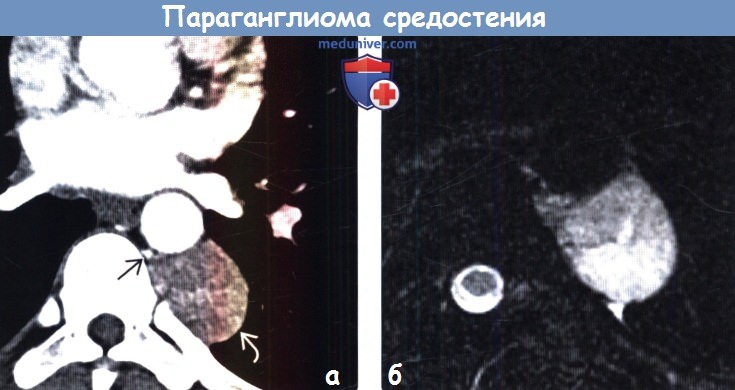 При этом протонная терапия снижает дозу излучения, попадающую на соседние окружающие ткани, что в случае параганглиом головы и шеи помогает защитить от воздействия излучения ротовую полость, мозг, ствол головного мозга, внутреннее ухо, ротоглотку и кожу пациента.
При этом протонная терапия снижает дозу излучения, попадающую на соседние окружающие ткани, что в случае параганглиом головы и шеи помогает защитить от воздействия излучения ротовую полость, мозг, ствол головного мозга, внутреннее ухо, ротоглотку и кожу пациента.
«Близость этих функционально критических структур, является важным обоснованием выбора протонов для радиотерапии этих опухолей», — написали ученые.
В результатах этого ретроспективного исследования они сообщают об опыте использования протонной терапии для лечения 37 пациентов (общее количество опухолей — 40) с параганглиомами головы и шеи, которое проводилось в стенах одного медицинского учреждения в период с 1997 по 2016 год с целью определения степени безопасности и эффективности этого лечебного метода.
Протонная терапия проводилась со средней дозой 50.4 Гр.
В соответствии с тем фактом, что эти опухоли в 30-40 % случаев связаны с наследственными факторами, ученые обнаружили, что генетическая/наследственная предрасположенность к этому заболеванию ассоциируется с множественными опухолями, а также с выявлением его в более юном возрасте. «… Это два случая, когда избирательное применение протонной терапии может существенно помочь пациентам», — объясняют исследователи.
«… Это два случая, когда избирательное применение протонной терапии может существенно помочь пациентам», — объясняют исследователи.
После протонной терапии наблюдалось облегчение симптомов у двадцати шести пациентов (70%). Чаще всего исчезали или ослаблялись такие симптомы как дизартрия (67%), тиннитус (57%), боль в ушах и заложенность ушей (33%), головная боль (33%). Кроме того, 65% опухолей уменьшились в объеме на 20% и более.
Побочные эффекты 2 и 3 степени включали субъективное нарушение слуха (19%), воспаление среднего уха (14%) и сухость во рту (8%).
«Пациентов с параганглиомами головы и шеи можно эффективно и безопасно лечить протонной терапией и в большинстве случаев добиваться отличных результатов (безрецидивной выживаемости), успешного снижения объема опухоли и облегчения симптомов, — пишут ученые. –Протонная терапия может быть особенно эффективна для лечения пациентов с генетическими мутациями, вызывающими опухоли, и/или семейной историей болезни (параганглиомы головы и шеи в семейном анамнезе), множественными опухолями или диагностикой этого заболевания в раннем возрасте.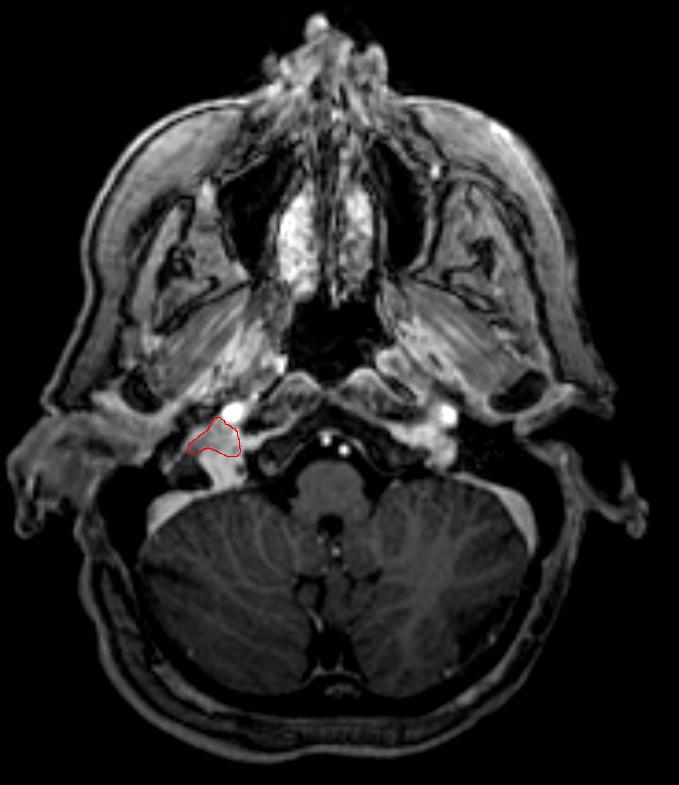
Оригинал новости можно прочитать здесь.
Назад к списку
параганглиом — лечение, типы и симптомы | Гора Синай
Параганглиомы, также называемые гломусными опухолями, встречаются в различных местах головы и шеи. Они редко бывают злокачественными. Почти половина всех параганглиом возникает в кости на стороне головы / черепа (височная кость). Эти опухоли относительно просты и часто связаны с другими неврологическими опухолями, развивающимися у эмбрионов, такими как хемодэктомы и нейрокристопатические опухоли. В Mount Sinai мы применяем многопрофильный медицинский подход к лечению параганглиом.
Типы параганглиом
Мы классифицируем параганглиомы в зависимости от их расположения.
- Кароидные параганглиомы появляются с расширяющейся и пульсирующей массой. Когда эта параганглиома проявляется в виде простого изолированного поражения, у вас может быть относительно мало симптомов. Эти опухоли обычно появляются на шее, но могут распространяться в пространство между головой и шеей.
 Некоторые из наиболее частых симптомов — это боль, охриплость голоса, обморок (обморок), затрудненное глотание (дисфагия), проблемы с глазами (синдром Хорнера) и паралич языка.
Некоторые из наиболее частых симптомов — это боль, охриплость голоса, обморок (обморок), затрудненное глотание (дисфагия), проблемы с глазами (синдром Хорнера) и паралич языка. - Параганглиомы шейки матки — это медленнорастущие опухоли, которые могут вызвать паралич и распространиться на основание черепа. Иногда бывает трудно отличить опухоли, поражающие блуждающий нерв, от опухолей, поражающих сонную артерию.
- Яремные параганглиомы, обычно большие , часто появляются при параличе четвертого, пятого и 11-го черепных нервов. Симптомы различаются. Если они парализуют паралич четвертого нерва, это может вызвать двоение в глазах; если это беспокоит паралич пятого нерва, может наблюдаться некоторое онемение лица; и если опухоль поражает 11-й черепной нерв, вам может быть трудно пошевелить плечом.Когда опухоль выходит за пределы яремного отверстия, она может поражать 12-й черепной нерв, что может вызвать паралич и / или слабость языка.

- Секреторные параганглиомы могут развиваться примерно у одного из восьми пациентов и могут включать выброс катехоламинов. Симптомы могут включать головные боли, гипертонию или высокое кровяное давление, учащенное сердцебиение, повышенное потоотделение и беспокойство. Лечение может быть трудным, потому что параганглиома будет вызывать выделение некоторых гормонов.
- Височные параганглиомы могут иметь один или несколько из следующих симптомов: потеря слуха, ритмичная стук в ухе, паралич лица, выделения из уха, боль, головокружение, кровотечение из уха (оторрагия), паралич нижних черепных нервов. , тошнота и рвота, проблемы со зрением, головные боли и изменения в поведении.
- Параганглиомы блуждающего нерва могут вызвать паралич нижних черепных нервов (включая 10-й черепной нерв, который может вызвать паралич диафрагмы), паралич 12-го черепного нерва (с параличом языка), проблемы с глотанием и проблемы с поднятием плечо.

Поскольку бывает трудно отличить барабанные и чистые яремные параганглиомы, мы считаем их все височными параганглиомами.
Иногда параганглиомы появляются в других местах головы и шеи. Обычно нам необходимо выполнить биопсию, чтобы диагностировать это.
Диагностические тесты
Визуальное сканирование может помочь нам диагностировать параганглиомы всех типов. На горе Синай мы обычно используем этот диагностический тест:
- Сканирование компьютерной томографии помогает нам увидеть, переместилась ли опухоль в какие-либо близлежащие костные структуры, включая каменную кость, височную кость и кости головы и шеи.
- Магнитно-резонансная томография — лучший диагностический тест для параганглиом. Это помогает нам увидеть, насколько они велики и переместились ли кровеносные сосуды в соседние структуры и другие сосудистые области.
- Ангиография демонстрирует васкуляризацию параганглиом, венозный отток и движение в сосудистые структуры, такие как яремная вена или сигмовидный синус.

Варианты лечения
На горе Синай мы используем эмболизацию для лечения параганглиом — это эмболизация.Этот современный метод может уменьшить опухоль и уменьшить кровотечение, что значительно упрощает удаление хирургическим путем. Мы также используем ангиографию, чтобы получить информацию о точном размере и местоположении опухолей.
Когда опухоль растет медленно и мы не можем проводить операцию и эмболизацию, мы можем провести облучение.
Вы и ваши гормоны от Общества эндокринологов
Феохромоцитома вне надпочечников
КТ-изображение с контрастным усилением поперечного сечения, показывающее образования (параганглиомы) на обеих сторонах шеи.
Что такое параганглиома?
Параганглиома — это тип опухоли, которая возникает из периферической нервной системы (часть нервной системы за пределами головного и спинного мозга), которая далее подразделяется на симпатическую нервную систему и парасимпатическую нервную систему. Периферическая нервная система участвует в управлении множеством функций организма, включая артериальное давление, частоту сердечных сокращений, движения кишечника и мочеиспускание. Параганглиомы чаще всего возникают в брюшной полости, но также могут возникать на шее и груди и связаны с опухолью надпочечников, называемой феохромоцитомой, но не совсем таковой.
Периферическая нервная система участвует в управлении множеством функций организма, включая артериальное давление, частоту сердечных сокращений, движения кишечника и мочеиспускание. Параганглиомы чаще всего возникают в брюшной полости, но также могут возникать на шее и груди и связаны с опухолью надпочечников, называемой феохромоцитомой, но не совсем таковой.
Что вызывает параганглиомы?
Неясно, почему возникают параганглиомы. Однако в некоторых случаях мутации в определенных генах повышают вероятность развития параганглиомы.
Каковы признаки и симптомы параганглиом?
Во многих случаях параганглиомы могут не вызывать никаких симптомов, кроме случаев:
Они вырастают достаточно большими, чтобы давить на другие органы или распространяться на другие органы. Например, если опухоль распространилась на кости, это может вызвать боль в костях.На шее (каротидная параганглиома) они могут быть видны как опухоль или сдавить соседние нервы, такие как блуждающий нерв.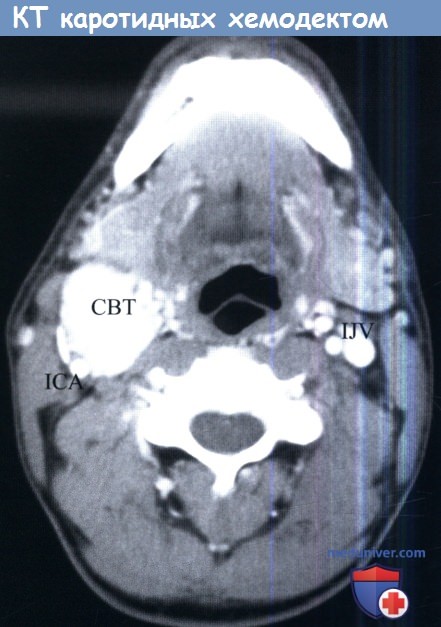 Тип параганглиомы (гломус параганглиома) в среднем ухе может привести к потере слуха и шуму в ушах.
Тип параганглиомы (гломус параганглиома) в среднем ухе может привести к потере слуха и шуму в ушах.
Они выделяют в кровоток гормоны, такие как норадреналин или, реже, адреналин. Чрезмерный уровень этих гормонов может вызвать потоотделение, учащенное сердцебиение, чувство тревоги, головную боль и высокое кровяное давление. Эти симптомы могут быть похожи на панические атаки.
Насколько распространены параганглиомы?
Параганглиомы встречаются редко. По оценкам, каждый год диагностируется один случай на 300 000 человек населения. В Великобритании это примерно 200 новых случаев в год.
Параганглиомы передаются по наследству?
Примерно каждая четвертая параганглиома наследуется как часть синдрома семейной параганглиомы, множественной эндокринной неоплазии 2 типа, синдрома фон Гиппеля-Линдау или нейрофиброматоза. Известно, что дефекты в генах, таких как субъединицы сукцинатдегидрогеназы B (SDHB), C (SDHC) и D (SDHD), связаны с синдромом семейной параганглиомы. Мутации в гене RET (перегруппированные во время трансфекции) также являются генетическими причинами параганглиомы.
Мутации в гене RET (перегруппированные во время трансфекции) также являются генетическими причинами параганглиомы.
Наследственные формы параганглиомы могут быть связаны с:
- младший возраст при постановке диагноза
- В семейном анамнезе опухоли надпочечников или почек
- Семейный анамнез феохромоцитомы
- внезапная необъяснимая смерть в раннем возрасте.
Как диагностируются параганглиомы?
Большинство тестов на параганглиомы проводятся амбулаторно.Для поиска доказательств чрезмерной секреции адреналина или норадреналина пациентов могут попросить собрать мочу в течение 24 часов или сдать анализ крови. Компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) тела используются для поиска параганглиом и любых признаков роста опухолей.
Специальное сканирование для ядерной медицины, такое как сканирование с использованием метаиодобензилгуанидина (MIBG) или позитронно-эмиссионной томографии (ПЭТ), также иногда используется для выявления параганглиом и любых свидетельств распространения опухолей.
Анализ крови для выявления генных дефектов может быть проведен при подозрении на семейную параганглиому, обычно при наличии семейного анамнеза или если опухоль появилась в молодом возрасте. Обычно это делают в амбулаторных условиях специалисты-генетики, которые расскажут о последствиях генетического тестирования.
Как лечат параганглиомы?
Параганглиомы обычно удаляются хирургическим путем. Операция проходит в стационаре в специализированных больницах.Непосредственно перед операцией может потребоваться специальный период подготовки, чтобы гарантировать, что артериальное давление хорошо контролируется и не повышается или не падает чрезмерно. Это может включать прием за три дня или около того до запланированной операции для инъекций / перорального приема лекарств от кровяного давления.
Если параганглиомы распространились в места, где невозможно хирургическое вмешательство по удалению опухолей (например, в печень или кости), для замедления роста опухолей могут использоваться методы ядерной медицины, такие как радиоактивный MIBG или октреотид. Это лечение обычно проводится в стационаре в специализированных больницах.
Это лечение обычно проводится в стационаре в специализированных больницах.
Лекарства от кровяного давления (например, феноксибензамин, доксазозин или пропранолол) часто используются для блокирования воздействия избытка адреналина или норадреналина на организм с целью снижения и стабилизации кровяного давления. Его можно вводить в виде таблеток амбулаторно или в виде инъекции в больнице.
Есть ли у лечения побочные эффекты?
После операции будет отслеживаться артериальное давление пациента, чтобы убедиться, что оно не повышается или не падает чрезмерно.В противном случае это может привести к повышенному риску сердечного приступа или инсульта. Побочные эффекты хирургического вмешательства могут включать чрезмерное кровотечение, инфекции, боль и возможное повреждение любой окружающей структуры (твердого органа, сосудов и т. Д.) Вокруг параганглиомы.
Лечение ядерной медициной обычно не вызывает побочных эффектов, но, если проводится много лечения, это может привести к тому, что костный мозг перестанет вырабатывать клетки крови.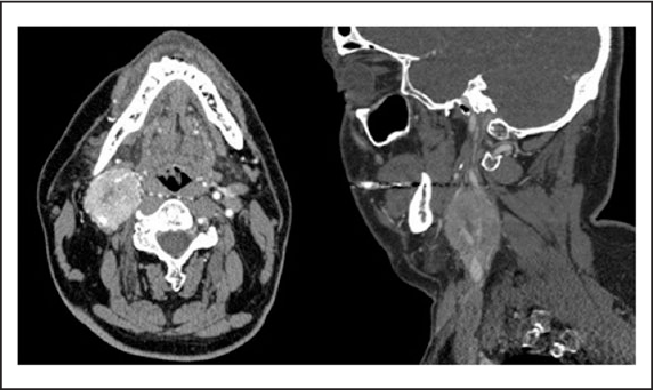 Это может вызвать недостаток красных кровяных телец, переносящих кислород, или недостаток лейкоцитов, которые защищают от инфекций.Тем не менее, пациенты, получающие это лечение, будут тщательно контролироваться на предмет наличия признаков этих побочных эффектов.
Это может вызвать недостаток красных кровяных телец, переносящих кислород, или недостаток лейкоцитов, которые защищают от инфекций.Тем не менее, пациенты, получающие это лечение, будут тщательно контролироваться на предмет наличия признаков этих побочных эффектов.
Лекарства от кровяного давления могут вызывать чрезмерно низкое кровяное давление, ведущее к обморокам и головокружению, особенно при вставании. Некоторые лекарства также могут вызвать заложенность носа и похолодание рук и ног. У мужчин феноксибензамин может вызвать отсутствие эякуляции.
Каковы более долгосрочные последствия параганглиом?
Параганглиомы — это обычно медленнорастущие опухоли.Результат зависит от того, насколько далеко распространилась опухоль, но пациенты, получившие лечение, могут прожить много лет сверх своего первоначального диагноза.
Последняя проверка: янв 2019
Междисциплинарное лечение параганглиом головы и шеи, часть 1
РЕФЕРАТ: Параганглиомы чаще всего возникают в сонной артерии, югулотимпанальной области и блуждающем нерве, но также были зарегистрированы в других областях головы и шеи.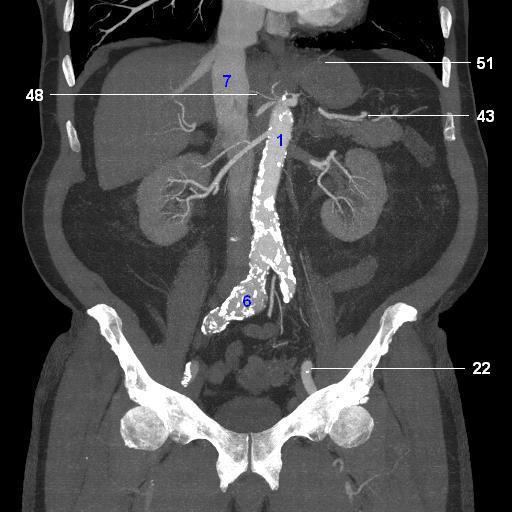 Эти опухоли очень сосудистые и для них характерно раннее поражение кровеносных сосудов и нервов, что делает их лечение особенно сложным. Хирургия традиционно была предпочтительным методом лечения, особенно в свете последних достижений в технике. Однако по сравнению с лучевой терапией это может привести к более высокой частоте дисфункции черепных нервов. Лучевая терапия имеет то преимущество, что позволяет избежать повышенной хирургической болезненности, предлагая при этом равные возможности излечения.Первая часть этой статьи, состоящей из двух частей, посвящена методам диагностики параганглиомы, а также показаниям и использованию хирургического вмешательства в качестве основного лечения. Рассмотрены осложнения, обычно связанные с хирургическим вмешательством, и представлены стратегии реабилитации пострадавших пациентов.
Эти опухоли очень сосудистые и для них характерно раннее поражение кровеносных сосудов и нервов, что делает их лечение особенно сложным. Хирургия традиционно была предпочтительным методом лечения, особенно в свете последних достижений в технике. Однако по сравнению с лучевой терапией это может привести к более высокой частоте дисфункции черепных нервов. Лучевая терапия имеет то преимущество, что позволяет избежать повышенной хирургической болезненности, предлагая при этом равные возможности излечения.Первая часть этой статьи, состоящей из двух частей, посвящена методам диагностики параганглиомы, а также показаниям и использованию хирургического вмешательства в качестве основного лечения. Рассмотрены осложнения, обычно связанные с хирургическим вмешательством, и представлены стратегии реабилитации пострадавших пациентов.
Параганглиомы — это высокососудистые новообразования, возникающие эмбриологически из параганглии происхождения нервного гребня и чаще всего возникающие в области головы и шеи. Как правило, параганглиомы проявляются на 5-6-м десятилетии жизни [1,2] преимущественно у женщин.[3-6] Медленно увеличивающееся образование на шее и / или находки, соответствующие дисфункции черепных нервов, являются отличительными признаками проявления.
Как правило, параганглиомы проявляются на 5-6-м десятилетии жизни [1,2] преимущественно у женщин.[3-6] Медленно увеличивающееся образование на шее и / или находки, соответствующие дисфункции черепных нервов, являются отличительными признаками проявления.
В первой части этой статьи, состоящей из двух частей, рассматриваются этиология и эпидемиология параганглиом, их диагностика и хирургические подходы к лечению. Часть 2, которая будет опубликована в номере за следующий месяц, описывает использование лучевой терапии в управлении и предлагает общий алгоритм лечения.
Обзор
РИСУНОК 1
Анатомия параганглиомы
Параганглии являются частью диффузной нейроэндокринной системы, ранее известной как декарбоксилатная система предшественника амина, и могут секретировать нейропептиды и катехоламины.[7,8] Параганглиомы чаще всего встречаются в сонной артерии, югулотимпанальной области и параганглии блуждающего нерва (рис. 1), хотя они также наблюдались в гортани, [9] орбите, [10] щитовидной железе, [11] языке, [12] носовая полость, [13] придаточные пазухи носа, [13,14] наружный слуховой проход, [15] и супратенториальные области. [16,17]
[16,17]
Факторы риска включают большую высоту и, в 5-10% случаев , [18,19] наследственная предрасположенность, характеризующаяся аутосомно-доминантной генетической передачей с переменным проникновением [20] и отцовским импринтингом.[20-22] Мультицентрические опухоли часто встречаются в семейных случаях (от 78% до 87% имеют множественные параганглиомы) [6,19], но также встречаются в 10% спорадических случаев [23]. Такое проявление может привести к рефрактерной гипертензии из-за потери барорецептивной функции после резекции двусторонних опухолей каротидного тела, тогда как множественные опухоли, включая параганглиомы блуждающего нерва или яремной вены, могут привести к множественной дисфункции нижних черепных нервов.
Злокачественные параганглиомы встречаются редко, и их диагноз может быть подтвержден только наличием метастазов, обычно в регионарных лимфатических узлах.В пределах первичной опухоли нет строгих гистологических критериев, позволяющих отличить доброкачественные параганглиомы от злокачественных. Параганглиомы очень сосудистые и обычно связаны с ранним поражением кровеносных сосудов (сонная артерия, луковица яремной впадины) и невральных областей (блуждающий нерв, барабанное сплетение), в дополнение к основанию черепа и потенциальному внутричерепному расширению.
Параганглиомы очень сосудистые и обычно связаны с ранним поражением кровеносных сосудов (сонная артерия, луковица яремной впадины) и невральных областей (блуждающий нерв, барабанное сплетение), в дополнение к основанию черепа и потенциальному внутричерепному расширению.
Все эти факторы способствуют эффективному лечению этих опухолей. Традиционно хирургия была предпочтительным методом лечения, особенно с развитием более сложных подходов к основанию черепа, более безопасных протоколов эмболизации и расширенных процедур сосудистого обхода.[24] Послеоперационная дисфункция черепных нервов ожидается у пациентов с более крупными опухолями и поражением основания черепа, что делает реабилитационные мероприятия в центре внимания.
Лучевая терапия традиционно использовалась для лечения неоперабельных параганглиом или опухолей у пожилых или ослабленных пациентов. Достижения в радиационной онкологии и увеличение опыта лечения параганглиом головы и шеи привели к улучшению долгосрочных ответов опухоли с приемлемыми осложнениями от лучевой терапии. Лучевая терапия представляет собой разумный вариант первичного лечения, особенно при местнораспространенных или многоцентровых опухолях, которые в случае хирургической резекции могут привести к чрезмерным осложнениям.
Лучевая терапия представляет собой разумный вариант первичного лечения, особенно при местнораспространенных или многоцентровых опухолях, которые в случае хирургической резекции могут привести к чрезмерным осложнениям.
Заболеваемость
ТАБЛИЦА 1
Распределение параганглиом ТАБЛИЦА 2
Симптомы параганглиом ТАБЛИЦА 3
Физические данные, указывающие на параганглиомы
9 00002 Параганглиомы головы и шеи являются редкими.012% всех опухолей, рассмотренных отделением хирургической патологии Мемориального онкологического центра Слоуна-Кеттеринга в период с 1938 по 1975 гг. [25] Каротидное тело — наиболее частое место возникновения параганглиом на голове и шее. Опухоли сонных артерий, яремные параганглиомы и барабанные параганглиомы составляют 80% всех параганглиом головы и шеи [26], а параганглиомы блуждающего нерва составляют еще 5% [27]. Намного реже встречаются носовые, орбитальные, гортанные и другие параганглиомы. Наш обзор 47 пациентов с 53 параганглиомами, пролеченных в течение 10-летнего периода (1990–2000 гг. ), Согласуется с относительной частотой конкретных параганглиом, о которой сообщают другие (таблицы 1-3).[28]
), Согласуется с относительной частотой конкретных параганглиом, о которой сообщают другие (таблицы 1-3).[28]
Злокачественный вариант
Злокачественные параганглиомы встречаются редко. Наиболее важным критерием злокачественности являются задокументированные лимфатические узлы или отдаленные метастазы, поскольку гистологическое исследование первичной опухоли не позволяет установить диагноз злокачественной опухоли. Распространенность злокачественного новообразования зависит от локализации первичной опухоли. Среди наиболее распространенных типов параганглиом головы и шеи параганглиомы блуждающего нерва, скорее всего, связаны с самым высоким уровнем злокачественности (около 10%) [29], причем региональные лимфатические узлы и легкие являются наиболее частыми местами метастазов.
Сообщается, что злокачественные опухоли сонной артерии и опухоли югулотимпанального гломуса встречаются примерно в 3–6% случаев. [30,31] Из параганглиом головы и шеи, первичные опухоли орбиты и гортани демонстрируют самый высокий уровень злокачественности (20%). до 25% случаев) [23] Наиболее частыми местами метастазов опухоли отдаленных сонных артерий являются кости, легкие и печень [32], в то время как для югулотимпанальных параганглиом наиболее частыми местами метастазов являются легкие, лимфатические узлы, печень, позвонки, ребра и селезенка.[33]
до 25% случаев) [23] Наиболее частыми местами метастазов опухоли отдаленных сонных артерий являются кости, легкие и печень [32], в то время как для югулотимпанальных параганглиом наиболее частыми местами метастазов являются легкие, лимфатические узлы, печень, позвонки, ребра и селезенка.[33]
В обзоре 43 случаев злокачественных опухолей каротидного тела Пачеко-Охеда [34] обнаружил, что локорегиональный контроль требует резекции первичной опухоли и рассечения шеи с последующей лучевой терапией. Интервал между первичной резекцией и появлением метастатического поражения может быть длительным, от 20 месяцев до 20 лет. Распространенное заболевание относительно невосприимчиво к химиотерапии.
Скорость роста
Параганглиомы — это медленнорастущие опухоли со средней скоростью роста 1.0 мм / год и среднее время удвоения 4,2 года. Янсен и др. Сообщили о меньшем росте очень маленьких и очень больших параганглиом по сравнению с опухолями среднего размера, что указывает на двухфазный характер роста. [35] Скорость роста метастазов низкая, время удвоения составляет 2000 дней.
[35] Скорость роста метастазов низкая, время удвоения составляет 2000 дней.
Функционирующие параганглиомы
Хотя все параганглиомы обладают потенциалом выделения вазоактивных веществ, таких как катехоламины и дофамин [29,36], только от 1% до 3% дают соответствующие клинические результаты [36,37], включая повышенное потоотделение, гипертензию, тахикардию. , нервозность и потеря веса.[36] Лабораторные скрининговые тесты, в том числе суточные уровни метанефрина в моче (нормальное значение <1,3 мг) и уровень ванилминдальной кислоты (нормальный = 1,8-7,0 мг), часто повышаются в 10-15 раз от нормы у пациентов с активно секретирующими опухолями [36]. ]
Уровни катехоламинов в сыворотке, включая норэпинефрин и адреналин в сыворотке, также имеют значение при оценке состояния пациентов. Поскольку параганглиомы головы и шеи не выделяют адреналин, повышенный уровень адреналина в сыворотке крови свидетельствует о сопутствующей феохромоцитоме.[36] В нескольких отчетах отмечена связь между феохромоцитомой и семейными, и несемейными параганглиомами.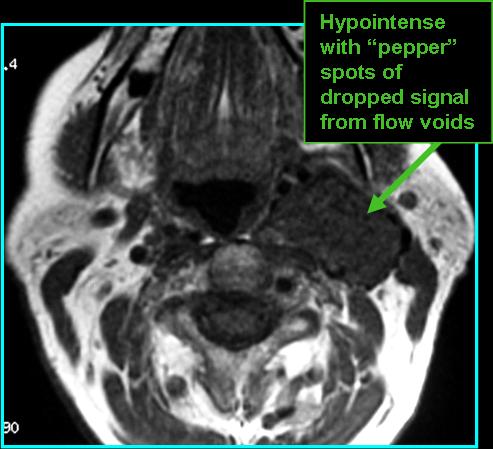 [38-40] Параганглиомы могут возникать у пациентов как с типом IIA (феохромоцитома, медуллярная карцинома щитовидной железы и гиперплазия паращитовидной железы), так и с типом IIB (также включая невромы слизистой оболочки) семейная множественная эндокринная неоплазия. [41]
[38-40] Параганглиомы могут возникать у пациентов как с типом IIA (феохромоцитома, медуллярная карцинома щитовидной железы и гиперплазия паращитовидной железы), так и с типом IIB (также включая невромы слизистой оболочки) семейная множественная эндокринная неоплазия. [41]
Диагностическая оценка
Компьютерная томография
РИСУНОК 2
Опухоль сонной артерии
Компьютерная томография (КТ) с тонкими срезами (1-3 мм) — отличный метод визуализации, с помощью которого можно идентифицировать параганглиомы и задокументировать степень опухоли с точной оценкой инвазии в кости.Классические результаты КТ параганглиом включают однородную массу с интенсивным усилением после введения внутривенного контраста (рис. 2). Хотя такой вид типичен для этих опухолей, он также может наблюдаться при других сосудистых опухолях, таких как нейролеммома и менингиома. [24]
РИСУНОК 3
Поражение сосудов
Расположение опухоли, смещение крупных сосудов и характер поражения или инвазии окружающих структур помогают в диагностике параганглиомы.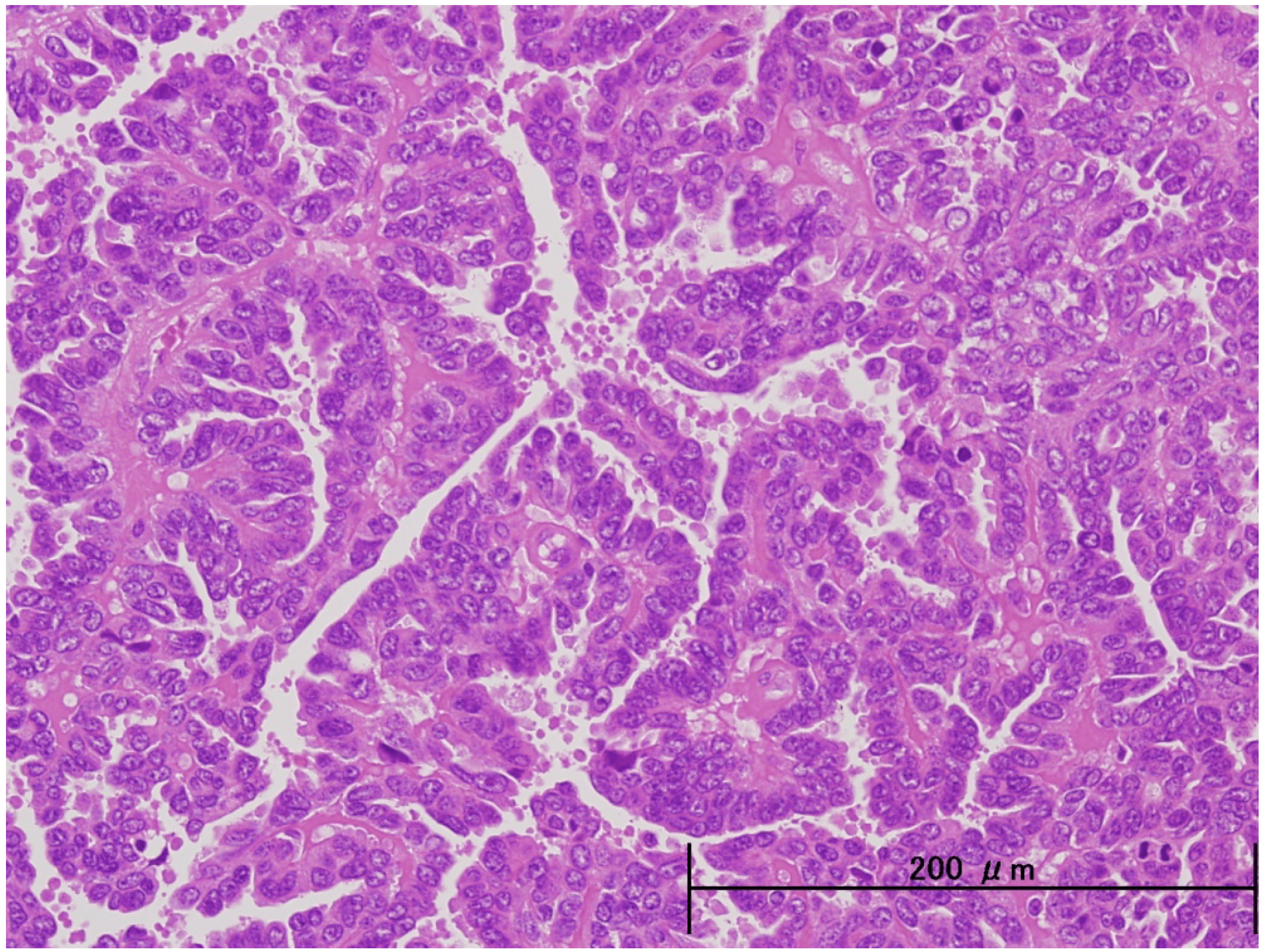 Например, опухоли каротидного тела обычно демонстрируют бифуркацию общей сонной артерии с заднебоковым смещением внутренней сонной артерии (рис. 3A) [27]. Напротив, параганглиомы блуждающего нерва смещают как внутренние, так и наружные сонные артерии кпереди (рис. 3В) и связаны с эрозией и расширением яремного отверстия.
Например, опухоли каротидного тела обычно демонстрируют бифуркацию общей сонной артерии с заднебоковым смещением внутренней сонной артерии (рис. 3A) [27]. Напротив, параганглиомы блуждающего нерва смещают как внутренние, так и наружные сонные артерии кпереди (рис. 3В) и связаны с эрозией и расширением яремного отверстия.
Яремные параганглиомы можно отличить от тимпанальных опухолей на основании раннего поражения основания черепа, эрозии сонно-яремного отдела позвоночника [27,42] и разрушения цепи слуховых косточек, что необычно для барабанных опухолей.[43]
Магнитно-резонансная томография
РИСУНОК 4
Т2-взвешенное МРТ-исследование с гадолиниевым контрастом
Хотя КТ является предпочтительным исследованием для оценки поражения костей, магнитно-резонансная томография (МРТ) позволяет тщательно изучить мягкие ткани. детализирует и определяет вовлечение основания черепа, внутричерепного, твердого мозга и нервной системы, особенно с использованием усиления гадолиния (Рисунок 4) [28].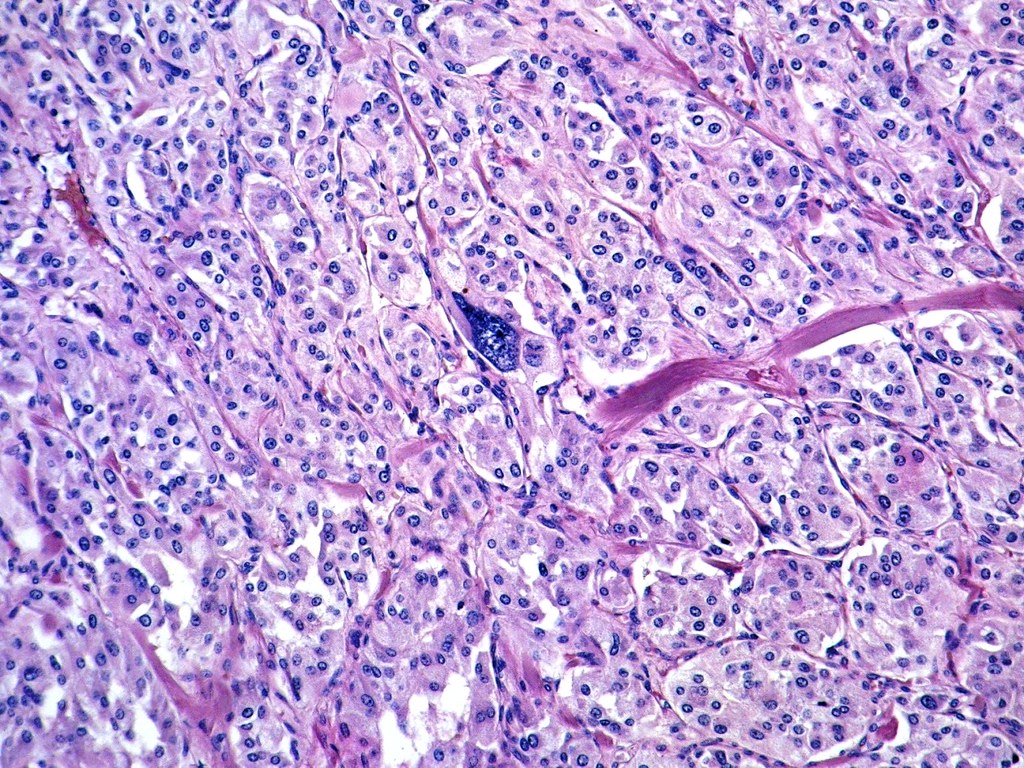 Благодаря способности создавать изображения в нескольких плоскостях, МРТ превосходит КТ в определении взаимосвязи параганглиом с соседними структурами сосудов и основания черепа.
Благодаря способности создавать изображения в нескольких плоскостях, МРТ превосходит КТ в определении взаимосвязи параганглиом с соседними структурами сосудов и основания черепа.
МРТ-исследования параганглиом демонстрируют фоновую матрицу опухоли с промежуточной интенсивностью сигнала на T1- и протонно-взвешенных изображениях и умеренно высокой интенсивности сигнала на T2-взвешенных изображениях, наряду с рассеянными областями пустот фокального сигнала, отражающими кровеносные сосуды с высоким кровотоком . [44] Видно интенсивное однородное усиление контраста. [44] На T2-взвешенных изображениях классический вид МРТ «соль и перец», первоначально описанный Olsen et al [45] и присутствующий в большинстве поражений больше 1.5 см отражает сигнальные пустоты, смешанные с областями фокусно высокой интенсивности сигнала, последние из которых, вероятно, связаны с участками медленного потока в плоскости изображения (Рисунок 4). [44]
Эти данные, однако, не специфичны для параганглиом и могут наблюдаться при других гиперваскулярных поражениях (например, метастазирующем почечно-клеточном раке и раке щитовидной железы).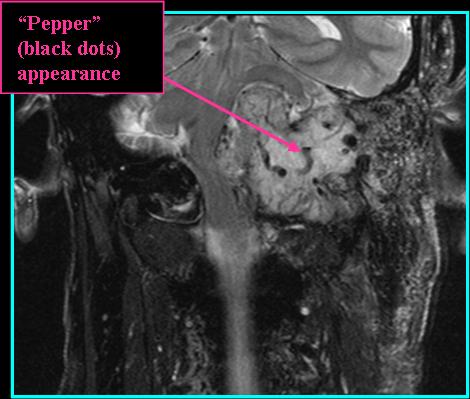 При этом типично гладкий контур, характеристики сигнала и расположение параганглиом в сочетании с подробным анамнезом и физическими данными должны привести к точному диагнозу.
При этом типично гладкий контур, характеристики сигнала и расположение параганглиом в сочетании с подробным анамнезом и физическими данными должны привести к точному диагнозу.
Также стоит отметить, что МРТ более эффективна, чем КТ, в выявлении небольших синхронных параганглиом, особенно тех, которые меньше 5 мм. (КТ наиболее эффективна для выявления поражений размером более 8 мм. [46])
Магнитно-резонансная ангиография (МРА) обеспечивает превосходную визуализацию основных сосудов головы и шеи и может продемонстрировать смещение сосудов, крупное поражение опухоли и возможное нарушение кровотока. . Это может быть полезно для определения связанного с потоком усиления поражений более 1.5 см. [27] Хотя трехмерная времяпролетная ангиография, по-видимому, превосходит другие методы МРА в идентификации некоторых источников опухоли, ее чувствительность недостаточно высока, чтобы продемонстрировать детальное сосудистое снабжение опухоли, что лучше всего определяется с помощью суперселективной ангиографии с цифровым вычитанием [47].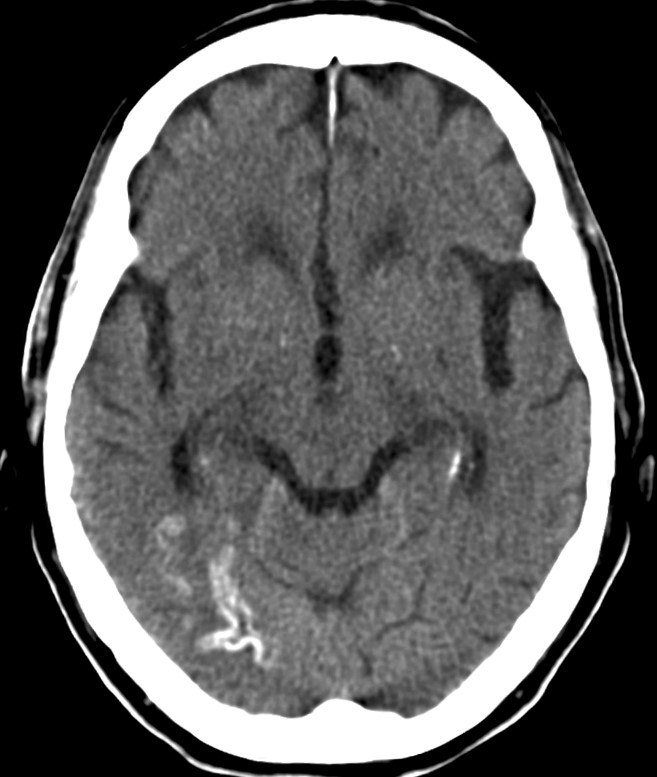
Радиоизотопная визуализация
Было обнаружено, что параганглиомы, как и другие нейроэндокринные опухоли, имеют высокую плотность рецепторов соматостатина 2-го типа на поверхности клеток. Октреотид (Сандостатин) представляет собой аналог соматостатина, который при соединении с радиоизотопом индия-111 создает сцинтиграфическое изображение опухолей, экспрессирующих рецепторы соматостатина 2 типа.В исследовании 21 пациента с предполагаемыми параганглиомами головы и шеи, которым была проведена сцинтиграфия индий-111 / октреотид, Telischi и др. Продемонстрировали точность 90%, чувствительность 94% и специфичность 75% при обнаружении опухолей с помощью этого метода. [48]
Радиоизотопная сцинтиграфия обеспечивает неинвазивный метод визуализации, который особенно полезен при скрининге семей с параганглиомами в анамнезе. Кроме того, он полезен при обнаружении как синхронных, так и метахронных метастатических опухолей.
Ангиографическая оценка
Ангиография играет важную роль в оценке параганглиом, если планируется хирургическое вмешательство. Он обеспечивает изысканную детализацию анатомии сосудов, очерчивание кровоснабжения опухоли (и возможные анастомозы), [2] смещение сосудов, потенциальное повреждение сосудов из-за инвазии опухоли и адекватность внутричерепного кровообращения, если необходима жертва внутренней сонной артерии; этот метод также позволяет выявить ранее не диагностированные синхронные параганглиомы.[49] Суперселективная ангиография позволяет проводить безопасную предоперационную эмболизацию сосудистой сети опухоли, надеясь избежать окклюзии проксимальных сосудов и неожиданной миграции эмболизационного материала в церебральный или системный кровоток.
Он обеспечивает изысканную детализацию анатомии сосудов, очерчивание кровоснабжения опухоли (и возможные анастомозы), [2] смещение сосудов, потенциальное повреждение сосудов из-за инвазии опухоли и адекватность внутричерепного кровообращения, если необходима жертва внутренней сонной артерии; этот метод также позволяет выявить ранее не диагностированные синхронные параганглиомы.[49] Суперселективная ангиография позволяет проводить безопасную предоперационную эмболизацию сосудистой сети опухоли, надеясь избежать окклюзии проксимальных сосудов и неожиданной миграции эмболизационного материала в церебральный или системный кровоток.
РИСУНОК 5
Контралатеральные сосуды головного мозга
Наш метод внутренней окклюзии каротидного баллона, выполняемый под местной анестезией с мониторингом психических функций в течение 20 минут, кажется надежным в прогнозировании толерантности пациента к прерыванию кровотока в сонной артерии.Совсем недавно мы полагались на ангиографические доказательства адекватной контралатеральной церебральной крови без выполнения плановой окклюзии внутреннего каротидного баллона (рис..jpg) 5).
5).
В нашем исследовании 28 пациентов, перенесших церебральную ангиографию, 26 (93%) продемонстрировали ангиографические или баллонные тесты на окклюзию, свидетельствующие о толерантности к возможному разрушению сонной артерии. [28] С этой предоперационной информацией можно принять хирургическое решение о вариантах каротидного шунтирования. Даже при подготовке к трансплантации внутренней сонной артерии обзор нескольких серий сообщает о 9.7% инсультов и 2,4% смертности. [50]
ТАБЛИЦА 4
Часто используемые системы стадирования для опухолей сонных артерий и югулотимпанальных параганглиом
В нашей серии 4 из 47 пациентов с ранее не обнаруженными параганглиомами были диагностированы с помощью ангиографии (три опухоли каротидного тела, одна параганглиома вагины). По этим причинам двусторонняя каротидная ангиография является важной частью протокола нашей оценки пациентов, которым предстоит операция.[28]
Биопсия
При подозрении на диагноз параганглиомы инцизионная биопсия противопоказана из-за риска кровотечения и последующего фиброза в месте операции.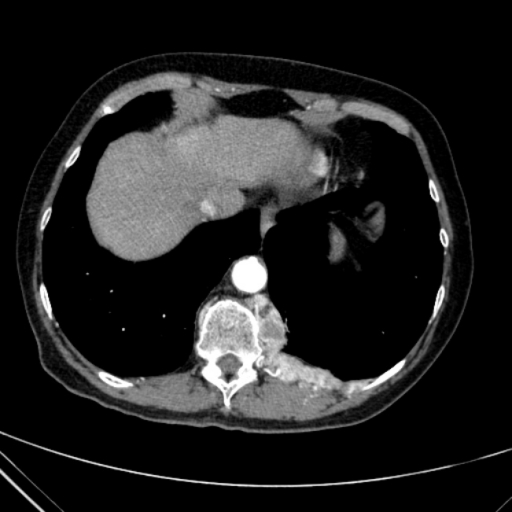 [51] Аспирационная биопсия тонкой иглой может быть выполнена безопасно с минимальным риском кровотечения.
[51] Аспирационная биопсия тонкой иглой может быть выполнена безопасно с минимальным риском кровотечения.
Стадия
Наиболее часто используемые системы стадирования для опухолей сонной артерии и югулотимпанальных параганглиом перечислены в таблице 4.
Варианты лечения
Традиционно хирургическая резекция была основным методом лечения этих опухолей, но результат зависит от множество факторов, которые могут повлиять на идеальный результат тотального удаления опухоли и минимальные послеоперационные осложнения.Относительные противопоказания к хирургическому вмешательству включают обширное поражение основания черепа или внутричерепное поражение, пожилой возраст пациента, сопутствующие заболевания, а также двусторонние или множественные параганглиомы, которые могут привести к неприемлемым послеоперационным осложнениям и двусторонним параличам нижних черепных нервов.
Если в качестве курса лечения выбран хирургический метод, проводится предоперационная эмболизация. Эмболизация параганглиом явилась чрезвычайно полезным дополнением к нашему протоколу лечения. Хотя это и не является общепринятым, [52-56] выполнение эндоваскулярной эмболизации перед последующей операцией имеет серьезные преимущества, если предположить, что перед проведением эмболизации были соблюдены определенные критерии.[41,57-61] Опытная бригада сосудистых радиологов должна быть хорошо знакома со сложностями и возможными вариациями анатомии сосудов головы и шеи. Между внешней и внутренней каротидной системой существует множество анастомозов, и без этого знания могут иметь катастрофические неврологические последствия [62]. Безопасное выполнение этой процедуры с помощью интервенционной сосудистой радиологии должно быть установлено и задокументировано с приемлемым уровнем заболеваемости и смертности. [60,63]
Эмболизация параганглиом явилась чрезвычайно полезным дополнением к нашему протоколу лечения. Хотя это и не является общепринятым, [52-56] выполнение эндоваскулярной эмболизации перед последующей операцией имеет серьезные преимущества, если предположить, что перед проведением эмболизации были соблюдены определенные критерии.[41,57-61] Опытная бригада сосудистых радиологов должна быть хорошо знакома со сложностями и возможными вариациями анатомии сосудов головы и шеи. Между внешней и внутренней каротидной системой существует множество анастомозов, и без этого знания могут иметь катастрофические неврологические последствия [62]. Безопасное выполнение этой процедуры с помощью интервенционной сосудистой радиологии должно быть установлено и задокументировано с приемлемым уровнем заболеваемости и смертности. [60,63]
Операция
Операция проводится в течение 2 дней после ангиографии и эмболизации, чтобы избежать повторного включения коллатеральной опухоли. кровоснабжение и до наступления значительного поствоспалительного эффекта. [28] Если есть опасения по поводу отека опухоли, который может затруднить рассечение, назначают кратковременные стероиды. Анестезиолог должен быть готов противодействовать сердечно-сосудистому эффекту, вызванному альфа- и бета-адренергическими катехоламинами, при работе с «секретирующими» опухолями.
[28] Если есть опасения по поводу отека опухоли, который может затруднить рассечение, назначают кратковременные стероиды. Анестезиолог должен быть готов противодействовать сердечно-сосудистому эффекту, вызванному альфа- и бета-адренергическими катехоламинами, при работе с «секретирующими» опухолями.
Опухоли сонных артерий
Для адекватного удаления опухоли требуется субадвентициальное рассечение сонной артерии. Нервы, прикрепленные к этим опухолям, но не инфильтрованные ими, обычно могут быть мобилизованы; к ним относятся блуждающий, подъязычный и, иногда, языкоглоточный нервы.Симпатическая цепь и верхний гортанный нерв часто прикрепляются к опухоли, особенно в случаях медиального расширения в парафарингеальное пространство.
Югулотимпанальные параганглиомы
Тимпанальные параганглиомы, ограниченные средним ухом (Гласскока-Джексона, тип I, Фиш, класс A), доступны через трансканальный доступ [64]. Эти небольшие опухоли не требуют предоперационной эмболизации.
Вовлечение луковицы яремной вены требует комбинированного трансмастоидного и трансцервикального доступа.[65] Рассечение опухоли тщательно проводится от внутренней сонной артерии. Выходящие черепные нервы сохраняются, если их можно адекватно отделить от опухоли. Дополнительное воздействие на подвисочную ямку может быть достигнуто путем резекции мыщелка нижней челюсти и скуловой дуги. Такой подход позволяет получить доступ к задней и средней черепной ямке, и, при необходимости, дальнейшая резекция опухоли может быть выполнена с помощью нейрохирургического интракраниального доступа. Височный, височно-теменной или грудинно-сосцевидный лоскут на ножке используется для реконструкции и устранения дефекта.Наружный слуховой проход закрыт по проходу. Катетеры для спинального дренажа используются в послеоперационном периоде при значительной утечке спинномозговой жидкости.
Параганглиомы блуждающего нерва
Параганглиомы блуждающего нерва могут различаться по степени поражения основания черепа или внутричерепного поражения. Большинство параганглиом блуждающего нерва возникают в узловом (нижнем) ганглии, примерно на 2 см ниже яремного отверстия. Когда эти опухоли растут, они распространяются на основание черепа и затрагивают постшиловидное парафарингеальное пространство.Параганглиомы блуждающего нерва, возникающие в средних или верхних ганглиях блуждающего нерва, связаны с ранним поражением основания черепа с внутричерепным расширением.
Большинство параганглиом блуждающего нерва возникают в узловом (нижнем) ганглии, примерно на 2 см ниже яремного отверстия. Когда эти опухоли растут, они распространяются на основание черепа и затрагивают постшиловидное парафарингеальное пространство.Параганглиомы блуждающего нерва, возникающие в средних или верхних ганглиях блуждающего нерва, связаны с ранним поражением основания черепа с внутричерепным расширением.
Как и в случае со всеми параганглиомами, полная рентгенографическая оценка с использованием МРТ и КТ с контрастированием определит степень поражения. Комбинированный шейно-сосцевидный доступ к основанию черепа лучше всего подходит для безопасного и широкого обнажения. Опухоль почти всегда включает в себя жертву блуждающего нерва и дополнительных черепных нервов в зависимости от размера и локального поражения.[6]
Осложнения
Осложнения, связанные с хирургическим вмешательством на голове и параганглиоме, можно разделить на три основные категории: повреждение черепного нерва, повреждение сосудов и повреждение комплекса сонная артерия / сонный синус.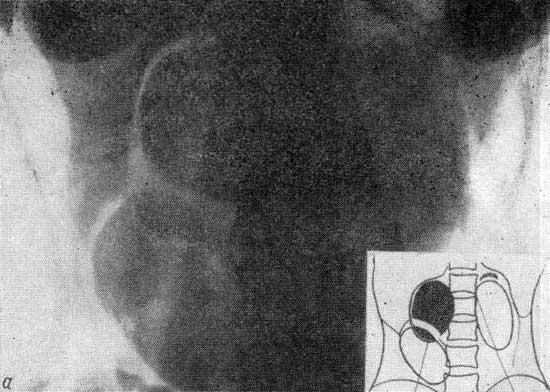
Травма черепного нерва
Дисфункция нижнего черепного нерва — частое осложнение хирургической резекции параганглиом головы и шеи и часто требует послеоперационной реабилитации. [6] Действительно, более крупные опухоли, затрагивающие височную кость, могут проникать между пучками черепных нервов даже при нормальной функции нервов.Эти пораженные нервы необходимо пожертвовать, чтобы произвести полную резекцию опухоли. [66] Наш опыт с послеоперационной дисфункцией черепных нервов отражает комбинацию полного паралича, вызванного жертвой нерва и пареза, с окончательным восстановлением функции за счет нервного тракта.
ТАБЛИЦА 5
Послеоперационный дефицит черепных нервов у пациентов с параганглиомой
Частота пораженных нервов зависит от типа и размера опухоли и используемого хирургического подхода (Таблица 5).[28] Хотя изолированное повреждение одного из нижних черепных нервов (IX-XII) иногда вызывает лишь временные незначительные затруднения при глотании, аспирации, фонации, подвижности плеча или движения языка, повреждение блуждающего нерва и множественное повреждение черепных нервов может привести к значительным осложнениям.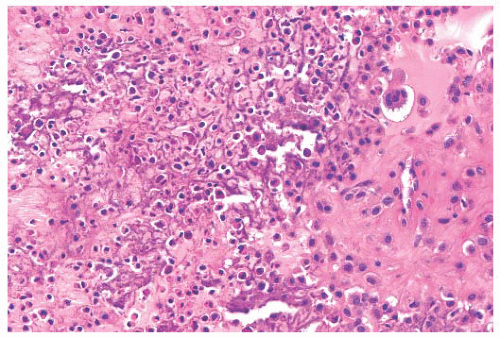 [67] Множественные дефициты черепных нервов особенно плохо переносятся пожилыми пациентами. Двусторонние параличи нижних черепных нервов чаще всего представляют собой тяжелую, потенциально опасную для жизни ситуацию.
[67] Множественные дефициты черепных нервов особенно плохо переносятся пожилыми пациентами. Двусторонние параличи нижних черепных нервов чаще всего представляют собой тяжелую, потенциально опасную для жизни ситуацию.
Послеоперационная реабилитация
Хирургия параганглиомы обычно вызывает послеоперационную нервную дисфункцию, и для надлежащего ухода за пациентом необходимо знать методы реабилитации.Если резекция опухоли приводит к перерезке нерва, то первичный анастомоз, если это возможно, обеспечивает приемлемую функцию. Особенно это касается лицевого, добавочного и подъязычного нервов. Также можно использовать кабельные трансплантаты с использованием большого ушного или икроножного нервов, особенно в случае дисфункции лицевого и добавочного нервов.
Реабилитация пациентов с послеоперационной нервной дисфункцией зависит от функционального дефицита и может потребовать дополнительного хирургического вмешательства, включая имплантаты верхнего века с золотым весом для защиты роговицы, трансоральную гемипалатальную адгезию при небной недостаточности, [68] височную и жевательную мышцу / фасциальную перевязку или адинамические фасциальные слинги или слинги с аллотрансплантатом для слабости лицевых мышц, и инъекция желатина (Gelfoam) / имплантат из силиката парализованной голосовой связки для медиализации, чтобы усилить глотание и улучшить качество голоса.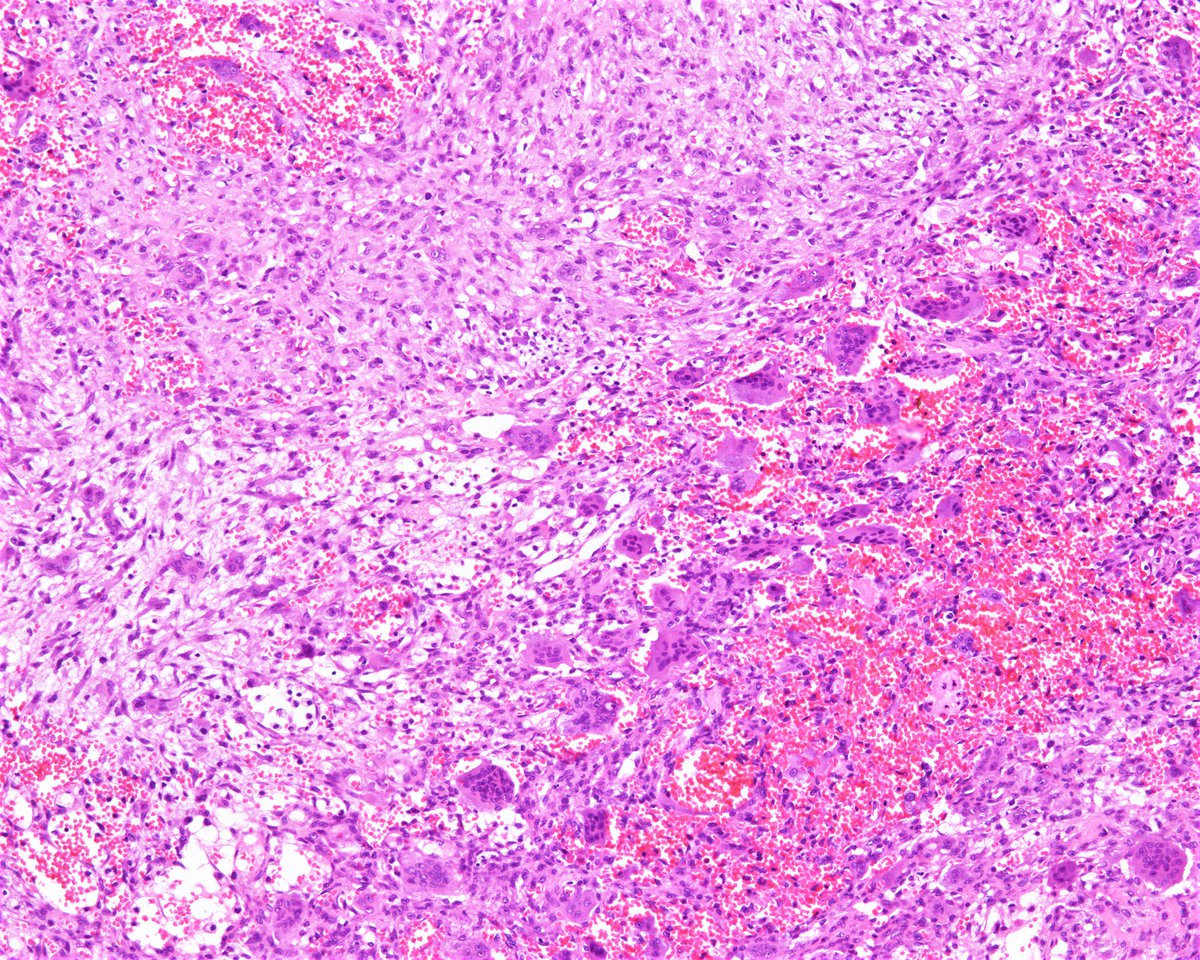
Сосудистая травма
Частота интраоперационного или послеоперационного инсульта резко снизилась по мере улучшения хирургических и анестезиологических методов. Это улучшение было связано со многими факторами, включая детальную предоперационную визуализацию и ангиографическую оценку для определения вовлечения сосудов опухолью, исследование окклюзии сонной артерии, корреляцию результатов двусторонней церебральной ангиографии с постокклюзионной церебральной функцией и достижения в хирургических методах реваскуляризации артерий.Недавние исследования сообщают, что частота серьезных инсультов составляет от 0% до 2% как осложнение резекции опухоли каротидного тела [1,50,55,69-72]; в более ранних сериях сообщалось о частоте от 10% до 20%. [72,73]
СПРАВОЧНОЕ РУКОВОДСТВО
Терапевтические агенты
Упомянутые в этой статье
Клонидин
Феноксибензамин (дибензилин)
Нитропруссид натрия
указываются в скобках только в том случае, если лекарство не доступно в общем виде и продается не более чем как два товарных знака или зарегистрированных продуктов.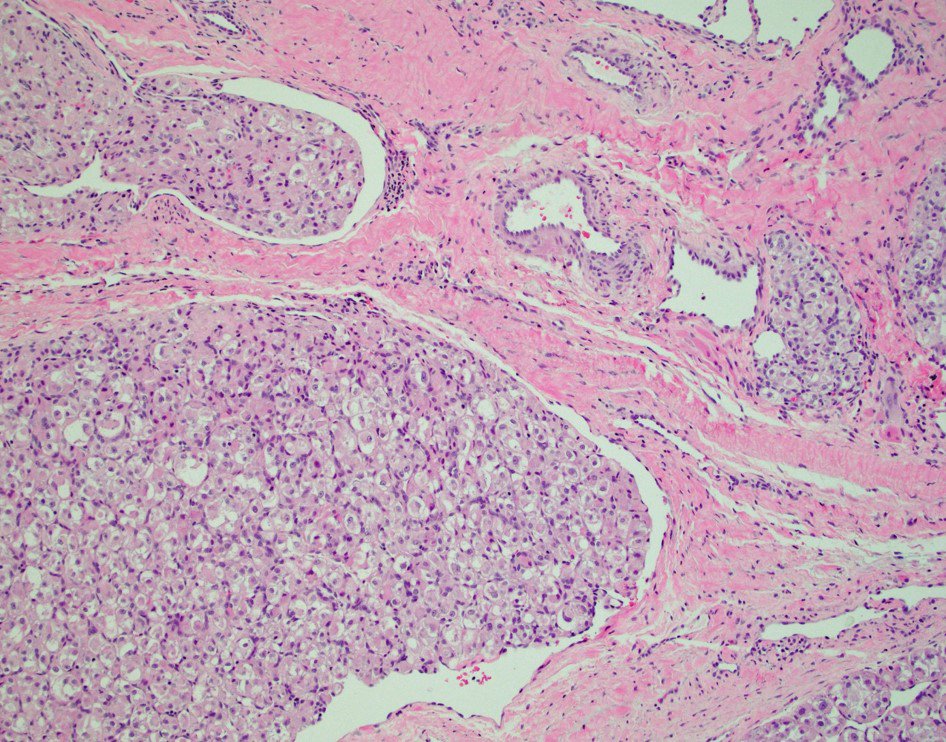 В скобках также могут быть включены более знакомые альтернативные общие обозначения.
В скобках также могут быть включены более знакомые альтернативные общие обозначения.
По сравнению с параганглиомами сонных артерий параганглиомы блуждающего нерва обычно не так тесно связаны с магистральными сосудами, что снижает вероятность повреждения сосудов. [74] Netterville и др. Сообщили о покрытии сонной артерии у 5 из 46 пациентов с параганглиомами блуждающего нерва [6]. Другие параганглиомы, связанные с повреждением сосудов, включают большие яремные параганглиомы, которые обычно затрагивают внутреннюю сонную артерию, особенно если имеется эрозия костной перегородки между внутренней яремной веной и внутренней сонной артерией.Повреждение внутренней сонной артерии произошло только у 1% пациентов с большими параганглиомами основания черепа [75].
Комплекс каротидного тела / каротидного синуса
Резекция двусторонних опухолей каротидного тела может привести к барорецептивной дисфункции из-за двусторонней денервации каротидного синуса. Эта дисфункция проявляется в виде стойкой гипертонии и тахикардии.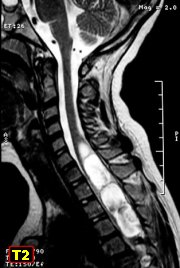 Netterville и др. Сообщили, что 10 из 11 пациентов, перенесших двустороннюю денервацию каротидного синуса, продемонстрировали тяжелую лабильную гипертензию / гипотензию, головную боль, потоотделение и эмоциональную нестабильность.[19]
Netterville и др. Сообщили, что 10 из 11 пациентов, перенесших двустороннюю денервацию каротидного синуса, продемонстрировали тяжелую лабильную гипертензию / гипотензию, головную боль, потоотделение и эмоциональную нестабильность.[19]
Поскольку парасимпатический ответ теряется, безальтернативные симпатические стимулы приводят к сердечно-сосудистым заболеваниям, которые обычно успешно купируются в послеоперационном периоде с помощью альфаадренергических антагонистов. Нитропруссид натрия вводят в раннем послеоперационном периоде для профилактики гипертонии. Долгосрочные сердечно-сосудистые эффекты контролируются клонидином или феноксибензамином (дибензилином).
Раскрытие финансовой информации: Авторы не имеют значительных финансовых интересов или иных отношений с производителями каких-либо продуктов или поставщиками любых услуг, упомянутых в этой статье.
Ссылки:
1.
Williams MD, Phillips MJ, Nelson WK, et al: Опухоль каротидного тела. Arch Surg 127: 963-968, 1992.B
Arch Surg 127: 963-968, 1992.B
2.
Gaylis H, Davidge-Pitts K, PantanowitzD: Опухоли каротидного тела. Обзор 52 дел. S Afr J Surg 72: 493-496, 1987.
3.
Джексон К.Г., Харрис П.Ф., Глассок М.Э., 3-й и др.: Диагностика и лечение параганглиом основания черепа. Am J Surg 159: 389-393, 1990.
4.
Лоусон В. Тельца и опухоли Glomus. NY State J Med 80: 1567-1575, 1980.
5.
Moore G, Yarington CT Jr, Manham CAJr: Опухоли блуждающего нерва: диагностика и лечение. Ларингоскоп 96: 533-536, 1986.
6.
Неттервилл Дж. Л., Джексон К. Г., Миллер Ф. Р. и др.: Параганглиома блуждающего нерва: обзор 46 пациентов, пролеченных в течение 20-летнего периода. ArchOtolaryngol Head Neck Surg 124: 1133-1140, 1998.
7.
Пирс A: Цитохимия и ультраструктура продуцирующих полипептидный гормон клеток серии APUD и эмбриональные, физиологические и патологические последствия этой концепции.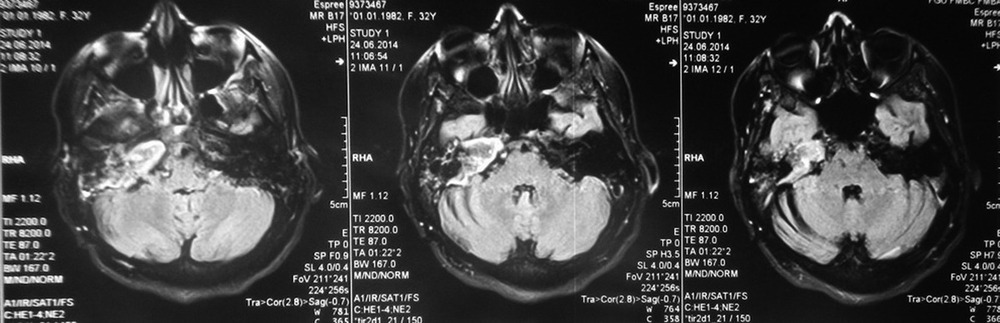 J. Histochem Cytochem 17: 303-313, 1969.
J. Histochem Cytochem 17: 303-313, 1969.
8.
Пирс A: Диффузная нейроэндокринная система: Исторический обзор. Front Horm Res 12: 1-7, 1984.
9.
Thirlwall AS, Bailey CM, Ramsay AD, et al: Параганглиома гортани у пятилетнего ребенка — самый молодой из когда-либо зарегистрированных случаев.JLaryngol Otol 113: 62-64, 1999.
10.
Венкатарамана Н.К., Коллури В.Р., КумарДВ и др.: Параганглиома орбиты с распространением на среднюю черепную ямку: отчет из клинического случая. Нейрохирургия 24: 762-764, 1989.
11
. Kronz JD, Argani P, Udelsman R, et al: Параганглиома щитовидной железы: два случая, которые проясняют и расширяют клинический спектр. HeadNeck 22: 621-625, 2000.
12.
Nielsen TO, Sejean G, Onerheim RM: Параганглиома языка.Arch Pathol LabMed 124: 877-879, 2000.
Параганглиома языка..png) Arch Pathol LabMed 124: 877-879, 2000.
Arch Pathol LabMed 124: 877-879, 2000.
13.
Велкоборский HJ, Gosepath J, Jacob R, et al: Биологические характеристики параганглиом носовой полости и придаточных пазух носа. AmJ Rhinol 14: 419-426, 2000.
14.
Sharma HS, et al: Злокачественная параганглиома лобно-этмоидальной области. Auris NasusLarynx 26: 487-493, 1999.
15.
Скиннер Л.Дж., Курран А.Дж., Барнс С. и др.: Параганглиома наружного слухового прохода: необычный случай. J Laryngol Otol 114: 370-372, 2000.
16.
Sambaziotis D, Kontogeroges G, KovacsK и др.: Интраселлярная параганглиома, представляющая нефункционирующую аденому гипофиза. Arch Pathol Lab Med 1999: 429-432.
17
. Ямаути Т., Кубота М., Саеки Н. и др.: Отчет о параганглиоме в основании фронтального черепа.Neurol Med Chir 39: 308-312, 1999.
18.
Grufferman S, Gillman MW, PasternakLR, et al.: Семейные опухоли сонной артерии: Casereport и эпидемиологический обзор. Cancer46: 2116-2122, 1980.
19.
Netterville JL, ReillyKM, Robertson D, et al: Каротидные опухоли тела: обзор 30 пациентов с 46 опухолями. Laryngoscope 105: 115-126, 1995.
20.
Oosterwijk J, Jansen JC, van SchothorstEM и др.: Первый опыт генетического консультирования, основанного на прогнозирующей ДНК-диагностике наследственных опухолей клубочков (параганглиомы).JMed Genet 33: 379-383, 1996.
21.
van der Mey AG, Maaswinkel-MooyPD, Cornelissa CJ, et al: Gentic imprinting наследственные опухоли клубочков: доказательства новой генетической теории. Lancet 2: 1291-1894, 1989.
22.
Heutink P, van der Mey AG, SankuijlLA и др.: Ген, подлежащий геномному импринтингу и ответственный за наследственные карты параганглиом в хромосоме 11q23-qter. HumMol Genet 1: 7-10, 1992.
HumMol Genet 1: 7-10, 1992.
23.
Сайкс Дж., Оссофф Р. Параганглиомы головы и шеи. Otolaryngol Clin North Am19: 755-767, 1986.
24.
Jackson G: Диагностика для планирования лечения и вариантов лечения. Laryngoscope103: 17-22, 1993.
25.
Lack EF, Cubilla AL, Woodruff JM и др.: Параганглиомы области головы и шеи: клиническое исследование 69 пациентов. Cancer39: 397-409, 1977.
26.
Kliewer KE, Wen DR, Cancilla PA, et al: Paragangliomas: Оценка прогноза с помощью гистологических, иммуногистохимических и ультраструктурных методов.Хум Патол 20: 29-39, 1989.
27.
Rao AB, Koeller KK, Adair CF: Из архивов AFIP. Параганглиомы головы и шеи: радиолого-патологическая корреляция. Институт патологии вооруженных сил. Рентгенография 19: 1605-1632, 1999.
28.
Persky MS, Setton A, Niimi Y и др .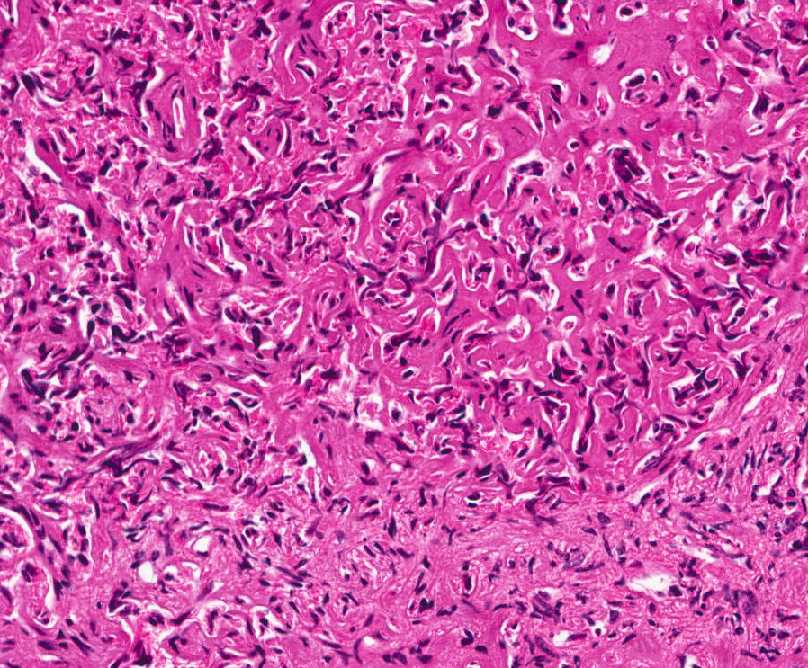 : Комбинированные эндоваскулярные и хирургическое лечение параганглиом головы и шеи — групповой подход. Head Neck 24: 423-431, 2002.
: Комбинированные эндоваскулярные и хирургическое лечение параганглиом головы и шеи — групповой подход. Head Neck 24: 423-431, 2002.
29.
Батсакис Дж .: Параганглиомы головы и шеи, в Опухолях головы и шеи: Клиническое и патологическое рассмотрение, стр. 369-380. Балтимор, Уильямс и Уилкинс, 1979.
30.
Shamblin WR, Mine WH, Sheps SG, et al: Опухоль каротидного тела (хемодэктома): клинико-патологический анализ девяноста случаев. Am Surg122: 732-739, 1971.
31.
Манолидис С., Шохет Дж. А., Джексон К. Г. и др.: Злокачественные опухоли гломуса.Laryngoscope 109: 30-34, 1999.
32.
Zbaren P, Lehman W: Параганглиома сонной артерии с метастазами. Laryngoscope 95: 450-454, 1985.
33.
El Fiky FM, Paparella MM: опухоль с метастатическим гломомусом. Отчет о височной кости. Am J Otol 5: 197-200, 1984.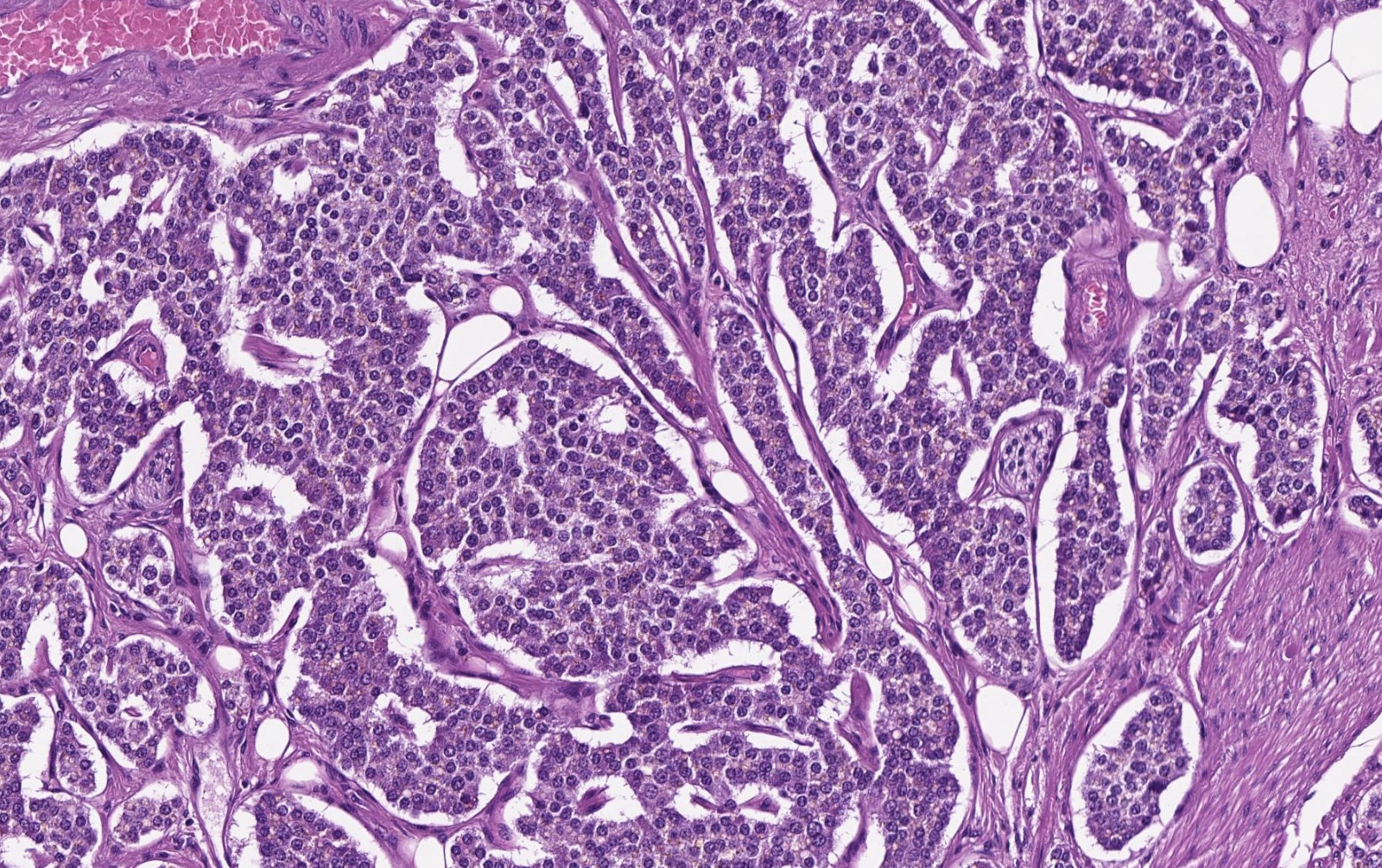
34.
Пачеко-Охеда Л.: Злокачественные опухоли сонной артерии: отчет о трех случаях. Анн Отол РинолЛарингол 110: 36-40, 2001.
35.
Янсен Дж. К., ван ден Берг Р., Койпер А. и др.: Оценка скорости роста у пациентов с параганглиомами головы и шеи влияет на выбор лечения. Cancer 88: 2811-2816, 2000.
36.
Schwaber MK, Glasscock ME, NissenAJ, et al: Диагностика и лечение катехоламинекретирующих гломусных опухолей. Laryngoscope 94: 1008-1015, 1984.
37.
Зак Ф.Г., Лоусон В.: Система параганглионарных хеморецепторов. Нью-Йорк, Springer-Verlag, 1982.
38.
Irons GB, Weiland LH, Brown WL: Параганглиомы шеи: Клинический и патологический анализ 116 случаев. Surg Clin NorthAm 57: 575-583, 1977.
39.
Паркин JL: Семейные опухоли множественного гломуса и феохромоцитомы. Ann Otol RhinolLaryngol 90: 60-63, 1981.
Ann Otol RhinolLaryngol 90: 60-63, 1981.
40.
Revak CS, Morris SE, Alexander GH: Феохромоцитома и рецидивирующие хемодэктомы в течение двадцати пяти лет.Радиология 100: 53-54, 1971.
41.
Майер В., Марангос Н., Ласциг Р.: Параганглиома как системный синдром: подводные камни и стратегии. Дж. Ларингол Отол 113: 978-982, 1999.
42.
Cheng A, Niparko JK: Тест на визуализацию 2. Опухоль височной кости Glomus tympanicum. Arch Otolaryngol Head Neck Surg123: 549, 551-552, 1997.
43.
Swartz JD, Harnsberger HR, MukherjiSK: височная кость.Современная диагностическая дилемма. Radiol Clin North Am 36: 819-853, 1998.
44.
Som PM, Braun IF, Shapiro MD и др.: Опухоли парафарингеального пространства и верхней части шеи: характеристики МРТ. Radiology 164: 823-829, 1987.
45.
Olsen WL, Dillon WP, Kelly WM, et al: МРТ параганглиом..jpg) AJR Am JRoentgenol 148: 201-204, 1987.
AJR Am JRoentgenol 148: 201-204, 1987.
46.
van Gils AP, van der May AG, HoogmaRP и др.: МРТ-скрининг родственников с риском развития параганглиом: поддержка геномного импринтинга при наследственных гломусах. .Br J Cancer 65: 903-907, 1992.
47.
van den Berg R, Wasser MN, van GilsAP и др.: Васкуляризация параганглиом головы и шеи: сравнение трех методов МР-ангиографии с цифровой субтракционной ангиографией. Am J Neuroradiol 21: 162-170,2000.
48.
Telischi FF, Bustillo A, Whiteman ML, et al: Октреотидная сцинтиграфия для обнаружения параганглиом. Otolaryngol Head NeckSurg 122: 358-362, 2000.
49.
Lasjaunias AP, Berenstein K: Хирургическая нейроангиография: эндоваскулярное лечение черепно-лицевых поражений, том 2. Нью-Йорк, Springer-Verlag, 1987.
50.
Ананд В.К., Алемар Г.О., Сандерс Т.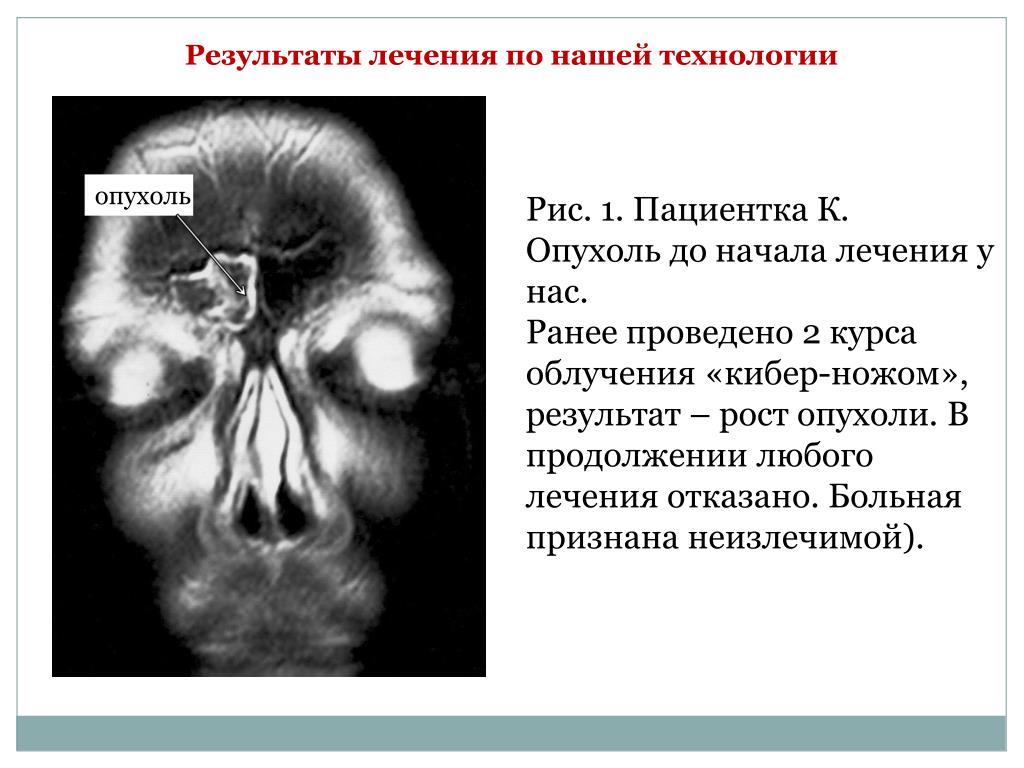 С.: Управление внутренней сонной артерии во время операции по поводу опухоли каротидного тела. Laryngoscope105 (3 pt 1): 231-235, 1995.
С.: Управление внутренней сонной артерии во время операции по поводу опухоли каротидного тела. Laryngoscope105 (3 pt 1): 231-235, 1995.
51.
Сакураи Х., Хаякава К., Мицухаши Н. и др.: Хемодэктома каротидного тела, леченная лучевой терапией: отчет о клиническом случае.RadiatMed 13: 191-194, 1995.
52.
Биллер Х., Лоусон В., Сом П. и др.: Опухоли Гломусвагале. Ann Otol Rhinol Laryngol98 (1 pt 1): 21-26, 1989.
53.
Brackman D, Kinney S, Fu K: Glomustumor: Диагностика и лечение. Head NeckSurg 9: 306-311, 1987.
54.
Леонетти Дж. П., Донцелли Дж. Дж., Литтой Ф. Н. и др.: Периоперационные стратегии в лечении опухолей сонной артерии. Otolaryngol Head NeckSurg 117: 111-115, 1997.
55.
Matticari S, Credi G, Pratesi G и др.: Диагностика и хирургическое лечение опухолей каротидного тела. J Cardiovasc Surg 36: 233-239, 1995.
56.
Литле В.Р., Рейли Л.М., Рамос Т.К .: Предоперационная эмболизация опухолей сонной артерии: когда это целесообразно? Ann Vasc Surg 10: 464-468, 1996.
57.
Merland JJ, Reizine D, Guimaraens L, et al: Диагностическая и терапевтическая ангиография при оценке и лечении опухолей ягодичного клубка.По поводу 32 случаев (французский). Neuro-Chirurgie 31: 358-366, 1985.
58.
Ogura JH, Spector GJ, Gado M: Glomusjugulare and vagale. Ann Otol 87 (5 pt 1): 622-629, 1978.
59.
Smith RF, Shetty PC, Reddy DJ: Хирургическое лечение каротидных параганглиом, представляющее необычные технические трудности. Значение предоперационной эмболизации. J Vasc Surg7: 631-637, 1988.
60.
LaMuraglia GM, Fabian RL, BrewsterDC, et al: Текущее хирургическое лечение параганглиом сонных артерий.J Vasc Surg15: 1038-1045 (включая обсуждение), 1992.
61.
Ward PH, Liu C, Vinuela F и др.: Эмболизация: дополнительная мера для удаления опухолей каротидного тела. Ларингоскоп 98: 1287-1291, 1988.
62.
Lasjaunias P: Ангиофибромы носоглотки: опасность эмболизации. Радиология 136: 119-123, 1980.
63
. Мерфи Т.П., Бракманн Д.Е.: Влияние предоперационной эмболизации на опухоль ягодичного гломуса.Ларингоскоп 99: 1244-1247, 1989.
64.
House WF, Glasscock ME: Glomus tympanicumtumors. Арка Отоларингол 87: 550,1968.
65.
Brackmann D, Arriaga M: Хирургия опухолей forglomus, в Brackmann D, Shelton C, Arriaga M (eds): Otologic Surgery. Philadelphia, WB Saunders, 1994.
66.
Sen C, Hague K, Kacchera R, et al: Яремное отверстие: микроскопические анатомические особенности и значение для сохранения нервной ткани со ссылкой на опухоли гломуса, затрагивающие височную кость.Нейрохирургия 48: 838-848,2001.
67.
Джексон К.Г .: Хирургия основания черепа. Am JOtol 3: 161-171, 1981.
68.
Netterville JL, Vrabec JT: Односторонняя небная адгезия при параличе после сильной вагалинной травмы. Arch Otolaryngol Head Neck Surg 120: 218-221, 1994.
69.
Dickinson PH, Griffin SM, Guy AJ, et al: Опухоль сонной артерии: 30 лет опыта. BR J Surg 73: 14-16, 1986
70.
Hallett JW Jr, Nora JD, Hollier LH, et al: Тенденции нейроваскулярных осложнений хирургического лечения каротидного тела и параганглиом шейки матки: пятидесятилетний опыт работы со 153 опухолями. J Vasc Surg 7: 284-291,1988.
71.
Воск МК, Бриант TD: Опухоли сонных артерий: обзор. Дж. Отоларингол 21: 277-285, 1992.
72.
Muhm M, Polterauer P, Gstottner W, et al: Диагностические и терапевтические подходы к опухолям каротидного тела.Обзор 24 пациентов. Arch Surg 132: 279-284, 1997.
73.
Monro R: Естественная история опухолей сонных артерий, их диагностика и лечение. Br J Surg 37: 4445-453, 1950.
74.
Urquhart AC, Johnson JT, Myers EN, et al: Glomus vagale: Параганглиома блуждающего нерва. Laryngoscope 104: 440-445, 1994.
75.
Woods CI, Strasnick B, Jackson CG: Хирургия клубочковой опухоли: Опыт группы отологов.Ларингоскоп 103: 65-70, 1993.
Параганглиома Симптомы, лечение, диагностика и многое другое
Круглосуточные анализы мочи и крови (плазмы) обычно используются при подозрении на феохромоцитому или параганглиому.
Pheo часто называют «великим подражателем». Получить диагноз и отличить фео-парат от других состояний может быть непросто. В недавнем опросе 35% респондентов указали, что на постановку диагноза уходит более 4 лет.
Суточный анализ мочи и анализ плазмы крови измеряют катехоламины и метанефрины (которые являются метаболитами катехоламинов).
Метанефрины выделяются из опухоли непрерывно, в отличие от катехоламинов, которые обычно выделяются с перерывами. Это непрерывное высвобождение метанефринов из опухоли объясняет, почему тестирование на метанефрины предпочтительнее тестирования на катехоламины. В редких случаях параганглиома, часто в области головы / шеи, может не производить катехоламины или метанефрины.В этих последних случаях предпочтительным методом диагностики является визуализация.
24-часовой анализ мочи и анализ плазмы крови одинаково эффективны для измерения свободных метанефринов и, в конечном итоге, для постановки диагноза. Оба теста имеют точность примерно 95%. Некоторые лаборатории измеряют только общие метанефрины, и это почти так же точно, как измерения свободных метанефринов. Выбор теста зависит от ваших предпочтений и предпочтений вашего врача.
Круглосуточный анализ мочи:
Суточный тест на метанефрин в моче определяет количество свободных метанефринов в моче.24-часовой сбор мочи осуществляется путем сбора мочи в специальный контейнер в течение 24-часового периода. Это может быть менее удобно, чем анализ крови. Когда 24-часовая моча собрана не полностью, результат теста может оказаться ложноотрицательным (нормальный результат теста у пациента с фео). Истинно положительные значения (аномальный результат теста у пациента с фео) обычно в два и более раз превышают верхний предел нормы.
Анализ плазмы крови:
Тест на отсутствие метанефринов в плазме — это анализ крови, который измеряет количество метанефринов в крови.Этот тест по сравнению с 24-часовым анализом мочи может быть более удобным, так как это только разовый забор крови. Руководство эндокринологического общества предлагает брать кровь после того, как пациент немного отдохнет и находится в положении лежа на спине (лежа на спине), но многие лаборатории не следуют этому руководству. Пациенты с феосом или паразитами часто имеют верхний предел нормы в два или более раз, поэтому может потребоваться повторное тестирование в положении лежа на спине, если ваша кровь была взята, когда вы сидели, и результаты неопределенны.
3-метокситирамин
3-метокситирамин (3MT), который является продуктом распада дофамина, иногда используется для тестирования. Этот анализ крови может быть умеренно полезным у пациентов с явными симптомами для подтверждения фео-парадиагностики. Это также может быть полезно при выявлении пациентов с параганглиомами головы / шеи. 3-МТ может быть измерен у пациентов с генетическими мутациями, особенно у SDHB, который имеет более высокий риск метастатического заболевания. Наконец, это может быть полезно при обнаружении метастазов.Однако тестирование 3MT недоступно в большинстве лабораторий в США.
.
Ложноотрицательные / Ложноположительные / Неопределенные результаты
Иногда результаты теста являются ложноотрицательными (нормальный результат теста у пациента с фео), ложноположительными (аномальный результат теста у пациента без фео) или неопределенными (уровни могут быть немного выше верхнего предела нормы). В последнем случае врач может повторно обследовать вас или рассмотреть возможность визуализации.
Почему ложноотрицательный?
- очень маленькие опухоли
- опухолей, не продуцирующих катехоламины
- неполный сбор мочи
Почему ложное срабатывание?
- Кровь брали в сидячем положении.Руководство эндокринологического общества предлагает брать кровь после того, как пациент немного отдохнет и находится в положении лежа на спине (лежа на спине), но многие лаборатории не следуют этому руководству.
- сильная боль, сердечная недостаточность или острый физический или эмоциональный стресс.
- добавок, прописанных лекарств, безрецептурных или запрещенных препаратов; см. Ниже список, который может повлиять на результаты. Однако это зависит от технической процедуры, используемой для измерения.
Сообщите своему врачу обо всех прописанных и отпускаемых без рецепта лекарствах, добавках и запрещенных лекарствах, которые вы принимаете.Не прекращайте прием прописанных лекарств без предварительной консультации с врачом. Вот список лекарств / веществ, которые могут повлиять на результаты анализов:
Ацетаминофен, симпатомиметики, трициклические антидепрессанты, селективный обратный захват серотонина, ингибиторы обратного захвата серотонин-норэпинефрина, циклобензаприн, леводопа, ингибиторы моноаминоксидазы, некоторые бета-адреноблокаторы, некоторые альфа-блокаторы (феноксибензамин
, препараты марихуаны
), марихуана
Обработка изображений
Визуализация, фотографирование внутренней части тела, часто используется, когда биохимические тесты указывают на фео или пара.Визуализация поможет определить, где, сколько и размер опухоли (опухолей). КТ / МРТ часто используются в первую очередь до использования функциональной визуализации.
Функциональная визуализация — это визуализация с использованием радиоактивного вещества для фотографирования тела. Некоторые из этих радиоактивных веществ также можно использовать для лечения метастатических фео-пара, что может сбивать с толку. Общество ядерной медицины и молекулярной визуализации имеет множество онлайн-ресурсов, чтобы объяснить использование обоих и решить вопросы, связанные с радиационным воздействием.
Компьютерная томография (компьютерная томография):
Компьютерная томография позволяет получить серию подробных снимков внутри тела в таких местах, как шея, грудь, живот и таз. Снимки, сделанные под разными углами, сделаны компьютером, подключенным к рентгеновскому аппарату. В вену можно ввести краситель, чтобы органы или ткани были видны более четко. Эта процедура также называется компьютерной томографией, компьютерной томографией или компьютерной осевой томографией.
МРТ (магнитно-резонансная томография):
МРТ использует магнит, радиоволны и компьютер, чтобы сделать серию подробных снимков таких областей внутри тела, как шея, грудь, живот и таз.Эта процедура также называется ядерной магнитно-резонансной томографией (ЯМРТ).
Функциональная визуализация:
Функциональная визуализация позволяет врачам видеть, как функционирует организм, и измерять его химические и биологические процессы. Для феопаратов функциональная визуализация может включать 123 I-MIBG, 18 F-FDG-PET / CT, 18 F-DOPA-PET / CT или 68 GaDOTATATE PET / CT сканирование. Небольшое количество радиофармпрепарата вводится пациенту и обнаруживается специальными камерами, чтобы обеспечить очень точные изображения области тела, на которой снимается изображение.
Функциональная визуализация может использоваться для определения того, распространилось ли заболевание на другие части тела (метастатическое), и где расположены опухоли. Поскольку стоимость этих сканирований может быть непомерно высокой, они не являются широко доступными и могут не покрываться страховкой.
Несиндромная параганглиома: MedlinePlus Genetics
Гены VHL , RET , SDHB и SDHD могут мутировать как в синдромальной, так и в несиндромной формах параганглиомы и феохромоциомы.Мутации по крайней мере в трех дополнительных генах, TMEM127 , SDHA и KIF1B , были идентифицированы у людей с несиндромной формой этих состояний. Генные мутации увеличивают риск развития параганглиомы или феохромоцитомы, влияя на контроль роста и деления клеток.
Мутации в генах VHL , SDHA , SDHB и SDHD повышают риск развития несиндромной параганглиомы или феохромоцитомы.Белок, производимый из гена VHL , помогает расщеплять другие ненужные белки, включая белок, называемый HIF, который стимулирует деление клеток и образование кровеносных сосудов в определенных клеточных условиях. Белки, продуцируемые генами SDHA , SDHB и SDHD , являются частями (субъединицами) фермента, который важен для производства энергии в клетке. Этот фермент также играет роль в расщеплении белка HIF. Мутации в генах VHL , SDHA , SDHB и SDHD стабилизируют белок HIF, заставляя его накапливаться в клетках.Избыток белка HIF стимулирует клетки к делению и запускает производство кровеносных сосудов, когда они не нужны. Быстрое и неконтролируемое деление клеток вместе с образованием новых кровеносных сосудов может привести к развитию опухолей.
Мутации в гене RET были обнаружены в несиндромной феохромоцитоме в дополнение к синдрому предрасположенности к феохромоцитоме. Белок, продуцируемый геном RET , участвует в передаче сигналов внутри клеток, которые могут стимулировать деление или созревание клеток.Мутации в гене RET чрезмерно активизируют сигнальную функцию белка, что может запускать рост и деление клеток в отсутствие сигналов извне. Это неконтролируемое деление клеток может привести к образованию опухолей в надпочечниках.
Мутации в гене TMEM127 чаще всего выявляются у людей с несиндромной феохромоцитомой и редко встречаются у людей с другими параганглиомами. Белок TMEM127 обычно контролирует сигнальный путь, который индуцирует рост и выживание клеток.Исследования показывают, что мутации в гене TMEM127 приводят к аномальной активации роста клеток, что может вызвать образование опухоли.
Сообщалось о мутациях в гене KIF1B при несиндромной феохромоцитоме. Исследования показывают, что эти мутации нарушают функцию белка KIF1B, который обычно вызывает самоуничтожение клеток в процессе, называемом апоптозом. Когда апоптоз нарушен, клетки растут и делятся слишком быстро или неконтролируемым образом, что может привести к образованию опухоли.
Многие люди с несиндромной параганглиомой или феохромоцитомой не имеют мутации ни в одном из генов, связанных с этим заболеванием. Вероятно, что другие, неидентифицированные гены также предрасполагают к развитию параганглиомы или феохромоцитомы.
Протонная терапия перспективна при параганглиомах головы и шеи
Пациенты с параганглиомами головы и шеи могут безопасно и эффективно лечиться протонной терапией, что дает результаты, сопоставимые с результатами, полученными при лечении обычными стратегиями фотонной лучевой терапии, согласно результатам, опубликованным в Head & Neck .
Параганглиомы головы и шеи — это редкие, обычно доброкачественные нейроэндокринные опухоли, которые образуются в группе нервных клеток нервной системы, которые позволяют нервным клеткам формироваться в любом месте симпатической и парасимпатической нервной систем. Выделяют два типа: хромаффинные параганглиомы и нехромаффинные параганглиомы.
Эти опухоли обычно возникают внутри или вдоль височной кости, яремного отверстия, блуждающего нерва или каротидного тела.
Хирургия и лучевая терапия являются нынешним стандартом лечения, популярность лучевой терапии растет из-за заболеваемости, связанной с удалением параганглиомы головы и шеи из яремного отверстия.
«Основная цель терапии — остановить рост опухоли при минимизации заболеваемости», — пишут исследователи. «… Хотя основная цель лучевой терапии — остановить рост существующей опухоли, она может дополнительно обеспечить уменьшение объема и улучшение симптомов, связанных с параганглиомой головы и шеи».
По мере роста использования радиации следует решение использовать протонную или фотонную лучевую терапию. Однако было обнаружено, что протонная терапия снижает дозу побочного излучения на окружающие нормальные ткани, что при параганглиоме головы и шеи может защитить полость рта, мозг, ствол мозга, улитку, ротоглотку и кожу.
«Из-за непосредственной близости этих функционально важных структур есть убедительное обоснование для рассмотрения полезности протонов для радиационного управления этими опухолями», — пишут исследователи.
В этом ретроспективном обзоре они сообщили о своем опыте использования протонной терапии у 37 пациентов (всего 40 опухолей) с параганглиомами головы и шеи, пролеченных в одном учреждении с 1997 по 2016 год для определения безопасности и эффективности схемы.
Протонная терапия была проведена в среднем 50 человек.4 Гр.
В соответствии с тем фактом, что эти опухоли возникают в результате семейного риска в 30-40% случаев, исследователи обнаружили, что наличие генетической / семейной предрасположенности к заболеванию было связано с мультифокальными опухолями, а также с более молодым диагнозом. . «… Оба фактора, при которых избирательная эффективность протонной терапии может принести значительную пользу пациентам», — пояснили исследователи.
У 26 пациентов (70%) наблюдалось улучшение симптомов после лечения протонной терапией. Наиболее часто улучшавшиеся симптомы включали дизартрию (67%), шум в ушах (57%), боль / давление в ушах (33%) и головную боль (33%).Кроме того, 65% обработанных опухолей показали 20% или более объемную усадку.
Более того, пятилетняя безрецидивная выживаемость и общая выживаемость составили 97%.
Побочные эффекты 2–3 степени включали субъективное нарушение слуха (19%), воспаление среднего уха (14%) и сухость во рту (8%).
«Пациентов с (параганглиомами головы и шеи) можно эффективно и безопасно лечить с помощью протонной терапии с достижением отличного (безрецидивная выживаемость), успешного объемного уменьшения опухоли и улучшения симптомов в большинстве случаев», — заключили исследователи.«Эти результаты сопоставимы с результатами, достигнутыми при использовании традиционных стратегий фотонной лучевой терапии. Протонная терапия может быть особенно убедительной для пациентов с предрасположенными генетическими мутациями и / или семейным анамнезом (параганглиомы головы и шеи), мультифокальным заболеванием или более молодым возрастом на момент постановки диагноза ».
Мультимодальная визуализация параганглиом головы и шеи | Взгляд на визуализацию
Параганглиомы, также известные как опухоли гломуса, возникают из параганглионарных клеток, которые составляют основу внеадреналовой нейроэндокринной системы.Эти клетки выполняют различные регуляторные функции в организме, включая функции хеморецепторов, которые позволяют организму реагировать на стрессы, такие как гипоксия, гиперкапния и гипогликемия. Когда эти клетки демонстрируют неоплазию в области головы и шеи, они обычно присутствуют в характерных местах и с общей симптоматикой; таким образом, понимание этих ключевых особенностей в сочетании с их визуализацией может привести к точной и быстрой диагностике. Визуализирующая оценка параганглиом головы и шеи использует различные методы визуализации поперечного сечения для оценки степени заболевания и помощи в управлении хирургическим вмешательством путем оценки поражения костной и нервно-сосудистой систем.В этой статье мы рассмотрим предполагаемое анатомическое расположение параганглиом и их общий вид на изображениях на компьютерной томографии (КТ) и магнитном резонансе (МРТ), а также при КТ и МР ангиографии. Кроме того, мы обсудим другие дифференциальные аспекты для поражений, обнаруженных в этих местах. Понимая эти фундаментальные концепции, радиолог сможет точно дифференцировать в целом доброкачественную параганглиому от потенциально более агрессивного новообразования головы и шеи.
Их наиболее частые анатомические местоположения включают сонное пространство, яремное отверстие, среднее ухо и вдоль хода блуждающего нерва (рис. 1). Большинство параганглиом головы и шеи являются доброкачественными и инвазивными только местно, и только около 2–13% параганглиом демонстрируют злокачественность [1]. Злокачественность определяется анатомическим наличием метастазов, поскольку в настоящее время не существует гистопатологических диагностических критериев, которые могли бы точно отличить злокачественные параганглиомы от их доброкачественных аналогов [2].Злокачественные параганглиомы головы и шеи чаще всего демонстрируют метастазы в регионарные лимфоузлы, а отдаленные метастазы встречаются крайне редко [3].
Рис. 1
Анатомические области параганглиом головы и шеи
Хотя большинство случаев носят спорадический характер, приблизительно 40% считаются наследственными [4]. Эти семейные опухоли, как правило, возникают раньше, чем их спорадические аналоги, с пиком распространенности в возрасте 30–35 лет [5]. Кроме того, семейные параганглиомы чаще бывают мультицентрическими, чем спорадические опухоли.Параганглиомы головы и шеи чаще встречаются у женщин, причем эта предрасположенность наиболее характерна для яремного (3: 1) и тимпанального подтипов (6: 1) [6]. Параганглиомы связаны с множественными синдромами и генами и обычно наблюдаются у пациентов с фон Хиппель-Линдау (VHL), нейрофиброматозом I типа (NF I) и множественной эндокринной неоплазией II типа (MEN II) [7, 8].
Характеристики изображения
Ультразвук обычно используется на ранних этапах диагностического процесса, часто для первоначальной оценки пальпируемого образования на шее.Сонографическая оценка параганглиом демонстрирует четко выраженное, неоднородно гипоэхогенное образование с выраженной внутренней васкуляризацией на цветном допплеровском исследовании (рис. 2). Тщательная оценка характера смещения внутренних и внешних сонных артерий может вызвать подозрение на наличие параганглиом сонной артерии и блуждающего нерва, а также провести оперативную визуализацию поперечного сечения.
Рис. 2
Цветное доплеровское ультразвуковое изображение правой шейки шейки матки демонстрирует относительно гипоэхогенное, четко очерченное образование с внутренним сосудистым потоком (белые стрелки) в правой области уровня II.Масса расширяет наружную сонную артерию поверхностно (стрелки)
Магнитно-резонансная томография (МРТ) является наиболее чувствительным методом визуализации для оценки параганглиом, учитывая ее превосходное разрешение мягких тканей, и она может легко отличить эти опухоли от других новообразований головы и шеи. По сравнению с прилегающими мягкими тканями, параганглиомы обычно демонстрируют гипоинтенсивный сигнал на T1-взвешенных последовательностях и изоинтенсивный или гиперинтенсивный сигнал на T2-взвешенных последовательностях. Учитывая сосудистую природу большинства параганглиом, обычно наблюдаются пустоты внутреннего кровотока, особенно на Т2-взвешенных последовательностях.Реже области гиперинтенсивного межопухолевого кровоизлияния можно увидеть как на T1-, так и на T2-взвешенных последовательностях. Перемежение этих гипоинтенсивных пустот и участков гиперинтенсивного кровотечения приводит к появлению характерного «соли и перца», который наиболее очевиден для опухолей размером более 1 см. Параганглиомы чаще всего демонстрируют сильное гомогенное усиление после внутривенного введения контрастных веществ гадолиния.
На компьютерной томографии (КТ) параганглиомы представлены в виде четко выраженной аттенуированной массы мягких тканей.Чаще всего они демонстрируют однородное, сильное усиление после введения внутривенного контраста, хотя гетерогенность может возникать в поражениях с внутриопухолевым тромбозом или кровотечением. Кроме того, параганглиомы могут вызывать местную эрозию прилегающих костных структур, а компьютерная томография отлично подходит для оценки поражения костей. В случае параганглиом, поражающих основание черепа, обычно выполняется специальная компьютерная томография височной кости с высоким разрешением для оценки поражения ключевых структур и руководства хирургическим лечением.
Ангиография с использованием КТ-ангиографии (КТА), МР-ангиографии (МРА) или цифровой субтракционной ангиографии (ДСА) обычно выполняется как дополнение к КТ или МРТ, а также в предоперационных условиях [9]. Эти методы позволяют оценить перфузию опухоли и идентифицировать питающие сосуды, которые могут определять последующую эмболизацию или хирургические подходы [10]. Учитывая сосудистую природу параганглиом в области головы и шеи, ангиография обычно демонстрирует множественные усиливающие и питающие периопухолевые сосуды, включая артериальную и венозную сосудистую сеть.Кроме того, и КТА, и МРА полезны для демонстрации наличия многоцентрового заболевания [11, 12].
Для оценки многоцентрового или метастатического заболевания могут использоваться различные методы визуализации в ядерной медицине, включая метаиодобензилгуанидин I-131 и I-123 (MIBG), октреотид In 111 и ПЭТ / КТ F-18 [13, 14], демонстрирующие очаговые повышенное поглощение в пределах поражения (Рис. 3.
Рис. 3
Аксиальная КТ ( a ) демонстрирует расширение правого луковицы яремной вены с изъеденными молью стенками правого яремного отверстия (белая стрелка).ПЭТ с коррекцией осевого ослабления ( b ) демонстрирует заметное поглощение ФДГ в яремном отверстии, соответствующее гиперметаболической активности (белая стрелка). Т1-взвешенный постконтрастный МРТ ( c ) демонстрирует четко выраженную увеличивающуюся расширяющуюся массу с центром в правом яремном отверстии (изогнутая белая стрелка)
Параганглиомы каротидного тела
Параганглиомы сонных артерий являются наиболее распространенными параганглиомами внутри голова и шея, что составляет примерно 60% всех случаев.Большинство случаев встречается у пожилых пациентов в возрасте от 40 до 70 лет со средним возрастом 57 лет [15]. Как следует из названия, они возникают из каротидного тела, группы хеморецепторов, которые расположены между внутренней и внешней сонными артериями в месте разветвления общей сонной артерии. Тело сонной артерии обеспечивает регулирующую функцию как для оксигенации, так и для углекислого газа и pH в крови. Опухоли каротидного тела обычно представляют собой медленно растущую безболезненную опухоль в боковой части шеи [16], часто подвижную с боков, но фиксированную вертикально (известную как признак Фонтена).По мере роста опухоли в каротидном пространстве она может сдавливать соседние нервы (чаще всего блуждающий нерв), вызывая такие симптомы, как дисфагия, охриплость голоса или синдром Хорнера [17]. Большинство параганглиом сонных артерий односторонние, хотя двусторонние поражения наблюдаются примерно у 18% пациентов [6]. Повышенная частота (до 10% пациентов) спорадических параганглиом каротидного тела наблюдается у пациентов, живущих на большой высоте, или в условиях хронической обструктивной болезни легких [18].
Как КТ, так и МРТ полезны для первоначальной оценки потенциальных параганглиом каротидного тела и демонстрируют увеличение массы ослабления мягких тканей, расположенных в каротидном пространстве с центром в бифуркации сонной артерии. Связанный масс-эффект обычно приводит к расширению внутренней и внешней сонных артерий, что приводит к характерному «признаку лиры» [16], а не смещению их вместе (рис. 4, 5, 6 и 7). Дифференциальные соображения при обнаружении образования в этом месте включают шванномы и нейрофибромы; однако эти опухоли, как правило, менее сосудистые и не должны демонстрировать характерных пустот, наблюдаемых при параганглиомах.Кроме того, следует учитывать гиперваскулярные метастазы, например, при первичном злокачественном новообразовании почек или щитовидной железы. При оценке опухоли каротидного тела важно описать степень сосудистой оболочки, особенно ВСА. Обеспечивая степень максимального окружного контакта ВСА с опухолью каротидного тела, поражение может быть помещено в систему классификации Шамблина, которая используется для прогнозирования сосудистой патологии и дефицита черепных нервов на основании резекции [19].
Рис. 4
Аксиальная ( a) и сагиттальная ( b ) КТ шеи с контрастным усилением демонстрирует четко выраженную, сильно увеличивающуюся массу мягких тканей (белые стрелки) в левом каротидном пространстве. Масса расширяет проксимальные наружную и внутреннюю сонные артерии (белые стрелки) на уровне бифуркации сонной артерии, характерной для опухоли каротидного тела (в отличие от блуждающего нерва, который обычно смещает ВСА и НСА вместе). Масса охватывает менее 50% левой ВСА.Обратите внимание на нормальное соотношение правой ECA и ICA на противоположной стороне шеи (черные стрелки).
Рис. масса мягких тканей (белая стрелка) в левом каротидном пространстве с множественными точечными очагами низкого сигнала, представляющими пустоты сосудистого кровотока. Точечные участки гиперинтенсивности (кровотечения), а также эти пустоты для потока создают классический вид «соль и перец». b Постконтрастные изображения аксиального Т1 демонстрируют резкое увеличение массы (белая стрелка), снова расширяя проксимальные наружные и внутренние сонные артерии (белые стрелки). c Трехмерная проекция максимальной интенсивности (MIP) время пролета ангиография демонстрирует высокососудистую опухоль, расположенную внутри бифуркации сонной артерии, с многочисленными питающими сосудами, ответвляющимися от соседних ВСА и НСА (белые стрелки)
Рис.6
Осевой контраст -Улучшенные КТ-изображения шеи через верхнюю ( a ) и нижнюю ( b ) части бифуркации сонной артерии демонстрируют четко очерченные, сильно увеличивающиеся массы мягких тканей (белые стрелки) в двусторонних каротидных пространствах, которые расширяют внешнюю и внутренние сонные артерии.Двусторонние параганглиомы каротидного тела гораздо чаще встречаются у пациентов, живущих на большой высоте.
Рис. 7
Пациенту впоследствии была проведена предоперационная эмболизация новообразования. Обычные ангиографические изображения ( и ) после выбора левой общей сонной артерии демонстрируют интенсивный румянец опухоли (белая стрелка), возникающий между левой внутренней и внешней сонными артериями (белые стрелки). Последующие изображения после эмболизации частицами ( b ) опухоли демонстрируют заметное интервальное уменьшение покраснения опухоли, с лишь небольшой остаточной частью румянца (черная стрелка) вдоль проксимального отдела НСА.Окончательная патология соответствовала параганглиоме сонной артерии
Параганглиомы блуждающего нерва
Параганглиомы блуждающего нерва встречаются в одном из ганглиев блуждающего нерва (CN X). Они являются наименее распространенной параганглиомой головы и шеи, составляя приблизительно 5% всех случаев [20]. Параганглиомы блуждающего нерва обычно обнаруживаются у пациентов среднего и пожилого возраста, средний возраст которых составляет 48 лет [6]. Как и опухоли сонной артерии, они обычно представляют собой медленно растущее безболезненное образование на шее. Однако симптоматика отличается тем, что паралич блуждающего нерва и охриплость голоса из-за паралича голосовых связок довольно часто встречаются у 33–37% пациентов [6, 21].
Блуждающие параганглиомы могут возникать в любом месте по ходу блуждающего нерва, но обычно видны высоко в надподъязычной шейке в пределах нижнего (узловатого) ганглия, который формируется сразу после выхода блуждающего нерва из яремного отверстия [22]. Они демонстрируют аналогичные характеристики изображения на КТ и МРТ для опухолей каротидного тела, но из-за заднебокового хода блуждающего нерва по отношению к внутренней и внешней сонным артериям, его результирующий массовый эффект вызывает смещение этих сосудов вместе переднемедиально (рис.8), а не раздвинуты. КТ имеет особое значение при оценке высоких параганглиом блуждающего нерва, поскольку с ее помощью можно определить наличие костного поражения переднего основания черепа.
Рис. 8
Аксиальный T2 FSE ( a ) и пост-контрастный T1 ( b ) КТ-изображения демонстрируют большую, четко выраженную расширяющуюся массу с центром в правом каротидном пространстве (белая стрелка). Поражение неоднородно гиперинтенсивно на Т2 и сильно усиливается после контрастирования.Поточные полости правой внутренней и внешней сонных артерий смещены вместе переднемедиально (белые стрелки). Осевая 2D времяпролетная МР-ангиография ( c ) демонстрирует массу (белые стрелки), а также четко очерчивает результирующий массовый эффект, оказываемый на правую ВСА и НСА, которые сдвинуты вместе спереди в пределах шеи (белые стрелки ). Это контрастирует с контрлатеральными сонными сосудами слева, которые находятся в нормальном положении.
Яремные параганглиомы
Яремные параганглиомы — вторая по распространенности параганглиома головы и шеи [6] и самая распространенная опухоль, обнаруживаемая в яремной ямке.Они возникают из параганглии, связанной с адвентицией яремной луковицы. Средний возраст обращения — 53 года; наиболее частыми клиническими симптомами являются односторонний шум в ушах или потеря слуха (51% пациентов) [6].
Эти опухоли расширяются из яремного отверстия по пути наименьшего сопротивления и обычно распространяются на пневматизированные части височной кости, соседние сосудистые и нервные отверстия и евстахиеву трубу. Характерно, что яремные параганглиомы агрессивно разрастаются, на более поздних стадиях височная кость выглядит «съеденной молью» из-за связанной с ней эрозии кости (рис.9). Это отличает яремные параганглиомы от барабанных параганглиом, которые, как правило, меньше по размеру и менее агрессивны, сохраняя луковицу яремной железы и косточки. Из-за частоты поражения костей специальная компьютерная томография височной кости необходима для предоперационной оценки яремных параганглиом. Следует исключить любое расслоение дна барабанной полости или расширение барабанной полости. Кроме того, при обследовании яремных параганглиом необходимо следить за тем, чтобы исключить аберрантное течение внутренней сонной артерии, так как травма во время резекции может привести к значительным осложнениям.Обследование на отсутствующий или гипопластический вертикальный сегмент каротидного канала может надежно исключить этот нормальный вариант. МРТ выполняет дополнительную роль в оценке, так как она более чувствительна к любому ассоциированному внутричерепному расширению, которое, если оно присутствует, может значительно изменить лечение [16].
Рис. 9
Аксиальная КТ ( a ) демонстрирует эрозию правой луковицы яремной вены с изъеденными молью стенками правого яремного отверстия (белая стрелка). В среднее ухо нет вторжения или расширения, так как мыс улитки остается нетронутым (белые стрелки).Аксиальные ( b ) и корональные ( c ) Т2-взвешенные МРТ-изображения ФСЭ демонстрируют четко выраженное, преимущественно T2-гиперинтенсивное, расширяющееся поражение с центром в правом яремном отверстии (белые стрелки). Присутствует характерный «соль и перец» внешний вид с точечными участками гиперинтенсивности, представляющими «соль», в то время как небольшие пустоты потока представляют «перец». Распространения в среднее ухо не наблюдается.
Барабанная параганглиома
Барабанная параганглиома — самая распространенная опухоль среднего уха [23].Они возникают из барабанной ветви языкоглоточного нерва (CN IX), также известного как нерв Якобсена. Средний возраст обращения составляет 60 лет, при этом отмечается явная женская склонность: 80–90% барабанных параганглиом встречаются у женщин [6, 23]. Как и яремные параганглиомы, они чаще всего проявляются пульсирующим шумом в ушах или односторонней потерей слуха. Эти опухоли обычно видны как красные или голубоватые пульсирующие образования в среднем ухе при отоскопическом обследовании [23].
Методом визуализации для оценки барабанных параганглиом является компьютерная томография височной кости с высоким разрешением и контрастированием.Эти опухоли представляют собой массу мягких тканей, возникающую из мыса улитки, ограниченную барабанной полостью (рис. 10). Обычно костные косточки сохраняются, а поражение костей встречается редко. Следует исключить любую костную эрозию вокруг луковицы яремной вены, поскольку это считается диагностическим признаком яремной или югулотимпанальной, а не барабанной параганглиомы. Барабанные параганглиомы представляют собой опухоли с высоким содержанием сосудов и демонстрируют заметное усиление как на КТ, так и на МРТ, что отличает эти поражения от других распространенных опухолей барабанной полости, таких как холестеатомы.МРТ полезна для дальнейшей характеристики мягкотканного компонента новообразования и может помочь исключить мимику, такую как сгущенные выделения.
Рис.10
Аксиальный ( a ) и коронарный ( b ) КТ-изображения через правую височную кость демонстрируют гладкую, четко очерченную гладкую массу мягких тканей, выходящую из латеральной стороны мыса улитки, расширяющуюся наружу в среднее ухо (белые стрелки). Обратите внимание на неповрежденную луковицу яремной вены (белый наконечник стрелки)
Югулотимпанальные параганглиомы
Югулотимпанальные параганглиомы определяются как параганглиомы, которые нельзя однозначно классифицировать как яремные или барабанные.Их определяющей характеристикой является вторжение как в яремное отверстие, так и в среднее ухо, без явного прохождения ни в одном из этих пространств. Как и их яремные и тимпанальные аналоги, наиболее частые симптомы включают пульсирующий шум в ушах; однако из-за их большого размера часто наблюдается дефицит черепных нервов IX и X. КТ и МРТ височной кости используются для оценки эпицентра поражения, а также для оценки эрозии луковицы яремной вены и распространения в яремное отверстие и среднее ухо (рис.

 В черепных нервы этих яремного отверстия может быть сжаты, результате глотания трудности, или ипсилатеральную слабости верхних трапециевидного и sternocleiodomastoid мышцы (от сжатия спинного добавочного нерва ). У этих пациентов наблюдается красноватая выпуклость позади неповрежденной барабанной перепонки. Это состояние также известно как «Красный барабан». При надавливании на наружный слуховой проход с помощью пневматического ушного зеркала можно было увидеть, что масса побледнела. Этот знак известен как «знак Брауна». Недостаточная костная пластинка вдоль барабанной части внутренней сонной артерии (аберрантная ВСА) является нормальным вариантом и может быть ошибочно принята за glomus jugulare.
В черепных нервы этих яремного отверстия может быть сжаты, результате глотания трудности, или ипсилатеральную слабости верхних трапециевидного и sternocleiodomastoid мышцы (от сжатия спинного добавочного нерва ). У этих пациентов наблюдается красноватая выпуклость позади неповрежденной барабанной перепонки. Это состояние также известно как «Красный барабан». При надавливании на наружный слуховой проход с помощью пневматического ушного зеркала можно было увидеть, что масса побледнела. Этот знак известен как «знак Брауна». Недостаточная костная пластинка вдоль барабанной части внутренней сонной артерии (аберрантная ВСА) является нормальным вариантом и может быть ошибочно принята за glomus jugulare. 4 , C75.5 , D35.5 , D35.6 , D44.6 , D44.7
4 , C75.5 , D35.5 , D35.6 , D44.6 , D44.7 Некоторые из наиболее частых симптомов — это боль, охриплость голоса, обморок (обморок), затрудненное глотание (дисфагия), проблемы с глазами (синдром Хорнера) и паралич языка.
Некоторые из наиболее частых симптомов — это боль, охриплость голоса, обморок (обморок), затрудненное глотание (дисфагия), проблемы с глазами (синдром Хорнера) и паралич языка.