В12-дефицитная анемия — причины появления, симптомы заболевания, диагностика и способы лечения
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
В12-дефицитная анемия: причины появления, симптомы, диагностика и способы лечения.
Определение
В12-дефицитная анемия (пернициозная анемия) – заболевание, для которого характерно нарушение кроветворения, вызванное дефицитом витамина В12 (кобаламина, цианокобаламина). В крови снижается количество эритроцитов и падает уровень гемоглобина. Кроме того, недостаток витамина В12 вызывает поражения желудочно-кишечного тракта и неврологические расстройства.
Причины появления В12-дефицитной анемии
Витамин В12 не синтезируется в организме, его запасы пополняются только за счет пищи.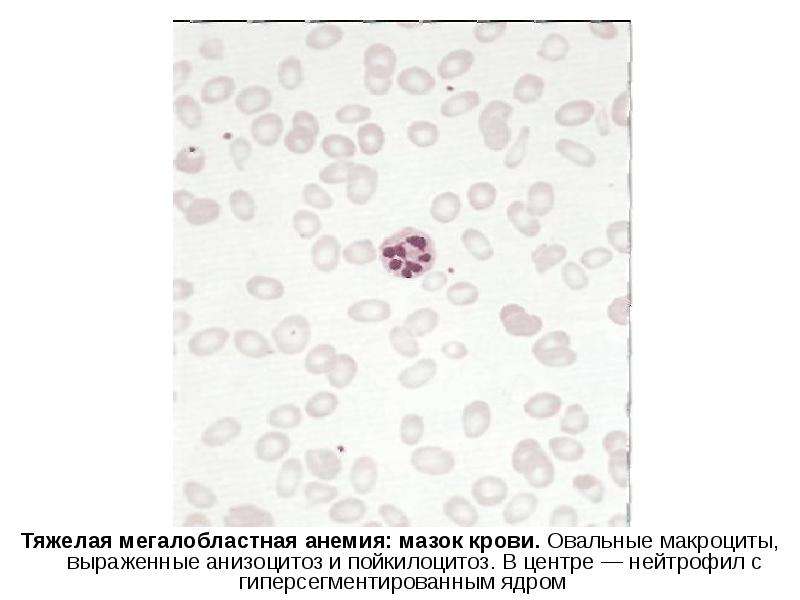 Кобаламин в достаточном количестве присутствует в продуктах животного происхождения: печени, яйцах, молоке, мясе. Всасывание кобаламина происходит в кишечнике в присутствии специфичного фермента – внутреннего фактора Касла (вырабатывается клетками слизистой оболочки желудка). Таким образом, поступающий с пищей витамин В12 связывается с этим ферментом в желудке, и образовавшийся комплекс вступает во взаимодействие с рецепторами клеток слизистой оболочки подвздошной кишки, в результате чего кобаламин попадает в кровоток, а внутренний фактор Касла остается в кишечнике. Попав в кровь, витамин В12 связывается с транспортным белком – транскобаламином, который и доставляет его в костный мозг, где он участвует в процессе кроветворения, и в печень, где он депонируется.
Кобаламин в достаточном количестве присутствует в продуктах животного происхождения: печени, яйцах, молоке, мясе. Всасывание кобаламина происходит в кишечнике в присутствии специфичного фермента – внутреннего фактора Касла (вырабатывается клетками слизистой оболочки желудка). Таким образом, поступающий с пищей витамин В12 связывается с этим ферментом в желудке, и образовавшийся комплекс вступает во взаимодействие с рецепторами клеток слизистой оболочки подвздошной кишки, в результате чего кобаламин попадает в кровоток, а внутренний фактор Касла остается в кишечнике. Попав в кровь, витамин В12 связывается с транспортным белком – транскобаламином, который и доставляет его в костный мозг, где он участвует в процессе кроветворения, и в печень, где он депонируется.
Недостаточное поступление витамина В12 в организм является основной причиной развития В12-дефицитной анемии.
К группе риска относятся строгие вегетарианцы, беременные и кормящие женщины, дети 4–6-го месяцев жизни при грудном вскармливании матерью-вегетарианкой, а также голодающие люди.
Вторая причина — нарушение всасывания витамина В12 из-за снижения кислотности желудочного сока. Пониженная кислотность характерна для людей, перенесших резекцию желудка, для пациентов с атрофическим гастритом (часто встречается у людей старшей возрастной группы), поражениями слизистой желудка при ожогах химическими веществами, раком желудка.
Длительный бесконтрольный прием лекарственных средств, снижающих секрецию соляной кислоты, также ведет к нарушению всасывания кобаламина.
Возможен и аутоиммунный характер В12-дефицитной анемии, когда организм продуцирует антитела, чья активность направлена против клеток желудка или внутреннего фактора Касла.
Тяжелые заболевания поджелудочной железы нередко становятся причиной развития В12-дефицитной анемии. Это объясняется нарушением секреции сока поджелудочной железы, транспорта и высвобождения витамина В12 в кишечнике.
При заболеваниях кишечника или удалении какой-то его части нарушается всасывание питательных веществ, в том числе и витамина В12, и развивается так называемый синдром мальабсорбции – недостаточной всасываемости. Чаще всего он наблюдается при воспалительных заболеваниях кишечника, например, болезни Крона, илеите (хроническом воспалении подвздошной кишки), амилоидозе (патологическом процессе, при котором происходит отложение в тканях кишечника амилоида – белка, не встречающегося в здоровом организме), лимфоме (злокачественном поражении лимфоидной ткани кишечника).
Чаще всего он наблюдается при воспалительных заболеваниях кишечника, например, болезни Крона, илеите (хроническом воспалении подвздошной кишки), амилоидозе (патологическом процессе, при котором происходит отложение в тканях кишечника амилоида – белка, не встречающегося в здоровом организме), лимфоме (злокачественном поражении лимфоидной ткани кишечника).
Достаточно редкой причиной развития В12-дефицитной анемии является конкурентное потребление витамина В12 микроорганизмами и гельминтами, паразитирующими в тонком отделе кишечника, — например при инвазии ленточными червями Diphyllobothrium latum.
Существует ряд наследственных патологий (наследственный дефицит транскобаламина, синдромом Имерслунд-Гресбека и др.), при которых нарушения всасывания и транспорта витамина В12.
Классификация В12-дефицитной анемии
В12-дефицитную анемию подразделяют на врожденную (наследственную) и приобретенную.
Среди приобретенных анемий выделяют первичную форму, обусловленную наличием антител к внутреннему фактору Касла, и вторичные, ассоциированные с одним или несколькими факторами риска развития В12-дефицита (например, наличие врожденной гемолитической анемии, строгая веганская диета и т. д.). Аутоиммунный дефицит витамина В12 зачастую осложняет течение аутоиммунного тиреоидита и сахарного диабета 1-го типа. Наследственные формы дефицита кобаламина описаны у детей с врожденными генетическими дефектами, приводящими к нарушению транспорта витамина В12.
д.). Аутоиммунный дефицит витамина В12 зачастую осложняет течение аутоиммунного тиреоидита и сахарного диабета 1-го типа. Наследственные формы дефицита кобаламина описаны у детей с врожденными генетическими дефектами, приводящими к нарушению транспорта витамина В12.
Симптомы В12-дефицитной анемии
Запасы витамина В12 в печени достаточно большие, и при полном исключении поступления витамина извне их истощение происходит лишь спустя 2–3 года.
Анемия развивается постепенно и долгое время может протекать скрыто, определяясь лишь изменениями в анализах крови.
При развитии клинической картины В12-дефицитной анемии наблюдается поражение системы кроветворения, желудочно-кишечного тракта и нервной системы.
Для анемии любой этиологии, в том числе и вызванной дефицитом кобаламина, характерно появление анемического синдрома. Этот синдром развивается при снижении количества гемоглобина и эритроцитов в крови.
Происходит нарушение доставки кислорода в органы и ткани, что приводит к развитию следующих симптомов:
- бледности, при В12-дефицитной анемии иногда с желтушным оттенком за счет разрушения крупных эритроцитов;
- общей слабости;
- повышенной утомляемости;
- одышке;
- учащенному сердцебиению;
- головокружению;
- шуму в ушах;
- для детей характерно отставание в развитии.

Перечисленные симптомы могут манифестировать, когда анемия приобрела уже тяжелую стадию, — это связано с очень медленным развитием заболевания и успешной компенсацией организмом.
Поражение желудочно-кишечного тракта при В12-дефицитной анемии проявляется нарушением аппетита, потерей массы тела, снижением желудочной секреции и развитием атрофического гастрита. Одним из неспецифических симптомов В12-дефицитной анемии является «лакированный» язык – из-за атрофии сосочков языка исчезает его рельеф, также могут появиться заеды в уголках рта (ангулярный стоматит). Больные жалуются на покалывание и жжение языка.
При В12-дефицитной анемии происходит специфическое поражение периферической нервной системы — нарушение образования миелина (специальной оболочки нервных клеток, которая служит для защиты и ускорения проведения нервного импульса). В связи с этим развивается дегенерация задних и боковых столбов спинного мозга – фуникулярный миелоз и симметричная нейропатия нижних конечностей.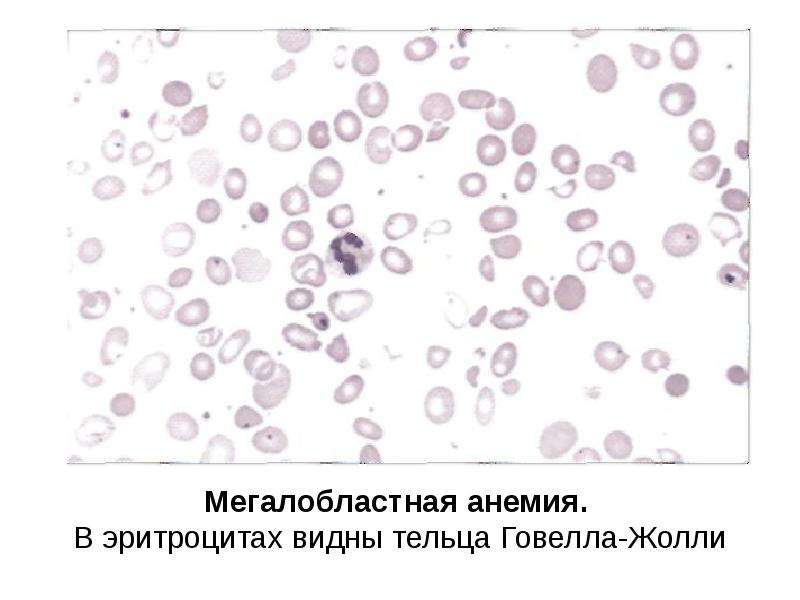 Сначала появляются различные нарушения чувствительности, или парестезии. Затем происходит потеря вибрационной и позиционной чувствительности, нарушается согласованность движений (атаксия).
Сначала появляются различные нарушения чувствительности, или парестезии. Затем происходит потеря вибрационной и позиционной чувствительности, нарушается согласованность движений (атаксия).
Данное состояние может прогрессировать вплоть до развития спастических судорог, парезов и параличей, недержания кала и мочи. В редких случаях возможна потеря памяти и развитие деменции.
Основные симптомы дефицита витамина В12
Для детей раннего возраста дефицит В12 грозит отставанием в психомоторном развитии, предрасположенностью к инфекционным заболеваниям, различным нарушениям в работе желудочно-кишечного тракта.
Диагностика В12-дефицитной анемии
Для проведения диагностики В12-дефицитной анемии до начала лечения врач составляет план необходимых лабораторных и инструментальных обследований. В него могут быть включены следующие исследования:
- пункция, или трепанобиопсия, с исследованием красного костного мозга является золотым стандартом диагностики В12-дефицитной анемии.
 Проведение данного исследования позволяет исключить другие опасные состояния, приводящие к похожим изменениям формулы крови;
Проведение данного исследования позволяет исключить другие опасные состояния, приводящие к похожим изменениям формулы крови; - уровень витамина В12 в крови;
Пернициозная анемия
Продолжая тему анемий, затронутую в одной из предыдущих статей нашей рубрики, сегодня внимание будет уделено анемии, которая возникает в результате дефицита витамина В12. Такую анемию называют пернициозной. В прошлом это заболевание носило название «злокачественное малокровие», оно было широко распространенным и плохо поддавалось лечению. К счастью, современная терапия пернициозной анемии сложностей не представляет, и заболевание хорошо поддается лечению.
Причины
Болезнь может развиваться по разным причинам, но в большинстве случаев корнем проблемы является недостаточное усвоение витамина В12. В частности, заболевание вызывается отсутствием, так называемого внутреннего фактора, основного гликопротеина для правильной абсорбции вышеупомянутого микроэлемента. Это вещество секретируется обкладочными клетками желудка. Приблизительно у 90% пациентов эти клетки поддаются атаке со стороны иммунной системы.
Это вещество секретируется обкладочными клетками желудка. Приблизительно у 90% пациентов эти клетки поддаются атаке со стороны иммунной системы.
Факторы риска
Ряд факторов риска в отношении пернициозной анемии включает в себя: пожилой возраст, семейный анамнез, наличие эндокринных аутоиммунных патологий, таких как хронический тиреоидит, болезнь Грейвса, гипопаратиреоз, диабет І типа, витилиго, а также кишечные паразитные инвазии, целиалкия и болезнь Крона.
В обычных условиях, благодаря наличию внутреннего фактора, витамин В12 всасывается в нижней части тонкого кишечника, называемой повздошной кишкой, Хирургическая резекция этого участка может через несколько лет привести к недостатку витамина В12 и последующей пернициозной анемии.
Аналогичная ситуация возникает, когда удаляется часть желудка (гастрэктомия) или применяется желудочное шунтирование для снижения массы тела. В таких обстоятельствах, фактически, синтез внутреннего фактора на желудочном уровне отсутствует.
Пернициозная анемия из-за уменьшенного потребления пищи стала чрезвычайно редкой. Люди, подверженные этому риску, являются строгими вегетарианцами и неимущими, особенно если они пожилые, (из-за низкой пищеварительной и абсорбционной эффективности).
Среди других возможных причин болезни, следует назвать хроническую инфекцию H. pilori или подавление желудочной кислоты с помощью противоязвенных препаратов.
Симптомы и диагностика
Во время пернициозной анемии отмечается небольшое пожелтение кожи и склер, которое вызвано повышением катаболизма эритроцитов и уровня непрямого билирубина в сыворотке крови. Больной жалуется на трудности с концентрацией внимания, раздражительность, головную боль, депрессию, нарушения памяти.
В наиболее тяжелых формах пернициозная анемия также поражает нервную систему. Парестезия распространяется в основном на конечности и снижает восприятие боли.
Часто при пернициозной анемии наблюдается атрофический глоссит, при котором слизистая оболочка языка гладкая и краснеет по краям и на кончике.
У большинства пациентов с пернициозной анемией повышен уровень гастрина в сыворотке крови, гормона, секретируемого желудком для увеличения желудочной секреции, которая обычно отсутствует или недостаточна при данном заболевании.
Лабораторную диагностику анемий проводят в любом из пунктов забора лаборатории «Лакмус». Цена исследования уровня витамина В12 на сегодня составляет 190 грн. Время исполнения – 4 дня.
Лечение и профилактика
Для лечения пернициозной анемии назначаются внутримышечные инъекции витамина В12, обычно с интервалом около 30 дней. В качестве альтернативы можно использовать пероральные дозы, которые превышают суточную потребность.
Следует иметь в виду, что витамин В12 присутствует, прежде всего, в мясных продуктах. В человеческом организме он сосредоточен в печени, где его запасы в несколько миллиграмм покрывают наши потребности в течение длительного периода времени (до трех – пяти лет). В связи с этим до того, как витамин В12 был открыт и выделен, злокачественное малокровие лечилось большим количеством говяжьей печени.
Лечение B12-дефицитной анемии | Клиника Семейный доктор
В12-дефицитная анемия — заболевание, вызванное нарушением процесса кроветворения в связи с дефицитом витамина В12. Механизм возникновения синдрома обусловлен нарушением создания эритроидных клеток в костном мозге.
Причины В12-дефицитной анемии
Нехватка витамина В12 может быть связана со следующими причинами или их комбинацией:
-
нарушение всасывания витамина в кишечнике: гастрит, сопряженный с инфицированием Хеликобактер Пилори, болезнь Крона, перенесенные операции на кишечнике, полипоз слизистой желудка, рак, кишечные свищи и пр.; -
врожденные нарушения обменных процессов; -
хроническая интоксикация оксидом азота, используемого в качестве седации в анестезиологии. -
незначительные нарушения всасывания, например, снижение доступности В12 в пище при хроническом панкреатите, умеренном атрофическом гастрите, приеме метформина, лекарств для снижения выработки соляной кислоты и пр. ;
;
-
скудный рацион, вегетарианство; -
хронический алкоголизм.
Одной из форм В12- дефицитной анемии является болезнь Аддисона-Бирмера. При ней появляются аутоантитела к клеткам слизистой оболочки желудка.
Стоит отметить, что В12- и фолиеводефицитные анемии тесно связаны. Фолиевая кислота (витамин В9) также принимает участие в процессах образования эритроцитов. Даже полноценное поступление этих компонентов в продуктах питания не гарантирует отсутствия анемии в тех случаях, когда наблюдается их повышенный расход или имеет место нарушение утилизации в костном мозге. Это может быть связано с паразитозом, дисбактериозом кишечника, беременностью, болезнями печени и крови.
Симптомы анемии
Симптомы В12-дефицитной анемии
На начальной стадии развития симптомы могут быть стертыми или не беспокоить вовсе. По мере развития синдрома могут появляться следующие признаки:
-
снижение веса, не связанное с объективными причинами; -
жжение языка и изменение вкусовых ощущений; -
увеличение размеров языка, сглаживание сосочков, краснота слизистых; -
чередование запоров и диареи; -
тошнота; -
покалывания в руках и ногах, онемения; -
нарушение походки; -
нарушения мочеиспускания; -
снижение полового влечения; -
снижение тонуса мышц; -
нарушения зрения; -
бледность, желтушность кожных покровов; -
поседение волос; -
учащенное сердцебиение; -
одышка; -
витилиго (пятна на коже) и др.
Стоит отметить, что нередки нарушения со стороны психоэмоциональной и познавательной сфер: ухудшение памяти, внимания и мышления, переменчивость настроения, плаксивость, раздражительность, депрессивные тенденции. У пожилого человека может развиться слабоумие. Тяжесть психоневрологических симптомов не зависит от выраженности анемии, а определяется тем, насколько долго она протекает и как быстро человек получит медицинскую помощь.
Особенности диагностики
Лечение В12-дефицитной анемии назначается после комплексного обследования. Врач направит на следующие лабораторные гематологические и иные исследования:
-
общий анализ крови; -
биохимические и иммунологические исследования: определение уровня В12 в плазме, оценка уровня гомоцистеина в сыворотке или плазме крови, определение антител к париетальным клеткам желудка и др.; -
аспирационная или трепанобиопсия костного мозга.
Также может потребоваться гастроскопия для выявления атрофического гастрита.
Диагноз устанавливает врач на основании жалоб, проявлений болезни, параметров лабораторных исследований. Важно выяснить причину синдрома, в особенности обнаружить болезнь Аддисона-Бирмера.
Кроме того, специалисту необходимо отличить эту разновидность анемии от других болезней, сопровождающихся нарушениями процессов кроветворения. Так, при подозрении на цирроз печени, нарушения, связанные с длительным приемом некоторых препаратов (сульфаниламиды, противосудорожные средства), сидеробластную анемию потребуется дифференциальная диагностика.
Особенности лечения
Лечение В12-дефицитной анемии основывается на восполнении дефицита с помощью препаратов витамина В12. Почти во всех случаях это позволяет получить положительный эффект. Иногда целесообразно парентеральное введение. Внутримышечные инъекции делаются ежедневно или через день, дозировка — до 500 мкг в зависимости от степени тяжести состояния.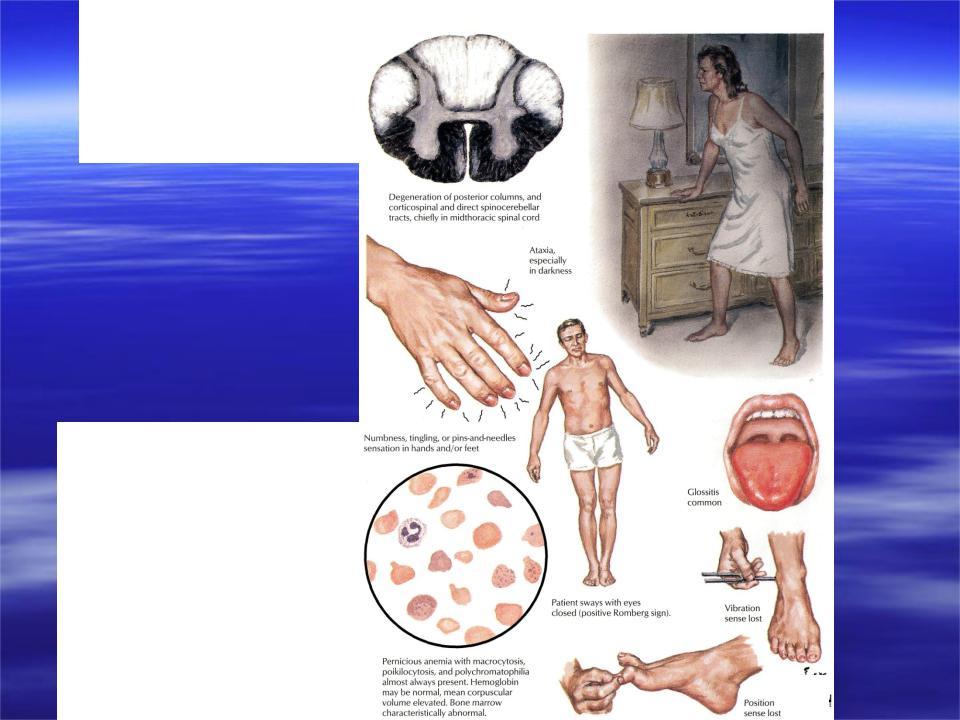 При наличии прекоматозного состояния может потребоваться доза до 1000 мкг.
При наличии прекоматозного состояния может потребоваться доза до 1000 мкг.
Дозировка снижается по мере роста количества эритроцитов и повышения уровня гемоглобина. Поэтому важно выполнять промежуточный контроль, врач расскажет о том, как часто потребуется сдавать анализ крови во время терапии. Обычно курс лечения занимает не менее 21–28 дней.
Если имеются симптомы фуникулярного миелоза (парестезии — онемения конечностей), витамин В12 вводится в большой дозировке ежедневно в течение минимум 10 дней. Затем доза уменьшается, а курс терапии дополняется витамином В1 по 100 мкг в сутки.
Критерием эффективности лечения является : увеличение числа ретикулоцитов на пятый – седьмой день от начала курса терапии. Как только будет достигнута ремиссия, пациента переводят на поддерживающую терапию. Она заключается в применении препарата В12 в дозировке 100–200 мкг 2–3 раза в месяц с учетом суточной потребности.
Стоит отметить, что пациентов с выраженной неврологической симптоматикой могут перевести на пожизненную поддерживающую терапию: 1 мг ежемесячно.
Важно понимать, что форма лекарственного средства не имеет значения − одинаково хорошо усваиваются препараты в таблетках и растворе для инъекций. Но второй способ предпочтительнее в случаях, когда имеют место заболевания желудочно-кишечного тракта или нарушения усваивания витаминов в кишечнике.
Фолиевую кислоту используют внутримышечно или перорально, стандартная доза — 50–60 мг. Обычно ее сочетают с В12. Однако важно знать, что использование фолиевой кислоты становится причиной повышенного потребления В12, иногда это приводит к усилению парестезий в конечностях. Врач разработает схему лечения В12-дефицитной анемии с учетом этого факта индивидуально, особенно это относится к беременным пациенткам.
При выраженном снижении уровня гемоглобина могут быть показаны переливание крови. Также основанием для серьезного вмешательства служат прекоматозное, коматозное состояние, кардиологическая симптоматика. Предпочтительнее выбрать переливание эритроцитарной массы курсом до 6 трансфузий.
Особенности диеты
Важно придерживаться сбалансированной полноценной диеты. Необходимо включать продукты питания, богатые витамином В12: говядину, субпродукты, яйца, молоко, сыр, зеленые листовые овощи. В качестве вспомогательного средства могут выступать блюда и продукты с высоким содержанием аскорбиновой кислоты: красный перец, черная смородина, шиповник, цитрусовые. Рекомендуется употребление витаминного чая из ягод при отсутствии аллергии и прочих противопоказаний.
Прогноз и профилактика
Своевременное лечение В12-дефицитной анемии в большинстве случаев позволяет полностью устранить гематологическое нарушение. Уже на 4−5 сутки можно обнаружить изменения в результатах анализов, рост гемоглобина, количества эритроцитов наблюдается на 7 день. Полностью нормализуются эти показатели через 8 недель.
Неврологические симптомы могут проходить довольно долгое время, до полугода. Повреждения спинного мозга, связанные с анемией, необратимы, поэтому очень важно своевременно обратиться к врачу: гематологу или терапевту.
Повышенное внимание профилактике этого недуга нужно уделять пациентам, которые перенесли бариатрические операции, гастрэктомию. В группе риска вегетарианцы, люди, придерживающиеся строгих диет с ограничением мяса и субпродуктов, беременные и недавно родившие женщины. Профилактика заключается в применении препарата В12 в форме таблеток или инъекций, врач подберет профилактическую безопасную дозу.
Преимущества обращения в клинику «Семейный доктор»
Гематологи клиники «Семейный доктор» специализируются на лечении анемии, обусловленной дефицитом витамина В12. Также врачи занимаются терапией других форм нарушения кроветворения.
Современное оснащение позволяет проводить точную и быструю диагностику. Мы выполняем комплекс лабораторных и аппаратных исследований, чтобы выяснить причину и реальную картину болезни. Наши специалисты придерживаются современных эффективных стандартов лечения, предоставляют развернутые рекомендации по профилактике.
Для записи на удобное для Вас время, позвоните по телефону единого контакт-центра в Москве +7 (495) 775 75 66, заполните форму on-line записи или обратитесь в регистратуру клиники.
Стоимость
врач-гематолог, к.м.н.
Публикации в СМИ
Анемии этой группы развивается вследствие дефицита витамина B12 (суточная потребность 1–5 мкг). Пернициозная анемия — аутоиммунное заболевание с образованием АТ к париетальным клеткам желудка или внутреннему фактору Касла. В большинстве случаев сочетается с фундальным гастритом и ахлоргидрией. Существуют также B12-дефицитные анемии алиментарного генеза. Пернициозная анемия может быть врождённой или приобретённой. Преобладающий возраст — старше 60 лет.
Этиология • Пернициозная анемия •• Фундальный гастрит (тип А) ••• АТ к париетальным клеткам желудка ••• Иммунные нарушения (выработка АТ к внутреннему фактору Касла) • Другие B12-дефицитные анемии •• Вегетарианская диета без дополнительного приёма витамина B12 •• Гастрэктомия •• Синдром приводящей петли •• Инвазия лентецом широким •• Синдром мальабсорбции •• Хронический панкреатит •• Хронический алкоголизм •• ЛС (бигуаниды, фенилбутазон, аминосалициловая кислота, пероральные контрацептивы).
Генетические аспекты. Существует ряд генетически разнородных форм пернициозной анемии • Классическая пернициозная анемия взрослых (170900, предположительно Â) с нарушением всасывания витамина В12 • Пернициозная анемия у подростков с полигландулярным аутоиммунным синдромом (*240300, 21q22.3, r) • Пернициозная анемия ювенильная с относительной недостаточностью всасывания витамина B12 и протеинурией (*261100, синдром Иммурслунд–Грасбека, 10p12.1, MGA1, r). При этой мегалобластной анемии возможны мальформации мочевыделительного тракта и протеинурия • Врождённая пернициозная анемия (*261000, хр. 11, мутация гена GIF, r) вследствие отсутствия секреции гастромукопротеина при нормальных кислотности желудочного сока и морфологии слизистой оболочки. Характерна экспрессия HLA-DR2, HLA-DR4.
Патоморфология • Костный мозг — мегалобластный тип кроветворения, повышенное содержание железа, гиперсегментированные нейтрофилы • Желудок — фундальный гастрит, гипертрофия бокаловидных клеток, атрофия париетальных клеток, атрофия главных клеток, характерен клеточный атипизм • Спинной мозг — дегенерация миелина задних и боковых столбов, дегенеративные изменения ганглиев задних корешков (фуникулярный миелоз) • Дегенерация периферических нервов.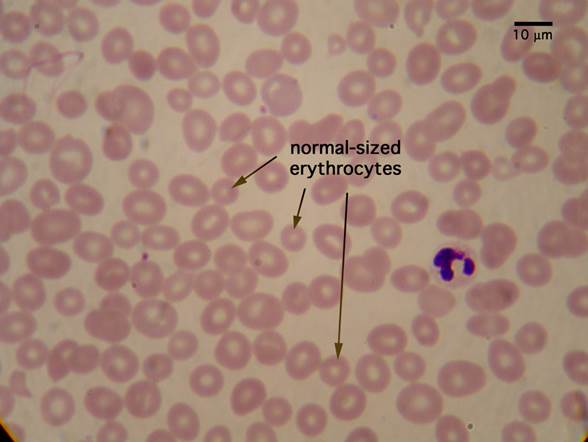
Клиническая картина определяется дефицитом витамина B12 • Общие признаки анемии (слабость, одышка, тахикардия, бледность, шум в ушах и др.) • Фуникулярный миелоз (парестезии, снижение вибрационной чувствительности, атрофии мышц, полиневрит, патологические рефлексы) • Нарушение координации (положительные проба Ромберга и пальценосовая проба) • Психические нарушения (спутанность сознания, депрессия, деменция) • Со стороны ЖКТ — атрофический глоссит (малиновый «лакированный» язык), гепатоспленомегалия, анорексия • Кожа — гиперпигментация, пурпура, витилиго.
Возрастные особенности • Ювенильная пернициозная анемия часто возникает у подростков и в целом аналогична анемии у взрослых • Врождённая пернициозная анемия обычно проявляется до 3 лет • У пожилых пернициозная анемия возникает наиболее часто в сочетании с другими аутоиммунными нарушениями, депрессией и деменцией.
Сопутствующая патология • Аутоиммунные заболевания (ревматоидный артрит, болезнь Грейвса, гипотиреоз, гипопаратиреоз, тиреоидит Хашимото, СД) • Идиопатическая надпочечниковая недостаточность • ЖДА • Агаммаглобулинемия • Спру тропическая • Болезнь Крона • Инфильтративные заболевания подвздошной и тонкой кишки.
Лабораторные исследования • Панцитопения (анемия, лейкопения, тромбоцитопения) • Мазок периферической крови: макроцитоз (средний эритроцитарный объём >115 мкм3), эллиптоцитоз, анизоцитоз, пойкилоцитоз; тельца Хауэлла–Жолли (сферические или овоидные эксцентрично расположенные гранулы; встречаются в циркулирующих эритроцитах, чаще и в большем количестве после спленэктомии) и кольца Кэбота, гиперсегментированные нейтрофилы, количество ретикулоцитов нормально или несколько снижено • Концентрация витамина B12 в плазме крови <100 пг/мл (в норме 160–950 пг/мл) • Увеличение концентрации ферритина в сыворотке крови • Ахлоргидрия • Гипергастринемия • При стимуляции пентагастрином pH желудочного сока >6 • АТ к внутреннему фактору Касла • АТ к париетальным клеткам • Гипербилирубинемия за счёт прямой фракции • Уменьшение содержания гаптоглобина • Увеличение активности ЛДГ.
Состояния, влияющие на результаты исследований • Ложное повышение среднего эритроцитарного объёма обусловливают следующие факторы: •• холодовые агглютинины •• гипергликемия •• выраженный лейкоцитоз • Ложное нормальное содержание витамина B12 в плазме крови обусловливают следующие состояния: •• миелопролиферативные заболевания •• заболевания печени • Ложное снижение содержания B12 в плазме крови обнаруживают при наличии следующих факторов: •• множественная миелома •• приём пероральных контрацептивов •• беременность •• недостаточность фолиевой кислоты •• недостаточность транскобаламина II.
Специальные исследования • Проба Шиллинга — уменьшенное поглощение витамина B12 • Пункция костного мозга.
ЛЕЧЕНИЕ
Тактика ведения • При пернициозной анемии лечение необходимо проводить пожизненно • Режим амбулаторный • Ежемесячное введение цианокобаламина • Эндоскопическое обследование каждые 5 лет для исключения рака желудка или по показаниям • Диета с повышенным содержанием белка.
Лекарственная терапия. Цианокобаламин — по 100 мкг п/к ежедневно в течение 1 нед, затем 1 раз в неделю в течение 1 мес и далее 1 р/мес в течение всей жизни.
Осложнение лечения — гипокалиемия (может появиться на 1-й неделе лечения).
Течение и прогноз благоприятные при своевременном и адекватном лечении витамином цианокобаламином. Признаки поражения ЦНС могут сохраняться, если лечение пациента было начато через 6 мес и более от начала заболевания.
Синонимы • Злокачественная анемия • Аддисона–Бирмера болезнь • Бирмера болезнь
МКБ-10 • D51 Витамин-B12-дефицитная анемия
Ход В12: шах и мат пернициозной анемии
История открытия последнего из известных на сегодня витаминов, В12, напоминает сложную многоходовую шахматную партию между жизнью и смертью.
Она продолжалась больше 100 лет, пока всем учёным и врачам, подобно гроссмейстерам международного уровня, игравшим в этой партии белыми фигурами жизни, не удалось победить своего чёрного противника – пернициозную анемию, смертельное заболевание крови, связанное с изменением качества этой жидкой ткани человеческого организма.
Сложность этой истории была во всём: в симптомах заболевания, в фатальности исхода, особенности функционирования систем организма, вовлечённых в болезнь, не говоря уже о химическом строении молекулы открытого соединения, витамина В12, оказавшегося, как и все остальные витамины, фактором пищи. Поэтому придётся окунуться как в исторические события, так и в некоторые теоретические знания.
Пожалуй, сегодня практически каждому известен термин «анемия», который в переводе с древнегреческого дословно означает «некровь» (ἀν – приставка со значением отрицания и αἷμα «кровь») или, в более приемлемой для нас адаптации, «малокровие».
Анемия сопровождает человечество на протяжении всей его истории, ведь в борьбе за выживание в дикой природе, а позже и во время военных событий, люди были подвержены ранениям с сопутствующей кровопотерей разной степени тяжести. Кровь, конечно же, способна к самовосстановлению, но для этого требуется время. Длительность такого периода зависит от количества потерянной крови и индивидуальных возможностей конкретного организма, а весь восстановительный период сопровождается анемией.
Кровь, конечно же, способна к самовосстановлению, но для этого требуется время. Длительность такого периода зависит от количества потерянной крови и индивидуальных возможностей конкретного организма, а весь восстановительный период сопровождается анемией.
Анемия, описанная ещё в середине XVI века, проявлялась бледностью кожи с зелёным оттенком, сердцебиениями, одышкой и отвращением к мясной пище.
Обратите внимание, что среди симптомов присутствует один, относящийся к питанию. То есть, ещё в далёкие времена появилось предположение о связи анемии также и с качеством питания. Поскольку кровь здорового человека обладает ярко-красной окраской и определённой плотностью (густотой), то для проверки её качества у людей с описанными симптомами врачи в доисторические времена, возможно, прибегали к флеботомии (кровопусканию), обнаруживая при этом гораздо более бледную и жидкую кровь своих пациентов.
Но со временем среди пациентов с анемическим синдромом выделили таких, у которых также наблюдались чрезвычайная слабость и бледность кожи, но при этом бледность была другого оттенка, грязного, даже землистого, покрывавшая кожу и слизистую оболочку (главным образом дёсна) пятнами, но главное – у этих пациентов не было ранее обильных кровотечений и кровопотерь.
Первым такую особенную форму анемии описал Джеймс Скарт Комб из Эдинбурга (Шотландия) в 1824 году, но больше к изучению этого заболевания не возвращался.
Томас Аддисон (1793–1860)
Более подробное описание страшного недуга было сделано известнейшим английским врачом знаменитой Лондонской больницы Гая Томасом Аддисоном (1793–1860), непревзойдённым диагностом, клиницистом и лектором своего времени.
Он с 1843 года занимался изучением особой разновидности анемии у пациентов в возрасте от 20 до 60 лет. При этом, к уже перечисленным симптомам (слабости, одышке, сердцебиению) добавлялись ещё такие, как специфическая пигментация кожи, глоссит (воспаление языка), анорексия (неприятие пищи), диарея, а со временем развивалось нарушение координации движений, деменция и, в финале, – смерть…
Безысходность болезни и отсутствие методов её лечения вызывала страх не только у пациентов, но и у врачей, считавших эту анемию страшнее злокачественной опухоли, которую хотя бы можно было удалить хирургическим путём. Иногда в медицинской литературе этот диагноз ещё фигурировал как «злокачественная анемия».
Иногда в медицинской литературе этот диагноз ещё фигурировал как «злокачественная анемия».
В книге, опубликованной в 1855 году, Т. Аддисон пишет, что данная разновидность анемии удивительна тем, что у неё нет видимых причин: предшествовавших заболеванию обильных кровопотерь, хлороза, пурпура (склонность к кровотечениям), продолжительной диареи, болезни селезёнки, почек, внутренних желез, а также онкологии. Но всех пациентов объединяло то, что это были взрослые люди, и то, что в каждом случае исход был один – летальный. Из-за отсутствия видимых причин он назвал эту форму анемии «идиопатической», т.е. неопределённой, неясной.
К сожалению, Томас Аддисон был к этому времени серьёзно болен и через 3 года вынужден был прекратить преподавание и врачебную практику, а в 1860 году выдающийся врач-учёный скончался, оставив после себя яркий след в медицине. Но после него в Великобритании больше никто не исследовал это опасное заболевание.
Михаэль Антон Бирмер
(1827–1892)
Зато работа по изучению и анализу идиопатической анемии была продолжена в Медицинском центре Цюрихского университета (Швейцария) немецким профессором медицины Михаэлем Антоном Бирмером (1827–1892). Он описал гораздо более подробно симптомы всех случаев, с которыми он столкнулся на практике. Вкладом Бирмера в изучение этого заболевания стала констатация того факта, что оно является прогрессирующим и пернициозным (от лат. perniciosus – гибельный, опасный) в связи с фатальным (смертельным) исходом, о котором писал ещё Т. Аддисон.
Он описал гораздо более подробно симптомы всех случаев, с которыми он столкнулся на практике. Вкладом Бирмера в изучение этого заболевания стала констатация того факта, что оно является прогрессирующим и пернициозным (от лат. perniciosus – гибельный, опасный) в связи с фатальным (смертельным) исходом, о котором писал ещё Т. Аддисон.
С того момента эта патология стала называться прогрессирующей пернициозной анемией, или болезнью Аддисона-Бирмера. Кроме того, анализ всех случаев заболевания позволил Бирмеру предположить, что одной из причин могут быть тяжёлый труд в условиях мощно развивающейся в то время промышленной индустрии и обнищание рабочих, в результате чего их питание становилось невероятно скудным. И этот вывод вновь делает акцент на связи грозного заболевания с питанием.
Несмотря на то, что анемия – это заболевание крови, самого-то описания её состояния ни Томас Аддисон, ни Михаэль Бирмер и не проводили. И были на это объективные причины.
Для полноценного исследования состояния крови, как мы сегодня уже знаем, необходим микроскопический анализ специальным образом приготовленных образцов. Хотя в середине XIX века микроскоп уже активно использовался в науке и медицине, но ещё не были разработаны методики окрашивания биологического материала, позволявшие оценить количественно и качественно состав крови.
Антони ван Лёвенгук
(1632–1723)
О том, что в крови человека находятся красные «корпускулы» (тельца круглой формы) первым сообщил в далёком 1695 году известный голландский микроскопист Антони ван Левенгук (1632–1723), член Лондонского Королевского общества.
Красные кровяные шарики впоследствии были названы эритроцитами (греч. eruthrós – «красный », κΰτος kytos – «сосуд», «клетка») и были первыми обнаруженными клетками крови.
Вот теперь стало понятно, что цвет крови дают именно эритроциты, в смысле вещество, которое в них содержится. Но что же оно из себя представляет?
В 1826 году немецкий химик Иоганн Фредерик Энгельгард обнаружил, что красный цвет придаёт крови вещество семейства под общим названием «альбумины» (от лат. albumen «(яичный) белый; красящий яйцо в белый цвет», нем. еiweisskörper «белковые тела»).
albumen «(яичный) белый; красящий яйцо в белый цвет», нем. еiweisskörper «белковые тела»).
Это вещество содержало железо, а значит, молекулярная масса соединения должна была быть кратной атомной массе этого металла. Тогда такой вывод Энгельгарда вызвал насмешки и был назван «поспешным», но спустя 100 лет это предположение было полностью подтверждено. Кроме того, учёный установил, что отношение железа к остальной части молекулы у различных видов позвоночных одинаково.
В 1840 году ещё один немецкий физиолог и химик Фредерик Людвиг Хюнефельд в своей книге «Химизм в организации животных» подробно описывает процесс кроветворения, природу клеток крови и их ядер, и формулирует главное своё наблюдение, что красные кровяные тельца поглощают кислород. Хюнефельд понял, что вещество, красные остроугольные кристаллы которого в сухих препаратах крови он наблюдал под микроскопом, – это железосодержащий белок, вещество, описанное Иоганном Энгельгардом.
Красные кровяные клетки – эритроциты
Другой немецкий химик, физиолог, основоположник современной биохимии и молекулярной биологии Эрнест Эммануэль Феликс Гоппе-Зейлер (1825-1895), с которым Фредерик Хюнефельд вместе работал в середине 1850-х годов в университете Грайсвальда, провёл детальное исследование кристаллических препаратов железосодержащего белка из эритроцитов с помощью уже известного к тому времени метода спектрального анализа.
Феликс Гоппе-Зейлер первый описал оптический спектр поглощения этого белка и показал наличие двух характерных полос, что указывает на присутствие в молекуле белковой части и небелковой (гема), в состав которой и входит железо. Именно гемовая часть белка отвечает за красный цвет крови, атом железа связывается с кислородом, более того, это связывание обратимо, то есть молекула гемоглобина может как присоединить молекулярный кислород, так и отщепить его.
Все эти открытия Феликса Гоппе-Зейлера подтвердили ранние предположения его коллег-соотечественников Энгельгарда и Хюнефельда о строении и функциях эритроцитарного белка. Его молекула имеет круглую форму, а такие белки объединены названием глобулины. Вот тогда Гоппе-Зейлер и назвал этот белок гемоглобин – гемсодержащий глобулин. Гемоглобин состоит из четырёх одинаковых субъединиц, каждая из которых содержит гем, то есть одна молекула имеет 4 кислород-связывающих участка.
Так вот оно что! В эритроцитах находится железосодержащий белок гемоглобин, который имеет красный цвет и обратимо связывает кислород воздуха! Это и есть одна из основных функций крови – перенос кислорода от дыхательных путей (лёгких) по кровеносным сосудам к остальным органам и тканям.
После того, как исследования Феликса Гоппе-Зейлера расставили точки над «i» в вопросе с функцией эритроцитов и гемоглобина как переносчика кислорода в организме, стало ясно, что анемия связана со снижением количества как этого белка, так и клеток, которые его содержат. А низкое содержание гемоглобина означает то, что клетки и ткани не получают достаточного количества кислорода, развивается гипоксия, и как следствие появляются утомляемость и слабость, а кожа и слизистая оболочка становятся бледными.
Встал вопрос о необходимости определять уровень гемоглобина в крови, позволяющий поставить диагноз «анемия». Метод определения этого показателя разработал английский врач Уильям Ричард Говерс в 1878 году. Кстати сказать, метод Говерса лежит в основе современного определения гемоглобина, только для этого используется автоматический прибор, и требуется всего несколько капель капиллярной крови.
Кроме того, к середине XIX века в крови были обнаружены белые клетки, лейкоциты (др. -греч. λευκός – белый) и кровяные пластинки, тромбоциты (от греч. θρόμβος – сгусток и κύτος – клетка; устаревшее название – кровяные пластинки), и учёные-исследователи крови пришли к одному очень важному выводу: при различных заболеваниях форма и количество красных и белых клеток крови меняются!
-греч. λευκός – белый) и кровяные пластинки, тромбоциты (от греч. θρόμβος – сгусток и κύτος – клетка; устаревшее название – кровяные пластинки), и учёные-исследователи крови пришли к одному очень важному выводу: при различных заболеваниях форма и количество красных и белых клеток крови меняются!
Итак, после этих открытий стало понятно, что кровь – это жидкая ткань организма, которая состоит из жидкой среды – плазмы (от греч. πλάσμα «нечто сформированное, образованное») и взвешенных в ней форменных элементов (лейкоцитов, эритроцитов и тромбоцитов).
Так сформировалась гематология – наука о заболеваниях крови, окончательный прорыв в этом осуществил уже известный нам по предыдущим историям немецкий учёный-биолог Пауль Эрлих (1854–1915), будущий Нобелевский лауреат, а на тот момент, в 1879 году, молодой 25-летний доктор медицины. Он разработал и опубликовал методику окрашивания плёнок крови и свой метод дифференциального подсчёта её клеток!
П. Эрлих создал первую теорию кроветворения, дуалистическую, согласно которой процесс образования клеток крови протекает в костном мозге (миелоидная система) и лимфе (лимфоидная система).
Эрлих создал первую теорию кроветворения, дуалистическую, согласно которой процесс образования клеток крови протекает в костном мозге (миелоидная система) и лимфе (лимфоидная система).
Что же такое кроветворная система и в чём её предназначение?
Клетки крови в норме
и при пернициозной анемии
Все клетки крови имеют своё ограниченное время жизни (от нескольких дней до нескольких месяцев), которое определяется функциями каждого их вида. Кроме того, по разным причинам возможны кровопотери. В связи с этим для поддержания нормального состояния крови необходимо её постоянное обновление – образование новых клеток. Такой процесс называется кроветворением или гемопоэзом, и он проходит в костном мозге, лимфатических узлах и селезёнке, трёх органах, объединённых в кроветворную систему (согласно современной унитарной теории кроветворения).
Процесс созревания эритроцитов, соответственно, имеет название эритропоэз и проходит в 9 этапов. Очень подробно мы это описывать не будем, скажем, только, что в результате прохождения всех стадий деления, преобразования и приобретения определённых признаков клетка-предшественник эритроцита предпоследнего этапа созревания в костном мозге – это очень крупная клетка круглой формы с ядром и рибосомами, в которой активно идёт синтез гемоглобина. Называется она мегалобласт (megaloblastus; megalo – большой + греч. blastos – росток, зародыш).
Очень подробно мы это описывать не будем, скажем, только, что в результате прохождения всех стадий деления, преобразования и приобретения определённых признаков клетка-предшественник эритроцита предпоследнего этапа созревания в костном мозге – это очень крупная клетка круглой формы с ядром и рибосомами, в которой активно идёт синтез гемоглобина. Называется она мегалобласт (megaloblastus; megalo – большой + греч. blastos – росток, зародыш).
На следующем этапе клетка-зародыш избавляется от ядра и уменьшается в объёме в 10 раз, приобретает форму диска, превращаясь в ретикулоцит, раннюю форму эритроцита, которая выходит из костного мозга в кровяное русло.
Ретикулоцит уже не имеет ядра, но ещё содержит рибосомы в течение 1–2 суток после выхода из костного мозга, то есть способен продолжать синтезировать гемоглобин до тех пор, пока этим белком не будет заполнен весь внутренний объём клетки. После этого ретикулоцит избавляется от рибосом и становится, наконец, зрелым эритроцитом. Эритроциты имеют более насыщенный красный цвет по сравнению с ретикулоцитами, которые по окраске ближе к розовому цвету.
Эритроциты имеют более насыщенный красный цвет по сравнению с ретикулоцитами, которые по окраске ближе к розовому цвету.
Отсутствие ядра и рибосом у зрелых красных кровяных клеток означает только одно – зрелые эритроциты не могут (и не должны) делиться и синтезировать белок, их задача связывать и разносить кислород в периферические ткани и органы, там его высвобождать, а присоединять и выводить углекислый газ – конечный продукт распада всех органических соединений.
Джордж Майнот (1885–1950)
Зная все эти особенности формирования зрелого эритроцита, врач имеет возможность после изучения окрашенного препарата крови пациента сделать вывод о его состоянии. И в случае присутствия в периферической крови ненормально крупных клеток с ядром и небольшим количеством гемоглобина (мегалобластов) ставится диагноз пернициозная или мегалобластная анемия.
Ну что же, опасного противника врачи теперь смогли узнать «в лицо», но он по-прежнему оставался смертельным. Методов лечения этой формы анемии так и не было найдено ещё долгие десятилетия до конца XIX и начала ХХ веков.
Но переломить ход этой смертельной партии всё-таки удалось, и случилось это в Соединённых Штатах Америки в 1920-х годах, когда вся мировая наука активизировалась после окончания Первой мировой войны, а одним из приоритетных направлений медицины стал поиск новых кровезаменителей и путей улучшения кроветворения в связи с массовой гибелью людей от кровопотерь во время военных действий и беспомощностью служб переливания крови того периода.
Джордж Хойт Уиппл
(1878–1976)
Первый важный вклад в победу над пернициозной анемией внесли трое американских учёных – Джордж Хойт Уиппл (1878–1976), Джордж Майнот (1885–1950) и Уильям Перри Мерфи (1892–1987). Этот этап, завершившийся присуждением Нобелевской премии по физиологии и медицине в 1934 году, заслуживает более детального описания. Итак…
Джордж Хойт Уиппл был талантливым и непревзойдённым врачом-патологом, организатором медицинских исследований, преподавателем и руководителем медицинского факультета сначала в Университете Джонса Хопкинса (Сан-Франциско, штат Калифорния), а затем в университете Рочестера (штат Нью-Йорк).
Во время командировки в Панаму сразу после получения диплома врача в 1908 году для борьбы с эпидемией чёрной лихорадки Джордж наблюдал массовый гемолиз (разрушение эритроцитов), сопровождавший это страшное заболевание, что оставило неизгладимое впечатление и побудило его всерьёз заняться гематологией.
Уильям Перри Мерфи
(1892–1987)
Знания по этой дисциплине после возращения из командировки он шлифовал в Гейдельбергском университете (Германия), где освоил моделирование анемии на кроликах. Изучение процессов кроветворения стало для Уиппла приоритетом в его исследованиях на всю последующую жизнь.
Так, по возвращении в США, в Университете Джонса Хопкинса, Джордж Уиппл приступает к исследованию кроветворной системы у собак на модели острого отравления хлороформом. В серии этих экспериментов учёный обнаружил прямую связь между процессами свёртывания крови и функционированием печени.
Затем в 1914 году последовала работа по исследованию желтухи, болезни, которая сопровождается повышенным содержанием билирубина (жёлтый пигмент и составной компонент желчи) в крови и тканях, из-за чего кожа и слизистые оболочки окрашиваются в жёлтый цвет.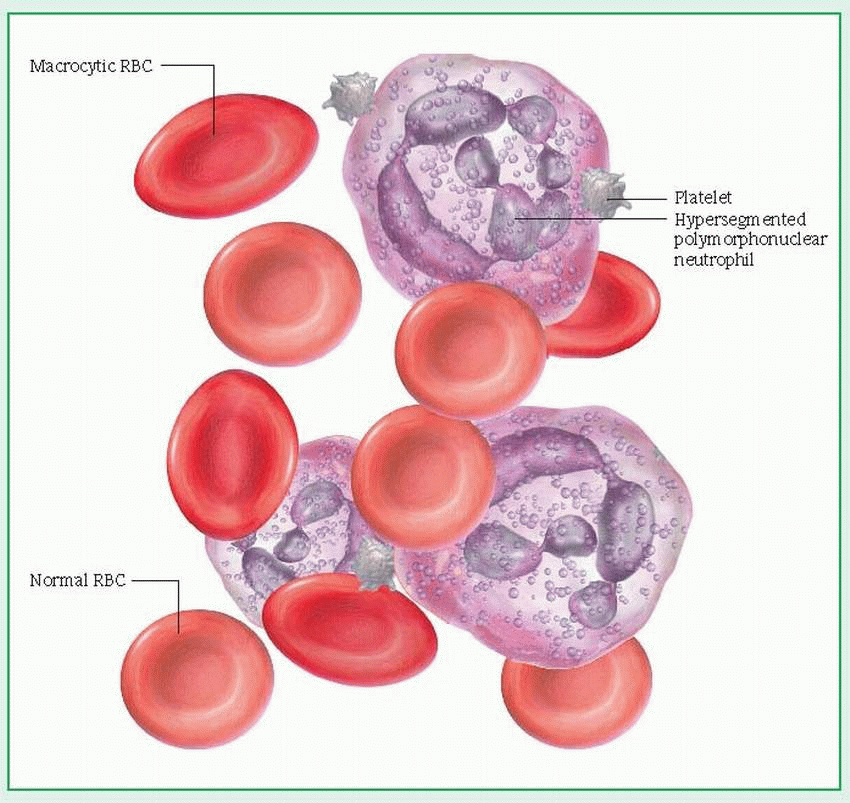 Благодаря этим работам Уиппл и его коллега Чарлз Хупер в течение следующих 2 лет опубликовали 12 статей. И тогда мир узнал, что:
Благодаря этим работам Уиппл и его коллега Чарлз Хупер в течение следующих 2 лет опубликовали 12 статей. И тогда мир узнал, что:
- билирубин является продуктом распада гема эритроцитов и миоглобина (белок с такими же функциями и строением, как и гемоглобин) в мышцах,
- для образования новых эритроцитов билирубин не используется,
- распад гема с образованием билирубина проходит в печени, а также в плевральной и брюшной полости.
Джорджу Уипплу, Уильяму Мерфи
и Джорджу Майноту вручают
Нобелевскую премию
Согласитесь, эти открытия сегодня уже стали фундаментальными знаниями медицины и физиологии. А тогда они позволили пролить свет на важность печени в процессах кроветворения. И тот факт, что в сыворотке крови больных пернициозной анемией наблюдалось повышенное содержание билирубина, ещё раз подтверждал, что при этом заболевании прогрессирует необратимый процесс разрушения эритроцитов с распадом гемоглобина, вследствие чего кожа и слизистые оболочки приобретают землисто-жёлтый оттенок, который так привлёк внимание Томаса Аддисона ещё в середине предыдущего столетия.
Но в карьере нашего героя наступил переломный момент, в 1921 году ему предложили работу по организации и последующему управлению медицинским факультетом в университете Рочестера.
На новом месте Дж. Уиппл продолжил работу по изучению проблем анемии. Для этого в моделях на собаках, у которых вызывалась хроническая анемия в результате обильных кровопотерь, группа под руководством Уиппла стала изучать влияние диет различного состава на процессы регенерации крови.
Среди компонентов пищи и лекарственных препаратов с возможностью влияния на синтез гемоглобина и кроветворение были использованы железосодержащие таблетки, хлеб, мясные продукты, и даже мышьяк и диоксид германия. Самым эффективным средством из этого списка оказалось, как вы думаете, что? Сырая говяжья печень!
Как это часто бывает, в гениальные открытия вмешивается Его Величество Случай (помните, как это было с открытием антиберийных свойств рисовой шелухи?). В этот раз произошло нечто подобное.
Уиппл после всех работ, о которых было рассказано выше, понял, что печень надо добавить в рацион собак с анемией для усиления регенерации крови. И животных стали кормить отварной печенью. Улучшения в показателях крови были заметными и превышали те, что были у животных, содержащихся на других рационах. Но вдруг через несколько дней произошёл резкий скачок уровня гемоглобина и количества эритроцитов у собак. Учёный был несказанно обрадован, но вместе с тем и удивлён, не понимая причины такой динамики.
И животных стали кормить отварной печенью. Улучшения в показателях крови были заметными и превышали те, что были у животных, содержащихся на других рационах. Но вдруг через несколько дней произошёл резкий скачок уровня гемоглобина и количества эритроцитов у собак. Учёный был несказанно обрадован, но вместе с тем и удивлён, не понимая причины такой динамики.
Ответ был найден очень скоро и оказался следствием невероятно курьёзного случая. На должность лаборанта, отвечающего за приготовление пищи для собак, взяли нового сотрудника, оказавшегося жутко ленивым. Он просто поленился варить печень и кормил животных сырым продуктом!
В результате в 1925 году была опубликована серия статей под общим названием «Регенерация крови при тяжёлой анемии». Этими результатами заинтересовались двое других учёных, которые также, как и Джордж Уиппл, занимались поисками путей лечения анемии. Ими были Джордж Майнот и Уильям Перри Мерфи.
Джорж Майнот, потомственный врач, начал карьеру гематолога в 1913 году в Университете Джонса Хопкинса в Балтиморе (в то же время, когда там работал и Джордж Уиппл) в лаборатории знаменитого Уильяма Генри Хоуэлла, исследователя свёртываемости крови. А уже в следующем году предпринял первые попытки лечения пернициозной анемии.
А уже в следующем году предпринял первые попытки лечения пернициозной анемии.
В то время считалось, что одной из причин этого заболевания может быть нарушение работы селезёнки как кроветворного органа, и в качестве лечения предлагалось её удаление. Молодой врач пошёл этим путём, дававшим на какое-то время положительный эффект, о наличии которого он сделал вывод на основании микроскопического исследования крови своих пациентов.
После удаления селезёнки наблюдалось повышение количества ретикулоцитов в крови, то есть налицо была активация процессов кроветворения. Правда, через какое-то время картина вновь возвращалась к исходному состоянию.
Во время Первой мировой войны Майнот занимался лечением пациентов со специфической анемией – рабочих военных заводов, установив, что причиной болезни был контакт с тротилом.
Вновь к поискам средств лечения анемии Аддисона-Бирмера Дж. Майнот вернулся в 1921 году в Бостоне, где занимался изучением компонентов продуктов питания в рационе пациентов с этим диагнозом. Узнав о том, что его знакомый по Университету Джонса Хопкинса Джордж Уиппл смог вылечить анемию у собак с помощью сырой печени, Майнот загорелся идеей проверить эффективность этого метода у пациентов с неизлечимой формой анемии.
Узнав о том, что его знакомый по Университету Джонса Хопкинса Джордж Уиппл смог вылечить анемию у собак с помощью сырой печени, Майнот загорелся идеей проверить эффективность этого метода у пациентов с неизлечимой формой анемии.
О возможности использовать специфическую диету для лечения фатального заболевания Майнота заставило задуматься ещё одно очень печальное событие. В 1921 году у нашего героя диагностировали сахарный диабет, и на тот момент единственным средством лечения этого заболевания была низкокалорийная диета.
Препараты В12
Кстати, сказать, годом позже Ф. Дж. Бантинг и Чарльз Бест получили инсулин, и Джордж Майнот стал одним из первых пациентов, начавших принимать препараты этого гормона, чем смог сберечь своё здоровье и продлить жизнь, совершив небывалый прорыв в медицине.
Но вернёмся к пернициозной анемии. Незадолго до описываемых событий Майнот познакомился с ординатором Бостонского госпиталя Питера Бента Бригама Уильямом Мерфи, который в скором времени открыл ещё и частную практику. Среди пациентов Мерфи были те, у которых было диагностировано интересующее Майнота заболевание.
Среди пациентов Мерфи были те, у которых было диагностировано интересующее Майнота заболевание.
После детального изучения сути и перспектив нового метода лечения специфической диетой Мерфи без колебаний принял предложение Майнота и уговорил своих пациентов принять участие в рискованном эксперименте. Риск был вознаграждён, анализ крови больных после начала лечения сырой печенью неоднозначно говорил о радикальных сдвигах в течении болезни: регенерация эритроцитов имела устойчивую положительную динамику!
На собрании Ассоциации американских врачей в Бостоне 4 мая 1926 года Майнот и Мерфи описали свои результаты наблюдения 45 пациентов с пернициозной анемией, содержавшихся на высокобелковой диете от шести недель до двух лет. Ежедневный рацион больных включал 120–240 г сырой печени и 120 г мяса, что приводило к симптоматическому улучшению и росту числа эритроцитов.
На той же встрече Уильям Мерфи подробно рассказал о гематологических изменениях. В течение четырёх-десяти дней после начала диеты наблюдался рост образование ретикулоцитов в среднем с 1% до 8%, уменьшение желтухи за счёт снижения концентрации билирубина из-за восстановления динамического равновесия между образованием и разрушением эритроцитов, и, как главный итог – увеличение концентрации гемоглобина и количества красных клеток крови.
Наконец-то свершилось! Страшную болезнь с неизменным летальным исходом, уносившую ежегодно 6 тыс. жизней до этого переломного момента, удалось победить, обнаружен новый фактор пищи с антианемическим действием. После первых успехов и осторожных выводов Дж. Майнот и У. Мерфи продолжили официальные клинические исследования, которые подтвердили неоспоримый эффект нового подхода в лечении злокачественной анемии.
Но… Всегда в решении любой сложной проблемы есть хотя бы одно «но». Не обошлось без препятствия и в этом случае. Эффект давало лечение с использованием в рационе не менее полуфунта (226,8 г!!) сырой печени. Вы можете себе представить больного с описанными выше симптомами, среди которых страшная слабость, стойкая анорексия (неприятие пищи) и диарея, уплетающего за обе щеки сырую (или слабо обработанную термически) печень? Нет? Правильно делаете. Майноту и Мерфи приходилось прилагать особые усилия, чтобы уговорить, а порой и заставить, своих пациентов съедать «лекарство». Некоторым приходилось вводить его через зонд. Чего не сделаешь ради спасения жизни человека!
Некоторым приходилось вводить его через зонд. Чего не сделаешь ради спасения жизни человека!
Итак, в сырой печени присутствует антианемический фактор, новый витамин. Как известно, следующим этапом в любой витаминной истории следует выделение этого вещества из природного источника. Джордж Майнот, который был учёным и исследователем в отличие от своего коллеги Мерфи, практикующего врача, занялся этим вопросом вплотную.
Самостоятельно он такую задачу решить был не в силах, поэтому стал активно искать специалиста в области физической химии белков и аминокислот, а конкретнее – их экстракции из биологических источников.
Выход был найден. Как раз в 1925 году вышла статья «Физические свойства белков» гарвардского специалиста Эдвина Джозефа Кона (1892–1953), в которой были изложены новаторские методы выделения белков, и Майнот обратился именно к нему за помощью.
За два года сотрудничества, в 1928 г., удалось получить экстракт говяжьей печени, в 50–100 раз эффективнее сырого продукта.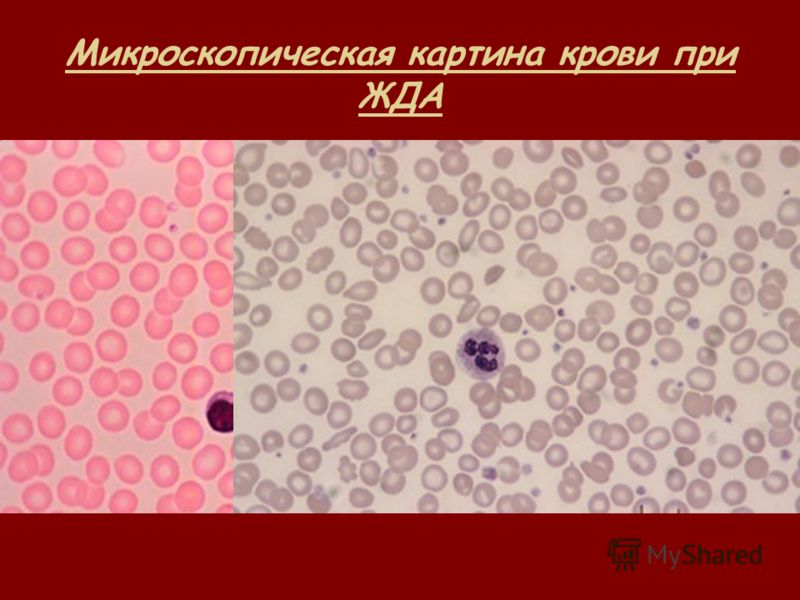 Сухой препарат можно было использовать перорально (с питьем и едой) или внутримышечно. В начале 1930-х годов У. Мерфи показал, что одноразовое введение нового препарата, известного как «Фракция G», по действию равнозначно употреблению 11 фунтов сырой печени в течение нескольких недель.
Сухой препарат можно было использовать перорально (с питьем и едой) или внутримышечно. В начале 1930-х годов У. Мерфи показал, что одноразовое введение нового препарата, известного как «Фракция G», по действию равнозначно употреблению 11 фунтов сырой печени в течение нескольких недель.
Структура В12
Эдвин Кон продолжил работу с полученным экстрактом, пытаясь выделить в чистом состоянии искомый фактор, антианемический витамин. Но оказался бессилен. Тем не менее, несколько важных ходов в этой сложной партии со смертельной болезнью американский биохимик успешно выполнил!
Логическим завершением такого важного этапа стало награждение Джорджа Майнота, Уильяма Мерфи и Джорджа Уиппла Нобелевской премией по физиологии и медицине в 1934 году «за их открытия, касающиеся применения печени в лечении пернициозной анемии».
Всё! В опасной и затянувшейся почти на 100 лет партии поставлен шах и мат пернициозной анемии. Но история на этом не закончилась. Как нам уже известно из предыдущих рассказов, при обнаружении нового фактора пищи с важной биологической функцией требуются следующие этапы: выделение в чистом (кристаллическом) состоянии, расшифровка молекулярной структуры, а также синтез этого соединения. Эта часть пути была не менее важной и сложной.
Эта часть пути была не менее важной и сложной.
Что же представляет собой жизненно важный компонент печени, и каким образом он влияет на кроветворение, в частности на эритропоэз?
Поиском ответов на эти вопросы занимался ещё одни гарвардский врач Уильям Босуворт Касл (1897–1987). В 1921 г., будучи молодым ординатором в Массачусетской больнице, он попал под влияние таланта Джорджа Майнота, который в то время работал там же и стал для молодых врачей образцом скрупулёзного исследователя тяжёлого недуга, пернициозной анемии. Изучение этой болезни для Касла стало основным направлением исследований на долгие годы.
Работа со всей доступной на то время литературой и наблюдения из собственной практики позволили молодому врачу примерно в 1929 году, когда уже были широко признаны открытия Дж. Майнота, У. Мерфи и Дж. Уиппла, сделать предположение о том, что в развитии данной патологии одно из центральных мест занимает желудочно-кишечный тракт. На эту мысль Касла натолкнуло то, что у пациентов с пернициозной анемией обнаруживалась низкая кислотность желудочного сока, а после резекции (удаления) желудка (полной или частичной) у онкологических больных лечение диетой с сырой печенью и бараниной не давало результата.
Уильям Босуворт Касл
(1897–1987)
Кроме того, он знал, что при другом заболевании желудочно-кишечного тракта – спру – также нарушается процесс кроветворения, в частности эритропоэз (развивается мегалобластоз), но эта патология успешно лечится витамином В2.
У. Касл предположил следующую схему: антианемичный фактор вырабатывается или попадает с пищей в организм млекопитающих и человека, а затем депонируется в печени, после чего поступает в костный мозг, обеспечивая нормальный эритропоэз, тогда как у больных мегалобластной анемией это вещество в организме отсутствует. Но если больного кормить большим количеством сырой печени, можно полностью восполнить дефицит этого фактора и возобновить образование эритроцитов.
А поскольку у пациентов с болезнью Аддисона-Бирмера и нарушением функции желудочно-кишечного тракта введение пищевого антианемичного фактора, который Касл назвал внешним, не давало клинического эффекта, значит, у здоровых людей должен существовать ещё и «внутренний фактор», и только комбинация этих двух составляющих в организме – необходимое звено для поддержания нормального эритропоэза.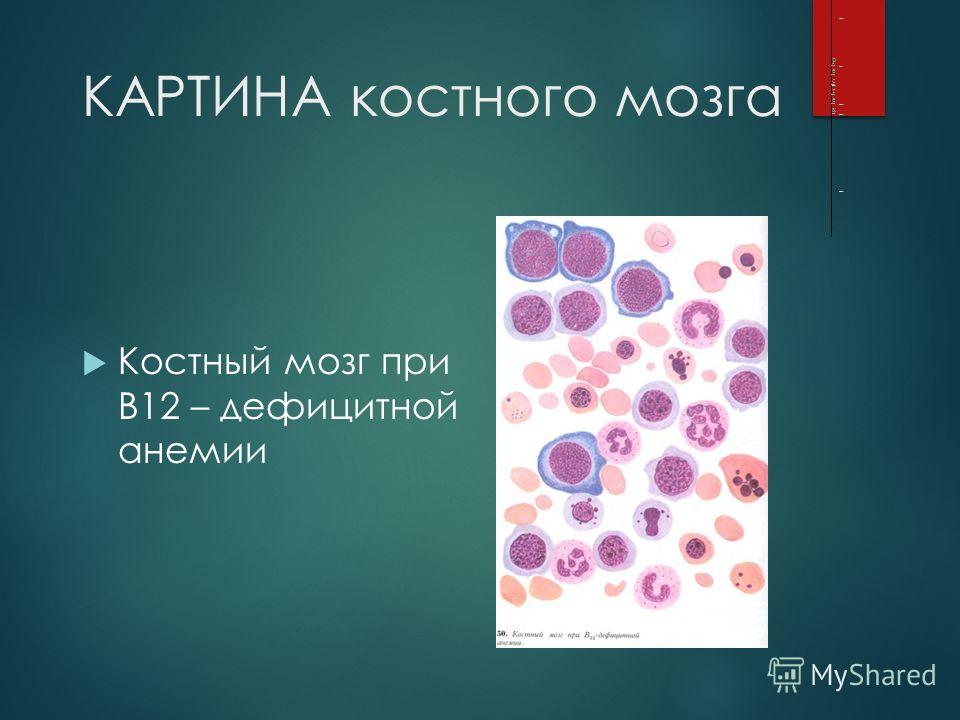
Чтобы доказать свою правоту, находчивый Уильям Касл прибег к очень экстравагантному эксперименту. Будучи человеком со здоровыми печенью и желудком, он съедал порцию сырой говяжьей печени, мясо говядины или баранины, после чего зондом собирал у себя желудочный сок и остатки непереваренного мяса. Затем самым отважным пациентам, очевидно считавшимся тогда безнадёжными, которых Касл смог уговорить пойти на такой риск, снова-таки через зонд вводили смесь из желудка самого доктора.
Через несколько дней у больных наблюдался активный ретикулоцитоз, считавшийся ранним подтверждением положительной динамики выздоровления. Введение только желудочного сока или только полупереваренного мяса или печени эффекта не давало.
Но вопрос с выделением в кристаллическом виде антианемического фактора продолжал оставаться открытым ещё несколько десятилетий, пока в 1948 году две независимые группы исследователей крупных и известных сегодня фармацевтических компаний – в Англии Glaxo (Эрнест Лестер Смит с сотрудниками) и Merck в США (Карл Огест Фолкерс с сотрудниками) – смогли завершить работу, начатую Эдвином Коном, и наконец-то получить кристаллические препараты неуловимого и мистического, но такого жизненно необходимого вещества из печени млекопитающих.
Детальные исследования обеими группами кристаллов красного цвета показали наличие в них циана, кобальта и аминогрупп. Как мы помним, аминосодержащие витамины объединены в группу В, и Карл Фолкерс, руководитель лаборатории компании Merck, даёт ему полное имя «витамин В12», или цианокобаламин.
Профессор Дж. Гласс (справа) и
А. Звеж (Медицинский Колледж
Нью-Йорка, 1972)
Гениальное предположение Уильяма Касла о существовании внутреннего фактора кроветворения подтвердилось в 1952 году, когда доктор медицины из медицинского колледжа Нью-Йорка Джордж Б. Ежи Гласс (1910–1982), американец польского происхождения, выделил из желудочного сока соединение, обладающее гемопоэтической активностью. Этим соединением оказался сложный белок гастромукопротеин, который вырабатывают железы слизистой оболочки желудка.
Именно этот белок соединяется в желудке с поступающим с пищей цианокобаламином, и только в таком комплексе витамин В12 может пройти кишечный барьер. В противном случае он будет уничтожен кишечной микрофлорой, что и происходит у людей с патологией желудка и, соответственно, дефицитом внутреннего фактора Касла.
В противном случае он будет уничтожен кишечной микрофлорой, что и происходит у людей с патологией желудка и, соответственно, дефицитом внутреннего фактора Касла.
Теперь учёные могли утверждать, что глубокий атрофический процесс слизистой желудка лежит в основе возникновения болезни Аддисона-Бирмера, или пернициозной анемии.
Если на этапе получения кристаллов цианокобаламина конкурирующие в изучении этого биологически активного соединения США и Англия так и не смогли поделить пальму первенства, то расшифровка структуры молекулы витамина В12 – полная заслуга британской школы биохимиков.
Для этого были объективные причины, ведущие специалисты структурной химии, которые использовали прогрессивную методику рентгеноструктурного анализа, находились в Оксфордском университете (Великобритания). Но надо отдать должное английским учёным, которые на определённых этапах решения этой архисложной задачи, завершившейся присуждением также Нобелевской премии, обращались за помощью к своим американским коллегам.
Красота и сложность процесса расстановки всех химических элементов и функциональных групп, входящих в состав молекулы цианокобаламина, заслуживают подробного описания.
Дороти Мери Кроуфут-Ходжкин
(1910–1994)
Эрнест Лестер Смит, руководитель исследовательской лаборатории компании Glaxo, сразу после получения кристаллов витамина В12, понимая, что следующим логическим шагом должна быть расшифровка структуры молекулы, передаёт препарат Дороти Мери Кроуфут-Ходжкин (1910–1994), главному специалисту по кристаллографии с использованием рентгеновского излучения, сотруднице Оксфордского университета.
К 1948 году на счету этой незаурядной женщины-учёного была расшифровка структуры нескольких сложных соединений: холестерола, кальциферола (витамин Д3), пенициллина, гемоглобина и глобулинов растительного происхождения. Она ещё до начала Второй мировой войны приступила к работе над изучением строения молекулы инсулина, но вынуждена была её приостановить из-за необходимости провести такую же работу с пенициллином, важным антибактериальным веществом, от применения которого зависела жизнь многих раненых во время военных действий.
Открытие пенициллина Александром Флемингом и получение кристаллических препаратов этого антибиотика совместно с Эрнестом Б. Чейном и Хоуардом У. Флори также было отмечено Нобелевской премией по физиологии и медицине в 1945 году.
Расшифровка структуры молекул методом рентгеноструктурного анализа – это невероятно сложный, кропотливый, многоэтапный и длительный процесс, но работа с веществами, в состав молекул которых входили атомы металлов, значительно упрощалась, поскольку эти атомы являются самыми тяжёлыми в молекуле и их идентификация более простая в сравнении с анализом спектральной информации от остальных элементов. И это ноу-хау принадлежит Дороти Ходжкин. Поэтому, когда выяснилось, что в состав молекулы витамина В12 входит кобальт, работа сдвинулась с мёртвой точки, и дальнейшее исследование показало, что атом металла соединён с атомом углерода и порфириновым кольцом.
Так впервые была идентифицирована связь «углерод-металл» в металлоорганическом соединении.
Главной сложностью кристаллографического метода была математическая интерпретация полученных рентгеновских данных. Для этого использовались сложные расчёты и составление двумерных, а позже и трёхмерных карт молекулярных связей – рутинная и кропотливая работа, занимавшая огромное количество времени.
Дороти Ходжкин была единственной, кто использовал разработанные ею лично физические подходы, позволявшие сократить время расчётов без потери точности в определении всех компонентов и связей в молекуле вещества. Но в случае цианокобаламина всё оказалось гораздо сложнее. Приблизительное количество атомов было порядка 100, требовались точные сложные расчёты рентгеновских данных, облегчить которые стало возможно к середине 1950-х годов благодаря разработке и использованию первых электронно-вычислительных машин (ЭВМ).
Вот тут в партию вступают снова американские учёные, которым принадлежит создание первых мощных ЭВМ. Дороти Ходжкин обращается за помощью к таким специалистам как доктор Кеннет Трубланд из Калифорнии и Дэвид Крукшенк из Манчестера.
В определение структуры цианокобаламина также внёс значительный вклад выдающийся шотландский химик, Нобелевский лауреат по химии 1957 года «за роботу по нуклеотидам и нуклеотидным коэнзимам» Александер Робертус Тодд (1907–1997). Он проводил исследования химическими методами и в 1955 г. установил наличие отдельных компонентов и функциональных групп в молекуле этого соединения.
В 1956 году была закончена расшифровка структуры витамина В12, финальным числом атомов в которой оказалось 90. Признанием заслуг Дороти Ходжкин «за определение с помощью рентгеновских лучей структур биологически активных веществ» стало награждение её Нобелевской премией по химии в 1964 году.
При презентации член Шведской королевской академии наук Гуннар Хегг сказал: «Знание структуры соединения является абсолютно необходимым для того, чтобы интерпретировать его свойства и реакции и решать, каким образом его синтезировать из более простых соединений . .. Определение структуры пенициллина было удивительным стартом новой эры кристаллографии … Определение структуры витамина В12 – это триумф рентгеноструктурного анализа кристаллов с точки зрения химического и биологического значения результатов при большой сложности структуры».
.. Определение структуры пенициллина было удивительным стартом новой эры кристаллографии … Определение структуры витамина В12 – это триумф рентгеноструктурного анализа кристаллов с точки зрения химического и биологического значения результатов при большой сложности структуры».
Роберт Бёрнс Вудворт (1917–1976)
Победным финишем многотрудного пути исследования сложного соединения, фактора пищи, дефицит которого является причиной злокачественной анемии, стал его направленный синтез для массового производства лечебных препаратов витамина В12. Этот ход был сделан вновь на Североамериканском континенте, в США, Робертом Бёрнсом Вудвортом (1917–1976) гением органического синтеза ХХ века, Нобелевским лауреатом по химии 1965 года.
Им было синтезировано много сложных природных соединений – хинин (1944), кортизон (1951), резерпин (1956), хлорофилл (1960), тетрациклин (1962), холестерин. Роберт Вудворт показал, что тщательное соблюдение принципов физической химии и детальное планирование этапов работы является основой синтеза любого природного продукта, а время расцвета его творчества вошло в историю науки как «Эпоха Вудворта».
Учитывая структуру молекулы витамина В12, которая является самой сложной из всех молекул витаминов и содержит корриновое кольцо (подобное порфириновому кольцу в молекуле гемоглобина), задача по выполнению синтеза этого соединения была такой же безумно сложной.
К её решению Роберт Вудворт с командой, состоящей более чем из 100 студентов и аспирантов, приступил в начале 1960-х годов. Работа проходила в сотрудничестве с коллегами из Цюриха (Швейцария) под руководством Альберта Эшенмозера, продолжалась несколько лет и завершилась в 1973 году победной публикацией результатов в специализированном издании Pure and Applied Chemistry.
Получив в своё распоряжение синтезированный витамин В12, учёные-биохимики приступили к тщательному исследованию его биологической роли. На сегодня нам известно, что этот витамин является коферментом двух типов биохимических реакций в организме, которые причастны к нескольким важным биологическим процессам.
Среди них: рост, нормальное кроветворение и созревание эритроцитов, работа нервной системы (образование холина, метионина, адреналина), синтез азотистых оснований нуклеиновых кислот и аминокислот белков. После этого стало понятно, почему одним из поздних симптомов пернициозной анемии являются нервные расстройства.
Также важным выводом учёных стало то, что биохимическая функция этого витамина тесно связана с фолиевой кислотой (витамин В9). Только тандем этих факторов поддерживает нормальное течение всех перечисленных процессов.
Интригующим открытием явился ещё один факт, касающийся удивительного витамина В12. Несмотря на то, что мы получаем его главным образом из продуктов животного происхождения (печень, мясо) и в гораздо меньшей степени из растений, тем не менее, сами животные, а также растения не синтезируют это вещество!
Как вы думаете, кому доверила природа такую важную задачу?? Ими оказались некоторые микроскопические грибы и микроорганизмы, составляющие здоровую микрофлору кишечника млекопитающих (в большей степени жвачных животных и меньше всего человека) и благодаря которым цианокобаламин в достаточном количестве накапливается в мышцах и печени этих животных. И уже потом с пищей попадает в наш организм.
И уже потом с пищей попадает в наш организм.
Для поддержания работы здорового организма человека суточная доза витамина В12 составляет 3–10 мкг, а при лечении анемии необходимо вводить 100–150 мкг этого соединения в сутки.
Прочитав всё, что мы тут рассказали, вы догадываетесь, как много изучено и выяснено о витамине В12, но всё же остаются ещё механизмы его действия в организме, покрытые тайной…
Р.П. Виноградова, доктор биологических наук, профессор,
О.А. Гудкова, ведущий инженер,
Институт биохимии им. А.В. Палладина НАН Украины
По теме:
Витамин-В12-дефицитная анемия: Причины,Симптомы,Лечение | Doc.ua
Причины
Анемия может развиваться при нарушении усвояемости витамина В12. Основные причины – нарушение работы ЖКТ. Часто анемия развивается с элементарным не поступлением витаминов в организм. Например, при строгом вегетарианстве, когда продукты животного происхождения полностью исключаются. Заболевание может развиваться у беременных, раковых больных, когда необходимость в нем возрастает в несколько раз.
Заболевание может развиваться у беременных, раковых больных, когда необходимость в нем возрастает в несколько раз.
Если развитие заболевания происходит в связи с нарушением нормальной работы ЖКТ, то это связано:
- с сопутствующими заболеваниями желудка;
- с проблемами тонкого кишечника, например, наличие глистов;
- по причине употребления противосудорожных средств или контрацептивов.
Симптомы
Данное заболевание не протекает бессимптомно. Основные проявления связаны с ненормальной работой и различными нарушениями в двух системах:
- центральная нервная система;
- ЖКТ (плохая всасываемость продуктов питания из желудка, недостаточный внутренний фактор Кастла, рак и прочие причины).
В12 анемия и ее симптомы по группам:
- нервная система. Ключевые проявления характеризуется снижением рефлексов, частыми «мурашками», а также онемением конечностей. Некоторые больные отмечают явление ватных ног, поэтому наблюдается нарушение походки и ее шаткость.
 Отмечают потерю памяти;
Отмечают потерю памяти; - ЖКТ. Больные указывают на повышение чувствительности к кислой пище. Может быть затруднено глотание, со временем развивается нарушение развития и нормального функционирования слизистой желудка. Это провоцирует увеличение печени и селезенки. Могут быть частые вздутия живота. Ухудшается пищеварение, возможно резкое снижение массы, вплоть до состояния анорексии.
К симптомам витаминно-дефицитной анемии относятся и такие проявления, как бледность кожи, появление «шума» в ушах, частые головные боли. При ходьбе возникает одышка и быстрая усталость, при этом отмечается учащенное сердцебиение. У женщин может прекратиться менструальный цикл, отмечены случаи развития бесплодия.
Диагностика
Витамин-в12-дефицитная анемия протекает на мегалобластическом уровне. Как это выглядит: вырабатываются эритроциты, которые имеют увеличенный размер и укороченный срок жизни; в центре клеток нет просветления, окрас равномерный; форма становится похожей на грушу или овал; наблюдаются тельца Жолли и кольца Кабо.
В крови присутствуют также нейтрофилы, которые имеют гигантские размеры. Эозинофилов и базофилов становится очень мало, вплоть до их полного отсутствия. Все это выявляется простым анализом крови. С уменьшением концентрации билирубина может отмечаться небольшая желтушность кожи и склер глаз.
Исследования:
- общий анализ мочи на наличие уробилина;
- общий анализ крови;
- обязательно выполняется пункция костного мозга для установления полной картины течения заболевания.
Осложнения
Данный вид заболевания имеет тяжелые осложнения. Процесс протекает в виде дегенерации нервов. Это связано с тем, что ЦНС и костный мозг очень восприимчивы к нехватке витамина В12. Ни в коем случае нельзя затягивать с постановкой правильного диагноза и лечением заболевания. Своевременная квалифицированная помощь поможет быстро восстановиться и продолжать нормальную жизнь.
Лечение
Лечение данного заболевания сводится к восстановлению нормального питания. Необходимо также пролечить все желудочно-кишечные заболевания. Важно, чтобы в организм было налажено достаточное поступление витамина В12.
Необходимо также пролечить все желудочно-кишечные заболевания. Важно, чтобы в организм было налажено достаточное поступление витамина В12.
Специалистом назначаются инъекции недостающего витамина, при помощи которых будет быстро нормализовать питание костного мозга. Дозировка должны быть следующая: 1 мг/сутки в течение недели делается внутримышечно. Повторные уколы выполняют по 1 мг. 1 раз в неделю в течение 1-2 месяцев. Если нормализовался уровень гемоглобина, то уколы могут быть отменены. Далее делают инъекции по 1 мг. 1 раз в месяц. После данного лечения важно тщательно соблюдать нормальное питание, чтобы с пищей поступало достаточное количество витамина В12.
В12-дефицитная анемия › Болезни › ДокторПитер.ру
В12-дефицитная анемия — одна из витаминодефицитных (мегалобластных) анемий, возникающих при недостаточном поступлении в организм витамина В12 (цианокобаламина), в результате чего поражается кроветворная функция, пищеварительная и нервная системы. Обычно встречается в пожилом и старческом возрасте, чаще у мужчин.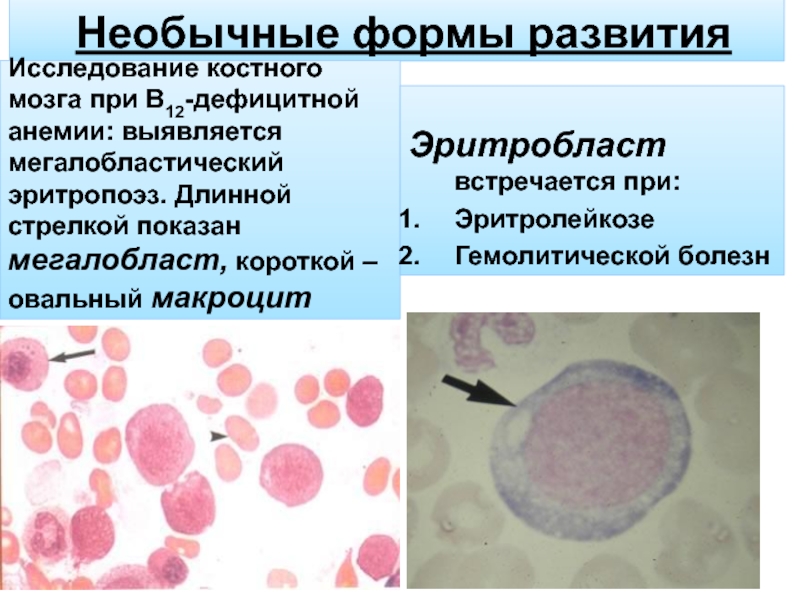 Развивается постепенно.
Развивается постепенно.
Признаки
Человек, страдающий В12-дефицитной анемией, испытывает симптомы, общие для анемий: слабость, снижение работоспособности, головокружение, одышка, сердцебиение, жжение, порой, боли в языке, боли в ногах, парестезия, пошатывание при ходьбе. Но они сочетаются с такими специфическими признаками, как желтушный цвет кожи, глоссит («полированный» язык из-за атрофии языковых сосочков), незначительное увеличение селезенки и печени, тахикардия, глухость тонов, негромкий систолический шум на верхушке.
Иногда возникает поражение нервной системы (фуникулярный миелоз, или комбинированный склероз), который выражается в нарушении чувствительности, атрофии мышц, полиневрите, даже параличах нижних конечностей.
Случается ухудшение памяти, дезориентация.
Описание
Из названия этой патологии понятно, что развивается она из-за недостаточного поступления витамина В12 в организм.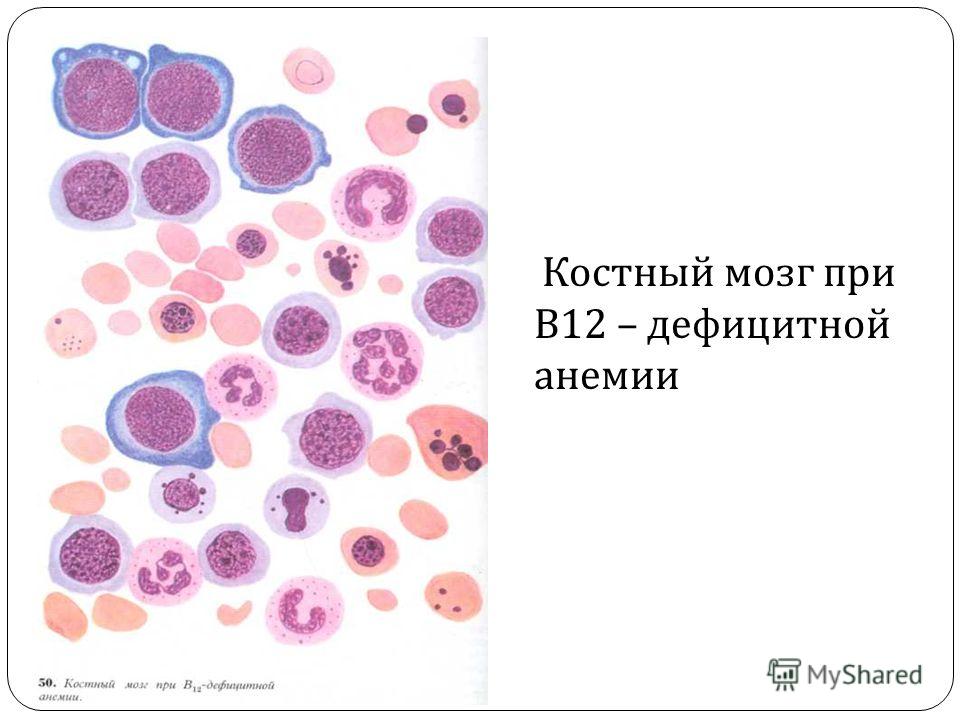 Это может быть связано с неправильным питанием (голодание, вегетарианство, несбалансированное питание, которое часто встречается у пожилых), алкоголизмом, анорексией (отсутствием аппетита).
Это может быть связано с неправильным питанием (голодание, вегетарианство, несбалансированное питание, которое часто встречается у пожилых), алкоголизмом, анорексией (отсутствием аппетита).
Дефицит витамина В12 возникает также на фоне нарушения всасывания в связи с мальабсорбцией (синдром нарушенного всасывания), изменений слизистой оболочки кишечника, таких заболеваний, как целиакия, спру, болезнь Крона, регионарный илеит, лимфома кишечника, а также становится следствием приема противосудорожных препаратов.
Потребность организма в витамине В12 увеличивается в связи с беременностью, гемолитической анемией, эксфолиативным дерматитом и псориазом.
В12-дефицитная анемия может развиться также из-за нарушения усваивания витамина В12, причинами которого могут быть алкоголизм, прием препаратов — антагонистов фолатов (производные фолиевой кислоты), врожденные нарушения метаболизма фолатов, атрофический гастрит, операции на ЖКТ (резекция тонкой кишки, гастроэктомия, синдром «слепой петли» и т. д.), такие заболевания, как инвазия широким лентецом, энтериты, дивертикулез толстого кишечника, поражение печени, рак желудка.
д.), такие заболевания, как инвазия широким лентецом, энтериты, дивертикулез толстого кишечника, поражение печени, рак желудка.
Причиной такой разновидности В12-дефицитной анемии, как пернициозная анемия (злокачественная анемия Аддисона-Бирмера), является генетически наследуемый дефицит транскоррина — белка, необходимого для всасывания витамина В12.
Диагностика
Обычно диагноз В12-дефицитной анемии ставится без проблем. Для этого потребуется консультация гематолога, гастроэнтеролога, навролога и нефролога. Для постановки диагноза берут кровь на общий и биохимический анализы, исследуют уровень витаминов В12 в сыворотке крови (при болезни он снижается до 10-150 нг/мл), а в моче определяют наличие метилмалоновой кислоты, повышение уровня которой указывает на тканевой или клеточный дефицит B12. Кроме того, используют радиоизотопные методы исследования всасывания витамина В12 и проводят ультразвуковое исследование органов брюшной полости.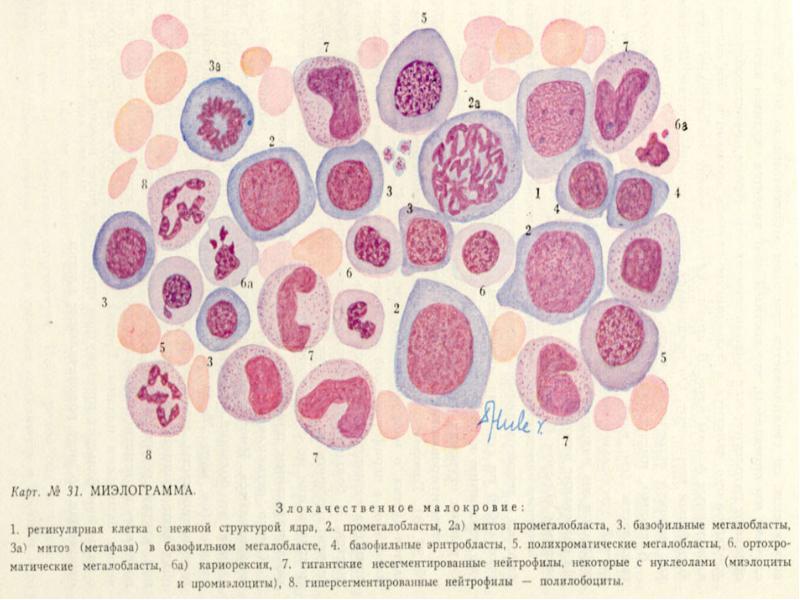
Может быть использован метод окраски мазков костного мозга ализариновым красным, который при В12-дефицитной анемии окрашивает мегалобласты – огромные клетки, вырастающие из-за дефицита витамина В12 и фолиевой кислоты. Этот метод позволяет также отличить фолиево-дефицитную анемию от В12-дефицитной.
По показаниям проводится аспирационная биопсия костного мозга, но ее следует делать до назначения витамина В12, поскольку мегалобласты могут исчезнуть из костного мозга уже после первых же инъекций.
Лечение
Назначаются препараты витамина В12. Они вводятся внутримышечно вначале терапевтическими дозами, через 4-6 недель – поддерживающими.
При содержании гемоглобина менее 60 г/л, нарушениях гемодинамики, угрозе анемической комы проводятся трансфузии эритроцитов. Препараты фолиевой кислоты не назначаются.
В тех случаях, когда сочетаются дефицит витамина В12 и железа, дополнительно назначаются препараты железа, которые применяются также и при развитии относительного дефицита железа, возникшего из-за лечения витамином В12.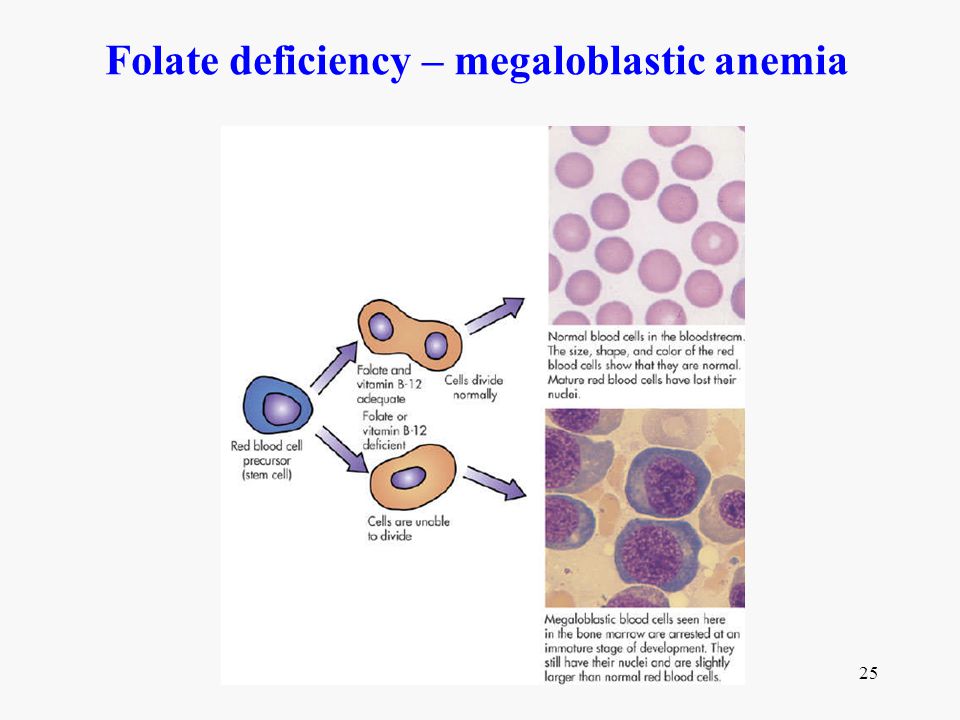
Если причина В12-дефицитной анемии — глистная инвазия, необходимо избавиться от гельминтов. Для нормализации кишечной флоры, при поносах назначают ферментные препараты, а также диету для ликвидации синдромов бродильной (гнилостной) диспепсии. Кроме того, необходим полный отказ от алкоголя.
Лечением мегалобластных анемий несомненно является правильное, сбалансированное питание, содержащее витамины и белки. Продукты должны быть богаты витамином В12.
Профилактика
Анемия может развиться через 4 месяца полного отсутствия поступления витамина В12 с пищей. Для ее профилактики необходимо рациональное питание, включающее мясо и рыбу. Вегетарианцы должны регулярное употреблять молоко и сою. Необходимо также вовремя выявлять и лечить дифиллоботриоз (поражение организма гельминтом — широким лентецом).
При заболеваниях, сопровождающихся нарушением всасывания витамина В12, а также после операций нужно под контролем содержания витамина В12 в моче и крови назначать лечебные или профилактические курсы витаминотерапии.
© Доктор Питер
Пагубная анемия: симптомы, причины и лечение
Анемия — это заболевание, при котором в крови мало нормальных эритроцитов.
Пагубная анемия — одна из причин анемии, вызванной недостаточностью витамина B-12. Считается, что это в основном вызвано аутоиммунным процессом, из-за которого человек не может вырабатывать в желудке вещество, называемое внутренним фактором.
Это вещество необходимо для абсорбции витамина B-12 в тонком кишечнике. Витамин B-12 — это необходимое питательное вещество, которое способствует правильному производству и функционированию эритроцитов в организме.
Согласно исследованию 2012 года, опубликованному в Journal of Blood Medicine, пагубная анемия — редкое заболевание, распространенность которого составляет 0,1 процента среди населения в целом и 1,9 процента среди людей старше 60 лет.
Однако до 50 процентов анемии из-за дефицита витамина B-12 у взрослых вызывается злокачественной анемией.
Этот тип анемии называется «пагубной», потому что когда-то считался смертельным заболеванием. Это было связано с отсутствием доступного лечения.
Сегодня, однако, болезнь относительно легко поддается лечению с помощью инъекций витамина B-12 или, возможно, даже пероральных добавок.Однако, если его не лечить, дефицит витамина B-12 по любой причине может привести к серьезным осложнениям.
Пагубная анемия обычно развивается медленно. Распознать симптомы может быть сложно, потому что вы, возможно, привыкли к плохому самочувствию.
Общие симптомы включают:
В более тяжелых или длительных случаях дефицита витамина B-12, в том числе из-за пагубной анемии, у людей могут возникать неврологические симптомы. К ним могут относиться:
Другие симптомы дефицита витамина B-12, в том числе вызванные злокачественной анемией, включают:
Недостаток витамина B-12 в рационе
У людей с анемией низкий уровень нормальных эритроцитов (эритроцитов). ).Витамин B-12 играет роль в создании эритроцитов, поэтому организму требуется адекватное потребление витамина B-12. Витамин B-12 содержится в:
).Витамин B-12 играет роль в создании эритроцитов, поэтому организму требуется адекватное потребление витамина B-12. Витамин B-12 содержится в:
- мясе
- домашней птице
- моллюсках
- яйцах
- молочных продуктах
- обогащенных соевом, ореховом и рисовом молоке
- пищевых добавках
Отсутствие внутреннего фактора в организме
Вашему организму также необходим белок, называемый внутренним фактором (IF), для поглощения витамина B-12. IF — это белок, продуцируемый париетальными клетками желудка.
После того, как вы потребляете витамин B-12, он попадает в желудок, где с ним связывается IF. Затем эти два вещества всасываются в последней части тонкого кишечника.
В большинстве случаев злокачественной анемии иммунная система организма атакует и разрушает клетки, известные как париетальные клетки, которые продуцируют ПФ в желудке.
Если эти клетки разрушены, желудок не сможет вырабатывать IF, а тонкий кишечник не сможет абсорбировать витамин B-12 из пищи, в том числе из продуктов, перечисленных выше.
Заболевания тонкого кишечника
Заболевания тонкого кишечника могут вызывать дефицит витамина B-12. Это может быть глютеновая болезнь, болезнь Крона или ВИЧ.
При хирургическом удалении подвздошной части тонкой кишки может возникнуть дефицит витамина B-12.
Нарушение нормальной микрофлоры тонкой кишки также может привести к дефициту витамина B-12. Антибиотики могут вызвать дефицит бактерий, необходимых для нормального всасывания в кишечнике.
У других людей может быть слишком много бактерий тонкого кишечника, вызывающих мальабсорбцию, а также дефицит витамина B-12.
Другой дефицит витамина B-12, например, вызванный плохим питанием, часто путают с пагубной анемией.
Пагубная анемия в основном считается аутоиммунным заболеванием, при котором поражаются париетальные клетки желудка. Это приводит к недостаточному производству IF и плохому всасыванию B-12.
Однако злокачественная анемия может иметь и генетический компонент, потенциально передаваемый в семьях. Есть также дети с пагубной анемией, которые рождаются с генетическим дефектом, который не позволяет им делать IF.
Есть также дети с пагубной анемией, которые рождаются с генетическим дефектом, который не позволяет им делать IF.
Пагубную анемию и анемию, вызванную мальабсорбцией тонкого кишечника, можно лечить с помощью внутримышечной инъекции B-12 вашим врачом. Пероральный прием высоких доз витамина B-12 также может быть эффективным вариантом для некоторых людей с пагубной анемией.
Для людей с анемией, вызванной дефицитом витамина B-12, когда организм может усваивать B-12, пероральные добавки витамина B-12 и корректировка диеты могут быть эффективным лечением.
У некоторых людей вероятность развития злокачественной анемии выше, чем у других. Факторы риска включают в себя:
- семейный анамнез заболевания
- североевропейского или скандинавского происхождения
- сахарный диабет 1 типа, аутоиммунное состояние или определенные кишечные заболевания, такие как болезнь Крона,
- , часть вашего желудок удален
- от 60 лет
Риск развития злокачественной анемии также увеличивается с возрастом.
Вашему врачу обычно необходимо сделать несколько анализов, чтобы диагностировать у вас злокачественную анемию. К ним относятся:
- Общий анализ крови. Этот тест позволяет выявить анемию в целом по таким показателям, как уровень гемоглобина и гематокрита.
- Уровень витамина В-12. Если подозревается, что причиной анемии является дефицит витамина B-12, ваш врач может оценить ваш уровень витамина B-12 с помощью этого анализа крови. Уровень ниже нормы указывает на недостаток.
- ПФ и антитела к париетальным клеткам. Кровь проверяется на антитела против IF и париетальных клеток желудка.
В здоровой иммунной системе антитела отвечают за обнаружение бактерий или вирусов. Затем они помечают вторгшиеся микробы для уничтожения.
При аутоиммунном заболевании, таком как злокачественная анемия, иммунная система организма перестает различать больные и здоровые ткани. В этом случае аутоантитела разрушают клетки желудка, производящие ПФ.
Лечение злокачественной анемии состоит из двух частей. Ваш врач лечит любой существующий дефицит витамина B-12.
Лечение злокачественной анемии обычно состоит из:
- инъекций витамина B-12, за которыми внимательно следят в течение долгого времени
- после определения уровня витамина B-12 в крови в течение курса терапии
- внесения соответствующих корректировок в витамин B-12 дозирование
Инъекции витамина B-12 можно делать ежедневно или еженедельно до тех пор, пока уровень B-12 не вернется к норме (или приблизится к норме).В течение первых нескольких недель лечения врач может порекомендовать ограничить физическую активность.
После того, как ваш уровень витамина B-12 станет нормальным, вам может потребоваться делать прививку только один раз в месяц. Вы можете сделать прививки самостоятельно или попросить кого-нибудь сделать их вам дома, чтобы избежать поездок к врачу.
После того, как ваш уровень B-12 станет нормальным, ваш врач может порекомендовать вам принимать пероральные дозы добавок B-12 вместо инъекции.
Однако, в зависимости от того, насколько у вас дефицит внутреннего фактора, из-за которого у вас может быть плохое всасывание витамина B-12 в кишечнике, вам могут потребоваться инъекции витамина B-12 в качестве единственного средства лечения пагубной анемии.
Ваш врач, скорее всего, захочет видеть вас на долгосрочной основе. Это поможет им определить возможные серьезные последствия злокачественной анемии.
Опасным потенциальным осложнением является рак желудка. Они могут контролировать вас на наличие симптомов рака при регулярных посещениях, а также при необходимости с помощью визуализации и биопсии.
Другие потенциальные осложнения пернициозной анемии включают:
Эти осложнения чаще всего возникают в результате длительной пернициозной анемии. Они могут быть постоянными.
Многим людям с злокачественной анемией требуется пожизненное лечение и наблюдение. Это может помочь предотвратить долговременное повреждение различных систем организма.
Поговорите со своим врачом, если вы считаете, что у вас могут быть симптомы злокачественной анемии. Ранняя диагностика, лечение и тщательный мониторинг важны для предотвращения любых проблем в будущем.
Ранняя диагностика, лечение и тщательный мониторинг важны для предотвращения любых проблем в будущем.
Пагубная анемия: симптомы, причины и лечение
Анемия — это заболевание, при котором в крови мало нормальных эритроцитов.
Пагубная анемия — одна из причин анемии, вызванной недостаточностью витамина B-12. Считается, что это в основном вызвано аутоиммунным процессом, из-за которого человек не может вырабатывать в желудке вещество, называемое внутренним фактором.
Это вещество необходимо для абсорбции витамина B-12 в тонком кишечнике. Витамин B-12 — это необходимое питательное вещество, которое способствует правильному производству и функционированию эритроцитов в организме.
Пагубная анемия — редкое заболевание с распространенностью 0.1 процент среди населения в целом и 1,9 процента среди людей старше 60 лет, согласно исследованию 2012 года, опубликованному в Journal of Blood Medicine.
Однако до 50 процентов анемии из-за дефицита витамина B-12 у взрослых вызывается злокачественной анемией.
Этот тип анемии называется «пагубной», потому что когда-то считался смертельным заболеванием. Это было связано с отсутствием доступного лечения.
Сегодня, однако, болезнь относительно легко поддается лечению с помощью инъекций витамина B-12 или, возможно, даже пероральных добавок.Однако, если его не лечить, дефицит витамина B-12 по любой причине может привести к серьезным осложнениям.
Пагубная анемия обычно развивается медленно. Распознать симптомы может быть сложно, потому что вы, возможно, привыкли к плохому самочувствию.
Общие симптомы включают:
В более тяжелых или длительных случаях дефицита витамина B-12, в том числе из-за пагубной анемии, у людей могут возникать неврологические симптомы. К ним могут относиться:
Другие симптомы дефицита витамина B-12, в том числе вызванные злокачественной анемией, включают:
Недостаток витамина B-12 в рационе
У людей с анемией низкий уровень нормальных эритроцитов (эритроцитов). ).Витамин B-12 играет роль в создании эритроцитов, поэтому организму требуется адекватное потребление витамина B-12. Витамин B-12 содержится в:
- мясе
- домашней птице
- моллюсках
- яйцах
- молочных продуктах
- обогащенных соевом, ореховом и рисовом молоке
- пищевых добавках
Отсутствие внутреннего фактора в организме
Вашему организму также необходим белок, называемый внутренним фактором (IF), для поглощения витамина B-12. IF — это белок, продуцируемый париетальными клетками желудка.
После того, как вы потребляете витамин B-12, он попадает в желудок, где с ним связывается IF. Затем эти два вещества всасываются в последней части тонкого кишечника.
В большинстве случаев злокачественной анемии иммунная система организма атакует и разрушает клетки, известные как париетальные клетки, которые продуцируют ПФ в желудке.
Если эти клетки разрушены, желудок не сможет вырабатывать IF, а тонкий кишечник не сможет абсорбировать витамин B-12 из пищи, в том числе из продуктов, перечисленных выше.
Заболевания тонкого кишечника
Заболевания тонкого кишечника могут вызывать дефицит витамина B-12. Это может быть глютеновая болезнь, болезнь Крона или ВИЧ.
При хирургическом удалении подвздошной части тонкой кишки может возникнуть дефицит витамина B-12.
Нарушение нормальной микрофлоры тонкой кишки также может привести к дефициту витамина B-12. Антибиотики могут вызвать дефицит бактерий, необходимых для нормального всасывания в кишечнике.
У других людей может быть слишком много бактерий тонкого кишечника, вызывающих мальабсорбцию, а также дефицит витамина B-12.
Другой дефицит витамина B-12, например, вызванный плохим питанием, часто путают с пагубной анемией.
Пагубная анемия в основном считается аутоиммунным заболеванием, при котором поражаются париетальные клетки желудка. Это приводит к недостаточному производству IF и плохому всасыванию B-12.
Однако злокачественная анемия может иметь и генетический компонент, потенциально передаваемый в семьях.Есть также дети с пагубной анемией, которые рождаются с генетическим дефектом, который не позволяет им делать IF.
Пагубную анемию и анемию, вызванную мальабсорбцией тонкого кишечника, можно лечить с помощью внутримышечной инъекции B-12 вашим врачом. Пероральный прием высоких доз витамина B-12 также может быть эффективным вариантом для некоторых людей с пагубной анемией.
Для людей с анемией, вызванной дефицитом витамина B-12, когда организм может усваивать B-12, пероральные добавки витамина B-12 и корректировка диеты могут быть эффективным лечением.
У некоторых людей вероятность развития злокачественной анемии выше, чем у других. Факторы риска включают в себя:
- семейный анамнез заболевания
- североевропейского или скандинавского происхождения
- сахарный диабет 1 типа, аутоиммунное состояние или определенные кишечные заболевания, такие как болезнь Крона,
- , часть вашего желудок удален
- от 60 лет
Риск развития злокачественной анемии также увеличивается с возрастом.
Вашему врачу обычно необходимо сделать несколько анализов, чтобы диагностировать у вас злокачественную анемию. К ним относятся:
- Общий анализ крови. Этот тест позволяет выявить анемию в целом по таким показателям, как уровень гемоглобина и гематокрита.
- Уровень витамина В-12. Если подозревается, что причиной анемии является дефицит витамина B-12, ваш врач может оценить ваш уровень витамина B-12 с помощью этого анализа крови. Уровень ниже нормы указывает на недостаток.
- ПФ и антитела к париетальным клеткам. Кровь проверяется на антитела против IF и париетальных клеток желудка.
В здоровой иммунной системе антитела отвечают за обнаружение бактерий или вирусов. Затем они помечают вторгшиеся микробы для уничтожения.
При аутоиммунном заболевании, таком как злокачественная анемия, иммунная система организма перестает различать больные и здоровые ткани. В этом случае аутоантитела разрушают клетки желудка, производящие ПФ.
Лечение злокачественной анемии состоит из двух частей. Ваш врач лечит любой существующий дефицит витамина B-12.
Лечение злокачественной анемии обычно состоит из:
- инъекций витамина B-12, за которыми внимательно следят в течение долгого времени
- после определения уровня витамина B-12 в крови в течение курса терапии
- внесения соответствующих корректировок в витамин B-12 дозирование
Инъекции витамина B-12 можно делать ежедневно или еженедельно до тех пор, пока уровень B-12 не вернется к норме (или приблизится к норме).В течение первых нескольких недель лечения врач может порекомендовать ограничить физическую активность.
После того, как ваш уровень витамина B-12 станет нормальным, вам может потребоваться делать прививку только один раз в месяц. Вы можете сделать прививки самостоятельно или попросить кого-нибудь сделать их вам дома, чтобы избежать поездок к врачу.
После того, как ваш уровень B-12 станет нормальным, ваш врач может порекомендовать вам принимать пероральные дозы добавок B-12 вместо инъекции.
Однако, в зависимости от того, насколько у вас дефицит внутреннего фактора, из-за которого у вас может быть плохое всасывание витамина B-12 в кишечнике, вам могут потребоваться инъекции витамина B-12 в качестве единственного средства лечения пагубной анемии.
Ваш врач, скорее всего, захочет видеть вас на долгосрочной основе. Это поможет им определить возможные серьезные последствия злокачественной анемии.
Опасным потенциальным осложнением является рак желудка. Они могут контролировать вас на наличие симптомов рака при регулярных посещениях, а также при необходимости с помощью визуализации и биопсии.
Другие потенциальные осложнения пернициозной анемии включают:
Эти осложнения чаще всего возникают в результате длительной пернициозной анемии. Они могут быть постоянными.
Многим людям с злокачественной анемией требуется пожизненное лечение и наблюдение. Это может помочь предотвратить долговременное повреждение различных систем организма.
Поговорите со своим врачом, если вы считаете, что у вас могут быть симптомы злокачественной анемии. Ранняя диагностика, лечение и тщательный мониторинг важны для предотвращения любых проблем в будущем.
Пагубная анемия: симптомы, причины и лечение
Анемия — это заболевание, при котором в крови мало нормальных эритроцитов.
Пагубная анемия — одна из причин анемии, вызванной недостаточностью витамина B-12. Считается, что это в основном вызвано аутоиммунным процессом, из-за которого человек не может вырабатывать в желудке вещество, называемое внутренним фактором.
Это вещество необходимо для абсорбции витамина B-12 в тонком кишечнике. Витамин B-12 — это необходимое питательное вещество, которое способствует правильному производству и функционированию эритроцитов в организме.
Пагубная анемия — редкое заболевание с распространенностью 0.1 процент среди населения в целом и 1,9 процента среди людей старше 60 лет, согласно исследованию 2012 года, опубликованному в Journal of Blood Medicine.
Однако до 50 процентов анемии из-за дефицита витамина B-12 у взрослых вызывается злокачественной анемией.
Этот тип анемии называется «пагубной», потому что когда-то считался смертельным заболеванием. Это было связано с отсутствием доступного лечения.
Сегодня, однако, болезнь относительно легко поддается лечению с помощью инъекций витамина B-12 или, возможно, даже пероральных добавок.Однако, если его не лечить, дефицит витамина B-12 по любой причине может привести к серьезным осложнениям.
Пагубная анемия обычно развивается медленно. Распознать симптомы может быть сложно, потому что вы, возможно, привыкли к плохому самочувствию.
Общие симптомы включают:
В более тяжелых или длительных случаях дефицита витамина B-12, в том числе из-за пагубной анемии, у людей могут возникать неврологические симптомы. К ним могут относиться:
Другие симптомы дефицита витамина B-12, в том числе вызванные злокачественной анемией, включают:
Недостаток витамина B-12 в рационе
У людей с анемией низкий уровень нормальных эритроцитов (эритроцитов). ).Витамин B-12 играет роль в создании эритроцитов, поэтому организму требуется адекватное потребление витамина B-12. Витамин B-12 содержится в:
- мясе
- домашней птице
- моллюсках
- яйцах
- молочных продуктах
- обогащенных соевом, ореховом и рисовом молоке
- пищевых добавках
Отсутствие внутреннего фактора в организме
Вашему организму также необходим белок, называемый внутренним фактором (IF), для поглощения витамина B-12. IF — это белок, продуцируемый париетальными клетками желудка.
После того, как вы потребляете витамин B-12, он попадает в желудок, где с ним связывается IF. Затем эти два вещества всасываются в последней части тонкого кишечника.
В большинстве случаев злокачественной анемии иммунная система организма атакует и разрушает клетки, известные как париетальные клетки, которые продуцируют ПФ в желудке.
Если эти клетки разрушены, желудок не сможет вырабатывать IF, а тонкий кишечник не сможет абсорбировать витамин B-12 из пищи, в том числе из продуктов, перечисленных выше.
Заболевания тонкого кишечника
Заболевания тонкого кишечника могут вызывать дефицит витамина B-12. Это может быть глютеновая болезнь, болезнь Крона или ВИЧ.
При хирургическом удалении подвздошной части тонкой кишки может возникнуть дефицит витамина B-12.
Нарушение нормальной микрофлоры тонкой кишки также может привести к дефициту витамина B-12. Антибиотики могут вызвать дефицит бактерий, необходимых для нормального всасывания в кишечнике.
У других людей может быть слишком много бактерий тонкого кишечника, вызывающих мальабсорбцию, а также дефицит витамина B-12.
Другой дефицит витамина B-12, например, вызванный плохим питанием, часто путают с пагубной анемией.
Пагубная анемия в основном считается аутоиммунным заболеванием, при котором поражаются париетальные клетки желудка. Это приводит к недостаточному производству IF и плохому всасыванию B-12.
Однако злокачественная анемия может иметь и генетический компонент, потенциально передаваемый в семьях.Есть также дети с пагубной анемией, которые рождаются с генетическим дефектом, который не позволяет им делать IF.
Пагубную анемию и анемию, вызванную мальабсорбцией тонкого кишечника, можно лечить с помощью внутримышечной инъекции B-12 вашим врачом. Пероральный прием высоких доз витамина B-12 также может быть эффективным вариантом для некоторых людей с пагубной анемией.
Для людей с анемией, вызванной дефицитом витамина B-12, когда организм может усваивать B-12, пероральные добавки витамина B-12 и корректировка диеты могут быть эффективным лечением.
У некоторых людей вероятность развития злокачественной анемии выше, чем у других. Факторы риска включают в себя:
- семейный анамнез заболевания
- североевропейского или скандинавского происхождения
- сахарный диабет 1 типа, аутоиммунное состояние или определенные кишечные заболевания, такие как болезнь Крона,
- , часть вашего желудок удален
- от 60 лет
Риск развития злокачественной анемии также увеличивается с возрастом.
Вашему врачу обычно необходимо сделать несколько анализов, чтобы диагностировать у вас злокачественную анемию. К ним относятся:
- Общий анализ крови. Этот тест позволяет выявить анемию в целом по таким показателям, как уровень гемоглобина и гематокрита.
- Уровень витамина В-12. Если подозревается, что причиной анемии является дефицит витамина B-12, ваш врач может оценить ваш уровень витамина B-12 с помощью этого анализа крови. Уровень ниже нормы указывает на недостаток.
- ПФ и антитела к париетальным клеткам. Кровь проверяется на антитела против IF и париетальных клеток желудка.
В здоровой иммунной системе антитела отвечают за обнаружение бактерий или вирусов. Затем они помечают вторгшиеся микробы для уничтожения.
При аутоиммунном заболевании, таком как злокачественная анемия, иммунная система организма перестает различать больные и здоровые ткани. В этом случае аутоантитела разрушают клетки желудка, производящие ПФ.
Лечение злокачественной анемии состоит из двух частей. Ваш врач лечит любой существующий дефицит витамина B-12.
Лечение злокачественной анемии обычно состоит из:
- инъекций витамина B-12, за которыми внимательно следят в течение долгого времени
- после определения уровня витамина B-12 в крови в течение курса терапии
- внесения соответствующих корректировок в витамин B-12 дозирование
Инъекции витамина B-12 можно делать ежедневно или еженедельно до тех пор, пока уровень B-12 не вернется к норме (или приблизится к норме).В течение первых нескольких недель лечения врач может порекомендовать ограничить физическую активность.
После того, как ваш уровень витамина B-12 станет нормальным, вам может потребоваться делать прививку только один раз в месяц. Вы можете сделать прививки самостоятельно или попросить кого-нибудь сделать их вам дома, чтобы избежать поездок к врачу.
После того, как ваш уровень B-12 станет нормальным, ваш врач может порекомендовать вам принимать пероральные дозы добавок B-12 вместо инъекции.
Однако, в зависимости от того, насколько у вас дефицит внутреннего фактора, из-за которого у вас может быть плохое всасывание витамина B-12 в кишечнике, вам могут потребоваться инъекции витамина B-12 в качестве единственного средства лечения пагубной анемии.
Ваш врач, скорее всего, захочет видеть вас на долгосрочной основе. Это поможет им определить возможные серьезные последствия злокачественной анемии.
Опасным потенциальным осложнением является рак желудка. Они могут контролировать вас на наличие симптомов рака при регулярных посещениях, а также при необходимости с помощью визуализации и биопсии.
Другие потенциальные осложнения пернициозной анемии включают:
Эти осложнения чаще всего возникают в результате длительной пернициозной анемии. Они могут быть постоянными.
Многим людям с злокачественной анемией требуется пожизненное лечение и наблюдение. Это может помочь предотвратить долговременное повреждение различных систем организма.
Поговорите со своим врачом, если вы считаете, что у вас могут быть симптомы злокачественной анемии. Ранняя диагностика, лечение и тщательный мониторинг важны для предотвращения любых проблем в будущем.
Причины, симптомы, диагностика и лечение
Когда ваше тело не может вырабатывать достаточно здоровых эритроцитов из-за недостатка витамина B-12, у вас злокачественная анемия (PA).Когда-то это заболевание считалось смертельным («пагубный» — смертельный). В наши дни это легко лечится таблетками или уколами B-12. После лечения вы сможете жить без симптомов.
Причины этого?
Вашему организму нужно много здоровых эритроцитов. Это то, что переносит кислород во все части вашего тела. Без них ваши ткани и органы не будут работать должным образом.
Витамин B-12 — важная часть этого процесса. Если ваше тело не поглощает достаточное количество пищи, которую вы едите, ваши красные кровяные тельца будут слишком большими, чтобы пройти через ваше тело.Из-за этого ваше тело будет их меньше вырабатывать. А созданные клетки отмирают раньше, чем должны.
Причина, по которой это происходит, часто связана с нехваткой желудочного белка, называемого «внутренним фактором» (IF). Без него ваше тело не может усвоить витамин B-12.
Продолжение
Некоторые проблемы со здоровьем повышают вероятность развития ПА. К ним относятся:
Некоторые лекарства, такие как антациды или препараты для лечения диабета 2 типа, могут затруднить усвоение организмом достаточного количества B-12.
Строгая вегетарианская диета также подвергает вас риску развития ПА, поскольку вы не будете есть продукты, богатые B-12, такие как яйца, молоко и птица.
Кроме того, если у кого-то из членов вашей семьи есть PA, ваш риск этого также возрастает.
Каковы симптомы?
PA влияет на людей по-разному. Это могут быть признаки:
- Усталость (Многие люди просыпаются уставшими, несмотря на то, что высыпаются.)
- Одышка
- Чувство головокружения
- Холодные руки и ноги
- Боль в груди
- Бледная или желтая кожа
- Проблемы с равновесием (например, изо всех сил пытается надеть штаны или носки, когда вы стоите)
- Чувство жжения в ногах или ступнях.Ночью ситуация может ухудшиться
- Депрессия
- Проблемы с фокусировкой
Как это диагностировать?
Ваш врач спросит о вашей семейной истории. Они захотят узнать о ваших симптомах, а также о том, какую пищу вы часто едите и какие лекарства вы принимаете каждый день.
Во время медицинского осмотра врач послушает ваше сердце, проверит, не увеличена ли ваша печень, и будет искать какие-либо признаки повреждения нервов. Они могут провести тесты, которые проверят ваше равновесие, насколько хорошо вы ходите и ваше психическое состояние.
Ваш врач также назначит анализ крови. Это может выявить низкий уровень гемоглобина. Это вещество в красных кровяных тельцах, которое помогает переносить кислород по всему телу. Он может проверить размер и форму ваших эритроцитов. Он также может определить количество B-12 в вашей крови, которое «активно» и готово к употреблению вашим организмом.
Что такое лечение?
Витамины, которые вы покупаете в аптеке, не содержат достаточного количества B-12 для лечения ПА. Ваш врач должен будет прописать вам специальную добавку.Это часто делается в кадре. Сначала вам может понадобиться принимать один через день. Со временем вы сможете сократить до одного раза в месяц.
Продолжение
Extra B-12 также можно прописать в виде таблеток, спрея для носа, назального геля или лекарства, которое вы кладете под язык.
Ваш врач, вероятно, также порекомендует некоторые изменения в вашем рационе. Употребление большего количества продуктов с высоким содержанием витамина B-12 также может помочь вам почувствовать себя лучше.
Анемия злокачественная — NORD (Национальная организация по редким заболеваниям)
Симптомы злокачественной анемии могут включать усталость, одышку, учащенное сердцебиение, желтуху или бледность, покалывание и онемение рук и ног, потерю аппетита, диарею и т. Д. шаткость при ходьбе, кровоточивость десен, нарушение обоняния и спутанность сознания.
Симптомы подростковой пернициозной анемии обычно очевидны в возрасте от 4 до 28 месяцев. У большинства пораженных младенцев развивается форма анемии, известная как мегалобластная анемия. В крови обнаруживаются большие незрелые эритроциты (мегалобласты), которые ухудшают способность крови доставлять кислород к тканям тела. Другие типы клеток крови (например, тромбоциты и лейкоциты) также могут быть дефицитными (панцитопения). Симптомы могут включать рвоту, диарею, утомляемость, головную боль, неспособность заснуть (бессонницу), отсутствие аппетита, нарушение нормального роста, желтый цвет кожи (желтуха), раздражительность и / или бледность лица.Умственная отсталость также часто встречается у младенцев с пернициозной анемией среди подростков. У заболевших младенцев могут повторяться эпизоды крайней анемии и желтухи. У некоторых детей с ювенильной формой заболевания в моче присутствует белок крови (стойкая протеинурия), а у некоторых могут быть пороки развития мочевыводящих путей.
Лица с врожденной пернициозной анемией имеют симптомы, очень похожие на ювенильную форму. Однако они прогрессируют сравнительно медленно; настолько медленно, что признаки неврологического дефицита могут предшествовать тем, которые связаны со снижением кровоснабжения.Симптомы могут включать общую слабость и утомляемость, затрудненное дыхание (одышку), аномально учащенное сердцебиение (тахикардия) и / или боли в груди (стенокардия). У больных также могут быть проблемы с желудочно-кишечным трактом, такие как полное отсутствие аппетита (анорексия), боли в животе, расстройство желудка, отрыжка и / или запор и диарея. Также часто наблюдается потеря веса. У некоторых людей с пагубной анемией может быть аномально увеличенная печень (гепатомегалия) или селезенка (спленомегалия). Могут развиться и другие проблемы, связанные с функцией мочеиспускания.
Поскольку нервным клеткам для правильного функционирования необходим витамин B12, у некоторых людей с злокачественной анемией проявляются неврологические симптомы. Нервы, отличные от нервов головного и спинного мозга (периферическая нервная система), часто поражаются. Иногда может поражаться и спинной мозг. Неврологические симптомы могут включать онемение, покалывание, потерю чувствительности в руках и / или ногах (акропарестезии). Другие неврологические симптомы могут включать нарушение способности координировать движения (атаксия), положительный знак Бабинского (движение большого пальца наружу, вызванное поглаживанием подошвы стопы) и / или преувеличенные рефлексы (гиперрефлексия).Некоторые люди с пагубной анемией также могут стать чрезвычайно раздражительными или подавленными, а в некоторых редких случаях даже испытывать паранойю (мегалобластное безумие).
Что вызывает злокачественную анемию? | HOA
Пагубная анемия вызвана отсутствием внутреннего фактора или другими причинами, такими как инфекции, хирургическое вмешательство, лекарства или диета.
Отсутствие внутреннего фактора
Внутренний фактор — это белок, вырабатываемый в желудке. Это помогает вашему организму усваивать витамин B12. У некоторых людей аутоиммунный ответ вызывает отсутствие внутреннего фактора.
Аутоиммунный ответ возникает, если иммунная система организма вырабатывает антитела (белки), которые по ошибке атакуют и повреждают ткани или клетки организма.
При злокачественной анемии организм вырабатывает антитела, которые атакуют и разрушают париетальные (pa-RI-eh-tal) клетки. Эти клетки выстилают желудок и создают внутренний фактор. Почему возникает этот аутоиммунный ответ, неизвестно.
В результате этой атаки желудок перестает вырабатывать внутренний фактор. Без внутреннего фактора ваше тело не может перемещать витамин B12 через тонкий кишечник, где он всасывается.Это приводит к дефициту витамина B12.
Отсутствие внутреннего фактора также может возникнуть, если вам удалили часть или весь желудок хирургическим путем. Этот тип хирургии уменьшает количество париетальных клеток, доступных для выработки внутреннего фактора.
В редких случаях дети рождаются с наследственным заболеванием, которое не позволяет их телу вырабатывать внутренний фактор. Это заболевание называется врожденной злокачественной анемией.
Другие причины
Пагубная анемия имеет и другие причины, помимо отсутствия внутреннего фактора.Нарушение всасывания в тонком кишечнике и диета с недостатком витамина B12 могут привести к пагубной анемии.
Нарушение всасывания в тонком кишечнике
Иногда злокачественная анемия возникает из-за того, что тонкий кишечник не может должным образом усваивать витамин B12. Это может быть результатом:
- Слишком много неподходящих бактерий в тонком кишечнике. Это частая причина злокачественной анемии у пожилых людей. Бактерии израсходуют доступный витамин B12 до того, как тонкий кишечник сможет его усвоить.
- Заболевания, нарушающие всасывание витамина B12. Одним из примеров является глютеновая болезнь. Это генетическое заболевание, при котором ваше тело не может переносить белок, называемый глютеном. Другой пример — болезнь Крона, воспалительное заболевание кишечника. ВИЧ также может препятствовать всасыванию витамина B12.
- Определенные лекарства, которые влияют на рост бактерий или препятствуют правильному усвоению витамина B12 в тонком кишечнике. Примеры включают антибиотики и некоторые лекарства от диабета и судорог.
- Хирургическое удаление части или всего тонкого кишечника.
- Инфекция ленточного червя. Ленточный червь питается витамином B12. Недоваренная зараженная рыба может вызвать этот тип инфекции.
Диета без витамина B12
Некоторые люди заболевают пагубной анемией из-за того, что в их рационе недостаточно витамина B12. Эта причина злокачественной анемии встречается реже, чем другие причины.
Хорошие пищевые источники витамина B12 включают:
- Сухие завтраки с добавлением витамина B12
- Мясо, такое как говядина, печень, птица и рыба
- Яйца и молочные продукты (например, молоко, йогурт и сыр)
- Продукты, обогащенные витамином B12, такие как напитки на основе сои и вегетарианские гамбургеры
Строгие вегетарианцы, которые не едят никаких продуктов животного происхождения или молочных продуктов и не принимают добавки с витамином B12, подвержены риску развития пагубной анемии.
Младенцы, находящиеся на грудном вскармливании от матерей-строгих вегетарианцев, также подвержены риску злокачественной анемии. У этих младенцев анемия может развиться в течение нескольких месяцев после рождения. Это потому, что у них не было достаточно времени, чтобы накапливать витамин B12 в своем организме. Врачи лечат этих младенцев добавками витамина B12.
Другие группы, такие как пожилые люди и люди, страдающие алкоголизмом, также могут быть подвержены риску злокачественной анемии. Эти люди могут не получать необходимых питательных веществ в своем рационе.
Источник: Национальный институт сердца, легких и крови, Национальные институты здравоохранения.
Пагубная анемия | HOA — Hematology-Oncology Associates of CNY
Пагубная анемия (per-NISH-us uh-NEE-me-uh) — это состояние, при котором организм не может производить достаточно здоровых эритроцитов из-за недостатка витаминов. B12.
Витамин B12 — это питательное вещество, содержащееся в некоторых продуктах питания. Организм нуждается в этом питательном веществе для выработки здоровых красных кровяных телец и для нормальной работы нервной системы.
Люди, страдающие злокачественной анемией, не могут усваивать достаточное количество витамина B12 с пищей.Это потому, что им не хватает внутреннего (in-TRIN-sik) фактора, белка, вырабатываемого в желудке. Недостаток этого белка приводит к дефициту витамина B12.
Другие условия и факторы также могут вызывать дефицит витамина B12. Примеры включают инфекции, хирургическое вмешательство, лекарства и диету. Технически термин «злокачественная анемия» относится к дефициту витамина B12 из-за отсутствия внутреннего фактора. Однако часто дефицит витамина B12 по другим причинам также называют злокачественной анемией.
В этой статье обсуждается злокачественная анемия, вызванная отсутствием внутреннего фактора и другими причинами.
Обзор
Пагубная анемия — это разновидность анемии. Термин «анемия» обычно относится к состоянию, при котором в крови содержится более низкое, чем обычно, количество эритроцитов. При злокачественной анемии организм не может производить достаточно здоровых эритроцитов, потому что ему не хватает витамина B12.
Без достаточного количества витамина B12 ваши красные кровяные тельца не делятся нормально и становятся слишком большими. У них могут быть проблемы с выходом из костного мозга — губчатой ткани внутри костей, где образуются клетки крови.
Без достаточного количества красных кровяных телец для доставки кислорода к вашему телу вы можете чувствовать усталость и слабость. Тяжелая или длительная злокачественная анемия может привести к повреждению сердца, мозга и других органов тела.
Пагубная анемия также может вызывать другие проблемы, такие как повреждение нервов, неврологические проблемы (например, потеря памяти) и проблемы с пищеварительным трактом. Люди, страдающие злокачественной анемией, также могут быть подвержены более высокому риску ослабления прочности костей и рака желудка.
Outlook
Термин «пагубный» означает «смертельный».Это состояние называется злокачественной анемией, потому что в прошлом оно часто приводило к летальному исходу, до того как стали доступны препараты витамина B12. Пагубную анемию обычно легко лечить с помощью таблеток или уколов витамина B12.
При постоянном уходе и надлежащем лечении большинство людей, страдающих злокачественной анемией, могут выздороветь, почувствовать себя хорошо и жить нормальной жизнью.
Без лечения злокачественная анемия может привести к серьезным проблемам с сердцем, нервами и другими частями тела. Некоторые из этих проблем могут быть постоянными.
Источник: Национальный институт сердца, легких и крови, Национальные институты здравоохранения.
.


 Проведение данного исследования позволяет исключить другие опасные состояния, приводящие к похожим изменениям формулы крови;
Проведение данного исследования позволяет исключить другие опасные состояния, приводящие к похожим изменениям формулы крови; ;
;


 Отмечают потерю памяти;
Отмечают потерю памяти;