Посев мокроты и трахеобронхиальных смывов на микрофлору с определением чувствительности к антимикробным препаратам и микроскопией мазка
Исследуемый материал
Мокрота, промывные воды бронхов или трахеи
Бактериологический диагноз инфекционных поражений дыхательных путей и обоснование рациональной антибиотикотерапии.
Диагностика и лечение лёгочной патологии основана на многих специальных методах исследования. Важнейшим из них является микробиологический метод. Он необходим при дифференциальной диагносте пневмоний (пневмококковая, стафилококковая, стрептококковая и др.), абсцесса лёгких, хронических обструктивных заболеваний лёгких, бронхоэктазов. Только микробиологический диагноз позволять обосновать действительно рациональную терапию и излечить больного.
Выделяемые возбудители: этиологически значимые — H. influenzae, S. pneumoniae и M. catarrhalis, грамотрицательные бактерии семейства Enterobacteriaceae, P. aeruginosa, S. aureus (включая MRSA), S. pyogenes, Acinetobacter sp., грибы рода Candida.
Мокрота, проходя через верхние дыхательные пути и полость рта, может контаминироваться вегетирующей в них микрофлорой, это могут быть зеленящие стрептококки (S. viridans group), стафилококки (S.еpidermidis), непатогенные нейссерии (Neisseria sp.), непатогенные дифтероиды (Corynebacterium sp.), Lactobacillus sp., Candida sp. и некоторые другие.
Обращаем внимание на необходимость приобретения стерильного контейнера для сбора мокроты или других биологических жидкостей, которые рекомендуем заранее приобрести в любом медицинском офисе ИНВИТРО под залог. Возврат залоговых средств осуществляется при сдаче анализа и при условии наличия чека за внесение залога.
Литература
- Беркоу Р. (Ред.). Руководство по медицине, т. I М. «Мир», 1997. 1045 с.
- Приказ МЗ СССР от 22 апреля 1985 г. № 535 Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений.

- Энциклопедия клинических лабораторных тестов под ред. Н.У. Тица. Издательство «Лабинформ» — М. — 1997 — 942 с.
- Nightingale C. et al./ Antimicrobial Pharmacodynamics in Theory And Clinical Practice/2006/ M.Dekker inc./ 550 ps.
Посев мокроты на микрофлору и определение чувствительности к бактериофагам
Исследование мокроты направлено на выделение возбудителя заболевания и на определение количественных значений обнаруженных бактерий.
При бактериологических исследованиях мокроты оценивается общая картина микрофлоры. Идентифицируются грамположительные кокки — Staphylococcus spp., Micrococcus spp., Streptococcus spp; ланцетовидные грамположительные диплококки — Str.pneumoniae, грамотрицательные диплококки — Neisseria spp; грамотрицательные палочки — Enterobacteriaceae, Pseudomonas spp., Haemophilus spp., Klebsiella spp., Haemophilus spp. и др.
Предпочтительно исследование утренней порции мокроты. Перед сбором мокроты необходимо почистить зубы, десны, язык, слизистую оболочку щек зубной щеткой и тщательно прополоскать рот кипяченой водой.
Методика взятия: сделать 2 глубоких вдоха-выдоха, задержать дыхание на несколько секунд после каждого вдоха. Вдохнуть третий раз и с силой выдохнуть воздух. Вдохнуть еще раз и затем покашлять. Это способствует получению мокроты из глубоких отделов легких. После появления продуктивного кашля поднести к губам стерильный контейнер и аккуратно сплюнуть в него мокроту. Избегать попадания слюны и носовой слизи в образец. Минимально достаточный объем исследуемой порции мокроты составляет 3-5 мл.
Хранение и доставке в лабораторию в течение 4 часов при +4 — +8°С.
Исследование обычно проводится при воспалительных заболеваниях нижних отделов дыхательных путей, сопровождающихся отделением мокроты.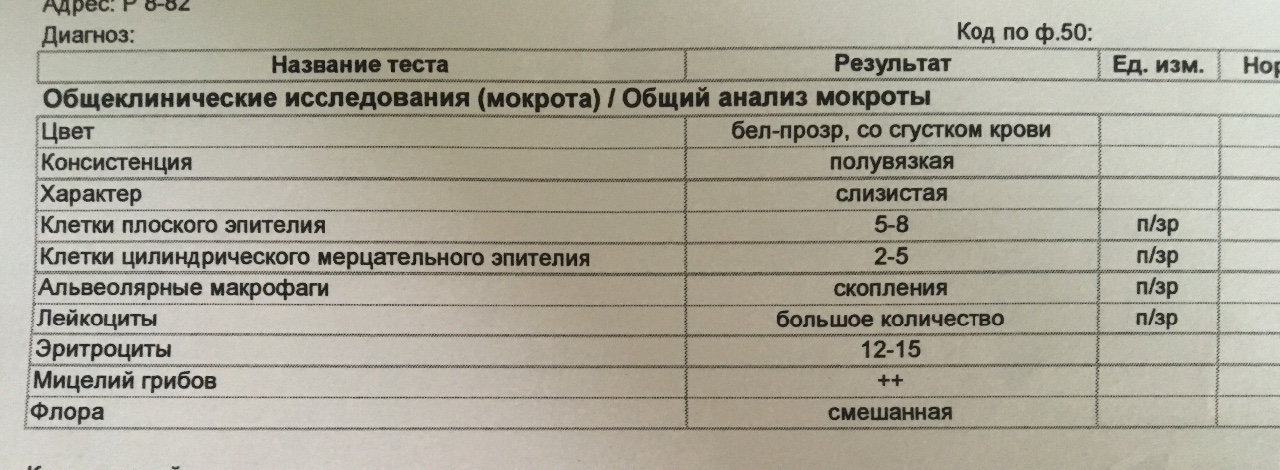 Особую важность исследование имеет при абсцессе легкого, гангрене легкого, бронхоэктатической болезни, эмпиеме плевры.
Особую важность исследование имеет при абсцессе легкого, гангрене легкого, бронхоэктатической болезни, эмпиеме плевры.
Бактериофаги — это вирусы избирательно поражающие бактериальные клетки.
Бактериофаги используются для антибактериальной терапии в качестве альтернативы приему антибиотиков. Обычно используются для лечения бактериальных инфекций, возбудители
Основной целью определения чувствительности микроорганизмов к АБП является прогнозирование их эффективности при лечении инфекций у конкретных пациентов. Определение чувствительности также проводят при наблюдении за распространением резистентности среди микроорганизмов.
Определение чувствительности к АБП проводится при выявлении этиологически значимых микроорганизмов в количестве 103 и более КОЕ/мл.
Основой для выбора АБП, подлежащих включению в исследование, являются данные о природной чувствительности обнаруженных микроорганизмов или их групп, о распространении среди них приобретенной резистентности, а также клинической эффективности АБП.
При необходимости подбора бактериофагов используется 2-3 различных антибактериальных препарата.
Посев мокроты и др. отделяемого нижних дыхательных путей на микрофлору и определение чувствительности к антибиотикам (с микроскопией мазка мокроты) (Lower Respiratory (sputum, lavage) Culture, Routine with Gram stain. Aerobic Bacteria Identification and S
Исследуемый материал
Мокрота, промывные воды бронхов или трахеи
Бактериологический диагноз инфекционных поражений дыхательных путей и обоснование рациональной антибиотикотерапии.
Диагностика и лечение лёгочной патологии основана на многих специальных методах исследования. Важнейшим из них является микробиологический метод. Он необходим при дифференциальной диагносте пневмоний (пневмококковая, стафилококковая, стрептококковая и др. ), абсцесса лёгких, хронических обструктивных заболеваний лёгких, бронхоэктазов. Только микробиологический диагноз позволять обосновать действительно рациональную терапию и излечить больного.
), абсцесса лёгких, хронических обструктивных заболеваний лёгких, бронхоэктазов. Только микробиологический диагноз позволять обосновать действительно рациональную терапию и излечить больного.
Выделяемые возбудители: этиологически значимые — H. influenzae, S. pneumoniae и M. catarrhalis, грамотрицательные бактерии семейства Enterobacteriaceae, P. aeruginosa, S. aureus (включая MRSA), S. pyogenes, Acinetobacter sp., грибы рода Candida.
Мокрота, проходя через верхние дыхательные пути и полость рта, может контаминироваться вегетирующей в них микрофлорой, это могут быть зеленящие стрептококки (S. viridans group), стафилококки (S.еpidermidis), непатогенные нейссерии (Neisseria sp.), непатогенные дифтероиды (Corynebacterium sp.), Lactobacillus sp., Candida sp. и некоторые другие.
Литература
- Беркоу Р. (Ред.). Руководство по медицине, т. I М. «Мир», 1997. 1045 с.
- Приказ МЗ СССР от 22 апреля 1985 г. № 535 Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений.
- Энциклопедия клинических лабораторных тестов под ред. Н.У. Тица. Издательство «Лабинформ» — М. — 1997 — 942 с.
- Nightingale C. et al./ Antimicrobial Pharmacodynamics in Theory And Clinical Practice/2006/ M.Dekker inc./ 550 ps.
Бактериология: посев на микрофлору мокроты
Посев на микрофлору мокроты с определением чувствительности к расширенному спектру АБ
Посевом мокроты на микрофлору называют бактериологический анализ патологического отделяемого нижнего отдела дыхательного тракта (бронхов и легких). Исследование мокроты проводится с целью выявления воспалительных процессов в легких и бронхов, а также определения чувствительности микроорганизмов к расширенному спектру антибиотиков.
Подготовка к исследованию:
- Исследование проводят до начала антибиотикотерапии
- Процедура проводится после тщательного туалета ротовой полости
Тип биоматериала: мокрота (отхаркивание, аспирация, бронхоскопия легких)
Синонимы (rus): Бакпосев на флору мокроты и определение восприимчивости бацилл к антибиотикам расширенного спектра
Синонимы (eng): Bacterial culture on the flora of sputum and determination of the susceptibility of bacteria to antibiotics extended-spectrum
Методы исследования: микробиологическое исследование
Сроки выполнения: 3-5 дней
Микрофлора мокроты
В норме микрофлора мокроты, которая выводится из респираторных путей при откашливании, заселена условно-патогенными микробами:
- стафило- и стрептококками;
- корине-, фузо- и лакто-бактериями;
- нейсерией;
- бактероидами;
- вейлонеллой;
- дрожжеподобными грибками;
- дифтероидами.
Посев на микрофлору мокроты имеет важное значение при диагностировании легочных заболеваний и определении вида возбудителя воспалительной реакции. Для выбора специфической терапии проводится анализ на восприимчивость выявленных микроорганизмов к расширенному спектру антимикробных средств (антибиотикограмма).
Когда назначают бактериальный анализ?
Опытные специалисты — терапевты, пульмонологи назначают бактериальный анализ мокроты при наличии у пациента признаков воспалительных процессов в органах дыхания:
- пневмонии;
- острых или хронических бронхитов;
- абсцесса легкого;
- эмпиемы плевры;
- бронхоэктатической болезни;
- туберкулеза.
Расшифровка анализа
В специальных условиях собранный секрет респираторного тракта (мокроту) помещают на подготовленные культуральные среды для роста колоний бактерий. Затем выросшие бациллы изучают, оценивают их тип и активность, определяют количество и чувствительность к широкому спектру антибиотиков.
Затем выросшие бациллы изучают, оценивают их тип и активность, определяют количество и чувствительность к широкому спектру антибиотиков.
Результаты анализа предоставляют микроскопическую картину образца мокроты:
- наличие или отсутствие роста колоний бактерий;
- количество выросших микробов, их вид;
- восприимчивость возбудителей к АБ.
Диагностическое значение имеет титр >103 КОЕ/мл – «положительный результат» — указывает на легочную инфекцию. Основными микроорганизмами, которые приводят к патологическому процессу в дыхательных органах относят:
- золотистый стафилококк;
- гемофильную палочку инфлюэнце;
- бета-гемолитический стрептококк;
- пневмококк;
- моракселлу;
- грибы Candida;
- нокардии;
- плеоморфные грам-негативные палочки рода Acinetobacter;
- хламидию пситаки;
- микобактерии туберкулеза (палочки Коха).
Результаты посева на микрофлору мокроты интерпретируются только квалифицированным специалистом, который учитывает общее состояние пациента и клинические признаки воспалительной реакции.
Посев мокроты и трахеобронхиальных смывов на микрофлору с определением чувствительности к антимикробным препаратам и микроскопией мазка
Бактериологический диагноз инфекционных поражений дыхательных путей и обоснование рациональной антибиотикотерапии.
Диагностика и лечение лёгочной патологии основана на многих специальных методах исследования. Важнейшим из них является микробиологический метод. Он необходим при дифференциальной диагносте пневмоний (пневмококковая, стафилококковая, стрептококковая и др.), абсцесса лёгких, хронических обструктивных заболеваний лёгких, бронхоэктазов. Только микробиологический диагноз позволять обосновать действительно рациональную терапию и излечить больного.
Выделяемые возбудители: этиологически значимые — H.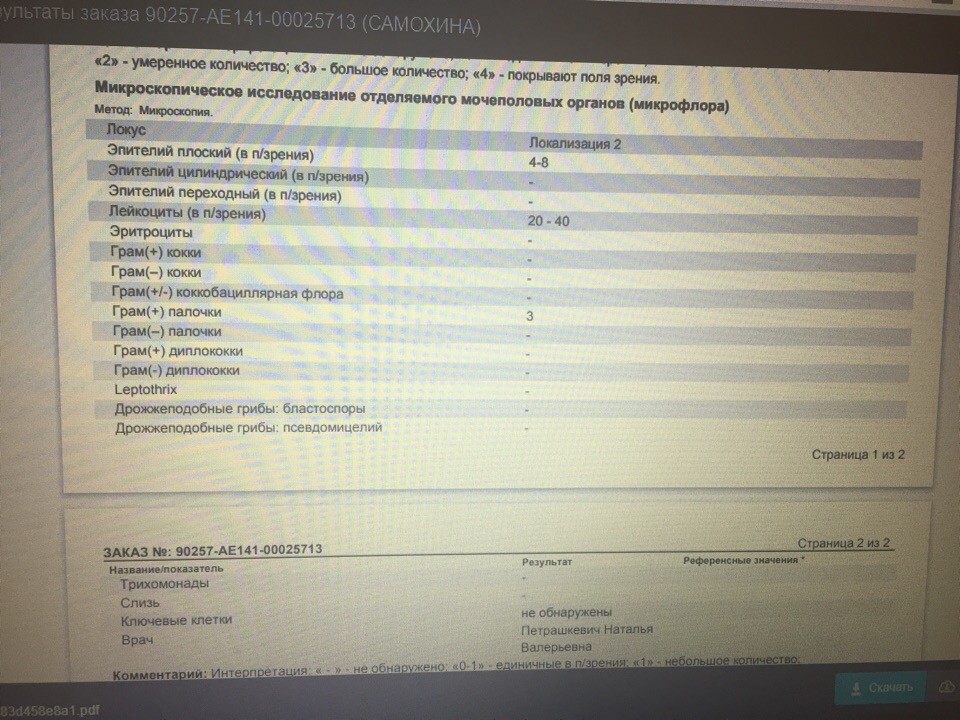 influenzae, S. pneumoniae и M. catarrhalis, грамотрицательные бактерии семейства Enterobacteriaceae, P. aeruginosa, S. aureus (включая MRSA), S. pyogenes, Acinetobacter sp., грибы рода Candida.
influenzae, S. pneumoniae и M. catarrhalis, грамотрицательные бактерии семейства Enterobacteriaceae, P. aeruginosa, S. aureus (включая MRSA), S. pyogenes, Acinetobacter sp., грибы рода Candida.
Мокрота, проходя через верхние дыхательные пути и полость рта, может контаминироваться вегетирующей в них микрофлорой, это могут быть зеленящие стрептококки (S. viridans group), стафилококки (S.еpidermidis), непатогенные нейссерии (Neisseria sp.), непатогенные дифтероиды (Corynebacterium sp.), Lactobacillus sp., Candida sp. и некоторые другие.
Обращаем внимание на необходимость приобретения стерильного контейнера для сбора мокроты или других биологических жидкостей, которые рекомендуем заранее приобрести в любом медицинском офисе СТУДИЯ ДОКТОР под залог. Возврат залоговых средств осуществляется при сдаче анализа и при условии наличия чека за внесение залога. Исследование проводят до начала лечения антибиотиками. В состав исследования входят посев и бактериоскопическое исследование. Мазок на стекле делается сотрудниками лаборатории при поступлении материала. 445 тест дополнительно не назначается.
Если исследование проводится во время приёма антибиотиков, то может быть получен ложноотрицательный результат.
Инструкция по сбору биоматериала.
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Даётся информация:
- об отсутствии или наличии роста;
- о количестве выросших в посеве микроорганизмов;
- о родовой и видовой принадлежности;
- о чувствительности к антимикробным препаратам; Список АМП определяется видом выявленных возбудителей, со списками можно ознакомиться здесь>>;
- в комментарии описывается микроскопическая картина.

Важно! Определение вида грибов и постановка чувствительности к антимикотическим средствам в этот анализ не входит (при подозрении на грибковую инфекцию назначается тест № 442).
Интерпретация: в неадекватно взятом материале, в основном представленном слюной, в посеве вырастают сапрофитные или условно-патогенные бактерии в низком титре. При микроскопическом исследовании эпителиальных клеток более 25 в п/зр., лейкоцитов менее 10 в п/зр. (увеличение х 100). При заболевании выделяются этиологически значимые бактерии в диагностическом титре (> 105 кое/мл). При отсутствии роста исследование рекомендуется повторить, т. к. материал, возможно, был неадекватно собран или собран на фоне приема антибиотиков.
Внимание! Дозаказ определения чувствительности к расширенному спектру АМП не возможен, для этой цели предназаначен Тест 472КЧА-Р.
Микробиологическое (культуральное) исследование на аэробную и факультативно-анаэробную флору с определением чувствительности к основному спектру антимикробных препаратов
Биоматериал
Для данного исследования лаборатория принимает следующий биоматериал:
Подготовка к исследованию
Условия подготовки определяются лечащим врачом. Взятие материала рекомендуется проводить до начала антибактериальной терапии или не ранее, чем через две недели после ее окончания.
Внимание! Для хранения и транспортировки биологического материала лаборатория CMD предоставляет специальные расходные материалы, которые необходимо получить в ближайшем офисе перед обращением к врачу.
Проводится зондирование, в соответствии с методикой. Желчь собирается в три контейнера пластиковых универсальных, 60 мл. по порциям A, B, C. Контейнеры предварительно промаркировать, указав порции А, В, С. Пропитать желчью зонд-тампоны в течение 5 секунд, после чего поместить их в коллекторы с транспортной с жидкой средой Эймса.
Внимание! После взятие биологического материала открутите крышку коллектора и поместите в него зонд-тампон, не касаясь наружных стенок, и стараясь не пролить жидкую среду, содержащуюся внутри коллектора. Отломите зонд-тампон в коллекторе, поместив «насечку», указанную на зонд-тампоне к краю коллектора. Для этого наклоните зонд-тампон на 180°, используя умеренное давление. Остатки зонда-тампона утилизируйте в соответствии с действующими правилами для медицинских отходов. Плотно закрутите крышку на пробирке и осторожно встряхните. При недостаточном количестве или отсутствии жидкой транспортной среды в коллекторе, неправильном соотношении транспортная среда/биологическая жидкость лаборатория пробы в работу не принимает.
Доставка
в лабораторию в день взятия биоматериала при Т=+2+25 °С в коллекторе.
Замораживание образцов недопустимо!
Выявление неспецифической микрофлоры и ее лекарственной резистентности у больных туберкулезом легких
Цель исследования – определить современный спектр неспецифической микрофлоры, а также ее лекарственную чувствительность при проведении микробиологической диагностики у больных туберкулезом легких. Проанализированы материалы бактериологического исследования 79 образцов мокроты, полученных от пациентов с различными клиническими формами туберкулеза. Положительные результаты получены в 52 случаях. Основным показанием к проведению исследования на наличие условно патогенных и облигатно-патогенных микроорганизмов служила фоновая патология. У больных с впервые выявленным туберкулезом микрофлора была представлена грамположительными кокками, преимущественно облигатными патогенами Streptococcus pyogenes и St. рneumoniae (55,6%). У пациентов с хроническими формами туберкулеза преобладала условно патогенная микрофлора (61,7%). Во всех случаях у больных туберкулезом, ассоциированным с вирусом иммунодефицита человека, обнаружено сочетание бактериального возбудителя (грамположительные кокки, микробы семейства Enterobacteriaceae) с грибами рода Candida. Зарегистрирована высокая частота лекарственной устойчивости неспецифической микрофлоры к фторхинолонам, кларитромицину, ампициллину, цефтриаксону. Не исключена связь между свойствами лекарственной резистентности неспецифической микрофлоры и микобактерий туберкулеза, что требует дальнейшего изучения.
рneumoniae (55,6%). У пациентов с хроническими формами туберкулеза преобладала условно патогенная микрофлора (61,7%). Во всех случаях у больных туберкулезом, ассоциированным с вирусом иммунодефицита человека, обнаружено сочетание бактериального возбудителя (грамположительные кокки, микробы семейства Enterobacteriaceae) с грибами рода Candida. Зарегистрирована высокая частота лекарственной устойчивости неспецифической микрофлоры к фторхинолонам, кларитромицину, ампициллину, цефтриаксону. Не исключена связь между свойствами лекарственной резистентности неспецифической микрофлоры и микобактерий туберкулеза, что требует дальнейшего изучения.
Показания для проведения и результаты исследования на неспецифическую микрофлору
Таблица 1. Клинические формы туберкулеза у пациентов с положительным результатом посева на неспецифическую микрофлору
Таблица 2. Микробный пейзаж нижних дыхательных путей у больных туберкулезом
Таблица 3. Лекарственная устойчивость неспецифической микрофлоры у больных туберкулезом
Введение
В настоящее время туберкулез, будучи ведущей инфекционной причиной заболеваемости и смертности во всем мире, представляет одну из актуальных проблем здравоохранения. Несмотря на стабилизацию и некоторое снижение основных показателей заболеваемости и распространенности туберкулеза в Российской Федерации, эпидемическая ситуация в отношении туберкулеза остается напряженной. Помимо выявления новых случаев туберкулеза ежегодно увеличивается количество больных как с первичными, так и с вторичными лекарственно-устойчивыми формами заболевания. Кроме того, туберкулезный процесс зачастую развивается на фоне неспецифических патологических воспалительных изменений в органах дыхания [1–3]. Совместное сочетание инфекционных патогенов [4–6] оказывает взаимное негативное влияние на прогноз и возможность клинического выздоровления [7, 8]. Так, хроническая обструктивная болезнь легких (ХОБЛ) на фоне туберкулеза поддерживает патологический процесс, замедляя репарацию, осложняя течение туберкулеза, и приводит к неблагоприятному исходу [9, 10]. Туберкулезный процесс у больных ХОБЛ характеризуется более тяжелыми формами с более высокой частотой образования полостей распада, бактериовыделением в мокроте, наличием осложнений, замедленной динамикой [10].
Так, хроническая обструктивная болезнь легких (ХОБЛ) на фоне туберкулеза поддерживает патологический процесс, замедляя репарацию, осложняя течение туберкулеза, и приводит к неблагоприятному исходу [9, 10]. Туберкулезный процесс у больных ХОБЛ характеризуется более тяжелыми формами с более высокой частотой образования полостей распада, бактериовыделением в мокроте, наличием осложнений, замедленной динамикой [10].
Целью работы стало определение спектра неспецифической микрофлоры и ее лекарственной чувствительности к антимикробным средствам у больных туберкулезом легких.
Материал и методы
Проанализированы результаты микробиологического исследования мокроты, полученной от 79 (21,7%) больных туберкулезом, поступивших на обследование и лечение в стационарные отделения противотуберкулезного диспансера г. Оренбурга в течение шести месяцев 2018 г. Всего за указанный период в стационаре обследовано 364 (100%) пациента. Изучен спектр нетуберкулезной микрофлоры, а также ее лекарственная чувствительность к антимикробным препаратам. Оценивались основные показания к направлению на анализ, результаты проведенного обследования и его эффективность. Исследование мокроты на неспецифическую микрофлору проводилось количественным методом, согласно приказу Минздрава России от 9 января 1995 г. № 8 «О развитии и совершенствовании деятельности лабораторий клинической микробиологии (бактериологии) лечебно-профилактических учреждений». Из 1 мл доставленной в лабораторию мокроты готовилась гомогенная эмульсия с последующим десятикратным поэтапным разведением и посевом на плотные питательные среды: 5% кровяной агар, желточно-солевой агар, среда Эндо, среда Сабуро. Посевы инкубировались при температуре 37 °С, через 24 часа учитывалась численность каждого вида микроорганизмов. Положительный результат регистрировался при наличии микроорганизма в этиологически значимых концентрациях – содержание бактерий ≥ 107 КОЕ в 1 мл мокроты. Лекарственную чувствительность выделенных культур к антибактериальным препаратам оценивали диско-диффузионным методом, в соответствии со стандартами и методическими указаниями МУК 4.2.1890–04 «Определение чувствительности микроорганизмов к антибактериальным препаратам», утвержденными Главным государственным санитарным врачом РФ 4 марта 2004 г. Из всех участников исследования положительный результат посева на неспецифическую микрофлору зарегистрирован у 52. В свою очередь эти пациенты были разделены на две группы. В первую вошли 18 (34,6%) пациентов с впервые выявленным туберкулезом, во вторую – 34 (65,4%) пациента с хроническими формами заболевания.
Лекарственную чувствительность выделенных культур к антибактериальным препаратам оценивали диско-диффузионным методом, в соответствии со стандартами и методическими указаниями МУК 4.2.1890–04 «Определение чувствительности микроорганизмов к антибактериальным препаратам», утвержденными Главным государственным санитарным врачом РФ 4 марта 2004 г. Из всех участников исследования положительный результат посева на неспецифическую микрофлору зарегистрирован у 52. В свою очередь эти пациенты были разделены на две группы. В первую вошли 18 (34,6%) пациентов с впервые выявленным туберкулезом, во вторую – 34 (65,4%) пациента с хроническими формами заболевания.
Статистическую обработку полученных результатов проводили с использованием пакета программ MS Excel. Для значений, описываемых нормальным распределением, рассчитывали среднюю арифметическую величину М, стандартное отклонение δ, стандартную ошибку средней величины m. Две выборки сравнивали с помощью непараметрического критерия хи-квадрат.
Результаты и обсуждение
На исследование мокроты на неспецифическую микрофлору за шесть месяцев 2018 г. из 364 пациентов, пребывавших в стационаре, было направлено 79 (21,7%). Основные причины направления на обследование представлены на рисунке.
Наличие хронических неспецифических заболеваний легких в анамнезе для направления на обследование послужило поводом для обследования в 69,6% случаев. С целью дифференциальной диагностики туберкулеза с неспецифическими заболеваниями легких в бактериологическую лабораторию были направлены образцы мокроты, полученные от 17,7% пациентов. Незначительная доля пациентов, обследуемых для выявления этиологии воспалительного процесса в легких при проведении дифференциальной диагностики внебольничной пневмонии и туберкулеза, может быть обусловлена специализированным характером уровня оказания медицинской помощи и качеством первичной дифференциальной диагностики на амбулаторно-поликлиническом этапе. При несоответствии клинической и рентгенологической картины или отсутствии положительной динамики туберкулезного процесса обследовались 12,7% пациентов.
При несоответствии клинической и рентгенологической картины или отсутствии положительной динамики туберкулезного процесса обследовались 12,7% пациентов.
Таким образом, основным показанием для выявления условно патогенных и облигатно-патогенных микроорганизмов стала фоновая патология.
В процессе исследования зафиксировано высокое число положительных результатов детекции неспецифических микроорганизмов – от 53% при имеющихся заболеваниях легочной системы до 67% при неэффективном лечении туберкулеза.
Половозрастной состав в группах сравнения не имел статистически достоверных различий. В первой группе мужчины составили 77,8% (средний возраст – 44,4 года), во второй – 85,3% (средний возраст – 43,2 года) (р > 0,05). В первой группе (n = 18) преобладали пациенты с длительным стажем курения в анамнезе (более десяти лет) – 11 (61,1%). Вo второй группе (n = 34) таковых насчитывалось 15 (44,1%) (р 0,05). Иная сопутствующая патология, коморбидная туберкулезу, ВИЧ-инфекция была зарегистрирована у шести (33,3%) пациентов первой группы и 19 (55,9%) пациентов – второй (р
В микробном пейзаже нижних дыхательных путей у больных туберкулезом были выделены две группы микроорганизмов (табл. 2). Ассоциации микроорганизмов, представленные бактериальным возбудителем и грибами рода Candida во всех случаях, зарегистрированы в двух (11,2%) пробах в первой группе и 21 (64,7%) пробе – во второй. Это сочетание встречалось только у пациентов с ВИЧ-инфекцией на поздних стадиях заболевания и скорее всего было связано с сопутствующими кандидозами, часто генерализованного характера при развитии выраженного иммунодефицита.
У больных с впервые выявленным туберкулезом микрофлора была представлена грамположительными кокками, преимущественно облигатными патогенами Streptococcus pyogenes и St. рneumoniae (55,6%). У пациентов с хроническими формами туберкулеза преобладала условно патогенная микрофлора – 61,7%.
Таким образом, проведенное исследование доказывает фактическое замещение резидентной микрофлоры несвойственными в норме грамотрицательными палочками, в том числе представителями условно патогенной микрофлоры рода Citrobacter. Данное обстоятельство связано с длительным антибактериальным лечением туберкулеза комбинацией нескольких антимикробных препаратов. Кроме того, установлено, что все облигатные патогены, такие как St. pyogenes и St. pneumoniaе, в обеих группах выявлены у пациентов с туберкулезом и ВИЧ-инфекцией.
В отношении зарегистрированной неспецифической микрофлоры были дополнительно проведены исследования профилей резистентности антимикробных препаратов (табл. 3). Лекарственную чувствительность выделенных штаммов оценивали с использованием антибактериальных препаратов первого ряда и по необходимости дополнительных средств, характеризующихся природной активностью в отношении выделенных микроорганизмов и клинически подтвержденной эффективностью при соответствующих инфекциях.
Согласно полученным результатам, зафиксирована высокая частота лекарственной устойчивости неспецифической микрофлоры к фторхинолонам, кларитромицину, ампициллину, цефтриаксону. Это важно учитывать при лечении пациентов с вторичной инфекцией.
Выводы
Микробный пейзаж нижних дыхательных путей больных туберкулезом легких в подавляющем большинстве случаев представлен грамположительными кокками, преимущественно условно патогенными микроорганизмами рода Streptococcus.
Не исключена связь между свойствами лекарственной резистентности неспецифической микрофлоры и микобактерий туберкулеза, что требует дальнейшего изучения.
Цвет мокроты и бактерии при обострениях хронического бронхита: общий анализ
Реферат
Мы исследовали корреляцию между цветом мокроты и наличием потенциально патогенных бактерий при обострении хронического бронхита (AECB).
Были объединены данные шести многоцентровых исследований, сравнивающих моксифлоксацин с другими противомикробными препаратами у пациентов с ОКБ. Перед антимикробной терапией собирали мокроту, и бактерии определяли посевом и окрашиванием по Граму.Связь между цветом мокроты и бактериями определяли с помощью логистической регрессии.
Из 4089 образцов мокроты цвет был зарегистрирован в 4003; 1898 (46,4%) были положительными по культуре. Образцы зеленой или желтой мокроты с наибольшей вероятностью выявляли бактерии (58,9% и 45,5% образцов соответственно) по сравнению с 18% прозрачных и 39% образцов ржавого цвета, положительными на потенциально патогенные микроорганизмы. Факторами, предсказывающими положительный посев, были цвет мокроты (самый сильный предиктор), гнойность мокроты, усиление одышки, мужской пол и отсутствие лихорадки.Зеленый или желтый цвет по сравнению с белым цветом мокроты был связан с чувствительностью 94,7% и специфичностью 15% на присутствие бактерий.
Цвет мокроты, особенно зеленый и желтый, был более сильным предиктором потенциально патогенных бактерий, чем гнойность мокроты и усиление одышки у пациентов с ОЭКБ. Однако это не обязательно предсказывает необходимость лечения антибиотиками у всех пациентов с ОКБ.
Одно из наиболее сложных решений, с которыми ежедневно приходится сталкиваться в клинической практике первичного звена, — назначать или не назначать противомикробные препараты пациентам с обострением хронического бронхиального заболевания ( i.е. хронический бронхит, бронхоэктатическая болезнь или хроническая обструктивная болезнь легких (ХОБЛ)). Такие решения принимаются эмпирически на основании клинических данных. Чрезмерное использование противомикробных препаратов в обществе явно связано с повышенным риском развития бактериальной устойчивости [1]. Диагностический инструмент, который можно использовать на месте оказания медицинской помощи для выявления пациентов, которым можно безопасно лечить без противомикробных препаратов, может снизить количество случаев неправильного назначения.
Антонисен и др. .[2] сообщили, что пациенты, поступившие как минимум с двумя из них: повышенная одышка, выделение мокроты и гнойность мокроты, с большей вероятностью выздоравливали, если прописали противомикробный препарат , по сравнению с пациентами с одним из симптомов. Однако в их исследование были включены пациенты с тяжелой и очень тяжелой ХОБЛ, и эти критерии никогда не проверялись на пациентах с необструктивным хроническим бронхитом. Совсем недавно Stockley et al. [3] заметил, что только гнойная мокрота по сравнению со слизистой мокротой в значительной степени связана с присутствием бактерий во время обострения.Изменение цвета мокроты на более темный во время обострения обнаруживается клинически и согласуется с повышенным рекрутированием нейтрофилов, что указывает на новый или значительный бактериальный стимул. Это потемнение мокроты указывает на присутствие миелопероксидазы, фермента зеленого цвета из гранул азурофилов нейтрофилов [3].
Для получения дополнительных доказательств того, что более темный цвет мокроты указывает на присутствие бактерий во время обострения хронического бронхита (AECB), были собраны данные рандомизированного клинического исследования моксифлоксацина для лечения этого состояния.Их использовали в объединенном анализе для определения корреляции между цветом мокроты и присутствием потенциально патогенных микроорганизмов (PPM) в мокроте пациентов с AECB. Все исследования имели одинаковые критерии включения и исключения и использовали один и тот же вопросник для регистрации цвета и внешнего вида мокроты. Поскольку предыдущие исследования цвета мокроты как диагностического маркера были одноцентровыми исследованиями [3–5], эти данные из многих различных центров в Европе и Северной Америке могут дать новое понимание полезности цвета мокроты в качестве помощи при принятии решений о лечении в клинических условиях. практика у пациентов с ОВХБ разной степени тяжести.
МЕТОДЫ
Дизайн исследования
Исходные данные были объединены из шести клинических испытаний с использованием аналогичных методологий, сравнивающих моксифлоксацин с другими противомикробными препаратами у пациентов с ОКБ (таблица 1), чтобы определить взаимосвязь между инфекцией и цветом мокроты [6–10].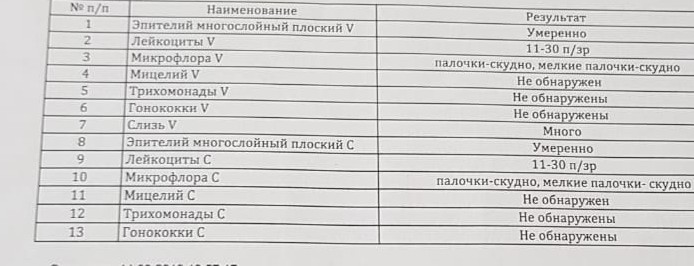 Все клинические испытания были проспективными, рандомизированными, контролируемыми многоцентровыми исследованиями, проведенными в Европе и Северной Америке.
Все клинические испытания были проспективными, рандомизированными, контролируемыми многоцентровыми исследованиями, проведенными в Европе и Северной Америке.
Таблица 1
Дизайн шести исследований, включенных в анализ мокроты
Пациенты
Пациенты мужского и женского пола в возрасте> 18 лет с хроническим бронхитом с клиническими симптомами обострения имели право присоединиться к исследованиям.Критерии включения включали обострения по Антонисену I типа (все исследования) или обострения по Антонисену II типа (одно исследование). Обострение типа I определялось как наличие повышенной одышки, выделения мокроты и гнойной мокроты [2]. Для постановки диагноза обострения Антонисена типа II требовалось наличие двух из этих симптомов. Хронический бронхит определялся как ежедневное выделение мокроты в течение большей части дней в течение не менее трех месяцев подряд на протяжении более двух лет подряд [11]. Лихорадку оценивали при включении во все исследования.Критерии исключения: значительная почечная или печеночная недостаточность; тяжелая инфекция дыхательных путей, требующая парентеральной антимикробной терапии или искусственной вентиляции легких; диагноз пневмонии; нерешенное злокачественное новообразование грудной клетки; туберкулез; кистозный фиброз; бронхоэктазы; в анамнезе тяжелая сердечная недостаточность; беременность или период лактации; радиологические доказательства бронхолегочных инфильтратов или необходимость сопутствующей системной противомикробной терапии с агентами, не указанными в протоколах исследования; аллергия на фторхинолоны, производные карбоксихинолона или противомикробные препараты сравнения; удлинение интервала QTc или прием лекарств для увеличения интервала QTc; тендинопатия, связанная с фторхинолонами; любое заболевание, которое может привести к смерти в течение 6 месяцев; получение системной противомикробной терапии> 24 ч в течение 7 дней с момента включения в исследование; или получение любого исследуемого препарата в течение 30 дней с момента регистрации.
Все исследования были проведены в соответствии с Хельсинкской декларацией и получили соответствующее одобрение местных комитетов по этике и регулирующих органов. Перед началом исследования каждый пациент предоставил письменное информированное согласие. Во всех исследованиях были получены индивидуальные данные пациентов.
Микробиологическая оценка
В каждом исследовании перед началом антимикробной терапии (исходный уровень) собирали мокроту. Все центры и исследователи использовали одну и ту же анкету для регистрации характеристик мокроты, включая цвет мокроты.Все образцы достаточного качества были проанализированы посевом и окраской по Граму в местной лаборатории каждого исследователя. Были включены только образцы с <10 плоскоклеточными клетками на поле низкого увеличения и> 25 полиморфноядерными лейкоцитами на поле низкого увеличения, идентифицированными с помощью окрашивания по Граму. Присутствие PPM ( Haemophilus influenzae , Haemophilus parainfluenzae , Staphylococcus aureus , Streptococcus pneumoniae , Klebsiella pneumoniae , Pseudomonas 9xaruginosa и др.) определяли посевом.
Статистический анализ
Все параметры, связанные с воздействием и лечением AECB, были проанализированы с использованием описательной статистики. Чтобы определить полезность использования зеленого или желтого цвета мокроты в качестве диагностического теста на наличие PPM, для каждого из шести клинических испытаний были рассчитаны следующие статистические данные диагностических тестов, включая 95% доверительные интервалы: чувствительность, специфичность, положительная прогностическая ценность. , отрицательная прогностическая ценность, положительное отношение правдоподобия и отрицательное отношение правдоподобия.Объединенные оценки были рассчитаны для чувствительности и специфичности с использованием двумерного метода [12]. В соответствии с рекомендациями Кокрановского сотрудничества [13] объединенные оценки не рассчитывались для положительных и отрицательных прогностических значений, поскольку они зависят от лежащей в основе распространенности, которая несколько варьировалась в шести испытаниях. Кроме того, никакие объединенные оценки для положительных и отрицательных отношений правдоподобия не рассчитывались, как рекомендовано Zwinderman и Bossuyt [14].
Кроме того, никакие объединенные оценки для положительных и отрицательных отношений правдоподобия не рассчитывались, как рекомендовано Zwinderman и Bossuyt [14].
Модель логистической регрессии использовалась для проверки того, является ли цвет мокроты статистически значимым предиктором присутствия микроорганизма.Сначала была проведена пошаговая логистическая регрессия с использованием следующих возможных объясняющих переменных: пол, возрастная группа (<65 против ≥65 лет), долгосрочное использование ингаляционных бронходилататоров и / или кортикостероидов, географический регион, исследование, аспект мокроты ( гнойный, слизисто-гнойный или слизистый), количество предыдущих обострений, увеличение одышки, уровень С-реактивного белка (СРБ) до лечения и количество лейкоцитов, наличие лихорадки и длительность обострения до исследования. В этой пошаговой процедуре каждая переменная добавлялась к существующей модели по одной.Если значение p для новой переменной было <0,05 (что означает, что это, вероятно, был значимым предиктором присутствия микроорганизмов, даже с учетом других переменных, уже присутствующих в модели), оно добавлялось в модель. Если была добавлена новая переменная, общая модель запускалась снова; если какая-либо переменная в новой модели имела значение p> 0,05, то она исключалась из модели. Этот шаг был выполнен для каждой из потенциальных переменных. После завершения пошаговой процедуры была запущена окончательная модель с использованием только переменных, определенных пошаговой процедурой.p-значения, точечные оценки и 95% доверительные интервалы для отношений шансов были предоставлены для каждой переменной в окончательной модели. Основная цель модели логистической регрессии состояла в том, чтобы показать, что цвет мокроты является важным предиктором присутствия PPM, даже при корректировке других важных переменных-предикторов в модели. Модель со случайными эффектами исследования была адаптирована в качестве анализа чувствительности для подтверждения результатов модели с фиксированными эффектами исследования.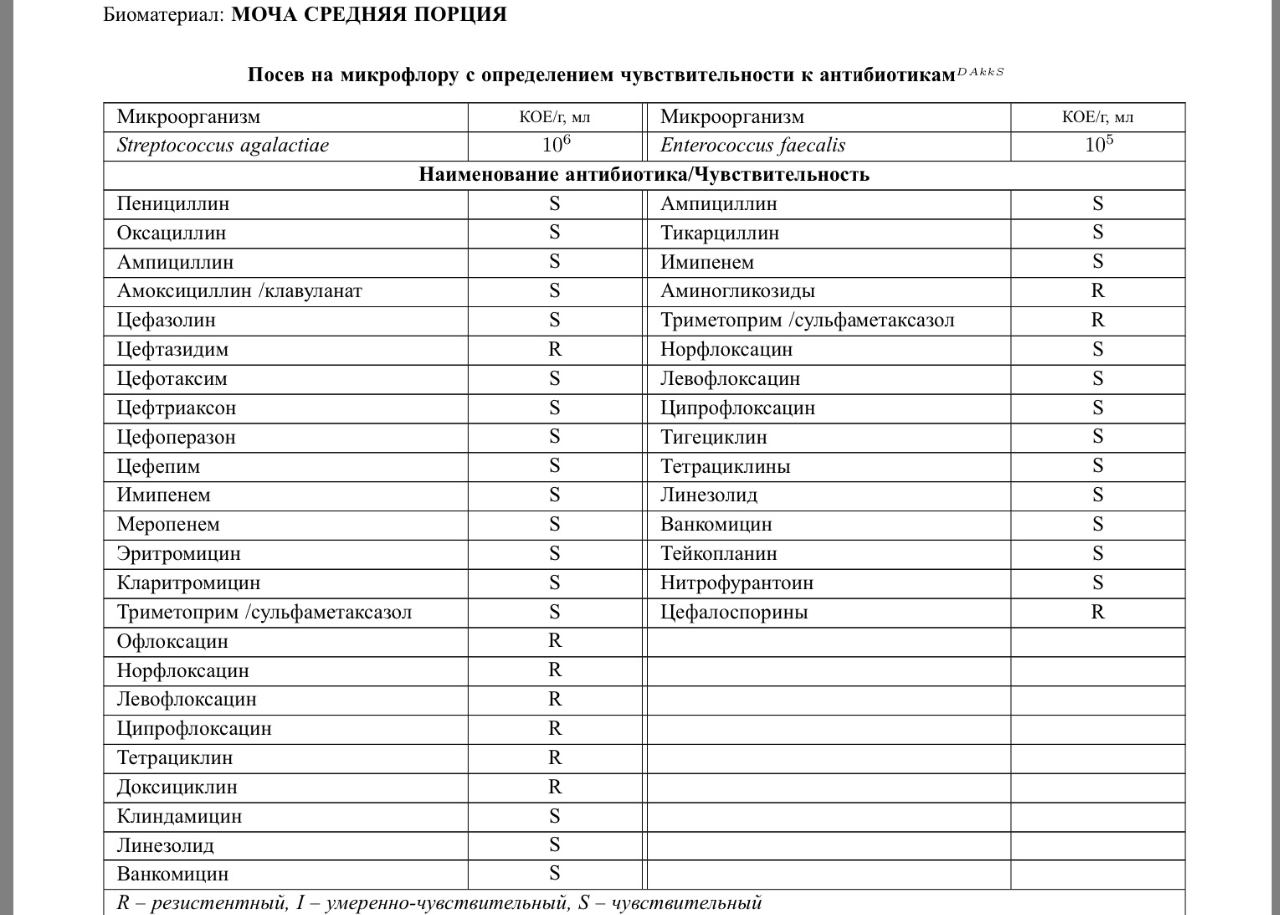
РЕЗУЛЬТАТЫ
Характеристики пациента
Всего у 4089 пациентов был взят образец мокроты.Пациенты в основном были мужчинами (55,0%), белыми (78,6%) и в возрасте> 45 лет (74,8%) (таблица 2). В целом у 44,5% пациентов за предыдущий год было три и более обострения. Хотя характеристики населения в целом и пациентов с положительными или отрицательными культурами были в целом схожими, одно заметное различие заключалось в том, что пациенты с положительными культурами с большей вероятностью курили в прошлом или в настоящее время, чем пациенты с отрицательными культурами (85,8% против 75,4%, соответственно; p <0.001).
Таблица 2-
Демографические данные пациентов, включенных в анализ мокроты
Характеристики мокроты и микробиология
Из 4089 образцов мокроты цвет был зарегистрирован в 4003 (97,9%) и 1898 (46,4%) были положительными на исходном уровне. У большинства пациентов была желтая (56,7%) или зеленая (29,8%) мокрота; Еще у 466 пациентов была мокрота белого (8,6%) или ржавого (2,8%) цвета (таблица 3). После культивирования из 1898 образцов было обнаружено 2331 PPM.
Таблица 3–
Обычно изолированные потенциально патогенные микроорганизмы: общее количество и соотношение по цвету мокроты
Инфекционные организмы чаще всего выделялись из зеленой или желтой мокроты, 58.9% и 45,5% этих проб, соответственно, были бактериологически положительными (рис. 1). Пациенты с прозрачной или белой мокротой реже имели PPM (18,4%).
Рисунок 1-
Процент образцов мокроты с выявленным патогеном по цвету мокроты. Данные в столбцах представлены как n / N.
H. influenzae был наиболее часто выделяемым организмом в мокроте всех цветов (таблица 3). Зеленый или желтый цвет был наиболее часто встречающимся цветом мокроты, где присутствовали PPM, за ним следовали ржавчина или белый цвет.Цветовые узоры были одинаковыми для всех видов изолированных PPM; следовательно, конкретный цвет не может быть ассоциирован с данным микроорганизмом (рис.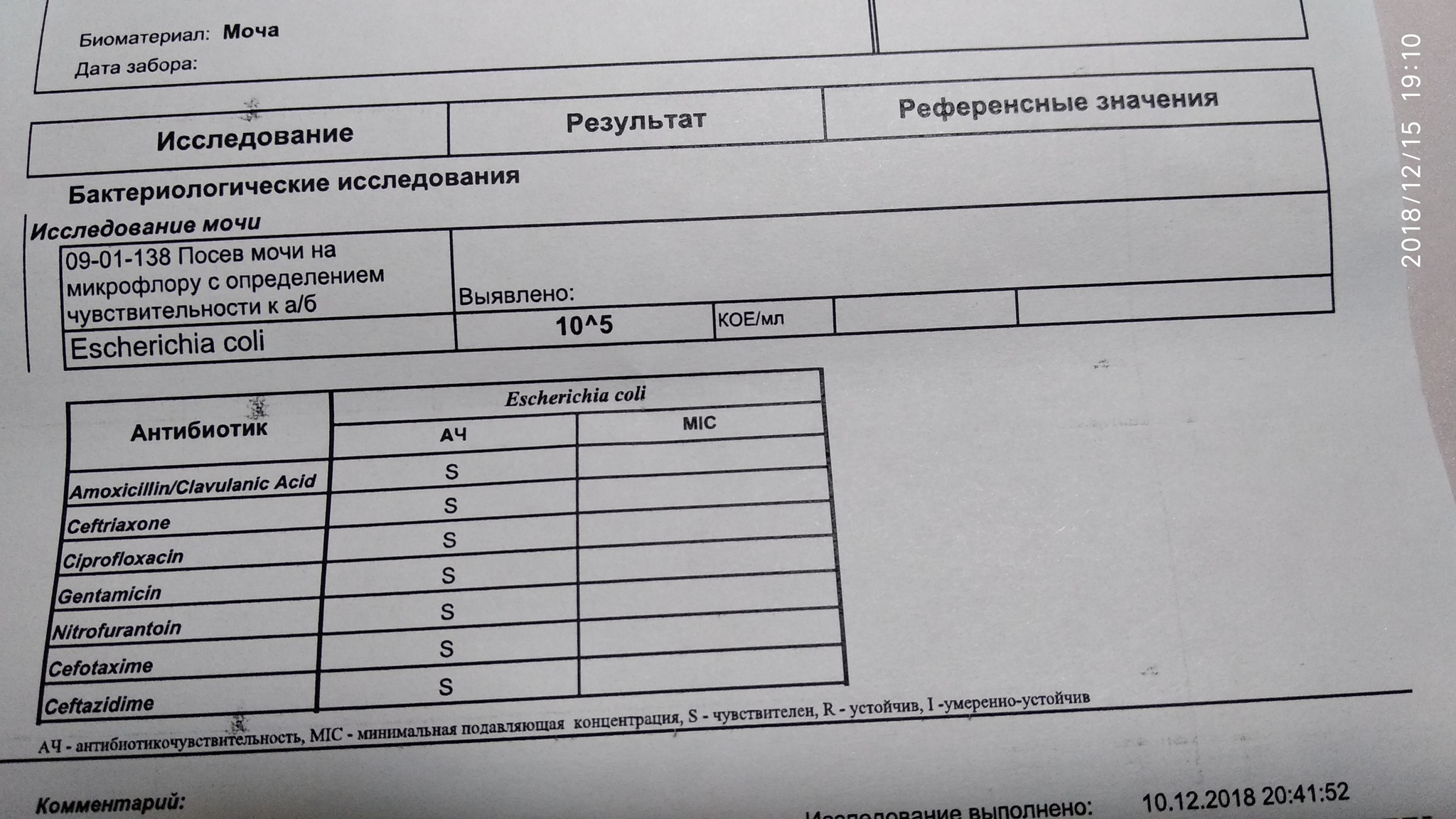 2).
2).
Фигура 2-
Распределение цвета мокроты по видам-возбудителям. a) Haemophilus influenzae , b) Streptococcus pneumoniae , c) Moraxella catarrhalis , d) Haemophilus parainfluenzae , e) Staphylococcus aureus , f)
0 Klebsiella pneumoniae, Klebsiella. ) Haemophilus spp.
Наличие зеленой или желтой мокроты по сравнению с белой мокротой имело чувствительность к наличию PPM от 91,1% до 96,8% в исследованиях, с объединенной оценкой 94,7% и специфичностью от 4,7% до 24,4%, с объединенная оценка 15,0%. Прогнозирующая ценность положительного результата варьировала от 41,6% до 56,6%, а прогностическая ценность отрицательного результата — от 65,2% до 87,9% в разных испытаниях. Все положительные отношения правдоподобия в испытаниях были> 1, а отрицательные отношения правдоподобия были <1 (таблица 4).
Таблица 4–
Параметры эффективности цвета мокроты при диагностике наличия потенциального патогенного микроорганизма путем исследования
Регрессионный анализ: прогнозирование бактериальной инфекции на основании характеристик пациента и мокроты
При логистическом регрессионном анализе факторами, предсказывающими присутствие инфекционного организма, были цвет мокроты, гнойность мокроты, усиление одышки, мужской пол и отсутствие лихорадки (таблица 5). Было обнаружено, что цвет мокроты является более сильным предиктором наличия PPM, чем другие факторы (таблица 5), хотя все факторы были значимыми.Анализ хи-квадрат нулевой гипотезы («отсутствие связи между цветом мокроты и присутствием PPM») дал значение p <0,001 (хи-квадрат 108, три степени свободы), что указывает на сильную связь между цветом мокроты и наличие бактерий. Наличие бактерий также строго прогнозировалось по гнойной мокроте (p <0,001, хи-квадрат 27, четыре степени свободы). Модель со случайными эффектами исследования подтвердила, что цвет мокроты является самым сильным предиктором наличия PPM.
Таблица 5–
Регрессионный анализ значимых факторов, прогнозирующих наличие потенциально патогенных микроорганизмов в мокроте
ОБСУЖДЕНИЕ
Настоящее исследование показало, что цвет мокроты является лучшим маркером наличия PPM в мокроте во время AECB по сравнению с аспектом мокроты, одышкой или лихорадкой. PPM был выделен в 46,4% образцов от пациентов с обострением типа I или II, при этом почти 60% положительных образцов были получены из зеленой мокроты и только 18.4% из белой мокроты. В соответствии с другими исследованиями [15], H. influenzae был PPM, наиболее часто выделяемым в нашей большой серии, и мы не обнаружили специфического цветового рисунка для различных PPM, присутствующих в образцах мокроты.
PPM был выделен в 46,4% образцов от пациентов с обострением типа I или II, при этом почти 60% положительных образцов были получены из зеленой мокроты и только 18.4% из белой мокроты. В соответствии с другими исследованиями [15], H. influenzae был PPM, наиболее часто выделяемым в нашей большой серии, и мы не обнаружили специфического цветового рисунка для различных PPM, присутствующих в образцах мокроты.
Критерии Антонисена (, т. Е. усиление одышки, выделение мокроты и гнойность мокроты) считаются наиболее надежными предикторами бактериальной инфекции как причины обострения, требующего противомикробного лечения, в течение> 20 лет [2].Однако эти критерии были описаны для ХОБЛ: у всех пациентов объем форсированного выдоха за 1 с (ОФВ 1 ) <80% от прогнозируемого; Фактически, в исследовании Anthonisen et al. средний ОФВ 1 составлял только 33%. [2], который представляет популяцию с тяжелой или очень тяжелой формой ХОБЛ. Эти критерии никогда не применялись при простом, необструктивном хроническом бронхите. Более того, наиболее важным достижением в нашей способности прогнозировать участие бактерий в обострениях хронического бронхиального заболевания стало наблюдение, что не все три критерия имеют одинаковую прогностическую ценность.Стокли и др. . [3] с помощью цветовой диаграммы продемонстрировали, что изменение цвета мокроты во время обострения является чувствительным и специфическим маркером бактериального присутствия, а также позволяет прогнозировать высокую бактериальную нагрузку в бронхиальном секрете. Эти результаты были повторены другими группами [4, 5] и были подтверждены с использованием более специфичных и чувствительных методов отбора проб, таких как метод защищенной кисти для образцов у госпитализированных пациентов. Этот метод продемонстрировал, что изменение гнойности мокроты, описанное пациентом, имело чувствительность 89.5% и специфичность 76,2% для наличия PPM во время эпизода обострения [16].
Наши результаты согласуются с предыдущими наблюдениями, демонстрируя связь между более темным цветом мокроты и более высокой частотой выделения PPM. Мы расширили общее количество наблюдений, включив очень большую выборку пациентов из многих центров в Европе и Северной Америке, включая не только людей с ХОБЛ, но и пациентов с необструктивным хроническим бронхитом. Результаты показывают, что желтый и особенно зеленый цвет мокроты является хорошим маркером наличия PPM по всему спектру хронических бронхиальных заболеваний, включая острый кашель [17], стабильную ХОБЛ [18] и бронхоэктазы [19].
Одним из ограничений настоящего исследования является то, что, в отличие от предыдущих исследований [3–5], не использовалась стандартизированная цветовая диаграмма. Однако согласованность результатов в этой большой международной выборке позволяет предположить, что цвет мокроты легко распознается врачами и даже пациентами. В исследовании Soler et al . [16], образцы мокроты исследователи не видели; их цвет описывался исключительно самими пациентами и обеспечивал хорошую диагностическую точность на наличие PPM.
Также собиралась информация о гнойной мокроте. Гнойность сильно зависит от цвета, но еще более субъективна. В проспективных исследованиях слизистая мокрота обычно описывается как бесцветная или белая, а гнойная мокрота — от бледно-желтой до темно-зеленой [20]. Мы обнаружили значительную и последовательную взаимосвязь между гнойностью и наличием PPM в мокроте, хотя она имела меньшую прогностическую ценность, чем цвет образца.
Вторым ограничением настоящего исследования является то, что в исследование были включены только пациенты с обострениями типа I и II, поскольку в эту популяцию входили кандидаты в испытание противомикробных препаратов в AECB.Нам удалось продемонстрировать взаимосвязь между цветом мокроты и наличием PPM, изучая только пациентов с высокой вероятностью бактериального обострения. Вероятно, что расширение исследования на пациентов с обострениями типа III, даже с той же тяжестью основного заболевания [21], покажет еще более сильную связь между цветом мокроты и бактериальной инфекцией. Это отражено в низкой специфичности, наблюдаемой в нашем исследовании (15%). Вероятно, это связано с очень низким количеством пациентов с белой мокротой в нашей выборке, потому что только в одно из испытаний были включены пациенты с обострением типа II ( i.е. пациентов, у которых потенциально могла быть белая мокрота). Наши результаты показывают большее сходство с результатами, полученными Дэниелсом и др. . [22], которые сообщили о чувствительности и специфичности 70% и 39% соответственно для сообщаемого цвета мокроты, но, в отличие от нашего исследования, до одной трети их пациентов имели слизистую мокроту. Важным следствием наших результатов является то, что белая мокрота является хорошим предиктором отрицательного посева мокроты и может помочь предотвратить использование антибиотиков у тех пациентов, которые вряд ли принесут пользу.
Это отражено в низкой специфичности, наблюдаемой в нашем исследовании (15%). Вероятно, это связано с очень низким количеством пациентов с белой мокротой в нашей выборке, потому что только в одно из испытаний были включены пациенты с обострением типа II ( i.е. пациентов, у которых потенциально могла быть белая мокрота). Наши результаты показывают большее сходство с результатами, полученными Дэниелсом и др. . [22], которые сообщили о чувствительности и специфичности 70% и 39% соответственно для сообщаемого цвета мокроты, но, в отличие от нашего исследования, до одной трети их пациентов имели слизистую мокроту. Важным следствием наших результатов является то, что белая мокрота является хорошим предиктором отрицательного посева мокроты и может помочь предотвратить использование антибиотиков у тех пациентов, которые вряд ли принесут пользу.
Результаты, полученные в выбранной нами популяции пациентов, удовлетворяющих критериям включения в клинические испытания, нельзя экстраполировать на более гетерогенную популяцию пациентов с хроническим бронхитом, получающих первичную медико-санитарную помощь. Однако наши результаты согласуются с результатами других исследований, проведенных у пациентов в обычной клинической практике, с различной степенью тяжести [3–5, 16, 18].
Информации о вирусной инфекции не собиралось. Вирусы могут быть изолированы до 45% обострений тяжелой ХОБЛ отдельно или вместе с бактериями [23].Вирусные обострения ХОБЛ чаще всего сопровождаются лихорадкой [24]. Наличие лихорадки неизменно ассоциировалось с более низкой вероятностью выделения бактерий у наших пациентов, что снова указывает на то, что обострения лихорадки с большей вероятностью связаны с вирусами. В другом исследовании лихорадочные обострения ХОБЛ не были достоверно связаны с гнойной мокротой по сравнению с обострениями без лихорадки [25].
Уровень CRP в плазме не позволяет прогнозировать наличие PPM в мокроте.Предыдущее исследование показало, что тестирование на СРБ при инфекциях нижних дыхательных путей в учреждениях первичной медико-санитарной помощи значительно сокращает количество назначений противомикробных препаратов без ущерба для выздоровления пациента [26].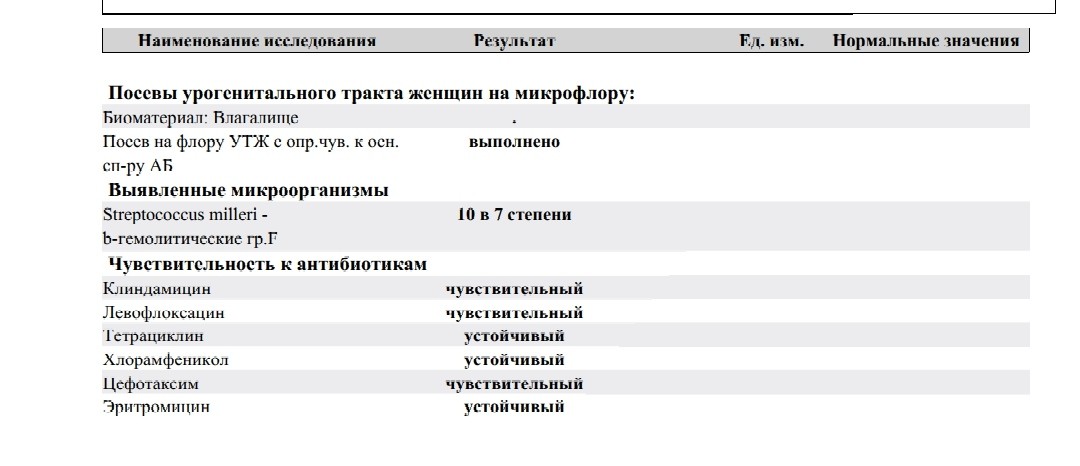 Однако пациенты имели легкое заболевание и средний возраст 50 лет, и только 7% имели диагноз ХОБЛ. У лиц с более тяжелым заболеванием Gompertz et al . [20] и Стокли и др. . [3] сообщили о значительно более высоких концентрациях CRP у пациентов с гнойными обострениями по сравнению с мукоидными обострениями; пациенты с положительным посевом мокроты в настоящем исследовании также имели более высокие (хотя и не значительно более высокие) концентрации CRP.Возможно, включение пациентов с обострениями III типа сделало бы эту разницу более очевидной. В многофакторном анализе СРБ не позволял предсказать присутствие PPM в мокроте; в систематическом обзоре тестирование на CRP неизменно не было ни достаточно чувствительным, чтобы исключить, ни достаточно специфичным, чтобы исключить инфильтрат на рентгенограмме грудной клетки и бактериальную этиологию инфекции нижних дыхательных путей [27]. В области биомаркеров измерение уровня прокальцитонина является многообещающим средством выявления пациентов с обострениями ХОБЛ, которым требуется лечение противомикробными препаратами [28].
Однако пациенты имели легкое заболевание и средний возраст 50 лет, и только 7% имели диагноз ХОБЛ. У лиц с более тяжелым заболеванием Gompertz et al . [20] и Стокли и др. . [3] сообщили о значительно более высоких концентрациях CRP у пациентов с гнойными обострениями по сравнению с мукоидными обострениями; пациенты с положительным посевом мокроты в настоящем исследовании также имели более высокие (хотя и не значительно более высокие) концентрации CRP.Возможно, включение пациентов с обострениями III типа сделало бы эту разницу более очевидной. В многофакторном анализе СРБ не позволял предсказать присутствие PPM в мокроте; в систематическом обзоре тестирование на CRP неизменно не было ни достаточно чувствительным, чтобы исключить, ни достаточно специфичным, чтобы исключить инфильтрат на рентгенограмме грудной клетки и бактериальную этиологию инфекции нижних дыхательных путей [27]. В области биомаркеров измерение уровня прокальцитонина является многообещающим средством выявления пациентов с обострениями ХОБЛ, которым требуется лечение противомикробными препаратами [28].
Четвертым ограничением нашего исследования было использование посева мокроты в качестве маркера бактериального участия в этиологии обострения. Хорошо известно, что отрицательный посев мокроты не исключает бактериальной инфекции [29]. Фактически, исследования с использованием инвазивных методов у более тяжелых госпитализированных пациентов, таких как метод защищенной щетки для образцов, продемонстрировали высокую распространенность бактерий у пациентов с окрашенной мокротой [16], что более надежно, чем процент положительных культур.Что еще более важно, эти исследования продемонстрировали высокую точность использования слизистой мокроты для исключения бактериальной инфекции [3, 16]. Очевидно, что использование инвазивных диагностических методов в рутинной клинической практике нецелесообразно, и отбор мокроты по-прежнему незаменим в диагностическом подходе к инфекциям нижних дыхательных путей в обществе. Однако следует отметить, что присутствие PPM в мокроте не подтверждает его роль в качестве причины обострения и не обязательно означает, что антибактериальная терапия будет полезна для разрешения обострения.
Однако следует отметить, что присутствие PPM в мокроте не подтверждает его роль в качестве причины обострения и не обязательно означает, что антибактериальная терапия будет полезна для разрешения обострения.
Заключение
Этот объединенный анализ результатов клинических испытаний AECB показал, что цвет мокроты является более сильным предиктором наличия PPM, чем другие факторы, включая гнойность мокроты и усиление одышки. Наибольшая связь между цветом мокроты и наличием бактерий была обнаружена с более темной (зеленой и желтой) мокротой. Изменение цвета мокроты в ходе обострения может быть использовано в планах самоконтроля [30, 31], что приведет к ранней антимикробной терапии, которая может сократить продолжительность обострения и улучшить результаты [32, 33].Кроме того, отказ от использования противомикробных препаратов для лечения обострений, когда мокрота имеет белый цвет, снизит количество случаев неправильного назначения антибиотиков в сообществе и поможет замедлить развитие резистентности бактерий [1].
Сноски
Заявление о поддержке
Это исследование финансировалось Bayer Schering Pharma. Коммуникационная консалтинговая компания Highfield, финансируемая Bayer Shering Pharma, оказала редакционную помощь в подготовке этой рукописи.
Заявление о заинтересованности
Заявление о заинтересованности всех авторов и самого исследования можно найти на сайте www.erj.ersjournals.com/site/misc/statements.xhtml
- Получено 8 марта, 2011.
- Принято 3 октября 2011 г.
Лаборатория клинической микробиологии в диагностике инфекций нижних дыхательных путей
ВВЕДЕНИЕ
Инфекции нижних дыхательных путей (ИДП) являются причиной от 5 до 10% всех случаев смерти, зарегистрированных в CDC через Систему отчетности о смертности в 122 городах (5). Клиническая лаборатория играет жизненно важную роль в диагностике этих инфекций, но сталкивается с многочисленными проблемами из-за сложности ИДПТ, включая качество и разнообразие образцов; заражение образцов ротоглоточной флорой; разнообразная популяция патогенов, которая включает бактерии, вирусы и грибки; и комплексная патофизиология инфекций дыхательных путей, особенно в особых группах населения. Обсуждались пять актуальных вопросов клинической микробиологии (КМ) ИДПТ:
Клиническая лаборатория играет жизненно важную роль в диагностике этих инфекций, но сталкивается с многочисленными проблемами из-за сложности ИДПТ, включая качество и разнообразие образцов; заражение образцов ротоглоточной флорой; разнообразная популяция патогенов, которая включает бактерии, вирусы и грибки; и комплексная патофизиология инфекций дыхательных путей, особенно в особых группах населения. Обсуждались пять актуальных вопросов клинической микробиологии (КМ) ИДПТ:
Каково реальное значение окрашивания по Граму откашливаемой мокроты?
Какова ценность методов количественного посева на образцах бронхоальвеолярного лаважа (БАЛ) и мини-БАЛ, эндотрахеальных (ЭТ) аспиратах и образцах трансбронхиальной биопсии?
Какова роль лаборатории клинической микробиологии в диагностике обострений хронического бронхита (AECB)?
Как оптимизировать микробиологическую оценку пациентов с муковисцидозом (МВ) с обострениями?
Какова оптимальная лабораторная оценка пациентов с возможным туберкулезом легких?
Присутствовали участники дискуссии как из промышленности, так и из клинической практики, а также из самых разных условий клинической практики.Удивительно, но было сравнительно немного областей разногласий или серьезных разногласий.
Окрашивание по Граму мокроты
Окрашивание мокроты по Граму, стандартная процедура в клинической микробиологии, используется для оценки качества образцов, получения предварительной и быстрой диагностической информации, а также для обеспечения лабораторного качества.
Несколько систем используются для оценки качества образцов с помощью окрашивания мокроты по Граму. Для проверки качества образцов был разработан ряд количественных критериев, все из которых основаны на предположении, что обилие клеток плоского эпителия указывает на поверхностное заражение ротоглотки (18).Образцы, составленные по окраске по Граму как состоящие преимущественно из материала верхних дыхательных путей, отклоняются для обычного бактериального посева.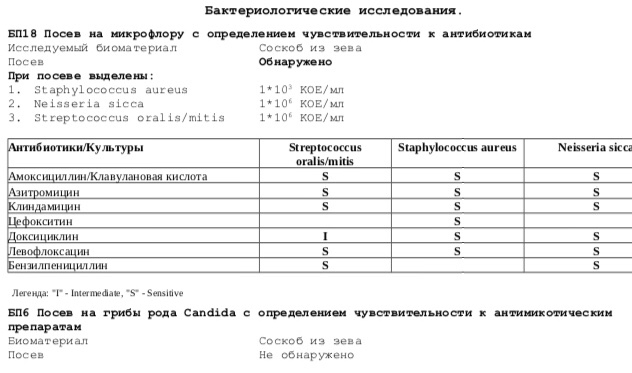 В этом случае окраска по Граму выполняет две функции: экономичность и предотвращение передачи ложной информации врачу, что может привести к ошибочному диагнозу, что приведет к неправильному или ненужному лечению. Предоставления вводящей в заблуждение клинической информации также можно избежать за счет отказа от мокроты для посева, загрязненной флорой верхних дыхательных путей, поскольку многие из потенциальных патогенов, вызывающих пневмонию, также могут колонизировать верхние дыхательные пути.
В этом случае окраска по Граму выполняет две функции: экономичность и предотвращение передачи ложной информации врачу, что может привести к ошибочному диагнозу, что приведет к неправильному или ненужному лечению. Предоставления вводящей в заблуждение клинической информации также можно избежать за счет отказа от мокроты для посева, загрязненной флорой верхних дыхательных путей, поскольку многие из потенциальных патогенов, вызывающих пневмонию, также могут колонизировать верхние дыхательные пути.
Значение окрашивания мокроты по Граму для предварительной диагностики респираторных заболеваний хорошо известно. Важно отметить, что критерии для интерпретации и регистрации микроорганизмов в окрашенных по Граму мазках секрета нижних дыхательных путей (LRT) различны. Кроме того, были даны рекомендации, чтобы результаты посева мокроты коррелировали с результатами прямого окрашивания по Граму (9, 11, 19), чтобы предоставить более клинически значимую информацию в свете ограничений посева.Наконец, окраска по Граму — полезный инструмент в обеспечении качества лабораторных исследований. Сравнение результатов окрашивания по Граму и результатов посева может выявить ошибки в процедуре, проблемы сбора и / или транспортировки образцов, а также ошибки идентификации и отслеживания образцов.
Обсуждение. Обсуждение было сосредоточено на том, чтобы сделать окрашивание мокроты по Граму еще более ценным клиническим инструментом, сообщая больше клинически полезной информации, чем в настоящее время сообщается в большинстве лабораторий; см. примеры в таблице 1. Поскольку такая управляемая отчетность сопряжена с определенным риском неправильного направления поставщиков, разработка рекомендаций, направленных на поддержку лабораторий в согласованных, основанных на фактических данных схемах отчетности, была бы полезной.
Таблица 1.
Отчет об интерпретации окрашивания мокроты по Граму
КОЛИЧЕСТВЕННЫЕ КУЛЬТУРЫ
Микробиологическая оценка легочных образцов, полученных во время бронхоскопических процедур, осложняется не только разнообразием пациентов, которые проходят такие процедуры, и разнообразием полученных образцов, но и наличие колонизирующей флоры, особенно у интубированных пациентов. Текущие процедуры количественного культивирования зависят от типа образца. Как правило, количество колоний <10 4 / мл предполагает заражение, количество от 10 4 до 10 5 / мл представляет результат серой зоны, а количество> 10 5 / мл основного изолята предполагает потенциальный возбудитель.Бронхиальные щетки помещают в 1 мл физиологического раствора, а затем проводят количественный посев, высевая 10 мкл материала. Количество> 10 3 КОЕ / мл коррелирует с заболеванием при подозрении на пневмонию (20).
Текущие процедуры количественного культивирования зависят от типа образца. Как правило, количество колоний <10 4 / мл предполагает заражение, количество от 10 4 до 10 5 / мл представляет результат серой зоны, а количество> 10 5 / мл основного изолята предполагает потенциальный возбудитель.Бронхиальные щетки помещают в 1 мл физиологического раствора, а затем проводят количественный посев, высевая 10 мкл материала. Количество> 10 3 КОЕ / мл коррелирует с заболеванием при подозрении на пневмонию (20).
Обсуждение. Хотя количественная культура стандартизирует лабораторную оценку этих ценных, сложных образцов, участники обсуждения подчеркнули значительные проблемы: (i) методы трудоемки, (ii) методы сбора, включая объем физиологического раствора, использованного в процедуре, не стандартизированы; и (iii) время транспортировки образца в лабораторию, особенно из пунктов направления и центров амбулаторных процедур, часто влияет на последующую нагрузку организма в образце.Примечательно, что исследования, на которых основаны наши текущие методы количественного культивирования, датируются примерно двумя десятилетиями давности и не отражают сегодняшние популяции пациентов, в частности, большое количество реципиентов солидных органов и трансплантатов костного мозга, которым проводится бронхоскопия. Группа рекомендовала, чтобы новые исследования, оценивающие эффективность и интерпретацию количественных культур бронхоскопических образцов, со стандартизацией как сбора, так и микробиологического анализа в конкретных группах пациентов, необходимы для документального подтверждения ценности этих трудоемких процедур.
КАКОВА РОЛЬ ЛАБОРАТОРИИ КЛИНИЧЕСКОЙ МИКРОБИОЛОГИИ В ДИАГНОСТИКЕ AECB?
Синдром хронического бронхита состоит из нарушения толерантности к физической нагрузке, одышки при нагрузке и хронического продуктивного кашля без определенной установленной этиологии. Пациенты обычно старше, много курят и могут иметь другие сопутствующие заболевания. Они подвержены риску тяжелой пневмонии, ишемической болезни сердца и других заболеваний, некоторые из симптомов которых в значительной степени совпадают с острым обострением хронического бронхита (AECB).
Они подвержены риску тяжелой пневмонии, ишемической болезни сердца и других заболеваний, некоторые из симптомов которых в значительной степени совпадают с острым обострением хронического бронхита (AECB).
AECB — это плохо изученное состояние. Клинически это выражается в резком усилении симптомов, выходящих за рамки обычных ежедневных колебаний, как правило, в одном или нескольких основных симптомах: (i) учащение частоты и / или тяжести кашля, (ii) увеличение объема и / или изменение характера выделения мокроты и (iii) усиление одышки.
Хотя от 70 до 80% случаев ОЭКБ связаны с инфекцией, неясно, вносит ли микробиологическая лабораторная диагностика значительный вклад в лечение синдрома.В лабораторию редко сообщают, что образец взят от пациента с ОКБ. Потенциальные бактериальные патогены, такие как Haemophilus influenzae, Streptococcus pneumoniae и Moraxella catarrhalis, которые могут способствовать обострениям, также изолированы от пациентов в период между обострениями. Хотя эти организмы, скорее всего, вносят вклад в основную патологию, их выделение из мокроты в условиях обострения не имеет большого значения или не имеет никакого значения. Точно так же такие организмы, как Staphylococcus aureus, хотя и нечасто выделяются, при обнаружении могут иметь мало общего с обострением (17).AECB тесно связан с приобретением новых штаммов некоторых из этих организмов, но типирование штаммов в настоящее время является дорогостоящим, медленным и ограниченным в наличии. Антибиотики улучшают исходы при ОКБ, особенно у самых тяжелых пациентов, но терапия носит эмпирический характер, а не определяется патогенами. Респираторные вирусы, включая риновирус, вирус гриппа, вирус парагриппа, коронавирус, аденовирус, респираторно-синцитиальный вирус и метапневмовирус человека, часто связаны с AECB; однако терапевтические возможности ограничены, за исключением умеренно эффективных методов лечения гриппа.Таким образом, ценность тестирования на вирусы также сомнительна. На первый взгляд кажется, что лаборатория играет небольшую роль в лечении хронической обструктивной болезни легких (ХОБЛ), а экономически эффективная практика предполагает ограничение микробиологического обследования.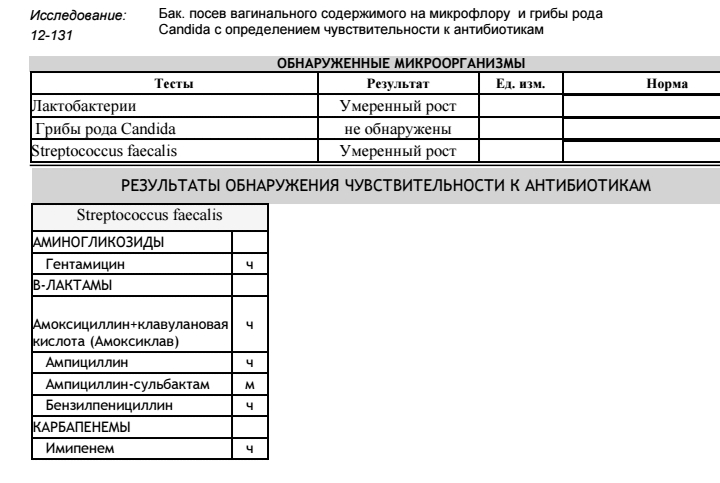 В рекомендациях Глобальной инициативы по хронической обструктивной болезни легких (GOLD) 2007 года и рекомендациях Американского колледжа врачей 2001 года говорится, что посев мокроты не следует проводить во время большинства обострений ХОБЛ.
В рекомендациях Глобальной инициативы по хронической обструктивной болезни легких (GOLD) 2007 года и рекомендациях Американского колледжа врачей 2001 года говорится, что посев мокроты не следует проводить во время большинства обострений ХОБЛ.
Обсуждение.Некоторые лабораторные тесты показывают ценность в AECB. Тестирование на респираторно-синцитиальный вирус имеет прогностическое значение, а для пациентов, поступивших в больницу, результаты вирусной диагностики имеют значение инфекционного контроля. Можно было ожидать, что выявление вирусной этиологии позволит отменить антибиотики, но, что критически важно, безопасность этого подхода еще не доказана клиническими испытаниями.
Препятствием к ограничению лабораторного использования является то, что диагноз AECB редко бывает простым.Другие болезни, в том числе пневмония, входят в дифференциальный диагноз. Из пациентов с ХОБЛ, умерших в течение 24 часов после поступления с обострением ХОБЛ, 28% умерли от пневмонии (21). Таким образом, несмотря на то, что микробиологические исследования имеют ограниченную ценность при лечении ОКБ, лаборатория может по-прежнему проверять мокроту у этих пациентов как часть комплексной оценки, которая включает другие диагнозы, по крайней мере, у самых тяжелых пациентов.
Не было ощущения, что посев мокроты чрезмерно используется в AECB, но микробиологи на сеансе признали, что такое использование могло не привлекать их внимания.
КАК МЫ ОПТИМИЗИРУЕМ МИКРОБИОЛОГИЧЕСКУЮ ОЦЕНКУ БОЛЬНЫХ МВ С ОБЯЗАТЕЛЬСТВАМИ?
Как и пациенты с ХОБЛ, пациенты с муковисцидозом (МВ) имеют основное заболевание легких, которое обычно приводит к постоянным симптомам и важным изменениям в физиологии легких и микробиоте (10). Точно так же изменения окружающей среды и микробов могут вызвать усиление симптомов у пациентов с МВ.
Относительно предсказуемая серия патогенов колонизирует дыхательные пути пациентов с МВ.Нетипируемые Haemophilus influenzae и Staphylococcus aureus обычно обнаруживаются в раннем возрасте, причем S.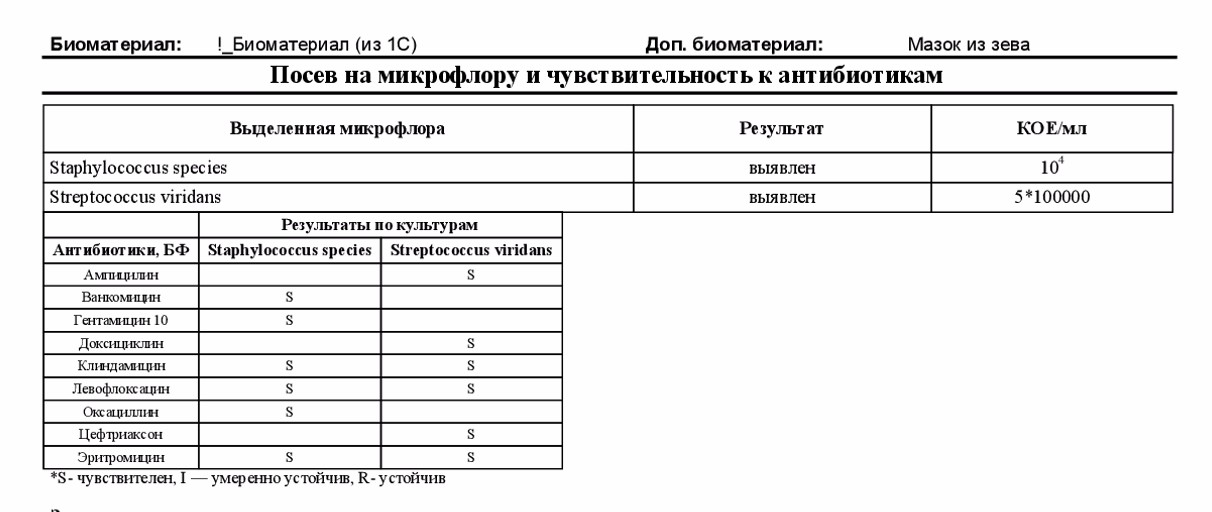 aureus является одним из наиболее распространенных бактериальных патогенов, выделяемых из дыхательных путей у людей с МВ (14). С другой стороны, распространенность инфекции, вызванной синегнойной палочкой, значительно варьируется в зависимости от возраста: от примерно 25% для детей в возрасте 5 лет и младше до 80% для взрослых в возрасте от 25 до 34 лет (6). Другие бактериальные оппортунисты включают Stenotrophomonas maltophilia, Achromobacter xylosoxidans, Burkholderia cepacia complex, виды Ralstonia, виды Cupriavidus, виды Pandoraea и нетуберкулезные микобактерии (NTM), особенно быстро растущие.Помимо бактерий, грибки, такие как виды Aspergillus, виды Scedosporium и Exophiala dermatidis, были вовлечены в качестве причин хронической колонизации или инфекции дыхательных путей (14). Доступен набор научно обоснованных руководств по использованию селективных сред и процедур (16). Надлежащее тестирование образцов CF требует материалов и трудозатрат, поскольку тестирование проводится как для симптоматических заболеваний, так и для эпиднадзора за конкретным организмом.
aureus является одним из наиболее распространенных бактериальных патогенов, выделяемых из дыхательных путей у людей с МВ (14). С другой стороны, распространенность инфекции, вызванной синегнойной палочкой, значительно варьируется в зависимости от возраста: от примерно 25% для детей в возрасте 5 лет и младше до 80% для взрослых в возрасте от 25 до 34 лет (6). Другие бактериальные оппортунисты включают Stenotrophomonas maltophilia, Achromobacter xylosoxidans, Burkholderia cepacia complex, виды Ralstonia, виды Cupriavidus, виды Pandoraea и нетуберкулезные микобактерии (NTM), особенно быстро растущие.Помимо бактерий, грибки, такие как виды Aspergillus, виды Scedosporium и Exophiala dermatidis, были вовлечены в качестве причин хронической колонизации или инфекции дыхательных путей (14). Доступен набор научно обоснованных руководств по использованию селективных сред и процедур (16). Надлежащее тестирование образцов CF требует материалов и трудозатрат, поскольку тестирование проводится как для симптоматических заболеваний, так и для эпиднадзора за конкретным организмом.
Роль микробиологической лаборатории в ведении пациентов с МВ осложняется хроническим характером заболевания и сложностью взаимодействий между хозяином и микробом:
Сложная бактериальная флора требует селективной среды и сложных протоколов для изоляции возможных патогенов.
Редко удается уничтожить колонизирующие патогены, такие как Pseudomonas и S. aureus , хотя протоколы ранней ликвидации P. aeruginosa у некоторых пациентов успешны. Целью терапии часто является клиническое улучшение, а не искоренение инфекции.
Ингаляционные методы лечения, которые позволяют достичь высоких местных концентраций антибиотиков, используются как для хронического подавления, так и для лечения обострений.
Фармакокинетика антибиотиков изменяется у пациентов с МВ.
Необычные или измененные штаммы обычных бактерий (например, мукоид P.
 aeruginosa [8]) и необычных патогенов (Burkholderia cepacia complex [13], быстрорастущие микобактерии) затрудняют идентификацию бактерий и рутинные тесты на чувствительность к антибиотикам. .
aeruginosa [8]) и необычных патогенов (Burkholderia cepacia complex [13], быстрорастущие микобактерии) затрудняют идентификацию бактерий и рутинные тесты на чувствительность к антибиотикам. .
Обсуждение. На эту тему было сравнительно мало дискуссий. Текущие руководства, хотя и являются сложными и трудоемкими, хорошо составлены, основаны на фактических данных и эффективны для текущего состояния наших возможностей в клинической микробиологии и лечении МВ, особенно если количество посевов для наблюдения может быть ограничено до 4 культур в год, как рекомендуют руководящие принципы. .CLSI в настоящее время разрабатывает рекомендации по тестированию чувствительности к антибиотикам организмов, выделенных от пациентов с МВ, которые должны прояснить некоторые вопросы или, по крайней мере, предоставить стандартные процедуры для дальнейшей оценки.
ЧТО ТАКОЕ ОПТИМАЛЬНАЯ ЛАБОРАТОРНАЯ ОЦЕНКА БОЛЬНЫХ ВОЗМОЖНЫМ ТУБЕРКУЛЕЗОМ ЛЕГКИХ?
Туберкулезная палочка была описана Кохом в 1882 году, но диагностика туберкулеза легких (ТБ) все еще является сложным, медленным, неопределенным и дорогостоящим процессом.Оптимальная лабораторная диагностика требует взятия нескольких образцов с интервалами для кислотостойкого окрашивания, возможно, молекулярных анализов для прямого обнаружения Mycobacterium tuberculosis, культивирования в быстром бульоне и на твердой среде, последующей идентификации с использованием фенотипических или молекулярных методов и, при необходимости, тестирования чувствительности к противомикробным препаратам. .
Каноническое «правило трех мокростей» для исключения туберкулеза легких подверглось критике как минимум с двух сторон. Более короткие сроки пребывания в больнице, высокая заполняемость больниц и контроль за расходами побуждают поставщиков как можно быстрее вывозить пациентов из изоляционных палат с соблюдением мер предосторожности.Все чаще доступные молекулярные методы диагностики обещают лучшую чувствительность, чем кислотно-быстрый мазок и микроскопия при быстром обнаружении M. tuberculosis, потенциально уменьшая количество требуемых образцов (2), но со значительной стоимостью и все еще недоказанным влиянием на общий диагностический результат и общественное здравоохранение (15). Последние рекомендации CDC (3) рекомендуют всем пациентам с подозрением на туберкулез легких сдать хотя бы один образец с помощью теста амплификации нуклеиновых кислот (NAAT).
tuberculosis, потенциально уменьшая количество требуемых образцов (2), но со значительной стоимостью и все еще недоказанным влиянием на общий диагностический результат и общественное здравоохранение (15). Последние рекомендации CDC (3) рекомендуют всем пациентам с подозрением на туберкулез легких сдать хотя бы один образец с помощью теста амплификации нуклеиновых кислот (NAAT).
Разработка тестов высвобождения гамма-интерферона (IGRA) предоставила новый инструмент для оценки статуса инфицирования больных туберкулезом (1, 3, 4).В отличие от известной туберкулиновой кожной пробы (TST), которая требует тщательной инъекции, повторного посещения и очень субъективной процедуры чтения, клиницистам необходимо выполнить только простую венепункцию для сбора образцов для IGRA. И наоборот, с лабораторной точки зрения, IGRA неудобны, требуя специальных материалов для сбора и / или ограниченной по времени и часто трудоемкой обработки образцов перед тестированием. IGRA обеспечивает некоторые преимущества в производительности по сравнению с TST, поскольку существует ограниченная перекрестная реактивность с нетуберкулезными микобактериями и отсутствует с штаммами вакцины Mycobacterium bovis BCG.Некоторые IGRA могут быть более чувствительными, чем TST, хотя отсутствие золотого стандарта для латентной инфекции ТБ затрудняет это определение (7). Относительная чувствительность IGRA и TST в популяциях с ослабленным иммунитетом и у детей младшего возраста все еще остается неясной (12). Кроме того, для отдельных пациентов результаты TST и двух доступных IGRA могут не совпадать, что еще больше усложняет интерпретацию этих тестов. Подобно NAAT для лечения туберкулеза легких, IGRA обеспечивают клиническое удобство и некоторое улучшение производительности при значительных затратах для лаборатории.
Обсуждение. Ни один из участников дискуссии в небольшой группе и немногие участники собрания не внедрили рутинное тестирование с помощью NAAT для всех пациентов с подозрением на ТБ, независимо от результата мазка на кислотоустойчивые бациллы (КУБ). Только один NAAT одобрен FDA для образцов с отрицательным мазком мокроты, поэтому доступ к соответствующему тестированию является проблемой, но основной проблемой были сомнения в эффективности вмешательства и стоимости для лабораторий. Были опубликованы многочисленные исследования способности анализов амплификации нуклеиновых кислот (NAA) непосредственно обнаруживать M.tuberculosis в клинических образцах. Однако сделать окончательные выводы относительно чувствительности, специфичности, прогностической ценности и клинической полезности анализов NAA на основании множества исследований — непростая задача. Очевидно, что наиболее значительным преимуществом анализов NAA является их быстрое обнаружение M. tuberculosis , что может иметь важные последствия для ведения пациентов и борьбы с туберкулезом. Однако оценить эффективность этих тестов на основе имеющейся литературы проблематично.Необходимы дополнительные клинические корреляционные исследования, чтобы стало очевидным лучшее понимание того, когда и как использовать NAAT в сочетании с доступной клинической информацией, чтобы эти анализы использовались экономически эффективным образом при оптимальном ведении пациентов. Рабочие характеристики большинства NAAT, выполняемых на образцах с отрицательным мазком, не определены, и можно ожидать, что при рутинном использовании они будут хуже, чем в тщательно контролируемых и ограниченных по продолжительности исследованиях, из-за накопления загрязнения и ошибок оператора.Затраты, скорее всего, будут нести лаборатории, если только поставщик услуг не сможет эффективно управлять электронными медицинскими картами или аналогичной системой; Убедить больницы нести эти расходы — непростая задача. Стоимость поиска одного пациента с недиагностированным туберкулезом в большинстве центров будет чрезвычайно высокой. Польза для общественного здравоохранения носит преимущественно теоретический характер и основывается на оценках доли пациентов с отрицательным мазком мокроты, которые будут распространять туберкулез.
Только один NAAT одобрен FDA для образцов с отрицательным мазком мокроты, поэтому доступ к соответствующему тестированию является проблемой, но основной проблемой были сомнения в эффективности вмешательства и стоимости для лабораторий. Были опубликованы многочисленные исследования способности анализов амплификации нуклеиновых кислот (NAA) непосредственно обнаруживать M.tuberculosis в клинических образцах. Однако сделать окончательные выводы относительно чувствительности, специфичности, прогностической ценности и клинической полезности анализов NAA на основании множества исследований — непростая задача. Очевидно, что наиболее значительным преимуществом анализов NAA является их быстрое обнаружение M. tuberculosis , что может иметь важные последствия для ведения пациентов и борьбы с туберкулезом. Однако оценить эффективность этих тестов на основе имеющейся литературы проблематично.Необходимы дополнительные клинические корреляционные исследования, чтобы стало очевидным лучшее понимание того, когда и как использовать NAAT в сочетании с доступной клинической информацией, чтобы эти анализы использовались экономически эффективным образом при оптимальном ведении пациентов. Рабочие характеристики большинства NAAT, выполняемых на образцах с отрицательным мазком, не определены, и можно ожидать, что при рутинном использовании они будут хуже, чем в тщательно контролируемых и ограниченных по продолжительности исследованиях, из-за накопления загрязнения и ошибок оператора.Затраты, скорее всего, будут нести лаборатории, если только поставщик услуг не сможет эффективно управлять электронными медицинскими картами или аналогичной системой; Убедить больницы нести эти расходы — непростая задача. Стоимость поиска одного пациента с недиагностированным туберкулезом в большинстве центров будет чрезвычайно высокой. Польза для общественного здравоохранения носит преимущественно теоретический характер и основывается на оценках доли пациентов с отрицательным мазком мокроты, которые будут распространять туберкулез. Лаборатория редко, если вообще когда-либо, информируется о диагнозе, поэтому неясно, как тестирование будет ограничиваться пациентами, прошедшими тестирование на туберкулез, в отличие от тех, у которых вероятным диагнозом является инфекция NTM.Это руководство будет встречать постоянное сопротивление со стороны лабораторного сообщества, если не будут предоставлены более убедительные данные, если не будут одобрены более рациональные и менее дорогие тесты, порядок заказа и использования можно будет контролировать, а также не будет предоставлена компенсация. Ни одно из этих условий в настоящее время не применяется.
Лаборатория редко, если вообще когда-либо, информируется о диагнозе, поэтому неясно, как тестирование будет ограничиваться пациентами, прошедшими тестирование на туберкулез, в отличие от тех, у которых вероятным диагнозом является инфекция NTM.Это руководство будет встречать постоянное сопротивление со стороны лабораторного сообщества, если не будут предоставлены более убедительные данные, если не будут одобрены более рациональные и менее дорогие тесты, порядок заказа и использования можно будет контролировать, а также не будет предоставлена компенсация. Ни одно из этих условий в настоящее время не применяется.
IGRA явно играют признанную роль в выявлении туберкулезной инфекции у TST-положительных лиц, иммунизированных БЦЖ. Однако необходимы дополнительные клинические данные об их эффективности, прежде чем можно будет сделать выводы относительно их полезности для детей и различных популяций с ослабленным иммунитетом.С лабораторной точки зрения, роль IGRA также потребует признания увеличения затрат на рабочую силу и реагенты для лаборатории, что сопоставимо с простотой использования для клиник и улучшенным соблюдением требований к скринингу и управлению экспозицией благодаря исключению последующих посещений. .
РЕЗЮМЕ ПОТРЕБНОСТЕЙ
В ходе этой сессии был определен ряд потребностей:
Основанные на фактах рекомендации по интерпретации результатов окрашивания мокроты по Граму позволят лабораториям предоставлять доступную, клинически значимую информацию для ведения пациентов с пневмонией.
Обновленные исследования полезности и эффективности количественных культур образцов из нижних дыхательных путей в текущих популяциях пациентов со стандартизованными методами отбора проб и анализа необходимы для документального подтверждения ценности (если таковые имеются) этих процедур.
Необходимы клинические испытания, чтобы определить, получают ли пациенты с ОКБ и у которых обнаружен вирусный агент эмпирическую антибактериальную терапию; Важность рутинной диагностики респираторных вирусных инфекций в этой популяции в настоящее время не подтверждена документально.

Стандартизованные протоколы тестирования чувствительности у пациентов с МВ, которые в настоящее время разрабатываются, позволят стандартизировать практику и поддержат дальнейшие исследования терапевтической микробиологии МВ.
Исследования результатов и рентабельности рутинного использования IGRA для здоровья сотрудников и скрининга на латентный туберкулез с учетом рисков предоставят доказательства для установления их надлежащего использования.
Результаты исследования воздействия на общественное здоровье рутинного тестирования, проводимого NAAT, у пациентов с туберкулезом с отрицательным результатом мазка AFB, необходимы для документального подтверждения ценности этого чрезвычайно дорогостоящего, нефинансированного вмешательства, если таковое имеется.
Дискуссанты: Мэтью Бинникер, Пол Бурбо, Карен Кэрролл, Кристиан Куган, Дэвид Т. Дюрак, Джордж Гёдески, Аманда Т. Харрингтон, Натан А. Ледебоер, Майкл Лёффельхольц, Линда М. Манн, Александр Дж. Макадам, Майкл А. Соболле, Шэрон Шинн и Б. Джейн Смит.
- Авторские права © 2011, Американское общество микробиологии. Все права защищены.
Микробиологические профили аспиратов мокроты и желудочного сока у пациентов с муковисцидозом
Gibson, R.Л., Бернс, Дж. Л. и Рэмси, Б. В. Патофизиология и лечение легочных инфекций при муковисцидозе. Am J Respir Crit Care Med 168, 918–951 (2003).
Артикул
Google ученый
Андерсен, Д. Х. Муковисцидоз поджелудочной железы и его связь с целиакией: клиническое и патологическое исследование. Am J Dis Child 56, 344–399 (1938).
Артикул
Google ученый
Дэвис, П.B. Муковисцидоз с 1938 года. Am J Respir Crit Care Med 173, 475–482 (2006).
Артикул
Google ученый
Гован, Дж. Р. и Деретич, В. Микробный патогенез при муковисцидозе: мукоид Pseudomonas aeruginosa и Burkholderia cepacia. Microbiol Rev 60, 539–574 (1996).
CAS
PubMed
PubMed Central
Google ученый
Блондо К. и др.Гастроэзофагеальный рефлюкс и аспирация желудочного содержимого у взрослых пациентов с муковисцидозом. Gut 57, 1049–1055 (2008).
CAS
Статья
Google ученый
Pauwels, A. et al. Опорожнение желудка и различные типы рефлюкса у взрослых пациентов с муковисцидозом. Aliment Pharmacol Ther 34, 799–807 (2011).
CAS
Статья
Google ученый
Наварро, Дж.и другие. Факторы, связанные с плохой легочной функцией: поперечный анализ данных ERCF. Eur Respir J 18, 298–305 (2001).
CAS
Статья
Google ученый
Шейх, С. И., Райан-Венгер, Н. А. и Маккой, К. С. Результаты хирургического лечения тяжелой ГЭРБ у пациентов с муковисцидозом. Pediatr Pulmonol 48, 556–562 (2013).
Артикул
Google ученый
DiMango, E.и другие. Влияние эзомепразола по сравнению с плацебо на легочные обострения при муковисцидозе. BMC Pulm Med 14, 21 (2014).
Влияние эзомепразола по сравнению с плацебо на легочные обострения при муковисцидозе. BMC Pulm Med 14, 21 (2014).
Артикул
Google ученый
Дю Мулен, Г., Хедли-Уайт, Дж., Патерсон, Д. и Лисбон, А. Аспирация желудочных бактерий у пациентов, принимающих антациды: частая причина послеоперационной колонизации дыхательных путей. Ланцет 319, 242–245 (1982).
Артикул
Google ученый
Мадан, Дж.C. et al. Серийный анализ кишечного и респираторного микробиома при муковисцидозе в младенчестве: взаимодействие между кишечником и дыхательными путями и влияние пищевых факторов. MBio 3, e00251–00212 (2012).
CAS
Статья
Google ученый
Сегал Р., Дэн М., Погорелюк И. и Лейбовиц А. Патогенная колонизация желудка у пожилых пациентов, получающих энтеральное питание: сравнение чрескожной эндоскопической гастростомии с назогастральным зондом.J Am Geriatr Soc 54, 1905–1908 (2006).
Артикул
Google ученый
Белафски П. К., Постма Г. Н. и Куфман Дж. А. Достоверность и надежность индекса симптомов рефлюкса (RSI). J Voice 16, 274–277 (2002).
Артикул
Google ученый
Blauwendraat, C., Dixon, G. L. J., Hartley, J. C., Foweraker, J. & Harris, K. A. Использование метода секвенирования с двумя генами для точного различения видов в комплексе Mycobacterium abscessus и Mycobacterium chelonae. Eur J Clin Microbiol Infect Dis 31, 1847–1853 (2012).
Eur J Clin Microbiol Infect Dis 31, 1847–1853 (2012).
CAS
Статья
Google ученый
Harris, K. A. et al. Молекулярный фингерпринт штаммов Mycobacterium abscessus в когорте педиатрических пациентов с муковисцидозом. J Clin Microbiol, JCM. 00155–00112 (2012).
Turton, J. F. et al. Оценка схемы тандемных повторов с девятью локусами с переменным числом переменных для типирования Pseudomonas aeruginosa. Clin Microbiol Infect 16, 1111–1116 (2010).
CAS
Статья
Google ученый
Козич, Дж. Дж., Весткотт, С. Л., Бакстер, Н. Т., Хайлендер, С. К. и Шлосс, П. Д. Разработка стратегии двухиндексного секвенирования и конвейера курирования для анализа данных последовательностей ампликонов на платформе секвенирования MiSeq Illumina. Appl Environ Microbiol 79, 5112–5120 (2013).
CAS
Статья
Google ученый
Schloss, P.Д., Геверс, Д. и Весткотт, С. Л. Снижение эффектов амплификации ПЦР и артефактов секвенирования на исследования на основе 16S рРНК. PLos One 6, e27310 (2011).
CAS
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Эрикссон, Л., Кеттане-Волд, Н., Трюгг, Дж., Викстрём, К. и Уолд, С. Анализ многомерных и мегавариантных данных: Часть I: основные принципы и приложения. PLS (Umetrics, Umea), стр. 63–101 (2006).
Диксон, Р.П., Мартинес, Ф. Дж. И Хаффнагл, Г. Б. Роль микробиома в обострениях хронических заболеваний легких. Ланцет 384, 691–702 (2014).
CAS
Статья
Google ученый
Чо И. и Блазер М. Дж. Микробиом человека: на стыке здоровья и болезни. Nature Reviews Genetics 13, 260–270 (2012).
CAS
Статья
Google ученый
Бик, Э.M. et al. Молекулярный анализ бактериальной микробиоты желудка человека. Proc Natl Acad Sci USA 103, 732–737 (2006).
CAS
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Jelsbak, L. et al. Молекулярная эпидемиология и динамика популяций синегнойной палочки в легких больных муковисцидозом. Infect Immun 75, 2214–2224 (2007).
CAS
Статья
Google ученый
Бернс, Дж.L. et al. Продольная оценка Pseudomonas aeruginosa у детей раннего возраста с муковисцидозом. J Infect Dis 183, 444–452 (2001).
CAS
Статья
Google ученый
Johansson, E., Welinder-Olsson, C., Gilljam, M., Pourcel, C. & Lindblad, A. Генотипирование Pseudomonas aeruginosa показывает высокое разнообразие, стабильность во времени и хорошие результаты искоренения. Journal of Cystic Fibrosis 14, 353–360 (2015).
CAS
Статья
Google ученый
Могайзель, П.J. Jr. et al. Основное руководство по лечению муковисцидоза легких. Фармакологические подходы к профилактике и искоренению исходной инфекции Pseudomonas aeruginosa. Анналы Американского торакального общества 11, 1640–1650 (2014).
Артикул
Google ученый
Brodzicki, J., Trawinska-Bartnicka, M. & Korzon, M. Частота, последствия и фармакологическое лечение гастроэзофагеального рефлюкса у детей с муковисцидозом.Мед. Научный монит 8, 537 (2002).
Google ученый
Хаксли, Э. Дж., Вирослав, Дж., Грей, У. Р. и Пирс, А. К. Глоточная аспирация у здоровых взрослых и пациентов с подавленным сознанием. Американский медицинский журнал 64, 564–568 (1978).
CAS
Статья
Google ученый
Глисон, К., Эггли, Д. Ф. и Максвелл, С. Л. Количественная аспирация во время сна у нормальных субъектов.CHEST Journal 111, 1266–1272 (1997).
CAS
Статья
Google ученый
Бассис, К. М. и др. Анализ микробиоты верхних дыхательных путей как источника микробиоты легких и желудка у здоровых людей. mBio 6, e00037–00015 (2015).
Артикул
Google ученый
Палм, К., Савицки, Г. и Розен, Р. Влияние бремени рефлюкса на положительную реакцию на псевдомонаду у детей с муковисцидозом.Pediatr Pulmonol 47, 582–587 (2012).
Артикул
Google ученый
Rosen, R. et al. Профилирование сообщества 16S выявляет различия, связанные с ингибиторами протонной помпы, в микрофлоре желудка, легких и орофарингеальной микрофлоры. Журнал педиатрии 166, 917–923 (2015).
CAS
Статья
Google ученый
Walter, S. et al. Эпидемиология хронических инфекций Pseudomonas aeruginosa в дыхательных путях реципиентов легкого с муковисцидозом.Thorax 52, 318–321 (1997).
CAS
Статья
Google ученый
Nunley, D. R. et al. Колонизация аллотрансплантата и инфекции pseudomonas у реципиентов трансплантата легких с кистозным фиброзом. CHEST Journal 113, 1235–1243 (1998).
CAS
Статья
Google ученый
Krishnan, A. et al. Идентичные биопленкообразующие штаммы Pseudomonas aeruginosa встречаются в БАЛ аллотрансплантата легких и желудочном соке пациентов с МВ с гастроэзофагеальным рефлюксом.Журнал трансплантации сердца и легких 32, S28 (2013).
Артикул
Google ученый
Griffin, S. M. et al. Аспирация и повреждение аллотрансплантата, вторичное по отношению к гастроэзофагеальному рефлюксу, происходит в ближайшем периоде после трансплантации легкого (проспективное клиническое испытание). Ann Surg 258, 705–712 (2013).
Артикул
Google ученый
Cantu III, E. et al.Ранняя фундопликация предотвращает хроническую дисфункцию аллотрансплантата у пациентов с гастроэзофагеальной рефлюксной болезнью. Анналы торакальной хирургии 78, 1142–1151 (2004).
Артикул
Google ученый
Andersson, A. F. et al. Сравнительный анализ микробиоты кишечника человека с помощью пиросеквенирования со штрих-кодом. ПЛос один 3, е2836 (2008 г.).
ADS
Статья
Google ученый
Чжао, Дж.и другие. Десятилетняя динамика бактериального сообщества при муковисцидозе дыхательных путей. Proceedings of the National Academy of Sciences 109, 5809–5814 (2012).
CAS
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Джонс, Р., Пирсон, Дж. И Уорд, К. Функциональная диспепсия. Медицинский журнал Новой Англии 374, 895 (2016).
Артикул
Google ученый
Литтлвуд, Дж.М., Вулф, С. П. и Конвей, С. П. Диагностика и лечение кишечной мальабсорбции при муковисцидозе. Pediatr Pulmonol 41, 35–49 (2006).
Артикул
Google ученый
Com, G., Cetin, N. & O’Brien, C.E. Осложненный колит Clostridium difficile у детей с муковисцидозом: связь с подавлением кислоты желудочного сока? Journal of Cystic Fibrosis 13, 37–42 (2014).
CAS
Статья
Google ученый
% PDF-1.4
%
1 0 obj
> поток
конечный поток
эндобдж
2 0 obj
> поток
х +
Обработка мокроты, от вязкой слизи до однородных образцов
Разжижение мокроты: от вязкой гетерогенной слизи до эквивалентных однородных образцов
Обработка мокроты имеет одну главную цель; довести вязкий неоднородный образец до однородного состояния (равномерно распределенная суспензия).Эта гомогенная суспензия будет разделена на несколько аликвот для криоконсервации, микроскопии мазка, окрашивания по Граму и посева. Каждая аликвота должна быть репрезентативной для исходного образца. Этого можно добиться за счет разжижения мокроты.
Мокрота — это густая слизь или мокрота, которая отхаркивается из нижних дыхательных путей (бронхов и легких) и важна для исследования респираторных заболеваний. Трудно обработать несколько эквивалентных образцов мокроты, поскольку это неоднородное и вязкое вещество, которое различается по внешнему виду (слизисто-гнойный, слизисто-гнойный и с прожилками крови).Следовательно, различные компоненты хозяина и организмы в мокроте распределяются неравномерно. Мокрота часто содержит сеть связанных молекул муцина, которые улавливают микроорганизмы (например, бактерии), заставляя их слипаться вместе, что приводит к неравномерному распределению. Это требует эффективного высвобождения патогенных бактерий из муциновой матрицы мокроты в процессе химического и / или механического разжижения.
Химическое разжижение использует муколитический агент для разрушения муциновой матрицы с целью снижения вязкости и высвобождения бактерий, которые могут быть захвачены сложной сеткой мокроты.Существует множество муколитических агентов, но наиболее широко используются дитиотреитол (DTT) и N-ацетил-L-цистеин (NAC). Это классические муколитические агенты, содержащие сульфгидрильную группу, которая расщепляет дисульфидные связи, связывающие молекулы муцина, что снижает вязкость. Исследования показали, что разжижение мокроты с помощью низких концентраций DTT более эффективно, чем NAC, с более чем 90% снижением эластичности мокроты и большим количеством организмов и размером колоний после посева (1, 3). Это может быть связано с тем, что DTT является дитиолом (имеющим 2 окислительно-восстановительных остатка цистеина), тогда как NAC является монотиолом (2).
Механическое разжижение — еще один метод переваривания мокроты, который часто используется в сочетании с химическим разжижением. Мокроту можно разжижить путем встряхивания с помощью стеклянных шариков, магнитной мешалки и пластины для перемешивания или путем обработки ультразвуком в присутствии или в отсутствие муколитического агента. Однако механическое разжижение менее эффективно без муколитического агента и обычно используется для химического разжижения. Например, мокрота при муковисцидозе не переваривалась эффективно с помощью DTT или NAC, но полная гомогенизация была достигнута, когда мокрота обрабатывалась DTT и обрабатывалась ультразвуком с перерывами в течение 120 секунд (30-секундные интервалы) (4).
Чтобы усложнить задачу, многие образцы заражены быстрорастущей комменсальной микробной флорой, которая обычно присутствует во рту, горле и т. Д. Важно дифференцировать нормальную флору и идентифицировать болезнетворные (патогенные) бактерии в культуре. Идентификация — это пошаговый процесс, который может включать в себя несколько биохимических, иммунологических и / или молекулярных тестов и наблюдения за характеристиками роста организма.
После приготовления гомогенной суспензии крайне важно, чтобы мокрота в небольших количествах помещалась в криопробирки (1.5-1,8 мл) и хранить при -70 ° C как можно скорее. Избегайте многократных циклов замораживания-оттаивания, которые могут повлиять либо на измеряемый аналит, либо на жизнеспособность патогенных бактерий.
Чувствительность анализа мокроты во многом зависит от эффективности протокола обработки мокроты для создания однородных репрезентативных образцов. G-Biosciences предлагает Sputo-LR ™, который представляет собой концентрированный стерильный раствор реагента Клеланда (DTT) в фосфатном буфере при pH 7,0. Sputo-LR ™ снабжен простым и эффективным протоколом обработки мокроты, который эффективен при разжижении сложных образцов мокроты.К образцу добавляется небольшое количество DTT, поэтому он не влияет на морфологию, рост или окрашивание патогенов в мокроте флуоресцентными антителами.
Список литературы
- Nielsen H, et al. Упругие вклады доминируют над вязкоупругими свойствами мокроты пациентов с муковисцидозом. Биофизическая химия 2004; 112: 193-200.
- Rancourt RC, et al. Тиоредоксин разжижает и снижает вязкоупругость мокроты при муковисцидозе. Американский журнал физиологии, клеточной и молекулярной физиологии легких, 2004 г .; 286: L931-L938.
- Сарасвати В.В. и др. Сравнительный анализ морфологии клеток в образцах мокроты, гомогенизированных дитиотреитолом, N-ацетил-1 цистеином, консервантом Cytorich® Red и препаратами клеточного блока для повышения чувствительности цитологии мокроты для диагностики рака легких. Диагностическая цитопатология 2015; 43: 551-558.
- Baxter CG, et al. Гомогенизация мокроты при муковисцидозе ультразвуком — важный этап ПЦР на Aspergillus. Журнал микробиологических методов 2011; 85: 75-81.
Бактерии при ХОБЛ; их потенциальная роль и лечение | Трансляционная респираторная медицина
Флетчер CM: Хронический бронхит. Распространенность, природа и патогенез. Am Rev Respir Dis 1959, 80: 483–494.
CAS
PubMed
Google ученый
Anthonisen NR: Возвращение к британской гипотезе. Eur Respir J 2004, 23 (5): 657–658.10.1183 / 0
36.04.00013004
CAS
PubMed
Google ученый
Fletcher C, Peto R: Естественное течение хронической обструкции дыхательных путей. Br Med J 1977, 1 (6077): 1645–1648. 10.1136 / bmj.1.6077.1645
CAS
PubMed Central
PubMed
Google ученый
Вестбо Дж., Прескотт Э., Ланге П: Связь хронической гиперсекреции слизи со снижением ОФВ1 и заболеваемостью хронической обструктивной болезнью легких.Копенгагенская городская группа изучения сердца. Am J Respir Crit Care Med 1996, 153 (5): 1530–1535. 10.1164 / ajrccm.153.5.8630597
CAS
PubMed
Google ученый
Kanner RE, Anthonisen NR, Connett JE: Заболевания нижних дыхательных путей способствуют снижению ОФВ (1) у нынешних курильщиков, но не у бывших курильщиков с легкой хронической обструктивной болезнью легких: результаты исследования здоровья легких. Am J Respir Crit Care Med 2001, 164 (3): 358–364.10.1164 / ajrccm.164.3.2010017
CAS
PubMed
Google ученый
Donaldson GC, Seemungal TA, Bhowmik A, Wedzicha JA: Взаимосвязь между частотой обострений и снижением функции легких при хронической обструктивной болезни легких. Thorax 2002, 57 (10): 847–852. 10.1136 / торакс.57.10.847
CAS
PubMed Central
PubMed
Google ученый
Wilkinson TM, Patel IS, Wilks M, Donaldson GC, Wedzicha JA: Бактериальная нагрузка в дыхательных путях и снижение ОФВ1 у пациентов с хронической обструктивной болезнью легких. Am J Respir Crit Care Med 2003, 167 (8): 1090–1095. 10.1164 / rccm.200210-1179OC
PubMed
Google ученый
Shapiro SD: Конечная стадия хронической обструктивной болезни легких: сигарета выгорела, но воспаление продолжается. Am J Respir Crit Care Med 2001, 164 (3): 339–340. 10.1164 / ajrccm.164.3.2105072c
CAS
PubMed
Google ученый
Hogg JC, Chu F, Utokaparch S, Woods R, Elliott WM, Buzatu L, Cherniack RM, Rogers RM, Sciurba FC, Coxson HO, et al .: Природа обструкции легких дыхательных путей при хронической обструктивной болезни легких. N Engl J Med 2004, 350 (26): 2645–2653.10.1056 / NEJMoa032158
CAS
PubMed
Google ученый
Hogg JC: Патофизиология ограничения воздушного потока при хронической обструктивной болезни легких. Lancet 2004, 364 (9435): 709–721. 10.1016 / S0140-6736 (04) 16900-6
PubMed
Google ученый
Vollenweider DJ, Jarrett H, Steurer-Stey CA, Garcia-Aymerich J, Puhan MA: Антибиотики при обострениях хронической обструктивной болезни легких. Кокрановская база данных Syst Rev 2012., 12: CD010257
Google ученый
Альберт Р.К., Коннетт Дж., Бейли В.К., Касабури Р., Купер Дж. А. младший, Крайнер Дж. Дж., Кертис Дж. Л., Дрансфилд М.Т., Хан М.К., Лазарус С.К., и др. .: Азитромицин для предотвращения обострений ХОБЛ. N Engl J Med 2011, 365 (8): 689–698. 10.1056 / NEJMoa1104623
CAS
PubMed Central
PubMed
Google ученый
Hooper LV, Littman DR, Macpherson AJ: Взаимодействие между микробиотой и иммунной системой. Наука 2012 г., 336 (6086): 1268–1273. 10.1126 / science.1223490
CAS
PubMed Central
PubMed
Google ученый
Мерфи К., Трэверс П., Уолпорт М.: Т-клеточный иммунитет. In Janeway’s Immunobiology . 7-е издание. Под редакцией: Мерфи К., Трэверс П., Уолпорт М.Нью-Йорк: наука о гирляндах; 2008: 323–372.
Google ученый
Morris A, Beck JM, Schloss PD, Campbell TB, Crothers K, Curtis JL, Flores SC, Fontenot AP, Ghedin E, Huang L, et al .: Сравнение респираторного микробиома у здоровых некурящие и курильщики. Am J Respir Crit Care Med 2013, 187 (10): 1067–1075. 10.1164 / rccm.201210-1913OC
PubMed Central
PubMed
Google ученый
Beck JM, Young VB, Huffnagle GB: Микробиом легких. Transl Res 2012, 160 (4): 258–266. 10.1016 / j.trsl.2012.02.005
CAS
PubMed Central
PubMed
Google ученый
Angrill J, Agusti C, De-Celis R, Rano A, Gonzalez J, Sole T, Xaubet A, Rodriguez-Roisin R, Torres A: Бактериальная колонизация у пациентов с бронхоэктазами: микробиологическая картина и факторы риска . Грудь 2002, 57 (1): 15–19. 10.1136 / thorax.57.1.15
CAS
PubMed Central
PubMed
Google ученый
Pelton SI: Регулирование распространения бактерий в носоглотке. Paediatr Respir Rev 2012, 13 (3): 150–153. 10.1016 / j.prrv.2012.04.001
PubMed Central
PubMed
Google ученый
Hurst JR: Верхние дыхательные пути. 3: поражение придаточных пазух носа при хронической обструктивной болезни легких. Thorax 2010, 65 (1): 85–90. 10.1136 / thx.2008.112888
CAS
PubMed
Google ученый
Abreu NA, Nagalingam NA, Song Y, Roediger FC, Pletcher SD, Goldberg AN, Lynch SV: Истощение разнообразия микробиома синуса и обогащение Corynebacterium tuberculostearicum опосредуют риносинусит. Sci Transl Med 2012, 4 (151): 151ra124. 10.1126 / scitranslmed.3003783
PubMed
Google ученый
Hilty M, Burke C, Pedro H, Cardenas P, Bush A, Bossley C, Davies J, Ervine A, Poulter L, Pachter L, и др. .: Нарушенные микробные сообщества в астматических дыхательных путях. PLoS One 2010, 5 (1): e8578. 10.1371 / journal.pone.0008578
PubMed Central
PubMed
Google ученый
Чарлсон Э.С., Чен Дж., Кастерс-Аллен Р., Биттингер К., Ли Х., Синха Р., Хванг Дж., Бушман Ф. Д., Коллман Р.Г.: Нарушенные микробные сообщества в верхних дыхательных путях курильщиков сигарет. PLoS One 2010, 5 (12): e15216. 10.1371 / journal.pone.0015216
CAS
PubMed Central
PubMed
Google ученый
Эрб-Даунворд Дж. Р., Томпсон Д. Л., Хан М. К., Фриман К. М., Макклоски Л., Шмидт Л. А., Янг В. Б., Тойс ГБ, Кертис Дж. Л., Сундарам Б., и др. .: Анализ микробиома легких у «здорового» курильщика и при ХОБЛ. PLoS One 2011, 6 (2): e16384. 10.1371 / journal.pone.0016384
CAS
PubMed Central
PubMed
Google ученый
Sze MA, Dimitriu PA, Hayashi S, Elliott WM, McDonough JE, Gosselink JV, Cooper J, Sin DD, Mohn WW, Hogg JC: Микробиом легочной ткани при хронической обструктивной болезни легких. Am J Respir Crit Care Med 2012, 185 (10): 1073–1080.10.1164 / rccm.201111-2075OC
PubMed Central
PubMed
Google ученый
Прагман А.А., Ким Х.Б., Рейли С.С., Вендт С., Исааксон RE: Микробиом легких при умеренной и тяжелой хронической обструктивной болезни легких. PLoS One 2012, 7 (10): e47305. 10.1371 / journal.pone.0047305
CAS
PubMed Central
PubMed
Google ученый
Moller LV, Timens W, van der-Bij W, Kooi K, de-Wever B, Dankert J, van-Alphen L: Haemophilus influenzae в эксплантатах легких пациентов с терминальной стадией легочной болезни. Am J Respir Crit Care Med 1998, 157 (3 Pt 1): 950–956.
CAS
PubMed
Google ученый
Дроманн Д., Рупп Дж., Рохманн К., Осбар С., Ульмер А.Дж., Марвиц С., Рошманн К., Абдулла М., Шульц Х., Фоллмер Э., и др. .: TGF-бета-псевдорецептор BAMBI сильно экспрессируется в легких с ХОБЛ и регулируется нетипируемым Haemophilus influenzae. Respir Res 2010, 11: 67. 10.1186 / 1465-9921-11-67
PubMed Central
PubMed
Google ученый
King P: Haemophilus influenzae и легкое (Haemophilus и легкое). Clin Transl Med 2012, 1 (1): 10. 10.1186 / 2001-1326-1-10
PubMed Central
PubMed
Google ученый
Cosio MG, Saetta M, Agusti A: Иммунологические аспекты хронической обструктивной болезни легких. N Engl J Med 2009, 360 (23): 2445–2454. 10.1056 / NEJMra0804752
CAS
PubMed
Google ученый
Stampfli MR, Anderson GP: Как сигаретный дым искажает иммунные реакции, способствуя инфекции, заболеваниям легких и раку. Nat Rev Immunol 2009, 9 (5): 377–384.10.1038 / nri2530
PubMed
Google ученый
Herr C, Shaykhiev R, Bals R: Роль кателицидина и дефенсинов в воспалительных заболеваниях легких. Expert Opin Biol Ther 2007, 7 (9): 1449–1461. 10.1517 / 14712598.7.9.1449
CAS
PubMed
Google ученый
Маллиа П., Футит Дж., Сотеро Р., Джепсон А., Контоли М., Трухильо-Торральбо М.Б., Кебадзе Т., Анищенко Дж., Олешкевич Г., Грей К., и др. .: Риновирусная инфекция вызывает деградацию антимикробных пептидов и вторичную бактериальную инфекцию при хронической обструктивной болезни легких. Am J Respir Crit Care Med 2012, 186 (11): 1117–1124. 10.1164 / rccm.201205-0806OC
CAS
PubMed Central
PubMed
Google ученый
Sethi S: Инфекционная этиология обострений хронического бронхита. Сундук 2000, 117 (5 доп 2): 380S-385S.
CAS
PubMed
Google ученый
Beasley V, Joshi PV, Singanayagam A, Molyneaux PL, Johnston SL, Mallia P: Микробиология легких и обострения при ХОБЛ. Int J Chron Obstruct Pulmon Dis 2012, 7: 555–569.
PubMed Central
PubMed
Google ученый
Сетхи С., Эванс Н., Грант Б.Дж., Мерфи TF: Новые штаммы бактерий и обострения хронической обструктивной болезни легких. N Engl J Med 2002, 347 (7): 465–471. 10.1056 / NEJMoa012561
PubMed
Google ученый
Sethi S, Sethi R, Eschberger K, Lobbins P, Cai X, Grant BJ, Murphy TF: Концентрации бактерий в дыхательных путях и обострения хронической обструктивной болезни легких. Am J Respir Crit Care Med 2007, 176 (4): 356–361. 10.1164 / rccm.200703-417OC
PubMed
Google ученый
Papi A, Bellettato CM, Braccioni F, Romagnoli M, Casolari P, Caramori G, Fabbri LM, Johnston SL: Инфекции и воспаление дыхательных путей при тяжелых обострениях хронической обструктивной болезни легких. Am J Respir Crit Care Med 2006, 173 (10): 1114–1121. 10.1164 / rccm.200506-859OC
PubMed
Google ученый
Марин А., Монсо Е., Гарсия-Нуньес М., Сауледа Дж., Ногера А., Понс Дж., Агусти А., Морера Дж.: Вариабельность и эффекты колонизации бронхов у пациентов с умеренной ХОБЛ. Eur Respir J 2010, 35 (2): 295–302. 10.1183 / 0
36.00126808
CAS
PubMed
Google ученый
Miravitlles M, Marin A, Monso E, Vila S, de la-Roza C, Hervas R, Esquinas C, Garcia M, Millares L, Morera J, et al .: Цвет мокроты маркер бактериальной колонизации при хронической обструктивной болезни легких. Respir Res 2010, 11: 58.10.1186 / 1465-9921-11-58
PubMed Central
PubMed
Google ученый
Patel IS, Seemungal TA, Wilks M, Lloyd-Owen SJ, Donaldson GC, Wedzicha JA: Взаимосвязь между бактериальной колонизацией и частотой, характером и серьезностью обострений ХОБЛ. Thorax 2002, 57 (9): 759–764. 10.1136 / thorax.57.9.759
CAS
PubMed Central
PubMed
Google ученый
Banerjee D, Khair OA, Honeybourne D: Влияние бактерий мокроты на воспаление дыхательных путей и состояние здоровья при клинически стабильной ХОБЛ. Eur Respir J 2004, 23 (5): 685–691. 10.1183 / 0
36.04.00056804
CAS
PubMed
Google ученый
Sethi S, Maloney J, Grove L, Wrona C, Berenson CS: Воспаление дыхательных путей и бактериальная колонизация бронхов при хронической обструктивной болезни легких. Am J Respir Crit Care Med 2006, 173 (9): 991–998. 10.1164 / rccm.200509-1525OC
PubMed Central
PubMed
Google ученый
Soler N, Ewig S, Torres A, Filella X, Gonzalez J, Zaubet A: Воспаление дыхательных путей и микробный состав бронхов у пациентов со стабильной хронической обструктивной болезнью легких. Eur Respir J 1999, 14 (5): 1015–1022. 10.1183 / 0
36.99.14510159
CAS
PubMed
Google ученый
Weinreich UM, Korsgaard J: Бактериальная колонизация нижних дыхательных путей при здоровых и хронических заболеваниях легких. Clin Respir J 2008, 2 (2): 116–122. 10.1111 / j.1752-699X.2008.00048.x
CAS
PubMed
Google ученый
Wedzicha JA: Роль вирусов в обострениях хронической обструктивной болезни легких. Proc Am Thorac Soc 2004, 1 (2): 115–120. 10.1513 / патс.2306030
PubMed
Google ученый
Wilkinson TM, Hurst JR, Perera WR, Wilks M, Donaldson GC, Wedzicha JA: Эффект взаимодействия между бактериальной и риновирусной инфекцией нижних дыхательных путей при обострениях ХОБЛ. Сундук 2006, 129 (2): 317–324. 10.1378 / сундук.129.2.317
PubMed
Google ученый
Matkovic Z, Miravitlles M: Хроническая бронхиальная инфекция при ХОБЛ. Есть ли инфекционный фенотип? Respir Med 2013, 107 (1): 10–22. 10.1016 / j.rmed.2012.10.024
PubMed
Google ученый
Kim V, Criner GJ: Хронический бронхит и хроническая обструктивная болезнь легких. Am J Respir Crit Care Med 2013, 187 (3): 228–237. 10.1164 / rccm.201210-1843CI
CAS
PubMed
Google ученый
Barnes PJ: Хроническая обструктивная болезнь легких. N Engl J Med 2000, 343 (4): 269–280. 10.1056 / NEJM200007273430407
CAS
PubMed
Google ученый
Hurst JR, Perera WR, Wilkinson TM, Donaldson GC, Wedzicha JA: Системное воспаление верхних и нижних дыхательных путей при обострении хронической обструктивной болезни легких. Am J Respir Crit Care Med 2006, 173 (1): 71–78.10.1164 / rccm.200505-704OC
CAS
PubMed
Google ученый
Pant S, Walters EH, Griffiths A, Wood-Baker R, Johns DP, Reid DW: Воспаление дыхательных путей и антипротеазная защита быстро улучшаются во время лечения обострения ХОБЛ. Respirology 2009, 14 (4): 495–503. 10.1111 / j.1440-1843.2009.01517.x
PubMed
Google ученый
Aaron SD, Angel JB, Lunau M, Wright K, Fex C, Le-Saux N, Dales RE: Гранулоцитарные маркеры воспаления и инфекции дыхательных путей во время обострения хронической обструктивной болезни легких. Am J Respir Crit Care Med 2001, 163 (2): 349–355. 10.1164 / ajrccm.163.2.2003122
CAS
PubMed
Google ученый
Фудзимото К., Ясуо М., Урушибата К., Ханаока М., Коидзуми Т., Кубо К.: Воспаление дыхательных путей во время стабильной и остро обостренной хронической обструктивной болезни легких. Eur Respir J 2005, 25 (4): 640–646. 10.1183 / 0
36.05.00047504
CAS
PubMed
Google ученый
Perera WR, Hurst JR, Wilkinson TM, Sapsford RJ, Mullerova H, Donaldson GC, Wedzicha JA: Воспалительные изменения, восстановление и рецидивы при обострении ХОБЛ. Eur Respir J 2007, 29 (3): 527–534. 10.1183 / 0
36.00092506
CAS
PubMed
Google ученый
Gompertz S, O’Brien C, Bayley DL, Hill SL, Stockley RA: Изменения бронхиального воспаления во время острых обострений хронического бронхита. Eur Respir J 2001, 17 (6): 1112–1119. 10.1183 / 0
36.01.901
CAS
PubMed
Google ученый
Цумакиду М., Цанакис Н., Хризофакис Г., Сиафакас Н.М.: Нитрозативный стресс, экспрессия гемоксигеназы-1 и воспаление дыхательных путей во время тяжелых обострений ХОБЛ. Сундук 2005, 127 (6): 1911–1918. 10.1378 / сундук.127.6.1911
CAS
PubMed
Google ученый
Bathoorn E, Liesker JJ, Postma DS, Boorsma M, Bondesson E, Koeter GH, Kauffman HF, van-Oosterhout AJ, Kerstjens HA: Противовоспалительные эффекты комбинированного будесонида / формотерола при обострениях ХОБЛ. Copd 2008, 5 (5): 282–290. 10.1080 / 15412550802363360
PubMed
Google ученый
Sethi S, Muscarella K, Evans N, Klingman KL, Grant BJ, Murphy TF: Воспаление дыхательных путей и этиология обострений хронического бронхита. Сундук 2000, 118 (6): 1557–1565. 10.1378 / сундук.118.6.1557
CAS
PubMed
Google ученый
White AJ, Gompertz S, Bayley DL, Hill SL, O’Brien C, Unsal I, Stockley RA: Разрешение бронхиального воспаления связано с уничтожением бактерий после лечения обострений хронического бронхита. Thorax 2003, 58 (8): 680–685. 10.1136 / торакс.58.8.680
CAS
PubMed Central
PubMed
Google ученый
Hill AT, Campbell EJ, Hill SL, Bayley DL, Stockley RA: Связь между бактериальной нагрузкой в дыхательных путях и маркерами воспаления дыхательных путей у пациентов со стабильным хроническим бронхитом. Am J Med 2000, 109 (4): 288–295. 10.1016 / S0002-9343 (00) 00507-6
CAS
PubMed
Google ученый
Bresser P, Out TA, van-Alphen L, Jansen HM, Lutter R: Воспаление дыхательных путей при необструктивном и обструктивном хроническом бронхите с хронической инфекцией дыхательных путей haemophilus influenzae. Сравнение с неинфицированными пациентами с хронической обструктивной болезнью легких. Am J Respir Crit Care Med 2000, 162 (3 Pt 1): 947–952.
CAS
PubMed
Google ученый
Марин А., Гарсия-Эймерих Дж., Сауледа Дж., Белда Дж., Милларес Л., Гарсия-Нуньес М., Серра I, Бенет М., Агусти А., Анто Дж. М., и др. .: Влияние колонизации бронхов на дыхательные пути и системное воспаление при стабильной ХОБЛ. Copd 2012, 9 (2): 121–130. 10.3109 / 15412555.2011.636407
PubMed
Google ученый
Garcha DS, Thurston SJ, Patel AR, Mackay AJ, Goldring JJ, Donaldson GC, McHugh TD, Wedzicha JA: Изменения распространенности и нагрузки бактериями дыхательных путей с использованием количественной ПЦР при стабильной и обострившейся ХОБЛ. Thorax 2012, 67 (12): 1075–1080.10.1136 / thoraxjnl-2012-201924
PubMed
Google ученый
King PT, Lim S, Pick A, Ngui J, Prodanovic Z, Downey W, Choong C, Kelman A, Baranyai E, Francis M, et al .: Т-клеточные ответы легких на нетипируемые Haemophilus influenzae у пациентов с хронической обструктивной болезнью легких. J Allergy Clin Immunol 2013, 131 (5): 1314–1321. e1314 10.1016 / j.jaci.2012.09.030
PubMed
Google ученый
Mackay AJ, Hurst JR: Обострения ХОБЛ: причины, профилактика и лечение. Immunol Allergy Clin North Am 2013, 33 (1): 95–115. 10.1016 / j.iac.2012.10.006
PubMed
Google ученый
Stockley RA, Bayley D, Hill SL, Hill AT, Crooks S, Campbell EJ: Оценка нейтрофилов дыхательных путей по цвету мокроты: корреляция с воспалением дыхательных путей. Thorax 2001, 56 (5): 366–372.10.1136 / thorax.56.5.366
CAS
PubMed Central
PubMed
Google ученый
Stockley RA, O’Brien C, Pye A, Hill SL: Взаимосвязь цвета мокроты с природой и амбулаторное ведение острых обострений ХОБЛ. Сундук 2000, 117 (6): 1638–1645. 10.1378 / сундук.117.6.1638
CAS
PubMed
Google ученый
Nagendra S, Bourbeau P, Brecher S, Dunne M, LaRocco M, Doern G: Вариабельность выборки при микробиологической оценке откашливаемой мокроты и эндотрахеального аспирата. J Clin Microbiol 2001, 39 (6): 2344–2347. 10.1128 / JCM.39.6.2344-2347.2001
КАС
PubMed Central
PubMed
Google ученый
Cooper GM, Jones JJ, Arbique JC, Flowerdew GJ, Forward KR: Внутри- и межтехнологическая изменчивость при оценке качества образцов из дыхательных путей. Диагностика Microbiol Infect Dis 2000, 37 (4): 231–235. 10.1016 / S0732-8893 (00) 00156-5
CAS
PubMed
Google ученый
Geckler RW, Gremillion DH, McAllister CK, Ellenbogen C: Микроскопическое и бактериологическое сравнение парных мокроты и транстрахеальных аспиратов. J Clin Microbiol 1977, 6 (4): 396–399.
CAS
PubMed Central
PubMed
Google ученый
Gleckman R, DeVita J, Hibert D, Pelletier C, Martin R: Оценка окраски мокроты по грамму при внебольничной бактериемической пневмонии. J Clin Microbiol 1988, 26 (5): 846–849.
CAS
PubMed Central
PubMed
Google ученый
Мердок DR: Тесты амплификации нуклеиновой кислоты для диагностики пневмонии. Clin Infect Dis 2003, 36 (9): 1162–1170.10.1086 / 374559
CAS
PubMed
Google ученый
Loens K, Ursi D, Goossens H, Ieven M: Молекулярная диагностика инфекций дыхательных путей Mycoplasma pneumoniae. J Clin Microbiol 2003, 41 (11): 4915–4923. 10.1128 / JCM.41.11.4915-4923.2003
КАС
PubMed Central
PubMed
Google ученый
Wimberley N, Faling LJ, Bartlett JG: Метод волоконно-оптической бронхоскопии для получения незагрязненных секретов нижних дыхательных путей для бактериальной культуры. Am Rev Respir Dis 1979, 119 (3): 337–343.
CAS
PubMed
Google ученый
Thorpe JE, Baughman RP, Frame PT, Wesseler TA, Staneck JL: Бронхоальвеолярный лаваж для диагностики острой бактериальной пневмонии. J Infect Dis 1987, 155 (5): 855–861. 10.1093 / infdis / 155.5.855
CAS
PubMed
Google ученый
Rasmussen TR, Korsgaard J, Moller JK, Sommer T., Kilian M: Количественная культура жидкости бронхоальвеолярного лаважа при внебольничных инфекциях нижних дыхательных путей. Respir Med 2001, 95 (11): 885–890. 10.1053 / средн.2001.1160
CAS
PubMed
Google ученый
Moller LV, Regelink AG, Grasselier H, Dankert-Roelse JE, Dankert J, van-Alphen L: Множественные штаммы Haemophilus influenzae и варианты штаммов сосуществуют в дыхательных путях пациентов с муковисцидозом. J Infect Dis 1995, 172 (5): 1388–1392. 10.1093 / infdis / 172.5.1388
CAS
PubMed
Google ученый
Wilson RW: Взаимодействие бактерий и хозяев и хронический бронхит. в респираторных инфекциях . Под редакцией: Торрес А., Эвиг С., Манделл А., Вудхед М. Лондон: Ходдер Арнольд; 2006: 89–102.
Google ученый
Saint S, Bent S, Vittinghoff E, Grady D: Антибиотики при обострениях хронической обструктивной болезни легких. Мета-анализ. Джама 1995, 273 (12): 957–960.
CAS
PubMed
Google ученый
Miravitlles M, Torres A: Пожалуйста, больше никаких исследований эквивалентности антибиотиков при обострениях ХОБЛ. Сундук 2004, 125 (3): 811–813. 10.1378 / сундук.125.3.811
PubMed
Google ученый
Энтонисен Н.Р., Манфреда Дж., Уоррен С.П., Хершфилд Е.С., Хардинг Г.К., Нельсон Н.А.: Антибактериальная терапия при обострениях хронической обструктивной болезни легких. Ann Intern Med 1987, 106 (2): 196–204. 10.7326 / 0003-4819-106-2-196
CAS
PubMed
Google ученый
Llor C, Moragas A, Hernandez S, Bayona C, Miravitlles M: Эффективность антибактериальной терапии при острых обострениях хронической обструктивной болезни легких от легкой до умеренной. Am J Respir Crit Care Med 2012, 186 (8): 716–723. 10.1164 / rccm.201206-0996OC
CAS
PubMed
Google ученый
Soler N, Esperatti M, Ewig S, Huerta A, Agusti C, Torres A: Использование антибиотиков на основе гнойной мокроты у госпитализированных пациентов с обострениями ХОБЛ. Eur Respir J 2012, 40 (6): 1344–1353. 10.1183 / 0
36.00150211
CAS
PubMed
Google ученый
Christ-Crain M, Jaccard-Stolz D, Bingisser R, Gencay MM, Huber PR, Tamm M, Muller B: Влияние лечения под контролем прокальцитонина на использование антибиотиков и исход при инфекциях нижних дыхательных путей: кластерно-рандомизированные, единичные слепое вмешательство. Lancet 2004, 363 (9409): 600–607. 10.1016 / S0140-6736 (04) 15591-8
CAS
PubMed
Google ученый
Stolz D, Christ-Crain M, Bingisser R, Leuppi J, Miedinger D, Muller C, Huber P, Muller B, Tamm M: Лечение антибиотиками обострений ХОБЛ: рандомизированное контролируемое исследование по сравнению прокальцитонина -сопровождение стандартной терапией. Сундук 2007, 131 (1): 9–19. 10.1378 / сундук.06-1500
CAS
PubMed
Google ученый
MacNee W: Системные воспалительные биомаркеры и сопутствующие заболевания хронической обструктивной болезни легких. Ann Med 2013, 45 (3): 291–300. 10.3109 / 07853890.2012.732703
CAS
PubMed
Google ученый
Стайкова Т., Блэк П.Н., Чако Е.Е., Пул П: Профилактическая антибактериальная терапия хронического бронхита. Кокрановская база данных Syst Rev 2003., 1: CD004105
Google ученый
Seemungal TA, Wilkinson TM, Hurst JR, Perera WR, Sapsford RJ, Wedzicha JA: Длительная терапия эритромицином связана с уменьшением обострений хронической обструктивной болезни легких. Am J Respir Crit Care Med 2008, 178 (11): 1139–1147.10.1164 / rccm.200801-145OC
CAS
PubMed
Google ученый
Yamaya M, Azuma A, Tanaka H, Takizawa H, Chida K, Taguchi Y, Mikasa K, Kadota J, Kudoh S: Подавляющее действие макролидных антибиотиков при обострениях и госпитализации при хронической обструктивной болезни легких в Японии : ретроспективный многоцентровый анализ. J Am Geriatr Soc 2008, 56 (7): 1358–1360.
PubMed
Google ученый
He ZY, Ou LM, Zhang JQ, Bai J, Liu GN, Li MH, Deng JM, MacNee W., Zhong XN: Влияние 6 месяцев лечения эритромицином на воспалительные клетки в индуцированной мокроте и обострения хронической обструктивной болезни легких. Дыхание 2010, 80 (6): 445–452. 10.1159 / 000321374
CAS
PubMed
Google ученый
Blasi F, Bonardi D, Aliberti S, Tarsia P, Confalonieri M, Amir O, Carone M, Di-Marco F, Centanni S, Guffanti E: Долгосрочное применение азитромицина у пациентов с хронической обструктивной болезнью легких болезнь и трахеостомия. Pulm Pharmacol Ther 2010, 23 (3): 200–207. 10.1016 / j.pupt.2009.12.002
CAS
PubMed
Google ученый
Patel IS, Vlahos I, Wilkinson TM, Lloyd-Owen SJ, Donaldson GC, Wilks M, Reznek RH, Wedzicha JA: Бронхоэктазия, показатели обострения и воспаление при хронической обструктивной болезни легких. Am J Respir Crit Care Med 2004, 170 (4): 400–407.10.1164 / rccm.200305-648OC
PubMed
Google ученый
О’Брайен С., Гест П.Дж., Хилл С.Л., Стокли Р.А.: Физиологические и радиологические характеристики пациентов с диагнозом хроническая обструктивная болезнь легких в условиях первичной медико-санитарной помощи. Грудь 2000, 55 (8): 635–642. 10.1136 / thorax.55.8.635
PubMed Central
PubMed
Google ученый
Wong C, Jayaram L, Karalus N, Eaton T, Tong C, Hockey H, Milne D, Fergusson W., Tuffery C, Sexton P, и др. .: Азитромицин для предотвращения обострений при бронхоэктазах без кистозного фиброза ( EMBRACE): рандомизированное двойное слепое плацебо-контролируемое исследование. Lancet 2012, 380 (9842): 660–667. 10.1016 / S0140-6736 (12) 60953-2
CAS
PubMed
Google ученый
Serisier DJ, Martin ML, McGuckin MA, Lourie R, Chen AC, Brain B, Biga S, Schlebusch S, Dash P, Bowler SD: Влияние длительного приема низких доз эритромицина на легочные обострения среди пациентов с бронхоэктазами без кистозного фиброза: рандомизированное контролируемое исследование BLESS. Джама 2013, 309 (12): 1260–1267. 10.1001 / jama.2013.2290
CAS
PubMed
Google ученый
Венцель Р.П., Фаулер А.А., 3-й, Эдмонд МБ: Антибиотикопрофилактика острых обострений ХОБЛ. N Engl J Med 2012, 367 (4): 340–347. 10.1056 / NEJMct1115170
CAS
PubMed
Google ученый
Ray WA, Murray KT, Hall K, Arbogast PG, Stein CM: Азитромицин и риск сердечно-сосудистой смерти. N Engl J Med 2012, 366 (20): 1881–1890. 10.1056 / NEJMoa1003833
CAS
PubMed Central
PubMed
Google ученый
Svanstrom H, Pasternak B, Hviid A: Использование азитромицина и смерть от сердечно-сосудистых причин. N Engl J Med 2013, 368 (18): 1704–1712.10.1056 / NEJMoa1300799
CAS
PubMed
Google ученый
Pesek R, Lockey R: Вакцинация взрослых с астмой и ХОБЛ. Аллергия 2011, 66 (1): 25–31. 10.1111 / j.1398-9995.2010.02462.x
CAS
PubMed
Google ученый
Poole PJ, Chacko E, Wood-Baker RW, Cates CJ: Вакцина против гриппа для пациентов с хронической обструктивной болезнью легких. Кокрановская база данных Syst Rev 2006., 1: CD002733
Google ученый
Ансальди Ф., Турелло В., Лай П., Бастон Г., Де-Лука С., Росселли Р., Дурандо П., Стикки Л., Гаспарини Р., Дельфино Е., и др. .: Эффективность 23- валентная полисахаридная вакцина в профилактике пневмонии и неинвазивной пневмококковой инфекции у пожилых людей: крупномасштабное ретроспективное когортное исследование. J Int Med Res 2005, 33 (5): 490–500.10.1177 / 147323000503300503
CAS
PubMed
Google ученый
Ли TA, Weaver FM, Weiss KB: Влияние пневмококковой вакцинации на частоту пневмонии у пациентов с ХОБЛ и астмой. J Gen Intern Med 2007, 22 (1): 62–67. 10.1007 / s11606-007-0118-3
PubMed Central
PubMed
Google ученый
Vila-Corcoles A, Ochoa-Gondar O, Guzman JA, Rodriguez-Blanco T, Salsench E, Fuentes CM: Эффективность 23-валентной полисахаридной пневмококковой вакцины против инвазивного пневмококкового заболевания у людей 60 лет и старше . BMC Infect Dis 2010, 10: 73. 10.1186 / 1471-2334-10-73
PubMed Central
PubMed
Google ученый
Granger R, Walters J, Poole PJ, Lasserson TJ, Mangtani P, Cates CJ, Wood-Baker R: Инъекционные вакцины для предотвращения пневмококковой инфекции у пациентов с хронической обструктивной болезнью легких. Кокрановская база данных Syst Rev 2006., 4: CD001390
Google ученый
Clancy R, Cripps A, Murree-Allen K, Yeung S, Engel M: Пероральная иммунизация убитым Haemophilus influenzae для защиты от острого бронхита при хронической обструктивной болезни легких. Lancet 1985, 2 (8469–70): 1395–1397.
CAS
PubMed
Google ученый
Tandon MK, Phillips M, Waterer G, Dunkley M, Comans P, Clancy R: Пероральная иммунотерапия с инактивированным нетипируемым Haemophilus influenzae снижает тяжесть острых обострений при тяжелой ХОБЛ. Сундук 2010, 137 (4): 805–811. 10.1378 / сундук.09-1382
PubMed
Google ученый
Roede BM, Bresser P, Bindels PJ, Kok A, Prins M, ter-Riet G, Geskus RB, Herings RM, Prins JM: Лечение антибиотиками связано со снижением риска последующего обострения при обструктивной болезни легких болезнь: историческое популяционное когортное исследование. Thorax 2008, 63 (11): 968–973.10.1136 / thx.2008.095349
CAS
PubMed
Google ученый
Cates C: Ингаляционные кортикостероиды при ХОБЛ: количественная оценка рисков и преимуществ. Thorax 2012, 68 (6): 499–500.
PubMed
Google ученый
Hayden FG, Herrington DT, Coats TL, Kim K, Cooper EC, Villano SA, Liu S, Hudson S, Pevear DC, Collett M, et al .: Эффективность и безопасность перорального плеконарила для лечения простуды, вызванной пикорнавирусами, у взрослых: результаты 2 двойных слепых рандомизированных плацебо-контролируемых исследований. Clin Infect Dis 2003, 36 (12): 1523–1532. 10.1086 / 375069
CAS
PubMed
Google ученый
Calverley PM, Rabe KF, Goehring UM, Kristiansen S, Fabbri LM, Martinez FJ: Roflumilast при симптоматической хронической обструктивной болезни легких: два рандомизированных клинических испытания. Lancet 2009, 374 (9691): 685–694. 10.1016 / S0140-6736 (09) 61255-1
CAS
PubMed
Google ученый
Fabbri LM, Calverley PM, Izquierdo-Alonso JL, Bundschuh DS, Brose M, Martinez FJ, Rabe KF: Roflumilast при умеренной и тяжелой хронической обструктивной болезни легких, леченных с помощью длительно действующих бронходилататоров: два рандомизированных клинических испытания . Lancet 2009, 374 (9691): 695–703.10.1016 / S0140-6736 (09) 61252-6
CAS
PubMed
Google ученый
Decramer M, Rutten-van Molken M, Dekhuijzen PN, Troosters T, van-Herwaarden C, Pellegrino R, van-Schayck CP, Olivieri D, Del-Donno M, de-Backer W, et al. .: Влияние N-ацетилцистеина на исходы при хронической обструктивной болезни легких (Бронхит, рандомизированный по исследованию стоимости-полезности NAC, BRONCUS): рандомизированное плацебо-контролируемое исследование. Lancet 2005, 365 (9470): 1552–1560. 10.1016 / S0140-6736 (05) 66456-2
CAS
PubMed
Google ученый
Форсайт P: Пробиотики и болезни легких. Сундук 2011, 139 (4): 901–908. 10.1378 / сундук. 10-1861
CAS
PubMed
Google ученый
Helicobacter pylori [38] |
|
| |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Legionella pneumophila |
| jejuni |
| ||||||||||||||
Pseudomonas aeruginosa [41] [42] |
| ||||||||||||||||
| Burkholderia cepacia | 2 | ||||||||||||||||
| Vibrio vulnificus [46] |
| ||||||||||||||||
Vibrio parahaemolyticus 16| Vibrio parahaemolyticus 16 937 8 34 34 34 | |



 aeruginosa [8]) и необычных патогенов (Burkholderia cepacia complex [13], быстрорастущие микобактерии) затрудняют идентификацию бактерий и рутинные тесты на чувствительность к антибиотикам. .
aeruginosa [8]) и необычных патогенов (Burkholderia cepacia complex [13], быстрорастущие микобактерии) затрудняют идентификацию бактерий и рутинные тесты на чувствительность к антибиотикам. .