Восстановление проходимости дыхательных путей.
1). Сначала надо выполнить 3 действия:
— разогнуть голову в позвоночно- затылочном сочленении;
— поднять подбородок;
— выдвинуть вперед и вверх нижнюю челюсть.
2). Удаление инородных тел, жидкости— следующий этап восстановления
проходимости верхних дыхательных путей,
3). Отсасывание или удаление инородных материалов пальцем или
инструментами,
Рассмотрим алгоритм «Обеспечение проходимости дыхательных путей у взрослых»
(см. следующую страницу).
Обеспечение проходимости дыхательных путей у взрослых.
Методы восстановления проходимости дыхательных путей.
Если у пострадавшего нарушено дыхание, первую помощь начинайте с восстановления проходимости дыхательных путей.
Пострадавший без сознания Полость рта забита пищевыми,
рвотными массами, кровью
При этом нарушение дыхания
возникает, как правило, Повернув голову пострадавшего
в результате западения языка. на бок и открыв ему рот, очистите
Прежде всего разогните ему полость рта пальцем, обернутым
голову так, как показано на марлей или платком.
рисунке. Но этим приемом
пользоваться нельзя, если есть
подозрение на перелом шейных
позвонков.
Пострадавший поперхнулся или подавился во время еды, в дыхательные попало инородное тело
Ударьте его в межлопаточную область (в положении стоя, сидя, лежа) ладонью, но не кулаком!
Встаньте сзади пострадавшего, обхватите его обеими руками и одновременно с силой сдавите грудную клетку с боков и подложечную область. Вытолкнутое потоком воздуха инородное тело освободит дыхательные пути
Вытолкнутое потоком воздуха инородное тело освободит дыхательные пути
Уложите ребенка на руку лицом вниз так, чтобы голова находилась ниже таза, и постучите ладонью по его спине.
После восстановления проходимости дыхательных путей у пострадавшего появляется самостоятельное дыхание, ели оно отсутствует, немедленно начинайте проводить искусственную вентиляцию легких способом «изо рта в рот» либо «изо рта в нос» и продолжайте до приезда «скорой».
Первая помощь при острых нарушениях дыхания и кровообращения.
В обычных условиях после остановки сердца и дыхания (клиническая смерть) клетки головного мозга гибнут через 5 минут.
Общее охлаждение тела удлиняет период клинической смерти.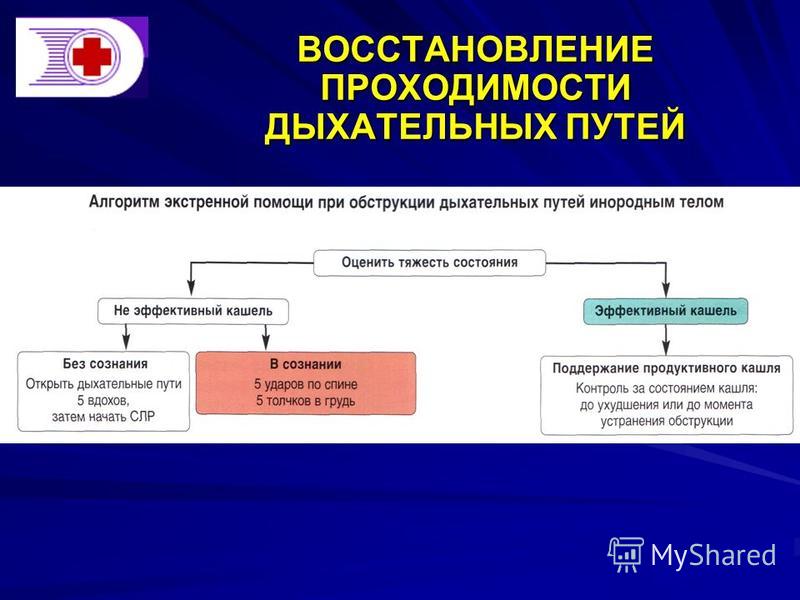
Предшествовавшее перегревание и кислородная недостаточность укорачивают период клинической смерти и ведут к необратимому состоянию — смерти биологической.
Признаки остановки дыхания
Отсутствие потока воздуха возле рта и носа
Отсутствие экскурсии грудной клетки.
Признаки остановки сердца
а) Отсутствие пульса на сонной артерии.
б) Отсутствие дыхания.
в) Расширенные зрачки не реагирующие на свет
Читайте также:
Непроходимость дыхательных путей — Реанимация — Неотложная хирургическая помощь при травмах — Мед312.ру
06.07. 2011
2011
Наиболее частыми причинами, вызывающими непроходимость дыхательных путей, являются утопление, термические поражения дыхательных путей, отравление химическими веществами, травма черепа, шеи, средостения и др., нарушение проходимости дыхательных путей инородными телами.
В экстренных случаях часто встречается нарушение проходимости верхних дыхательных путей: носовой и ротовой полостей, гортани, трахеи.
Попадание в носовые ходы инородных тел, переломы лицевого скелета приводят к закрытию носовых ходов и в связи с этим дыхание через нос становится невозможным. При переломах основания черепа может быть кровотечение в носовую полость и дыхательные пути.
Самой частой причиной непроходимости дыхательных путей у пострадавших в бессознательном состоянии является западение языка, у которых резко снижается мышечный тонус. Расслабление мышц приводит к тому, что челюсть отвисает и тянет за собой язык, который своим основанием закрывает вход в гортань.
В этих случаях необходимо максимально запрокинуть голову и при необходимости фиксировать язык. Нарушение проходимости дыхательных путей может наступить вследствие попадания в них жидких или твердых веществ при вдохе.
Нарушение проходимости дыхательных путей может наступить вследствие попадания в них жидких или твердых веществ при вдохе.
При потере сознания защитные рефлексы или отсутствуют, или резко снижены, поэтому инородные тела беспрепятственно попадают в трахею и бронхи. Аспирация рвотных масс, крови наиболее часто бывает при черепно-мозговой травме, утоплении.
Непроходимость дыхательных путей может быть полной или частичной. При полной непроходимости во время вдоха наблюдается западение грудной клетки и мышц шеи, не определяется поток воздуха около рта и носа. Частичная непроходимость при спонтанном дыхании распознается по западению межреберных промежутков и надключичной области, при этом отмечается шумное дыхание.
Существуют следующие методы восстановления проходимости дыхательных путей.
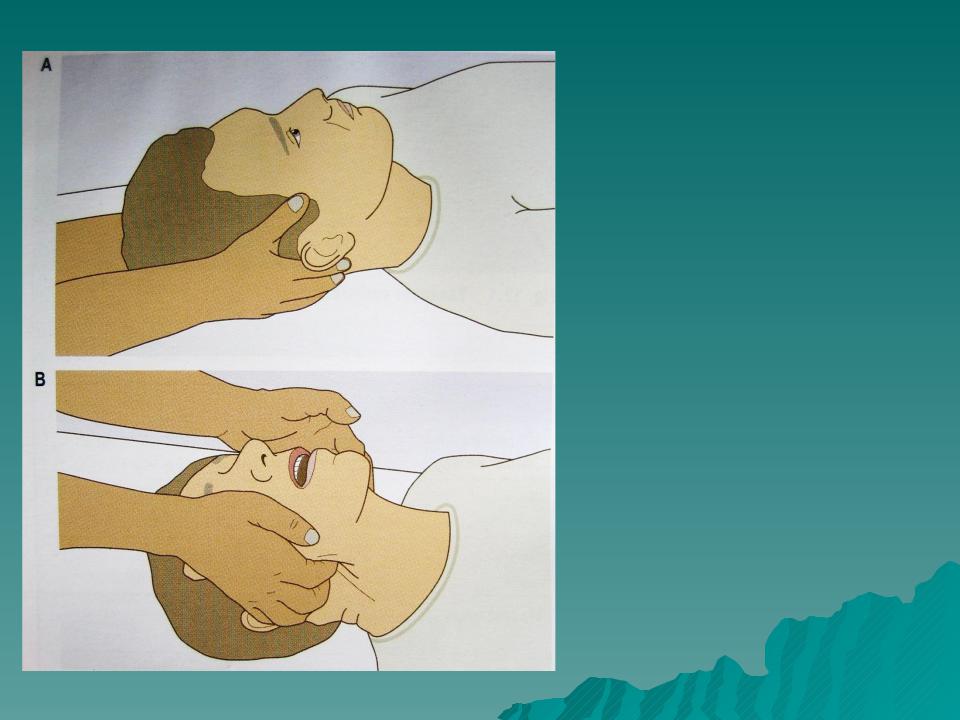
Метод запрокидывания головы. Для восстановления проходимости дыхательных путей пострадавшего необходимо уложить на спину на твердую поверхность и запрокинуть ему голову.
Восстановление проходимости
верхних дыхательных путей запрокидыванием головы
Данный метод в большинстве случаев устраняет закупорку дыхательных путей корнем языка, однако он неэффективен при массивной аспирации.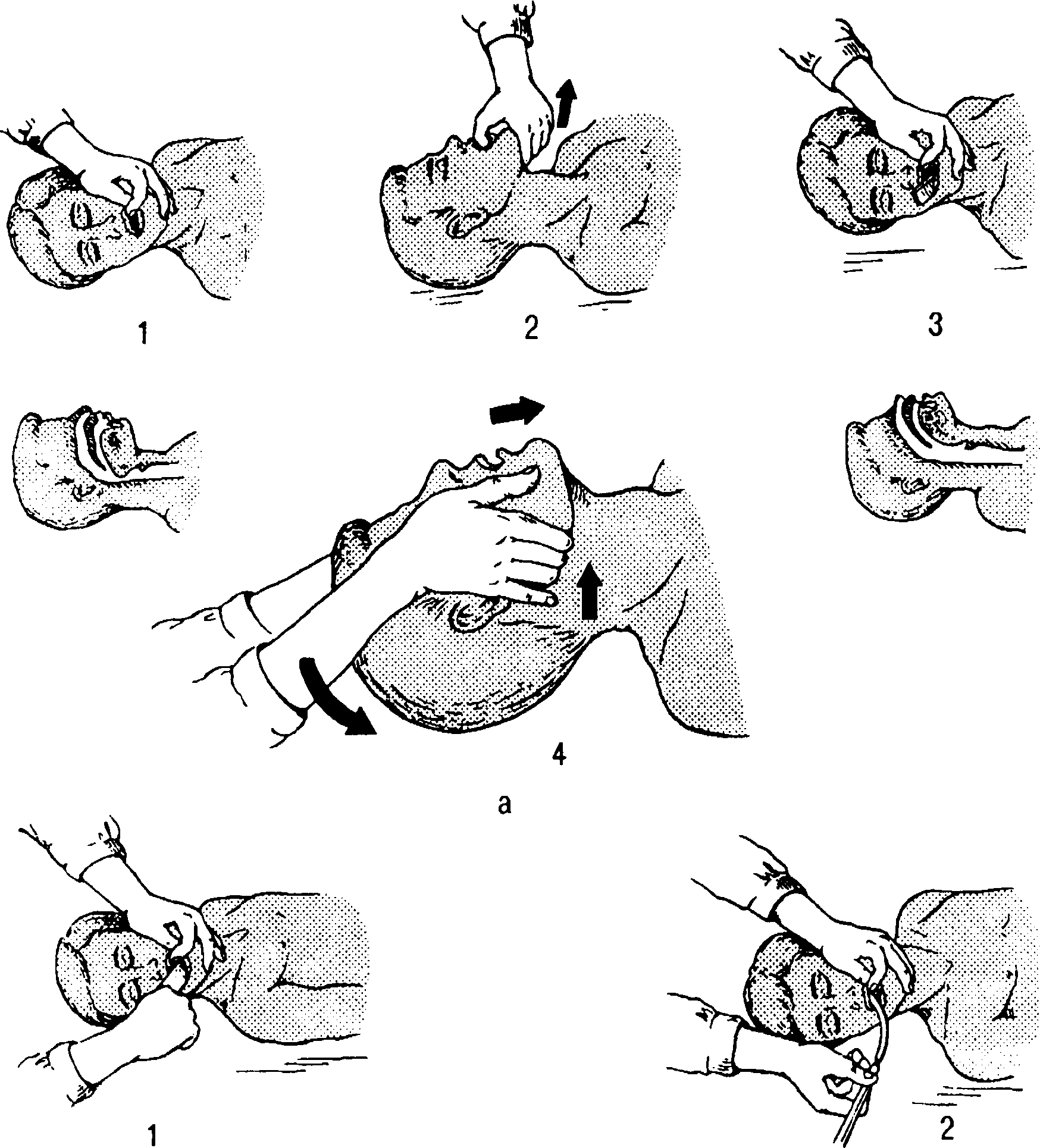
Метод выдвижения нижней челюсти. Нижнюю челюсть выдвигают двумя руками, при этом большие пальцы располагают на подбородке или на лбу, а остальные надавливают на мандибулярные отростки.
Восстановление проходимости верхних дыхательных путей
выдвижением нижней челюсти
Располагая большие пальцы на подбородке (а) и 2—3-й пальцы на мандибулярных отростках (б).
Такие приемы могут обеспечить проходимость дыхательных путей у больных, находящихся в глубокой коме, при расслаблении мышц во время и после наркоза.
Виды воздуховодов
«Тройной» метод заключается в синхронном умеренном запрокидывании головы пострадавшего с одновременным выдвижением вперед нижней челюсти и приоткрыванием рта; эффективен при искусственной вентиляции легких.
В тех случаях, когда невозможно поддержать проходимость дыхательных путей вышеописанными методами, применяют воздуховоды, которые обеспечивают их проходимость, предупреждая смещение корня языка кзади. Воздуховод вводят ротационными движениями поверх языка.
Воздуховод вводят ротационными движениями поверх языка.
«Неотложная хирургическая помощь при травмах»,
под ред. Б.Д.Комарова
Персональный сайт — Сердечно-лёгочная реанимация
Учебная информация
Этапы сердечно-легочной реанимации
1. Восстановление проходимости дыхательных путей.
2. Искусственная вентиляция легких
3. Непрямой массаж сердца.
4. Введение медикаментозных средств.
5. Дефибриляция
6. Интенсивная терапия в послереанимационном периоде, направленная на поддержание и стабилизацию важных функций организма.
Элементарная СЛР, которую можно провести вне лечебного учреждения, включает в себя первые три этапа.
Восстановление проходимости дыхательных путей
Восстановление проходимости дыхательных путей – важнейший этап, без которого не мысленно осуществить эффективную СЛР.
Причины нарушения проходимости дыхательных путей могут быть различными: западание языка, наличие слизи,мокроты, рвотных масс, крови, инородных тел.
Выбор метода восстановления проходимости дыхательных путей зависит от уровня непроходимости и обстоятельств возникновения непроходимости. На улице, в транспорте, не месте происшествия, катастрофы приходится обходиться минимальными средствами.
Алгоритм действия:
1. Уложите пострадавшего на спину на жесткое основание.
2. Расстегнуть стесняющую одежду.
3. Пальцами обеих рук захватите нижнюю челюсть пострадавшего около ушной раковины и сместите челюсть вперед и вверх так, чтобы нижние и верхние зубы располагались в одной плоскости.
4. Большими пальцами сместите нижнюю челюсть и откройте рот пострадавшему (эти приемы используют при западении языка).
5. повернув голову пострадавшего на бок, пальцами, обернутыми носовым платком или марлей,круговыми движениями обследуйте полость рта и очистите ее от слизи, рвотных масс, крови, мокроты и т.д.
6. При наличии инородных тел в ротовой полости 2-3 пальцами, как пинцетом,постарайтесь захватить и удалить его (если это возможно).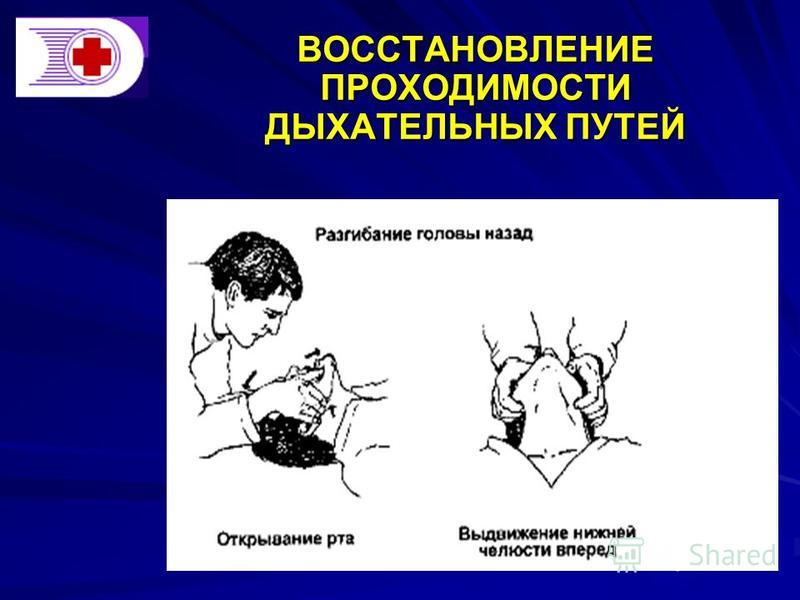 Для удаления инородных тел из других отделов дыхательных путей используйте один из приемов,описанных выше.
Для удаления инородных тел из других отделов дыхательных путей используйте один из приемов,описанных выше.
7. Подведите левую руку под шею, а правую положите на лоб и запрокиньте голову пострадавшегоназад.
Внимание!
Если Вы подозреваете, перелом позвоночника у пострадавшего, голову назад запрокидывать не рекомендуется.
8. Под лопатки подложите валик. В таком положении язык поднимается вверх и отходит от задней стенки глотки,таким образом, устраняется препятствие на пути воздуха, и просвет дыхательных путей наибольший.
Данные мероприятия необходимы потому,что в положении на спине и расслабленных мышцах просвет дыхательных путей уменьшается, а корень языка закрывает вход в трахею.
Убедившись, что дыхательные пути свободны, приступают к ИВЛ.
Искусственная вентиляция легких
ИВЛ необходимо проводить в случаях,когда дыхание отсутствует или нарушено в такой степени, что это угрожает жизни пострадавшего. ИВЛ проводят методом активного вдувания воздуха в легкие пострадавшего.
ИВЛ проводят методом активного вдувания воздуха в легкие пострадавшего.
Задача ИВЛ – заместить утраченный или ослабленный объем вентиляции легочных альвеол.
ИВЛ может быть осуществлена несколькими способами. Самый простой из них – ИВЛ «рот в рот» или «рот в нос».
Алгоритм действия:
1. Обеспечьте проходимость дыхательных путей.
2. Большими указательным пальцами руки, находящейся на лбу пострадавшего, зажмите нос и проведите ИВЛ способом «изо рта в рот».
3. Сделайте глубокий вдох.
4. Плотно прижав свой рот к изолированному марлевой салфеткой (или носовым платком) рту пострадавш
Хирургические методы лечения дыхательных путей — Руководство по неотложной помощи в дыхательных путях, 3-е издание
Руководство по экстренной организации прохождения дыхательных путей, 3-е издание
16.Хирургические методы лечения дыхательных путей
Роберт Дж. Виссерс
Аарон Э. Баир
Баир
Введение
Хирургическое лечение проходимости дыхательных путей определяется как создание проходимых путей с помощью инвазивной техники. Все другие методы управления проходимостью дыхательных путей используют существующие анатомические порталы доступа к трахее (т.е., носоглотка, ротоглотка). Хирургическое лечение проходимости дыхательных путей включает создание отверстия в трахее хирургическим путем. Это отверстие затем используется для вентиляции и оксигенации. Существует некоторая путаница, связанная с использованием термина хирургическое управление дыхательными путями . В некоторых дискуссиях хирургическое лечение проходимости дыхательных путей включает как крикотиротомию, так и игольчатую крикотиротомию с чрескожной транстрахеальной вентиляцией (ЧТВ). Другие дискуссии ограничивают хирургическое вмешательство в дыхательных путях крикотиротомией и рассматривают PTV как просто еще один метод управления проходимостью дыхательных путей. В целях обсуждения в этой главе считается, что хирургическое вмешательство в дыхательные пути включает крикотиротомию, PTV и установку хирургического дыхательного пути с помощью крикотиротома, который представляет собой устройство, предназначенное для чрескожного введения хирургического дыхательного пути, обычно в один или два этапа, без выполнение формальной крикотиротомии. Крикотиротомы можно рассматривать как альтернативу крикотиротомии; однако крикотиротомы, в которые устанавливается трубка без наручников, не защищают дыхательные пути.
В целях обсуждения в этой главе считается, что хирургическое вмешательство в дыхательные пути включает крикотиротомию, PTV и установку хирургического дыхательного пути с помощью крикотиротома, который представляет собой устройство, предназначенное для чрескожного введения хирургического дыхательного пути, обычно в один или два этапа, без выполнение формальной крикотиротомии. Крикотиротомы можно рассматривать как альтернативу крикотиротомии; однако крикотиротомы, в которые устанавливается трубка без наручников, не защищают дыхательные пути.
PTV через катетер редко, если вообще, у взрослых.Он не защищает дыхательные пути и значительно уступает крикотиротомии с точки зрения защиты дыхательных путей и газообмена. У взрослых предпочтительна крикотиротомия открытым способом или методом Сельдингера. PTV следует назначать детям младше 12 лет, анатомия которых не способствует крикотиротомии. Преподаватели курса «Трудные дыхательные пути: неотложная помощь» недавно разработали комплект, который предлагает инструменты и оборудование для выполнения чрескожной крикотиротомии по Сельдингеру или открытой крикотиротомии с использованием трубки с манжетой для обоих методов (универсальный набор катетеров для экстренной крикотиротомии Melker, Cook Critical Care, Блумингтон, Индиана; рис. 16-1). Каждый основной метод хирургического вмешательства на дыхательных путях подробно описан в следующих разделах.
16-1). Каждый основной метод хирургического вмешательства на дыхательных путях подробно описан в следующих разделах.
Описание
Крикотиротомия — это создание хирургического отверстия в дыхательных путях через перстнещитовидную мембрану и установку трахеостомической трубки с манжетой или эндотрахеальной трубки (ЭТТ).
Крикотиротом — это комплект или устройство, предназначенное для хирургического восстановления дыхательных путей без формальной крикотиротомии. В этих наборах используются два основных подхода.Один из подходов основан на технике Сельдингера, при которой доступ к дыхательным путям осуществляется через небольшую иглу, через которую пропускается гибкий проводник. Затем устройство для прохождения дыхательных путей с расширителем пропускается по проволочному проводнику в дыхательные пути аналогично тому, как это делается при размещении центральной линии по методу Сельдингера. Другой метод основан на прямом чрескожном размещении устройства для дыхательных путей без использования техники Сельдингера.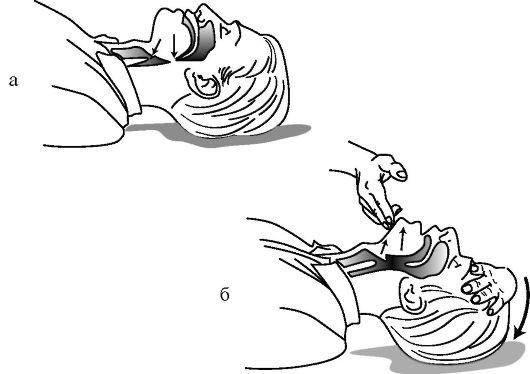 На сегодняшний день нет клинических исследований, демонстрирующих превосходство одного подхода над другим или любого из этих устройств над формальной хирургической крикотиротомией.Однако определенные атрибуты устройств делают их интуитивно более или менее опасными для установки (см. Раздел Evidence ).
На сегодняшний день нет клинических исследований, демонстрирующих превосходство одного подхода над другим или любого из этих устройств над формальной хирургической крикотиротомией.Однако определенные атрибуты устройств делают их интуитивно более или менее опасными для установки (см. Раздел Evidence ).
Показания и противопоказания
Первичным показанием к крикотиротомии является нарушение проходимости дыхательных путей (см. Главу 2) и невозможность адекватной вентиляции или оксигенации пациента с помощью мешка и маски, или когда пациент адекватно оксигенирован, но нет другого доступного устройства (например,g., оптоволоконный зонд, освещенный стилет, интубационная ларингеальная маска для дыхательных путей [LMA]), которая, как полагают, может успешно защитить дыхательные пути. Второе показание — это метод первичного управления проходимостью дыхательных путей у пациентов, которым интубация противопоказана или считается невозможной.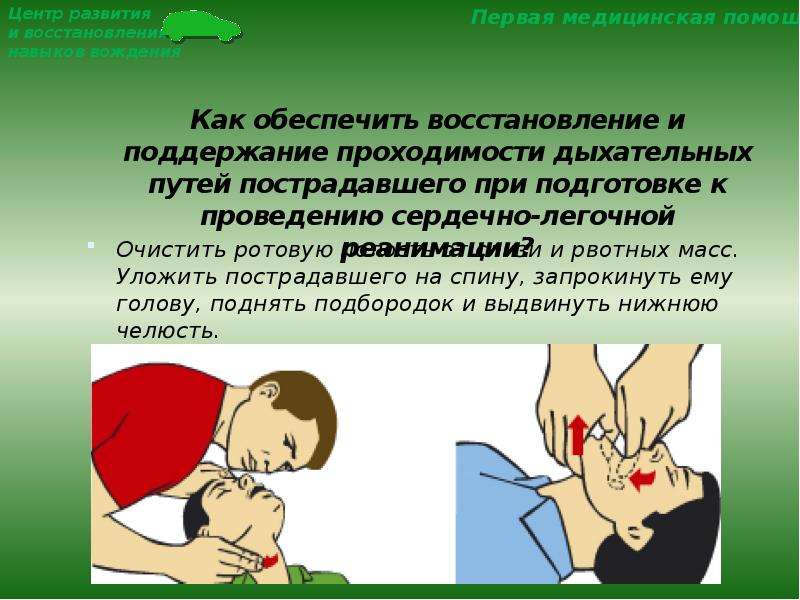 Таким образом, крикотиротомию следует рассматривать как метод спасения в большинстве случаев, и лишь изредка она будет использоваться в качестве основного метода лечения проходимости дыхательных путей. Примером обстоятельств, в которых крикотиротомия является основным методом управления проходимостью дыхательных путей, является пациент с тяжелой травмой нижней части лица, у которого доступ через рот или нос был бы слишком трудоемким или невозможным.Этому пациенту требуется немедленная обработка проходимости дыхательных путей из-за риска аспирации крови и секретов, и показана крикотиротомия.
Таким образом, крикотиротомию следует рассматривать как метод спасения в большинстве случаев, и лишь изредка она будет использоваться в качестве основного метода лечения проходимости дыхательных путей. Примером обстоятельств, в которых крикотиротомия является основным методом управления проходимостью дыхательных путей, является пациент с тяжелой травмой нижней части лица, у которого доступ через рот или нос был бы слишком трудоемким или невозможным.Этому пациенту требуется немедленная обработка проходимости дыхательных путей из-за риска аспирации крови и секретов, и показана крикотиротомия.
Рисунок 16-1 • A: Набор универсальных катетеров для экстренной крикотиротомии Melker (Cook Critical Care, Блумингтон, Индиана). B: Открытый набор, содержащий трахеостомическую трубку с манжетой, а также оборудование как для открытой хирургии, так и для техники Сельдингера. |
Основным препятствием для выполнения крикотиротомии является простое понимание того, когда необходимо продолжить хирургическое лечение проходимости дыхательных путей, и отказ от дальнейших попыток ларингоскопии или использования альтернативного устройства. Быстрая последовательная интубация (RSI), дополненная различными неинвазивными методами управления проходимостью дыхательных путей, настолько успешна, что крикотиротомия часто рассматривается как крайний метод, который следует проводить только после того, как несколько неинвазивных попыток или методов потерпели неудачу.Однако безжалостное и безуспешное стремление к неинвазивному дыханию вместе с вытекающей отсрочкой начала хирургического вмешательства в дыхательных путях легко может привести к гипоксической катастрофе. Этот факт особенно актуален в ситуации « не может, интубировать, не может, оксигенации» (CICO), когда сразу показано хирургическое вмешательство в дыхательных путях и не следует откладывать попытки использования других устройств.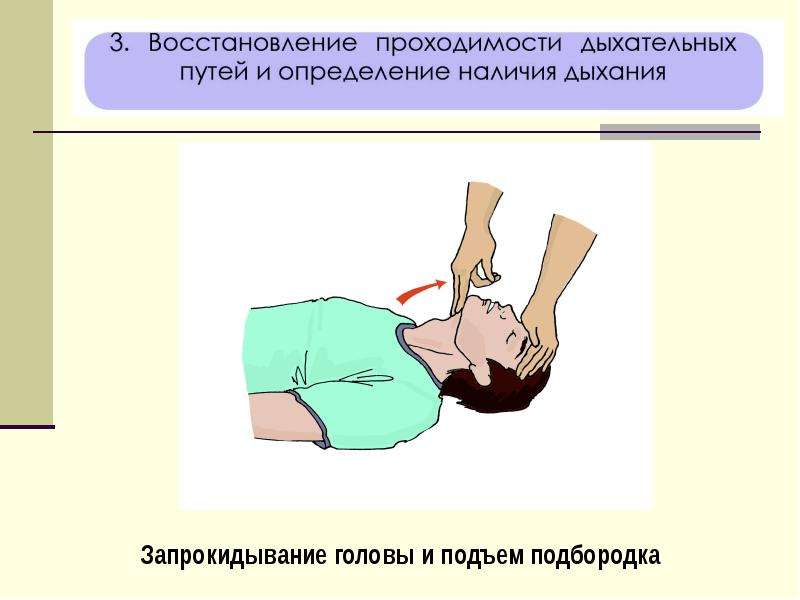
После того, как было принято решение о хирургическом вмешательстве в дыхательные пути, необходимо учитывать несколько фундаментальных факторов:
а.Будет ли доступ к перстневидной мембране эффективным ? Другими словами, сможет ли разрез на уровне перстневидной перепонки обойти препятствие и решить проблему? Если препятствующее поражение находится значительно дистальнее перстневидной мембраны, выполнение крикотиротомии является критической тратой времени (см. Главу 36).
г. Будет ли сложна крикотиротомия из-за анатомии пациента или патологического процесса? Размещение первоначального кожного разреза основывается на пальпации соответствующей анатомии.Если ожирение, ожоги, травмы или инфекция затрудняют эту процедуру, следует соответствующим образом скорректировать стратегию. Мнемоника сложной крикотиротомии (КОРОТКАЯ) показана во вставке 16-1 и обсуждается в главе 7.
г. Какой инвазивный метод тип будет использоваться наиболее легко (т.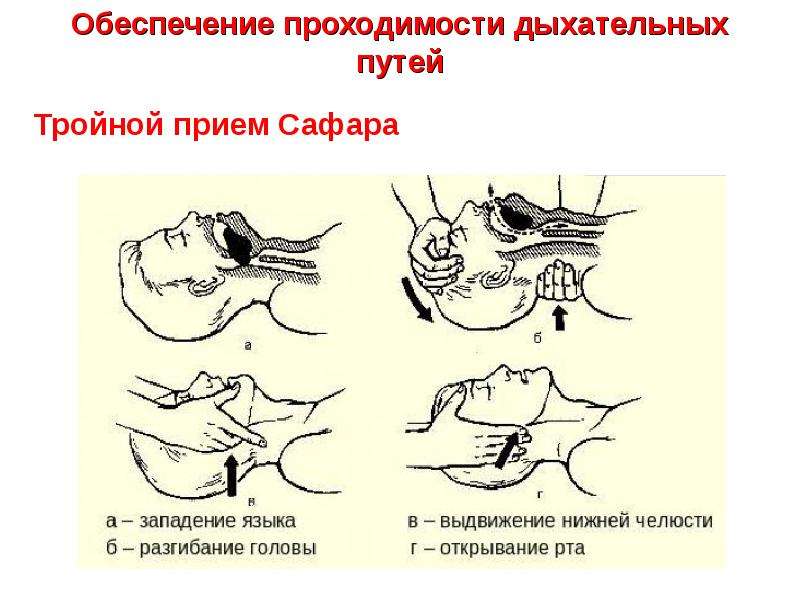 Е. Открытый хирургический или чрескожный)? При этом учитываются предпочтения провайдера, основанные на предыдущем опыте и доступности оборудования.
Е. Открытый хирургический или чрескожный)? При этом учитываются предпочтения провайдера, основанные на предыдущем опыте и доступности оборудования.
Противопоказания к хирургическому лечению дыхательных путей немногочисленны и, за одним исключением, относительны.Единственное исключение — молодой возраст. У детей маленькая, податливая, подвижная гортань и перстневидный хрящ, что чрезвычайно затрудняет крикотиротомию. Для детей младше 12 лет, если они не подросткового или взрослого возраста, PTV следует использовать как предпочтительный хирургический метод управления проходимостью дыхательных путей (см. Главы 21 и 22). Относительные противопоказания включают ранее существовавшую патологию гортани или трахеи, такую как опухоль, инфекции или абсцесс в области, в которой будет проводиться процедура; гематома или другое анатомическое разрушение ориентиров, которое сделало бы процедуру трудной или невозможной; коагулопатия; и отсутствие опыта оператора.Крикотиротомия успешно выполнена после системной тромболитической терапии.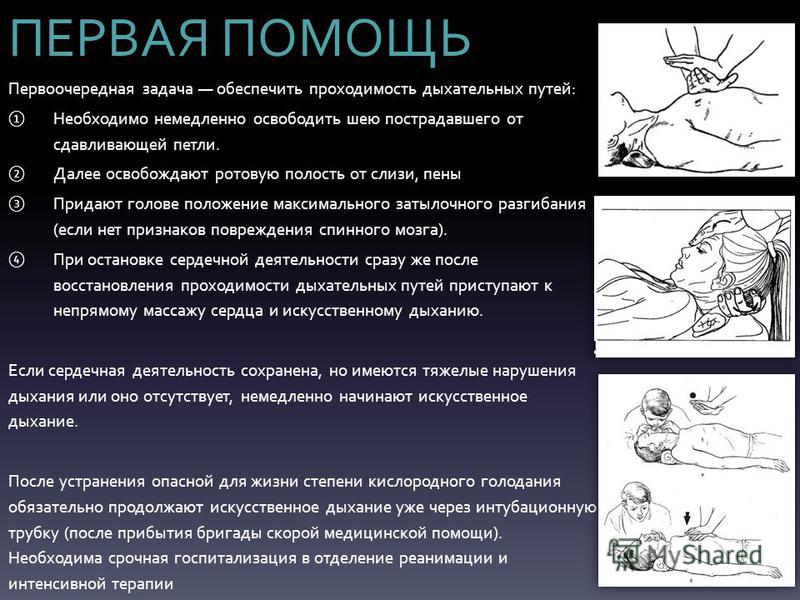 Крикотиротомия имеет высокий уровень успеха при выполнении в отделении неотложной помощи (ED). В частности, наличие анатомического барьера должно побудить к рассмотрению альтернативных методов, которые могут привести к успешному прохождению дыхательных путей. Однако в случаях, когда ни один альтернативный метод обеспечения проходимости дыхательных путей вряд ли окажется успешным или достаточно своевременным, следует без колебаний выполнять крикотиротомию. Те же принципы применяются как для крикотиротома, так и для PTV.
Крикотиротомия имеет высокий уровень успеха при выполнении в отделении неотложной помощи (ED). В частности, наличие анатомического барьера должно побудить к рассмотрению альтернативных методов, которые могут привести к успешному прохождению дыхательных путей. Однако в случаях, когда ни один альтернативный метод обеспечения проходимости дыхательных путей вряд ли окажется успешным или достаточно своевременным, следует без колебаний выполнять крикотиротомию. Те же принципы применяются как для крикотиротома, так и для PTV.
ВСТАВКА 16-1 КОРОТКАЯ Мнемоника для сложной крикотиротомии
· S Ургент (операции на шее в анамнезе, наличие хирургического рубца)
· H эматома
· O Besity
· R (история или свидетельство лучевой терапии)
· T rauma (прямая травма гортани с нарушенными ориентирами)
PTV не противопоказан маленьким детям и фактически является хирургическим методом выбора дыхательных путей для детей младше 12 лет. Не было продемонстрировано, что крикотиротомы улучшают показатели успеха, время или уменьшают частоту осложнений по сравнению с хирургической крикотиротомией. Как и в случае формальной крикотиротомии, для успеха при использовании крикотиротома необходимы опыт, навыки, знание анатомии и соблюдение надлежащей техники.
Не было продемонстрировано, что крикотиротомы улучшают показатели успеха, время или уменьшают частоту осложнений по сравнению с хирургической крикотиротомией. Как и в случае формальной крикотиротомии, для успеха при использовании крикотиротома необходимы опыт, навыки, знание анатомии и соблюдение надлежащей техники.
Техника
Анатомия и ориентиры
Перстнещитовидная мембрана — это анатомическое место доступа к выходным хирургическим дыхательным путям, независимо от используемой техники.Он имеет несколько преимуществ перед трахеей в экстренной ситуации. Перстневидно-щитовидная железа расположена кпереди, чем нижняя часть трахеи, и между ней и кожей меньше мягких тканей. Менее кровоснабжение и меньше вероятность значительного кровотечения.
Мембрана перстневидно-щитовидной железы идентифицируется путем определения местоположения выступа (выемки) щитовидной железы в гортани. Примерно на один палец ниже выступа гортани мембрану можно пальпировать по средней линии передней части шеи, как мягкое углубление между нижней частью щитовидного хряща вверху и твердым перстневидным кольцом внизу. Соответствующая анатомия может быть легче оценить у мужчин из-за более заметной выемки на щитовидной железе. Также следует идентифицировать щитовидно-подъязычное пространство, которое находится над выступом гортани, и подъязычную кость, расположенную высоко на шее. Это предотвратит ошибочную идентификацию тирео-подъязычной мембраны как перстнещитовидную мембрану, что приведет к неправильному смещению трахеостомической трубки над голосовыми связками. У детей перстневидная мембрана непропорционально меньше из-за большего перекрытия щитовидного хряща с перстневидным хрящом.По этой причине крикотиротомия не рекомендуется детям в возрасте 12 лет и младше.
Соответствующая анатомия может быть легче оценить у мужчин из-за более заметной выемки на щитовидной железе. Также следует идентифицировать щитовидно-подъязычное пространство, которое находится над выступом гортани, и подъязычную кость, расположенную высоко на шее. Это предотвратит ошибочную идентификацию тирео-подъязычной мембраны как перстнещитовидную мембрану, что приведет к неправильному смещению трахеостомической трубки над голосовыми связками. У детей перстневидная мембрана непропорционально меньше из-за большего перекрытия щитовидного хряща с перстневидным хрящом.По этой причине крикотиротомия не рекомендуется детям в возрасте 12 лет и младше.
К сожалению, те же анатомические или физиологические отклонения (например, травмы, патологическое ожирение, врожденные аномалии), которые потребовали хирургического вмешательства в дыхательные пути, также могут препятствовать легкой пальпации ориентиров. Один из способов оценить расположение перстневидно-щитовидной железы — положить четыре пальца на шею в продольном направлении так, чтобы мизинец находился в вырезе грудины. Перепонка находится примерно под указательным пальцем и может служить точкой, в которой делается первоначальный разрез.За исключением случаев, описанных ниже в методике быстрой четырехэтапной крикотиротомии, предпочтительным является вертикальный разрез кожи, особенно если анатомические ориентиры не видны сразу. Затем пальпация через этот вертикальный разрез может подтвердить расположение перстнещитовидной железы. В качестве альтернативы идентификация может быть облегчена с помощью иглы-локатора, прикрепленной к шприцу, содержащему физиологический раствор или лидокаин. Аспирация пузырьков воздуха предполагает попадание в дыхательные пути, но не позволяет различить перстнещитовидную мембрану и нижнее расположение трахеи.
Перепонка находится примерно под указательным пальцем и может служить точкой, в которой делается первоначальный разрез.За исключением случаев, описанных ниже в методике быстрой четырехэтапной крикотиротомии, предпочтительным является вертикальный разрез кожи, особенно если анатомические ориентиры не видны сразу. Затем пальпация через этот вертикальный разрез может подтвердить расположение перстнещитовидной железы. В качестве альтернативы идентификация может быть облегчена с помощью иглы-локатора, прикрепленной к шприцу, содержащему физиологический раствор или лидокаин. Аспирация пузырьков воздуха предполагает попадание в дыхательные пути, но не позволяет различить перстнещитовидную мембрану и нижнее расположение трахеи.
Техника без капель
Набор инструментов для крикотиротомии должен быть простым и состоять только из оборудования, необходимого для выполнения процедуры. Примерный перечень рекомендуемого содержимого ложки для крикотиротомии приведен во вставке 16-2. Сейчас доступны коммерческие наборы, которые также содержат инструменты, необходимые для крикотиротомии (рис. 16-1).
Сейчас доступны коммерческие наборы, которые также содержат инструменты, необходимые для крикотиротомии (рис. 16-1).
1. Укажите ориентиры. Перстнещитовидная мембрана идентифицируется с использованием ранее описанных ориентиров (рис.16-2).
2. Подготовьте шейку. Если позволяет время, нанесите соответствующий антисептический раствор. Местная анестезия желательна, если пациент находится в сознании. Инфильтрация кожи и подкожной клетчатки передней части шеи 1% раствором лидокаина обеспечит адекватную анестезию. Если позволяет время, а пациент находится в сознании и чувствителен, обезболивайте дыхательные пути, вводя лидокаин путем пункции транскрико-тироидной мембраны (см. Главу 8). Пациент будет кратковременно кашлять, но дыхательные пути будут в достаточной степени обезболены, а дальнейшие кашлевые рефлексы подавлены.
3. Обездвиживаем гортань. На протяжении всей процедуры необходимо иммобилизовать гортань (рис. 16-3). Лучше всего это сделать, поместив большой и длинный пальцы на противоположные стороны верхних рогов гортани, задней верхней части хряща гортани. Поместив таким образом большой и длинный пальцы, указательный палец идеально расположен спереди, чтобы переместить и повторно идентифицировать перстнещитовидную мембрану в любой момент во время процедуры.
Поместив таким образом большой и длинный пальцы, указательный палец идеально расположен спереди, чтобы переместить и повторно идентифицировать перстнещитовидную мембрану в любой момент во время процедуры.
4. Надрезать кожу. Следует использовать вертикальный разрез кожи по средней линии 2 см (рис. 16-4). Следует проявлять осторожность, чтобы не порезать более глубокие структуры шеи. Перстнещитовидная мембрана отделена от внешнего мира только кожей, подкожной клетчаткой и передней шейной фасцией. Слишком сильный разрез может привести к повреждению гортани, перстневидного хряща и трахеи.
Рисунок 16-2 • Анатомия гортани. Перстневидная перепонка ( стрелка ) ограничена сверху щитовидным хрящом, а снизу — перстневидным хрящом. |
Рисунок 16-3 • A: Анатомия поверхности дыхательных путей. |
5. Повторно идентифицируйте мембрану. Большим и длинным пальцами, поддерживающими иммобилизацию гортани, указательный палец теперь может пальпировать переднюю часть гортани, перстневидную перепонку и перстневидный хрящ без какой-либо промежуточной кожи или подкожной клетчатки (рис. 16-5). Подтвержденные таким образом ориентиры: указательный палец можно оставить в ране, поместив его на нижнюю часть передней части гортани, таким образом, обеспечивая четкий индикатор верхней протяженности перстневидно-щитовидной железы.
6. Надрезать мембрану. Перстневидно-щитовидная перепонка должна быть разрезана в горизонтальном направлении с разрезом длиной не менее 1 см (рис. 16-6A). Рекомендуется попытаться разрезать нижнюю половину перепонки, а не верхнюю половину из-за относительно головного расположения верхней перстнещитовидной артерии и вены; тем не менее, это может быть нереально в условиях возникновения ситуации (рис. 16-6B).
16-6B).
Рисунок 16-4 • Смещая указательный палец в сторону, но продолжая твердую иммобилизацию гортани, делается вертикальный разрез кожи по средней линии до глубины структур гортани. |
Рисунок 16-5 • После разреза кожи указательный палец теперь может непосредственно пальпировать перстнещитовидную мембрану. |
Рисунок 16-6 • A: Горизонтальный разрез мембраны делается около нижнего края перстневидно-щитовидной железы. Указательный палец можно отвести в сторону или остаться в ране, пальпируя нижний край щитовидного хряща, чтобы направить скальпель к мембране. |
7. Вставьте крючок для трахеи. Трахеальный крючок вращается так, чтобы он был ориентирован в поперечной плоскости, проходит через разрез, а затем снова поворачивается, чтобы крючок был ориентирован в головном направлении. Затем крючок прикладывают к нижнему краю щитовидного хряща и прикладывают осторожное движение вверх и в головной части, чтобы вывести дыхательные пути сразу к кожному разрезу (рис.16-7). Если есть ассистент, этот крючок можно передать ассистенту для поддержания иммобилизации гортани.
8. Вставьте расширитель Труссо. Расширитель Труссо можно ввести одним из двух способов. Один из методов — вставить расширитель через разрез, направляя лезвия расширителя в продольном направлении по дыхательным путям. Второй метод, который является предпочтительным, заключается в минимальном введении расширителя в переднюю рану с ориентацией лезвий вверх и вниз, позволяя расширителю открыться и увеличить вертикальную протяженность разреза перстневидно-щитовидной мембраны, что часто является анатомически ограничивающим размером ( Рис. 16-8). При использовании этой техники следует проявлять осторожность, чтобы не ввести расширитель слишком глубоко в дыхательные пути, поскольку это будет препятствовать последующему прохождению трахеостомической трубки.
16-8). При использовании этой техники следует проявлять осторожность, чтобы не ввести расширитель слишком глубоко в дыхательные пути, поскольку это будет препятствовать последующему прохождению трахеостомической трубки.
Рисунок 16-7 • A: Во время введения крючок для трахеи ориентирован поперечно. B и C: После введения на нижний край щитовидного хряща накладывается головная тракция. |
9. Вставьте трахеостомическую трубку. Трахеостомическая трубка с внутренней канюлей на месте осторожно вводится через разрез между лезвиями расширителя Труссо. По мере того, как трубка плавно продвигается по ее естественному изгибу, расширитель Труссо поворачивается, чтобы позволить лопаткам ориентироваться продольно в дыхательных путях (рис. 16-9). Трахеостомическая трубка продвигается до тех пор, пока она не будет плотно прилегать к передней части шеи. Затем осторожно удаляют расширитель Труссо.
16-9). Трахеостомическая трубка продвигается до тех пор, пока она не будет плотно прилегать к передней части шеи. Затем осторожно удаляют расширитель Труссо.
10. Надуйте манжету и подтвердите положение трубки. При надутой манжете положение трахеостомической трубки можно проверить теми же методами, что и положение ЭТТ. Обнаружение углекислого газа (CO 2 ) надежно указывает на правильное размещение трубки и является обязательным, как при эндотрахеальной интубации. Немедленная подкожная эмфизема с мешком предполагает возможное паратрахеальное размещение. Если сомнения остаются, быстрое введение назогастрального зонда через трахеостомическую трубку приведет к легкому прохождению трубки, если трубка находится в трахее, и обструкции, если трубка была введена через ложный проход в ткани шеи.Также рекомендуется аускультация обоих легких и эпигастральной области, хотя установка трахеостомической трубки через пищевод крайне маловероятна. Рентгенография грудной клетки должна быть выполнена, чтобы помочь в оценке размещения трубки и для оценки наличия баротравмы.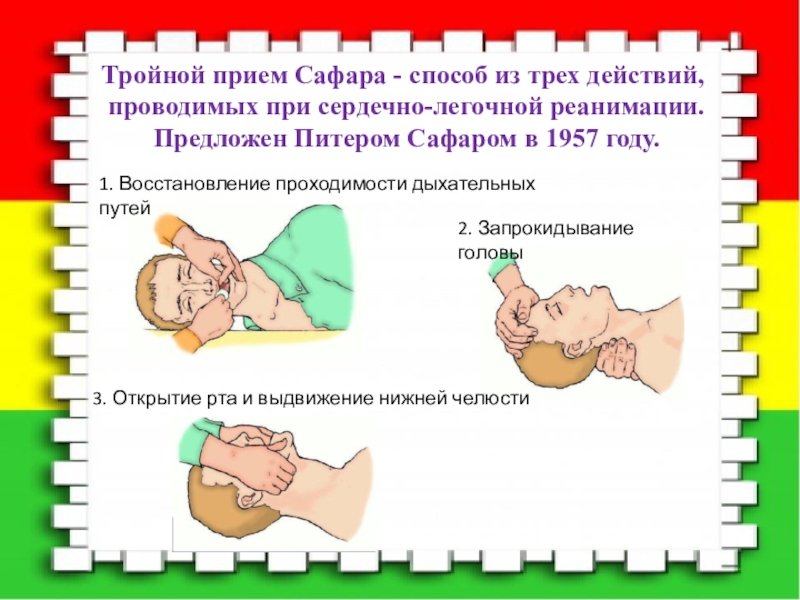
Рисунок 16-8 • A: Расширитель Труссо вводится в разрез на небольшом расстоянии. B: В этой ориентации расширитель увеличивает отверстие по вертикали, что является решающим размером. |
ВСТАВКА 16-2 Рекомендуемое содержимое ложки для крикотиротомии
· Расширитель Труссо
· Трахеальный крючок
· Скальпель нет. 11 лезвие
· С манжетами, без окон, № 4 трахеостомическая трубка
· Дополнительное оборудование: несколько марлевых губок 4 × 4, два небольших кровоостанавливающих зажима и хирургические простыни
Быстрая четырехступенчатая техника
Этот сокращенный метод крикотиротомии был разработан и принят для обучения в некоторых центрах. Как и во всех других методах, пациент должен быть максимально насыщен кислородом, и, если у него будет достаточно времени, можно подготовить переднюю часть шеи и провести местную анестезию, как при бескапельном методе. Из позиции у изголовья кровати быстро выполняется четырехэтапная техника крикотиротомии:
Как и во всех других методах, пациент должен быть максимально насыщен кислородом, и, если у него будет достаточно времени, можно подготовить переднюю часть шеи и провести местную анестезию, как при бескапельном методе. Из позиции у изголовья кровати быстро выполняется четырехэтапная техника крикотиротомии:
Рисунок 16-9 • A: Введение трахеостомической трубки. B: Вращение расширителя Труссо для продольной ориентации лезвий в дыхательных путях облегчает прохождение трахеостомической трубки. C: Трахеостомическая трубка вставлена полностью; инструменты удалены. |
Рисунок 16-10 • Пальпация: большой палец оператора находится на подъязычной кости, а перстнещитовидная перепонка определяется с помощью указательного пальца. |
1. Пальпируйте и определите ориентиры. Перстневидно-щитовидная перепонка должна быть идентифицирована, как описано ранее (рис. 16-10).Если ключевые ориентиры не могут быть идентифицированы путем пальпации через мягкие ткани, то для точной идентификации требуется вертикальный разрез кожи.
2. Сделайте надрез на коже. После того, как определена соответствующая пальпируемая анатомия, перепонка перстневидно-щитовидной железы рассекается. Если анатомия полностью оценивается через неповрежденную кожу и нет никаких сомнений в отношении ориентиров или местоположения, тогда надрежьте кожу и перстневидную перепонку одновременно с одним горизонтальным разрезом примерно 1.5 см в длину (рис. 16-11А). Для этого типа разреза нет. 20 скальпелем дает разрез, который требует небольшого расширения, когда-то использованный для прокола кожи и перстнещитовидной железы. Если анатомию невозможно легко и однозначно идентифицировать через кожу, следует сделать первоначальный вертикальный разрез, чтобы позволить более точную пальпацию анатомии и идентификацию перстневидно-щитовидной железы. В любом случае перстнещитовидная мембрана рассекается с помощью № 20 лезвия, которое удерживается в дыхательных путях, в то время как крючок трахеи (предпочтительно тупой крючок) размещается параллельно скальпелю на каудальной стороне лезвия (рис.16-11Б). Затем крючок поворачивают, чтобы ориентировать его в каудальном направлении, чтобы мягко тянуть перстневидное кольцо. Затем скальпель удаляется из дыхательных путей. Во время этой процедуры разрез ни в коем случае нельзя оставлять без инструментального контроля дыхательных путей. Эта деталь особенно важна в случае, когда пациент все еще может ответить или сглотнуть. Вновь созданная стома может быть безвозвратно утеряна, если дыхательные пути не контролируются и перемещаются относительно разреза кожи. Кроме того, как и в случае без-капельного метода, это метод, основанный исключительно на пальпации ключевых структур.Кровотечение неизбежно затруднит визуализацию анатомии. Не следует тратить время зря, используя присоску или марлю, или манипулируя верхним освещением.
В любом случае перстнещитовидная мембрана рассекается с помощью № 20 лезвия, которое удерживается в дыхательных путях, в то время как крючок трахеи (предпочтительно тупой крючок) размещается параллельно скальпелю на каудальной стороне лезвия (рис.16-11Б). Затем крючок поворачивают, чтобы ориентировать его в каудальном направлении, чтобы мягко тянуть перстневидное кольцо. Затем скальпель удаляется из дыхательных путей. Во время этой процедуры разрез ни в коем случае нельзя оставлять без инструментального контроля дыхательных путей. Эта деталь особенно важна в случае, когда пациент все еще может ответить или сглотнуть. Вновь созданная стома может быть безвозвратно утеряна, если дыхательные пути не контролируются и перемещаются относительно разреза кожи. Кроме того, как и в случае без-капельного метода, это метод, основанный исключительно на пальпации ключевых структур.Кровотечение неизбежно затруднит визуализацию анатомии. Не следует тратить время зря, используя присоску или марлю, или манипулируя верхним освещением.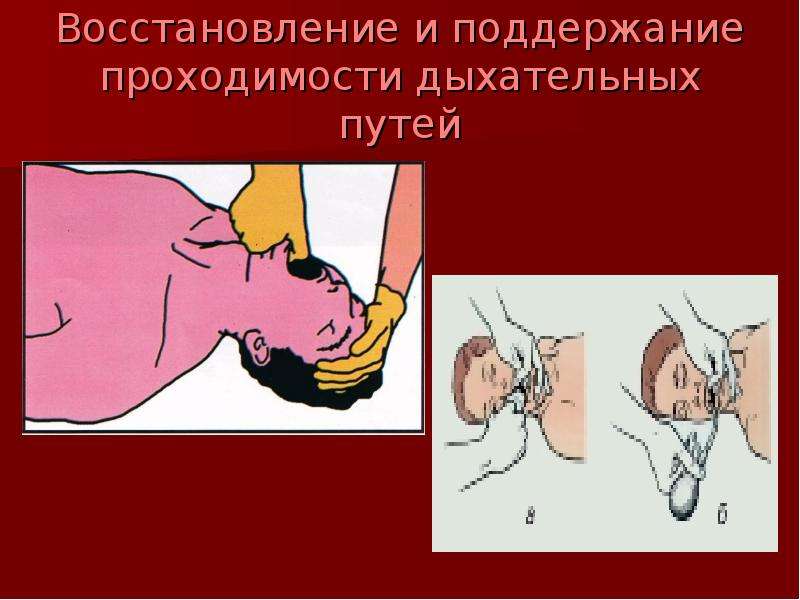
3. Приложите тягу. Трахеальный крючок, который повернут каудально и контролирует перстневидное кольцо, теперь используется для подъема дыхательных путей к кожному разрезу. Это действие обеспечивает умеренное расширение стомы. Направление тяги крючка напоминает направление вверх и в сторону, используемое при ларингоскопии (рис. 16-12). Величина тягового усилия, необходимого для легкой интубации (18 ньютонов или 4.05 фунтов силы) значительно ниже, чем сила, связанная с разрывом перстневидного кольца (54 ньютона или 12,14 фунта силы). Использование крючка в этом направлении обычно обеспечивает достаточное расширение разреза, и расширитель Труссо обычно не требуется. Техника вытягивания дыхательных путей вверх таким образом также сводит к минимуму возможность интубации предтрахеального потенциального пространства.
Рисунок 16-11 • Разрез: A: Горизонтальный разрез выполняется для стабилизации гортани. |
4. Интубация. При адекватном контроле проходимости дыхательных путей с помощью крючка, закрепленного на перстневидном кольце, трахеостомическая трубка легко вводится в дыхательные пути и фиксируется (рис. 16-13). Техники подтверждения действуют, как описано в методике без капель.
Осложнения
Из-за широкого распространения RSI крикотиротомия в отделениях неотложной помощи выполняется нечасто, поэтому сообщения об осложнениях трудно оценить.В исследовании Национального реестра дыхательных путей (NEAR II) менее 1% из более чем 7700 интубаций ED включали крикотиротомию.
Рисунок 16-12 • Тяга: крючок прикладывается к перстневидному кольцу и поднимается. |
Наиболее серьезным осложнением для пациента в контексте хирургического лечения проходимости дыхательных путей является то, что отсроченное принятие решения после неудачной исходной интубации приводит к длительным, неэффективным попыткам интубации, которые приводят к гипоксическому поражению.Неспособность быстро ввести трахеотомическую трубку в трахею или неправильное размещение трубки в мягких тканях шеи является скорее техническим недостатком, чем осложнением, и это должно быть обнаружено немедленно, как и в случае любой неправильно установленной ЭТТ. Осложнения, такие как пневмоторакс, значительное кровотечение, требующее оперативного вмешательства, травма гортани или трахеи, а также долгосрочные осложнения, такие как субгортанный стеноз или постоянное изменение голоса, возникают относительно редко и обычно незначительны.Возможность возникновения этих осложнений никоим образом не перевешивает необходимость установления проходимости дыхательных путей. В целом частота всех осложнений, немедленных и отсроченных, серьезных или незначительных, составляет примерно 20%. Большинство из этих осложнений незначительны, особенно по сравнению с последствиями постоянно нарушенной проходимости дыхательных путей. Во вставке 16-3 перечислены осложнения хирургического лечения дыхательных путей.
В целом частота всех осложнений, немедленных и отсроченных, серьезных или незначительных, составляет примерно 20%. Большинство из этих осложнений незначительны, особенно по сравнению с последствиями постоянно нарушенной проходимости дыхательных путей. Во вставке 16-3 перечислены осложнения хирургического лечения дыхательных путей.
Рисунок 16-13 • Интубация: трахеостомическая трубка вводится в разрез, поскольку крючок стабилизирует перстневидное кольцо. |
ВСТАВКА 16-3 Осложнения хирургического лечения проходимости дыхательных путей
· Кровоизлияние
· Пневмомедиастинум
· Травма гортани / трахеи
· Разрыв перстневидного кольца
· Баротравма (транстрахеальная струйная вентиляция)
· Инфекция
· Смена голоса
· Подсвязочный стеноз
Методика крикотиротома
Техника Сельдингера
Доступно множество коммерческих устройств для крикотиротома. В универсальном наборе катетеров для экстренной крикотиротомии Melker используется модифицированная техника Сельдингера, помогающая установить дыхательные пути трахеи (рис. 16-1 и 16-14A). Этот метод похож на тот, который обычно используется при установке центральных венозных катетеров, и предлагает некоторое знакомство оператору, который не чувствует себя комфортно или не имеет опыта в хирургической технике крикотиротомии, описанной ранее. Рекомендуются устройства с надувной манжетой (рис. 16-14B).
В универсальном наборе катетеров для экстренной крикотиротомии Melker используется модифицированная техника Сельдингера, помогающая установить дыхательные пути трахеи (рис. 16-1 и 16-14A). Этот метод похож на тот, который обычно используется при установке центральных венозных катетеров, и предлагает некоторое знакомство оператору, который не чувствует себя комфортно или не имеет опыта в хирургической технике крикотиротомии, описанной ранее. Рекомендуются устройства с надувной манжетой (рис. 16-14B).
1. Укажите ориентиры. Перстневидно-щитовидная мембрана идентифицируется описанным ранее методом. Недоминирующая рука используется для контроля гортани и идентификации ориентиров.
2. Подготовить шейку. Антисептический раствор наносится на переднюю часть шеи, и, если позволяет время, рекомендуется инфильтрация этого места 1% лидокаином с адреналином.
3. Вставьте локаторную иглу. Затем локаторную иглу (калибр 18) вводят в перстнещитовидную мембрану немного каудально (рис. 16-14С). Игла присоединяется к шприцу и продвигается доминирующей рукой, в то время как на шприце поддерживается отрицательное давление. Внезапное вдыхание воздуха свидетельствует о введении иглы в просвет трахеи.
16-14С). Игла присоединяется к шприцу и продвигается доминирующей рукой, в то время как на шприце поддерживается отрицательное давление. Внезапное вдыхание воздуха свидетельствует о введении иглы в просвет трахеи.
4. Вставьте направляющий провод. Затем шприц вынимается из иглы. Проволочный проводник с мягким наконечником вводится через иглу в трахею в каудальном направлении (рис. 16-14D). Затем игла удаляется, а проволока остается на месте. Необходимо постоянно контролировать провод.
5. Надрезать кожу. Затем рядом с проволокой делается небольшой кожный разрез. Это облегчает прохождение воздуховода через кожу (рис. 16-14E). В качестве альтернативы, разрез кожи можно сделать вертикально над мембраной перед введением иглы и проволочного проводника.
6. Вставьте дыхательный путь и расширитель. Катетер для дыхательных путей (внутренний диаметр 3–6 мм [ID]) с установленным внутренним расширителем вводится через проволоку в трахею (рис.16-14F). Если сопротивление будет встречено, кожный разрез следует углубить и легкими вращательными движениями применить к устройству дыхательных путей (рис. 16-14G). Когда устройство для дыхательных путей прочно вошло в трахею, провод и расширитель удаляются вместе (рис. 16-14H).
Рисунок 16-14 • A: Состав комплекта. B: Трубка с манжетой. C: Установка иглы. D: Проволока через иглу. E: Маленький разрез. F: Дыхательный путь с расширителем, введенным с проволочной направляющей. G: Дыхательный канал вставлен в ступицу легким вращательным движением. H: Проволока и расширитель удалены как одно целое. (Универсальный набор для крикотиротомии Melker, Cook Critical Care, Блумингтон, Индиана) |
7. Подтвердите местоположение трубки. Если на устройстве есть манжета, накачайте ее в это время. Затем можно подтвердить местоположение трубки, как при хирургической крикотиротомии, включая обязательное определение CO 2 в конце выдоха.На рентгенограммах аппараты рентгеноконтрастны. После этого необходимо надежно закрепить дыхательные пути.
Устройства прямого введения в дыхательные пути
В продаже имеется несколько устройств для прямого прохождения дыхательных путей (например, Nu-Trake, Pertrach). Обычно они включают несколько этапов введения с использованием большого устройства, которое функционирует как интродуктор, так и как дыхательный путь. Подробная информация о стентировании шунтирования дыхательных путей
при тяжелой эмфиземе
Эмфизема поражает около 60 миллионов человек во всем мире.Это заболевание, связанное со значительной заболеваемостью в виде одышки, ограничения физических упражнений и смертности. Патология, стоящая за этим, заключается в разрушении паренхимы легких, как стенок альвеол, так и интерстициальной ткани.
Введение:
Эмфизема поражает около 60 миллионов человек во всем мире. Это заболевание, связанное со значительной заболеваемостью в виде одышки, ограничения физических упражнений и смертности. Патология, стоящая за этим, заключается в разрушении паренхимы легких, как стенок альвеол, так и интерстициальной ткани.Физиологические особенности заключаются в потере упругой отдачи, приводящей к обструкции воздушного потока в состоянии покоя и динамической гиперинфляции. В свою очередь, это нарушает механику дыхания, что в конечном итоге приводит к дыхательной недостаточности.
Рисунок 1 — Разрез легкого, показывающий нормальное легкое (слева; A) и тяжелую эмфизему (справа; B). Обратите внимание на смежные макроскопические расширенные воздушные пространства в последнем.
Деструкция паренхимы легких обычно видна макроскопически при патологоанатомическом исследовании или в течение жизни при компьютерной томографии с высоким разрешением (HRCT) (, рис. 1, ).Было отмечено, что газы могут переходить из одной доли или даже доли в соседнюю долю или долю через патологические пути «побочной вентиляции» [1]. В отличие от нормальных субъектов, Terry и соавторы [2] отметили у пациентов с эмфизематозом, что сопротивление этих коллатеральных путей снижалось с увеличением растяжения легких, в то время как сопротивление фактически возрастало в собственных дыхательных путях. Это привело к тому, что Маклем предложил возможность использования этих путей с низким сопротивлением для вентиляции легких непосредственно через отверстие в грудной стенке (дыхальце), «минуя» закупоренные дыхательные пути [3].Дыхальца представляют собой нормальный механизм газообмена у насекомых и акул.
Используя эти концепции и свой опыт хирургического уменьшения объема легких при эмфиземе, Джоэл Купер и его коллеги из Вашингтонского университета выдвинули гипотезу о том, что создание прямых проходов между дыхательными путями и легочной паренхимой уменьшит гиперинфляцию, тем самым улучшив механику легких и уменьшив обструкцию воздушного потока [4 ]. Они описывают серию из 12 эксплантированных эмфизематозных легких человека, взятых во время трансплантации и оцененных в барокамере до и после введения 3-5 небольших паренхиматозных стентов для дыхательных путей.После 3 стентов объем форсированного выдоха за одну секунду (ОФВ1) снизился с 245 + 107 до 447 + 199 мл (p <0,001). Это увеличилось до 666 + 248 мл (p <0,001) с дополнительными 2 стентами. Дальнейшая предварительная работа на людях и животных подтвердила осуществимость и безопасность процедуры обхода дыхательных путей [5,6], и с коммерческим спонсором (Broncus Technologies, Inc., Маунтин-Вью, Калифорния) проводятся исследования фазы II [7].
Выбор пациентов и техника:
Процедура обхода дыхательных путей Exhale® в настоящее время предназначена для амбулаторных стабильных пациентов с тяжелой двусторонней эмфиземой и гиперинфляцией (т.е., ОФВ1 <40% прогнозируемого, остаточный объем> прогнозируемого 220%, общая емкость легких> прогнозируемого 133%). Он направлен на значительное уменьшение остаточного объема, что, в свою очередь, приведет к улучшению одышки и качества жизни [7]. Исследования показывают, что снижение ПЖ является основой для улучшения функции легких после вмешательств по уменьшению объема [8] и является наиболее чувствительной физиологической мерой ответа на лечение у пациентов с эмфиземой [9].
Процедура выполняется с использованием 4.Гибкий волоконно-оптический бронхоскоп 8 мм (с рабочим каналом 2 мм) через большую эндотрахеальную трубку или жесткий бронхоскоп под общей анестезией [5,6] ( Видео 1 ). Катетер Доплера (Broncus Technologies, Inc.) вводится в дыхательные пути через рабочий канал для обнаружения перибронхиальных сосудов. Затем тщательно выбирается подходящий участок без прилегающей сосудистой сети на сегментарном или субсегментарном уровне. В идеале, этот участок будет коррелировать с участками наиболее серьезных разрушений, как указано на предоперационной КТВР.После удаления допплеровского зонда комбинация иглы 25 калибра и баллонного катетера 2,5 мм (Broncus
Рисунок 2 — Стент для обхода дыхательных путей Broncus® по размеру в сравнении с головкой карандаша.
Technologies, Inc.) используется для прокола стенки дыхательных путей и создания отверстия для стента. Игла извлекается, и проход повторно проверяется доплеровским датчиком, прислушиваясь к любому сигналу, указывающему на кровоток. После удаления допплеровского зонда комбинированный стент и баллонный катетер (Broncus Technologies, Inc.) помещается в новое отверстие, и стент раскрывается за счет надувания баллона. Специально разработанный стент из нержавеющей стали, покрытый силиконовой резиной, расширяется до 3 мм в длину и 3 мм в ширину ( Видео 2 ). Обычно через стент можно увидеть эмфизематозную паренхиму легкого (, рис. 2, ). Процедуры 30–120 минут, в зависимости от точной анатомии бронхов и сосудов, а также от количества установленных стентов (в настоящее время максимум 6).
Видео 1
Видео 2
Специфические интраоперационные осложнения процедуры связаны с возможностью кровотечения в дыхательных путях, пневмоторакса и других утечек воздуха.Тщательное сканирование сосудов дыхательных путей с помощью допплера имеет решающее значение для минимизации вероятности кровотечения; Используя этот подход, Choong сообщил о 8 эпизодах незначительных кровотечений при установке 157 стентов у 25 собак [10], в то время как Lausberg сообщил о установке 47 стентов у 15 человек с 2 легко управляемыми эпизодами кровотечения (<20 мл, леченных всасыванием и местным адреналином) [4]. Однако одна смерть произошла после интраоперационного кровотечения в последней серии из 30 человек [7,11].Один пневмоторакс, лечившийся с помощью установки межреберной трубки, был описан в серии из 70 стентов, установленных у 12 собак [6], в то время как серия исследований Лаусберга с людьми не выявила никаких пневмотораксов.
На сегодняшний день около 30 человек прошли процедуру обхода дыхательных путей в соответствии с протоколами, описанными выше [7], с приближением более крупного рандомизированного исследования [11]. Результаты для 30 пациентов еще не опубликованы. В настоящее время опубликованные данные об эффективности ограничиваются обсуждением проходимости стента на модели собаки [6,10].По сравнению с необработанными стентами Choong продемонстрировал улучшенную проходимость стентов, многократно окрашенных местно с использованием 0,2 мл 1 мг / мл митомицина С или стентов, элюирующих паклитаксел [6,10]. Действительно, 65% из 107 стентов с паклитакселом у 25 собак оставались проходимыми через 12 недель [10].
Обсуждение:
Крайне необходимы методы лечения, которые могут улучшить клинические симптомы эмфиземы. Основываясь на представленных ранних работах на животных и людях, процедура обхода дыхательных путей имеет для этого значительный потенциал.Баланс между безопасностью и эффективностью имеет решающее значение, но у пациентов с симптоматической, сильно обструктивной и гиперинфлированной диффузной эмфиземой трансплантация легких может быть единственной альтернативной терапией, и риски следует, по крайней мере, учитывать в этом контексте. Эффективность пока не доказана. Вероятно, что эффективность будет, по крайней мере, связана с продолжительностью проходимости стентов; с этой целью перспективна развивающаяся работа Choong со стентами с лекарственным покрытием [10]. В качестве альтернативы, когда возникает обструкция стента, может оказаться возможным повторно открыть заблокированные стенты или повторить первоначальную процедуру в соседнем дыхательном пути.
Заключение:
В настоящее время технически возможно безопасно размещать небольшие стенты из дыхательных путей в паренхиму легких у людей с тяжелой эмфиземой. Степень и длительность клинических и физиологических улучшений, связанных с этой новой терапией, еще предстоит осознать, и мы очень ждем первых результатов текущих исследований на людях.
Примечание : Все фото и видео любезно предоставлены компанией Broncus Technologies.Автор не имеет личных прямых финансовых отношений с Broncus Technologies, но является исследователем их стента для обхода дыхательных путей.
Список литературы
- Woolcock AJ, Macklem PT. Механические факторы, влияющие на коллатеральную вентиляцию легких человека, собаки и свиньи. J. Appl Physiol 1971; 30: 99-115.
- Терри П. Б., Трайстман П. Т., Терлбек В. М.. Сопротивление коллатеральных каналов в иссеченных легких человека. Дж. Клин Инвест, 1969; 48: 421-431.
- Macklem PT: Дополнительная вентиляция.New Engl J Med 1978; 298: 49-50.
- Lausberg HF, Chino K, Patterson GA, Meyers BF, Toeniskoetter PD, Cooper JD. Бронхиальная фенестрация улучшает поток выдоха в легких человека с эмфизематозом. Энн Торак Сург 2003; 75: 393-398.
- Рендина Э.А., ДеДжакомо Т., Венута Ф., Колони Г.Ф., Мейерс Б.Ф., Паттерсон Г.А., Купер Дж.Д. Возможность и безопасность процедуры обхода дыхательных путей у пациентов с эмфиземой. J Thorac Cardiovasc Surg 2003; 125: 1294-1299.
- Чунг С.К., Хаддад Ф.Дж., Джи ЭЙ, Купер Дж.Д.Возможность и безопасность установки стента для обхода дыхательных путей и влияние местного митомицина С на проходимость стента. J Thorac Cardiovasc Surg 2005; 129: 632-638.
- www.clinicaltrials.gov/ct/show/NCT00207337?order=4, по состоянию на 27 октября 2005 г.
- Ingenito EP, Loring SH, Moy ML, Mentzer SJ, Swanson SJ, Reilly JJ. Физиологическая характеристика вариабельности ответа на операцию по уменьшению объема легких. J Appl Physiol. 2003; 94: 20-30.
- O’Donnell DE, Forkert L, Webb KA. Оценка реакции бронходилататоров у пациентов с «необратимой» эмфиземой.Eur Respir J. 2001; 18: 914-20.
- www.aats.org/annualmeeting/Abstracts/2005/printXML_1_68_68, по состоянию на 20 октября 2005 г.
- Личное общение Т. Крамер, Broncus Technologies
Frontiers | Новый неинвазивный подход к измерению сжимаемости верхних дыхательных путей у мышей
Введение
Обструктивное апноэ во сне — распространенное заболевание с предполагаемой распространенностью от 2 до 4% в общей популяции (1, 2). Он характеризуется прежде всего повторяющейся окклюзией верхних дыхательных путей во время сна.Последующая десатурация оксигемоглобина и периодические возбуждения составляют основную сердечно-легочную и метаболическую заболеваемость этого расстройства (3, 4). Постоянное положительное давление в дыхательных путях в носу может лечить обструктивное апноэ во сне, открывая глоточные дыхательные пути (5). Хотя СИПАП остается основой терапии, его приемлемость затруднена из-за низкой приверженности терапии (6). Недавно фармакологические альтернативы CPAP были апробированы для конкретных подгрупп пациентов (7–9). Тем не менее, разработке новых стратегий препятствует отсутствие легко развертываемых моделей на животных, в которых можно было бы провести доказательные исследования концепции для моделирования и лечения обструкции верхних дыхательных путей.
Исследователи продемонстрировали, что повышение гибкости глотки играет ключевую роль в патогенезе обструктивного апноэ во сне (10–12), что отражается в повышении критического давления закрытия (P CRIT ). Предыдущие исследования на крупных животных смоделировали структурные изменения и нарушения нервно-мышечного контроля верхних дыхательных путей (13–15), оба из которых могут способствовать повышению P CRIT . Совсем недавно исследователи смогли определить пассивные структурные и активные нервно-мышечные компоненты сжимаемости дыхательных путей у грызунов (16–18), охарактеризовав P CRIT по вариациям динамики давления и потока в дыхательных путях в течение дыхательного цикла (17–20).У мышей обструкция выдоха развивается во время постепенного снижения назального давления, когда назальное и трахеальное давление расходятся по мере ослабления нервно-мышечной активности. Исследователи использовали этот подход для характеристики воздействия факторов риска апноэ во сне (например, ожирения, центрального ожирения и возраста) (17, 18), нервно-мышечной активности (21) и нейрогуморальных факторов (например, лептина) (18, 22) на дыхательные пути. разборчивость. Тем не менее, мониторинг давления в трахее поставил серьезные технические проблемы и ограничил этот подход экспериментами по невыживанию.
Основная цель настоящего исследования заключалась в разработке оптимизированного неинвазивного метода для характеристики сжимаемости дыхательных путей у анестезированных мышей во время постепенного снижения назального давления без мониторинга давления в трахее. Мы предположили, что отрицательное назальное давление будет препятствовать прохождению дыхательных путей, когда нервно-мышечная активность глотки ослабевает во время выдоха. В этих обстоятельствах обструкция выдоха должна характеризоваться уменьшением потока выдыхаемого воздуха, задержкой воздуха в легких за препятствием и удлинением выдоха.Мы предположили, что амплитуда и временные показатели обструкции потока выдыхаемого воздуха могут быть использованы для оценки золотого стандарта измерений P CRIT на основе измерений давления в трахее (7, 18). Наши результаты предлагают новый подход к оптимизации измерений P CRIT как у людей, так и у животных.
Методы
Подход
В предыдущей работе был разработан подход к измерению P CRIT путем понижения назального давления в виде пандуса и определения назального давления, при котором давление в трахее расходится (17, 18).Когда назальное давление упало ниже P CRIT , мы обнаружили, что назальное давление больше не передавалось в трахею, когда дыхательные пути становились наиболее гибкими во время фазы выдоха дыхательного цикла. Во время вдоха давление в носу и трахее снова уравновешивалось, что указывало на восстановление проходимости дыхательных путей с фазовой нервно-мышечной активностью верхних дыхательных путей. Этот метод требовал размещения и поддержания сигнала трахеального давления с высокой точностью через трахеостомию во время операции, не связанной с выживанием, что серьезно ограничивало ее применимость по техническим причинам и исключало повторные измерения с течением времени.
Чтобы преодолеть эти ограничения, мы оценили признаки обструкции потока выдыхаемого воздуха из сигналов приливного воздушного потока во время отрицательного изменения назального давления (рис. 1). Как и прежде, для непрерывного мониторинга приливного воздушного потока использовалась плетизмография без головы (17, 18). Этот сигнал использовался для получения показателей амплитуды и времени для определения давления в носу, при котором возникла обструкция воздушного потока на выдохе (спадение глотки). В частности, мы оценили влияние постепенного снижения назального давления на пиковый поток выдоха и дыхательный объем, а также на продолжительность выдоха и рабочий цикл.P CRIT оценивался по уровню назального давления, при котором развитие обструкции потока выдыхаемого воздуха можно было предположить по изменениям этих параметров, и сравнивался с измерениями золотого стандарта P CRIT . P Оценки CRIT были получены из записей в предыдущих экспериментах (17, 18).
Рисунок 1 . Экспериментальная установка с мышью в камере, запечатанной вокруг шеи. Мыши были проинструктированы, чтобы контролировать соотношение давления и потока в верхних дыхательных путях.Маска с закрытой мордой, прикрепляемая к ноздрям с закрытым ртом. Контролируется давление в носу и трахее, а также приливный поток воздуха из камеры. К носу подсоединен источник переменного давления. Электромиографическая активность на вдохе фаза гениально-язычного яруса (EMG GG ; условные единицы, у.е.) с сердечным артефактом (спайками).
Дизайн исследования
Оценки
Gold Standard и P CRIT были измерены на двух группах мышей. Группа развития ( n = 8) была использована для моделирования ассоциаций между золотым стандартом P CRIT и прогнозируемыми физиологическими параметрами минимум из 3 опытов на каждой мыши.Затем уравнения регрессии из набора данных разработки были применены к данным группы проверки ( n = 16), чтобы проверить их точность при прогнозировании P CRIT . Это исследование было проведено в соответствии с рекомендациями и одобрением Комитета по уходу и использованию животных Джонса Хопкинса.
Мыши
Самцов мышей C57BL / 6J (BL6) были получены из лаборатории Джексона (Бар-Харбор, штат Мэн), содержались в помещении для микроизоляции с контролируемой температурой и влажностью, получали обычную пищу и воду ad libitum , и исследовали через ~ 14 недель. возраста (таблица 1).Протоколы исследования были одобрены Комитетом по уходу и использованию животных Джонса Хопкинса (JHACUC), и все эксперименты на животных проводились в соответствии с руководящими принципами JHACUC. Возраст и масса мышей-самцов указаны в исследованиях, проведенных в предыдущих экспериментах по контролю над верхними дыхательными путями у мышей (17, 18).
Таблица 1 . C57BL / 6J Характеристики мыши.
Экспериментальная установка, процедуры и протокол
Мышей оснастили инструментами и изучали экспериментально, как описано ранее (17, 18).Вкратце, анестезия изофлураном была титрована между 0,5 и 1,5% (обычно ~ 1%) для достижения частоты дыхания в диапазоне от 60 до 80 в минуту. Для минимизации секреции дыхательных путей вводили атропин (0,001 мг внутримышечно), а температуру тела поддерживали на уровне 36,5–37,5 ° C. Затем трахею канюлировали с помощью конической канюли через разрез по средней линии, и канюлю фиксировали швами. Две тонкие спицы с тефлоновым покрытием также были проделаны подкожно и с двух сторон пришиты к вентральной поверхности группы подъязычно-подъязычных / подъязычно-язычных мышц.Затем рот был закрыт. Затем мышь помещали в плетизмограф, направленный наружу, в положение лежа (17, 18).
Экспериментальная установка для регистрации давления-расхода состояла из следующего. Над мордой помещали плотно прилегающую назальную канюлю с малым мертвым пространством и плотно прилегающей к ней носовой канюлей, которую подключали к продувочному дыхательному контуру, через который вводили свежий кислород и изофлуран. Назальное давление (P N ) и давление в трахее (P TRACH ) контролировали с помощью датчиков перепада давления, относящихся к атмосферному давлению.Калиброванный пневмотахометр с ламинарным потоком был установлен на плетизмограф и подключен к датчику дифференциального давления. Все сигналы давления и воздушного потока были усилены и оцифрованы для отображения, хранения и анализа данных в реальном времени. Сигнал электромиографической активности подбородочно-язычного слухового прохода (EMG GG ) был усилен, подвергнут полосовой фильтрации от 30 до 1000 Гц, оцифрован с частотой 1 кГц, выпрямлен и вычислено скользящее среднее с постоянной времени 55 мс.
Для определения P CRIT , P N был понижен наподобие пандуса с ~ +5 см вод. Ст. 2 O до ~ -20 см вод. Ст. 2 O (рис. 2).Перед каждым накатом P N проходимость трахеостомической трубки обеспечивалась промыванием трахеальной канюли. В конце исследования мышей умерщвляли передозировкой пентобарбитала (60 мг IP).
Рисунок 2 . Критическое давление (P CRIT ), определяемое по нарастающему снижению назального давления (P N ) за серию вдохов примерно от +5 до -20 см H 2 О. Поскольку P N постепенно снижается, P на выдохе N и давление в трахее (P TRACH ) отслеживали друг друга в течение начальной серии вдохов (слева от вертикальной пунктирной линии), указывая на проходимость дыхательных путей.Как только назальное давление упало ниже P CRIT (справа от вертикальной линии), назальное и трахеальное давление расходились во время выдоха (Expir), но не во время вдоха (Insp), что указывает на обструкцию выдоха. Физиологические маркеры обструкции потока выдыхаемого воздуха наблюдались в ответе приливного воздушного потока на уменьшение P N , включая изменение направления пикового потока выдоха, дыхательного объема (площадь под кривой выдоха по сравнению с графиком потока вдоха), времени (T E ) и рабочего цикла Т Е / Т ТОТ ).В конце выдоха внезапная струя выдыхаемого потока (см. *) Совпадает с началом электромиографической активности фазового язычного язычка (не показано), что указывает на высвобождение захваченного воздуха при повторном открытии глотки.
Анализ данных
Функцию верхних дыхательных путей оценивали во время выдоха (17, 18), когда EMG GG упала до тонического уровня. Золотой стандарт измерений пассивного P CRIT был определен P N , при котором P TRACH в конце выдоха расходился с дальнейшим уменьшением P N .Ранее мы продемонстрировали, что место обструкции выдоха на этой модели мыши было расположено рострально по отношению к небному краю и было неотличимо от результатов измерений P CRIT во время полной нервно-мышечной блокады (17).
Каждое линейное изменение P N (прогон) оценивалось для определения P CRIT как P N , при котором дальнейшее уменьшение P N больше не передавалось на P TRACH в конце срока действия, как описано ранее. (17, 18) (рисунок 3).Чтобы обеспечить точность измерений P CRIT , требовалось минимум 5 вдохов для оценки P CRIT в диапазоне P N от 0 до -10 см вод. Ст. 2 O, тем самым обеспечивая достаточную разрешающую способность для выявления расхождения. в P N и P TRACH . Точные оценки P CRIT были также обеспечены путем введения требования о резком изменении или обратном изменении амплитуды и временных параметров в ходе линейного изменения назального давления, как показано на рисунке 4.
Рисунок 3 . Метод измерения критического давления по золотому стандарту (P CRIT ). Градиент давления на выдохе, возникающий между назальным (P N ) и трахеальным (P TRACH ) давлениями во время линейного снижения P N для записи, показанной на рисунке 2. P N и P TRACH расходились, что указывает на что дыхательные пути заблокированы, когда P N упало ниже критического давления (P CRIT на горизонтальной пунктирной линии).Точки данных представляют измерения P N (ромбики) и P TRACH (кружки) для каждого дыхательного цикла.
Рисунок 4 . Метод оценки золотого стандарта P CRIT с физиологическими заменителями обструкции выдоха. Изменения продолжительности выдоха, рабочего цикла выдоха, пикового потока выдоха, дыхательного объема выдоха и отношения дыхательного объема выдоха к дыхательному объему (Tv) на выдохе происходили на одном и том же вдохе в рампе отрицательного давления, показанной на Рисунке 2.Открытые ромбики выделяют дыхание, при котором произошли эти переходы, и соответствующее назальное давление, используемое для оценки критического давления. P CRIT оценки и измерения золотого стандарта (тонкая вертикальная линия на каждом графике) хорошо совпадают.
Физиологические маркеры обструкции выдоха были получены из сигнала приливного воздушного потока и нанесены на график в зависимости от среднего назального давления в конце выдоха в начале и в конце каждого вдоха во время постепенного изменения скорости, как показано ниже. Пиковый поток выдыхаемого воздуха был измерен непосредственно по кривой выдыхаемого потока.Дыхательные объемы вдоха и выдоха рассчитывались путем интегрирования сигналов воздушного потока во время каждой фазы дыхательного цикла. Этот сигнал использовался для получения дыхательного объема выдоха и отношения дыхательного объема выдоха к вдоху (далее обозначаемого как отношение дыхательного объема ). Также были измерены индексы времени дыхания, включая продолжительность выдоха (T E ) и рабочий цикл выдоха (T E / T TOT ), где T TOT — это период всего дыхательного цикла.Как видно на Рисунке 2, начало обструкции потока выдыхаемого воздуха было также связано с увеличением постоянной времени выдоха и прединспираторной струей выдыхаемого воздуха. Последнее совпало с началом фазовой инспираторной активности и представляло собой высвобождение захваченного воздуха из легких при повторном открытии дыхательных путей (см. Ниже).
Затем были нанесены
амплитудные и временные параметры относительно P N . Эти графики использовались для оценки P CRIT как уровня P N , при котором происходили изменения или изменения этих параметров в зависимости от дыхания (рис. 4), что согласуется с развитием обструкции потока выдыхаемого воздуха.P Значения CRIT были оценены для каждого индекса обструкции дыхательных путей на выдохе и сравнивались с измерениями золотого стандарта P CRIT .
Статистический анализ
Наш аналитический план был разработан (1) для сравнения физиологических суррогатов обструкции выдыхаемого воздушного потока с измерениями золотого стандарта P CRIT в наборе данных разработки и (2) для прогнозирования P CRIT в проверочной выборке. В наборе данных разработки использовалась линейная регрессия для моделирования взаимосвязи между золотым стандартом и каждой оценкой P CRIT .Эти прогнозные уравнения затем были применены к набору данных проверки, чтобы определить, насколько хорошо каждая оценка P CRIT предсказывала золотой стандарт P CRIT . Анализ Бланда-Альтмана применяли для сравнения различий между физиологическими маркерами и золотым стандартом P CRIT , а также для определения смещения и доверительных интервалов для каждого физиологического суррогата с золотым стандартом P CRIT . В каждом наборе данных для моделирования этих взаимосвязей использовались средние значения для оценок золотого стандарта и P CRIT .Все анализы проводились в XLSTAT (Microsoft Inc.). Статистическая значимость была выведена на уровне p <0,05. Значения были выражены как средние ± стандартная ошибка.
Результаты
Иллюстративное изменение назального давления
На рисунке 4 амплитуда и временные параметры показаны для каждого вдоха в рампе назального давления, показанной на рисунке 2. P Оценки CRIT показаны для каждого параметра в точке, где он меняет курс (см. Переходное дыхание на открытых ромбах, рисунок 4) и совпадают с золотым стандартом P CRIT (см. Вертикальные тонкие линии).На каждом графике резкое изменение наклона происходит между непрерывным дыханием в начале линейного изменения и затрудненным дыханием в конце линейного изменения. Начальное уменьшение продолжительности выдоха и рабочего цикла, а также увеличение пикового потока выдоха, дыхательного объема и отношения дыхательного объема выдоха к дыхательному объему на вдохе можно увидеть по мере того, как назальное давление постепенно снижается, что соответствует увеличению управляющего давления по отношению к потоку выдоха. Однако дальнейшее снижение назального давления сверх золотого стандарта P CRIT приводит к постепенному увеличению продолжительности выдоха и рабочего цикла, а также к уменьшению пиковой скорости выдоха, дыхательного объема и соотношения дыхательных объемов.Внезапное изменение каждого параметра может быть связано с развитием обструкции выдоха, на что указывает расхождение между назальным и трахеальным давлением на выдохе по золотому стандарту P CRIT (рисунки 2, 3).
Набор данных для разработки
В ограниченном наборе данных разработки модели линейной регрессии продемонстрировали, что назальное давление, при котором продолжительность выдоха начинала увеличиваться во время нарастания назального давления, было важным предиктором золотого стандарта P CRIT и составляло 54% дисперсии этого параметр (Таблица 2, p = 0.038). Точно так же была обнаружена тенденция между назальным давлением, при котором дыхательный объем выдоха начал падать, и золотым стандартом P CRIT (таблица 2, p = 0,121). Однако изменения в других амплитудных и временных параметрах не были связаны с измерениями золотого стандарта P CRIT (Таблица 2, p = н.у.).
Таблица 2 . Модели регрессии для золотого стандарта по сравнению с оценкой P CRIT на основе критериев времени и амплитуды в наборе данных разработки ( n = 8).
Набор данных валидации
После применения уравнений регрессии, сгенерированных в результате разработки, к набору данных проверки, мы обнаружили, что связь между изменением продолжительности выдоха и P CRIT сохраняется ( p = 0,004, таблица 3). Мы также обнаружили, что ассоциации оставались значимыми, когда среднее значение всех параметров и когда средние значения времени и амплитуды использовались для прогнозирования золотого стандарта P CRIT (рис. 5, верхние панели).Графики Бланда-Альтмана для каждого набора переменных-предикторов продемонстрировали небольшое смещение в оценках P CRIT (рис. 5, нижние панели). Тем не менее, существенное сокращение общей систематической ошибки и доверительных интервалов (ДИ) вокруг оценок P CRIT произошло на основе среднего значения всех параметров и среднего значения для временных и амплитудных параметров (рисунок 5, нижние панели). Последнее указывает на то, что параметры среднего времени выдоха и амплитуды обеспечивают надежные оценки P CRIT у наркозных мышей.
Таблица 3 . Модели регрессии для золотого стандарта по сравнению с оценкой P CRIT на основе критериев времени и амплитуды в наборе данных проверки ( n = 16).
Рисунок 5 . Линейные и прямоугольные диаграммы для оценочного и золотого стандарта P CRIT в группе валидации, основанной только на продолжительности выдоха (верхняя левая панель), средних значениях для всех физиологических суррогатов (верхняя средняя панель) и средних временных и амплитудных средних суррогатов (верхняя правая панель) ) вместе с соответствующими графиками Бланда-Альтмана (нижние панели).Смещение и доверительные интервалы (CI) уменьшаются, когда для оценки P CRIT используются суррогатные средние (средняя и правая против левой нижней панели).
Обсуждение
Настоящее исследование позволило сделать два важных вывода. Во-первых, наш набор данных по разработке демонстрирует постоянную взаимосвязь между измерениями золотого стандарта P CRIT и конкретными маркерами обструкции воздушного потока на выдохе, а именно продолжительностью выдоха и дыхательным объемом выдоха. Во-вторых, после применения уравнений регрессии от разработки к набору данных проверки мы обнаружили, что комбинация амплитуды выдоха и временных параметров оказалась надежными предикторами золотого стандарта P CRIT с минимальной систематической ошибкой и узкими доверительными интервалами.Взятые вместе, наши результаты показывают, что маркеры обструкции воздушного потока на выдохе можно использовать для моделирования сжимаемости верхних дыхательных путей в пассивных (гипотонических) условиях, и что эти маркеры могут обеспечить чувствительные измерения изменений сжимаемости дыхательных путей в моделях обструктивного апноэ во сне на грызунах. Такой подход устраняет необходимость в установке трахеальной канюли (как это требуется для проведения измерений золотого стандарта P CRIT ) и, таким образом, может облегчить неинвазивные повторные измерения P CRIT у грызунов с течением времени.
Наши результаты демонстрируют заметные изменения в динамике давления-потока на выдохе во время роста отрицательного давления между периодами с обструкцией верхних дыхательных путей и без нее. Эти различия связаны с динамическим увеличением коллапсируемости дыхательных путей во время выдоха, когда нервно-мышечная активность глотки ослабевает у анестезированных грызунов (16-18). Во время выдоха гибкость глотки в значительной степени определяется механическими свойствами верхних дыхательных путей, которые повышаются до уровней, наблюдаемых при полной нервно-мышечной блокаде (17, 23).Сначала прогрессирующее снижение назального давления приводило к быстрому увеличению потока выдоха и дыхательных объемов (рис. 6, L по сравнению со средней панелью). Пока дыхательные пути оставались полностью проходимыми во время вдоха, поток вдоха и дыхательный объем не изменялись (рис. 6, средняя панель). По мере дальнейшего снижения назального давления дыхательные пути разрушались, когда нервно-мышечная активность глотки ослабевала во время выдоха. Обструкция потока выдоха (рис. 6, панель R) привела к снижению пикового потока выдоха и дыхательного объема с воздухом, захваченным внутри легкого.Увеличение объема легких в конце выдоха активировало рецепторы растяжения легких (рефлекс Херринга-Брейера) (15, 24), что объясняет наблюдаемое увеличение продолжительности выдоха и рабочего цикла выдоха. Напротив, дыхательные объемы вдоха оставались хорошо сохраненными, поскольку фазовая нервно-мышечная активность восстанавливала проходимость дыхательных путей во время этой фазы дыхательного цикла (13, 14). Таким образом, резкие изменения продолжительности выдоха и рабочего цикла, а также пикового потока выдоха и дыхательного объема означали развитие динамического коллапса дыхательных путей выдоха во время нарастания назального давления.
Рисунок 6 . Моделирование влияния обструкции выдоха на время дыхания и амплитудные показатели. Когда назальное давление (P N ) было 0 или положительным, вдох и выдох оставались беспрепятственными (панель L). Первоначальные сокращения P N вытягивали воздух из легких и увеличивали выдох (средняя панель), тогда как вдох оставался неизменным (средняя панель). Напротив, дальнейшее снижение назального давления привело к схлопыванию глотки во время выдоха (панель R), что привело к снижению пиковой скорости выдоха и дыхательного объема.Улавливание выдыхаемого воздуха активировало рецепторы растяжения легких (рефлекс Херринга-Брейера), что увеличивало продолжительность выдоха и рабочий цикл. Однако фазовая активность глоточных мышц восстанавливает проходимость дыхательных путей, позволяя вдоху проходить нормально.
Наши данные о динамике потока выдоха во время постепенного снижения назального давления имеют как практическое, так и теоретическое значение. В предыдущих исследованиях установка и обслуживание трахеальной канюли требовали значительной подготовки, навыков и внимания к качеству сигнала.Современный подход устраняет необходимость в инвазивном мониторинге давления в трахее и упрощает подготовку к эксперименту. Идентификация физиологических маркеров обструкции потока выдыхаемого воздуха позволяет нам оптимизировать методы оценки пассивного P CRIT у анестезированных мышей. Таким образом, текущий подход сделает этот метод доступным для исследователей, стремящихся повысить производительность исследований, изучающих влияние генетических, экологических и фармакологических факторов на сжимаемость верхних дыхательных путей.Устранение необходимости в трахеостомии и интубации трахеи также облегчит повторные оценки P CRIT внутри мыши в ответ на вмешательства. Этот неинвазивный подход позволяет мышам пережить экспериментальное лечение и другие дополнительные измерения (например, визуализацию).
При оценке результатов нашего исследования следует учитывать несколько ограничений. Во-первых, все измерения проводились в стабильном состоянии анестезии, которая, как известно, снижает частоту дыхания, увеличивает фазовую инспираторную нервно-мышечную активность и снижает тоническую экспираторную активность.Фазовые различия в контроле механики дыхательных путей предрасполагают к обструкции выдоха и заметным изменениям амплитуды выдоха и временных показателей во время отрицательного роста назального давления. Во-вторых, не все точки перегиба этих индексов возникали равномерно с началом обструкции выдоха. Тем не менее, преобладающая картина возникла в отношении нескольких маркеров обструкции выдоха, что взаимно подкрепляло вывод о том, что коллапс произошел при определенных уровнях назального давления.В-третьих, хотя точные анатомические корреляты коллапса глотки не определены, мы ранее изолировали обструкцию небно-глоточных дыхательных путей (17), скорее всего, из-за коллапса небного края (14, 25). В-четвертых, мы признаем, что наш метод был специально разработан для оценки коллапсируемости глотки во время выдоха (когда активность ЭМГ была относительно низкой), что отражает структурные, а не нервно-мышечные детерминанты коллапсируемости дыхательных путей (16). Поэтому мы нацелены на измерения P CRIT на выдохе, регулируя концентрацию изофлурана, чтобы снизить частоту дыхания и продлить выдох.В этих условиях мы ранее показали, что наши измерения Pcrit на выдохе неотличимы от измерений во время полной нервно-мышечной блокады (17). В-пятых, мы признаем, что наши результаты не могут быть распространены на другие анестетики или на другие линии мышей любого возраста и веса.
Наши данные об обструкции выдоха у мышей имеют широкое применение для исследований как на грызунах, так и на людях. Снижение нервно-мышечной активности глотки во время выдоха может предрасполагать оба вида к обструкции воздушного потока на выдохе.Уникальное преимущество нашей методологии заключается в том, что она позволяет динамически оценивать степень разрушения дыхательных путей в пассивных условиях, когда нервно-мышечная активность дыхательных путей находится в покое. Таким образом, этот подход может идеально подходить для оценки влияния анатомических структур на коллапсируемость дыхательных путей, особенно при оценке пациентов во время медикаментозной эндоскопии сна при определенных типах реконструктивных (26–28) или подъязычных операций по стимуляции дыхательных путей (29). Наша методология также создает основу для изучения влияния фармакологических агентов и хемогенетики на лечение обструктивного апноэ во сне в экспериментальных исследованиях на мышах (30, 31).Наконец, оптимизация физиологической оценки коллапсируемости верхних дыхательных путей может служить для выяснения функциональных эффектов генетических дефектов у инбредных линий мышей (32, 33). Наш подход имеет потенциал для оптимизации измерений P CRIT и облегчения исследований между видами и вмешательствами.
Авторские взносы
YN, AS собрал и проанализировал данные, провел статистический анализ и подготовил рукопись. RA собрал и проанализировал данные.HP, LP и TC проанализировали данные и провели статистический анализ. В.П. подготовил рукопись.
Финансирование
NIH предоставил грантовую поддержку работе, описанной в этой рукописи.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
NIH R01HL128970, R01HL133100, R01HL138932, R01HL144859.
Список литературы
1. Peppard PE, Young T, Barnet JH, Palta M, Hagen EW, Hla KM. Повышенная распространенность нарушения дыхания во сне у взрослых. Am J Epidemiol. (2013) 177: 1006–14. DOI: 10.1093 / aje / kws342
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Янг Т., Пеппард П., Палта М., Хла К.М., Финн Л., Морган Б. и др. Популяционное исследование нарушения дыхания во сне как фактора риска гипертонии. Arch Intern Med. (1997) 157: 1746–52. DOI: 10.1001 / archinte.1997.00440360178019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Янг Т., П. Пеппард, Д. Готтлиб. Эпидемиология обструктивного апноэ во сне: взгляд на здоровье населения. Am J Respir Crit Care Med. (2002) 165: 1217–39. DOI: 10.1164 / rccm.2109080
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Салливан К.Э., Исса Ф.Г., Бертон-Джонс М., Ив Л. Устранение обструктивного апноэ во сне с помощью постоянного положительного давления в дыхательных путях, прикладываемого через ноздри. Ланцет (1981) 1: 862–5. DOI: 10.1016 / S0140-6736 (81) 92140-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Уивер Т.Э., Грюнштейн Р.Р. Соблюдение режима непрерывной терапии положительным давлением в дыхательных путях: проблема эффективного лечения. Proc Am Thorac Soc. (2008) 5: 173–8. DOI: 10.1513 / патс.200708-119MG
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Eckert DJ, Owens RL, Kehlmann GB, Wellman A, Rahangdale S, Yim-Yeh S, et al.Эзопиклон увеличивает порог респираторного возбуждения и снижает индекс апноэ / гипопноэ у пациентов с синдромом обструктивного апноэ сна с низким порогом возбуждения. Clin Sci. (2011) 120: 505–14. DOI: 10.1042 / CS20100588
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Эдвардс Б.А., Коннолли Дж. Г., Кампана Л. М., Сэндс С. А., Триндер Дж. А., Уайт Д. П. и др. Ацетазоламид ослабляет респираторную реакцию на возбуждение у пациентов с синдромом обструктивного апноэ во сне. Сон (2013) 36: 281–5.DOI: 10.5665 / sleep.2390
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Эдвардс Б.А., Сэндс С.А., Оуэнс Р.Л., Эккерт Д.Д., Ландри С., Уайт Д.П. и др. Комбинация дополнительного кислорода и снотворного заметно улучшает обструктивное апноэ во сне у пациентов с легкой или средней степенью разрушения верхних дыхательных путей. Сон (2016) 39: 1973–83. DOI: 10.5665 / sleep.6226
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Eckert DJ, White DP, Jordan AS, Malhotra A, Wellman A.Определение фенотипических причин обструктивного апноэ во сне. Выявление новых терапевтических целей. Am J Respir Crit Care Med. (2013) 188: 996–1004. DOI: 10.1164 / rccm.201303-0448OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Золото AR, Schwartz AR. Критическое давление в глотке. Почему и как использовать назальное постоянное положительное давление в дыхательных путях для диагностики. Сундук (1996) 110: 1077–88. DOI: 10.1378 / сундук.110.4.1077
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12.Шварц А.Р., О’Доннелл С.П., Барон Дж., Шуберт Н., Алам Д., Самади С.Д. и др. Гипотонические верхние дыхательные пути при обструктивном апноэ во сне: роль структур и нервно-мышечная активность. Am J Respir Crit Care Med. (1998) 157: 1051–7.
PubMed Аннотация | Google Scholar
13. Schwartz AR, Thut DC, Russ B, Seelagy M, Yuan X, Brower RG, et al. Влияние электростимуляции подъязычного нерва на механику воздушного потока в изолированных верхних дыхательных путях. Am Rev Respir Dis. (1993) 147: 1144–50. DOI: 10.1164 / ajrccm / 147.5.1144
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Schwartz AR, Thut DC, Brower RG, Gauda EB, Roach D., Permutt S, et al. Модуляция максимального инспираторного воздушного потока нервно-мышечной активностью: эффект CO2. J. Appl Physiol. (1993) 74: 1597–605. DOI: 10.1152 / jappl.1993.74.4.1597
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Силиджи М.М., Шварц А.Р., Расс Д.Д., Кинг Э.Д., Мудрый Р.А., Смит П.Л.Рефлекторная модуляция динамики воздушного потока через верхние дыхательные пути. J. Appl Physiol. (1994) 76: 2692–700. DOI: 10.1152 / jappl.1994.76.6.2692
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Лю А., Пичард Л., Шнайдер Х., Патил С.П., Смит П.Л., Полоцкий В. и др. Нейромеханический контроль изолированных верхних дыхательных путей мышей. J. Appl Physiol. (2008) 105: 1237–45. DOI: 10.1152 / japplphysiol.
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17.Полоцкий М., Эльсайед-Ахмед А.С., Пичард Л.Е., Ричардсон Р.А., Смит П.Л., Шнайдер Х. и др. Влияние возраста и веса на функцию верхних дыхательных путей на мышиной модели. J. Appl Physiol. (2011) 111: 696–703. DOI: 10.1152 / japplphysiol.00123.2011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Полоцкий М., Эльсайед-Ахмед А.С., Пичард Л., Харрис С.С., Смит П.Л., Шнайдер Х. и др. Влияние лептина и ожирения на функцию верхних дыхательных путей. J. Appl Physiol. (2012) 112: 1637–43.DOI: 10.1152 / japplphysiol.01222.2011
.


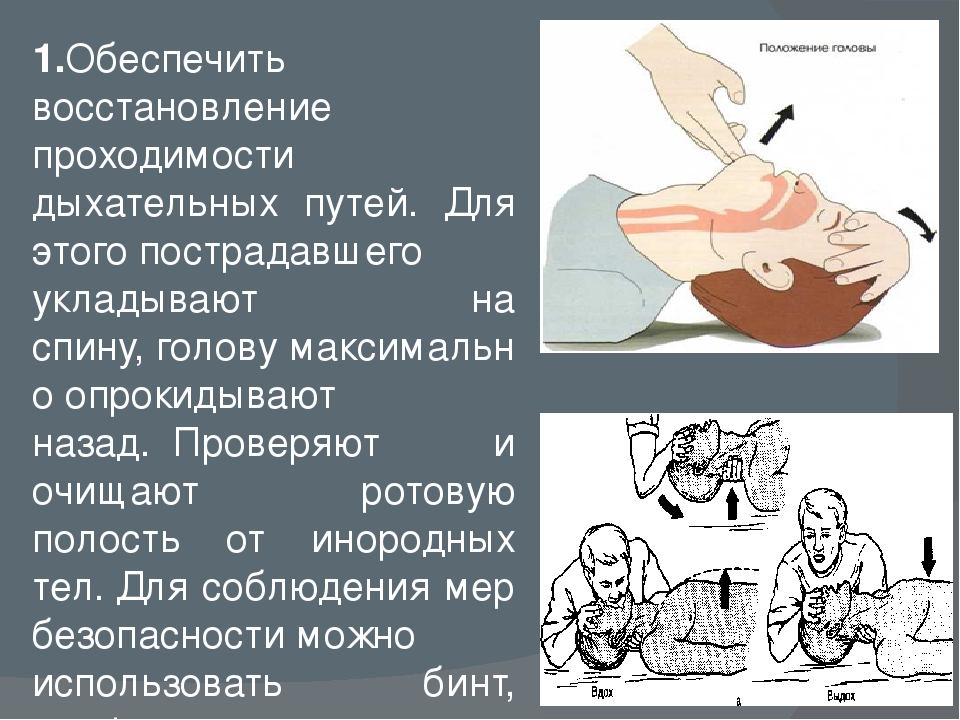 B: Большой и длинный пальцы обездвиживают верхний рог гортани; указательный палец используется для пальпации перстневидно-щитовидной железы.
B: Большой и длинный пальцы обездвиживают верхний рог гортани; указательный палец используется для пальпации перстневидно-щитовидной железы. B: При низком разрезе перстневидно-щитовидной железы избегают верхних перстневидных сосудов, которые проходят в поперечном направлении около верхней части мембраны.
B: При низком разрезе перстневидно-щитовидной железы избегают верхних перстневидных сосудов, которые проходят в поперечном направлении около верхней части мембраны.
 B: Перед тем, как удалить скальпель из дыхательных путей, на каудальной стороне скальпеля, параллельно лезвию, помещают крючок.
B: Перед тем, как удалить скальпель из дыхательных путей, на каудальной стороне скальпеля, параллельно лезвию, помещают крючок.