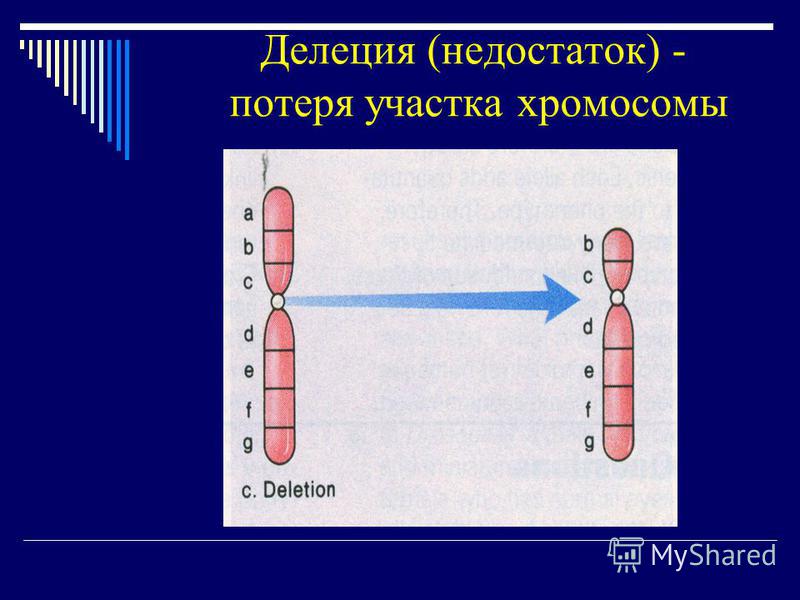
Когда кариотипы родителей могут явиться причиной повторяющихся выкидышей
Невынашивание является самым частым осложнением беременности на ранних сроках. Эпизодические (спорадические) выкидыши, как мы уже рассмотрели в других публикациях, в основном представляют собой потерю беременности вследствие нежизнеспособности эмбриона с аномальным кариотипом (набором хромосом) по причине случайного «числового хромосомного сбоя» при его формировании. Это нарушение носит название нерасхождения хромосом в процессе клеточного деления при образовании половых клеток или утраты хромосом в результате анафазного отставания, когда во время движения к полюсу одна из гомологичных хромосом может отстать от других негомологичных хромосом. Лишь небольшая часть таких хромосомных дефектов представлена выживанием, но тогда могут рождаться дети с такими известными всем хромосомными синдромами, как синдром Дауна, Патау, Эдвардса (в следствие трисомий), Ди Джорджи (в следствии выпадения участка хромосомы, микроделеции), или единственная совместимая с жизнью моносомия по Х — хромосоме (синдром Шершевского-Тернера), а также ряд других.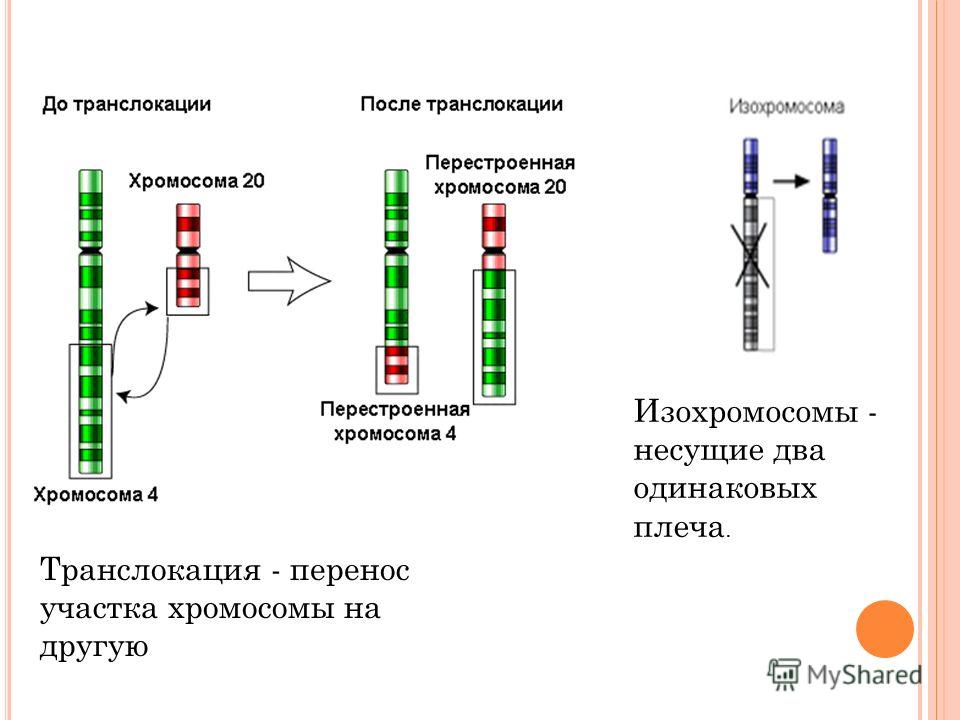
Установить, какая именно произошла «поломка», можно с помощью тщательного генетического анализа ДНК погибшего плода. Заказать такой тест можно здесь.
Мы рекомендуем данный тест даже если беременность прервалась впервые, и исключены все иные (соматические) причины для этого. Не дожидаясь повторного случая. Почему? Потому что подобные случайные хромосомные дефекты — не единственная проблема формирования хромосомно-аномального зародыша у вполне (соматически и генетически) здоровых родителей. Существует еще и проблема привычного невынашивания беременности — повторные и последовательные выкидыши, которые имеют под собой не случайную, а вполне определенную генетическую наследственную причину, установить которую необходимо как можно раньше.
Одной из таких причин является носительство одним из родителей сбалансированной структурной перестройки/транслокации (внутрихромосомной, межхромосомной) в своем кариотипе. Такими перестройками обусловлены 3–10% случаев привычного невынашивания. Формирование перестройки происходит вследствие двунитевых разрывов ДНК с последующей ошибкой репарации.
Формирование перестройки происходит вследствие двунитевых разрывов ДНК с последующей ошибкой репарации.
Чаще всего это реципрокные транслокации, когда сегмент одной хромосомы располагается на месте другого сегмента негомологичной хромосомы. Когда у родителя имеется подобная транслокация, при мейозе затрудняются процессы спаривания и разделения хромосом, и может произойти утрата (делеция) или удвоение (дупликация) участков хромосом в формирующихся гаметах. В результате в кариотипе будущего ребенка формируются несбалансированные хромосомные перестройки, которые и приводят к нежизнеспособности эмбриона/плода и заканчиваются выкидышем. В иных, более редких случаях, ребенок может стать носителем тяжёлой хромосомной патологии. При этом имеет значение, кто из родителей является носителем сбалансированной структурной перестройки. Эмпирически доказано, что риск для потомства при наличии перестройки у матери существенно выше, чем при носительстве отцом.
Или, например, робертсоновские гомологичные транслокации. Этот вид исключает даже возможность рождения здорового ребенка, приводит к абсолютному привычному невынашиванию, либо чередованию выкидышей и рождения больного хромосомной патологией ребенка.
Этот вид исключает даже возможность рождения здорового ребенка, приводит к абсолютному привычному невынашиванию, либо чередованию выкидышей и рождения больного хромосомной патологией ребенка.
Как установить эту подчас роковую генетическую причину? Во-первых, на это может указать генетическое исследование абортивного материала. Если в ДНК погибшего эмбриона/плода будет найдена несбалансированная траслокация, то это явится показанием для исследования кариотипов супругов с поиском сбалансированной транслокации у одного из них.
Во-вторых, если вам не удалось провести анализ абортивного материала, кариотипирование пары будет абсолютно показано по анамнезу повторных эпизодов репродуктивных потерь или при уже имеющемся в семье ребенке с хромосомной патологией.
Почему так важно пройти кариотипирование будущими родителями? Чтобы иметь представление об уровне возможных рисков, ответить на вопрос: повторится ли замершая беременность, и далее определиться с методом зачатия для снижения риска.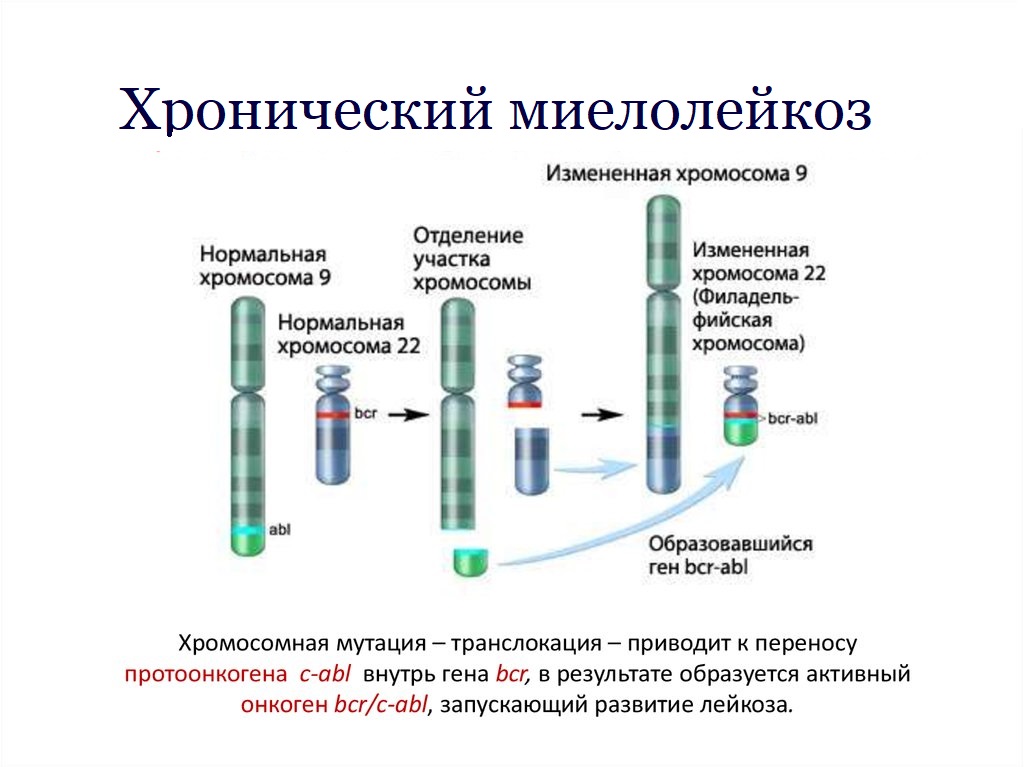 Мы рекомендуем тест кариотипирования всем будущим родителям еще на стадии планирования беременности.
Мы рекомендуем тест кариотипирования всем будущим родителям еще на стадии планирования беременности.
При некоторых транслокациях риск настолько велик, что выбором при лечении привычного невынашивания беременности становится метод ЭКО с проведением преимплантационного генетического тестирования.
PS. Знаете ли вы, что более 500 известных транслокаций специфически связаны со злокачественными новообразованиями, например хронический миелолейкоз, лимфобластный лейкоз?
Все публикации
Реципрокная транслокация у матери
Вопросы: «Какие шансы иметь здорового ребенка при реципрокной хромосомной транслокации 18-ой и 20-ой хромосомы у женщины? Муж здоров. Уже прерывали одну беременность на 6-ом месяце из-за пороков, тогда ещё ничего не знали.»
Отвечает Игорь Иванович Гузов, акушер-гинеколог, к.м.н., главный врач ЦИР.
Безусловно, если есть такая хромосомная транслокация, то здесь шансы повторения ситуации несбалансированных проблем у ребенка достаточно велики.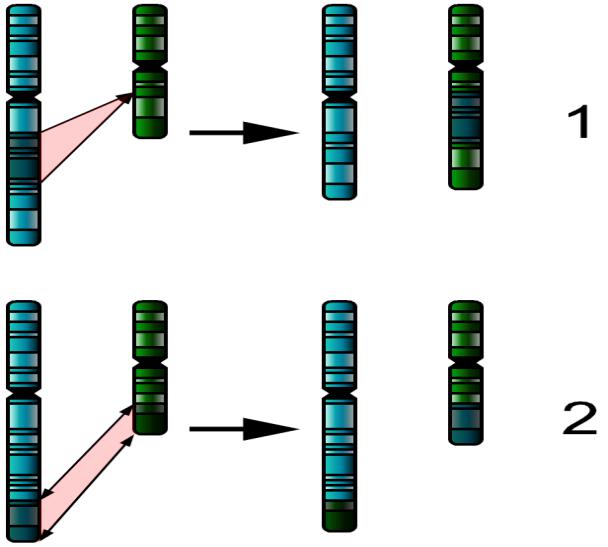 Сказать какие шансы, вот так сходу я не могу, потому что это нужно смотреть по специальным таблицам. И генетики это обычно смотрят достаточно хорошо.
Сказать какие шансы, вот так сходу я не могу, потому что это нужно смотреть по специальным таблицам. И генетики это обычно смотрят достаточно хорошо.
Допустим, у женщины кусок одной 18-ой хромосомы перекинулся на кусок другой 20-ой хромосомы, здоровый ребенок будет тогда, когда либо вот эта измененная 18-ая или измененная 20-ая хромосома в этом участке, который захватывает транслокация, не будет вступать в кроссинговер. То есть вы получите 18-ую и 20-ую хромосомы, условно говоря, являющимися копиями этих двух ваши хромосом. Вы можете передать ребенку сбалансированную транслокацию, и тогда это будет абсолютно здоровый ребенок со сбалансированной транслокацией. И беременность будет протекать абсолютно хорошо.
Либо же, если вы получите 18-ую и 20-ую хромосомы, которые не вступят в кроссинговер, тогда ваш ребенок будет абсолютно здоров, у него будет 18-ая хромосома без транслокации, полученная от матери, и 20-ая хромосома, тоже полученная от матери.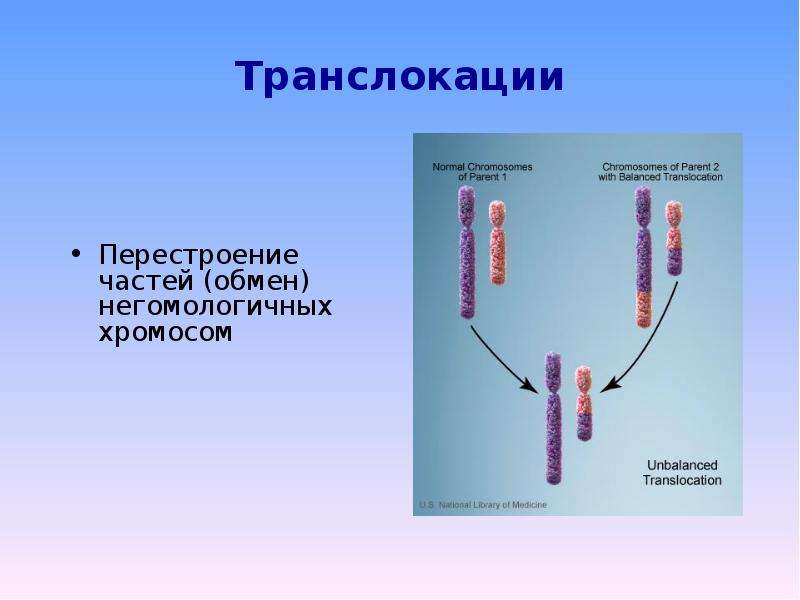
Если будет комбинация: допустим, одна 18-ая хромосома у вас будет здоровая, а вторая 20-ая с куском транслокации, либо хорошая 20-ая будет передана в яйцеклетку, а 18-ая будет с куском транслокации — несбалансированность хромосомного материала будет достаточно велика.
Поэтому здесь очень тяжело говорить о каких-то факторах риска. Я не сторонник широкого применение предимплантационной генетической диагностики, но в данном случае, если пойти по пути ЭКО и получить определенное количество зародышей, то при проведении секвенирования генов нового поколения мы можем не увидеть транслокации, но мы увидим четко, что хромосомный материал у ребенка полностью сбалансирован.
То есть отобрать те эмбрионы, у которых будет сбалансированный хромосомный материал. Среди этих эмбриончиков могут быть эмбрионы либо с полностью сбалансированной транслокацией, либо без транслокации. Это может помочь выбрать абсолютно нормального хромосомно- и геносбалансированного ребенка.
То есть вот возможен такой вариант.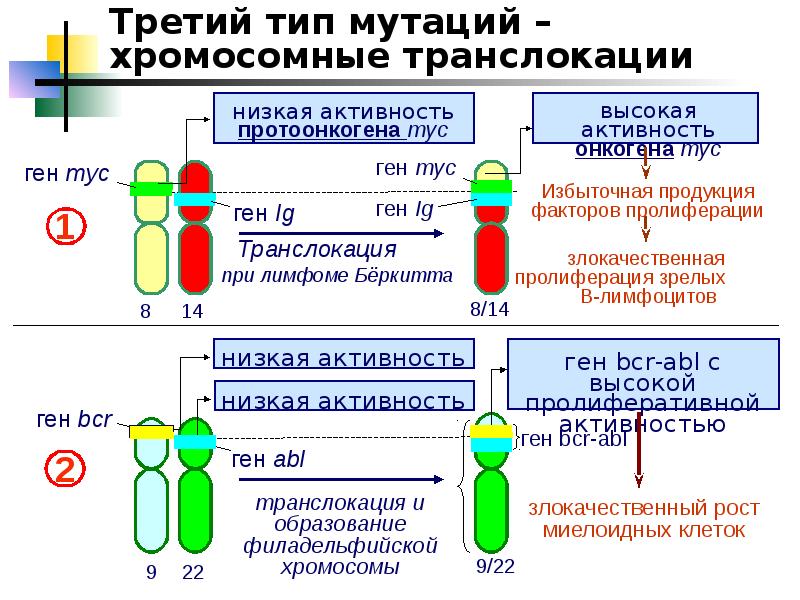
Если у Вас есть вопросы, особенно если вы планируете беременность или ждёте малыша, приходите на приём в Центр иммунологии и репродукции. Записаться на приём.
Центр Молекулярной Генетики — Хромосомные транслокации
Данная брошюра содержит информацию о том, что такое хромосомные транслокации, как они могут наследоваться и какие проблемы они могут вызывать. Данная брошюра не может заменить Ваше общение с врачом, однако она может помочь Вам при обсуждении интересующих Вас вопросов.
Данная брошюра не может заменить Ваше общение с врачом, однако она может помочь Вам при обсуждении интересующих Вас вопросов.
Что такое хромосомные транслокации?
Для того, чтобы понять, что такое хромосомные транслокации, вначале будет полезно узнать, что такое гены и хромосомы.
Что такое гены и хромосомы?
Наше тело состоит из миллионов клеток. Большинство клеток содержат полный набор генов. У человека тысячи генов. Гены можно сравнить с инструкциями, которые используются для контроля роста и согласованной работы всего организма. Гены отвечают за множество признаков нашего организма, например, за цвет глаз, группу крови или рост.
Гены расположены на нитевидных структурах, называемых хромосомами. Как правило, в большинстве клеток организма содержится по 46 хромосом. Хромосомы передаются нам от родителей – 23 от мамы, и 23 от папы, поэтому мы часто похожи на своих родителей. Таким образом, у нас два набора по 23 хромосомы, или 23 пары хромосом. Так как на хромосомах расположены гены, мы наследуем по две копии каждого гена, по одной копии от каждого из родителей. Хромосомы (следовательно, и гены) состоят из химического соединения, называемого ДНК.
Так как на хромосомах расположены гены, мы наследуем по две копии каждого гена, по одной копии от каждого из родителей. Хромосомы (следовательно, и гены) состоят из химического соединения, называемого ДНК.
Рисунок 1: Гены, хромосомы и ДНК
Хромосомы (см. Рисунок 2), пронумерованные от 1 до 22, одинаковые у мужчин и у женщин. Такие хромосомы называют аутосомами. Хромосомы 23-й пары различны у женщин и мужчин, и их называют половыми хромосомами. Есть 2 варианта половых хромосом: Х-хромосома и Y-хромосома. В норме у женщин присутствуют две Х-хромосомы (ХХ), одна из них передается от матери, другая – от отца. В норме у мужчин есть одна X-хромосома и одна Y-хромосома (XY), при этом Х-хромосома передается от матери, а Y-хромосома — от отца. Так, на Рисунке 2 изображены хромосомы мужчины, так как последняя, 23-я, пара представлена сочетанием XY.
Рисунок 2: 23 пары хромосом, распределенные по размеру; хромосома под номером 1 – самая большая. Две последние хромосомы – половые.
Две последние хромосомы – половые.
Правильный хромосомный набор является очень важным для нормального развития человека. Это связано с тем, что гены, которые дают «инструкции к действиям» клеткам нашего организма, находятся на хромосомах. Любое изменение количества, размера или структуры наших хромосом может привести к трудностям в обучении, задержке развития и другим проблемам здоровья ребенка.
Что такое транслокация?
Транслокация означает, что существует какая-либо необычная структура хромосом. Причины для этого могут быть разные:
- А) перестройка возникла во время созревания яйцеклетки или сперматозоида, или при оплодотворении
- Б) перестройка хромосомы была унаследована от матери или отца
Существует два основных типа транслокаций: реципрокная транслокация и робертсоновская траслокация.
Реципрокные транслокации
Реципрокные транслокации возникают в том случае, если два фрагмента из двух разных хромосом отрываются и меняются местами
Рисунок 3: Как возникает реципрокная транслокация
две нормальные хромосом из пары части двух хромосом отрываются и снова прикрепляются к другим хромосомах
Робертсоновские транслокации
Робертсоновские транслокации возникают в том случае, когда одна хромосома соединяется с другой. На Рисунке 4 показана робертсоновская транслокация, в которую вовлечены две хромосомы
На Рисунке 4 показана робертсоновская транслокация, в которую вовлечены две хромосомы
Рисунок 4: Как возникает робертсоновская транслокация
две нормальные хромосом из пары Робертсоновская транслокация: хромосома одной пары оказываются прикрепленной к хромосоме из другой пары
Почему возникают транслокации?
Несмотря на то, что транслокации встречаются довольно часто (примерно у 1 человека из 500), причины их возникновения остаются неясными. Мы знаем, что хромосомы, по-видимому, могут разрываться и восстанавливаться во время процесса созревания сперматозоида или яйцеклетки, или при оплодотворении, и лишь в некоторых случаях это приводит к проблемам. Мы не можем контролировать эти изменения.
Когда это может приводить к проблемам?
В обоих рассмотренных нами примерах хромосомные перестройки происходили таким образом, что общее количество хромосомного материала не менялось. Такие перестройки называются сбалансированными транслокациями.
Как правило, человек, имеющий сбалансированную транслокацию, не страдает от этого, и часто даже не подозревает, что в его (ее) хромосомах есть перестройка. И важным это может оказаться только в случае, когда у него (или у нее) появляется ребенок. Это связано с тем, что у ребенка может возникнуть несбалансированная транслокация.
Несбалансированные транслокации
Если один из родителей является носителем сбалансированной транслокации, существует вероятность, что у ребенка возникнет несбалансированная транслокация, при которой присутствует лишний фрагмент одной хромосомы и/или потеря части материала другой хромосомы.
Часто бывает так, что ребенок рождается с транслокацией, несмотря на то, что у обоих родителей нормальные хромосомы. Это называется «вновь возникшей» перестройкой, или перестройкой «de novo» (от латинского слова). В этом случае вероятность повторного рождения ребенка с транслокацией у этих родителей крайне мала.
Ребенок, имеющий несбалансированную транслокацию, может иметь трудности в обучении, задержку развития и другие проблемы со здоровьем. Выраженность проявлений зависит от того, какие участки хромосомы оказались вовлеченными в перестройку, и какой материал хромосомы присутствует в избытке, или отсутствует, так как некоторые районы хромосомы важнее других.
Выраженность проявлений зависит от того, какие участки хромосомы оказались вовлеченными в перестройку, и какой материал хромосомы присутствует в избытке, или отсутствует, так как некоторые районы хромосомы важнее других.
Если у родителя есть сбалансированная транслокация, всегда ли она передается ребенку?
- Необязательно, возможны несколько исходов каждой беременности:
- Ребенок может получить совершенно нормальный набор хромосом.
- Ребенок может унаследовать такую же сбалансированную транслокацию, которая есть у родителя. В большинстве таких случаев транслокация не будет иметь последствий для ребенка.
- Ребенок может унаследовать несбалансированную транслокацию, и тогда после рождения он может иметь трудности в обучении, задержка развития или другие проблемы со здоровьем.
- Возможно самопроизвольное прерывание беременности.
Таким образом, у носителя сбалансированной транслокации могут рождаться здоровые дети, и во многих случаях происходит именно так. Однако, для носителя сбалансированной транслокации существует повышенный риск рождения ребенка с определенной степенью задержки развития, при этом тяжесть проявлений зависит от конкретного типа транслокации.
Однако, для носителя сбалансированной транслокации существует повышенный риск рождения ребенка с определенной степенью задержки развития, при этом тяжесть проявлений зависит от конкретного типа транслокации.
Диагностика хромосомных транслокаций
Возможно проведение генетического анализа для выявления носительства транслокации. Берется образец крови, и клетки крови исследуют в специализированной лаборатории для выявления хромосомных транслокаций. Такой анализ называется кариотипированием. Также возможно проведение теста во время беременности для выявления хромосомных транслокаций. Это называется пренатальной диагностикой, и этот вопрос следует обсудить с врачом-генетиком. Более подробная информация на эту тему представлена в брошюрах «Биопсия ворсин хориона» и «Амниоцентез».
Какое отношение это имеет к другим членам семьи?
Если у одного из членов семьи обнаружена транслокация, возможно, Вы захотите обсудить этот вопрос с другими членами семьи. Это даст возможность другим родственникам, при желании, пройти обследование (анализ хромосом в клетках крови) для определения носительства транслокации.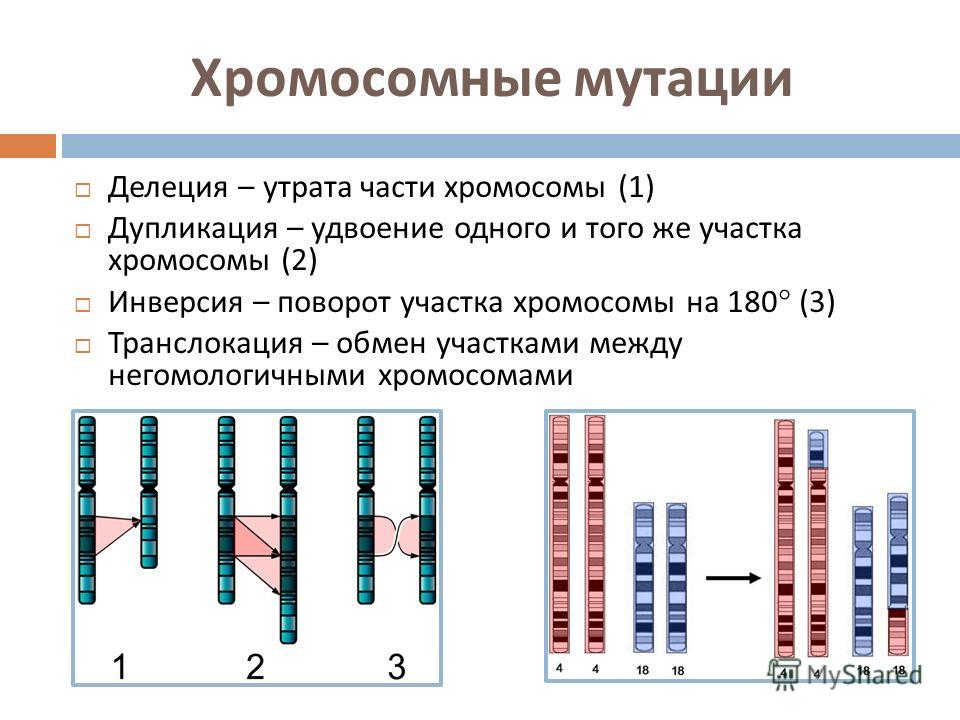 Это может быть особенно важно для родственников, уже имеющих детей или планирующих беременность. Если они не являются носителями транслокации, они не могут передать ее своим детям. Если же они являются носителями, то им могут предложить пройти обследование во время беременности для анализа хромосом плода.
Это может быть особенно важно для родственников, уже имеющих детей или планирующих беременность. Если они не являются носителями транслокации, они не могут передать ее своим детям. Если же они являются носителями, то им могут предложить пройти обследование во время беременности для анализа хромосом плода.
Некоторым людям сложно обсуждать проблемы, связанные с хромосомной перестройкой, с членами семьи. Они могут бояться причинить беспокойство членам семьи. В некоторых семьях люди из-за этого испытывают сложности в общении и теряют взаимопонимание с родственниками. Врачи-генетики, как правило, имеют большой опыт в решении подобных семейных ситуаций и могут помочь Вам в обсуждении проблемы с другими членами семьи.
Что важно помнить
- Люди, являющиеся носителями сбалансированной транслокации, как правило, здоровы. Проблемы могут возникнуть на этапе деторождения.
- Транслокация может как наследоваться от родителей, так и возникать в процессе оплодотворения.

- Транслокацию нельзя исправить – она остается на всю жизнь.
- Транслокация не заразна, например, ее носитель может быть донором крови.
- Люди часто испытывают чувство вины в связи с тем, что в их семье есть такая проблема, как транслокация. Важно помнить, что это не является чьей-либо виной или следствием чьих-либо действий.
Общие вопросы по генетике: страница 2
Обсуждаем вопросы наследственности, хромосомные аномалии и врожденные пороки, амнеоцентез и т.д. На вопросы по генетическим заболеваниям отвечают врачи генетики медицинского центра «Арт-Мед».
Вторая беременность, первая — роды. Сын здоровый. Первый скрининг: прием Дюфастона 1 таблетка 3 раза в день, на ночь 200 мг Утрожестан, Метипред 1/2 таблетки. Результаты Узи: беременность 12 недель + 3 дня; КТР 59,2; ЧСС 157 уд/м; ТВП 1,20. Кость носа определяется. ХГЧ 85,41 ме/л ( 2,274 МоМ), РАРР-А 6,540 ме/л ( 1,784 МоМ). Трисомия 21 базовый 1: 714 индивидуальный 1:14286. Трисомия 18 1:1705 индивидуальный 1: 20000. Трисомия 13 1: 5360 индивидуальный 1:20000. Стоит ли бить тревогу? Возраст 29 лет.
Кость носа определяется. ХГЧ 85,41 ме/л ( 2,274 МоМ), РАРР-А 6,540 ме/л ( 1,784 МоМ). Трисомия 21 базовый 1: 714 индивидуальный 1:14286. Трисомия 18 1:1705 индивидуальный 1: 20000. Трисомия 13 1: 5360 индивидуальный 1:20000. Стоит ли бить тревогу? Возраст 29 лет.
В Вашем случае риск хромосомных аномалий у плода оценен как низкий. По этому поводу для беспокойства нет причин.
3 месяца назад была замершая беременность, закончившаяся выкидышем на сроке 17 недель. По результатам скрининга у ребенка была с вероятностью 1:3 трисомия 18, и с вероятностью 1:2 СЛОС (Смит-Лемли-Опиц). У нас трое детей, общие двое младших, возраст детей 19, 12, 1.7, ни у кого из детей или наших родственников генетических аномалий нет. У меня ранее выкидышей и замерших беременностей не было. Причина трисомии и СЛОС у ребенка — мой возраст? Нужно ли в случае наступления беременности проводить какие-либо исследования, кроме стандартных скринингов? Стоит ли сделать какие-либо генетические анализы нам с мужем? Какова вероятность повторения в случае следующей беременности? Мне 40 лет, мужу 38.
СЛОС – аутосомно-рецессивное заболевание, при котором оба супруга, как правило, несут в себе по одному мутантному гену. Риск рождения больного ребёнка в этом случае повышен. Вам желательно прийти на консультацию к генетику с результатами обследования плода (УЗИ+скрининг) для решения вопроса о проведении ДНК — обследования, если вы ещё планируете беременность.
В 2012 году — прерывание беременности по менингоцеле плода в 22 недели. В 2014 — родился здоровый ребёнок, в 2016 — прерывание беременности в 18 нед в связи с синдромом Денди-Уокера, ДМЖП, гиперэхогенным кишечником и др. множественными пороками. Кариотип жены — 46 xx, 1qh; мужа — 46 xy, 9 ph+. При планировании последней беременности все инфекции отрицательные. Перед прерыванием беременности в 2016 году анализ показал наличие Цитомегаловируса. По анализу на мутации в генах фолатного цикла у жены: риск гипергомоцестеинемии средний. Скажите, какой шанс родить здорового ребёнка, могут ли наши кариотипы стать причиной ВПР плода, что мы должны сделать в плане подготовки беременности, чтобы снизить риск повтора ВПР, что могло стать причиной пороков в 2016 году?
У вас у обоих вариант нормального кариотипа, что не влечёт за собой ВПР плода.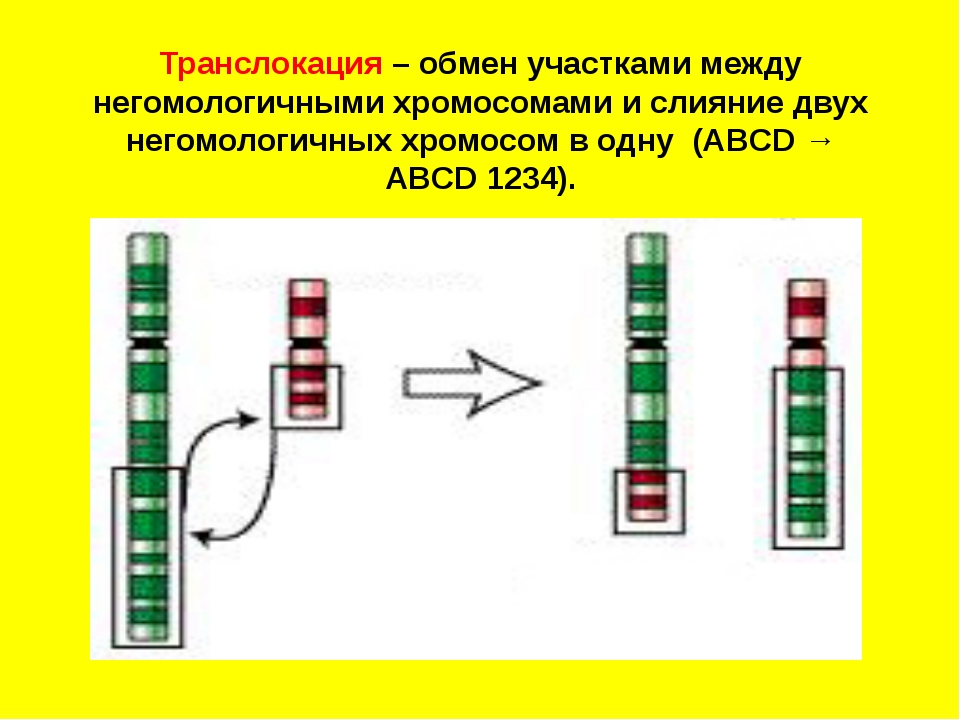 Перед прерыванием беременности в 2016 г. Вам надо было обследовать плод – сделать хотя бы ему анализ кариотипа. Возможна также причина –в генной мутации. Вам желательно прийти на консультацию к генетику с результатами УЗИ при обеих беременностях, чтобы решить вопрос о проведении ДНК-анализа. Без уточнённого диагноза говорить о профилактике повторения сложно.
Перед прерыванием беременности в 2016 г. Вам надо было обследовать плод – сделать хотя бы ему анализ кариотипа. Возможна также причина –в генной мутации. Вам желательно прийти на консультацию к генетику с результатами УЗИ при обеих беременностях, чтобы решить вопрос о проведении ДНК-анализа. Без уточнённого диагноза говорить о профилактике повторения сложно.
Первая беременность — аборт. Вторая беременность через 7 лет — роды (январь месяц). Родилась девочка с пороком сердца — Тетрада Фалло, умерла через 5 дней. Третья беременность замершая, через 3 месяца после родов. Моя родная сестра имеет порок сердца, тоже Тетрада Фалло и диагноз — умственная отсталость (сказали, что родовая травма, было ягодичное предлежание). Она не оперирована (мама отказалась), ей 36 лет . Это был 80-ый год, маме сказали, что порок сердца из-за того, что она работала на химическом заводе в закрытом цехе лаборантом со всякими вредными веществами, во время беременности её не вывели из этого цеха в более щадящие условия. У мужа кариотип в норме, а у меня сбалансированная транслокация между 4 и 10 хромосомой. Могла ли моя транслокация передаться мне по наследству? Больше пороков сердца не наблюдается ни у одного из родственников. Есть ли шанс иметь здоровых детей? В самом начале беременности был контакт с ребёнком, у которого была краснуха, краснухой я не болела, но на 4 месяце беременности сдала анализ на краснуху и были обнаружены клетки памяти к данному вирусу. До этого, за год до беременности, при сдаче этого анализа всё было отрицательно. Может именно Вирус краснухи повлиял на развитие данного порока у дочери? Или вся причина в транслокации? Мне 30, мужу 40.
У мужа кариотип в норме, а у меня сбалансированная транслокация между 4 и 10 хромосомой. Могла ли моя транслокация передаться мне по наследству? Больше пороков сердца не наблюдается ни у одного из родственников. Есть ли шанс иметь здоровых детей? В самом начале беременности был контакт с ребёнком, у которого была краснуха, краснухой я не болела, но на 4 месяце беременности сдала анализ на краснуху и были обнаружены клетки памяти к данному вирусу. До этого, за год до беременности, при сдаче этого анализа всё было отрицательно. Может именно Вирус краснухи повлиял на развитие данного порока у дочери? Или вся причина в транслокации? Мне 30, мужу 40.
С высокой степенью вероятности причиной патологии у дочери была именно Ваша сбалансированная транслокация ( у неё она могла стать несбалансированной хромосомной аномалией). Желательно сделать анализ кариотипа также Вашей сестре. А Вам с супругом показана консультация генетика с целью планирования деторождения. В Вашей семье высокий риск неблагоприятного исхода беременности.
Беременность 12 недель. Результаты первого скрининга: Узи: ЧСС плода 169, КТР 57.6, ТВП 1.3, венозный проток 1.120, хорион/плацента высоко по задней стенке. Кость носа определяется. Примечания: узлы миомы матки по пер. ст.- 16мм, нижний сегмент — 34 мм, по задней стенке 17 мм, дно — 40 мм. Биохимия: ХГЧ — 219, 5 МЕ/л, 5.755 Мом, РАРР-А — 4.473 МЕ/л, 1.860 МоМ, Uterine artery PI — 1/96, 1.170 МОМ Длина цервикального канала 35.0 мм Трисомия 21 -баз 1:153, инд. 1:3050 Трисомия 18 — баз. 1:361, инд. 1:7223 Трисомия 13 — баз. 1:1136, инд. 1:20000 Самопроизвольные роды до 34 недели 1:762 Отправляют к генетику. Какие есть риски? Мне 37 лет.
Вероятность рождения ребенка с хромосомными аномалиями у Вас низкая.
🤰 Генетические анализы при планировании беременности
Кариотипирование одного или обоих супругов
Кариотипирование — это исследование количественного набора хромосом, а также их структурных перестроек (хромосомных аберраций). Перестройки могут быть внутри- и межхромосомными, могут сопровождаться нарушением порядка фрагментов хромосом (делеции, дупликации, инверсии, транслокации).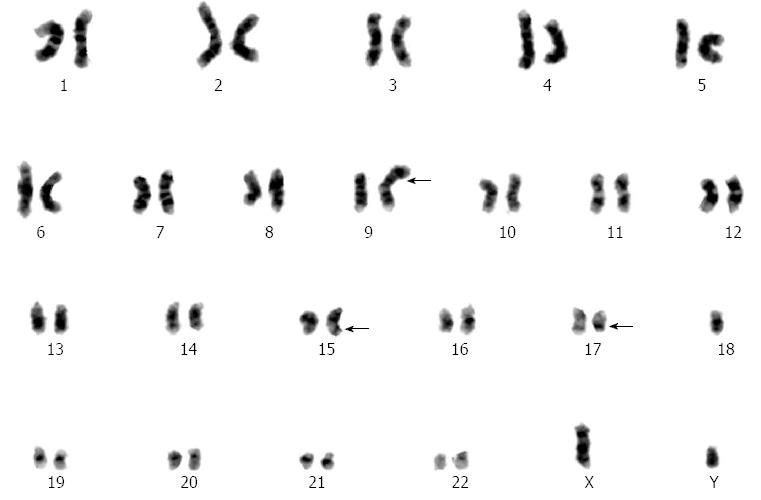 Хромосомные перестройки подразделяют на:
Хромосомные перестройки подразделяют на:
- Сбалансированные. Иинверсии, реципрокные транслокации не приводят к потере или добавлению генетического материала, поэтому их носители, как правило, фенотипически нормальны.
- Несбалансированные. Делеции и дупликации меняют дозовое соотношение генов, и, как правило, их носительство сопряжено с существенными отклонениями от нормы.
У здорового человека должно быть 22 пары аутосом и 1 пара половых хромосом (ХХ или ХУ). Для пар, страдающих от бесплодия, кариотипирование назначается скорее из-за перестраховки, его назначение более оправдано при привычном невынашивании, особенно если оно было связано с доказанной анеуплоидией эмбриона/ов.
У пациентов с бесплодием хромосомные перестройки встречаются редко. С привычным невынашиванием сбалансированные перестройки встречаются чаще, но занимают всего лишь 4–5% в структуре причин привычного невынашивания. При этом у таких пациентов всегда есть шанс на рождение здорового ребенка без проведения дорогостоящего обследования и лечения.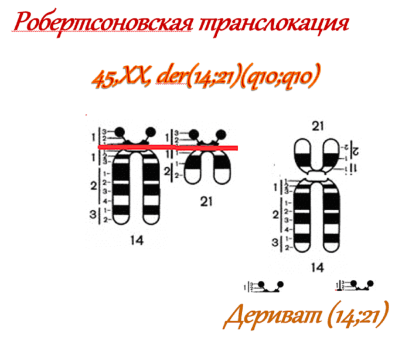 Без соответствующих исследований и лечения риски повторного невынашивания и рождения ребенка с тяжелыми проявлениями несбалансированной транслокации существуют, но они достаточно низкие.
Без соответствующих исследований и лечения риски повторного невынашивания и рождения ребенка с тяжелыми проявлениями несбалансированной транслокации существуют, но они достаточно низкие.
Так как анализ проводится на коммерческой основе, пара должна понимать, что выявление нарушений кариотипа повлечет за собой рекомендацию делать предимплантационную генетическую диагностику эмбрионов (ПГД) на конкретную хромосомную поломку, а также ПГТ-А для исключения численных хромосомных нарушений у эмбрионов.
Скрининг одного или обоих супругов на носительство наиболее распространенных моногенных заболеваний
Этот скрининг можно смело предлагать всем парам. Почему? Все мы — носители хотя бы нескольких аутосомно-рецессивных моногенных заболеваний. Как правило, мы об этом не знаем, так как второй ген из парной хромосомы от другого родителя без поломок, и болезнь себя никак не проявляет. Если же супруги носители одного и того же заболевания, то риск рождения больного ребёнка составляет 25%.
В связи с этим некоторые банки донорских клеток тестируют всех своих доноров на носительство наиболее распространенных в популяции моногенных заболеваний. Очевидно, что скрининг тоже перестраховка, и что риск рождения больного ребёнка низкий (не выше 1 на 1000). Но если вдруг в результате проведения ЭКО с применением донорских клеток или у совершенно здоровой пары родится ребёнок с неизлечимым генетическим заболеванием с тяжелыми проявлениями, то последствия будут плачевны.
Если вы еще сомневаетесь, стоит ли вам проходить это тестирование, исключите хотя бы носительство СМА, спинальной мышечной атрофии! В основную панель включены также нейросенсорная тугоухость, муковисцидоз, фенилкетонурия, адреногенитальный синдром.
Генетические анализы на мутации муковисцидоза (CFTR) и мутации AZF
При тяжёлых формах мужского бесплодия (азооспермии или значительной олигозооспермии, менее 5 млн сперматозоидов в 1 мл спермы неоднократно) врачи-андрологи обычно назначают дополнительные генетические анализы на мутации муковисцидоза (CFTR) и мутации AZF.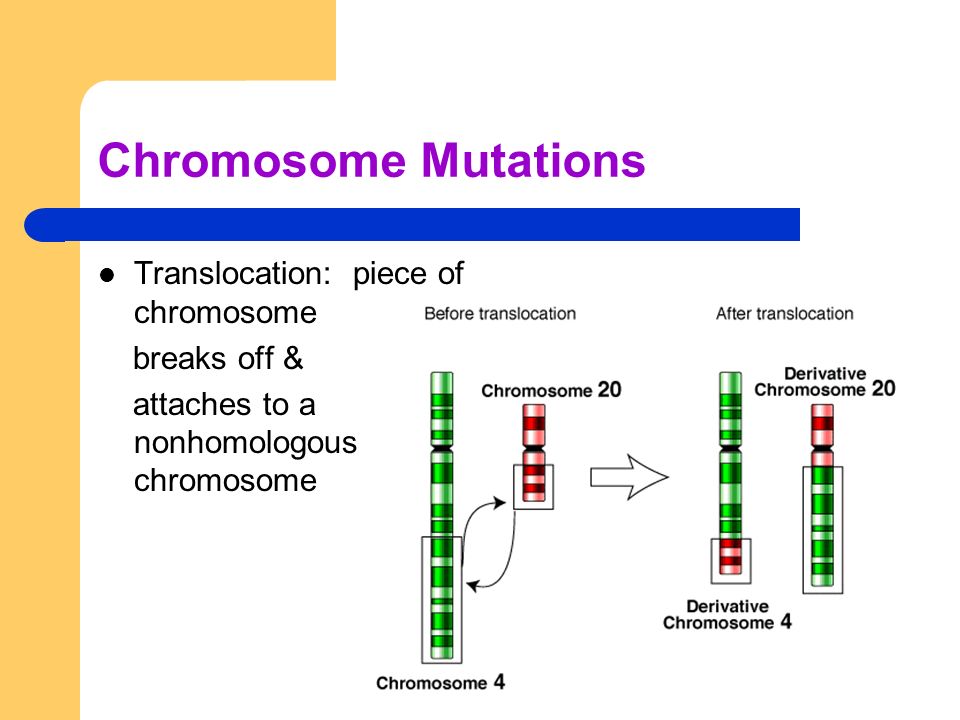
При выявлении носительства муковисцидоза рекомендовано обследовать и партнершу на это же заболевание (помним, что при наличии у партнеров одинаковой мутации, вероятность рождения больного ребенка у пары — 25%).
При выявлении мутации AZF рекомендовано ЭКО с ПГТ-А и перенос эмбрионов женского пола, так как мальчик унаследует такую же мутацию (Y хромосома неизбежно достанется ему от больного отца), и ребенок тоже будет бесплодным.
Обследование на повторы в гене FMR1 (синдром хрупкой Х-хромосомы)
При низком овариальном резерве (АМГ менее 1 нг/мл) у женщин до 35 лет и преждевременной недостаточности яичников (прекращение месячных до 40 лет), женщину обычно обследуют на повторы в гене FMR1 (это синдром ломкой (хрупкой) Х-хромосомы). Назвали этот синдром так, потому что при специальном окрашивании Х-хромосома выглядит нетипично, как будто один кусок от неё отделился, хотя физически она цельная.
При выявлении повторов в данном гене рекомендовано проведение ПГТ-А для переноса эмбрионов женского пола (у мальчиков почти в 3 раза выше риск развития синдрома Мартина-Белл, проявляющийся умственной отсталостью).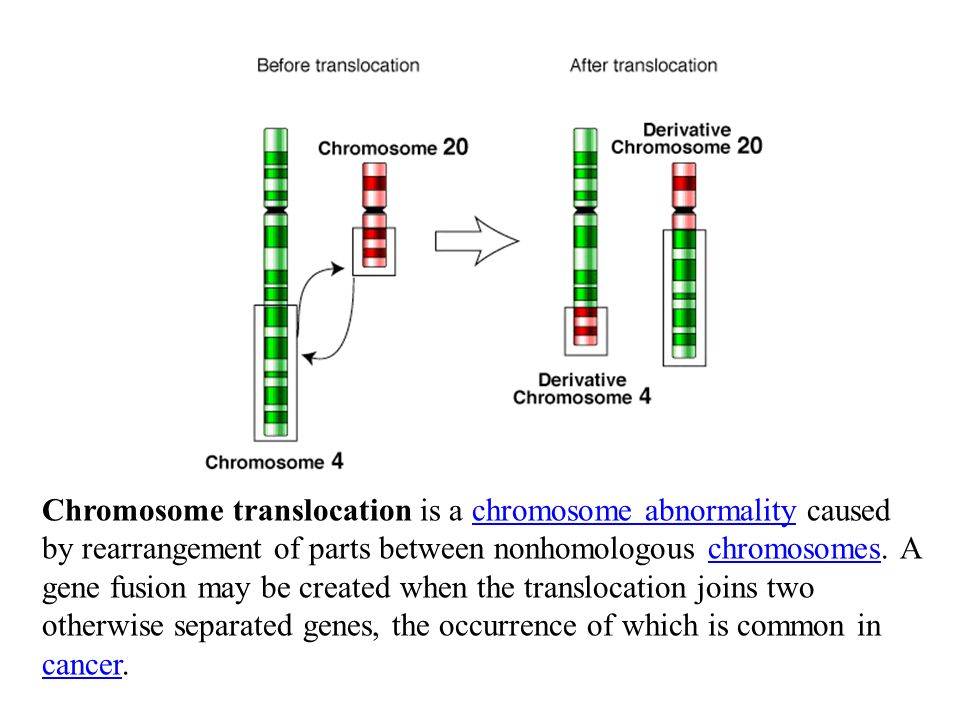
HLA-типирование
При привычном невынашивании или многократных неудачах ЭКО иногда ещё предлагают провести HLA-типирование. При этом множественные (от 3-х) совпадения по HLA (главному комплексу гистосовместимости) самостоятельной причиной бесплодия и привычного невынашивания беременности не являются, хотя и могут вносить некоторый вклад в развитие иммунных причин обоих заболеваний.
Надо сказать, что при бесплодии и привычном невынашивании ни одно генетическое исследование не является строго обязательным. Они проводятся за счет средств пациента, и являются профилактическими мерами, то есть направлены на снижение риска повторного невынашивания и рождения больного потомства.
Мнение эксперта
Клименко Мария Петровна
Акушер-гинеколог, репродуктолог, врач ультразвуковой диагностики
реципрокная транслокация — 21 рекомендаций на Babyblog.
 ru
ru
Cравнительная геномная гибридизация (aCGH) aCGH — технология высокоразрешающего скрининга всего генома на предмет вариации числа копий отдельных его сегментов. (M Shinawi, S. W. Cheung. 2008 )
Другими словами: метод, позволяющий диагностировать анеуплоидии и микроструктурные хромосомные аномалии одномоментно во всех хромосомах
Преимущества:
• Высокая разрешающая способность ( >1000 раз по сравнению с одномоментно во всех хромосомах.
• Высокая разрешающая способность ( >1000 раз по сравнению с кариотипированием)
• Скрининг всех хромосом (по сравнению с FISH)
• Возможность количественной детекции участков хромосом и однородительских дисомий
• Автоматизация исследования • Объективность результатов
• Сокращенные сроки получения результата (1‐3 сут)
Возможности aCGH:
• Микроскопические хромосомные нарушения
— Анеуплоидия (включая мозаицизм)
— Несбалансированные транслокации
— Маркерные хромосомы
• Субмикроскопические нарушения
— Микроделеционные/ микродупликационные синдромы
— Несбалансированные субтеломерные перестройки (del, dup, der)
Ограничения метода aCGH
• Сбалансированные перестройки
— Реципрокные транслокации
— Инверсии
— Робертсоновские транслокации
— Реципрокные инсерции
• Несбалансированные перестройки за г р ц рр ани цей раз решения
— Точечные мутации
— Тринуклеотидные экспансии
— Делеции /дупликации (ниже границы чувствительности )
• Результаты оцениваются совместно с методами классической цитогенетики
Клиническое применение aCGH
• Предимплантационная диагностика
• Пренатальная диагностика
• Диагностика при невынашивании беременности
• Постнатальная диагностика при:
• ВПР • недифференцированной умственной отсталости • Моногенная Моногенная патология патология ( мышечная дистрофия дистрофия Дюшена ) • онкологической патологии
• Верификация результатов цитогенетических исследований aCGH — единственный на сегодня метод, позволяющий произвести точную количественную оценку микроделеционных и й 19 микродупликационных изменений одномоментно во всем геноме.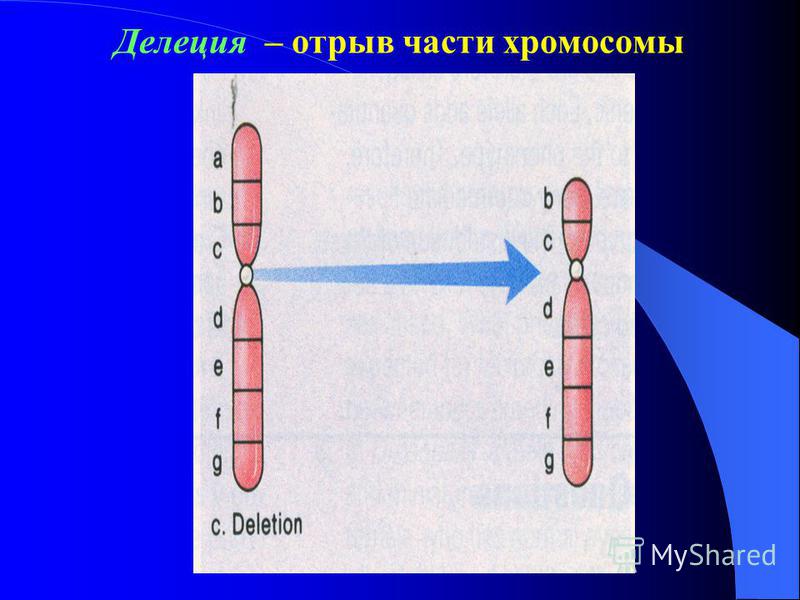
Технические ограничения aCGH для PGS/PGD
• Качество исходного материала
• Значимость отклонений
•Нарушения и особенности амплификации всего генома (WGA) клетки — Чувствителен к качеству исходного материала — Образование фрагментов 100‐1000 п.н. (ср.размер — 400 п.н.) — Амплификация 60‐80% генома — Амплификация разных участков происходит с разной эффективностью (преимущественная амплификация) — Неспецифическая амплификация Неспецифическая амплификация (из‐за образования вторичных структур за образования вторичных структур ДНК) — Наличие активной полимеразы после окончания реакции деградирует продукты амплификации продукты амплификации — При работе с одной клеткой не исключается allele‐drop‐out
Следствие:
• ~ 7% недиагносцированных эмбрионов •Фактическое разрешение для PGS/PGD от 2 ‐ 5 Мbp в зависимости от места расположения перестройки 23 зависимости от места расположения перестройки
•Детекция мозаицизма (от 30%) •Ограниченная возможность детекции полиплоидии
Выводы
• aCGH — единственный на сегодня метод, позволяющий исследовать одновременно весь геном на предмет макро‐ и микроструктурных и микроструктурных несбалансированных хромосомных аномалий
• aCGH не подменяет кариотипирование!
• В случае детекции перестроек «на границе чувствительности» метода необходима FISH‐ или/и ПЦР‐верификация верификация.
• Определение хромосомных изменений с неустановленной клинической значимостью не неустановленной клинической значимостью не должно идти в разрез с общепринятыми этическими и этическими и деонтологическими деонтологическими нормами.
Подробнее по ссылке.
http://www.ivf.com.ua/web/upload-files/Webinar_20120120_Mykytenko.pdf
Хромосомные транслокации | Исследования в медико-генетическом центре «Геномед»
Перестройку, при которой происходит перенос участка хромосомы на негомологичную хромосому, называют транслокацией. Подобные мутации в клетках могут быть причиной развития заболеваний (лимфомы, саркомы, лейкоза).
Как возникают транслокации
Формирование такой перестройки происходит вследствие повреждения ДНК. Как правило, это двунитевые разрывы с последующей ошибкой репарации. Аномалии возникают:
- при неправильном воссоединении разрывов во время репарации за счет негомологичной рекомбинации;
- ошибочном выборе паралогичной последовательности ДНК (вместо гомологичной) при репарации разрыва ДНК во время гомологичной рекомбинации.

Повреждение ДНК может быть обусловлено экзогенными (химиотерпией, ионизирующим излучением) и эндогенными (воздействием свободных радикалов) факторами.
Кроме того, перестройки в хромосомах могут возникать во время созревания яйцеклетки и сперматозоида. Подобные мутации могут наследоваться от отца или матери.
Реципрокные транслокации
Представляют собой сбалансированную хромосомную перестройку. В этом случае не происходит потери генетического материала. Реципрокные перестройки считаются наиболее распространенной хромосомной аномалией человека.
Носители обычно фенотипически нормальны, но имеют повышенную вероятность бесплодия, сниженную фертильность, риски спонтанных выкидышей и рождения детей с генетическими болезнями. У 5 % носителей встречаются врожденные аномалии развития, задержки развития (у 50 % наблюдается умственная отсталость).
Робертсоновские транслокации
Формируются тогда, когда одна хромосома соединяется с другой. Данные мутации представляют собой одну из обширных групп врожденных хромосомных аномалий у человека.
Носители остаются нормальными фенотипически, но у них высоки риски самопроизвольного выкидыша и рождения детей с несбалансированным кариотипом. Транслокации обычно затрагивают 13-ю и 14-ю хромосомы. Перестройки в 21-й хромосоме вызывают наследуемый (семейный) синдром Дауна.
Несбалансированные транслокации
Возникают, если один из родителей является носителем сбалансированной хромосомной перестройки. В этом случае у ребенка выявляется несбалансированная транслокация в виде присутствия лишнего фрагмента хромосомы или потери части материала другой хромосомы в паре. Подобная мутация может возникать и у детей с нормальными родителями (т. н. вновь возникшая перестройка).
Дети с несбалансированной хромосомной транслокацией страдают от задержек развития, испытывают трудности в обучении, имеют проблемы со здоровьем. Выраженность патологии зависит от того, какая именно хромосома пострадала.
Диагностика транслокаций
Для выявления носительства может проводиться генетический анализ. Кариотипирование помогает обнаружить различные виды транслокаций, в т. ч. несбалансированные.
Кариотипирование помогает обнаружить различные виды транслокаций, в т. ч. несбалансированные.
Выявить патологии можно во время вынашивания ребенка. Для этого предусмотрены инвазивные пренатальные тесты.
Анализ кариотипа можно пройти в медико-генетическом центре «Геномед».
Носители сбалансированной транслокации обычно здоровы. Проблемы у них появляются при желании иметь детей. Для таких людей следует заранее пройти обследование и получить консультацию врача-генетика. Во время беременности можно сделать биопсию ворсин хориона, амниоцентез, кордоцентез в целях исключения хромосомных аномалий у плода.
Сбалансированная транслокация и повторный выкидыш
Сбалансированная или хромосомная транслокация — это состояние, при котором часть хромосомы оторвалась и снова прикрепилась в другом месте. Другими словами, это означает, что участки двух хромосом поменялись местами. Транслокации могут быть совершенно безвредными или могут вызвать серьезные проблемы со здоровьем, в зависимости от обстоятельств.
В первом случае многие люди могут иметь транслокации, даже не подозревая об этом состоянии.Обычно это относится к реципрокной (или сбалансированной) транслокации, типу хромосомной транслокации, которая увеличивает риск повторных выкидышей. Этот обзор поможет вам лучше понять, что такое сбалансированная транслокация и какое потенциальное влияние она может оказать на беременность.
Что означает сбалансированная транслокация
При сбалансированной транслокации человек обычно имеет весь генетический материал, необходимый для нормального роста — часть хромосомы просто отламывается и прикрепляется к другой.
Однако, когда клетки этого человека делятся, чтобы создать яйцеклетку или сперматозоиды для воспроизводства, яйцеклетки или сперматозоиды могут оказаться с дополнительным генетическим материалом или отсутствовать генетический материал, что может привести к выкидышу в зависимости от того, какие хромосомы и гены затронуты.
Частота повторных выкидышей
Примерно в 4,5% всех пар с повторяющимися выкидышами у одного или обоих родителей наблюдается сбалансированная транслокация. Исследования показали, что у пар со сбалансированными транслокациями вероятность выкидыша выше, чем у пар без сбалансированных транслокаций.Есть некоторые доказательства того, что сбалансированные транслокации с участием определенных хромосом с большей вероятностью вызывают выкидыши, чем другие.
Тестирование
Сбалансированная транслокация диагностируется с помощью теста, называемого кариотипом, в котором образцы крови обоих родителей анализируются в поисках транслокации. Некоторые исследования показывают, что сбалансированная транслокация у матери, скорее всего, связана с повторными выкидышами, но отцы также могут быть носителями.
Лечение
От сбалансированной транслокации нет лекарства, и в большинстве случаев единственным неблагоприятным эффектом для здоровья являются повторяющиеся выкидыши.Для пар, затронутых сбалансированной транслокацией, шансы на успешную беременность в какой-то момент повышаются, но очевидно, что с повторными выкидышами трудно справиться эмоционально.
Рецидивирующие выкидыши также могут иметь физические последствия. У некоторых женщин повторные выкидыши могут вызвать осложнения, такие как образование рубцовой ткани после D&C. Соответственно, пары с известным сбалансированным перемещением, которые опасаются как эмоциональных, так и физических травм, которые может вызвать повторная потеря беременности, могут захотеть изучить более высокотехнологичные способы вынашивания беременности.Взаимодействие с другими людьми
Высокотехнологичные процедуры
В некоторых случаях пары со сбалансированной транслокацией могут выбрать лечение, называемое предимплантационной генетической диагностикой (ПГД). При ПГД пара осуществляет зачатие посредством экстракорпорального оплодотворения вместе с генетическим тестированием эмбрионов, чтобы убедиться, что у них нет несбалансированной транслокации.
ПГД и ЭКО очень дороги и большую часть времени не покрываются страховкой, что является еще одной причиной, по которой многие пары вынуждены продолжать попытки без вмешательства.
При этом вы можете получить ссуды, которые помогут оплатить эти процедуры, подать заявку на грант парам, нуждающимся в ЭКО, или самостоятельно сэкономить деньги и указать свои медицинские расходы как налоговый вычет, если они превышают 7,5% от ваших валовой доход за вычетом разрешенных законом удержаний.
Родительская сбалансированная транслокация и выкидыш: Репродуктивные партнеры университета: репродуктивные эндокринологи
Родительская сбалансированная транслокация является фактором в некоторых случаях повторного выкидыша.
ПОНИМАНИЕ РОДИТЕЛЬСКОГО СБАЛАНСИРОВАННОГО ПЕРЕВОДА
Прежде чем обсуждать связь между родительской сбалансированной транслокацией и выкидышем, сначала важно понять родительскую сбалансированную транслокацию.
Обычно у человека 23 пары хромосом, которые несут генетический материал, который делает их такими, какие они есть. Половина хромосом принадлежит матери, а другая половина — отцу. Для этого части хромосомных пар разделяются, так что ребенок получает генетический материал от каждого родителя.
Транслокация происходит, когда одна часть хромосомы прикрепляется к другой части хромосомы из другой пары. Никакой генетический материал не теряется, участки хромосом просто соединены в неправильном месте. Поскольку количество хромосом правильное, но часть одной из хромосом прикреплена неправильно, это называется сбалансированной транслокацией.
По оценкам, один из 560 человек имеет сбалансированную транслокацию. Непонятно, почему происходит сбалансированная транслокация.Это может быть унаследованная черта или может возникнуть у плода, даже если ни один из родителей не затронут этим заболеванием. Новые транслокации могут происходить при формировании сперматозоидов или яйцеклеток или сразу после оплодотворения. Большинство людей со сбалансированной транслокацией не страдают от побочных эффектов и часто не диагностируются до тех пор, пока не начнут страдать от бесплодия.
Ошибки сбалансированной транслокации диагностируются с помощью кариотипирования. Образцы крови берутся у каждого родителя и анализируются на предмет транслокации.
СБАЛАНСИРОВАННАЯ ТРАНСЛОКАЦИЯ И ПОВТОРЯЮЩАЯСЯ НЕПРАВИЛЬНОСТЬ
Многие люди со сбалансированной транслокацией имеют детей. У них может быть ребенок с нормальным хромосомным набором, или у ребенка может быть сбалансированная транслокация, как и у родителя.
Естественное зачатие и живорождение возможно в случаях сбалансированной транслокации, но у людей с этим заболеванием может быть больше трудностей с зачатием и они подвергаются большему риску повторного выкидыша, чем те, у кого его нет.Когда у партнера — мужчины или женщины — сбалансированная транслокация, риск выкидыша увеличивается до 20, 30 или даже 50 процентов. Чем больше хромосомный дисбаланс у плода, тем выше вероятность выкидыша.
При каждой беременности родитель со сбалансированной транслокацией может производить ребенка с нормальными хромосомами или ребенка с несбалансированными хромосомами.
ВАРИАНТЫ ФЕРМЕНТОВ ДЛЯ ПАРЫ С СБАЛАНСИРОВАННОЙ ТРАНСЛОКАЦИЕЙ
Важно, чтобы пары полностью понимали свои варианты, включая риски, затраты и вероятность успеха.Варианты лечения включают:
- Выживающее ведение — иногда называемое бдительным ожиданием — наименее затратный из методов лечения. Однако риск выкидыша может достигать 50%
- Донорство гамет или эмбрионов — устраняет риски, связанные со сбалансированной транслокацией, но затраты на лечение выше, и нет генетической связи с обоими родителями
- IVF-PGD (преимплантационная генетическая диагностика) — повышает шансы на успешную беременность и живорождение и поддерживает генетическую связь с родителями.ЭКО и ПГД дороги, но могут помочь обеспечить перенос только эмбрионов без несбалансированной хромосомной транслокации. Исследования показали, что методы ПГД с использованием 24-хромосомного скрининга предлагают более надежный подход к снижению частоты выкидышей у лиц со сбалансированной транслокацией
Обратитесь в местную клинику URA в Хасбрук-Хайтс, Хобокен и Уэйн, штат Нью-Джерси, для получения дополнительной информации. Ваша дружная команда URA будет рада предоставить дополнительную информацию о родительской сбалансированной транслокации.
Обнаружение сбалансированного носителя транслокации с помощью биопсии трофэктодермы: клинический случай | Молекулярная цитогенетика
Ван Дайк Д.Л., Вайс Л., Роберсон Дж. Р., Бабу В.Р. Частота и частота мутаций сбалансированных аутосомных перестроек у человека, оцененные на основе пренатальных генетических исследований для пожилого возраста матери. Am J Hum Genet. 1983; 35 (2): 301-8.
Джейкобс П.А., Браун С., Грегсон Н., Джойс С., Уайт Х. Оценки частоты хромосомных аномалий, обнаруживаемых у неотобранных новорожденных с использованием умеренных уровней разбивки.J Med Genet. 1992. 29 (2): 103–8.
CAS
Статья
Google Scholar
Лледо Б., Ортис Дж. А., Моралес Р., Тен Дж., Де ла Фуэнте П. Э., Гарсия-Очоа С. и др. Отцовский эффект переносчиков хромосомной транслокации наблюдается в результате мейотической сегрегации эмбрионов. Hum Reprod. 2010. 25 (7): 1843–8.
CAS
Статья
Google Scholar
Джанароли Л., Магли М.С., Ферраретти А.П., Мунне С., Баликкиа Б., Эскудеро Т. и др.Возможный межхромосомный эффект у эмбрионов, генерируемый гаметами от носителей транслокации. Hum Reprod. 2002. 17 (12): 3201–7.
CAS
Статья
Google Scholar
Тран QT, Яценко Т., Пуламец О., Цуйко О., Любенец Д., Рейманд Т. и др. Хромосомное сканирование отдельных сперматозоидов путем комбинирования сортировки клеток с активацией флуоресценции и секвенирования нового поколения. J Assist Reprod Genet. 2018; 36 (1): 91-7.
Артикул
Google Scholar
Идову Д., Меррион К., Веммер Н., Маш Дж. Г., Петтерсен Б., Киячич Д. и др. Исходы беременности после преимплантационной генетической диагностики по 24 хромосомам в парах со сбалансированными реципрокными или робертсоновскими транслокациями. Fertil Steril. 2015; 103 (4): 1037–42.
Артикул
Google Scholar
Sugiura-Ogasawara M, Ozaki Y, Sato T., Suzumori N, Suzumori K. Плохой прогноз для рецидивирующих абортов с материнскими или отцовскими реципрокными транслокациями.Fertil Steril. 2004. 81 (2): 367–73.
Артикул
Google Scholar
Verlinsky Y, Tur-Kaspa I, Cieslak J, Bernal A, Morris R, Taranissi M, et al. Преимплантационное тестирование на хромосомные нарушения улучшает репродуктивный исход у пациентов с плохим прогнозом. Воспроизвести BioMed Online. 2005. 11 (2): 219–25.
CAS
Статья
Google Scholar
Munné S, Sandalinas M, Escudero T, Fung J, Gianaroli L, Cohen J.Результат преимплантационной генетической диагностики транслокаций. Fertil Steril. 2000. 73 (6): 1209–18.
Артикул
Google Scholar
Фишер Дж., Коллс П., Эскудеро Т., Мунне С. Преимплантационная генетическая диагностика (ПГД) улучшает исход беременности для носителей транслокаций с рецидивирующими потерями в анамнезе. Fertil Steril. 2010. 94 (1): 283–9.
Артикул
Google Scholar
Fiorentino F, Spizzichino L, Bono S, Biricik A, Kokkali G, Rienzi L и др. ПГД для реципрокных и робертсоновских транслокаций с использованием сравнительной геномной гибридизации массива. Hum Reprod. 2011. 26 (7): 1925–35.
CAS
Статья
Google Scholar
Гарднер Д.К., Лейн М, Стивенс Дж., Шленкер Т., Скулкрафт ВБ. Оценка бластоцисты влияет на имплантацию и исход беременности: в сторону однократного переноса бластоцисты. Fertil Steril.2000. 73 (6): 1155–8.
CAS
Статья
Google Scholar
Zhang S, Lei C, Wu J, Sun H, Zhou J, Zhu S, et al. Анализ паттернов сегрегации четырехвалентных структур и влияние на стабильность генома во время мейоза у носителей реципрокной транслокации. Hum Reprod. 2018; 33 (4): 757–67.
Артикул
Google Scholar
Е Й, Цянь И, Сюй Ц., Цзинь Ф.Анализ мейотической сегрегации эмбрионов от носителей реципрокной транслокации в циклах PGD; 2012.
Книга
Google Scholar
Dul E, van Echten-Arends J, Groen H, Kastrop P, Wissen LA, Engelen J, et al. Могут ли характеристики реципрокных транслокаций предсказать вероятность переноса эмбрионов в циклах ПГД? J Clin Med. 2014. 3 (2): 348–58.
Артикул
Google Scholar
Treff NR, Forman EJ, Katz-Jaffe MG, Schoolcraft WB, Леви Б., Скотт РТ. Случайная идентификация пациентов со сбалансированным переносчиком транслокаций посредством комплексного хромосомного скрининга бластоцист, полученных в результате ЭКО. J Assist Reprod Genet. 2013. 30 (6): 787–91.
Артикул
Google Scholar
Sundheimer LW, Liu L, Buyalos RP, Hubert G, Al-Safi Z, Shamonki M. Диагностика родительских сбалансированных реципрокных транслокаций с помощью биопсии трофэктодермы и всестороннего хромосомного скрининга.J Assist Reprod Genet. 2018; 35 (1): 165–9.
CAS
Статья
Google Scholar
Робинсон К., Нейтцель Д., Рейнвальд Дж., Чжу М., Фолкнер Н. Идентификация ранее неизвестных сбалансированных носителей транслокации посредством рутинного доимплантационного генетического скрининга с использованием целевого анализа секвенирования ДНК следующего поколения (NGS). Fertil Steril. 2017; 107 (3): e49.
Артикул
Google Scholar
De Braekeleer M, Dao TN. Цитогенетические исследования в парах, перенесших повторную потерю беременности, Репродукция человека. 1990. 5 (5): 519–28.
Артикул
Google Scholar
Кайед Х.Ф., Мансур Р.Т., Абулгар М.А., Серур Г.И., Амер А.Е., Абдразик А. Скрининг хромосомных аномалий у 2650 бесплодных пар, подвергающихся ИКСИ. Воспроизвести BioMed Online. 2006. 12 (3): 359–70.
Артикул
Google Scholar
Popovic M, Dheedene A, Christodoulou C, Taelman J, Dhaenens L, Van Nieuwerburgh F и др. Хромосомный мозаицизм в бластоцистах человека: главная проблема доимплантационного генетического тестирования? Hum Reprod. 2018; 33 (7): 1342–54.
CAS
Статья
Google Scholar
Клементини Э., Палка С., Иецци I, Ступпиа Л., Гуфинлили-Франки П., Тибони Г.М. Распространенность хромосомных аномалий у 2078 бесплодных пар, направленных на вспомогательные репродуктивные технологии.Hum Reprod. 2005. 20 (2): 437–42.
CAS
Статья
Google Scholar
Raziel A, Friedler S, Schachter M, Kasterstein E, Strassburger D, Ron-El R. Повышенная частота хромосомных аномалий женского партнера у пациентов с неудачной имплантацией высокого порядка после экстракорпорального оплодотворения. Fertil Steril. 2002. 78 (3): 515–9.
Артикул
Google Scholar
Стерн С, Пертиле М, Норрис Х, Хейл Л., Бейкер HWG. Хромосомные транслокации в парах с неудачной имплантацией экстракорпорального оплодотворения. Hum Reprod. 1999. 14 (8): 2097–101.
CAS
Статья
Google Scholar
Де Саттер П., Стадхаудерс Р., Дутре М., Геррис Дж., Донт М. Распространенность хромосомных аномалий и время анализа кариотипа у пациентов с рецидивирующей неудачей имплантации (RIF) после вспомогательной репродукции.Факты Виды Vis Obgyn. 2012. 4 (1): 59–65.
PubMed
PubMed Central
Google Scholar
van den Boogaard E, Hermens RPMG, Verhoeve HR, Kremer JAM, van der Veen F, Knegt AC, et al. Селективное кариотипирование при повторном невынашивании беременности: приняты ли рекомендуемые руководства в повседневной клинической практике? Hum Reprod. 2011; 26 (8): 1965–70.
Артикул
Google Scholar
Jauniaux E, Farquharson RG, Christiansen OB, Exalto N. Основанные на доказательствах рекомендации по исследованию и лечению повторного выкидыша. Hum Reprod. 2006. 21 (9): 2216–22.
Артикул
Google Scholar
Бендер Атик Р., Кристиансен О. Б., Элсон Дж., Колте А. М., Льюис С., Миддельдорп С. и др. Рекомендации ESHRE: повторяющееся невынашивание беременности. Hum Reprod Open. 2018; 2018 (2): hoy004. https://academic.oup.com/hropen/article/2018/2/hoy004/4963604.
Rosenwaks Z, Handyside AH, Fiorentino F, Gleicher N, Paulson RJ, Schattman GL, et al. Плюсы и минусы преимплантационного генетического тестирования на анеуплоидию: клинические и лабораторные перспективы. 2018;
Google Scholar
Пелестор Ф., Анахори Т., Лефорт Дж., Пуэчберти Дж., Лир Т., Хедон Б. и др. Сложные хромосомные перестройки: происхождение и мейотическое поведение. Обновление Hum Reprod. 2011. 17 (4): 476–94.
CAS
Статья
Google Scholar
Оливер-Бонет М., Бенет Дж., Сан Ф., Наварро Дж., Абад С., Лир Т. и др. Мейотические исследования двух реципрокных транслокаций человека и их связи со сперматогенной недостаточностью. Hum Reprod. 2005. 20 (3): 683–8.
CAS
Статья
Google Scholar
Mittwoch U, Mahadevaiah SK. Непарные хромосомы при мейозе: причина или следствие гаметогенной недостаточности? Cytogenet Cell Genet.1992. 59 (4): 274–9.
CAS
Статья
Google Scholar
Munné S, Wells D. Обнаружение мозаицизма на стадии бластоцисты с использованием секвенирования нового поколения с высоким разрешением. Fertil Steril. 2017; 107 (5): 1085–91.
Артикул
Google Scholar
Grati FR, Gallazzi G, Branca L, Maggi F, Simoni G, Yaron Y. Основанная на фактах система подсчета очков для определения приоритетности мозаичных анеуплоидных эмбрионов после преимплантационного генетического скрининга.Воспроизвести BioMed Online. 2018; 36 (4): 442–9.
Артикул
Google Scholar
Генетические факторы как причина RPL «Fertility Associates of Memphis
ГЕНЕТИЧЕСКИЕ ФАКТОРЫ КАК ПРИЧИНА RPL
Существует множество генетических факторов, которые могут привести к невозможности беременности. К ним относятся анеуплоидия (приобретение или потеря хромосомы), хромосомный дисбаланс в результате родительских транслокаций или инверсий, делеции или дупликации генетической информации в хромосомах, а также мутации одного гена.В общих чертах, генетические факторы можно разделить на эмбриональные ошибки, происходящие из известных хромосомных аномалий родителей, и эмбриональные ошибки, которые возникают de novo у очевидно нормальных в хромосомном отношении родителей.
Хромосомные нарушения родителей
Аномалии родительских хромосом встречаются у 3-5% пар с RPL по сравнению с 0,7% в общей популяции. К ним относятся транслокации, инверсии и относительно редкие кольцевые хромосомы.Сбалансированные транслокации являются наиболее частыми хромосомными аномалиями, способствующими повторной потере беременности. В парах с RPL эта аномалия чаще встречается у партнера-женщины в соотношении от 2: 1 до 3: 1 (женщина: мужчина). В дополнение к генетическим ошибкам, возникающим в результате родительской сбалансированной транслокации, недавние данные преимплантационного генетического тестирования показали, что эмбрионы, полученные от родителей, укрывающих сбалансированную реципрокную транслокацию, также имеют частоту неродственной хромосомной анеуплоидии, превышающую 35%.
При транслокациях происходит обмен сегментами хромосом между негомологичными хромосомами. Есть два основных типа сбалансированной транслокации: реципрокная и робертсоновская. Робертсоновские транслокации затрагивают две акроцентрические хромосомы (номера 13,14,15,21,22), которые сливаются около центромеры с потерей коротких плеч. Исследования показывают, что, когда транслокация Робертсона является материнской, существует больший риск того, что плод будет демонстрировать несбалансированный фенотип. При реципрокных транслокациях тип перестройки возникает в результате разрыва негомологичных хромосом с реципрокным обменом оторванными сегментами [64].Считается, что сбалансированные реципрокные транслокации напрямую способствуют как бесплодию, так и повторной потере беременности (RPL).
Родительские сбалансированные хромосомные ошибки, такие как транслокации или инверсии, диагностируются посредством кариотипирования пар. Хромосомная аномалия у одного из родителей может быть обнаружена у 3-5% пар, у которых произошли множественные самопроизвольные выкидыши. Если результаты по хромосоме выкидыша недоступны и пара имеет в анамнезе как минимум 2 ранние потери, мы рекомендуем получить родительский кариотип.
Рецидивирующая анеуплоидия
Первый выкидыш с хромосомными отклонениями был зарегистрирован в 1961 году, и с тех пор накопилось большое количество данных о хромосомном статусе выкидышей. Общая частота хромосомных аномалий при самопроизвольных выкидышах составляет не менее 50%. Большинство этих аномалий числовые: 52% — трисомии, 29% — моносомия 45, X, 16% — триплоидии, 6% — тетраплоидии и 4% — структурные перестройки.В крупнейшем исследовании хромосомных результатов выкидыша в когорте повторяющихся выкидышей риск анеуплоидии у женщин моложе 35 лет был меньше в RPL по сравнению с общей репродуктивной популяцией. Эти данные предполагают, что существуют факторы, помимо генетических, которые способствуют выкидышу у многих женщин с ППН. Признаков рецидивирующей анеуплоидии обнаружено не было; как и в общей репродуктивной популяции, риск трисомии возрастает с увеличением возраста матери. Подавляющее большинство эмбриональных анеуплоидий считается результатом нерасхождения материнских мейотических клеток во время развития ооцитов, хотя возможны аномалии, возникающие из-за компонента сперматозоидов, особенно в парах с мужским бесплодием.
В профессиональном сообществе ведутся серьезные споры о том, насколько распространена анеуплоидия среди эмбрионов RPL. Новые данные предполагают, что пациенты с RPL могут иметь более низкую частоту эмбриональной анеуплоидии при выкидышах в первом триместре по сравнению со всеми женщинами. Например, исследование, оценивающее 4873 эмбриона с помощью микроматрицы с однонуклеотидным полиморфизмом (SNP), показало, что частота анеуплоидии, обнаруженная с помощью биопсии трофэктодермы на стадии бластоцисты при RPL, была значительно ниже (32%), чем частота анеуплоидии, обнаруженной при биопсии на стадии дробления (61 %).Этот более низкий уровень анеуплоидии у доимплантационных эмбрионов от женщин с RPL отражается в более низкой частоте анеуплоидии, обнаруженной при анализе хромосом выкидыша. Другие данные небольших исследований показывают, что уровень анеуплоидии у эмбрионов при RPL превышает 65%. Истинная частота эмбриональной анеуплоидии в парах с диагнозом RPL в настоящее время является предметом больших споров среди репродуктивных эндокринологов.
Хромосомные делеции и дупликации
В отличие от анеуплоидии, которая представляет собой приобретение или потерю всей хромосомы, также возможны хромосомные делеции и дупликации отдельных участков хромосом у эуплоидных эмбрионов.Влияние делеций и дупликаций на эти области до сих пор неясно. Определенные делеции и дупликации, при которых критическая область хромосомы значительно изменена, безусловно, могут привести к серьезным заболеваниям или остановке развивающегося эмбриона.
.
Сбалансированные транслокации: что делать?
Теоретически , особь со сбалансированной транслокацией должна иметь следующие вероятности при каждом зачатии: потомство с несбалансированным кариотипом в 50% случаев , потомство со сбалансированным кариотипом в 25% случаев и потомство с нормальный кариотип в оставшихся 25% случаев . В действительности , процент новорожденных с несбалансированным кариотипом и последующим патологическим фенотипом намного ниже из-за того, что гаметы и эмбрионы с несбалансированным кариотипом часто отбираются отрицательно (т. Е. Они истощаются еще до зачатия или до того, как беременность может пойти на, объясняя бесплодие и повторяющуюся потерю беременности у носителей транслокации).
Таким образом, вероятность наступления срока беременности новорожденным с несбалансированным кариотипом и, следовательно, с патологическим фенотипом (т.е. врожденные пороки развития и / или умственная отсталость), зависит от некоторых факторов:
- пол родителя, несущего сбалансированную транслокацию
- тип вовлеченной хромосомы и размер обмениваемой хромосомной части .
- метод определения несбалансированной транслокации у родителя (например, если сбалансированная транслокация была диагностирована после рождения уродливого ребенка с несбалансированным кариотипом или во время обследований на предмет повторной потери беременности или бесплодия).
Как правило, если в семье нет лиц, пострадавших от несбалансированной транслокации, репродуктивный риск рождения новорожденного с несбалансированным кариотипом и, следовательно, страдающих врожденными пороками развития и / или умственной отсталостью, составляет: 7%, если носителем сбалансированной транслокации является мать, 3%, если носителем сбалансированной транслокации является отец . Этот риск может быть дополнительно снижен, если родительский носитель был диагностирован во время установления повторного невынашивания беременности: в этом случае риск рождения ребенка с несбалансированным кариотипом на сроке беременности составляет всего 2% .Напротив, если было установлено, что родитель является носителем сбалансированной транслокации, потому что родился ребенок с несбалансированным кариотипом, риск рождения еще одного ребенка с несбалансированным кариотипом выше и эмпирически оценивается в 20% для каждого ребенка. беременность (причина ясна: в этом случае несбалансированная транслокация порождает патологический фенотип, который, однако, совместим с жизнью, будучи генетически менее сложным, чем транслокация, вызывающая повторную потерю беременности, т.е.е. формирование эмбриона с таким хромосомным дисбалансом, что он не может дожить до срока беременности).
PGD от FISH для реципрокной транслокации: первый ребенок из Индии
Одной из причин повторяющихся выкидышей является наличие сбалансированной транслокации в хромосомах мужа или жены. Это можно обнаружить только с помощью кариотипирования, поскольку носители сбалансированных транслокаций фенотипически нормальны. Раньше можно было обойти проблему с помощью донорской спермы или ооцитов.С появлением преимплантационной генетической диагностики (ПГД) пары теперь могут иметь собственное биологическое потомство и избегать повторных выкидышей.
ПГД включает в себя определенные дополнительные этапы цикла ЭКО. Несмотря на то, что естественное зачатие возможно, парам необходимо пройти вспомогательную репродукцию, чтобы получить несколько эмбрионов, из которых затем отбираются нормальные для переноса. После подавления с последующей стимуляцией яичников гормонами и последующим извлечением ооцитов в каждый ооцит вводят один сперматозоид с использованием интрацитоплазматической инъекции сперматозоидов (ИКСИ) или более современной техники интрацитоплазматической морфологически отобранной инъекции сперматозоидов (IMSI).На 3-й день, когда эмбрионы достигли стадии 6-8 клеток, из каждого эмбриона берут биопсию одного бластомера, обрабатывают гипотоническим раствором и фиксируют на предметных стеклах фиксатором Карнуа таким образом, чтобы цитоплазма была удалена, а ядро было видно под 10-кратный объектив фазово-контрастного микроскопа [1]. Используя метод быстрой флуоресцентной гибридизации in situ (FISH), по меньшей мере, три центромерных / субтеломерных зонда хромосом, участвующих в транслокации, гибридизуются с ядрами отдельных клеток.После отмывки после гибридизации под флуоресцентным микроскопом видны различные цветные сигналы. Интерпретация основана на количестве сигналов или цветных точек, видимых для каждого используемого датчика. Клетка со сбалансированной транслокацией или без транслокации покажет два сигнала каждого использованного зонда. Любая другая комбинация сигналов указывает на несбалансированную транслокацию, которая обычно приводит к выкидышу, и, следовательно, эти эмбрионы не переносятся. За один цикл переносится не более трех эмбрионов.Если есть дополнительные нормальные эмбрионы, они подвергаются криоконсервации путем витрификации для дальнейшего использования. В Индии PGD методом FISH для хромосомных транслокаций находится в зачаточном состоянии. Ранее авторы сообщили о первой успешной беременности после ПГД по поводу Робертсоновской транслокации в Индии [2], в результате которой родилась здоровая девочка. Здесь они сообщают о первом ребенке, родившемся в Индии после ПГД в результате реципрокной транслокации с помощью FISH.
Хромосомные транслокации в парах с неудачной имплантацией экстракорпорального оплодотворения | Репродукция человека
Аннотация
Известно, что рецидивирующий выкидыш связан с родительскими хромосомными аномалиями, особенно с сбалансированными реципрокными и робертсоновскими транслокациями.Целью этого исследования было проверить гипотезу о том, что пары с неудачной имплантацией экстракорпорального оплодотворения (ЭКО), как и пары с повторным выкидышем, имеют более высокую, чем ожидалось, распространенность транслокаций, которые могут повлиять на исход беременности. Пациенты, у которых ранее было перенесено не менее 10 эмбрионов без достижения клинической беременности, оценивались на хромосомные аномалии в рамках скрининговых исследований на неудачу имплантации. Также были протестированы пациенты с рецидивирующим выкидышем, в анамнезе которых было не менее трех абортов в первом триместре подряд.Результаты сравнивались с сообщениями о пациентах с бесплодием, обращающихся за лечением, и с программами популяционного неонатального скрининга. Хромосомные аномалии в целом были обнаружены у 13 из 514 человек с неудачной имплантацией (2,5%) и у 15 из 319 человек с повторным выкидышем (4,7%). Транслокации (реципрокные и робертсонианские) были обнаружены у 7/514 человек (1,4%) и 7/219 пар (3,2%) с неудачей имплантации ( P, <0,0005 по сравнению с бесплодным контролем и P <0.0001 по сравнению с новорожденными, прошедшими скрининг). Транслокации были обнаружены у 13/319 человек (4,1%) и 12/130 пар (9,2%) с повторным выкидышем. Сбалансированные родительские транслокации могут быть вовлечены в патогенез неудачной имплантации ЭКО. Генетическая оценка должна рассматриваться как часть обследования этих пациентов.
Введение
Несмотря на то, что экстракорпоральное оплодотворение (ЭКО) произвело революцию в лечении бесплодия, все еще существует много пар, которым несколько раз переносят эмбрионы хорошего качества без успешной имплантации.Хромосомные аномалии, особенно транслокации, как известно, причастны к различным формам репродуктивной недостаточности, начиная от дефектного гаметогенеза (Crosignani and Rubin, 1982) до рецидивирующего спонтанного выкидыша (Campana et al ., 1986). Хотя несколько групп сообщили, что частота хромосомных аберраций у бесплодных пациентов выше, чем в популяционных скрининговых исследованиях (Chandley, 1983; Koulisher and Gillerot, 1985; Hens et al ., 1988), за исключением мужского фактора бесплодия. , хромосомный анализ обычно не проводится для новых пациентов, обращающихся в клиники по лечению бесплодия.
Хромосомные транслокации включают перенос генетического материала от одной хромосомы к другой и могут быть реципрокными, включая разрыв двух негомологичных хромосом с обменом сегментами, или Робертсоновские транслокации, связанные с точками разрыва, близкими к центромере двух акроцентрических хромосом. Важность транслокаций связана с характером сегрегации в мейозе.
Паттерны наследования сложны и зависят от конкретных вовлеченных хромосом и размера перестроек (Gardner and Sutherland, 1996).С развитием доимплантационной генетической диагностики, включающей тестирование на Робертсоновские и реципрокные транслокации (Cassel et al ., 1997; Munné et al ., 1998a, b), обнаружение этих структурных хромосомных аномалий у пар, получающих лечение ЭКО, становится очень важным. важность.
Мы постулировали, что причины неудачной имплантации ЭКО и повторяющейся потери беременности на ранних сроках одинаковы (Stern et al ., 1998), и, таким образом, некоторые случаи стойкой неудачной имплантации ЭКО могут быть связаны со сбалансированными родительскими аутосомными транслокациями.Чтобы проверить это, мы исследовали кариотипы пациентов с неудачной имплантацией ЭКО и сравнили результаты с результатами пациентов с повторным невынашиванием беременности в качестве положительной контрольной группы, а также опубликовали исторические контрольные группы бесплодных пациентов и новорожденных.
Материалы и методы
Одобрение было получено от комитетов по исследованиям и этике Королевской женской больницы до начала исследования.
Группы пациентов
пациентов были набраны из клиники ЭКО и повторных выкидышей Королевской женской больницы, а также из соответствующего частного учреждения ЭКО.Все были проконсультированы и дали свое информированное согласие.
Группа неудач имплантации (IF)
Были набраны пары, которым ранее было перенесено не менее 10 эмбрионов (в среднем 17, диапазон 10–50), не достигнув клинической беременности. Для целей настоящего исследования клиническая беременность определялась как беременность, изначально диагностированная биохимическим методом через 17 дней после переноса эмбриона (уровень βHCG в сыворотке> 100 МЕ), с последующим подтверждением наличия гестационного мешка ± сердца плода при трансвагинальном ультразвуковом исследовании через 28 дней после переноса эмбриона. .Результаты были доступны для 293 женщин (средний возраст 36 лет, от 24 до 47 лет) и 221 партнера. Для 219 пар были доступны результаты обоих партнеров. Основные диагнозы бесплодия для этих пациентов были следующими: ановуляция у шести пациентов (2%), окклюзионное заболевание маточных труб, диагностированное при лапароскопии или рентгенологическом обследовании у 69 пациентов (23%), значительный эндометриоз яичников, классифицированный как пересмотренный AFS (Американское общество фертильности). , 1985) стадия 3 или 4, диагностированная при лапароскопии у 25 пациентов (9%), изолированное мужское факторное бесплодие (согласно рекомендациям Всемирной организации здравоохранения по субфертильности) (ВОЗ, 1992) у 86 пациентов (29%), комбинированное мужское и трубное бесплодие. у 14 пациентов (5%) и бесплодие необъяснимого характера у 93 пациентов (32%).Также были проведены подробные исследования других возможных причин IF, включая тестирование на аутоантитела и амбулаторную гистероскопию.
Группа повторных выкидышей (РМК)
Мы также обследовали 184 женщины в возрасте 19–47 лет (средний возраст 34 года), посещавших Клинику повторных выкидышей. Все эти женщины перенесли по крайней мере три последовательных клинических потери беременности в первом триместре (в среднем 4, диапазон 3–16). Также были протестированы сто тридцать пять партнеров, и результаты были доступны для обоих партнеров в 130 парах.Опять же, были предприняты подробные исследования других возможных причин RMC, включая тестирование на аутоантитела и амбулаторную гистероскопию.
Контрольные группы
Чтобы оценить значимость наших результатов, мы сравнили результаты групп пациентов с двумя группами исторического контроля: (i) бесплодная контрольная группа: 500 пар, направленных на ЭКО или родственное лечение бесплодия (Hens et al ., 1988) , возрастной диапазон женщин 20–45 лет, модальный возраст 30 лет; (ii) контрольная группа неонатальной популяции: 94 465 младенцев, прошедших скрининг в рамках популяционных программ скрининга (van Assche et al ., 1996), включая 13 751 младенца мужского пола (Walzer and Gerald, 1977), 45 804 младенца (Hook and Hamerton, 1977) и 34 910 младенцев (17 872 мальчика и 17 038 девочек, Nielsen and Wohlert, 1991).
Цитогенетические исследования
Цитогенетические препараты были получены из лимфоцитов периферической крови, стимулированных фитогемагглютинином (ФГА). Культуры были созданы стандартными методами (Rooney and Czepulkowski, 1992) и синхронизированы с 300 мкг / мл бромдезоксиуридина (BrdU), аналога тимидина, через 48 часов после начала.BrdU удаляли через 14 ч и к культурам добавляли свежую среду; клетки собирали через 6 часов. Хромосомный анализ был проведен на метафазах с G-полосой с рутинным исследованием минимум 10 клеток. Еще 20-40 клеток исследовали при подозрении на хромосомный мозаицизм. В исторических исследованиях изучались переменные числа метафаз.
Статистический анализ
Различия между частотами были проверены с использованием биномиального распределения.Влияние различных факторов на неудачу имплантации или повторный выкидыш анализировали с помощью регрессионного анализа.
Результаты
Хромосомные аномалии (исключая синдром Тернера и синдром Клайнфельтера) были обнаружены у 13/514 человек в группе IF (2,5%) и 15/319 человек в группе RMC (4,7%), по сравнению с 13/1000 человек в группе исторического бесплодия. контрольная группа (1,3%) и 299/94465 новорожденных, прошедших исторический скрининг (0,3%). Аномалии половых хромосом были обнаружены у 5/514 (1%) пациентов с ИФ и у 1/319 (0.3%) пациентов с РМЦ. Было обнаружено, что у одного партнера мужского пола по ПФ была сбалансированная парацентрическая инверсия хромосомы 15, а у одного пациента с ПМЦ — вариант хромосомы 1. Аутосомные транслокации были обнаружены у 7/514 человек в группе ПФ (1,4%) (см. Таблицу I) и, таким образом, были значительно чаще в этой группе, чем в контрольной группе с бесплодием ( P <0,0005) и новорожденных, прошедших скрининг ( P <0,0001). Транслокации, обнаруженные в группе IF, включали три реципрокные транслокации у партнеров-женщин и три реципрокные транслокации и одну транслокацию Робертсона у партнеров-мужчин (см. Таблицу II и Рисунки 1 и 2).В этой группе не было пар с историей повторного самопроизвольного выкидыша, но две пары имели в анамнезе один самопроизвольный выкидыш в анамнезе до развития бесплодия. Одна из мужских транслокаций (46, XY, t (5; 21)) была обнаружена у пары, у которой было значительное мужское бесплодие, и у этого мужчины также была обнаружена микроделеция Yq (de Kretser et al ., 1997 ).
Транслокации были обнаружены у 7/219 пар (3,2%) с ИФ, где были протестированы оба партнера (см. Рисунок 3).
Когда результаты были проанализированы в зависимости от пола, было обнаружено, что 3/293 женщин в группе IF (1,0%) имеют транслокации, по сравнению с 1/500 женщин контрольной группы с историческим бесплодием (0,2%) ( P <0,005), в то время как 4/221 мужчин (1,8%) в группе IF несли транслокации по сравнению с 2/500 мужчин контрольной группы с историческим бесплодием (0,4%) ( P <0,005).
Чтобы выяснить, были ли какие-либо особенности пациента или эмбриона связаны с хромосомными аномалиями, был проведен регрессионный анализ Пуассона.
Не было никакой связи между диагнозом бесплодия и наличием хромосомной аномалии. Не было статистически значимой разницы в качестве эмбрионов, то есть пропорции эмбрионов хорошего качества (1 или 2 степени) между пациентами с транслокациями, пациентами с неудачной имплантацией ЭКО без транслокаций и нашей общей популяцией ЭКО (48,6, 51,7 и 47,6% соответственно. ). Ни у одного из пациентов с хромосомной аномалией не было обнаружено других потенциальных причин IF при оценке аутоантител и гистероскопии.
Транслокации были обнаружены у 13/319 человек в группе повторного выкидыша (4,1%). Одиннадцать из 184 партнеров-женщин (6,0%) несли сбалансированные транслокации, из которых семь были реципрокными и четыре были аномалиями Робертсона, в то время как две реципрокные транслокации были обнаружены у 135 партнеров-мужчин (1,5%) женщин с RMC (см. Таблицу III). В одной паре с RMC у обоих партнеров были обнаружены реципрокные транслокации (46, XX, t (7; 22) и 46, XY, t (7; 11). В двенадцати из 130 пар с RMC, где тестировались оба партнера. , сбалансированная транслокация была обнаружена у одного или обоих партнеров (9.2%).
У одной пациентки с транслокацией также были обнаружены антифосфолипидные антитела, и ни у одной пациентки не было гистероскопических аномалий.
Выводы
Это исследование показало, что пары с необъяснимой повторной неудачей имплантации эмбриона ЭКО имеют больший, чем ожидалось, шанс перенести сбалансированную хромосомную транслокацию. Таким образом, возможно, что наличие несбалансированной транслокации в некоторых гаметах может предрасполагать к преимплантационной неудаче развития эмбриона и увеличивать риск повторной неудачи лечения ЭКО.
Исторические контрольные данные из отобранных популяций новорожденных были использованы в целях сравнения в этом отчете, поскольку в нашем исследовании было невозможно выполнить нашу собственную популяционную программу скрининга кариотипа.
Из всех известных самопроизвольных абортов около 50% имеют хромосомную аномалию. В парах с повторным самопроизвольным абортом сбалансированная транслокация была обнаружена у одного партнера примерно в 5–7% случаев, в зависимости от количества предыдущих выкидышей (Campana et al ., 1986). В нашей серии пар, имевших по крайней мере три предыдущих последовательных выкидыша, было обнаружено, что 9,2% имели сбалансированные транслокации у одного или обоих партнеров.
Аутосомно-сбалансированные транслокации также участвуют в лечении пациентов с бесплодием, особенно мужского бесплодия (Chandley, 1984; De Braekeleer and Dao, 1991). Существует повышенный риск выявления олигозооспермии у мужчин с аутосомными аномалиями (Yoshida et al ., 1996), а хромосомные исследования сперматозоидов показывают несбалансированный кариотип в различных пропорциях, например.грамм. 54% для реципрокных транслокаций (Martin and Hulten, 1993) и 13,7% для робертсоновских транслокаций (Martin et al ., 1992). Имеется лишь ограниченная информация о влиянии структурных аберраций на оогенез (Speed, 1988; Tupler and Barbierato et al ., 1994).
В недавнем исследовании хромосомных аномалий у 447 пар, подвергшихся интрацитоплазматической инъекции сперматозоидов (ИКСИ), аутосомные транслокации были обнаружены у 2% пар, четыре у партнеров-мужчин и пять у партнеров-женщин (Meschede et al ., 1998). В другом исследовании, в котором оценивали 305 пар, поступающих на ИКСИ, транслокации были обнаружены в 3,2% пар, пять реципрокных транслокаций и одна Робертсоновская транслокация у партнеров-мужчин и две реципрокные и две Робертсоновские транслокации у партнеров-женщин (van der Ven et al . , 1998). В недавнем сообщении мужчина с тяжелой олигоастенотератозооспермией прошел хромосомное тестирование после двух циклов ИКСИ, и было обнаружено, что он несет редкую транслокацию de novo t (Y; 16).После генетического консультирования он решил пройти дальнейшее лечение ИКСИ, в результате которого родились здоровые близнецы, один с кариотипом 46, XX, а другой с кариотипом 46, X, t, (Y; 16), как у отца. (Гилтай и др. ., 1998).
Однако имеется очень мало информации, касающейся хромосомных аномалий в парах, которые неоднократно пытались пройти лечение ЭКО с получением адекватного количества эмбрионов хорошего качества и, очевидно, надлежащим образом подготовленным эндометрием, без получения доказательств клинической беременности.В этих парах эмбрионы могут быть потеряны на стадии дробления, стадии бластоцисты или даже в период периимплантации.
Заманчиво предположить, что в некоторых случаях неудачной имплантации, например, при повторном самопроизвольном выкидышах, эмбрионы не развиваются из-за несбалансированных структурных хромосомных дефектов. Большинство очень ранних зачатий, которые не могут развиться, скорее всего, будут хромосомными аномалиями (Munné et al ., 1994). Некоторые аномалии, в том числе структурно несбалансированные, могут способствовать начальному развитию до стадии бластоцисты и даже имплантации, но затем не могут продолжить развитие (Miller et al ., 1980; Craft и др. ., 1982).
Паттерны наследования транслокаций относительно непредсказуемы и определяются различными способами сегрегации в мейозе I. Характер сегрегации и последствия для гамет потомства зависят от конкретных вовлеченных хромосом и размера перестройки (Gardner and Sutherland, 1996).
Хотя некоторые авторы пытались связать количественный дисбаланс хроматина с риском выкидыша или рождения живорожденного ребенка с заболеванием (Daniel et al ., 1989; Cohen et al ., 1994), риски пре- и периимплантационной потери, связанные со сбалансированными родительскими транслокациями, в значительной степени неизвестны. Это чрезвычайно затрудняет консультирование пар с бесплодием и неудачной имплантацией.
Разработка методов, позволяющих доимплантационную диагностику структурных аномалий (Munné et al ., 1998a, b), имеет особое значение для бесплодных пар со сбалансированными аутосомными транслокациями и может уменьшить разочарование, связанное с хромосомно несбалансированными эмбрионами.В недавнем отчете было проведено совместное культивирование эмбрионов от женщин, которые, как известно, носят de novo сбалансированную реципрокную транслокацию между хромосомами 1 и 22, чтобы попытаться частично отобрать эмбрионы in vitro . У пяти из семи эмбрионов, арестованных и при последующем тестировании с использованием трехцветной гибридизации in-situ, были обнаружены серьезные летальные цитогенетические аномалии, связанные с материнской транслокацией. Два эмбриона, которые развились до стадии бластоцисты, были перенесены, что привело к рождению мальчика-одиночки, унаследовавшего материнскую сбалансированную транслокацию (Ménézo et al ., 1997).
В заключение, это исследование продемонстрировало, что сбалансированные родительские транслокации могут быть вовлечены в патогенез неудачной имплантации ЭКО. Хромосомную оценку следует рассматривать как часть обследования этих пациентов, а генетическое консультирование и рассмотрение доимплантационной диагностики должно быть неотъемлемой частью планирования дальнейших стратегий лечения.
Таблица I.
Транслокации в группах пациентов и контрольной группе
| IVF-IF . | RMC . | Пациенты с бесплодием . | Неонатальная популяция . |
|---|---|---|---|
| n = 514 . | n = 319 . | n = 1000 . | n = 94 465 . |
| n (%) . | n (%) . | n (%) . | n (%) . |
| * P <0,0001 по сравнению с популяцией новорожденных; † P <0,0005 по сравнению с пациентами с бесплодием. | |||
| IVF-IF = неудачная имплантация при экстракорпоральном оплодотворении; RMC = повторный выкидыш. | |||
| 7 (1,4) * † | 13 (4,1) | 3 (0,3) | 174 (0.2) |
| IVF-IF . | RMC . | Пациенты с бесплодием . | Неонатальная популяция . |
|---|---|---|---|
| n = 514 . | n = 319 . | n = 1000 . | n = 94 465 . |
| n (%) . | n (%) . | n (%) . | n (%) . |
| * P <0,0001 по сравнению с популяцией новорожденных; † P <0,0005 по сравнению с пациентами с бесплодием. | |||
| IVF-IF = неудачная имплантация при экстракорпоральном оплодотворении; RMC = повторный выкидыш. | |||
| 7 (1,4) * † | 13 (4.1) | 3 (0,3) | 174 (0,2) |
Таблица I.
Транслокации в группах пациентов и контрольной группе
| ЭКО-ИФ . | RMC . | Пациенты с бесплодием . | Неонатальная популяция . |
|---|---|---|---|
| n = 514 . | n = 319 . | n = 1000 . | n = 94 465 . |
| n (%) . | n (%) . | n (%) . | n (%) . |
| * P <0,0001 по сравнению с популяцией новорожденных; † P <0,0005 по сравнению с пациентами с бесплодием. | |||
| IVF-IF = неудачная имплантация при экстракорпоральном оплодотворении; RMC = повторный выкидыш. | |||
| 7 (1,4) * † | 13 (4,1) | 3 (0,3) | 174 (0,2) |
| IVF-IF . | RMC . | Пациенты с бесплодием . | Неонатальная популяция . |
|---|---|---|---|
| n = 514 . | n = 319 . | n = 1000 . | n = 94 465 . |
| n (%) . | n (%) . | n (%) . | n (%) . |
| * P <0,0001 по сравнению с популяцией новорожденных; † P <0,0005 по сравнению с пациентами с бесплодием. | |||
| IVF-IF = неудачная имплантация при экстракорпоральном оплодотворении; RMC = повторный выкидыш. | |||
| 7 (1,4) * † | 13 (4,1) | 3 (0,3) | 174 (0,2) |
Таблица II.
Описание хромосомных транслокаций a , выявленных у пациентов с неудачной имплантацией, направленных на хромосомный анализ
| a Транслокации были de novo у пациентов, которые согласились на тестирование; пять пар, однако, не согласились, и поэтому неизвестно, была ли транслокация de novo или семейной. |
| 46, XX, t (2; 18) (q31; p11.2) |
| 46, XX, t (8; 11) (p11.2; p15.1) |
| 46, XX, t (8; 16) (q11.2; q13) |
| 46, XY, t (1; 9) (p32; q22.3) |
| 46, XY, t (5; 21) (p12; q11.2) |
| 46, XY, t (3; 9) (p21.1; q22.1) |
| 45, XY, der (13; 14) (q10; q10 ) |
| a Транслокации были de novo у пациентов, которые согласились на тестирование; пять пар, однако, не согласились, и поэтому неизвестно, была ли транслокация de novo или семейной. |
| 46, XX, t (2; 18) (q31; p11.2) |
| 46, XX, t (8; 11) (p11.2; p15.1) |
| 46, XX, t (8; 16) (q11.2; q13) |
| 46, XY, t (1; 9) (p32; q22.3) |
| 46, XY, t (5; 21) (p12; q11.2) |
| 46, XY, t (3; 9) (p21.1; q22.1) |
| 45, XY, der (13; 14) (q10; q10 ) |
Таблица II.
Описание хромосомных транслокаций a , выявленных у пациентов с неудачной имплантацией, направленных на хромосомный анализ
| a Транслокации были de novo у пациентов, которые согласились на тестирование; пять пар, однако, не согласились, и поэтому неизвестно, была ли транслокация de novo или семейной. |
| 46, XX, t (2; 18) (q31; p11.2) |
| 46, XX, t (8; 11) (p11.2; p15.1) |
| 46, XX, t (8; 16) (q11.2; q13) |
| 46, XY, t (1; 9) (p32; q22.3) |
| 46, XY, t (5; 21) (p12; q11.2) |
| 46, XY, t (3; 9) (p21.1; q22.1) |
| 45, XY, der (13; 14) (q10; q10 ) |
| a Транслокации были de novo у пациентов, которые согласились на тестирование; пять пар, однако, не согласились, и поэтому неизвестно, была ли транслокация de novo или семейной. |
| 46, XX, t (2; 18) (q31; p11.2) |
| 46, XX, t (8; 11) (p11.2; p15.1) |
| 46, XX, t (8; 16) (q11.2; q13) |
| 46, XY, t (1; 9) (p32; q22.3) |
| 46, XY, t (5; 21) (p12; q11.2) |
| 46, XY, t (3; 9) (p21.1; q22.1) |
| 45, XY, der (13; 14) (q10; q10 ) |
Таблица III.
Описание хромосомных транслокаций a , выявленных у пациентов с повторным выкидышем, направленных на хромосомный анализ
| a См. Сноску к Таблице II; b партнера. |
| 46, XX, t (6; 10) (q22.32; q11.23) |
| 46, XX, t (6; 8) (p22.2; q21.2) |
| 46, XX, t (4; 14) (p14; q31) |
| 46, XX, t (11; 18) (q23.3; q11.2) |
| 46, XX, t ( 3; 6) (p14.1; p21.1) |
| 46, XX, t (7; 22) (p13; q11.2) a |
| 46, XX, t (5; 11 ) (q15; q21) |
| 45, XX, der (13; 14) (q10; q10) |
| 45, XX, der (13; 14) (q10; q10) |
| 45, XX, der (13; 14) (q10; q10) |
| 45, XX, der (13; 14) (q10; q10) |
| 46, XY, t (2; 13) (p13; q22 ) |
| 46, XY, t (7; 11) (q22; q23) b |
| a См. Сноску к Таблице II; b партнера. |
| 46, XX, t (6; 10) (q22.32; q11.23) |
| 46, XX, t (6; 8) (p22.2; q21.2) |
| 46, XX, t (4; 14) (p14; q31) |
| 46, XX, t (11; 18) (q23.3; q11.2) |
| 46, XX, t ( 3; 6) (p14.1; p21.1) |
| 46, XX, t (7; 22) (p13; q11.2) a |
| 46, XX, t (5; 11 ) (q15; q21) |
| 45, XX, der (13; 14) (q10; q10) |
| 45, XX, der (13; 14) (q10; q10) |
| 45, XX, der (13; 14) (q10; q10) |
| 45, XX, der (13; 14) (q10; q10) |
| 46, XY, t (2; 13) (p13; q22 ) |
| 46, XY, t (7; 11) (q22; q23) b |
Таблица III.
Описание хромосомных транслокаций a , выявленных у пациентов с повторным выкидышем, направленных на хромосомный анализ
| a См. Сноску к Таблице II; b партнера. |
| 46, XX, t (6; 10) (q22.32; q11.23) |
| 46, XX, t (6; 8) (p22.2; q21.2) |
| 46, XX, t (4; 14) (p14; q31) |
| 46, XX, t (11; 18) (q23.3; q11.2) |
| 46, XX, t ( 3; 6) (стр.1; p21.1) |
| 46, XX, t (7; 22) (p13; q11.2) a |
| 46, XX, t (5; 11) (q15; q21) |
| 45, XX, der (13; 14) (q10; q10) |
| 45, XX, der (13; 14) (q10; q10) |
| 45, XX, der (13; 14 ) (q10; q10) |
| 45, XX, der (13; 14) (q10; q10) |
| 46, XY, t (2; 13) (p13; q22) |
| 46, XY, t (7; 11) (q22; q23) b |
| a См. Сноску к Таблице II; b партнера. |
| 46, XX, t (6; 10) (q22.32; q11.23) |
| 46, XX, t (6; 8) (p22.2; q21.2) |
| 46, XX, t (4; 14) (p14; q31) |
| 46, XX, t (11; 18) (q23.3; q11.2) |
| 46, XX, t ( 3; 6) (p14.1; p21.1) |
| 46, XX, t (7; 22) (p13; q11.2) a |
| 46, XX, t (5; 11 ) (q15; q21) |
| 45, XX, der (13; 14) (q10; q10) |
| 45, XX, der (13; 14) (q10; q10) |
| 45, XX, der (13; 14) (q10; q10) |
| 45, XX, der (13; 14) (q10; q10) |
| 46, XY, t (2; 13) (p13; q22 ) |
| 46, XY, t (7; 11) (q22; q23) b |
Рисунок 1.
Микрофотография кариотипа пациента с неудачной имплантацией ЭКО, показывающая реципрокную транслокацию 46, XX, t (8; 11) (p11.2; p15.1).
Рисунок 1.
Микрофотография кариотипа пациента с неудачной имплантацией ЭКО, показывающая реципрокную транслокацию 46, XX, t (8; 11) (p11.2; p15.1).
Рисунок 2.
Микрофотография кариотипа пациента с неудачной имплантацией ЭКО, показывающая Робертсоновскую транслокацию 45, XY, der (13; 14) (q10; 10).
Рис. 2.
Микрофотография кариотипа пациента с неудачной имплантацией ЭКО, показывающая Робертсоновскую транслокацию 45, XY, der (13; 14) (q10; 10).
Рисунок 3.
Транслокации в парах, где тестируются оба партнера.
Рисунок 3.
Транслокации в парах, где тестируются оба партнера.
Список литературы
Американское общество фертильности (
1985
) Пересмотренная классификация эндометриоза Американского общества фертильности.
Fertil. Стерил.
,
43
,
351
.
Кампана М., Серра А. и Нери Г. (
1986
) Роль хромосомных аберраций в повторных абортах: исследование 269 сбалансированных транслокаций.
Am. J. Med. Genet.
,
24
,
341
–356.
Cassel, M.J., Munné, S., Fung, J. and Weier, H.-U.G. (
1997
) ДНК-зонды, специфичные для носителей, охватывающие точки разрыва: подход к преимплантационной генетической диагностике в интерфазных клетках.
Hum. Репрод.
,
12
,
2019
–2027
Chandley, A.C. (1983) Бесплодие и повторный аборт. В Эмери, Э. и Rimoin, D.L. (eds), Принципы и практика медицинской генетики. Черчилль Ливингстон, Эдинбург, стр. 224.
Chandley, A. (
1984
) Бесплодие и хромосомные аномалии.
Oxf. Rev. Reprod. Биол.
,
6
,
1
–46.
Коэн, О., Банки, К., Мермет, М.А. et al. (
1994
) Пороги жизнеспособности для частичных трисомий и моносомий. Исследование 1159 жизнеспособных несбалансированных реципрокных транслокаций.
Hum. Genet.
,
93
,
188
–194.
Craft, I., Djahanbakhch, O., McLeod, F. et al. (
1982
) Беременность человека после переноса ооцитов и сперматозоидов в матку.
Ланцет
,
и
,
1031
–1033.
Crosignani, P.G. и Рубин Б. (eds) (1982) Генетический контроль производства и функции гамет. Academic Press, Нью-Йорк.
Дэниэл А., Хук Э. и Вульф Г. (
1989
) Риски несбалансированного потомства при амниоцентезе для носителей хромосомных перестроек: данные лабораторий США и Канады.
Am. J. Med. Genet.
,
31
,
14
–53.
Де Бракелер М. и Дао Т. (
1991
) Цитогенетические исследования мужского бесплодия.
Hum. Репрод.
,
6
,
245
–250.
Де Крецер, Д., Маллидис, К. и Бхасин, К. (
1997
) Делеции Y-хромосомы и мужское бесплодие.
Reprod Med. Сборка
,
6
,
37
–53.
Гарднер Р. Дж. МакК. И Сазерленд Г. Р. (1996) Хромосомные аномалии и генетическое консультирование. Oxford University Press, стр. 39, 60–94.
Гилтай, Дж., Тимессен, К., van Inzen, W. et al. (
1998
) Один нормальный ребенок и хромосомно сбалансированный / нормальный близнец после интрацитоплазматической инъекции сперматозоидов у мужчины с транслокацией de novo t (Y; 16).
Hum. Репрод.
,
13
,
2745
–2747.
Hens, L., Bonduelle, M., Liebaers, I. et al. (
1988
) Хромосомные аберрации у 500 пар, направленных на экстракорпоральное оплодотворение или лечение от бесплодия.
Hum. Репрод.
,
3
,
451
–457.
Крюк, Э. и Hamerton, J.L. (1977). Частота хромосомных аномалий, обнаруженных в последовательных исследованиях новорожденных — различия между исследованиями — результаты по полу и тяжести фенотипического поражения. In Hook, Э. and Porter, H. (eds), Population Cytogenetics: Studies in Humans. Academic Press, Нью-Йорк, США, стр. 80–92.
Кулишер Л. и Жиллеро Ю. (
1985
) Хромосомы и бесплодие: исследование 7672 случаев.
Контрацепция , Fertil. Стерил.
,
1
,
195
–202.
Мартин Р., Ко, Э. и Хильдебранд К. (
1992
) Анализ хромосомных комплементов сперматозоидов мужчины, гетерозиготного по Робертсоновской транслокации 45 XY, t (15q; 22q).
Am. J. Med. Genet.
,
43
,
855
–857.
Мартин Р. и Халтен М. (
1993
) Хромосомные комплементы в 695 сперматозоидах трех мужчин, гетерозиготных по реципрокным транслокациям, и обзор литературы.
Наследие
,
118
,
165
–175.
Ménézo, Y., Bellec, V., Zaroukian, A. et al. (
1997
) Отбор эмбрионов с помощью ЭКО, совместное культивирование и перенос на стадии бластоцисты в случае транслокации.
Hum. Репрод.
,
12
,
2802
–2803.
Meschede, D., Lemcke, B., Exeler, J. et al. (
1998
) Хромосомные аномалии у 447 пар, подвергшихся внутрицитоплазматической инъекции сперматозоидов — распространенность, типы, распределение по полу и репродуктивная значимость.
Hum. Репрод.
,
13
,
576
–582.
Миллер Дж., Уильямсон Э., Клей Дж. и др. (
1980
) Потеря плода после имплантации. Перспективное исследование.
Ланцет
,
ii
,
554
–556.
Munné, S., Grifo, J., Cohen, J. et al. (
1994
) Хромосомные аномалии в арестованных доимплантационных эмбрионах человека: исследование FISH с множеством зондов.
Am. J. Hum. Genet.
,
55
,
150
–159.
Munné, S., Scott, R., Sable, D. et al. (
1998a
) Первые беременности после предварительной диагностики транслокаций материнского происхождения.
Fertil. Стерил.
,
69
,
675
–681.
Munné, S., Fung, J., Cassel, M.J. et al. (
1998b
) Преимплантационный генетический анализ транслокаций: специфические зонды для анализа интерфазных клеток.
Hum. Genet.
,
102
,
663
–674.
Nielsen, J. и Wohlert, M. (
1991
) Хромосомные аномалии, обнаруженные у 34 910 новорожденных: результаты 13-летнего исследования заболеваемости в Орхусе, Дания.
Hum. Genet.
,
22
,
81
–83.
Руни, D.E. and Czepulkowski, (eds) (1992) Human Cytogenetics, A Practical Approach , vol. 1. IRL Press в Oxford University Press, стр.36–41.
Speed, R. (
1988
) Возможная роль аномалий мейотического спаривания в атрезии ооцитов плода человека.
Hum. Genet.
,
78
,
260
–266.
Stern, C., Chamley, L., Hale, L. et al. (
1998
) Антитела к β2 гликопротеину I связаны с неудачей имплантации экстракорпорального оплодотворения, а также с повторным выкидышем: результаты исследования распространенности.
Fertil.Стерил.
,
70
,
938
–945.
Tupler, R., Barbierato, L., Larizza, D. et al. (
1994
) Сбалансированные аутосомные транслокации и дисгенезия яичников.
Hum. Genet.
,
94
,
171
–176.
Уолцер С. и Джеральд П. (1977) Обследование хромосом 13751 новорожденного мужского пола. In Hook, Э. and Porter, H. (eds), Population Cytogenetics: Studies in Humans. Academic Press, Нью-Йорк, США, стр.45–61.
Van Assche, E., Bonduelle, M., Tournaye, H. et al. (1996) Цитогенетика бесплодных мужчин. В Van Steirteghem, A. Devroey, P. and Liebaers, I. (eds), Genetics and Assisted Human Conception. Гм. Репрод. , 11 (Приложение 4), 1–24.
Ван дер Вен, К., Пешка, Б., Монтаг, М. et al. (
1998
). Повышенная частота врожденных хромосомных аберраций у женщин-партнеров пар, подвергающихся внутрицитоплазматической инъекции спермы.
Hum. Репрод.
,
13
,
48
–54.
Всемирная организация здравоохранения (1992) Лабораторное руководство ВОЗ по исследованию взаимодействия человеческой спермы и сперматозоидов с цервикальной слизью, 3-е изд.