скелетогенный — это… Что такое скелетогенный?
- скелетогенный
скелетогенный
Слитно или раздельно? Орфографический словарь-справочник. — М.: Русский язык.
Б. З. Букчина, Л. П. Какалуцкая.
1998.
- скелетно-мышечный
- скелетоподобный
Смотреть что такое «скелетогенный» в других словарях:
синцитий скелетогенный — (s. skeletogenum) образованный клетками мезенхимы С., из которого развивается хрящевая ткань … Большой медицинский словарь
рост аппозиционный — (лат. appono, appositum прибавлять) P., происходящий путем образования новой ткани и наслоения ее на поверхность старой, напр. в мезенхиме, окружаю щей скелетогенный зачаток … Большой медицинский словарь
Кость — основная часть Скелета позвоночных животных и человека. Вместе с суставами и связками, соединяющими К. скелета между собой, и мышцами, прикрепленными к К. сухожилиями, К. образуют опорно двигательный аппарат. По форме и строению К. бывают … Большая советская энциклопедия
Круглоротые* — (Cyclostomata) подкласс рыб со скелетом, частью хрящевым, частью перепончатым скелетом, сосательным ртом, круглым, лишенным челюстей, одним носовым отверстием, без парных плавников, без чешуи, с 6 7 мешкообразными жаберными полостями с каждой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Позвоночные животные* — Характеристика типа П. Состав типа П. Форма тела. Накожные покровы. Мышечная система. Скелет. Нервная система. Органы чувств. Органы пищеварения. Кровеносная система. Выделительная система. Половая система. Развитие. Происхождение П. П. животные… … Энциклопедический словарь Ф.
 А. Брокгауза и И.А. Ефрона
А. Брокгауза и И.А. ЕфронаКруглоротые — (Cyclostomata) подкласс рыб со скелетом, частью хрящевым, частью перепончатым скелетом, сосательным ртом, круглым, лишенным челюстей, одним носовым отверстием, без парных плавников, без чешуи, с 6 7 мешкообразными жаберными полостями с каждой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Позвоночные животные — Характеристика типа П. Состав типа П. Форма тела. Накожные покровы. Мышечная система. Скелет. Нервная система. Органы чувств. Органы пищеварения. Кровеносная система. Выделительная система. Половая система. Развитие. Происхождение П. П. животные… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Рост — I процесс увеличения числа и размеров клеток органов и тканей организма. В узком смысле Р. это длина тела. Динамика Р. меняется в зависимости от возрастного периода и определяется на молекулярном и клеточном уровнях скоростью синтеза белка и… … Медицинская энциклопедия
Слушать (5 328 Кб):
Остеогенез — развитие костной ткани
Различают два способа образования кости: прямой (первичный, из мезенхимы) и непрямой (вторичный, на месте хрящевой модели)
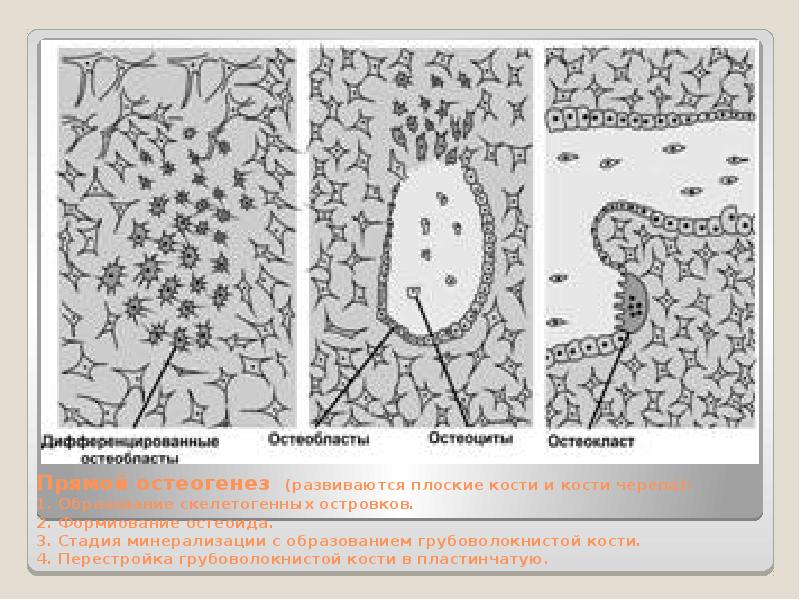
Прямой (первичный) остеогистогенез. Развитие кости из мезенхимы.
Такой способ остеогенеза характерен для развития грубоволокнистой костной ткани при образовании плоских костей, например покровных костей черепа. Этот процесс наблюдается в основном в течение первого месяца внутриутробного развития и характеризуется образованием сначала первичной «перепончатой», остеоидной костной ткани с последующим отложением солей кальция, фосфора и др. в межклеточном веществе.
Первая стадия — образование скелетогенного островка. В местах развития будущей кости происходят очаговое размножение мезенхимных клеток и васкуляризация скелетогенного островка.
Вторая стадия – остеоидная. Во второй стадии происходит дифференцировка клеток островков, образуется органическая матрица костной ткани, или остеоид, – оксифильное межклеточное вещество с коллагеновыми фибриллами. Разрастающиеся волокна раздвигают клетки, которые, не теряя своих отростков, остаются связанными друг с другом. В основном веществе появляются мукопротеиды (оссеомукоид), цементирующие волокна в одну прочную массу.
Некоторые клетки, дифференцирующиеся в остеоциты, уже в этой стадии могут оказаться включенными в толщу волокнистой массы. Другие, располагающиеся по поверхности, дифференцируются в остеобласты. В течение некоторого времени остеобласты располагаются по одну сторону волокнистой массы, но вскоре коллагеновые волокна появляются и с других сторон, отделяя остеобласты друг от друга. Постепенно эти клетки оказываются «замурованными» в межклеточном веществе, теряют способность размножаться и превращаются в остеоциты. В то же время из окружающей мезенхимы образуются новые генерации остеобластов, которые наращивают кость снаружи.
Третья стадия (прямого остегенеза) — обызвествление, или кальцификация, межклеточного вещества.
Кальцификацию оссеоида связывают с матриксными везикулами.
Процесс биологической минерализации протекает в 2 фазы.
I фаза заключается в образовании исходных кристаллов гидроксиапатита внутри матриксных везикул.
II фаза состоит в разрыве мембран матриксных везикул с выходом сформированных кристаллов в экстрацеллюлярное пространство, где дальнейшее размножение их контролируется условиями внеклеточного микроокружения. Важную роль имеют протеазы и мембранные фосфолипазы, которые обеспечивают разрыв мембран и выход минералов наружу.
Одним из посредников кальцификации является остеонектин — гликопротеин, избирательно связывающий соли кальция и фосфора с коллагеном. В результате кальцификации образуются костные перекладины, или балки. Затем от этих перекладин ответвляются выросты, соединяющиеся между собой и образующие широкую сеть. Пространства между перекладинами оказываются занятыми соединительной волокнистой тканью с проходящими в ней кровеносными сосудами.
К моменту завершения остеогенеза по периферии зачатка кости в эмбриональной соединительной ткани появляется большое количество волокон и остеогенных клеток. Часть этой волокнистой ткани, прилегающей непосредственно к костным перекладинам, превращается в надкостницу, или периост (periosteum), который обеспечивает трофику и регенерацию кости.
Развитие пластинчатой костной ткани тесно связано с процессом разрушения отдельных участков кости и врастанием кровеносных сосудов в толщу ретикулофиброзной кости. В этом процессе как в период эмбрионального остеогенеза, так и после рождения принимают участие остеокласты.
Костные пластинки обычно образуются вокруг кровеносных сосудов путем дифференцировки прилегающей к ним мезенхимы. Над такими пластинками образуется слой новых остеобластов и возникают новые пластинки.
В отличие от хрящевой ткани кость всегда растет способом наложения новой ткани на уже имеющуюся, т.е. путем аппозиции, а оптимальное кровоснабжение необходимо для дифференцировки клеток скелетогенного островка.
Непрямой (вторичный) остеогистогенез. Развитие кости на месте хряща.
На 2-м месяце эмбрионального развития в местах будущих трубчатых костей закладывается из мезенхимы хрящевой зачаток, который очень быстро принимает форму будущей кости (хрящевая модель). Зачаток состоит из эмбрионального гиалинового хряща, покрытого надхрящницей. Некоторое время он растет как за счет клеток, образующихся со стороны надхрящницы, так и за счет размножения клеток во внутренних участках.
Развитие кости на месте хряща, т.е. непрямой остеогенез, начинается в области диафиза (т.н. перихондральное окостенение). Образованию перихондральной костной манжетки предшествует разрастание кровеносных сосудов. Происходит дифференцировка остеобластов, образующих в виде манжетки сначала ретикулофиброзную костную ткань (первичный центр окостенения), затем заменяющуюся на пластинчатую.
Образование костной манжетки нарушает питание хряща. Вследствие этого в центре диафизарной части хрящевого зачатка возникают дистрофические изменения. Хондроциты вакуолизируются, их ядра пикнотизируются, образуются так называемые пузырчатые хондроциты. Рост хряща в этом месте прекращается. Удлинение перихондральной костной манжетки сопровождается расширением зоны деструкции хряща и появлением остеокластов, которые очищают пути для врастающих в модель трубчатой кости кровеносных сосудов и остеобластов.
Это приводит к появлению очагов «внутреннего» эндохондрального окостенения (вторичные центры окостенения). В связи с продолжающимся ростом соседних неизмененных дистальных отделов диафиза хондроциты на границе эпифиза и диафиза собираются в продольные колонки. Таким образом, в колонке хондроцитов имеются два противоположно направленных процесса — размножение и рост в дистальных отделах диафиза и дистрофические процессы в его проксимальном отделе.
Одновременно между набухшими клетками происходит отложение минеральных солей, обусловливающее появление резкой базофилии и хрупкости хряща.
С момента разрастания сосудистой сети и появления остеобластов надхрящница перестраивается, превращаясь в надкостницу. В дальнейшем кровеносные сосуды с окружающей их мезенхимой, остеогенными клетками и остеокластами врастают через отверстия костной манжетки и входят в соприкосновение с обызвествленным хрящом. Под влиянием ферментов, выделяемых остеокластами, происходит растворение (хондролиз) обызвествленного межклеточного вещества.
Процесс отложения кости внутри хрящевого зачатка получил название эндохондрального, или энхондрального, окостенения (греч. endon — внутри).
Одновременно с процессом развития энхондральной кости появляются и признаки ее разрушения остеокластами.
Разрастаясь в длину по направлению к эпифизам и увеличиваясь в толщину, они образуют плотный (компактный) слой кости. Дальнейшая организация периостальной кости протекает иначе, чем организация энхондральной костной ткани. Вокруг сосудов, которые идут по длинной оси зачатка кости из прилегающей к ним мезенхимы, на месте разрушающейся ретикулофиброзной кости начинают образовываться концентрические пластинки, состоящие из параллельно ориентированных тонких коллагеновых волокон и цементирующего межклеточного вещества. Так возникают первичные остеоны.
Вслед за диафизом центры окостенения появляются в эпифизах. Этому предшествуют сначала дифференцировка хондроцитов, их гипертрофия, сменяемая ухудшением питания, дистрофией и кальцинацией. В дальнейшем отмечается процесс окостенения, подобный описанному выше. Оссификация сопровождается врастанием в эпифизы сосудов.
В промежуточной области между диафизом и эпифизами сохраняется хрящевая ткань — метафизарный хрящ, являющийся зоной роста костей в длину.
Некоторые термины из практической медицины:
|
Карта сайта
Страница не найдена. Возможно, карта сайта Вам поможет.
-
Главная -
Университет-
Об университете -
Структура -
Нормативные документы и процедуры -
Лечебная деятельность -
Международное сотрудничество -
Пресс-центр-
Новости -
Анонсы -
События -
Объявления и поздравления -
Online конференции -
Фотоальбом-
Королева Студенчества ГрГМУ — 2021 -
День открытых дверей-2021 -
Управление личными финансами (встреча с представителями «БПС-Сбербанк») -
Весенний «Мелотрек» -
Праздничный концерт к 8 Марта -
Диалоговая площадка с председателем Гродненского облисполкома -
Расширенное заседание совета университета -
Гродно — Молодежная столица Республики Беларусь-2021 -
Торжественное собрание, приуроченное к Дню защитника Отечества -
Вручение свидетельства действительного члена Белорусской торгово-промышленной палаты -
Новогодний ScienceQuiz -
Финал IV Турнира трех вузов ScienseQuiz -
Областной этап конкурса «Студент года-2020″ -
Семинар дистанционного обучения для сотрудников университетов из Беларуси «Обеспечение качества медицинского образования и образования в области общественного здоровья и здравоохранения» -
Студент года — 2020 -
День Знаний — 2020 -
Церемония награждения лауреатов Премии Правительства в области качества -
Военная присяга -
Выпускной лечебного факультета-2020 -
Выпускной медико-психологического факультета-2020 -
Выпускной педиатрического факультета-2020 -
Выпускной факультета иностранных учащихся-2020 -
Распределение — 2020 -
Стоп коронавирус! -
Навстречу весне — 2020 -
Профориентация — 18-я Международная специализированная выставка «Образование и карьера» -
Спартакиада среди сотрудников «Здоровье-2020″ -
Конференция «Актуальные проблемы медицины» -
Открытие общежития №4 -
Встреча Президента Беларуси со студентами и преподавателями медвузов -
Новогодний утренник в ГрГМУ -
XIX Республиканская студенческая конференция «Язык. Общество. Медицина»
Общество. Медицина»
-
Alma mater – любовь с первого курса -
Актуальные вопросы коморбидности сердечно-сосудистых и костно-мышечных заболеваний в амбулаторной практике -
Областной этап «Студент года-2019″ -
Финал Science Qiuz -
Конференция «Актуальные проблемы психологии личности и социального взаимодействия» -
Посвящение в студенты ФИУ -
День Матери -
День открытых дверей — 2019 -
Визит в Азербайджанский медицинский университет -
Семинар-тренинг с международным участием «Современные аспекты сестринского образования» -
Осенний легкоатлетический кросс — 2019 -
40 лет педиатрическому факультету -
День Знаний — 2019 -
Посвящение в первокурсники -
Акция к Всемирному дню предотвращения суицида -
Турслет-2019 -
Договор о создании филиала кафедры общей хирургии на базе Брестской областной больницы -
День Независимости -
Конференция «Современные технологии диагностики, терапии и реабилитации в пульмонологии» -
Выпускной медико-диагностического, педиатрического факультетов и факультета иностранных учащихся — 2019 -
Выпускной медико-психологического факультета — 2019 -
Выпускной лечебного факультета — 2019 -
В добрый путь, выпускники! -
Распределение по профилям субординатуры -
Государственные экзамены -
Интеллектуальная игра «Что? Где? Когда?» -
Мистер и Мисс факультета иностранных учащихся-2019 -
День Победы -
IV Республиканская студенческая военно-научная конференция «Этих дней не смолкнет слава» -
Республиканский гражданско-патриотический марафон «Вместе — за сильную и процветающую Беларусь!» -
Литературно-художественный марафон «На хвалях спадчыны маёй» -
День открытых дверей-2019 -
Их имена останутся в наших сердцах -
Областной этап конкурса «Королева Весна — 2019″ -
Королева Весна ГрГМУ — 2019 -
Профориентация «Абитуриент – 2019» (г. Барановичи)
Барановичи)
-
Мероприятие «Карьера начинается с образования!» (г. Лида) -
Итоговое распределение выпускников — 2019 -
«Навстречу весне — 2019″ -
Торжественная церемония, посвященная Дню защитника Отечества -
Торжественное собрание к Дню защитника Отечества — 2019 -
Мистер ГрГМУ — 2019 -
Предварительное распределение выпускников 2019 года -
Митинг-реквием у памятника воинам-интернационалистам -
Профориентация «Образование и карьера» (г.Минск) -
Итоговая коллегия главного управления здравоохранения Гродненского областного исполнительного комитета -
Спартакиада «Здоровье — 2019» -
Итоговая научно-практическая конференция «Актуальные проблемы медицины». -
Расширенное заседание Совета университета. -
Научно-практическая конференция «Симуляционные технологии обучения в подготовке медицинских работников: актуальность, проблемные вопросы внедрения и перспективы» -
Конкурс первокурсников «Аlma mater – любовь с первого курса» -
XVI съезд хирургов Республики Беларусь -
Итоговая практика -
Конкурс «Студент года-2018» -
Совет университета -
1-й съезд Евразийской Аритмологической Ассоциации (14.09.2018 г.) -
1-й съезд Евразийской Аритмологической Ассоциации (13.09.2018 г.) -
День знаний -
День независимости Республики Беларусь -
Церемония награждения победителей конкурса на соискание Премии СНГ -
День герба и флага Республики Беларусь -
«Стань донором – подари возможность жить» -
VIII Международный межвузовский фестиваль современного танца «Сделай шаг вперед» -
Конкурс грации и артистического мастерства «Королева Весна ГрГМУ – 2018» -
Окончательное распределение выпускников 2018 года -
Митинг-реквием, приуроченный к 75-летию хатынской трагедии -
Областное совещание «Итоги работы терапевтической и кардиологической служб Гродненской области за 2017 год и задачи на 2018 год» -
Конкурсное шоу-представление «Мистер ГрГМУ-2018» -
Предварительное распределение выпускников 2018 года -
Итоговая научно-практическая конференция «Актуальные проблемы медицины» -
II Съезд учёных Республики Беларусь -
Круглый стол факультета иностранных учащихся -
«Молодежь мира: самобытность, солидарность, сотрудничество» -
Заседание выездной сессии Гродненского областного Совета депутатов -
Областной этап республиканского конкурса «Студент года-2017» -
Встреча с председателем РОО «Белая Русь» Александром Михайловичем Радьковым -
Конференция «Актуальные вопросы инфекционной патологии», 27. 10.2017
10.2017
-
XIX Всемирный фестиваль студентов и молодежи -
Республиканская научно-практическая конференция «II Гродненские аритмологические чтения» -
Областная научно-практическая конференция «V Гродненские гастроэнтерологические чтения» -
Праздник, посвящённый 889-летию города Гродно -
Круглый стол на тему «Место и роль РОО «Белая Русь» в политической системе Республики Беларусь» (22.09.2017) -
ГрГМУ и Университет медицины и фармации (г.Тыргу-Муреш, Румыния) подписали Соглашение о сотрудничестве -
1 сентября — День знаний -
Итоговая практика на кафедре военной и экстремальной медицины -
Квалификационный экзамен у врачей-интернов -
Встреча с Комиссией по присуждению Премии Правительства Республики Беларусь -
Научно-практическая конференция «Амбулаторная терапия и хирургия заболеваний ЛОР-органов и сопряженной патологии других органов и систем» -
День государственного флага и герба -
9 мая -
Республиканская научно-практическая конференция с международным участием «V белорусско-польская дерматологическая конференция: дерматология без границ» -
«Стань донором – подари возможность жить» -
«Круглый стол» Постоянной комиссии Совета Республики Беларусь Национального собрания Республики Беларусь по образованию, науке, культуре и социальному развитию -
Весенний кубок КВН «Юмор–это наука» -
Мисс ГрГМУ-2017 -
Распределение 2017 года -
Общегородской профориентационный день для учащихся гимназий, лицеев и школ -
Праздничный концерт, посвященный Дню 8 марта -
Конкурсное шоу-представление «Мистер ГрГМУ–2017» -
«Масленица-2017» -
Торжественное собрание и паздничный концерт, посвященный Дню защитника Отечества -
Лекция профессора, д. м.н. О.О. Руммо
м.н. О.О. Руммо
-
Итоговая научно-практическая конференция «Актуальные проблемы медицины» -
Меморандум о сотрудничестве между областной организацией Белорусского общества Красного Креста и региональной организацией Красного Креста китайской провинции Хэнань -
Визит делегации МГЭУ им. А.Д. Сахарова БГУ в ГрГМУ -
«Студент года-2016» -
Визит Чрезвычайного и Полномочного Посла Королевства Швеция в Республике Беларусь господина Мартина Оберга в ГрГМУ -
Конкурс первокурсников «Аlma mater – любовь с первого курса» -
День матери в ГрГМУ -
Итоговая практика-2016 -
День знаний -
Визит китайской делегации в ГрГМУ -
Визит иностранной делегации из Вроцлавского медицинского университета (Республика Польша) -
Торжественное мероприятие, посвященное профессиональному празднику – Дню медицинского работника -
Визит ректора ГрГМУ Виктора Александровича Снежицкого в Индию -
Республиканская университетская суббота-2016 -
Республиканская акция «Беларусь против табака» -
Встреча с поэтессой Яниной Бокий -
9 мая — День Победы -
Митинг, посвященный Дню Государственного герба и Государственного флага Республики Беларусь -
Областная межвузовская студенческая научно-практическая конференция «1941 год: трагедия, героизм, память» -
«Цветы Великой Победы» -
Концерт народного ансамбля польской песни и танца «Хабры» -
Суботнiк ў Мураванцы -
«Мисс ГрГМУ-2016» -
Визит академика РАМН, профессора Разумова Александра Николаевича в УО «ГрГМУ» -
Визит иностранной делегации из Медицинского совета Мальдивской Республики -
«Кубок ректора Гродненского государственного медицинского университета по дзюдо» -
«Кубок Дружбы-2016» по мини-футболу среди мужских и женских команд медицинских учреждений образования Республики Беларусь -
Распределение выпускников 2016 года -
Визит Министра обороны Республики Беларусь на военную кафедру ГрГМУ -
Визит Первого секретаря Посольства Израиля Анны Кейнан и директора Израильского культурного центра при Посольстве Израиля Рей Кейнан -
Визит иностранной делегации из провинции Ганьсу Китайской Народной Республики в ГрГМУ -
Состоялось открытие фотовыставки «По следам Библии» -
«Кубок декана» медико-диагностического факультета по скалолазанию -
Мистер ГрГМУ-2016 -
Приём Первого секретаря Посольства Израиля Анны Кейнан в ГрГМУ -
Спартакиада «Здоровье» УО «ГрГМУ» среди сотрудников 2015-2016 учебного года -
Визит Посла Республики Индия в УО «ГрГМУ» -
Торжественное собрание и концерт, посвященный Дню защитника Отечества -
Митинг-реквием, посвященный Дню памяти воинов-интернационалистов -
Итоговое заседание коллегии главного управления идеологической работы, культуры и по делам молодежи Гродненского облисполкома -
Итоговая научно-практическая конференция Гродненского государственного медицинского университета -
Новогодний концерт -
Открытие профессорского консультативного центра -
Концерт-акция «Молодёжь против СПИДа» -
«Студент года-2015» -
Открытые лекции профессора, академика НАН Беларуси Островского Юрия Петровича -
«Аlma mater – любовь с первого курса» -
Открытая лекция Регионального директора ВОЗ госпожи Жужанны Якаб -
«Открытый Кубок по велоориентированию РЦФВиС» -
Совместное заседание Советов университетов г. Гродно
Гродно
-
Встреча с Министром здравоохранения Республики Беларусь В.И. Жарко -
День города -
Дебаты «Врач — выбор жизни» -
День города -
Праздничный концерт «Для вас, первокурсники!» -
Акция «Наш год – наш выбор» -
День знаний -
Открытое зачисление абитуриентов в УО «Гродненский государственный медицинский университет» -
Принятие военной присяги студентами ГрГМУ -
День Независимости Республики Беларусь -
Вручение дипломов выпускникам 2015 года -
Республиканская олимпиада студентов по педиатрии -
Открытие памятного знака в честь погибших защитников -
9 мая -
«Вторая белорусско-польская дерматологическая конференция: дерматология без границ» -
Мистер университет -
Мисс универитет -
КВН -
Гродненский государственный медицинский университет -
Чествование наших ветеранов -
1 Мая -
Cовместный субботник
-
-
Наши издания -
Медицинский календарь -
Университет в СМИ -
Видео-презентации
-
-
Общественные объединения -
Комиссия по противодействию коррупции -
Образовательная деятельность
-
-
Абитуриентам -
Студентам -
Выпускникам -
Слайдер -
Последние обновления -
Баннеры -
Иностранному гражданину -
Научная деятельность -
Поиск
Развитие корня зуба гистология — Медицина мира
В формировании зубов принимает участие экто — и мезодерма.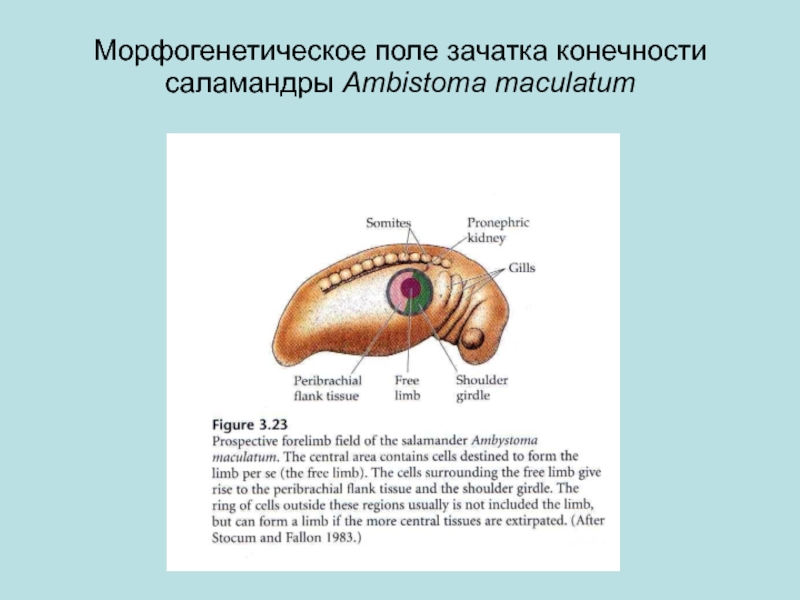 Закладка зубных зачатков происходит на 6-7-й неделе внутриутробного развития плода. Скопления эпителия в виде валиков постепенно погружаются в подлежащие ткани, образуя зачатки молочных и постоянных зубов. Мезодерма принимает участие в образовании пульпы зуба.
Закладка зубных зачатков происходит на 6-7-й неделе внутриутробного развития плода. Скопления эпителия в виде валиков постепенно погружаются в подлежащие ткани, образуя зачатки молочных и постоянных зубов. Мезодерма принимает участие в образовании пульпы зуба.
Механизм прорезывания зубов сложен и еще не совсем изучен. Наиболее полное объяснение этого процесса мы находим в теории, предложенной отечественным стоматологом А.Я. Катцем (1940). По его мнению, растущий зачаток давит на внутренние поверхности альвеолярного отростка и вызывает рассасывание компактной пластинки альвеолярного отростка. Одновременно с прорезыванием зубов происходит активный рост альвеолярных отростков челюстей. Прорезывание зубов — важный и сложный физиологический этап развития зубочелюстной системы. Этот процесс обусловлен взаимодействием нейрогуморальных факторов организма и факторов внешней среды.
Молочные зубы начинают прорезываться в возрасте 6-7 мес, в период, когда заканчивается развитие коронки молочного зуба и начинается формирование его корня. Окончательное формирование зуба происходит вскоре после его прорезывания.
При нормальном развитии ребенка первыми в 6-8 мес прорезываются нижние центральные резцы, в 7-9 мес — верхние центральные и нижние боковые резцы, в 8-10 мес — верхние боковые резцы. Первые нижние моляры прорезываются в норме в возрасте 12-16 мес, первые верхние моляры — в 16-21 мес, вторые нижние моляры — в 21-30 мес, верхние молочные моляры — в 21-30 мес. У человека молочный прикус формируется к двум годам и состоит из 20 зубов: 2 резцов, 1 клыка, 2 моляров на каждой стороне челюсти. Наличие и состояние зубов записывают в виде так называемой зубной формулы, где молочные зубы обозначаются римскими цифрами:
Постоянные зубы начинают прорезываться с 6 лет. Первым прорезывается нижний моляр в 6-7 лет, затем прорезывается первый резец в 7-8 лет, второй резец — в 9-10 лет, первый премоляр — в 9-10 лет, второй премоляр — в 9-11 лет, второй моляр — в 11-12 лет, клык — в 10-13 лет. Третьи моляры прорезываются между 16 и 24 годами, а зачастую и в более поздние сроки.
Третьи моляры прорезываются между 16 и 24 годами, а зачастую и в более поздние сроки.
Постоянный прикус состоит из 32 зубов: половина каждой челюсти имеет 2 резца, 1 клык, 2 премоляра и 3 моляра. Постоянный прикус записывают также в виде зубной формулы:
В отличие от обозначения зубов молочного прикуса зубы постоянного прикуса обозначаются арабскими цифрами.
Постоянные резцы, клыки и премоляры прорезываются на месте молочных зубов, а постоянные моляры — позади места расположения молочного моляра. При прорезывании постоянных зубов происходит рассасывание корня и альвеолы молочного зуба, что способствует выпадению сменяемого зуба и прорезыванию постоянного.
Прорезывание постоянных зубов происходит, как правило, безболезненно, исключение иногда составляют лишь нижние третьи моляры. Прорезывание зубов в определенной степени отражает состояние здоровья ребенка, поэтому важно знать сроки и очередность прорезывания зубов.
Функции зубов различны. Передние зубы — резцы и клыки — служат для откусывания пищи, боковые — премоляры и моляры — для размельчения. В связи с этим различна их форма: острый режущий край у передних зубов, большая жевательная поверхность у боковых.
В зубном ряду человека имеются однокорневые зубы — резцы, клыки и премоляры (кроме первого верхнего), двухкорневые зубы — нижние моляры и первые верхние премоляры и трехкорневые зубы — верхние моляры.
Анатомическое строение зуба. Каждый зуб имеет коронку, шейку и корень. Коронка зуба (corona dentis) выступает над десневым краем после нормального прорезывания зуба. Наружный слой коронки представлен эмалью — самой твердой тканью человеческого организма.
Шейка зуба (cervix dentis) отделяет корень от коронки. В норме шейка зуба находится под десневым краем. На уровне шейки зуба заканчивается эмалевое покрытие коронки зуба.
Корень зуба (radix dentis) погружен в альвеолу челюсти. Основное назначение корня заключается в фиксации зуба в альвеоле челюсти с помощью мощного связочного аппарата.
В коронковой части зуба находится полость зуба (cavitas dentis), которая, сужаясь, переходит вканал корня зуба (canaiis radicis dentis), заканчивающийся корневым отверстием (foramen apicis dentis). В полости зуба находится рыхлая ткань — пульпа зуба (pulpa dentis). Коронковая пульпа, повторяя форму полости зуба, переходит в корневую пульпу. Пульпа богата сосудами и нервами.
Зуб фиксируется в лунке при помощи связочного аппарата — прочных соединительнотканных волокон, соединяющих шейку и корень зуба с пластинкой компактного костного вещества, выстилающей альвеолы челюсти. В области шейки зуба эти пучки имеют почти горизонтальное направление и совместно с десной и надкостницей челюсти образуют круговую связку зуба, которая отделяет пространство между корнем и пластинкой альвеолы от внешней среды. Связочный аппарат зуба, кровеносные, лимфатические сосуды и нервы называются периодонтом (periodontium).
Связочный аппарат зуба выполняет не только фиксирующую, но и амортизирующую функцию, что обеспечивается рыхлой клетчаткой и межтканевой жидкостью между пучками соединительнотканных волокон.
При жевании на каждый моляр падает нагрузка, равная 50-80 кг. Однако, несмотря на столь значительную нагрузку при жевании, связочный аппарат удерживает зуб в подвешенном положении, предупреждая тем самым травму дна альвеолы смещающимся по продольной оси корнем зуба.
В связи с прочностью связочного аппарата при удалении зуба необходимы особые приемы. Применение силы при этой операции может привести к отлому альвеолярного отростка, перелому челюсти. Сосуды периодонта через многочисленные отверстия в стенке альвеолы широко анастомозируют с сосудами челюсти, а сам периодонт сообщается с веществом костного мозга челюсти. Это способствует свободному проникновению возбудителей инфекции при воспалительном процессе из периодонта в костный мозг челюсти, что может явиться причиной одонтогенного остеомиелита.
Гистологическое строение зуба.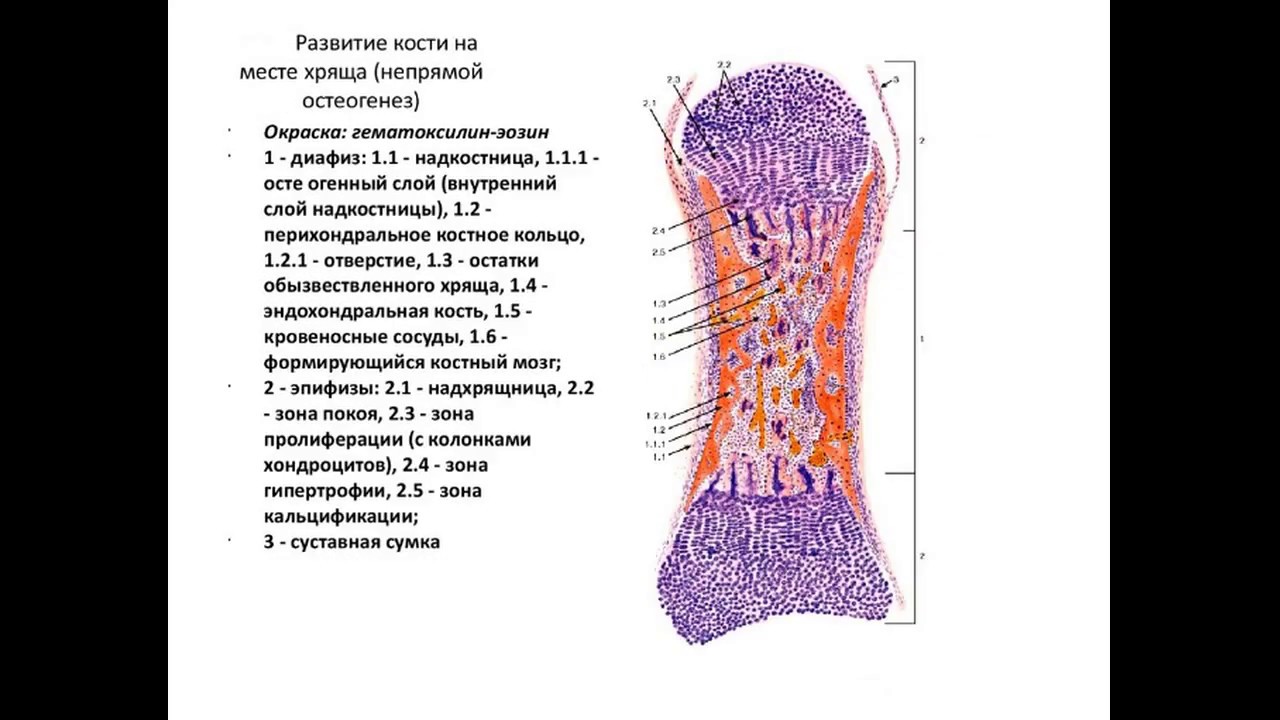 Зуб состоит из нескольких видов тканей. Основную массу составляет дентин (dentinum). Коронковая часть зуба покрыта тонким слоем эмали (enamelum), корневая — цементом (cementum).
Зуб состоит из нескольких видов тканей. Основную массу составляет дентин (dentinum). Коронковая часть зуба покрыта тонким слоем эмали (enamelum), корневая — цементом (cementum).
Дентин состоит из коллагенового остова, сильно пропитанного минеральными солями. Неорганические вещества, в первую очередь фосфорно- кислая известь, составляют 70-72% массы дентина, что обеспечивает высокую прочность дентина, уступающую только прочности эмали. Основное вещество дентина пронизано большим количеством тончайших канальцев, идущих в радиальном направлении от зубной полости до эмалево-дентинной границы. В 1 мм2 поперечного среза дентина насчитывается до 30-50 тыс. канальцев.
Эмаль по своей прочности близка к алмазу. Это объясняется ее высокой минерализацией: 95-98% массы эмали составляют неорганические вещества. Остов эмали представлен эмалевыми призмами и межпризменным веществом. Неповрежденная поверхность эмали покрыта пленкой — так называемой эмалевой кожицей. Среди стоматологов не существует единого мнения о жизненности эмали. Одни считают эмаль живой тканью, в которой происходят, хотя и ограниченно, обменные процессы, другие отрицают это.
Цемент, покрывая корневую часть зуба, по строению приближается к строению костной ткани. Цемент служит местом прикрепления связочного аппарата к зубу.
Пульпа зуба состоит из рыхлой соединительной ткани с большим количеством кровеносных и лимфатических сосудов, нервов. По периферии пульпы располагаются в несколько слоев одонтобласты, отростки которых, пронизывая через канальцы всю толщу дентина, осуществляют трофическую функцию. В состав отростков одонтобластов входят нервные образования, проводящие болевые ощущения при механическом, физическом и химическом воздействии на дентин.
Кровоснабжение и иннервация пульпы осуществляются зубными артериальными и нервными ветвями (аа. и nn. dentales) соответствующих артерий и нервов челюстей.
Проникая в зубную полость через апикальное отверстие канала корня зуба, сосудисто-нервный пучок распадается на более мелкие ветви артерий и нервов, пронизывая пульпу зуба и образуя густые сплетения.
Обладая запасом камбиальных элементов, пульпа участвует в регенеративных процессах, которые проявляются в образовании заместительного дентина при кариозном процессе. Кроме того, пульпа служит биологическим барьером, препятствующим проникновению микроорганизмов из кариозной полости через канал корня за пределы зуба в периодонт.
Нервные образования пульпы осуществляют регуляцию питания зуба, а также восприятие зубом различных раздражений, в том числе и болевых. Обилие сосудов и нервных образований способствует быстрому увеличению воспалительного отека при остром пульпите и сдавлению отеком нервных образований, что обусловливает сильную боль.
Источник: studopedia.su
Читайте также
Биология Ярыгин книга 2 (стр. 18 из 77)
Морфогенетические корреляции возникают между органами, пространственно связанными между собой. Они основаны либо на феномене эмбриональной индукции (см. разд. 8.2.6), либо на общности эмбриональных закладок органов. Эти корреляции проявляются уже на ранних стадиях онтогенеза, когда еще отсутствуют функциональные связи между формирующимися органами. Так, зачаток хорды обусловливает развитие нервной трубки на спинной стороне зародыша и дифференцировку скелетогенной ткани внутренних частей сомита — склеротома в хрящ или кость, а глазной бокал (вырост переднего мозга) — формирование хрусталика при морфогенезе глаза.
Примером развития ряда структур из одного общего зачатка является формирование у млекопитающих и человека из закладок 1-й и 2-й пар жаберных дуг первичных челюстей, подъязычной кости, части хрящей гортани, шиловидного отростка черепа и трех слуховых косточек. При нарушении развития закладок жаберных дуг обычно образуется комплекс аномалий указанных структур, называемый аномаладом первых жаберных дуг.
Эргонтические корреляции обусловлены функциональной взаимозависимостью органов и частей организма. Они возникают на более поздних стадиях развития, когда органы начинают функционировать, и проявляются, например, в соответствии между степенью развитости мышцы, костных выступов, к которым она прикрепляется, и интенсивностью ее кровоснабжения. К такого рода корреляциям относят также соответствие вторичных половых признаков развитию гонад.
К такого рода корреляциям относят также соответствие вторичных половых признаков развитию гонад.
Ведущие корреляции в онтогенезе — геномные. В конечном счете именно они лежат в основе других корреляций, значение которых на протяжении онтогенеза меняется. Это связано с первичностью изменений генотипа в процессе филогенеза.
Система корреляций и сама подвергается эволюционным преобразованиям. В процессе эволюции видоизменяются вначале более частные корреляции, в то время как наиболее общие могут воспроизводиться в конкретных онтогенезах очень длительное время. В результате в ходе исторического развития происходит как отбор наиболее общих корреляций, имеющих значение при любых перестройках организма и в различных условиях обитания (общий план строения, соответствие между степенью развитости нервного центра и иннервируемыми органами), так и накопление локальных корреляций частного значения, формирующихся у организмов разных видов и отражающих специфику их образа жизни.
Корреляции общего значения обусловливают преемственность формообразовательных процессов в череде поколений организмов данного типа организации, а частные корреляции — многообразие конкретных форм жизни.
Между филогенетическими координациями и онтогенетическими корреляциями имеется теснейшая связь. Очевидно, что корреляции существуют и воспроизводятся в поколениях благодаря тому, что на протяжении предшествующей эволюции органов они преобразовывались скоординированно. С другой стороны, филогенетические координации в последующей эволюции организмов будут реализовываться благодаря воспроизведению онтогенетических корреляций в ходе индивидуального развития конкретных особей. Таким образом, в виде соотношения корреляций и координации проявляется диалектическое единство онто- и филогенеза как целостного процесса исторического развития живого.
Сопоставление конкретных форм соотносительных преобразований органов приводит к выводу о том, что морфогенетические корреляции и топографические координации точно так же, как эргонтические корреляции и динамические координации, взаимно обусловливают друг друга. В паре геномные корреляции — биологические координации также обнаруживается соответствие.
В паре геномные корреляции — биологические координации также обнаруживается соответствие.
Осознание целостности и взаимообусловленности индивидуального и исторического развития необходимо врачу в связи с тем, что соотносительное преобразование биологических структур лежит в основе нормального развития организма человека, а нарушение даже одного незначительного компонента развивающейся системы может повлечь за собой возникновение целого комплекса нарушений в других ее элементах. С этим связано то, что практически все врожденные пороки развития, а также многочисленные генные болезни характеризуются не отдельными патологическими признаками, а синдромами, представляющими собой комплексы симптомов, связанных между собой процессом формирования.
Сердце у всех позвоночных закладывается на ранних этапах развития кпереди от глотки под челюстной дугой. В его морфогенезе участвует глотка как эмбриональный индуктор. Если это свойство глотки нарушено, тсгсердце может задержаться на двух- и трехкамерном уровне развития, при этом может быть нарушено и его перемещение в загрудинную область — шейная эктопия сердца (см. § 14.4). Эти явления — результат нарушений морфогенетических корреляций в развитии шейной области. Часто этот порок развития сопровождается нарушением отходящих от сердца сосудов (персистирование общего эмбрионального ствола, двух дуг аорты и т.д.) и недоразвитостью легких.
В возникновении данных аномалий ведущим механизмом выступает нарушение эргонтических корреляций сердце — сосуды — легкие. Первичным нарушением в описанном комплексе признаков является, вероятно, нарушение генетического контроля эмбриональной индукции, описанное ранее (см. разд. 8.2.6). Таким образом, приведенный пример иллюстрирует взаимоотношение разных форм соотносительных преобразований органов при формировании сложного комплекса патологических признаков, имеющих в целом атавистическую природу.
Примером нарушения чисто геномных корреляций является синдром Дауна. Увеличение доз генов 21-й хромосомы или ее части приводит к формированию тяжелой умственной отсталости, ослаблению тонуса мышц, аномалиям мозгового черепа и мягких частей лица, светлой пигментации волос и глаз.
Увеличение доз генов 21-й хромосомы или ее части приводит к формированию тяжелой умственной отсталости, ослаблению тонуса мышц, аномалиям мозгового черепа и мягких частей лица, светлой пигментации волос и глаз.
Кроме филогенетических координации, подкрепляемых в каждом поколении онтогенетическими корреляциями, целостность развивающегося организма отражают и такие соотносительные преобразования органов, как субституция и гетеробатмия.
Субституция — это такое эволюционное преобразование, при котором один орган замещается другим, выполняющим обычно ту же функцию с большей интенсивностью. При этом наблюдается развитие этих органов в разных направлениях. Один обычно подвергается редукции, другой — эволюционирует прогрессивно. Так, хорда замещается позвоночником и превращается в рудиментарное образование, а первичные хрящевые челюсти позвоночных заменяются вторичными костными (см. разд. 14.2.1). Это примеры гомотопной субституции, когда новый орган возникает на месте старого. При гетеротопной субституции заменяющий орган находится на новом месте. Так, функцию печени как органа кроветворения берет на себя красный костный мозг. Выделительная функция выполняется у рыб и земноводных туловищной почкой, а у пресмыкающихся и млекопитающих — тазовой.
Гетеробатмия — это такое эволюционное преобразование, при котором в одной группе организмов обнаруживается разный уровень эволюционной продвинутое™ и специализации разных частей одного и того органа, разных органов одной и той же системы или разных частей организма. Примером может являться человек, головной мозг которого за короткое время антропогенеза претерпел колоссальные морфофизиологические изменения, в то время как пищеварительная система соответствует уровню развития других приматов.
Гетеробатмия, наблюдающаяся внутри одной и той же системы органов в разных филогенетических группах, обусловливает феномен компенсации функций, благодаря которому одни и те же экологические задачи решаются разными способами. Так, грызуны и копытные млекопитающие питаются одинаковой растительной пищей, но у первых наиболее выраженные адаптации к растительноядности проявляются в строении зубов и морфофизиологии слюнных желез, в то время как вторые на фоне примитивной зубной системы имеют высокоспециализированные желудок и кишечник. Явления гетеробатмии и, следовательно, компенсации функций имеют огромное эволюционное значение в связи с тем, что в организме, даже вступившем на путь узкой специализации, всегда остаются органы и системы относительно мало специализированные, которые при меняющихся условиях могут еще прогрессивно развиваться, раскрывая перед такими филогенетическими группами новые адаптивные возможности.
Так, грызуны и копытные млекопитающие питаются одинаковой растительной пищей, но у первых наиболее выраженные адаптации к растительноядности проявляются в строении зубов и морфофизиологии слюнных желез, в то время как вторые на фоне примитивной зубной системы имеют высокоспециализированные желудок и кишечник. Явления гетеробатмии и, следовательно, компенсации функций имеют огромное эволюционное значение в связи с тем, что в организме, даже вступившем на путь узкой специализации, всегда остаются органы и системы относительно мало специализированные, которые при меняющихся условиях могут еще прогрессивно развиваться, раскрывая перед такими филогенетическими группами новые адаптивные возможности.
Все живые организмы подразделяются на неклеточных (вирусы) и клеточных (все остальные). Несмотря на то что филогенетические взаимоотношения между ними неясны, вирусы как облигатно-парази-тические формы (см. § 18.3), возможно, возникли от более высокоорганизованных организмов за счет упрощения в процессе адаптации к паразитизму. В то же время не исключена возможность существования вирусов как фрагментов нуклеиновых кислот еще на предбиологическом этапе эволюции и приобретения ими основных свойств живых организмов позже, при попадании в клетки. Клеточные организмы подразделяются на про- и эукариот. Эукариоты, вероятно, произошли от прокариот (см. § 1.5).
13.5.1. Типы питания и основные группы
живых организмов в природе
Древние эукариоты, будучи одноклеточными, по характеру питания специализировались на группы организмов, активно добывающих пищу путем ее поиска и захвата, и формы, добывающие продукты питания за счет их всасывания из среды. Первый способ питания называют голозойным, второй — голофитным.
Задания в тестовой форме
Выберите один или
несколько правильных ответов (количество
ответов дано в скобках).
1.
Функции скелетных тканей (3)
а) опорная
б) трофическая
в) механическая
г) поддержание
водно-солевого обмена
2.
Источником развития хрящевой ткани
является (1)
а) мезодерма
б) эктодерма
в) мезенхима
г) энтодерма
3.
Хрящевая ткань содержит (1)
а) 70-80% воды, 10-15%
органических веществ, 4-7% солей
б) 40-50% воды, 25-30%
органических веществ, 25-30% солей
в) 23% воды, 27%
органических веществ, 50% солей
г) 8-10% воды, 10-15%
органических веществ, 70-80% солей
4.
Хрящевая ткань состоит из (4)
а) хондроцитов
б) хондробластов
в) кровеносных
сосудов
г) коллагеновых,
эластических волокон
д) аморфного
вещества
5.
Хрящевые ткани входят в состав (3)
а) суставов
б) межпозвоночных
дисков
в) органов
дыхательной системы
г) органов
пищеварительной системы
6.
Во взрослом организме гиалиновая
хрящевая ткань встречается в (4)
а) ушной раковине
б) стекловидном
теле
в) местах соединения
ребер с грудиной
г) гортани
д) воздухоносных
путях
е) на суставных
поверхностях костей
7.
Эластическая хрящевая ткань образует
(2)
а) ушную раковину
б) хрящи воздухоносных
путей
в) суставные
поверхности костей
г) рожковидные и
клиновидные хрящи гортани
8.
Волокнистая хрящевая ткань находится
в (2)
а) ушной раковине
б) межпозвоночных
дисках
в) местах соединения
ребер с грудиной
г) связках и
сухожилиях
9.
Питательные вещества собственно
хрящевая ткань получает из (1)
а) кровеносных
сосудов изогенных групп клеток
б) волокнистого
слоя надхрящницы
в) лакун
г) хондрогенного
островка
10.
Межклеточное вещество хрящевой ткани
состоит из (2)
а) фибриллярных
белков (коллаген, эластин)
б) гликозаминогликанов,
протеогликанов
в) ферментов
г) аминокислот
11.
Возрастные изменения хрящевой ткани
(5)
а) уменьшение
концентрации протеогликанов
б) ослабление
процессов размножения хондробластов
в) повышение
активности хондрокластов
г) «омеление
хряща»
д) врастание
кровеносных сосудов
е) нарушение
трофики центральных участков хряща
12.
Физиологическая регенерация хрящевой
ткани осуществляется (1)
а) хондроцитами
изогенных групп клеток
б) хондробластами
надхрящницы
в) хондрокластами
г) мезенхимными
клетками хондрогенного островка
13.
Классификация хрящевых тканей основана
на (1)
а) особенностях
строения клеток
б) количестве
клеток
в) источниках
развития
г) особенностях
организации межклеточного вещества
д) локализации в
организме
14.
Хондрогенный островок – это (1)
а) мезенхимный
эмбриональный зачаток хрящевой ткани
б) хрящевой
дифферон
в) изогенная
группа клеток
г) территориальный
участок межклеточного вещества
15.
Аппозиционный рост хрящевой ткани
осуществляется (1)
а) стволовыми
клетками
б) изогенными
группами клеток
в) хондробластами
надхрящницы
г) хондрокластами
16.
Интерстициальный рост хрящевой ткани
осуществляется (1)
а) стволовыми
клетками
б) изогенными
группами клеток
в) хондробластами
надхрящницы
г) хондрокластами
17.
В процессе развития хрящевой ткани из
мезенхимы образуется клеточный дифферон
(1)
а) прехондробласты
– прехондроциты –хондроциты –
хондрокласты
б) стволовые
клетки – прехондробласты- хондробласты
– хондроциты
в) мезенхима –
хондроциты – хондрокласты – прехондроциты
г) хондробласты
– прехондроциты – хондроциты
18.
В ходе эмбрионального хондрогистогенеза
различают этапы
развития
(3)
а) формирование
хондрогенного островка
б) закладка
межклеточного вещества
в) образование
первичной хрящевой ткани
г) дифференцировка
хрящевой ткани
19.
Стадия дифференцировки хрящевой ткани
характеризуется образованием (2)
а) хондроцитов
б) хондробластов
в) надхрящницы
г) фибриллярных
белков
д) гликозаминогликанов,
протеогликанов
20.
Стадия первичной хрящевой ткани
характеризуется
образованием (2)
а) хондроцитов
б) хондробластов
в) надхрящницы
г) фибриллярных
белков
д) гликозаминогликанов,
протеогликанов
21.
Надхрящница – это оболочка, покрывающая
хрящ снаружи и состоящая из (2)
а) наружного
волокнистого слоя
б) промежуточного
фибриллярного слоя
в) территориального
слоя клеток
г) внутреннего
хондрогенного слоя
22.
Морфофункциональные особенности
хондробластов (3)
а) молодые
уплощенные клетки
б) способны к
пролиферации
в) синтезируют
межклеточное вещество
г) являются зрелой
формой клеток
23.
Изогенные группы – это (1)
а) хрящевой
дифферон
б) хмбриональный
зачаток
в) от 2-4 хондроцитов
погруженных в лакуны
г) стволовые
клетки
24.
Хондрокласты – это (1)
а) Макрофаги
хрящевой ткани
б) Молодые формы
клеток
в) зрелые формы
клеток
г) стволовые
клетки
25.
Ретикулофиброзную костную ткань у
взрослого человека можно встретить
(1)
а) в эпифизе
трубчатых костей
б) на месте черепных
швов
в) в межпозвоночных
дисках
г) на суставных
поверхностях
д) в диафизах
трубчатых костей
26.
Структурно-функциональной единицей
грубоволокнистой костной ткани является
(1)
а) остеон
б) коллагеновое
волокно
в) остеокласт
г) остеобласт
д) остеоцит
27.
Прямой остеогистогенез включает
несколько этапов (3)
а) образование
скелетогенного островка
б) формирование
перихондральной костной манжетки
в) дифференцировка
клеток и образование органической
матрицы
г) кальцификация
межклеточного вещества
28.
Прямой остеогенез начинается с (1)
а) образования
оссеомукоида
б) образования
костных балок
в) развития
периоста
г) образования
остеогенного островка
д) образования
костной пластинки
29.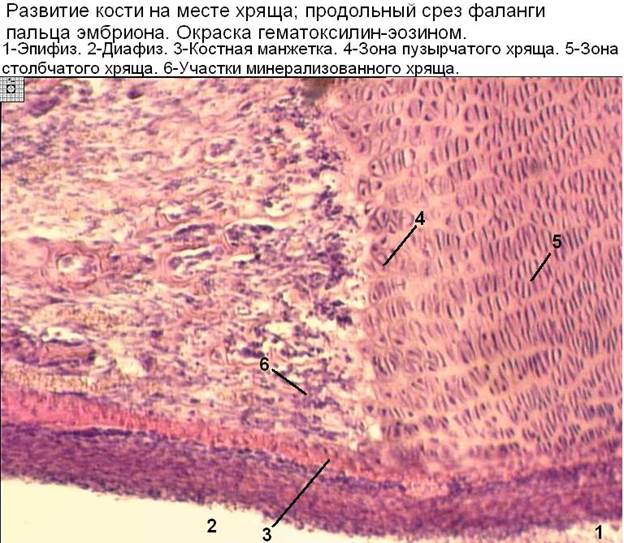
Развитие кости на месте хряща начинается
с (1)
а) перихондрального
окостенения
б) эндохондрального
окостенения
в) разрушения
хрящевой модели
г) окостенения
эпифиза
д) обезыствления
хрящевой модели
30.
Перихондральная кость – характерные
особенности (1)
а) содержит колонки
активно делящихся клеток
б) содержит участки
омелевшего хряща
в) образует костную
манжетку в середине диафиза
г) содержит
вакуолизированные клетки
31.
Эндохондральная кость – характерные
особенности (1)
а) содержит колонки
активно делящихся клеток
б) содержит участки
омелевшего хряща
в) образует костную
манжетку в середине диафиза
г) содержит
вакуолизированные клетки
32.
Рост кости в длину обеспечивается (1)
а) периостом
б) эндостом
в) эпифизарной
пластинкой
г) эпифизом
д) диафизом
33.
Особенности межклеточного вещества
грубоволокнистой костной ткани (1)
а) много эластических
волокон
б) коллагеновые
волокна организованы в пластины
в) параллельные
пучки коллагеновых волокон
г) мощные
неориентированные пучки коллагеновых
волокон
д) сеть коллагеновых
волокон
34.
Пластинчатая костная ткань локализуется
в (1)
а) межпозвоночных
дисках
б) местах
прикрепления сухожилия к костям
в) хрящевых частях
ребер
г) трубчатых
костях
д) ушной раковине
35.
Остеоциты локализуются в (1)
а) Скелетогенных
островках
б) надкостнице
в) костных лакунах
г) периваскулярных
пространствах каналов остеонов
36.
Структурно-функциональной единицей
компактной вещества кости является
(1)
а) остеон
б) остеоцит
в) коллагеновое
волокно
г) остеобласт
37.
Компактное вещество кости образовано
(4)
а) остеонами
б) надкостницей
в) наружными
генеральными пластинами
г) внутренними
генеральными пластинами
д) вставочными
пластинами
38.
Функциональные особенности остеоцитов
(1)
а) поддерживают
гомеостаз костной ткани
б) разрушают
обызвествленный хрящ и кость
в) обеспечивают
аппозиционный рост хряща
г) обеспечивают
интерстициальный рост хряща
д) образуют
оссеиновые волокна
39.
Соединения костей (суставы) осуществляются
с помощью (1)
а) плотной
волокнистой соединительной ткани
б) сочлененных
поверхностей покрытых хрящем
в) плотных
соединений без соединительной ткани
г) скелетных мышц
40.
Ультраструктурные признаки остеобластов
(1)
а) хорошо развита
гранулярная ЭПС
б) много вакуолейи
лизосом
в) много десмосом
г) имеют реснички
д) органеллы
развиты слабо
41.
Функциональные особенности остеокластов
(1)
а) поддерживают
гомеостаз костной ткани
б) разрушают
обызвествленный хрящ и кость
в) обеспечивают
аппозиционный рост хряща
г) обеспечивают
интерстициальный рост хряща
42.
К дифферону механоцитов костной ткани
относятся (4)
а) стволовые
остеогенные клетки
б) полустволовые
стромальные клетки
в) остеобласты
г) остеокласты
д) остеоциты
43.
Функциональные особенности остеобластов
(1)
а) поддерживают
гомеостаз костной ткани
б) разрушают
обызвествленный хрящ и кость
в) обеспечивают
аппозиционный рост хряща
г) обеспечивают
интерстициальный рост хряща
д) образуют
оссеиновые волокна
44.
При избытке паратирина наступают
изменения в костной ткани (1)
а) повышается
деятельность остеокластов
б) снижается
кальцификация, что приводит к размягчению
костей
в) подавляется
образование коллагеновых волокон
г) наблюдается
резорбция кости и образование фиброзной
ткани
д) возрастает
кальцификация
45.
При условиях недостатка витамина С
наступают изменения в костной ткани
(1)
а) повышается
деятельность остеокластов
б) снижается
кальцификация, что приводит к размягчению
костей
в) подавляется
образование коллагеновых волокон
г) наблюдается
резорбция кости и образование фиброзной
ткани
д) возрастает
кальцификация
46.
При дефиците витамина Д наступают
изменения в кости (1)
а) повышается
деятельность остеокластов
б) снижается
кальцификация костей, что приводит к
их размягчению
в) подавляется
образование коллагеновых волокон
г) наблюдается
резорбция кости и образование фиброзной
ткани
д) возрастает
кальцификация
47.
При гипервитаминозе А наступают
изменения в костной ткани (1)
а) повышается
деятельность остеокластов
б) снижается
кальцификация, что приводит к размягчению
костей
в) подавляется
образование коллагеновых волокон
г) наблюдается
резорбция кости и образуется фиброзная
ткань
д) возрастает
кальцификация
48.
При избытке тирокальцитонина наступают
изменения в костной ткани (1)
а) повышается
деятельность остеокластов
б) снижается
кальцификация
в) подавляется
образование коллагеновых волокон
г) наблюдается
резорбция кости и образование фиброзной
ткани
д) возрастает
кальцификация
Эталоны ответов:
1авг, 2в, 3а,
4абгд, 5абв, 6вгде, 7аг, 8бг, 9б, 10аб, 11абвде,
12б, 13г, 14а, 15в, 16б, 17б, 18авг, 19вд, 20аг, 21аг,
22абв, 23в, 24а, 25б, 26д, 27авг, 28г, 29а, 30в, 31б,
32в, 33г, 34г, 35в, 36а, 37авгд, 38а, 39б, 40а, 41б,
42абвд, 43д, 44г, 45в, 46б, 47а, 48д.
Мезенхима
Мезенхима — это эмбриональный зачаток, служащий источником развития соединительной ткани, крови, скелета и гладкой мышечной ткани. Мезенхима состоит из рыхло лежащих клеток с отростками и межклеточной жидкости, располагающихся в первичной полости тела в промежутках между зародышевыми листками.
См. также Зародыш.
Мезенхима (от греч. mesos — средний и enchyma — содержимое, заполняющая масса) — один из эмбриональных зачатков, представляющий разрыхленную часть среднего зародышевого листка, или мезодермы.
У позвоночных мезенхима возникает из сомитов в местах разрыхления их участков— дерматомов и склеротомов, а также в результате выселения клеток из висцерального и париетального листков спланхнотомов. Происходящая из дерматомов мезенхима дифференцируется в соединительнотканную основу кожи (собственно кожу, или дерму). Склеротомы дают начало скелетогенной мезенхимы, дифференцирующейся в хрящевую и костную ткани. Выселяющиеся из спланхнотомов клетки мезенхимы образуют соединительную ткань, кровеносные и лимфатические сосуды, клетки крови и лимфы, гладкую мышечную ткань внутренностей. Таким образом, мезенхима в целом является у позвоночных зачатком всей обширной группы тканей внутренней среды.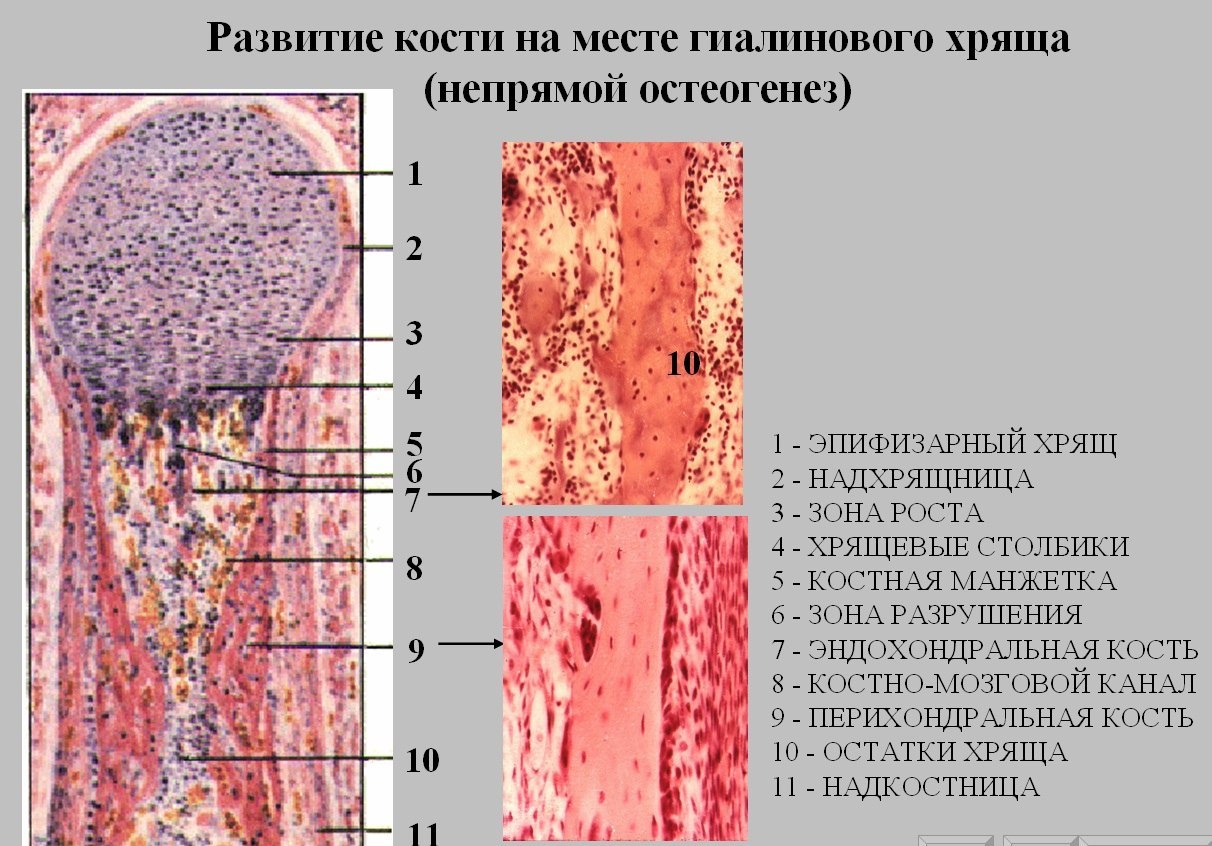 Развивающаяся из нее же гладкая мышечная ткань по многим свойствам ближе к соединительной ткани, чем к скелетно-мышечной. У позвоночных и у человека некоторая часть мезенхимы образуется не из мезодермы, а из нейроэктодермального зачатка, а именно нервного гребня, или ганглиозной пластинки (эктомезенхима, или нейромезенхима). Из нее возникают хроматофоры (пигментные клетки), некоторые хрящи гортани, возможно пульпа зубов и клетки — образователи дентина (одонтобласты).
Развивающаяся из нее же гладкая мышечная ткань по многим свойствам ближе к соединительной ткани, чем к скелетно-мышечной. У позвоночных и у человека некоторая часть мезенхимы образуется не из мезодермы, а из нейроэктодермального зачатка, а именно нервного гребня, или ганглиозной пластинки (эктомезенхима, или нейромезенхима). Из нее возникают хроматофоры (пигментные клетки), некоторые хрящи гортани, возможно пульпа зубов и клетки — образователи дентина (одонтобласты).
Мезенхима в период своего возникновения состоит из отростчатых клеток, сетевидно соединенных отростками. Промежутки между клетками заполнены межклеточной жидкостью. Отдельные клетки могут, вбирая отростки, высвобождаться из связи с другими клетками и, амебоидно передвигаясь при помощи ложноножек, фагоцитировать бактерии и иные инородные частицы, попавшие в организм зародыша. Таким образом, мезенхима состоит из фиксированных (оседлых) и подвижных клеток, которые могут превращаться друг в друга. Вместе с межклеточной жидкостью они и составляют внутреннюю среду зародыша. На первых стадиях развития мезенхима еще лишена специальных тканевых структур (волокон и т. п.) и представляет эмбриональный зачаток, а не ткань. Однако отдельные ее участки (особенно те, что входят в состав провизорных вспомогательных органов зародыша) очень рано претерпевают тканевую специализацию, превращаясь в эмбриональную соединительную ткань, клетки крови и т. д. По мнению большинства гистологов, эндотелий сосудов также развивается из мезенхимы. Однако некоторые считают его происходящим из особого сосудистого зачатка — ангиобласта, клетки которого, примешанные к мезенхиме, внешне не отличимы от ее клеток. Уже у зародыша вся мезенхима расходуется на образование тканей. Камбиальные (малодифференцированные) клетки соединительной ткани детского и взрослого организма качественно отличаются от мезенхимы зародыша относительно более высоким уровнем дифференцировки. Поэтому представление о «мезенхиме взрослого» или «мезенхимном резерве» несостоятельно: в составе дифференцированного организма неизменившиеся клетки зародыша не сохраняются.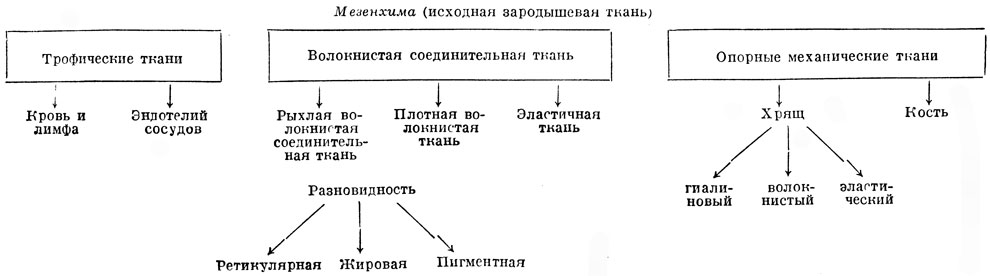 См. также Мезодерма.
См. также Мезодерма.
Скелетная система
— обзор
МЕХАНИЧЕСКАЯ НАГРУЗКА
Скелетная система обеспечивает механическую поддержку и защиту для множества органов позвоночных организмов. Чтобы противостоять нагрузке наиболее эффективным способом (максимальная прочность при минимальном количестве материала), скелет постоянно корректирует свою костную массу и архитектуру в ответ на нагрузку посредством ремоделирования кости. Фактически, адаптация и изменение формы костной структуры к механическим силам требует замены существующих костных пакетов или целых трабекул новыми, соответствующим образом ориентированными относительно преобладающих механических нагрузок.Тесная динамическая связь между структурой кости и силовыми линиями в кости может поддерживаться реакцией на порог механической деформации (сила на единицу площади), ниже которого происходит удаление костной ткани остеокластом, в то время как более высокая деформация будет стимулировать добавление кости. . Действительно, давно признано, что механическое напряжение, вызванное упражнениями с отягощением, увеличивает активность остеобластов и вызывает образование костей. И наоборот, отсутствие механической стимуляции в результате продолжительной иммобилизации или разгрузки вызывает серьезную потерю костной массы.Во время иммобилизации резорбция костной ткани увеличивается, а образование уменьшается, что способствует потере костной массы, связанной со слабостью и длительным постельным режимом. Точно так же продолжительный космический полет с отсутствием сил гравитации на скелет приводит к заметной потере костной массы и повышенной хрупкости костей у космонавтов.
Все больше данных свидетельствует о том, что основным типом механочувствительных клеток кости является остеоцит (см. Ранее). Остеоцит идеально расположен внутри пластинчатой кости для восприятия механических сил и может передавать сигналы другим остеоцитам, остеобластам и остеокластам на поверхности кости через соединительную канальцевую сеть.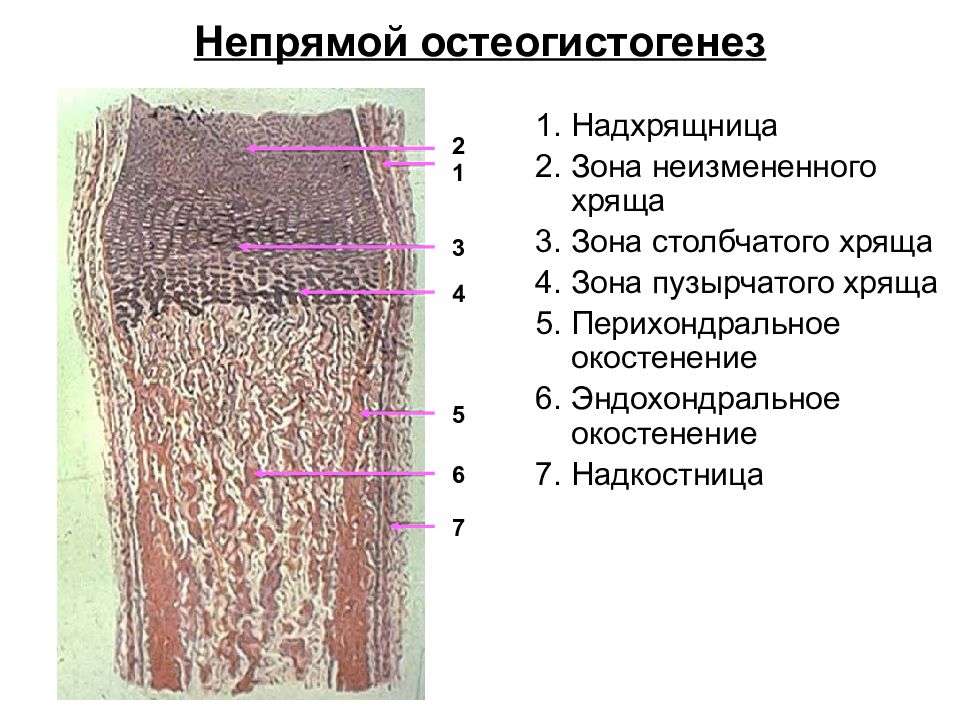 233,368-370 Было продемонстрировано, что остеоциты обладают способностью стимулировать резорбцию костей in vitro и in vivo. 371 , 372 Было высказано предположение, что эта модуляция ремоделирования кости вызывается апоптозом остеоцитов, который может быть следствием разгрузки. 373 И наоборот, механическая стимуляция способна поддерживать жизнеспособность остеоцитов. 374 , 375 Недавние исследования подчеркивают важность жизнеспособности остеоцитов для поддержания здоровья костной ткани и реакции на механическую нагрузку.Экспериментальное разрушение остеоцитов в мышиной кости посредством направленной экспрессии рецептора дифтерийного токсина под контролем специфичного для остеоцитов промотора DMP-1 быстро привело к крупномасштабному увеличению резорбции кости, уменьшению костеобразования и потере трабекулярной кости. В то же время эти мыши были устойчивы к потере костной массы, вызванной разгрузкой, что указывает на потребность в остеоцитах в ответ на механические сигналы. 376
233,368-370 Было продемонстрировано, что остеоциты обладают способностью стимулировать резорбцию костей in vitro и in vivo. 371 , 372 Было высказано предположение, что эта модуляция ремоделирования кости вызывается апоптозом остеоцитов, который может быть следствием разгрузки. 373 И наоборот, механическая стимуляция способна поддерживать жизнеспособность остеоцитов. 374 , 375 Недавние исследования подчеркивают важность жизнеспособности остеоцитов для поддержания здоровья костной ткани и реакции на механическую нагрузку.Экспериментальное разрушение остеоцитов в мышиной кости посредством направленной экспрессии рецептора дифтерийного токсина под контролем специфичного для остеоцитов промотора DMP-1 быстро привело к крупномасштабному увеличению резорбции кости, уменьшению костеобразования и потере трабекулярной кости. В то же время эти мыши были устойчивы к потере костной массы, вызванной разгрузкой, что указывает на потребность в остеоцитах в ответ на механические сигналы. 376
Механизмы, с помощью которых механический стимул преобразуется в биохимические сигналы в остеоцитах и остеобластах, и средства, с помощью которых эти клетки затем модулируют активность ремоделирования кости, не были четко идентифицированы.Влияния, которые были вовлечены в процесс, включают поперечные силы, создаваемые движением жидкости (например, в каналах, окружающих остеоцитарные дендриты), и различные мембранные белки, включая интегрины, коннексины и чувствительные к растяжению ионные каналы. 233 236 239 Например, механическая стимуляция увеличивает экспрессию коннексинов, трансмембранных белков, которые образуют регулируемые каналы; это позволяет осуществлять прямой обмен небольшими молекулами с соседними клетками, что приводит к межклеточной коммуникации между клетками. 239,377-379 Более того, остеоциты реагируют in vitro и in vivo на повышенную нагрузку изменением своей передачи сигналов. Например, в ответ на нагрузку остеоциты повышают выработку оксида азота, высвобождают простагландин (PG) E-2 и IGF-1 и снижают экспрессию транспортера глутамата. 233 Экспрессия DMP-1 также значительно увеличивается при механической стимуляции. 380 Инактивация DMP-1 у мышей связана с гипоминерализованным фенотипом, связанным с повышенным уровнем FGF-23 и дефектным формированием лакуны / канальцевой сети остеоцитов. 381 Производство MEPE в остеоцитах также является механочувствительным, демонстрируя замедленное производство после механической стимуляции, в отличие от DMP-1. 382 Целенаправленное разрушение MEPE приводит к увеличению костной массы и придает определенную степень устойчивости к возрастной потере трабекулярной кости. 383 Поскольку как DMP-1, так и MEPE могут регулировать метаболизм фосфатов и массу кости, эти результаты предполагают потенциальную связь между упражнениями, местной минерализацией костей, гомеостазом фосфатов и функцией почек, организованной через остеоциты, что может быть важно для понимания полный спектр последствий потери остеоцитов, наблюдаемых при старении костей. 233 237 243 384
Например, в ответ на нагрузку остеоциты повышают выработку оксида азота, высвобождают простагландин (PG) E-2 и IGF-1 и снижают экспрессию транспортера глутамата. 233 Экспрессия DMP-1 также значительно увеличивается при механической стимуляции. 380 Инактивация DMP-1 у мышей связана с гипоминерализованным фенотипом, связанным с повышенным уровнем FGF-23 и дефектным формированием лакуны / канальцевой сети остеоцитов. 381 Производство MEPE в остеоцитах также является механочувствительным, демонстрируя замедленное производство после механической стимуляции, в отличие от DMP-1. 382 Целенаправленное разрушение MEPE приводит к увеличению костной массы и придает определенную степень устойчивости к возрастной потере трабекулярной кости. 383 Поскольку как DMP-1, так и MEPE могут регулировать метаболизм фосфатов и массу кости, эти результаты предполагают потенциальную связь между упражнениями, местной минерализацией костей, гомеостазом фосфатов и функцией почек, организованной через остеоциты, что может быть важно для понимания полный спектр последствий потери остеоцитов, наблюдаемых при старении костей. 233 237 243 384
Большой интерес также представляет недавнее наблюдение, что механическая нагрузка изменяет уровни экспрессии SOST в остеоцитах, что приводит к быстрому снижению продукции склеростина. 385 Как уже упоминалось, склеростин ингибирует передачу сигналов Wnt посредством связывания с LRP5 / 6 240 , 241 ; SOST -нулевые мыши имеют очень высокую костную массу, 386 , 387 , тогда как трансгенные мыши, сверхэкспрессирующие склеростин в остеоцитах, наоборот, страдают серьезной потерей костной массы. 388 Остеоциты, таким образом, по-видимому, используют путь Wnt / β-катенин для передачи сигналов механической нагрузки клеткам на поверхности кости. 236 , 389
Морфология костей модульно регулируется глобальными и региональными генетическими программами
РЕЗЮМЕ
Во время скелетогенеза на поверхности длинных костей появляются различные выступы различной формы и размера. Эти сверхструктуры обеспечить стабильные сайты анкерными для связок и сухожилий во время сборки опорно-двигательного аппарата.Несмотря на их важность, механизм, с помощью которого формируются структуры надстройки и в конечном итоге приводят к уникальной морфологии каждой длинной кости, далек от понимания. В этой работе мы представляем дополнительные доказательства того, что длинные кости образуются модульно из клеток Sox9 + , которые вносят вклад в их субструктуру, и из предшественников Sox9 + / Scx + , которые дают начало надстройкам. Кроме того, мы идентифицируем компоненты генетической программы, которая контролирует формирование паттерна предшественников Sox9 + / Scx + , и показываем, что эта программа включает как глобальные, так и региональные регуляторные модули.
Эти сверхструктуры обеспечить стабильные сайты анкерными для связок и сухожилий во время сборки опорно-двигательного аппарата.Несмотря на их важность, механизм, с помощью которого формируются структуры надстройки и в конечном итоге приводят к уникальной морфологии каждой длинной кости, далек от понимания. В этой работе мы представляем дополнительные доказательства того, что длинные кости образуются модульно из клеток Sox9 + , которые вносят вклад в их субструктуру, и из предшественников Sox9 + / Scx + , которые дают начало надстройкам. Кроме того, мы идентифицируем компоненты генетической программы, которая контролирует формирование паттерна предшественников Sox9 + / Scx + , и показываем, что эта программа включает как глобальные, так и региональные регуляторные модули.
С помощью световой флуоресцентной микроскопии в сочетании с маркировкой генетических клонов мы картировали широкий вклад предшественников Sox9 + / Scx + в формирование костных надстроек. Кроме того, объединив литературные доказательства и сравнительный транскриптомный анализ различных популяций предшественников Sox9 + / Scx + , мы идентифицировали гены, потенциально участвующие в формировании паттерна костных надстроек.Мы представляем доказательства, указывающие, что Gli3 является глобальным регулятором формирования паттерна надстройки, тогда как Pbx1, Pbx2, Hoxa11 и Hoxd11 действуют как проксимальные и дистальные регуляторы, соответственно. Более того, демонстрируя дозозависимую регуляцию паттернов в составных мутациях Gli3 и Pbx1 , мы показываем, что глобальные и региональные регуляторные модули работают согласованно. В совокупности наши результаты предоставляют убедительные доказательства генетической регуляции формирования паттерна надстройки, что дополнительно подтверждает представление о том, что развитие длинных костей является модульным процессом.
ВВЕДЕНИЕ
Скелет позвоночного состоит из множества костей, каждая из которых имеет уникальную форму и размер. Тем не менее, несмотря на это морфологическое разнообразие, большинство костей формируется в результате общего процесса развития, а именно эндохондрального окостенения (Berendsen and Olsen, 2015; Cervantes-Diaz et al., 2017; Long and Ornitz, 2013; Olsen et al., 2000). Во время этого процесса мезенхимные клетки, происходящие из мезодермы латеральной пластинки под контролем фактора транскрипции SRY-box 9 ( Sox9) , конденсируются и дифференцируются в хондропрогениторы, образуя хрящевые зачатки будущих костей (Kawakami et al., 2006; Чжао и др., 1997). Затем каскад стадий дифференцировки хондроцитов приведет к появлению пластинок роста как на проксимальном, так и на дистальном концах зачатка. Впоследствии кровеносные сосуды проникают в зачаток хряща, вводя костные клетки, называемые остеобластами. Эти клетки откладывают кальций и оссифицируют хрящевую матрицу из средней части стержня, следя за развитием пластинок роста (Kronenberg, 2003).
Эндохондральная оссификация широко изучалась более двух столетий, что позволило получить огромное количество информации об общей регуляции этого процесса.Тем не менее, отсутствует механизм, придающий каждой кости отличительную форму. Отличительной чертой уникальной морфологии каждой длинной кости являются выступающие из ее поверхности надстройки, известные как костные возвышения, такие как большие и дельтовидные бугорки, большие и малые вертлуги и т. Д., И мыщелки, такие как дистальные боковые и медиальные надмыщелки плечевая кость. Одна из основных функций костных надстроек — обеспечивать точку крепления для сухожилий и связок, которые передают силу от сокращающихся мышц к скелету (Lessa et al., 2008; МакГенри и Корруччини, 1975; Полли, 2007).
Интересно, что ранее было показано, что место прикрепления сухожилия к кости образовано уникальным набором предшественников, коэкспрессирующих Sox9 и склераксис ( Scx ) (Blitz et al. , 2013; Sugimoto et al. , 2013). Более того, было продемонстрировано, что эти клетки, которые вносят вклад в костную сторону прикрепления, не происходят от клеток, которые создают зачаток костного стержня, и определяются после них. Наконец, было продемонстрировано, что эти уникальные предшественники специфически регулируются сигнальными путями TGFβ и BMP (Blitz et al., 2009; Blitz et al., 2013). Помимо обеспечения механизма развития места прикрепления сухожилия к кости, эти результаты также предлагают альтернативную модульную модель развития длинных костей. Согласно этой модели, один набор клеток Sox9 + формирует цилиндрический зачаток будущего стержня кости, который будет служить костной субструктурой, тогда как второй набор клеток Sox9 + / Scx + К этому основанию будет добавлено ячеек, чтобы создать различные надстройки.
, 2013; Sugimoto et al. , 2013). Более того, было продемонстрировано, что эти клетки, которые вносят вклад в костную сторону прикрепления, не происходят от клеток, которые создают зачаток костного стержня, и определяются после них. Наконец, было продемонстрировано, что эти уникальные предшественники специфически регулируются сигнальными путями TGFβ и BMP (Blitz et al., 2009; Blitz et al., 2013). Помимо обеспечения механизма развития места прикрепления сухожилия к кости, эти результаты также предлагают альтернативную модульную модель развития длинных костей. Согласно этой модели, один набор клеток Sox9 + формирует цилиндрический зачаток будущего стержня кости, который будет служить костной субструктурой, тогда как второй набор клеток Sox9 + / Scx + К этому основанию будет добавлено ячеек, чтобы создать различные надстройки.
Текущая литература предоставляет достаточно доказательств в поддержку модульной модели развития длинных костей, которая основана на отслеживании клонов, временной инициации и клеточной дифференцировке клеток-предшественников Sox9 + / Scx + . Однако в этой модели все еще отсутствует механизм, который регулирует раннее формирование паттерна клеток-предшественников Sox9 + / Scx + , так что надстройки будут формироваться на развивающейся длинной кости в нужном месте и нужного размера.В этом исследовании мы исследуем эти регуляторные механизмы, лежащие в основе этого аспекта модульности развития скелета. Трехмерная (3D) реконструкция различных длинных костей и их выступающих надстроек позволила нам продемонстрировать модульность в развитии длинных костей. Сравнительный транскриптомный анализ и анализы потери функции показали, что член семейства GLI-Kruppel, GLI3 ( Gli3 ) глобально регулирует пространственную организацию Sox9 + / Scx + как в передних, так и в задних конечностях, тогда как homeobox a11 ( Hoxa11 ) и Hoxd11 регулирует формирование паттерна дистальных надстроек, а гомеобокс 1 ( Pbx1 ) и Pbx2 регулируют проксимальные предшественники надстройки.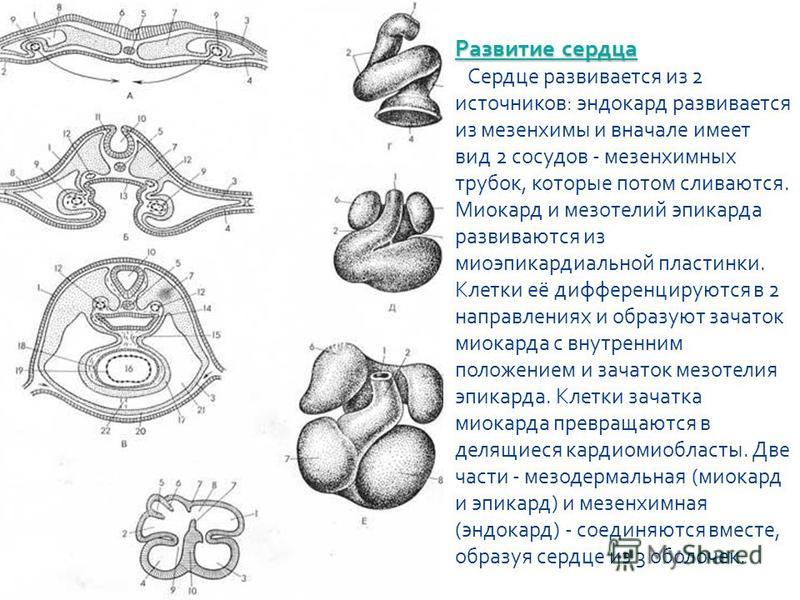 В целом, мы предоставляем клеточные доказательства существования механизма формирования паттерна, который включает как глобальную, так и региональную регуляцию, и выделяем некоторые из генов, которые способствуют формированию паттерна надструктур вдоль развивающихся длинных костей.
В целом, мы предоставляем клеточные доказательства существования механизма формирования паттерна, который включает как глобальную, так и региональную регуляцию, и выделяем некоторые из генов, которые способствуют формированию паттерна надструктур вдоль развивающихся длинных костей.
РЕЗУЛЬТАТЫ
Sox9 + / Scx + предшественники надстройки вносят значительный вклад в морфологию зачатка длинных костей
Чтобы лучше понять масштаб модульности в морфогенезе длинных костей, мы выполнили импульсную клеточную линию эксперименты путем скрещивания трансгенных репортерных мышей Sox9-CreER T2 или коллагена типа II альфа 1 ( Col2a1 ) — CreER T2 с репортерными мышами Rosa26-tdTomato (Madisen et al., 2010; Накамура и др., 2006; Soeda et al., 2010). Беременным женщинам вводили однократную дозу 0,03 мг / г тамоксифена на массу тела либо на E10.5, либо на E11.5. Ранее мы показали, что это временное окно позволяет эксклюзивно маркировать клетки цилиндрической костной субструктуры, оставляя клетки надстройки немечеными (подробно описано в (Blitz et al., 2013; Eyal et al., 2015)). Для комплексного картирования немеченых клеток надстройки в различных элементах скелета мы создали конвейер трехмерной визуализации, который включает оптическую очистку помеченных конечностей, флуоресцентную микроскопию светового слоя и, наконец, реконструкцию полученных изображений в трехмерный объект (Treweek et al., 2015; Ян и др., 2014). Чтобы лучше визуализировать надстройки, все конечности были иммуноокрашены на коллаген типа II альфа 1 (COL2A1).
Как видно на рис. 1A, B (и дополнительные видеоролики M1-M3), на E14.5 Sox9-tdTomato + или E15.5 Col2a1-tdTomato + конечностей, все надстройки длинных костей разных типов были td Tomato -отрицательными, включая большие, малые и дельтовидные бугорки, локтевой кости, а также большой, малый и третий вертлуги. Интересно, что в дополнение к возвышениям костей мы наблюдали различные мыщелки и сесамовидные кости, которые также были отрицательными по td Tomato , включая дистальный медиальный и латеральный надмыщелки плечевой кости, медиальный мыщелок большеберцовой кости, надколенник, а также медиальную и латеральную фабеллу. Эти результаты демонстрируют общность модульного процесса морфогенеза длинных костей конечностей.
Интересно, что в дополнение к возвышениям костей мы наблюдали различные мыщелки и сесамовидные кости, которые также были отрицательными по td Tomato , включая дистальный медиальный и латеральный надмыщелки плечевой кости, медиальный мыщелок большеберцовой кости, надколенник, а также медиальную и латеральную фабеллу. Эти результаты демонстрируют общность модульного процесса морфогенеза длинных костей конечностей.
Рис. 1. На морфологию длинных костей сильно влияют многочисленные пулы предшественников Sox9 + / Scx + .
Изображения, показывающие сагиттальный и коронарный виды надстроек, которые образуются вдоль длинных костей передних и задних конечностей. (A) Подготовка скелета конечностей E17.5 WT. Надстройки обозначены черными стрелками. (B) Проекционные изображения максимальной интенсивности (MIP) передней конечности E14.5 от Sox9-Cre ER — td Трансгенные эмбрионы Tomato и передние и задние конечности E15.5 от Col2a1-Cre ER — трансгенные эмбрионы td Tomato .Целые конечности окрашивали против COL2A1, визуализировали с помощью световой микроскопии и реконструировали. В то время как первая волна Sox9 + была помечена tdTomato, вторичная волна Sox9 + / Scx + оставалась неокрашенной. Прекурсоры tdTomato — способствовали исключительно формированию надстройки (белые стрелки). (C) Сагиттальный и коронарный срезы передних и задних конечностей E13.5 от трансгенных эмбрионов ScxGFP , окрашенных против SOX9.Клетки, коэкспрессирующие Sox9 и Scx , обозначены белыми стрелками. Сокращения: gt — бугристость большая; dt — бугристость дельтовидной мышцы; оле, олекранон; ltu — меньшая бугристость; mec, медиальный надмыщелок; lec, латеральный надмыщелок; lt, малый вертел; lf — боковая фабелла; па, надколенник; гтп, большой вертел; tt, третий вертел.
Чтобы дополнительно продемонстрировать эту модульность, мы исследовали сагиттальный и коронарный срезы передних и задних конечностей E13.5 трансгенных эмбрионов ScxGFP (Pryce et al., 2007), окрашенные антителами против SOX9. Как видно на рисунке 1C, мы наблюдали обилие предшественников Sox9 + / Scx + в предполагаемых анатомических местах различных надстроек вдоль стержней различных костей. Взятые вместе, эти результаты указывают на обширный вклад предшественников надстройки Sox9 + / Scx + в трехмерную морфологию хрящевого зачатка, подчеркивая модульность этого процесса как во временном, так и в клональном отношении.
Gli3 является глобальным регулятором Sox9 + / Scx + формирование паттерна предшественников во время разработки надстройки
Непосредственным следствием модульной модели является наличие механизма, который регулирует формирование паттерна Sox9 + / Scx + для правильного позиционирования супраструктуры вдоль костной основы. Чтобы раскрыть этот механизм, мы сначала исследовали литературу на предмет мутаций, ведущих к наблюдаемым аномалиям формирования паттернов надстройки.Мы обнаружили, что скелеты эмбрионов Gli3 -null, ранее известные как дополнительные пальцы ( Xt ), обнаруживают множество аномалий надстройки (Johnson, 1967). Чтобы охарактеризовать эти дефекты, мы скрестили Gli3 гетерозиготных мышей и исследовали препараты скелета от эмбрионов E17.5. Как видно на рис. 2A-I, как передние, так и задние конечности эмбрионов Gli3 null демонстрировали многочисленные диспластические надстройки, включая малую и дельтовидную бугристость, олекранон, надколенник и дополнительные эктопические сесамоиды.Примечательно, что аберрантный рисунок бугристости дельтовидной мышцы варьировался по степени тяжести от умеренно ненормальной морфологии до полного отделения от диафиза плечевой кости (сравните левую и правую передние конечности на рис. 2F и G, соответственно). Мы также исследовали Prx1-Cre ; Gli3 fl / fl эмбрионов, у которых Gli3 был условно нокаутирован (cKO) в конечностях (Blaess et al., 2008; Logan et al., 2002). Подобно Gli3 нулевым мутантам , специфичные для конечностей Gli3 cKO также приводили к разнообразным аномально структурированным надстройкам, таким как индукция избыточных сесамоидов вокруг колена, диспластический медиальный мыщелок большеберцовой кости и диспластические локтевые отростки (рис. .2J-O).
Рисунок 2. Gli3 регулирует формирование рисунка надстроек во всем мире.
(AO) Препараты скелета передних и задних конечностей E17.5 из Gli3 KO и контрольных эмбрионов (AI) и из специфичных для конечностей Prx1-Cre; Gli3 floxed cKO и контрольных эмбрионов (JO ). Затронутые надстройки обозначены черными стрелками. Сокращения: па, надколенник; es, эктопические сесамоиды; оле, олекранон; op, олекранонный отросток; цп, венечный отросток; mc, медиальный мыщелок большеберцовой кости; lf — боковая фабелла; мф, медиальная фабелла.
Чтобы изучить возможность того, что Gli3 регулируют формирование паттерна предшественников надстройки, мы попытались изучить распределение Sox9 + / Scx + клеток в Gli3 null конечностей. Для этого мы скрестили гетерозиготных мышей Gli3 с Gli3 +/- ; ScxGFP трансгенных репортерных мышей и окрашивали сагиттальные срезы передних и задних конечностей E13.5 против SOX9 для выделения хондроцитов.Как видно на рисунке 3A-F, пространственное распределение предшественников Sox9 + / Scx + в конечностях Gli3 null было аномальным. В то время как в контрольных конечностях эти предшественники располагались рядом с диафизом плечевой кости (фиг. 3A; пунктирная линия), у мутанта они были распределены латерально и менее уплотнены (фиг. 3D; пунктирная линия). Чтобы понять, как аномальное распределение предшественников Sox9 + / Scx + транслируется в аномалии надстройки, мы исследовали пространственно-временную дифференциацию предшественников бугристости дельтовидной мышцы в E13.5 и E16.5 сагиттальные срезы от контроля и передние конечности Gli3 KO. Срезы окрашивали с использованием антител против SOX9 и COL2A1, которые включают богатый коллагеном матрикс, отложенный дифференцированными хондроцитами (рис. 3G-L). Как и ожидалось, на ст. E13.5 мы неоднократно наблюдали латеральное распространение предшественников бугристости дельтовидной мышцы (рис. 3H и I; пунктирные линии). Более того, мы заметили, что степень клеточной латерализации различалась как по рисунку, так и по расстоянию от диафиза плечевой кости (рис.3H и I; белые полосы). На ст. E16.5 аномальная морфология бугристости дельтовидной мышцы была четко очевидна и варьировалась от диспластической до отдельной бугристости дельтовидной мышцы (рис. 3K, L, соответственно). Мы пришли к выводу, что Gli3 необходим для правильной пространственной организации бугристости дельтовидной мышцы Sox9 + / Scx + предшественников и, таким образом, для формирования паттерна надстройки.
Рисунок 3. Организация, но не спецификация предшественников Sox9 + / Scx + регулируется Gli3.
(A-F) Сагиттальные срезы проксимального отдела плечевой кости E13.5 Gli3 ; ScxGFP трансгенных эмбрионов, окрашенных против SOX9. В то время как коэкспрессирующие клетки Sox9 и Scx наблюдаются в контрольных и мутантных эмбрионах (C и F), их пространственная организация аномальна у мутантов Gli3 null (A и D, пунктирные линии). (G-L) Сагиттальные срезы проксимальных отделов плечевой кости E13.5 (G-I) и E16.5 (J-L) Gli3 KO и контрольные эмбрионы, окрашенные против SOX9 и COL2A1. На E13.5 пространственная организация предшественников DT аномальна у мутантов (H и I; пунктирные линии), показывая различные степени латерализации и расстояние от диафиза плечевой кости (H и I; белые полосы). У мутантов E16.5 аберрантная морфология DT варьируется от аплазии (K) до отслоения от диафиза плечевой кости (L).
Сравнительный транскриптомный анализ проксимального и дистального
Sox9 + / Scx + предшественников предсказывает региональную регуляцию формирования паттерна надстройки
Хотя Gli3 оказал глобальное влияние на формирование паттерна надстройки, мы подозревали, что региональные регуляторные схемы также существует, так что формирование определенных надстроек можно регулировать независимо.Для поиска генов, потенциально участвующих в этом механизме, мы разработали протокол для предполагаемого выделения Sox9-tdTomato + / ScxGFP + предшественников с помощью FACS. Более того, чтобы сделать возможным различие между глобальными и региональными регуляторами формирования паттерна, мы разработали нашу систему, чтобы позволить раздельную изоляцию проксимальных и дистальных популяций клеток. С этой целью мы скрестили репортерных мышей Sox9-CreER T2 ; Rosa26-tdTomato с трансгенными репортерными мышами ScxGFP .Беременным самкам вводили однократную дозу 0,03 мг / г тамоксифена / массу тела на E12.0 (фиг. 4A). Затем мы собрали эмбрионы E13.5 Sox9-tdTomato + / ScxGFP + и микро-препарировали их передние конечности на уровне плеча, выше предполагаемой DT и с фланговых сторон от локтя (рис. 4B). i и ii). Наконец, рассеченные сегменты собирали в отдельные пробирки, гомогенизировали и затем проспективно выделяли с помощью FACS (рис. 4Biii). Для каждого проксимального и дистального сегмента мы собрали по три биологических повтора из трех отдельных пометов.Каждый образец содержал 7-9% Sox9-tdTomato + / ScxGFP + предшественников от общей популяции клеток, из которых 10 000 клеток были собраны для секвенирования (фиг. 4C). Дополнительная информация, касающаяся элементов управления, настроек ворот и конфигурации прибора, находится на рис. 4D и в разделе «Материалы и методы».
Рисунок 4. Сравнительный транскриптомный анализ подчеркивает региональную регуляцию формирования паттерна надстройки.
(A) Сагиттальный разрез передней конечности E13.5 Sox9-CreER tdTomato ; Scx-GFP трансгенный репортерный эмбрион после введения тамоксифена на E12.0. Клетки, коэкспрессирующие Sox9 и Scx , показаны белыми стрелками. Пунктирные белые прямоугольники указывают на проксимальную и дистальную интересующие области, которые были проанализированы для FACS и анализа транскриптома. (B) Принципиальная схема подготовки проб. Меченые передние конечности иссекали (i), клетки проксимального и дистального сегментов выделяли (ii) и сортировали независимо (iii). (C) Таблица, обобщающая распределение типов ячеек среди 50 000 собранных и отсортированных с помощью FACS. Количество и процентное соотношение Sox9-tdTomato + / ScxGFP + указано черной стрелкой. (D) Иллюстрации настроек управления и стробирования. (i) Живые клетки контролировали окрашиванием DAPI. (ii) Одиночные клетки блокировали в соответствии с площадью капли (FSC-A) по сравнению с шириной (FSC-W). (iii) Параметры стробирования для Sox9-tdTomato + / ScxGFP + предшественников привели к сбору от 7 до 9% от общей популяции живых одноклеточных клеток (оранжевый прямоугольник).(E) Тепловая карта, показывающая кластеризацию 40 наиболее дифференциально экспрессируемых генов между проксимальным и дистальным Sox9-tdTomato + / ScxGFP + предшественниками. (F) С помощью программного обеспечения Ingenuity эти гены были аннотированы и оказались биологически значимыми для развития конечностей и морфологии тканей. (G) Шестнадцать из этих генов ранее участвовали в региональной регуляции формирования паттерна надстройки.
Сравнение транскриптомов проксимального и дистального Sox9-tdTomato + / ScxGFP + ; предшественники выявили 561 дифференциально экспрессируемый ген с по крайней мере двукратным изменением уровней экспрессии между сегментами (дополнительная таблица T1).Далее мы проанализировали 40 из этих генов, которые считались наиболее вероятными, на основании разницы в уровнях экспрессии, соответствующей биологической функции и аннотации генов развития (рис. 4E и 4F). Примечательно, что 16 из этих 40 генов-кандидатов (указанные на рис. 4G) ранее были задействованы в развитии надстройки, что является убедительным подтверждением эффективности нашей стратегии.
Hoxa11 , Hoxd11 и Pbx1 гены регионально регулируют формирование дистального или проксимального паттерна надстройки
Наш анализ транскриптома показал, что Hoxa11 и Hoxd11 были высоко экспрессированы в дистальных Sox9-tdTomato / Sox9-tdTomato ScxGFP + предшественников и практически не экспрессируется в проксимальных клетках.Интересно, что предыдущее исследование продемонстрировало, что составная мутация Hoxa11 / Hoxd11 ( Hox11 aadd ) привела к различным дистальным аномалиям передних конечностей, таким как образование отслоившегося олекранона, напоминающего сесамовидную кость, тогда как проксимального сегмента конечности , включая DT, не пострадали (Koyama et al., 2010). Тем не менее, механизм, лежащий в основе аномального развития олекранона, еще предстоит выяснить. Поэтому мы приступили к изучению этого процесса на Hox11 и мутантных эмбрионах.
С этой целью мы скрестили двойных гетерозиготных мышей Hox11 aaDd и собрали эмбрионы на ст. E13.5 и E17.5 (Wellik and Capecchi, 2003). Исследование препаратов скелета контрольных и мутантных эмбрионов E17.5 подтвердило аномальное развитие олекранона (фиг. 5A, A ’). Затем мы подтвердили дифференциальную экспрессию Hoxd11 методом флуоресцентной гибридизации in situ (FISH) на сагиттальных срезах передних конечностей E13.5. В соответствии с результатами нашего анализа транскриптома, Hoxd11 высоко экспрессируется дистально вблизи локтя, но почти не экспрессируется в проксимальных частях конечности (рис.5Б). Кроме того, экспрессия Hoxd11 подавлялась в мутантах Hox11 aadd (фиг. 5B ’). Дифференциальная экспрессия Hoxa11 на этой стадии была продемонстрирована ранее (Swinehart et al., 2013). Чтобы изучить регуляторные роли Hoxa11 и Hoxd11 в формировании дистального паттерна предшественников надстройки, мы исследовали формирование паттерна олекранона у контрольных и мутантных эмбрионов. Для этого мы скрестили двойных гетерозиготных мышей Hox11 aaDd и окрашивали срезы передних конечностей из E13.5 двойных гомозиготных Hox11 добавить эмбрионов с использованием антител против SOX9 и COL2A1, так что клетки субструктуры должны были быть Sox9 + / Col2a1 + и недифференцированными надстройками-предшественниками Sox9 + / Col2a1 — . Результаты показали, что предшественники олекранона не смогли организовать типичный паттерн, наблюдаемый в контрольных конечностях (фиг. 5C-E ’).В частности, клетки были разбросаны в проксолатеральном направлении от диафиза локтевой кости (фиг. 5C, C ’; пунктирные линии). Сечения мутантов E17.5 Hox11 aadd показали, что предшественники олекранона дифференцировались на расстоянии от диафиза локтевой кости, создавая отчетливый скелетный элемент, напоминающий сесамовидную кость (фиг. 5F, F ’). Эти результаты предполагают, что Hoxa11 и Hoxd11 необходимы для правильной локализации предшественников олекранона и, таким образом, для формирования их паттерна.Более того, правильное формирование паттерна предшественников надстройки на проксимальной стороне поддерживает нашу гипотезу, что Hoxa11 и Hoxd11 действуют как региональные дистальные регуляторы (Sup Fig. 1A-A ’).
Рис. 5. Формирование паттерна дистальной и проксимальной надстройки регулируется HoxA11 , HoxD11 и Pbx1.
(A-F ’) HoxA11 и HoxD11 регионально регулируют формирование паттерна дистального олекранона. (A, A ’): Препараты скелета E17.5 передних конечностей от соединения Hox11 и HoxD11 мутантных и контрольных эмбрионов. Дистальный олекранон, но не проксимальный DT развивался аномально у мутантных передних конечностей Hox11 aadd (черные стрелки и увеличенный прямоугольник). (B, B ’): флуоресцентная гибридизация in situ для Hoxd11 в срезах передних конечностей показывает, что на E13.5 Hoxd11 экспрессируется дистально в локтевой области (B, белые стрелки). Экспрессия HoxD11 подавлялась в мутантных передних конечностях Hox11 aadd (B ’).Длинные кости обозначены пунктирными линиями. (C-F ‘): сагиттальные срезы через локоть E13.5 (C-E’) и E17.5 (F, F ‘) Hox11 aadd составной мутантный и контрольный эмбрионы, окрашенные против SOX9 и COL2A1. На E13.5 пространственная организация предшественников олекранонов аномальна (C и C ’; белые стрелки). К ст. E17.5 развивающийся олекранон мутантных эмбрионов отделяется от локтевого стержня (F, F ’). (G-L ’) Pbx1 регионально регулирует формирование паттерна проксимальной DT.(G, G ’): Препараты скелета передних конечностей E15.0 от Pbx1 -нулевых и контрольных эмбрионов. Проксимальный DT, но не дистальный олекранон, развивался аномально у мутантных передних конечностей Pbx1 (черные стрелки). (H, H ’): Окрашивание против PBX1 и COL2A1 в срезах передних конечностей показывает, что на E13.5 Pbx1 экспрессируется проксимально в области плеча (H, белые стрелки). Экспрессия Pbx1 подавлялась в Pbx1 нулевых мутантных передних конечностях (H ’).(I-K ’): сагиттальные срезы проксимального отдела плечевой кости E13.5 Pbx1 ; ScxGFP трансгенных эмбрионов, окрашенных против SOX9. Хотя коэкспрессирующие клетки Sox9 и Scx наблюдаются в контрольных и мутантных эмбрионах (K и K ‘), их пространственная организация была аномальной у мутантов Pbx1 null (I и I’, белые стрелки) . (L, L ’): сагиттальные срезы проксимальных отделов плечевой кости мутантных эмбрионов E15.5 Pbx1 и контрольных эмбрионов, окрашенных против SOX9 и COL2A1.На E15.5 DT мутантных эмбрионов отделяется от диафиза плечевой кости (L, L ’).
Другим многообещающим геном-кандидатом из нашего анализа транскриптома был Pbx1 . В отличие от Hoxa11 и Hoxd11, Pbx1 был высоко экспрессирован в проксимальных Sox9-tdTomato + / ScxGFP + предшественниках по сравнению с дистальными клетками. Действительно, было показано, что мутация Pbx1 null влияет только на проксимальные элементы, такие как DT, тогда как дистальный сегмент конечности, включая олекранон, не был затронут (Selleri et al., 2001). Поэтому мы провели такой же анализ для Pbx1 null ; ScxGFP мутантов. После подтверждения фенотипа бугристости дельтовидной мышцы в препаратах скелета контрольных и мутантных эмбрионов E15.0 (рис. 5G, G ’) мы проанализировали экспрессию Pbx1 путем иммуноокрашивания сагиттальных срезов передних конечностей E13.5 против PBX1 и COL2A1. В соответствии с результатами анализа транскриптома, Pbx1 был высоко экспрессирован проксимально в непосредственной близости от бугристости дельтовидной мышцы и менее выражен в дистальном отделе передней конечности (рис.5H). Как и ожидалось, экспрессия Pbx1 была полностью устранена у мутантов Pbx1 нулевых (фиг. 5H ’).
Далее, секции передних конечностей из Pbx1 null ; ScxGFP + E13.5 эмбрионы окрашивали с использованием антител против SOX9. Как видно на фиг. 5I-K, предшественники бугристости дельтовидной мышцы Sox9 + / Scx + были определены как для контрольных, так и для мутантных конечностей; тем не менее, у мутанта они были организованы ненормально и разбросаны по сторонам.Наконец, исследование срезов, иммуноокрашенных против SOX9 и COL2A1 на E15.5, показало, что у мутантов Pbx1 null предшественники бугристости дельтовидной мышцы дифференцировались в отдельный сесамовидный хрящевой элемент, параллельный диафизу плечевой кости (рис. 5L, L ‘). Эти результаты показывают, что Pbx1 необходим для правильной локализации Sox9 + / Scx + предшественников бугристости дельтовидной мышцы и, таким образом, для формирования их паттерна.Важно, что формирование паттерна предшественников надстройки в дистальной области не зависело от регуляции Pbx1 (Sup Fig. 1B-B ’).
Вместе эти результаты показывают, что формирование паттерна надстройки регулируется регионально посредством ранней модуляции пространственной организации Sox9 + / Scx + предшественников Hoxa11, Hoxd11 и Pbx1 .
И
Pbx1 , и Pbx2 участвуют в формировании паттерна проксимальных надстроек
Pbx2 является паралогом Pbx1 , который экспрессируется по всей мезенхиме конечностей.Ранее было показано, что Pbx1 и Pbx2 действуют дозозависимым образом во время развития проксимальных конечностей (Capellini, 2006). Это привело нас к исследованию, ко-регулирует ли Pbx2 формирование паттерна проксимальных надстроек с Pbx1 . Чтобы избежать ранней эмбриональной летальности, мы удалили один аллель Pbx2 на фоне специфического для конечностей нокаута Pbx1 ( Prx1-Cre; Pbx1 fl / fl ; Pbx2 +/− ) и сравнили фенотип с обоими WT ( Prx1-Cre — ; Pbx1 + / + ; Pbx2 + / + ) или Pbx1 cKO ( Prx1-Cre; Pbx1 fl / fl ) эмбрионов (Ficara et al., 2008; Селлери и др., 2004). С этой целью срезы E13.5, E15.5 и E16.5 контрольных и мутантных передних конечностей иммуноокрашивали с использованием антител против SOX9 и COL2A1 (фиг. 6A-C »). На ст. E13.5 мы наблюдали аномальное формирование предшественников бугристости дельтовидной мышцы как у Prx1-Cre; Pbx1 fl / fl и Prx1-Cre; Pbx fl / fl ; Pbx2 + / — мутантных эмбрионов. Предшественники были разбросаны латерально (рис. 6A ’и A”), что сравнимо с предшественниками бугристости дельтовидной мышцы Pbx1 null конечностей (рис.5I ’). К E15.5 предшественники бугристости дельтовидной мышцы Prx1-Cre ; Pbx1 fl / fl эмбрионы полностью дифференцировались, тогда как у Prx1-Cre; Pbx1 fl / fl ; Pbx2 +/− мы наблюдали замедленную дифференцировку (рис. 6B-B »). Примечательно, что у эмбрионов Prx1-Cre; Pbx1 fl / fl граница плечевой кости и DT была заселена клетками Sox9 + , которые не были обнаружены в Prx1-Cre; Pbx1 fl / fl ; Pbx2 +/− эмбрионов.Более того, зазор между диафизом плечевой кости и предшественниками бугристости дельтовидной мышцы был примерно в два раза больше у Prx1-Cre ; Pbx1 эт / эт ; Pbx2 +/− конечностей, чем в Prx1-Cre ; Pbx1 эт / эт конечностей. Наконец, на E16.5 — бугристость дельтовидной мышцы Prx1-Cre ; Pbx1 fl / fl эмбрионов прикрепились к диафизу плечевой кости, в то время как дельтовидный бугорок Prx1-Cre; Pbx1 fl / fl ; Pbx2 +/− мутантов остались разделенными ( Инжир.6C-C ”), как и в случае Pbx1 нулевых мутантов (фиг. 5L’). Эти расходящиеся морфологии были дополнительно подтверждены препаратами скелета, сделанными из конечностей, взятых у каждого мутанта (рис. 6. D-D »). Взятые вместе, эти результаты подтверждают, что гены PBX действуют вместе, регулируя формирование паттерна проксимальных надстроек, возможно, регулируя уровень латерализации дозозависимым образом.
Рис. 6. Pbx1 и Pbx2 координируют формирование рисунка проксимальных надстроек.
(AC ”) Сагиттальные срезы проксимальных отделов плечевой кости конечностей E13.5 (AA”), E15.5 (BB ”) и E16.5 (CC”) из контроля (AC), Prx1-Cre; Pbx1 floxed (BB ”) или Prx1-Cre; Pbx1 floxed ; Pbx2 het (CC») мутантных эмбрионов, окрашенных против SOX9 и COL2A1. На панелях A-B ”правая сторона панели представляет собой увеличение пограничной области плечевой кости и DT, обозначенной белым прямоугольником слева.На ст. E13.5 пространственная организация предшественников DT у обоих мутантов была аномальной (A’ и A ”), поскольку предшественники DT были разбросаны латерально от ствола плечевой кости. Зазор между стволом плечевой кости и предшественниками DT был вдвое больше у мутантов Prx1-Cre; Pbx1 floxed ; Pbx2 het , чем у мутантов Prx1-Cre; Pbx1 8 floxed мутанты (A ‘и A ”; белые полосы). На ст. E15.5, в то время как клетки на границе плечевая кость-DT Prx1-Cre; Pbx1 aoxed мутанты начали экспрессировать высокие уровни Sox9 , такая экспрессия не наблюдалась в Prx1-Cre; Pbx1 floxed ; Pbx2 het мутантов.Более того, разница в размере граничной области оставалась неизменной (B и B ’; белые полосы). На E16.5 морфология DT варьировалась от прикрепленной, но апластической DT в Prx1-Cre; Pbx1 с флоксированными мутантами (C ‘) до отделившейся DT в Prx1-Cre; Pbx1 с флоксированием ; Pbx2 het мутантов (C ”). (D-D ’’) Препараты скелета передних конечностей E16.5 дополнительно подтверждают эти расходящиеся морфологии.
Взаимодействие между глобальными и региональными генетическими программами точно настраивает формирование паттерна надстройки
Обнаружение того, что формирование паттерна надстройки может регулироваться как глобально, так и регионально, привело нас к гипотезе о том, что эти две программы взаимодействуют друг с другом.Чтобы исследовать эту возможность, мы получили составных мутантных мышей, несущих специфичный для конечностей нокаут Pbx1 и Gli3 . В частности, на фоне специфического для конечностей нокаута Pbx1 ( Prx1-Cre ; Pbx1 fl / fl ) мы удалили один или два аллеля Gli3 ( Prx1-Cre ). ; Pbx1 эт / эт ; Gli3 эт / + или Prx1-Cre ; Pbx1 эт / эт ; Gli3 эт , соответственно).Затем срезы контрольных и мутантных передних конечностей E13.5 и E16.5 были иммуноокрашены с использованием антител против SOX9 и COL2A1 (фиг. 7A-B »). На E13.5 — предшественники бугристости дельтовидной мышцы в Prx1-Cre ; Pbx1 эт / эт ; Gli3f fl / fl эмбрионов были разбросаны латерально и заметно менее конденсированы, чем в Prx1-Cre ; Pbx1 эт / эт ; Gli3 fl / + эмбрионов (рис.7А-А »). Фенотипические различия между генотипами стали более выраженными к E16.5. В то время как удаление одного аллеля Gli3 приводило к диспластическому бугорку дельтовидной мышцы, который прикреплялся к диафизу плечевой кости, удаление обоих аллелей приводило к отслоению бугристости дельтовидной мышцы (Рис. 7B-B »). Эти расходящиеся морфологии были дополнительно подтверждены подготовкой скелета конечностей от каждого мутанта (Рис. 7. C-C »). В совокупности эти результаты предполагают, что аналогично мутации соединения Pbx1 / Pbx2 , генетические взаимодействия также происходили между Pbx1 и Gli3 дозозависимым образом, подчеркивая возможность взаимодействия между глобальными и региональными регуляторными программами.
Рисунок 7. Скоординированное регулирование с помощью Pbx1 и Gli3 подчеркивает взаимодействие между глобальными и региональными генетическими программами.
(A-B «) Сагиттальные срезы проксимальных отделов плечевой кости конечностей E13.5 (A-A») и E16.5 (B-B «) из контроля (A и B), Prx1-Cre ; Pbx флоксированный ; Gli3 fl / + (A ’и B’) или Prx1-Cre ; Pbx флоксированный ; Gli3 floxed (A ”и B”) мутантных эмбрионов, окрашенных против SOX9 и COL2A1.(C-C ”) Препараты скелета передних конечностей E17.5 из контроля (C), Prx1-Cre ; Pbx1 флоксированный ; Gli3 fl / + (C ’) или Prx1-Cre ; Pbx1 флоксированный ; Gli3 floxed (C ”) мутантных эмбрионов. На панелях A-A ”правая сторона панели представляет собой увеличение пограничной области плечевой кости и DT, обозначенной белым прямоугольником слева. На ст. E13.5 пространственная организация предшественников DT у обоих мутантов была аномальной (A ’, A”), поскольку предшественники DT были разбросаны латерально от ствола плечевой кости.Зазор между диафизом плечевой кости и предшественниками ДТ был вдвое больше у Prx1 — Cre ; Pbx1 флоксированный ; Gli3 floxed мутантов, чем Prx1-Cre ; Pbx1 флоксированный ; Gli3 fl / + мутанты (A ’, A”; белые полосы). На E16.5, тогда как клетки на границе плечевой кости и DT Prx1-Cre ; Pbx1 флоксированный ; Gli3 fl / + мутанты начали экспрессировать высокие уровни Sox9 , такая экспрессия не наблюдалась в Prx1-Cre ; Pbx1 флоксированный ; Gli3 флоксированные мутанты .Более того, разница в размере граничной области оставалась неизменной (B ’и B”; белые полосы). На E17.5 морфология DT варьировалась от прикрепленной, но апластической DT в Prx1-Cre ; Pbx1 флоксированный ; Gli3 fl / + мутантов (C ’) к отделенному DT в Cre ; Pbx флоксированный ; Gli3 флоксированные мутанты (C ”).
Рис. 8. Модульная модель развития длинных костей и формирования рисунка надстройки.
(A) Инициированию надстройки предшествует образование хрящевых субструктур, происходящих из первичных предшественников Sox9 + . (B) Вслед за дифференциацией подструктур вторичная волна de novo спецификации дает Sox9 + / Scx + предшественников надстройки. Эта вторая волна спецификации возникает при сопоставлении с субструктурой в разные моменты времени во время эмбриогенеза и регулируется сигнальным путем TGFβ.Начальное пространственное формирование паттерна предшественников надстройки регулируется как глобальными, так и региональными молекулярными игроками, такими как гены Gli3 или Pbx и Hox , соответственно. (C) Следуя спецификации, формированию рисунка и конденсации предшественников надструктур, они дифференцируются и становятся неотъемлемой частью зачатка субструктуры, создавая таким образом сложную трехмерную хрящевую матрицу, уникальную для каждой длинной кости. Дифференциация надстройки регулируется внутренней передачей сигналов BMP4 и внешними механическими стимулами. (D) Наконец, окостенение субструктуры, а затем и надстройки приведет к морфологии зрелой длинной кости.
ОБСУЖДЕНИЕ Опорно-двигательный система действует как система рычагов и шкивов, чтобы создать локомоции. Таким образом, один из способов достижения изменения в стратегиях опорно-двигательного аппарата, изменив расположение соединения между рычагом и шкива. Изменение положения костной надстройки, с которой мышца соединена сухожилием, вдоль стержня кости изменяет вектор тягового усилия данной мышцы и, таким образом, способствует развитию различных типов локомотивных возможностей.Различия в расположении надстроек и их влияние на передвижение хорошо задокументированы (Archer et al., 2011; Milne and O’Higgins, 2012; Polly, 2007; Salton and Sargis, 2008; Salton and Sargis, 2009). Однако механизм, вызывающий эти изменения, был неизвестен.
Ранним шагом в развитии эндохондральных костей является конденсация мезенхимы и формирование хрящевого шаблона, который является прообразом будущей кости. Здесь мы идентифицируем компоненты генетической программы, которая регулирует последующий этап этого процесса, а именно формирование паттерна и конденсацию предшественников надстройки.Более того, мы демонстрируем, что механизм формирования паттерна надстройки включает как глобальные, так и региональные модули, подчеркивая модульность в развитии длинных костей. В частности, объединив сравнительный транскриптомный анализ с перекрестными ссылками на существующую литературу, мы определили список генов-кандидатов, которые могут быть задействованы в этой генетической программе. Дальнейший анализ некоторых из этих генов-кандидатов, а именно, Gli3 , Pbx1 , Pbx2 , Hoxa11 и Hoxd11 , установил их участие в регуляции формирования паттерна надструктур.Важно, что возмущение Gli3 затрагивает надстройки во всех частях скелета конечностей, тогда как мутации в Pbx1 и Pbx2 или в Hoxa11 и Hoxd11 затрагивают проксимальные или дистальные надстройки, соответственно. Интересно, что мы обнаружили, что глобальные и региональные компоненты генетической программы взаимосвязаны, поскольку сложные мутации проксимального регулятора Pbx1 и глобального регулятора Gli3 приводили к увеличению тяжести фенотипа по сравнению с мутациями в одном из генов.
В дополнение к этим генам наш транскриптомный анализ выявил еще 12 генов-кандидатов, которые, как сообщается, участвовали в развитии длинных костей. Интересно, что многие из этих генов регулируют проксимальные или дистальные сегменты конечностей или, альтернативно, устанавливают саму проксодистальную ось. Например, мы идентифицировали дополнительные гены HOX, такие как Hoxa9 , Hoxd9 , Hoxal0 и Hoxd10 , которые, как было показано, регулируют формирование паттерна проксимальных надстроек, таких как бугристость дельтовидной мышцы (Wellik and Capecchi, 2003 ; Сюй, Веллик, 2011).Другие гены-кандидаты, такие как Shox2 или Meisl , действуют локально либо как нижестоящие эффекторы генов HOX (Neufeld et al., 2014), либо как кофакторы проксимальных регуляторов, таких как Pbx1 (Mercader et al., 2009). ), соответственно. В качестве альтернативы мы идентифицировали гены, которые контролируют формирование проксимодистальной оси, такие как Cyp26B1 , который модулирует уровни ретиноевой кислоты (Yashiro et al., 2004) или Irx3, Irx5 и Hand2 , которые модулируют активность сигнального пути Shh / Gli3 (Galli et al., 2010; Ли и др., 2014). Вместе эти отчеты дополнительно поддерживают модульную модель построения паттернов надстройки и предполагают участие как минимум двух иерархических программ в этом процессе. Выше находится программа, которая управляет установлением проксимодистальной оси, а ниже по течению местные программы регулируют развитие каждого отдельного сегмента. Наконец, несмотря на то, что наш транскриптомный анализ был разработан для выявления дифференциально экспрессируемых генов вдоль проксимодистальной оси, ему не хватало информации относительно глобально экспрессируемых генов, которые потенциально могли бы регулировать формирование паттерна надстройки, например Gli3 , который экспрессировался повсеместно как в проксимальном, так и в дистальном Sox9 + / Scx + предков.Дополнительное доказательство существования др. Глобальных регуляторных генов дается в недавнем отчете, демонстрирующем, что Tbx3 глобально регулирует формирование паттерна надстройки передних конечностей, а именно бугристости большой и дельтовидной мышцы и олекранона (Colasanto et al., 2016).
В то время как наша работа проливает свет на генетический механизм, который регулирует формирование паттерна надстройки, клеточный механизм, лежащий в основе процесса формирования паттерна, все еще отсутствует. Ключ к разгадке его природы дается наблюдениями, что у Gli3 , Pbx и Hox11 мутантных эмбрионов предшественники надстройки аномально распространяются от развивающейся костной субструктуры и обнаруживают замедленную дифференцировку.Это может означать существование механизма, контролирующего миграцию предшественников Sox9 + / Scx + к специфическому сайту конденсации. Как только эта программа нарушается, клетки мигрируют в неправильное место, где они образуют аномальный костный элемент. Альтернативно, возможно, что Sox9 + / Scx + хондропрогенаторы указаны из выбранных клеток, уже присутствующих в обозначенных местоположениях надстройки.В этом случае механизм будет включать активацию хондрогенной программы в определенных клеточных субпопуляциях с помощью внешних или внутренних сигналов в определенных пространственно-временных положениях. В любом сценарии механизм, который решает, где должно происходить развитие надстройки, включает гены Gli3, Pbx и Hox . Интересно, что несколько отчетов продемонстрировали, что неправильная структура определенных мышц сочетается с аберрантными надстройками. Например, удаление Tbx3 приводит к аномальному формированию паттерна мускулатуры шилопода, которая прикрепляется к диспластическому локтевому отростку и бугристости дельтовидной мышцы (Colasanto et al., 2016), тогда как у Hox11 aadd составных мутантов аномальное формирование паттерна мускулатуры zeugopod сопровождается аномальным формированием паттерна олекранонов (Swinehart et al., 2013). Эти результаты убедительно свидетельствуют о том, что формирование паттерна мышц и надстройки может регулироваться координированно.
В заключение, наши результаты дают представление о формировании, формировании рисунка и развитии надстройки длинных костей и их влиянии на морфологию кости. Кроме того, они предоставляют убедительные доказательства в поддержку модульной модели скелетогенеза и демонстрируют уровень модульности во время морфогенеза длинных костей с точки зрения клеточного происхождения, генетической регуляции, морфологии и скелетной сборки надстроек, а именно их способности прикрепляться или отсоединяться от субструктуры. .В частности, мы показываем, что в то время как предшественники Sox9, + устанавливают костную субструктуру (рис. 7A), зачаток надстройки формируется и собирается модульно на субструктуру с помощью Sox9 + / Scx + предшественников ( Рис. 7Б). Мы показываем, что эти уникальные предшественники Sox9 + / Scx + вносят вклад не только в возвышения костей, но и в различные мыщелки и сесамовидные кости, и что формирование их паттерна включает как глобальные, так и региональные регуляторные модули, которые включают Gli3 , Гены Pbx и Hox (рис.7Б). Следуя своей спецификации и формированию паттерна, эти надстройки дифференцируются и становятся неотъемлемой частью развивающихся длинных костей (Рис. 7C и D). Важно отметить, что с помощью сравнительного транскриптомного анализа мы смогли выделить дополнительные гены-кандидаты, которые могут участвовать в формировании паттерна надструктур. Дальнейшие исследования этих молекулярных игроков дадут лучшее понимание регуляторной сети, участвующей в формировании надстройки и морфогенезе длинных костей.
МАТЕРИАЛЫ И МЕТОДЫ
Животные
Все эксперименты с участием мышей были одобрены Комитетом по уходу и использованию животных (IACUC) Института Вейцмана.Для всех беременностей, рассчитанных по времени, дата введения пробки была определена как E0,5. Для сбора эмбрионов беременных самок умерщвляли путем смещения шейных позвонков. Беременную матку вырезали и суспендировали в ванне с холодным фосфатно-солевым буфером (PBS), и эмбрионы собирали после удаления плаценты. Хвостовую геномную ДНК использовали для генотипирования с помощью ПЦР.
Sox9-CreER T2 мышей (Soeda et al., 2010) были получены из лаборатории Харухико Акияма, Университет Киото, Киото, Япония. ScxGFP Трансгенные мыши были получены от Ronen Schweitzer, Исследовательского отделения детской больницы Shriners, Портленд, Орегон, США.
Поколение Col2A1-CreER T2 (Nakamura et al., 2006), Sox9-CreER T2 (Soeda et al., 2010), ScxGFP (Pryce et al. ., 2007), Gli3 null (Johnson, 1967), Prx1-Cre (Logan et al., 2002), floxed- Gli3 (Blaess et al., 2008), Pbx1 null (Selleri et al., 2001), floxed- Pbx1 (Ficara et al., 2008), Pbx2 null (Selleri et al., 2004 ), Hox-A11 null (Boulet, 2003), Hox-D11 null (Davis and Capecchi, 1994) и Rosa26-tdTomato (Madisen et al., 2010) мыши был описан ранее.
Для создания мутантных мышей Gli3 , Hox11 и и Pbx1 животных, гетерозиготных по мутациям, скрещивали; гетерозиготные эмбрионы использовали в качестве контроля.Для создания мутантных мышей Prx1-Gli3 или Prx1-Pbx1 , мышей floxed- Gli3 или floxed- Pbx1 скрещивали с Prx1-Cre-Gli3 или Prx1-Cre-Pbx1 соответственно. Для создания Prx1-Pbx1 flox — Pbx2 +/− мутантных мышей, floxed- Pbx1-Pbx2 +/- мышей скрещивали с Prx1-Cre-Pbx1 мутантных мышей. Для создания мутантных мышей Prx1-Pbx1-Gli3 , мышей -Pbx1-Gli3 скрещивали с мутантными мышами Prx1-Cre-Pbx1-Gli3 .В качестве контроля использовали Prx1-Cre -отрицательные эмбрионы.
Для анализа генетических линий и экспериментов FACS мышей Col2A1-CreER T2 или Sox9-CreER T2 скрещивали с репортерными мышами Rosa26-tdTomato . Индукцию Cre-рекомбиназы проводили на различных стадиях беременности путем введения 0,03 мг / г тамоксифена / масса тела в кукурузном масле через желудочный зонд (исходная концентрация составляла 5 мг / мл).
Препараты скелета
Хрящи и кости у целых эмбрионов мыши были визуализированы после снятия шкуры, потрошения, окрашивания альциановым синим и ализариновым красным S (Sigma) и осветления мягких тканей 3% гидроксидом калия и 100% глицерином (McLeod, 1980) .
Парафиновые срезы
Для приготовления парафиновых срезов эмбрионы разного возраста собирали, препарировали и фиксировали в 4% параформальдегиде (PFA) / PBS при 4 ° C в течение ночи. После фиксации ткани обезвоживали до 100% этанола и заливали парафином.Залитые ткани были разделены на срезы толщиной 7 мкм и помещены на предметные стекла.
ОКТ-срезы
Для приготовления ОКТ-срезов собирали эмбрионы разного возраста, препарировали и фиксировали в 1% параформальдегиде (PFA) / PBS при 4 ° C в течение ночи. Затем фиксированные эмбрионы обезвоживали в 30% сахарозе в течение ночи при 4 ° C. Затем образцы препарировали, вымачивали в ОКТ на 30-60 минут, а затем помещали в ОКТ. Из замороженных образцов нарезали срезы толщиной 10 мкм и помещали на предметные стекла.
Флуоресцентная гибридизация in situ
Флуоресцентная гибридизация in situ (FISH) на парафиновых срезах была проведена с использованием зондов, меченных дигоксигенином (DIG) (Shwartz and Zelzer, 2014). Все зонды доступны по запросу. Обнаружение зондов проводили с помощью анти-DIG-POD (Roche, 11207733910, 1: 300), а затем флуоресцентных красителей, меченных Cy3-тирамидом, в соответствии с инструкциями набора TSA Plus Fluorescent Systems Kit (Perkin Elmer). Наконец, предметные стекла подвергали контрастному окрашиванию с использованием DAPI.
Иммунофлуоресцентное окрашивание
Для иммунофлуоресцентного окрашивания на SOX9 и COL2A1 парафиновые срезы конечностей эмбриона толщиной 7 мкм депарафинизировали и регидратировали в воду. Затем антиген извлекали в 10 мМ цитратном буфере (pH 6,0), кипятили и варили в течение 10 минут в микроволновой печи. Чтобы заблокировать неспецифическое связывание иммуноглобулина, срезы инкубировали с 7% козьей сывороткой, 1% BSA, растворенным в PBST. После блокировки срезы инкубировали в течение ночи при 4 ° C с первичным антителом против SOX9 (1: 200; AB5535; Millipore).Затем срезы промывали PBST (PBS + 0,1% Triton X-100 + 0,01% азид натрия) и инкубировали с Cy3-конъюгированными вторичными флуоресцентными антителами (1: 100; Jackson Laboratories). После окрашивания на SOX9 слайды промывали PBST и фиксировали в 4% PFA при комнатной температуре в течение 10 минут. Затем слайды инкубировали с протеиназой К (Sigma, P9290), промывали и снова фиксировали в 4% PFA. Затем срезы промывали и инкубировали в течение ночи при 4 ° C с первичным антителом против COL2A1 (1:50; DSHB, Университет Айовы).На следующий день срезы промывали PBST и инкубировали с вторичными флуоресцентными антителами, конъюгированными с Cy2 (1: 200; Jackson Laboratories). Слайды закрепляли с помощью монтажной среды на водной основе Immuno-mount (Thermo). Для иммунофлуоресцентного окрашивания на PBX1 и COL2A1 проводили парафиновые срезы, извлечение антигена и блокирование неспецифического связывания, как описано выше. Окрашивание на PBX1 проводили с использованием первичных антител против PBX1 (Cell Signaling, C-4342, 1: 400), затем вторичных антител, конъюгированных с HRP (Jackson, 1: 1000), и флуоресцентных красителей, меченных Cy3-тирамидом, в соответствии с инструкциями Комплект для люминесцентных систем TSA Plus.Затем проводили окрашивание против COL2A1, как описано выше.
Для иммунофлуоресцентного окрашивания на SOX9 и ScxGFP использовали криостатные срезы конечностей эмбриона толщиной 10 мкм, эндогенно меченные для ScxGFP . Иммунофлуоресцентное окрашивание SOX9 проводили, как описано выше, за исключением этапа извлечения антигена, с использованием первичного антитела SOX9 и вторичного флуоресцентного антитела Cy3.
Очистка тканей для световой флуоресцентной микроскопии
Для получения изображений в целом образцы сначала очищали и иммуноокрашивали с использованием техники PACT-decal (Treweek et al., 2015; Ян и др., 2014). Вкратце, мышей Col2A1-CreER T2 или Sox9-CreER T2 — tdTomato скрещивали с репортерными мышами Rosa26-tdTomato . После введения тамоксифена на E11.5 ( Col2A1-CreER T2 ) или E10.5 ( Sox9-CreER T2 ), как описано выше, эмбрионы собирали на E15.5 или E14. 5 соответственно. Эмбрионы препарировали и фиксировали в 1% параформальдегиде (PFA) / PBS при 4 ° C в течение ночи.Затем образцы промывали PBST при комнатной температуре, затем заливали гидрогелем с 4% (масс. / Об.) Акриламидом в 1x PBS с 0,25% термическим инициатором 2,2′-азобис [2- (2-имидазолин-2-ил). ) пропан] дигидрохлорид (Wako, каталожный № VA-044). Гидрогелю позволяли полимеризоваться при 37 ° C в течение 5 часов. Образцы удаляли из гидрогеля, промывали PBST и перемещали в 10% SDS с 0,01% азида натрия, встряхивая при 37 ° C в течение 3 дней, меняя раствор SDS каждый день. Образцы промывали четыре раза с помощью 1x PBST при комнатной температуре в течение дня и в течение ночи и фиксировали в 4% PFA при комнатной температуре в течение 10 минут.Затем образцы инкубировали с протеиназой К (Sigma, P9290) в течение 30 минут при встряхивании при 37 ° C, промывали и снова фиксировали в 4% PFA. Для обнаружения COL2A1 образцы сначала инкубировали с 5% козьей сывороткой, растворенной в PBST, в течение ночи, чтобы заблокировать неспецифическое связывание иммуноглобулина. Затем образцы инкубировали с первичными антителами COL2A1 (1: 150) в 2,5% козьей сыворотке / PBST, встряхивая при 37 ° C в течение 3 дней, меняя раствор антител каждый день. Образцы промывали четыре раза 1x PBST при комнатной температуре в течение дня и ночи.Затем образцы инкубировали со вторичными антителами Cy3 или Cy2 (Jackson, 1: 150) в 2,5% козьей сыворотке / PBST, встряхивая при 37 ° C в течение ночи. Образцы снова промывали четырьмя сменами 1x PBST, и показатель преломления (RI) образца доводили до 1,45 путем погружения в раствор для согласования показателя преломления (RIMS), осторожно встряхивая при комнатной температуре в течение ночи. Наконец, образцы помещали в 1% агарозу с низким содержанием геля (Sigma) в PBS в стеклянном капилляре, погружали в RIMS и хранили в темноте при комнатной температуре до визуализации.
Световая флуоресцентная микроскопия
Очищенные образцы получали с помощью микроскопа Zeiss Lightsheet Z.1. Для каждой конечности было получено изображение с низким разрешением всей конечности с помощью объектива 20x Clarity с увеличением 0,36. При необходимости выполнялось световое слияние изображений (программное обеспечение Zen, Zeiss). Сшивание плитки и реконструкция 3D-изображения выполнялись с использованием программного обеспечения Arivis Vision4D (Arivis) и Imaris (Bitplane).
Сортировка клеток с активацией флуоресценции (FACS)
Анализ проточной цитометрии и сортировка выполнялись на приборе BD FACS AriaIII (BD Immunocytometry Systems), оборудованном лазерами 488, 407, 561 и 633 нм, с использованием сопла 70 мкм, контролируемого от BD FACS Diva software v8.0.1 (BD Biosciences), в основной лаборатории проточной цитометрии Института Вейцмана. Дальнейший анализ проводился с использованием программного обеспечения FlowJo v10.2 (Tree Star).
Для сбора клеток, Sox9-CreER T2 — tdTomato ; Мышей ScxGFP скрещивали с репортерными мышами Rosa26-tdTomato; ScxGFP . Эмбрионы собирали на E13.5 после введения тамоксифена на E12.0, как описано выше. Передние конечности иссекали и суспендировали в холодном PBS с использованием 15 мл пробирок.
Для извлечения клеток из тканей PBS заменяли 1 мл нагретого 0,05% трипсина (0,25% растворенного в DMEM, 37 ° C) и инкубировали в течение 15 минут при 37 ° C, осторожно перемешивая каждые 5 минут. Затем ткани диссоциировали энергичным пипетированием с использованием наконечников на 1 мл. Затем добавляли 4 мл DMEM с добавлением 10% FBS и 1% Pen Strep и суспензии клеток фильтровали в пробирку на 15 мл, используя шприц и сетку фильтра 40 мкм. Наконец, пробирки центрифугировали при 1000 об / мин в течение 7 минут, супернатант удаляли, клетки ресуспендировали в 1 мл холодного PBS и сразу же использовали для FACS.
Одноокрашенные контрольные клетки GFP и tdTomato использовали для конфигурации и определения границ ворот. Живые клетки определяли по размеру и зернистости с использованием FSC-A по сравнению с SSC-A и в соответствии с окрашиванием йодидом пропидия (PI, 1 мкг / мл) и DAPI (1 мкг / мл). FSC-W по сравнению с FSC-A использовали для дальнейшего различения одиночных клеток. Кроме того, неокрашенные, окрашенные только GFP и только tdTomato клетки смешивали в различных комбинациях, чтобы убедиться, что анализ исключил ложноположительные дублеты.
MARS-Seq
Очищенную РНК из FACS-выделенных образцов клеток Sox9 + / Scx + использовали для подготовки библиотеки в соответствии с протоколом MARS-Seq (Jaitin et al., 2014). Качество библиотеки анализировали с помощью прибора 2200 TapeStation (Agilent Technologies, данные не показаны). В результате эксперимента были получены библиотеки хорошего качества и в достаточном количестве. Затем библиотеки были секвенированы с помощью Illumina HiSeq 2500.
Биоинформатический анализ
Последовательность уникального молекулярного идентификатора (UMI), присутствующая при чтении R2, была вставлена в имя чтения файла последовательности R1 с использованием скрипта Python.Cutadapt использовался для обрезки низкокачественных поли-A / T и последовательностей адаптеров (-aAGATCGGAAGAGCACACGTCTGAACTCCAGTCAC -a «A {100}» -a «T {100}» — × 2 -q 20 -m 30). Последовательности картировали с использованием tophat2 для построения генома мыши mm10. Информация UMI была интегрирована в файлы BAM в виде тегов с использованием скрипта Python. Файл BAM был преобразован в формат SAM с помощью Samtools. Повторяющиеся чтения были отмечены на основе одного и того же UMI и сопоставления с одним и тем же геном с использованием скрипта Python. Количество считываний на ген рассчитывали с использованием HTSeq-count и файла Refseq gtf (загруженного из igenomes UCSC), который был изменен, чтобы содержать окно, окружающее 3 ’UTR.
DESeq2 использовали для нормализации и обнаружения дифференциально экспрессируемых генов на основе отрицательного биномиального распределения и модели обобщенной линейной регрессии. Используемая модель содержала два фактора: бугристость олекранона или дельтовидной мышцы Sox9 + / Scx + предшественников. Гены считались дифференциально экспрессируемыми, если разница в экспрессии по крайней мере между двумя типами образцов была статистически значимой после корректировки с помощью пакета fdrtool (скорректированное значение p -value≤0.05) (Стриммер, 2008). После фильтрации на основе уровней экспрессии (суммарное нормализованное количество во всех образцах больше 10 и максимальный уровень экспрессии выше 5), кластеризация стандартизованных нормализованных количеств была выполнена с использованием алгоритма щелчка (пакет Expander, (Ulitsky et al., 2010)). Дальнейший анализ проводился с использованием GSEA (Broad Institute) и Ingenuity (IPA).
ВЗНОС АВТОРА
S.E. спроектировал и провел эксперименты, проанализировал данные и написал рукопись; С.Ку. провели эксперименты FACS; S.R. провели эксперименты со световым листом; С.Кр совместно проводил эксперименты; К.М.П. и D.M.W. предоставили гетерозиготных мышей Hoxa11 и Hoxd11 и выполнили эксперименты по гибридизации Hoxd11 in situ ; E.Z. совместно разработали исследование, руководили проектом, анализировали и интерпретировали данные и написали рукопись.
БЛАГОДАРНОСТИ
Мы благодарим Н. Константина за квалифицированную редакционную помощь и сотрудников лаборатории Зельцера за их советы и предложения.Мы благодарим Р. Швейцера за предоставление мышей ScxGFP и Х. Акияму за предоставление мышей Sox9-CreER T2 . Мы благодарим Д. Лешковица, Т. Salame, Y. addadi и O. Golani из Отделения естественных наук Института Вейцмана за их руководство и помощь в проведении и анализе экспериментов и интерпретации данных. Визуализация светового листа стала возможной благодаря обсерватории клеток Де Пиччиотто-Меньшего, посвященной памяти Вольфа и Рут Лессер из MICC.Мы благодарим C. Vega из отдела дизайна, фотографии и печати Института Вейцмана за разработку модели.
Это исследование было поддержано грантами Национальных институтов здравоохранения (NIH, # R01 AR055580), Европейского исследовательского совета (ERC, # 310098), Фонда Жанны и Джозефа Ниссим для исследований в области наук о жизни, Института им. Молекулярная медицина, Бет Ром-Раймер, Поместье Дэвида Левинсона, Фонд Джеффа Бернарда и Одри, Фонд исследования рака Жоржа Люстгартена, Семейный центр Дэвида и Фелы Шапелл по генетическим заболеваниям, Фонд семьи Дэвида и Фелы Шапелл для доклинических исследований , и Поместье Бернарда Бишина для программы WIS-Клалит.
ССЫЛКИ
- ↵
Арчер, М., Бек, Р., Готт, М., Хэнд, С., Годтелп, Х. и Блэк, К. (2011). Первый ископаемый сумчатый крот в Австралии (Notoryctemorphia) разрешает споры об их эволюции и палеоэкологическом происхождении. Труды Королевского общества B: биологические науки 278, 1498–1506.
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- 17 955
- 917 955 955 1760 917 917 955 955
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
Milne, N.и О’Хиггинс, П. (2012). Масштабирование формы и функции ксенартрановой бедренной кости: 100-кратное увеличение массы тела смягчается перемещением третьего вертела. Труды Королевского общества B: биологические науки 279, 3449–3456.
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
Швельц, Э. Нерадиоактивная гибридизация in situ на срезах скелетной ткани.В «Развитие и восстановление скелета», стр. 203–215. Springer.
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
Сюй Б. и Веллик Д. М. (2011). Осевая активность Hox9 устанавливает заднее поле в развивающейся передней конечности. Труды Национальной академии наук 108, 4888–4891.
- ↵
- ↵
- ↵
955
Метаболизм глюкозы, индуцированный передачей сигналов Bmp, необходим для развития скелета мышей
Динамическая экспрессия Glut1 в развивающемся хряще
В качестве первого шага для исследования роли эндохондрального метаболизма развитие скелета, мы исследовали паттерн экспрессии классических переносчиков глюкозы семейства Glut.Эксперименты RT-qPCR показали, что уровень мРНК Glut1 был на два-три порядка выше, чем уровень мРНК Glut2 , Glut3 или Glut4 в первичных хондроцитах. Предыдущие работы др. Документально подтвердили, что мРНК Glut1 диффузно экспрессируется по всей мезенхиме конечностей до начала хондрогенеза у эмбриона мыши, но позже активируется в зачатках хряща 26 . Поэтому мы сосредоточились на характеристике экспрессии белка Glut1 с помощью иммунофлуоресцентного окрашивания.На E12.5, когда скелетные элементы начали формироваться в конечностях эмбрионов мыши, Glut1 был заметно обогащен зачатком хряща над окружающими тканями (Fig. 1a, верх). На ст. E14.5 уровень Glut1 был повышен в середине хрящевого шаблона, что совпало с началом гипертрофии хондроцитов (рис. 1b, вверху). К ст. E16.5 и E18.5, когда хрящ пластинки роста был организован в дискретные домены, Glut1 был наиболее сильно экспрессирован в предгипертрофической и ранней гипертрофической областях с очевидным подавлением в поздних гипертрофических хондроцитах (рис.1в, г, верх). Сильный сигнал Glut1 также был обнаружен в хондро-костном соединении (первичная губка) непосредственно под гипертрофической зоной (рис. 1c, d, двуглавая стрелка). Совместное окрашивание с маркером эндотелия эндомуцином показало, что кровеносные сосуды в хондро-костном соединении экспрессировали высокие уровни Glut1 (рис. 1e). На 8-й постнатальный день (P8) сильная экспрессия Glut1 сохранялась в ранней гипертрофической области и в первичных спонгиозах (Fig. 1f, upper). Кроме того, уровень Glut1 был повышен в предполагаемом центре вторичной оссификации, где хондроциты подвергались гипертрофии (рис.1е, звездочка). На всех исследованных стадиях экспрессия Glut1 в надхрящнице или костном воротнике была менее выраженной, чем в прегипертрофическом и раннем гипертрофическом хряще. В целом, уровень Glut1 в хондроцитах значительно увеличивается на ранних этапах гипертрофии.
Рис. 1
Генетическая делеция с помощью Prx1-Cre устраняет Glut1 в длинных костях мыши. a Иммунофлуоресцентное окрашивание на Glut1 на продольных срезах передних конечностей контроля E12.5 (Ctrl) или мутантных однопометников (Prx1-CKO).Звездочкой обозначены хрящевые элементы. Обратите внимание на сравнимую экспрессию в сосудистой сети контрольных и мутантных эмбрионов. b — f Иммуноокрашивание Glut1 на продольных срезах бедренной кости контрольных или мутантных эмбрионов из одного помета на E14.5 ( b ), E16.5 ( c ), E18.5 ( d , e ) и P8 ( f ). Области, выделенные рамкой, показаны справа при большем увеличении. Иммуноокрашивание эндомуцина в зеленый цвет отмечает эндотелиальные клетки ( e ).Двойные стрелки обозначают область губчатой кости ( c , d , f ). Масштабная линейка: 100 мкм ( a — e ) или 200 мкм ( f ). Каждое изображение представляет трех животных
Зависимость роста скелета от Glut1
Чтобы изучить потенциальную потребность Glut1 в развитии скелета конечностей, мы использовали Prx1-Cre для удаления Glut1 во всей мезенхиме конечностей, включая предшественников хондроцитов и остеобласты. Помимо конечностей, Prx1-Cre также нацелен на предшественников свода черепа или грудины.Иммуноокрашивание подтвердило, что белок Glut1 по существу элиминировался из хряща конечностей (но не из сосудистой сети конечностей) Prx1-Cre; Glut1 f / f эмбрионов (здесь обозначенных как Prx1-CKO ) на E12.5 (рис. 1a, ниже). Исследование более поздних стадий (E14.5, E16.5, E18.5, P8) подтвердило полное отсутствие Glut1 в скелетных элементах конечностей, тогда как экспрессия в эндотелиальных клетках (не нацеленных на Prx1-Cre) осталась неизменной (рис. 1б – г, е, внизу). Мутантные мыши развились до срока и выжили постнатально, но при рождении демонстрировали очевидное укорочение конечностей.Окрашивание скелета целиком на E18.5 подтвердило, что все элементы скелета конечностей были заметно короче у Prx1-CKO эмбрионов, чем обычно (Fig. 2a-c). Кости черепа оказались нормальными, но грудина у мутанта была недостаточно минерализованной (рис. 2d, e). Фенотип коротких конечностей был очевиден уже на ст. E16.5, когда лопатка и плечевая кость также демонстрировали гипоминерализацию, но и свод черепа, и стерна казались нормальными на этой стадии (Fig. 2f-j). На ст. E14.5 скелетные элементы конечностей имели нормальную длину, но были недостаточно минерализованы (рис.2к – м). Количественная оценка подтвердила, что бедренная и плечевая кость по существу перестала расти после E14.5 у мутанта (рис. 2n, o). Примечательно, что на E12.5 зачаток хряща в мутантном эмбрионе был в основном нормальным по форме и размеру, несмотря на эффективное удаление белка Glut1 с помощью Prx1-Cre на этой стадии, как показано ранее (Fig. 2p-r). Т.о., Glut1 в мезенхиме конечностей, по-видимому, незаменим для начального хондрогенеза, но важен для более позднего роста скелета у эмбрионов мышей.
Фиг.2
Удаление Glut1 с помощью Prx1-Cre приводит к серьезному укорочению конечности. a — m , p — r Полное окрашивание скелета нормальных (Ctrl) или мутантных (Prx1-CKO) эмбрионов из однопометников на E18.5 ( a — e ), E16. 5 ( f — j ), E14.5 ( k — m ) и E12.5 ( p — r ). Красные стрелки обозначают гипоминерализацию мутантной грудины по сравнению с контролем на E18.5. n , o Измерения длины бедренной кости ( n ) и плечевой кости ( o ) на указанных стадиях эмбриона.* p <0,05, n = 3, полоса ошибок указывает SD, двусторонний дисперсионный анализ и пост-тест Бонферрони. Каждое изображение представляет трех мышей
Роль Glut1 в пролиферации и гипертрофии хондроцитов
Затем мы оценили клеточные дефекты в длинных костях мутантных мышей Glut1 . Несмотря на относительно нормальную длину скелета на ст. E14.5, окрашивание срезов бедренной кости H&E показало небольшое, но последовательное уменьшение возникающей гипертрофической зоны (дополнительный рисунок 1A).К E16.5 мутантная секция лишена каких-либо распознаваемых гипертрофических хондроцитов или костного мозга, а презумптивная область костного мозга была занята костной тканью, которая, по-видимому, врастает в костный воротник (Fig. 3a). Кроме того, в мутантном хряще полностью отсутствовала типичная столбчатая организация хондроцитов. Такие же гистологические аномалии наблюдались на ст. E18.5 (дополнительный рисунок 1B). Точно так же столбчатые или гипертрофические хондроциты нормальной морфологии не наблюдались у мутантных мышей на P8 (рис.3б, синяя рамка). Более того, тогда как в норме на P8 вторичная гипертрофическая зона формируется внутри эпифиза, являясь прообразом вторичного центра окостенения, такая гипертрофия не происходит в мутантном хряще (Fig. 3b, red box). В результате у мутантных мышей на P16 не развивался вторичный центр окостенения (Fig. 3c). Чтобы подтвердить очевидный дефект гипертрофии хондроцитов, мы провели иммунофлуоресцентное окрашивание на коллаген X (ColX), маркер гипертрофических хондроцитов. Результаты показали, что уровень ColX-положительного домена значительно снизился на ст. E14.5 и практически отсутствует на E16.6, E18.5 и P8 у мутанта (рис. 3d). На P8 ColX обычно также был очевиден во вторичной зоне гипертрофии, но не обнаруживался в эквивалентной области у мутантного животного. MMP13, экспрессируемый как концевыми гипертрофическими хондроцитами, так и остеобластами, отсутствовал в хряще мышей Prx1-CKO либо на E16.5, либо на E18.5, хотя он был обнаружен в остеобластах на E18.5 (рис. 3e). . Следовательно, и гистологический анализ, и анализ молекулярных маркеров демонстрируют, что Glut1 необходим для правильной гипертрофии хондроцитов.
Рис. 3
Glut1 незаменим для правильного созревания хондроцитов. a — e Гистология бедренной кости на E16.5 ( a ), p8 ( b ) и p16 ( c ). Области, выделенные рамкой, показаны ниже при большем увеличении. d , e Иммунофлуоресцентное окрашивание ColX ( d ) или Mmp13 ( e ). Масштабная линейка: 200 мкм. Каждое изображение представляет трех мышей
Затем мы исследовали потенциальный эффект делеции Glut1 на пролиферацию хондроцитов.Чтобы отличить формирующиеся хондроциты от окружающей мезенхимы на E12.5, мы выполнили иммуноокрашивание на Sox9 и подтвердили, что хондрогенез был по существу нормальным на молекулярном уровне, хотя Glut1 практически не обнаруживался в зачатке хряща (дополнительный рисунок 2A). Более того, эксперименты по маркировке EdU показали, что делеция Glut1 не ухудшает скорость пролиферации клеток Sox9 + на этой стадии (дополнительная фигура 2B, C). Однако делеция Glut1 вызвала заметное снижение мечения EdU во всей пролиферативной зоне бедренной кости на E14.5, E16.5 и E18.5 (рис. 4a, дополнительный рисунок 2D, E). Количественная оценка в столбчатой области подтвердила, что процент хондроцитов EdU + был снижен на ~ 50% на E14.5 и ~ 80% на E16.5 или E18.5 в отсутствие Glut1 (рис. 4b). С другой стороны, тесты TUNEL не выявили очевидного апоптоза в хряще при делеции Glut1 на любой из стадий (фиг. 4c, дополнительный рисунок 2D, E). Фактически, по неизвестным в настоящее время причинам, апоптоз, обычно обнаруживаемый на границе хряща и диафизарной надхрящницы, оказался подавленным у мутантного эмбриона (рис.4c, дополнительный рисунок 2D, E). Таким образом, Glut1 имеет решающее значение для правильной пролиферации хондроцитов ростовой пластинки, но незаменим для их выживания.
Рис. 4
Glut1 необходим для пролиферации хондроцитов и продукции матрикса. a Репрезентативные изображения маркировки EdU (красный) в бедренной кости на E16.5. Область между пунктирными линиями используется для количественной оценки индекса маркировки. b Количественное определение EdU. * p <0,05, n = 3 мыши, полоса ошибок указывает SD, двусторонний тест Стьюдента t .Шкала шкалы: 250 мкм. c , d Репрезентативные изображения окрашивания TUNEL ( c ) или сафранином O ( d ). e Экспрессия гена, определенная методом RT-qPCR в хряще. * p <0,05, n = 3 мыши, полоса ошибок указывает SD, двусторонний тест Стьюдента t . Шкала шкалы: 250 мкм. Изображения представляют трех мышей
Поскольку основная функция хондроцитов заключается в производстве белков внеклеточного матрикса, мы затем спросили, требуется ли Glut1 для этого процесса.Окрашивание сафранином O постоянно обнаруживало более низкую интенсивность Glut1-дефицитного хряща на всех исследованных стадиях, что свидетельствует об общем снижении уровней протеогликана (фиг. 4d, дополнительный рисунок 3). Количественная оценка мРНК в хряще пластинки роста с помощью ОТ-ПЦР показала, что делеция Glut1 заметно снижает экспрессию Col2a1 и протеогликановых генов аггрекана ( Acan ), люмикана ( Lum ). эпификан ( Epyc ) (рис.4д). Следовательно, Glut1 имеет решающее значение для поддержки экспрессии генов хрящевого матрикса хондроцитами.
Поскольку предыдущие исследования показали участие Glut1 в дифференцировке остеобластов, мы исследовали формирование кости у Prx1-CKO эмбрионов 26 . Иммунофлуоресцентное окрашивание Sp7 выявляет преостеобласты и остеобласты как в надхрящнице / надкостнице, так и в первичном центре окостенения эмбрионов дикого типа на ст. E16.5 (рис. 5a, слева). У однопометника Prx1-CKO , хотя полость костного мозга отсутствовала, преостеобласты и остеобласты были в большом количестве в надхрящнице / надкостнице и начали вторгаться в центр матрицы хряща (рис.5а, справа). Иммуноокрашивание эндомуцина показало, что кровеносные сосуды были в большом количестве в утолщенной костной шейке, но только начинали вторгаться в собственно хрящ (рис. 5b). Окрашивание коллагена I типа пикросириусом красным подтвердило, что остеобласты активно продуцируют костный матрикс у мутантных мышей (рис. 5c). Однако окрашивание по фон Косса показало, что минерализация костного матрикса не определялась в бедренной кости двух из трех эмбрионов Prx1-CKO , проанализированных на ст. E16.5 (рис.5г). С другой стороны, минерализация кости легко обнаруживалась E18.5 у мутанта, что указывает только на умеренную задержку минерализации кости, вызванную делецией Glut1 . Следовательно, Glut1 незаменим для дифференцировки остеобластов, но, по-видимому, играет роль в поддержании нормальной минерализующей активности остеобластов.
Рис. 5
Потеря Glut1 препятствует минерализации костного матрикса на E16.5. a , b Иммунофлуоресцентное окрашивание Sp7 ( a ) или эндомуцина ( b ) на продольных срезах бедренной кости. c Окрашивание пикросириусом красным на коллаген I. d Окрашивание по фон Коссу на минералы. Масштабная линейка: 200 мкм. Каждое изображение представляет трех мышей
Использование Prx1-Cre не отличает прямую потребность в Glut1 в хондроцитах от потенциальных косвенных эффектов со стороны других типов мезенхимальных клеток конечности. Чтобы преодолеть это ограничение, мы удалили Glut1 с Col2-Cre , которые нацелены как на хондроциты, так и на остеобласты, но не на другие мезенхимные клетки конечностей.Подобно мутантам Prx1-CKO , Col2-Cre; Мыши Glut1 f / f ( Col2-CKO ) демонстрировали сильное укорочение скелетных элементов конечностей в сочетании с отсутствием очевидных столбчатых или гипертрофических хондроцитов на E18.5 (фиг. 6a). Иммуноокрашивание подтвердило, что Glut1 не обнаруживается в хряще эмбрионов Col2-CKO (фиг. 6b). Как маркер пангипертрофии ColX, так и маркер конечной гипертрофии Mmp13 отсутствовали в мутантном хряще (рис.6в, г). Более того, пролиферация хондроцитов, согласно оценке с помощью мечения EdU, была снижена на ~ 80% у эмбриона Col2-CKO (рис. 6e). Таким образом, эти результаты подтверждают мнение, что Glut1 непосредственно необходим хондроцитам для их правильной пролиферации и гипертрофии.
Рис. 6
Делеция Glut1 с помощью Col2-Cre нарушает пролиферацию и созревание хондроцитов. a H&E окрашивание продольных срезов бедренной кости в норме (Ctrl) по сравнению с Col2-Cre; Glut1 f / f (Col2-CKO) однопометные эмбрионы на E18.5. b — d Иммунофлуоресцентное окрашивание Glut1 ( b ), ColX ( c ) или Mmp13 ( d ) на бедренных срезах E18.5. e EdU-мечение хондроцитов бедренной кости на E18.5. Сигнал красный. * p <0,05, n = 3 мыши, полоса ошибок указывает SD, двусторонний тест Стьюдента t . Масштабная линейка: 200 мкм
Индукция Glut1 с помощью передачи сигналов Bmp2-mTORC1-Hif1a
Поскольку известно, что передача сигналов Bmp способствует пролиферации и гипертрофии хондроцитов, мы затем проверили гипотезу о том, что передача сигналов Bmp и Glut1 могут быть связаны в регуляции.В соответствии с предыдущими открытиями мы обнаружили, что делеция Bmpr1a с Col2-Cre приводит к более коротким скелетным элементам, связанным с дезорганизацией столбчатой области и уменьшенной гипертрофической зоной (Рис. 7a) 19 . Хотя общий фенотип укорочения конечностей здесь был менее серьезным, дефект созревания хондроцитов был качественно подобен дефекту, вызванному делецией Glut1 . Важно отметить, что иммунофлуоресцентное окрашивание показало, что уровни Glut1 были заметно снижены в столбчатых и гипертрофических хондроцитах Col2-Cre; Bmpr1a f / f эмбрионов (рис.7б). Кроме того, Hif1a, известный активатор транскрипции для Glut1 , также заметно уменьшался в столбчатом и гипертрофическом хряще в отсутствие Bmpr1a (Fig. 7c). Таким образом, передача сигналов Bmp, по-видимому, действует выше Glut1 в развивающемся хряще пластинки роста.
Рис. 7
Делеция Bmpr1a с помощью Col2-Cre нарушает созревание хондроцитов и снижает экспрессию Glut1. a Репрезентативное окрашивание бедренной кости H&E в норме (Ctrl) по сравнению с Col2-Cre; Bmpr1a f / f однопометных эмбрионов на E18.5. Области в рамке, показанные ниже при большом увеличении. b , c Иммунофлуоресцентное окрашивание Glut1 ( b ) или Hif1a ( c ) в бедренной кости на E18.5. Три пары однопометников были проанализированы с аналогичными результатами. Масштабная линейка: 200 мкм. Каждое изображение представляет трех мышей
Затем мы исследовали возможность того, что передача сигналов Bmp может напрямую модулировать экспрессию Glut1. Обработка первичных хондроцитов рекомбинантным BMP2 увеличивала уровень белка Glut1 примерно в два раза через 24 часа, тогда как рекомбинантный Igf1 или агонист Hh пурморфамин, оба, также известные как регулирующие развитие хондроцитов, не влияли на уровни Glut1 (рис.8а). Эффект BMP2 зависел от времени, так как 6 часов лечения не увеличивали уровни белка Glut1 (дополнительный рисунок 4). Анализ мРНК с помощью RT-qPCR подтвердил, что Glut1 была преобладающей изоформой над Glut2, , 3 и 4 в хондроцитах, и что BMP2 специфически индуцировал мРНК Glut1 более чем в два раза через 24 часа (рис. 8б). В соответствии с индукцией Glut1, BMP2 стимулировал потребление глюкозы хондроцитами через 48 часов (рис.8c). Таким образом, передача сигналов Bmp индуцирует экспрессию Glut1 и способствует метаболизму глюкозы в первичных хондроцитах.
Рис. 8
BMP2 индуцирует экспрессию Glut1 через Smad4 и mTORC1. a Вестерн-блот анализ первичных хондроцитов после 24 часов лечения, как указано. b Анализ RT-qPCR в первичных хондроцитах с обработкой BMP2 или без нее в течение 24 часов. * p <0,05, n = 3, полоса ошибок указывает SD, двусторонний тест Стьюдента t-. c Потребление глюкозы первичными хондроцитами с обработкой BMP2 или без нее в течение 48 часов. Данные нормализованы к геномной ДНК. * p <0,05, n = 3, полоса ошибок указывает SD, двусторонний тест Стьюдента t -тест. d , e Эффекты нокдауна Smad4 на индукцию Glut1 с помощью BMP2, проанализированные с помощью вестерн-блоттинга ( d ) или RT-qPCR ( e ). shLuc использовали в качестве отрицательного контроля. Использовали две разные кшРНК Smad4. * p <0,05, n = 3, полоса ошибок указывает SD, двусторонний тест Стьюдента t -тест. f Вестерн-блоттинг анализ нокдауна Smad4 на BMP2-индуцированную активацию mTORC1. г анализов RT-qPCR мРНК Pten. * p <0,05, n = 3, полоса ошибок указывает SD, двусторонний тест Стьюдента t -тест. Количественная оценка всех вестерн-блотов означает среднее кратное изменение по сравнению с контролем носителя после нормализации до β-актина ( a , d ) или общего S6 ( f ) (± SD, n = 3)
. молекулярный механизм, ответственный за индукцию Glut1, мы исследовали роль передачи сигналов Smad ниже Bmp.Нокдаун Smad4 двумя разными shРНК заметно снижал индукцию белка Glut1 и мРНК BMP2 (рис. 8d, e). Хотя результат сам по себе предполагает, что факторы транскрипции Smad могут напрямую активировать транскрипцию гена Glut1 в ответ на Bmp, предыдущее исследование ChIP-seq не смогло обнаружить связывание Smad4 в промоторной области (от -5kb до + 5b вокруг сайта начала транскрипции) гена Glut1 в эмбриональном хряще 27 . Поэтому мы исследовали потенциальную роль передачи сигналов mTORC1 из-за его известной значимости для клеточного метаболизма и его участия в передаче сигналов Bmp 28 .Через 24 часа обработки BMP2 индуцировал фосфорилированную фракцию S6 (P-S6, считывание активности mTORC1) по сравнению с общими уровнями S6, но индукция уменьшалась после нокдауна Smad4 (фиг. 8f). Поскольку предыдущие исследования показали, что Smad4 снижает мРНК Pten , которая кодирует негативный регулятор активности mTORC1, мы исследовали супрессию Pten как потенциальный механизм активации mTORC1 29,30 для Bmp. Действительно, BMP2 снижал мРНК Pten в хондроцитах, и подавление отменялось при нокдауне Smad4 (рис.8г). В подтверждение функциональной важности mTORC1, ингибирование передачи сигналов mTORC1 с помощью рапамицина или Torin1 отменяет индукцию Glut1 с помощью BMP2, а также снижает базальный уровень Glut1 (фиг. 9a). Точно так же индукция мРНК Glut1 была либо полностью отменена, либо заметно подавлена ингибиторами mTOR (фиг. 9b). Следовательно, передача сигналов Bmp стимулирует экспрессию Glut1, вероятно, ниже активации Smad4 и mTORC1.
Рис. 9
Hif1α опосредует индукцию Glut1 ниже передачи сигналов Bmp-mTORC1. a — c Вестерн-блоттинг ( a , c ) или RT-qPCR ( b ) анализы в первичных хондроцитах после 24 часов обработки BMP2 с ингибиторами mTOR или без них. Рапа: рапамицин. d Вестерн-блот анализ первичных хондроцитов в ответ на BMP2 с ингибиторами Hif1α или без них в течение 24 часов. Количественная оценка всех вестерн-блоттингов означает среднее кратное изменение по сравнению с контролем с носителем после нормализации до β-актина (± стандартное отклонение, n = 3). * p <0.05, n = 3, полоса ошибок указывает SD, двусторонний тест Стьюдента t-
Далее мы исследовали механизм ниже по течению от mTORC1, ведущий к индукции Glut1. Как показано ранее, Hif1a уменьшался одновременно с Glut1 в хряще Col2-Cre; Bmpr1a c / c эмбрионов (рис. 7б, в). Поскольку в предыдущем исследовании сообщалось, что mTORC1 усиливает трансляцию Hif1a, мы протестировали Hif1a как потенциальный медиатор передачи сигналов Bmp при активации экспрессии Glut1 31 .BMP2 последовательно индуцировал белок Hif1a в первичных хондроцитах через 24 часа, но индукция отменялась рапамицином или Torin1 (рис. 9c). Более того, химическое ингибирование Hif1a с помощью PX-478 или акрифлавина дозозависимо устраняет индукцию Glut1 с помощью BMP2 (фиг. 9d). В совокупности результаты демонстрируют, что передача сигналов Bmp активирует Glut1 посредством активации mTORC1 и Hif1a в хондроцитах.
Клетки, полученные из конечностей, как парадигма для инженерии самособирающихся скелетных тканей, Журнал тканевой инженерии и регенеративной медицины
Аннотация
Имитация событий развития была предложена в качестве стратегии создания тканевых конструкций для регенеративной медицины.Однако этот подход еще не исследован для скелетных тканей. Здесь показано, что эктопическая имплантация эмбрионального зачатка длинных костей мыши на 14,5-е сутки, диссоциированного на отдельные клетки и случайного включения в биоинженерную конструкцию, дает начало эпифизарным пластинчатым структурам, костям и костному мозгу, которые имеют много общих морфологических и молекулярных структур. сходство с эпифизарными единицами, которые формируются после трансплантации интактного зачатка длинных костей, демонстрируя существенную надежность и автономность сложной самосборки ткани и общего процесса органогенеза. Исследования in vitro подтверждают способность клеток зачатка к самоагрегации и формированию паттерна и демонстрируют, что модель может использоваться для оценки влияния больших и малых молекул на биологическое поведение. Эти результаты показывают сохранение способности клеток зачатка к самоорганизации и формированию собственного паттерна даже тогда, когда они отсоединены от их ниши развития и подвергаются системным возмущениям, таким как клеточная диссоциация. Эти неотъемлемые свойства делают клетки зачатка длинных костей привлекательными в качестве модельной системы для технологий тканевой инженерии, направленных на создание конструкций, которые обладают потенциалом самосборки и самоконфигурации сложных архитектурных структур.
中文 翻译 :
肢体 衍生 细胞 是 工程 化 自 组装 骨骼 组织 的 范例
摘要
的 组织 构建 体 的 策略。 针对 组织 方法 在 了 异位 第 第 14.5 天 的 小的 胚胎 长 胶原 蛋白 , 成 单个 细胞 细胞 随机 体 中 , 会 рост 生长 板状 骨髓 , 子 结构骨 损伤 后 形成 的 骨 phy 单位 相似 , 复杂 组织 自 组装 和 整个 着 的 鲁棒 性 和 自治 外.该 模型 可 用于 评估 大分子 和 小 分子 对 生物 行为 的 影响。 这些 结果 表明 破损 细胞 的 其 发育 环境 并 受到 类能力。 这些 固有 特征 使 长 骨痛 细胞 成为 组织 工程 技术 的 模型 系统 的 吸引力 , 该 模型 系统 旨在 创建 的 组装 和 模式 建筑 潜力
% PDF-1.3
%
202 0 объект
>
эндобдж
xref
202 113
0000000016 00000 н.
0000002612 00000 н.
0000002787 00000 н.
0000002818 00000 н.
0000003609 00000 п.
0000003944 00000 н.
0000004011 00000 н.
0000004250 00000 н.
0000004358 00000 п.
0000004464 00000 н.
0000004591 00000 н.
0000004753 00000 н.
0000004911 00000 н.
0000005053 00000 н.
0000005189 00000 н.
0000005363 00000 п.
0000005523 00000 н.
0000005694 00000 п.
0000005835 00000 н.
0000005973 00000 п.
0000006157 00000 н.
0000006343 00000 п.
0000006508 00000 н.
0000006664 00000 н.
0000006858 00000 н.
0000006982 00000 н.
0000007098 00000 н.
0000007238 00000 п.
0000007379 00000 н.
0000007529 00000 н.
0000007657 00000 н.
0000007795 00000 н.
0000007920 00000 н.
0000008100 00000 н.
0000008229 00000 н.
0000008357 00000 н.
0000008453 00000 п.
0000008547 00000 н.
0000008643 00000 п.
0000008739 00000 н.
0000008835 00000 н.
0000008931 00000 н.
0000009027 00000 н.
0000009123 00000 н.
0000009219 00000 п.
0000009313 00000 п.
0000009406 00000 п.
0000009500 00000 н.
0000009594 00000 н.
0000009689 00000 н.
0000009784 00000 н.
0000009879 00000 п.
0000009975 00000 н.
0000010069 00000 п.
0000010164 00000 п.
0000010258 00000 п.
0000010353 00000 п.
0000010447 00000 п.
0000010542 00000 п.
0000010636 00000 п.
0000010731 00000 п.
0000010825 00000 п.
0000010920 00000 п.
0000011014 00000 п.
0000011109 00000 п.
0000011205 00000 п.
0000011300 00000 п.
0000011396 00000 п.
0000011491 00000 п.
0000011588 00000 п.
0000011685 00000 п.
0000011781 00000 п.
0000011876 00000 п.
0000011972 00000 п.
0000012068 00000 н.
0000012165 00000 п.
0000012410 00000 п.
0000012852 00000 п.
0000013533 00000 п.
0000014212 00000 п.
0000014504 00000 п.
0000014704 00000 п.
0000015291 00000 п.
0000015992 00000 п.
0000016014 00000 п.
0000016920 00000 н.
0000016942 00000 п.
0000017834 00000 п.
0000017856 00000 п.
0000018671 00000 п.
0000018866 00000 п.
0000019086 00000 п.
0000019108 00000 п.
0000020044 00000 п.
0000020066 00000 п.
0000020979 00000 п.
0000021001 00000 п.
0000021817 00000 п.
0000021858 00000 п.
0000021880 00000 п.
0000022806 00000 п.
0000022828 00000 п.
0000023379 00000 п.
0000023458 00000 п.
0000023901 00000 п.
0000027330 00000 н.
0000036053 00000 п.
0000038728 00000 п.
0000049071 00000 п.
0000060449 00000 п.
0000061792 00000 п.
0000002877 00000 н.
0000003587 00000 н.
трейлер
]
>>
startxref
0
%% EOF
203 0 объект
>
эндобдж
204 0 объект
[
205 0 руб.
]
эндобдж
205 0 объект
>
/ Ж 237 0 Р
>>
эндобдж
313 0 объект
>
транслировать
Hb«f`e`g` ̀
Отсутствие срединных плюсневых костей соответствует дисгенезу подошвенной артериальной дуги
Недостатки срединных плюсневых лучей, которые встречаются примерно в половине врожденных коротких конечностей с малоберцовой недостаточностью, являются наиболее дистальными и убедительными проявлениями жидкий спектр врожденных сокращений длинных костей нижних конечностей человека; этот спектр синдромально влияет на триаду длинных костей проксимального отдела бедренной кости, малоберцовой кости и средней линии плюсневых костей.Костные дефекты соответствуют участкам быстрого перехода эмбриональной артерии. Длинные кости сначала начинают окостеневать из-за сосудистых инвазий их соответствующих мезенхимальных / хрящевых зачатков, протекающих в проксимально-дистальной последовательности вдоль формирующейся эмбриональной конечности. Одноосная артерия первоначально формируется в эмбриональной нижней конечности посредством васкулогенеза. Дополнительные артерии развиваются в виде перекрывающихся переходных волн вблизи различных зачатков в течение шестой и седьмой недель после оплодотворения.К восьмой неделе выявляется иросшая структура сосудов. Артериальные изменения в виде оставшихся примитивных эмбриональных сосудов и / или уменьшенных отсутствующих взрослых сосудов наблюдались клинически в вышеупомянутых местах, где происходит редукция скелета. Сохранение примитивных сосудов в сочетании с триадой сокращений длинных костей позволяет эвристически оценить время, место и природу таких сочетанных дисгенезий сосудов и костей. Постулируется, что артериальный дисгенез произошел, когда развивающиеся артериальные и скелетные структуры одновременно были уязвимы для тератогенных воздействий из-за нестабильности эмбриональной артерии, фактора риска во время артериального перехода.Здесь выдвинута гипотеза, что дефектные артериальные переходы подвергают предварительно заданные модели хряща длинных костей быстрорастущей конечности риску тератогенеза в одном или нескольких наиболее быстро растущих на тот момент участках. Дефицит срединной плюсневой кости является краеугольным камнем этой концепции развития ошибки развития конечности, которая возникает в результате неудачного завершения медиальной части подошвенной дуги. Следовательно, историческая номенклатура врожденных дефектов длинных костей выиграет от модификации нынешней зависимости от эмпирической физической таксономии до основы развития.
% PDF-1.4
%
595 0 объект
>
эндобдж
xref
595 164
0000000016 00000 н.
0000003632 00000 н.
0000003733 00000 н.
0000004368 00000 н.
0000006463 00000 н.
0000007737 00000 н.
0000007909 00000 н.
0000008070 00000 н.
0000009341 00000 п.
0000009373 00000 п.
0000009531 00000 н.
0000009690 00000 н.
0000009713 00000 н.
0000011630 00000 п.
0000011653 00000 п.
0000013304 00000 п.
0000013482 00000 п.
0000014756 00000 п.
0000014779 00000 п.
0000016597 00000 п.
0000016620 00000 п.
0000018321 00000 п.
0000018344 00000 п.
0000020133 00000 п.
0000020156 00000 п.
0000021785 00000 п.
0000021955 00000 п.
0000023229 00000 н.
0000023385 00000 п.
0000024656 00000 п.
0000024679 00000 п.
0000026550 00000 п.
0000026573 00000 п.
0000028134 00000 п.
0000029331 00000 п.
0000029354 00000 п.
0000029377 00000 п.
0000029400 00000 н.
0000035976 00000 п.
0000037195 00000 п.
0000037218 00000 п.
0000037453 00000 п.
0000037689 00000 п.
0000046430 00000 н.
0000046453 00000 п.
0000046476 00000 п.
0000046499 00000 н.
0000046522 00000 п.
0000050718 00000 п.
0000050741 00000 п.
0000051932 00000 п.
0000052152 00000 п.
0000053361 00000 п.
0000054565 00000 п.
0000054791 00000 п.
0000059848 00000 н.
0000060090 00000 н.
0000067552 00000 п.
0000067575 00000 п.
0000067636 00000 п.
0000067697 00000 п.
0000067758 00000 п.
0000067819 00000 п.
0000067880 00000 п.
0000067941 00000 п.
0000068002 00000 п.
0000068063 00000 п.
0000068124 00000 п.
0000068186 00000 п.
0000068248 00000 п.
0000068309 00000 п.
0000068370 00000 п.
0000068432 00000 п.
0000068493 00000 п.
0000068554 00000 п.
0000068615 00000 п.
0000068676 00000 п.
0000068737 00000 п.
0000068798 00000 п.
0000068859 00000 п.
0000068920 00000 н.
0000068981 00000 п.
0000069043 00000 п.
0000069104 00000 п.
0000069165 00000 п.
0000069226 00000 п.
0000069287 00000 п.
0000069348 00000 п.
0000069409 00000 п.
0000069470 00000 п.
0000069531 00000 п.
0000069592 00000 п.
0000069653 00000 п.
0000069714 00000 п.
0000069775 00000 п.
0000069837 00000 п.
0000069898 00000 п.
0000069959 00000 н.
0000070020 00000 н.
0000070081 00000 п.
0000070142 00000 п.
0000070203 00000 п.
0000070264 00000 п.
0000070325 00000 п.
0000070386 00000 п.
0000070448 00000 п.
0000070509 00000 п.
0000070570 00000 п.
0000070631 00000 п.
0000070692 00000 п.
0000070753 00000 п.

 А. Брокгауза и И.А. Ефрона
А. Брокгауза и И.А. Ефрона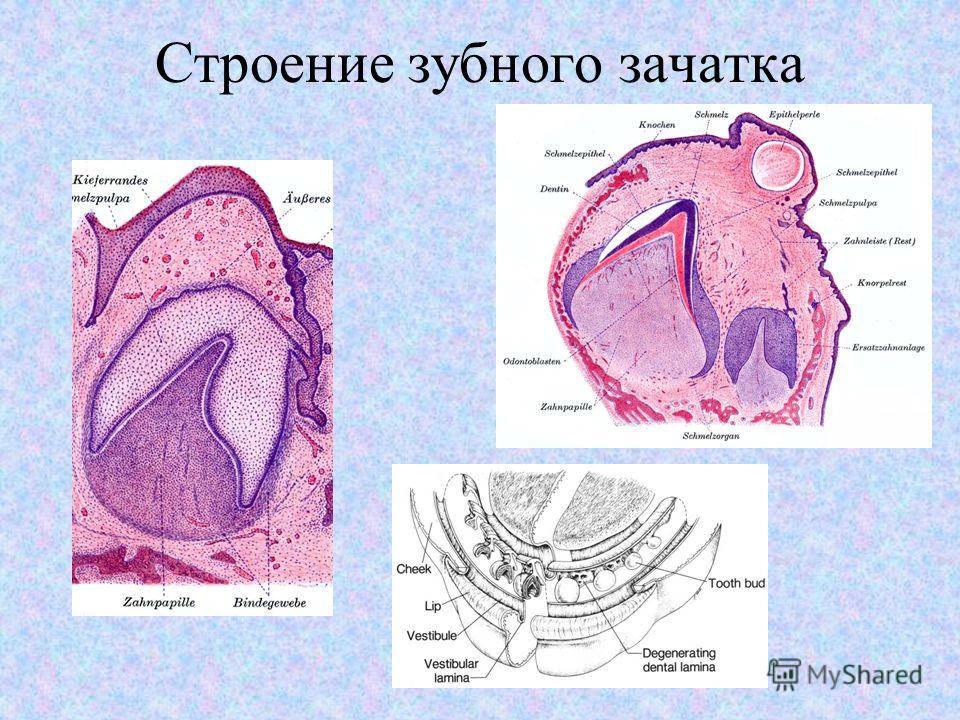
 Эта фаза контролируется фосфатазами (включая щелочную фосфатазу), а также кальцийсвязывающими молекулами (фосфолипидами и белками), которыми богаты матриксные везикулы.
Эта фаза контролируется фосфатазами (включая щелочную фосфатазу), а также кальцийсвязывающими молекулами (фосфолипидами и белками), которыми богаты матриксные везикулы.
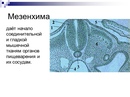
 Вследствие разрушения энхондральной костной ткани образуются еще большие полости и пространства (полости резорбции) и, наконец, возникает костномозговая полость. Из проникшей сюда мезенхимы образуется строма костного мозга, в которой поселяются стволовые клетки крови и соединительной ткани. В это же время по периферии диафиза со стороны надкостницы нарастают все новые и новые перекладины костной ткани, образующейся из надкостницы.
Вследствие разрушения энхондральной костной ткани образуются еще большие полости и пространства (полости резорбции) и, наконец, возникает костномозговая полость. Из проникшей сюда мезенхимы образуется строма костного мозга, в которой поселяются стволовые клетки крови и соединительной ткани. В это же время по периферии диафиза со стороны надкостницы нарастают все новые и новые перекладины костной ткани, образующейся из надкостницы. : остеопсатироз, fragilitas ossium) — наследственная болезнь, обусловленная аномалией остеогенеза, проявляющаяся повышенной ломкостью костей, деформациями скелета на месте заживления переломов, иногда голубым цветом склер и отосклерозом; наследуется по аутосомно-доминантному, реже по аутосомно-рецессивному типу;
: остеопсатироз, fragilitas ossium) — наследственная болезнь, обусловленная аномалией остеогенеза, проявляющаяся повышенной ломкостью костей, деформациями скелета на месте заживления переломов, иногда голубым цветом склер и отосклерозом; наследуется по аутосомно-доминантному, реже по аутосомно-рецессивному типу; Общество. Медицина»
Общество. Медицина»
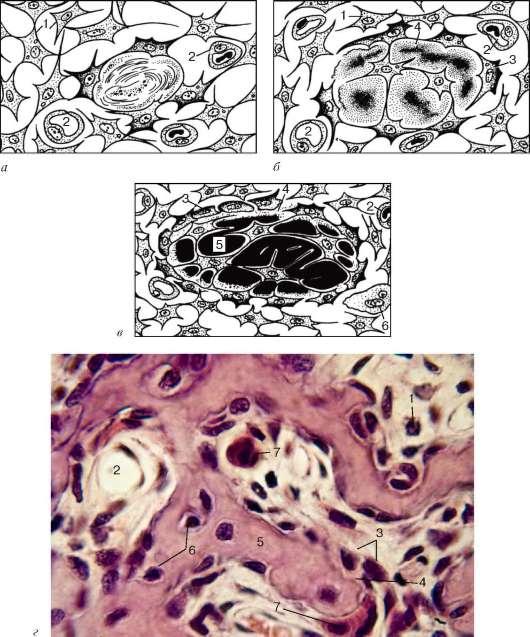 Барановичи)
Барановичи)
 10.2017
10.2017
 м.н. О.О. Руммо
м.н. О.О. Руммо
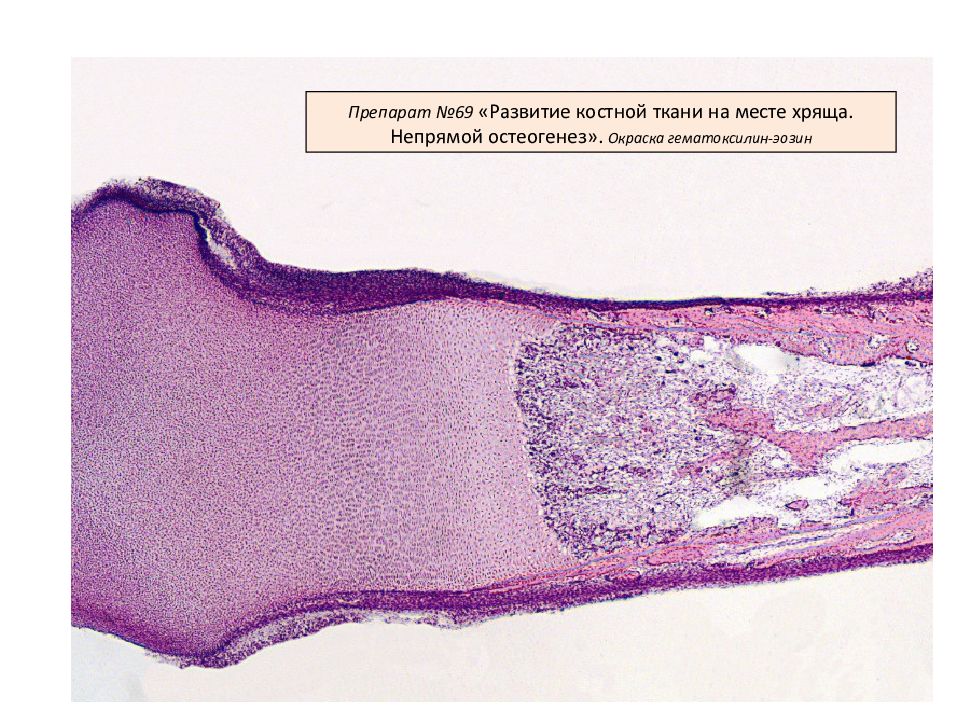 Гродно
Гродно