ГЕМОПОЭЗ ИЛИ КРОВЕТВОРЕНИЕ: КАК ЗАРОЖДАЕТСЯ КРОВЬ В НАШЕМ ОРГАНИЗМЕ?
Кровь – это уникальная жидкая соединительная ткань, в структуре которой выделяют жидкую среду – плазму, красные и белые форменные элементы крови. Ее движение по замкнутой системе осуществляет сердце. Но откуда появляется кровь в организме? Как происходит этот процесс?
Гемопоэз или как зарождается кровь
Кровь не может возникать ниоткуда. Это сложный процесс, который контролируется многими органами и системами и называется гемопоэзом. В ходе этого процесса происходит превращение стволовой в зрелые клетки крови. Когда рождаются эритроциты, этот процесс называется эритропоэом, лейкоциты – лейкпоэзом, тромбоциты – тромбоцитопоэзом и др.
Стволовые гемопоэтические клетки, то есть те, из которых организм может сделать кровь, сосредоточены в красном костном мозге, но их циркуляция может осуществляться в органах, не относящихся к кроветворению.
Содержание клеток в крови у относительно здорового человека стабильно, но при некоторых адаптационных процессах, например, в условиях высокогорья, кровопотери или инфекции, дифференцировка этих клеток ускоряется, что и отображается в анализе крови.
Известно, что ежедневно теряется 2-5 миллиардов клеток, но они замещаются равным количеством новых. Поэтому гемопоэз не прекращается на протяжении всей жизни. Учеными был подсчитан общий вес клеток, которые образуются за всю жизнь (примерно 70 лет): 460 кг эритроцитов, 40 кг тромбоцитов и 275 кг лимфоцитов.
Представление о гемопоэзе основано не теории А.А. Максимова о стволовых клетках. Согласно этой теории, существует одна клетка-прародитель, которая впоследствии может превратиться в любую клетку крови, будь то эритроцит, тромбоцит или лимфоцит. Существует 2 основные линии, схемы кроветворения: лимфоидная, в ходе которой образуются различные виды лимфоцитов, и миелоидная, ведущая к образованию всех остальных клеток крови.
Гемопоэтические стволовые клетки
Стволовые клетки уникальны по своей природе, они могут превращаться не только в клетки крови, но и в клетки других тканей, например, воспроизводить все ткани плода во время внутриутробного развития, уже после рождения строить ткани внутренних органов, крови и т.д.
Для всех стволовых клеток характерен ряд общих свойств:
-
их строение уникально, т.к. отсутствуют структурные компоненты. А вот строение клетки крови значительно отличаются, ее компоненты выполняют определенные функции; -
способны делиться на десятки, сотни и тысячи клеток; -
могут перерождаться и превращаться в зрелые клетки, а их строение соответствует ее типу; -
способны к асимметричному делению: если в этом процессе образуется одна стволовая клетка, то вторая превращается в специализированную; -
могут перемещаться в очаги повреждения и в буквальном смысле латать дыры, так и происходит регенерация тканей, например, кожи при ее повреждениях.
Где получается кровь?
После рождения главным органом гемопоэза является красный костный мозг, который сосредоточен в большинстве костей, например, ребрах, грудине, а также эпифизе трубчатых костей.
Регуляция процесса образования крови происходит в соответствии с потребностями организма. Чтобы запустить процесс дифференцировки стволовых клеток, нужен сигнал, который поступает от цитокинов, гормонов, которые «рассказывают» о составе крови. И именно они тормозят или ускоряют процесс кроветворения.
В этом процессе принимают участие и играют важную роль витамины, макро- и микроэлементы и, конечно, вода.
Витамин В12 и В9 (фолиевая кислота) участвуют в процессе созревания и деления клеток. Железо и медь необходимы для синтеза гемоглобина, а также для созревания эритробластов – предшественников эритроцитов.
Эритропоэз
Или формирование эритроцитов, которое происходит в костном мозге тазовых и других костей, а у малышей – в эпифизе трубчатых костей. Срок жизни эритроцитов 3-4 месяца, а их утилизация (апоптоз) происходит в печени и селезенке.
Прежде чем выходить в кровь, будущие эритроциты проходят через последовательные стадии созревания, соответствующие красному ростку кроветворения.
Стволовая клетка дает клетку-предшественник – унипотентную клетку, которая имеет рецепторы к эритропоэтину – гормону, вырабатываемому почками, он и контролирует созревание красных кровяных клеток.
Колониеобразующая единица эритроцитов дает начало эритробласту, и через несколько стадий развития они дают «потомство» по следующей схеме:
-
эритробласт; -
пронормоцит; -
несколько последовательных форм нооцитов; -
ретикулоцит; -
нооцит – зрелый эритроцит, когда он выходит в кровоток и за непродолжительное время становится полноценным эритроцитом.
Лейкопоэз
Лейкоциты могут образовываться в ходе последовательных клеточных превращений, происходящих в органах кроветворения, он начинается в красном костном мозге.
Различают 5 типов лейкоцитов: гранулоциты – это нейтрофилы, эозинофилы, базофилы, и агранулоциты, к числу которых относят моноциты и лимфоциты. Они и составляют лейкоцитарную формулу.
Из стволовой клетки I класса образуется клетка-предшественник миелопоэза или лимфопоэза. И уже эти клетки через определенное число делений и этапов дифференцировки превращаются в зрелые лейкоциты, причем у каждого вида лейкоцита количество этих стадий неодинаково.
Регуляция процесса кроветворения – сложнейшая и генетически обусловленная система. Любые нарушения в этой системе, будь то нарушения выработки гормонов или же болезни, приводят к нарушению нормального состава крови и развитию тех или иных заболеваний.
Так как циркулирует кровь по всему организму, она, можно сказать, является переносчиком информации и может многое рассказать о состоянии здоровья, главное – уметь интерпретировать полученные результаты, но об этом в других материалах.
Текст: Юлия Лапушкина
Гемопоэз (гемоцитопоэз) — образование клеток крови. Схема процесса
Процесс образования клеток крови, их дифференцировки и созревания, называется гемопоэзом или гемоцитопоэзом; он происходит непрерывно в основном в красном костном мозге некоторых костей, в меньшей степени — в плечевых костях и лимфатических железах. Процесс непрерывный, поскольку все клеточные элементы живут недолго, поэтому необходимо, чтобы они вырабатывались постоянно. Гемопоэз проходит в костном мозге, где находятся проклетки, которые могут развиться в любой тип кровяных клеток: универсальные материнские клетки способны воспроизводить себя делением, из них развиваются возможные материнские клетки, из которых может развиться только определенный вид кровяных телец.
Каждая кровяная клетка проходит долгий этап созревания и на различных этапах называется по-разному, на последнем этапе развития кровяные клетки превращаются в красные кровяные тельца, белые кровяные тельца или тромбоциты.
Каждый день вырабатывается:
• 100000—250 000 млн. красных кровяных телец;
• 30 000 млн. белых кровяных телец;
• 70 000—150 000 млн. тромбоцитов;
Гемоцитопоэз полностью не изучен, существуют различные версии и теории о происхождении кровяных клеток и о клетке-предшественнице гемопоэза.
Рисунок справа является схемой гемопоэза и иллюстрирует одну из наиболее распространенных теорий образования клеток крови. В настоящее время существует твердое убеждение, что все образующиеся элементы крови происходят только из одного вида полипотентных гемопоэтических стволовых клеток (ПГСК), которые, в свою очередь, происходят из первичных ретикулярных клеток (РК). Последние по своему происхождению являются производными мезенхимы на ранних стадиях эмбриогенеза. К несчастью, попытки обнаружить стволовые клетки визуально оказались безуспешными.
В настоящее время стволовые клетки обозначают как колониеобразующие единицы селезенки (KOE-С), потому что их существование как полипотентных элементов было впервые ясно продемонстрировано на основании образования гемопоэтических колоний в селезенках летально облученных мышей. С тех пор они считаются клетками-предшественницами в процессах гранулоцитопоэза, эритроцитопоэза, моноцитопоэза и мегакариоцитопоэза.
КОЕ-С делятся на два вида клеток: один вид образует самообновляющийся пул КОЕ-С, другой — дифференцируется во все остальные элементы крови.
1. Эритроцитопоэз — образование и созревание красных кровяных клеток — эритроцитов. Из КОЕ-С дифференцируются первыми клетки, коммутированные на эритроцитопоэз, — взрывообразующие единицы эритроцитопоэза (ВОЕ-Э), а из них происходят колониеобразующие единицы эритроцитопоэза (КОЕ-Э). Есть только косвенные доказательства существования ВОЕ-Э и КОЕ-Э. Первая распознаваемая клетка эритроидной линии — проэритробласт (Пэб), который делится и дает начало двум генерациям базофильных эритробластов (БЭ), за которыми следуют две генерации полихроматофильных эритробластов (ПЭ). Из последних дифференцируются ортохроматические эритробласты (ОЭ). На этой стадии ядра (Я) вытесняются из клеток и затем разрушаются макрофагами. Безъядерная часть клетки — ретикулоцит (Р) поступает в кровеносный синус, где становится зрелым эритроцитом (Э).
2. Тромбоцитопоэз — это формирование кровяных пластинок, или тромбоцитов. Из КОЕ-С образуется мегакариобласт (Мкб), который затем становится промегакариоцитом (Пмк) и в конечной стадии — мегакариоцитом (Мкц). Его цитоплазма фрагментируется в кровоток, давая начало кровяным пластинкам (КП).
3. Моноцитопоэз — это образование и созревание моноцитов. Из КОЕ-С образуется колониеобразующая единица КОЕ-ГМ, которая является общим предшественником в фанулоцитопоэзе и моноцитопоэзе. Промонобласты (Пмб) развиваются из КОЕ-ГМ и затем новообразуются в монобласты (Мбл), а последние в моноциты (Мц). Они покидают костный мозг и попадают в кровоток, мигрируя затем в соединительную ткань. Здесь моноциты превращаются в тканевые макрофаги, или гистиоциты (Гц).
4. Гранулоцитопоэз — это процесс образования и созревания гранулоцитов. Некоторые из КОЕ-ГМ дифференцируются в промиелобласты (не показаны) и миелобласты (Миб) Миелобласты развиваются с образованием азурофильных, или первичных, гранул в промиелоциты (Ими), которые делятся митотически и дают начало другим промиелоцитам. Последние дифференцируются в миелоциты (Миц). На этой стадии появляются специфические, или вторичные, гранулы, которые позволяют различать нейтрофильные (н), базофильные (б) и эозинофильные (э) миелоциты. Последующие митозы приводят к генерации метамиелоцитов (Мет), которые в конечном итоге дифференцируются в соответствующие гранулоциты (Гр), выходящие в кровоток. При нормальных условиях эозинофильные гранулоциты (Гр/э) могут покидать кровеносные капилляры и проникать в соединительную ткань.
5. Лимфоцитопоэз — это процесс образования и созревания лимфоцитов. Из полипотентной гемопоэтической стволовой клетки (ПГСК) происходит общая клетка-предшественница лимфопоэза (КПЛ). Эта клетка делится на два вида лимфоидных стволовых клеток. Те, которые предназначены стать Т-лимфоцитами, мигрируют в кору тимуса, где подвергаются пролиферации (новообразованию) и дифференцировке с образованием Т-лимфоцитов и их подклассов.
Другие, предназначенные стать В-лимфоцитами, остаются в костном мозге для постоянного сохранения линии В-лимфоцитов. Другие стволовые клетки В-лимфоцитопоэза мигрируют в лимфатические узлы, селезенку и в аналог сумки, где они расселяются и заканчивают свое созревание. Эти В-лимфоциты являются предшественниками будущих генераций иммунокомпетентных В-лимфоцитов.
В обеих линиях диференцировки В-лимфоцитов процесс начинается с лимфобластов (Лб), которые делятся несколько раз, давая начало В-лимфоцитам (Б-Л). В-лимфоциты циркулируют в крови и мигрируют в ткани, где они при соответствующей стимуляции антигенами могут дифференцироваться через плазмобласты (Пб) в плазматические клетки (ПК). Контроль за качеством и количеством образующихся форменных элементов осуществляется группой гликопротеидов, называющихся колониестимулирующими факторами, которые включают эритропоэтин, интерлейкин-3 и др.
Предполагают, что элементы стромы, т. е. ретикулярные клетки (Peт), и другие клетки, происходящие от них, такие, как алвентициальные клетки (АК), жировые клетки (ЖК) и, возможно, макрофаги (М), развиваются из специализированных клеток, называемых колониеобразующими фибробластическими единицами (КОЕ-Ф). которые, возможно, также происходят из первичных ретикулярных клеток (РК).
Лейкопоэз – процесс созревания лейкоцитов; является частью гемопоэза.
Лейкопоэз начинается в костном мозге со стволовой клетки, которая способна к неограниченной пролиферации и может дать начало форменным элементам периферической крови. Стволовые клетки представляют I-й класс полипотентных клеток-предшественниц в схеме кроветворения.
Деление и дифференцировка лейкоцитов индуцируется разными факторами.Под влиянием гемопоэтических факторов роста (колониестимулирующих факторов, интерлейкинов-3,-6,-7 и др.) деление стволовой клетки приводит к образованию частично детерминированных клеток-предшественников миелопоэза (колониеобразующая единица гранулоцитарно-эритроцитарномоноцитарно-мегакариоцитарного ряда, или КОЕ-ГЭММ) и лимфопоэза (колониеобразующая единица лимфоцитарного ряда или КОЕ-Л) – II-й класс, которые могут развиваться в нескольких направлениях. Факторы роста необходимы для деления клеток и их жизнеспособности, вызывают размножение клетокпредшественников и образование в них факторов дифференцировки.
Из клеток II-го класса образуются унипотентные клеткипредшественники, иликолониеобразующие клетки (III-й класс), которые дифференцируются в строго определенном направлении: гранулоцитопоэз: нейтрофилов, базофилов, эозинофилов, моноцитов и лимфопоэз В-лимфоцитов, Т-лимфоцитов и мегакариоцитов.
Клетки I, II и III класса морфологически нераспознаваемы, выглядят как малые лимфоциты с интенсивно окрашенным плотным ядром и с узким ободком базофильной цитоплазмы.
Клетки III класса превращаются в бластные клетки (IV класс – класс морфологически распознаваемых пролиферирующих клеток): миелобласты, монобласты, эритробласты, мегакариобласты, лимфобласты. Все бластные клетки, кроме эритро- и мегакариобластов, при обычных методах окраски похожи друг на друга. Дифференцировать их помогают цитохимические методы, иммунофенотипирование.
Созревание зернистых лейкоцитов:
Миелобласты имеют большое круглое ядро с нежной сетчатой структурой хроматина, а также 2-5 ядрышек, узкий ободок цитоплазмы, не содержащий гранул (диаметр 12-20 мкм).
Промиелоцит – самая крупная из клеток (диаметр до 25 мкм) имеет большое количество азурофильной зернистости, в ядре находится 1-2 ядрышка, ядерно-цитоплазматическое соотношение в сторону ядра.
Миелоцит (диаметр 14-16 мкм) – последняя способная к делению клетка, в ядре отсутствуют ядрышки.
Метамиелоцит (диаметр 12-15 мкм) имеет бухтообразное вдавление ядра, цитоплазма содержит нежную специфическую зернистость.
В палочкоядерных лейкоцитах ядро имеет форму изогнутой палочки.
Сегментоядерные гранулоциты – это зрелые клетки (VI класс), ядро которых состоит из 2-4 сегментов.
Материнские клетки миелобласты встречаются в норме в небольшом количестве в костном мозге (в 0,5-2% от всех ядерных клеток). Миелобласт представляет собой большую клетку (диаметром 10-20 мкм) с большим слабо окрашивающимся ядром и небольшой площадью цитоплазмы. Структура хроматина нежно-сетчатая, с равномерной окраской и калибром нитей. Ядра могут содержать от 2 до 5 мелких голубых ядрышек. Цитоплазма голубая («чистое голубое небо») и не содержит зернистости.
Дальнейшее развитие миелобласта приводит к переходу его в миелоцит, который является преобладающей формой гранулоцитов в костном мозге. Между миелобластом и миелоцитом имеется ряд переходных форм, которые объединены под названием промиелоцитов. В последних содержится много азурофильной зернистости (самые «грязные» клетки). Зернистость содержит катионные белки хром-содержащий энзим миелопероксидазу.
Клетки V класса (созревающие) проходят через различное количество стадий. В процессе созревания гранулоцитов (нейтрофилов, эозинофилов и базофилов) их ядро уплотняется и подвергается сегментации. В цитоплазме при окраске по Райту появляются специфические нейтро-, эозино- или базофильные гранулы.
Созревание гранулоцитов заключается в уменьшении его размеров и в изменениях тонкой структуры цитоплазмы и ядра. Изменения в цитоплазме заключаются в постепенном уменьшении содержания в ней базофильного вещества. Поэтому цвет цитоплазмы при окраске по Романовскому-Гимза постепенно переходит из синего в светло-голубой. Одновременно с ослаблением базофилии в цитоплазме начинает появляться зернистость. Сначала зернистость азурофильна, но по мере дальнейшего созревания она становится дифференцированной, приобретает окраску, которая свойственна зернистости вполне сформировавшегося миелоцита.
Одновременно с изменениями в цитоплазме происходят и изменения в ядре: последнее уменьшается, приобретает круглую или овальную пузырькообразную форму, хроматин располагается в нем в виде толстых перекладин.
Дифференциация клеток гранулоцитарного ряда на нейтрофилы, эозинофилы и базофилы начинается с миелоцита. Нейтрофильная зернистость мелкая, сине-фиолетовая, пылевидная, эозинофильная – крупная, желто-розово-оранжевого цвета, одинакового размера («красная икра»), базофильная – разнокалиберная (от очень крупных до пылевидных), темно-фиолетового цвета. В костном мозге можно встретить три вида миелоцитов: нейтрофильные, эоэинофильные и базофильные. Каждый вид миелоцита дает при дальнейшем развитии соответственный зрелый гранулоцит: из нейтрофильного миелоцита развивается нейтрофильный лейкоцит, из эозинофильного – эозинофильный, а из базофильного – базофильный.
Созревание миелоцита при переходе в зрелый гранулоцит заключается также в уменьшении размеров и в изменении ядра. Последнее приобретает более сложную структуру, становится сначала почкообразным (у метамиелоцитов), затем подковообразным (у палочкоядерных лейкоцитов), начинает разделяться на отдельные лопасти и, наконец, на отдельные сегменты, соединенные между собой тоненькими мостиками. Эта сегментация слабо выражена в базофилах, более выражена в эозинофилах и достигает своего, окончательного развития в нейтрофилах. Структура ядра миелоцита зависит от степени зрелости: молодые формы имеют ядра более равномерного (рыхлого) строения, более зрелые – компактную, глыбчатую структуру. Таким образом, признаками незрелости («юности») гранулоцитов являются большие размеры клетки, недифференцированное и бледно окрашенное ядро, базофилия цитоплазмы и отсутствие в ней зернистости (за исключением миелоцитов).
Зрелые нейтрофилы (VI класс) представляют собой круглые клетки в 1,5-2 раза больше эритроцита; при окраске по методу Романовского-Гимза цитоплазма нейтрофилов имеет слаборозовую окраску. Ядра нейтрофилов густо окрашиваются основной краской в сине-фиолетовый цвет. Ядро состоит из больших петель хроматина, между которыми находится более светло окрашенный парахроматин. В зрелых нейтрофилах ядра состоят из 2-4 сегментов, соединенных между собой тоненькими мостиками (сегментоядерные нейтрофилы). В цитоплазме отмечается тонкая пылевидная зернистость красновато-фиолетового цвета.
В нормальной крови встречаются в небольшом количестве нейтрофилы менее зрелые; ядро таких клеточных элементов не сегментировано, а представляется в виде узкого вытянутого колбасовидного образования (палочкоядерные нейтрофилы). В очень редких случаях в нормальной периферической крови могут попадаться еще более молодые нейтрофилы с компактным ядром, имеющим бухтообразное вдавление, которое придает ядру почковидную форму – метамиелоциты (юные).
Время созревания нейтрофилов в костном мозге составляет 10-14 дней. При инфекционно-воспалительных процессах и большей, чем в норме, потребности в нейтрофилах, этот процесс значительно ускоряется. Палочкоядерные и сегментоядерные нейтрофилы не покидают сразу костный мозг, остаются в нем в течение 3-4-х дней, формируя костно-мозговой резерв нейтрофилов, которые каждые 3-5 дней обновляются.
В периферической крови выделяют два пула лейкоцитов: циркулирующий и маргинальный (краевой), количества их практически равны. Время циркуляции нейтрофилов в сосудистом русле равно 4-6 часам. Из сосудистого русла нейтрофилы через стенку сосудов выходят в ткани, где участвуют в защитных иммунных реакциях. Выполнив свою функцию в тканях, нейтрофилы разрушаются путем апоптоза.
Эозинофилы несколько больше по размерам, чем нейтрофилы. Ядро их состоит обычно из двух грушевидных, соединенных тоненьким мостиком лопастей. Для эозинофилов характерна обильная грубая зернистость, густо рассеянная в протоплазме и окрашивающаяся эозином в ярко-красный цвет.
Эозинофилы созревают в костном мозге за 3-5 дней. Не образуя резерва, выходят в сосудистое русло, где циркулируют в течение 5-24 часов. Тканевые эозинофилы могут возвращаться в сосудистое русло, чем объясняют длительность эозинофильных реакций.
Базофилы несколько меньше нейтрофилов. Протоплазма содержит многочисленные крупные зерна, окрашенные основной краской в сине-фиолетовый цвет. Эта зернистость покрывает большую часть ядра. Ядро неправильной формы, лопастное, иногда разделено на две или три части.
Лимфоциты по происхождению представляют собой клетки лимфоидного ряда. Место их образования – лимфоидная ткань лимфатических узлов, селезенка и отчасти костный мозг, откуда они поступают в кровь.
Лимфоциты – нефагоцитирующие лейкоциты, они осуществляют и регулируют иммунный ответ. Различают две основные разновидностилимфоцитов: Т-лимфоциты (тимус-зависимые) – составляют основную часть (70%) циркулирующих лимфоцитов и В-лимфоциты (бурса-зависимые).
На мембранах лимфоцитов различных стадий развития присутствуют поверхностные антигены лимфоцитов (кластеры дифференцировки, или СD-антигены «сlusterdifferentiation»). Среди Т-лимфоцитов, в зависимости от экспрессируемых ими рецепторов CD, выделяют следующие популяции: Т-хелперы (CD4), цитотоксические Т-лимфоцитыи Т-супрессоры (CD8). Образовавшись из стволовых клеток костного мозга, незрелые протимоциты «заселяют» корковый слой тимуса, а затем мигрируют в селезенку, где созревают и приобретают характерные для Т-лимфоцитов антигенные свойства.
Созревание В-лимфоцитов. Материнская клетка – лимфобласт обнаруживается в зародышевых центрах лимфатических узлов и фолликулов селезенки. Это большая клетка с базофильно окрашивающейся по методу Романовского-Гимза в голубой цвет цитоплазмой, большим, бледно окрашенным ядром, в котором содержатся 1-2 светло-голубых ядрышка. Структура хроматина в ядре мелкогранулярная, равномерная. По мере созревания клетки размеры ее уменьшаются, ядро становится более компактным и окрашивается в более темный фиолетово-красный цвет.
Лимфобласты (диаметр 20-22 мкм) имеют четкую перинуклеарную зону, грубую структуру хроматина и 1-2 ядрышка.
Пролимфоцит (диаметр 11-12 мкм) с ядром рыхлой структуры, наличием ядрышка либо его остатков, наличием ободка цитоплазмы различной ширины и азурофильной зернистостью в T-лимфоцитах.
Лимфоцит (диаметр 7-15 мкм) с компактным ядром, глыбчатой структуры с небольшими про светлениями и узким либо широким ободком базофильной, либо бесцветной цитоплазмы.
Зрелые лимфоциты равны или несколько больше эритроцитов, имеют диаметр от 7 до 15 мкм. Цитоплазма при окраске по методу Романовского-Гимза окрашена в светло-голубой цвет. Ядро круглой или слегка овальной формы окрашивается основной краской в голубой цвет. Оно часто имеет с одной стороны бухтообразное вдавление. Вокруг ядра остается бледный ободок, более светлый, чем остальная цитоплазма (перинуклеарная зона). В цитоплазме отдельных лимфоцитов можно иногда при хорошей окраске обнаружить несколько красновато-фиолетовых крупных гранул (азурофильная зернистость).
Моноциты входят в систему мононуклеарных фагоцитов, элементы которой рассеяны во многих местах организма, в том числе в костном мозге.
На поверхности моноцитов и макрофагов имеется множество рецепторов: для иммуноглобулинов, различных антигенов, белков системы комплемента, лимфокинов, ряда гормонов и др. В цитоплазме находятся гранулы (лизосомы), содержащие ферменты. Макрофаги выполняют важные функции: участие в неспецифическом и специфическом иммунном ответе, участие в обмене веществ (метаболизм липидов, железа, пигментов).
Ранние предшественники моноцитов развиваются из полипотентной стволовой клетки костного мозга под влиянием гемопоэтинов. Моноциты образуются в костном мозге, где проходят следующие морфологически различимые стадии созревания: монобласт, промоноцит, моноцит. Моноциты крови не являются еще окончательно зрелыми клетками – в тканях они превращаются в макрофаги.
монобластпромоноци моноциты
Монобласт имеет округлое либо округло-вытянутое ядро, иногда бобовидное, нежной структуры с ядрышками и напоминает миелобласт. У промоноцита имеется изогнутое ядро с волнистыми очертаниями. Цитоплазма окрашивается в базофильные тона.
Моноциты самые большие клетки нормальной периферической крови: их диаметр колеблется от 14 до 20 мкм. Цитоплазма моноцитов при окраске по методу Романовского-Гимзасероголубого цвета. Ядро крупное, неправильно-круглой, овальной, почковидной или подковообразной формы, расположено в клетке эксцентрично. Оно бедно хроматином и потому слабо окрашено, так что между ним и цитоплазмой нет такого контраста, как в других лейкоцитах. В отличие от лимфоцитов в моноцитах перинуклеарной зоны нет. При очень хорошей окраске в цитоплазме обнаруживается чрезвычайно мелкая азурофильная зернистость.
Дифференцировка моноцитов из монобластов происходит в течение 5 дней, после чего они сразу выходят в кровоток, не образуя костномозгового резерва. Моноциты циркулируют в крови от 30 до 104 часов и затем уходят в ткани, где под влиянием различных тканевых факторов дифференцируются в органо- и тканеспецифические макрофаги.
Кроветворение — это… Что такое Кроветворение?
Гемопоэз (лат. haemopoesis), кроветворение — это процесс образования, развития и созревания клеток крови — лейкоцитов, эритроцитов, тромбоцитов у позвоночных.
Выделяют:
Гемопоэз у рыб
В отличие от высших позвоночных, у рыб отсутствуют костный мозг и лимфатические узлы, гемопоэз происходит как в органах, в состав которых входит ретикулярный синцитий (жаберный аппарат, почки, лимфоидный орган), так и эндотелии сосудов жаберного аппарата и сердца и селезёнке и, в некоторых случаях, слизистая кишечника У костных рыб основным органом кроветворения являются переднии части почек, гемопоэз идёт также и в лимфоидных органах, и в селезёнке. Особенностью рыб является наличие в крови как зрелых, так и молодых эритроцитов, эритроциты имеют ядра.
Гемопоэз у человека.
Гемопоэз у млекопитающих осуществляется кроветворными органами, прежде всего миелоидной тканью красного костного мозга. Некоторая часть лимфоцитов развивается в лимфатических узлах, селезёнке, вилочковой железе (тимусе), которые совместно с красным костным мозгом образуют систему кроветворных органов.
Предшественниками всех клеток — форменных элементов крови являются плюрипотентные гемопоэтические стволовые клетки костного мозга, которые могут дифференциироваться двумя путями: в предшественников миелоидных клеток (миелопоэз) и в предшественников лимфоидных клеток (лимфопоэз).
Миелопоэз
При миелопоэзе (греч. myelopoesis; миело- + греч. poiesis выработка, образование) в костном мозге образуются все форменные элементы крови, кроме лимфоцитов. Миелопоэз происходит в миелоидной ткани, расположенной в эпифизах трубчатых и полостях многих губчатых костей. Ткань, в которой происходит миелопоэз, называется миелоидной.
Предшественники лейкоидных клеток, проходя несколько стадий дифференциации, образуют лейкоциты различных типов (лимфопоэз), в случае миелопоэза дифференциация ведёт к образованию эритроцитов, гранулоцитов, моноцитов и тромбоцитов. Особенностью миелопоэза человека является изменение кариотипа клеток в процессе дифференциации, так, предшественниками тромбоцитов являются полиплоидные мегакариоциты, а эритробласты при трансформации в эритроциты лишаются ядер.
Лимфопоэз
Лимфопоэз происходит в лимфатических узлах, селезёнке, тимусе и костном мозге.
Эмбриональный гемопоэз млекопитающих
Гемопоэз на эмбриональной стадии претерпевает изменения при онтогенезе. На ранних стадиях развития эмбрионов млекопитающих гемопоэз начинается в утолщениях мезодермы желточного мешка, продуцирующего эритроидные клетки примерно с 16 — 19 дня развития и прекращается после 60-го дня развития, после чего функция кроветворения переходит к печени и начинается лимфопоэз в тимусе. Последним из кроветворных органов в онтогенезе развивается красный костный мозг, играющий главную роль в гемопоэзе взрослых особей. Костный мозг начинает формироваться в период, когда гематопоэз уже иссяк в желточном мешке, временно осуществляется в печени и активно развивается в тимусе. После окончательного формирования костного мозга гемопоэтическая функция печени угасает.
Литература
- Анисимова И. М., Лавровский В. В. Ихтиология. Высшая школа, 1983
- Manuela Tavian, Bruno Peault. Embryonic development of the human hematopoietic system. Int. J. Dev. Biol. 49: 243—250 (2005)
См. также
Wikimedia Foundation.
2010.
Кроветворение — это… Что такое Кроветворение?
гемопоэз (от греч. háima — кровь и póiēsis — изготовление, сотворение), процесс образования, развития и созревания клеток крови у животных и человека. Форменные элементы крови — высокоспециализированные клетки с коротким жизненным циклом: у эритроцитов (См. Эритроциты) человека он длится около 120 суток, у лейкоцитов (См. Лейкоциты) — около 5 суток, у лимфоцитов (См. Лимфоциты) — от нескольких дней до нескольких месяцев, у тромбоцитов (См. Тромбоциты) — около 4 суток. Несмотря на непрерывное разрушение клеток крови, количество их в течение жизни организма сохраняется более или менее постоянным, т. к. гибнущие клетки заменяются новыми. К. у беспозвоночных животных осуществляется в основном в полостных жидкостях и в самой крови. У взрослых млекопитающих и человека К. происходит в кроветворных органах (См. Кроветворные органы): образование эритроцитов, зернистых лейкоцитов и тромбоцитов — в костном мозге; лимфоцитов — в лимфатических узлах, селезёнке, зобной железе, костном мозге; Моноциты и Макрофаги также образуются из клеток костного мозга. Все зрелые клетки крови, несмотря на различия между ними, происходят, по-видимому, из единых родоначальных (стволовых) кроветворных клеток. Линия таких родоначальных клеток поддерживается в организме в течение всей его жизни, что обеспечивает непрерывность К. При созревании (дифференцировке (См.
Дифференцировка)) кроветворные клетки подвергаются сложным изменениям и делятся ещё несколько раз. Т. о., из небольшого числа родоначальных клеток образуется большое число специализированных форменных элементов крови.
К. подчиняется сложной регуляции, чем обеспечивается изменение количества и качества кровяных клеток в соответствии с потребностями организма (например, при изменении содержания кислорода в воздухе), а также восстановление их числа при потерях крови. Эта регуляция осуществляется рядом гормонов, витаминов (например, цианкобаламин — B12, фолиевая кислота — Вс), а также особыми веществами — Эритропоэтинами, к которым чувствительны различные стадии процесса К. Механизмы, регулирующие темпы размножения и созревания отдельных категорий кроветворных клеток, остаются ещё во многом неизвестными.
У зародышей млекопитающих животных и человека К. начинается в желточном мешке, где первые кроветворные клетки возникают из клеток мезенхимы; затем очаги кроветворной ткани формируются в мезенхиме тела, а позже — в печени зародышей (здесь образуются эритроциты и лейкоциты) и в зобной железе (здесь образуются лимфоциты). На более поздних стадиях развития процесс К. перемещается в костный мозг, а лимфоциты начинают развиваться не только в зобной железе, но и в селезёнке и лимфатических узлах.
Лит.: Заварзин А. А., Избр. тр.; т. 4 — Очерки эволюционной гистологии крови и соединительной ткани, М.— Л., 1953; Физиология системы крови, Л., 1968; Черниговский В. Н., Шехтер С. Ю., Ярошевский А. Я., Регуляция эритропоэза, Л., 1967; Экспериментальные исследования механизмов гемопоэза, [Сб. ст.], Свердловск, 1971; Hematopoietic cellular proliferation, ed. F. Stohiman, N. Y., 1970; Regulation of hematopoiesis, ed. A. S. Gordon, V. I—2, Appleton, 1970.
А. Я. Фриденштейн.
Нарушения кроветворения лежат в основе патогенеза (механизма развития патологического процесса) болезней системы крови. Нарушения К. могут возникнуть под влиянием внешних (физических, химических, инфекционных и др.) и внутренних (гормональных, обменных, врождённых, наследственных и др.) факторов; при ряде заболеваний системы крови причины этих нарушений пока не установлены.
В зависимости от характера повреждения кроветворных органов нарушения К. определяют как гиперпластические (с избыточным образованием элементов кроветворной ткани) и гипо- и апластические (с подавлением К., нарушением деления и в меньшей степени — созревания кроветворных клеток). Определяющим в характеристике заболевания является также категория поражаемых клеток и степень их зрелости (малодифференцированные, различной степени зрелости клетки, элементы грануло-, эритро-, тромбоцито-, лимфопоэза).
Гиперпластические состояния кроветворения наиболее выражены при Лейкозах и эритремии. Клетки костного мозга при лейкозах утрачивают способность дифференцироваться (созревать), а пролиферация (размножение) у них может быть замедлена. Продолжительность жизни в организме этих незрелых элементов увеличивается, в результате чего в кроветворных органах и крови накапливается огромное количество клеток различных клеточных линий и различной степени зрелости, что и определяет форму лейкоза (острый, хронический, миело-, лимфолейкоз и др.).
Кариологическими (от греч. kărgon — ядро) исследованиями при некоторых формах лейкоза обнаружены изменения в хромосомах кроветворных клеток, что свидетельствует о наследственном характере нарушений К.
При гипо- и апластических состояниях поражаются либо родоначальные кроветворные клетки, либо наиболее ранние клеточные формы эритро-, грануло- и тромбоцитопоэза. Выражением этих нарушений наряду с обеднённостью костного мозга кроветворными клетками является уменьшение в крови числа эритроцитов (и, следовательно, количества гемоглобина), лейкоцитов (гранулоцитов), тромбоцитов (гипо- и апластической анемии, агранулоцитозы, метастазы опухолей в костный мозг и др.).
При недостатке в организме некоторых витаминов, микроэлементов, ферментов и др. нарушения К. приобретают своеобразный характер. Так, при дефиците в организме витамина B12 и фолиевой кислоты нарушается нормальное образование эритроцитов и в костном мозге обнаруживаются клетки, характерные для эмбрионального кроветворения в печени (В12— и фолиеводефицитные анемии). При дефиците железа в эритроцитах содержится мало гемоглобина и, хотя общее количество эритроцитообразующих клеток в костном мозге и эритроцитов в крови может быть нормальным, развивается железодефицитная Анемия. При нарушениях структуры гемоглобина (см. Гемоглобинопатии), отсутствии или недостатке в эритроцитах некоторых ферментов (энзимопатии) и др. факторов эритроциты становятся неполноценными и быстро разрушаются либо в кровеносном русле, либо преимущественно в селезёнке (гемолитической анемии). В костном мозге и периферической крови в этих случаях обнаруживается значительное количество молодых клеток (нормобластов, ретикулоцитов) эритроцитарного ряда.
Нарушения К., протекающие с поражением преимущественно лимфопоэза, приводят к нарушению Иммунитета и некоторым белковым изменениям крови. От истинных нарушений К. гиперпластического типа следует отличать реактивные его состояния, т. н. лейкемоидные реакции. Их возникновению способствуют различные инфекции, интоксикации и др. При устранении основной причины, вызвавшей реактивные состояния К., наступает фаза нормализации К.
Лит.: Файнштейн Ф. Э., Апластические и гипопластические анемии, М., 1965; Кассирский И. А., Алексеев Г. А., Клиническая гематология, 4 изд., М., 1970; Поликар А., Бесси М., Элементы патологии клетки, пер. с франц., М., 1970.
А. М. Полянская.
Схема развития кровяных клеток.
Эритропоэз — как происходит образование эритроцитов крови?
Синтез эритроцитов представляет собой один из самых важнейших и сложных процессов формирования клеток в организме. В норме каждую секунду создается два-три миллиона кровяных телец. Сам процесс образования эритроцитов называется эритропоэзом. Как же он происходит? Как выполняется нервная и гуморальная регуляция этого процесса?
Кроветворение
Можно выделить единую схему образования всех компонентов крови, в том числе и эритроцитов. На ней кратко и отчетливо видны стадии развития конкретной клетки. С помощью данной схемы можно отследить, на каком этапе произошла ошибка, и образование эритроцита прекратилось.
Специалист может активизировать созревание телец на этой стадии. Пользуясь схемой можно понять физиологию процесса кроветворения, верно поставить диагноз и вовремя предпринять меры по устранению патологии.
 Схема образования клеток крови
Схема образования клеток крови
Физиология формирования клеток
Какова же физиология образования кровяных клеток? Эритропоэзом называют процесс, в ходе которого формируются и созревают кровяные тельца – эритроциты. Это происходит в костном мозге человека. Первый элемент, от которого начинается происхождение эритроцитов, – полипотентная стволовая клетка.
Она способна дифференцироваться во все клетки без исключения и подвергается нескольким этапам деления, в результате чего появляются клетки-предшественники, от которых потом начинают развиваться эритроциты, лейкоциты, лимфоциты.
Все предшественники эритроцитов в костном мозге и зрелые клетки в кровотоке образуют замкнутую систему, которая называется эритроном. Клетки созревают под регуляцией гормона эритропоэтина и других необходимых компонентов. По времени этот процесс протекает не более двух недель.
Со стадии проэритробласта начинает вырабатываться гемоглобин. Ядро по мере развития эритроцита уменьшается, а потом исчезает вовсе. Уже на стадии ретикулоцита кровяные тельца выходят в кровь. В ней они за нескольких часов дозревают до полноценных эритроцитов.
Когда у человека происходят какие-либо патологические нарушения, которые сопровождаются анемией: острые кровопотери, отравления, инфекционные болезни, в крови могут образовываться недозрелые тельца, называемые нормобластами. Это говорит о том, что эритропоэз происходит в усиленном режиме. Для проверки физиологии этого нарушения проводятся лабораторные исследования.
Важно! Стоит отметить, что при образовании предшественников эритроцитов происходит разрушение части клеток еще в костном мозге. Этот процесс называют неэффективным эритропоэзом. Он заключается в разрушении и гибели кровяных телец, которые не обладают функциональной полноценностью. Роль неэффективного типа эритропоэза состоит в регуляции эритрона.
Компоненты, необходимые для эритропоэза
Чтобы все этапы эритропоэза проходили нормально, требуются микроэлементы, гормоны, витамины и прочие важные для этого процесса веществ. К ним относят:
- Железо. Для образования эритроцитов организму требуется до 25 мг железа в сутки. Этот элемент поступает в костный мозг, когда происходит разрушение кровяных телец. Накапливается железо в печени и селезенке, немного в других органах. При дефиците данного компонента образуется железодефицитная анемия.
- Медь. Ее роль тоже очень важна для формирования эритроцитов. Она усваивается непосредственно в костном мозге, участвует в выработке гемоглобина. Без меди эритроциты не могут развиваться полностью, они доходят только до стадии ретикулоцита. Если уровень меди снижен, то синтез крови в костном мозге останавливается, что вызывает анемию.
- Витамин B12 и фолиевая кислота. Данные компоненты взаимодополняют друг друга, положительно влияя на эритропоэз.
- Витамин В6 нужен, чтобы в гемоглобине сформировалось железо.
- Витамин В2 Требуется для нормализации окислительных и восстановительных процессов в организме.
- Гормоны, отвечающие за обмен белков и кальция и принимающие участие в созревании клеток.
- Половые гормоны мужчин. Они немного активизируют процесс эритропоэза. А вот женские эстрогены, наоборот, тормозят его. Этим и объясняется тот факт, что количество эритроцитов у женщин меньше, чем у мужчин.
Важно! Главным элемент эритропоэза – гормон эритропоэтин, гуморальный регулятор созревания кровяных телец. Секреция и синтез данного компонента происходит в перитубулярных клетках почек. Некоторая часть эритропоэтинов формируется в печени, селезенке и костном мозге.
Как меняются клетки?
Проходя через все стадии эритропоэза, клетки подвергаются изменения морфологических характеристик. Происходит следующее:
- Меняются параметры клеток в сторону уменьшения.
- Увеличивается число цитоплазматического матрикса.
- Изменяется оттенок телец от голубого до красного. Это происходит потому, что снижается концентрация РНК и ДНК, а уровень гемоглобина, наоборот, повышается.
- Становятся меньше параметры ядра, в конечном итоге оно вообще исчезает.
- Содержащий в эритроцитах хроматин приобретает большую плотность.
 Стадии созревания клеток
Стадии созревания клеток
Гуморальная регуляция
Регуляция образования крови еще не полностью исследована на данный момент. Чтобы эритропоэз протекал непрерывно, все потребности различных клеток удовлетворялись в полной мере, обеспечивалось постоянство и баланс гомеостаза, требуется работа сложного регуляторного механизма.
Главный гуморальный регулятор, как уже говорилось, – гормон эритропоэтин. Он образуется в различных внутренних органах человека, но больше всего в почках, сосудах и печени. Концентрация этого компонента всегда одинаковая. Но возникают ситуации, когда уровень гормона нарушается. Это происходит при обильном кровотечении, подъеме в горы, ишемической болезни почек.
Вместе с гуморальным регулятором эритропоэтином в синтезе эритроцитов принимают участие ингибиторы. Они представляют собой разнообразные вещества, некоторые из которых относятся к токсинам, выделяющимся при патологических нарушениях.
На первых стадиях дифференцировки регуляция происходит благодаря факторам микроокружения клеток. Затем только в игру вступают эритропоэтин и ингибиторы.
Когда организму требуется в краткий срок сформировать множество новых кровяных телец, начинает действовать стрессовый механизм. Это значит, что эритропоэтин становится намного активнее ингибиторов эритропоэза, в результате чего нарушается регуляция эритропоэза. Возможен и обратный эффект, когда ингибиторы сильнее воздействуют на созревание клеток, приводя к торможению этого процесса.
Нервная регуляция
Конечно же, воздействие гуморальных факторов на эритропоэз намного сильнее и значимее, чем влияние нервной системы, но все же и последнее имеется. Когда возбуждается симпатический отдел вегетативной нервной системы, повышается количество эритроцитов в крови. Такое нарушение имеет перераспределительный характер и во многом зависит от опорожнения селезенки, в которой скапливаются кровяные тельца.
В это же время адреналин и норадреналин способствует стимуляции аденилатциклазной системы. В итоге усиленно выделяется эритропоэтин. В гипоталамусе человека присутствуют особые центры, благодаря которым происходит нервная регуляция эритропоэза. Если на него воздействует какой-то раздражитель, то он начинает провоцировать образование клеток, что приводит к повышению уровня эритроцитов в крови.
Выработка гемоглобина
Гемоглобин содержит в себе железо, дефицит которого может вызвать развитие анемии. Выработка этого вещества и эритропоэз связаны друг с другом. Когда уровень гемоглобина достигает определенного порога, образование эритроцитов останавливается.
Синтез гемоглобина начинается в клетках-предшественниках кровяных телец. Это происходит еще при внутриутробном развитии плода. После появления ребенка на свет у него появляется гемоглобин F, а потом гемоглобин А. У взрослых может отмечаться возникновение гемоглобина F, например, при кровопотере.
В составе гемоглобина содержатся два типа цепей глобина. Они располагаются вокруг гема, который содержит в себе железо. Исходя из того, как изменяются последовательности остатков аминокислот в цепях, модифицируются и свойства гемоглобина. К примеру, он может под воздействием некоторых условий преобразовываться в кристаллы и терять способность к растворению.
Образование эритроцитов и прочих компонентов крови – это довольно сложный и важный процесс, который проходит в несколько этапов. Любое нарушение в созревании клеток может привести к отклонениям в работе организма, поэтому необходимо своевременно выявлять факторы, способные вызвать его.
Происхождение стволовых кроветворных клеток в эмбриональном развитии • Е. И. Домарацкая, О. В. Паюшина • Журнал общей биологии • Выпуск 5 • Том 79, 2018 г.
В организме взрослых млекопитающих кроветворение происходит главным образом в костном мозге. На протяжении всей жизни в нем поддерживаются стволовые кроветворные клетки (СКК), образующие все типы форменных элементов крови. В эмбриональном развитии кроветворение происходит в нескольких анатомических образованиях – желточном мешке, аорто-гонадо-мезонефральной области, плаценте и печени. Однако до сих пор не вполне ясно, где именно в ходе развития эмбриона впервые появляются клетки-предшественники, дающие начало СКК зрелого костного мозга. В обзоре рассмотрены современные представления об особенностях кроветворных клеток, образующихся в желточном мешке, аорто-гонадо-мезонефральной области и плаценте, и их вкладе в заселение печени зародыша, а впоследствии и костного мозга взрослого организма.
Костный мозг – основной орган кроветворения у взрослых млекопитающих, в котором на протяжении всей жизни воспроизводятся стволовые кроветворные клетки (СКК) и образуются зрелые клетки крови. СКК взрослого организма способны давать все типы форменных элементов крови (нейтрофилы, базофилы, эозинофилы, моноциты, лимфоциты, эритроциты, тромбоциты). Кроме того, после деления СКК воспроизводят самих себя, т.е. самоподдерживаются. Благодаря этому они обеспечивают кроветворение неопределенно долгое время. Основным функциональным критерием наличия в ткани СКК является способность к восстановлению кроветворения как после естественной гибели клеток, так и в ходе патологических процессов или действия повреждающих агентов. Полный набор этих свойств появляется у СКК только после рождения, в результате созревания их предшественников, так называемых пре-стволовых кроветворных клеток (пре-СКК), которые возникают в раннем развитии задолго до формирования костного мозга. Хотя процесс образования кроветворной системы изучается более 100 лет, остается не ясным вопрос, где впервые возникают клетки, дающие начало СКК, существующим во взрослом организме.
В эмбриональном развитии клетки крови образуются в нескольких органах, функционирующих в разное время, а именно в желточном мешке, области аорты, половых желез и почек (так называемом аорто-гонадо-мезонефросе или АГМ), плаценте и печени (заглавная иллюстрация). Иными словами кроветворение в ходе развития меняет свою локализацию. По-видимому, его переселение из органа в орган обусловлено не только анатомическими изменениями в процессе развития, но и тем, что в процессе становления кроветворной системы эти органы играют неодинаковую роль. Так, например, основная функция желточного мешка состоит в образовании первых клеток крови, в первую очередь эритроцитов, снабжающих развивающийся эмбрион кислородом. В то же время остается неясным, работает ли этот орган не только на текущие потребности зародыша, но и на перспективу, то есть участвует ли он в образо-вании полноценных, так называемых дефинитивных СКК, которые в дальнейшем заселят костный мозг и обеспечат кроветворение у взрослого организма. Дело в том, что образующиеся в желточном мешке кроветворные клетки-предшественники не соответст-вуют важнейшему функциональному критерию дефинитивных СКК – способности восстанавливать кроветворение при трансплантации реципиенту, у которого собственная кроветворная ткань разрушена облучением. Предшественники взрослого кроветворения, которые этой способностью обладают, появляются в ходе развития организма несколько позже и закладываются практически одновременно в нескольких независимых источниках – в стенке дорзальной аорты и других крупных сосудах, в сердце, а также в плаценте. В этих образованиях они возникают de novo, а затем перемещаются из них в печень. Функции этих источников, по-видимому, не идентичны. Так, в АГМ образуются лишь единичные СКК, способные заселять кроветворные органы взрослого реципиента, однако здесь массово размножаются их предшественники, пре-СКК, которые впоследствии и мигрируют в печень. Возможно, АГМ является главным поставщиком пре-СКК для первоначального заселения печени, где они дозревают до стадии СКК, размножаются и приобретают способность давать начало всем типам зрелых клеток крови. Параллельно с печенью размножение СКК идет и в плаценте, но в этом органе, в отличие от печени, они не дифференцируются. Очевидно, основная роль плаценты как кроветворного органа – это наработка СКК.
В печени зародыша собственные предшественники кроветворных клеток не образуются. Кроветворение в ней начинается и поддерживается только за счет миграции клеток, приходящих из желточного мешка, АГМ и плаценты. В печени СКК не только самоподдерживаются и размножаются, но и впервые в эмбриогенезе образуют все типы кроветворных клеток красного и белого рядов. Таким образом, печень является основным кроветворным органом развивающегося плода и обеспечивает его потребность как в стволовых, так и в зрелых клетках крови, что становится особенно важным на тех стадиях развития, когда желточный мешок уже прекращает выполнять кроветворную функцию. В конце внутриутробного периода печень переключается на выполнение специфических функций, свойственных ей во взрослой жизни, а кроветворная активность ней угасает. СКК при этом покидают печень и перемещаются в костный мозг, где к тому моменту уже складываются условия для их существования и самообновления. Попав в костный мозг, СКК прекращают интенсивно делиться и переходят в состояние покоя.
Ведущая роль в смене мест, где в ходе индивидуального развития происходит кроветворение, принадлежит микроокружению. В желточном мешке, АГМ, плаценте и печени оно неодинаково, и это обуславливает различия в поведении кроветворных клеток в этих органах. Так, под влиянием микроокружения плаценты СКК активно размножаются, а микроокружение печени благоприятствует не только их делению, но и дифференцировке. Ключевую роль в формировании микроокружения, или ниши для СКК, играют мезенхимные стромальные клетки (МСК). В ходе развития эмбриона МСК появляются в местах кроветворной активности, по-видимому, подготавливая «ложе» для кроветворных клеток, причем обе системы – мезенхимная и кроветворная – развиваются скоординировано. В индивидуальном развитии МСК претерпевают не только количественные, но и функциональные изменения, что отражает процесс созревания кроветворной ниши. Именно качественные изменения качества кроветворного микроокружения, происходящее параллельно с изменениями СКК, могут иметь определяющее влияние на приобретение последними дефинитивных свойств, присущих клеткам взрослого организма.
Таким образом, эмбриональное кроветворение осуществляется во многих анатомических образованиях, обеспечивающих на протяжении пренатального периода разные этапы формирования и созревания кроветворных клеток. Кроветворные функции этих образований частично перекрываются, но каждое из них имеет и уникальные особенности: желточный мешок служит первым местом продукции функционально активных клеток крови (примитивных эритроцитов), в АГМ закладываются de novo предшественники дефинитивных СКК, плацента обеспечивает размножение СКК, а печень – их поддержание и дифференцировку в множественных направлениях. Существование нескольких мест для кроветворения способствует, с одной стороны, быстрому образованию первых дифференцированных клеток крови, необходимых эмбриону для выживания и роста, а с другой – продукции множества СКК, которые потребуется организму в дальнейшем, уже после рождения. Однажды возникнув, СКК собираются в печени зародыша для размножения и дифференцировки, после чего заселяют костный мозг. На этом пути они попадают в различные ниши и подвергаются различным воздействиям, способствующим их размножению и функциональному созреванию, в результате чего приобретают свойства СКК взрослого организма.
Хотя эмбриональное развитие кроветворной системы изучается уже много лет, многие вопросы, связанные с происхождением клеток крови в эмбриогенезе, до сих пор остаются без ответа. Дальнейшее изучение клеточных и молекулярных механизмов формирования СКК в индивидуальном развитии имеет несомненную значимость не только для понимания фундаментальных аспектов функционирования кроветворной системы, но и для совершенствования методов лечения гематологических заболеваний.
Гематологический глоссарий — Hematology.org
Кровь — это специализированная биологическая жидкость. Он состоит из четырех основных компонентов: плазмы, красных кровяных телец, лейкоцитов и тромбоцитов. Кровь выполняет множество различных функций, в том числе:
- транспортирует кислород и питательные вещества к легким и тканям
- образование тромбов для предотвращения чрезмерной кровопотери
- , несущие клетки и антитела, борющиеся с инфекцией
- переносит продукты жизнедеятельности в почки и печень, которые фильтруют и очищают кровь
- регулятор температуры тела
Кровь, которая течет по венам, артериям и капиллярам, известна как цельная кровь, смесь примерно 55 процентов плазмы и 45 процентов клеток крови.От 7 до 8 процентов вашего общего веса составляет кровь. У мужчины среднего роста в теле около 12 пинт крови, а у женщины среднего роста — около 9 пинт.
Компоненты крови и их значение
Многие люди сдавали анализ крови или сдавали кровь, но гематология — исследование крови — охватывает гораздо больше. Врачи, специализирующиеся в области гематологии (гематологи), возглавляют многие достижения в лечении и профилактике заболеваний крови.
Если у вас или вашего близкого человека диагностировано заболевание крови, ваш лечащий врач может направить вас к гематологу для дальнейшего обследования и лечения.
Плазма
Жидкий компонент крови называется плазмой, смесью воды, сахара, жира, белка и солей. Основная задача плазмы — транспортировать клетки крови по вашему телу вместе с питательными веществами, продуктами жизнедеятельности, антителами, белками свертывания крови, химическими посредниками, такими как гормоны, и белками, которые помогают поддерживать баланс жидкости в организме.
Красные кровяные тельца (также называемые эритроцитами или эритроцитами)
Известные своим ярко-красным цветом, красные клетки являются наиболее многочисленными клетками крови, составляя от 40 до 45 процентов ее объема. Форма эритроцита представляет собой двояковогнутый диск со сплющенным центром — другими словами, на обеих сторонах диска есть неглубокие углубления, похожие на чашу (эритроцит выглядит как пончик).
Производство красных кровяных телец контролируется эритропоэтином, гормоном, вырабатываемым в основном почками.Красные кровяные тельца появляются в костном мозге как незрелые клетки и примерно через семь дней созревания попадают в кровоток. В отличие от многих других клеток, красные кровяные тельца не имеют ядра и могут легко менять форму, помогая им проходить через различные кровеносные сосуды в вашем теле. Однако, хотя отсутствие ядра делает эритроцит более гибким, оно также ограничивает жизнь клетки, поскольку она проходит через мельчайшие кровеносные сосуды, повреждая мембраны клетки и истощая ее запасы энергии.В среднем эритроцит выживает всего 120 дней.
Красные клетки содержат особый белок, называемый гемоглобином, который помогает переносить кислород из легких к остальным частям тела, а затем возвращает углекислый газ из организма в легкие, чтобы его можно было выдохнуть. Кровь кажется красной из-за большого количества красных кровяных телец, которые приобретают свой цвет благодаря гемоглобину. Процент объема цельной крови, который состоит из эритроцитов, называется гематокритом и является общей мерой уровня эритроцитов.
Белые кровяные тельца (также называемые лейкоцитами)
Белые кровяные тельца защищают организм от инфекции. Их намного меньше, чем красных кровяных телец, и они составляют около 1 процента вашей крови.
Наиболее распространенным типом лейкоцитов является нейтрофил, который является клеткой «немедленного ответа» и составляет от 55 до 70 процентов от общего количества лейкоцитов. Каждый нейтрофил живет меньше суток, поэтому ваш костный мозг должен постоянно вырабатывать новые нейтрофилы, чтобы поддерживать защиту от инфекции.Переливание нейтрофилов, как правило, неэффективно, поскольку они не остаются в организме надолго.
Другой основной тип белых кровяных телец — лимфоциты. Есть две основные популяции этих клеток. Т-лимфоциты помогают регулировать функцию других иммунных клеток и напрямую атакуют различные инфицированные клетки и опухоли. В-лимфоциты вырабатывают антитела, которые представляют собой белки, которые нацелены на бактерии, вирусы и другие чужеродные материалы.
Тромбоциты (также называемые тромбоцитами)
В отличие от красных и белых кровяных телец, тромбоциты на самом деле не клетки, а скорее небольшие фрагменты клеток.Тромбоциты помогают процессу свертывания крови (или коагуляции), собираясь в месте травмы, прилипая к слизистой оболочке поврежденного кровеносного сосуда и образуя платформу, на которой может происходить свертывание крови. Это приводит к образованию фибринового сгустка, который покрывает рану и предотвращает вытекание крови. Фибрин также образует начальную основу, на которой формируется новая ткань, способствуя заживлению.
Более высокое, чем обычно, количество тромбоцитов может вызвать ненужное свертывание крови, что может привести к инсультам и сердечным приступам; однако, благодаря достижениям в области антиагрегантной терапии, существуют методы лечения, помогающие предотвратить эти потенциально смертельные события.И наоборот, более низкое, чем обычно, количество может привести к обширному кровотечению.
Полный анализ крови (CBC)
Полный анализ крови (CBC) дает вашему врачу важную информацию о типах и количестве клеток в вашей крови, особенно об эритроцитах и их процентном содержании (гематокрит) или содержании белка (гемоглобин), лейкоцитах и тромбоцитах. Результаты общего анализа крови могут диагностировать такие состояния, как анемия, инфекция и другие расстройства. Количество тромбоцитов и тесты на свертываемость плазмы (протомбиновое время, частичное тромбопластиновое время и тромбиновое время) можно использовать для оценки нарушений кровотечения и свертывания крови.
Ваш врач может также сделать мазок крови, который позволяет исследовать ваши кровяные тельца под микроскопом. В нормальном мазке крови эритроциты выглядят как обычные круглые клетки с бледным центром. Различия в размере или форме этих клеток могут указывать на заболевание крови.
Откуда берутся клетки крови?
Клетки крови развиваются из гемопоэтических стволовых клеток и образуются в костном мозге посредством строго регулируемого процесса гемопоэза.Гематопоэтические стволовые клетки способны превращаться в эритроциты, лейкоциты и тромбоциты. Эти стволовые клетки циркулируют в крови и костном мозге у людей любого возраста, а также в пуповине новорожденных. Стволовые клетки из всех трех источников можно использовать для лечения различных заболеваний, включая лейкоз, лимфому, недостаточность костного мозга и различные иммунные нарушения.
Где я могу найти дополнительную информацию?
Если вы хотите узнать больше о болезнях и расстройствах крови, вот еще несколько ресурсов, которые могут вам помочь:
статей из гематологии , учебной программы ASH
Учебное пособие Американского общества гематологии (ASH), ежегодно обновляемое экспертами в данной области, представляет собой сборник статей о текущих вариантах лечения, доступных пациентам.Статьи сгруппированы здесь по типу заболевания. Если вы хотите узнать больше о конкретном заболевании крови, мы рекомендуем вам поделиться этими статьями и обсудить их со своим врачом.
Результаты клинических исследований, опубликованные в Кровь
Найдите Кровь , официальный журнал ASH, чтобы найти результаты последних исследований крови. В то время как недавние статьи обычно требуют входа в систему, пациенты, заинтересованные в просмотре статьи с контролируемым доступом в Blood , могут получить копию, отправив запрос по электронной почте в издательский офис Blood .
Группы пациентов
Этот раздел включает список веб-ссылок на группы пациентов и другие организации, которые предоставляют информацию.
.Образование
клеток крови | Описание, процесс и типы клеток крови
Образование клеток крови , также называемое гематопоэз или гематопоэз , непрерывный процесс, при котором клеточные компоненты крови пополняются по мере необходимости. Клетки крови делятся на три группы: красные кровяные тельца (эритроциты), белые кровяные тельца (лейкоциты) и тромбоциты крови (тромбоциты). Лейкоциты подразделяются на три большие группы: гранулоциты, лимфоциты и моноциты.
Британская викторина
Человеческое тело
Как называется система в организме человека, транспортирующая кровь?
Клетки крови образуются не в самом кровотоке, а в определенных кроветворных органах, особенно в костном мозге определенных костей. У взрослого человека костный мозг производит все эритроциты, 60–70 процентов лейкоцитов (т.е.е., гранулоциты) и все тромбоциты. Лимфатические ткани, особенно тимус, селезенка и лимфатические узлы, производят лимфоциты (составляющие 20–30 процентов белых клеток). Ретикулоэндотелиальные ткани селезенки, печени, лимфатических узлов и других органов продуцируют моноциты (4–8 процентов лейкоцитов). Тромбоциты, представляющие собой небольшие клеточные фрагменты, а не полные клетки, образуются из кусочков цитоплазмы гигантских клеток (мегакариоцитов) костного мозга.
Мазок костного мозга с миелоцитами Мазок костного мозга показывает скопление эритроидных клеток (A), нейтрофильных миелоцитов (B и C) и ранних нейтрофильных метамиелоцитов (D). Unifformed Services University of the Health Sciences (USUHS)
В человеческом эмбрионе первым местом образования крови является желточный мешок. Позднее в эмбриональном периоде печень становится наиболее важным органом, формирующим эритроциты, но вскоре на смену ей приходит костный мозг, который во взрослой жизни является единственным источником как красных кровяных телец, так и гранулоцитов.И красные, и белые кровяные тельца возникают в результате серии сложных, постепенных и последовательных превращений из примитивных стволовых клеток, которые обладают способностью образовывать любой из предшественников клетки крови. Клетки-предшественники — это стволовые клетки, которые достигли той стадии, когда они готовы к формированию определенного типа новых клеток крови.
тромбоцитов Микрофотография круглой агрегации тромбоцитов (увеличение в 1000 раз). Доктор Ф. Гилберт / Центры по контролю и профилактике заболеваний (CDC) (Номер изображения: 6645)
У нормального взрослого человека в костном мозге каждые поллитра (почти пинта) крови вырабатываются эритроциты. неделю.Почти 1 процент эритроцитов в организме вырабатывается каждый день, и баланс между производством эритроцитов и удалением стареющих эритроцитов из кровообращения точно поддерживается. Скорость образования клеток крови варьируется в зависимости от человека, но типичное производство может составлять в среднем 200 миллиардов эритроцитов в день, 10 миллиардов лейкоцитов в день и 400 миллиардов тромбоцитов в день.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской.
Подпишитесь сегодня
.
Текущие достижения в создании эритроцитов с использованием стволовых клеток из различных источников
Переливания крови являются неотъемлемой частью современной системы здравоохранения. На сегодняшний день кровоснабжение во многом зависит от донаций. К сожалению, сбор продуктов крови клинического качества стал сложной задачей из-за ускоренного старения населения, которое не только увеличивает потребность в переливании крови, но и уменьшает количество здоровых доноров. Более того, людям с тяжелыми гематологическими аномалиями или редкими фенотипами крови необходимы альтернативные терапевтические подходы вместо обычного переливания крови.В этих аспектах возникла концепция производства клеток крови in vitro / ex vivo , и многие попытки были сосредоточены на производстве зрелых эритроцитов, так называемых красных кровяных телец (эритроцитов), наиболее распространенного и важного компонента. среди производных крови. В этом обзоре мы даем общий обзор текущих стратегий создания эритроцитов из различных источников стволовых клеток, включая плюрипотентные стволовые клетки (PSC), а также стволовых клеток циркулирующей крови, а также оставшихся проблем, которые необходимо преодолеть до их практического применения.
1. Введение
Клиническая потребность в переливании крови остается высокой при хирургических вмешательствах и гематологических злокачественных новообразованиях. Однако дисбаланс в предложении и спросе на кровь усилился из-за демографического старения, учащения вспышек передачи инфекционных заболеваний, таких как лихорадка Эбола и денге, и ограниченной совместимости донорской крови [1, 2]. Старение населения снижает количество здоровых доноров и увеличивает частоту заболеваний, требующих переливания крови [3].Кроме того, современные технологии не позволяют полностью контролировать заболевания, передаваемые через кровь, что вызывает проблемы с безопасностью [4]. Другой серьезной проблемой традиционной системы кровоснабжения является нехватка продуктов крови для пациентов с множественными аллоантителами или антигенами с высокой заболеваемостью, а также с редкими группами крови [5]. Таким образом, поколение универсальных кровезаменителей in vitro было широко исследовано в попытке снизить клиническую зависимость от донорства крови и решить неудовлетворенные клинические потребности [6, 7].
Эритропоэз — это процедура развития, при которой мультипотентные гемопоэтические стволовые клетки / клетки-предшественники (HSPC) ограничиваются образованием циркулирующих эритроцитов [8]. При приверженности клеточной судьбы эритроидному клону HSPC теряют свой потенциал самообновления и начинают дифференцироваться в эритроидных предшественников, которые состоят из активно делящихся эритроидных взрывообразующих единиц (BFU-E), за которыми следуют менее пролиферативные эритроидные колониеобразующие единицы ( КОЕ-Е). После дальнейшего созревания последовательные промежуточные стадии эритробластов, называемые проэритробластами и базофильными, полихроматофильными и ортохроматическими эритробластами, дают ретикулоциты, которые затем окончательно дифференцируются в зрелые эритроциты.Весь процесс происходит в нише костного мозга, состоящей из клеточных и внеклеточных взаимодействий, и регулируется несколькими биологически активными молекулами, такими как факторы роста, цитокины и гормоны [9, 10]; поэтому создание функциональных эритроцитов in vitro по-прежнему является сложной задачей.
Поскольку полностью дифференцированные эритроциты не являются пролиферативными, создание расширяемых HSPC и / или эритроидных предшественников, поддающихся эритропоэзоподобному процессу созревания in vitro , было приоритетным вопросом для производства эритроцитов.В последние десятилетия исследователи успешно создали эритроциты в лаборатории и доказали их терапевтический потенциал на животных моделях [11]. Было разработано несколько стратегий для получения эритроцитов in vitro : (1) повторение онтогенетического гематопоэза в направлении эритрогенеза с использованием плюрипотентных стволовых клеток (PSC), (2) перепрограммирование судьбы стволовых клеток или соматических клеток до гематопоэтического происхождения и (3) ) стимулирование роста и созревания циркулирующих HSPCs, выделенных из пуповинной крови (UCB) и периферической крови (PB) [12, 13].Поскольку общие основы производства эритроцитов были установлены, исследователи сейчас пытаются оптимизировать процедуру, чтобы получить достаточное количество функциональных эритроцитов наиболее удобным и экономичным способом (таблица 1). Например, недавно была предпринята попытка иммортализации HSPC или предшественников эритроидов для получения достаточного количества зрелых эритроцитов. В этом обзоре мы представляем текущие стратегии генерации эритроцитов с последними достижениями и обсуждаем остающиеся проблемы для клинического применения, чтобы обеспечить обзор текущего состояния этой области.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
PSC: плюрипотентные стволовые клетки; ESC: эмбриональные стволовые клетки; ИПСК: индуцированная плюрипотентная стволовая клетка; UCB: пуповинная кровь; PB: периферическая кровь; HSPC: гемопоэтические стволовые клетки / клетки-предшественники. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2. Повторение гематопоэза развития с помощью PSC
Благодаря монументальной работе Яманака и его коллег, индуцированные PSC (ИПСК) могут быть получены из широкого спектра соматических клеток с использованием хорошо воспроизводимых, четко определенных протоколов [ 14, 15]. Этот прорыв позволяет нам использовать плюрипотентные стволовые клетки в терапевтических целях с меньшими этическими проблемами по сравнению с эмбриональными стволовыми клетками (ЭСК) [16, 17]. Подобно ESCs, iPSCs являются бессмертными клетками с бесконечной способностью к самообновлению, и они могут генерировать эмбриональные тела (EB), которые спонтанно дифференцируются в три зародышевых листка — эктодерму, мезодерму и энтодерму in vitro и in vivo .Поскольку образование EB повторяет несколько ключевых аспектов эмбрионального развития, можно смещать направление дифференцировки в сторону предполагаемого происхождения или типа клеток посредством модуляции активности транскрипционных факторов и морфогенных сигналов, как наблюдалось in vivo [18]. Поэтому было предпринято множество попыток трансформировать PSC в RBC посредством последовательной модификации условий культивирования после образования EB [19]. В общем, процедура дифференцировки состоит из двух этапов: этап 1, генерация HSPC, происходящих из PSC, и этап 2, спецификация клонов HSPC в зрелые RBC.
На сегодняшний день несколько биоактивных компонентов, включая интерлейкин- (IL-) 3, IL-6, лиганд Flt3 (Flt3-L), гранулоцитарный колониестимулирующий фактор (G-CSF), фактор стволовых клеток (SCF) и тромбопоэтин. (ТПО) считаются важными факторами эмбрионального гематопоэза [20–23]. Кроме того, известно, что активин А стимулирует участие мезодермального клона в гематопоэтической судьбе посредством сигнального пути активин / узел [24], в то время как костный морфогенетический белок-4 (BMP-4), критический морфоген, ответственный за дорсально-вентральный ориентация оси во время ранней стадии эмбриона может увеличивать гематопоэтическую популяцию CD34 + с высоким свойством самообновления [24, 25].Эти четко определенные химические комбинации широко используются для стимуляции гемопоэтической дифференцировки EB, а дополнительное лечение эритроидными факторами, такими как эритропоэтин (EPO) [26] и фактор роста эндотелия сосудов (VEGF) [27], может стимулировать дальнейшую дифференцировку. HSPC, происходящих из ПСХ, в эритроциты [28, 29].
В дополнение к методу EB стромальные питающие клетки могут поддерживать гематопоэтическую приверженность PSCs в качестве основного клеточного компонента во время гематопоэтического развития in vivo .Choi et al. обнаружили, что иммортализованные стромальные клетки OP9, происходящие из костного мозга мышей, могут стимулировать гематопоэтическую эритромиелоидную дифференцировку iPSCs [30, 31], как это наблюдается в ESCs [32, 33]. Сообщалось, что стромальные клетки, происходящие из области аорта-гонады-мезонефроса мышиных эмбрионов, обладают высокой способностью поддерживать образование и размножение HSPC in vitro [34]. Между тем, несколько групп выделили HSPC из ткани тератомы, полученной из ИПСК, после трансплантации in vivo .HSPCs, происходящие из тератомы, обладают мультипотентными потенциалами дифференцировки, которые могут успешно восстанавливать гематопоэтическую систему мышей-реципиентов с ослабленным иммунитетом, подтверждая, что тератома может действовать как гематопоэтическая ниша [35, 36]. Хотя этот подход не может быть применен в практической области из-за соображений безопасности, он может способствовать моделированию заболеваний и генетическим исследованиям гематологических заболеваний в доклинических условиях.
В 2007 году Hanna et al. создали HSPC, производные ИПСК, и доказали их терапевтический потенциал при аутосомно-рецессивном гематологическом заболевании с аномальными гемоглобин-содержащими эритроцитами, серповидноклеточной анемии (SCA) [37].Вкратце, они создали аутологичные ИПСК мыши с использованием дермального фибробласта, выделенного из модели гуманизированного нокаута SCA, и провели генную коррекцию для создания нормальных линий ИПСК. Затем ИПСК были вынуждены агрегировать с образованием EB в гемопоэтических условиях, чтобы стимулировать гемопоэтическую дифференцировку. Наконец, полученные HSPC, полученные из ИПСК, трансплантировали мышам-донорам и оценивали терапевтические результаты. Они показали, что полученные из ИПСК клетки крови были успешно приживлены, а патологические характеристики дефектов эритроцитов, обнаруженных в SCA, были улучшены у мышей, получавших лечение клетками, что означает, что полученные из ИПСК HSPC могут полностью дифференцироваться в нормальные эритроциты и заменить нарушенную систему крови in vivo. .Точно так же Raya et al. собирали взрослые фибробласты пациента с анемией Фанкони (FA), редким генетическим заболеванием, характеризующимся гематологическими аномалиями из-за недостаточности костного мозга [38]. Они исправили мутировавшие гены, чтобы исправить генетический дефект, затем преобразовали их в ИПСК (FA-ИПСК) с последующим образованием EB в присутствии OP9, чтобы вызвать эффективную гематопоэтическую дифференцировку. Было отмечено, что генно-скорректированные FA-ИПСК дали начало нормальным гематопоэтическим линиям в виде ИПСК без FA после имплантации in vivo мышам, что подчеркивает терапевтический потенциал специфичных для пациента ИПСК-производных HSPC после генной коррекции генетических гематологических нарушений. .
Кроме того, иммортализация эритроидных предшественников, происходящих из PSC, посредством генетической модификации будет способствовать увеличению производства ex vivo RBC. Такаяма и др. представила стратегию иммортализации для поколения мегакариоцитов-эритроцитов-предшественников из ИПСК с использованием временной системы экспрессии c-Myc во время индукции HSPC [39]. Они изменили исходный протокол гемопоэтической дифференцировки, чтобы улучшить спецификацию эритроидов, и обнаружили, что присутствие ЭПО в культуральной среде может увеличивать пролиферацию, а также дифференцировку сверхэкспрессированных c-Myc ИПСК в направлении эритроидного происхождения, хотя эти дифференцированные клетки, по-видимому, претерпевают апоптоз [40 ].Чтобы предотвратить апоптотическую гибель клеток, они дополнительно трансдуцировали PSC с помощью Dox-индуцируемого вектора экспрессии для гена B-клеточной лимфомы-экстрабольшой (Bcl-xL), члена семейства Bcl-2, который функционирует как антиапоптотический белок. Следует отметить, что сверхэкспрессия как c-Myc, так и Bcl-xL позволяет эритробластным клеткам экспоненциально увеличиваться. Наконец, они смогли создать иммортализованные линии клеток-предшественников эритроцитов с помощью клональной селекции и подтвердили их способность к созреванию в эритроциты и способность к восстановлению in vivo .В другом исследовании Kurita et al. сгенерировали бессмертных предшественников эритроидов из ИПСК, используя двухэтапный протокол [41]; вкратце, они сверхэкспрессировали один гемопоэтический транскрипционный фактор Tal1 в ИПСК, чтобы индуцировать дифференцировку эритроидов более эффективно, чем культивируемые клетки в условиях гемопоэтической культуры в течение 16 дней. Затем дифференцированные HSPC были иммортализованы путем трансформации белками E6 / E7. Эти установленные клеточные линии могут непрерывно размножаться и поддерживать скорость деления клеток более года.Они также сообщили, что постепенное производство гемоглобина с увеличением экспрессии маркера зрелых эритроцитов, такого как гликофорин (GPA), наблюдалось в этих клетках после дифференцировки эритробластов, демонстрируя практический потенциал иммортализованных линий HSPC и / или RBC, полученных из PSC, в качестве замены обычные продукты крови.
3. Репрограммирование судьбы клеток с использованием гемопоэтических факторов транскрипции (TF)
Основная концепция создания ИПСК заключается в преобразовании полностью дифференцированных клеток в ESC-подобные примитивные плюрипотентные стволовые клетки.С определенными четырьмя TF, Oct3 / 4, Sox2, Klf4 и c-Myc, возможно обратить вспять процесс развития и переориентировать судьбу соматических клеток на iPSCs [14, 15]. Как описано выше, iPSCs затем подвергаются «направленной дифференцировке» в целевую линию с использованием специфических факторов роста и морфогенов; однако этот процесс требует всестороннего понимания биологии развития, чтобы имитировать оптимальные условия дифференцировки in vivo , а также трудоемкую и дорогостоящую процедуру культивирования in vitro .
В этом отношении была разработана усовершенствованная технология так называемого «прямого преобразования». Основываясь на данных профилирования экспрессии в масштабе всего генома, исследователи проанализировали глобальные паттерны транскриптомов во время фиксации клонов и обнаружили несколько основных ТФ, специфичных для типов клеток, которые инициируют и / или управляют процедурой дифференцировки. Важно отметить, что когда эти TF вводятся в соматические клетки, они перепрограммируют судьбу клеток непосредственно в предполагаемую линию, не проходя через плюрипотентное состояние.Используя этот метод, можно успешно трансдифференцировать несколько типов клеток, включая нервные стволовые клетки [42], гепатоциты [43], кардиомиоциты [44] и клетки поджелудочной железы [45] из соматических клеток.
За последние несколько лет в многочисленных исследованиях сообщалось о различных комбинациях TF для достижения гематопоэтического преобразования [10, 46]. На сегодняшний день наиболее часто используемым фактором репрограммирования является TF Gata2, регулирующий гематопоэз, и другие родственные TF, такие как Lmo2, Tal1, Scl, Fos, Gfi1B и Erg, должны быть объединены для репрограммирования судьбы соматических клеток как таковых в гематопоэтических клетках. происхождение [47–49].Известно, что большинство этих TF коррелируют с гематопоэтической спецификацией во время эмбрионального развития. После гиперэкспрессии гемопоэтического ТФ соматические клетки вынуждены подвергаться де-дифференцировке на стадии гемогенного эндотелия, а затем приобретают HSPC-подобные характеристики с потенциалом многолинейной дифференцировки. Интересно, что эктопическая экспрессия единственного фактора Oct4, который является важным TF для приобретения плюрипотентности, может трансформировать фибробласты в HSPC-подобную популяцию в условиях гемопоэтической культуры; однако производные клетки демонстрируют ограниченную мультипотентность, а также плохую способность к приживлению [50].Mitchell et al. также применили этот метод для репрограммирования судьбы фибробластов и обнаружили, что экспрессирующие Oct4 фибробласты могут генерировать либо гематопоэтические клетки, либо нейрональные предшественники, в зависимости от состава среды, используемой в процессе репрограммирования [51]. Это исследование предполагает, что избыточная экспрессия Oct4 может увеличивать пластичность клеток из-за его мощного потенциала репрограммирования, тогда как оптимизация условий культивирования должна быть объединена для завершения спецификации клонов.
Стратегия перепрограммирования, индуцированного TF, также применима к ESC и iPSC для повышения эффективности их преобразования в HPSC.Поскольку эти клетки готовы к дифференцировке, они, как правило, требуют меньшего количества TF для дифференцировки HSPC по сравнению со зрелыми соматическими клетками. Гомеодомен TF HoxB4 и родственный ему регулятор Cdx4, как известно, способствуют индукции гемогена в ПСХ in vitro и in vivo [52, 53]. Интересно, что потенциал дифференцировки происходящих из PSC HSPCs может управляться TF. Сообщается, что комбинация Gata2 и Etv2 стимулировала ESCs для генерации пан-миелоидных предшественников, тогда как замена Etv2 на Tal1 вместо этого приводила к асимметричному процессу дифференцировки в сторону эритромегакариоцитарного клона [54].Следовательно, определение роли каждого гемопоэтического TF должно предшествовать установлению надежной и эффективной стратегии перепрограммирования гемопоэза.
4. Использование циркулирующих HSPC, непосредственно выделенных из крови
Исследователи разработали протокол спецификации in vitro RBC из циркулирующих HSPC и доказали терапевтический потенциал сгенерированных RBC как в доклинических, так и в клинических условиях [55–57]. Циркулирующие HSPC можно получить непосредственно из костного мозга или крови.Из-за инвазивности процедуры забора костного мозга PB и UCB считаются наиболее распространенными источниками HSPC CD34 + и ex vivo -продуцируемых эритроцитов. Кроме того, мононуклеарные клетки, выделенные из лейкоцитов донорской крови, могут дифференцироваться в эритроциты [58].
Как резервуар для CD34 + HSPC, UCB имеет ряд преимуществ перед PB [59, 60]. Клетки, происходящие из UCB, имеют относительно низкую вероятность заражения инфекционными агентами, передающимися с кровью, и клеточными аномалиями, связанными со старением, такими как спонтанные генетические мутации.UCB, как известно, часто содержит незрелые примитивные предшественники с превосходным потенциалом пролиферации и дифференцировки. Действительно, Giarratana et al. сообщили, что происходящие из UCB HSPCs способны в среднем увеличиваться в 140 000 раз, в то время как плато пролиферации составляло только 16 500 и 29 000 раз для собранных естественным путем и мобилизованных с помощью G-CSF PB-HSPC, соответственно [56]. Более того, стандартизованные банковские системы UCB предоставляют надежную возможность использовать UCB с удобством. Напротив, поставка PB в значительной степени зависит от здоровых добровольцев, что затрудняет решение этических проблем, а также технических проблем при получении клеток CD34 + клинического уровня.Эти преимущества UCB приводят к более широкому применению клеток, полученных из UCB, по сравнению с другими клетками человеческого происхождения как в фундаментальных, так и в клинических областях исследований.
Учитывая количество эритроцитов, необходимое для обычного переливания (количество клеток на одну единицу переливания), основным препятствием для практического использования выделенных из крови HSPC является их ограниченная способность к самообновлению. Согласно нашим наблюдениям, около CD34 + HSPC можно выделить с помощью 1 мл UCB. Другие сообщили, что ~ 10 9 мононуклеарных клеток присутствуют в одной единице UCB (100 ~ 150 мл), в то время как только 1-2% из них составляют HSPC CD34 + [61].Поэтому было предпринято множество попыток получить достаточное количество HSPCs и / или предшественников эритроидного клона до индукции созревания эритроцитов (Таблица 2).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E: эритропоэтин; F: родственный fms лиганд тирозинкиназы 3; GM: гранулоцитарно-макрофагальный колониестимулирующий фактор; I: интерлейкин 3; S: фактор стволовых клеток; Т: тромбопоэтин. Складчатая экспансия CD34 + HSPC и эритробластов; количество гемоглобина 10 6 CD34 + RBC клеточного происхождения; ссылались на оценку авторов.1 единица переливания эритроцитов — это примерно эритроциты. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4.1. Оптимизация традиционных методов культивирования
За последние несколько десятилетий было разработано несколько протоколов для оптимизации процесса, подобного эритропоэзу in vitro . В настоящее время в большинстве методов получения эритроцитов используется система культивирования бессывороточных жидких сред с различными гематопоэтическими и эритропоэтическими факторами [62]. Отмечено, что ЭПО опосредует экспансию, выживание и дифференциацию КОЕ-Е и предшественников, коммитированных эритроидом, в то время как генетические мутации в ЭПО или гене рецептора ЭПО приводят к эмбриональной летальности с тяжелой анемией [62, 63].SCF — еще один важный фактор для развития эритроцитов, учитывая, что нарушение передачи сигналов набора рецепторов SCF посредством мутации или лечения антагонистами привело к нарушению эритропоэза в костном мозге из-за дефекта образования BFU-E и CFU-E [64]. Хотя комбинация EPO и SCF значительно увеличила распространение проэритробластов CD34 + HSPC CD71 + по сравнению с одним только EPO или SCF [65], они могут играть отличительную роль в генерации эритроцитов в отношении различных паттернов экспрессии их рецепторов. во время уточнения эритроидной линии.Между тем, ТПО, важный стимулятор роста HSPC, по-видимому, вызывает мегакариоцитарную дифференцировку с последующим относительным сокращением популяции эритроцитов [66], хотя он может стимулировать восстановление системы крови за счет увеличения размножения эритроидных предшественников и созревания эритроцитов, как это наблюдается при миелосупрессивном лечении. модель мыши [67]. Таким образом, следует установить стадийно-зависимые комбинации факторов для получения полностью зрелых эритроцитов из выделенных из крови HSPC in vitro (таблица 2).
Кроме того, совместное культивирование со стромальными клетками может не только стимулировать пролиферацию CD34 + HSPC, но также повысить эффективность созревания эритроцитов.Giarratana et al. продемонстрировали, что стромальные клетки мыши MS-5 могут успешно поддерживать экспоненциальную экспансию выделенных UCB HSPCs и их созревание в функциональные, энуклеированные эритроциты как in vitro , так и in vivo [56, 68]. Fujimi et al. сообщили о продвинутом состоянии эритропоэтического совместного культивирования с использованием двух разных поддерживающих клеток в зависимости от стадии [69]. В этом исследовании производные PB клетки CD34 + совместно культивировали с трансдуцированными геном теломеразы человеческими стромальными клетками во время так называемой «первой фазы» для увеличения популяции HSPC.Эти клетки заставляли дифференцироваться в эритробласты с использованием обычного метода жидкого культивирования (вторая фаза), а затем совместно культивировали с макрофагами с третьей по четвертую фазы для дальнейшего размножения и созревания эритроцитов. Используя этот метод, исследователи достигли примерно 10 6 -кратного расширения эритробласта из одной клетки CD34 + . Более того, окончательный фенотипический анализ на 38 день культивирования показал, что совместное культивирование с макрофагом может увеличить долю энуклеированных эритроцитов в общем количестве клеток на 40-70% до более 99%.Таким образом, теоретически около 3 трансфузионных единиц эритроцитов () можно получить только из PB-изолированных клеток CD34 + . Принимая во внимание более высокую пролиферативную активность HSPC, происходящих из UCB, чем у PB-клеток [56], возможно, стоит оценить выход генерации RBC из выделенных UCB HSPC с использованием этого метода. Другой отчет Baek et al. предположил важность происхождения стромальных питающих клеток во время генерации эритроцитов [70]. Они выделили клетки CD34 + из UCB, затем индуцировали дифференцировку RBC в течение трех недель, включая стадию сокультивирования с BM-MSC или UCB-MSC с 8 по 21 день.Интересно, что наиболее эффективный результат наблюдался, когда процесс спецификации RBC поддерживался UCB-MSCs, в которых окончательная кратность экспансии была почти удвоена по сравнению с BM-MSC. Хотя лежащий в основе механизм не был выяснен, это исследование предоставит новое понимание для применения клеток, полученных из UCB, для генерации эритроцитов, поскольку оно может предоставить питающие MSCs, а также производные от CD34 + HSPC эритроидные предшественники.
4.2. Применение системы биореактора или биомиметической ниши
Гематопоэз происходит в нише костного мозга, и это специализированное микроокружение состоит из различных типов клеток, таких как МСК, остеобласты, адипоциты и эндотелиальные клетки с хорошо организованным внеклеточным матриксом [71, 72] .Они производят биоактивные сигнальные соединения и обеспечивают оптимальные механические силы за счет сложных взаимодействий. Более того, величина уровней экспрессии цитокинов и концентрация кислорода в нише костного мозга жестко регулируются для поддержания оптимального микроокружения для гемопоэза. В самом деле, экспансия HSPC была значительно увеличена в костном каркасе, содержащем BM-MSCs [73–75]. В этом отношении неудивительно, что было предпринято множество попыток воспроизвести гематопоэтическую нишу in vitro с помощью биомиметических материалов.Чтобы создать искусственную нишу, сначала необходимо подготовить адекватную структуру каркаса, а затем ввести поддерживающие нишу клетки с последующим посевом HSPC. МСК, происходящие из BM и UCB, являются наиболее часто используемыми типами клеток, имитирующими нишу, поскольку они обладают как остеогенным, так и адипогенным потенциалами. Кроме того, были впервые применены несколько биосравнительных материалов для создания повторяющей нишу структуры для эффективного производства крови. По сравнению с традиционной системой 2D-культивирования, 3D-каркас с макропористой структурой, такой как изготовленная полимерная матрица, сделанная из любого природного вещества (например,например, коллаген и фибронектин) или синтетические материалы (например, L-молочно-гликолевая кислота и пористый диакрилат полиэтиленгликоля), по-видимому, полезны для поддержания высокоэффективных функциональных HSPC в течение длительного периода времени [76–78] . Одним из критических ограничений этого метода является то, что клетки должны быть изолированы от подобных нише структур для дальнейшей спецификации клонов и созревания в RBC. Таким образом, биомиметическая система культивирования, зависящая от ниши, нуждается в технических модификациях для прямого получения зрелых эритроцитов.
Недавно система биореактора также была применена для крупномасштабного производства клеток in vitro [79]. Поскольку питательная среда в биореакторе автоматически заменяется для поддержания оптимальных условий культивирования, можно получить большое количество клеток-мишеней за пределами лабораторного уровня. Кроме того, система без кормушки позволяет производителям установить экономически эффективный протокол культивирования, не содержащий ксено, что дает большое преимущество для клинических приложений.Согласно последнему отчету, авторы продемонстрировали, что теоретически более 500 трансфузионных единиц эритроцитов могут быть получены только из пяти миллионов полученных из CB клеток CD34 + с использованием биореакторного метода [80]; однако ни о конечной скорости энуклеации, ни об общем количестве зрелых эритроцитов после фильтрации для удаления ядерных клеток не сообщалось. Следовательно, воспроизводимость и выполнимость этих результатов должны быть подтверждены до практического использования.
4.3. Генетические модификации для иммортализации эритробластов, полученных из крови
Поскольку HSPC и коммитированные эритропоэтические предшественники, выделенные из UCB или PB, постепенно прекращают пролиферировать в течение 2-3 недель после культивирования и вместо этого начинают дифференцироваться в зрелые эритроциты, регуляторы клеточного цикла и факторы, вызывающие плюрипотентность являются обычными кандидатами на генетические манипуляции для поддержания деления клеток, а также на другие стратегии иммортализации [81, 82].Было отмечено, что время генетической модификации имеет решающее значение для получения высокопролиферативных функциональных эритробластов.
Группа Ченга представила индуцирующие ИПСК факторы Oct4, Sox2, Klf4 и c-Myc в сочетании с p53-siRNA в эритробласты CD235 + , полученные из UCB. Они обнаружили, что эритробласты со сверхэкспрессией Klf4, Sox2 и c-Myc (iE-клетки) показали значительную способность к пролиферации (~ 10 68 раз в год) при сохранении незрелого фенотипа, в то время как экспрессия Oct4 была незаменимой и даже играла роль несколько отрицательная роль в долгосрочной культуре [83].Далее они отметили, что только Sox2 и c-Myc могут поддерживать генерацию иммортализованных предшественников эритроцитов. Всестороннее сравнение глобального транскриптома между iE-клетками и первичными эритробластами, происходящими из UCB, показало, что несколько семейств Sox2 (Sox2, Sox4, Sox6 и Sox21) и Myb были активированы в iE-клетках по сравнению с первичными клетками, не только предоставляя информацию об основных механизмах. но также предлагает новые кандидаты TF для иммортализованного поколения предшественников эритроцитов. В другом исследовании Geiler et al.сосредоточили внимание на потенциальной роли транскрипта SPI-1 PU.1, ключевого гематопоэтического транскрипционного фактора, в эритропоэзе и выдвинули гипотезу, что избыточная экспрессия PU.1 может препятствовать созреванию эритроцитов и вместо этого стимулировать экспансию предшественников эритроцитов [84]. Чтобы подтвердить гипотезу, вектор PiggyBac, содержащий SPI-1, трансфицировали в эритробласты, происходящие из PB-HSPC. Они наблюдали непрерывное размножение трансфицированных эритробластов в течение 45 дней без дальнейшего созревания в эритроциты на основе их паттернов экспрессии маркеров CD (CD71 + CD117 + ), оцененных с помощью проточной цитометрии.Trakarnsanga et al. продемонстрировали другой протокол иммортализации для эритроидных предшественников, полученных из клеток CD34 + , полученных из PB [85]. В этом отчете PB-HSPC были трансдуцированы с помощью Tet-индуцибельной системы экспрессии E6 / E7, а затем культивированы в условиях спецификации эритроида для создания иммортализованных взрослых предшественников эритроидов (называемых клетками BEL-A). Они подчеркнули, что клетки BEL-A имеют несколько общих морфологических и молекулярных характеристик со взрослыми эритробластами и ретикулоцитами, включая паттерны экспрессии мембранных антигенов и гемоглобина.Эритроциты, полученные из BEL-A, после процесса энуклеации могут транспортировать кислород аналогично нормальным эритроцитам взрослых. Наконец, выживаемость и созревание ретикулоцитов BEL-A были подтверждены в кровотоке мышей, что указывает на их большой потенциал для клинического использования. Взятые вместе, эти исследования предполагают, что генная инженерия с факторами репрограммирования или гематопоэтическими регуляторами может преобразовывать первичные эритробласты в иммортализованную клеточную линию, что усиливает возможность применения продукта ex vivo RBC в клинической области.
5. Текущие ограничения и перспективы генерации эритроцитов
Чтобы установить надежный и эффективный протокол генерации эритроцитов, сначала необходимо определить лучший источник клеток для индукции эритроцитов. Наиболее выдающимися характеристиками ESC и iPSC являются их неограниченная возможность расширения. В частности, ИПСК могут быть более предпочтительным источником клеток, чем ЭСК, потому что они могут быть применены к генерации крови, специфичной для пациента или реципиента, с дополнительными модификациями генов, как описано выше [37, 38].Также возможно пройти через весь протокол от генерации ИПСК до созревания эритроцитов в условиях надлежащей производственной практики (GMP), что будет важным требованием для использования in vitro / ex vivo -генерированных биоматериалов в клинической области. . С другой стороны, общие вопросы безопасности, включая потенциальную канцерогенную способность недифференцированных ИПСК, должны быть решены до практического применения продуктов, полученных на основе ИПСК. Между тем, UCB содержит примитивные мультипотентные HSPC, которые можно легко дифференцировать в клон-специфичное потомство в определенных условиях культивирования.UCB также может предоставлять другие клеточные компоненты для поддержания гемопоэтической культуры, такие как МСК и другие гемопоэтические клетки, которые могут поддерживать пролиферацию, а также дифференцировку HSPC. Наконец, в банковской системе будут сохранены только те UCB, которые соответствуют количеству (количеству ячеек) и критериям безопасности (без каких-либо инфекционных агентов). Следовательно, удобнее получать кроветворные клетки из UCB с проверенным качеством по сравнению с другими источниками человеческого происхождения.
Чтобы перевести эритроцитов, продуцируемых in vitro / ex vivo , в клиническую область, необходимо решить несколько сложных проблем.Во-первых, необходима фенотипическая характеристика произведенных эритроцитов по сравнению с наивными эритроцитами. Поскольку PSCs и происходящие из UCB клетки ближе к эмбрионам, чем к взрослым с точки зрения статуса развития, PSC- и UCB-производные RBCs имеют тенденцию обладать недостаточными паттернами созревания [28, 86]. В нескольких исследованиях сообщалось, что эритроциты, происходящие из PSC, в основном экспрессируют эмбриональный и эмбриональный гемоглобин с незначительной экспрессией взрослого гемоглобина [86, 87]. Точно так же RBC, происходящие из UCB, содержат более незрелый тип глобинов, чем производные PB, хотя недостаточное созревание RBC может быть завершено in vivo [88, 89].Эти незрелые гемоглобины все еще функционируют и обладают даже более высоким сродством связывания кислорода, чем взрослые [90]; тем не менее, для определения сопоставимости эритроцитов, происходящих из PSC или UCB, необходимо интенсивное сравнение глобинов взрослого и плода. Кроме того, было отмечено, что некоторые из поверхностных антигенов эритроцитов, происходящие из UCB, по-видимому, дифференциально экспрессируются по сравнению с антигенами наивных или PB-полученных RBC [58]. Учитывая, что профилирование поверхностных антигенов важно для оценки зрелости эритроцитов, а также для прогнозирования проблем безопасности и эффективности после переливания, различия в характере экспрессии антигенов группы крови между нормальными и произведенными эритроцитами следует оценить до клинического применения.
Другой серьезной проблемой является получение значительного количества эритроцитов для переливания. Следует отметить, что динамическая система культивирования в суспензии с биореактором рассматривается как отличный заменитель традиционной 2D-культуры. Теоретически 560 единиц трансфузии, самый высокий выход за всю историю, может быть получен из одной единицы UCB в системе биореактора, когда клетки были дополнены SCF, EPO и IL-3 [80]. Кроме того, исследователи успешно создали иммортализованную линию предшественников эритроидов, которая имеет экспоненциальный потенциал роста и, следовательно, может быть долгосрочным источником ex vivo эритроцитов [83].Любая техника может применяться сама по себе; однако оптимизированная комбинация этих двух стратегий дала бы больший результат. Следует отметить, что эффективное генерирование эритроцитов также способствует проведению различных попыток с использованием передовой концепции, направленной на производство пригодных для использования клеточных продуктов. Недавно Хоксворт и др. продемонстрировали доказательство концепции улучшения совместимости эритроцитов с использованием техники редактирования генов [91]. В этом исследовании 5 основных антигенов группы крови, включая KEL, RHAG, ACKR1, FUT1 и GYPB, были удалены из иммортализованной линии эритроидных клеток BEL-A посредством нацеливания на комбинацию генов с помощью системы CRISPR-Cas9 для минимизации проблем безопасности, связанных с несовместимым переливанием. .Авторы успешно создали несколько нокаутных линий эритроидов без каких-либо нецелевых мутаций и подтвердили устранение экспрессии каждого антигена с помощью непрямого анализа антиглобулинов. Важно отметить, что никаких заметных физиологических изменений в процессе дифференцировки и созревания в нокаут-клетках по сравнению с нормальными эритроцитами не наблюдалось, что позволяет предположить, что не только обычное, но и индивидуальное трансфузионное устройство для реципиентов с редкими типами крови может быть произведено в больших масштабах из иммортализованных линий эритроцитов. .В целом, эти непрерывные усилия по разработке передовых стратегий для рентабельной, высокоэффективной системы культивирования эритроцитов в сочетании с инженерными методами в конечном итоге будут способствовать практическому использованию ex vivo -генерируемых эритроцитов в ближайшем будущем.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов относительно публикации этой статьи.
Вклад авторов
Юджин Со и Кён-Хва Шин внесли равный вклад в эту работу.
Благодарности
Это исследование было поддержано грантом Института биомедицинских исследований (2017-B003) больницы Пусанского национального университета.
.
границ | Красные кровяные тельца: в погоне за взаимодействиями
Введение
Красные кровяные тельца (эритроциты) — наиболее распространенный тип клеток в крови человека. Они лишены ядер, рибосом, митохондрий и других органелл, которые важны в других типах клеток для выполнения специфических функций, критических для выживания клеток (Adams, 2010). Этот нетрадиционный клеточный состав был разработан для того, чтобы обеспечить накопление гемоглобина, белка, который отвечает за доставку кислорода (O 2 ) к периферическим тканям.У типичного здорового взрослого человека каждую секунду 2 миллиона новообразованных эритроцитов попадают в кровоток из костного мозга и в то же время выводится примерно такое же количество (Хиггинс, 2015). Производство эритроцитов, или эритропоэз, — это строго регулируемый процесс, при котором новые эритроциты постоянно производятся в нише костного мозга, располагаясь бок о бок в богатой среде с различными клетками и другими тканями, такими как эндотелиальные клетки (ЭК), остеобласты, стромальные клетки, гемопоэтические клетки, а также белки внеклеточного матрикса.В костном мозге они находятся в прямом контакте с молекулами клеточной адгезии, факторами роста и цитокинами (Dzierzak and Philipsen, 2013). На последнем этапе процесса созревания эритроцитов, который происходит в течение первых двух дней в кровотоке, ретикулоциты или преждевременные эритроциты попадают в периферическую кровь. Они проходят процесс выборочной сортировки, в ходе которого они теряют 20% плазматической мембраны и оставшееся содержание РНК. В частности, мембрана эритроцитов претерпевает различные морфологические и структурные изменения от стадии созревания до стадии клиренса.Они подвергаются множественным и часто строго регулируемым процессам, чтобы реконструировать свою структуру, начиная с утраты сложной системы органелл и последующего приобретения типичной двояковогнутой формы.
Этот процесс вызывает отбор, сегрегацию и истощение мембранных белков (Moras et al., 2017), как снижение Na + / K + АТФазы, натрий-водородного антипортера 1 (NHE1), гликофорина A ( GPA), кластер дифференцировки 47 (CD47) и кластер дифференцировки 36 (CD36), система антиген / хемокин Даффи (DARC) и антиген Келла (XK) с потерей рецептора трансферрина (CD71) и молекулы межклеточной адгезии-4 ( ICAM4).Напротив, другие соответствующие мембранные белки увеличиваются во время созревания эритроцитов по сравнению с ретикулоцитами, такие как полоса 3, гликофорин C (GPC), резус-белок (Rh), Rh-ассоциированные гликопротеины (RhAG), XK и GPA (Minetti и др., 2018).
После созревания эритроциты приобретают замечательную способность к деформации в ответ на внешние силы (Huisjes et al., 2018) и используют это для прохождения через самые узкие кровеносные капилляры (Viallat and Abkarian, 2014). Важность этой характеристики становится более очевидной, когда дефекты и аномалии, связанные с формой и / или деформируемостью эритроцитов, приводят к резкому и преждевременному очищению клеток.Эти изменения могут предоставить ключевую информацию для установления дифференциального диагноза и классификации различных заболеваний (Ford, 2013).
В последние десятилетия много сообщалось о сложности взаимодействий между различными компонентами зрелой мембраны эритроцитов и другими клетками. Однако полный обзор этих взаимодействий отсутствует. В этом обзоре мы сосредоточены на широких и разнообразных типах взаимодействий, которые, как было описано, происходят между эритроцитами и другими клетками, присутствующими в периферической крови, а также на последствиях этих взаимодействий.Многие из известных взаимодействий опосредуются компонентами мембран эритроцитов (рис. 1).
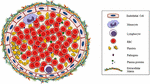
Рис. 1. В сечении сосуда показаны все возможные клетки, белки плазмы, бактерии и внеклеточный матрикс, которые участвуют во взаимодействии с эритроцитами.
Структура мембраны эритроцитов и мембранного каркаса
В эритроцитах цитоскелет и плазматическая мембрана чрезвычайно и тесно связаны, образуя фундаментальную и сложную структуру, называемую мембранным скелетом.Это важно для формы и обратимой деформируемости эритроцитов. Благодаря сохранению структурной целостности мембраны; РБК гибки и способны выжить в обращении (Lux, 2016). RBC могут деформироваться с линейным удлинением примерно до 250%, тогда как увеличение площади поверхности на 3–4% приводит к лизису клетки. Этими уникальными мембранными свойствами эритроциты обязаны взаимодействию оболочки плазматической мембраны с цитоскелетом. Плазматическая мембрана состоит из липидного бислоя со встроенными трансмембранными белками, которые образуют мультибелковые комплексы.Сам бислой состоит из равных пропорций холестерина и фосфолипидов (Cooper, 2000). Для структурной целостности бислой связывается с мембранным скелетом через два комплекса макропротеинов: анкириновый комплекс и соединительный комплекс (также известный как комплекс 4.1R). Скелет эритроцитов — это белковая сеть, наиболее важными компонентами которой являются спектрин, актин, актин-ассоциированные белки, белок 4.1R и анкирин. Мембранный скелет состоит из тетрамеров спектрина, которые связывают короткие актиновые филаменты, которые, в свою очередь, образуют псевдогексагональное расположение с шестью треугольными спектринами, связывающими один актиновый филамент.Каждое расположение имеет три комплекса соединений и три комплекса анкирина, которые способствуют связям мембрана-цитоскелет (Goodman and Shiffer, 1983; Mankelow et al., 2012; Lux, 2016). Анкириновый комплекс может связывать анкирин с β-спектрином с одной стороны и полосой 3 и RhAG в мембране эритроцитов с другой стороны. Комплекс соединений связывает мембранные белки GPC и GPD, XK, Rh и Duffy с актин-спектриновым цитоскелетом посредством взаимодействия с белком 4.1R (Mohandas and Gallagher, 2008; Burton and Bruce, 2011; Lux, 2016).
Существует более 50 типов трансмембранных белков, встроенных в липидный бислой, которые участвуют в транспорте, адгезии и структурной целостности (Рисунок 2). Трансмембранный транспорт осуществляется несколькими белками, такими как полоса 3, аквапорин-1, переносчик глюкозы 1 (GLUT1), белок антигена Кидда, RhAG и различные переносчики ионов, в зависимости от груза. Белки, участвующие в адгезии или межклеточных взаимодействиях, включают ICAM-4 и Lu. Как правило, эритроциты не считаются адгезивными клетками, но в нескольких исследованиях сообщалось об экспрессии большого количества молекул адгезии (Altankov, Serafimov-Dimitrov, 1990; de Oliveira, Saldanha, 2010; Weisel and Litvinov, 2019).Однако при ряде патологических и связанных с заболеванием обстоятельств, таких как серповидно-клеточная анемия (ВСС), малярия, истинная полицитемия, наследственный сфероцитоз, окклюзия вены сетчатки и сахарный диабет, эритроциты заметно меняют свое поведение и становятся стимулированными и, следовательно, прилипают к ним. друг друга (Steffen et al., 2011) и, в частности, эндотелию (Coste et al., 2001; Kaul, 2008; Grossin et al., 2009b; Colin et al., 2014).
Рисунок 2. Сечение мембраны эритроцитов с акцентом на состав интегральных мембранных белков, включенных в фосфолипидный бислой.
Взаимодействия, опосредованные трансмембранными транспортными белками
Ионный транспортёр
Большая часть мембраны эритроцитов занята анионообменными белками. Это позволяет эритроцитам поддерживать правильный баланс между внеклеточной и внутриклеточной водой и содержанием растворенных веществ, чтобы сохранить нормальную физиологическую функциональность и гомеостаз эритроцитов. Например, если приток натрия превышает отток калия, эритроциты набухают, и, наоборот, если отток калия превышает приток натрия в эритроциты, клетки сокращаются (Gallagher, 2017).По этой причине резкое изменение или дефект в механизме, контролирующем баланс гидратации, может привести к измененному и необычному поведению эритроцитов (Azouzi et al., 2018).
Группа 3
Основным белком-анионообменником в мембранах RBC является полоса 3. Этот трансмембранный гликопротеин (100 кДа) обеспечивает целостность мембраны RBC. Кроме того, N-концевая сторона цитоплазмы является ключевым местом для соединения с мембранным скелетом, гликолитическими ферментами и дезоксигемоглобином, тогда как C-концевая интегральная сторона мембраны выполняет роль переносчика анионообменного обмена и поддерживает транспорт углекислого газа (Lux, 2016 ).Изменения на уровне гамоглобина могут передаваться на мембрану, и это вызывает окислительный стресс и олигомеризацию полосы 3, которая играет важную роль в опосредованном макрофагами клиренсе измененных и старых эритроцитов за счет образования индуцированных старением антигенов, которые распознаются естественными антителами ( NAbs; Klei et al., 2017; Azouzi et al., 2018).
Многочисленные сайты связывания связывают полосу 3 с другими мембранными белками. Таким образом обеспечивается важная сеть, позволяющая передавать сигналы от мембраны к цитоскелету и наоборот, регулируя тем самым гибкость, стабильность и деформируемость эритроцитов.Рифкинд и Нагабабу показали, что взаимодействие гемоглобина (Hb) с полосой 3 в условиях гипоксии является критическим для генерации изменений мембраны эритроцитов, которые запускают удаление из кровотока (Rifkind and Nagababu, 2013). У пациентов с сахарным диабетом полоса 3 гликозилирована (AGE) и связывается с рецептором конечных продуктов гликирования (RAGE), присутствующих на ЭК, и это усиливает оксидантный стресс в стенке сосудов (Schmidt et al., 1996; Grossin et al. ., 2009а). Гликирование белков вызывает ряд изменений, которые связаны с высоким риском сосудистых осложнений, что особенно характерно при сахарном диабете в микроциркуляции глаз, что приводит к ретинопатии и диабетической нефропатии (Wautier et al., 2004).
PIEZO1
Недавно обнаруженный неселективный катионный канал PIEZO1 представляет собой механосенсор, который играет важную роль в поддержании гомеостаза объема эритроцитов. Известно, что генетические мутации PIEZO1 являются основной причиной наследственного ксероцитоза. Эти генетические изменения влияют на кинетику каналов, реакцию на осмотический стресс и мембранный перенос (Glogowska et al., 2017), тем самым вызывая снижение общего содержания клеточных катионов, кальция и калия без пропорционального потребления натрия и воды, что в конечном итоге приводит к значительному обезвоживанию ( Bae et al., 2013; Оноре и др., 2015; Patel et al., 2015). Природа этого канала в первую очередь и напрямую зависит от активации механическими силами (то есть толчками, растяжением и напряжением сдвига) (Cahalan et al., 2015; Gottlieb, 2017; Parpaite and Coste, 2017). Существует несколько гипотез относительно механизмов активации PIEZO1. Один поддерживает модель «силы от липидов», в которой натяжение мембраны может вызвать реорганизацию липидов вокруг белка, вызывая открытие канала. Другая теория — это «сила от филаментов», которая поддерживает модель взаимодействия и связывания канала с внеклеточным матриксом или межклеточными белками цитоскелета (Murthy et al., 2017). Функциональные исследования показали, что определенные области белка более восприимчивы к механическим воздействиям, чем другие области. Более того, существует множество механических стимулов, таких как напряжение сдвига, создаваемое потоком жидкости по клеткам, которые могут взаимодействовать и, следовательно, активировать каналы PIEZO1 (Murthy et al., 2017). Однако эти механизмы до сих пор полностью не изучены, и PIEZO1 признан потенциальным кандидатом на катионный путь, индуцированный растяжением, и участвует в старении эритроцитов и стрессе сдвига кровообращения (Багрянцев и др., 2014). Также было описано, что он играет роль в инвазии малярийного паразита ( Plasmodium falciparum ) (Zuccala et al., 2016; Ma et al., 2018). Интересно, что было обнаружено, что треть африканского населения является носителем нового варианта PIEZO1, который связан с устойчивостью к малярии in vitro (Ma et al., 2018).
Канал KCNN4-Гардос
Канал Гардоса, или KCNN4 / IK-1, представляет собой активируемый кальцием калиевый канал, который присутствует в небольшом количестве копий на мембране эритроцитов.Фактически, расчетное количество каналов на один измеренный эритроцит составляет около 10 (Grygorczyk et al., 1984; Brugnara et al., 1993; Thomas et al., 2011; Kaestner, 2015). Опосредованные каналом Gardos взаимодействия с другими типами клеток являются косвенными и часто опосредуются двумя другими мембранными белками: PIEZO1 и другим неизвестным рецептором. Примером является способность эритроцитов изменять свое соотношение форма / объем, чтобы проходить через узкие капилляры и промежутки (Danielczok et al., 2017). Механизм, стоящий за этим, заключается в активации PIEZO1, что приводит к увеличению внутриклеточного Ca 2+ , который, в свою очередь, инициирует активность канала Gardos.Это также подразумевает, что каналы Гардоса играют роль в нарушениях, связанных с гидратацией эритроцитов, например, при наследственном ксероцитозе (Gallagher, 2017; Rapetti-Mauss et al., 2017).
Что касается взаимодействия между каналом Gardos и предполагаемым ассоциированным неизвестным рецептором на мембране RBC, была обнаружена связь между рецептором эндотелина и активностью Gardos с повышенными уровнями цитокинов, таких как эндотелин-1, интерлейкин-8 и фактор активатора тромбоцитов ( PAF) в плазме пациентов с SCD: это заболевание характеризуется внутренним свойством гемоглобина S серповидно при деоксигенации.Серповидность усиливается при различных условиях, включая обезвоживание из-за активации каналов Gardos с последующей потерей K + (Rivera et al., 2002). Кроме того, было показано, что SCD RBC взаимодействует с сосудистыми ЭК, тем самым стимулируя высвобождение эндотелина-1 и регулируя экспрессию соответствующего гена в культуре. Этот механизм может вносить вклад в вазоокклюзионные явления, наблюдаемые при SCD (Phelan et al., 1995).
Недавно были обнаружены патологические изменения, коррелирующие с мутациями в гене канала Gardos (Fermo et al., 2017): на самом деле, в некоторых случаях сообщалось о пациентах с гемолитической анемией, несущих исключительно эти мутации, ответственные за это заболевание (Glogowska et al., 2015; Gallagher, 2017). Эти мутации изменяют чувствительность Ca 2+ , влияя на порог активации, но также изменяют функциональные свойства, делая канал более активным, что приводит к обезвоживанию эритроцитов с дефицитом внутриклеточного калия (Archer et al., 2014; Andolfo et al., 2015; Rapetti -Mauss et al., 2015; Fermo et al., 2017).
Другие транспортные белки
Другими важными транспортными белками эритроцитов являются GLUT-1, ответственный за транспорт глюкозы, ABCB6 (аденозинтрифосфат-связывающая кассета), связанный с биосинтезом гема и транспортом порфирина, пассивный переносчик мочевины (Azouzi et al., 2013), для сохранения осмотического стабильность и деформируемость клетки (Macey, 1984), аквапорин-1, ключевая пора для транспорта воды и фундамент для метаболизма и транспорта CO 2 , а также анионные каналы с регулируемым объемом (VRAC), небольшой проводник, растягивающийся активированный канал с важным и недавно обнаруженным компонентом SWELL1 (LRRC8A), расположенный вблизи поры канала и ответственный за регуляцию гомеостаза объема клетки (Qiu et al., 2014; Syeda et al., 2016; Галлахер, 2017; Hsu et al., 2017). Кроме того, существуют также регуляторные белки, которые взаимодействуют с функциями транспортных каналов, такие как стоматин, который является основным белком мембран эритроцитов человека, который в основном взаимодействует с каналами, упомянутыми выше (Rungaldier et al., 2013). В настоящее время неизвестно, могут ли эти транспортные белки вызывать взаимодействия с другими клетками.
Взаимодействия, опосредованные фосфолипидами
Мембраны эритроцитов состоят из сложной смеси различных видов фосфолипидов, различающихся головной группой и боковыми цепями (Kuypers, 2008).Состав липидного бислоя аналогичен составу любой другой клетки: имеется равное распределение холестерина и фосфолипидов (Cooper, 2000), в то время как существует асимметричная пропорция четырех основных фосфолипидов между двумя листочками (Рисунок 3). Фактически, внешний листок мембраны богат фосфатидилхолином (PC, 27% от общего количества фосфолипидов мембраны) и сфингомиелином (SM, 23%), в то время как внутренний листок в основном состоит из фосфатидилэтаноламина (PE, 30%) фосфатидилсерина (PS , 15%) и минорный фосфоинозитид (PI, 5%) (Goodman, Shiffer, 1983; Pasvol et al., 1992; Кайперс и де Йонг, 2004 г .; Мохандас и Галлахер, 2008 г .; Фудзимото и Пармрид, 2016). Белки транслоказы, присутствующие в мембране эритроцитов, флиппаза, флоппаза и скрамблаза, ответственны за движение фосфолипидов. Флиппаза и флоппаза поддерживают и регулируют асимметрию в ответ на разные стимулы и сигналы (Smith and Lambert, 2003; Hankins et al., 2015). Напротив, известно, что активация скрамблазы участвует в потере и нарушении асимметрии мембранных фосфолипидов, что важно для поддержания гомеостаза липидов в мембранах эритроцитов (Pretorius et al., 2016).
Рисунок 3. Пример состава основных фосфолипидов мембраны эритроцитов.
Несбалансированная пропорция и состав мембранных липидов приводят к дефектам, которые могут влиять на активацию мембранных белков и в некоторых случаях приводить к таким заболеваниям, как гемолитическая анемия: на самом деле, повышенное содержание фосфатидилхолина в эритроцитах было зарегистрировано при некоторых промежуточных синдромах наследственный ксероцитоз, связанный с дефектом PIEZO1 (Clark et al., 1993; Имашуку и др., 2016; Галлахер, 2017).
Фосфатидилсерин (PS)
Фосфатидилсерин — аминофосфолипид, который, как известно, играет решающую роль в опосредовании распознавания стареющих эритроцитов, выступая в качестве сигнала «съешь меня». Во время старения, при повреждении клеток или при определенных патологических условиях скрамблаза перемещает PS из внутреннего листочка во внешний, что приводит к увеличению концентрации на внешней поверхности (Nguyen et al., 2011). Было показано, что эритроциты пациентов с SCD экспонируют PS при деоксигенации, и этот процесс опосредуется притоком Ca 2+ , активирующим каналы Gardos.Фактически, скрамблазе требуется Ca 2+ для скремблирования PS (Weiss et al., 2011; Wesseling et al., 2016). Воздействие PS на эритроциты выполняет вторую фундаментальную физиологическую функцию, которая способствует коагуляции. Обычно описывается, что воздействие ПС увеличивает адгезионную способность (Kaestner et al., 2012; Kaestner and Minetti, 2017). Что касается его роли в коагуляции, было показано, что эритроциты могут напрямую связываться с CD36 и PS-рецептором (PSR) на ЭК (Closse et al., 1999; Manodori et al., 2000; Setty et al., 2002; Heppel, 2008), а также через CXCL16 или CD36, присутствующие на тромбоцитах после их активации (с помощью ADP или тромбина) (Walker et al., 2013). PSR активируется после активации микрососудистых ЭК липополисахаридами (LPS), цитокинами, гипоксией и гемом (Setty and Betal, 2008). Хемокиновый лиганд 16 CXC (CXCL16) является прямым лигандом для PS, экспонированного на RBC (Borst et al., 2012). CXCL16 сильно активируется при стимуляции воспалительными цитокинами, такими как IFN-γ или TNF-α (Abel et al., 2004), но также пептидогликанами бактериальной стенки (Abed et al., 2013). Другой способ стимулирования воздействия PS — взаимодействие тромбоцитов с FasR в эритроцитах через FasL (Mackman, 2018). Более того, ключевым взаимодействием, индуцированным PS, является инициирование клиренса клеток, в котором участвуют различные фагоцитирующие клетки, такие как макрофаги, и обычно происходит в печени и селезенке. Было идентифицировано, что различные рецепторы опосредуют прямое связывание посредством распознавания PS, такие как Tim1, Tim4 и Stabilin-1, что приводит к фагоцитозу (Kobayashi et al., 2007; Park et al., 2009). Кроме того, существует несколько мостиковых молекул или опсонинов, таких как лактадгерин, тромбоспондин, Gas6, белок S, которые могут облегчить распознавание макрофагов при взаимодействии с PS, экспонируемым на RBC (de Back et al., 2014). Наконец, было показано, что изменения в соотношении холестерин / фосфолипид в эритроцитах оказывают заметное влияние на воздействие PS: фактически, избыток холестерина ингибирует воздействие PS, тогда как истощение холестерина увеличивает его (van Zwieten et al., 2012) и это может привести к повышенной чувствительности к клиренсу этих клеток.
Взаимодействия, опосредованные гликопротеинами
Гликофорины
Семейство гликофоринов представляет собой группу трансмембранных белков [гликопротеинов A-D (GPA-D)], которые играют важную роль в регулировании механических свойств RBC (Chasis and Mohandas, 1992).Они представляют собой наиболее распространенный интегральный тип белков мембраны эритроцитов, насчитывающий около миллиона копий на клетку (Alenghat and Golan, 2013; Aoki, 2017).
Гликофорин A является основным сиалогликопротеином, ответственным за чистый отрицательный поверхностный заряд клеточной мембраны: по этой причине сильно гликозилированные гликаны во внеклеточном домене важны для минимизации межклеточных взаимодействий и агрегации эритроцитов (Chasis and Mohandas, 1992; Poole , 2000). С этой сложной внеклеточной структурой GPA играет роль в составе перицеллюлярного матрикса, гликокаликса (Poole, 2000).GPA также участвует в распознавании патогенов, действуя как рецептор-ловушка в эритроцитах. Он опосредует связывание патогенов с поверхностью эритроцитов, тем самым предотвращая вторжение этих организмов в важные ткани (Morera and MacKenzie, 2011). Следовательно, нагрузка патогенов снижается, поскольку патогены, связанные с эритроцитами, обычно выводятся макрофагами в селезенке (Baum et al., 2002).
Кроме того, показано, что сиалогликопротеины (GPA, GPB и GPC) играют решающую роль во вторжении малярийных паразитов в эритроциты (т.е.е., P. falciparum ). Эритроциты, дефицитные по любому из сиалогликофоринов, в разной степени сопротивляются заражению мерозоитами (Pasvol, 1984). Например, Гербих-отрицательная группа крови (Ge-), характеризующаяся дефектной экспрессией рецептора GPC, связана с устойчивостью к малярии с высокой распространенностью в эндемичных по малярии регионах (Williams, 2006).
Молекула межклеточной адгезии 4 (ICAM-4)
Молекула межклеточной адгезии 4 представляет собой гликопротеин, который играет решающую роль в межклеточном взаимодействии или адгезии с потенциальным значением во множестве физиологических процессов, включая гемостаз и тромбоз (de Oliveira and Saldanha, 2010).Он связывается с различными членами семейств рецепторов интегрина, экспрессируемыми в лейкоцитах (WBC) и ЭК (Goel, 2002; Hermand et al., 2002), и может активироваться в RBC под действием гормона адреналина. При воздействии адреналина ICAM-4 способен напрямую связываться с интегрином α v β 3 на ЭК (Zennadi et al., 2004; Kaul et al., 2006; Trinh-Trang-Tan et al., 2010 ; Zhang et al., 2017) посредством активации пути цАМФ-PKA. Адреналин стимулирует β2-адренорецепторы в эритроцитах, которые, в свою очередь, стимулируют аденилатциклазу.Аденилилциклаза катализирует производство цАМФ из АТФ. Наконец, АТФ активирует протеинкиназу A (PKA) через каскад киназы 1/2 (ERK 1/2), регулируемый внеклеточными сигналами, и фосфорилирует ICAM-4 до активного состояния, которое может связываться с интегрином α v β 3 на активированные ЭК. В этом процессе заякоренные белки А-киназы (AKAP) имеют решающее значение, поскольку они направляют PKA в определенные места в клетке, инициируя фосфорилирование соседних рецепторов эритроцитов (Zennadi et al., 2012; Maciaszek et al., 2013; Zhang et al., 2017). Также было показано, что ICAM-4 имеет потенциальное физиологическое значение в опосредовании взаимодействий эритроцитов и тромбоцитов при гемостазе и тромбозе (Hermand et al., 2004). Интегрин тромбоцитов α IIb β 3 (рецептор фибриногена GPIIb-IIIa) был идентифицирован как рецептор для ICAM-4 in vitro (Hermand et al., 2002) и в условиях потока (Du et al., 2014). Специфический связывающий ICAM-4 пептид может конкурентно блокировать связывание фибриногена с интегрином α IIb β 3 .Блокирование взаимодействия через ICAM-4 и интегрин α IIb β 3 уменьшало отложение тромбина и фибрина, при этом в сформированных тромбах присутствовали более толстые и меньшее количество волоконных ветвей. Вероятно, это будет иметь клинические последствия, поскольку значительно более длительное время кровотечения из хвоста наблюдалось у мышей, у которых был заблокирован путь ICAM4-интегрина α IIb β 3 . Механизм снижения образования тромбов может заключаться в том, что взаимодействие ICAM-4-α IIb β 3 вызывает внутриклеточную передачу сигналов в тромбоцитах, активируя другие тромбоциты (Du et al., 2014). За счет блокирования α IIb β 3 связывание эритроцитов с тромбоцитами снизилось с 72 до 29% (Du et al., 2014), что указывает на то, что α IIb β 3 участвует во взаимодействии эритроцитов с тромбоцитами. Кроме того, было высказано предположение, что это взаимодействие, ведущее к агрегатам эритроцитов и тромбоцитов, может вносить вклад в вазоокклюзионные события, обычно наблюдаемые при SCD (Hermand et al., 2004).
Наконец, другие исследования адгезии гемопоэтических и негемопоэтических клеток показали, что ICAM-4 может также взаимодействовать с интегринами α v β 1 и α v β 5 (Hermand et al., 2004).
Кластер дифференцировки 36 (CD36)
Кластер дифференцировки 36 представляет собой сильно гликозилированный белок, способный связываться с тромбоспондином, фактором фон Виллебранда (vWF) и фибронектином (Lee et al., 2001). Он участвует в гемостазе, тромбозах и воспалениях. CD36 представляет собой молекулу адгезии для моноцитов, тромбоцитов и ЭК. Первоначально экспрессия CD36 на предшественниках эритроидов снижалась по мере созревания, но в начале 1990-х van Schravendijk et al.показали, что CD36 также присутствует на поверхности нормальных эритроцитов взрослого человека. Они также показали, что его экспрессия оказывается физиологически значимой во время заражения P. falciparum , когда CD36 действует как рецептор для образования розеток RBC, инфицированных P. falciparum , с неинфицированными RBC: на самом деле, CD36 определяется как мусорщик. рецептор, связывающий множество лигандов, включая избирательное взаимодействие со специфическим доменом мембранного белка эритроцитов P. falciparum 1 (PfEMP1) (Glenister et al., 2009; Cabrera et al., 2019). Более того, низкая экспрессия этого рецептора может быть достаточной для важных физиологических взаимодействий, ведущих к клеточной адгезии, не только при малярии (Handunnetti et al., 1992). Высокая экспрессия CD36 была обнаружена в SCD RBC и играет ключевую роль в адгезии серповидных клеток к эндотелию и последующему вазоокклюзионному процессу (Lee et al., 2001; Sakamoto et al., 2013). Наконец, также показано, что травма-геморрагический шок вызывает увеличение нескольких молекул адгезии эритроцитов, включая CD36, которые ответственны за адгезию к эндотелиальным рецепторам, таким как интегрин α v
.
