Спонтанный бактериальный перитонит — причины, симптомы, диагностика и лечение
Спонтанный бактериальный перитонит — это инфицирование асцитической жидкости при отсутствии интраабдоминального источника инфекции. Патология проявляется разлитыми болями в животе, фебрильной лихорадкой, диспепсическими расстройствами. Основными в диагностике являются лабораторные методики: стандартный анализ крови, микроскопическое и микробиологическое исследование перитонеального транссудата, ПЦР для обнаружения генетического материала бактерий. Вспомогательный метод — сонография брюшной полости. При СБП назначается этиотропная антибиотикотерапия, также используют пробиотики, растворы альбумина.
Общие сведения
Спонтанный бактериальный перитонит (СБП) — один из клинических вариантов первичного асцита-перитонита. Заболевание считается тяжелым полиэтиологическим осложнением цирроза печени (ЦП). Состояние встречается у 10-37% пациентов, поступивших в стационар с декомпенсированной формой ЦП, намного реже выявляется у амбулаторных больных. Спонтанный перитонит микробного происхождения чаще диагностируется у людей пожилого возраста. Развитие бактериального воспаления брюшины является прогностически неблагоприятным фактором.
Спонтанный бактериальный перитонит
Причины
Спонтанная форма бактериального перитонита возникает только на фоне цирроза печени, сопровождающегося асцитом. В 80% случаев болезнь вызвана двумя видами микроорганизмов: кишечной палочкой и клебсиеллой. В последнее время в гепатологии наметилась тенденция к возрастанию роли грамположительных энтерококков и метициллин-резистентных стафилококков (MRSA). Реже воспаление обусловлено полирезистентными ESBL-продуцирующими бактериями.
Источником инфицирования в большинстве случаев является нормальная микрофлора кишечника. Иногда бактерии проникают из органов мочевыделительной системы, дыхательных путей, очагов инфекции кожи и мягких тканей. Основной фактор риска — прогрессирующий печеночный цирроз с оценкой более 9 пунктов по шкале Чайлд-Пью. У госпитализированных пациентов спонтанный бактериальный перитонит встречается чаще, чем у находящихся на амбулаторном лечении. Такая закономерность связана с высокой частотой инвазивных манипуляций.
Патогенез
Главный патогенетический механизм развития СБП — бактериальная транслокация. Происходит миграция условно-патогенной флоры или продуктов метаболизма бактерий из кишечника в брыжеечные лимфатические узлы, а затем в асцитическую жидкость (АЖ). При циррозе транслокации возбудителей способствует избыточный бактериальный рост в кишечнике на фоне снижения перистальтики, недостатка желчных кислот и гипохлоргидрии.
При миграции бактериальных возбудителей спонтанный перитонит начинается не всегда. Вероятность заболевания зависит от состояния общих и местных факторов иммунной защиты. При декомпенсированном циррозе печени определяется снижение активности системы комплемента, дисфункция нейтрофильных лейкоцитов. В результате происходит активная колонизация асцитической жидкости микроорганизмами с появлением клинической симптоматики.
Классификация
Необходимость классифицировать спонтанный бактериальный перитонит на отдельные формы возникла в клинической гастроэнтерологии сравнительно недавно. Классификация нужна для более точного понимания патогенетических моментов, выбора тактики лечения и отдаленного прогноза для пациентов. При систематизации спонтанного бактериального перитонита учитывают состав перитонеального выпота. Выделяют 4 варианта болезни:
- Классический спонтанный бактериальный перитонит. Характеризуется числом лейкоцитов в АЖ свыше 250 в 1 мкл, а также наличием типичных возбудителей бактериальной инфекции.
- Культуронегативный нейтрофильный асцит. При данной форме в АЖ выявляют повышенное содержание лейкоцитов, но при культуральном исследовании бактерии отсутствуют.
- Мономикробный бактериальный асцит. Представляет собой фазу колонизации в инфицировании асцитической жидкости одним микроорганизмом, не сопровождается клиническими признаками воспалительного процесса.
- Полимикробный бактериальный асцит. Обычно становится результатом травматического парацентеза, когда при ошибке специалиста игла повреждает кишечную стенку. Характеризуется наличием разных бактерий в мазке АЖ.
Симптомы
Признаки бактериального перитонита при цирротическом поражении печени выражены недостаточно, поскольку они накладываются на клиническую картину ведущей патологии. Основным симптомом является боль в полости живота различной локализации и интенсивности. Болевой синдром сопровождается многократной рвотой, которая содержит слизь, желчь, прожилки крови. В начале заболевания характерна диарея, которая сменяется задержкой стула и газов.
Зачастую на первый план выходят проявления системной воспалительной реакции. У большинства больных повышается температура тела до 38°С и выше. Наблюдается одышка с частотой дыхания до 30-40 в минуту. Отмечается тахикардия, пульс слабый, прощупывается с трудом. Возможно угнетение сознания: пациент становится заторможенным, отвечает на вопросы врача или родственников односложно.
Осложнения
Спонтанный бактериальный перитонит протекает тяжело и часто сопровождается полиорганными нарушениями. Самое распространенное осложнение заболевания — гепаторенальный синдром, который наблюдается у 33% больных. Для него характерны низкие уровни артериального давления в сочетании с высокими показателями билирубина. Прогрессирующая почечная недостаточность, резистентная к терапии, приводит к летальному исходу в 54-87% случаев.
В 22,2% случаев СБП осложняется печеночной энцефалопатией, которая без назначения немедленной медикаментозной коррекции переходит в стадию комы. Спонтанный перитонит, как проявление системного воспаления, в 3-10% трансформируется в сепсис и септический шок. Общий уровень смертности при бактериальном инфицировании АЖ и декомпенсации цирроза печени остается достаточно высоким — около 10%.
Диагностика
Постановка диагноза только по клиническим симптомам вызывает затруднения даже у опытных врачей-гастроэнтерологов и гепатологов. Классические признаки — симптомы раздражения брюшины — наблюдаются всего у 20-25%. Для подтверждения спонтанного бактериального перитонита назначается комплекс лабораторно-инструментальных методов, которые должны проводиться незамедлительно. Информативные методы диагностики:
- Общий анализ крови. Для системного воспалительного ответа характерно повышение уровня лейкоцитов более 12 х 109/л и сдвиг лейкоцитарной формулы влево. Одновременно увеличивается показатель СОЭ. Прогностически неблагоприятна лейкопения при прогрессирующем ухудшении состояния пациента.
- Анализ асцитической жидкости. Материал для исследования получают путем диагностического лапароцентеза. Для постановки диагноза достаточно выявления уровня нейтрофилов более 250 клеток в 1 мл. Золотой стандарт диагностики спонтанного перитонита — культуральный посев АЖ для идентификации чистых культур микроорганизмов.
- Определение маркеров микробной инфекции. Современный точный диагностический метод предполагает обнаружение микроорганизмов путем ПЦР. Исследование используется для быстрого определения самых распространенных возбудителей. Дополнительно измеряются уровни молекул иммунного ответа.
- УЗИ брюшной полости. Ультразвуковое исследование выполняется для оценки макроскопических свойств жидкости, скопившейся между листками брюшины. Акустическая неоднородность АЖ, наличие флотирующих нитей фибрина и фибринозных наложений на брюшине позволяет врачу заподозрить диагноз СБП.
Лечение спонтанного бактериального перитонита
Пациентам подбирается консервативная терапия. Согласно рекомендациям международной организации по изучению проблем асцита IAC (International Ascites Club), при выявлении лейкоцитоза в перитонеальном трассудате рекомендована эмпирическая антибиотикотерапия цефалоспоринами 3 поколения, защищенными пенициллинами или фторхинолонами.
После получения результатов посева показана коррекция принимаемых или вводимых антибиотиков при условии их недостаточной эффективности. Лечение антибиотиками длится до нормализации состояния больного и ликвидации лабораторных признаков воспаления. Дополнительно назначается патогенетическая терапия.
Для нормализации онкотического давления крови и уменьшения степени асцита проводят внутривенные вливания растворов альбумина. С целью подавления избыточной бактериальной колонизации кишечника используются пробиотики, которые содержат 3 компонента живых лиофилизированных бактерий. После курса пробиотиков переходят на длительное применение пребиотиков (лактулозы).
Прогноз и профилактика
При раннем начале терапии удается ликвидировать проявления бактериального перитонита, длительный прогноз определяется тяжестью основной патологии. Неблагоприятное течение наблюдается при развитии полиорганной недостаточности. Профилактика СБП путем назначения фторхинолонов необходима всем пациентам с циррозом печени, осложненным асцитом. Больным из группы высокого риска показана непрерывная превентивная антибиотикотерапия.
Спонтанный бактериальный перитонит » Медвестник
Грозное последствие цирроза
Спонтанный бактериальный перитонит (СБП) остается часто встречающимся, но редко диагностируемым осложнением цирроза печени (ЦП). Уточню, что СБП— это прогностически тяжелое осложнение декомпенсированного ЦП. Оно развивается в результате бактериальной транслокации на фоне снижения резистентности организма, избыточного бактериального роста. СБП проявляется контаминацией асцитической жидкости и воспалением брюшины. Частота этого грозного осложнения за последние годы колеблется в пределах от 10 до 37% среди стационарных больных ЦП, осложненным асцитом.
В 1960 годы летальность при этом осложнении составляла около 90%. Отсутствие понимания, правильной диагностики, своевременной и адекватной терапии приводило к неоправданно высокой смертности. В последующие годы смертность от СБП в условиях стационара снизилась до 20—38%.
По своей сути спонтанный бактериальный перитонит — это частная форма первичного асцита-перитонита. Этот термин отражает острое или хроническое воспаление брюшины у больного с асцитом и инфицированием асцитической жидкости, сопровождающееся местными и общими симптомами и нарушением жизненно важных функций организма.
Бактерии проникают через барьер
В основе патогенетических механизмов СБП лежит теория бактериальной транслокации. Суть этого явления заключается в проникновении жизнеспособных бактерий через эпителиальный барьер ЖКТ в экстраинтестинальные ткани организма, например мезентериальные лимфоузлы, селезенку. Там часть из них подвергается лизису макрофагами, часть — через воротную вену попадает в печеночные синусы и лизируется макрофагами печени.
Особое значение в развитии болезни играют факторы патогенности и вирулентности микроорганизмов. К ним относят: факторы адгезии и колонизации, факторы инвазии, факторы, препятствующие фагоцитозу, ферменты «защиты и агрессии» бактерий, а также эндотоксины. Наиболее часто при СБП в асцитической жидкости выявляются следующие микроорганизмы: Escherichia сoli, несколько реже — Streptococci, Staphylococci, реже — Klebsiella oxytoca, Salmonella enteritidis, Enterococcus faecium, Acinectobacter anitratus.
При декомпенсированном ЦП классов В и С по Child-Pugh возникает целый ряд взаимосвязанных механизмов, нарушающих нормальные функции организма, способствующих бактериальной кишечной транслокации и развитию СБП. Это портальная гипертензия, асцит, повышение внутрибрюшного давления, замедление пассажа содержимого по кишечнику, синдром избыточного бактериального роста, снижение белково-синтетической функции печени, белковое голодание, снижение общей иммунореактивности, энтеральной недостаточности, эндотоксемии, а также локальные изменения слизистой кишки в виде нарушения микроциркуляции и проницаемости.
Важную роль в развитии СБП имеет внутрибрюшная гипертензия (ВБГ), которая возрастает при декомпенсации ЦП за счет портальной гипертензии и асцита, с одной стороны, и развития синдрома избыточного бактериального роста— с другой. Увеличение ВБГ замедляет кровоток по нижней полой вене и уменьшает венозный возврат, способствует снижению лимфооттока по грудному лимфатическому протоку, замедляет всасывание асцитической жидкости. Транслокация бактерий формируется по прошествии 3 часов после повышения внутрибрюшного давления до 15 мм рт. ст. А транслокация бактерий при внутрибрюшном давлении > 25 мм рт. ст. развивается в течение часа.
Наличие ЦП классов В и С по Child-Pugh с нарушением функции печени, сопровождается снижением как белково-синтетической функции, так и нарушением функции ретикуло-эндотелиальной системы, что приводит к снижению способности образования антител и формированию вторичного иммунодефицита.
Доказано, что активированные микроорганизмами нейтрофилы, моноциты, макрофаги и клетки эндотелия продуцируют провоспалительные медиаторы — цитокины, кинины, метаболиты арахидоновой кислоты, фактор активации тромбоцитов и оксид азота, которые инициируют и поддерживают воспалительную реакцию, вызывают вторичное выделение аналогичных медиаторов с повреждением эндотелия и снижением органной перфузии и доставки кислорода. В этих условиях печень вместо синтеза альбумина, который и так резко снижен при декомпенсированном ЦП, начинает продуцировать белки острой фазы, такие как гликопротеины, ?1-антитрипсин, С-реактивный белок, церулоплазмин, факторы свертывания, компоненты комплемента, ферритин — вещества, которые, обладая различным действием, способствуют усилению процессов свертывания, воспаления, нарушению метаболизма.
Кроме того, при СБП в итоге происходит снижение функции нейтрофилов, нарушение синтеза лейкотриена, супероксидного аниона, тромбоцитоактивирующего фактора.
Контроль за реализацией иммунной и воспалительной реактивности осуществляется системой цитокинов. Именно баланс взаимоотношений между про- и антивоспалительными медиаторами, при физиологических условиях, способствует созданию условий для уничтожения патогенов и поддержания гомеостаза. При нарушении баланса цитокиновой системы превалируют деструктивные эффекты медиаторов воспаления. Концентрация отдельных провоспалительных цитокинов в крови в норме обычно не превышает 5—20 пкг/мл, может возрастать в 5—10 и более раз, все это приводит к нарушению проницаемости и функции эндотелия капилляров, запуску синдрома ДВC (диссеминированное внутрисосудистое свертывание крови), формированию отдаленных очагов системного воспаления.
Осложнение распознается с трудом
СБП представляет трудно разрешимую диагностическую задачу для клинициста и является одним из наиболее тяжелых и трудно распознаваемых осложнений декомпенсированного ЦП.
Очень редко заболевание дебютирует картиной септического шока, проявляющегося снижением АД ниже 90 мм рт. ст., тахикардией более 100 ударов в 1 мин, олигурией менее 20 мл в 1 час. Многие авторы подразделяют симптомы СБП на местные (боль в животе, рвота, диарея, признаки пареза кишечника) и системные проявления инфекции: лихорадка (повышение температуры выше 37,4 ?С), лейкоцитоз (повышение числа лейкоцитов выше 10 х 109 кл/л), а также энцефалопатия, быстро нарастающая печеночная недостаточность, гепаторенальный синдром. Почечная недостаточность является одним из наиболее грозных осложнений, в значительной степени определяющих прогноз. В связи с этим любое клиническое ухудшение у больного ЦП, осложненным отечно-асцитическим синдромом, может являться следствием СБП.
Диагностика СБП многие годы основывалась на выявлении микроорганизмов в асцитической жидкости с использованием посева на специальные среды. В литературе широко обсуждался вопрос о целесообразности и безопасности диагностического парацентеза при отсутствии подозрений на СБП. До настоящего времени обязательным в диагностике СБП считается исследование асцитической жидкости с проведением подсчета числа полиморфноядерных лейкоцитов (ПЯЛ), определение содержания белка, концентрации альбумина, посева асцитической жидкости на культуральные среды.
Перед диагностическим парацентезом, как правило, проводится УЗИ, при котором в асцитической жидкости могут быть визуализированы нити фибрина, взвесь. При бактериальном перитоните вне зависимости от этиологии увеличивается количество и калибр взвешенных частиц, выявляются множественные нити фибрина, свободно колеблющиеся в асцитической жидкости в такт дыхательным движениям.
«Золотым стандартом» диагностики СБП считается способ определения возбудителей инфекционного процесса с использованием посева асцитической жидкости на питательные среды для выявления роста микроорганизмов с последующей идентификацией в чистой культуре. Бесспорным достоинством метода является его абсолютная специфичность. Однако чувствительность культурального метода не превышает 25—42%, естественно, что отрицательные результаты посева не могут гарантировать отсутствия бактериемии.
В общепринятой клинической практике диагностика СБП основывается на количественном определении содержания нейтрофилов в асцитической жидкости и результатах культурального метода. В соответствии с международными рекомендациями достаточным для постановки диагноза СБП является количество ПЯЛ, равное 250 кл/мм?.
В зависимости от числа нейтрофилов и идентификации возбудителей инфекции выделяют 3 формы проявления СБП:
I — классический, полный вариант СБП. Асцитическая жидкость содержит более 250 ПЯЛ на мм?, дает рост культуры при высевании. Такое сочетание определяет назначение антибактериальной терапии.
II — культуро-негативный нейтрофильный асцит, когда асцитическая жидкость содержит более 250 ПЯЛ на мм?, не дает ростa культуры при высевании. Это состояние также требует обязательного проведения антибактериальной терапии.
III — культуропозитивный асцит с низким содержанием нейтрофилов. Асцитическая жидкость содержит менее 250 ПЯЛ на мм?, дает рост культуры при высевании.
Однако пока остается неясным, какова правильная тактика по отношению к той группе больных, где имеет место клиническая картина СБП, но отсутствует нейтрофилез в асцитической жидкости, а посев жидкости и крови не дает роста, поскольку совершенно очевидно, что такие больные вызывают тревогу у врачей и требуют особой клинической настороженности. Низкая чувствительность метода культивирования асцитической жидкости на средах не позволяет исключить и так называемый IV вариант течения СБП — ложнокультуронегативный с низким содержанием нейтрофилов и наличием клинической картины СБП.
Амилаза и липаза — важные критерии
Дифференциальная диагностика СБП основана на исключении перитонита вторичного генеза, определении основного заболевания, вызвавшего асцит, исключении асцита смешанного генеза, определении наличия инфицированности асцитической жидкости. Наиболее часто у больных с декомпенсированным ЦП проводится дифференциальный диагноз между СБП и вторичными перитонитами, среди которых наиболее часто встречается панкреатит, а также туберкулез. Во многом это связано с тем, что большая часть больных СБП страдает ЦП алкогольной этиологии, хроническим панкреатитом, туберкулезом.
Инфекционные осложнения с поражением поджелудочной железы и забрюшинного пространства развиваются у 40—70% больных панкреонекрозом. Особенно трудна диагностика панкреонекроза у больных с ЦП алкогольной этиологии с транзиторным асцитом, продолжающих злоупотребление алкоголем, когда нарастание асцита может ошибочно расцениваться как проявление отечно-асцитического синдрома. Основными клинико-морфологическими формами панкреатической инфекции являются инфицированный панкреонекроз и панкреатогенный абсцесс, нагноение псевдокисты поджелудочной железы.
Важными диагностическими критериями является повышение уровня амилазы и липазы в асцитической жидкости. В качестве критерия инфицированности применяется определение С-реактивного белка, прокальциотонина.
Во всех случаях необходима оценка клинической картины заболевания, с учетом причин, которые могут вызвать перитонит у больных и без асцита. Число нейтрофилов в асцитической жидкости, как правило, в этих случаях превышает 500 кл/мм3. Наиболее характерным является повышение уровня лактатдегидрогеназы >225 mU/L, общего белка >1 г/дл, снижения глюкозы до 50 мг/дл. По данным УЗИ при вторичном перитоните значительно чаще, чем при СБП, выявляются множественные нити фибрина. Решающее значение в этих случаях имеет лапароскопия.
В дифференциальной диагностике первичного и вторичного бактериальных перитонитов всегда стоит вопрос о целесообразности проведения диагностической лапаротомии или лапароскопии. Хорошо известно, что при ЦП с осложненным течением внутрибрюшные хирургические вмешательства часто имеют неблагоприятный исход. Оперативное вмешательство, даже малоинвазивное, целесообразно только при подозрении на ургентную патологию, поскольку может осложнять течение СБП, приводить к острой печеночной недостаточности.
Международный клуб асцита рекомендует
В соответствии с Рекомендациями Международного клуба асцита подходы к лечению больного с СБП при ЦП могут быть представлены следующим образом. Необходимы, во-первых, антибактериальная терапия, во-вторых, парацентез с возмещением объема плазмы альбумином, в-третьих, лечение и профилактика осложнений.
Антибактериальную эмпирическую терапию проводят цефалоспоринами III поколения (цефотаксим, цефтизоксим, цефтазидим, цефоницид). Наиболее хорошо изученный и часто применяемый препарат из этой группы цефотаксим назначается каждые 12 часов в течение 5 дней в/в, минимальная разовая доза 2 г. Амоксициллин/клавунат калия по эффективности сравним с цефотаксимом, применяется в/в 1,2 г каждые 6 часов в течение 5—7 дней.
Точка зрения на выбор антибиотиков первой линии на сегодняшний день неоднозначна, что связано с ростом резистентности микроорганизмов к антибиотикам. Больным неосложненным СБП (при отсутствии шока, илеуса, гастроинтестинального кровотечения, выраженной печеночной энцефалопатии или повышения сывороточного креатинина более 3 мг/дл), не получавшим ранее профилактически фторхинолоны, может быть рекомендован офлоксацин внутрь в дозе не менее 400 мг каждые 12?часов. Есть исследования, указывающие, что по эффективности применение таблетированного ципрофлоксацина по 500 мг каждые 12 часов не уступает по эффективности цефотаксиму и цефтриксону и даже превосходит их по эффективности в лечении СБП.
В соответствии с международными рекомендациями эффективность проведения адекватной антибактериальной терапии достигает 90%, и она оценивается по снижению содержания ПЯЛ менее 250 кл/мм3 в асцитической жидкости, по исчезновению местных и системных проявлений инфекции.
Оптимальным критерием эффективности считается снижение числа ПЯЛ в асцитической жидкости через два дня от начала антибактериальной терапии по сравнению с исходными показателями. В связи с этим в ходе терапии рекомендуется проводить хотя бы один повторный парацентез через 48 часов от начала терапии. Критериями же неэффективности считается ухудшение состояния в течение первых часов антибактериальной терапии, а также снижение числа ПЯЛ в асцитической жидкости менее чем на 25%.
При отсутствии эффекта от антибактериальной терапии рекомендуется смена антибиотика с учетом чувствительности микрофлоры или эмпирически при отрицательных результатах посева, а также необходимо проведение более тщательной дифференциальной диагностики с вторичным перитонитом.Парацентез с возмещением объема плазмы альбумином рекомендуется к применению при лечении рефрактерных асцитов. Взгляд на эффективность и безопасность этой методики у пациентов с СБП остается спорным.
Непреложной истиной является необходимость проведения мероприятий, направленных на предупреждение и лечение осложнений ЦП, являющихся факторами риска СБП, первичную профилактику СБП.
В настоящее время большие рандомизированные исследования показали высокую эффективность непрерывной профилактики СБП с применением фторхинолонов у больных ЦП, перенесших СБП. В соответствии с Международными рекомендациями профилактика возвратного бактериального перитонита проводится непрерывно норфлоксацином по 400 мг/сут. В связи с низкой выживаемостью после первого эпизода спонтанного перитонита, которая в течение первого года составляет 30—50%, а в течение второго всего 25—30%, рекомендуется рассматривать таких пациентов в качестве кандидатов на трансплантацию печени.
Спонтанный бактериальный перитонит при циррозе является распространенным осложнением, характеризуется высокой смертностью, поздней выявляемостью. Существующие методы диагностики являются либо недостаточно чувствительными, либо обладают низкой специфичностью, сложны в практическом применении, длительны по срокам выполнения. Все это делает актуальными проблемы поиска и разработки новых методов диагностики, лечения и профилактики подобного заболевания.
В связи с расширением представлений о патогенезе спонтанного бактериального перитонита, позволяющим оценить роль избыточного бактериального роста, процессов микробной транслокации, обоснован интерес гепатологов к бактериальным препаратам пробиотикам и эубиотикам в аспекте лечения этого заболевания.
«Золотым стандартом» диагностики СБП считается способ определения возбудителей инфекционного процесса с использованием посева асцитической жидкости на питательные среды для выявления роста микроорганизмов с последующей идентификацией в чистой культуре. Бесспорным достоинством метода является его абсолютная специфичность.
Диагностика вторичного бактериального перитонита требует срочного хирургического вмешательства.
Асцит и спонтанный бактериальный перитонит
При физикальном исследовании у пациентов с асцитом можно выявить притупление перкуторного звука и флюктуацию (симптом, свидетельствующий о наличии свободной жидкости в брюшной полости). Это возможно при ее объеме более чем 500 мл.
Перкуссии больного с асцитом.
При перкуссии живота у пациентов с асцитом обнаруживается тупость над боковыми областями живота, а в центре — тимпанический звук. Перемещение больного на левый бок вызывает смещение тупого звука книзу, и он определяется над левой половиной живота, а справа — тимпанический звук.
При наличии осумкованной жидкости, обусловленной слипчивым перитонитом туберкулезной этиологии или кисты яичника, область выявления перкуторного тимпанического звука не смещается при перемене положения больного.
Для выявления небольшого количества жидкости применяется перкуссия в положении больного стоя: при асците появляется тупой или притупленный звук в нижних отделах живота, исчезающий при переходе больного в горизонтальное положение.
С этой же целью используется такой пальпаторный прием, как флюктуация жидкости: врач правой рукой наносит отрывочные толчки по поверхности живота, а ладонь его левой руки ощущает волну, передающуюся на противоположную стенку живота.
При массивном асците пальпация брюшной стенки болезненна, отмечается выпячивание пупка.
У
больных наблюдаются также периферические отеки, выраженность которых может не соответствовать степени тяжести асцита. Они возникают вследствие сдавления нижней полой вены асцитической жидкостью, а также в результате гипоальбуминемии.
Кроме того, наблюдаются такие симптомы, как: варикозное расширение вен голени, геморроидальных вен; смещение диафрагмы вверх (возникает одышка), смещение сердца и повышение давления в яремной вене; диафрагмальная грыжа и пищеводный рефлюкс, которые способствуют эрозии и кровотечению из вен пищевода. На растянутой брюшной стенке можно увидеть венозные коллатерали.
Плевральный выпот, обычно на правой стороне, имеется приблизительно у 10% больных асцитом, обусловленным циррозом. Одним из основных механизмов образования плеврального выпота является движение перитонеальной жидкости вверх через диафрагмальные лимфатические сосуды. Определенную роль в этом процессе могут играть приобретенные дефекты диафрагмы и повышенное портальное давление. Ликвидация или уменьшение асцита приводят к исчезновению плеврального выпота.
При осмотре пациентов с асцитом можно выявить признаки хронического заболевания печени: желтуху, пальмарную эритему, сосудистые звездочки.
Пальпация печени может быть затруднена из-за скопления асцитической жидкости в брюшной полости.
Наличие узла сестры Мери Джозеф (плотный лимфоузел в области пупка) может быть доказательством перитонеального карциноматоза вследствие опухолей желудка, поджелудочной железы или первичных опухолей печени.
Обнаружение узла Вирхова (верхний левый надключичный лимфоузел) свидетельствует в пользу злокачественных новообразований в области верхних отделов ЖКТ.
У пациентов с сердечно-сосудистыми заболеваниями или нефротическим синдромом можно выявить анасарку.
Спонтанный бактериальный перитонит — симптомы болезни, профилактика и лечение Спонтанного бактериального перитонита, причины заболевания и его диагностика на EUROLAB
Что такое Спонтанный бактериальный перитонит —
Спонтанный бактериальный перитонит (СБП) является наиболее частым и в то же время тяжелым осложнением у больных с асцитом при декомпенсированном циррозе печени. Среди больных с асцитом это осложнение составляет 8-32 %.
Что провоцирует / Причины Спонтанного бактериального перитонита:
Наиболее вероятно развитие СБП у больных алкогольным циррозом печени, а также у больных с фульминантиым течением острого гепатита и у лиц, страдающих первичным билиарным циррозом. К основным факторам риска развития спонтанного бактериального перитонита относятся:
- Цирроз печени.
- Гастроинтсстинальное кровотечение.
- Эпизоды СБП в анализе.
- Содержание белка в асцитической жидкости меньше 1 г%.
- Уровень сывороточного альбумина больше 2,5 мг/дл.
- Уровень сывороточного креатинина больше 2 мг/дл.
Развитие СБП, как правило, обусловлено микробной контаминацией асцитической жидкости, которая чаще инфицируется без видимой причины или после парацентеза. Инфицирование происходит гематогенным и транслокационным путями и в 90 % случаев обусловлено одним возбудителем, чаще кишечной группы. Основным источником обсеменения брюшной полости является микрофлора толстой кишки, проникающая в асцитическую жидкость вследствие повышенной проницаемости стенки кишки. Важное место отводится гепатогенному распространению инфекции на фоне нарастающей бактериемии, при осложненном парацентезе, перфорации или дилатации толстой кишки или очаге инфекции в брюшной полости. Возбудителями спонтанного бактериального перитонита чаще являются Escherihia coll (70 % случаев). Реже причиной перитонита служат Streptococcus pneumoniae , Strepto coccus faecalis , анаэробы. В 10 % высевают смешанную флору.
Проникновению патологических возбудителей в кровь способствует нарушение проницаемости стенки кишечника. При циррозе печени в брыжеечных лимфатических узлах часто обнаруживаются бактерии. Предрасположенность к развитию спонтанного бактериального перитонита у данной категории пациентов обусловлена снижением неспецифической резистентности организма и антибактериальной активности асцитической жидкости.
Патогенез (что происходит?) во время Спонтанного бактериального перитонита:
В развитии СБП важная роль отводится характеру и количеству асцитической жидкости. При большом ее объеме уменьшается возможность контакта нейтрофилов с бактериальными клетками. Жидкость становится благоприятной средой для роста бактерий, нормальный фагоцитоз жидкости нарушен вследствие дефицита опсонинов, в результате чего нарушаются процессы фагоцитоза. «Опсоническая» активность асцитической жидкости прямо пропорциональна количеству белка, поэтому спонтанный бактериальный перитонит чаще возникает при концентрации белка в ней менее 1%. К факторам биохимического риска развития СБП, помимо содержания белка, относятся высокие уровни сывороточного билирубина, креатинина. Кроме того, в асцитической жидкости уменьшается содержание иммуноглобулинов (IgA, IgG), компонентов системы комплемента (СЗ), фибриногена, фибронектина.
Известно, что ведущую роль в обезвреживании эндотоксина грамотрицательных бактерий, образовавшегося в кишечнике, играют резидентные печеночные макрофаги — клетки Купфера, эндотелиоциты, находящиеся в тесном взаимодействии с гистиоцитами. При циррозе печени существенно угнетается их функциональная активность, нарушается кооперативное взаимоотношение между клетками, что способствует поступлению в системную циркуляцию большого количества токсинов и их метаболитов. Нарушение процессов детоксикации усугубляется нарушением гемодинамики в печеночной ткани, вследствие чего значительное количество эндотоксинов попадает в общий кровоток в обход синусоидов по внутри- и внепеченочным портосистем-ным шунтам. Высокая энтотоксемия способствует существенному нарушению процессов фагоцитоза микроорганизмов: хемотаксиса, адгезии, дегрануляции, захвата и инактивации. Наличие воспалительно-деструктивных процессов и избыточное содержание токсинов приводит к усиленному образованию иммунных комплексов.
В печени происходит обезвреживание эндотоксина грамотрицательных бактерий, образующегося в кишечнике и поступающего в портальный кровоток. Основную роль по элиминации эндотоксина в печени выполняют клетки Купфера, эндотелиоциты, гепатоциты. Нами установлено, что при цирротическом процессе нарушается кооперативное взаимодействие клеточных популяций, участвующих в процессах детоксикации, что приводит к избыточному поступлению эндотоксина в системную циркуляцию, активизации каскада провоспалительных цитокинов, угнетающих защитные механизмы. Следствием указанных процессов является нарушение всех этапов фагоцитоза, функции комплемента.
Симптомы Спонтанного бактериального перитонита:
Клинические проявления.Основными симптомами спонтанного бактериального перитонита являются высокая лихорадка (30-76 %), боли в животе, болезненность при пальпации брюшной стенки (63-72 %), рвота, диарея, парез кишечника, проявления печеночной энцефалопатии (46-71%).
В ряде случаев появляются признаки септического шока: тахикардия (более 100 уд/мин), снижение АД ниже 90 мм рт. ст., олигурия.
В то же время у 14 % больных СБП почечная симптоматика отсутствует или является стертой. У 30 % пациентов СБП не проявляется никакими клиническими симптомами и распознается только с помощью парацентеза. Заболевание при этом выявляется случайно или при исследовании асцитической жидкости Наиболее тяжелым осложнением, определяющим прогноз спонтанного бактериального перитонита, является почечная недостаточность.
Диагностика Спонтанного бактериального перитонита:
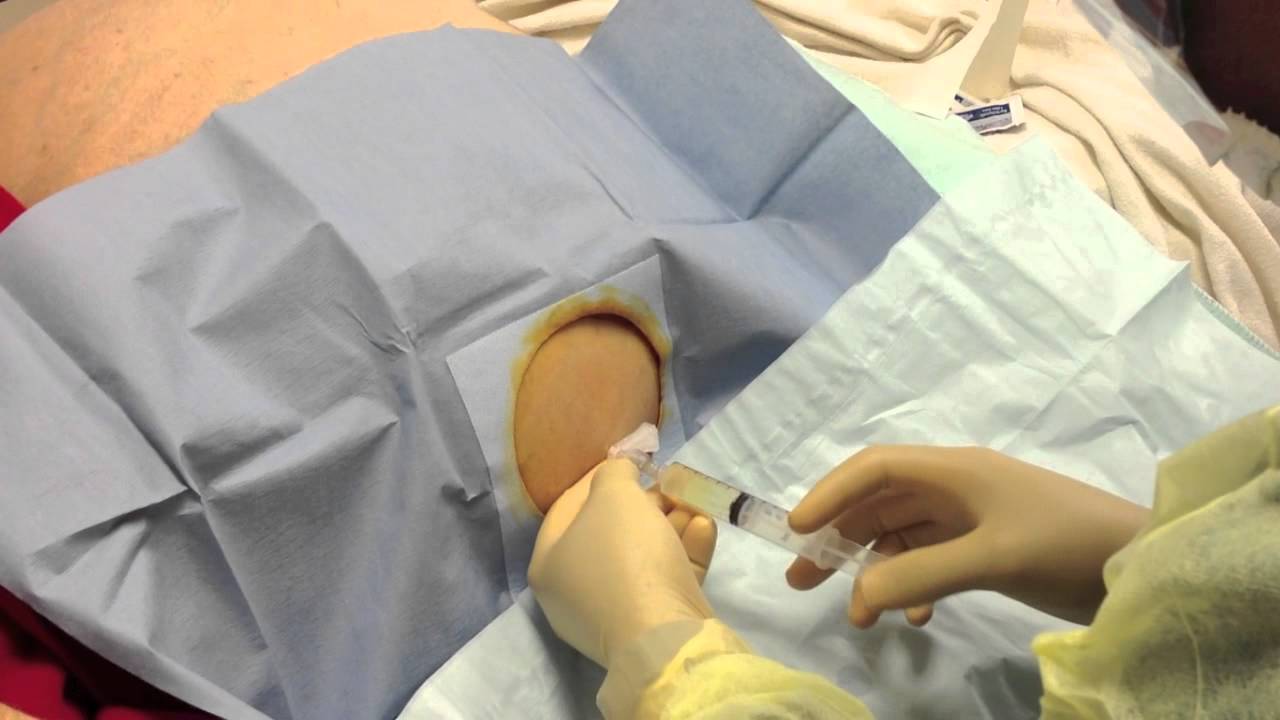
Диагностика СБП в классических случаях, как правило, несложна. Спонтанный бактериальный перитонит можно заподозрить в случаях резкого ухудшения состояния и развития печеночной энцефалопатии у больных циррозом печени. Решающее значение в диагностике имеет исследование асцитической жидкости — парацентез, который проводится с целью выявления СБП.
Процедура парацентеза показана больным циррозом печени с наличием асцита даже при отсутствии клинических признаков инфекции При этом выделяют собственно спонтанный бактериальный перитонит и культуронегативный нейтрофильный асцит. Показаниями к парацентезу являются:
- местные признаки перитонеальной инфекции — болевой синдром в брюшной полости, нарушение перистальтики кишечника;
- системные проявления инфекции — лихорадка, лейкоцитоз, септические состояния;
- нарастание признаков печеночной энцефалопатии без видимых причин;
- обследование больных с асцитом, осложненным кровотечением из желудочно-кишечного тракта, для выбора антибактериальной терапии.
У большинства больных СБП выявляются монобактериальные инфекции. Диагноз собственно спонтанного бактериального перитонита подтверждают при положительном результате посева асцитической жидкости, где количество нейтрофилов превышает 250/мм3 (либо больше 500 в 1 мм3 независимо от результата посева). В посеве обнаруживается рост бактерий, отсутствуют интраабдоминальные источники инфицирования. При геморрагическом асците количество эритроцитов, как правило, больше 10 000/мм3, количество же лейкоцитов необходимо оценивать из расчета 1 лейкоцит на 250 эритроцитов.
Для культуронегативного нейтрофильного асцита характерно наличие нейтрофилов более 250/мм3 при отрицательном результате посева и отсутствии антибиотикотерапии в течение 30 предшествующих дней. У большинства больных СБП инфекционный агент, выделенный из крови, является этиологическим фактором, минимальное количество асцитической жидкости для посева составляет 10 мл. Повышенное количество палочкоядерных лейкоцитов в асцитической жидкости при ложноотрицательных результатах исследования асцитической жидкости и крови на стерильность необходимо расценивать как признак СБП. Термин «бактериальный асцит» используется для обозначения колонизации асцитической жидкости бактериями при отсутствии в ней воспалительной реакции. Диагноз бактериального асцита используется в случаях выделения бактериальной культуры при количестве палочкоядерных лейкоцитов ниже 250/мм3.
Лечение Спонтанного бактериального перитонита:
Лечение СБП целесообразно начинать очень быстро, что способствует увеличению выживаемости больных еще до получения культуры бактерий, высеянной из асцитической жидкости. Если не удается высеять микроорганизмы и, следовательно, приходится проводить учение «вслепую», целесообразно одновременно использовать нор-Флоксацин и лактулозу для предотвращения проникновения бактерий из кишечника.
Препаратом выбора в терапии СБП является цефотаксим — антибиотик из группы цефалоспоринов 3-го поколения. Препарат назначается по 2 г 2 раза в сутки в течение 7 дней. Антибиотик обладает минимальной гепатотоксичностью. Положительный результат лечения цефотаксимом наблюдается в 78-95 % случаев. В качестве альтернативного метода лечения используется комбинация 1 г амоксициллина и 0,2 г клавулаиовой кислоты каждые 6 ч в течение 14 дней.
Низкая эффективность антибиотикотерапии определяется следующими признаками:
- Отсутствие клинического эффекта через 3 дня после начала лечения.
- Отсутствие снижения количества нейтрофилов в асцитической жидкости.
- Наличие резистентной к данному антибиотику флоры по результатам посева.
Наличие одного или нескольких из этих признаков является показанием для замены антибиотика. Инфицирование анаэробами является показанием к назначению метронидазола.
Профилактический курс антибиотикотерапии показан больным циррозом печени при наличии кровотечений из органов желудочно-кишечного тракта для предупреждения бактериальных осложнений. Профилактику можно осуществлять несколькими антибиотиками. Препаратом выбора является норфлоксацин в дозе 400 мг 2 раза в день в течение 7 дней Однако при этом появляется резистентные колонии бактерий. Эффективен триметоприл (сульфометоксазол).
При развитии почечной недостаточности у больных циррозом печени показаны инфузии альбумина, противошоковых жидкостей (поли-глюкин) в комбинации с фуросемидом внутривенно 80-160 мг в сутки. Кроме того, назначение диуретиков способствует повышению общего содержания белка и стимулирует «опсонирующую» активность асцитической жидкости. Рецидивирующий спонтанный бактериальный перитонит является показанием к трансплантации печени.
После первого эпизода СБП общая смертность в течение года достигает 61-78%.
К каким докторам следует обращаться если у Вас Спонтанный бактериальный перитонит:
- Гастроэнтеролог
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Спонтанного бактериального перитонита, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Eurolab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Eurolab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу.
Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Eurolab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Другие заболевания из группы Болезни желудочно-кишечного тракта:
Если Вас интересуют еще какие-нибудь виды болезней и группы заболеваний человека или у Вас есть какие-либо другие вопросы и предложения – напишите нам, мы обязательно постараемся Вам помочь.
Спонтанный бактериальный перитонит » Библиотека врача
Е.В. ВИННИЦКАЯ, старший научный сотрудник отделения хронических заболеваний печени Центрального научно-исследовательского института гастроэнтерологии Департамента здравоохранения г. Москвы, доктор медицинских наук
Е.В. ВИННИЦКАЯ, старший научный сотрудник отделения хронических заболеваний печени Центрального научно-исследовательского института гастроэнтерологии Департамента здравоохранения г. Москвы, доктор медицинских наук
Грозное последствие цирроза
Спонтанный бактериальный перитонит (СБП) остается часто встречающимся, но редко диагностируемым осложнением цирроза печени (ЦП). Уточню, что СБП— это прогностически тяжелое осложнение декомпенсированного ЦП. Оно развивается в результате бактериальной транслокации на фоне снижения резистентности организма, избыточного бактериального роста. СБП проявляется контаминацией асцитической жидкости и воспалением брюшины. Частота этого грозного осложнения за последние годы колеблется в пределах от 10 до 37% среди стационарных больных ЦП, осложненным асцитом.
В 1960 годы летальность при этом осложнении составляла около 90%. Отсутствие понимания, правильной диагностики, своевременной и адекватной терапии приводило к неоправданно высокой смертности. В последующие годы смертность от СБП в условиях стационара снизилась до 20—38%.
По своей сути спонтанный бактериальный перитонит — это частная форма первичного асцита-перитонита. Этот термин отражает острое или хроническое воспаление брюшины у больного с асцитом и инфицированием асцитической жидкости, сопровождающееся местными и общими симптомами и нарушением жизненно важных функций организма.
Бактерии проникают через барьер
В основе патогенетических механизмов СБП лежит теория бактериальной транслокации. Суть этого явления заключается в проникновении жизнеспособных бактерий через эпителиальный барьер ЖКТ в экстраинтестинальные ткани организма, например мезентериальные лимфоузлы, селезенку. Там часть из них подвергается лизису макрофагами, часть — через воротную вену попадает в печеночные синусы и лизируется макрофагами печени.
Особое значение в развитии болезни играют факторы патогенности и вирулентности микроорганизмов. К ним относят: факторы адгезии и колонизации, факторы инвазии, факторы, препятствующие фагоцитозу, ферменты «защиты и агрессии» бактерий, а также эндотоксины. Наиболее часто при СБП в асцитической жидкости выявляются следующие микроорганизмы: Escherichia сoli, несколько реже — Streptococci, Staphylococci, реже — Klebsiella oxytoca, Salmonella enteritidis, Enterococcus faecium, Acinectobacter anitratus.
При декомпенсированном ЦП классов В и С по Child-Pugh возникает целый ряд взаимосвязанных механизмов, нарушающих нормальные функции организма, способствующих бактериальной кишечной транслокации и развитию СБП. Это портальная гипертензия, асцит, повышение внутрибрюшного давления, замедление пассажа содержимого по кишечнику, синдром избыточного бактериального роста, снижение белково-синтетической функции печени, белковое голодание, снижение общей иммунореактивности, энтеральной недостаточности, эндотоксемии, а также локальные изменения слизистой кишки в виде нарушения микроциркуляции и проницаемости.
Важную роль в развитии СБП имеет внутрибрюшная гипертензия (ВБГ), которая возрастает при декомпенсации ЦП за счет портальной гипертензии и асцита, с одной стороны, и развития синдрома избыточного бактериального роста— с другой. Увеличение ВБГ замедляет кровоток по нижней полой вене и уменьшает венозный возврат, способствует снижению лимфооттока по грудному лимфатическому протоку, замедляет всасывание асцитической жидкости. Транслокация бактерий формируется по прошествии 3 часов после повышения внутрибрюшного давления до 15 мм рт. ст. А транслокация бактерий при внутрибрюшном давлении > 25 мм рт. ст. развивается в течение часа.
Наличие ЦП классов В и С по Child-Pugh с нарушением функции печени, сопровождается снижением как белково-синтетической функции, так и нарушением функции ретикуло-эндотелиальной системы, что приводит к снижению способности образования антител и формированию вторичного иммунодефицита.
Доказано, что активированные микроорганизмами нейтрофилы, моноциты, макрофаги и клетки эндотелия продуцируют провоспалительные медиаторы — цитокины, кинины, метаболиты арахидоновой кислоты, фактор активации тромбоцитов и оксид азота, которые инициируют и поддерживают воспалительную реакцию, вызывают вторичное выделение аналогичных медиаторов с повреждением эндотелия и снижением органной перфузии и доставки кислорода. В этих условиях печень вместо синтеза альбумина, который и так резко снижен при декомпенсированном ЦП, начинает продуцировать белки острой фазы, такие как гликопротеины, ?1-антитрипсин, С-реактивный белок, церулоплазмин, факторы свертывания, компоненты комплемента, ферритин — вещества, которые, обладая различным действием, способствуют усилению процессов свертывания, воспаления, нарушению метаболизма.
Кроме того, при СБП в итоге происходит снижение функции нейтрофилов, нарушение синтеза лейкотриена, супероксидного аниона, тромбоцитоактивирующего фактора.
Контроль за реализацией иммунной и воспалительной реактивности осуществляется системой цитокинов. Именно баланс взаимоотношений между про- и антивоспалительными медиаторами, при физиологических условиях, способствует созданию условий для уничтожения патогенов и поддержания гомеостаза. При нарушении баланса цитокиновой системы превалируют деструктивные эффекты медиаторов воспаления. Концентрация отдельных провоспалительных цитокинов в крови в норме обычно не превышает 5—20 пкг/мл, может возрастать в 5—10 и более раз, все это приводит к нарушению проницаемости и функции эндотелия капилляров, запуску синдрома ДВC (диссеминированное внутрисосудистое свертывание крови), формированию отдаленных очагов системного воспаления.
Осложнение распознается с трудом
СБП представляет трудно разрешимую диагностическую задачу для клинициста и является одним из наиболее тяжелых и трудно распознаваемых осложнений декомпенсированного ЦП.
Очень редко заболевание дебютирует картиной септического шока, проявляющегося снижением АД ниже 90 мм рт. ст., тахикардией более 100 ударов в 1 мин, олигурией менее 20 мл в 1 час. Многие авторы подразделяют симптомы СБП на местные (боль в животе, рвота, диарея, признаки пареза кишечника) и системные проявления инфекции: лихорадка (повышение температуры выше 37,4 ?С), лейкоцитоз (повышение числа лейкоцитов выше 10 х 109 кл/л), а также энцефалопатия, быстро нарастающая печеночная недостаточность, гепаторенальный синдром. Почечная недостаточность является одним из наиболее грозных осложнений, в значительной степени определяющих прогноз. В связи с этим любое клиническое ухудшение у больного ЦП, осложненным отечно-асцитическим синдромом, может являться следствием СБП.
Диагностика СБП многие годы основывалась на выявлении микроорганизмов в асцитической жидкости с использованием посева на специальные среды. В литературе широко обсуждался вопрос о целесообразности и безопасности диагностического парацентеза при отсутствии подозрений на СБП. До настоящего времени обязательным в диагностике СБП считается исследование асцитической жидкости с проведением подсчета числа полиморфноядерных лейкоцитов (ПЯЛ), определение содержания белка, концентрации альбумина, посева асцитической жидкости на культуральные среды.
Перед диагностическим парацентезом, как правило, проводится УЗИ, при котором в асцитической жидкости могут быть визуализированы нити фибрина, взвесь. При бактериальном перитоните вне зависимости от этиологии увеличивается количество и калибр взвешенных частиц, выявляются множественные нити фибрина, свободно колеблющиеся в асцитической жидкости в такт дыхательным движениям.
«Золотым стандартом» диагностики СБП считается способ определения возбудителей инфекционного процесса с использованием посева асцитической жидкости на питательные среды для выявления роста микроорганизмов с последующей идентификацией в чистой культуре. Бесспорным достоинством метода является его абсолютная специфичность. Однако чувствительность культурального метода не превышает 25—42%, естественно, что отрицательные результаты посева не могут гарантировать отсутствия бактериемии.
В общепринятой клинической практике диагностика СБП основывается на количественном определении содержания нейтрофилов в асцитической жидкости и результатах культурального метода. В соответствии с международными рекомендациями достаточным для постановки диагноза СБП является количество ПЯЛ, равное 250 кл/мм?.
В зависимости от числа нейтрофилов и идентификации возбудителей инфекции выделяют 3 формы проявления СБП:
I — классический, полный вариант СБП. Асцитическая жидкость содержит более 250 ПЯЛ на мм?, дает рост культуры при высевании. Такое сочетание определяет назначение антибактериальной терапии.
II — культуро-негативный нейтрофильный асцит, когда асцитическая жидкость содержит более 250 ПЯЛ на мм?, не дает ростa культуры при высевании. Это состояние также требует обязательного проведения антибактериальной терапии.
III — культуропозитивный асцит с низким содержанием нейтрофилов. Асцитическая жидкость содержит менее 250 ПЯЛ на мм?, дает рост культуры при высевании.
Однако пока остается неясным, какова правильная тактика по отношению к той группе больных, где имеет место клиническая картина СБП, но отсутствует нейтрофилез в асцитической жидкости, а посев жидкости и крови не дает роста, поскольку совершенно очевидно, что такие больные вызывают тревогу у врачей и требуют особой клинической настороженности. Низкая чувствительность метода культивирования асцитической жидкости на средах не позволяет исключить и так называемый IV вариант течения СБП — ложнокультуронегативный с низким содержанием нейтрофилов и наличием клинической картины СБП.
Амилаза и липаза — важные критерии
Дифференциальная диагностика СБП основана на исключении перитонита вторичного генеза, определении основного заболевания, вызвавшего асцит, исключении асцита смешанного генеза, определении наличия инфицированности асцитической жидкости. Наиболее часто у больных с декомпенсированным ЦП проводится дифференциальный диагноз между СБП и вторичными перитонитами, среди которых наиболее часто встречается панкреатит, а также туберкулез. Во многом это связано с тем, что большая часть больных СБП страдает ЦП алкогольной этиологии, хроническим панкреатитом, туберкулезом.
Инфекционные осложнения с поражением поджелудочной железы и забрюшинного пространства развиваются у 40—70% больных панкреонекрозом. Особенно трудна диагностика панкреонекроза у больных с ЦП алкогольной этиологии с транзиторным асцитом, продолжающих злоупотребление алкоголем, когда нарастание асцита может ошибочно расцениваться как проявление отечно-асцитического синдрома. Основными клинико-морфологическими формами панкреатической инфекции являются инфицированный панкреонекроз и панкреатогенный абсцесс, нагноение псевдокисты поджелудочной железы.
Важными диагностическими критериями является повышение уровня амилазы и липазы в асцитической жидкости. В качестве критерия инфицированности применяется определение С-реактивного белка, прокальциотонина.
Во всех случаях необходима оценка клинической картины заболевания, с учетом причин, которые могут вызвать перитонит у больных и без асцита. Число нейтрофилов в асцитической жидкости, как правило, в этих случаях превышает 500 кл/мм3. Наиболее характерным является повышение уровня лактатдегидрогеназы >225 mU/L, общего белка >1 г/дл, снижения глюкозы до 50 мг/дл. По данным УЗИ при вторичном перитоните значительно чаще, чем при СБП, выявляются множественные нити фибрина. Решающее значение в этих случаях имеет лапароскопия.
В дифференциальной диагностике первичного и вторичного бактериальных перитонитов всегда стоит вопрос о целесообразности проведения диагностической лапаротомии или лапароскопии. Хорошо известно, что при ЦП с осложненным течением внутрибрюшные хирургические вмешательства часто имеют неблагоприятный исход. Оперативное вмешательство, даже малоинвазивное, целесообразно только при подозрении на ургентную патологию, поскольку может осложнять течение СБП, приводить к острой печеночной недостаточности.
Международный клуб асцита рекомендует
В соответствии с Рекомендациями Международного клуба асцита подходы к лечению больного с СБП при ЦП могут быть представлены следующим образом. Необходимы, во-первых, антибактериальная терапия, во-вторых, парацентез с возмещением объема плазмы альбумином, в-третьих, лечение и профилактика осложнений.
Антибактериальную эмпирическую терапию проводят цефалоспоринами III поколения (цефотаксим, цефтизоксим, цефтазидим, цефоницид). Наиболее хорошо изученный и часто применяемый препарат из этой группы цефотаксим назначается каждые 12 часов в течение 5 дней в/в, минимальная разовая доза 2 г. Амоксициллин/клавунат калия по эффективности сравним с цефотаксимом, применяется в/в 1,2 г каждые 6 часов в течение 5—7 дней.
Точка зрения на выбор антибиотиков первой линии на сегодняшний день неоднозначна, что связано с ростом резистентности микроорганизмов к антибиотикам. Больным неосложненным СБП (при отсутствии шока, илеуса, гастроинтестинального кровотечения, выраженной печеночной энцефалопатии или повышения сывороточного креатинина более 3 мг/дл), не получавшим ранее профилактически фторхинолоны, может быть рекомендован офлоксацин внутрь в дозе не менее 400 мг каждые 12?часов. Есть исследования, указывающие, что по эффективности применение таблетированного ципрофлоксацина по 500 мг каждые 12 часов не уступает по эффективности цефотаксиму и цефтриксону и даже превосходит их по эффективности в лечении СБП.
В соответствии с международными рекомендациями эффективность проведения адекватной антибактериальной терапии достигает 90%, и она оценивается по снижению содержания ПЯЛ менее 250 кл/мм3 в асцитической жидкости, по исчезновению местных и системных проявлений инфекции.
Оптимальным критерием эффективности считается снижение числа ПЯЛ в асцитической жидкости через два дня от начала антибактериальной терапии по сравнению с исходными показателями. В связи с этим в ходе терапии рекомендуется проводить хотя бы один повторный парацентез через 48 часов от начала терапии. Критериями же неэффективности считается ухудшение состояния в течение первых часов антибактериальной терапии, а также снижение числа ПЯЛ в асцитической жидкости менее чем на 25%.
При отсутствии эффекта от антибактериальной терапии рекомендуется смена антибиотика с учетом чувствительности микрофлоры или эмпирически при отрицательных результатах посева, а также необходимо проведение более тщательной дифференциальной диагностики с вторичным перитонитом.Парацентез с возмещением объема плазмы альбумином рекомендуется к применению при лечении рефрактерных асцитов. Взгляд на эффективность и безопасность этой методики у пациентов с СБП остается спорным.
Непреложной истиной является необходимость проведения мероприятий, направленных на предупреждение и лечение осложнений ЦП, являющихся факторами риска СБП, первичную профилактику СБП.
В настоящее время большие рандомизированные исследования показали высокую эффективность непрерывной профилактики СБП с применением фторхинолонов у больных ЦП, перенесших СБП. В соответствии с Международными рекомендациями профилактика возвратного бактериального перитонита проводится непрерывно норфлоксацином по 400 мг/сут. В связи с низкой выживаемостью после первого эпизода спонтанного перитонита, которая в течение первого года составляет 30—50%, а в течение второго всего 25—30%, рекомендуется рассматривать таких пациентов в качестве кандидатов на трансплантацию печени.
Спонтанный бактериальный перитонит при циррозе является распространенным осложнением, характеризуется высокой смертностью, поздней выявляемостью. Существующие методы диагностики являются либо недостаточно чувствительными, либо обладают низкой специфичностью, сложны в практическом применении, длительны по срокам выполнения. Все это делает актуальными проблемы поиска и разработки новых методов диагностики, лечения и профилактики подобного заболевания.
В связи с расширением представлений о патогенезе спонтанного бактериального перитонита, позволяющим оценить роль избыточного бактериального роста, процессов микробной транслокации, обоснован интерес гепатологов к бактериальным препаратам пробиотикам и эубиотикам в аспекте лечения этого заболевания.
«Золотым стандартом» диагностики СБП считается способ определения возбудителей инфекционного процесса с использованием посева асцитической жидкости на питательные среды для выявления роста микроорганизмов с последующей идентификацией в чистой культуре. Бесспорным достоинством метода является его абсолютная специфичность.
Диагностика вторичного бактериального перитонита требует срочного хирургического вмешательства.
дифференциальная диагностика и лечение uMEDp
Диагностика спонтанного бактериального перитонита (СБП) у больных циррозом печени и асцитом чрезвычайно сложна. По сути, СБП является диагнозом исключения. Результаты клинических исследований подтверждают, что СБП – сложный инфекционный процесс, сопровождающийся синдромом системной воспалительной реакции. Именно поэтому СБП требует своевременной профилактики и адекватной антибактериальной терапии на ранних этапах развития.
Таблица 1. Заболевания, проявляющиеся асцитом
Таблица 2. Источники вторичного бактериального перитонита
Cпонтанный бактериальный перитонит (СБП) – частный случай первичного перитонита у больных декомпенсированным циррозом печени. СБП развивается в результате транслокации кишечной флоры на фоне избыточного бактериального роста, воспаления брюшины, контаминации асцитической жидкости (АЖ).
Первичный бактериальный перитонит встречается достаточно редко и вызывает трудности при диагностике. Существует несколько способов проникновения микроорганизмов в брюшную полость: гематогенный путь, при котором бактерии попадают в кровь из отдаленных очагов инфекции (одонтогенный, урогенитальный, бронхогенный и др.), лимфогенный. Кроме того, микроорганизмы могут проникать в брюшную полость при сальпингоофорите [1–6].
Вторичный бактериальный перитонит является следствием перфорации полых органов, ущемления грыжевых выпячиваний, хирургических вмешательств, тяжелых воспалительных процессов в брюшной полости и малом тазу. При диагностике вторичного бактериального перитонита следует руководствоваться правилом исключения всех часто встречающихся причин, вызывающих перитонит у больных без асцита. Во всех случаях вторичный бактериальный перитонит служит абсолютным показанием к оперативному лечению.
Дифференциальная диагностика
Дифференциальная диагностика бактериального перитонита у больных асцитом основана:
-
на определении генеза асцита; -
верификации инфицированности АЖ; -
установлении одного или нескольких этиологических факторов, спровоцировавших перитонит.
В 15% случаев асцит не связан с болезнями печени. Асцит и периферические отеки могут развиться на фоне осложнений болезней сердца, почек, при нарушении кровотока в нижней, воротной и нижней полой венах, нарушении всасывания и экссудации белков в тонкой кишке, микседеме [1]. В структуре асцита на долю так называемых смешанных асцитов, вызванных двумя и более причинами, приходится около 5% [1]. Как правило, пациенты с таким заболеванием страдают не только циррозом печени (ЦП), но также туберкулезом и канцероматозом брюшины. Неполный перечень заболеваний, способных приводить к асциту, представлен в табл. 1 [1–6].
В клинической практике часто проводят дифференциальный диагноз между СБП и вторичным бактериальным перитонитом, развившимся в результате перфорации полых органов, тяжелыми воспалительными процессами в брюшной полости и малом тазу, панкреатогенным асцитом, абдоминальной формой туберкулеза, канцероматозом брюшины. В случае диагностирования вторичного бактериального перитонита необходимо срочное хирургическое вмешательство. В то же время применение диагностической лапаротомии и даже лапароскопии способно существенно ухудшить прогноз у больных декомпенсированным ЦП и СБП [2, 3]. Источники вторичного бактериального перитонита перечислены в табл. 2 [1–3, 5, 6].
Клинические наблюдения, экспериментальные данные, в том числе результаты научных изысканий, выполненных И.А. Ерюхиным и соавт. [3], подтверждают патогенетическую сущность формирования перитонита от реактивной фазы к токсической как результат прорыва биологических барьеров, сдерживающих эндогенную интоксикацию. К таковым прежде всего относятся печень, брюшина, кишечная стенка. Переход к терминальной фазе перитонита определяется истощением защитно-компенсаторных механизмов.
При развитии такого процесса у больных декомпенсированным ЦП на фоне истощения иммунных механизмов имеют место синдром избыточного бактериального роста и повышение внутрибрюшного давления. Указанные процессы могут носить необратимый, фатальный характер с последующим развитием сепсиса и полиорганной недостаточности.
СБП, будучи частным случаем первичного перитонита у больных декомпенсированным ЦП, обычно не требует хирургического вмешательства. В повседневной клинической практике СБП представляет трудноразрешимую диагностическую задачу и остается распространенным, но редко диагностируемым осложнением ЦП [7].
Клинические симптомы СБП, как правило, невыразительны, носят стертый характер [8–10]: разлитая абдоминальная боль различной интенсивности, лихорадка, рвота, диарея, иногда парез кишечника. Особую роль играют клинические проявления системной воспалительной реакции (СВР) (лейкоциты ≥ 12,0 × 109/л и сдвиг лейкоцитарной формулы влево, температура тела > 38 °С, тахикардия и одышка). Иногда присутствует сразу несколько симптомов.
По данным ряда исследований, в процентном соотношении частота клинических проявлений СБП различна. Например, V. Arroyo констатирует, что боли в животе при этом осложнении ЦП отмечаются в 76–82% случаев, лихорадка – в 69–82%, рвота – в 10–14%, энцефалопатия – в 15–20%, диарея – в 10–11%, парез кишечника – в 6–8%, шок – в 3–10% случаев [11]. Напротив, по результатам наших исследований, у больных СБП болевой синдром наблюдается только в 44% случаев (то есть вдвое реже), симптомы раздражения брюшины – в 22%. Нередко выявляются признаки СВР (лейкоциты ≥ 12,0 × 109/л и сдвиг лейкоцитарной формулы влево – в 66,7% случаев, температура тела > 38 °С – в 55,6%, тахикардия и одышка – в 41,4 и 37% соответственно) [12].
Почечная недостаточность (гепаторенальный синдром – ГРС) в значительной степени определяет прогноз СБП и развивается у 1/3 больных. C.G. Perdomo и A. Alves de Mattos, обследовав 1030 больных ЦП, из которых у 61 больного развился СБП, в 55,9% случаев выявили ГРС, резко осложнивший течение заболевания [13]. В качестве факторов риска авторы рассматривали исходно низкие показатели артериального давления и сывороточной концентрации натрия, высокий уровень билирубина и нейтрофилез. Прогрессирующая почечная недостаточность при СБП отличается крайней резистентностью к терапии и приводит к летальному исходу, несмотря на ликвидацию инфекции. Причем в этом случае показатель смертности возрастает до 54–87%, что позволяет рассматривать ГРС как один из наиболее тяжелых прогностических признаков [14].
Печеночная энцефалопатия, внезапно нарастающая и осложняющая течение ЦП, также служит одним из важнейших диагностических критериев СБП. В наших наблюдениях она была диагностирована у 22,2% больных СБП, причем встречалась вдвое чаще, чем при вторичном бактериальном перитоните [12].
Таким образом, любое клиническое ухудшение у больных декомпенсированным ЦП, осложненным асцитом, может стать следствием СБП. В то же время, по данным B. Chinnock и соавт., чувствительность оценки клинических симптомов СБП составляет 76%, а специфичность – 34%. Это позволило авторам сделать вывод, что диагностика по клиническим проявлениям недостаточна и требует дополнительных методов исследования [15].
Ультразвуковое исследование (УЗИ) брюшной полости. При обследовании больных ЦП и асцитом непременным условием является предварительное УЗИ для определения объема, акустической однородности АЖ. Отметим, что при перитоните, по данным УЗИ, в АЖ могут визуализироваться флотирующие нити фибрина, взвешенные частицы белка, фибринозные наложения. Однако их наличие не является строго патогномоничным для СБП. Между тем выявление акустической неоднородности может направить диагностический поиск в правильном направлении, оказать значительную помощь в диагностике.
Диагностический парацентез. Как и прежде, сегодня диагностический парацентез имеет огромное значение. Обязательными считаются посев АЖ на культуральные среды, проведение подсчета числа полиморфноядерных лейкоцитов, определение содержания белка и концентрации альбумина, амилазы. В качестве диагностического критерия возможно определение сывороточно-асцитического альбуминового градиента.
Ряд экспертов обращают внимание на необходимость диагностического парацентеза при развитии ГРС, учитывая, что ГРС возникает в 30% случаев на фоне СБП [14]. Для исключения или подтверждения СБП проведение диагностического парацентеза должно быть обязательным диагностическим мероприятием при подозрении на ГРС (уровень доказательности А1).
Микробиологический метод исследования АЖ. Золотым стандартом диагностики СБП всегда считался способ определения возбудителей инфекционного процесса с использованием посева АЖ на питательные среды для выявления роста микроорганизмов с последующей идентификацией в чистой культуре. Бесспорное преимущество – абсолютная специфичность метода. Однако невысокая частота выделения культуры, то есть низкая чувствительность [16], резко снижает диагностическую значимость. Чувствительность микробиологического метода не превышает 25–42%. Даже при использовании последних достижений биотехнологий рост культуры можно получить лишь при наличии в исследуемом материале жизнеспособных бактерий, не поврежденных естественными факторами иммунной защиты или лекарственными препаратами, в частности антибиотиками. Концентрация жизнеспособных бактерий для их определения должна быть достаточно высокой. Это положение подтверждается данными многих научных исследований. В частности, калифорнийские ученые выявили очень низкую эффективность культурального метода: только у семи больных из 201 с доказанным диагнозом удалось получить рост культуры микроорганизмов [15]. В наших исследованиях информативность микробиологического метода была также чрезвычайно низкой – всего 8,9% [12].
Кроме того, к недостаткам способа относится невозможность идентификации и определения концентрации химических субстанций бактериального происхождения. Согласно современным представлениям, последние играют ведущую роль в инициации воспалительных реакций при септических состояниях различной этиологии [15, 16].
Метод подсчета числа полиморфноядерных лейкоцитов АЖ. Широкое распространение в клинической практике получила диагностика СБП, основанная на количественном определении содержания полиморфноядерных лейкоцитов (ПЯЛ) в АЖ. В исследованиях O. Riggio проведен сравнительный анализ чувствительности, точности и специфичности методов подсчета ПЯЛ в АЖ автоматическим и ручным методами. Авторы не получили различий в результатах и сделали вывод, что автоматический подсчет предпочтительнее [17]. В соответствии с международными рекомендациями [10, 18] основным предиктором СБП является количество ПЯЛ > 500 кл/мм3. Чувствительность этого признака – около 86%, специфичность – 98%. При более низком содержании нейтрофилов > 250 кл/мм3 чувствительность возрастает до 93%, однако специфичность снижается до 94%. Считается, что для постановки диагноза СБП достаточно количество нейтрофилов, равное 250 кл/мм3. В зависимости от числа нейтрофилов и идентификации возбудителей инфекции в соответствии с международными рекомендациями выделяют три формы СБП:
-
I – классический, полный вариант, когда АЖ содержит > 250 ПЯЛ/мм³ и дает рост культуры при микробиологическом исследовании; -
II – культуро-негативный нейтрофильный асцит: АЖ содержит > 250 ПЯЛ/мм³, но не дает ростa культуры при микробиологическом исследовании; -
III – культуро-позитивный асцит с низким содержанием нейтрофилов. АЖ содержит
В наших исследованиях показано, что низкая чувствительность метода культивирования АЖ на средах не позволяет исключить еще один вариант СБП – ложно культуро-негативный с низким содержанием нейтрофилов, число которых еще не достигло критического значения 250 ПЯЛ/мм3. Как правило, пациенты, у которых имеется клиническая картина СБП, но отсутствует нейтрофилез, а посев АЖ так же, как и посев крови, не дает роста, вызывают особую тревогу и требуют своевременной и адекватной терапии [12].
Биомаркер микробной инфекции. Под этим термином понимается лабораторный показатель, который может быть измерен как индикатор биологических процессов в норме и при микробных воспалительных процессах [16, 19]. Выделяют три направления поиска микробных инфекций:
-
выявление микроорганизмов на уровне ДНК или РНК; -
определение продуктов жизнедеятельности микробов и структурных компонентов микробной клетки; -
измерение уровня молекул иммунного ответа.
Выявление маркеров микробной инфекции на уровне ДНК или РНК микроорганизмов. Совершенствование методов молекулярной диагностики открывает новые возможности в диагностике и определении этиологии микробных инфекций. Применение полимеразно-цепной реакции (ПЦР) позволяет не только выявить этиологию бактериемии, но и определить микроорганизмы в биологических жидкостях, в частности в АЖ при бактериальном перитоните. В последнее время появились первые сообщения о клиническом применении коммерческих тестов для определения этиологии бактериемии. Применение тест-систем основано на идентификации микробной клетки и ее дифференциации от человеческой ДНК. Так, уже существующий тест Septi/Fast позволяет выявить ДНК целого ряда наиболее часто встречающихся условно-патогенных микробов. Применяемый способ обладает высокой чувствительностью. Следует также отметить отсутствие влияния воздействия антибиотиков в крови на результат исследования. Однако метод узкоспецифичен и лишь подтверждает либо исключает одну из предполагаемых версий об этиологии инфекции, но не позволяет идентифицировать микроорганизмы при неизвестном возбудителе инфекционного процесса. Новая технология диагностики бактериемии уже нашла применение в научных исследованиях [20, 21]. R. Frances и соавт. исследовали наличие ДНК бактерий в АЖ и сыворотке крови больных ЦП методом ПЦР. В 32% случаев в АЖ и сыворотке крови выявлена бактериальная ДНК. Методом секвенирования у семи больных идентифицирована ДНК Escherichia coli и у двух – Staphylococcus aureus, что подтверждает теорию бактериальной транслокации [21]. В дальнейшем использование количественного метода определения молекул ДНК и РНК с помощью метода ПЦР может получить более широкое применение.
Измерение маркеров микробной инфекции на уровне молекул иммунного ответа. К молекулам иммунного ответа относят С-реактивный белок (СРБ), комплемент С-3а, интерлейкины (ИЛ), прокальцитонин. Наибольшее практическое значение в диагностике СБП имеют прокальцитониновый тест и определение СРБ [22–24].
СРБ – белок плазмы крови, относящийся к группе белков острой фазы. Синтез происходит преимущественно в гепатоцитах и инициируется антигенами, иммунными комплексами, бактериями, грибами под воздействием ИЛ-6 и других цитокинов. В крови здоровых людей содержание СРБ минимально. Концентрация СРБ в крови имеет высокую корреляцию с активностью заболевания и стадией процесса (при выраженном воспалительном процессе возможно более чем 20-кратное повышение). СРБ в качестве теста, позволяющего получить объективную информацию о наличии воспаления, широко применяется в клинической практике. Результаты наших исследований, основанные на определении содержания СРБ в АЖ, показали высокую информативность в отношении наличия воспалительного процесса при СБП. Однако отсутствие строгой специфичности ограничивает его применение, поскольку повышение уровня СРБ наблюдается при воспалении практически любого генеза.
Прокальцитонин широко внедряется в практику диагностики тяжелых бактериальных инфекций. Данные метаанализа результатов 33 исследований, проведенных в 1999–2004 гг., демонстрируют преимущества теста на прокальцитонин перед тестом на СРБ. Метод обладает более высокой чувствительностью, является перспективным в диагностике бактериальной инфекции, однако из-за отсутствия специфичности не решает проблемы диагностики СБП [23].
Отсутствие специфичности, сложность в интерпретации ограничивают применение цитокинов.
Лечение бактериального перитонита при циррозе печени
В соответствии с рекомендациями Международного клуба по изучению асцита (International Ascites Club – IAC) (2010) до получения результатов посева АЖ всем больным при превышении числа нейтрофилов АЖ > 250 кл/мм3 рекомендуется эмпирическая антибактериальная терапия [10, 18] цефалоспоринами третьего поколения. Цефотаксим – наиболее хорошо изученный и часто применяемый препарат из этой группы – назначается каждые 12 часов в течение пяти дней внутривенно, минимальная разовая доза – 2 г. Цефтриаксон назначается по 1,0 г два раза в сутки. Амоксициллин натрия/клавуланат калия по эффективности сравним с цефотаксимом, применяется внутривенно по 1,2 г каждые шесть часов в течение 5–7 дней.
Сегодня точка зрения, касающаяся выбора антибиотиков первой линии, неоднозначна. Это связано с ростом резистентности микроорганизмов к антибиотикам, продолжительностью жизни тяжелых больных. Итальянские ученые во главе с S. Angeloni провели ряд исследований с целью верификации эффективности рекомендаций IAC по лечению СБП. Была проведена терапия цефотаксимом 32 больным с классическими проявлениями СБП. В результате эффективность терапии составила 59%. Остальным пациентам пришлось через 48 часов сменить антибиотик. Смена антибиотика привела к разрешению инфекции в 87% случаев. Анализируя эффективность цефотаксима в группе больных СБП, в которой удалось получить рост бактериальной культуры, авторы отметили хороший эффект в 44% случаев. Такую низкую эффективность авторы связывают с резистентностью микробоорганизмов к данному антибиотику. Ученые сделали вывод о необходимости поиска других антибиотиков первой линии в лечении СБП [25, 26].
Проведен ряд крупных исследований по изучению комплексного применения антибиотиков. Так, французские исследователи провели сравнительный анализ эффективности комбинированной антибактериальной терапии у 139 больных ЦП, осложненным СБП (во всех случаях СПБ верифицирован микробиологически). Энтерококки (Enterococcus faecium – 27,7%) были выделены у 48% пациентов, получавших профилактику фторхинолонами. E. coli была чувствительна к амоксициллину/клавулановой кислоте и цефалоспоринам третьего поколения в 62,5 и 89,5% случаев соответственно. Эффективность ни одного из применяемых антибиотиков в качестве монотерапии не превысила 60%. Авторы указали на эффективность комбинированной антибактериальной терапии, в частности сочетания амоксициллина и цефалоспоринов третьего поколения или ко-тримоксазола в 75–80% случаев (при отсутствии нозокомиальной инфекции) [26]. Применение антибиотиков более широкого спектра действия, по мнению авторов, должно рассматриваться для эмпирической терапии нозокомиальных инфекций.
Оптимальным критерием эффективности считается снижение числа нейтрофилов в АЖ через два дня после начала антибактериальной терапии по сравнению с исходными показателями [10, 18]. В связи с этим в ходе терапии рекомендуется проводить хотя бы один повторный парацентез через 48 часов от начала терапии.
Критериями неэффективности считаются ухудшение состояния в течение первых часов антибактериальной терапии, а также снижение числа нейтрофилов в АЖ менее чем на 25%. В отсутствие эффекта от антибактериальной терапии рекомендуется смена антибиотика с учетом чувствительности микрофлоры или эмпирически.
Применение альбумина. Парацентез с возмещением объема плазмы альбумином часто применяется при лечении рефрактерных асцитов. Взгляд на эффективность и безопасность этой методики у пациентов со спонтанным бактериальным перитонитом остается спорным. C.H. Choi и соавт. провели исследование эффективности внутривенного введения альбумина у больных СБП на фоне ЦП. 42 больных СБП были рандомизированы на две группы. Первую группу составил 21 больной, получавший стандартную терапию. 21 пациент второй группы применял альбумин и диуретики. Остальная терапия проводилась по общепринятым стандартам с использованием антибактериальных средств. Общие показатели выживаемости были низкими – 42,5 и 22,5% через шесть и 12 месяцев после лечения соответственно. Обе терапевтические схемы продемонстрировали одинаковую эффективность в лечении СБП. Тем не менее исследователи считают, что применение парацентеза с удалением больших объемов жидкости с внутривенной инфузией альбумина (8 г на каждый литр удаленной АЖ) целесообразно включать в комплексную терапию напряженного или рефрактерного асцита и добавлять к обычной терапии асцита у пациентов с ЦП и СБП по 1 г/кг в первые шесть часов и 20–40 г в день в дальнейшем для профилактики почечной недостаточности (ГРС) [25–27].
Бактериальная терапия. Интерес гепатологов к бактериальным препаратам в аспекте применения в лечении СБП обусловлен расширением представлений о патогенезе СБП, позволяющим оценить роль избыточного бактериального роста, процессов микробной транслокации.
Пробиотики – препараты, состоящие из живых микроорганизмов или продуктов микробного происхождения, проявляющие профилактические и лечебные эффекты и регулирующие нормальную индигенную микрофлору хозяина. В качестве заместительной терапии из множества пробиотиков чаще применяют препараты, содержащие несколько групп микроорганизмов, комплексно воздействующих на микрофлору и способствующих восстановлению биоценоза [5]. Хороший эффект оказывают препараты, содержащие три компонента живых лиофилизированных бактерий, устойчивых к антибиотикам и химиотерапевтическим средствам: Bifidobacterium injantis v. liberorum, Lactobacillus acidophilus, Streptococcous faecium. Бифидобактерии, лактобациллы, нетоксигенный молочнокислый стрептококк группы D поддерживают и регулируют микробиоценоз, обеспечивают антимикробную, витаминную, пищеварительную функции. Попадая в кишечник, их компоненты создают неблагоприятные условия для размножения патогенных микроорганизмов, участвуют в синтезе витаминов группы В, С, РР, К, Е, фолиевой кислоты, способствуют снижению рH кишечного содержимого, а также всасыванию железа, кальция, витаминов.
Профилактика спонтанного бактериального перитонита
Профилактику СБП рекомендуется проводить всем больным ЦП, осложненным асцитом с высоким риском развития тяжелых бактериальных инфекций, с применением фторхинолонов (норфлоксацин, ципрофлоксацин, офлоксацин) 400 мг внутрь каждые 12 часов не менее семи дней. В настоящее время фторхинолоны рассматриваются как важная самостоятельная группа химиотерапевтических препаратов в составе класса хинолонов – ингибиторов ДНК-гиразы, которые характеризуются высокой клинической эффективностью, широкими показаниями к применению и составляют серьезную альтернативу бета-лактамным антибиотикам широкого спектра действия. Основными особенностями фторхинолонов являются высокая биодоступность при приеме внутрь, большой объем распределения, низкое связывание с сывороточными белками, хорошее проникновение в органы, ткани и клетки макроорганизма, длительная циркуляция в организме, элиминация почечными и внепочечными механизмами. Появление резистентной микрофлоры в этом случае остается существенной проблемой. В связи с низкой выживаемостью после первого эпизода спонтанного перитонита, составляющей в течение первого года 30–50%, а в течение второго года всего 25–30%, рекомендуется рассматривать таких пациентов в качестве кандидатов на трансплантацию печени. Больные ЦП класса В и С по шкале Чайлда – Пью, перенесшие СБП, входят в группу риска повторного развития заболевания.
В настоящее время большие рандомизированные исследования показали высокую эффективность непрерывной антибактериальной профилактики у больных ЦП, перенесших СБП.
В соответствии с международными рекомендациями профилактика возвратного бактериального перитонита проводится непрерывно препаратами фторхинолонового ряда (норфлоксацин 400 мг/сут). Рандомизированные исследования норфлоксацина, проведенные J. Fernández и соавт., подтвердили его эффективность в профилактике СБП [28].
В последних научных исследованиях рассматривается роль комбинированного применения пентоксифиллина и спарфлоксацина для профилактики СБП. Результаты исследования T.M. Mostafa
указывают на высокий синергизм этих препаратов, что позволяет рассматривать применение их в комбинации для профилактики СБП [29].
Одним из наиболее реальных и перспективных направлений остается профилактическая коррекция синдрома избыточного бактериального роста, применение рифаксимина, пре- и пробиотиков на ранних этапах формирования ЦП.
Заключение
Дифференциальная диагностика СБП базируется на определении генеза основного заболевания, вызвавшего асцит, исключении асцита смешанного генеза, то есть сочетания двух и более причин, определении инфицированности асцитической жидкости и выявлении этиологического фактора, а также (возможно в первую очередь) на исключении вторичного бактериального перитонита.
Тяжелое течение морфологически доказанного ЦП известной этиологии при повторном наблюдении может уводить начинающего клинициста от мысли о необходимости постоянной проверки диагноза, определяющего тяжесть состояния больного. Именно поэтому необходимо помнить, что наличие асцита у больных ЦП не исключает развития перитонита вторичного характера в такой же степени (возможно и чаще), как у больных без ЦП.
СБП у больных ЦП и асцитом чрезвычайно сложен в диагностике и по своей сути является диагнозом исключения. Клинические данные подтверждают представления об СПБ как о сложном инфекционном процессе, сопровождающемся синдромом системной воспалительной реакции, который в итоге может приводить к развитию сепсиса и полиорганной недостаточности. СБП требует своевременной профилактики и адекватной антибактериальной терапии.
Спонтанный бактериальный перитонит — Студопедия
(табл. 9-1)
Асцитическая жидкость может инфицироваться без видимой причины или после парацентеза. Спонтанный перитонит осложняет течение асцита примерно у 8% больных циррозом печени, особенно часто при тяжёлом декомпенсированном течении. В большинстве случаев инфицирование происходит во время госпитализации. У таких больных чаще развиваются желудочно-кишечное кровотечение и почечная недостаточность, требующие срочного хирургического или консервативного лечения.
Инфицирование происходит гематогенным путём и в 90% случаев вызвано одним возбудителем (рис. 9-6), обычно кишечной группы. Проникновению микробов в кровь способствует нарушение проницаемости кишечной стенки при циррозе. В брыжеечных лимфатических узлах обнаруживаются бактерии [53]. Защитные механизмы при циррозе печени нарушены, бактерицидная активность асцитической жидкости снижена. Угнетена также функция ретикулоэндотелиальной системы. При алкоголизме нарушается функция нейтрофилов. Асцитическая жидкость становится благоприятной средой для роста бактерий, дефицит опсонинов нарушает нормальный фагоцитоз. «Опсоническая» активность асцитической жидкости прямо пропорциональна количеству белка, поэтому спонтанный бактериальный перитонит чаще возникает при концентрации белка менее 1 г%.
Рис. 9-5. Компьютерная томограмма. Видны сморщенная цирротическая печень, увеличенная селезёнка и асцит (указано стрелкой).
Таблица 9-1. Спонтанный бактериальный перитонит
Обычно возникает при наличии асцита у больных циррозом печени прогностических групп В и С по Чайлду
Клинические проявления могут отсутствовать и количество лейкоцитов может быть в пределах нормы
Концентрация белка в асцитической жидкости обычно меньше 1 г%
Обычно мономикробная грамотрицательная флора
Необходимо начать антибиотикотерапию, если в асцитической жидкости количество нейтрофилов превышает 250 в 1 мм3
Смертность достигает 50%
У 69% больных наблюдается рецидив в течение года
Рис. 9-6. Патогенез спонтанного бактериального перитонита у больных циррозом печени.
Перитонит, вызванный полимикробной флорой, обычно развивается как осложнение парацентеза, перфорации или дилатации толстой кишки либо при наличии очага инфекции в брюшной полости.
Количество нейтрофилов в асцитической жидкости превышает 250 в 1 мм3, в посеве обнаруживают рост бактерий. Спонтанный бактериальный перитонит можно заподозрить в тех случаях, когда у больного циррозом печени резко ухудшается состояние, особенно при появлении признаков энцефалопатии. У больных, не имевших прежде асцита, может наблюдаться молниеносная форма спонтанного бактериального перитонита. Уровень белка в асцитической жидкости менее 1 г/мл и высокий уровень билирубина в сыворотке независимо предсказывают развитие спонтанного бактериального перитонита [2]. Особенно велик риск у больных с кровотечением из варикозно-расширенных вен или у перенёсших ранее бактериальный перитонит. Основные симптомы — высокая лихорадка, боль в животе и болезненность брюшной стенки, лейкоцитоз. Однако они могут отсутствовать, и подтвердить диагноз можно лишь после анализа асцитической жидкости.
Если количество нейтрофилов превышает 250 в 1 мм3, антибиотикотерапию нужно начать немедленно.
Число бактерий в асцитической жидкости невелико. Возбудителями чаще всего являются Escherichia coli или стрептококки группы D, реже — менингококк [7], Campylobacter foetus [65] и бактерии группы Pasteurella [18]. Анаэробы выявляются редко. При угнетении функции иммунной системы могут обнаруживаться условно-патогенные микроорганизмы. Посев крови выявляет рост микробов в 80% случаев.
Мономикробная обсеменённость асцитической жидкости без увеличения числа нейтрофилов может исчезнуть и без лечения, но иногда возможно развитие спонтанного бактериального перитонита [50].
Прогноз
Худший прогноз наблюдается при значительном нарастании уровня билирубина и креатинина в крови и выраженном лейкоцитозе.
Больничная летальность при спонтанном бактериальном перитоните достигает 50%, а у 69% выживших больных в течение года возникает рецидив, приводящий к смерти 50% из них [б7].
Прогноз зависит от наличия недавнего желудочно-кишечного кровотечения [10], тяжести инфекции и степени печёночной и почечной недостаточности [33].
Лечение
Обычно эффективно парентеральное введение цефалоспоринов третьего поколения, например цефотаксима, в течение 5 дней [48, 52, 68]. Пероральные фторхинолоны (офлоксацин) дешевле и так же эффективны в большинстве случаев.
Профилактическое применение антибиотиков в амбулаторных условиях снизило частоту рецидивов, однако показатель выживаемости не изменился. Обычно применяют норфлоксацин в дозе 400 мг/сут в течение 2—3 нед, однако при этом появляются резистентные штаммы бактерий, что нужно учитывать, если в последующем планируется трансплантация печени. Триметоприм/сульфаметоксазол — более дешёвый, но столь же эффективный препарат [60]. Диуретическая терапия повышает общее содержание белка и «опсонизирующую» активность асцитической жидкости [51]. Парацентез не даёт таких эффектов, но при этом не повышается также риск возникновения спонтанного бактериального перитонита как непосредственно после парацентеза, так и в отдалённые сроки [61].
Рецидивирующий спонтанный бактериальный перитонит, если нет других препятствий, является показанием к трансплантации печени.
Лечение асцита у больных циррозом печени
Диуретические препараты или парацентез эффективны в большинстве случаев. Однако даже при хорошем начальном ответе не исключена возможность развития в последующем почечной недостаточности или энцефалопатии. Показаниями к лечению асцита являются:
Асцит неясного генеза. Уменьшение количества асцитической жидкости облегчает пальпацию живота и проведение таких процедур, как пункционная биопсия, сцинтиграфия и флебография.
Большой асцит, сопровождающийся болями в животе и одышкой.
Напряжённый асцит с изъязвлением и угрозой разрыва пупочной грыжи. Это осложнение сопровождается высокой летальностью и может привести к развитию шока и почечной недостаточности.
Лечить асцит у больных циррозом труднее, чем другие формы накопления жидкости в организме. Диуретическая терапия может привести к электролитным нарушениям, энцефалопатии и почечной недостаточности.
Ограничение физической активности уменьшает количество метаболитов, образующихся в печени. В положении больного лёжа усиливается портальный венозный и почечный кровоток. Суточный диурез и масса тела являются адекватными показателями эффективности лечения, которые нужно измерять ежедневно в одно и то же время. Определённое, хотя и не столь существенное, значение имеет исследование содержания электролитов в моче. У госпитализированных больных 2 раза в неделю определяют уровень электролитов в крови. Терапия включает ограничение соли в пище, диуретические препараты и парацентез (табл. 9-2).
В лёгких случаях (при амбулаторном лечении) бывает достаточно диеты и диуретической терапии, но при госпитализации больного лечение обычно начинают с парацентеза. По данным гепатологов Европы, 50 % врачей используют парацентез до начала диуретической терапии [1]. При этом 50% полностью удаляют асцитическую жидкость, другие 50% считают достаточным лишь уменьшение асцита до облегчения симптомов.
У больных с асцитом, не ограничивающих потребление соли с пищей, суточная экскреция натрия с мочой снижена до 10 ммоль (0,2 г) и менее.
Таблица 9-2. Основные принципы лечения асцита
Постельный режим. Диета с низким содержанием натрия (не более 22 ммоль/сут). Ограничивают приём жидкости до 1 л в сутки. Определяют уровень электролитов в сыворотке и моче. Ежедневно измеряют массу тела, диурез. Исследуют асцитическую жидкость
При напряжённом асците оценивают показания к парацентезу (см. табл. 9-6)
Спиронолактон по 200 мг/сут
После 4 дней лечения рассматривают показания к добавлению фуросемида по 80 мг/сут. Осуществляют контроль за уровнем электролитов в сыворотке
Показания для отмены диуретических препаратов: прекоматозное состояние, «хлопающий» тремор, гипокалиемия, азотемия или алкалоз
Продолжают измерение массы тела. При необходимости увеличивают дозу диуретиков
Внепочечные потери его достигают 0,5 г. Употребление более 0,75 г натрия в сутки ведёт к развитию асцита; при этом каждый грамм натрия задерживает 200 мл жидкости. Поэтому в сутки с пищей должно поступать не более 22 ммоль (0,5 г) натрия, а количество жидкости нужно ограничить до 1.л.
Спонтанный бактериальный перитонит — WikEM
См. Перитонит, связанный с перитонеальным диализом, для перитонита БП
Фон
- Развивается при обширном клинически очевидном асците, вторичном по отношению к циррозу печени.
- Портальная гипертензия → отек кишечника → нормальная флора перемещается через стенку кишечника в брюшину
- У 30% пациентов с асцитом в конкретный год разовьется спонтанный бактериальный перитонит (САБ)
Возбудители
Клинические характеристики
Дифференциальная диагностика
Диффузная боль в животе
Оценка
Рассмотрение альтернативных диагнозов одновременно
Определение SBP асцитической жидкости с помощью парацентеза
- Количество ячеек с дифференциалом
- Окраска по Граму
- Посев (10 мл во флаконе для посева крови)
- Глюкоза
- Белок
Диагностика САД с помощью анализа асцитической жидкости
Стандартная оценка
- Результаты парацентеза, подтверждающие диагноз САД:
- Абсолютное количество нейтрофилов (PMN) ≥250, pH <7.35, ИЛИ градиент pH при асците крови> 0,1 [1]
- Бактерии на окраске по Граму (один тип)
- SAAG> 1.1
- Диагностика портальной гипертензии с точностью 97% [2]
- САД редко развивается у пациентов без портальной гипертензии
- Белок <1, глюкоза> 50 (в противном случае может возникнуть вторичный бактериальный перитонит)
При кровоточивости вычтите 1 лейкоцит на каждые 250 эритроцитов [3]
Если на перитонеальном диализе
См. Перитонит, связанный с перитонеальным диализом
- Количество клеток> 100 / мм с> 50% нейтрофилов, наиболее соответствующих инфекции [4]
Спонтанный бактериальный перитонит по сравнению с вторичным
- Важность различия
- Смертность от вторичного бактериального перитонита (напр.перфорированный аппендицит, холецистит) ~ 100% при лечении только антибиотиками без операции
- Смертность от ненужного хирургического вмешательства у пациентов с САД ~ 80%
- Лабораторные данные
- Вторичный бактериальный перитонит убедительно предположили:
- Нейтроцитарная жидкость (PMN ≥250) с двумя или более из следующего:
- Общая концентрация белка> 1 г / дл (10 г / л)
- Концентрация глюкозы <50 мг / дл (2,8 ммоль / л)
- ЛДГ выше верхнего предела нормы для сыворотки
- Щелочной фосфор асцитной кислоты> 240
- Окраска по Граму
- Большое количество различных бактериальных форм
- Нейтроцитарная жидкость (PMN ≥250) с двумя или более из следующего:
- Вторичный бактериальный перитонит убедительно предположили:
- изображений
- При наличии вторичного бактериального перитонита получить визуализацию брюшной полости.
- Если нет признаков экстравазации свободного воздуха или контрастного вещества, операция не показана
- При наличии вторичного бактериального перитонита получить визуализацию брюшной полости.
Ведение
Антибиотики
Альбумин
Снижает почечную недостаточность и больничную смертность при введении в течение 6 часов [5] [6] [7]
- Дайте для всего или (более сильного эффекта), если креатинин> 1 мг / дл, АМК> 30 мг / дл или Т-били> 4 мг / дл
- 1.5 г / кг в течение 6 часов после постановки диагноза; 1 г / кг в день 3
Утилизация
- Самые популярные
- Можно рассмотреть вопрос о выписке с помощью пероральных антибиотиков при легкой неосложненной форме заболевания и при тщательном наблюдении
См. Также
Список литературы
- ↑ Вилкерсон Р., Синерт Р. Использование парацентеза в оценке состояния пациента с асцитом. Энн Эмерг Мед 2009, 54 (3): 465-68.
- ↑ Runyon BA, Montano AA, Akriviadis EA, et al.Градиент сывороточного асцитного альбумина превосходит концепцию экссудат-транссудат в дифференциальной диагностике асцита. Ann Intern Med 1992; 117: 215.
- ↑ Hoefs JC «Повышение асцитных лейкоцитов и концентрации белка во время диуреза у пациентов с хроническим заболеванием печени». Гепатология. 1981; 1 (3): 249. PMID 7286905
- ↑ РУКОВОДСТВО / РЕКОМЕНДАЦИИ ISPD http://www.ispd.org/guidelines/articles/update/ispdperitonitis.pdf
- ↑ Jamtgaard, et al. Снижает ли инфузия альбумина почечную недостаточность и смертность у пациентов с САД.Летопись ЭМ. Апрель 2016. 67 (4): 458-458.
- ↑ Sort, P et al. Влияние внутривенного альбумина на почечную недостаточность и смертность у пациентов с циррозом печени и спонтанным бактериальным перитонитом. N Engl J Med. 1999 5 августа; 341 (6): 403-9.
- ↑ Сюэ, HP et al. Влияние инфузии альбумина на предотвращение ухудшения функции почек у пациентов со спонтанным бактериальным перитонитом. Китайский журнал болезней органов пищеварения, 2002, 3 января: 32-34.
.
Спонтанный бактериальный перитонит — REBEL EM
16 ноября 2017
Спонтанный бактериальный перитонит
 Определение: Острая инфекция асцитической жидкости у пациента с заболеванием печени без другого источника инфекции
Определение: Острая инфекция асцитической жидкости у пациента с заболеванием печени без другого источника инфекции
Эпидемиология: (Runyon 1988, Runyon 1988, Borzio 2001)
- Заболеваемость
- 10-25% риск хотя бы одного эпизода в год
- Риск 20% у пациентов с асцитом, госпитализированных
- Исторически смертность ~ 50%
Патофизиология:
- Не совсем понял
- Повышенная портальная системная гипертензия
- Вызывает отек слизистой оболочки кишечника
- Увеличивает трансмуральную миграцию кишечных организмов в асцитную жидкость
- Нарушение фагоцитарной функции печени
- Нарушение иммунологической активности в асцитической жидкости
 Представительство:
Представительство:
- Классическая триада: лихорадка, боли в животе и нарастающий асцит. Наличие всех трех компонентов нечасто
- Симптомы
- Лихорадка или озноб
- Боль в животе
- Вздутие живота
- Усталость
- Недомогание
- Знаков
- Переменная болезненность брюшной полости
- Обычно диффузный
- Может быть легким без перитонеальных признаков
- Может быть тяжелым с отскоком и / или защитой
- Вздутие живота
- Изменение психического статуса (вследствие печеночной энцефалопатии)
- Переменная болезненность брюшной полости
Диагностика:
- Получение пробы асцитической жидкости имеет решающее значение для постановки диагноза
- Анализы сыворотки крови (т.е. WBC, CRP, ESR) не помогают в постановке этого диагноза
- Из-за различных проявлений и значительной смертности, связанной с САД, следует рассмотреть возможность проведения парацентеза ВСЕМ пациентам с асцитической жидкостью, которые поступают в стационар (Gaetano 2016).
- Диагностический парацентез (EM: RAP HD)
-

Парацентез (DrER.tv)
Анализы асцитической жидкости
- Количество ячеек
- Ищите лейкоцитов> 250-500 клеток / мм 3 или количество нейтрофилов> 250 клеток / мм 3
- Пациенты на перитонеальном диализе: количество нейтрофилов> 100 клеток / мм
- pH <7.34 чаще встречается в SBP (Wong 2008)
- Окраска по грамму асцитической жидкости (редко положительная) и посев
- Количество ячеек
- Если у пациента жар (температура> 100 o F) или боль / болезненность в животе, следует назначить эмпирических антибиотиков , даже если количество нейтрофилов <250 клеток / мм 3
Менеджмент:
- Антибиотики
- Наиболее частые бактериальные причины: E. Coli, S. Pneumoniae, Enterococci
- Цефалоспорин 3-го поколения охватывает подавляющее большинство случаев
- Цефтриаксон 25 мг / кг до 2 г ежедневно
- Цефотаксим 25 мг / кг до 1 г Q8
- Альтернативные варианты антибиотиков
- Ципрофлоксацин 400 мг внутривенно 2 раза в сутки
- Левофлоксацин 750 мг внутривенно ежедневно
- Пиперациллин / Тазобактам 4.5 г в / в три раза в сутки
- Эртапенем 1 г в / в каждые сутки
- Имипенем / циластатин 500 мг в / в 4 раза в сутки
- Настой альбумина (Runyon 2012)
- Рекомендовано Американской ассоциацией по изучению заболеваний печени (AASLD) в определенных подгруппах с SBP
- Присутствие любого из следующих факторов должно побудить к введению альбумина
- Креатинин сыворотки> 1 мг / дл
- Азот мочевины крови (АМК)> 30 мг / дл
- Общий билирубин> 4 мг / дл
- Воздействие инфузии альбумина (сортировка 1999 г.)
- Снижение почечной недостаточности на 25%
- Снижение смертности на 20%
- Доза
- 1.5 грамм / кг в течение 6 часов
- 1,0 г / кг на 3-й день лечения
- Рекомендовано Американской ассоциацией по изучению заболеваний печени (AASLD) в определенных подгруппах с SBP
- Пациентам с единичным эпизодом САД следует рассмотреть возможность назначения антибиотикопрофилактики (норфлоксацином, ципрофлоксацином или TMP / SMX) (Runyon 2012)

Подход к диагностике и лечению СБП (Вашингтонский университет)
Take Home Очки:
- SBP — это сложный диагноз, потому что проявления изменчивы.Рассмотрите возможность диагностического парацентеза у всех пациентов, поступающих в отделение неотложной помощи с асцитом от цирроза печени
- Асцит, количество PMN> 250 клеток / мм 3 является диагностическим признаком САД, но лечение следует рассмотреть у любого пациента с асцитом и болью в животе или лихорадкой
- Лечение САД — цефалоспорин 3-го поколения с добавлением инфузии альбумина у любого пациента, отвечающего критериям AASLD (Cr> 1,0 мг / дл, BUN> 30 мг / дл или общий билирубин> 4 мг / дл)
Для получения дополнительной информации по этой теме заказ:
Артикул:
- Runyon BA et al.Анализ асцитической жидкости при асците, связанном со злокачественными новообразованиями. Гепатология 1988; 8 (5): 1104-1109. PMID: 3417231
- Runyon BA. Спонтанный бактериальный перитонит: информационный взрыв. Гепатология 1988; 8: 171–175. PMID: 3338704
- Borzio M et al. Бактериальная инфекция у пациентов с запущенным циррозом печени: многоцентровое проспективное исследование. Dig Liver Dis 2001; 33 (1): 41-48. PMID: 11303974
- Gaetano et al. Польза парацентеза для госпитализированных взрослых с циррозом и асцитом.Журнал гастроэнтерологии и гепатологии 2016. PMID: 26642977
- Wong CL et al. У этого пациента бактериальный перитонит или портальная гипертензия? Как выполнить парацентез и проанализировать результаты? JAMA 2008; 299 (10): 1166-78. PMID: 18334692
- Runyon BA. Ведение взрослых пациентов с асцитом вследствие цирроза: обновление 2012 г. Практическое руководство AASLD. Ссылка
- Sort P et al. Внутривенное введение альбумина у пациентов с циррозом печени и спонтанным бактериальным перитонитом.NEJM 1999; 341: 1773-4. PMID: 10432325
Сообщение Рецензент: Салим Резаи (Twitter: @srrezaie)
Цитируйте эту статью как: Ананд Сваминатан, «Спонтанный бактериальный перитонит», блог REBEL EM, 16 ноября 2017 г. Доступно по адресу: https://rebelem.com/spontaneous-bacterial-peritonitis/. Следующие две вкладки изменяют содержание ниже .

REBEL EM Заместитель редактора и автор

.
Перитонит — Симптомы и причины
Обзор
Перитонит — это воспаление брюшины — шелковой мембраны, выстилающей внутреннюю брюшную стенку и покрывающую органы внутри брюшной полости, — обычно вызванное бактериальной или грибковой инфекцией. Есть два типа перитонита:
- Спонтанный бактериальный перитонит. Иногда перитонит развивается как осложнение заболевания печени, например цирроза печени, или заболевания почек.
- Вторичный перитонит. Перитонит может возникнуть в результате разрыва (перфорации) брюшной полости или как осложнение других заболеваний.
Перитонит требует немедленной медицинской помощи для борьбы с инфекцией и, при необходимости, для лечения любых основных заболеваний. Лечение перитонита обычно включает антибиотики и, в некоторых случаях, хирургическое вмешательство. При отсутствии лечения перитонит может привести к серьезной, потенциально опасной для жизни инфекции по всему телу.
Частой причиной перитонита является перитонеальный диализ. Если вы получаете терапию перитонеальным диализом, вы можете предотвратить перитонит, соблюдая правила гигиены до, во время и после диализа.
Продукты и услуги
Показать больше продуктов от Mayo Clinic
Симптомы
Признаки и симптомы перитонита включают:
- Боль или болезненность в животе
- Вздутие живота или ощущение распирания в животе
- Лихорадка
- Тошнота и рвота
- Потеря аппетита
- Диарея
- Низкий диурез
- Жажда
- Невозможность отхождения стула или газов
- Усталость
- Путаница
Если вы получаете перитонеальный диализ, симптомы перитонита также могут включать:
- Мутный диализирующий раствор
- Белые пятна, нити или комки (фибрин) в диализирующем растворе
Когда обращаться к врачу
Перитонит может быть опасным для жизни, если его не лечить вовремя.Немедленно обратитесь к врачу, если у вас сильная боль или болезненность в животе, вздутие живота или ощущение полноты, связанное с:
- Лихорадка
- Тошнота и рвота
- Низкий диурез
- Жажда
- Невозможность отхождения стула или газов
Если вы получаете перитонеальный диализ, немедленно обратитесь к своему врачу, если у вас диализный раствор:
- Мутная или необычного цвета
- С белыми пятнами
- Содержит нити или комки (фибрин)
- Имеет необычный запах, особенно если область вокруг трубки (катетера) красная или болезненная.
Перитонит может возникнуть в результате разрыва аппендикса или травмы брюшной полости.
- Немедленно обратитесь за медицинской помощью , если у вас возникла настолько сильная боль в животе, что вы не можете сидеть на месте или найти удобное положение.
- Позвоните 911 или обратитесь за неотложной медицинской помощью , если у вас возникла сильная боль в животе после несчастного случая или травмы.
Причины
Заражение брюшины может произойти по разным причинам.В большинстве случаев причина — разрыв (перфорация) брюшной стенки. Хотя это бывает редко, заболевание может развиться без разрыва живота.
Общие причины разрывов, приводящих к перитониту, включают:
- Медицинские процедуры, например перитонеальный диализ. При перитонеальном диализе используются трубки (катетеры) для удаления продуктов жизнедеятельности из крови, когда ваши почки больше не могут это сделать. Инфекция может возникнуть во время перитонеального диализа из-за нечистоты окружающей среды, плохой гигиены или зараженного оборудования.Перитонит может также развиться как осложнение желудочно-кишечной хирургии, использования зондов для кормления или процедуры по отказу жидкости из брюшной полости, и редко как осложнение колоноскопии или эндоскопии.
- Разрыв аппендикса, язва желудка или перфорация толстой кишки. Любое из этих состояний может позволить бактериям попасть в брюшину через отверстие в желудочно-кишечном тракте.
- Панкреатит. Воспаление поджелудочной железы (панкреатит), осложненное инфекцией, может привести к перитониту, если бактерии распространяются за пределы поджелудочной железы.
- Дивертикулит. Инфекция небольших выпуклых мешочков в пищеварительном тракте (дивертикулез) может вызвать перитонит, если один из мешочков разорвется, и кишечные отходы попадут в брюшную полость.
- Травма. Травма или травма могут вызвать перитонит из-за попадания бактерий или химических веществ из других частей тела в брюшину.
Перитонит, развивающийся без разрыва брюшной полости (спонтанный бактериальный перитонит), обычно является осложнением заболевания печени, например цирроза.При запущенном циррозе в брюшной полости накапливается большое количество жидкости. Это скопление жидкости подвержено бактериальной инфекции.
Факторы риска
Факторы, повышающие риск перитонита, включают:
- Перитонеальный диализ. Перитонит может возникать у людей, проходящих перитонеальный диализ.
- Прочие медицинские состояния. Следующие заболевания, среди прочего, повышают риск развития перитонита: цирроз печени, аппендицит, болезнь Крона, язва желудка, дивертикулит и панкреатит.
- История перитонита. После того, как вы переболели перитонитом, риск его повторного развития может быть выше, чем для человека, никогда не болевшего перитонитом.
Осложнения
При отсутствии лечения перитонит может распространяться за пределы брюшины и вызывать:
- Инфекция во всем теле (сепсис). Сепсис — это быстро прогрессирующее, опасное для жизни заболевание, которое может вызвать шок, отказ органов и смерть.
Профилактика
Часто перитонит, связанный с перитонеальным диализом, вызывается микробами вокруг трубки (катетера). Если вы получаете перитонеальный диализ, примите следующие меры для предотвращения перитонита:
- Вымойте руки, в том числе под ногтями и между пальцами, прежде чем прикасаться к катетеру.
- Ежедневно очищайте кожу вокруг катетера антисептиком.
- Храните все необходимое в санитарном помещении.
- Носите хирургическую маску во время замены диализирующего раствора.
- Поговорите со своей бригадой по диализу о правильном уходе за катетером для перитонеального диализа.
Если у вас ранее был перитонит или если у вас накопление жидкости в брюшной полости из-за такого заболевания, как цирроз печени, ваш врач может назначить антибиотики для предотвращения перитонита. Если вы принимаете ингибитор протонной помпы, врач может попросить вас прекратить его прием.
.
Вторичный бактериальный перитонит
0
Введение с чемоданом
0
Пациент с тяжелым алкогольным циррозом печени поступает в больницу с лихорадкой и измененным психическим статусом. При обследовании отмечается вздутие живота с болезненностью отскока. Прикроватное ультразвуковое исследование выявляет большое количество асцита, образцы которого тщательно отбираются, выявляя мутную жидкость с 15000 нейтрофилов / мкл и 90% нейтрофилов (видео ультразвукового исследования левого нижнего квадранта брюшной полости показано выше).Поставлен диагноз спонтанный бактериальный перитонит, больному проведено лечение. Однако через десять часов у пациента развивается артериальная гипотензия и тахикардия, требующие перевода в отделение интенсивной терапии. Что пошло не так?
0
Вторичный бактериальный перитонит
0
Все мы хорошо знакомы со спонтанным бактериальным перитонитом: пациенту с циррозом и асцитом в брюшину попадает крошечный посевной материал с бактериями низкой степени тяжести.Этот диагноз бывает сложно поставить, потому что пациенты могут не испытывать сильной боли в животе и обычно не выглядят токсичными.
Вторичный бактериальный перитонит более опасен и редок (в 20 раз реже, чем спонтанный бактериальный перитонит). Это инфицированная асцитная жидкость из-за основного источника инфекции, поддающегося хирургическому лечению (например, перфорации внутренних органов, аппендицита, холецистита, ишемии брыжейки и т. Д.). Важно отличать это от спонтанного бактериального перитонита, потому что вторичный бактериальный перитонит обычно требует хирургического вмешательства.
Диагноз вторичного бактериального перитонта часто откладывается или пропускается из-за низкой осведомленности об этом состоянии. Возможность вторичного бактериального перитонита всегда следует тщательно рассматривать, прежде чем делать вывод о том, что у пациента спонтанный бактериальный перитонит.
0
Тревожные признаки вторичного бактериального перитонита
При обследовании пациента с асцитом и вероятным спонтанным бактериальным перитонитом следующие признаки могут вызвать подозрение на альтернативный диагноз:
(1) Выраженное раздражение брюшины : По нашему опыту, обследование брюшной полости при спонтанном бактериальном перитоните часто не дает впечатляющих результатов, а обследование брюшной полости, указывающее на явный перитонит, должно вызывать подозрение на альтернативный диагноз.Тем не менее, это лишь слабо подтверждено доказательствами: в ряде исследований сообщается о болезненности рикошета у 17% пациентов со вторичным бактериальным перитонитом по сравнению с 10% пациентов со спонтанным бактериальным перитонитом (Koulaouzidis 2007). Тем не менее, цирроз не защищает от других заболеваний брюшной полости. Поэтому может быть разумным сканировать пациента с признаками, указывающими на явный перитонит, даже если у него сосуществующий асцит.
(2) Свободный воздух для ультразвукового исследования у постели больного : Эксперты достигают чувствительности 85–90% и специфичности около 100%.На практике производительность варьируется в зависимости от оператора, оборудования, количества свободного воздуха и точного набора визуализируемых результатов. Это обследование занимает несколько минут и может быть включено в повседневную практику при проведении УЗИ для оценки асцита или боли в животе (Hoffmann 2012).
(3) Окраска по Граму с множественными микроорганизмами : Спонтанный бактериальный перитонит — это мономикробный процесс. Если на окраске по Граму обнаруживаются несколько бактерий различной морфологии, это почти указывает на вторичный бактериальный перитонит.Если вы беспокоитесь о вторичном бактериальном перитоните, иногда очень помогает окрашивание по статистике.
(4) Неудача лечения : Всегда следует ставить альтернативный диагноз, когда пациент не отвечает на соответствующую терапию.
Многие источники предполагают, что количество лейкоцитов в асцитической жидкости выше 10 000 нейтрофилов / мкл указывает на вторичный бактериальный перитонит. Однако Runyon 1990 обнаружил значительное совпадение между спонтанным и вторичным бактериальным перитонитом (8,500 +/- 12,000 vs.10,000 +/- 13,000 соответственно).
0
Алгоритмы диагностики
0
0
В 1990 году Руньон опубликовал вышеупомянутый алгоритм дифференциации спонтанного бактериального перитонита от вторичного. С тех пор в учебниках и статьях точно воспроизводятся версии этого алгоритма. Суть этого алгоритма — Критерий Руньона для вторичного бактериального перитонита, который требует двух из этих трех характеристик: общий белок> 1 г / дл, глюкоза. Эти критерии были разработаны для выявления пациентов с перфорацией.Поэтому в оригинальной публикации Runyon использовал повторный парацентез через 48 часов для выявления неперфорированного вторичного бактериального перитонита. Эта стратегия имеет очевидный недостаток, заключающийся в том, что она требует 48-часовой задержки для диагностики любого пациента с вторичным бактериальным перитонитом без перфорации.
В 2010 году Сориано провел ретроспективное исследование 24 пациентов с диагнозом вторичный перитонит по сравнению со 106 пациентами со спонтанным бактериальным перитонитом. Критерии Руньона имели чувствительность 67% и специфичность 90% среди всех пациентов с вторичным бактериальным перитонитом и только 64% чувствительности среди пациентов с перфорацией.Средняя задержка от парацентеза до постановки диагноза составила 2,5 дня. Это исследование предполагает, что критерии Руньона недостаточно чувствительны.
0
0
Наш диагностический подход показан выше. Хотя вторичный бактериальный перитонит составляет только ~ 5% пациентов с циррозом и асцитом, этот диагноз имеет большое значение для лечения. Добавление красных флажков к критериям Руньона может улучшить чувствительность и тем самым сократить время задержки до постановки диагноза. В целом, должен быть низкий порог для получения изображений (компьютерная томография и, возможно, УЗИ, если речь идет о патологии желчевыводящих путей).
0
Значение УЗИ для выявления асцитической жидкости с перегородками.
0
Стерильная асцитическая жидкость от цирроза печени должна иметь простой безэховый (черный) вид на ультразвуковом исследовании у постели больного. Наличие перегородок и мусора указывает на значительное воспаление с дифференциальным диагнозом, включая злокачественные новообразования, туберкулез и бактериальную инфекцию. Септации не различают спонтанный бактериальный перитонит и вторичный бактериальный перитонит.
0
Лечение
0
Лечение сосредоточено вокруг антибиотиков широкого спектра действия и контроля источников. Было показано, что альбумин снижает почечную дисфункцию при спонтанном бактериальном перитоните, что указывает на его потенциальную полезность при сопутствующих инфекциях. Недавнее рандомизированное контролируемое исследование показало улучшение функции почек при назначении альбумина пациентам с циррозом и инфекциями, отличными от спонтанного бактериального перитонита (Guevara 2012).
К сожалению, это заболевание трудно поддается лечению.Пациенты с запущенным циррозом печени имеют высокую смертность при проведении внутрибрюшных операций. Для пациентов с терминальной стадией цирроза, которые не являются кандидатами на трансплантацию, необходимо откровенное обсуждение между пациентом, хирургом и основной бригадой. Многие из этих пациентов получат наибольшую пользу от паллиативной терапии. Это идеальный вариант для раннего обсуждения, когда пациент остается стабильным и ясным.
0
Заключение по делу
0
Пациент был стабилизирован в отделении интенсивной терапии с помощью интубации, вазопрессоров и установки центральной линии.Компьютерная томография выявила перфорацию двенадцатиперстной кишки. Из-за обострения мутиорганной недостаточности пациент не был сочтен кандидатом на операцию. Несмотря на агрессивную помощь, пациент не выжил.
0
Пункты выдачи
- Вторичный бактериальный перитонит всегда следует рассматривать перед постановкой диагноза спонтанного бактериального перитонита.
- Тревожные признаки вторичного бактериального перитонита:
- Признаки брюшины при физикальном осмотре
- Ультрасонография в месте оказания медицинской помощи показывает свободный воздух
- Окраска по Граму множественными организмами
- Неудача лечения
- В стерильной асцитической жидкости, вызванной циррозом, не должны наблюдаться перегородки.Наличие перегородок предполагает наличие инфекции, будь то первичный или вторичный бактериальный перитонит.
- Что касается возможности вторичного бактериального перитонита, должен быть низкий порог для получения компьютерной томографии.
В соавторстве с Полом Фаркасом, моим отцом и старшим консультантом по гастроэнтерологии.
Джош — создатель PulmCrit.org. Он доцент кафедры легочной медицины и реанимации в Университете Вермонта.
Последние сообщения Джоша Фаркаса (посмотреть все)
.

 Представительство:
Представительство: