Неинвазивная вентиляция легких при новой коронавирусной инфекции COVID-19 | Авдеев
1. Zhu N., Zhang D., Wang W. et al. A Novel coronavirus from patients with pneumonia in China, 2019. N. Engl. J. Med. 2020; 382 (8): 727–733. DOI: 10.1056/NEJMoa2001017.
2. Huang C., Wang Y., Li X. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020; 395 (10223): 497–506. DOI: 10.1016/S01406736(20)30183-5.
3. Wu Z., McGoogan J.M. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China. JAMA. 2020; 323 (17): 1239–1242. DOI: 10.1001/jama.2020.2648.
4. Ruan Q., Yang K., Wang W. et al.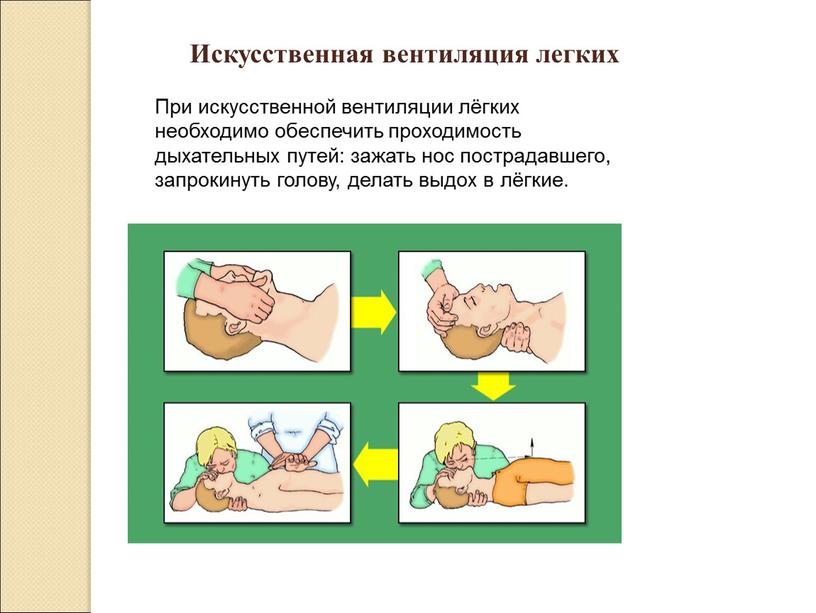 Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020; 46 (6): 1294–1297. DOI: 10.1007/s00134-020-06028-z.
Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020; 46 (6): 1294–1297. DOI: 10.1007/s00134-020-06028-z.
5. Bellani G., Laffey J.G., Pham T. et al. Noninvasive ventilation of patients with acute respiratory distress syndrome: Insights from the LUNG SAFE study. Am. J. Respir. Crit. Care Med. 2017; 195 (1): 67–77. DOI: 10.1164/rccm.2016061306OC.
6. Intensive Care National Audit & Research Centre (ICNARC). ICNARC report on COVID-19 in critical care, 10 April 2020. Available at: https://www.icnarc.org/OurAudit/Audits/Cmp/Reports
7. Richardson S., Hirsch J.S., Narasimhan M. et al. Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York City area. JAMA. 2020; 323 (20): 2052. DOI: 10.1001/jama.2020.6775.
JAMA. 2020; 323 (20): 2052. DOI: 10.1001/jama.2020.6775.
8. Hua J., Qian C., Luo Z. et al. Invasive mechanical ventilation in COVID-19 patient management: the experience with 469 patients in Wuhan. Crit. Care. 2020; 24 (1): 348. DOI: 10.1186/s13054-020-03044-9.
9. Rochwerg B., Brochard L., Elliott M.W. et al. Official ERS/ ATS clinical practice guidelines: noninvasive ventilation for acute respiratory failure. Eur. Respir. J. 2017; 50 (2): 1602426. DOI: 10.1183/13993003.02426-2016.
10. Авдеев С.Н. Неинвазивная вентиляция легких при острой дыхательной недостаточности: от клинических рекомендаций – к реальной клинической практике. Пульмонология. 2018; 28 (1): 32–35. DOI: 10.18093/08690189-2018-28-1-32-35.
11. Авдеев С.Н. Неинвазивная вентиляция легких при острой дыхательной недостаточности. Пульмонология. 2005; (6): 37–54.
Авдеев С.Н. Неинвазивная вентиляция легких при острой дыхательной недостаточности. Пульмонология. 2005; (6): 37–54.
12. Авдеев С.Н. Неинвазивная вентиляция легких у пациентов c хронической обструктивной болезнью легких в стационаре и домашних условиях. Пульмонология. 2017; 27 (2): 232–249. DOI: 10.18093/0869-0189-2017-272-232-249.
13. Faculty of Intensive Care Medicine, Intensive Care Society, Association of Anaesthetists and Royal College of Anaesthetists. Critical care preparation and management in the COVID-19 pandemic. Available at: https://www.icmanaesthesiacovid-19.org/critical-care-preparation-and-management-in-the-covid-19-pandemic (Accessed: Marсh 25, 2020).
14. World Health Organization. Clinical management of severe acute respiratory infection (SARI) when COVID-19 disease is suspected: interim guidance, 13 March 2020. Available at: https://apps.who.int/iris/handle/10665/331446?show=full
Available at: https://apps.who.int/iris/handle/10665/331446?show=full
15. Alhazzani W., Muller M.H., Arabi Y.M. et al. Surviving sepsis campaign: Guidelines on the management of critically ill adults with coronavirus disease 2019 (COVID-19). Crit. Care Med. 2020; 48 (6): e440–469. DOI: 10.1097/ccm.0000000000004363.
16. NHS. Guidance for the role and use of non-invasive respiratory support in adult patients with COVID-19 (confirmed or suspected). 6 April 2020, Version 3. Available at: https://www.england.nhs.uk/coronavirus/wp-content/uploads/sites/52/2020/03/specialty-guide-NIV-respiratory-support-and-coronavirus-v3.pdf
17. Vitacca M., Nava S., Santus P. et al. Early consensus management for non-ICU ARF SARS-CoV-2 emergency in Italy: From ward to trenches. Eur. Respir. J. 2020; 55 (5): 2000632. DOI: 10.1183/13993003.00632-2020.
Eur. Respir. J. 2020; 55 (5): 2000632. DOI: 10.1183/13993003.00632-2020.
18. Troosters T. Managing the respiratory care of patients with COVID-19: Italian recommendations. European Respiratory Society; 2020, Mar. 23. Available at: https://www.ersnet.org/covid-19-blog/sharing-italian-recommendations
19. Cinesi Gómez C., Peñuelas Rodríguez Ó., Luján Torné M. et al. Recomendaciones de consenso respecto al soporte respiratorio no invasivo en el paciente adulto con insuficiencia respiratoria aguda secundaria a infección por SARSCoV-2. Arch. Bronconeumol. 2020; 56 (2): 11–18. DOI: 10.1016/j.arbres.2020.03.005.
20. Авдеев С.Н., Царева Н.А., Мержоева З.М. и др. Практические рекомендации по кислородотерапии и респираторной поддержке пациентов с COVID-19 на дореанимационном этапе. Пульмонология. 2020; 30 (2): 151–163. DOI: 10.18093/0869-0189-2020-30-2-151-163.
Пульмонология. 2020; 30 (2): 151–163. DOI: 10.18093/0869-0189-2020-30-2-151-163.
21. Crimi C., Noto A., Cortegiani A. et al. Noninvasive respiratory support in acute hypoxemic respiratory failure associated with COVID-19 and other viral infections. medRxiv [Preprint. Posted: 2020, May 26]. DOI: 10.1101/2020.05.24.20111013.
22. Attanasi M., Pasini S., Caronni A., Pellegrino G.M. et al. Inpatient care during the COVID-19 pandemic: A survey of Italian physicians. Respiration. 2020; 99 (8): 667–677. DOI: 10.1159/000509007.
23. Lai X., Wang M., Qin C. et al. Coronavirus disease 2019 (COVID-2019) infection among health careworkers and implications for prevention measures in a tertiary hospital in Wuhan, China. JAMA Netw. Open. 2020; 3 (5): e209666. DOI: 10. 1001/jamanetworkopen.2020.9666.
1001/jamanetworkopen.2020.9666.
24. Tran K., Cimon K., Severn M. et al. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: A systematic review. PLoS One. 2012; 7 (4): e35797. DOI: 10.1371/journal.pone.0035797.
25. Wu Z., McGoogan J.M. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72314 cases from the Chinese Center for Disease Control and Prevention. JAMA. 2020; 323 (13): 1239. DOI: 10.1001/jama.2020.2648.
26. Niederman M.S., Richeldi L., Chotirmall S.H., Bai C. Rising to the challenge of COVID-19: Advice for pulmonary and critical care and an agenda for research. Am. J. Respir. Crit. Care Med. 2020; 201 (9): 1019–1022. DOI: 10.1164/rccm.202003-0741ED.
DOI: 10.1164/rccm.202003-0741ED.
27. Ferioli M., Cisternino C., Leo V. et al. Protecting healthcare workers from SARS-CoV-2 infection: practical indications. Eur. Respir. Rev. 2020; 29 (155): 200068. DOI: 10.1183/16000617.0068-2020.
28. Remy K.E., Lin J.C., Verhoef P.A. High-flow nasal cannula may be no safer than non-invasive positive pressure ventilation for COVID-19 patients. Crit. Care. 2020; 24 (1): 169. DOI: 10.1186/s13054-020-02892-9.
29. Lyons C., Callaghan M. The use of high-flow nasal oxygen in COVID-19. Anaesthesia. 2020; 75 (7): 843–847. DOI: 10.1111/anae.15073.
30. Stetzenbach L.D., Buttner M.P., Cruz P. Detection and enumeration of airborne biocontaminants. Curr. Opin. Biotechnol. 2004; 15 (3): 170–174. DOI: 10.1016/j.copbio.2004.04.009.
Opin. Biotechnol. 2004; 15 (3): 170–174. DOI: 10.1016/j.copbio.2004.04.009.
31. Hui D.S., Chan M.T.V., Chow B. Aerosol dispersion during various respiratory therapies: a risk assessment model of nosocomial infection to health care workers. Hong Kong Med. J. 2014; 20 (Suppl. 4): 9–13.
32. Hui D.S., Chow B.K., Lo T. et al. Exhaled air dispersion during noninvasive ventilation via helmets and a total facemask. Chest. 2015; 147 (5): 1336–1343. DOI: 10.1378/chest.14-1934.
33. Hui D.S., Chow B.K., Lo T. et al. Exhaled air dispersion during high-flow nasal cannula therapy versus CPAP via different masks. Eur. Respir. J. 2019; 53 (4): 1802339. DOI: 10.1183/13993003.02339-2018.
34. Simonds A.K., Hanak A., Chatwin M. et al. Evaluation of droplet dispersion during non-invasive ventilation, oxygen therapy, nebuliser treatment and chest physiotherapy in clinical practice: implications for management of pandemic influenza and other airborne infections. Health Technol. Assess. 2010; 14 (46): 131–172. DOI: 10.3310/hta14460-02.
Simonds A.K., Hanak A., Chatwin M. et al. Evaluation of droplet dispersion during non-invasive ventilation, oxygen therapy, nebuliser treatment and chest physiotherapy in clinical practice: implications for management of pandemic influenza and other airborne infections. Health Technol. Assess. 2010; 14 (46): 131–172. DOI: 10.3310/hta14460-02.
35. Raoof S., Nava S., Carpati C. et al. High flow, non-invasive ventilation and awake (non-intubation) proning in patients with COVID-19 with respiratory failure. Chest. [Preprint. Posted: 2020, Jul. 15]. DOI: 10.1016/j.chest.2020.07.013.
36. Oranger M., Gonzalez-Bermejo J., Dacosta-Noble P. et al. Continuous positive airway pressure to avoid intubation in SARS-CoV-2 pneumonia: a two-period retrospective case-control study. Eur. Respir. J. 2020; 56 (2): 2001692. DOI: 10.1183/13993003.01692-2020.
37. Wang T., Tang C., Chen R. et al. Clinical features of coronavirus disease 2019 patients with mechanical ventilation: A nationwide study in China. Crit. Care Med. 2020; 48 (9): e809–812. DOI: 10.1097/CCM.0000000000004473.
38. Schnell D., Timsit J.F., Darmon M. et al. Noninvasive mechanical ventilation in acute respiratory failure: trends in use and outcomes. Intensive Care Med. 2014; 40 (4): 582–591. DOI: 10.1007/s00134-014-3222-y.
39. Bellani G., Laffey J.G., Pham T. et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016; 315 (8): 788–800. DOI: 10.1001/jama.2016.0291.
40. L’Her E., Deye N., Lellouche F. et al. Physiologic effects of noninvasive ventilation during acute lung injury. Am. J. Respir. Crit. Care Med. 2005; 172 (9): 1112–1118. DOI: 10.1164/rccm.200402-226oc.
L’Her E., Deye N., Lellouche F. et al. Physiologic effects of noninvasive ventilation during acute lung injury. Am. J. Respir. Crit. Care Med. 2005; 172 (9): 1112–1118. DOI: 10.1164/rccm.200402-226oc.
41. Morais C.C.A., Koyama Y., Yoshida T. et al. High positive end-expiratory pressure renders spontaneous effort non-injurious. Am. J. Respir. Crit. Care Med. 2018; 197 (10): 12851296. DOI: 10.1164/rccm.201706-1244OC.
42. Navalesi P., Maggiore S.M. Positive end-expiratory pressure. In: Tobin M.J., ed. Principles and practice of mechanical ventilation. 3 rd ed. New York: McGraw Hill Medical; 2013: 253–302.
43. Olivieri C., Costa R., Spinazzola G. et al. Bench comparative evaluation of a new generation and standard helmet for delivering non-invasive ventilation. Intensive Care Med. 2013; 39 (4): 734–738. DOI: 10.1007/s00134-012-2765-z.
Intensive Care Med. 2013; 39 (4): 734–738. DOI: 10.1007/s00134-012-2765-z.
44. Grieco D.L., Menga L.S., Raggi V. et al. Physiological comparison of high-flow nasal cannula and helmet noninvasive ventilation in acute hypoxemic respiratory failure. Am. J. Respir. Crit. Care Med. 2020; 201 (3): 303–312. DOI: 10.1164/rccm.201904-0841oc.
45. Cosentini R., Brambilla A.M., Aliberti S. et al. Helmet continuous positive airway pressure vs oxygen therapy to improve oxygenation in community-acquired pneumonia: A randomized, controlled trial. Chest. 2010; 138 (1): 114–120. DOI: 10.1378/chest.09-2290.
46. Brambilla A.M., Aliberti S., Prina E. et al. Helmet CPAP vs. oxygen therapy in severe hypoxemic respiratory failure due to pneumonia. Intensive Care Med. 2014; 40 (7): 942–949. DOI: 10.1007/s00134-014-3325-5.
DOI: 10.1007/s00134-014-3325-5.
47. Agarwal R., Aggarwal A.N., Gupta D. Role of noninvasive ventilation in acute lung injury/acute respiratory distress syndrome: a proportion meta-analysis. Respir. Care. 2010; 55 (12): 1653–1660.
48. Ferreyro B.L., Angriman F., Munshi L. et al. Association of noninvasive oxygenation strategies with all-cause mortality in adults with acute hypoxemic respiratory failure. A systematic review and meta-analysis. JAMA. 2020; 324 (1): 57. DOI:10.1001/jama.2020.9524.
49. Carteaux G., Millan-Guilarte T., De Prost N. et al. Failure of noninvasive ventilation for de novo acute hypoxemic respiratory failure: Role of tidal volume. Crit. Care Med. 2016; 44 (2): 282–290. DOI: 10.1097/CCM.0000000000001379.
50. Frat J.P., Ragot S., Coudroy R. et al. Predictors of intubation in patients with acute hypoxemic respiratory failure treated with a noninvasive oxygenation strategy. Crit. Care Med. 2018; 46 (2): 208–215. DOI: 10.1097/ccm.0000000000002818.
Frat J.P., Ragot S., Coudroy R. et al. Predictors of intubation in patients with acute hypoxemic respiratory failure treated with a noninvasive oxygenation strategy. Crit. Care Med. 2018; 46 (2): 208–215. DOI: 10.1097/ccm.0000000000002818.
51. Tonelli R., Fantini R., Tabbì L. et al. Inspiratory effort assessment by esophageal manometry early predicts noninvasive ventilation outcome in de novo respiratory failure: A pilot study. Am. J. Respir. Crit. Care Med. 2020; 202 (4): 558–567. DOI: 10.1164/rccm.201912-2512OC.
52. Brochard L., Lefebvre J.C., Cordioli R.L. et al. Noninvasive ventilation for patients with hypoxemic acute respiratory failure. Semin. Respir. Crit. Care Med. 2014; 35 (4): 492–500. DOI: 10.1055/s-0034-1383863.
53. Antonelli M., Conti G. , Moro M.L. et al. Predictors of failure of noninvasive positive pressure ventilation in patients with acute hypoxemic respiratory failure: a multi-center study. Intensive Care Med. 2001; 27 (11): 1718–1728. DOI: 10.1007/s00134-001-1114-4.
, Moro M.L. et al. Predictors of failure of noninvasive positive pressure ventilation in patients with acute hypoxemic respiratory failure: a multi-center study. Intensive Care Med. 2001; 27 (11): 1718–1728. DOI: 10.1007/s00134-001-1114-4.
54. Demoule A., Chevret S., Carlucci A. et al. Changing use of noninvasive ventilation in critically ill patients: trends over 15 years in francophone countries. Intensive Care Med. 2016; 42(1): 82–92. DOI: 10.1007/s00134-015-4087-4.
55. Duca A., Memaj I., Zanardi F. et al. Severity of respiratory failure and outcome of patients needing a ventilatory support in the emergency department during Italian novel coronavirus SARS-CoV-2 outbreak: Preliminary data on the role of helmet CPAP and non-invasive ventilation. EClinicalMedicine. 2020; 24: 100419. DOI: 10.1016/j.eclinm.2020.100419.
56. Pagano A., Porta G., Bosso G. et al. Non-invasive CPAP in mild and moderate ARDS secondary to SARS-CoV-2. Respir. Physiol. Neurobiol. 2020; 280: 103489. DOI: 10.1016/j.resp.2020.103489.
Pagano A., Porta G., Bosso G. et al. Non-invasive CPAP in mild and moderate ARDS secondary to SARS-CoV-2. Respir. Physiol. Neurobiol. 2020; 280: 103489. DOI: 10.1016/j.resp.2020.103489.
57. Nightingale R., Nwosu N., Kutubudin F. et al. Is continuous positive airway pressure (CPAP) a new standard of care for type 1 respiratory failure in COVID-19 patients? A retrospective observational study of a dedicated COVID-19 CPAP service. BMJ Open Resp. Res. 2020; 7 (1): e000639. DOI: 10.1136/bmjresp-2020-000639.
58. Burns G.P., Lane N.D., Tedd H.M. et al. Improved survival following ward-based non-invasive pressure support for severe hypoxia in a cohort of frail patients with COVID-19: retrospective analysis from a UK teaching hospital. BMJ Open Resp. Res. 2020; 7 (1): e000621. DOI: 10.1136/bmjresp-2020-000621.
59. Aliberti S., Radovanovic D., Billi F. et al. Helmet CPAP treatment in patients with COVID-19 pneumonia: a multicenter, cohort study. Eur. Respir. J. 2020: 2001935. [Preprint. Posted: 2020, Aug. 3]. DOI: 10.1183/13993003.01935-2020.
Aliberti S., Radovanovic D., Billi F. et al. Helmet CPAP treatment in patients with COVID-19 pneumonia: a multicenter, cohort study. Eur. Respir. J. 2020: 2001935. [Preprint. Posted: 2020, Aug. 3]. DOI: 10.1183/13993003.01935-2020.
60. Franco C., Facciolongo N., Tonelli R. et al. Feasibility and clinical impact of out-of-ICU non-invasive respiratory support in patients with COVID-19 related pneumonia. Eur. Respir. J. 2020: 2002130. [Preprint. Posted: 2020, Jan.]. DOI: 10.1183/13993003.02130-2020.
61. Mukhtar A., Lotfy A., Hasanin A. et al. Outcome of non-invasive ventilation in COVID-19 critically ill patients: A retrospective observational study. Anaesth. Crit. Care Pain Med. [Preprint. Posted: 2020, Jul. 28]. DOI: 10.1016/j.accpm.2020.07.012.
62. McLaughlin K. M., Murray I.M., Thain G. et al. Wardbased noninvasive ventilation for hypercapnic exacerbations of COPD: a “real-life” perspective. QJM. 2010; 103 (7): 505–510. DOI: 10.1093/qjmed/hcq063.
M., Murray I.M., Thain G. et al. Wardbased noninvasive ventilation for hypercapnic exacerbations of COPD: a “real-life” perspective. QJM. 2010; 103 (7): 505–510. DOI: 10.1093/qjmed/hcq063.
63. Hess D.R., Pang J.M., Camargo C.A. Jr. A survey of the use of noninvasive ventilation in academic emergency departments in the United States. Respir. Care. 2009; 54 (10): 1306–1312.
64. COVID-19 Research. UCL-Ventura breathing aid (CPAP) Design and manufacturing package. Available at: https://covid19research.uclb.com/product/ucl-cpap
65. Antonelli M., Conti G., Pelosi P. et al. New treatment of acute hypoxemic respiratory failure: noninvasive pressure support ventilation delivered by helmet: a pilot controlled trial. Crit. Care Med. 2002; 30 (3): 602–608. DOI: 10. 1097/00003246-200203000-00019.
1097/00003246-200203000-00019.
66. Patel B.K., Wolfe K.S., Pohlman A.S. et al. Effect of noninvasive ventilation delivered by helmet vs face mask on the rate of endotracheal intubation in patients with acute respiratory distress syndrome: A randomized clinical trial. JAMA. 2016; 315 (22): 2435–2441. DOI: 10.1001/jama.2016.6338.
67. Force A.D.T., Ranieri V.M., Rubenfeld G.D. et al. Acute respiratory distress syndrome: The Berlin definition. JAMA. 2012; 307 (23): 2526–2533. DOI: 10.1001/jama.2012.5669.
68. Wu C., Chen X., Cai Y. et al. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern. Med. 2020; 180 (7): 934. DOI: 10.1001/jamainternmed.2020.0994.
69. ClinicalTrials.gov. HFNC and NIV for COVID-19 complicated by respiratory failure. Available at: https://clinicaltrials.gov/ct2/show/results/NCT04452708?view=results
ClinicalTrials.gov. HFNC and NIV for COVID-19 complicated by respiratory failure. Available at: https://clinicaltrials.gov/ct2/show/results/NCT04452708?view=results
70. Perkins G.D., Couper K., Connolly B. et al. RECOVERY respiratory support: Respiratory strategies for patients with suspected or proven COVID-19 respiratory failure; Continuous positive airway pressure, high-flow nasal oxygen, and standard care: A structured summary of a study protocol for a randomised controlled trial. Trials. 2020; 21 (1): 687. DOI: 10.1186/s13063-020-04617-3.
Неинвазивная вентиляция легких у пациентов с хронической обструктивной болезнью легких в стационаре и домашних условиях | Авдеев
1. Brochard L., Isabey D., Piquet J. et al. Reversal of acute exacerbations of chronic obstructive lung disease by inspiratory assistance with a face mask. N. Engl. J. Med. 1990; 323 (22): 1523–1530. DOI: 10.1056/NEJM199011293232204.
N. Engl. J. Med. 1990; 323 (22): 1523–1530. DOI: 10.1056/NEJM199011293232204.
2. Meduri G.U., Conoscenti C.C., Menashe P., Nair S. Noninvasive face mask ventilation in patients with acute respiratory failure. Chest. 1989; 95 (4): 865–870.
3. Intermittent positive pressure breathing therapy of chronic obstructive pulmonary disease. A clinical trial. Ann. Intern. Med. 1983; 99: 612–620.
4. Авдеев С.Н., Третьяков А.В. Использование неинвазивной вентиляции легких с двумя уровнями положительного давления у больных с острой дыхательной недостаточностью. Пульмонология. 1996; (4): 33–37.
5. Авдеев С.Н., Чучалин А.Г. Неинвазивная вентиляция легких при острой дыхательной недостаточности у больных хронической обструктивной болезнью легких. Терапевтический архив. 2000; 72 (3): 59–65.
Терапевтический архив. 2000; 72 (3): 59–65.
6. Soo Hoo G.W. The Role of Noninvasive Ventilation in the Hospital and Outpatient Management of Chronic Obstructive Pulmonary Disease. Semin. Respir. Crit. Care Med. 2015; 36 (4): 616–629. DOI: 10.1055/s-00351556074.
7. Walkey A.J., Wiener R.S. Use of noninvasive ventilation in patients with acute respiratory failure, 2000–2009: a population-based study. Ann. Am. Thorac. Soc. 2013; 10 (1): 10–17. DOI: 10.1513/AnnalsATS.201206-034OC.
8. Demoule A., Girou E., Richard J.C. et al. Increased use of noninvasive ventilation in French intensive care units. Intensive Care Med. 2006; 32 (11): 1747–1755. DOI: 10.1007/s00134-006-0229-z.
9. Keenan S.P., Sinuff T., Burns K.E. et al. Clinical practice guidelines for the use of noninvasive positive-pressure ventilation and noninvasive continuous positive airway pressure in the acute care setting. CMAJ. 2011; 183 (3): E195–E214. DOI: 10.1503/cmaj.100071.
Keenan S.P., Sinuff T., Burns K.E. et al. Clinical practice guidelines for the use of noninvasive positive-pressure ventilation and noninvasive continuous positive airway pressure in the acute care setting. CMAJ. 2011; 183 (3): E195–E214. DOI: 10.1503/cmaj.100071.
10. Tobin M.J. Respiratory muscles in disease. Clin. Chest Med. 1988; 9 (2): 263–286.
11. Brochard L., Mancebo J., Wysocki M. et al. Noninvasive ventilation for acute exacerbations of chronic obstructive pulmonary disease. N. Engl. J. Med. 1995; 333 (13): 817–822. DOI: 10.1056/NEJM199509283331301.
12. Carrey Z., Gottfried S.B., Levy R.D. Ventilatory muscle support in respiratory failure with nasal positive pressure ventilation. Chest. 1990; 97 (1): 150–158.
13. Belman M.J., Soo Hoo G.W., Kuei J.H., Shadmehr R. Efficacy of positive vs negative pressure ventilation in unloading the respiratory muscles. Chest. 1990; 98 (4): 850–856.
14. Bott J., Carroll M.P., Conway J.H. et al. Randomised controlled trial of nasal ventilation in acute ventilatory failure due to chronic obstructive airways disease. Lancet. 1993; 341 (8860): 1555–1557.
15. Авдеев С.Н. Сравнительное контролируемое исследование применения неинвазивной вентиляции легких при острой дыхательной недостаточности на фоне обострения хронического обструктивного заболевания легких. Пульмонология. 1997; (4): 30–31.
16. Kramer N., Meyer T.J., Meharg J. et al. Randomized, prospective trial of noninvasive positive pressure ventilation in acute respiratory failure. Am. J. Respir. Crit. Care Med. 1995; 151 (6): 1799–1806.
17. Авдеев С.Н., Третьяков А.В., Григорьянц Р.А. и др. Исследование применения неинвазивной вентиляции легких при острой дыхательной недостаточности на фоне обострения хронического обструктивного заболевания легких. Анестезиология и реаниматология. 1998; (3): 45–51.
18. Girou E., Schortgen F., Delclaux C. et al. Association of noninvasive ventilation with nosocomial infections and survival in critically ill patients. JAMA. 2000; 284 (18): 2361–2367.
19. Nava S., Hill N. Non-invasive ventilation in acute respiratory failure. Lancet. 2009; 374 (9685): 250–259. DOI: 10.1016/S0140-6736(09)60496-7.
20. Авдеев С.Н. Неинвазивная вентиляция легких при острой дыхательной недостаточности. Пульмонология. 2005; (6): 37–54.
21. Авдеев С.Н. Неинвазивная вентиляция легких при острой дыхательной недостаточности у больных с хронической обструктивной болезнью легких. Пульмонология. 2008; (6): 5–14.
22. Terzano C., Di Stefano F., Conti V. et al. Mixed acid-base disorders, hydroelectrolyte imbalance and lactate production in hypercapnic respiratory failure: the role of noninvasive ventilation. PLoS ONE. 2012; 7 (4): e35245. DOI: 10.1371/journal.pone.0035245.
23. Confalonieri M., Garuti G., Cattaruzza M.S. et al. A chart of failure risk for noninvasive ventilation in patients with COPD exacerbation. Eur. Respir. J. 2005; 25 (2): 348–355. DOI: 10.1183/09031936.05.00085304.
24. Plant P.K., Owen J.L., Elliott M.W. Early use of non-invasive ventilation for acute exacerbations of chronic obstructive pulmonary disease on general respiratory wards: a multicentre randomised controlled trial. Lancet. 2000; 355 (9219): 1931–1935.
25. Soo Hoo G.W., Hakimian N., Santiago S.M. Hypercapnic respiratory failure in COPD patients: response to therapy. Chest. 2000; 117 (1): 169–177.
26. Scala R., Naldi M., Archinucci I. et al. Noninvasive positive pressure ventilation in patients with acute exacerbations of COPD and varying levels of consciousness. Chest. 2005; 128 (3): 1657–1666. DOI: 10.1378/chest.128.3.1657.
27. Soo Hoo G.W., Santiago S., Williams A.J. Nasal mechanical ventilation for hypercapnic respiratory failure in chronic obstructive pulmonary disease: determinants of success and failure. Crit. Care Med. 1994; 22 (8): 1253–1261.
28. Diaz G.G., Alcaraz A.C., Talavera J.C. et al. Noninvasive positive-pressure ventilation to treat hypercapnic coma secondary to respiratory failure. Chest. 2005; 127 (3): 952–960. DOI: 10.1378/chest.127.3.952.
29. Попова К.А., Авдеев С.Н. Возможность использования неинвазивной вентиляции легких при гиперкапнической коме у больных ХОБЛ с острой дыхательной недостаточностью. Пульмонология. 2013; (1): 108–111.
30. Avdeev S., Chuchalin A., Grigoriants R. et al. Factors predicting outcome of noninvasive positive pressure ventilation. Eur. Respir. J. 1997; 10: 185s.
31. McLaughlin K.M., Murray I.M., Thain G., Currie G.P. Ward-based noninvasive ventilation for hypercapnic exacerbations of COPD: a ‘real-life’ perspective. QJM. 2010; 103 (7): 505–510. DOI: 10.1093/qjmed/hcq063.
32. Paus-Jenssen E.S., Reid J.K., Cockcroft D.W. et al. The use of noninvasive ventilation in acute respiratory failure at a tertiary care center. Chest. 2004; 126 (1): 165–172. DOI: 10.1378/chest.126.1.165.
33. Hess D.R., Pang J.M., Camargo C.A. Jr. A survey of the use of noninvasive ventilation in academic emergency departments in the United States. Respir. Care. 2009; 54 (10): 1306–1312.
34. Kwok H., McCormack J., Cece R. et al. Controlled trial of oronasal versus nasal mask ventilation in the treatment of acute respiratory failure. Crit. Care Med. 2003; 31 (2): 468–473. DOI: 10.1097/01.CCM.0000045563.64187.20.
35. Pisani L., Carlucci A., Nava S. Interfaces for noninvasive mechanical ventilation: technical aspects and efficiency. Minerva Anestesiol. 2012; 78 (10): 1154–1161.
36. Devlin J.W., Nava S., Fong J.J. et al. Survey of sedation practices during noninvasive positive-pressure ventilation to treat acute respiratory failure. Crit. Care Med. 2007; 35 (10): 2298–2302.
37. Devlin J.W., Al-Qadheeb N.S., Chi A. et al. Efficacy and safety of early dexmedetomidine during noninvasive ventilation for patients with acute respiratory failure: a randomized, double-blind, placebo-controlled pilot study. Chest. 2014; 145 (6): 1204–1212. DOI: 10.1378/chest.13-1448.
38. Marino W. Intermittent volume cycled mechanical ventilation via nasalmask in patientswith respiratory failure due to COPD. Chest. 1991; 99 (3): 681–684.
39. Meduri G.U., Abou-Shala N., Fox R.C. et al. Noninvasive face mask mechanical ventilation in patients with acute hypercapnic respiratory failure. Chest. 1991; 100 (2): 445–454.
40. Schonhofer B., Sortor-Leger S. Equipment needs for noninvasive mechanical ventilation. Eur. Respir. J. 2002; 20 (4): 1029–1036.
41. Strumpf D.A., Carlisle C.C., Millman R.P. et al. An evaluation of the respironics BiPAP Bi-Level CPAP device for delivery of assisted ventilation. Respir. Care. 1990; 35 (5): 415–422.
42. Confalonieri M., Calderini E., Terraciano S. et al. Noninvasive ventilation for treating acute respiratory failure in AIDS patients with Pneumocystis carinii pneumonia. Intensive Care Med. 2002; 28 (9): 1233–1238.
43. Keenan S.P., Sinuff T., Cook D.J., Hill N.S. Which patients with acute exacerbation of chronic obstructive pulmonary disease benefit from noninvasive positive-pressure ventilation? A systematic review of the literature. Ann. Intern. Med. 2003; 138 (11): 861–870.
44. Ambrosino N., Foglio K., Rubini F. et al. Noninvasive mechanical ventilation in acute respiratory failure due to chronic obstructive pulmonary disease: correlates for success. Thorax. 1995; 50 (7): 755–757.
45. Anton A., Guell R., Gomez J. et al. Predicting the result of noninvasive ventilation in severe acute exacerbations of patients with chronic airflow limitation. Chest. 2000; 117 (3): 828–833.
46. Moretti M., Cilione C., Tampieri A. et al. Incidence and causes of non-invasive mechanical ventilation failure after initial success. Thorax. 2000; 55 (10): 819–825.
47. Organized Jointly by the American Thoracic Society, the European Respiratory Society, the European Society of Intensive Care Medicine, and the Societe de Reanimation de Langue Francaise, and approved by the ATS Board of Directors, December 2000. International Consensus Conferences in Intensive Care Medicine: Noninvasive Positive Pressure Ventilation in Acute Respiratory Failure. Am. J. Respir. Crit. Care Med. 2001; 163: 283–291.
48. British Thoracic Society Standards of Care Committee. Noninvasive ventilation in acute respiratory failure. Thorax. 2002; 57 (3): 192–211.
49. Lightowler J.V., Wedzicha J.A., Elliott M.W., Ram F.S. Non-invasive positive pressure ventilation to treat respiratory failure resulting from exacerbations of chronic obstructive pulmonary disease: Cochrane systematic review and meta-analysis. BMJ. 2003; 326 (7382): 185.
50. Chandra D., Stamm J.A., Taylor B. et al. Outcomes of noninvasiveventilation for acute exacerbations of chronic obstructive pulmonary disease in the United States, 1998–2008. Am. J. Respir. Crit. Care Med. 2012; 185 (2): 152–159. DOI: 10.1164/rccm.201106-1094OC.
51. Avdeev S., Kutsenko M., Tretyakov A. et al. Posthospital survival in COPD patients after noninvasive positive pressure ventilation (NIPPV). Eur. Respir. J. 1998; 11: 312s.
52. Dres M., Tran T.C., Aegerter P. et al. Influence of ICU case-volume on the management and hospital outcomes of acute exacerbations of chronic obstructive pulmonary disease. Crit. Care Med. 2013; 41 (8): 1884–1892. DOI: 10.1097/CCM.0b013e31828a2bd8.
53. Tsai C.L., Lee W.Y., Delclos G.L. et al. Comparative effectiveness of noninvasive ventilation vs invasive mechanical ventilation in chronic obstructive pulmonary disease patients with acute respiratory failure. J. Hosp. Med. 2013; 8 (4): 165–172. DOI: 10.1002/jhm.2014.
54. Carpe-Carpe B., Hernando-Arizaleta L., Ibanez-Perez M.C. et al. Evolution of the use of noninvasive mechanical ventilation in chronic obstructive pulmonary disease in a Spanish region, 1997–2010. Arch. Bronconeumol. 2013; 49 (8): 330–336. DOI: 10.1016/j.arbres.2013.04.006.
55. Ozsancak Ugurlu A., Sidhom S.S., Khodabandeh A. et al. Use and outcomes of noninvasive positive pressure ventilation in acute care hospitals in Massachusetts. Chest. 2014; 145 (5): 964–971. DOI: 10.1378/chest.13-1707.
56. Epstein S.K. Etiology of extubation failure and the predictive value of the rapid shallow breathing index. Am. J. Respir. Crit. Care Med. 1995; 152 (2): 545–549.
57. Esteban A., Frutos-Vivar F., Ferguson N.D. et al. Noninvasive positive-pressure ventilation for respiratory failure after extubation. N. Engl. J. Med. 2004; 350 (24): 2452–2460. DOI: 10.1056/NEJMoa032736.
58. Ferrer M., Esquinas A., Leon M. et al. Noninvasive ventilation in severe hypoxemic respiratory failure: a randomized clinical trial. Am. J. Respir. Crit. Care Med. 2003; 168 (12): 1438–1444.
59. Nava S., Ambrosino N., Clini E. et al. Noninvasive mechanical ventilation in the weaning of patients with respiratory failure due to chronic obstructive pulmonary disease. A randomized, controlled trial. Ann. Intern. Med. 1998; 128 (9): 721–728.
60. Burns K.E., Meade M.O., Premji A., Adhikari N.K. Noninvasive ventilation as a weaning strategy for mechanical ventilation in adults with respiratory failure: a Cochrane systematic review. CMAJ. 2014; 186 (3): E112– E122. DOI: 10.1503/cmaj.130974.
61. Hilbert G., Gruson D., Portel L. et al. Noninvasive pressure support ventilation in COPD patients with postextubation hypercapnic respiratory insufficiency. Eur. Respir. J. 1998; 11: 1349–1353. DOI: 10.1183/09031936.98.11061349.
62. Ferrer M., Valencia M., Nicolas J.M. et al. Early noninvasive ventilation averts extubation failure in patients at risk: a randomized trial. Am. J. Respir. Crit. Care Med. 2006; 173 (2): 164–170.
63. Ferrer M., Sellares J., Valencia M. et al. Non-invasive ventilation after extubation in hypercapnic patients with chronic respiratory disorders: randomised controlled trial. Lancet. 2009; 374 (9695): 1082–1088.
64. Nava S., Gregoretti C., Fanfulla F. et al. Noninvasive ventilation to prevent respiratory failure after extubation in high-risk patients. Crit. Care Med. 2005; 33 (11): 2465–2470.
65. Confalonieri M., Potena A., Carbone G. et al. Acute respiratory failure in patients with severe communityacquired pneumonia. A prospective randomized evaluation of noninvasive ventilation. Am. J. Respir. Crit. Care Med. 1999; 160 (5, Pt 1): 1585–1591.
66. Carrillo A., Gonzalez-Diaz G., Ferrer M. et al. Non-invasive ventilation in community-acquired pneumonia and severe acute respiratory failure. Intensive Care Med. 2012; 38 (3): 458–466. DOI: 10.1007/s00134-012-2475-6.
67. Auriant I., Jallot A., Herve P. et al. Noninvasive ventilation reduces mortality in acute respiratory failure following lung resection. Am. J. Respir. Crit. Care Med. 2001; 164 (7): 1231–1235.
68. Perrin C., Jullien V., Venissac N. et al. Prophylactic use of noninvasive ventilation in patients undergoing lung resectional surgery. Respir. Med. 2007; 101 (7): 1572–1578. DOI: 10.1016/j.rmed.2006.12.002.
69. Lorut C., Lefebvre A., Planquette B. et al. Early postoperative prophylactic noninvasive ventilation after major lung resection in COPD patients: a randomized controlled trial. Intensive Care Med. 2014; 40 (2): 220–227.
70. Ioachimescu O.C., Teodorescu M. Integrating the overlap of obstructive lung disease and obstructive sleep apnoea: OLDOSA syndrome. Respirology. 2013; 18 (3): 421–431. DOI: 10.1111/resp.12062.
71. Owens R.L., Malhotra A. Sleep-disordered breathing and COPD: the overlap syndrome. Respir. Care. 2010; 55 (10): 1333–1344.
72. Flenley D.C. Sleep in chronic obstructive lung disease. Clin. Chest Med. 1985; 6 (4): 651–661.
73. Carrillo A., Ferrer M., Gonzalez-Diaz G. et al. Noninvasive ventilation in acute hypercapnic respiratory failure caused by obesity hypoventilation syndrome and chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2012; 186 (12): 1279–1285.
74. Scala R., Naldi M., Maccari U. Early fiberoptic bronchoscopy during non-invasive ventilation in patientswith decompensated chronic obstructive pulmonary disease due to community-acquiredpneumonia. Critical Care. 2010; 14 (2): R80. DOI: 10.1186/cc8993.
75. Esquinas A., Zuil M., Scala R., Chiner E. Bronchoscopy during noninvasive mechanical ventilation: a review of techniques and procedures. Arch. Bronconeumol. 2013; 49 (3): 105–112. DOI: 10.1016/j.arbr.2013.01.007.
76. Ambrosino N., Guarracino F. Unusual applications of noninvasive ventilation. Eur. Respir. J. 2011; 38 (2): 440–449. DOI: 10.1183/09031936.00192810.
77. Benditt J.O. Novel uses of noninvasive ventilation. Respir. Care. 2009; 54 (2): 212–219.
78. Batzlaff C.M., Karpman C., Afessa B., Benzo R.P. Predicting 1-year mortality rate for patients admitted with an acute exacerbation of chronic obstructive pulmonary disease to an intensive care unit: an opportunity for palliative care. Mayo Clin. Proc. 2014; 89 (5): 638–643.
79. Connors A.F. Jr, Dawson N.V., Thomas C. et al. Outcomes following acute exacerbation of severe chronic obstructive lung disease. The SUPPORT investigators (Study to Understand Prognoses andPreferences for Outcomes and Risks of Treatments). Am. J. Respir. Crit. Care Med. 1996; 154 (4, Pt 1): 959–967.
80. Chu C.M., Chan V.L., Lin A.W. et al. Readmission rates and life threatening events in COPD survivors treated with non-invasive ventilation for acute hypercapnic respiratory failure. Thorax. 2004; 59 (12): 1020–1025.
81. Elliott M.W., Mulvey D.A., Moxham J. et al. Domiciliary nocturnal nasal intermittent positive pressure ventilation in COPD: mechanisms underlying changes in arterial blood gas tensions. Eur. Respir. J. 1991; 4 (9): 1044–1052.
82. Hill N.S., Eveloff S.E., Carlisle C.C., Goff S.G. Efficacy of nocturnal nasal ventilation in patients with restrictive thoracic disease. Am. Rev. Respir. Dis. 1992; 145 (2, Pt 1): 365–371.
83. Leger P., Bedicam J.M., Cornette A. et al. Nasal intermittent positive pressure ventilation. Long-term follow-up in patients with severe chronic respiratory insufficiency. Chest. 1994; 105 (1): 100–105.
84. Simonds A.K., Elliott M.W. Outcome of domiciliary nasal intermittent positive pressure ventilation in restrictive and obstructive disorders. Thorax. 1995; 50 (6): 604–609.
85. Clinical indications for noninvasive positive pressure ventilation in chronic respiratory failure due to restrictive lung disease, COPD, and nocturnal hypoventilation – a consensus conference report. Chest. 1999; 116 (2): 521–534.
86. Braun N., Marino W.D. Effect of daily intermittent rest of respiratory muscle in patients with severe chronic airflow obstruction. Chest. 1984; 85 (6, Suppl): 595S.
87. Renston J.P., DiMarco A.F., Supinski G.S. Respiratory muscle rest using nasal BiPAP ventilation in patients with stable severe COPD. Chest. 1994; 105 (4):1053–1060.
88. Schonhofer B., Polkey M.I., Suchi S., Kohler D. Effect of home mechanical ventilation on inspiratory muscle strength in COPD. Chest. 2006; 130 (6): 1834–1838. DOI: 10.1378/chest.130.6.1834.
89. Diaz O., Begin P., Torrealba B. et al. Effects of noninvasive ventilation on lung hyperinflation in stable hypercapnic COPD. Eur. Respir. J. 2002; 20 (6): 1490–1498.
90. Elliott M.W., Simonds A.K., Carroll M.P. et al. Domiciliary nocturnal nasal intermittent positive pressure ventilation in hypercapnic respiratory failure due to chronicobstructive lung disease: effects on sleep and quality of life. Thorax. 1992; 47 (5): 342–348.
91. Appendini L., Patessio A., Zanaboni S. et al. Physiologic effects of positive end-expiratory pressure and mask pressure support during exacerbations of chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 1994; 149 (5): 1069–1076. DOI: 10.1164/ajrccm.149.5.8173743.
92. Clini E., Sturani C., Porta R. et al. Outcome of COPD patients performing nocturnal non-invasive mechanical ventilation. Respir. Med. 1998; 92 (10): 1215–1222.
93. Hill N.S., Eveloff S.E., Carlisle C.C., Goff S.G. Efficacy of nocturnal nasal ventilation in patients with restrictive thoracic disease. Am. Rev. Respir. Dis. 1992; 145: 365–371. DOI: 10.1164/ajrccm/145.2-Pt-1.365.
94. Marin J.M., Soriano J.B., Carrizo S.J. et al. Outcomes in patients with chronic obstructive pulmonary disease and obstructive sleep apnea: the overlap syndrome. Am. J. Respir. Crit. Care Med. 2010; 182 (3): 325–331. DOI: 10.1164/rccm.200912-1869OC.
95. Schonhofer B., Geibel M., Sonnerborn M. et al. Daytime mechanical ventilation in chronic respiratory insufficiency. Eur. Respir. J. 1997; 10 (12): 2840–2846.
96. Strumpf D.A., Millman R.P., Carlisle C.C. et al. Nocturnal positive pressure ventilation via nasal mask in patients with severe chronic obstructive pulmonary disease. Am. Rev. Respir. Dis. 1991; 144 (6): 1234–1239.
97. Lin C.C. Comparison between nocturnal nasal positive pressure ventilation combined with oxygen therapy and oxygen monotherapy in patients with severe COPD. Am. J. Respir. Crit. Care Med. 1996; 154 (2, Pt 1): 353–358.
98. Gay P.C., Hubmayr R.D., Stroetz R.W. Efficacy of nocturnal nasal ventilation in stable, severe chronic obstructive pulmonary disease during a 3-month controlled trial. Mayo Clin. Proc. 1996; 71 (6): 533–542.
99. Meecham Jones D.J., Paul E.A., Jones P.W., Wedzicha J.A. Nasal pressure support ventilation plus oxygen compared with oxygen therapy alone in hypercapnic COPD. Am. J. Respir. Crit. Care Med. 1995; 152 (2): 538–544.
100. Casanova C., Celli B.R., Tost L. et al. Long-term controlled trial of nocturnal nasal positive pressure ventilation in patients with severe COPD. Chest. 2000; 118 (6): 1582–1590.
101. Clini E., Sturani C., Rossi A. et al. The Italian multicentre study on noninvasive ventilation in chronic obstructive pulmonary disease patients. Eur. Respir. J. 2002, 20 (3): 529–538.
102. Kolodziej M.A., Jensen L., Rowe B., Sin D. Systematic review of noninvasive positive pressure ventilation in severe stable COPD. Eur. Respir. J. 2007; 30 (2): 293–306. DOI: 10.1183/09031936.00145106.
103. Wijkstra P.J., Lacasse Y., Guyatt G.H. et al. A meta-analysis of nocturnal noninvasive positive pressure ventilation in patients with stable COPD. Chest. 2003; 124 (1): 337–343.
104. McEvoy R.D., Pierce R.J., Hillman D. et al. Nocturnal non-invasive nasal ventilation in stable hypercapnic COPD: a randomised controlled trial. Thorax. 2009; 64 (7): 561–566.
105. Struik F.M., Sprooten R.T., Kerstjens H.A. et al. Nocturnal non-invasive ventilation in COPD patients with prolonged hypercapnia after ventilatory support for acute respiratory failure: a randomised, controlled, parallelgroup study. Thorax. 2014; 69 (9): 826–834. DOI: 10.1136/thoraxjnl-2014-205126.
106. Kohnlein T., Windisch W., Kohler D. et al. Non-invasive positive pressure ventilation for the treatment of severe stable chronic obstructive pulmonary disease: a prospective, multicentre, randomised, controlled clinical trial. Lancet Respir. Med. 2014; 2 (9): 698–705. DOI: 10.1016/S22132600(14)70153-5.
107. Murphy P., Arbane G., Bourke S. et al. Improving admission free survival with home mechanical ventilation (HMV) and home oxygen therapy (HOT) following life threatening COPD exacerbations: HoT-HMV UK Trial NCT00990132. Eur. Respir. J. 2016; 48: OA3527.
108. Windisch W. Impact of home mechanical ventilation on healthrelated quality of life. Eur. Respir. J. 2008; 32 (5): 1328–1336. DOI: 10.1183/09031936.00066407.
109. Leger P., Bedicam J.M., Cornette A. et al. Nasal intermittent positive pressure ventilation. Long-term follow-up in patients with severe chronic respiratory insufficiency. Chest. 1994; 105: 100–105.
110. Авдеев С.Н., Баймаканова Г.Е. Подбор режимов неинвазивной вентиляции легких у больных ХОБЛ: Методические рекомендации. М.: ФГУ «НИИ пульмонологии» ФМБА России; 2011.
111. Windisch W., Vogel M., Sorichter S. et al Normocapnia during nIPPV in chronic hypercapnic COPD reduces subsequent spontaneous PaCO2. Respir. Med. 2002; 96 (8): 572–579.
112. Windisch W., Kostic S., Dreher M. et al. Outcome of patients with stable COPD receiving controlled noninvasive positive pressure ventilation aimed at a maximal reduction of Pa(CO2). Chest. 2005; 128 (2): 657–662. DOI: 10.1378/chest.128.2.657.
113. Windisch W., Haenel M., Storre J.H., Dreher M. Highintensity noninvasive positive pressure ventilation for stable hypercapnic COPD. Int. J. Med. Sci. 2009; 6 (2): 72–76.
114. Lukacsovits J., Carlucci A., Hill N. et al. Physiological changes during low- and high-intensity noninvasive ventilation. Eur. Respir. J. 2012; 39 (4): 869–875. DOI: 10.1183/09031936.00056111.
115. Dreher M., Storre J.H., Windisch W. Noninvasive ventilation during walking in patients with severe COPD: a randomised cross-over trial. Eur. Respir. J. 2007; 29 (5): 930–936. DOI: 10.1183/09031936.00075806.
116. Dreher M., Doncheva E., Schwoerer A. et al. Preserving oxygenation during walking in severe chronic obstructive pulmonary disease: noninvasive ventilation versus oxygen therapy. Respiration. 2009; 78 (2): 154–160. DOI: 10.1159/000187717.
117. Porszasz J., Cao R., Morishige R. et al. Physiologic effects of an ambulatory ventilation system in chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2013; 188 (3): 334–342. DOI: 10.1164/rccm.201210-1773OC.
118. Carlin B.M., Wiles K.S., McCoy R.W. et al. Effects of a highly portable noninvasive open ventilation system on activities of daily living in patients with COPD. J. COPD F. 2015; 2 (1): 35–47. DOI: 10.15326/jcopdf.2.1.2014.0116.
Трехуровневая вентиляция легких, первый клинический опыт | Torok
Аннотация
Исходя из проблематики искусственной вентиляции легких (ИВЛ) при негомогенных патологических процессах в легких (ОПЛ, ОРДС, пневмония и др.) применили трехуровневую ИВЛ. Трехуровневую вентиляцию определили как способ (модификацию) ИВЛ, при которой основной уровень вентиляции представлен режимом вентиляции CMV, PCV, или PS (ASB), а надстройку, так называемую «вентиляцию на фоне» создают два уровня PEEP: PEEP (постоянный) и PEEPh (PEEP high) с изменяемой частотой и продолжительностью (чередованием) перехода между их отдельными уровнями. Цель работы — выяснить можно ли посредством трехуровневой ИВЛ при выраженной неравномерности распределения газов в тяжело поврежденных легких улучшить доставку газов в так называемые «медленные» бронхоаль-веолярные компартменты при уменьшении объемной нагрузки так называемых «быстрых» компартментов и улучшить обмен газов в легких, сохраняя при этом правила «безопасной ИВЛ». Результаты. У 12 больных с тяжелым не гомогенным повреждением легких (атипичная пневмония и ARDS/ALI) и малоэффективной вентиляцией в режиме PCV, после «маневра открытия» (PaO2(kPa)/FiO2=5—6), применили трехуровневую вентиляцию легких (3LV). После начала 3LV с частотой fPCV=26±4 вдохов /мин и PEEPh с частотой fpeeph=7±2 вдохов/min с минутной вентиляцией MV=12±4 l/мин в течение 1—4 часов произошли отчетливые положительные изменения обмена газов в легких. В процессе использования 3LV произошло уменьшение фракции внутрилегочного шунта с 50±5% до 30±5%, повысилась элиминация CO2 с падением PaCO2 до значений ниже 6±0,3 kPa и увеличилось PaO2 до значений 7,5±1,2 kPa, при понижении FiO2 до 0,8—0,4. В улучшение обмена газов внес также вклад «маневр открытия» легких: под влиянием PEEP=1,2±0,4 kPa статическая торакопульмональная податливость (Cst) повысилась с 0,18±0,02 l/kPa до 0,3±0,02 l/kPa, а затем — до 0,38±0,05 l/kPa. Сопротивление дыхательных путей (Raw) уменьшилось более, чем на 30%. Улучшение аэрации легких оценивается как проявление доставки газов в области с более продолжительной постоянной времени. После 5±1 дней использования 3LV больных перевели в режим вентиляции PS, после постепенного уменьшения вентиляционной поддержки они были отключены от вентилятора и переведены в профильное отделение. Заключение. Несмотря на то, что из-за небольшого числа обследованных больных статистическая оценка результатов не проведена, клинические результаты, по крайней мере, не противоречат результатам теоретической математической симуляции 3LV в математической и физической модели. 3LV в сравнении с PCV, применяемой в течение первых 2—4 часов ИВЛ, улучшила обмен газов в легких. Она может быть многообещающим способом вентиляции легких, пораженных диффузионным негомогенным патологическим процессом. Ключевые слова: ИВЛ, трехуровневая ИВЛ, ОРДС, ОПЛ.
Медики рассказали о тяжелых формах коронавируса и призвали югорчан беречь здоровье
В отделении реанимации «красной зоны» окружной клинической больницы Ханты-Мансийска сегодня находятся 8 пациентов. Как сообщает пресс-служба медучреждения, два из них – на аппарате искусственной вентиляции легких через эндотрахеальную трубку. Шесть пациентов — на неинвазивной искусственной вентиляции легких. Она проводится с использованием специальной маски.
Заведующий отделением анестезиологии и реанимации, врач высшей квалификационной категории Владимир Власов рассказал о случаях, когда коронавирусная инфекция протекает в средне-тяжелой и тяжелой форме.
— При поражении легких, человек не может сделать глубокий вдох, газообмен в них не происходит, кровь кислородом не насыщается, организм испытывает гипоксию. Больной пытается с этим бороться, дышать чаще, глубже, но ничего не получается. И если у него имеются, не дай бог, сопутствующие заболевания, к примеру, сердечно-сосудистой системы, или легких, — это все протекает в более тяжелей форме, критическое состояние наступает гораздо быстрее, — говорит врач.
При тяжелой дыхательной недостаточности человек испытывает фактически страх смерти. И тогда он попадает в руки реаниматологов, которые пытаются оказать ему помощь и спасти его жизнь. Как правило, при новой коронавирусной инфекции, искусственная вентиляция легких требуется при тяжелом течении болезни. Существует несколько методов улучшения так называемой оксигенации крови (насыщение кислородом).
При инвазивной респираторной поддержке аппарат ИВЛ обеспечивает принудительную вентиляцию легких и полностью берет на себя функцию дыхания. Газовая смесь подается аппаратом ИВЛ через эндотрахеальную трубку, помещенную в трахею больному.
Неинвазивная вентиляция легких относится к искусственной респираторной поддержке без инвазивного доступа к дыхательным путям. Оборудование подает смесь в легкие пациенту через специальное устройство- маску для неинвазивной вентиляции легких.
Заведующий отделением анестезиологии и реанимации говорит о том, что каждый день видит беспечность жителей города, которые уверены, что с ними уж точно не произойдет ничего страшного, и новая коронавирусная инфекция обойдет стороной. Но количество заболевших в Югре растет.
— Мы готовы в случае необходимости находиться круглыми сутками в средствах индивидуальной защиты и оказывать помощь больным, хоть это тяжелая повседневная работа. А все остальные люди готовы тяжело болеть новой коронавирусной инфекцией? И, возможно, умереть от нее?- обращается к жителям Югры врач анестезиолог-реаниматолог.
Медики призывают не пренебрегать способами защиты от коронавируса, тем более, что они не самые сложные. Это ношение масок в общественных местах и тех учреждениях, где это требуется, соблюдение социальной дистанции и соблюдение режима самоизоляции для групп населения, которые декретированы соответствующими постановлениями правительства округа. В основном, это лица, имеющие сопутствующие заболевания, лица пенсионного возраста, они должны находиться по возможности дома, как можно меньше иметь контактов с посторонними людьми.
Для московской скорой закупили 70 портативных аппаратов искусственной вентиляции легких
Для Станции скорой и неотложной медицинской помощи имени А.С. Пучкова закупили новые портативные аппараты искусственной вентиляции легких. Об этом сообщил Сергей Собянин на своей странице в «Твиттере».
Всего Департамент здравоохранения города Москвы закупил 70 аппаратов экспертного класса. Они помогают оказывать дыхательную поддержку пациентам в тяжелом состоянии и даже детям с критически низкой массой тела, в том числе недоношенным малышам.
«Современные аппараты искусственной вентиляции легких, которыми уже сейчас оснащена станция, повышают качество оказания скорой медицинской помощи не только пациентам с новой коронавирусной инфекцией, но также и всем остальным больным, нуждающимся в экстренной дыхательной поддержке. Например, пострадавшим с тяжелой черепно-мозговой травмой, с тяжелыми инсультами, осложненными развитием коматозного состояния. Однако возможности нашего нового дыхательного оборудования — портативных аппаратов ИВЛ — позволяют гораздо большему числу бригад эффективно проводить искусственную вентиляцию легких даже детям с критически низкой массой тела», — сообщил главный врач Станции скорой и неотложной медицинской помощи имени А.С. Пучкова Николай Плавунов.
Новые аппараты ИВЛ дают возможность проводить не только традиционную (инвазивную) искусственную, но также и вспомогательную (масочную) вентиляцию легких. При этом используются щадящие режимы работы для пациентов. Такое оборудование уже показало свою эффективность в лечении тяжелой двусторонней пневмонии на фоне COVID-19.
«В московской скорой помощи аппараты ИВЛ были всегда, но функционал новых портативных аппаратов превосходит наши прошлые возможности в несколько раз», — добавил Петр Давыдов, заместитель главного врача Станции скорой и неотложной медицинской помощи имени А.С. Пучкова.
В столичных реанимобилях теперь можно проводить биохимический анализ кровиВ Москве цифровые технологии позволяют повысить качество оказания экстренной помощи
Станция скорой и неотложной помощи имени А.С. Пучкова — это крупнейшая в городе медицинская организация. В ее состав входит 60 подстанций и 107 постов, из которых 20 постов расположено на крупных автомагистралях, 10 — на МКАД, и 77 — на территории стационаров и поликлинических медицинских организаций. На Станции скорой и неотложной медицинской помощи имени А.С. Пучкова работают 2,5 тысячи врачей, 8,4 тысячи специалистов со средним медицинским образованием.
Вентиляция легких: естественная и механическая
3.2.1 Анатомия дыхательной системы
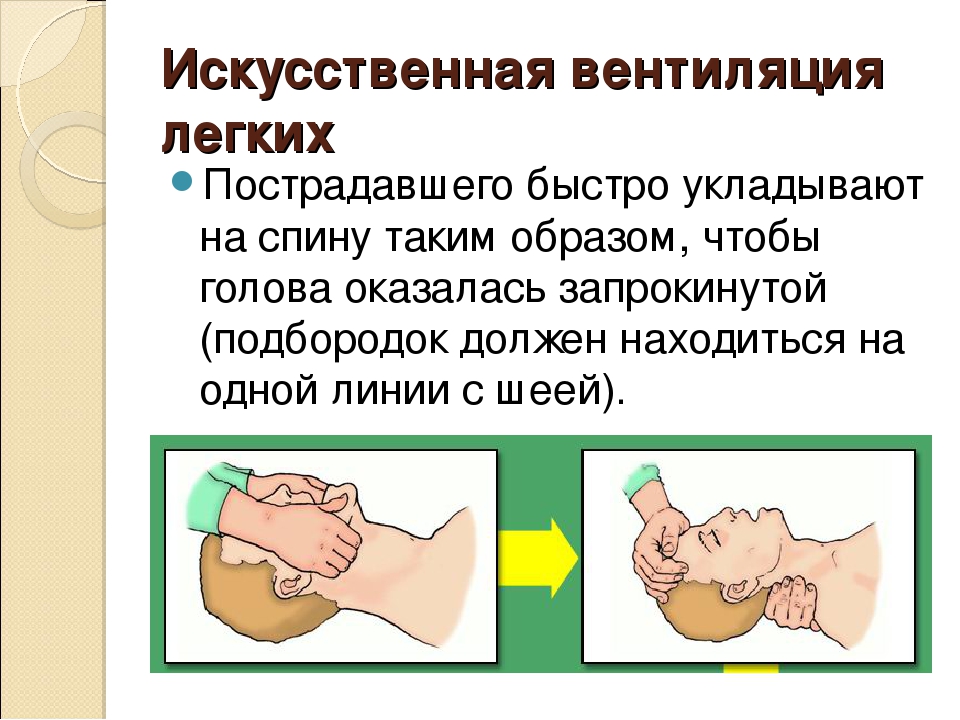
Дыхательная система относится к шести функциональным частям, необходимым для завершения жизненно важного процесса газообмена: дыхательные пути , легкие, грудная клетка, дыхательные мышцы, диафрагмальный нерв и дыхательный центр . Эти части можно условно разделить на две группы: (а) анатомическая основа газообмена и (б) движущая сила и регулирование этого газообмена (рис.3.1).
Рис. 3.1 Шесть ключевых частей дыхательной системы.
Воздуховод
Дыхательные пути, также известные как легочные дыхательные пути или дыхательные пути , относятся к тем частям дыхательной системы, через которые проходит воздух, начиная с носа и рта и заканчивая альвеолами (рис. 3.2). Как следует из этих названий, дыхательные пути — это проход газа между атмосферой и альвеолами. Он не участвует в газообмене между альвеолами и кровью.
Рис. 3.2 Дыхательные пути и легкие.
Дыхательный путь состоит из верхних дыхательных путей и нижних дыхательных путей. Обычно мы думаем, что верхние дыхательные пути включают нос, носовую полость, рот, глотку и гортань. Нижние дыхательные пути включают все, от трахеи до небольших бронхиол.
Дыхательный путь создает сопротивление потоку газа в обоих направлениях. Сопротивление дыхательных путей — одно из важнейших свойств механики легких. Некоторые респираторные заболевания, такие как астма, обструкция верхних дыхательных путей и бронхоспазм, возникают в результате аномально высокого сопротивления дыхательных путей.
Дыхательные пути обычно содержат определенное количество газа, который всегда является неотъемлемой частью дыхательного объема. Этот объем называется мертвым пространством или анатомическим мертвым пространством , потому что объем не участвует в газообмене. Нам нужно уделять особое внимание мертвому пространству, особенно когда дыхательный объем крошечный.
Легкие
У человека есть два легких , расположенных в грудной клетке. Это губчатые органы. Трахея делится на два основных ствола бронхов для соответствующих легких.Каждый главный стволовый бронх затем разветвляется на все меньшие и меньшие бронхи, как дерево. Самая крошечная ветвь называется бронхиолой . В конце каждой бронхиолы находится группа крошечных воздушных мешочков, называемых альвеол .
(стр.16)
Каждая альвеола имеет сеть крошечных кровеносных сосудов, называемых капиллярами . Очень тонкие стенки альвеол и бронхиол создают влажную, чрезвычайно тонкую и большую поверхность для газообмена. Градиенты парциального давления O 2 и CO 2 заставляют газы диффундировать (рис.3.3). Вдыхаемый O 2 диффундирует из альвеол в капилляры, а CO 2 из крови диффундирует в альвеол. Отработанный CO 2 в альвеолах затем выводится через вентиляцию легких.
Рис. 3.3 Газообмен на стенке альвеол.
Поскольку потребность в энергии для всех живых клеток и тканей непрерывна, дыхание также должно быть непрерывным. Как для отдельной клетки, так и для всего тела смерть неизбежна, если дыхание останавливается на определенное время.
Легкие и грудная клетка
стенки эластичные. Во время спокойного дыхания вдох является активным процессом, а это означает, что сокращение дыхательных мышц, особенно диафрагмы, вызывает увеличение общего объема легких по сравнению с тем, когда легкие находились в положении покоя. Выдох — обычно пассивный процесс, означающий, что мышцы вдоха расслабляются, а нагруженная упругая сила отдачи грудной стенки и легких возвращает легкие в исходное положение. Это похоже на то, как растянутая резинка убирается при снятии приложенной силы.Эластичность легких и грудной стенки составляет основу податливости легких , что является еще одним ключевым свойством дыхательной системы.
(стр.17)
механика. Эластичность может быть выше нормы (вызывая «жесткие легкие», как у пациентов с острым респираторным дистресс-синдромом (ОРДС)), или ниже нормы (вызывая «мягкие легкие», как у пациентов с хронической обструктивной болезнью легких (ХОБЛ)). . В случае пневмоторакса эластичность вызывает частичное или полное коллапс пораженного легкого.
Эффективность альвеолярного газообмена определяется: (а) общей площадью и толщиной диффузионной мембраны, (б) альвеолярной вентиляцией и (в) легочной капиллярной циркуляцией. Мы обсудим это далее в разделе 3.2.2.
Стенка грудной клетки
Грудь или грудная клетка — это часть туловища человека между шеей и животом (рис. 3.4). Грудная стенка состоит из костей и мышц. Кости (прежде всего ребра, грудина и позвонки) образуют защитную клетку для внутренних структур грудной клетки.Основными мышцами грудной стенки являются наружные и внутренние межреберные . Сокращение внешних межреберных костей увеличивает грудную полость, сближая ребра и поднимая грудную клетку, в то время как внутренние межреберные мышцы уменьшают размеры грудной полости.
Рис. 3.4 Анатомическое строение грудной стенки и внутренних органов.
Внутри грудной клетки есть три отдела. Два боковых отдела удерживают легкие. Между легкими находится средостение , которое содержит сердце, магистральные сосуды, части трахеи и пищевода и другие структуры.
Поверхность легких и внутренняя стенка грудной клетки фактически не прикреплены друг к другу напрямую. Вместо этого легкое буквально плавает в грудной полости, окруженное очень тонким слоем.
(стр.18)
плевральной жидкости. Это потенциальное пространство называется плевральной полостью . Полость обычно содержит небольшое количество серозной жидкости для смазки движений легких во время дыхания. Хотя обычно плевральная полость является потенциальным пространством, в ненормальных условиях она может содержать большое количество воздуха (пневмоторакс) или жидкости (плевральный выпот).Если это так, пораженное легкое частично или полностью разрушается, не позволяя ему выполнять свою функцию.
В грудной клетке находится несколько жизненно важных мягких органов, включая сердце, легкие и крупные кровеносные сосуды. Высокое положительное давление в конце выдоха (PEEP) для расширения легких сдавливает соседние органы и в определенной степени нарушает гемодинамику.
Как мы упоминали ранее, эластичность легких является ключевым свойством легочной системы. Это измерение эластичности легких и грудной стенки вместе.Иногда респираторная податливость используется для обозначения общей или суммы податливости легких и податливости грудной стенки.
Грудь и брюшная полость разделены мягкой диафрагмой , которая позволяет легко передавать грудное давление в брюшную полость и наоборот. По этой причине высокое ПДКВ может привести к высокому напряжению живота. С другой стороны, высокое напряжение живота может снизить респираторную податливость.
Дыхательные мышцы
Сокращение и расслабление дыхательных мышц увеличивает или уменьшает объем грудной полости, что приводит к соответствующим изменениям альвеолярного давления.Воздух засасывается в легкие, когда альвеолярное давление ниже атмосферного. Газ выталкивается из легких, когда альвеолярное давление выше, чем давление окружающей среды.
Во время вдохновения
Основными мышцами, участвующими в вдохе, являются диафрагма и внешние межреберные мышцы. Грудная полость увеличивается двумя способами: (а) сокращение диафрагмы увеличивает вертикальные размеры грудной полости, или (б) сокращение внешней межреберной мышцы увеличивает ширину грудной полости.При интенсивном дыхании во вдохе участвуют и вспомогательные дыхательные мышцы. Типичными добавочными мышцами являются грудинно-ключично-сосцевидная и лестничная мышцы.
По истечении срока
При спокойном дыхании выдох — это пассивный процесс. Когда мышцы вдоха расслабляются, упругая сила отдачи легких и грудной стенки переводит объем легких в исходное положение, создавая положительное альвеолярное давление. Возникающий в результате градиент давления выталкивает определенное количество газа внутрь легких.Когда выдох активен, мышцы живота, а также внутренние и самые внутренние межреберные мышцы помогают вытеснить газ.
Поочередное сокращение и расслабление дыхательных мышц обеспечивает конечную движущую силу для вентиляции легких. Если мышечная активность ослаблена или подавлена болезнью, усталостью, общей анестезией или травмой, вентиляция легких ухудшается. В этом случае показана искусственная вентиляция легких.
Активация дополнительных респираторных мышц является убедительным признаком респираторной недостаточности или «недостатка воздуха».
Нервы дыхательные
Диафрагма иннервируется левым и правым диафрагмальными нервами, которые отходят от шейного отдела спинного мозга (C3 – C5) у человека. Иннервация дыхательных межреберных мышц и мышц живота происходит от грудопоясничного отдела спинного мозга, T1 – T11 и T7 – L2, соответственно.
Опираясь на этот факт, шведский производитель аппаратов ИВЛ Maquet разработал техническую функцию под названием NAVA (вспомогательная система искусственной вентиляции легких). Вспомогательная система искусственной вентиляции легких с нервной регулировкой использует специальный катетер , датчик , расположенный в нижней части пищевода, для обнаружения импульсов диафрагмального нерва.Обнаруженные сигналы, в свою очередь, используются для управления работой аппарата ИВЛ.
(стр.19)
Повреждение спинного мозга на уровне C4 или выше может нарушить нервные импульсы от головного мозга к диафрагмальному нерву. Такие травмы могут парализовать диафрагму, в результате чего пострадавший должен находиться на ИВЛ. Повреждение спинного мозга ниже C5 не затрагивает диафрагмальный нерв; Таким образом, человек с такой травмой может дышать, несмотря на возможный паралич нижних конечностей.
Дыхательный центр
Дыхательный центр относится к группе нервных клеток в продолговатом мозге и мосту головного мозга, которые: (а) получают сенсорные сигналы об уровне O 2 , CO 2 и pH в крови и спинномозговая жидкость; (б) определить, нужно ли и как изменить характер дыхания; и (c) посылать сигналы дыхательным мышцам для выполнения этого изменения в модели дыхания.
Функционирование дыхательного центра имеет решающее значение для правильного дыхания. У большинства пациентов, находящихся на ИВЛ, дыхательный центр не поврежден, то есть у активного пациента наблюдается нормальная респираторная реакция на изменения в крови O 2 , CO 2 и pH. Нормальный респираторный центр требуется для нескольких новых функций аппарата ИВЛ, таких как режим пропорциональной вспомогательной вентиляции (PAV), компенсация сопротивления трубки , (TRC или автоматическая компенсация трубки (ATC)) и NAVA.Тем не менее дыхательный центр может не функционировать должным образом у неврологических или нейрохирургических пациентов.
3.2.2 Физиология дыхания
Два основных вопроса о дыхании
Почему необходимо дыхание?
Все живые клетки нуждаются в источнике энергии, чтобы выжить и выполнять свои физиологические функции. Энергия вырабатывается в клетках в ходе биохимического процесса метаболизма (рис.3.5). В ходе метаболического химического процесса потребляются кислород (O 2 ) и глюкоза, а также образуется вода, диоксид углерода (CO 2 ) и аденозинтрифосфат (АТФ), который является основной «валютой» энергии в организме.
Рис. 3.5 Схема обменного процесса.
Метаболизм — это непрерывный процесс, в котором непрерывно потребляется O 2 и образуется CO 2 . Чтобы поддерживать локальные концентрации O 2 и CO 2 в надлежащих пределах, новый O 2 должен постоянно доставляться в ячейки, а отработанный CO 2 должен удаляться.Это задача дыхания.
Что такое дыхание?
Короче говоря, дыхание — это процесс транспортировки O 2 из атмосферного воздуха к клеткам в тканях и перенос CO 2 из клеток в воздух. В общем, дыхание состоит из трех основных частей: газообмена в легких, кровообращение и газообмен в тканях и клетках (рис. 3.6).
Рис. 3.6 Схема всего процесса дыхания.
Кислород и CO 2 переносятся кровью по мере ее циркуляции.Если кровоснабжение ткани резко снижается или даже прекращается, локальная концентрация O 2 падает, а концентрация CO 2 быстро возрастает. Ткань погибнет, если нормальное кровоснабжение быстро не восстановится. Типичный пример — инфаркт сердца.
(стр.20)
Газовый транспорт
Кислород и CO 2 транспортируются тремя способами: (1) диффузия газа, (2) вентиляция легких и (3) кровообращение.
Газодиффузионная
Диффузия газа — это естественный процесс, при котором молекулы газа перемещаются из области с высокой концентрацией в соседнюю область с низкой концентрацией.Эти две области имеют общую диффузионную мембрану. Такая диффузия газа происходит в основном в трех областях: (а) стенки альвеол, (б) стенки кровеносных капилляров и (в) ткани и клеточные мембраны.
Скорость диффузии газа зависит от: (а) разницы в молекулярных концентрациях газа, (б) свойств диффузионной мембраны, включая ее общую площадь и толщину, и (в) растворимости и молекулярной массы вовлеченного газа. Углекислый газ диффундирует в 20 раз быстрее, чем O 2 .
Транспортировка крови O 2 и CO 2
Кислород в крови переносится двумя путями. Эритроциты или эритроцитов несут 97% всех молекул O 2 в химической комбинации с гемоглобином. Остальные 3% растворяются в плазме.
Гемоглобин (Hb), глобулярный белок, является основным транспортным средством для переноса O 2 в крови. В альвеолярном капилляре, где концентрация O 2 высока, O 2 легко связывается с гемоглобином.
(стр.21)
настоящее время. В капиллярах ткани, где концентрация O 2 низкая, гемоглобин высвобождает O 2 в ткань.Кривая диссоциации кислород-гемоглобин используется для выражения взаимосвязи между концентрацией O 2 и тем, получает или высвобождает гемоглобин молекулы O 2 .
CO 2 переносится с кровью тремя путями. Большинство молекул CO 2 транспортируются в виде ионов бикарбоната (HCO 3 -), около 10% связываются с гемоглобином и белками плазмы, а оставшиеся 5% растворяются в плазме.
Легочная вентиляция
Легочная вентиляция — важная часть дыхания, отвечающая за газообмен между альвеолами и атмосферным воздухом.Он предполагает регулярную замену застоявшихся газов в легких свежими газами из атмосферы.
Простая физическая модель может помочь нам лучше понять вентиляцию легких (рис. 3.7). Подходящим вариантом является модифицированная пара сильфонов камина с «расширяемыми грудными стенками», «дыхательными путями» и «общим объемом легких». Между двумя ручками сильфона добавлена пружина, имитирующая «упругую силу отдачи». Еще одна модификация заключается в том, что модель не имеет одностороннего клапана, поэтому воздух входит и выходит исключительно через форсунку.
Рис. 3.7 Узел дыхательных путей, легких и грудной клетки можно имитировать с помощью модифицированных сильфонов камина.
В дыхательной системе всегда действуют две противоположные силы: одна — для расширения легких, а другая — для втягивания легких. Объем легких определяется балансом двух сил. Легкие надуваются, если сила расширения больше, чем сила втягивания, и сдуваются, если происходит обратное. Объем легких не изменяется, если обе силы равны. В конце выдоха объем легких стабилен в положении покоя.Этот объем называется функциональной остаточной емкостью (FRC) (рис. 3.8). FRC имеет решающее значение для альвеолярного газообмена.
Рис. 3.8 Функциональная остаточная емкость (FRC), дыхательный объем и мертвое пространство.
T e : время выдоха: T i ; время вдоха: V T ; дыхательный объем.
Во время естественного вдоха сокращение дыхательных мышц (в основном диафрагмы) увеличивает объем грудной клетки, создавая временное отрицательное альвеолярное давление (P alv ).Воздух всасывается в легкие и смешивается с содержащимися там газами. Этот объем вдыхаемого газа называется дыхательным объемом на вдохе . Во время вдоха усиливается упругая сила отдачи (показанная как растянутая пружина).
Во время выдоха дыхательные мышцы расслабляются, и сила упругой отдачи возвращает грудную клетку и легкие в исходное положение, создавая временное положительное значение P alv . Некоторое количество газа выталкивается из легких. Этот объем выдыхаемого газа называется дыхательный объем выдоха .(стр.22)
Дыхание должно включать как вдох, так и выдох. Дыхательные объемы вдоха и выдоха примерно равны.
Дыхательный объем каждого вдоха состоит из двух частей. В альвеолярном газообмене участвует альвеолярный дыхательный объем . Другая часть, не участвующая в газообмене, — это (анатомическое) мертвое пространство . Объем мертвого пространства всегда сначала перемещается или удаляется.
Мертвое пространство неизбежно.Не забывайте об этом при установке и интерпретации дыхательного или минутного объема. Во время механической вентиляции мертвое пространство обычно увеличивается из-за наличия искусственных дыхательных путей. Эффективная альвеолярная вентиляция определяется разницей между дыхательным объемом и общим мертвым пространством. Если дыхательный объем очень близок к объему мертвого пространства или равен ему, альвеолярная вентиляция (почти) равна нулю, то есть удаление CO 2 равно (почти) нулю. Эта нежелательная ситуация известна как вентиляция мертвого пространства .
Обратите внимание, что после каждого вдоха замещается только часть альвеолярного газа.
Помимо определения вентиляции как одного вдоха, мы также можем определить ее через минутный интервал (рис. 3.9). Когда мы говорим о -минутной вентиляции, или -минутном объеме, , нам необходимо определить несколько общих респираторных терминов:
Рис. 3.9. Связь между минутным объемом, дыхательным объемом, скоростью и мертвым пространством.
Взаимосвязь может быть выражена простым уравнением:
Альвеолярный минутный объем = Частота × (Дыхательный объем — Мертвое пространство)
Регуляция дыхания
Даже в нормальных условиях потребность человека в энергии сильно различается.Подумайте, сколько энергии вам нужно во время сна по сравнению с физическими упражнениями. Биохимически эти активности сильно различаются по скорости метаболизма, потреблению O 2 и производству CO 2 . Нормального значения потребности в энергии не существует.
С другой стороны, физиологически важно поддерживать артериальное парциальное давление кислорода и углекислого газа (PaO 2 , PaCO 2 ) и pH в относительно узких нормальных диапазонах даже при изменении потребности в энергии.Это достигается за счет механизма управления, который автоматически и точно адаптирует характер дыхания (то есть частоту и глубину дыхания) к текущим уровням PaO 2 , PaCO 2 и pH. В некоторой степени мы можем свободно менять свое дыхание.
Этот механизм управления использует последовательность из трех частей:
Механизм реагирует на изменения PaCO 2 , PaO 2 и артериального pH. Из них основным стимулятором является PaCO 2 .Как показано на рис. 3.10, увеличение PaCO 2 приводит к резкому усилению альвеолярной вентиляции и наоборот. Таким образом, все три стимулятора обычно поддерживаются в пределах своих нормальных значений, даже когда потребление O 2 и / или производство CO 2 резко меняется.
Рис. 3.10 Влияние увеличения РСО в артериях 2 и снижения рН в артериях на скорость альвеолярной вентиляции.
Перепечатано с разрешения Учебник медицинской физиологии , 8-е издание, Гайтон А.С., с. 447. Авторские права (1990) с разрешения Harcourt College Publishers и Elsevier Inc.
У большинства пациентов, находящихся на ИВЛ, этот механизм контроля дыхания остается неизменным. Этот механизм играет ключевую роль в респираторном дистресс-синдроме, асинхронности между пациентом и аппаратом ИВЛ и отлучении от груди. У некоторых неврологических и нейрохирургических пациентов это может быть ненормально.
3.2.3 Дыхательная недостаточность
Таким образом, дыхание — это механизм, поддерживающий PaO 2 и PaCO 2 в пределах их нормального диапазона, даже когда потребность в энергии колеблется.
Дыхательная недостаточность относится к синдрому, при котором дыхательная система не может поддерживать PaO 2 или PaCO 2 в пределах нормы, то есть PaO 2 = 80–100 мм рт. Ст. И PaCO 2 = 35–45 мм рт. (Таблица 3.1). Дыхательная недостаточность может возникать из-за тяжелого функционального нарушения дыхательных путей, легких, грудной клетки, дыхательного центра, дыхательных нервов и дыхательных мышц по ряду клинических причин.
Таблица 3.1 Определение нормального и аномального pH, PaO 2 и PaCO 2
Ниже нормы | Нормальные диапазоны | Выше нормы |
|---|---|---|
pH 7.35–7,45 | ||
| PaO 2 80–100 мм рт. Ст. |
|
| PaCO 2 35–45 мм рт. Ст. |
|
Здесь необходимо ввести два ключевых термина. Гипоксия означает, что PaO 2 ниже 80 мм рт. Ст., А гиперкапния означает, что PaCO 2 выше 45 мм рт.
Дыхательную недостаточность можно условно разделить на два типа: тип 1 и тип 2.
Дыхательная недостаточность 1 типа также известна как гипоксическая дыхательная недостаточность или легочная недостаточность . Его основная особенность — аномально низкий PaO 2 (<60 мм рт. Ст.), Но почти нормальный PaCO 2 .Дыхательная недостаточность 1 типа обычно вызвана недостаточной оксигенацией при прохождении крови через легкие из-за: (а) несоответствия вентиляции / перфузии, (б) артериовенозного шунта или (в) нарушения диффузии газа.
Дыхательная недостаточность 2 типа также известна как гиперкапническая дыхательная недостаточность или отказ помпы . Его основная особенность — аномально высокое PaCO 2 (> 50 мм рт. Ст.) И аномально низкое PaO 2 (<60 мм рт. Ст.). Дыхательная недостаточность 2 типа обычно вызвана недостаточной вентиляцией легких из-за: (а) чрезмерного (п.24) сопротивление дыхательных путей, (б) снижение респираторного драйва, (в) усталость или недостаточность дыхательных мышц, или (г) аномальное состояние легких и грудной стенки.
Клинические признаки дыхательной недостаточности включают тахипноэ, тахикардию, цианоз, потливость, втягивание межреберных промежутков, хрюканье и вздутие носа. Пульсоксиметрия и анализ газов крови могут помочь диагностировать дыхательную недостаточность. Обратите внимание, что эти клинические признаки неспецифичны.
Для простоты мы можем рассматривать патофизиологический процесс дыхательной недостаточности как состоящий из нескольких этапов (рис.3.11):
Рис. 3.11 Дыхательная недостаточность — это нисходящая спираль.
Если пациент может поддерживать нормальные значения PaO 2 и PaCO 2 с помощью этих усиленных дыхательных усилий, компенсация будет успешной. Однако в противном случае дыхательная недостаточность неизбежна.
В зависимости от основного заболевания оба типа дыхательной недостаточности могут быть острыми, с быстрым появлением симптомов; например, при утоплении, приступе астмы, остановке дыхания, передозировке наркотиками, обструкции верхних дыхательных путей или травме грудной клетки и легких.Дыхательная недостаточность также может быть прогрессирующей (хронической), как при эмфиземе, хроническом бронхите или нервно-мышечном заболевании. Для целей клинического лечения важно различать типы 1 и 2, как показано в таблице 3.2.
Таблица 3.2 Краткое описание респираторной недостаточности
Классификация | Дыхательная недостаточность 1 типа | Дыхательная недостаточность 2 типа |
|---|---|---|
Прочие наименования | ||
Основная характеристика | Гипоксия и нормальный PaCO 2 | Гиперкапния и гипоксия |
Типичные причины |
Лечение дыхательной недостаточности обычно включает: (а) кислородную терапию, (б) поддержку искусственной вентиляции легких с помощью системы искусственной вентиляции легких или системы постоянного положительного давления в дыхательных путях (СРАР), (в) лечение основной причины и (г) другую поддерживающую терапию. такие меры, как введение жидкости и питание.Острая дыхательная недостаточность обычно лечится в отделении интенсивной терапии, а хроническая дыхательная недостаточность обычно лечится дома или в учреждении длительного ухода.
Физиология, легочная вентиляция и перфузия — StatPearls
Введение
Одной из основных функций легких является облегчение газообмена между кровеносной системой и внешней средой. Легкие состоят из ветвящихся дыхательных путей, которые заканчиваются респираторными бронхиолами и альвеолами, которые участвуют в газообмене.Большинство бронхиол и крупных дыхательных путей являются частью проводящей зоны легких, которая доставляет газ к участкам газообмена в альвеолах. В легких происходит газообмен между альвеолярным воздухом и кровью легочных капилляров. Для эффективного газообмена альвеолы необходимо вентилировать и перфузировать. Вентиляция (V) относится к потоку воздуха в альвеолы и из них, а перфузия (Q) относится к потоку крови к альвеолярным капиллярам. Отдельные альвеолы имеют разную степень вентиляции и перфузии в разных областях легких.Коллективные изменения вентиляции и перфузии в легких измеряются клинически с использованием отношения вентиляции к перфузии (V / Q). Изменения соотношения V / Q могут влиять на газообмен и способствовать гипоксемии.
Клеточный
Газообмен происходит в респираторной зоне легких, где находятся альвеолы. Дыхательная зона легкого включает респираторные бронхиолы, альвеолярные протоки, альвеолярные мешочки и альвеолы. Прилегающие альвеолы разделяют тонкие альвеолярные перегородки. Соседние альвеолы соединяются небольшими отверстиями, называемыми порами Кона, которые обеспечивают боковой поток воздуха и выравнивание давления между альвеолами.Управление открытием или закрытием альвеол для регулирования вентиляции происходит в общих альвеолярных отверстиях с помощью выступов гладких мышц, называемых альвеолярными бугорками.
Альвеолярная перегородка имеет множество капилляров и тонкие стенки для газообмена. Помимо эндотелиальных клеток капилляров, альвеолярная перегородка содержит пневмоциты I типа, которые очень тонкие и выстилают альвеолы, а также пневмоциты II типа, которые секретируют сурфактант дипальмитоилфосфатидилхолин (DPPT) для снижения поверхностного натяжения альвеол.Альвеолярные макрофаги, также известные как пылевые клетки, активны в защите от патогенов и раздражителей.
Газообмен в альвеолах происходит главным образом за счет диффузии. Двигаясь из альвеол в капиллярную кровь, газы должны проходить через альвеолярный сурфактант, альвеолярный эпителий, базальную мембрану и эндотелий капилляров. Согласно закону диффузии Фика, диффузия газа через альвеолярную мембрану увеличивается с:
Увеличенной площадью поверхности мембраны
Увеличенной разностью альвеолярного давления (PA-Pa)
Увеличенной растворимостью газа
Уменьшение толщины мембраны
Обмен кислорода и углекислого газа ограничен перфузией.Распространение газов достигает равновесия на одной трети пути через границу раздела капилляр / альвеол. Деоксигенированная кровь из легочных артерий имеет PVO2 40 мм рт. Ст., А альвеолярный воздух имеет PAO2 100 мм рт. Между тем, парциальное давление углекислого газа снижается с PVCO2 46 мм рт. Ст. До PaCO2 40 мм рт. Ст. В альвеолярных капиллярах из-за PACO2, равного 40 мм рт.
Вовлеченные системы органов
- Сердечно-сосудистая система
Легочная циркуляция
Альвеолярные капилляры
- Дыхательная система
Альвеолы
Альвеолярные мешки
Альвеолярные протоки
Дыхательные бронхиолы
Механизм 9065 перфузия
Оценка соотношения V / Q вентиляции (Q.Есть региональные различия в соотношении V / Q в легких. Вентиляция у основания легкого на 50% больше, чем у верхушки. Вес жидкости в плевральной полости увеличивает внутриплевральное давление у основания до менее отрицательного значения. В результате альвеолы менее расширены и имеют более высокую податливость у основания, что приводит к более значительному увеличению объема на вдохе для усиления вентиляции. Перфузия также выше у основания легкого из-за силы тяжести, притягивающей кровь к основанию.В целом перфузия увеличивается больше, чем вентиляция у основания легкого, что приводит к более низким отношениям V / Q в основании легкого по сравнению с верхушкой. У здорового человека соотношение V / Q составляет 1 в средней части легкого, с минимальным разбросом соотношений V / Q от 0,3 до 2,1 от основания до вершины [1]. В случаях высокого отношения V / Q PO2 увеличивается, а PCO2 уменьшается, поскольку альвеолярный воздух более соответствует большему объему вдыхаемого воздуха, чем перфузируемая кровь. [2] С другой стороны, низкие отношения V / Q приводят к снижению PO2 и увеличению PCO2.
Сопутствующие испытания
Клинически диффузионная способность легких (DLCO) измеряется с использованием низких концентраций окиси углерода. DLCO можно рассчитать по формуле VCO = DLCO (PACO — PaCO). PaCO приблизительно равен нулю из-за связывания гемоглобина, так что уравнение может измениться на DLCO = VCO / PACO. Для измерения DLCO воздух с низким содержанием CO вдыхается в течение 10 секунд, при этом поток CO в легкие и из легких измеряется для расчета VCO. [3] Измерение PACO позволяет рассчитать DLCO, при этом нормальное значение DLCO составляет 25 мл / мин / мм рт.
DLCO связан с коэффициентом диффузии (D) окиси углерода, площадью альвеол (A) и толщиной альвеол (T) в соответствии с уравнением DLCO = D x A / T. Поскольку D является константой, значение DLCO дает представление об альвеолярной области и толщине, которые влияют на газообмен. Кроме того, диффузию других газов можно рассчитать при различных условиях давления путем корректировки их различных коэффициентов диффузии.
Отношение V / Q в легких можно измерить методом множественного удаления инертного газа (MIGET).Легкое делится на несколько отделений, и вдыхается смесь из 6 газов. [4] V / Q каждого отсека можно рассчитать, используя истечение различных газов и математические модели.
Патофизиология
Системное кровообращение в легкие происходит через бронхиальное кровообращение, которое в конечном итоге стекает в легочную вену. Этот нормальный анатомический шунт слева направо приводит к небольшому падению PaO2 со 100 мм рт. Ст. В конце легочных капилляров до 95 мм рт. Ст. В легочной вене.Градиент A-a обычно измеряет это небольшое падение парциального давления кислорода от альвеол (PAO2) к легочной вене (PaO2) из-за шунтирования, которое может увеличиваться при некоторых патологических состояниях. Шунты справа налево могут дополнительно снижать PaO2, вызывая гипоксемию и проявлять повышенный градиент A-a. Проблемы с диффузией также могут привести к увеличению градиента A-a, поскольку артериальная кровь может не достичь равновесия с альвеолярным воздухом из-за ограниченного диффузией газообмена.
Физиологические условия могут привести к экстремальным отношениям V / Q за пределами нормального диапазона.При шунте справа налево часть легочного кровотока отводится от альвеол, что приводит к вентиляции без перфузии и более высокому соотношению V / Q. Хотя диффузия между капиллярами и альвеолами не нарушена, артериальное РО2 снижается из-за недостаточной вентиляции шунтированной крови, что приводит к увеличению градиента А-а. PCO2 в артериальной крови также увеличивается из-за отсутствия газообмена. Из-за плато на кривой связывания кислорода гемоглобина небольшое изменение содержания кислорода в артериальной крови вызывает значительный сдвиг PO2.В результате шунты справа налево вызывают большую гипоксемию, чем гиперкапнию. Как правило, повышение FiO2 с помощью дополнительной кислородной терапии не улучшает гипоксемию у пациентов с шунтированием справа налево, потому что повышенное содержание кислорода во вдыхаемом воздухе никогда не достигает шунтированной крови для газообмена.
Мертвое пространство альвеол возникает, когда некоторые альвеолы не вентилируются, что приводит к низкому соотношению V / Q. Альвеолярное мертвое пространство увеличивает общее физиологическое мертвое пространство, уменьшая альвеолярную вентиляцию; это приводит к снижению отношения V / Q и снижению PAO2 для функциональных альвеол.Гипоксемия возникает в результате снижения PAO2, которое можно скорректировать кислородной терапией, чтобы увеличить PAO2 функционирующих альвеол.
Клиническая значимость
Ряд условий может вызвать шунты справа налево, которые вызывают несоответствие V / Q. На микроскопическом уровне легочные артериовенозные мальформации обеспечивают путь от артериальной к венозной крови в малом круге кровообращения, минуя легочные капилляры, где происходит газообмен. Врожденные пороки сердца могут вызывать шунты справа налево на макроскопическом уровне.В случае дефекта межжелудочковой перегородки правый желудочек может гипертрофироваться до такой степени, что в правом желудочке во время систолы давление выше, чем в левом желудочке, в результате чего кровь течет из правого в левый желудочек в обход малого круга кровообращения. Физиологические шунты справа налево также могут возникать, если перфузия достигает участков легких, которые не вентилируются, что может быть результатом обструкции дыхательных путей, отека легких и пневмонии. Эффект физиологического шунтирования справа налево сводится к минимуму за счет гипоксической вазоконстрикции в малом круге кровообращения, которая перенаправляет кровоток в лучше вентилируемые области легких для более эффективного обмена.
Астму часто называют «ложным шунтом», потому что бронхоспазм снижает вентиляцию, что приводит к низкому соотношению V / Q, как это происходит в мертвом пространстве альвеол. В случае астмы показана кислородная терапия, потому что некоторая вентиляция бронхоконстриктированных альвеол все еще происходит, а кислородная терапия увеличивает PAO2 альвеол с затрудненным воздушным потоком. Лечение бронходилататорами, такими как агонист бета-2, более полезно для пациентов с астмой, чем кислородная терапия, из-за уменьшения бронхоспазма.
Несоответствие
V / Q может возникнуть в случае тромбоэмболии легочной артерии (PE). Эмболы могут ограничивать кровоток в малом круге кровообращения, в результате альвеолы вентилируются, но не перфузируются; это приводит к увеличению отношения V / Q и снижению газообмена. Нарушение газообмена может вызвать гипоксемию при ТЭЛА. [5]
Гипоксия на вдохе, возникающая на большой высоте, может вызывать несоответствие V / Q и влиять на газы крови. Пониженное атмосферное давление на высоте вызывает снижение PAO2.Хотя происходит нормальная диффузия (нормальный градиент A-a), артериальное PaO2 снижается и возникает гипоксемия. Кислородная терапия может исправить гипоксемию в этом случае, потому что вдыхаемый воздух увеличивает PAO2 до нормального уровня.
Внутренние диффузионные барьеры между альвеолами и капиллярами могут привести к гипоксемии. Хотя PAO2 в норме, нарушение диффузии приводит к снижению PaO2 и увеличению градиента A-a. Пациенты с проблемами диффузии чаще страдают гипоксемией, чем гиперкапнией, и кислородная терапия улучшает гипоксемию при дефиците диффузии.Дополнительный кислород увеличивает PAO2, что приводит к увеличению градиента кислорода, способствующему диффузии. Даже при кислородной терапии все еще наблюдается повышенный градиент A-a.
На диффузию могут влиять различные условия, которые можно оценить клинически с помощью DLCO. При фиброзе легких утолщение легочной ткани увеличивает толщину альвеолярной стенки, уменьшая DLCO. [3] DLCO также уменьшается при эмфиземе, в этом случае из-за разрушения альвеол, уменьшая площадь газообмена.[3] Уменьшение диффузии при эмфиземе иногда вызывает ограниченный диффузией обмен кислорода во время упражнений, так как учащение пульса сокращает время, которое кровь проводит в альвеолярных капиллярах для газообмена.
Существенной причиной проблем с диффузией является отек легких, поскольку жидкость в легких увеличивает эффективную толщину альвеолярной стенки и уменьшает область газообмена. Отек легких приводит к большей гипоксемии, чем гиперкапния, потому что углекислый газ легче растворяется в жидкости и достигает альвеолярной мембраны для обмена.Отек препятствует попаданию воздуха в легочные капилляры, что приводит к перфузии без вентиляции и мертвому пространству альвеол.
Отек легких имеет несколько причин, большинство из которых влияет на силы Старлинга, увеличивающие фильтрацию в альвеолярных капиллярах. Левосторонняя сердечная недостаточность может повышать давление в левом предсердии, что, в свою очередь, может приводить к увеличению гидростатического давления в капиллярах, вызывая отек легких. Чрезмерное введение жидкостей для внутривенного введения может аналогичным образом увеличить капиллярное гидростатическое давление и вызвать отек.Острый респираторный дистресс-синдром (ОРДС) и сепсис могут вызывать повышенную проницаемость капилляров и вызывать отек легких. Снижение осмотического давления капилляров также может вызвать отек легких, как это происходит при нефротическом синдроме и печеночной недостаточности. Отек легких также может быть результатом затрудненного лимфодренажа отфильтрованной жидкости, как это может происходить с опухолями.
Дополнительное образование / Контрольные вопросы
Список литературы
- 1.
- Вагнер П.Д., Ларавусо, РБ, Уль-Р.Р., Западный Джуби.Непрерывное распределение соотношений вентиляции и перфузии у здоровых субъектов, дышащих воздухом и 100-процентным O2. J Clin Invest. 1974 июл; 54 (1): 54-68. [Бесплатная статья PMC: PMC301524] [PubMed: 4601004]
- 2.
- Petersson J, Glenny RW. Газообмен и вентиляционно-перфузионные отношения в легких. Eur Respir J. Октябрь 2014 г .; 44 (4): 1023-41. [PubMed: 25063240]
- 3.
- Enright Md P. Офисные тесты DLCO помогают пульмонологам принимать важные клинические решения. Respir Investig.2016 сентябрь; 54 (5): 305-11. [PubMed: 27566377]
- 4.
- Wagner PD. Метод множественного удаления инертного газа (MIGET). Intensive Care Med. 2008 июн; 34 (6): 994-1001. [PubMed: 18421437]
- 5.
- Huet Y, Lemaire F, Brun-Buisson C, Knaus WA, Teisseire B, Payen D, Mathieu D. Гипоксемия при острой тромбоэмболии легочной артерии. Грудь. 1985 декабрь; 88 (6): 829-36. [PubMed: 4064770]
Физиология, легочная вентиляция и перфузия — StatPearls
Введение
Одной из основных функций легких является облегчение газообмена между кровеносной системой и внешней средой.Легкие состоят из ветвящихся дыхательных путей, которые заканчиваются респираторными бронхиолами и альвеолами, которые участвуют в газообмене. Большинство бронхиол и крупных дыхательных путей являются частью проводящей зоны легких, которая доставляет газ к участкам газообмена в альвеолах. В легких происходит газообмен между альвеолярным воздухом и кровью легочных капилляров. Для эффективного газообмена альвеолы необходимо вентилировать и перфузировать. Вентиляция (V) относится к потоку воздуха в альвеолы и из них, а перфузия (Q) относится к потоку крови к альвеолярным капиллярам.Отдельные альвеолы имеют разную степень вентиляции и перфузии в разных областях легких. Коллективные изменения вентиляции и перфузии в легких измеряются клинически с использованием отношения вентиляции к перфузии (V / Q). Изменения соотношения V / Q могут влиять на газообмен и способствовать гипоксемии.
Клеточный
Газообмен происходит в респираторной зоне легких, где находятся альвеолы. Дыхательная зона легкого включает респираторные бронхиолы, альвеолярные протоки, альвеолярные мешочки и альвеолы.Прилегающие альвеолы разделяют тонкие альвеолярные перегородки. Соседние альвеолы соединяются небольшими отверстиями, называемыми порами Кона, которые обеспечивают боковой поток воздуха и выравнивание давления между альвеолами. Управление открытием или закрытием альвеол для регулирования вентиляции происходит в общих альвеолярных отверстиях с помощью выступов гладких мышц, называемых альвеолярными бугорками.
Альвеолярная перегородка имеет множество капилляров и тонкие стенки для газообмена. Помимо эндотелиальных клеток капилляров, альвеолярная перегородка содержит пневмоциты I типа, которые очень тонкие и выстилают альвеолы, а также пневмоциты II типа, которые секретируют сурфактант дипальмитоилфосфатидилхолин (DPPT) для снижения поверхностного натяжения альвеол.Альвеолярные макрофаги, также известные как пылевые клетки, активны в защите от патогенов и раздражителей.
Газообмен в альвеолах происходит главным образом за счет диффузии. Двигаясь из альвеол в капиллярную кровь, газы должны проходить через альвеолярный сурфактант, альвеолярный эпителий, базальную мембрану и эндотелий капилляров. Согласно закону диффузии Фика, диффузия газа через альвеолярную мембрану увеличивается с:
Увеличенной площадью поверхности мембраны
Увеличенной разностью альвеолярного давления (PA-Pa)
Увеличенной растворимостью газа
Уменьшение толщины мембраны
Обмен кислорода и углекислого газа ограничен перфузией.Распространение газов достигает равновесия на одной трети пути через границу раздела капилляр / альвеол. Деоксигенированная кровь из легочных артерий имеет PVO2 40 мм рт. Ст., А альвеолярный воздух имеет PAO2 100 мм рт. Между тем, парциальное давление углекислого газа снижается с PVCO2 46 мм рт. Ст. До PaCO2 40 мм рт. Ст. В альвеолярных капиллярах из-за PACO2, равного 40 мм рт.
Вовлеченные системы органов
- Сердечно-сосудистая система
Легочная циркуляция
Альвеолярные капилляры
- Дыхательная система
Альвеолы
Альвеолярные мешки
Альвеолярные протоки
Дыхательные бронхиолы
Механизм 9065 перфузия
Оценка соотношения V / Q вентиляции (Q.Есть региональные различия в соотношении V / Q в легких. Вентиляция у основания легкого на 50% больше, чем у верхушки. Вес жидкости в плевральной полости увеличивает внутриплевральное давление у основания до менее отрицательного значения. В результате альвеолы менее расширены и имеют более высокую податливость у основания, что приводит к более значительному увеличению объема на вдохе для усиления вентиляции. Перфузия также выше у основания легкого из-за силы тяжести, притягивающей кровь к основанию.В целом перфузия увеличивается больше, чем вентиляция у основания легкого, что приводит к более низким отношениям V / Q в основании легкого по сравнению с верхушкой. У здорового человека соотношение V / Q составляет 1 в средней части легкого, с минимальным разбросом соотношений V / Q от 0,3 до 2,1 от основания до вершины [1]. В случаях высокого отношения V / Q PO2 увеличивается, а PCO2 уменьшается, поскольку альвеолярный воздух более соответствует большему объему вдыхаемого воздуха, чем перфузируемая кровь. [2] С другой стороны, низкие отношения V / Q приводят к снижению PO2 и увеличению PCO2.
Сопутствующие испытания
Клинически диффузионная способность легких (DLCO) измеряется с использованием низких концентраций окиси углерода. DLCO можно рассчитать по формуле VCO = DLCO (PACO — PaCO). PaCO приблизительно равен нулю из-за связывания гемоглобина, так что уравнение может измениться на DLCO = VCO / PACO. Для измерения DLCO воздух с низким содержанием CO вдыхается в течение 10 секунд, при этом поток CO в легкие и из легких измеряется для расчета VCO. [3] Измерение PACO позволяет рассчитать DLCO, при этом нормальное значение DLCO составляет 25 мл / мин / мм рт.
DLCO связан с коэффициентом диффузии (D) окиси углерода, площадью альвеол (A) и толщиной альвеол (T) в соответствии с уравнением DLCO = D x A / T. Поскольку D является константой, значение DLCO дает представление об альвеолярной области и толщине, которые влияют на газообмен. Кроме того, диффузию других газов можно рассчитать при различных условиях давления путем корректировки их различных коэффициентов диффузии.
Отношение V / Q в легких можно измерить методом множественного удаления инертного газа (MIGET).Легкое делится на несколько отделений, и вдыхается смесь из 6 газов. [4] V / Q каждого отсека можно рассчитать, используя истечение различных газов и математические модели.
Патофизиология
Системное кровообращение в легкие происходит через бронхиальное кровообращение, которое в конечном итоге стекает в легочную вену. Этот нормальный анатомический шунт слева направо приводит к небольшому падению PaO2 со 100 мм рт. Ст. В конце легочных капилляров до 95 мм рт. Ст. В легочной вене.Градиент A-a обычно измеряет это небольшое падение парциального давления кислорода от альвеол (PAO2) к легочной вене (PaO2) из-за шунтирования, которое может увеличиваться при некоторых патологических состояниях. Шунты справа налево могут дополнительно снижать PaO2, вызывая гипоксемию и проявлять повышенный градиент A-a. Проблемы с диффузией также могут привести к увеличению градиента A-a, поскольку артериальная кровь может не достичь равновесия с альвеолярным воздухом из-за ограниченного диффузией газообмена.
Физиологические условия могут привести к экстремальным отношениям V / Q за пределами нормального диапазона.При шунте справа налево часть легочного кровотока отводится от альвеол, что приводит к вентиляции без перфузии и более высокому соотношению V / Q. Хотя диффузия между капиллярами и альвеолами не нарушена, артериальное РО2 снижается из-за недостаточной вентиляции шунтированной крови, что приводит к увеличению градиента А-а. PCO2 в артериальной крови также увеличивается из-за отсутствия газообмена. Из-за плато на кривой связывания кислорода гемоглобина небольшое изменение содержания кислорода в артериальной крови вызывает значительный сдвиг PO2.В результате шунты справа налево вызывают большую гипоксемию, чем гиперкапнию. Как правило, повышение FiO2 с помощью дополнительной кислородной терапии не улучшает гипоксемию у пациентов с шунтированием справа налево, потому что повышенное содержание кислорода во вдыхаемом воздухе никогда не достигает шунтированной крови для газообмена.
Мертвое пространство альвеол возникает, когда некоторые альвеолы не вентилируются, что приводит к низкому соотношению V / Q. Альвеолярное мертвое пространство увеличивает общее физиологическое мертвое пространство, уменьшая альвеолярную вентиляцию; это приводит к снижению отношения V / Q и снижению PAO2 для функциональных альвеол.Гипоксемия возникает в результате снижения PAO2, которое можно скорректировать кислородной терапией, чтобы увеличить PAO2 функционирующих альвеол.
Клиническая значимость
Ряд условий может вызвать шунты справа налево, которые вызывают несоответствие V / Q. На микроскопическом уровне легочные артериовенозные мальформации обеспечивают путь от артериальной к венозной крови в малом круге кровообращения, минуя легочные капилляры, где происходит газообмен. Врожденные пороки сердца могут вызывать шунты справа налево на макроскопическом уровне.В случае дефекта межжелудочковой перегородки правый желудочек может гипертрофироваться до такой степени, что в правом желудочке во время систолы давление выше, чем в левом желудочке, в результате чего кровь течет из правого в левый желудочек в обход малого круга кровообращения. Физиологические шунты справа налево также могут возникать, если перфузия достигает участков легких, которые не вентилируются, что может быть результатом обструкции дыхательных путей, отека легких и пневмонии. Эффект физиологического шунтирования справа налево сводится к минимуму за счет гипоксической вазоконстрикции в малом круге кровообращения, которая перенаправляет кровоток в лучше вентилируемые области легких для более эффективного обмена.
Астму часто называют «ложным шунтом», потому что бронхоспазм снижает вентиляцию, что приводит к низкому соотношению V / Q, как это происходит в мертвом пространстве альвеол. В случае астмы показана кислородная терапия, потому что некоторая вентиляция бронхоконстриктированных альвеол все еще происходит, а кислородная терапия увеличивает PAO2 альвеол с затрудненным воздушным потоком. Лечение бронходилататорами, такими как агонист бета-2, более полезно для пациентов с астмой, чем кислородная терапия, из-за уменьшения бронхоспазма.
Несоответствие
V / Q может возникнуть в случае тромбоэмболии легочной артерии (PE). Эмболы могут ограничивать кровоток в малом круге кровообращения, в результате альвеолы вентилируются, но не перфузируются; это приводит к увеличению отношения V / Q и снижению газообмена. Нарушение газообмена может вызвать гипоксемию при ТЭЛА. [5]
Гипоксия на вдохе, возникающая на большой высоте, может вызывать несоответствие V / Q и влиять на газы крови. Пониженное атмосферное давление на высоте вызывает снижение PAO2.Хотя происходит нормальная диффузия (нормальный градиент A-a), артериальное PaO2 снижается и возникает гипоксемия. Кислородная терапия может исправить гипоксемию в этом случае, потому что вдыхаемый воздух увеличивает PAO2 до нормального уровня.
Внутренние диффузионные барьеры между альвеолами и капиллярами могут привести к гипоксемии. Хотя PAO2 в норме, нарушение диффузии приводит к снижению PaO2 и увеличению градиента A-a. Пациенты с проблемами диффузии чаще страдают гипоксемией, чем гиперкапнией, и кислородная терапия улучшает гипоксемию при дефиците диффузии.Дополнительный кислород увеличивает PAO2, что приводит к увеличению градиента кислорода, способствующему диффузии. Даже при кислородной терапии все еще наблюдается повышенный градиент A-a.
На диффузию могут влиять различные условия, которые можно оценить клинически с помощью DLCO. При фиброзе легких утолщение легочной ткани увеличивает толщину альвеолярной стенки, уменьшая DLCO. [3] DLCO также уменьшается при эмфиземе, в этом случае из-за разрушения альвеол, уменьшая площадь газообмена.[3] Уменьшение диффузии при эмфиземе иногда вызывает ограниченный диффузией обмен кислорода во время упражнений, так как учащение пульса сокращает время, которое кровь проводит в альвеолярных капиллярах для газообмена.
Существенной причиной проблем с диффузией является отек легких, поскольку жидкость в легких увеличивает эффективную толщину альвеолярной стенки и уменьшает область газообмена. Отек легких приводит к большей гипоксемии, чем гиперкапния, потому что углекислый газ легче растворяется в жидкости и достигает альвеолярной мембраны для обмена.Отек препятствует попаданию воздуха в легочные капилляры, что приводит к перфузии без вентиляции и мертвому пространству альвеол.
Отек легких имеет несколько причин, большинство из которых влияет на силы Старлинга, увеличивающие фильтрацию в альвеолярных капиллярах. Левосторонняя сердечная недостаточность может повышать давление в левом предсердии, что, в свою очередь, может приводить к увеличению гидростатического давления в капиллярах, вызывая отек легких. Чрезмерное введение жидкостей для внутривенного введения может аналогичным образом увеличить капиллярное гидростатическое давление и вызвать отек.Острый респираторный дистресс-синдром (ОРДС) и сепсис могут вызывать повышенную проницаемость капилляров и вызывать отек легких. Снижение осмотического давления капилляров также может вызвать отек легких, как это происходит при нефротическом синдроме и печеночной недостаточности. Отек легких также может быть результатом затрудненного лимфодренажа отфильтрованной жидкости, как это может происходить с опухолями.
Дополнительное образование / Контрольные вопросы
Список литературы
- 1.
- Вагнер П.Д., Ларавусо, РБ, Уль-Р.Р., Западный Джуби.Непрерывное распределение соотношений вентиляции и перфузии у здоровых субъектов, дышащих воздухом и 100-процентным O2. J Clin Invest. 1974 июл; 54 (1): 54-68. [Бесплатная статья PMC: PMC301524] [PubMed: 4601004]
- 2.
- Petersson J, Glenny RW. Газообмен и вентиляционно-перфузионные отношения в легких. Eur Respir J. Октябрь 2014 г .; 44 (4): 1023-41. [PubMed: 25063240]
- 3.
- Enright Md P. Офисные тесты DLCO помогают пульмонологам принимать важные клинические решения. Respir Investig.2016 сентябрь; 54 (5): 305-11. [PubMed: 27566377]
- 4.
- Wagner PD. Метод множественного удаления инертного газа (MIGET). Intensive Care Med. 2008 июн; 34 (6): 994-1001. [PubMed: 18421437]
- 5.
- Huet Y, Lemaire F, Brun-Buisson C, Knaus WA, Teisseire B, Payen D, Mathieu D. Гипоксемия при острой тромбоэмболии легочной артерии. Грудь. 1985 декабрь; 88 (6): 829-36. [PubMed: 4064770]
Физиология, легочная вентиляция и перфузия — StatPearls
Введение
Одной из основных функций легких является облегчение газообмена между кровеносной системой и внешней средой.Легкие состоят из ветвящихся дыхательных путей, которые заканчиваются респираторными бронхиолами и альвеолами, которые участвуют в газообмене. Большинство бронхиол и крупных дыхательных путей являются частью проводящей зоны легких, которая доставляет газ к участкам газообмена в альвеолах. В легких происходит газообмен между альвеолярным воздухом и кровью легочных капилляров. Для эффективного газообмена альвеолы необходимо вентилировать и перфузировать. Вентиляция (V) относится к потоку воздуха в альвеолы и из них, а перфузия (Q) относится к потоку крови к альвеолярным капиллярам.Отдельные альвеолы имеют разную степень вентиляции и перфузии в разных областях легких. Коллективные изменения вентиляции и перфузии в легких измеряются клинически с использованием отношения вентиляции к перфузии (V / Q). Изменения соотношения V / Q могут влиять на газообмен и способствовать гипоксемии.
Клеточный
Газообмен происходит в респираторной зоне легких, где находятся альвеолы. Дыхательная зона легкого включает респираторные бронхиолы, альвеолярные протоки, альвеолярные мешочки и альвеолы.Прилегающие альвеолы разделяют тонкие альвеолярные перегородки. Соседние альвеолы соединяются небольшими отверстиями, называемыми порами Кона, которые обеспечивают боковой поток воздуха и выравнивание давления между альвеолами. Управление открытием или закрытием альвеол для регулирования вентиляции происходит в общих альвеолярных отверстиях с помощью выступов гладких мышц, называемых альвеолярными бугорками.
Альвеолярная перегородка имеет множество капилляров и тонкие стенки для газообмена. Помимо эндотелиальных клеток капилляров, альвеолярная перегородка содержит пневмоциты I типа, которые очень тонкие и выстилают альвеолы, а также пневмоциты II типа, которые секретируют сурфактант дипальмитоилфосфатидилхолин (DPPT) для снижения поверхностного натяжения альвеол.Альвеолярные макрофаги, также известные как пылевые клетки, активны в защите от патогенов и раздражителей.
Газообмен в альвеолах происходит главным образом за счет диффузии. Двигаясь из альвеол в капиллярную кровь, газы должны проходить через альвеолярный сурфактант, альвеолярный эпителий, базальную мембрану и эндотелий капилляров. Согласно закону диффузии Фика, диффузия газа через альвеолярную мембрану увеличивается с:
Увеличенной площадью поверхности мембраны
Увеличенной разностью альвеолярного давления (PA-Pa)
Увеличенной растворимостью газа
Уменьшение толщины мембраны
Обмен кислорода и углекислого газа ограничен перфузией.Распространение газов достигает равновесия на одной трети пути через границу раздела капилляр / альвеол. Деоксигенированная кровь из легочных артерий имеет PVO2 40 мм рт. Ст., А альвеолярный воздух имеет PAO2 100 мм рт. Между тем, парциальное давление углекислого газа снижается с PVCO2 46 мм рт. Ст. До PaCO2 40 мм рт. Ст. В альвеолярных капиллярах из-за PACO2, равного 40 мм рт.
Вовлеченные системы органов
- Сердечно-сосудистая система
Легочная циркуляция
Альвеолярные капилляры
- Дыхательная система
Альвеолы
Альвеолярные мешки
Альвеолярные протоки
Дыхательные бронхиолы
Механизм 9065 перфузия
Оценка соотношения V / Q вентиляции (Q.Есть региональные различия в соотношении V / Q в легких. Вентиляция у основания легкого на 50% больше, чем у верхушки. Вес жидкости в плевральной полости увеличивает внутриплевральное давление у основания до менее отрицательного значения. В результате альвеолы менее расширены и имеют более высокую податливость у основания, что приводит к более значительному увеличению объема на вдохе для усиления вентиляции. Перфузия также выше у основания легкого из-за силы тяжести, притягивающей кровь к основанию.В целом перфузия увеличивается больше, чем вентиляция у основания легкого, что приводит к более низким отношениям V / Q в основании легкого по сравнению с верхушкой. У здорового человека соотношение V / Q составляет 1 в средней части легкого, с минимальным разбросом соотношений V / Q от 0,3 до 2,1 от основания до вершины [1]. В случаях высокого отношения V / Q PO2 увеличивается, а PCO2 уменьшается, поскольку альвеолярный воздух более соответствует большему объему вдыхаемого воздуха, чем перфузируемая кровь. [2] С другой стороны, низкие отношения V / Q приводят к снижению PO2 и увеличению PCO2.
Сопутствующие испытания
Клинически диффузионная способность легких (DLCO) измеряется с использованием низких концентраций окиси углерода. DLCO можно рассчитать по формуле VCO = DLCO (PACO — PaCO). PaCO приблизительно равен нулю из-за связывания гемоглобина, так что уравнение может измениться на DLCO = VCO / PACO. Для измерения DLCO воздух с низким содержанием CO вдыхается в течение 10 секунд, при этом поток CO в легкие и из легких измеряется для расчета VCO. [3] Измерение PACO позволяет рассчитать DLCO, при этом нормальное значение DLCO составляет 25 мл / мин / мм рт.
DLCO связан с коэффициентом диффузии (D) окиси углерода, площадью альвеол (A) и толщиной альвеол (T) в соответствии с уравнением DLCO = D x A / T. Поскольку D является константой, значение DLCO дает представление об альвеолярной области и толщине, которые влияют на газообмен. Кроме того, диффузию других газов можно рассчитать при различных условиях давления путем корректировки их различных коэффициентов диффузии.
Отношение V / Q в легких можно измерить методом множественного удаления инертного газа (MIGET).Легкое делится на несколько отделений, и вдыхается смесь из 6 газов. [4] V / Q каждого отсека можно рассчитать, используя истечение различных газов и математические модели.
Патофизиология
Системное кровообращение в легкие происходит через бронхиальное кровообращение, которое в конечном итоге стекает в легочную вену. Этот нормальный анатомический шунт слева направо приводит к небольшому падению PaO2 со 100 мм рт. Ст. В конце легочных капилляров до 95 мм рт. Ст. В легочной вене.Градиент A-a обычно измеряет это небольшое падение парциального давления кислорода от альвеол (PAO2) к легочной вене (PaO2) из-за шунтирования, которое может увеличиваться при некоторых патологических состояниях. Шунты справа налево могут дополнительно снижать PaO2, вызывая гипоксемию и проявлять повышенный градиент A-a. Проблемы с диффузией также могут привести к увеличению градиента A-a, поскольку артериальная кровь может не достичь равновесия с альвеолярным воздухом из-за ограниченного диффузией газообмена.
Физиологические условия могут привести к экстремальным отношениям V / Q за пределами нормального диапазона.При шунте справа налево часть легочного кровотока отводится от альвеол, что приводит к вентиляции без перфузии и более высокому соотношению V / Q. Хотя диффузия между капиллярами и альвеолами не нарушена, артериальное РО2 снижается из-за недостаточной вентиляции шунтированной крови, что приводит к увеличению градиента А-а. PCO2 в артериальной крови также увеличивается из-за отсутствия газообмена. Из-за плато на кривой связывания кислорода гемоглобина небольшое изменение содержания кислорода в артериальной крови вызывает значительный сдвиг PO2.В результате шунты справа налево вызывают большую гипоксемию, чем гиперкапнию. Как правило, повышение FiO2 с помощью дополнительной кислородной терапии не улучшает гипоксемию у пациентов с шунтированием справа налево, потому что повышенное содержание кислорода во вдыхаемом воздухе никогда не достигает шунтированной крови для газообмена.
Мертвое пространство альвеол возникает, когда некоторые альвеолы не вентилируются, что приводит к низкому соотношению V / Q. Альвеолярное мертвое пространство увеличивает общее физиологическое мертвое пространство, уменьшая альвеолярную вентиляцию; это приводит к снижению отношения V / Q и снижению PAO2 для функциональных альвеол.Гипоксемия возникает в результате снижения PAO2, которое можно скорректировать кислородной терапией, чтобы увеличить PAO2 функционирующих альвеол.
Клиническая значимость
Ряд условий может вызвать шунты справа налево, которые вызывают несоответствие V / Q. На микроскопическом уровне легочные артериовенозные мальформации обеспечивают путь от артериальной к венозной крови в малом круге кровообращения, минуя легочные капилляры, где происходит газообмен. Врожденные пороки сердца могут вызывать шунты справа налево на макроскопическом уровне.В случае дефекта межжелудочковой перегородки правый желудочек может гипертрофироваться до такой степени, что в правом желудочке во время систолы давление выше, чем в левом желудочке, в результате чего кровь течет из правого в левый желудочек в обход малого круга кровообращения. Физиологические шунты справа налево также могут возникать, если перфузия достигает участков легких, которые не вентилируются, что может быть результатом обструкции дыхательных путей, отека легких и пневмонии. Эффект физиологического шунтирования справа налево сводится к минимуму за счет гипоксической вазоконстрикции в малом круге кровообращения, которая перенаправляет кровоток в лучше вентилируемые области легких для более эффективного обмена.
Астму часто называют «ложным шунтом», потому что бронхоспазм снижает вентиляцию, что приводит к низкому соотношению V / Q, как это происходит в мертвом пространстве альвеол. В случае астмы показана кислородная терапия, потому что некоторая вентиляция бронхоконстриктированных альвеол все еще происходит, а кислородная терапия увеличивает PAO2 альвеол с затрудненным воздушным потоком. Лечение бронходилататорами, такими как агонист бета-2, более полезно для пациентов с астмой, чем кислородная терапия, из-за уменьшения бронхоспазма.
Несоответствие
V / Q может возникнуть в случае тромбоэмболии легочной артерии (PE). Эмболы могут ограничивать кровоток в малом круге кровообращения, в результате альвеолы вентилируются, но не перфузируются; это приводит к увеличению отношения V / Q и снижению газообмена. Нарушение газообмена может вызвать гипоксемию при ТЭЛА. [5]
Гипоксия на вдохе, возникающая на большой высоте, может вызывать несоответствие V / Q и влиять на газы крови. Пониженное атмосферное давление на высоте вызывает снижение PAO2.Хотя происходит нормальная диффузия (нормальный градиент A-a), артериальное PaO2 снижается и возникает гипоксемия. Кислородная терапия может исправить гипоксемию в этом случае, потому что вдыхаемый воздух увеличивает PAO2 до нормального уровня.
Внутренние диффузионные барьеры между альвеолами и капиллярами могут привести к гипоксемии. Хотя PAO2 в норме, нарушение диффузии приводит к снижению PaO2 и увеличению градиента A-a. Пациенты с проблемами диффузии чаще страдают гипоксемией, чем гиперкапнией, и кислородная терапия улучшает гипоксемию при дефиците диффузии.Дополнительный кислород увеличивает PAO2, что приводит к увеличению градиента кислорода, способствующему диффузии. Даже при кислородной терапии все еще наблюдается повышенный градиент A-a.
На диффузию могут влиять различные условия, которые можно оценить клинически с помощью DLCO. При фиброзе легких утолщение легочной ткани увеличивает толщину альвеолярной стенки, уменьшая DLCO. [3] DLCO также уменьшается при эмфиземе, в этом случае из-за разрушения альвеол, уменьшая площадь газообмена.[3] Уменьшение диффузии при эмфиземе иногда вызывает ограниченный диффузией обмен кислорода во время упражнений, так как учащение пульса сокращает время, которое кровь проводит в альвеолярных капиллярах для газообмена.
Существенной причиной проблем с диффузией является отек легких, поскольку жидкость в легких увеличивает эффективную толщину альвеолярной стенки и уменьшает область газообмена. Отек легких приводит к большей гипоксемии, чем гиперкапния, потому что углекислый газ легче растворяется в жидкости и достигает альвеолярной мембраны для обмена.Отек препятствует попаданию воздуха в легочные капилляры, что приводит к перфузии без вентиляции и мертвому пространству альвеол.
Отек легких имеет несколько причин, большинство из которых влияет на силы Старлинга, увеличивающие фильтрацию в альвеолярных капиллярах. Левосторонняя сердечная недостаточность может повышать давление в левом предсердии, что, в свою очередь, может приводить к увеличению гидростатического давления в капиллярах, вызывая отек легких. Чрезмерное введение жидкостей для внутривенного введения может аналогичным образом увеличить капиллярное гидростатическое давление и вызвать отек.Острый респираторный дистресс-синдром (ОРДС) и сепсис могут вызывать повышенную проницаемость капилляров и вызывать отек легких. Снижение осмотического давления капилляров также может вызвать отек легких, как это происходит при нефротическом синдроме и печеночной недостаточности. Отек легких также может быть результатом затрудненного лимфодренажа отфильтрованной жидкости, как это может происходить с опухолями.
Дополнительное образование / Контрольные вопросы
Список литературы
- 1.
- Вагнер П.Д., Ларавусо, РБ, Уль-Р.Р., Западный Джуби.Непрерывное распределение соотношений вентиляции и перфузии у здоровых субъектов, дышащих воздухом и 100-процентным O2. J Clin Invest. 1974 июл; 54 (1): 54-68. [Бесплатная статья PMC: PMC301524] [PubMed: 4601004]
- 2.
- Petersson J, Glenny RW. Газообмен и вентиляционно-перфузионные отношения в легких. Eur Respir J. Октябрь 2014 г .; 44 (4): 1023-41. [PubMed: 25063240]
- 3.
- Enright Md P. Офисные тесты DLCO помогают пульмонологам принимать важные клинические решения. Respir Investig.2016 сентябрь; 54 (5): 305-11. [PubMed: 27566377]
- 4.
- Wagner PD. Метод множественного удаления инертного газа (MIGET). Intensive Care Med. 2008 июн; 34 (6): 994-1001. [PubMed: 18421437]
- 5.
- Huet Y, Lemaire F, Brun-Buisson C, Knaus WA, Teisseire B, Payen D, Mathieu D. Гипоксемия при острой тромбоэмболии легочной артерии. Грудь. 1985 декабрь; 88 (6): 829-36. [PubMed: 4064770]
Физиология, легочная вентиляция и перфузия — StatPearls
Введение
Одной из основных функций легких является облегчение газообмена между кровеносной системой и внешней средой.Легкие состоят из ветвящихся дыхательных путей, которые заканчиваются респираторными бронхиолами и альвеолами, которые участвуют в газообмене. Большинство бронхиол и крупных дыхательных путей являются частью проводящей зоны легких, которая доставляет газ к участкам газообмена в альвеолах. В легких происходит газообмен между альвеолярным воздухом и кровью легочных капилляров. Для эффективного газообмена альвеолы необходимо вентилировать и перфузировать. Вентиляция (V) относится к потоку воздуха в альвеолы и из них, а перфузия (Q) относится к потоку крови к альвеолярным капиллярам.Отдельные альвеолы имеют разную степень вентиляции и перфузии в разных областях легких. Коллективные изменения вентиляции и перфузии в легких измеряются клинически с использованием отношения вентиляции к перфузии (V / Q). Изменения соотношения V / Q могут влиять на газообмен и способствовать гипоксемии.
Клеточный
Газообмен происходит в респираторной зоне легких, где находятся альвеолы. Дыхательная зона легкого включает респираторные бронхиолы, альвеолярные протоки, альвеолярные мешочки и альвеолы.Прилегающие альвеолы разделяют тонкие альвеолярные перегородки. Соседние альвеолы соединяются небольшими отверстиями, называемыми порами Кона, которые обеспечивают боковой поток воздуха и выравнивание давления между альвеолами. Управление открытием или закрытием альвеол для регулирования вентиляции происходит в общих альвеолярных отверстиях с помощью выступов гладких мышц, называемых альвеолярными бугорками.
Альвеолярная перегородка имеет множество капилляров и тонкие стенки для газообмена. Помимо эндотелиальных клеток капилляров, альвеолярная перегородка содержит пневмоциты I типа, которые очень тонкие и выстилают альвеолы, а также пневмоциты II типа, которые секретируют сурфактант дипальмитоилфосфатидилхолин (DPPT) для снижения поверхностного натяжения альвеол.Альвеолярные макрофаги, также известные как пылевые клетки, активны в защите от патогенов и раздражителей.
Газообмен в альвеолах происходит главным образом за счет диффузии. Двигаясь из альвеол в капиллярную кровь, газы должны проходить через альвеолярный сурфактант, альвеолярный эпителий, базальную мембрану и эндотелий капилляров. Согласно закону диффузии Фика, диффузия газа через альвеолярную мембрану увеличивается с:
Увеличенной площадью поверхности мембраны
Увеличенной разностью альвеолярного давления (PA-Pa)
Увеличенной растворимостью газа
Уменьшение толщины мембраны
Обмен кислорода и углекислого газа ограничен перфузией.Распространение газов достигает равновесия на одной трети пути через границу раздела капилляр / альвеол. Деоксигенированная кровь из легочных артерий имеет PVO2 40 мм рт. Ст., А альвеолярный воздух имеет PAO2 100 мм рт. Между тем, парциальное давление углекислого газа снижается с PVCO2 46 мм рт. Ст. До PaCO2 40 мм рт. Ст. В альвеолярных капиллярах из-за PACO2, равного 40 мм рт.
Вовлеченные системы органов
- Сердечно-сосудистая система
Легочная циркуляция
Альвеолярные капилляры
- Дыхательная система
Альвеолы
Альвеолярные мешки
Альвеолярные протоки
Дыхательные бронхиолы
Механизм 9065 перфузия
Оценка соотношения V / Q вентиляции (Q.Есть региональные различия в соотношении V / Q в легких. Вентиляция у основания легкого на 50% больше, чем у верхушки. Вес жидкости в плевральной полости увеличивает внутриплевральное давление у основания до менее отрицательного значения. В результате альвеолы менее расширены и имеют более высокую податливость у основания, что приводит к более значительному увеличению объема на вдохе для усиления вентиляции. Перфузия также выше у основания легкого из-за силы тяжести, притягивающей кровь к основанию.В целом перфузия увеличивается больше, чем вентиляция у основания легкого, что приводит к более низким отношениям V / Q в основании легкого по сравнению с верхушкой. У здорового человека соотношение V / Q составляет 1 в средней части легкого, с минимальным разбросом соотношений V / Q от 0,3 до 2,1 от основания до вершины [1]. В случаях высокого отношения V / Q PO2 увеличивается, а PCO2 уменьшается, поскольку альвеолярный воздух более соответствует большему объему вдыхаемого воздуха, чем перфузируемая кровь. [2] С другой стороны, низкие отношения V / Q приводят к снижению PO2 и увеличению PCO2.
Сопутствующие испытания
Клинически диффузионная способность легких (DLCO) измеряется с использованием низких концентраций окиси углерода. DLCO можно рассчитать по формуле VCO = DLCO (PACO — PaCO). PaCO приблизительно равен нулю из-за связывания гемоглобина, так что уравнение может измениться на DLCO = VCO / PACO. Для измерения DLCO воздух с низким содержанием CO вдыхается в течение 10 секунд, при этом поток CO в легкие и из легких измеряется для расчета VCO. [3] Измерение PACO позволяет рассчитать DLCO, при этом нормальное значение DLCO составляет 25 мл / мин / мм рт.
DLCO связан с коэффициентом диффузии (D) окиси углерода, площадью альвеол (A) и толщиной альвеол (T) в соответствии с уравнением DLCO = D x A / T. Поскольку D является константой, значение DLCO дает представление об альвеолярной области и толщине, которые влияют на газообмен. Кроме того, диффузию других газов можно рассчитать при различных условиях давления путем корректировки их различных коэффициентов диффузии.
Отношение V / Q в легких можно измерить методом множественного удаления инертного газа (MIGET).Легкое делится на несколько отделений, и вдыхается смесь из 6 газов. [4] V / Q каждого отсека можно рассчитать, используя истечение различных газов и математические модели.
Патофизиология
Системное кровообращение в легкие происходит через бронхиальное кровообращение, которое в конечном итоге стекает в легочную вену. Этот нормальный анатомический шунт слева направо приводит к небольшому падению PaO2 со 100 мм рт. Ст. В конце легочных капилляров до 95 мм рт. Ст. В легочной вене.Градиент A-a обычно измеряет это небольшое падение парциального давления кислорода от альвеол (PAO2) к легочной вене (PaO2) из-за шунтирования, которое может увеличиваться при некоторых патологических состояниях. Шунты справа налево могут дополнительно снижать PaO2, вызывая гипоксемию и проявлять повышенный градиент A-a. Проблемы с диффузией также могут привести к увеличению градиента A-a, поскольку артериальная кровь может не достичь равновесия с альвеолярным воздухом из-за ограниченного диффузией газообмена.
Физиологические условия могут привести к экстремальным отношениям V / Q за пределами нормального диапазона.При шунте справа налево часть легочного кровотока отводится от альвеол, что приводит к вентиляции без перфузии и более высокому соотношению V / Q. Хотя диффузия между капиллярами и альвеолами не нарушена, артериальное РО2 снижается из-за недостаточной вентиляции шунтированной крови, что приводит к увеличению градиента А-а. PCO2 в артериальной крови также увеличивается из-за отсутствия газообмена. Из-за плато на кривой связывания кислорода гемоглобина небольшое изменение содержания кислорода в артериальной крови вызывает значительный сдвиг PO2.В результате шунты справа налево вызывают большую гипоксемию, чем гиперкапнию. Как правило, повышение FiO2 с помощью дополнительной кислородной терапии не улучшает гипоксемию у пациентов с шунтированием справа налево, потому что повышенное содержание кислорода во вдыхаемом воздухе никогда не достигает шунтированной крови для газообмена.
Мертвое пространство альвеол возникает, когда некоторые альвеолы не вентилируются, что приводит к низкому соотношению V / Q. Альвеолярное мертвое пространство увеличивает общее физиологическое мертвое пространство, уменьшая альвеолярную вентиляцию; это приводит к снижению отношения V / Q и снижению PAO2 для функциональных альвеол.Гипоксемия возникает в результате снижения PAO2, которое можно скорректировать кислородной терапией, чтобы увеличить PAO2 функционирующих альвеол.
Клиническая значимость
Ряд условий может вызвать шунты справа налево, которые вызывают несоответствие V / Q. На микроскопическом уровне легочные артериовенозные мальформации обеспечивают путь от артериальной к венозной крови в малом круге кровообращения, минуя легочные капилляры, где происходит газообмен. Врожденные пороки сердца могут вызывать шунты справа налево на макроскопическом уровне.В случае дефекта межжелудочковой перегородки правый желудочек может гипертрофироваться до такой степени, что в правом желудочке во время систолы давление выше, чем в левом желудочке, в результате чего кровь течет из правого в левый желудочек в обход малого круга кровообращения. Физиологические шунты справа налево также могут возникать, если перфузия достигает участков легких, которые не вентилируются, что может быть результатом обструкции дыхательных путей, отека легких и пневмонии. Эффект физиологического шунтирования справа налево сводится к минимуму за счет гипоксической вазоконстрикции в малом круге кровообращения, которая перенаправляет кровоток в лучше вентилируемые области легких для более эффективного обмена.
Астму часто называют «ложным шунтом», потому что бронхоспазм снижает вентиляцию, что приводит к низкому соотношению V / Q, как это происходит в мертвом пространстве альвеол. В случае астмы показана кислородная терапия, потому что некоторая вентиляция бронхоконстриктированных альвеол все еще происходит, а кислородная терапия увеличивает PAO2 альвеол с затрудненным воздушным потоком. Лечение бронходилататорами, такими как агонист бета-2, более полезно для пациентов с астмой, чем кислородная терапия, из-за уменьшения бронхоспазма.
Несоответствие
V / Q может возникнуть в случае тромбоэмболии легочной артерии (PE). Эмболы могут ограничивать кровоток в малом круге кровообращения, в результате альвеолы вентилируются, но не перфузируются; это приводит к увеличению отношения V / Q и снижению газообмена. Нарушение газообмена может вызвать гипоксемию при ТЭЛА. [5]
Гипоксия на вдохе, возникающая на большой высоте, может вызывать несоответствие V / Q и влиять на газы крови. Пониженное атмосферное давление на высоте вызывает снижение PAO2.Хотя происходит нормальная диффузия (нормальный градиент A-a), артериальное PaO2 снижается и возникает гипоксемия. Кислородная терапия может исправить гипоксемию в этом случае, потому что вдыхаемый воздух увеличивает PAO2 до нормального уровня.
Внутренние диффузионные барьеры между альвеолами и капиллярами могут привести к гипоксемии. Хотя PAO2 в норме, нарушение диффузии приводит к снижению PaO2 и увеличению градиента A-a. Пациенты с проблемами диффузии чаще страдают гипоксемией, чем гиперкапнией, и кислородная терапия улучшает гипоксемию при дефиците диффузии.Дополнительный кислород увеличивает PAO2, что приводит к увеличению градиента кислорода, способствующему диффузии. Даже при кислородной терапии все еще наблюдается повышенный градиент A-a.
На диффузию могут влиять различные условия, которые можно оценить клинически с помощью DLCO. При фиброзе легких утолщение легочной ткани увеличивает толщину альвеолярной стенки, уменьшая DLCO. [3] DLCO также уменьшается при эмфиземе, в этом случае из-за разрушения альвеол, уменьшая площадь газообмена.[3] Уменьшение диффузии при эмфиземе иногда вызывает ограниченный диффузией обмен кислорода во время упражнений, так как учащение пульса сокращает время, которое кровь проводит в альвеолярных капиллярах для газообмена.
Существенной причиной проблем с диффузией является отек легких, поскольку жидкость в легких увеличивает эффективную толщину альвеолярной стенки и уменьшает область газообмена. Отек легких приводит к большей гипоксемии, чем гиперкапния, потому что углекислый газ легче растворяется в жидкости и достигает альвеолярной мембраны для обмена.Отек препятствует попаданию воздуха в легочные капилляры, что приводит к перфузии без вентиляции и мертвому пространству альвеол.
Отек легких имеет несколько причин, большинство из которых влияет на силы Старлинга, увеличивающие фильтрацию в альвеолярных капиллярах. Левосторонняя сердечная недостаточность может повышать давление в левом предсердии, что, в свою очередь, может приводить к увеличению гидростатического давления в капиллярах, вызывая отек легких. Чрезмерное введение жидкостей для внутривенного введения может аналогичным образом увеличить капиллярное гидростатическое давление и вызвать отек.Острый респираторный дистресс-синдром (ОРДС) и сепсис могут вызывать повышенную проницаемость капилляров и вызывать отек легких. Снижение осмотического давления капилляров также может вызвать отек легких, как это происходит при нефротическом синдроме и печеночной недостаточности. Отек легких также может быть результатом затрудненного лимфодренажа отфильтрованной жидкости, как это может происходить с опухолями.
Дополнительное образование / Контрольные вопросы
Список литературы
- 1.
- Вагнер П.Д., Ларавусо, РБ, Уль-Р.Р., Западный Джуби.Непрерывное распределение соотношений вентиляции и перфузии у здоровых субъектов, дышащих воздухом и 100-процентным O2. J Clin Invest. 1974 июл; 54 (1): 54-68. [Бесплатная статья PMC: PMC301524] [PubMed: 4601004]
- 2.
- Petersson J, Glenny RW. Газообмен и вентиляционно-перфузионные отношения в легких. Eur Respir J. Октябрь 2014 г .; 44 (4): 1023-41. [PubMed: 25063240]
- 3.
- Enright Md P. Офисные тесты DLCO помогают пульмонологам принимать важные клинические решения. Respir Investig.2016 сентябрь; 54 (5): 305-11. [PubMed: 27566377]
- 4.
- Wagner PD. Метод множественного удаления инертного газа (MIGET). Intensive Care Med. 2008 июн; 34 (6): 994-1001. [PubMed: 18421437]
- 5.
- Huet Y, Lemaire F, Brun-Buisson C, Knaus WA, Teisseire B, Payen D, Mathieu D. Гипоксемия при острой тромбоэмболии легочной артерии. Грудь. 1985 декабрь; 88 (6): 829-36. [PubMed: 4064770]
Вентиляция легких — обзор
Динамическая гиперинфляция собственного легкого
Динамическая гиперинфляция собственного легкого — это проблема, которая возникает у пациентов с эмфизематозной болезнью, перенесших трансплантацию одного легкого, особенно при значительной реперфузионное повреждение трансплантата.Проблема возникает из-за различий в податливости естественного легкого (высокая податливость) и трансплантированного легкого (низкая податливость). При вентиляции с положительным давлением через однопросветную эндотрахеальную трубку происходит преимущественная вентиляция естественного эмфизематозного легкого. Это может привести к чрезмерному растяжению собственного легкого, недостаточной вентиляции трансплантата и сдвигу средостения (рис. 13-2 A ). Умеренная степень динамической гиперинфляции на удивление хорошо переносится.Однако тяжелая динамическая гиперинфляция связана с гипоксемией, гиперкарбией и гемодинамическим коллапсом. Дифференциальный диагноз включает напряженный пневмоторакс в естественном легком и закупорку слизи в трансплантате (таблица 13-5). Неправильная установка дренажа из грудной клетки в этой ситуации может вызвать серьезную утечку воздуха, что потенциально усугубит проблемы с вентиляцией.
Если на рентгенограмме грудной клетки очевидна динамическая гиперинфляция, но состояние пациента стабильно, обычно достаточно простых вмешательств (например, β-агонистов).Они включают в себя отказ от дыхательных стратегий, которые способствуют захвату воздуха внутри естественного легкого (таких как высокая частота, высокое ПДКВ и короткое время выдоха; см. Главу 29) и перевод пациента в режим спонтанного дыхания. Однако тяжелая динамическая гиперинфляция, связанная с нарушением газообмена и гипотонией, требует срочного начала независимой вентиляции легких (см. Рис. 13-2 B ).
Независимая вентиляция легких.
Независимая вентиляция легких требуется до 10% реципиентов трансплантата одного легкого. 35 Техника выполняется посредством установки двухпросветной эндотрахеальной трубки и описана в главе 40. Точная и своевременная установка двухпросветной эндотрахеальной трубки может быть затруднена и должна выполняться специалистом, имеющим опыт их использования. Соответствующие стратегии вентиляции для двух легких совершенно разные, потому что трансплантированное легкое обычно имеет рестриктивную физиологию, тогда как родное легкое имеет обструктивную физиологию. Последствия этого объясняются в главе 29.Предлагаемые начальные настройки вентилятора приведены в Табл. 13-6.
Правильное расположение двухпросветной трубки имеет решающее значение для успеха независимой вентиляции легких, и трубка может легко смещаться при движении пациента. Кроме того, такой режим вентиляции очень неудобен для бодрствующего пациента. По этим причинам пациентам сначала следует дать седативные препараты и парализовать их. Впоследствии можно будет использовать только седативный эффект или даже позволить пациенту проснуться и спонтанно дышать собственным легким, в то время как трансплантат подвергается механической вентиляции.По мере постепенного улучшения эластичности трансплантата, обычно в течение 24–72 часов, можно возобновить нормальную вентиляцию легких. Первоначально это делается с установленной двухпросветной трубкой, поэтому в случае рецидива гиперинфляции можно быстро восстановить независимую вентиляцию легких.
Иногда требуется длительная независимая вентиляция легких. В одном отчете о хороших результатах сообщалось у двух пациентов после 25 и 35 дней независимой вентиляции легких. 36 Одним из вариантов лечения трудноизлечимой гиперинфляции нативного легкого является операция по уменьшению объема нативного легкого.Одновременная трансплантация одного легкого и операция по уменьшению объема легких были предложены как способ избежать послеоперационной динамической гиперинфляции. 35
В чем разница между вентиляцией и дыханием?
Крис Эбрайт
Вас учили с первого дня измерения показателей жизнедеятельности считать дыханий . Однако я здесь, чтобы сказать, что ваш звездный инструктор ЕМТ подвел вас, потому что это неправильно.Та же самая неправильная терминология также используется в многочисленных учебниках, в отчетах о тестах и ежедневно используется медицинскими специалистами. Итак, теперь вы спрашиваете: хорошо, умные штаны, тогда каков правильный термин? Подходящий термин, мои коллеги-профессионалы, — это вентиляций.
Разве эти термины по сути не то же самое? Простой ответ — нет. Более сложный вопрос: а почему бы и нет? В этом выпуске «Назад к основам» обсуждаются эти физиологические процессы и их различия.Так что, пожалуйста, читайте дальше.
Несмотря на то, что вентиляция и дыхание являются независимыми физиологическими процессами, они также взаимозависимы, чтобы обеспечить выживание человеческого тела. (Фото / Getty Images)
Вентиляция
Проще говоря, вентиляция — это дыхание — физическое движение воздуха между внешней средой и легкими.Воздух проходит через рот и носовые ходы, а затем вниз по глотке. Достигнув голосовых связок, воздух попадает в трахею, переходя из верхних дыхательных путей в нижние. Здесь он продолжается дистальнее киля, затем через главные бронхи, различные ветви бронхиол и в конечном итоге достигает альвеол. Это вдох. Движение воздуха по обратному пути от альвеол ко рту и носу — выдох. Вдох с последующим выдохом приравнивается к одной вентиляции.Это то, что вы наблюдаете (подъем и опускание груди) при определении частоты дыхания.
Вентиляция может иметь место только в том случае, если ствол мозга, черепные и связанные с ним периферические нервы, диафрагма, межреберная мускулатура и легкие находятся в рабочем состоянии. Сочетая в себе функции всех этих структур, механизм легочной вентиляции устанавливает два градиента давления газа. Первый, при котором давление в альвеолах ниже атмосферного — это вызывает вдох.Другой, при котором давление в альвеолах выше атмосферного, вызывает выдох. Эти необходимые изменения внутрилегочного давления происходят из-за изменений объема легких.
Итак, как изменяется объем легких? Проще говоря, это комбинация мышечных сокращений, стимулируемых центральной нервной системой, и движения серозной оболочки в грудной клетке, называемой плеврой. Плевра состоит из двух слоев: париетального слоя, выстилающего внутреннюю часть грудной клетки, и висцерального слоя, покрывающего легкие и прилегающие структуры (кровеносные сосуды, бронхи и нервы).Между висцеральным и париетальным слоями находится небольшое заполненное жидкостью пространство, называемое плевральной полостью.
Запуск вентиляции начинается со ствола мозга, где импульсы (потенциалы действия) генерируются в продолговатом мозге, а затем распространяются дистально по спинному мозгу. Импульс проходит индивидуально через третий, четвертый и пятый шейные нервы до уровня чуть выше ключицы. Здесь три шейных нерва сливаются в один большой нерв, называемый диафрагмальным нервом, который прикрепляется дистально к диафрагме.Представьте себе эти два нерва, напоминающие пару подтяжек на передней части груди. Импульс, подаваемый диафрагмальным нервом, вызывает сокращение диафрагмы.
Межреберные мышцы — это группа внутренних мышц грудной стенки, занимающая межреберные промежутки. Они расположены отдельно в трех различных слоях (внешние межреберные мышцы, внутренние межреберные мышцы и самые внутренние межреберные мышцы). Межреберные нервы, которые стимулируют эти мышцы, берут начало от грудных нервов 1–11 спинного мозга.
Вдыхание инициируется при стимуляции куполообразной диафрагмы. По мере того как она сжимается и уплощается, грудная клетка расширяется снизу. Внутренние и самые внутренние межреберные мышцы расслабляются, в то время как внешние межреберные мышцы сокращаются от раздражения грудных нервов. Это вызывает движение ребер вверх и наружу (аналогично движению ручки ведра) и грудины (аналогично движению вверх за ручку водяного насоса).Жидкость в плевральной полости действует как клей, прикрепляя грудную клетку к легким. Следовательно, когда грудная клетка расширяется в вертикальном и латеральном направлении, теменный слой увлекает за собой висцеральный слой, заставляя легкие расширяться. Адекватное расширение легких приводит к снижению давления в альвеолах. Поэтому, когда альвеолярное давление падает ниже атмосферного, воздух устремляется в легкие.
Помните, для вдоха требуется стимул, инициированный центральной нервной системой.Думайте об этом как о включении света. Свет не горит, пока вы не щелкнете выключателем (CNS), высвобождая электричество и стимулируя компоненты лампочки. Пока переключатель включен и есть импульс, свет продолжает гореть. Однако, если вы выключите выключатель, стимул исчезнет, и свет погаснет. Выдох сродни выключению переключателя, так сказать.
Рецепторы растяжения грудной клетки постоянно контролируют расширение грудной клетки.Как только достигается приемлемый предел расширения, они посылают в центральную нервную систему сигнал «выключить тумблер». Все нервы, стимулирующие сокращение диафрагмальных и наружных межреберных мышц, временно перестают проводить. Следовательно, диафрагма и внешние межреберные мышцы расслабляются, уменьшая грудной объем — как выпуск воздуха из воздушного шара. Помогая этому пассивному процессу, стимулируются внутренние и самые внутренние межреберные мышцы. Их сокращение тянет грудную клетку и прикрепленную плевру вниз и внутрь, сжимая легкие и увеличивая давление воздуха в альвеолах.Когда альвеолярное давление превышает атмосферное, воздух выходит из легких.
Вот и все — просто, правда? Взрослые обычно вентилируют воздух от 12 до 20 раз в минуту благодаря вегетативной нервной системе. Нам даже не нужно думать об этом! Тем не менее, что становится проблемой (и почему получает вызов службы экстренной помощи), когда нервная система, грудная мускулатура или легкие становятся больными или недееспособными.Вот неполный список патологий, нарушающих вентиляцию:
- Нервная система: Травма ствола головного мозга / черепно-мозговая травма, травма шейного отдела позвоночника, миастения гравис, БАС (болезнь Лу Герига), синдром Гийена-Барре
- Грудная клетка: тупая травма грудной клетки, перелом ребра / цепной грудной клетки, разрыв диафрагмы / грыжа, проникающая травма грудной клетки / пневмоторакс, гемоторакс, плевральный выпот, сдавление грудной клетки
- Легкие: эмфизема, хронический бронхит, астма, обструкция дыхательных путей инородным телом, муковисцидоз, рак легких / опухоль
Дыхание
Дыхание — это движение газа через мембрану.Газообмен в легких называется внешним дыханием. Очень тонкая мембрана, пересекающая газ, называется дыхательной мембраной, отделяя воздух в альвеолах от крови в легочных капиллярах. Его структура состоит из альвеолярной стенки, капиллярной стенки и соответствующей базальной мембраны. Базальная мембрана — это тонкая волокнистая структура, которая отделяет внутреннюю или внешнюю поверхность тела от подлежащей соединительной ткани. Думайте об этом как о рождественской обертке коробки.
Напомним, что адекватная вентиляция позволяет воздуху достигать альвеол и создавать градиент давления. Альвеолярное давление кислорода обычно составляет от 80 до 100 мм рт. Ст., Тогда как альвеолярное давление вдыхаемого углекислого газа очень низкое (обычно 40 мм рт. Ст.). Обедненная кислородом кровь, транспортируемая из клеток организма обратно в правую часть сердца, перекачивается в легочный ствол и через легочные артерии.В конце концов кровь пробивается через дистальные легочные капилляры, окружающие альвеолы. Кислород в легочном кровотоке обычно имеет давление 40 мм рт. Ст., А углекислый газ — 45 мм рт. Эти различия в давлении обеспечивают диффузию кислорода из альвеолярного воздуха через дыхательную мембрану и на гемоглобин эритроцитов. Углекислый газ диффундирует от гемоглобина, пересекает дыхательную мембрану и попадает в альвеолярное пространство.
Результат внешнего дыхания устанавливает давление кислорода гемоглобина выше 100 мм рт. Ст. И пониженное давление углекислого газа до 40 мм рт.Обмен кислорода и углекислого газа продолжается через дыхательную мембрану до тех пор, пока не установится равновесие каждого газа. Затем богатая кислородом кровь течет из легких по легочным венам обратно в левую часть сердца. Здесь он перекачивается через аорту во все ткани тела.
Кровь течет из большого круга кровообращения вниз по артериям, артериолам и, в конечном итоге, к капиллярам. Капилляры достаточно велики, чтобы вместить по одному эритроциту за раз, и кровоток на этом уровне очень медленный.Это максимизирует время высвобождения кислорода и реабсорбции углекислого газа. Клеткам для правильного функционирования требуется кислород высокой концентрации. Таким образом, между отдельными клетками организма и системными капиллярами должен иметь место еще один мембранный газообмен.
Эта операция происходит с газом, уже находящимся в организме, поэтому это называется внутренним дыханием. Органеллы внутри клетки берут кислород и объединяют его с глюкозой, жиром или белком и производят энергию (АТФ) посредством ряда сложных химических реакций.В результате образуются отходы с высокой концентрацией углекислого газа. Таким образом, когда артериальная кровь течет в капилляры, ожидающая клетка имеет низкое давление кислорода (обычно 40 мм рт. Ст.) И высокое давление углекислого газа (45 мм рт. Ст.).
Кислород, связанный с гемоглобином, поддерживает давление около 100 мм рт. Ст., А углекислый газ — 40 мм рт. Снова устанавливается диффузионный градиент, только на этот раз в направлении, противоположном тому, что происходило в легких.На клеточном уровне обмен кислорода и углекислого газа начинается через клеточную / капиллярную мембрану до тех пор, пока не установится равновесие каждого газа. Кровоток продолжается через венулы, вены, полую вену, сердце и обратно в легкие с давлением кислорода гемоглобина 40 мм рт. Ст. И давлением углекислого газа 45 мм рт. Промыть и повторять каждую минуту, каждый день на всю жизнь.
К сожалению, на внешнее и внутреннее дыхание также могут отрицательно влиять и подавляться различные болезненные процессы.На момент написания этой статьи наиболее заметная респираторная патология вызвана коронавирусом COVID-19. Просмотрите видеоролик на YouTube от доктора Санджая Мукхопадхая из клиники Кливленда (можно найти в списках литературы), чтобы из первых рук узнать, что COVID-19 делает с альвеолярно-капиллярной мембраной.
Кроме того, вот некоторые другие распространенные респираторные патологии:
- Отек легких.Левосторонняя сердечная недостаточность
- Потеря поверхностно-активного вещества. Утопление / аспирация
- Легочная эмболия. Отсутствие капиллярного кровотока
- Внутреннее / внешнее кровотечение. Недостаточный объем крови, возвращающейся к сердцу
- Ушиб легкого. Сбор крови в альвеолах
- Ателектаз. Различные заболевания, увеличивающие размер дыхательной оболочки
Надеюсь, теперь вы понимаете разницу между вентиляцией и дыханием. Несмотря на то, что это независимые физиологические процессы, они также взаимозависимы, чтобы обеспечить выживание человеческого тела.Итак, в следующий раз, когда кто-то злоупотребит одним из этих терминов, поправьте их с улыбкой. Скажи им, что Крис сказал тебе.
Список литературы
- https://www.slideshare.net/cud2018/respiratory-1-pulmonary-ventilation-physiology
- Мухопадхьяй, Санджай. (2020). https://www.youtube.com/watch?v=v2EHsG-C_Rg
- Панавала, Лакна.(2017). Разница между внутренним и внешним дыханием. Получено с: http://pediaa.com/difference-between-internal-and-external-respiration/
- Уччхас, Назиб. (2017). Дыхание и дыхание. Получено с: https://www.slideshare.net/uchchhas/breathing-respiration
Об авторе
Крис Эбрайт (Chris Ebright) — специалист по обучению EMS в компании ProMedica Air and Mobile в Толедо, штат Огайо, руководит всеми аспектами внутреннего непрерывного обучения EMS, а также многочисленными системами EMS на северо-западе Огайо и юго-востоке Мичигана.Он был зарегистрированным в стране фельдшером в течение 25 лет, обеспечивая первичную неотложную помощь, наземный и воздушный транспорт для оказания неотложной помощи. Крис обучил сотни специалистов по оказанию первой помощи, врачей скорой помощи, парамедиков и медсестер за 24 года с помощью своих торговых сессий с классной доской, в том числе уроженцев Каймановых островов и Австралии. Страсть Криса к образованию в настоящее время также отражается в ежемесячных статьях, публикуемых на веб-сайте Limmer Education. За последние 13 лет он был ведущим на многочисленных местных, государственных и национальных конференциях EMS и любит ежегодно путешествовать по Соединенным Штатам, встречаясь с профессионалами EMS из всех слоев общества.Крис самопровозглашает себя наркоманом в спорте, кино и американских горках и имеет степень бакалавра образования в Университете Толедо в Толедо, штат Огайо. С ним можно связаться по электронной почте [email protected] или через его веб-сайт www.christopherebright.
