Вирус папилломы человека (ВПЧ) и рак шейки матки
Что такое ВПЧ?
Вирус папилломы человека (ВПЧ) является самой распространенной вирусной инфекцией половых путей. Большинство сексуально активных женщин и мужчин приобретают инфекцию в какой-то момент своей жизни, а некоторые могут быть повторно инфицированы.
Пиковый период инфицирования как для женщин, так и для мужчин начинается вскоре после того, как они становятся сексуально активными. ВПЧ передается половым путем, но для передачи вируса не обязателен проникающий секс. Телесный генитальный контакт является хорошо установленным путем передачи инфекции.
Многие типы ВПЧ не причиняют проблем. ВПЧ-инфекции обычно проходят сами, без каких-либо вмешательств, через несколько месяцев после инфицирования, и около 90% проходят в течение 2 лет. Небольшая доля инфекций, вызываемых определенными типами ВПЧ, может продолжаться и приводить к развитию рака шейки матки.
На сегодняшний день рак шейки матки является самой распространенной болезнью, связанной с ВПЧ. Почти все случаи рака шейки матки могут быть обусловлены ВПЧ‑инфекций.
Почти все случаи рака шейки матки могут быть обусловлены ВПЧ‑инфекций.
Инфекция, вызываемая некоторыми типами ВПЧ, может также приводить к развитию рака ануса, вульвы, влагалища, пениса и ротоглотки, который можно предотвратить благодаря использованию таких же стратегий первичной профилактики, как и для рака шейки матки.
Типы ВПЧ, не вызывающие рак (особенно типы 6 и 11), могут приводить к развитию остроконечных кондилом и респираторного папилломатоза (болезнь, при которой опухоли вырастают в дыхательных путях, ведущих из носа и рта в легкие). И хотя эти состояния очень редко приводят к смерти, они часто могут приводить к заболеваниям. Остроконечные кондиломы широко распространены, крайне инфекционны и негативно сказываются на сексуальной жизни.
Как ВПЧ-инфекция приводит к развитию рака шейки матки?
Хотя большинство ВПЧ-инфекций и предраковых поражений проходят сами по себе, для всех женщин существует риск того, что ВПЧ-инфекция может стать хронической, а предраковые поражения разовьются в инвазивный рак шейки матки.
У женщин с нормальной иммунной системой рак шейки матки развивается в течение 15-20 лет. У женщин с ослабленной иммунной системой, например с ВИЧ-инфекцией при отсутствии лечения, на его развитие может потребоваться лишь 5-10 лет.
Факторы риска персистенции ВПЧ и развития рака шейки матки
- тип ВПЧ – его канцерогенность, или способность вызывать рак;
- иммунный статус – люди с ослабленной иммунной системой, такие как ВИЧ-инфицированные люди, с большей вероятностью имеют стойкие ВПЧ-инфекции, которые быстрее развиваются в предрак и рак;
- коинфекция другими возбудителями, передаваемыми половым путем, такими как возбудители простого герпеса, хламидиоза и гонореи;
- количество родов (число рожденных детей) и ранние первые роды;
- употребление табака.
Глобальное бремя рака шейки матки
Рак шейки матки является четвертым наиболее распространенным видом рака среди женщин в глобальных масштабах – по оценкам, в 2018 г. произошло 570 000 новых случаев заболевания, и на этот вид рака пришлось 7,5% всех случаев смерти женщин от рака. По оценкам, более 85% из более чем 311 000 ежегодных случаев смерти от рака шейки матки происходят в странах с низким и средним уровнем дохода. Вероятность заболевания раком шейки матки у женщин с ВИЧ-инфекцией в шесть раз выше, чем у женщин, не инфицированных ВИЧ, и, по оценкам, 5% всех случаев заболевания раком шейки матки связаны с ВИЧ (2).
произошло 570 000 новых случаев заболевания, и на этот вид рака пришлось 7,5% всех случаев смерти женщин от рака. По оценкам, более 85% из более чем 311 000 ежегодных случаев смерти от рака шейки матки происходят в странах с низким и средним уровнем дохода. Вероятность заболевания раком шейки матки у женщин с ВИЧ-инфекцией в шесть раз выше, чем у женщин, не инфицированных ВИЧ, и, по оценкам, 5% всех случаев заболевания раком шейки матки связаны с ВИЧ (2).
В странах с высоким уровнем дохода имеются программы, которые предоставляют девочкам возможности для вакцинации против ВПЧ, а женщинам – для регулярного скрининга. Скрининг позволяет выявлять предраковые поражения на стадиях, когда их можно легко лечить.
В странах с низким и средним уровнем дохода доступ к таким профилактическим мерам ограничен, и рак шейки матки часто выявляется лишь на поздних стадиях, когда развиваются симптомы. Кроме того, доступ к лечению болезни на таких поздних стадиях (например, хирургическая операция, лучевая терапия и химиотерапия) может быть очень ограниченным, что приводит к высоким уровням смертности от рака шейки матки в этих странах.
Высокую глобальную смертность от рака шейки матки (стандартизированный по возрасту показатель: 6,9/100 000 в 2018 г.) можно снизить с помощью эффективных мероприятий.
Борьба с раком шейки матки: комплексный подход
В Глобальной стратегии по ускорению элиминации рака шейки матки как проблемы общественного здравоохранения, принятой ВАЗ в 2020 г., рекомендуется применять комплексный подход к профилактике рака шейки матки и борьбе с ним. Рекомендуемый комплекс мер включает мероприятия, охватывающие весь жизненный цикл.
| Первичная профилактика | Вторичная профилактика | Третичная профилактика |
|---|---|---|
Девочки 9-14 лет
| Женщины 30 лет или старше | Все женщины по мере необходимости |
Девочки и мальчики в соответствующих случаях
|
| Лечение инвазивного рака в любом возрасте
|
Борьба должна быть многодисциплинарной и включать компоненты просвещения на уровне общин, социальной мобилизации, вакцинации, скрининга, лечения и паллиативной помощи.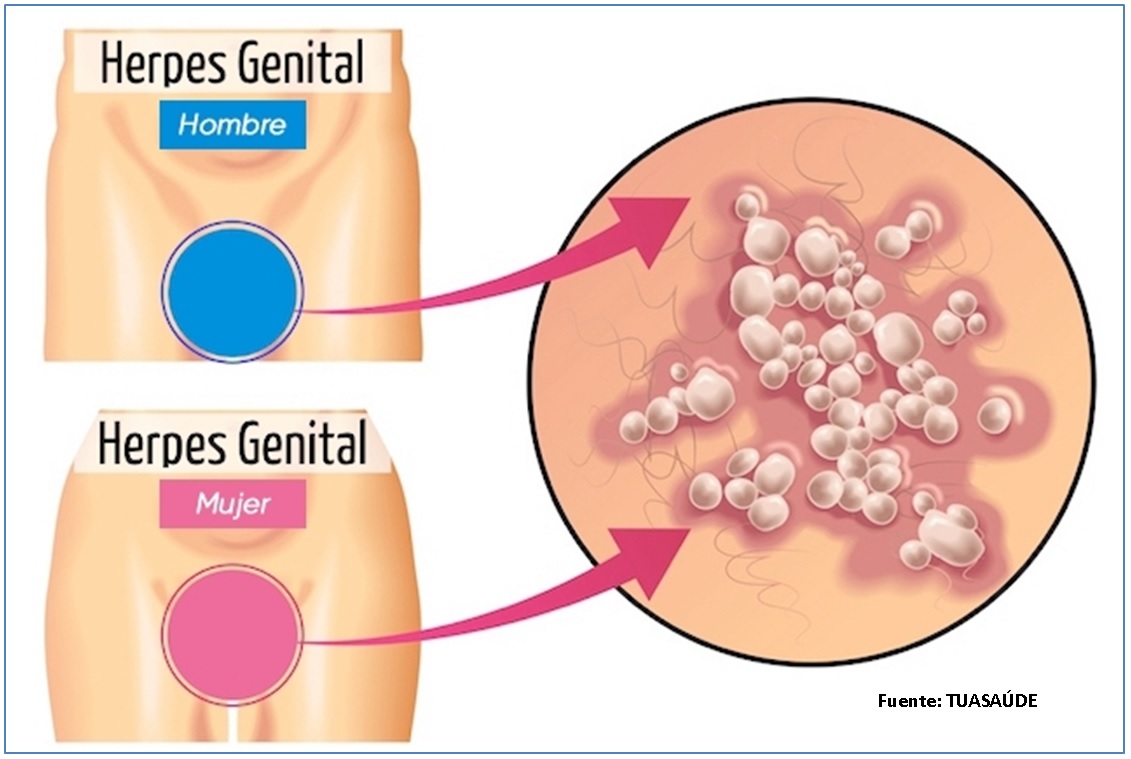
Первичная профилактика начинается с вакцинации девочек против ВПЧ в возрасте 9‑14 лет, то есть до того, как они становятся сексуально активными.
Женщины, ведущие активную половую жизнь, должны проходить скрининг для выявления аномальных цервикальных клеток и предраковых поражений начиная с 30‑летнего возраста. Скрининг сексуально активных женщин с ВИЧ-инфекцией следует начинать в более раннем возрасте, сразу после получения положительного результата теста на ВИЧ.
Для лечения предраковых поражений рекомендуется удаление аномальных клеток или поражений, которое проводится амбулаторно (аномальную ткань шейки матки можно разрушить с помощью криотерапии или термоабляции).
При наличии признаков рака шейки матки варианты лечения инвазивного рака включают хирургическую операцию, лучевую терапию и химиотерапию, и пациентов необходимо направлять на правильный уровень обслуживания.
Вакцинация против ВПЧ
В настоящее время имеются 3 преквалифицированные вакцины, защищающие от ВПЧ
16 и 18, которые, как известно, вызывают как минимум 70% раковых заболеваний шейки матки. Третья вакцина защищает еще от пяти канцерогенных типов ВПЧ, которые вызывают еще 20% раковых заболеваний шейки матки. Учитывая, что вакцины, которые защищают только от ВПЧ 16 и 18, имеют также некоторую перекрестную защиту от этих менее распространенных типов ВПЧ, вызывающих рак шейки матки, ВОЗ считает, что эти три вакцины в равной мере защищают от рака шейки матки. Две из этих вакцин защищают также от ВПЧ 6 и 11 типов, которые приводят к развитию аногенитальных кондилом.
Третья вакцина защищает еще от пяти канцерогенных типов ВПЧ, которые вызывают еще 20% раковых заболеваний шейки матки. Учитывая, что вакцины, которые защищают только от ВПЧ 16 и 18, имеют также некоторую перекрестную защиту от этих менее распространенных типов ВПЧ, вызывающих рак шейки матки, ВОЗ считает, что эти три вакцины в равной мере защищают от рака шейки матки. Две из этих вакцин защищают также от ВПЧ 6 и 11 типов, которые приводят к развитию аногенитальных кондилом.
Результаты клинических испытаний и пост-маркетингового наблюдения свидетельствуют о том, что вакцины против ВПЧ в высокой степени безопасны и эффективны в профилактике ВПЧ-инфекций, серьезных предраковых поражений и инвазивного рака (3).
Вакцины против ВПЧ наиболее эффективны, если вакцинация проводится до воздействия ВПЧ. Поэтому ВОЗ рекомендует проводить вакцинацию девочек в возрасте от 9 до 14 лет, когда большинство из них еще не начинают половую жизнь. Вакцины не могут лечить ВПЧ-инфекции или связанные с ВПЧ заболевания, такие как рак.
В некоторых странах введена вакцинация мальчиков с учетом того, что вакцинация позволяет предотвращать развитие генитального рака как у мужчин, так и у женщин, а две имеющиеся вакцины позволяют также предотвращать развитие генитальных кондилом у мужчин и женщин.
ВОЗ рекомендует проводить вакцинацию девочек в возрасте 9-14 лет, поскольку это является самой эффективной с точки зрения затрат мерой общественного здравоохранения против рака шейки матки.
Вакцинация против ВПЧ не заменяет скрининг на рак шейки матки. В странах, где вакцинация против ВПЧ введена в действие, программы скрининга все еще могут нуждаться в разработке или усилении.
Скрининг на предраковые поражения и их лечение
Скрининг на рак шейки матки включает тестирование на предрак и рак, при этом проводится все больше тестов на ВПЧ-инфекцию. Тестирование проводится среди женщин, не имеющих симптомов и чувствующих себя совершенно здоровыми. Если скрининг выявляет ВПЧ-инфекцию или предраковые поражения, их можно легко лечить и тем самым предотвратить развитие рака. Скрининг может также выявить рак на ранней стадии с высокой вероятностью излечения.
Скрининг может также выявить рак на ранней стадии с высокой вероятностью излечения.
С учетом того что предраковые поражения развиваются на протяжении многих лет, каждой женщине начиная с 30 лет, а затем регулярно (в зависимости от используемого теста) рекомендуется проходить скрининг. Для сексуально активных женщин с ВИЧ‑инфекцией скрининг необходимо проводить как можно раньше, как только они узнают о своем ВИЧ-статусе.
Скрининг должен быть увязан с лечением и ведением пациентов с положительными результатами скрининга. Скрининг без надлежащего ведения пациентов не соответствует требованиям этики.
В настоящее время ВОЗ рекомендует 3 разных типа скрининга:
- ДНК-тестирование на типы ВПЧ высокого риска
- визуальная проверка с использованием уксусной кислоты
- обычный тест Папаниколау (Pap) и жидкостная цитология
Для лечения предраковых поражений ВОЗ рекомендует использовать криотерапию или термоабляцию, а также процедуру электрохирургического петлевого иссечения при ее наличии. В случае поражений на поздних стадиях женщин следует направлять для дальнейших исследований и надлежащего лечения.
В случае поражений на поздних стадиях женщин следует направлять для дальнейших исследований и надлежащего лечения.
Лечение инвазивного рака шейки матки
Женщин с симптомами, позволяющими предполагать рак шейки матки, необходимо направлять в соответствующие медицинские учреждения для дальнейшего обследования, диагностики и лечения.
Симптомы ранней стадии рака шейки матки могут включать:
- нерегулярные кровянистые выделения или небольшие кровотечения в период между менструациями у женщин репродуктивного возраста;
- кровянистые выделения или кровотечения в постклимактерический период;
- кровотечения после полового акта; и
- обильные влагалищные выделения, иногда с неприятным запахом.
По мере развития рака шейки матки могут появляться более серьезные симптомы, включая:
- постоянные боли в области спины, ноги и/или таза;
- потеря веса, усталость, потеря аппетита;
- выделения с неприятным запахом и неприятные ощущения во влагалище; и
- отек ноги или обеих нижних конечностей.

На более поздних стадиях могут возникать другие тяжелые симптомы в зависимости от того, на какие органы распространился рак.
Диагноз рака шейки матки должен ставиться на основе результатов гистопатологического исследования. Определение стадии проводится на основе размера опухоли и распространения болезни в пределах таза и на удаленные органы. Лечение зависит от стадии болезни и включает хирургическую операцию, лучевую терапию и химиотерапию. Паллиативная помощь также является важным элементом ведения онкологических пациентов, позволяющим облегчать чрезмерную боль и страдания.
Деятельность ВОЗ
Всемирная ассамблея здравоохранения приняла глобальную стратегию по ускорению элиминации рака шейки матки как проблемы общественного здравоохранения и установленные в ней цели и задачи на период 2020-2030 гг. (WHA73.2) (4). В рамках глобальной стратегии поставлены задачи для ускорения элиминации рака шейки матки:
- пороговое значение для элиминации в качестве проблемы общественного здравоохранения установлено на уровне 4 на 100 000 женщин в год;
- для того чтобы страны встали на путь элиминации рака шейки матки к 2030 г.
 должны быть достигнуты приведенные ниже целевые показатели 90-70-90;
должны быть достигнуты приведенные ниже целевые показатели 90-70-90; - 90% девочек к 15 годам должны быть в полной мере вакцинированы против ВПЧ;
- 70% женщин должны пройти скрининг на основе высокоэффективного теста в возрасте 35 лет и затем в возрасте 45 лет;
- 90% женщин с выявленной болезнью шейки матки должны получать лечение (обеспечить лечение для 90% женщин с предраком; обеспечить ведение 90% женщин с инвазивным раком).
ВОЗ разработала руководство и инструментарий по профилактике рака шейки матки и борьбе с ним путем вакцинации, скрининга и лечения инвазивного рака, которые размещены в хранилище знаний. ВОЗ сотрудничает со странами и партнерами в разработке и осуществлении всеобъемлющих программ в соответствии с глобальной стратегией.
Справочная литература
(1) Ferlay J, Ervik M, Lam F, Colombet M, Mery L, Piñeros M, Znaor A, Soerjomataram I, Bray F (2018). Global Cancer Observatory: Cancer Today. Lyon, France: International Agency for Research on Cancer. Available from: https://gco.iarc.fr/today
Global Cancer Observatory: Cancer Today. Lyon, France: International Agency for Research on Cancer. Available from: https://gco.iarc.fr/today
(2) Stelzle D, Tanaka LF, Lee KK, et al. Estimates of the global burden of cervical cancer associated with HIV. Lancet Glob Health 2020; published online Nov 16. DOI:S2214-109X(20)30459-9 https://www.thelancet.com/journals/langlo/article/PIIS2214-109X(20)30459-9/fulltext
(3) Lei et al (2020) HPV Vaccination and the Risk of Invasive Cervical Cancer. N Engl J Med 2020;383:1340-8. DOI: 10.1056/NEJMoa1917338
(4) World Health Organization. Global strategy to accelerate the elimination of cervical cancer as a public health problem https://www.who.int/publications/i/item/9789240014107
Лечение вирусных инфекций в ЕМС
Рассказывает дерматовенеролог, врач высшей категрии Артур Иванов
Основным путем заражения урогенитальными формами вируса папилломы человека (ВПЧ) и вируса герпеса является половой контакт, включая орально-генитальныую и анальную формы. Возможно заражение новорожденных при родах, что является причиной возникновения ларингеального папилломатоза (образование папиллом в гортани) у детей и аногенитальных бородавок у младенцев; герпетического стоматита и дерматита при заражении вирусом простого герпеса.
Возможно заражение новорожденных при родах, что является причиной возникновения ларингеального папилломатоза (образование папиллом в гортани) у детей и аногенитальных бородавок у младенцев; герпетического стоматита и дерматита при заражении вирусом простого герпеса.
К основным факторам риска инфицирования относят: раннее начало половой жизни, частую смену половых партнеров, игнорирование использования барьерной контрацепции (презерватив), наличие других инфекций, передаваемых половым путем (хламидиоз, гонорея, трихомониаз, кандидоз, и др.), внутренние факторы (авитаминоз, снижение иммунитета, в том числе на фоне беременности, стрессы).
Основными клиническими проявлениями папилломавирусной инфекции (ВПЧ) гениталий являются остроконечные кондиломы и кондилломатоз (одиночные или множественные образования, их обширное распространение и слияние). Это доброкачественные высыпания, которые локализуются в основном в местах перехода малых половых губ, влагалища, шейки матки, устье уретры, область ануса, кожных покровов и на слизистых.
В случае длительной активности ВПЧ в толще кожи или слизистых оболочек, а также при наличии отдельных разновидностей вирусов высокого онкориска, возможно формирование предраковых и раковых изменений, так называемых дисплазий разной степени тяжести или карцином. Наиболее часто ВПЧ провоцирует развитие рака шейки матки, рака шейки мочевого пузыря, прямой кишки, полового члена, рак ротоглотки.
На первом этапе необходимо провести точную диагностику папилломавирусной инфекции (ВПЧ), которая должна включать определение типа вируса и группу онкологического риска, цитологическое и гистологическое исследования, кольпоскопию.
Вторым шагом является полноценное лечение ВПЧ. Это различные методы удаления высыпаний (криодеструкция, электро-, лазеро-, радиоволновая деструкция, в некоторых случаях и хирургическое иссечение).
Третьим шагом является своевременная профилактика возникновения злокачественных образований, вызванных ВПЧ — вакцинация и иммунотерапия.
Согласно рекомендациям СDС (Центра по Контролю за Заболеваниями, США) применение вакцины рекомендовано даже при отсутствии вирусоносительства.
В клинике Дерматовенерологии и Аллергологии-Иммунологии ЕМС успешно применяется вакцинопрофилактика с целью предотвращения заражения типами вируса папилломы человека высокого онкориска (6,11,16,18), при помощи вакцины «Гардасил» (Gardasil) производства Merck&Co., Германия.
Кроме того, врачи-венерологи ЕМС проводят вакцинацию пациентов, которые уже являются носителями ВПЧ.
Исследования, проведенные нашими зарубежными коллегами, подтверждают высокую эффективность вакцинации, способствующей более быстрому выведению вируса из организма и обеспечивающую значительное снижение риска возникновения рецидивов клинических проявлений папилломавирусной инфекции. Это позволяет многократно усилить воздействие антивирусной терапии.
Второй по частоте появления среди вирусных инфекций — вирус простого герпеса. Возбудителем является вирус простого герпеса (ВПГ). Причем это может быть, как ВПГ-2 (второго типа), так и ВПГ-1 (первого типа), которые поражают кожу и слизистую оболочку губ, глаз, носа и др. Основные клинические проявления герпетической инфекции гениталий — ограниченные «пузырьковые» высыпания. Причем первый контакт с вирусом простого герпеса может проявиться появлением обильной пузырьковой сыпи, нарушением общего состояния, повышением температуры тела, увеличением лимфатических узлов. В случаях рецидивирования герпетической инфекции высыпания характеризуются сгруппированными пузырями на фоне обширного отека. Главными симптомами, беспокоящими пациентов, являются жжение или выраженный зуд, значительно снижающие качество жизни.
Возбудителем является вирус простого герпеса (ВПГ). Причем это может быть, как ВПГ-2 (второго типа), так и ВПГ-1 (первого типа), которые поражают кожу и слизистую оболочку губ, глаз, носа и др. Основные клинические проявления герпетической инфекции гениталий — ограниченные «пузырьковые» высыпания. Причем первый контакт с вирусом простого герпеса может проявиться появлением обильной пузырьковой сыпи, нарушением общего состояния, повышением температуры тела, увеличением лимфатических узлов. В случаях рецидивирования герпетической инфекции высыпания характеризуются сгруппированными пузырями на фоне обширного отека. Главными симптомами, беспокоящими пациентов, являются жжение или выраженный зуд, значительно снижающие качество жизни.
Заражение вирусом простого герпеса происходит от больного человека с клиническими проявлениями активности инфекции.
Для диагностики герпетической инфекции используют молекулярно-генетические методы (ПЦР), серологические методы (определение антител в крови пациента к 1 или 2 типу вируса простого герпеса).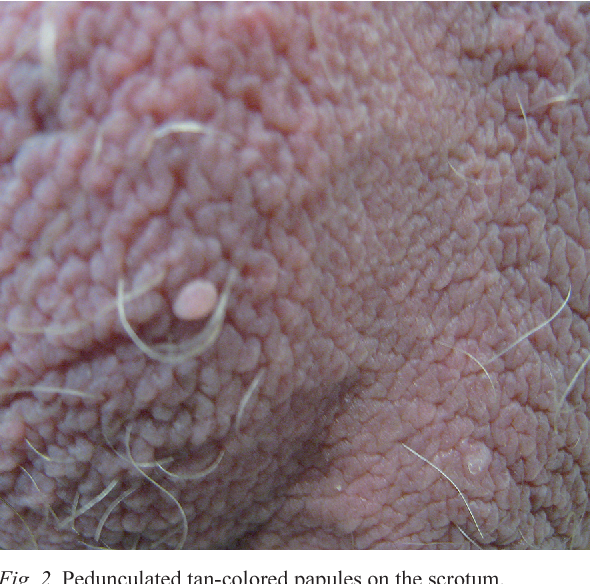
В ЕМС существует возможность быстрого и полноценного обследования пациентов с герпетической инфекцией, определением титров антител к конкретному типу вируса и противовирусного иммунитета у каждого конкретного пациента. Это позволяет подобрать необходимое лечение, которое обеспечит значительное снижение числа рецидивов.
Лечение часто рецидивирующего генитального герпеса — сложная задача. Согласно европейским протоколам лечения, пациенту рекомендован длительный прием противовирусных препаратов. Длительность терапии подбирается индивидуально и может занимать большой промежуток времени.
В ЕМС практикуется индивидуальный подход к каждому пациенту, что позволяет подобрать полноценное лечение и минимизировать проявления побочных эффектов терапии. В случае доказанного факта снижения иммунитета используется иммуномодуляторы (препараты, корректирующие уровень иммунной системы). Наиболее эффективны в данном случае интерфероны и их производные.
В ряде случаев, при наличии противопоказаний к длительному приему противовирусных препаратов, используется терапия герпетической вакциной, что обычно не приводит к элиминации вируса простого герпеса, но позволяет значительно уменьшить количество рецидивов заболевания, вплоть до полного их исчезновения.
Активная на протяжении длительного времени герпетическая инфекция гениталий, особенно у мужчин, может приводить к бесплодию и формированию синдрома хронической тазовой боли.
Бережно относитесь к своему здоровью.
консультируем покупателя — журнал «Катрен Стиль»
Первый стол регулярно отпускает местные противовирусные и иммуномодулирующие препараты, показанные для лечения герпетической и/или папилломавирусной инфекции (ВПЧ). Обе инфекции принадлежат к числу самых распространенных в мире патологий, передающихся половым путем. Как качественно и деликатно консультировать клиентов с этими болезнями, какие советовать противовирусные лекарственные средства при ВПЧ, какие от герпеса и на что обращать внимание — читайте в нашей статье.
ВПГ и ВПЧ: сходства и отличия
Прежде всего, важно понимать, что вирус простого герпеса (ВПГ) и вирус папилломы человека (ВПЧ), провоцирующие герпетическую и папилломавирусную инфекции соответственно, кардинально отличаются друг от друга.
«Галавит» при герпесвирусной инфекции способствует:
- Выраженной элиминации вирусов из организма
- Повышению эффективности противовирусной терапии
- Сокращению периода высыпаний и ускорению процессов регенерации
- Увеличению продолжительности ремиссии
У взрослых и подростков старше 12 лет в комплексной терапии:
Суппозитории — 5 дней по 1 суппозиторию, затем по одному через день. Курс — 2 упаковки суппозиториев.
Таблетки подъязычные — 10 дней по 1 таблетке 4 раза в день. Затем продолжить прием через сутки в течение 10 дней по 4 таблетки в день.
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. НЕОБХОДИМО ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
ВПГ
Генитальный герпес ассоциирован с заражением ВПГ 1‑го или 2‑го типа. По статистике, заболеванием страдают около 12 % популяции [1]. Однажды проникнув в организм, вирус «поселяется» в нем навсегда — на сегодняшний день не существует метода лечения от вируса герпеса, которое позволило бы окончательно избавиться от возбудителя. Симптомы генитального герпеса, которые возникают периодически, во время рецидивов, значительно снижают качество жизни. Интересно, что частота новых эпизодов заболевания зависит от типа вируса: при инфицировании ВПГ-1 фиксируют примерно 1 рецидив в год, в то время как при заражении ВПГ-2 их число может достигать 6 и более [2].
Однажды проникнув в организм, вирус «поселяется» в нем навсегда — на сегодняшний день не существует метода лечения от вируса герпеса, которое позволило бы окончательно избавиться от возбудителя. Симптомы генитального герпеса, которые возникают периодически, во время рецидивов, значительно снижают качество жизни. Интересно, что частота новых эпизодов заболевания зависит от типа вируса: при инфицировании ВПГ-1 фиксируют примерно 1 рецидив в год, в то время как при заражении ВПГ-2 их число может достигать 6 и более [2].
Несмотря на то, что специфического лечения ВПГ не существует, ряд препаратов может облегчить состояние при обострениях. Согласно отечественным и западным рекомендациям, с этой целью применяют пероральные противовирусные средства от герпеса на основе ацикловира и валацикловира. Однако в России также рекомендована местная терапия, не включенная в западные стандарты. За границей такие методы в рекомендациях отсутствуют ввиду их меньшей активности по сравнению с таблетками [3].
ВПЧ
Несколько по‑другому обстоит ситуация с папилломавирусной инфекцией (ВПЧ). Она считается самым распространенным в мире заболеванием, передаваемым половым путем [4]. В какой‑то момент жизни ВПЧ заражается большинство взрослых людей, однако в 90 % случаев в течение двух лет после заражения происходит естественная элиминация вируса. В противном случае инфицированный становится пожизненным носителем.
К сожалению, лекарства от вируса папилломы человека не существует, так же как и в случае с вирусом простого герпеса. Однако первый, в отличие от второго, может быть смертельно опасен: ВПЧ 16‑го и 18‑го типов ассоциированы со злокачественными новообразованиями — в частности, с раком шейки матки и некоторыми другими опухолями. Единственное эффективное на сегодня медикаментозное лечение папилломавирусной инфекции заключается в эрадикации кондилом, которые являются проявлениями клинической и субклинической форм инфекции. С этой целью при лечении вируса папилломы человека применяют ряд местных противовирусных препаратов, доказавших активность в исследованиях. В то же время в отечественной практике врачи назначают и ЛС, имеющие сомнительную доказательную базу. Рассмотрим их преимущества и недостатки более детально.
Локальные иммуномодуляторы при ВПЧ и ВПГ
К числу «универсальных» средств, которые могут назначаться при различных вирусных инфекциях — от банальных респираторных до герпетической и папилломавирусной, — относятся интерфероны. В частности — препараты интерферона альфа-2b человеческого рекомбинантного.
Интерферон альфа-2b имеет противовирусные, иммуномодулирующие и антипролиферативные свойства. Он подавляет репликацию РНК- и ДНК-содержащих вирусов, усиливает активность макрофагов, увеличивает цитотоксичность лимфоцитов к клеткам-мишеням. Применение содержащих интерферон альфа-2b средств сопровождается повышением уровня иммуноглобулинов типа А, нормализацией IgE [5]. Однако эти терапевтические эффекты в полной мере проявляются при системном введении препарата, когда достигается его высокая концентрация в крови. При этом следует заметить, что могут развиваться достаточно мощные побочные эффекты, в том числе лихорадка, потеря аппетита, головные, мышечные, суставные боли и множество других неблагоприятных реакций.
Из-за специфического профиля безопасности инъекционные препараты интерферона назначаются только в очень серьезных случаях, когда риск побочных эффектов оправдан — например, при лечении гепатитов, ряда онкологических заболеваний и пр. ВПГ и ВПЧ-инфекции к таким ситуациям не относятся и не являются показаниями для системного назначения интерферона. В то же время в РФ зарегистрирован весьма внушительный перечень местных форм интерферона альфа-2b, в том числе и мазей/кремов для обработки слизистых оболочек при генитальном герпесе.
Теоретически локальные препараты интерферона должны обладать всеми преимуществами инъекционных и не иметь их побочных эффектов, поскольку местные формы или очень незначительно всасываются в системный кровоток, или вовсе не проникают в кровь. Однако, на сегодня нет достаточно надежных доказательств эффективности интерферонов при местном применении. Тем не менее, в отечественной практике их довольно часто назначают в составе комплексного лечения рецидивов генитальной герпетической инфекции.
Наряду с местными формами, содержащими только интерферон альфа-2b, в РФ зарегистрировано и несколько комбинированных препаратов:
- Интерферон альфа-2b+ацикловир+лидокаин, мазь. Показания — ВПГ.
-
Интерферон альфа-2b+таурин+бензокаин, суппозитории вагинальные и ректальные, рецептурные. Показания — ВПГ, ВПЧ. Таурин, по данным инструкции, выполняет в комбинации роль репаранта, антиоксидантного и противовоспалительного компонента.
+ Высокий профиль безопасности.
! Целесообразность применения местных форм ацикловира при генитальном герпесе подвергается серьезным сомнениям ввиду недостаточной активности, что подтверждено в западных рекомендациях [3].Препараты интерферона альфа-2b, как моно-, так и комбинированные, отпускаются как по рецепту, так и без — в зависимости от указания на правила отпуска в инструкции конкретного препарата. Важно обратить внимание посетителя на то, что препараты от ВПЧ первой линии лечения — пероральные формы ацикловира и валацикловира — должен выписать врач, поэтому нужно посоветовать незамедлительно обратиться за консультацией к доктору.
Синтетические противовирусные местные препараты
Эту группу ЛС можно условно разделить на средства, применяемые при генитальной герпетической инфекции, и противовирусные препараты, назначаемые для лечения папиллом и кондилом, связанных с папилломавирусной инфекцией.
Местные препараты при генитальном герпесе
Несколько ЛС, зарегистрированных в РФ, применяются для лечения и профилактики рецидивов генитального герпеса.
Тромантадин
Противовирусный препарат от герпеса, производное адамантана (подобно известным противовирусным римантадину и амантадину). Ингибирует прикрепление вируса к поверхности клеточной мембраны, препятствуя проникновению возбудителя внутрь клетки. Предотвращает слияние клеток и затрудняет распространение вируса за счет изменения синтеза гликопротеинов [5]. Выпускается в форме геля для наружного применения, который можно наносить на слизистые оболочки при обострении ВПГ-инфекции [5].
Отпуск: без рецепта.
! Есть данные о развитии контактной аллергической реакции при использовании препарата [7].
Аминодигидрофталазиндион натрия
Иммуномодулятор, способный регулировать активность клеток врожденного и приобретенного иммунитета, в том числе макрофаги, нейтрофилы и натуральные киллеры. При этом этот противовирусный препарат против герпеса повышает устойчивость организма к бактериальным, вирусным и грибковым инфекциям, сокращая их частоту, выраженность и длительность (5). Кроме того, препарат нормализует образование антител и регулирует выработку интерферонов, а также блокирует избыточный синтез провоспалительных цитокинов и снижает уровень оксидантного стресса (5).
Отпуск: Без рецепта
+ Высокий профиль безопасности (5).
Азоксимера бромид
Российский препарат, предположительно, проявляющий иммуностимулирующий эффект. По данным инструкции [5], напрямую влияет на фагоциты и естественные киллеры, стимулирует образование антител и синтез интерферона, проявляет антиоксидантные и детоксикационные свойства. В отечественной практике применяется при широком спектре заболеваний — от гриппа до злокачественных новообразований.
Вагинальные суппозитории азоксимера бромида применяются для профилактики рецидивов генитального герпеса.
Отпуск: без рецепта.
+ Высокий профиль безопасности. По данным производителя [5], побочные эффекты не зарегистрированы.
! Суппозитории азоксимера бромида не показаны для лечения активной формы герпеса!
Местные противовирусные препараты для лечения ВПЧ (папилломавируса)
Некоторые топические противовирусные препараты, активные в отношении папилломавирусов, в отличие от ряда препаратов, помогающих от вируса герпеса, имеют прочную доказательную базу и применяются во всем мире для лечения проявлений ВПЧ — в частности, кондилом.
Имихимод
Модификатор иммунного ответа, не оказывающий противовирусного действия. Активность проявляет за счет способности индуцировать выработку интерферона-альфа и других цитокинов. Показан для лечения остроконечных кондилом в урогенитальной зоне [5].
Отпуск: по рецепту.
+ Прочная доказательная база. Препарат определенно снижает вирусную нагрузку. Доказано, что применение крема имихимода 5 %-ного 3 раза в неделю на ночь на протяжении 16 недель эффективно и безопасно для лечения кондилом. Частота рецидивов оценивается как низкая [8]. Имихимод рекомендован для лечения генитальных кондилом авторитетным американским регулятором FDA [8].
! При нанесении имихимода более чем в 10 % случаев наблюдаются зуд и боль [5], о чем следует предупредить покупателя.
Местные противовирусные средства растительного происхождения
Аммония глицирризинат
Активный компонент препарата — активированную глицирризиновую кислоту — получают из корня солодки. Оказывает комплексное иммуностимулирующее, противовирусное, противовоспалительное, противозудное действие. Глицирризиновая кислота прерывает репликацию ряда ДНК и РНК вирусов, в том числе вируса простого герпеса, папилломы человека, цитомегаловируса [5].
Показана в качестве препарата для лечения папилломавирусной инфекции и вируса простого герпеса, в том числе и при инфицировании вирусами онкогенного типа. Выпускается в форме спрея, который распыляют на слизистые оболочки и пораженные участки кожи.
Отпуск: без рецепта.
+ Имеет широкий спектр показаний, среди которых профилактика и лечение кандидозного вульвовагинита, дискомфорт в области половых органов. Может применяться при беременности и кормлении грудью; хорошо переносится.
Подофиллотоксин
Активный компонент подофиллина, производного растительных экстрактов, выделяемых из корневищ с корнями подофилла щитовидного — растения семейства барбарисовых. Обладает выраженными противоопухолевыми и противовирусными свойствами, оказывает цитотоксическое действие. При наружном применении прижигает и мумифицирует кондиломы. Применяется в качестве препарата для местного лечения от вируса папилломы человека. Выпускается в форме раствора для обработки остроконечных кондилом [8].
Отпуск: по рецепту.
+ Доказанный эффект. По данным исследований, 0,5 %-ный раствор подофиллотоксина уменьшает число аногенитальных бородавок с 6,3 до 1,1, разрушая около 70 % образований [8].
! Необходимо соблюдать осторожность при применении — попадание на здоровую кожу может приводить к изъязвлению. Местные реакции при применении, аллергические реакции. Первостольник, отпуская этот противовирусный препарат от папиллом и кондилом, должен обратить внимание клиента на эту особенность и напомнить, что ЛС следует хранить в недоступном для детей месте.
Тетрагидроксиглюкопиранозилксантен
Российский препарат. Активный компонент выделяют из растения копеечника альпийского или копеечника желтеющего.
Согласно инструкции, обладает противовирусной активностью в отношении ВПГ-1 и ВПГ-2, а также цитомегаловируса и некоторых других ДНК-содержащих вирусов. Кроме того, предположительно, препарат активирует клеточный и гуморальный иммунитет, ингибирует рост ряда бактерий и патогенных простейших, в том числе трихомонад, а также оказывает умеренное противовоспалительное действие. Применяют в форме мази в составе комбинированного лечения острых и рецидивирующих форм герпеса, в том числе генитального [5].
Отпуск: без рецепта.
+ Благоприятный профиль безопасности, возможность применять в составе комплексного лечения.
Полисахариды побегов Solanum tuberosum
Рецептурный российский препарат, активный компонент получают из побегов паслена клубненосного. По данным инструкции, проявляет противовирусный эффект в отношении ВПГ-1 и ВПГ-2, способствует индукции интерферонов и повышает иммунный ответ [5]. Следует заметить, что фармакокинетические свойства препарата не изучались. Вагинальные суппозитории применяются в комплексной терапии генитального герпеса.
Отпуск: без рецепта.
+ Высокий профиль безопасности. Побочные эффекты проявляются редко.
Десмодиума канадского травы экстракт
Противовирусный препарат от герпеса растительного происхождения, созданный из сухого экстракта травы десмодиума канадского. По данным инструкции, проявляет противовирусную активность в отношении вирусов герпеса, стимулирует выработку интерферона [5]. Мазь показана для применения при острых и рецидивирующих формах герпеса, в том числе урогенитального.
Отпуск: без рецепта.
+ Высокий профиль безопасности — побочные эффекты не выявлены.
Гипорамина экстракт
Российская разработка на основе экстракта листьев облепихи. По данным инструкции, активен в отношении вирусов простого герпеса, цитомегаловирусов и некоторых других [5]. Мазь, содержащая экстракт гипорамин, показана для лечения и профилактики эпизодов герпеса, в том числе и генитального.
Отпуск: без рецепта.
+ Высокий профиль безопасности; возможность использовать во время беременности и лактации (после консультации с врачом).
Мелиссы лекарственной листьев экстракт
По данным инструкции, проявляет противовирусную активность в отношении ВПГ, оказывает противовоспалительное действие [5]. Крем, содержащий экстракт листьев мелиссы, применяют при поражениях слизистых и кожи, в том числе и в урогенитальной зоне.
Отпуск: без рецепта.
+ Высокий профиль безопасности.
В заключение хочется еще раз подчеркнуть: широкий ассортимент позволяет первостольникам предлагать разные ЛС при запросах на местные средства для лечения проявлений ВПГ или лекарства от ВПЧ. Но при этом не следует забывать о необходимости рекомендовать посетителю обратиться к врачу, ведь именно доктор должен назначить препараты первой линии и подобрать при необходимости комплексную схему лечения папилломавирусной инфекции.
Источники
- Vos T. et al. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015 //The Lancet. 2016; 388 (10053): 1545–1602.
- How the facts about Genital Herpes can help. By New Zealand Herpes Foundation. Retrieved June 2014.
- Patel R. et al. 2017 European guidelines for the management of genital herpes //International journal of STD & AIDS. 2017; 28 (14): 1366–1379.
- Milner D. A. Diagnostic Pathology: Infectious Diseases E-Book. — Elsevier Health Sciences, 2015.
- По данным ГРЛС на 21.02.2019.
- Petersen C. S. et al. Topical tromantadine in the treatment of genital herpes. A double-blind placebo controlled study //Danish medical bulletin. 1993; 40 (4): 506–507.
- Maatouk I. Contact balanitis to tromantadine //Clinical and experimental dermatology. 2016; 41 (8): 926–926.
- IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 90. Human Papillomaviruses.
- Pompei R. et al. Antiviral activity of glycyrrhizic acid //Cellular and Molecular Life Sciences. 1980; 36 (3): 304–304.
ВПЧ — КВД №2
Что такое ВПЧ?
Генитальная папилломавирусная инфекция – это инфекция, передаваемая половым путем (ИППП). Возбудитель папилломавирусной инфекции — вирусы папилломы человека (ВПЧ). Вирусы папилломы человека – это группа вирусов, которая включает около 100 различных типов. Более 30 типов ВПЧ передаются половым путем, инфицируют половые органы и область ануса женщин и мужчин.
Большинство инфицированных не знают о своем заболевании, не имеют клинических проявлений и, более того, могут самопроизвольно выздороветь.
Часть этих вирусов называют вирусами «высокого канцерогенного риска», они могут вызвать предраковые поражения гениталий. Исследования последних лет подтвердили главную роль ВПЧ в развитии рака шейки матки. ВПЧ высокого риска также играют роль в возникновении рака вульвы, влагалища у женщин и рака полового члена у мужчин. К вирусам высокого риска относят 16, 18, 31, 33, 35, 39, 45, 52, 53, 56, 58, 59, 68, 69 типы – эти типы ВПЧ ответственны за 95-98% случаев развития рака шейки матки. Они вызывают рост ненормальных клеток, который является обычно плоским и почти невидим при обычном осмотре по сравнению с доброкачественными бородавками, которые вызываются вирусами низкого риска – 6, 11 типами. Доброкачественные аногенитальные бородавки появляются через 2 – 6 месяцев после заражения. На развитие предраковых или раковых изменений, связанных с носительством ВПЧ высокого риска уходят годы и часто происходит самопроизвольное излечение от ВПЧ.
Инфекция наиболее распространена в возрасте от 15 до 40 и затрагивает одинаково и женщин и мужчин. К 50 годам жизни, около 80 процентов женщин приобретут ВПЧ — инфекцию.
Около 50-75% сексуально активных людей инфицируются ВПЧ в течение их жизни, и в большинстве случаев инфекция не вызывает заболевания и самопроизвольно излечивается.
Приблизительно 90% ВИЧ-инфицированных также имеют ВПЧ-инфекцию.
Как передается ВПЧ
Вирусы папилломы человека, инфицирующие половую область, передаются, через половые контакты. Большинство заразившихся не имеют видимых проявлений заболевания и поэтому носители ВПЧ не знают о своем инфицировании и могут заразить своих половых партнеров. Иногда инфицированная мать может заразить новорожденного во время родов. Это может привести к так называемому папилломатозу гортани новорожденных.
Проявления инфекции
Большинство заразившихся людей не знают об этом. ВПЧ часто не вызывает никаких проявлений на коже и слизистых оболочках. У части людей развиваются половые бородавки или происходят предраковые изменения на шейке матки, вульве, анальной области или половом члене. Очень редко эти изменения переходят непосредственно в рак. От инфицирования до развития тяжелой дисплазии в среднем проходит 20 лет. Большинство женщин спонтанно излечиваются в течение 9 – 15 месяцев от момента заражения. Основное проявление папилломавирусной инфекции – половые бородавки или остроконечные кондиломы (вызываются ВПЧ 6 и 11 типа) — мягкие бородавчатые образования на короткой тонкой ножке, напоминающие цветную капусту или петушиный гребень с различным расположением (головка полового члена, половой член, малые и большие половые губы, влагалище, шейка матки, область ануса). Остроконечные кондиломы появляются через 2 – 6 месяцев после заражения. Видимые кондиломы обнаруживаются при осмотре.
Диагностика инфекции
Диагностика кондилом проводится на основании осмотра. Диагностика ВПЧ высокого канцерогенного риска и связанных с ними изменений, более сложная задача. В основе диагностики предраковых заболеваний шейки матки в течении многих стоял цитологический анализ мазка (исследование мазка под микроскопом). Однако он имеет ряд существенных недостатков – сложность, низкая чувствительность и высокая частота неопределенных результатов. Американский комитет FDA (комитет по медикаментам и продовольствию) одобрил исследование ВПЧ методом полимеразной цепной реакции — ПЦР, который может определить 13 типов ВПЧ высокого риска. ПЦР на ВПЧобладает высокой чувствительностью, прост в исполнении. Совместное использование цитологических исследований и ПЦР тестов позволяет значительно повысить эффективность диагностики, чувствительность увеличивается до 99 – 100%. Применяемые в РКВД ПЦР тест-системы не уступают, а чаще, даже превосходят зарубежные аналоги. Важно, что выявление ВПЧ высокого риска происходит задолго до появления предраковых изменений слизистых.
ПЦР исследование на ВПЧ высокого риска рекомендовано:
— Как первичный метод в дополнение к цитологии для женщин старше 30 лет.
— Для разрешения сомнительных результатов цитологического исследования.
— Пациенткам, проходящим лечение по поводу дисплазии или рака.
— На первом этапе диагностики для стран, где плохо организованы программы обследования на папилломавирусную инфекцию.
— Для обследования мужчин.
Можно ли излечить это заболевание?
Диагностика и лечение ИППП, должна проводиться в условиях специализированной клиники – КВД, имеющей все необходимые средства для быстрой и точной диагностики.
Специфического лекарства против ВПЧ на сегодняшний день нет. Существует множество методов удаления кондилом, но болезнь может вернуться вновь, поскольку вирус остается в организме человека. Рецидивы возможны в 25% случаев в течение 3 месяцев после лечения. При лечении кондилом необходим осмотр половых партнеров. Однако подавляющее большинство половых партнеров заражены ВПЧ и просто не имеют видимых проявлений заболевания.
Лечение предраковых заболеваний заключается в использовании химических, физических и других методов, с целью изменить структуру пораженных участков слизистых оболочек, а также в применении препаратов стимулирующих иммунитет. В дальнейшем необходимо ежегодное цитологическое исследование и определение ВПЧ методом ПЦР.
Какая связь между ВПЧ и раком шейки матки?
Только факты:
- Вирусы папилломы человека высокого риска являются основной причиной рака шейки матки.
- В случаях тяжелой дисплазии (предрака) и рака шейки матки ВПЧ выявляется почти в 100% случаев.
- Выявление ВПЧ связано с 250-кратным увеличением риска развития тяжелой дисплазии.
- Рак шейки матки занимает 1-е место среди причин женской смертности в развивающихся странах.
- Рак шейки матки занимает 2-е место после рака молочной железы среди женщин в мире – 250 тысяч смертей ежегодно.
- В России ежегодно 12 300 женщин заболевает раком шейки матки и более 6 тысяч пациенток ежегодно умирает.
- За последние 10 лет средний возраст заболевших снизился с 58 до 55 лет.
- У женщин до 29 лет заболеваемость выросла в 2 раза.
- ВПЧ высокого риска вызывают рак шейки матки в 100% случаев, рак заднего прохода – 90%, рак влагалища и вульвы – 40%, рак полового члена – 40% и рак ротоглотки в 12% случаев.
- Американское Общество Раковых Заболеваний прогнозировали на 2004 год, что приблизительно у 10 520 женщин разовьется агрессивный рак шейки матки и приблизительно 3 900 женщины умрут от этой болезни. Большинство женщин с агрессивным раком шейки матки, не проходили правильного обследования на ВПЧ инфекцию.
Профилактика инфекции
Вернейший способ предотвращения половой ВПЧ-инфекции состоит в том, чтобы воздержаться от любого полового контакта с другим индивидуумом.
Долговременные сексуальные отношения с постоянным половым партнером не дает 100% гарантии от инфицирования ВПЧ. Трудно определить, без специальных тестов, инфицирован ли в настоящее время половой партнер.
Мужские презервативы из латекса, при правильном применении снижают риск передачи инфекции.
Любые проявления, такие как боль или неприятные ощущения при мочеиспускании, необычная сыпь, выделения являются сигналом для прекращения половых контактов и немедленного обследования в условиях специализированной клиники – РКВД. Если у больного обнаружены ИППП, он должен сообщить об этом своим половым партнерам, для того чтобы они также прошли полное обследование и соответствующее лечение. Это снизит риск развития серьезных осложнений и предотвратит возможность повторного заражения.
симптомы, типы вируса и лечение в Красноярске
Вирус папилломы человека – это один из самых распространенных групп вирусов, поражающих слизистые оболочки и кожу. Вирус опасен тем, что он способен внедрять свою ДНК в хромосомы человека и быстро распространяться, становясь возбудителем для ракового перерождения клеток и, как следствие, развития злокачественной опухоли. Часто инфекция протекает бессимптомно.
Как передается вирус папилломы?
- Половым путем. Можно заразиться также и через анальные и оральные виды половых контактов. Это 16 и 18 типы вирусов. Таким путем появляются остроконечные бородавки, которые располагаются на гениталиях женщин и мужчин. В группу риска входят люди, часто меняющие половых партнеров.
- От рождения. Вирус передается от матери к ребенку во время его прохождения через родовые пути. Бородавки часто появляются у малышей в первые годы жизни во рту или на коже.
- Путем самозаражения. Часто во время бритья или эпиляции ВПЧ переносится с одного участка тела на другой.
- Бытовым способом. Вирус может передаваться через рукопожатие, поцелуй, через повреждения на коже. ВПЧ быстро распространяется во влажной среде, поэтому стоит вести себя аккуратно при посещении общественных мест – саун, бань, спортзалов, туалетов, бассейнов.
Здоровой и сильной иммунной системе не страшен вирус папилломы человека, потому что иммунные клетки организма его уничтожают и заражения не происходит. Однако, существуют факторы, которые способствуют заражению и распространению ВПЧ, среди которых:
- уменьшение общего иммунитета;
- переутомление;
- частые стрессовые ситуации;
- сбои в гормональной системе;
- беременность;
- нарушения метаболизма и обмена веществ.
Существуют три формы проявления ВПЧ:
- Клиническая, при которой появляются образования на коже и слизистых оболочках – папилломы, кондиломы, плоские и остроконечные, подошвенные бородавки.
- Субклиническая – появление на половых органах незаметных без врачебного осмотра высыпаний. Они могут не ощущаться, либо приносить некоторый дискомфорт пациенту.
- Латентная – нет никаких симптомов и внешнего проявления. Определить наличие ВПЧ можно с помощью соскоба эпителия методом ПЦР.
Вирус папилломы у мужчин
Мужчины чаще являются переносчиками заболевания, которое протекает бессимптомно. Часто формируются генитальные папилломы и бородавки на лице из-за повреждений кожи во время бритья и переноса вируса с одного участка тела на другой.
У мужчин строение половых органов обеспечивает целостность кожного покрова, поэтому вероятность заразиться ВПЧ у них меньше, чем у женщин. Также у мужчин меньшая вероятность перехода вируса в злокачественную опухоль, чем у женщин.
Вирус папилломы у женщин
Заболевание может протекать в скрытой форме, либо также, как и у мужчин формируются генитальные папилломы. Опасность ВПЧ для женского организма заключается в том, что он может вызвать образование и бессимптомное развитие злокачественной опухоли шейки матки, вульвы или заднего прохода. Поэтому своевременное обследование и лечение вируса папилломы человека позволяет предотвратить развитие онкологии.
Диагностика вируса
Если вы обнаружили бородавки, высыпания или испытываете неприятные ощущения, обратитесь в первую очередь к своему лечащему терапевту. Однако, зачастую записи к терапевту в городской поликлинике приходится ждать неделями, а после еще несколько часов сидеть в очереди на прием. Поэтому вы можете записаться на консультацию к терапевту в клинике «Медюнион» сегодня и уже завтра пройти осмотр.
Терапевт изучит вашу историю болезни, выяснит жалобы и направит на анализы, а также на прием к узкопрофильному специалисту. В зависимости от локализации заболевания это может быть консультация дерматолога, гинеколога, уролога, колопроктолога, стоматолога, офтальмолога, хирурга. В случае выявления злокачественной опухоли, понадобится посетить онколога. Имеет ли место злокачественное образование, определяется с помощью лабораторных анализов:
- общий анализ крови;
- общий анализ мочи;
- кольпоскопия – для выявления состояния цервикального канала у женщин;
- ПАП-тест – мазок для диагностики рака шейки матки;
- гистология ткани – определение наличия опасных клеток в организме;
- ПЦР – полимеразная цепная реакция. Определение типа вируса;
- уретроскопия – осмотр уретры у мужчин;
- биопсия – забор клеток на диагностику.
Как лечить вирус папилломы человека?
Для лечения наростов применяются разные интерфероны. Они обладают противовирусным и иммуномодулирующим действием.
Наличие остроконечных кондилом, папиллом и генитальных бородавок повышает риск развития рака, их удаляют малоинвазивным путем:
- Радиохирургический способ. Специалист электродом срезает наросты и прижигает сосуды.
- Электрокоагуляция. Удаление происходит при помощи тока.
- Для лечения вируса папилломы у женщин используется криокоагуляция. Низкие температуры закиси азота в аппарате разрушают пораженные ткани во влагалище.
Пройдите полное профилактическое обследование или лечение в медицинском центре «Медюнион» и избавьтесь от вируса папилломы человека с помощью опытных специалистов и современных исследований. Для консультации или справки обратитесь по телефону +7 (391) 201-03-03.
Безобидны ли папилломы или как избавиться от вируса папилломы человека
Папилломы — цилиндрические наросты кожи на тонких подвижных ножках, которые сигнализируют о наличии в организме ВПЧ — вируса папилломы человека.
Отследить их появление сложно, так как они могут долго не проявляться аналогично герпесу, а затем возникнуть словно ниоткуда. Чаще всего, сначала выскакивает одна небольшая папилломка-«мама», которая скоро приводит за собой кучу «деток».
Любимые зоны кожных наростов — сгибы локтей, подмышки, веки, подколенные ямки. Однако ими они не ограничиваются: папилломы могут успешно разрастись в любом месте.
Многие мужчины воспринимают это достаточно спокойно и не пытаются бороться с неприятными гостями. Больше озабочен папилломами прекрасный пол, ведь это косметический дефект. Давайте разберемся, так ли безобидны папилломы, и нужно ли с ними бороться.
Что такое вирус папилломы человека
ВПЧ — вирус, который вызывает доброкачественную опухоль в виде папилломы. Он относится к заболеваниям, передающимся половым путем (ЗППП) наряду с сифилисом, гонореей, трихомониазом и хламидиозом. Однако им можно заразиться и в быту — например, при тесном контакте с носителем вируса через прикосновения или при посещении общественных мест (проникает через царапины на коже). Существует еще один способ заражения — самозаражение при бритье или эпиляции.
Когда вирус уже «прижился» у вас в организме, вспышку папиллом провоцирует любой, даже самый незначительный, на первый взгляд, фактор – стресс, обострение заболеваний ЖКТ, недавно перенесенная простуда. Как правило, папилломовирус возникает именно на фоне слабого иммунитета.
Как проявляется ВПЧ
Существуют различные штаммы вируса папилломы. Например, остроконечные кондилломы — кожные сосочкообразные наросты на половых органах и промежности. В зависимости от интенсивности поражения эти образования могут выглядеть по-разному: и как единичные наросты, и как целое скопление, визуально похожее на кочан цветной капусты. Наросты вызывают множество неудобств: они зудят и даже кровоточат.
Бывает так, что в медицинские центры «СМ-Клиника» приходят пациентки, годами безуспешно лечившиеся от «обострений кандидоза» с помощью «всего одной таблетки». Немало удивления у них вызывает тот факт, что никакой молочницы у них нет, мазок оказывается «чистым», а зуд и раздражение вызывают кондиломы.
Папилломы и кондиломы аналогично герпесу периодически появляются и пропадают, поскольку являются лишь следствиями самого вируса. Обострение заболевания происходит в период снижения защитных сил.
Папилломы в горле
Вирус папилломы человека проявляется не только на веках и других видимых частях тела. Зачастую папилломатоз возникает в респираторном тракте: ткань носоглотки может разрастаться до самых легких. Эти доброкачественные образования захватывают гортань, принося человеку массу неприятных ощущений.
В отличие от обычных поликлиник в медицинских центрах «СМ-Клиника» не только точно диагностируют данный вид ВПЧ, но и производят быстрое и безболезненное удаление наростов. Участковые терапевты и ЛОР-врачи не всегда распознают папилломотоз гортани, поэтому назначают лишь неэффективные полоскания.
Кто может заразиться вирусом
Высокий риск заражения имеют любители табака и алкогольных напитков, а также люди, ведущие беспорядочную интимную жизнь. В зоне риска и женщины, долгое время использующие противозачаточные таблетки. При этом носителем ВПЧ может быть кто угодно — ребенок, молодой человек, старик.
ВПЧ и планирование беременности
Вирус папилломы у женщин может вызвать серьезные последствия. Если мать является его носителем, то малыш, проходящий через родовые пути, заразится им почти в 100% случаев. ВПЧ попадет младенцу в ротовую полость и глаза, а затем распространяется по организму. Вот почему так важно перед зачатием пройти обследование и исключить любые виды заболеваний, относящихся к ЗППП. Определение ВПЧ — важный этап подготовки к беременности.
При выявлении во время беременности вируса, ранее находившегося в скрытой форме, не стоит отчаиваться: обратитесь к квалифицированным врачам «СМ-Клиника». Они проконсультируют вас и расскажут, что можно предпринять без вреда здоровью матери и ребенка.
Диагностика вируса папилломы человека
Учеными выявлено свыше сотни типов ВПЧ. Не все они безобидны: некоторые подвиды могут стать причиной онкологии шейки матки!
Неонкогенные папилломавирусы — HPV 1, 2, 3, 5.
Онкогенные папилломавирусы низкого онкогенного риска — HPV 6, 11, 42, 43, 44, 54, 61, 70, 72, 81.
Онкогенные папилломавирусы среднего онкогенного риска — HPV 26, 53, 66.
Онкогенные папилломавирусы высокого онкогенного риска — HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68.
Из-за бессимптомного течения заболевания многие носители вируса вовремя не обращаются к специалистам. Единственный способ защиты от ВПЧ — сделать прививку, лучше до начала половой жизни. Однако можно предотвратить развитие онкологии, даже если вы не прививались от вируса.
Чтобы избежать неприятностей, необходимо пару раз в год посещать гинеколога и проходить обследование. Так, предраковые изменения шейки матки выявляют посредством теста по Папаниколау (мазок на цитологию). ДНК вируса успешно определяют и по анализу крови по методу ПЦР.
Центры «СМ-Клиника» располагают собственными лабораториями с качественными реактивами – это гарантирует высокую точность результатов анализов на ВПЧ. Только после исследований крови и мазка можно определить типы вируса, присутствующие в вашем организме, и провести удаление папиллом.
Помните: мелкие образования на вашем теле свидетельствуют о неблагополучном состоянии здоровья. Возможно, стоит посетить врача и провериться на заболевания ЖКТБ или гинекологической сферы.
Кожные наросты не рекомендуется отрывать, чесать или перевязывать ниткой. Это не решит проблему, а лишь усугубит ее: вирус станет более агрессивным и начнет захватывать новые территории.
Чтобы убрать образования эффективно и безболезненно, обратитесь к специалистам «СМ-Клиника». Удаление папиллом в Рязани проводится без осложнений и следов на коже. В это же время лучше соблюдать определенные условия: правильно питаться, избегать стрессов, гулять и спать не менее 6-8 часов в сутки.
Если вы заметили на коже неприятные наросты, не затягивайте с диагностикой и лечением: запишитесь к опытному врачу по телефону +7 (4912) 77-67-51. Так вы сохраните здоровье и избежите негативных последствий.
ВПЧ-диагностика в Кемерово – Исследование, цены, консультация
ВПЧ-диагностика – лабораторное исследование в Кемерово
ВПЧ-диагностика – важное исследование, которое проводят с целью ранней диагностики и предупреждения рака шейки матки.
ВПЧ (вирус папилломы человека) – это общее название для целой группы вирусов. На сегодняшний день ученые выявили более 100 типов вирусов, 14 из которых являются онкогенными. Передается обычно половым путем и часто не имеет выраженных симптомов.
Поэтому такие исследования гинекологи назначают всем пациенткам, в особенности после 35 лет.
Как диагностируется
Направление на исследование выдает лечащий врач – гинеколог, уролог или дерматолог. В зависимости от материала исследования выбирается метод:
- ПЦР-диагностика, позволяет обнаружить даже незначительное присутствие вируса, путем определения его ДНК,
- Кольпоскопия, проводится с помощью кольпоскопа, прибора детально изучающего слизистые оболочки матки и увеличивая изображение,
- Цитологический метод, изучение мазка с помощью микроскопа,
- Гистологическое исследование биоптатов, для исследования используется ткань пациента,
- Digene-тест. Новейший и максимально точный метод, который сразу показывает не только наличие вируса, но и определяет его тип и онкогенность. Для исследования берут соскоб с ткани.
- Наша клиника предлагает полный комплекс возможный исследований. Благодаря новейшему современному оборудованию и высококвалифицированному персоналу мы гарантируем оперативное и точное выполнение ВПЧ-диагностики в кротчайшие сроки.
Факторы и группы риска
По последним данным ВОЗ в мире папилломавирусом инфицированы около 70% людей, большинство не подозревают о его наличие, т.к. вирус находится в спящем состоянии и иммунитет способен противостоять его активности.
Но существуют факторы риска, которые провоцируют размножение вируса в организме, это:
- наличие не долеченных инфекций, передающихся половым путем, таких как генитальный герпес, хламидиоз и гонорея,
- нарушение иммунитета,
- количество родов и абортов в анамнезе, и роды и аборты в раннем возрасте,
- курение.
Своевременная диагностирование и выявление ВПЧ на начальных стадиях, помогает избежать серьезных последствий и полностью победить вирус.
В нашей клинике мы предлагаем вакцинацию.
Язвенный эзофагит простого герпеса у здоровых детей
Реферат
Вирус простого герпеса является частой причиной язвенного эзофагита у ослабленного или ослабленного иммунитета. Несмотря на высокую распространенность первичной и рецидивирующей инфекции, вызванной вирусом простого герпеса, в общей популяции, эзофагит, вызванный вирусом простого герпеса (HSVE), по-видимому, встречается редко у иммунокомпетентного хозяина. Мы сообщаем о трех случаях эндоскопического диагноза HSVE у явно иммунокомпетентных детей; Обращение характеризовалось острым началом лихорадки, одинофагией и дисфагией.В двух случаях диагноз был подтвержден гистологически путем выявления включений вируса герпеса и культивирования вируса при наличии воспаления. Третий случай считался вероятным HSVE на основании наличия типичного герпеса на губе, типичных эндоскопических данных, гистопатологических свидетельств воспаления при биопсии пищевода и положительных серологических свидетельств острой инфекции вируса простого герпеса. Двум пациентам был проведен внутривенный курс ацикловира, а в одном случае выздоровление было самоограниченным.Все три случая имели нормальное иммунологическое обследование и отличное здоровье при долгосрочном наблюдении.
Ключевые слова: Дети, эзофагит, вирус простого герпеса
Вирус простого герпеса (ВПГ) является частой причиной язвенного эзофагита у ослабленного или ослабленного иммунитета. [1] Несмотря на высокую распространенность первичной и рецидивирующей инфекции ВПГ в общей популяции, эзофагит ВПГ (HSVE), по-видимому, редко встречается у иммунокомпетентного хозяина [2]. Однако это заболевание может быть недостаточно диагностировано, поскольку оно не учитывается при дифференциальной диагностике одинофагии у детей (проявляющейся как острое самоограничивающееся заболевание), если у них нет основного состояния с ослабленным иммунитетом.Мы сообщаем о трех случаях эндоскопического диагноза HSVE у явно иммунокомпетентных детей; у двоих из этих детей не было признаков герпетических поражений на губах или ротоглотке, но они перешли к эндоскопической и гистопатологической диагностике, поскольку клинические характеристики предполагали наличие HSVE.
ОТЧЕТЫ О ПРАКТИКАХ
Пациент 1
Здоровый 13-летний мужчина поступил с внезапным появлением гнойной боли, болью за грудиной и лихорадкой в течение трех дней. В анамнезе не было рвоты, недавней потери веса, предыдущих жалоб со стороны желудочно-кишечного тракта, приема лекарств или проглатывания коррозионных веществ.У него не было факторов риска заражения вирусом иммунодефицита человека (ВИЧ) или контактов с кем-либо, инфицированным ВПГ. При физическом осмотре ничего особенного не было, за исключением температуры 38,5 ° C. В частности, у него не было повреждений кожи, губ или ротоглотки. Эндоскопия выявила множественные дискретные язвы с эритемой в верхней части пищевода и обширные сливные язвы с некротическим экссудатом в нижней половине пищевода []. Состояние пациента улучшилось через 72 часа после перорального приема омепразола 20 мг два раза в день.Гистологическое исследование биоптатов слизистой оболочки пищевода показало острое воспаление и внутриядерные включения, соответствующие вирусной инфекции []. Окрашивание иммунопероксидазой и вирусная культура подтвердили инфекцию HSV-1 []. Пятна от грибков были отрицательными. Тесты на ВПГ иммунглобулин G и иммуноглобулин M типа IgG и IgM были положительными. Иммунологическое обследование, включая общие иммуноглобулины, подклассы иммуноглобулинов-G и субпопуляции Т-лимфоцитов, было нормальным. Пациент оставался здоровым в течение четырех месяцев после начала болезни, без рецидива симптомов со стороны пищевода или развития признаков иммунодефицита.
Эндоскопический снимок некротических сливных язв пищевода
Внутриядерные включения вируса (стрелка) при биопсии язвы пищевода (окраска гематоксилин-эозином × 200 HPF при высоком увеличении поля зрения)
Положительное иммуноокрашивание на HSV-1 (указатель стрелки), (иммуноокрашивание) 200 мощное поле HPF)
Пациент 2
Трехлетняя девочка поступила с острым приступом гнойнофагии, загрудинной болью, лихорадкой и отказом от еды и жидкости в течение шести дней. Ей поставили диагноз «щелкунчик» пищевод в возрасте 18 месяцев, когда при манометрии пищевода у нее появились дисфагия, раздражительность и характерные высокоамплитудные перистальтические сокращения.У нее было полное исчезновение симптомов за последний год на блокаторе кальциевых каналов. В анамнезе не было случаев гастроэзофагеального рефлюкса (ГЭР), приема внутрь инородного тела, приема лекарств или проглатывания агрессивного вещества. Она была в тесном контакте со своим отцом, у которого был «герпес». При медицинском осмотре была обнаружена плохо питающаяся, плохо выглядящая девочка с температурой 38 ° C и умеренным обезвоживанием. Поражений кожи, губ и ротоглотки не было. Верхняя эндоскопия выявила множественные дискретные язвы небольшого диаметра с четко очерченными контурами от середины до нижней части пищевода [].Биопсия показала внутриядерные вирусные включения и окрашивание иммунопероксидазой, а вирусная культура была положительной на ВПГ типа 1. Пациент мог переносить мягкую диету через 48 часов после начала внутривенного введения ацикловира. Иммунологическое обследование, включая общие иммуноглобулины, подклассы иммуноглобулинов-G и субпопуляции Т-лимфоцитов, было нормальным. При последующем наблюдении ребенок сохранил хорошее здоровье, симптомы со стороны пищевода не рецидивировали.
Эндоскопический вид дискретных язв пищевода (стрелки)
Пациент 3
У 12-летнего ранее здорового юноши в течение четырех дней возникла внезапная сильная одинофагия, выраженная загрудинная боль и лихорадка.Этому предшествовало продромальное заболевание с головной болью, болью в горле, генерализованным недомоганием и болезненной язвой губы продолжительностью в одну неделю. В анамнезе не было жалоб со стороны желудочно-кишечного тракта, недавней потери веса, травм, хирургических вмешательств или эндоскопии. Факторов риска заражения ВИЧ-инфекцией у пациента не было. При физикальном обследовании был обнаружен хорошо питающийся мальчик с температурой 39 ° C и покрытым коркой, возможно, герпетиформным поражением на нижней губе. В остальном его осмотр был нормальным. Из-за тяжести симптомов его лечили внутривенным морфином и внутривенным ацикловиром.Двадцать четыре часа спустя была выполнена верхняя эндоскопия для подтверждения диагноза. У него была воспаленная рыхлая, изъязвленная слизистая оболочка в средней и нижней части пищевода с множеством мелких язв, расположенных линейно. У него также было несколько эрозий желудка. Биопсия показала острый воспалительный инфильтрат с экссудатом нейтрофилов, соответствующий соседней язве, но не обнаружил признаков внутриядерных телец включения. Окрашивание иммунопероксидазой и вирусная культура были отрицательными. Серологическая оценка выявила положительный IgM к HSV и отрицательный IgG к HSV.Спустя двадцать четыре часа пациент уже смог переносить мягкую диету. Иммунологическое тестирование включало нормальные сывороточные иммуноглобулины и отрицательную серологию на ВИЧ. Пациент завершил десять дней приема ацикловира и две недели перорального приема ранитидина 4 мг / кг / день. Его иммунологические тесты были нормальными, и последующее состояние здоровья было отличным.
ОБСУЖДЕНИЕ
Первичные инфекции ВПГ часто встречаются в детском возрасте. К подростковому возрасту 90% всех людей обладают антителами к ВПГ 1 типа [3]. Пик клинических проявлений заболевания приходится на два года жизни, наиболее частым проявлением является гингивостоматит.[3] Мы выявили 17 случаев HSVE у иммунокомпетентных детей, о которых сообщается в англоязычной медицинской литературе. [4–12]
Пациенты с тяжелым герпетическим гингивостоматитом или фарингитом могут иметь нераспознанный эзофагит. У маленьких детей отказ от перорального приема может быть вызван как болью во рту, так и дискомфортом во рту. Кроме того, поскольку HSVE является самоограничивающимся состоянием иммунокомпетентного хозяина, у некоторых пациентов могут быть диагностированы симптомы рефлюкса, если их клиническое улучшение совпадает с назначением кислотосупрессивной терапии.
HSVE у иммунокомпетентных детей обычно представляет собой первичную изолированную инфекцию, но может сопровождаться реактивацией [4] и в некоторых случаях был связан с поражением желудка. [13,14] Мужчины чаще поражаются, чем женщины, с соотношением 3,4: 1. [15] Представления наших пациентов были аналогичны описанным в литературе с острым началом триады одинофагии, загрудинной боли и лихорадки, которой может предшествовать гриппоподобный продромальный период в течение трех-десяти дней. Как сообщалось ранее, чаще всего не возникает сопутствующих поражений полости рта, хотя при наличии поражений полости рта пациентам может не проводиться эндоскопия для проверки наличия эзофагита.[7] Было высказано предположение, что травма ткани пищевода может предрасполагать к HSVE у иммунокомпетентного хозяина. Такая травма может возникнуть в результате ГЭР, пищеводных инструментов, назогастрального дренажа, приема каустических веществ или задержанного инородного тела. [16–18] В анамнезе наших пациентов не было ГЭР или других предрасполагающих факторов.
У пациентов без сторожевых очагов эндоскопия и биопсия помогают установить диагноз. У всех наших пациентов были характерные эндоскопические признаки рыхлой слизистой оболочки, многочисленных поверхностных язв, некоторые из которых были дискретными, а другие располагались линейно, обычно с поражением средней и дистальной части пищевода.Пациент 1 имел более обширное поражение всего пищевода со сливными язвами, покрытыми некротическим экссудатом, что было трудно эндоскопически отличить от кандидозной инфекции [19]. Хотя эндоскопический вид HSVE может быть характерным, дифференциальная диагностика язв пищевода включает другие инфекции (цитомегаловирус, вирус опоясывающего герпеса, ВИЧ, кандиды и бактерии), травмы, включая термическое повреждение, прием разъедающих веществ, пероральные препараты в форме таблеток и воспалительные состояния. такие как болезнь Крона или болезнь Беше.[15]
Гистопатологически диагноз HSVE может быть предложен по сочетанию острого воспаления, изъязвления и изменений эпителиальных клеток, указывающих на вирусную инфекцию, включая баллонную дегенерацию и некроз. [7] Однако абсолютный гистологический диагноз HSVE требует идентификации вирусных включений герпеса или культуры вируса при наличии воспаления. Биопсия с края язвы обеспечивает наилучший диагностический результат [18].
ВПГ в предыдущих сериях почти всегда относились к типу 1 [15], что согласуется с нашими выводами у пациентов 1 и 2.Нам не удалось изолировать ВПГ из ткани пищевода у пациента 3, вероятно, из-за предшествующей противовирусной терапии, но из-за истории болезни, наличия типичного герпеса на губе, типичных эндоскопических результатов, острого воспаления при биопсии пищевода и серопозитивности. IgM к ВПГ поставили вероятный диагноз ВПГ.
HSVE обычно купируется самостоятельно с благоприятным исходом у большинства иммунокомпетентных пациентов. Сообщалось о гематемезисе и перфорации пищевода.[10,20]
Быстрое выздоровление от инфекции и нормальное состояние здоровья при последующем наблюдении предполагают, что у наших пациентов сохранен гуморальный и клеточный иммунитет. Детальное иммунологическое обследование не может быть показано, если HSVE не сохраняется или не рецидивирует. Тщательный сбор анамнеза важен для выявления основного иммунологического заболевания или факторов риска ВИЧ-инфекции.
Основа терапии — поддержание гидратации, питания и адекватного обезболивания, включая кислотосупрессивную терапию. У пациентов 2 и 3 симптоматическое облегчение наступило в течение 48 часов после внутривенного введения ацикловира.Продолжительность симптомов у пациентов, получающих только симптоматическое лечение, колебалась от 2 до 20 дней после обращения [2]. Использование внутривенного ацикловира для лечения HSVE у иммунокомпетентного хозяина все еще остается спорным [2,8,15,21] из-за отсутствия контролируемых исследований, которые могут быть невозможны из-за редкости заболевания. Мы считаем, что раннее начало приема ацикловира может сократить клиническое течение болезни, особенно у пациентов с тяжелой одинофагией.
HSVE остается необычной инфекцией у здоровых детей, но, вероятно, встречается чаще, чем это считается в настоящее время, и должен рассматриваться у любого ребенка, обращающегося с одинофагией, даже при отсутствии поражений кожи или ротоглотки.
Смертельный герпетический энцефалит у пациента с мелкоклеточным раком легкого после профилактического облучения черепа — клинический случай с обзором литературы
Реферат
Вирус простого герпеса 1 (HSV-1) является основной причиной вирусного некротического энцефалита в развитых странах. Мелкоклеточная карцинома легкого составляет около 15% всех случаев рака легкого. ВПГ-индуцированный энцефалит (HSE) после профилактического краниального облучения (PCI) при SCLC встречается редко. Здесь мы описываем случай 58-летней женщины с ограниченной стадией SCLC, рассеянным склерозом (MS) и кожной волчанкой, у которой после ЧКВ развился фатальный HSE.Мы изучаем литературу, чтобы изучить взаимосвязь между этими заболеваниями и лечением HSE.
Вирус простого герпеса 1 (HSV-1) является основной причиной вирусно-некротического энцефалита в развитых странах с зарегистрированной смертностью около 70%. По оценкам, около 15-20% пациентов с HSV-индуцированным энцефалитом (HSE) умирают, несмотря на лечение, и около 60% выживших имеют долгосрочные неврологические последствия (9). Пожилой возраст, лимфоцитарный плеоцитоз, задержка с проведением люмбальной пункции, наличие эритроцитов (эритроцитов) в спинномозговой жидкости (ЦСЖ) и задержка начала приема ацикловира связаны с повышенной заболеваемостью HSE (1, 9).Считается, что HSE является результатом реактивации латентного HSV-1, находящегося в ганглии тройничного нерва взрослых. Вирус мигрирует туда посредством ретроградного аксонального транспорта после первичной инфекции слизистой оболочки губы или щек. У лиц с ослабленным иммунитетом точный пусковой механизм реактивации и механизм быстрого распространения четко не известны.
На мелкоклеточный рак легкого (МРЛ) приходится около 15% всех случаев рака легкого. Химиотерапия цисплатином и этопозидом остается первой линией лечения МРЛ с 1960-х годов.Кроме того, лучевая терапия (ЛТ) рекомендуется пациентам с ограниченной стадией заболевания, в то время как профилактическое краниальное облучение (ЧКВ) предлагается всем пациентам после завершения терапии первой линии. Развитие HSE после ЧКВ — редкое явление и обычно связано с высокой смертностью. Мы сообщаем о случае пациента с SCLC, рассеянным склерозом (MS) и кожной волчанкой в стадии ремиссии после успешной химиолучевой терапии, у которого развился HSE через семь дней после завершения PCI и который умер, несмотря на агрессивную противовирусную терапию и поддерживающее лечение.Это третий случай HSE, связанный с PCI для SCLC, описанный в литературе. Мы обсуждаем возможную связь между SCLC, HSE, MS и кожной волчанкой и ведением HSE.
История болезни
58-летняя женщина европеоидной расы была доставлена в отделение неотложной помощи своей дочерью с однодневной историей обострения спутанности сознания. Дочь сообщила, что накануне пациентка была сбита с толку и не могла говорить. В отделении неотложной помощи пациент жаловался только на затылочную головную боль, но отрицал наличие лихорадки.Она недавно оправилась от приступа гастроэнтерита, и, хотя диарея утихла, у нее продолжалась периодическая рвота в течение предыдущих двух недель. Дочь также сообщила, что ее мать похудела на 10 фунтов за эти две недели. Ее дочь сообщила, что утром в день поступления в больницу у пациентки случился 15-секундный приступ генерализованного припадка дома.
История болезни пациентки имела важное значение для подострой кожной волчанки, леченной гидроксихлорохином, SCLC (T2N2M0), диагностированного восемь месяцев назад, от которого она лечилась с помощью химиолучевой терапии, и рассеянного склероза (MS), который никогда не лечился.Она завершила курс лечения МРЛ шестью циклами цисплатина и этопозида, и примерно пять месяцев назад она была признана благополучной. Она также получила лучевую терапию грудной клетки одновременно с химиотерапией (всего 51,4 Гр за 26 фракций). Затем ей было начато профилактическое краниальное облучение, и примерно тремя днями ранее она завершила 17-дневный курс ЧКВ (всего 25 Гр за 10 фракций). В анамнезе у нее была гипонатриемия из-за синдрома несоответствующей секреции антидиуретического гормона (SIADH) и гипомагниемия, предположительно вторичная по отношению к SCLC и токсичности цисплатина, соответственно.Обзор систем был положительным только в отношении боли в левом верхнем квадранте живота. В отделении неотложной помощи у пациента наблюдался генерализованный припадок, который быстро отреагировал на внутривенное введение лоразепама.
При первичном осмотре ее температура составляла 37,3 ° C, артериальное давление 151/88 мм рт. Было отмечено, что она была пепельно-серого цвета. Она потеряла волосы во время лучевой терапии.Было отмечено, что у нее не было существенной реакции на вредные раздражители. Рефлекс Бабинского был двусторонним разгибающим. Первоначальное лабораторное обследование было значимым для гипонатриемии (124 мЭкв / л), гипокальциемии (7,1 мг / дл), гипомагниемии (1,7 мг / дл), гипоальбуминемии (3,3 г / дл), анемии (гемоглобин 11,2 г / дл) и тромбоцитопении (133000 / мм 3 ). Неконтрастная компьютерная томография (КТ) головы выявила стойкие изменения МС. Рентген грудной клетки был нормальным. Уровень натрия в пятне мочи составлял 140, осмоляльность сыворотки 252, а осмоляльность мочи 670, что соответствует SIADH.Свободный Т4 составлял 1,11, а ТТГ 0,29. Анализ мочи показал пиурию [13 лейкоцитов / поле высокой мощности (hpf)], микроскопическую гематурию (22 эритроцитов / hpf) и положительную реакцию на эстеразу лейкоцитов. Она была начата эмпирическим приемом пиперациллин-тазобактама по поводу предполагаемой инфекции мочевыводящих путей (ИМП) и переведена в отделение интенсивной терапии (ОИТ).
В отделении интенсивной терапии у нее прогрессировало ухудшение тонуса, но интубации не потребовалось. Через два дня после поступления сделана люмбальная пункция. Анализ CSF показал прозрачную жидкость с 10 лейкоцитами / мкл, 27 эритроцитами / мкл и 36% нейтрофилов.Дальнейший анализ выявил повышенный уровень основного белка миелина (12,1 нг / мл, эталон 0-1,1 нг / мл), нормального IgG (для сравнения общий уровень сывороточного IgG был низким — 581 мг / дл, эталон 768-1632 мг / дл), нормальный альбумин ЦСЖ (22 мг / дл, эталон 0-35 мг / дл). Хотя первоначальная компьютерная томография не показала острых отклонений, последующая магнитно-резонансная томография (МРТ) выявила гиперинтенсивные поражения Т2 в медиальной части правой височной доли, очень подозрительные для HSE (рис. 1). По результатам МРТ ей начали эмпирически вводить ацикловир (10 мг / кг) каждые восемь часов на третий день госпитализации.На 4 день полимеразная цепная реакция (ПЦР) дала положительный результат на ДНК HSV-1. Дальнейший анализ ЦСЖ был значимым для отсутствия паранеопластических антител и моноклональных белков. Электроэнцефалограмма (ЭЭГ), выполненная, когда пациент находился в коме, выявила фоновую активность, состоящую из паттерна подавления вспышек с медленными волнами и промежуточной дельта-активности. Посев мочи был положительным на Klebsiella pneumoniae и Candida albicans , от которых пациент лечился соответствующими антибиотиками (левофлоксацин и флуконазол).Однако она не показала значительного неврологического улучшения. Повторная компьютерная томография через 19 дней после поступления выявила новые очаги поражения в правой теменной, двусторонней лобной и левой височных долях, свидетельствующие о прогрессировании HSE. Из-за отсутствия неврологических улучшений и прогрессирующей гипоксии, требующей кислорода, семья приняла меры по обеспечению комфорта, и через 17 дней прием ацикловира был прекращен. Впоследствии пациентка умерла от кардиореспираторной недостаточности через 22 дня после госпитализации.
Обсуждение
Ежегодная заболеваемость HSE среди населения в целом оценивается примерно в 2 раза.2 на миллион. Напротив, среди пациентов с онкологическими заболеваниями, проходящих лучевую терапию всего мозга (WBRT), заболеваемость оценивается примерно в 4 случая на 1000 (примерно в 2000 раз выше, чем в общей популяции) (3; 5). По сравнению с показателем смертности от 15 до 30% среди населения в целом, в одном исследовании пять пациентов с онкологическими заболеваниями (возрастной диапазон = 45-73 года) после WBRT и HSE умерли. Все пятеро поступили с нарушением сознания на момент осмотра и принимали дексаметазон. У трех пациентов HSE возникла во время лучевой терапии (кумулятивная доза облучения от 8 до 48 Гр), а у двух других — через 10-30 дней после WBRT (5).
Клинические признаки HSE включают энцефалопатию (> 90% случаев), лихорадку (80%), судороги (50-70%) и очаговый дефицит (30-70%). При визуализации одностороннее поражение височной области встречается чаще (60-70%), чем двустороннее поражение (около 20%). HSE может проявляться атипично у пациентов с ослабленным иммунитетом, у которых часто отсутствуют продромальные симптомы (29% против 80% у иммунокомпетентных) или очаговые дефициты (29% против 73%) и у которых значительно выше смертность [36%, vs. . 7% в одном исследовании (13)] по сравнению с пациентами с неповрежденной иммунной системой. В исследовании 14 пациентов с ослабленным иммунитетом и 15 иммунокомпетентных пациентов с HSE не было значительных различий в результатах ЦСЖ или аномалиях нейровизуализации между двумя группами (13). Однако при гистопатологии мозг пациентов с ослабленным иммунитетом показал значительно меньшее воспаление и некроз. Пациенты с ослабленным иммунитетом при обращении часто имеют атипичные признаки спинномозговой жидкости. В исследовании Jacob et al. при обзоре пяти пациентов с раком, перенесших WBRT, у всех пациентов был лимфоцитарный плеоцитоз, но с низким количеством лейкоцитов в спинномозговой жидкости (1-7 / мкл).Кроме того, у одного были нормальные уровни белка в спинномозговой жидкости при поступлении, а у другого была отрицательная ПЦР на ВПГ (разные пациенты). В своей статье Джейкоб и его коллеги упоминают, что в литературе описано 28 случаев HSE в сочетании с химиолучевой терапией, в том числе восемь случаев у пациентов, получавших только лучевую терапию (5).
Фигура 1.
Магнитно-резонансная томография (МРТ) головного мозга выявляет изменения, вызванные герпетическим энцефалитом (HSE) и рассеянным склерозом. A: МРТ головного мозга с ослабленным инверсионным восстановлением жидкости T2 (FLAIR), показывающая области гиперинтенсивности в медиальной части правой височной доли, очень подозрительные на герпетический энцефалит.B: МРТ, сделанная за месяц до презентации, не выявила никаких доказательств улучшения изображений, обработанных T2 FLAIR, в височной доле. C: Гиперинтенсивные области на T2 FLAIR MRI при представлении представляют собой области демиелинизации, свидетельствующие о рассеянном склерозе. D: МРТ головного мозга, сделанная месяцем ранее, показывает те же поражения, которые остались неизменными во время госпитализации по поводу HSE. E: Осевые изображения головного мозга, взвешенные по диффузии, демонстрируют заметное усиление правой височной области с более умеренным усилением левой медиальной височной доли.F: Осевые изображения, взвешенные по диффузии, за месяц до постановки диагноза HSE не выявляют признаков гиперинтенсивности в височных долях.
Текущие руководства рекомендуют лечение HSE ацикловиром внутривенно в дозе 10 мг / кг каждые 8 часов в течение 2-3 недель (14). Если есть сомнения, присутствует ли ВПГ после завершения лечения, следует проверить ЦСЖ на ДНК ВПГ с помощью ПЦР. Если результат ПЦР положительный, рекомендуется еще одна или две недели дополнительной терапии. У пациентов с ослабленным иммунитетом, получающих ацикловир с профилактической целью, может развиться к нему устойчивость из-за приобретения вирусом гена тимидинкиназы.Расчетная частота резистентных вариантов HSV-1 у пациентов с ослабленным иммунитетом составляет 5-25%. Этим пациентам рекомендуется фоскарнет или цидофовир. Цидофовир нефротоксичен, но его преимущество заключается в том, что его можно вводить один раз в неделю. Использование кортикостероидов ограничено пациентами с тяжелым вазогенным отеком и сдвигом средней линии на КТ или МРТ. Несмотря на то, что в настоящее время проводятся испытания для оценки эффективности добавления дексаметазона к ацикловиру [испытание GACHE (8)], в настоящее время нет доказательств, рекомендующих его рутинное использование (12).
Учитывая редкость этого HSE у пациентов, перенесших ЧКВ, мы провели поиск опубликованной литературы, чтобы изучить другие случаи, когда HSE имел место у пациентов с SCLC. Мы также искали любую сообщенную связь между РС, кожной волчанкой и SCLC и их связь с HSE. Это было основано на гипотезе о том, что пациент с предшествующим аутоиммунным заболеванием и раком, получавший химиотерапию и лучевую терапию, может быть более восприимчивым к развитию HSE. В базе данных PubMed был проведен поиск по терминам «кожная волчанка и рассеянный склероз», «рассеянный склероз и энцефалит, вызванный вирусом простого герпеса», «рассеянный склероз и мелкоклеточный рак легкого», «мелкоклеточный рак легкого и энцефалит, вызванный вирусом простого герпеса» и «кожная волчанка и мелкоклеточный рак легких».Мы извлекли только два других случая HSE, связанных с SCLC. Один был у 75-летнего мужчины, который обратился с жалобой на потерю сознания с последующими парциальными припадками, лихорадкой и ненормальным поведением. Впоследствии ему был поставлен диагноз SCLC через три недели после поступления в больницу. На МРТ поражены двусторонние области гиппокампа. Интересно, что его спинномозговая жидкость была проанализирована и оказалась отрицательной на паранеопластические антитела (анти-Ма и анти-Hu), но несколько лет спустя исследователи отметили, что сыворотка реагировала с клетками Пуркинье и клетками молекулярного слоя мозжечка мыши.Вестерн-блоттинг экстракта мозжечка мыши с сывороткой пациента выявил полосу 29 кДа. Однако идентичность этого белка не исследовалась (4). Второй случай был у 55-летнего мужчины с ограниченной стадией МРЛ, у которого появились симптомы простуды и температура 39 ° C через десять дней после начала ЧКВ. В течение следующих пяти дней он запутался, у него были заметные когнитивные нарушения, лихорадка с дрожащим ознобом, а затем он стал более сонным и, наконец, в коме. В то время как компьютерная томография при поступлении выявила лишь легкую атрофию паренхимы, МРТ через девятнадцать дней после поступления выявила геморрагические пятна в белом веществе, а также отек левого ушка и парагиппокампального извилина, указывающие на острый энцефалит.Люмбальная пункция в этот момент дала положительный результат на ДНК ВПГ-1, и пациенту был назначен ацикловир. Однако состояние пациента не улучшилось, и он умер через 55 дней после завершения терапии ЧКВ (10). Мы нашли еще один отчет HSE, связанный с ЧКВ при раке груди. Это была 55-летняя женщина с раком груди, у которой примерно через 13 лет после первоначального диагноза были обнаружены генерализованные судороги и метастазы в головной мозг. Ей назначили лучевую терапию, левитирацетам и дексаметазон. После 16 фракций ЛТ у нее появились когнитивные нарушения без каких-либо других системных симптомов.За этим последовали парциальные припадки, симптомы, похожие на менингит, и прогрессирующее ухудшение ее клинического статуса. У нее была обнаружена гипонатриемия, умеренный лейкоцитоз и лимфопения. После того, как HSV был идентифицирован в CSF, пациенту начали в / в ацикловир, который продолжали в течение четырех недель. Однако она оставалась в коме и умерла через 59 дней после последней дозы лучевой терапии. Ее МРТ показала диффузные двусторонние лобные, височные и теменные поражения, а ЭЭГ выявила дельта- и трехфазный волновой паттерн с подавлением вспышек (6).Эти отчеты свидетельствуют о том, что HSE после ЧКВ обычно приводит к летальному исходу, несмотря на соответствующее лечение.
Мы также нашли два отчета о случаях рассеянного склероза, связанных с HSE. В одном случае 49-летней женщине с односторонней головной болью и онемением был поставлен диагноз хронического лимфолейкоза (ХЛЛ) и энцефалита, вызванного вирусом простого герпеса, и она успешно вылечила ацикловир. Через месяц у нее появился новый очаговый дефицит, и ей был поставлен диагноз РС, который отреагировал на парентеральные стероиды в высоких дозах (11). В другом сообщении у 36-летней женщины с РС развился генерализованный приступ острого начала через девять дней после завершения шестой инфузии натализумаба.У нее была афазия и острое нарушение памяти. МРТ головного мозга выявила гиперинтенсивные поражения Т2 в левом височном, островковом, корковом и подкорковом белом веществе, а спинномозговая жидкость показала плеоцитоз и положительный эффект на ВПГ-1. ЭЭГ показала тета- и дельта-активность в левой височной области. После лечения ацикловиром в течение 21 дня у пациента наблюдались стойкие тяжелые эпизодические нарушения памяти, анозогнозия и афазия через пять месяцев после выписки (7). В обоих случаях пациенты выжили, но остались с неврологическим дефицитом.
Наконец, мы провели поиск в литературе на предмет связи между рассеянным склерозом и кожной волчанкой. Это выявило только единичный случай пациентки с давним РС, у которой развилась кожная и системная волчанка (1). Сообщений о РС в связи с ГКРЛ не поступало. Остается без ответа вопрос о том, повлияло ли наличие волчанки и рассеянного склероза на шансы нашего пациента на развитие SCLC и последующего развития HSE.
Ключевой вопрос, требующий ответа: является ли инфекция HSV у пациентов с HSE первичной инфекцией нервной системы или просто реактивацией латентного вируса? Кроме того, важно выяснить, какие механизмы лежат в основе агрессивного характера инфекции HSV-1 у пациентов с онкологическими заболеваниями или у пациентов, получавших WBRT.Обзор литературы показывает, что, как кусочки большой головоломки, ответ находится в стадии разработки. Следует упомянуть несколько наблюдений. В целом очевидно, что иммуносупрессия способствует HSE (5). На мышиной модели Адлер и его сотрудники продемонстрировали, что отсутствие как естественных киллеров (NK), так и Т-клеток, но не только Т-клеток, привело к более высокой (100%) смертности от HSE после интраназальной инокуляции HSV-1. . Типом вирусной инфекции в этой модели является начальный пневмонит, за которым следует миграция вируса в мозг, вызывающая либо явный энцефалит, либо латентную инфекцию ганглия тройничного нерва (15).Известно, что андростендиол (AED), продукт метаболизма дегидроэпиандростерондиона, стероида надпочечников, обладает иммуномодулирующими свойствами. Когда мышам вводили AED за четыре часа до заражения HSV-1, они имели значительно более низкую смертность по сравнению с контрольными мышами (без AED). Кроме того, через шесть дней после инъекции у мышей, которым вводили AED, наблюдалось значительное повышение уровней цитокинов, интерферона гамма (IFNG) и интерлейкина-2 (IL-2) в их ганглиях тройничного нерва, а также повышение активности NK-клеток в ганглиях тройничного нерва. селезенка.Интересно, что не было разницы в вирусной нагрузке в ганглии тройничного нерва при лечении по сравнению с контрольными мышами даже через шесть дней после заражения (2). Исследования на пациентах с наследственной недостаточностью toll-подобного рецептора 3 (TLR3) показали, что у этих пациентов нейрональные клетки не могут продуцировать высокие уровни IFNG при инфицировании HSV-1 in vitro . Однако периферические мононуклеарные клетки одного и того же пациента продуцировали адекватное количество IFNG при заражении таким же образом.Эти исследования показывают, что дефицит TLR3 снижает способность нейронных клеток продуцировать IFNG в ответ на инфекцию HSV1, тем самым способствуя агрессивной репликации вируса и инфекции (2). Примечательно, что хорошо известно, что высокие уровни IFNG вызывают апоптоз олигодендроцитов, но не влияют на нейроны. Таким образом, высокий уровень циркуляции IFNG может ухудшить симптомы рассеянного склероза. Гипотеза о том, что HSE является первичной инфекцией нервной системы, основана на наблюдениях, что пациенты с рецидивирующим герпесом на губах (который, как считается, вызван реактивацией HSV-1, находящегося в ганглии тройничного нерва), редко получают HSE.Кроме того, штаммы, вызывающие labialis герпеса, отличаются от штаммов, вызывающих HSE. Однако в наиболее распространенной гипотезе считается, что человек заражается инфекцией ВПГ-1 в первом или втором десятилетии жизни. Затем вирус остается латентным в ганглиях дорзального корешка и ганглиях тройничного нерва. При активации вирусы распространяются на височные и лобные доли по аксонам тройничного нерва и вызывают некротический энцефалит. Некоторые исследования предполагают, что ингибирование аутофагии в клетках-хозяевах может использоваться вирусом как механизм для обеспечения его выживания и распространения [HSV-энцефалит подробно рассмотрен в (12)].
Заключение
В заключение, HSE у пациентов с ослабленным иммунитетом, таких как пациенты с SCLC после ЧКВ, может проявляться незаметными симптомами. Наиболее важным прогностическим фактором для этих пациентов является раннее начало противовирусной терапии. Ацикловир является терапией первой линии, но если пациент не реагирует быстро, следует учитывать возможность резистентности и следует рассмотреть альтернативные препараты, такие как фоскарнет или цидофовир. Общий прогноз у пациентов с ослабленным иммунитетом и HSE плохой.Механизмы, лежащие в основе совместного возникновения SCLC, MS и кожной волчанки у нашей пациентки, неизвестны и могли способствовать ее смерти. Срочно необходимы дальнейшие исследования в этой области.
- Получено 28 мая 2013 г.
- Исправление получено 23 июня 2013 г.
- Принято 25 июня 2013 г.
- Copyright © 2013 Международный институт противораковых исследований (доктор Джон Г. Делинассиос), Все права защищены
Лечение рака толстой кишки онколитическим вирусом простого герпеса в доклинических моделях
Создание колоносфер
Клетки HT-29, LoVo, HCT116 и SW620 культивировали при плотности 3 × 10 5 / мл в среде стволовых клеток.На 3-й день мы могли видеть образование сфер (больших, круглых и несвязанных плавающих сфероидных колоний) (рис. 1а). Размер колоносфер со временем увеличивался. Когда сфероидные клетки культивировали в полной среде с 10% фетальной бычьей сывороткой (FBS), они прикреплялись к колбе, постепенно мигрировали из колоносфер и морфологически трансформировались в прикрепленные клетки. Кроме того, могут быть пассированы сфероидные клетки в колоносферах. Для удобства описания мы обозначили сфероидные клетки как Xsphere (т.е.г., HT-29sphere).
Рисунок 1
Образование клонов адгезивных и колоносферных клеток HT-29, HCT116, SW620 и LoVo. ( a ) Создание колоносфер in vitro . Клетки HT-29, клетки SW620, клетки HCT116 и клетки LoVo могли генерировать большие круглые и незакрепленные плавающие сферы при культивировании в среде стволовых клеток на 3-й день. ( b ) Потенциал образования клонов в группах клеток колоносферы был выше по сравнению с с родителями.( c ) Клетки HT-29sphere, SW620sphere, HCT116sphere и LoVosphere показали 3,19- (500 ячеек) / 2,16-кратное (1000 ячеек), 2,09- (500 ячеек) / 1,88-кратное (1000 ячеек), 3,03-кратное рост колониеобразующей эффективности в 1,63 раза ( n = 18). ( d ) Способность к образованию клонов как в клетках рака толстой кишки, так и в клетках колоносферы была значительно ослаблена, и они не могли образовывать клоны. ** P <0,01.
Эффективность образования колоний различных типов клеток и влияние oHSV2, чтобы определить, обладают ли сфероидные клетки более высокой способностью выживать в одиночку и пролиферировать, и может ли инфекция oHSV2 ослабить эту способность, мы провели анализы образования клонов для каждого рака толстой кишки. клеточная линия.В соответствии с нашими ожиданиями, способность к образованию колоний в группах сфероидных клеток была выше по сравнению с их родительскими аналогами (рис. 1b и c). После заражения вирусом HSV2 ни раковые клетки толстой кишки, ни клетки колоносферы не могли образовывать клоны (рис. 1d), а инфицированные сферические клетки, культивированные в условной среде, в конечном итоге подвергались лизису.
Клетки колоносферы обладают более высокой онкогенной способностью, тогда как инфекция oHSV2 ослабляет их онкогенную способность
in vivo
Мы исследовали онкогенную способность клеток HT-29 и HT-29sphere in vivo .У мышей в группе клеток 1 × 10 4 , 1 × 10 5 и 1 × 10 6 не образовывались опухоли через 2 месяца после трансплантации. Однако у мышей из группы 5 × 10 6 клеток развились опухоли, а клетки HT-29sphere обладали более высокой онкогенной способностью по сравнению с их родительскими клетками (рис. 2а). У всех мышей (6/6) в группе HT-29sphere развились опухоли к 7 дню, тогда как только у двух мышей (2/6) в группе HT-29 развились опухоли (дополнительный рисунок S1). Объемы подкожных опухолей в группе HT-29sphere были значительно больше, чем в группе HT-29 (рис. 2b).Кроме того, мыши в группе HT-29sphere умерли раньше (день 16, 2/6), чем мыши в группе HT-29 (день 24, 2/6).
Рисунок 2
Онкогенная способность in vivo . ( a ) Объемные изменения в опухолях, которые развились из клеток HT-29 или HT-29sphere in vivo . ( b ) Типичные мыши с опухолями, образованными из клеток HT-29 (справа) или HT-29sphere (слева) на 24-й день. ( c ) Изменения объема опухолей, продуцируемых HT-29 или HT- Клетки 29sphere, инфицированные или неинфицированные oHSV2 in vivo .( d ) Состояние мышей, у которых развились опухоли из клеток сферы HT-29 или HT-29, инфицированных или неинфицированных oHSV2 на 36 день.
Мы проверили влияние oHSV2 на онкогенную способность HT-29 и HT -29sphere клеток in vivo , и обнаружили, что у мышей в группе HT-29sphere к 7-му дню развились дефинитивные опухоли на их левых боках (6/6) и меньшие опухоли на их правом фланге (2/6). опухоли на правом фланге уменьшились к 14 дню. У мышей в группе HT-29 также развились подтвержденные опухоли на их левых боках (6/6), но не опухоли на правых боках к 7 дню.Опухоли на левых боках у всех мышей постепенно становились больше, тогда как опухоли на правом боках со временем исчезли (к 80-му дню опухолей не было). Как показано на фиг. 2c и d, инфицирование oHSV2 значительно ослабило онкогенную способность клеток HT-29 и HT-29sphere in vivo .
Клетки колоносферы демонстрируют более высокую способность к миграции и инвазии, тогда как заражение oHSV2 снижает этот потенциал
in vitro
Чтобы изучить злокачественный профиль клеток колоносферы, мы провели эксперименты с пересечением лунок для оценки способности клеток колоносферы к миграции и инвазии в сравнении со своими приверженцами.Мы обнаружили, что клетки колоносферы показали значительное увеличение подвижности клеток (рис. 3а). По сравнению с адгезивными клетками LoVo, клетки LoVosphere показали 2,97-кратное ( P = 0) увеличение хемотаксического потенциала через 20 часов (рис. 3b). Способность клеток LoVosphere проникать в слой матригеля, количественно определенная путем подсчета количества клеток на нижней поверхности вставки через 46 часов (рис. 3c), была значительно выше (в 2,10 раза, P = 0) по сравнению с адгезивных клеток LoVo.
Рисунок 3
Миграция и вторжение. ( a ) Число мигрирующих oHSV2-инфицированных и неинфицированных клеток LoVo и LoVosphere в каждом HPF (× 200, левая панель). Мигрирующих клеток LoVosphere было больше, чем клеток LoVo (464,33 ± 35,29 против 156,30 ± 38,57). В инфицированной группе также было больше мигрирующих клеток LoVosphere, чем клеток LoVo (41,80 ± 3,56 против 12,53 ± 4,00). Количество инвазивных oHSV2-инфицированных и неинфицированных клеток LoVo и LoVosphere в каждом HPF (× 400, правая панель) или во всей камере.Инвазивных клеток LoVosphere было больше, чем клеток LoVo (727,60 ± 32,93 против 346,70 ± 29,56). В инфицированной группе также было больше инвазивных клеток LoVosphere, чем клеток LoVo (35,33 ± 5,16 против 26,50 ± 4,81). ( b и c ) Необработанные клетки показали значительно более высокую инвазивную способность по сравнению с клетками, обработанными oHSV2. ( d ) Миграция инфицированных oHSV2 клеток LoVo и LoVosphere в каждом HPF (× 200). * P <0,05 и ** P <0,01.
oHSV2 подавляет миграцию и инвазию клеток колоносферы и их прилипающих аналогов. Клетки LoVo и LoVosphere были инфицированы oHSV2 при множественности инфицирования (MOI), равной 1, и были исследованы, как указано выше. Наблюдалось, что через мембрану камеры мигрировало больше клеток LoVo и LoVosphere, чем соответствующих клеток, инфицированных oHSV2 (в 12,47 и 11,11 раза соответственно). При сравнении инфицированных клеток (рис. 3d) мы обнаружили, что инфицированные клетки LoVosphere по-прежнему обладают более высокой миграционной и инвазивной способностью по сравнению с инфицированными клетками LoVo (41.80 ± 3,56 против 12,53 ± 4,00 ( P = 0), 35,33 ± 5,16 против 26,50 ± 4,81 ( P = 0) соответственно). Эти результаты показывают, что клетки колоносферы обладают более высокой миграционной и инвазивной способностью, тогда как oHSV2 значительно подавляет потенциал миграции и инвазии.
oHSV2 эффективно убивает различные типы клеточных линий рака толстой кишки и взаимодействует с 5-Fu
in vitro
Было обнаружено, что
oHSV2 обладает высокой цитотоксичностью по отношению к клеткам рака толстой кишки in vitro .Вирус вызвал цитопатический эффект клеток рака толстой кишки (рис. 4a), и количество цитопатических клеток постепенно увеличивалось с течением времени (рис. 4b). Мы дополнительно исследовали влияние oHSV2 на пролиферацию и выживаемость клеток с помощью анализа CCK-8 (Cell Counting Kit-8). Показатели выживаемости клеток рака толстой кишки, инфицированных oHSV2 при различных MOI, сравнивались в различные моменты времени, и мы обнаружили, что с увеличением MOI и времени, клетки рака толстой кишки имели значительно более низкие показатели выживаемости (рис. 4c).Цитотоксичность oHSV2 была незначительной при низкой MOI или в течение короткого периода времени (данные не показаны). Чтобы проверить, увеличивает ли комбинация oHSV2 и химиотерапевтических препаратов цитотоксичность, мы исследовали выживаемость клеток рака толстой кишки на модели SW620. Комбинация oHSV2 и 5-фторурацила (5-Fu) показала более высокую цитотоксичность, чем любое лечение по отдельности (рис. 4d).
Рисунок 4
Цитотоксичность oHSV2. ( a ) Морфология клеток с цитопатическим эффектом (ЦПЭ) в разной степени.Наблюдались набухание клеток, округление и дефлювий. ( b ) CPE клеток HT-29, HCT116 и LoVo, вызванный oHSV2 в разные моменты времени. CPE, очевидно, был улучшен за счет увеличения MOI и / или увеличения времени. Каждый тип клеток показал разную чувствительность. ( c ) Выживаемость клеток SW620, инфицированных oHSV2, при MOI 0, 0,1, 0,5, 1, 5 и 10 в течение 48, 60 и 72 часов (левая панель). Показатели выживаемости клеток HT-29, инфицированных oHSV2, при MOI 0, 1, 5 и 10 в течение 60 и 72 часов (средняя панель).Показатели выживаемости клеток LoVo и HCT116, инфицированных oHSV2, при MOI 0, 1, 5 и 10 в течение 48 часов и 36 часов соответственно (правая панель). ( d ) Комбинированное воздействие oHSV2 и 5-Fu на клетки SW620 в течение 48 часов. ** P <0,01.
oHSV2 значительно изменяет структуру клеточного цикла и вызывает некроз клеток
Для дальнейшего исследования влияния oHSV2 на клеточный цикл клетки рака толстой кишки были инфицированы oHSV2 с MOI 0, 0,1, 1 и 10, а клетки были проанализированы на их статус клеточного цикла с помощью проточного цитометра через 12, 24, 48 и 72 часа.Значительное увеличение доли клеток в фазе S и значительное уменьшение количества клеток в фазе G0 / G1 наблюдались с увеличением MOI и времени (Рисунки 5a и b и дополнительная таблица 1). Эти наблюдения показывают, что oHSV2 в основном убивает клетки в фазе G0 / G1 и вызывает остановку в S-фазе клеточного цикла.
Рисунок 5
Анализ клеточного цикла и апоптоза. ( a ) Изменения в структуре клеточного цикла клеток HT-29, вызванные различными дозами oHSV2 через 12, 24, 48 и 72 часа.Наблюдалось значительное увеличение доли клеток в фазе S и значительное уменьшение количества клеток в фазе G0 / G1 с увеличением MOI и времени. ( b ) oHSV2 индуцировал изменения клеточного цикла в клетках SW620, HCT116 и LoVo в соответствии с результатами HT-29. ( c ) Влияние oHSV2 в сочетании с 5-Fu на клеточный цикл SW620. 5-Fu вызывал достоверное снижение (с 46,64 ± 1,11 до 31,41 ± 3,91) доли клеток в S-фазе и увеличение (с 39.От 37 ± 0,44 до 66,48 ± 3,93) по количеству клеток в фазе G0 / G1, тогда как oHSV2 оказал противоположный эффект (до 66,93 ± 2,69 и 30,66 ± 1,17 соответственно). Комбинация oHSV2 и 5-Fu приводила к увеличению (66,03 ± 4,07) процента клеток в фазе S и убивала все клетки в фазе G2 / M. ( d ) Анализ апоптоза клеточного цикла в клетках HCT116. Уровни позднего апоптоза и некроза клеток HCT116, инфицированных oHSV2, были значительно увеличены. * P <0,05 и ** P <0.01.
Чтобы продемонстрировать влияние oHSV2 в сочетании с 5-Fu на клеточный цикл, клетки рака толстой кишки обрабатывали oHSV2 с MOI 1 и 20 мкг / мл -1 5-Fu в течение 48 часов. Как показано на рисунке 5c и в дополнительной таблице 3, 5-Fu вызывал значительное уменьшение доли клеток в фазе S и увеличение количества клеток в фазе G0 / G1, тогда как oHSV2 вызывал противоположный эффект в соответствии с предыдущие результаты (рисунок 5b и дополнительная таблица 2). Комбинированная обработка приводила к увеличению доли клеток в S-фазе и убивала все клетки в G2 / M-фазе.В сочетании с цитотоксическим эффектом обоих (как упоминалось ранее на фиг. 4d) результаты показывают, что оба лечения дополняют друг друга, убивая клетки в разных фазах и глубоко останавливая клеточный цикл в S-фазе.
Чтобы определить основной тип гибели клеток, вызванный oHSV2, мы измерили апоптоз клеток с помощью набора Annexin V-FITC / PI Kit (BD Pharmingen, San Diego, CA, USA) в соответствии с инструкциями производителя. Анализ проточного цитометра показал, что oHSV2 индуцировал некроз большего числа клеток, чем апоптоз.Скорости некроза и поздний апоптоз на инфицированных oHSV2 клетках HCT116 через 48 часов показали статистически значимое различие между контрольной и обработанной oHSV2 группами (рисунок 5d и дополнительный рисунок S2).
oHSV2 способствует регрессии опухоли в ксенотрансплантатах клеток рака толстой кишки
Для оценки противоопухолевой эффективности in vivo oHSV2 установленные опухоли стереотаксически инокулировали вирусом или фосфатно-солевым буфером (PBS) (имитация). Как показано на фиг. 6а и дополнительной фиг. S3, обработка oHSV2 значительно ингибировала рост опухоли у мышей с опухолью HT-29.К конечной точке наблюдалась значительная разница в объеме опухоли между контрольной и лечебной группами. Произошло значительное уменьшение массы опухоли, и степень ингибирования опухоли составила 98,54%. Аналогичные результаты были получены на моделях опухолей SW620 (дополнительный рисунок S4) и LoVo (дополнительный рисунок S5).
Рисунок 6
Лечение опухолей in vivo . ( a ) Изменения объема опухоли и массы тела у мышей с опухолью HT-29. Всех мышей с опухолью HT-29 умерщвляли на 30 день.Статистически значимая разница в объеме опухоли наблюдалась между контролем (775,27 ± 261,82 мм 3 ; n = 9) и всеми группами лечения (0 мм 3 ; n = 8, P = 0). ( b ) Патологических изменений основных паренхиматозных органов не наблюдалось. ( c ) Состояние опухолей у мышей в конечной точке. ( d ) Кривые выживаемости Каплана-Мейера мышей с опухолями SW620 или LoVo после обработки oHSV2. Выживаемость мышей в группах лечения oHSV2 ( n = 7) была значительно выше по сравнению с таковой у мышей в контрольной группе ( n = 7) ( P = 0.002 и 0,001 соответственно).
Терапия oHSV2 оказалась нетоксичной для мышей, поскольку их масса тела оставалась относительно стабильной на протяжении всего исследования, а патологические изменения в основных паренхиматозных органах (сердце, легкие, печень, селезенка и почки) не наблюдались ( Рисунок 6б). Эти результаты демонстрируют, что oHSV2 явно способствует регрессии опухоли (фиг. 6c) и почти не вызывает побочных эффектов in vivo .
После комбинированной терапии oHSV2 и 5-Fu наблюдалось статистически значимое уменьшение как объема опухоли, так и массы опухоли по сравнению с группой 5-Fu.Степень ингибирования опухоли в группе комбинированной терапии составила 83,67%. В итоге не было различий в массе тела мышей (дополнительный рисунок S6). Эти результаты подтверждают мнение, что режим комбинированной терапии гораздо более эффективен и не более токсичен, чем лечение одним 5-Fu.
На основании кривых Каплана-Мейера было обнаружено, что выживаемость мышей с опухолью SW620 в группе oHSV2 ( n = 7) выше, чем у мышей в контрольной группе ( n = 7 ) (логранговый тест, P = 0.002; Рисунок 6d). Согласованные результаты были получены на мышах с опухолями LoVo ( n = 7, P = 0,001; фигура 6d). Анализ выживаемости подтверждает мнение о том, что лечение oHSV2 может продлить жизнь мышей с опухолью и оказать доброкачественный эффект на регресс опухоли.
Влияние экстракта черного чая на инфицирование культивированных клеток вирусом простого герпеса-1 | Комплементарная медицина и терапия BMC
Клетки
Эпителиальные клетки человека (A549) [Американская коллекция типовых культур (ATCC), Манассас, штат Вирджиния, США] культивировали до слияния в питательной среде 1X Ham’s F-12K, модификации Кайна с 2 мМ L -глутамин с добавкой, содержащей 10% фетальной бычьей сыворотки (FBS) (Biowest, Майами, Флорида, США) и 1 мкг / мл гентамицина при 37 ° C и 5% CO 2 .
Клетки Vero [АТСС (Манассас, Вирджиния)] культивировали до конфлюэнтности в среде Игла, модифицированной Дульбекко (DMEM) с 5% FBS и 1 мкг / мл гентамицина при 37 ° C и 5% CO 2 .
Поддержание вируса HSV-1 UL-46
Рекомбинантный штамм HSV-1, GHSV-UL46, который содержит последовательность зеленого флуоресцентного белка (GFP), слитого с белком тегумента pUL46, был использован во всех экспериментах [18] (ATCC, Манассас, Вирджиния, США). Пассирование вируса осуществляли во флаконах Т-25, и клеткам давали возможность достичь полного цитопатического эффекта (ЦПЭ).Затем среду собирали, центрифугировали и супернатант, содержащий вирус, хранили в криогенных флаконах при -80 ° C.
Приготовление экстракта черного чая (BTE)
Экстракт черного чая ≥ 80% теафлавинов (BTE) (10 мг) (Sigma-Aldrich, Saint Louis, MO, USA) растворяли в 1 мл 10% среды FBS для производят исходную концентрацию 14 мМ раствора БТЭ. Десятикратные разведения (1,4 мМ — 0,014 нМ) исходного материала хранили в микроцентрифужных пробирках при 4 ° C.
Цитотоксичность BTE
Наблюдение за морфологией клеток
Морфологию клеток оценивали с помощью микроскопа Accu-Scope 3002 путем сравнения обработанных и необработанных образцов.Клетки A549 и Vero помещали в 6-луночные планшеты, выращивали в течение 24 часов, а затем в лунки добавляли различные концентрации BTE (от 14 мМ до 0,014 нМ). Через 1 час BTE удаляли аспирацией и клетки промывали PBS. В лунки добавляли свежую среду, и клетки исследовали при 400X на предмет морфологических изменений после дополнительных 48 часов инкубации при 37 ° и 5% CO 2 .
Анализы жизнеспособности клеток
Клетки A549 и Vero помещали в 6-луночные планшеты, и через 24 часа в каждую лунку добавляли различные концентрации BTE.Через один час BTE аспирировали и клетки промывали PBS, и клетки, включая контрольные группы, инкубировали со средой в течение 24 часов при 37 ° и 5% CO 2 . Затем клетки окрашивали трипановым синим и подсчитывали с помощью гемоцитометра.
Анализ пролиферации клеток
Суспензии клеток A549 и Vero (100 мкл) переносили в отдельные лунки 96-луночного планшета. В каждую лунку, содержащую образец, добавляли 10 мкл реагента для пролиферации клеток WST-1 (Roche Diagnostics, Индианаполис, Индиана, США); планшет осторожно покачивали, затем помещали в инкубатор при 37 ° C и 5% CO 2 на 30 минут.Уровень поглощения для каждой лунки измеряли при 450 нм в считывающем устройстве для микропланшетов.
Ингибирование вируса
Анализ инактивации вируса
100 мкл растворов заушек смешивали со 100 мкл HSV-1 в микроцентрифужных пробирках и инкубировали при 37 ° C и 5% CO 2 в течение 1 часа. Затем 200 мкл каждой смеси добавляли в отдельную лунку на 6-луночном планшете, содержащем клетки Vero, из которых была аспирирована среда. Планшеты инкубировали при 37 ° C и 5% CO 2 в течение 1 часа и встряхивали каждые 15 минут.Через 1 час любой неабсорбированный вирус аспирировали и 2,5 мл 5% FBS-среды добавляли в каждую лунку клеток Vero и инкубировали при 37 ° C и 5% CO 2 в течение 48 часов; затем собирали среду из каждой лунки и использовали для заражения свежих монослоев клеток Vero (конфлюэнтность 70-80%). Планшеты инкубировали в течение 48 часов при 37 ° C и 5% CO 2 и контролировали цитопатический эффект. Титры вирусов определяли с помощью анализа бляшек.
Экстракты, обработанные клетками
Клетки A549 и Vero помещали в 6-луночные планшеты с 2.В каждую лунку добавляли 5 мл клеточной суспензии и инкубировали при 37 ° C и 5% CO 2 до 80% конфлюэнтности. Среду аспирировали, и клетки в каждой лунке обрабатывали 100 мкл одной из 10 концентраций раствора BTE. Планшеты встряхивали и выдерживали в инкубаторе при 37 ° C и 5% CO 2 в течение 15 минут. Неабсорбированный раствор отсасывали и в каждую лунку добавляли 100 мкл вируса. Клетки инкубировали при 37 ° C и 5% CO 2 в течение 1 часа и встряхивали каждые 15 минут.Через 1 час любой неабсорбированный вирус аспирировали и в каждую лунку добавляли 2,5 мл 10% FBS-среды. Планшеты инкубировали при 37 ° C и 5% CO 2 в течение 48 часов, затем собирали среду из каждой лунки и хранили при -80 ° C.
Экстракты, обработанные вирусом
Для получения среды с вирионами из клеток Vero и A549, инфицированных вирусными частицами, обработанными растворами BTE, 100 мкл неразбавленного HSV-1 смешивали со 100 мкл раствора BTE в пробирке для микроцентрифуги. каждая из 10 концентраций раствора БТЭ.Смеси оставались при комнатной температуре в течение 15 минут. Затем 200 мкл каждой смеси добавляли в отдельную лунку на 6-луночном планшете, содержащем клетки A549 и Vero, соответственно, из которых была отсосана среда. Планшеты инкубировали при 37 ° C и 5% CO 2 в течение 1 часа и встряхивали каждые 15 минут. Через 1 час любой неабсорбированный вирус аспирировали и 2,5 мл 10% FBS-среды добавляли в каждую лунку с клетками A549 и инкубировали при 37 ° C и 5% CO 2 в течение 48 часов, затем среду из каждой лунки инкубировали. собирают и хранят при температуре −80 ° C.
Определение титра вируса с помощью анализа бляшек
Десятикратные серийные разведения обработанных клетками и обработанных вирусом экстрактов HSV-1 были приготовлены до инфицирования. Затем конфлюэнтные монослои клеток A549 и Vero инфицировали различными разведениями 100 мкл HSV-1 и позволяли адсорбироваться в течение 1 часа при 37 ° C и 5% CO 2 . Неабсорбированные вирусы аспирировали, затем чашки покрывали агаром, содержащим питательную среду, и инкубировали при 37 ° C и 5% CO 2 в течение 3 дней.Бляшки визуализировали окрашиванием клеток кристаллическим фиолетовым и подсчетом в течение 50 часов. Анализ зубного налета проводили в трех повторностях.
Анализ уменьшения бляшек
Экспериментальные лунки 6-луночных планшетов, содержащие конфлюэнтные монослои клеток A549 и Vero, инфицировали вирусными суспензиями для получения 20-30 бляшек на лунку. После 1 ч инкубации при 37 ° C и 5% CO 2 неабсорбированные вирионы были аспирированы. Затем в соответствующие лунки добавляли раствор BTE (1,4 мМ, 0,14 мМ, 14 мкМ и 0,14 мкМ соответственно), а затем агар, содержащий питательную среду; планшеты инкубировали при 37 ° C и 5% CO 2 в течение 3 дней.Бляшки подсчитывали, как описано выше.
Анализ адсорбции вируса
Равные объемы (100 мкл) раствора BTE и вирусной суспензии, содержащей вирус для получения 20–30 бляшек на лунку, помещали в микроцентрифужные пробирки, и смеси инкубировали при 37 ° C в течение 1 часа. . Затем образцы помещали на монослои клеток A549 и Vero в 6-луночные планшеты и позволяли вирусу адсорбироваться в присутствии экстракта. Неабсорбированные растворы аспирировали, затем в каждую лунку добавляли агар, содержащий питательную среду, и планшеты инкубировали при 37 ° C и 5% CO 2 в течение 3 дней.Эффективность адсорбции оценивали путем подсчета бляшек, как описано выше.
Анализ прикрепления вируса
Раствор
BTE добавляли в лунки 6-луночных планшетов, содержащих монослои клеток A549 и Vero, и планшеты инкубировали при 4 ° C в течение 1 часа. Затем удаляли растворы экстрактов и в каждую лунку добавляли суспензии вирусов, содержащие вирус, чтобы получить 20-30 бляшек на лунку. Планшеты инкубировали при 4 ° C в течение 2 часов для прикрепления, затем монослои промывали 3 раза холодным PBS; неабсорбированные растворы были аспирированы.Затем в каждую лунку добавляли агар, содержащий питательную среду, и планшеты инкубировали при 37 ° C и 5% CO 2 в течение 3 дней. Бляшки подсчитывали, как описано выше.
Анализ проникновения вируса
Суспензии вируса готовили на льду для получения 20–30 бляшек на лунку на монослоях клеток A549 и Vero в 6-луночных планшетах. Суспензии вирусов помещали на клетки, и планшеты инкубировали при 4 ° C в течение 2 часов для прикрепления. Затем в лунки добавляли раствор BTE при комнатной температуре и планшеты инкубировали при 37 ° C в течение 10 минут для обеспечения проникновения.Затем непривязанные вирионы смывали PBS (pH = 3), а неабсорбированные растворы аспирировали. Затем в каждую лунку добавляли агар, содержащий питательную среду, и планшеты инкубировали при 37 ° C и 5% CO 2 в течение 3 дней. Бляшки подсчитывали, как описано выше.
Флуоресцентная микроскопия
Для визуализации эффекта, который раствор заушных нервных клеток оказывал на распространение вируса, клетки A549 и Vero помещали в 6-луночные планшеты. Сначала 100 мкл GHSV-UL46 смешивали со 100 мкл раствора BTE в микроцентрифужной пробирке.Смеси оставались при комнатной температуре в течение 15 минут. Затем 200 мкл каждой смеси добавляли в отдельную лунку на 6-луночном планшете, который содержал конфлюэнтные клетки. Клетки инкубировали при 37 ° C и 5% CO 2 в течение 1 часа и встряхивали каждые 15 минут. Любой неабсорбированный раствор отсасывали из клеток и в каждую лунку добавляли 2,5 мл среды FBS. Планшеты инкубировали при 37 ° C и 5% CO 2 . Клетки наблюдали с помощью флуоресцентного микроскопа при 400-кратном увеличении каждые 6 часов после заражения в течение 24 часов.
Экстракция и количественное определение ДНК
ДНК экстрагировали из инфицированных клеток A549 и Vero, которые содержали либо 10% FBS-среду, либо 5% FBS-среду, соответственно, или равные объемы вируса HSV-1, обработанные в микроцентрифужной пробирке с 1,4 мМ BTE раствор или 10% FBS-среду (клетки A549), или один из следующих лизатов HSV-1 / BTE: концентрации 0,14 мМ, 14 мкМ, 1,4 мкМ и 0,14 мкМ (клетки Vero). Клетки инкубировали в течение 12 часов при 37 ° C и 5% CO 2 . ДНК из каждой из пяти групп клеток экстрагировали с помощью набора Qiagen DNeasy® Blood & Tissue Kit (Qiagen Sciences, Germantown, MD, США) в соответствии с протоколом производителя.Для количественного определения общего количества ДНК как в экстрагированной ДНК, так и в продуктах ПЦР использовали спектрофотометр NanoDrop ND-1000 с сопутствующим компьютерным программным обеспечением (NanoDrop Technologies Incorporated, Уилмингтон, Делавэр, США) в соответствии с протоколом производителя.
Дизайн праймера и амплификация вирусных генов с помощью полимеразной цепной реакции (ПЦР)
Три набора праймеров были разработаны для примирования различных областей генома HSV-1 на основе опубликованных последовательностей: HSV-1 US6 (кодирующий гликопротеин D), HSV- 1 GFP [19] и HSV-1 UL46 (кодирующий VP11 / VP12).Последовательность, температура плавления (T m ) и размер ампликонов прямого и обратного праймеров перечислены в таблице 1. ДНК (100 нг), экстрагированная из обработанных инфицированных HSV-1 клеток Vero и A549, добавляли к каждой реакции ПЦР. Стандартная ПЦР-амплификация выполнялась в реакциях объемом 25 мкл с начальной денатурацией при 95 ° C в течение 2 минут с последующими 30 циклами денатурации при 95 ° C в течение 30 секунд, отжигом при 60 ° C в течение 1 минуты и удлинением при 72 ° C в течение 30 секунд. секунд, после чего следует последний период продления при 72 ° C в течение 10 минут.Подтверждение правильного размера ампликона определяли электрофорезом в 1% агарозном геле и окрашиванием бромидом этидия.
Таблица 1
Последовательность, Т
м
и размер ампликона сконструированных праймеров, используемых в ПЦР
Бета-герпесвирус с флуоресцентными капсидами для изучения транспорта в живых клетках
Реферат
Флуоресцентное мечение вирусных частиц генетическими методами позволяет изучать динамику вирусов в живых клетках.Однако изучение проникновения и морфогенеза бета-герпесвируса этим методом в настоящее время ограничено. Это происходит из-за отсутствия компетентных к репликации флуоресцентных вирусов, меченных капсидом. Здесь мы сообщаем о жизнеспособных рекомбинантных MCMV, несущих эктопические вставки малого капсидного белка (SCP), слитого с флуоресцентными белками (FP). FP были вставлены во внутреннее положение, которое позволило продуцировать жизнеспособные, флуоресцентно меченые цитомегаловирусы, которые реплицировались с кинетикой дикого типа в культуре клеток.Флуоресцентные частицы легко обнаружить несколькими методами. Более того, в анализе распространения меченые капсиды накапливались вокруг ядра вновь инфицированных клеток без какой-либо детектируемой экспрессии вирусных генов, что свидетельствует о нормальном проникновении и перемещении частиц. Эти рекомбинанты использовали для записи динамики частиц с помощью микроскопии живых клеток во время выхода MCMV с высоким пространственным и временным разрешением. Из полученных треков мы получили не только средние скорости треков, но и их среднеквадратичные смещения и коэффициенты диффузии.Обладая этой ключевой информацией, мы смогли описать поведение частиц с высокой степенью детализации и различать треки частиц, демонстрирующие направленное движение, и треки, в которых частицы демонстрировали свободную или аномальную диффузию.
Образец цитирования: Bosse JB, Bauerfeind R, Popilka L, Marcinowski L, Taeglich M, Jung C, et al. (2012) Бета-герпесвирус с флуоресцентными капсидами для изучения транспорта в живых клетках. PLoS ONE 7 (7):
e40585.
https://doi.org/10.1371 / journal.pone.0040585
Редактор: Пол Дигард, Эдинбургский университет, Великобритания
Поступила: 21 января 2012 г .; Дата принятия: 9 июня 2012 г .; Опубликовано: 11 июля 2012 г.
Авторские права: © 2012 Bosse et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана Немецким исследовательским фондом как часть «Schwerpunktprogramm 1175» (SPP1175) и Bayerisch-FranzösischesHochschulzentrum / Centre de Coopération Universitaire Franco-Bavarois (BFHZ-CCUFB20) в рамках проекта FFHZ-CCUFB20. . JBB был поддержан стипендией PhD Немецкого национального академического фонда (Studienstiftung des deutschenVolkes). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Герпесвирусы — это двухцепочечные ДНК-вирусы, которые, по-видимому, эволюционировали вместе со своими соответствующими хозяевами [1]. В настоящее время известно восемь различных вирусов герпеса человека. Три могут быть сгруппированы в альфа-подсемейство (вирус простого герпеса 1, HSV-1; вирус простого герпеса 2, HSV-2; вирус ветряной оспы, VZV), три — в бета-подсемейство (цитомегаловирус человека, HCMV; вирус герпеса человека. 6, HHV-6; вирус герпеса человека 7, HHV-7) и два в гамма-подсемейство (вирус Эпштейна-Барра, EBV; вирус, связанный с карпози-саркомой, KSHV).Несмотря на клиническую важность всех герпесвирусов человека, большинство новаторских фундаментальных исследований проводится на изучении альфа-герпесвирусов. Однако неясно, в какой степени результаты, полученные в одном подсемействе, могут быть отнесены к другим герпесвирусам, поскольку сравнительные исследования литического жизненного цикла герпесвирусов возможны только после введения обратной генетики во все подсемейства [2], [3] , [4], [5].
Одним из менее понятных аспектов морфогенеза вирусов является динамика транспорта вирусных частиц.Эти динамические события лучше всего изучаются с помощью флуоресцентно меченных вирусных частиц в сочетании с флуоресцентной микроскопией живых клеток. В последние годы рекомбинантные вирусы, экспрессирующие слияния структурных белков с флуоресцентными белками, широко расширили наши представления о динамических процессах, участвующих в морфогенезе большого числа различных вирусов [6], [7], [8], [9], [9], [ 10], [11], [12], [13], [14], [15], [16].
Описанные подходы в отношении вирусов герпеса можно условно разделить на три группы.Первый подход — это мечение гликопротеина. Это позволяет отслеживать первые шаги инфекции от прикрепления до слияния с мембранами хозяина или от оболочки до высвобождения [17], [18]. Второй подход — использование белка тегумента в качестве партнера слияния [15], [19], [20]. В зависимости от используемого белка этот подход позволяет отслеживать события после слияния и до обертывания и даже в ядре хозяина после присоединения продукта слияния к капсиду. В последнем подходе используется капсидный белок [7], [21], [22].Только такой подход позволяет проследить большинство этапов морфогенеза вируса, за исключением тех, которые касаются исключительно процессинга вирусной ДНК. Хотя комбинация этих подходов [5], [23], [24], [25], [26] может быть полезна для различения этапов морфогенеза, например в оболочке из капсидов без оболочки. Поэтому рекомбинантный вирус, меченный капсидом, является наиболее желательным, поскольку он позволяет отслеживать почти все этапы морфогенеза. Однако до сих пор только альфа-герпесвирусы, такие как HSV-1, вирус псевдобешенства (PRV) и вирус герпеса лошадей типа 1 (EHV-1) [7], [22], [27], [28], [29], [ 30] могут быть созданы для экспрессии флуоресцентных капсидов.Напротив, все попытки слить флуоресцентные белки с капсидными белками бета- или гамма-герпесвирусов до сих пор не увенчались успехом [31], [32], [33].
Таким образом, мы стремились создать новые рекомбинантные бета-герпесвирусы, экспрессирующие меченые капсиды путем слияния флуоресцентного белка (FP) с капсидным белком. Однако это непростая задача. Большинство капсидных белков герпесвирусов подвергаются многочисленным и упорядоченным взаимодействиям друг с другом или с другими белками, чтобы построить капсид [32]. Чистая масса нескольких копий FP, необходимых для доставки яркого флуоресцентного сигнала, вызывает стерические проблемы и может сделать рекомбинантные вирусы нежизнеспособными.Как впервые описано Desai et al. [7] белок малого капсида (SCP) некоторых альфа-герпесвирусов, таких как HSV-1, PRV [22], VZV [21] и EHV [27], по-видимому, допускает аминотерминальное слияние с FP. Этот капсидный белок исключительно подходит в качестве партнера по слиянию, поскольку он расположен на самой внешней стороне структуры ядро-капсид, что, по-видимому, дает достаточную стерическую свободу для принятия слияния с объемными флуоресцентными белками. Более того, это очень распространенный белок с 900 копиями на капсид (6 копий на гексон), что дает достаточно яркий флуоресцентный сигнал при слиянии с флуоресцентным белком.
Тем не менее, мечение SCP в HSV-1 привело к умеренному дефекту роста с титрами, сниженными примерно до 50% по сравнению с вирусом дикого типа. Более того, степень ослабления была неотличима от степени ослабления нуль-мутанта SCP [5], что является аргументом в пользу того, что GFP-тегирование некоторых SCP сделало их биологически неактивными. Это дополнительно подтверждается другим исследованием PRV, показывающим, что аминотерминальное слияние с GFP делает продукт слияния биологически нефункциональным [34]. Таким образом, очевидно, что мечение SCP-объектов альфа-герпесвируса возможно только потому, что они не являются необходимыми для репликации вируса.
В отличие от альфа-герпесвирусов существенны SCP бета-, а также гамма-герпесвирусов, и все попытки слияния флуоресцентного белка с SCP этих подсемейств привели к нежизнеспособным или даже доминантно-отрицательным мутантам [31], [32]. ], [33], [35].
Здесь мы сообщаем о первом успешном создании флуоресцентных, меченных капсидом мышиных цитомегаловирусов (MCMV). Эти жизнеспособные вирусы несли эктопические вставки слияния SCP-FP, оставляя нетронутым локус дикого типа (WT) соответствующего гена SCP.Полученные рекомбинантные вирусы были жизнеспособными и демонстрировали яркие флуоресцентные сигналы. Мы использовали эти рекомбинантные вирусы для изучения транспорта капсида как во время проникновения вируса, так и во время его выхода путем отслеживания отдельных частиц. Мы смогли показать, что внутриклеточный транспорт MCMV-частиц в основном направлен и зависит от микротрубочек.
Материалы и методы
Клетки и вирусы
эмбриональных фибробластов мыши BALB / c (MEF), стромальных клеток костного мозга M2-10B4 (ATCC CRL-1972) и фибробластов NIH-3T3 (ATCC CRL-1658) получали и обрабатывали, как описано ранее [36].Все MCMV, использованные в этом исследовании, основаны на бактериальной искусственной хромосоме (BAC) pSM3fr-Δm1-16-FRT [37]. Соответствующий вирус, обозначенный MCMV-Δm1-16-FRT, лишенный крайних левых 16 генов, кодирующих вирусные иммуноэвазины [38], на протяжении всей этой работы обозначается WT, потому что его репликационные свойства недавно были тщательно изучены и, как было обнаружено, неотличимы от генов дикого типа. вирус в культуре ткани [37]. Все вирусы, представленные в этом исследовании, были восстановлены из соответствующих BAC путем нуклеофекции клеток NIH / 3T3.Нуклеофекцию проводили с использованием 96-луночной системы Shuttle Amaxa (Lonza) в соответствии с инструкциями производителей для клеток NIH-3T3. Вкратце, 5 × 10 5 клеток подвергали нуклеофекции с помощью 400 нг очищенной ВАС-ДНК и высевали вместе с 1,5 × 10 5 нетрансфицированных клеток в одну лунку 24-луночного планшета. Через 3 дня после нуклеофекции клеточный слой проверяли на наличие бляшек и делили на 1-4. Обычно через шесть дней после нуклеофекции можно было наблюдать полный CPE. Культуры собирали и образцы замораживали до нулевого пассажа.После этого инокуляты вируса были увеличены в масштабе на клетках M2-10B4, как описано ранее [36]. Титры вирусов определяли количественно на MEF с помощью стандартного анализа бляшек [39].
Анализ роста вирусов in vitro
MEF были инфицированы вирусами, подлежащими анализу в двух экземплярах при множественности инфицирования (MOI) 0,1 бляшкообразующей единицы (БОЕ) на клетку при 37 o C. Посевные клетки удаляли через 1 час, затем культуры промывали. три раза с фосфатно-солевым буфером Дульбекко (DPBS), добавляли нормальную среду и продолжали инкубацию.Супернатанты инфицированных клеток собирали ежедневно в дни с 1 по 5 после заражения, и количество высвобожденных инфекционных частиц определяли с помощью анализа бляшек на MEF.
Для определения размеров бляшек стандартные анализы бляшек на MEF проводили в 48-луночных планшетах, а инфицированные культуры покрывали карбоксиметилцеллюлозой, как описано ранее [39]. Через 5 дней после инфицирования наложение удаляли и проводили стандартное иммуноокрашивание (см. Ниже) с использованием моноклонального антитела против MCMV ie-1 [58] и соответствующих вторичных антител, конъюгированных с Alexa (Invitrogen).Цифровые изображения отдельных бляшек были получены с помощью конфокальной микроскопии (см. Ниже), а размер их пикселей был измерен с помощью инструмента ImageJs line [40] и преобразован в мкм.
Конструкция плазмиды
Для создания конструкции pOTO-S-GFP-SCP мы амплифицировали последовательность с праймерами SCPPfor и SCPPrev (таблица S1), связывающимися с положениями 74153–74173 и 73766–73786 штамма MCMV Smith (эталонная последовательность NCBI: NC_004065.1), соответственно. Ампликон кодировал предложенную последовательность промотора m48.2, а также первые 34 аминокислоты (аа) m48.2. Праймер SCPPfor добавил сайт Eco RV к 5′-концу, в то время как SCPPrev слил сайты Afl II и Spe I, а также кодирующую последовательность гемагглютинина (HA) -метки на 3′-конце. Фрагмент ПЦР разрезали с помощью Eco RV и Afl II и вставляли в ранее описанную плазмиду pO6-IET-gfpSCP [33], заменяя ее фрагмент Afl II — Ssp I.
Другой вариант этого вектора спасения, кодирующего слияние SCP с mCherry, был получен путем амплификации соответствующих флуоресцентных белков с праймерами SP- Afl II-FP- Bsr GI и ASP- Afl II-FP- Bsr GI (таблица S1) от pmCherry-C1 (Clontech), который добавил сайты Afl II и Bsr GI к соответствующим концам.Продукты ПЦР были разрезаны с использованием Bsr GI и Afl II и вставлены в ранее описанную плазмиду pOTO-S-GFP-SCP, заменив ее фрагмент Bsr GI- Afl II, что привело к pOTO-S- mCherry-SCP соответственно.
Для создания мутанта S-GFP-SCP *, лишенного последних 14 C-концевых кодонов открытой рамки считывания (ORF) SCP, родительский вектор pOTO-S-GFP-SCP был разрезан с помощью Pvu II и Apa. I, тем самым удаляя кодирующую последовательность для последних 17 аминокислот С-концевой области m48.2. Чтобы впоследствии восстановить недостающие девять кодонов, а также стоп-кодон, соответствующий участок pOTO-S-GFP-SCP был амплифицирован с праймерами SP-MCP и ASP-MCP (Таблица S1) и вставлен с помощью Pvu II и Apa I приводит к pOTO-S-GFP-SCP *.
Рекомбинационное клонирование для создания дрожжевых векторов-приманок и жертв для дрожжевых двух гибридных тестов в основном проводили, как описано в Fossum et al. [41]. Плазмиды pOTO-S-GFP-SCP или pOTO-S-GFP-SCP использовали в качестве шаблонов ПЦР для амплификации вставки с праймерами attB1-S-GFP-SCP-attB2-SP, attB1-S-GFP-SCP-binding-negative -No-Stop-attB2-ASP и attB1-SCP-S-GFP-SCP-no-stop-attB2-ASP (Таблица S1).Полученные продукты ПЦР подвергали ВР-рекомбинации с помощью Gateway-опосредованной рекомбинации в pDONR-221 в соответствии с инструкциями производителя (Invitrogen). Впоследствии кодирующие области были перенесены в добычную плазмиду pGADCg [42], создав плазмиды pGADCg-S-GFP-SCP и pGADCg-S-GFP-SCP *, которые кодируют слияние С-конца с доменом активации (AD). .
Целостность всех упомянутых выше конструкций была подтверждена аналитическими анализами и секвенированием ДНК важнейших элементов.
Конструирование рекомбинантных ВАС MCMV
Чтобы вставить кассеты экспрессии в ВАС MCMV, мы вставили описанные выше спасательные плазмиды в MCMV-BAC с помощью системы FRT / Flp. Штамм Escherichia coli Dh20B (Invitrogen), содержащий pSM3fr-Δm1-16-FRT BAC [37] и термочувствительную плазмиду экспрессии рекомбиназы Flp pCP20 [43], трансформировали различными pOTO-конструкциями, несущими различные слияния SCP, и обрабатывали, как описано ранее [33]. Правильные рекомбинации были проверены рестрикционным анализом и секвенированием in loco .
Анализ двух гибридных дрожжей
Дрожжевой двугибридный анализ взаимодействий между конструкциями SCP и MCP выполняли, как описано в протоколе производителя (BD Biosciences / Clontech). Вкратце, плазмида-приманка pGBKT7-MCP [41] трансформировалась в штамм дрожжей Y187, тогда как плазмиды-жертвы pGADCg-S-GFP-SCP и pGADCg-S-GFP-SCP * трансформировались в штамм Ah209. Диплоидные дрожжевые клетки, несущие оба вектора, были получены путем скрещивания штаммов и последующей селекции на среде SDC-Leu-Trp.Рост диплоидных клеток на среде SDC-Leu-Trp-His использовали для оценки взаимодействия приманки и молитвы через репортер HIS3. Плазмиды наживки и жертвы без вставок использовали в качестве контроля.
Очистка ядерных и внеклеточных MCMV частиц с градиентом плотности
Градиентную очистку внеклеточных частиц MCMV проводили либо на самоформирующихся градиентах Optiprep (Sigma), либо с 10–40% предварительно сформированным Nycodenz (Axis-Shield). В обоих случаях супернатанты от инфицированных вирусом клеток центрифугировали на низкой скорости (5500 г / 15 мин) для удаления клеточного дебриса.После этого вирионы концентрировали высокоскоростным центрифугированием (23000 g / 210 мин) и полученный осадок вируса осторожно ресуспендировали в VS-буфере (0,05 М Трис, 0,012 М KCL, 0,005 М EDTA, pH 7,8). Свободную ДНК / РНК удаляли обработкой в течение ночи 625 ед. / Мл Benzonase (Novagen) при 4 ° C.
Очистку в градиенте Найкоденца в основном проводили, как описано в Doehner et al. [44]. Вкратце, полученную суспензию загружали в непрерывный градиент плотности 10-40% Nycodenz (Axis-Shield), приготовленный на GradientStation ip (Biocomp), и разделяли при 20000 g в течение 105 мин в роторе Beckman SW28 при 4 ° C. .Полученные полосы были визуализированы и собраны на GradientStation ip .
Очистку частиц в самоформирующихся градиентах Optiprep проводили путем смешивания равных количеств 60% раствора Optiprep и ресуспендированных гранул. Затем смесь загружали в центрифужные пробирки и вращали при 144000 g в течение 16 часов. Полученные полосы визуализировались над источником света и собирались.
Очистку ядер MCMV в градиенте сахарозы проводили, как описано Radtke et al.[45]. После очистки по плотности на градиенте сахарозы полосы собирали, как описано выше. Все фракции были проанализированы с помощью стандартной электронной микроскопии (ЭМ) с отрицательным окрашиванием [46], подтверждающей их целостность и чистоту.
Аналитические полимеразные цепные реакции (ПЦР)
Вирусная ДНК была экстрагирована из обработанных бензоназой (Novagen), градиентно очищенных вирионов с использованием набора для крови и тканей DNeasy (Qiagen) в соответствии с инструкциями производителя. Его количественно оценивали с помощью ПЦР в реальном времени с использованием детектора последовательности ABI Prism 7700 (Applied Biosystems).Перед амплификацией очищенную ДНК расщепляли с помощью Pae I в течение 1 ч при 37 ° C с последующей тепловой инактивацией. Чтобы определить отношение числа копий вирусного генома к БОЕ, количественную ПЦР проводили для каждого образца в трех повторностях с использованием праймеров и зондов, специфичных для MCMV M54, как описано Scrivano et al. [47]. Затем рассчитывали число копий вирусной ДНК, сравнивая амплификацию со стандартной кривой, построенной с использованием ДНК-матрицы pSM3fr-BAC. Чтобы нормализовать потерю ДНК во время очистки, мы определили соотношение определенного количества ДНК pSM3fr-BAC до и после очистки.
Иммуноблоттинг
Экспрессию вирусного белка анализировали путем инфицирования конфлюэнтного слоя клеток M2-10B4 при MOI 1 в течение 48 часов в чашках диаметром 6 см. Затем клетки промывали DPBS и лизировали в буфере для общего лизиса (62,5 мМ Трис, pH 6,8, 2% (об. / Об.) Додецилсульфат натрия (SDS), 10% (об. / Об.) Глицерин, 6 М мочевина, 5% (об. / об.) β-меркаптоэтанол, 0,01% (мас. / об.) бромфенолового синего, 0,01% (мас. / об.) фенолового красного) плюс 125 ед. Benzonase (Novagen) в течение 90 мин при 4 ° C. После денатурации при 95 ° C в течение 10 мин образцы наносили на 15% SDS-полиакриламидные гели и разделяли электрофорезом (SDS-PAGE).
Для анализа белков из очищенных вирионов объем, соответствующий приблизительно 1,1 × 10 5 БОЕ препарата градиентно очищенного вируса на дорожку, разбавляли в 10 мл буфера TNE (100 мМ NaCl, 10 мМ ЭДТА, 50 мМ Трис-Cl pH 7,5). Частицы вируса осаждали центрифугированием образцов при 107000 g в течение 1 часа при 4 ° C. Супернатант удаляли и осадок ресуспендировали в восстанавливающем буфере 1 × LDS (Invitrogen), загруженном на 4-15% гели Bis-Tris (Invitrogen). и разделены SDS-PAGE.
После SDS-PAGE разделенные белки переносили на мембраны PVDF в присутствии буфера для блоттинга (25 мМ Трис, 192 мМ глицин, 20% (об. / Об.)] Метанол, pH 8,3). Мембраны блокировали в TBS-T (трис-буферный солевой раствор, 0,05% (об. / Об.) Твин 20), содержащем 5% BSA или 5% сухого молока, в течение 1 ч при комнатной температуре (RT). Для обнаружения SCP MCMV была создана поликлональная антисыворотка, направленная против SCP, путем иммунизации кроликов связанными с овальбумином (OVA) пептидами, соответствующими аминокислотам 36-50 и 59-86 m48.2 ORF (Метабион). Для обнаружения МСР использовали поликлональную антисыворотку крыс [33]. GFP обнаруживали поликлональной кроличьей антисывороткой (Invitrogen). mCherry был обнаружен с помощью поликлональной кроличьей антисыворотки, щедро предоставленной Винсентом Гели (CNRS, Марсель) через Земера Гитаи (Принстонский университет). Заблокированные мембраны инкубировали с соответствующей антисывороткой в течение ночи при 4 ° C, а затем промывали TBS-T и инкубировали с соответствующим вторичным антителом, конъюгированным с пероксидазой хрена (POX).HA-метку выявляли с помощью HA-специфического POX-конъюгированного моноклонального крысиного антитела (Roche) в соответствии с инструкциями производителя. Реакции вестерн-блоттинга визуализировали с помощью субстрата SuperSignal West Dura Extended Duration Substrate (Pierce) с использованием считывающего устройства Fusion luminiscence (Vilber) или авторадиографической пленки и затем сканировали. Затем изображения вестерн-блоттинга были немного увеличены с помощью инструмента «Маска нерезкости» в Adobe Photoshop.
Иммобилизация вирионов на покровных стеклах
Иммобилизацию частиц MCMV проводили путем загрузки приблизительно 1 × 10 5 БОЕ очищенных в градиенте плотности вирусных препаратов, разведенных в 200 мкл DBPS, на покрытые фибронектином стеклянные покровные стекла и инкубировали в течение 1 часа при 37 ° C.После связывания вирионы подвергали иммуноокрашиванию, как описано ниже.
Иммуноокрашивание для микроскопии
Непрямой иммунофлуоресцентный анализ проводили на предметных стеклах, микропланах с каналами или 8 лунками (Ibidi) путем фиксации клеток или вирионов 4% параформальдегидом в DPBS (мас. / Об.) В течение 10 мин при 37 ° C. В фиксирующий раствор дважды добавляли DPBS, и клетки подвергали проницаемости в течение 10 минут с помощью раствора 0,1% Triton X-100 в DPBS. После обширной промывки DPBS клетки блокировали с использованием 3% (мас. / Об.) BSA в DPBS (блокирующем растворе) в течение 1 часа при комнатной температуре.Первичные антитела (поликлональная антисыворотка крыс против MCP [33], поликлональная антисыворотка кролика против GFP (Invitrogen), крысиные моноклональные антитела против HA-tag (Roche)) наносили в блокирующий раствор и инкубировали с клетками или вирионами при комнатной температуре. в течение 1 ч с последующими тремя стадиями промывки DPBS и 1 ч инкубации при комнатной температуре с 1-1000 разведений конъюгированных с Alexa Fluor специфических вторичных антител (Invitrogen) в блокирующем растворе. После заключительной стадии обширной промывки DPBS препараты были визуализированы непосредственно или помещены на предметные стекла с помощью Prolong Gold (Invitrogen).
Количественная оценка распределения интенсивности флуоресценции частиц
Примерно 1 × 10 4 БОЕ градиентно очищенных вирусных препаратов, разведенных в 400 мкл DPBS, связывали на покрытых поли-лизином чашках со стеклянным дном (MatTek) в течение 1 ч при 4 ° C в темноте. После этого чашки промывали один раз DPBS и непосредственно отображали на эпифлуоресцентном микроскопе Nikon, оборудованном объективом 60 × NA 1,4. Снимки были записаны в 16-битном режиме с помощью камеры EMCCD (Andor iXon 3), а время экспозиции, а также усиление электромагнитного излучения были скорректированы для максимизации записанного динамического диапазона.
Анализ изображений проводился в Matlab 2011b с использованием специально разработанного программного пакета. Подпрограммы загружали каждое сохраненное изображение, удаляли медленно меняющийся фон, находили самые яркие объекты (те, которые превышают стандартное отклонение фона более чем в 2,5 раза) в каждом изображении, извлекали интересующую область вокруг каждого объекта-кандидата, затем подгоняли каждого кандидата к 2D гауссов профиль. Локации потенциальных источников были отделены от ложных событий, несовместимых с двухмерной моделью функции рассеяния точки, путем выборочного сокращения степени согласия (хи-квадрат) и ширины соответствия.Остальные данные информировали о распределении флуоресценции исходной популяции. После первоначального выделения и отбора оставшиеся частицы использовали для определения распределения флуоресценции в популяции путем интегрирования наиболее подходящей гауссовой модели по интересующей области для каждой частицы.
Флуоресцентная микроскопия
Конфокальная лазерная сканирующая микроскопия
была выполнена с использованием системы Zeiss LSM510 Meta, системы LSM710 или системы Olympus FV1000, оснащенной масляными иммерсионными объективами с высокой числовой апертурой.GFP возбуждали лазерной линией 488 нм. mCherry возбуждали лазерной линией 543 нм или 561 нм. Эмиссию флуоресценции белка регистрировали с помощью соответствующих наборов фильтров микроскопов. Фторсодержащие красители Alexa были обнаружены в соответствии с инструкциями производителя. Диаметры точечных отверстий были отрегулированы до ширины, соответствующей толщине оптического среза 1 мкм для всех каналов. Размеры пикселей были выбраны на основе критериев Найквиста и варьировались около 110 нм / пиксель в случае объектива 63x, NA 1,4.В общем, были выбраны условия визуализации, которые привели к оптимальному компромиссу между освещением и шумом детектора и поддерживались постоянными между съемками одного и того же эксперимента. Визуализацию живых клеток проводили с клетками, растущими на µ-предметных стеклах (Ibidi) или чашках со стеклянным дном (MatTek). Во время сбора клетки инкубировали в камере с контролируемой средой при 37 ° C либо с 5% CO 2 , либо в среде, не зависящей от CO 2 (Invitrogen). Все изображения были обработаны в соответствии с рекомендациями журналов с использованием ImageJ [40], а также программного обеспечения Photoshop CS4 (Adobe).В частности, шум в покадровой съемке был уменьшен с помощью фильтрации Калмана в ImageJ. Постепенное обесцвечивание было исправлено с помощью плагина ImageJ Bleach Correction (написанного Дж. Ридорфом). Все изображения были усилены контрастом для оптимизации для печати.
Отслеживание отдельных частиц
Полученные картины флуоресценции отдельных вирусных частиц были аппроксимированы двумерной функцией Гаусса: (1) где A 0 и σ — амплитуда и ширина на полувысоте двумерной кривой Гаусса, а x 0 и y 0 координаты положения отдельных вирусных частиц.Процедура отслеживания отдельных частиц была автоматизирована с использованием специально написанного программного обеспечения Labview (National Instruments) [48].
Для каждой траектории набор значений квадратного смещения r 2 (t) между двумя наблюдениями, разделенных временной задержкой t lag = n • Δt (где Δt — временной интервал между последовательными кадрами фильмы, n = 0, 1, 2,…, N-1, где N — общее количество точек на траектории) вычислялось согласно: (2)
Затем были построены среднеквадратические смещения (MSD =
Нормальная диффузия: (3)
Аномальная диффузия: (4)
Направленное движение с диффузией: (5) где D — коэффициент диффузии, α — аномальный показатель, а v — скорость направленного переноса.
Чтобы определить для каждой отдельной траектории, какой режим движения лучше всего описывает данные, каждый график MSD был аппроксимирован уравнениями 3, 4 и 5, и были сравнены уменьшенные значения хи-квадрат подгонок. Модель нормальной диффузии (Уравнение 3) использовалась до тех пор, пока более сложные модельные функции для аномальной диффузии (Уравнение 4) и направленное движение с диффузией (Уравнение 5) не приводили как минимум к двукратному уменьшению приведенной ци. -квадрат пригонки. В случаях, когда это условие выполнялось, выбирался режим движения с минимальным приведенным хи-квадрат.Следовательно, эта процедура приводит к кластеризации диффундирующих частиц в три различных класса, представляющих различные режимы диффузии.
Просвечивающая электронная микроскопия (ЭМ)
Клетки
NIH 3T3 или M2-10B4 выращивали на сапфировых дисках с углеродным покрытием и инфицировали при MOI 0,5 с центрифугированием при 1600 g / RT в течение 30 мин. Еще через час инокулят заменяли нормальной средой и клетки инкубировали в течение 48 часов. Затем клетки фиксировали замораживанием под высоким давлением с помощью прибора HPF 01 (М.Wohlwend GmbH), замороженные и залитые пластиком, как описано ранее [50]. Встроенные образцы были разрезаны на тонкие срезы и просмотрены на Zeiss EM 10 при 80 кВ в режиме передачи. Фенотип инфицированных клеток NIH 3T3 или M2-10B4 не отличался. Снимки были записаны на пленку EM (MACO), оцифрованы с разрешением 1200 dpi, с усилением контраста и резкостью с нерезкой маской в соответствии с рекомендациями журналов в Photoshop CS4 (Adobe).
Иммуноэлектронная микроскопия
Ядерные капсиды адсорбировали на угле и покрывали пленкой Formvar медные сетки 400 меш (Stork Veco), образцы промывали PBS.После блокирования сайтов связывания неспецифических белков с помощью 10 мг / мл BSA в PBS сетки инкубировали в течение 30 минут с кроличьей антисывороткой GFP (Invitrogen, разведение 1 × 100), затем промывали PBS с последующей 15-минутной инкубацией с белком A gold. (10 нм; Центр клеточной микроскопии, Утрехтская школа медицины, Нидерланды). После промывания PBS и дистиллированной водой препараты отрицательно контрастировали с использованием 2% (мас. / Об.) Уранилацетата (Merck) и анализировали с помощью Tecnai G20 (FEI) при 200 кВ. Для количественного анализа изображения капсидов были взяты случайным образом с увеличением 55000x.
Результаты
Создание рекомбинантных MCMV, продуцирующих флуоресцентные капсиды
Нашей целью было изучение динамики капсида бета-герпесвируса в живых клетках. Однако жизнеспособный, меченый капсидом бета-герпесвирус не был доступен для отслеживания перемещений вирусных частиц в живых клетках. Поэтому мы проанализировали опубликованные подходы к созданию флуоресцентных вирусов герпеса, меченных капсидом. Поскольку мы хотели разработать инструмент, который позволил бы отслеживать также появляющиеся вирусные частицы, начиная с первых шагов созревания капсида, мы решили пометить SCP.Помимо SCP, не было сообщений об успешном подходе, в котором использовался бы известный компонент прокапсидов вируса герпеса. Благодаря расположению этого белка на внешней оболочке капсида, он может позволить добавлять объемные белковые метки без стерического нарушения важных белок-белковых взаимодействий. SCP важен для бета- и гамма-герпесвирусов [31], [32], [35], но не важен для HSV, PRV и VZV [21], [22], [51]. Все опубликованные испытания, касающиеся бета-герпесвирусов, основывались на прямом слиянии флуоресцентного белка (FP) на самом N-конце SCP или с ним, что напоминало стратегию, первоначально опубликованную Desai et al.[7]. Полученные гибридные белки были нефункциональными, а в некоторых случаях даже доминантно-отрицательными, тем самым предотвращая восстановление вируса [31], [32], [33]. Таким образом, мы пришли к выводу, что свободный N-конец или мотив последовательности на самом N-конце SCP бета-герпесвируса важен для его функции. Это было дополнительно подтверждено выравниванием аминокислотных (аа) последовательностей всех SCP бета-герпесвируса, доступных в настоящее время в базах данных, которое показало некоторую консервативность в этой области (рис. 1А). Наиболее важным в этом контексте было открытие, что MCMV кодирует последовательность, подобную GS-линкеру, на своем N-конце SCP (а.о. с 10 по 34).Этот линкер, по-видимому, разделяет N-конец на две отдельные области (Fig. 1A). Мы предположили, что этот линкер придает N-концу гибкость, которая может потребоваться для его взаимодействия с белками капсида. Объемный партнер слияния, такой как GFP, может препятствовать этим взаимодействиям простыми стерическими средствами, или данная гибкость этой линкерной последовательности может не допускать необычного увеличения размера. Поэтому мы решили продублировать саму N-концевую область, состоящую из первых 34 аминокислот, и слили ее, разделенную дополнительным линкером и HA-меткой, с N-концом GFP.Затем эту конструкцию сливали с полноразмерной последовательностью SCP, которая включает вторую, WT-копию N-концевого домена (рис. 1B). Поскольку эта конструкция состоит из первой трети SCP (S), зеленого флуоресцентного белка (GFP) и полноразмерного SCP, мы назвали эту конструкцию S-GFP-SCP. Чтобы включить обнаружение в различных настройках визуализации, мы также заменили кодирующую последовательность GFP на открытые рамки считывания mCherry, сохранив тот же контекст SCP. Чтобы сделать возможным внедрение на основе технологии ВАС в вирусный контекст посредством простой реакции, опосредованной Flp-рекомбиназой, мы сконструировали эти гибридные гены на основе ранее опубликованной плазмиды pO6-IET-gfpSCP [33].Плазмиду pOTO-S-GFP-SCP эктопически вставляли в ВАС pSM3fr-Δm1-16-FRT. Этот ВАС кодирует MCMV-Δm1-16-FRT, вирус, в котором первые 16 генов слева удалены и вставлен сайт FRT. Делеция этих генов обеспечивала достаточную способность к клонированию для вставки рекомбинантных плазмид. Этот вирус был тщательно охарактеризован, и было обнаружено, что он неотличим от MCMV дикого типа в культуре ткани [37]. Более того, рекомбинантные MCMV со сходными субтерминальными делециями также реплицируются как WT MCMV in vitro [38], [52].Поскольку кодирующая последовательность флуоресцентного белка (FP) в векторе pOTO-S-GFP-SCP фланкирована I-сайтами Spe , это позволило опосредованному Spe I удалить FP, что привело к слитой конструкции, которая был только что помечен тегом HA. Эта конструкция использовалась для контроля эффектов вставки, зависящих от размера. Рис. 1B в общем изображает полученные конструкции.
Рис. 1. Конструирование слитых белков SCP.
(A) Сопоставление последовательностей SCP бета-герпесвируса с T-Coffee [62].Встречающаяся в природе последовательность, подобная глицин-серин-линкеру, разделяет N-конец в MCMV. (B) Подробное представление слитого белка S-GFP-SCP, а также основная генетическая структура используемых мутантных вирусов, несущих флуоресцентный белок (FP) и метку гемагглютинина (HA). GFP или mCherry использовались в качестве FP. FP может быть удален с помощью простого SpeI-опосредованного дайджеста, что приводит к конструкции, кодирующей только SCP с меткой HA. N обозначает дублированную N-концевую область SCP. Плазмиды, несущие слитые конструкции, вставляли в ВАС MCMV посредством Flp-опосредованной рекомбинации.
https://doi.org/10.1371/journal.pone.0040585.g001
Восстановление рекомбинантных MCMV
Восстановление конструкций pSM3fr-Δm1-16-FRT-pOTO-S-FP-SCP в клетках NIH-3T3 привело к появлению флуоресцентных бляшек с отчетливым паттерном флуоресценции, которые в основном локализованы в ядрах инфицированных клеток (см. Рис. 2A для репрезентативный пример рекомбинантной экспрессии S-GFP-SCP). Морфология и размер бляшек были сопоставимы с бляшками вируса WT (рис.2А, В). Такие же результаты были получены для других рекомбинантов, экспрессирующих S-FP-SCP и S-HA-SCP (фиг. 2C). Чтобы выяснить кинетику роста рекомбинантного вируса, мы построили многоступенчатые кривые роста на клетках MEF. Все слияния S-FP-SCP, использованные в этом исследовании, а также мутант S-HA-SCP показали кинетику роста, сравнимую с WT (рис. 2B).
Рис. 2. Мутанты, несущие помеченные SCP, жизнеспособны.
(A) WT (WT), а также мутантные вирусы, кодирующие HA- (S-HA-SCP) или HA-GFP-меченый SCP wt (S-GFP-SCP), титровали на клетках MEF.Через 4 дня после инфицирования (dpi) клетки фиксировали PFA и обрабатывали для иммунофлуоресценции против HA-эпитопа. Масштабные линейки представляют 100 мкм. (B) Многоступенчатая кривая роста мутантных вирусов, использованных в этом исследовании, по сравнению с вирусом WT. C) Сравнение диаметров бляшек одновременно титрованного WT, HA-, GFP- и mCherry-tagged вируса 4 dpi на клетках MEF. (D) Соотношение генома к БОЕ GFP-меченого вируса и вируса WT. Соотношение между содержанием генома и титром для двух независимо приготовленных и очищенных исходных вирусов на вирус определяли титрованием и количественной ПЦР в трех повторностях.
https://doi.org/10.1371/journal.pone.0040585.g002
Чтобы сравнить инфекционность вирионов S-GFP-SCP с вирионами WT, мы сначала определили соотношение генома к БОЕ. С этой целью мы подготовили градиентно очищенные вирусные запасы обоих вирусов, которые регулярно проверяли на целостность и чистоту с помощью электронной микроскопии (ЭМ) с отрицательным окрашиванием. Впоследствии мы определили инфекционность препаратов с помощью стандартного анализа бляшек, а также копий генома с помощью количественной ПЦР.Измеренные копии генома должны равняться количеству ДНК, упакованной в вирусные частицы, поскольку запасы вируса обрабатывались разрушающим ДНК ферментом бензоназой в процессе очистки. Средние значения двух независимых градиентных очисток с одновременной количественной оценкой копий генома в трех экземплярах с помощью ПЦР в реальном времени, а также анализов бляшек для определения количества БОЕ сравнивались, и полученные соотношения предполагали, что рекомбинантные вирусные частицы, экспрессирующие S-GFP-SCP, и Частицы WT демонстрируют аналогичную инфекционность (23 vs.25 геномов / БОЕ соответственно, см. Рис. 2D). На основании этих данных мы пришли к выводу, что наш новый подход не оказал заметного влияния на жизнеспособность рекомбинантного MCMV.
Характеристика частиц MCMV, меченных FP
Затем мы проанализировали, продуцирует ли рекомбинантный вирус S-GFP-SCP вирионы, меченные GFP. С этой целью очищенные градиентом вирионы иммобилизовали на покрытых фибронектином покровных стеклах и проводили непрямой иммунофлуоресцентный анализ (IF) с антисывороткой против главного капсидного белка MCP [33], а также с антисывороткой, направленной против GFP (рис.3А). Затем мы записали соответствующие сигналы флуоресценции и подсчитали количество частиц в репрезентативных областях с помощью плагина ImageJ «Анализировать частицы». Колокализация определялась командой «Колокализация» и последующим подсчетом колокализованных частиц. Всего мы насчитали 2653 MCP-положительных частицы. 91,46% + / — 3,88% из них совместно локализовались с антисывороткой, направленной против GFP, что указывает на то, что большое количество частиц включает обнаруживаемые количества S-GFP-SCP. 83,42% + / — 3,64% всех MCP-положительных частиц также можно было обнаружить по их эндогенной флуоресценции GFP на низком конфокальном микроскопе.
Рис. 3. SCP-объекты, помеченные GFP, встроены в вирусные частицы.
(A) Градиентно очищенные вирусные частицы иммобилизовали на покрытых фибронектином покровных стеклах, зафиксировали и обработали для иммунофлуоресценции. MCP-специфическая поликлональная сыворотка использовалась в качестве индикатора вирусных капсидов, а GFP-специфическая поликлональная антисыворотка использовалась для сравнения MCP- и GFP-специфических сигналов. Прямая флуоресценция GFP была обнаружена путем возбуждения лазерным светом 488 нм и соответствующими фильтрами излучения.На вставках изображено 2-кратное увеличение. Масштабные линейки представляют 10 мкм и 2,5 мкм во вставках. (B) Количественная оценка распределения интенсивности флуоресценции частиц. Очищенные градиентом препараты вируса S-GFP-SCP или S-mCherry-SCP связывали на покрытых поли-лизином чашках со стеклянным дном, и флуоресцентные пятна регистрировали в 16-битном режиме. Время экспозиции, а также усиление ЭМ были скорректированы, чтобы максимизировать записанный динамический диапазон. На графике показано интегрированное распределение флуоресценции для S-GFP-SCP (черный) и S-mCherry-SCP (красный).(C) Иммуноблоттинг градиентно очищенных вирусных частиц. Приблизительно 1 * 10 5 БОЕ на полосу веса, (WT), S-GFP-SCP (S-GFP-SCP), S-mCherry-SCP (S-mCherry-SCP) или S-GFP-SCP * ( S-GFP-SCP *) были раскручены и лизированы. Белки разделяли с помощью SDS-PAGE, блотировали и подвергали иммунодетекции с помощью поликональных сывороток против SCP, GFP и mCherry. (D) Иммуноэлектронная микроскопия очищенных ядерных капсидов. Ядерные капсиды очищали от инфицированных клеток wt (WT), S-GFP-SCP (S-GFP-SCP) или S-GFP-SCP * (S-GFP-SCP *) и иммуно-золотом, меченного антителом против GFP с последующим белок А, связанный с золотом 10 нм.Масштабная линейка показывает 50 нм. (E) Количественная оценка интенсивности маркировки золотом. Количество золотых шариков на капсид было подсчитано по меньшей мере для 20 представлений, содержащих по меньшей мере 20 капсидов на состояние, как показано на (D). Отображаются среднее и стандартное отклонение.
https://doi.org/10.1371/journal.pone.0040585.g003
Затем мы хотели выяснить, приводило ли использование разных FP для маркировки SCP MCMV к разному распределению интенсивности флуоресценции, как это было недавно описано для мутантов PRV, несущих либо EGFP или mCherry пометили SCP [30].С этой целью мы иммобилизовали либо очищенные градиентом EGFP, либо меченные mCherry вирионы на покрытых поли-L-лизином покровных стеклянных чашках и регистрировали флуоресценцию частиц непосредственно без фиксации с помощью 16-битной камеры EMCCD с высоким динамическим диапазоном. Для меченых mCherry вирионов первоначально было выделено 8120 событий-кандидатов, из которых 5675 (~ 70%) были использованы для определения распределения флуоресценции. Для вирионов, меченных GFP, первоначально было выделено 2746 событий-кандидатов, из которых 2170 (~ 79%) были использованы для определения распределения флуоресценции.Яркость флуоресценции каждого события определялась путем интегрирования наиболее подходящей гауссовой модели по интересующей области (рис. 3B).
Для сравнения гистограмм интенсивности мы определили полную ширину на полувысоте (FWHM) обоих вирусов, что является безразмерным описанием степени распространения. FWHM для S-mCherry-SCP составлял около 0,9 * 10 5 , в то время как FWHM для S-GFP-SCP составлял около 0,5 * 10 5 , что указывает на то, что популяции вирусов, продуцируемые MCMV S-GFP-SCP и MCMV S-mCherry-SCP несут сопоставимые минимальное и максимальное количество флуоресцентного белка SCP.Интересно, что оба распределения согласуются с мультимерными гауссовыми распределениями, что особенно заметно в данных GFP. Вполне возможно, что предлагаемые мультимеры, представляющие более высокие интенсивности, связаны с мультимерами частиц, образующимися на этапах приготовления, или с вирусными частицами, имеющими несколько капсидов, как мы регулярно наблюдали в T-EM инфицированных клеток (данные не показаны).
Затем мы использовали вестерн-блоттинг для визуализации SCP, меченных GFP или mCherry, в препаратах вирусов, очищенных градиентом (рис.3С). Мы использовали три антисыворотки, одна специфична для SCP, а другая — для GFP или mCherry. Мы смогли обнаружить WT SCP в родительском, а также в помеченном GFP и mCherry вирусе с массой примерно 17 кДа, что больше, чем рассчитанный размер около 10 кДа (рис. 3С), что может отражать посттрансляционную модификацию. Кроме того, используя реактивную сыворотку GFP, мы обнаружили две полосы, специфичные для S-GFP-SCP и S-mCherry-SCP, каждая из которых имеет диапазон приблизительно от 40 до 50 кДа. Однако верхняя специфическая полоса GFP была намного слабее, чем специфическая полоса mCherry.Обе полосы также могут быть обнаружены антисывороткой, реактивной к SCP, что указывает на то, что эти две полосы соответствуют производным S-FP-SCP. Эти данные показали, что слитый белок включен в вирусные частицы. Тем не менее, специфичные для верхних GFP и mCherry полосы были примерно на 8 кДа выше, чем ожидалось для конструкций S-GFP-SCP или S-mCherry-SCP, что могло отражать посттрансляционную модификацию, как это видно для WT SCP, в то время как нижние полосы отражали немодифицированные форма. Более того, соотношение между ними было другим при использовании GFP и помеченного вирусом mCherry, что, возможно, отражает различия в объеме посттрансляционной обработки.
S-GFP-SCP взаимодействует с MCP и включается в вирусные капсиды зависимым от MCP способом
Мы смогли показать, что очищенные вирусные частицы являются флуоресцентными и что эта флуоресценция совмещена с окрашиванием анти-MCP. Однако этого анализа недостаточно, чтобы различить специфическое включение S-GFP-SCP в капсид и неспецифическое включение гибридного белка в вирионы через тегумент из-за его высокой распространенности на поздних этапах инфицирования.Поэтому мы спросили, может ли слитый белок S-GFP-SCP специфически взаимодействовать с капсидом или с компонентом капсида.
Поскольку основная часть тегумента набирается на капсиды в цитоплазме, мы очистили ядерные капсиды от клеток, инфицированных S-GFP-SCP, чтобы проверить, связывается ли S-GFP-SCP с капсидами. Затем мы выполнили иммуноэлектронную микроскопию с GFP-специфической антисывороткой на этих капсидах и сравнили соответствующую плотность золотых шариков с ядерными капсидами дикого типа (рис. 3D). Мы смогли обнаружить в среднем примерно 15 золотых шариков на ядерных капсидах S-GFP-SCP, в то время как ядерные капсиды WT с золотой маркировкой не были значительно выше фоновой частоты, свидетельствующей о специфическом включении S-GFP-SCP в капсиды (рис.3D).
Для дальнейшего развития нашего представления мы решили спросить, взаимодействует ли S-GFP-SCP конкретно с компонентом капсида. Для этого мы использовали генетический подход. Было показано, что HCMV SCP и MCP взаимодействуют через короткий C-концевой пептид SCP [53]. Поэтому мы сначала проверили, верно ли это для гомологов MCMV, используемых в нашем исследовании. С этой целью мы удалили соответствующий пептид из гибридного белка S-GFP-SCP и протестировали этот мутант (S-GFP-SCP *), а также родительский S-GFP-SCP в дрожжевом двугибридном (Y2H). настройка против MCP.Как показано на фиг. S1, слитый белок S-GFP-SCP взаимодействовал с MCP, в то время как мутант S-GFP-SCP *, лишенный предполагаемой области связывания MCP, не взаимодействовал.
Зная, что S-GFP-SCP взаимодействует с MCMV MCP через свой MCP-связывающий мотив, мы затем хотели узнать, может ли S-GFP-SCP * неспецифически включаться в ядерные капсиды. Поэтому мы создали мутант MCMV, эктопически экспрессирующий описанный выше мутант S-GFP-SCP *, который не может связываться с MCP и, следовательно, не обогащен ядрами инфицированных клеток (см.также рис.S2). Очистив ядерные капсиды от этого мутанта и используя их в иммуно-ЭМ-зондировании для GFP, мы смогли контролировать взаимодействие между S-GFP-SCP и MCP в контексте вируса. Как показано на рис. 3D и 3E, нанесение золотых шариков на капсиды S-GFP-SCP * было неотличимо от того, что было видно на частицах WT, ясно доказывая, что S-GFP-SCP * не был включен в ядерные капсиды. Более того, мы также не смогли обнаружить GFP-специфический сигнал при вестерн-блоттинге градиентно очищенных вирионов S-GFP-SCP * (рис.3C), показывая, что S-GFP-SCP * также не был включен неспецифично в вирионы, например слой тегумента. Взятые вместе, наши результаты показали, что слитые белки S-FP-SCP взаимодействуют с капсидами и что это взаимодействие является специфическим и опосредовано MCP.
Вирусные мутанты, меченные S-GFP-SCP и S-HA-SCP, являются генетически стабильными
Вирусные геномы, несущие неблагоприятные мутации, сталкиваются с негативным эволюционным давлением. Следовательно, возникновение адаптивных генетических изменений в мутантном локусе является признаком снижения вирусной пригодности данного мутанта.Чтобы решить проблему генетической стабильности и оценить пригодность наших конструкций, мы пассировали S-GFP-SCP, несущий вирус 5, а также 10 раз на клетках M2-10B4. В качестве контроля мы использовали вирус WT и вирус, экспрессирующий S-HA-SCP. Мы рассудили, что последний служит хорошим контролем для эффектов, зависящих от размера вставки, из-за очень малого размера HA-тега по сравнению с GFP.
Во-первых, мы хотели узнать, как экспрессируется наш продукт слияния и какие изменения в экспрессии белка произошли после продолжительных пассажей.Поэтому мы инфицировали клетки M2-10B4 пассажами 0, 5 и 10 вышеупомянутых вирусов, лизировали клетки 48 hpi и выполнили иммуноблоттинг, специфичный для GFP, SCP и HA. Как показано на рис. 4, мы смогли обнаружить специфический сигнал SCP во всех инфицированных MCMV образцах (полоса g на рис. 4). Мы также смогли обнаружить специфичную для S-HA-SCP полосу (полоса f) примерно с 22 кДа вместо предполагаемых 12 кДа как с SCP, так и с антисывороткой, специфичной для метки HA, что снова отражает возможную посттрансляционную модификацию. В дорожках, соответствующих клеткам, инфицированным S-GFP-SCP, мы могли определить три полосы (полосы a, b, c), окрашенные специфично для SCP, GFP и HA-метки.Две меньшие (полосы b и c), расположенные рядом с полосой маркера 46 кДа, напоминали полосы, обнаруженные в очищенных вирионах (рис. 3C), в то время как более медленная мигрирующая полоса, проходящая под маркером 58 кД (полоса a), не была обнаружена в вирионы. Более того, мы смогли обнаружить еще две полосы (полосы d и e) ниже 46 кДа, которые были окрашены положительно только антисывороткой против GFP. Эти полосы могут отражать субпопуляции SCP-FP, которые представляют собой промежуточные продукты деградации белка и / или посттрансляционные модификации, которые присутствуют в инфицированных клетках, но не (эффективно) включены в вирионы.Однако никаких серьезных изменений в уровнях экспрессии белка или в структуре экспрессируемого белка не может быть обнаружено при инфицировании пассажа 0, 5 или 10 любого из протестированных рекомбинантных вирусов. Таким образом, эти данные показали, что уровни экспрессии белков вирусов S-HA-SCP или S-GFP-SCP были стабильными в течение длительного времени.
Рис. 4. Вирусы, несущие помеченные мутанты SCP, генетически стабильны.
Иммуноблоттинг клеток M2-10B4, инфицированных вирусом wt, S-HA-SCP или S-GFP-SCP, полученных из пассажей 0, 5 или 10 после восстановления.Клетки инфицировали при MOI, равном 1, и собирали 48 hpi путем лизиса в общем лизисном буфере. Белки разделяли с помощью SDS-PAGE, блотировали и иммунопробировали на GFP, SCP, HA и MCP, а также на бета-тубулин в качестве контролей загрузки. Строчные буквы обозначают обсуждаемые белковые полосы.
https://doi.org/10.1371/journal.pone.0040585.g004
Для дальнейшего тестирования генетической стабильности эктопического локуса SCP мы амплифицировали соответствующие последовательности с помощью ПЦР из супернатантов клеток, инфицированных пассажем 0, 5 или 10 вирусов, экспрессирующих S-HA-SCP или S-GFP-SCP.Полученные продукты ПЦР очищали в геле, секвенировали и проверяли на изменения последовательности. Опять же, никаких изменений не было обнаружено ни в одном из образцов, что свидетельствует о расширенной генетической стабильности как локусов S-HA-SCP, так и S-GFP-SCP (данные не показаны).
Нормальный морфогенез рекомбинантных MCMV, меченных S-FP-SCP
Чтобы проанализировать, влияет ли морфогенез вируса из-за экспрессии слитого белка S-GFP-SCP, клетки инфицировали вирусом S-GFP-SCP и обрабатывали для передачи EM через 48 часов после заражения.Как показано на рис. 5, все основные этапы морфогенеза вируса, например, сборка капсида, упаковка капсида, первичная оболочка в ядре, а также вторичная оболочка оказались неотличимы от вируса WT в отношении фенотипического внешнего вида и общей частоты. Однако в некоторых ядрах клеток, инфицированных S-GFP-SCP, можно было обнаружить полукристаллические структуры (данные не показаны). Эти структуры в основном состояли из незаполненных капсидов, подобных тому, что наблюдалось ранее для вируса HSV VP26-mRFP [23], но также и во время инфекции WT HSV [54].Эти данные продемонстрировали, что основные внутриклеточные этапы жизненного цикла вируса оказались нормальными для флуоресцентно меченного рекомбинантного вируса MCMV.
Рис. 5. Ультраструктурная оценка клеток, инфицированных S-GFP-SCP.
Клетки NIH-3T3 и M2-10B4 (верхний ряд) или M2-10B4 (нижний ряд) были инфицированы с MOI 0,5 и центрифужным усилением WT (верхний ряд) или вирусом, меченным S-GFP-SCP (нижний ряд) и инкубировали 48 ч. После этого клетки замораживали под высоким давлением, замораживали, заливали пластиком и делали тонкие срезы.Изображены репрезентативные детали двух независимых экспериментов, показывающие, что B- и C-капсиды без оболочки в ядре (первая колонка), первичная оболочка в ядре (2 -й столбец ), без оболочки C-капсиды около клеточных мембран, возможно, во время вторичная оболочка (третья колонка), а также обволакивающие капсиды в цитоплазме (правая колонка). Шкала показывает 200 нм.
https://doi.org/10.1371/journal.pone.0040585.g005
Затем мы проанализировали, распространяются ли флуоресцентные вирусные частицы от клетки к клетке в культуре ткани.Клетки NIH-3T3 высевали на покровные стекла в 24-луночные планшеты и инфицировали с низким MOI (100 БОЕ на 50000 клеток). Чтобы предотвратить распространение вируса через супернатант, мы покрыли инфицированные клетки карбоксиметилцеллюлозой, как описано для стандартного анализа бляшек [39]. Через четыре дня после инфицирования покровную среду удаляли, бляшки фиксировали и выполняли IF. MCP детектировали с помощью специфической поликлональной антисыворотки и сравнивали с флуоресценцией S-GFP-SCP. Кроме того, TO-PRO-3 использовался для окрашивания ядер клеток.Как показано на фиг. 6, клетки в центре бляшки демонстрировали обильное окрашивание MCP и флуоресценцию S-GFP-SCP (желтая) внутри ядер, что указывает на позднюю стадию инфекции. Клетки на краю бляшки (рис. 6 вставка 1), однако, не показали никаких сигналов MCP или S-GFP-SCP в своих ядрах, что указывает на то, что эти клетки не начали синтез de novo MCP и S-GFP. -SCP слитый белок. Тем не менее, в некоторых из этих клеток мы могли обнаружить флуоресцентные частицы рядом с ядром клетки, рядом с ободком ядра (рис.6 вставка 2). Эти частицы были положительными как по флуоресценции GFP, так и по МСР. Таким образом, мы пришли к выводу, что эти частицы, скорее всего, были вирусными частицами, которые были перенесены в ядро только что инфицированных клеток. Это открытие предполагает, что меченые вирионы правильно передавались от инфицированных клеток к незараженным.
Рис. 6. Флуоресцентные вирусные частицы обладают способностью к распространению.
(A) Конфлюэнтные клетки M2-10B4 инфицировали вирусом, меченным S-GFP-SCP, на покровных стеклах в 24 лунках по 100 БОЕ на лунку и покрывали метилцеллюлозой.Клетки с разрешением 4 dpi фиксировали и обрабатывали для иммунофлуоресценции. MCP-специфическая антисыворотка использовалась для обнаружения вирусопродуцирующих клеток, а также отдельных вирусных частиц, в то время как флуоресценцию GFP визуализировали напрямую. Ядра клеток контрастировали с ТО-ПРО-3. На вставках изображены отдельные вирусные частицы, окружающие ядро клетки (кружки), без каких-либо доказательств того, что они находятся на поздней стадии инфекции и продуцируют инфекционные частицы. Шкала показывает 20 мкм в верхнем ряду и 5 мкм в нижнем ряду.
https://doi.org/10.1371/journal.pone.0040585.g006
Количественная оценка путей движения цитоплазмы при выходе вируса герпеса
После проверки свойств вируса WT мутанта S-GFP-SCP мы решили использовать этот новый вирус для отслеживания заражения MCMV. Поскольку подходы слежения наиболее легко применяются в сценариях проникновения вируса в выступы клеток (из-за хорошего отношения сигнал / шум и плоской среды), мы сначала сосредоточили нашу работу на выступах клеток (рис.S3, Video S1 и данные не показаны).
После создания рабочего процесса отслеживания мы затем хотели узнать, возможно ли количественно определить внутриклеточные перемещения вновь продуцируемых вирусных частиц. В отличие от проникновения вируса [55], эту проблему можно решить только с помощью генетически кодируемой флуоресцентной метки. Для следующих экспериментов мы использовали вариант MCMV, меченный mCherry, названный S-mCherry-SCP. Примерно через 20 часов после заражения в ядрах MEF появились первые флуоресцентные сигналы с параметрами обнаружения, подходящими для визуализации в реальном времени (данные не показаны).В районе 24 часов на дюйм в цитоплазме можно было проследить флуоресцентные пятна различной интенсивности. Эти пятна, скорее всего, представляли собой как оболочечные, так и оболочечные вирусные частицы внутри пузырьков. Для альфа-герпесвирусов направленный цитоплазматический транспорт вирусных капсидов оказался зависимым от микротрубочек [56]. Поэтому мы предположили, что это верно и для бета-герпесвируса MCMV. Чтобы проверить, подходит ли вирус S-mCherry-SCP для количественной оценки внутриклеточного транспорта частиц, мы использовали это открытие в качестве пробного камня.Мы инфицировали клетки MEF при MOI 0,5 с помощью MCMV, кодирующего слитый белок S-mCherry-SCP, и растворили сеть микротрубочек в контрольных клетках 23 hpi путем добавления 5 мкг / мл нокодазола в течение 1 ч и затем визуализировали цитоплазматические флуоресцентные сигналы. Окрашивание антител против бета-тубулина использовали для контроля эффекта нокодазола на инфицированные клетки (данные не показаны). Нарушение сети микротрубочек оказало драматическое влияние на подвижность цитоплазматических флуоресцентных пятен. Как показано на рис.7, а также в видеороликах S2 и S3, цитоплазматические движения флуоресцентных пятен в основном прекратились, что свидетельствует о зависимом от микротрубочек транспорте основной массы вирусных частиц в цитоплазме инфицированных MCMV клеток.
Рис. 7. Нокодазол блокирует подвижность флуоресцентных частиц MCMV.
клеток MEF инфицировали S-mCherry-SCP в течение 23 часов и обрабатывали 5 мкг / мл ноккодазола в течение 1 часа или нет. Эмиссия S-mCherry-SCP в живых клетках, записанная в условиях контролируемой окружающей среды, с частотой 5 кадров в секунду.Интенсивность флуоресценции кодируется ложными цветами от темно-синего до желтого. Три кадра из покадрового стека, каждый записанный с интервалом 6 секунд (30 кадров), показаны для необработанной (верхний ряд) и обработанной нокодазолом клетки (нижний ряд). Линии обозначают ядро (Nuc.), А также цитоплазму (Cyt.). Кружки указывают положение флуоресцентной частицы. На правом рисунке показаны все количественно определенные треки с эллипсами, обозначающими треки от частиц, выделенных слева.
https: // doi.org / 10.1371 / journal.pone.0040585.g007
Чтобы количественно оценить эти цитоплазматические эффекты, мы зарегистрировали периферию 7 инфицированных фиктивных и 7 обработанных нокодазолом клеток со скоростью 5 кадров в секунду и впоследствии отслеживали наиболее легко идентифицируемые флуоресцентные частицы (180 частиц -обработанные клетки / 163 частицы в обработанных нокодазолом клетках). Затем мы рассчитали их кривые MSD, определив среднеквадратичные смещения (MSD) и построив их в зависимости от времени задержки. Полученные кривые были сгруппированы в два класса.К первому классу относятся все подвижные частицы, а ко второму — все неподвижные частицы. Мы различали эти два класса, анализируя их кривые MSD и принимая во внимание экспериментальную точность позиционирования используемого алгоритма отслеживания. Мы определили экспериментальную ошибку позиционирования около 30 нм на ось, что соответствует примерно 14,500 нм 2 на наших графиках МСД. Все кривые, которые не превышали этого значения, были классифицированы как неподвижные, поскольку их изменение положения во время сбора данных было меньше экспериментальной точности локализации 30 нм на ось.Напротив, все частицы, которые превышали это значение, были классифицированы как подвижные (рис. 8A, B). Согласно этой количественной оценке, 88,4% частиц в клетках, обработанных имитатором, были подвижными. Напротив, 84,6% частиц в клетках, обработанных нокодазолом, были неподвижными. Неожиданно 15,4% частиц в клетках, обработанных нокодазолом, все еще оставались подвижными после 1 ч инкубации с 5 мкг / мл нокодазола (фиг. 8C).
Рис. 8. Количественная оценка треков частиц.
(A) Отслеживали 180 частиц из клеток, обработанных имитацией, и наносили их MSD в зависимости от времени задержки.Треки частиц были сгруппированы в два класса, представляющих мобильные (левая диаграмма) и неподвижные частицы (правая диаграмма), в зависимости от тенденции MSD. (B) 163 трека от клеток, обработанных нокодазолом, были сгруппированы таким же образом, как в (A). Подвижные частицы были дополнительно сгруппированы в зависимости от того, какой режим диффузии они проявляли, в соответствии с их соответствием трем различным моделям диффузии. (C) Распределение классов подвижности частиц для фиктивных, а также обработанных нокодазолом клеток в процентах. Данные разделены на четыре класса (неподвижный, аномальная диффузия, свободная диффузия, направленное движение).(D) Гистограмма, отображающая распределение средних скоростей треков всех частиц, демонстрирующих направленное движение. (E) Те же данные, что и в (D), суммированные в прямоугольной диаграмме со средним (линия) средним (квадрат), 25 -м до 75 -го процентиля (прямоугольник) и усами (5 -й -95 -й процентиль). (F) Гистограмма, показывающая распределение всех измеренных коэффициентов диффузии. (G) Коробчатая диаграмма тех же данных, что и на (F).
https://doi.org/10.1371/journal.pone.0040585.g008
Режим диффузии был определен путем расчета среднеквадратичных смещений (MSD) и их построения в зависимости от времени запаздывания. Для дальнейшего анализа свойств подвижных популяций мы подобрали соответствующие кривые MSD в двухэтапном процессе в соответствии с тремя диффузионными моделями. Этими моделями были аномальная диффузия (MSD = 4D t α ), свободная диффузия (MSD = 4D t ) и направленное движение с диффузией (MSD = 4D t + ( vt) 2 ) (для подробнее см. материалы и методы).
79,2% треков подвижных частиц в клетках, обработанных имитатором, можно было сопоставить с функцией MSD = 4D t + (vt) 2 по сравнению с 6,2% в клетках, обработанных нокодазолом, что указывает на небольшую долю частиц в обработанных нокодазолом клетках. клетки демонстрируют направленное движение, что указывает на возможный путь транспорта, устойчивый к нокодазолу.
Интересно, что обработка нокодазолом не оказала сильного влияния на количество свободно диффундирующих частиц (соответствует MSD = 4D t ) или аномальным образом (соответствует MSD = 4D t α ) (рис.8C). Вместе с сильным увеличением количества неподвижных частиц при лечении нокодазолом эти данные могут свидетельствовать о том, что вирусные частицы были либо захвачены в очень маленькой молекулярной клетке, либо прикреплены к какому-либо молекулярному якору после лечения нокодазолом.
Когда мы подобрали подвижную фракцию частиц, которые демонстрировали направленное движение, с MSD = 4D t + (vt) 2 , мы могли напрямую определить общую среднюю скорость данного трека частицы без его диффузионной составляющей.Как показано на фиг. 8D и E, средние скорости треков (в течение всего времени сбора данных, составляющего приблизительно 20 секунд) в имитационно обработанных клетках имели среднее значение 0,101 ± 0,073 мкм / с. Однако в клетках, обработанных нокодазолом, частицы, которые демонстрировали направленное движение, имели среднюю скорость трека только 0,041 ± 0,042 мкм / сек. Это открытие показало, что высокие средние скорости треков были в основном основаны на чувствительном к нокодазолу и, следовательно, наиболее вероятно, связанном с микротрубочками транспортном режиме.
Вторым параметром, который мы могли определить, был коэффициент диффузии D.Он был рассчитан для всех подвижных частиц, и медиана в клетках, обработанных имитацией, составила 1,24 · 10 −8 см 2 / с, тогда как 0,56 · 10 −8 см 2 / с в клетках, обработанных нокодазолом (рис. . 8F, G). Интересно, что ширина распределения D в клетках, обработанных имитацией, была выше, чем ожидалось для суспензии монодисперсных частиц (фиг. 8F). D обратно пропорционален гидродинамическому радиусу частицы, если все другие переменные, такие как температура и вязкость среды, не изменяются (D = kT / 6πηr).Следовательно, наблюдаемое распределение D может быть индикатором более широкого диапазона диаметров отслеживаемых частиц.
Обсуждение
В этом исследовании мы сообщаем о бета-герпесвирусах, которые генетически помечены на капсиде FP. Эти рекомбинантные вирусы экспрессируют дополнительную копию сконструированного SCP в cis , которая несет FP во внутренней позиции, соединенной через два гибких линкера. Этот второй ген SCP, меченный FP, экспрессируется под контролем своего собственного промотора для поддержания физиологических уровней экспрессии.Эта стратегия привела к получению капсидов, содержащих смесь FP-меченых WT SCP. Присутствие SCP-WT кажется важным, поскольку аналогичный рекомбинантный ВАС, не содержащий эндогенного SCP, оказался нежизнеспособным (данные не показаны). Этот феномен, заключающийся в том, что аллель WT полностью компенсирует нефункциональную мутацию, присутствующую на отдельном аллеле, хорошо известен в генетике герпесвирусов и использовался для картирования чувствительных к температуре мутантов в прошлом [57]. Описанный здесь случай аналогичен, но они отличаются тем, что два аллеля находятся в одном геноме.Зачем нужен WT SCP, неясно. Одно из объяснений — стерические ограничения, поскольку объемный флуоресцентный белок может быть слишком большим, чтобы поместиться шесть раз на гексон капсида, в то время как смесь немеченых и меченых SCP делает это. Другое объяснение состоит в том, что меченый вариант не может вступать в существенные взаимодействия с соседними белками, но поскольку не все молекулы должны участвовать в этом взаимодействии, немеченая часть молекул SCP может быть достаточной для компенсации этого дефицита. Тем не менее, рекомбинантный MCMV, несущий S-HA-SCP, был жизнеспособным даже после делеции нативного локуса SCP (данные не показаны), что свидетельствует о зависимой от размера метки дефиците представленных S-FP-SCP.Эта зависимость от размера может позволить маркировать SCP в нативном локусе, используя, например, недавно опубликованные новые флуоресцентные метки меньшего размера на основе домена LOV, такие как iLov [58], с использованием нашего дизайна.
Слитый белок S-GFP-SCP явно был включен в вирусные частицы, что связано с его взаимодействием с MCP. Однако мы не можем исключить, что слитые белки S-FP-SCP лишены других связывающих функций, которые должны быть замещены эндогенными SCP. Следовательно, хотя наш мутантный гибридный белок не заменяет WT SCP, он не является ингибирующим, как показано в кинетике роста вируса, диаметре бляшки и соотношении числа генома и БОЕ.WT-вирусоподобные свойства новых рекомбинантных MCMV, меченных FP, являются важным достижением, поскольку совершенно аналогичное слияние GFP-SCP, разработанное ранее в нашей лаборатории, показало сильное доминирующее негативное влияние на рост вируса при экспрессии в cis из индуцибельного локуса. [59]. Разница между этими двумя слияниями по существу заключается в дублировании первых 34 аминокислот, которые добавляются к N-концу флуоресцентного белка. Эти 34 а.о. могут участвовать в важных взаимодействиях или обеспечивать дополнительную гибкость, которая отличает слияние S-GFP-SCP от его доминирующего негативного предка gfp-SCP.
Недавно было показано, что мутанты PRV, несущие SCP, меченные GFP, демонстрируют гораздо более широкое распределение интенсивности, чем эквивалентный мутант, несущий mRFP вместо GFP. [30]. В описанных здесь мутантах FWHM были очень похожи, с примерно двукратной разницей между GFP и mCherry (вариант mRFP). Однако в нашем случае мутант с меткой mCherry показал более высокую ценность по сравнению с вариантом с меткой GFP. Интересно, что мы нашли доказательства мультимерного гауссова распределения.Это может быть связано с вирусными частицами, имеющими несколько капсидов, как мы регулярно наблюдали в T-EM инфицированных клеток (данные не показаны), или с агрегацией частиц во время процедуры очистки, которая необходима для удаления клеточного мусора.
Затем мы проверили фенотипические изменения в ультраструктуре инфицированных клеток и не смогли найти очевидных морфологических различий, за исключением некоторых клеток на поздней стадии инфекции, которые показали парахристаллические массивы того, что казалось B-капсидами.Этот феномен также описан для HSV-1, несущего SCP-меченные mRFP, а также для инфекции WT HSV-1 [23], [54].
Количественная оценка интенсивности мечения капсида, а также доли помеченных частиц показала, что большинство частиц помечены в степени, допускающей отслеживание частиц.
Мы также попытались пометить SCP HCMV с помощью той же стратегии, и это привело к сильно аттенуированному рекомбинантному вирусу. Эти данные показали, что процедура была просто правильной, но для каждого вида вируса герпеса необходима точная настройка подхода к маркировке.Наверное, решающее значение имеет размер вставленного тега. Кроме того, у разных видов герпесвирусов может быть разница в толерантности к слишком большим размерам.
Затем мы протестировали очищенные вирусные препараты MCMV S-GFP-SCP в анализе проникновения и смогли обнаружить прикрепление частиц к выступам клеток и перемещение по ним. Нам удалось установить рабочий процесс отслеживания с несколькими частицами, что привело к очень точной локализации отдельных вирусных частиц (45 ± 19 нм) (см. Рис. S3). Отслеживание внеклеточных вирусных частиц обеспечивает среду с низким фоном и низкой плотностью частиц и идеально подходит для создания рабочего процесса отслеживания.Но в целом проникновение вирусов может происходить, по крайней мере, с вирусами без оболочки, за ними могут следовать химически меченые вирионы [55]. Огромным преимуществом вируса, генетически кодирующего флуоресцентные маркеры, является возможность проследить судьбу вновь продуцируемых внутриклеточных вирусных частиц. Однако движение частиц в цитоплазме во время выхода вируса происходит в среде, характеризующейся высоким фоновым шумом, большим количеством частиц и уменьшенным поперечным сечением клеток из-за вызванного вирусом округления клеток.Мы отслеживали частицы вскоре после того, как они впервые появились в цитоплазме, и отслеживали их подвижность. В качестве отрицательного контроля использовали инфицированные клетки, обработанные деполимеризующим микротрубочки препаратом нокодазолом. Используя сложный подход к подгонке, мы могли сгруппировать полученные треки частиц в четыре класса, представляющие неподвижные частицы и подвижные частицы, демонстрирующие либо аномальную диффузию, либо свободную диффузию, либо направленное движение. Мы обнаружили, что обработка нокодазолом резко снижает долю подвижных частиц примерно с 88% до 15%.Этот эффект был в основном связан с уменьшением частиц, демонстрирующих направленное движение (с 79% до 6%), в то время как доля частиц, демонстрирующих свободную или аномальную диффузию, сильно не изменилась. Это было ожидаемо, поскольку ранее было показано, что вирусный цитоплазматический транспорт в основном опосредован микротрубочками. Однако было удивительно, что диссоциация микротрубочек под действием нокодазола не увеличивала значительно долю свободных или аномальных диффундирующих частиц (от 4,4% до 6,8% и от 5,2% до 2,5% соответственно).
Это открытие может указывать на то, что частицы все еще связаны с фрагментами микротрубочек после обработки нокодазолом, поскольку данные отслеживания указывают на очень большую долю частиц, которые не перемещались больше, чем точность локализации 30 нм (классифицируются как неподвижные). Тем не менее, также возможны другие механизмы иммобилизации капсидов, такие как захват в молекулярной клетке или фиксация на молекулярном якоре.
Примечательно, что до сих пор около 6% треков частиц от клеток, обработанных нокодазолом, можно было подогнать в соответствии с моделью направленного движения.Два объяснения кажутся правдоподобными. Во-первых, оставшееся движение после лечения нокодазолом может быть вызвано присутствием стабилизированных устойчивых к нокодазолу микротрубочек, подобных тем, которые были описаны для инфекций HSV-1 [60]. С другой стороны, наблюдаемое движение, устойчивое к нокодазолу, основано на актиновых филаментах, гипотеза, которая подчеркивается в недавнем отчете, описывающем зависимость секреции вириона HSV-1 от Myosin V [61]. Однако, чтобы конкретно ответить на этот вопрос, необходимы дальнейшие эксперименты.
Вместо сфокусированного распределения коэффициента диффузии, как ожидалось для монодисперсного раствора частиц, мы обнаружили более широкое распределение D. Предполагая однородную вязкость цитоплазмы, это открытие привело бы к неравномерному распределению размеров везикул, используемых вирусом для переносят частицы. Простое объяснение более широкого распределения D может заключаться в том, что оно отражает разницу в размерах между оболочкой и голым капсидом. Кроме того, мы могли наблюдать большую разницу в размерах везикул для вирусных везикул при передаче ЭМ (рис.5 и данные не показаны). Сумма этих интерпретаций может привести к наблюдаемому фенотипу. Более того, он демонстрирует возможности отслеживания отдельных частиц для исследования среды, в которой находятся измеряемые частицы, без необходимости обширной совместной маркировки.
Мы также вычислили средние скорости треков по трекам частиц, которые можно было подогнать в соответствии с моделью направленного движения. Примечательно, что эти средние скорости следов были намного меньше, чем сообщается для HCMV [15]. У этого может быть несколько причин, помимо внутренних различий между HCMV и MCMV: во-первых, мы случайным образом выбирали частицы, которые технически можно было отслеживать, и не выбирали для мобильных частиц.Следовательно, наши средние скорости шага должны были быть меньше, поскольку были включены более медленно движущиеся частицы. Кроме того, мы использовали другой подход к отслеживанию и расчету. Используемые здесь средние скорости трека отображают среднюю скорость, которую демонстрирует данная частица по всему измеренному треку. Поскольку мы не выбирали процессы быстрой транспортировки во время отслеживания и не использовали сегментацию дорожек, как показано на рис. S3, наши средние скорости дорожек должны быть меньше, чем скорости из «вручную выбранных» (под-) дорожек. Поэтому применяемый здесь подход должен быть намного лучше приспособлен для аппроксимации реальной средней скорости переноса, с которой частицы цитоплазматического герпеса переносятся в течение более длительных периодов времени.
До сих пор мы не проводили количественной оценки подвижности цитоплазмы других вирусов с аналогичной меткой. Будущие исследования нацелены на различение частиц, покрытых оболочкой, от частиц без оболочки (например, с дополнительным слиянием гликопротеина и FP) и изучение направления транспорта для получения более подробной картины процессов транспорта в цитоплазме во время выхода MCMV.
В целом мы смогли создать первый жизнеспособный и стабильный рекомбинантный бета-герпесвирус, который продуцирует флуоресцентно меченые капсиды.По сравнению с широко используемыми мутантами, меченными капсидом HSV-1 и PRV, описанный здесь рекомбинант не обнаруживал каких-либо дефектов роста в культуре клеток и проявлял биологические характеристики, сопоставимые с их родительским вирусом WT [5], [34]. Все протестированные рекомбинанты продуцировали флуоресцентные вирусные капсиды с интенсивностью, достаточной для отслеживания отдельных частиц в течение продолжительных периодов времени при микроскопии живых клеток. Анализ внутриклеточного транспорта частиц во время выхода MCMV, впервые с субпиксельным пространственным и высоким временным разрешением в области герпесвируса, позволил нам с высокой детализацией охарактеризовать цитоплазматический транспорт бета-герпесвируса.
Будущие исследования имеют право перенести описанный здесь подход для маркировки гамма-герпесвируса, что позволит провести сравнительное изучение динамики капсида альфа-, бета- и гамма-герпесвирусов.
Дополнительная информация
Рисунок S1.
(в поддержку Рис. 3 ) Схематическая диаграмма, суммирующая результаты дрожжевого двугибридного анализа, исследующего взаимодействие между MCP и S-GFP-SCP или S-GFP-SCP *. У мутанта S-GFP-SCP * отсутствуют последние 14 а.о. на С-конце, которые, как предполагается, взаимодействуют с MCP.В качестве контроля использовали пустую приманку и плазмиды жертвы (ctrl). Белые квадраты указывают на отсутствие роста на селективном агаре и отсутствие взаимодействия. Черные квадраты обозначают рост на селективном агаре и взаимодействие.
https://doi.org/10.1371/journal.pone.0040585.s001
(TIF)
Рисунок S2.
(в поддержку Рис. 3 ) MEF засевали на 8-луночные пластиковые слайды и инфицировали 100 БОЕ вируса на лунку, эктопически экспрессирующую S-GFP-SCP (вверху) или S-GFP. -SCP-слитый белок, в котором отсутствует предполагаемый пептид, взаимодействующий с MCP (S-GFP-SCP *, внизу). Клетки покрывали метилцеллюлозой после инфицирования, фиксировали и обрабатывали для иммунофлуоресценции 4 dpi. Флуоресценцию GFP визуализировали непосредственно, в то время как цитоплазма и ядра клеток контрастировали с высокой концентрацией TO-PRO-3, тем самым окрашивая целые клетки, но все же показывая ядра клеток. Мутант, у которого отсутствует взаимодействующий с MCP пептид, локализован по всей цито- и нуклеоплазме. Шкала показывает 10 мкм.
https://doi.org/10.1371/journal.pone.0040585.s002
(TIF)
Рисунок S3.
(в поддержку Рис. 7 и 8 ) Отслеживание движения внеклеточных частиц. клеток M2-10B4 высевали с низкой плотностью на чашки для культивирования со стеклянным дном и инфицировали при MOI 100 градиентно очищенным и контролируемым ЭМ исходным вирусом S-GFP-SCP. Сразу после заражения в камере с контролируемой средой была начата визуализация в реальном времени с лазерным возбуждением 488 нм, а также с дифференциальным интерференционным контрастом (ДИК).Частицы вируса, прикрепленные к выступам клеток, идентифицировали по их флуоресценции и регистрировали со скоростью 1,8 кадра в секунду. (A) Изменяющиеся положения двух флуоресцентных частиц на выступе клетки изображены с течением времени (кружки). Цифрами обозначены отдельные частицы. (B) Следы частиц 1 и 2 (вставка). Не удалось получить положения для частиц 1 и 2, если треки частиц перекрываются; поэтому каждый трек частицы делится на две части (обе черные для частицы 1, красные и черные для частицы 2).Ручное разделение треков было выполнено путем выбора суб-траекторий, в которых частицы явно демонстрируют движение на большие расстояния. Затем каждая полученная суб-траектория была проанализирована индивидуально путем вычисления их MSD и аппроксимации полученных графиков MSD в соответствии с моделями, указанными на рис. 8. 19 выбранных вручную субтреков, на которых частицы ясно показывали перемещения на большие расстояния, обозначены наложенными цветами. Направление движения указано стрелками. (C) Гистограмма, отображающая распределение измеренных средних скоростей треков для всех использованных субтреков, в которых частицы показали движение на большие расстояния.(D) Гистограмма, изображающая распределение измеренных коэффициентов диффузии для тех же субтреков, что и в (C). Мы определяем общую среднюю скорость трека (v) и коэффициент диффузии (D) из всех субтреков. Для двух выбранных частиц средняя скорость треков субтреков составляла 0,10 ± 0,05 мкм / сек, а среднее значение D составляло 5,87 ± 3,3 мкм 2 / сек, что указывало на высокую подвижность (D).
https://doi.org/10.1371/journal.pone.0040585.s003
(TIF)
Видео S1.
(в поддержку рис.7 и рисунок S3) Отслеживание внеклеточного трафика MCMV. клеток M2-10B4 высевали с низкой плотностью на чашки для культивирования со стеклянным дном и инфицировали при MOI 100 градиентно очищенным исходным вирусом S-GFP-SCP. Сразу после заражения в камере с контролируемой средой была начата флуоресцентная визуализация живых клеток с лазерным возбуждением 488 нм параллельно с микроскопией дифференциального интерференционного контраста (ДИК). Частицы вируса, прикрепленные к выступам клеток, идентифицировали по их флуоресценции и регистрировали с помощью 1.8 кадров в секунду. Видео представляет собой наложение каналов DIC и GFP.
https://doi.org/10.1371/journal.pone.0040585.s005
(AVI)
Видео S3.
(в поддержку рис. 7 ) Подвижность флуоресцентных частиц MCMV. клеток MEF инфицировали S-mCherry-SCP в течение 24 часов. Впоследствии излучение S-mCherry-SCP-SCP было зарегистрировано в живых клетках в условиях, контролируемых окружающей средой, с частотой 5 кадров в секунду. Интенсивность флуоресценции кодируется ложными цветами от темно-синего до желтого.
https://doi.org/10.1371/journal.pone.0040585.s007
(AVI)
Благодарности
Мы благодарим Sigrid Seelmeier, Simone Boos (MvP, Мюнхен) и Eberhard Schmid (Центральный блок электронной микроскопии, Ульм) за отличную техническую помощь, Bastian Seidel (Центральный блок электронной микроскопии, Ульм) за помощь с ЭМ, Энн Бинц за отрицательный результат. окрашивание, а также Беате Содейк (обе Ганноверская медицинская школа) и Харальду Водриху (Университет Бордо II) за очень полезные обсуждения и введение в микроскопию живых клеток.Мы также благодарим Стипана Йониджича (Университет Риеки), предоставившего нам моноклональное антитело, специфичное для ie-1. Кроме того, мы хотели бы поблагодарить Линн Энквист и Томас Шенк за их щедрое разрешение на проведение дополнительных экспериментов в своих лабораториях, а также Джейсона Пучаллу и Бенджамина Арара за помощь с количественной оценкой интенсивности вирусных частиц (все Принстонский университет). Мы также хотели бы поблагодарить Винсента Гели (CNRS, Марсель) и Земера Гитаи (Принстонский университет) за щедрое предоставление нам антисыворотки против mCherry.
Вклад авторов
Задумал и спроектировал эксперименты: JBB RB UHK ZR. Проведены эксперименты: JBB RB LP LM HS. Проанализированы данные: MT CJ JBB ZR. Предоставленные реагенты / материалы / инструменты анализа: RB CJ JvE UG PW UHK ZR. Написал статью: JBB RB JvE PW UHK ZR.
Ссылки
- 1.
McGeoch DJ, Dolan A, Ralph aC (2000) К всеобъемлющей филогении вирусов герпеса млекопитающих и птиц. Журнал вирусологии 74: 10401–10406. - 2.Adler H, Messerle M, Wagner M, Koszinowski UH (2000) Клонирование и мутагенез генома мышиного гаммагерпесвируса 68 как инфекционной бактериальной искусственной хромосомы. Журнал вирусологии 74: 6964–6974.
- 3.
Borst EM, Hahn G, Koszinowski UH, Messerle M (1999) Клонирование генома цитомегаловируса человека (HCMV) как инфекционной бактериальной искусственной хромосомы в Escherichia coli: новый подход к конструированию мутантов HCMV. J Virol 73: 8320–8329. - 4.Messerle M, Crnković I, Hammerschmidt W, Ziegler H, Koszinowski UH (1997) Клонирование и мутагенез генома герпесвируса как инфекционной бактериальной искусственной хромосомы. Слушания Национальной академии наук Соединенных Штатов Америки 94: 14759–14763.
- 5.
Нагель Ч.-Х., Дёнер К., Фатоллахи М., Страйв Т., Борст Э.М. и др. (2008) Ядерный выход и оболочка капсидов вируса простого герпеса, проанализированные с помощью двухцветной флуоресценции HSV1 (17+). Журнал вирусологии 82: 3109–3124. - 6.
Das SC, Nayak D, Zhou Y, Pattnaik AK (2006) Визуализация внутриклеточного транспорта нуклеокапсидов вируса везикулярного стоматита в живых клетках. J Virol 80: 6368–6377. - 7.
Десаи П., Человек С. (1998) Включение зеленого флуоресцентного белка в капсид вируса простого герпеса типа 1. Журнал вирусологии. - 8.
Эндресс Т., Лампе М., Бриггс ЯГ, Кройсслих Х.Г., Бройхле С. и др. (2008) Взаимодействия ВИЧ-1 с клетками проанализированы путем отслеживания одного вируса.Европейский биофизический журнал: EBJ 37: 1291–1301. - 9.
Finke S, Brzózka K, Conzelmann K – K (2004) Отслеживание флуоресцентно-меченного вируса бешенства: усиленный зеленый флуоресцентный белок, меченный фосфопротеином P, поддерживает экспрессию вирусных генов и образование инфекционных частиц. J Virol 78: 12333–12343. - 10.
Geada MM, Galindo I, Lorenzo MM, Perdiguero B, Blasco R (2001) Движение внутриклеточных оболочечных вирионов вируса коровьей оспы с GFP, меченным к белку оболочки F13L.J Gen Virol 82: 2747–2760. - 11.
Glotzer JB, Michou AI, Baker A, Saltik M, Cotten M (2001) Независимая от микротрубочек подвижность и ядерное нацеливание аденовирусов с флуоресцентно мечеными геномами. Журнал вирусологии 75: 2421–2434. - 12.
Лампе М., Бриггс Я.Г., Эндресс Т., Гласс Б., Ригельсбергер С. и др. (2007) Частицы ВИЧ-1 с двойной меткой для изучения взаимодействия вирус-клетка. Вирусология 360: 92–104. - 13.
Lux K, Goerlitz N, Schlemminger S, Perabo L, Goldnau D и др.(2005) Зеленые флуоресцентные меченые белками аденоассоциированные вирусные частицы позволяют изучать цитозольный и ядерный трафик. J Virol 79: 11776–11787. - 14.
Rietdorf J, Ploubidou A, Reckmann I, Holmström A, Frischknecht F, et al. (2001) Кинезин-зависимое движение по микротрубочкам предшествует основанной на актине подвижности вируса осповакцины. Nat Cell Biol. 3: 992–1000. - 15.
Sampaio KL, Cavignac Y, Stierhof Y-D, Sinzger C (2005) Цитомегаловирус человека, меченный зеленым флуоресцентным белком, для анализа движений внутриклеточных частиц в реальном времени.J Virol 79: 2754–2767. - 16.
Уорд Б.М., Мосс Б. (2001) Визуализация внутриклеточного движения вирионов вируса осповакцины, содержащих химеру мембранного белка зеленого флуоресцентного белка-B5R. Журнал вирусологии 75: 4802. - 17.
Gill MB, Edgar R, May JS, Stevenson PG, Masucci MG (2008) Гликопротеиновый комплекс гамма-герпесвируса манипулирует актином, чтобы способствовать распространению вируса. Плохой 3: e1808. - 18.
Potel C, Kaelin K, Gautier I, Lebon P, Coppey J, et al.(2002) Включение зеленого флуоресцентного белка в основной гликопротеин оболочки B вируса простого герпеса типа 1. Journal of Virological Methods 105: 13–23. - 19.
Доннелли М., Эллиотт Г. (2001) Флуоресцентное маркирование протеина тегумента вируса простого герпеса VP13 / 14 при вирусной инфекции. Журнал вирусологии 75: 2575–2583. - 20.
Elliott G, O’Hare P (1999) Анализ живых клеток инфекции вируса простого герпеса, меченной зеленым флуоресцентным белком.Журнал вирусологии 73: 4110. - 21.
Чаудхури В., Соммер М., Раджамани Дж., Зербони Л., Арвин А.М. (2008) Функции капсидного белка ORF23 вируса ветряной оспы в репликации вируса и патогенез кожной инфекции. J Virol 82: 10231–10246. - 22.
Смит Г.А., Гросс С.П., Энквист Л.В. (2001). Герпесвирусы используют двунаправленный быстрый аксональный транспорт для распространения в сенсорных нейронах. Слушания Национальной академии наук Соединенных Штатов Америки 98: 3466–3470. - 23.
де Оливейра А.П., Глаузер Д.Л., Лаймбахер А.С., Штрассер Р., Шранер Э.М. и др. (2008) Живая визуализация динамики компартмента вируса простого герпеса 1 типа. Журнал вирусологии 82: 4974–4990. - 24.
Сугимото К., Уэма М., Сагара Х., Танака М., Сата Т. и др. (2008) Одновременное отслеживание локализации капсида, тегумента и белка оболочки в живых клетках, инфицированных трехфлуоресцентным вирусом простого герпеса 1. Journal of Virology 82: 5198–5211. - 25.
Antinone SE, Smith GA (2006) Два режима передачи вируса герпеса в нейронах: приобретение мембраны направляет движение. Журнал вирусологии 80: 11235–11240. - 26.
Hutchinson I, Whiteley A, Browne H, Elliott G (2002) Последовательная локализация двух белков тегумента вируса простого герпеса для пунктирования ядерных точек, прилегающих к доменам ICP0. Журнал вирусологии 76: 10365–10373. - 27.
Фрэмптон-младший А. Р., Учида Х., фон Эйнем Дж., Гоинс В. Ф., Гранди П. и др.(2010) Лошадиный герпесвирус типа 1 (EHV-1) использует микротрубочки, динеин и ROCK1 для продуктивного заражения клеток. Ветеринарная микробиология 141: 12–21. - 28.
Конвей Дж. Ф., Кокрелл С. К., Коупленд А. М., Ньюкомб В. В., Браун Дж. К. и др. (2010) Маркировка и локализация капсидного белка UL25 вируса простого герпеса и его взаимодействие с двумя ближайшими к Пентону триплексами. Журнал молекулярной биологии 397: 575–586. - 29.
Cockrell SK, Huffman JB, Toropova K, Conway JF, Homa FL (2011) Остатки белка UL25 вируса простого герпеса, которые необходимы для его стабильного взаимодействия с капсидами.Журнал вирусологии 85: 4875–4887. - 30.
Bohannon KP, Sollars PJ, Pickard GE, Smith GA (2012) Слияние флуоресцентного белка с минорным капсидным белком pUL25 вируса псевдобешенства позволяет визуализировать капсид живых клеток с незначительным влиянием на инфекцию. Журнал общей вирусологии 93: 124–129. - 31.
Borst EM, Mathys S, Wagner M, Muranyi W, Messerle M (2001) Генетические доказательства важной роли белка малого капсида цитомегаловируса в вирусном росте.J Virol 75: 1450–1458. - 32.
Henson BW, Perkins EM, Cothran JE, Desai P (2009) Самосборка капсидов вируса Эпштейна-Барра. Журнал вирусологии 83: 3877–3890. - 33.
Rupp B, Ruzsics Z, Sacher T., Koszinowski UH (2005) Условная репликация цитомегаловируса in vitro и in vivo. Дж. Вирол 79: 486–494. - 34.
Krautwald M, Maresch C, Klupp BG, Fuchs W, Mettenleiter TC (2008) Делеция или маркировка зеленым флуоресцентным белком капсидного компонента pUL35 вируса псевдобешенства нарушает репликацию вируса в культуре клеток и нейроинвазию у мышей.Журнал общей вирусологии 89: 1346–1351. - 35.
Перкинс Э.М., Анакер Д., Дэвис А., Санкар В., Амбиндер РФ и др. (2008) Малый капсидный белок pORF65 необходим для сборки капсидов герпесвируса Капоши, ассоциированного с саркомой. Журнал вирусологии 82: 7201–7211. - 36.
Menard C, Wagner M, Ruzsics Z, Holak K, Brune W и др. (2003) Роль членов семейства гена цитомегаловируса мыши US22 в репликации в макрофагах. J Virol 77: 5557–5570. - 37.Maninger S, Bosse JB, Lemnitzer F, Pogoda M, Mohr CA и др. (2011) M94 необходим для вторичной оболочки мышиного цитомегаловируса. Журнал вирусологии 85: 9254–9267.
- 38.
Kleijnen MF, Huppa JB, Lucin P, Mukherjee S, Farrell H, et al. (1997) Гликопротеин цитомегаловируса мыши, gp34, образует комплекс со свернутыми молекулами MHC класса I в ER, который не удерживается, а транспортируется на поверхность клетки. EMBO J 16: 685–694. - 39.
Reddehase MJ, Weiland F, Münch K, Jonjić S, Luske A и др.(1985) Интерстициальная мышиная цитомегаловирусная пневмония после облучения: характеристика клеток, ограничивающих репликацию вируса во время установленной инфекции легких. Дж. Вирол 55: 264–273. - 40.
Abramoff MD, Magelhaes PJ, Ram SJ (2004) Обработка изображений с помощью ImageJ. Биофотоникс Интернэшнл 11: 36–42. - 41.
Fossum E, Friedel CC, Rajagopala SV, Titz B, Baiker A, et al. (2009) Эволюционно консервативные сети взаимодействия герпесвирусных белков.Возбудители PLoS 5: e1000570. - 42.
Стеллбергер Т., Хойзер Р., Байкер А., Похинени В.Р., Хаас Дж. И др. (2010) Улучшение дрожжевой двугибридной системы с помощью пермутированных гибридных белков: взаимодействие вируса Varicella Zoster. Proteome Science 8: 8. - 43.
Черепанов П.П., Вакернагель В. (1995) Нарушение гена в Escherichia coli: кассеты TcR и KmR с возможностью катализированного Flp иссечения детерминанты устойчивости к антибиотикам. Ген 158: 9–14. - 44.Döhner K, Radtke K, Schmidt S, Sodeik B (2006) Фаза затмения инфекции вируса простого герпеса типа 1: эффективный динеин-опосредованный транспорт капсида без малого капсидного белка VP26. Журнал вирусологии 80: 8211–8224.
- 45.
Радтке К., Кинеке Д., Вольфштейн А., Майкл К., Штеффен В. и др. (2010) Двигатели микротрубочек, направленные на плюс и минус, одновременно связываются с капсидами вируса простого герпеса, используя различные внутренние структуры тегумента. Возбудители PLoS 6: e1000991. - 46.
Hazelton PR, Gelderblom HR (2003) Электронная микроскопия для быстрой диагностики инфекционных агентов в экстренных ситуациях. Новые инфекционные болезни 9: 294–303. - 47.
Скривано Л., Эстерлехнер Дж., Мюльбах Х., Эттишер Н., Хаген С. и др. (2010) Продукт гена m74 цитомегаловируса мыши (MCMV) является функциональным гомологом gO CMV человека и определяет путь проникновения MCMV. Журнал вирусологии 84: 4469–4480. - 48.
Кирстейн Дж, Юнг С., Хеллригель С. (2005) Спектроскопия одиночных молекул: поступательная и вращательная диффузия одиночных флуоресцентных красителей в наноструктурированных пористых материалах.Журнал Американского химического общества 130, 1638–1648. - 49.
Сакстон М.Дж., Якобсон К. (1997) ОТСЛЕЖИВАНИЕ ОДИНАРНЫХ ЧАСТИЦ: приложения к мембранной динамике. Ежегодный обзор биофизики и структуры биомолекул 26: 373–399. - 50.
Walther P, Ziegler A (2002) Замораживание замороженных образцов под высоким давлением: видимость биологических мембран улучшается, когда замещающая среда содержит воду. Журнал микроскопии 208: 3–10. - 51.Desai P, DeLuca NA, Person S (1998) VP26 вируса простого герпеса типа 1 не важен для репликации в культуре клеток, но влияет на выработку инфекционного вируса в нервной системе инфицированных мышей. Вирусология 247: 115–124.
- 52.
Oliveira SA, Park SH, Lee P, Bendelac A, Shenk TE (2002) Семейство генов мышиного цитомегаловируса m02 защищает от иммунного надзора, опосредованного естественными клетками-киллерами. Журнал вирусологии 76: 885–894. - 53.
Lai L, Britt WJ (2003) Взаимодействие между основным белком капсида и самым маленьким капсидным белком цитомегаловируса человека зависит от двух линейных последовательностей в самом маленьком капсидном белке.J Virol 77: 2730–2735. - 54.
Nil S, Morgan C, Rose HM (1968) Электронная микроскопия вируса простого герпеса II. Последовательность развития. Микробиология 2: 517–536. - 55.
Суомалайнен М., Накано М.Ю., Келлер С., Буке К., Стидвилл Р.П. и др. (1999) Зависимые от микротрубочек подвижность, направленная на плюс и минус конец, являются конкурирующими процессами за ядерное нацеливание аденовируса. Журнал клеточной биологии 144: 657–672. - 56.
Лайман М.Г., Энквист Л.В. (2009) Взаимодействие вируса герпеса с цитоскелетом хозяина.Журнал вирусологии 83: 2058–2066. - 57.
Schaffer PA (1975) Термочувствительные мутанты герпесвирусов. Актуальные темы микробиологии и иммунологии 70: 51–100. - 58.
Чапман С., Фолкнер С., Кайзерли Е., Гарсия-Мата С., Савенков Е.И. и др. (2008) Фотообратимый флуоресцентный белок iLOV превосходит GFP в качестве репортера вирусной инфекции растений. Труды Национальной академии наук Соединенных Штатов Америки 105: 20038–20043. - 59.
Рупп Б., Ружикс З., Базер С., Адлер Б., Вальтер П. и др. (2007) Случайный скрининг доминантно-отрицательных мутантов ядерного выходного белка цитомегаловируса М50. Журнал вирусологии 81: 5508–5517. - 60.
Elliott G, ÒHare P (1998) Tegument Protein VP22 вируса простого герпеса типа 1 индуцирует стабилизацию и гиперацетилирование микротрубочек. Журнал вирусологии 72: 6448. - 61.
Робертс К.Л., Бейнс Дж.Д. (2010) Миозин Va усиливает секрецию вирионов вируса простого герпеса 1 и экспрессию вирусных гликопротеинов на клеточной поверхности.J Virol 84: 9889–9896. - 62.
Notredame C, Higgins DG, Heringa J (2000) T-Coffee: новый метод быстрого и точного выравнивания множественных последовательностей. Журнал молекулярной биологии 302: 205–217.
ЖУРНАЛ ДОКАЗАТЕЛЬСТВ МЕДИЦИНЫ И ЗДРАВООХРАНЕНИЯ
1. Доцент кафедры медицины, ASCOMS & Hospital, Сидра, Джамму и Кашмир.
2. Доцент кафедры медицины, ASCOMS & Hospital, Сидра, Джамму и Кашмир.
3. Старший ординатор медицинского отделения ASCOMS и больницы, Сидра, Джамму и Кашмир.
4. Доцент кафедры медицины, ASCOMS & Hospital, Сидра, Джамму и Кашмир.
Д-р Саураб Шарма,
Электронная почта: [email protected]
Автор для переписки:
Д-р Саурабх Шарма,
# 309/1, Чанни Химмат, Джамму-180015, Джамму и Кашмир.
Электронная почта: docsaurabhmd @ gmail.com
РЕФЕРАТ
ВВЕДЕНИЕ
Острые инфекции нервной системы являются одной из самых важных проблем в медицине, поскольку раннее распознавание, эффективное принятие решений и быстрое начало терапии могут спасти жизнь. Постановка клинического диагноза острого менингита зависит от краеугольного камня исследования спинномозговой жидкости (ЦСЖ). Мы представляем случай с вышеупомянутой трудностью и подход, связанный с установлением точного диагноза и назначением соответствующего лечения.
ЗАКЛЮЧЕНИЕ
При обнаружении вирусного менингита следует быть осторожным при оценке отчета по ЦСЖ, чтобы не поставить ошибочный диагноз и не отложить лечение. Наиболее важным анализом у пациентов, симптомы которых соответствуют менингиту простого герпеса, является обнаружение дезоксирибонуклеиновой кислоты вируса простого герпеса (ВПГ-ДНК) в спинномозговой жидкости с помощью полимеразной цепной реакции (ПЦР).
КЛЮЧЕВЫЕ СЛОВА
Спинальная жидкость (ЦСЖ), дезоксирибонуклеиновая кислота вируса простого герпеса (ДНК ВПГ), полимеразная цепная реакция (ПЦР).
ВВЕДЕНИЕ: Острые инфекции нервной системы 1 относятся к числу наиболее важных проблем в медицине, поскольку раннее распознавание, эффективное принятие решений и быстрое начало терапии могут спасти жизнь. Отчетливый клинический синдром включает острый бактериальный менингит, вирусный менингит, энцефалит, очаговые инфекции, такие как абсцесс головного мозга. Каждый может проявляться неспецифическим продромом лихорадки, головной боли, измененного сознания, очаговых неврологических симптомов или судорог.Ключевые цели раннего лечения — срочное различение этих состояний, выявление патогенов и начало соответствующей антимикробной терапии. Постановка клинического диагноза острого менингита зависит от краеугольного камня исследования спинномозговой жидкости. Классическое описание трех часто встречающихся инфекционных причин менингита — бактериальной, вирусной и туберкулезной — во многом зависит от классической картины спинномозговой жидкости. Однако классическое описание спинномозговой жидкости при трех типах менингита иногда трудно интерпретировать из-за того, что картина спинномозговой жидкости, которая обычно варьируется в зависимости от описываемого, демонстрирует перекрывающиеся черты другой этиологии.Другая трудность возникает, когда рентгенологический объект для диагностики, то есть МРТ и компьютерная томография, не способствует диагностике.
Мы представляем случай с вышеупомянутой трудностью и подход, связанный с установлением точного диагноза и назначением соответствующего лечения.
СЛУЧАЙНЫЙ СЛУЧАЙ: Мы сообщаем о случае 53-летнего мужчины, известного случая СД2, который был доставлен в больницу с высокой температурой в анамнезе; головная боль и измененные сенсорные ощущения за 5 ч до поступления.Пациент был в своем обычном состоянии здоровья, когда у него внезапно началась сильная лихорадка, и в течение нескольких часов у него появилась рвота, головная боль и изменились сенсорные ощущения. Детальное неврологическое обследование при поступлении выявило сонливость и возбуждение. При обследовании двигательной системы он двигал всеми 4 конечностями и локализовал болевой раздражитель, хотя вербальная реакция была запутанной. Его шкала комы Глазго (оценка по GCS) на момент поступления составляла 12/15. Присутствовала скованность в шее. Зрачки нормального размера, реагируют на свет.Левая подошва была опущена, а правая двусмысленна. Через несколько часов сенсориум пациента еще больше ухудшился, пациент стал ступорозным и у него начались приступы GTC. Пациент был переведен в отделение интенсивной терапии, интубирован и помещен на искусственную вентиляцию легких. Его стандартные лабораторные параметры были следующими: случайный уровень сахара в крови 280 мг / дл, мочевина в крови 40 мг / дл, креатинин сыворотки 1,3 мг / дл, ТСХ — 14 000 клеток / куб. мм, DLC — нейтрофилы 76%, лимфоциты 20%, моноциты 03%. Гемоглобин 10 г%, тромбоциты 1,5 мкг, СОЭ 5 мм / час., ПТИ 88%. Общий белок сыворотки 7,6 г / дл, сывороточный альбумин 3,5 г / дл, билирубин сыворотки 0,8 мг%, конъюгированный 0,2 мг%. Обычное исследование мочи: альбумин ноль, глюкоза 3+, гнойные клетки 2–3 / hpf. Рентген грудной клетки в пределах нормы. ЭКГ в норме, ритм синусовый. Было проведено нейровизуализационное исследование. Компьютерная томография показала, что боковые желудочки с обеих сторон видны, остальное — в норме. Была проведена МРТ головного мозга и получены взвешенные изображения T1 и T2. На МРТ головного мозга существенных отклонений не обнаружено.Была сделана люмбальная пункция, результаты которой составили: — Общий белок в спинномозговой жидкости 285 мг / дл, глюкоза в спинномозговой жидкости 70 мг / дл, хлорид 126 мэкв.
Цитология
CSF была следующей: TLC -800 клеток / мкл. DLC: нейтрофилы 80%, лимфоциты 16%. RBC 10-12 / hpf. Культура CSF не показала признаков какого-либо роста. Окрашивание ЦСЖ по Граму также было отрицательным. Окрашивание спинномозговой жидкости препаратом KoH и индейскими чернилами также было отрицательным.
Отправлена ПЦР CSF на HSV1 и HSV2. Он был положительным на ВПГ2. Первоначально пациенту была начата эмпирическая схема лечения менингита.Однако после получения отчета ПЦР для HSV2 лечение было адаптировано к вирусному менингиту. Пациенту был назначен ацикловир внутривенно на 10 дней. У пациента наступило клиническое улучшение, улучшилась сенсорная система. У него не было никаких новых припадков, и он отключился от аппарата искусственной вентиляции легких на 4 день. Последующая контрольная люмбальная пункция была произведена на 10 сутки. Отчет был следующим: белок ЦСЖ 43 мг / дл, сахар 76 мг / дл. ТСХ: 5 клеток / hpf. DLC: все лимфоциты. Пациент полностью выздоровел и выписан из стационара на 14 день поступления.
ОБСУЖДЕНИЕ: Быстрая диагностика инфекции ЦНС, вызванной HSV. 2 важна из-за потенциальной заболеваемости и смертности, связанных с энцефалитом, вызванным вирусом простого герпеса, и доступности противовирусной терапии. Доказано, что ацикловир облегчает это заболевание. Без терапии> 70% случаев энцефалита, вызванного вирусом простого герпеса, заканчиваются летальным исходом. Было показано, что лечение ацикловиром снижает уровень смертности до 20% для пациентов любого возраста.
HSV представляет собой нейронофагический вирус 3 , который обычно вызывает геморрагический некроз височной доли.Это свойство принято в качестве отличительной находки при дифференциальной диагностике от других энцефалитов. Широкий спектр клинических синдромов, связанных с HSV-инфекцией ЦНС, представлен как 1 из 3-х основных состояний: неонатальная инфекция; энцефалит; менингит. Инфекции новорожденных чаще всего вызываются вирусом простого герпеса 2 типа, который передается вертикально во время родов. Вирусный менингит, вызываемый ВПГ, преимущественно относится к типу 2 ВПГ. Обычными клиническими проявлениями этого заболевания являются головная боль, лихорадка плюс признаки раздражения менингеальных сосудов, связанные с воспалительной ЦСЖ.Однако глубокое изменение сенсориума, ступор, кома, судороги необычны для вирусного менингита и предполагают наличие поражения паренхимы и энцефалита. ВПГ-энцефалит — это острый локализованный некроз паренхимы головного мозга с локализованными поражениями ЦНС. Классически вовлекаются височные и лобные доли. Это может произойти у пациентов любого возраста после периода новорожденности. Это преимущественно вызвано вирусом простого герпеса 1 типа {> 85%}. Хотя в нашем случае у пациента были глубокие изменения сенсориума и повторяющиеся судороги GTC, указывающие на поражение паренхимы и энцефалит.
Его отчет ПЦР был положительным на ВПГ 2 типа.
Сообщается, что
ВПГ-менингит является последствием первичного генитального герпеса у 36% пораженных женщин и 13% пораженных мужчин. Но только 25% — 33% пациентов когда-либо сообщают о поражении половых органов в анамнезе. В этом конкретном случае пациент не сообщал о каких-либо поражениях половых органов. Подгруппа этих пациентов, возможно, до 25% имеет повторные 4 приступов ВПГ-менингита, разделенных бессимптомными периодами от месяцев до лет.
Анализ CSF 5 нашего пациента с менингоэнцефалитом HSV2 отличался от ожидаемого количества при типичном вирусном менингите, в то время как количество клеток CSF 25-500 клеток / мкл с преобладанием мононуклеарных клеток обычно ожидается при вирусных инфекциях. У нашего пациента общее количество клеток в спинномозговой жидкости составило 800 клеток / мкл. Известно, что лишь несколько вирусных инфекций ЦНС, таких как LCMV и эпидемический паротит, вызывают в спинномозговой жидкости несколько тысяч клеток. Клеточная картина преобладающих нейтрофилов в спинномозговой жидкости, хотя известно, что встречается при некоторых вирусных менингитах, таких как вирус ECHO, энцефалит восточных лошадей и эпидемический паротит, обычно не регистрируется при менингите, вызванном HSV2.В нашем случае цитологический анализ спинномозговой жидкости показал 80% нейтрофилов. Последующая люмбальная пункция через 10 дней после лечения ацикловиром показала, что количество клеток в спинномозговой жидкости снизилось до 5 клеток / hpf, и все они были лимфоцитами. В данном случае также было обнаружено, что количество эритроцитов в спинномозговой жидкости составляет 10-12 / hpf, что согласуется с известными доказательствами наличия эритроцитов в спинномозговой жидкости при герпетическом энцефалите. В нашем случае уровень глюкозы в спинномозговой жидкости был в пределах нормы. Тем не менее, белки спинномозговой жидкости, ожидаемые при вирусном менингите, представляют собой небольшое повышение до 20-80 мг / дл, тогда как в нашем случае сообщалось о заметном повышении на 285 мг / дл.Нейровизуализация в форме МРТ 6 головного мозга помогает идентифицировать или исключать альтернативный диагноз и помогает дифференцировать очаговый энцефалитный процесс от диффузного. Очаговые находки у пациента с энцефалитом всегда должны указывать на возможность энцефалита, вызванного вирусом простого герпеса. Основные результаты включают: {1} Области повышенной интенсивности сигнала в лобно-височной, поясной или островной областях на Т2-взвешенной МРТ-визуализации. {2} Фокусные области с низким поглощением, масс-эффектом и усилением контраста на КТ.{3} Периодические очаговые всплески височных долей на фоне медленной или малоамплитудной активности на ЭЭГ. Это; однако следует иметь в виду, что хотя МРТ очень чувствительна и специфична при обнаружении поражений, упомянутых выше; приблизительно у 10% пациентов с подтвержденным ПЦР 7 энцефалит ВПГ будет нормальным МРТ. КТ менее чувствительна, чем МРТ, и является нормальной у 33% пациентов. В описанном нами случае результаты МРТ и компьютерной томографии были нормальными и не внесли вклад.
В настоящее время определение ДНК ВПГ в спинномозговой жидкости методом ПЦР стало золотым стандартом диагностики менингита ВПГ.ДНК ВПГ в спинномозговой жидкости может быть положительной через 24 часа после появления симптомов заболевания до одной недели спустя после начала лечения. В проведенных исследованиях было установлено, что чувствительность и специфичность обнаружения ДНК ВПГ составляет 98% и 99% соответственно. Было показано, что диагностическая ценность обнаружения ДНК ВПГ такая же, как и при биопсии височной доли. Исследования показали, что противовирусная терапия очень слабо влияет на чувствительность и специфичность ДНК ВПГ в ПЦР ЦСЖ.ВПГ –ДНК оказался положительным во всех образцах, взятых до лечения, и в 98% образцов, взятых через неделю после лечения. Прогнозирующая ценность положительного результата снизилась примерно до 50% на второй неделе лечения. В данном случае образец ПЦР ВПГ-ДНК ЦСЖ был отправлен на следующий день госпитализации и был зарегистрирован как положительный результат ПЦР-ВПГ-2. Akran ogus et al. Сообщили о двух случаях полностью нормальных результатов в спинномозговой жидкости, у которых с помощью ДНК ВПГ был диагностирован энцефалит ВПГ.
ЗАКЛЮЧЕНИЕ: Таким образом, принимая во внимание различия в результатах анализа спинномозговой жидкости при вирусном менингите, следует быть осторожным при оценке отчета о спинномозговой жидкости и не делать неправильный диагноз и не откладывать лечение. 7
Наиболее важным анализом у пациентов, симптомы которых соответствуют менингиту простого герпеса, является определение ДНК ВПГ в спинномозговой жидкости с помощью ПЦР.
Список литературы
- Энтони С. Фок. Принцип Харрисона внутренней медицины. McGraw-Hill Medical 2008; 2 (18 th Edn): 2621-2622.
- Whitley RJ, Kimberlin DW, Roizman B. Вирусы простого герпеса. Clin infect dis 1998; 26 (3) 541-553.
- Новости Университета Флориды.Изучены возможности новой терапии герпеса. Новости. УФЛ. EDU 3 февраля 2009 г.
- Теддер Г., Эшли Р., Тайлер К.Л. и др. Инфекции, вызванные вирусом простого герпеса, как причина доброкачественного рецидивирующего лимфоцитарного менингита. Энн Интерн Мед 1994; 121 (5): 334-338.
- Stoppe G. Stark E, Patzold U. Менингит Моллареца: иммуноцитологическое исследование спинномозговой жидкости J Neurol 1987: 234 (2): 103-106.
- Whitley R, Lukeman F. Инфекции, вызванные вирусом простого герпеса центральной нервной системы: терапевтические и диагностические соображения.Clin Infect Dis 1995: 20 (2): 414-240.
- Bergstrom T, Alestig K. Лечение ацикловиром первичного и рецидивирующего менингита, вызванного вирусом простого герпеса 2 типа. Scand J Infect Dis 1990; 22 (2): 239-240.
% PDF-1.4
%
30 0 объект
>
эндобдж
xref
30 91
0000000016 00000 н.
0000002708 00000 н.
0000002838 00000 н.
0000002872 00000 н.
0000003382 00000 н.
0000003407 00000 н.
0000003545 00000 н.
0000003674 00000 н.
0000003947 00000 н.
0000004368 00000 н.
0000004729 00000 н.
0000005247 00000 н.
0000005695 00000 п.
0000006114 00000 п.
0000006545 00000 н.
0000006656 00000 н.
0000006903 00000 н.
0000007016 00000 н.
0000007374 00000 н.
0000007399 00000 н.
0000008048 00000 н.
0000008301 00000 п.
0000008770 00000 н.
0000009784 00000 н.
0000010512 00000 п.
0000011158 00000 п.
0000011292 00000 п.
0000011720 00000 п.
0000011745 00000 п.
0000012528 00000 п.
0000013268 00000 н.
0000014017 00000 п.
0000014156 00000 п.
0000014710 00000 п.
0000015011 00000 п.
0000015620 00000 н.
0000015645 00000 п.
0000016135 00000 п.
0000016402 00000 п.
0000017491 00000 п.
0000018070 00000 п.
0000048807 00000 п.
0000049087 00000 н.
0000049474 00000 п.
0000071426 00000 п.
0000116235 00000 н.
0000142071 00000 н.
0000142556 00000 н.
0000142625 00000 н.
0000142765 00000 н.
0000170156 00000 н.
0000170416 00000 н.
0000170485 00000 н.
0000170554 00000 н.
0000170688 00000 н.
0000193559 00000 н.
0000214059 00000 н.
0000214331 00000 п.
0000214984 00000 н.
0000215102 00000 н.
0000232033 00000 н.
0000232299 00000 н.
0000232648 00000 н.
0000232744 00000 н.
0000232813 00000 н.
0000251643 00000 н.
0000251896 00000 н.
0000252234 00000 н.
0000281892 00000 н.
0000282139 00000 п.
0000282687 00000 н.
0000299400 00000 н.
0000299678 00000 н.
0000300026 00000 н.
0000300052 00000 н.
0000300515 00000 н.
0000300647 00000 н.
0000300673 00000 п.
0000301079 00000 п.
0000301218 00000 н.
0000301613 00000 н.
0000301997 00000 н.
0000302336 00000 н.
0000302636 00000 н.
0000303006 00000 п.
0000303370 00000 н.
0000303727 00000 н.
0000304098 00000 н.
0000305263 00000 н.
0000305340 00000 н.
0000002116 00000 н.
трейлер
] / Назад 534879 >>
startxref
0
%% EOF
120 0 объект
> поток
hb«`b`8 [̀
.


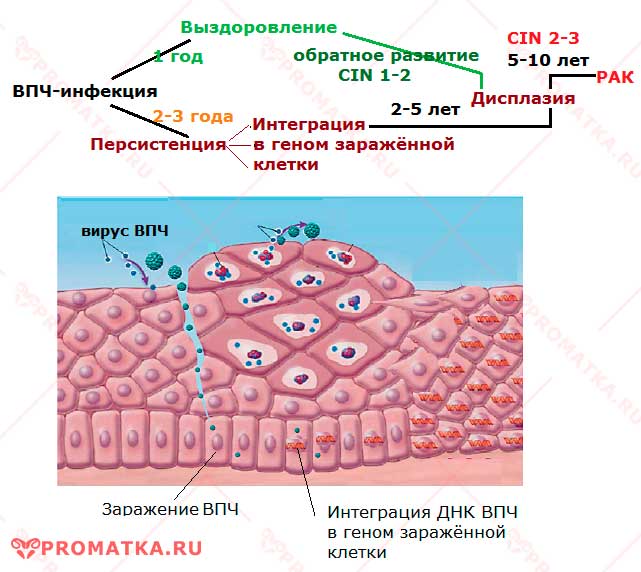 должны быть достигнуты приведенные ниже целевые показатели 90-70-90;
должны быть достигнуты приведенные ниже целевые показатели 90-70-90;