Взятие мазка из зева и носа на бациллу Лефлера
27.12.2011 00:20
Гигиена ребенка
Проводят при подозрении на дифтерию (в течение 3 дней), однократно — пациентам с ангиной при наличии налетов, при заболеваниях глотки и гортани, контактным с больным дифтерией, детям при поступлении в детские учреждения.
Приготовьте:
— герметично закрытые стерильные пробирки с ватными тампонами на стержнях;
— шпатель в крафт-пакете;
— штатив;
— бикс для транспортировки;
— стеклограф;
— манипуляционный стол;
— направление в лабораторию формы 204/у; перчатки;
— спиртовку.
Технология.
1. Обработайте руки.
2. Наденьте перчатки.
3. Продезинфицируйте манипуляционный стол.
4. Обработайте руки.
5. Подготовьте все необходимое на манипуляционном столе.
6. Стеклографом пронумеруйте пробирки в соответствии с направлением.
7. Поставьте пробирки в штатив.
8. Положение пациента — сидя лицом к источнику света с широко открытым ртом. Маленьким детям рот открывают с помощью шпателя.
9. Прижмите корень языка шпателем левой рукой.
10. Правой рукой с помощью тампона на стержне снимите слизь с миндалин, дужек, задней стенки глотки на границе здоровой слизистой и пораженного участка.
11. При взятии мазка следите за тем, чтобы тампон не касался языка, зубов и др.
12. Края пробирки обожгите над пламенем спиртовки и введите тампон в пробирку.
13. Для взятия мазка из носа следует осторожно вращательными движениями ввести стерильный тампон в носовой ход.
14. Края пробирки обожгите над пламенем спиртовки и введите тампон в пробирку.
15. Снимите перчатки, погрузите их в дезраствор.
16. Вымойте и просушите руки.
17. Оформите направление.
18. В течение двух часов оттранспортируйте материал в баклабораторию.
Мазок из зева берут натощак, до приема антибиотиков, рот предварительно полоскать не надо.
Похожие статьи:
Следующие статьи:
Предыдущие статьи:
Интересная статья?
Особенности взятия мазков со слизистой оболочки носа и зева на бациллу Леффлера.
· Предварительно очистить носовые проходы, убрать корки
· Взять материал из носовых ходов, вводя тампон глубоко в каждую ноздрю и плотно прикасаясь всеми его сторонами к стенкам и перегородке носа.
· Мазок из зева брать с использованием шпателя при хорошей освещенности. Вращательными движениями тампона необходимо захватить слизь с пораженных миндалин на границе воспалительного очага с налетами и здоровых тканей. При отсутствии налета слизь забирают с поверхности миндалин, небных дужек, язычка, при этом нельзя касаться слизистой языка и щек.
· Доставить в лабораторию не позднее 3-х часов с момента взятия материала.
· Пробирки от одного лица должны быть скреплены вместе. На каждой пробирке должен быть четко написан порядковый номер анализа.
Особенности взятия материала из носоглотки на менингококк.
· Металлическую палочку с тампоном согнуть для удобства взятия материала под углом примерно 450.
· Ввести тампон концом кверху за мягкое небо в носоглотку и провести 2-3 раза по задней стенки носоглотки.
· Немедленно доставить материал в лабораторию, в банке с водой температуры 37-38 градусов. Либо в биксе с грелкой температурой 37-38 градусов.
Внимание!При данных исследованиях обязательно надавливание шпателем на корень языка; ни в коем случае не коснуться тампоном зубов, слизистой щек, языка, язычка; в холодное время года материал доставляется в лабораторию в сумках-термосах.
Дата и количество
| ||
| Доклиническая практика | Учебная практика | Технологическая практика |
№ 34. Выполнение прививок против коклюша, дифтерии, столбняка
(АКДС, АКДС-М, АДС, АДС-М, АД-М).
Цель: профилактика коклюша, дифтерии, столбняка.
Показания: здоровый ребенок соответствующего возраста, согласно календарю профилактических прививок
Материальное обеспечение:1) прививочные препараты: АКДС, АКДС-М, АДС, АДС-М, АД-м; 2) шприцы однократного применения 2,0; 3) наждачный диск; 4) стерильный столик с ватными шариками, салфетками, пинцетом; 5) холодовой элемент с ячейками; 6) спирт этиловый; 7) лоток для использованного материала; 10) перчатки; 8) кукла-фантом; 9) две емкости с 3% р-ром хлорамина для промывания и обеззараживания использованных шприцев и игл; 10) мензурка.
Подготовительный этап выполнения манипуляции:
1. Проверить наличие письменного разрешения на прививку и соответствие ее допустимым срокам.
Сообщить маме/ребенку цель и ход предстоящей манипуляции.
2. Подготовить необходимое оснащение.
3. Вымыть и осушить руки, надеть перчатки.
4. Достать из холодильника соответствующий прививочный препарат, проверить наличие этикетки, срок годности, целость ампулы, внешний вид препарата и растворителя. Достать из упаковки ампулу с вакциной. Протереть шейку ампулы ватным шариком, смоченным 70% этиловым спиртом. Надрезать наждачным диском. Накрыть стерильной салфеткой и надломить.
5. Отработанные ватный шарик и салфетку сбросить в емкость с дезраствором.
6. ампулу поставить в мензурку.
7. Вскрыть упаковку шприца. Надеть на него иглу с колпачком, зафиксировать иглу на канюле. Снять с иглы колпачок.
8. Взять ампулу с АКДС-вакциной и набрать в шприц 0,5 мл препарата (пустую ампулу сбросить в дезраствор).
9. Взять пинцетом со стерильного столика салфетку и выпустить в нее воздух из шприца (сбросить салфетку в емкость с дезраствором).Положить шприц внутрь стерильного столика.
Основной этап:
1. Обработать верхне-наружный квадрант ягодицы 70% спиртом.
2. Ввести вакцину внутримышечно, извлечь иглу. Обработать место инъекции ватным шариком.
3. Сбросить ватный шарик и шприц в лоток с дезраствором, предварительно промыв шприц и удалив иглу.
Заключительный этап:
1. Снять перчатки, вымыть и осушить руки.
2. Данные о прививке внести во все учетные формы.
3. Наблюдать за ребенком в течение часа после прививки и в течение последующих 3-х дней. Предупредить родителей о возможных поствакцинальных реакциях.
Дата и количество
| ||
| Доклиническая практика | Учебная практика | Технологическая практика |
№ 35. Уход за ребенком после люмбальной пункции.
§ Перевести больного в палату, переложить на койку.
§ Предупредить больного, что он должен лежать на животе без подушки 3-4 часа, затем на боку 12-24 часа. В течении указанного времени следить за положением больного.
§ Кормление больного, лежащего на боку, допускается через 3-4 часа после пункции в лежачем положении.
Дата и количество
| ||
| Доклиническая практика | Учебная практика | Технологическая практика |
№ 36. Вакцинация против кори и паротита.
Цель: профилактика кори и паротита.
Показания: здоровый ребенок соответствующего возраста, согласно календарю профилактических прививок
Материальное обеспечение:1) прививочные препараты: паротитно-коревая вакцина и растворитель; 2) шприцы однократного применения 2,0; 3) наждачный диск; 4) стерильный столик с ватными шариками, салфетками, пинцетом; 5) холодовой элемент с ячейками; 6) спирт этиловый; 7) лоток для использованного материала; 10) перчатки; 8) кукла-фантом; 9) две емкости с 3% р-ром хлорамина для промывания и обеззараживания использованных шприцев и игл; 10) мензурка.
Подготовительный этап выполнения манипуляции:
1. Проверить наличие письменного разрешения на прививку и соответствие ее допустимым срокам.
Сообщить маме/ребенку цель и ход предстоящей манипуляции.
2. Подготовить необходимое оснащение.
3. Вымыть и осушить руки, надеть перчатки.
4. Достать из холодильника соответствующий прививочный препарат, проверить наличие этикетки, срок годности, целость ампулы, внешний вид препарата и растворителя. Достать из упаковки ампулу с вакциной и ампулу с растворителем, поставить на холодовой элемент, ампулу с вакциной накрыть светозащитным конусом. Протереть шейку ампулы растворителя ватным шариком, смоченным 70% этиловым спиртом. Надрезать наждачным диском. Накрыть стерильной салфеткой и надломить.
5. Отработанные ватный шарик и салфетку сбросить в емкость с дезраствором.
6. Вскрыть упаковку шприца. Надеть на него иглу с колпачком, зафиксировать иглу на канюле. Снять с иглы колпачок.
7. Набрать растворитель в шприц из расчета 0,5 мл на одну дозу вакцины. Ампулу сбросить в лоток для использованного материала. Положить шприц внутрь стерильного столика.
8. Взять ампулу с паротитно-коревой вакциной. Протереть шейку ампулы ватным шариком, смоченным 70% этиловым спиртом. Надрезать наждачным диском. Накрыть стерильной салфеткой и надломить.
9. Взять шприц из укладки, ввести растворитель в ампулу с сухой вакциной. Перемешать вакцину встряхиванием и возвратно-поступательным движением поршня до полного растворения, набрать в шприц 0,5 мл препарата (пустую ампулу сбросить в дезраствор).
9. Взять пинцетом со стерильного столика салфетку и выпустить в нее воздух из шприца (сбросить салфетку в емкость с дезраствором).
Основной этап:
1. Обработать двумя шариками со спиртом кожу ребенка в подлопаточной области или на границе нижней и средней трети наружной поверхности плеча.
2..Снять колпачок с иглы, сбросить в емкость с 3% раствором хлорамина.
3.Захватить рукой складку кожи и ввести в ее основание 0,5 мл вакцины.
4.Обработать кожу в области инъекции спиртом.
5. Сбросить ватный шарик и шприц в лоток с дезраствором, предварительно промыв шприц и удалив иглу.
Заключительный этап:
1. Снять перчатки, вымыть и осушить руки.
2. Данные о прививке внести во все учетные формы.
3. Наблюдать за ребенком в течение часа после прививки и в течение последующих 3-х дней. Предупредить родителей о возможных поствакцинальных реакциях с 6-го по 12-й день после введения вакцины в виде недомогания, кратковременной сыпи, и о которых необходимо сообщить в поликлинику.
Дата и количество
| ||
| Доклиническая практика | Учебная практика | Технологическая практика |
№ 37. Исследование на коклюш методом кашлевых пластинок.
Цель:собрать материал для бак. исследования.
Показания. Выделение возбудителя у лиц с подозрением на коклюш для подтверждения диагноза; обследование контактных при наличии кашля; обследование бактерионосителей после их санации.
Общие сведения. Наиболее часто возбудитель высевается в первые 2 недели заболевания. Взятие материала производят натощак или через 2-3 часа после еды. При доставке в лабораторию его необходимо беречь от охлаждения, поэтому чашки Петри и пробирки транспортировать в биксе между слоями пеленки, на дне которой находится грелка с температурой 37-380 С. Результат посева получают через 72 часа.
Материальное обеспечение: 1) герметично закрытые стерильные пробирки с ватными тампонами на металлическом стержне в биксе или крафт-пакетах; 2) чашка Петри с питательной средой; 3) шпатель в крафт-пакете; 4) бикс для транспортировки пробирок, штатив, пеленка, грелка, термометр; 5) стеклограф; 6) перчатки; 7) инструментальный столик; 8) бланк-направление; 9) фантом ротоглотки.
Взятие мазка на бл у ребенка. Мазок на bl бланк заполненный
3. На флакон, прикрепить этикетку
4. Накануне исследования принести пациенту флакон и в конфиденциальной обстановке информировать о предстоящем исследовании.
5. Объяснить цель исследования:
· Определение возбудителей патологического процесса
· подбор антибиотиков, эффективных при данном возбудителе.
6. Получить его согласие
7. Научить пациента сбору мокроты на анализ:
· Перед сном почистить зубы, прополоскать полость рта, приготовить ½ стакана кипяченой воды
· утром, после сна, почистить зубы и тщательно прополоскать рот и горло 10-15 раз кипяченой водой
· откашлять мокроту (мокрота собирается во время кашля!)
· открыть крышку, не касаясь руками ее внутренней поверхности,
· сплюнуть мокроту во флакон, не касаясь губами флакона
· Закрыть крышкой
· предупредить пациента, что нельзя долго держать флакон открытым
· объяснить пациенту, где он должен оставить флакон с мокротой
6. Попросить пациента повторить всю информацию
8. Утром доставить флакон с направлением в бактериологическую лабораторию в специальном термостате или в контейнере (в зимнее время в контейнере должна быть грелка t˚ 37˚с)
9. Сдать лично лаборанту
В амбулаторных условиях пациент должен накануне с бак. лаборатории взять флакон. В течении 2 часов после сбора анализа принести анализ в лабораторию, в холодное время года обернуть грелкой.
МАЗОК ИЗ ЗЕВА
Алгоритм действия м/с при взятии мазка из зева:
2. Написать направление:
3. Информировать пациента о предстоящем исследовании
· мазок берется при подозрении на дифтерию, коклюш
· для диагностики менингококковой инфекции,
· при язвенно-некротических изменениях миндалин,
· при поступлении в хирургический стационар для профилактики ВБИ)
5. Получить согласие пациента
6. Предупредить пациента о проведении исследования натощак (за 2 часа до исследования не есть, не пить, не полоскать горло, не жевать жвачку)
7. Вымыть руки, надеть перчатки и маску
8. Взять в левую руку стерильный шпатель
9. Правой рукой извлечь из пробирки стержень
10. Попросить пациента открыть рот
11. Шпателем нажать на корень языка
12. Тампоном сделать мазок:
· Мазок на микрофлору — с миндалин
· Мазок на ВL (бактерии Лефлера – на дифтерию) – снять налет на границе пораженного и здорового участков миндалин (пленки с миндалин не срывать!!!)
· Мазок на менингококковую инфекцию: тампон завести за мягкое небо концом вверх
· Мазок на коклюш и паракоклюш: завести тампон за корень языка концом вниз, произвести мазок по задней стенке глотки
· НЕ КАСАТЬСЯ ЯЗЫКА И ЩЕК!!!
13. Ввести тампон в пробирку
14. Положить шпатель в накопитель
15. Отнести штатив с пробирками и направлением в бактериологическую лабораторию в специальном контейнере или термостате
16. Сдать лично лаборанту
МАЗОК ИЗ ЗЕВА НА ЧУВСТВИТЕЛЬНОСТЬ К АНТИБИОТИКАМ БЕРЕТСЯ ДО АНТИБИОТИКОТЕРАПИИ!
МАЗОК ИЗ НОСА
(на стафилококк, на BL)
1. С бактериологической лаборатории взять стерильные пробирки с металлическим стержнем, на одном конце которых ватный тампон, а в середине — притертая к пробирке пробка
2. Написать направление:
3. Информировать пациента о предстоящем исследовании и получить его согласие
4. Сообщить цель исследования:
Обнаружение на слизистой носа стафилококка
Возбудителя дифтерии
5. Вымыть руки, надеть перчатки и маску
6. Попросить пациента высморкаться.
7. Правой рукой извлечь из пробирки металлический стержень, левой = придерживать кончик носа пациента
8. Ввести тампон в одну половинку носа на 2-3 см, и вращательным движением снять слизь с носовой перегородки, затем так же в другую половинку носа (если не назначено брать мазки в разные пробирки)
9. Ввести тампон в пробирку, не касаясь стенок
10. Отнести штатив с пробирками И НАПРАВЛЕНИЯМИ в бактериологическую лабораторию в специальном контейнере или термостате
11. Сдать лично лаборанту
ПРАВИЛА ДОСТАВКИ АНАЛИЗОВ В БАКЛАБОРАТОРИЮ
26.03.2013
Comments are closed.
Анна Парфенова
, детский отоларинголог клиники «Нева»
— Нужны ли антибиотики при ангине и зачем берётся мазок на
BL?
Все бактериальные ангины лечатся антибиотиками,- вирусные, возможно нет. Большую роль в принятии решения играет точная диагностика.
Мазок на BL- забор содержимого сухим ватным тампоном с поверхности поражённых миндалин для обнаружения бациллы Леффлера- возбудителя дифтерии. Дифтерия- достаточно редкое в настоящее время (благодаря вакцинации) заболевание, крайне опасное своими осложнениями.
Настороженность профильных специалистов на выявление BL- постоянная.
— Лечение гайморита. Можно- ли обойтись без пункций пазух?
Благодаря современным методикам и эффективным антибиотикам в 70% случаев – да.
— Преимущества видеоотоскопа в диагностике ЛОР- болезней для врача и пациента.
Отличная визуализация патологии уха, горла или носа при многократном увеличении в естественном цвете на экране монитора. Появляется прекрасная возможность врачу и пациенту наблюдать эффективность назначенного лечения. При необходимости картинка архивируется для сравнения состояния проблемной зоны при повторных обращениях.
— Скрининговая аудиометрия- что это и зачем.
Импедансный аудиометр- современный изящный диагностический инструмент.
Его применение позволяет в течении нескольких минут безболезненно выявить ряд проблем из-за которых снижен слух:
— накопление жидкости в барабанной полости
— нарушение проходимости Евстахиевой трубы
— разрыв в цепи слуховых косточек или их тугоподвижность
— возможность определения бессимпомного(без жалоб) снижения слуха у детей до 3-х лет.
Раздел IV. Лабораторная диагностика инфекционных
⇐ ПредыдущаяСтр 4 из 4
И паразитарных заболеваний.
Бактериологическое исследование кала на патогенную кишечную флору.
Существует два метода взятия материала:
I. Из прямой кишки.
II. Из горшка или с пеленки (3-5 гр) – чаще используется у детей.
Техническая подготовка:
Вымыть, высушить руки, надеть перчатки.
На инструментальный столик, поставить:
— герметично закрытые стерильные пробирки со средой (30% раствор глицерина). В них находится ректальная трубка для забора материала;
— стеклограф;
— бланк-направление;
— штатив, бикс.
Выполнение манипуляции(взятие материала для бактериологического исследования кала из прямой кишки):
1.Стеклографом поставить номер на пробирке, соответствующий номеру в направлении.
2.Установить пробирку в штатив.
3.Уложить ребенка раннего возраста на спинку, старшего — на левый бок на чистую пеленку.
4.Из пробирки вынуть ректальную трубку для забора материала, взять в правую руку.
Левой рукой раздвинуть ребенку ягодицы, правой осторожно, без насилия, зращательно-поступательными движениями ввести ректальную трубку для забора материала в прямую кишку на расстояние
3-4 см. (детям раннего возраста),
5-6 см. (детям старшего возраста).
5. Извлечь ректальную трубку, поместить в пробирку, не касаясь ее краев, плотно закрыть пробкой.
Заключительный этап:
1. Вымыть и обработать антисептиком руки в перчатках, снять их, вымыть и
высушить руки.
2. Оформить направление в лабораторию.
Взятие материала на BL (бациллу Леффлера).
— Выполняется мазок из зева и носа стерильными .ватными тампонами;
— проводят натощак, до чистки зубов, полоскания полости рта, приема лекарственных средств;
— взятый материал немедленно отправляется в лабораторию:
Техническая подготовка:
1. Вымыть руки, просушить, надеть перчатки.
2. На инструментальный столик поставить:
а). Герметично закрытые 2-е стерильные пробирки с ватными тампонами на
металлическом стержне, пропущенном через пробку.
б). Шпатель в крафт-пакете.
в). Штатив, бикс для транспортировки пробирок.
г). Стеклограф.
д). Бланк-направление.
е). Лоток для использованного материала.
Выполнение манипуляции:
1.Стеклографом поставить номер на пробирках, соответствующий номеру в направлении, на одной из них поставить букву Н (для носа), на другой — 3 (для зева).
2.Усадить ребенка к источнику света и предложить открыть рот. Детей младшего возраста фиксирует помощница.
3.Левой рукой шпателем фиксировать язык.
4.Правой рукой вынуть стерильный тампон из пробирки (3), снять слизь с миндалин и дужек на границе здорового и пораженного участка (не касаться зубов, неба).
5.Тампон поместить в пробирку, не касаясь краев. Шпатель бросить в лоток для использованного материала.
Из пробирки (Н) взять второй тампон, ввести глубоко в носовой ход, сделать вращательное движение.
Осторожно извлечь тампон, не касаясь кожи носа, поместить его во вторую пробирку (Н).
Заключительный этап:
1. Использованный шпатель замочить в дез. р-ре.
2.Вымыть и высушить руки. Снять перчатки.
3.Оформить направление в лабораторию.
4.Поместить пробирки в бикс.
Взятие материала на палочку Борде-Жангу.
Показания: выделение возбудителя у лиц с подозрением на коклюш.
Взятие материала осуществляют:
а), натощак; б), используют методы:
I метод — с помощью ватного тампона;
II метод — «кашлевых пластинок».
Техническая подготовка:
1.Герметично закрытые стерильные пробирки с ватными тампонами на металлическом стержне.
2.Чашка Петри с питательной средой.
3.Шпатель в крафт-пакете.
4.Штатив, бикс для транспортировки пробирок, термометр, грелка.
5.Стеклограф.
6.Перчатки.
Выполнение манипуляции:
1. Вымыть и просушить руки, надеть перчатки.
2. Стеклографом поставить номер на чашке Петри или пробирке, соответствующий номеру в направлении.
3. Установить пробирку в штатив.
4. Усадить ребенка к источнику света. Детей младшего возраста фиксирует помощник
I метод — взятие материала с помощью ватного тампона.
Открыть пробку, не вынимая тампон из пробирки изогнуть его о край пробирки под углом 35 гр. на расстоянии 3-4 см от его конца.
Предложить ребенку широко открыть рот.
Левой рукой взять шпатель и фиксировать язык. Ввести тампон в полость рта и взять слизь с задней стенки глотки. Не касаться десен, зубов, языка.
Извлечь тампон, поместить его в пробирку, пробку плотно закрыть. Поставить в термостат (тем. 37 гр.).
П метод — «кашлевых пластинок».
1.. Чашку Петри с питательной средой открыть на расстоянии 5-10 см. от рта,
больного просят 5-6 раз покашлять в течении 10-20 секунд (при отсутствии
кашля надавить на гортань).
2. Быстро закрыть чашку. Поместить в термостат (37-38 гр.).
Заключительный этап:
1.Вымыть и обработать антисептиком руки в перчатках, снять перчатки , зымыть руки.
2.Оформить направление в лабораторию.
Взятие материала на энтеробиоз (метод отпечатка на липкой ленте). Метод Грехэма.
Заранее предупредить маму ребенка или медицинский персонал о том, что процедура делается утром и ребенка не подмывают.
Техническая подготовка:
1. Вымыть и высушить руки. Надеть перчатки.
2. На инструментальный столик положить:
— прозрачную липкую ленту;
— шпатель;
— ножницы;
— предметные стекла;
— стеклограф;
— лотки;
— бланк-направление.
Выполнение манипуляции:
1. Стеклографом поставить номер на предметном стекле, аналогичный номеру в направлении.
2. На кушетке постелить чистую пеленку.
3. Уложить ребенка на левый бок.
4. Отрезать кусок липкой ленты по размеру предметного стекла.
5. Раздвинуть ягодицы ребенка (выполняется матерью или помощником).
6. К перианальной области приложить отрезок ленты, плотно прижав его шпателем.
7. Снять ленту и перенести ее на предметное стекло.
Заключительный этап:
Вымыть и обработать антисептиком руки в перчатках, снять их, вымыть и высушить руки.
Оформить направление в лабораторию.
Соскоб на энтеробиоз (метод Рабиновича)
Техническая подготовка:
1. Глазная лопаточка.
2. Пенал-штатив.
3. Перчатки.
4. Клей: клеол-10 гр., касторовое масло-2,5 грамма, этиловый спирт 96,5 градусный-2,5 грамма, этиловый эфир-5грамм.
Выполнение манипуляции:
1.Уложить ребенка на живот.
2.Вымыть руки, надеть перчатки.
3.Развести ягодицы.
4.Стерильную глазную лопатку опустить в клей и подсушить.
5.Провести соприкосновение лопатки с кожей перианальных складок.
6.Поставить лопатку в соответствующее гнездо штатива.
Заключительный этап:
1.Снять перчатки и вымыть руки.
2.Направить штатив в клиническую лабораторию
Примечание:
· Использованные глазные лопатки прокипятить в мыльном растворе,
· Штатив – пенал протереть тампоном, смоченным 70 градусным этиловым спиртом и промыть в мыльном растворе.
· Перчатки замочить в 3% растворе хлорамина.
Сбор мочи для анализа у детей раннего возраста.
Техническая подготовка:
1.Бикс или крафт-пакет со стерильным материалом.
2.Антисептический раствор.
3.Перчатки.
4.Чистая сухая емкость.
5.Мочеприемник.
6.Клеенка.
7.Пеленки.
8.Направление.
9. Два лотка.
10.Ножницы.
Выполнение манипуляции:
1. Вымыть руки, надеть перчатки.
2. Постелить клеенку, пеленку.
3. Ребенка подмыть, обсушить.
4. Зафиксировать мочеприемник.
5. После мочеиспускания отклеить мочеприемник с мочой и перелить в емкость, обрезав нижний край мочеприемника над баночкой.
Заключительный этап:
1.Ребенка запеленать, уложить в кроватку.
2.Снять перчатки и вымыть руки.
3.Оформить направление на исследование.
Литература.
1. Волков С.Р., Волкова М.М. Здоровый человек и его окружение М. «Медицина»» 2005.
2. Гребнев А.Л., Шептулин А.А. Основы общего ухода за больными. М., 1991.
3. Детские болезни (Под ред. Л.А. Исаевой. М.) 1994.
4. Каткова З.И. Медицинские манипуляции в детских лечебно-профилактических учреждениях. Киев. 1989.
5. Мазурин А.В., Запруднов A.M., Григорьев К.И. Общий уход за детьми. М., 1989.
6. Мухина С.А. Теоретические основы сестринского ухода. М., 1997.
7. Солодухо Н.Н., Ежова Н.В., Русакова Е.М. Сестринское дело в педиатрии. 1998.
8. Щамсиев Ф.С, Еренкова Н.В. Уход за больными детьми. 1999.
ВЗЯТИЕ МАТЕРИАЛА НА ПАЛОЧКУ БОРДЕ—ЖАНГУ — Студопедия
Показания.Выделение возбудителя у лиц с подозрением на коклюш для подтверждения диагноза; обследование контактных при наличии кашля; обследование бактерионосителей после их санации.
Общие сведения.Наиболее часто возбудитель высевается в первые 2 недели заболевания. Взятие материала производят натощак или через 2—3 ч после еды. При доставке в лабораторию его необходимо беречь от охлаждения, поэтому чашки Петри и пробирки транспортировать в биксе между слоями пеленки, на дне которого находится грелка с температурой 37—38° С. Результат посева получают через 72 ч.
Материальное обеспечение:
1)герметично закрытые стерильные пробирки с ватными тампонами на металлическом стержне в биксе или крафт-пакетах; 2) чашка Петри с питательной средой; 3) шпатель в крафт-пакете; 4) бикс для транспортировки пробирок, штатив, пеленка, грелка, термометр; 5) стеклограф; 6) перчатки; 7) инструментальный столик; 8) бланк-направление; 9) фантом ротоглотки.
Подготовительный этап выполнения манипуляции.
1.Вымыть и просушить руки, надеть перчатки.
2. Поставить на инструментальный столик необходимое оснащение.
3. Поставить стеклографом номер на чашке Петри (про
бирке), соответствующий номеру в направлении. Установить пробирку в штатив.
4. Усадить ребенка к источнику света. Детей младшего возраста фиксирует помощник.
I методвзятия материала с помощью ватного тампона.
5. Изогнуть стерильный ватный тампон о край пробирки под углом 135° на расстоянии 3—4 см от конца или взять готовый изогнутый тампон.
6. Предложить широко открыть рот. Левой рукой надавить шпателем на корень языка. Ввести тампон и провести им 2—3 раза по задней стенке глотки. Осторожно извлечь тампон, не касаясь слизистой оболочки рта и зубов.
7. Произвести посев материала на чашку Петри с питательной средой. Содержимое тампона нанести на ее поверхность, не нарушая целости.
II метод«кашлевых пластинок».
Основной этап выполнения манипуляции.5. Взять чашку Петри, при появлении кашля открыть ее и держать на расстоянии 5—10 см от рта больного в течение 10—20 с, улавливая 5—6 кашлевых толчков. При отсутствии кашля вызвать кашлевую реакцию, надавливая шпателем на корень языка.
6. Быстро закрыть чашку Петри и поставить в термостат с температурой
36—37° С.
Заключительный этап выполнения манипуляции.
7. Вымыть и обработать антисептическим раствором руки в перчатках, снять перчатки, вымыть и просушить руки.
8. Оформить направление.
9. Транспортировать взятый материал в биксе в бактериологическую лабораторию.
ЛЕФФЛЕРА МЕТОДЫ — Большая Медицинская Энциклопедия
Леффлера методы (F. Loeffler, немецкий бактериолог, 1852—1915) — методические приемы при бактериологических исследованиях, разработанные и введенные в практику Ф. Леффлером. Из них в совр, лабораторной практике применяются: методы приготовления среды для культивирования дифтерийной палочки — среда Леффлера (см. Дифтерия, этиология), способ окраски дифтерийных бактерий и окраска жгутиков у бактерий.
Метод окраски жгутиков по Леффлеру
Культура бактерий выращивается на питательном агаре в течение 12—18 час. при оптимальной температуре. В чистую пробирку помещают 1,5 мл дистиллированной или водопроводной воды. Платиновой петлей берут небольшое количество исследуемой культуры бактерий и несколько раз погружают ее в воду до получения равномерной взвеси. Взвесь ставят в термостат на 10— 20 мин. На чистое, прокаленное предметное стекло, платиновой петлей наносят несколько капель взвеси культуры бактерий и высушивают их на воздухе, а затем быстро фиксируют, проводя через пламя горелки не более 2—3 раз. Фиксированный препарат погружают на 0,5—2 мин. в протраву следующего состава: 20% водный р-р танина — 100 мл; насыщенный на холоду р-р сернокислого железа — 50 мл; насыщенный спиртовой р-р фуксина — 10 мл. Обработку в протраве ведут при слабом подогреве. После протравы препарат тщательно промывают водой и высушивают, а затем окрашивают анилиновым фуксином Эрлиха в течение 2—3 мин. Окрашенный препарат промывают водой, высушивают и микроскопируют.
Модификация метода Леффлера по М. А. Пешкову. Препараты готовят на чистых покровных стеклах. Для окраски необходима протрава из трех р-ров.
1. Насыщенный спиртовой р-р основного фуксина: к 1—2 крупным кристаллам фуксина добавляют 10 мл 96% этилового спирта и ставят в термостат на 1 — 2 часа или на водяную баню при t ° 50°.
2. Водный 20% р-р танина.
3. Насыщенный на холоду р-р соли Мора (сернокислое закисное аммиачное железо). Смешивают 1 мл р-ра 1 и 10 мл р-ра 2; к смеси прибавляют 5,5 мл р-ра 3; на фиксированный препарат с избытком наливают профильтрованный р-р протравы и оставляют его на стекле на 10—15 мин., следя за тем, чтобы жидкость не подсыхала и не подтекала под нижнюю поверхность стекла.
Препарат промывают сильной струей дистиллированной воды (30 сек.). Тонкой тряпочкой удаляют с краев стекла остатки протравы и повторно промывают дистиллированной водой. Обработанный препарат мазком вниз помещают в часовое стекло и подливают профильтрованный фуксин Циля, разбавленный в два раза водой. Окраску производят в течение 3—5 мин., после чего препарат промывают водой.
Библиогр.: Руководство по микробиологической диагностике инфекционных болезней, под ред. К. И. Матвеева, с. 34, М., 1973; Справочник по микробиологическим и вирусологическим методам исследования, под ред. М. О. Биргера, с. 28, М., 1973. См. также библиогр, к ст. Леффлер Ф.
Д. М. Гольдфарб.
Мазок из зева на бациллу леффлера. Анализ мазка на стафилококк
Оснащение:
Резиновые перчатки, маска.
Стерильные пробирки с сухими ватными
тампонами (2 шт.).
Штатив для пробирок (2 шт.).
Стерильный шпатель в лотке.
Бланк-направление в лабораторию.
Стеклограф.
Подготовка к процедуре.
Выписать направление в лабораторию,
указать №.
Вымыть и осушить руки, надеть маску,
перчатки.
Поставить на инструментальный столик
необходимое оснащение (расположив по
правую руку; слева – штатив для пробирок
с забранным материалом).
Стеклографом промаркировать пробирки
«Н», «З», № совпадающий с номером на
бланке-направлении.
Усадить ребенка лицом к источнику
света.
Выполнение процедуры.
Взять в левую руку пробирку, маркированную
знаком «Н».
Извлечь ватный тампон из пробирки, не
касаясь краев пробирки, взяв его правой
рукой за пробку, в которую он вмонтирован.
Большим пальцем левой руки приподнять
кончик носа ребенка.
Осторожно ввести тампон вращательными
движениями в один носовой ход, затем в
другой, плотно прикасаясь к их стенкам.
Собрав материал, поместить тампон в
пробирку, не касаясь ее краев.
Пробирку поместить в штатив, находящийся
по правую руку.
Взять одновременно в левую руку шпатель
как писчее перо и пробирку, маркированную
знаком «З».
Попросить ребенка широко открыть рот
и шпателем нажать на корень языка.
Извлечь ватный тампон из пробирки, взяв
его правой рукой за пробку в которую
он вмонтирован.
Осторожно не касаясь языка и щек, ввести
тампон в полость рта.
Снять тампоном слизь с небных дужек и
миндалин в следующей последовательности:
дужка – миндалина – язычок – дужка –
миндалина.
Примечание:
при
наличии пленке в зеве – материал собирать
на границе здоровой и пораженной ткани.
Извлечь тампон из ротовой полости и
поместить в пробирку, не касаясь ее
краев.
Пробирку помести в штатив, предназначенный
для пробирок с забранным материалом.
Завершение процедуры.
Вымыть и обработать руки антисептическим
материалом руки в перчатках.
Снять маску, перчатки.
Вымыть и осушить руки.
Отправить материал в бактериологическую
лабораторию в сопровождении направления
(не позднее 3 часов после забора при
условии хранения в холодильнике).
Взятие материала на патогенную кишечную флору Взять анализ кала для бактериологического исследования на кишечную группу.
Оснащение:
Стерильная пробирка с металлической
петлей и консервантом.
Штатив для пробирок.
Перчатки.
Бланк-направление, стеклограф.
Подготовка к процедуре.
Подготовить необходимое оснащение.
Выписать направление в баклабораторию.
Поставить стеклографом номер на
пробирке, соответствующий номеру в
направлении.
Вымыть и осушить руки надеть перчатки.
Выполнение процедуры.
Уложить ребенка на левый бок с согнутыми
в коленях и приведенными к животу
ногами.
Взять пробирку в левую руку.
Раздвинуть ягодицы ребенка 1 и 2 пальцами
левой руки и зафиксировать ребенка в
данном положении.
Правой рукой взять из пробирки
металлическую петлю и осторожно
вращательными движениями ввести ее в
прямую кишку и собрать содержимое со
стенок.
Примечание:
глубина введения петли у детей раннего
возраста 3 – 4 см., у старших детей – 6 –
8 см.; петлю продвигают вначале по
направлению к пупку, затем параллельно
позвоночнику.
Извлечь петлю из прямой кишки и поместить
в пробирку с консервантом, не касаясь
краев пробирки.
Примечание:
не брать кал с явными примесями крови,
т.к. кровь имеет бактерицидные свойства.
Завершение процедуры.
Снять перчатки, поместить в дезраствор.
Вымыть и осушить руки.
Отправить материал в баклабораторию
в сопровождении направления (допускается
хранение пробирки с консервантом в
холодильнике при температуре +3 — +4 0 С).
Мазок для исследования клеточного состава на слизистой оболочке ротоглотки позволяет подтвердить наличие болезнетворных микроорганизмов. На основании результатов анализа врач диагностирует заболевание, назначает лекарственные средства для борьбы с возбудителем.
Одним из наиболее часто проводимых исследований является мазок из зева на стафилококк.
Анализ назначается:
Бактериальные споры: строение, виды, спороношение и прорастание

- Спора представляет собой метаболически спящую структуру, вырабатываемую в неблагоприятных условиях в процессе, называемом споруляцией
- Споруляция происходит во время поздней логарифмической фазы или ранней стационарной фазы
- При благоприятных условиях споры прорастают с образованием вегетативных клеток.
- Размер: 0,2 мкм
- Spore устойчивы к пищевому голоданию, температуре, экстремальному pH, антибиотикам и т. Д.
Структура эндоспоры:
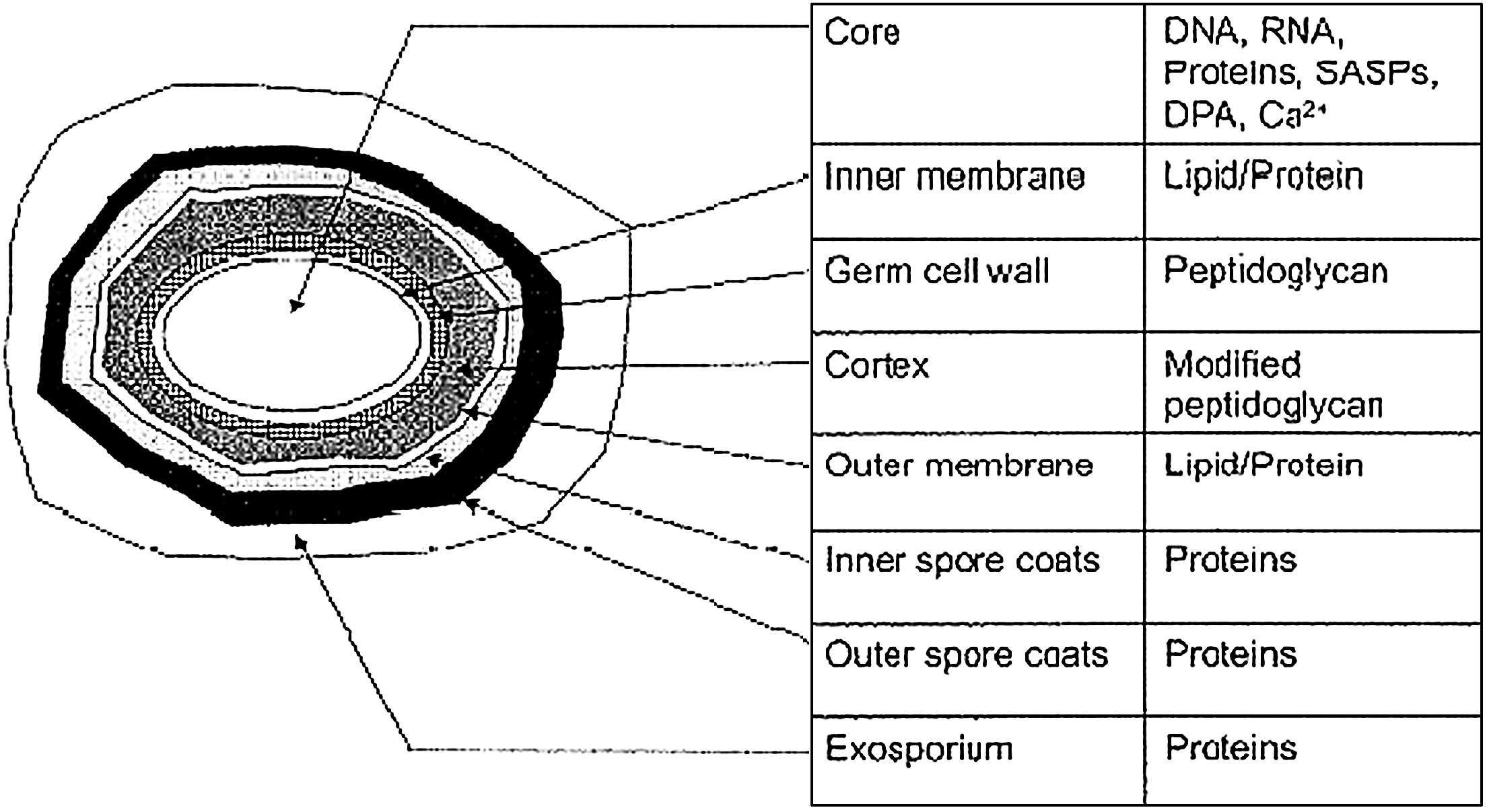
Эндоспора имеет следующие слои
- Экзоспориум
- Споровое пальто
- Cortex
- ядро
Экзоспориум:
- Это внешний слой, состоящий из белка, который покрывает споровую оболочку.
- В некоторых бактериальных спорах экзоспорий состоит из полисахарида и липида.
Споровое покрытие:
- Толстое двухслойное покрытие, покрывающее кору
- Покрытие спор состоит из специфического для спор белка, в основном содержит цистеин и гидрофобные аминокислоты. Благодаря наличию этих аминокислот споры устойчивы к неблагоприятным условиям окружающей среды.
Кора:
- Внутри оболочки Spore есть кора, состоящая из рыхлого слоя пептидогликана.
- Внутренний слой: содержит около 20% пептидогликана, плотно прилегающий
- Наружный слой: рыхлый, может гидролизоваться во время прорастания спор. Состоит из алалнина (55%), тетрапептида (15%) и мурамического лактата (30%).
Ядро:
- Это самая внутренняя часть споры
- Он также известен как протопласт спор
- Ядро состоит из центральной стенки, цитоплазматической мембраны, цитоплазмы, нуклеоида, рибосом и других клеточных материалов.
- Ядро содержит (10-25%) воды, поэтому цитоплазма гелевая, как
- Он содержит большое количество кальция и дипиколиновой кислоты в виде дипиколината кальция (10-15% от сухой массы).
- Core также содержит высокий процент мало растворимого в кислоте белка (SASP).
- SASP синтезируется во время споруляции, он связывается с ДНК в ядре и защищает ее от потенциальных повреждений, вызванных УФ-излучением, сушкой и сушкой.
- Кроме того, SASP также обеспечивает питание и энергию для прорастания спор.
Виды спор бактерий
1. Эндоспора:
- Вырабатывается внутри бактериальной клетки.
- Бактерии, продуцирующие эндоспоры: Bacillus, Clostridium, Sporosarcina и т. Д.
2. Экзоспора:
- Производится вне ячейки
- Бактерии, продуцирующие экзоспоры: Methylosinus
Споруляция
- В неблагоприятных условиях вегетативные клетки превращаются в споры в процессе, известном как споруляция
- Споруляцию можно разделить на несколько этапов.В Bacillus subtilis весь процесс споруляции занимает 8 часов от стадии 0 до стадии VII
Этапы споруляции:
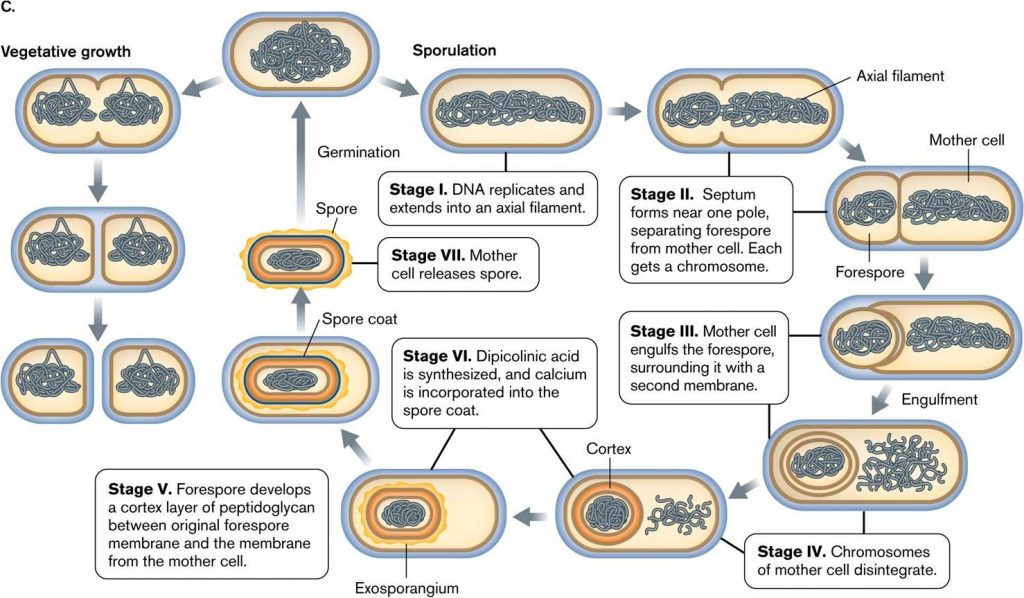
Этап 0
- Нормальное состояние вегетативной клетки
Этап I: этап формирования осевой нити
- На этой стадии бактериальная хромосома становится нитью, известной как осевая нить
- Аксиальные филаменты, прикрепленные к цитоплазматической мембране мезосомой
- Удлинение ячейки занимает
- PHBA — это зарезервированный пищевой материал в Bacillus spp. используется при споруляции.
II стадия: формирование предспоры
- Происходит асимметричное деление клеток
- Клеточная мембрана образует перегородку на одном конце, которая охватывает небольшую часть ДНК, образующую передспору
Стадия III: захват предспоры
- Мембрана материнской клетки разрастается вокруг поглощающей ее передспоры.
- Fore spore теперь имеет двухслойную мембрану
Этап IV: синтез экзоспория
- Хромосома материнской клетки распадается
- Происходит синтез экзоспориума
- Forespore начинает формирование первичной коры между двумя мембранами.
- Обезвоживание клетки
Этап V: синтез дипиколоновой кислоты
- Происходит производство SASP и дипиколиновой кислоты
- Включение ионов кальция с дипиколоновой кислотой с образованием дипиколоната кальция
- Дальнейшее обезвоживание цитоплазмы
- Формирование покровного слоя
Этап VI: созревание
Этап VII: высвобождение эндоспор
- Лизис клеток и высвобождение эндоспор
Прорастание спор
- Эндоспора остается бездействующей в течение многих лет.Но при благоприятных условиях каждая эндоспора прорастает, давая начало вегетативной клетке.
Прорастание спор включает 3 процесса.
- Активация
- Прорастание
- Нарост
Активация эндоспор:
- Прорастание бактериальных спор не происходит даже при благоприятных условиях окружающей среды, если только они не были сначала активированы.
- Сначала необходимо повредить шерсть Spore путем нагревания в течение нескольких минут.
Прорастание:
- Активированная спора инициирует прорастание после связывания эффекторных молекул.
- Связывание эффекторных молекул активирует автолиз, разрушающий пептидогликан коры.
- После разрушения пептидогликана вода поглощается и высвобождается дипиколиновая кислота кальция.
Вырост:
- После поглощения воды происходит набухание спор.
- Наряду с набуханием также происходит синтез ДНК, РНК и белков.
- Маленькая зародышевая клетка появляется после разрушения оболочки спор и начинает расти в вегетативную клетку.
Споры бактерий: строение, виды, спороношение и прорастание
.
Повышенная продукция целлюлазы из Bacillus subtilis путем оптимизации физических параметров для производства биоэтанола
Исследовали влияние физических параметров, таких как начальный pH, перемешивание (об / мин) и температура (° C), на продукцию целлюлазы из Bacillus subtilis AS3. Для оптимизации активности целлюлазы и роста клеток применялся центральный составной дизайн экспериментов с последующей функцией множественной желательности. Влияние температуры и перемешивания оказалось значимым среди трех независимых переменных.Оптимальные уровни начального pH, температуры и перемешивания для продуцирования щелочной карбоксиметилцеллюлазы (CMCase), предсказанные моделью, составляли 7,2, 39 ° C и 121 об / мин, соответственно. Активность CMCase при неоптимизированных физических параметрах и ранее оптимизированном составе среды составляла 0,43 Ед / мл. Максимальная активность (0,56 Ед / мл) и рост клеток (2,01 мг / мл), предсказанные моделью, совпадали со значениями (0,57 Ед / мл, 2,1 мг / мл), полученными с использованием оптимизированной среды и оптимальных значений физических параметров.После оптимизации было зарегистрировано 33% повышение активности CMCase (0,57 Ед / мл). При расширении процесса производства целлюлазы в биореакторе со всеми оптимизированными условиями была достигнута активность 0,75 Ед / мл. Следовательно, бактериальная целлюлаза, используемая для производства биоэтанола с использованием (5%, мас. / Об.) Предварительно обработанной NaOH дикорастущей травы Zymomonas mobilis , дала максимальный титр этанола 7,56 г / л и 11,65 г / л на уровне встряхиваемой колбы и биореактора. соответственно.
1. Введение
Целлюлазы находят разнообразное применение в текстиле, прачечной, целлюлозно-бумажной промышленности, экстракции фруктовых соков и добавках в корм для животных [1].Кроме того, они находят применение при осахаривании лигноцеллюлозных агроостаточных продуктов до сбраживаемых сахаров, которые можно использовать для производства биоэтанола, молочной кислоты и одноклеточного белка [2]. Бактерии широко исследовались на предмет продуцирования целлюлазы благодаря их высокой скорости роста, экспрессии мультиферментных комплексов, стабильности при экстремальных температурах и pH, меньшему ингибированию обратной связи и способности противостоять различным стрессам окружающей среды [1]. Среди них Bacillus sp. продолжает оставаться доминирующей бактериальной рабочей лошадкой из-за способности продуцировать и секретировать большие количества внеклеточных ферментов [3, 4].Однако физические параметры процесса, такие как температура, pH и скорость перемешивания, играют жизненно важную роль для эффективности производства целлюлазы микроорганизмами. Скорость перемешивания является важным фактором, регулирующим уровень растворенного кислорода в культуральной жидкости, который влияет на рост клеток микроорганизмов, продуцирующих целлюлазу [5]. Однако было показано, что более высокая скорость перемешивания ингибирует активность целлюлазы [5, 6]. Аналогичный профиль роста и активности ферментов при изменении pH и температуры также хорошо известен [5, 7, 8].Следовательно, оптимизация условий культивирования для улучшения продукции ферментов имеет важное значение.
Традиционный подход к оптимизации «по одной переменной за раз» не учитывает сложные взаимодействия между различными компонентами. Статистически обоснованные экспериментальные планы, такие как план Плакета-Бермана и методология поверхности отклика (RSM), могут быть эффективно использованы для изучения влияния факторов и поиска оптимальных уровней параметров для желаемого ответа [9]. Методы статистического моделирования успешно применялись во многих исследованиях, таких как производство целлюлозы Trichoderma reesei [9], Bacillus subtilis AS3 [10] и производство ксиланазы Bacillus pumilus [11].
Процесс одновременного осахаривания и ферментации (SSF) сочетает ферментативный гидролиз целлюлозы с последующей ферментацией редуцирующего сахара (глюкозы) до этанола [12]. Сообщалось об исследованиях SSF из лигноцеллюлозной биомассы, такой как пшеничная и рисовая солома, стебли кукурузы, кукурузные початки и отходы лесного хозяйства, с использованием целлюлазы из природных источников [13, 14]. Благодаря присущим ключевым ферментам для ферментации этанола, алкогольдегидрогеназе и пируватдекарбоксилазе, обнаруженным в Zymomonas mobilis, исследования были сосредоточены на нем как на многообещающем альтернативном производителе этанола из-за его высокого потребления сахара и улучшенной толерантности к этанолу [15].
В настоящем исследовании параметры физического процесса, такие как начальный pH, температура и скорость перемешивания культуры, были оптимизированы с помощью метода центрального составного дизайна с использованием многоответного анализа для повышения активности щелочной КМЦазы из недавно выделенных B. subtilis (AS3 ). Оптимальные уровни физических параметров процесса, предсказанные моделью, были проверены как в колбе, так и в биореакторе. Впоследствии бактериальную целлюлазу использовали для испытаний SSF на предварительно обработанной дикой траве во встряхиваемой колбе и биореакторе с Z.mobilis, соответственно.
2. Материалы и методы
2.1. Реагенты и субстрат
Карбоксиметилцеллюлоза (КМЦ) была приобретена у Sigma-Aldrich (Сент-Луис, США). Все другие химические вещества и реагенты аналитической чистоты, такие как дихромат калия (K 2 Cr 2 O 7 ), глюкоза, дрожжевой экстракт и пептон, использованные в исследовании, были закуплены в лабораториях Merck и Himedia (Индия). Лигноцеллюлозная биомасса дикой травы ( Achnatherum hymenoides ) была предоставлена профессором Динеш Гоял, Департамент биотехнологии и наук об окружающей среде, Университет Тапар, Патиала, Пенджаб, Индия.Биомассу трижды промывали водой для удаления приставших частиц пыли, сушили при комнатной температуре и, наконец, измельчали в смесителе-измельчителе до размера ячеек 1 мм.
2.2. Микроорганизмы и условия культивирования
Bacillus subtilis AS3 (номер доступа в Genbank EU754025), выделенный из коровьего навоза и используемый для производства целлюлазы, был любезным подарком профессора Д. Гояла, Университет Тапар, Патиала, Пенджаб, Индия. Культуру поддерживали на скошенном питательном агаре при 4 ° C и пересевали каждые 2 недели.Посевной материал был приготовлен путем взятия петли, полной культуры из скошенного питательного агара, в 100 мл колбе Эрленмейера, содержащей 25 мл питательного бульона, и инкубации при 37 ° C и 180 об / мин в течение 16–18 ч (= 0,6–0,8). 2% (об. / Об.) Свежей посевной культуры добавляли к 50 мл оптимизированной среды, содержащей (г / л): CMC, 18; пептон, 8; дрожжевой экстракт, 5; К
.
Производство и частичная очистка альфа-амилазы из Bacillus subtilis (MTCC 121) с использованием твердофазной ферментации
Амилаза — это фермент, который катализирует расщепление крахмала на сахара и играет ключевую роль в различных областях, таких как использование в качестве пищеварительных средств, для производство этанола и кукурузного сиропа с высоким содержанием фруктозы, моющих средств, текстильных изделий, модифицированных крахмалов, гидролиз буровых растворов для нефтяных промыслов и переработка бумаги. В настоящей работе твердофазная ферментация (SSF) для производства α -амилазы была использована вместо глубокой ферментации (SmF) из-за ее простой техники, низких капитальных вложений, более низких уровней катаболитной репрессии и лучшего извлечения продукта. Bacillus subtilis хорошо известен как продуцент альфа-амилазы и был протестирован с использованием твердофазной ферментации в течение 48 часов при 37 ° C с пшеничными отрубями в качестве субстрата. Сравнение различных часов ферментации продемонстрировало высокий выход альфа-амилазы через 48 часов. Эта альфа-амилаза имеет оптимальные значения pH и температуры 7,1 и 40 ° C соответственно. С целью очистки альфа-амилазы 30–70% (NH 4 ) фракция 2 SO 4 концентрировала активность амилазы в три раза по сравнению с сырым ферментированным экстрактом.Это было подтверждено методом количественного анализа DNS, а также с помощью профиля геля зимограммы. Точный молекулярный вес амилазы еще предстоит определить с помощью других методов очистки белка.
1. Введение
Амилаза катализирует расщепление крахмала на сахара. α -Амилаза может расщеплять длинноцепочечные углеводы, в конечном итоге давая мальтозу из амилозы или мальтозу, глюкозу и «предельный декстрин» из амилопектина. Амилазы продуцируются широким спектром организмов, хотя каждый источник дает биохимические фенотипы, которые значительно различаются по параметрам, таким как оптимумы pH и температуры, а также потребности в ионах металлов [1].К настоящему времени у микроорганизмов идентифицированы два основных класса амилаз, а именно α -амилаза и глюкоамилаза. α -Амилазы (эндо-1,4-a-D-глюканглюкогидролаза) представляют собой внеклеточные ферменты, которые случайным образом расщепляют 1,4-a-D-глюкозидные связи между соседними единицами глюкозы в линейной цепи амилазы. Глюкоамилаза (экзо-1,4-a-D-глюканглюканогидролаза) гидролизует отдельные звенья глюкозы с невосстанавливающих концов амилозы и амилопектина ступенчатым образом [1, 2]. Это металлоферменты кальция, которые полностью не могут функционировать в отсутствие кальция.Кальций стабилизирует поверхность раздела между центральным доменом A (291 остаток) с бочкообразной структурой ( β / α ) 8 и более вариабельным доменом B (от 104 до 206 остатков) [3–7].
Благодаря своему разнообразному применению амилаза привлекает внимание исследователей спустя десятилетия после ее первого выделения и идентификации в 1894 году из грибкового источника, который использовался в качестве добавок в фармацевтических пищеварительных препаратах [8]. С момента его открытия до сих пор продолжаются исследования с участием микроорганизмов в качестве потенциального источника амилазы.Микроорганизмы выбираются предпочтительно для производства амилазы из-за относительной простоты обращения, доступности, благоприятных условий роста и потребности в дешевых питательных веществах по сравнению с другими продуцентами, такими как растения и животные. Амилаза занимает основную долю (около 25%) на мировом рынке ферментов из-за высокого спроса на нее, исключающего химический гидролиз крахмала в процессе разжижения крахмала [9, 10]. Он также используется в текстильной, пищевой, пивоваренной и целлюлозно-бумажной промышленности [11–13].
SmF был традиционным способом производства промышленно важных ферментов с давних пор благодаря множеству возможностей, таких как лучший контроль над факторами окружающей среды, а именно pH, температурой, аэрацией и уровнем влажности.Культуры, которые, как сообщается, используются для продукции амилазы с использованием SmF, принадлежат к разнообразным видам Bacillus , таким как Bacillus sp. PN5, Bacillus subtilis JS-2004, Bacillus sp. IMD 435, Bacillus sp. I-3, Bacillus caldolyticus DSM405, Bacillus licheniformis GCBU-8 и т. Д. [14–19]. Однако SSF заменяет SmF, поскольку имитирует естественную среду обитания микроорганизмов. SSF — лучший выбор по сравнению с SmF из-за его простоты, низких капитальных вложений, более низкого энергопотребления, меньшего выхода воды и отсутствия пены [20–22].
С появлением биотехнологических инноваций, особенно в области технологии ферментации и производства ферментов, SSF с агроотходами, такими как WB, RB, COC и GOC, заменил дорогостоящие среды, обычно используемые при глубокой ферментации для получения альфа-амилазы. Bacillus видов часто используются для продукции α -амилазы с помощью SSF с использованием пшеничных отрубей [23–29].
Принимая во внимание, что неочищенная частично очищенная амилаза использовалась в дижестивах, в настоящей работе мы частично очистили α -амилазу, экстрагированную из Bacillus subtilis .Зная, что твердофазная ферментация (SSF) гораздо более рентабельна и эффективна, чем погруженная ферментация (SmF), мы использовали пшеничные отруби в качестве субстрата для производства α -амилазы. Удельную активность неочищенного и очищенного фермента определяли с помощью DNS-анализа и метода Лоури [30, 31]. Определены pH и температурный оптимум альфа-амилазы. Амилаза из ферментированного экстракта была частично очищена с использованием фракции сульфата аммония и проверена в нативном ПААГ, а также на зимограмме.
2. Материалы и методы
2.1. Приготовление посевного материала для твердофазной ферментации
1,5 мл посевного материала было добавлено к 50 мл среды LB. После инокуляции среды культурой среду выдерживали при 37 ° C в течение 48 часов и проверяли внешний диаметр (внешний диаметр 600 = 0,450). Инокулят, имеющий OD, эквивалентный O.D 600 = 0,450, добавляли к 4 г автоклавированных пшеничных отрубей (WB), доступных на местном рынке для SSF, и выдерживали при температуре 37 ° C в течение 48-часового периода ферментации.
2.2. Экстракция ферментов
После 48 часов ферментации ферментированные среды извлекали и замачивали в 20 мМ фосфатном буфере (pH = 7,0) на 30 минут при 4 ° C в роторном шейкере. Его центрифугировали при 8000 об / мин в течение 15 мин при 4 ° C. После этого собирали супернатант, который представляет собой ферментный экстракт.
2.3. Анализ амилазы
Альфа-амилазная активность экстракта измерялась методом DNS [30]. Вкратце, отбирали реакционную смесь, содержащую 1% растворимого крахмала, 20 мМ фосфатный буфер (pH = 7) и ферментированный экстракт, и инкубировали при 37 ° C в течение 20 минут с последующим добавлением 3,5-динитросалициловой кислоты (DNS).Количество редуцирующего сахара, высвобожденного во время анализа, оценивали путем измерения проявления окраски при 540 нм на спектрофотометре UV-VIS. 1 единица активности амилазы определяется как количество фермента, которое высвобождает микромоль мальтозы в минуту при стандартных условиях анализа.
2.4. Оценка белка
Содержание белка в экстракте определяли по методу Лоури [31].
3. Очистка альфа-амилазы с помощью осаждения сульфатом аммония
Для (0–30)% фракции 10 мл ферментного экстракта брали в соколе и (268 мг 10 мкл.е., 2,68 г) сульфата аммония медленно добавляют в экстракт. Смесь тщательно перемешивали в течение 30 минут. Затем раствор центрифугировали, осадок извлекали и супернатант оставляли. После этого осадок ресуспендировали в 2 мл 20 мМ фосфатного буфера.
Для разреза (30–70)% был взят полученный супернатант и 2,56 грамма. сульфата аммония. Снова повторили предыдущие шаги диализа.
3.1. Нативный ПААГ и зимограмма
В состав 10 мл рассасывающегося геля входит 4 мл dH 2 O, 2.50 мл 1,5 M трис, 2,667 мл бис-акриламида, 0,733 мл 1% APS и 5 мкл л TEMED. Спустя некоторое время, когда растворяющийся гель застыл, укладывающийся гель вылили и дали ему осесть. Состав 10 мл укладывающегося геля состоял из 5,70 мл dH 2 O, 2,50 мл 0,5 M трис, 1,0 мл бис-акриламида и 0,70 мл 1% APS, 10 мк л TEMED.
Теперь гель был разработан для зимограммы путем погружения в 1% раствор крахмала на 5 минут с последующим добавлением к нему нескольких капель йода.1% раствор крахмала был приготовлен из 1 г крахмала в 100 мл 20 мМ фосфатного буфера. Для приготовления раствора йода 10 г кристаллов KI растворяли в 100 мл дистиллированной воды и добавляли к нему 5 г йода.
4. Результаты и обсуждение
Виды Bacillus считаются наиболее важными источниками α -амилазы и часто используются для производства ферментов с использованием SSF.
4.1. Твердотельная ферментация для производства α -амилазы
После 48 часов твердофазной ферментации при 37 ° C с использованием Bacillus subtilis, было обнаружено образование α -амилазы путем определения ферментативной активности с использованием метода DNS при 40 °. С.Удельная активность амилазы составила 13,14 ( мкМ, моль / мг / мин) при 40 ° C (таблица 1).
| ||||||||||||||||||||
4.2. Определение активности амилазы при разной температуре и pH.
Температура и pH оказывают сильное влияние на ферментативную активность. 48 часов ферментированного экстракта продемонстрировали оптимальную температуру для амилазы, как показано на Фигуре 1, которая составляет около 40 ° C. Удельная активность амилазы составила 13,14 мкМ моль / мг / мин при 40 ° C.
Для определения подходящего диапазона pH для ферментативной активности, буферы для анализа ферментов варьировали как 6,6, 7,1, 7,6 и 8,6. Максимальная активность фермента наблюдалась при pH 7.1 (8,74 мкм моль / мг / мл) при 40 ° C. Использование более щелочного буфера привело к резкому снижению активности фермента (рис. 2).
5. Частичная очистка α -амилазы
Частичная очистка α -амилазы из сырого ферментного экстракта, полученного при твердофазной ферментации пшеничных отрубей, была достигнута с использованием (NH 4 ) 2 SO 4 осадков. Ферментный анализ проводили для определения активности α -амилазы во фракциях сульфата аммония.Локализация активности амилазы наблюдалась в 30–70% фракции супернатанта, полученной из (0–30%) фракции, по сравнению с активностью фермента из фракции 0–30%. Удельная активность увеличивается примерно в 3 раза по сравнению с сырой нефтью. Удельная активность амилазы составила 7,73 μ моль / мин / мг при 40 ° C в 30–70%, тогда как удельная активность 1,47 μ моль / мин / мг была обнаружена в другой фракции 0–30%.
6. Характеристика α -амилазы на PAGE
Альфа-амилаза, полученная из 48 часов ферментированного экстракта, была охарактеризована в 8% нативном геле.Наблюдение представлено на рисунке 3; из профиля геля было видно, что фракция (NH 4 ) 2 SO 4 по отношению к неочищенному экстракту была обогащена белком на 30–70%. Это также подтверждается количественным определением активности амилазы (таблица 2). Было обнаружено, что фракция 0–30% (NH 4 ) 2 SO 4 имела относительно низкую активность амилазы в отношении содержания в ней белка (удельная активность = 1,47 μ моль / мин / мг).Эти данные подтверждены на фиг. 3, где на дорожке 2 полное исчезновение полосы белка соответствует минутной активности амилазы (удельная активность = 1,47 мк моль / мин / мг).
| |||||||||||||||||||||||
Для подтверждения присутствия амилазы во фракции 30–70% (NH 4 ) 2 SO 4 зимограмма альфа-амилазы была проведена с использованием другой половины родного геля.Наблюдение было отмечено на рисунке 3 (б). На дорожке 3 активность амилазы была обнаружена в виде четкой полосы на темном фоне в присутствии крахмала иода. Отсутствие четкой полосы из-за активности амилазы в дорожках 1 и 2, соответствующих неочищенной фракции и фракции 0–30%, свидетельствует об относительной очистке амилазы во фракции 30–70%. Активность α -амилазы обусловлена превращением предельного декстрина под влиянием избытка β -амилазы в продукты, которые при воздействии йода дают красно-коричневую окраску.Молекулярная масса α -амилазы из видов Bacillus колеблется от 50 до 60 кДа, хотя некоторые исключения существуют в случае α -амилазы (молекулярная масса 31 кДа), выделенной из Bacillus licheniformis [32–34]. В настоящем исследовании частичная очистка α -амилазы ограничивает наши знания, чтобы сделать конкретный вывод о молекулярной массе α амилазы. Дальнейшая работа должна быть проведена для определения молекулярной массы того же самого.
Высокий рыночный спрос на амилазы для конкретных применений в пищевой и фармацевтической промышленности требует производства и частичной очистки этого ценного фермента с использованием дешевого сырья, такого как пшеничные отруби из SSF. С этой целью в настоящей работе делается попытка очистить амилазу от Bacillus subtilis, который можно использовать в ряде областей, таких как моющие средства, текстиль, гидролиз буровых растворов для нефтяных промыслов и бумажная промышленность.
7. Заключение
Хотя некоторые предварительные ферментативные параметры, такие как оптимум pH и оптимум температуры, были определены для альфа-амилазы после 48 часов SSF при 37 ° C, полная очистка, а также определение молекулярной массы еще предстоит выполнить.В настоящее время, с целью очистки альфа-амилазы, частичная концентрация фермента была достигнута с помощью 30-70% (NH 4 ) 2 SO 4 срезов, что подтверждается данными зимограммы. Дальнейшие работы по полной очистке альфа-амилазы будут проводиться с помощью других методов очистки.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
.
Запланированы дополнительные исследования распространенных добавок — ScienceDaily
Новое исследование ученых Национального института здравоохранения и их тайских коллег показывает, что «хорошие» бактерии, обычно встречающиеся в пробиотических пищеварительных добавках, помогают уничтожить Staphylococcus aureus , тип бактерий, которые может вызвать серьезные инфекции, устойчивые к антибиотикам. Исследователи, возглавляемые учеными из Национального института аллергии и инфекционных заболеваний (NIAID) Национального института здоровья, неожиданно обнаружили, что бактерий Bacillus предотвратили S.aureus от роста в кишечнике и носу здоровых людей. Затем, используя модель исследования на мышах, они точно определили, как это происходит. Над проектом сотрудничали исследователи из Университета Махидол и Технологического университета Раджамангала в Таиланде.
«Пробиотики часто рекомендуются в качестве пищевых добавок для улучшения здоровья пищеварительной системы, — сказал директор NIAID Энтони С. Фаучи, доктор медицинских наук. — Это одно из первых исследований, в которых точно описано, как они могут действовать для улучшения здоровья.Возможность того, что пероральный прием Bacillus может быть эффективной альтернативой лечению антибиотиками при некоторых состояниях, является интригующим с научной точки зрения и определенно заслуживает дальнейшего изучения ».
Staphylococcus инфекции являются причиной десятков тысяч смертей во всем мире каждый год. Метициллин-устойчивый Staphylococcus aureus , или MRSA, знаком многим как причина серьезных заболеваний. Менее известно, что S. aureus часто может жить в носу или кишечнике, не причиняя никакого вреда.Однако, если кожный барьер нарушен или иммунная система нарушена, эти колонизирующие бактерии могут вызвать серьезные инфекции.
Одной из стратегий предотвращения инфекций Staph является устранение колонизации S. aureus . Однако некоторые стратегии деколонизации спорны, потому что они требуют значительных количеств местных антибиотиков и имеют ограниченный успех, отчасти потому, что они нацелены только на нос и бактерии, быстро повторно колонизирующиеся из кишечника.
Ученые набрали 200 добровольцев в сельской местности Таиланда для исследования.Они предположили, что это население не будет так затронуто стерилизацией пищевых продуктов или антибиотиками, как люди в высокоразвитых городских районах. Сначала ученые проанализировали образцы фекалий каждого из участников исследования на наличие бактерий, коррелирующих с отсутствием S. aureus . Они обнаружили 101 образец с положительным результатом на Bacillus , в первую очередь на B. subtilis — тип, обнаруженный в смеси с другими бактериями во многих пробиотических продуктах. Бактерии Bacillus образуют споры, которые могут выжить в суровых условиях окружающей среды и обычно естественным образом попадают в организм с овощами, что позволяет им временно расти в кишечнике.Затем ученые взяли пробы у тех же 200 человек на S. aureus в кишечнике (25 положительных результатов) и носу (26 положительных результатов). Поразительно, но они не обнаружили S. aureu ни в одном из образцов, где присутствовали Bacillus .
В исследованиях на мышах ученые обнаружили сенсорную систему S. aureus , которая должна функционировать, чтобы бактерии могли расти в кишечнике. Интересно, что все из более чем 100 изолятов Bacillus , которые они извлекли из человеческих фекалий, эффективно подавляли эту систему.
Используя методы хроматографии и масс-спектрометрии, ученые определили фенгицины, особый класс липопептидов — молекул, которые являются частью пептида и частью липида — как специфическое вещество Bacillus , которое ингибирует сенсорную систему S. aureus . Дополнительные тесты показали, что фенгицины имели одинаковый эффект на несколько различных штаммов S . aureus , в том числе MRSA высокого риска USA300, который вызывает большинство связанных с населением инфекций MRSA в США и становится все более частой причиной инфекций MRSA, связанных с оказанием медицинской помощи.
Для дальнейшей проверки своих выводов ученые колонизировали кишечник мышей S. aureus и скармливали им спор B. subtilis , чтобы имитировать потребление пробиотиков. Пробиотик Bacillus , вводимый каждые два дня, уничтожил S. aureus в кишечнике мышей. Тот же тест с использованием Bacillus , в котором была удалена продукция фенгицина, не дал никакого эффекта, и S. aureus росли, как ожидалось.
NIAID и тайские ученые планируют проверить, действительно ли пробиотический продукт содержит только B.subtilis может уничтожить S. aureus у людей. Они планируют привлечь к проекту больше тайских волонтеров. Майкл Отто, доктор философии, ведущий исследователь NIAID, говорит: «В конечном итоге мы надеемся определить, можно ли использовать простой режим приема пробиотиков для снижения уровня инфицирования MRSA в больницах».
.
