Учёные выяснили, какие факторы влияют на выработку антител к ВИЧ
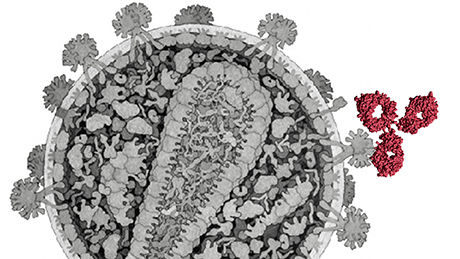 Антитела (выделены красным) связываются со структурами на оболочке ВИЧ.
Антитела (выделены красным) связываются со структурами на оболочке ВИЧ.
Организм некоторых людей, инфицированных ВИЧ, производит антитела, которые борются не только с тем штаммом вируса, которым они заражены, но и другими его типами. Швейцарские исследователи установили, какие факторы отвечают за формирование нейтрализующих антител широкого спектра действия — и в будущем эта информация может пригодиться при создании вакцины от ВИЧ. Результаты работы опубликованы в журнале Nature Medicine.
Около 1% людей, заражённых вирусом иммунодефицита человека, вырабатывают антитела к ВИЧ, которые связываются с так называемыми «шипами» — комплексами сахаров и белков на оболочке вируса, характерными для всех его штаммов. Эти антитела широкого действия могут пригодиться при разработке эффективной вакцины от ВИЧ — и швейцарских исследователей интересовало, как и почему они образуются.
Учёные обследовали 4500 участников Швейцарского когортного исследования ВИЧ (нем. Schweizerische HIV Kohortenstudie, англ. Swiss HIV Cohort Study) и Цюрихского исследования первичной ВИЧ-инфекции (нем. Zürich primäre HIV-Infektionsstudie, англ. Zurich Primary HIV Infection Study) и нашли среди них 239 человек, которые вырабатывали антитела. Научной группе удалось установить, что на образование антител влияли три свойства болезни: количество копий вируса в организме, его генетическое разнообразие и то, как долго инфекцию не лечили. «Мы впервые продемонстрировали, что каждый из этих трёх параметров — вирусная нагрузка, вирусное разнообразие и продолжительность инфекции — влияет на выработку антител широкого спектра действия независимо от остальных, — объясняет один из авторов исследования Ульрих Гюнтард (Huldrych Günthard). — Поэтому при разработке вакцины от ВИЧ нам не обязательно учитывать все три».
Второй важный фактор — этническая принадлежность: темнокожие больные вырабатывают больше антител, чем белые. Однако учёные считают, что этот факт нужно изучить подробнее. «Прежде всего, нам необходимо лучше понять, как генетические, географические и социоэкономические факторы влияют на формирования этих антител у представителей разных народов», — говорит Александра Тркола (Alexandra Trkola), один из авторов исследования.
И наконец, на тип вырабатываемых антител влияет подтип вируса. Например, подтип B, распространённый в Европе и Америке, запускает образование антител, которые «целятся» в участок оболочки вируса, связывающийся с клетками иммунной системы (так называемый «участок связывания с CD4»). Под влиянием других подтипов вырабатываются антитела, которые связываются с сахарным компонентом шипов вируса. Таким образом, на особенности связывания антител влияют специфические особенности вирусной оболочки.
«Наше исследование показывает, какие факторы способствуют выработке антител, борющихся с разными штаммами вируса. Это открытие позволит нам планомерно продвигаться к разработке эффективной вакцины от ВИЧ», — заключает Тркола.
Вирус иммунодефицита человека (ВИЧ) — ретровирус из рода лентивирусов, вызывающий медленно прогрессирующее заболевание — ВИЧ-инфекцию. Поражает клетки иммунной системы, имеющие на своей поверхности рецепторы CD4: Т-хелперы, моноциты, макрофаги, дендритные клетки, клетки микроглии. В результате работа иммунной системы угнетается и развивается синдром приобретённого иммунного дефицита (СПИД), организм больного теряет возможность защищаться от инфекций и опухолей. Без врачебного вмешательства оппортунистические заболевания вызывают смерть пациента в среднем через 9—11 лет после заражения.
В современной классификации различают два основных вида ВИЧ — ВИЧ-1 и ВИЧ-2. Эти вирусы предположительно возникли в результате независимой передачи людям SIV (вируса иммунодефицита обезьян) шимпанзе и мангобеев соответственно. ВИЧ-1 классифицируют на главную группу М и несколько побочных групп, вирусы группы М являются причиной более 90 % случаев ВИЧ-инфекции. Группу М классифицируют на несколько клад, называемых подтипами, также обозначаемых буквами.
Есть ли антитела вич при острой стадии — Лечение ВИЧ и СПИД
В нашей стране используется клиническая классификация ВИЧ-инфекция, предложенная акад. В. И. Покровским, согласно которой различают следующие стадии и фазы болезни:
Стадия инкубации (стадия 1):
Период от момента заражения до появления реакции организма в виде клинических проявлений «острой инфекции» или выработки антител. Продолжительность – от 3 недель до 3 месяцев. Клинических проявлений заболевания нет, антитела еще не выявляются.
Стадия первичных проявлений (стадия 2):
Продолжается активная репликация вируса в организме, что сопровождается выработкой антител и клиническими проявлениями. Имеет несколько форм.
Стадия первичных проявлений (варианты течения):
А. Бессимптомная.
Б. Острая ВИЧ-инфекция без вторичных заболеваний.
В. Острая ВИЧ-инфекция со вторичными заболеваниями.
Бессимптомная стадия (стадия 2А):
Какие-либо клинические проявления отсутствуют. Ответ организма на внедрение ВИЧ проявляется лишь выработкой антител.
Острая ВИЧ-инфекция без вторичных заболеваний (стадия 2Б):
Разнообразные клинические проявления, в большинстве своем похожие на симптомы других инфекций: лихорадка, высыпания на коже и слизистых, увеличением лимфатических узлов, фарингит. Может отмечаться увеличение печени, селезенки, появление диареи. Иногда развивается так называемый «асептический менингит», проявляющийся менингиальным синдромом. Такая клиническая симптоматика может отмечаться при многих инфекционных болезнях, особенно при так называемых «детских инфекциях». Поэтому острую ВИЧ-инфекцию иногда называют «мононуклеозоподобный синдром», «краснухоподобный синдром». В крови больных с острой ВИЧ-инфекцией могут обнаруживаться широкоплазменные лимфоциты («мононуклеары»). Это еще больше усиливает сходство острой ВИЧ-инфекции с инфекционным мононуклеозом. Однако яркая «мононуклеозоподобная» или «краснухоподобная» симптоматика отмечается лишь у 15-30% больных с острой ВИЧ-инфекцией. У остальных отмечается 1 – 2 вышеперечисленных симптома в любых сочетаниях. В целом острая клиническая инфекция отмечается у 50-90% инфицированных лиц в первые 3 месяца после заражения.
Острая ВИЧ-инфекция со вторичными заболеваниями (стадия 2В):
На фоне временного снижения CD4+ лимфоцитов развиваются вторичные заболевания – ангина, бактериальная пневмония, кандидоз, герпесвирусная инфекция – как правило, хорошо поддающиеся лечению. Эти проявления кратковременны, хорошо поддаются терапии.
Субклиническая (латентная) стадия (стадия 3):
Медленное прогрессирование иммунодефицита. Единственным клиническим проявлением является увеличение лимфоузлов, которое может и отсутствовать. Увеличение лимфоузлов может отмечаться и на более поздних стадиях ВИЧ-инфекции, однако в субклинической стадии оно является единственным клиническим проявлением. Длительность субклинической стадии может варьировать от 2-3-х до 20 и более лет, в среднем — 6-7 лет. В этот период отмечается постепенное снижение уровня CD4-лимфоцитов.
Стадия вторичных заболеваний (стадия 4):
4А. Потеря массы тела менее 10%; грибковые, вирусные, бактериальные поражения кожи и слизистых оболочек; опоясывающий лишай; повторные синуситы, фарингиты.
4Б. Потеря массы тела более 10%; необъяснимая диарея или лихорадка более 1 месяца; волосистая лейкоплакия; туберкулез легких; повторные или стойкие вирусные, бактериальные, грибковые, протозойные поражения внутренних органов; повторный или диссеминирующий опоясывающий лишай; локализованная саркома Капоши.
4В. Кахексия; генерализованные вирусные, бактериальные, грибковые, протозойные заболевания; пневмоцистная пневмония, кандидоз пищевода, бронхов, легких; внелегочный туберкулез; атипичные микобактериозы; диссеминированная саркома Капоши; поражения центральной нервной системы различной этиологии.
Фазы (стадии 4А, 4Б, 4В):
Прогрессирование:
— На фоне отсутствия противовирусной терапии.
— На фоне противовирусной терапии.
Ремиссия:
— Спонтанная.
— После ранее проводимой противовирусной терапии.
— На фоне противовирусной терапии.
Терминальная стадия (стадия 5) — (стадия СПИДа):
Поражение органов и систем носит необратимый характер. Даже адекватно проводимые противовирусная терапия и лечение оппортунистических заболеваний не эффективны, и больной погибает в течение нескольких месяцев.
Введение в классификационную систему стадии инкубации, включающей в себя период от момента заражения до ответа организма на него, в виде появления клинических проявлений и/или выработки антител, обусловлено существующей у нас практикой наблюдения за лицами, имевшими эпидемиологически значимый контакте больными ВИЧ-инфекцией. При использовании методик, позволяющих выявлять в организме зараженного вирус или его фрагменты, имеется возможность диагностировать заболевание и на этой стадии.
Стадия первичных проявлений включает в себя состояния, обусловленные непосредственно взаимодействием макроорганизма с ВИЧ.
Присоединение на фоне стойкого иммунодефицита вторичных возбудителей и появление опухолей свидетельствует о переходе болезни в стадию вторичных заболеваний. Терминальная стадия может развиться не только в результате прогрессирования состояний, характерных для стадии 3В, ной вследствие поражения ЦНС, не опосредованного другими, помимо ВИЧ, возбудителями.
Таким образом, в данную классификацию могут вмещаться все проявления болезни от момента заражения до гибели больного, включая и те, которые, возможно, ещё и не известны.
Инкубационный период продолжается от 2 нед до 2 мес, иногда до 6м ее.
Стадия первичных проявлений в острой фазе болезни нередко протекает без четких клинических симптомов, но у 30-50% инфицированных появляются симптомы острой ВИЧ-инфекции («острый ретровирусный синдром»), наиболее часто проявляющейся в виде «мононуклеозоподобного», «гриппоподобного» или «экзантематозного» заболевания. В этих случаях острая лихорадочная фаза болезни сопровождается: лихорадкой (у 96%), лимфаденопатией (у 74%), эритематозной и макулопапулезной сыпью на лице, туловище, иногда на конечностях (у 70%), миалгией или артралгией (у 54%). Реже встречаются другие симптомы, такие как диарея, головная боль, тошнота и рвота, увеличение печени и селезенки. Неврологические симптомы встречаются примерно у 12% больных и характеризуются развитием менинго-энцефалитаили асептического менингита, имеющих доброкачественное течение. Продолжительность острой лихорадочной фазы обычно составляет 1-3 нед.
Острая ВИЧ-инфекция нередко остается нераспознанной из-за сходства ее проявлений с симптомами гриппа, инфекционного моно-нуклеоза и других распространенных инфекций. Кроме того, у части больных она протекает бессимптомно. Для подтверждения диагноза острой ВИЧ-инфекции целесообразно определять РНК ВИЧ с помощью полимеразной цепной реакцией или антиген р24. Антитела к ВИЧ в этот период могут не выявляться, они появляются позже, спустя 1-3 мес после заражения.
ВИЧ-инфекция 139
Острая ВИЧ-инфекция, как правило, переходит в бессимптомную. Начинается следующий период — бессимптомная фаза, продолжающийся несколько лет (от 1 до 8 лет, иногда более), когда человек считает себя здоровым, ведет обычный образ жизни, являясь источником инфекции.
Гораздо реже после острой инфекции начинается стадия персистирующей аенерализоеанной лимфаденопатии (ПГЛ), и в исключительных случаях болезнь сразу прогрессирует вплоть до стадии СПИДа.
ПГЛ характеризуется увеличением лимфоузлов в двух и более группах (за исключением паховых лимфоузлов у взрослых), сохраняющимся не менее 3 мес. При этом увеличенные лимфоузлы достигают в диаметре 1 см и более у взрослых и 0,5 см — у детей. Наиболее часто увеличиваются шейные, затылочные, подмышечные лимфоузлы. Они безболезненны, эластичны, не спаяны с подлежащей тканью, кожа над ними не изменена. Стадия ПГЛ также длится довольно долго -до 5-8 лет, в течение которых лимфоузлы могут уменьшаться и вновь увеличиваться. В этот период отмечается постепенное снижение уровня С04-лимфоцитов, в среднем со скоростью 50-70 клеток в 1 мм3 в год. На стадиях бессимптомной инфекции и ПГЛ пациенты, как правило, к врачам не обращаются и выявляются при случайном обследовании.
Вслед за этими стадиями, общая продолжительность которых может варьировать от 2-3 до 10-15 лет, начинается стадия вторичных заболеваний (хроническая клинически манифестированная фаза ВИЧ-инфекции), которая характеризуется различными инфекциями вирусной, бактериальной, грибковой природы, которые вначале протекают довольно благоприятно и купируются обычными терапевтическими средствами. Возникают повторные заболевания верхних дыхательных путей — отит, синусит, трахеобронхит и др., поверхностные поражения кожи — локализованная кожно-слизистая форма рецидивирующего простого герпеса, рецидивирующий опоясывающий герпес, кандидоз слизистых оболочек, дерматомикозы, себоррея и др.
Затем эти изменения становятся более глубокими, не реагируют на стандартные методы лечения, приобретая упорный, затяжной характер. Человек начинает худеть, потеря массы тела достигает более 10%, появляются лихорадка, ночные поты, диарея.
На фоне нарастающей иммуносупрессии развиваются тяжелые прогрессирующие формы болезни, которые не встречаются у человека с нормально функционирующей иммунной системой. Это болезни, которые ВОЗ определила как СПИД-маркерные, СПИД-индикаторные.
Source: hiv.pp.ua
Читайте также
Не только ВИЧ. Какие еще бывают иммунодефициты и насколько они опасны?
Иммунодефицит — это когда иммунитет ослаб и просто нужно пить витамины?
Нет, настоящий иммунодефицит — это серьезное заболевание, при нем в организме часто появляются инфекционные заболевания, которые протекают тяжело. Речь совсем не про ОРВИ. Иммунодефицитом врачи также называют состояние, при котором один или несколько факторов иммунной системы перестают защищать организм. В целом термин можно назвать собирательным, потому что причины, по которым эти факторы перестают работать, могут быть разными.
Глобально иммунодефициты можно разделить на три группы.
- Физиологические иммунодефициты
Их не стоит бояться, врачи определяют их как нормальное состояние человека. Физиологические иммунодефициты сигнализируют, что организм проходит через разные этапы жизнедеятельности. Они могут быть в детстве, во время беременности или в старости. Лечить их не нужно, просто важно понимать, что в это время люди болеют чаще. Поддерживать организм в эти периоды можно только с помощью вакцинации и здорового образа жизни.
- Первичные иммунодефициты (ПИД)
Они возникают чаще всего в результате генетической поломки. Допустим, ребенок рождается с поломанным участком гена, отвечающего за какой-то из компонентом иммунной системы. В таком случае у него может не быть определенных клеток или белковых факторов, из-за этого ребенок начинает часто и тяжело болеть.
Современной медицине известно более 250 видов ПИД. Британское общество иммунологии отмечает, что в мире насчитывается около 6 миллионов людей с этим заболеванием, однако точное количество больных с ПИД установить невозможно — порядка 70—90 % из них остаются не диагностированными. Группа исследователей следила за жизнью 235 пациентов с первичным иммунодефицитом на протяжении 22 лет, за это время 32 из них умерли.
В России один из 500 россиян рождается с первичным иммунодефицитом. В российском регистре Национальной ассоциации экспертов в области ПИДС состоит 3017 пациентов.
- Вторичные иммунодефициты
Само название говорит о том, что изменения в иммунной системе появились не при рождении, а вторично — в результате какого-то патологического процесса или воздействующих факторов. Яркий пример вторичного иммунодефицита — это люди с ВИЧ-инфекцией. Изначально здоровый человек инфицируется вирусом, поражающим клетки иммунной системы, в результате развивается иммунодефицит. К этой же группе могут относиться пациенты с онкологическими заболеваниями, получающие химиотерапию. Вторичный иммунодефицит, как правило, протекает на фоне других заболеваний. Развитие иммунодефицитного состояния затрудняет их лечение, способствует формированию осложнений. Помимо ВИЧ к этой группе можно отнести лучевую болезнь, лимфопролиферативные заболевания, то есть связанные с клетками лимфоидной природы. Вторичный иммунодефицит, в отличие от ПИД, может пройти без лечения, например, если исчезнет воздействующий фактор.
Может ли человек с первичным иммунодефицитом вылечиться?
У некоторых людей с ПИД действительно нет шансов на полное выздоровление. Медицина может предложить им только поддерживающую терапию, направленную на борьбу с инфекцией. Но случается, что у самых тяжелых пациентов с первичным иммунодефицитом есть шанс на полное выздоровление. Это может произойти благодаря трансплантации гемопоэтических стволовых клеток от донора. Поэтому важно, чтобы как можно больше человек вступали в регистр доноров костного мозга.
Насколько опасны вторичные иммунодефициты?
Если говорить о ВИЧ, то без антиретровирусной терапии прогноз неблагоприятный. У человека могут развиться не только тяжелые инфекции, но и онкологические заболевания на последних стадиях (уже при СПИДе). Если говорить о вторичных иммунодефицитах, которые формируются в результате химиотерапии, то они проходят самостоятельно, как только заканчивается курс лечения.
Иммунодефициты легко распознать? Бывает ли, что врачи начинают лечить здоровых людей, думая, что у них иммунодефицит?
Важно понимать, что иммунодефицит — это тяжело протекающие инфекционные заболевания бактериального, грибкового и вирусного характера. И речь не про ОРЗ и ОРВИ. У людей с ним зачастую в анамнезе несколько пневмоний, синуситов, абсцессов, тяжелый кандидоз кожи и слизистых, тяжелое течение герпетических вирусов.
Врачи разделяют ПИД на пять групп, которые указывают на недостаточность какого-то звена иммунитета: больше половины всех ПИД связаны с дефектом гуморального звена, около четверти — комбинированные иммунодефициты, 10—15 % заболеваний связаны с дефектами фагоцитов, менее распространены дефекты клеточного звена (5—10 %) и дефекты комплемента (не более 2 %). Заподозрить первичный иммунодефицит можно по определенным показаниям. В интернете легко найти 12 настораживающих признаков ПИД и убедиться, что ни в одном пункте речь не идет про ОРВИ, даже если они происходят ежемесячно. Например, такой список опубликован на сайте благотворительного фонда «Подсолнух»:
-
Случай ПИД или ранних смертей от инфекций в семье.
-
Восемь и более гнойных отитов в течение года.
-
Два или более тяжелых синусита в течение года.
-
Две или более пневмонии в течение года.
-
Антибактериальная терапия, проводимая более 2 месяцев, без эффекта.
-
Осложнения при проведении вакцинации ослабленными живыми вакцинами. Имеются в виду БЦЖ или полиомиелит.
-
Нарушения переваривания в период грудного возраста.
-
Рецидивирующие глубокие абсцессы (нарывы, гнойные воспаления) кожи и мягких тканей.
-
Две или более генерализованные инфекции. Например, менингит, остеомиелит, септический артрит, эмпиема плевры, сепсис.
-
Персистирующая кандидозная инфекция кожи и слизистых у детей старше года.
-
Хроническая реакция трансплантат против хозяина. Например, неясные эритемы (покраснения) у детей грудного возраста.
-
Тяжелые инфекции, вызванные атипичными микроорганизмами (пневмоцистой, атипичными микобактериями, плесневыми грибками).
На вторичный иммунодефицит могут указывать повторяющиеся инфекции, переход инфекционных заболеваний в хроническую форму, неэффективность обычного лечения, небольшое, но длительное повышение температуры тела. Быстрая утомляемость, снижение работоспособности, проявление условно-патогенных инфекций также могут этому сопутствовать. Однако установить возникновение заболевания может только врач-иммунолог.
К сожалению, об этом помнят не все, и иммунодефицит часто приписывается пациентам с прекрасно функционирующей иммунной системой. Детям, которые пошли в сад и начали часто болеть. Или взрослым людям, которые живут в сумасшедшем режиме и совсем забыли про сон и здоровый образ жизни. Это все не иммунодефицит.
Что делать, если есть подозрения на иммунодефицит? Какие бывают способы диагностики?
Настораживающие признаки должны быть подтверждены лабораторными исследованиями. Если они покажут, что у пациента не хватает звена иммунитета, то тогда уже можно говорить о ПИД. Рабочая группа Европейского общества по ПИД разработала набор основных скрининговых и дополнительных тестов по диагностике заболеваний этой категории. В нее входят различные тестирования крови и кожи человека, молекулярно-генетические исследования. Сегодня врачи также могут проводить тестирования на ПИД, пока ребенок находится в утробе матери. Для этого используются клетки пуповинной крови и околоплодные воды.
В случае вторичного иммунодефицита проводятся анализы крови и ее компонентов, иммунологические тесты. Диагноз может быть установлен только после того, как иммунолог оценил иммунный статус пациента.
В каком возрасте можно диагностировать первичный иммунодефицит?
С учетом того, что это врожденное генетически обусловленное заболевание, то его проявления врач может отметить уже в первые годы жизни ребенка. Но есть варианты ПИД, которые обнаруживают и во взрослом возрасте, даже после 20 лет. К ним относится общая вариабельная иммунная недостаточность (ОВИН) — нарушение, при котором в сыворотке крови содержится низкий уровень иммуноглобулинов (антител), из-за чего человек становится более чувствителен к инфекциям. Такое заболевание может проявляться в виде рецидивирующих инфекций уха, придаточных пазух, носа, легких и бронхов.
Заразны ли иммунодефициты?
Люди с первичным иммунодефицитом совершенно не опасны для окружающих. Можно сказать, даже наоборот — другие люди и весь окружающий мир опасны для них. А вот ВИЧ-инфекцией можно инфицироваться половым путем или через кровь. Бытовым путем ВИЧ не передается, так как вирус легко разрушается в окружающей среде. Но важно помнить, что человек с ВИЧ может передать вирус другому, только если не принимает антиретровирусную терапию. При лечении у него становится неопределяемая вирусная нагрузка, и он никого не может инфицировать. Поэтому крайне важно ежегодно узнавать свой ВИЧ-статус.
Как лечатся иммунодефициты?
Каждый тип ПИД лечится по-своему, если больному недостает иммуноглобулинов, то ему проводят заместительную терапию в течение всей жизни. Для этого используют сыворотки с антителами или донорской плазмой крови. Если у такого человека возникают инфекционные осложнения, ему могут назначить лечение антибиотиками, противовирусными или противогрибковыми препаратами. Значительно улучшить состояние больного с тяжелой формой ПИД можно только с помощью трансплантации костного мозга. Если пересадка пройдет успешно, у больного образуется своя иммунная система. С помощью этого способа можно вылечить ПИД полностью.
Для лечения вторичных иммунодефицитов в зависимости от их видов используются вакцины, заместительное лечение: иммуноглобулины, лейкоциты, интерфероны, препараты иммунотропного действия.
Стало ясно, почему часть переболевших COVID-19 не приобретает иммунитета
«Примерно 40% людей получили вирус от носителя в бессимптомной стадии», — отмечает Баранова, подчеркивая, что у многих людей вирус так и не переходит на вторую стадию.
Вторая стадия сопровождается симптомами, например кашлем и температурой. Иногда болезнь переходит в третью, тяжелую стадию, сопровождающуюся одышкой, цитокиновым штормом (потенциально летальная реакция иммунной системы организма, приводящая к разложению тканей) и расстройством коагуляции (повышением свертываемости крови).
На первой стадии организм подавляет размножения вирусов с помощью интерфероновой системы, на этой стадии организм уже распознает вирус, но еще не вырабатывает антитела. С середины второй стадии заболевания организм включает в борьбу с вирусом выработанные антитела.
Комментируя новые исследования китайских ученых, Баранова отметила, что у 7−8% переболевших пациентов второй и третьей стадии не было обнаружено антител. «Это значит, что они избавились от вируса путем собственного интерферонового ответа. У этих людей нет антител, а значит, нет иммунитета», — поясняет ученый.
У части иммунитет вырабатывается очень слабый и не сможет помочь при повторном заражении. И только у примерно 15% больных вырабатывается стойкий выраженный иммунитет, причем сила иммунитета положительно коррелирует с возрастом и тяжестью заболевания.
Количество антител снижается с течением времени, что также ослабляет иммунитет, следует из наблюдений китайских ученых.
Вирус — вроде простая штука, особенно на картинках. Тем более, что нам вроде как объяснили, как и чем он цепляется. Казалось бы, в чем сложность.
На самом деле все несколько иначе, точнее, все не так просто. В новом исследовании пытаются это прояснить, в том числе и для тех, кто разрабатывает вакцины. Я возьму на себя смелость забрать из статьи пару простых тезисов.
Если очень грубо, то вирус, проникая в организм хочет поразить его. Ему на руку играет то, что внешне вирусная частица для иммунитета не сильно отличима от обычных клеток: разница в наличии вирусных белков.
Разумеется, умный вирус не хочет быть обнаруженным иммунитетом: скажем так, работает закон самосохранения. Вирус развивается и маскируется: оборачивая свою поверхность так называемыми гликанами.
Гликаны, или разновидность полисахаридов, в данном контексте выступает щитом от иммунитета, который еще надо постараться пробить: именно этот щит делает вирус недоступным для антител.
Организм не видит угрозы, вирус спокойненько существует внутри и развивается так, как ему надо. Что зачастую заканчивается прискорбно.
Яркий пример здесь, кстати, ВИЧ: это наиболее защищенный вирус, что подтверждается невозможностью сделать универсальную вакцину на протяжении уже долгого времени. Оболочка гликанов чрезвычайно плотна, хотя и есть надежды (например, в 2011 году писали, что щит все-таки удалось пробить).
Итак, для иммунитета вирусы часто выглядят «нормально», а если иммунная система начинает что-то подозревать, то выработать антитела для защищенных вирусов не так просто. С Ковид, например, антитела, как следует из ряда исследований, появляются в среднем за 28 дней!
Но, грубо говоря, с Ковидом нам повезло. Иллюстрация, которая приложена к статье это демонстрирует:
Серым на картинке показаны белки вируса, которые следует атаковать, а цветами от белого до зеленого по шкале — гликаны. Они разные по «мощности» противостояния. Но не суть.
Суть в том, что если мы сравним, скажем, HIV (ВИЧ) и наш, текущий, то увидим разницу, которая заключается в их плотности. В случае с ВИЧ, например, явно труднее подобраться к белку.
Плотность же гликанов на Ковид сильно ниже, и белок достаточно открыт и — следовательно — более уязвим для антител. И следовательно же: для него должно быть значительно проще создать вакцину.
Тем не менее, наш вирус тоже не рубаха-парень, к сожалению.
Вирус оказался хитрее нашего иммунитета, и это факт. Но среди опасностей он — не самый страшный и достаточно открытый, что вселяет некоторый оптимизм и надежду.
Также эта его особенность роднит его с более ранними вирусами схожего типа: они, как видно из иллюстрации тоже были прилично уязвимы. В общем, новость в коем-то веке позитивная!
С середины марта мир пытается остановить пандемию коронавируса. Заболевших в мире уже больше четырех миллионов, в России — 242 тысячи. До сих пор в знаниях о новом коронавирусе много белых пятен. О том, какие гипотезы считают главными, чем отличаются коронавирусы в разных странах и есть ли иммунитет у переболевших, «Ленте.ру» рассказала доктор биологических наук, профессор Школы системной биологии университета Джорджа Мейсона (США), директор Центра по изучению хронических заболеваний метаболизма в Колледже наук GMU Анча Баранова.
«Лента.ру»: По поводу иммунитета у выздоровевших по-прежнему противоречивые сведения поступают. Он есть или его нет?
Анча Баранова: Пока мы не очень хорошо понимаем, каковы сила и устойчивость противокоронавирусного иммунитета у перенесших ковид и насколько это зависит от индивидуального состояния человека. Недавно ученые из Китая опубликовали препринт [черновик] научной работы. Они взяли группу пациентов, перенесших болезнь, у некоторых была достаточно легкая форма, а у некоторых — тяжелая. «Легкие» больные не были бессимптомными носителями, у каждого наблюдались температура и кашель, но одышки не было ни у кого.
Сразу после выздоровления у этих людей померили наличие антител. Оказалось, что из 171 человека у 11 их вообще не было выявлено. То есть примерно семь-восемь процентов избавились от вируса путем собственного интерферонового ответа. Организм у них так и не выработал антитела. Стоит ли ожидать, что у этих людей есть иммунитет к этому коронавирусу? Очень маловероятно.
Примерно у 14 процентов из этой группы обнаружен высокий уровень антител или даже супервысокий. У большинства же титры антител оказались средними, а еще у 15-20 процентов антитела хоть были, но, прямо скажем, маловато. Среди тех, кто переболел, но не получил никакого иммунитета, молодых гораздо больше, чем пожилых.
Причем обнаружилась корреляция: чем тяжелее человек болел, тем сильнее у него иммунитет, и эта тенденция видна даже после поправки на возраст. Через месяц ученые снова замерили уровень антител у этих же пациентов. И обнаружили, что у многих он быстро падает.
Что это значит?
Не все переболевшие ковидом защищены от повторной инфекции.
Для многих период защищенности продлится относительно недолго. Но будут и супергерои, которым теперь никакой ковид не страшен
И пока мы не умеем точно угадывать, кто получит сильный и прочный иммунитет, а кто — просто какие-то антитела, которые укажут ученым на перенесенную в прошлом инфекцию, но практической пользы их обладателю не принесут.
Сейчас обсуждают статью исследователей из США, в которой они утверждают, что антитела к ковиду есть у всех переболевших, а следовательно — есть предпосылки к формированию иммунитета. Получается, у них с китайцами диаметрально противоположный взгляд?
Тут нет противоречий. Американские коллеги измерили с помощью простых диагностических китов [тестов] наличие антител у выздоровевших. Однако антитела могут быть любыми, не все из них могут бороться с патогеном. Чтобы измерить уровень именно нейтрализующих антител, требуется более серьезный лабораторный анализ. Нужно взять сыворотку, полученную из крови человека, затем взять сам вирус (ну или специально созданное «чучело» вируса) и высадить его в этой сыворотке. А дальше смотреть — «склеились» ли частички вируса. Если да, то антитела «рабочие».
Имеющиеся на рынке диагностические тесты могут сказать, сколько именно антител у человека. Разве на основании этого нельзя определить силу иммунитета?
Нельзя. Те киты, которые сейчас созданы, — это просто наборы, выявляющие антитела путем предъявления им отдельных вирусных антигенов. Представьте себе машинку, сделанную из лего. Вместо целой машинки (вируса), антителам предъявляют только одну ее часть — например, передний бампер. С помощью таких наборов можно количественно померить антитела, но только против этого самого переднего бампера. А против заднего — уже нет. Такой тест не может увидеть, обладают ли антитела вирус-нейтрализирующей способностью.
Чтобы получить ответ на этот вопрос, возможны два пути. Один нам доступен уже сегодня, и я про него говорила — это работа с вирусом и сывороткой крови лабораторно. А второй способ пока недоступен. Для него нужно проанализировать тысячи разных сывороток крови, взятых у пациентов из разных географических точек. Затем выявить антигены, вызывающие преципитацию, то есть нейтрализацию вируса. Затем на основе этих «трудолюбивых» антител создать диагностический тест. То есть взять для него не любые антигены, а специфические. Например, к правому колесу и к левой фаре. Какие именно части вируса надо включать в такой набор для уверенного выявления нейтрализирующей силы антител, покажут только крупные популяционные исследования на тысячах переболевших ковид.
Но это сопоставимо с задачей по созданию вакцины, потому что на самом деле это и является первым этапом работы над ней. И требует большого труда и больших затрат.
Я правильно понимаю, что тесты на антитела, которые предлагаются сегодня в больницах, бесполезны?
Я бы не стала так категорично разделять. Организаторы здравоохранения с помощью этих тестов могут понять, как распространяется инфекция в популяции. Допустим, в Новосибирской области, условно, на 15 апреля диагностические наборы намерили восемь процентов переболевших, а на 15 мая те же самые наборы уже показали 15 процентов. В какой-то момент переболевших станет 70 процентов, и тогда карантин абсолютно ни к чему.
Но для конкретного человека тесты действительно могут ничего не значить, хотя зависимость между общим уровнем антител и наличием среди них нейтрализирующих есть. Допустим, у вас уровень 20 тысяч условных единиц активности антител. Тогда вероятность наличия среди них нейтрализующих — 90 процентов. А при 1500 антител вероятность нейтрализующих — 10 процентов. Цифры тут лишь для примера, условные. Но, кстати, многие диагностические наборы даже не определяют количества, они устроены как тесты на беременность: показывают плюсик или минусик. Они могут просто сказать, сталкивались вы с таким антигеном или нет. И все.
То есть гражданам нет смысла тратить деньги на эти анализы ?
Мне все время вопросы присылают: «Мы всей семьей ужасно мучились в феврале, кашляли, но все прошло. Это был коронавирус или нет?» Некоторых граждан этот вопрос прямо жжет. Хочется удовлетворить свое любопытство — почему бы не протестироваться, если есть лишние деньги? Ну, а если кто-то думает, что получить информацию о том, что болел ковидом, значит приобрести свободу от нового заражения и возможность завтра пойти в кино, на дискотеку, то — нет.
Есть ли данные о том, сколько минимально может сохраняться иммунитет после болезни?
Пока единственный способ понять длительность иммунитета — ждать, то есть мониторить во времени. Когда мы месяц назад разговаривали, я считала, что нам нужен тест на антитела, чтобы выпускать людей из карантина. Переболел — значит, свободен. Так думала не только я, но и другие «ведущие собаководы», то есть ученые. Но сейчас, когда реально все проанализировали, оказалось, что коронавирус — не такой уж простой орешек. У людей все очень индивидуально. У кого-то титры антител исчезнут за месяц, у других — за год или за пять. Поэтому мерить нужно не качественно, как в тестах на беременность, а количественно. Причем мерить регулярно, раз в месяц, так как иммунитет — не вечный.
Это нужно делать, и делать дешево, как на конвейере, если мы хотим открывать экономику, запускать предприятия. А то, что сейчас в Москве предлагают тестировать по желанию на наличие антител, — это довольно бесполезно. Протестировали сегодня рабочего — он защищен. А через неделю все же инфицировался и перезаразил всех вокруг.
Когда в России эпидемия только-только разгонялась, вы рассказывали, что рассматривается гипотеза о «добрых» и «злых» версиях вируса SARS-CoV-2. Она подтвердилась?
На международной карте распространения SARS-CoV-2 видно, что сегодня образовалось около 30 штаммов — то есть вариантов этого коронавируса. Давайте вспомним, как это происходило. Сначала вирус появился в Китае. Затем через Иран пришел в Европу и там очень сильно разошелся. Этот ирано-европейский вирус пришел в Россию. Но параллельно с этим движением шел совершенно другой поток. Из Китая вирус распространился в страны Азии, а также на Западное побережье США.
Пока о патогенности вирусов мы можем судить по исследованиям in vitro, то есть в пробирке. Исследователи заражали одну и ту же клеточную культуру в одной и той же концентрации китайским и азиатским штаммами. Оказалось, что разница между ними в вирулентности, то есть в производстве вирусных частиц, в 270 раз. То есть азиатский штамм SARS-CoV-2 менее заразен, чем европейский.
Получается, что уханьский вирус при переезде из Китая в Европу стал более «злым»? По идее, он должен приспосабливаться, становиться слабее, чтобы не убить нового хозяина — человека. А вместо этого он опровергает все теории эволюции?
В Америке вышло исследование, где показано, что степень выраженности заболевания у тех, кто заразился разными вариантами вируса, одинакова. То есть «злой» и «добрый» вирусы с одинаковой вероятностью кладут людей на вентилятор [аппарат ИВЛ]. Все, что злой вирус делает эффективнее, — быстрее распространяется в популяции. И, вероятно, организует большее количество бессимптомных носителей. Это значит, что число людей, которые оказались на ИВЛ, на самом деле разбавляется. То есть с помощью «злого» вируса мы быстрее достигаем стадного иммунитета. Значит, с точки зрения эволюции он — «добрый», пусть и притворяется «злым». Хотя, конечно, вирус с меньшей вирулентностью легче утоптать карантинными мерами.
А то, что работает теория эволюции, когда паразит приспосабливается к хозяину, видно на примере Южной Кореи. Вы помните, что там вспышка ковида быстро сошла на нет. Сейчас в Южной Корее выделен вирус, который утратил опасную S1/S2 вставку, сайт для TMPRSS2-протеазы.
Это та самая протеаза, которая расщепляет С-белок вируса и помогает ему проникать в клетки человека. Про этот сайт так много говорили потому, что его нет в других типах коронавирусов. Есть гипотеза, что именно он обуславливает тяжелые случаи течения ковида. Произошла делеция [перестройка] вируса, причем не один раз, а три — немного в разных местах. Вирус с утраченным сайтом уже не так опасен, как его «родственник», который на нас напал.
Какая практическая польза обычным людям от информации о наличии разных штаммов вируса?
Если случается научный прорыв, то дальше включаются в игру какие-то компании, которые преобразуют новые знания в полезный продукт. На это может уйти какое-то время. Первое, что могут компании сделать, — диагностику на мутации. Подтвердили у человека коронавирус, и тут же сказали, «злой» он или «добрый». Знания об инфекционности вируса могут стать основой для моделирования ситуации в конкретном регионе. Сейчас модели развития эпидемии строятся на данных об общей заболеваемости и общей смертности. Это дает приблизительную точность. Если мы будем знать, что в каком-то городе бушует «мягкий» вариант коронавируса, и смертность там 0,01 процента, то почему бы не выпустить людей из карантина? Пусть выращивают для всех остальных морковь и кур.
Получается, что переболевшие вирусом в Сеуле, приехав в Москву, снова могут заболеть? Иммунитета против другого варианта коронавируса у них не будет?
Пока не ясно. В задаче слишком много неизвестных. У вируса есть три основных антигенных белка. Допустим, какая-то мутация произошла в одном из них, но если у вас имеются нейтрализующие антитела на другие белки — тогда все равно, что произошло в этом первом. Но кто-то может иметь нейтрализующие антитела только на мутировавший белок. Тогда он действительно может пострадать — то есть снова заразиться. Все эти варианты нужно изучать, собирать кучу образцов в популяции, сравнивать их, иметь детальные медицинские записи о пациентах — только тогда можно что-то понять.
На создание вакцины наличие 30 вариантов вируса с разными характеристиками как-то повлияет?
Сферические частицы нового коронавируса (на фото окрашены в синий цвет)
Изображение: Hannah A. Bullock, Azaibi Tamin / CDC / AP
В мире сейчас примерно 170 разных компаний, разрабатывающих вакцины. Они начинали с разных прототипов препарата. Некоторые работают над живыми вакцинами, другие — над рекомбинантными [генно-инженерными], третьи — над инактивированными [изготовленными из убитых вирусов]. В случае рекомбинантных выбирается какой-то белок, и с его помощью проводят иммунизацию. Но представьте, что кто-то с самого начала выбрал белок, который был у «старого» уханьского вируса, начал испытывать вакцину на мышах, и она отлично работала. А потом вирус изменился, и разработчик отброшен на два месяца назад…
Конечно, не все вакцины так отсеются. Мутации вируса не повлияют, например, на процесс изготовления инактивированных препаратов. Но я все-таки думаю, что спасут нас не искусственные вакцины, а естественные.
Каким образом?
Вирус в популяции постепенно становится «добрее». Таким образом ослабленные штаммы вируса сами могут превратиться в вакцину. Максимум, что они смогут вызвать, — это бронхит.
Зато переболевший уже может не бояться более сильных штаммов вируса. Это утверждение не вступает в противоречие с китайским исследованием, что не все переболевшие приобретают иммунитет потому, что «злых» вирусов при этом станет намного меньше, — они просто вытеснятся из популяции
А если все же кто-то заразится не слабым, а сильным штаммом?
Это плохо, это рулетка. Лучшая стратегия для человека пожилого или среднего возраста сейчас — отсидеться годика два-три, сократить максимально контакты, чтобы не встретиться с вирусом. А потом нас будет защищать стадный иммунитет, сформированный детьми и молодыми.
Мое детство прошло в 1970-е годы. У нас в то время были эпидемии ветрянки, свинки, и от этого никто не прививал, поэтому практически все дети заражались. С корью, ветрянкой, свинкой какая проблема? В детском возрасте эти болезни переносятся достаточно легко. А вот у взрослых все течет гораздо тяжелее. Коронавирус ведет себя так же. Более серьезную проблему он представляет для старшего поколения, чем для молодежи. И мне кажется, что в этом случае все может прийти к тому, что дети и молодежь переболеют и образуют круги защиты для пожилых.
Климатические условия как-то влияют на распространение ковида?
Есть сопоставление с другими эпидемиологическими проблемами — например, с гриппом. Поскольку грипп притихает летом из-за сухой жаркой погоды, есть надежда, что и коронавирус последует его примеру. Но поскольку жаркое лето еще не наступило, наверняка тут не скажешь. Так что нам предстоит поставить большой научный эксперимент.
Но почему тогда в других жарких странах эпидемия не стихает?
Жаркие страны бывают разные. Например, в Узбекистане — сухой жаркий континентальный климат, и там действительно все идет на спад. В Америке, в штате, где я живу, — субтропический климат. Летом большая влажность: утром жарко, а вечером — дожди. В таком климате вирусу нормально. В Сингапуре, например, почти каждый день дожди. В Индии — влажные субтропики, побережье. В тропическом климате сезонов практически нет. Там, где нет сезонов, не нужно ждать сезонности эпидемий.
То, о чем мы говорим, имеет отношение только к умеренному климату. В Москве, если засуха встанет на две недели, вирусу не поздоровится. Россия в смысле климата и его влияния на эпидемию — в выгодном положении.
Судя по статистическим данным, мужчины переносят эту болезнь гораздо тяжелее. Почему?
Мужчины с точки зрения здоровья — слабый пол. У них раньше развиваются сердечно-сосудистые заболевания, возникают метаболические проблемы. Женщин в этом плане защищает гормон эстроген. И с ковидом также ничего специального нет. Женщины склонны реагировать на проблемы в организме больше аутоиммунным способом, а мужчины — воспалительным. То есть у мужчин выше вероятность возникновения цитокинового шторма [воспалительная реакция иммунитета, приводящая к системному поражению организма].
До сих пор считалось, что главная проблема, к которой приводит ковид, — это пневмония. Сейчас появились версии, что причина затемнения легких на компьютерных снимках — воспаления кровеносных сосудов. Может быть так, что одно заболевание принимали за другое и не так лечили?
Не в этом дело. В том, что возникает пневмония, сомнений нет. Просто врачи стали лучше понимать патогенез ковида. Во всех странах говорят о гиперкоагуляции, то есть повышенной свертываемости крови в присутствии коронавирусной инфекции. В результате этого во всех системах организма, в том числе в легких, могут образовываться тромбы.
Мы уже знаем, что если происходит закупорка сосудов в головном мозге — это инсульт, если в сердце — инфаркт. А когда затыкается масса разных сосудов в разных других местах, то получается состояние, которое называется диссеминированное внутрисосудистое свертывание крови — ДВС-синдром.
В прессе много сообщений о том, что у ковида есть кожные проявления. Это красные точки, кровоподтеки на руках, ногах, теле. Они образуются из-за разрывов мелких сосудов, вызванных сгустками крови. То есть человек может обнаружить сначала проблемы с кожей, а затем его состояние может внезапно ухудшиться со стороны легких.
В самом начале, когда только началась эпидемия в России, рассказывали про женщину, которая сначала была официально признана первой умершей от ковида. Но после вскрытия ее из списка погибших от ковида вычеркнули, посчитав, что причина ее смерти — сопутствующее заболевание, вызвавшее тромбообразование. Сейчас, спустя месяц, уже понятно, что нужно пересматривать подобные случаи. Гиперкоагуляция — один из главных признаков ковида. Многие пациенты погибают от этого состояния по всему миру.
Лучшее понимание специфики болезни добавило ясности в лечении?
Врачи стараются предотвратить ДВС-синдром, начинают вводить в схемы лечения антикоагулянтную терапию. Но эти препараты можно использовать только в больнице, под очень строгим лабораторным контролем.
Важно знать, что гиперкоагуляция — часто единственный признак ковида, особенно у бессимптомных и малосимптомных пациентов. В США собирается очень хорошая госпитальная статистика. По определенным группам заболеваний больницы должны отчитываться еженедельно. За две недели апреля 2020 года количество людей моложе 40 лет с сердечно-сосудистыми патологиями — инсультами и инфарктами — в семь раз выше, чем за этот же период в 2019-м и в 2018 годах. Причем эти цифры не из одного госпиталя, а из многих. То есть у молодых людей инсульт может стать первым и последним симптомом ковида. И надо обращать на это внимание.
Как?
Прислушиваться к себе. В американскую госпитальную статистику попали только явные случаи, когда инсульты и инфаркты сопровождались явными симптомами, не заметить которые сложно, — тот же паралич, например. И нужно отдавать отчет, что есть и скрытая часть айсберга, то есть цифры как минимум нужно умножать на три. Многие люди просто сидят дома, никуда не едут, потому что боятся подхватить коронавирус. В результате состояние их здоровья ухудшается или они просто умирают. Особенно пожилые, которые надеются отлежаться.
Помните Дейнерис Таргариен из фильма «Игра престолов»? Актриса, которая сыграла эту роль, — Эмилия Кларк — во втором сезоне сериала получила инсульт. После этого она очень мало в фильме двигалась, зато к четвертому-пятому сезону снова стала очень активно летать на драконах. Вовремя проведенная противоинсультная терапия и быстрая реабилитация помогут сохранить здоровье.
Если вдруг на фоне ковида у вас страшно заболела голова, особенно посреди ночи, — не сидите дома, вызывайте скорую. То же самое — при внезапном проявлении функциональных дефицитов: забыл слово «интернет», на руке перестал двигаться палец для компьютерной мышки… Помните, что экстренное обращение к врачу вам просто необходимо!
антитела не единственная защита от ковида — Реальное время
Исследование профессора иммунологии Университета Тафтса (США)
Фото: Илья Репин
Количество антител у переболевшего коронавирусом снижается вдвое уже через 5 недель, заявила главный внештатный детский специалист по профилактической медицине Минздрава России Лейла Намазова-Баранова. «А дальше, вероятно, еще больше, что, собственно, делает нас, скорее всего, беззащитными для следующего заражения», — считает медик. По ее словам, аналогичным неустойчивым постинфекционным эффектом обладает еще ряд инфекционных заболеваний, например, коклюш, которым также можно заразиться повторно через 3-4 месяца. Впрочем, высокое количество антител в крови — не единственная защита от COVID-19, пришел к выводу в статье для издания The Conversation профессор иммунологии Университета Тафтса (США) Александр (Саша) Полторак. «Реальное время» предлагает ознакомиться с переводом публикации ученого.
Антитела важны, но это не единственный фактор
Большинство людей знает, что тестирование на наличие антител в крови человека может показать, был ли он заражен каким-либо определенным заболеванием, например, COVID-19. Эти антитела обеспечивают защиту организма от повторного заражения.
Однако в статье, опубликованной New England Journal of Medicine, исследователи сообщают, что количество антител у людей, которые выздоровели от COVID-19, снижается вдвое каждые 36 дней. Означает ли это, что люди, излечившиеся от COVID-19, постепенно теряют свой иммунитет?
Я генетик, интересующийся врожденным иммунным ответом — той частью иммунной системы, которую мы получаем при рождении, — и тем, как врожденные иммунные клетки «обучают» клетки, продуцирующие антитела, как идентифицировать и уничтожить патоген. Как я объясню впоследствии, антитела важны для иммунитета, но они не являются единственным фактором, который имеет значение.
Две руки иммунной системы
Иммунная система состоит из двух частей: врожденного иммунитета и адаптивного или приобретенного иммунитета.
Врожденная иммунная система, которая включает в себя белые кровяные клетки, называемые дендритными клетками, моноциты и нейтрофилы, присутствует при рождении человека и мгновенно реагирует на возбудителей заболеваний. Эта группа белых кровяных телец атакует патогены разрушительными химическими веществами, поглощает и уничтожает вирусы и бактерии. Врожденная иммунная система обеспечивает мгновенную реакцию на патоген. Проблема в том, что это довольно тупой инструмент — он одинаково реагирует на все воспринимаемые угрозы.
Адаптивная иммунная система, состоящая из В-клеток и Т-клеток, должна узнать о патогене и его характеристиках от врожденных иммунных клеток. Этой системе требуется больше времени для начала активной деятельности, но плюс в том, что она очень специфична и во многих случаях работает на протяжении всей жизни.
Фото tvsamara.ru
Память иммунной системы
История воздействия патогена на организм «записывается» в так называемых Т-клетках памяти и В-клетках памяти. Эти клетки располагаются в периферических тканях организма, таких как лимфатические узлы или селезенка, и служат памятью о болезнетворном вирусе после того, как инфекция побеждена и уже исчезла. Такая иммунологическая память отвечает за защиту организма и вступает в действие в случае второй волны или атаки патогена.
Это нормально, когда уровень антител снижается после того, как человек выздоровел от болезни. Но статья в New England Journal of Medicine вызвала беспокойство, потому что она предполагает, что мы теряем нашу иммунологическую память, что в свою очередь так же плохо, как потеря реальной памяти.
Какую роль в иммунитете играют Т-клетки?
В-клетки и антитела это только часть иммунного ответа. Т-клетки помогают В-клеткам вырабатывать антитела белки, которые могут связываться с определенным патогеном и разрушать его.
Это происходит так. Сначала В-клетки «проглатывают» вирус и начинают вырабатывать антитела. Т-клетки не могут проглотить вирус. Но тип белых кровяных телец, называемый антигенпрезентирующей клеткой, может. После этого он «показывает» различные части вируса Т-клеткам. Затем Т-клетки узнают о вирусе, который они теперь могут искать и уничтожать.
Т-клетки также прилипают к В-клеткам и посылают им сигналы активации, которые помогают В-клеткам наращивать выработку антител.
Фото vzsar.ru
Чем угрожает иммунитету сокращение числа антител к COVID-19?
Это говорит о том, что когда в крови меньше антител, существует большая вероятность того, что ряд отдельных вирусных частиц, называемых вирионами, выживет и избежит уничтожения. Поэтому оставшиеся вирионы будут продолжать размножаться и вызывать болезни.
Что означает снижение числа антител для образования коллективного иммунитета?
Коллективный иммунитет относится к популяции и возникает, когда достаточно большое число людей в сообществе невосприимчивы к вирусу и неспособны его передавать. Это обеспечивает защиту для тех, кто все еще уязвим. Например, если 60% людей защищены от COVID-19, потому что они подверглись инфицированию и выработали антитела, — это может защитить (через менее частые взаимодействия) оставшиеся 40% людей от заболевания.
Но исследования, опубликованные в вышеупомянутом медицинском журнале, предполагают, что люди с более низким уровнем антител все еще могут переносить вирус и не иметь никаких симптомов заболевания.
Это означает, что если такие люди с низким уровнем антител окружают здоровых, неинфицированных людей, они представляют опасность для них, потому что они могут передавать вирус.
Фото Ильи Репина
Когда число антител сокращается, то иммунитет исчезает?
В общем, ответа нет. Если вирус попытается вызвать вторую инфекцию, то В- и Т-клетки памяти способны распознать ее, размножиться миллионами раз и защитить организм от вируса, не давая ему спровоцировать еще одну полномасштабную инфекцию.
Защита, обеспечиваемая Т- и В-клетками памяти, является причиной того, что защита, приобретенная на основе вакцины, работает.
Однако есть и исключения. Пожизненная вакцина против гриппа не работает, потому что генетический код гриппа быстро меняется, изменяя внешний вид гриппа, и поэтому каждый сезон требуется новая вакцина.
Но с SARS-CoV-2 проблема, как я ее вижу, заключается в том, что эти Т-клетки памяти и В-клетки, похоже, стерты.
Антитела представляют собой белки и сохраняются в кровообращении всего от трех до четырех недель. Чтобы поддерживать высокий уровень антител, В-клетки должны пополнять их свежим запасом. Но в случае COVID-19 снижение уровня антител свидетельствует о том, что клетки, продуцирующие эти антитела, не присутствуют в достаточном количестве, что объясняет падение уровня антител. Исследование того, как долго длится иммунитет от COVID-19, могут пролить больше света на этот вопрос, пока же о причинах снижения числа антител в организме можно только догадываться.
Александр Полторак, перевела Анна Николаева
ОбществоМедицина
Что такое антитела? | Живая наука
Антитела — это специализированные белки Y-образной формы, которые, как замок, связываются с чужеродными захватчиками в организме — будь то вирусы, бактерии, грибки или паразиты. Они представляют собой «поисковый» батальон системы поиска и уничтожения иммунной системы, которому поручено найти врага и пометить его для уничтожения.
«Их выпускают из камеры, и они выходят на охоту», — сказал доктор Уорнер Грин, директор Центра исследований по лечению ВИЧ при институтах Гладстона в Сан-Франциско.
Когда антитела находят свою цель, они связываются с ней, что затем запускает каскад действий, которые побеждают захватчика. По словам Грин, антитела являются частью так называемой «адаптивной» иммунной системы, ветви иммунной системы, которая учится распознавать и устранять определенные патогены.
Связано: Схема иммунной системы человека (инфографика)
Как выглядят антитела?
Два плеча в верхней части Y-образной формы антитела связываются с так называемым антигеном.Антиген может быть молекулой или молекулярным фрагментом — часто частью вируса или бактерий. (Например, новый коронавирус SARS-CoV-2 имеет уникальные «шипы» на внешней оболочке, и некоторые антитела связываются с этими шипованными белками и распознают их.)
Нижняя часть Y или ножка связывается с несколькими другими соединения иммунной системы, которые могут помочь убить антиген или мобилизовать иммунную систему другими способами. Один из них, например, запускает каскад дополнений, сказал Грин Live Science.
«Комплемент — это на самом деле палач», который пробивает дыры в клетке-мишени, такой как мембрана вируса, — сказал Грин.
Антитела, которые также называются иммуноглобулинами (Ig), имеют одну и ту же основную Y-образную форму, но существует пять вариаций на эту тему — IgG, IgM, IgA, IgD и IgE, — сказал Джейсон Цистер, профессор микробиологии. и иммунология в Калифорнийском университете в Сан-Франциско.
Каждый вариант выглядит немного по-разному и играет немного разные роли в иммунной системе.Например, иммуноглобулин G или IgG — это всего лишь один Y, тогда как IgM немного похож на десятирукую индуистскую богиню Дургу, с пятью Y, сложенными вместе, и каждый зубец может связывать один антиген.
IgG и IgM — это антитела, которые циркулируют в кровотоке и проникают в твердые органы, сказал Цистер. IgA «выбрасывается из организма» со слизью или выделениями, сказала Цистер Live Science. По данным Американской академии аллергии, астмы и иммунологии, IgE — это антитело, которое обычно вызывает аллергические реакции, например, на пыльцу или арахис.IgD исторически был загадкой, но одна из его функций — помочь активировать клетки, вырабатывающие антитела.
Связанный: Сенная лихорадка и сезонные аллергии: симптомы, причины и лечение
Антитела представляют собой Y-образные белки. Два плеча в верхней части Y связываются с молекулой-нарушителем. Нижняя часть Y, или ножка, связывается с несколькими другими соединениями иммунной системы, которые могут помочь убить злоумышленника или дать сигнал иммунной системе позаботиться о нем другими способами.(Изображение предоставлено Shutterstock)
Где образуются антитела?
Чтобы понять антитела, вам сначала нужно узнать о B-клетках, которые представляют собой тип белых кровяных телец, которые образуются в костном мозге. В организме около триллиона B-клеток, и каждая из них имеет уникальное антитело IgM, которое находится на поверхности B-клеток и каждое связывается с одним антигеном, — сказал Саймон Гудман, менеджер программы по науке и технологиям Общества антител. , некоммерческая организация, представляющая тех, кто занимается исследованиями и разработками антител.
Этот ошеломляющий уровень вариаций позволяет организму распознавать практически любое вещество, которое может попасть внутрь. Вот как достигается такое разнообразие: в каждой B-клетке гены, кодирующие сайт связывания антитела, перемешиваются, как игральные карты в колоде.
«Количество перестроек, которое может произойти, огромно», — сказала Цистер Live Science.
Связано: 11 удивительных фактов об иммунной системе
Эти В-клетки затем патрулируют тело, часто задерживаясь дольше в таких областях, как лимфатические узлы или миндалины, сказала Цистер.В большинстве случаев эти В-клетки ничего не связывают. Но если с вероятностью один на миллион, B-клетка действительно связывает какое-то чужеродное вещество, «это заставляет B-клетку сказать:« Эй, нам нужно активироваться », — сказал Цистер.
B-клетка увеличивается в размерах и начинает делиться в результате так называемого «клонального расширения», — сказал Цистер.
«Это идентичная копия родителя, как и мать», — сказала Цистер. Примерно через неделю таких копий может быть от сотен тысяч до миллиона.
В конце концов, эти клонально размноженные В-клетки дифференцируются в плазматические клетки, которые представляют собой фабрики антител.
«Они секретируют 10 000 антител на клетку в секунду. Они могут делать это в течение недель или лет, если вам повезет», — сказал Цистер.
Но не все B-клетки делят одинаковое количество.
«Если вы считаете B-ячейку замком, и вы считаете, что все эти разные вещи плавают вокруг, это разные ключи, то некоторые ключи подходят лучше, некоторые хуже, а некоторые выигрывают» это вообще не подходит », — сказал Гудман Live Science. «И в зависимости от того, насколько хорошо ключ входит в замок на поверхности конкретной B-клетки, эта клетка будет запускаться для большего деления.«Затем более плодовитые В-клетки производят больше плазматических клеток и производят больше антител определенного типа.
Тело не просто производит один тип антител; оно производит беспорядочный, хаотичный их зоопарк. блокируется на разных частях захватчика.
Рисунки B-клетки, T-клетки, антител и макрофага. (Изображение предоставлено Shutterstock)
И антитела не все делают одно и то же, когда они связались с Некоторые будут пресекать инфекцию в зародыше, напрямую нейтрализуя угрозу, предотвращая проникновение патогена в клетку.Другие маркируют захватчиков, чтобы клетки-киллеры иммунной системы (не являющиеся антителами) могли удалить их, сказал Грин. Третьи могут окутывать вирусы или бактерии липкой пленкой. А другие антитела могут сказать Pac-Man-подобным иммунным клеткам, называемым макрофагами, чтобы они сожрали захватчика. (Эта стратегия может иногда иметь обратный эффект с вирусами, которые могут кооптировать этот ответ для вторжения в новые клетки, добавил Цистер.)
Первый тип антител, образующихся после воздействия вируса, — это IgM, который появляется в пределах 7-10 через несколько дней после заражения, сказал Грин.IgM может связываться с захватчиком, но каждый «Y» в этом 10-плечевом белке делает это довольно слабо. Но так же, как пять слабых людей, работающих вместе, могут бороться с большим и сильным противником, пять Y (10 плеч) IgM, работающие вместе, могут прочно связываться с антигеном, добавил он.
Примерно через 10–14 дней в организме начинает вырабатываться IgG, который является «основной рабочей лошадкой» иммунной системы, — сказал Грин. «IgG может проникать через плаценту у беременной женщины, обеспечивая новорожденному пассивную защиту от болезней, пока его собственная иммунная система не сможет усилиться», — добавил Грин.
Обычно иммунная система потрясающе хороша в распознавании врага и игнорировании или терпении наших собственных клеток. Однако иногда этот процесс идет наперекосяк. Именно тогда и появляются Т-клетки (другой тип белых кровяных телец). Организм использует эти Т-клетки для перекрестной проверки целей — только если и В-клетка, и Т-клетка распознают что-то как чужеродного захватчика, иммунная — сказал Гудман. Предполагается, что организм удаляет В-клетки, вырабатывающие так называемые аутоантитела, которые реагируют на собственные клетки организма.Но когда этого не происходит, организм может пометить свои собственные клетки для разрушения, а затем безжалостно их уничтожить. По словам Гудмана, результатом могут быть аутоиммунные заболевания, такие как волчанка, ревматоидный артрит или диабет 1 типа. По данным Американской ассоциации аутоиммунных заболеваний, существует более 100 аутоиммунных заболеваний.
Что такое моноклональные антитела?
Антитела стали основой некоторых из самых полезных лекарств, а также некоторых из самых мощных лабораторных методов в биологии, сказал Гудман.Одно из таких клинических и терапевтических суперзвезд — так называемое моноклональное антитело.
Чтобы создать моноклональное антитело, исследователи вакцинируют животное (или, возможно, человека), чтобы стимулировать выработку антител против определенного вещества. Организм постепенно вырабатывает антитела, которые становятся все более и более эффективными против этого антигена. Эти продуцирующие антитела клетки затем отфильтровываются из лейкоцитов и помещаются в чашку, чтобы увидеть, какие клетки лучше всего связывают антиген, сказал Гудман.Затем выделяется клетка, которая лучше всего связывается — это фабрика по производству антител, специально отточенная, чтобы производить одно суперселективное антитело.
Оттуда эта клетка сливается с клеткой рака крови, производя нечто, называемое гибридомой. Эта гибридома, или моноклон, является неиссякаемым генератором одного и того же антитела снова и снова. (Исследователи связывают моноклональную клетку с раковой клеткой, потому что рак просто продолжает воспроизводиться.)
«Он просто производит, производит и производит, и это никогда не прекратится, и это рак, поэтому он по сути бессмертен», — сказал Гудман.Он производит моноклональные антитела.
Связано: Кровь выживших после Эболы может стать основой для будущей вакцины
Такие клеточные линии имеют невероятно широкий спектр применения. По словам Гудмана, существуют миллионы коммерческих моноклональных антител, которые используются в лабораториях для маркировки мельчайших и наиболее специфичных клеточных мишеней для исследования.
«Они невероятные, это удивительно точные инструменты», — сказал Гудман.
Моноклональные антитела также составляют основу многих препаратов-блокбастеров.Например, лекарственный препарат адалимумаб (торговая марка Humira) представляет собой моноклональное антитело, которое лечит ревматоидный артрит путем ингибирования воспалительного белка, известного как цитокин. Другой, называемый бевацизумаб (Авастин), нацелен на молекулу, которая способствует росту кровеносных сосудов; Блокируя эту молекулу, бевацизумаб может замедлить рост рака легких, толстой кишки, почек и некоторых видов рака мозга.
Во время пандемии SARS-CoV-2 врачи по всему миру стремятся создать моноклональные антитела, которые, как мы надеемся, нейтрализуют новый коронавирус, сказал Грин.Эти антитела фильтруются из плазмы людей, выздоровевших от COVID-19 (также называемой сывороткой выздоравливающего). Есть надежда, что путем выделения наиболее эффективных антител, а затем их массового производства, врачи смогут создать лечение, обеспечивающее временный «пассивный» иммунитет до тех пор, пока организм не сможет его наверстать и выработать эффективный, более продолжительный ответ на — свое собственное, — сказал Грин.
Связано: Каждый пятый человек, прошедший тестирование в Нью-Йорке, имеет антитела к коронавирусу
Напротив, поликлональные антитела происходят из нескольких B-клеток.Поликлональные антитела — это библиотека антител, которые все связываются с немного разными частями антигена или мишени. Согласно исследованию 2005 года, опубликованному в журнале Института лабораторных исследований животных (ILAR), поликлональные антитела обычно получают путем инъекции животному антигена, стимуляции иммунного ответа и последующего извлечения плазмы животных для массового производства антител.
В отличие от моноклональных антител, производство которых может занять до 6 месяцев, поликлональные антитела могут быть получены за 4-8 недель и требуют меньших технических знаний.Кроме того, для определенных типов тестов, в которых вы пытаетесь обнаружить антиген, поликлональные антитела могут иметь больше шансов связываться с целевым антигеном, что делает их потенциально более чувствительными. Обратной стороной поликлональных антител является то, что, поскольку каждое отдельное животное может продуцировать различный набор антител, создание поликлональных антител, которые будут согласованы от партии к партии, может быть более сложной задачей, и, по мнению авторов, не так просто иметь большой запас. исследование 2005 г., опубликованное в журнале Biotechniques.
Как работают тесты на антитела?
Тесты на антитела определяют, вырабатывает ли организм определяемое количество антител к определенной молекуле, и, следовательно, могут выявить, был ли кто-то инфицирован определенным вирусом или бактериями в прошлом. Обычно эти тесты выявляют IgM или IgG, сообщала ранее Live Science.
Например, тесты на антитела к SARS-CoV-2 обычно обнаруживают либо часть, либо весь спайк-белок коронавируса и могут выявить, был ли у кого-то COVID-19 в прошлом.Поскольку организму требуется время, чтобы нарастить выработку антител, люди обычно дают положительный результат только через две недели после первого контакта с патогеном, как ранее сообщала Live Science.
Связано: Могут ли тесты на антитела определить, есть ли у вас иммунитет к COVID-19?
Существует два распространенных типа тестов на антитела — тесты бокового потока и тесты иммуноферментного анализа (ELISA). Оба включают фиксацию антигена на поверхности, а затем определение, связывается ли антитело с этим антигеном.Обычно химическая реакция, такая как флуоресценция или изменение цвета, запускается, когда антитело связывается с антигеном. Анализы бокового кровотока аналогичны тестам на беременность «мочу на палочку»; Вместо того, чтобы мочиться, для тестов на антитела кровь или сыворотку промывают по плоской поверхности, которой обычно является бумага. Тесты ELISA работают по схожему принципу, только тесты проводятся в микропланшетах и требуют участия лаборанта, а результаты могут быть не сразу считаны, — Шарлотта Свэрке Йоргенсен, изучающая вирусную и микробиологическую специальную диагностическую серологию в Statens Serum Institut в Копенгагене, ранее сообщил Live Science в электронном письме.
Хороший тест на антитела — это тест, который дает несколько ложноположительных и несколько ложноотрицательных результатов, как ранее сообщала Live Science. Чтобы это произошло, ученым необходимо «откалибровать» свой тест, например, удостоверившись, что образцы, о которых известно, что не содержит антиген, не дают ложно положительного результата. Например, с SARs-CoV-2 это будет означать тестирование образцов крови до начала пандемии и проверку того, что ни один из них не окажется положительным. Им также необходимо взять образцы, в которых определенно есть антитела, и убедиться, что тест на антитела помогает выявить эти положительные результаты.
Дополнительные ресурсы:
.
Почему COVID-19 убивает одних людей и щадит других. Вот что находят ученые.
Новый коронавирус, вызывающий COVID-19, кажется, поражает одних людей сильнее, чем других, при этом некоторые люди испытывают только легкие симптомы, а другие госпитализируют и нуждаются в вентиляции. Хотя сначала ученые думали, что возраст является доминирующим фактором, а молодые люди избегают наихудших результатов, новое исследование выявило ряд особенностей, влияющих на тяжесть заболевания. Эти влияния могут объяснить, почему некоторые совершенно здоровые 20-летние с этим заболеванием находятся в ужасном положении, в то время как 70-летний пожилой человек избегает критических вмешательств.
Считается, что основные состояния здоровья являются важным фактором, влияющим на тяжесть заболевания. Действительно, исследование более 1,3 миллиона случаев COVID-19 в Соединенных Штатах, опубликованное 15 июня в журнале Morbidity and Mortality Weekly Report , показало, что частота госпитализаций была в шесть раз выше, а уровень смертности — в 12 раз выше. Пациенты с COVID-19 с сопутствующими заболеваниями по сравнению с пациентами без сопутствующих заболеваний. Основными заболеваниями, о которых чаще всего сообщалось, были болезни сердца, диабет и хронические заболевания легких.
В целом, факторы риска более тяжелых исходов COVID-19 включают:
Возраст
Диабет (тип 1 и тип 2)
Болезни сердца и гипертония
Курение
Группа крови
Ожирение
Генетические факторы
Возраст
По данным U, около 8 из 10 смертей, связанных с COVID-19 в США, произошли среди взрослых в возрасте 65 лет и старше.S. Центры по контролю и профилактике заболеваний (CDC). Риск смерти от инфекции и вероятность необходимости госпитализации или интенсивной медицинской помощи значительно возрастают с возрастом. Например, взрослые в возрасте 65-84 лет составляют примерно 4-11% смертей от COVID-19 в США, а взрослые в возрасте 85 лет и старше составляют 10-27%.
Эта тенденция может быть частично связана с тем, что многие пожилые люди имеют хронические заболевания, такие как сердечная болезнь и диабет , которые, по данным CDC, могут усугубить симптомы COVID-19.Способность иммунной системы бороться с патогенами также снижается с возрастом, делая пожилых людей уязвимыми для тяжелых вирусных инфекций, сообщает Stat News .
Связанный: Коронавирус в США: Последние новости о COVID-19 и количество случаев
Диабет
(Изображение предоставлено Shutterstock)
Сахарный диабет — группа заболеваний, которые приводят к опасному высокому уровню сахара в крови уровни — также, похоже, связаны с риском более серьезных инфекций COVID-19.
Наиболее распространенной формой в США является диабет типа 2 , который возникает, когда клетки организма не реагируют на гормон инсулин. В результате сахар, который в противном случае переместился бы из кровотока в клетки для использования в качестве энергии, просто накапливается в кровотоке. (Когда поджелудочная железа вырабатывает мало или вообще не вырабатывает инсулин, это состояние называется диабетом типа 1 ).
В обзоре 13 соответствующих исследований ученые обнаружили, что людей с диабетом было почти 3.Они сообщили в Интернете 23 апреля в Инфекционный журнал .
Тем не менее, ученые не знают, увеличивает ли диабет прямую тяжесть заболевания или виноваты другие заболевания, которые, похоже, сопровождают диабет, включая сердечно-сосудистые заболевания и заболевания почек.
Это соответствует тому, что исследователи наблюдали при других инфекциях и диабете. Например, грипп и пневмония более распространены и более серьезны у пожилых людей с диабетом 2 типа, сообщили 9 апреля ученые онлайн в журнале Diabetes Research and Clinical Practice . При поиске в литературе соответствующих исследований, посвященных связи между COVID-19 и диабетом, авторы этой статьи обнаружили несколько возможных механизмов, объясняющих, почему человеку с диабетом может быть хуже, если он инфицирован COVID-19.Эти механизмы включают: «Хроническое воспаление, повышенная коагуляционная активность, нарушение иммунного ответа и возможное прямое повреждение поджелудочной железы SARS-CoV-2».
Связано: 13 мифов о коронавирусе, развенчанных наукой
Растущие исследования показали, что прогрессирование диабета 2 типа связано с изменениями в иммунной системе организма. Эта связь также может сыграть роль в ухудшении исходов у человека с диабетом, подвергшегося воздействию SARS-CoV-2, вируса, вызывающего COVID-19.
Никаких исследований не изучали этот конкретный вирус и иммунный ответ у пациентов с диабетом; тем не менее, в исследовании, опубликованном в 2018 году в журнале Journal of Diabetes Research , ученые обнаружили на основе обзора прошлых исследований, что у пациентов с ожирением или диабетом обнаружена неисправная иммунная система с нарушением лейкоцитов, называемое Natural Killer. (NK) -клетки и B-клетки, которые помогают организму бороться с инфекциями. Исследование также показало, что у этих пациентов повышена выработка воспалительных молекул, называемых цитокинами.Когда иммунная система выделяет слишком много цитокинов, может вспыхнуть так называемый «цитокиновый шторм» и повредить органы тела. Некоторые исследования показали, что цитокиновые штормы могут быть причиной серьезных осложнений у людей с COVID-19, , о которых ранее сообщала Live Science, . В целом диабет 2 типа связан с нарушением самой системы организма, которая помогает бороться с инфекциями, такими как COVID-19, и может объяснить, почему человек с диабетом подвергается высокому риску серьезной инфекции.
Однако не все люди с диабетом 2 типа подвержены одинаковому риску: исследование, опубликованное 1 мая в журнале Cell Metabolism , показало, что у людей с диабетом, которые держат уровень сахара в крови в более узком диапазоне, вероятность заболевания гораздо ниже. тяжелое течение болезни, чем у людей с более высокими колебаниями уровня сахара в крови.
Люди с сахарным диабетом 1 типа (СД1) также подвержены повышенному риску неблагоприятных исходов, говорится в небольшом исследовании, опубликованном в Diabetes Care. Исследование, координируемое T1D Exchange — некоммерческой исследовательской организацией, специализирующейся на лечении людей с диабетом 1 типа, — показало, что из 64 человек с симптомами COVID-19 или COVID-19 двое умерли.Примерно 4 из 10 человек лечились в больнице. И почти у трети из них был диабетический кетоацидоз — потенциально смертельное состояние, при котором организм испытывает нехватку инсулина, а уровень сахара в крови опасно повышается. Средний возраст пациента составлял около 21 года, что позволяет предположить, что риски потенциально могут быть выше для старших возрастных групп.
Болезни сердца и гипертония
(Изображение предоставлено Shutterstock)
Люди с заболеваниями, влияющими на сердечно-сосудистую систему , такими как болезнь сердца и гипертония, как правило, страдают от COVID-19 более тяжелых осложнений, чем те, у кого ранее не было заболеваний , по данным Американской кардиологической ассоциации .Тем не менее, исторически здоровые люди также могут пострадать от вирусной инфекции.
Первая зарегистрированная смерть от коронавируса в США, например, произошла, когда вирус каким-то образом повредил сердечную мышцу женщины, что в конечном итоге привело к ее разрыву, сообщает Live Science . 57-летняя женщина сохранила хорошее здоровье и регулярно занималась спортом, прежде чем заразиться, и, как сообщается, у нее было здоровое сердце «нормального размера и веса». Исследование пациентов с COVID-19 в Ухане, Китай, показало, что более чем у 1 из 5 пациентов развилось поражение сердца — у некоторых из выбранных пациентов были сердечные заболевания, а у некоторых — нет.
Наблюдая за появлением этих закономерностей, ученые разработали несколько теорий относительно того, почему COVID-19 может повредить как поврежденные, так и здоровые сердца, согласно отчету Live Science .
В одном сценарии, поражая легкие напрямую, вирус может истощить запасы кислорода в организме до такой степени, что сердце должно работать больше, чтобы перекачивать насыщенную кислородом кровь по телу. Вирус также может напрямую атаковать сердце, так как сердечная ткань содержит ангиотензинпревращающего фермента 2 (ACE2) — молекулу, которую вирус вставляет для заражения клеток.У некоторых людей COVID-19 также может запустить чрезмерно раздутый иммунный ответ, известный как цитокиновый шторм, при котором тело сильно воспаляется, и в результате может пострадать сердце.
Курение
(Изображение предоставлено Shutterstock)
Люди, которые курят сигареты, могут быть предрасположены к тяжелым инфекциям COVID-19, что означает, что они сталкиваются с повышенным риском развития пневмонии , повреждения органов и потребности в поддержке дыхания. Исследование более 1000 пациентов в Китае, опубликованное в New England Journal of Medicine , иллюстрирует эту тенденцию: 12.3% нынешних курильщиков, включенных в исследование, были помещены в отделения интенсивной терапии, были помещены на искусственную вентиляцию легких или умерли по сравнению с 4,7% некурящих.
Сигаретный дым может сделать организм уязвимым для коронавируса несколькими способами, согласно недавнему отчету Live Science . Изначально курильщики могут быть уязвимы для заражения вирусными инфекциями, поскольку воздействие дыма со временем ослабляет иммунную систему, повреждает ткани дыхательных путей и вызывает хроническое воспаление.Курение также связано с множеством заболеваний, таких как эмфизема и атеросклероз, которые могут усугубить симптомов COVID-19 .
Недавнее исследование, опубликованное 31 марта в базе данных препринтов bioRxiv , предложило более умозрительное объяснение того, почему COVID-19 сильнее поражает курильщиков. Предварительные исследования еще не прошли экспертную оценку, но ранняя интерпретация данных предполагает, что воздействие дыма увеличивает количество рецепторов ACE2 в легких — рецепторов, которые SARS-CoV-2 подключает для заражения клеток.
Многие рецепторы появляются на так называемых бокаловидных и булавовых клетках, которые выделяют слизеподобную жидкость для защиты респираторных тканей от патогенов, мусора и токсинов. Хорошо известно , что количество этих клеток увеличивается, чем дольше человек курит, но ученые не знают, приводит ли последующее усиление рецепторов ACE2 напрямую к ухудшению симптомов COVID-19. Более того, неизвестно, является ли высокий уровень ACE2 относительно уникальным для курильщиков или обычным явлением среди людей с хроническими заболеваниями легких.
Ожирение
Несколько ранних исследований предположили связь между ожирением и более тяжелым заболеванием COVID-19 у людей. Одно исследование, в котором анализировалась группа пациентов с COVID-19, которые были моложе 60 лет в Нью-Йорке, показало, что те, кто страдали ожирением, были в два раза чаще госпитализированы, чем люди, не страдающие ожирением, и в 1,8 раза чаще. быть помещенным в реанимацию.
«Это имеет важные и практические последствия» для такой страны, как США, где почти 40% взрослых страдают ожирением, — написали авторы в исследовании, которое было принято в журнал Clinical Infectious Diseases , но еще не рецензировано или опубликовано.Точно так же другое предварительное исследование, которое еще не было рецензировано, показало, что двумя самыми большими факторами риска госпитализации из-за коронавируса являются возраст и ожирение. В этом исследовании, опубликованном в medRxiv , рассматривались данные тысяч пациентов с COVID-19 в Нью-Йорке, но исследования из других городов по всему миру показали аналогичные результаты, как сообщает The New York Times .
Предварительное исследование из Шэньчжэня, Китай, которое также не было рецензировано, показало, что у пациентов с ожирением COVID-19 вероятность развития тяжелой пневмонии более чем в два раза выше, чем у пациентов с нормальным весом, согласно отчету. опубликовано в виде препринта в Интернете в журнале The Lancet Infectious Diseases .Авторы сообщают, что у людей с избыточным весом, но не страдающих ожирением, риск развития тяжелой пневмонии на 86% выше, чем у людей с «нормальным» весом. Другое исследование, принятое в журнал Obesity и прошедшее рецензирование, показало, что почти половина из 124 пациентов с COVID-19, поступивших в отделение интенсивной терапии в Лилле, Франция, страдали ожирением.
Непонятно, почему ожирение связано с увеличением количества госпитализаций и более тяжелым заболеванием COVID-19, но есть несколько возможностей, пишут авторы исследования.Ожирение обычно рассматривается как фактор риска тяжелой инфекции. Например, у людей с ожирением во время эпидемии свиного гриппа болезнь была более продолжительной и тяжелой, пишут авторы. Пациенты с ожирением также могут иметь пониженную емкость легких или усиление воспаления в организме. Большое количество воспалительных молекул, циркулирующих в организме, может вызывать вредные иммунные реакции и приводить к тяжелым заболеваниям.
Группа крови
(Изображение предоставлено Shutterstock)
Группа крови, по-видимому, является предиктором того, насколько человек подвержен заражению SARS-CoV-2, хотя ученые не обнаружили связи между группой крови как таковой и степенью тяжести болезни.
Цзяо Чжао из Южного научно-технологического университета, Шэньчжэнь, и его коллеги изучили группы крови 2173 пациентов с COVID-19 в трех больницах в Ухане, Китай, а также групп крови из более чем 23000 не- COVID-19 в Ухане и Шэньчжэне. Они обнаружили, что люди с группой крови в группе A (A-положительный, A-отрицательный и AB-положительный, AB-отрицательный) подвергались более высокому риску заражения этим заболеванием по сравнению с типами, не относящимися к группе A. Люди с O-группой крови (O-отрицательной и O-положительной) имели более низкий риск заражения по сравнению с не-O-группами крови, писали ученые в базе данных препринтов medRxiv 27 марта; исследование еще не было рассмотрено коллегами в этой области.
В более позднем исследовании группы крови и COVID-19, опубликованном в Интернете с 11 апреля по medRxiv , ученые рассмотрели 1559 человек, прошедших тестирование на SARS-CoV-2 в пресвитерианской больнице Нью-Йорка; из них 682 дали положительный результат. Лица с группой крови A (A-положительной и A-отрицательной) имели на 33% больше шансов получить положительный результат теста, чем другие группы крови, и как O-отрицательная, так и O-положительная группы крови имели меньше шансов получить положительный результат, чем другие группы крови. (Существует 95% -ная вероятность того, что увеличение риска составляет от 7% до 67%.) Хотя были включены только 68 человек с группой крови AB, результаты показали, что у этой группы также меньше шансов получить положительный результат теста на COVID-19, чем у других.
Исследователи рассмотрели взаимосвязь между группой крови и факторами риска COVID-19, включая возраст, пол, наличие у человека избыточного веса, другие основные заболевания, такие как сахарный диабет, гипертония, легочные и сердечно-сосудистые заболевания. Они обнаружили, что некоторые из этих факторов связаны с группой крови, а также между диабетом и группами крови B и A, между статусом избыточного веса и O-положительными группами крови, например, среди прочего.Когда они учли эти связи, исследователи все же обнаружили связь между группой крови и восприимчивостью к COVID-19. Когда исследователи объединили свои данные с исследованием Чжао и его коллег из Китая, они обнаружили аналогичные результаты, а также значительное снижение числа положительных случаев COVID-19 среди людей с группой крови B.
Неизвестно, почему группа крови может увеличить или уменьшить риск заражения SARS-CoV-2. Группа крови человека указывает на то, какие антигены покрывают поверхность его клеток крови; Эти антигены вырабатывают определенные антитела, которые помогают бороться с патогеном.Предыдущие исследования показали, что, по крайней мере, в случае коронавируса SARS (SARS-CoV) антитела против А помогают подавить вирус; По словам команды Чжао, это может быть тот же механизм, что и SARS-CoV-2, помогающий людям с группой крови O не допустить распространения вируса.
Генетические факторы
(Изображение предоставлено Shutterstock)
Многие медицинские условия могут ухудшить симптомы COVID-19, но почему исторически здоровые люди иногда опасно заболевают или умирают от вируса? Ученые подозревают, что определенные генетические факторы могут сделать некоторых людей особенно восприимчивыми к этой болезни, и многие исследовательские группы стремятся точно определить , где именно эти уязвимости лежат в нашем генетическом коде.
В одном сценарии гены, которые инструктируют клетки строить рецепторы ACE2, могут различаться у людей, которые заразились тяжелыми инфекциями, и у людей, у которых практически не развиваются какие-либо симптомы, сообщает Science magazine. С другой стороны, различия могут заключаться в генах, которые помогают сплотить иммунную систему против инвазивных патогенов, согласно недавнему отчету Live Science .
Например, исследование, опубликованное 17 апреля в журнале Journal of Virology , предполагает, что определенные комбинации генов лейкоцитарного антигена человека (HLA) , которые тренируют иммунные клетки распознавать микробы, могут защищать от SARS-CoV-2, в то время как другие комбинации оставляют тело открытым для атаки.Однако HLA представляют собой лишь один винтик в механизме нашей иммунной системы, поэтому их относительное влияние на инфекцию COVID-19 остается неясным. Кроме того, в исследовании Journal of Virology использовались компьютерные модели только для имитации активности HLA против коронавируса; Клинические и генетические данные пациентов с COVID-19 потребуются, чтобы конкретизировать роль HLA в реальных иммунных реакциях.
Первоначально опубликовано на Live Science .
.
Важность разнообразия антител • iBiology
Важность разнообразия антител • iBiology
Часть 1: Иммунология: основы разнообразия антител
Часть 2: Необычные фрагменты антител: видео Нанотела верблюдов
900711 этот доклад
-

 Часть 1: Иммунология: основы разнообразия антител Аудитория:
Часть 1: Иммунология: основы разнообразия антител Аудитория:- Студент
- Исследователь
- Педагоги
- Преподаватели H.Школа / вводный курс бакалавриата
- Педагоги адв. Студент / выпускник
-

 Часть 2: Необычные фрагменты антител: нанотела верблюдовых Аудитория:
Часть 2: Необычные фрагменты антител: нанотела верблюдовых Аудитория:- Исследователь
- Преподаватели адв. Бакалавриат / аспирантура
Общая продолжительность: 1:13:32
Записано: июль 2017
.


