Дисбактериоз кишечника: симптомы, коррекция и лечение дисбиоза у взрослых и детей, степени, анализы и профилактика
Дисбактериозом (дисбиоз) называют симптоматическое состояние, характеризующееся нарушением микрофлоры кишечника. В кишечнике в этот момент размножаются патологические бактерии, и нарушается естественный микробный баланс.
Причины дисбактериоза
Существуют различные предпосылки и состояния, которые способны привести к развитию дисбактериоза:
- заболевания органов ЖКТ,
- прием лекарственных препаратов, нарушающих микрофлору кишечника (антибиотики),
- неправильное питание,
- физиологические возрастные изменения,
- прием гормональных препаратов,
- курсы лучевой и химиотерапии,
- стрессы и неправильный режим дня,
- пищевые отравления,
- инфекционные процессы в организме.
Банальные респираторные инфекции или аллергические заболевания могут стать причиной нарушения микрофлоры кишечника, так как в этот период пациенту могут назначаться различные лекарственные препараты, негативно влияющие на микробный баланс.
Как понять, что у вас дисбиоз?
На разных стадиях заболевания симптоматика дисбактериоза различна. Специалисты рекомендуют обращать внимание на следующие проявления:
- отрыжка,
- тошнота,
- урчащие звуки в животе,
- вздутие и метеоризм,
- ноющие или режущие боли в области живота,
- запоры либо диарея и жидкий стул,
- сухость кожных покровов,
- неприятный привкус и запах изо рта,
- утомляемость и нарушение сна.
Наличие одного или нескольких перечисленных симптомов – повод обратиться к врачу.
Диагностика дисбактериоза
Самостоятельно диагностировать состояние дисбактериоза невозможно. Поставить точный диагноз способен только опытный специалист, который обследует пациента при помощи лабораторных методов и специальной аппаратуры. Обратившись за медицинской помощью, пациент проходит обследование, которое включает:
- исследования мочи и кала,
- ПЦР-диагностику микрофлоры,
- визуальный осмотр кожных покровов.

Профилактика дисбактериоза
Развитие заболевания можно предотвратить, если внимательно следить за питанием, избегать стрессовых состояний, соблюдать режим сна и отдыха, не употреблять необоснованных лекарственных препаратов, занимаясь самолечением, контролировать состояние органов желудочно-кишечного тракта.
Что будет, если не лечить дисбактериоз?
Если не лечить дисбиоз, заболевание может перейти в более тяжелую форму, и не исключено появление осложнений. В результате этих процессов в кишечнике будут образовываться токсические вещества, которые с кровотоком будут разнесены по всем органам и тканям. Всасывание и усвоение минералов и витаминов будет нарушено, иммунитет организма ослабнет, и защитные свойства значительно снизятся. Пациент будет легко подвержен различным инфекциям, банальное расстройство кишечника может привести к серьезным заболеваниям, лечение которых нередко требует оперативного вмешательства.
Как вылечить дисбактериоз?
При лечении дисбактериоза важнейшим шагом становится лечение основного заболевания, которое вызвало патологию в кишечнике пациента. Затем проводится терапия по восстановлению микрофлоры кишечника, наиболее правильно подбирать препараты на основе лабораторных исследований посева.
Затем проводится терапия по восстановлению микрофлоры кишечника, наиболее правильно подбирать препараты на основе лабораторных исследований посева.
Диета при дисбактериозе
В период лечения и для предупреждения рецидивов необходимо исключить употребление жирного, острого, соленого, жареного, не пить алкоголь. Питание должно быть сбалансированным и щадящим, в рационе должны присутствовать кисломолочные продукты.
Проконсультироваться о диагностике и лечении дисбактериоза и записаться к специалисту вы можете, позвонив в нашу клинику или записавшись через форму на сайте.
УЗНАТЬ ЦЕНЫ
Лекарство от дисбактериоза – как выбрать лучший препарат?
Проблемы со стулом, неприятное чувство в животе может быть связано не только с отравлением пищей. У взрослых и детей за этими симптомами часто скрывается дисбактериоз. Врачи не считают его заболеванием, это состояние часто сопровождает другие патологии или является их следствием. Но устранять нарушение микрофлоры нужно как можно раньше.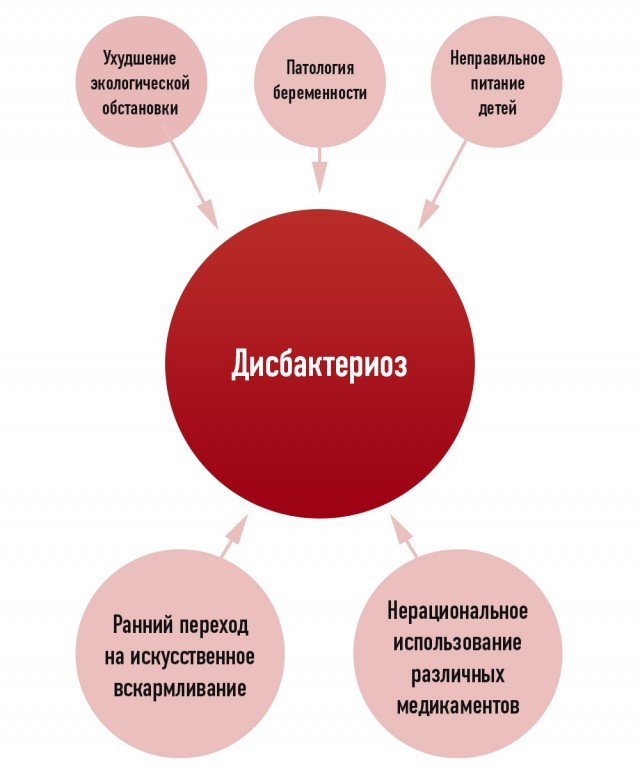
Что такое дисбактериоз
Ребенок появляется на свет стерильным, в его организме в норме нет бактерий. Кишечник, кожа заселяются постепенно, начиная с первого прикладывания младенца к груди. Чем старше становится ребенок и более разнообразна его пища, тем больше различных бактерий попадают в кишечник и формируют его микрофлору. У взрослых людей состав микроорганизмов стабилизируется, но становится разнообразным. Его можно сравнить с отпечатком пальцев, несмотря на сходство, он не повторяется ни у одного человека.
Среди кишечных бактерий насчитывается сотни видов хороших микроорганизмов, но в норме встречаются и плохие, рост которых организм может сдерживать. Условно выделяют три типа микробов:
- доминирующие – присутствуют у всех здоровых людей, к ним относятся эубактеры, бактероиды, бифидобактерии, лактобактерии;
- непостоянные виды – встречаются не у всех или при определенных условиях, это стрептококки, кишечная палочка, протей, цитобактер;
- транзиторные виды – иногда попадают в кишечник, но долго там не задерживаются, это такие типы, как дрожжевые грибы, клостридии, синегнойная палочка.

Хорошими микроорганизмами являются доминирующие бактерии, их должно быть большинство. Благодаря присутствию нормальной микрофлоры переваривается пища. Бактерии помогают ферментировать некоторые неперевариваемые продукты, участвуют в всасывании витаминов, аминокислот, сахаров. Сами они тоже синтезируют витамины группы В, К, жирные кислоты. Поэтому при дисбактериозе появляются признаки гиповитаминоза.
Хорошие бактерии выполняют роль живого щита. Они формируют защитный слой на кишечной стенке, которые не позволяет прикрепиться патогенным микроорганизмам и ограничивает их в питательных веществах. Иммунная функция заключается в тренировке клеток иммунитета и регуляции его ответа на проникновение чужеродных микроорганизмов или белков.
Но при изменении соотношения бактерий, увеличении количества транзиторных видов, появлении дрожжевых грибков, развивается дисбактериоз. Его нельзя назвать заболеванием, но самочувствие у человека нарушается. При дисбактериозе в кишечнике нет патогенных микроорганизмов (сальмонелл, холерного вибриона, иерсиний, патогенных эшерихий, а также вирусов). Изменения состава происходят за счет дисбаланса нормальной флоры и увеличения концентрации условно-патогенных бактерий, появления грибков.
Изменения состава происходят за счет дисбаланса нормальной флоры и увеличения концентрации условно-патогенных бактерий, появления грибков.
Причины
Микрофлора кишечника у взрослых находится в состоянии динамического равновесия. В нем присутствуют определенные бактерии, которые составляют большинство, и около 3 % микроорганизмов, которые меняют свой состав. В норме колебания происходят под влиянием продуктов питания и пищевых привычек. На микрофлору влияет преобладание в рационе сладкого и жирного или преимущественно растительная пища.
Исследования показывают, что жирная еда угнетает бифидобактерии и энтерококки, но в этих условиях размножаются бактероиды. Преимущественно углеводная диета стимулирует размножение бифидобактерий и общего количество микроорганизмов. Но таки перемены носят временный характер и не ведут к появлению симптомов дисбактериоза. Они сами исчезают после изменения питания.
Дисбактериоз кишечника у взрослых появляется в результате других заболеваний. Основными причинами нарушения микрофлоры являются:
Основными причинами нарушения микрофлоры являются:
- длительное лечение антибиотиками;
- патологии вышележащих отделов пищеварительного тракта;
- продолжительные монодиеты и постоянное неправильное питание;
- кишечные инфекции.
Антибиотики широкого спектра действия действуют неселективно. Они угнетают рост или вызывают гибель всех микроорганизмов. Чем дольше курс лечения, тем выше вероятность, что после него разовьется дисбактериоз. Особенно опасны тетрациклиновые антибиотики. Они значительно угнетают размножение кишечной микрофлоры, что приводит к гиповитаминозу В, К, увеличению риска кровотечений.
Гастрит, холецистит, панкреатит, гепатит или дискинезия желчных путей могут привести к развитию дисбактериоза. Опасны цирроз печени, опухолевые процессы в желудке или язва. Эти патологии сопровождаются нарушением переваривания пищи, выработки ферментов. Поэтому в кишечник пища поступает недостаточно обработанной и не может служить питательной средой для бактерий. Часть из них гибнет, а на их место приходит словно-патогенная флора.
Часть из них гибнет, а на их место приходит словно-патогенная флора.
Разгрузочный день, когда рацион строится на употреблении одного продукта питания, не наносит вреда организму. Но монодиета, которая длится несколько недель или становится образом жизни, может привести к дисбактериозу. Опасно постоянное употребление еды, содержащей простые углеводы, животные жиры. Это сладкое, мучное, блюда из фаст-фуда. Такой рацион угнетает размножение нормальной флоры, в кишечнике активируются процессы брожения, появляется большое количество дрожжевых грибков.
Двойной вред кишечнику наносят пищевые инфекции. Они повреждают слизистую оболочку, а лечение антибиотиками убивает полезные бактерии. Поэтому восстановление после болезни проходит особенно тяжело.
Негативно на состояние кишечника влияет курение. Оно создает условия для размножения дрожжевых грибков, поэтому курильщики часто мучаются неприятными симптомами.
Симптомы дисбактериоза
Нет строгих симптомов, которые с большой вероятностью указывают на дисбактериоз. Проявления патологии часто не соответствуют степени тяжести нарушений. Самый частый признак – нарушение пищеварения по типу кишечной диспепсии. Она проявляется следующими симптомами:
Проявления патологии часто не соответствуют степени тяжести нарушений. Самый частый признак – нарушение пищеварения по типу кишечной диспепсии. Она проявляется следующими симптомами:
- урчание в животе;
- метеоризм, усиленное газообразование;
- вздутие живота;
- нарушения стула;
- появление в кале патологических примесей.
Усиление газообразования на начальном этапе происходит после нарушения питания. Если в определенный день в рационе присутствовало молоко, бобовые, большое количество мучного и сладкого, симптомы проявляются ярко.
Нарушения стула изменчивы. Чаще всего дисбактериоз проявляется диареей. Она может сопровождаться спазмами и болью в животе. Иногда неоформленный стул появляется всего раз в сутки, поэтому не попадает под критерий диареи.
Понос может сменяться запором. Такой процесс наблюдается у людей, которые ограничивают количество клетчатки и пищевых волокон в рационе. Это лишает бактерии необходимых питательных веществ, не позволяет удерживать в просвете кишечника воду. Слизистые патологические примеси в каловых массах, боль в животе появляются при запущенных формах дисбактериоза.
Слизистые патологические примеси в каловых массах, боль в животе появляются при запущенных формах дисбактериоза.
Нарушение состава микрофлоры приводит к дефициту витаминов. Если он не компенсируется при помощи питания или приема поливитаминных препаратов, появляются симптомы гиповитаминоза:
- ухудшается состояние волос, ногтей;
- на коже появляются высыпания;
- проявляются аллергические реакции или пищевая непереносимость;
- повышается утомляемость, снижается работоспособность;
- нарушается сон.
Кишечные микроорганизмы синтезируют витамин К, который участвует в свертывании крови. При гиповитаминозе учащается появление синяков, гематом под кожей от небольшого механического воздействия. При язве желудка, небольших травмах увеличивается риск продолжительного кровотечения.
В тяжелых случаях дисбактериоз, который сопровождается диареей, приводит к обезвоживанию. У многих пациентов снижается масса тела.
Какое нужно обследование
Симптомы дисбактериоза неспецифические.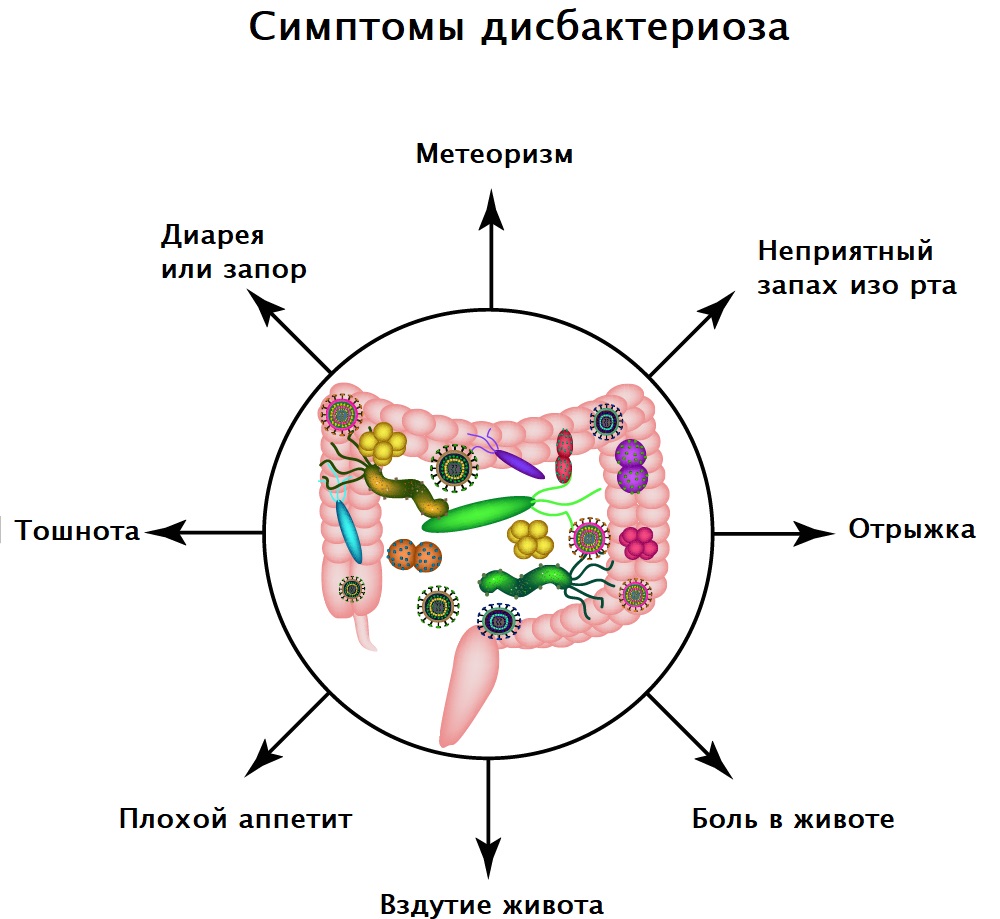 За одинаковыми признаками могут маскироваться патология органов пищеварения или гиповитаминоз. Поэтому дисбактериоз считается клинико-лабораторным синдромом.
За одинаковыми признаками могут маскироваться патология органов пищеварения или гиповитаминоз. Поэтому дисбактериоз считается клинико-лабораторным синдромом.
Диагностика начинается с копрологического исследования, которое позволяет оценить пищеварительную функцию, состояние ферментных систем, перистальтику и скорость продвижения пищевого комка.
Но изменение состава кала еще не говорит о дисбактериозе. Необходимо подтвердить изменение состава бактерий в просвете кишечника. В Москве во многих клиниках применяют методы газожидкостной и ионной хроматографии. Они позволяют определить состав микрофлоры по полученным метаболитам.
Часто используют бактериологическое исследование. Для этого смывы со слизистой оболочки кишечника, фекалии или соскоб высевают на специальные питательные среды. Этот способ позволяет получить колонии бактерий и с высокой точностью определить их тип. Также используют специальный анализ кала на дисбактериоз. Но обязательное условие – биологический материал должен попасть в лабораторию не позже, чем через час после его получения от пациента. Кал необходимо поддерживать в теплом виде, чтобы не вызвать гибель бактерий. Метод не оправдывает себя тем, что дает представление только о состоянии флоры толстого кишечника.
Кал необходимо поддерживать в теплом виде, чтобы не вызвать гибель бактерий. Метод не оправдывает себя тем, что дает представление только о состоянии флоры толстого кишечника.
Золотой стандарт диагностики дисбактериоза – интестиноскопия. Это эндоскопический метод, во время которого в полость тонкой кишки через рот и желудок или прямую и толстую кишку вводят гибкий зонд с видеокамерой. Он необходим для осмотра слизистой кишечника и получения аспирата его содержимого. Полученную жидкость также засевают на питательную среду. Недостаток метода – необходимость общей анестезии, специальных бактериологических сред и долгое ожидание результата. Иногда для диагностики дисбактериоза применяют дыхательный тест с меченным Н2.
Препараты и их действие
Самый эффективный способ восстановить микрофлору и избавиться от дисбактериоза – использовать препараты из группы пробиотиков. Производители предлагают лекарственные средства в разных формах:
- капсулы;
- таблетки;
- порошок;
- капли;
- раствор.

Лекарственную форму подбирает врач в зависимости от возраста пациента. Детям и пожилым людям, которым тяжело глотать таблетки, назначают раствор или порошок для его приготовления. В возрасте 0-3 лет ребенку легче дать капли с пробиотиком. Всем остальным рекомендованы средства в виде капсул или таблеток.
Препараты от дисбактериоза – это лекарства, которые можно приобрести без рецепта врача. Но самолечением заниматься не рекомендуется, только специалист может подсказать, какой тип лучше принимать.
В составе пробиотиков обычно 1-2 типа бактерий, которые хорошо восстанавливают слизистую. Обычно это лакто- и бифидобактерии. Они являются нормальными обитателями кишечника, которые помогают улучшить микробный баланс. Механизм действия этой терапевтической группы связан с подавлением роста патогенной флоры. Молочнокислые бактерии конкурируют за рецепторы на эпителии слизистой оболочки, питательные вещества. Они выделяют молочную кислоту, цитокины, которые оказывают угнетающее действие на патогены.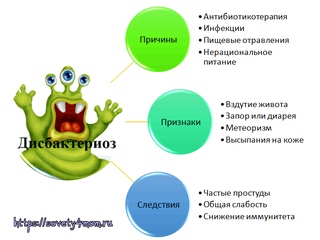
Эффективно вылечить дисбактериоз помогают препараты из группы пребиотиков. Это лекарства, которые относятся к группе пищевых волокон: инулин и лактулоза, а также препараты на их основе.
Они не расщепляются пищеварительными ферментами и попадают в неизменном виде в толстый кишечник, где становятся питательным субстратом для лакто- и бифидобактерий. Поэтому микробы хорошо размножаются, увеличивают объем бактериальной массы, восстанавливают стенку кишечника. Чтобы лечение было максимально эффективное, рекомендуется пить одновременно пребиотики и пробиотики.
Лечение дисбактериоза не противопоказано при сопутствующих патологиях пищеварительного тракта. Пробиотики не наносят вреда пациентам с язвой желудка, заболеваниями печени или желчного пузыря. А в некоторых случаях они ускорят восстановление.
В запущенных случаях дисбактериоза кишечника и когда симптомы диспепсии слишком мучительны, могут помочь лекарства из группы ферментов. Их должен подбирать врач, в зависимости от типа нарушения пищеварения. Эти средства необходимо пить ежедневно до еды
Эти средства необходимо пить ежедневно до еды
Сколько времени придется лечить дисбактериоз, сказать тяжело. В некоторых случаях это может растянуться на несколько недель, а при запущенном состоянии – несколько месяцев.
Профилактика дисбактериоза
Даже если использовать эффективные препараты и избавиться от дисбактериоза, нельзя точно сказать, не придется ли его лечить еще раз. Поэтому врачи рекомендуют соблюдать меры профилактики.
Самый эффективный – постоянно придерживаться диеты. Она подбирается в зависимости от типа диспепсии. Универсальное средство профилактики – употреблять продукты, которые содержат естественные пробиотики. К ним относятся крупяные каши, кисломолочные продукты с закваской из бифидобактерий, некоторые сорта хлеба. Если постоянно ощущается брожение в кишечнике, на время терапии нужно исключить из рациона углеводы, молоко, горох и сою. Не рекомендуют употреблять продукты, богатые эфирными маслами. У ним относятся лук, чеснок, редька, редис.
Хорошо пить не менее 1,5 л чистой воды в сутки. Действенный способ стабилизировать состав микрофлоры – принимать растительные соки. В этом помогают морковный, тыквенный, картофельный. Помогают многие растительные продукты: ягоды черники, земляники, абрикосы, клюква. Врач может назначить отвары лекарственных растений. Лечить дисбактериоз при преобладании грибковой флоры можно растворимым цикорием. В некоторых случаях эффективны эвкалипт, календула, соя, зверобой.
В список полезных веществ при дисбактериозе входит инулин. Он ускоряет рост и размножение бифидобактерий, чем помогает увеличить объем полезных микробов в кишечнике. Инулин помогает восстановить слизистую за счет увеличения выработки слизи, изменения степени рН и создания благоприятной среды для бактерий.
К мерам профилактики дисбактериоза относится использование пробиотиков заранее у пациентов, которым необходимо пройти курс лечения антибиотиками или химиотерапию. Это позволяет поддержать нормальный состав микрофлоры и избежать неприятных симптомов после окончания терапии.
Токарева Людмила Георгиевна, врач-терапевт медицинских кабинетов 36,6
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ, ПЕРЕД ПРИМЕНЕНИЕМ НЕОБХОДИМО ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ
Дисбактериоз кишечника у детей | Симптомы | Диагностика | Лечение
Одним из часто встречающихся у детей заболеваний является дисбактериоз кишечника. При этом состоянии нарушается нормальный баланс микрофлоры, которая необходима для жизнедеятельности организма. Снижается количество «полезных» бактерий и увеличивается содержание патогенных микроорганизмов.
Причины
Основной причиной развития дисбактериоза у новорожденных и детей старшего возраста является нерациональная медикаментозная терапия. Особенно это относится к антибактериальному лечению. Однако дисбаланс микрофлоры может появляться и при наличии других заболеваний, а также под влиянием факторов, снижающих иммунитет:
- ожоги;
- тяжелые операции;
- повышенное влияние ионизирующего излучения;
- ухудшение экологической ситуации;
- перевод на искусственное питание, позднее начало грудного вскармливания, заболевания матери.

Симптомы дисбактериоза
Симптомы дисбактериоза зависят возраста ребенка.
У детей старшего возраста может наблюдаться:
У грудничка патология проявляется следующими симптомами:
Такие дети плохо растут и мало прибавляют в весе, могут болеть рахитом или анемией.
Если Вы обнаружили у себя схожие симптомы, незамедлительно обратитесь к врачу. Легче предупредить болезнь, чем бороться с последствиями.
Диагностика
Для определения нарушения микрофлоры врачи назначают следующие исследования:
- анализ кала, в том числе биохимическое исследование;
- бактериологическое изучение состава кишечного содержимого и желчи;
- эзофагогастроскопия с последующим бактериологическим изучением соскоба со слизистой оболочки двенадцатиперстной кишки;
- колоноскопия с бактериологическим исследованием соскоба слизистой оболочки толстой и прямой кишки.
Лечение дисбактериоза у детей
Лечение дисбактериоза начинается с устранения причины, которая способствовала его развитию. Для нормализации состава микрофлоры применяются пребиотики и пробиотики. В целом лечение похоже на лечение дисбактериоза у взрослых.
Для нормализации состава микрофлоры применяются пребиотики и пробиотики. В целом лечение похоже на лечение дисбактериоза у взрослых.
Диета
Диета при дисбактериозе у детей зависит от особенностей клинической картины у каждого пациента: показателей кислотности желудочного сока, степени нарушения пищеварения, локализации патологического процесса. Питание ребенка при дисбактериозе должно быть сбалансированным и легкоусвояемым.
Опасность
Опасность заключается в нарушении водно-электролитного баланса, истощения малыша вследствие длительного поноса.
Группа риска
В группу риска входят малыши, которые перенесли:
- родовые травмы;
- глистные инвазии;
- искусственное вскармливание;
- колит, энтерит;
- инфекционные заболевания (дизентерия, тиф).
Профилактика
Профилактика заключается в соблюдении режима питания малыша и проведении рациональной антибиотикотерапии.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
Все о дисбактериозе | Медицинский центр «Новая медицина»
ВСЁ О ДИСБАКТЕРИОЗЕ
Дисбактериоз очень распространенное заболевание. По данным Минздрава дисбактериоз выявляют у 90% взрослого населения и свыше 25% детей в возрасте до года. Многие заболевания, в том числе и хронические, связаны с нарушением микробиоценоза кишечника и часто являются следствием дисбактериоза, а не его причиной.
Дисбактериоз считается основной социальной болезнью 21-го века. Актуальность проблемы требует постоянного поиска новых средств лечения дисбактериоза и его коррекции.
ДИСБАКТЕРИОЗ У ДЕТЕЙ
Дисбактериоз у детей, как и у взрослых, возникает вследствие нарушения баланса микрофлоры кишечника. Определить его наличие без анализа в лаборатории крайне сложно, поскольку это не является самостоятельным заболеванием, а возникает вследствие воспалительного процесса в организме или же в случае нарушения баланса витаминов. В медицинской терминологии также применяется определение «дисбиоз», которое является синонимом «дисбактериоза».
Чаще всего возникает дисбактериоз у детей грудного возраста. К основному фактору его появления относится искусственное вскармливание малыша и недостаток витаминов, получаемых с дополнительной пищей. Также дисбактериоз у детей может возникнуть при аллергических реакциях организма, приема антибиотиков, зоны повышенной радиации, острых и хронических заболеваний пищеварительной системы или нарушения нормального функционирования кишечника из-за недостатка бактерий, расщепляющих кислоты и питательные вещества. Источник, как правило, устанавливает врач.
Кишечно-желудочный тракт взрослого человека содержит примерно 1,5 кг бактерий, около 400—500 разных видов, а у детей до двух лет, вскармливаемых грудным молоком, преобладают в основной массе бифидобактерии, которые препятствуют развитию кишечно-желудочных заболеваний. У малышей, которых вскармливают искусственным путем, из-за невозможности кормить грудью, не формируется преобладание какой-то определенной группы бактерий — бифидо бактерий, такое питание не сможет предотвратить дисбактериоз у ребенка и защитить организм от других заболеваний.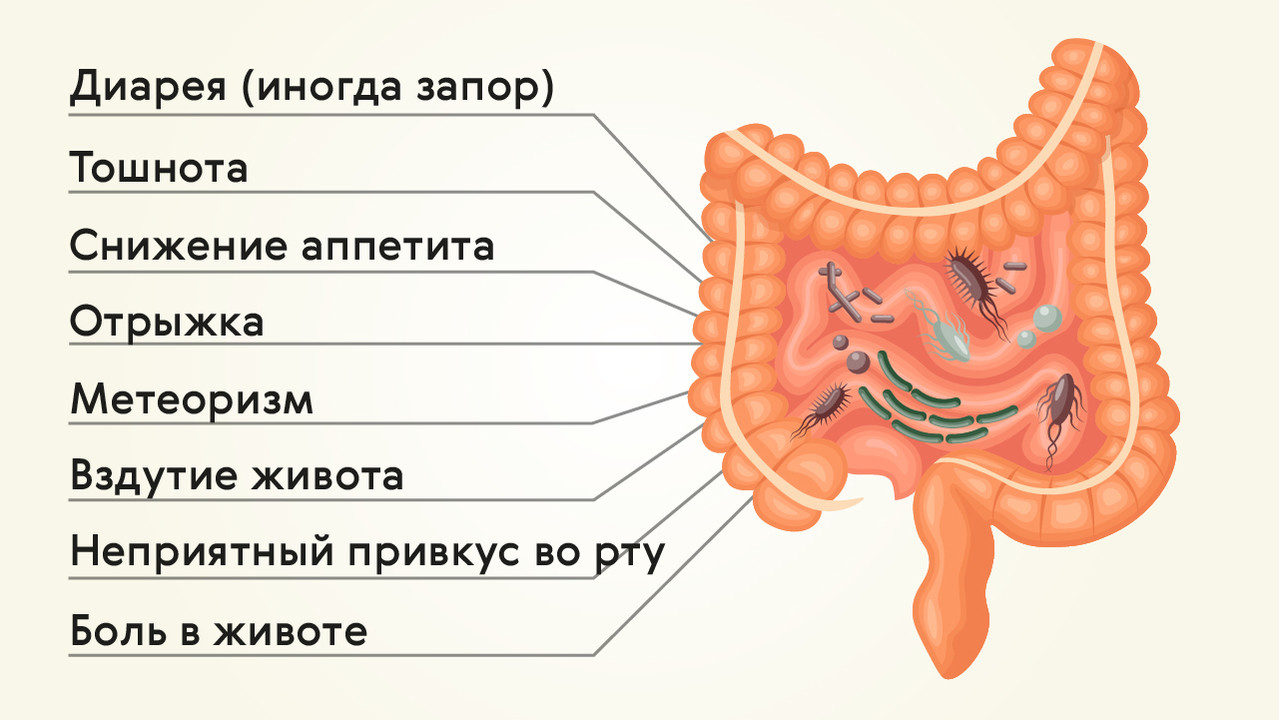 Поэтому врачи рекомендуют кормить теми кисломолочными смесями, которые способствуют их размножению. Информацию о свойствах смесей можно прочитать на упаковке и выбрать оптимальную для ребенка.
Поэтому врачи рекомендуют кормить теми кисломолочными смесями, которые способствуют их размножению. Информацию о свойствах смесей можно прочитать на упаковке и выбрать оптимальную для ребенка.
Преобладание бифидобактерий в детском организме важно тем, что они помогают регулировать обмен желчных кислот, а также принимают участие в формировании органических веществ и кислот, необходимых для работы кишечника. Способствуют усваиванию витаминов К, группы В, D, солей, никотиновой и фолиевой кислоты, получаемых с питанием. Имеют антиаллергическое, антирахитическое и антианемическое действие на организм, а кроме того формируют иммунитет.
Как мы уже говорили, симптомов, по которым можно однозначно сделать вывод, что это дисбактериоз — нет, поэтому нужно искать в первую очередь причину — то заболевание, которое может сопровождаться дисбактериозом.
Раньше дисбактериоз определяли с помощью анализа состава кала, но так как осуществить правильный сбор кала в стерильную посуду не возможно, результат такого анализа не до конца объективен. На сегодняшний день в современной медицине применяются более сложные и точные методы, такие как исследование с помощью биохимии; для гастроскопии — анализ соскоба слизистой 12-перстнойлибо тощей кишки, для колоноскопии — анализ соскоба прямой и толстой кишки. Но такие сложные исследования проводятся только по назначению лечащего врача.
На сегодняшний день в современной медицине применяются более сложные и точные методы, такие как исследование с помощью биохимии; для гастроскопии — анализ соскоба слизистой 12-перстнойлибо тощей кишки, для колоноскопии — анализ соскоба прямой и толстой кишки. Но такие сложные исследования проводятся только по назначению лечащего врача.
Каким же образом происходит лечение?
Первостепенно необходимо лечить причину его возникновения — основное заболевание, которое устанавливает один из врачей, назначенных педиатром. Курс лечения будет состоять из лечения очага заболевания и специализированного питания смесями, способствующими либо образованию правильной (здоровой) микрофлоры кишечника либо смесями, которые уже содержат микроорганизмы.
Предотвращается возможный дисбактериоз у ребенка в первую очередь длительным грудным кормлением и своевременным введением дополнительного прикорма к молоку. Лучше всего все этапы вскармливания ребенка согласовывать с наблюдающим педиатром, собственная интуиция важна, но совет профессионала не менее важен, тем более в этом возрасте закладывается основа иммунитета на всю жизнь. Дополнять рацион питания рекомендуется специальными кисло-молочными смесями, которые содержат в себе бифидо и лактобактерии полезные деткам.
Дополнять рацион питания рекомендуется специальными кисло-молочными смесями, которые содержат в себе бифидо и лактобактерии полезные деткам.
В том случае, если врач установил дисбактериоз у ребенка, к основному питанию добавляются кисло-молочные продукты, в зависимости от направления лечения. Наринэ-Форте, Биовестин, Биовестин-лакто содержат бифидо и лактобактерии в пропорциях и состояние, которые способны стимулировать развитие микроорганизмов нормальной флоры.
Но не забывайте — не только питанием лечится дисбактериоз у детей, а также предупреждением первоисточника его возникновения, который определяет врач. Лучше всего сразу применять смеси, которые способствуют образованию бифидобактерий, как прикорм к основному питанию, для того, чтобы поддерживать необходимую микрофлору кишечника и предотвратить дисбактериоз у ребенка, а именно лечение смесями уже осуществлять под руководством врача в сочетании с лечением очага воспаления.
ДИСБАКТЕРИОЗ — ВРАГ ЗДОРОВЬЯ
Каждый день наш организм нуждается в еде. Без пищи человек не может существовать. Прием пищи становится ритуалом, который человек должен соблюдать изо дня в день. Однако не всегда наш организм в силе переварить ее. Особенно, если мы позволяем себе лишнего.
Без пищи человек не может существовать. Прием пищи становится ритуалом, который человек должен соблюдать изо дня в день. Однако не всегда наш организм в силе переварить ее. Особенно, если мы позволяем себе лишнего.
Например, переедаем за ужином или перед сном, едим не совсем полезную и здоровую пищу. Полноценное пищеварение возможно только в случае наличия в желудке каждого человека самых разнообразных микробов. Причем эти микробы могут быть как положительными, так и, как это ни странно, отрицательными. Именно они помогают нашему желудку все это переварить.
Если говорить о дисбактериозе, то это состояние, во время которого все микробы нашего организма изменяют свой состав. Это изменение в свою очередь ведет к нарушению работы желудка и кишечника.
Вполне правильным будет вопрос — почему же все это происходит? Изменение состава Вашего кишечника происходит в результате каких-либо изменений в Вашем организме. Что это значит? Ваш организм чем-то заражен или в него попала какая-то инфекция. Все это приводит к появлению дисбактериоза.
Все это приводит к появлению дисбактериоза.
Рассмотрим подробнее причины появления дисбактериоза. Этот сбой работы кишечника может произойти в результате неправильного применения различных антибиотиков. Если Вы страдаете заболеваниями пищеварительного тракта, у Вас также может появиться дисбактериоз. Слабый иммунитет, послеоперационное состояние или неправильное питание — еще три причины появления дисбактериоза.
Во время дисбактериоза кишечник перестает обладать полезными микробами. Он наполнен только вредными бактериями, которые приводят к болям в области кишечника. В этот момент организм человека практически не получает никаких витаминов, жиров и других важных для организма веществ. Все это приводит к сильному снижению веса больного. При дисбактериозе у больного болит и вздувается живот. У него обязательно меняется стул.
Чтобы выявить наличие этого заболевания, Вам необходимо обратиться к врачу-гастроэнтерологу. Он назначит Вам гастроскопию, то есть проверят Ваш кишечник при помощи специального аппарата. Вам также проверят кишку и возьмут анализы кала. Все эти процедуры помогут врачу назначить Вам правильный курс лечения.
Вам также проверят кишку и возьмут анализы кала. Все эти процедуры помогут врачу назначить Вам правильный курс лечения.
При любом курсе лечения этого заболевания Вы должны будете соблюдать диету. Эта диета обязательно будет включать в свой состав различные продукты, которые богаты полезными бактериями. Чаще всего таковыми являются различные кисломолочные продукты. Также Вам пропишут антибиотики или бактериофаги. Это препараты, которые помогут Вам очистить кишечник от вредных бактерий. Также Ваше лечение не обойдется без лекарственных препаратов, которые помогут Вашему кишечнику нормализоваться. Это такие препараты как: Нарине-Форте, Бификол, Биовестин, Нарине Ф-баланс и др.
Чаще всего для полного выздоровления хватает двух месяцев. Однако есть одно но. Как правило, после лечения ни один врач не даст Вам стопроцентной гарантии, что Вы не заболеете дисбактериозом вновь. Микрофлора кишечника имеет один большой минус. Она очень быстро реагирует на любые изменения Вашего организма. Чтобы избежать всех этих неприятностей, Вам необходимо вовремя избавляться от любых неполадок Вашего органи. Например можно проводить профилактику — время от времени пропивать препараты, которые нормализуют микрофлору кишечника. Для этих целей отлично подойдет Нарине-Форте или Нарине Ф-баланс. При регулярном применение эти препараты не дадут развиться дисбактериозу, а так же нормализуют микрофлору пищеварительного тракта, что улучшит аппетит, стул и защитит Ваш кишечник от патогенных микробов. Также Вам не стоит принимать никакие антибиотики без консультации у врача.
Чтобы избежать всех этих неприятностей, Вам необходимо вовремя избавляться от любых неполадок Вашего органи. Например можно проводить профилактику — время от времени пропивать препараты, которые нормализуют микрофлору кишечника. Для этих целей отлично подойдет Нарине-Форте или Нарине Ф-баланс. При регулярном применение эти препараты не дадут развиться дисбактериозу, а так же нормализуют микрофлору пищеварительного тракта, что улучшит аппетит, стул и защитит Ваш кишечник от патогенных микробов. Также Вам не стоит принимать никакие антибиотики без консультации у врача.
Если говорить честно, то все в Ваших руках. Здоровье каждого человека в огромнейшей степени зависит исключительно от него самого. Если Вы будете себя беречь, Вы навсегда останетесь здоровыми и счастливыми.
БАД — ЭТО ТО, ЧТО НАМ НЕ ХВАТАЕТ В ПИЩЕ?
Относятся ли БАДы к разряду медикаментозных препаратов? Вызывают ли пищевые добавки привыкание? Могут ли добавки заменить обычное питание? Как правильно их применять? Что входит в их состав? Есть ли у БАДов противопоказания, и в каких случаях необходимо посоветоваться с врачом, прежде чем их принимать? На вопросы отвечает директор направления по улучшению качества пищевых продуктов канадского Института Здоровья Nutrilite.
Кто из нас не мечтает укрепить здоровье и продлить отпущенный природой срок жизни? Для этих целей вроде бы и выпускаются различные биологически активные добавки (БАДы). О них ходит множество мифов. Кто-то считает их панацеей от всего, кто-то убежден, что они не дают никакого эффекта, а их производители — шарлатаны…
Так что же такое БАДы и как правильно их принимать? С этим вопросом «Правда.ру» обратилась к Одре Дэвис — директору направления по улучшению качества пищевых продуктов канадского Института Здоровья Nutrilite.
— Относятся ли БАДы к разряду медикаментозных препаратов?
— Биологически активные добавки к пище — не лекарства. Но использовать их в комплексе с лекарственными средствами вполне разумно и оправданно. Они помогают оздоровить организм, сократить длительность болезни, снизить риск развития осложнений и обострений, позволяют увеличить продолжительность жизни. Лекарства хороши, когда человек уже заболел. А БАДы применяются как средства профилактики, предупреждения болезней. Ведь, за исключением травм и инфекций, болезнь никогда не возникает внезапно. Зачастую развитие заболевания являет собой длительный процесс, на протяжении которого организм пытается бороться с патологическими изменениями… Если в это время прибегнуть к БАДам, возможно, удастся восстановить нормальную работу органов еще до того, как нарушения станут очевидны.
Ведь, за исключением травм и инфекций, болезнь никогда не возникает внезапно. Зачастую развитие заболевания являет собой длительный процесс, на протяжении которого организм пытается бороться с патологическими изменениями… Если в это время прибегнуть к БАДам, возможно, удастся восстановить нормальную работу органов еще до того, как нарушения станут очевидны.
— Вызывают ли пищевые добавки привыкание?
— Физиологического привыкания не вызывают. Но есть люди, «зацикленные» на приеме различных витаминов, добавок и лекарств. На самом деле в состав добавок входят вещества, которые должны присутствовать в нашем ежедневном рационе. Но мало кто из нас умеет питаться рационально. Вот и бежим покупать БАДы!
— Могут ли добавки заменить обычное питание? Как правильно их применять?
— БАДы являются именно добавками к пище, а не ее заменителями. С их помощью организм адаптируется к воздействию различных внешних и внутренних факторов. Биодобавки и витаминно-минеральные комплексы рекомендуется принимать регулярно в осенно-зимне-весенний период, когда организм ослаблен непогодой и гиповитоминозами. Кроме того, они могут оказать незаменимую помощь в восстановлении после стрессов и физических нагрузок.
Кроме того, они могут оказать незаменимую помощь в восстановлении после стрессов и физических нагрузок.
— А что входит в их состав?
— БАДы включают в себя компоненты животного, растительного и минерального происхождения. В их состав могут входить как природные ингредиенты, так и соединения, полученные биотехнологическими или химическими методами. Могу с уверенностью сказать, что генетически модифицированные продукты при производстве биологически активных добавок не используются. В России утвержден и действует список из 190 разрешенных компонентов. Есть и перечень запрещенных: это, во-первых, сильнодействующие психотропные и ядовитые вещества, а также вещества, не являющиеся аналогами элементов нашего пищевого рациона, неприродные синтетические продукты, гормоны и ряд других…
— Есть ли у БАДов противопоказания, и в каких случаях необходимо посоветоваться с врачом, прежде чем их принимать?
— Предупреждения о возможных противопоказаниях потребитель может прочитать на этикетке к препарату. В России БАДы обязательно проходят государственную регистрацию. Но за консультацией к врачу не мешает обратиться, если вы беременны, кормите грудью, а также, если препарат предназначается для ребенка. Стоит помнить и о том, что у разных людей организм может по-разному реагировать на те или иные продукты и препараты, даже, на первый взгляд, безвредные. Поэтому совет грамотного специалиста никогда не помешает.
В России БАДы обязательно проходят государственную регистрацию. Но за консультацией к врачу не мешает обратиться, если вы беременны, кормите грудью, а также, если препарат предназначается для ребенка. Стоит помнить и о том, что у разных людей организм может по-разному реагировать на те или иные продукты и препараты, даже, на первый взгляд, безвредные. Поэтому совет грамотного специалиста никогда не помешает.
РОДИТЕЛЯМ ОБ АНТИБИОТИКАХ
Вторую половину ХХ века можно смело назвать антибактериальной эрой, и это не будет преувеличением: число жизней, спасенных с помощью антибиотиков, давно перешагнуло за миллиард! Об их чудотворной силе ходят легенды, но и хулы в их адрес приходится слышать не меньше. Виной тому поверхностное знание, провоцирующее неоправданные ожидания, а стало быть — и многочисленные обвинения антибиотиков в бедах, за которые они на самом деле ответственности вовсе не несут.
А хуже всего то, что антибиотики применяют гораздо чаще, чем это необходимо, нанося тем самым серьезнейший вред не только больным, но и обществу в целом. Я далек от мысли научить родителей самостоятельно использовать антибиотики — это дело врача. Но я убежден, что понимать логику назначения врача современные родители не только могут, но и обязаны.
Я далек от мысли научить родителей самостоятельно использовать антибиотики — это дело врача. Но я убежден, что понимать логику назначения врача современные родители не только могут, но и обязаны.
О ПОЛЬЗЕ ГРЯЗНОЙ ПОСУДЫ
Слово «антибиотик» образовано из двух элементов греческого происхождения: anti- — «против» и bios — «жизнь». Антибиотиками называют образуемые микроорганизмами, высшими растениями или тканями животных организмов вещества, избирательно подавляющие развитие микроорганизмов (или клеток злокачественных опухолей).
Любопытна история открытия первого антибиотика — пенициллина — шотландским бактериологом Александером Флемингом в 1829 г.: будучи по природе человеком неряшливым, он очень не любил… мыть чашки с бактериологическими культурами. Каждые 2—3 недели на его рабочем столе вырастала целая груда грязных чашек, и он скрепя сердце приступал к очистке «авгиевых конюшен». Одна из таких акций дала неожиданный результат, масштаб последствий которого сам ученый оценить в тот момент не мог. В одной из чашек обнаружилась плесень, подавляющая рост высеянной культуры болезнетворной бактерии группы staphylococcus. Кроме того, «бульон», на котором разрослась плесень, приобрел отчетливо выраженные бактерицидные свойства по отношению ко многим распространенным патогенным бактериям. Плесень, которой была заражена культура, относилась к виду penicillium.
В одной из чашек обнаружилась плесень, подавляющая рост высеянной культуры болезнетворной бактерии группы staphylococcus. Кроме того, «бульон», на котором разрослась плесень, приобрел отчетливо выраженные бактерицидные свойства по отношению ко многим распространенным патогенным бактериям. Плесень, которой была заражена культура, относилась к виду penicillium.
В очищенном виде пенициллин был получен лишь в 1940 г., т. е. спустя 11 лет после его открытия, в Великобритании. Сказать, что это произвело революцию в медицине, — значит не сказать ничего. Но у любой медали, увы, две стороны…
ОБОРОТНАЯ СТОРОНА МЕДАЛИ
Открыв столь мощное оружие в борьбе с болезнетворными микроорганизмами, человечество впало в эйфорию: к чему долго и кропотливо подбирать лекарственную терапию, если можно «шарахнуть» по зловредным микробам антибиотиком? Но и микробы «не лыком шиты» — они весьма эффективно защищаются от грозного оружия, вырабатывая устойчивость к нему. Если антибиотик, скажем, блокирует синтез необходимых микробу белков — микроб в ответ на это просто… меняет белок, обеспечивающий его жизнедеятельность. Некоторые микроорганизмы ухитряются научиться выработке ферментов, разрушающих сам антибиотик. Короче говоря, способов множество, и «хитроумные» микробы ни одним из них не пренебрегают. Но самое печальное заключается в том, что устойчивость микробов может передаваться от одного вида другому путем межвидового скрещивания! Чем чаще применяется антибиотик, тем быстрее и успешнее микробы приспосабливаются к нему. Возникает, как вы понимаете, порочный круг — чтобы разорвать его, ученые вынуждены вступить в навязанную микробами «гонку вооружений», создавая все новые и новые виды антибиотиков.
Некоторые микроорганизмы ухитряются научиться выработке ферментов, разрушающих сам антибиотик. Короче говоря, способов множество, и «хитроумные» микробы ни одним из них не пренебрегают. Но самое печальное заключается в том, что устойчивость микробов может передаваться от одного вида другому путем межвидового скрещивания! Чем чаще применяется антибиотик, тем быстрее и успешнее микробы приспосабливаются к нему. Возникает, как вы понимаете, порочный круг — чтобы разорвать его, ученые вынуждены вступить в навязанную микробами «гонку вооружений», создавая все новые и новые виды антибиотиков.
НОВОЕ ПОКОЛЕНИЕ ВЫБИРАЕТ…
К настоящему времени создано более 200 противомикробных препаратов, из них более 150 используются для лечения детей. Их мудреные названия нередко ставят в тупик людей, не имеющих отношения к медицине. Как же разобраться в обилии замысловатых терминов? На помощь, как всегда, приходит классификация. Все антибиотики делятся на группы — в зависимости от способа воздействия на микроорганизмы.
Пенициллины и цефалоспорины разрушают оболочку бактериальной клетки.
Аминогликозиды, макролиды, левомицетин, рифампицин и линкомицин убивают бактерии, подавляя синтез разных ферментов — каждый своего.
Фторхинолоны уничтожают микроорганизмы более «изощренно»: подавляемый ими фермент отвечает за размножение микробов.
В непрекращающемся состязании с микробами ученым приходится придумывать все новые и новые методы борьбы — каждый из них дает начало новому поколению соответствующей группы антибиотиков.
Теперь о названиях. Увы, здесь царит изрядная неразбериха. Дело в том, что помимо основных международных (так называемых генерических) названий многие антибиотики имеют и фирменные, запатентованные тем или иным конкретным производителем (в России их более 600). Так, например, один и тот же препарат может называться амоксициллином, Оспамоксом и Флемоксин Солютабом. Как же разобраться? По закону наряду с патентованным фирменным названием на упаковке лекарства обязательно указывается и его генерическое название — мелким шрифтом, нередко по-латыни (в данном случае — amoxycillinum).
При назначении антибиотика часто говорят о препаратепервого выбора и резервных препаратах. Препарат первого выбора — это тот препарат, назначение которого определяется диагнозом — если у больного нет устойчивости или аллергии к этому лекарственному средству. В последнем случае обычно назначаются резервные препараты.
ЧЕГО ЖДАТЬ И ЧЕГО НЕ ЖДАТЬ ОТ АНТИБИОТИКОВ?
Антибиотики способны излечить заболевание, вызванное бактериями, грибками и простейшими, но не вирусами. Именно поэтому бесполезно ожидать эффекта от антибиотика, назначенного при ОРВИ, точнее, эффект в таких случаях бывает негативным: температура держится несмотря на прием антибиотика — вот вам и «питательная среда» для распространения молвы о якобы потерянной эффективности антибиотиков или же о повальной устойчивости микробов.
Назначение антибиотика при вирусной инфекции не предотвращает бактериальных осложнений. Напротив, подавляя рост чувствительных к препарату микробов, например обитающих в дыхательных путях, антибиотик облегчает заселение дыхательных путей устойчивыми к нему патогенными бактериями, легко вызывающими осложнение.
Антибиотики не подавляют воспалительного процесса, обусловливающего подъем температуры, так что «сбить температуру» через полчаса, как парацетамол, антибиотик не может. При приеме антибиотика падение температуры наступает лишь через несколько часов или даже через 1—3 дня. Именно поэтому нельзя давать одновременно антибиотик и жаропонижающее: падение температуры от парацетамола может замаскировать отсутствие эффекта от антибиотика, а при отсутствии эффекта антибиотик, естественно, необходимо как можно скорее сменить.
Однако сохранение температуры нельзя считать признаком, однозначно свидетельствующим о неэффективности принимаемого антибиотика: порой выраженная воспалительная реакция, образование гноя требуют дополнительного к антибактериальному лечения (назначения противовоспалительных средств, вскрытия гнойника).
ВЫБОР ЗА ВРАЧОМ
Для лечения заболеваний, вызываемых чувствительными к антибиотикам микробами, обычно используются препараты первого выбора. Так, ангину, отит, пневмонию лечат амоксициллином или оспеном, микоплазменную инфекцию или хламидиоз эритромицином или другим антибиотиком из группы макролидов.
Возбудители кишечных инфекций зачастую быстро вырабатывают устойчивость к антибиотикам, поэтому при лечении кишечных инфекций антибиотики применяются лишь в тяжелых случаях — обычно цефалоспорины 2—3-го поколений или хинолоны.
Инфекции мочевых путей вызываются представителями кишечной флоры, их лечат амоксициллином или, при устойчивости возбудителей, резервными препаратами.
Как долго принимают антибиотик? При большинстве острых болезней его дают в течение 2—3 дней после падения температуры, однако есть много исключений. Так, отит обычно лечат амоксициллином не более 7—10 дней, а ангину — не менее 10 дней, иначе может быть рецидив.
ТАБЛЕТКИ, СИРОПЫ, МАЗИ, КАПЛИ…
Для детей особенно удобны препараты в детских формах. Так, препарат амоксициллина Флемоксин Солютаб выпускается в растворимых таблетках, их легко дать с молоком или чаем. Многие препараты, такие как джосамицин (Вильпрафен), азитромицин (Сумамед), цефуроксим (Зиннат), амоксициллин (Оспамокс) и др., выпускаются в сиропе или в гранулах для его приготовления.
Есть несколько форм антибиотиков для наружного применения — левомицетиновая, гентамициновая, эритромициновая мази, тобрамициновые глазные капли и др.
ОПАСНЫЕ ДРУЗЬЯ
Опасности, связанные с приемом антибиотиков, часто преувеличивают, но помнить о них необходимо всегда.
Поскольку антибиотики подавляют нормальную флору организма, они могут вызывать дисбактериоз, т. е. размножение бактерий или грибов, не свойственных тому или иному органу, прежде всего кишечнику. Однако лишь в редких случаях такой дисбактериоз опасен: при недлительном (1—3 недели) лечении антибиотиками проявления дисбактериоза фиксируются крайне редко, к тому же пенициллин, макролиды, цефалоспорины 1-го поколения не подавляют роста флоры кишечника. Так что противогрибковые (нистатин) и бактериальные (Бифидумбактерин, Лактобактерин) препараты применяются для предупреждения дисбактериоза лишь в случаях длительного лечения несколькими лекарственными препаратами широкого антибактериального спектра.
Термином «дисбактериоз», однако, в последнее время стали злоупотреблять — ставят его в качестве диагноза, списывая на него чуть ли не любые нарушения функционирования желудочно-кишечного тракта. Есть ли вред от такого злоупотребления? Да, поскольку это мешает постановке правильного диагноза. Так, например, у многих детей с пищевой непереносимостью диагностируют дисбактериоз, а потом «лечат» Бифидумбактерином, обычно без успеха. Да и стоят анализы кала на дисбактериоз немало.
Еще одна опасность, подстерегающая при приеме антибиотиков, — аллергия. У некоторых людей (в том числе и у грудных детей) имеется аллергия к пенициллинам и другим препаратам-антибиотикам: сыпи, шоковые реакции (последние, к счастью, встречаются очень редко). Если у вашего ребенка уже наблюдалась реакция на тот или иной антибиотик, об этом надо обязательно сообщить врачу, и он легко подберет замену. Особенно часты аллергические реакции в тех случаях, когда антибиотик дают больному, страдающему заболеванием небактериальной природы: дело в том, что многие бактериальные инфекции как бы снижают «аллергическую готовность» больного, что уменьшает риск реакции на антибиотик.
Аминогликозиды могут вызывать поражение почек и глухоту, их без большой надобности их не применяют. Тетрациклины окрашивают эмаль растущих зубов, их дают детям только после 8 лет. Препараты фторхинолонов детям не назначают из-за опасности нарушения роста, их дают лишь по жизненным показаниям.
Принимая во внимание все вышеперечисленные «факторы риска», врач обязательно оценивает вероятность осложнений и применяет препарат только тогда, когда отказ от лечения сопряжен с большой степенью риска.
В заключение остается лишь сказать несколько слов об экономических аспектах назначения антибиотиков. Новые антибиотики стоят очень дорого. Спору нет, бывают ситуации, когда их применение необходимо, однако я часто сталкиваюсь со случаями, когда эти препараты назначаются без надобности, при заболеваниях, которые можно легко вылечить дешевыми лекарствами «старого образца». Я согласен с тем, что не следует скупиться, если речь идет о лечении ребенка. Но траты должны быть разумными! (Можно, например, купить антибиотик в форме сиропа: сиропы довольно дороги, но дети их принимают охотно, да и дозировать сироп или капли очень удобно.) Однако это не означает, что при выборе препарата вовсе не следует принимать во внимание финансовую сторону дела. Не надо стесняться спросить у врача, во что обойдется вам выписанный рецепт, и если он вас не устраивает (слишком дорог или слишком дешев — это тоже нередко настораживает родителей), поищите вместе с врачом удовлетворяющую вас замену. Хочу еще раз повторить: десятки препаратов, имеющиеся сегодня в аптеках, почти всегда позволяют найти эффективное лекарство, соответствующее вашим возможностям.
ДИСБАКТЕРИОЗ — АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
Проблема сохранения здоровья, поиск путей снижения неблагоприятного воздействия на организм внешней среды являются в настоящее время крайне актуальными для нашей страны. По данным Российской академии наук, более 90% населения Российской Федерации в настоящее время имеют отклонения от физиологической нормы по тем или иным показателям, характеризующим здоровье человека.
Техногенные и экологические катастрофы, инфекционные болезни, экспансия некачественных лекарственных средств и продуктов питания, самоотравление алкоголем и наркотиками, психоэмоциональное напряжение и множество других вредоносных факторов истощают защитные силы организма, снижают его адаптационный потенциал.
Одной из важнейших систем поддержания и сохранения гомеостаза организма является его нормальная микрофлора, населяющая желудочно-кишечный тракт, мочеполовую систему, кожные покровы. Она оказывает многоплановое влияние на защитные, адаптационные и обменно-трофические механизмы организма, а ее нарушения под влиянием факторов эндогенной или экзогенной природы могут привести к утрате или искажению этих функций, которые влекут за собой проявления дисбактериоза — изменения качественного и количественного состава микрофлоры организма. Спектр клинических синдромов и патологических состояний, патогенез которых связан с дисбактериозом, в настоящее время очень широк и имеет тенденцию к увеличению.
Это возводит проблему разработки средств, повышающих адаптационный потенциал организма человека, в ранг первостепенных задач не только медицинского, но и экономического и политического характера.
В настоящее время одним из наиболее доступных и эффективных способов экологической реабилитации являются пробиотики — продукты, биологически активные добавки и фармацевтические препараты на основе полезных микроорганизмов, прежде всего, бифидобактерий и лактобацилл, оказывающих многофакторное регулирующее и стимулирующее воздействиие на организм человека, укрепляющих иммунную систему, защищающих от болезнетворных микробов. И не случайно, согласно данным российских маркетологов, занятых анализом объемов потребления фармпрепаратов и БАД, начиная с 2000 года только два сегмента этого рынка имеют тенденцию к росту — антиканцерогенные и пробиотические препараты. Им принадлежит ведущая роль в нормализации микробиоценоза кишечника, поддержании неспецифической резистентности организма, улучшении процессов всасывания и гидролиза жиров, белкового и минерального обмена, синтезе биологически активных веществ.
Представители нормофлоры синтезируют витамины группы В, никотиновую кислоту, биотин, витамин К. Большая роль принадлежит им в защите организма от токсических элементов экзогенного происхождения и эндогенных субстратов и метаболитов. Они принимают активное участие в метаболизации разнообразных веществ растительного, животного и микробного происхождения, рециркуляции желчных кислот, активно влияют на метаболизм билирубина и холестерина. Установлена их антиканцерогенная и антимутагенная активность. Известна способность инактивировать гистамин, играющий важную роль в проявлении аллергии.
Все эти положительные эффекты позволяют рассматривать представителей нормальной микрофлоры как эффективный биокорректор и основу для создания различных форм пробиотиков.
По материалам сайта www.disbakterioza.net
Дисбактериоз. Отвечает врач — гастроэнтеролог
Уважаемые зеленоградцы! На ваши вопросы о дисбактериозе отвечает заведующая филиалом № 1 ГБУЗ «Городской поликлиники № 201 ДЗМ», врач — гастроэнтеролог Елена Владимировна Маркина.
– Что такое дисбактериоз кишечника, отчего возникает это заболевание?
– Дисбактериоз не является самостоятельным заболеванием, это симптомокомплекс, который может сопутствовать многим заболеваниям (последствия лечения антибиотиками и иммунодепрессантами, воздействия вредных факторов внешней среды, неправильное питание, физические и эмоциональные стрессы), в том числе и заболеваниям желудочно-кишечного тракта. В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения. Не следует решать эти вопросы самостоятельно, занимаясь самолечением.
– Мне сказали, что нервно-психические симптомы могут быть связаны с нарушением функции печени, так ли это?
– Клинические проявления болезней печени определяются формой и тяжестью основного заболевания – холецистита, желчно-каменной болезни, механической желтухи, цирроза печени. Поскольку печень – один из главных органов по очистке организма, то нарушение ее функции неизбежно приводит к накоплению токсических продуктов обмена веществ. В биохимических анализах крови при большинстве печеночных заболеваний может обнаружиться повышение билирубина, холестерина, желчных кислот; нарушается обмен фибриногена, витаминов С и К, что ведет к патологии свертываемости крови и увеличению проницаемости сосудов.
В основе нервно-психических симптомов при поражении печени лежит интоксикация. Наиболее частым проявлением такой интоксикации является неврастения. Этот синдром может проявляться в двух вариантах – «раздражительном» (повышенная возбудимость с гневливостью и несдержанностью в эмоциях, неустойчивость эмоций и двигательная подвижность) и «заторможенном» (физическая и психическая утомляемость, обидчивость, мнительность).
Для неврастении также характерно нарушение сна в различных его вариантах – расстройство засыпания или пробуждения, поверхностный и тревожный сон. Больные обычно жалуются на головную боль, ощущение тяжести в голове, головокружение, а также на давление в области сердца, сердцебиение, расстройства в половой сфере (импотенция, нарушение менструального цикла).
Другим важным симптомом нервно-психического поражения при заболеваниях печени может быть появление кожного зуда, что обычно свойственно для застоя желчи в печени или желчном пузыре. Объясняются эти расстройства чувствительности токсическим действием билирубина. При хроническом печеночном заболевании с застоем желчи возможно постепенное расширение зон нарушения чувствительности, а также постепенное присоединение чувства онемения в мышцах, похолодания кончиков пальцев на кистях и стопах. Наряду с этим появляется изменение формы ногтей на руках и ногах – их утолщение и потемнение, что говорит о хронической печеночной интоксикации. Лечение нервно-психических проявлений при печеночной патологии напрямую связано с лечением основного заболевания – печени или желчных путей.
– Говорят, что после тридцати лет у большинства людей начинается потеря костной массы, что приводит к развитию остеопороза. Можно ли отсрочить развитие этого заболевания?
– Да, причем у женщин потеря костной массы происходит в четыре раза быстрее, чем у мужчин. Отсрочить развитие остеопороза возможно с помощью коррекции питания. Фрукты и овощи, продукты питания, богатые кальцием, магнием, калием и фосфатами, помогают поддержанию нормального pH крови, таким образом, из костей не будет вымываться кальций. А такие вещества, как флавоноиды, также содержащиеся во фруктах и овощах, способствуют формированию костной ткани.
– Не вредно ли для здоровья пытаться снижать вес с помощью голодания?
– Голодание при метаболическом синдроме (ожирении) противопоказано, так как является тяжелым стрессом, и при имеющихся обменных нарушениях может привести к острым сосудистым осложнениям, депрессии, срыву в «пищевой запой».
– У меня возникает аллергическая реакция на некоторые лекарственные препараты. С чем это может быть связано?
– Различные неблагоприятные реакции на лекарственные препараты становятся всё большей проблемой пациентов и лечащих врачей, что в современном обществе во многом связано с доступностью лекарственных средств, их разнообразием и обилием рекламных акций в средствах массовой информации. Лекарственная аллергия не является побочным эффектом лекарственного средства. Это реакция, обусловленная индивидуальной непереносимостью данного лекарственного вещества. Очень часто встречаются псевдоаллергические реакции на лекарственные препараты, которые по своим проявлениям схожи с истинной аллергией. Задуматься о псевдоаллергическом характере лекарственной непереносимости особенно стоит в том случае, если список «не воспринимаемых организмом» средств превышает 3-4 наименования и содержит препараты многих фармакологических групп. Псевдоаллергические реакции чаще всего связаны с заболеваниями системы пищеварения, эндокринной системы, с дисфункцией вегетативной нервной системы.
Дисбактериоз у новорожденных и грудных детей | Bifiform ru
В норме микрофлора кишечника состоит в среднем из 1 млн микробов на 1 мл содержимого. Нормальную микрофлору составляют 15-20 представителей анаэробных (бактерии, которые не могут жить в присутствии кислорода) и аэробных (способных существовать в присутствии кислорода) бактерий основных родов: бактероиды, бифидобактерии, лактобактерии и другие. Бифидобактерии относятся к доминирующей микрофлоре (Ig10-11)1,2
Здоровая микрофлора участвует в пищеварительных процессах организма, усиливает активность пищеварительных ферментов, действует на моторику желудочно-кишечного тракта, способствует выработке витаминов, гормонов, аминокислот и повышает иммунитет.
Также микрофлора выполняет детоксикационную и антиаллергенную функции. Защитные функции кишечника сводятся к созданию барьера для размножения болезнетворных бактерий и разрушения аллергенов. Нормальная микрофлора также обладает антиоксидантными, антимутагенными и противораковыми функциями1,2
Формирование микрофлоры
Формирование и функционирование иммунной системы происходит в 2 этапа. Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Второй этап — начинается после рождения человека и заселения микробами слизистых оболочек, в том числе и ЖКТ. Кишечник – представляет собой не только часть пищеварительной системы, но и является иммунным органом, до 80% иммунных клеток располагаются именно в кишечнике. Таким образом, формирование собственного кишечного иммунитета у грудного ребенка происходит с период ранней микробной колонизации и начинается сразу после рождения ребенка. Поэтому момент появления на свет является одним из ключевых этапов в формировании здорового ЖКТ3.
В становлении нормальной микрофлоры ребенка особенно важную роль играют бифидобактерии. Количество бифидобактерий в кишечнике ребенка, находящегося на грудном вскармливании, быстро нарастает в первые недели его жизни. В течение первого года жизни меняется видовой состав кишечной микрофлоры, что связано с различными периодами в жизни ребенка: периодом грудного вскармливания до введения прикорма, после введения прикорма, после появления в рационе твердой пищи, после прекращения грудного вскармливания. Беременность мамы, микрофлора родовых путей, течение родов, рождение раньше срока, наличие и продолжительность грудного вскармливания, раннее введение прикорма, частые простудные заболевания определяют становление этого процесса.
Нормальная микрофлора ребенка
Микрофлора обусловливает защиту слизистой кишечника от внедрения патогенных микроорганизмов, поддерживает и активирует иммунную систему, участвует в обмене белков, липидов, углеводов, выполняет антиаллергическую функцию, участвует в синтезе аминокислот, витаминов, гормонов, влияет на пищеварительные функции желудочно-кишечного тракта 1.
Пробиотический комплекс Бифиформ Бэби можно давать даже новорожденным с первых дней жизни. Его основное назначение – формирование сбалансированной микрофлоры кишечника, в том числе, при различных проблемах, связанных с кормлением. Особый комплекс бактерий может способствовать профилактикекишечных расстройств различного характера, включая колики 4.
Нормальную микрофлору кишечника составляют множество видов микроорганизмов. Одни из значимых и изученных на сегодняшний день:
Бифидобактерии
Представители рода Bifidobacterium являются наиболее важным компонентом нормальной микробиоты желудочно-кишечного тракта человека. Большая часть бифидобактерий находится в толстой кишке, составляя у детей более 90% всех микроорганизмов 5 Начинают доминировать в кишечной микрофлоре младенцев к концу первой недели жизни. Синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, витамины группы В: B1 — тиамин, B2 — рибофлавин, B3 — никотиновую кислоту, фолиевую кислоту, B6 — пиридоксин. Способствуют усилению процессов всасывания через стенки кишечника ионов кальция, железа, витамина D 6.
Лактобактерии
Уменьшают активность пероксидазы, оказывая антиоксидантный эффект, обладают противоопухолевой активностью, стимулируют продукцию иммуноглобулина А (IgA), подавляют рост патогенной микрофлоры и стимулируют рост лакто- и бифидофлоры, оказывают противовирусное действие 6
Нарушения микрофлоры
Дисбактериоз является нарушением качественного и количественного состава микрофлоры кишечника. Это означает, что патогенных микроорганизмов может стать значительно больше, чем полезных. Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Дисбактериоз у грудных детей может проявляться в виде изменения частоты, состава и цвета стула, нарушения процессов переваривания пищи, повышенного газообразования, беспокойного поведения ребенка, плача, повышенной раздражительности, плохого аппетита и сна, ухудшение состояния кожного покрова и даже аллергических реакций 3.
Причины возникновения дисбактериоза у новорожденных и грудничков
В группе риска по нарушению баланса микрофлоры находятся дети, мамы которых имели различные осложнения в период беременности и родах, а также дети, находящиеся на искусственном вскармливании, недоношенные. Простудные заболевания, прием некоторых лекарственных препаратов (лечение антибиотиками) могут приводить к нарушениям баланса микрофлоры кишечника. Внешними проявлениями этого состояния могут быть нарушения сна, плаксивость, нарушение аппетита, аллергические высыпания, колики и постоянное бурчание в животе после кормления 1,3.
Сдача анализов
При возникновении симптомов недомогания у Вашего ребенка, обязательно проконсультируйтесь с врачом. Для постановки диагноза дисбактериоза врач может порекомендовать сдать анализ кала на дисбактериоз.
Как правильно собрать кал для анализа на дисбактериоз:
Кал собирается в стерильную баночку, предварительно прокипяченную вместе с крышкой в течение 20 минут. Посуда для анализа, на основании результатов которого будет проводиться лечение дисбактериоза у грудных детей, должна храниться в холодильнике не более суток. Собранный в стерильную емкость анализ доставляется в лабораторию в течение 2 часов (не позднее). Результаты подготавливаются через 7-10 дней.
Для получения информации о том, где можно приобрести Бифиформ Бэби , посетите раздел «Где купить».
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
- Донских Е.Е. Микрофлора — Дисбактериоз у детей http://lekmed.ru/info/literatyra/disbakterioz-y-detei.html
- Корниенко Е.А., Мазанкова Л.Н., Горелов А.В. Применение пробиотиков в педиатрии: анализ лечебного и профилактического действия с позиций доказательной медицины. Лечащий врач 2015.
- И.А. Беляева. Пробиотические добавки для коррекции младенческих колик: перспективы использоавния.
- Беляева И.А., Митиш М.Д., Катосова Л.К. Эффективность использования пробиотиков у недоношенных детей. РМЖ 2009.
- Рыбальченко О.В., Бондаренко В.М. Оценка микробиоты и пробиотических штаммов с позиций новых научных технологий. Фарматека №11, 2016
- Бельмер С.В., Малкоч А.В. Кишечная микрофлора и значение пребиотиков для ее функционирования. Лечащий врач 2006, 4
PP-BIB-RUS-0082
Пища для здоровья кишечника — ОГАУЗ ‘Поликлиника №10’
Переваривание пищи не заканчивается в желудке, оно продолжается в кишечнике, который тоже нуждается в подходящей пище. Именно об этом мы и поговорим в этой статье.
Кишечник — канал, по которому проходит пища. Когда пища продвигается по тонкой кишке, усваивается большая часть содержащихся в ней основных питательных веществ.
Два наиболее распространённых нарушения работы кишечника связаны со скоростью, с которой пища проходит по кишечнику:
- Слишком быстрое продвижение пищи приводит к диарее, влекущей за собой обезвоживание, потерю минеральных солей и других питательных веществ, которые не впитываются организмом.
- Слишком медленное продвижение приводит к запору. Фекалии разлагаются и выделяют токсичные вещества. Они всасываются в кровь, что приводит к отравлению организма. Поэтому запор связан не только с дискомфортом.
Запор
Запор — медленное, затруднённое прохождение содержимого кишечника с редкими испражнениями и чрезмерно твёрдыми фекалиями. В большинстве случаев запор имеет функциональный характер и является следствием пониженного тонуса или слабости мышц толстой кишки. Органические причины наблюдаются в исключительных случаях. Наиболее серьёзные из них — рак толстой или прямой кишки. Нормальной считается частота испражнений от двух раз в день до одного раза в два дня. Если испражнения происходят реже, диагностируется запор.
Факторы, которые ускоряют или предрасполагают к атоническому функциональному запору, таковы:
- Неправильная диета с недостаточным потреблением воды и/или клетчатки. Как результат — внутренняя оболочка кишечника не стимулируется и ослабевает.
- Нерегулярные привычки кишечника. Если из-за нервного напряжения или в спешке человек игнорирует биологический позыв к дефекации, можно утратить рефлекс кишечника.
- Злоупотребление слабительными. Приводит к непрерывному воспалению слизистой кишечника, что влечёт за собой её невосприимчивость к нормальным стимулам.
- Недостаток физических упражнений, необходимых для стимуляции рефлекса к испражнению.
Диета
В большинстве случаев функциональный атонический запор устраняется, как только устраняются эти четыре причины. Правильная диета необходима для решения этой проблемы.
|
Увеличьте |
Сократите или исключите |
|
Воду |
Промышленную выпечку |
|
Клетчатку |
Белый хлеб |
|
Цельнозерновой хлеб |
Моллюсков и ракообразных |
|
Пшеничные отруби |
Шоколад |
|
Фрукты |
Мясо |
|
Овощи |
Рыбу |
|
Бобовые |
|
|
Чернослив |
|
|
Инжир |
|
|
Мед |
|
Целиакия
Болезнь, возникающая вследствие непереносимости глютена — белка, содержащегося в пшенице, ячмене, ржи и в меньшей степени в овсе. Это заболевание, как правило, имеет генетическое происхождение. Однако существуют факторы, ускоряющие развитие целиакии, например раннее введение коровьего молока или зерновых в прикорм ребёнка. Первые проявления обычно видны в период грудного вскармливания или младенчества, хотя могут появиться и во взрослом возрасте. Диагноз ставится по результатам биопсии кишечника. Наиболее распространённые симптомы таковы:
- Диарея. Кал при целиакии пенистый по причине содержащихся в нём жиров, которые не усваиваются организмом.
- Вздутие живота и ощущение дискомфорта, метеоризм.
- Усталость, депрессия, общий дискомфорт.
- Язвы во рту.
Диета
Все эти симптомы пропадают, если устранить из рациона глютен. Непереносимость глютена в стадиях, предшествующих целиакии, встречается гораздо чаще, чем принято считать.
|
Увеличьте |
Сократите или исключите |
|
Рис |
Глютен |
|
Кукурузу |
Мучное |
|
Бобовые |
Молочные продукты |
|
Тапиоку |
Жиры |
|
Зеленые листовые овощи |
Колбасу |
|
Фрукты |
Пиво |
|
Гречку |
|
|
Просо |
|
|
Витамины, добавки |
|
Раздражённый кишечник
Это функциональный синдром, характеризующийся недомоганием, вздутием живота и внезапным чередованием случаев запора и диареи. Диагноз всегда ставится методом исключения патологий кишечника.
В дополнение к диетическим рекомендациям важно иметь в виду следующие факторы, которые могут вызвать синдром раздражённого кишечника:
- Приём раздражающих кишечник лекарств, таких как железосодержащие препараты или антибиотики.
- Аллергия или непереносимость определённых продуктов, таких как лактоза или глютен.
- Стресс, тревожность или неврологический дисбаланс.
|
Увеличьте |
Сократите или исключите |
|
Овес |
Пшеничный хлеб |
|
Фрукты |
Бобовые |
|
Кукурузу |
Молоко |
|
Хурму |
Твердые сыры |
|
Папайю |
Глютен |
|
Чернику |
Мясо |
|
Клетчатку |
|
|
Йогурт |
|
|
Воду |
|
Диарея
Диарея — это патология, характеризующаяся чрезмерно частым жидким или водянистым стулом. Диарея приводит к потере воды и минеральных солей, которые следует возместить. Дети и пожилые люди наиболее чувствительны к дисбалансу жидкости в организме. В каждом случае следует установить причины диареи. Наиболее частые причины — желудочные инфекции, пищевые токсины, аллергия на продукты или непереносимость определённых продуктов.
Диета
В случае сильной диареи желательно употреблять в течение 24–48 часов только воду и некоторые из жидкостей:
- Овощной бульон (богатый минеральными солями).
- Регидратирующий раствор (его можно приготовить, добавив чайную ложку соли и четыре столовые ложки сахара в литр воды).
- Разбавленный лимонный сок.
- Чаи, заваренные на вяжущих целебных травах.
- Детская смесь и/или соевое молоко для грудных детей.
- В дополнение к специфическому лечению пациенту по прошествии обострения можно давать мягко вяжущие продукты и продукты, снимающие воспаление слизистой желудка.
|
Увеличьте |
Сократите или исключите |
|
Соевое молоко |
Молоко |
|
Миндальное молоко |
Яйца |
|
Яблоки и айву |
Курицу |
|
Гранат |
Моллюсков и ракообразных |
|
Банан |
Фруктовые соки |
|
Морковь |
|
|
Папайю |
|
|
Рис |
|
|
Йогурт |
|
Колит
Воспаление толстой кишки — наиболее важного участка кишечника. Признаком колита является неустойчивый стул, который может содержать слизь или кровь. Обычно колит — результат инфекции, но он может быть вызван аллергией или непереносимостью ряда продуктов. Антибиотики или слабительные средства также могут сыграть роль в его развитии.
Диета
Мягкая диета для толстой кишки может значительно способствовать лечению. Поэтому те же продукты, которые используются в случае диареи, рекомендованы при колите. Пшеничные отруби при употреблении их в качестве слабительного в чрезмерном количестве могут вызвать колит у склонных к запорам людей.
|
Увеличьте |
Сократите или исключите |
|
Продукты, рекомендованные при диарее |
Пшеничные отруби |
|
Овощи |
Рафинированную выпечку |
|
Цукини |
Молоко |
|
Витамины, микроэлементы |
Кофе |
|
|
Острые специи |
Язвенный колит
Сложная форма колита, которая может принять хронический характер и не поддаваться лечению.
Рафинированная пища, богатая мясом и насыщенными жирами, бедная фруктами, овощами и зерновыми, является фактором, повышающим риск заболевания язвенным колитом.
Явные признаки язвенного колита — диарея, боли в животе, кровяной стул, усталость, потеря веса. Из язвенного колита может развиться рак толстой кишки.
Диета
Хотя не существует специфического лечения, течение этого заболевания может облегчить диета, защищающая толстую кишку.
|
Увеличьте |
Сократите или исключите |
|
Продукты, рекомендованные при диарее |
Продукты, нежелательные при колите |
|
Капусту |
Гамбургеры |
|
Масло примулы |
Мясо |
|
Рыбий жир |
|
Болезнь Крона
Воспаление желудочно-кишечного тракта, которое может поражать как тонкую, так и толстую кишку.
Причины заболевания недостаточно изучены. Однако болезнь Крона связана с распространённым в западном обществе рационом, бедным клетчаткой и овощами, но богатым рафинированной и обработанной пищей. Это заболевание чаще поражает любителей фастфуда.
|
Увеличьте |
Сократите или исключите |
|
Продукты, рекомендованные при диарее |
Сахар |
|
Клетчатку |
Гамбургеры |
|
Растительное масло |
|
|
Рыбий жир |
|
|
Железо, фолиевая кислота |
|
Геморрой
Заболевание, связанное с воспалением и расширением геморроидальных вен в анатомически чувствительной зоне. Запор требует определённых усилий во время дефекации, они вызывают расширение вен ануса и приводят к геморрою. Если вены расширились, они не уменьшатся сами по себе. Правильная диета и гигиена могут предотвратить воспаление этих тканей и формирование тромбов внутри них (геморроидальный тромбоз). Тромбы могут быть очень болезненными и требовать хирургического лечения.
|
Увеличьте |
Сократите или исключите |
|
Продукты, рекомендованные при запоре |
Продукты, нежелательные при запоре |
|
Клубнику |
Острые специи |
|
Чернику |
Белый сахар |
|
Бруснику |
|
Метеоризм
Метеоризм — это избыточное скопление газов в кишечнике, вызывающее спазмы и вздутие живота. Скапливающийся в кишечнике газ имеет два источника: воздух, заглатываемый во время еды, и газ, производимый бактериями кишечной флоры.
Избыток газа имеет следующие причины:
- Дисбактериоз, или нарушение микрофлоры кишечника, которое можно корректировать простыми диетическими средствами.
- Избыточное употребление продуктов растительного происхождения, богатых клетчаткой.
Метеоризм может раздражать в большей или меньшей степени, но он не опасен. Собирающиеся газы, как правило, не имеют запаха в отличие от газов, которые возникают в результате внутрикишечного гниения, вызванного употреблением мяса и животного белка. Ограничивая потребление богатых клетчаткой продуктов и придерживаясь простых кулинарных рецептов, можно устранить метеоризм. Заглатывание воздуха во время стресса или гнева, особенно во время еды.
Диета В дополнение к нижеперечисленным продуктам рекомендуется активированный уголь, который эффективно борется с метеоризмом.
|
Увеличьте |
Сократите или исключите |
|
Ростки |
Клетчатку |
|
Ароматические травы |
Бобовые |
|
Йогурт |
Овощи |
|
Хурму |
Хлеб |
|
|
Молоко |
|
|
Пасту |
Дивертикулёз Заболевание ещё называют дивертикулярной болезнью толстой кишки. Оно характеризуется образованием большого количества крошечных кист, или дивертикулов, на стенках желудочно-кишечного тракта, в особенности в толстой кишке.
Факторы, способствующие образованию дивертикулов:
- Ослабленные стенки кишечника.
- Повышенное давление внутри кишечника. Маленькие и твёрдые фекалии заставляют мышцы кишечника интенсивно сокращаться, чтобы продвигать их. В результате повышается давление на стенки кишечника. Когда дивертикулы воспаляются из-за каловых масс, не выведенных из организма, это вызывает серьёзное заболевание — дивертикулит. Это осложнение дивертикулёза следует лечить в больнице при соблюдении строгой диеты и иногда путём хирургического вмешательства.
Диета Перечисленные продукты снижают риск образования новых дивертикулов и не дают расти тем, что уже имеются. Однако эти продукты не в силах заставить исчезнуть уже сформировавшиеся дивертикулы.
|
Увеличьте |
Сократите или исключите |
|
Воду |
Рафинированную выпечку |
|
Клетчатку |
Жиры |
|
Цельнозерновые продукты |
Мясо |
|
Фрукты |
|
|
Овощи |
|
|
Бобовые |
|
|
|
|
В конце остаётся пожелать вам, чтобы об этих болезнях вы знали только из статей. Питайтесь правильно, питайтесь с удовольствием и будьте здоровы.
По материалам книги «Здоровая пища»
Дисбактериоз кишечника у детей с синдромом короткой кишки связан с нарушением исхода | Microbiome
Предпосылки
Детская кишечная недостаточность (IF) определяется как неспособность желудочно-кишечного тракта поддерживать адекватный рост, гидратацию и гомеостаз электролитов у детей без парентерального питания (PN). Синдром короткой кишки (SBS) является наиболее частой причиной детской IF. Состояние вызвано массивной резекцией тонкой кишки из-за некротического энтероколита (НЭК) или заворота, а также врожденных пороков развития, таких как гастрошизис и атрезия тощей кишки.СБС новорожденных — заболевание с высокой заболеваемостью и смертностью [1]. Медицинское руководство SBS направлено на обеспечение полного энтерального / перорального кормления и отлучение от PN.
Кишечная микробиота, по-видимому, является основным фактором в определении успешного клинического исхода SBS, определяемого как независимость от лечения PN и кишечной адаптации. Изменения в микробиоте могут привести к серьезным осложнениям, таким как избыточный бактериальный рост в тонкой кишке (SBBO) и воспаление слизистой оболочки кишечника, что может предотвратить отлучение от ПП за счет нарушения абсорбционных функций кишечника [2,3].При SBBO у детей рекомендовано длительное лечение люминальными / пероральными антибиотиками [4,5]. Большинство случаев SBS возникает у новорожденных в период, когда стерильный кишечник обычно заселяется бактериями, достигая микробного профиля, характерного для желудочно-кишечного тракта взрослых, примерно в возрасте от 2 до 4 лет [6]. Нарушение сбалансированного микробного сообщества кишечника, то есть дисбактериоз, с повышенным относительным содержанием факультативных анаэробных Enterobacteriaceae в толстой кишке, наблюдается при воспалительном заболевании кишечника (ВЗК) на моделях мышей, у людей с болезнью Крона и у людей. НЭК у недоношенных детей [7,8].
На сегодняшний день нет сообщений о картировании кишечной микробиоты у детей с SBS. Здесь мы представляем первый отчет о микробном профиле у детей с SBS с использованием секвенирования гена 16S рРНК на платформе Illumina MiSeq.
Методы
Пациенты
Это исследование было одобрено региональным комитетом по этике медицинских исследований в Упсале (Dnr2012 / 002). Информированное письменное согласие на сбор образцов и последующие анализы было получено от родителей.Характеристики исследуемой группы и соответствующих здоровых братьев и сестер представлены в таблице 1. В исследование включены 11 детей в возрасте от 1,5 до 7 лет с диагнозом ИФ / СБС в неонатальном периоде, из которых двое относятся к группе тройняшек (2А и 3А) (таблица 1). Все дети, кроме одного, родились преждевременно. Ребенку 1А, 8А и 13А была проведена процедура удлинения кишечника с серийной поперечной энтеропластикой (STEP) [9]. Пятеро детей не были отлучены от ПП на момент исследования. Семь здоровых братьев и сестер служили контролем.Дети, получавшие ПП, получали пероральный и / или энтеральный прием безлактозной гидролизованной белковой смеси и соответствующий возрасту потребление твердой пищи со снижением содержания дисахаридов в соответствии с таблицей 1.
Таблица 1
Характеристики исследуемой группы и соответствующих здоровых братьев и сестер
Сбор данных и статистический анализ
Образцы фекалий собирали и хранили при -80 ° C до анализа.ДНК экстрагировали из каждого образца фекалий с помощью набора для выделения ультрачистой фекальной ДНК (MoBio, Naxo Ltd, Тарту, Эстония) в соответствии с инструкциями производителя.
Библиотеки секвенирования
получали путем амплификации области V3-V4 гена 16S рРНК с использованием праймеров 341f-805r, описанных Hugerth et al . [10]. После начальной амплификации была проведена вторая ПЦР для присоединения адаптеров Illumina, а также штрих-кодов, которые позволяют мультиплексировать. Образцы были секвенированы с использованием IlluminaMiSeq, что дало в общей сложности 10 136 440 считываний 2 × 300 пар оснований со средним значением 307 165 считываний на образец.Последовательности праймеров были обрезаны, а считывания парных концов, полученные с помощью инструмента для секвенирования, были объединены с использованием SeqPrep версии 1.1 (https://github.com/jstjohn/SeqPrep) с параметрами по умолчанию и затем обработаны с помощью конвейера QIIME 1.8.0 ( Количественное понимание микробной экологии) [11]. Объединенные чтения были случайным образом разбиты на подвыборку до равной глубины 151 610 считываний на выборку, что было минимальным числом считываний среди выборок. Используя алгоритм UCLUST [12], встроенный в конвейер QIIME, последовательности были сгруппированы с 97% идентичностью по справочной базе данных Greengenes, что дало 4216 OTU (операционных таксономических единиц) [11].Для каждого образца; количество не-одноэлементных OTU, а также наиболее доминирующих OTU с соответствующим описанием представлено в дополнительных данных (Дополнительный файл 1). Индексы разнообразия Шеннона были рассчитаны для детей с SBS, получавших и не принимавших PN, и проверены на значимость с помощью критерия суммы рангов Вилкоксона. Используя конвейер QIIME, были получены невзвешенные расстояния UniFrac, которые использовались для исследования бета-разнообразия путем построения координат PCA. Подробная информация о праймерах гена 16S рРНК, условиях амплификации и штрих-кодах образцов представлена в дополнительных данных (Дополнительный файл 2).
Результаты
Рисунок 1 показывает, что индекс разнообразия Шеннона значительно снижен у детей с SBS, все еще получающих PN, по сравнению с детьми, отлученными от PN. Ни у кого из детей, получавших ПП, не осталось ICV.
Рисунок 1
Индекс разнообразия Шеннона у детей с SBS, все еще получающих PN, по сравнению с детьми, отлученными от PN.
У детей, все еще получающих PN, четверо из пяти (1A, 3A, 8A и 9A) были обследованы на предмет нескольких эпизодов подозрения на SBBO, также во время взятия пробы кала (Таблица 1).Их лечили пероральным метронидазолом, триметоприм-сульфаметоксазолом, гентамицином или амоксициллин-клавулановой кислотой. У этих пациентов Enterobacteriacae были наиболее многочисленным таксономическим семейством и полностью доминировали в микробном сообществе этих детей (рис. 2). У оставшегося пациента в этой группе (12A), все еще принимавшего PN и с пониженным индексом разнообразия Шеннона, было обнаружено относительное преобладание Lactobacillaceae , за которым следовали Enterobacteriacae. В целом высокая относительная численность Enterobacteriacae была связана с SBS у 6 из 11 пациентов (1A, 3A, 8A, 9A, 11A и 12A). У оставшихся пяти пациентов с SBS, все без PN (2A, 4A, 13A, 16A и 18A), был более разнообразный состав микробиоты и более равномерное распределение таксономических семейств. Однако ни один из детей SBS, кроме одного (2А), не достиг показателей разнообразия Шеннона на том же уровне, что и контрольная группа (таблица 1). У одного из детей, все еще получающих PN (1A), верхняя и нижняя эндоскопия с биопсией выявила макроскопическое и гистопатологическое острое воспаление в желудке, двенадцатиперстной кишке, тонкой кишке и проксимальном отделе толстой кишки.У ребенка 3А, также получавшего ПП, верхняя эндоскопия с биопсией показала атрофию ворсинок тонкой кишки.
Рисунок 2
Микробные сообщества у детей с SBS, получавших PN (1A, 3A, 8A, 9A, 12A), детей с SBS, отлученных от PN (2A, 4A, 11A, 13A, 16A, 18A), и братьев и сестер (2C1, 2C2, 11C1, 11C2, 12C, 13C1, 13C2). На рисунке показана относительная численность 19 наиболее распространенных таксономических семейств, на которую приходится не менее 84% численности во всех выборках.
На рисунке 3 представлены индексы разнообразия Шеннона, а на рисунке 4 — невзвешенные расстояния UniFrac у детей с SBS на PN (1A, 3A, 8A, 9A, 12A), дети SBS, отлученные от PN (2A, 4A, 11A, 13A). , 16A, 18A) и братьев и сестер (2C1, 2C2, 11C1, 11C2, 12C, 13C1, 13C2).
Рисунок 3
Индекс разнообразия Шеннона у детей с SBS, получавших PN (1A, 3A, 8A, 9A, 12A), детей с SBS, отлученных от PN (2A, 4A, 11A, 13A, 16A, 18A) и братьев и сестер (2C1 , 2C2, 11C1, 11C2, 12C, 13C1, 13C2).
Рис. 4
График PCoA, описывающий невзвешенное расстояние UniFrac между образцами. Попарные расстояния между всеми образцами проецируются на двумерное пространство, где ось PC1 описывает наивысшую степень вариации. Таким образом, считается, что образцы, которые сгруппированы близко друг к другу, имеют большую долю филогенетического дерева по сравнению с образцами, которые более разделены.
У нас была уникальная возможность изучить тройню, представляющую все три группы. Ребенок 2А и ребенок 3А были тройняшками мужского пола, рожденными на 23 неделе беременности. Оба мальчика в неонатальном периоде перенесли НЭК, что привело к резекции тонкой кишки (таблица 1). Третий тройняшек (2С2) остался здоровым. У ребенка 2А было резецировано только 2 см тонкой кишки, однако после обширной НЭК у него развился ИФ, и он стал зависимым от ПП. Во время лечения ПН у него не было признаков СБО. Его приучили к полноценному пероральному вскармливанию и без антибиотиков за 3 месяца до забора фекалий.Его кишечное бактериальное разнообразие было таким же, как у его здорового брата (SDI 4, 67 и 4, 97, соответственно).
Ребенок 12A лечился антибиотиками только в течение первых 2 недель постнатального периода, у него не было признаков SBBO, и отлучение от PN продвигалось, но медленно. Ее фекальное бактериальное разнообразие показало, что Lactobacillacae являются наиболее относительно многочисленным таксономическим семейством в соответствии с нашими предыдущими результатами (Рисунок 2) [13]. Мы смогли обнаружить Clostridium difficile у двух из десяти пациентов с SBS (пациенты 2A и 11A) и в очень низкой относительной численности (данные не показаны).
Выводы
Тенденция SBBO и воспаления кишечника к задержке или предотвращению отлучения от PN у этих детей с SBS, по-видимому, связана с микробным дисбиозом в кишечном тракте. Этот вывод согласуется с предыдущим исследованием, показывающим, что введение ПП было независимо связано с SBBO [14]. Влияние PN на изменение профиля из-за голодания микробиома маловероятно, поскольку нарушение всасывания при пероральном / энтеральном питании является основной проблемой при SBS.В целом наблюдаемые изменения микробиоты у детей с SBS, скорее всего, являются как причиной, так и следствием болезненного статуса ребенка. Ограничением исследования является небольшая исследовательская группа, и смешанные факторы, которые могут повлиять на результаты, — это возраст, длина кишечника и лечение антибиотиками. Тем не менее, когорта в настоящем исследовании представляет детей с SBS в клинической практике.
В нашем центре мы лечим SBBO пероральными антибиотиками в соответствии с рекомендациями других центров [4-6].Однако наиболее вероятно, что антибиотики в дальнейшем будут способствовать развитию дисбактериоза у этих детей. У детей с SBS нормальная колонизация нарушается из-за раннего и частого использования антибиотиков, а уменьшение бактериального разнообразия позволяет потенциальным патогенным бактериям разрастаться. Антибиотики были предложены для снижения устойчивости к колонизации против Enterobacteriacae , таких как Escherichia coli и Salmonella enterica , за счет повышения воспалительного тонуса слизистой оболочки кишечника [15].Чаще всего пробиотики используются для изменения кишечной микробиоты при SBS; однако существуют противоречивые данные и сообщения о пробиотической сепсисе [16].
Общее снижение бактериального разнообразия у наших детей с SBS согласуется с дисбактериозом кишечника у пациентов с IBD, младенцев с NEC, а также было описано в модели SBS у поросят [7,8,17,18]. Кроме того, у детей с рецидивирующей диареей, связанной с C. difficile-, наблюдается снижение фекального разнообразия с уменьшением на Bacteriodetes и Firmicutes [19].У этих детей успешность трансплантации фекальной микробиоты (FMT) превышает 90%. Такое лечение также успешно использовалось в качестве дополнения к лечению ВЗК [19,20]. Следовательно, FMT может оказаться альтернативой лечения в тщательно отобранных случаях SBS с дисбактериозом. Однако, поскольку дети с SBS часто уязвимы из-за своего первоначального состояния здоровья, необходимо учитывать трудности и риски FMT. Хотя случаи серьезных побочных эффектов редки, одним из таких рисков является заражение донором, когда бессимптомные микроорганизмы, не вызывающие проблем у здорового донора, могут вызвать реакцию у реципиента.Кроме того, массовое появление новой микробиоты может также вызвать аутоиммунное заболевание, а также развитие бактерий и септический шок. Также следует проявлять особую осторожность при FMT, если у пациента есть какие-либо признаки иммунодефицита [21].
Это первый отчет, описывающий микробный профиль кишечника у детей с SBS с использованием секвенирования следующего поколения. Мы наблюдали выраженный микробный дисбактериоз у детей с SBS, все еще получающих PN, по сравнению с детьми, отлученными от PN с повышенным относительным количеством протеобактерий, большинство из которых длительное время лечились антибиотиками.Наши результаты показывают, что дисбактериоз кишечника у детей с SBS связан с ухудшением исхода с длительной зависимостью от PN. В будущих исследованиях необходимо найти новые стратегии лечения дисбактериоза кишечника у этих детей.
Желудочно-кишечная микробиота и некоторые детские болезни: обзор
Бактериальная колонизация определяется сразу после рождения, через прямой контакт с материнской микробиотой, и на нее можно повлиять во время лактации. Появляются доказательства, указывающие на то, что количественные и качественные изменения микробиоты кишечника способствуют изменениям в активации иммунной системы слизистой оболочки, что приводит к внутри- или внекишечным заболеваниям.Баланс между патогенной и полезной микробиотой в детстве и подростковом возрасте важен для здоровья желудочно-кишечного тракта, включая защиту от патогенов, ингибирование патогенов, переработку питательных веществ (синтез витамина K), стимуляцию ангиогенеза и регулирование накопления жира в организме хозяина. Пробиотики могут способствовать преднамеренной модуляции кишечной микробиоты в пользу здоровья хозяина. Эта статья представляет собой обзор модуляции кишечной микробиоты при профилактике и адъювантном лечении детских желудочно-кишечных заболеваний.
1. Состав и функция желудочно-кишечной микробиоты
Микробиота желудочно-кишечного тракта человека обитает в сложной экосистеме [1]. Обычно он попадает к новорожденному после рождения и подвержен влиянию родов и загрязнению окружающей среды [2]. При рождении желудочно-кишечный тракт незрелый, и их развитие продолжается в течение первых лет жизни [3]. В этот период на колонизацию бактерий в желудочно-кишечном тракте также могут влиять другие факторы, такие как тип кормления грудью (грудное вскармливание или «искусственное вскармливание») и, возможно, генетические характеристики (генотип) [3–5].
Факультативные анаэробные бактерии, такие как энтеробактерии, энтерококки и стрептококки, доминируют на первой стадии колонизации в течение недели после рождения. После этой ранней стадии эти пропорции меняются, и количество строго анаэробных бактерий, таких как Bifidobacteria, Bacteroides и Clostridia, начинает превышать количество факультативных бактерий-анаэробов [6]. Комменсальные бактерии играют важную роль в регуляции гомеостаза кишечника [7].
Адекватный процесс микробной колонизации кишечника способствует физиологическому развитию кишечника и созреванию иммунной системы, тем самым определяя риск развития заболевания в более позднем возрасте [6].Согласно Roberfroid et al. [1], несколько факторов могут влиять на количество и разнообразие бактерий, присутствующих в различных областях желудочно-кишечного тракта. Основными факторами, способствующими возникновению разнообразия бактерий, являются pH, перистальтика, доступность питательных веществ, окислительно-восстановительный потенциал в тканях, возраст хозяина, здоровье хозяина, бактериальная адгезия, взаимодействие бактерий, выделения слизи, содержащие иммуноглобулин, антагонизм бактерий и время прохождения [1 ].
Бактериальная нагрузка в желудке у здоровых людей низкая.Преобладающие выделенные организмы включают лактобациллы, стрептококки и дрожжи [8, 9]. В двенадцатиперстной кишке (тонком кишечнике) среда кислая (pH от 4 до 5), преобладают лактобациллы и стрептококки. У здоровых людей количество бактерий в двенадцатиперстной кишке выше, чем в желудке, примерно 10 2 –10 4 колониеобразующих единиц по сравнению с 10 2 КОЕ. Микробиота сильно изменяется от двенадцатиперстной кишки к подвздошной кишке по мере уменьшения скорости внутрипросветного содержимого и увеличения pH, увеличивая бактериальную нагрузку до 10 6 –10 8 КОЕ.Популяция микробиоты толстой кишки достигает 10 10 –10 12 КОЕ [8]; у взрослого человека может быть около 10 14 КОЕ, что превышает количество эукариотических клеток в организме человека [10].
В этом контексте есть два фактора, связанных с наибольшей физиологической колонизацией толстого кишечника: нейтральный pH и более длительное время прохождения. Исследования показали, что среднее время прохождения через толстую кишку у педиатрических пациентов без нарушений моторики составляет примерно 30 часов [11, 12], что выше, чем в тонком кишечнике, где транзит варьируется от 2 до 4 часов [1].
Основная функция кишечной микробиоты заключается в ограничении роста потенциальных патогенных микроорганизмов, предотвращении инвазии и внедрения этих микроорганизмов в экосистему. Кроме того, микробиота конкурирует за пространство и обладает способностью выделять антимикробные вещества (бактериоцины), которые препятствуют размножению других бактерий. В этом процессе микробиота остается стабильной, метаболизируя вычитаемые и неперевариваемые продукты [1]. Ферментация неперевариваемых углеводов производит короткоцепочечные жирные кислоты (SCFA: ацетат, пропионат и бутират), которые играют важную роль в модуляции различных процессов в желудочно-кишечном тракте, включая электролиты (Ca, Mg и Fe) и воду. абсорбция, пролиферация и дифференцировка клеток, секреция гормонов и активация иммунной системы [8, 13].Кроме того, SCFAs используются организмом в качестве источников энергии, включая колоноциты и небольшую часть печени и мышц [13]. Метаболические функции также приписываются микробиоте, например, производство витаминов (K, B12, биотин, фолиевая кислота и пантотеновая кислота) и синтез аминокислот из аммиака или мочевины [14].
В настоящее время ясно, что индукция и регуляция иммунной системы зависит от микробиоты. Исследования показывают, что на способность лейкоцитов мигрировать в очаг воспаления и уничтожать микробные патогены также могут влиять SCFAs.По данным Vinolo et al. [15] короткоцепочечные жирные кислоты могут регулировать функцию лейкоцитов посредством цитокинов (TNF- α , IL-2, IL-6 и IL-10), продукции эйкозаноидов и хемокинов.
В более широком контексте энтероциты играют важную роль в логистике иммунной системы, поскольку их положение в контакте с просветом кишечника имеет решающее значение для начального распознавания чужеродных молекул и генерации сигналов, которые передаются иммунокомпетентным клеткам. Участие энтероцитов в защитном механизме не ограничивается только врожденной защитой.Они могут действовать как антигенпрезентирующие клетки, вызывая приобретенный иммунный ответ, опосредованный Т-лимфоцитами [16, 17]. После активации антигенпрезентирующими клетками размножение клональных Т-клеток приводит к образованию хелперных лимфоцитов (Th-клеток) различных фенотипов: Th2, Th3 или регуляторных Т-клеток. Регуляторные Т-клетки играют ключевую роль в иммунной толерантности, поскольку они секретируют регуляторные цитокины, противовоспалительные элементы, такие как IL-10 и TGF- β , в ответ на антигены, которые распознаются как непатогены.Этот механизм объясняет, как ведет себя иммунотолерантность при воздействии безвредной антигенной нагрузки, такой как пищевые продукты. С другой стороны, нарушение активности этих клеток способствует развитию заболеваний из-за нарушения иммунной регуляции [17].
В этой статье был определен приоритет основных внутри- и внекишечных детских болезней, которые связаны с микробиотой желудочно-кишечного тракта. Среди желудочно-кишечных заболеваний были включены Helicobacter pylori , некротический энтероколит, воспалительные заболевания кишечника, целиакия, запоры и диарея.К внекишечным заболеваниям относились ожирение и аллергические реакции, которые в настоящее время широко исследуются и обсуждаются.
2. Желудочно-кишечная микробиота и болезни
2.1.
Helicobacter pylori Инфекция
Хотя бактериальная нагрузка в желудке низкая, особое внимание было уделено видам Helicobacter из-за их связи с различными желудочными заболеваниями [1]. Helicobacter pylori — это грамотрицательные спиральные бактерии, вызывающие гастрит, язвы желудка и двенадцатиперстной кишки, рак желудка и лимфому лимфоидной ткани, ассоциированную со слизистой оболочкой [18], представляющую собой одну из самых распространенных бактериальных инфекций в мире [19].У педиатрических пациентов эта инфекция связана с болями в животе в детском возрасте, гастроэзофагеальной рефлюксной болезнью и задержкой роста [19]. Недавние исследования показали, что у взрослых он увеличивает риск ишемической болезни сердца [20]. В целом более 50% населения мира инфицировано Helicobacter pylori , 30–40% в развитых странах и более 80% в развивающихся странах [21]. Среди лиц моложе 20 лет распространенность инфекции составляет около 80% в развивающихся странах, что выше, чем в развитых странах.Различия в распространенности связаны с социально-демографическими факторами, такими как низкий социально-экономический статус, семья с низким доходом и плохие условия жизни [18].
2.2. Некротический энтероколит
Некротический энтероколит (НЭК) — это наиболее частая желудочно-кишечная неотложная медицинская помощь, которая возникает у новорожденных. Он представляет собой серьезную клиническую проблему у младенцев и поражает до 10% младенцев с массой тела менее 1500 г, особенно новорожденных с чрезвычайно низкой массой тела при рождении (<1000 г) и сроком гестации менее 28 недель [22].Распространенность смертности колеблется в пределах 20–30%. Распространенность заболеваемости также высока, в основном это долговременные нарушения развития нервной системы у новорожденных с чрезвычайно низкой массой тела при рождении [22, 23]. Несмотря на достижения в области интенсивной терапии новорожденных, НЭК продолжает оставаться потенциально опасным заболеванием для недоношенных новорожденных без значительных изменений в «частоте» смертности и долгосрочной заболеваемости [23].
Патогенез неизвестен. Существует несколько факторов, включая недоношенность, гипоксию, кормление смесями, особенно избыток белкового субстрата в просвете кишечника, сепсис, кишечную ишемию и колонизацию кишечника патогенными бактериями [22, 23].В недавно опубликованном исследовании [24] сообщается о более высокой доле протеобактерий у новорожденных после постановки диагноза НЭК, что подтверждает другие результаты. Интересно, что в этом исследовании, проведенном на девяти новорожденных пациентах с НЭК и девяти в контрольной группе, за неделю до постановки диагноза была обнаружена более низкая доля этих бактерий у пациентов с НЭК по сравнению с контрольной группой [24]. Авторы отметили, что недоношенные дети без достаточной колонизации Proteobacteria в течение первой недели жизни могут быть не в состоянии модулировать адаптивный иммунологический ответ на последующее увеличение Proteobacteria [24].Следовательно, незрелость механизма толерантности под влиянием качества и количества микробиоты может быть связана с данной патологией.
2.3. Воспалительные заболевания кишечника
При воспалительных заболеваниях кишечника (болезнь Крона и язвенный колит) иммунная система оказывает аномальное действие на элементы микробиоты, которые присутствуют в слизистой оболочке кишечника и вызывают поражение кишечника [25]. У пациентов с воспалительным заболеванием кишечника в присутствии комменсальных бактерий наблюдается повышение уровня антител IgG, а Т-лимфоциты, представленные на слизистой оболочке, гиперактивны, что свидетельствует о подавлении местных механизмов толерантности [26].Фактически, существует несколько факторов, которые влияют на активацию и ремиссию воспалительной активности, например, выделение фекального потока, использование антибиотиков для лечения болезни Крона и антибиотиков широкого спектра действия при язвенном колите толстой кишки [27, 28]. Учитывая, что болезнь Крона у людей возникает в терминальном отделе подвздошной и толстой кишки, где концентрация бактерий выше [26], предполагается, что непереносимость, вызванная микробиотой, в сочетании с генетической предрасположенностью, способствует развитию этого воспаления [25].
Собственная пластинка — это участок ткани, где иммунные клетки первоначально распознают бактериальный антиген, прежде чем мигрировать в дистальную лимфоидную ткань, чтобы вызвать воспалительный ответ [29]. Эпителиальные клетки представляют рецепторы, называемые Toll-подобными рецепторами и рецепторами NOD2, которые важны для запуска иммунного ответа. После активации эти рецепторы могут генерировать внутриклеточный ответ, продуцируя провоспалительные цитокины [30]. Этот механизм способствует созреванию дендритных клеток слизистой оболочки, которое после контакта с антигеном переходит в локальные лимфоидные структуры, такие как пятна Пейера, и дренирует мезентериальные лимфатические узлы, чтобы инициировать или поддерживать Т- и В-клеточные иммунные ответы.Дендритные клетки инициируют иммунный ответ, контролируют воспаление кишечника и поддерживают толерантность. В этом контексте предполагается, что дендритные клетки слизистой оболочки играют ключевую роль в регулировании иммунных ответов в антигенной среде желудочно-кишечного тракта, поддержании гомеостаза кишечника и обеспечении мирного сосуществования с эндогенной микрофлорой [29]. У здоровых людей комменсальная флора не может пересечь эпителиальный барьер; однако, когда какая-либо из этих бактерий проходит через кишечный барьер, они быстро фагоцитируются макрофагами слизистой оболочки, избегая активации кишечного иммунного ответа; но, с другой стороны, когда патогенные микроорганизмы пересекают барьер, этот ответ активируется [31].
Язвенный колит и болезнь Крона обычно развиваются в районах с самой высокой концентрацией кишечной микробиоты, что позволяет предположить, что комменсальные бактерии, связанные с генетической предрасположенностью, могут вносить вклад в патогенез этих заболеваний [32]. Кроме того, несколько исследований, процитированных Фава и Данезе [33], предполагают, что микробиота, обнаруженная у пациентов с воспалительными заболеваниями кишечника, отличается от здоровых людей, предполагая, что дисбактериоз может привести к непереносимости. Эти пациенты имеют слабо диверсифицированную микробиоту с преобладанием Clostridia, Bactoroides и Bifidobacteria (комменсальная микробиота) и сопутствующего увеличения вредных бактерий, таких как Escherichia coli , что редко встречается у лиц без воспалительных заболеваний кишечника [33].Доля вредных бактерий может составлять 30–40% от доминирующих бактерий, хотя и значительна, но причинно-следственная связь не установлена [34]. Интересно отметить, что низкое разнообразие видов связано с нестабильностью экосистемы, что подразумевает большую предрасположенность к изменению состава под влиянием окружающей среды. Таким образом, нестабильность экосистемы может способствовать риску воспаления.
2.4. Целиакия
Целиакия — это аутоиммунное заболевание тонкого кишечника, характеризующееся пожизненной непереносимостью глиадина и связанных с ним проламинов из пшеницы и других злаков, которая встречается у людей, генетически предрасположенных к непереносимости глютена [35].Благодаря механизмам непереносимости глютена активируются оба иммунных ответа: (1) адаптивный иммунный ответ, в котором преобладают провоспалительные цитокины Th2, и (2) врожденный иммунный ответ, опосредованный интерлейкином-15, который приводит к эпителиальным изменениям с изменениями проницаемости и проницаемости. целостность слизистой оболочки кишечника, благоприятствующая активной фазе заболевания [36]. В ответ на активацию иммунной системы развивается атрофия ворсинок кишечника разной степени, вплоть до полной атрофии ворсинок, что связано с увеличением длины крипт и количества клеток [35].Эта аномалия в структуре слизистой оболочки может привести к нарушению всасывания питательных веществ, задержке развития, остеопении, остеопорозу, внекишечным аутоиммунным расстройствам, таким как герпетиформный дерматит, бесплодию и неопластическим процессам, которые можно предотвратить, исключив глютен из рациона. Таким образом, строгая безглютеновая диета является единственной терапией для ремиссии клинических симптомов и осложнений со здоровьем у этих пациентов [35, 37].
Роль микробиоты при глютеновой болезни до конца не изучена по сравнению со здоровыми людьми [38].Генетические факторы были связаны с колонизацией видов Bacteroides [39]. Исследования показали, что строгая безглютеновая диета у пациентов с глютеновой болезнью способствует снижению количества полезных бактерий, особенно Bifidobacterium и Lactobacillus , по сравнению с грамотрицательными бактериями ( Bacteroides и E . coli ) [36 ]. Это изменение микробиоты из-за исключения глютена может быть результатом исключения важных источников углеводов, основного источника энергии для комменсальной микробиоты [39].Диетическое лечение этих пациентов не полностью способствует гомеостазу кишечника; однако иммуносупрессивная реакция микробиоты может быть полезной для пациентов с глютеновой болезнью [40].
По оценкам, более чем у 1 из каждых 100 новорожденных будет развиваться болезнь на протяжении всей жизни. Раньше считалось, что глютеновая болезнь редко появляется в детстве, в настоящее время она известна как относительно распространенное заболевание, которое можно диагностировать в любом возрасте. Это связано с тем, что распространенность типичных форм заболевания у детей выше, чем у взрослых, соответственно 67.0% против 14,3% случаев [41], но до 20% пациентов диагностируются после 60 лет. В настоящее время наблюдаются большие успехи в диагностике целиакии, которая принесет пользу пациентам и их семьям, а также лицам, не имеющим симптомов [37]. Параллельно с этим развитие знаний о микробиоте может способствовать профилактике заболеваний.
2,5. Запор
Хронический запор — основная жалоба педиатров, обращающихся за консультациями в 25% гастроэнтерологов [42, 43].Это обычное состояние у педиатрических пациентов с многофакторной этиологией, которое в 90–95% случаев связано с функциональными причинами [44]. Критерии Рима III определяют хронический запор как наличие, по крайней мере, двух из следующих симптомов в течение двух или более месяцев: (1) два или меньше дефекаций в неделю; (2) не менее одного эпизода недержания кала в неделю; (3) в анамнезе сохраняющаяся поза или чрезмерная задержка стула по воле; (4) болезненные или твердые испражнения в анамнезе; (5) наличие большого количества каловых масс в прямой кишке; (6) наличие в анамнезе стула большого диаметра, который может мешать унитазу [43].
Zoppi et al. [45] с целью исследования состава кишечной экосистемы при хроническом функциональном запоре обнаружили дисбактериоз у детей с запором (средний возраст — годы). В этом исследовании наблюдалось большее количество клостридий и бифидобактерий в кале, чем у здоровых детей. При оценке младенцев Aguirre et al. [46] обнаружили, что искусственное вскармливание увеличивает в 4,5 раза риск запора по сравнению с преимущественно грудным вскармливанием. У младенцев, находящихся на грудном вскармливании, Bifidobacterium spp.Преобладают , что составляет до 90% от общей фекальной микробиоты, тогда как у младенцев, вскармливаемых смесью, микробиота более гетерогенная [47, 48]. Было показано, что грудное молоко является постоянным источником комменсальных бактерий для кишечника младенца, возможно, из-за состава пребиотиков, который стимулирует рост и поддержание Lactobacillus и Bifidobacterium [47, 48]. Добавление пребиотиков к искусственной детской смеси увеличивает количество бифидобактерий [49], частоту стула и снижает консистенцию стула, что аналогично характеристикам, наблюдаемым у младенцев, находящихся на грудном вскармливании [50, 51].
Присутствие комменсальных бактерий в толстой кишке способствует снижению pH, что стимулирует дальнейший рост, благодаря высокому процентному содержанию воды, что обеспечивает более влажный стул [52, 53] и более низкую консистенцию, что облегчает их выведение [54].
2.6. Диарея
Диарея — это симптом, определяемый как жидкий жидкий несформированный стул более трех раз в день или объем дефекации более 200 мл / день. Острая диарея — главный симптом острого гастроэнтерита.Согласно ESPGHAN (Европейское общество детской гастроэнтерологии, гепатологии и питания), острый гастроэнтерит определяется как снижение консистенции кала (мягкий или жидкий) и / или увеличение частоты стула (3 или более раз за 24 часа) с или без лихорадки или рвоты, обычно длится менее 7 дней и никогда не превышает 14 дней [55]. В некоторых случаях это сопровождается болями в животе и обезвоживанием [56].
В Европе частота диареи колеблется в пределах 0.5 и 1,9 эпизода в год у детей до 3 лет [55]. По оценкам недавнего систематического обзора, в котором участвовали 139 стран с низким и средним уровнем дохода, заболеваемость диареей снизилась с 3,4 эпизодов на ребенка в год в 1990 году до 2,9 эпизодов на ребенка в год в 2010 году, что является самым высоким показателем среди младенцев в возрасте 6–11 месяцев. возраст (4,5 эпизода на ребенка в год в 2010 г.) [57]. Несмотря на то, что с годами произошло снижение частоты эпизодов на одного ребенка, количество эпизодов все еще велико: в 2010 г. было зарегистрировано около 1,7 миллиарда случаев [57].
Наиболее распространенными этиологическими агентами являются ротавирусы, среди бактерий наиболее распространенным является Campylobacter , за которым следует Salmonella . Такие паразиты, как Giardia lamblia и Cryptosporidium , нечасто вызывают диарею у здоровых детей. Основные этиологические агенты могут меняться с возрастом ребенка: у детей до 1 года преобладают ротавирус, норовирус, аденовирус и сальмонелла . От 1 до 4 лет преобладают те же агенты, добавляя Campylobacter и Yersinia .У детей старше 5 лет — Campylobacter , Salmonella и ротавирус [55]. Диарея, связанная с приемом антибиотиков, также является частым явлением, достигая 30% случаев [58].
Основным патогенетическим механизмом гастроэнтерита, независимо от его причины, является изменение всасывания и секреции воды и электролитов через слизистую кишечника, это увеличивает, особенно у младенцев, риск развития острого обезвоживания, считающегося основным осложнением гастроэнтерита. [59].В этом смысле изменение кишечной микробиоты может помочь контролировать симптомы и осложнения диареи в рамках адъювантного лечения.
3. Кишечная микробиота и внекишечные заболевания
Кишечник — это первый барьер для питательных веществ и компонентов просвета, составляющий одну из первых линий защиты от инфекционных агентов и аллергенов [26]. Бактериальная транслокация вызывается увеличением кишечной проницаемости в результате нарушения кишечного барьера [60].Как упоминалось ранее, изменения кишечной микробиоты могут быть связаны с развитием внекишечных заболеваний, таких как ожирение и аллергические реакции.
3.1. Ожирение
В настоящее время ожирение становится серьезной проблемой общественного здравоохранения. Распространенность детского ожирения может достигать 20% в странах Европейского Союза и продолжает расти в развивающихся странах [61]. Нарушение баланса между потреблением энергии и расходом энергии является основным фактором риска чрезмерного набора веса у детей и подростков.
Недавние исследования указывают на различия в количестве и качестве микробиоты у тучных и худых детей, как указано Angelakis et al. [62]. В ходе проспективного наблюдения Kalliomäki et al. [63] наблюдали, что дети с нормальным весом в 7 лет имели более высокую распространенность видов Bifidobacterium в течение первого года жизни, чем дети с избыточной массой тела. На присутствие бактерий у новорожденного влияют материнские бактерии, а затем воздействие грудного молока или принятый тип вскармливания [62].
До беременности у женщин с избыточным весом количество Bacteroides выше, чем у женщин с нормальным весом. Кроме того, увеличение числа Bacteroides во время беременности связано с чрезмерным набором веса [64]. В отношении уменьшения или увеличения количества Bacteroides у взрослых, страдающих ожирением, но не страдающих ожирением, исследования противоречивы, но многие из них приходят к выводу, что Bacteroides увеличивается у людей с ожирением, включая людей с диабетом [62].В экспериментальной модели на животных увеличение содержания Bacteroides в микробиоте кишечника было связано с предрасположенностью к накоплению энергии и ожирению [63]. У взрослых недавний метаанализ не обнаружил каких-либо различий в концентрации Bacteroides между людьми с ожирением и нормальным весом [62].
Среди детей высокая кишечная концентрация Bacteroides fragilis и низкая концентрация Staphylococcus у младенцев были связаны с более высоким ИМТ у детей дошкольного возраста [65].С другой стороны, у детей с избыточным весом в 7 лет не наблюдалось значительного увеличения количества Bacteroides по сравнению с детьми с нормальным весом в том же возрасте [63]. У подростков и взрослых значительное увеличение соотношения Bacteroides было коррелировано с потерей веса после программы похудания [62].
До сих пор основная связь кишечной микробиоты с ожирением связана с присутствием бифидобактерий. Мета-анализ, проведенный с участием 159 субъектов с ожирением по сравнению с 189 контрольными субъектами из шести опубликованных исследований, продемонстрировал значительное истощение бифидобактерий в группе с ожирением [62].Другой метаанализ показал, что микробиота людей с ожирением представлена меньшими Firmicutes и Methanobrevibacter spp . концентрации, чем у лиц с нормальным весом [62]. Таким образом, исследования предполагают причинную связь между микробиотой и ожирением.
3.2. Аллергические реакции
В западных странах распространенность пищевой аллергии может поражать 6–8% детей в возрасте до 10 лет и 1–4% взрослого населения. Пищеварительные аллергические проявления могут возникать в любом месте тела, включая желудочно-кишечный тракт, кожу и дыхательную систему [66].Несколько исследований показывают повышенную кишечную проницаемость у пациентов с аллергией, что способствует прохождению протеиновых антигенов, поступающих с пищей [67]. Кроме того, эпидемиологические исследования показали, что у детей-аллергиков микробиота отличается от здоровых детей с более высоким уровнем клостридий и более низким уровнем бифидобактерий [68]. С другой стороны, у неаллергических детей в составе микробиоты чаще встречаются бифидобактерии и лактобациллы, что позволяет предположить, что модуляция микробиоты может способствовать предотвращению аллергических проявлений [68, 69].
Большинство публикаций о модуляции кишечной микробиоты у пациентов с аллергией сосредоточено на дерматологической патологии, особенно при атопическом дерматите. Это хроническое заболевание кожи, которым страдают от 10% до 25% западных детей [70]. Генетика — не единственный фактор риска. «Гигиеническая гипотеза» предполагает, что быстрое увеличение атопических проявлений может быть связано с меньшим воздействием инфекций на первом этапе жизни. Следуя этой теории, относительное отсутствие микробной стимуляции иммунной системы кишечника младенцев и чрезмерная гигиена, характерная для типичного западного образа жизни в раннем детстве, влияют на созревание иммунной системы [68].
Развитие иммунной системы ребенка имеет тенденцию быть направленным на фенотип Т-хелперов типа 2 (Th3) у младенцев, тогда как постнатальное созревание связано с постепенным ингибированием Th3 и увеличением сродства Th2. Согласно Prescott et al. [71], у детей с атопией в течение первого года жизни наблюдается быстрое подавление ответов Th3, в то время как реакция у детей с атопией стимулируется. Преобладающий ответ Th3 связан с повышенной выработкой антител IgE к антигенам окружающей среды и эозинофилии, лежащих в основе аллергических процессов.
Что касается микробиоты и атопических реакций, другие исследования также показали, что ранняя колонизация потенциально более патогенными бактериями, такими как Clostridium difficile и Staphylococcus aureus , чаще встречается у детей, у которых развивается аллергия [68].
4. Модуляция кишечной микробиоты
Научные достижения ежедневно приводят к все большему количеству знаний о микробиоте и ее связи с педиатрическими заболеваниями. В свете опубликованных исследований ведется поиск альтернатив для модуляции кишечной микробиоты, чтобы предотвратить и лечить широкий спектр заболеваний.В настоящее время использование пробиотиков рассматривается как терапевтическая стратегия из-за их способности подавлять чрезмерный рост патогенных бактерий и развитие воспалительных кишечных инфекций [72]. Пробиотики определяются как «живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина» [8]. Чтобы штамм микроорганизмов считался полезным для организма, или пробиотики должны соответствовать следующим критериям: (1) оставаться жизнеспособным в кишечнике, сопротивляясь перевариванию желудочной кислоты и желчных солей; (2) прилипает к эпителию желудочно-кишечного тракта; (3) быть метаболически активным; (4) снижает pH толстой кишки; (5) проявляет антибактериальную активность против патогенных бактерий [72]. Lactobacillus plantarum , L. rhamnosus , L. reuteri , L. casei , L. acidophilus , Bifidobacterium longum , B. brevis и B. bifidum main с доказанными пробиотическими эффектами. Преимущества пробиотического действия варьируются в зависимости от интервала времени, в течение которого бактерии остаются в кишечнике, и их количества [73].
Хотя количество и время приема важны для положительного эффекта, его рекомендация требует внимания.Наиболее серьезная проблема при использовании пробиотиков — это риск сепсиса [72]. Пробиотики обладают определенным действием на конкретных пациентов. Таким образом, важно подчеркнуть, что пробиотики очень гетерогенны с различиями по составу и биологической активности [73].
Далее рассматриваются признаки модуляции пробиотической микробиоты кишечника для каждого заболевания, представленного в этой статье.
4.1.
Helicobacter pylori
Исследования in vitro показали, что L.acidophilus LB, связанный с терапией антибиотиками, оказывает агонистический эффект против бактерий, отрицательно влияя на рост бактерий, ингибируя гликолипиды рецепторов адгезии и снижая активность уреазы, необходимую для их выживания в кислой среде [74]. У людей пробиотический штамм может улучшить состояние инфекции, но недостаточно для ликвидации H. pylori , как показано в недавно опубликованном обзоре, посвященном инфекции Helicobacter pylori и детскому возрасту [19].Авторы заявляют, что среда, в которой живут дети, важна для предотвращения этой инфекции.
Использование добавки с ферментированным молоком, содержащей пробиотик L. casei DN-114 001 (Actimel) в течение 14 дней, способствовало эрадикации H. pylori у детей, получавших омепразол, амоксициллин и кларитромицин в течение 7 дней [ 75]. Этот результат предполагает, что пробиотик можно использовать в качестве адъювантной терапии для эрадикации HP у детей.
4.2. Некротический энтероколит
Оценка использования пробиотиков для снижения риска НЭК основана на двух недавних метаанализах. В первом упомянутом метаанализе было отобрано 11 испытаний с использованием модели фиксированного эффекта с участием недоношенных новорожденных с очень низкой массой тела (<34 недель беременности и массой тела при рождении <1500 г). Энтеральное введение любого пробиотика, начатое в течение первых 10 дней жизни и продолжающееся не менее 7 дней, позволило снизить частоту НЭК на 30%. Кроме того, было продемонстрировано, что у недоношенных новорожденных, получавших добавки, более низкий риск смерти [23].Во втором метаанализе добавление энтеральных пробиотиков также снизило частоту тяжелых НЭК (ОР 0,32; 95% ИК 0,17–0,6) и смертность (ОР 0,43; 95% ИК 0,25–0,75) у недоношенных новорожденных (<37 нед. беременность и / или вес при рождении <2500 г) [76]. В обоих исследованиях использование пробиотиков не снижает риск сепсиса.
Исследования показали значительные различия в штаммах пробиотиков и протоколах лечения, данные предполагают, что необходимы дополнительные плацебо-контролируемые испытания.Согласно Deshpande et al. [23] если предлагается в качестве рутинной терапии для недоношенных новорожденных, должен быть сделан строгий выбор продукта, включая тщательный мониторинг целевой группы перед употреблением. Хотя результаты положительные, Комитет по питанию ESPGHAN по-прежнему не рекомендует рутинное использование пробиотиков для предотвращения НЭК [77].
4.3. Воспалительные заболевания кишечника
Пробиотики могут регулировать метаболическую активность кишечной флоры и ее компонентов, предотвращая бактериальный рост, поддерживая целостность кишечного барьера слизистой оболочки, улучшая их функцию, проницаемость, стабильность и индукцию апоптоза Т-клеток.Благодаря такому механизму действия пробиотики могут регулировать иммунный ответ и снижать секрецию провоспалительных факторов [4, 8].
При лечении язвенного колита использование непатогенного препарата Escherichia coli Nissle, 1917, было оценено 116 пациентов в возрасте 18–80 лет в рандомизированном клиническом исследовании, контролируемом месалазином. Авторы обнаружили снижение ремиссии на 74,6% у пациентов, принимавших месалазин, по сравнению с 68,4% у пациентов, принимавших пробиотики (OR 1.35; 95% IC 0,6–3,04). В этом исследовании время до ремиссии было примерно одинаковым — 44 и 42 дня соответственно [78]. С другой стороны, метаанализ, опубликованный в 2010 г., в котором было отобрано 13 рандомизированных контролируемых исследований, предполагает, что использование пробиотиков не дало дополнительных преимуществ в индукционной ремиссии, хотя в поддержании симптомов ремиссии пробиотик 1,36 (95% ДИ 1,07 –1,73) был более эффективным, чем плацебо 0,69 (95% ДИ 2,47–1,01) [79]. Принимая во внимание контролируемые исследования, Escherichi coli, Nissle, 1917 (2.5 × 10 10 ) [78, 80], Bifidobacteria (ферментированное бифидобактериями молоко 100 мл / день) [81] и Lactobacilli GG (18 × 10 9 ) [82] были пробиотиками, которые напоминают действие месалазина в поддерживающее лечение ремиссии.
При лечении активных и неактивных болезней Крона было проведено множество исследований с несколькими штаммами пробиотиков ( E. coli Nissle, LGG, L. johnsonii LA1, S. boulardii и VSL номер 3), но размер выборки был небольшим.Кроме того, результаты этих исследований, а также экспериментальных исследований на животных [83] не показали значительной разницы в уменьшении воспаления [84]. В ходе открытой пилотной оценки с использованием Lactobacillus GG (10 10 КОЕ) дважды в день в течение 6 месяцев, у 3 из 4 детей улучшились показатели индекса болезни Крона у детей (PCDAI). Но необходимы дополнительные рандомизированные контролируемые испытания для оценки эффективности Lactobacillus GG при болезни Крона у детей, а также для оценки других штаммов пробиотиков [85].
4.4. Целиакия
В настоящее время нет показаний к применению пробиотиков в качестве вспомогательного средства для лечения целиакии. Однако развитие знаний о микробиоте позволит проводить исследования в будущем, особенно в области микробиологии и генетической предрасположенности.
Основным генетическим фактором риска целиакии являются гены человеческого лейкоцитарного антигена (HLA) -DQ [35]. Недавно была изучена связь между типом кормления грудью и HLA-генотипом на состав кишечной микробиоты младенцев с семейной историей глютеновой болезни.Palma et al. [6] опубликовали первое исследование, которое обнаружило эту связь. По мнению авторов, у младенцев с высоким генетическим риском развития целиакии было больше B. fragilis и Staphylococcus spp. , и меньшее число Bifidobacterium spp . и B. longum . Грудное вскармливание уменьшило связанные с генотипом различия в составе микробиоты, что может частично объяснить защитную роль грудного молока при этом заболевании.Эпидемиологические исследования показывают, что грудное вскармливание оказывает защитное действие против риска развития целиакии, главным образом, когда глютен вводится в рацион, когда младенцы все еще находятся на грудном вскармливании [86]. Следовательно, защитный эффект грудного вскармливания также связан с его способностью модулировать кишечную микробиоту у младенцев, способствуя увеличению и поддержанию бифидобактерий.
4.5. Запор
Недавний систематический обзор нефармакологических методов лечения запоров у детей считает недостаточными доказательства действия пробиотиков [87].Обзор взрослых и детей показывает, что использование пробиотиков для лечения запоров следует рассматривать как исследовательское [88]. У взрослых исследования демонстрируют положительный пробиотический эффект по сравнению с плацебо, что можно увидеть в перекрестном исследовании с Lactobacillus casei Shirota (0,5–5 × 10 9 UCF) [89] и в рандомизированном контрольном исследовании с E. coli Nissle, 1917 (6.5 × 10 9 UCF) [90]. У педиатрических пациентов положительный пробиотический эффект при функциональном запоре наблюдался с различными штаммами пробиотиков.Йогурт с добавкой 10 9 КОЕ / мл Bifidobacterium longum по сравнению с плацебо показал значительные различия в частоте дефекации, боли при дефекации и боли в животе в перекрестном двойном слепом контролируемом исследовании, в котором участвовали 59 детей и подростков в возрасте 5-15 лет. лет [91]. Лечение Lactobacillus casei rhamnosus Lcr35 (8 × 10 8 КОЕ / день) не показало разницы в эффективности по сравнению с оксидом магния (50 мг / кг / день), поскольку боль в животе менее распространена в группе Lcr35. [92].В пилотном исследовании по оценке эффективности смеси пробиотиков (Ecologic Relief: Bifidobacteria B. bifidum, B. infantis, B. longum, Lactobacilli casei, L. plantarum и L. rhamnosus ) у педиатрических пациентов в возрасте от 4 до 16 лет. лет в течение 4 недель наблюдался значительный эффект этой смеси (4 × 10 9 КОЕ), увеличивая частоту стула и уменьшая количество недержания кала и болей в животе [93]. С другой стороны, Lactobacillus GG в качестве дополнения к лактулозе для лечения функционального запора у детей не оказал положительного эффекта [94], но в этом случае следует учитывать слабительный эффект лактулозы.В целом, использование пробиотиков, по-видимому, приносит пользу при функциональном запоре у педиатрических пациентов, но для заключения необходимо большее количество случаев и более длительное наблюдение.
У нормальных здоровых младенцев (до 6 месяцев жизни) рандомизированное контролируемое исследование продемонстрировало значительное увеличение частоты стула и улучшение консистенции кала при использовании смеси с добавлением LGG [95]. Противоречиво, введение B. lactis , B. longum BL 999 и rhamnosus LPR не было связано с изменением частоты и консистенции стула, что привело к неясным пробиотическому эффекту у младенцев согласно комментарию ESPGHAN, опубликованному в 2012 году [77 ].
4.6. Диарея
Использование пробиотиков может способствовать уменьшению диарейных симптомов за счет множественных механизмов действия. Во-первых, он может сохранять функцию кишечного эпителия, избегая повышенной кишечной проницаемости [96] и вторжения патогенных микроорганизмов [97]. Во-вторых, за счет подкисления толстой кишки, производства бактерицидов, конкуренции за питательные вещества и выработки IgA он предотвращает рост патогенных штаммов [98]. Наконец, производство короткоцепочечных жирных кислот в толстой кишке стимулирует абсорбцию натрия колоноцитами [8]. штаммов Lactobacillus и Saccharomyces boulardii , типа дрожжей, являются наиболее изученными микроорганизмами.
Несколько метаанализов [58, 99–102] подтвердили положительный эффект Lactobacillus GG и Saccharomyces boulardii при адъювантном лечении диареи. Хотя рандомизированные клинические испытания, проведенные с Saccharomyces boulardii , продемонстрировали высокую методологическую вариативность, они показали положительные результаты. В большом метаанализе было подтверждено, что эти дрожжи снижают риск диареи через 3 дня (RR 0.66; 95% IC 0,55–0,77) и в среднем снижение на 30,48 ч (95% IC 18,51–42,46 ч), что доказывает его эффективное действие при лечении регидратации [103].
В терапии антибиотиками вспомогательная добавка Saccharomyces boulardii снизила риск диареи с 17,2% до 6,7% (ОР 0,43; 95% IC 0,23–0,78) у детей и подростков в возрасте от 6 месяцев до 14 лет [58] . В другом пересмотре, включавшем педиатрических пациентов (1015 субъектов лечения и 971 контрольный), авторы наблюдали значительное снижение частоты диареи, связанной с антибиотиками, при введении пробиотиков (RR 0.49; 95% IC 0,32–0,74) [104]. В более недавнем исследовании с участием 3432 детей и подростков в возрасте от 0 до 18 лет были получены положительные результаты для пробиотиков, но анализ подгрупп показал, что более высокие дозы (≥5 миллиардов КОЕ / день) более эффективны, чем более низкие дозы пробиотиков. дозы (<5 миллиардов КОЕ / день) () [105]. По данным Johnston et al. [105], частота диареи, связанной с антибиотиками, в исследованиях с высокими дозами в группах пробиотиков и плацебо составляла, соответственно, 8% и 22% (1474 участника; ОР 0.40; 95% ДИ 0,29–0,55). В то время как для исследований низких доз была обнаружена частота 8% в группе пробиотиков и 11% в контрольной группе (1382 участника; ОР 0,80; 95% ДИ 0,53–1,21) [105].
У детей с острой диареей добавление Lactobacillus GG связано со значительным сокращением продолжительности диареи, особенно вызванной ротавирусом и диареей, с более низким семидневным риском. Хотя перкуссии в объеме кала не наблюдалось, его применение было связано с умеренным преимуществом [100].
У госпитализированных детей потребление Lactobacillus GG по сравнению с плацебо потенциально может снизить общую частоту диареи, связанной с оказанием медицинской помощи (ОР 0,37; 95% ДИ 0,23–0,59), включая симптоматический ротавирусный гастроэнтерит (0,49 ОР; 95% ДИ 0,28–0,86) [102]. Saccharomyces boulardii сокращал продолжительность диареи у госпитализированных пациентов с острой инфекционной диареей [106]. Dinleyici et al. [106] обнаружили сокращение продолжительности диареи примерно на 24 часа и сокращение госпитализации на 20 часов, что существенно повлияло на клиническую практику.
Имеются убедительные доказательства клинической пользы Lactobacillus и Saccharomyces boulardii [107] при лечении диареи. Что касается эффективности и безопасности других пробиотиков при лечении диареи у детей, делать выводы преждевременно. Требуются дальнейшие исследования для оценки эффектов дозы и ее безопасности [105].
4.7. Ожирение
При ожирении не рекомендуется дополнительное лечение пробиотиками. Ранее несколько краткосрочных рандомизированных контролируемых исследований показали положительное влияние пробиотиков на чувствительность к инсулину, воспалительные маркеры и толерантность к глюкозе [108].Учитывая, что истощение запасов бифидобактерий во время лактации является ассоциированным фактором развития ожирения в школьном возрасте [63], а первые годы жизни имеют решающее влияние на состав микробиоты кишечника человека, были разработаны исследования для оценки пробиотических добавок во время пренатального и послеродового периода. периоды [108].
Влияние перинатального пробиотического вмешательства на развитие избыточной массы тела в течение 10-летнего периода наблюдения оценивали Luoto et al. [109]. В этом исследовании потребление 10 10 КОЕ Lactobacillus GG за 4 недели до ожидаемых родов, продленных на 6 месяцев постнатально, казалось, сдерживало чрезмерную прибавку в весе, особенно среди детей до 24–48 месяцев. Lactobacillus GG и Bifidobacterium lactis , введенные во время беременности, снижали риск гестационного сахарного диабета и снижали риск рождения большего размера в пораженных случаях [110]. В настоящее время данные по педиатрии ограничены. Хотя исследования продемонстрировали связь между ожирением и диабетом 2 типа со специфическими изменениями в составе кишечной микробиоты, в основном на животных моделях [111], необходимы дальнейшие исследования для экстраполяции на человека.
4.8. Аллергическая реакция
Существует множество исследований, посвященных изучению роли пробиотиков при атопическом дерматите у детей младше 2 лет. Предложение Lactobacillus GG по сравнению с плацебо снизило вдвое риск атопической экземы у генетически предрасположенных детей в первый год жизни (ОР 0,51; 95% ДИ 0,32–0,84) [112]. В этом исследовании обе формы введения были эффективны: младенцем в течение 6 месяцев после родов или его матерью во время беременности.Другие исследования продемонстрировали значительное снижение индекса тяжести атопического дерматита с использованием Lactobacillus fermentum VRI-033 PCC 1 × 10 9 КОЕ два раза в день в течение 8 недель [113] и Lactobacillus GG у младенцев с подозрением на аллергию на коровье молоко. IgE -сенсибилизированный [114]. У детей старше 2 лет также была обнаружена значительная разница в снижении степени тяжести индекса атопического дерматита с добавлением Lactobacillus GG [115] и Lactobacillus reuteri [116] по сравнению с плацебо.
Метаанализ, опубликованный в 2012 году на основе 14 исследований, предоставил доказательства в поддержку умеренной роли пробиотиков при атопическом дерматите. Прием пробиотиков снижал частоту атопического дерматита (ОР 0,79; 95% ДИ 0,71–0,88) и IgE-опосредованного атопического дерматита у младенцев (ОР 0,80; 95% ДИ 0,66–0,96) при использовании во время беременности или в начале жизни [117]. Кроме того, важно отметить, что грудное вскармливание может защитить от инфекций и атопии у младенцев, доставляя IgA и другие защитные молекулы TGF и IL-10 (с противовоспалительными свойствами) и способствуя увеличению количества лактобацилл и бифидобактерий [66].
Учитывая респираторные симптомы, Bifidobacterium lactis является наиболее распространенным пробиотиком, изучаемым у детей. Используемый у доношенного ребенка, у матери которого был поставлен диагноз ВИЧ, B. lactis CNCM I-3446 не продемонстрировал значительного влияния на частоту бронхопневмонии (ОР 0,75; 95% ДИ: 0,2–2,6) [118]. При испытании на младенцах в возрасте от 4 до 10 месяцев B. lactis , as L. reuteri также не оказали влияния на частоту и продолжительность респираторных заболеваний.В этом исследовании было замечено, что у младенцев, получавших контрольную смесь, было больше эпизодов диареи и эпизодов большей продолжительности [119].
Смесь для младенцев с добавлением Lactobacillus salivarius CECT5713 (2 × 10 6 КОЕ) обеспечила значительное снижение количества эпизодов респираторных инфекций по сравнению с контрольной смесью, соответственно, 53 против 36 после 6 месяцев потребления [120 ]. Использование формулы L. johnsonii с добавлением La1 не показало какого-либо положительного влияния на количество респираторных инфекций по сравнению с контрольной формулой [121].Согласно Комитету по питанию ESPGHAN, имеющихся данных недостаточно, чтобы сделать надежный вывод об использовании пробиотических добавок для профилактики респираторных инфекций у младенцев [77].
5. Заключение
Ключевая роль в здоровье человека может зависеть от баланса гомеостаза среди видов микробов, населяющих кишечник. Таким образом, кишечная микробиота считается не только потенциальным биомаркером, но и важным фактором адъювантной терапии, терапевтической мишенью при внутри- и внекишечных заболеваниях.Хотя все люди генетически запрограммированы, эти изменения в микробиоте желудочно-кишечного тракта можно регулировать. Тем не менее, при назначении пробиотических добавок следует учитывать тип бактерий, режим дозирования, способ доставки и хозяина.
Конфликт интересов
Авторы заявили об отсутствии конфликта интересов.
Дисбактериоз кишечника новорожденных | Журнал перинатологии
Домингес-Белло М.Г., Годой-Виторино Ф., Найт Р., Блазер М.Дж.Роль микробиома в развитии человека. Кишечник. 2019; 68: 1108–14.
CAS
PubMed
PubMed Central
Google Scholar
Генсоллен Т., Айер С.С., Каспер Д.Л., Блумберг Р.С. Как колонизация микробиотой в раннем возрасте формирует иммунную систему. Наука. 2016; 352: 539–44.
CAS
PubMed
PubMed Central
Google Scholar
Ayres JS. Совместное поведение микробной толерантности в мутуализме микробиоты хозяина.Клетка. 2016; 165: 1323–31.
CAS
PubMed
PubMed Central
Google Scholar
Санчес К.К., Чен Г.Й., Шибер АМП, Редфорд С.Е., Шохирев М.Н., Леблан М. и др. Совместная метаболическая адаптация хозяина может способствовать бессимптомной инфекции и способствовать снижению вирулентности кишечного патогена. Клетка. 2018; 175: 146–58.e15.
CAS
PubMed
PubMed Central
Google Scholar
Сорбара МТ, Памер Э.Г. Межбактериальные механизмы устойчивости к колонизации и стратегии, используемые патогенами для их преодоления. Mucosal Immunol. 2019; 12: 1–9.
CAS
PubMed
PubMed Central
Google Scholar
Кох А., Бэкхед Ф. От ассоциации к причинности: роль кишечной микробиоты и ее функциональных продуктов в метаболизме хозяина. Mol Cell. 2020; 78: 584–96.
CAS
PubMed
PubMed Central
Google Scholar
Gevers D, Kugathasan S, Denson LA, Vazquez-Baeza Y, Van Treuren W., Ren B, et al. Микробиом, ранее не получавший лечения, при впервые возникшей болезни Крона. Клетка. Хост-микроб. 2014; 15: 382–92.
CAS
PubMed
PubMed Central
Google Scholar
Клингберг Э., Магнуссон М.К., Стрид Х., Демингер А., Шталь А., Сундин Дж. И др. Различный состав микробиоты кишечника у пациентов с анкилозирующим спондилитом связан с повышенным уровнем кальпротектина в кале.Arthritis Res Ther. 2019; 21: 248.
CAS
PubMed
PubMed Central
Google Scholar
Фалони Дж., Джоосенс М., Виейра-Силва С., Ван Дж., Дарзи И., Фауст К. и др. Популяционный анализ изменчивости микробиома кишечника. Наука. 2016; 352: 560–4.
CAS
PubMed
PubMed Central
Google Scholar
Яцуненко Т.Р., Манари М.Дж., Трехан И., Домингес-Белло М.Г., Контрерас М., Магрис М. и др.Микробиом кишечника человека в зависимости от возраста и географии. Природа 2012; 486: 222–7.
CAS
PubMed
PubMed Central
Google Scholar
Биттингер К., Чжао С., Ли И, Форд Э, Фридман Э.С., Ни Дж. И др. Бактериальная колонизация перепрограммирует метаболом кишечника новорожденных. Nat Microbiol. 2020; 5: 838–47.
CAS
PubMed
PubMed Central
Google Scholar
Vangay P, Ward T, Gerber JS, Knights D. Антибиотики, детский дисбактериоз и болезни. Клетка. Хост-микроб. 2015; 17: 553–64.
CAS
PubMed
PubMed Central
Google Scholar
Deshmukh HS, Liu Y, Menkiti OR, Mei J, Dai N, O’Leary CE, et al. Микробиота регулирует гомеостаз нейтрофилов и устойчивость хозяина к сепсису Escherichia coli K1 у новорожденных мышей. Nat Med. 2014; 20: 524–30.
CAS
PubMed
PubMed Central
Google Scholar
Грачи MG, Гарретт WS. Кишечник. микробиота, метаболиты и иммунитет хозяина. Nat Rev Immunol. 2016; 16: 341–52.
CAS
PubMed
PubMed Central
Google Scholar
Ольшак Т., Ан Д., Цейссиг С., Вера М.П., Рихтер Дж., Франке А. и др. Воздействие микробов в молодом возрасте оказывает стойкое влияние на функцию естественных Т-клеток-киллеров. Наука. 2012; 336: 489–93.
CAS
PubMed
PubMed Central
Google Scholar
Cox LM, Yamanishi S, Sohn J, Alekseyenko AV, Leung JM, Cho I, et al. Изменение кишечной микробиоты во время критического периода развития имеет долгосрочные метаболические последствия. Клетка. 2014; 158: 705–21.
CAS
PubMed
PubMed Central
Google Scholar
Кимура И., Миямото Дж., Оуэ-Китано Р., Ватанабе К., Ямада Т., Онуки М. и др. Микробиота кишечника матери во время беременности влияет на метаболический фенотип потомства мышей.Наука. 2020; 367: eaaw8429.
CAS
PubMed
PubMed Central
Google Scholar
Гордон Х.А., Пести Л. Животное-гнотобиотическое животное как инструмент в изучении микробных взаимоотношений хозяина. Бактериол. Ред. 1971; 35: 390–429.
CAS
PubMed
PubMed Central
Google Scholar
Лучинский П., Маквей Нойфельд К.А., Ориач К.С., Кларк Г., Динан Т.Г., Крайан Дж.Ф.Выращивание в пузыре: использование стерильных животных для оценки влияния микробиоты кишечника на мозг и поведение. Int J Neuropsychopharmacol. 2016; 19: pyw020.
PubMed
PubMed Central
Google Scholar
Уилкс М. Бактерии и раннее развитие человека. Early Hum Dev. 2007; 83: 165–70.
PubMed
PubMed Central
Google Scholar
Гериг Дж. Л., Венкатеш С., Чанг Х. В., Хибберд М. С., Кунг В. Л., Ченг Дж. И др.Влияние продуктов, содержащих микробиоту, на животных-гнотобиотов и детей с недостаточным питанием. Наука. 2019; 365: eaau4732.
PubMed
PubMed Central
Google Scholar
Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию. Природа. 2006; 444: 1027–31.
PubMed
PubMed Central
Google Scholar
Safari Z, Джерард П. Связь между микробиомом кишечника и неалкогольной жировой болезнью печени (НАЖБП). Клетка. Mol Life Sci. 2019; 76: 1541–58.
CAS
PubMed
PubMed Central
Google Scholar
Цзян Ц., Ли Дж., Хуанг П., Лю З., Чжао Б. Микробиота кишечника и болезнь Альцгеймера. J. Alzheimers Dis. 2017; 58: 1–15.
PubMed
PubMed Central
Google Scholar
Lee YP, Chiu CC, Lin TJ, Hung SW, Huang WC, Chiu CF, et al. Моноколонизация мышей без микробов с помощью Bacteroides fragilis улучшает индуцированный азоксиметаном / декстрансульфатом натрия колоректальный рак, вызванный колитом. Immunopharmacol Immunotoxicol. 2019; 41: 207–13.
CAS
PubMed
PubMed Central
Google Scholar
Tissier H. Recherches sur la flore кишечника дез nourrissons. C R Mem Soc Biol. 1899; 51: 943.
Google Scholar
Logan WR. Кишечная флора младенцев и детей раннего возраста. J Pathol. 1913; 18: 527–51.
Google Scholar
Гарридо Д., Бариле Д., Миллс Д.А. Молекулярная основа обогащения бифидобактериями желудочно-кишечного тракта младенцев. Adv Nutr. 2012; 3: 415С – 21С.
CAS
PubMed
PubMed Central
Google Scholar
Ruiz-Moyano S, Totten SM, Garrido DA, Smilowitz JT, German JB, Lebrilla CB, et al.Различия в потреблении олигосахаридов грудного молока младенческими кишечными штаммами Bifidobacterium breve. Appl Environ Microbiol. 2013; 79: 6040–9.
CAS
PubMed
PubMed Central
Google Scholar
Живкович AM, German JB, Lebrilla CB, Mills DA. Гликобиом грудного молока и его влияние на микробиоту желудочно-кишечного тракта младенцев. Proc Natl Acad Sci USA. 2011; 108 (Приложение 1): 4653–8.
CAS
Google Scholar
Хенрик Б.М., Хаттон А.А., Палумбо М.С., Касабури Дж., Митчелл Р.Д., Андервуд М.А. и др. Повышенный pH фекалий указывает на глубокое изменение микробиома кишечника грудного ребенка из-за уменьшения количества бифидобактерий за последнее столетие. мСфера. 2018; 3: e00041–18.
PubMed
PubMed Central
Google Scholar
Litvak Y, Byndloss MX, Tsolis RM, Baumler AJ. Распространение дисбиотических протеобактерий: микробный признак дисфункции эпителия.Curr Opin Microbiol. 2017; 39: 1–6.
CAS
Google Scholar
Milani C, Duranti S, Bottacini F, Casey E, Turroni F, Mahony J, et al. Первые микробные колонизаторы кишечника человека: состав, деятельность и последствия для здоровья микробиоты кишечника младенца. Microbiol Mol Biol Rev.2017; 81: e00036-17.
PubMed
PubMed Central
Google Scholar
La Rosa PS, Warner BB, Zhou Y, Weinstock GM, Sodergren E, Hall-Moore CM и др. Структурированное развитие бактериальных популяций в кишечнике недоношенных детей. Proc Natl Acad Sci USA. 2014; 111: 12522–7.
Google Scholar
Korpela K, Blakstad EW, Moltu SJ, Strommen K, Nakstad B, Ronnestad AE, et al. Развитие кишечной микробиоты и гестационный возраст у недоношенных новорожденных. Научный отчет 2018; 8: 2453.
PubMed
PubMed Central
Google Scholar
Ватанен Т., Плихта Д.Р., Сомани Дж., Мунк П.С., Артур Т.Д., Холл А.Б. и др. Геномная изменчивость и штамм-специфическая функциональная адаптация микробиома кишечника человека в раннем возрасте. Nat Microbiol. 2019; 4: 470–9.
CAS
Google Scholar
Raman AS, Gehrig JL, Venkatesh S, Chang HW, Hibberd MC, Subramanian S, et al. Единица разреженного коваринга, которая описывает развитие здоровой и нарушенной микробиоты кишечника человека. Наука. 2019; 365: eaau4735.
PubMed
PubMed Central
Google Scholar
Younge NE, Newgard CB, Cotten CM, Goldberg RN, Muehlbauer MJ, Bain JR, et al. Нарушение созревания микробиоты и метаболома у крайне недоношенных детей с послеродовой задержкой роста. Научный доклад 2019; 9: 8167.
PubMed
PubMed Central
Google Scholar
Лю Дж, Ли Й, Фэн Й, Пан Л, Се З, Янь З и др.Структурное прогрессирование микробиоты кишечника, связанное с некротическим энтероколитом и поздним сепсисом у недоношенных детей: проспективное исследование в отделении интенсивной терапии новорожденных в Китае. PeerJ. 2019; 7: e7310.
PubMed
PubMed Central
Google Scholar
Галаццо Дж., Ван Бест Н., Бервоетс Л., Дапаа И.О., Савелкул PH, Хорнеф М.В. и др. Развитие микробиоты и ассоциации с режимом рождения, диетой и атопическими расстройствами в продольном анализе образцов стула, собранных с младенчества до раннего детства.Гастроэнтерология. 2020; 158: 1584–96.
CAS
Google Scholar
Madan JC, Hoen AG, Lundgren SN, Farzan SF, Cottingham KL, Morrison HG, et al. Связь кесарева сечения и добавления смеси с кишечным микробиомом 6-недельных младенцев. JAMA Pediatr. 2016; 170: 212–9.
PubMed
PubMed Central
Google Scholar
Стюарт С.Дж., Аджами, штат Нью-Джерси, О’Брайен Д.Л., Хатчинсон Д.С., Смит Д.П., Вонг М.С. и др.Временное развитие микробиома кишечника в раннем детстве по данным исследования TEDDY. Природа. 2018; 562: 583–8.
CAS
PubMed
PubMed Central
Google Scholar
Combellick JL, Shin H, Shin D, Cai Y, Hagan H, Lacher C и др. Различия в фекальной микробиоте новорожденных, рожденных дома или в больнице. Научный доклад 2018; 8: 15660.
PubMed
PubMed Central
Google Scholar
Savage JH, Lee-Sarwar KA, Sordillo JE, Lange NE, Zhou Y, O’Connor GT и др. Диета во время беременности и младенчества и микробиом кишечника младенца. J Pediatr. 2018; 203: 47–54.e4.
PubMed
PubMed Central
Google Scholar
Лундгрен С.Н., Мадан Дж. К., Эмонд Дж. А., Моррисон Х. Г., Кристенсен BC, Карагас М. Р. и др. Диета матери во время беременности связана с микробиомом детского стула в зависимости от способа родов.Микробиом. 2018; 6: 109.
PubMed
PubMed Central
Google Scholar
Уильямс Дж. Э., Карротерс Дж. М., Лаки К. А., Битти Н. Ф., Брукер С. Л., Петерсон Х. К. и др. Между молочным, оральным и фекальным микробиомами в диадах мать-младенец существуют сильные многомерные отношения в течение первых шести месяцев после родов. J Nutr. 2019; 149: 902–14.
PubMed
PubMed Central
Google Scholar
Азад М.Б., Конья Т., Персо Р.Р., Гутман Д.С., Чари Р.С., Филд С.Дж. и др. Влияние антибиотиков во время родов, методов родов и грудного вскармливания на микробиоту кишечника в течение первого года жизни: проспективное когортное исследование. Int J Obstet Gynaecol. 2016; 123: 983–93.
CAS
Google Scholar
Coker MO, Hoen AG, Dade E, Lundgren S, Li Z, Wong AD, et al. Конкретный класс антибиотиков во время родов связан с созреванием микробиоты кишечника младенца: проспективное когортное исследование.Int J Obstet Gynaecol. 2020; 127: 217–27.
CAS
Google Scholar
Eck A, Rutten N, Singendonk MMJ, Rijkers GT, Savelkoul PHM, Meijssen CB, et al. Развитие микробиоты новорожденных и действие антибиотиков в раннем возрасте определяется двумя разными типами поселенцев. PloS ONE. 2020; 15: e0228133.
CAS
PubMed
PubMed Central
Google Scholar
Гупта Р.В., Тран Л., Норори Дж., Феррис М.Дж., Эрен А.М., Тейлор С.М. и др. Блокаторы рецепторов гистамина-2 изменяют фекальную микробиоту у недоношенных детей. J Pediatr Gastroenterol Nutr. 2013; 56: 397–400.
CAS
Google Scholar
Леви Э.И., Хоанг Д.М., Ванденплас Й. Влияние ингибиторов протонной помпы на микробиом у маленьких детей. Acta Paediatr. 2020; 109: 1531–8.
CAS
Google Scholar
Vich Vila A, Collij V, Sanna S, Sinha T, Imhann F, Bourgonje AR, et al. Влияние часто используемых лекарств на состав и метаболическую функцию микробиоты кишечника. Nat Commun. 2020; 11: 362.
CAS
PubMed
PubMed Central
Google Scholar
Джексон М.А., Верди С., Максан М.Э., Шин С.М., Цирер Дж., Бойер Р.Ц.и др. Связь микробиоты кишечника с распространенными заболеваниями и лекарствами, отпускаемыми по рецепту, в популяционной когорте.Nat Commun. 2018; 9: 2655.
PubMed
PubMed Central
Google Scholar
Iszatt N, Janssen S, Lenters V, Dahl C, Stigum H, Knight R, et al. Экологические токсиканты в грудном молоке норвежских матерей, а также состав и метаболиты кишечных бактерий у их младенцев в возрасте 1 месяца. Микробиом 2019; 7:34.
PubMed
PubMed Central
Google Scholar
Лауэ Х.Э., Моройши Ю., Джексон Б.П., Палис Т.Дж., Мадан Дж.К., Карагас МР.Смеси питательных и токсичных элементов и микробиом кишечника в раннем постнатальном периоде в когорте продольных рождений в США. Environ Int. 2020; 138: 105613.
CAS
Google Scholar
Маклин К., Джун С., Козырский А. Влияние курения матери на микробиоту кишечника младенца и его связь с избыточным весом ребенка: обзорный обзор. Мир J Pediatr. 2019; 15: 341–9.
Google Scholar
Tun HM, Konya T, Takaro TK, Brook JR, Chari R, Field CJ и др. Контакт с домашними пушистыми домашними животными влияет на микробиоту кишечника младенца в 3-4 месяца после различных сценариев рождения. Микробиом. 2017; 5: 40.
PubMed
PubMed Central
Google Scholar
D’Agata AL, Wu J, Welandawe MKV, Dutra SVO, Kane B, Groer MW. Влияние стресса ОИТН в раннем возрасте на развивающийся микробиом кишечника. Dev Psychobiol. 2019; 61: 650–60.
PubMed
PubMed Central
Google Scholar
Ho TTB, Groer MW, Kane B, Yee AL, Torres BA, Gilbert JA, et al. Дихотомическое развитие микробиома кишечника у недоношенных детей. Микробиом. 2018; 6: 157.
PubMed
PubMed Central
Google Scholar
Parra-Llorca A, Gormaz M, Alcantara C, Cernada M, Nunez-Ramiro A, Vento M и др. Микробиом кишечника недоношенных в зависимости от типа кормления: значение донорского грудного молока.Front Microbiol. 2018; 9: 1376.
PubMed
PubMed Central
Google Scholar
Taft DH, Salinero LK, Vongbhavit K, Kalanetra KM, Masarweh C, Yu A, et al. Бактериальная колонизация и гены устойчивости к противомикробным препаратам в трубках для энтерального питания новорожденных. FEMS Microbiol Ecol. 2019; 95: физ039.
CAS
PubMed
PubMed Central
Google Scholar
Ногачка А., Салазар Н., Суарес М., Милани С., Арболея С., Солис Г. и др.Влияние антимикробной профилактики во время родов на микробиоту кишечника и распространенность генов устойчивости к антибиотикам у доношенных новорожденных, родившихся через естественные родовые пути. Микробиом. 2017; 5: 93.
PubMed
PubMed Central
Google Scholar
Гаспаррини А.Дж., Крофтс Т.С., Гибсон М.К., Тарр П.И., Уорнер Б.Б., Дантас Г. Нарушение антибиотиками микробиома кишечника недоношенных детей и резистома. Кишечные микробы. 2016; 7: 443–9.
CAS
PubMed
PubMed Central
Google Scholar
Гибсон М.К., Ван Б., Ахмади С., Бернхэм Калифорния, Тарр П.И., Уорнер Б.Б. и др. Динамика развития микробиоты кишечника недоношенных новорожденных и антибиотикорезистома. Nat Microbiol. 2016; 1: 16024.
CAS
PubMed
PubMed Central
Google Scholar
Rutayisire E, Huang K, Liu Y, Tao F. Способ родов влияет на разнообразие и характер колонизации кишечной микробиоты в течение первого года жизни младенцев: систематический обзор.BMC Gastroenterol. 2016; 16:86.
PubMed
PubMed Central
Google Scholar
Dahl C, Stigum H, Valeur J, Iszatt N, Lenters V, Peddada S, et al. У недоношенных новорожденных есть различные микробиомы, которые не объясняются способом родов, продолжительностью грудного вскармливания или воздействием антибиотиков. Int J Epidemiol. 2018; 47: 1658–69.
PubMed
PubMed Central
Google Scholar
Tun MH, Tun HM, Mahoney JJ, Konya TB, Guttman DS, Becker AB. и другие. Послеродовое воздействие бытовых дезинфицирующих средств, микробиоты кишечника младенцев и последующий риск избыточного веса у детей. Can Med Assoc J. 2018; 190: E1097 – e107.
Google Scholar
Шоу К.А., Берта М., Хофмеклер Т., Чопра П., Ватанен Т., Шриватса А. и др. Дисбактериоз, воспаление и реакция на лечение: продольное исследование педиатрических субъектов с недавно диагностированным воспалительным заболеванием кишечника.Genome Med. 2016; 8: 75.
PubMed
PubMed Central
Google Scholar
Xia GH, You C, Gao XX, Zeng XL, Zhu JJ, Xu KY, et al. Индекс дисбактериоза инсульта (SDI) в микробиоме кишечника связан с травмой головного мозга и прогнозом инсульта. Фронт Neurol. 2019; 10: 397.
PubMed
PubMed Central
Google Scholar
Гуо Ю., Чжан Ю., Герхард М., Гао Дж. Дж., Мехиас-Луке Р., Чжан Л. и др.Влияние Helicobacter pylori на микробиоту желудочно-кишечного тракта: популяционное исследование в Linqu, зоне высокого риска рака желудка. Кишечник. 2019. https://doi.org/10.1136/gutjnl-2019-319696.
Casen C, Vebo HC, Sekelja M, Hegge FT, Karlsson MK, Ciemniejewska E, et al. Отклонения в микробиоте кишечника человека: новый диагностический тест для определения дисбактериоза у пациентов с СРК или ВЗК. Пищевая Pharmacol Therap. 2015; 42: 71–83.
CAS
Google Scholar
Мандл Т., Марсал Дж., Олссон П., Олссон Б., Андреассон К. Тяжелый кишечный дисбактериоз распространен при первичном синдроме Шегрена и связан с системной активностью заболевания. Arthritis Res Ther. 2017; 19: 237.
PubMed
PubMed Central
Google Scholar
Ватанен Т., Костич А.Д., д’Хеннезель Э., Сильяндер Х., Франзоса Э.А., Яссур М. и др. Вариабельность иммуногенности LPS микробиома способствует развитию аутоиммунитета у людей.Клетка. 2016; 165: 842–53.
CAS
PubMed
PubMed Central
Google Scholar
Ватанен Т., Франзоза Э.А., Швагер Р., Трипати С., Артур Т.Д., Вехик К. и др. Микробиом кишечника человека при диабете типа 1 с ранним началом из исследования TEDDY. Природа. 2018; 562: 589–94.
CAS
PubMed
PubMed Central
Google Scholar
Chua HH, Chou HC, Tung YL, Chiang BL, Liao CC, Liu HH, et al.Дисбактериоз кишечника с обилием ruminococcus gnavus ассоциируется с аллергическими заболеваниями у младенцев. Гастроэнтерология. 2018; 154: 154–67.
PubMed
PubMed Central
Google Scholar
Lee MJ, Kang MJ, Lee SY, Lee E, Kim K, Won S, et al. Нарушения генов микробиома кишечника у младенцев с атопическим дерматитом в зависимости от типа вскармливания. J Allergy Clin Immunol. 2018; 141: 1310–9.
CAS
PubMed
PubMed Central
Google Scholar
Ламонт РФ, Моллер Люф Б., Стенер Йоргенсен Дж. Воспалительные заболевания и нарушение обмена веществ у детей после воздействия антибиотиков во время беременности, антенатально, во время родов и в неонатальном периоде. F1000Res. 2020; 9: 144.
Google Scholar
Доухауэр Карпа К., Пол И.М., Леки Дж. А., Шунг С., Каркачи-Салли Н., Врана К. Е. и др. Обзор ретроспективной карты для выявления перинатальных факторов, связанных с пищевой аллергией. Нутр Дж. 2012; 11: 87.
PubMed
PubMed Central
Google Scholar
Metz TD, McKinney J, Allshouse AA, Knierim SD, Carey JC, Heyborne KD. Воздействие стрептококковой антибиотикопрофилактики группы B и индекс массы тела в раннем детстве в когорте вагинальных родов. J Matern Fetal Neonatal Med. 2020; 33: 3318–3323.
PubMed
PubMed Central
Google Scholar
Wohl DL, Curry WJ, Mauger D, Miller J, Tyrie K. Антибиотики во время родов и детский атопический дерматит. J Am Board Fam Med. 2015; 28: 82–9.
PubMed
PubMed Central
Google Scholar
Памми М., Коуп Дж., Тарр П.И., Уорнер Б.Б., Морроу А.Л., Май В. и др. Дисбактериоз кишечника у недоношенных детей, предшествующий некротическому энтероколиту: систематический обзор и метаанализ. Микробиом. 2017; 5:31.
PubMed
PubMed Central
Google Scholar
Olm MR, Bhattacharya N, Crits-Christoph A, Firek BA, Baker R, Song YS, et al.Некротическому энтероколиту предшествует усиленная репликация кишечных бактерий, клебсиелл и бактерий, кодирующих фимбрии. Sci Adv. 2019; 5: eaax5727.
CAS
PubMed
PubMed Central
Google Scholar
Esmaeilizand R, Shah PS, Seshia M, Yee W, Yoon EW, Dow K. Воздействие антибиотиков и развитие некротического энтероколита у очень недоношенных новорожденных. Педиатр детского здоровья. 2018; 23: e56 – e61.
PubMed
PubMed Central
Google Scholar
Esaiassen E, Fjalstad JW, Juvet LK, van den Anker JN, Klingenberg C. Воздействие антибиотиков у новорожденных и ранние неблагоприятные исходы: систематический обзор и метаанализ. J Antimicrob. Chemother. 2017; 72: 1858–70.
CAS
PubMed
PubMed Central
Google Scholar
Guillet R, Stoll BJ, Cotten CM, Gantz M, McDonald S, Poole WK, et al. Связь терапии h3-блокаторами и более высокой частоты некротического энтероколита у младенцев с очень низкой массой тела при рождении.Педиатрия. 2006; 117: e137–42.
PubMed
Google Scholar
Hewitt KM, Mannino FL, Gonzalez A, Chase JH, Caporaso JG, Knight R, et al. Бактериальное разнообразие в двух отделениях интенсивной терапии новорожденных (ОИТН). PloS ONE. 2013; 8: e54703.
CAS
PubMed
PubMed Central
Google Scholar
Бокулич Н.А., Миллс Д.А., Андервуд М.А. Поверхностные микробы в отделении интенсивной терапии новорожденных: изменения в процессе регулярной чистки и со временем.J Clin Microbiol. 2013; 51: 2617–24.
PubMed
PubMed Central
Google Scholar
Брукс Б., Олм М.Р., Файрек Б.А., Бейкер Р., Геллер-МакГрат Д., Реймер С.Р. и др. Развитие кишечного микробиома недоношенных детей является основным фактором, формирующим микробиом отделений интенсивной терапии новорожденных. Микробиом. 2018; 6: 112.
PubMed
PubMed Central
Google Scholar
Стюарт С.Дж., Эмблтон Н.Д., Маррс Э.Л., Смит Д.П., Фофанова Т., Нельсон А. и др. Продольное развитие кишечного микробиома и метаболома у недоношенных новорожденных с поздним началом сепсиса и у здоровых людей. Микробиом. 2017; 5: 75.
PubMed
PubMed Central
Google Scholar
Сингер JR, Blosser EG, Zindl CL, Silberger DJ, Conlan S, Laufer VA и др. Предотвращение дисбактериоза кишечного микробиома новорожденных мышей защищает от позднего сепсиса.Nat Med. 2019; 25: 1772–82.
CAS
PubMed
PubMed Central
Google Scholar
Маси А.С., Стюарт К.Дж. Роль кишечного микробиома недоношенных при сепсисе и некротизирующем энтероколите. Early Hum Dev. 2019; 138: 104854.
PubMed
PubMed Central
Google Scholar
Хемми М.Х., Вольке Д., Шнайдер С. Связь между проблемами с плачем, сном и / или кормлением в младенчестве и долгосрочными поведенческими результатами в детстве: метаанализ.Arch Dis Child. 2011; 96: 622–9.
PubMed
PubMed Central
Google Scholar
Loughman A, Quinn T., Nation ML, Reichelt A, Moore RJ, Van TTH, et al. Детская микробиота при коликах: предиктивные ассоциации с проблемным плачем и последующим поведением ребенка. J Dev Orig Health Dis. 2020: 1–11. https://doi.org/10.1017/S2040174420000227.
Huttenhower C, Kostic AD, Xavier RJ. Воспалительное заболевание кишечника как модель трансляции микробиома.Иммунитет. 2014; 40: 843–54.
CAS
PubMed
PubMed Central
Google Scholar
Mayer EA, Tillisch K, Gupta A. Ось кишечника / мозга и микробиота. J Clin исследования. 2015; 125: 926–38.
PubMed
PubMed Central
Google Scholar
Honda K, Littman DR. Микробиота в адаптивном иммунном гомеостазе и болезнях. Природа. 2016; 535: 75–84.
CAS
PubMed
PubMed Central
Google Scholar
Schroeder BO, Bäckhed F. Сигналы от микробиоты кишечника к отдаленным органам в физиологии и болезнях. Nat Med. 2016; 22: 1079–89.
CAS
PubMed
PubMed Central
Google Scholar
Леви М., Колодзейчик А.А., Тайс К.А., Элинав Э. Дисбактериоз и иммунная система. Nat Rev Immunol. 2017; 17: 219–32.
CAS
PubMed
PubMed Central
Google Scholar
Марувада П., Леоне В., Каплан Л. М., Чанг Е.Б. Микробиом человека и ожирение: выход за рамки ассоциаций. Клетка. Хост-микроб. 2017; 22: 589–99.
CAS
PubMed
PubMed Central
Google Scholar
Бах Дж.Ф. Гипотеза гигиены при аутоиммунных заболеваниях: роль патогенов и комменсалов. Nat Rev Immunol. 2018; 18: 105–20.
CAS
PubMed
PubMed Central
Google Scholar
Браун JM, Хазен SL. Микробная модуляция сердечно-сосудистых заболеваний. Nat Rev.2018; 16: 171–81.
CAS
Google Scholar
Тилг Х., Змора Н., Адольф Т.Е., Элинав Е. Кишечная микробиота, питающая метаболическое воспаление. Nat Rev Immunol. 2020; 20: 40–54.
CAS
PubMed
PubMed Central
Google Scholar
Якоб С., Якоб Д.Г. Инфекционные угрозы, кишечный барьер и его троянский конь: дисбактериоз.Front Microbiol. 2019; 10: 1676.
PubMed
PubMed Central
Google Scholar
Fouhse JM, Yang K, More-Bayona J, Gao Y, Goruk S, Plastow G, et al. Воздействие амоксициллина на новорожденных изменяет долгосрочный иммунный ответ, несмотря на временное воздействие на кишечную микробиоту у поросят. Фронт Иммунол. 2019; 10: 2059.
CAS
PubMed
PubMed Central
Google Scholar
Бомонт М., Паес С., Муссар Э., Кнудсен С., Каукиль Л., Эймард П. и др. Метаболиты кишечной микробиоты способствуют созреванию кишечного барьера при переходе от сосания к отъему. Кишечные микробы. 2020; 11: 1268–86.
PubMed
PubMed Central
Google Scholar
Сух Ш., Чхве К., Хонг С.П., Чон Ш., Мякинен Т., Ким К.С. и др. Микробиота кишечника регулирует целостность молочных желез, индуцируя VEGF-C в макрофагах ворсинок кишечника.EMBO Rep.2019; 20: e46927.
PubMed
PubMed Central
Google Scholar
Kulkarni DH, McDonald KG, Knoop KA, Gustafsson JK, Kozlowski KM, Hunstad DA, et al. Пассажи антигена, связанные с бокаловидными клетками, ингибируются во время инфекции Salmonella typhimurium, чтобы предотвратить распространение патогена и ограничить реакцию на пищевые антигены. Mucosal Immunol. 2018; 11: 1103–13.
CAS
PubMed
PubMed Central
Google Scholar
Abo H, Chassaing B, Harusato A, Quiros M, Brazil JC, Ngo VL, et al. Регулятор дифференцировки эритроидов-1, индуцированный микробиотой в раннем возрасте, управляет пролиферацией и регенерацией стволовых клеток кишечника. Nat Commun. 2020; 11: 513.
CAS
PubMed
PubMed Central
Google Scholar
Fung TC, Vuong HE, Luna CDG, Проновост Г.Н., Александрова А.А., Райли Н.Г. и др. Воздействие кишечного серотонина и флуоксетина модулирует бактериальную колонизацию кишечника.Nat Microbiol. 2019; 4: 2064–73.
PubMed
PubMed Central
Google Scholar
Canfora EE, Meex RCR, Venema K, Blaak EE. Метаболиты кишечных микробов при ожирении, НАЖБП и СД2. Обзоры природы. Эндокринология. 2019; 15: 261–73.
CAS
PubMed
PubMed Central
Google Scholar
Лау В.Л., Вазири Н.Д. Микробные короткоцепочечные жирные кислоты кишечника и риск диабета.Нат Рев Нефрол. 2019; 15: 389–90.
PubMed
PubMed Central
Google Scholar
Санна С., ван Зуйдам Н.Р., Махаджан А., Курильщиков А., Вич Вила А., Воса У и др. Причинно-следственные связи между микробиомом кишечника, короткоцепочечными жирными кислотами и метаболическими заболеваниями. Нат Жене. 2019; 51: 600–5.
CAS
PubMed
PubMed Central
Google Scholar
De Vadder F, Kovatcheva-Datchary P, Goncalves D, Vinera J, Zitoun C, Duchampt A, et al.Метаболиты, вырабатываемые микробиотой, улучшают метаболизм через нервные цепи кишечника и мозга. Клетка. 2014; 156: 84–96.
PubMed
PubMed Central
Google Scholar
Далиле Б., Ван Ауденхове Л., Вервлиет Б., Вербеке К. Роль короткоцепочечных жирных кислот в коммуникации между микробиотой, кишечником и мозгом. Нат Рев Гастроэнтерол Гепатол. 2019; 16: 461–78.
PubMed
PubMed Central
Google Scholar
Parada Venegas D, De la Fuente MK, Landskron G, Gonzalez MJ, Quera R, Dijkstra G и др. Короткоцепочечные жирные кислоты (SCFAs), опосредуемые эпителиальной и иммунной регуляцией кишечника, и ее значение при воспалительных заболеваниях кишечника. Фронт Иммунол. 2019; 10: 277.
PubMed
PubMed Central
Google Scholar
Frese SA, Hutton AA, Contreras LN, Shaw CA, Palumbo MC, Casaburi G, et al. Стойкость добавок Bifidobacterium longum subsp.Infantis EVC001 у младенцев на грудном вскармливании. мСфера. 2017; 2: e00501–17.
PubMed
PubMed Central
Google Scholar
Zheng N, Gao Y, Zhu W., Meng D, Walker WA. Короткоцепочечные жирные кислоты, образующиеся при взаимодействии кишечных комменсальных бактерий с сцеженным грудным молоком, обладают противовоспалительным действием в незрелых энтероцитах человека. PloS ONE. 2020; 15: e0229283.
CAS
PubMed
PubMed Central
Google Scholar
Waligora-Dupriet AJ, Dugay A, Auzeil N, Nicolis I, Rabot S, Huerre MR, et al. Короткоцепочечные жирные кислоты и полиамины в патогенезе некротического энтероколита: аспекты кинетики у гнотобиотических перепелов. Анаэроб. 2009; 15: 138–44.
CAS
PubMed
PubMed Central
Google Scholar
Рой С.К., Менг К., Садовиц Б.Д., Коллиш-Сингул М., Епури Н., Саталин Дж. И др. Энтеральное введение смеси, ферментированной бактериями, новорожденным поросятам: высокоточная модель некротического энтероколита (NEC).PloS ONE. 2018; 13: e0201172.
PubMed
PubMed Central
Google Scholar
Meng D, Sommella E, Salviati E, Campiglia P, Ganguli K, Djebali K, et al. Индол-3-молочная кислота, метаболит триптофана, секретируемый Bifidobacterium longum подвидом infantis, оказывает противовоспалительное действие в незрелом кишечнике. Pediatr Res. 2020. https://doi.org/10.1038/s41390-019-0740-x.
Mukhopadhyay S, Wade KC, Puopolo KM.Препараты для профилактики и лечения сепсиса у новорожденных. Clin Perinatol. 2019; 46: 327–47.
PubMed
PubMed Central
Google Scholar
Caballero-Flores G, Sakamoto K, Zeng MY, Wang Y, Hakim J, Matus-Acuña V, et al. Иммунизация матери обеспечивает защиту потомства от прикрепляющегося и удаляющегося патогена за счет доставки IgG с грудным молоком. Клетка. Хост-микроб. 2019; 25: 313–23.e4.
CAS
PubMed
PubMed Central
Google Scholar
Mukhopadhyay S, Sengupta S, Puopolo KM. Проблемы и возможности рационального использования антибиотиков среди недоношенных детей. Arch Dis Child. 2019; 104: F327 – f32.
Google Scholar
Шульман Дж., Диманд Р. Дж., Ли ХК, Дуэнас Г. В., Беннетт М. В., Гулд Дж. Б.. Использование антибиотиков в отделении интенсивной терапии новорожденных. Педиатрия. 2015; 135: 826–33.
PubMed
PubMed Central
Google Scholar
Шульман Дж., Профит Дж., Ли ХК, Дуэнас Дж., Беннетт М.В., Паруча Дж. И др. Варианты использования антибиотиков в неонатальном периоде. Педиатрия. 2018; 142: e20180115.
PubMed
PubMed Central
Google Scholar
Chi C, Buys N, Li C, Sun J, Yin C. Влияние пребиотиков на сепсис, некротический энтероколит, смертность, непереносимость кормления, время до полного энтерального питания, продолжительность пребывания в больнице и частоту стула в недоношенные дети: метаанализ.Eur J Clin Nutr. 2019; 73: 657–70.
CAS
PubMed
PubMed Central
Google Scholar
Sun J, Marwah G, Westgarth M, Buys N, Ellwood D, Gray PH. Влияние пробиотиков на некротический энтероколит, сепсис, внутрижелудочковое кровотечение, смертность, продолжительность пребывания в больнице и прибавку в весе у очень недоношенных детей: метаанализ. Adv Nutr. 2017; 8: 749–63.
PubMed
PubMed Central
Google Scholar
Deshpande G, Jape G, Rao S, Patole S. Преимущества пробиотиков у недоношенных новорожденных в странах с низким и средним доходом: систематический обзор рандомизированных контролируемых испытаний. BMJ Open. 2017; 7: e017638.
PubMed
PubMed Central
Google Scholar
Dermyshi E, Wang Y, Yan C, Hong W, Qiu G, Gong X и др. «Золотой век» пробиотиков: систематический обзор и метаанализ рандомизированных и наблюдательных исследований недоношенных детей.Неонатология. 2017; 112: 9–23.
CAS
PubMed
PubMed Central
Google Scholar
Olsen R, Greisen G, Schroder M, Brok J. Профилактические пробиотики для недоношенных детей: систематический обзор и метаанализ обсервационных исследований. Неонатология. 2016; 109: 105–12.
PubMed
PubMed Central
Google Scholar
Куанг Л., Цзян Ю. Влияние пробиотических добавок на беременных женщин: метаанализ рандомизированных контролируемых исследований.Br J Nutr. 2020; 123: 870–80.
CAS
Google Scholar
Skonieczna-Zydecka K, Janda K, Kaczmarczyk M, Marlicz W., Loniewski I., Loniewska B. Влияние пробиотиков на симптомы, микробиоту кишечника и маркеры воспаления при детской колике: систематический обзор, метаанализ и мета-регрессия рандомизированных контролируемых исследований. J Clin Med. 2020; 9: 999.
CAS
Google Scholar
van den Akker CHP, van Goudoever JB, Shamir R, Domellof M, Embleton ND, Hojsak I, et al. Пробиотики и недоношенные младенцы: позиционный документ Европейского общества педиатрической гастроэнтерологии, гепатологии и комитета по питанию по вопросам питания и рабочей группы Европейского общества детской гастроэнтерологии, гепатологии и питания по пробиотикам и пребиотикам. J Pediatr Gastroenterol Nutr. 2020; 70: 664–80.
Google Scholar
van den Akker CHP, van Goudoever JB, Szajewska H, Embleton ND, Hojsak I., Reid D., et al. Пробиотики для недоношенных детей: систематический обзор штаммов и сетевой метаанализ. J Pediatr Gastroenterol Nutr. 2018; 67: 103–22.
Google Scholar
Su GL, Ko CW, Bercik P, Falck-Ytter Y, Sultan S, Weizman AV, et al. Руководство AGA по клинической практике о роли пробиотиков в лечении желудочно-кишечных расстройств.Гастроэнтерология. 2020. https://doi.org/10.1053/j.gastro.2020.05.059.
Льюис З.Т., Шани Г., Масарве К.Ф., Попович М., Фрезе С.А., Села Д.А. и др. Подтверждение идентичности видов и подвидов бифидобактерий в коммерческих пробиотических продуктах. Pediatr Res. 2016; 79: 445–52.
CAS
Google Scholar
Chiang MC, Chen CL, Feng Y, Chen CC, Lien R, Chiu CH. Lactobacillus rhamnosus сепсис, связанный с терапией пробиотиками у крайне недоношенных новорожденных: патогенез и обзор для клиницистов.J Microbiol Immunol Infect. 2020. https://doi.org/10.1016/j.jmii.2020.03.029
Pell LG, Loutet MG, Roth DE, Sherman PM. Аргументы против рутинного приема пробиотиков для профилактики НЭК. Curr Opin Pediatrics. 2019; 31: 195–201.
Google Scholar
Кишечная микробиота и развитие детских заболеваний
Turnbaugh PJ, Ley RE, Hamady M, et al. Проект микробиома человека. Природа.2007. 449 (7164): 804–10.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Сюй Дж., Гордон Дж. Почитай симбионтов твоих. Proc Natl Acad Sci U S. A. 2003; 100 (18): 10452–9.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Гилл С.Р., Поп М., Дебой Р.Т. и др. Метагеномный анализ микробиома дистального отдела кишечника человека. Наука.2006. 312 (5778): 1355–9.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Палмер С., Бик Е.М., ДиДжиулио Д.Б. и др. Развитие кишечной микробиоты младенца у человека. PLoS Biol. 2007; 5 (7): e177.
PubMed Central
PubMed
Статья
Google Scholar
Azad MB, Konya T, Maughan H, et al. Микробиота кишечника младенцев и гигиеническая гипотеза аллергического заболевания: влияние домашних животных и братьев и сестер на состав и разнообразие микробиоты.Allergy Asthma Clin Immunol. 2013; 9 (1): 15.
PubMed Central
PubMed
Статья
Google Scholar
Виртанен С.М., Таккинен Х.М., Нвару Б.И. и др. Воздействие микробов в младенчестве и последующее появление аутоантител, связанных с сахарным диабетом 1 типа: когортное исследование. JAMA Pediatr. 2014. 168 (8): 755–63.
PubMed
Статья
Google Scholar
Harmsen HJ, Wildeboer-Veloo AC, Raangs GC, et al. Анализ развития кишечной флоры у детей, находящихся на грудном вскармливании и на искусственном вскармливании, с использованием методов молекулярной идентификации и обнаружения. J Pediatr Gastroenterol Nutr. 2000. 30 (1): 61–7.
CAS
PubMed
Статья
Google Scholar
Penders J, Thijs C, Vink C, et al. Факторы, влияющие на состав кишечной микробиоты в раннем детстве. Педиатрия. 2006. 118 (2): 511–21.
PubMed
Статья
Google Scholar
Тернбо П.Дж., Ридаура В.К., Фейт Дж.Дж. и др. Влияние диеты на микробиом кишечника человека: метагеномный анализ на гуманизированных гнотобиотических мышах. Sci Transl Med. 2009; 1 (6): 6ра14.
PubMed Central
PubMed
Статья
Google Scholar
Ву Г.Д., Чен Дж., Хоффманн С. и др. Связь долгосрочных диетических моделей с кишечными микробными энтеротипами.Наука. 2011. 334 (6052): 105–8.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Домингес-Беллоа М.Г., Костеллоб Е.К., Контрерас М. и др. Способ доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci U S. A. 2010; 107 (26): 11971–5.
CAS
Статья
Google Scholar
Jakobsson HE, Abrahamsson TR, Jenmalm MC и др. Снижение разнообразия кишечной микробиоты, задержка колонизации Bacteroidetes и снижение ответа Th2 у младенцев, рожденных с помощью кесарева сечения. Кишечник. 2014. 63 (4): 559–66.
CAS
PubMed
Статья
Google Scholar
Капоне К.А., Дауд С.Е., Стаматас Г.Н. и др. Разнообразие микробиома кожи человека в раннем возрасте. J Investigate Dermatol. 2011. 131 (10): 2026–2032.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Munyaka PM, Khafipour E, Ghia JE. Внешнее влияние на формирование микробиоты кишечника в раннем детстве и последующие последствия для здоровья. Фронт Педиатр. 2014; 2: 109.
PubMed Central
PubMed
Статья
Google Scholar
Жако А., Невё Д., Аужулат Ф. и др. Динамика и клиническая эволюция бактериальной микрофлоры кишечника у крайне недоношенных пациентов. J Pediatr. 2011. 158 (3): 390–6.
PubMed
Статья
Google Scholar
Fouhy F, Guinane CM, Hussey S, et al. Высокопроизводительное секвенирование показывает неполное краткосрочное восстановление микробиоты кишечника младенцев после парентерального лечения антибиотиками ампициллином и гентамицином. Противомикробные агенты Chemother. 2012. 56 (11): 5811–20.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Стюарт CJ, Marrs EC, Nelson A, et al. Развитие кишечного микробиома недоношенных близнецов с риском некротизирующего энтероколита и сепсиса.PLoS One. 2013; 8 (8): e73465.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Чанг Дж.Й., Антонопулос Д.А., Калра А. и др. Снижение разнообразия фекального микробиома при рецидивирующей диарее, связанной с Clostridium difficile. J Infect Dis. 2008. 197 (3): 435–8.
PubMed
Статья
Google Scholar
Детлефсен Л., Релман Д.А.Неполное восстановление и индивидуальные реакции микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков. Proc Natl Acad Sci U S. A. 2011; 108 (Приложение 1): 4554–61.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Рассел С.Л., Голд М.Дж., Хартманн М. и др. Изменения микробиоты в раннем возрасте, вызванные приемом антибиотиков, повышают восприимчивость к аллергической астме. EMBO Rep. 2012; 13 (5): 440–7.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Bailey LC, Forrest CB, Zhang P и др. Связь антибиотиков в младенчестве с ожирением в раннем детстве. JAMA Pediatr. 2014. 168 (11): 1063–9.
PubMed
Статья
Google Scholar
Рамакришна Б.С. Роль микробиоты кишечника в питании и метаболизме человека. J Gastroenterol Hepatol. 2013; 28 (Приложение 4): 9–17.
CAS
PubMed
Статья
Google Scholar
Collado MC, Isolauri E, Salminen S. Специфические штаммы пробиотиков и их комбинации противодействуют адгезии Enterobacter sakazakii к кишечной слизи. FEMS Microbiol Lett. 2008. 285 (1): 58–64.
CAS
PubMed
Статья
Google Scholar
Yu LC, Shih YA, Wu LL, et al. Кишечный дисбактериоз способствует развитию устойчивых к антибиотикам бактериальных инфекций: системного распространения устойчивых и комменсальных бактерий через эпителиальный трансцитоз.Am J Physiol Gastrointest Liver Physiol. 2014; 307 (8): G824–35.
CAS
PubMed
Статья
Google Scholar
Рудин А., Лунделл А.С. Память младенцев B-клеток и бактериальная колонизация кишечника. Кишечные микробы. 2012; 3 (5): 474–5.
PubMed Central
PubMed
Статья
Google Scholar
Mazmanian SK, Liu CH, Tzianabos AO, et al. Иммуномодулирующая молекула симбиотических бактерий направляет созревание иммунной системы хозяина.Клетка. 2005. 122 (1): 107–18.
CAS
PubMed
Статья
Google Scholar
Abrahamsson TR, Jakobsson HE, Andersson AF, et al. Низкое разнообразие кишечной микробиоты в раннем младенчестве предшествует астме в школьном возрасте. Clin Exp Allergy. 2014; 44 (6): 842–50.
CAS
PubMed
Статья
Google Scholar
Биззарро М.Дж., Эренкранц Р.А., Галлахер П.Г. Сопутствующие инфекции кровотока у младенцев с некротическим энтероколитом.J Pediatr. 2014. 164 (1): 61–6.
PubMed
Статья
Google Scholar
Май В., Янг С.М., Уханова М. и др. Микробиота кала у недоношенных детей до некротического энтероколита. PLoS One. 2011; 6 (6): e20647.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Claud EC, Keegan KP, Brulc JM, et al. Структура бактериального сообщества и функциональный вклад в возникновение некротического энтероколита у недоношенных детей.Микробиом. 2013; 1 (1): 20.
PubMed Central
PubMed
Статья
Google Scholar
Александр В.Н., Нортруп В., Биззарро М.Дж. Воздействие антибиотиков в отделении интенсивной терапии новорожденных и риск некротического энтероколита. J Pediatr. 2011. 159 (3): 392–7.
PubMed Central
PubMed
Статья
Google Scholar
Sullivan S, Schanler RJ, Kim JH, et al.Диета, основанная исключительно на грудном молоке, связана с более низким уровнем некротического энтероколита, чем диета на основе грудного молока и продуктов на основе коровьего молока. J Pediatr. 2010. 156 (4): 562e1–567e1.
Google Scholar
Бергманн К.Р., Лю С.Х., Тиан Р. и др. Бифидобактерии стабилизируют клаудины в плотных контактах и предотвращают дисфункцию кишечного барьера при некротическом энтероколите у мышей. Am J Pathol. 2013. 182 (5): 1595–606.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Prideaux L, Kamm MA, De Cruz PP, et al. Воспалительное заболевание кишечника в Азии: систематический обзор. J Gastroenterol Hepatol. 2012. 27 (8): 1266–80.
PubMed
Статья
Google Scholar
Диксвед Дж., Халфварсон Дж., Розенквист М. и др. Молекулярный анализ микробиоты кишечника однояйцевых близнецов с болезнью Крона. ISME J. 2008; 2 (7): 716–27.
CAS
PubMed
Статья
Google Scholar
Франк Д. Н., Сент-Аманд А. Л., Фельдман Р. А. и др. Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. Proc Natl Acad Sci U S. A. 2007; 104 (34): 13780–5.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Мартин Р., Чейн Ф, Микель С. и др. Комменсальная бактерия Faecalibacterium prausnitzii является защитной в моделях хронического умеренного и тяжелого колита, вызванного DNBS.Воспаление кишечника. 2014; 20 (3): 417–30.
PubMed
Статья
Google Scholar
Каллиомяки М., Колладо М.С., Салминен С. и др. Ранние различия в составе фекальной микробиоты у детей могут предсказать избыточный вес. Am J Clin Nutr. 2008. 87 (3): 534–8.
PubMed
Google Scholar
Чо И., Яманиши С., Кокс Л. и др. Антибиотики в раннем возрасте изменяют микробиом толстой кишки и ожирение мышей.Природа. 2012. 488 (7413): 621–6.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Райли Л.В., Рафаэль Э., Фаерштейн Э. Ожирение в Соединенных Штатах — дисбактериоз от воздействия низких доз антибиотиков? Фронт общественного здравоохранения. 2013; 1:69.
PubMed Central
PubMed
Статья
Google Scholar
Эге М.Дж., Майер М., Норманд А.С. и др.Воздействие микроорганизмов окружающей среды и детская астма. N Engl J Med. 2011; 364 (8): 701–9.
CAS
PubMed
Статья
Google Scholar
Страчан Д.П. Сенная лихорадка, гигиена и размер домочадца. BMJ. 1989. 299 (6710): 1259–60.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Smith PM, Garrett WS. Микробиота кишечника и Т-клетки слизистой оболочки.Front Microbiol. 2011; 2: 111.
PubMed Central
PubMed
Статья
Google Scholar
Каллиомяки М., Кирьявайнен П., Эерола Э и др. Отчетливые паттерны микрофлоры кишечника новорожденных у младенцев, у которых атопия развивалась и не развивалась. J Allergy Clin Immunol. 2001. 107 (1): 129–34.
PubMed
Статья
Google Scholar
Abrahamsson TR, Wu RY, Jenmalm MC.Микробиота кишечника и аллергия: важность периода беременности. Pediatr Res. 2015; 77 (1–2): 214–9.
PubMed
Статья
Google Scholar
Рассел С.Л., Голд М.Дж., Рейнольдс Л.А. и др. Перинатальные изменения микробиоты кишечника, вызванные приемом антибиотиков, по-разному влияют на воспалительные заболевания легких. J Allergy Clin Immunol. 2015; 135 (1): 100–9.
CAS
PubMed
Статья
Google Scholar
Abrahamsson TR, Jakobsson HE, Andersson AF, et al. Низкое разнообразие микробиоты кишечника у младенцев с атопической экземой. J Allergy Clin Immunol. 2012; 129 (2): 434–40.e2.
PubMed
Статья
Google Scholar
Иемоли Э, Трабаттони Д., Паризотто С. и др. Пробиотики уменьшают транслокацию кишечных микробов и улучшают атопический дерматит у взрослых. J Clin Gastroenterol. 2012; 46 (Прил.): S33–40.
PubMed
Статья
Google Scholar
Нермес М., Кантеле Дж. М., Атосуо Т. Дж. И др. Взаимодействие перорально вводимого Lactobacillus rhamnosus GG с микробиотой кожи и кишечника и гуморальным иммунитетом у младенцев с атопическим дерматитом. Clin Exp Allergy. 2011. 41 (3): 370–7.
CAS
PubMed
Статья
Google Scholar
Минемура М., Симидзу Ю. Микробиота кишечника и заболевания печени. Мир Дж. Гастроэнтерол. 2015; 21 (6): 1691–702.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Chou HH, Chien WH, Wu LL, et al. Возрастное иммунное очищение от инфекции вируса гепатита В требует установления микробиоты кишечника. Proc Natl Acad Sci U S. A. 2015; 112 (7): 2175–80.
CAS
PubMed
Статья
Google Scholar
Чен Й, Ян Ф, Лу Х и др. Характеристика фекальных микробных сообществ у пациентов с циррозом печени. Гепатология. 2011; 54 (2): 562–72.
PubMed
Статья
Google Scholar
Bajaj JS, Ridlon JM, Hylemon PB и др. Связь микробиома кишечника с познанием при печеночной энцефалопатии. Am J Physiol Gastrointest Liver Physiol. 2012; 302 (1): G168–75.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Fox JG, Feng Y, Theve EJ, Raczynski AR, et al. Кишечные микробы определяют риск рака печени у мышей, подвергшихся воздействию химических и вирусных трансгенных канцерогенов. Кишечник. 2010. 59 (1): 88–97.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Фурри Э., Макфарлейн С., Кеннеди А. и др. Синбиотическая терапия (Bifidobacterium longum / Synergy 1) инициирует разрешение воспаления у пациентов с активным язвенным колитом: рандомизированное контролируемое пилотное исследование. Кишечник. 2005. 54 (2): 242–9.
CAS
PubMed Central
PubMed
Статья
Google Scholar
Петроф Е.О., Кодзима К., Ропелески М.Дж. и др. Пробиотики ингибируют ядерный фактор-κB и индуцируют белки теплового шока в эпителиальных клетках толстой кишки посредством ингибирования протеасом. Гастроэнтерология. 2004. 127 (5): 1474–87.
CAS
PubMed
Статья
Google Scholar
Кикучи Ю., Кунито-Асари А., Хаякава К. и др. Пероральное введение штамма Lactobacillus plantarum AYA усиливает секрецию IgA и обеспечивает защиту выживания от инфицирования вирусом гриппа у мышей.PLoS One. 2014; 9 (1): e86416.
PubMed Central
PubMed
Статья
Google Scholar
Орландо А., Линсалата М., Нотарникола М. и др. Lactobacillus GG: восстановление индуцированного глиадином разрушения эпителиального барьера: роль клеточных полиаминов. BMC Microbiol. 2014; 14:19.
PubMed Central
PubMed
Статья
Google Scholar
Кунце В.А., Мао Ю.К., Ван Б. и др.Lactobacillus reuteri усиливает возбудимость нейронов АГ толстой кишки, ингибируя открытие кальцийзависимых калиевых каналов. J Cell Mol Med. 2009. 13 (8B): 2261–70.
PubMed
Статья
Google Scholar
Остин М., Меллоу М., Тирни В.М. Трансплантация фекальной микробиоты в лечении инфекций Clostridium difficile. Am J Med. 2014. 127 (6): 479–83.
PubMed
Статья
Google Scholar
Collado MC, Rautava S, Isolauri E, et al. Микробиота кишечника: источник новых средств для снижения риска заболеваний человека? Pediatr Res. 2015; 77 (1–2): 182–8.
PubMed
Статья
Google Scholar
Culligan EP, Sleator RD, Marchesi JR, et al. Функциональный экологический скрининг метагеномной библиотеки идентифицирует stlA; уникальный локус солеустойчивости из микробиома кишечника человека. PLoS One. 2013; 8 (12): e82985.
PubMed Central
PubMed
Статья
Google Scholar
Юн СС, Ким Е.К., Ли В.Дж. Функциональный геномный и метагеномный подходы к пониманию мутуализма кишечной микробиоты и животных. Curr Opin Microbiol. 2015; 24: 38–46.
CAS
PubMed
Статья
Google Scholar
Lakhdari O, Cultrone A, Tap J, et al. Функциональная метагеномика: метод высокопроизводительного скрининга для расшифровки модуляции NF-κB, вызванной микробиотой, в кишечнике человека. PLoS One. 2010; 5 (9): e13092.
Диагностика дисбактериоза
Дисбиоз — это состояние, при котором кишечные бактерии становятся несбалансированными, что приводит к широкому спектру нарушений пищеварения, включая вздутие живота, диарею, запоры и спазмы желудка, среди прочего.Это состояние было связано с различными заболеваниями, включая синдром раздраженного кишечника (СРК), воспалительное заболевание кишечника и гастрит, и это лишь некоторые из них.
Что такое дисбактериоз?
Дисбактериоз — это нарушение баланса кишечных бактерий. В результате возникает широкий спектр симптомов нарушения пищеварения, включая диарею, спазмы, запор, вздутие живота и несварение желудка. Когда наблюдается несоответствие нормальной микрофлоры кишечника из-за недостатка полезных бактерий и чрезмерного роста вредных бактерий, это может вызвать дисбактериоз.
В микробиоме кишечника обнаружено не менее 400 видов бактерий. Они необходимы для общего здоровья, поскольку помогают пищеварению, борются с патогенными микроорганизмами и синтезируют витамины. Нормальную флору тела можно найти в различных областях, и они необходимы для общего здоровья и хорошего самочувствия. Когда эти бактерии становятся несбалансированными, а вредные подавляют полезные бактерии или бесконтрольно разрастаются, это может вызвать болезнь.
Что вызывает дисбактериоз?
Существует множество факторов, которые могут привести к состоянию, включая чрезмерное или неправильное использование антибиотиков, чрезмерное употребление алкоголя, повышенное потребление сахара или белка, частое использование антацидов, воздействие пестицидов и хронический стресс, и это лишь некоторые из них.Кроме того, плохая гигиена полости рта и беспокойство также могут привести к дисбактериозу.
В некоторых случаях исследования связывают дисбактериоз с рождением через кесарево сечение и вскармливанием смеси среди новорожденных.
Признаки и симптомы дисбактериоза
Основными признаками и симптомами дисбактериоза являются нарушения пищеварения. Люди с этим заболеванием могут испытывать частые газы или вздутие живота. Это означает, что они ощущают вздутие живота почти все дни недели. Кроме того, они страдают от спазмов в животе, диареи и запоров со слизью в стуле.У них может быть сочетание диареи и запора, пищевой чувствительности, пищевой непереносимости и хронического неприятного запаха изо рта.
В некоторых случаях люди могут испытывать затруднение при мочеиспускании, вагинальный или ректальный зуд, боль в груди, сыпь, усталость, проблемы с концентрацией внимания, депрессию, беспокойство и туман в мозгу.
Диагностика дисбактериоза
Врач может диагностировать дисбактериоз на основании признаков и симптомов, истории болезни, физического осмотра и диагностических тестов. У человека может быть дисбактериоз, если у него или у нее есть диагноз синдрома раздраженного кишечника (СРК), длительное употребление антибиотиков в анамнезе, аутоиммунное заболевание или гастроэнтерит в анамнезе.Однако для подтверждения диагноза врач может порекомендовать следующие диагностические тесты:
Тесты на органическую кислоту
Врач порекомендует тест на органическую кислоту. Это делается путем сбора пробы мочи и ее исследования в лаборатории. Они будут искать и проверять определенные кислоты, которые выделяют бактерии в кишечнике. Аномальные уровни означают, что некоторые бактерии выходят из-под контроля.
Комплексный анализ пищеварительного стула (CDSA)
Полный анализ стула может дать наиболее глубокий анализ бактерий, как хороших, так и патогенных, которые обитают в кишечнике.Кроме того, исследование стула может определить наличие других оппортунистических инфекций, таких как паразитарные организмы.
Врач разрешит пациенту забрать домой специальное оборудование для сбора пробы стула. Затем образец будет отправлен в лабораторию. Стул будет исследован на наличие бактерий, дрожжей или грибков.
Водородный дыхательный тест
Водородный тест груди определяет наличие газов, производимых бактериями в кишечнике. В водородном дыхательном тесте врач разрешает пациенту выпить раствор глюкозы или сахара.После этого пациент дышит в специальный баллон, где воздух исследуется на наличие газов, производимых бактериями. Когда количество газов слишком велико или слишком много, это может указывать на дисбаланс кишечных бактерий.
Биопсия
Врач может взять образец бактериальной ткани из кишечника, где есть активная инфекция, чтобы увидеть, какой тип бактерий присутствует.
Лечение дисбактериоза — это больше, чем просто прием пробиотиков для поддержания баланса в кишечнике.Это как-то связано с правильным выбором пищи, отказом от определенных продуктов и занятий, ограничением потребления алкоголя или его полным искоренением. Соблюдение здоровой диеты и сокращение количества потребляемого сахара и пищевых добавок — многообещающий способ обуздать дисбактериоз и сохранить здоровье кишечника.
Дополнительная литература
Лечение синдрома раздраженного кишечника у детей
Хуан Р. Малагелада 1 * , Каролина Малагелада 1
1 Отдел исследования пищеварительной системы, Университетская больница Валь-д’Эброн, Центр биомедицинских исследований и красных энфермедадес Hepáticas y Digestivas (Ciberehd), Медицинский факультет Автономного университета Барселоны, Барселона, Испания
СРК — это клиническое состояние, включающее частые (≥4 дней в месяц) и хронические (> 2 месяцев) боли в животе и нарушение стула.Вздутие живота — частый и очень неприятный сопутствующий симптом. Диагноз устанавливается путем применения критериев симптомов, выясненных с помощью ряда медицинских экспертных групп (процесс «ROME» I, II, III и IV). Диагностические критерии для детей и взрослых очень похожи 1 . Что касается нарушений опорожнения кишечника, то у детей чаще встречается паттерн с преобладанием запора, чем с преобладанием диареи или смешанный, чередующийся паттерн запор / диарея 2-4 .Сдвиги модели во времени довольно обычны 3 .
К настоящему времени выявленные механизмы заболевания СРК многочисленны, разнообразны и не всегда полностью изучены. Патофизиологические особенности СРК, подтвержденные убедительными научными данными, включают висцеральную гиперчувствительность, нарушение моторики желудочно-кишечного тракта, воспаление кишечника, триггеры питания, дисбактериоз кишечника и нарушения оси кишечник-мозг. Таким образом, СРК может рассматриваться патогенетически как неоднородное заболевание, как было недавно рассмотрено 5 .Семейная агрегация часто заметна, но неясно, является ли причиной этого генетическое или экологическое влияние, включая повышенное осознание ощущений в животе.
СРК довольно часто встречается как у детей, так и у взрослых. Хорошо проведенное, хотя и относительно более старое исследование показало, что 14% учащихся средних школ и 6% учащихся средних школ в США страдают от симптомов, соответствующих IBS 6 . Более свежие данные в целом подтверждают очень высокую распространенность СРК у детей 2, 4, 7 и, следовательно, высокое экономическое бремя 8 .В клинической практике диагноз СРК нередко применяется довольно свободно, поскольку СРК определяется исключительно по относительно сложной формуле симптома без поддающегося проверке биологического маркера. Поэтому клиницисты иногда наносят ярлык IBS на любого пациента без признаков «определенного» органического заболевания, который жалуется на неострую боль в животе в сочетании с измененным типом опорожнения кишечника. Как указано Quigley & Shanahan 9 , такое заболевание, как СРК, которое определяется исключительно критериями симптомов, может создавать иллюзию понимания и приравнивать жалобы к «заболеванию».Этот аспект может быть особенно актуален для детей, у которых симптомы могут проявляться расплывчато и непоследовательно. У этой возрастной группы пациентов также может быть трудно определить реальную «интенсивность жалоб». Важны стрессовые события, влияющие на ребенка и семью, а также отношения и факторы окружающей среды 10, 11 .
Целесообразно осмотрительное и тщательно взвешенное применение диагностических тестов. Сначала следует попытаться поставить «положительный» диагноз СРК, основанный на критериях симптомов, а не «исключающий» диагноз СРК, как это традиционно делается, потому что последний предполагает гораздо более высокие ятрогенные риски и / или экономическое бремя.Тем не менее, некоторые базовые методы оценки оправданы, если есть сомнения, если давление со стороны семьи является значительным, если быстрое решение не достигается применением терапевтических мер первой линии и, конечно, если наблюдаются тревожные клинические признаки. Первые широко применяемые диагностические обследования включают анализ крови, проверку стула на наличие паразитов или крови, ультразвуковое исследование брюшной полости и эндоскопическое обследование желудочно-кишечного тракта.
Клиницисты, обследующие ребенка с абдоминальными симптомами, также должны обращать внимание на внекишечные проявления и сопутствующие заболевания, такие как усталость, головные боли, мочевые и скелетно-мышечные симптомы и т. Д., Как показали исследования СРК у взрослых 12 .Совпадение этих различных симптоматических проявлений у одного и того же человека предполагает, что участие ЦНС искажает и интегрирует периферические входы, что приводит к концепции центральных сенсибилизирующих расстройств, которые могут включать СРК. Действительно, у детей с хроническими симптомами пищеварения наблюдается преувеличенная реакция ствола мозга на окружающие стимулы, а неадекватное поведение родителей, по-видимому, усугубляет симптомы 13 . И наоборот, кажущееся спонтанное разрешение СРК не редкость 14 .
Ярлык СРК в современном гиперкоммуникационном обществе может также включать концептуальные элементы «мема», распространяющегося посредством заражения среди клиницистов, родственников или опекунов детей 15 . Сами симптомы могут быть потенциально усилены окружением ребенка и даже медицинским персоналом, стремящимся установить диагноз у ребенка с необъяснимыми в противном случае жалобами на брюшную полость. Этот механизм может объяснить растущую распространенность диагноза СРК в западных обществах как у детей, так и у взрослых.
При рассмотрении лечения СРК может быть полезно попытаться выяснить патогенетический механизм или, по крайней мере, преобладающее патофизиологическое нарушение, действующее у отдельных пациентов, поскольку подход, основанный на механизме, вероятно, повышает терапевтическую эффективность. 5 .
Диета может выступать как индуктор симптомов, так и терапевтическая возможность. Само собой разумеется, что не все дети одинаково переносят несколько компонентов нормальной диеты.Специфическая пищевая аллергия может проявляться клинически очевидным образом, что не оставляет сомнений в их патогенетической роли. Однако более тонкие формы иммунных взаимодействий между питательными веществами и клетками могут лежать в основе симптомов, подобных СРК 16, 17 . Задача состоит в том, чтобы установить определенную ответственность за определенные пищевые продукты в возникновении симптомов, когда простое наблюдение дает только двусмысленные ответы. В настоящее время доступен ряд коммерческих тестов под названием «тесты на пищевую непереносимость».К ним относятся аллерген-специфическая реакция IgG на различные продукты питания, электродермальные тесты, сублингвальные или внутрикожные тесты, цитотоксические тесты и другие. Хотя некоторые из этих тестов вызвали интерес у врачей и, в частности, у широкой общественности, они не получили твердого научного одобрения, и есть сомнения относительно того, действительно ли результаты тестов отражают клинически значимую непереносимость. Кроме того, растет беспокойство по поводу того, что необоснованные и радикальные ограничения в диете могут привести к дисбалансу питания, включая накопление токсичных веществ металлических элементов (т.е. ртуть) в крови и тканях 18 .
Неаллергическая пищевая непереносимость в основном связана с ограниченной способностью кишечника переваривать и поглощать сахар и другие обычные пищевые компоненты. Истинная непереносимость лактозы в основном связана с низкой доступностью лактазы в кишечнике, но клинически проявляется только при относительно больших нагрузках лактозы, поэтому предупрежденных пациентов легко ее избежать. 19 . Фруктоза, моносахарид, присутствующий во многих обработанных пищевых продуктах, имеет относительно низкий порог абсорбции в тонком кишечнике человека, и, следовательно, диета, богатая фруктозой, может вызывать симптомы кишечника у восприимчивых людей за счет стимуляции перистальтики кишечника 20 .Психологические факторы могут влиять на симптоматическую реакцию на мальабсорбцию сахара, поскольку это хорошо задокументировано для лактозы 21 . Таким образом, субъективная оценка симптомов представляет собой потенциальное искажающее клиническое влияние, которое необходимо принимать во внимание.
Механизмы абдоминальных симптомов, развивающихся в контексте мальабсорбции питательных веществ, включают увеличение количества выделений из тонкой кишки, попадающих в толстую кишку 22 . В свою очередь, эти молекулы ферментируются бактериями толстой кишки, увеличивая выработку газа в толстой кишке и вырабатывая осмотические стимуляторы и стимуляторы моторики, которые вызывают выделения из толстой кишки и спазматическую деятельность кишечника.В дополнение к лактозе и фруктозе в нормальном рационе есть много не полностью усвояемых углеводов, которые при определенных обстоятельствах могут также вызывать перегрузку толстой кишки ферментируемыми субстратами, генерирующими газ, что плохо переносится пациентами с СРК. К ним относятся группа, известная как FODMAP (фруктаны, галакто-сахариды и полиолы, включая сорбит, маннит и ксилит), которые естественным образом присутствуют во многих фруктах и овощах, а также в таких добавках, как искусственные подсластители (рис. 1).Накоплены существенные доказательства того, что диета, ограничивающая компоненты FODMAP, облегчает симптомы СРК. Респондеры, по-видимому, содержат больше видов сахаролитических бактерий в своем микробиоме 23 . К сожалению, длительная выдержка этой и других строго ограничительных диет обременительна для многих пациентов. Более того, было высказано предположение, что обычные и разумные ограничения в диете могут быть столь же эффективными, как и строгая диета FODMAP, хотя этот вопрос все еще является предметом обсуждения 24 .Последний подход может заключаться в отказе от молочных продуктов, жирной пищи, напитков с искусственными подсластителями или напитков, содержащих кофеин.
По этой теме есть два аспекта, которые имеют отношение к патогенезу и лечению СРК. Во-первых, это проблема постинфекционного СРК, хорошо задокументированная эпидемиологическими исследованиями у людей, как детей, так и взрослых, 25 , ранее пострадавших от инфекционного гастроэнтерита. Примерно у 10% (цифры различаются) таких людей впоследствии развиваются симптомы, совместимые с СРК 26 .Лямблиоз также представляет собой признанный фактор риска 27, 28 . Молодой возраст, психологические расстройства, предшествующее лечение антибиотиками и другие факторы, по-видимому, предрасполагают к постинфекционному гастроэнтериту. СРК-подобный синдром 29 . Патогенетические факторы включают активацию иммунных клеток слизистой оболочки и пролиферацию иммунных клеток, которые могут усиливать периферическую сенсорную передачу сигналов и приводить к висцеральной гиперчувствительности 30 . Примечательно, что некоторые формы инфекционного гастроэнтерита в детстве, например, вызванные видами Salmonella, увеличивают вероятность развития СРК во взрослом возрасте 31 .
Второй аспект микробного воздействия на патогенез СРК связан с нарушениями микробиома. С этой целью необходимо учитывать две ситуации: чрезмерная микробная транслокация в тонкую кишку (избыточный бактериальный рост в тонкой кишке — SIBO-) и изменения в экологии микробиома. Доказательства SIBO получены в основном из анализа дыхательного теста. К сожалению, быстрый транзит тестового субстрата через тонкую кишку может вызвать ранний пик сигнала из-за раннего поступления субстрата в толстую кишку, что может быть ошибочно интерпретировано как внутрипросветная ферментация тонкой кишки 32 .Изменения в микробиоме толстой кишки также вовлечены в патогенез СРК. В самом деле, некоторые виды микробиома человека могут влиять на функцию кишечника и даже потенциально изменять взаимодействие кишечника с мозгом. Например, было замечено, что F. prausnitzii может модулировать гиперчувствительность толстой кишки, а Lactobacillus reuterii участвует в регуляции транзита через толстую кишку 33 . Изменения микробиоты, наблюдаемые при постинфекционном СРК, включают повышенное присутствие типа Bacteroidetes, который напоминает состав микробиоты, наблюдаемый при СРК с преобладанием диареи 34 .Однако для прояснения этих аспектов потребуются дальнейшие исследования, поскольку текущие данные являются предварительными и все еще не могут быть приняты как окончательные.
Усилия по восстановлению микробной экологии включают применение антибиотиков, пребиотиков и пробиотиков. Антибиотики были предложены для лечения предполагаемого СИБР, а также для «исправления» состава микробиома. В этом отношении предпочтение отдается рифаксимину на основании его неабсорбируемости и эмпирических данных об эффективности. У взрослых относительно высокие дозы от 800 до 1650 мг / день в течение 10-14 дней, по-видимому, улучшают общую симптоматику СРК и вздутие живота, связанное с СРК.Данные у детей предполагают, что рифаксимин может быть особенно полезным у пациентов с положительным результатом дыхательного теста на лактулозу 35, 36 . Клинически благоприятный модулирующий эффект рифаксимина, в отличие от ранее испытанных и бесполезных антибиотиков широкого спектра действия, интригует. Это может быть связано с более высокими внутрипросветными концентрациями в кишечнике, достигаемыми с помощью рифаксимина из-за его неабсорбируемости 37 . Дополнительным фактором может быть предполагаемое специфическое действие рифаксимина на бактериальную вирулентность и бактериальную метаболическую активность.В свою очередь, они могут уменьшить висцеральную гиперчувствительность и уменьшить гипералгезию.
Пробиотики в настоящее время пользуются большой популярностью среди пациентов и многих врачей из-за интуитивной привлекательности предполагаемого механизма действия и присущей им безопасности (хотя по этому последнему вопросу были высказаны некоторые сомнения). Однако, хотя экспериментальные данные иногда подтверждали их противовоспалительное, антиноцицептивное и даже модифицирующее действие на поведение и настроение мозга, результаты клинических исследований остаются двусмысленными, а иногда и противоречивыми.Как указали Шанахан и Куигли, 38 существует множество мягких заявлений о пробиотиках, включая непроверенные этикетки, пробелы между результатами исследований и заявлениями на рынке. Также неудовлетворены утверждения на этикетке о количестве и типах жизнеспособных микробов, а также о спецификациях на полке относительно выживаемости упакованных микробных продуктов. Хотя некоторые пробиотики прошли хорошо спланированные и надежные испытания с положительными результатами, сообщалось о других безуспешных испытаниях. У детей Francavilla et al. 39 показали положительный ответ на Lactobacillus GG, а другие исследователи также на Lactobacillus reuterii, VSL # 3, Bifidobacterium infantis, brevis и longum 40 .Ясно, что только дальнейшие качественные исследования могут подтвердить реальную ценность пробиотиков в терапии СРК.
Пребиотики — это пищевые продукты, которые способствуют размножению видов бактерий, которые потенциально уменьшают воспаление слизистой оболочки. У пребиотиков есть теоретический недостаток, заключающийся в том, что они могут способствовать образованию газа посредством внутрипросветной ферментации. Однако недавние данные показывают, что это может быть временным явлением, которое задерживает, но не устраняет их в остальном благоприятные эффекты 41 .
Воспалительная основа симптомов типа СРК подтверждена прямыми доказательствами измененной иммунной активности слизистых оболочек, наличия инфильтратов иммунных клеток слизистой оболочки, пролиферации тучных клеток в непосредственной близости от нервных окончаний, повышенной проницаемости апикального соединения и других признаков 16, 17, 42 .Эти воспалительные реакции могут быть результатом постинфекционной, аллергической или идиопатической кишечной реакции. Клинические данные о симптоматике СРК, развивающейся у лиц с атопией, с астматическими, кожными или другими тканевыми иммунными воспалительными реакциями или без них, растут. Также сообщалось об индуцированной микробами иммунной активности слизистой оболочки, связанной с конкретными видами бактерий в кишечнике 43 .
Несмотря на соблазнительный экспериментальный фон, введение противовоспалительных средств для облегчения клинических проявлений СРК пока не имело большого клинического успеха.Кортикостероиды, месалазин и другие противовоспалительные средства не показали особой эффективности 44 . Только стабилизатор тучных клеток кетотифен, по-видимому, дал предварительные положительные результаты 45 .
Теоретическая модель «двух мозгов», которая предполагает, что центральный мозг работает совместно с кишечным мозгом, чтобы контролировать и регулировать функцию кишечника, остается не полностью определенной и лишь частично подтвержденной экспериментальными данными. Однако это мощная концепция и потенциально полезная в клиническом ведении, поскольку она обеспечивает основу для фармакологического вмешательства по центрально-периферической оси 46 .Важным дополнительным элементом, который следует учитывать, является тесное и хорошо установленное взаимодействие между нервной и иммунной системами в кишечнике 47 .
При функциональных состояниях, таких как СРК, боль — это субъективное переживание, которое, даже если возникает из-за ноцицептивных раздражителей в кишечнике, формируется механизмами, действующими в различных слоях вдоль оси мозг-кишечник. Усиление и искажение афферентных сигналов из-за воспаления, сенсибилизации и других местных факторов приводит к нарушению передачи сигналов о боли.Кроме того, нарушение модуляции боли по нисходящей линии дополнительно усиливает входные сигналы в центральные цепи для восприятия и модуляции боли. Между эмоциями и когнитивной модуляцией боли существует ключевая связь, которая подчеркивает сильное влияние стресса и тревоги на восприятие висцеральных сигналов. Следовательно, боль в животе, являющаяся признаком СРК, вероятно, является результатом комбинации нарушенной периферической передачи сигналов и нарушенной модуляции эмоциональной боли 48 .
Управление болью при СРК смещается в сторону агентов, которые модулируют висцеральную гиперчувствительность, проявляя свои действия, все еще плохо изученные, на различных участках оси кишечник-мозг.В связи с этим было указано, что интенсивность и рефрактерность боли, проявляемой пациентами, могут указывать на преобладающий механизм ноцицепции. Вообще говоря, более интенсивные и непрекращающиеся уровни боли указывают на большее вовлечение головного мозга в отличие от абдоминальных механизмов 48 . Следовательно, в тяжелых случаях существует большая потребность в использовании нейрофармакологических агентов, действующих на центральном уровне. В этом отношении блокаторы ГАМК и антидепрессанты, особенно те, которые обладают ингибирующим действием на обратный захват норадреналина, кажутся особенно эффективными.Классические трициклические антидепрессанты, такие как амитриптилин, нортриптилин и дезипрамин, которые включают в себя несколько целевых механизмов, также могут быть полезны, хотя они, как правило, связаны с более неприятными побочными эффектами, такими как сонливость, антихолинергические системные эффекты и гипотония. Важно титрование дозы. Некоторые классы антидепрессантов действуют на определенные рецепторы, что делает их особенно полезными при определенных жалобах. Например, сродство миртазапина к h2-рецепторам можно использовать для коррекции бессонницы и увеличения веса.Среди ингибиторов ГАМК прегабалин оказывает сильное ингибирующее действие на генерализованную тревогу и ноцицепцию, что может быть весьма полезным 49 .
Практическую полезность нейрофармакологических агентов для лечения боли нельзя легко отделить от их воздействия на основное тревожное / депрессивное расстройство. Однако относительно низкие дозы этих препаратов, которые обычно используются для лечения СРК, обычно ниже, чем обычные для лечения психических состояний, если только психопатологический компонент не требует полного использования психотропов.
Психологические подходы, включая поведенческую терапию, были с энтузиазмом предложены как немедикаментозный подход к коррекции эмоционального компонента расстройств функционального типа. К ним относятся психотерапия для облегчения вызванной стрессом тревоги, такая как когнитивно-поведенческая терапия и психодинамическая терапия. Гипнотерапия, проводимая хорошо обученным терапевтом, может помочь ребенку погрузиться в состояние транса. Сообщается, что эти официально проводимые психологические методы лечения достигли значительного успеха и все чаще применяются сегодня.Однако клиницисты должны знать о высокой частоте ответа на плацебо, наблюдаемой в большинстве контролируемых исследований СРК и связанных состояний (30–70%). Кроме того, более структурированные психотерапевтические подходы требуют много времени, а их долгосрочная эффективность остается недоказанной.
На периферическом уровне препараты, воздействующие на моторную и / или секреторную функцию, уже давно используются для облегчения боли, а также для уменьшения характерного характера дефекации при СРК, будь то запор и / или диарея, которые, препятствуя упорядоченному движению, могут вызывать боль. .В эту группу средств входят классические спазмолитики, антидиарейные и слабительные средства различных типов. Санкционированное временем использование таких агентов, свидетельствующее об их популярности, не предполагает доказанной клинической эффективности. В частности, классические спазмолитики с антихолинергическим действием (следовательно, с неприятными побочными эффектами) и неантихолинергические спазмолитики (в первую очередь блокаторы кальциевых каналов), такие как мебеверин и отилония бромид, хотя и широко используются, имеют лишь слабые научные доказательства их клинической эффективности.
Обычно используются обычные противодиарейные средства, такие как лоперамид, но при диарее, связанной с СРК, их трудно модулировать, и они проявляют склонность к ускорению запора, что беспокоит пациента, который обычно ожидает более стабильного регулирующего воздействия на дефекацию 7 .
Диарея при СРК также может быть вызвана или усугублена мальабсорбцией желчных кислот с перетеканием в толстую кишку, где эти молекулы, особенно в их неконъюгированной форме (как побочные продукты бактериального гидролиза), раздражают слизистую оболочку толстой кишки и вызывают отток воды 50 .Избыточное выделение желчных кислот может быть результатом либо аномально ускоренного транзита по тонкому кишечнику, либо нарушения слизистой оболочки подвздошной кишки со снижением реабсорбции желчных кислот подвздошной кишки или перепроизводства печенью. Независимо от конкретного механизма, оральные секвестранты желчных кислот, действующие внутримышечно, такие как холестирамин и более приятный на вкус продукт колесевелам, могут помочь контролировать диарею 51 . Тщательное титрование доз этих агентов необходимо для предотвращения неоправданного перехода к запорам и вздутию живота.
Элюксадолин представляет собой комплексный активатор опиодных рецепторов, который оказался полезным в качестве противодиарейного и антиноцицептивного средства при СРК-D 52 . Его эффекты более тонкие, чем у традиционного противодиарейного средства лоперамида, но он показал тревожную, хотя и необычную, склонность к панкреатиту, хотя в основном у холецистэктомированных пациентов.
Терапевтический эффект обычных слабительных средств у детей сложно изменить. Растворы ПЭГ являются предпочтительным агентом.Появляются новые потенциально полезные агенты. Линаклотид, агонист энтеральной гуанилатциклазы, и любипростон, аналог простагландина Е, способствуют выведению воды в кишечник. Кроме того, они обладают предполагаемым антиноцицептивным действием, что делает их пригодными для лечения СРК-З. К сожалению, несмотря на то, что они весьма полезны для взрослых, до сих пор ни один из этих двух агентов не одобрен для терапевтических целей у детей (и даже сообщалось о некоторых отрицательных эффектах любипростона в этой молодой возрастной группе) 53 .
Семейное окружение может положительно или отрицательно влиять на проявление детьми симптомов СРК. Похоже, что парентеральное отношение, моделирование симптомов, методы совладания, психологические особенности и подверженность семье стрессу могут потенциально влиять на сообщения о желудочно-кишечных и не желудочно-кишечных симптомах детьми 54 . Таким образом, привлечение родителей и, возможно, других членов семьи для помощи в изменении поведения ребенка в связи с болезнью и его симптомов, влияющих на повседневную деятельность, имеет определенную теоретическую основу.Однако исследований, подтверждающих терапевтическую пользу вмешательства через родственников, еще предстоит провести.
- Камиллери М., Ди Лоренцо С. Ось мозга и кишечника: от базового понимания до лечения СРК и связанных с ним расстройств. J Pediatr Gastroenterol Nutr. 2012; 54: 446-53.
- Self MM, Czyzewski DI, Chumpitazi BP, et al. Подтипы синдрома раздраженного кишечника у детей и подростков. Клин Гастроэнтерол Гепатол. 2014; 12: 1468-73.
- Giannetti E, de’Angelis G, Turco R, et al.Подтипы синдрома раздраженного кишечника у детей: распространенность при постановке диагноза и при последующем наблюдении. J Pediatr. 2014; 164: 1099-1103 e1.
- Saps M, Velasco-Benitez CA, Bloom PJJ, et al. Проспективное исследование желудочно-кишечных симптомов у школьников Южной Америки. J Pediatr Gastroenterol Nutr. 2018; 66: 391-394.
- Малагелада Дж. Р., Малагелада С. Механизмно-ориентированная терапия синдрома раздраженного кишечника. Достижения в терапии. 2016; 33: 877-893.
- Hyams JS, Burke G, Davis PM, et al.Боль в животе и синдром раздраженного кишечника у подростков: исследование на уровне сообщества. J Pediatr. 1996; 129: 220-6.
- Sandhu BK, Paul SP. Синдром раздраженного кишечника у детей: патогенез, диагностика и доказательное лечение. Мир Дж. Гастроэнтерол. 2014; 20: 6013-23.
- Hoekman DR, Rutten JM, Vlieger AM, et al. Годовые затраты на лечение синдрома раздраженного кишечника у детей, функциональной боли в животе и синдрома функциональной боли в животе. J Pediatr. 2015; 167: 1103-8 e2.
- Куигли Е.М., Шанахан Ф. Язык медицины: слова как слуги и негодяи. Clin Med (Лондон). 2009; 9: 131-135.
- Philips EM, Peeters B, Teeuw AH, et al. Стрессовые жизненные события у детей с функциональными нарушениями дефекации. J Pediatr Gastroenterol Nutr. 2015; 61: 384-92.
- Chogle A, Mintjens S, Saps M. Педиатрический IBS: обзор патофизиологии, диагностики и лечения. Pediatr Ann. 2014; 43: e76-82.
- Чанг Л., Берман С., Майер Е.А. и др.Ответы мозга на висцеральные и соматические раздражители у пациентов с синдромом раздраженного кишечника с фибромиалгией и без нее. Am J Gastroenterol. 2003; 98: 1354-61.
- Сейно С., Ватанабе С., Ито Н. и др. Повышенная слуховая реакция ствола мозга и стиль родительской привязанности у детей с желудочно-кишечными симптомами. PLoS One. 2012; 7: e32913.
- Giannetti E, Maglione M, Sciorio E, et al. Вырастают ли дети из-за синдрома раздраженного кишечника. J Pediatr. 2017; 183: 122-126.e1.
- Росс SE. «Мемы» как возбудители психосоматических заболеваний. Ann Intern Med. 1999; 131: 867-71.
- Matricon J, Meleine M, Gelot A и др. Обзорная статья: Связь между активацией иммунной системы, кишечной проницаемостью и синдромом раздраженного кишечника. Алимент Pharmacol Ther. 2012; 36: 1009-31.
- Cremon C, Gargano L, Morselli-Labate AM и др. Иммунная активация слизистой оболочки при синдроме раздраженного кишечника: гендерная зависимость и связь с пищеварительными симптомами.Am J Gastroenterol. 2009; 104: 392-400.
- Элли Л., Росси В., Конте Д. и др. Повышенный уровень ртути у пациентов с глютеновой болезнью после безглютеновой схемы. Гастроэнтерол Рес Прак. 2015; 2015: 953042.
- Итан Ю., Джонс Б.Л., Инграм С.Дж. и др. Мировая корреляция фенотипа и генотипов персистенции лактазы. BMC Evol Biol. 2010; 10: 36.
- Мэдсен Дж. Л., Линнет Дж., Румессен Дж. Дж. Влияние неабсорбированных количеств смеси фруктозы и сорбита на транзит через тонкий кишечник у здоровых добровольцев.Dig Dis Sci. 2006; 51: 147-53.
- Casellas F, Aparici A, Casaus M и др. Субъективное восприятие непереносимости лактозы не всегда указывает на нарушение всасывания лактозы. Клин Гастроэнтерол Гепатол. 2010; 8: 581-6.
- Мюррей К., Уилкинсон-Смит В., Хоад С. и др. Дифференциальные эффекты FODMAP (ферментируемые олиго-, ди-, моносахариды и полиолы) на содержимое тонкого и толстого кишечника у здоровых людей, показанные с помощью МРТ. Am J Gastroenterol. 2014; 109: 110-9.
- Chumpitazi BP, Cope JL, Hollister EB, et al.Рандомизированное клиническое исследование: биомаркеры кишечного микробиома связаны с клинической реакцией на диету с низким содержанием FODMAP у детей с синдромом раздраженного кишечника. Алимент Pharmacol Ther. 2015; 42: 418-27.
- Бон Л., Стёрсруд С., Лильебо Т. и др. Диета с низким содержанием FODMAP снижает симптомы синдрома раздраженного кишечника, а также традиционные диетические рекомендации: рандомизированное контролируемое исследование. Гастроэнтерология. 2015; 149: 1399-1407.e2.
- Табане М., Симунович М., Ахтар-Данеш Н. и др.Вспышка острого бактериального гастроэнтерита связана с учащением случаев синдрома раздраженного кишечника у детей. Am J Gastroenterol. 2010; 105: 933-9.
- Даунс И.А., Арониадис О.К., Келли Л. и др. Постинфекционный синдром раздраженного кишечника: связь между гастроэнтеритом, воспалением, микробиомом и функциональными заболеваниями. J Clin Gastroenterol. 2017; 51: 869-877.
- Ханевик К., Диздар В., Лангеланд Н. и др. Развитие функциональных нарушений ЖКТ после инфицирования Giardia lamblia.BMC Gastroenterol. 2009; 9: 27.
- Nakao JH, Collier SA, Gargano JW. Лямблиоз и последующий синдром раздраженного кишечника: продольное когортное исследование с использованием данных медицинского страхования. J Infect Dis. 2017; 215: 798-805.
- Schwille-Kiuntke J, Enck P, Zendler C, et al. Постинфекционный синдром раздраженного кишечника: наблюдение группы пациентов с подтвержденными случаями бактериальной инфекции Salmonella или Campylobacter. Нейрогастроэнтерол Мотил. 2011; 23: e479-88.
- Spreadbury I, Ochoa-Cortes F, Ibeakanma C, et al.Сопутствующий психологический стресс и инфекционный колит являются ключом к поддержанию усиленной периферической сенсорной сигнализации. Нейрогастроэнтерол Мотил. 2015; 27: 347-55.
- Cremon C, Stanghellini V, Pallotti F и др. Сальмонеллезный гастроэнтерит в детстве является фактором риска развития синдрома раздраженного кишечника во взрослом возрасте. Гастроэнтерология. 2014; 147: 69-77.
- Yu D, Cheeseman F, Vanner S. Комбинированная оро-цекальная сцинтиграфия и водородный дыхательный тест на лактулозу демонстрируют, что дыхательный тест выявляет проходимость по слепой кишке, а не избыточный бактериальный рост в тонкой кишке у пациентов с СРК.Кишечник. 2011; 60: 334-40.
- Микель С., Мартин Р., Лашермес А. и др. Антиноцицептивный эффект Faecalibacterium prausnitzii на невоспалительных моделях, подобных СРК. Научный представитель 2016; 6: 19399.
- Jalanka-Tuovinen J, Salojarvi J, Salonen A, et al. Состав фекальной микробиоты и перекрестный диалог между хозяином и микробом после гастроэнтерита и постинфекционного синдрома раздраженного кишечника. Кишечник. 2014; 63: 1737-45.
- Scarpellini E, Giorgio V, Gabrielli M, et al. Лечение рифаксимином избыточного бактериального роста в тонком кишечнике у детей с синдромом раздраженного кишечника.Eur Rev Med Pharmacol Sci. 2013; 17: 1314-20.
- Коллинз Б.С., Лин Х.С. Двойное слепое плацебо-контролируемое исследование избыточного бактериального роста в тонком кишечнике у детей с хронической болью в животе. J Pediatr Gastroenterol Nutr. 2011; 52: 382-6.
- Jiang ZD, Ke S, Palazzini E, et al. Активность и концентрация рифаксимина в фекалиях in vitro после перорального приема. Противомикробные агенты Chemother. 2000; 44: 2205-6.
- Шанахан Ф, Куигли Э.М.Манипуляции с микробиотой для лечения IBS и IBD-проблем и противоречий. Гастроэнтерология. 2014; 146: 1554-63.
- Francavilla R, Miniello V, Magista AM и др. Рандомизированное контролируемое исследование Lactobacillus GG у детей с функциональной болью в животе. Педиатрия. 2010; 126: e1445-52.
- Джаннетти Э, Стаяно А. Пробиотики при синдроме раздраженного кишечника: клинические данные у детей. J Pediatr Gastroenterol Nutr. 2016; 63 Приложение 1: S25-6.
- Huaman JW, Mego M, Manichanh C и др.Эффекты пребиотиков по сравнению с диетой с низким содержанием пищевых добавок у пациентов с функциональным расстройством кишечника. Гастроэнтерология. 2018; 28 июня [EPUB перед печатью]
- О’Мэлли Д. Иммуномодуляция кишечной нервной функции при синдроме раздраженного кишечника. Мир Дж. Гастроэнтерол. 2015; 21: 7362-6.
- Пауэлл Н., Уокер М.М., Талли, штат Нью-Джерси. Иммунная система слизистых оболочек: главный регулятор двунаправленных сообщений кишечника и мозга. Нат Рев Гастроэнтерол Гепатол. 2017; 14: 143-159.
- Törnblom H, Simrén M.В поисках модифицирующего болезнь лечения синдрома раздраженного кишечника. Кишечник. 2016; 65: 2-3.
- Klooker TK, Braak B, Koopman KE и др. Кетотифен, стабилизатор тучных клеток, снижает висцеральную гиперчувствительность и улучшает кишечные симптомы у пациентов с синдромом раздраженного кишечника. Кишечник. 2010; 59: 1213-21.
- Колоски Н.А., Джонс М., Калантар Дж. И др. Путь между мозгом и кишечником при функциональных желудочно-кишечных расстройствах является двунаправленным: 12-летнее проспективное популяционное исследование.Кишечник. 2012; 61: 1284-90.
- Ghia JE, Blennerhassett P, Collins SM. Нарушение парасимпатической функции увеличивает восприимчивость к воспалительному заболеванию кишечника на мышиной модели депрессии. J Clin Invest. 2008; 118: 2209-18.
- Дроссман Д.А. Redux: вырастают ли маленькие брюхопухи, чтобы стать большими. Клин Гастроэнтерол Гепатол. 2014; 12: 2033-6.
- Сапс М., Миранда А. Желудочно-кишечная фармакология. Handb Exp Pharmacol. 2017; 239: 147-176.
- Баджор А., Торнблом Х., Рудлинг М. и др.Повышенное воздействие желчных кислот толстой кишки: важный фактор для симптомов и лечения СРК. Кишечник. 2015; 64: 84-92.
- Camilleri M, Acosta A, Busciglio I, et al. Влияние колесевелама на фекальные желчные кислоты и функции кишечника при синдроме раздраженного кишечника с преобладанием диареи. Алимент Pharmacol Ther. 2015; 41: 438-48.
- Уэйд П.Р., Палмер Дж. М., МакКенни С. и др. Модуляция функции желудочно-кишечного тракта с помощью MuDelta, смешанного агониста µ-опиоидных рецепторов / антагониста µ-опиоидных рецепторов.Br J Pharmacol. 2012; 167: 1111-25.
- Hyman PE, Di Lorenzo C, Prestridge LL, et al. Любипростон для лечения функциональных запоров у детей. J Pediatr Gastroenterol Nutr. 2014; 58: 283-91.
- ван Тилбург М.А., Леви Р.Л., Уокер Л.С. и др. Психосоциальные механизмы передачи соматических симптомов от родителей детям. Мир Дж. Гастроэнтерол. 2015; 21: 5532-41.
Дисбактериоз кишечника Причины, симптомы, тестирование и лечение
Дисбактериоз кишечника означает дисбаланс между хорошими и плохими микробами.Этот дисбаланс может привести к синдрому раздраженного кишечника (СРК), запорам, диарее, гастриту, колиту и другим состояниям, которые, возможно, не связаны со своим пищеварительным трактом, таким как фибромиалгия и аутоиммунные заболевания. В этой статье рассказывается о причинах и симптомах дисбактериоза, а также о том, как проверить наличие дисбактериоза и как вылечить дисбактериоз кишечника.
Каковы преимущества хороших кишечных бактерий?
Микрофлора, иногда называемая микробиотой, относится к бактериям, грибам и вирусам, которые живут в вашем теле.В вашем теле от 10 до 100 триллионов микробных клеток, состоящих из 500-1000 различных видов. Хотя большинство из них находится в кишечнике (отсюда упор на микрофлору кишечника), они также живут во рту, коже, гениталиях и любых слизистых оболочках. Микробиом относится к генетическому материалу этих организмов.
Ваша микробиота и ваши человеческие клетки живут в симбиотических отношениях. Ваше тело обеспечивает среду обитания и пищу, и они выполняют важные функции для вас.
Микробиота кишечника:
- Помогает извлекать питательные вещества и энергию из продуктов питания
- Вырабатывает витамины, такие как витамин К, и поглощает минералы
- Переваривайте клетчатку, поскольку у нас нет ферментов, которые ее расщепляют.В результате они производят короткоцепочечные жирные кислоты (SCFA), которые питают и укрепляют клетки, выстилающие кишечник
- Помощь с детоксикацией
- Является частью нашей иммунной системы, помогая нам бороться с патогенами и иностранными захватчиками
- Поддерживает целостность слизистой оболочки кишечника, предотвращая кишечную проницаемость или повышенную проницаемость кишечника
- Участвует в балансировании гормонов, включая эстроген
- Поддержание здоровой моторики кишечника
Низкое микробное разнообразие связано с воспалительными заболеваниями кишечника (ВЗК), такими как болезнь Крона или колит.Дисбаланс микробиоты кишечника также связан с астмой, аутоиммунными заболеваниями, экземой, аутизмом, глютеновой болезнью, тревожностью, устойчивостью к антибиотикам, диабетом 2 типа, ожирением, сердечными заболеваниями и раком.
Что такое дисбактериоз кишечника?
Дисбактериоз кишечника означает дисбаланс между хорошими и плохими бактериями и другими микробами в кишечнике. Различают 3 типа дисбактериоза:
- Недостаточно хороших бактерий для защиты от болезнетворных микробов, модуляции иммунной системы, питания клеток кишечника и выполнения других функций
- Наличие или значительная доля вредных патогенных бактерий, грибков, вирусов или паразитов, которые вызывают заболевание или воспаление.К ним могут относиться кишечная палочка, H. pylori, клостридии, лямблии, кандида и другие.
- Чрезмерный рост бактерий в тонком кишечнике, состояние, известное как избыточный бактериальный рост в тонком кишечнике (СИБР). В тонком кишечнике происходит переваривание и всасывание питательных веществ, и чрезмерный рост бактерий в нем мешает этим важным функциям. СИБР может быть основной причиной до 70% случаев СРК. (1)
Узнайте, как определить НАСТОЯЩИЕ причины проблем с кишечником.
Загрузите My Free Guide. →
Причины дисбактериоза кишечника
Несколько различных компонентов влияют на количество микробных клеток в кишечнике и разнообразие.
- Рождение (вагинальное или кесарево)
Когда младенцы рождаются естественным путем, они подвергаются воздействию микрофлоры влагалища матери, что приводит к нормальному «посеву» микрофлоры кишечника ребенка и развитию здоровой иммунной системы. Желудочно-кишечный тракт младенцев, рожденных естественным путем, изначально колонизирован хорошими лактобациллами, тогда как у младенцев с кесаревым сечением, как правило, больше патогенных бактерий обнаруживается на коже и в больницах.Дети с кесаревым сечением подвержены повышенному риску развития астмы, аллергического ринита, гастроэнтерита, целиакии и диабета 1 типа. (2)
Младенцы, находящиеся на грудном вскармливании, получают треть кишечных бактерий с грудным молоком матери и еще 10% — с кожей груди матери. Чем больше грудных детей кормят грудью, тем больше их кишечная флора напоминает материнскую грудь mil k. (3) Грудное вскармливание помогает бифидобактериям колонизировать кишечник ребенка, тогда как у детей, вскармливаемых исключительно смесями, как правило, больше E.coli и клостридии (патогенные) в дополнение к бифидобактериям. (4)
Здоровье вашего кишечника связано со здоровьем вашей матери. А если вы женщина, здоровье вашего кишечника и микробное разнообразие повлияют на вашего ребенка (детей).
- Использование антибиотиков в младенчестве
Использование антибиотиков в младенчестве приводит к дисбактериозу и влияет на разнообразие и стабильность кишечной микробиоты. (5) Антибиотики повышают риск иммунных, воспалительных и метаболических заболеваний, таких как воспалительное заболевание кишечника, астма, аллергия, аутизм, диабет 1 и 2 типа и ожирение.Младенцы, подвергшиеся воздействию антибиотиков, как правило, имеют больше генов устойчивости к антибиотикам.
В то время как антибиотики необходимы для борьбы с некоторыми бактериальными инфекциями, которые представляют серьезный риск для здоровья человека, их чрезмерное использование и без внимания к восстановлению кишечной флоры приводит к серьезным последствиям. Антибиотики уменьшают разнообразие кишечной флоры, вызывают нарушения вашей иммунной функции (что приводит к ослаблению иммунитета против патогенов и аутоиммунитета к вашим собственным клеткам), повышают устойчивость к антибиотикам и влияют на метаболизм и чувствительность к инсулину.(6) Вот почему вы почти каждый день видите исследования, связывающие микрофлору кишечника с такими заболеваниями или состояниями здоровья, как болезнь Крона, диабет, сердечно-сосудистые заболевания и т. Д.! Если вы склонны испытывать чрезмерный рост дрожжевых грибков (женщины часто сообщают о чрезмерном росте дрожжевых грибков во влагалище), когда принимаете антибиотики, это признак того, что ваша кишечная флора ослаблена и у вас дисбактериоз.
То, что вы едите, влияет на микробиоту кишечника. Диеты с высоким содержанием жиров (более 45% калорий) имеют тенденцию увеличивать количество бактерий, которые могут негативно повлиять на здоровье человека.(7) Рацион с повышенным содержанием мононенасыщенных жиров (оливковое и авокадо) и омега-3 жирных кислот увеличивает количество полезных лактобактерий и бифидобактерий. (7) Когда дело доходит до полиненасыщенных жиров, важно проводить различие между полезными омега-6 и вредными воспалительными жирами омега-6, которые поступают из промышленных растительных масел (кукурузного, хлопкового, соевого и т. Д.), Как правило, смещают баланс в сторону вредные бактерии. В то время как большинство исследований показывают, что насыщенные жиры негативно влияют на микробиоту кишечника, одно исследование показало, что ненасыщенные жиры омега-6 на самом деле хуже для ваших плотных контактов, которые поддерживают целостность слизистой оболочки кишечника.(8) Хотите знать, какие жиры есть? Прочтите раздел о лечении дисбактериоза кишечника.
Диеты с высоким содержанием сахара без достаточного количества клетчатки приводят к дисбактериозу. Слишком много сахарозы, глюкозы, фруктозы, а также искусственных подсластителей вредно для микробного баланса. (7) Хлеб, выпечка и все крахмалы в конечном итоге расщепляются до глюкозы и увеличивают сахарную нагрузку в вашем теле, а продукты, приготовленные с высоким содержанием фруктозы кукурузного сиропа и других сиропов, питают кишечные патогены. Хотя антиоксиданты из овощей и фруктов не могут напрямую влиять на дисбактериоз, они уменьшают воспалительные соединения в кишечнике, вырабатываемые вредными бактериями.
У вас 100% контроль над тем, что вы едите. Диета — это то, где вы можете значительно склонить чашу весов в сторону лечения дисбактериоза и предотвращения связанных с ним состояний.
- Проблемы с моторикой кишечника и пищеварением
Ваша пищеварительная система сокращается, чтобы направить пищу вниз по потоку для переваривания, затем она снова сокращается, когда вы голодаете между приемами пищи, чтобы убрать отходы, бактерии и непереваренную пищу. Нарушения моторики кишечника будут способствовать развитию дисбактериоза, поскольку патогены начинают питать эти непереваренные частицы пищи.Я уже говорил о пастбищах, MMC и SIBO.
Другие проблемы с пищеварением включают тот факт, что мы производим меньше пищеварительных ферментов с возрастом, низкое производство HCL из-за использования PPI и других антацидов, снижение выделения желчи из-за проблем с печенью или желчным пузырем или их удаления.
Чтобы полностью избавиться от боли и дискомфорта и предотвратить долгосрочные последствия дисбактериоза, необходимо восстановить пищеварение и здоровую моторику кишечника. Помимо помощи моим клиентам в выборе более качественных продуктов для лечения и восстановления кишечника, эти два шага необходимо выполнять правильно и в правильном порядке, чтобы получить устойчивые результаты.Вы можете прочитать больше о моей полной программе здесь.
Стресс включает вашу парасимпатическую нервную систему, которая вызывает реакцию «бей или беги». Это полезно во время острого стресса, поскольку ваше тело будет перекачивать больше крови к вашим мышцам, сердцу и зрачкам, поэтому вы можете стать более внимательными и пережить опасность, которая впереди вас. Напряжение мышц и учащенное сердцебиение после того, как вы едва избежали автомобильной аварии, — это работа вашей парасимпатической нервной системы. Этот ответ также уменьшит приток крови к некритическим частям вашего тела, таким как кишечник, уменьшит выработку кислоты из желудка и замедлит сокращения перистальтики кишечника.(9) Хотя это полезно во время острого кратковременного стресса, к сожалению, многие из нас имеют дело с хроническим стрессом, который не проходит. Когда пищеварение вялое и постоянно замедленное, это приводит к дисбактериозу, особенно СИБР.
Большинство людей связывают стресс с внешними факторами, такими как работа, школа, социальные обязательства, финансы и отношения, но стресс также может быть внутренним и физиологическим. Колебания уровня сахара в крови, обработанные пищевые продукты, хронические скрытые инфекции кишечника, токсичность тяжелых металлов и воздействие плесени также являются источниками стресса.Важно определить источник стресса и устранить его. Вы улучшите свои пищеварительные симптомы, если будете справляться со стрессом, но исходя из своей клинической практики, я считаю, что при возникновении дисбактериоза одного лишь устранения источника стресса недостаточно. В какой-то момент, чтобы обратить вспять повреждение и восстановить кишечник, вам действительно понадобится полноценная диета и план приема добавок, а также такие жизненные навыки, как медитация, дыхание и терапия.
- Инфекционный гастроэнтерит
Гастроэнтерит, известный как желудочный грипп, может привести к дисбактериозу даже после исчезновения начальной острой фазы тошноты и рвоты.Гастроэнтерит вызывается бактериями или вирусом после контакта с водой, пищей или контактом с инфицированным человеком (смена подгузников, прикосновение к дверным ручкам или смесителям в общественных туалетах и т. Д.). Большинство людей и врачей считают желудочный грипп нарушением нормальной жизни на 24 часа. Однако люди с менее чем оптимальной микробиотой кишечника, ослабленной иммунной системой или люди, предрасположенные к аутоиммунитету, могут получить долгосрочный удар.
Определенные вирусы, паразиты или бактерии могут вызывать дисфункцию илеоцекального клапана, области, которая отделяет тонкую кишку от толстой, и запускать СИБР.Микробы, такие как кампилобактер, сальмонелла, лямблии, кишечная палочка или вирусы, продуцируют токсин, известный как токсин, растягивающий цитолеты (CDT), который повреждает интерстициальные клетки кахаля (ICC). Эти клетки считаются водителем ритма кишечника. (10) Они соединяют нервные клетки кишечника с клетками гладкой мускулатуры кишечника с помощью электрических волн и запускают мышечные сокращения, ответственные за перистальтику (пищеварение) и MMC (очистку). Воздействие CDT заставляет вашу иммунную систему вырабатывать антитела, которые атакуют ваш собственный ICC.(11) Если вы начали испытывать рефлюкс, вздутие живота, боль в животе, диарею или запор после случая пищевого отравления или желудочного гриппа, или если вам сказали, что у вас постинфекционный СРК, почти гарантировано, что вы у вас дисбактериоз и, возможно, аутоиммунная атака в кишечнике.
Симптомы дисбактериоза кишечника
Как узнать, есть ли у вас дисбактериоз кишечника? Официального медицинского контрольного списка или критериев для диагностики дисбактериоза кишечника пока нет.Ваш врач может даже не поверить в это! Однако то, как вы себя чувствуете, может указывать на то, что у вас может быть дисбаланс микрофлоры кишечника, особенно если некоторые из причин, которые я только что обсудил, применимы к вам. Вот список симптомов дисбактериоза кишечника. Если вы киваете головой, просматривая список, будет очень важно продолжить расследование с помощью надлежащего тестирования.
- Частые газы, вздутие живота и / или спазмы
- Свободный стул, неотложные позывы, диарея
- Запор
- Чередование диареи и запора
- Диагностика синдрома раздраженного кишечника (СРК) (СРК-З, СРК-Д, постинфекционный СРК)
- Слизь в стуле
- Кислотный рефлюкс, ГЭРБ или если вы использовали ИЦП в течение длительного периода времени
- Тихий кислотный рефлюкс, LPR
- Хронический неприятный запах изо рта
- Диагностика воспалительного заболевания кишечника (ВЗК), такого как болезнь Крона и колит
- Быстрое чувство сытости после еды, даже небольшими порциями, независимо от того, что вы едите
- Усталость или низкая энергия
- Боль в суставах и мышцах
- Заложенность пазух носа
- Хронические головные боли и мигрени
- Туман мозга, беспокойство и / или депрессия
- Пищевая чувствительность и аллергия
- Астма и аллергия на окружающую среду
- Недостаток питательных веществ, таких как железо, витамин D, витамин B12
- Непереносимость углеводов, непереносимость продуктов, содержащих крахмал или клетчатку
- Аутоиммунитет или аутоиммунное состояние, такое как тиреоидит Хашимото, псориаз, РА, рассеянный склероз
- Симптомы непереносимости гистамина, такие как сыпь, головная боль, боль в желудке, проблемы с носовыми пазухами
- желудочный грипп, гастроэнтерит и / или пищевое отравление в анамнезе
- История длительного использования антибиотиков, например, от прыщей или синусита
Узнайте, как определить НАСТОЯЩИЕ причины проблем с кишечником.
Загрузите My Free Guide. →
Тесты на дисбактериоз кишечника
Хотя колоноскопия и эндоскопия могут помочь вам исключить целиакию, ВЗК, непроходимость и рак, они не диагностируют дисбактериоз. Из клинической практики я считаю, что лучшими диагностическими инструментами для выявления дисбактериоза являются дыхательный тест на SIBO, микроскопические (не культуральные) тесты стула, которые определяют генетический материал микробов, а также анализ мочи на органическую кислоту. Подайте заявку на участие в сеансе стратегии, чтобы узнать больше об этих тестах и о том, как они могут помочь вам определить ваш конкретный тип и основные причины дисбактериоза кишечника.
Почему важно лечить дисбактериоз кишечника?
Чтобы предотвратить эти 6 проблем со здоровьем, важно вылечить и обратить вспять дисбактериоз кишечника:
- Аутоиммунные болезни. Дисбактериоз — один из факторов риска и триггеров аутоиммунитета. (12) Если у вас есть аутоиммунное заболевание, его нельзя обратить вспять или вылечить, но с ним можно справиться или вывести его в ремиссию, изменив диету и устранив первопричины. К сожалению, многие люди живут с болезненными и разрушительными аутоиммунными заболеваниями, особенно с болезнью Хашимото, в течение многих лет, прежде чем им поставят диагноз.Другие, к сожалению, всю жизнь живут с аутоиммунными заболеваниями, не зная о связи с кишечником и о том, что они могут уменьшить боль с помощью правильной диеты и протокола заживления кишечника.
- Воспалительное заболевание кишечника (ВЗК) . Болезнь Крона и колит — это два воспалительных заболевания кишечника, которые представляют собой сочетание гиперактивной иммунной системы и аутоиммунитета. И то и другое может вызвать сильную боль, кровь в стуле, дефицит питательных веществ и может привести к хирургическому удалению частей кишечника.Вы не можете излечиться от ВЗК, вы можете только привести свое состояние в состояние ремиссии, и поэтому профилактика является ключевым моментом.
- Дисбаланс гормонов эстрогена. Группа микробов в кишечнике, известная как эстроболом, участвует в балансировании метаболизма эстрогена и детоксикации. Дисбиоз увеличивает количество свободного эстрогена, циркулирующего в вашем теле, что активирует рецепторы эстрогена и усиливает связанные с эстрогеном состояния, такие как ПМС, ожирение, остеопороз, болезни сердца, эндометриоз, СПКЯ, а также рак, зависимый от эстрогена.(13)
- Неврологические и психиатрические заболевания . Дисбактериоз кишечника был связан с несколькими психическими, неврологическими и психиатрическими состояниями, такими как тревога, депрессия, СДВ / СДВГ, аутизм, болезнь Паркинсона и возрастное снижение когнитивных функций. (14, 15, 16)
- Раки . Дисбактериоз кишечника был связан с раком желудка, пищевода, раком, связанным с эстрогеном, колоректальным раком и другими. Кроме того, здоровая флора кишечника и пробиотики могут улучшить лечение рака и его результаты.(17, 18)
- Метаболический синдром . Дисбактериоз кишечника был связан с ожирением, диабетом 2 типа и сердечными заболеваниями, которые являются предотвратимыми хроническими состояниями и основными причинами смерти в США и во всем мире.
Дисбактериоз кишечника может быть очень болезненным, неудобным и в конечном итоге привести к более серьезным осложнениям, которые влияют на качество и продолжительность вашей жизни. Есть надежда, но только если вы определите свои первопричины и правильно купите воспаление кишечника!
Лечение дисбактериоза кишечника
Лучшее лечение дисбактериоза кишечника будет зависеть от типа дисбактериоза, который у вас есть.Например, если вы страдаете диареей или болями в животе, возможно, у вас SIBO, H. Pylori, клостридии, дрожжи или что-то еще. Важно определить патоген, который присутствует или не сбалансирован, чтобы вы могли сузить варианты лечения. Также важно определить первопричины, такие как перистальтика кишечника, стресс, прием лекарств, и либо поддержать нормальное функционирование, либо устранить источник первопричины.
Дисбактериоз бывает трудно диагностировать и сложнее исправить.К сожалению, некоторые врачи не верят в дисбактериоз кишечника и его способность влиять на многие состояния здоровья и симптомы. Обычные врачи могут не связать ваш ревматоидный артрит, болезнь Хашимото, беспокойство или псориаз с микрофлорой кишечника. Если ваше состояние связано с кишечником, например симптомы СРК, ВЗК, H. pylori или SIBO, варианты лечения вашего гастроэнтеролога обычно ограничиваются фармацевтическими препаратами, такими как антибиотики, ИПП или стероидные препараты. Вы можете вылечить кишечник и вылечить дисбактериоз кишечника комплексно, но вы должны обратить внимание на многие аспекты правильно функционирующего кишечника.Вот почему я разработал свою комплексную программу восстановления кишечника.
(Отказ от ответственности: эта статья предназначена для образовательных целей и не заменяет индивидуальную медицинскую помощь, и вам всегда следует поговорить со своим врачом, прежде чем добавлять или прекращать прием лекарства.
Мои пациенты приходят ко мне, потому что им нужна пища и питательные вещества для поддержки их иммунной системы, уравновешивания кишечной флоры и избавления от боли и дискомфорта. Им не предлагаются тесты, которые определяют дисбактериоз, а планы лечения почти не затрагивают влияние вашего ежедневного выбора пищи, который вы можете контролировать на 100%.Если вы хотите узнать, как я могу помочь вам определить первопричины вашего дисбактериоза кишечника и разработать индивидуальный план питания и исцеления питательными веществами, подайте заявку на сеанс стратегии, чтобы наметить ваш самый быстрый путь к выздоровлению и процветанию. Между тем, вот 4 вещи, которые вы можете начать делать сегодня, чтобы улучшить здоровье кишечной флоры и предотвратить или снизить риск дисбактериоза кишечника:
- Очистите свой рацион. Исключите из своего рациона сахар, коммерческие продукты, трансжиры, коммерческие масла, десерты и химические вещества.Тема жиров чрезвычайно сложна для обсуждения здесь, но мои общие советы — придерживаться умеренного количества жиров (около 35% калорий) из оливок, авокадо, жирной рыбы омега-3, яиц, орехов и семян пастбищного откорма. Красное мясо травяного откорма 2–3 раза в неделю должно быть в порядке. Любой ценой избегайте трансжиров и продуктов, приготовленных из соевых бобов, семян хлопка, кукурузы или растительных масел.
- Ешьте продукты с высоким содержанием клетчатки, особенно пребиотической клетчатки . Старайтесь есть не менее 4–5 чашек разных овощей; Группа Brassica (брокколи, цветная капуста, капуста), листовая зелень (капуста, шпинат), красные и оранжевые овощи (помидоры, сладкий перец, кабачки) и ароматические вещества (чеснок, лук, сельдерей).Ешьте 2–3 порции фруктов в день, таких как ягоды, яблоки, груши, апельсины. Если вы можете переносить бобы, чечевицу и цельнозерновые продукты, добавьте их в свой рацион в небольшом количестве. Большинство лечебных диет, которые я использую для людей, которые уже страдают СРК, ВЗК или аутоиммунными заболеваниями, исключают бобовые и зерновые. Если вы находитесь на поддерживающей или профилактической фазах, возможно, вы сможете добавить небольшое количество в свой рацион без побочных эффектов.
- Примите пробиотики. Ферментированные продукты, такие как кефир, йогурт, квашеная капуста и другие ферментированные овощи (без уксуса), содержат здоровые живые культуры, которые улучшают микрофлору кишечника.Добавки с пробиотиками также могут помочь уменьшить симптомы и увеличить разнообразие микробов.
- Управляйте стрессом . Я понимаю, что это проще, чем сделать. Если возможно, устраните источник стресса, такой как токсичные отношения или токсичная работа. Уменьшите свои обязательства и обязательства. Скажите «нет» тому, что не соответствует вашим приоритетам и основным ценностям. Управляйте своей реакцией на факторы стресса. Сделайте ставку на себя и свое здоровье. Притормози и дыши. Медитируйте. Упражнение.Найдите время для личного ухода за собой. Обратитесь за помощью к семье или друзьям. Работайте с терапевтом или консультантом. Список можно продолжать и продолжать; найдите то, что лучше всего подходит для вашей ситуации и вашего типа стресса.
Независимо от того, что вы делаете, чем раньше вы решите свой дисбактериоз кишечника, тем легче и быстрее он вылечится и станет лучше. Вы не можете контролировать здоровье, диету и образ жизни своей мамы, свою генетику, независимо от того, родились вы вагинально или нет, кормили грудью или нет, и принимали ли вы антибиотики в детстве или нет.Однако у вас есть полный контроль над тем, что вы едите, и готовы ли вы раскрыть источник дисбактериоза и устранить его. Дисбиоз поддается лечению и обратим, а баланс кишечной микробиоты предотвратит серьезные проблемы со здоровьем, которые усложняют вашу жизнь и тратят впустую ваше здоровье, богатство, время и энергию.
Часто задаваемые вопросы о дисбактериозе кишечника
Как предотвратить дисбактериоз кишечника? Чтобы предотвратить дисбактериоз, вы должны понимать первопричины и избегать их.Воспользуйтесь моими рекомендациями по лечению дисбактериоза кишечника для профилактики. Если вы не можете сделать это в одиночку, если вы попытались безрезультатно или если вы не знаете, с чего начать, я буду рад предложить бесплатный звонок, чтобы объяснить мою программу и рассказать, чем я могу вам помочь.
Сколько времени нужно для лечения дисбактериоза кишечника? Нет одного ответа, который удовлетворил бы всех. Со своими частными клиентами я повторно тестирую такие вещи, как SIBO, H. Pylori и другие патогены. Некоторым пациентам достаточно 8-12 недель лечебной диеты и протокола приема добавок, чтобы искоренить патоген и получить отрицательный результат теста.Для других это может занять больше времени. В целом, чем серьезнее ваши симптомы и чем дольше они у вас наблюдаются, тем больше времени потребуется для заживления. Вот почему я всегда говорю людям не игнорировать то, что они чувствуют, и отмахиваться от них как обычно. «Небольшой» запор, «чувствительный» или «глупый» желудок — это то, что люди с тяжелым дисбактериозом обычно говорят, чтобы описать свой кишечник. Айсберг под поверхностью может быть огромным!
Какая диета при дисбактериозе кишечника самая лучшая? Лучшая долгосрочная диета для предотвращения дисбактериоза должна включать в себя большое количество пребиотических волокон, ферментированных продуктов, овощей (сырых и приготовленных), небольшого количества фруктов, умеренного количества нежирных белков и полезных жиров, а также небольшого количества бобы и зерна по переносимости.Людям, страдающим дисбактериозом, лечебные диеты будут совсем другими. Я использую различные диеты с моими пациентами, в том числе с низким содержанием FODMAP, SIBO, SCD и AIP, в то же время настраивая план с учетом пищевой чувствительности.
Какой тест на дисбактериоз кишечника самый лучший? Из клинической практики я считаю, что лучшими диагностическими инструментами для выявления дисбактериоза являются дыхательный тест на SIBO, микроскопические (не культуральные) тесты стула, которые определяют генетический материал микробов, а также анализ мочи на органическую кислоту.Я предлагаю их в рамках своей комплексной программы восстановления кишечника.
Дисбактериоз кишечника — это то же самое, что и СИБР? SIBO — один из видов дисбактериоза, на который приходится до 78% всех случаев СРК. СИБР связан с другими нарушениями пищеварения, поскольку может быть вызван H. pylori, патогенными бактериями в толстом кишечнике, низкой кислотностью желудка, токсином CDT, проблемами с моторикой или проблемами с илеоцекальным клапаном.




