Комплекс Эйзенменгера у детей
Комплексом Эйзенменгера называют врожденный порок сердца, обусловленный гипертрофией правого желудочка, декстропозицией аорты, дефектом межжелудочковой перегородки. Сосудистое заболевание обычно выявляется в детстве, но может проявиться и в старшем возрасте. Причинами патологии являются:
- вирусные заболевания во время беременности;
- влияние опасных внешних факторов;
- наследственная предрасположенность;
- воздействие на плод тяжелых металлов, лекарственных препаратов, излучения.
Для данного анатомического дефекта характерен повышенный уровень давления в легочную артерию, что со временем провоцирует спазм капилляров, утолщение легочных сосудов, развитие гипертензии.
Как вовремя обнаружить синдром Эйзенменгера у ребенка?
Первые месяцы младенцев заболевание никак себя не проявляет. Малыш остается активным, нормально физически развивается. Заподозрить комплекс на такой стадии сложно. Когда происходит сброс крови в сердце, аномалия сопровождается такими признаками:
- Одышка.
- Учащенное сердцебиение.
- Посинение слизистых оболочек и кожи.
- Повышенная утомляемость.
- Общая слабость.
- Головные боль.
- Боль в груди.
- Кровотечение из носа.
- Происходит деформация ногтевой пластины и пальцев, позвоночника и грудной клетки.
Если вовремя не обратиться к врачу и не получить адекватную медицинскую помощь, у ребенка может развиться патологическое изменение легочных сосудов, что при тяжелой форме комплекса приводит к летальному исходу.
Лечение детей с комплексом Эйзенменгера в Tel Aviv Medical Clinic
Израильская клиника располагает специализированным современным оборудованием, позволяющим эффективно проводить диагностику. Обследование маленьких пациентов с подозрением на врожденный порок сердца дает 100% достоверный результат. Это помогает назначить ребенку оптимальное лечение, направленное на коррекцию дефекта. Мы предоставляем каждому пациенту комфортную обустроенную палату, где он может находиться вместе с сопровождающим родителем, круглосуточное внимание и заботу персонала.
Это помогает назначить ребенку оптимальное лечение, направленное на коррекцию дефекта. Мы предоставляем каждому пациенту комфортную обустроенную палату, где он может находиться вместе с сопровождающим родителем, круглосуточное внимание и заботу персонала.
В Tel Aviv Medical Clinic действуют вполне демократичные расценки, идентичные тарифам государственных больниц. Но при этом, у нас ребенок получит полный спектр услуг высочайшего уровня, правильное лечение, ориентированное на устранение аномалии и возвращение малыша к нормальной жизни. После терапии пациенту предложат пройти восстановительные этапы в нашем центре реабилитации под контролем специалистов.
Врожденные пороки сердца у взрослых. Синдром Эйзенменгера
Авторы:
Л.Ф. Коноплева
Л.Ф. Коноплева
Продолжение. Начало в № 4.
Особенности гемодинамики и клинической диагностики синдрома Эйзенменгера (СЭ) при дефекте межжелудочковой перегородки (ДМЖП)
ДМЖП относится к числу самых распространенных врожденных пороков сердца (ВПС) у детей (30-40% случаев). У взрослых он встречается значительно реже в связи со спонтанным закрытием, даже при наличии значительного шунта, между 1 и 4 годами жизни у 25% больных, гибели части больных от сердечной недостаточности (СН) и хирургической коррекции порока в детстве.
В зависимости от локализации в области межжелудочковой перегородки (МЖП) дефекты делятся на 4 группы:
• перимембранозные дефекты (80% случаев) — расположены в мембранозной части перегородки;
• дефекты в мышечной трабекулярной части (до 15-20% случаев) — покрыты мышцами, с разной локализацией, часто множественные. Для них особенно характерно спонтанное закрытие;
• дефекты выносного тракта (около 5% случаев) — локализуются под полулунными клапанами в конечной или выносной части перегородки;
• открытый атриовентрикулярный (АВ) канал — расположен в части МЖП непосредственно под аппаратом АВ-клапана, как правило, при синдроме Дауна.
Именно в первой группе больных как одно из самых грозных осложнений развивается легочная артериальная гипертензия (ЛАГ) и со временем формируется СЭ. Дефект в мышечной части МЖП (болезнь Толочинова-Роже) является прогностически благоприятным и ЛAГ, как правило, не сопровождается.
В основе нарушения гемодинамики при ДМЖП лежит сброс крови через дефект из левого желудочка (ЛЖ) в правый, который определяется размерами дефекта и сопротивлением сосудов малого и большого кругов кровообращения. Это вызывает увеличение легочного кровотока и, следовательно, притока к левым отделам сердца, объемную перегрузку ЛЖ и левого предсердия (ЛП). Компенсация достигается гиперфункцией и гипертрофией мощного ЛЖ. При небольших дефектах, менее 4-5 мм с небольшим сбросом крови, гипертрофия ЛЖ обеспечивает полную компенсацию нарушений гемодинамики. При больших дефектах сброс крови слева направо велик. Давление в обоих желудочках выравнивается. Величина сброса крови и его направление при этом зависят лишь от соотношения сосудистых сопротивлений обоих кругов кровообращения. Если дефект расположен высоко, под левой аортальной створкой, открывается у клапана легочной артерии (ЛА), то струя крови из ЛЖ направляется непосредственно в ЛА, нарушения гемодинамики выражены резче. ЛАГ при ДМЖП наблюдается в 25-50% случаев.
Клиника порока определяется величиной сброса крови и ЛАГ. При болезни Толочинова-Роже жалоб, как правило, не предъявляют. При обследовании пальпаторно определяются систолическое дрожание и грубый систолический шум с эпицентром в ІІІ-ІV межреберье у левого края грудины («много шума из ничего»). Данные электрокардиографического (ЭКГ), рентгенологического и эхокардиографического (ЭхоКГ) исследований без изменений. Порок диагностируется только при допплер-ЭхоКГ.
В случае дефекта в мембранозной части перегородки при отсутствии ЛАГ или ее умеренной выраженности больные жалуются на одышку при физической нагрузке и утомляемость. В анамнезе таких больных — частые бронхолегочные инфекции. В ходе физикального обследования отмечается бледность кожи, цианоз отсутствует. В области сердца может обнаруживаться сердечный горб, пальпаторно — усиленный верхушечный толчок, который смещается влево. Границы сердца увеличены влево и вверх. При аускультации характерны: 1) систолический шум с эпицентром в ІІІ-ІV межреберье слева у края грудины, сопровождающийся систолическим дрожанием; 2) акцент ІІ тона над ЛА, его расщепление; 3) может выслушиваться ІІІ тон за счет резкого и значительного наполнения ЛЖ.
В ходе физикального обследования отмечается бледность кожи, цианоз отсутствует. В области сердца может обнаруживаться сердечный горб, пальпаторно — усиленный верхушечный толчок, который смещается влево. Границы сердца увеличены влево и вверх. При аускультации характерны: 1) систолический шум с эпицентром в ІІІ-ІV межреберье слева у края грудины, сопровождающийся систолическим дрожанием; 2) акцент ІІ тона над ЛА, его расщепление; 3) может выслушиваться ІІІ тон за счет резкого и значительного наполнения ЛЖ.
ЭКГ у больных с нормальным давлением в ЛА: электрическая ось не отклонена, наблюдаются признаки изолированной перегрузки ЛЖ. Рентгенологическое исследование не обнаруживает изменений границ сердца и малого круга кровообращения (МКК). Пропорционально величине сброса крови слева направо отмечаются усиление легочного рисунка, увеличение размеров сердца за счет ЛЖ и ЛП. При умеренной и тяжелой легочной гипертензии (ЛГ) увеличивается и правый желудочек (ПЖ). У всех больных выявляется усиленная пульсация ствола ЛА. Дуга аорты уменьшается.
ЭхоКГ-признаками порока являются увеличение размеров ЛП, ЛЖ, гиперкинез стенок ЛЖ, возможны увеличение ПЖ, визуализация дефекта, если его размер превышает 1 см2. Допплер-ЭхоКГ, выявляя турбулентный поток через перегородку слева направо, верифицирует диагноз.
При развитии СЭ жалобы и данные физикального обследования приближаются к таковым у больных идиопатической ЛАГ (ИЛАГ): нарастают одышка и слабость, появляются головокружение, обмороки при физической нагрузке, боль в области сердца, часто стенокардического характера. Возможно кровохарканье, которое чаще всего обусловлено разрывом капилляров, артерио-венозных анастомозов, развитием инфарктов легких в связи с мелкими тромбами in situ из-за склероза легочных сосудов. В ходе обследования отмечается цианоз, который усиливается при нагрузке, формируются симптомы «барабанных палочек» и «часовых стекол». При осмотре и пальпации грудной клетки в прекардиальной области определяется сердечный горб, отмечается выраженная пульсация за счет гипертрофии ПЖ.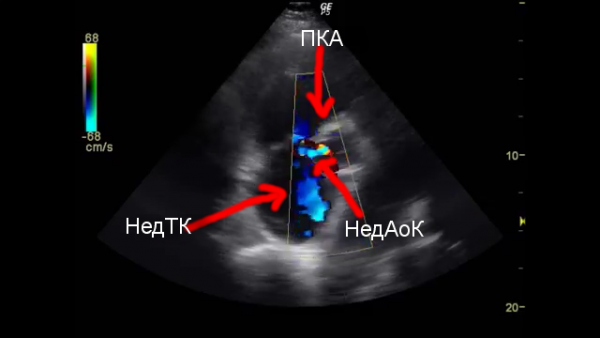 Границы сердца увеличиваются умеренно до развития СН. Систолическое дрожание, которое определялось до развития СЭ, может исчезнуть. Одновременно происходит эволюция систолического шума: он укорачивается до 1/2-1/3 систолы по сравнению с пан- или голосистолическим шумом, становится менее звучным и может вообще не выслушиваться. Постоянным симптомом становится нерасщепленный акцентуированный ІІ тон над ЛА.
Границы сердца увеличиваются умеренно до развития СН. Систолическое дрожание, которое определялось до развития СЭ, может исчезнуть. Одновременно происходит эволюция систолического шума: он укорачивается до 1/2-1/3 систолы по сравнению с пан- или голосистолическим шумом, становится менее звучным и может вообще не выслушиваться. Постоянным симптомом становится нерасщепленный акцентуированный ІІ тон над ЛА.
При ЭКГ-исследовании в 60% случаев наблюдается изолированная гипертрофия ПЖ, реже можно выявить некоторые признаки увеличения ЛЖ. Чаще всего отмечается графика, похожая на ЭКГ больных с ИЛАГ, — синусовый ритм, отклонение электрической оси вправо, гипертрофия ПЖ с признаками его систолической перегрузки, в ряде случаев — гипертрофия правого предсердия (ПП).
Рентгенографический легочный рисунок обедняется, особенно на периферии, определяется значительное расширение ствола ЛА и ее главных ветвей, сердце увеличено за счет ПЖ. При ЭхоКГ-исследовании подтверждаются признаки гипертрофии и дилатации правых отделов сердца, удается верифицировать ДМЖП, измерить его параметры. При допплер-ЭхоКГ выявляются направление и объем тока крови, градиент давления в области дефекта. Одновременно имеется возможность измерить систолическое давление в ЛА (СДЛА), оценить функциональное состояние ПЖ и ЛЖ.
В ходе исследования общего анализа крови при всех ВПС и СЭ обнаруживаются повышение уровня гемоглобина вместе с увеличением количества эритроцитов иногда до 6-7×1012, повышение уровня гематокрита, снижение СОЭ. Все это свидетельствует о выраженной гипоксии, компенсаторном усилении работы костного мозга. Состав белой крови, как правило, не изменен.
Клинический пример
Больная К., 48 лет, искусствовед, наблюдается нами с 16-летнего возраста. О ВПС знает с детства. В 16 лет были проведены катетеризация сердца и сосудов, ангиокардиография (АКГ). СДЛА — 114/80 мм рт. ст. При АКГ выявлены ДМЖП в мембранозной части МЖП 1,8 см в диаметре, широкая ЛА. Больная жалуется на утомляемость, одышку при физической нагрузке, головные боли и головокружение, отмечает обморочные состояния при физической нагрузке, периодическое кровохарканье, иногда довольно длительное. В 1990 году в связи с обильным кровохарканьем и легочным кровотечением больной была проведена эмболизация бронхиальных артерий слева. Обращает на себя внимание диффузный цианоз лица, кистей, стоп. Пальцы рук и ног изменены по типу формирующихся «барабанных палочек». В области сердца определяется пульсация в прекардиальной области за счет ПЖ, пальпаторно определяется акцент ІІ тона над ЛА. Границы сердца расширены вправо на 1,5 см. Шумы не выслушиваются. На ЭКГ — признаки гипертрофии и систолической перегрузки ПЖ. ЭхоКГ подтверждает данные о гипертрофии и дилатации правых отделов сердца, визуализируется высокий ДМЖП. СДЛА — 120 мм рт. ст. В ходе исследования крови обнаружена полицитемия (гемоглобин — 220 г/л, гематокрит — 60%, СОЭ — 1 мм/ч). Клинические признаки правожелудочковой недостаточности не выявлены.
Больная жалуется на утомляемость, одышку при физической нагрузке, головные боли и головокружение, отмечает обморочные состояния при физической нагрузке, периодическое кровохарканье, иногда довольно длительное. В 1990 году в связи с обильным кровохарканьем и легочным кровотечением больной была проведена эмболизация бронхиальных артерий слева. Обращает на себя внимание диффузный цианоз лица, кистей, стоп. Пальцы рук и ног изменены по типу формирующихся «барабанных палочек». В области сердца определяется пульсация в прекардиальной области за счет ПЖ, пальпаторно определяется акцент ІІ тона над ЛА. Границы сердца расширены вправо на 1,5 см. Шумы не выслушиваются. На ЭКГ — признаки гипертрофии и систолической перегрузки ПЖ. ЭхоКГ подтверждает данные о гипертрофии и дилатации правых отделов сердца, визуализируется высокий ДМЖП. СДЛА — 120 мм рт. ст. В ходе исследования крови обнаружена полицитемия (гемоглобин — 220 г/л, гематокрит — 60%, СОЭ — 1 мм/ч). Клинические признаки правожелудочковой недостаточности не выявлены.
Пациентка в течение многолетнего периода наблюдения остается трудоспособной. Много работает в области искусствоведения, являясь автором десятков статей, монографий. Об удовлетворительной компенсации свидетельствует не только отсутствие увеличения сердца в динамике, других признаков недостаточности кровообращения, но и высокие показатели пробы с шестиминутной ходьбой (560 м).
Известно, что ЛАГ при ДМЖП развивается у 25-70% больных. Как и в случае с другими ВПС с увеличенным легочным кровотоком, причины возникновения ЛАГ до сих пор полностью не раскрыты.
R. Leachman и соавт., изучив 355 пациентов с ДМЖП с повторной их катетеризацией, показали, что случаи с высоким легочным сосудистым сопротивлением (ЛСС) после периода раннего детского возраста возникают с рождения или с очень раннего детского возраста, а не в ответ на увеличение легочного кровотока, существующего длительное время. Подтверждением этому являются данные целого ряда исследователей, которые, проведя повторные катетеризации, обнаруживали повышение давления в ЛА в единичных случаях. О преимущественно врожденном характере ЛГ при ДМЖП свидетельствует и сходство строения сосудов плода и больных СЭ. Ряд авторов считает, что в возникновении ЛАГ у данной категории больных играет роль индивидуальная реакция организма на некоторые раздражители — гипоксемию, ацидоз, снижение напряжения кислорода в альвеолах.
О преимущественно врожденном характере ЛГ при ДМЖП свидетельствует и сходство строения сосудов плода и больных СЭ. Ряд авторов считает, что в возникновении ЛАГ у данной категории больных играет роль индивидуальная реакция организма на некоторые раздражители — гипоксемию, ацидоз, снижение напряжения кислорода в альвеолах.
Согласно современным взглядам на роль микроциркуляции и эндотелия сосудов, скорее всего, нарушение функции последнего под влиянием различных факторов является главным пусковым механизмом ЛАГ и склероза сосудов при ВПС с увеличенным легочным кровотоком, что по патогенезу сближает СЭ при ВПС с ИЛАГ.
Осложнения ВПС при СЭ
Легочно-гипертонический криз (в современной литературе принято определение «обострение ЛАГ») — одно из осложнений СЭ. Механизмом его развития является дополнительное повышение ЛСС у больных с ВПС и ЛАГ. Провоцирующие факторы — физическая нагрузка, эмоциональный стресс, катетеризация легочных сосудов, тромбоз мелких ветвей ЛА, оперативные вмешательства. В патогенезе криза, очевидно, имеет значение спазм артериол, обусловливающий дополнительное повышение ЛСС и острую перегрузку ПЖ. В связи с резким расширением ПЖ происходит еще более выраженное парадоксальное смещение МЖП с уменьшением сердечного выброса. В большинстве случаев возникает синкопальное состояние из-за выраженной гипоксии мозга.
О таком механизме криза свидетельствует, например, тот факт, что в исследовании М.Ф. Зиньковского (134 пациента с ВПС, осложненными ЛАГ) легочно-гипертонические кризы наблюдались у больных с умеренно и даже мало выраженными признаками склеротических изменений в сосудах и совсем не наблюдались у лиц с резко выраженными признаками облитерирующей болезни легочных сосудов.
Клиническими проявлениями легочно-гипертонического криза являются пароксизмальная одышка, усиление болей в области сердца. При этом наблюдаются быстрое снижение системного артериального давления (АД), резкое усиление пульсации ПЖ в прекардиальной области, усиление акцента II тона над ЛА, появление хлопающего І тона на верхушке при выслушивании, признаки увеличения перегрузки ПЖ и ПП на ЭКГ. Одним из клинических проявлений заболевания является также развитие сердечного обморока — синкопе. Легочно-гипертонический криз — одна из причин смерти при СЭ.
Одним из клинических проявлений заболевания является также развитие сердечного обморока — синкопе. Легочно-гипертонический криз — одна из причин смерти при СЭ.
Синкопальные состояния. Сердечный обморок (синкопе) наблюдался нами у 36% больных. Картина обморока у всех была одинаковой — значительная бледность кожных покровов, резкое снижение АД, вплоть до того, что оно не определялось, брадикардия или тахикардия, резкая глухость тонов. В двух случаях отмечались судороги. Обмороки наблюдались только при физической и эмоциональной нагрузке. У семерых пациентов они возникали в момент легочно-гипертонического криза, у двух — обмороки были одним из проявлений тромбоза в системе ЛА. Еще у троих больных обморок был связан с нарушением ритма (синоаурикулярная (СА) блокада, пароксизм фибрилляции предсердий — ФП). Таким образом, наиболее частой причиной сердечного обморока является уменьшение кровоснабжения мозга при увеличенной потребности в кислороде из-за высокого ЛСС. Часто обморочные состояния наблюдаются в период формирования СЭ и в дальнейшем не повторяются. У другой группы больных обмороки отмечались в финале заболевания и отражали отсутствие увеличения сердечного выброса при любой нагрузке, что, как правило, подтверждалось во время ЭхоКГ-исследования в виде малого конечно-диастолического и конечно-систолического объема при нормальной фракции выброса (ФВ).
Дифференциальная диагностика сердечного обморока у пациентов с ВПС должна проводиться с другими заболеваниями, при которых наблюдаются обмороки в связи с низким сердечным выбросом, — аортальным стенозом, гипертрофической кардиомиопатией, стенозом ЛА, тромбоэмболией ЛА (ТЭЛА), миксомой ЛП, шаровидным тромбом, обширным инфарктом миокарда, расслаивающей аневризмой аорты. Очень важным является исключение нарушений ритма как причины синкопе в связи с разницей в подходах к лечению.
Аневризма ЛА. Вследствие развития атеросклероза основного ствола и крупных ветвей ЛА на фоне постоянно высокого давления в ЛА создаются условия для развития аневризматического выпячивания стенки сосудов. При этом клинически отмечаются патологическая пульсация в области аневризмы слева во ІІ-IV межреберье, увеличение границ сердца вверх и влево, а при аневризме правой ветви — вправо. При выслушивании у 30% больных над аневризмой основного ствола ЛА обнаруживаются диастолический шум как результат развития относительной недостаточности клапана ЛА, систолический «клик» и систолический шум изгнания. Следует подчеркнуть, что зона выслушивания шумов и акцента ІІ тона над ЛА смещается влево и в ІІІ межреберье. Диагноз подтверждается рентгенологически: во фронтальной проекции отмечается резкое выбухание второй сердечной дуги по левому контуру сердечной тени (при аневризме основного ствола ЛА) или в области корней легких (при аневризмах основных ветвей ЛА). В таких случаях возникают дифференциально диагностические трудности для исключения опухолей средостения, заболеваний лимфатических узлов, бронхогенного рака легких, саркоидоза. Важно провести рентгеноскопическое исследование, в ходе которого отмечается связь образования с пульсацией и тенью сердца. Надежным в данном случае является проведение компьютерной томографии (КТ) грудной клетки.
При этом клинически отмечаются патологическая пульсация в области аневризмы слева во ІІ-IV межреберье, увеличение границ сердца вверх и влево, а при аневризме правой ветви — вправо. При выслушивании у 30% больных над аневризмой основного ствола ЛА обнаруживаются диастолический шум как результат развития относительной недостаточности клапана ЛА, систолический «клик» и систолический шум изгнания. Следует подчеркнуть, что зона выслушивания шумов и акцента ІІ тона над ЛА смещается влево и в ІІІ межреберье. Диагноз подтверждается рентгенологически: во фронтальной проекции отмечается резкое выбухание второй сердечной дуги по левому контуру сердечной тени (при аневризме основного ствола ЛА) или в области корней легких (при аневризмах основных ветвей ЛА). В таких случаях возникают дифференциально диагностические трудности для исключения опухолей средостения, заболеваний лимфатических узлов, бронхогенного рака легких, саркоидоза. Важно провести рентгеноскопическое исследование, в ходе которого отмечается связь образования с пульсацией и тенью сердца. Надежным в данном случае является проведение компьютерной томографии (КТ) грудной клетки.
Наличие аневризмы основного ствола и/или левой ветви ЛА может привести к сдавлению возвратного нерва, провисанию голосовой связки и изменением в связи с этим голоса вплоть до афонии.
Сдавление крупных бронхов обусловливает раздражение афферентных зон кашлевого рефлекса, в связи с чем больных беспокоит упорный сухой кашель, трудно поддающийся лечению.
Наиболее грозным осложнением аневризмы ЛА является ее расслоение и разрыв.
Расслоение и разрыв ЛА. Диагностика разрыва ЛА сложна. Часто предвестником разрыва ЛА является ее расслоение. В таких случаях больные указывают на усиление болевого синдрома, снижение уровня системного АД.
Мы наблюдали два случая расслоения и разрыва аневризмы основного ствола ЛА у молодых женщин 27 и 25 лет.
Клинический пример
Больная К., 27 лет, поступила в кардиологическое отделение с жалобами на одышку при физической нагрузке и сердцебиение. В последнее время отмечала ноющие и давящие боли в области сердца, частые головные боли, головокружения, периодически — кровохарканье.
В последнее время отмечала ноющие и давящие боли в области сердца, частые головные боли, головокружения, периодически — кровохарканье.
Считает себя больной с раннего детства, всегда чувствовала одышку при нагрузке, слабость. Находилась на учете как имеющая ВПС, лечение не получала. В 20 лет состояние ухудшилось, появилось кровохарканье, при обследовании были установлены диагнозы ВПС и ЛАГ (СЭ), оперативное лечение не предлагалось. Наследственность не отягощена. Замужем, детей нет, 3 года назад имело место самопроизвольное прерывание беременности.
При поступлении состояние средней тяжести. Выражен цианоз лица, кистей. Пальцы по форме напоминают «барабанные палочки», ногти в виде «часовых стекол». Пульс — 80 ударов в минуту, ритмичный. АД — 120/80 мм рт. ст. Границы сердца смещены влево и вправо на 1 см, верхняя — ІІ ребро. Тоны сердца ослаблены, систолический и диастолический шум над ЛА, акцент ІІ тона. При пальпации определяется пульсация в ІІІ межреберье слева. Частота дыхания — 18 в 1 минуту. В легких везикулярное дыхание. Печень пальпируется на 1,5 см ниже реберной дуги. Отеков нет. На ЭКГ — гипертрофия ПЖ, его систолическая перегрузка. Рентгенологически — аневризма основного ствола ЛА.
Спустя 3 дня у больной во время разговора внезапно появились сильная загрудинная боль, которая не прекращалась более 12 ч, и чувство онемения в левой руке. Пульс оставался на уровне 88 ударов в минуту, АД повысилось до 150/100 мм рт. ст. ЭКГ-исследование показало увеличение признаков перегрузки ПЖ.
Несмотря на применение вазодилататоров и обезболивающих, боли не прекращались, иррадиировали в эпигастральную область, появились тошнота, рвота, носовое кровотечение. Через 18 ч больная умерла во сне.
Клинический диагноз: «ВПС: вторичный дефект межпредсердной перегородки, СЭ. Аневризма основного ствола ЛА, относительная недостаточность клапана ЛА. СН І-ІІА стадии. Тромбоз мелких ветвей ЛА?».
Результаты вскрытия (протокол № 3 от 5 января 2005 года): в сердечной сорочке обнаружена кровь, сердце увеличено за счет ПЖ, толщина его стенки — 1,4 см, толщина стенки ЛЖ — 1 см. Относительная недостаточность клапанов ЛА, дефект межпредсердной перегородки (ДМПП) 1×1 см, основной ствол и ветви ЛА аневризматически изменены. Интима основного ствола ЛА надорвана, между слоями стенки ЛА гематома 4×3 см, проникающая в перикард.
Относительная недостаточность клапанов ЛА, дефект межпредсердной перегородки (ДМПП) 1×1 см, основной ствол и ветви ЛА аневризматически изменены. Интима основного ствола ЛА надорвана, между слоями стенки ЛА гематома 4×3 см, проникающая в перикард.
В литературе нам удалось найти данные о 25 случаях разрыва ЛА, возникшего в области аневризмы ее ствола. В 11 случаях причиной развития аневризмы был ВПС, сопровождающийся повышением давления в сосудах МКК. Клиническими проявлениями этого осложнения явились усиление болей стенокардического характера, клинико-инструментальные признаки тяжелой ЛАГ, явления коллапса.
В нашем наблюдении явления коллапса не регистрировались. Наоборот, отмечалось повышение уровня АД. Диагноз разрыва аневризмы при жизни установлен не был.
Кровохарканье и легочное кровотечение. Среди болезней сердечно-сосудистой системы причиной кровохарканья и легочного кровотечения наиболее часто являются заболевания, сопровождающиеся повышением давления в системе МКК (прекапиллярная и посткапиллярная ЛГ, пороки развития сосудов легких, васкулиты в системе МКК), а также тромбоцитопения, нарушения коагуляции.
Источником кровотечения у больных СЭ являются сосуды системы ЛА, бронхиальные сосуды или анастомозы между системой большого и малого кругов кровообращения либо между артериальными и венозными сосудами МКК.
У пациентов с ВПС и СЭ кровохарканье и легочное кровотечение, по данным литературы, встречаются в 10-20% случаев. При этом речь идет в основном о кровохарканье. Легочное кровотечение встретилось в нашей практике у трех больных. У одного из них оно привело к летальному исходу.
Следует обратить внимание на две самые частые причины кровохарканья у этих пациентов:
1. Разрывы мелких склерозированных сосудов, артерио-артериальных, артерио-венозных анастомозов.
2. Развитие инфарктов легких по причине тромбоза in situ вследствие склероза легочных сосудов, ТЭЛА мелких ветвей ЛА, нарушения свертывающих свойств крови у больных СЭ, замедления кровотока.
Лечебная тактика при этих состояниях различна. В случае обильного легочного кровотечения с угрозой развития анемии, расстройств гемодинамики, показана АКГ с эмболизацией бронхиальных артерий.
Тромбоз в системе ЛА. Условиями для развития тромбозов у больных СЭ являются склеротические изменения сосудов легких с глубокими изменениями их эндотелиальной функции, замедление тока крови по легочным сосудам, сгущение крови, выраженная гипоксия, дисфункция желудочков, расширение легочных стволов. В ряде случаев речь может идти о тромбоэмболии, особенно у лиц с выраженной правожелудочковой недостаточностью. В зависимости от калибра сосудов легких, где образуется тромб, или величины эмбола инфаркт легкого может не развиваться. В наших наблюдениях данное заболевание было диагностировано у четырех больных.
Классические проявления инфаркта легкого — боль в груди при глубоком вдохе и кашле, кашель, кровохарканье, треугольная тень в легких при рентгенологическом исследовании — не являются частыми симптомами. Чаще клиническими проявлениями тромбоза сосудов были усиление одышки и цианоза, боли в области сердца, нарушения ритма и проводимости. Физикальные симптомы скудны. Шум трения плевры выслушивается редко. Рентгенологически возможно обнаружить затенение или уменьшение одного из сегментов, приблизительно в 1/3 случаев на стороне поражения отмечается более высокое стояние диафрагмы. Если инфаркт охватывает только один сегмент легкого, он имеет вид гомогенного затенения треугольной формы. Основание этого треугольника обращено к висцеральной плевре, а верхушка — к воротам легкого. Иногда инфаркт легкого проявляется в виде линейной горизонтальной тени, расположенной на 1-3 см выше диафрагмы. Подтвердить данный диагноз можно методом сканирования легких с применением микроагрегатов альбумина, меченных І‑131, Cr‑51 или Тс‑99m. Подтверждению диагноза способствует также проведение спиральной КТ (СКТ). Золотым стандартом диагностирования ТЭЛА является вентрикулография с ангиографией сосудов легких.
Относительная недостаточность клапанов ЛА была зарегистрирована нами в 23% случаев. По данным других авторов, она имеет место у 5-10% больных ВПС.
Патогенез относительной недостаточности клапана ЛА связан со значительным и стойким повышением АД в ЛА, развитием атеросклероза в основном стволе и ветвях ЛА, что приводит к снижению эластичности стенки сосуда, расширению клапанного кольца ЛА. Развитию данного осложнения способствует и аневризма ЛА.
Клинически осложнение проявляется протодиастолическим шумом Грехема Стилла, иногда сопровождающимся диастолическим дрожанием. Шум выслушивается в ограниченной области, лучше всего — в III-IV межреберных промежутках, на некотором расстоянии от грудины. Он не настолько громкий, как шум, вызываемый недостаточностью аортальных клапанов (НАК), и отличается меньшей проводимостью. Возникает необходимость дифференциальной диагностики с шумом, обусловленным НАК (имеет место в некоторых случаях сочетание с СЭ, особенно при ДМЖП с НАК), а также диастолическим компонентом систоло-диастолического шума при открытом артериальном протоке (ОАП). В отличие от шума при НАК отсутствуют проведение шума к верхушке сердца и признаки на периферических артериях (быстрый, высокий пульс, шум Дюрозье). При ОАП это непрерывный систоло-диастолический шум («шум туннеля»). Диагноз подтверждается посредством ЭхоКГ и допплер-ЭхоКГ.
Парез голосовой связки. Осиплость голоса, вызванная параличем левой голосовой связки вследствие сдавления левого возвратного нерва, встретилась нами среди больных ВПС и СЭ в 14% случаев. В литературе данный синдром носит имя Ортнера.
Впервые изменение голоса до его полной потери было описано при митральном пороке. Л. Вакез обнаружил 116 таких случаев до 1921 года. Фарти и Галонен, В. Йонаш описывают единичные наблюдения пареза голосовой связки у больных с митральными пороками на значительном материале. Возникновение нарушений голоса при митральном пороке объяснялось давлением ЛП на возвратный нерв. Однако было обращено внимание, что появление охриплости при митральном стенозе (МС) возможно и без значительного увеличения ЛП. В действительности давление на нерв увеличенным ЛП является практически невозможным. В настоящее время принято считать, что причиной паралича левого возвратного нерва при МС может быть давление, оказываемое расширенной ЛА с повышением в ней давления.
Однако было обращено внимание, что появление охриплости при митральном стенозе (МС) возможно и без значительного увеличения ЛП. В действительности давление на нерв увеличенным ЛП является практически невозможным. В настоящее время принято считать, что причиной паралича левого возвратного нерва при МС может быть давление, оказываемое расширенной ЛА с повышением в ней давления.
Следует отметить, что иногда возникают сложности при дифференциальной диагностике причин изменения голоса, если данный симптом резко выражен и больные придают ему большее значение, чем одышке. В нашей практике встречались пациенты с СЭ, которые безуспешно длительно наблюдались у отоларингологов.
Относительная недостаточность трехстворчатого клапана (НТК). Минимальная НТК, обнаруживаемая при допплер-ЭхоКГ, является вариантом нормы. Клинически выраженная НТК обнаруживается более чем у 1/3 больных СЭ (34,5%).
Патогенез осложнения связан с дилатацией ПЖ вследствие его постоянной систолической перегрузки у пациентов с СЭ, а у пациентов с ДМПП — и вследствие предшествующей диастолической перегрузки, обусловленной особенностями гемодинамики порока. Развитие относительной НТК, как правило, свидетельствует о декомпенсации ПЖ.
Клинически при осмотре у больного обнаруживается пульсация шейных вен, синхронная с желудочковой систолой («положительный венный пульс»). Аускультативно характерен систолический шум у основания грудины. Вследствие значительного расширения ПЖ у этих больных локализация шума смещена влево, а иногда определяется в области левого соска, что приводит к необходимости дифференциации с систолическим шумом митральной недостаточности: шум недостаточности митрального клапана проводится в подмышечную впадину; шум трехстворчатого клапана усиливается на вдохе — симптом Риверо-Корвальо. Рентгенологически обнаруживается увеличение сердечной тени вправо. Диагноз подтверждается посредством допплер-ЭхоКГ.
При развитии относительной НТК в ряде случаев отмечается снижение СДЛА. Этот феномен объясняет снижение ЛАГ при СЭ и уменьшение право-левого сброса крови у ряда больных в процессе наблюдения, что не должно рассматриваться как положительный симптом.
Этот феномен объясняет снижение ЛАГ при СЭ и уменьшение право-левого сброса крови у ряда больных в процессе наблюдения, что не должно рассматриваться как положительный симптом.
Нарушение ритма и проводимости. Для СЭ у пациентов с ОАП и ДМЖП характерно сохранение синусового ритма. У пациентов с ДМПП согласно данным литературы ФП встречается в 25% случаев. На нашем материале мы наблюдали ФП у 27% больных ДМПП. Полная блокада правой ножки пучка Гиса отмечена у 27,2% больных, неполная — у 67,2%, миграция водителя ритма наблюдалась у отдельных пациентов, СА-, АВ-блокада 1 и 2 степени — в единичных случаях. Все эти изменения не отражались на состоянии пациентов и не требовали специфического лечения, за исключением ФП.
Сердечная недостаточность. СН — основная причина смерти больных СЭ. Особенностью СН у больных СЭ является довольно позднее ее развитие в условиях резкой перегрузки ПЖ.
СН при СЭ развивается как первично правожелудочковая. Признаком правожелудочковой недостаточности является повышение центрального венозного давления. В связи с этим основные клинические признаки СН, кроме одышки, — набухание шейных вен, увеличение печени, отеки, асцит. У больных не регистрируются приступы ночной одышки, удушья, отек легких в связи с прекапиллярным характером ЛГ. Такие симптомы, как цианоз, снижение уровня насыщения крови О2 у данной категории больных являются признаками шунтирования венозной крови в артериальное русло, а не проявлением застойной СН.
Нарушения гемостаза. У больных СЭ описываются многочисленные нарушения гемостаза, включая тромбоцитопению, увеличение времени кровотечения, протромбинового времени, парциального (частичного) тромбопластинового времени, дефицит витамин-К-зависимых факторов свертывания, повышение вязкости крови и патологию фибринолиза. Поскольку геморрагии, связанные с нарушениями гемостаза у больных СЭ, как правило, носят нетяжелый характер и локализуются преимущественно на слизистых оболочках, угрозы для жизни они не представляют и требуют симптоматической терапии.
Симптомы гипервязкости крови у пациентов с СЭ появляются обычно при уровне гематокрита ≥65%. Следствиями повышения вязкости крови являются головная боль, слабость, головокружение, утомляемость, шум в ушах, нарушение зрения, парестезии, боль в мышцах.
Ведущими механизмами внутрисосудистых осложнений у этих пациентов называют гемоконцентрацию, высокую динамическую вязкость крови, появление агрегатов эритроцитов и тромбоцитов в микрососудах легких.
Нами изучены состояния плазменного, тромбоцитарного и эритроцитарного гемостаза у 55 больных СЭ. Как правило, обнаруженные изменения венозного гемостаза свидетельствовали о наличии хронического синдрома диссеминированного внутрисосудистого свертывания крови (ДВС-синдром) в разных стадиях, преимущественно в III (гипокоагуляционной) стадии. Существенные изменения эритроцитарного звена гемостаза не выявлены. Об изменениях тромбоцитарного гемостаза у больных СЭ свидетельствовало уменьшение количества тромбоцитов в венозной крови за счет коагулопатии потребления с одновременным повышением их адгезивности и антигепариновой активности.
Гипертрофическая остеоартропатия. Артралгии являются частым симптомом у больных СЭ и нередко манифестируют появление гипертрофической остеоартропатии. Синдром характеризуется избыточной пролиферацией кожи и костной ткани конечностей. Это проявляется в изменениях пальцев кистей и стоп по типу «барабанных палочек» и периостите пястных, плюсневых и длинных костей предплечий и ног. Слабо выраженная или умеренная артралгия коленных и локтевых суставов часто сопровождается синовиальным выпотом. Симптомы «барабанных палочек» и «часовых стекол» зависят от длительности заболевания и сочетаются с эритроцитозом и цианозом.
Подагра. Гиперурикемия обнаруживается у больных СЭ с уровнем гематокрита >65% и эритроцитозом. Заболевание характерно для ВПС «синего» типа, что связано с повышением продукции и снижением почечного клиренса мочевой кислоты. Выраженные клинические проявления подагры в виде острого подагрического артрита и мочекаменной болезни встречаются редко, хотя артралгии наблюдаются часто и обусловлены они гипертрофической остеоартропатией. В нашей практике больные СЭ с острым приступом подагры встречены не были.
В нашей практике больные СЭ с острым приступом подагры встречены не были.
Холелитиаз. Пациенты с СЭ и эритроцитозом имеют повышенный риск развития кальций-билирубинатных желчных камней и холецистита из-за повышенной концентрации неконъюгированного билирубина в желчном секрете как следствия большой эритроцитарной массы. Хирургическое лечение таким больным показано только при остром холецистите.
Почечная дисфункция. Более чем у 1/3 взрослых с СЭ имеют место случаи гломерулопатий — протеинурия, повышение концентрации сывороточного креатинина, патология анализов мочи (гематурия, неинфекционная лейкоцитурия, цилиндрурия). Могут наблюдаться снижение почечного кровотока и уровня почечной фильтрации, азотемия, патология секреции мочевой кислоты и нефротический синдром. Частота почечной патологии увеличивается с развитием и длительностью цианоза и сопутствующей ему эритроцитемии.
Концентрация сывороточного креатинина может адекватно не отражать почечной дисфункции у больных СЭ. Оценка его уровня должна учитываться при назначении лекарственных средств, которые могут повлиять на функцию почек, например нестероидных противовоспалительных препаратов, или при проведении диагностических исследований с применением контрастных веществ.
Инфекционный эндокардит. Абсцесс головного мозга (АГМ). У пациентов с СЭ за счет эритроцитоза, являющегося реакцией костного мозга на хроническую гипоксию, возможны цереброваскулярные осложнения. Известно, что у больных с ВПС и АГМ почти всегда наблюдаются полицитемия, повышенная вязкость крови, замедление кровотока, которые обусловливают тромбообразование в сосудах и ишемию мозга. Это является не менее важным фактором при возникновении АГМ, чем наличие самих бактерий, что согласуется с данными других исследователей. Клиническая симптоматика при АГМ неспецифична. Чаще всего отмечают классическую триаду: лихорадка (регистрируется в 50% случаев), головная боль (70%), очаговые неврологические нарушения.
Нами АГМ встречен у 4 пациентов с СЭ из 55. Во всех случаях он был диагностирован и успешно оперирован. Больные живы, наблюдение за ними продолжается.
Дифференциальная диагностика при СЭ
Так как при ВПС в стадии СЭ клиническую картину и прогноз обуславливает ЛАГ, дифференциальная диагностика проводится с заболеваниями, сопровождающимися данным синдромом. ЛГ наблюдается более чем при 100 заболеваниях внутренних органов. В зависимости от локализации первичного повышения давления различают прекапиллярную (артериальную) и посткапиллярную (венозную) ЛГ.
Наиболее частыми причинами хронической прекапиллярной ЛГ являются поражение артериальных сосудов легких, группа заболеваний, выделенных по классификации как ЛАГ.
Необходимость дифференциальной диагностики СЭ с вышеуказанными заболеваниями возникает особенно часто в случае отсутствия шумов в области сердца при выслушивании из-за выравнивания давления в желудочках при ДМЖП и ОАП, из-за более позднего развития СЭ и более частого возникновения ФП при ДМПП, а также в случае длительного отсутствия выраженного диффузного цианоза и симптомов «барабанных палочек» и «часовых стекол».
ИЛАГ — заболевание невыясненной этиологии, проявляющееся повышением давления в ЛА и приводящее к изолированным изменениям сосудов легких и повышением ЛСС с гипертрофией ПЖ при отсутствии какой-либо врожденной или приобретенной патологии сердца или заболеваний легких. Клинические признаки общие с таковыми у больных ВПС и СЭ, так как обе эти формы относятся к группе прекапиллярной ЛГ. Из особенностей следует отметить, что признаки гипертрофии ПЖ при ИЛАГ резко выражены, преобладают над дилатацией. Длительный период времени сохраняется близкое к норме насыщение крови кислородом (SaO2) в отличие от СЭ, при котором всегда снижена сатурация, особенно после физической нагрузки вследствие увеличения сброса крови справа налево. В связи с постоянным сбросом венозной крови из правых отделов сердца или ЛА (при ОАП) у больных СЭ постоянными клиническими признаками являются диффузный цианоз и «барабанные палочки», что нехарактерно для ИЛАГ. ФП также редко наблюдается при ИЛАГ, но встречается в около 25% случаев при СЭ и ДМПП. ИЛАГ характерна для юношеского и молодого возраста, больные СЭ встречаются в зрелом и даже пожилом возрасте в связи с более благоприятным прогнозом для жизни по сравнению и ИЛАГ. Диагностика ИЛАГ основывается на последовательном исключении других, более распространенных причин со схожей клинической симптоматикой. Для скрининга, кроме стандартного комплексного обследования, необходимо оценить давление в ЛА посредством ЭхоКГ. ЭхоКГ, в том числе допплер-ЭхоКГ, выявляет дилатацию правых отделов сердца, гипертрофию ПЖ, отсутствие патологических сообщений.
ФП также редко наблюдается при ИЛАГ, но встречается в около 25% случаев при СЭ и ДМПП. ИЛАГ характерна для юношеского и молодого возраста, больные СЭ встречаются в зрелом и даже пожилом возрасте в связи с более благоприятным прогнозом для жизни по сравнению и ИЛАГ. Диагностика ИЛАГ основывается на последовательном исключении других, более распространенных причин со схожей клинической симптоматикой. Для скрининга, кроме стандартного комплексного обследования, необходимо оценить давление в ЛА посредством ЭхоКГ. ЭхоКГ, в том числе допплер-ЭхоКГ, выявляет дилатацию правых отделов сердца, гипертрофию ПЖ, отсутствие патологических сообщений.
Хроническая тромбоэмболическая ЛГ (ТЭЛГ). Диагностирование ТЭЛГ является трудным в связи с постепенным началом заболевания и отсутствием классических признаков ТЭЛА (речь идет о ТЭЛА мелких ветвей ЛА, в том числе рецидивирующей). В отличие от СЭ заболевание развивается чаще у лиц среднего и пожилого возраста. При сборе анамнеза важно выявить факторы, предрасполагающие к развитию тромбоэмболической болезни: тромбоз глубоких вен нижних конечностей, гинекологические или урологические операции, иммобилизация (даже кратковременная), онкологические заболевания, ФП, застойная СН. В клинической картине можно выделить синдром так называемых малых признаков ТЭЛА (S.K. Pingleton et al., 1993). Он включает скудные, неспецифические проявления, которые позволяют заподозрить это заболевание и провести целенаправленное обследование у лиц с факторами риска. К ним относятся:
• необъяснимая одышка, тахикардия или другие признаки ухудшения течения хронического заболевания сердца или легких;
• необъяснимый субфебрилитет, не уступающий антибиотикотерапии;
• рецидивирующая пневмония то в одном, то в другом сегменте легких;
• сухой или экссудативный плеврит;
• пароксизмы ФП;
• «малые» неврологические симптомы — головокружение, обморок, тошнота, рвота;
• чувство тревоги и сдавление в груди.
Распознавание ТЭЛА в таких случаях облегчается при наличии признаков флеботромбоза, которые, однако, даже при целенаправленном осмотре отсутствуют примерно у половины больных.
Значительно реже развивается клиника повторных инфарктов легких — боль в грудной клетке, усиливающаяся на вдохе, кровохарканье, кашель, повышение температуры тела, иктеричность кожных покровов, физикальные признаки легочного инфильтрата (притупление перкуторного тона, крепитация), шум трения плевры. Тромбоэмболическая природа ЛГ становится вероятной, если имеются следующие признаки:
• временная связь возникновения ЛГ с вышеуказанными факторами риска ТЭЛА;
• появление одышки и цианоза в начале болезни;
• прогрессирующая, резистентная к терапии правожелудочковая недостаточность;
• артериальная гипоксемия;
• гиперкоагуляция.
Диагноз подтверждается посредством ЭхоКГ, радионуклидного исследования, СКТ и ангиопульмонографии, которая является золотым стандартом диагностики рецидивирующей ТЭЛА.
ЛАГ, ассоциированная с поражением органов дыхания. Одним из ранних проявлений ЛАГ, ассоциированной с поражением дыхательной системы (хроническое обструктивное заболевание легких — ХОЗЛ, интерстициальные заболевания легких), является развитие легочной недостаточности: обструктивной ее формы при ХОЗЛ, рестириктивной — при поражении паренхимы легких. Клиническая картина ЛАГ при ХОЗЛ состоит из трех групп симптомов: основного бронхолегочного заболевания, легочной недостаточности и ЛАГ. В анамнезе выявляется длительно протекающая бронхолегочная патология (чаще всего у многолетних курильщиков). Характерна одышка экспираторного характера, не уменьшающаяся в положении сидя. Беспокоят кашель различного характера, периодическое повышение температуры тела. При объективном обследовании — бочкообразная грудная клетка, уменьшение дыхательной экскурсии легких, хрипы, в том числе свистящие. Особенностью ЛГ при ХОЗЛ является ее слабая выраженность (СДЛА редко превышает 40-45 мм рт. ст.). Изменения со стороны функции внешнего дыхания постоянны. Характерны изменения показателей, указывающих на нарушение бронхиальной проходимости (OFV1, проба Тиффно, форсированная жизненная емкость легких). Напряжение кислорода в крови значительно снижено, так же, как и насыщение крови О2. Гипоксемия не корригируется при вдыхании 100% кислорода. Развивается полицитемия.
Напряжение кислорода в крови значительно снижено, так же, как и насыщение крови О2. Гипоксемия не корригируется при вдыхании 100% кислорода. Развивается полицитемия.
Выявить ЛГ у больных ХОЗЛ более надежно помогает ЭхоКГ, позволяющая обнаружить дилатацию полостей ПЖ и ПП, увеличение толщины стенки ПЖ, определить давление в ЛА. Однако при ХОЗЛ не всегда удается провести качественное ЭхоКГ-исследование. Наиболее точным методом выявления гипертрофии и дилатации ПЖ в данном случае является сцинтиграфия миокарда с 201Тс, нуклидная правосторонняя вентрикулография, катетеризация правых отделов сердца.
При деформации грудной клетки, которая может сопровождать ВПС, в том числе и при СЭ, возникает необходимость дифференцировать СЭ с заболеваниями, ограничивающими движение грудной клетки, — кифоз, кифосколиоз, болезнь Бехтерева и др. Установлена прямая зависимость степени ЛГ от тяжести и давности деформации грудной клетки. Клинические симптомы ЛГ нарастают по мере прогрессирования основного заболевания — усиливается одышка, нарастает цианоз. Легочные объемы (жизненная и общая емкость легких) уменьшены. Диагноз подтверждается анамнезом, осмотром и рентгенологическим исследованием грудной клетки, наличием признаков легочной недостаточности преимущественно по рестриктивному типу.
При Пиквикском синдроме больные жалуются на одышку, сонливость, повышенный аппетит, иногда жажду, избыточную массу тела, адинамию. При осмотре отмечаются ожирение, цианоз. Легочная недостаточность обусловлена не только уменьшением объема грудной клетки, но и центральными нарушениями регуляции дыхания. Наиболее часто снижается минутный объем дыхания, уменьшается жизненная и общая емкость легких, нарушается ритм дыхания, чаще по типу Чейна-Стокса с периодами апноэ. При исследовании газов крови обнаруживается гипоксемия, повышенное напряжение СО2. Наблюдаются эритроцитоз, замедление СОЭ. Методами подтверждения наличия, установления степени ЛГ, отсутствия патологических шунтов являются ЭхоКГ, сцинтиграфия, КТ.
ВПС «синего» типа — это пороки сердца с обедненным легочным кровотоком (стеноз ЛА, тетрада, пентада Фалло). Общими с СЭ признаками являются цианоз, одышка, наличие симптомов «барабанных палочек» и «часовых стекол», клинических и ЭКГ-признаков гипертрофии правых отделов сердца. При дифференциальной диагностике учитывают характерные для «синей» тетрады гипоксические и цианотические приступы, которые проявляются резкой одышкой, усугублением цианоза, иногда — обмороками и судорогами. Эти приступы можно предотвратить присаживанием на корточки или переходом в коленно-локтевое положение, чем и пользуются больные. В анамнезе отмечается цианоз с раннего детства (3-6 мес), чего не наблюдается при СЭ. Важным для дифференциальной диагностики с СЭ являются ослабление (а не усиление, характерное для СЭ) ІІ тона над ЛА. Рентгенологически вместо выбухания ствола ЛА и расширения ее ветвей определяется вогнутость в области легочного ствола, и сердце имеет характерную конфигурацию в виде «деревянного башмачка». Легочный сосудистый рисунок обеднен или не изменен. При двухмерной ЭхоКГ с допплеровским исследованием диагностируются анатомические признаки порока, что подтверждается ангиовентрикулографией.
Системные васкулиты с поражением ЛА
Неспецифический аортоартериит (НАА, болезнь Такаясу) — гранулематозное воспаление, характеризующееся воспалительными и деструктивными изменениями в стенке дуги аорты и ветвей, сопровождающееся их стенозированием и ишемией кровоснабжающих органов. Описан неспецифический артериит ЛА — форма Lupi-Herrera. Заболевание редкое, встречается преимущественно у молодых женщин. При такой локализации клиническая картина напоминает ЛАГ с характерными для нее клиническими симптомами (боль в грудной клетке, одышка, ЛГ, признаки перегрузки правых отделов сердца). Клинические проявления НАА делятся на 2 группы: 1) неспецифические симптомы системного воспаления; 2) синдромы, основой которых являются нарушение кровоснабжения различных органов и систем, особенно конечностей, а также развитие ЛАГ при поражении ЛА.
Узелковый полиартериит с поражением ЛА — наиболее известная форма системного артериита. На основании преимущественной топографии процесса выделяется ряд синдромов: кардиоваскулярный с наиболее частым поражением коронарных сосудов; абдоминальный; почечный; легочный. Описаны случаи, когда заболевание начиналось с легочной симптоматики: одышки, кровохарканья, симптомов ЛГ. Для заболевания характерны лихорадка, лейкоцитоз, ускоренная СОЭ, анемия, снижение массы тела, тахикардия, мышечные и суставные боли. Совокупность этих явлений в различной комбинации создает фон, на котором выявляются симптомы легочной патологии.
Системная склеродермия (ССД). Необходимо помнить о возможности развития синдрома ЛГ у больных другими системными заболеваниями, в первую очередь ССД. Поражение легких при ССД развивается на ранней и поздней стадиях болезни и характеризуется клинико-рентгенологической симптоматикой базального, а затем и диффузного пневмофиброза, при котором в патологический процесс вовлекаются все структуры легкого — сосуды, паренхима, плевра. Особенностью пневмофиброза при ССД является раннее поражение сосудов с развитием симптоматики ЛГ и нагрузки на правые отделы сердца. При объективном обследовании обращают на себя внимания признаки, характерные для ССД, — отек и утолщение кожи лица, затруднения при открытии рта, эрозивно-некротические изменения кожи нижних и верхних конечностей, изменения суставов кистей — деформация суставов, остеолиз фаланг, пигментация и депигментация участков кожи, атрофия и индуративный отек. Диагноз ЛАГ, ассоциированной с ССД, ставится на основании жалоб на прогрессирующую одышку, постоянное сердцебиение, боли в области сердца, отечность нижних конечностей, а также ЭКГ-данных, свидетельствующих о выраженной гипертрофии правых отделов сердца с систолической перегрузкой ПЖ, и ЭхоКГ-показателей, в том числе высокого СДЛА, значительного расширения правых отделов сердца, парадоксального движения МЖП, относительной НТК, уменьшения полости ЛЖ.
Посткапиллярная (венозная) ЛГ имеет место при клапанных поражениях и левожелудочковой недостаточности любой этиологии.
ЛГ при заболеваниях левых отделов сердца
Посткапиллярная форма ЛГ является наиболее распространенной и отмечается в 95% случаев всех заболеваний, сопровождающихся ЛГ. К ним относятся заболевания, сопровождающиеся систолической и диастолической дисфункцией ЛЖ, а также болезни клапанов сердца. Дифференциально-диагностические трудности возможны при заболеваниях, сопровождающихся СН. ЛГ, связанная с заболеваниями левых отделов сердца (СДЛА >35 мм рт. ст), наблюдается:
• у всех пациентов с СН — 79%;
• при СН с сохраненной ФВ — 50-80%;
• при СН со сниженной ФВ — 16-63%;
• у пациентов с артериальной гипертензией и сохраненной ФВ — 83%;
• у пациентов с заболеваниями митрального клапана — 73%;
• у пациентов с аортальным стенозом — 30-50%.
В анамнезе можно обнаружить заболевания ЛЖ (инфаркт миокарда, кардиомиопатия), наличие факторов риска, связанных с заболеваниями левых отделов сердца, — пожилой возраст, сахарный диабет, ожирение, артериальная гипертензия. При объективном обследовании характерными являются сочетание одышки с наличием застойных хрипов в легких, состояние ортопноэ или пароксизмальной ночной одышки.
Левожелудочковая недостаточность, обусловленная ишемической болезнью сердца, гипертонической болезнью, недостаточностью митрального клапана, аортальными пороками, характеризуется признаками дилатации и, в большинстве случаев, гипертрофией ЛЖ. По данным ЭКГ обнаруживаются патологический зубец Q, увеличение ЛП, блокада левой ножки пучка Гиса, ФП, ишемия миокарда во время нагрузочных проб. При ЭхоКГ и катетеризации сердца выявляются изменения, характерные для систолической дисфункции (снижение ФВ до >40%), или диастолическая дисфункция ЛЖ, гипертрофия и/или дилатация, повышение конечно-диастолического давления в ЛЖ, ЛП и легочных капиллярах. Большое значение, кроме стандартных методов обследования, имеет определение уровня мозгового натрийуретического гормона (отмечается его повышение). Решающее значение для диагноза имеет катетеризация правых отделов сердца и ЛА: в зависимости от величины транспульмонального градиента (ГТД = среднее давление в ЛА - давление заклинивания) диагностируется посткапиллярная (пассивная) ЛГ (при ГТД <12 мм рт. ст.) или реактивная ЛГ (при ГТД >12 мм рт. ст.).
Эритремия. Иногда больных СЭ направляют к гематологу для исключения эритремии в связи с обнаружением в анализах периферической крови повышения показателей красной крови (эритроцитоз, повышение уровня гемоглобина, гематокрита). Для эритремии имеет значение нормальное насыщение артериальной крови кислородом (в отличие от СЭ). Большую роль играет выявление спленомегалии. Также имеет значение, наряду с эритроцитозом, увеличение массы циркулирующих эритроцитов.
Трансбиопсия подвздошной кости позволяет разрешить диагностические сомнения в подавляющем большинстве случаев. При вторичном эритроцитозе, что имеет место при СЭ, костный мозг обычно или не изменен, или гиперплазирован один эритроидный росток.
Лечение больных с ВПС и СЭ
Наличие анатомических дефектов развития сердца позволяет рассматривать ВПС как «хирургическую» патологию. Хирургическая коррекция ВПС у больных СЭ могла бы вызывать разгрузку ПЖ, который работает в условиях высокого общелегочного сопротивления и ЛАГ. Однако закрытие шунта при СЭ быстро приводит к правожелудочковой недостаточности и смерти больных.
В последние годы в качестве хирургического метода лечения предложена трансплантация сердца и легкого. В мире существует 369 центров, которые проводят трансплантацию сердца, легких, комплекса «сердце-легкие», из них 130 — в США, 25 — в Германии, 9 — в Испании, 8 — в Австралии. Выполнено более 50 тысяч трансплантаций. Так, в Немецком кардиологическом центре в Берлине с 1986 по 2010 год проведено 1680 пересадок сердца, 390 пересадок легких и 99 — комплекса «сердце-легкие». В России с 2006 по 2010 год проведено 199 трансплантаций в 8 центрах. К настоящему времени улучшились результаты операций и прогноз. Национальная служба здравоохранения Великобритании заявляет, что выживаемость пациентов составляет сейчас около 85% через год после трансплантации комплекса «сердца-легкие» и 45% – через 5 лет. По данным реестра за 2002 год, 5- и 10-летняя выживаемость после трансплантации комплекса «сердце-легкие» составляет 44 и 25% соответственно. Считается, что трансплантация комплекса «сердце-легкие» для больных СЭ является операцией выбора. Однако выживаемость пациентов с СЭ, которым не была проведена пересадка (37 больных), согласно данным W.E. Hopkins и соавт. составляла 97% в течение 1 года, 89% — в течение 2 лет и 77% — в течение 3 лет, то есть на ближайшие 3 года даже при естественном течении жизненный прогноз оказывается благоприятным.
Таким образом, имеется недостаточно данных, чтобы широко использовать указанный метод лечения. Кроме прочего, это связано, как и при всякой трансплантации, с недостатком доноров, необходимостью проведения иммуносупрессивной терапии, высокой стоимостью лечения. Ограниченные успехи трансплантации и хорошая выживаемость среди пациентов, получавших медикаментозное лечение, обязывают к тщательному отбору пациентов для трансплантации и разработке медикаментозной терапии.
Цель медикаментозного лечения больных ВПС и СЭ заключается в уменьшении выраженности симптомов, замедлении прогрессирования заболевания, улучшении качества жизни и увеличении ее продолжительности. Рекомендации, разработанные для лечения пациентов с СЭ, основаны на данных рандомизированных клинических исследований больных ИЛAГ, однако в некоторых из них принимали участие и больные СЭ. Хотя клиническое течение ИЛАГ и ЛАГ, связанной с ВПС, отличаются, схожесть их гистопатологической картины предполагает общий подход к лечению. Оно направлено на три основных патофизиологических механизма, характерных для ЛГ прекапиллярного генеза, — вазоконстрикцию, пролиферацию (ремоделирование сосудов) и тромбозы.
Антагонисты кальция вызывают легочно-сосудистую и системную вазодилатацию. Согласно современным рекомендациям (2004) антагонисты кальция не должны назначаться до выполнения острой пробы с вазодилататором. В ответ на применение антагонистов кальция у больных СЭ может развиться системная гипотония и в связи с этим может увеличиться право-левый сброс, что может привести к синкопе. Долгосрочные гемодинамические эффекты пролонгированных антагонистов кальция при лечении взрослых с СЭ неизвестны.
Простагландины имеют антипролиферативные и цитопротекторные свойства. Важным механизмом их действия является ремодуляция сосудистой стенки с уменьшением повреждения эндотелия и профилактики гиперкоагуляции. Препараты нашли применение при ИЛАГ. О положительном эффекте простагландинов есть данные и у больных СЭ. Однако указывается на проблемы с внутривенным введением простациклина и токсичность этого препарата.
В клинической практике применяются также аналоги простациклина — эпопростенол и илопрост. У 15 детей с СЭ, находившихся на ингаляциях илопроста на протяжении 12 мес, было выявлено улучшение гемодинамических показателей в правых отделах сердца, улучшились результаты теста с шестиминутной ходьбой. Илопрост был рекомендован для лечения ЛАГ и СЭ в Европе.
Новым направлением в лечении ЛАГ при ВПС и других заболеваниях, сопровождающихся ЛАГ, является применение антагонистов рецепторов эндотелина. Поиск антагонистов эндотелиновых рецепторов увенчался синтезом таких препаратов, как бозентан и ситаксетан. Бозентан является пероральным активным антагонистом эндотелиновых рецепторов. Он доказал свою эффективность для прекапиллярной ЛГ при I-IV функциональных классах (ФК) в ходе рандомизированных клинических испытаний. Бозентан улучшает легочную гемодинамику, результат теста шестиминутной ходьбы, отдаляет время клинического ухудшения. Доказан положительный эффект лечения бозентаном больных СЭ, в связи с чем он рекомендован для лечения больных СЭ III ФК в соответствии с классификацией Всемирной организации здравоохранения (класс рекомендаций I, уровень доказательности B).
Силденафил — мощный селективный ингибитор цГМФ-специфической фосфодиэстеразы‑5 (ФДЭ‑5), который увеличивает содержание циклического гуанозинмонофосфата (цГМФ) в гладкомышечных клетках легочных сосудов, вызывая их дилатацию. Опыт применения силденафила у взрослых с ВПС очень ограничен: в исследовании с участием 14 пациентов с ЛAГ только 5 имели ВПС. Эти и другие исследования дали основания для длительной терапии больных ЛАГ и больных СЭ, в том числе и для комбинированной терапии.
Учитывая известные нарушения в свертывающей системе крови из-за выраженного склероза сосудов легких, дисфункции эндотелия с выработкой протромботических факторов, замедление тока крови в легких, гипоксию, а также принимая во внимание частоту тромбозов сосудов легких в клинике, в качестве патогенетической терапии предложено назначение антитромбоцитарных препаратов, подвергающееся, впрочем, сомнению, ведь на сегодняшний день нет стандартизированных подходов к назначению указанных препаратов. Профилактика тромбоэмболических осложнений при помощи ацетилсалициловой кислоты считается неэффективной. Антикоагулянты рекомендуются только при ФП.
Так как у большинства больных СЭ развивается эритроцитоз ввиду хронической гипоксии и компенсаторного повышения гемопоэза, существует мнение о целесообразности проведения систематических кровопусканий для профилактики тромбозов. Однако в настоящее время считается, что рутинное кровопускание приводит к риску ухудшения доставки кислорода к тканям и таким образом увеличивает риск инсульта. Одновременно развиваются дефицит железа и микросфероцитоз, которые увеличивают вязкость крови. Поэтому рекомендуется проводить кровопускания только при клинических симптомах гипервязкости, развивающихся при уровне гемоглобина >200 г/л или гематокрита >65% и проявляющихся головной болью, утомляемостью, снижением концентрации внимания. При кровопускании необходимо временное изоволюмическое заместительное переливание жидкости (5% глюкоза, физиологический раствор и т.д.).
Патогенетически обоснованным является назначение оксигенотерапии. Имеются данные исследования с участием 23 взрослых с СЭ, которым постоянно проводилась кислородотерапия в ночное время в течение 2 лет (Saudo-Val et al., 2001): снижения давления в ЛА не наблюдалось, и результаты выживаемости не улучшились. Однако считается, что домашняя кислородотерапия улучшает выживаемость и симптоматику болезни, используется на эмпирической основе. Кислородотерапия полезна в случае улучшения SaO2 на ее фоне.
Эффективность сердечных гликозидов при лечении ЛАГ, в том числе у больных СЭ, не доказана. Из-за риска аритмогенного действия дигоксин применяется только в случае декомпенсированной правожелудочковой недостаточности. Более того, гипоксемия и гипокалиемия на фоне диуретической терапии увеличивают риск гликозидной интоксикации.
В качестве общих принципов ведения пациентов с СЭ можно отметить следующие:
• ограничение физических нагрузок, особенно связанных с поднятием тяжестей;
• исключение дегидратации, например длительного пребывания на солнце, в жарком климате;
• избегание пребывания в высокогорной местности ввиду усиления гипоксии, опасности синкопальных состояний;
• необходимость контрацепции. При этом исключается пероральная контрацепция, содержащая эстрогены как потенцирующие тромбоэмболии;
• избегание беременности, так как известно, что материнская смертность у этих женщин составляет 30-50%;
• соблюдение безопасности во время воздушных путешествий, избегание длительного пребывания в одной позе;
• учитывание опасности при проведении катетеризации сердца, ангиографии из-за опасности легочно-гипертонического криза, нарушений ритма и смерти;
• проведение ежегодной противогриппозной иммунизации пациентам.
Таким образом, следует подчеркнуть, что научно разработанная и стандартизированная терапия данного заболевания в настоящее время отсутствует. Рандомизированные исследования в этой области продолжаются. По предварительным данным, рациональным и полезным является использование антагонистов эндотелина. Для предотвращения осложнений (СН, тромбозы и др.) целевыми направлениями являются назначение антикоагулянтов, оксигенотерапии в ночное время, хроническая терапия простациклином, оксидом азота, трансплантация комплекса «сердце-легкие».
Больных СЭ необходимо наблюдать в течение всей жизни с подбором соответствующей терапии по мере течения заболевания и осложнений. Поскольку существует корреляция между толерантностью к физической нагрузке и выраженностью ЛАГ, в качестве контроля может использоваться нагрузочный тест, например с шестиминутной ходьбой.
Жизненный прогноз при ВПС и СЭ
Большинство исследователей считают, что у больных с ВПС в фазе СЭ с момента развития цианоза до смерти проходит не более 10 лет. В то же время описывается целый ряд больных с ВПС и СЭ, которые живут до ≥40 лет с право-левым шунтом более чем 20-летней давности. В этом плане представляет интерес исследование S. Саnne и соавт. (1991), в ходе которого изучались 62 больных СЭ, наблюдающиеся одним и тем же кардиологом. Средний период наблюдения составил 16 лет, а у 22 пациентов — более 20 лет. Показано, что половина пациентов прожила более 30 лет. Сопоставление данных прогноза жизни больных ИЛАГ и СЭ при одинаковых цифрах давления в ЛА и длительности заболевания свидетельствует о значительно лучшем прогнозе при ВПС с СЭ. Выживаемость до возраста 50, 60 лет составила 77 и 54% соответственно.
Профилактика развития СЭ у больных ВПС
Единственным методом предупреждения СЭ у больных с ВПС и увеличенным кровотоком является хирургическая коррекция порока, которая должна проводиться как можно раньше. В настоящее время она проводится в младенческом возрасте (исключая больных ДМПП), при котором операция может проводиться позже (более позднее развитие СЭ). При своевременной коррекции порока достигается нормализация гемодинамики и практическое выздоровление детей. С развитием ЛАГ резко возрастает операционная смертность и значительно ухудшаются отдаленные результаты лечения.
СТАТТІ ЗА ТЕМОЮ Кардіологія
25.03.2021
Кардіологія
Небіволол: додаткові докази вже відомих ефектів і нові цікаві властивості
Небіволол – кардіоселективний β-адреноблокатор третього покоління, що має гіпотензивний, вазодилатаційний, антиангінальний та антиаритмічний ефекти. Показаннями до його застосування є артеріальна гіпертензія (АГ), хронічна серцева недостатність (ХСН)
і (віднедавна для оригінального препарату Небілет) хронічна ішемічна хвороба серця (ІХС).
Пропонуємо нашим читачам огляд найновіших публікацій, у яких висвітлені різні аспекти ефективності та безпеки небівололу….
24.03.2021
Кардіологія
Терапія та сімейна медицина
Сучасні грані статинотерапії в практиці сімейного лікаря: запитання та відповіді
Протягом багатьох десятиліть серцево-судинні захворювання (ССЗ), зумовлені атеросклерозом, посідають провідне місце в структурі причин смертності населення
більшості країн. Щорічно в Європі кардіоваскулярна патологія забирає життя понад
4 млн осіб. За даними Державної служби статистики України, 2019 року питома вага серцево-судинної патології в структурі загальної смертності становила 67%, що багато в чому визначає несприятливу демографічну ситуацію в нашій країні: загалом смертність перевищує народжуваність майже вдвічі….
15.03.2021
Кардіологія
Унікальні можливості телмісартану в лікуванні хворих із серцево-судинною патологією
Сучасна терапія пацієнтів із серцево-судинною патологією має бути спрямована не тільки на досягнення цільових значень рівня артеріального тиску (АТ), а й на зниження рівня серцево-судинного ризику.
Для поліпшення довгострокової захворюваності та смертності в популяції пацієнтів з артеріальною гіпертензією (АГ) рекомендується використовувати препарати з доведеною здатністю щодо захисту від розвитку як фатальних, так і нефатальних ускладнень, віддаючи перевагу лікарським засобам із найсильнішою доказовою базою, отриманою в клінічних дослідженнях і великих метааналізах наукових даних. …
15.03.2021
Кардіологія
Хронічна серцева недостатність у хворих на ЦД 2 типу: нові рекомендації
Наприкінці січня відбулося онлайн-засідання громадської організації «Придніпровська асоціація лікарів-інтерністів», присвячене коморбідній патології у хворих на цукровий діабет (ЦД), а також іншим проблемам внутрішньої медицини, в якому взяв участь завідувач кафедри терапії, кардіології та сімейної медицини ФПО ДЗ «Дніпропетровська медична академія МОЗ України», член Ради Всеукраїнської асоціації кардіологів України (ВАКУ), доктор медичних наук, професор Валерій Аркадійович Потабашній, виступивши з доповіддю «Особливості лікування серцевої недостатності в пацієнтів із цукровим діабетом: огляд рекомендацій ВАКУ 2020 року»….
Комплекс Эйзенменгера | Детская больница «Сафра»
- Детская больница Сафра > Центр детской кардиологии и кардиохирургии> Комплекс Эйзенменгера
Доктор Мишали Давид
Специализация:
Кардиохирургия
Ведущий израильский детский кардиохирург. Заведующий отделением хирургии сердца
Этот сложный врожденный порок сердца встречается не так часто, составляя 4-5% от всех врожденных аномалий сердца. Но у новорожденных с дефектом межжелудочковой перегородки он отмечается уже в 10% случаев.
Комплекс Эйзенменгера характеризуется сочетанием трех признаков, это дефект межжелудочковой перегородки, смещение аорты вправо (т.н. декстропозиция аорты) и гипертрофия правого желудочка.
Дефект межжелудочковой перегородки является в данном случае довольно большим и представляет собой уменьшение размеров перегородки, в норме разделяющей правый и левый желудочки, а иногда речь идет и, практически, полном отсутствии такого разделения.
При этом смещенная вправо аорта, которая в норме должна отходить от левого желудочка и нести в большой круг кровообращения богатую кислородом кровь, в случае развития комплекса Эйзенменгера отходит одновременно от обоих желудочков. Создается впечатление, словно аорта “сидит верхом” на правом и левом желудочках. За счет такого смещения, сочетающегося с дефектом межжелудочковой перегородки, в аорту попадает смешанная кровь, поступающая из обоих желудочков. А это значит, что значительно уменьшается количество кислорода в большом круге кровообращения, и организм испытывает кислородное голодание. Тяжесть состояния усугубляется повышенным давлением в малом (легочном) круге кровообращения, связанным с патологическими изменениями в стенках артериол. Правый желудочек, а нередко и правое предсердие гипертрофированы.
К типичным симптомам комплекса Эйзенменгера относятся быстрая утомляемость даже при самой незначительной физической нагрузке, одышка, общая слабость, даже если пациент ведет неактивный образ жизни. В результате смешивания артериальной и венозной крови возникает цианоз — синюшность кожных покровов, носогубных складок, губ, ногтей. Поскольку все органы тела страдают от кислородного голодания, сердце вынуждено работать быстрее и сокращаться чаще, что проявляется сердцебиением. Нередко у пациентов отмечается кровохаркание, а также носовые кровотечения.
При обследовании у пациента обнаруживается “сердечный горб” — выпячивание в области сердца. Иногда заметна пульсация слева от грудины. При аускультации слышны шумы в работе сердца, их характеристика зависит от размеров дефекта межжелудочковой перегородки. Нередко определяется характерный симптом “кошачьего мурлыканья”. Изменены сердечные тоны над легочной артерией. Наконец, бывает слышен специфический систолодиастолиический шум, указывающий на незаращение аортального протока, поскольку этот порок нередко сопутствует комплексу Эйзенменгера.
Данные рентгенологического исследования и электрокардиографии часто бывают неспецифичны. Они могут указывать на наличие сердечной патологии, однако не несут признаков, однозначно указывающих на конкретный порок сердца. Большую диагностическую ценность имеют результаты зондирования сердца и ангиокардиографии. Так, в ходе выполнения последней, в правый желудочек вводится контрастная масса, которая заполняет одновременно и аорту, и легочную артерию.
Дифференциальная диагностика проводится с целым рядом заболеваний, при которых существует расширение ствола и ветвей легочной артерии. К ним относятся: стеноз легочной артерии, незаращение Боталлова (артериального) протока, большой дефект межжелудочковой перегородки, а также и дефект межпредсердной перегородки.
Лечение комплекса Эйзенменгера только хирургическое. В случае, когда заболевание было выявлено своевременно, прогноз оперативного вмешательства благополучный, при условии проведения его в специализированной клинике. От хирурга требуется одновременное устранение дефекта межжелудочковой перегородки и возвращение аорты в нормальную позицию. Почти всегда при этом необходима имплантация искусственного аортального клапана.
Успех операции зависит от мастерства и квалификации хирурга, а также от наличия в клинике соответствующего оборудования. Сочетание этих важнейших условий представлены в больнице Сафра с его уникальными кардиохирургическим центром и известными во всем медицинском мире кардиохирургами.
«Клинические рекомендации «Гипертензионная сосудистая болезнь легких, ассоциированная с врожденными пороками сердца, у детей»
(утв. Минздравом России)
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ГИПЕРТЕНЗИОННАЯ СОСУДИСТАЯ БОЛЕЗНЬ ЛЕГКИХ,
АССОЦИИРОВАННАЯ С ВРОЖДЕННЫМИ ПОРОКАМИ СЕРДЦА, У ДЕТЕЙ
МКБ 10: I27.8
Год утверждения (частота пересмотра): 2018 (не реже 1 раза в 3 года)
ID: КР50
URL
Профессиональные ассоциации
— Ассоциация детских кардиологов России; Ассоциация сердечно-сосудистых хирургов России
Ключевые слова
— гипертензионная сосудистая болезнь легких;
— дети;
— легочно-сосудистая болезнь;
— легочная гипертензия;
— легочная артериальная гипертензия;
— врожденный порок сердца.
Список сокращений
АВ — артерио-венозный
АКГ — ангиокардиография
АРЭ — антогонисты рецепторов эндотелина
ВА — вено-артериальный
ВОЗ — всемирная организация здравоохранения
ВПС — врожденный порок сердца
ДЛА — давление в легочной артерии
ДМЖП — дефект межжелудочковой перегородки
ДМПП — дефект межпредсердной перегородки
иЛАГ — идиопатическая легочная артериальная гипертензия
ИМДЛА — инвазивный мониторинг давления в легочной артерии
ИФДЭ5 — ингибиторы фосфодиэстеразы 5
КТ — компьютерная томография
ЛА — легочная артерия
ЛАГ — легочная артериальная гипертензия
ЛГ — легочная гипертензия
МРТ — магнитно-резонансная томография
ОАП — открытый артериальный проток
ОЛС — общее легочное сопротивление
ОПС — общее периферическое сопротивление
ПП — правое предсердие
ПЖ — правый желудочек
СИБКК — сердечный индекс большого круга кровообращения
ЭКГ — электрокардиография
Эхо-КГ — эхокардиография
BNP — мозговой натрийуретический пептид
Sat O2 — насыщение крови кислородом
TAPSE — систолическая экскурсия фиброзного кольца трикуспидального клапана
Термины и определения
Гипертензионная сосудистая болезнь легких (легочно-сосудистая болезнь) — заболевание, характеризующееся патологическими морфологическими изменениями легочных сосудов, уменьшением площади легочно-сосудистого русла и прогрессирующим нарастанием общелегочного сопротивления (ОЛС).
1. Краткая информация
1.1 Определение
Гипертензионная сосудистая болезнь легких, ассоциированная с врожденными пороками сердца (ВПС) у детей — состояние, при котором среднее давление в легочной артерии (ЛА) в покое, определенное методом катетеризации сердца, составляет 25 мм рт. ст., а ОЛС 3 Ед/м2 для ВПС с бивентрикулярной гемодинамикой [1 — 3].
Гипертензионная сосудистая болезнь легких для ВПС с унивентрикулярной гемодинамикой у детей — состояние, при котором среднее давление в ЛА в покое, определенное методом катетеризации сердца, составляет 15 мм рт. ст., ОЛС 3 Ед/м2, а транспульмональный градиент давления 6 мм рт. ст [4 — 6].
1.2 Этиология и патогенез
Гипертензионная сосудистая болезнь легких развивается при естественном течении ВПС, представленных в таблице 1.
Таблица 1 — Врожденные пороки сердца, приводящие к развитию гипертензионной сосудистой болезни легких
Тип врожденного порока сердца/тип легочной гипертензии | Врожденный порок сердца |
1. Врожденный порок сердца с увеличением притока крови в малый круг кровообращения/прекапиллярная легочная гипертензия | 1.1. Надтрикуспидальные дефекты перегородок сердца 1.1.1. Аномальный дренаж легочных вен 1.1.1.1. Частичный аномальный дренаж легочных вен с межпредсердным сообщением или без него 1.1.1.2. Тотальный аномальный дренаж легочных вен с межпредсердным сообщением 1.1.2. Дефект межпредсердной перегородки (ДМПП) 1.1.3. Атриовентрикуляный канал, неполная форма 1.2. Подтрикуспидальные дефекты перегородок сердца 1.2.1. Дефект межжелудочковой перегородки (ДМЖП) 1.2.2. Открытый артериальный проток (ОАП) 1.2.3. Дефект аорто-легочной перегородки 1.3. Сложные ВПС с над- и подтрикуспидальным сбросом крови 1.3.1. Атриовентрикулярный канал, полная форма 1.3.2. Общий артериальный ствол 1.3.3. Двойное отхождение сосудов от правого (левого) желудочка с ДМЖП без стеноза ЛА 1.3.4. Транспозиция магистральных сосудов с ДМПП и (или) ОАП и (или) ДМЖП без стеноза ЛА 1.3.5. Функционально единственный желудочек сердца без стеноза ЛА 1.3.5.1. В том числе синдром гипоплазии левых отделов сердца 1.3.6. Сложные комбинированные ВПС со сбросом крови на уровне перегородок сердца [атриовентрикулярная и вентрикулоартериальная дискордантость, criss-cross сердце и другие с ДМЖП и (или) ДМПП и (или) ОАП без стеноза ЛА] 1.4. ВПС с сегментарным увеличением легочного кровотока 1.4.1. Отхождение правой или левой ЛА от восходящей аорты 1.4.2. Большие аорто-легочные коллатеральные артерии без стенозирования при сложных ВПС 1.4.3. Отхождение ЛА от ОАП или больших аорто-легочных коллатеральных артерий без стенозирования при сложных ВПС 1.5. Другие ВПС с увеличенным легочным кровотоком 1.6. Комбинация ВПС с увеличенным легочным кровотоком |
2. Врожденный порок сердца с затруднением оттока крови из малого круга кровообращения/посткапиллярная легочная гипертензия | 2.1. Стеноз легочных вен/коллектора легочных вен 2.2. Трехпредсердное сердце 2.3. Врожденный порок (стеноз и\или недостаточность) митрального клапана 2.4. Рестриктивное межпредсердное сообщение при атрезии левого атриовентрикулярного клапана или порок левого атриовентрикулярного клапана (стеноз и\или недостаточность) у пациентов с унивентрикулярной гемодинамикой 2.5. Врожденный порок (стеноз и\или недостаточность) аортального клапана 2.6. Коарктация, гипоплазия или перерыв дуги аорты 2.7. Патология левого желудочка при ВПС 2.7.1. Гипоплазия левого желудочка 2.7.2. Фиброэластоз эндокарда левого желудочка 2.7.3. Выраженное вторичное снижение функциональной способности левого желудочка при ВПС 2.7.3.1. при патологии коронарных артерий (аномальное отхождение коронарных артерий от ЛА, коронаро-сердечные и коронаро-легочные фистулы и др.) 2.7.3.2. при патологии коронарных вен (стеноз или атрезия коронарного синуса и др.) 2.7.3.3. вторичное снижение функциональной способности левого желудочка вследствие других ВПС 2.8. Кардиомиопатия, развившаяся пренатально 2.9. Новообразования с обструкцией кровотока в левых отделах сердца, развившиеся пренатально 2.10. ВПС с сегментарным затруднением оттока крови из малого круга кровообращения 2.10.1. Стеноз части легочных вен\коллектора с частичным дренажем легочных вен 2.11. Другие ВПС с затруднением оттока крови из малого круга кровообращения 2.12. Комбинация ВПС с затруднением оттока крови из малого круга кровообращения |
3. Комбинированные врожденный порок сердца с увеличением притока и затруднением оттока крови из малого круга кровообращения | Комбинированная пре- и посткапиллярная гипертензионная сосудистая болезнь легких |
4. Идиопатическая ЛАГ в сочетании с врожденным пороком сердца | Выраженное повышение ОЛС при дефектах малой величины, которые сами по себе не могут вызвать тяжелую гипертензионную сосудистую болезнь легких |
Развитие гипертензионной сосудистой болезни легких при ВПС с патологическим внутрисердечным сбросом крови зависит от анатомического варианта, размера дефекта и от объема сброса крови через дефект [7, 8]. Дети с некорригированными общим артериальным стволом, транспозицией магистральных сосудов с ДМЖП, не рестриктивными ДМЖП и ОАП имеют риск наиболее раннего развития легочно-сосудистой болезни. Группу позднего риска составляют дети с дефектом межпредсердной перегородки. Скорость развития легочно-сосудистой болезни зависит также от генетической предрасположенности.
Большие системно-легочные анастомозы (Ватерстоуна-Кули, Поттса и др.), наложенные детям с исходно обедненным легочным кровотоком (тетрада Фалло и др.), при длительном функционировании также приводят к развитию гипертензионной сосудистой болезни легких.
Морфологические изменения легочных артериолл и (или) вен при гипертензионной сосудистой болезни легких включают гипертрофию медии, пролиферацию интимы (1 — 3 обратимые стадии по классификации Heath-Edwards), дилятационные, тромботические и плексиформные изменения, а на терминальных стадиях некротический артериит (4 — 6 необратимые стадии по классификации Heath-Edwards) [9 — 12].
Патогенез и клиническое течение «идиопатической легочной артериальной гипертензии (иЛАГ) в сочетании с ВПС» схожи с идиопатической ЛАГ [7, 13, 14]. Закрытие дефектов перегородок сердца при «иЛАГ в сочетании с ВПС» противопоказано.
1.3 Эпидемиология
Гипертензионная сосудистая болезнь легких у детей, ассоциированная с ВПС, составляет 24 — 58% от всех случаев легочной артериальной гипертензии у детей [6, 7, 14, 24].
Заболеваемость и смертность от педиатрической гипертензионной сосудистой болезни легких, ассоциированной с ВПС, в Российской Федерации в настоящее время не известна.
1.4 Кодирование по МКБ 10
I27.8 — другие уточненные формы легочно-сердечной недостаточности
1.5. Классификация
Возможны пре- и посткапиллярная формы ЛГ (таблица 2). У детей с бивентрикулярной гемодинамикой ЛГ характеризуется как прекапиллярная, если давление заклинивания ЛА составляет 15 мм рт. ст., как посткапиллярная — если давление заклинивания в ЛА > 15 мм рт. ст. Прекапиллярная ЛГ при ВПС — частный случай «легочной артериальной гипертензии (ЛАГ)», наблюдаемой при широком спектре заболеваний.
Таблица 2 — Формы легочной гипертензии для бивентрикулярной гемодинамики
Формы легочной гипертензии для бивентрикулярной гемодинамики | Определение |
Прекапиллярная легочная гипертензия | — Среднее давление в ЛА 25 мм рт. ст. — ОЛС > 3 Ед/м2 — Давление заклинивания ЛА 15 мм рт. ст. |
Посткапиллярная легочная гипертензия | — Среднее давление в ЛА 25 мм рт. ст. — Давление заклинивания ЛА > 15 мм рт. ст. — Нормальный или сниженный сердечный выброс |
Изолированная посткапиллярная легочная гипертензия | Диастолическое давление в ЛА минус давление заклинивания ЛА < 7 мм рт. ст. |
Комбинированная постапиллярная и прекапиллярная легочная гипертензия | Диастолическое давление в ЛА минус давление заклинивания ЛА 7 мм рт. ст. |
В свою очередь, посткапиллярная ЛГ, в зависимости от того, является ли она только следствием передачи повышенного давления из левых отделов сердца или же имеет собственный морфологический субстрат в легочных сосудах, делится на изолированную посткапиллярную и комбинированную (посткапиллярную и прекапиллярную). При изолированной посткапиллярной ЛГ диастолическая разница давления в артериях и венах малого круга кровообращения (диастолическое давление в ЛА минус давление заклинивания ЛА) < 7 мм рт. ст., ОЛС 3 ед\м2, при комбинированной пост- и прекапиллярной диастолическая разница давления 7 мм рт. ст., ОЛС > 3 ед\м2.
При ВПС с дефектами перегородок сердца, в зависимости от тяжести гипертензионной сосудистой болезни легких, может иметь место артерио-венозный, двунаправленный или вено-артериальный (синдром Эйзенменгера) сброс крови на внутрисердечных дефектах.
Гипертензионная сосудистая болезнь легких может сохраняться или прогрессировать после хирургической коррекции ВПС (таблица 3). Как правило, это наблюдается при поздней радикальной коррекции ВПС, паллиативной коррекции ВПС, сохраняющихся резидуальных дефектах и ошибочном закрытии дефектов перегородок сердца у детей с «иЛАГ в сочетании с ВПС».
Таблица 3 — Гипертензионная сосудистая болезнь легких после коррекции врожденного порока сердца
Тип коррекции врожденного порока сердца | Особенности гипертензионной сосудистой болезни легких |
1. После радикальной коррекции врожденного порока сердца | 1.1. При наличии резидуального ВПС 1.2. При полном устранении ВПС 1.2.1. При поздней радикальной коррекции ВПС 1.2.1. При закрытии дефектов перегородок сердца у пациентов с «иЛАГ в сочетании с ВПС» |
2. После паллиативной коррекции врожденного порока сердца | 2.1. Суживания ЛА 2.2. Системно-легочного анастомоза 2.3. Унифокализации больших аорто-легочных коллатеральных артерий 2.4. Реконструкции путей оттока из правого желудочка с сохранением ДМЖП 2.5. Паллиативных операций предсердного переключения 2.6. Реконструкции или протезирования клапанов сердца при сохранении других компотентов сложного ВПС 2.7. Операции Норвуда и Дамус-Кей-Стенсел с системно-легочным анастомозом, гибридного хирургического лечения синдрома гипоплазии левых отделов сердца — стентирования ОАП с двусторонним суживанием ЛА 2.8. Устранения коарктации аорты при сохранении других компонентов сложного ВПС 2.9. После других паллиативных операций при ВПС |
3. После операций «обхода» правых отделов сердца — гемодинамической коррекции | 3.1 Двунаправленного кавопульмонального анастомоза 3.2. Операции Фонтена 3.3. Полуторажелудочковой коррекции 3.4. После других операций «обхода» правых отделов сердца |
1.6 Клиническая картина
Помимо симптомов того или иного ВПС при прогрессировании ЛГ усиливается одышка и дополнительно снижается толерантность к физической нагрузке [7, 10, 11, 13 — 15, 19]. У детей с дефектами перегородок из-за уменьшения артериовенозного сброса крови при нарастании ЛАГ клинические признаки застойной сердечной недостаточности (увеличение печени, влажные хрипы в легких) становятся менее выраженными, снижается частота застойных бронхо-легочных заболеваний. При далеко зашедшей стадии легочно-сосудистой болезни вновь нарастает правожелудочковая недостаточность, может появиться кровохарканье (из-за разрыва патологических коллатеральных легочных сосудов).
Синдром Эйзенменгера — веноартериальный сброс крови через дефекты перегородок — характеризуется прогрессирующим цианозом, вторичным эритроцитозом на фоне гипоксемии, повышением вязкости крови со склонностью к коагулопатиям (как к тромбозам, так и к кровотечениям). Возможны парадоксальные системные эмболии с нарушением мозгового, почечного и печеночного кровообращения. Другие системные проявления синдрома Эйзенменгера — гипертрофическая остеоартропатия, сколиоз, гиперурикемия и холелитиаз. Угрозу для жизни могут представлять аритмии, легочные кровотечения, компрессия коронарных артерий дилатированной легочной артерией и нарушения мозгового кровообращения [7, 10, 11, 13 — 15, 19].
Прогрессирующее ухудшение функционального класса легочной артериальной гипертензии наряду с положительными биохимическими тестами на сниженное кровообращение внутренних органов, нарастающей гипоксемией и правожелудочковой недостаточностью — значимый фактор риска летального исхода.
Легочно-гипертензионный криз — быстрое и значительное повышение легочного сосудистого сопротивления при ЛГ, обусловленное различными провоцирующими факторами (физическая нагрузка, гиповолемия, периоперационный стресс, ацидоз и др.). Рост сосудистого сопротивления малого круга кровообращения приводит к правожелудочковой недостаточности, уменьшению преднагрузки левого желудочка, снижению сердечного выброса, системной гипотензии и может стать причиной смерти.
В случае если легочно-гипертензионный криз развивается у пациента с внутрисердечными коммуникациями, на последних может появиться или усилиться вено-артериальный сброс крови и в известной мере предотвратить недостаточную преднагрузку левого желудочка, системную гипотензию и критическое ухудшение состояния ценой нарастания гипоксемии. Наличие и возможность увеличения вено-артериального сброса крови обеспечивают большую продолжительность жизни пациентов при синдроме Эйзенменгера по сравнению с идиопатической ЛАГ и с резидуальной ЛАГ после коррекции ВПС [7, 10, 11, 13 — 15, 19].
2. Диагностика
2.1 Жалобы и анамнез
— При сборе анамнеза и жалоб для верификации диагноза рекомендуется выяснить у ребенка с гипертензионной сосудистой болезнью легких и/или его родителей о существовании у него одышки и прогрессирующего снижения толерантности к физической нагрузке для верификации диагноза [1 — 3, 7, 10, 11, 13 — 15, 19, 20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
— При сборе анамнеза и жалоб для верификации диагноза рекомендуется выяснить у ребенка с гипертензионной сосудистой болезнью легких и/или его родителей о существовании у него сердцебиения и ангинозных болей [1 — 3, 7, 10, 11, 13 — 15, 19, 20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
2.2 Физикальное обследование
— Во время физикального обследования рекомендуется всем пациентам провести общий осмотр, исследовать кожные покровы и подкожную клетчатку лица, туловища и конечностей, перкуторно определить границы сердца, характеристики верхушечного и сердечного толчка, осмотреть и пропальпировать шейные вены, провести аускультацию сердца, пропальпировать и проперкутировать печень для верификации диагноза [1 — 3, 7, 10, 11, 13 — 15, 19, 20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
Комментарии: При физикальном обследовании следует обратить внимание на цвет кожных покровов, изменения фаланг пальцев по типу «барабанных палочек» и «часовых стекол», на расширение границ сердца, пульсацию шейных вен, на акцент 2 тона сердца над легочной артерией, систолический шум трикуспидальной регургитации и диастолический шум недостаточности легочного клапана (шум Грехем-Стила), а также шум артерио-венозного сброса крови на дефекте, на увеличение печени и периферические отеки.
2.3 Лабораторная диагностика
— С целью подтверждения или исключения гипертензионной сосудистой болезни легких и для контроля проводимой медикаментозной терапии рекомендуется всем пациентам определять уровень мозгового натрийуретического пептида (BNP) [1 — 3, 7, 10, 11, 13 — 15, 19, 20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
2.4 Инструментальная диагностика
— Диагноз гипертензионной сосудистой болезни легких, ассоциированной с ВПС, рекомендуется устанавливать пациентам на основании ЭКГ (признаки отклонения электрической оси сердца вправо и гипертрофии правых отделов сердца) [7, 15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
— Диагноз гипертензионной сосудистой болезни легких, ассоциированной с ВПС, рекомендуется устанавливать пациентам на основании рентгенографии грудной клетки (признаки усиления и «ампутации» легочного сосудистого рисунка, выбухание дуги легочной артерии, уменьшения ранее увеличенных размеров сердца) [7, 15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
— Диагноз гипертензионной сосудистой болезни легких, ассоциированной с ВПС, рекомендуется устанавливать пациентам на основании пульсоксиметрии отдельно на руках и ногах в состоянии покоя и физической нагрузки [7, 15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
Комментарии: при вено-артриальном сбросе крови с синдромом Эйзенменгера наблюдается снижение сатурации капиллярной крови < 94%.
— Диагноз гипертензионной сосудистой болезни легких, ассоциированной с ВПС, рекомендуется устанавливать пациентам на основании результатов двухмерной трансторакальной Эхо-КГ, являющейся основным неинвазивным методом исследования, по скорости трикуспидальной регургитации > 2,8 м/сек [7, 15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
— Пациентам старше 6 месяцев с ЛГ 70% от системного давления, по данным Эхо-КГ, для оценки степени имеющейся легочно-сосудистой болезни рекомендуется катетеризация сердца с расчетом гемодинамики по методу Фика [7, 10, 16 — 18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
— Пациентам старше 6 месяцев с ВПС и прекапиллярной ЛГ 70% от системного давления по данным катетеризации сердца рекомендуется инвазивный мониторинг давления в легочной артерии (ИМДЛА) с тестом на вазореактивность для уточнения показаний к хирургическому и (или) медикаментозному лечению [7, 19 — 23].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — IIa)
Комментарии: При ИМДЛА у детей с изолированной пост капиллярной ЛГ тест на вазореактивность не проводится.
— Для оценки эффективности и коррекции проводимой медикаментозной терапии у детей с резидуальной ЛГ после коррекции ВПС и у неоперабельных детей с ВПС в возрасте старше 6 лет рекомендуется тест 6-минутной ходьбы [1 — 3, 7, 10, 11, 13 — 15, 19, 20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
3. Лечение
3.1 Хирургическое лечение ВПС
— Рекомендуется пациентам с гипертензионной сосудистой болезни легких проводить коррекцию ВПС в раннем возрасте [1 — 3, 7, 10, 11, 13 — 15, 19 — 21].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — IIa)
Комментарии: Возможности хирургической коррекции ВПС представлена в таблице 4.
Таблица 4 — Возможность хирургической коррекции ВПС при гипертензионной сосудистой болезни легких
Тип гемодинамики | Возможность коррекции | |
1. При бивентрикулярной гемодинамике | 1. | 1.1. Возможна радикальная хирургическая коррекция 1.1.1. С нормализацией давления в ЛА 1.1.2. С сохранением резидуальной ЛГ и необходимостью медикаментозной терапии ЛГ в послеоперационном периоде |
2. | 1.2. Возможна паллиативная хирургия 1.2.1. В качестве самостоятельного хирургического вмешательства 1.2.2. С последующей радикальной коррекцией | |
3. | 1.3. Неоперабельные | |
2. При унивентрикулярной гемодинамике | 4. | 2.1. Возможен полный многоэтапный «обход» правых отделов сердца 1) Суживание ЛА, операции Дамус-Кей-Стенсел, Норвуда или гибридная коррекция синдрома гипоплазии левых отделов сердца со стентированием ОАП и двухсторонним суживанием ЛА; 2) Двунаправленный кавопульмональный анастомоз; 3) Операция Фонтена |
5. | 2.2. Возможен только первый и второй этапы хирургического лечения | |
6. | 2.3. Возможен только первый этап хирургического лечения | |
7. | 2.4. Неоперабельные | |
— При невозможности радикальной коррекции у пациентов с ВПС и гипертензионной сосудистой болезнью легких рекомендуется проводить паллиативные хирургические и эндоваскулярные вмешательства, представленные в таблице 5 [1 — 3, 7, 10, 11, 13 — 15, 19 — 21].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — IIa)
Комментарии: Паллиативные хирургические и эндоваскулярные вмешательства у пациентов с ВПС и гипертензионной сосудистой болезнью легких представлены в табл 5.
Таблица 5. Паллиативные хирургические и эндоваскулярные вмешательства у пациентов с ВПС и гипертензионной сосудистой болезнью легких
Цель хирургического лечения | Хирургические вмешательства | |
1. Паллиативная коррекция ВПС и\или устранение ЛГ | 1.1. При бивентрикулярной гемодинамике 1.1.1. Суживание ЛА 1.1.2. Суживание ОАП 1.1.3. Паллиативные операции Сеннинга и Мастарда 1.1.4. Пластика или протезирование клапанов сердца 1.1.5. Устранение коарктации аорты 1.1.6. Другие вмешательства с сохранением сообщений между левыми и правыми камерами сердца 1.1. При унивентрикулярной гемодинамике 1.2.1. Суживание ЛА 1.2.2. Операции Дамус-Кей-Стенсел, Норвуда и гибридная коррекция синдрома гипоплазии левых отделов сердца со стентированием ОАП и двухсторонним суживанием ЛА 1.2.3. Расширение рестриктивного межпредсердного сообщения у пациентов со стенозом или атрезией митрального клапана 1.2.4. Пластика или протезирование клапанов сердца 1.2.5. Устранение коарктации аорты 1.2.6. Другие вмешательства | |
2. Купирование супрасистемной ЛАГ при прогрессирующем течении легочно-сосудистой болезни после радикальной бивентрикулярной коррекции ВПС | 1. | 2.1. Эндоваскулярная атриосептостомия |
2. | 2.2. Легочно-артериальный анастомоз Поттса | |
3. Устранение кровохарканья при прогрессирующем течении легочно-сосудистой болезни у пациентов с ВПС | 3.1. Эндоваскулярная эмболизация аорто-легочных коллатеральных артерий | |
Дети с ВПС и бивентрикулярной гемодинамикой
— Пациентам с ВПС, бивентрикулярной гемодинамикой и ЛГ для предотвращения развития легочно-сосудистой болезни рекомендуется ранняя хирургическая коррекция порока [10, 24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
— Радикальная коррекция порока рекомендуется пациентам с ВПС и бивентрикулярной гемодинамикой в возрасте менее 6 месяцев, независимо от степени имеющейся у них ЛГ, ввиду обратимости морфологических изменений сосудов легких [1 — 3, 7, 10, 11, 13 — 15, 19 — 21].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — IIa)
— У пациентов старше 6 месяцев, имеющих ВПС с бивентрикулярной гемодинамикой и увеличенным легочным кровотоком, в качестве показаний к радикальной коррекции рекомендуются клинические признаки выраженного артерио-венозного сброса крови в сочетании с наличием 1Б-3А гемодинамической группы по классификации В.И. Бураковского и соавторов (приложение Г2) [18, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
— Радикальная коррекция ВПС рекомендуется пациентам старше 6 месяцев с минимальным артерио-венозным сбросом крови на дефектах перегородок, отнесенным к 3Б гемодинамической группе по классификации В.И. Бураковского и соавторов (приложение Г2) и имеющим положительный тест на вазореактивность [18 — 21].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — IIa)
— У пациентов старше 6 месяцев с признаками двунаправленного перекрестного сброса крови на дефектах перегородок, отнесенным к 3Б-4 (Приложение Г2) гемодинамическим группам и имеющим сомнительный результат теста на вазореактивность, рекомендуется паллиативное хирургическое лечение ВПС в сочетании с биопсией легкого [18 — 21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
Комментарии: Показания к последующей радикальной коррекции рекомендуется рассмотреть во время повторного ИМДЛА в отдаленном периоде после паллиативных вмешательств при условии наличия 1 — 3 стадии морфологических изменений по классификации Heath-Edwards [9].
— Пациентам с бивентрикулярной гемодинамикой и легочно-сосудистой болезнью, имеющим отрицательный или парадоксальный результат ИМДЛА, хирургическая коррекция ВПС не рекомендуется [18 — 21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
— Закрытие дефектов перегородок сердца детям с «иЛАГ в сочетании с ВПС» не рекомендуется [1, 2, 19, 21, 26].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — IIa)
— Пациентам с прогрессирующей супрасистемной ЛАГ в отдаленном периоде после радикальной бивентрикулярной коррекции ВПС при отсутствии эффективности медикаментозной терапии рекомендуется атриосептостомия или легочно-артериальный анастомоз Поттса [18 — 21].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
Дети с ВПС и унивентрикулярной гемодинамикой
— Пациентам с функционально единственным желудочком сердца и ЛГ рекомендуется многоэтапное хирургическое лечение с суживанием ЛА, операциями Норвуда, Дамус-Кей-Стенсел с системно-легочным анастомозом или гибридным хирургическим лечением на первом этапе, двунаправленным кавопульмональным анастомозом на втором этапе и операцией Фонтена на третьем этапе [4, 5, 12, 18 — 21].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — IIa)
Комментарии: оперативное вмешательство выполняется в возрасте 3 — 8 недель.
— Пациентам с атрезией или стенозом митрального клапана и рестриктивным межпредсердным сообщением для предотвращения развития легочно-сосудистой болезни рекомендуется расширение межпредсердного сообщения [4, 5, 12, 18 — 21].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — IIa)
— Пациентам с ВПС, легочно-сосудистой болезнью и кровохарканьем рекомендуется эмболизация аорто-легочных коллатеральных артерий [4, 5, 12, 18 — 21].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — IIa)
3.2 Консервативное лечение
Консервативное лечение состоит из комплекса общих мероприятий, поддерживающей и специфической медикаментозной терапии.
— Пациентам с легочно-сосудистой болезнью с целью уменьшения вязкости и улучшения реологических свойств крови рекомендуются кровопускания (флеботомия) с восполнением плазмопотери у при уровне гемоглобина > 200 г/л и гематокрита > 65% при отсутствии признаков обезвоживания [1, 19, 31, 32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
— Долгосрочная антикоагулянтная терапия (варфарин**) с целевым уровнем международного нормализованного отношения 1,5 — 2,5 или дезагрегантная терапия (#ацетилсалициловая кислота**) в возрастных дозировках рекомендуется у детей с легочно-сосудистой болезнью без признаков кровотечений [1, 19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
— Оксигенотерапия рекомендуется пациентам при наличии следующих показаний:
1) пациентам с тяжелыми клиническими проявлениями и гипоксемией (насыщение в капиллярной крови менее 93%) в случае, если оксигенотерапия приводит к уменьшению гипоксемии и клиническому улучшению;
2) для профилактики клинического ухудшения при интеркурентных заболеваниях, гипертермии, возбуждении, болевом синдроме, авиаперелетах и других потенциально опасных состояниях;
3) для купирования легочно-гипертензионного криза [1, 19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
— Пациентам с ВПС и синдромом Эйзенменгера и пациентам с резидуальной ЛГ или ЛАГ после хирургической коррекции ВПС рекомендуется терапия селективными легочными вазодилататорами [1, 7, 14, 19, 33 — 36, 38 — 53].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — I)
Комментарии: препараты подбираются с учетом степени риска ЛГ (приложение Г1).
1. Бозентан** 4 мг/кг/сутки, разделенный на 2 приема (противопоказан детям до 3 лет) [63 — 75]
2. #Силденафил 1 — 2 мг/кг/сутки, разделенный на 3 приема, (у силденафила 2 АТХ, используется CO2KX01 (вазодилятатор)
3. Ингаляционный #илопрост 1,25 — 5 мкг, 6 — 9 ингаляций в сутки. [57 — 62]
Детям с резидуальной ЛАГ после коррекции ВПС и детям с ВПС и синдромом Эйзенменгера при низком риске терапию рекомендуется начинать с одного перорального препарата — бозентана**. В случае отсутствия эффекта монотерапии рекомендуется рассмотреть вопрос о комбинированном лечении) [19].
Детям с резидуальной ЛАГ после коррекции ВПС и детям с ВПС и синдромом Эйзенменгера при высоком риске терапию рекомендуется начинать с ингаляции илопроста, затем рекомендуется рассмотреть вопрос о комбинированной терапии.
— ЛАГ-специфическую терапию у пациентов с резидуальной ЛАГ после хирургической коррекции ВПС рекомендуется продолжать до полной нормализации давления в ЛА и затем в течение как минимум 1 года [19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
Комментарии: ЛАГ-специфическую терапию при «идиопатической ЛАГ в сочетании с ВПС» проводится аналогично терапии идиопатической ЛАГ.
— У пациентов с унивентрикулярной гемодинамикой после кавопульмонального анастомоза и операции Фонтена в комплексной терапии недостаточности кровообращения рекомендуется бозентан**, #силденафил и #илопрост (дозировки описаны выше) [45 — 47, 76].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — I)
Комментарии: препараты, назначенные вне зарегистрированных показаний, могут быть рекомендованы при наличии информированного согласия родителей и заключения врачебной комиссии.
— ЛАГ-специфическая терапия не рекомендуется не оперированным пациентам с ВПС и посткапиллярной ЛГ, а также не оперированным пациентам с ВПС и прекапиллярной ЛГ 1-3А гемодинамических групп [1, 2, 19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
3.3 Иное лечение
Обезболивающая терапия у детей
— Рекомендуется пациентам для премедикации, с целью седации и обеспечения эмоциональной стабильности перед транспортировкой в операционную, применять опиаты и/или бензодиазепины в возрастных дозировках [54 — 56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
Комментарии: Дети до 6 месяцев в премедикации не нуждаются. Дети от 6 месяцев до 3 лет: мидазолам** или диазепам** в/м, либо в/в в возрастных дозировках.
Дети старше 3 лет: тримепередин** и/или мидазолам**, либо диазепам** в/м, в/в в возрастных дозировках.
— Рекомендуется пациентам для индукции в наркоз и поддержания анестезии использовать: фентанил**, пропофол**, бензоадиазепины, натрия оксибутират**, фторсодержащие газовые анестетики в возрастных дозировках. Предпочтительным является проведение комбинированной анестезии с применением галогенсодержащих газовых анестетиков на всех этапах хирургического вмешательства, включая искусственное кровообращение [54 — 56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
Комментарии: препараты, используемые для индукции и поддержании анестезии у детей:
Индукция: Дети до 1 месяца: мидазолам**/натрия оксибутират** и фентанил** в/в в возрастных дозировках. Дети старше 1 месяца: мидазолам**/натрия оксибутират**/пропофол** и фентанил** — в/в в возрастных дозировках. Во всех возрастных группах возможно проведение индукции севофлураном** (как моноиндукции, так и в комбинации с в/в введением фентанила**).
Поддержание анестезии: Дети до 1 месяца: мидазолам**/натрия оксибутират** и фентанил** в/в в возрастных дозировках. Дети старше 1 месяца: мидазолам**/натрия оксибутират**/пропофол** и фентанил** в/в в возрастных дозировках. Во всех возрастных группах возможно применение галогенсодержащих газовых анестетиков в комбинации с фентанилом**. При превышении дозировок (применении дозировок, превышающих указанные в инструкции к препарату) необходимо решение врачебной комиссии.
— Рекомендуется пациентам для обезболивания в раннем послеоперационном периоде использовать опиаты и нестероидные противовоспалительные препараты в возрастных дозировках [54 — 56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
Комментарии: препараты, используемые для обезболивания в послеоперационном периоде:
Первые сутки после операции — тримепередин** в/м каждые 6 — 8 часов, либо в/в инфузия морфина** в возрастных дозировках, далее НПВП. При сохранении выраженного болевого синдрома тримеперидин**/морфин** в возрастных дозировках по показаниям. При превышении дозировок (применении дозировок, превышающих указанные в инструкции к препарату) необходимо решение врачебной комиссии.
При сохранении выраженного болевого синдрома тримеперидин**/морфин** в возрастных дозировках по показаниям.
4. Реабилитация
Программа реабилитации для педиатрической гипертензионной сосудистой болезни легких, ассоциированной с ВПС, к настоящему времени не разработана.
5. Профилактика
— Для профилактики развития гипертензионной болезни легких, ассоциированной с ВПС у детей, рекомендуется ранняя (в возрасте до 6 месяцев) коррекция ВПС [7, 10, 11, 14, 15, 19].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — IIa)
— Пациентам с резидульной ЛГ в отдаленном периоде после коррекции ВПС и детям с ВПС и ЛГ с неоперабельным состоянием не рекомендуются состояния, связанные с высоким риском обострения ЛГ: интенсивная физическая нагрузка, выраженное возбуждение и болевой синдром, обезвоживание, воздействие высокой температуры, постоянное нахождение на большой высоте [1, 2, 7, 10, 11, 15, 19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
— Пациентам с резидуальной ЛГ в отдаленном периоде после коррекции ВПС и неоперабельным детям с ВПС и ЛГ рекомендуется вакцинация от гриппа и пневмококковой инфекции для профилактики гриппа и пневмококковой инфекции [1, 14, 19].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — IIa)
— Всем пациентам с резидуальной ЛГ после коррекции ВПС и детям с ВПС и синдромом Эйзенменгера при стабильном клиническом течении рекомендуется наблюдение детского кардиолога 1 раз в 3 месяца [1, 2, 7, 10, 11, 15, 19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — IIa)
Комментарии: помимо клинического обследования выполняется пульсоксиметрия, ЭКГ, Эхо-КГ и биохимический анализ крови (АСТ и АЛТ) 1 раз в 3 месяца.
6. Дополнительная информация, влияющая на течение и исход заболевания
При использовании венозного доступа у детей с ВПС и синдромом Эйзенменгера проводится тщательная профилактика воздушной эмболии путем (дополнительное обучение медицинского персонала, использования фильтров) [19, 27].
7. Организация медицинской помощи
Показания для плановой госпитализации:
1. первичная диагностика гипертензионной сосудистой болезни легких, ассоциированной с ВПС у детей;
2. плановое хирургическое лечение ВПС с ЛГ;
3. контроль за состоянием пациентов с гипертензионной сосудистой болезнью легких, ассоциированной с ВПС у детей;
4. ухудшение клинического состояния при гипертензионной сосудистой болезни легких, ассоциированной с ВПС у детей.
Показания для экстренной госпитализации:
1. резкое ухудшение клинического состояния при гипертензионной сосудистой болезни легких, ассоциированной с ВПС у детей;
2. развитие легочно-гипертензионных кризов при гипертензионной сосудистой болезни легких, ассоциированной с ВПС у детей
Показания к выписке пациента из стационара:
1. окончание диагностики и подбора лечения при гипертензионной сосудистой болезни легких, ассоциированной с ВПС у детей
Критерии оценки качества медицинской помощи
N | Критерии качества | Уровень убедительности рекомендаций | Уровень достоверности доказательств |
11 | Проведен сбор анамнеза и жалоб у пациента и его родителей | C | IIa |
2 | Проведен физикальный осмотр пациента | C | IIa |
3 | Проведена пациенту трансторакальная эхокардиография (Эхо-КГ) | C | IIa |
4 | Проведена пациенту рентгенография грудной клетки | C | IIa |
5 | Проведена пульсоксиметрия пациенту (отдельно на руках и ногах в состоянии покоя и физической нагрузки) | C | IIa |
6 | Ребенку старше 6 месяцев с ЛГ 70% от системного давления по данным Эхо-КГ выполнена катетеризация сердца с расчетом гемодинамики по методу Фика | C | IIa |
7 | Ребенку старше 6 месяцев с ВПС и прекапиллярной ЛГ 70% от системного давления по данным катетеризации сердца выполнен ИМДЛА с тестом на вазореактивность для уточнения показаний к хирургическому и (или) медикаментозному лечению | C | IIa |
8 | Для оценки эффективности и коррекции проводимой медикаментозной терапии у ребенка с резидуальной ЛГ после коррекции ВПС или у неоперабельного ребенка с ВПС в возрасте старше 6 лет выполнен тест 6-минутной ходьбы | C | IIa |
9 | Пациенту с ВПС, бивентрикулярной гемодинамикой и ЛГ для предотвращения развития легочно-сосудистой болезни выполнена ранняя хирургическая коррекция порока | C | IIa |
10 | У ребенка с бивентрикулярной гемодинамикой и легочно-сосудистой болезнью, имеющего отрицательный или парадоксальный результат ИМДЛА, хирургическая коррекция ВПС не была выполнена | C | IIa |
11 | Ребенку с функционально единственным желудочком сердца и ЛГ выполнено многоэтапное хирургическое лечение с суживанием ЛА, операциями Норвуда, Дамус-Кей-Стенсел с системно-легочным анастомозом или гибридным хирургическим лечением на первом этапе, двунаправленным кавопульмональным анастомозом на втором этапе и операцией Фонтена на третьем этапе | C | IIa |
12 | Ребенку с атрезией или стенозом митрального клапана и рестриктивным межпредсердным сообщением для предотвращения развития легочно-сосудистой болезни о выполнено расширение межпредсердного сообщения | C | IIa |
13 | Ребенку с ВПС и синдромом Эйзенменгера или ребенку с резидуальной ЛГ после хирургической коррекции ВПС назначена ЛАГ-специфическая терапия | C | IIa |
Список литературы
1. N, Humbert M, Vachiery JL, Gibbs S, Lang I, Torbicki A. et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J. 2016; 37(1).
2. N, Simonneau G. (eds). Updates in Pulmonary Hypertension Proceedings of the 5th World Symposium on Pulmonary Hypertension. J Am Coll Cardiol. 2013; 62(25), Suppl D.
3. Чазова И.Е., Мартынюк Т.В. (ред.). Легочная гипертензия. М., 2015.
4. Choussat A., Fontan F., Besse P. Selection criteria for Fontan»s procedure. — In: Anderson R.H., Shineborne E.A. (eds). Pediatric cardiology. Edinburgh: Churchhill Livingstone; 1977: 559 — 570.
5. Hosein RB, Clarke AJ, McGuirk SP, Griselli M, Stumper O, De Giovanni JV et. al. Factors influencing early and late outcome following the Fontan procedure in the current era. The «Two Commandments»? Eur J Cardiothorac Surg. 2007; 31(3): 344 — 52.
6. Cerro MJ, Abman S, Diaz G, Freudenthal AH, Freudenthal F, Harikrishnan S et al. A consensus approach to the classification of pediatric pulmonary hypertensive vascular disease: Report from the PVRI Pediatric Taskforce, Panama 2011. Pulm Circ. 2011; (2): 286 — 298.
7. Dimopoulos K, Wort SJ, Gatzoulis MA. Pulmonary hypertension related to congenital heart disease: a call for action. Eur Heart J. 2014; 35(11): 691 — 700.
8. Nadas AS, Fyler DF. Pediatric cardiology. Philadelphia: WB Saunders; 1972: 684.
9. Heath D, Edwards JE. The pathology of hypertensive pulmonary vascular disease. Circulation. 1958; 18: 533 — 547.
10. Baumgartner H, Bonhoeffer P, De Groot NM, de Haan F, Deanfield JE, Galie N et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J. 2010; 31(23): 2915 — 57.
11. D»Alto M, Mahadevan VS. Pulmonary arterial hypertension associated with congenital heart disease. Eur Respir Rev. 2012; 21(126): 328 — 37.
12. Gorbachevsky SV, Shmalts AA and Zaets SB. What Can Cause Pulmonary Vascular Disease in Functionally Single Ventricle? Anatomy & Physiology. 2016; 6(1):1000e137. Available at: http://dx.doi.org/ 10.4172/2161-0940.1000e137.
13. Therrien J, Rambihar S, Newman B, Siminovitch K, Langleben D, Webb G et al. Eisenmenger syndrome and atrial septal defect: nature or nurture? Can J Cardiol. 2006; 22: 1133 — 1136.
14. Manes A, Palazzini M, Leci E, Bacchi Reggiani ML, Branzi A, N. Current era survival of patients with pulmonary arterial hypertension associated with congenital heart disease: a comparison between clinical subgroups. Eur Heart J. 2014; 35(11): 716 — 24.
15. D»Alto M, Romeo E, Argiento P, Correra A, Santoro G, Gaio G et al. Hemodynamics of patients developing pulmonary arterial hypertension after shunt closure. Int J Cardiol. 2013; 168(4): 3797 — 801.
16. D’Alto M, Romeo E, Argiento P, Santoro G, Sarubbi B, Gaio G et al. Pulmonary vasoreactivity predicts long-term outcome in patients with Eisenmenger syndrome receiving bosentan therapy. Heart Br Card Soc. 2010; 96: 1475 — 1479.
17. Post MC, Janssens S, Van deWerf F, BudtsW. Responsiveness to inhaled nitric oxide is a predictor for mid-term survival in adult patients with congenital heart defects and pulmonary arterial hypertension. Eur Heart J. 2004; 25: 1651 — 1656.
18. Бураковский В.И., Бухарин В.А., Плотникова Л.Р. Легочная гипертензия при врожденных пороках сердца. М.: Медицина; 1975.
19. Горбачевский С.В., Шмальц А.А. Гипертензионная сосудистая болезнь легких, ассоциированная с врожденными пороками сердца. В кн.: Детская кардиохирургия. Руководство для врачей. М., 2016: 833 — 850.
20. Горбачевский С.В., Шмальц А.А., Белкина М.В. Гренадеров М.А., Барышникова И.Ю., Пурсанов М.Г. и др. Алгоритм диагностики гипертензионной сосудистой болезни легких, ассоциированной с врожденными пороками сердца. Бюллетень НЦССХ им. А.Н. Бакулева РАМН Сердечно-сосудистые заболевания. 2015; 16(S3): 12.
21. Горбачевский С.В., Шмальц А.А., Белкина М.В., Гренадеров М.А., Рахмонов К.Х. Алгоритм определения показаний к хирургическому лечению врожденных пороков сердца с гипертензионной сосудистой болезнью легких. Бюллетень НЦССХ им. А.Н. Бакулева РАМН Сердечно-сосудистые заболевания. 2015; 16(S3): 12.
22. Lopes AA, Leary PW. Measurement, interpretation and use of hemodynamic parameters. Cardiol Young. 2009; 19(Suppl 1): 8 — 12.
23. Douwes JM, van Loon RL, Hoendermis ES, Vonk-Noordegraaf A, Roofthooft MT, Talsma MD et al. Acute pulmonary vasodilator response in paediatric and adult pulmonary arterial hypertension: occurrence and prognostic value when comparing three response criteria. Eur Heart J. 2011; 32(24): 3137 — 46.
24. Nakanishi T. Pulmonary arterial hypertension associated with congenital heart disease. Personal perspectives. Int Heart J. 2015; 56. Suppl: S1 — 3. doi: 10.1536/ihj.15-064.
25. Moller JH, Patton C, Varco RL, Lillehei CW. Late results (30 to 35 years) after operative closure of isolated ventricular septal defect from 1954 to 1960. Am J Cardiol 1991; 68: 1491 — 1497.
26. Galie` N, Manes A, Palazzini M, Negro L, Marinelli A, Gambetti S et al. Management of pulmonary arterial hypertension associated with congenital systemic-to-pulmonary shunts and Eisenmenger’s syndrome. Drugs. 2008; 68: 1049 — 1066.
27. Kaemmerer H, Niwa K, Oechslin E, Ewert P, Webb GD, Hess J. Pulmonary Arterial Hypertension in Congenital Heart Disease: Eisenmenger»s Syndrome — A Global Perspective. Bremen: UNI-MED, 2013
28. Broberg CS, Ujita M, Prasad S, Li W, Rubens M, Bax BE et al. Pulmonary arterial thrombosis in Eisenmenger syndrome is associated with biventricular dysfunction and decreased pulmonary flow velocity. J Am Coll Cardiol. 2007; 50: 634 — 642.
29. Sandoval J, Aguirre JS, Pulido T, Martinez-Guerra ML, Santos E, Alvarado P et al. Nocturnal oxygen therapy in patients with the Eisenmenger syndrome. Am J Respir Crit Care Med. 2001; 164: 1682 — 1687.
30. Diller GP, Lammers AE, Haworth SG, Dimopoulos K, Derrick G, Bonhoeffer P et al. A modelling study of atrial septostomy for pulmonary arterial hypertension, and its effect on the state of tissue oxygenation and systemic blood flow. Cardiol Young. 2010; 20: 25 — 32.
31. Broberg CS, Bax BE, Okonko DO, Rampling MW, Bayne S, Harries C et al. Blood viscosity and its relationship to iron deficiency, symptoms, and exercise capacity in adults with cyanotic congenital heart disease. J Am Coll Cardiol. 2006; 48: 356 — 365.
32. Rhodes CJ, Howard LS, Busbridge M, Ashby D, Kondili E, Gibbs JS et al. Iron deficiency and raised hepcidin in idiopathic pulmonary arterial hypertension clinical prevalence, outcomes, and mechanistic insights. J Am Coll Cardiol. 2011; 58: 300 — 309.
33. Galie` N, Beghetti M, Gatzoulis MA Granton J, Berger RM, Lauer A et al. Bosentan therapy in patients with Eisenmenger syndrome: a multicenter, double-blind, randomized, placebo-controlled study. Circulation. 2006; 114: 48 — 54.
34. Gatzoulis MA, Beghetti M, Galie` N, Granton J, Berger RM, Lauer A et al. Longer-term bosentan therapy improves functional capacity in Eisenmenger syndrome: results of the BREATHE-5 open-label extension study. Int J Cardiol. 2007; 127: 27 — 32.
35. Zuckerman WA, Leaderer D, Rowan CA, Mituniewicz JD, Rosenzweig EB. Ambrisentan for pulmonary arterial hypertension due to congenital heart disease. J Am Coll Cardiol. 2011; 107: 1381 — 1385.
36. Mukhopadhyay S, Sharma M, Ramakrishnan S, Yusuf J, Gupta MD, Bhamri N et al. Phosphodiesterase-5 inhibitor in Eisenmenger syndrome: a preliminary observational study. Circulation. 2006; 114: 1807 — 1810.
37. Rosenzweig EB, Kerstein D, Barst RJ. Long-term prostacyclin for pulmonary
38. Tay EL, Papaphylactou M, Diller GP, Alonso-Gonzalez R, Inuzuka R, Giannakoulas G et al. Quality of life and functional capacity can be improved in patients with Eisenmenger syndrome with oral sildenafil therapy. Int J Cardiol 2011; 149: 372 — 376.
39. Zhang ZN, Jiang X, Zhang R, Li XL, Wu BX, Zhao QH et al. Oral sildenafil treatment for Eisenmenger syndrome: a prospective, open-label, multicentre study. Heart 2011; 97: 1876 — 1881.
40. Chau EM, Fan KY, Chow WH. Effects of chronic sildenafil in patients with Eisenmenger syndrome versus idiopathic pulmonary arterial hypertension. Int J Cardiol 2007; 120: 301 — 305.
41. Rosenkranz S, Ghofrani HA, Beghetti M, Ivy D, Frey R, Fritsch A et al. Riociguat for pulmonary arterial hypertension associated with congenital heart disease. Heart. 2015; 101(22): 1792 — 9.
42. Pulido T, Adzerikho I, Channick RN, Delcroix M, N, Ghofrani HA et al. Macitentan and morbidity and mortality in pulmonary arterial hypertension. N Engl J Med. 2013; 369(9): 809 — 18.
43. N, Ghofrani HA, Torbicki A, Barst RJ, Rubin LJ, Badesch D et al. Sildenafil citrate therapy for pulmonary arterial hypertension. N Engl J Med. 2005; 353(20): 2148 — 57.
44. Galie` N, Rubin L, Hoeper M, Jansa P, Al-Hiti H, Meyer G et al. Treatment of patients with mildly symptomatic pulmonary arterial hypertension with bosentan (EARLY study): a double-blind, randomised controlled trial. Lancet. 2008; 371: 2093 — 2100.
45. Hebert A, Mikkelsen UR, Thilen U, Idorn L, Jensen AS, Nagy E et al. Bosentan improves exercise capacity in adolescents and adults after Fontan operation: the TEMPO (Treatment With Endothelin Receptor Antagonist in Fontan Patients, a Randomized, Placebo-Controlled, Double-Blind Study Measuring Peak Oxygen Consumption) study. Circulation. 2014; 130(23): 2021 — 30.
46. Goldberg DJ, French B, McBride MG, Marino BS, Mirarchi N, Hanna BD et al. Impact of oral sildenafil on exercise performance in children and young adults after the fontan operation: a randomized, double-blind, placebo-controlled, crossover trial. Circulation. 2011; 123(11): 1185 — 93.
47. Shang XK, Lu R, Zhang X, Zhang CD, Xiao SN, Liu M J et al. Efficacy of Bosentan inpatients after Fontan procedures: a double-blind, randomized controlled trial. J Huazhong Univ Sci Technolog Med Sci. 2016; 36(4): 534 — 40.
48. Mori H, Park IS, Yamagishi H, Nakamura M, Ishikawa S, Takigiku K et al. Sildenafil reduces pulmonary vascular resistance in single ventricular physiology. Int J Cardiol. 2016; 221: 122 — 7.
49. Hirono K, Yoshimura N, Taguchi M, Watanabe K, Nakamura T, Ichida F et al. Bosentan induces clinical and hemodynamic improvement in candidates for right-sided heart bypass surgery. J. Thorac. Cardiovasc. Surg. 2010; 140: 346 — 351.
50. Inuzuka R, Tatebe S, Wakiguchi S, Nakajima H, Ohtsu H, Dimopoulos K et al. B-type natriuretic peptide at the early stage of univentricular circulation reflects inadequate adaptation to volume overload. Int J Cardiol. 2012; 159(2): 88 — 93.
51. Iversen K, Jensen AS, Jensen TV, Vejlstrup NG, L. et al. Combination therapy with bosentan and sildenafil in Eisenmenger syndrome: a randomized, placebo-controlled, double-blinded trial. Eur Heart J. 2010; 31: 1124 — 1131.
52. D’Alto M, Romeo E, Argiento P, Sarubbi B, Santoro G, Grimaldi N et al. Bosentan-sildenafil association in patients with congenital heart disease-related pulmonary arterial hypertension and Eisenmenger physiology. Int J Cardiol. 2012; 155: 378 — 82.
53. Montani D, Savale L, Natali D, X, Herve P, Garcia G et al. Long-term response to calcium-channel blockers in nonidiopathic pulmonary arterial hypertension. Eur Heart J. 2010; 31: 1898 — 1907.
54. Рыбка М.М., Хинчагов Д.Я., Мумладзе К.В., Лобачева Г.В., Ведерникова Л.В. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения кардиохирургических операций, выполняемых у новорожденных и детей. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2014.
55. Рыбка М.М., Хинчагов Д.Я. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения кардиохирургических операций, выполняемых при ишемической болезни сердца, патологии клапанного аппарата, нарушениях ритма, гипертрофической кардиомиопатии, аневризмах восходящего отдела аорты у пациентов различных возрастных групп. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2015.
56. Рыбка М.М., Хинчагов Д.Я., Мумладзе К.В., Никулкина Е.С. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения рентгенэндоваскулярных и диагностических процедур, выполняемых у кардиохирургических пациентов различных возрастных групп. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2018
57. Xu Z, Zhu L, Liu X, Gong X, Gattrell W, Liu J. Iloprost for children with pulmonary hypertension after surgery to correct congenital heart disease. Pediatr Pulmonol. 2015; 50(6): 588 — 95.
58. Alehan D, I, Sahin M, Ozkutlu S, Ozer S, T. Long-term inhaled iloprost use in children with pulmonary arterial hypertension. Cardiol Young. 2012; 22(4): 396 — 403.
59. Sung KW, Jeon YB, Kim NY, Park KY, Park CH, Choi CH et al. The effects of perioperative inhaled iloprost on pulmonary hypertension with congenital heart disease. Cardiology. 2013; 126(4): 224 — 9.
60. A, Torrent-Vernetta A, de Mir Messa I, Rovira Amigo S, Gran F, Gartner S et al. Use of inhaled iloprost in children with pulmonary hypertension. Pediatr Pulmonol. 2015; 50(4): 370 — 9.
61. Limsuwan A, Wanitkul S, Khosithset A, Attanavanich S, Samankatiwat P. Aerosolized iloprost for postoperative pulmonary hypertensive crisis in children with congenital heart disease. Int J Cardiol. 2008; 129(3): 333 — 8.
62. M, Scholz S, Maxeiner H, Brenck F, Valeske K, Thul J et al. Efficacy of inhaled iloprost in the management of pulmonary hypertension after cardiopulmonary bypass in infants undergoing congenital heart surgery. A case series of 31 patients. HSR Proc Intensive Care Cardiovasc Anesth. 2011; 3(2): 123 — 30.
63. Beghetti M, Haworth SG, Bonnet D, Barst RJ, Acar P, Fraisse A, Ivy DD et al. Pharmacokinetic and clinical profile of a novel formulation of bosentan in children with pulmonary arterial hypertension: the FUTURE-1 study. Br J Clin Pharmacol. 2009; 68: 948 — 55.
64. Berger RM, Haworth SG, Bonnet D, Dulac Y, Fraisse A, N et al. FUTURE-2: Results from an open-label, long-term safety and tolerability extension study using the pediatric FormUlation of bosenTan in pUlmonary arterial hypeRtEnsion. Int J Cardiol. 2016; 202: 52 — 8.
65. M, Sidharta PN, Dingemanse J. Bosentan Pharmacokinetics in Pediatric Patients with Pulmonary Arterial Hypertension: Comparison of Dried Blood Spot and Plasma Analysis. Pharmacology. 2016; 98(3 — 4): 111 — 4.
66. Brun H, Thaulow E, Fredriksen PM, Holmstrom H. Treatment of patients with Eisenmenger’s syndrome with Bosentan. Cardiol Young. 2007; 17(3): 288 — 94.
67. Ivy DD, Doran A, Claussen L, Bingaman D, Yetman A. Weaning and discontinuation of epoprostenol in children with idiopathic pulmonary arterial hypertension receiving concomitant bosentan. Am J Cardiol. 2004; 93(7): 943 — 6.
68. Gilbert N, Luther YC, Miera O, Nagdyman N, Ewert P, Berger F et al. Initial experience with bosentan (Tracleer) as treatment for pulmonary arterial hypertension (PAH) due to congenital heart disease in infants and young children. Z Kardiol. 2005; 94(9): 570 — 4.
69. Apostolopoulou SC, Manginas A, Cokkinos DV, Rammos S. Effect of the oral endothelin antagonist bosentan on the clinical, exercise, and haemodynamic status of patients with pulmonary arterial hypertension related to congenital heart disease. Heart. 2005; 91(11): 1447 — 52.
70. van Loon RL, Hoendermis ES, Duffels MG, Vonk-Noordegraaf A, Mulder BJ, Hillege HL et al. Long-term effect of bosentan in adults versus children with pulmonary arterial hypertension associated with systemic-to-pulmonary shunt: does the beneficial effect persist? Am Heart J. 2007; 154(4): 776 — 82.
71. Maiya S, Hislop AA, Flynn Y, Haworth SG. Response to bosentan in children with pulmonary hypertension. Heart. 2006; 92(5): 664 — 70.
72. Simpson CM, Penny DJ, Cochrane AD, Davis AM, Rose ML, Wilson SE et al. Preliminary experience with bosentan as initial therapy in childhood idiopathic pulmonary arterial hypertension. J Heart Lung Transplant. 2006; 25(4): 469 — 73.
73. Ivy DD, Rosenzweig EB, JC, Brand M, Rosenberg D, Barst RJ. Long-term outcomes in children with pulmonary arterial hypertension treated with bosentan in real-world clinical settings. Am J Cardiol. 2010; 106(9): 1332 — 8.
74. Hislop AA, Moledina S, Foster H, Schulze-Neick I, Haworth SG. Long-term efficacy of bosentan in treatment of pulmonary arterial hypertension in children. Eur Respir J. 2011; 38(1): 70 — 7.
75. Taguchi M, Ichida F, Hirono K, Miyawaki T, Yoshimura N, Nakamura T et al. Pharmacokinetics of bosentan in routinely treated Japanese pediatric patients with pulmonary arterial hypertension. Drug Metab Pharmacokinet. 2011; 26(3): 280 — 7.
76. Rhodes J, Ubeda-Tikkanen A, Clair M, Fernandes SM, Graham DA, Milliren CE et al. Effect of inhaled iloprost on the exercise function of Fontan patients: a demonstration of concept. Int J Cardiol. 2013; 168(3): 2435 — 40.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Л.А. Бокерия, академик РАН, профессор, директор ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» МЗ РФ;
2. С.В. Горбачевский, д.м.н., профессор, директор экспертного Центра хирургического и эндоваскулярного лечения легочной гипертензии ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» МЗ РФ;
3. А.А. Шмальц, д.м.н., ведущий научный сотрудник отделения хирургического лечения заболеваний сердца с прогрессирующей легочной гипертензией ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» МЗ РФ;
4. М.А. Школьникова, д.м.н., профессор, научный руководитель Обособленного структурного подразделения «Научно-исследовательский клинический институт педиатрии имени академика Ю.Е. Вельтищева» ФГБОУ ВО РНИМУ им. Н.И. Пирогова;
5. И.М. Миклашевич, к.м.н., руководитель детского кардиологического отделения Обособленного структурного подразделения «Научно-исследовательский клинический институт педиатрии имени академика Ю.Е. Вельтищева» ФГБОУ ВО РНИМУ им. Н.И. Пирогова;
6. С.Н. Иванов, д.м.н., профессор, ведущий научный сотрудник лаборатории врожденных пороков сердца Центра детской кардиохирургии и хирургии новорожденных детей ФБГУ «НМИЦ им. академика Е.Н. Мешалкина» МЗ РФ;
7. В.П. Подзолков, академик РАН, профессор, заместитель директора по научной работе ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» МЗ РФ;
8. Е.Л. Бокерия, д.м.н., руководитель 2-го отделения патологии новорожденных и недоношенных детей ФГБУ «НМИЦ акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» МЗ РФ;
9. И.Е. Чазова, академик РАН, профессор, заместитель Генерального директора, директор института клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ Кардиологии» МЗ РФ;
10. Т.В. Мартынюк, д.м.н., руководитель Отдела легочной гипертензии и заболеваний сердца института клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ Кардиологии» МЗ РФ;
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория разработанных клинических рекомендаций:
1. Врач-сердечно-сосудистый хирург
2. Врач-детский кардиолог
3. Врач-педиатр
Таблица П1. Уровни убедительности рекомендаций
Уровень достоверности доказательности | Определение |
A | Доказательства получены на основании многочисленных рандомизированных клинических исследований и мета-анализов |
B | Доказательства получены на основании отдельных рандомизированных или больших нерандомизированных исследований |
C | Единодушное мнение экспертов и\или небольшие исследования, ретроспективные исследования, регистры |
Таблица П2 — Уровни достоверности доказательности
Уровень убедительности рекомендаций | Описание | |
Уровень I | Процедура или лечение являются полезными/эффективными, они должны быть выполнены/назначены. | |
Уровень II | Уровень IIa | Процедура или лечение с большой долей вероятности являются полезными/эффективными, их разумно было бы выполнить/назначить. |
Уровень IIb | Противоречивые доказательства о пользе/эффективности процедуры или лечения, их выполнение/назначение может быть рассмотрено. | |
Уровень III | Процедура или лечение являются вредными/неэффективными, они не должны выполняться/назначаться. | |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию — не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Нет
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Алгоритм ведения пациентов с гипертензионной сосудистой болезнью легких, ассоциированную с ВПС
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Легочная гипертензия — угрожающее патологическое состояние, когда в легких ухудшается циркуляция крови и сердцу становится крайне трудно работать. Именно так происходит у детей, страдающих этим потенциально смертельным заболеванием, долгое время считавшимся неизлечимым.
Одышка, сердцебиение и повышенная утомляемость заставляют думать, что у ребенка болезнь сердца или астма. Но в ряде случаев эти симптомы могут быть вызваны патологическими изменениями кровеносных сосудов легких. Сосуды становятся все более и более узкими. В результате все меньше крови доходит до воздушных мешочков (альвеол) легких, затрудняя получение организмом ребенка кислорода. Ощущения страдающих легочной гипертензией подобны пребыванию на высоте нескольких тысяч метров. Сердце ведет все более ожесточенную борьбу с дополнительным сопротивлением, создаваемым суженными кровеносными сосудами, пока в конце концов не отказывает.
У некоторых детей повышен риск развития легочной гипертензии, например, при пороке сердца, аутоиммунных заболеваниях, бронхолегочной дисплазии или ВИЧ-инфекции. Правильный диагноз часто устанавливают слишком поздно. Поскольку легочная гипертензия развивается постепенно и на начальном этапе симптомы отсутствуют, ее часто диагностируют уже в тяжелой стадии. Как правило, требуется консультация нескольких врачей, прежде чем удается поставить диагноз легочной гипертензии. Важную информацию можно получить при эхокардиографическом исследовании. Полученные данные необходимо, если позволяет состояние пациента, подтвердить, напрямую измеряя давление в сердце и сосудах с помощью специального катетера.
Если удается выявить заболевание на ранней стадии, можно стабилизировать состояние пациента и поддерживать более высокое качество жизни. Недавно единственной надеждой для пациентов с легочной гипертензией была пересадка легких. Однако уже сейчас имеется возможность эффективно лечить легочную гипертензию специальными лекарственными препаратами.
Каждый организм реагирует на методы лечения и лекарственные препараты по-разному. Поэтому сказать, какие из них окажутся наиболее действенными именно для Вашего ребенка, без специального обследования и последующего постоянного наблюдения не представляется возможным. Проконсультируйтесь у своего лечащего врача.
Приложение Г
Приложение Г1
КРИТЕРИИ
ТЯЖЕСТИ ТЕЧЕНИЯ ГИПЕРТЕНЗИОННОЙ СОСУДИСТОЙ БОЛЕЗНИ ЛЕГКИХ
У ДЕТЕЙ
Факторы риска | Низкий риск | Высокий риск |
Клинические признаки ПЖ недостаточности | Нет | Да |
Клиническое ухудшение | Нет | Да |
Синкопальные состояния | Нет | Да |
Развитие ребенка | Нет отставания в развитии | Отставание в развитии |
Функциональный класс по ВОЗ | I, II | III, IV |
Мозговой натрийуретический пептид (BNP) | Минимальное повышение | Существенное повышение |
Эхокардиография | Нет существенной дилатации\дисфункции ПЖ Нет перикардиального выпота | Существенная дилатация\дисфункция ПЖ Перикардиальный выпот |
Гемодинамические показатели | СИБКК > 3,0 л\мин\м2 среднее ДЛА \ среднее АД < 0,75 Положительный тест на вазореактивность | СИБКК < 2,5 л\мин\м2 среднее ДЛА \ среднее АД > 0,75 Давление в ПП > 10 мм рт. ст. ОЛС > 20 Ед\м2 |
Приложение Г2
ГЕМОДИНАМИЧЕСКАЯ КЛАССИФИКАЦИЯ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ ПРИ ВПС
(В.И. Бураковский, В.А. Бухарин, Л.Р. Плотникова,
1975 [18]).
Гемодинамическая группа | ЛГ, % | АВ сброс крови, % | ОЛС\ОПС, % |
I А | < 30 | < 30 | < 30 |
I Б | < 30 | > 30 | < 30 |
II | 30 — 70 | 50 — 60 | ~ 30 |
III А | > 70 | > 40 | < 60 |
III Б | > 70 | < 40 | > 60 |
IV | 100 или > | Обратный | 100 или > |
Kompleksnoe lechenie detey s vtorichnoy legochnoy gipertenziey | Maytbasova
Цель. Провести анализ результатов комплексного лечения детей с врожденными пороками сердца (ВПС), осложненными легочной гипертензией (ЛГ).Материал и методы. В исследование были включены 62 пациента с септальными дефектами (дефект межжелудочковой перегородки, дефект межпредсердной перегородки, атриовентрикулярная коммуникация), осложненными ЛГ 2-4-й степени, зарегистрированной до и после операции, а также 2 пациента (9 и 12 лет) с неоперабельными дефектами межжелудочковой перегородки в связи с развитием у них синдрома Эйзенменгера. Исследуемые были разделены на 3 группы и 4 подгруппы в зависимости от степени ЛГ и терапии. Возраст детей — от 6 мес до 12 лет. Мальчиков — 34 (54,8%), девочек — 28 (45,2%). Обследование и лечение проводились в стационарных условиях и включали сбор анамнеза, общеклинические исследования, ЭКГ, ЭхоКГ, рентгенографию органов грудной клетки и др. Обследование в катамнезе пациентов с ВПС, получавших в составе комплексной терапии силденафил, проведено через 3 и 6 мес.Результаты. Первая группа представлена 47 пациентами со 2-й степенью ЛГ, вторая — 13 с 3-й степенью ЛГ и третья — 2 с синдромом Эйзенменгера. Все пациенты со 2-й степенью ЛГ, 4 пациента с 3-й степенью в дооперационном периоде наряду с диуретиками и 17 с сердечным гликозидами получали в лечении Капотен (каптоприл) в дозе 0,5-1,0 мг/кг в сутки, а 4 пациентам с 3-й степенью ЛГ вместо Капотена назначался силденафил 1 мг/кг в сутки. В раннем послеоперационном периоде у 16 пациентов не было выявлено значимого уменьшения легочного сосудистого сопротивления. Поэтому из них 11 детей с резидуальной ЛГ получали Капотен; 5 детей, а также дети с синдромом Эйзенменгера — силденафил. У пациентов, принимавших силденафил в течение 6 мес, отмечались уменьшение выраженности одышки, исчезновение кашля, улучшение общего самочувствия и состояния, а также снижение функционального класса — ФК (с IV до III — у 4 детей и с III до II — у 7). По результатам ЭхоКГ снижение среднего давления в легочной артерии (СДЛА) достигало 17-31% от СДЛА дооперационного периода (9). Но в связи с малым числом наблюдений детей с ВПС и вторичной ЛГ, принимавших в терапии силденафил, результаты исследования не являются достоверными. У пациентов, получавших в лечении Капотен в дооперационном периоде, со 2-й (47) и 3-й степенью ЛГ (4), а также с резидуальной ЛГ (11) отмечалась высокая эффективность терапевтического действия. Диуретики назначались пациентам с ВПС, осложненным ЛГ, как для лечения, так и для профилактики застойных явлений. Антагонисты альдостерона (спиронолактон, верошпирон, 1-2 мг/кг в сутки) использовали для длительного приема при развитии хронической сердечной недостаточности, особенно у пациентов с сердечной недостаточностью III-IV ФК в связи с небезопасностью длительного приема фуросемида.Заключение. Таким образом, своевременно проведенная комплексная медикаментозная терапия позволила либо отсрочить оперативное вмешательство, либо подготовленных к операции больных направить на хирургическую коррекцию, а также уменьшить степень выраженности резидуальной ЛГ, тем самым снизить летальность и инвалидность детей с ВПС.
Врожденные пороки сердца – диагностика и лечение пороков сердца
Пороки сердца врожденные – это патологии, возникшие в результате незавершенного или нарушенного формообразования сердца или крупных сосудов в стадии внутриутробного развития. Среди всех пороков чаще всего встречаются дефекты межжелудочковой перегородки.
Клиническая картина и диагностика
Стеноз легочного ствола проявляется одышкой, которая становится сильнее при физической нагрузке, быстрой утомляемостью и сердцебиением. При диагностике определяют грубые систолические шумы и дрожание, признаки увеличения размеров правого желудочка и предсердия, а также повышение давления. ЭхоКГ позволяет определить точное место сужения и его характер.
Врожденный стеноз устья аорты беспокоит пациентов одышкой, сжимающими болями в сердце, головокружениями, обмороками, утомляемостью. При диагностическом исследовании определяются смещение верхушечного толчка влево, грубый систолический шум в подреберье, систолическое дрожание. На электрокардиограмме видны признаки гипертрофии левого желудочка, при запущенном стенозе – заметна ишемия миокарда и мерцательная аритмия. ЭхоКГ позволяет определить характер и степень сужения, его расположение, регистрируют расстройство сократительной функции миокарда левого желудочка при недостаточности коронарных сосудов.
Открытый артериальный проток – его главными симптомами являются сердцебиение и одышка, усиливающаяся при нагрузке. Ребенок подвержен заболеваниям дыхательного тракта и отстает в физическом развитии. При выслушивании во втором межреберье слева прослушивается непрерывный систолический шум. ЭКГ показывает нормограмму, а при выраженной легочной гипертензии – правограмму. На рентгене выявляется увеличение кровенаполнения сосудов легких . Осложнением открытого артериального протока является аневризматическое расширение кровяного протока и его разрыв, а также бактериальный эндокардит.
Дефект межпредсердной перегородки. Для этого порока характерны одышка и приступы сердцебиения, утомляемость при нормальной физической нагрузке, задержка в росте, склонность к пневмонии и простудным заболеваниям. При диагностике выявляются систолические шумы, сердечный горб, усиление второго тона над легочной артерией, расширение границ сердца, изменение размеров желудочков, повышение амплитуды движения задней стенки левого предсердия. Окончательный диагноз ставится на основании ультразвука и катеризации сердца.
Дефект межжелудочковой перегородки. Как правило, у новорожденных малышей и детей первых лет жизни патология протекает крайне тяжело, с явлениями декомпенсации, что проявляется одышкой, гипотрофией, увеличением печени. У ребят более старшего возраста симптомы не так явны. При обследовании диагностируют ассиметрию грудной клетки за счет сердечного горба, бледность кожных покровов, отставание в физическом развитии. Многие необратимые аномалии в сосудах легких, как правило, могут образовываться на первом году жизни.
Тетрада Фалло. Новорожденные с этим пороком развиты нормально. Первые признаки Тетрады появляются очень скоро, как правило, через несколько дней после рождения. При крике или кормлении появляется синюшность и одышка, которые с каждым месяцем становятся все более характерными. В 1-2 года кожа приобретает синеватый оттенок, на ней становятся видны увеличенные венозные сосуды. Особенно заметна синева на конъюнктивах, ногтевых фалангах рук и ног, губах, ушных раковинах. Часто пальчики имеют вид барабанных палочек. Естественно, что при таком пороке физическое развитие ребенка отстает от нормального. Нередко Тетраде Фалло сопутствуют и другие патологии: незаращение верхней губы и/или мягкого неба, плоскостопие, воронкообразная грудь.
Лечение врожденных пороков сердца
Врожденные пороки сердца лечатся хирургическим путем.
При стенозе легочного ствола показана вальвулопластика.
Операция при врожденном стенозе устья аорты показана детям грудного возраста при недостаточности кровообращения; детям старше 3 лет операция назначается при разнице систолического давления между аортой и левым желудочком более 50 мм ртутного столба; больным старшего возраста операция показана при жалобах и клинических признаках артериального стеноза независимо от величины градиента давления.
Дефект межжелудочковой перегородки должен быть оперативно устранен до появления синдрома Эйзенменгера.
При Тетраде Фалло используют радикальные и паллиативные методы коррекции пороков. В первом случае операция заключается в закрытии межжелудочкового дефекта и устранении стеноза, во втором – коррекция Тетрады происходит путем наложения обходных межартериальных анастомозов.
В сети клиник «Медицентр» принимают высококвалифицированные кардиологи, которые помогут разобраться в особенностях того или иного порока, проведут диагностику и дадут рекомендации по устранению врожденных патологий и последующей реабилитации.
Наши клиники в Санкт-Петербурге
Медицентр Юго-Запад
Пр.Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону
+7 (812) 640-55-25
Лечение комплекса Эйзенменгера в Израиле: цены, отзывы, стоимость. Комплекс Эйзенменгера Израиль: центры, клиники, больницы
В медицине достаточно много сердечных заболеваний, которые считаются неизлечимыми. В Израильских центрах лечения комплекса Эйзенменгера каждый пациент компании ServiceMed имеет уникальную возможность пройти высокоточное обследование и получить эффективное лечение.
Комплекс (синдром) Эйзенменгера представляет собою сочетание нескольких сердечных патологий: дефекта межжелудочковой перегородки, правостороннего смещения аорты и гипертрофии правого желудочка. Иногда это понятие включает и другие сердечные пороки, такие как отсутствие желудочка и др.
Комплекс выражается в том, что аорта, смещенная вправо, отходит одновременно от правого и левого желудочка, что нарушает процесс правильного кровообращения. Таким образом, в аорту поступает смешанная кровь. За счет этого организм недополучает кислород, правый желудочек значительно гипертрофирован и наблюдается увеличенное давление в малом легочном круге кровообращения.
Сегодня израильские специалисты все чаще побеждают различные сердечные заболевания, благодаря современному техническому оснащению и применению инновационных методик лечения. Узнать подробнее…
Диагностика: усовершенствованные классические и инновационные методы
Как и в случае любого другого заболевания, крайне важно раннее обследование, предоставляющее возможность своевременного начала лечения. С целью диагностики, в больницах Израиля применяются следующие методы:
- Электрокардиография
- Рентгенограмма грудной зоны
- Эхокардиография
- Контрастная антиография
- Зондирование сердца
- Катетеризация.
Последние диагностические методы являются проникающими, что позволяет исследовать сердце изнутри. Это современное обследование, которое предоставляет максимально детальные данные о характере заболевания, его стадиях и особенностях.
Лечение
С комплексом Эйзенменгера больной человек может жить продолжительное время, однако кислородное голодание со временем не может негативно не сказаться на работе жизненно-важных органов. В будущем данное заболевание может также привести к внезапной остановке сердца и летальному исходу. Успех лечения напрямую зависит от того, насколько своевременно его провели.
В клиниках Израиля единственный эффективный метод устранения патологии — это хирургическая операция. Преимуществом выполнения такой операции в Израиле является высокий процент эффективности, безупречная точность хирургического вмешательства, высокотехнологическое оборудование, которое применяется в процессе операции и действенные восстановительные программы, способствующие скорейшему возвращению к привычному образу жизни.
В процессе операции хирург выполняет:
- коррекцию дефекта межжелудочковой перегородки;
- выправление аорты, смещение ее к левому предсердию;
- устанавливает искусственный сердечный клапан. Узнать больше…
На сегодняшний день сотни пациентов с синдромом Эйзенменгера в Израиле прошли сложную операцию, которая предоставила им шанс избавиться от патологии и жить долгой и счастливой жизнью.
Программа лечения
- Консультация у кардиолога
- Диагностика
- Выбор оптимального времени для хирургического вмешательства
- Проведение операции
- Реабилитационная программа
- Заключительная консультация у кардиолога
- Мониторинг состояния здоровья после возвращения домой.
Вопросы наших пациентов
1. Врачи обнаружили у меня открытый артериальный проток. Есть подозрение на синдром Эйзенменгера, так ли это?
Действительно, иногда такие пороки сердца, как открытый артериальный проток, отсутствие желудочка и атриовентрикулярный канал называют синдромом Эйзенменгера. Однако здесь следует понимать, что комплекс – это совокупность двух и более пороков, а каждый по отдельности – самостоятельное заболевание. Но если врачи подозревают наличие синдрома Эйзенменгера, на это есть причины и требуется дополнительная диагностика.
2. У меня шестой месяц беременности, на УЗИ выявили синдром Эйзенменгера, как быть?
В случае выявления порока сердца, большинство врачей рекомендуют прервать беременность, так как болезнь может привести к неправильному развитию органов ребенка. Если показатели не столь критичны (поскольку данный синдром – совокупность нескольких сердечных патологий, приводящих к усугублению заболевания постепенно), есть возможность сохранить плод, но после рождения сразу же потребуется сложнейшая операция. Лечение комплекса Эйзенменгера в Израиле предоставляет большие шансы для ребенка на выздоровление.
3. У меня комплекс Эйзенменгера. Могу ли я родить ребенка?
При комплексе Эйзенменгера беременность противопоказана по причине высокой смертности беременных женщин с этим заболеванием. Она составляет около 40%. И даже прерывание беременности в первые три месяца срока может привести к летальному исходу. Никто не может дать гарантию, что именно вы войдете или не войдете в число этих женщин. Однако отзывы об устранении комплекса Эйзенменгера в Израиле в подавляющем большинстве — положительные, потому следует дополнительно проконсультироваться с израильскими специалистами.
4. Какая стоимость лечения комплекса Эйзенменгера?
Цены на лечение комплекса Эйзенменгера несколько отличаются в разных медицинских учреждениях и зависят от течения заболевания. Специалисты компании ServiceMed готовы рассмотреть вашу историю болезни и предложить максимально выгодный для вас вариант лечения.
Преимущества лечения с ServiceMed
- Лечение только в лучших израильских клиниках
- Опытные специалисты
- Прогрессивные лечебные методики
- Современное техническое оснащение
- Разумные цены.
Лечение комплекса Эйзенменгера с компанией ServiceMed – ваш шанс на выздоровление!
Синдром Эйзенменгера — Педиатрия — Справочник Merck Professional Edition
Лекарственные средства для лечения легочной артериальной гипертензии (например, аналоги простациклина, антагонисты эндотелина, ингибиторы фосфодиэстеразы-5)
Подход «Обработка и ремонт»
Трансплантация сердца и легких
В идеале, для предотвращения синдрома Эйзенменгера корректирующие операции должны проводиться раньше.После развития синдрома не существует специального лечения, кроме трансплантации сердца и легких, но было показано, что препараты, которые могут снизить давление в легочной артерии, оказывают, по крайней мере, умеренное положительное влияние на выживаемость (1, 2).
Аналоги простациклина (например, трепростинил, эпопростенол), антагонисты эндотелина (например, бозентан) и ингибиторы фосфодиэстеразы-5 (например, силденафил, тадалафил) улучшают результативность в тестах с 6-минутной ходьбой и снижают уровень N-концевой про — уровни мозгового натрийуретического пептида (NT-proBNP).У небольшого числа пациентов агрессивная терапия легочными вазодилатирующими препаратами привела к чистому шунтированию слева направо, что позволило хирургическому лечению основного сердечного дефекта и значительному снижению среднего давления в легочной артерии. Это называется лечением и восстановлением.
Поддерживающая терапия включает предотвращение состояний, которые могут усугубить синдром (например, беременность, истощение объема, изометрические упражнения, высота над уровнем моря, курение). Дополнительный кислород может дать некоторую пользу.
Симптоматическую полицитемию можно лечить осторожной флеботомией для снижения гематокрита до 55–65% плюс одновременное восполнение объема физиологическим раствором. Однако компенсированная и бессимптомная полицитемия не требует кровопускания независимо от гематокрита. Флеботомия в конечном итоге приводит к дефициту железа, что связано с более высоким риском неблагоприятных исходов. В случае подтвержденного дефицита железа следует осторожно назначать дополнительное железо для восполнения запасов железа.
Гиперурикемию можно лечить с помощью аллопуринола 300 мг перорально один раз в день.
Антикоагулянтная терапия противоречива, потому что риск тромбоза легочной артерии и других тромбоэмболических явлений должен быть сбалансирован с риском легочного кровотечения. Терапия варфарином потенциально опасна из-за риска легочного кровотечения, поэтому использование антикоагулянтов должно быть индивидуальным (1). Хотя нет четких доказательств, низкие дозы аспирина потенциально могут предотвратить тромботические осложнения.
Ожидаемая продолжительность жизни зависит от типа и тяжести основной врожденной аномалии и составляет от 20 до 50 лет. У нелеченных пациентов низкая толерантность к физической нагрузке и вторичные осложнения серьезно снижают качество жизни. Было показано, что использование передовых методов лечения легочными вазодилататорами улучшает функциональную способность и, по-видимому, улучшает выживаемость.
Трансплантация сердца и легкого может быть вариантом, но трансплантация предназначена для пациентов с тяжелыми симптомами и неприемлемым качеством жизни.Долгосрочный прогноз после трансплантации осторожен.
Всем пациентам следует проводить профилактику эндокардита перед стоматологическими или хирургическими процедурами, которые могут вызвать бактериемию.
1. Диллер Г.П., Кортен М.А., Бауэр УММ и др.: Текущая терапия и исходы синдрома Эйзенменгера: данные Немецкого национального регистра врожденных пороков сердца. Eur Heart J 37 (18): 1449–1455, 2016. doi: 10.1093 / eurheartj / ehv743
2.Кемпни А., Хьортшой С.С., Гу Х. и др.: Предикторы смерти у современных взрослых пациентов с синдромом Эйзенменгера: многоцентровое исследование. Тираж 135 (15): 1432–1440, 2017. doi: 10.1161 / CIRCULATIONAHA.116.023033
Синдром Эйзенменгера — NORD (Национальная организация по редким заболеваниям)
УЧЕБНИКИ
Димопулос К., Диллер Г.-П. Легочная гипертензия при врожденных пороках сердца у взрослых. Чам, Швейцария: Шпрингер; 2017.
СТАТЬИ В ЖУРНАЛЕ
Димопулос К., Кондлифф Р., Талло Р.М.Р. и др.Эхокардиографическое обследование на легочную гипертензию при врожденных пороках сердца. Обзор недели JACC. J Am Coll Cardiol. 4 декабря 2018 г .; 72 (22): 2778-2788.
Meng M-L, Fu A, Westhoff C, et al. Синдром Эйзенменгера при беременности: когда пора делать ЭКМО ?: отчет о болезни. Международное общество исследования анестезии. 2018; 11 (10): 270-272.
Ядав Л., Реом М., Николс В. Синдром Эйзенменгера, проявившийся в 73 года: никогда не поздно! Общество интенсивной терапии.2018; 46 (1).
Нашат Х., Кемпни А., МакКейб С. и др. Синдром Эйзенменгера: современные перспективы. Отчеты об исследованиях в клинической кардиологии. 2017; 8.
Соренсен Хьортсхой CM, Кемпни А., Йенсен А.С. и др. Прошлая и текущая смертность от конкретных причин при синдроме Эйзенменгера. Европейское общество кардиологов. 2017; 38 (26): 2060-2067.
Sheehan R, Perloff JK, Fishbein MC, Gjerston D, Aberle DR. Легочная неоваскуляризация: отличительная рентгенологическая находка при синдроме Эйзенменгера. Тираж.2005; 112: 2778-85.
Хопкинс WE. Замечательный правый желудочек пациентов с синдромом Эйзенменгера. Ишемическая болезнь сердца. 2005; 16 (1): 19-25. DOI: 10.1097 / 00019501-200502000-00004.
Синдром Будтса В. Эйзенменгера: стратегии медицинской профилактики и лечения. Эксперт Opin Pharmacother. 2005; 6: 2047-60.
Агапито А.Ф., Соуза Л., Оливейра Дж. А. и др., Синдром Эйзенменгера у взрослых — опыт применения новых препаратов для лечения легочной гипертензии. Rev Port Cardiol. 2005; 24: 421-31.
Christensen DD, McConnell ME, Book WM, Mahle WT. Первоначальный опыт терапии бозентаном у пациентов с синдромом Эйзенменгера. Am J Cardiol. 2004; 94: 261-3.
Берман Е.Б., Барст Р.Дж. Синдром Эйзенгерменгера: текущее лечение. Prog Cardiovasc Dis. 2002; 45: 129-38.
Уодделл Т.К., Беннетт Л., Кеннед Р., Тодд Т.Р., Кешавджи Ш. Трансплантация сердце-легкое или легкое при синдроме Эйзенменгера. J Пересадка сердца и легких. 2002; 21: 731-37.
Stoica SC, Макнил К.Д., Перреас К. и др.Трансплантация сердце-легкие при синдроме Эйзенменгера: ранние и отдаленные результаты. Ann Thorac Surg. 2001; 72-1887-91.
Кантор В.Дж., Харрисон Д.А., Муссаджи Дж.С. и др. Детерминанты выживания и продолжительности выживания у взрослых с синдромом Эйзенменгера. Американский журнал кардиологии. 1999; 84 (6): 677-681.
Синдром Эйзенменгера | Стэнфордское здравоохранение
Что такое синдром Эйзенменгера?
Синдром Эйзенменгера — это заболевание, которое в первую очередь поражает подростков и взрослых с определенными врожденными пороками сердца, которые никогда не восстанавливаются или не восстанавливаются после первого года жизни.
Из-за этих пороков сердца кровь не распределяется по телу должным образом и часто приводит к легочной гипертензии (высокое кровяное давление в легких).
Симптомы синдрома Эйзенменгера
Симптомы синдрома Эйзенменгера могут напоминать другие заболевания или проблемы с сердцем. Всегда консультируйтесь с врачом для тщательной оценки. Эти симптомы могут включать, но не ограничиваются:
- Цианоз (бледно-голубой или сероватый оттенок кожи)
- Одышка во время активности
- Одышка в покое
- Боль или стеснение в груди
- Головная боль, головокружение или обморок
- Онемение пальцев ног
- Затуманенное зрение
Кроме того, с синдромом Эйзенменгера часто возникают осложнения.Сюда могут входить:
- Сгустки крови
- Кровоизлияние
- Ход
- Абсцессы головного мозга
- Подагра
Что вызывает синдром Эйзенменгера?
Синдром Эйзенменгера — это состояние, которое возникает в результате высокого кровяного давления в легких (легочная гипертензия), вызванного врожденным пороком сердца.
Вот некоторые распространенные врожденные пороки сердца, которые могут привести к синдрому Эйзенменгера:
- Открытый артериальный проток (ОАП)
- Дефект межпредсердной перегородки (ДМПП)
- Дефект межжелудочковой перегородки (VSD)
- Дефект предсердно-желудочкового канала (AV-канал)
Узнайте больше о причинах синдрома Эйзенменгера.
Диагностика синдрома Эйзенменгера
Пациенты — дети или подростки с врожденным пороком сердца, который не лечили или лечили в возрасте старше 1 года, — наиболее подвержены риску развития синдрома Эйзенменгера.
Наряду с физическим осмотром сердца и легких ваш врач может использовать следующие инструменты для диагностики синдрома Эйзенменгера:
Лечение синдрома Эйзенменгера
Цели лечения синдрома Эйзенменгера направлены на повышение качества жизни пациента.Это может включать, но не ограничивается:
- Снижение артериального давления в легких
- Повышение уровня кислорода в крови
- Уменьшение цианоза (синяя / серая кожа)
- Уменьшение эритроцитоза (повышенное количество эритроцитов)
Врач определит курс лечения синдрома Эйзенменгера на основе истории болезни каждого пациента и их индивидуальных предпочтений. Дополнительные факторы могут включать:
- Возраст и общее состояние здоровья пациента
- Степень заболевания / скорость прогрессирования
- Переносимость лекарств пациентом
Вот некоторые методы лечения, которые помогают улучшить качество жизни пациентов, страдающих синдромом Эйзенменгера:
Синдром Эйзенменгера — обзор
СИНДРОМ АЙЗЕНМЕНГЕРА ПРИ АЦИАНОТИЧЕСКИХ ДЕФЕКТАХ
Синдром Эйзенменгера относится к развитию легочных сосудистых заболеваний и, как следствие, шунтирования справа налево у пациентов с ИБС.Облитерирующие изменения легочных капилляров и артериол возникают в этих сосудах после хронического воздействия повышенного давления и кровотока. Сопротивление легочных сосудов возрастает по мере разрушения сосудов, что в конечном итоге приводит к обращению шунта в исходные дефекты бледной перегородки, такие как ДМПП, ДМЖП и ОАП. Заболевания легочных сосудов могут развиваться у пациентов со сложной цианотической болезнью сердца. Фактически считается, что цианоз ускоряет его развитие, так что у пациентов с d-TGA или артериальным стволом могут развиться легочные сосудистые заболевания в течение первого года жизни, если их не исправить хирургическим путем.
Пациенты с синдромом Эйзенменгера не могут увеличить сердечный выброс в ответ на физическую нагрузку без увеличения шунта справа налево и могут иметь неадекватный системный сердечный выброс в покое. Следовательно, они проявляются утомляемостью и одышкой, головокружением или обмороком при физической нагрузке. Кроме того, по мере развития дисфункции правого желудочка становятся очевидными признаки и симптомы правосторонней ХСН. Стойкий цианоз приводит к полицитемии, которая, если она выражена, может вызывать симптомы повышенной вязкости, такие как головная боль, головокружение и нарушения зрения.Шунтирование справа налево подвергает этих пациентов риску абсцесса головного мозга и системной эмболизации. Кроме того, у пациентов с длительной легочной гипертензией может развиться кровохарканье.
Физические признаки, соответствующие легочной гипертензии, включают припухлость правого желудочка вдоль левой нижней границы грудины и пальпируемое закрытие клапана легочной артерии (P 2 ) во втором левом межреберье. P 2 — громкий, а если легочная гипертензия развита, S 2 — однократный.Может присутствовать систолический щелчок выброса из расширенной легочной артерии. В качестве вторичных последствий легочной гипертензии могут быть слышны два типа шумов: легочная регургитация, вызывающая диастолический шум регургитации на левой границе грудины, и трехстворчатая регургитация, которая вызывает резкий голосистолический шум на нижней левой и правой границах грудины. Оба шума будут относительно высокими из-за повышенного правостороннего давления. При правожелудочковой недостаточности могут отмечаться одышка, тахикардия, повышенное давление в яремных венах, галоп, гепатомегалия и периферические отеки.
ЭКГ демонстрирует отклонение оси вправо и гипертрофию правого желудочка, часто с деформацией. Рентген грудной клетки показывает расширенные центральные легочные артерии и, на поздних стадиях, уменьшенные периферические сосуды. У пациентов с ДМЖП и ОАП сердце обычно нормального размера, тогда как у пациентов с ДМПП возникает кардиомегалия из-за предшествующей дилатации правого желудочка.
Синдром Эйзенменгера имеет гораздо лучшее естественное течение, чем первичная легочная гипертензия, при этом 54% пациентов с ДМЖП и синдромом Эйзенменгера во втором исследовании естественной истории все еще живы через 20 лет после постановки диагноза синдрома Эйзенменгера. 41 Дефект перегородки не следует закрывать после установления необратимого легочного сосудистого заболевания, поскольку он обеспечивает механизм для поддержания системного сердечного выброса при резком повышении легочного сосудистого сопротивления. Следует избегать беременности, поскольку материнская смертность составляет примерно 45%. 42 Точно так же несердечная хирургия связана с летальностью около 19% и, при необходимости, должна проводиться под специальной анестезией и при поддержке отделения интенсивной терапии. 42
Медикаментозное лечение синдрома Эйзенменгера включает поддерживающую терапию и избегание раздражителей, которые могут усугубить легочную гипертензию. Легочный гипертонический криз — это спираль усиленного шунтирования справа налево, обострения гипоксии и повышения легочного сосудистого сопротивления, которое может быть спровоцировано такими факторами, как острое истощение объема, лекарственные препараты, снижающие системное сосудистое сопротивление, и альвеолярная гипоксия. Поддерживающая медикаментозная терапия включает дигиталис и осторожное применение диуретиков у пациентов с признаками сердечной недостаточности.Легочные вазодилататоры используются, если положительный ответ продемонстрирован в лаборатории катетеризации. В этой категории самый продолжительный опыт связан с блокаторами кальциевых каналов, но изучаются новые препараты, включая различные формы аналогов простагландинов и антагонистов рецепторов эндотелина. Дополнительный кислород может быть полезен в определенных условиях, в том числе во время физических упражнений у пациентов со значительной десатурацией, связанной с физической нагрузкой, у пациентов с правожелудочковой недостаточностью, во время полетов на самолете и, конечно, в условиях интеркуррентных инфекций нижних дыхательных путей.Некоторые авторы выступают за кислород в ночное время. Низкие дозы варфарина (т.е. международное нормализованное отношение [INR] 1,5–2,0) используются некоторыми практикующими врачами для предотвращения внутрисердечного или венозного тромбоза у этих пациентов с полицитемией и часто относительно малоподвижным образом жизни. Системная эмболия или тромбоэмболия легочной артерии могут иметь серьезные последствия. Риск кровотечения, включая кровохарканье, необходимо сопоставить с потенциальными преимуществами антикоагулянтов. Следует избегать оральных контрацептивов, заместительной гормональной терапии, обезвоживания и дефицита железа из-за их связи с гиперкоагуляцией и повышенной вязкостью.Если дефицит железа и острое обезвоживание исключены и гематокрит превышает 65%, при появлении симптомов повышенной вязкости в тщательно контролируемой среде может быть проведена флеботомия с заменой объема. Пациентам следует избегать проживания или отдыха на большой высоте; им также следует избегать приема лекарств (например, средств для подавления аппетита), связанных с развитием легочной гипертензии.
Синдром Эйзенменгера, связанный с дефектом межпредсердной перегородки
Синдром Эйзенменгера редко встречается у пациентов с изолированным РАС.Большинство исследований взрослых с диагнозом РАС в зрелом возрасте обнаруживают, что у 6–15% повышенное сопротивление легочных сосудов наблюдается при катетеризации сердца. 43, 44 Считается, что легочные сосудистые заболевания, связанные с РАС, в детстве встречаются очень редко. Синдром Эйзенменгера при РАС обычно возникает после 20 лет и встречается преимущественно у женщин, что интересно по эпидемиологии, аналогичной первичной легочной гипертензии. При физикальном обследовании десатурация артерий присутствует, если правый желудочек менее податлив, чем левый желудочек, что приводит к шунтированию справа налево в ДМПП.Длительное обесцвечивание приводит к появлению клубов. Шум не может быть связан с потоком через ДМПП, но другие признаки легочной гипертензии, описанные выше, будут присутствовать.
Синдром Эйзенменгера, связанный с дефектом межжелудочковой перегородки
Риск развития синдрома Эйзенменгера у пациента с ДМЖП зависит от величины шунта и давления в легочной артерии на ранней стадии болезни пациента, факторов, которые связаны с размером опухоли. дефект. Пациенты обычно имеют в анамнезе хроническую сердечную недостаточность в раннем возрасте, связанную со значительным шунтом слева направо.Синдром Эйзенменгера может развиться у детей с большими ДМЖП в раннем детстве. 45 При физикальном обследовании десатурация артерий присутствует, если сопротивление легочных сосудов выше системного сосудистого сопротивления, что приводит к шунтированию справа налево в ДМЖП. Хроническая десатурация приводит к появлению клубов. Голосистолический шум при ДМЖП значительно уменьшается или исчезает по мере выравнивания давления в правом и левом желудочке. Другие признаки легочной гипертензии, описанные выше, присутствуют.
Синдром Эйзенменгера, связанный с незащищенным артериальным протоком
Точный риск синдрома Эйзенменгера, связанный с ОАП, трудно определить по многим причинам. Обычное хирургическое закрытие этих дефектов, когда оно связано с симптомами или типичными физическими данными, практикуется уже более 50 лет. ОАП существует при различных степенях ограничения давления и потока, и шунт может быть трудно определить количественно даже при катетеризации сердца. Наконец, с учетом снижения заболеваемости материнской краснухой из-за плановой вакцинации, больших КПК встречаются редко после первых нескольких дней жизни.Ясно одно: синдром Эйзенменгера, вызванный большим ОАП, может развиться в возрасте 4–7 лет. 46
При физикальном обследовании имеется дифференциальный цианоз, при этом правая верхняя конечность получает полностью насыщенную кислородом кровь, в то время как дезоксигенированная кровь шунтируется через ОАП и достигает нижних конечностей. Клубы также являются дифференциальными, правая рука не используется. Шум, связанный с ОАП, сначала теряет диастолический компонент по мере повышения легочного сосудистого сопротивления, а позже также исчезает систолический компонент.Следовательно, при тяжелом заболевании легочных сосудов шум не может быть связан с КПК, но будут присутствовать признаки легочной гипертензии, описанные выше.
Синдром Эйзенменгера при полном общем атриовентрикулярном канале
Синдром Эйзенменгера также может возникать у пациентов с полным общим предсердно-желудочковым каналом. Пациенты с синдромом Дауна подвержены более высокому риску заболевания сосудов легких и склонны к более раннему развитию этого осложнения. Физиология аналогична синдрому Эйзенменгера при ДМЖП.
Синдром Эйзенменгера у детей — AHealthyMe — Blue Cross Blue Shield of Massachusetts
Что такое синдром Эйзенменгера у детей?
Синдром Эйзенменгера — это запущенная форма гипертонии легочной артерии . В этом состоянии артерии, по которым кровь идет от сердца к легким, сужаются. Это делает давление кровотока на стенки артерий (артериальное давление) слишком высоким. Сердце должно работать больше, чтобы перекачивать кровь в легкие.Это вызывает повреждение легких.
Синдром Эйзенменгера чаще всего поражает подростков и взрослых с определенными пороками сердца. Он также может поражать детей, хотя встречается не так часто. Когда пороки сердца не восстанавливаются или не устраняются в более позднем возрасте, это увеличивает риск этого состояния. У некоторых людей это может произойти даже после устранения дефекта.
Что вызывает синдром Эйзенменгера у ребенка?
Синдром Эйзенменгера развивается с течением времени. Это результат высокого кровяного давления в легких, связанного с некоторыми проблемами с сердцем, которые присутствуют при рождении (врожденные).Причиной этого с большей вероятностью являются проблемы, при которых кровь течет из левой части сердца в правую часть сердца (шунт слева направо).
Синдром Эйзенменгера более вероятен при более крупных пороках сердца.
Каковы симптомы синдрома Эйзенменгера у ребенка?
Наиболее частые симптомы синдрома Эйзенменгера:
Синяя или сероватая кожа из-за недостатка кислорода в крови (цианоз)
Одышка при активности
Одышка в покое
Чувство усталости
Боль в груди или стеснение в груди
Прыгающее или учащенное сердцебиение
Головная боль
Головокружение или обморок (обморок)
Онемение или покалывание пальцев рук и ног
Затуманенное зрение
Изменения пальцев рук и ног (дубинка)
Вздутие
Увеличенная печень
Как диагностируется синдром Эйзенменгера у ребенка?
Лечащий врач вашего ребенка спросит о симптомах вашего ребенка.Медицинский работник может увидеть признаки при осмотре вашего ребенка. Ваш врач может услышать ненормальный звук сердца, когда слушает сердце вашего ребенка с помощью стетоскопа.
Ваш ребенок может быть направлен к детскому кардиологу. Это врач со специальной подготовкой для лечения сердечных заболеваний у младенцев и детей.
Вашему ребенку могут потребоваться анализы. Сюда могут входить:
Пульсоксиметрия. Маленький зонд используется для проверки количества кислорода в крови.
Анализы крови. Могут быть выполнены анализы для проверки высокого или низкого уровня эритроцитов.
Рентген грудной клетки. Рентген грудной клетки показывает сердце и легкие. В легких могут быть изменения из-за дополнительного кровотока.
Электрокардиограмма (ЭКГ). ЭКГ регистрирует электрическую активность сердца.Он также показывает аномальные ритмы и определяет напряжение сердечной мышцы.
Эхокардиограмма (эхо). Эхо использует звуковые волны для создания движущегося изображения сердца и сердечных клапанов. Эхо может показать направление кровотока. Он может узнать размер дефекта. Могут быть выполнены различные типы эхо-тестов.
Исследование функции легких (легких). Тестирование функции легких проверяет, насколько хорошо работают легкие вашего ребенка.
Катетеризация сердца (катетеризация). Кардиологическая катетера дает очень подробную информацию о структурах внутри сердца. Врач вводит небольшую гибкую трубку (катетер) в кровеносный сосуд в паху. Врач подводит катетер к сердцу. Он или она измеряет кровяное давление и кислород. В некоторых случаях врач может ввести контрастный краситель, чтобы более четко увидеть кровоток и структуры внутри сердца.
МРТ сердечно-сосудистой системы (CMRI). Этот тест позволяет получить подробные изображения сердца и кровеносных сосудов. МРТ может использоваться для проверки объема и направления шунтирования крови.
Компьютерная томография и КТ-ангиография. Эти тесты могут использоваться для проверки наличия тромбов в легочных артериях и легких.
Стресс-тест. Это ЭКГ, сделанная во время тренировки ребенка.
Как лечится синдром Эйзенменгера у ребенка?
Лечение будет зависеть от симптомов, возраста и общего состояния вашего ребенка.Это также будет зависеть от степени тяжести состояния.
Лечение направлено на снижение давления в легочной артерии. Он также направлен на то, чтобы доставить больше кислорода к тканям легких и облегчить цианоз.
Лечение
Лечение помогает справиться с симптомами. Лечебные процедуры включают:
Медицина. Вашему ребенку будут даны лекарства, которые расширяют кровеносные сосуды и снижают кровяное давление в легких.
Кислород. Ваш ребенок будет получать кислород во время сна или отдыха, или постоянно.
Флеботомия. Врач может удалить немного крови, если у вашего ребенка высокое количество эритроцитов и загустевшая кровь.
Какие возможные осложнения синдрома Эйзенменгера у ребенка?
Осложнения этого состояния могут включать:
Сгустки крови, которые могут быть в глубоких венах ног (тромбоз глубоких вен) или легких (тромбоэмболия легочной артерии)
Кровотечение (кровоизлияние)
Кровохарканье (кровохарканье)
Ход
Зараженный материал в головном мозге (абсцесс)
Подагра
Нерегулярные сердечные ритмы (аритмии)
Сердечная недостаточность
Внезапная смерть
Нарушение функции почек
Камни в желчном пузыре
Инфекции сердечных клапанов (эндокардит)
Как я могу помочь своему ребенку жить с синдромом Эйзенменгера?
Некоторые дети с синдромом Эйзенменгера могут дожить до среднего взрослого возраста.Некоторые могут дожить до 50 или 60 лет.
Рекомендации для детей с синдромом Эйзенменгера:
Анестезия и хирургическое вмешательство относятся к группе высокого риска и должны быть тщательно спланированы. Если вашему ребенку нужна операция, хирург и другие поставщики медицинских услуг должны работать с детским кардиологом вашего ребенка.
Ваш ребенок не должен подниматься на большую высоту. Ваш ребенок может летать, пока самолет находится под давлением.Использование кислорода во время полета также может снизить вероятность осложнений.
Ваш ребенок не должен курить или пить.
Защитите своего ребенка от вещей, которые подвергают его повышенному риску. К ним относятся обезвоживание, физические упражнения, чрезмерная жара и дефицит железа.
Контролируйте или предотвращайте кашель с помощью препаратов, подавляющих кашель.Это помогает снизить риск кровотечения из легких.
Делайте прививку от гриппа вашему ребенку каждый год. Обсудите с лечащим врачом вашего ребенка пневмококковую вакцину и другие важные вакцины.
Проконсультируйтесь с подростком старшего возраста или молодым человеком, если они планируют беременность. Синдром подвергает серьезному риску как мать, так и ребенка. Чтобы предотвратить беременность, подростку можно использовать противозачаточные средства, содержащие только прогестин.Это не повышает риск образования тромбов.
Обсудите с лечащим врачом вашего ребенка конкретные долгосрочные перспективы для вашего ребенка, подростка или молодого взрослого с синдромом Эйзенменгера.
Когда мне следует позвонить поставщику медицинских услуг для моего ребенка?
Ухудшение симптомов или появление новых симптомов могут быть ранними настораживающими признаками. Как можно скорее позвоните лечащему врачу вашего ребенка.
Позвоните в службу 911 или на местный номер службы экстренной помощи, если у вашего ребенка серьезные симптомы.К ним относятся:
Серьезное кровотечение
Сильная головная боль
Обморок
Потеря сознания
Основные сведения о синдроме Эйзенменгера у детей
Синдром Эйзенменгера означает, что артерии, по которым кровь идет от сердца к легким, сужены.Это оказывает слишком сильное давление на стенки артерий и повреждает легкие.
Заболевание чаще всего поражает подростков и молодых людей с определенными врожденными пороками сердца, которые не восстанавливаются или не восстанавливаются поздно.
Лечение синдрома Эйзенменгера направлено на снижение давления в легочной артерии, увеличение количества кислорода к тканям легких и уменьшение синюшности кожи и ногтей (цианоза).
Важно работать с медицинским персоналом вашего ребенка, чтобы снизить риск осложнений.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от посещения лечащего врача вашего ребенка:
Знайте причину визита и то, что вы хотите.
Перед визитом запишите вопросы, на которые хотите получить ответы.
Во время посещения запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите все новые инструкции, которые ваш поставщик дает вам для вашего ребенка.
Узнайте, почему прописано новое лекарство или лечение и как они помогут вашему ребенку. Также знайте, каковы побочные эффекты.
Спросите, можно ли вылечить состояние вашего ребенка другими способами.
Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
Знайте, чего ожидать, если ваш ребенок не принимает лекарство, не проходит обследование или процедуру.
Если вашему ребенку назначен повторный прием, запишите дату, время и цель этого визита.
Узнайте, как можно связаться с лечащим врачом вашего ребенка в нерабочее время.Это важно, если ваш ребенок заболел и у вас есть вопросы или вам нужен совет.
Легочная гипертензия у детей с врожденными пороками сердца (ЛАГ-ИБС, PPHVD-CHD). Консенсусное заключение экспертов по диагностике и лечению детской легочной гипертензии. Европейская сеть педиатрических легочных сосудов, одобренная…
Введение
Легочная гипертензия (ЛГ), связанная с врожденным пороком сердца (ВПС), обычно связана с дефектами шунтирования слева направо или обструктивным заболеванием левого сердца, вызывающим посткапиллярную ЛГ.1 Однако такая простая группировка признаков ИБС не отражает неоднородности детской ЛГ в условиях ИБС. В последнем обновлении 5-го Всемирного симпозиума по ЛГ (WSPH) в Ницце в 2013 г. был предложен более подробный подход к ЛГ, ассоциированной с ИБС. 2 ИБС с объемной нагрузкой на легочные артерии были сгруппированы в класс 1.4.4 «Врожденные пороки сердца». (см. согласованное заявление о «диагностике, мониторинге, амбулаторном лечении» 3). ЛГ, ассоциированная с застойными заболеваниями левого отдела сердца, теперь можно найти в классе 2.4 «Врожденная / приобретенная обструкция тракта притока / оттока левых отделов сердца и врожденные кардиомиопатии». И, наконец, сегментарная ЛГ, которая не влияет на все сегменты легкого, отнесена к группе 5.
Сложность лечения ЛГ при детской ИБС еще больше усугубляется сложностью лежащей в основе ИБС и частыми сопутствующими заболеваниями. Конечно, сопутствующие заболевания, которые включают недоношенность, неонатальные заболевания легких (бронхолегочная дисплазия и гипоплазия легких), хромосомные аномалии и синдромы полимальформаций, могут озадачить врача при оценке этиологии и патофизиологии повышенного легочного сосудистого сопротивления (ЛСС) при ИБС.Чтобы соответствовать сложности детской ЛГ с увеличением ЛСС, педиатрической рабочей группой Института легочных сосудов (Панама, 2011) была предложена более подробная и зависящая от возраста классификация, которая расширила термин легочная артериальная гипертензия (ЛАГ) на педиатрическую. легочная гипертензивная сосудистая болезнь (PPHVD) 4–6
В Нидерландах частота и распространенность идиопатической легочной артериальной гипертензии (ИЛАГ) оценивалась в 0,7 и 4,4 на миллион детей, соответственно, тогда как ЛАГ, ассоциированная с врожденными пороками сердца ( ЛАГ-ИБС) предполагаемая частота встречаемости 2.2 и распространенность 15,6 на миллион. 7
Патофизиология ИБС с внутрисердечными и внесердечными шунтами может сильно различаться при пре-трикуспидальном и посттрикуспидальном поражениях (т. Е. Проксимальнее или дистальнее сублегочного атриовентрикулярного клапана в кровотоке. ).
Предтрикуспидальные шунты — это шунты слева направо (или двунаправленные) при низком уровне давления, которые приводят к объемной нагрузке на правый желудочек (ПЖ) и малое кровообращение без немедленного или среднесрочного увеличения легочной артерии. давление (PAP).При пре-трикуспидальном поражении развитие ЛАГ-легочно-сосудистого заболевания (ПВД) / ПРГЗ может произойти после четвертого десятилетия жизни в 6-17% 8. Риск развития ПВД связан не только с размером межпредсердной перегородки. дефект (ASD), но также зависит от податливости правого желудочка (→ величина шунта слева направо). Те же соображения применимы к частичному аномальному оттоку легочных вен (PAPVR). На объемную нагрузку малого круга кровообращения сильно влияют дополнительные поражения левых отделов сердца и дисфункция левого желудочка.Однако синдром Эйзенменгера у взрослых с РАС встречается редко и, по оценкам, встречается только у 2% пациентов.9
Посттрикуспидальные поражения — это шунты слева направо с высоким уровнем давления, которые приводят к объемной нагрузке. на левом желудочке и малом круге кровообращения. Если посттрикуспидальные дефекты достаточно велики, легочное давление повысится до уровня системного артериального давления (дефекты межжелудочковой перегородки без ограничения давления). При посттрикуспидальных поражениях развитие ЛАГ-ПВД / ППГВ будет происходить в течение первых лет жизни.При отсутствии лечения ≈50% пациентов с посттрикуспидальными поражениями разовьется супрасистемный PVR с обращением шунта на шунт справа налево через заранее сформированные поражения шунта, то есть так называемый комплекс Eisenmenger . В то время как взрослые с ЛАГ Эйзенменгера имеют лучшую выживаемость, чем пациенты с идиопатической / наследственной ЛАГ, дети с ЛАГ-ИБС и PVD (т. Е. PPHVD) имеют 5-летнюю смертность, которая, по-видимому, сопоставима с таковой у детей с идиопатической / наследственной ЛАГ (29 % против 25%) .10 Тяжесть ЛАГ-ИБС у взрослых обычно недооценивается, поскольку очевидная выживаемость связана с бессмертным систематическим отбором пациентов в зарегистрированных регистрах.1
Конкретная гемодинамика кровообращения Fontan хрупкая (полное кавопульмональное соединение: нет сублегочного желудочка, системные вены хирургически связаны с малым кругом кровообращения). На самом деле, потенциально существует несколько причин для возникновения ситуации «провала Fontan». Дисфункция одного желудочка, хронически повышенное центральное венозное давление, повышенный PVR (для пассивного легочного кровотока) или обструкции венозных или артериальных путей могут вызвать сердечную недостаточность или специфические осложнения, такие как пластический бронхит или энтеропатия с потерей белка.Пациенты с неэффективным лечением ЛАГ не соответствуют стандартным критериям ЛГ, но могут иметь повышенное ЛСС, судя по градиенту транспульмонального давления.2 Недавно появились доказательства потенциального клинического ответа на специфические методы лечения ЛАГ у пациентов с Фонтаном, которые требуют дальнейшего изучения. до того, как будут даны терапевтические рекомендации2. Цель этой статьи — представить текущие доказательства для наиболее точной оценки и лечения ЛАГ-ИБС, ПГЗС, ассоциированных с ИБС, у детей и подростков, в том числе в соответствии с согласованными рекомендациями.
Методы
Рекомендации, приведенные в таблице 1, относятся к системе оценок, предложенной в настоящее время Европейским обществом кардиологов (ESC) и Американской кардиологической ассоциацией, и основаны только на педиатрических данных (класс, уровень доказательности). В этом выпуске описан процесс выставления оценок и голосования в группе авторов.11 Компьютерный поиск в библиографической базе данных PubMed / MEDLINE проводился с 1990 по июнь 2015 года. Разработчик провел поиск по терминам «легочная гипертензия у детей», «врожденный порок сердца», «легочная артериальная гипертензия», «вазореактивность при легочной гипертензии», «кавопульмональный анастомоз, легочная гипертензия», «кровообращение фонтана и легочные сосудистые заболевания», «работоспособность при легочной гипертензии». врожденные пороки сердца у детей »,« Оксид азота при легочной гипертензии у детей »,« Синдром Эйзенменгера и легочная гипертензия ».
Таблица 1
Рекомендации по оценке и лечению легочной гипертензии (ЛГ) у детей и подростков с врожденным пороком сердца (ЛАГ-ИБС, PPHVD-CHD)
Рисунок 1
Алгоритм ведения пациентов с врожденным пороком сердца, ассоциированным с ЛАГ / PPVD и врожденные поражения шунта (изменено из Lopes et al 13 и рабочей группы PVRI PAH-CHD (pdf на веб-сайте PVRI). Показания для инвазивной диагностики и право на операцию / операбельность при комплексной катетеризации левого и правого сердца включает базовую оценку и AVT, последнее, особенно в серой зоне неопределенности прогнозов.ДМПП, дефект межпредсердной перегородки; ПВТ, острое вазодилатирующее тестирование; ИБС, врожденный порок сердца; ЛАГ, легочная артериальная гипертензия; PDA, открытый артериальный проток; ЛГ, легочная гипертензия; до ОП, до операции; PVR — легочное сосудистое сопротивление; PVRI, индекс PVR; Qp — легочный кровоток; Qs — системный кровоток; SVR — системное сосудистое сопротивление; ДМЖП, дефект межжелудочковой перегородки; WU, Деревянные блоки.
Диагностика легочной гипертензии, связанной с врожденным пороком сердца
Модифицированная клиническая классификация ЛАГ, ассоциированной с ИБС, основанная на самых последних рекомендациях WSPH (2013 г.) 2, приведена во вставке 1.Подробные рекомендации по оценке пациентов с ЛАГ с помощью эхокардиографии даны Koestenberger и др. ,34 в этом выпуске. Эхокардиография — самый ценный инструмент для описания морфологии, гемодинамики и функции желудочков. Кроме того, можно сделать оценку прекапиллярной или посткапиллярной PH. Несмотря на то, что катетеризация сердца является золотым стандартом диагностики ЛГ с PVD и без нее, эхокардиография может прогнозировать PAP и PVR и является ценным рутинным инструментом.При сложной ИБС или субоптимальных эхокардиографических окнах, МРТ сердца или КТ грудной клетки могут быть выполнены для определения массы и объема желудочков, клапанной регургитации или любой обструкции одиночного или бивентрикулярного кровообращения.35 Кроме того, пациентов с ЛГ следует обследовать на предмет сопутствующих заболеваний (сердца, легкие, брюшная полость) с последствиями для ведения и прогноза, особенно в группах пациентов с сопутствующими заболеваниями, увеличивающими риск развития ПРГБ.3
Операция и операбельность пациентов с ЛАГ-ИБС и бивентрикулярным кровообращением
Для корректируемой ИБС своевременное хирургическое лечение имеет первостепенное значение для предотвращения легочной гипертонической болезни сосудов14, 32, 33, 36 (рисунок 1).Следовательно, корригирующая или паллиативная хирургия при ИБС и значительном шунтировании слева направо выполняется в основном в первые шесть месяцев жизни, чтобы предотвратить сохраняющуюся или развивающуюся нагрузку давления на легочную сосудистую сеть. Тем не менее, ЛАГ после хирургического вмешательства по поводу ИБС сообщалось у 7,4% взрослых пациентов с ИБС.37 На сегодняшний день нет четкого консенсуса по критериям работоспособности шунтов слева направо с повышенным ЛСС. Однако операбельность имеет первостепенное значение, поскольку было показано, что прогноз послеоперационной ЛАГ-ИБС, которую можно предотвратить своевременным закрытием шунта в большинстве случаев, идентичен или хуже, чем при ИЛАГ.38 Не существует единого мнения относительно ведения ЛАГ у пациентов с ИБС, которые не соответствуют критериям работоспособности или у которых сохраняется ЛАГ после исправления дефекта (вставка 1).
Вставка 1
Клиническая классификация легочной артериальной гипертензии, связанной с врожденным пороком сердца (модифицированная из Simonneau
et al. 2)
Синдром Эйзенменгера
▸ Включает все большие внутрисердечные и внесердечные дефекты, системные и легочные шунты, которые со временем могут прогрессировать до серьезного повышения ЛСС и реверсирования (легочно-системное) или двунаправленного шунтирования; обычно присутствуют цианоз, вторичный эритроцитоз и поражение многих органов.Посттрикуспидальные шунты, такие как ДМЖП, ОАП и аортопульмональное окно, чаще и раньше прогрессируют до тяжелого легочного сосудистого заболевания, реверсирования шунта и физиологии Эйзенменгера, чем поражения предтрикуспидального шунта (например, ДМПП).
Легочная артериальная гипертензия, связанная с превалирующим системным шунтированием в легкие
с поправкой *
без поправки
▸ Включите умеренные и крупные дефекты; ЛСС увеличивается от легкой до умеренной, системное шунтирование в легкие все еще превалирует, тогда как цианоз в покое не является признаком.
Легочная артериальная гипертензия с небольшими / случайными † дефектами
▸ Заметное повышение PVR при наличии небольших пороков сердца, которые сами по себе не являются причиной развития повышенного PVR; Клиническая картина очень похожа на идиопатическую ЛАГ. Закрытие дефекта противопоказано.
Легочная артериальная гипертензия после коррекции врожденных пороков сердечно-сосудистой системы
▸ Врожденный порок сердца лечится, но ЛАГ либо сохраняется сразу после коррекции, либо рецидивирует / развивается через месяцы или годы после коррекции при отсутствии значительных послеоперационных гемодинамических нарушений.
* С хирургическим вмешательством или внутрисосудистой чрескожной процедурой.
† Размер относится к взрослым пациентам.
ДМПП, дефект межпредсердной перегородки; ЛАГ, легочная артериальная гипертензия; PDA, открытый артериальный проток; PVR — легочное сосудистое сопротивление; ДМЖП, дефект межжелудочковой перегородки.
Так называемые «простые шунтирующие дефекты»
При «простых» дефектах шунтирования слева направо (ДМПП, ДМЖП, открытый артериальный проток (ОАП)), которые диагностируются у новорожденных / младенцев с клиническими признаками сердечной недостаточности (из-за объемной перегрузки и низкого систематического сердечного выброса, связанного с шунтом) и нормальной сатурации кислорода, катетеризацию сердца и исследование острой вазореактивности (ПВТ) можно не проводить, и пациентов следует направлять на хирургическое закрытие шунта (рис. 1).Невыявленная ИБС, которая протекает бессимптомно в течение многих лет и не проявляется ЛАГ до взрослого возраста, например, РАС у взрослых, представляет собой особую сущность, и ее нельзя сравнивать с РАС в детстве (39). -правые шунты (например, ASD, PAPVR), полная оценка давления, транспорта и использования кислорода, а также производные расчетные переменные являются обязательными перед рассмотрением операции. Комбинация прекапиллярной и посткапиллярной ЛГ может присутствовать, особенно у взрослых с хронической ЛГ, что требует принятия экспертных решений в отношении хирургического вмешательства или лечения, или фармакотерапии перед операцией (концепция «лечить до конца», см. Hansmann and Apitz40).
При посттрикуспидальных шунтах («простые»: ДМЖП, ОАП; или более сложные ИБС, позволяющие закрывать шунт) ранняя хирургическая коррекция ИБС в течение первых двух лет жизни необходима для предотвращения необратимого ремоделирования легочной сосудистой сети. Пациентам с дополнительным (генетическим) риском PPHVD, тяжестью PPHVD или послеоперационным персистирующим PPHVD, как при синдроме Дауна, операция в большинстве случаев должна проводиться в течение первых шести месяцев жизни. Эти типичные даты операции, указывающие оптимальные временные рамки для предотвращения персистирующей или прогрессирующей ЛАГ-ИБС, хорошо приняты и должны устранить или уменьшить (например, фенестрированный пластырь на межжелудочковой перегородке) связанное с потоком / напряжением сдвига повышение PAP и PVR.36, 41
Продвинутая ЛАГ-ИБС и синдром Эйзенменгера
Есть пациенты с ЛАГ-ИБС (например, из развивающихся стран), у которых возраст превышает оптимальный для операции возраст при поступлении на обследование. В этих случаях необходимо провести полную оценку легочной и системной гемодинамики. Если физиология уже соответствует синдрому Эйзенменгера , закрытие дефекта на этой стадии связано с повышенной смертностью и не должно преследоваться.8 Пациенты с ЛАГ-ИБС без шунта справа налево, которые реагируют на AVT42, могут иметь длительные периоды, пока они не изменят направление шунта и не превратятся из розового в синий.До сих пор не было доказано, обязательно ли у каждого пациента с ЛАГ-ИБС, персистирующим посттрикуспидальным шунтом слева направо и различной степенью ЛГБС-ИБС возникает синдром Эйзенменгера, или существуют два разных заболевания с переменной восприимчивостью к медицинское лечение.17, 43 Благодаря улучшенной диагностике и своевременному лечению можно ожидать, что комплекс Эйзенменгера у пациентов с ИБС в будущем станет редкостью в передовых системах здравоохранения.
Посткапиллярная легочная гипертензия
Порок клапанов сердца , такой как митральный стеноз, может привести к посткапиллярной ЛГ, но обычно поддается хирургическому лечению постепенным снижением и нормализацией легочного давления, тогда как в рестриктивная физиология желудочков связана с посткапиллярной PH, обратимость PH менее очевидна.Оценка этих пациентов с преимущественно посткапиллярной ЛГ должна следовать тем же рекомендациям по полной гемодинамической оценке (включая ПВТ), что и для ЛАГ / ЛГБЗ-ИБС в этом вопросе 42, независимо от того, происходят ли они изолированно или в сочетании с поражениями, которые могут вызывать прекапиллярную ЛГ (т. Е. , ПАУ). У части этих пациентов с обструкцией левого сердца и гипертензией левого предсердия действительно наблюдается реактивная вазоконстрикция легких. Такая ситуация, характеризующаяся преимущественно посткапиллярной ЛГ с прекапиллярным компонентом, сопровождается заметным повышением диастолического давления в легочной артерии и повышенным диастолическим транспульмональным градиентом давления (> 7 мм рт.ст. у взрослых) (подробнее см. Apitz et al 42) .Прекапиллярный компонент называется «реактивным» PH, а комбинированное состояние раньше часто называли «непропорциональным» PH. Возможно, у этой подгруппы пациентов как с прекапиллярной, так и с посткапиллярной ЛГ со временем развивается более тяжелая PVD.44
Биопсия легкого
Биопсия легкого у пациентов с ЛАГ-ИБС с прогрессирующей, наиболее вероятной необратимой легочной гипертензией, сосудистой болезнью показывает пролиферацию интимы и сужение сосудов. связаны с нарушением апоптоза эндотелиальных клеток и антиапоптотической передачи сигналов от периваскулярных воспалительных клеток.45 Из-за низкой вероятности изменения диагноза и лечения и значительного риска заболеваемости и смертности открытая или торакоскопическая биопсия легкого в большинстве случаев не рекомендуется пациентам с ЛАГ-ИБС / ПГВБ-ИБС33. Однако в определенных ситуациях, когда PAP и PVR остаются высокими или даже ухудшаются после закрытия шунта у пациентов с ЛАГ-ИБС, медицинские работники могут рассмотреть возможность биопсии легких в дополнение к КТ грудной клетки, чтобы исключить или подтвердить дополнительное паренхиматозное заболевание легких, такое как дисплазия альвеолярных капилляров.46
Исследование острой вазореактивности (ПВТ) при ЛАГ / ПГЗД-ИБС и последствия для хирургического лечения
ПВТ при детской ЛГ включает ингаляционный оксид азота (iNO), кислород, iNO + кислород и / или (в идеале) ингаляционный илопрост13, 25– 28, 47 (подробнее см. Apitz et al 42). Для пациентов с ИБС не было доказано, что ПВТ может предсказать долгосрочный прогноз, а также не было показано, что пороговые значения указывают на абсолютные противопоказания к операции. Тем не менее, существует соглашение об оценке и прогнозировании риска развития или сохранения ЛАГ на ранних и поздних сроках после операции по поводу ИБС.13 В то время как при бивентрикулярном кровообращении с пульсирующим легочным потоком диагностический предел mPAP <25 мм рт. Устойчивость (SVR), особенно в молодой возрастной группе, важна для оценки работоспособности или трансплантации сердца.29, 48 Тестирование вазореактивности охватывает ответ на вазодилатирующие препараты и, более того, определение легочной эндотелиальной дисфункции.28, 49
Основываясь на ограниченных опубликованных клинических исследованиях и нашем собственном опыте, мы предлагаем протокол структурированной катетеризации и два отдельных определения положительной ПВТ: (1) ПВТ для оценки прогноза и показаний для специфической терапии ЛГ и (2) ПВТ для оценить работоспособность ассоциированной легочной гипертензии (APAH) с CHD (ADAH-CHD) .12 Протокол ПВТ и последние определения можно найти в Apitz et al. дефект шунта (Qp: Qs> 1.5; APAH-CHD-shunt) для детей следует рассматривать как снижение PVR-индекса и PVR / SVR на> 20% с соответствующими окончательными значениями <6 WU × m 2 и <0,3. Тем не менее, операционная безопасность при APAH-CHD с шунтом не может быть гарантирована (приблизительная серая зона - PVR-индекс 6–8 WU × m 2 , и отношение PVR / SVR 0,3–0,5), и элемент клинической субъективности неизбежен. . Необходимы дальнейшие исследования в отдельных группах населения, таких как растущее число детей с ИБС, осложненной хроническим заболеванием легких недоношенных, 46 и в развивающихся странах, где пациенты с большей вероятностью поздно обращаются с запущенной легочной гипертензией и сосудистой болезнью и часто с обратным шунтом ( справа налево, т. е. синдром Эйзенменгера).
Послеоперационная легочная гипертензия у пациентов с ЛАГ-ИБС
Если послеоперационное повышение ДЛА, подозрительное на ЛГБЗ-ИБС, наблюдается на ранней стадии после хирургического вмешательства и не считается временным явлением с помощью мер интенсивной терапии, 50 может быть показана комплексная катетеризация левых и правых отделов сердца. для оценки необходимости специфической терапии ЛАГ. Последняя инвазивная диагностика, безусловно, показана при поздней послеоперационной ЛАГ-ИБС, то есть спустя годы после операции, будь то стойкая / прогрессирующая или «de novo».
Транскатетерные вмешательства и хирургическое лечение с созданием шунта справа налево
Наконец, доказано, что инновационные хирургические вмешательства и транскатетерные вмешательства помогают целенаправленно обратить пациентов с ЛАГ на физиологию Эйзенменгера: создать межпредсердную коммуникацию51, 52 и / или установить шунт Поттса (левая легочная артерия к нисходящей аорте) или стентирование очевидного артериального протока.52, 53
В совокупности критерии закрытия шунтов при ИБС реализованы в положениях WSPH Nice (2013) 2 и руководящих принципах ESC / ERS. (2015), 33, но не делают заметных различий между детьми и взрослыми.Несмотря на уровень доказательности, не превышающий уровень экспертного мнения (C), ценный алгоритм принятия решений, включая ПВТ, был недавно предложен Лопесом и др. .13 Мы предлагаем аналогичный подход, исходя из клинических данных, а не -инвазивные и гемодинамические данные (алгоритм, рисунок 1). Невозможно окончательно ответить на вопрос, способна ли ПВТ предсказать долгосрочную нормализацию давления и сопротивления легочной артерии.
Легочная гипертоническая сосудистая болезнь в контексте физиологии одного желудочка
Пациенты с гипоплазией левого желудочка (ЛЖ) или ПЖ и пациенты, у которых левое и правое сердце не могут быть разделены по другим причинам, проходят (модифицированную) процедуру Фонтана , что приводит к физиологии одного желудочка и непульсирующему легочному кровотоку (без сублегочного желудочка).В большинстве случаев требуется первый шаг для обеспечения и определения легочной перфузии и обеспечения беспрепятственной системной перфузии (операция на этапе 1, Норвуд с классическим шунтом BT или шунтом RV-PA). После этого выполняются две кавопульмональные операции по соединению системных вен с легочными артериями. Первый — это двунаправленный анастомоз между верхней полой веной (SVC) и легочными артериями (частичный кавопульмональный анастомоз, син. Анастомоз Гленна), а на втором этапе — соединение нижней полой вены с легочными артериями (тотальный кавопульмональный анастомоз (TCPC) / Fontan).
Измерения среднего транспульмонального градиента давления (mTPG = mPAP-LAP mean) и индекса PVR (PVRI) имеют решающее значение для надлежащего отбора пациентов для циркуляции TCPC / Fontan. Принимая ограничения на вычисление и интерпретацию PVR при моножелудочковом кровообращении, mTPG ≤6 мм рт. Если измерения выходят за эти пределы, было предложено предварительно лечить сосудорасширяющими средствами, такими как ингибиторы ФДЭ5 или антагонист рецепторов эндотелина, для уменьшения ЛСС с целью достижения критериев паллиативной терапии TCPC / Фонтана.Однако клиническая эффективность такой фармакотерапии не доказана.
Не существует стандартов, как правильно оценивать гемодинамику TCPC / Fontan во время катетеризации сердца. Неизвестно, следует ли обследовать пациентов под общим наркозом, седативным действием или только под местной анестезией. Системы датчиков иногда ненадежны при измерении непульсирующего давления внутри легочных артерий. Кроме того, аортопульмональные коллатерали, остаточный антеградный кровоток из желудочка и венозные коллатерали (в легочные вены) или артериовенозные шунты затрудняют оценку правильного отношения Qp / Qs.
Тем не менее, необходимо найти стандартные процедуры, позволяющие преодолеть эти вопросы, поскольку неэффективность TCPC / Фонтана и снижение толерантности к физической нагрузке при отсутствии тяжелой желудочковой дисфункции или регургитации атриовентрикулярного клапана могут быть связаны в первую очередь с увеличением ЛСС.
Краткий обзор реальных стратегий лечения с их влиянием на снижение PVRI, 54, 55 улучшение качества жизни и тесты с физической нагрузкой был опубликован другими12 и далее изложен в нашем соответствующем экспертном консенсусе по педиатрической терапии ЛГ.40
Для пациентов с ЛАГ-ИБС в серой зоне оценки PVRI (6–8 WU × m 2 , рисунок 1) может проводиться медикаментозное лечение до закрытия дефекта шунта (концепция «лечить до закрытия») , и закрытие дефекта можно рассматривать, если в последующем гемодинамическом исследовании индекс PVR будет <6 WU × m 2 . Убедительные долгосрочные данные для этой стратегии остаются скудными. Если пациент остается в серой зоне индексированного ЛСС, можно рассмотреть модифицированную операцию, например, с закрытием фенестрированного дефекта.56
Большинство исследований «таргетной терапии» при ЛАГ-ИБС были опубликованы для взрослых пациентов с болезнью Эйзенменгера17, 43, 57–60, и рекомендации ESC / ERS33, 61 охватывают эту группу пациентов, включая поддерживающую терапию. Было показано, что добавление железа улучшает симптомы и вторичную недостаточность органов у взрослых пациентов с Эйзенменгером18, 19, 62
Благоприятные гемодинамические эффекты силденафила и бозентана были продемонстрированы также при нарушении кровообращения по Фонтану.63–68 Было показано, что бозентан улучшает физическую нагрузку. толерантность и сатурация кислорода после операции Фонтана.69 Силденафил улучшенный макс. потребление кислорода (VO 2 макс.) и легочный кровоток у пациентов с кровообращением Фонтана. Другое рандомизированное перекрестное исследование показало, что терапия силденафилом улучшала переносимость физической нагрузки и эффективность вентиляции у пациентов с Фонтаном.64 Данных об использовании риоцигуата или селексипага у пациентов с Фонтаном в настоящее время нет. Был опубликован анализ подгрупп 35 пациентов с послеоперационной ЛАГ-ИБС, получавших риоцигуат в рамках исследования PATENT.41 Предстоящие результаты международного реестра (COMPERA-KIDS) расширят наши знания о медикаментозном лечении различных состояний ЛАГ-ИБС.
Заключение
При ЛАГ-ИБС дифференциация состояний, которые способствуют повышению давления в легочной артерии или ПВД, является обязательной и требует соответствующей классификации ЛАГ-ИБС. В то время как комплекс Эйзенменгера при нелеченных поражениях стал редкостью в передовых системах здравоохранения, сохраняющаяся / прогрессирующая ЛАГ даже после своевременной операции и сценариев низкого давления / высокого сопротивления остается сложной задачей. Пациенты с ИБС и физиологией одного желудочка (Fontan / TCPC) требуют особенно поэтапного и индивидуального подхода.Для оптимизации предоперационного и послеоперационного ведения пациентов с ИБС в статье представлены алгоритмы диагностики и лечения.
Синдром Эйзенменгера: симптомы, диагностика и лечение
Обзор
Что такое синдром Эйзенменгера?
Синдром Эйзенменгера развивается из определенного врожденного (присутствующего при рождении) сердечного заболевания, включающего структурные дефекты сердца.У большинства людей с болезнью Эйзенменгера между двумя камерами сердца имеется большое отверстие.
Насколько распространен синдром Эйзенменгера?
Врачи чаще всего диагностируют синдром Эйзенменгера у людей молодого возраста. Число людей с врожденным пороком сердца, у которых развивается это заболевание, уменьшилось с 8 процентов до 4 процентов за последние несколько десятилетий. Уменьшение числа людей, у которых развивается синдром Эйзенменгера, связано с ультразвуком и достижениями в кардиохирургии.Синдром Эйзенменгера поражает в равной степени мужчин и женщин.
Симптомы и причины
Что вызывает синдром Эйзенменгера?
Неисправленные структурные дефекты сердца вызывают синдром Эйзенменгера. Большинство людей с этим заболеванием родились с дефектом межжелудочковой перегородки (отверстие между двумя нижними камерами сердца).Через это отверстие в легкие поступает больше крови, чем обычно, что вызывает легочную гипертензию (повышенное давление в артериях легких).
Со временем легочная гипертензия повреждает кровеносные сосуды в легких. Это повреждение приводит к тому, что кровоток меняет направление и возвращается к телу, не получая кислорода в легких. Во избежание серьезных осложнений пациентам, возможно, придется ограничить физические нагрузки и физические нагрузки.
Помимо дефекта межжелудочковой перегородки, другие врожденные проблемы с сердцем, которые могут вызвать синдром Эйзенменгера, включают:
- Дефект межпредсердной и предсердно-желудочковой перегородки — совмещенное отверстие в двух верхних камерах сердца
- Открытый артериальный проток — нарушение закрытия прохода между легочной артерией (кровеносным сосудом, ведущим к легким) и аортой (главной артерией тела) после рождения ребенка
- Truncus arteriosus — только один кровеносный сосуд выходит из сердца вместо двух нормальных
Каковы симптомы синдрома Эйзенменгера?
Симптомы синдрома Эйзенменгера различаются в зависимости от порока сердца и пораженных органов.Обычно они не возникают, пока люди не достигнут подросткового возраста, 20 или 30 лет. Признаки медленно ухудшаются.
К наиболее частым признакам и симптомам этого состояния относятся:
Диагностика и тесты
Как диагностируется синдром Эйзенменгера?
Врачи используют несколько тестов для диагностики синдрома Эйзенменгера.В дополнение к медицинскому осмотру ваш врач может использовать:
- Электрокардиограмма. Использует маленькие электроды, размещенные на груди, для измерения электрической активности сердца.
- Эхокардиограмма или катетеризация сердца. Может смотреть на сердце под разными углами; измеряет давление в легочной артерии и содержание кислорода
- МРТ . Создает изображения поперечных сечений структур сердца
- Анализы крови. Измерьте количество эритроцитов и количество кислорода в крови
Ведение и лечение
Как управляется или лечится синдром Эйзенменгера?
В идеале структурный дефект сердца обнаруживается в раннем возрасте и исправляется хирургическим путем, что позволяет предотвратить синдром Эйзенменгера.Когда порок сердца не обнаружен и не устранен до повреждения легочных артерий, результатом является синдром Эйзенменгера. Лечение синдрома Эйзенменгера направлено на устранение его симптомов и осложнений.
Специалисты используют лекарства для лечения легочной гипертензии и антибиотики для предотвращения инфекций. Лекарства, используемые для лечения легочной гипертензии, включают аналоги простациклина (такие как трепростинил [Ремодулин®], эпопростенол [Флолан®]), антагонисты эндотелина (такие как бозентан [Tracleer®]) и усилители оксида азота (такие как силденафил [Виагра®]).
Некоторые люди получают кислородную терапию, чтобы чувствовать себя более комфортно.В редких случаях, если другие усилия по уменьшению осложнений не увенчались успехом, врачи могут лечить синдром Эйзенменгера с помощью трансплантации сердца и легких.
Какие осложнения связаны с синдромом Эйзенменгера?
Беременность вызывает сердечно-сосудистые изменения в организме, которые могут угрожать жизни женщин с синдромом Эйзенменгера. Врачи советуют женщинам с этим заболеванием не беременеть.
Помимо симптомов, у людей с синдромом Эйзенменгера могут развиваться различные осложнения.В их числе:
- Усиленное кровотечение, например легкое образование синяков, сильное кровотечение во время менструации (у женщин) и кашель с кровью
- Сердечная недостаточность
- Повышенный риск инфекций сердца, легких, кожи и мозга
- Ход
- Подагра (опухоль пальцев ног и других суставов)
- Нарушение функции почек
- Проблемы с костями и суставами, включая сколиоз (искривленный позвоночник)
- Камни в желчном пузыре
Действия, которые вы можете предпринять для лечения осложнений, связанных с синдромом Эйзенменгера, включают:
- Поддерживать здоровье зубов и десен, чтобы избежать инфекций
- Принимайте антибиотики перед стоматологическим лечением для предотвращения эндокардита (сердечной инфекции)
- Сделайте ежегодную прививку от гриппа
Чтобы избежать осложнений, избегайте:
Перспективы / Прогноз
Каков прогноз (перспективы) для людей с синдромом Эйзенменгера?
Перспективы людей с синдромом Эйзенменгера зависят от реакции пациента на лечение.Многие люди, которые справляются со своими симптомами и лечат их, наслаждаются хорошим качеством жизни. Наблюдение за своим здоровьем с регулярными посещениями специалиста и своевременное лечение осложнений помогут сделать жизнь более продолжительной и активной.
Жить с
Какие вопросы я должен задать своему врачу?
Если у вас синдром Эйзенменгера, вы можете спросить своего врача:
- Насколько серьезен этот синдром?
- Какие изменения в образе жизни мне нужно сделать?
- На какие признаки осложнений следует обращать внимание?
- Как узнать, работает ли лечение?
Когда я смогу вернуться к своим обычным занятиям?
Людям с диагнозом синдрома Эйзенменгера часто приходится на протяжении всей жизни менять образ жизни, чтобы справиться с этим заболеванием.
