Acinetobacter lwoffii лечение — Iealmed-Klinika.ru
Инфекции, вызванные Acinetobacter
Микроорганизмы рода Acinetobacter — это плеоморфные грамотрицательные палочки, которые легко спутать с микроорганизмами рода Neisseria. Тяжелые инфекции, вызванные этими микроорганизмами, включая менингит, бактериальный эндокардит, пневмонию, бактериемию, описывают с возрастающей частотой.
Этиология
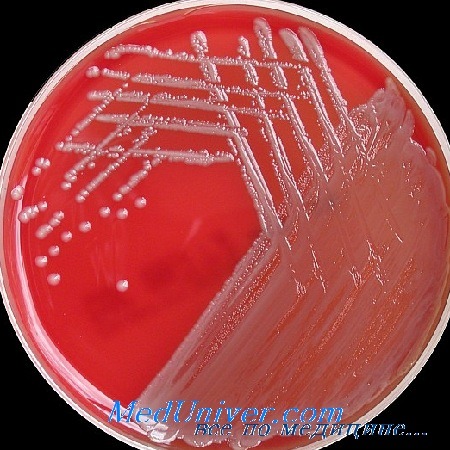
A. calcoaceticus вариант Iwoffi был описан DeBord как Mima polymorpha в 1939 г . Это один из двух хорошо известных вариантов Acinetobacter. Другим является A. calcoaceticus вариант anitratus, вначале названный Herella vaginicola. Микроорганизмы, описанные как Bacterium anitratum и B5W, могут быть обозначены синонимом Acinetobacter. Эти микроорганизмы плеоморфны, инкапсулированы, неподвижны, грамотрицательны. Они хорошо растут на простых питательных средах, образуя белые, выпуклые, гладкие колонии. Среди микробов, выросших на плотных средах, преобладают диплококковые формы; палочковидные и нитевидные варианты возбудителя чаще выявляются на жидкой среде. Видовая идентификация от энтеробактерий основывается на их отрицательной реакции с нитратами, а от представителей рода Neisseria, которых они могут напоминать по морфологии, — по их неприхотливости к питательным средам, по палочковидной форме на жидких средах и по свойственной им отрицательной оксидазной реакции.
Эпидемиология и патогенез
Микроорганизмы рода Acinetobacter распространены повсеместно. Они являются нормальными обитателями кожных покровов у 25% здоровых людей. В случаях возможного участия Acinetobacter в бактериемиях, развивающихся во время использования у больного внутривенных катетеров, основными входными воротами инфекции считаются кожные покровы. Возросшая частота вызванной Acinetobacter пневмонии, как первичной, так и развившейся в результате суперинфекции, также свидетельствует в пользу того, что дыхательные пути могут служить важными воротами инфекции. По всей вероятности, этот микроорганизм является обычным комменсалом, обладающим относительно низкой вирулентностью, который гораздо чаще обусловливает бактерионосительство, чем вызывает развитие инфекции. Создается впечатление, что болезни, вызываемые Acinetobacter, развиваются у лиц, неожиданно встречающихся с внутрибольничной грамотрицательной инфекцией. Тяжелые инфекции развиваются в условиях сниженной резистентности макроорганизма, при инструментальных вмешательствах или после длительной антимикробной терапии препаратами широкого спектра действия. Было отмечено необъяснимое повышение частоты вызванных Acinetobacter легочных инфекций поздним летом. Участие этого микроорганизма в этиологии конъюнктивитов, вагинитов и уретритов требует дальнейшего подтверждения.
Проявления
К тяжелым инфекциям, вызванным Acinetobacter, относятся менингиты, подострые и острые бактериальные эндокардиты, пневмонии, инфекции мочевых путей и бактериемия. Обычно клинические проявления и симптомы этой инфекции не отличаются от таковых при аналогичных заболеваниях, вызванных другими возбудителями. Иногда Acinetobacter может обусловливать молниеносную бактериемию с выраженной лихорадкой, сосудистым коллапсом, петехиями, массивными подкожными кровоизлияниями, которые неотличимы от менингококкемии. Гораздо чаще, однако, бактериемия ассоциируется с очевидным внедрением инфекции через венозную систему, в частности через венозные катетеры, хирургические раны или ожоговые поверхности. Она может также развиваться после инструментальных вмешательств на мочеиспускательном канале или в других областях. В клинических проявлениях таких заболеваний доминирует эндотоксемия, и прогноз их неблагоприятный.
Диагностика
Диагностика инфекции, вызванной Acinetobacter, может быть затруднена тем, что персонал •лабораторий клинической бактериологии мало осведомлен об этих микроорганизмах, что приводит к неправильной интерпретации результатов исследования. Путаница, наблюдающаяся при таксономической классификации этих микроорганизмов, также не облегчает задачу. В практическом плане выделение Acinetobacter из крови, спинномозговой жидкости, мокроты, мочи или гноя должно расцениваться как имеющее клиническое значение, если нет доказательств одновременного наличия какого-либо другого возбудителя. В практическом плане обязательной является дифференциация Acinetobacter и Neisseria, так как первые устойчивы к пенициллину, а вторые — чувствительны.
Лечение
Чувствительность отдельных штаммов Acinetobacter к антибиотикам варьирует, но большинство из них подавляются гентамицином, тобрамицином, амикацином и уреидопенициллинами, такими как пиперациллин. Чувствительность к тетрациклинам непредсказуема, и большинство штаммов устойчивы к пенициллину, ампициллину, цефалоспоринам, эритромицину и левомицетину. При тяжелых системных инфекциях следует применять соответствующий антибиотик, как правило, из ряда аминогликозидов. При локализованных абсцессах, вызываемых этими микроорганизмами, необходимо применять хирургическое дренирование.
Acinetobacter lwoffii лечение
Acinetobacter spp. относится к микроорганизмам, свободно живущим в окружающей среде (сапрофиты), па различных объектах в лечебных учреждениях, в воде, пищевых продуктах. Помимо этого Acinetobacter spp. выделяется из различных биотопов (например, с кожи, слизистой оболочки) человека.
Присутствие Acinetobacter spp. в биоматериалах от пациента, находящегося в стационаре, может быть как следствием колонизации слизистых оболочек и кожи, так и причиной инфекционных осложнений различной локализации. У 25% взрослых людей имеет место колонизация кожи, а у 7% детей колонизированы верхние дыхательные пути. Acinetobacter spp., так же как и P. aeruginosa, способна месяцами находиться на различных объектах окружающей среды в жизнеспособном состоянии.
Кроме того, Acinetobacter spp. устойчива ко многим бактерицидным растворам, например к хлоргексидину.
По данным CDC (NNIS), за последние 20 лет значение неферментирующих грамотрицательных палочек рода Acinetobacter как возбудителей НКИ значительно позросло во всем мире. При хирургических вмешательствах Acinetobacter spp. выделяют из гнойных ран в 2,1 % случаев. Вид A. baumannii составляет 80% всех видов этого рода, ответственных за ЕКИ, и поэтому выделение любого другого вида этого рода дает основание предполагать, что имеет место коптам и нация исследуемого биоматериала.
Повторное выделение Acinetobacter spp. из любых биоматериалов важно для исключения контаминации или колонизации и, в конечном счете, для правильной трактовки полученных результатов микробиологических исследований. Следует заметить, что наиболее часто Acinetobacter spp. выделяют при пневмонии (Acinetobacter spp. составляет 6,9% всех возбудителей при этой локализации), особенно если ей предшествовала колонизация слизистых верхних дыхательных путей. Летальность при пневмонии, обусловленной Acinetobacler spp., составляет 40-64%.
Наряду с другими микробами-оппортунистами (такими, как S. maltophilia) Acinetobacter spp. отличается высокой резистентностью к большинству антимикробных препаратов, хотя имеются существенные различия по антибиотикорезистентности штаммов в разных странах и регионах. В настоящее время, по сообщениям различных авторов, большинство штаммов А. baumannii резистентно ко многим классам антимикробных препаратов. Фторхинолоны, тигециклин, цефтазидим, триметоприм/сульфаметоксазол, доксициклин, имипенем, меропенем, дорипенем, полимиксин В и колистин до недавнего времени считались активными против госпитальных штаммов A. baumannii.
Быстрое развитие резистентности A. baumannii к большинству антибиотиков (МDR-Acinetobacter) регистрируется во всем мире. Сульбактам имеет более высокую природную бактерицидную активность против MDR-Acinetobacter в сравнении с тазобактамом и клавулановой кислотой, в то же время отмечается увеличение резистентности и к сульбактаму. Комбинация имипенема с амикацином в исследованиях in vitro показала синергизм в отношении MDR-штаммов, тогда как in vivo эффект менее выражен. Комбинация фторхинолонов с амикацином приемлема, когда имеет место низкая МПК фторхинолонов для госпитальных штаммов A baumannii.
При выделении штаммов МDR-A. baumannii применяют комбинацию полимиксипа В с рифампицином (или с имипенемом, или с азитромицином). Имеется небольшое количество исследований по применению тигециклина для лечения инфекций, обусловленных A. baumannii, но уже сейчас использование этого антибиотика связывают с постепенным увеличением резистентности. По данным из Германии, резистентность к тигециклину среди A. baumannii составляет 6%, тогда как к кол истину — 2,8%.
По данным SENTRY 2001-2004 гг. (30 стран Европы), доля штаммов Acinetobacter spp., резистентных к имипенему, меропенему, ампициллину/сульбактаму и полимиксину В составляет 26,3, 29,6, 51,6 и 2,7% соответственно. Важно отметить, что даже в странах с низким уровнем резистентности феномен распространения MDR-, XDR- или PDR-штаммов A. baumannii пока неясен. Одним из факторов риска MDR-A. baumannii считается назначении карбапенемов и цефалоспоринов III поколения.
Кроме того, риск связан с искусственной вентиляцией легких (ИВЛ), длительным пребыванием в реанимации, оперативным вмешательством, контаминацией окружающих объектов.
Инфекции, вызываемые acinetobacter: лечение, симптомы
Вид Acinetobacter может вызывать гнойные инфекции в любой системе организма; эти бактерии часто являются оппортунистами у госпитализированных пациентов.
Acinetobacter встречается повсеместно и способна выжить на сухих поверхностях в течение месяца, увеличивая вероятность колонизации пациентов и заражения медицинского оборудования. Существует много разновидностей Acinetobacter, но A. baumannii (АВ) считают причиной приблизительно 80% инфекций.
Болезни, вызываемые Acinetobacter (АВ)
Инфекции АВ, как правило, выявляют у пациентов, госпитализированных в критическом состоянии. Уровень смертности, связанный с инфекцией АВ, составляет 19-54%.
Наиболее часто поражаются органы дыхания. Acinetobacter часто колонизирует места трахеостомы и может вызывать внебольничный бронхиолит и трахеобронхит у здоровых детей и трахеобронхит у взрослых с ослабленным иммунитетом. Приобретенные в больнице пневмонии, вызванные Acinetobacter, часто многодолевые и осложненные. Характерны вторичная бактериемия и септический шок, что предопределяет неблагоприятный прогноз.
Вид Acinetobacter может также вызывать гнойные инфекции в любой системе организма, включая легкие, мочевыводящие пути, кожу и мягкие ткани; возможна бактериемия. Редко эти микроорганизмы вызывают менингит (прежде всего после нейрохирургических процедур), целлюлит или флебит у пациентов с постоянным венозным катетером, глазные инфекции, врожденный или спровоцированный протезом клапана эндокардит, остеомиелит, септический артрит и абсцессы поджелудочной железы и печени.
Значимость выделенных изолятов из клинических образцов определить трудно,потому что они часто представляют собой колонизацию.
Факторы риска. Факторы риска развития инфекции зависят от следующих факторов -это приобретенная в больнице, внебольничная, резистентность ко многим лекарствам.
| Тип инфекции | Факторы риска |
|---|---|
| Приобретенная в больнице | |
| Внебольничная форма | |
| Резистентность ко многим лекарствам |
Ацинетобактер лечение — БэбиБлог
Обновлено: 10 июля, 01:20
![]()
Золотистый стафилококк 10*5 и Acinetobacter baumannii 10*2 в носоглотке.
Сдали бак посев.В носу стафилококк (aureus) 10*5 и ацинетобактер.В зеве стафилококк (aureus) 10 в 3 степени.Посев сдавали т.к. сын (5 лет) стал очень часто болеть и каждый раз с бак осложнениями. И готовимся к удалению аденоидов ( 3ст, тугоухость 1 ст, острый евстахиит).К врачу с анализами идем на след неделе. Знаю, много споров по поводу посевов, флоры и лечения. Поэтому хочу заранее послушать опыт других, если была аналогичная картина при посеве, что говорили вам врачи, чем лечили и лечили ли.Почитала…
Читать далее →
![]()
Бактерии Proteus mirabilis и Acinetobacter spp.
Во время последней Б (ЗБ) у меня в бакпосеве из влагалища было обнаружено Proteus mirabilis. Был назначен антибиотик цефтриаксон, который мне не подошел (аллергия), назначили свечи гексикон.
Через некоторое время я снова сдала бакпосев, Proteus mirabilis не было, а было обнаружено Acinetobacter spp.
Обе эти бяки являются грамотрицательными бактериями, которые могут находится в половых путях и в то же время, могут вызывать воспалительное процессы.
Мазок и ПЦР были чистые.
Proteus mirabilis — представитель нормальной, условно-патогенной микрофлоры кишечника человека. Может вызывать…
Читать далее →
![]()
Сентябрь тоже в пролете
Я писала, что август, на который я возлагала все надежды с января месяца, не оказался месяцем зачатия. Начала курс лечения хр.тонзиллита (и продолжаю). Не рискнула планировать.
Помимо тонзиллита, меня постоянно беспокоили тянущие боли внизу живота после похода по-маленькому. Началось все давно, еще в мае где-то, но 2 раза анализы мочи были идеальные. Пила Канефрон по совету врача, он сказал, больше ничего не нужно делать, мол, пройдет.
Когда стало болеть после каждого похода в туалет , я отправилась к урологу (до…
Читать далее →
![]()
А если доплер не улучшится,что дальше?
Добрый день девочки! Сейчас налаживаю кровоток по доплеру — базальные артерии единичные локус; спиральные вообще не виз-ся((( далее под кат эндик всего 5,5, назначили лечение на 2мес — пью Актовегин ,Флебодиа, свечи Лонгидаза, физио и Фемостон 2/10. Еще репр-г поставила ХЭ в неакт.течении .По узи в матке расшир.полость с содержимым, М.скудные , прошу прощения , темного цвета((. Сдала сама бакпосев из ЦК, высеялся какой то Ацинетобактер в оч.мал.степени, менее 10и2. В общем прошел цикл, М.пообильнее но оно и понятно -…
Читать далее →

Краткие выводы о тактике лечения ангины
Краткие выводы о тактике лечения ангины А.Демкин, врач, СПб, 2009Особенности антибиотикотерапии острых тонзиллитов. Страница 2
1. Не всем больным с ангиной (острым тонзиллитом) требуется назначение антибиотиков 2. Предположительный или подтвержденный диагноз стрептококковой ангины требует назначения антибиотиков. 3. Диагноз стрептококковой ангины может быть предположительнопоставлен по клинической картине заболевания на основании критериев Centor, и подтвержден с помощью микробиологической диагностики или экспресс тестов типа Strep A. 4. Основная цель назначения антибиотиков при стрептококковой ангине – предупреждение развития ранних и поздних осложнений. Антибиотики не оказывают значительного воздействия на сроки и выраженность клинических проявлений ангины. 5. Лучшие результаты (при отсутствии непереносимости – 90 % всех пациентов) и максимальная эрадикация…
Читать далее →
| Резистентность ко многим лекарствам |
Acinetobacter junii в зеве
Acinetobacter: характеристика, патогенность, симптоматика, диагностика, лечение

Acinetobacter – повсеместно распространенный, свободно живущий, сапрофитный микроорганизм, обитающий у здоровых людей на коже, в кишечнике и урогенитальном тракте. Эти микробы обычно колонизируют участки кожного покрова на ногах и в паху. Чаще всего бактерии вызывают внутрибольничные инфекции, имеющие вялотекущий характер, а также пищевые токсикоинфекции и диарею путешественников. Большинство микробов рода Acinetobacter чрезвычайно устойчивы к проводимой терапии.
В 1911 году микробиолог из Голландии Мартин Виллем Бейеринк впервые выделил из почвы бактерии кокковидной формы, способные утилизировать ацетат кальция в качестве источника энергии. Он назвал их Micrococcus calcoaceticus. Спустя несколько лет были описаны свойства этих микробов: неподвижность, неспособность окислять углеводы и редуцировать нитраты. Многие авторы описывали подобные микроорганизмы. В 1954 году официально открыли род Acinetobacter, в который были включены только оксидазонегативные микроорганизмы. Термин «ацинетобактер» в переводе с древнегреческого языка означает «неподвижная бактерия», лишенная флагеллярных органелл движения — жгутиков.
Acinetobacter spp. до недавнего времени считали малопатогенными микроорганизмами. Современные ученые доказали, что при определенных условиях вирулентность микробов повышается. Это приводит к развитию тяжелых инфекционных процессов – менингита и септицемии. С 2017 года ацинетобактеры стали официально относиться к классу опасных бактерий, что обусловлено их резистентностью к современным противомикробным средствам.
Acinetobacter spp. встречается в различных природных объектах: воде, почве, стоках. A. baumannii — клинически значимый представитель данного рода. Он является типичным возбудителем внутрибольничной инфекции. У тяжелых больных A. baumannii вызывает пневмонию, трахеобронхит, сепсис, уретрит, раневую инфекцию.
Рост полирезистентных штаммов ацинетобактерий — серьезная проблема современной медицины. В настоящее время появились бактерии, устойчивые ко всем основным группам антибиотиков. Они с трудом поддаются элиминации из организма. Ученые-медики активно ведут поиск профилактических мер и разрабатывают новые медикаменты, активные в отношении таких возбудителей.
Этиология
Ацинетобактер — род неферментирующих микроорганизмов из семейства Moraxellaceae.
-

Acinetobacter baumannii
Морфология. Acinetobacter — плеоморфные короткие и округлые палочковидные бактерии, способные приобретать форму кокков при определенных условиях. Они являются аспорогенными, капсульными и неподвижными. Некоторые штаммы демонстрируют «дергающуюся» подвижность – движение рывками за счет полярно расположенных фимбрий. Фимбрии и капсула имеются не у всех представителей данного рода. В ядре бактерий содержится циркулярно замкнутая молекула ДНК.
- Тинкториальные свойства. Бактерии окрашиваются по Грамму в красный цвет и располагаются в мазке парами, короткими цепочками или беспорядочными скоплениями.
- Физиологические свойства. Ацинетобактер – хемоорганотроф с окислительным метаболизмом, строгий аэроб. Этот микроб характеризуются универсальной активностью метаболизма, обеспечивающей его удивительную экологическую пластичность. В качестве источника питания ацинетобактерии используют разнообразные вещества – простые углеводы, нефть, ткани организма человека. Бактерии проявляют высокую липолитическую активность.
- Биохимические свойства. Ацинетобактер — неферментирующий микроорганизм. Он не образует индол, сероводород и оксидазу, является каталазопозитивным и оксидазонегативным. Большинство штаммов разлагают сахара с образованием кислоты.
- Культуральные свойства. Acinetobacter растут на простых питательных средах. Им не требуются факторы роста. Обычно используют для культивирования минеральные среды с единственным источником энергии – этанолом, ацетатом или лактатом. Селективная среда для ацинетобактерий — Лидс-агар1, а также хромогенный агар CHROMagar, UriSelect. Некоторые штаммы могут продуцировать слизь, бледно-желтый и светло-серый пигмент. Температурный оптимум 30—32 °С.
- Антигенные свойства. Ацинетобактер имеет капсульный К-антиген, устойчивый к нагреванию, и соматический О-антиген, вступающий в межвидовые перекрестные реакции агглютинации.
- Факторы патогенности: белки-адгезины; пили; экзотоксин – липополисахарид клеточной стенки; эндотоксин, вызывающий гибель и разрушение лейкоцитов; ферменты: фосфолипаза, ДНК-аза, сериновая протеаза, аминопептидаза, уреаза и кислая фосфатаза. Капсула подавляет эффективность фагоцитарных реакций и облегчает адгезию к эпителию, а способность к секреции бактериоцинов обеспечивает колонизацию.
- Резистентность. Ацинетобактерии устойчивы к детергентам, высушиванию и обезвоживанию. Они чувствительны к кипячению и большинству хлорсодержащих дезинфицирующих средств.
Эпидемиология
Ацинетобактерии охотно заселяют любые биотопы с минимально подходящими для них условиями и контаминируют самые разнообразные объекты. Штаммы бактерий обнаруживают во всех образцах почвы и воды, на коже и слизистых оболочках верхних дыхательных путей здоровых людей.
Бактерии рода Acinetobacter выделяют также из пастеризованного молока, замороженных продуктов, воздуха стационаров и смывов с различного медицинского оборудования. Они обладают низкой вирулентностью и являются нормальными обитателями организма человека. Появление микробов в большом количестве на коже, в мокроте или моче указывает не на развитие инфекционного процесса, а на колонизацию или контаминацию.

Источником и резервуаром инфекции являются инфицированные и больные люди, а также контаминированные предметы. Распространение бактерий осуществляется воздушно-капельным, контактно-бытовым, гематогенным путями.
Факторы, предрасполагающие к развитию инфекции:
- Экстренная госпитализация,
- Тяжелые сопутствующие заболевания — гематологические, онкологические, эндокринные,
- Длительная ИВЛ,
- Ингаляционное введение препаратов,
- Инвазивные медицинские манипуляции — введение катетеров и зондов, трахеостомия,
- Недоношенные и новорожденные дети в первую неделю жизни,
- Лечение цитостатиками или гормонами,
- Перенесенные операции и трансплантации,
- Долгое стационарное лечение,
- Мужской пол и пожилой возраст.
Для ацинетобактерной инфекции характерна сезонность вспышек в летний сезон, что связано с увеличением колонизации кожи микробами за счет потливости.
A. baumannii – микроб, обитающий преимущественно в водных объектах: искусственных и естественных водоемах. На сухой поверхности бациллы сохраняют свою жизнеспособность в течение месяца. В лечебно-профилактических учреждениях ацинетобактер колонизирует растворы многоразового использования.
Acinetobacter spp. вызывают назокомиальные инфекции у истощенных, физически ослабленных или умственно отсталых больных. Микробы обладают тропностью к эпителию респираторного и урогенитального трактов, ликвору, крови, перитонеальной жидкости. У иммуноскомпрометированных больных обычно развиваются пневмонии, бактериемия, септицемия, менингит, эндокардит, абсцессы мозга и легких, эмпиема плевры, медиастенит, перитонит.
В стационарных условиях A. baumannii колонизирует:
- Постельные принадлежности, белье, предметы мебели, водопроводные краны,
- Медицинскую аппаратуру — ИВЛ, инфузоматы, тонометры, термометры, системы переливания крови, катетеры,
- Перчатки, маски, халаты и прочие принадлежности медперсонала,
- Разнообразные растворы,
- Материалы для медицинских манипуляций — гидротерапии, операций, катетеризации, трахеостомии, люмбальной пункции.
Симптоматика
Ацинетобактерии – условно-патогенный микроорганизм, вызывающий инфекционный процесс только при снижении иммунной защиты.
Acinetobacter вызывает:
- Воспаление органов дыхания — придаточных пазух носа, трахеи и бронхов, легких,
- Инфицирование крови — бактериемию, септицемию,
- Патологию урогенитального тракта — цистит, уретрит,
- Поражение кожи и мягких тканей,
- Болезни ЦНС — воспаление мозговых оболочек и абсцессы мозга,
- Патологию внутрибрюшного пространства – абсцессы, перитонит,
- Заболевания костей и суставов – остеомиелит, артрит,
- Поражение глаз – неблагоприятно протекающие эндофтальмиты и кератиты.
A. calcoaceticus — возбудитель воспалительных процессов в легочной ткани, урогенитальном тракте, крови. A. junii вызывает у больных бактериемию и сепсис, гнойное воспаление подкожно-жировой клетчатки. A. lwoffii и A. pittii — возбудители гастрита и колита, а A. haemolyticus — кровавой диареи.
 Инфекции кровотока, вызванные A. baumannii протекают в форме бактериемии или сепсиса. Входными воротами являются внутрисосудистые катетеры. Микробы могут проникать в кровь из имеющихся очагов – мочевыводящих путей, инфицированных мягких тканей, ожоговых поверхностей, органов брюшной полости и ЦНС. Молниеносная бактериемия проявляется выраженной лихорадкой, сосудистым коллапсом, петехиями, массивными подкожными кровоизлияниями. При отсутствии эффективной терапии у 30% пациентов развивается инфекционно-токсический шок.
Инфекции кровотока, вызванные A. baumannii протекают в форме бактериемии или сепсиса. Входными воротами являются внутрисосудистые катетеры. Микробы могут проникать в кровь из имеющихся очагов – мочевыводящих путей, инфицированных мягких тканей, ожоговых поверхностей, органов брюшной полости и ЦНС. Молниеносная бактериемия проявляется выраженной лихорадкой, сосудистым коллапсом, петехиями, массивными подкожными кровоизлияниями. При отсутствии эффективной терапии у 30% пациентов развивается инфекционно-токсический шок.
При инфицировании дыхательных путей развиваются нозокомиальные пневмонии, которые характеризуются одновременным поражением нескольких сегментов, формированием полостей, плевральным выпотом, образованием бронхоплевральной фистулы. У больных на фоне тяжелой интоксикации появляется удушающий кашель с гнойной мокротой, одышка, дыхание становится шумным с влажными хрипами. Ацинетобактерная пневмония имеет тяжелое течение и с трудом поддается лечению. Нередко она заканчивается смертью больных.
A. baumannii – значимый патоген, инфицирующий ожоговые поверхности и послеоперационные раны. Инфекции кожи и мягких тканей часто осложняются бактериемией. Этот микроб является возбудителем назокомиального менингита и абсцедирования мозгового вещества. У больных возникают характерные признаки: интоксикация, очаговая симптоматика, менингеальные знаки. На коже появляется петехиальная сыпь, в ликворе — плейоцитоз, увеличение уровня белка и молочной кислоты, снижение глюкозы.
Ацинетобактерии в более редких случаях вызывают:
- Перитонит у лиц на диализе;
- Инфицирование мочевыводящих путей при катетеризации мочевого пузыря и нефролитиазе;
- Воспаление желчевыводящих путей после их дренирования;
- Остеомиелиты и артриты, обусловленный травматическим повреждением или установкой имплантатов;
- Поражения глаз, обусловленные инфицирование контактных линз.
Диагностика
Основным диагностическим методом ацинетобактерной инфекции является бактериологический. Он заключается в правильном заборе материала, быстрой его доставке в лабораторию, идентификации выделенного возбудителя, определении его этиологической значимости и чувствительности к антибактериальным средствам.
Материал отбирают до начала противомикробной терапии непосредственно из очага инфекции с соблюдением правил асептики, предупреждающих его контаминацию посторонней микрофлорой. Отбор осуществляют стерильным ватным тампоном, который помещают в специальные транспортные среды. Жидкий биоматериал помещают в стерильные и плотно закрывающиеся контейнеры. Пробы доставляют в лабораторию не позднее 1,5–2 ч от момента отбора.

Материал засевают на жидкие и плотные питательные среды, инкубируют в термостате и учитывают результаты. На плотных средах образуются гладкие, непрозрачные, блестящие, мелкие колонии. На КА через 48 ч формируются выпуклые серовато-белые колонии, иногда окруженные зоной гемолиза. Микроскопическое исследование заключается в изучении окрашенного препарата под световым микроскопом. В мазках из нативного материала доминируют кокки и коккобациллы, а в мазках из культур — палочковидные формы. Ацинетобактерии относятся к грамотрицательным микробам. После выделения чистой культуры проводят идентификацию возбудителя по биохимическим свойствам. Ацинетобактер не ферментирует лактозу и окисляет глюкозу до кислоты.
Обнаружение ацинетобактерий в мокроте в количестве 106 КОЕ/мл – диагностически значимый критерий. В бронхиальном смыве это количество составляет 104 КОЕ/мл, а в моче 105 КОЕ/мл.
Лечение
Лечение ацинетобактерной инфекций — серьезная проблема, актуальность которой растет с каждым днем. Это связано с увеличением частоты встречаемости микробов, повышением их резистентности к лекарствам и снижением эффективности проводимой терапии.

Этиотропное противомикробное лечение заключается в применении следующих препаратов:
- «Имипенема» или «Меропенема»,
- «Амикацина»,
- «Ципрофлоксацина»,
- «Левофлоксацина»,
- «Ампициллин/сульбактама»,
- «Цефоперазон/сульбактама»,
- «Полимиксина»,
- «Тетрациклина»,
- «Рифампицина»,
- «Тайгециклина».
При необходимости используют комбинации:
- «Цефоперазон/сульбактам» и «Амикацин»,
- «Имипенем» и «Амикацин».
Выбор антибиотика основывается на результатах антибиотикограммы.
При локализованных абсцессах, вызванных этими микроорганизмами, необходимо применять хирургическое дренирование.
Acinetobacter spp. – достаточно проблематичный возбудитель тяжелых состояний и заболеваний, встречающихся в пульмонологической и терапевтической практике. Бактерии вызывают нозокомиальную пневмонию и муковисцидоз, а также целые ряд внебольничных патологий. Эти микроорганизмы обладают природной устойчивостью и приобретенной резистентностью. Большинство штаммов имеют мультирезистентность — устойчивость к основным группам антибиотиков. Члены научного медицинского общества ведут активное наблюдение за состоянием чувствительности таких микробов, создают формуляры и стандарты применения противомикробных средств.
Профилактические мероприятия
Специфическая профилактика ацинетобактерной инфекции в настоящее время не разработана. Неспецифические профилактические мероприятия имеют большое значение, поскольку микроорганизмы имеют высокую резистентность к антибиотикам. Они быстро вырабатывают новые механизмы устойчивости.
В основе профилактических мероприятий госпитальной инфекции лежат принципы и нормы инфекционного контроля.
Мероприятия, предупреждающие инфицирование ацинетобактером :
- Проведение дезинфекционных и антисептических процедур в медучреждениях,
- Исключение контактов с больными людьми,
- Использование средств индивидуальной защиты в местах массового скопления людей в эпидемически опасный период,
- Соблюдение индивидуальных гигиенических норм медперсоналом,
- Рациональное назначение антибиотиков с учетом данных антибиотикограммы,
- Своевременная санация очагов хронической инфекции – лечение кариеса, тонзиллита, синуситов,
- Укрепление иммунитета – закаливание, питание растительной и молочнокислой пищей, занятия спортом, оптимальный режим труда и отдыха, полноценный сон, прогулки на свежем воздухе,
- Поддержание чистоты тела и жилища, регулярное проветривание комнат, влажная уборка в общественных помещениях с хлорсодержащими дезинфектантами,
- Плановое прохождение врачебных осмотров,
- Прием витаминно-минеральных комплексов в весенний и осенний периоды.
Acinetobacter — род микроорганизмов, вызывающих преимущественно внутрибольничную инфекцию и поражающих тяжелобольных пациентов. Эти условно-патогенные микробы являются нормальными обитателями различных локусов человеческого организма. При определенных условиях они активно размножаются и вызывают заболевания внутренних органов и систем, которые требуют проведения специфического противомикробного лечения. Прогноз и исход ацинетобактериальной инфекции зависят от патогенности штамма, активности иммунной системы макроорганизма, своевременности и грамотности назначенного лечения.
Инфекции, вызванные Acinetobacter
Определение. Микроорганизмы рода Acinetobacter — это плеоморфные грамотрицательные палочки, которые легко спутать с микроорганизмами рода Neisseria. Тяжелые инфекции, вызванные этими микроорганизмами, включая менингит, бактериальный эндокардит, пневмонию, бактериемию, описывают с возрастающей частотой.
Этиология. A. calcoaceticus вариант Iwoffi был описан DeBord как Mima polymorpha в 1939 г. Это один из двух хорошо известных вариантов Acinetobacter. Другим является A. calcoaceticus вариант anitratus, вначале названный Herella vaginicola. Микроорганизмы, описанные как Bacterium anitratum и B5W, могут быть обозначены синонимом Acinetobacter. Эти микроорганизмы плеоморфны, инкапсулированы, неподвижны, грамотрицательны. Они хорошо растут на простых питательных средах, образуя белые, выпуклые, гладкие колонии. Среди микробов, выросших на плотных средах, преобладают диплококковые формы; палочковидные и нитевидные варианты возбудителя чаще выявляются на жидкой среде. Видовая идентификация от энтеробактерий основывается на их отрицательной реакции с нитратами, а от представителей рода Neisseria, которых они могут напоминать по морфологии, — по их неприхотливости к питательным средам, по палочковидной форме на жидких средах и по свойственной им отрицательной оксидазной реакции.
Эпидемиология и патогенез. Микроорганизмы рода Acinetobacter распространены повсеместно. Они являются нормальными обитателями кожных покровов у 25% здоровых людей. В случаях возможного участия Acinetobacter в бактериемиях, развивающихся во время использования у больного внутривенных катетеров, основными входными воротами инфекции считаются кожные покровы. Возросшая частота вызванной Acinetobacter пневмонии, как первичной, так и развившейся в результате суперинфекции, также свидетельствует в пользу того, что дыхательные пути могут служить важными воротами инфекции. По всей вероятности, этот микроорганизм является обычным комменсалом, обладающим относительно низкой вирулентностью, который гораздо чаще обусловливает бактерионосительство, чем вызывает развитие инфекции. Создается впечатление, что болезни, вызываемые Acinetobacter, развиваются у лиц, неожиданно встречающихся с внутрибольничной грамотрицательной инфекцией. Тяжелые инфекции развиваются в условиях сниженной резистентности макроорганизма, при инструментальных вмешательствах или после длительной антимикробной терапии препаратами широкого спектра действия. Было отмечено необъяснимое повышение частоты вызванных Acinetobacter легочных инфекций поздним летом. Участие этого микроорганизма в этиологии конъюнктивитов, вагинитов и уретритов требует дальнейшего подтверждения.
Проявления. К тяжелым инфекциям, вызванным Acinetobacter, относятся менингиты, подострые и острые бактериальные эндокардиты, пневмонии, инфекции мочевых путей и бактериемия. Обычно клинические проявления и симптомы этой инфекции не отличаются от таковых при аналогичных заболеваниях, вызванных другими возбудителями. Иногда Acinetobacter может обусловливать молниеносную бактериемию с выраженной лихорадкой, сосудистым коллапсом, петехиями, массивными подкожными кровоизлияниями, которые неотличимы от менингококкемии. Гораздо чаще, однако, бактериемия ассоциируется с очевидным внедрением инфекции через венозную систему, в частности через венозные катетеры, хирургические раны или ожоговые поверхности. Она может также развиваться после инструментальных вмешательств на мочеиспускательном канале или в других областях. В клинических проявлениях таких заболеваний доминирует эндотоксемия, и прогноз их неблагоприятный.
Диагностика. Диагностика инфекции, вызванной Acinetobacter, может быть затруднена тем, что персонал • лабораторий клинической бактериологии мало осведомлен об этих микроорганизмах, что приводит к неправильной интерпретации результатов исследования. Путаница, наблюдающаяся при таксономической классификации этих микроорганизмов, также не облегчает задачу. В практическом плане выделение Acinetobacter из крови, спинномозговой жидкости, мокроты, мочи или гноя должно расцениваться как имеющее клиническое значение, если нет доказательств одновременного наличия какого-либо другого возбудителя. В практическом плане обязательной является дифференциация Acinetobacter и Neisseria, так как первые устойчивы к пенициллину, а вторые — чувствительны.
Лечение. Чувствительность отдельных штаммов Acinetobacter к антибиотикам варьирует, но большинство из них подавляются гентамицином, тобрамицином, амикацином и уреидопенициллинами, такими как пиперациллин. Чувствительность к тетрациклинам непредсказуема, и большинство штаммов устойчивы к пенициллину, ампициллину, цефалоспоринам, эритромицину и левомицетину. При тяжелых системных инфекциях следует применять соответствующий антибиотик, как правило, из ряда аминогликозидов. При локализованных абсцессах, вызываемых этими микроорганизмами, необходимо применять хирургическое дренирование.
Acinetobacter pittii — МедВопрос, ответ врача
Добрый день!
Ребенку 4 месяца.
У нас следующая ситуация:
в 3 месяцабыло хлюпание носа, доктор сказал узкие носовые ходы. Капали акваморисом и аспиратором вытягивали слизь белую, через недели 2 появились зелёные сопли. Сново пошли к ЛОРу но к другому, лор сказала, что узкие носовые ходы не мешают дыханию малыша во время сна. наш же храпел. Прописала левомецитиновые капли и сдать мазки из зева и носа мне и малышу.
В анализе, который делается около 10 дней, высеялось:
у малыша:
Зев:streptococcus viridans 10×5(по верхней границе нормы)
Нос:acinetobacter pittii 10х3,
staphylococcus aureus 10×3.
У меня:
Зев:neisseria subflava 10×4, streptococcus viridans 10×5(по верхней границе нормы)
Нос:staphylococcus aureus 10×3.
Пошли к педиатору с результатами, сказала лечить это не нужно.
Сдавали кровь в 3,5 месяца было СОЭ 12, попросила дать направление на пересдачу и в 4 месяца показало 20 СОЭ. Ещё сдавали кал, т. к. стул бвл зеленый и частый, и боли в в животе, показал дисбактериоз, и ещё у нас бывает аллергия и на сгибе ноги возле ступни спереди с рождения краснота (похоже на не запущенный атопический дерматит). Купали в увлажняющий эмульсии, сейчас перестали 5 дней купали в обычной воде и в череде, складка раскраснелась появились точки и трещина, стала мокнуть.
В итоге:
Назначили пить ромашку, бифидумбактерин, и мазать мустелой (я мажу бипантеном), промывание носа физраствором с аспиратором.
Беспокоит показатель СОЭ в крови, и мазки из носа, и то что малыш начиная кушать плачет(как будто животик беспокоит но успокаиваю и дальше кушает нормально), и раздражение на ноге, подскажите пожалуйста, Ваше мнение по поводу нашей ситуации? и может стоит дообследовать? Очень боюсь что- то запустить. Переживаю.
Заранее благодарю.
Обнаружили acinetobacter baumannii — Онлайн врач
Вирусы вместо антибиотиков. Как бороться с суперинфекциями
МОСКВА, 11 апр — РИА Новости, Альфия Еникеева. С некоторых пор болезнетворные бактерии стали вырабатывать устойчивость к антибиотику последнего резерва — колистину.
Его применяют в тех случаях, когда остальные лекарства бессильны перед возбудителями инфекций.
Неубиваемые микроорганизмы появились даже в Арктике, а Всемирная организация здравоохранения составила список из 12 наиболее опасных супербактерий, средство против которых необходимо найти уже сейчас.
Глобальная угроза
По данным британских исследователей, к 2050 году число смертей от антибиотикорезистентных супербактерий с сегодняшних семисот тысяч увеличится до десяти миллионов в год.
Чаще всего люди, как считают специалисты ВОЗ, будут умирать от устойчивых к карбапенему энтеробактерий, синегнойной палочки (Pseudomonas aeruginosa) и ацинетобактера (Acinetobacter baumannii).
Все эти возбудители связаны с так называемыми внутрибольничными инфекциями, которые пациенты цепляют в госпиталях и поликлиниках, где лечатся от других заболеваний.
Также среди наиболее опасных супербактерий, по данным ВОЗ, оказались энтерококки (Enterococcus faecium), золотистый стафилококк (MRSA), гонококк и устойчивый к кларитромицину хеликобактер — патогены, вызывающие менингит, заражение крови, пневмонию, гонорею и инфекции мочевыводящих путей.
Судя по эксперименту гарвардских ученых, невосприимчивость к лекарствам развивается у этих микроорганизмов стремительно. Обычная кишечная палочка Escherichia coli всего за 11 дней приспособилась к тысячекратной дозе антибиотиков и фактически превратилась в супермикроб, практически неуязвимый для любых существующих препаратов.
Найти новый антибиотик
Теоретически ученые способны создать лекарство против бактерий, нечувствительных к нынешним антибиотикам, однако его разработка и испытания могут занять долгие годы. А это, в свою очередь, может быть финансово невыгодно фармацевтическим компаниям.
Выход из сложившейся ситуации предложили исследователи из МФТИ, МГУ и Института биохимии и генетики РАН, придумавшие полуавтоматический метод поиска антибиотиков нового класса. Он основан на анализе того, как те или иные вещества действуют на патогенные микроорганизмы и уничтожают их.
Ученые проверили действие почти 125 тысяч соединений на штамме кишечной палочки Escherichia coli и выявили 688 веществ, обладающих выраженной антибактериальной активностью. Некоторые из них обладали одинаковой подструктурной 2-пиразол-1-ил-тиазол группой.
А значит, соединения, относящиеся к этому классу, могут быть эффективны в борьбе с лекарственно устойчивыми бактериями.
Затем исследователи проанализировали принадлежащие к этой группе восемь молекул, которые уничтожали микроорганизмы, блокируя им синтез белка. Среди изученных веществ только одно не проявляло цитотоксического эффекта и гипотетически не представляло опасности для человека. Однако его еще следует тщательно исследовать и испытывать на модельных животных, отмечают авторы работы.
Вирусы против бактерий
Американские ученые предлагают бороться с микроорганизмами, устойчивыми к антибиотикам, с помощью бактериофагов — вирусов, избирательно поражающих бактериальные клетки. Правда, при такой терапии следует использовать частицы, созданные специально под определенный штамм возбудителя.
Специалисты уже помогли подобным образом пациентке, страдающей муковисцидозом и хронически инфицированной антибиотикорезистентным штаммом Mycobacterium abscessus. В начале 2018 года девушке провели двустороннюю трансплантацию легких, а потом обнаружили в анализах опасную микобактерию, спровоцировавшую загноение послеоперационной раны.
Противомикробная терапия в течение семи месяцев не давала никаких результатов.
Тогда ученые подобрали три фага, наиболее агрессивных по отношению к патогенному микроорганизму, смешали их и проверили действие созданного препарата на культуре штамма GD01 Mycobacterium abscessus, который был выделен у пациентки через месяц после операции. Полученная смесь не оставляла в живых ни одной бактерии, даже при высоких концентрациях.
Затем комбинацию из трех бактериофагов в течение 32 недель внутривенно вводили пациентке каждые 12 часов. В результате ее состояние значительно улучшилось: послеоперационная рана стала заживать, а опасная бактерия больше не проявлялась в мокроте и крови.
Впрочем, авторы статьи предупреждают: говорить об эффективности лечения бактериофагами пока рано, ведь это единичный клинический случай. Тем не менее в медицинской литературе уже описана успешная терапия инфекций, вызванных супербактериями, с помощью антибиотиков и бактериофага.
Искусственные и эффективные
Китайские, американские и сингапурские ученые синтезировали вещество, способное разрушить сразу несколько бактерий, устойчивых к антибиотикам, — в том числе синегнойную палочку и золотистый стафилококк (MRSA).
Речь идет о биоразлагаемом поликарбонатном полимере с гуанидиновыми функциональными группами, чьи молекулы могут связываться с бактериальной мембраной и, не разрушая ее, проникать внутрь клетки. Там гуанидин нарушает структуру белков цитоплазмы, и они выпадают в осадок, убивая бактерию.
Исследователи протестировали новое лекарство на крысиных эритроцитах и клетках эмбриональных человеческих почек. Полимер оказался абсолютно нетоксичен для первых и менее ядовит для вторых, чем антибиотик полимиксин В, используемый сегодня в лечении бактериальных инфекций.
Кроме того, новое соединение полностью разлагалось за трое суток, а продукты его распада были безвредны.
Кроме того, выяснилось, что созданный учеными полимер не вызывает привыкания у опасных микроорганизмов. Специалисты обрабатывали культуру Acinetobacter baumannii — возбудителя пневмонии — этим соединением в концентрациях, позволявших некоторым бактериям выживать.
Затем из них выращивали новую культуру и снова обрабатывали ее поликарбонатом. И так тридцать раз подряд. Однако даже после этого микробы не выработали устойчивости к полимеру.
Для сравнения: резистентность к антибиотику, который обычно применяют против Acinetobacter baumannii, бактерии выработали за восемь циклов.
Авторы работы намерены в будущем протестировать созданный ими полимер на людях.
Источник: https://ria.ru/20200411/1569880170.html
Acinetobacter lwoffii лечение
- Acinetobacter baumannii
- Pseudomonas aeruginosa
- Enterobacteriaceae
бактерий, устойчивых к антибиотикам, заслуженно возглавляют грамотрицательные микроорганизмы — возбудители большинства нозокомиальных (внутрибольничных) инфекций в отделениях реанимации и интенсивной терапии, гнойной хирургии и онкологии. Вызывают инфекции кожи и мягких тканей, ЖКТ, мочевыводящих путей, раневые, эндокардит, менингит, остеомиелит.
«Природное» местообитание A. baumannii не установлено, однако этих бактерий обнаруживают в стационарах по всему миру. Вызывает до 1 % всех нозокомиальных инфекций, с уровнем смертности от 8 до 35 %.
A. baumannii резистентна к пенициллинам, цефалоспоринам, аминогликозидам, хинолонам и тетрациклину. Отмечено значительное увеличение резистентности к карбапенемам — более 50 % в отдельных странах.
https://www..com/watch?v=upload
В терапии карбапенем-резистентной A. baumannii относительно эффективны комбинации антибиотиков: полимиксин Е рифампицин/карбапенемы/хинолоны/цефепим/ампициллин-сульбактам/пиперациллин-тазобактам.
Синегнойная палочка распространена повсеместно, встречается в почве и воде, на/в растениях, животных, людях. Вызывает до 20 % нозокомиальных инфекций. Чувствительность к антибактериальной терапии очень сильно варьирует.
В тяжелых случаях отмечается развитие резистентности к ранее высокоэффективным цефалоспоринам, фторхинолонам, карбапенемам, аминогликозидам, азтреонаму, пиперациллину-тазобактаму.
Сохраняется чувствительность к полимиксину Е, а также комбинациям антибиотиков.
Смертность при развитии инфекций, вызванных мультирезистентной P. aeruginosa, варьирует от 5 до 50 %, в зависимости от состояния пациента и локализации процесса.
Enterobacteriaceae
Из большого семейства энтеробактерий основные проблемы в стационарах доставляют Klebsiella, Escherichia coli, Citrobacter, Salmonella, Enterobacter, Serratia, Proteus. Вызывает опасения растущее повсеместное снижение чувствительности семейства к карбапенемам. Описаны единичные случаи резистентности E. coli ко всем существующим антибиотикам, включая полимиксин Е.
- Enterococcus faecium
- Staphylococcus aureus
- Helicobacter pylori
- Campylobacter spp.
- Salmonellae
- Neisseria gonorrhoeae
Бактерии второй группы объединены по признаку повсеместного распространения, высокой социально-экономической значимости вызываемых ими заболеваний и быстрого развития резистентности к основным антибиотикам, используемым для их эрадикации, однако в резерве еще остается один или несколько эффективных препаратов.
E. faecium входит в состав нормальной микрофлоры кишечника, но в то же время является условно-патогенным микроорганизмом. У ослабленных больных может вызывать инфекции мочевыводящих путей, раневую инфекцию, сепсис и эндокардит.
Резистентен к аминогликозидам, пенициллинам и цефалоспоринам. Беспокойство вызывает снижение чувствительности к ванкомицину — до 72 % в отдельных популяциях. Большинство штаммов E.
faecium чувствительны к линезолиду, тигециклину, даптомицину.
Золотистый стафилококк, колонизирующий кожу и слизистые оболочки, способен вызывать тяжелые инфекции кожи и мягких тканей, респираторные, раневые инфекции, остеомиелит, сепсис, артрит, эндокардит. Недавнее появление и распространение ванкомицин- и гликопептид-резистентных штаммов в дополнение метициллин-резистентному S.
Helicobacter pylori
Тревогу ВОЗ вызывает увеличение случаев резистентности всем известной H. pylori к кларитромицину, что сказывается на эффективности традиционных схем эрадикационной терапии, в том числе и в России.
Перед эрадикацией ВОЗ рекомендует проверить чувствительность бактерии к этому антибиотику, при выявлении устойчивости — использовать схемы без него — с метронидазолом, тетрациклином или рифаксимином, а также добавлять висмута трикалия дицитрат.
Campylobacter spp
Бактерии рода Campylobacter удерживают первое место в мире по гастроэнтеритам, которые у большинства населения планеты протекают в легкой форме, но представляют опасность для маленьких детей, беременных, стариков и иммунокомпрометированных больных. В большинстве случаев достаточно регидратации и восстановления электролитного баланса, антибактериальную терапию назначают при тяжелом течении.
Проблемой является резистентность Campylobacter к фторхинолонам, основному средству борьбы с кишечной микрофлорой, и макролидам. Устойчивость к этим препаратам, впрочем, сильно варьирует от страны к стране — от менее 5 % в Финляндии до более 90 % в Индии. В Европе и России эритромицин всё еще остается препаратом выбора.
Salmonellae
Представители рода сальмонелл также вызывают набор кишечных инфекций, от легкого энтерита до брюшного тифа. Большинство этих бактерий уже резистентны к бета-лактамам, аминогликозидам, тетрациклинам, хлорамфениколу и ко-тримоксазолу.
Устойчивость к фторхинолонам растет во всем мире, но пока не привела к полной бесполезности этих препаратов, они остаются антибиотиками выбора, наравне с макролидами и цефалоспоринами третьего поколения.
Антибактериальной терапии требуют только тяжелые случаи кишечных инфекций и, конечно, брюшной тиф и паратифы.
Гонорея из неприятной, но относительно легко излечимой болезни эволюционировала в глобальную медицинскую проблему. Гонококк потерял чувствительность к пенициллинам, тетрациклинам, сульфаниламидам и фторхинолонам.
Особое опасение вызывает появление и постепенное распространение штаммов, резистентных к цефалоспоринам (цефтриаксону), долгое время служивших безотказным средством борьбы с этой инфекцией.
При резистентной к стандартным схемам лечения гонорее рекомендовано использовать комбинацию азитромицина с высокими дозами цефтриаксона.
В России гонококк также практически резистентен к фторхинолонам, но пока сохраняет 100 %-ную чувствительность к цефтриаксону.
Средний уровень приоритетности
- Streptococcus pneumoniae
- Haemophilus influenzae
- Shigella spp.
Третью группу также представляют широко распространенные бактерии, чья устойчивость к «обычным» антибиотикам пока не приняла угрожающих масштабов, однако чревата большими проблемами в будущем.
Пневмококки — одни из основных возбудителей инфекций ЛОР-органов, внебольничной пневмонии, менингита. Резистентны к тетрациклину и ко-тримоксазолу. В мире постепенно снижается чувствительность S. pneumoniae к бета-лактамам и макролидам, однако, как и в других случаях, доля резистентных штаммов сильно варьирует от страны к стране.
Гемофильная инфекция у детей младшего возраста протекает в виде бактериемии, гнойного менингита, пневмонии, целлюлита и эпиглоттита, у взрослых — в основном в виде пневмонии.
Тревогу ВОЗ вызывает развитие полной резистентности гемофильной палочки к ранее эффективному ампициллину, в результате чего от него пришлось повсеместно отказаться.
В России эффективны амоксициллин, цефалоспорины и макролиды, однако рекомендуется проводить бактериологический анализ с оценкой резистентности.
Shigella spp
Возбудители дизентерии практически не чувствительны к ампициллину. Как и прочие энтеробактерии, они также постепенно вырабатывают устойчивость к фторхинолонам, которые тем не менее всё еще остаются препаратами выбора. В качестве альтернативы — цефалоспорины III поколения, ко-тримоксазол.
Итого
Появление устойчивых к антибиотикам бактерий и публикация этого списка в очередной раз привлекают внимание человечества к необходимости создания — в идеале — принципиально новых средств борьбы с микроорганизмами, иначе, по пессимистичным прогнозам, из-за появления бактерий, устойчивых к антибиотикам, через несколько десятилетий одна только послеоперационная летальность может скатиться до уровня начала прошлого века.
https://www..com/watch?v=ytpolicyandsafetyru
Проблема лекарственной устойчивости среди возбудителей нозокомиальных инфекций — первые пять бактерий списка — актуальна и для российского здравоохранения.
Остальные перечисленные микроорганизмы, по данным российских исследований, на территории РФ в целом сохраняют чувствительность к «своим» антибиотикам.
Тем не менее, учитывая возросшую мобильность населения, можно ожидать завоза и распространения резистентных штаммов.
Сводная таблица: чувствительность возбудителей к антибактериальной терапии
| Возбудитель | Чувствительность к антибактериальной терапии | ||
| Нет или в большинстве случаев утеряна | Снижается | В основном сохранена | |
| Acinetobacter baumannii | Пенициллины, цефалоспорины, аминогликозиды, тетрациклин, хинолоны, азтреонам, пиперациллин-тазобактам | Карбапенемы, полимиксин Е | Комбинации:полимиксин Е рифампицин/карбапенемы/хинолоны/цефепим/ампициллин-сульбактам/пиперациллин-тазобактам |
Источник: https://onsmeta.ru/ainetobater-loffii-lehenie/
Характеристики Acinetobacter baumannii, морфология, обмен веществ / биология
Acinetobacter baumannii Это грамотрицательная бактерия, принадлежащая к отряду псевдомонад. На протяжении всей своей таксономической истории он находился в Micrococcus, Moraxella, Alcaligenes, Mirococcuscalco-aceticus, Herellea и Achromobacter, пока он не был расположен в своем нынешнем жанре в 1968 году.
. baumannii Это патогенная бактерия, которая считается видом, наиболее часто встречающимся в инфекциях своего рода. Она была замешана в различных типах инфекций, таких как сепсис, пневмония и менингит..
Это оппортунистический паразит, который часто встречается в больничных или внутрибольничных заболеваниях. Передача через искусственную вентиляцию легких была указана как важная причина инфекции, особенно в отделениях интенсивной терапии.
Несмотря на то, что он считается низкосортным патогеном, он обладает способностью увеличивать свою вирулентность у штаммов, вовлеченных в частые инфекции. Обладает большой способностью развивать резистентность и мультирезистентность к антибиотикам..
В больницах он передается в основном через контакт с персоналом, через загрязненные больничные материалы, а также через воздух на короткие расстояния..
Всемирная организация здравоохранения включает А. Бауманны в списке устойчивых патогенов, для которых срочно требуются новые антибиотики, с присвоением категории 1 с критическим приоритетом.
индекс
- 1 Биологические характеристики
- 2 Морфология
- 3 Метаболизм
- 4 Устойчивость к антибиотикам
- 5 патологий
- 6 Симптомы
- 7 Лечение
- 8 ссылок
Биологические характеристики
Все виды рода Acinetobacter они имеют широкое распространение в разных природных нишах. А. Бауманны он может естественным образом обитать на коже здоровых людей, будучи способен колонизировать слизистые поверхности, что является важным эпидемиологическим резервуаром. Тем не менее, среда обитания А. Бауманны это почти исключительно для больниц.
Эти бактерии не имеют жгутики или структуры, используемые для передвижения. Однако движение достигается за счет структур, которые позволяют им расширить и втягиваться, а также химических механизмов, таких, как выведение пленки с высокой молекулярной массой, экзополисахарида позади бактерий.
А. Бауманны может колонизировать большое количество живых или инертных сред и обладает большой способностью выживать на искусственных поверхностях в течение длительного периода времени.
Эта способность, возможно, из-за его способность противостоять обезвоживанию, используя различные источники углерода через различные метаболические пути и способность образовывать биопленки. По этой причине он является общим, чтобы найти его в больничных принадлежностей, таких как катетеры и механической вентиляции устройства.
морфология
A. baumannii – коккобацилл, промежуточный по форме между кокосами и тростниками. Они измеряют от 1,5 до 2,5 на 1-1,5 мкм, когда популяции находятся в логарифмической фазе роста. Они более сферические, когда достигают стационарной фазы.
метаболизм
Бактерия А. Бауманны это не ферментер глюкозы; он строго аэробный, то есть для метаболизма необходим кислород.
Вид рода Acinetobacter они являются единственными из семейства Moraxellaceae, в которых отсутствуют оксидазы цитохрома с, для которых они дают отрицательные результаты в тестах оксидаз.
А. Бауманны растет при температуре от 20 до 44ºC, оптимальная температура от 30 до 35ºC.
Устойчивость к антибиотикам
Постоянная генерация устойчивости к антибиотикам не только препятствует лечению инфекций, вызываемых А. Бауманны, это также способствует отбору эндемических и эпидемических мультирезистентных штаммов.
Некоторые внутренние механизмы А. Бауманны, которые способствуют устойчивости к антибиотикам:
- Наличие β-лактамазы придают устойчивость к b-лактамам.
- Продукция специфических ферментов, таких как аммониглюкозид-3′-фосфотрансфераза VI, инактивирует амикацин.
- Присутствие оксациллиназы ОХА-51 гидролизует пенициллины и карбапенемы.
- Присутствие и избыточная экспрессия эффлюксных наркотиков насосов, которые являются насосами, которые высылать вне клетки к малым молекулам, которые способны ввести в цитоплазму, снижающие чувствительность к антибиотикам.
Биопленки, созданные А. Бауманны они изменяют метаболизм микроорганизмов, снижая их чувствительность к антибиотикам, а также создают физический барьер против больших молекул и предотвращают обезвоживание бактерий..
патологиями
А. Бауманны колонизирует нового хозяина путем контакта с инфицированными людьми или с загрязненным медицинским оборудованием. Во-первых, эта бактерия прилипает к поверхности кожи и слизистой оболочки. Для размножения необходимо выжить антибиотики и ингибиторы и условия этих поверхностей.
Увеличение числа бактерий на поверхности слизистых оболочек, в частности в стационарных катетеров контакта внутрисосудистых или эндотрахеальных трубок, может повысить риск инфекции дыхательных путей и кровоток.
Пневмония в больницах является наиболее распространенной из инфекций, вызываемых А. Баумании. Обычно заключаются в отделениях интенсивной терапии пациентами, получающими искусственное дыхание.
А. Баумании Это также вызвало серьезные проблемы из-за заражения военнослужащих послевоенными травмами, особенно в Ираке и Афганистане. В частности, из-за остеомиелита и инфекций мягких тканей, которые могут вызвать некроз и целлюлит.
Есть также риск менингита от А. Баумании у пациентов, восстанавливающихся после нейрохирургии.
Лица, подверженные заражению А. Баумании включают в себя те, которые были ранее подвергнуты антибиотикам, серьезной операции, ожоги, травмы, иммуносупрессии или использования инвазивных медицинских устройств, в первую очередь для искусственной вентиляции легких в отделениях интенсивной терапии.
симптомы
Не существует специфической симптоматики инфекций из-за А. Баумании. Каждая из различных инфекций, вызываемых этой бактерией, имеет свои характерные симптомы.
В целом симптомы инфекций, которые могут включать А. Баумании или другие оппортунистические бактерии, такие как Klebsiella pneumoniae и Streptococcus pneumoniae, Они могут включать лихорадку, озноб, сыпь, болезненное мочеиспускание, насущную необходимость часто мочиться, путаницы или измененных психических состояний, тошнота, боли в мышцах, груди и кашель.
лечение
Антибиотики для лечения инфекций А. Бауманны они чрезвычайно ограничены из-за их большой способности приобретать сопротивления и мультирезистентность. Поэтому важно определить восприимчивость каждого штамма к различным антибиотикам, чтобы обеспечить эффективность каждого лечения..
В связи с устойчивостью к карбапенемам использовалось использование полимиксинов, в частности колистина, несмотря на относительно низкий индекс резистентности и его побочные эффекты на почки..
Однако штаммы, устойчивые к колистину, уже были обнаружены. В качестве альтернативы устойчивости к этим антибиотикам использовалась комбинированная терапия..
ссылки
- Bergogne-Bérézin, E. & Towner, K.J. Acinetobacter spp. как внутрибольничные патогены: микробиологические, клинические и эпидемиологические особенности. Clin Microbiol Rev, 9 (1996), pp. 148-165.
- Fournier, P.E., Richet, H. (2006). Эпидемиология и контроль Acinetobacter baumanii в учреждениях здравоохранения. Клинические инфекционные заболевания, 42: 692-9.
- Эрнандес Торрес, А., Гарсия Васкес, Е., Ягуэ, Г. &, Гомес Гомес, J. (2010) Acinetobacter baumanii мультирезистентность: текущая клиническая ситуация и новые перспективы Испанский журнал химиотерапии, 23 (1): 12-19.
- Марагакис Л.Л., Perl TM. Acinetobacter baumanii: эпидемиология, устойчивость к противомикробным препаратам и варианты лечения. Clin Infec Dis 2008; 46: 1254-63.
- McConnell, M.j., Actis, L. & Pachón, J. (2013) Acinetobacter baumannii: инфекции человека, факторы, способствующие патогенезу и модели на животных. FEMS Microbiology Reviews, 37: 130-155.
- Peleg, A.Y., Seifert, H. & Paterson, D.L. (2008). Acinetobacter baumannii: появление успешного возбудителя. Клиническая Микробиология Обзоры, 21 (3): 538-82.
- Ванегас-Мунера, J.M., Roncancio-Villamil, G. & Jiménez-Quiceno, J.N. (2014). Acinetobacter baumannii: клиническое значение, механизмы резистентности и диагностика. CES Medicine Journal, 28 (2): 233-246.
Источник: https://ru.thpanorama.com/articles/biologa/acinetobacter-baumannii-caractersticas-morfologa-metabolismo.html
Проклятая дюжина
Опубликован список из 12 бактерий, устойчивых к действию большинства антибиотиков
В конце февраля 2017 г. Всемирная организация здравоохранения впервые опубликовала список бактерий с уже выработанной или растущей устойчивостью к действию большинства антибиотиков.
Задача публикации — стимулировать на государственном уровне поиск новых лекарственных препаратов против перечисленных возбудителей, «представляющих наибольшую угрозу для здоровья человека».
Включенные в список бактерии разделены на три группы по приоритетности в плане поиска новых антибиотиков.
Критически высокий уровень приоритетности
- Acinetobacter baumannii
- Pseudomonas aeruginosa
- Enterobacteriaceae
бактерий, устойчивых к антибиотикам, заслуженно возглавляют грамотрицательные микроорганизмы — возбудители большинства нозокомиальных (внутрибольничных) инфекций в отделениях реанимации и интенсивной терапии, гнойной хирургии и онкологии. Вызывают инфекции кожи и мягких тканей, ЖКТ, мочевыводящих путей, раневые, эндокардит, менингит, остеомиелит. У ослабленных пациентов особое значение имеют инфекции кровотока и ИВЛ-ассоциированная пневмония. Для бактерий этой группы практически не осталось антибиотиков резерва.
Acinetobacter baumannii
«Природное» местообитание A. baumannii не установлено, однако этих бактерий обнаруживают в стационарах по всему миру. Вызывает до 1 % всех нозокомиальных инфекций, с уровнем смертности от 8 до 35 %. A.
baumannii резистентна к пенициллинам, цефалоспоринам, аминогликозидам, хинолонам и тетрациклину. Отмечено значительное увеличение резистентности к карбапенемам — более 50 % в отдельных странах.
Выявлены случаи резистентности к «последнему резерву» антибактериальной терапии, полимиксинам, ранее широко не использовавшимся из‑за высокой нефротоксичности.
В терапии карбапенем-резистентной A. baumannii относительно эффективны комбинации антибиотиков: полимиксин Е + рифампицин/карбапенемы/хинолоны/цефепим/ампициллин-сульбактам/пиперациллин-тазобактам.
Pseudomonas aeruginosa
Синегнойная палочка распространена повсеместно, встречается в почве и воде, на/в растениях, животных, людях. Вызывает до 20 % нозокомиальных инфекций. Чувствительность к антибактериальной терапии очень сильно варьирует.
В тяжелых случаях отмечается развитие резистентности к ранее высокоэффективным цефалоспоринам, фторхинолонам, карбапенемам, аминогликозидам, азтреонаму, пиперациллину-тазобактаму.
Сохраняется чувствительность к полимиксину Е, а также комбинациям антибиотиков.
Смертность при развитии инфекций, вызванных мультирезистентной P. aeruginosa, варьирует от 5 до 50 %, в зависимости от состояния пациента и локализации процесса.
Высокий уровень приоритетности
- Enterococcus faecium
- Staphylococcus aureus
- Helicobacter pylori
- Campylobacter spp.
- Salmonellae
- Neisseria gonorrhoeae
Бактерии второй группы объединены по признаку повсеместного распространения, высокой социально-экономической значимости вызываемых ими заболеваний и быстрого развития резистентности к основным антибиотикам, используемым для их эрадикации, однако в резерве еще остается один или несколько эффективных препаратов.
Enterococcus faecium
E. faecium входит в состав нормальной микрофлоры кишечника, но в то же время является условно-патогенным микроорганизмом. У ослабленных больных может вызывать инфекции мочевыводящих путей, раневую инфекцию, сепсис и эндокардит.
Резистентен к аминогликозидам, пенициллинам и цефалоспоринам. Беспокойство вызывает снижение чувствительности к ванкомицину — до 72 % в отдельных популяциях. Большинство штаммов E.
faecium чувствительны к линезолиду, тигециклину, даптомицину.
Staphylococcus aureus
Золотистый стафилококк, колонизирующий кожу и слизистые оболочки, способен вызывать тяжелые инфекции кожи и мягких тканей, респираторные, раневые инфекции, остеомиелит, сепсис, артрит, эндокардит.
Недавнее появление и распространение ванкомицин- и гликопептид-резистентных штаммов в дополнение метициллин-резистентному S.
aureus значительно сужает выбор антибактериальных препаратов, однако у возбудителя сохраняется чувствительность к аминогликозидам, эритромицину, тетрациклину, ко-тримоксазолу, линезолиду.
Neisseria gonorrhoeae
Гонорея из неприятной, но относительно легко излечимой болезни эволюционировала в глобальную медицинскую проблему. Гонококк потерял чувствительность к пенициллинам, тетрациклинам, сульфаниламидам и фторхинолонам.
Особое опасение вызывает появление и постепенное распространение штаммов, резистентных к цефалоспоринам (цефтриаксону), долгое время служивших безотказным средством борьбы с этой инфекцией.
При резистентной к стандартным схемам лечения гонорее рекомендовано использовать комбинацию азитромицина с высокими дозами цефтриаксона.
В России гонококк также практически резистентен к фторхинолонам, но пока сохраняет 100 %-ную чувствительность к цефтриаксону.
Streptococcus pneumoniae
Пневмококки — одни из основных возбудителей инфекций ЛОР-органов, внебольничной пневмонии, менингита. Резистентны к тетрациклину и ко-тримоксазолу. В мире постепенно снижается чувствительность S.
pneumoniae к бета-лактамам и макролидам, однако, как и в других случаях, доля резистентных штаммов сильно варьирует от страны к стране.
В России большинство штаммов пневмококков, к счастью, всё еще чувствительны к пенициллинам и макролидам, также эффективны хлорамфеникол, рифампицин, левофлоксацин, ванкомицин.
Haemophilus influenzae
Гемофильная инфекция у детей младшего возраста протекает в виде бактериемии, гнойного менингита, пневмонии, целлюлита и эпиглоттита, у взрослых — в основном в виде пневмонии.
Тревогу ВОЗ вызывает развитие полной резистентности гемофильной палочки к ранее эффективному ампициллину, в результате чего от него пришлось повсеместно отказаться.
В России эффективны амоксициллин, цефалоспорины и макролиды, однако рекомендуется проводить бактериологический анализ с оценкой резистентности.
Acinetobacter lwoffii лечение — БэбиБлог
Обновлено: 7 июля 2017, 21:03

дизбактериоз или лактозная непереносимость?
Добрый день. ребенок 1,5 месяца КС 4650, 57 см. Проблемы с животиком, сильное бурление понос, когда стала сцеживать первое молоко, с животом стало полегче, но за первый месяц набрали 500 гр. Вздутия нет, срыгиваний нет, но когда ест сучит ножками, через час тянет ноги к животу и кряхтит, плачет. Сдали кал на дизбектериоз
Дисбактериоз кишечника с определением чувствительности к антибиотикам и бактериофагам
в пределах нормы; норма: 10^10 —
10^11
Бифидофлора 1*10^11
Молочнокислые бактерии 1*10^5 снижено; норма: 10^6 — 10^7
E.coli…
Читать далее →
![]()
Пищевая непереносимость и дисбактериоз кишечника.
Анна Николаевна! Добрый день, прошу совета( консультации). Ситуация такая. Я уже пиала ранее про сына( месяцев На Фрисопепе 2-ой месяц, высыпания на коже мелкопапулезно- везикулезного характера( атопический дерматит) 2 месяца, жидкий стул от 2 до 5 раз в сутки зеленого цвета, периодически с непереваренными элементами, мелкими черными вкраплениями, с едким запахом. В анамнезе 3 обструктивных бронхита( один раз лечение антибиотиками, после чего нарушился стул- диаррея месяц, лечение интестифагом, ациполом, энтеролом). 2 недели назад( и-за пробы перевести на Неокейт) резко участился…
Читать далее →
Acinetobacter: инфекция, виды и лечение
Acinetobacter — это тип бактерий, устойчивый ко многим типам антибиотиков.
Обычно присутствует во влажных средах, таких как:
- почвы и грязи
- прудов
- водно-болотных угодий
- сточных вод
- рыбных ферм
- морской воды
Здоровые люди также могут нести бактерии Acinetobacter кожи, особенно если они работают в медицинских учреждениях.Он может долго выживать на сухих поверхностях, что затрудняет его устранение.
Все виды бактерий Acinetobacter могут вызывать инфекции у людей. В этой статье вы узнаете больше о инфекциях Acinetobacter , включая их симптомы, факторы риска и многое другое.
Один тип Acinetobacter под названием Acinetobacter baumannii вызывает большинство инфекций у людей.
Этот тип Acinetobacter может вызывать различные инфекции у людей, в том числе:
Симптомы могут варьироваться в зависимости от типа инфекции, вызываемой бактериями.Люди могут иметь следующие симптомы для каждого типа инфекции.
Инфекция крови:
- лихорадка
- озноб
- рвота
- спутанность сознания
Инфекция мочевых путей:
- частая потребность в мочеиспускании
- боль или ощущение жжения при мочеиспускании
- моча
- моча
- неприятно пахнущая моча
Пневмония:
Инфекция раны:
- покраснение и гной в ране или вокруг нее
- лихорадка
- боль вокруг раны
Симптомы инфекции Ацинто-бактерия где-то между 4 и 40 днями после контакта человека с бактериями, но они обычно появляются примерно через 12 дней.
Acinetobacter не всегда может вызывать симптомы. Человек может также нести бактерии в и на своем теле без каких-либо инфекций.
Существует более 50 видов бактерий Acinetobacter . Acinetobacter baumannii является видом, который вызывает приблизительно 80% зарегистрированных инфекций Acinetobacter у людей.
Acinetobacter calcoaceticus и Acinetobacter lwoffii являются двумя другими типами бактерий, которые обычно вызывают инфекции.
Исследователи обнаружили вышеупомянутые типы Acinetobacter , а также несколько других типов, на овощах, молочных продуктах, мясе, домашнем скоте и коже человека. Этот факт свидетельствует о том, что существует множество способов, с помощью которых люди могут вступать в контакт с бактериями Acinetobacter .
Эти штаммы Acinetobacter имеют сильную устойчивость к антибиотикам.
Поскольку штаммы Acinetobacter часто устойчивы ко многим типам обычно назначаемых антибиотиков, врач решит, какое лечение лучше в каждом конкретном случае.
Врачи проведут тестирование бактерий Acinetobacter , вызывающих инфекцию, в лаборатории. Это позволит им определить, какие антибиотики могут подойти для борьбы с ним.
Врач выберет антибиотик, который эффективно работает против бактерий с учетом любых возможных побочных эффектов. Они также рассмотрят, будут ли антибиотики мешать другим лекарствам, которые принимает человек.
Большинство бактерий Acinetobacter устойчивы практически ко всем типам антибиотиков, включая мощную группу антибиотиков, называемых карбапенемами.
Если у человека этот тип инфекции Acinetobacter , врач может назвать ее устойчивой к карбапенему инфекцией Acinetobacter (CRAB).
Врач может использовать другие методы лечения антибиотиками, такие как бета-лактамные антибиотики или другие антимикробные препараты для лечения инфекции. Исследователи также изучают новые антибиотики, которые могут стать вариантом лечения в будущем.
Соблюдение надлежащей гигиены и тщательная очистка медицинского оборудования и медицинских учреждений могут помочь предотвратить инфекцию Acinetobacter .
Работники здравоохранения и лица, проходящие лечение, могут принять следующие меры предосторожности:
- принимать антибиотики только тогда, когда это необходимо, и именно так, как врач предписывает
- ежедневно чистить больничные помещения и помещения
- тщательно чистить медицинское оборудование и поверхности
- носить халаты и перчатки при лечении человека с инфекцией Acinetobacter
Тщательное мытье рук также очень важно для профилактики инфекции Acinetobacter .Люди должны обязательно очистить руки:
- перед приготовлением или употреблением пищи
- после использования туалета
- перед тем, как дотронуться до рта, носа или глаз
- до и после использования любого медицинского оборудования, особенно трубок и катетеров, которые входят тело
- до и после перевязки ран или смены повязок
- после кашля, чихания или сморкания
- после касания поверхностей в медицинских учреждениях, таких как дверные ручки и тумбочки
- после касания телефонов или пульта дистанционного управления
человек можно мыть руки с мылом и теплой водой или использовать дезинфицирующее средство для рук на спиртовой основе.
Количество и тяжесть инфекций Acinetobacter возросли в связи с использованием медицинского оборудования, такого как вентиляторы и катетеры, а также лечения антибиотиками.
Самый высокий уровень из инфекций Acinetobacter наблюдается в отделениях интенсивной терапии.
Люди, работающие или получающие лечение в медицинских учреждениях, например в больницах, подвергаются наибольшему риску заражения Acinetobacter .
Бактерии Acinetobacter могут долго выживать на поверхностях и оборудовании в медицинских учреждениях.Люди могут передавать бактерии другим через нечистые руки, поверхности или медицинское оборудование.
Определенные факторы также увеличивают риск инфекций Acinetobacter , в том числе:
- ослабленной иммунной системы
- хронических заболеваний легких
- диабет
- с использованием аппарата ИВЛ
- с использованием катетеров
- открытых ран от операции
- интенсивная терапия
- длительное пребывание в стационаре
У людей с хорошим здоровьем очень низкий риск возникновения инфекций Acinetobacter .Однако у людей, которые очень больны, инфекция Acinetobacter может быть опасной для жизни.
Acinetobacter — это вид бактерий, которые присутствуют в окружающей среде и могут жить на коже человека. Если бактерии попадают в организм, это может вызвать инфекцию.
Некоторые виды Acinetobacter вызывают инфекции крови, легких или мочевыводящих путей.
Большинство здоровых людей имеют низкий риск Acinetobacte р инфекций. Однако использование катетеров и вентиляторов может увеличить риск.Люди, которые находятся в реанимации или имеют хронические заболевания, также подвергаются большему риску.
Многие виды Acinetobacter устойчивы к некоторым доступным антибиотикам, поэтому тип лечения будет зависеть от конкретного случая.
Acinetobacter Baumannii — Симптомы и риски
Супербаг Acinetobacter может вызывать такие заболевания, как пневмония и менингит.
Acinetobacter baumannii — это бактерия, которая может вызывать целый ряд заболеваний.
Обычно заражает людей в медицинских учреждениях — врачи называют их «внутрибольничными» инфекциями.
Существует много различных видов Acinetobacter, которые могут вызывать заболевание, но, по данным Центров по контролю и профилактике заболеваний (CDC), на долю A. baumannii приходится около 80 процентов зарегистрированных инфекций Acinetobacter в США.
Acinetobacter Risks
Здоровые люди имеют очень низкий риск заражения A. baumannii, согласно CDC.
Следующие факторы повышают риск заражения:
- Наличие ослабленной иммунной системы
- Хроническое заболевание легких
- Диабет
- Длительное пребывание в стационаре
- Заболевания, требующие использования аппарата искусственной вентиляции легких
- Лечение открытой раны в больнице
- Лечение, требующее инвазивных устройств, таких как мочевые катетеры
Бактерии Acinetobacter не передаются по воздуху, но могут передаваться при непосредственном контакте с поверхностями, объектами или кожей людей, загрязненных A.baumannii.
Acinetobacter Симптомы
Acinetobacter является условно-патогенной бактерией, которая вызывает различные заболевания с различными симптомами.
Типы возможных инфекций A. baumannii включают:
Симптомы инфекций A. baumannii часто клинически неотличимы от симптомов инфекций, вызванных другими условно-патогенными бактериями, такими как Klebsiella pneumoniae и Streptococcus pneumoniae.
Инфекции крови часто изначально вызывают такие симптомы, как жар и озноб, сыпь и спутанность сознания или другие измененные психические состояния, и часто связаны с повышенным уровнем молочной кислоты, который обнаруживается при тяжелом сепсисе.
ИМП, как правило, вызывают различные симптомы мочеиспускания, в том числе боль или ощущение жжения при мочеиспускании, неприятно пахнущая моча, которая может быть мутной или кровянистой, и сильное желание часто мочиться.
Менингит может вызывать ряд гриппоподобных симптомов, включая лихорадку, головную боль, спутанность сознания, чувствительность к яркому свету и тошноту (с рвотой или без нее).
Пневмония может вызывать ряд симптомов, включая, но не ограничиваясь:
- Озноб
- Лихорадка
- Головная боль
- Проблемы с дыханием
- Мышечные боли и боли в груди
- Кашель, иногда с желтой, зеленой или кровянистой слизью
В некоторых случаях A.Baumannii может колонизировать участок, такой как открытая рана или место трахеостомии, не вызывая инфекции или симптомов.
Лечение Acinetobacter и устойчивость к антибиотикам Superbug
CDC считает Acinetobacter, в том числе A. baumannii, серьезной угрозой для общественного здравоохранения, поскольку он часто устойчив к множественным антибиотикам.
На самом деле 63% штаммов Acinetobacter обладают множественной лекарственной устойчивостью, отмечает CDC.
До 1970-х годов инфекцию A. baumannii можно было лечить целым рядом различных антибиотиков, таких как аминогликозиды, β-лактамы и тетрациклины, согласно отчету в журнале Clinical Microbiology Reviews.
Однако сегодня некоторые штаммы A. baumannii устойчивы к большинству антибиотиков, включая антибиотики первого ряда и карбапенемы, которые часто используются только в качестве крайней меры.
Для лечения инфекции A. baumannii обычно требуются тесты на лекарственную чувствительность, которые проверяют наличие антибиотиков, которые все еще эффективны против определенного штамма бактерий.
В некоторых случаях противомикробные препараты сульбактама и полимиксина по-прежнему работают против A. baumannii, когда другие антибиотики не дают результатов.
Минутку …
Пожалуйста, включите Cookies и перезагрузите страницу.
Этот процесс автоматический. Ваш браузер будет перенаправлен на запрошенный контент в ближайшее время.
Пожалуйста, подождите до 5 секунд …
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [ ] + !! [] + !! []) + (+ [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! []) + (+ !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! []) + (! + [] — (!! [])) + (+ [] + (!! [!]) — []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [ ] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []))
+ (( ! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [ ] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! [])) + + !! [] + !! []) + (+ (+ [] + (!! []!)! ! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! [] ) + !! [] + !! []) + (! + [] + (!! []) + !! [+ !! [] + !! [] + !! [] + !!] [] )) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! [ ]) + !! [] + !! []) + (+ [] -! (!! [])) + (+ [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (+ !! []) + (! + [] + (!! []) + !! [ ] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! [])) + (+ [] — (!! [])) + ( ! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (! ! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! [] ) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] +! ! [] + !! []) + (+ [] + (!! [!]) + !! []) + (+ !! []) + (+ [] — (!! [])) )
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + [] ) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + ( ! + [] + (!! []) + !! [] + !! [] + !! []) + (+ [] — (!! [])) + (+ [] + (! ! []) + !! [] + !! []) + (+ [] + (!! []) -! []) + (+ [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [] + !! [ ] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] +! ! []) + (+ !! []) + (+ [] — (!! [])) + (+ [] — (!! [])) + (+ !! []) + ( ! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! [] ) — []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (+ [] — (!! []!)) + (+ [] + (!! []) + !! [] + !! []) + (+ [] + (!! [!]) — []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [ ] + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ [] + (!! [!]) — [ ]) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] — (!! [])) + (+ [] + (!! [!]) + !! [] + !! [] + !! []) + (+ [] — (!! [ ])) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (! ! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] +! ! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (! ! []) + !! [] + !! [] + !! []) + (+ [] -! (!! [])) + (+ [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [ ]) + (! + [] + (!! []) — []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] +! ! [] + !! [] + !! []) + (! + [] — (!! [])) + (! + [] + (!! []) + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + ( ! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (! ! []) + !! [] + !! []) + (+ !! [])) / + ((+ [] + (!! []) — [] + []) + (+! [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! []) + (+ [] + (!! []) — []) + (+ !! []) + (+ !! []) + (! + [] + (!! []) — []) + (! + [] — (!! [])) + (! + [] + (!! []) — []))
,
Последнее обновление: by Sagar Aryal
Лабораторная диагностика
- Диагноз инфекции Acinetobacter ставится по росту Acinetobacter из образца пациента (например, мокроты, крови, спинномозговой жидкости) в обстановке других клинических данных, которые предполагают инфекцию в этом месте.
- Так как колонизация Acinetobacter является распространенным явлением, а лечение трудным и потенциально связано с существенной токсичностью, важное значение имеет различие между колонизацией и инфекцией, при лечении, предназначенном для истинных инфекций.
- В качестве примера, Acinetobacter , выделенный из мокроты вентилируемого пациента, с большей вероятностью представляет колонизацию, чем инфекцию при отсутствии лихорадки, лейкоцитоза, повышенной секреции дыхательных путей, необходимости в дополнительной респираторной поддержке или новых нарушениях при визуализации грудной клетки.
- Для случаев пневмонии количественные или полуколичественные культуры на образцах мокроты также могут быть полезны при различении инфекции и колонизации.
Образцы и коллекция образцов
А.baumannii был выделен из крови, мокроты, кожи, плевральной жидкости и мочи, обычно при инфекциях, связанных с устройством.
Кровь
- Собрать кровь строгой асептической техникой.
- Очистите резиновую пробку флакона для культивирования крови спиртовой салфеткой.
- Инокулировать кровь в сосуды для культивирования крови.
- Маркируйте флаконы для культивирования крови с указанием даты, имени и номера больницы пациента и отправляйте образцы в лабораторию
- Хранить инокулированные флаконы при 37 o C или при комнатной температуре.
Мокрота
- Дайте пациенту стерильный контейнер с завинчивающейся крышкой.
- Попросите пациента сделать глубокий вдох 2–3 раза и выкашлять глубоко из груди.
- Откройте контейнер и выплюните мокроту в бутылку. Избегайте слюны или выделения из носа.
- Закройте контейнер для дальнейшей обработки.
Бронхоальвеолярный лаваж (BAL) и бронхиальные промывания
- Сбор образцов бронхов путем введения переменного объема физиологического раствора через канал бронхоскопа и аспирации в 3–4 аликвотах.
- Соберите аспират в стерильный одноразовый 40-миллилитровый контейнер с красной крышкой или в стерильные флаконы.
- Сбор промываний бронхов путем аспирации небольшого количества закапанного физиологического раствора из крупных дыхательных путей дыхательных путей.
- Храните образцы в одноразовых стерильных емкостях по 40 мл с широким горлышком или, если они от ICU, в стерильных флаконах по 100 мл.
Выполнить окрашивание по Граму
Acinetobacter spp. появляются грамотрицательные и коккобациллы в форме.

Предварительная идентификация Acinetobacter spp. по способу культивирования и размножению образцов культур
- Отберите образцы из собранных пробирок, которые показали грамотрицательные коккобациллы в окраске по Граму.
- Пробы с полосками стерильной одноразовой инокуляционной петлей на питательном агаре, агаре Макконки или на чашках с кровяным агаром
- Инкубируйте инокулированные чашки при 37 ° С в аэробных условиях.
- Морфология колоний на питательном агаре, кровяном агаре и чашках с агаром МакКонки должна быть соблюдена и задокументирована.
- На питательном агаре будут наблюдаться немукоидных, непрозрачных и круглых колоний.
- На кровяном агаре будут обнаружены колоний негемолитического, непрозрачного, круглого и серого цвета.
- На агаре Макконки будут обнаружены нелилактозных, ферментирующих, непрозрачных и круглых колоний.
- Привить биохимические реакции для предварительной идентификации.
- Тест на цитохромоксидазу (отрицательный)
- Маннит-подвижная среда (Маннит неферментированный и немобильный)
- Трехкомпонентный сахарный железный агар (щелочной приклад и наклон; № H 2 S или газ)
- Индольный тест (Отрицательный для индола)
- Тест на использование цитрата (Цитрат положительный)
- Уреазный тест (отрицательный)
- Привить биохимические вещества для идентификации видов.
- Окислительно-ферментативная среда (Окислительная утилизация глюкозы)
- Аргинин-декарбоксилазный тест (положительный)
- Тест на снижение содержания нитратов (отрицательный)
- Интерпретировать результаты на основе положительного и отрицательного контроля.
Лечение
- Хотя карбапенемы являются эффективными антибиотиками для лечения инфекций A. baumannii , показатель устойчивости к карбапенемам А.изоляты baumannii постепенно увеличивались.
- Имипенем или цефтазидим в сочетании с аминогликозидами используется для серьезных инфекций.
- Для лечения MDR A. baumannii имеется только несколько эффективных вариантов антибиотиков. Для борьбы с МЛУ или резистентностью к пандруму (PDR) A. baumannii , которые устойчивы ко всем доступным антибиотикам, комбинированная терапия, включая колистин / имипенем, колистин / меропенем, колистин / рифампицин, колистин / тигециклин, колистин / сульбактам, колистин / тейкопланин и имипенем / сульбактам были тщательно изучены.
Профилактика инфекций
- Acinetobacter может жить на коже и может выживать в окружающей среде в течение нескольких дней, что делает профилактику Acinetobacter baumannii деликатной проблемой.
- Тщательное внимание к процедурам инфекционного контроля, таким как гигиена рук и очистка окружающей среды, может снизить риск передачи инфекции.
- Пациентов помещают в контактную изоляцию, если установлено, что возбудителем является MDR.
Гигиена рук
Гигиена рук — это самая фундаментальная, эффективная и экономически эффективная стратегия снижения перекрестной инфекции и предотвращения распространения устойчивых бактерий.
Меры предосторожности при обращении
- Микробиологическая лаборатория должна своевременно и надежно уведомлять клиницистов при выявлении штамма XDR-GNB.
- Клиницисты могут применять меры предосторожности при контакте, такие как отдельная комната и частичное расстояние не менее 1 м между кроватями для пациентов, инфицированных XDR-GNB, и сократить практику совместного использования устройств.
- Сфигмоманометр, стетоскоп, термометр, инфузионный насос и другие соответствующие устройства должны быть предоставлены специально для пациентов с инфекцией XDR-GNB
Активный скрининг
В отделениях интенсивной терапии и других отделениях с широко распространенными штаммами XDR-GNB пациенты должны проходить скрининг с помощью образцов перианальных и ректальных мазков на CRE, секрецию раны и область носоглотки для неферментаторов XDR, чтобы быстро идентифицировать резистентные бактерии с помощью обычных или быстрых методы диагностики.Пациенты должны быть изолированы надлежащим образом.
Экологическая дезинфекция поверхностей
- Поверхность объектов, с которыми часто сталкиваются медицинские работники и пациенты в больничной среде, должна регулярно и полностью дезинфицироваться.
- Флуоресцентная маркировка или система мониторинга гигиены ATP могут использоваться для контроля эффективности дезинфекции и, таким образом, обеспечения эффективной блокировки передачи устойчивых штаммов.
Деколонизация
Пациенты, колонизированные XDR-GNB, могут иметь губчатую ванну для всего тела с хлоргексидином, которая помогает уменьшить катетерные инфекции кровотока.
Список литературы
- Lee, C.R., Lee, J.H., Park, M., Park, K.S., Bae, I.K., Kim, Y.B., Lee, S.H. (2017). Биология Acinetobacter baumannii: Патогенез, механизмы устойчивости к антибиотикам и возможные варианты лечения.Границы в клеточной и инфекционной микробиологии, 7, 55. doi: 10.3389 / fcimb.2017.00055
- Asif, M., Alvi, I.A. & Rehman, S. U. (2018). Ознакомление с Acinetobacter baumannii : патогенез, глобальная резистентность, механизмы резистентности, варианты лечения и альтернативные методы. Инфекционная и лекарственная устойчивость, 11, 1249–1260. doi: 10.2147 / IDR.S166750
- https://cmr.asm.org/content/30/1/409
- https://www.fda.gov/media/103337/download
- https: // www.uptodate.com/contents/ Acinetobacter -инфекция-эпидемиология-микробиология-патогенез-клиника-особенности-диагностика
- https://bestpractice.bmj.com/topics/en-gb/720
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4585070/
- https://www.sciencedirect.com/science/article/pii/S1198743X15009866
- https://www.sciencedirect.com/topics/immunology-and-microbiology/ Acinetobacter -baumannii
- http: // solutionsdesignedforhealthcare.com / Acinetobacter -Баумания-профилактика
Acinetobacter baumannii- Lab Диагностика, лечение и профилактика
,

 Загрузка…
Загрузка…

 Ацинетобактер (англ. Acinetobacter) — род грамотрицательных споронеобразующих неферментирующих строго аэробных бактерий.
Ацинетобактер (англ. Acinetobacter) — род грамотрицательных споронеобразующих неферментирующих строго аэробных бактерий. Загрузка…
Загрузка…

