Место таргетных синтетических препаратов в лечении ревматических заболеваний: фокус на тофацитиниб
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!
Журнал «Медицинский совет» №2/2020
DOI: 10.21518/2079-701X-2020-2-83-94
Д.Е. Каратеев, ORCID: 0000-0002-2352-4080, е-mail: [email protected], Е.Л. Лучихина, ORCID: 0000-0002-6519-1106, е-mail: [email protected], Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Лечение иммуновоспалительных ревматических заболеваний значительно продвинулось за последние десятилетия в связи с разработкой биологических препаратов, которые, однако, не лишены недостатков. К ним относится иммуногенность, парентеральный путь введения, потенциально недостаточная стабильность состава препарата. Большие надежды возлагаются на относительно новый класс таргетных синтетических иммуномодулирующих препаратов, в настоящее время в ревматологии представленный ингибиторами JAK-киназ (тофацитиниб, барицитиниб, упадацитиниб) и ингибитором фосфодиэстеразы-4 (апремиласт). Наиболее активно развивается группа ингибиторов JAK-киназ, влияющих на один из важнейших сигнальных путей иммунной системы. В это семейство входит 4 субтипа: JAK1, JAK2, JAK3 и тирозин-киназа2 (TYK2). JAK-киназы селективно связаны с цитоплазматическими доменами различных цитокиновых рецепторов, активация которых включает внутриклеточный сигнальный путь JAK-STAT (Signal Transducer and Activator of Transcription). Белки STAT отвечают за передачу сигнала более чем 50 цитокинов, гормонов и факторов роста, регулирующих ключевые процессы, такие как выживание, пролиферация и дифференцировка иммунных клеток. Наибольший опыт практического применения накоплен в отношении тофацитиниба. Этот препарат зарегистрирован в России по нескольким показаниям: ревматоидный артрит, псориатический артрит, псориаз, неспецифический язвенный колит. Исследования III фазы из серии ORAL при ревматоидном артрите и OPAL при псориатическом артрите продемонстрировали высокую эффективность тофацитиниба в различных клинических ситуациях.
Наиболее активно развивается группа ингибиторов JAK-киназ, влияющих на один из важнейших сигнальных путей иммунной системы. В это семейство входит 4 субтипа: JAK1, JAK2, JAK3 и тирозин-киназа2 (TYK2). JAK-киназы селективно связаны с цитоплазматическими доменами различных цитокиновых рецепторов, активация которых включает внутриклеточный сигнальный путь JAK-STAT (Signal Transducer and Activator of Transcription). Белки STAT отвечают за передачу сигнала более чем 50 цитокинов, гормонов и факторов роста, регулирующих ключевые процессы, такие как выживание, пролиферация и дифференцировка иммунных клеток. Наибольший опыт практического применения накоплен в отношении тофацитиниба. Этот препарат зарегистрирован в России по нескольким показаниям: ревматоидный артрит, псориатический артрит, псориаз, неспецифический язвенный колит. Исследования III фазы из серии ORAL при ревматоидном артрите и OPAL при псориатическом артрите продемонстрировали высокую эффективность тофацитиниба в различных клинических ситуациях. В рамках Российского стратегического исследования РЕМАРКА на фоне лечения тофацитинибом наблюдалась очень быстрая положительная динамика показателей активности, 68,8% больных достигли состояния низкой активности или ремиссии к 6-му месяцу наблюдения. Российское открытое многоцентровое наблюдательное исследование тофацитиниба у 101 больного ревматоидным артритом с недостаточной эффективностью базисных и биологических препаратов продемонстрировало достижение низкой активности или ремиссии у 60% больных, а также достоверное улучшение качества жизни при очень низкой частоте отмен из-за нежелательных явлений (менее 2%).
В рамках Российского стратегического исследования РЕМАРКА на фоне лечения тофацитинибом наблюдалась очень быстрая положительная динамика показателей активности, 68,8% больных достигли состояния низкой активности или ремиссии к 6-му месяцу наблюдения. Российское открытое многоцентровое наблюдательное исследование тофацитиниба у 101 больного ревматоидным артритом с недостаточной эффективностью базисных и биологических препаратов продемонстрировало достижение низкой активности или ремиссии у 60% больных, а также достоверное улучшение качества жизни при очень низкой частоте отмен из-за нежелательных явлений (менее 2%).
Для цитирования: Каратеев Д.Е., Лучихина Е.Л. Место таргетных синтетических препаратов в лечении ревматических заболеваний: фокус на тофацитиниб. Медицинский совет. 2020;(2):83–94. https://doi.org/10.21518/2079-701X-2020-2-83-94
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
The role of targeted synthetic drugs in the treatment of rheumatic diseases: focus on tofacitinib
Dmitry E. Karateev, ORCID: 0000-0002-2352-4080, е-mail: [email protected], Elena L. Luchikhina, ORCID: 0000-0002-6519-1106, е-mail: [email protected], Moscow Regional Research and Clinical Institute
The treatment of immuno-inflammatory rheumatic diseases has advanced significantly in recent decades due to development of biological medications, which, however, are not without some weak points. They include immunogenicity, parenteral administration, and potentially insufficient stability of the composition of the drug. Great hopes are related to a relatively new class of targeted synthetic immunomodulatory drugs, currently represented in rheumatology by JAK kinase inhibitors (tofacitinib, baricitinib, upadacitinib) and phosphodiesterase 4 inhibitor (apremilast). The most actively developed group is JAK inhibitors that influence one of the most important signal pathway of immune system. This family includes 4 subtypes: JAK1, JAK2, JAK3 и tyrosine-kinase2 (TYK2). JAK-kinases selectively aggregate with cytoplasmic domains of different cytokine receptors, activation of which includes intracellular signal pathway JAK-STAT (Signal Transducer and Activator of Transcription). STAT proteins are responsible for transduction of the signals from more than 50 cytokines, hormones and growth factors that regulate key processes of survival, proliferation and differentiation of immune cells. The greatest practical experience achieved on tofacitinib. This medication approved in Russia for several indications: rheumatoid arthritis, psoriatic arthritis, psoriasis, ulcerative colitis. Clinical trials of III phase of ORAL series in rheumatoid arthritis and OPAL series in psoriatic arthritis showed high efficacy of Tofacitinib in different clinical situations. In Russian strategic trial REMARKA after treatment with Tofacitinib very fast improvement of the signs of activity was observed, 68,8% patients achieved low disease activity or remission at 6th month of follow-up.
This family includes 4 subtypes: JAK1, JAK2, JAK3 и tyrosine-kinase2 (TYK2). JAK-kinases selectively aggregate with cytoplasmic domains of different cytokine receptors, activation of which includes intracellular signal pathway JAK-STAT (Signal Transducer and Activator of Transcription). STAT proteins are responsible for transduction of the signals from more than 50 cytokines, hormones and growth factors that regulate key processes of survival, proliferation and differentiation of immune cells. The greatest practical experience achieved on tofacitinib. This medication approved in Russia for several indications: rheumatoid arthritis, psoriatic arthritis, psoriasis, ulcerative colitis. Clinical trials of III phase of ORAL series in rheumatoid arthritis and OPAL series in psoriatic arthritis showed high efficacy of Tofacitinib in different clinical situations. In Russian strategic trial REMARKA after treatment with Tofacitinib very fast improvement of the signs of activity was observed, 68,8% patients achieved low disease activity or remission at 6th month of follow-up. Russian open multi-center observational study of Tofacitinib in 101 patients with rheumatoid arthritis and insufficient efficacy of basic and biologic drugs showed achievement of low disease activity or remission in 60% patients, as well as significant improvement of quality of life with a very low frequency of withdrawals due to adverse events (less than 2%).
Russian open multi-center observational study of Tofacitinib in 101 patients with rheumatoid arthritis and insufficient efficacy of basic and biologic drugs showed achievement of low disease activity or remission in 60% patients, as well as significant improvement of quality of life with a very low frequency of withdrawals due to adverse events (less than 2%).
For citation: Karateev D.E., Luchikhina E.L. The role of targeted synthetic drugs in the treatment of rheumatic diseases: focus on tofacitinib. Meditsinskiy sovet = Medical Council. 2020;(2):83–94. (In Russ.) https://doi.org/10.21518/2079-701X-2020-2-83-94
Conflict of interest: the authors declare no conflict of interest.
Список литературы / References
- Smolen J., Aletaha D., Bijlsma J.W.J., et al. Treating rheumatoid arthritis to target: recommendations of an international task force.
 Ann Rheum Dis. 2010;69(4):631-637. https://doi.org/10.1136/ard.2009.123919.
Ann Rheum Dis. 2010;69(4):631-637. https://doi.org/10.1136/ard.2009.123919. - Smolen J.S., Landewé R., Bijlsma J. et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis. 2017;76(6):960-977. https://doi.org/10.1136/annrheumdis-2016-210715.
- Burmester G.R., Bijlsma J.W.J., Cutolo M., McInnes I.B. Managing rheumatic and musculoskeletal diseases — past, present and future. Nat Rev Rheumatol. 2017;13(7):443-448. https://doi.org/10.1038/nrrheum.2017.95.
- Насонов Е.Л., Мазуров В.И., Каратеев Д.Е., Лукина Г.В., Жиляев Е.В., Амирджанова В.Н., Муравьев Ю.В., Чичасова Н.В. Проект рекомендаций по лечению ревматоидного артрита Общероссийской общественной организации «Ассоциация ревматологов России» — 2014 (часть 1). Научно-практическая ревматология. 2014;52(5):477-494. Режим доступа: https://rheumatolog.su/media/media/2018/08/20/npr_1_2014.pdf.
- Smolen J.
 S., Schöls M., Braun J. et al. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international task force. Ann Rheum Dis. 2018;77(1):3- 17. https://doi.org/10.1136/annrheumdis-2017-211734.
S., Schöls M., Braun J. et al. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international task force. Ann Rheum Dis. 2018;77(1):3- 17. https://doi.org/10.1136/annrheumdis-2017-211734. - Каратеев Д.Е., Лучихина Е.Л., Мисиюк А.С. Российский и международный опыт применения ингибитора Янус-киназ при ревматоидном артрите. Медицинский совет. 2017;(10):87-92. https://doi.org/10.21518/2079-701X-2017-10-87-92.
- Pincus T., Yazici Y., van Vollenhoven R. Why are only 50% of courses of anti-tumor necrosis factor agents continued for only 2 years in some set-tings? Need for longterm observations in standard care to complement clinical trials. J Rheumatol. 2006;33(12):2372-2375. Available at: https://www.ncbi.nlm.nih.gov/pubmed/17143975.
- Boers M. Cost-effectiveness of biologics as first-line treatment of rheumatoid arthritis: Case closed? Ann Intern Med. 2009;151(9):668-669.
 https://doi.org/10.1059/0003-4819-151-9-200911030-00013.
https://doi.org/10.1059/0003-4819-151-9-200911030-00013. - Каратеев Д.Е. Факторы, определяющие длительный успех терапии генно-инженерными биологическими препаратами при ревматоидном артрите. Современная ревматология. 2015;9(3):54-60. https://doi.org/10.14412/1996-70122015-3-54-60.
- Wolbink G.J., Aarden L.A., Dijkmans B.A. Dealing with immunogenicity of biologicals: Assessment and clinical relevance. Curr Opin Rheumatol. 2009;21(3):211-215. https://doi.org/10.1097/bor.0b013e328329ed8b.
- Каратеев Д.Е. Вопросы иммуногенности биологических препаратов: теория и практика. Современная ревматология. 2009;3(1):67-72. Режим доступа: https://cyberleninka.ru/article/n/voprosy-immunogennosti-biologicheskih-preparatov-teoriya-i-praktika.
- Kay J. Biosimilars: a regulatory perspective from America. Arthritis Res Ther. 2011;13:112. https://doi.org/10.1186/ar3310.
- Castañeda-Hernández G., Szekanecz Z., Mysler E., Azevedo V.F.
 , Guzman R., Gutierrez M., Rodríguez W., Karateev D. Biopharmaceuticals for rheumatic diseases in Latin America, Europe, Russia, and India: innovators, biosimilars, and intended copies. Joint Bone Spine. 2014;81(6):471-477. https://doi.org/10.1016/j.jbspin.2014.03.019.
, Guzman R., Gutierrez M., Rodríguez W., Karateev D. Biopharmaceuticals for rheumatic diseases in Latin America, Europe, Russia, and India: innovators, biosimilars, and intended copies. Joint Bone Spine. 2014;81(6):471-477. https://doi.org/10.1016/j.jbspin.2014.03.019. - Насонов Е.Л. Биоаналоги в ревматологии. Научно-практическая ревматология. 2016;54(6):628-640. https://doi.org/10.14412/19954484-2016-628-640.
- Schwartz D.M., Kanno Y., Villarino A., Ward M., Gadina M., O’Shea J.J. JAK inhibition as a therapeutic strategy for immune and inflammatory diseases. Nat Rev Drug Discov. 2017;16(12):843- 862. https://doi.org/10.1038/nrd.2017.201.
- Kotyla P.J. Are Janus Kinase Inhibitors Superior over Classic Biologic Agents in RA Patients? Biomed Res Int. 2018;2018:7492904. https://doi.org/10.1155/2018/7492904.
- Yamaoka K. Janus kinase inhibitors for rheumatoid arthritis. Curr Opin Chem Biol. 2016;32:29-33. https://doi.org/10.1016/j. cbpa.2016.
 03.006.
03.006. - Ghoreschi K., Laurence A., O’Shea J. Janus kinases in immune cell signaling. Immunological Reviews. 2009;228(1):273-287. https://doi.org/10.1111/j.1600-065X.2008.00754.x.
- Darnell J.R., Jr. STATS and gene regulation. Science. 1997;277(5332):1630-1635. https://doi.org/10.1126/science.277.5332.1630.
- Malemud C.J. The role of the JAK/STAT signal pathway in rheumatoid arthritis. Ther Adv Musculoskelet Dis. 2018;10(5-6):117-127 https://doi.org/10.1177/1759720X18776224.
- O’Shea J.J., Holland S.M., Staudt L.M. JAKs and STATs in Immunity, Immunodeficiency, and Cancer. The New England journal of medicine. 2013;368(2):161-170. https://doi.org/10.1056/NEJMra1202117.
- Насонов Е.Л., Denisov L.N., Stanislav M.I. Новые аспекты фармакотерапии ревматоидного артрита: ингибиторы малых молекул. Научно¬практическая ревматология. 2012;50(2):66-75. https://doi.org/10.14412/1995-44842012-1276.
- Каратеев Д.Е. Новое направление в патогенетической терапии ревматоидного артрита: первый ингибитор Янус-киназ тофацитиниб.
 Современная ревматология. 2014;8(1):39-44. https://doi.org/10.14412/1996-7012-2014-1-39-44.
Современная ревматология. 2014;8(1):39-44. https://doi.org/10.14412/1996-7012-2014-1-39-44. - Fleischmann R., Kremer J., Cush J., PlaceboControlled Trial of Tofacitinib Monotherapy in Rheumatoid Arthritis. N Engl J Med. 2012; 367:495-507. https://doi.org/10.1056/NEJMoa1109071.
- Meyer S.C., Levine R.L. Molecular pathways: molecular basis for sensitivity and resistance to JAK kinase inhibitors. Clin Cancer Res. 2014;20(8):2051-2059. https://doi.org/10.1158/10780432.CCR-13-0279.
- McLornan D.P., Khan A.A., Harrison C.N. Immunological consequences of JAK inhibition: friend or foe? Curr Hematol Malig Rep. 2015;10(4):370-379. https://doi.org/10.1007/s11899015-0284-z.
- Schwartz D.M., Bonelli M., Gadina M., et al. Type I/II cytokines, JAKs, and new strategies for treating autoimmune diseases. Nat Rev Rheumatol. 2016;12(1):25-36. https://doi.org/10.1038/nrrheum.2015.167.
- Kontzias A., Kotlyar A., Laurence A., et al. Jakinibs: a new class of kinase inhibitors in cancer and autoimmune diseases.
 Curr Opin Pharmacol. 2012;12(4):464-470. https://doi.org/10.1016/j. coph.2012.06.008.
Curr Opin Pharmacol. 2012;12(4):464-470. https://doi.org/10.1016/j. coph.2012.06.008. - Morelli M., Scarponi C., Mercurio L. et al. Selective Immunomodulation of Inflammatory Pathways in Keratinocytes by the Janus Kinase (JAK) Inhibitor Tofacitinib: Implications for the Employment of JAK-Targeting Drugs in Psoriasis. J Immunol Res. 2018;2018:7897263. https://doi.org/10.1155/2018/7897263.
- Goropevšek A., Holcar M., Avčin T. The Role of STAT Signaling Pathways in the Pathogenesis of Systemic Lupus Erythematosus. Clin Rev Allergy Immunol. 2017;52(2):164-181. https://doi.org/10.1007/s12016-016-8550-y.
- Damsky W., King B.A. JAK inhibitors in dermatology: The promise of a new drug class. J Am Acad Dermatol. 2017;76(4):736-744. https://doi.org/10.1016/j.jaad.2016.12.005.
- Pallandre J.R., Brillard E., Créhange G. et al. Role of STAT3 in CD4+CD25+FOXP3+ regulatory lymphocyte generation: implications in graft-versus-host disease and antitumor immunity.
 J Immunol. 2007;179(11):7593- 7604. https://doi.org/10.4049/jimmunol.179.11.7593.
J Immunol. 2007;179(11):7593- 7604. https://doi.org/10.4049/jimmunol.179.11.7593. - Avalle L., Camporeale A., Camperi A., Poli V. STAT3 in cancer: A double edged sword. Cytokine. 2017;98:42-50. https://doi.org/10.1016/j. cyto.2017.03.018.
- Srivastava J., DiGiovanni J. Non-canonical Stat3 signaling in cancer. Mol Carcinog. 2016;55(12):1889-1898. https://doi.org/10.1002/mc.22438.
- Fleischmann R., Kremer J., Cush J. et al; for the ORAL Solo Investigators. Placebo-Controlled Trial of Tofacitinib Monotherapy in Rheumatoid Arthritis. N Engl J Med. 2012;367:495-507. https://doi.org/10.1056/NEJMoa1109071.
- Lee E.B., Fleischmann R., Hall S., Wilkinson B., Bradley J.D., et al; ORAL Start Investigators. Tofacitinib versus methotrexate in rheumatoid arthritis. N Engl J Med. 2014;370(25):2377-2386. https://doi.org/10.1056/NEJMoa1310476.
- Burmester G.R., Blanco R., Charles-Schoeman C., Wollenhaupt J., et al; ORAL Step investigators.
 . Tofacitinib (CP-690,550) in combination with methotrexate in patients with active rheumatoid arthritis with an inadequate response to tumour necrosis factor inhibitors: a randomised phase 3 trial. Lancet. 2013;381(9865):451-460. https://doi.org/10.1016/S0140-6736(12)61424-X.
. Tofacitinib (CP-690,550) in combination with methotrexate in patients with active rheumatoid arthritis with an inadequate response to tumour necrosis factor inhibitors: a randomised phase 3 trial. Lancet. 2013;381(9865):451-460. https://doi.org/10.1016/S0140-6736(12)61424-X. - van Vollenhoven R.F., Fleischmann R., Cohen S., Lee E.B., Meijide J.A.G., Wagner S., et al. Tofacitinib or Adalimumab versus Placebo in Rheumatoid Arthritis. NEJM. 2012;367(6):508- 519. https://doi.org/10.1056/NEJMoa1112072.
- van der Heijde D., Tanaka Y., Fleischmann R. et al; ORAL Scan Investigators. Tofacitinib (CP690,550) in patients with rheumatoid arthritis receiving methotrexate: twelve-month data from a twenty-four-month phase III randomized radiographic study. Arthritis Rheum. 2013;65(3):559- 570. https://doi.org/10.1002/art.37816.
- Fleischmann R., Mease P.J., Schwartzman S., Hwang L.-J., Soma K., Connell C.A., Takiya L., Bananis E. Efficacy of tofacitinib in patients with rheumatoid arthritis stratified by background methotrexate dose group.
 Clin Rheumatol. 2017;36(1):15-24. https://doi.org/10.1007/s10067-016-3436-1.
Clin Rheumatol. 2017;36(1):15-24. https://doi.org/10.1007/s10067-016-3436-1. - Kremer J., Zhan-Guo Li, Hall S., et al. Tofacitinib in Combination With Nonbiologic Disease-Modifying Antirheumatic Drugs in Patients With Active Rheumatoid Arthritis: A Randomized Trial. Ann Intern Med. 2013;159(4):253-261. https://doi.org/10.7326/00034819-159-4-201308200-00006.
- Strand V., Ahadieh S., French J. Systematic review and meta-analysis of serious infections with tofacitinib and biologic diseasemodifying antirheumatic drug treatment in rheumatoid arthritis clinical trials. Arthritis Res Ther. 2015;17:362. https://doi.org/10.1186/s13075015-0880-2.
- Каратеев Д.Е. Ингибиторы киназ при ревматоидном артрите: реальность и перспективы. Медицинский Совет. 2013;(12):90-96. https://doi.org/10.21518/2079-701X-2013-12-90-96.
- Каратеев Д.Е., Лучихина Е.Л., Муравьев Ю.В., Демидова Н.В., Grineva G.I., Новикова Д.С., Александрова Е.Н., Новиков А.А., Смирнов А.
 В., Волков А.В., Avdeyeva A.S., Lopareva E.V., Олюнин Ю.А., Лукина Г.В., Попкова Т.В., Насонов Е.Л. Первое российское стратегическое исследование фармакотерапии ревматоидного артрита (РЕМАРКА). Научно-практическая ревматология. 2013;51(2):117- 125. https://doi.org/10.14412/1995-4484-2013-637.
В., Волков А.В., Avdeyeva A.S., Lopareva E.V., Олюнин Ю.А., Лукина Г.В., Попкова Т.В., Насонов Е.Л. Первое российское стратегическое исследование фармакотерапии ревматоидного артрита (РЕМАРКА). Научно-практическая ревматология. 2013;51(2):117- 125. https://doi.org/10.14412/1995-4484-2013-637. - Насонов Е.Л., Каратеев Д.Е., Сатыбалдыев А.М., Лучихина Е.Л., Лукина Г.В., Николенко М.В., и соавт. Ревматоидный артрит в Российской Федерации по данным Российского регистра больных артритом (сообщение I). Научно-практическая ревматология. 2015;53(5):472- 484. https://doi.org/10.14412/1995-4484-2015-472-484.
- Лучихина Е.Л., Каратеев Д.Е., Демидова Н.В., Мисиюк А.С., Александрова Е.Н., Новиков А.А., Смирнов А.В., Насонов Е.Л. Эффективность и безопасность терапии тофацитинибом у больных активным ревматоидным артритом с резистентностью к стандартной терапии: предварительные результаты открытого клинического исследования. Современная ревматология. 2016;10(2):17-23. https://doi.
 org/10.14412/1996-7012-2016-2-17-23.
org/10.14412/1996-7012-2016-2-17-23. - Каратеев Д.Е., Абдулганиева Д.И., Бабаева А.Р., Баранов А.А., Евстигнеева Л.П., Иванова О.Н., Лукина Г.В., Лучихина Е.Л., Мазуров В.И., Мисиюк А.С., Семагина О.В., Сизиков А.Э., Сороцкая В.Н. Применение тофацитиниба для лечения больных ревматоидным артритом, резистентных к синтетическим и биологическим базисным противовоспалительным препаратам, в реальной клинической практике (результаты многоцентрового наблюдательного исследования). Современная ревматология. 2016;10(3):52-61. https://doi.org/10.14412/1996-7012-2016-3-52-61.
- Каратеев Д.Е., Абдулганиева Д.И., Бабаева А.Р., Баранов А.А., Евстигнеева Л.П., Иванова О.Н., Лукина Г.В., Лучихина Е.Л., Мазуров В.И., Мисиюк А.С., Семагина О.В., Сизиков А.Э., Сороцкая В.Н. Влияние тофацитиниба на показатели функции и качества жизни у больных ревматоидным артритом, резистентных к синтетическим и биологическим базисным противовоспалительным препаратам, в реальной клинической практике (результаты многоцентрового наблюдательного исследования).
 Современная ревматология. 2017;11(1):12-18. https://doi.org/10.14412/19967012-2017-1-12-18.
Современная ревматология. 2017;11(1):12-18. https://doi.org/10.14412/19967012-2017-1-12-18. - Luchikhina L., Karateev D., Borisova M., Loukina G., Demidova N., Nasonov E. Comparative efficacy of tofacitinib and biologic DMARDS in patients with rheumatoid arthritis with insufficient response to subcutaneous methotrexate in clinical practice. Ann Rheum Dis. 2018;77(Suppl 2):A1403. https://doi.org/10.1136/annrheumdis-2018-eular.7306.
- Coates L.C., Kavanaugh A., Mease P.J., Soriano E.R., et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 treatment recommendations for psoriatic arthritis. Arthritis Rheumatol. 2016;68(5):1060-1071. https://doi.org/10.1002/art.39573.
- Kuo C.M., Tung T.H., Wang S.H., Chi C.C. Efficacy and safety of tofacitinib for moderate-tosevere plaque psoriasis: a systematic review and meta-analysis of randomized controlled trials. J Eur Acad Dermatol Venereol. 2018;32(3):355-362. https://doi.org/10.1111/jdv.
 14695.
14695. - Fleming P. Tofacitinib: a new oral Janus kinase inhibitor for psoriasis. Br J Dermatol. 2019;180(1):13-14. https://doi.org/10.1111/bjd.17323.
- Wang T.S., Tsai T.F. Tofacitinib in psoriatic arthritis. Immunotherapy. 2017;9(14):1153- 1163. https://doi.org/10.2217/imt-2017-0087.
- Paik J., Deeks E.D. Tofacitinib: A Review in Psoriatic Arthritis. Drugs. 2019;79(6):655-663. https://doi.org/10.1007/s40265-019-01091-3.
- Mease P., Hall S., Fitzgerald O., van der Heijde D., Merola J.F., Avila-Zapata F., et al. Tofacitinib or adalimumab versus placebo for psoriatic arthritis. N Engl J Med. 2017;377:1537-1550. https://doi.org/10.1056/NEJMoa1615975.
- Gladman D., Rigby W., Azevedo V.F., Behrens F., Blanco R., Kaszuba A., et al. Tofacitinib for psoriatic arthritis in patients with an inadequate response to TNF inhibitors. N Engl J Med. 2017;377:1525- 1536. https://doi.org/10.1056/NEJMoa1615977.
- Strand V., de Vlam K.
 , Covarrubias-Cobos J.A., Mease P.J. et al. Tofacitinib or adalimumab versus placebo: patient-reported outcomes from OPAL Broaden-a phase III study of active psoriatic arthritis in patients with an inadequate response to conventional synthetic disease-modifying antirheumatic drugs. RMD Open. 2019;5(1):e000806. https://doi.org/10.1136/rmdopen-2018-000806.
, Covarrubias-Cobos J.A., Mease P.J. et al. Tofacitinib or adalimumab versus placebo: patient-reported outcomes from OPAL Broaden-a phase III study of active psoriatic arthritis in patients with an inadequate response to conventional synthetic disease-modifying antirheumatic drugs. RMD Open. 2019;5(1):e000806. https://doi.org/10.1136/rmdopen-2018-000806. - Strand V., de Vlam K., Covarrubias-Cobos J.A., Mease P.J. et al. Effect of tofacitinib on patient-reported outcomes in patients with active psoriatic arthritis and an inadequate response to tumour necrosis factor inhibitors in the phase III, randomised controlled trial: OPAL Beyond. RMD Open. 2019;5(1):e000808. https://doi.org/10.1136/rmdopen-2018-000808.
- Nash P., Coates L.C., Fleischmann R., Papp K.A. et al. Efficacy of Tofacitinib for the Treatment of Psoriatic Arthritis: Pooled Analysis of Two Phase 3 Studies. Rheumatol Ther. 2018;5(2):567-582. https://doi.org/10.1007/s40744-018-0131-5.
- Helliwell P.
 , Coates L.C., FitzGerald O., Nash P. et al. Disease-specific composite measures for psoriatic arthritis are highly responsive to a Janus kinase inhibitor treatment that targets multiple domains of disease. Arthritis Res Ther. 2018;20(1):242. https://doi.org/10.1186/s13075-0181739-0.
, Coates L.C., FitzGerald O., Nash P. et al. Disease-specific composite measures for psoriatic arthritis are highly responsive to a Janus kinase inhibitor treatment that targets multiple domains of disease. Arthritis Res Ther. 2018;20(1):242. https://doi.org/10.1186/s13075-0181739-0. - Nash P., Coates L.C., Kivitz A.J., Mease P.J., et al. Safety and Efficacy of Tofacitinib, an Oral Janus Kinase Inhibitor, up to 36 Months in Patients with Active Psoriatic Arthritis: Data from the Second Interim Analysis of OPAL Balance, an Open-Label, Long-Term Extension Study [abstract]. Arthritis Rheumatol. 2017;69(suppl 10). Available at: https://acrabstracts.org/abstract/safety-and-efficacy-oftofacitinib-an-oral-janus-kinase-inhibitor-upto-36-months-in-patients-with-active-psoriatic-arthritis-data-from-the-third-interim-analysis-of-opal-balance-an-open-label-lo.
- Nash P., Coates L., Kivitz A., et al. SAT0293 Safety and efficacy of tofacitinib, an oral janus kinase inhibitor, up to 36 months in patients with active psoriatic arthritis: data from the third interim analysis of opal balance, an open-label, long-term extension study.
 Annals of the Rheumatic Diseases. 2018;77:1010-1011. https://doi.org/10.1136/annrheumdis-2018-eular.3115.
Annals of the Rheumatic Diseases. 2018;77:1010-1011. https://doi.org/10.1136/annrheumdis-2018-eular.3115. - Насонов Е.Л., Лила А.М. Ингибиторы Янускиназ при иммуновоспалительных ревматических заболеваниях: новые возможности и перспективы. Научно-практическая ревматология. 2019;57(1):8-16. https://doi.org/10.14412/1995-4484-2019-8-16.
- Virtanen A.T., Haikarainen T., Raivola J., Silvennoinen O. Selective JAKinibs: Prospects in Inflammatory and Autoimmune Diseases. BioDrugs. 2019;33(1):15-32. https://doi.org/10.1007/s40259-019-00333-w.
Дефицит янус-киназы 3 — Janus kinase 3 deficiency
| Дефицит янус-киназы 3 | |
|---|---|
| Другие имена | Дефицит JAK3 |
Дефицит JAK3 (Janus kinase 3) представляет собой дисфункцию в передаче сигналов рецепторами цитокинов и выработке ими цитокинов.
JAK3 — это тирозиновая протеинкиназа , фермент, кодируемый геном JAK3 . Это киназа, которая активируется только цитокинами, рецепторы которых содержат общую субъединицу гамма-цепи ( IL-2 , IL-4 , IL-7 , IL-9 , IL-15 и IL-21 ). JAK3 участвует в инициировании передачи сигналов для рецепторов цитокинов, потому что они сами по себе не обладают ферментативной активностью. После активации киназа JAK фосфорилирует определенные тирозиновые остатки на субъединицах цитокинового рецептора, которые затем активируют факторы транскрипции STAT . JAK3 помогает регулировать дифференцировку и созревание В-клеток , Т-клеток и NK-клеток .
Это киназа, которая активируется только цитокинами, рецепторы которых содержат общую субъединицу гамма-цепи ( IL-2 , IL-4 , IL-7 , IL-9 , IL-15 и IL-21 ). JAK3 участвует в инициировании передачи сигналов для рецепторов цитокинов, потому что они сами по себе не обладают ферментативной активностью. После активации киназа JAK фосфорилирует определенные тирозиновые остатки на субъединицах цитокинового рецептора, которые затем активируют факторы транскрипции STAT . JAK3 помогает регулировать дифференцировку и созревание В-клеток , Т-клеток и NK-клеток .
Мутации в гене JAK3 могут вызывать дисфункцию киназы, приводящую к аутосомно-тяжелому комбинированному иммунодефициту (SCID), или, наоборот, активация мутировавшего JAK3 может привести к развитию лейкемии . Тирозинкиназа JAK3 мутирует в 10–16% случаев Т-клеточного острого лимфобластного лейкоза (T-ALL).
У пациентов с дефицитом JAK3 отсутствуют необходимые иммунные клетки , а это означает, что у них нет Т-клеток и NK-клеток, но они имеют нормальный уровень, но плохо функционируют В-клетки. Необходимые иммунные клетки обладают сопротивлением и способностью бороться с определенными бактериями , вирусами и грибками . В этом случае пациенты подвержены повторяющимся и стойким инфекциям, которые могут быть очень серьезными или опасными для жизни.
Необходимые иммунные клетки обладают сопротивлением и способностью бороться с определенными бактериями , вирусами и грибками . В этом случае пациенты подвержены повторяющимся и стойким инфекциям, которые могут быть очень серьезными или опасными для жизни.
У пораженных младенцев обычно развивается хроническая диарея , грибковая инфекция во рту, называемая молочницей полости рта (кандидоз) , пневмония и кожная сыпь . Постоянное заболевание также вызывает замедление развития больных. Без лечения люди с JAK3-дефицитным ТКИД обычно доживают до раннего детства.
Диагностика
В suspection генетической мутации после физического осмотра, проверки личной и семейной истории болезни и лабораторных тестов (измерение уровня определенных веществ или биохимический анализ крови и мочи) можно использовать генетическое тестирование в качестве определенного диагноза. Генетическое тестирование выявляет изменения в хромосомах , генах или белках . Однако для некоторых состояний нет специального генетического теста; либо генетическая причина состояния неизвестна, либо тест еще не разработан. В этих случаях для постановки диагноза может использоваться комбинация перечисленных выше подходов.
Однако для некоторых состояний нет специального генетического теста; либо генетическая причина состояния неизвестна, либо тест еще не разработан. В этих случаях для постановки диагноза может использоваться комбинация перечисленных выше подходов.
лечение
Лечением дефицита JAK3 является трансплантация аллогенных гемопоэтических стволовых клеток , которая, как было продемонстрировано, спасает жизнь пострадавшим пациентам.
Другой вариант — генная терапия , которая может стать альтернативным лечением дефицита JAK3. Из-за клинического и биохимического сходства между дефицитом JAK3 и тяжелым комбинированным иммунодефицитом , связанным с Х-хромосомой , генетическая коррекция и приживление аутологичных гемопоэтических стволовых клеток может предполагать восстановление иммунитета у пациентов с дефицитом JAK3.
Смотрите также
использованная литература
дальнейшее чтение
<img src=»//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
Новый метод лечения кожного саркоидоза
Существуют доказательства того, что сигнальный путь JAK-STAT (Янус-киназа – преобразователь сигнала и активатор транскрипции) играет роль в патогенезе саркоидоза.
Авторы этого исследования лечили пациента с кожным саркоидозом при помощи тофацитиниба – ингибитора JAK; пациент ранее не отвечал на терапию другими лекарствами и не получал системные глюкокортикоиды. Это лечение привело к клинической и гистологической ремиссии кожных проявлений заболевания. Секвенирование РНК и иммуногистохимическое исследование образцов кожных поражений, полученных от пациента до и во время терапии, и иммуногистохимическое исследование образцов поражений, полученных от других пациентов с кожным саркоидозом, подтверждают роль сигнального пути JAK-STAT при кожном саркоидозе.
Лечение тофацитинибом (ингибитором JAK1 и JAK3) привело к клинической и гистологической ремиссии кожного заболевания. Прекращение лечения привело к рецидиву заболевания, кожные поражения уменьшились после возобновления лечения, и при продолжающемся лечении наблюдалась стабильная клиническая ремиссия. Лечение не повлияло на легочный саркоидоз пациента.
Несколько исследований показали, что при поражениях саркоидозом происходит активация транскрипции с помощью JAK-STAT, особенно активация STAT1. Это было также обнаружено у пациента в этом исследовании, у которого наблюдалось повышение транскрипции STAT1 в образце поражения кожи до лечения, и это открытие согласуется с ролью, которая приписывается производному Т-лимфоцитов – интерферону-γ – в стимулировании активации макрофагов в гранулемах. Прямое ингибирование пути интерлейкин-6-STAT3, который также участвует в патогенезе саркоидоза, также может играть роль в ответе на терапию тофацитинибом, на основании данных секвенирования РНК. Авторы также обнаружили, что транскрипционная активность не-JAK-STAT-зависимых путей, которые участвуют в патогенезе саркоидоза, включая mTORC1 и TNFα, подавляется тофацитинибом. Кроме того, уровни дополнительных провоспалительных факторов, включая toll-подобные рецепторы, интерлейкин-1β, интерлейкин-12, интерлейкин-18, интерлейкин-27, CXCL9 и CXCL10, которые, по данным предыдущих исследований, активны у пациентов с саркоидозом, были снижены при лечении тофацитинибом. Улучшения в JAK-STAT-зависимых и JAK-STAT-независимых путях и транскриптах позволяют предположить, что нарушение регуляции JAK-STAT-зависимых цитокинов (например, интерферона-γ) патогенно вовлечено в кожный саркоидоз и, вероятно, в саркоидоз в целом.
Это было также обнаружено у пациента в этом исследовании, у которого наблюдалось повышение транскрипции STAT1 в образце поражения кожи до лечения, и это открытие согласуется с ролью, которая приписывается производному Т-лимфоцитов – интерферону-γ – в стимулировании активации макрофагов в гранулемах. Прямое ингибирование пути интерлейкин-6-STAT3, который также участвует в патогенезе саркоидоза, также может играть роль в ответе на терапию тофацитинибом, на основании данных секвенирования РНК. Авторы также обнаружили, что транскрипционная активность не-JAK-STAT-зависимых путей, которые участвуют в патогенезе саркоидоза, включая mTORC1 и TNFα, подавляется тофацитинибом. Кроме того, уровни дополнительных провоспалительных факторов, включая toll-подобные рецепторы, интерлейкин-1β, интерлейкин-12, интерлейкин-18, интерлейкин-27, CXCL9 и CXCL10, которые, по данным предыдущих исследований, активны у пациентов с саркоидозом, были снижены при лечении тофацитинибом. Улучшения в JAK-STAT-зависимых и JAK-STAT-независимых путях и транскриптах позволяют предположить, что нарушение регуляции JAK-STAT-зависимых цитокинов (например, интерферона-γ) патогенно вовлечено в кожный саркоидоз и, вероятно, в саркоидоз в целом.
Источник:
https://www.nejm.org/doi/full/10.1056/NEJMoa1805958#article_references
Damsky, W., Thakral, D., Emeagwali, N., Galan, A., & King, B. (2018). Tofacitinib treatment and molecular analysis of cutaneous sarcoidosis. New England Journal of Medicine, 379(26), 2540-2546. [PMID: 30586518]
Материал подготовлен Эбрагимом Джафарадзе Шейх
Место таргетных синтетических препаратов в лечении ревматических заболеваний: фокус на тофацитиниб | Каратеев
1. Smolen J., Aletaha D., Bijlsma J.W.J., et al. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis. 2010;69(4):631–637. doi: 10.1136/ard.2009.123919.
2. Smolen J.S., Landewé R., Bijlsma J. et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis. 2017;76(6):960–977. doi: 10.1136/annrheumdis-2016-210715.
Ann Rheum Dis. 2017;76(6):960–977. doi: 10.1136/annrheumdis-2016-210715.
3. Burmester G.R., Bijlsma J.W.J., Cutolo M., McInnes I.B. Managing rheumatic and musculoskeletal diseases – past, present and future. Nat Rev Rheumatol. 2017;13(7):443–448. doi: 10.1038/nrrheum.2017.95.
4. Насонов Е.Л., Мазуров В.И., Каратеев Д.Е., Лукина Г.В., Жиляев Е.В., Амирджанова В.Н., Муравьев Ю.В., Чичасова Н.В. Проект рекомендаций по лечению ревматоидного артрита Общероссийской общественной организации «Ассоциация ревматологов России» – 2014 (часть 1). Научно¬ практическая ревматология. 2014;52(5):477–494. Режим доступа: https://rheumatolog.su/media/media/2018/08/20/npr_1_2014.pdf.
5. Smolen J.S., Schöls M., Braun J. et al. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international task force. Ann Rheum Dis. 2018;77(1):3– 17. doi: 10.1136/annrheumdis-2017-211734.
Ann Rheum Dis. 2018;77(1):3– 17. doi: 10.1136/annrheumdis-2017-211734.
6. Каратеев Д.Е., Лучихина Е.Л., Мисиюк А.С. Российский и международный опыт применения ингибитора Янус-киназ при ревматоидном артрите. Медицинский совет. 2017;(10):87–92. doi: 10.21518/2079-701X-2017-10-87-92.
7. Pincus T., Yazici Y., van Vollenhoven R. Why are only 50% of courses of anti-tumor necrosis factor agents continued for only 2 years in some set-tings? Need for longterm observations in standard care to complement clinical trials. J Rheumatol. 2006;33(12):2372–2375. Available at: https://www.ncbi.nlm.nih.gov/pubmed/17143975.
8. Boers M. Cost-effectiveness of biologics as first-line treatment of rheumatoid arthritis: Case closed? Ann Intern Med. 2009;151(9):668–669. doi: 10.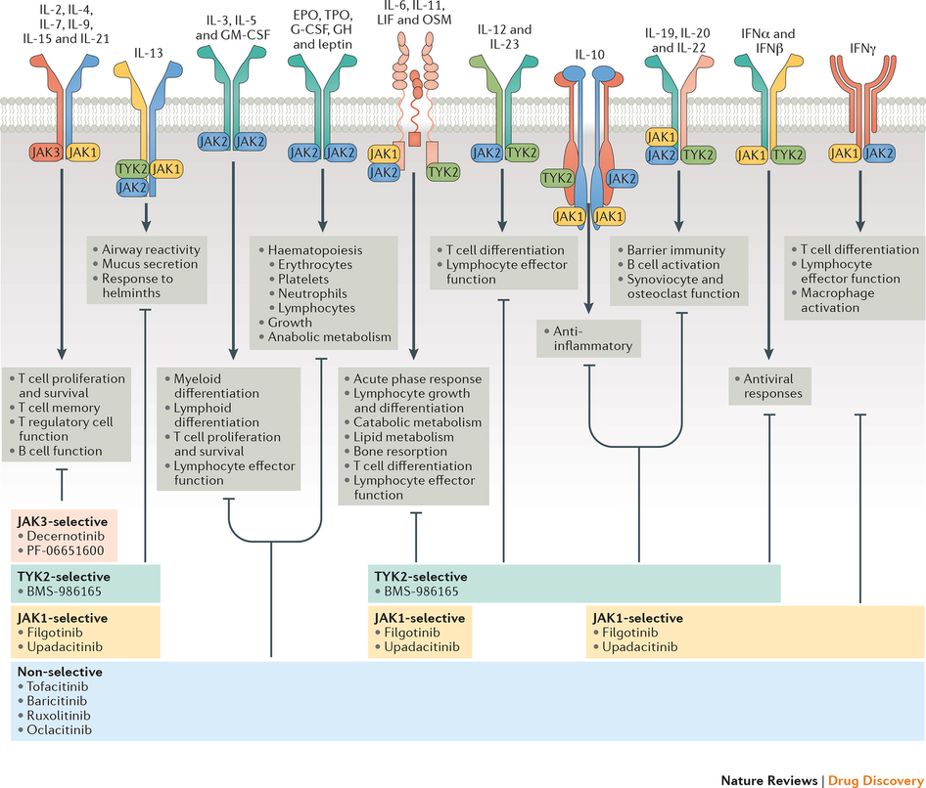 1059/0003-4819-151-9-200911030-00013.
1059/0003-4819-151-9-200911030-00013.
9. Каратеев Д.Е. Факторы, определяющие длительный успех терапии генно-инженерными биологическими препаратами при ревматоидном артрите. Современная ревматология. 2015;9(3):54–60. doi: 10.14412/1996-70122015-3-54-60.
10. Wolbink G.J., Aarden L.A., Dijkmans B.A. Dealing with immunogenicity of biologicals: Assessment and clinical relevance. Curr Opin Rheumatol. 2009;21(3):211–215. doi: 10.1097/bor.0b013e328329ed8b.
11. Каратеев Д.Е. Вопросы иммуногенности биологических препаратов: теория и практика. Современная ревматология. 2009;3(1):67–72. Режим доступа: https://cyberleninka.ru/article/n/voprosy-immunogennosti-biologicheskih-preparatov-teoriya-i-praktika.
12. Kay J. Biosimilars: a regulatory perspective from America. Arthritis Res Ther. 2011;13:112. doi: 10.1186/ar3310.
Kay J. Biosimilars: a regulatory perspective from America. Arthritis Res Ther. 2011;13:112. doi: 10.1186/ar3310.
13. Castañeda-Hernández G., Szekanecz Z., Mysler E., Azevedo V.F., Guzman R., Gutierrez M., Rodríguez W., Karateev D. Biopharmaceuticals for rheumatic diseases in Latin America, Europe, Russia, and India: innovators, biosimilars, and intended copies. Joint Bone Spine. 2014;81(6):471-477. doi: 10.1016/j.jbspin.2014.03.019.
14. Насонов Е.Л. Биоаналоги в ревматологии. Научно¬практическая ревматология. 2016;54(6):628–640. doi: 10.14412/19954484-2016-628-640.
15. Schwartz D.M., Kanno Y., Villarino A., Ward M., Gadina M., O’Shea J.J. JAK inhibition as a therapeutic strategy for immune and inflammatory diseases. Nat Rev Drug Discov. 2017;16(12):843– 862. doi: 10.1038/nrd.2017.201.
doi: 10.1038/nrd.2017.201.
16. Kotyla P.J. Are Janus Kinase Inhibitors Superior over Classic Biologic Agents in RA Patients? Biomed Res Int. 2018;2018:7492904. doi: 10.1155/2018/7492904.
17. Yamaoka K. Janus kinase inhibitors for rheumatoid arthritis. Curr Opin Chem Biol. 2016;32:29–33. doi: 10.1016/j. cbpa.2016.03.006.
18. Ghoreschi K., Laurence A., O’Shea J. Janus kinases in immune cell signaling. Immunological Reviews. 2009;228(1):273–287. doi: 10.1111/j.1600-065X.2008.00754.x.
19. Darnell J.R., Jr. STATS and gene regulation. Science. 1997;277(5332):1630–1635. doi: 10.1126/science.277.5332.1630.
20. Malemud C.J. The role of the JAK/STAT signal pathway in rheumatoid arthritis. Ther Adv Musculoskelet Dis. 2018;10(5–6):117–127 doi: 10.1177/1759720X18776224.
Malemud C.J. The role of the JAK/STAT signal pathway in rheumatoid arthritis. Ther Adv Musculoskelet Dis. 2018;10(5–6):117–127 doi: 10.1177/1759720X18776224.
21. O’Shea J.J., Holland S.M., Staudt L.M. JAKs and STATs in Immunity, Immunodeficiency, and Cancer. The New England journal of medicine. 2013;368(2):161–170. doi: 10.1056/NEJMra1202117.
22. Насонов Е.Л., Denisov L.N., Stanislav M.I. Новые аспекты фармакотерапии ревматоидного артрита: ингибиторы малых молекул. Научно¬практическая ревматология. 2012;50(2):66–75. doi: 10.14412/1995-44842012-1276.
23. Каратеев Д.Е. Новое направление в патогенетической терапии ревматоидного артрита: первый ингибитор Янус-киназ тофацитиниб. Современная ревматология. 2014;8(1):39–44. doi: 10.14412/1996-7012-2014-1-39-44.
24. Fleischmann R., Kremer J., Cush J., PlaceboControlled Trial of Tofacitinib Monotherapy in Rheumatoid Arthritis. N Engl J Med. 2012; 367:495–507. doi: 10.1056/NEJMoa1109071.
25. Meyer S.C., Levine R.L. Molecular pathways: molecular basis for sensitivity and resistance to JAK kinase inhibitors. Clin Cancer Res. 2014;20(8):2051–2059. doi: 10.1158/10780432.CCR-13-0279.
26. McLornan D.P., Khan A.A., Harrison C.N. Immunological consequences of JAK inhibition: friend or foe? Curr Hematol Malig Rep. 2015;10(4):370–379. doi: 10.1007/s11899015-0284-z.
27. Schwartz D.M., Bonelli M., Gadina M., et al. Type I/II cytokines, JAKs, and new strategies for treating autoimmune diseases. Nat Rev Rheumatol. 2016;12(1):25–36. doi: 10.1038/nrrheum.2015.167.
Nat Rev Rheumatol. 2016;12(1):25–36. doi: 10.1038/nrrheum.2015.167.
28. Kontzias A., Kotlyar A., Laurence A., et al. Jakinibs: a new class of kinase inhibitors in cancer and autoimmune diseases. Curr Opin Pharmacol. 2012;12(4):464–470. doi: 10.1016/j. coph.2012.06.008.
29. Morelli M., Scarponi C., Mercurio L. et al. Selective Immunomodulation of Inflammatory Pathways in Keratinocytes by the Janus Kinase (JAK) Inhibitor Tofacitinib: Implications for the Employment of JAK-Targeting Drugs in Psoriasis. J Immunol Res. 2018;2018:7897263. doi: 10.1155/2018/7897263.
30. Goropevšek A., Holcar M., Avčin T. The Role of STAT Signaling Pathways in the Pathogenesis of Systemic Lupus Erythematosus. Clin Rev Allergy Immunol. 2017;52(2):164–181. doi: 10.1007/s12016-016-8550-y.
31. Damsky W., King B.A. JAK inhibitors in dermatology: The promise of a new drug class. J Am Acad Dermatol. 2017;76(4):736–744. doi: 10.1016/j.jaad.2016.12.005.
32. Pallandre J.R., Brillard E., Créhange G. et al. Role of STAT3 in CD4+CD25+FOXP3+ regulatory lymphocyte generation: implications in graft-versus-host disease and antitumor immunity. J Immunol. 2007;179(11):7593– 7604. doi: 10.4049/jimmunol.179.11.7593.
33. Avalle L., Camporeale A., Camperi A., Poli V. STAT3 in cancer: A double edged sword. Cytokine. 2017;98:42–50. doi: 10.1016/j. cyto.2017.03.018.
34. Srivastava J., DiGiovanni J. Non-canonical Stat3 signaling in cancer. Mol Carcinog. 2016;55(12):1889–1898. doi: 10. 1002/mc.22438.
1002/mc.22438.
35. Fleischmann R., Kremer J., Cush J. et al; for the ORAL Solo Investigators. Placebo-Controlled Trial of Tofacitinib Monotherapy in Rheumatoid Arthritis. N Engl J Med. 2012;367:495–507. doi: 10.1056/NEJMoa1109071.
36. Lee E.B., Fleischmann R., Hall S., Wilkinson B., Bradley J.D., et al; ORAL Start Investigators. Tofacitinib versus methotrexate in rheumatoid arthritis. N Engl J Med. 2014;370(25):2377–2386. doi: 10.1056/NEJMoa1310476.
37. Burmester G.R., Blanco R., Charles-Schoeman C., Wollenhaupt J., et al; ORAL Step investigators.. Tofacitinib (CP-690,550) in combination with methotrexate in patients with active rheumatoid arthritis with an inadequate response to tumour necrosis factor inhibitors: a randomised phase 3 trial. Lancet. 2013;381(9865):451–460. doi: 10.1016/S0140-6736(12)61424-X.
doi: 10.1016/S0140-6736(12)61424-X.
38. van Vollenhoven R.F., Fleischmann R., Cohen S., Lee E.B., Meijide J.A.G., Wagner S., et al. Tofacitinib or Adalimumab versus Placebo in Rheumatoid Arthritis. NEJM. 2012;367(6):508– 519. doi: 10.1056/NEJMoa1112072.
39. van der Heijde D., Tanaka Y., Fleischmann R. et al; ORAL Scan Investigators. Tofacitinib (CP690,550) in patients with rheumatoid arthritis receiving methotrexate: twelve-month data from a twenty-four-month phase III randomized radiographic study. Arthritis Rheum. 2013;65(3):559– 570. doi: 10.1002/art.37816.
40. Fleischmann R., Mease P.J., Schwartzman S., Hwang L.-J., Soma K., Connell C.A., Takiya L., Bananis E. Efficacy of tofacitinib in patients with rheumatoid arthritis stratified by background methotrexate dose group. Clin Rheumatol. 2017;36(1):15–24. doi: 10.1007/s10067-016-3436-1.
Clin Rheumatol. 2017;36(1):15–24. doi: 10.1007/s10067-016-3436-1.
41. Kremer J., Zhan-Guo Li, Hall S., et al. Tofacitinib in Combination With Nonbiologic Disease-Modifying Antirheumatic Drugs in Patients With Active Rheumatoid Arthritis: A Randomized Trial. Ann Intern Med. 2013;159(4):253–261. doi: 10.7326/00034819-159-4-201308200-00006.
42. Strand V., Ahadieh S., French J. Systematic review and meta-analysis of serious infections with tofacitinib and biologic diseasemodifying antirheumatic drug treatment in rheumatoid arthritis clinical trials. Arthritis Res Ther. 2015;17:362. doi: 10.1186/s13075015-0880-2.
43. Каратеев Д.Е. Ингибиторы киназ при ревматоидном артрите: реальность и перспективы. Медицинский Совет. 2013;(12):90–96. doi: 10.21518/2079-701X-2013-12-90-96.
44. Каратеев Д.Е., Лучихина Е.Л., Муравьев Ю.В., Демидова Н.В., Grineva G.I., Новикова Д.С., Александрова Е.Н., Новиков А.А., Смирнов А.В., Волков А.В., Avdeyeva A.S., Lopareva E.V., Олюнин Ю.А., Лукина Г.В., Попкова Т.В., Насонов Е.Л. Первое российское стратегическое исследование фармакотерапии ревматоидного артрита (РЕМАРКА). Научно¬ практическая ревматология. 2013;51(2):117– 125. doi: 10.14412/1995-4484-2013-637.
45. Насонов Е.Л., Каратеев Д.Е., Сатыбалдыев А.М., Лучихина Е.Л., Лукина Г.В., Николенко М.В., и соавт. Ревматоидный артрит в Российской Федерации по данным Российского регистра больных артритом (сообщение I). Научно¬ практическая ревматология. 2015;53(5):472– 484. doi: 10.14412/1995-4484-2015-472-484.
46. Лучихина Е.Л., Каратеев Д.Е., Демидова Н. В., Мисиюк А.С., Александрова Е.Н., Новиков А.А., Смирнов А.В., Насонов Е.Л. Эффективность и безопасность терапии тофацитинибом у больных активным ревматоидным артритом с резистентностью к стандартной терапии: предварительные результаты открытого клинического исследования. Современная ревма¬ тология. 2016;10(2):17–23. doi: 10.14412/1996-7012-2016-2-17-23.
В., Мисиюк А.С., Александрова Е.Н., Новиков А.А., Смирнов А.В., Насонов Е.Л. Эффективность и безопасность терапии тофацитинибом у больных активным ревматоидным артритом с резистентностью к стандартной терапии: предварительные результаты открытого клинического исследования. Современная ревма¬ тология. 2016;10(2):17–23. doi: 10.14412/1996-7012-2016-2-17-23.
47. Каратеев Д.Е., Абдулганиева Д.И., Бабаева А.Р., Баранов А.А., Евстигнеева Л.П., Иванова О.Н., Лукина Г.В., Лучихина Е.Л., Мазуров В.И., Мисиюк А.С., Семагина О.В., Сизиков А.Э., Сороцкая В.Н. Применение тофацитиниба для лечения больных ревматоидным артритом, резистентных к синтетическим и биологическим базисным противовоспалительным препаратам, в реальной клинической практике (результаты многоцентрового наблюдательного исследования). Современная ревма¬ тология. 2016;10(3):52–61. doi: 10.14412/1996-7012-2016-3-52-61.
48. Каратеев Д.Е., Абдулганиева Д.И., Бабаева А.Р., Баранов А.А., Евстигнеева Л.П., Иванова О.Н., Лукина Г.В., Лучихина Е.Л., Мазуров В.И., Мисиюк А.С., Семагина О.В., Сизиков А.Э., Сороцкая В.Н. Влияние тофацитиниба на показатели функции и качества жизни у больных ревматоидным артритом, резистентных к синтетическим и биологическим базисным противовоспалительным препаратам, в реальной клинической практике (результаты многоцентрового наблюдательного исследования). Современная ревмато¬ логия. 2017;11(1):12–18. doi: 10.14412/19967012-2017-1-12-18.
Каратеев Д.Е., Абдулганиева Д.И., Бабаева А.Р., Баранов А.А., Евстигнеева Л.П., Иванова О.Н., Лукина Г.В., Лучихина Е.Л., Мазуров В.И., Мисиюк А.С., Семагина О.В., Сизиков А.Э., Сороцкая В.Н. Влияние тофацитиниба на показатели функции и качества жизни у больных ревматоидным артритом, резистентных к синтетическим и биологическим базисным противовоспалительным препаратам, в реальной клинической практике (результаты многоцентрового наблюдательного исследования). Современная ревмато¬ логия. 2017;11(1):12–18. doi: 10.14412/19967012-2017-1-12-18.
49. Luchikhina L., Karateev D., Borisova M., Loukina G., Demidova N., Nasonov E. Comparative efficacy of tofacitinib and biologic DMARDS in patients with rheumatoid arthritis with insufficient response to subcutaneous methotrexate in clinical practice. Ann Rheum Dis. 2018;77(Suppl 2):A1403. doi: 10.1136/annrheumdis-2018-eular.7306.
50. Coates L.C., Kavanaugh A., Mease P.J., Soriano E.R., et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 treatment recommendations for psoriatic arthritis. Arthritis Rheumatol. 2016;68(5):1060–1071. doi: 10.1002/art.39573.
Coates L.C., Kavanaugh A., Mease P.J., Soriano E.R., et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 treatment recommendations for psoriatic arthritis. Arthritis Rheumatol. 2016;68(5):1060–1071. doi: 10.1002/art.39573.
51. Kuo C.M., Tung T.H., Wang S.H., Chi C.C. Efficacy and safety of tofacitinib for moderate-tosevere plaque psoriasis: a systematic review and meta-analysis of randomized controlled trials. J Eur Acad Dermatol Venereol. 2018;32(3):355–362. doi: 10.1111/jdv.14695.
52. Fleming P. Tofacitinib: a new oral Janus kinase inhibitor for psoriasis. Br J Dermatol. 2019;180(1):13–14. doi: 10.1111/bjd.17323.
53. Wang T.S., Tsai T.F. Tofacitinib in psoriatic arthritis. Immunotherapy. 2017;9(14):1153– 1163. doi: 10. 2217/imt-2017-0087.
2217/imt-2017-0087.
54. Paik J., Deeks E.D. Tofacitinib: A Review in Psoriatic Arthritis. Drugs. 2019;79(6):655–663. doi: 10.1007/s40265-019-01091-3.
55. Mease P., Hall S., Fitzgerald O., van der Heijde D., Merola J.F., Avila-Zapata F., et al. Tofacitinib or adalimumab versus placebo for psoriatic arthritis. N Engl J Med. 2017;377:1537–1550. doi: 10.1056/NEJMoa1615975.
56. Gladman D., Rigby W., Azevedo V.F., Behrens F., Blanco R., Kaszuba A., et al. Tofacitinib for psoriatic arthritis in patients with an inadequate response to TNF inhibitors. N Engl J Med. 2017;377:1525– 1536. doi: 10.1056/NEJMoa1615977.
57. Strand V., de Vlam K., Covarrubias-Cobos J.A., Mease P.J. et al. Tofacitinib or adalimumab versus placebo: patient-reported outcomes from OPAL Broaden-a phase III study of active psoriatic arthritis in patients with an inadequate response to conventional synthetic disease-modifying antirheumatic drugs. RMD Open. 2019;5(1):e000806. doi: 10.1136/rmdopen-2018-000806.
RMD Open. 2019;5(1):e000806. doi: 10.1136/rmdopen-2018-000806.
58. Strand V., de Vlam K., Covarrubias-Cobos J.A., Mease P.J. et al. Effect of tofacitinib on patient-reported outcomes in patients with active psoriatic arthritis and an inadequate response to tumour necrosis factor inhibitors in the phase III, randomised controlled trial: OPAL Beyond. RMD Open. 2019;5(1):e000808. doi: 10.1136/rmdopen-2018-000808.
59. Nash P., Coates L.C., Fleischmann R., Papp K.A. et al. Efficacy of Tofacitinib for the Treatment of Psoriatic Arthritis: Pooled Analysis of Two Phase 3 Studies. Rheumatol Ther. 2018;5(2):567–582. doi: 10.1007/s40744-018-0131-5.
60. Helliwell P., Coates L.C., FitzGerald O., Nash P. et al. Disease-specific composite measures for psoriatic arthritis are highly responsive to a Janus kinase inhibitor treatment that targets multiple domains of disease. Arthritis Res Ther. 2018;20(1):242. doi: 10.1186/s13075-0181739-0.
Arthritis Res Ther. 2018;20(1):242. doi: 10.1186/s13075-0181739-0.
61. Nash P., Coates L.C., Kivitz A.J., Mease P.J., et al. Safety and Efficacy of Tofacitinib, an Oral Janus Kinase Inhibitor, up to 36 Months in Patients with Active Psoriatic Arthritis: Data from the Second Interim Analysis of OPAL Balance, an Open-Label, Long-Term Extension Study [abstract]. Arthritis Rheumatol. 2017;69(suppl 10). Available at: https://acrabstracts.org/abstract/safety-and-efficacy-oftofacitinib-an-oral-janus-kinase-inhibitor-upto-36-months-in-patients-with-active-psoriatic-arthritis-data-from-the-third-interim-analysis-of-opal-balance-an-open-label-lo/.
62. Nash P., Coates L., Kivitz A., et al. SAT0293 Safety and efficacy of tofacitinib, an oral janus kinase inhibitor, up to 36 months in patients with active psoriatic arthritis: data from the third interim analysis of opal balance, an open-label, long-term extension study. Annals of the Rheumatic Diseases. 2018;77:1010–1011. doi: 10.1136/annrheumdis-2018-eular.3115.
Annals of the Rheumatic Diseases. 2018;77:1010–1011. doi: 10.1136/annrheumdis-2018-eular.3115.
63. Насонов Е.Л., Лила А.М. Ингибиторы Янускиназ при иммуновоспалительных ревматических заболеваниях: новые возможности и перспективы. Научно¬практическая ревма¬ тология. 2019;57(1):8–16. doi: 10.14412/1995-4484-2019-8-16.
64. Virtanen A.T., Haikarainen T., Raivola J., Silvennoinen O. Selective JAKinibs: Prospects in Inflammatory and Autoimmune Diseases. BioDrugs. 2019;33(1):15–32. doi: 10.1007/s40259-019-00333-w.
Описание УПАДАЦИТИНИБ показания, дозировки, противопоказания активного вещества UPADACITINIB
Имеются данные о развитии тяжелых и иногда смертельных инфекций у пациентов с ревматоидным артритом, принимавших данное лекарственное средство. Наиболее распространенные тяжелые инфекции, которые наблюдались, включали пневмонию и флегмону.
Наиболее распространенные тяжелые инфекции, которые наблюдались, включали пневмонию и флегмону.
Были отмечены такие оппортунистические инфекции, как туберкулез, мультидерматомный опоясывающий лишай, кандидоз ротовой полости/пищевода и криптококкоз.
Не следует применять для лечения пациентов с тяжелыми инфекциями в активной форме, включая локализованные инфекции. Следует учитывать риски и преимущества проведения терапии до начала применения препарата у пациентов с хронической или рецидивирующей инфекцией; находившихся в контакте с пациентом с туберкулезом; с указаниями на тяжелую или оппортунистическую инфекцию в анамнезе; которые проживали или путешествовали в районах с повышенным риском инфицирования туберкулезом или эндемическим микозом; с сопутствующими заболеваниями, увеличивающими риск развития инфекции.
В случае развития у пациента тяжелой или оппортунистической инфекции следует прервать прием препарата. В случае развития у пациента нового инфекционного заболевания во время терапии, необходимо быстро провести полное, подходящее для больных с ослабленным иммунитетом диагностическое обследование и начать соответствующую терапию.
Перед началом терапии следует провести обследование пациентов на предмет наличия туберкулеза. Не следует назначать терапию пациентам с активной формой туберкулеза. При наличии у пациентов ранее не леченной латентной формы туберкулеза перед началом терапии следует рассмотреть применение противотуберкулезной терапии.
Необходимо тщательное наблюдение за пациентами с целью выявления признаков и симптомов туберкулеза, включая пациентов с отрицательным результатом теста на наличие латентной формы туберкулеза до начала терапии.
В клинических исследованиях были отмечены случаи реактивации вирусных инфекций (например, опоясывающего герпеса). Если у пациента развился опоясывающий герпес, следует рассмотреть возможность временного прерывания терапии до разрешения эпизода заболевания.
Перед началом и во время терапии пациентов следует обследовать на предмет наличия вирусного гепатита и, необходимо мониторировать пациентов на предмет реактивации вирусной инфекции в соответствии с клиническими рекомендациями. При обнаружении ДНК гепатита В следует проконсультироваться со специалистом.
При обнаружении ДНК гепатита В следует проконсультироваться со специалистом.
Следует оценить пользу и риск применения препарата перед началом терапии у пациентов с диагностированным злокачественным новообразованием, кроме успешно излеченного немеланоцитарного рака кожи , и перед продолжением терапии у пациентов, злокачественное новообразование у которых развилось в ходе терапии.
У пациентов, получавших лечение были отмечены случаи развития немеланоцитарного рака кожи.
Терапия лекарственным средством сопровождалась увеличением частоты развития нейтропении.
Вклинических исследованиях были отмечены случаи снижения уровня гемоглобина до 8 г/дл и ниже.
Терапия лекарственным средством сопровождалась увеличением концентрации липидов, включая уровень общего холестерина, ЛПНП и ЛПВП. При использовании терапии статинами повышенный уровень ЛПНП снижался до значений, наблюдавшихся до начала лечения.
Терапия лекарственным средством сопровождалась увеличением частоты повышения уровня печеночных ферментов по сравнению с приемом плацебо. Если во время рутинного ведения пациента наблюдается повышение активности АЛТ или ACT, и есть подозрение на медикаментозное поражение печени, следует прервать терапию до тех пор, пока этот диагноз не будет исключен.
Если во время рутинного ведения пациента наблюдается повышение активности АЛТ или ACT, и есть подозрение на медикаментозное поражение печени, следует прервать терапию до тех пор, пока этот диагноз не будет исключен.
Лейкемию вызывает взаимодействие двух генов
Похоже, в понимании процесса развития такого агрессивного рака крови, как острый лимфобластный лейкоз совершен прорыв. Гены, вызывающие рак, и их функции в этом процессе уже были известны в научном мире, однако в новом исследовании было показано, что к развитию лейкемии приводит взаимодействие двух из них.
Острый лимфобластный лейкоз – наиболее часто встречающийся вид рака у детей. И хотя заболевание поддается лечению, серьезное влияние на здоровье как в краткосрочной, так и в долгосрочной перспективе оказывают побочные эффекты химиотерапии.
Исследователи под руководством профессора Яна Коулса решили найти альтернативные способы терапии лейкоза, которые бы не обладали тяжелыми побочными эффектами.
Острый лимфобластный лейкоз вызывают накопившиеся генетические мутаций, которые изменяют поведение развивающихся иммунных клеток, превращая их в агрессивные лейкозные клетки. Недавние исследования показали, что острый лимфобластный лейкоз часто связан с мутациями в определенном генном пути, называемом JAK3/STAT5.
«Мутации JAK3/STAT5 важны для развития лимфобластного лейкоза, так как они стимулируют рост клеток. Однако у пациентов с лейкемией возникают дополнительные мутации генов, и мы обнаружили, что наряду с JAK3/STAT5 часто мутациям подвергается и HOXA9», — говорит профессор Ян Коулз.
В ходе исследовании ученые во главе с Яном Коулсом вывели лабораторных мышей, у которых были смоделированы ассоциированные с раком мутации JAK3/STAT5 и HOXA9.
«Изучая взаимодействие между JAK3/STAT5 и HOXA9, мы заметили, что HOXA9 усиливает действие других генов, что приводит к развитию опухоли. Когда присутствуют обе мутации JAK3/STAT5 и HOXA9, лейкоз развивается быстрее и становится более агрессивным», — отмечает один из авторов исследования Шарль де Бок, сотрудник Левенского центра биологии рака (VIB-KU Leuven Center for Cancer Biology).
Обнаруженная учеными взаимосвязь между двумя генами открывает возможность для создания таргетной терапии не только для лечения острого лимфобластного лейкоза, но и других видов лейкоза, при которых наблюдается взаимодействие JAK3/STAT5 с HOXA9.
Charles E. de Bock, Sofie Demeyer, Sandrine Degryse, Delphine Verbeke, Bram Sweron, Olga Gielen, Roel Vandepoel, Carmen Vicente, Marlies Vanden Bempt, Antonis Dagklis, Ellen Geerdens, Simon Bornschein, Rik Gijsbers, Jean Soulier, Jules P. Meijerink, Merja Heinäniemi, Susanna Teppo, Maria Bouvy-Liivrand, Olli Lohi, Enrico Radaelli, Jan Cools. HOXA9 cooperates with activated JAK/STAT signaling to drive leukemia development.. Cancer Discovery, 2018; CD-17-0583 DOI: 10.1158/2159-8290.CD-17-0583
Ингибиторы янус-киназ: перспективы применения при ревматоидном и псориатическом артрите и других ревматических заболеваниях. Клиническая фармакология и терапия
Генно-инженерные препараты (ГИБП) в настоящее время применяют для лечения ревматоидного артрита (РА) и других
заболеваний преимущественно в случае неэффективности или плохой переносимости стандартных базисных
противовоспалительных препаратов (БПВП). ГИБП представляют собой моноклональные антитела, растворимые рецепторы или
ГИБП представляют собой моноклональные антитела, растворимые рецепторы или
гибридные молекулы, которые блокируют функцию различных цитокинов, таких как фактор некроза опухоли (ФНО)-α,
интерлейкин (ИЛ)-1b, ИЛ-6, ИЛ-17, ИЛ-23, или Т- и В-клеток, играющих ключевую роль в патогенезе ревматических
заболеваний. В последние годы большой интерес у исследователей и разработчиков лекарственных средств вызывает
изучение внутриклеточных сигнальных систем, опосредующих действие цитокинов и факторов роста, которое привело к
появлению нового класса лекарственных препаратов, получивших название таргетных БПВП. Пока к этой группе относят
только ингибиторы янус-киназ, оказывающие действие на внутриклеточную систему JAK/STAT, которая включает в себя
янус-киназы (JAK1, JAK2, JAK3 и тирозинкиназу 2) и белок-трансдуктор и активатор транскрипции (STAT – signal
transducer and activator of transcription) [1-3]. При взаимодействии цитокина с соответствующим рецептором JAK
фосфорилируют белки STAT, которые индуцируют транскрипцию генов, опосредующих действие цитокинов.
В Российской Федерации зарегистрированы два ингибитора янус-киназ – тофацитиниб и барицитиниб, однако в клинических
исследованиях изучается еще около десятка подобных препаратов [4]. Все ингибиторы янус-киназ – это низкомолекулярные
синтетические препараты. В отличие от ГИБП, они предназначены для приема внутрь и не обладают иммуногенностью, т.е.
не вызывают образование антител, которые могут нейтрализовать активность белковых молекул и снизить эффективность
лечения. В ревматологии ингибиторы янус-киназ применяют для лечения РА и псориатического артрита (ПсА), однако в
ближайшем будущем можно ожидать расширения показаний к назначению этих препаратов.
Тактика применения ингибиторов янус-киназ для лечения ревматодного артрита
В рекомендациях Европейской антиревматической лиги (EULAR) 2016 г. лечение РА было предложено начинать с
монотерапии стандартными БПВП, прежде всего метотрексатом, дозу которого следует быстро увеличить до 25-30
мг/нед в случае хорошей переносимости [5]. Если в течение 6 мес не удается добиться низкой активности или
Если в течение 6 мес не удается добиться низкой активности или
ремиссии РА, то при наличии неблагоприятных прогностических факторов (сохраняющаяся высокая активность
заболевания, аутоантитела, ранние эрозии, отсутствие ответа на два БПВП) к терапии целесообразно присоединить
ГИБП или ингибитор янус-киназ. При выборе между последними предпочтение было отдано ГИБП, учитывая больший опыт
их применения в клинической практике.
Недавно были опубликованы обновленные рекомендации EULAR по лечению РА [6]. В целом стратегия лечения этого
заболевания не претерпела особых изменений, в частности препаратом первой линии по-прежнему остается
метотрексат. Тем не менее, изменения коснулись выбора препаратов второй линии. В новой версии рекомендаций
повышена роль ингибиторов янус-киназ, т.е. сегодня при выборе тактики дальнейшей терапии у пациентов, не
ответивших на метотрексат или другие стандартные БПВП, нет оснований отдавать предпочтение именно ГИБП и
рассматривать таргетные БПВП как препараты “резерва». Основанием для пересмотра рекомендаций EULAR послужили
Основанием для пересмотра рекомендаций EULAR послужили
результаты клинических исследований, подтвердивших высокую эффективность и благоприятный профиль безопасности
ингибиторов янус-киназ в лечении РА, а также накопление опыта их применения в клинической практике. Так, к
апрелю 2019 года в мире тофацитиниб получали более 200 000 больных РА.
Программа регистрационных исследований ингибиторов янус-киназ была сходной и предусматривала изучение различных
схем их применения преимущественно у больных РА, у которых лечение стандартными БПВП и/или ГИБП не позволило
достичь необходимого ответа. Эффективность и безопасность тофацитиниба в комбинации со стандартными БПВП
сравнивали с плацебо и/или адалимумабом в 5 исследованиях, в том числе ORAL Scan, ORAL Standard, ORAL Sync, ORAL
Step и ORAL Strategy [7]. Во всех этих исследованиях тофацитиниб оказывал быстрое действие (в течение 2-4
недель), а его присоединение к метотрексату или другим стандартным БПВП по сравнению с плацебо приводило к
значительному увеличению частоты ответа на лечение, улучшению качества жизни и функциональной активности и
задерживало прогрессирование рентгенологических изменений суставов. В рандомизированном исследовании ORAL
В рандомизированном исследовании ORAL
Standard у 717 больных РА, у которых сохранялась умеренная или высокая активность заболевания на фоне терапии
метотрексатом в стабильной дозе, частота ответа по критериям Американской коллегии ревматологов (АКР20) через 6
мес после присоединения тофацитиниба в дозах 5 или 10 мг два раза в день (51,5% и 52,6%, соответственно) почти в
два раза превышала таковую в группе плацебо (28,3%, p<0,001) и была сходной с таковой в группе адалимумаба.
Достоверное превосходство тофацитиниба в обеих дозах над плацебо было подтверждено и при анализе двух других
первичных конечных точек, в том числе динамики счета нетрудоспособности (HAQ-DI) и частоты достижения ремиссии
РА, которую оценивали на основании счета DAS28-4(СОЭ) [8].
Исследование ORAL-Step проводилось по сходному протоколу, однако в него были включены 399 больных РА, не
ответивших на лечение ингибиторами ФНО-α [9]. Через 3 мес после начала лечения частота ответа по критериям АКР20
Через 3 мес после начала лечения частота ответа по критериям АКР20
у больных, получавших тофацитиниб в дозах 5 или 10 мг два раза в сутки в сочетании с метотрексатом, составила
41,7% и 48,1%, соответственно, и достоверно превышала частоту ответа у пациентов, продолжавших прием
метотрексата в комбинации с плацебо (24,4%). Динамика счета HAQ-DI и частота ремиссии РА также были достоверно
выше в обеих группах тофацитиниба.
В целом результатых этих и других исследований в рамках программы ORAL показали, что при недостаточной
эффективности стандартных БПВП присоединение тофацитиниба позволяет значительно уменьшить активность РА, в том
числе у больных, не ответивших на лечение ГИБП.
Сходные результаты были получены при изучении эффективности барицитиниба у пациентов с РА, не ответивших на
лечение стандартными БПВП (исследования RA BEAM и RA BUILD) и/или ГИБП (RA BEACON) [10,11]. В исследовании
В исследовании
RA-BEAM, в которое были включены 1307 больных РА, не отвечавших на метотрексат, через 12 недель частота ответа
по критериям АКР20 при лечении барицитинибом в дозе 4 мг один раз в сутки и метотрексатом (70%) достоверно
превышала таковую при применении метотрексата в сочетании не только с плацебо (40%, p<0,001), но и
адалимумабом (61%, p=0,01). Частота ремиссии РА, которую оценивали на основании счета SDAI через 12 недель, в
группе барицитиниба также была выше, чем в группе плацебо, и сопоставимой с таковой в группе адалимумаба.
Недавно были опубликованы результаты клинических исследований 3 фазы, подтвердивших эффектив ность упадацитиниба
в лечении активного РА у пациентов, не ответивших на стандартные БПВП (исследование SELECT NEXT) или ГИБП
(исследование SELECT BEYOND) [12,13]. В обоих исследованиях комбинированная терапия ингибитором янус-киназ и
стандартным БПВП по эффективности превосходила плацебо в сочетании с БПВП. Например, в исследовании SELECT
Например, в исследовании SELECT
BEYOND через 12 недель частота ответа по критериям АКР20 в группах упадацитиниба в дозах 15 и 30 мг/сут
составила 65% и 56%, соответственно, а в группе плацебо – 28%.
Таким образом, результаты рандомизированных клинических исследований свидетельствуют о том, что у больных РА
умеренной или высокой активности ингибиторы янус-киназ могут рассматриваться как препараты второй и третьей
линии и использоваться при недостаточной эффективности или плохой переносимости как метотрексата или других
стандартных БПВП, так и ГИБП.
Монотерапия ингибиторами янус-киназ при РА
ГИБП и таргетные БПВП рекомендуется применять в сочетании с метотрексатом или другими стандартными БПВП. Однако
результаты различных регистров, которые проводятся в Европе и США, свидетельствуют о том, что около трети
больных РА получают ГИБП в виде монотерапии, что может быть связано с плохой переносимостью БПВП, наличием
противопоказаний к их назначению или сопутствующих заболеваний [1416]. По данным регистра Swiss RA (SCQM-RA), в
По данным регистра Swiss RA (SCQM-RA), в
который были включены более 3000 пациентов с РА, факторами, ассоциировавшимися с назначением монотерапии ГИБП,
были пожилой возраст, сопутствующие заболевания, длительность РА и более высокая его активность, низкий индекс
массы тела, а также опыт применения ГИБП в анамнезе [14]. Сходные данные были получены и в регистре Британского
общества ревматологов [17]. Создается впечатление, что врачи назначают монотерапию ГИБП больным РА, лечение
которых представляет собой более сложную задачу.
Данные наблюдательных исследований, проводившихся в обычной клинической практике, свидетельствуют о том, что от
10 до 77% больных РА прекращают прием метотрексата из-за нежелательных эффектов [18]. Основным фактором риска
развития нежелательных явлений при лечении метотрексатом является низкая скорость клубочковой фильтрации,
которая приводит к снижению клиренса метотрексата и повышению его концентрации в сыворотке. Не все пациенты
Не все пациенты
сообщают врачу о том, что они не принимают метотрексат в комбинации с ГИБП, например, из-за легких нежелательных
явлений или нежелания отказываться от приема алкоголя. По данным исследования, проводившегося в Канаде на
основании анализа аптечных баз данных, около трети больных РА не приобретали выписанные им БПВП, в том числе
метотрексат, в течение 6 мес после назначения ГИБП [19]. С одной стороны, приведенные данные свидетельствуют о
том, что в клинической практике ревматологам следует строже контролировать сделанные назначения, но с другой
стороны, очевидно существование группы больных РА, у которых применение препаратов второй-третьей линии возможно
только в виде монотерапии.
Как тофацитиниб, так и барицитиниб разрешено назначать в виде монотерапии. Эффективность монотерапии
тофацитинибом изучалась в трех исследованиях, в том числе ORAL Strategy, ORAL Start и ORAL Solo. В двойное
слепое, плацебо-контролируемое исследование ORAL Solo были включены 611 больных РА, у которых сохранялась
активность заболевания несмотря на лечение стандартными БПВП или ГИБП [20]. Через 3 мес после начала монотерапии
Через 3 мес после начала монотерапии
тофацитинибом в дозах 5 или 10 мг два раза в сутки частота ответа по критериям АКР20 (59,8% и 65,7%,
соответственно) была достоверно выше, чем в контрольных группах больных, получавших плацебо (26,7%; p<0,001).
Кроме того, лечение тофацитинибом по сравнению с плацебо привело к более значительному снижению счета HAQ-DI и
увеличению частоты достижения низкой активности РА. Через 3 мес частота ремиссии РА достоверно не отличалась
между группами сравнения, однако через 6 мес (после 3 мес всех пациентов групп плацебо переводили на прием
тофацитиниба) она достигла 14,2% в группе тофацитиниба 10 мг.
В исследовании ORAL Strategy у 1146 больных РА, не ответивших на метотрексат, сравнивали эффективность
монотерапии тофацитинибом и комбинированной терапии метотрексатом с тофацитинибом или адалимумабом [21]. В этом
исследовании частота ответа по критериям АКР50 через 6 мес в группе больных, получавших монотерапию
тофацитинибом в дозе 10 мг два раза в сутки, была несколько ниже, чем в группах сравнения (38% против 46% и 44%,
соответственно), хотя разница между ними не достигла статистической значимости.
В исследовании RA BEGIN была сопоставлена эф фективность монотерапии барицитинибом или меторексатом и
комбинированной терапии барицитинибом и метотрексатом у 588 больных РА [22]. Через 24 недели монотерапия
ингибитором янус-киназ по эффективности, которую оценивали на основании частоты ответа по критериям АКР20,
превосходила монотерапию метотрексатом (77% и 62%, соответственно; p<0,01) и вызывала значительное снижение
активности заболе вания и улучшение физической функции, а также задерживала прогрессирование рентгенологических
изменений суставов. Следует отметить, что в это исследование включали первичных пациентов с РА, которые не
получали ранее БПВП. В настоящее время применение ингибиторов янус-киназ, как и ГИБП, в качестве препаратов
линии не рекомендуется.
Эффективность монотерапии упадацитинибом в дозе 15 или 30 мг/сут изучалась в плацебо-контролируемом исследовании
SELECT MONOTHERAPY у 648 больных РА, у которых сохранялась активность болезни несмотря на лечение метотрексатом
[23]. Через 14 недель после начала лечения ингибитором янус-киназ частота ответа по критериям АКР20 (68-71%)
Через 14 недель после начала лечения ингибитором янус-киназ частота ответа по критериям АКР20 (68-71%)
достоверно превышала таковую у пациентов, продолжавших прием метотрексата (41%; p<0,0001). Частота достижения
низкой активности РА при монотерапии упадацитибином также была достоверно выше, чем при лечении метотрексатом
(45-53% против 19%; p<0,0001).
В целом приведенные данные свидетельствуют о том, что монотерапия ингибиторами янус-киназ может проводиться у
пациентов с активным РА, не ответивших на лечение стандартными БПВП или ГИБП, если применение метотрексата или
других БПВП невозможно изза побочных эффектов или противопоказаний. Более того, в рекомендациях EULAR указано,
что монотерапия ингибиторами янус-киназ может иметь преимущества перед монотерапией ГИБП (за исключением
тоцилизумаба) [3].
Исследование ORAL-Shift
У части больных РА применение современных антиревматических препаратов в сочетании со стандартными БПВП
позволяет достичь стойкой ремиссии, что позволяет обсуждать возможность уменьшения интенсивности
иммуносупрессивной терапии. Очевидные достоинства такого подхода включают в себя снижение риска нежелательных
Очевидные достоинства такого подхода включают в себя снижение риска нежелательных
явлений и затрат и улучшение приверженности к терапии [25]. Из экономических соображений эксперты EULAR в таких
случаях рекомендуют отменять ГИБП и продолжать монотерапию стандартными БПВП [4]. Следует отметить, что полная
отмена ГИБП более чем у половины пациентов приводит к развитию обострения РА [25-27], поэтому на первом этапе
можно попытаться снизить дозу препарата или увеличить интервалы между его введениями. Факторы, позволяющие
предсказать сохранение достигнутого ответа на лечение после прекращения введения ГИБП, включают в себя ранний
РА, глубину и длительность ремиссии [28].
Высокая частота рецидивов РА после отмены ГИБП позволяет обсуждать целесообразность альтернативного подхода к
ослаблению интенсивности иммуносупрессивной терапии путем отмены БПВП. Доводом в пользу подобной практики может
служить и тот факт, что ГИБП или таргетные БПВП чаще всего назначают пациентам, у которых стандартные БПВП
оказываются недостаточно эффективными. В рандомизированном исследовании TARA были сопоставлены результаты
В рандомизированном исследовании TARA были сопоставлены результаты
постепенной отмены (в течение 6 мес) стандартных БПВП или ингибиторов ФНО-α у 189 больных РА, у которых была
достигнута ремиссия заболевания на фоне комбинированной терапии двумя препаратами [29]. Полной отмене БПВП
предшествовало последовательное двукратное снижение дозы в два раза под контролем активности РА, в то время как
ингибитор ФНО-α отменяли после увеличения интервала между введениями в два раза и последующего снижения дозы.
Через 1 год кумулятивная частота рецидивов РА (33% и 43% после отмены БПВП и ингибиторов ФНО-α, соответ
ственно) и значения счета DAS, HAQ-DI и EQ-5D достоверно не отличались между группами, хотя обращала на себя
внимание тенденция к увеличению риска развития рецидива после отмены ГИБП по сравнению с БПВП. В отдельных
исследованиях изучали результаты отмены стандартных БПВП у пациентов, получавших их в комбинации с ингибиторами
ФНО-α или ИЛ-6. Например, в исследованиях COMP-ACT и JUST-ACT монотерапия тоцилизумабом после отмены
Например, в исследованиях COMP-ACT и JUST-ACT монотерапия тоцилизумабом после отмены
метотрексата по эффективности не уступала продолжающейся комбинированной терапии тоцилизумабом и метотрексатом у
пациентов с РА, достигших низкой активности заболевания [30,31].
Недавно были опубликованы результаты исследования ORAL Shift, в котором изучалась возможность отмены
метотрексата у больных РА, достигших низкой активности заболевания на фоне комбинированной терапии тофацитинибом
и метотрексатом [32]. В этом исследования применялась новая форма тофацитиниба, которую можно назначать один раз
в день. В фармакокинетическом исследовании установлена биоэквивалентность тофацитиниба модифицированного
высвобождения в дозе 11 мг один раз в день и стандартной формы тофацитиниба в дозе 5 мг два раза в день (рис. 1)
[33]. В открытую 24-недельную фазу исследования были включены 694 больных РА, у которых сохранялась активность
заболевания несмотря на лечение метотрексатом в дозе 15-25 мг/нед в течение по крайней мере 4 мес. Во время
Во время
первой фазы все пациенты получали тофацитиниб модифицированного высвобождения в дозе 11 мг один раз в сутки и
метотрексат. У 533 из 623 больных, продолжавших комбинированную терапию в течение 24 недель, была достигнута
низкая активность РА, которую оценивали на основании счета CDAI (≤10). Во вторую 24-недельную двойную слепую
фазу исследования были включены 533 больных с низкой активностью РА, которых рандомизировали на две группы: у
267 пациентов основной группы метотрексат был заменен на плацебо, т.е. они продолжили монотерапию тофацитинибом,
в то время как у 266 больных группы сравнения во время второй фазы проводилась комбинированная терапия
тофацитинибом и метотрексатом. Первичный анализ эффективности двух схем терапии предполагал сравнение изменений
счета DAS28-4(СОЭ).
Рис. 1. Кривые зависимости концентрации тофацитиниба в
плазмеотвременипослеодногократного (вверху)имногократного (5 дней; внизу) применения тофацитиниба XR и
стандартноготофацитиниба.
Две группы были сопоставимы по демографическим и клиническим показателям. Во время двойной слепой фазы
активность РА в обеих группах оставалась низкой, а достоверной разницы изменения счета DAS28-4(СОЭ) между двумя
группами выявлено не было. Это позволило сделать вывод о том, что монотерапия тофацитинибом после отмены
метотрексата у больных РА, достигших низкой активности заболевания на фоне комбинированной терапии, по
эффективности не уступала продолжению комбинированной терапии. В конце исследования частота ответа по критериям
АКР20 и АКР70 была сходной в группах больных, получавших монотерапию тофацитинибом и комбинированную терапию, в
то время как частота ответа по критериям АКР50 была ниже на фоне монотерапии (55% и 67%, соответственно). У
большинства больных двух групп во время двойной слепой фазы не были зарегистрированы обострения РА (нарастание
счета DAS28-4(СОЭ)≥1,2 по сравнению с таковым перед рандомизацией). Доля больных, у которых отмечались
Доля больных, у которых отмечались
обострения РА, в двух группах была сопоставимой как через 36 недель (16% и 13%, соответственно), так и через 48
недель (14% и 9%).
Рис. 2. Динамика счета DAS28-4(СОЭ) и частота ответа по
критериям АКР при монотерапии тофацитинибом и комбинированной терапии тофацитинибом и метотрексатом у
пациентов с РА, достигших низкой активности заболевания.
Таким образом, первичный и большинство вторичных показателей активности РА оставались стабиль ными после отмены
метотрексата у больных, продолжавших монотерапию тофацитинибом, которая по эффективности не уступала
комбинированной терапии тофацитинибом и метотрексатом. Переносимость двух схем была сопоставимой. Это не было
неожиданным, так как больные, которые плохо переносили тофацитиниб или метотрексат, были исключены из
исследования во время открытой фазы. Результаты исследования ORAL-Shift показали, что у больных РА, достигших
низкой активности заболевания на фоне комбинированной терапии тофацитинибом и метотрексатом, отмена стандартного
БПВП не приводит к ухудшению эффективности лечения. Следует обратить внимание на то, что более чем у 85%
Следует обратить внимание на то, что более чем у 85%
больных, получавших монотерапию ингибитором янус-киназ, не были зарегистрированы обострения РА, частота которых
была сходной с таковой на фоне комбинированной терапии.
Эффективность тофацитиниба в лечении псориатического артрита
Тофацитиниб стал первым ингибитором янус-киназ, зарегистрированным для лечения бляшечного псориаза и ПсА.
Эффективность и безопасность тофацитиниба в дозах 5 и 10 мг два раза в сутки в лечении ПсА изучались в двух
плацебо-контролируемых исследованиях в целом у 710 больных, не ответивших на лечение стандартными БПВП (ORAL
Broaden) или комбинированную терапию БПВП и ингибиторами ФНО-α (ORAL Beyond) [34-36]. В обоих исследованиях
ингибитор янус-киназ применяли в сочетании со стандартными БПВП, чаще всего метотрексатом. В исследовании ORAL
Broaden была выделена также группа больных, которые получали адалимумаб. Через 3 мес частота ответа по критериям
АКР20 в группах тофацитиниба (50,0-53,0%) достоверно превышала таковую в группе плацебо (28,0%) (рис. 3).
3).
Сходные результаты были получены при анализе ответа по критериям АКР50 и АКР70. Кроме того, лечение
тофацитинибом привело к более значительному улучшению функциональной активности больных, которую оценивали на
основании счета HAQ-DI, и снижению числа болезненных и опухших суставов. Преимущество тофацитиниба перед плацебо
было отмечено и при оценке эффективности лечения псориаза (частота улучшения по критериям PASI75), энтезита и
дактилита, а также спондилита (счет BASDAI). В исследовании ORAL Broaden тофацитиниб по эффективности
существенно не отличался от адалимумаба.
Рис. 3. ЧастотаответапокритериямАКРна лечение тофацитинибом у
больных ПсА, не ответивших на стандартные БПВП или ГИБП в исследованиях ORAL Broaden иORAL Beyond.
*p<0,05, **p<0,01, ***p<0,001 по сравнению с плацебо
Перспективы применения ингибиторов янус-киназ при анкилозирующем спондилите
Ингибиторы янус-киназ модулируют активность ИЛ17, ИЛ-21, ИЛ-23 и ФНО-α, которые играют ключевую роль в
патогенезе анкилозирующего спондилита (АС), что открывает перспективы их применения при этом заболевании.
Эффективность тофацитиниба в различных дозах (2, 5 и 10 мг два раза в сутки) в лечении АС изучалась в
плацебо-контролируемом 16-недельном исследовании 2 фазы у 206 больных, не ответивших на нестероидные
противовоспалительные препараты или плохо переносивших эти препараты [37]. По частоте ответа по критериям ASAS20
через 12 недель (первичный показатель эффективности) тофацитиниб в дозе 5 мг два раза в сутки достоверно
превосходил плацебо (80,8% и 41,2%, соответственно, p<0,01). В группах тофацитиниба 2 и 10 мг два раза в
сутки частота ответа по критериям ASAS20 также была выше (51,9% и 55,8%, соответственно), чем в группе плацебо,
однако разница между ними не достигла статистической значимости. Преимущество тофацитиниба перед плацебо было
подтверждено при анализе различных вторичных показателей эффективности, таких как частота ответа по критериям
ASAS40, ASAS5/6, BASDAI50 и др. Лечение тофацитинибом было более эффективным у больных с высоким содержанием
С-реактивного белка. Спектр нежелательных эффектов оказался сходным с таковым при применении тофацитиниба по
Спектр нежелательных эффектов оказался сходным с таковым при применении тофацитиниба по
другим показаниям. Результаты исследования обосновывают дальнейшее изучение эффективности тофацитиниба в лечении
АС в исследованиях 3 фазы.
Заключение
Пероральные ингибиторы янус-киназ, которые представляют собой малые молекулы, не обладающие иммуногенностью, все
чаще применяют как альтернативу ГИБП у больных РА, не отвечающих на лечение метотрексатом или другими БПВП. В
клинических исследованиях эффективность ингибиторов янус-киназ установлена и у больных РА, у которых терапия
ингибиторами ФНО-α не позволила достичь необходимого ответа. Как правило, ингибиторы янус-киназ целесообразно
назначать в комбинации со стандартными БПВП, однако при необходимости, например, при плохой переносимости БПВП
или при наличии противопоказаний к их применению, возможна и монотерапия тофацитинибом или барицитинибом. В
исследовании ORAL Shift у больных РА, достигших низкой активности заболевания в результате терапии тофацитинибом
с метотрексатом, отмена последнего не приводила к ухудшению результатов лечения, в частности повышению частоты
обострений, по сравнению с продолжением комбинированной терапии. Тофацитиниб стал первым ингибитором янус-киназ,
Тофацитиниб стал первым ингибитором янус-киназ,
зарегистрированным для лечения ПсА, псориаза и язвенного колита. В настоящее время изучаются новые показания к
применению препаратов этой группы, в частности в клиническом исследовании 2 фазы была показана эффективность
тофацитиниба у больных АС, что обосновывает дальнейшей изучение его в клинических исследованиях 3 фазы.
Ингибитор Янус-киназы 3 — обзор
Ингибиторы Янус-киназы 3
JAK3 — это тирозинкиназа, необходимая для передачи сигнала от общей γ-цепи цитокиновых рецепторов для IL-2, IL-4, IL-7, IL- 9, IL-15 и IL-21 к ядру. Его экспрессия ограничена иммунными клетками, и эта особенность делает его привлекательной мишенью для новых иммунодепрессантов. Дефицит JAK3 приводит к тяжелому синдрому комбинированного иммунодефицита. 152, 212, 214, 215 Поскольку трансплантация костного мозга является излечивающей для пациентов с тяжелым синдромом комбинированного иммунодефицита, можно сделать вывод, что JAK3 не имеет других важных функций в других системах или органах. 182
182
Было разработано несколько ингибиторов JAK3 — тирфостин AG-490, PNU156804, диметоксихиназолиновые соединения (WHI-P131), CP-690 550 и основание Манниха NC1153. Из исследований клеток острого лимфобластного лейкоза был сделан вывод, что тирфостин AG-490 был селективным ингибитором JAK2, проявляя только стороннюю ингибирующую активность против JAK3. В других линиях Т-клеток AG-490 проявлял специфическую ингибирующую активность против JAK3. 301 У крыс комбинация тирфостина AG-490 и циклоспорина приводила к удлинению сердечных аллотрансплантатов. 19, 125, 126
PNU156804 — антибиотик семейства ундецилпродигиоизина и ингибитор JAK3. 172 В модели трансплантации сердца на крысах он продлевал выживаемость аллотрансплантата и проявлял синергизм с циклоспорином. 70, 233 WHI-P131 изначально разрабатывался как противолейкозный препарат. 252 WHI-P131 предотвращал острую реакцию «трансплантат против хозяина», сохраняя при этом эффект «трансплантат против лейкемии» 284 и предотвращая возникновение диабета у мышей NOD. 43 WHI-P131 нарушает функцию тромбоцитов, и этот эффект не зависит от ингибирования JAK3, что вызывает вопросы селективности этого препарата. 274
43 WHI-P131 нарушает функцию тромбоцитов, и этот эффект не зависит от ингибирования JAK3, что вызывает вопросы селективности этого препарата. 274
CP-690 550 — самый мощный (ингибирующая способность 1 нМ) и селективный ингибитор JAK3 на сегодняшний день. У грызунов и нечеловеческих приматов CP-690 550 оказывал сильное подавление иммунных реакций и увеличивал выживаемость аллотрансплантата сердца и почек. При монотерапии он значительно замедлял наступление отторжения аллотрансплантатов почек. 28, 29, 44, 130 У нечеловеческих приматов CP-690 550 значительно снижал продукцию IFN-γ, усиленную Т-клеточным IL-2, и экспрессию CD25 и CD71, а также подавлял клеточные аллоиммунные ответы in vitro. 44, 192 Введение in vivo приводило к снижению количества естественных клеток-киллеров и Т-клеток, тогда как эффекторные Т-клетки памяти CD8 + не затрагивались. 56, 192 Наиболее частым побочным эффектом CP-690 550 является анемия, связанная с ингибированием JAK2-опосредованной передачи сигналов через рецептор эритропоэтина. Другой возможный пагубный результат вмешательства в передачу сигналов IL-2 связан с тем фактом, что индукция толерантности существенно зависит от пути IL-2. 132, 156, 157 Основание Манниха NC1153 преимущественно ингибировало JAK3, увеличивало выживаемость почечного аллотрансплантата и индуцировало переносимость трансплантации у крыс без токсических эффектов. 243
Другой возможный пагубный результат вмешательства в передачу сигналов IL-2 связан с тем фактом, что индукция толерантности существенно зависит от пути IL-2. 132, 156, 157 Основание Манниха NC1153 преимущественно ингибировало JAK3, увеличивало выживаемость почечного аллотрансплантата и индуцировало переносимость трансплантации у крыс без токсических эффектов. 243
В заключение следует отметить, что специфические ингибиторы JAK3 имеют большие перспективы в качестве новых эффективных иммунодепрессантов с небольшим количеством побочных эффектов.Клинические исследования аутоиммунных заболеваний и трансплантации органов продолжаются.
Идентификация китайских травяных соединений с потенциалом в качестве ингибиторов JAK3
Киназы Януса (JAK) состоят из четырех аналогичных тирозинкиназ и функционируют как ключевые узлы в сигнальных путях, которые участвуют как в врожденном, так и в адаптивном иммунитете. Среди четырех членов JAK3, вероятно, является более привлекательной мишенью для лечения воспалительных заболеваний, поскольку его ингибирование демонстрирует наибольшую иммуносупрессию и наиболее глубокий эффект при лечении таких нарушений. Хотя многие ингибиторы JAK3 уже доступны, были выявлены определенные недостатки, в основном приобретенная лекарственная устойчивость или нежелательные побочные эффекты. Чтобы обнаружить и идентифицировать новых многообещающих ведущих кандидатов, в этом исследовании структура JAK3 (3LXK) была получена из банка данных по белкам и использована для имитационного моделирования и анализа взаимодействия белок-лиганд. ~ 36 000 китайских травяных соединений, полученных из базы данных TCM @ Taiwan, были виртуально проверены программой стыковки AutoDock Vina и отфильтрованы с помощью правил Липинского и виртуальных прогнозов ADME / T.Из-за высокой частоты ложных попаданий во время стыковки мы выбрали 12 фитохимических веществ, которые продемонстрировали модулирующие выражения JAK среди 50 лучших химических веществ по результатам стыковки. Чтобы проверить, способны ли эти соединения непосредственно опосредовать киназу JAK3, мы исследовали ингибирующую активность с использованием анализов ферментативной активности, вестерн-блоттинга и анализов трансактивности клеток HEK 293 STAT5.
Хотя многие ингибиторы JAK3 уже доступны, были выявлены определенные недостатки, в основном приобретенная лекарственная устойчивость или нежелательные побочные эффекты. Чтобы обнаружить и идентифицировать новых многообещающих ведущих кандидатов, в этом исследовании структура JAK3 (3LXK) была получена из банка данных по белкам и использована для имитационного моделирования и анализа взаимодействия белок-лиганд. ~ 36 000 китайских травяных соединений, полученных из базы данных TCM @ Taiwan, были виртуально проверены программой стыковки AutoDock Vina и отфильтрованы с помощью правил Липинского и виртуальных прогнозов ADME / T.Из-за высокой частоты ложных попаданий во время стыковки мы выбрали 12 фитохимических веществ, которые продемонстрировали модулирующие выражения JAK среди 50 лучших химических веществ по результатам стыковки. Чтобы проверить, способны ли эти соединения непосредственно опосредовать киназу JAK3, мы исследовали ингибирующую активность с использованием анализов ферментативной активности, вестерн-блоттинга и анализов трансактивности клеток HEK 293 STAT5. Молекулярный анализ включал моделирование стыковки и молекулярной динамики (МД) с целью изучения структурных конформаций и изучения ключевых аминокислот во взаимодействии между киназой JAK3 и ее предполагаемыми лигандами.Результаты показали, что криптотаншинон, икаритин и индирубин проявляют существенную ингибирующую активность в отношении киназы JAK3 in vitro . Результаты также предоставляют модели связывания белок-лигандного взаимодействия с подробным описанием взаимодействующих аминокислотных остатков в активных АТФ-связывающих доменах киназы JAK3. В заключение, наша работа открыла 3 потенциальных естественных ингибитора киназы JAK3 и может предоставить новые возможности и стимулировать новые идеи для лечения заболеваний, нацеленных на JAK3.
Молекулярный анализ включал моделирование стыковки и молекулярной динамики (МД) с целью изучения структурных конформаций и изучения ключевых аминокислот во взаимодействии между киназой JAK3 и ее предполагаемыми лигандами.Результаты показали, что криптотаншинон, икаритин и индирубин проявляют существенную ингибирующую активность в отношении киназы JAK3 in vitro . Результаты также предоставляют модели связывания белок-лигандного взаимодействия с подробным описанием взаимодействующих аминокислотных остатков в активных АТФ-связывающих доменах киназы JAK3. В заключение, наша работа открыла 3 потенциальных естественных ингибитора киназы JAK3 и может предоставить новые возможности и стимулировать новые идеи для лечения заболеваний, нацеленных на JAK3.
1. Введение
Киназы Януса (JAK) представляют собой семейство из четырех схожих тирозинкиназ (JAK1, JAK2, JAK3 и TYK2), которые функционируют как ключевые узлы в сигнальных путях и рецепторах для цитокинов, участвующих как в врожденных, так и в адаптивных процессах.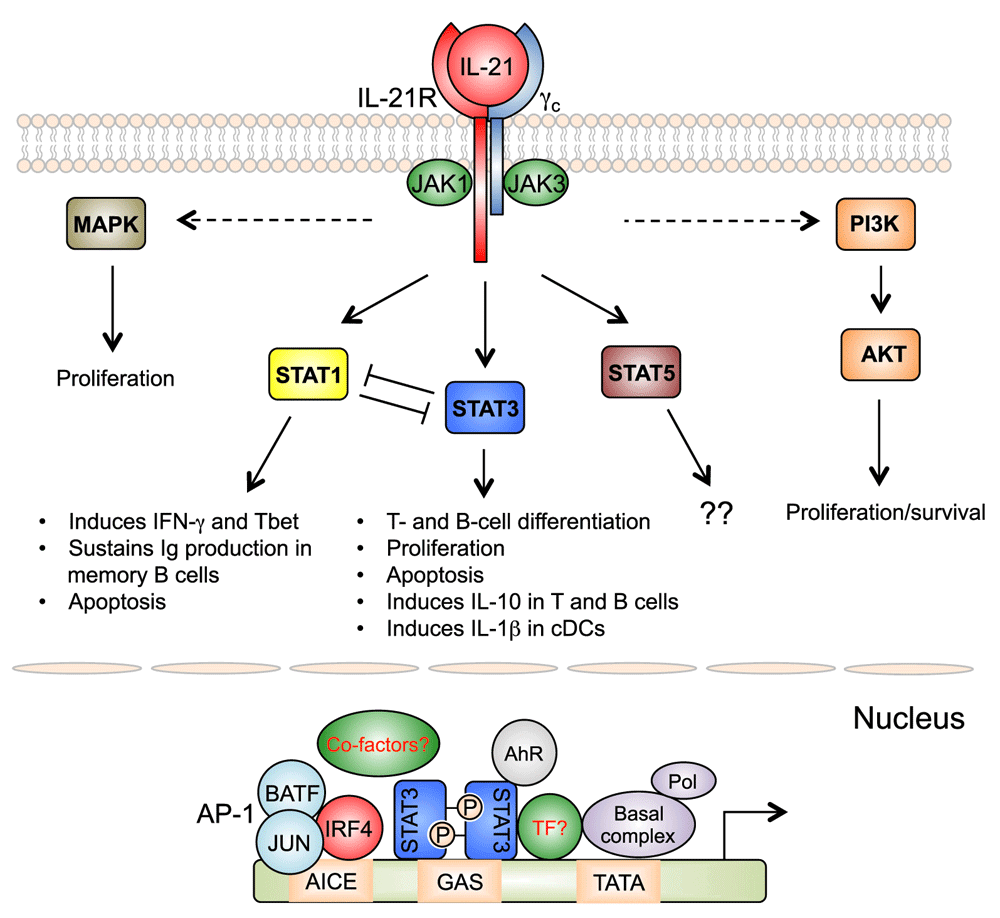 иммунитет [1, 2]. В последние годы JAK были определены как привлекательные терапевтические мишени при воспалительных заболеваниях как в биотехнологии, так и в фармацевтике. Среди четырех членов семейства JAK JAK3, вероятно, является более привлекательной мишенью, поскольку он проявляет наибольшую иммуносупрессию и вызывает наиболее глубокий эффект при лечении воспалительных заболеваний [1, 3].Однако одобренные в настоящее время ингибиторы JAK3 проявляют нежелательные побочные эффекты, включая анемию и нейтропению [4, 5].
иммунитет [1, 2]. В последние годы JAK были определены как привлекательные терапевтические мишени при воспалительных заболеваниях как в биотехнологии, так и в фармацевтике. Среди четырех членов семейства JAK JAK3, вероятно, является более привлекательной мишенью, поскольку он проявляет наибольшую иммуносупрессию и вызывает наиболее глубокий эффект при лечении воспалительных заболеваний [1, 3].Однако одобренные в настоящее время ингибиторы JAK3 проявляют нежелательные побочные эффекты, включая анемию и нейтропению [4, 5].
Составы китайских трав были признаны огромным вкладом в разработку лекарств, поскольку они обычно хорошо переносятся, обладают лучшей биосовместимостью и разнообразием молекулярной структуры и биоактивных субструктур [6].
Таким образом, китайские травяные химические вещества могут быть разработаны как перспективные ведущие кандидаты в ингибиторы против JAK3. Структура JAK3 была получена из банка данных по белкам (код PDB ID: 3LXK) и использовалась для имитационного моделирования и анализа взаимодействия белок-лиганд. ~ 36 000 китайских травяных соединений, полученных из TCM Database @ Taiwan [7], были виртуально проверены док-программой AutoDock Vina [8] и отфильтрованы с помощью правил Липинского [9, 10] и виртуальных предсказаний ADME / T [11].
~ 36 000 китайских травяных соединений, полученных из TCM Database @ Taiwan [7], были виртуально проверены док-программой AutoDock Vina [8] и отфильтрованы с помощью правил Липинского [9, 10] и виртуальных предсказаний ADME / T [11].
Хотя имитация стыковки обычно использовалась при виртуальном скрининге разработки лекарств, результаты стыковки иногда ставились под сомнение из-за большого количества ложных наиболее эффективных попаданий [12, 13]. Сообщается, что отбор кандидатов из проверенных традиционных китайских лекарств может эффективно повысить эффективность разработки лекарств [14].Поэтому, чтобы обнаружить и идентифицировать наиболее потенциальных кандидатов в ингибитор JAK3, мы тщательно оценили и выбрали 12 китайских травяных химикатов среди 50 лучших химических веществ по результатам стыковки. Отобранные 12 фитохимических веществ, которые модулируют экспрессию JAK и, таким образом, являются эффективными при лечении воспалительных заболеваний, были продемонстрированы с помощью вестерн-блоттинга или иммуногистохимических анализов с помощью поиска в Web of Science Core Collection. Эти фитохимические вещества были протестированы на их способность связываться с JAK3 с использованием анализов биологической активности.Впоследствии, на основе результатов анализов биоактивности, были отобраны 3 соединения с наивысшим сродством к JAK3 (IC 50 <100 мк M), и их взаимодействие с киназой JAK3 было исследовано снова путем стыковочного вычисления и оценено с помощью молекулярной динамики. (MD) моделирования, чтобы обеспечить дальнейшее понимание вероятных взаимодействий белок-лиганд JAK3 (12 химических веществ были перечислены в таблице 1).
Эти фитохимические вещества были протестированы на их способность связываться с JAK3 с использованием анализов биологической активности.Впоследствии, на основе результатов анализов биоактивности, были отобраны 3 соединения с наивысшим сродством к JAK3 (IC 50 <100 мк M), и их взаимодействие с киназой JAK3 было исследовано снова путем стыковочного вычисления и оценено с помощью молекулярной динамики. (MD) моделирования, чтобы обеспечить дальнейшее понимание вероятных взаимодействий белок-лиганд JAK3 (12 химических веществ были перечислены в таблице 1).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.
 Материалы и методы
Материалы и методы
2.1. Реагенты и материалы
Двенадцать китайских травяных соединений, модулирующих киназу JAK, были отобраны из результатов первого раунда стыковки и опубликованной литературы, приобретены и протестированы, как подробно описано в таблице 1.
Моноклональные антифосфотирозин-пероксидазные антитела, полученные у мышей (номер каталога A5964), синтетический полипептид поли (Glu, Tyr), натриевая соль, 20-50 кДа (номер по каталогу P0275), глобулин бычьего сывороточного альбумина (BSA) (номер по каталогу A3059), DL-дитиотреитол (номер по каталогу D9779), аденозин-50 гидрат динатриевой соли -трифосфата (АТФ) (№ по каталогу A2383) и ортованадат натрия (Na3VO4) (№ по каталогу S6508) были приобретены у Sigma-Aldrich GmbH, Германия.Киназный домен JAK3 (аминокислоты с 781 по 1124) был приобретен в компании Millipore, UK (номер в каталоге D8EN006U-H). 2- [4- (2-гидроксиэтил) пиперазин-1-ил] этансульфоновая кислота (HEPES) (№ по каталогу L1613) была получена от Biochrom GmbH, Германия. MgCl 2 · 6h3O (№ по каталогу 105833) был приобретен у Merck KGA, Германия. Реагент пероксидазы 3,3 ’, 5,5’-тетраметилбензидина (TMB) (№ по каталогу 555214) был получен от BD Biosciences Europe. Микротитровальные планшеты Nunc MaxiSorp® (№ по каталогу 442404) были получены от Fisher Scientific GmbH, Германия.Плазмиды pGL4.52-luc2P / STAT5RE (№ по каталогу E465A) и pRL-TK (№ по каталогу E2241) и набор для двойного анализа люциферазы (№ по каталогу E1980) были приобретены у Promega, США. Липофектамин 2000 (№ по каталогу 11668019) был получен от Invitrogen, США. Клетки НЕК 293 были приобретены из банка клеток коллекции типовых культур Китайской академии наук. На протяжении всего исследования использовалась сверхчистая вода, полученная с использованием устройства для очистки воды Millipore Synergy UV. Все реагенты были ультрачистой чистоты.
MgCl 2 · 6h3O (№ по каталогу 105833) был приобретен у Merck KGA, Германия. Реагент пероксидазы 3,3 ’, 5,5’-тетраметилбензидина (TMB) (№ по каталогу 555214) был получен от BD Biosciences Europe. Микротитровальные планшеты Nunc MaxiSorp® (№ по каталогу 442404) были получены от Fisher Scientific GmbH, Германия.Плазмиды pGL4.52-luc2P / STAT5RE (№ по каталогу E465A) и pRL-TK (№ по каталогу E2241) и набор для двойного анализа люциферазы (№ по каталогу E1980) были приобретены у Promega, США. Липофектамин 2000 (№ по каталогу 11668019) был получен от Invitrogen, США. Клетки НЕК 293 были приобретены из банка клеток коллекции типовых культур Китайской академии наук. На протяжении всего исследования использовалась сверхчистая вода, полученная с использованием устройства для очистки воды Millipore Synergy UV. Все реагенты были ультрачистой чистоты.
2.2. Анализ ферментативной активности JAK3
Активность киназы определяли с помощью анализа на основе ELISA в соответствии с процедурой, описанной Bauer [27].
Киназный буфер (KB), содержащий 100 мМ HEPES, 10 мМ MgCl 2 , 4 мМ дитиотреитол, 0,1 мМ Na 3 VO 4, и 5 мкМ M АТФ, приготовили в сверхчистой воде. рН доводили до 6,8–6,9 и использовали для приготовления раствора киназы JAK3 с концентрацией 100 нг / мл и для разведения тестируемых соединений.Синтетический полипептид poly (Glu, Tyr) служил субстратом для киназы JAK3. Его растворяли в PBS в концентрации 10 мкл мкг / мл, а затем каждую лунку 96-луночного микропланшета покрывали путем добавления 100 мкл мкл этого рабочего раствора. Планшет герметично закрывали и инкубировали в течение ночи при 4 ° C. В лунки планшета для анализа добавляли 50 мкл л либо чистого KB, либо KB, содержащего киназу JAK3 (100 нг / мл конечной концентрации), либо KB, содержащего киназу JAK3 и тестируемое соединение, с последующей инкубацией при 37 ° C в течение один час.Сто мкл мкл антитела, конъюгированного с фосфотирозин-пероксидазой (разведенного 1:10 000), добавляли в каждую лунку планшета, который инкубировали при 37 ° C в течение дополнительного часа. Наконец, в лунки добавляли реагент субстрата TMB и инкубировали при комнатной температуре в течение 5 мин. Реакцию блокировали добавлением 25 мкл л 1 М серной кислоты. Оптическую плотность (OD) лунок измеряли сразу при 450 нм с помощью считывающего устройства для микропланшетов. Количество фосфорилированного субстрата киназы было пропорционально активности киназы JAK3.CP-690,550 был выбран в качестве положительного контроля. OD самостимуляции (STIM) без ингибиторов указывала на максимальное фосфорилирование, а OD простого KB (NSB) рассматривали как отрицательный контроль. Активность ингибирования рассчитывают по следующему уравнению: ингибирование (%) = 100% × [1 — (-) / (-)].
Наконец, в лунки добавляли реагент субстрата TMB и инкубировали при комнатной температуре в течение 5 мин. Реакцию блокировали добавлением 25 мкл л 1 М серной кислоты. Оптическую плотность (OD) лунок измеряли сразу при 450 нм с помощью считывающего устройства для микропланшетов. Количество фосфорилированного субстрата киназы было пропорционально активности киназы JAK3.CP-690,550 был выбран в качестве положительного контроля. OD самостимуляции (STIM) без ингибиторов указывала на максимальное фосфорилирование, а OD простого KB (NSB) рассматривали как отрицательный контроль. Активность ингибирования рассчитывают по следующему уравнению: ингибирование (%) = 100% × [1 — (-) / (-)].
2.3. Вестерн-блоттинг
Чтобы проверить, способны ли пораженные соединения опосредовать киназу JAK3 в клетках, мы исследовали фосфорилирование JAK3 с помощью вестерн-блоттинга в целлюлозе.
Клетки НЕК 293 высевали в 6-луночные планшеты с плотностью 5 × 10 4 клеток / лунку в 2 мл культуры клеток на лунку. Клетки обрабатывали криптотаншиноном, икаритином и индирубином в концентрациях 25 и 50 мкМ М в течение 1 часа перед стимуляцией 20 нг / мл IL-2 в течение 3 часов и собирали для определения передачи сигналов фосфо-JAK3. Клетки без лекарственной обработки были отобраны и использованы в качестве контрольной группы. Вышеупомянутые анализы были выполнены в трех независимых экспериментах.
Клетки обрабатывали криптотаншиноном, икаритином и индирубином в концентрациях 25 и 50 мкМ М в течение 1 часа перед стимуляцией 20 нг / мл IL-2 в течение 3 часов и собирали для определения передачи сигналов фосфо-JAK3. Клетки без лекарственной обработки были отобраны и использованы в качестве контрольной группы. Вышеупомянутые анализы были выполнены в трех независимых экспериментах.
Клетки всех групп лизировали и общий белок экстрагировали с использованием буфера для лизиса RIPA (Beyotime, Шанхай, Китай) плюс ингибиторы фосфатазы PhosStop (Roche, Индианаполис, Индиана, США) и ингибиторы протеазы Complete Ultra (Roche). Равные количества белка использовали для проведения электрофореза на 12% SDS-полиакриламидном геле и затем переносили на мембраны из поливинилидендифторида (PVDF) (Millipore, Billerica, MA, USA). После блокирования 5% BSA в трис-буферном физиологическом растворе (TBS), содержащем 0.1% Твин-20 в течение 1 ч при комнатной температуре, мембраны инкубировали в течение ночи при 4 ° С с первичными антителами (1: 1000). Первичные антитела, кроличий моноклональный фосфо-JAK3, были приобретены у Cell Signaling Technology (BSN, США). Мембраны трижды промывали трис-буферным солевым раствором Tween-20 (TBST) в течение 5 минут, а затем инкубировали в течение 2 часов при комнатной температуре с вторичным антителом, конъюгированным с пероксидазой хрена (1: 1000; Boster, Wuhan, China). После трех промывок TBST полосы целевых белков были обнаружены с помощью усиления реагентов Pierce ECL Plus (ThermoFisher, Rockford, IL, USA) и подвергнуты рентгеновской пленке (Eastman Kodak, Rochester, NY, USA) для визуализации.GAPDH использовали в качестве внутреннего контроля загрузки для нормализации белка.
Первичные антитела, кроличий моноклональный фосфо-JAK3, были приобретены у Cell Signaling Technology (BSN, США). Мембраны трижды промывали трис-буферным солевым раствором Tween-20 (TBST) в течение 5 минут, а затем инкубировали в течение 2 часов при комнатной температуре с вторичным антителом, конъюгированным с пероксидазой хрена (1: 1000; Boster, Wuhan, China). После трех промывок TBST полосы целевых белков были обнаружены с помощью усиления реагентов Pierce ECL Plus (ThermoFisher, Rockford, IL, USA) и подвергнуты рентгеновской пленке (Eastman Kodak, Rochester, NY, USA) для визуализации.GAPDH использовали в качестве внутреннего контроля загрузки для нормализации белка.
2.4. Активность трансактивации Stat5
Активация JAK может индуцировать конститутивную экспрессию STAT5, которую можно обнаружить во время воспалительной реакции. STAT5 является одним из основных нижестоящих сигнальных белков, индуцируемых активированным JAK3, и играет важную роль в воспалении и выживании клеток. Чтобы исследовать регуляцию STAT5 китайскими растительными соединениями, транскрипционная активность STAT5 была количественно определена с использованием плазмиды pSTAT5-Luc.
Чтобы исследовать регуляцию STAT5 китайскими растительными соединениями, транскрипционная активность STAT5 была количественно определена с использованием плазмиды pSTAT5-Luc.
Клетки HEK 293 временно котрансфицировали плазмидами pGL4.52-luc2P / STAT5RE / Hygro (люцифераза светлячка) и pRL-TK (люцифераза рениллы), последняя действовала как контроль трансфекции [28, 29]. Клетки HEK 293-STAT5-Luc, которые пролиферировали экспоненциально, высевали в лунки 24-луночного планшета в концентрации 5 × 10 4 клеток / лунку. Через 24 часа после трансфекции клетки предварительно инкубировали с соответствующей концентрацией каждого соединения китайских трав в течение 1 часа.Затем клетки в каждой лунке стимулировали 20 нг / мл IL-2 в течение дополнительных 3 часов, после чего добавляли буфер для пассивного лизиса (50 мкл л / лунку). Затем планшет инкубировали в течение 15 мин на платформе для встряхивания. Набор для двойного анализа люциферазы использовали для измерения экспрессии люциферазы с помощью люминометра GloMAX 20/20. Транскрипционная активность соответствовала отношению люминесценции люциферазы светлячка к люминесценции люциферазы renilla.
Транскрипционная активность соответствовала отношению люминесценции люциферазы светлячка к люминесценции люциферазы renilla.
2,5. Компьютерное молекулярное моделирование
Китайские травяные соединения были использованы для изучения их взаимодействия с белком JAK3 в соответствии с методами Рашида [30].
2.5.1. Белковые структуры киназы JAK3
Кристаллическая структура киназы JAK3 (PDB ID: 3LXK) была получена из банка данных по белкам (PDB) (http://www.rcsb.org). Минимизация энергии структуры была использована с использованием силового поля Янтаря и алгоритмов сопряженного градиента, предоставленных в программном обеспечении UCSF Chimera 1.5.6 [31].
2.5.2. Препарат лиганда
В первом раунде моделирования стыковки китайские травяные соединения (~ 40 000) были получены из базы данных TCM на Тайване, предоставленной Dr.Chen’s, и использовали инструменты AutoDock 4.2 для виртуального скрининга на основе структуры JAK3.
Во втором раунде моделирования стыковки были выбраны три китайских растительных соединения, идентифицированные как ингибирующие JAK3, демонстрирующие высокое сродство к JAK3 (IC50 <100 мкМ M), и сравнивались с CP690,550 (2-циано-3- (3,4 -дигидроксифенил) -N- (фенилметил) -2-пропенамид), положительный контроль для исследования лиганд-связывающего взаимодействия доменов JAK3-PTK.
2.5.3. Моделирование стыковки
Моделирование молекулярной стыковки киназы JAK3 было проведено с использованием AutoDock 4.2 и AutoDock Vina (Исследовательский институт Скриппса) в соответствии с опубликованными методами [32, 33]. Ожидалось, что результаты стыковки должны предоставить первичные конформации связывания JAK3 с его лигандами до моделирования МД, после которого будут установлены оптимизированные сайты связывания и взаимодействия. Во-первых, все атомы водорода нужно было добавить либо к белку, либо к лигандам. Однако во время моделирования стыковки используются только полярные координаты водорода. Атомные заряды Гастайгера-Марсили учитываются в AutoDock при расчетах электростатических взаимодействий и энергий десольватации.Во время моделирования стыковки всем вращающимся связям химических лигандов был предоставлен свободный выбор крутильных степеней свободы. При моделировании стыковки предполагались жесткий рецептор и гибкий лиганд. Сетка 60 Å × 60 Å × 60 Å была определена на структуре киназы JAK3, чтобы создать карту сетки.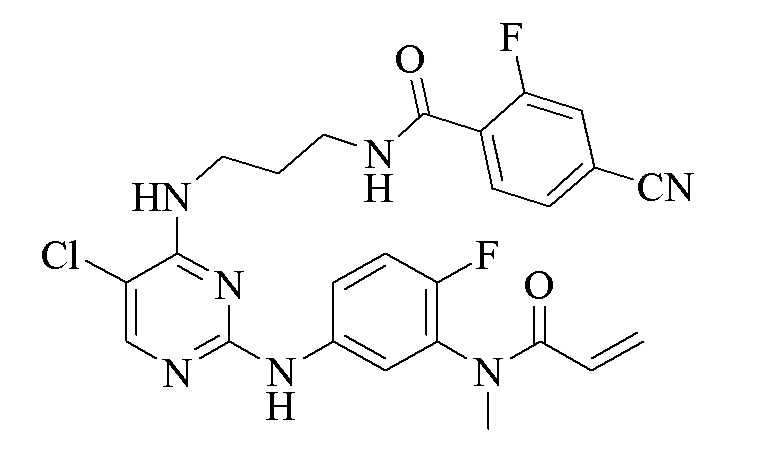 Каждое моделирование стыковки повторялось 100 раз с использованием эмпирической свободной энергии и генетического алгоритма Ламарка со следующими параметрами: популяция составляла 150 случайно выбранных особей, максимум 27000 поколений, частота мутаций 0.02, коэффициент кроссовера 0,80 и оценка энергии 2,5 × 10 6 . Конформация стыкованного комплекса с самой низкой энергией связывания для каждого рецептора была выбрана для дальнейшего МД-анализа. Гидрофобные и электростатические взаимодействия пристыкованных комплексов были картированы с использованием инструментов визуализации Ligplot + [34] и Discovery Studio 3.5 (http://accelrys.com/events/webinars/discovery-studio/index.php).
Каждое моделирование стыковки повторялось 100 раз с использованием эмпирической свободной энергии и генетического алгоритма Ламарка со следующими параметрами: популяция составляла 150 случайно выбранных особей, максимум 27000 поколений, частота мутаций 0.02, коэффициент кроссовера 0,80 и оценка энергии 2,5 × 10 6 . Конформация стыкованного комплекса с самой низкой энергией связывания для каждого рецептора была выбрана для дальнейшего МД-анализа. Гидрофобные и электростатические взаимодействия пристыкованных комплексов были картированы с использованием инструментов визуализации Ligplot + [34] и Discovery Studio 3.5 (http://accelrys.com/events/webinars/discovery-studio/index.php).
2.5.4. Моделирование MD
Моделирование MD было выполнено с использованием Groningen Machine for Chemicals Simulations (GROMACS) 4.6.5 [35] с использованием силового поля GROMOS96 43A1 [36] и модели молекулярной воды SPC / E [37, 38]. Файл топологии и параметры силового поля химических лигандов были получены с помощью программы PRODRG [39]. МД-моделирование было построено в виде куба с размерами 120 Å по каждому краю. Ионы натрия или хлора были добавлены к моделированию МД, чтобы нейтрализовать общий заряд. Алгоритм SHAKE использовался для фиксации длин связей, содержащих атомы водорода [40], и сетки частиц Эвальда (PME), используемой для расчета электростатических взаимодействий на большие расстояния.Перед выполнением МД моделирования минимизация энергии была выполнена с максимальной силой на комплекс не более 1000 кДж / моль Å. Уравновешивание комплексов при постоянной температуре и давлении проводили в течение 1000 пс. Наконец, построенные МД-моделирование проводилось в течение 20 нс при температуре 300 К и давлении 1 атмосфера. Координаты записывались каждые 100 пс.
МД-моделирование было построено в виде куба с размерами 120 Å по каждому краю. Ионы натрия или хлора были добавлены к моделированию МД, чтобы нейтрализовать общий заряд. Алгоритм SHAKE использовался для фиксации длин связей, содержащих атомы водорода [40], и сетки частиц Эвальда (PME), используемой для расчета электростатических взаимодействий на большие расстояния.Перед выполнением МД моделирования минимизация энергии была выполнена с максимальной силой на комплекс не более 1000 кДж / моль Å. Уравновешивание комплексов при постоянной температуре и давлении проводили в течение 1000 пс. Наконец, построенные МД-моделирование проводилось в течение 20 нс при температуре 300 К и давлении 1 атмосфера. Координаты записывались каждые 100 пс.
После проведения моделирования MD конформации, траектории и поведение каждого моделирования были проанализированы с помощью VMD [41], PyMol (http: // www.pymol.org) [42] и программное обеспечение GROMACS.
2.5.5. Статистический анализ
Статистический анализ выполнялся с использованием GraphPad Prism Version 5. 01. Данные выражены как среднее значение ± стандартная ошибка среднего (SEM). Достоверность различий между группами оценивали с помощью одностороннего дисперсионного анализа с поправкой на повторные измерения с помощью множественных сравнительных тестов Даннета.
01. Данные выражены как среднее значение ± стандартная ошибка среднего (SEM). Достоверность различий между группами оценивали с помощью одностороннего дисперсионного анализа с поправкой на повторные измерения с помощью множественных сравнительных тестов Даннета.
3. Результаты
3.1. Анализ ферментативной активности JAK3
На основании результатов первого раунда стыковки и опубликованных в литературе эффектов китайских травяных соединений на путь JAKs / STATs, мы выбрали и исследовали влияние 12 соединений на активность фосфорилирования JAK3.Среди них 3 соединения, криптотаншинон, икаритин и индирубин, продемонстрировали значительное снижение активности JAK3 (IC 50 <100 μ M). Результаты 3 природных соединений, показывающих наивысшее сродство, показаны на рис. 1 и S2.
3.2. Анализ ферментативной активности JAK3
Три хитовых соединения, криптотаншинон, икаритин и индирубин, продемонстрировали прямое ингибирующее действие на активность фермента.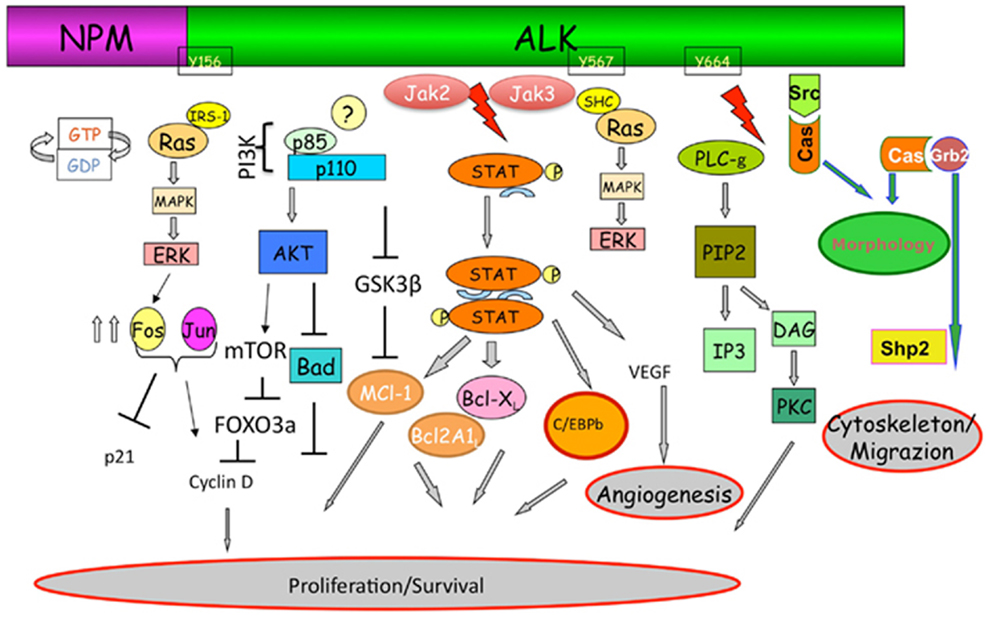 Поэтому в данной работе мы измерили изменения содержания фосфо-JAK3 в клетках HEK 293 с помощью вестерн-блоттинга.Результат показал, что 3 растительных соединения чинси, криптотаншинон, икаритин и индирубин, ослабляют индуцированное IL-2 фосфорилирование JAK3 в клеточной линии HEK 293 на фиг. 2.
Поэтому в данной работе мы измерили изменения содержания фосфо-JAK3 в клетках HEK 293 с помощью вестерн-блоттинга.Результат показал, что 3 растительных соединения чинси, криптотаншинон, икаритин и индирубин, ослабляют индуцированное IL-2 фосфорилирование JAK3 в клеточной линии HEK 293 на фиг. 2.
3.3. Активность трансактивации SATA5
3.3.1. Эксперименты с люциферазой
Ожидается, что ингибирование активности фосфорилирования JAK3 приведет к снижению уровней фосфорилирования нижестоящего STAT5. Таким образом, мы стремились изучить способность хитовых соединений ингибировать передачу сигналов JAK3 в клетках человека с использованием анализа люциферазного репортера.В этом исследовании использовали клетки НЕК 293, трансфицированные репортерным геном люциферазы, управляемым промотором, содержащим несколько копий ответного элемента STAT5. Транскрипционную активность STAT5 определяли количественно путем измерения люциферазной активности клеточных лизатов с помощью люминометра. Мы провели анализ доза-ответ трех китайских соединений в их способности ослаблять индуцированную IL-2 передачу сигналов STAT5 (рис. 1).
Мы провели анализ доза-ответ трех китайских соединений в их способности ослаблять индуцированную IL-2 передачу сигналов STAT5 (рис. 1).
Соединения ингибировали индуцированную IL-2 активность люциферазы дозозависимым образом.Хотя три других соединения также ингибировали активность люциферазы, индуцированную IL-2, эффективность их ингибирования составляла приблизительно 1% от эффективности CP-690,550.
3.4. Моделирование стыковки
Рабочий процесс моделирования стыковки представлен на схеме 1. Молекулярная модель JAK3 для анализа стыковки была построена с использованием сообщенной рентгеновской сокристаллической структуры JAK3 с использованием эталонного ингибитора CP-690,550. Сайт связывания JAK3 был определен как находящийся в пределах 3Å от связанного ингибитора, расположенный в АТФ-связывающем кармане домена фосфорилированной тирозинкиназы (PTK) JAK3.
В первом раунде виртуального экрана фитохимические вещества с высокими показателями стыковки были отфильтрованы с использованием правил пяти Липински и виртуальных предсказаний ADME / T. Поскольку фитохимические вещества получены из натуральных растений, было разрешено одно или два нарушения правил Липинского [43]. Допускались химические вещества с токсичностью ниже 2 степени виртуальных предсказаний ADME / T [11]. 50 лучших химических веществ были перечислены в S1.
На основании результатов биоанализов 3 соединения, криптотаншинон (CRY), икаритин (ICA) и индирубин (IND) с наивысшей биологической активностью, были исследованы путем стыковочного вычисления с использованием AutoDock 4.2 снова. Контакт между соединениями и связывающим карманом JAK3 анализировали с использованием LigPlus 2.1 и Discovery Studio Viewer 3.5. Результаты стыковочного анализа показали, что взаимодействие трех растительных соединений может происходить в области связывающего кармана JAK3. В анализе икаритин образовывал водородные связи с теми же остатками киназного домена (KD), что и контрольное соединение CP-690,550, включая Glu903 и Leu 905, тогда как индирубин образовывал водородные связи с остатком KD Cys909. Криптотаншинон не может образовывать водородные связи.Критические остатки и взаимодействия в пределах АТФ-связывающего домена комплекса JAK3-лиганд перечислены в таблице 2. Поза связывания с наименьшей энергией и взаимодействия белок-лиганд показаны на рисунке 3.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.5. Молекулярно-динамическое моделирование
Чтобы исследовать стабильность каждого комплекса JAK3-лиганд, конформации связывания оптимально стыкованных комплексов изучали с помощью анализов моделирования МД. В каждом случае при вычислении среднеквадратических отклонений (RMSD) использовали метод наименьших квадратов связывающих комплексов. RMSD для каждого комплекса рассчитывали за 5 нс. На выходных графиках отображены RMSD для каждой структуры JAK3-лиганда в ее минимизированном уравновешенном состоянии. Анализ моделирования методом МД показал, что профиль RMSD основной цепи для комплексов JAK3-соединение был достаточно стабильным (1.5–3 Å) на всех траекториях МД, демонстрируя стабильность комплексов во время моделирования МД (Рисунок 4). Сходящееся поведение, показанное этими результатами, обеспечивает достоверность результатов стыковки.
4. Обсуждение
киназы JAK играют решающую роль в воспалительных и онкологических заболеваниях [44]. Несколько ингибиторов JAK были разработаны для лечения воспалительных заболеваний, таких как ревматоидный артрит (РА), и аутоиммунных заболеваний, таких как воспалительное заболевание кишечника и псориаз [1, 3].
В отличие от других членов семейства JAK, экспрессия JAK3 в основном происходит в гематопоэтических клетках, где он ассоциируется исключительно с рецепторами цитокинов, несущими общую субъединицу гамма-цепи ( γ c), что позволяет JAK3 специфически работать в иммунных клетках [45]. Следовательно, JAK3 представляет собой привлекательную мишень для лечения воспалительной иммуносупрессии [46]. Ингибитор JAK3 тофацитиниб был одобрен в США для лечения пациентов с РА [47].
Хотя многие ингибиторы JAK3 уже доступны, были выявлены определенные недостатки, в основном приобретенная лекарственная устойчивость или нежелательные побочные эффекты [48, 49].Физиологическая среда более сложна, чем in vitro экспериментальных условий, и непредсказуемые токсические эффекты могут возникнуть в результате использования сильнодействующего ингибитора [50]. Например, европейские регулирующие органы не одобрили тофацитиниб из-за опасений по поводу его эффективности и безопасности [49]. Исследования на животных показали наличие канцерогенеза, мутагенеза и ухудшения фертильности (информация о назначении XELJANZ, Labeling.Pfizer.com). Таким образом, требуется разработка новых ингибиторов JAK3 или применение лекарств, которые ингибируют JAK3 с ограниченными побочными эффектами.
В этом исследовании мы провели анализ ингибирования, чтобы определить ингибирующую активность 12 фитохимических веществ из китайских трав против JAK3, используя бесклеточный ферментный анализ и анализ трансактивности клеток НЕК 293 pSTAT5.
Анализы киназы и трансактивности показали, что большинство из 12 тестируемых соединений не проявляли киназной активности (IC 50 <100 мкМ M), что квалифицировало их как «хит». Некоторые проявляли лишь ограниченную активность, тогда как другие не проявляли никакой прямой активности.Таким образом, эти nonhit соединения, вероятно, модулируют путь JAK / STAT посредством других механизмов или факторов. Однако 3 соединения показали прямое ингибирование киназы JAK3 in vitro . Эти результаты показывают, что IC 50 Cryptotanshinone составляет около . 25 μ M, Икаритин ок. 20 μ M и Индирубин ок. 50 μ M.
Эти соединения также продемонстрировали ингибирование при низкой концентрации в клеточных анализах.Для этого может быть две причины. Во-первых, в условиях культивирования клеток существует динамический баланс между киназой и фосфатазой, тогда как каталитическая реакция киназы продолжается in vitro и до тех пор, пока субстраты не станут насыщенными. Соединения в низкой концентрации могут нарушить этот баланс. Во-вторых, соединения могут влиять на фосфорилирование STAT3 через другие механизмы. Однако соединения nonhit не проявляли активности ни в киназном анализе, ни в клеточных анализах.
В китайской медицине существует традиция использования трав, содержащих самые популярные фитохимические вещества, с древних времен, что свидетельствует о рекордной безопасности и эффективности [6, 51].Таким образом, наше исследование показало, что хитовые соединения и их оригинальные китайские травы обеспечивают эффективность при лечении воспалительных заболеваний и иммунных нарушений за счет прямого взаимодействия с киназой JAK3.
Чтобы исследовать структурные конформации и изучить ключевые аминокислоты, участвующие во взаимодействии между киназой JAK3 и хитовыми лигандами, мы выполнили вычислительные расчеты, используя моделирование стыковки и молекулярной динамики.
В предыдущих отчетах компьютерное молекулярное моделирование на основе структуры использовалось для идентификации соединений-кандидатов, способных ингибировать фосфорилирование JAK3 [52, 53].Структура домена кармана, связывающего АТФ JAK3, была использована для компьютерных химических анализов малых молекул. Для исследования моделей связывания соединения с доменом связывающего кармана JAK3 было проведено компьютерное моделирование.
АТФ-индуцированное фосфорилирование Tyr в домене Jh2 белка JAK3 является критическим для функции и модуляции киназы JAK3 [54]. АТФ-связывающий сайт киназы JAK3 состоит из узкой и гидрофобной щели, расположенной между N- и C-долями киназного домена (KD), причем две доли соединены вместе областью связывающего кармана, состоящей из донора водородной связи и акцепторные остатки из белковой цепи.Ключевым фактором в определении ингибирующей активности киназы является идентичность остатков в глицине, шарнире и петлях активации, которые контролируют доступ ингибитора к гидрофобному карману. По этой причине мы оценили величину ингибирования JAK3 3 соединений, нацеленных на домен АТФ-связывающего кармана, с помощью компьютерных анализов.
Стратегии стыковки генерируют оценки связывания или сродства для различных сайтов и положений целевого белка. Хотя стыковка широко применялась при открытии лекарств, некоторые результаты стыковки показывают высокие баллы стыковки, которые плохо коррелируют с фактической биологической активностью, что также не удается при моделировании МД [13].Чтобы повысить достоверность наших результатов стыковки, мы также выполнили МД-моделирование, результаты которого продемонстрировали стабильное и сходящееся поведение комплексов на всех траекториях МД.
Результаты моделирования стыковки 3 соединений с использованием AutoDock 4.2, которые немного ниже, чем при использовании AutoDock Vina, показали высокий балл стыковки (энергия связывания криптотаншинона с киназой JAK3 составляла 9,2 ккал / моль, икаритина 9,3 ккал / моль, Индирубин 9,1 ккал / моль и CP-690,550 8,8 ккал / моль), что указывает на то, что три фитохимических вещества действительно являются отличными потенциальными ингибиторами.Позы, найденные при таком подходе к моделированию, показали, что 3 китайских растительных соединения, возможно, могут связываться с доменом Jh2 JAK3. Уточненная модель предсказала, что эти соединения связываются в специфическом сайте, в котором остатки связывающего кармана расположены в домене JAK3 Jh2 (Таблица 2). Модель также предсказала, что икаритин может образовывать ряд водородных связей с соседними аминокислотными остатками, включая Glu903, Leu905, Ala966 и Asp967, и что индирубин может образовывать водородную связь с Cys909 (рис. 3).Результаты также показывают, что аминокислотные остатки Leu828, Gly829, Lys830, Val836, Ala853, Met902, Glu903, Tyr904, Leu905, Gly908, Cys909, Leu956, Ala966 и Asp967 в основном участвуют во взаимодействии между киназой JAK3 и соединениями. и, возможно, являются наиболее важными остатками в связывающем кармане для взаимодействия белок-лиганд.
Таким образом, путем объединения анализов биоактивности и компьютерных исследований в настоящем исследовании были идентифицированы 3 китайских растительных соединения, которые могут служить в качестве потенциальных кандидатов для ингибирования киназы JAK3 и заболеваний, нацеленных на JAK3.
5. Выводы
В заключение, мы обнаружили 3 потенциальных природных ингибитора JAK3, криптотаншинон, икаритин и индирубин. Наша работа может предоставить новые возможности и стимулировать новые идеи для лечения заболеваний, нацеленных на JAK3.
Доступность данных
Авторы заявляют, что данные, подтверждающие выводы этого исследования, доступны в статье и дополнительном информационном файле.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этой статьи.
Благодарности
Эта работа была поддержана «Фондом естественных наук провинции Гуандун в Китае» (номер гранта 2016A030313366; 2018A030313419), «Администрацией традиционной китайской медицины провинции Гуандун в Китае» (номер гранта 20182169), «Наука и технологии. Проект планирования китайского города Чжуншань »(номер гранта 2018B1037; 201811110) и« Развитие специальных фондов научно-технического инновационного проекта и программы альпинизма для студентов Гуандунского колледжа »(номер гранта pdjh3017b0916).
Дополнительные материалы
Таблица S1: 50 лучших результатов стыковки. (Дополнительные материалы)
JAK3-селективный ингибитор PF-956980 обращает резистентность к цитотоксическим агентам, индуцированную обработкой интерлейкином-4 клеток хронического лимфоцитарного лейкоза: потенциал для отмены цитопротекции микроокружением | Кровь
Хронический лимфолейкоз (ХЛЛ), который когда-то считался доброкачественным, теперь известен как агрессивная подгруппа, характеризующаяся немутантными генами вариабельной тяжелой цепи иммуноглобулина (IGHV), высокой экспрессией CD38 на поверхности клетки и белка тирозина. киназа, протеинкиназа 70, ассоциированная с дзета-цепью (ZAP-70). 1 Пролиферативный компартмент в ХЛЛ расположен в «псевдофолликулах» в костном мозге и лимфоидной ткани, 2 , и доступ клеток ХЛЛ к этим компартментам зависит от мигрирующих сигналов хемокинов, включая хемокиновый (мотив CXC) лиганд 12 (CXCL12) , 2 хемокин (мотив СС), лиганд 19 (CCL19) и CCL21. 3 ХЛЛ лечат хлорамбуцилом или флударабином, но неизлечимы только химиотерапией. 4 Поскольку лекарственная устойчивость является серьезным препятствием для лечения, важно выявить и оценить механизмы, которые способствуют устойчивости к апоптозу при ХЛЛ, и разработать стратегии их преодоления.
Обычные цитотоксические агенты, повреждающие ДНК, включая флударабин и хлорамбуцил, убивают клетки CLL посредством индукции проапоптотического белка p53. 5 Следовательно, мутации или делеции, затрагивающие гены р53, являются основной причиной лекарственной устойчивости. 6 Однако генетические изменения с участием p53 выбираются во время лечения, и этот тип устойчивости приобретается с течением времени. 6 Напротив, факторы окружающей среды опосредуют лекарственную устойчивость с момента начала лечения, что приводит к защите опухолевых клеток от различных химиотерапевтических агентов и выживанию очагов остаточного заболевания. 2,7 Поэтому желательно разработать стратегии, которые могут применяться во время начального лечения и призваны минимизировать выживаемость злокачественных клеток и последующее появление приобретенной устойчивости.
Клетки
CLL, особенно те, которые расположены в костном мозге или лимфоидной ткани, подвергаются внеклеточным сигналам, которые способствуют их выживанию и пролиферации за счет подавления путей апоптоза. 2 Интерлейкин-4 (IL-4) представляет собой лимфокин Th3, который сигнализирует через опосредованную рецептором активацию тирозинкиназ Janus, JAK1 и JAK3, и последующее фосфорилирование и активацию сигнального преобразователя и активатора транскрипции 6 (STAT6) фактор транскрипции. 8 IL-4 продлевает базальную выживаемость клеток CLL in vitro, 9 и рецептор IL-4 обильно экспрессируется клетками CLL по сравнению с нормальными B-лимфоцитами, что коррелирует со значительно более сильным антиапоптотическим эффектом IL-4 на Клетки CLL. 10,11 Обширные данные свидетельствуют о том, что взаимодействия IL-4 / CLL также происходят in vivo. Во-первых, при ХЛЛ увеличивается популяция Т-лимфоидов, секретирующих IL-4, CD3 + / CD8 + / CD28 — . 12 Во-вторых, клетки CLL секретируют IL-6, который переключает Т-лимфоциты с Т-хелпера 1 (Th2) на фенотип Th3, секретирующий IL-4. 13 В-третьих, 40-65% CD8 + Т-клеток пациентов с ХЛЛ содержали ИЛ-4, в то время как <10% этих клеток от нормальных субъектов содержали его. 14 Эти Т-клетки также были способны секретировать IL-4 без активации. В-четвертых, доля IL-4-положительных Т-клеток была выше у пациентов с прогрессирующим заболеванием по сравнению со стабильными пациентами, что позволяет предположить, что IL-4 играет патофизиологическую роль в подавлении гибели клеток. 15 Наконец, клетки ХЛЛ в лимфатических узлах и костном мозге находятся в тесном контакте с Т-клетками, 2 , которые сильно окрашиваются на ИЛ-4, а также другие цитокины, полученные из Т-клеток, включая ИЛ-2, ИЛ-6 и IL-10, который может дополнительно способствовать передаче антиапоптотических сигналов. 16 Таким образом, вероятно, что цитопротективные взаимодействия между клетками CLL, IL-4 и другими цитокинами, которые приводят к лекарственной устойчивости, могут происходить преимущественно в этих сложных микросредах, а не на периферии. 2
Мезенхимальные стромальные клетки костного мозга (МСК) представляют собой in vitro аналог преобладающего типа клеток микроокружения костного мозга при ХЛЛ. 17 Первоначально было показано, что МСК защищают клетки CLL от базального апоптоза. 18 Цитопротекция опосредуется множеством контактно-зависимых и независимых сигнальных белков, включая хемокин, CXCL12. 19 Связывание CXCL12 с его рецептором, CXCR4 (CD184), приводит к активации JAK2 и 3 и фосфорилированию STAT1, 3 и 5. 20 МСК защищают клетки CLL от индукции апоптоза после обработки цитотоксическими агентами 17, 21 и способствуют сохранению очагов остаточной болезни.
Исследования, представленные здесь, были разработаны для выявления внутриклеточных путей, которые активируются после обработки IL-4 клеток CLL, чтобы определить, может ли PF-956980, JAK3-селективный ингибитор, 22 аннулировать передачу сигналов, опосредованную IL-4, и обратить вспять способность IL-4 блокировать апоптотическое уничтожение клеток CLL цитотоксическими агентами и определять, может ли PF-956980 также ограничивать антиапоптотическую защиту, обеспечиваемую MSC.
Открытие DWP212525, мощного двойного целевого ингибитора JAK3 и BTK для лечения аутоиммунных заболеваний
Информация о сеансе
Тип сессии: Стендовая сессия (понедельник)
Время сеанса: 9:00 — 11:00
Предпосылки / цель: Янус-киназа (JAK) и тирозинкиназа Брутона (BTK) играют решающую роль в активации и функционировании Т-клеток и В-клеток.Известно, что нарушение регуляции этого процесса вызывает различные иммунные заболевания. Тофацитиниб, ингибитор JAK, первоначально был разработан как ингибитор JAK3, но он показал ограниченную селективность в отношении JAK1 и JAK2. Хотя доказано терапевтическое действие тофацитиниба при РА, часто сообщалось о серьезных побочных эффектах, таких как анемия и нейтропения. Между тем, существующие ингибиторы БТК обладают недостаточной клинической эффективностью, что создает более высокие требования к лечению с повышенной эффективностью. DWP212525 представляет собой новый и селективный ингибитор JAK3 и BTK, который может иметь синергетический эффект при лечении ревматоидного артрита и других воспалительных заболеваний, таких как вульгарная пузырчатка (PV).
Методы: Ингибирование активности ферментов JAK3 и BTK и селективность в отношении группы киназ семейства Cys оценивали с помощью серии биохимических анализов. Клеточную активность по целевому фосфорилированию в человеческих Т- и В-клетках измеряли с помощью клеточного набора Phospho-STAT5 или фосфо-BTK. BCR-зависимые экспрессии CD69 определяли в hPBMC. Для измерения занятости BTK селезенку мыши извлекали в несколько временных точек в течение 24 часов после перорального введения DWP212525.Занятость количественно оценивали по количеству несвязавшихся BTK в анализе на основе ELISA с использованием биотинилированного DWP212525, который связывается со свободным активным сайтом мишени после перорального введения DWP212525. Кроме того, эффективность DWP212525 была исследована на модели индуцированного коллагеном артрита (CIA) мыши и модели PV мыши по сравнению с селективным ингибитором BTK.
Результаты: Мы разработали новый мощный ингибитор двойной мишени DWP212525 со значением 0 JAK3 IC 50 .2 нМ и значение БТК IC 50 1,5 нМ. Что еще более важно, DWP212525 очень селективен в отношении JAK3 и BTK, но имеет низкое сродство к JAK1, JAK2 и EGFR. DWP212525 показывает успешное ингибирование BCR-зависимой экспрессии CD69 в В-клетках (значение IC 50 составляет 132 нМ). In vivo , пероральное введение низких доз DWP212525 (1 мг / кг) показало, что спленоциты мыши занимают более 80% БТК. Интересно, что концентрация DWP212525 в плазме быстро снижалась, но высокий уровень занятости BTK сохранялся в течение 24 часов.В модели CIA на мышах мы наблюдали дозозависимое улучшение симптомов артрита в группе, получавшей DWP212525. Значение DWP212525 по ED 50 составляет 0,8 мг / кг. В модели PV мыши DWP212525 уменьшал тяжесть заболевания, индексный балл предотвращал потерю массы тела и подтвердил, что выживаемость была выше, чем в группе положительного контроля, получавшей ингибитор BTK, и группе носителя в конце 32-дневного перорального введения после индукция болезни.
Заключение: Мы разработали новый, высокоэффективный и селективный ковалентный ингибитор JAK3 и BTK, DWP212525.Мы продемонстрировали, что DWP212525 обладает сильной фармакологической активностью in vitro, и in vivo, по сравнению с тофацитинибом и существующим селективным ингибитором BTK. Эти результаты предполагают, что
DWP212525 может быть более эффективным из-за добавления ингибитора JAK3, чем селективный ингибитор BTK, для лечения различных аутоиммунных заболеваний, включая RA и PV.
Раскрытие информации: Y. Shin , Нет; Дж.Юнг , нет; Э. Ким , нет; S. IM , Нет; S. Jun , нет; Н. Ким , нет; С. Чжон , нет; Х. Хён , нет; Дж. Парк , Нет.
Чтобы процитировать этот реферат в стиле AMA:
Shin Y, Jung J, Kim E, IM S, Jun S, Kim N, Jeong S, Hyun H, Park J. Открытие DWP212525, мощного ингибитора двойной цели JAK3 и BTK для лечения аутоиммунных заболеваний [аннотация]. Arthritis Rheumatol. 2019; 71 (приложение 10).
https://acrabstracts.org/abstract/discovery-of-dwp212525-a-potent-jak3-and-btk-dual-target-inhibitor-for-the-treatment-of-autoimmune-diseases/. По состоянию на 18 февраля 2021 г.
«Назад к ежегодному собранию ACR / ARP 2019
Тезисы заседаний ACR — https://acrabstracts.org/abstract/discovery-of-dwp212525-a-potent-jak3-and-btk-dual-target-inhibitor-for-the-treatment-of-autoimmune-diseases /
Лечение астмы путем нацеливания на JAK3 с помощью JANEX-1
Информация для малого бизнеса
PARADIGM PHARMACEUTICALS, ООО, 2685 ПАТТОН РД, УЛ.ПАВЕЛ, Миннесота, 55113
Принадлежит HUBZone:
N
Женщина принадлежит:
N
Социально и экономически неблагополучные:
N
Аннотация
ОПИСАНИЕ (предоставлено заявителем): Около 50 миллионов человек страдают астмой и аллергией, из которых 5 миллионов находятся в возрасте до 18 лет.Это наша центральная рабочая ГИПОТЕЗА, что JAK3 играет центральную роль в патофизиологии аллергической астмы, а ингибиторы JAK3 могут быть полезны для предотвращения астматических реакций in vivo путем ингибирования высвобождения медиатора тучных клеток и рекрутирования эозинофилов в дыхательные пути. Чтобы проверить эту гипотезу, мы изучим действие ингибитора JAK3 JANEX-1, используя хорошо изученную модель аллергической астмы на мышах. В частности, мы исследуем влияние JANEX-1 на величину и исход антиген-индуцированных астматических реакций на хорошо охарактеризованной модели аллергической астмы на мышах.В модели аллергической астмы мышей, получавших JANEX-1, будут исследовать на предмет их индуцированного антигеном раннего (обструкция дыхательных путей), а также поздней фазы астматического ответа, гиперчувствительности бронхов и воспаления дыхательных путей. Мы рассмотрим, может ли: (i) хроническое предварительное лечение (внутрибрюшинное, а также пероральное) мышей ингибитором JAK3 предотвратить антиген-индуцированную гиперреактивность бронхов и рекрутирование эозинофилов. Мы также рассмотрим, можно ли отменить текущую астматическую реакцию с помощью внутривенного лечения ингибиторами JAK3.Кроме того, поскольку аэрозольные препараты обеспечивают лучшую стратегию лечения астмы, мы также исследуем влияние аэрозольных ингибиторов JAK3 на аллергическую астму у мышей. Чтобы оценить воспалительную реакцию, высвобождение медиаторов воспаления (например, ИЛ-5, гистамин, ЭПО, лейкотриен С4) и приток воспалительных клеток, а именно. (базофилы, эозинофилы, нейтрофилы) также будут оцениваться в жидкостях бронхоальвеолярного лаважа. Ткань легких, полученная от обработанных и необработанных мышей JANEX-1, будет исследована на клеточную инфильтрацию и патологические изменения.Завершение предложенных исследований может стать основой для новых профилактических и терапевтических мер против аллергической астмы.
* Информация указана выше на момент подачи. *
Разработка селективных ковалентных ингибиторов янус-киназы 3 (журнальная статья)
Тан, Ли, Акахане, Коши, МакНалли, Рэндалл, Рейскенс, Кэтлин М. С. Э., Фикарро, Скотт Б., Лю, Суху, Хертер-Спри, Грит С., Кояма, Шохей, Паттисон, Майкл Дж., Лабелла, Кэтрин, Йоханнесен, Лив, Акбай, Эсра А., Вонг, Квок-Кин, Франк, Дэвид А., Марто, Джаррод А., Смотри, Томас А., Артур , Дж. Саймон К., Эк, Майкл Дж. И Грей, Натанаэль С. Разработка селективных ковалентных ингибиторов янус-киназы 3 . США: Н. П., 2015.
Интернет. DOI: 10.1021 / acs.jmedchem.5b00710.
Тан, Ли, Акахане, Коши, МакНалли, Рэндалл, Рейскенс, Кэтлин М.С.Э., Фикарро, Скотт Б., Лю, Суху, Хертер-Спри, Грит С., Кояма, Шохей, Паттисон, Майкл Дж., Лабелла, Кэтрин, Йоханнесен, Лив, Акбай, Эсра А., Вонг, Квок-Кин, Франк, Дэвид А., Марто, Джаррод А., Лук, Томас А., Артур, Дж. Саймон К., Эк, Майкл Дж. И Грей, Натанаэль С. Разработка селективных ковалентных ингибиторов Янус-киназы 3 . Соединенные Штаты. https://doi.org/10.1021/acs.jmedchem.5b00710
Тан, Ли, Акахане, Коши, МакНалли, Рэндалл, Рейскенс, Кэтлин М.С.Э., Фикарро, Скотт Б., Лю, Суху, Хертер-Спри, Грит С., Кояма, Шохей, Паттисон, Майкл Дж., Лабелла, Кэтрин, Йоханнесен, Лив, Акбай, Эсра А., Вонг, Квок-Кин, Франк, Дэвид А., Марто, Джаррод А., Слушай, Томас А., Артур, Дж. Саймон К., Эк, Майкл Дж. И Грей, Натанаэль С. Мон.
«Разработка селективных ковалентных ингибиторов янус-киназы 3». Соединенные Штаты. https://doi.org/10.1021/acs.jmedchem.5b00710. https://www.osti.gov/servlets/purl/1430281.
@article {osti_1430281,
title = {Разработка селективных ковалентных ингибиторов янус-киназы 3},
автор = {Тан, Ли и Акахан, Коши и МакНалли, Рэндалл и Рейскенс, Кэтлин М.С.Э. и Фикарро, Скотт Б. и Лю, Суху и Хертер-Спри, Грит С. и Кояма, Шохей и Паттисон, Майкл Дж. И Лабелла, Кэтрин и Йоханнесен, Лив и Акбай, Эсра А. и Вонг, Квок-Кин и Франк, Дэвид А. и Марто, Джаррод А. и Лук, Томас А. и Артур, Дж. Саймон К. и Эк, Майкл Дж. И Грей, Натанаэль С.},
abstractNote = {Янус-киназы (JAK) и их нижестоящие эффекторы, преобразователи сигналов и активаторы белков транскрипции (STAT) образуют критическую сигнальную цепь иммунных клеток, которая имеет фундаментальное значение для врожденного иммунитета, воспаления и гематопоэза, а также нарушения регуляции часто наблюдается при иммунных заболеваниях и раке.Высокая степень структурной консервации карманов связывания JAK-АТФ представляет собой серьезную проблему для медицинских химиков, стремящихся разработать высокоселективные ингибиторы в качестве фармакологических зондов и в качестве клинических лекарств. Здесь мы сообщаем об открытии и оптимизации 2,4-замещенных пиримидинов в качестве ковалентных ингибиторов JAK3, которые используют уникальный остаток цистеина (Cys909) в JAK3. Исследование взаимосвязи структура-активность (SAR) с использованием биохимических и трансформированных клеточных анализов Ba / F3 привело к идентификации сильных и селективных ингибиторов, таких как соединения 9 и 45.Сокристаллическая структура 2,9 Å JAK3 в комплексе с 9 подтверждает ковалентное взаимодействие. Соединение 9 проявляет хорошие фармакокинетические свойства и подходит для использования in vivo. В результате эти ингибиторы предоставляют набор полезных инструментов для фармакологического исследования JAK3-зависимой биологии.},
doi = {10.1021 / acs.jmedchem.5b00710},
url = {https://www.osti.gov/biblio/1430281},
journal = {Journal of Medicinal Chemistry},
issn = {0022-2623},
число = 16,
объем = 58,
place = {United States},
год = {2015},
месяц = {8}
}
Pfizer начинает фазу 2b / 3 клинических испытаний PF-06651600, перорального ингибитора JAK3, для лечения пациентов с умеренной и тяжелой алопецией Areata
«Мы с гордостью начинаем это глобальное ключевое испытание фазы 2b / 3 для PF-06651600 у пациентов с очаговой алопецией.Мы надеемся, что это потенциальное лечение сможет помочь пациентам, которые в настоящее время имеют ограниченные возможности лечения », — сказал Майкл Корбо, директор по развитию отдела воспаления и иммунологии, Pfizer Global Product Development. «Включая нашу программу JAK3, у Pfizer есть несколько программ селективных киназ в клинике с исследованиями, охватывающими ревматологию, желудочно-кишечные расстройства и медицинскую дерматологию, где мы стремимся предоставлять потенциально трансформирующие лекарства людям, живущим с хроническими аутоиммунными и воспалительными состояниями.”
Положительные данные фазы 2a для PF-06651600 были недавно представлены в 27 -й Европейской академии дерматологии и венерологии (EADV) как последние. Исследование достигло основной конечной точки эффективности в улучшении отрастания волос на коже черепа по сравнению с исходным уровнем на 24 неделе, что было измерено с помощью шкалы оценки тяжести алопеции (SALT) (100-балльная шкала). В дополнение к достижению первичной конечной точки эффективности, исследуемый кандидат также соответствовал всем вторичным конечным точкам в исследовании.В целом частота нежелательных явлений (НЯ) была сопоставима между группами лечения. Наиболее частые нежелательные явления, наблюдаемые в исследовании, касались инфекций, желудочно-кишечного тракта и кожи / подкожной ткани. Случаев реактивации опоясывающего герпеса не было.
На основании совокупности данных и нового клинического профиля PF-06651600 получил от FDA США статус прорывной терапии для лечения очаговой алопеции в сентябре 2018 года. PF-06651600 также будет продолжать оцениваться на предмет ревматоидного артрита и болезни Крона. и язвенный колит.
О программе PF-06651600 Phase 2b / 3
В базовое испытание будет вовлечено около 660 пациентов, оно будет двойным слепым плацебо-контролируемым исследованием с определением дозировки для оценки безопасности и эффективности PF-06651600 у взрослых и подростков (12 лет и старше), у которых 50% или большая потеря волос на коже головы. Более подробную информацию об исследовании можно найти на сайте www.clinicaltrials.gov под идентификатором NCT03732807.
О Alopecia Areata
Гнездная алопеция — это аутоиммунное заболевание, характеризующееся выпадением волос, часто неоднородным, на коже черепа, лица или тела. 1,2 Люди, страдающие очаговой алопецией, испытывают симптомы, когда иммунные клетки атакуют здоровые волосяные фолликулы, вызывая выпадение волос, часто начиная с гладких круглых пятен. 1,2 Средний возраст начала заболевания составляет от 25 до 35 лет, но он также может повлиять на детей и подростков и наблюдается у представителей обоих полов и всех этнических групп. 1,2 Более половины пациентов с очаговой алопецией имеют плохое качество жизни, связанное со здоровьем, и, как следствие, это состояние может привести к серьезным психологическим последствиям, включая высокий уровень депрессии и тревоги. 1
О руководстве PF-06651600 и ингибиторами киназы Pfizer
Считается, что пути JAK играют важную роль в воспалительных процессах, поскольку они участвуют в передаче сигналов более чем 50 цитокинам и факторам роста, многие из которых вызывают иммуноопосредованные состояния. 3 Ингибирование JAK может предложить пациентам с этими состояниями новый потенциальный вариант лечения. 4
PF-06651600 представляет собой пероральный ингибитор JAK3, который также исследуется для лечения ревматоидного артрита, болезни Крона и язвенного колита. 4
Компания Pfizer создала ведущие исследовательские возможности по изучению киназ и разработала несколько уникальных методов лечения ингибиторами киназ. Будучи пионером в области науки JAK, компания продолжает продвигать несколько исследовательских программ для молекул с новыми профилями селективности, которые, в случае утверждения, потенциально могут обеспечить трансформирующую терапию для пациентов. В дополнение к PF-06651600, Pfizer имеет ряд ингибиторов киназ, которые проходят клинические испытания по множеству показаний, в том числе:
- PF-04965842: исследуемый селективный ингибитор JAK1 в клинических испытаниях фазы 3 для лечения атопического дерматита (AD) 5 ; PF-04965842 получил от FDA статус прорывной терапии для лечения пациентов с БА средней и тяжелой степени в феврале 2018 г.
- PF-06700841: ингибитор тирозинкиназы 2 (TYK2) / JAK1, исследуемый для лечения псориаза, болезни Крона, язвенного колита и очаговой алопеции
- PF-06650833: Ингибитор киназы 4, ассоциированной с рецептором интерлейкина-1 (IRAK4), исследуемый для лечения ревматоидного артрита
- PF-06826647: ингибитор TYK2, исследуемый для лечения псориаза и воспалительного заболевания кишечника (ВЗК)
Совместная работа ради более здорового мира ®
В Pfizer мы применяем науку и наши глобальные ресурсы, чтобы предлагать людям методы лечения, которые продлевают и значительно улучшают их жизнь.Мы стремимся установить стандарты качества, безопасности и ценности при открытии, разработке и производстве товаров для здоровья. В наш глобальный портфель входят лекарства и вакцины, а также многие из самых известных в мире потребительских товаров для здоровья. Каждый день коллеги Pfizer работают на развитых и развивающихся рынках, чтобы улучшить здоровье, профилактику, лечение и лечение, которые бросают вызов наиболее опасным заболеваниям нашего времени. В соответствии с нашей ответственностью как одной из ведущих мировых инновационных биофармацевтических компаний, мы сотрудничаем с поставщиками медицинских услуг, правительствами и местными сообществами для поддержки и расширения доступа к надежной и доступной медицинской помощи по всему миру.Более 150 лет мы работаем, чтобы изменить мир к лучшему для всех, кто полагается на нас. Мы регулярно размещаем информацию, которая может быть важной для инвесторов, на нашем веб-сайте www.pfizer.com. Кроме того, чтобы узнать больше, посетите нас на www.pfizer.com и подпишитесь на нас в Twitter на @Pfizer и @Pfizer_News, LinkedIn, YouTube и поставьте нам лайк на Facebook на Facebook.com/Pfizer.
УВЕДОМЛЕНИЕ О РАСКРЫТИИ ИНФОРМАЦИИ: Информация, содержащаяся в этом выпуске, относится к 3 января 2019 г. Pfizer не берет на себя никаких обязательств по обновлению прогнозных заявлений, содержащихся в этом выпуске, в результате появления новой информации или будущих событий или разработок.
Этот выпуск содержит прогнозную информацию о PF-06651600 и текущих исследовательских программах Pfizer по терапии ингибиторами киназ, включая их потенциальные преимущества, которые связаны со значительными рисками и неопределенностями, которые могут привести к тому, что фактические результаты будут существенно отличаться от тех, которые выражены или подразумеваются в таких заявлениях. . Риски и неопределенности включают, среди прочего, неопределенности, присущие исследованиям и разработкам, в том числе возможность уложиться в ожидаемые даты начала и завершения клинических исследований и даты подачи в регулирующие органы, а также возможность неблагоприятных результатов клинических исследований, включая неблагоприятные новые клинические данные. и дополнительный анализ существующих данных; риски, связанные с предварительными данными; риск того, что данные клинических испытаний могут быть интерпретированы по-разному, и, даже если мы рассматриваем данные как достаточные для поддержки безопасности и / или эффективности продукта-кандидата, регулирующие органы могут не разделять наши взгляды и могут потребовать дополнительные данные или могут отказать в одобрении все вместе; будут ли регулирующие органы удовлетворены дизайном и результатами наших клинических исследований; можно ли и когда подавать заявки на лекарственные препараты в любых юрисдикциях по любому потенциальному показанию для PF-06651600 или любых других исследуемых терапий ингибиторами киназ; могут ли и когда какие-либо такие заявки быть одобрены регулирующими органами, что будет зависеть от оценки такими регулирующими органами профиля польза-риск, предлагаемого на основе всей представленной информации об эффективности и безопасности, и, если одобрено, будет ли PF-06651600 , или любые другие исследуемые методы лечения ингибиторами киназ будут коммерчески успешными; решения регулирующих органов относительно маркировки, безопасности и других вопросов, которые могут повлиять на доступность или коммерческий потенциал PF-06651600 или любых других исследуемых методов лечения ингибиторами киназ; и конкурентные разработки.
Дальнейшее описание рисков и неопределенностей можно найти в годовом отчете Pfizer по форме 10-K за финансовый год, закончившийся 31 декабря 2017 г., и в его последующих отчетах по форме 10-Q, в том числе в его разделах, озаглавленных «Факторы риска». »И« Перспективная информация и факторы, которые могут повлиять на будущие результаты », а также в последующих отчетах по форме 8-K, которые подаются в Комиссию по ценным бумагам и биржам США и доступны по адресу www.sec.gov и www.pfizer.com .
______________________
1 Villasante Fricke AC, Miteva M. Эпидемиология и бремя очаговой алопеции: систематический обзор. Клиническая, косметическая и исследовательская дерматология. 2015; 8: 397-403. DOI: 10.2147 / CCID.S53985.
2 Pratt CH, King LE, Messenger AG, Christiano AM, Sundberg JP. Гнездная алопеция. Nature reviews Праймеры от болезней . 2017; 3: 17011. DOI: 10.1038 / nrdp.2017.11.
3 Banerjee, S., Biehl, A., Gadina, M. et al. JAK – STAT-сигнализация как мишень для воспалительных и аутоиммунных заболеваний: текущие и будущие перспективы. Наркотики. 2017; 77: 521. https://doi.org/10.1007/s40265-017-0701-9
4 Теллиез Дж. Б., Даути М. Е., Ван Л., Юссиф Дж., Лин Т., Ли Л. и др. Открытие JAK3-селективного ингибитора: функциональная дифференциация JAK3-селективного ингибирования по сравнению с pan-JAK или JAK1-селективным ингибированием. ACS Chem Biol. 2016; 11 (12): 3442–51.DOI: 10.1021 / acschembio.6b00677.
5 J Med Chem. 2018 8 февраля; 61 (3): 1130-1152. DOI: 10.1021 / acs.jmedchem.7b01598. Epub 2018 23 января
См. Исходную версию на businesswire.com: https://www.businesswire.com/news/home/201
.

 Ann Rheum Dis. 2010;69(4):631-637. https://doi.org/10.1136/ard.2009.123919.
Ann Rheum Dis. 2010;69(4):631-637. https://doi.org/10.1136/ard.2009.123919. S., Schöls M., Braun J. et al. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international task force. Ann Rheum Dis. 2018;77(1):3- 17. https://doi.org/10.1136/annrheumdis-2017-211734.
S., Schöls M., Braun J. et al. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international task force. Ann Rheum Dis. 2018;77(1):3- 17. https://doi.org/10.1136/annrheumdis-2017-211734. https://doi.org/10.1059/0003-4819-151-9-200911030-00013.
https://doi.org/10.1059/0003-4819-151-9-200911030-00013. , Guzman R., Gutierrez M., Rodríguez W., Karateev D. Biopharmaceuticals for rheumatic diseases in Latin America, Europe, Russia, and India: innovators, biosimilars, and intended copies. Joint Bone Spine. 2014;81(6):471-477. https://doi.org/10.1016/j.jbspin.2014.03.019.
, Guzman R., Gutierrez M., Rodríguez W., Karateev D. Biopharmaceuticals for rheumatic diseases in Latin America, Europe, Russia, and India: innovators, biosimilars, and intended copies. Joint Bone Spine. 2014;81(6):471-477. https://doi.org/10.1016/j.jbspin.2014.03.019. 03.006.
03.006. Современная ревматология. 2014;8(1):39-44. https://doi.org/10.14412/1996-7012-2014-1-39-44.
Современная ревматология. 2014;8(1):39-44. https://doi.org/10.14412/1996-7012-2014-1-39-44. Curr Opin Pharmacol. 2012;12(4):464-470. https://doi.org/10.1016/j. coph.2012.06.008.
Curr Opin Pharmacol. 2012;12(4):464-470. https://doi.org/10.1016/j. coph.2012.06.008. J Immunol. 2007;179(11):7593- 7604. https://doi.org/10.4049/jimmunol.179.11.7593.
J Immunol. 2007;179(11):7593- 7604. https://doi.org/10.4049/jimmunol.179.11.7593. . Tofacitinib (CP-690,550) in combination with methotrexate in patients with active rheumatoid arthritis with an inadequate response to tumour necrosis factor inhibitors: a randomised phase 3 trial. Lancet. 2013;381(9865):451-460. https://doi.org/10.1016/S0140-6736(12)61424-X.
. Tofacitinib (CP-690,550) in combination with methotrexate in patients with active rheumatoid arthritis with an inadequate response to tumour necrosis factor inhibitors: a randomised phase 3 trial. Lancet. 2013;381(9865):451-460. https://doi.org/10.1016/S0140-6736(12)61424-X. Clin Rheumatol. 2017;36(1):15-24. https://doi.org/10.1007/s10067-016-3436-1.
Clin Rheumatol. 2017;36(1):15-24. https://doi.org/10.1007/s10067-016-3436-1. В., Волков А.В., Avdeyeva A.S., Lopareva E.V., Олюнин Ю.А., Лукина Г.В., Попкова Т.В., Насонов Е.Л. Первое российское стратегическое исследование фармакотерапии ревматоидного артрита (РЕМАРКА). Научно-практическая ревматология. 2013;51(2):117- 125. https://doi.org/10.14412/1995-4484-2013-637.
В., Волков А.В., Avdeyeva A.S., Lopareva E.V., Олюнин Ю.А., Лукина Г.В., Попкова Т.В., Насонов Е.Л. Первое российское стратегическое исследование фармакотерапии ревматоидного артрита (РЕМАРКА). Научно-практическая ревматология. 2013;51(2):117- 125. https://doi.org/10.14412/1995-4484-2013-637. org/10.14412/1996-7012-2016-2-17-23.
org/10.14412/1996-7012-2016-2-17-23. Современная ревматология. 2017;11(1):12-18. https://doi.org/10.14412/19967012-2017-1-12-18.
Современная ревматология. 2017;11(1):12-18. https://doi.org/10.14412/19967012-2017-1-12-18. 14695.
14695. , Covarrubias-Cobos J.A., Mease P.J. et al. Tofacitinib or adalimumab versus placebo: patient-reported outcomes from OPAL Broaden-a phase III study of active psoriatic arthritis in patients with an inadequate response to conventional synthetic disease-modifying antirheumatic drugs. RMD Open. 2019;5(1):e000806. https://doi.org/10.1136/rmdopen-2018-000806.
, Covarrubias-Cobos J.A., Mease P.J. et al. Tofacitinib or adalimumab versus placebo: patient-reported outcomes from OPAL Broaden-a phase III study of active psoriatic arthritis in patients with an inadequate response to conventional synthetic disease-modifying antirheumatic drugs. RMD Open. 2019;5(1):e000806. https://doi.org/10.1136/rmdopen-2018-000806. , Coates L.C., FitzGerald O., Nash P. et al. Disease-specific composite measures for psoriatic arthritis are highly responsive to a Janus kinase inhibitor treatment that targets multiple domains of disease. Arthritis Res Ther. 2018;20(1):242. https://doi.org/10.1186/s13075-0181739-0.
, Coates L.C., FitzGerald O., Nash P. et al. Disease-specific composite measures for psoriatic arthritis are highly responsive to a Janus kinase inhibitor treatment that targets multiple domains of disease. Arthritis Res Ther. 2018;20(1):242. https://doi.org/10.1186/s13075-0181739-0. Annals of the Rheumatic Diseases. 2018;77:1010-1011. https://doi.org/10.1136/annrheumdis-2018-eular.3115.
Annals of the Rheumatic Diseases. 2018;77:1010-1011. https://doi.org/10.1136/annrheumdis-2018-eular.3115.