Дисбактериоз. Симптомы, профилактика и лечение.
Человеческий организм и окружающая среда составляют единую экологическую систему, в которой важная физиологическая роль принадлежит микробам – симбионтам, проживающих внутри человеческого организма и на его поверхности. Такое сосуществование с обоюдной пользой позволяет человеку получать витамины, которые производят микробы – симбионты, а также дает, в их лице, верного соратника в борьбе с болезнетворными (патогенными) бактериями. Любое изменение в составе аутофлоры(это еще одно умное название симбионтов) может привести к многочисленным нарушениям в обменных и иммунных процессах нашего организма.
Первичное заселение микроорганизмами кишечника ребенка, изначально совершенно стерильного, происходит в процессе родов микрофлорой материнского влагалища. Дальнейшее формирование «личного состава» симбионтов происходит при еде и контакте с окружающими людьми.
Необычайно интересен факт значительного отличия в представителях микробного царства в зависимости от места их «постоянной прописки» в человеческом организме, что обусловлено разными параметрами кислотности, кровоснабжения в разных отделах кишечника.
Группы микроорганизмов – симбионтов
- Транзиторные – это те микробы, которые присутствуют в организме человека, но не имеют возможности в нем задержаться. Иными словами они постоянно поступают с пищей и так же постоянно выделяются естественным путем наружу.
- Нормальная флора, которая приносит несомненную пользу организму человека(в основном это бифидобактерии):
- способствуют расщеплению и усвоению питательных веществ.
- образуют витамины группы «В».
- проявляют антагонизм(противодействие) к болезнетворным микробам.
- Условно патогенные(болезнетворные) микробы. Постоянно находятся в нашем организме без видимого вреда для человека. С натяжкой можно сказать, что их присутствие норма. Однако, при снижении активности иммунитета, они «набрасываются» на ослабленный организм как шакалы на раненого льва, что приводит к серьезным заболеваниям.
 Типичным представителем данной группы является стафилококк. Существует еще одно мнение в ученом сообществе, что наличие в нашем организме представителей микроорганизмов данной группы не норма, а носительство.
Типичным представителем данной группы является стафилококк. Существует еще одно мнение в ученом сообществе, что наличие в нашем организме представителей микроорганизмов данной группы не норма, а носительство. - Возбудители инфекционных заболеваний.
Для корректной оценки полезности и вредности для человека различных микроорганизмов, необходимо помнить, что проявление или не проявление ими «вредных» для нас свойств зависит от многих причин:
- Утомление (Иначе редкий и не полноценный отдых).
- Инфекции (особенно опасно хождение на работу в больном состоянии).
- Травмы.
- Интоксикации (курение, алкоголь, наркотики, проживание в городе, употребление не доброкачественной воды и еды, бесконтрольный прием лекарств).
- Воздействие ионизирующих излучений и электромагнитных полей.
- Аллергии.
- Депрессия.
- Нарушения в менструальном цикле.

- Прерывание беременности.
В норме кровь и внутренние органы человека стерильны (не содержат микробов).
Нормальная флора влагалища однообразна и состоит из лактобацилл – палочек Дедерлейна(L. Fermenti, L. Cellobiosus, L. Casei, L. Acidophilus.). Наличие этих молочнокислых бацилл, кислой реакции среды влагалища и отсутствие лейкоцитов характеризует первую(самую высокую) степень чистоты женских половых органов. Всего степеней 4. Четвертая самая грязная: нет лактобацилл, щелочная среда во влагалище, наличие разнообразных микробов кокковой формы, большое количество лейкоцитов. Интересен факт наличия во влагалище детей до 3-4 недель жизни, у беременной и кормящей женщины гликогена, которым лактобациллы питаются с образованием молочной кислоты, чем обеспечивают защиту от болезнетворных микроорганизмов. Часто сам факт беременности приводит к очищению половой сферы женщины – так природа заботится о будущем ребенке (ну и о его матери, конечно, тоже). В климактерическом периоде за норму принимается третья степень чистоты, что связано со снижением эстрогенов (женских половых гормонов) в организме пожилых дам.
В климактерическом периоде за норму принимается третья степень чистоты, что связано со снижением эстрогенов (женских половых гормонов) в организме пожилых дам.
Нормальная флора носа сравнительно невелика: микрококк, разнообразные стафилококки, дифтероиды(коринебактерии), пневмококк, нейсерия(в том числе и N.meningitis-возможный возбудитель воспаления мозговых оболочек!).
Слизистая оболочка трахеи и бронхов в норме стерильна.
Нормальная флора конъюнктивы глаз: Corinebacterium xerosis, стафилококки, пневмококки.
Нормальная микрофлора кожи: Стафилококки, сарцины, дифтероиды, некоторые стрептококки, грибы. Удивительно, как эти маленькие условные друзья сражаются за территорию на нашей коже с болезнетворными микробами. Так палочка брюшного тифа уничтожается симбионтами без следа уже через 10 минут после нанесения ее на кожу! Правды ради, необходимо заметить, что, помимо симбионтов, с микробами сражается и сама кожа своими многочисленными факторами иммунитета:
- Величина PH,
- выделение перекисей,
- бактерицидные липиды,
- фагоцитарная (пожирательная) способность лейкоцитов,
- активность лизоцима (естественного антибиотика) слюны,
- насыщенность тканей аскорбиновой кислотой (витамин «С»).

Важно знать, что кожа после мытья обладает значительно большей способностью самоочищения чем до мытья. Однако и при умывании желательно соблюдать золотую середину. Дело в том, что мытьё рук в течении 3-5 минут снижает количество микробов в 10 раз, но после 10-15 минут мытья, количество микробов возвращается к прежнему уровню! Они (микробы) «вылезают» из потовых и сальных желез, волосяных фолликулов, где находятся в большом количестве. Отсюда следует принципиальный вывод: чрезмерный уход приносит коже такой же вред, как и полное игнорирование правил личной гигиены!
Проблема состоит в том, что эти самые условные друзья — симбионты в большом количестве вызывают гнойные процессы на коже и слизистых оболочках, а в малом количестве ее защищают. Диалектика! Необычайно гомеопатично. Не правда ли?
Микрофлора пищеварительного тракта в норме: Самыми «грязными» участками ЖКТ являются рот и прямая кишка. Обращаю внимание на этот факт любителей половых перверзий: анального и орального секса.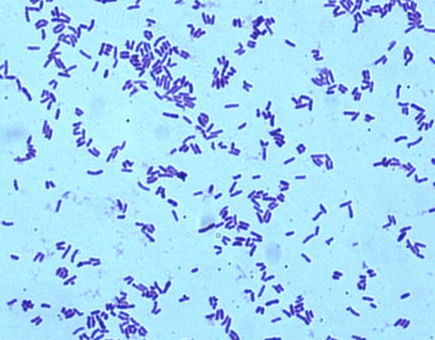 Не удивляйтесь печальным последствиям сомнительных пристрастий в виде воспалений мочеполовой сферы.
Не удивляйтесь печальным последствиям сомнительных пристрастий в виде воспалений мочеполовой сферы.
Итак, в норме во рту встречаются: дифтероиды, вибрионы, спирохеты, спириллы, ацидофильные палочки, простейшие, лактобактерии, микрококки, диплококки, стрептококки, актиномицеты. Симбионты-сапрофиты(нормальная флора) могут вызывать кариес при их способности к кислотообразованию и достаточном количестве углеводов – информация для сластен. К кариогенной (вызывающей кариес) микрофлоре относят Streptococcuc mutans.
Микрофлора желудка крайне бедна, что объясняется защитными (бактерицидными) свойствами пищеварительных соков. При заболеваниях желудка ситуация меняется и все бактерии, без разбора, попадают в кишечник.
Микрофлора двенадцатиперстной кишки и вообще тонкой кишки в норме: молочнокислые, бифидобактерии, фекальный стрептококк.
Флора толстого кишечника в норме: бифидобактерии, молочнокислые бактерии, кишечная палочка, бактероиды, клостридии, клебсиела, протей, энтеробактер, стрептококки, стафилококки, дрожжи.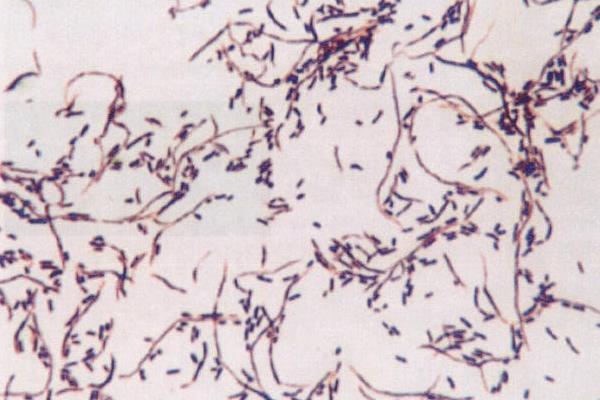 Общая масса бактерий этого отдела кишечника составляет 13 от каловых масс! Представляете, какое количество токсинов-продуктов их (микробного) обмена поступает в кровь человека при склонности к запорам?
Общая масса бактерий этого отдела кишечника составляет 13 от каловых масс! Представляете, какое количество токсинов-продуктов их (микробного) обмена поступает в кровь человека при склонности к запорам?
Физиологическая ценность Бифидобактерий – синтез витаминов группы «В»(В1, Фолиевой кислоты, никотиновой кислоты), способствуют усвоению солей кальция, витамина Д, железа то есть предотвращают остеопороз, анемию. При кормлении детей грудью содержание у них в кишечнике бифидобактерий значительно больше нежели у детей с искусственным вскармливанием.
Лактобактерии(молочнокислые бактерии) – так же являются нормальной флорой кишечника. Основные виды лактобактерий: L. Fermenti, L. Acidophilus, L. Casei, L. Plantarum, L. Brevis.
Так что же собственно называется дисбактериозом?
Дисбактериоз это нарушение изначального соотношения «полезных», «вредных» и «условно вредных» микроорганизмов. Такое нарушение чаще всего возникает после массивного или частого применения антибиотиков. Степень клинического проявления дисбактериоза зависит от состояния организма, его реактивности. Далеко не всегда нарушения в нормальной микрофлоре приводят к ярким проявлениям, в силу больших компенсаторных возможностей нашего тела. Однако любой предрасполагающий момент: стрессы, острые заболевания, травмы и т. д. может способствовать появлению заболеваний, связанных с условно – патогенной флорой кишечника. Базой для возникновения дисбактериоза являются воспалительные заболевания желудочно – кишечного тракта: гастрит, колит, энтерит, ахилия (недостаток секреции саляной кислоты и пищеварительных ферментов желудком). Первыми на Дисбактериоз откликаются стафилококк, грибки рода Candida и кишечная палочка – они начинают бешено делиться, вызывая нагноения и воспаления в разных частях тела. Причем патогенные (болезнетворные) микробы часто имеют устойчивость к антибиотикам, в отличии от полезной флоры. Наиболее серьёзно Дисбактериоз проявляется у детей в возрасте до трех лет. Более старшие дети и взрослые люди гораздо легче переносят нарушения флоры кишечника (очевидно за счет больших компенсаторных возможностей).
Степень клинического проявления дисбактериоза зависит от состояния организма, его реактивности. Далеко не всегда нарушения в нормальной микрофлоре приводят к ярким проявлениям, в силу больших компенсаторных возможностей нашего тела. Однако любой предрасполагающий момент: стрессы, острые заболевания, травмы и т. д. может способствовать появлению заболеваний, связанных с условно – патогенной флорой кишечника. Базой для возникновения дисбактериоза являются воспалительные заболевания желудочно – кишечного тракта: гастрит, колит, энтерит, ахилия (недостаток секреции саляной кислоты и пищеварительных ферментов желудком). Первыми на Дисбактериоз откликаются стафилококк, грибки рода Candida и кишечная палочка – они начинают бешено делиться, вызывая нагноения и воспаления в разных частях тела. Причем патогенные (болезнетворные) микробы часто имеют устойчивость к антибиотикам, в отличии от полезной флоры. Наиболее серьёзно Дисбактериоз проявляется у детей в возрасте до трех лет. Более старшие дети и взрослые люди гораздо легче переносят нарушения флоры кишечника (очевидно за счет больших компенсаторных возможностей).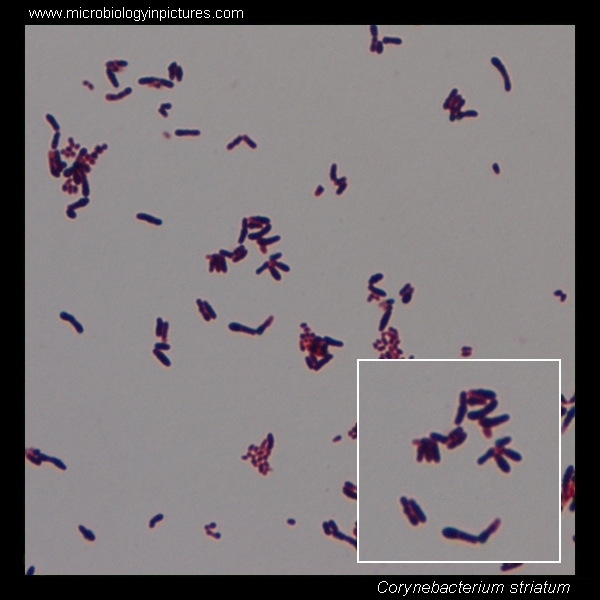 Весьма проблемна ситуация заселения болезнетворной флорой тонкого кишечника так как именно там происходит всасывание основного количества питательных веществ:
Весьма проблемна ситуация заселения болезнетворной флорой тонкого кишечника так как именно там происходит всасывание основного количества питательных веществ:
- микробы начинают конкурировать с хозяином за использование пищи в своем обмене.
- продукты их жизнедеятельности (индол, скатол, фенол, аммоний и т. д. ) из просвета кишечника поступают в кровь, что основательно нагружает печень как орган обезвреживающий все токсины.
- Микробная ферментация пищевого гистидина приводит к накоплению гистамина, что провоцирует аллергические реакции, особенно на фоне снижения гистаминазы – фермента кишечника, инактивирующего гистамин).
- Гиповитаминоз по многим витаминам приводит к сильным обменным проблемам.
- Снижают иммунитет человеческого организма (особенно это касается лизоцима, который уменьшает проницаемость сосудистых тканевых барьеров). При его недостатке бактерии попадают в кровь (бактериемия) и разносятся по всему организму.

- Провоцируют выделение в просвет кишки иммуноглобулинов, что сенсибилизирует (аллергизирует) организм. Не исключено, что так стартуют аутоаллергические процессы – атака иммунной системы на ткани своего организма (воспаления щитовидной железы, суставов и т. д. ).
- Дисбактериоз в крайней степени декомпенсации может привести к развитию сепсиса, псевдомембранозного энтероколита.
- Кишечная палочка может приводить к холециститу, аппендициту, перитониту, отиту, менингиту, пневмонии, абсцессам, сепсису, циститу, пиелонефриту.
- Нередко к кишечной палочке присоединяется энтерококк, который знаменит подлой способностью быстро делиться (размножаться) даже при комнатной температуре. Его излюбленным местом является влагалище, где он вызывает воспаление.
- Протей при дисбактериозе может вызывать менингит, энцефалит, мочеполовые воспаления, энтероколиты, пневмонии, сепсис.
- Грибы рода кандида (Candida albicans) способны поражать практически все органы, в том числе и внутренние, проникая через кишечную стенку в кровь, откуда и разносятся по всему организму.

- Очень злобной особой показывает себя и синегнойная палочка, которая способна вызывать разнообразные и грозные воспалительные реакции.
- Капсульная бактерия (klebsiella aerogenes) – еще один коварный агрессор, активизирующийся при дисбактериозе и вредящий нашему здоровью. К сожалению даже этот, не малый уже, список далеко не полон и помещен он (список) в этой статье только с одной целью: показать, что центральным звеном во взаимоотношении человека с окружающей средой является его иммунитет со всеми его многочисленными факторами. Вот чем надо заниматься, а не хвататься по поводу и без повода за антибиотики. Ведь применение антибактериальных препаратов, само по себе, имеет естественные ограничения и золотую середину и является средством не первой помощи, а резервным способом подавления далеко зашедших инфекционных заболеваний. В противном случае нам угрожает Дисбактериоз со всеми вытекающими из этого последствиями.
Таким образом Дисбактериоз — это сложный процесс, отягощающее основное заболевание, а в ряде случаев являющийся основным звеном в патогенезе (развитии болезни). Общей чертой микроорганизмов, вызывающих Дисбактериоз, является их устойчивость к антибиотикам.
Общей чертой микроорганизмов, вызывающих Дисбактериоз, является их устойчивость к антибиотикам.
Любой представитель бактериальной флоры при уменьшении содержания типичных представителей аутофлоры и снижении ее антагонистического воздействия может занять доминирующее положение в заселении кишечника, причем приобретают особо агрессивные свойства.
Интересен факт, что кишечная флора новорожденных тождественна флоре персонала роддома, а не материнской флоре. Что наводит на очевидную мысль: внешний вид персонала является одним из самых важных факторов при выборе места рождения вашего ребенка.
Дисбактериоз часто проявляется в виде воспаления гепатобилиарной системы: холециститах, холангитах, гепатотоксемического синдрома.
Признаки воспаления кишечника – муцин и тканевой белок в кале.
В крови и желчи признаком воспаления может быть лизоцим (при снижении его активности можно говорить о воспалении). Иммуноглобулины и комплемент крови наоборот повышаются при воспалении.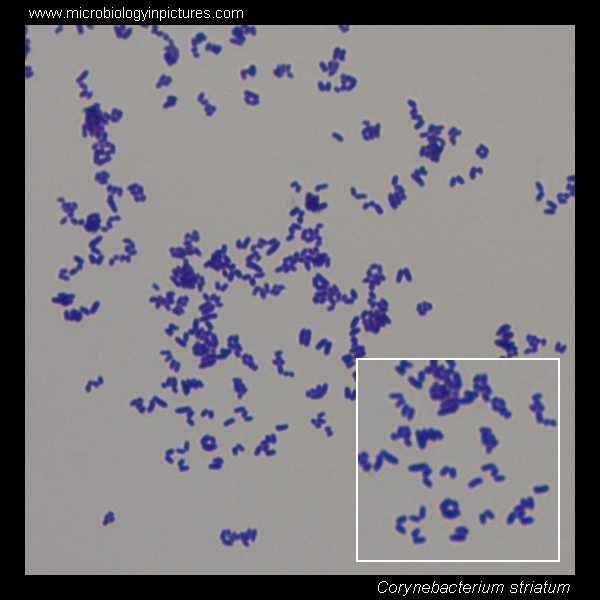 Не следует забывать, что антибиотики снижают активность многих ферментов, в том числе и лизоцима.
Не следует забывать, что антибиотики снижают активность многих ферментов, в том числе и лизоцима.
Лечение и профилактика дисбактериоза
Самолечение при дисбактериозе крайне затруднительно, но если у вас есть предубеждение перед врачами, ниже представлены отечественные препараты для решения этой проблемы.
Колибактерин выпускается в виде таблеток и во флаконах. Не надо забывать, что при лечении дисбактериоза при неспецифическом язвенном колите колибактерин часто вызывает обострение. Дается колибактерин за 30-40 минут до еды, 10-12 доз(таблеток) в сутки, детям до 1 года дают 2-3 дозы, до 3 лет 8доз. Длительность курса от 3 недель до 2 месяцев. Детям первых месяцев жизни колибактерин не показан! Кишечная палочка обладает ярко выраженной способностью к подавлению палочек брюшного тифа. Колибактерин(штамм М-17) не инактивируется протейным бактериофагом, поэтому рекомендован для, совместного с ним, лечения дисбактериоза.
Бифидумбактерин – сами образуют вокруг себя кислую среду, в которой с удовольствием размножаются. Поэтому при сочетании бифидобактерий с молочнокислыми бактериями эффект наиболее выражен. В молоке кормящей женщины содержаться бифидум факторы (лактулоза, бифидус фактор- 1 и бифидус фактор- 2).
Поэтому при сочетании бифидобактерий с молочнокислыми бактериями эффект наиболее выражен. В молоке кормящей женщины содержаться бифидум факторы (лактулоза, бифидус фактор- 1 и бифидус фактор- 2).
Применение 23 молока и 13 -7% лактозы обеспечивает быстрое размножение бифидобактерий и ацидофильных палочек в кишечнике. Наибольшей активностью бифидум бактерии обладают против возбудителей дизентерии, энтеропатогенных палочек и сальмонелл. Детям до 6 месяцев – 1-2 дозы 3 раза в день. Более встаршим детям и взрослым2-3 раза в день от 3 до 5 дозна прием. Курс 30 дней с повторением через 10 дней.
Лактобактерин – Наиболее устойчивыми к антибиотикам оказались L. Fermenti и L. Plantarum. Это свойство важно при совмесном применении с антибактериальными препаратами. Очень важно, что у L. Fermenti не обнаружено трансмиссивных плазмид множественной антибиотикорезистентности. Это послужило поводом для выбора именно этого штамма для производства лактобактерина. Лактобактерии(особенно L.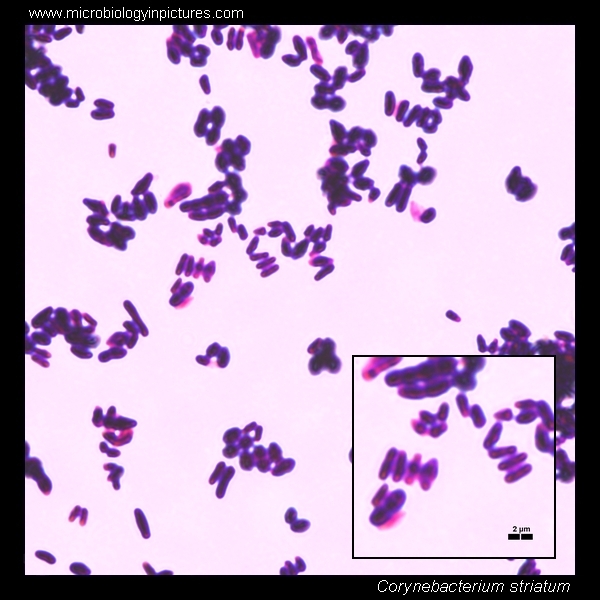 Plantarum) является естественным антагонистом протея. Лактобактерии наиболее активно размножаются в кислой среде.
Plantarum) является естественным антагонистом протея. Лактобактерии наиболее активно размножаются в кислой среде.
Свойства лактобактерий:
- Свою антагонистическую активность лактобактерии проявляеют посредством молочной кислоты, которая выделяется в большом количестве при сбраживании ими молочного сахара.
- Молочная кислота используется в организме при переводе кальция в растворимую форму лактата кальция, который легко усваивается в организме.
- Участвуют в синтезе витаминов.
- Участвуют в расщеплении белков с образованием незаменимых аминокислот.
- Образуя кислую среду стимулируют деление бифидобактерий.
- В отличии от бифидобактерий лактобактерии легко сквашивают молоко, что удобно при производстве молочнокислых продуктов. Назначают от 1 до 10 доз в сутки в зависимости от возраста. За 30 минут до еды, 10-15 дней. Рекомендовано сочетать прием лактобактерина ис витамином «С».

- Наиболее эффектифно лактобактерин назначать с первых дней инфекционных болезней (дизентерии). При хронической инфекции лактобактерин может применяться курсом до 5 месяцев. Возможна профилактика в течении 1-2 месяцев колибактерином или лактобактерином.
Бификол и другие ассоциированные препараты:
Комбинированный препарат с B.bifidum и E. Coli M-17.
Бактериофаги: Вирусы, уничтожающие микробы. Обладают большой избирательностью. В природе бактериофаги являются естественными факторами самоочищения.
Существуют разнообразные бактериофаги: дизентерийный, брюшнотифозный, сальмонелезный, коли-протейный. Бактериофаги совнршенно не переносят ультрафиолетовый свет, поэтому хранятся в темном месте. При высокой эффективности у этого метода лечения есть проблемы: необходима постоянная работа по выявлению новых видов бактериофагов, для действия на постоянно изменяющихся микробов. Кислая среда инактивирует бактериофаги поэтому они предпочитают щелочную среду.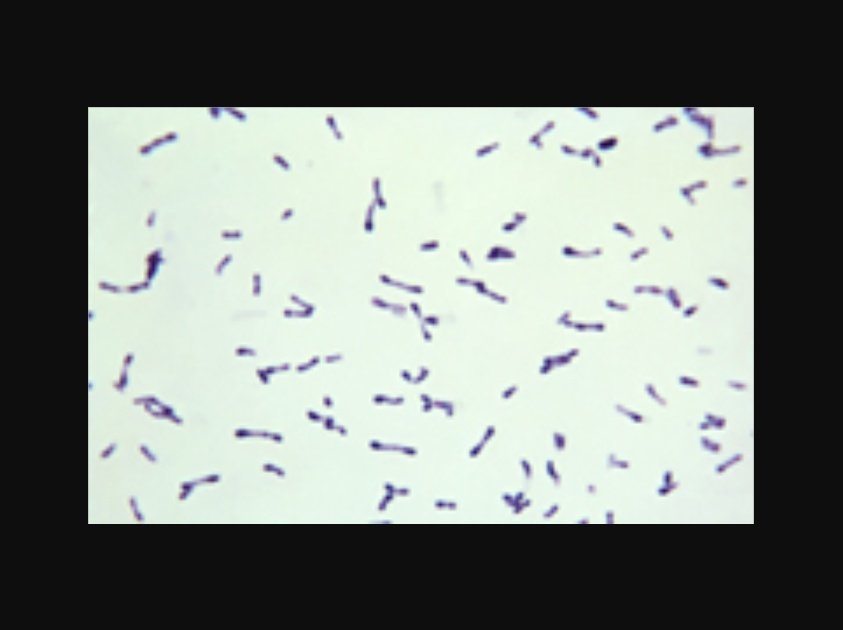
Льготные цены и скидки на повторные приемы действительны только при записи по прямым телефонам центра.
витамины, диагноз, как проявляется, симптомы и лечение
Показания
Женщинам репродуктивного возраста, даже не предъявляющим жалоб на состояние здоровья, показан анализ мазка на флору дважды в год. Это позволяет на ранних стадиях выявить возможные отклонения в работе мочеполовой системы и провести при необходимости лечение.
Срочно сдать анализ рекомендуется в следующих случаях:
- появились обильные выделения из влагалища;
- беспокоит зуд гениталий;
- при мочеиспускании возникает боль и жжение;
- во время полового акта появляется резь и боль;
- выделения из половых путей стали неприятно пахнуть и приобрели зеленоватый оттенок;
- при беременности.
Забор материала происходит безболезненно для женщины, а расшифровка гинекологического мазка доступна в течение рабочего дня, кроме бактериологического посева.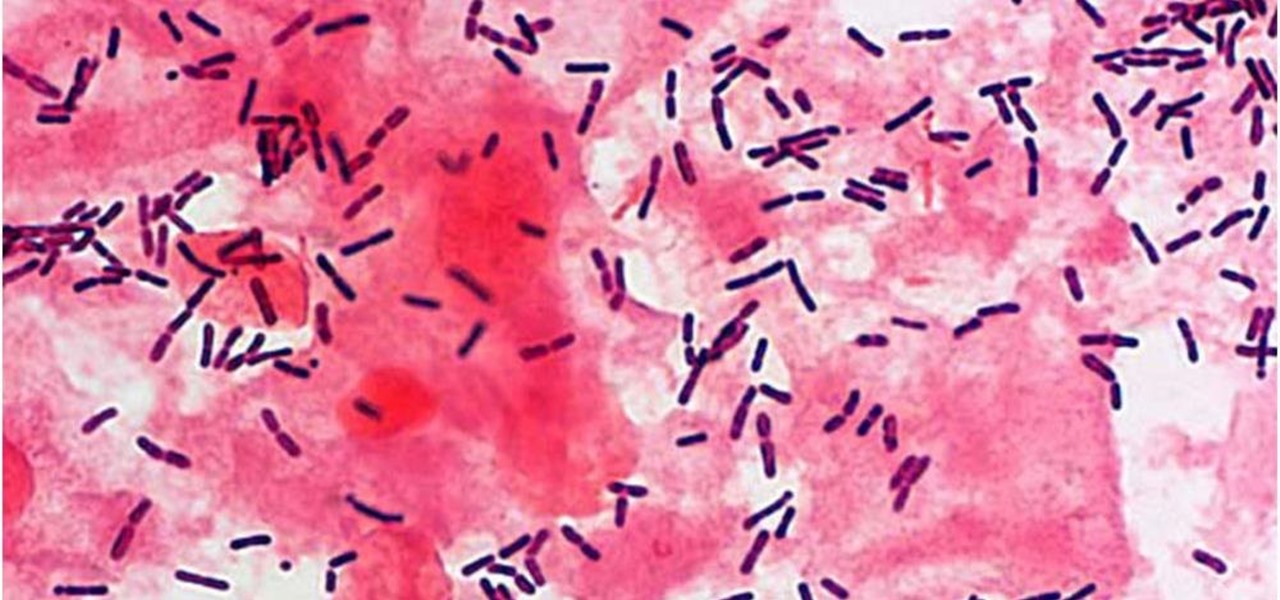
Нормальные показатели
Установить нормальные значения содержания детрита в кале может только лечащий врач. При этом недопустимо изолированное применение критерия или копрограммы для установления окончательного диагноза. Комплексное обследование помимо лабораторной диагностики должно сопровождаться УЗИ органов брюшной полости и гастроскопией.
Детрит в копрограмме в большинстве случаев выявляется и в норме, что объясняет столь широкий разброс допустимых значений критерия в результатах анализа от малого до значительного. Как правило, у здоровых детей и взрослых пациентов обнаруживается умеренное содержание детрита исследуемом биоматериале.
Полноценный процесс пищеварения предполагает выделение непереваренных и переваренных остатков пищевого комка. При этом также выделяются представители кишечной микрофлоры, что является вариантом физиологической нормы.
youtube.com/embed/N_VtTK7ctj8?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Подготовка
Достоверность результатов анализа зависит от соблюдения простых подготовительных правил.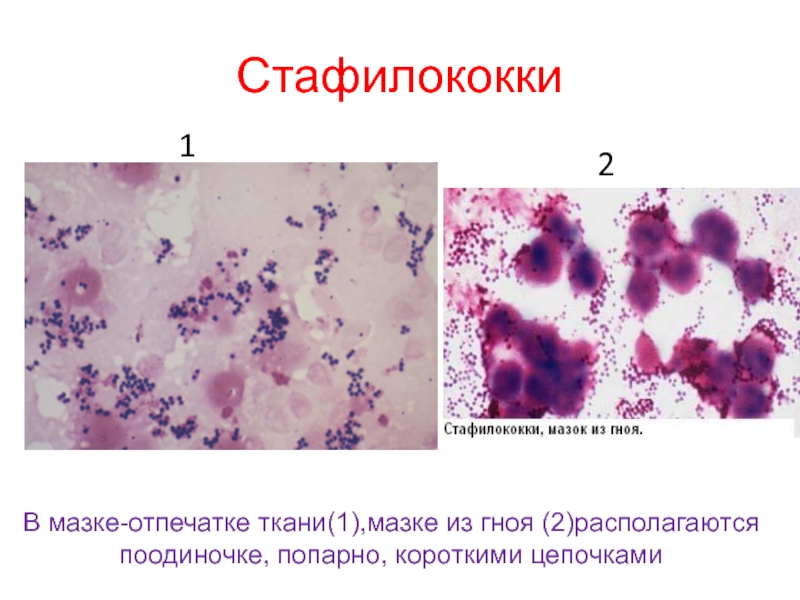 Мазок нельзя сдавать во время месячных. Допускается взятие биоматериала спустя 3-4 дня после окончания менструальных выделений. За 2 дня до обследования женщине необходимо отказаться от сексуальных отношений, спринцеваний, использования свечей, мазей, гелей для интимной гигиены.
Мазок нельзя сдавать во время месячных. Допускается взятие биоматериала спустя 3-4 дня после окончания менструальных выделений. За 2 дня до обследования женщине необходимо отказаться от сексуальных отношений, спринцеваний, использования свечей, мазей, гелей для интимной гигиены.
Чтобы не получить плохой мазок на флору, женщина за пару часов до посещения женской консультации тщательно проводит туалет наружных половых органов. Последнее мочеиспускание должно быть не позднее двух часов до забора биоматериала.
Что еще можно обнаружить в мазке
При выполнении бактериоскопии можно сделать оценку биоценоза. Такое исследование еще называют мазком на стафилококк.
Но совместно с этим не исключено выявление псевдомицелия, смешанной микрофлоры, определяются грибковые споры, энтеробактерии, стрептококки, гемофильная палочка, коринебактерии. Они относятся к потенциальным возбудителям вагинита, вульвита и вульвовагинита.
Они относятся к потенциальным возбудителям вагинита, вульвита и вульвовагинита.
Нормой содержания во влагалищной среде для условно-патогенных микроорганизмов является показатель не более 104 КОЕ (колониеобразующих единиц). При повышенном содержании нельзя исключать воспаление, могут присутствовать нейтрофильные лейкоциты (более 5 в поле зрения).
youtube.com/embed/st2ER38XBLs?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Нормы
При взятии биоматериала гинеколог латинской буквой обозначает место его забора: V –мазок из влагалища; С – из шейки матки; U – из уретры (мочеиспускательного канала). Расшифровка гинекологического мазка на флору включает в себя следующие показатели:
- Эп. или пл. эп. – это эпителиальные клетки;
- L – лейкоциты;
- Гр.+ — палочки Дедерлейна;
- Gn – гонококки;
- Trich – трихомонады;
- ключевые клетки;
- слизь;
- дрожжеподобные грибы Кандида.

Здоровая микрофлора влагалища на 90% состоит из лактобацилл (молочных бактерий) – палочек Дедерлейна. В кодировке мазка они занимают ключевое место и квалифицируют степень чистоты влагалища.
I степень
Множественное скопление лактобактерий. Эпителий и лейкоциты практически не попадают в поле зрения. Слизи немного.
II степень
Лейкоциты не превышают норму. Эпителиальных клеток и слизи немного. Достаточно палочек Дедерлейна. Незначительно определяются условно-патогенные бактерии или дрожжевые грибки.
III степень
Лактобацилл немного. Лейкоциты значительно выше нормы. В большом количестве обнаруживаются болезнетворные бактерии, эпителиальные клетки и слизь.
IV степень
Палочек Дедерлейна практически нет. Сплошь определяются лейкоциты и болезнетворные бактерии.
Нормальные результаты мазка на флору не должны содержать атипичные ключевые клетки. Если они присутствуют в биоматериале, то женщину отправляют на дополнительное детальное обследование, включающее биопсию, кольпоскопию, консультацию онколога.
Коринебактерия дифтерии
Corynebacterium diphtheriae является возбудителем опасного для человека заболевания — дифтерии. В настоящее время патология регистрируется крайне редко и лишь у отдельных лиц, которые, скорее всего, не были своевременно вакцинированы.
Распространение инфекции происходит воздушно-капельным или контактным путем во время общения с больными людьми или через инфицированные предметы. В случае заражения пищевых продуктов становится актуальным алиментарный путь. В эпидемиологическом отношении наибольшую опасность представляют здоровые бактерионосители.
В зависимости от расположения первичного очага инфекции выделяют различные формы заболевания. Спустя 7-10 дней инкубации появляются первые клинические признаки. Фибринозное воспаление развивается в месте локализации патологического очага. Оно приводит к разрушению эпителиоцитов и кровеносных сосудов. В постепенно образующемся экссудате содержится много фибриногена, который сворачивается и образует налет на слизистой серо-белого цвета. Он плотно спаивается с подслизистым слоем и не поддается снятию. При попытке удалить налет начинается кровотечение. Кроме местных признаков воспаления, обусловленных локализацией входных ворот инфекции, возникает тяжелая интоксикация с лихорадкой, ознобом, гипергидрозом, ломотой в теле, вялостью, бледностью кожи, адинамией, гипотонией и прочими признаками.
Он плотно спаивается с подслизистым слоем и не поддается снятию. При попытке удалить налет начинается кровотечение. Кроме местных признаков воспаления, обусловленных локализацией входных ворот инфекции, возникает тяжелая интоксикация с лихорадкой, ознобом, гипергидрозом, ломотой в теле, вялостью, бледностью кожи, адинамией, гипотонией и прочими признаками.
Дифтерия зева — самая опасная форма инфекции, способная привести к развитию крупа, который является причиной смертельного исхода. Он обусловлен отеком слизистой гортани и выраженной асфиксией.
Основным диагностическим методом дифтерии является микробиологический. При появлении плотных фибриновых пленок и отека глотки или других частей тела необходимо взять у больного мазок на дифтерию и начать данное исследование. Отделяемое зева, слизь из носа, налет с миндалин — биоматериал, который доставляют в бактериологическую лабораторию для проведения анализа. Его засевают на среды, содержащие сыворотку или кровь с теллуритом калия, который угнетает рост вторичной микрофлоры.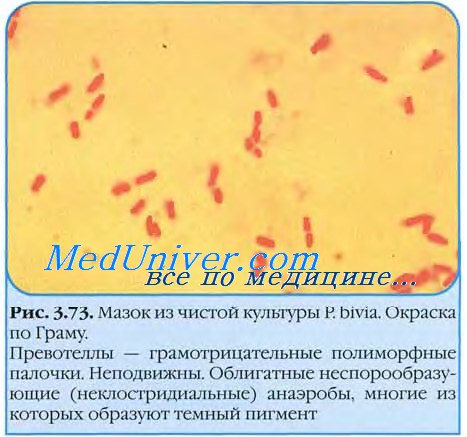 После инкубации выросшие колонии микроскопируют, накапливают чистую культуру и проводят окончательную идентификацию до вида. Для клиницистов важны результаты серо- и фаготипирования. Определение токсигенности выделенной культуры имеет важное диагностическое значение.
После инкубации выросшие колонии микроскопируют, накапливают чистую культуру и проводят окончательную идентификацию до вида. Для клиницистов важны результаты серо- и фаготипирования. Определение токсигенности выделенной культуры имеет важное диагностическое значение.
Этиотропная терапия дифтерии заключается во введении больным антитоксической сыворотки, антибиотиков и сульфаниламидов. Симптоматическая и патогенетическая терапия улучшают общее состояние больных, избавляя их от симптомов. После снятия острых явлений патологии показаны санирующие физиопроцедуры — ультразвук и лазеротерапия непосредственно на очаг.
Чтобы предупредить развитие такого серьезного заболевания, как дифтерия, проводят всеобщую иммунизацию населения вакциной АКДС в соответствии с Национальным календарем прививок. Массовая вакцинация в настоящее время значительно снизила показатели заболеваемости дифтерией и смертности от нее.
Corynebacterium non diphtheriae являются обитателями внешней среды.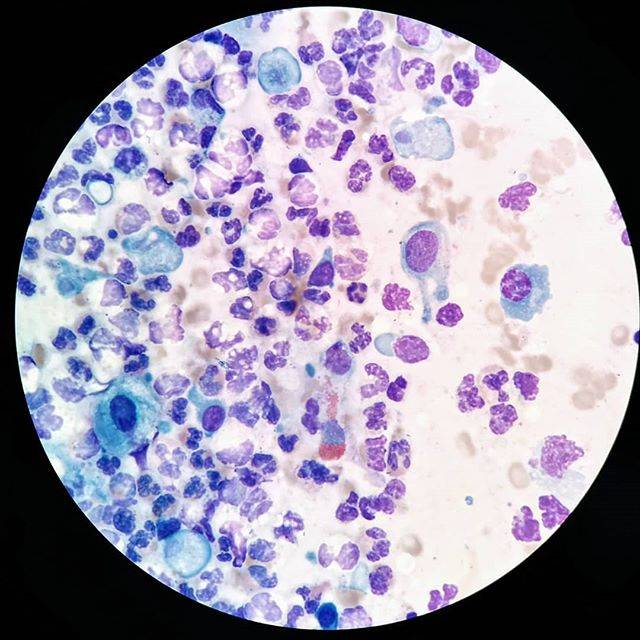 Они обнаруживаются на коже и слизистой внутренних органов, являясь представителями нормоценозов. У ослабленных лиц из группы риска эти микробы способны вызывать воспалительные процессы, которые протекают также тяжело, как заболевания, вызванные безусловными патогенами. Чтобы правильно подобрать этиотропную терапию и вылечить больного, необходимо точно и быстро идентифицировать микроб.
Они обнаруживаются на коже и слизистой внутренних органов, являясь представителями нормоценозов. У ослабленных лиц из группы риска эти микробы способны вызывать воспалительные процессы, которые протекают также тяжело, как заболевания, вызванные безусловными патогенами. Чтобы правильно подобрать этиотропную терапию и вылечить больного, необходимо точно и быстро идентифицировать микроб.
Расшифровка
Слизь в мазке на флору у женщин считается нормой, когда она в сносном количестве. Если слизистых тяжей много, то это подтверждает существование воспалительных заболеваний мочеполовой системы. Врач может заподозрить уретрит, кольпит, эндоцервицит, вульвовагинит, эндометрит.
У здоровой женщины сумма клеток плоского эпителия в мазке не должна превышать 10 в поле зрения. Отсутствие показателя вовсе указывает на гормональный дисбаланс в организме. Основной причиной атрофического типа мазка является понижение уровня эстрогена и превышение количества мужского гормона. Такое состояние бывает в период менопаузы.
Иногда расшифровка гинекологического мазка содержит фразу «сапрофитная микрофлора в бакпосеве». Это означает, что в организме женщины обнаружены условно болезнетворные бактерии, которые в маленьком количестве абсолютно безвредны.
Превышение нормы их содержания провоцируют воспалительные и инфекционные заболевания. Например, дифтероиды в мазке на флору вызывают бактериальный вагиноз, enterobacter aerogenes в бакпосеве говорит о недостаточной личной гигиене женщины, грибки рода Candida являются причиной молочницы.
Бывают ситуации, когда микрофлора отсутствует в мазке. Первопричина данного состояния – это высокодозная терапия антибактериальными средствами. Лекарственные препараты подобного рода способны убивать всё на своем пути, поэтому при лечении ими нужно пить пробиотики. Вторая причина – частые спринцевания, особенно накануне исследования.
Обнаруженные в мазке на флору эритроциты считаются нормой, если их количество не превышает 2-5 в поле зрения врача-лаборанта.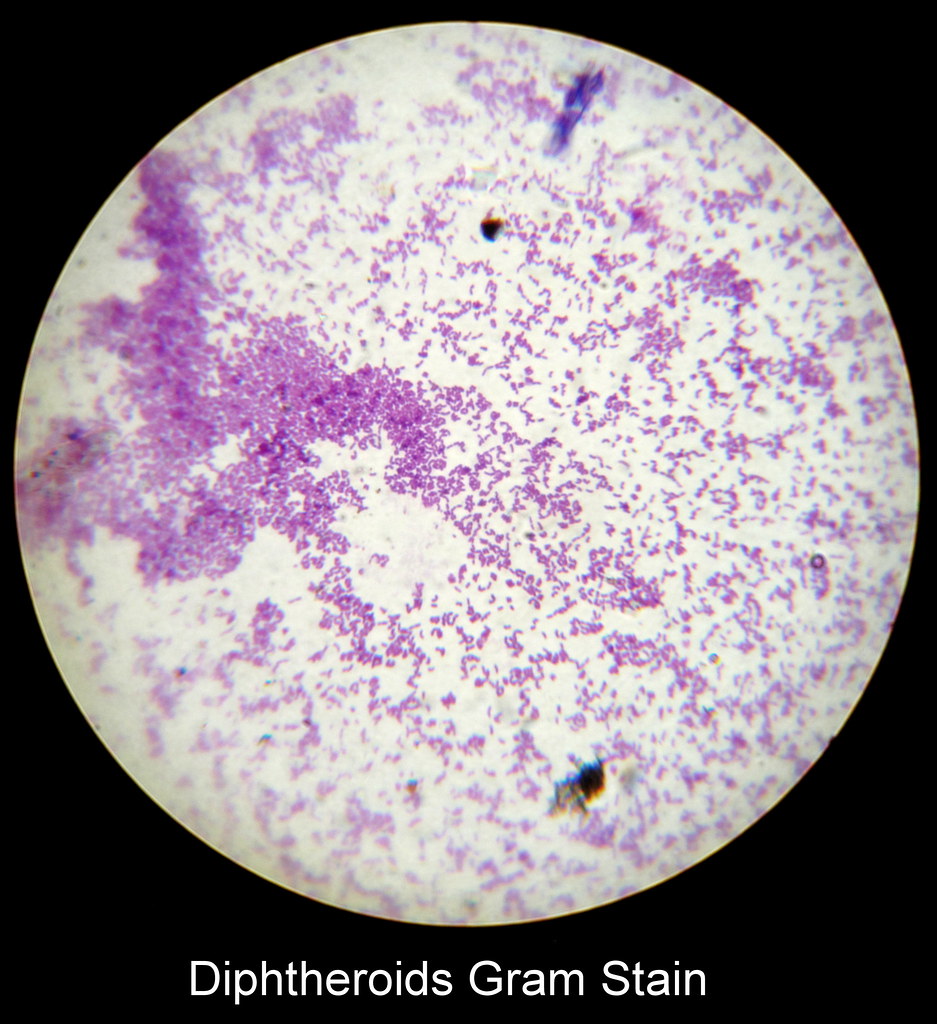 Все дело в том, что гинекологический мазок берется щеточкой с ворсинками, которые из-за своей упругости могут незначительно поцарапать тонкую слизистую половых органов.
Все дело в том, что гинекологический мазок берется щеточкой с ворсинками, которые из-за своей упругости могут незначительно поцарапать тонкую слизистую половых органов.
Большое количество эритроцитов в результатах исследования косвенно свидетельствует о наличии воспалительного процесса. Сильное воспаление делает ткани шейки матки более ранимыми и при заборе мазка щеточка повреждает их до крови. Естественными причинами попадания эритроцитов в биоматериал считаются следующие моменты:
- забор мазка во время менструации;
- период овуляции женщины;
- 26-28 день менструального цикла – начало менструальных выделений.
Часто при расшифровке мазка указывается фраза – фагоцитоз не завершен. Такое определение говорит о выживании и даже размножении болезнетворных микроорганизмов в клетках иммунной системы, которые призваны защищать организм путём поглощения чужеродных агентов.
Ослабленный иммунитет не способен в полной мере бороться с болезнями, поэтому врач может назначить курс иммуностимулирующих препаратов или антибиотики.
Коринебактерии
Бактерия делится на несколько типов, каждый из которых уникален, обладает особенностями специфического характера. Исходя из разновидности, микроорганизмы поражают кожу, влияют на работу внутренних органов. Риску подвергаются люди, имеющие слабый иммунитет. Бактериемия начнет развитие в случае, когда бактерии поразят брюшные, венозные катетеры.
Микроорганизмы подразделяются:
- На коринебактерии, поражающие представителей растительного мира;
- Бактерии-паразиты, наносящие вред животным и человеческим организмам;
- Непатогенные коринебактерии, обитающие в среднем объеме в здоровом организме. Населяют область дыхательных и репродуктивных органов, кожи, слизистых оболочек.
При наличии у мужчин или женщин коринебактерий, велика вероятность появления септического артрита, пневмонии.
При беременности
За все время вынашивания беременности женщина сдает анализ на флору не менее четырех раз. Результаты анализа у нее будут немного отличаться от нормальных показателей не беременных пациенток. Во-первых, сильно увеличивается численность палочек Дедерлейна, что обеспечивает кислую среду во влагалище. Так организм женщины повышает защиту плода от вторжения в матку возбудителей болезней.
Во-первых, сильно увеличивается численность палочек Дедерлейна, что обеспечивает кислую среду во влагалище. Так организм женщины повышает защиту плода от вторжения в матку возбудителей болезней.
Возможно определение значительного количества лейкоцитов и эпителия. Это обусловлено перестройкой гормонального фона, колебаниями рН влагалища и усилением выделений. В остальных показателях разницы не видно, ведь при выявлении болезнетворных возбудителей или дрожжеподобных грибков необходимо назначение щадящего лечения.
Простой и безболезненный метод исследования способствует выявлению хронических инфекций, дисбактериоза, а также оценивает защитные возможности женского организма. После получения результатов анализа необходимо посетить врача-гинеколога для расшифровки показателей и при необходимости назначения адекватного лечения.
Поделиться:
Мобилункус
Существуют скрытые инфекционные заболевания, включающие опасные бактерии, такие как mobiluncus spp и corynebacterium spp, присутствующие в ДНК.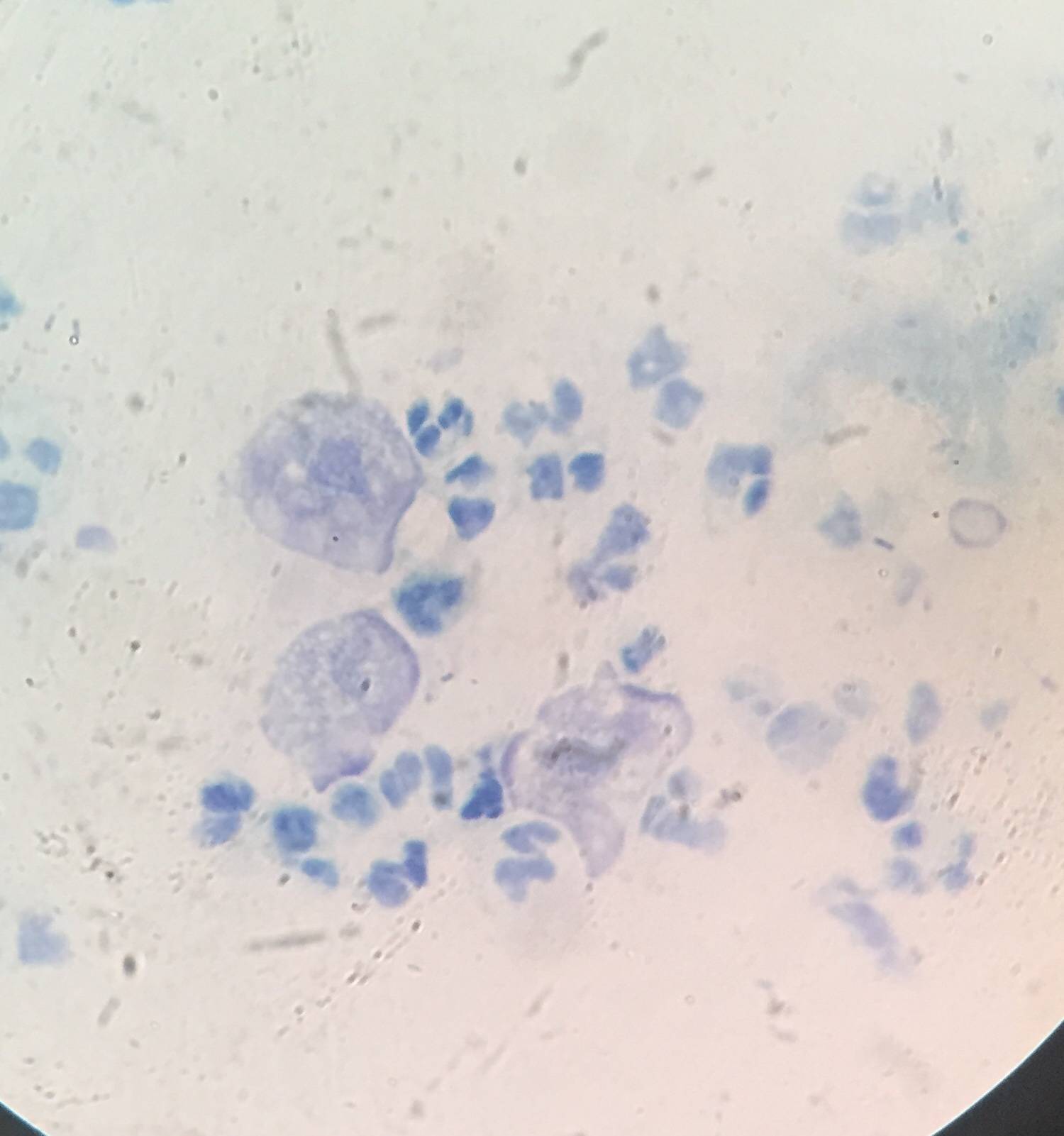 Наличие в моче, в сперме или в мазке опасных бактерий приведет к воспалительным процессам. У мужчин развивается патология урогенитального тракта, приводящая к орхоэпидидимиту, простатиту, негонококковому уретриту и прочим.
Наличие в моче, в сперме или в мазке опасных бактерий приведет к воспалительным процессам. У мужчин развивается патология урогенитального тракта, приводящая к орхоэпидидимиту, простатиту, негонококковому уретриту и прочим.
Часто подвижный микроорганизм встречается в женских влагалищных выделениях, как имеющих бактериальный вагиноз, так и у здоровых. При скоплениях мобилункуса в области прямой кишки, может возникнуть контаминация влагалища, во время анального секса произойдет заражение.
Чтобы диагностировать наличие бактерии, пользуются несколькими методами:
- Полимеразной цепной реакцией;
- Бактериоскопическим исследованием.
- Серологическими методами.
Интимная тема — статьи от специалистов клиники «Мать и дитя»
Нормальная микрофлора
Микрофлора влагалища – это сообщество разных микроорганизмов, живущих в определенной среде. В норме 95% микрофлоры влагалища – это молочнокислые бактерии, палочки Дедерлейна (лактобактерии): они вырабатывают молочную кислоту и не дают возможности закрепиться и размножаться во влагалище нежелательным бактериям. Благодаря деятельности лактобактерий среда во влагалище кислая, именно такая среда подавляет рост различных болезнетворных микроорганизмов. Если по каким-то причинам среда становится щелочной, то ее защитные свойства снижаются и вероятность заболеть увеличивается. Остальные 5% микроорганизмов во влагалище – это условно патогенная флора: кишечная палочка, стафилококки, стрептококки, гарднерелла, грибы (условно патогенной флора называется потому что, присутствуя в организме в небольшом количестве, она не наносит ему вреда). При особых обстоятельствах (стресс, прием антибиотиков, снижение иммунитета, изменение гормонального фона) условно патогенные бактерии могут активизироваться и начать размножаться. Однако более неприятны для женщины те микроорганизмы, которые попадают во влагалище извне, например, во время полового акта. Самые частые опасные микроорганизмы – это гонококки, (вызывающие гонорею), трихомонады (из-за которых начинается трихомониаз), вирус герпеса, хламидии, микоплазмы.
Благодаря деятельности лактобактерий среда во влагалище кислая, именно такая среда подавляет рост различных болезнетворных микроорганизмов. Если по каким-то причинам среда становится щелочной, то ее защитные свойства снижаются и вероятность заболеть увеличивается. Остальные 5% микроорганизмов во влагалище – это условно патогенная флора: кишечная палочка, стафилококки, стрептококки, гарднерелла, грибы (условно патогенной флора называется потому что, присутствуя в организме в небольшом количестве, она не наносит ему вреда). При особых обстоятельствах (стресс, прием антибиотиков, снижение иммунитета, изменение гормонального фона) условно патогенные бактерии могут активизироваться и начать размножаться. Однако более неприятны для женщины те микроорганизмы, которые попадают во влагалище извне, например, во время полового акта. Самые частые опасные микроорганизмы – это гонококки, (вызывающие гонорею), трихомонады (из-за которых начинается трихомониаз), вирус герпеса, хламидии, микоплазмы.
Микрофлора и беременность
Во время беременности под влиянием гормонов флора влагалища меняется. Чаще всего в ней появляется избыточное количество микроорганизмов рода Candida – грибка, который входит в состав нормальной микрофлоры ротовой полости, влагалища и толстого кишечника большинства здоровых людей. Грибок может мирно обитать в организме человека, не доставляя ему абсолютно никаких неудобств.
У беременных женщин кандидоз встречается в 2–3 раза чаще, чем вне беременности. Основная причина – это повышение уровня женских половых гормонов, что и приводит к созданию благоприятных условий для размножения грибков. Во время беременности среда во влагалище становится более кислой, и именно в таких условиях легко размножаются грибки рода Candida.
Еще одна причина возникновения молочницы – снижение иммунитета в период ожидания малыша. Изменение иммунного статуса наблюдается у каждой беременной и не является патологией. Сам по себе плод чужероден для тканей матери и для того, чтобы иммунная система его «не замечала», природой запланировано закономерное снижение активности защитной системы материнского организма. Кроме того, прогестерон – гормон беременности, достигая высокого уровня, сам по себе оказывает иммуносупрессивное действие.
Сам по себе плод чужероден для тканей матери и для того, чтобы иммунная система его «не замечала», природой запланировано закономерное снижение активности защитной системы материнского организма. Кроме того, прогестерон – гормон беременности, достигая высокого уровня, сам по себе оказывает иммуносупрессивное действие.
При кандидозе чаще всего женщину беспокоят обильные выделения творожистой консистенции (отсюда и название «молочница»), которые имеют кисловатый запах и раздражают кожу, что сопровождается зудом, чувством жжения. Уже по одним только этим признакам врач может заподозрить кандидоз влагалища. Почему же нет стопроцентной гарантии и уверенности в диагнозе? Все дело в том, что похожие симптомы (зуд, жжение, выделения) имеют и другие инфекционные заболевания, и чтобы точно знать, от чего лечить женщину, требуется сначала выявить возбудитель заболевания.
Исследование под микроскопом
Для того чтобы определить состав микрофлоры влагалища, а заодно и определить, в чем причина неприятных ощущений во влагалище, проводят бактериоскопию – оценку окрашенного мазка на флору под микроскопом.
Обычно это исследование назначают не менее двух-трех раз за всю беременность. Сначала мазок из влагалища берут при постановке на учет в женскую консультацию, потом его повторяют во время II–III триместра, и последний раз мазок берут перед родами, на 37–38-й неделе беременности. Почему нужно проводить бактериоскопию несколько раз? Некоторые влагалищные инфекции и заболевания часто являются причиной невынашивания ребенка или преждевременных родов. Также может произойти внутриутробное инфицирование или ребенок может заразиться инфекцией во время родов. Да и сама воспаленная слизистая родовых путей становится очень ранимой, и роды могут осложниться разрывами. Поэтому необходимо узнать об этих болезнях в начале беременности и вовремя их пролечить.
При сдаче мазка на флору надо предварительно подготовиться к анализу:
- Воздержаться от секса в течение двух суток перед процедурой.
- Отказаться от свечей, таблеток, мазей. Они могут повлиять на состав микрофлоры и исказить результаты.

- Не применять щелочных средств гигиены. Лучше всего провести ополаскивание без использования мыла и спринцевания.
- За два часа до взятия мазков воздержаться от мочеиспускания.
Мазок берется во время обычного гинекологического осмотра на кресле: врач специальной палочкой делает соскоб влагалищной слизи и наносит ее на предметное стекло. В лаборатории после высыхания секрета его покроют красителями и посмотрят под микроскопом. Благодаря этой процедуре врачи оценивают состав микрофлоры влагалища.
В норме в мазке можно обнаружить:
- Палочки Дедерлейна (их количество преобладает). Количество других микроорганизмов (кокков) – незначительно.
- Эпителиальные клетки (поверхностный слой стенок влагалища, которому свойственно шелушиться).
- Незначительное количество лейкоцитов (белых кровяных телец, которые ведут борьбу с различными возбудителями инфекций).
 Лейкоцитов в мазке должно быть до 20 в поле зрения микроскопа. Если же их число превышает допустимые нормы, значит, у женщины имеется какая-то инфекционная патология.
Лейкоцитов в мазке должно быть до 20 в поле зрения микроскопа. Если же их число превышает допустимые нормы, значит, у женщины имеется какая-то инфекционная патология. - Эритроциты (красные клетки крови) – их не должно быть больше 5 в поле зрения. Повышенное количество говорит о нарушении целостности сосудов.
- Слизь: ее количество должно быть умеренное.
Важно: Мазок на флору не выявляет таких инфекций, как микоплазма, уреаплазма и хламидии, их можно обнаружить только при посеве на скрытые инфекции. Также в мазке не определяются вирусы (герпеса, папилломы человека) – чтобы обнаружить эти заболевания, также потребуется дополнительное исследование.
Исследование микрофлоры влагалища – анализ хотя и очень простой, но необходимый, сделать его надо, даже если будущую маму ничего не беспокоит. Проводится бактериоскопия в любой женской консультации (бесплатно) или медицинском центре, а результаты будут готовы уже на следующий день.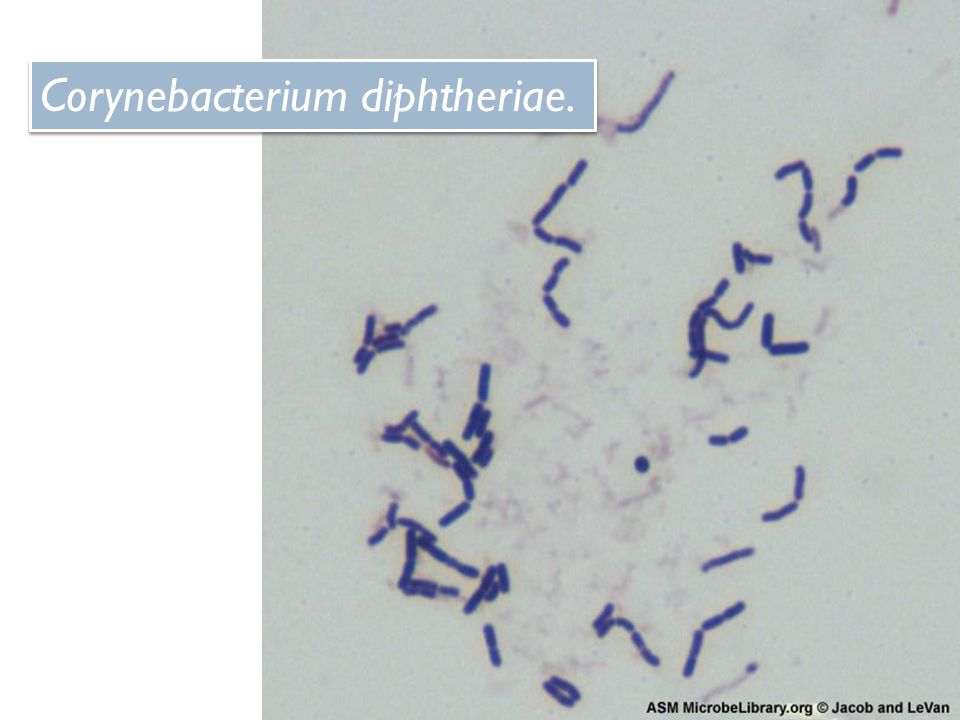
ПАМЯТКА
Как снизить риск нарушения влагалищной микрофлоры
- Совершать туалет половых органов лучше под проточной водой, струя воды должна быть направлена спереди назад, чтобы патогенные микроорганизмы из заднего прохода не попали во влагалище.
- Не надо постоянно использовать моющие средства – они часто сушат и раздражают слизистую наружных половых органов и влагалища.
- Ежедневные прокладки не должны иметь в своем составе отдушек (ароматических веществ): это снизит риск аллергических реакций. Менять прокладки следует каждые 3–4 часа.
- У женщины должны быть личные средства гигиены: мочалка, отдельное полотенце для интимного ухода.
- Белье не должно содержать синтетику – она не пропускает воздух и создает благоприятную среду для ускоренного размножения патогенных микроорганизмов.
Особенности диагностики и лечения бактериального вагиноза uMEDp
В статье рассмотрены этиология, клиника, диагностика и терапия бактериального вагиноза.
Доказана эффективность использования для лечения БВ комбинированных препаратов, содержащих наряду с антибактериальным и антимикотический компонент, таких как Нео-Пенотран и Нео-Пенотран Форте.
Таблица. Типы и концентрации бактерий, выделенных из вагинальных культур
Рис. 1. «Ключевые клетки» (микроскопия мазка, окрашенного по Граму)
Рис. 2. Бактериальный вагиноз (микроскопия мазка, окрашенного по Граму)
Рис. 3. Схема развития бактериального вагиноза
Рис. 4. Роль эндогенных и экзогенных факторов в возникновении бактериального вагиноза
Бактериальный вагиноз (БВ) является наиболее распространенной формой вагинальных нарушений у женщин репродуктивного возраста. Проблема бактериального вагиноза в настоящий момент весьма актуальна, поскольку его патогенез окончательно не ясен, методы лечения несовершенны, а заболеваемость неуклонно растет.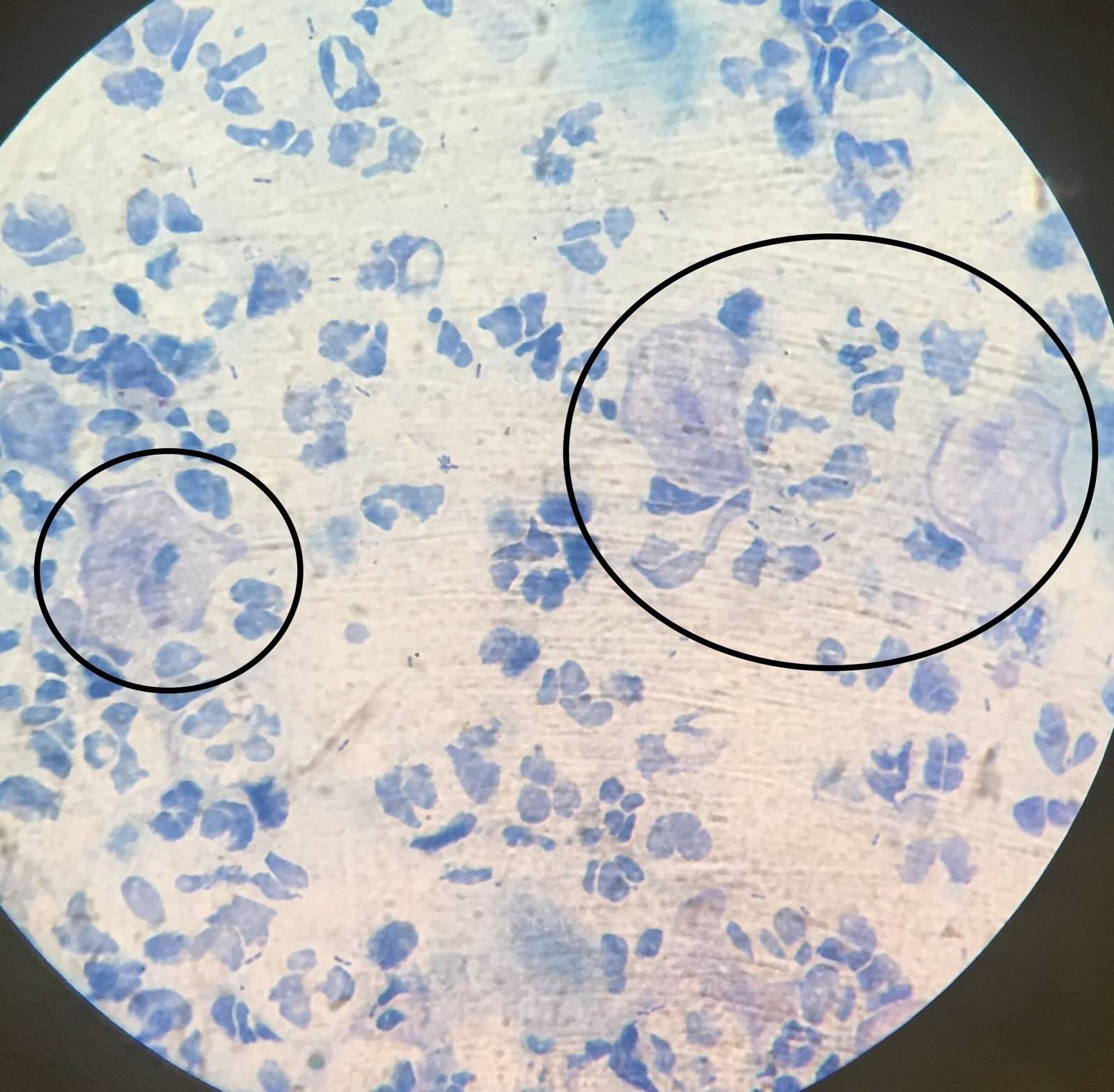 Статистические данные разных авторов показывают, что 40–50% всех случаев появления или изменения влагалищных выделений обусловлены бактериальным вагинозом и примерно от 25 до 50% женщин на сегодняшний день страдают этим заболеванием [1–5]. Частота встречаемости данного нарушения часто зависит от контингента обследованных женщин. Она составляет 17–19% в клиниках планирования семьи и среди студенток, наблюдающихся в студенческих поликлиниках; 24–37% – среди женщин, находящихся на лечении в клиниках венерических заболеваний; 20–25% – среди беременных женщин [6, 7]. Наличие этого заболевания отмечается у 30–50% афроамериканок, у 10–20% женщин белой расы [8, 9].
Статистические данные разных авторов показывают, что 40–50% всех случаев появления или изменения влагалищных выделений обусловлены бактериальным вагинозом и примерно от 25 до 50% женщин на сегодняшний день страдают этим заболеванием [1–5]. Частота встречаемости данного нарушения часто зависит от контингента обследованных женщин. Она составляет 17–19% в клиниках планирования семьи и среди студенток, наблюдающихся в студенческих поликлиниках; 24–37% – среди женщин, находящихся на лечении в клиниках венерических заболеваний; 20–25% – среди беременных женщин [6, 7]. Наличие этого заболевания отмечается у 30–50% афроамериканок, у 10–20% женщин белой расы [8, 9].
До определенного времени любой воспалительный процесс во влагалище, не связанный с гонореей, трихомониазом или кандидозом, относился к неспецифическим вагинитам. В 1955 г. H.L. Gardner и C.D. Dukes описали синдром нарушения микрофлоры влагалища у пациенток с так называемым неспецифическим бактериальным вагинитом. Нарушения микроэкологии влагалища проявлялись снижением количества молочнокислых бактерий и колонизацией влагалища неизвестными ранее микроорганизмами, которые получили название Haemophilus vaginalis. В 1980 г. этот микроорганизм был переименован в Gardnerella vaginalis, а неспецифические вагиниты стали относить к гарднереллезам. Однако позднее было установлено, что Gardnerella vaginalis присутствуют не только у пациенток с неспецифическими вагинитами, но и у здоровых женщин и не являются единственными возбудителями данного заболевания. Существуют данные, согласно которым Gardnerella vaginalis выделяется из влагалища у 5–60% здоровых женщин [10–13]. В 1984 г. на I Международном симпозиуме по вагинитам (Стокгольм, Швеция) было предложено современное название заболевания – бактериальный вагиноз [14, 15].
В 1980 г. этот микроорганизм был переименован в Gardnerella vaginalis, а неспецифические вагиниты стали относить к гарднереллезам. Однако позднее было установлено, что Gardnerella vaginalis присутствуют не только у пациенток с неспецифическими вагинитами, но и у здоровых женщин и не являются единственными возбудителями данного заболевания. Существуют данные, согласно которым Gardnerella vaginalis выделяется из влагалища у 5–60% здоровых женщин [10–13]. В 1984 г. на I Международном симпозиуме по вагинитам (Стокгольм, Швеция) было предложено современное название заболевания – бактериальный вагиноз [14, 15].
В настоящее время бактериальный вагиноз не рассматривается как инфекционное заболевание влагалища, однако вопрос о передаче БВ половым путем остается дискутабельным. В работах разных авторах отмечено, что у 50–70% мужчин – половых партнеров женщин с бактериальным вагинозом присутствует колонизация уретры Gardnerella vaginalis и другими возбудителями заболевания [16, 17].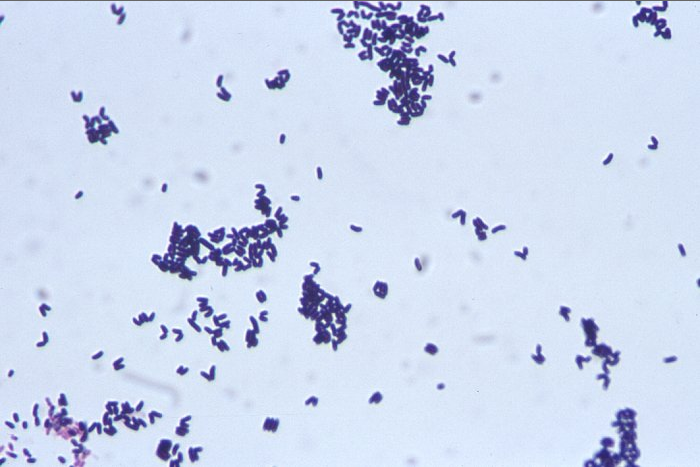 При этом мужчину ничто не беспокоит, и носительство выявляется только при обследовании высокоточными лабораторными методами. В пользу гипотезы о передаче заболевания половым путем свидетельствуют также следующие факты:
При этом мужчину ничто не беспокоит, и носительство выявляется только при обследовании высокоточными лабораторными методами. В пользу гипотезы о передаче заболевания половым путем свидетельствуют также следующие факты:
- одновременное выделение Gardnerella vaginalis из половых путей женщин, страдающих бактериальным вагинозом, и у их сексуальных партнеров;
- высокая частота реинфекции у излеченных женщин, половые партнеры которых не лечились одновременно;
- достоверные случаи заболевания бактериальным вагинозом здоровых женщин после половых контактов с мужчинами, у которых обнаружены Gardnerella vaginalis.
Другие исследователи не выявили статистической достоверности половой передачи БВ. Так, БВ был выявлен у 12% из 52 девственниц подросткового возраста и у 15% из 68 девочек той же возрастной группы, уже живших половой жизнью [2, 17].
Этиология бактериального вагиноза
Этиология БВ обсуждается на протяжении последних 40–50 лет.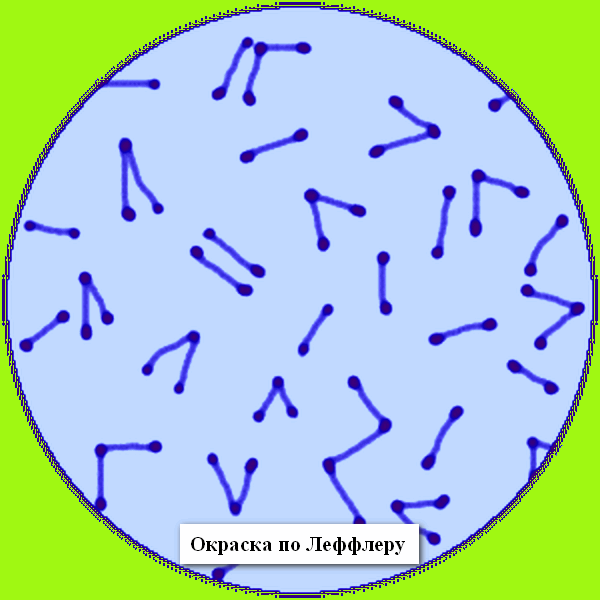 Известен состав нормальной микрофлоры влагалища у здоровых женщин, в который входят преимущественно лактобактерии – 70–98% – и 3–5% других видов бактерий [10, 14, 15, 18, 19]. Лактобактерии представляют собой полиморфные грамположительные палочки, обладающие высокой способностью препятствовать размножению условно-патогенной флоры. Продуктом жизнедеятельности лактобацилл является альфа-оксипропионовая, или молочная, кислота, которая обеспечивает кислую среду влагалищного содержимого. Наряду с молочной кислотой нормальная кислотность влагалищного отделяемого (рН 3,8–4,5) регулируется высокими уровнями содержания эстрогенов. Таким образом, микробиоценоз влагалища имеет прямую зависимость от кислотно-щелочного состояния.
Известен состав нормальной микрофлоры влагалища у здоровых женщин, в который входят преимущественно лактобактерии – 70–98% – и 3–5% других видов бактерий [10, 14, 15, 18, 19]. Лактобактерии представляют собой полиморфные грамположительные палочки, обладающие высокой способностью препятствовать размножению условно-патогенной флоры. Продуктом жизнедеятельности лактобацилл является альфа-оксипропионовая, или молочная, кислота, которая обеспечивает кислую среду влагалищного содержимого. Наряду с молочной кислотой нормальная кислотность влагалищного отделяемого (рН 3,8–4,5) регулируется высокими уровнями содержания эстрогенов. Таким образом, микробиоценоз влагалища имеет прямую зависимость от кислотно-щелочного состояния.
Кроме кислой среды, размножению патогенных микроорганизмов препятствуют образующаяся в результате жизнедеятельности лактобацилл перекись водорода, лизоцим и другие гликолитические ферменты. Лактобактерии стимулируют фагоцитарную активность нейтрофилов и макрофагов, образование интерферонов и секреторных иммуноглобулинов. Антагонистические свойства лактобацилл по отношению к патогенным микробным агентам, их витаминообразующая и ферментная функции поддерживают природную резистентность к инфекционным заболеваниям. Преобладание кислотопродуцирующих (пероксидпродуцирующих) микроорганизмов определяет так называемую колонизационную резистентность – совокупность механизмов, обеспечивающих стабильность количественного и видового состава нормальной микрофлоры и предотвращение заселения влагалища патогенными микроорганизмами или чрезмерное размножение условно-патогенных микроорганизмов, входящих в состав нормального микроценоза. При нарушенной колонизационной резистентности риск заболевания сифилисом и ВИЧ-инфекцией возрастает в 3 раза: частота заболевания сифилисом составляет 1 на 3–5 контактов, ВИЧ-инфекцией – 1 на 50 контактов, в то время как при нормобиоценозе частота заболевания сифилисом и ВИЧ-инфекцией составляет 1 на 12–15 и 1 на 150 контактов соответственно.
Антагонистические свойства лактобацилл по отношению к патогенным микробным агентам, их витаминообразующая и ферментная функции поддерживают природную резистентность к инфекционным заболеваниям. Преобладание кислотопродуцирующих (пероксидпродуцирующих) микроорганизмов определяет так называемую колонизационную резистентность – совокупность механизмов, обеспечивающих стабильность количественного и видового состава нормальной микрофлоры и предотвращение заселения влагалища патогенными микроорганизмами или чрезмерное размножение условно-патогенных микроорганизмов, входящих в состав нормального микроценоза. При нарушенной колонизационной резистентности риск заболевания сифилисом и ВИЧ-инфекцией возрастает в 3 раза: частота заболевания сифилисом составляет 1 на 3–5 контактов, ВИЧ-инфекцией – 1 на 50 контактов, в то время как при нормобиоценозе частота заболевания сифилисом и ВИЧ-инфекцией составляет 1 на 12–15 и 1 на 150 контактов соответственно.
При бактериальном вагинозе количество защитных лактобацилл снижается, повышается pH влагалища.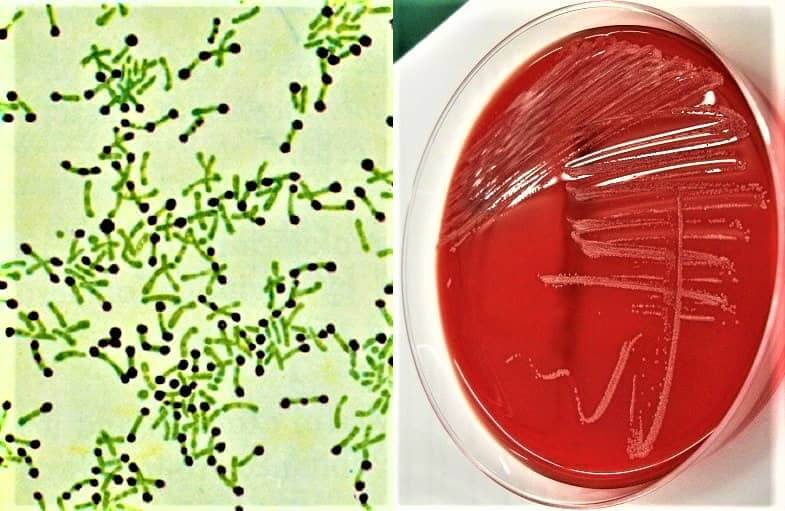 Кроме того, лактобактерии у больных БВ обладают недостаточной способностью продуцировать Н2О2, которая подавляет рост патогенных микроорганизмов, начинают распространяться анаэробные виды возбудителей. К снижению кислотности влагалища и концентрации лактобацилл приводит не один патогенный микроорганизм, а несколько, вследствие чего бактериальный вагиноз считается полимикробным заболеванием [1, 10, 20, 21].
Кроме того, лактобактерии у больных БВ обладают недостаточной способностью продуцировать Н2О2, которая подавляет рост патогенных микроорганизмов, начинают распространяться анаэробные виды возбудителей. К снижению кислотности влагалища и концентрации лактобацилл приводит не один патогенный микроорганизм, а несколько, вследствие чего бактериальный вагиноз считается полимикробным заболеванием [1, 10, 20, 21].
A. Swidsinski и соавт. (2005) исследовали микробиоценоз влагалища у женщин с БВ. В исследовании приняли участие 20 пациенток с бактериальным вагинозом и 40 здоровых женщин из группы контроля в пре- и постменопаузальном периодах. Было установлено, что бактериальный вагиноз ассоциируется с большим количеством и высокой концентрацией ряда бактериальных групп. Однако только Gardnerella vaginalis явилась специфичным микроорганизмом для бактериального вагиноза (табл.). Было выявлено также, что штамм Gardnerella vaginalis, связанный с бактериальным вагинозом, обладает цитотоксическим эффектом по отношению к эпителиальным клеткам влагалища [22].
Таким образом, в большинстве случаев БВ предоминирующим видом бактерий становится Gardnerella vaginalis. Однако чистые культуры Gardnerella vaginalis не всегда вызывают БВ, и в отсутствие симптомов женщины часто являются носителями небольшого количества Gardnerella vaginalis. Налицо противоречие: Gardnerella vaginalis – оппортунистический патоген и причина развития БВ или БВ – полимикробное состояние, обусловленное изменениями микрофлоры? Последние исследования потенциала формирования биопленки и цитотоксической активности Gardnerella vaginalis возродили интерес к вирулентному потенциалу этого микроорганизма.
В отличие от пациенток с нормальной флорой, женщины с БВ имеют не факультативно-, а облигатно-анаэробные лактобактерии [1, 15, 23]. Некоторые авторы отмечают высокий полиморфизм анаэробов при бактериальном вагинозе [4, 6, 24]. Было выявлено, что концентрация различных факультативно- (Gardnerella vaginalis) и облигатно-анаэробных (Bacteroidеs peptococcus) бактерий при БВ выше, чем у здоровых женщин. Так, например, концентрация микроаэрофильных бактерий (Gardnerella vaginalis) повышается в 100 раз, а анаэробных микроорганизмов (Bacteroides spp., Peptococcus spp.) – в 1000 раз и более [11, 20, 25]. На долю других видов микроорганизмов, находящихся в малых концентрациях (дифтероиды, Streptococcus spp., Staphylococcus spp., Escherichia coli, Gardnerella vaginalis, облигатные анаэробы), приходится менее 5–10% общей вагинальной флоры. Общая концентрация бактерий во влагалище возрастает до 1011 КОЕ/мл.
Так, например, концентрация микроаэрофильных бактерий (Gardnerella vaginalis) повышается в 100 раз, а анаэробных микроорганизмов (Bacteroides spp., Peptococcus spp.) – в 1000 раз и более [11, 20, 25]. На долю других видов микроорганизмов, находящихся в малых концентрациях (дифтероиды, Streptococcus spp., Staphylococcus spp., Escherichia coli, Gardnerella vaginalis, облигатные анаэробы), приходится менее 5–10% общей вагинальной флоры. Общая концентрация бактерий во влагалище возрастает до 1011 КОЕ/мл.
Высокие концентрации этих микроорганизмов влекут за собой изменения в состоянии влагалища. Так, уменьшение содержания молочной кислоты, продуцируемой факультативными лактобациллами, приводит к повышению рН, что, в свою очередь, стимулирует рост анаэробных микроорганизмов [23, 26]. При увеличении бактериального роста при БВ возрастает продукция аномальных аминов факультативными анаэробами. Амины при увеличении вагинального рН становятся летучими, обусловливая типичный «рыбный» запах, усиливающийся при добавлении 10%-ного раствора гидроокиси калия к влагалищному секрету. Бактериальные полиамины вместе с находящимися во влагалище органическими кислотами (уксусной и янтарной) оказывают цитотоксическое действие, вызывая отторжение эпителиальных клеток, что приводит к обильным вагинальным выделениям. Gardnerella vaginalis способствует интенсификации процесса отторжения эпителиальных клеток, особенно в условиях алкалоза, обнаруживаемого при БВ. В результате образуются патогномоничные «ключевые клетки» (эпителиальные клетки, покрытые гарднереллами и анаэробами) (рис. 1, 2).
Бактериальные полиамины вместе с находящимися во влагалище органическими кислотами (уксусной и янтарной) оказывают цитотоксическое действие, вызывая отторжение эпителиальных клеток, что приводит к обильным вагинальным выделениям. Gardnerella vaginalis способствует интенсификации процесса отторжения эпителиальных клеток, особенно в условиях алкалоза, обнаруживаемого при БВ. В результате образуются патогномоничные «ключевые клетки» (эпителиальные клетки, покрытые гарднереллами и анаэробами) (рис. 1, 2).
На биоценоз влагалища, безусловно, влияют гормональные изменения, происходящие в организме женщины на протяжении всей жизни. Эпителиальные ткани, в том числе эпителий свода влагалища и шейки матки, реагируют на изменение окружающей их гормональной среды сходным образом, и в первую очередь на уровень стероидных гормонов [13, 14, 16]. Под действием эстрогенов происходит рост и созревание многослойного плоского эпителия, синтез гликогена, продукция слизистого секрета в шейке матки. Многослойный плоский эпителий, насыщенный гликогеном, и слизистая пробка цервикального канала, выполняя барьерную функцию, преграждают путь повреждающему агенту (специфической или неспецифической инфекции), препятствуют развитию воспаления [7, 15]. Аналогичное эстрогенам пролиферативное действие на влагалищный эпителий могут оказывать и андрогены. Прогестерон тормозит созревание многослойного плоского эпителия. Если его количество увеличено, то клетки могут созреть только до промежуточного слоя. Под действием прогестерона происходит цитолиз и десквамация многослойного плоского эпителия с высвобождением в просвет влагалища гликогена. Из гликогена при участии клеточных ферментов образуются сахара мальтоза и декстроза, являющиеся питательной средой для молочнокислых бактерий.
Многослойный плоский эпителий, насыщенный гликогеном, и слизистая пробка цервикального канала, выполняя барьерную функцию, преграждают путь повреждающему агенту (специфической или неспецифической инфекции), препятствуют развитию воспаления [7, 15]. Аналогичное эстрогенам пролиферативное действие на влагалищный эпителий могут оказывать и андрогены. Прогестерон тормозит созревание многослойного плоского эпителия. Если его количество увеличено, то клетки могут созреть только до промежуточного слоя. Под действием прогестерона происходит цитолиз и десквамация многослойного плоского эпителия с высвобождением в просвет влагалища гликогена. Из гликогена при участии клеточных ферментов образуются сахара мальтоза и декстроза, являющиеся питательной средой для молочнокислых бактерий.
В период постменопаузы в силу уменьшения продукции стероидных гормонов, влекущего за собой изменение процессов цитолиза и десквамации, уменьшение уровня гликогена, повышается рН влагалища, что вызывает дальнейшее ухудшение состояния и способствует росту патогенных микроорганизмов [10, 11].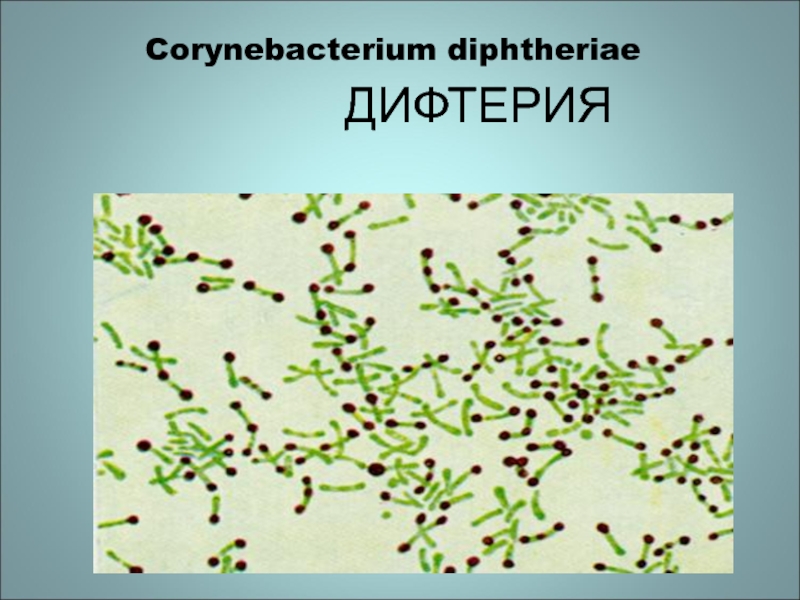 Анализируя патогенез бактериального вагиноза, можно предложить достаточно простую схему развития процесса (рис. 3) [27].
Анализируя патогенез бактериального вагиноза, можно предложить достаточно простую схему развития процесса (рис. 3) [27].
Определенная роль в возникновении БВ отводится нарушениям микробиоценоза влагалища, происходящим в результате воздействия как эндогенных, так и экзогенных триггерных факторов заболевания [10, 13, 27, 28] (рис. 4). В нашей стране к триггерным факторам развития БВ в большей мере относят эндогенные факторы, а в зарубежной литературе [17, 18, 24, 29], наоборот, среди основных триггерных факторов развития БВ называют экзогенные причины, такие как частые незащищенные половые контакты, частые влагалищные души, смена полового партнера, ношение облегающего негигроскопичного белья, куннилингус, характер флоры препуциального мешка у партнеров и др. Следует отметить, что все эти факторы далеко не всегда приводят к нарушению микрофлоры влагалища. Иммунная система организма поддерживает нормальную микрофлору и помогает ей восстанавливаться в случае незначительного нарушения.
Клиника бактериального вагиноза
Результаты проведенных исследований позволяют выделить два варианта клинического течения БВ: бессимптомное и с клиническими симптомами. Следует отметить, что большинство женщин (50–75%), у которых выявляют бактериальный вагиноз, вообще не имеют никаких симптомов этого состояния. В этом случае говорят о так называемой бессимптомной форме бактериального вагиноза. При бессимптомном течении отсутствуют клинические проявления заболевания наряду с положительными лабораторными признаками. Остальные пациентки с БВ, как правило, предъявляют жалобы на обильные выделения из половых путей белого или серого цвета, часто с «рыбным» запахом, особенно после незащищенного полового акта или во время менструации. Семенная жидкость имеет рН 7,0, поэтому после эякуляции вагинальная рН возрастает, вследствие чего амины переходят в свободное состояние и обусловливают неприятный запах. Таким образом, усиление неприятного запаха после полового сношения служит определенным дифференциально-диагностическим признаком БВ. Длительность существования этих симптомов может исчисляться годами. При прогрессирующем процессе выделения приобретают желтовато-зеленоватую окраску, становятся более густыми, пенистыми, слегка тягучими и липкими, равномерно распределяются по стенкам влагалища. Количество белей варьирует от умеренных до весьма обильных. Сам по себе БВ не представляет угрозы здоровью, однако длительные и обильные вагинальные выделения сопровождаются значительным снижением качества жизни женщины (нарушается половая функция, снижается работоспособность и т.п.).
Длительность существования этих симптомов может исчисляться годами. При прогрессирующем процессе выделения приобретают желтовато-зеленоватую окраску, становятся более густыми, пенистыми, слегка тягучими и липкими, равномерно распределяются по стенкам влагалища. Количество белей варьирует от умеренных до весьма обильных. Сам по себе БВ не представляет угрозы здоровью, однако длительные и обильные вагинальные выделения сопровождаются значительным снижением качества жизни женщины (нарушается половая функция, снижается работоспособность и т.п.).
По другим данным, бактериальный вагиноз признается фактором риска, а иногда и одной из причин возникновения заболеваний женской репродуктивной системы, осложнений течения беременности, родов и послеродового периода [2, 11, 14, 16, 20, 30]. Исследования многих авторов показали, что бактериальный вагиноз может привести к развитию патологических маточных кровотечений, росту частоты осложнений после операций на органах малого таза и кесарева сечения, преждевременному разрыву плодных оболочек, аномалии родовой деятельности, хорионамниониту, послеродовому эндометриту, снижению веса и пневмонии у новорожденного. При бактериальном вагинозе увеличивается риск инфицирования ВИЧ-инфекцией и другими инфекциями, передающимися половым путем. Перечисленные обстоятельства диктуют необходимость разработки новых способов лечения бактериального вагиноза [4, 31].
При бактериальном вагинозе увеличивается риск инфицирования ВИЧ-инфекцией и другими инфекциями, передающимися половым путем. Перечисленные обстоятельства диктуют необходимость разработки новых способов лечения бактериального вагиноза [4, 31].
Диагностика бактериального вагиноза
Основным клиническим проявлением БВ являются выделения из влагалища с неприятным запахом. Большинство женщин при данной патологии отмечают диспареунию. Жалобы на зуд, жжение во влагалище, дизурические расстройства предъявляют 20–30% больных. При объективном исследовании чаще всего отмечается наличие у больных гомогенных, жидких, серого цвета выделений, равномерно распределенных по стенкам влагалища. Визуально и при кольпоскопии не выявляются признаки воспаления слизистой оболочки влагалища.
В настоящее время для диагностики бактериального вагиноза приняты критерии, предложенные R. Amsel и соавт. в 1983 г. [32]. Диагноз бактериального вагиноза можно поставить при выявлении трех из четырех симптомов:
- обильные выделения из влагалища с неприятным запахом;
- появление запаха «гнилой рыбы» при проведении аминного теста с вагинальными выделениями;
- увеличение pH вагинального содержимого выше 4,5;
- наличие «ключевых клеток» в мазках, окрашенных по Граму.

Одним из наиболее доступных и информативных методов диагностики БВ является положительный аминный тест – усиление или появление запаха «гнилой рыбы» при смешивании равных пропорций гидроокиси калия и влагалищных выделений. Этот признак достоверен у 94% пациенток с БВ [1, 2, 12, 31, 33]. «Рыбный» запах, вызываемый алкилированием влагалищного содержимого, свидетельствует о наличии летучих аминов, таких как кадаверин, фенетиламин, тирамин, путресцин, гистамин, изобутиламин, – продуктов метаболизма строгих анаэробов. Значение рН вагинального отделяемого при БВ превышает нормативные показатели (более 4,5), что определяется элиминацией лактофлоры или резким снижением ее содержания. Для выполнения рН-метрии можно использовать универсальную индикаторную бумагу с эталонной шкалой или различные модификации рН-метров.
В 1991 г. R.P. Nugent и соавт. предложили для диагностики БВ модификацию метода Spiegel по оценке окрашенных по Граму вагинальных мазков [34]. Метод основан на определении относительной доли морфотипов бактерий в окрашенных по Граму мазках из влагалища. Оценка проводится по наличию больших грамположительных палочек (морфотипы Lactobacillus), малых грамотрицательных/грамвариабельных палочек (морфотипы Gardnerella vaginalis) и изогнутых грамвариабельных палочек (морфотипы Mobiluncus spp.), шкала включает от 0 до 10 пунктов (баллов). Оценка 6 баллов (7–10) соответствует наличию бактериального вагиноза [34]. Однако данный анализ не позволяет учесть патологические изменения флоры, помимо явного бактериального вагиноза. Кроме того, природа так называемой промежуточной флоры остается неясной. Кроме скрининговых тестов, для диагностики БВ используют лабораторные методы: микроскопию вагинального мазка, окрашенного по Граму, хроматографическое исследование микробных метаболитов в вагинальном содержимом, выявление ферментов пролинаминопептидазы, сиалидазы и некоторых других [1, 16, 21, 23]. Метод газо-жидкостной хроматографии позволяет сравнить содержание в вагинальном отделяемом основных продуктов метаболизма лактобацилл и облигатно-анаэробных микроорганизмов: молочной и янтарной кислоты.
Оценка проводится по наличию больших грамположительных палочек (морфотипы Lactobacillus), малых грамотрицательных/грамвариабельных палочек (морфотипы Gardnerella vaginalis) и изогнутых грамвариабельных палочек (морфотипы Mobiluncus spp.), шкала включает от 0 до 10 пунктов (баллов). Оценка 6 баллов (7–10) соответствует наличию бактериального вагиноза [34]. Однако данный анализ не позволяет учесть патологические изменения флоры, помимо явного бактериального вагиноза. Кроме того, природа так называемой промежуточной флоры остается неясной. Кроме скрининговых тестов, для диагностики БВ используют лабораторные методы: микроскопию вагинального мазка, окрашенного по Граму, хроматографическое исследование микробных метаболитов в вагинальном содержимом, выявление ферментов пролинаминопептидазы, сиалидазы и некоторых других [1, 16, 21, 23]. Метод газо-жидкостной хроматографии позволяет сравнить содержание в вагинальном отделяемом основных продуктов метаболизма лактобацилл и облигатно-анаэробных микроорганизмов: молочной и янтарной кислоты.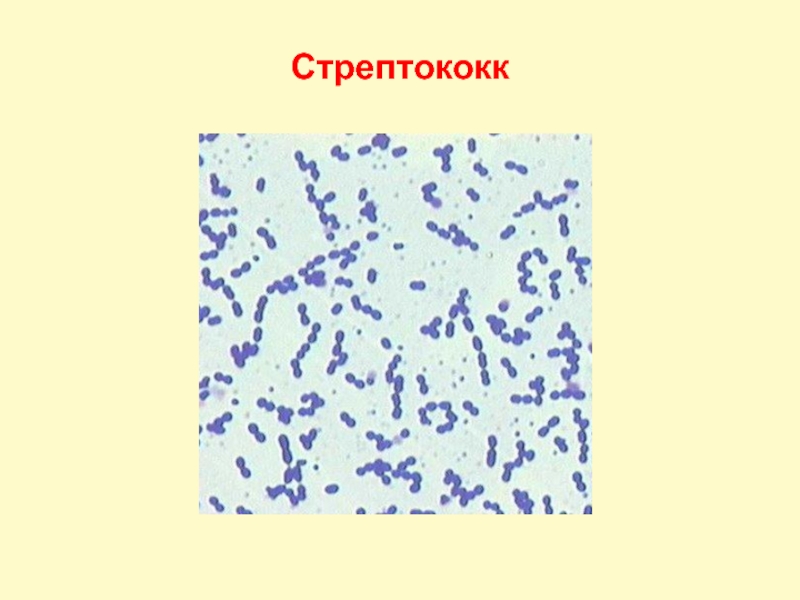 В норме соотношение янтарной и молочной кислот – менее 0,4, а при БВ – более 0,4. Методом выбора для диагностики БВ в настоящее время считают микроскопию вагинального мазка, окрашенного по Граму. Чувствительность и специфичность метода близки к 100%.
В норме соотношение янтарной и молочной кислот – менее 0,4, а при БВ – более 0,4. Методом выбора для диагностики БВ в настоящее время считают микроскопию вагинального мазка, окрашенного по Граму. Чувствительность и специфичность метода близки к 100%.
При бактериоскопии мазков дополнительными признаками БВ, кроме «ключевых клеток», являются: 1) преобладание эпителиальных клеток над лейкоцитами; 2) обнаружение при увеличении с иммерсией менее 5 лактобацилл в поле зрения. Культуральное исследование Gardnerella vaginalis для диагностики БВ не рекомендуется, поскольку не является специфичным.
В последнее время в практике акушеров-гинекологов часто наблюдаются рецидивы БВ. Нет четких критериев для определения рецидивирующего бактериального вагиноза. В основном под рецидивом подразумевается повторение эпизода заболевания в течение 3 месяцев после курса лечения. По оценкам различных авторов, частота рецидивов составляет от 15 до 30%. После повторного курса лечения почти у 52% пациенток отмечаются повторные рецидивы в течение года.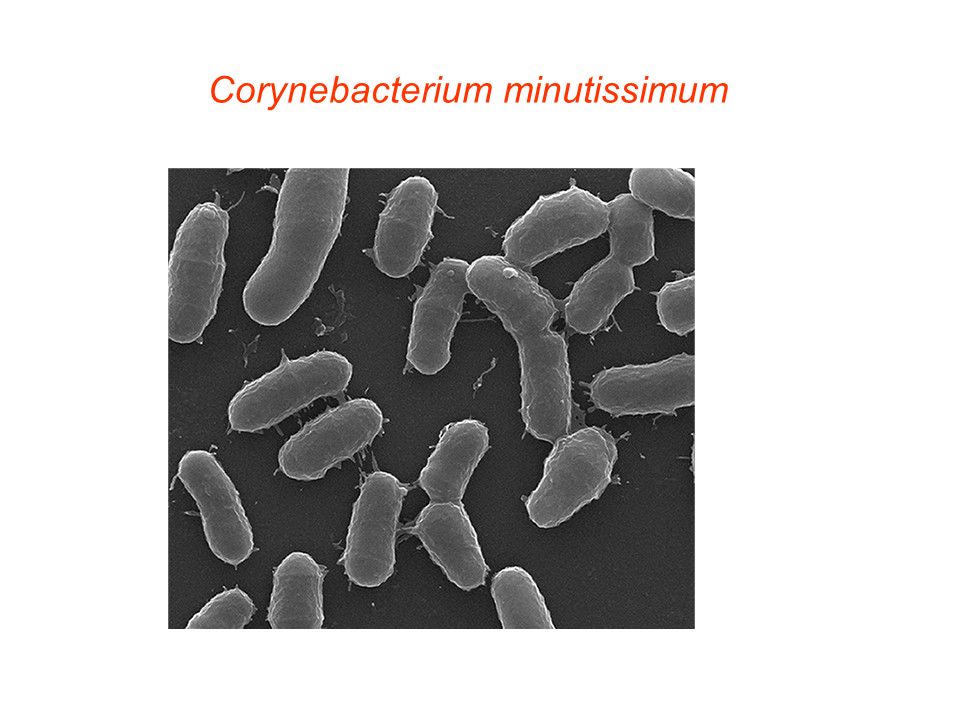
Лечение бактериального вагиноза
Успешное лечение БВ, как и любого заболевания, зависит от правильной и своевременной постановки диагноза и проведения патогенетически обоснованной терапии. Цель лечения БВ – подавить чрезмерный рост условно-патогенных микроорганизмов и восстановить нормальную микрофлору влагалища. Терапия БВ остается непростой задачей ввиду частого рецидивирования заболевания и низкой эффективности ряда препаратов. Принципами лечения бактериального вагиноза являются:
- элиминация условно-патогенных микроорганизмов и анаэробов, выявляемых при БВ в высокой концентрации;
- восстановление микробиоценоза влагалища (пробиотики, иммунокоррекция, восстановление pH влагалища, исключение триггерных факторов развития БВ).
Следует отметить, что БВ разрешается спонтанно у одной трети небеременных женщин и у половины беременных [4, 5]. Лечение показано для устранения симптомов у женщин с признаками инфекции и для предупреждения послеоперационной инфекции у женщин с бессимптомным течением БВ при абортах или гистерэктомиях. В лечении также могут нуждаться женщины с бессимптомным течением БВ и преждевременными родами в анамнезе, однако их скрининг и лечение остаются дискутабельными. Доказано, что лечение БВ снижает риск заражения ИППП, включая ВИЧ [5, 13]. По этой причине некоторые эксперты поддерживают концепцию лечения всех женщин с БВ вне зависимости от наличия или отсутствия симптомов.
В лечении также могут нуждаться женщины с бессимптомным течением БВ и преждевременными родами в анамнезе, однако их скрининг и лечение остаются дискутабельными. Доказано, что лечение БВ снижает риск заражения ИППП, включая ВИЧ [5, 13]. По этой причине некоторые эксперты поддерживают концепцию лечения всех женщин с БВ вне зависимости от наличия или отсутствия симптомов.
Многочисленные работы последних лет свидетельствуют о том, что для этиотропной терапии БВ выбираются препараты, которые обладают антианаэробной активностью [2, 12, 21, 22, 28, 30, 35, 36]. Для лечения бактериального вагиноза применяется множество антимикробных средств (например, ампициллин, пенициллин и др.). Однако лекарством выбора при лечении БВ и одним из наиболее широко применяемых препаратов является метронидазол. Согласно рекомендациям Центра по контролю за заболеваемостью (Center for Disease Control, CDC), схема лечения БВ включает:
- метронидазол перорально по 500 мг 2 р/сут в течение 7 дней;
- клиндамициновый крем 2% – 1 полный аппликатор (5 г) интравагинально на ночь в течение 7 дней;
- метронидазоловый гель 0,75% – 1 аппликатор (5 г) интравагинально на ночь в течение 5 дней.

В качестве альтернативных режимов лечения называют следующие:
- метронидазол перорально по 2 г однократно;
- клиндамицин перорально по 300 мг 2 р/сут в течение 7 дней;
- клиндамицин по 100 мг интравагинально на ночь в течение 3 дней.
Согласно рекомендациям Всемирной организации здравоохранения (ВОЗ), стандартом терапии бактериального вагиноза является прием метронидазола 400 или 500 мг 2 р/сут на протяжении 7 дней или 2 г однократно. Европейская ассоциация по ИППП (IUSTI/WHO) также рекомендует метронидазол 400 или 500 мг 2 р/сут в течение 7 дней или 2 г однократно или клиндамицин вагинальный крем 2% 5 г на ночь на протяжении 7 дней. Согласно Федеральному руководству 2010 г. (Формулярная система), при БВ рекомендуется:
- клиндамицин 2% 5 г 1 р/сут (на ночь) в/вл (с помощью стандартного аппликатора) в течение 3 дней;
- метронидазол п/о по 0,5 г каждые 12 ч курсом 7 дней;
- метронидазол в/вл 1 таб.
 (0,5 г) на ночь, курс 10 дней;
(0,5 г) на ночь, курс 10 дней; - метронидазол гель 0,75% (5,0 г) на ночь, курс 5 дней.
В рандомизированном клиническом исследовании с применением плацебо в качестве контроля изучалось ежедневное применение вагинального метронидазола в течение 16 недель [22]. В результате у 70% женщин в группе лечения не проявлялось симптомов БВ, по сравнению с 30% в группе плацебо. После окончания лечения рецидивы возникли у 65% женщин в группе лечения через 12 месяцев и у 80% женщин – в группе плацебо. Кроме того, у пациенток, применявших вагинальный крем метронидазол, чаще выявлялся вульвовагинальный кандидоз (р = 0,02).
С учетом вышесказанного, актуальным представляется использование для лечения БВ комбинированных препаратов, содержащих, кроме антибактериального, также и антимикотический компонент. Одним из таких комбинированных препаратов является Нео-Пенотран, содержащий 500 мг метронидазола и 100 мг миконазола нитрата в удобной форме в виде влагалищных пессариев, практически не оказывающих местного раздражающего действия на слизистую влагалища, обеспечивающих быструю растворимость и хорошую приемлемость для пациентов, что выгодно отличает их от лекарственной формы – влагалищных таблеток. Благодаря сочетанному антибактериальному, противопротозойному и антимикотическому действию представленная комбинация обладает высокой клинической эффективностью. По данным разных авторов [2], частота излечения БВ при применении Нео-Пенотрана достигает 96–98%. Препарат назначают по 1 вагинальному суппозиторию 2 р/сут в течение 7 дней.
Благодаря сочетанному антибактериальному, противопротозойному и антимикотическому действию представленная комбинация обладает высокой клинической эффективностью. По данным разных авторов [2], частота излечения БВ при применении Нео-Пенотрана достигает 96–98%. Препарат назначают по 1 вагинальному суппозиторию 2 р/сут в течение 7 дней.
В настоящее время существует вторая форма препарата – Нео-Пенотран Форте, отличающаяся дозировкой составляющих компонентов и в связи с этим имеющая ряд преимуществ. Предлагаемая комбинированная форма является более сбалансированной и содержит 750 мг метронидазола и 200 мг миконазола нитрата. Это дает возможность применения препарата во II и III триместрах беременности и лактации под наблюдением врача. При необходимости применения во время лактации на время лечения следует прекратить грудное вскармливание, поскольку метронидазол проникает в грудное молоко. Однако кормление грудью можно возобновить через 24–48 часов после окончания лечения в связи с отсутствием системного действия препарата. Еще одно преимущество Нео-Пенотрана Форте – достижение лечебного эффекта при использовании 1 р/сут. Рекомендованная схема применения: по 1 вагинальному суппозиторию 1 р/сут в течение 7 дней. При рецидиве симптомов применение препарата может быть продлено до 14 дней.
Еще одно преимущество Нео-Пенотрана Форте – достижение лечебного эффекта при использовании 1 р/сут. Рекомендованная схема применения: по 1 вагинальному суппозиторию 1 р/сут в течение 7 дней. При рецидиве симптомов применение препарата может быть продлено до 14 дней.
Влагалищное применение имеет ряд преимуществ перед пероральным введением лекарственных средств. Во-первых, это отсутствие системного воздействия на организм женщины, что имеет немаловажное значение при наличии экстрагенитальных заболеваний у пациентки, в том числе заболеваний желудочно-кишечного тракта, гепатобилиарной системы, мочевыводящих путей, уменьшение возможности развития системных побочных реакций. Во-вторых, быстрое и непосредственное воздействие на патологический процесс. При местной аппликации препарат доставляется непосредственно в место, колонизированное возбудителями заболевания, что позволяет достичь высокой эффективности при использовании малых доз антимикробного препарата.
Заключение
Таким образом, рациональная тактика ведения пациенток с бактериальным вагинозом предполагает комплексное клинико-лабораторное обследование, оценку и коррекцию выявленных факторов риска, способствующих рецидиву, определение видовой принадлежности микроорганизмов с оценкой их чувствительности к антибактериальным препаратам, поддержание рH
Следует подчеркнуть, что помимо лечебных мероприятий важную роль играет профилактика БВ, которая включает изучение здоровья женщин, оценку особенностей сексуального поведения, гигиены, регулярное посещение гинеколога, а также оценку факторов риска развития заболевания.
Можно заключить, что своевременная патогенетически обоснованная терапия бактериального вагиноза позволяет снизить общую заболеваемость бактериальным вагинозом, а также предотвратить развитие рецидивов и осложнений, ассоциированных с этим заболеванием.
Бакпосев на флору и чувствительность к антибиотикам — из ЗЕВА
Универсальное микробиологическое исследование, позволяющее определить наличие и основные культуральные свойства (титр, количество), чувствительность к основным группам антибактериальных препаратов) большинства аэробных микроорганизмов, растущих на обычных питательных средах. Для исследования подходит практически любой вид биологического материала. Анализ используют для микробиологической диагностики неспецифических инфекционных заболеваний, выявления возбудителей хронических инфекций, определения наиболее подходящего препарата для антибактериальной терапии. Чувствительность к антибиотикам для нормальной микрофлоры не определяется.
Список нормальной микрофлоры:
- Зев и нос:- Streptococcus viridians — Staphylococcus epidermidis — Staphylococcus saprophyticus — Staphylococcus haemolyticus — Дифтероиды — Neisseria spp (кроме Neissria meningitidis)
- Мазки урогенитальные (женские) – Lactobacillus — Сorynebacterium urealytica (дифтероиды) — Staphylococcus epidermidis (в титре ниже 1х10^4) — Staphylococcus saprophyticus(в титре ниже 1х10^4)
Указанные выше микроорганизмы относятся к постоянной нормальной микрофлоре и не требуют лечения антимикробными препаратами, т.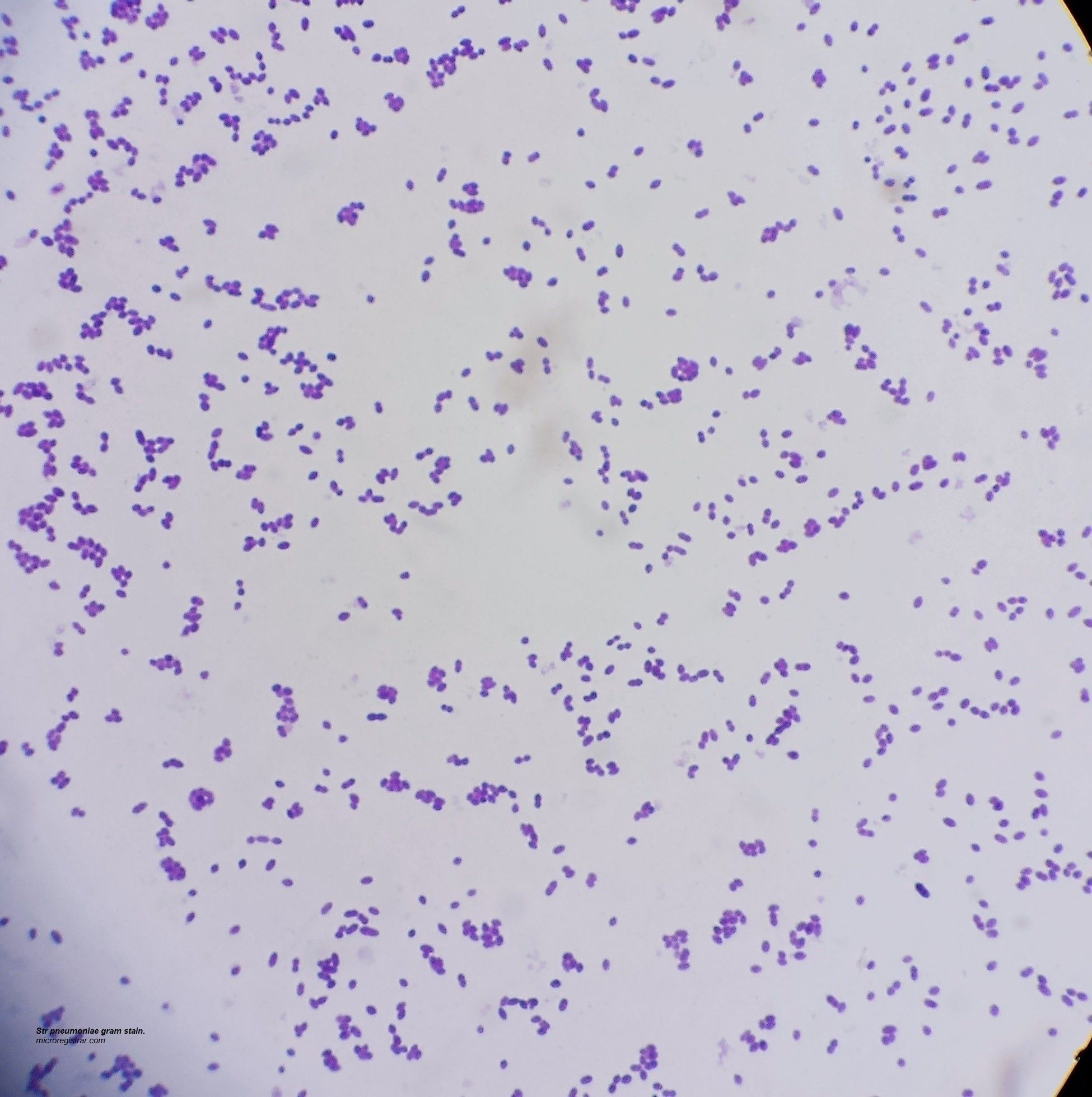 к. при их отсутствии могут возникнуть проблемы «дисбактериоза» в указанных органах (снижение местного иммунитета, рецидивы хронических заболеваний) . Лечение этих микроорганизмов антибиотиками сравнимо, с лечением антибиотиками лакто- и бифидобактерий в кишечнике. При обнаружении микробиологическим методом микроорганизмов, составляющих нормальную микрофлору, или условно-патогенных микроорганизмов в титре менее диагностического не определяется чувствительность к антибиотикам и бактериофагам, так как это количество не является значимым и не требует лечения противомикробными препаратами.
к. при их отсутствии могут возникнуть проблемы «дисбактериоза» в указанных органах (снижение местного иммунитета, рецидивы хронических заболеваний) . Лечение этих микроорганизмов антибиотиками сравнимо, с лечением антибиотиками лакто- и бифидобактерий в кишечнике. При обнаружении микробиологическим методом микроорганизмов, составляющих нормальную микрофлору, или условно-патогенных микроорганизмов в титре менее диагностического не определяется чувствительность к антибиотикам и бактериофагам, так как это количество не является значимым и не требует лечения противомикробными препаратами.
Стоимость исследования
дифтероиды в мазке — 2 рекомендаций на Babyblog.ru
Уреаплазменную инфекциюлишь символически можно отнести к инфекциям, передаваемым половым путем. Дело в том, что возбудителем при этом является Ureaplasma urealyticum из рода микоплазм, которые действительно могут обитать в половых путях и передаваться при половых контактах. Но все-таки роль уреаплазм, как и иных микоплазм, за исключением М. genitalium, в возникновении воспалительной реакции достаточно неоднозначна, вследствие чего этот возбудитель большинство авторов, особенно за рубежом, относят к условно-патогенным. И в международном признанном списке заболеваний, такого заболевания, как уреаплазмоз или уреаплазменная инфекция, не приведено. Между тем ряд ученых приводят довольно убедительные доказательства, которые свидетельствуют в пользу патогенности этой инфекции. Не так давно в Москве даже была защищена докторская диссертация, автор которой отстаивал как раз эту точку зрения. В 1954 г. Шепард первый раз выявил U. urealyticum в выделениях, полученных от больного уретритом, и назвал их T-микоплазмами (от английского слова tiny — крошечный).
Но все-таки роль уреаплазм, как и иных микоплазм, за исключением М. genitalium, в возникновении воспалительной реакции достаточно неоднозначна, вследствие чего этот возбудитель большинство авторов, особенно за рубежом, относят к условно-патогенным. И в международном признанном списке заболеваний, такого заболевания, как уреаплазмоз или уреаплазменная инфекция, не приведено. Между тем ряд ученых приводят довольно убедительные доказательства, которые свидетельствуют в пользу патогенности этой инфекции. Не так давно в Москве даже была защищена докторская диссертация, автор которой отстаивал как раз эту точку зрения. В 1954 г. Шепард первый раз выявил U. urealyticum в выделениях, полученных от больного уретритом, и назвал их T-микоплазмами (от английского слова tiny — крошечный).
По своим размерам уреаплазмы являются одними из мельчайших представителей бактериальной флоры, выявляемой у человека, а по виду своей жизнедеятельности их относят к внутриклеточным паразитам.
Уреаплазмы– это мельчайшие бактерии, которые обитают на слизистых половых органов и мочевых путей человека. В самом начале уреаплазмы относились к микоплазмам, но были определены в отдельный класс бактерий из-за своей способности расщеплять мочевину.
В самом начале уреаплазмы относились к микоплазмам, но были определены в отдельный класс бактерий из-за своей способности расщеплять мочевину.
Ранее выделяли два подвида Ureaplasma urealyticum: (1) parvum и (2) Т-960. На сегодняшний день эти подвиды расцениваются, как два самостоятельных вида: Ureaplasma parvum и Ureaplasma urealyticum соответственно.
Уреаплазмоз – вызывается микроорганизмами, которые по размерам приближаются к крупным вирусам и не имеют ни ДНК, ни клеточной оболочки. Их изредка рассматривают как своего рода переходную ступень от вирусов к одноклеточным. Передача инфекции происходит, как правило, половым путем, но может быть и внутриутробное инфицирование от больной матери, а кроме того, микробы могут проникать в половые пути ребенка во время родов и сохраняться там всю жизнь, до поры находясь в спящем состоянии.
Уреаплазмы могут провоцировать воспаление любых отделов мочеполового тракта — мочевого пузыря, уретры, простаты, яичек и их придатков, а у женщин — влагалища, матки и придатков.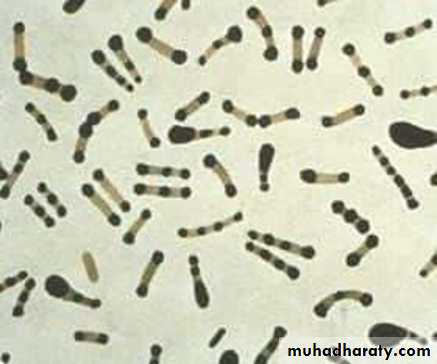 Кроме того, при кое-каких исследованиях удалось выяснить, что уреаплазмы могут фиксироваться на сперматозоидах и нарушать их двигательную активность, а в ряде случаев просто уничтожать спермии. В конце концов, микробы способны вызывать воспаление суставов, особенно при ревматоидном артрите. Авторы, которые относят уреаплазмы к облигатным патогенам, считают, что они вызывают уретриты, простатиты, послеродовые эндометриты, цервициты, пиелонефриты, бесплодие, разнообразную патологию беременности (хориоамниониты) и плода (легочную патологию). Другие ученые считают, что уреаплазмы являются частью условно-патогенной флоры урогенитального тракта и могут быть причиной инфекционно-воспалительных болезней мочеполовых органов только при конкретных условиях (в частности, при недостаточности иммунитета) или при соответствующих микробных ассоциациях.
Кроме того, при кое-каких исследованиях удалось выяснить, что уреаплазмы могут фиксироваться на сперматозоидах и нарушать их двигательную активность, а в ряде случаев просто уничтожать спермии. В конце концов, микробы способны вызывать воспаление суставов, особенно при ревматоидном артрите. Авторы, которые относят уреаплазмы к облигатным патогенам, считают, что они вызывают уретриты, простатиты, послеродовые эндометриты, цервициты, пиелонефриты, бесплодие, разнообразную патологию беременности (хориоамниониты) и плода (легочную патологию). Другие ученые считают, что уреаплазмы являются частью условно-патогенной флоры урогенитального тракта и могут быть причиной инфекционно-воспалительных болезней мочеполовых органов только при конкретных условиях (в частности, при недостаточности иммунитета) или при соответствующих микробных ассоциациях.
Уреаплазмоз может развиваться как в острой, так и в хронической форме. Как и при многих других инфекциях, болезнь не имеет симптомов, типичных для данного возбудителя. Клинические проявления уреаплазмоза зависят от инфицированного органа. В то же время современными способами возбудитель часто определяется и у совершенно здоровых женщин, не предъявляющих никаких жалоб, и нередко в сочетании с другими инфекциями.
Клинические проявления уреаплазмоза зависят от инфицированного органа. В то же время современными способами возбудитель часто определяется и у совершенно здоровых женщин, не предъявляющих никаких жалоб, и нередко в сочетании с другими инфекциями.
На сегодняшний день имеется ряд объективных сложностей в решении проблемы уреаплазмоза:
1. Уреаплазмоз, действительно, является заболеванием, которое склонно к хроническому протеканию.
2. При диагностике уреаплазмоза нередко встречаются ложноположительные ответы, что приводит к гипердиагностике и ложным ответам при контроле за лечением.
3. Хронический уреаплазмоз требует комплексного лечения.
4. Уреаплазма – условно патогенный микроорганизм (для некоторых женщин – это нормальная флора влагалища). «Лечить или не лечить уреаплазму» может решить только квалифицированный врач.
Лечение уреаплазмы
Лечение уреаплазмы включает комплексные процедуры в зависимости от местонахождения воспалительного процесса. В общем виде применяются антибактериальные средства, которые направлены на уничтожение инфекции; иммуномодуляторы, которые активизируют защитные силы организма; лекарства, уменьшающие риск побочных явлений при приеме антибиотиков.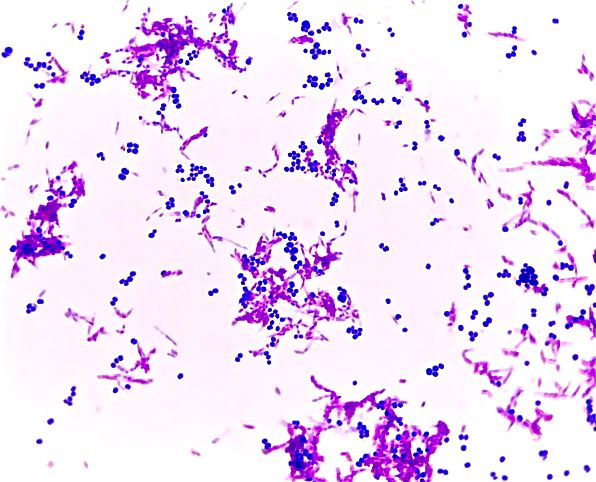 Конкретная схема лечения уреаплазмы может определяться только специалистом, владеющим всей информацией о больном ( осмотр, анамнез, анализы). Как и проблема патогенности уреаплазм, вопрос о необходимости элиминации этих возбудителей из урогенитального тракта также остается открытым. Как правило доктора предлагают принимать меры по элиминации этих микроорганизмов при наличии у человека инфекционно-воспалительного процесса в месте их существования (уретрите, простатите, цервиците, вагините), а также при бесплодии, невынашивании беременности, воспалительных заболеваниях органов малого таза, хориоамнионите, послеродовых лихорадочных состояниях при существовании уреаплазм в мочеполовом тракте.
Конкретная схема лечения уреаплазмы может определяться только специалистом, владеющим всей информацией о больном ( осмотр, анамнез, анализы). Как и проблема патогенности уреаплазм, вопрос о необходимости элиминации этих возбудителей из урогенитального тракта также остается открытым. Как правило доктора предлагают принимать меры по элиминации этих микроорганизмов при наличии у человека инфекционно-воспалительного процесса в месте их существования (уретрите, простатите, цервиците, вагините), а также при бесплодии, невынашивании беременности, воспалительных заболеваниях органов малого таза, хориоамнионите, послеродовых лихорадочных состояниях при существовании уреаплазм в мочеполовом тракте.
Этиотропное лечение уреаплазменной инфекции основывается на назначении антибактериальных препаратов различных групп. Активность медикаментозных средств в отношении любой инфекции определяется по минимальной подавляющей концентрации в исследованиях in vitro. Показатели минимальной подавляющей концентрации, обычно, коррелируют с результатами клинического лечения. Казалось бы, оптимальными лекарствами должны являться антибиотики с наименьшей минимальной подавляющей концентрацией, но при этом нельзя сбрасывать со счетов серьезность таких параметров, как биодоступность, способность к созданию больших внутритканевых и внутриклеточных концентраций, переносимость и комплаентность лечения.
Казалось бы, оптимальными лекарствами должны являться антибиотики с наименьшей минимальной подавляющей концентрацией, но при этом нельзя сбрасывать со счетов серьезность таких параметров, как биодоступность, способность к созданию больших внутритканевых и внутриклеточных концентраций, переносимость и комплаентность лечения.
Уреаплазмы устойчивы к бета-лактамным антибиотикам (пенициллинам и цефалоспоринам), из-за того что у них отсутствует клеточная стенка, и сульфаниламидам, так как эти микроорганизмы не вырабатывают кислоту. При лечении уреаплазменной инфекции могут быть результативны те антибактериальные агенты, которые воздействуют на синтез белка из ДНК, то есть те которые обладают бактериостатическим действием. Это препараты тетрациклинового ряда, макролиды, фторхинолоны, аминогликозиды, левомицетин и некоторые другие.
Из антибиотиков тетрациклинового ряда самые удобные в применении доксициклин и миноциклин, поскольку они, в отличие от других препаратов этой группы, могут применяться 1-2 раза в день.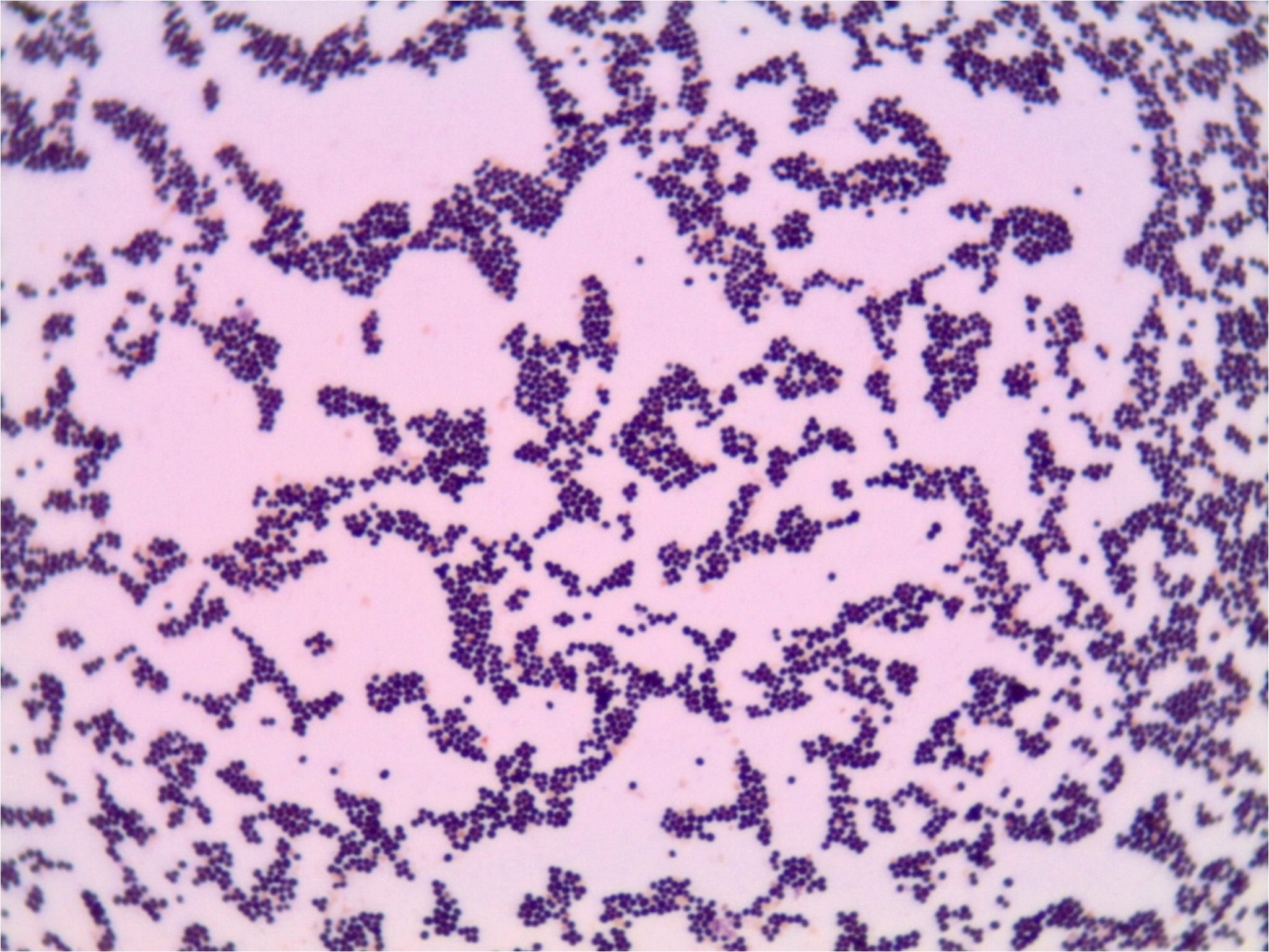 В данное время миноциклин в на территории стран СНГ не зарегистрирован.
В данное время миноциклин в на территории стран СНГ не зарегистрирован.
Соответственно методическим рекомендациям 1998г. по руководству по использованию лекарственных средств, при уреаплазменной инфекции рекомендуется назначение доксициклина (юнидокс солютаб, вибрамицин, медомицин). Препарат назначают по 100 мг 2 раза в день на протяжении 7-14 дней. Обычно при первом приеме антибиотика дозу удваивают.
Положительные результаты были получены при назначении доксициклина женщинам, которые заражены различными микоплазмами (в том числе уреаплазмами) и которые страдают бесплодием или привычным невынашиванием беременности. После избавления от микоплазм в ряде случаев наступала беременность, которая оканчивалась нормальными родами в срок и без осложнений.
Нужно, однако, отметить, что от 2 до 33% штаммов уреаплазм могут быть устойчивы к тетрациклину. К другим весомым недостаткам препаратов тетрациклинового ряда можно отнести противопоказания к их назначению беременным и детям до 8 лет, большую частоту побочных реакций со стороны желудочно-кишечного тракта, а также фотосенсибилизацию кожи во время их употребления.
При рождении детей, которые были внутриутробно инфицированы уреаплазмами, также проводят терапию эритромицином. Предпочтительно внутривенное, капельное назначение препарата из расчета 20-40 мг на 1 кг массы тела.
Все виды микоплазм очень чувствительны к новым фторхинолонам, особенно офлоксацину Его главенствующее положение в этой группе обусловлено обширным антибактериальным спектром воздействия, высокой бактерицидной активностью, хорошими фармакокинетическими характеристиками (быстротой всасывания, высокими концентрациями лекарства в тканях, клетках, биологических жидкостях), низкой токсичностью.
Симптомы уреаплазмы
С момента инфицирования уреаплазмозом до появления первых симптомов уреаплазмоза проходит, обычно, от 4 дней до месяца. Впрочем, скрытый период уреаплазмоза может длиться и дольше, иногда достигая по длительности нескольких месяцев. На протяжении скрытого периода человек уже является носителем уреаплазмоза сам, и может стать источником инфекции для своих половых партнеров.
После окончания инкубационного периода, то есть в среднем через месяц после заражения, появляются первые симптомы уреаплазмоза. Нужно отметить, что часто уреаплазмоз проявляется несильно заметными симптомами, на которые заболевший может не обратить внимания, а иногда не проявляется вообще. Особенно бессимптомное развитие уреаплазмоза характерно для женщин, которые могут десятилетиями жить с инфекцией, не зная об этом.
Больше того, так же, как в случае с микоплазмозом, каких-то конкретных признаков уреаплазмоз не вызывает и симптоматика уреаплазмоза полностью совпадает с симптоматикой любых других воспалительных инфекций мочеполового тракта.
Симптомы уреаплазмы у мужчин:
Негонококковый уретрит – наиболее частое проявление уреаплазмоза у мужчин.
• частое отсутствие субъективных симптомов (рези, болевые ощущения при мочеиспускании)
• небольшие, мутные выделения из мочеиспускательного канала, преимущественно после продолжительной задержки мочи (по утрам)
• склонность к вялотекущему, рецидивирующему течению (выделения из уретры самопроизвольно то пропадают на определенный период времени, то появляются опять)
• Орхоэпидимит — воспаление придатка яичка и яичка возникает на фоне вялотекущего уретрита.
Симптомы уреаплазмоза у женщин:
• Цервицит — диагноз цервицита часто устанавливается только на основании результатов микроскопического исследования мазка из цервикального канала • частое, болезненное мочеиспускание;
• выделения из влагалища кольпит – очень часто U.urealyticum обнаруживается при бактериальном вагинозе • болевые ощущения внизу живота, появление эндометрита, миометрита, сальпингооофорита – достаточно редкое проявление уреаплазменной инфекции.
О своем заболевании пациент, как правило, долго не подозревает. Скрытый период в среднем составляет около месяца, по прошествии этого срока проявляется довольно скудная симптоматика.
Уреаплазма и беременность
Уреаплазмоз входит в число тех инфекций, на которые женщине нужно обследоваться при планированием беременности. Это нужно сделать по двум причинам:
Во-первых, даже незначительное количество уреаплазм в мочеполовом тракте здоровой женщины во время беременности (которая является значительным стрессом для иммунной системы будущей матери) может оживиться и привести к развитию уреаплазмоза.
Во-вторых, лечить уреаплазму во время беременности, тем более на ранних сроках, когда она самая опасная для плода и может привести к выкидышу, нельзя из-за того, что влияние антибиотиков на плод в первые недели беременности может быть опасным. Исходя из этого при планировании беременности женщине, которая заботится о своем здоровье и здоровье будущего малыша, необходимо подумать о том, чтобы вовремя «вывести» уреаплазмы из организма.
Вопрос о влиянии уреаплазм на репродуктивную функцию людей остается открытым. Между тем женское бесплодие может быть объяснено и воспалительными процессами в области половых органов, зараженными уреаплазмами, которые приводят к изменению прохождения яйцеклетки в полость матки. Мужское бесплодие может быть объяснено, во-первых, воспалительными процессами, а во-вторых – влиянием уреаплазм на сперматогенез. Локализация уреаплазм на поверхности сперматозоидов может нарушать их подвижность, морфологию и хромосомный аппарат.
Уреаплазма при беременности опасна еще и тем, что во время родов младенец может инфицироваться, проходя по зараженным родовым путям больной матери. Вот почему крайне важно диагностировать заболевание и провести правильное лечение еще до наступления беременности. Лечение в течении беременности может отрицательно сказаться на развитии ребенка.
Вот почему крайне важно диагностировать заболевание и провести правильное лечение еще до наступления беременности. Лечение в течении беременности может отрицательно сказаться на развитии ребенка.
Что касается плода, то во время беременности инфицирование происходит в редчайших случаях, так как плод надежно защищен плацентой, не пропускающей уреаплазмы. Однако приблизительно в половине случаев ребенок инфицируется во время продвижения по инфицированным родовым путям в процессе родов. В таких случаях уреаплазмы выявляются на половых органах младенцев, наиболее часто у девочек, или же в носоглотке младенцев, независимо от пола.
Если в течении беременности женщина все же заболела уреаплазмозом, то ей нужно как можно скорее обратиться к врачу, который наблюдает ее беременность. Специалист назначит необходимые анализы, которые необходимы для того, чтобы подтвердить диагноз.
Для того чтобы избежать инфицирования ребенка в родах и понизить риск преждевременных родов, беременной женщине с уреаплазмозом после 22 недели беременности назначают лечение антибиотиками, которые подбирает специалист с учетом беременности пациентки. Кроме того, беременной с уреаплазмозом прописывают препараты, укрепляющие иммунитет для того, чтобы свести к минимуму риск вторичных инфекций.
Кроме того, беременной с уреаплазмозом прописывают препараты, укрепляющие иммунитет для того, чтобы свести к минимуму риск вторичных инфекций.
На современном этапе медицина уже успешно справляется с уреаплазмозом беременных, и наличие уреаплазмы при беременности не является показанием к искусственному прерыванию беременности.
Если беременная женщина не теряя времени обращается к грамотному гинекологу или специалисту-венерологу, то возможность нормального протекания беременности и родов здорового ребенка довольно высока.
Анализы на уреаплазмоз
Диагностика уреаплазмоза довольно часто бывает затруднена по нескольким причинам. В первую очередь, уреаплазмы могут составлять естественную биологическую среду мочеполовых путей полностью здорового человека и способны провоцировать патологические процессы только при определенном стечении обстоятельств. Поэтому, существование в мочеполовых путях человека уреаплазм еще не говорит о наличии у него уреаплазмоза.
Самое большое значение в диагностике уреаплазмоза имеет не столько факт присутствия или продолжительного нахождения уреаплазм в половых путях, сколько их количество и распространенность по отделам мочеполового тракта.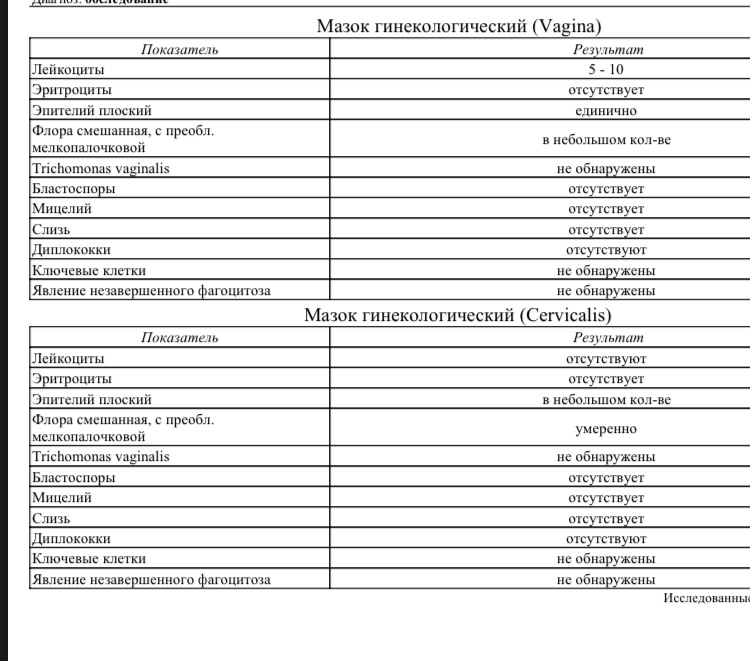 Только в том случае, если уреаплазмы найдены в большом количестве, и у больного налицо все внешние признаки заболевания, доктор имеет право ставить диагноз «уреаплазмоз» и говорить о необходимости лечения уреаплазмы.
Только в том случае, если уреаплазмы найдены в большом количестве, и у больного налицо все внешние признаки заболевания, доктор имеет право ставить диагноз «уреаплазмоз» и говорить о необходимости лечения уреаплазмы.
Для диагностики уреаплазмоза специалист всегда использует совокупность диагностических методов. Определить, есть ли в организме уреаплазма, можно пр помощи специальных анализов. Для того чтобы женщине сдать анализы на уреаплазмоз, нужно обратиться к гинекологу, мужчине – к урологу. По результатам общего мазка (как у мужчин, так и у женщин) можно лишь предположить наличие уреаплазм. При уреаплазме количество лейкоцитов в общем мазке может быть увеличено немного или вообще не превышать нормы. Для определения возбудителя применяют более точные способы обследоваия – ПЦР и бактериальный посев.
Довольно часто (до 75-80% случаев) отмечается одновременное обнаружение уреаплазм, микоплазм и анаэробной микрофлоры (гарднерелла, мобилункус). Оптимальное значение pH для размножения микоплазм 6,5 — 8. Во влагалище норма рН составляет 3,8 — 4,4. Кислую реакцию поддерживает молочная кислота, образуемая лактобациллами из гликогена клеток слизистой генитального тракта. В норме 90 — 95% микроорганизмов составляют лактобациллы, на долю других приходится соответственно 5 — l0% (дифтероиды, стрептококки, кишечная палочка, стафилококки, гарднерелла). В следствии различных неблагоприятных воздействий: применения антибиотиков гормонотерапии, радиоактивного облучения, ухудшения условий жизни и формирования иммунодефицита, а также психических стрессов возникает состояние дисбиоза и увеличивается количество условно-патогенной микрофлоры.
Во влагалище норма рН составляет 3,8 — 4,4. Кислую реакцию поддерживает молочная кислота, образуемая лактобациллами из гликогена клеток слизистой генитального тракта. В норме 90 — 95% микроорганизмов составляют лактобациллы, на долю других приходится соответственно 5 — l0% (дифтероиды, стрептококки, кишечная палочка, стафилококки, гарднерелла). В следствии различных неблагоприятных воздействий: применения антибиотиков гормонотерапии, радиоактивного облучения, ухудшения условий жизни и формирования иммунодефицита, а также психических стрессов возникает состояние дисбиоза и увеличивается количество условно-патогенной микрофлоры.
Крайне важно сообщить своим половым партнерам о болезни, в том случае даже если их ничего не беспокоит, и убедить их обязательно пройти обследование и лечение. Так как бессимптомное развитие болезни не снижает риска осложнений.
Методы диагностики урепалазмы
• Культуральное исследование на селективных средах. Такое Обследование позволяет в течение 3 дней определит культуру возбудителя и отделить уреаплазмы от других микоплазм. Материалами для исследования служат соскобы из урогенитального тракта и моча больного. Способ позволяет определить чувствительность выделенных возбудителей к различным антибиотикам, что крайне важно с учетом доволно частой сегодня антибиотикорезистентности. Специфичность метода составляет 100%. Этот способ используется для одновременного выявления Mycoplasma hominis и Ureaplasma urealyticum.
• Выявление ДНК возбудителей методом ПЦР. Обследование позволяет в течение суток обнаружить возбудителя в соскобе из урогенитального тракта и определить его видовую принадлежность.
• Серологические тесты. Могут выявить присутствие антигенов и специфических антител к ним в крови. Могут быть полезны при рецидивирующем протекании болезни, при формировании осложнений и бесплодии.
Пути передачи
Инфицирование уреаплазмами может быть от матери во время родов. Их выявляют на половых органах и в носоглотке новорожденных.
Взрослые заражаются при половых контактах. Бытовое инфицирование маловероятно.
Уреаплазмы обнаруживают на половых органах приблизительно у каждой третьей новорожденной девочки. У мальчиков этот показатель значительно меньше.
Нередко у детей, инфицирванных} во время родов, со временем происходит самоизлечение от уреаплазм. Как правило часто это происходит у мальчиков.
Поэтому у школьниц, которые не живут половой жизнью, уреаплазмы выявляют лишь в 5-22% случаев.
У людей, которые живут половой жизнью, распространенность уреаплазм увеличивается, что связано с инфицированием при половых контактах.
Носителями уреаплазм являются как правило женщины. У мужчин они наблюдаются редко. У мужчин возможно самоизлечение.
Уреаплазма передается иногда контактно бытовым, и половым путем, при этом последний самый распространенный. Вероятен и вертикальный путь передачи, который может происходить в следствии восходящей инфекции из влагалища и цервикального канала. Внутриутробный путь заражения — при наличии уреаплазмы в околоплодных водах, плод заражается через пищеварительный тракт, кожу, глаза, урогенитальный тракт. Для мужчин уреаплазмоз – исключительно половая инфекция.
Инкубационный период – в среднем 2-3 недели.
Данные по зараженности урогенитального тракта уреаплазмами среди сексуально активного населения варьируют от 10 до 80%. Уреаплазмы, обычно, обнаруживают у людей, ведущих активную половую жизнь, а довольно часто эти микроорганизмы выявляются у людей, которые имеют три и более половых партнеров.
Мазок из уха
Мазок из уха – один из методов диагностики воспалительных процессов, применяемых в медицинском центре «Медлайн Сургут».
Мазок из уха назначается, когда врач подозревает развитие острого или хронического отита инфекционной и грибковой этиологии. Лабораторные исследования дают возможность отоларингологу поставить диагноз, подобрать соответствующее лечение, предотвратив переход заболевания в хроническую форму.
Как правило, мазок проводится до начала антибактериальной терапии.
Что выявляет?
Часто мазок из уха выявляет такие патогенные микроорганизмы:
- энтеробактерии;
- протей;
- золотистый стафилококк;
- стрептококки;
- непатогенные дифтероиды и грибы рода кандида.
Кроме того, данный анализ показывает микрофлору слизистой уха, дает возможность определить чувствительность патогенных микроорганизмов к основным группам антибиотиков.
Причины развития инфекции в ухе:
- переохлаждение;
- микротравмы, например, при чистке уха;
- снижение иммунитета;
- вода, попавшая в ухо и долго там находящаяся;
- авитаминоз;
- сахарный диабет;
- повышенное выделение ушного секрета;
- грибы;
- неправильное самолечение.
При развитии отита к основному возбудителю заболевания часто добавляется вторичная микрофлора, распознать которую помогает мазок. Чтобы правильно подобрать антибактериальное лечение, нужно сначала дифференцировать патогенную микрофлору.
Взятие мазка и результаты
- Мазок из уха лучше сдавать до начала приема антибактериальных препаратов, чтобы результат отображал реальную картину заболевания.
- Для бакпосева берется мазок из наружного уха или аспират из среднего уха.
- Мазок на флору берется из наружного уха ватной палочкой или ушным крючком и наносится на предметное стекло перекатыванием по нему ватной палочкой. Каждое стекло промаркировано, чтобы можно было различить исследование мазка, взятого из правого и левого уха, так как результаты анализов могут отличаться. Мазок на микрофлору и чувствительность к антибиотикам делается в пробирке.
В результате исследования могут выявиться:
- кишечная и синегнойная палочки – не являются нормой и требуют лечения;
- энтеробактерии – свидетельствуют о воспалительном процессе;
- нейтрофилы – разновидность лейкоцитов, наличие которых говорит о патологическом состоянии и об интоксикации тканей уха микроорганизмами;
- дрожжеподобные грибки – считаются нормой, так как они присутствуют в небольшом количестве в здоровой слизистой уха. Однако резкое увеличение их числа приводит к заболеванию, поэтому важную роль играет количественный показатель;
- процесс фагоцитоза (захват и переваривание патогенных микроорганизмов) – является подтверждением наличия патогенной микрофлоры в полости уха.
Анализ, диагностику и лечение всех ЛОР-заболеваний может проводить только специалист-отоларинголог! Обращайтесь за квалифицированной помощью в клинику «Медлайн Сургут»!
Клиническая значимость комменсальных грамположительных палочек, регулярно выделяемых из образцов пациентов
ВВЕДЕНИЕ
В клинических микробиологических образцах часто в дополнение к истинным патогенам вырастают различные уровни комменсальных бактерий на коже и слизистой оболочке (1). Большинство этих изолятов представляют собой аэробные, аспорогенные, неправильной формы, не частично кислотоустойчивые, каталазоположительные, грамположительные палочки из нескольких родов с нечеткой морфологией колоний, обычно классифицируемых как дифтероиды (2).Термины дифтероид и коринеформные бактерии взаимозаменяемы, и для всестороннего обзора бактериальных родов, классифицируемых как коринеформные бактерии, см. Два превосходных обзора Bernard et al. (2, 3). Короче говоря, релевантные с медицинской точки зрения роды, морфологические и биохимические описания которых соответствуют классификации дифтероидов, включают Arcanobacterium, Arthrobacter, Brevibacterium, Cellulomonas, Cellulosimicrobium, Corynebacterium (non-diphtheriae), Curtobacterium, Dermabacter, Exiguellsonifacterium, , Pseudoclavibacter и Trueperella (2–4).
Кроме того, некоторые виды в пределах других родов имеют некоторые, но не все черты дифтероидов, являются частью микробиома кожи, часто выделяются из образцов клинической микробиологии и обычно включаются в классификацию дифтероидов (2, 4–6). Например, аэротолерантные виды Propionibacterium, такие как P. acnes, могут быть выделены из аэробных чашек и отвечать критериям классификации дифтероидов (6). Точно так же большинство видов Rothia, таких как R. mucilaginosa, являются грамположительными кокками, но R.dentocariosa часто имеет палочковидную форму и имеет положительную каталазу (4). Виды Actinomyces часто классифицируются как анаэробные и каталазонегативные, но большинство важных с медицинской точки зрения штаммов, включая все штаммы, кроме A. meyeri, выделенные в этом исследовании, являются аэротолерантными, а подмножество, включающее A. neuii и A. viscosus, является каталазоположительным (4 , 5). Морфология актиномицетов также различна, от ветвящихся палочек до коккобацилл, а некоторые виды, такие как A. neuii, являются плеоморфными палочками (4). Таким образом, когда колония А.neuii изолирован в клинической лаборатории, он выглядит как каталаза-положительный грамположительный плеоморфный стержень и, в зависимости от характеристик культуры, предположительно идентифицируется как дифтероид или в дальнейшем идентифицируется до уровня вида. Таким образом, термин дифтероид охватывает разнообразную группу бактерий, принадлежащих к нескольким родам, которые имеют сходные морфологические и биохимические характеристики с недифтерийными видами Corynebacterium.
Считается, что большинство дифтероидов являются контаминантами, но есть существенные свидетельства того, что многие виды в рамках этой классификации являются условно-патогенными микроорганизмами хозяев с ослабленным иммунитетом, протезов и людей во время длительного пребывания в больнице (2).Ожидается, что с учетом увеличения популяции восприимчивых хозяев распространенность инфекций, связанных с дифтериоидом, возрастет. В пределах рода Corynebacterium 54 из 89 видов связаны с оппортунистическими инфекциями человека или зоонозами (4). Инфекции, вызванные C. diphtheriae, сейчас редки при ранней плановой вакцинации, но дифтерийное заболевание по-прежнему вызывается C. ulcerans и редко C. pseudotuberculosis (2). C. urealyticum вызывает инфекции мочевыводящих путей (ИМП), C. jeikeium — системные инфекции, а C.kroppenstedtii ассоциируется с хроническим маститом (2). C. striatum является патогеном в нескольких местах, и несколько видов в пределах родов Actinomyces и Propionibacterium являются известными патогенами в избранных анатомических участках и в отдельных популяциях пациентов (5, 6).
Помимо этих примеров, потенциальным связям между дифтероидами и клиническими инфекциями исторически препятствовала неспособность эффективно и точно идентифицировать изоляты на уровне вида, что приводило к обычному отклонению результатов как не имеющих клинического значения (4).Текущий лабораторный рабочий процесс для выявления и регистрации дифтероидов зависит от характеристик культуры. Например, если дифтероидоподобные колонии связаны с аналогичными уровнями других известных комменсальных организмов, они считаются частью местной флоры и сообщаются как часть коллективной группы организмов, заключенных под терминами «дифтероиды», «кожная флора», «Ротоглоточная флора» или «урогенитальная флора». Напротив, если колония является преобладающей или чистой, тогда априорное подозрение на возможное участие в инфекции возрастает, и предпринимаются попытки идентификации на уровне видов.Согласующиеся результаты прямого окрашивания по Граму повышают уровень достоверности причастности к инфекции и полезны для ретроспективного обзора наборов данных, но решение выбрать изоляты для идентификации на уровне видов с помощью матричной лазерной десорбционной ионизации — времяпролетной масс-спектрометрии ( MALDI-TOF MS) в большинстве лабораторий не зависит от результатов прямого окрашивания по Граму. С появлением и внедрением MALDI-TOF MS в клиническую микробиологическую лабораторию большинство этих подозрительных дифтероидов теперь можно стандартно идентифицировать до уровня вида (7, 8).
Значение многих из этих видов неясно, и потенциально патогенные изоляты могут быть неправильно отнесены к категории дифтероидов. За редкими исключениями, клиницисты рассматривают термин «дифтероид» как представитель местной флоры и отвергают изолят как непатогенный. Таким образом, крайне важно, чтобы лаборатория клинической микробиологии оставила за собой термин «дифтероиды» для обозначения только непатогенных видов в рамках классификации дифтеидов.Это исследование направлено на расширение нашего понимания дифтероидов при клинических инфекциях, чтобы помочь составить лабораторную отчетность о клинических изолятах и улучшить уход за пациентами. В рамках этой работы мы провели ретроспективный обзор данных (с 2012 по 2015 год) для выявления всех дифтероидов с априорным подозрением на возможное участие в инфекции, которые были идентифицированы до уровня вида, и использовали лабораторные критерии для конкретных участков и обзоры диаграмм для выявления репрезентативных изолятов. истинной инфекции по сравнению с заражением.
РЕЗУЛЬТАТЫ
Лабораторная идентификация дифтероидов с помощью MALDI-TOF MS и секвенирования гена 16S рРНК. Ретроспективный обзор данных микробиологических культур с 1 июня 2013 г. по 1 июля 2015 г. выявил 1065 зарегистрированных изолятов в рамках классификации дифтероидов. Предположительная идентификация 65 изолятов была выполнена только на основании характерных морфологических признаков. Остальные 1000 изолятов продемонстрировали достаточное априорное подозрение на участие в инфекции, чтобы гарантировать идентификацию на уровне вида с помощью MALDI-TOF MS.Однако 139 из этих изолятов не были идентифицированы на уровне видов, что дало раздельную идентификацию видов внутри одного и того же рода, включая 106 изолятов Corynebacterium, 31 изолят Propionibacterium, 1 изолят Rothia и 1 изолят Microbacterium. Девяносто процентов изолятов Corynebacterium без идентификации на уровне вида были 50% -ными идентификациями C. amycolatum и C. xerosis. Идентификация этих изолятов на уровне видов в дальнейшем не проводилась, и они были исключены из набора данных.MALDI-TOF MS (98%) или секвенирование 16S рРНК (2%) было успешным при идентификации на уровне видов оставшихся 84% бактериальных изолятов. После удаления повторяющихся образцов база данных включала 762 дифтероидов с идентификацией на уровне видов из 13 родов, составляющих 41 вид бактерий (Таблица 2).
ТАБЛИЦА 2
Клиническая значимость дифтероидных изолятов из образцов пациентов a
Наиболее часто обнаруживаемыми изолятами были P. acnes (33%), C.striatum (20%) и A. neuii (8%), за которыми следуют несколько видов Corynebacterium. Виды, требующие секвенирования для идентификации, включали Actinotignum schaalii (4/4 изолята), A. viscosus (1/3), Corynebacterium aurimucosum (1/25), C. auriscanis (1/1), C. glucuronolyticum (1/12). ), C. kroppenstedtii (1/18), C. thomssenii (1/1), C. tuberculostearicum (1/27), Microbacterium lacticum (1/1), Microbacterium oxydans (1/1) и Propionimicrobium lymphophilum (1 / 1). Распределение этих изолятов было следующим: образцы анаэробных ран — 36% изолятов, образцы аэробных ран — 24%, кровь — 14%, моча — 16%, спинномозговая жидкость — 3%, офтальмологические культуры — 3% и стерильные участки. на 3%.
Клиническая значимость дифтероидных изолятов. Для скрининга бактериальных изолятов с вероятной ролью в возникновении инфекции использовались комплексные лабораторные критерии, специфичные для конкретных участков, и эти изоляты были дополнительно изучены на предмет потенциальной клинической значимости с помощью обзора диаграмм. Лабораторные и клинические критерии, использованные для оценки клинической значимости, приведены в таблице 1. Суммативные данные по всем клиническим изолятам и их клиническое значение выделены в таблице 2.
Наши данные показывают, что 18% всех дифтероидных изолятов априори считались потенциально вовлеченные в инфекцию на основании условий культивирования были действительно клинически значимыми, и 82% были контаминантами.Клинически значимые изоляты на основе типа культуры были получены из образцов анаэробных ран (18%), образцов аэробных ран (30%), крови (5,5%), мочи (22%), спинномозговой жидкости (24%), офтальмологических культур (8%). %) и стерильные участки (20%).
В образцах анаэробных ран было обнаружено 274 изолята от 21 вида дифтероидов. Наиболее распространенными изолятами были P. acnes (55%), C. striatum (16%), A. neuii (6%) и C. kroppenstedtii (5%). Клинически значимыми были признаны несколько видов Actinomyces, включая A.europaeus (1/1 изолята), A. meyeri (2/2), A. neuii (4/14; 29%), A. odontolyticus (1/2), A. radingae (2/5) и A. turicensis (1/3). В соответствии с полимикробной природой инфекций Actinomyces, все клинически значимые изоляты Actinomyces, кроме одного (один изолят A. neuii), при окрашивании по Граму демонстрировали морфологически несходные организмы, и все значительные поражения представляли собой абсцессы, кисты или серомы, способствующие анаэробному росту. (5). Множественные изоляты Corynebacterium также были клинически значимыми, включая C.kroppenstedtii (11/12; 92%) и C. striatum (5/43; 12%). Все изоляты C. kroppenstedtii из ткани молочной железы были клинически значимыми (11/11; 100%). Один изолят был также идентифицирован из образца носового абсцесса, коинфицированного синегнойной палочкой. Все значимые изоляты C. striatum были изолированы от иммунокомпетентных пациентов из нескольких мест. Клинически значимые изоляты P. acnes (16/137; 12%) были связаны с протезами (7/16 изолятов) и поражениями головы и шеи (6/16).Кроме того, у пациентов с хроническими нативными инфекциями суставов были выявлены две значимые инфекции, в том числе одна с предшествующей инфекцией Staphylococcus aureus, которая, как считается, предрасполагает сустав к колонизации P. acnes. Единственный изолят Propionibacterium avidum (1/10) из перигепатической кисты также считался клинически значимым.
Аэробные раневые культуры дали 184 изолята от 17 видов. В отличие от изолятов из анаэробных ран, наиболее распространенными изолятами были C. striatum (28%) и A.neuii (13%), причем P. acnes и A. turicensis составляют 11% от всех изолятов. Как и образцы анаэробных ран, несколько видов Actinomyces были признаны клинически значимыми, включая A. europaeus (6/8; 75%), A. neuii (10/22; 45%), A. radingae (3/10; 30%). и A. turicensis (10/20; 50%). Все клинически значимые изоляты, за исключением одного изолятов A. europaeus и двух изолятов A. neuii, при окрашивании по Граму демонстрировали морфологически несходные организмы. Большинство клинически значимых изолятов происходило из поверхностных фурункулов, пилонидальных кист или кожных абсцессов, включая A.europaeus (4/6 изолятов), A. neuii (8/10), A. radingae (3/3) и A. turicensis (8/10). Кроме того, единственный значимый изолят A. neuii был получен из челюсти человека с клинической картиной, весьма подозрительной на актиномикоз. Значимые изоляты Corynebacterium включали C. jeikeium (2/10; 20%), C. striatum (7/51; 14%) и C. tuberculostearicum (3/13; 23%). Все 3 вида дали значительные изоляты из язв диабетической стопы и голеностопного сустава, включая 2/2 C. jeikeium, 3/7 C. striatum и 2/3 C.tuberculostearicum и еще 3 изолята C. striatum были получены от пациентов с той или иной формой иммуносупрессии. Клинически значимые изоляты P. acnes (7/21; 33%) и P. avidum (4/10; 40%) были получены из поверхностных кист или абсцессов в 6/7 и 4/4 случаях соответственно. Один изолят Trueperella pyogenes (1/1) был клинически значимым и ассоциировался с остеомиелитом пальца.
Всего 109 изолятов 27 видов были выделены из гемокультуры.Наиболее распространенными видами были P. acnes (36%), C. striatum (9%) и Dermabacter hominis (6%). Четыре вида соответствовали критериям истинной инфекции: C. striatum (3/9 изолятов), C. jeikeium (1/3), Actinotignum schaalii (1/3) и Dermabacter hominis (1/7). Значительные инфекции C. jeikeium (1/1 изолятов) и C. striatum (1/3) наблюдались при иммуносупрессии. Остальные значимые изоляты C. striatum (2/3) встречались у лиц с неповрежденным иммунитетом, но с множественными сопутствующими заболеваниями (болезнь сердца и легких и инсульт).Согласно литературным данным, единственный значимый изолят Actinotignum schaalii был получен от пожилого человека с пиелонефритом (9).
Посев мочи дал 121 изолят от 14 видов дифтероидов. Наиболее распространенными изолятами были C. striatum (32%), C. aurimucosum (17%) и A. neuii (13%). Шесть видов соответствовали критериям истинной инфекции, включая C. striatum (10/28 изолятов; 36%), C. aurimucosum (3/14; 21%), C. urealyticum (2/3), C. simulans (1/3 ), C. coyleae (1/8) и A.neuii (3/14; 21%). Значимые изоляты C. striatum были изолированы от людей с постоянными катетерами (5/10 изолятов), пожилых людей с историей рецидивирующих ИМП, подтвержденных культурой (4/10), и недавних операций на мочеполовых путях (3/10). Однако 4 из 10 изолятов были получены от пациентов младше 45 лет с острой дизурией, только у одного из которых был камень. Значимые изоляты C. aurimucosum (2/3 изолятов) и один изолят C. coyleae (1/1) также наблюдались у пожилых людей с историей рецидивирующих ИМП, подтвержденных культурой, и никому из этих людей не была проведена катетеризация.Изоляты C. urealyticum (2/2) были также изолированы от пожилых людей с постоянным катетером или внутрипузырным кальцинированным мусором. C. simulans (1/1 изолят) был изолирован от пациента с почечным камнем, а изоляты A. neuii были связаны либо с камнями (2/3), либо с постоянными катетерами (1/3).
Цереброспинальная жидкость содержала 25 изолятов от 3 видов дифтероидов: P. acnes (84%), C. striatum (12%) и C. tuberculostearicum (4%). Только два вида соответствовали критериям истинного заражения: P.acnes (CSF, 2/19 [10%]; шунты, 2/2) и C. striatum (CSF, 0/1; шунты, 2/2). Офтальмологические культуры дали 26 изолятов и 8 видов дифтероидов. Наиболее часто обнаруживаемыми изолятами были P. acnes (65%), C. striatum (8%), Corynebacterium macginleyi (8%) и A. viscosus (4%). Только P. acnes (1/16; 6%) и A. viscosus (1/1) были признаны клинически значимыми. Стерильные участки дали в общей сложности 23 изолята и 13 видов. Наиболее часто обнаруживаемыми изолятами были P. acnes (30%), C. striatum (13%) и Microbacterium testaceum (9%), причем 2/4, 1/3 и 1/2 из этих изолятов, соответственно, были клинически значимо.Значимые изоляты P. acnes (2/2) были выделены из инфицированных нативных суставов у одного пациента с диабетом и второго пациента с неактивной подагрой. C. striatum был выделен из асцитической жидкости у послеоперационного пациента с множественными абдоминальными дренажами. Единственный значимый изолят M. testaceum был получен из плевральной жидкости пациента с метастатическим злокачественным новообразованием.
ОБСУЖДЕНИЕ
В этом исследовании мы применили лабораторные критерии для конкретных участков и провели обзор диаграмм, чтобы определить клиническую значимость подозрительных изолятов комменсальных бактерий, культивируемых из образцов пациентов.Идентификация известного патогена в клиническом образце требует отчета лечащему врачу с четкой идентификацией организма, что, в свою очередь, помогает принимать решения о лечении и уходе за пациентом (10). Тем не менее, клинический микробиолог часто сталкивается с более сложными сценариями, например с тем, что сообщить клиницистам, когда подозрительный бактериальный изолят является составной частью местной флоры с ограниченными данными, подтверждающими его патогенную роль. Большинство этих организмов не связаны с инфекцией; однако различие между комменсалом и патогеном лежит в континууме, в значительной степени определяемом иммунным статусом хозяина и доступом к подходящим условиям роста (2).Этот маятник все больше смещается в сторону патогенеза у пациентов с ятрогенными вмешательствами, множеством сопутствующих заболеваний и вторичным иммунодефицитом (2). Необходимы дополнительные исследования для выявления редких видов бактерий, связанных с инфекцией в определенных местах. Неспособность признать важность этих редких патогенов отрицательно сказывается на уходе за пациентами. Например, до недавнего времени о выделении C. kroppenstedtii из ран груди повсеместно сообщалось лечащим врачам как «дифтероид».Естественно, сообщение о дифтероидах указывало на «нормальную флору» и снимало опасения лечащего врача по поводу инфекции. Это часто приводило к использованию стероидов для ослабления воспаления и задержке приема соответствующих антибиотиков для лечения мастита, вызванного C. kroppenstedtii, что приводило к более тяжелому заболеванию (11, 12).
MALDI-TOF MS произвела революцию во многих аспектах клинической микробиологии, включая рутинную идентификацию на уровне видов подозрительных дифтероидных изолятов и создание наборов данных для клинических исследований (13, 14).Настоящее исследование было проведено для определения роли дифтероидов как потенциальных патогенов, и хотя мы показываем, что 82% подозрительных изолятов дифтероидов не соответствовали критериям истинной инфекции, оставшиеся 18% были клинически значимыми, что требует сообщения лечащим врачам на уровне вида. . Наши результаты согласуются с недавним отчетом о дифтероидах в крови, в котором 56% изолятов идентифицированы как потенциальные загрязнители (13). Для повседневной идентификации потенциальных патогенов мы рекомендуем, чтобы все дифтероидоподобные изоляты, которые преобладают или являются чистыми в культуре, были идентифицированы до уровня вида с помощью MALDI-TOF MS или секвенирования 16S рРНК.Данные прямого окрашивания по Граму следует исследовать во время считывания на планшете, чтобы скорректировать предварительное подозрение на инфекцию. Например, прямое окрашивание по Граму, показывающее обильные плеоморфные грамположительные палочки как преобладающую или единственную морфологию, должно вызвать подозрение в отношении возможной роли в инфекции и снизить порог для отбора изолятов с пограничной численностью для идентификации на уровне видов. Затем идентификация на уровне видов может быть использована для определения того, следует ли сообщать клиницистам об изоляте из определенного места культивирования на уровне вида или как о дифтероиде.Как недавно показали Патель и др., Сообщение об изолятах дифтероидов на уровне вида влияет на решения о лечении (13), и крайне важно, чтобы термин «дифтероид» использовался исключительно для описания доброкачественной комменсальной флоры, изолированной от участков, в которых находится этот организм. не известно, чтобы вызвать инфекцию. Вкратце, клинически значимые дифтероиды из нашего набора данных, которые требуют сообщения клиницисту на уровне вида после оценки клинической значимости с использованием образцов из ран, включают все виды Actinomyces, C.kroppenstedtii, C. jeikeium, C. striatum, C. tuberculostearicum, P. acnes и P. avidum. Изоляты крови, которые требуют отчетности на уровне видов, включают A. schaalii, C. jeikeium, C. striatum и D. hominis. Изоляты, подлежащие регистрации, из образцов мочи включают A. neuii, C. aurimucosum, C. coyleae, C. simulans, C. striatum и C. urealyticum. Мы рекомендуем сообщать об обнаружении изолятов C. striatum и P. acnes во всех шунтирующих образцах CSF или в образцах CSF без наблюдения, когда организмы и / или нейтрофилы обнаруживаются при прямом окрашивании CSF по Граму.Мы также рекомендуем сообщать об изолятах P. acnes из глаз и стерильных участков, а также об изолятах C. striatum и M. testaceum из стерильных участков, когда организмы и / или повышенное количество нейтрофилов обнаруживаются при прямом окрашивании по Граму.
Хотя мы идентифицировали множество клинически значимых видов дифтеоидов, мы также предоставляем данные об изолятах, не связанных с истинной инфекцией, несмотря на априорные подозрения о возможном участии в инфекции. Эти данные следует интерпретировать с осторожностью, так как будущие исследования могут идентифицировать эти организмы как редкие причины определенных типов инфекций, а политика лабораторной отчетности требует постоянного переоценки литературы для выявления и точного сообщения о новых ассоциациях болезней.Поэтому мы рекомендуем сообщать о подозрительных изолятах, идентифицированных как непатогенные виды, лечащим врачам как дифтероидные при условии выполнения рутинных обзоров литературы для исключения потенциальных патогенов из списка доброкачественных образований.
MALDI-TOF MS смог идентифицировать подавляющее большинство подозрительных изолятов на уровне видов, включая 296 видов Corynebacterium. Однако 105 изолятов не были идентифицированы на уровне видов, что дало раздельную идентификацию видов в пределах рода Corynebacterium.Из них 95 на 50% были идентифицированы для C. amycolatum и C. xerosis. C. ксероз редко встречается в клинических образцах; однако C. amycolatum является обычным явлением, и, таким образом, большинство этих изолятов, вероятно, были C. amycolatum (2). C. amycolatum является патогеном мягких тканей, крови, стерильных участков и мочевыводящих путей и часто имеет множественную лекарственную устойчивость (МЛУ) (2, 15). Неспособность точно идентифицировать эти организмы является существенным ограничением настоящего исследования, и будущие обновления базы данных спектра белков bioMérieux должны быть направлены на устранение этих двусмысленностей.Напротив, система Bruker точно идентифицировала изоляты C. amycolatum из крови, большинство из которых были сочтены лечащими врачами значимыми (13). Между тем, если MALDI-TOF MS не может идентифицировать дифтероидный изолят с достаточным априорным подозрением на роль в инфекции, мы рекомендуем секвенирование или идентификацию 16S рРНК с помощью системы биохимической идентификации апикоринов (4, 16).
C. striatum составлял 20% от всех изолятов и был клинически значимым на всех участках, за исключением глаза.Эти результаты согласуются с C. striatum как появляющимся патогеном во многих местах и колонизатором постоянных медицинских устройств (17). Также сообщалось о вспышках множественной лекарственной устойчивости и внутрибольничных вспышках (18–21). Несмотря на небольшое количество сообщений об этом организме, вызывающем ИМП (22), 36% подозрительных изолятов C. striatum из мочи соответствовали критериям истинной инфекции. Половина этих изолятов была получена от пациентов с постоянными катетерами или нефростомическими трубками, что позволяет предположить роль биопленки C. striatum (18).Таким образом, данные из литературы и наш набор данных подтверждают рекомендацию о том, что все изоляты C. striatum с априорным подозрением на роль в инфекции должны сообщаться на уровне вида независимо от местонахождения.
Наши данные также идентифицировали несколько клинически значимых изолятов Corynebacterium из культур мочи: C. urealyticum, C. aurimucosum, C. coyleae и C. simulans. Наши данные и литературные данные подтверждают идентификацию изолятов C. urealyticum и C. aurimucosum на уровне видов.C. urealyticum — известная причина хронических ИМП у пациентов с заболеваниями мочеполовой системы, пожилого возраста и иммуносупрессией (4, 23). C. aurimucosum вызывает бактериемию и ассоциируется со спонтанными абортами (2). Его также можно выделить из урогенитальных органов, но только в отчетах о случаях он был идентифицирован как патоген мочевыводящих путей (24). В этом исследовании мы идентифицировали 3 из 14 клинически значимых изолятов C. aurimucosum в моче. Все пациенты имели симптомы ИМП от легкой до умеренной, а 2/3 пациентов были старше 80 лет с историей рецидивирующих хронических ИМП и с предшествующим выделением известных патогенов. ermX -опосредованная устойчивость к антибиотикам может способствовать росту C. aurimucosum в условиях предшествующего лечения антибиотиками (4). Также распространена резистентность к пенициллину; однако МЛУ не описан, а редкие изоляты синтезируют серовато-черный антиоксидантный пигмент с предполагаемой ролью в вирулентности (4, 25). Напротив, о C. coyleae и C. simulans следует сообщать только в индивидуальном порядке, поскольку данные из текущей литературы не подтверждают роль этих организмов в ИМП, а небольшое количество изолятов в нашем наборе данных не поддерживает окончательных выводов.
Существует 5 важных с медицинской точки зрения липофильных видов коринебактерий, включая C. tuberculostearicum, C. jeikeium, C. urealyticum и C. kroppenstedtii в ранах и C. macginleyi в конъюнктиве (2). Наши данные и данные в литературе подтверждают сообщения об этих патогенных микроорганизмах мягких тканей, когда они изолированы от ран, а данные в литературе подтверждают сообщения о C. macginleyi, когда он изолирован от конъюнктивы (26). C. tuberculostearicum, как известно, поражает несколько участков, включая богатую липидами ткань груди, а C.jeikeium вызывает бактериемию и раневые инфекции (2, 12). В этом исследовании оба вида были связаны с диабетическими язвами. C. kroppenstedtii в настоящее время является признанной причиной инфекционного мастита, и наши данные показывают, что 100% изолятов из молочной железы были значимыми (12). Все 5 образцов биопсии, полученные от этих пациентов, соответствовали уникальной гистопатологической картине, называемой кистозным нейтрофильным гранулематозным маститом, при котором бактерии занимают большие кистозные пространства на фоне гранулематозного воспаления с различными нейтрофильными инфильтратами (27).Мастит, вызванный C. kroppenstedtii, представляет собой хроническое воспалительное поражение груди, имитирующее аутоиммунное заболевание, и воспалительный рак груди, вызывающее биопсию (27). Однако осведомленность об этой гистопатологической сущности недостаточна, и клинические микробиологи должны работать над обучением своих коллег и жителей новым ассоциациям болезней, таким как мастит C. kroppenstedtii, с характерными патогистологическими находками (27). В соответствии с данными из нескольких недавних отчетов, 7 из 9 пациентов в нашем исследовании были выходцами из Латинской Америки (11, 12, 28–33).Эта связь может быть связана с многоплодием, грудным вскармливанием, низким социально-экономическим статусом или рождением за пределами США с географической изменчивостью флоры кожи (1).
D. hominis и M. testaceum вызывают раневые инфекции и бактериемию, а виды Trueperella связаны со смешанными анаэробными абсцессами (2, 4, 34). Наши данные согласуются с данными, приведенными в литературе, и, предполагая достаточное априорное подозрение на причастность к инфекции, мы рекомендуем идентификацию этих организмов на уровне видов лечащим врачам.
P. acnes является причиной вульгарных угрей, бактериемии, эндокардита, раневых инфекций, остеомиелита и кератита (6, 35), а образование биопленок приводит к колонизации медицинских устройств (6, 36). Наши данные показывают, что P. acnes был наиболее часто изолированным видом, составляя 33% всех изолятов, с вовлечением всех типов культур, кроме мочи, вероятно, из-за сокращенного времени инкубации этих культур. Клинически значимые изоляты также были идентифицированы в образцах ран, спинномозговой жидкости, офтальмологических образцах и стерильных участках.Примечательно, что в крови не было обнаружено значимых изолятов. Интересно, что образование биопленки, вероятно, было важным для инфицирования спинномозговой жидкости P. acnes у 2/2 пациентов с желудочковыми шунтами, у одного нативного сустава у пациента с предшествующим поражением стафилококком и у человека, носящего контактные линзы, с кератитом. В отличие от многих организмов, входящих в классификацию дифтероидов, P. acnes хорошо известен клиницистам как комменсальный организм с низким патогенным потенциалом, способный вызывать коварные инфекции в правильных условиях (6).Эти инфекционные сценарии, способствующие патогенности P. acnes, такие как спинномозговая аппаратура у пациента с положительными культурами из раны, не всегда очевидны для лаборанта во время исследования изолятов. Поэтому мы рекомендуем сообщать обо всех подозрительных изолятах P. acnes из любого места с названием вида, чтобы клиницисты могли определить их значимость. P. avidum вызывает аналогичные поверхностные поражения кожи, и его также следует идентифицировать на уровне вида при выделении из образцов ран.
Многие грамположительные анаэробные виды Actinomyces представляют собой комменсальные организмы, которые часто выделяются из клинических образцов вместе с другими бактериями (1, 5). Эти полимикробные инфекции затрудняют интерпретацию окрашивания по Граму и посевов; однако при выделении из образцов раны с априорным подозрением на роль в инфекции мы рекомендуем идентификацию всех изолятов Actinomyces до уровня вида. В соответствии с данными литературы, наши данные выявили клинически значимые раневые инфекции, вызванные A.europaeus, A. meyeri, A. neuii, A. odontolyticus, A. radingae и A. turicensis (5). Изоляты A. neuii были дополнительно клинически значимыми при инфекциях мочевыводящих путей, а A. viscosus был связан с истинной инфекцией в единственном образце из глаза. В отличие от других видов Actinomyces, A. neuii представляет собой небольшую неразветвленную палочку, которую часто ошибочно принимают за вид Corynebacterium (4, 5). Улучшенное обнаружение A. neuii с помощью MALDI-TOF MS привело к недавнему признанию этого организма патогеном мягких тканей (5, 37).Однако в литературе зарегистрировано очень мало инфекций мочевыводящих путей. Мы показываем, что A. neuii был единственным видом Actinomyces, выделенным из мочи, и что 3/14 изолятов были клинически значимыми и ассоциировались с камнями и катетеризацией, вызывающими симптомы ИМП от легкой до умеренной. Существует 2 подвида A. neuii, A. neuii subsp. neuii и A. neui subsp. anitratus (38). A. neuii subsp. anitratus получил свое название из-за своей неспособности восстанавливать нитраты (38). В отличие от A. neuii subsp. neuii является восстановителем нитратов, и результаты смешанного анализа мочи подтверждают, что оба подвида являются патогенами мочевыводящих путей. Поэтому мы дополнительно рекомендуем идентифицировать подозрительные изоляты A. neuii от мочи до уровня вида. Сообщение о подвиде может оказаться клинически полезным в будущем.
Actinotignum schaalii, ранее называвшийся Actinobaculum schaalii, филогенетически тесно связан с актиномицетами и является новым уропатогеном у пациентов старше 60 лет с сопутствующими заболеваниями, вызывающими уросепсис и раневые инфекции (4, 5).Наши результаты исследования клинически значимых изолятов A. schaalii из крови согласуются с данными литературы, и мы рекомендуем идентифицировать изоляты A. schaalii на уровне вида, особенно при обнаружении в крови или моче (9, 39).
Таким образом, технологические достижения, такие как MALDI-TOF MS, позволяют выполнять рутинную идентификацию на уровне видов многих бактерий в лаборатории клинической микробиологии, и точная идентификация имеет важное значение для изучения роли этих организмов в инфекциях человека (14).Все чаще комменсальные бактерии идентифицируются как клинически значимые при определенных типах инфекций, и лаборанты должны постоянно обновлять алгоритмы отчетности, чтобы исключить потенциальные патогены из классификации дифтероидов (2, 13). Ожидается, что по мере старения населения с увеличением числа иммуносупрессивных хозяев количество инфекций, вызванных этими условно-патогенными микроорганизмами, обитающими в нашем микробиоме, соответственно возрастет (2). Таким образом, для клинического микробиолога важно подходить к дифтероидам на индивидуальной основе с идентификацией на уровне видов и сообщением, если связанные микробиологические и клинические параметры вызывают подозрение на истинную инфекцию.
Дифтерия — Диагностика и лечение
Диагноз
Врачи могут заподозрить дифтерию у больного ребенка, у которого болит горло с серой пленкой, покрывающей миндалины и горло. Рост C. diphtheriae в лабораторной культуре материала из перепонки глотки подтверждает диагноз. Врачи также могут взять образец ткани из инфицированной раны и протестировать его в лаборатории, чтобы определить тип дифтерии, поражающей кожу (кожная дифтерия).
Если врач подозревает дифтерию, лечение начинается немедленно, даже до получения результатов бактериального анализа.
Лечение
Дифтерия — серьезное заболевание. Врачи лечат его немедленно и агрессивно. Лечебные процедуры включают:
- Антибиотики . Антибиотики, такие как пенициллин или эритромицин, помогают убивать бактерии в организме, избавляя от инфекций. Антибиотики сокращают время заражения дифтерией.
Антитоксин. Если врач подозревает дифтерию, он или она запросит лекарство, которое противодействует дифтерийному токсину в организме, в Центрах по контролю и профилактике заболеваний. Этот препарат, называемый антитоксином, вводится в вену или мышцу.
Перед введением антитоксина врачи могут провести пробы на кожную аллергию. Это делается для того, чтобы убедиться, что у инфицированного человека нет аллергии на антитоксин.
Если у кого-то есть аллергия, ему необходимо снизить чувствительность к антитоксину.Врачи делают это, сначала вводя небольшие дозы антитоксина, а затем постепенно увеличивая дозу.
Дети и взрослые, больные дифтерией, часто нуждаются в госпитализации для лечения. Они могут быть изолированы в отделении интенсивной терапии, потому что дифтерия может легко передаваться любому человеку, не прошедшему вакцинацию против этой болезни.
Профилактическое лечение
Если вы контактировали с человеком, инфицированным дифтерией, обратитесь к врачу для тестирования и возможного лечения.Ваш врач может выписать вам рецепт на антибиотики, которые помогут предотвратить развитие болезни. Вам также может потребоваться бустерная доза вакцины против дифтерии.
Людей, признанных переносчиками дифтерии, также лечат антибиотиками, чтобы очистить свой организм от бактерий.
Образ жизни и домашние средства
Чтобы вылечиться от дифтерии, необходим постельный режим.Избегать физических нагрузок особенно важно, если ваше сердце пострадало. Возможно, вам придется какое-то время питаться жидкостью и мягкой пищей из-за боли и затрудненного глотания.
Строгая изоляция, пока вы заразны, помогает предотвратить распространение инфекции. Тщательное мытье рук всеми в вашем доме важно для ограничения распространения инфекции.
После выздоровления от дифтерии вам понадобится полный курс вакцины против дифтерии, чтобы предотвратить рецидив.В отличие от некоторых других инфекций, дифтерия не гарантирует пожизненного иммунитета. Вы можете заразиться дифтерией более одного раза, если не прошли полную вакцинацию от нее.
Подготовка к приему
Если у вас есть симптомы дифтерии или вы контактировали с больным дифтерией, немедленно позвоните своему врачу. В зависимости от тяжести ваших симптомов и истории вакцинации вас могут попросить обратиться в отделение неотложной помощи или позвонить по номеру 911 или по местному номеру службы экстренной помощи для получения медицинской помощи.
Если ваш врач решит, что он или она должен сначала вас осмотреть, постарайтесь хорошо подготовиться к вашему приему. Вот некоторая информация, которая поможет вам подготовиться и узнать, чего ожидать от врача.
Информация, которую нужно собрать заранее
- Ограничения по предварительной записи. Во время записи на прием спросите, есть ли какие-либо ограничения, которым вы должны следовать во время до вашего визита, в том числе должны ли вы быть изолированы, чтобы избежать распространения инфекции.
- Инструкции по посещению офиса. Спросите своего врача, следует ли вам изолировать вас, когда вы придете в офис на прием.
- История симптомов. Запишите любые симптомы, которые у вас были, и как долго.
- Недавнее воздействие возможных источников инфекции. Вашему врачу будет особенно интересно узнать, ездили ли вы недавно за границу и где.
- Запись о вакцинации. Перед приемом к врачу узнайте, сделаны ли вам прививки.Если возможно, принесите с собой копию вашей истории болезни.
- История болезни. Составьте список вашей ключевой медицинской информации, включая другие состояния, от которых вы лечитесь, и любые лекарства, витамины или добавки, которые вы принимаете в настоящее время.
- Вопросы, которые следует задать врачу. Запишите свои вопросы заранее, чтобы вы могли проводить время с врачом максимально эффективно.
В приведенном ниже списке предлагаются вопросы о дифтерии, которые следует задать врачу.Не стесняйтесь задавать дополнительные вопросы во время приема.
- Как вы думаете, что вызывает мои симптомы?
- Какие тесты мне нужны?
- Какие существуют методы лечения дифтерии?
- Есть ли побочные эффекты от лекарств, которые я буду принимать?
- Сколько времени мне понадобится, чтобы поправиться?
- Есть ли длительные осложнения дифтерии?
- Я заразен? Как я могу снизить риск передачи моей болезни другим людям?
Чего ожидать от врача
Ваш врач, вероятно, также задаст вам ряд вопросов, например:
- Когда вы впервые заметили свои симптомы?
- Были ли у вас проблемы с дыханием, боль в горле или затруднение глотания?
- У вас была температура? Насколько высока была лихорадка на пике и как долго она длилась?
- Были ли вы в последнее время контактировали с кем-нибудь с дифтерией?
- Есть ли у кого-нибудь из ваших близких похожие симптомы?
- Вы недавно ездили за границу? Где?
- Обновляли ли вы свои прививки перед поездкой?
- Все ли ваши прививки действительны?
- Вы лечитесь от каких-либо других заболеваний?
Янв.01, 2020
Медицинская помощь, хирургическая помощь, консультации
Койл М.Б., Липский Б.А. Коринеформные бактерии при инфекционных заболеваниях: клинико-лабораторные аспекты. Clin Microbiol Ред. . 1990 июл.3 (3): 227-46. [Медлайн].
Ван ден Велде С., Лагроу К., Десмет К. и др. Идентификация видов коринебактерий с помощью клеточного анализа жирных кислот. Диагностика микробиологических инфекций . 2006 Февраль 54 (2): 99-104. [Медлайн].
Баумбах Дж.CoryneRegNet 4.0 — справочная база данных по регуляторным сетям коринебактериальных генов. BMC Биоинформатика . 6 ноября 2007 г. 8: 429. [Медлайн].
Neuweger H, Baumbach J, Albaum S, et al. CoryneCenter — онлайн-ресурс для комплексного анализа данных генома коринебактерий и транскриптомов. БМС Сист Биол . 22 ноября 2007 г., 1:55. [Медлайн].
Шарма NC, Банаваликер Дж. Н., Ранджан Р. и др. Бактериологические и эпидемиологические характеристики случаев дифтерии в Дели и его окрестностях — ретроспективное исследование. Индийский журнал J Med Res . 2007 декабрь 126 (6): 545-52. [Медлайн].
Рудреш С.М., Рави Г.С., Алекс А.М., Мамата К.Р., Сунита Л., Рамья К.Т. Недифтерийные коринебактерии: новый нозокомиальный патоген при инфекции кожи и мягких тканей. Дж Клин Диагностика Рес . 2015 9 (12) декабря: DC19-21. [Медлайн].
Добинсон Х.С., Андерсон Т.П., Чемберс СТ, Дуг М.П., Сивард Л., Верно А.М. Варианты антимикробного лечения гранулематозного мастита, вызванного видами Corynebacterium. Дж. Клин Микробиол . 2015 сентябрь 53 (9): 2895-9. [Медлайн].
Джозеф Дж, Нирмалкар К., Матхай А., Шарма С. Клинические особенности, микробиологический профиль и результаты лечения пациентов с эндофтальмитом Corynebacterium: обзор десятилетия из центра третичной офтальмологической помощи в южной Индии. Br J Офтальмол . 2016 Февраль 100 (2): 189-94. [Медлайн].
Baird GJ, Fontaine MC. Corynebacterium pseudotuberculosis и ее роль в казеозном лимфадените овец. Дж. Комп. Патол . 2007 ноябрь 137 (4): 179-210. [Медлайн].
Yeruham I, Elad D, Avidar Y, et al. Анализ инфекции мочевыводящих путей у молочного скота на уровне стада. Ветеринар J . 2006 Январь 171 (1): 172-6. [Медлайн].
Rogers EA, Das A, Ton-That H. Адгезия патогенными коринебактериями. Adv Exp Med Biol . 2011. 715: 91-103. [Медлайн].
Moreira Lde O, Andrade AF, Vale MD, et al.Влияние ограничения железа на прилипание и углеводы клеточной поверхности штаммов Corynebacterium diphtheriae. Прил. Микробиол. Среды . 2003 Октябрь 69 (10): 5907-13. [Медлайн].
Мандлик А., Сверчинский А., Дас А. и др. Corynebacterium diphtheriae использует специфические второстепенные пилины для нацеливания на эпителиальные клетки глотки человека. Мол микробиол . 2007 апр. 64 (1): 111-24. [Медлайн].
Мельников В.Г., Комбарова С.И., Борисова О.Ю. и др.[Нетоксигенный штамм Corynebacterium diphtheriae, несущий ген дифтерийного токсина]. Ж Микробиол Эпидемиол Иммунобиол . 2004 янв-фев. 3-7. [Медлайн].
De Zoysa A, Efstratiou A, Hawkey PM. Молекулярная характеристика генов-репрессоров дифтерийного токсина (dtxR), присутствующих в нетоксигенных штаммах Corynebacterium diphtheriae, выделенных в Соединенном Королевстве. Дж. Клин Микробиол . 2005, январь, 43 (1): 223-8. [Медлайн].
Moazzez A, Kelso RL, Towfigh S, Sohn H, Berne TV, Mason RJ.Бактериологические особенности абсцесса молочной железы в эпоху внебольничных эпидемий метициллинрезистентного Staphylococcus aureus. Арк Сург . 2007 сентябрь 142 (9): 881-4. [Медлайн].
Efstratiou A, Engler KH, Mazurova IK, et al. Современные подходы к лабораторной диагностике дифтерии. Дж. Заражение Дис . 2000 фев. 181 Приложение 1: S138-45. [Медлайн].
Кадырова Р., Картоглу ХУ, Штребель ПМ. Клиническая характеристика и ведение 676 госпитализированных больных дифтерией, Кыргызская Республика, 1995 г. Дж. Заражение Дис . 2000 фев. 181 Приложение 1: S110-5. [Медлайн].
Quick ML, Sutter RW, Kobaidze K, et al. Эпидемия дифтерии в Республике Грузия, 1993-1996 годы: факторы риска летального исхода среди госпитализированных пациентов. Дж. Заражение Дис . 2000 фев. 181 Прил. 1: S130-7. [Медлайн].
Wagner KS, White JM, Neal S, Crowcroft NS, Kupreviciene N, Paberza R, et al. Скрининг на Corynebacterium diphtheriae и Corynebacterium ulcerans у пациентов с инфекциями верхних дыхательных путей 2007–2008: многоцентровое европейское исследование. Клин Микробиол Инфекция . 2011 Апрель 17 (4): 519-25. [Медлайн].
Рен М.В., Шетти Н. Инфекции, вызываемые Corynebacterium diphtheriae: шестилетний опыт работы во внутренней лондонской клинической больнице. Бр. Журнал биомедицинских наук . 2005. 62 (1): 1-4. [Медлайн].
Маттос-Гуаральди А.Л., Морейра Л.О., Дамаско П.В. и др. Дифтерия остается угрозой для здоровья в развивающихся странах — обзор. Мем-инст Освальдо Крус . Декабрь 2003 г.98 (8): 987-93. [Медлайн].
Webb R, Voss L, Roberts S, Hornung T, Rumball E, Lennon D. Инфекционный эндокардит у детей Новой Зеландии 1994-2012. Педиатр Инфекция Дис. J . 2014 май. 33 (5): 437-42. [Медлайн].
Закихани К., Эфстратиу А. Дифтерия в Европе: современные проблемы и новые вызовы. Микробиол будущего . 2012 май. 7 (5): 595-607. [Медлайн].
Egwari LO, Nwokoye NN, Obisesan B, Coker AO, Nwaokorie FO, Savage KO.Бактериологическая и клиническая оценка двенадцати случаев послеоперационного сепсиса одонтогенных опухолей в специализированном центре. East Afr Med J . 2008 июнь 85 (6): 269-74. [Медлайн].
Wagner KS, White JM, Crowcroft NS, De Martin S, Mann G, Efstratiou A. Дифтерия в Соединенном Королевстве, 1986-2008: возрастающая роль Corynebacterium ulcerans. Эпидемиол. Инфекция . 2010 ноябрь 138 (11): 1519-30. [Медлайн].
Dias AA, Santos LS, Sabbadini PS, Santos CS, Silva Junior FC, Napoleão F и др.Corynebacterium ulcerans diphtheria: новый зооноз в Бразилии и во всем мире. Ред. Saude Publica . 2011 Декабрь 45 (6): 1176-91. [Медлайн].
Harnisch JP, Tronca E, Nolan CM, et al. Дифтерия среди городских взрослых алкоголиков. Десятилетний опыт работы в Сиэтле. Энн Интерн Мед. 1 июля 1989 г. 111 (1): 71-82. [Медлайн].
Cappuccino L, Bottino P, Torricella A, Pontremoli R. Нефролитиаз, вызванный инфекцией Corynebacterium urealyticum: обзор литературы и описание случая. Дж Нефрол . 2014 Апрель 27 (2): 117-25. [Медлайн].
Из Центров по контролю и профилактике заболеваний. Дифтерия дыхательных путей, вызываемая Corynebacterium ulcerans — Терре-Хот, Индиана, 1996 г. JAMA . 1997 июн 4. 277 (21): 1665-6. [Медлайн].
Девинтер Л.М., Бернард К.А., Ромни М.Г. Человеческие клинические изоляты Corynebacterium diphtheriae и Corynebacterium ulcerans, собранные в Канаде с 1999 по 2003 год, но не соответствующие критериям регистрации случаев дифтерии. Дж. Клин Микробиол . 2005 июл. 43 (7): 3447-9. [Медлайн].
Tarr PE, Stock F, Cooke RH, Fedorko DP, Lucey DR. Пневмония, вызванная Corynebacterium striatum с множественной лекарственной устойчивостью, у реципиента трансплантата сердца. Transpl Infect Dis . 2003 5 (1): 53-8. [Медлайн].
Ли П.П., Фергюсон Д.А. младший, Сарубби Ф.А. Corynebacterium striatum: недооцененное сообщество и нозокомиальный патоген. J Заражение . 2005 Май. 50 (4): 338-43.[Медлайн].
Манцелла Дж. П., Келлог Дж. А., Парси К. С.. Corynebacterium pseudodiphtheriticum: возбудитель респираторного тракта у взрослых. Клин Инфекция Дис . 1995 20 января (1): 37-40. [Медлайн].
Camello TC, Souza MC, Martins CA, Damasco PV, Marques EA, Pimenta FP и др. Corynebacterium pseudodiphtheriticum, выделенная из соответствующих клинических очагов инфекции: патоген для человека, игнорируемый в развивающихся странах. Lett Appl Microbiol .2009 Апрель, 48 (4): 458-64. [Медлайн].
Тюрк С., Корровиц П., Пунаб М. и др. Коринеформные бактерии в сперме больных хроническим простатитом. Инт Дж Андрол . 2007 Апрель 30 (2): 123-8. [Медлайн].
Иванов ИБ, Кузьмин МД, Гриценко В.А. Микрофлора семенной жидкости здоровых мужчин и мужчин, страдающих синдромом хронического простатита. Инт Дж Андрол . 2009 Октябрь, 32 (5): 462-7. [Медлайн].
Mathelin C, Riegel P, Chenard MP, Tomasetto C, Brettes JP.Гранулематозный мастит и коринебактерии: клинико-патологические корреляции. Грудь J . 2005 сентябрь-октябрь. 11 (5): 357. [Медлайн].
Suzuki T, Iihara H, Uno T и др. Кератит, связанный с наложением швов, вызванный Corynebacterium macginleyi. Дж. Клин Микробиол . 2007 ноябрь 45 (11): 3833-6. [Медлайн].
Otsuka Y, Kawamura Y, Koyama T, et al. Corynebacterium resistens sp. nov., новая коринеформная бактерия с множественной лекарственной устойчивостью, выделенная от инфекций человека. Дж. Клин Микробиол . 2005 г., 43 (8): 3713-7. [Медлайн].
Мокроусов И. Corynebacterium diphtheriae: разнообразие генома, популяционная структура и перспективы генотипирования. Заразить Genet Evol . 2009 января 9 (1): 1-15. [Медлайн].
[Рекомендации] Бернард К. Род corynebacterium и другие важные с медицинской точки зрения коринеформоподобные бактерии. Дж. Клин Микробиол . 2012 Октябрь 50 (10): 3152-8. [Медлайн]. [Полный текст].
Torres Lde F, Ribeiro D, Hirata Jr R, Pacheco LG, Souza MC, dos Santos LS, et al.Мультиплексная полимеразная цепная реакция для выявления и определения токсигенности Corynebacterium spp с зоонозным потенциалом и обзор инфекций человека и животных. Мем-инст Освальдо Крус . 2013 май. 108 (3): [Medline].
Раджамани Секар С.К., Вирарагхаван Б., Анандан С., Деванга Рагупати Н.К., Сангал Л., Джоши С. Усиление лабораторной диагностики патогенных видов коринебактерий в эпоху вакцин. Lett Appl Microbiol . 2017 ноябрь65 (5): 354-365. [Медлайн].
Ригель П., Руими Р., Кристен Р. и др. Видовая принадлежность и антимикробная чувствительность коринебактерий, выделенных из различных клинических источников. евро J Clin Microbiol Infect Dis . 1996 15 августа (8): 657-62. [Медлайн].
Spanik S, Trupl J, Kunova A, et al. Факторы риска, этиология, терапия и исход в 123 эпизодах прорывной бактериемии и фунгемии во время антимикробной профилактики и терапии у онкологических больных. Дж. Медицинский микробиол . 1997 июн. 46 (6): 517-23. [Медлайн].
Жоин-Ламберт О.Ф., Уаш М., Каниони Д. и др. Некротический лимфаденит, вызванный Corynebacterium pseudotuberculosis, у пациента 12 лет. Педиатр Инфекция Дис. J . 2006 Сентябрь 25 (9): 848-51. [Медлайн].
McCormack PL. Комбинированная вакцина против дифтерии, столбняка и бесклеточного коклюша с пониженным содержанием антигена, адсорбированная (Boostrix®): обзор ее свойств и использование в качестве однократной бустерной иммунизации. Наркотики . 2012 сентябрь 10, 72 (13): 1765-91. [Медлайн].
Гарсия-Корбейра П., Даль-Ре Р., Гарсиа-де-Ломас Дж. И др. Низкая распространенность дифтерийного иммунитета среди населения Испании: результаты перекрестного исследования. Вакцина . 1999, 9 апреля, 17 (15-16): 1978-82. [Медлайн].
Cameron C, White J, Power D и др. Бустеры дифтерии для взрослых: балансировка рисков. Дорожная инфекция . 2007 5 (1): 35-9. [Медлайн].
Мнение комитета нет. 521: обновленная информация об иммунизации и беременности: вакцинация от столбняка, дифтерии и коклюша. Акушерский гинекол . 2012 Март, 119 (3): 690-1. [Медлайн].
Ghide S, Jiang Y, Hachem R, Chaftari AM, Raad I. Катетерная бактериемия Corynebacterium: следует ли удалить катетер и ввести ванкомицин ?. евро J Clin Microbiol Infect Dis . 2010 29 февраля (2): 153-6. [Медлайн].
Reddy BS, Chaudhury A, Kalawat U, Jayaprada R, Reddy G, Ramana BV.Выделение, видообразование и антибиотикограмма клинически значимых недифтерийных коринебактерий (дифтероидов). Индийский журнал J Med Microbiol . 2012 30 января (1): 52-7. [Медлайн].
von Hunolstein C, Scopetti F, Efstratiou A, et al. Толерантность к пенициллину среди нетоксигенных Corynebacterium diphtheriae, выделенных в случаях фарингита. J Антимикробный препарат Chemother . 2002 июл.50 (1): 125-8. [Медлайн].
Консультативный комитет по практике иммунизации, Американская академия педиатрии, Американская академия семейных врачей.Рекомендуемый календарь иммунизации детей — США, 1997 г. MMWR Morb Mortal Wkly Rep . 1997 17 января. 46 (2): 35-40. [Медлайн].
Ballereau F, Schrive I, Fisch A, et al. Многоцентровое серологическое исследование иммунитета к дифтерии среди 1004 человек во Франции. Eur J Epidemiol . 1998 14 июля (5): 499-503. [Медлайн].
Коричневый AE. Другие коринебактерии и родококки. Манделл Г.Л., Долин Р., Дуглас Р.Г. и др., Ред. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета . Филадельфия, Пенсильвания: Черчилль Ливингстон; 1995. 1872-80.
Burch GE, Sun SC, Sohal RS и др. Дифтерийный миокардит. Гистохимическое и электронно-микроскопическое исследование. Ам Дж. Кардиол . 1968 21 февраля (2): 261-8. [Медлайн].
Центры по контролю и профилактике заболеваний. Дифтерия, столбняк и коклюш: Медицинская информация для международных поездок, 1999-2000 гг.2000. [Полный текст].
Центры по контролю и профилактике заболеваний. Отчет о состоянии Инициативы по детской иммунизации: уровни охвата вакцинацией детей в возрасте 19-35 месяцев на национальном уровне, уровне штата и в городах — США, 1996 г. MMWR Morb Mortal Wkly Rep . 1997 25 июля. 46 (29): 657-64. [Медлайн].
Центры по контролю и профилактике заболеваний. Toxigenic Corynebacterium diphtheriae — Индийская община Северных равнин, август-октябрь 1996 г. MMWR Morb Mortal Wkly Rep . 6 июня 1997 г. 46 (22): 506-10. [Медлайн]. [Полный текст].
Engler KH, Efstratiou A. Быстрый иммуноферментный анализ для определения токсигенности среди клинических изолятов коринебактерий. Дж. Клин Микробиол . 2000 апр. 38 (4): 1385-9. [Медлайн].
Favara BE, Franciosi RA. Дифтерийная миокардиопатия. Ам Дж. Кардиол . 1972 Сентябрь 30 (4): 423-6. [Медлайн].
Hadfield TL, McEvoy P, Polotsky Y, et al.Патология дифтерии. Дж. Заражение Дис . 2000 фев. 181 Дополнение 1: S116-20. [Медлайн].
Hou XG, Kawamura Y, Sultana F и др. Генетическая идентификация представителей рода Corynebacterium на уровне рода и вида с помощью зондов, нацеленных на 16S рДНК. Микробиол Иммунол . 1997. 41 (6): 453-60. [Медлайн].
Иммунизация во время беременности. Технический бюллетень ACOG № 160 — октябрь 1991 г. Int J Gynaecol Obstet .1993 г., 40 (1): 69-79. [Медлайн].
Хецуриани Н., Мьюзик С., Дефорест А. и др. Оценка однократной дозы дифтерийного анатоксина среди взрослых в Республике Грузия, 1995 г .: иммуногенность и побочные реакции. Дж. Заражение Дис . 2000 фев. 181 Прил. 1: S208-12. [Медлайн].
Lumio JT, Groundstroem KW, Melnick OB и др. Электрокардиографические аномалии у больных дифтерией: проспективное исследование. Ам Дж. Мед. .2004 15 января. 116 (2): 78-83. [Медлайн].
MacGregor RR. Corynebacterium diphtheriae. Манделл Г.Л., Долин Р., Дуглас Р.Г. и др., Ред. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета . Филадельфия, Пенсильвания: Черчилль Ливингстон; 1995. 1865-72.
Mothershed EA, Кэссидей П.К., Пирсон К. и др. Разработка флуоресцентного ПЦР-анализа в реальном времени для быстрого обнаружения гена дифтерийного токсина. Дж. Клин Микробиол .2002 декабрь 40 (12): 4713-9. [Медлайн].
Найдич М.Дж., Бауэр АГ. Дифтерия; исследование 1433 случаев, наблюдавшихся за десятилетний период в больнице округа Лос-Анджелес. Ам Дж. Мед. . 1954, 17 августа (2): 229-45. [Медлайн].
Саба МК, Саба ПЗ. Дифтерия. Справочный журнал Medscape [онлайн-сериал]. 2001. Доступно по адресу: emedicine.medscape.com/article/782051-overview. [Полный текст].
Scheid W. Дифтерийный паралич; анализ 2292 случаев дифтерии среди взрослых, включая 174 случая полиневрита. Дж. Нерв Мент Дис . 1952 Декабрь 116 (6): 1095-1101. [Медлайн].
Spiering MM. Белок-репрессор токсина дифтерии. Доступно на: http://www.umich.edu. [Полный текст].
Старк К., Шонфельд С., Барг Дж. И др. Распространенность серотипов и детерминанты антител к дифтерии, столбняку и полиомиелиту среди взрослых в Берлине, Германия. Вакцина . 1999 26 февраля, 17 (7-8): 844-50. [Медлайн].
Свенссон А, Бёттигер М, Густавссон О.Иммунитет у населения Швеции: дифтерия, столбняк и полиомиелит. Int J Эпидемиол . 1998 27 октября (5): 909-15. [Медлайн].
Тодар К. Дифтерия (Corynebacterium diphtheriae). Интернет-учебник по бактериологии Тодара. Доступно на http://textbookofbacteriology.net/diphtheria.html.
Coryneform Bacterium — обзор
Staphylococci
S . epidermidis — важный обитатель кожи.Этот грамположительный кокк можно отличить от других стафилококков по чувствительности к десфериоксамину, отсутствию образования трегалозы из кислоты, образованию небольших белых или бежевых колоний (1-2 мм в диаметре) и коагулазонегативным характеристикам. Хотя многие другие коагулазонегативные стафилококки были выделены из кожи; Считается, что ни одна из них не так распространена, как S . эпидермис . Эта бактерия обычно благополучно проживает на коже, причем инфекции чаще всего возникают у ослабленных пациентов, включая потребителей инъекционных наркотиков, пациентов, получающих иммуносупрессивную терапию, пациентов со СПИДом, недоношенных новорожденных и пациентов с постоянным устройством, таким как катетер или имплант.Если системный, S . epidermidis может вызывать сепсис и ряд других серьезных состояний, включая эндокардит собственных клапанов, или другие подострые или хронические состояния у восприимчивых пациентов.
Обработка для S . Инфекция epidermidis обычно связана с системными антибиотиками. Однако эта бактерия может образовывать биопленки на поверхности имплантатов, которые часто невозможно уничтожить с помощью антибиотиков, и которые могут быть защищены от иммунной системы хозяина.Удаление постоянного устройства часто необходимо для успешного лечения инфекции. S . epidermidis Белки , такие как белок автолизина AltE, были идентифицированы как вероятные факторы адгезии, обеспечивающие связывание бактерии с поверхностями, такими как катетеры или протезы. Действительно, сообщалось, что нарушение гена altE приводит к нарушению прикрепления мутанта S . epidermidis на поверхность из полистирола.
Вирулентность S . epidermidis также приписывают другим факторам вирулентности, включая полисахаридную межклеточную адгезию (PIA) и поли- N -сукцинил-глюкозамин (PNSG), которые опосредуют процесс, известный как межклеточная адгезия. В соответствии с этими данными гены PIA и PNSG были обнаружены только в нескольких штаммах S . epidermidis , в основном изолирован от катетерных инфекций, а не от нормальной здоровой кожи.
В отличие от S . epidermidis , коагулаза-положительный Staphylococcus aureus — ведущий патоген человека, ответственный за различные заболевания, от незначительных и самоизлечимых кожных инфекций до инвазивных и опасных для жизни заболеваний. Фенотипически его можно отличить от других стафилококков по образованию золотисто-желтых колоний и по полному лизису эритроцитов в пластинах кровяного агара (β-гемолиз). Хотя обычно он классифицируется как преходящий, вызывающий болезнь патоген, колонизация по S . aureus не является синонимом инфекции, и исследования показали, что до 20% населения постоянно колонизированы, в то время как еще 60% периодически переносят бактерии. Однако широкий спектр кожных инфекций, включая импетиго, фолликулит, фурункулы и подкожные абсцессы (, таблица 1, ), а также стафилококковый синдром ошпаривания кожи, могут быть вызваны S . aureus , и инфекции особенно распространены у катетеризованных пациентов или лиц с БА.В дополнение к этим локализованным инфекциям инвазивный S . aureus может вызывать серьезные заболевания, включая септический артрит, остеомиелит, пневмонию, менингит, сепсис и эндокардит.
S . Инфекции aureus обычно лечат антибиотиками, хотя эффективность такого лечения ограничена появлением устойчивых штаммов, включая устойчивые к метициллину S . aureus (MRSA), а также промежуточное звено к ванкомицину и устойчивое к ванкомицину S . aureus штаммы (VISA и VRSA).
В дополнение к генам, способным придавать устойчивость к антибиотикам, S . aureus может также экспрессировать многие секретируемые и связанные с клетками факторы вирулентности. Например, белок стафилококка, ингибирующий хемотаксис (CHIPS), связывается со специфическими рецепторами нейтрофилов, препятствуя их хемотаксису, а другой белок, Eap, связывается с молекулой внутриклеточной адгезии (ICAM) -1 на нейтрофилах, чтобы предотвратить адгезию лейкоцитов и экстравазацию. . S . aureus также защищен от уничтожения нейтрофилов за счет улавливания свободных радикалов золотым каротиноидным пигментом, в честь которого назван штамм. Помимо уклонения от нейтрофилов, эта бактерия также использует ряд стратегий для противодействия защитным силам, возникающим непосредственно из эпителия кожи. S . aureus относительно устойчив к уничтожению с помощью катионных антимикробных пептидов (АМП). Одним из механизмов, с помощью которого достигается такая устойчивость, является нейтрализация отрицательно заряженной поверхности бактериальных клеток белком Dlt, который направляет аминокислотные замены в белках, присутствующих в клеточной стенке, и ферментом MprF, который добавляет L-лизин, положительно заряженная аминокислота к другому компоненту клеточной стенки.Помимо нейтрализации клеточной поверхности для предотвращения связывания AMP, S . aureus также экспрессирует стафилокиназу, которая связывает и защищает от дефензинов, и ауреолизин, который расщепляет кателицидин человека LL-37. Эти факторы вирулентности явно играют центральную роль в S . aureus кожные инфекции и вносят вклад в классификацию S . aureus как важный кожный патоген.
Коринебактерии
Коринеформы — это грамположительные анаэробные актинобактерии, обычно встречающиеся на коже человека, и их можно разделить на Corynebacterium diphtheriae и дифтероидов (недифтерийные коринебактерии). С . diphtheriae можно разделить на токсигенные и нетоксигенные штаммы. Токсигенные штаммы продуцируют мощный дифтерийный токсин, экзотоксин, который препятствует синтезу белка в открытых клетках-хозяевах. Нетоксигенные штаммы также могут вызывать ряд потенциально опасных состояний, включая сепсис, септический артрит, эндокардит и остеомиелит. Иммунизация снизила распространенность дифтерии, хотя эта болезнь по-прежнему вызывает беспокойство у неиммунизированных и частично иммунизированных лиц, а также лиц, пострадавших от социально-экономических лишений.
Corynebacterium jeikeium , не дифтерийная коринебактерия, является нормальным обитателем кожи человека. Как S . epidermidis , C . jeikeium в значительной степени безобидно существует на коже, хотя C . jeikeium также стал источником внутрибольничных инфекций, особенно у пациентов с ослабленным иммунитетом, пациентов с постоянными устройствами или пациентов с дефектами кожного барьера.
Один раз C . jeikeium преодолел барьер, обеспечиваемый кожей, бактерия может вызывать состояния, включая сепсис и эндокардит. Хотя эти бактерии могут быть устойчивыми к некоторым системным антибиотикам из-за приобретения генов устойчивости к антибиотикам, чувствительность бактерий к гликопептидным антибиотикам может быть использована при лечении ванкомицином или тейкопланином.
Вирулентность также может быть связана с рядом других факторов. Геном C . jeikeium содержит множество последовательностей со значительной гомологией с факторами вирулентности из других грамположительных патогенов, и эта бактерия также обладает механизмами противодействия продукции активных форм кислорода клетками-хозяевами.
Антибиотикотерапия при положительных посевах крови — инфекционные заболевания и противомикробные препараты
ВВЕДЕНИЕ
Соответствующий выбор эмпирической антибактериальной терапии при положительном результате крови
культур — сложное и трудное решение. Бактерии только частично
идентифицирован по Граму
результаты окрашивания и видообразования и восприимчивости будут
дополнительные 24-48 часов после того, как посев считается положительным.Пока пациенты
при положительном посеве крови может быть бактериемия, указывающая на истинную инфекцию,
есть подгруппа пациентов с положительными культурами крови, которые связаны с
заражение и, следовательно, не указывает на истинную инфекцию. Из-за
высокая заболеваемость и смертность, связанные с бактериемией, своевременная оценка и
соответствующее эмпирическое лечение антибиотиками имеет первостепенное значение (3). Один раз
организм полностью идентифицирован, выбор антибиотиков можно изменить.Область обнаружения микроорганизмов на основе ПЦР быстро становится полезным инструментом
в выявлении и диагностике инфекций кровотока, особенно
вызванные грамположительными кокками (25, 28, 33). Пока молекулярные методы для
обнаружение бактерий в культурах крови более доступно и легче
внедрить (25, 31), клиницистам придется по-прежнему полагаться на окрашивание по Граму
как предварительный источник данных для принятия эмпирических терапевтических решений.
Американское общество инфекционных болезней (IDSA) и другие организации
выпустили рекомендации по лечению бактериемии в контексте
катетерные инфекции, которые включают как эмпирические, так и специфические
протоколы лечения на основе организма. Однако никаких рекомендаций относительно
первоначальный подбор антибиотиков на основе предварительных результатов Грама
пятно.В этой главе сделана попытка дать общие рекомендации для такого
клиническая ситуация.
ПОЛУЧЕНИЕ КУЛЬТУР КРОВИ
Правильная методика получения культур крови требует тщательной очистки
поверхности кожи 70% спиртом с последующим приготовлением йода или 0,5
% хлоргексидина в течение 1-2 минут (19, 23). Следует проявлять осторожность, чтобы
Загрязните место венепункции после подготовки и перед кровопусканием.В
флакон с культурой следует промыть 70% спиртом и ввести кровь без
замена иглы. За исключением педиатрических культур крови, минимум 2 флакона с
Для правильной обработки образцов требуется 8-10 куб. См крови на флакон. Несмотря
о том, что чувствительность посевов крови увеличивается пропорционально
количеству взятой крови современные автоматизированные системы обеспечивают адекватное
точность при объеме крови 8-10 куб. см (4).Должно пройти не менее 10-15 минут.
между взятием первого и второго образца крови. Учитывая рост
использование эмпирических антибиотиков, чувствительность 2 образцов посева крови
не всегда оптимально. Некоторые предполагают, что по крайней мере четыре набора крови
для достижения более высоких показателей обнаружения могут потребоваться культуры (16).
Хотя количество центральных линий уменьшилось, использование
Периферически вводимых центральных катетеров (PICC) значительно увеличилось.Инфекции, связанные с катетером, составляют примерно 11-37% (1) внутрибольничных инфекций.
бактериемии. Самый последний обзор нозокомиальных инфекций кровотока,
опубликованные Национальной сетью безопасности здравоохранения (NHSN) в 2007 г. (10), оценки
что уровень заражения центральных линий колеблется от 1,5 до 6,8 на 1000 человек.
центральная линия дней. Данные, опубликованные Nosocomial Infection Surveillance
System (NISS) в 2004 году выявили, что инфекции кровотока, связанные с катетером
были ответственны за примерно 24% всех инфекций кровотока (32).
Взятие образцов культуры крови с центральных катетеров
Большинство микробиологов
не рекомендуют брать посев крови из центральных катетеров из-за
возможна колонизация катетера кожной флорой. Хотя это правда, использование
количество посевов крови через катетер продолжает расти по практическим причинам
(меньше дискомфорта для пациента, нет альтернативного способа получения образцов крови и т. д.).В
для выявления катетерного источника бактериемии, исследования
подтвердили роль количественных культур (более высокое количество колоний
обычно обнаруживается в инфицированных катетерах, чем в периферической крови) и
«Дифференциальное время до положительного результата» (образцы, взятые из инфицированных катетеров, имеют тенденцию
стать положительным раньше, чем образцы периферической крови). Соответствующий
Интерпретация количественных культур и дифференциального времени до положительного результата потребует взятия хотя бы одного образца путем венепункции.
из периферической вены.Лаборатория должна гарантировать, что были взяты оба образца.
и инкубировали в одно и то же время и чтобы оба объема были одинаковыми. Хотя эти
продемонстрировали полезность в исследованиях, они не
обычно используется в клинической практике и диагностике катетерных
бактериемия зависит от клинического диагноза и посева на кончике катетера (с
количество колоний на кончике катетера, превышающее 15, обычно считается значимым).Таблица 1 включает список наиболее распространенных бактерий, связанных с катетеризацией.
инфекции кровотока (CR-BSI) (11, 15, 18, 24, 32).
ФАКТОРЫ РИСКА БАКТЕРЕМИИ
В таблице 2 перечислены важные факторы риска бактериемии. В общем, эти
применять ко всем бактериям; хотя некоторые факторы риска более специфичны для определенных
бактерии (например, заболевание печени в основном связано с грамотрицательными
бактериемия).
БАКТЕРИЯ ПРОТИВ ЗАРАЖЕНИЯ
Загрязнение образцов культур крови, переданных в микробиологию
лаборатория не является редкостью и может быть связана с неправильной асептической техникой или
колонизация внутривенного катетера, из которого берется кровь. Дифференцировать
заражение от истинной бактериемии иногда бывает затруднительным. Факторы, указывающие на
истинная бактериемия включает в себя: историю болезни пациента и физические данные,
наличие факторов риска бактериемии (таблица 2), температуры тела и
количество лейкоцитов. Staphylococcus aureus и Candida sp. изолирован от крови
никогда не следует рассматривать как загрязнитель. Хотя различие между
бактериемия и контаминация — это в основном клиническая оценка, основанная на клинических данных.
сценарий, количество положительных культур и окончательное определение
бактерии используются, чтобы помочь различить эти две ситуации. В
следующие микробиологические факторы могут указывать на загрязнение, а не
истинная бактериемия:
1.Когда выделяются типичные комменсальные организмы кожной флоры: коагулазонегативный стафилококк.
specie s , некоторые стрептококки и грамположительные палочки. Если
у пациента внутривенный катетер, вероятность истинного заражения
увеличивается даже при обычных кожных загрязнениях. Таблица 3 показывает процентное соотношение
какие распространенные бактерии могут вызывать ложноположительные посевы крови из-за
загрязнение.
2. Когда только один посев крови дает положительный результат из 2-х или более культур.
Справедливость этого утверждения прямо пропорциональна количеству
посев крови отрицательный и зависит от выявленного организма. Этот критерий
используется специально при оценке коагулазонегативных видов стафилококков
бактериемия, однако существуют противоречивые сообщения о ее точности и
прогностическая ценность (21, 29).
3. Когда образец чувствительности к антибиотикам одного организма, выделенного из
посев крови отличается от образца других организмов в
тот же или последующий набор культур (при условии, что организмы одного и того же
разновидность). Например, если 2 набора культур крови положительны на Staphylococcus epidermidis , но один набор показывает чувствительность к оксациллину и ципрофлоксацину, а другой набор показывает устойчивость к этим двум антибиотикам, то это
Вероятно, заражены оба набора культур крови.
ПОДХОД НА ОСНОВЕ ПЯТЕН
Выявление бактериемии только одно
компонент оценки пациента. Важно, чтобы источник
выявление бактериемии для проведения необходимых диагностических исследований
как помочь определить продолжительность терапии. Иногда потенциальный источник
могут быть идентифицированы по результатам окрашивания по Граму (грамположительные диплококки
соответствует Streptococcus pneumoniae вторично по отношению к пневмонии или тяжелой степени
синусит; Грамотрицательная бактериемия с сопутствующей пиурией предполагает наличие
мочеполовой источник и т. д.).Однако в большинстве случаев потенциальный источник
может быть неясным до тех пор, пока не будет идентифицирован вид бактерий.
На основании характеристик пятен по грамму,
в этой монографии организмы делятся на пять
категории: 1) грамположительные кокки, 2) грамположительные палочки, 3) грамотрицательные
бациллы, 4) анаэробы и 5) виды Candida. Мы не будем заниматься грамм-отрицательными
кокки, поскольку они редко являются причиной бактериемии (кроме Neisseria
meningitides , которая может быть разрушительной инфекцией) . Таблица 4 включает список
наиболее распространенные патогены, выделенные из мономикробного нозокомиального кровотока
инфекции (BSI) в порядке убывания частоты (32).
грамположительные кокки
Классификация грамположительных кокков основана на бактериальном окрашивании:
видно на окраске по Граму. Они образуют скопления (стафилококк) или цепочки
(стрептококк). Кластерные грамположительные кокки могут быть дополнительно дифференцированы
на основе реакций коагулазы и каталазы (см. рисунок 1 ниже), которые могут быть
выполняется примерно через 24 часа после инкубации на кровяном агаре.Для
цель ограничить наш обзор грамположительными кокками, которые наиболее часто
вызывают бактериемию, мы остановимся на клинически значимых видах:
к ним относятся S. aureus и коагулазонегативный стафилококк в
группы стафилококков, Streptococcus группы viridans и Streptococcus pneumoniae, в группе стрептококков и энтерококков.
грамположительные кокки в кластерах:
Золотистый стафилококк
Источник инфекции: стафилококк.
aureus бактериемия может быть первичной (нет
очевидный источник инфекции) или вторичный, в котором происхождение инфекции
удаленный орган или система.Положительный результат посева крови на Staphylococcus aureus всегда считается истинной бактериемией и никогда не должен считаться
загрязнение из-за возможных неблагоприятных последствий отказа от лечения. кожи, опорно-двигательный аппарат (кости / диски / суставы) и эндокард являются основными
источники вторичной бактериемии. Кроме того, важным источником вторичной бактериемии S. aureus является посев крови из инфицированного центрального
катетер.Может быть трудно отличить первичный от вторичного
бактериемия, особенно когда источником вторичной бактериемии является
костно-мышечной системы. Это различие усложняется тем фактом, что S. aureus имеет склонность прикрепляться к любому типу протезного протеза и вызывать инфекцию.
материал
(катетеры, ортопедические изделия, эндоваскулярные трансплантаты, вентрикулоперитонеальные шунты,
и др.) с развитием биопленки; следовательно
первичная бактериемия может вызвать отдаленное инфицирование протезного материала и
затем последующая вторичная бактериемия.
Оценка: минимальная оценка в любом
Пациент с бактериемией S. aureus должен включать тщательное физическое обследование, включая кожные,
суставы, а также катетеры периферических и центральных сосудов. Рентген грудной клетки и
изображения любых областей опорно-двигательного аппарата жалоб должны быть рассмотрены. Немного
одобрить чреспищеводный
эхокардиограмма (TEE) для всех пациентов. Мы
предлагают рассмотреть возможность проведения ЧПЭ у пациентов с факторами риска эндокардита (таблица 5), стойкой бактериемией или первичной бактериемией
без очевидного источника.Общий оценочный риск эндокардита в S.
aureus бактериемия составляет 10-15%, но сообщалось о 44-51% в
пациенты с факторами риска, перечисленными в таблице 5. Учитывая это, большинство клиницистов назначают хотя бы трансторакальный
эхокардиограмма (TTE), на которой видно, что чувствительность TTE меньше 50%.
Пациенты с диагнозом бактериемия S. aureus, как правило, должны проходить последующее наблюдение.
посев крови через 3-5 дней после начала соответствующей антибактериальной терапии для
убедитесь, что бактериемия исчезла.
Лечение: в то время как β-лактамы исторически были эффективны для лечения
из инфекций S. aureus , появление метициллин-резистентных стафилококков
aureus (MRSA) делает бета-лактамы практически устаревшими, в то время как восприимчивость
результаты ожидаются. IDSA недавно опубликовало руководство по лечению
Инфекции MRSA, включая бактериемию. Многочисленные исследования продемонстрировали
что правильная эмпирическая терапия оказывает значительное влияние на неблагоприятные последствия
из Staphylococcus aureus бактериемия.Поэтому мы предлагаем начальные
эмпирическая терапия ванкомицином или даптомицином внутривенно, которая может быть снижена до
антистафилококковые β-лактамы, такие как нафциллин,
оксациллин или цефазолин после
доступны результаты восприимчивости. Даптомицин не показан при легочных инфекциях, поэтому следует исключить респираторный источник бактериемии.
до начала терапии этим антибиотиком. Ванкомицин уступает
бета-лактамы или даптомицин для лечения метициллин-чувствительных S.aureus (5). Линезолид или тигециклин не считаются антибиотиками первого ряда для S.
aureus бактериемия из-за бактериостатических свойств и отсутствия клинических данных
предполагая его эффективность при бактериемии.
Продолжительность антибиотикотерапии бактериемии, вызванной S. aureus , должна составлять не менее 2 недель при внутривенном введении препарата. Если
бактериемия является вторичной по отношению к отдаленному источнику инфекции или в контексте
септическая эмболизация, рекомендуемая терапия — не менее 4-6 недель.Выбрано
пациенты с бактериемией S. aureus могут лечиться в течение 2 недель, если они соответствуют
следующие критерии: (1) удаление имеющихся внутрисосудистых катетеров
во время бактериемии (2) эндокардит исключен с помощью TEE, (3) отсутствие
имплантированный протез (протезы клапанов, сердечные устройства или артропластики, (4)
контрольные культуры, полученные через 2-4 дня после начала терапии, отрицательны
и (5) разрешение лихорадки и отсутствие локализованных симптомов или признаков
наводит на мысль о метастатической стафилококковой инфекции (9, 20).Несмотря на отсутствие клинических данных, подтверждающих пользу, если пациент
представляет собой тяжелую инфекцию или сепсис, поэтому следует рассмотреть возможность комбинированной терапии, которая
может включать 2 антистафилококковых средства (ванкомицин, даптомицин или линезолид
в комбинации) или добавление гентамицина для синергизма в течение первых 3-5 дней.
дней.
Коагулазонегативные стафилококки
Источник инфекции: наиболее частый источник отрицательных коагулазы.
Стафилококковая бактериемия — это центральная линия инфицирования.Коагулазо-отрицательный
Виды стафилококков — наиболее часто встречающиеся микроорганизмы при бактериемии любого вида.
этиология (первичная или вторичная) и особенно распространена как этиологическая
агент для инфекций кровотока, связанных с катетером. К сожалению, коагулазо-отрицательные
Виды стафилококков, особенно S. epidermidis , также являются наиболее распространенными кожными
контаминанты, обнаруженные в культурах крови. Применяя правила, указанные в
раздел бактериемии vs.загрязнение может помочь отличить истинное
бактериемия и заражение посевов крови.
Оценка: Первичная коагулазонегативная бактериемия стафилококков
редкий. Наиболее распространенным видом, вызывающим бактериемию, является S. epidermidis . Часто
бактериемия является вторичной по отношению к инфицированному внутривенному катетеру; поэтому закрыть
Следует обратить внимание на инфицированные периферические или центральные сосудистые катетеры.Удаление катетера рекомендуется, но не обязательно, если это не
кардиостимулятор или туннельный катетер с клиническими признаками инфекции. Некоторые виды
коагулазонегативных видов стафилококков заслуживают особого внимания, так как они
связаны с другими заболеваниями, которые могут вторично вызывать бактериемию. S. saprophyticus — частая причина
ИМП у женщин, S. lugdunensis связан с эндокардитом нативного клапана, менингитом и инфекциями кожи и мягких тканей,
наиболее серьезным из которых является эндокардит. S. haemolyticus также ассоциирован
при нативном клапанном эндокардите и менингите. Учитывая эти связанные клинические
условия, анализ мочи, повторные посевы крови и эхокардиограмма могут
быть необходимым.
Лечение: если изолят коагулазонегативного вида Staphylococcal обнаруживает β-лактамазо-отрицательный вид, тогда
пенициллин — препарат выбора. Полусинтетические антистафилококковые пенициллины (оксациллин и нафциллин) являются
производные пенициллина, которые слабо гидролизуются стафилококками
ß-лактамазы и являются препаратами выбора среди группы пенициллинов.Однако
большинство коагулазонегативных видов стафилококков, выделенных во время
госпитализация будет устойчивой к метициллину; поэтому ванкомицин или даптомицин будут подходящими вариантами. Продолжительность лечения зависит от
основной клинический сценарий. На основании рекомендаций IDSA 2009 г. (20) мы
предложить не менее 5-7 дней антибактериальной терапии, возможно, дольше в зависимости от
клинический сценарий (невозможно удалить катетер, присутствует протезный материал).Если нет опасений по поводу эндокардита (или он исключен) или
эквивалент эндокардита, антибиотики можно вводить перорально через 3-4 дня
IV терапии.
грамположительные кокки в цепях:
Энтерококк
Источник инфекции: Их обычная среда обитания — желудочно-кишечный тракт,
хотя их можно выделить из ротоглотки, мочеполовых путей и
кожа. Enterococcus faecalis — самый
общий патоген человека, но Enterococcus faecium все чаще становится
распространены при внутрибольничных инфекциях. Поскольку он может колонизировать кожу,
особенно после длительной госпитализации, это также может быть причиной
зараженные культуры крови в надлежащих клинических условиях. Клинически
К значительным источникам энтерококковой бактериемии относятся инфекции мочевыводящих путей, интраабдоминальные инфекции, инфицированные сосудистые катетеры и эндокардит.Энтерококковые виды — это
четвертая по частоте причина бактериемии, связанной с катетером.
Оценка: В дополнение к посеву крови, анализу мочи и
Абдоминальное обследование следует проводить всем пациентам с энтерококковой бактериемией.
Визуализирующие исследования (компьютерная томография, HIDA, УЗИ желчных и почек) должны быть
рассматривается в зависимости от клинического сценария. Если подозрение на эндокардит
присутствует (таблица 5), то необходимо провести эхокардиографию (TTE и, возможно, TEE).
выполнила.Пациентам, вероятно, следует пройти повторный посев крови, чтобы
обеспечить устранение бактериемии, особенно если вызывает беспокойство эндокардит.
Лечение: Энтерококки по своей природе устойчивы ко многим классам
антибиотики, которые активны в отношении других грамположительных кокков, в том числе
цефалоспорины, макролиды и клиндамицин. Антибиотики с различной степенью активности in vitro против энтерококков включают пенициллины (особенно пенициллин и ампициллин, но НЕ нафциллин),
гликопептиды (ванкомицин и тейкопланин), карбапенемы
(имипенем и меропенем, но НЕ эртапенем), даптомицин, хинупристин / далфопристин и линезолид.Другие антибиотики обладают некоторой активностью
но не следует регулярно использовать для лечения серьезных энтерококковых инфекций.
инфекции, такие как бактериемия. К ним относятся тетрациклины (тетрациклин, миноциклин и доксициклин),
хинолоны (включая ципрофлоксацин, моксифлоксацин и гемифлоксацин), хлорамфеникол и рифампицин. Пенициллины и
гликопептиды обладают лучшей активностью, а ампициллин обычно имеет больше
vitro убивает способность, чем ванкомицин.Ампициллин — препарат выбора, если
изолят восприимчив. Для пациентов с аллергией на пенициллин или пациентов с устойчивыми к ампициллину штаммами ванкомицин будет первым.
линейная терапия. При бактериемии, вызванной устойчивыми к ванкомицину энтерококками (VRE), можно выбрать даптомицин и хинупристин / далфопристин. При использовании
линезолид при чувствительной к пенициллину энтерококковой бактериемии не следует
рутинная бактериемия VRE — одно исключение, в котором
этот антибиотик может быть терапевтическим вариантом (34).
Осталось два вопроса
противоречиво в лечении энтерококковой бактериемии при отсутствии
эндокардит: продолжительность лечения и потребность в синергических антибиотиках. Если
у пациента нет эндокардита, затем 7-10 дней внутривенного лечения антибиотиками
может быть достаточно, но в противном случае рекомендуется более длительный курс. Нужда в
одновременная синергетическая терапия аминогликозидами рекомендуется только для
лечение эндокардита, но не при неосложненной энтерококковой бактериемии.Энтерококкам присуща низкая устойчивость к аминогликозидам из-за:
пониженная способность этих агентов проникать через клеточную стенку, но это может
можно преодолеть добавлением активных агентов клеточной стенки (таких как пенициллины
и гликопептиды), которые приводят к синергическому уничтожению организмов. Тем не мение,
важно помнить, что высокий уровень устойчивости к аминогликозидам (HLAR)
был продемонстрирован на некоторых штаммах энтерококков.В случае эндокардита
энтерококками с HLAR, ампициллин и цефтриаксон в комбинации
используется с некоторым успехом (14).
Streptococci группы Viridans (VGS)
Источник инфекции: стрептококки группы viridans в целом низкие
возбудители вирулентности, но, как и любые комменсальные организмы, тщательная оценка
кожа и структуры полости рта необходимы до того, как будет рассмотрена бактериемия ВГС
неклинически значимо.Некоторые из важных видов группы viridans
Стрептококки включают S. milleri, S. sanguis, S. mitis и S. bovis . Переходный
бактериемии могут возникать после стоматологических манипуляций и часто не имеют
последствия у пациентов без предрасполагающих состояний. Было оценено
что только 21-50% положительных посевов крови на VGS клинически
существенный. Стрептококки группы Viridans были наиболее частой причиной
эндокардит нативного клапана и эндокардит протезного клапана с поздним началом, но
в настоящее время S.aureus стал наиболее распространенным организмом (12). VGS также
были связаны с серьезными гноеродными инфекциями, бактериемией при нейтропении.
пациенты, неонатальный сепсис и синдром сепсиса / шока (также известный как «альфа стрептококк.
шоковый синдром »). Факторами риска бактериемии ВГС являются: нейтропения, мукозит полости рта,
облучение полости рта, антибиотикопрофилактика триметоприм-сульфаметоксазолом и фторхинолонами, внутривенное переедание,
химиотерапия в высоких дозах и женский пол
(30).
Оценка: Любая бактериемия, вызванная стрептококками группы viridans, требует рассмотрения
повторных посевов крови, чтобы исключить
эндокардит
(только если несколько наборов
посев крови положительный) и подробное стоматологическое и кожное обследование. An
эхокардиограмма может быть показана, если существует возможность эндокардита.
Рассмотрение визуальных исследований брюшной полости (компьютерная томография или УЗИ) для исключения
внутрибрюшные абсцессы (печень, селезенка, брюшина) также должны быть
развлекали.
Лечение: Любая вирусная группа Streptococci бактериемия, признанная клинически
до этого потребуется эмпирический охват эндокардита.
состояние исключено. Бета-лактамы активны
против Streptococci группы viridans и являются препаратами выбора. Пациентам с аллергией на PCN можно использовать ванкомицин и клиндамицин. Если аллергическая реакция на пенициллин не была анафилактической.
или опосредованный IgE цефтриаксон может быть подходящей и хорошо переносимой альтернативой.Две недели
антибиотикотерапии будет достаточно, если не лечить эндокардит или другой
сложные инфекции (абсцессы печени, абсцесс мозга и т. д.), при которых минимум
требуется 4-6 недель (2 недели PCN плюс гентамицин могут быть подходящими для
лечение неосложненного эндокардита). Терапия пероральными антибиотиками
(предпочтительно бета-лактамы) целесообразно при не внутрисосудистых инфекциях после
начальный курс внутривенной терапии.
Другие стрептококки
Другие виды стрептококков, помимо энтерококков и стрептококков группы viridans, иногда выделяются в культурах крови. Они
включают Streptococcus pneumoniae , β-гемолитический Streptococcus и другие. S. pneumoniae — диплококк, связанный с пневмонией, менингитом, перитонитом.
и другие тяжелые инфекции. Изоляция этого организма всегда важна
и надо лечить. S. pneumoniae все еще относительно чувствительна к
бета-лактамы, которые остаются терапией первой линии. Альтернативные агенты в областях
высокая устойчивость к пенициллину включает макролиды или хинолоны. Для ß-гемолитических
стрептококки (стрептококки группы А, стрептококки группы В и т. д.) бета-лактамы
являются антибиотиками первой линии.
грамположительные бациллы
Многие грамположительные бациллы являются частью нормальной кожной флоры, поэтому могут
заражают посевы крови или колонизируют внутривенные катетеры.Выявление этих
микроорганизмы в культуре крови могут указывать на ложноположительные результаты. Они
включают Propionibacterium acnes, виды Corynebacterium и виды Bacillus.
Следует помнить, что эти бактерии могут быть патогенными в контексте
выбранных клинических состояний, таких как
эндокардит, протезы клапанов сердца, инфекция суставов, нейтропения,
пр.
Наиболее распространенные виды грамположительных бацилл, выделенных при посеве крови
образцы будут кратко описаны, поскольку более подробное описание выходит за рамки
объем данной главы.
Corynebacterium Виды:
Хотя дифтерия — это хорошо описанный верхний
респираторная инфекция, выделение Corynebacterium spp. (часто называемые дифтероидами) от пациентов без типичных респираторных симптомов, обычно
указывает на загрязнение кожи. Есть исключения из этого, например,
пациенты с центральными катетерами или факторами риска эндокардита, когда они связаны
с несколькими положительными культурами крови для одного вида или нейтропенией
пациенты, у которых C.jeikeium изолирован. В этой популяции возможность
следует учитывать клинически значимую бактериемию. Коринебактерии чувствительны к пенициллинам, ванкомицину, эритромицину и клиндамицину.
Виды Propionibacterium (Anaerobe):
Обычный кожный житель,
следовательно, обычная контаминант посева крови. Если принято решение о лечении,
что было бы необычно, антибиотики, которые были бы наиболее эффективны, включают пенициллины, тетрациклины и макролиды. Propionibacterium acnes был
связан с верхней конечности протезирования совместной инфекции, следовательно, опорно-двигательного аппарата
необходимо обследование пациента с бактериемией Propionibacterium .
Виды Bacillus (кроме сибирской язвы):
Несмотря на широкое распространение организмов Bacillus , они
редко связаны с настоящими инфекциями и чаще выделяются в качестве
загрязнитель культуры.Исключением могут быть пациенты с симптомами эндокардита или глазных инфекций, к которым был причастен B. cereus .
Это также хорошо известная причина внутрисосудистого катетера.
сопутствующие инфекции.
Лечение пенициллином и клиндамицином обычно эффективно в отношении большинства Bacillus.
виды, когда показана терапия.
Грамотрицательные бациллы
Наличие грамотрицательных палочек в крови всегда значимо.В
список грамотрицательных бактерий, способных вызвать бактериемию, довольно обширен, но
микробиологическая лаборатория может быть очень полезной в предоставлении исходной информации, которая
позволит сузить возможности и выбрать соответствующие эмпирические
антибактериальная терапия. После посева культур крови на агар
пластины и рост был продемонстрирован (обычно более 24 часов), есть
несколько тестов, которые могут предоставить полезную информацию до окончательного вида
идентификация.Основываясь на росте пластинок МакКонки, грамотрицательные
бациллы можно разделить на ферментеры лактозы и неферментеры. Дальше
оценка с помощью тестов на индол и оксидазу также может помочь в прогнозировании
ожидается идентификация бактерий. На рисунке 2 показан упрощенный алгоритм для
показана идентификация грамотрицательных палочек. Он намеренно ограничен
наиболее распространенные грамотрицательные палочки, выделенные как у внебольничных, так и у
нозокомиальная бактериемия (15, 18).
Источник инфекции: в целом
в популяции (пациенты, не получающие ОИТ), мочевыводящие пути являются наиболее частым источником
Бактериемия грамотрицательных бактерий, за которой следует желудочно-кишечная и
дыхательные пути. У пациентов в отделении интенсивной терапии мочевыводящие пути все еще преобладают, но центральные линии и раневые инфекции следуют по частоте, опережая желудочно-кишечный тракт и дыхательные пути. Факторами риска бактериемии грамотрицательных бактерий являются:
перечислены в таблице 6.
Оценка: Любая бактериемия потребует обследования со стороны мочевого и желудочно-кишечного трактов.
Анализ мочи, общий анализ крови и, возможно, рентгенограмма KUB необходимы в любом
Пациент с бактериемией грамотрицательных бактерий. Если пациент находится в отделении интенсивной терапии,
следует оценить центральные линии и послеоперационные раны. При иммуносупрессии
пациентам может потребоваться компьютерная томография или УЗИ для оценки
скрытые проблемы с кишечником или мочеиспусканием, которые могут не проявляться клинически.
Лечение: Если бактериемия грамотрицательных бактерий внебольничная,
начальная терапия цефалоспорином третьего поколения или фторхинолоном
подходящее. Ключом к выбору начальной антибактериальной терапии является обзор
недавние антибиотики (3 месяца). Если пациент получал антибиотики в течение
предыдущие 3 месяца решение выбрать терапию из альтернативного класса
приветствуется, так как вероятность резистентности бактерий высока.Если
бактериемия связана со здоровьем, пациенту недавно назначили
антибиотики (особенно хинолоны), известно о злокачественных новообразованиях или
в состоянии с ослабленным иммунитетом рекомендуется, чтобы Pseudomonas sp. быть покрытым
первоначальный выбор антибиотиков. Большинство врачей будут лечить эмпирически
потенциальная бактериемия Pseudomonas с двумя препаратами от разных антибиотиков
классы.Это связано с тем, что Pseudomonas sp. может быстро развиваться
бета-лактамная резистентность. Комбинация антипсевдомонадного β-лактама
(пиперациллин-тазобактам, имипенем / меропенем или цефепим) плюс аминогликозид
(или антипсевдомонадхинолон, такой как ципрофлоксацин)
быть начальной стандартной терапией. Деэскалация начального режима до
рекомендуется один подходящий антибиотик после посева и определения чувствительности
результаты доступны (2, 26).Комбинированная терапия также рекомендуется для
бактериемия, вызванная Enterobacter и Klebsiella pneumonia ,
особенно когда есть опасения по поводу бета-лактамазы расширенного спектра
виды-продуценты (6). Появление устойчивых энтеробактерий, способных
производить Klebsiella pneumonia, карбапенемаз (KPC) и New Delhi Metallo-beta
лактамаза (NDM-1) представляет собой растущую угрозу для здоровья населения во всем мире.Клинически нестабильные пациенты
также следует получать комбинированную терапию при выявлении грамотрицательных
бактериемия. Пациентов с аллергией на пенициллин можно лечить азтреонамом (с или
без аминогликозида или ципрофлоксацина).
Оптимальная продолжительность антибактериальной терапии грамотрицательных бактерий
бактериемия не ясна, но должна быть продиктована клиническим ответом и
основная этиология бактериемии.Большинство врачей будут лечить как минимум 2
недель, особенно если Pseudomonas sp. изолирован.
Пероральная терапия может быть подходящей и
определяется паттернами восприимчивости изолированного организма.
Анаэробы
Анаэробные бактерии можно разделить с целью первоначального микробиологического исследования.
идентификация в грамположительных и
Грамотрицательные. Грамположительные виды
включают кокки ( Peptostreptococcus spp.) и
палочки ( Actinomyces,
Bifidobacterium, Eubacterium, Lactobacillus, Clostridium и Propionibacterium видов). К грамм-негативам (только палочки, без кокков) относятся Prevotella, Porphyromonas, Fusobacterium и Bacteroide s видов).
Многие аэробные бактерии будут расти в анаэробных питательных средах, поэтому
положительный результат анаэробной культуры изначально не исключает потенциального аэробного
инфекционное заболевание.
Источник инфекции: анаэробные бактерии обычно населяют слизистую оболочку полости рта и
тракт GI. У женщин некоторые анаэробные бактерии обычно обнаруживаются в мочевом пузыре.
площадь. При наличии анаэробной бактериемии обследование пациента
должны включать клинические и визуализационные исследования этих областей. Из клинического
точки зрения, наличие газа в любой ткани с большой вероятностью указывает на
анаэробная инфекция.
Оценка: Устно (попытка идентифицировать
плохой зубной ряд), обследование ЖКТ и мочевого пузыря обязательно при анаэробной бактериемии.
Некоторые анаэробы связаны со специфическими инфекциями (например, Actinomyces у женщин с инфекциями ВМС / матки, Fusobacterium в ротоглотке / головном мозге).
абсцессы и синдром Лемьера, Bacteroides при внутрибрюшных инфекциях).
Лечение:
Большинство оральных анаэробных бактерий
чувствительны к пенициллинам, в то время как большинство интраабдоминальных анаэробов
(в частности, B.fragilis ) являются бета-лактамазоположительными и, следовательно,
устойчивы к бета-лактамам, если также не вводится ингибитор (например,
t пиперациллин / тазобактам). Некоторые специфические виды — пенициллин.
устойчивы (из-за развития бета-лактамаз), поэтому до окончательного
проводится идентификация, может быть целесообразно использовать альтернативные препараты, такие как метронидазол,
карбапенем или комбинированный препарат,
включает ингибитор бета-лактамаз.Возросло сопротивление
сообщалось о клиндамицине и грамотрицательных анаэробах, поэтому следует соблюдать осторожность
с этим препаратом, особенно при лечении анаэробов, которые могут быть из брюшной полости.
источник.
Candida видов
Источник инфекции: род Candida.
содержит> 100 различных видов, но только ограниченное количество этих видов
обычно вызывают заболевание у людей (Таблица 7).Каким бы ни был источник инфекции, кандидемия всегда имеет клиническое значение и требует немедленного вмешательства.
Отсрочка лечения кандидемии приводит к значительному увеличению смертности
поэтому раннее лечение имеет важное значение (13). Кандидозная инфекция может развиться в
несколько областей: кожа, моча, легкие и т. д., но кандидемия
обычно ассоциируется с инфицированием центральных катетеров. Факторами риска кандидемии являются: внутривенные катетеры, нейтропения, гематологические злокачественные новообразования, госпитализация в ОИТ, ППП.
администрация, абдоминальные операции, перфорация кишечника, иммуносупрессия и
ВИЧ.
Оценка: когда клинически возможно,
центральные линии следует регулярно удалять в рамках лечения кандидемии. Осмотр сетчатки глаза опытным
врач / офтальмолог обязателен для исключения кандидозного эндофтальмита,
частое осложнение кандидемии. Посев крови следует повторять до тех пор, пока
документально подтверждено разрешение кандидемии. Эндокардит встречается не так часто с
Candidemia как есть с S.aureus бактериемия, поэтому оценка с
TEE или TTE не являются обязательными, за исключением случаев подтвержденной стойкой кандидемии и септической эмболизации.
Лечение: IDSA будет публиковать
руководства по лечению кандидемии в 2009 году.
Текущие рекомендации предполагают, что выбор противогрибкового средства зависит от 2
Факторы: а) наличие нейтропении или гемодинамической нестабильности и б) местные
данные о восприимчивости (22, 27).
Для пациентов с нейтропенией или гемодинамической нестабильностью рекомендуемые эмпирические
ранее применялась амфотерицин B (особенно липосомальные соединения).
Однако в настоящее время имеются достаточные данные о том, что эхинокандины (каспофунгин, анидулафунгин, микафунгин) или триазолы (вориконазол)
обеспечит адекватный
терапия со сниженным риском токсичности. При ненейтропении и клинически
у стабильных пациентов флуконазол является подходящей начальной терапией, если только он не распространен.
из С.glabrata или C. krusei в больнице высокий, или если
пациент ранее получал азол, в этом случае эхинокандин или
амфотерицин B был бы наиболее подходящим эмпирическим агентом. При нейтропении
и пациентам без нейтропении, удаление центральных линий при наличии
кандидемия имеет первостепенное значение. Основные факторы риска для не-albicans
Кандидемия — это предшествующее воздействие флуконазола и центральной линии.Тотальный парентеральный
питание, по-видимому, связано в основном с кровотоком C. albicans
инфекция, но не Candidemia, не относящаяся к albicans (7). На рисунке 3 представлен алгоритм лечения
кандидемия в соответствии с рекомендациями IDSA 2009 г.
Candida видов, выделенных из крови, следует регулярно отправлять на тестирование на чувствительность, чтобы помочь
с соответствующей терапией (хотя по этому поводу существуют разногласия).Кандидемию необходимо лечить в течение как минимум 2 недель с момента, когда кровь
посевы становятся отрицательными, кроме случаев внутрисосудистой инфекции, такой как эндокардит
, затем терапию часто продлевают как минимум до 6 недель.
ЗАКЛЮЧЕНИЕ
До разработки новых методов ПЦР, облегчающих раннюю идентификацию
микроорганизмов широко применяется, врач будет продолжать полагаться на
грамм
данные окрашивания для соответствующего выбора антибактериальной терапии.В
опасные для жизни инфекции, раннее лечение может существенно повлиять на
прогноз и летальность. В таблице 8 представлен упрощенный подход к выбору
первичные и альтернативные противомикробные препараты в зависимости от результатов
Окраска по Граму. Когда мы узнаем о преимуществах новой ПЦР и молекулярной технологии
может предоставить, нам нужно будет продолжать использовать наши клинические и микробиологические
навыки выбора подходящего эмпирического антибиотика и оказания наилучшего лечения
нашим пациентам.
ССЫЛКИ
1.
Антимикробная терапия и вакцины. Antimicrobe.org. [PubMed]
2.
Basseti M, Righi E, Viscoli C. Pseudomonas aeruginosa Серьезные инфекции: моно
или комбинированная противомикробная терапия. Curr Med Chem, 2008. 15: 517-522 [PubMed]
3.
Бирман GM, Венцель Р.П. Бактеремии: основная причина смерти. Arch Med Res 2005
Ноябрь-декабрь; 36 (6): 646-59.[PubMed]
4.
Bouza E, Sousa D, Rodriguez-Creixems M, et al. Объем культивированной крови
По-прежнему значимый фактор в диагностике инфекций кровотока ?. J Clin
микробиол. 2007; 45: 2765-2769. [PubMed]
5.
Чанг Ф.Й., Пикок Дж. Э. мл., Мушер Д.М. и др. Бактериемия золотистого стафилококка:
рецидив и влияние лечения антибиотиками в проспективном многоцентровом
изучать.Медицина 2003; 82: 333-9 [PubMed]
6.
Чоу JW, Yu VL. Комбинированная антибактериальная терапия против монотерапии грамотрицательных
бактериемия: комментарий. Int J Antimicrob Ag 1999; II: 7-12. [PubMed]
7.
Чоу Дж. К., Голан И., Рутазер Р. и др. Факторы, связанные с кандидемией, вызванной
не-albicans Candida Species в сравнении с Candida albicans в интенсивной терапии
Единица. Clin Infec Dis.2008; 46: 1206-13. [PubMed]
8 Руководство по клинической практике лечения кандидоза: Обновление 2009 г.
Общество инфекционных болезней Америки. http://www.journals.uchicago.edu/doi/pdf/10.1086/596757
9.
Косгроув С.Е., Фаулер В.Г. Лечение метициллин-устойчивого стафилококка
aureus Бактериемия. Clin Infec Dis. 2008; 46 (Приложение 5): С386-93. [PubMed]
10.
Эдвардс Дж., Петерсон К., Андрус М. и др.Национальная сеть безопасности здравоохранения (NHSN)
Отчет, сводка данных за 2006 г., выпущенный в июне 2007 г. Am J Infect Control
2007; 35: 290-301. [PubMed]
11.
Fatkenheuer G, Cornely O, Seifert H. Клиническое ведение катетер-связанных
инфекции. Клиническая микробиология и инфекция. 2002; 8: 545-9. [PubMed]
12.
Фаулер В.Г., Миро Дж. М., Хоен Б. и др. Золотистый стафилококк Эндокардит; а
Следствие медицинского прогресса.JAMA. 2005; 293: 3012-21. [PubMed]
13. Гарей К.В., Реги М., Пай М.П. и др. Время до начала терапии флуконазолом
Воздействие Смертность у пациентов с кандидемией; Многофункциональное исследование. Clin
Заразить Dis. 2006; 43: 25-31. [PubMed]
14.
Гавальда Дж., Лен О, Миро Дж. М. и др. Краткое сообщение: лечение энтерококка
faecalis эндокардит с ампициллином плюс цефтриаксон. Энн Интерн Мед 2008 Апрель
17; 146 (8): 574-9.[PubMed]
15.
Гейнс Р., Эдвардс-младший. Обзор нозокомиальных инфекций, вызванных грамотрицательными
бациллы. Clin Infect Dis. 2005; 41: 848-54. [PubMed]
16.
Ли А., Мирретт С., Реллер Л. Б., Вайнштейн депутат. Обнаружение инфекций кровотока
у взрослых: сколько нужно посевов крови? J Clin Microbiol.
2007; 45: 3546-3548. [PubMed]
17.
Лю С., Байер А., Косгроув С. и др.Руководство по клинической практике
Американское общество инфекционных болезней по лечению
Метициллин-резистентные инфекции Staphylococcus aureus у взрослых и
Children.Clin Infect Dis 2011; 52: 1-28 [PubMed]
18.
Луццаро Ф., Вигано Э. Ф., Фоссати Д. и др. Al. Распространенность и лекарственная чувствительность
патогены, вызывающие инфекции кровотока в северной Италии: двухлетнее исследование в
16 больниц.Eur J Clin Microbiol Infect Dis. 2002; 21: 849-55. [PubMed]
19. Мандель Г.Л., Беннет Дж. Э., Долин Р. Манделл, Беннет и Доллин: принципы и практика.
инфекционных болезней. Издание шестое. 2005. Издательство Elsevier. [PubMed]
20.
Мермел Л.А., Аллон М., Буза Э. и др. Руководство по клинической практике для
Диагностика и лечение внутрисосудистой катетерной инфекции: 2009 г.
Обновление Американского общества инфекционных болезней.Clin Infect Dis 2009;
49: 1–45. [PubMed]
21.
Мирретт С., Вайнштейн М., Реймер Л. и др. Актуальность количества положительных
Бутылки в определении клинической значимости коагулазо-отрицательных стафилококков
в культурах крови. Журнал Clin Microbiol 2001: 3279-3281. [PubMed]
22.
Паппас П.Г., Рекс Дж. Х., Собел Дж. Д. и др. Рекомендации по лечению кандидоза (IDSA
Руководящие указания).Clin Infect Dis. 2004; 38: 161-189. [PubMed]
23.
Реллер Л.Б., Секстон Диджей. Методика получения культур крови для выявления
бактериемия. В: UpToDate, Rose BD (Ed), UpToDate, Waltham, MA, 2007. [PubMed]
24. Rodriguez-Baňo J. Выбор эмпирической терапии у пациентов с катетеризацией.
Инфекции. Clin Microbiol Infect 2002; 8: 275-81. [PubMed]
25.
Руими Р., Дос-Сантос М., Раскин Л. и др.Точность и потенциальная полезность
Триплекс ПЦР в реальном времени для улучшения лечения пациентов с кровью антибиотиками
Культуры, показывающие кластерные грамположительные кокки на прямом мазке. J of Clin
Microbiol. 2008: 46: 2045-2051. [PubMed]
26.
Safdar N, Handelsman J, Maki, D. Уменьшает ли комбинированная антимикробная терапия?
смертность при грамотрицательной бактериемии? Метаанализ. Lancet Inf Dis.2004; 4: 520-7. [PubMed]
27. Спеллберг Б., Филлер С., Эдвардс Дж. Текущие стратегии лечения распространенных
Кандидоз. Clin Infect Dis 2006; 42: 244-51. [PubMed]
28. Тиссари П., Зумла А., Таркка Е. и др. Точная и быстрая идентификация
бактериальных видов из положительных культур крови с помощью микроматрицы на основе ДНК
платформа: обсервационное исследование. The Lancet, 2010; 375: 224-30 [PubMed]
29.Токарс Дж. Прогностическая ценность положительных культур крови на коагулазо-отрицательные
Стафилококки: значение для ухода за пациентами и обеспечения качества медицинской помощи.
Clin Infect Dis 2004: 39: 333-41. [PubMed]
30.
Тункель А., Сепковиц К. Инфекции, вызываемые стрептококками Viridans у пациентов
при нейтропении. Clin Infect Dis 2002; 34: 1524-9. [PubMed]
31.
Wiesinger-Mayr H, Vierlinger K, Pichler R, Kriegner A, Hirschl A, Presterl E,
Бодросси Л., Ноэхаммер К.Выявление патогенов человека, выделенных из крови
с использованием гибридизации микрочипов и распознавания образов сигналов. BMC Microbiology,
2007; 7: 78. [PubMed]
32.
Wisplinghoff H; Bischoff T; Таллент С.М. Seifert H; Wenzel RP; Эдмонд МБ.
Нозокомиальные инфекции кровотока в больницах США: анализ 24 179 случаев из
проспективное общенациональное эпиднадзорное исследование. Clin Infect Dis 2004; 39: 309-317.Epub, 15 июля 2004 г. [PubMed]
33.
Wllinghausen N, Kochem AJ, Disque C и др. Диагностика бактериемии в
образцы цельной крови с использованием коммерческой универсальной ПЦР на основе гена 16S рРНК и
анализ последовательности. J Clin Microbiol. 2009 сентябрь; 47 (9): 2759-65. Epub, 1 июля 2009 г. [PubMed]
34.
Вкладыш в пакет Zyvox. https://www.pfizerpro.com/sites/ppro/pages/products/zyvox_home.aspx
DM Lab 17
DM Lab 17
И.ВВЕДЕНИЕ
Выработка экзотоксинов играет важную роль в патогенезе нескольких
группы грамположительных бацилл. Коринебактерии, клостридии и бациллы различаются
значительно по другим параметрам, таким как метаболизм, споруляция, эпидемиология и
орган-мишень для инфекции, но они имеют общую способность производить тяжелые диссеминированные
заболевание путем выделения токсина из относительно локализованной инфекции.
CORYNEBACTERIA
Коринебактерии представляют собой грамположительные тонкие палочки, часто изогнутые или булавовидные.
фигурные, иногда с ветвистыми и нитевидными формами.
Corynebacterium diphtheriae является единственным патогенным микроорганизмом для человека
в силу его способности производить дифтерийный экзотоксин. Дифтерийный экзотоксин
вырабатывается организмом в первичном очаге инфекции, из которого он распространяется
через организм, чтобы вызвать такие осложнения, как дифтерийный кардит, и периферические
неврит. Человек — единственный значительный резервуар для C. diphtheriae .
Различные штаммы C. diphtheriae различаются по своей способности продуцировать экзотоксин; Только
лизогенный C. diphtheriae продуцирует дифтерийный экзотоксин . Другие коринебактерии, так-
называемые дифтероидов , встречаются среди нормальной комменсальной флоры носа,
горло, конъюнктива и влагалище. Они часто обнаруживаются в качестве загрязнителей в
эндодонтические инфекции.
CLOSTRIDIA
Клостридии — грамположительные спорулирующие бациллы, все из которых облигатно
анаэробов , хотя их чувствительность к кислороду значительно варьируется от вида к
разновидность.Благодаря анаэробному метаболизму клостридии прорастают и
размножаются только в строго определенных условиях окружающей среды, состоящих из
в первую очередь тех, у которых пониженный окислительно-восстановительный потенциал, такой как
ткани, омертвевшие травмой или в герметичных пищевых контейнерах.
Некоторые виды Clostridium считаются патогенными, поскольку они способны
производит сильные экзотоксины. Клинические симптомы клостридиальных заболеваний у человека
и животные, независимо от типа (столбняк, газовая гангрена, ботулизм), являются результатом
токсикоз, а не инфекция.
Самый мощный из всех экзотоксинов клостридиоза продуцируется Clostridium botulinum .
В качестве контаминантов неполностью стерилизованных консервов Clostridium botulinum
споры прорастают, когда существуют подходящие анаэробные условия, и производят свои
экзотоксин. Ботулизм возникает при проглатывании экзотоксина, содержащегося в пище.
Clostridium tetani вырабатывает мощный нейротоксин в месте бактериальной репликации,
обычно в ране, загрязненной фекалиями. Clostridium perfringens ,
другой контаминант раны вырабатывает смертельный, гемолитический, некротический экзотоксин.
C. perfringens — универсальный обитатель нижних отделов кишечника и изредка
влагалище; отсюда его частое применение в случаях септического аборта.
BACILLUS
Аэробные бациллы составляют большую группу из спорообразующих , грамположительных организмов.
широко распространен в природе.Только один представитель рода Bacillus ( Bacillus
anthracis , бацилла сибирской язвы) неизменно патогенна для человека и животных.
Эта группа микроорганизмов является источником как минимум двух широко используемых полипептидов.
антибиотики, а именно бацитрацин из Bacillus subtilis и полимиксин из Bacillus
Полимикса .
Споры, продуцируемые этими организмами, обладают заметной устойчивостью к теплу и другим воздействиям.
вредные агенты.Поэтому стерилизуемые материалы должны быть нагреты до уровня
обязательно превышение температуры, смертельной для спор бактерий. Обычно это
осуществляется паром под давлением (автоклавирование).
II. ЛАБОРАТОРНАЯ РАБОТА
Поставляемые материалы: (работают попарно)
- 2 чашки кровяного агара (BAP) с коринебактериальными культурами A и B
- 2 чашки Тинсдейла с коринебактериальными культурами A и B ( две красные полосы )
- 1 ANABAP, инокулированный Clostridium perfringens ( коричневая точка )
- 1 Тио HK-пробирка, инокулированная Clostridium perfringens ( коричневая точка )
- 1 BAP, инокулированный Bacillus subtilis ( фиолетовая точка )
Процедура:
- Сравните морфологию колоний предоставленных исходных культур.Размер заметки,
форма, цвет, текстура и тип производимого гемолиза.
- Приготовьте мазки, окрашенные по Граму, каждой исходной культуры
- Напишите краткое описание микроскопической морфологии каждого организма
уделяя особое внимание форме и расположению
коринебактерии, тип и степень гемолиза Bacillus subtilis, а также
производство газа Clostridium perfringens при выращивании в жидкости
средний.
- Запишите свое наблюдение за неопознанными видами коринебактерий на
ваш отчетный лист.
- Обратите внимание на различный вид коринебактериальных видов A и B на
пластин Тинсдейла и с помощью прилагаемой таблицы определите вид
идентичность A и B.
Агар Тинсдейла — селективная среда для коринебактериальных видов. Большая часть
нормальная флора верхних дыхательных путей подавляется концентрацией
теллурита калия в среде, в то время как коринебактерии хорошо растут
коричнево-черные колонии.Кроме того, колонии C. diphtheriae продуцируют
коричневато-черная размытость или «ореол» в агаре, непосредственно окружающем
колония. C. xerosis (дифтероид ) не создает этого ореола.
- Посмотрите на фотографию теста на токсигенность in vitro (IVTT) спереди.
стол и сделайте запись в листе отчета, если ваш неопознанный C. diphtheriae
токсигенный, как определено этим тестом.
Полоска фильтровальной бумаги, содержащая антитела к дифтерийному токсину
в пластину TSA. Тестируемый штамм C. diphtheriae инокулируют в
жирная прямая линия под прямым углом к полосе антитоксина. Положительный и
микроорганизмы отрицательного контроля также имеют полосы под прямым углом к полосе.
Неизвестный штамм C. diphtheriae идентифицируется как токсигенный, если линия
иммунопреципитация на обеих сторонах инокулированной бактериальной линии
наблюдаемый.(См. Диаграмму на следующей странице.) Обратите внимание, что диаграмма и фотография
может НЕ показывать те же результаты. Не сообщайте о результатах этого
диаграмма.
Несмотря на то, что мы делаем все возможное, чтобы эта информация была актуальной и точной, утверждения на этой странице предназначены только для информационных целей.
LSUMC WWW Политика публикации, 23.09.96
% PDF-1.4
%
171 0 объект
>
endobj
xref
171 297
0000000016 00000 н.
0000007108 00000 н.
0000007235 00000 н.
0000007271 00000 н.
0000008722 00000 н.
0000008943 00000 н.
0000009062 00000 н.
0000009181 00000 п.
0000009299 00000 н.
0000009416 00000 н.
0000009534 00000 п.
0000009651 00000 п.
0000009769 00000 н.
0000009889 00000 н.
0000010008 00000 п.
0000010129 00000 п.
0000010247 00000 п.
0000010366 00000 п.
0000010487 00000 п.
0000010608 00000 п.
0000010771 00000 п.
0000010901 00000 п.
0000011005 00000 п.
0000011109 00000 п.
0000011405 00000 п.
0000012055 00000 п.
0000012105 00000 п.
0000012155 00000 п.
0000012206 00000 п.
0000012916 00000 п.
0000013542 00000 п.
0000013592 00000 п.
0000013643 00000 п.
0000013693 00000 п.
0000014056 00000 п.
0000014110 00000 п.
0000014542 00000 п.
0000014593 00000 п.
0000014644 00000 п.
0000014862 00000 п.
0000015331 00000 п.
0000024616 00000 п.
0000029487 00000 п.
0000032816 00000 п.
0000036009 00000 п.
0000038976 00000 п.
0000042142 00000 п.
0000042232 00000 п.
0000042622 00000 п.
0000042788 00000 н.
0000042966 00000 п.
0000043559 00000 п.
0000043737 00000 п.
0000044109 00000 п.
0000044167 00000 п.
0000044225 00000 п.
0000044278 00000 н.
0000044752 00000 п.
0000044821 00000 п.
0000045414 00000 п.
0000045620 00000 п.
0000045914 00000 п.
0000046114 00000 п.
0000046391 00000 п.
0000046685 00000 п.
0000046904 00000 н.
0000047084 00000 п.
0000047370 00000 п.
0000047660 00000 п.
0000048313 00000 п.
0000048515 00000 п.
0000051532 00000 п.
0000062964 00000 н.
0000066400 00000 п.
0000066981 00000 п.
0000068308 00000 п.
0000068738 00000 п.
0000069160 00000 п.
0000074767 00000 п.
0000077142 00000 п.
0000077698 00000 п.
0000087258 00000 п.
00000
00000 п.
0000094147 00000 п.
0000094656 00000 п.
0000095209 00000 п.
0000095438 00000 п.
0000095755 00000 п.
0000096583 00000 п.
0000096912 00000 п.
0000097601 00000 п.
0000097760 00000 п.
0000099319 00000 п.
0000099542 00000 н.
0000117589 00000 н.
0000117628 00000 н.
0000166994 00000 н.
0000167033 00000 н.
0000167486 00000 н.
0000167939 00000 н.
0000168339 00000 н.
0000168469 00000 н.
0000168582 00000 н.
0000168859 00000 н.
0000168948 00000 н.
0000169057 00000 н.
0000169257 00000 н.
0000169685 00000 н.
0000169959 00000 н.
0000170395 00000 н.
0000170595 00000 н.
0000170767 00000 н.
0000170880 00000 н.
0000171080 00000 н.
0000171533 00000 н.
0000171813 00000 н.
0000172254 00000 н.
0000172454 00000 н.
0000172626 00000 н.
0000172739 00000 н.
0000172939 00000 н.
0000173369 00000 н.
0000173642 00000 н.
0000174070 00000 н.
0000174270 00000 н.
0000174442 00000 н.
0000174555 00000 н.
0000174755 00000 н.
0000175195 00000 н.
0000175475 00000 н.
0000175913 00000 н.
0000176113 00000 н.
0000176285 00000 н.
0000176398 00000 н.
0000176598 00000 н.
0000177005 00000 н.
0000177256 00000 н.
0000177663 00000 н.
0000177863 00000 н.
0000178035 00000 н.
0000178148 00000 н.
0000178348 00000 н.
0000178737 00000 н.
0000178989 00000 н.
0000179380 00000 н.
0000179580 00000 н.
0000179752 00000 н.
0000179865 00000 н.
0000180065 00000 н.
0000180453 00000 н.
0000180711 00000 н.
0000181102 00000 н.
0000181302 00000 н.
0000181474 00000 н.
0000181587 00000 н.
0000181787 00000 н.
0000182166 00000 н.
0000182418 00000 н.
0000182803 00000 н.
0000183003 00000 п.
0000183175 00000 н.
0000183288 00000 н.
0000183488 00000 н.
0000183900 00000 н.
0000184159 00000 н.
0000184563 00000 н.
0000184735 00000 н.
0000184848 00000 н.
0000185048 00000 н.
0000185444 00000 н.
0000185702 00000 н.
0000186095 00000 н.
0000186295 00000 н.
0000186467 00000 н.
0000186580 00000 н.
0000186780 00000 н.
0000187233 00000 н.
0000187533 00000 н.
0000187986 00000 п.
0000188186 00000 н.
0000188358 00000 н.
0000188471 00000 н.
0000188671 00000 н.
0000189060 00000 н.
0000189313 00000 н.
0000189713 00000 н.
0000189913 00000 н.
00001
00001
00000 н.
00001
00001 00000 н.
00001 00000 н.
0000191429 00000 н.
0000191629 00000 н.
0000191801 00000 н.
0000191914 00000 н.
0000192114 00000 н.
0000192511 00000 н.
0000192764 00000 н.
0000193162 00000 н.
0000193362 00000 н.
0000193534 00000 н.
0000193647 00000 н.
0000193847 00000 н.
0000194240 00000 н.
0000194495 00000 н.
0000194886 00000 н.
0000195086 00000 н.
0000195258 00000 н.
0000195371 00000 н.
0000195571 00000 н.
0000195970 00000 н.
0000196223 00000 н.
0000196618 00000 н.
0000196818 00000 н.
0000196990 00000 н.
0000197103 00000 н.
0000197303 00000 н.
0000197698 00000 н.
0000197948 00000 н.
0000198340 00000 н.
0000198540 00000 н.
0000198712 00000 н.
0000198825 00000 н.
0000199025 00000 н.
0000199478 00000 н.
0000199767 00000 н.
0000200220 00000 н.
0000200420 00000 н.
0000200592 00000 н.
0000200705 00000 н.
0000200905 00000 н.
0000201351 00000 н.
0000201653 00000 н.
0000202098 00000 н.
0000202298 00000 н.
0000202470 00000 н.
0000202583 00000 н.
0000202783 00000 н.
0000203233 00000 н.
0000203516 00000 н.
0000203958 00000 н.
0000204158 00000 н.
0000204330 00000 н.
0000204443 00000 н.
0000204886 00000 н.
0000205171 00000 н.
0000205618 00000 н.
0000205818 00000 н.
0000205990 00000 н.
0000206103 00000 н.
0000206303 00000 н.
0000206746 00000 н.
0000207041 00000 н.
0000207491 00000 н.
0000207691 00000 н.
0000207863 00000 н.
0000207976 00000 н.
0000208176 00000 н.
0000208606 00000 н.
0000208893 00000 н.
0000209338 00000 н.
0000209538 00000 н.
0000209710 00000 н.
0000209823 00000 н.
0000210023 00000 н.
0000210463 00000 п.
0000210744 00000 н.
0000211181 00000 п.

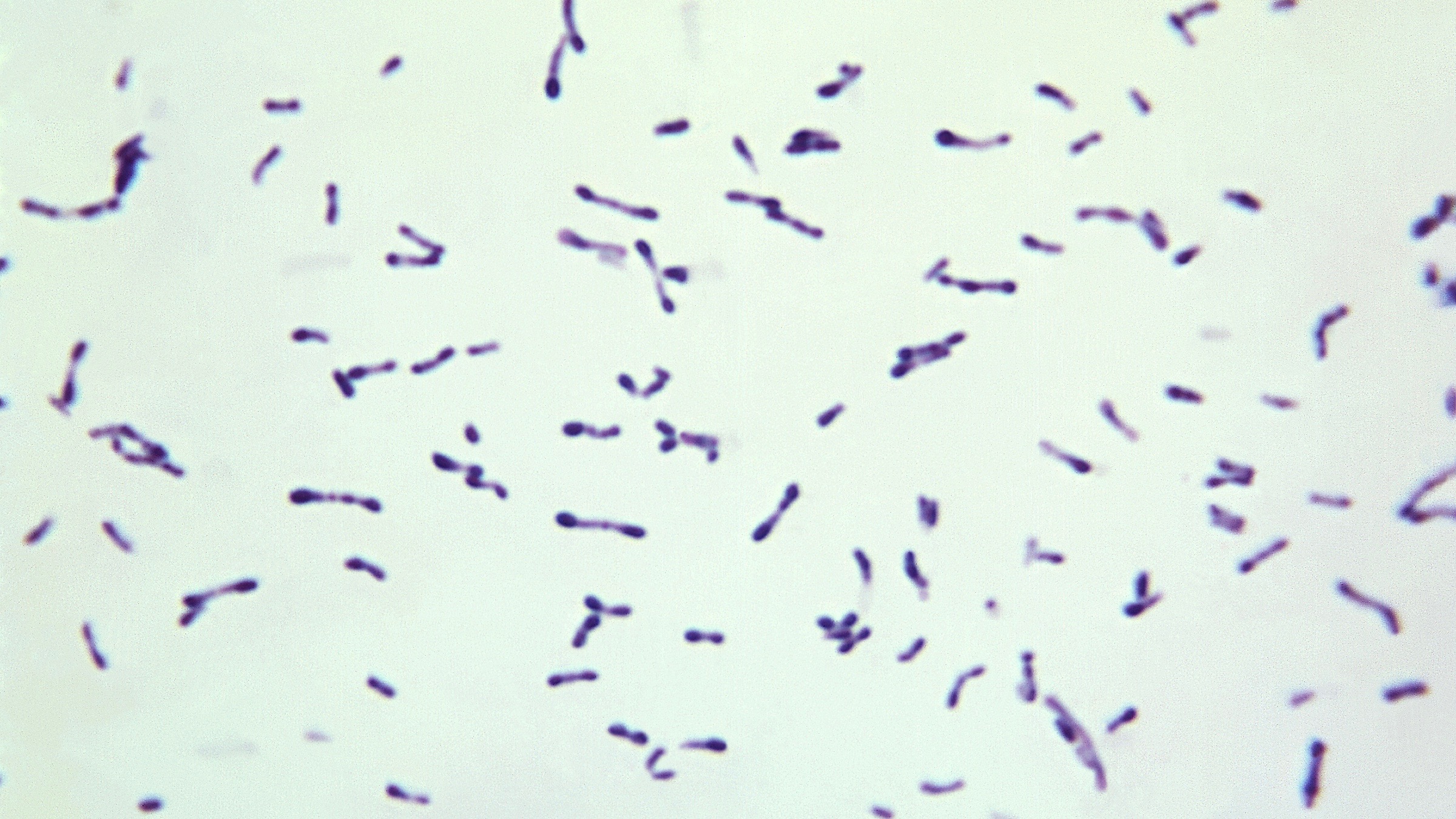 Типичным представителем данной группы является стафилококк. Существует еще одно мнение в ученом сообществе, что наличие в нашем организме представителей микроорганизмов данной группы не норма, а носительство.
Типичным представителем данной группы является стафилококк. Существует еще одно мнение в ученом сообществе, что наличие в нашем организме представителей микроорганизмов данной группы не норма, а носительство.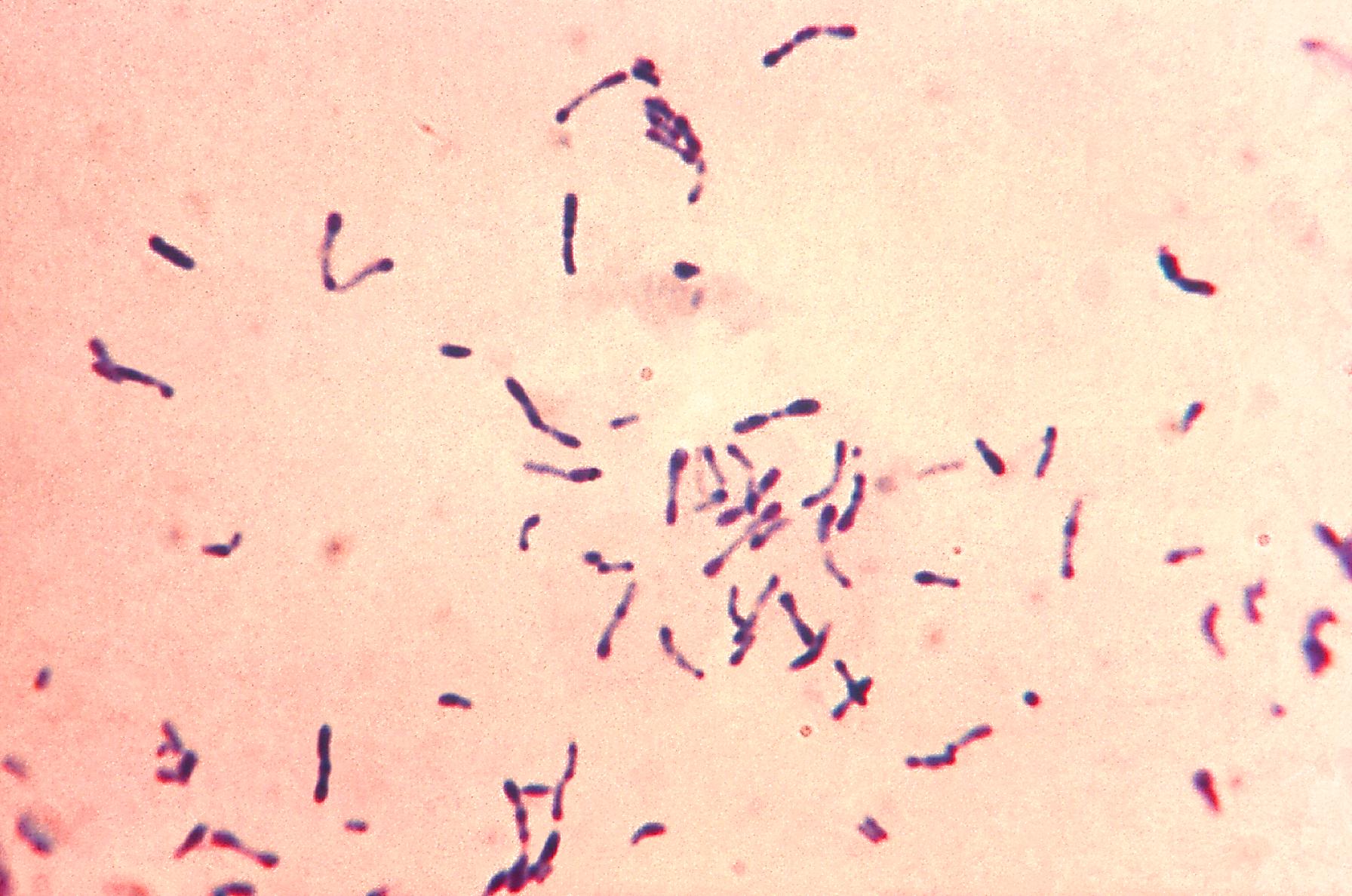
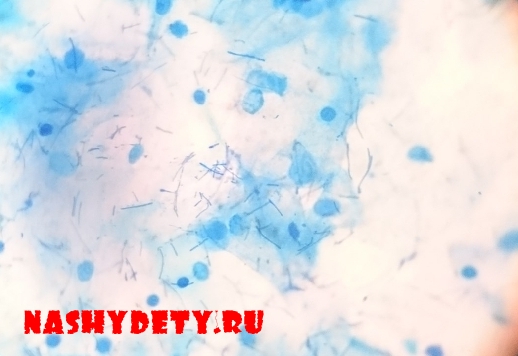


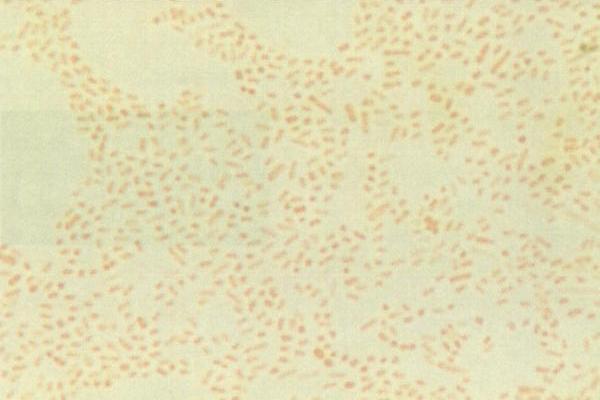

 Лейкоцитов в мазке должно быть до 20 в поле зрения микроскопа. Если же их число превышает допустимые нормы, значит, у женщины имеется какая-то инфекционная патология.
Лейкоцитов в мазке должно быть до 20 в поле зрения микроскопа. Если же их число превышает допустимые нормы, значит, у женщины имеется какая-то инфекционная патология.

 (0,5 г) на ночь, курс 10 дней;
(0,5 г) на ночь, курс 10 дней;