Бактериологическая диагностика анаэробной инфекции
Бактериологическая диагностика анаэробной инфекции
Анаэробные микроорганизмы, являясь представителями нормальной микрофлоры, в то же время они имеют потенциальные способности для развития инфекционного процесса практически в любом органе. Вследствие разных причин, например, при длительной терапии иммунодепрессантами, антибиотиками, а также в результате травмы, хирургического вмешательства, эти микроорганизмы попадают в кровяное русло, брюшную полость, различные органы и ткани и становятся причиной тяжелых гнойно-воспалительных процессов, сопровождающихся высокой смертностью, особенно при анаэробном сепсисе.
Важную роль анаэробы играют при развитии осложнений после хирургических вмешательств. В амбулаторной практике анаэробные инфекции с большой частотой встречаются у стоматологических, гинекологических больных, у женщин с отягощенным акушерским анамнезом.
Анаэробы являются участниками гнойно- воспалительных процессов, возникающих во всех отделах генитального тракта женщин. Их выделяют как единственного возбудителя или в составе ассоциации с аэробами при таких распространенных заболеваниях, как вагинит, вагиноз, послеродовый эндометрит. Установлена этиологическая роль анаэробов при возникновении воспалительных заболеваний придатков матки и околоматочного пространства, которые часто являются следствием абортов, инструментальных диагностических мероприятий, применения внутриматочных спиралей, хирургических вмешательств. Анаэробы также играют важную роль при возникновении пародонтоза — воспалительного процесса в тканях, прилегающих к зубам. По данным ВОЗ, около 95% взрослого населения планеты и 80% детей имеют признаки пародонтоза. Воспалительный процесс в тканях десны изначально возникает из-за массивных микробных скоплений и выделяемых ими ферментов и токсинов.
Бактериологическая диагностика при подозрении на анаэробную инфекцию весьма актуальна поскольку позволяет назначить наиболее эффективное лечение.
Принципы забора материала на исследование.
Материал для исследования следует брать по возможности до начала химиотерапии и лучше во время вскрытия или дренирования гнойного очага.
Особенно актуально проведение бактериологического анализа при неэффективности антимикробной терапии и при неблагоприятном течении заболевания и возникновении осложнений.
Отбор проб клинического материала при подозрении на анаэробную инфекцию и транспортировка этих образцов в бактериологическую лабораторию имеет ряд трудностей, связанных с необходимостью избежать агрессивного действия кислорода воздуха на строгие анаэробы.
Так как анаэробы являются представителями нормальной микрофлоры человека, материал для исследования следует брать с соблюдением правил асептики и строго с места локализации очага, чтобы исключить загрязнение посторонней микрофлорой.
Оптимальным способом получения проб материала является его аспирация с помощью шприца. Материал, забранный в шприц, должен быть доставлен в лабораторию для исследования в максимально короткий срок. Транспортные среды позволяют сохранить жизнеспособность анаэробных бактерий в течение достаточно продолжительного срока, указанного в инструкции.
Методы исследования.
Исследование клинического материала на анаэробы включает в себя все этапы культурального исследования, принятого в бактериологии, в том числе: выделение анаэробных микроорганизмов на искусственных питательных средах, изучение их свойств и идентификацию. Однако, учитывая физиологические особенности этой обширной группы микроорганизмов и их высокие питательные потребности, культивирование этих микробных патогенов представляется сложным и недоступным для большинства бактериологических лабораторий.
В лаборатории клинической микробиологии ГБУЗ НО «КДЦ» проводятся исследования на анаэробную инфекцию с использованием специального оборудования , импортных питательных сред и тест-систем для идентификации изучаемых микроорганизмов до рода и вида.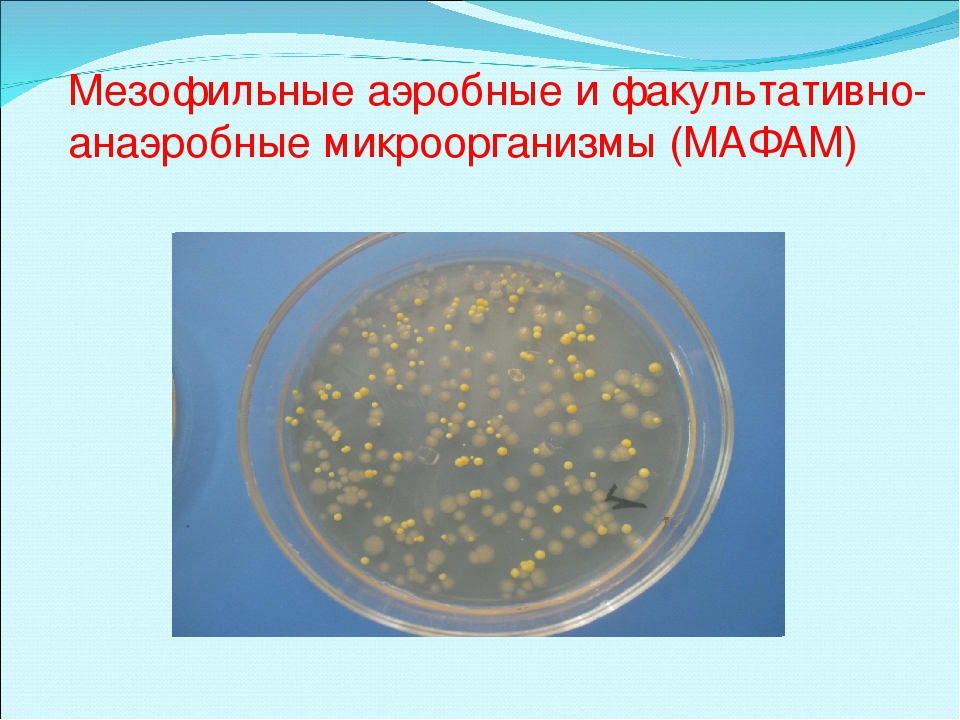
Аэробные и анаэробные бактерии — что это такое
Еще не так давно слово «бактерия» ассоциировалось у большинства людей с чем-то вредным и весьма опасным. Однако в последнее время эти микроорганизмы все чаще используются в качестве помощников в различных сферах жизни. Наиболее востребованными микробы являются в переработке отходов жизнедеятельности, избавляя от многих проблем и неприятностей, не нанося при этом вреда ни человеку, ни окружающей среде.
Аэробные бактерии — как работают?
Что это, и как оно работает? Купить биопрепарат, содержащий бактерии-помощники, можно в жидком, в сухом виде (в порошке или гранулах), а также в форме кассет или таблеток. В этих смесях бактерии находятся в «спячке» и активизируются, попав в питательную дружелюбную аэробную среду.
В состав подобных препаратов входят аэробные бактерии (нуждающиеся в кислороде для жизни и размножения), анаэробные также известные как бескислородные бактерии (вместо кислорода потребляют углерод, образующийся при разложении органики), ферменты (работают в качестве катализаторов) и энзимы.
Вносить биологические препараты необходимо в строго определенном количестве, в зависимости от объемов очищаемого резервуара, при этом колония полезных бактерий должна быть больше сообщества опасных.
Аэробным бактериям критически важен кислород, анаэробным — необязательно, а некоторым анаэробным микробам диоксид даже смертельно вреден, т.к. они питаются углекислым газом. Кстати, анаэробные бактерии бывают 2 видов:
- факультативные (условные) – могут жить без кислорода, но последний способствует ускоренному развитию анаэробов;
- облигатные (обязательные) – кислород губителен для таких бактерий.
Вот и все отличие.
Чтобы не было проблем с канализацией
Незаменимую помощь могут оказать аэробные или анаэробные бактерии на дачных участках и загородных домах без центральной канализации. Добавленные в выгребную яму бактерии уже через несколько дней полностью устраняют неприятный запах. Исчезнут и насекомые – постоянные спутники уличных туалетов. Кроме того, само содержимое ямы значительно уменьшится в объеме и превратиться из проблемы в пользу – станет удобрением.
Добавленные в выгребную яму бактерии уже через несколько дней полностью устраняют неприятный запах. Исчезнут и насекомые – постоянные спутники уличных туалетов. Кроме того, само содержимое ямы значительно уменьшится в объеме и превратиться из проблемы в пользу – станет удобрением.
Раньше для устранения запаха некоторые использовали хлорную известь (хлорку). Однако эффект от ее применения был довольно сомнительным. Вместо одного запаха на участке появлялся другой, не менее неприятный – резкий, въедливый запах хлорки.
Кроме того, после использования этого препарата долгое время ничего на месте туалета и рядом с ним не растет, даже сорные травы. Да и естественный процесс разложения отходов жизнедеятельности значительно замедлялся или даже вовсе прекращался.
Видео о том, как работает автономная канализация с бактериями
При добавлении же биологических препаратов всех этих неприятных последствий просто нет. Помимо этого, благодаря работе бактерий, реже возникает необходимость откачивать отходы, быстрее обеззараживают отходы, не разрушая при этом ни бетонные, ни пластиковые покрытия и стены, и не раздражая слизистые и кожные покровы человека. Эффективно применяется аэробная и анаэробная флора и при засорах в канализации, при необходимости быстрого начала очистительного процесса после долгого перерыва, при активном использовании канализационной системы, для очистки отстойника (септика) индивидуальной системы канализации и т.д.
Как сохранить бактерии от гибели?
Существуют правила, соблюдение которых позволит продлить жизнь бактерий в канализации:
- Регулярно пользоваться септиком (помните, микробы тоже нуждаются в пище).

- В случае длительного отсутствия требуется консервация автономной канализации (к примеру, на зиму).
- Избегать моющих средств, в составе которых есть щелочи, формальдегиды, фенол, кислоты и хлор.
- Бережно относиться к канализации: не засорять жесткой бумагой, мусором, очистками, прокладками и т.д. Что нельзя сбрасывать в автономную канализацию, читайте в нашей статье.
Ускоренное созревание компоста
О пользе хорошего компоста знают все дачники и садоводы. Однако для созревания хорошего удобрения в обычных условиях требуется несколько лет. И здесь снова приходят на помощь бактерии, значительно ускоряющие этот процесс.
При добавлении в компостную кучу биологических ускорителей, туда можно складывать практически любые отходы (органические), при этом не измельчая их. Главными аэробными условиями ускорения процесса является чередование садовых и кухонных отходов и постоянный доступ кислорода. Подобное компостирование помогает в несколько раз сократить время на подготовку удобрения и облегчить работу огороднику (нет необходимости мелко нарезать отходы и сооружать несколько компостных куч).
Уход за водоемами
Еще одним вариантом использования анаэробных или аэробных микробов является очистка водоемов, в частности садовых прудов. В отличие от больших естественных водоемов, где биологическое равновесие может восстанавливаться само собой, небольшие пруды на садовых участках требуют тщательного ухода. Переизбыток органических веществ в воде быстро приводит к ее помутнению и затхлости. И того, и другого можно избежать, если добавить в пруд препарат с микроорганизмами.
В результате, сначала специальный реагент собирает загрязняющие вещества хлопьями, которые оседают на дно. А здесь за них уже принимаются бактерии, содержащиеся все в том же препарате, которые разлагают органику. При этом на зиму бактерии-чистильщики «уходят в спячку», а весной вновь начинают свою работу.
Все эти препараты абсолютно безвредны для человека и всех обитателей пруда. Главное, о чем необходимо помнить, что наиболее эффективно микроорганизмы будут работать только в закрытых водоемах (нет поступлений и выхода воды).
Главное, о чем необходимо помнить, что наиболее эффективно микроорганизмы будут работать только в закрытых водоемах (нет поступлений и выхода воды).
Очистка колодцев и траншей для сточных вод
Рано или поздно, но любой колодец, в котором собираются сточные воды, загрязняется, покрывается илом. Очистить его также помогут микробиологические препараты (те же бактерии аэробы). Конечно совсем избежать заиливания не удастся, но срок службы колодца может увеличиться в разы.
Какие бактерии используются в наших канализациях
Во всех наших станциях используются только аэробные (живые и естественные природные бактерии). Точнеебудет сказать, что они сами появляются и размножаются в автономных системах канализаций, так как в них постоянно подаётся кислород.
Геологи нашли живших до кислородной катастрофы бактерий
Andrew Czaja / University of Cincinnati
Геологи из США и Южной Африки обнаружили ископаемые останки сероокисляющих бактерий, живших 2,5 миллиарда лет назад, еще до появления в атмосфере свободного кислорода. Статья опубликована в журнале Geology.
Возраст Земли, по последним данным, оценивается в 4,54 миллиарда лет. При этом первую половину этого срока в состав атмосферы почти не было свободного кислорода. Около 2,4 миллиарда лет назад произошло глобальное изменение состава атмосферы Земли, известное как кислородная катастрофа. В атмосфере при этом появилось большое количество свободного кислорода, а общий характер атмосферы изменился с восстановительного на окислительный, что привело к появлению аэробных организмов. Жизнь на Земле возникла еще до кислородной катастрофы, хотя точный момент ее возникновения не определен. По последним данным, жизнь существовала уже 3,8 миллиарда лет назад — а по некоторым оценкам, даже ранее 4 миллиардов лет назад.
Жизнь на Земле возникла еще до кислородной катастрофы, хотя точный момент ее возникновения не определен. По последним данным, жизнь существовала уже 3,8 миллиарда лет назад — а по некоторым оценкам, даже ранее 4 миллиардов лет назад.
Авторы новой статьи обнаружили ископаемые микроорганизмы в слоях южноафриканского кремнистого сланца, возраст которых оценивается как 2,52 миллиарда лет (это соответствует неоархею — последней эре архея). Эти коккоидные (округлые) микроорганизмы гораздо крупнее большинства современных бактерий, но похожи на некоторых бактерий, живущих сегодня в глубоких океанических водах, богатых серой и бедных кислородом и светом. Такое сходство неслучайно: обнаруженные организмы обитали в глубоких океанических водах. Исходя из морфологии и предполагаемой экологии этих микроорганизмов, авторы заключили, что они представляли собой сероокисляющие бактерии.
Микрофотографии найденных ископаемых бактерий
Czaja et al. 2016
Как предполагают авторы, бактерии окисляли сероводород в отсутствие кислорода, производя при этом сульфат. То же самое делают современные сероокисляющие бактерии, например, Thiomargarita namibiensis — факультативно анаэробные микроорганизмы, живущие в придонных морских осадках. Сероводород же попадал в океанические воды из богатых серой пород, вымывавшихся с существовавшего тогда суперконтинента Ваальбары.
Обнаруженные микроорганизмы — самые древние из известных на сегодняшний день сероокисляющих бактерий. Как предполагают авторы, они обеспечивали сульфатами сульфатредуцирующих бактерий (анаэробных бактерий, восстанавливающих сульфаты) еще до того, как в атмосфере и океане появилось достаточное количество кислорода.
Недавно ученые обнаружили следы самого древнего кислорода на Земле: осадочным железистым формациям в Гренландии, в формировании которых участвовали окислительно-восстановительные процессы, оказалось 3,8 миллиарда лет. Примерно такой же возраст у самых древних из известных на сегодняшний день ископаемых микроорганизмов: 3,7 миллиарда лет. Возраст древнейших из известных многоклеточных организмов при этом составляет около 1,56 миллиарда лет.
Примерно такой же возраст у самых древних из известных на сегодняшний день ископаемых микроорганизмов: 3,7 миллиарда лет. Возраст древнейших из известных многоклеточных организмов при этом составляет около 1,56 миллиарда лет.
Софья Долотовская
Анаэробные бактерии — угроза в вакууме – тема научной статьи по прочим технологиям читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
КАЧЕСТВО ПРОДУКЦИИ
Снеговая Н.В. ООО «Синтест»
АНАЭРОБНЫЕ БАКТЕРИИ УГРОЗА В ВАКУУМЕ
Все производители пищевых продуктов знают о необходимости микробиологического контроля, чтобы обеспечить качество и безопасность выпускаемой продукции. Проверке подвергается сырье, полуфабрикаты, готовая продукция, а также оборудование, рабочие поверхности и другие объекты окружающей среды.
Согласно ТР ТС 021/2011 объекты контроля необходимо проверять на различные виды микроорганизмов, но только один показатель относится к анаэробным бактериям — суль-фитредуцирующие клостридии. Об анаэробных бактериях, как правило, известно немного, однако, пренебрежительное отношение к выделению этих микрооганизмов может привести к самым серьёзным последствиям.
Анаэробные бактерии- микроорганизмы, получающие энергию при отсутствии доступа кислорода, то есть могут осуществлять жизнедеятельность либо при очень низком содержании кислорода, либо при его полном отсутствии. Организмы, гибнущие даже при минимальном количестве кислорода, называются строгими (облигатными) анаэробами, а атмосфера без содержания кислорода называется анаэробной.
Однако, именно анаэробная атмосфера образуется при упаковке многих продуктов питания. Как только бутылка, пакет или любая другая упаковка запаивается или завинчивается, доступ кислорода внутрь тары сразу прекращается, и это создает подходящие условия для развития анаэробных микроорганизмов. Наиболее благоприятные условия для анаэробов создаются при фасовке в вакуумную упа-
ковку и консервные банки, так как для сохранения качества продуктов внутри тары создается вакуум, то есть атмосфера полностью лишенная кислорода.
Анаэробные микроорганизмы известны с 1861 г., когда Луи Пастер ввел термин «анаэробы» и открыл бактерии маслянокислого брожения. Самые известные представители анаэробных бактерий-клостридии, грамположительные бактерии, образующие споры. Благодаря спорам клостридии становятся гораздо более устойчивыми к различным средствам обеззараживания, к примеру, в форме спор эти бактерии способны «пережить» пастеризацию. Прекрасно живут эти бактерии и на оборудовании, в замкнутых емкостях, трубопроводах, под пищевыми «пленками». Недостаточный контроль и неудовлетворительная санитарная обработка приводят к попаданию и сохранению жизнеспособных форм анаэробов в готовой продукции.
чем же опасны анаэробные микроорганизмы?
В первую очередь, они приводят к порче продуктов.
Маслянокислые бактерии (Clostridium butyricum, Clostridium tyrobutyricum) вызывают позднее вспучивание сыров, бомбаж консервов, появление прогорклого вкуса продуктов.
■
уШ
36
www./GettyImages-117451692-56a503b05f9b58b7d0da8ee3.jpg) Rosfood.info
Rosfood.info
№4 сентябрь 2018
Пищевая Индустрия
Бактерии родов Pectinatus и Megasphaera (строгие анаэробы) создают проблемы в пивоварении, приводя, к примеру, к появлению у пива неприятного запаха. Эти микроорганизмы адаптируются к условиям пивоваренного производства, не благоприятным для большинства бактерий, во многом благодаря образованию капсул, а повышение значения рН позволяет им развиваться более интенсивно.
При попадании анаэробных бактерий или их спор в продукты в вакуумной упаковке (мясопродукты, птицепродукты, сыры, овощи и др.) в большинстве случае они вызовут образование большого количества газа, а это приводит к раздуванию упаковки или даже самого продукта.
поэтому необходимость достоверного контроля анаэробных микроорганизмов на пищевых производствах трудно переоценить
Для выявления анаэробов использовались посев на специальные среды, эксикаторы, но это давало очень низкий процент вероятности создания действительно анаэробных условий, и остаточные количества кислорода приводили к гибели бактерий и ложноотрицательным результатам детекции.
Серьезным шагом к созданию оптимальных условий для культивирования анаэробов стали газ-пакеты, анаэростаты и С02-инкубаторы, которые могут создавать необходимую газовую атмосферу. Но газ-пакеты создают атмосферу химическим путем, отклонения в составе могут быть велики, что приводит к ложным результатам, а анаэростаты и С02-инкубаторы имеют возможность подключения только одного газа, что недостаточно для хорошего роста анаэробных микроорганизмов.
самым современным оборудованием, позволяющим со 100% точностью выявить присутствие анаэробных бактерий, является прибор Anoxomat (Advanced Instruments Inc. ), соответствует ГОСТ 29185-2014 (ISO 15213:2003), включен в ГОСТ 7702.2.6-2015.
), соответствует ГОСТ 29185-2014 (ISO 15213:2003), включен в ГОСТ 7702.2.6-2015.
Но главная опасность, которую несут в себе кло-стридии — это выделяемые ими энтеротоксины, которые устойчивы к термообработке и могут привести к пищевым токсикоинфекциям. Наиболее известная и распространенная Clostridium perfringens выделяет различные токсины, для человека наиболее опасны типы А и С: токсин А вызывает поражение ЖКТ, а токсин С — некротический энтерит. Clostridium botulinum вызывает тяжелое заболевание ботулизм, приводящее к поражению нервной системы, развивается дыхательная недостаточность.
Anoxomat для выявления анаэробных и микроаэрофильных бактерий
Используя метод откачивания-замещения газов, прибор за 3 минуты создает анаэробную атмосферу с 0% кислорода в специальных контейнерах разного размера. Это позволяет не пропустить бактерии или споры, если они действительно присутствуют в образце, и даже смоделировать условия, которые образуются внутри закрытой упаковки. Anoxomat не требует расходных материалов и позволяет производителям быть уверенными в безопасности выпускаемой продукции.
Syntest OOO «СИНТЕСТ» +7(495)668-07-93 • [email protected] • www.syntest.ru
Щ37
Как бактерии производят неприятный запах изо рта
Роль анаэробных бактерий в возникновении неприятного запаха изо рта.80 % проблем, связанных с несвежим дыханием возникают из-за чрезмерно быстрого роста количества бактерий во рту.
Если вы молоды, здоровы, и не подвержены хроническому синуситу, тонзиллиту или ларингиту, и страдаете из-за неприятного запаха изо рта, то, скорее всего, у вас есть проблемы в полости рта.
Когда появляется несвежее дыхание из-за заболеваний полости рта, вещества, запах которых вы чувствуете, являются составляющими серы, продуцируемыми анаэробными бактериями. Анаэробные бактерии живут в отсутствии кислорода, и они наиболее легко колонизируют области, где есть полости с ограниченным доступом кислорода. Класс веществ, которые производят анаэробы, названы летучие соединения серы.
Анаэробные бактерии живут в отсутствии кислорода, и они наиболее легко колонизируют области, где есть полости с ограниченным доступом кислорода. Класс веществ, которые производят анаэробы, названы летучие соединения серы.
Летучие соединения серы (ЛСС) включают такие вещества, как водородный сульфид (запах тухлого яйца), метил меркаптан (запах гнилой капусты и химикат, добавленный к природному газу, чтобы придать ему специфичный запах), и сульфид этана (запах разлагающихся овощей).
Существует более чем 400 типов бактерий, обитающих в полости рта. И только несколько десятков из них при благоприятных условиях могут вызвать неприятный запах. Такие бактерии усваивают белки, такие как мертвые клетки ткани, крови и слизистой оболочки. Белки собраны из стандартных блоков — аминокислот, а переваривание этих аминокислот снабжает бактерии энергией. Некоторые из аминокислот содержат серу, и эти составляющие серы преобразованы в ЛСС как ненужный продукт.
Здоровая ротовая полость может скрывать много различных видов бактерий. В любой части полости рта устанавливается своего рода баланс между конкурирующими видами. При соблюдении такого баланса запаха изо рта не образуется. Здоровый баланс бактерий называют нормальной микрофлорой, или «нормальным флоральным образцом». Существует очень широкий диапазон флоральных образцов, которые считаются здоровыми. У каждого он немного отличается. Но когда условия в любом участке полости рта изменяются из-за болезни или других факторов, таких как обезвоживание или присутствие способных к брожению веществ, таких как кровь, мертвые ткани или остатки пищи, баланс бактериальных разновидностей изменяется, приводя к чрезмерно быстрому росту анаэробных бактерий за счет остальной части нормальных микроорганизмов. Таким образом, неприятный запах из полости рта возникает из-за выработки ЛСС.
Ботулизм
\n
\nСпоры, вырабатываемые Clostridium botulinum устойчивы к высоким температурам и широко распространенные в окружающей среде. При отсутствии кислорода эти споры прорастают, развиваются и начинают выделять токсины. Существует 7 разных форм ботулотоксина – типы A – G. Четыре из них (типы A, B, E и в редких случаях F) вызывают ботулизм человека. Типы C, D и E вызывают болезнь у млекопитающих, птиц и рыб.
При отсутствии кислорода эти споры прорастают, развиваются и начинают выделять токсины. Существует 7 разных форм ботулотоксина – типы A – G. Четыре из них (типы A, B, E и в редких случаях F) вызывают ботулизм человека. Типы C, D и E вызывают болезнь у млекопитающих, птиц и рыб.
\n
\nБотулотоксины попадают в организм при потреблении продуктов, не прошедших надлежащую обработку, в которых бактерии или споры выживают и вырабатывают токсины. Основной причиной ботулизма человека является пищевая интоксикация, но он может быть вызван кишечной инфекцией у детей грудного возраста, раневыми инфекциями и в результате вдыхания.
\n
Симптомы пищевого ботулизма
\n
\nБотулотоксины нейротоксичны и поэтому оказывают воздействие на нервную систему. Для пищевого ботулизма характерен нисходящий вялый паралич, который может приводить к дыхательной недостаточности.
\n
\nРанними симптомами являются сильная утомляемость, слабость и головокружение, за которыми обычно следуют затуманенное зрение, сухость во рту, а также затрудненные глотание и речь. Могут также иметь место рвота, диарея, запор и вздутие живота. По мере прогрессирования болезни может появляться слабость в шее и руках, после чего поражаются дыхательные мышцы и мышцы нижней части тела. Температура не повышается и потери сознания не происходит.
\n
\nПричиной этих симптомов является не сама бактерия, а вырабатываемый ею токсин. Симптомы обычно появляются через 12–36 часов (минимум через 4 часа и максимум через 8 дней) после экспозиции. Показатели заболеваемости ботулизмом низкие, но показатели смертности высокие в случае, если не будет быстро поставлен правильный диагноз и незамедлительно предоставлено лечение (введение на ранних стадиях антитоксина и интенсивная искусственная вентиляция легких). Болезнь может заканчиваться смертельным исходом в 5–10% случаев.
\n
Экспозиция и передача
\n
Пищевой ботулизм
\n
\nC. botulinum является анаэробной бактерией — это означает, что она может развиваться только при отсутствии кислорода. Пищевой ботулизм развивается в случае, когда бактерии C. botulinum растут и вырабатывают токсины в пищевых продуктах до их потребления. C. botulinum вырабатывает споры, которые широко распространены в окружающей среде, включая почву, а также речную и морскую воду.
Пищевой ботулизм развивается в случае, когда бактерии C. botulinum растут и вырабатывают токсины в пищевых продуктах до их потребления. C. botulinum вырабатывает споры, которые широко распространены в окружающей среде, включая почву, а также речную и морскую воду.
\n
\nРост бактерий и выработка токсина происходят в продуктах с низким содержанием кислорода и при определенном сочетании температуры хранения и параметров консервации. Чаще всего это происходит в пищевых продуктах легкой консервации, а также в продуктах, не прошедших надлежащей обработки, консервированных или бутилированных в домашних условиях. В кислой среде (pH менее 4,6) развития C. botulinum не происходит, и поэтому в кислых продуктах токсин не вырабатывается (однако низкий уровень pH не разрушает токсинов, выработанных ранее). Для предотвращения роста бактерий и выработки токсина используются также низкие температуры хранения в сочетании с определенными уровнями содержания соли и/или кислотности.
\n
\nБотулотоксин обнаружен в широком ряде пищевых продуктов, включая низкокислотные консервированные овощи, такие как зеленая фасоль, шпинат, грибы и свекла; рыбу, такую как консервированный тунец, ферментированная, соленая и копченая рыба; и мясные продукты, такие как ветчина и сосиски. Продукты питания меняются в зависимости от стран и отражают местные особенности питания и методики консервации пищевых продуктов. Иногда ботулотоксины обнаруживаются в продуктах промышленного приготовления.
\n
\nНесмотря на то, что споры C. botulinum устойчивы к высоким температурам, токсин, вырабатываемый бактериями, которые развиваются из спор в анаэробных условиях, разрушается при кипячении (например, при температуре внутри >85C в течение пяти или более минут). Поэтому, чаще всего причиной ботулизма человека являются готовые к употреблению продукты в упаковках с низким содержанием кислорода.
\n
\nДля выяснения причины и предотвращения дальнейших случаев заболевания необходимо незамедлительно получить образцы продуктов, причастных к предполагаемым случаям заболевания, поместить их в надлежащие герметически закрытые контейнеры и направить в лаборатории.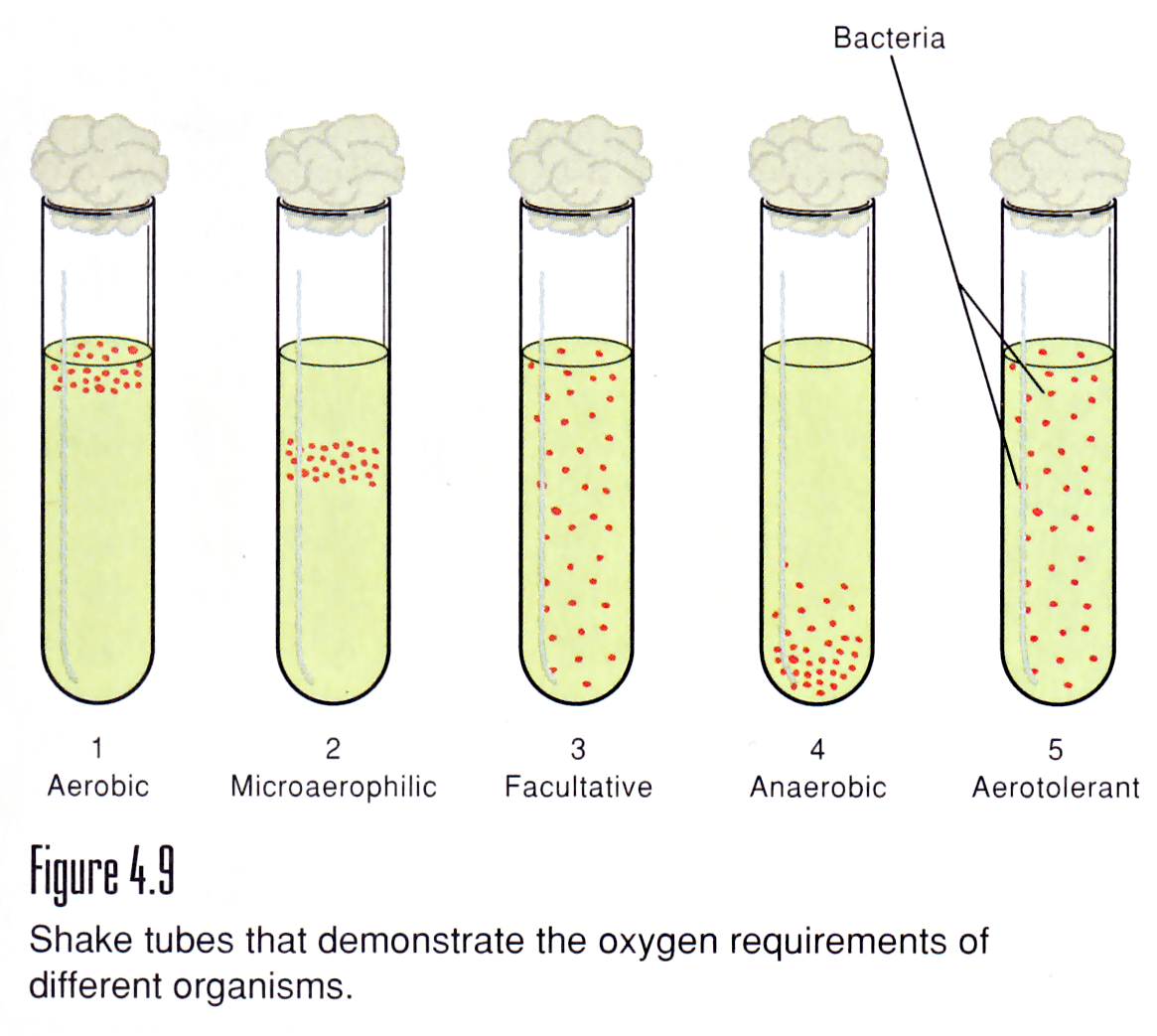
\n
Детский ботулизм
\n
\nДетский ботулизм развивается, в основном, у детей в возрасте до 6 месяцев. В отличие от пищевого ботулизма, вызываемого потреблением уже выработанных токсинов в пищевых продуктах (см. пункт «a» выше), детский ботулизм развивается в случае, когда дети проглатывают споры C. botulinum, из которых развиваются бактерии, колонизирующие кишечник и выделяющие токсины. У большинства взрослых людей и детей старше 6 месяцев этого не происходит, потому что естественные защитные механизмы кишечника, формирующиеся позже, предотвращают прорастание спор и рост бактерий.
\n
\nКлинические симптомы у детей грудного возраста включают запор, потерю аппетита, слабость, измененный плач и четко выраженную утрату способности держать головку. Существует несколько вероятных источников инфицирования детским ботулизмом, но определенное число случаев заболевания ассоциируется с медом, зараженным спорами. Поэтому, родителям и лицам, осуществляющим уход за детьми, не следует давать мед детям в возрасте до 1 года.
\n
Раневой ботулизм
\n
\nРаневой ботулизм развивается редко, в случаях, когда споры попадают в открытую рану и способны размножаться в анаэробных условиях. Симптомы схожи с пищевым ботулизмом, но могут появляться через две недели. Эта форма болезни связана с токсикоманией, в частности с инъекциями героина.
\n
Ботулизм в результате вдыхания
\n
\nБотулизм редко развивается в результате вдыхания. Такие случаи не происходят в естественных условиях, они связаны, например, со случайными или предумышленными событиями (такими как биотерроризм), которые приводят в высвобождению токсинов в аэрозолях. Клиническая картина в случае ботулизма, развивающегося в результате вдыхания, схожа с клинической картиной при пищевом ботулизме. Средняя летальная доза для людей оценивается на уровне 2 нанограммов ботулотоксина на килограмм веса тела, что примерно в 3 раза превышает аналогичный показатель в случаях пищевого ботулизма.
\n
\nСимптомы появляются через 1–3 дня после вдыхания токсинов или через более длительный период времени в случае более низких уровней интоксикации. Симптомы развиваются так же, как и при пищевом ботулизме, и на завершающей стадии происходит паралич мышц и недостаточность дыхания.
Симптомы развиваются так же, как и при пищевом ботулизме, и на завершающей стадии происходит паралич мышц и недостаточность дыхания.
\n
\nПри подозрении на воздействие токсина путем вдыхания аэрозоли необходимо предотвратить дополнительное воздействие на пациента и других людей. Следует снять с пациента одежду и хранить ее в полиэтиленовых пакетах до тех пор, пока она не будет тщательно выстирана в воде с мылом. Пациент должен принять душ и незамедлительно пройти дезинфекцию.
\n
Другие типы интоксикации
\n
\nТеоретически ботулизм может передаваться через воду в результате проглатывания токсина, выработанного ранее. Однако, учитывая тот факт, что при обработке воды (такой как кипячение или дезинфекции 0,1-процентным раствором гипохлорита) токсин разрушается, такой риск считается низким.
\n
\nБотулизм неопределенного происхождения обычно регистрируется среди взрослых людей в тех случаях, когда не установлен источник пищевого или раневого ботулизма. Эти случаи сопоставимы с детским ботулизмом и могут происходить при изменении нормальной флоры кишечника в результате хирургических вмешательств или терапии антибиотиками.
\n
\nЗарегистрированы неблагоприятные реакции на чистый токсин, используемый среди пациентов в медицинских и/или косметических целях, дополнительную информацию см. ниже в разделе «Ботокс»).
\n
Ботокс
\n
\nБактерия C. botulinum используется для производства ботокса — фармацевтического препарата, применяемого преимущественно для инъекций в клинических и косметических целях. Для ботокса используется очищенный и сильно разбавленный ботулинический нейротоксин типа А. Процедуры проводятся в медицинских учреждениях в соответствии с потребностями пациента и обычно хорошо переносятся, хотя в редких случаях наблюдаются побочные реакции.
\n
Диагностирование и лечение
\n
\nДиагноз обычно ставится на основе истории болезни и клинического осмотра при последующем лабораторном подтверждении, включающем демонстрацию присутствия ботулотоксина в сыворотке, стуле или пищевых продуктах или выращивание культуры C. botulinum в образцах стула, раневой жидкости или пищевых продуктов. Иногда ставится ошибочный диагноз ботулизма, так как его часто принимают за инсульт, синдром Гийена-Барре или тяжелую миастению.
botulinum в образцах стула, раневой жидкости или пищевых продуктов. Иногда ставится ошибочный диагноз ботулизма, так как его часто принимают за инсульт, синдром Гийена-Барре или тяжелую миастению.
\n
\nПосле постановки клинического диагноза необходимо как можно скорее ввести антитоксин. Раннее введение антитоксина эффективно снижает показатели смертности. В случае тяжелого ботулизма требуется поддерживающая терапия, в частности искусственная вентиляция легких, которая может требоваться в течение нескольких недель и даже месяцев. Антибиотики не требуются (за исключением случаев раневого ботулизма). Существует вакцина против ботулизма, но она редко используется, так как ее эффективность не оценена полностью и были зарегистрированы неблагоприятные реакции.
\n
Профилактика
\n
\nПрофилактика пищевого ботулизма основана на надлежащей практике приготовления пищевых продуктов, в частности во время тепловой обработки/стерилизации, и гигиене.
\n
\nПищевой ботулизм можно предотвращать путем инактивации бактерии и ее спор в стерилизованных путем нагрева (например, в автоклаве) или консервированных продуктах или путем подавления роста бактерий и выработки токсинов в других продуктах. Вегетативные формы бактерии могут быть уничтожены при кипячении, но споры могут оставаться жизнеспособными даже при кипячении в течение нескольких часов. Тем не менее, споры можно уничтожить путем тепловой обработки при очень высоких температурах, например при промышленном консервировании
\n
\nПромышленной тепловой пастеризации (включая пастеризованные продукты в вакуумной упаковке и продукты горячего копчения) может быть недостаточно для уничтожения всех спор и, поэтому, безопасность этих продуктов должна быть основана на предотвращении бактериального роста и выработки токсина. Низкие температуры в сочетании с содержанием соли и/или кислой средой препятствуют росту бактерий и выработке токсина.
\n
\nБрошюра ВОЗ «Пять важнейших принципов безопасного питания» служит основой образовательных программ для подготовки лиц, занимающихся обработкой и приготовлением пищевых продуктов, и для просвещения их потребителей. Они особенно важны для предотвращения пищевых отравлений.
Они особенно важны для предотвращения пищевых отравлений.
\n
\nЭто следующие пять принципов:
\n
- \n
- соблюдайте чистоту;
- отделяйте сырое от готового;
- проводите тщательную тепловую обработку;
- храните продукты при безопасной температуре;
- используйте чистую воду и чистое пищевое сырье.
\n
\n
\n
\n
\n
\n
Деятельность ВОЗ
\n
\nВспышки ботулизма происходят редко, но они являются чрезвычайными ситуациями в области общественного здравоохранения, которые требуют быстрого распознания для выявления источника инфекции, определения типа вспышки болезни (среди естественных, случайных или потенциально преднамеренных), предотвращения других случаев заболевания и эффективного лечения пострадавших пациентов. Успех лечения в значительной мере зависит от раннего диагностирования и быстрого введения ботулинического антитоксина.
\n
\nРоль ВОЗ в принятии ответных мер на вспышки ботулизма, которые могут иметь международное значение, заключается в следующем:
\n
- \n
- Эпиднадзор и выявление: ВОЗ поддерживает усиление национальных систем эпиднадзора и международного предупреждения для обеспечения быстрого выявления вспышек болезней на местах и принятия эффективных международных ответных мер. Основным инструментом ВОЗ для проведения эпиднадзора, осуществления координации и принятия ответных мер является Международная сеть органов по безопасности пищевых продуктов (ИНФОСАН), которая связывает национальные органы государств-членов, ответственных за управление событиями в области безопасности пищевых продуктов. Эта сеть находится в совместном управлении ФАО и ВОЗ.
- Оценка риска: в основе ответных мер ВОЗ лежит методология оценки риска, которая включает определение типа вспышки болезни — является ли она естественной, случайной или, возможно, преднамеренной. ВОЗ также предоставляет научные оценки в качестве основы для международных стандартов безопасности пищевых продуктов, руководящих принципов и рекомендаций, разрабатываемых Комиссией Кодекс Алиментариус.

- Изоляция источника инфекции: ВОЗ координирует деятельность с национальными и местными органами для сдерживания дальнейшего распространения вспышек болезней.
- Оказание содействия: ВОЗ координирует действия международных учреждений, экспертов, национальных лабораторий, авиакомпаний и коммерческих организаций по мобилизации оборудования, средств и материалов, необходимых для принятия ответных мер, включая поставки и введение ботулинического антитоксина.
\n
\n
\n
\n
\n
«,»datePublished»:»2018-01-10T10:22:00.0000000+00:00″,»image»:»https://www.who.int/images/default-source/imported/foodborne-trematodiases-jpg.jpg?sfvrsn=3f9ed163_0″,»publisher»:{«@type»:»Organization»,»name»:»World Health Organization: WHO»,»logo»:{«@type»:»ImageObject»,»url»:»https://www.who.int/Images/SchemaOrg/schemaOrgLogo.jpg»,»width»:250,»height»:60}},»dateModified»:»2018-01-10T10:22:00.0000000+00:00″,»mainEntityOfPage»:»https://www.who.int/ru/news-room/fact-sheets/detail/botulism»,»@context»:»http://schema.org»,»@type»:»Article»};
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ТЕЧЕНИЯ ЭКСПЕРИМЕНТАЛЬНОГО ОСТРОГО ОБСТРУКТИВНОГО ПИЕЛОНЕФРИТА, ВЫЗВАННОГО РАЗЛИЧНЫМИ НЕКЛОСТРИДИАЛЬНО-АНАЭРОБНЫМИ БАКТЕРИЯМИ | Пасечник
1. Бешлиев Д.А. Ходырева Л.А. Диагностика и лечение острого пиелонефрита // Трудный пациент. – 2007. – №12-13. – С. 5-8.
2. Лоран О.Б., Синякова Л.А., Косова И.В. Роль урогенитальных инфекций в этиологии цистита и необструктивного пиелонефрита у женщин (часть 1) // Урология. – 2005. – №2.– С. 74-79.
3. Урология: клинические рекомендации / Под ред. Н.А. Лопаткина. – М.: ГЭОТАР-Медиа, 2007. – 368 с.
4. Лопаткин Н.А., Деревянко И.И., Страчунский Л.С. Антибактериальная терапия острого цистита и пиелонефрита у взрослых // Публикация на сайте НИИ урологии МЗ РФ. – 2003 г. Url.: http://www.antibiotic.ru/rus/all/met od/ocp (дата обращения 24.04.13).
– 2003 г. Url.: http://www.antibiotic.ru/rus/all/met od/ocp (дата обращения 24.04.13).
5. Бондаренко, В.М. Генетические детерминанты патогенности Escherichia coli, изолированных из мочи и фекалий детей с различными клиническими вариантами инфекции мочевой системы // Журн. микробиол. – 2004. – №4 – С. 3-7.
6. Глыбочко П.В., Хачатуров К.А., Липский В.С. и соавт. Анаэробные паразитоценозы мочевыводящих путей как фактор риска развития острого пиелонефрита // Урология. – 2006. – №2. – С. 50-54.
7. Максимов В.А., Борисик В.И., Яровой С.К. Острый гломерулонефрит, осложнившийся острым обструктивным пиелонефритом // Урология. – 2010. – №1. – С. 71-73.
8. Коган М.И., Пасечник Д.Г., Набока Ю.Л. и соавт. Могут ли неклостридиально-анаэробные бактерии вызывать острый пиелонефрит? (экспериментальное исследование) // Урология. – 2012. – №2. – С. 8-13.
9. Brook I. Urinary tract and genitourinary suppurative infections due to anaerobic bacteria // International Journal of Urology – 2004. – Vol.11, №3. – P. 133-141.
10. Giamarellos-Bourboulis E.J., Adamis T., Laoutaris G. et al. Immunomodulatory clarithromycin treatment of experimental sepsis and acute pyelonephritis caused by multidrug-resistant Pseudomonas aeruginosa. // Antimicrob Agents Chemother. – 2004. – Vol 48, №1. – P. 93-99.
11. Методики клинических лабораторных исследований. Справочное пособие / Под ред. В.В. Меньшикова. – М.: Лабора. – 2009. – 880 с.
12. Apostolopoulou C., Konstantoulaki S., Androulakakis P. et al. Isolation of anaerobic organisms from kidney in serious renal infections // Urology – 1982. – Vol. 20, №5. – P. 479-481.
13. Bartlett J.G., Gorbach S.L. Anaerobic bacteria in suppurative infections of the male genitourinary system // J. Urol. – 1981. – Vol. 125, №3. – P. 376-378.
14. Brook I. Urinary tract infection caused by anaerobic bacteria in children // Urology – 1980. – Vol. 16, №6 – P. 596-598.
15. DuPrey K.M., Leon McCrea, Rabinowitch B.L. et al. Pyelonephritis and Bacteremia from Lactobacillus delbrueckii // Case Rep Infect Dis. – 2012. – №10. – P. 1155-1158.
16. Kumazawa J., Kiyohara H., Momose S. Significance of anaerobic bacteria isolated from the urinary tract. II. Experimental studies // Invest Urol. – 1976. – Vol.13, №4. – P. 309-312.
17. Schulte T. L. Bacteroides and anaerobic streptococci in infection of the urinary tract // Proc. Mayo Clin. – 1939. – №14. – P. 536.
Анаэробные бактерии — обзор
Эпидемиология
Анаэробные бактерии — повсеместные представители нормальной флоры кожи и слизистых оболочек всех млекопитающих, 166,171,176 и основные роды, обнаруженные как нормальная флора лошадей, кажутся похожими на клинически значительные и нормальные анаэробы флоры человека и других млекопитающих. Может показаться несколько нелогичным, что облигатно-анаэробные бактерии в большом количестве обнаруживаются в местах, подверженных воздействию окружающего воздуха, таких как кожа или полость рта.Однако в дополнение к врожденной аэротолерантности, которой обладают некоторые облигатные анаэробы, в этих областях создается анаэробная микросреда за счет факультативно анаэробной бактериальной флоры (включая многие другие бактерии, знакомые врачам, такие как стафилококки, стрептококки, пастереллы, актинобациллы и т. и представители Enterobacteriaceae), потребляющие свободный кислород. 177 Анаэробы также являются частыми условно-патогенными микроорганизмами, вызывающими инфекции, когда эти бактерии получают доступ к анаэробным условиям в тканях, обычно возникающим в результате наличия некротической ткани и коинфекции с факультативно анаэробными бактериями.Хотя анаэробы могут вызывать инфекции сами по себе, в большинстве случаев анаэробные инфекции являются полимикробными, с множеством облигатно анаэробных бактерий, а также факультативно анаэробных бактерий.
Хотя большинство клинически значимых анаэробов можно найти на большинстве участков тела, определенные роды чаще встречаются на определенных участках. У людей роды, которые преимущественно колонизируют данное место, также с наибольшей вероятностью могут быть обнаружены при инфекциях, связанных с этими анатомическими областями, и обнаружение определенных родов в крови может предсказать часть тела, где возникает инфекция.Хотя эта связь не была хорошо продемонстрирована для лошадей, это, скорее всего, отражает отсутствие информации о нормальной анаэробной флоре лошадей и рутинном анаэробном культивировании крови, а не отсутствие такой корреляции.
Наиболее клинически значимыми инфекциями лошадей, вызываемыми облигатно анаэробными бактериями, являются пневмония и плевропневмония (см. Главу 1). Анаэробы, которые обнаруживаются из ротовой полости и дыхательных путей лошадей, включают Bacteroides, Clostridium, Eubacterium, Fusobacterium, Peptostreptococcus, и Veillonella, , а также ряд других неопознанных анаэробных грамположительных палочек и кокков. 169 178 179 В одной серии исследований от 37% до 68% инфекций нижних дыхательных путей были связаны с анаэробами, обычно Bacteroides ; От 68% до 81% были смешаны с факультативными анаэробами, такими как стрептококки, пастереллы, актинобациллы и энтеробактерии; и 85% имели несколько анаэробов. 173 174 180 181 Наиболее часто встречающиеся анаэробы в случаях респираторных заболеваний лошадей включают Bacteroides , Clostridium , Eubacterium , Fusobacterium , Peptostreptococcus и Veillonella . 169 173 174 179-186 Клиническое значение анаэробного компонента этих инфекций подтверждается исследованиями, которые показали, что присутствие анаэробов было связано со снижением выживаемости, 173 173 174 181 185 и лошади, получавшие метронидазол, показали улучшенные клинические ответы и показатели выживаемости. 174 183 Анаэробные бактерии, вызывающие респираторные инфекции лошадей, скорее всего, возникают в результате аспирации нормальной флоры полости рта, поскольку большинство респираторных анаэробных патогенов также обнаруживаются на поверхности глоточных миндалин. 169 Анаэробы также часто связаны с различными параротовыми инфекциями, включая подчелюстные абсцессы, нижнечелюстной остеомиелит, инфекцию носовых пазух и зубные абсцессы. Преобладающие анаэробы, участвующие в этих инфекциях, очень похожи на анаэробы, обнаруживаемые при респираторных инфекциях, и как нормальная флора поверхности глоточных миндалин, 169 , и они, вероятно, возникают в результате условно-патогенных инфекций нормальной флоры.
Анаэробы также являются обычной флорой репродуктивного тракта лошадей (см. Главу 8).У нормальных жеребцов 96% проб, взятых из уретры, уретральной ямки, смегмы и предэякуляционной жидкости, содержали Bacteroides , Clostridium , Fusobacterium , Peptococcus и Peptostreptococcus . У нормальных кобыл 100% мазков из клитора, 24% мазков с эндометрия и 40% мазков с эндометрия содержали Bacteroides , Clostridium , Fusobacterium , Peptococcus и Peptostreptococcus spp. 187 Анаэробы, включая Bacteroides , Clostridium , Fusobacterium и Peptostreptococcus spp., Также могут быть выделены из образцов матки от кобыл с цитологическими признаками острого эндометрита. Предположительно, анаэробы могут вносить вклад в патологию матки во время активной инфекции, но возможность культивирования анаэробов от клинически здоровых кобыл иллюстрирует сложность интерпретации значения анаэробных бактерий, выявленных в образцах слизистой оболочки.
Анаэробные бактерии также часто связаны с внутрибрюшными инфекциями, такими как абсцессы и холангиогепатит. 188-190 Роды анаэробных бактерий, связанных с этими инфекциями, аналогичны родам, обнаруживаемым как нормальная флора в толстой кишке лошади, и включают Bacteroides , Bifidobacterium , Clostridium , Eubacterium , Lactobacillus и Пептострептококк. 191-194 Различные другие оппортунистические инфекции, включая ортопедические, 177 молочные, кожные и мышечные инфекции, 195 могут быть связаны с анаэробами.Как правило, любая рана или стерильный участок, особенно если инфекция вызвана заражением бактериями с кожи или слизистых оболочек, потенциально могут включать анаэробные бактерии.
Цитозащитные металлоорганические каркасы для анаэробных бактерий
Значимость
Культивирование бактерий для производства нужных химикатов уже давно практикуется в истории человечества, и недавно было принято в качестве многообещающего подхода к устойчивой энергии, когда этот процесс управляется солнечным светом и питанием CO 2 как единственный источник углерода.К числу этих микробов, производящих химические вещества, относятся анаэробные бактерии, изначально чувствительные к O 2 и химически активным формам кислорода, которые неизбежно образуются на анодах. Здесь мы обеспечиваем цитопротекцию против такого окислительного стресса, оборачивая бактерии искусственным материалом, металлоорганическими каркасами (MOF), что значительно увеличивает продолжительность жизни анаэробов в присутствии O 2 и поддерживает непрерывное производство уксусной кислоты из CO 2. Ультратонкая природа слоя MOF позволяет воспроизводить клетки без потери этого цитопротекторного материала.
Abstract
Мы сообщаем о стратегии равномерного обертывания бактерий Morella thermoacetica монослоем металлоорганического каркаса (MOF) нанометровой толщины для цитозащиты при искусственном фотосинтезе. Каталитическая активность корпуса MOF по отношению к разложению активных форм кислорода (ROS) снижает гибель строго анаэробных бактерий в пять раз в присутствии 21% O 2 и позволяет бактериям, защищенным цитопротезом, непрерывно производить ацетат из CO 2 фиксация при окислительном стрессе.Высокая четкость границы раздела MOF-бактерии, включающая прямую связь между фосфатными единицами на поверхности клетки и кластерами циркония на монослое MOF, обеспечивает увеличение продолжительности жизни на протяжении всего воспроизводства. Динамический характер оборачивания MOF обеспечивает удлинение и разделение клеток, включая спонтанное покрытие поверхности вновь выросших клеток. Открытые металлические участки на кластерах циркония приводят к 600 раз более эффективному разложению АФК по сравнению с наночастицами диоксида циркония.
Анаэробные бактерии уже давно разводятся и используются для ферментации органических веществ в отсутствие O 2 для производства химических веществ с добавленной стоимостью (этанол, уксусная кислота, молочная кислота, ацетон и бутанол) (1).Недавняя работа по искусственному фотосинтезу использует преимущества автотропного метаболизма этих бактерий за счет использования CO 2 в качестве единственного источника углерода наряду с солнечной энергией для производства топлива и химикатов (2–7). Хотя эти исследования показывают многообещающие, выделение O 2 и активных форм кислорода (ROS) на аноде вместе с образованием топлива пагубно сказывается на метаболизме анаэробных бактерий. Устранение этой неотъемлемой уязвимости к окислительному стрессу расширит диапазон и условия для осуществления действительно продуктивного искусственного фотосинтеза.В этой статье мы показываем, что при обертывании сенсибилизированных полупроводниками анаэробных бактерий ( Moorella thermoacetica ) монослоем металлоорганического каркаса (MOF) CO 2 превращался в ацетат в два раза дольше, чем это наблюдалось без такого оберточная бумага. Мы обнаружили пятикратное снижение гибели завернутых бактерий при воздействии окружающей среды O 2 (21%), и что они также способны к размножению без потери MOF. Хорошо известно, что виды O 2 могут превращаться в H 2 O 2 на клеточной мембране (8).В нашей системе за этой конверсией O 2 -H 2 O 2 следует разложение H 2 O 2 на звеньях оксида циркония MOF. Эта последовательность реакций, опосредованная MOF, предотвращает образование и накопление ROS, которые, как известно, вредны для бактерий, и, следовательно, значительно продлевает время жизни в окислительной среде. Высокая четкость структуры монослоя MOF позволила нам подтвердить, что Zr 4+ MOF связан с фосфатными звеньями на клеточной стенке, и что динамический химический состав этой связи является ключом к наблюдаемому увеличению срока службы. бактерий, эффективности упаковки и возможности их размножения.
Известно, что бактерии могут быть покрыты полимерами, неорганическими наночастицами и MOF для повышения их жизнеспособности при радиационном, термическом и механическом воздействии (9⇓⇓⇓⇓⇓ – 15), но не для решения критической проблемы окислительный стресс при искусственном фотосинтезе. Эти покрытия страдают от сложной синтетической процедуры, которая дает либо плохое покрытие, либо жесткие оболочки толщиной в сотни нанометров, которые улавливают клетки в спящем состоянии. Таким образом, защита, обеспечиваемая этими материалами, носит временный характер, поскольку покрытие материала необходимо повторять каждый раз, когда вводится новая партия ячеек.Тот факт, что бактерии, о которых мы здесь сообщаем, были покрыты слоем MOF толщиной всего 1-2 нм, а связи на границе раздела бактерии и MOF являются динамическими, приводит к легкому размножению и поддерживает защиту от окислительного стресса. Стоит отметить, что избыток MOF в культуральной среде может охватывать поверхности вновь выросших клеток, передавая эту защиту поколениям анаэробов.
Результаты и обсуждение
В этом исследовании мы выбрали MOF [Zr 6 O 4 (OH) 4 (BTB) 2 (OH) 6 (H 2 O) 6 ; BTB = 1,3,5-бензолтрибензоат] (рис.1 A ) для упаковки клеток, поскольку составляющие кластеры циркония обладают низкой токсичностью и высокой стабильностью. Тот факт, что эти кластеры могут быть соединены линкерами BTB в самоподдерживающийся монослой (16), делает этот материал идеальным кандидатом. Для создания конструкции бактерии-MOF мы разработали стратегию путем добавления предварительно синтезированного монослоя MOF в культуральную среду бактерий (рис. 1 B ). Этот постсинтетический метод, в отличие от роста оболочек MOF на бактериях in situ (10), позволяет спонтанно оборачиваться вокруг вновь выросшей клеточной поверхности, чему способствует координационная связь между циркониевым кластером и тейхоевой кислотой на клеточной стенке (рис. .1 С ). Предполагается, что завершенная упаковка MOF будет служить цитопротекторным слоем из-за его каталитической активности по отношению к реакции разложения ROS (рис. 1 D ).
Рис. 1.
Разработка и синтез системы упаковки M. thermoacetica –MOF. ( A ) Монослой MOF состоит из 6-связанного кластера Zr 6 O 4 (OH) 4 (-CO 2 ) 6 кластера и тригонального линкера BTB. ( B ) Монослой MOF спонтанно оборачивается вокруг M.thermoacetica , позволяя удлинение и разделение клеток, во время которого вновь образованная клеточная поверхность оборачивается in situ избытком MOF в культуральной среде. ( C ) Молекулярная структура на границе раздела иллюстрирует образование многовалентных координационных связей между неорганическими кластерами MOF и фосфатными фрагментами тейхоевой кислоты на клеточной стенке. ( D ) Разложение АФК монослойным покрытием MOF на поверхности клетки. В модели заполнения пространства атомы клеточной стенки и АФК представлены в голубых и зеленых сферах соответственно.Атомы водорода на кластерах циркония для ясности опущены. Цветовой код: синий, Zr; красный, О; серый, C; белый, H; yellow, P.
Монослой MOF получали по известной методике (16). Просвечивающая электронная микроскопия (ПЭМ) подтверждает образование самонесущего монослоя MOF с поперечными размерами микрометров (рис. 2 A ). Ранняя стационарная стадия M. thermoacetica , культивированная в гетеротрофной среде, была центрифугирована и повторно диспергирована вместе с монослоями MOF в автотрофной культуральной среде.После легкого встряхивания в течение 1 ч происходило самопроизвольное обертывание. Морфология полученных систем обертывания, M. thermoacetica –MOF, была исследована с помощью ПЭМ (Рис. 2 B и SI Приложение , Рис. S1 A — E ), сканирующей просвечивающей электронной микроскопии (Рис. STEM) (Рис.2 C и SI Приложение , Рис. S1 F ) и сканирующая электронная микроскопия (SEM) (Рис.2 D и SI Приложение , Рис.S2), подтверждая, что бактерии были покрыты ультратонкими слоями, покрывающими и далее высовывающимися из всего тела клетки. Химический состав оберточной конструкции анализировали с использованием картирования энергодисперсионной рентгеновской спектроскопии (EDXS) (рис. 2 E — H ). Перекрывающаяся область распределения атомов между цирконием, углеродом, серой и фосфором указывает на присутствие MOF в теле клетки. Структурированная световая микроскопия была использована для оценки структуры гетерогенной системы упаковки.Для этого эксперимента мы пометили монослой MOF и бактерии флуоресцеином ( SI Приложение , рис. S3) и внутриклеточными нанокристаллами золота, испускающими зеленую и красную флуоресценцию соответственно. Восстановленные трехмерные изображения ( SI Приложение , рис. S4) демонстрируют структуру ядро-оболочка, дополнительно подтверждая, что бактерии были обернуты MOF.
Рис. 2.
Структурная характеристика M. thermoacetica –MOF. ( A ) ПЭМ-изображение монослоя MOF. ПЭМ-изображение ( B ), высокоугловое кольцевое темнопольное изображение STEM ( C ) и SEM-изображение ( D ) M.thermoacetica –MOF. Картирование EDS выбранной области, помеченной желтым квадратом в C , подтверждает присутствие углерода ( E ), серы ( F ), фосфора ( G ) и циркония ( H ) на краю M. thermoacetica –MOF. ( I ) PXRD-картина и положение Брэгга (красные линии) M. thermoacetica –MOF, MOF, пропитанный культуральной средой, MOF в момент синтеза и смоделированная структура. ( J ) FTIR-спектры M.thermoacetica , M. thermoacetica –MOF, M. thermoacetica –MOF, культивируемая в среде без фосфатов (-NP), модельное соединение ZrDMPO, MOF, пропитанное культуральной средой, и MOF в исходном состоянии. Пики на 839 и 832 см -1 отмечены пунктирными линиями голубого и пурпурного цветов соответственно. ( K ) P 2p-спектры, полученные XPS ZrDMPO (синий), M. thermoacetica –MOF-NP (оранжевый) и M. thermoacetica (зеленый).
Кристалличность MOF и М.thermoacetica –MOF исследовали методом порошковой рентгеновской дифракции (PXRD). Было обнаружено, что полученные PXRD-рентгенограммы MOF, пропитанного культуральной средой, и конечной конструкции обертывания M. thermoacetica -MOF хорошо согласуются с таковой для синтезированной основы (рис. 2 I ), подтверждая, что MOF оставался неповрежденным во время процесса упаковки ячеек. Присутствие MOF было дополнительно подтверждено инфракрасными спектрами с преобразованием Фурье (FTIR), где M. thermoacetica –MOF имеет ароматические C = C (1,407 см -1 ) и участки CH (856 и 777 см -1 ). ) компоновщика BTB ( SI Приложение , рис.S5). Массовый процент монослоя MOF в полученной оберточной конструкции был определен с помощью атомно-эмиссионной спектроскопии с индуктивно связанной плазмой (ICP-AES) и составил 6,0 ± 0,9%.
Спонтанному обертыванию монослоя MOF на бактерии способствуют координационные центры на кластерах циркония, где гидроксильные и водные лиганды могут быть легко заменены фосфатными группами (17) тейхоевой кислоты на поверхности клетки (18, 19). Чтобы клеточная поверхность была единственным фосфатсодержащим лигандом, β-глицерофосфат, питательный компонент, был исключен из культуральной среды во время процесса упаковки для оценки структуры.Спектры FTIR полученной системы упаковки ( M. thermoacetica –MOF-NP) показывают появление пика при 839 см -1 , который не принадлежит ни бактериям, ни только MOF (рис. 2 J ) . Для определения его химической природы был синтезирован и использован в качестве модельного соединения молекулярный аналог предложенного фрагмента M. thermoacetica –MOF — диметилфосфат циркония (ZrDMPO). Структура ZrDMPO была определена методом дифракции рентгеновских лучей на монокристаллах (SXRD) ( SI Приложение , рис.S6 и таблицы S1 и S2) и содержал два атома кислорода DMPO, координирующих бидентатно с соседними ионами циркония. Было обнаружено, что именно это связывание проявляет растяжение (Zr) -OP при 839 см -1 в FTIR-спектре (20), что согласуется с пиком, который возникает из пика M. thermoacetica -MOF-NP (рис. 2 J ). Координация β-глицерофосфата с циркониевым кластером происходит, когда MOF пропитывается культуральной средой и демонстрирует участок (Zr) -OP (832 см -1 ), который вносит вклад в широкий пик в том же положении в ИК-Фурье спектры M.thermoacetica –MOF. Этот результат указывает на присутствие как β-глицерофосфата, так и связывания клеточной поверхности с кластерами циркония, когда упаковка обрабатывается в полной культуральной среде, конкуренция между которыми может обеспечить динамическое обертывание, которое позволяет удлинить и разделить клеточную стенку. Наличие координационных связей между фосфатными фрагментами на поверхности клетки и кластерами циркония было подтверждено данными рентгеновской фотоэлектронной спектроскопии (XPS) (рис.2 K и SI Приложение , рис.S7). Спектр P 2p M. thermoacetica –MOF-NP демонстрирует сдвиг энергии связи от 132,8 до 133,1 эВ по сравнению с «голыми» бактериями, аналогичный спектру модельного соединения ZrDMPO с энергией связи P 2p 133,2 эВ.
Для анализа биосовместимости монослоя MOF был профилирован гетеротрофный рост M. thermoacetica , культивированных в анаэробных условиях, путем подсчета колониеобразующих единиц (КОЕ). M. thermoacetica -MOF показала кривую роста, совпадающую с кривой роста голых бактерий (рис.3 A ), который показывает, что упаковка MOF поддерживает жизнь клеток и их репродуктивную способность. Это открытие было подтверждено наблюдением, что монослой MOF позволяет транспортировать небольшие молекулы, необходимые для роста клеток ( SI Приложение , Рис. S8). Процесс размножения Escherichia. coli , обернутую монослоем MOF в микрофлюидной ячейке, записывали в режиме покадровой видеозаписи путем маркировки MOF зеленой флуоресценцией (фиг. 3 B и фильмы S1 и S2).Было отслежено движение корпуса MOF, и было обнаружено, что оно перемещается в соответствии с удлинением и разделением поверхности клетки и переносится бактериями следующих поколений. Когда в культуральной среде присутствуют избыточные монослои MOF, поверхность вновь выросших клеток может быть спонтанно покрыта. Таким образом, процесс обертывания in situ позволяет воспроизводить клетки и гарантирует сохранение цитопротекции в будущих поколениях.
Рис. 3. Монослойный корпус
MOF обеспечивает размножение бактерий и увеличивает их жизнеспособность в условиях окислительного стресса.( A ) Гетеротрофные кривые роста M. thermoacetica и M. thermoacetica –MOF в анаэробных условиях. ( B ) Снимки процесса деления E. coli –MOF, снятые в темном поле ( слева, ) и поле флуоресценции ( справа, ). (Масштаб: 1 мкм.) ( C ) Кривые распада клеточной популяции M. thermoacetica и M. thermoacetica –MOF на воздухе и голого M. thermoacetica в анаэробных условиях.Жизнеспособность M. thermoacetica и M. thermoacetica –MOF в средах, содержащих H 2 O 2 при концентрациях 1 мкМ ( D ), 5 мкМ ( E ) и 50 мкМ ( F ). Планки погрешностей представляют стандартное отклонение.
Классифицированные как строгие анаэробы, несколько ацетогенных бактерий, используемых в искусственном фотосинтезе, в том числе M. thermoacetica (6), как сообщается, переносят только низкие уровни O 2 (8, 21, 22). Чтобы исследовать цитопротекторный эффект оболочки MOF на анаэробы при окислительном стрессе, M.thermoacetica после достижения стационарной фазы подверглись воздействию O 2 . Было обнаружено, что M. thermoacetica , снабженная оболочкой MOF, культивированная в среде 21% O 2 , проявляет высокую жизнеспособность 76 ± 8% через 2 дня, что сопоставимо с коэффициентом выживаемости 83 ± 7%, культивированным в анаэробной среде. условиях (рис.3 C ). Напротив, популяция «голых» бактерий без этого искусственного усиления распадалась до 50 ± 7% при воздействии того же уровня O 2 , что соответствовало пятикратному увеличению смертности.Кроме того, защита оболочки MOF от H 2 O 2 , преобладающей АФК, была проанализирована путем введения H 2 O 2 в культуральную среду в концентрациях 1, 5 и 50 мкМ. Было обнаружено, что цитопротекторный MOF приводит к значительному повышению жизнеспособности M. thermoacetica в этих средах H 2 O 2 (фиг. 3 D — F ).
Защита от окислительного стресса монослоем MOF может происходить из его каталитической активности в отношении разложения ROS из-за структурного сходства между кластерами циркония и активными центрами диоксида циркония (23).Механистические исследования этого процесса проводили путем измерения концентрации H 2 O 2 в среде MOF, определенной по трииодидному методу Гормли (24, 25), в различные промежутки времени. Наблюдалось начальное быстрое уменьшение концентрации H 2 O 2 , что приписывается физической адсорбции H 2 O 2 на поверхности MOF (рис. 4 A ). Когда физическая адсорбция достигает своего равновесия, каталитическое разложение H 2 O 2 становится доминирующим, что показывает зависимость скорости первого порядка от H 2 O 2 , аналогичную тому, что наблюдается для диоксида циркония (26 ).Каталитическая активность монослоя MOF дополнительно количественно определяется константой скорости второго порядка как k 2 = 3,26 ± 0,04 × 10 −9 · м · с −1 (рис. 4 B ). , число, которое в 28 раз выше, чем у наночастиц диоксида циркония, если нормировано на количество атомов циркония на поверхности, и в 600 раз больше, если нормировано по массе ( Материалы и методы, ). Чтобы дополнительно продемонстрировать преимущество обертывания бактерий монослоем MOF, мы сравниваем эффекты цитозащиты против окислительного стресса монослоем MOF и наночастицами диоксида циркония.При добавлении такого же количества наночастиц диоксида циркония (масса на основе Zr) в питательную среду жизнеспособность M. thermoacetica оставалась такой же, и не наблюдалось эффекта цитопротекции ( SI Приложение , рис. S10). Такое сравнение дополнительно подчеркивает эффективные каталитические характеристики монослоя MOF и указывает на преимущество близости к активным каталитическим центрам в системе обертывания.
Рис. 4.
Механизм защиты от окислительного стресса с помощью корпуса MOF.Нормализованная концентрация H 2 O 2 как функция времени в реакции разложения при различных температурах ([MOF] = 45,08 мкг · мл -1 ) ( A ) и при различных концентрациях MOF (335 К) ( В ). Были определены энергия активации Аррениуса E a , частотный коэффициент A и константа скорости второго порядка k 2 ( Материалы и методы и SI Приложение , рис.S9). Планки погрешностей представляют стандартное отклонение.
Каталитические характеристики монослоя MOF имеют жизненно важное значение для повышения устойчивости анаэробов к окислительному стрессу. Когда анаэробы, такие как M. thermoacetica , подвергаются воздействию O 2 , H 2 O 2 может генерироваться NADH-оксидазой (8) на клеточной мембране и диффундировать в клетку. Как только количество H 2 O 2 превышает буферную способность глутатиона, он представляет угрозу для выживания клеток из-за его превращения в токсичный гидроксильный радикал в результате реакции Фентона.В нашей системе мы демонстрируем, что за преобразованием O 2 -H 2 O 2 следует разложение H 2 O 2 на звеньях оксида циркония MOF. Эта последовательность реакций, опосредованная MOF, предотвращает накопление ROS и, следовательно, значительно увеличивает время жизни в окислительной среде. Повышенная устойчивость M. thermoacetica к окислительному стрессу обещает облегчить всю реакцию фотосинтеза ацетата из CO 2 в сочетании с реакцией выделения кислорода.Чтобы продемонстрировать доказательство концепции, в нашу предыдущую фотосинтетическую биогибридную систему (PBS) (6) было введено 2% O 2 , чтобы имитировать атмосферу всей фотосинтетической реакции. Было обнаружено, что чистый PBS без цитопротекторной упаковки MOF может быть функциональным только для фиксации CO 2 в ацетат в течение первого дня ( SI, приложение , рис. S11). Короткое время жизни PBS обусловлено цитотоксичностью O 2 и АФК, образующихся при фотосинтезе. Напротив, упаковка MOF поддерживает фотосинтез PBS в течение 2.5 дней при тех же условиях, и увеличивает продуктивность ацетата до 200%.
Материалы и методы
Все исходные материалы и растворители, если не указано иное, были получены от Aldrich Chemical Co. и использовались без дополнительной очистки.
Синтез MOF монослоя Zr
6 O 4 (OH) 4 (BTB) 2 (OH) 6 (H 2 O) 6.
Синтетический протокол был модифицирован на основании опубликованной литературы (16).Полученную дисперсию MOF многократно промывали центрифугированием с использованием N, N -диметилформамида (ДМФ), а затем воды. Промытый монослой MOF в виде белого геля, находящегося на дне центрифужных пробирок, повторно диспергировали в 0,1 М HCl и нагревали при 90 ° C в течение ночи для удаления формиатных лигандов. Полученную суспензию фильтровали через мембранные фильтры из полиэфирсульфона (размер пор 0,2 мкм, STERLITECH) и промывали водой. Осадок на фильтре перед сушкой повторно диспергировали в воде и хранили для дальнейшего использования.Концентрацию полученной монослойной дисперсии MOF в воде определяли путем измерения УФ-видимой спектроскопии. Коэффициент поглощения при 280 нм составил 0,10 мг -1 · л · см -1 путем количественного определения количества циркония с использованием ICP-AES. Затем это значение было использовано для дальнейшего использования при количественной оценке этого материала.
Приготовление гетеротрофной среды.
Среду готовили в анаэробных условиях с деионизированной водой. Техника Hungate или анаэробная камера (Coy Laboratory Products, Inc.) использовался во всех операциях для предотвращения воздействия кислорода на анаэробные бактерии. Рецепт общего бульона такой же, как и раньше (6). Для приготовления гетеротрофной среды необходимо использовать 25 мл 1 М раствора глюкозы, 20 мл 5 мас.% Раствора Cys · HCl, 800 мг β-глицерофосфата · 2Na · xH 2 O, 500 мг дрожжевого экстракта (BD Biosciences), и 500 мг триптона (BD Biosciences) добавляли в 1 л общего бульона и перемешивали до полного растворения. Затем анаэробные среды распределяли в смешанной атмосфере (смесь N 2 : CO 2 в соотношении 80:20) в анаэробные культуральные пробирки типа Balch размером 16 × 125 мм (Chemglass Life Sciences) с бутилкаучуковыми пробками и завинчивающимися крышками. и 18 × 150-мм анаэробные культуральные пробирки типа Балча (Chemglass Life Sciences) с пробками из бутилкаучука и алюминиевыми обжимными уплотнениями.Затем среду перед использованием автоклавировали в течение 15 минут при 121 ° C.
Культивирование
M. thermoacetica .
Первоначальный посевной материал M. thermoacetica (Американская коллекция типовых культур, ATCC 39073) культивировали в гетеротрофной среде, а поздние логарифмические культуры криоконсервировали в морозильной камере -80 ° C с 10% диметилсульфоксидом в качестве криопротектора. Для приготовления культур M. thermoacetica 0,5 мл размороженного криоконсервированного исходного материала M. thermoacetica инокулировали в 10 мл анаэробной гетеротрофной среды и инкубировали при периодическом перемешивании при 52 ° C.В свободном пространстве каждой трубки повышалось давление до 150 кПа потоком смешанной атмосферы (смесь N 2 : CO 2 в соотношении 80:20). Через 2 дня роста (OD 600 = 0,16) культуру повторно инокулировали при 5 об.% В свежую гетеротрофную среду и инкубировали при 52 ° C. После других 2 дней роста (OD 600 = 0,38) бактерии центрифугировали при 860 × g в течение 10 минут, промывали и ресуспендировали в эквивалентном объеме гетеротрофной среды.
Однослойная упаковка MOF около
M.Ашхабад .
В культуру бактерий в гетеротрофной среде добавляли монослойную дисперсию MOF с конечной концентрацией 0,05 мг / мл. Пробирки возвращали в инкубатор при 52 ° C и помещали в мини-шейкер (VMR) со скоростью 100 об / мин на 1 час. час Полученная система обертывания непосредственно использовалась для тестирования жизнеспособности и фотосинтеза. Для структурной характеристики избыток MOF в среде удаляли центрифугированием при 140 × g в течение 30 мин. Супернатант собирали и центрифугирование повторяли три раза.Соли в полученном супернатанте удаляли дальнейшим центрифугированием при 2500 об / мин в течение 20 мин. Осадок собирали и центрифугирование повторяли трижды. Наконец, осадок повторно диспергировали в воде для определения структуры.
Флуоресцентная маркировка монослоя MOF.
Молекулы, содержащие карбоксилатные группы, могут связываться с монослоем MOF через координационную связь между карбоксилатными фрагментами и циркониевыми кластерами. С этой целью была синтезирована 2-FITC-бифенил-4,4′-дикарбоновая кислота (FITC-H 2 BPDC) согласно опубликованным данным (27).Для функционализации монослоя MOF с помощью FITC-H 2 BPDC, 20 мг FITC-H 2 BPDC добавляли в раствор MOF (5 мг) в DMF (5 мл). Смесь инкубировали при 85 ° C в течение 24 ч перед повторной промывкой центрифугированием в ДМФ и воде. Конечный монослой MOF, функционализированный FITC-BPDC, повторно диспергировали в воде для дальнейшего использования.
Синтез модельного соединения ZrDMPO.
Смесь ZrCl 4 (10 мг) и диметилфосфата (30 мг) в ДМФ (2 мл) инкубировали при 85 ° C в течение 2 дней, и были получены ромбоэдрические монокристаллы.Кристаллы промывали ДМФ и ацетоном перед сушкой в вакууме.
Структурные характеристики.
Образцы
ТЕМ были приготовлены путем капания суспензий на медные сетки с размером ячеек 400 меш с кружевной углеродной подложкой. Сетки сушили на воздухе в течение 1 сут. Получение изображений с помощью просвечивающего электронного микроскопа выполняли на анализирующем электронно-эмиссионном электронном микроскопе JEOL 2100-F на 200 кВ, оборудованном системой обнаружения рентгеновских лучей Oxford INCA EDS (Oxford Instruments) в Молекулярном литейном цехе Национальной лаборатории Лоуренса Беркли (Беркли, Калифорния).Электронно-микроскопические изображения с высокоугловым кольцевым сканированием в темном поле и элементарное рентгеновское отображение получали с помощью зонда с длиной волны 1 нм при 200 кВ. Образцы были наклонены на 10 ° к детектору рентгеновского излучения для оптимизации геометрии детектирования рентгеновского излучения. Время сбора было индивидуально оптимизировано для достижения наилучших результатов. Образцы SEM были приготовлены путем капания суспензии на кремниевую пластину и высушены на воздухе в течение 1 дня. СЭМ-изображения регистрировали на аналитическом СЭМ Zeiss Gemini Ultra-55 с ускоряющим напряжением 5 кВ.
Визуализация с трехмерной структурированной подсветкой со сверхвысоким разрешением выполнялась на приборе Zeiss ELYRA PS.1 система (Carl Zeiss). Изображения получали с помощью масляного иммерсионного объектива Plan-Apochromat 100 × / 1.40 и камеры Andor iXon 885 EMCCD. Использовали полупроводниковый лазер с оптической накачкой и 486 нм мощностью 10 мВт (Coherent Inc.) и эмиссионный фильтр BP 510/620 нм (Optics Balzers AG). Было получено 30 изображений с 86 нм сечением z для создания изображений со сверхвысоким разрешением. Необработанные изображения были реконструированы и обработаны для демонстрации структуры с большим разрешением с помощью программного обеспечения ZEN 2011 (Carl Zeiss), а программное обеспечение Imaris использовалось для анализа реконструированных изображений.
ICP-AES (Optima 7000 DV; Perkin-Elmer) использовали для определения количества Zr в материале. Образцы переваривали в растворе смеси азотной кислоты (0,5 мл) и плавиковой кислоты (0,1 мл). Полученный раствор фильтровали, затем разбавляли 2% водным раствором азота до 10 мл перед измерением. Все образцы для PXRD были высушены под вакуумом перед измерением. Диаграммы PXRD были записаны с использованием прибора Rigaku Miniflex 600 (геометрия Брэгга-Брентано, Cu Kα-излучение λ = 1,54056 Å).Спектры FTIR собирали на спектрометре Bruker ALPHA FTIR, оборудованном платиновым алмазным модулем ATR с единичным отражением с ослабленным полным отражением (НПВО) компании ALPHA, который может собирать ИК-спектры на чистых образцах. XPS был получен с использованием сверхвысоковакуумной системы PHI 5400 XPS с немонохроматическим источником рентгеновского излучения из алюминия (Kα = 1486,7 эВ), работающим при мощности 350 Вт. Обзорные XPS-спектры были получены при энергии прохода анализатора 178,5 эВ и шаге 1 эВ. Спектры высокого разрешения области P 2p были получены при энергии прохождения анализатора 35 эВ и 0.Шаг по энергии 05 эВ. Шкалу энергии связи скорректировали, установив пик C 1s (sp2) в 284 эВ ( SI Приложение , рис. S7). Подгонка пиков выполнялась с использованием программного обеспечения Casa XPS.
Для исследования SXRD бесцветный ромбоэдрический кристалл (0,200 мм) был установлен на дифрактометре Bruker D8 Venture, оснащенном тонкофокусной рентгеновской трубкой с мишенью из Мо, работающей при мощности 40 Вт (40 кВ, 1 мА) и PHOTON. 100 CMOS-детектор. Образец охлаждали до 100 К с помощью криосистемы Oxford, охлаждаемой жидким азотом.Для сбора данных использовался программный пакет Bruker APEX2; Для обработки данных использовался программный пакет SAINT; Для коррекции поглощения использовалась программа SADABS; поправки на вымирание или распад не делались. Структура расшифрована прямыми методами в ромбоэдрической пространственной группе R-3 с помощью пакета программ SHELXTL и дополнительно уточнена методом наименьших квадратов. Все неводородные атомы уточнены анизотропно; весь водород был образован геометрически. Подробности кристаллографических данных приведены в SI Приложение , таблицы S1 и S2.
Жизнеспособность клеток при окислительном стрессе.
Объемное количество клеток определяли путем ручного подсчета с помощью счетной камеры Петрова-Хаузера. Параллельно проводили анализ КОЕ путем отбора проб и инокуляции 0,1 мл суспензии M. thermoacetica и M. thermoacetica –MOF в 5 мл расплавленного (T> 50 ° C) агарового бульона с добавлением 40 мМ глюкозы и 0,1 мл. мас.% цистеина. В пробирках для анализа создавали давление 150 кПа со смесью 80:20 N 2 : CO 2 и инкубировали вертикально при 52 ° C.Через 3 дня роста подсчитывали видимые белые круглые колонии для определения КОЕ ( -1 мл) как меры числа клеток и их жизнеспособности.
Жизнеспособность M. thermoacetica и M. thermoacetica –MOF при различных концентрациях O 2 и H 2 O 2 была проверена после перехода гетеротрофного роста в стационарную фазу. Стерильный O 2 вводили шприцем в среду для культивирования бактерий до достижения объемной концентрации 21% в свободном пространстве.H 2 O 2 вводили в культуральную среду путем инъекции шприцем до тех пор, пока концентрации не достигли 1, 5 и 50 мкМ. Для контрольного эксперимента в культуральную среду добавляли дисперсию наночастиц диоксида циркония (размер частиц <100 нм; Aldrich) в такой концентрации, чтобы количество Zr было сравнимо с количеством MOF.
E. coli –MOF получали так же, как M. thermoacetica –MOF. Инвертированный флуоресцентный микроскоп Zeiss Z1 AxioObserver использовался для измерения культур живых клеток в течение продолжительных периодов времени.Он оснащен функцией захвата цифровых изображений при слабом освещении как в цветных, так и в оттенках серого. Система полностью автоматизирована и может быть запрограммирована на длительные эксперименты на живых клетках. 100 мкл E. coli –MOF добавляли в планшет CellASIC ONIX B04X, который контролируется системой CellASIC Onix Microfluidics для перекачивания небольших бактерий в основную культуральную камеру в определенные моменты времени. Общие фильмы в светлом поле и возбужденном поле флуоресценции собирали с помощью камеры Hamamatsu 9100–13 EMCCD каждые 4 мин при определенном фокусе Zeiss.
Кинетическое исследование H
2 O 2 Разложение, катализируемое монослоем MOF.
Кинетику реакции разложения H 2 O 2 измеряли, загружая 100-мл колбу с различным количеством монослоя MOF и воды Milli-Q до конечного объема 78,4 мл. резиновую перегородку и нагревали на водяной бане с заданной температурой при перемешивании со скоростью 750 об / мин. После того, как дисперсия MOF достигнет заданной температуры, 1.6 мл H 2 O 2 (1 мМ) мгновенно вводили в раствор и начинали отсчет времени. Через разные интервалы времени шприцем отбирали 2 мл реакционной смеси и фильтровали через политетрафторэтиленовую мембрану (размер пор 200 нм; Whatman). Концентрация H 2 O 2 в полученном растворе определялась методом трииодида Гормли (24, 25), в котором I — количественно окисляется H 2 O 2 до I 3 — .В частности, в раствор образца добавляли 100 мкл 1 M KI, 100 мкл смешанного раствора, содержащего 1 M ацетат натрия и 1 M уксусную кислоту, и доводили до конечного объема 2 мл. Раствор оставляли реагировать в течение 5 минут. перед измерением оптической плотности при 350 нм. Раствор, содержащий KI, ацетат натрия и уксусную кислоту той же концентрации, готовили параллельно в качестве холостого контроля для измерения фона. Молярный коэффициент экстинкции I 3 — при 350 нм был принят равным 25 500 M -1 · см -1 для расчета концентрации H 2 O 2 .
В литературе (23) сообщается, что каталитическое разложение H 2 O 2 на диоксиде циркония следует кинетике первого порядка по отношению к H 2 O 2 . Когда присутствует избыток диоксида циркония, кинетика реакции может быть приближена к псевдопервому порядку. Таким образом, концентрация H 2 O 2 как функция времени реакции следует ln ([h3O2] [h3O2] 0) = — k1t,
, где k 1 — псевдопервый порядок константа скорости, t — время реакции, [H 2 O 2 ] — концентрация H 2 O 2 во время реакции t , и [H 2 O 2 ] 0 — концентрация при t = 0.Было обнаружено, что после того, как адсорбция H 2 O 2 на поверхности MOF достигает равновесия, его концентрация как функция времени хорошо согласуется с этим кинетическим поведением первого порядка (рис. 4 A ). . Расчет наклона такой линейной зависимости дает k 1 при различных температурах ( SI Приложение , рис. S9 A ), что следует уравнению Аррениуса ln (k1) = — EaR 1T + ln (A),
где E a — энергия активации Аррениуса, R — газовая постоянная, A — частотный коэффициент, а T — абсолютная температура.Из этой зависимости константы скорости от температуры извлекаются E a как 66,50 ± 0,07 кДж моль −1 и A как 2,8 ± 0,1 × 10 6 с −1 . Изменяя количество MOF, используемого в качестве катализатора, константа скорости второго порядка k 2 была получена путем изучения константы скорости псевдопервого порядка как функции отношения площади поверхности к объему раствора MOF согласно k1 = k2 (SAV),
, где S A — площадь поверхности MOF, а V — объем реакционной смеси.Используя удельную поверхность MOF, S MOF , это уравнение может быть выражено ask1 = k2 (SMOF [MOF] V),
, где [MOF] обозначает концентрацию MOF. Взяв S MOF = 883 м 2 g −1 (16), k 2 получено из наклона SI Приложение , Рис. S9 B для реакции на 335 K равно k 2 = 3,26 ± 0,04 × 10 −9 · м · с −1 .Это значение представляет собой внутреннюю каталитическую активность MOF в реакции разложения H 2 O 2. Для сравнения каталитической активности между MOF и диоксидом циркония мы берем k 2 диоксида циркония при той же температуре, что и 9,66 × 10 −10 мс −1 из литературы (23). Далее мы вычисляем атомную плотность циркония монослоя MOF как 0,91 нм -2 и грани (001) монолитного диоксида циркония как 7,5 нм -2 в соответствии с их кристаллической структурой.Используя эти значения, k 2 монослоя MOF, нормированного на числа атомов циркония, получают как 3,6 × 10 −27 · м 3 · с −1 , что в 28 раз больше, чем у оксида циркония ( 1,3 × 10 −28 · м 3 · с −1 ). При нормировании по массе, по сравнению с наночастицей диоксида циркония с площадью поверхности 5 м 2 г -1 (23), k 2 монослоя MOF в 600 раз больше.
Фотосинтез.
M. thermoacetica -CdS получали, как описано ранее (6). Обычно 1 мМ Cd (NO 3 ) 2 добавляли к M. thermoacetica , когда OD 600 достигало 0,42. Через 3 дня роста непрозрачная желтая суспензия выявила образование M. thermoacetica -CdS. ЗФР, защищенный цитопротекцией MOF, получали таким же способом, как показано выше. Перед фотосинтезом в каждую пробирку добавляли 0,2 мас.% Цистеина. Стерилизованный O 2 вводили в каждую пробирку до 2% (об. / Об.), Чтобы имитировать состояние окислительного стресса во всей реакции.Каждую пробирку перемешивали со скоростью 150 об / мин и нагревали до измеренной температуры 55 ° C с помощью перемешивающей горячей плиты. Источником освещения, используемым для измерений моделированного солнечного света, была коллимированная ксеноновая лампа мощностью 75 Вт (Newport, Corp.) с фильтром AM 1,5 G. Все интенсивности света калибровались кремниевым фотодиодом (Hamamatsu S1787-04). Концентрации продуктов фотосинтеза измеряли с помощью 1 H-qNMR с 3- (триметилсилил) -2,2 ‘, 3,3’-тетрадейтеропропионатом (TMSP-d 4 ; Cambridge Isotope Laboratories, Inc.) в качестве внутреннего стандарта в D 2 O. Спектры обрабатывали с использованием программного обеспечения MestReNova.
Статистический анализ.
Все данные выражены как среднее ± стандартное отклонение. Каждый эксперимент повторяли не менее трех раз.
Благодарности
Мы благодарим J. Baek и B. Rungtaweevoranit (OMY group) за получение данных XPS и изображений SEM, C. Zhao (OMY group) за помощь в механистических исследованиях разложения H 2 O 2 по MOF, CSДирксу (группа O.M.Y.) за обсуждения и К. Чену (группа P.Y.) за культивирование и подсчет клеток. SEM, XPS и STEM измерения были выполнены в Molecular Foundry Национальной лаборатории Лоуренса Беркли. Это исследование было поддержано BASF SE (Людвигсхафен, Германия) для синтеза и характеристики MOF, King Abdulaziz City for Science and Technology (Центр передового опыта в области наноматериалов и приложений чистой энергии) для механистических исследований и NASA, Центр использования биологической инженерии в космосе, получившей награду NNX17AJ31G за исследования бактерий.H.Z. признает стипендию промышленного парка Сучжоу.
Сноски
Вклад авторов: Z.J., H.Z., O.M.Y. и P.Y. спланированное исследование; З.Дж., Х.З. и Х.Л. проводили исследования; Z.J., H.Z. и H.L. предоставили новые реагенты / аналитические инструменты; Z.J., H.Z., O.M.Y. и P.Y. проанализированные данные; и Z.J., H.Z., O.M.Y. и P.Y. написал газету.
Рецензенты: J.C., Университет Йонсей; и W.R.D., Северо-Западный университет.
Заявление о конфликте интересов: О.M.Y и Уильям Р. Дихтель были частью одной команды MURI до 2017 года; они не работали вместе и не публиковались совместно.
Размещение данных: координаты атомов и структурные факторы депонированы в Кембриджской базе структурных данных, https://www.ccdc.cam.ac.uk/ (инвентарный номер CCDC 1863035).
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/lookup/suppl/doi:10.1073/pnas.1808829115/-/DCSupplemental.
- Авторские права © 2018 Автор (ы).Опубликовано PNAS.
Проект по очистке сточных вод использует анаэробные бактерии для экономии энергии
Преимущества для последующей переработки
Попадая на завод, сточные воды проходят через бункер анаэробных бактерий, которые медленно переваривают отходы. Затем вода проталкивается через ультрафильтрационную мембрану для уничтожения бактерий и становится достаточно чистой для орошения ландшафтов и некоторых промышленных применений. С помощью передовых систем очистки, подаренных водным округом долины Санта-Клара и другими, группа также изучит пригодность воды для дальнейшей обработки перед повторным использованием в качестве питьевой.
Помимо энергоэффективности, система анаэробной очистки требует меньше места, чем традиционные очистные сооружения, которые требуют огромных резервуаров и более сложных систем фильтрации. Анаэробная установка промышленного масштаба может быть на 40 процентов меньше, чем обычная установка, и производить как минимум на 30 процентов меньше твердых отходов — побочного продукта, который в настоящее время необходимо дополнительно обрабатывать и вывозить на грузовиках, что приводит к дополнительным расходам и выбросам парниковых газов.
По оценкам исследователей, полномасштабная анаэробная установка, способная работать с 15 миллионами галлонов в день, может сэкономить до 3000 долларов в день на потреблении энергии — 1 миллион долларов в год — по сравнению с сопоставимой аэробной установкой.С учетом другой экономии за счет более эффективного процесса, исследователи оценивают потенциальную экономию более 2 миллионов долларов в год.
Взгляд в будущее
Помимо экономии места и денег, исследователи из Стэнфорда заявили, что их анаэробный процесс имеет еще одно преимущество: способность переваривать фармацевтические препараты и мощные бытовые и промышленные гербициды, которые сложно усвоить стандартным аэробным бактериям. переваривать.
Вот почему Маккарти считает будущее за выносливыми анаэробами.«Они адаптировались к самым суровым условиям на Земле», — сказал он. «Они могут съесть почти все».
Демонстрационный проект в Редвуд Шорс в настоящее время намечен на работу до марта 2021 года. Будет ли проект продолжаться и расширяться, будет частично зависеть от того, насколько хорошо эти изрыгающие метан микробы оправдают ожидания Маккарти.
«Мы считаем, что эта прототипная система может принести пользу плательщикам электроэнергии, предлагая устойчивый подход к очистке сточных вод при успешной демонстрации», — сказал Дэвид Уэйтман из Калифорнийской энергетической комиссии, которая финансировала этот проект.
Между тем исследователи смотрят далеко вперед.
«Мы предлагаем изменить технологию, которая не менялась более ста лет», — сказал Хансен.
Крейг Криддл также является старшим научным сотрудником Стэнфорд-Вудского института окружающей среды , членом Stanford Bio-X и филиалом Precourt Institute for Energy .
Анаэробные бактерии
Изображения: Ссылки по теме на внешние сайты (из Bing)
Онтология:
Бактерии, Анаэробные
(C0004613)
| Определение (CSP) | см. RT для конкретных организмов. |
| Концепции | Бактерия ( T007 ) |
| MSH | D001421 |
| SnomedCT | 59343002 |
| Английский | Анаэробные бактерии, бактерии, анаэробные, анаэробные бактерии, анаэробные бактерии, анаэробы, анаэробные бактерии, анаэробные бактерии, анаэробы, анаэробы, анаэробные бактерии, анаэробные бактерии, анаэробные бактерии (организм) |
| Французский | Bactéries anaérobies |
| Шведский | Бактериер, анаэроба |
| Чешский | baktérie anaerobní |
| финский | Анаэробисет бактеэрит |
| Русский | АНАЭРОБНЫЕ БАКТЕРИИ, БАКТЕРИИ АНАЭРОБНЫЕ, АНАЭРОБНЫЕ БАКТЕРИИ, БАКТЕРИИ АНАЭРОБНЫЕ |
| Хорватский | БАКТЕРИЖЕ, АНАЭРОБНЕ |
| Польский | Bakterie beztlenowe, Beztlenowce, Anaeroby |
| Японский | 嫌 気 性 細菌, 嫌 気 性 菌, 細菌 — 嫌 気 性 |
| Норвежский | Анаэробный бактерьер |
| Испанский | бактерии анаэробные (Organismo), бактерии анаэробные, бактерии анаэробные (Organismo), бактерии анаэробные, Bacterias Anaerobias |
| Немецкий | Anaerobe Bakterien, Anaerobier, Bakterien, анаэроб |
| Итальянский | Баттери анаэроби |
| Голландский | Anaërobe bacteriën, Bacterie, anaërobe, Bacteriën, anaërobe |
| Португальский | Бактериас Анаэробиас |
Культура анаэробных бактерий | Энциклопедия.com
Определение
Культура анаэробных бактерий — это метод, используемый для выращивания анаэробов из клинических образцов. Облигатные анаэробы — это бактерии, которые могут жить только при отсутствии кислорода. Облигатные анаэробы уничтожаются при контакте с атмосферой всего за 10 минут. Некоторые анаэробы толерантны к небольшому количеству кислорода. Факультативные анаэробы — это те организмы, которые могут расти с кислородом или без него. Методы получения образцов для анаэробной культуры и процедуры культивирования выполняются для обеспечения защиты организмов от кислорода.
Назначение
Анаэробные бактериальные культуры выполняются для идентификации бактерий, которые растут только в отсутствие кислорода и могут вызвать инфекцию у человека. Если не заметить или убить под воздействием кислорода, анаэробные инфекции приводят к серьезным последствиям, таким как ампутация, органная недостаточность, сепсис, менингит , и смерть. Посев необходим для правильного определения анаэробных патогенов и начала эффективного лечения антибиотиками.
Меры предосторожности
Очень важно, чтобы поставщик медицинских услуг получил образец для посева с помощью асептического метода . Анаэробы обычно обнаруживаются на слизистых оболочках и других участках, таких как влагалище и полость рта. Поэтому образцы, которые могут быть заражены этими организмами, не следует отправлять на посев (например, мазок из горла или влагалища). Некоторые типы образцов всегда следует культивировать на анаэробы при подозрении на инфекцию. К ним относятся абсцессы, укусы, кровь, спинномозговая жидкость и экссудативные жидкости организма, глубокие раны , и некротические ткани. Образец должен быть защищен от кислорода во время сбора и транспортировки и должен быть немедленно доставлен в лабораторию.Член медицинской бригады, выполняющий сбор, должен соблюдать универсальные меры предосторожности для предотвращения передачи патогенов, передающихся с кровью.
Описание
Анаэробы обычно встречаются в определенных областях тела, но приводят к серьезным инфекциям, когда у них есть доступ к обычно стерильной биологической жидкости или глубоким тканям, которые плохо насыщены кислородом. Некоторые анаэробы обычно обитают в щелях кожи, в носу, рту, горле, кишечнике и влагалище.Повреждение этих тканей (т.е. порезы, колотые раны или травмы), особенно на слизистых оболочках или рядом с ними, позволяет анаэробам проникать в стерильные участки тела и является основной причиной анаэробной инфекции. Второй источник анаэробной инфекции возникает из-за попадания спор в обычно стерильное место. Анаэробы, продуцирующие споры, живут в почве и воде, и споры могут попадать через раны, особенно через проколы. Анаэробные инфекции чаще всего встречаются у лиц с ослабленным иммунитетом, у тех, кто недавно лечился антибиотиками широкого спектра действия , и у лиц с некротическими, обесцвеченными повреждениями на слизистой оболочке или рядом с ней, особенно если это место имеет неприятный запах.
Некоторые образцы, из которых, вероятно, будут изолированы анаэробы:
- кровь
- желчь
- костный мозг
- спинномозговая жидкость
- прямой аспират легкого
- биопсия ткани из обычно стерильного места
- стерильная жидкость участок (например, сустав)
- абсцесс зуба
- абсцесс брюшной полости или таза
- ножевое, огнестрельное или хирургическое ранение
- тяжелый ожог
Некоторые из образцов, которые не подходят для анаэробных культур, включают:
- кашля выделения (мокрота)
- ректальный мазок
- мазок из носа или горла
- уретральный мазок
- выделение мочи
сбор образцов
Ключом к эффективным культурам анаэробных бактерий является сбор образцов без контаминации и их защита от воздействия кислорода.Культуры анаэробных бактерий должны быть получены из подходящего места, чтобы медицинский работник не загрязнял образец бактериями из прилегающей кожи, слизистой оболочки или ткани. При сборе образцов для анаэробной культуры следует избегать мазков, поскольку хлопковые волокна могут быть вредными для анаэробов. Абсцессы или жидкости можно аспирировать с помощью стерильного шприца, который затем плотно закрывают для предотвращения попадания воздуха. Образцы ткани следует поместить в дегазированный мешок и запечатать или во флакон с завинчивающейся крышкой, который может содержать бескислородную предварительно восстановленную культуральную среду, и плотно закрыть.Образцы следует как можно быстрее поместить в культуральную среду, которая была приготовлена как предварительно восстановленная анаэробно стерилизованная среда (PRAS). В качестве альтернативы можно использовать среду, которая содержит восстановитель, такой как дитиотреитол или хлорид палладия, и хранилась в течение одного дня в анаэробной камере.
Культура
Бульон и твердая среда должны быть засеяны. Культуральная среда должна включать чашки с анаэробным кровяным агаром, обогащенным такими веществами, как инфузия мозг-сердце, дрожжевой экстракт, аминокислоты и витамин К ; селективная среда, такая как агар с канамицин-ванкомицином (KV) с кровяным агаром или лакированный кровяной агар; и бульон, такой как инфузионный бульон brain heart с тиогликолятом или другим восстанавливающим агентом.Выбор среды зависит от типа образца. Некоторые обычно используемые среды включают предварительно восстановленный бульон пептон-дрожжевой экстракт-глюкоза, который подходит для анализа летучих продуктов с помощью газовой хроматографии; агар с яичным желтком для определения активности лецитиназы Clostridium spp .; циклосерин-цефокситин-фруктозный агар (CCFA) для выделения Clostridium difficile из стула; и желчный эскулиновый агар с Bacteroides для выделения группы Bacteroides fragilis .
Культуры следует поместить в среду, свободную от кислорода, при температуре 95 ° F (35 ° C) как минимум на 48 часов, прежде чем чашки будут проверены на рост. Кроме того, чашки с кровяным агаром следует культивировать как в аэробных условиях, так и в 10% диоксиде углерода. Сравнение этих культур с анаэробными культурами необходимо для определения устойчивости организмов к кислороду. Анаэробный перчаточный ящик из акрила или пластика с запечатанными проймами и прикрепленными перчатками является наиболее часто используемой средой для анаэробного посева.Внутри перчаточного ящика или капота подается смесь из 10% водорода, 10% углекислого газа и 80% азота из сжатых газов. Инокуляцию и перенос можно производить в перчаточном ящике без риска воздействия кислорода. Альтернативой анаэробной камере является сосуд, такой как система GasPak. При использовании сосудов необходимо несколько сосудов для хранения незасеянной среды и планшетов с субкультурами (т.е. чашек, содержащих колонию, перенесенную из первичного изолята). В системе GasPak используется одноразовый конверт, содержащий лимонную кислоту, бикарбонат натрия, хлорид кобальта и боргидрид натрия.Когда добавляется вода, они реагируют с образованием газообразного водорода. Катализатор, палладий, расположенный в крышке, превращает водород и кислород в сосуде в воду. Силикагель или бумажные полотенца используются для впитывания воды, а индикаторная полоска метиленового синего используется для обозначения анаэробных условий. Метиленовый синий окисляется, когда в атмосфере содержится кислород, вызывая образование синего цвета.
Окрашивание по Граму выполняется на образце во время культивирования. Хотя инфекции могут быть вызваны аэробными или анаэробными бактериями или их смесью, некоторые инфекции с высокой вероятностью могут быть вызваны анаэробными бактериями.К этим инфекциям относятся абсцессы головного мозга, абсцессы легких, аспирационная пневмония , пневмония и стоматологические инфекции. Часто можно подозревать анаэробные организмы, потому что многие анаэробы имеют характерную микроскопическую морфологию (внешний вид). Например, Bacteroides spp. грамотрицательные палочки, плеоморфные (различающиеся по размеру и форме) и демонстрирующие нерегулярное биполярное окрашивание. Fusobacterium spp. часто представляют собой бледные грамотрицательные веретенообразные стержни с заостренными концами. Clostridium spp.представляют собой крупные грамположительные палочки, образующие споры. Расположение спор (центральная, субтерминальная, конечная или отсутствующая) является полезным отличительным признаком. Наличие роста, толерантности к кислороду и окрашивания по Граму достаточно для постановки диагноза анаэробной инфекции и начала лечения антибиотиками препаратом, подходящим для большинства анаэробов, таким как клиндамицин или ванкомицин.
Грамотрицательные анаэробы и некоторые из вызываемых ими инфекций включают следующие роды:
- Bacteroides (анаэробы, наиболее часто встречающиеся в культурах; внутрибрюшные инфекции, абсцессы прямой кишки, инфекции мягких тканей, инфекция печени )
- Fusobacterium (абсцессы, раневые инфекции, легочные и внутричерепные инфекции)
- Porphyromonas (аспирационная пневмония, пародонтит)
- Prevotella (внутрибрюшные инфекции, инфекции мягких тканей) следующие:
- Actinomyces (инфекции головы, шеи, тазовых органов; аспирационная пневмония)
- Bifidobacterium (инфекции уха, инфекции брюшной полости)
- Clostridium (гангрена, вызванная газом , пищевое отравление, синегнойная палочка, )
- Пептострептококк (или l, респираторные и внутрибрюшные инфекции)
- Propionibacterium (шунтирующие инфекции)
Изолированные организмы всегда субкультивируются, а чистая культура тестируется для идентификации микроорганизма.Идентификация анаэробов очень сложна, и лаборатории могут использовать разные системы идентификации. Частичная идентификация часто является целью. Например, существует шесть видов рода Bacteroides , которые можно идентифицировать как группу Bacteroides fragilis , а не идентифицировать по отдельности. Организмы идентифицируются по их колониальной и микроскопической морфологии, росту на селективных средах, устойчивости к кислороду и биохимическим характеристикам. К ним относятся ферментация сахара, растворимость желчи, гидролиз эскулина, крахмала и желатина, расщепление казеина и желатина, выработка каталазы, липазы, лецитиназы и индола, восстановление нитратов, летучие жирные кислоты, как определено газовой хроматографией, и чувствительность к антибиотикам.Профиль чувствительности к антибиотикам определяется методом разведения микропробирки. Многие виды анаэробов устойчивы к пенициллину, а некоторые — к клиндамицину и другим широко используемым антибиотикам.
Preparation
Лечащий врач должен проявлять особую осторожность при сборе образцов, свободных от контаминации. Все процедуры должны выполняться в асептических условиях. Медицинский работник, собирающий образец, должен быть готов взять два образца: один для анаэробной культуры, а другой — для аэробной, поскольку неизвестно, может ли патоген расти с кислородом или без него.Кроме того, медицинские работники должны документировать любые антибиотики, которые пациент принимает в настоящее время, и любые медицинские условия, которые могут повлиять на рост бактерий.
Последующий уход
В случае венепункции для анаэробных посевов крови следует оказывать прямое давление на место венепункции в течение нескольких минут или до тех пор, пока кровотечение не остановится. При необходимости можно наложить лейкопластырь. При появлении отека или синяка на место можно приложить лед. Для сбора образцов, отличных от крови, пациента и место сбора следует контролировать на предмет любых осложнений после аспирации, биопсии и т. Д.
Осложнения
Медицинская бригада должна проявлять особую осторожность при получении, транспортировке и подготовке образца для анаэробного посева. Плохая методология может задержать идентификацию бактерии, может привести к ухудшению состояния пациента и может потребовать от пациента предоставить больше образцов, чем потребовалось бы в противном случае. Пациенты могут испытывать синяки, дискомфорт или припухлость в месте сбора при взятии ткани, крови или других жидкостей.
Результаты
Отрицательные результаты не покажут патогенного роста в образце.Положительные результаты покажут рост, идентификацию каждой конкретной бактерии и ее профиль чувствительности к антибиотикам.
Роли медицинских бригад
Врач назначает посев, а врач, медсестра или фельдшер обычно собирают образец. Член медицинской бригады транспортирует образец в лабораторию. Решение о проведении анаэробного посева определяется типом образца, отправленного в лабораторию. Ученый-клинический лаборант / медицинский технолог выполняет посев и окраску по Граму.Врач получает отчет о посеве и при необходимости выбирает соответствующий антибиотик.
Обучение пациентов
Член медицинской бригады должен объяснить пациенту процедуру сбора образцов. Если пациент серьезно болен, член команды должен объяснить процедуру членам семьи пациента. Пациент и его семья должны понимать, что, поскольку бактериям нужно время, чтобы расти в лаборатории, для идентификации бактерий может потребоваться несколько дней.
КЛЮЧЕВЫЕ УСЛОВИЯ
Аэробные бактерии — Бактерии, которые могут свободно расти в богатой кислородом среде.
Асептический — Без живых болезнетворных организмов; стерильно и без примесей.
Патоген — Организм, способный вызывать заболевание.
Сепсис— Системная воспалительная реакция, вызванная инфекционным организмом, циркулирующим по всему телу. Сепсис может прогрессировать до тяжелого сепсиса и септического шока, когда артериальное давление падает (гипотония), кровоснабжение тканей снижается, а органы перестают работать.
Венепункция — Пункция вены иглой с целью взятия пробы крови для анализа.
Ресурсы
КНИГИ
Анель, Рамон Л. и Р. Филип Деллинджер. «Сепсис и бактериемия». В Терапия Конна 2001 . под редакцией Роберта Э. Ракеля и Эдварда Т. Бопе. Филадельфия: W.B. Saunders Company, 2001, стр. 56-62.
Фишбах, Фрэнсис. «Культуры крови». В Пособие по лабораторным и диагностическим исследованиям .6-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс, 2000, стр. 542-545.
Forbes, Бетти А., Дэниел Ф. Сам и Элис С. Вайсфельд. «Анаэробная бактериология». В Диагностическая микробиология Бейли и Скотта . 10-е изд. Сент-Луис: Мосби, 1998, стр. 687-713.
ПЕРИОДИЧЕСКИЕ ИЗДАНИЯ
Брук, Ицхак. «Анаэробные инфекции у детей». Достижения в педиатрии 47 (2000): стр. 395-437.
ОРГАНИЗАЦИИ
Американское общество микробиологов.1752 N St. N.W., Вашингтон, округ Колумбия, 20036. (202) 737-3600. 〈Http://www.asmusa.org〉.
Национальный центр инфекционных заболеваний, Центры по контролю и профилактике заболеваний. 1600 Clifton Road NE, Атланта, Джорджия 30333. (800) 311-3435. 〈Http://www.cdc.gov〉.
Некоторые анаэробные бактерии связаны с повышенным риском CRC
Определенные виды анаэробных бактерий были связаны с резким увеличением заболеваемости колоректальным раком (CRC), часто в течение года после заражения, хотя, по словам датских исследователей, еще предстоит определить, являются ли бактерии причиной.
«Мы не уверены, что все бактерии непосредственно участвуют в развитии CRC — они могли быть просто невинными свидетелями, вторгшимися в кровоток, когда рак [сам] вызвал разрыв в стенке кишечника», — ведущий автор Ульрик Юстесен, доктор медицинских наук. Университетская больница Оденсе, Дания, сообщила Medscape Medical News по электронной почте.
«Но алгоритм колоноскопии, основанный на [заражающих] видах, который затем может быть дополнен конкретными характеристиками [бактерий] наряду с возрастом, безусловно, является реалистичной перспективой», — добавил он.
Исследование должно было быть представлено на Европейском конгрессе клинической микробиологии и инфекционных заболеваний (ECCMID) в Париже, Франция, но конференция была отменена из-за COVID-19.
Другое исследование, предполагающее связь между бактериями и CRC, было опубликовано ранее в этом году в журнале Nature, , как сообщалось в то время в журнале Medscape Medical News . Это исследование, проведенное в Нидерландах, предполагает, что штамм Escherichia coli может участвовать в развитии CRC.
Популяционное исследование
Последнее исследование, проведенное в Дании, представляло собой популяционное исследование с участием более 2 миллионов человек.
Из этой большой когорты были проанализированы данные о культуре крови за 2007 и 2016 годы.
«Мы объединили данные посевов крови с национальным регистром колоректального рака — Датской базой данных группы колоректального рака — и определили инцидент CRC после бактериемии», — заявляют исследователи.
Риск возникновения CRC был исследован специально для анаэробных бактерий Bacteroides spp, Clostridium spp, и Fusobacterium spp.
Затем частота случаев
сравнивалась с таковой от нонанаэробных бактерий, включая группу Streptococcus bovis , Escherichia coli и Staphylococcus aureus, , а также с отрицательными образцами крови.
«Мы включили 45760 эпизодов бактериемии, из которых 492 или 1.У 1% был диагностирован CRC после бактериемии; 241 — 0,5% — в течение 1 года », — сообщают исследователи.
Риск CRC был заметно увеличен в связи с большинством анаэробных видов по сравнению с отрицательными культурами крови и с культурами E coli и S aureus , для которых риск был аналогичен риску отрицательных культур крови.
Например, инфицирование C septicum было связано с повышенным в 42 раза риском CRC в течение 1 года после инфицирования и в 21 раз большим риском в целом без ограничения по времени.
Инфекция B ovatus была связана с 13-кратным увеличением риска CRC в течение 1 года и в 6 раз более высоким риском в целом без ограничения по времени.
Таблица. Эпизоды бактериемии, за которыми следует CRC
Бактерии Без ограничения по времени В течение 1 года Bacteroides spp (кроме B pyogenes ) 2.3% 2,1% B fragilis 1,9% 1,9% B ovatus 6,7% 6,7% Clostridium spp 4,8% 4,4% C perfringens 1,8% 1.8% С септик 22,6% 20,8% Fusobacterium spp (за исключением F necrophorum ) 6,0% 3,0% Streptococcus bovis группа 5,1% 4,3% Отрицательный посев крови 1.1% 0,5% Justesen отметил, что их группа теперь сосредоточится на конкретных бактериях от больных раком, чтобы определить характеристики бактерий, которые могут быть вовлечены в развитие рака.
«Если это так, это может иметь большое значение, когда дело доходит до скрининга и лечения CRC», — сказал он в заявлении.
Например, если было доказательство того, что пациент был инфицирован C septicum, анаэробным видом, ассоциированным с наивысшим риском CRC в течение 1 года после заражения, «мы немедленно проинформируем лечащего врача об этом риске и [пациент] должен быть исследован дополнительно », — сказал он Medscape Medical News .
Justesen также отметил, что если есть доказательства того, что пациент был инфицирован какой-либо из этих бактерий высокого риска, и пациент был пожилым, «тогда определенно стоило бы проверить пациента на CRC», — сказал он. Тем не менее, необходимы дополнительные исследования, прежде чем можно будет дать конкретные рекомендации по скринингу CRC в контексте любой анаэробной инфекции, подчеркнул он.
Justesen не раскрыл никаких финансовых отношений.
Европейский конгресс клинической микробиологии и инфекционных заболеваний (ECCMID).Абстракция 7.
Следите за новостями Medscape Oncology в Твиттере: @MedscapeOnc.
Анаэробное культивирование | Продвинутые инструменты
Анаэробные бактерии являются частой причиной инфекции и не будут учитываться при клинической диагностике, если не будут приняты особые меры предосторожности для их изоляции и культивирования. При анаэробном культивировании микробиологи сталкиваются не только с проблемой получения хорошего образца, но и с тем, чтобы он не контактировал с воздухом 3 .
Анаэробные и микроаэрофильные бактерии также могут быть полезны для человека. Эти бактерии используются в промышленности в качестве «варочных котлов» для очистки разливов нефти, при образовании метана при утилизации отходов и фактически могут быть виновниками порчи пива.
Выращивание микроорганизмов в атмосфере с низким содержанием кислорода может происходить в CO2-инкубаторе или анаэробном перчаточном шкафу. Эти традиционные методы имеют множество недостатков, таких как позднее обнаружение утечек, медленный анаэробиаз или химические отходы.Массивные, занимающие пространство камеры с фиксированными средами потребляют огромное количество газа, а их обслуживание является дорогостоящим и неудобным. Кроме того, они часто неспособны одновременно культивировать микроаэрофильные и анаэробные организмы.
В качестве альтернативы для анаэробной инкубации чашки с агаром можно поместить в герметичный сосуд, сделанный анаэробным путем откачивания и замены атмосферы бескислородной газовой смесью. Advanced ™ Anoxomat ® — это управляемая микропроцессором система вакуумирования-замены для удаления насыщенных кислородом сред из сосудов.Anoxomat заменит насыщенную кислородом среду анаэробной, микроаэрофильной или запрограммированной газовой смесью.
Anoxomat использует широко известную систему эвакуации и замены McIntosh and Fildes для создания анэробной среды. Во время цикла анаэробной откачки кислород в сосуде заменяется водородом. После анаэробного цикла в сосуде остается всего 0,16% остаточного кислорода, который затем удаляется палладиевым катализатором. Анаэробный рецепт оставляет банку со строгим нулевым уровнем кислорода и 10% смесью углекислого газа.
Этот метод является наиболее эффективным способом создания точных воспроизводимых условий, поскольку он быстро удаляет насыщенную кислородом среду из сосуда и заменяет ее точными количествами анаэробных, микроаэрофильных или капнофильных газовых смесей.
Anoxomat может подключать до четырех комбинаций сосудов с газом, а его функция индивидуального программирования позволяет пользователю настраивать параметры газовой смеси. Эти индивидуальные рецепты можно сохранить в памяти Anoxomat.
Система Anoxomat также может культивировать микроаэрофильные, гипоксические и капнофильные бактерии.Микроаэрофильный рецепт создает среду с 6% кислорода и около 7% углекислого газа, идеальную смесь для выращивания Campylobacter.
Через 5 минут Anoxomat сообщит, что банка была успешно обработана и назначенная среда была создана. Затем банку можно отсоединить. Защелкивающаяся муфта на крышке закрывается при отсоединении. Емкость готова к инкубации, и Anoxomat готов к следующей работе.
Поскольку Anoxomat во многих условиях работает быстрее, чем анаэробные камеры и газовые пакеты, система обеспечивает необходимые условия для инкубации за меньшее время, а восстановление микроорганизмов, культивируемых в его банках, превосходит все другие методы, поскольку Anoxomat Anaerobic Jars гарантированно поддерживают одинаковую точную среду во время инкубации.


