Анаэробтар — Уикипедия
Уикипедия — ашық энциклопедиясынан алынған мәлімет
Анаэробтар, анаэробты микроорганизмдер — қоршаған ортада бос оттегі жоқ кезде өмір сүруге және көбеюге қабілетті микроорганизмдер[1]; атмосфералық оттегі болмайтын жерде тіршілік етуге бейім микроағзалар.
Анаэробтарға көптеген бактериялар, инфузориялар кейбір таспа құрттар, аскарид және аздаған ұлулар жатады.[2]
Анаэробты организмдер, анаэробтар (гр. an – сыз, сіз, емес қосымшасы, гр. aеer – ауа және гр. bіos – тіршілік) – оттексіз ортада өсіп-өніп, тіршілік ететін организмдер.
1861 жылы Л.Пастер май қышқылын ашытатын бактерияны тапқаннан кейін анаэробты организмдер терминін ғылымға енгізген. Анаэробты организмдер негізінен прокариотты организмдер арасында кең тараған. Ал эукариотты организмдер арасында ашытқы саңырауқұлақтарында, буынаяқтылардың ішегінде өмір сүретін қарапайымдарда, ал көп клеткалы организмдер ішінде ішек паразиттерінде (атап айтқанда таспа құрттар мен аскаридаларда) кездеседі. Анаэробты организмдер тіршілік ететін ортасында оттектің болу не болмауына байланысты олигатты анаэробты организмдер және факультативті анаэробты организмдер болып бөлінеді. Олигатты анаэробты организмдер – тіршілігі мүлдем оттексіз жүретін организмдер. Оларға май қышқылы бактериясы және сіреспе бактериялары жатады[3].
Анаэробты организмдер тіршілік ететін ортасында оттектің болу не болмауына байланысты олигатты анаэробты организмдер және факультативті анаэробты организмдер болып бөлінеді. Олигатты анаэробты организмдер – тіршілігі мүлдем оттексіз жүретін организмдер. Оларға май қышқылы бактериясы және сіреспе бактериялары жатады[3].
Көп клеткалы жануарлар арасында олигатты анаэробты организмдер кездеспейді. Факультативті анаэробты организмдер – табиғатта оттектің бар-жоғына қарамай тіршілік ететін организмдер (мысалы, ашытқы саңырауқұлақтары, іш сүзегі, топалаң қоздырғыштары, т.б.). Анаэробты организмдер негізінде құрамында оттек бар органикалық қосылыстарды (спиртті, сүт қышқылын, май қышқылын, т.б.), ал кейбір түрлері минералды қосылыстарды (сульфаттарды немесе нитраттарды) ыдыратып, осы процесс кезінде бөлініп шыққан оттекті өзінің тіршілік әрекетінде пайдаланады. Анаэробты организмдер аэробты организмдер сияқты табиғаттағы зат айналу процесіне, органикалық және минералды заттардың өзгеруіне үлкен әсер етеді. Олар спирт және сүт қышқылын ашыту процесінде кеңінен қолданылады. Кейбір анаэробты организмдер асқа, тағамға түссе, тез өсіп-өніп, адам мен жануарларды уландыруы, ал ауру тудырғыш (патогенді) анаэробты организмдер түрлі жұқпалы ауруларды (сіреспе, ботулизм газды гангрена, т.б.) таратуы мүмкін.[4]
Олар спирт және сүт қышқылын ашыту процесінде кеңінен қолданылады. Кейбір анаэробты организмдер асқа, тағамға түссе, тез өсіп-өніп, адам мен жануарларды уландыруы, ал ауру тудырғыш (патогенді) анаэробты организмдер түрлі жұқпалы ауруларды (сіреспе, ботулизм газды гангрена, т.б.) таратуы мүмкін.[4]
Дереккөздер[өңдеу]
- ↑ О.Д.Дайырбеков, Б.Е.Алтынбеков, Б.К.Торғауытов, У.И.Кенесариев, Т.С.Хайдарова Аурудың алдын алу және сақтандыру бойынша орысша-қазақша терминологиялық сөздік. Шымкент. “Ғасыр-Ш”, 2005 жыл. ISBN 9965-752-06-0
- ↑ Орысша-қазақша түсіндірме сөздік: Биология / Жалпы редакциясын басқарған э.ғ.д., профессор Е. Арын — Павлодар: «ЭКО» ҒӨФ. 2007. — 1028 б. ISBN 9965-08-286-3
- ↑ Пульмонология терминдерінің орысша-қазақша түсіндірме сөздігі. Алматы: Ана тілі. 1996. ISBN 5-630-00473-5
- ↑ Қазақстан Республикасының табиғаты, 7 том
Анаэробные организмы — Википедия
Анаэробы (от греч. αν - нет, греч.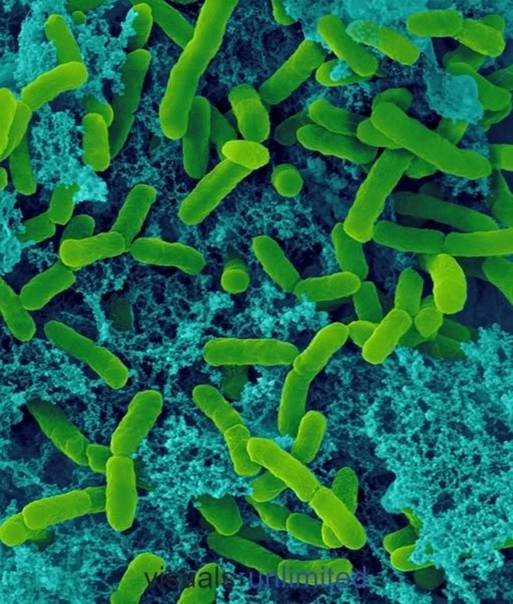 αέρ - воздух и греч. βιοζ - жизнь) — организмы, получающие энергию при отсутствии доступа кислорода путём субстратного фосфорилирования, конечные продукты неполного окисления субстрата при этом могут быть окислены с получением большего количества энергии в виде АТФ.
αέρ - воздух и греч. βιοζ - жизнь) — организмы, получающие энергию при отсутствии доступа кислорода путём субстратного фосфорилирования, конечные продукты неполного окисления субстрата при этом могут быть окислены с получением большего количества энергии в виде АТФ.
Аэробные и анаэробные бактерии предварительно идентифицируются в жидкой питательной среде по градиенту концентрации O2:
1. Облигатные аэробные бактерии в основном собираются в верхней части пробирки, чтобы поглощать максимальное количество кислорода. (Исключение: микобактерии — рост плёнкой на поверхности из-за восколипидной мембраны).
2. Облигатные анаэробные бактерии собираются в нижней части, чтобы избежать кислорода (либо не дают роста).
3. Факультативные бактерии собираются в основном в верхнем (окислительное фосфорилирование является более выгодным, чем гликолиз), однако они могут быть найдены на всём протяжении среды, так как от O2 не зависят.
4. Микроаэрофилы собираются в верхней части пробирки, но их оптимум — малая концентрация кислорода.
Микроаэрофилы собираются в верхней части пробирки, но их оптимум — малая концентрация кислорода.
5. Аэротолерантные анаэробы не реагируют на концентрации кислорода и равномерно распределяются по пробирке.
Анаэробы — обширная группа организмов, как микро-, так и макроуровня:
Помимо этого, анаэробное окисление глюкозы играет важную роль в работе поперечнополосатой мускулатуры животных и человека (особенно в состоянии тканевой гипоксии).
Термин «анаэробы» ввел Луи Пастер, открывший в 1861 году бактерии маслянокислого брожения.
Анаэробное дыхание — совокупность биохимических реакций, протекающих в клетках живых организмов при использовании в качестве конечного акцептора электронов не кислорода, а других веществ (например, нитратов) и относится к процессам энергетического обмена (катаболизм, диссимиляция), которые характеризуются окислением углеводов, липидов и аминокислот до низкомолекулярных соединений.
Степень аэробности средыПравить
Интерполяция руководства к системам BD Gaspak, описывающая условия среды генерируемые пакетом[1]
Для измерения потенциала среды М. Кларк предложил использовать величину pH20 — отрицательный логарифм парциального давления газообразного водорода. Диапазон [0-42,6] характеризует все степени насыщения водного раствора водородом и кислородом. Аэробы растут при более высоком потенциале [14-20], факультативные анаэробы [0-20], а облигатные — при наиболее низком [0-10][2].
Кларк предложил использовать величину pH20 — отрицательный логарифм парциального давления газообразного водорода. Диапазон [0-42,6] характеризует все степени насыщения водного раствора водородом и кислородом. Аэробы растут при более высоком потенциале [14-20], факультативные анаэробы [0-20], а облигатные — при наиболее низком [0-10][2].
Классификация анаэробовПравить
Согласно устоявшейся в микробиологии классификации, различают:
- Факультативные анаэробы
- Капнеистические анаэробы и микроаэрофилы
- Аэротолерантные анаэробы
- Умеренно-строгие анаэробы
- Облигатные анаэробы
Если организм способен переключаться с одного метаболического пути на другой (например, с анаэробного дыхания на аэробное и обратно), то его условно относят к факультативным анаэробам[3].
До 1991 года в микробиологии выделяли класс капнеистических анаэробов, требовавших пониженной концентрации кислорода и повышенной концентрации углекислоты (Бруцеллы бычьего типа — B. abortus)[2].
abortus)[2].
Умеренно-строгий анаэробный организм выживает в среде с молекулярным O2, однако не размножается. Микроаэрофилы способны выживать и размножаться в среде с низким парциальным давлением O2.
Если организм не способен «переключиться» с анаэробного типа дыхания на аэробный, но не гибнет в присутствии молекулярного кислорода, то он относится к группе аэротолерантных анаэробов. Например, молочнокислые и многие маслянокислые бактерии.
Облигатные анаэробы в присутствии молекулярного кислорода O2 гибнут — например,
представители рода бактерий и архей: Bacteroides,
Fusobacterium, Butyrivibrio, Methanobacterium). Такие анаэробы постоянно живут в лишённой кислорода среде. К облигатным анаэробам относятся некоторые бактерии, дрожжи, жгутиковые и инфузории.
Токсичность кислорода и его форм для анаэробных организмовПравить
Среда с содержанием кислорода является агрессивной по отношению к органическим формам жизни. Это связано с образованием активных форм кислорода в процессе жизнедеятельности или под действием различных форм ионизирующего излучения, значительно более токсичных, чем молекулярный кислород O2. Фактор, определяющий жизнеспособность организма в среде кислорода[4] — наличие у него функциональной антиоксидантной системы, способной к элиминации: супероксид-аниона(O2−), пероксида водорода(H2O2), синглетного кислорода(1O2), а также молекулярного кислорода (O2) из внутренней среды организма.
Это связано с образованием активных форм кислорода в процессе жизнедеятельности или под действием различных форм ионизирующего излучения, значительно более токсичных, чем молекулярный кислород O2. Фактор, определяющий жизнеспособность организма в среде кислорода[4] — наличие у него функциональной антиоксидантной системы, способной к элиминации: супероксид-аниона(O2−), пероксида водорода(H2O2), синглетного кислорода(1O2), а также молекулярного кислорода (O2) из внутренней среды организма.
Наиболее часто подобная защита обеспечивается одним или несколькими ферментами:
Аэробные организмы содержат чаще всего три цитохрома, факультативные анаэробы — один или два, облигатные анаэробы не содержат цитохромов.
Анаэробные микроорганизмы могут активно воздействовать на среду[2]
, создавая подходящий окислительно-восстановительный потенциал среды (например, Clostridium perfringens). Некоторые засеянные культуры анаэробных микроорганизмов, прежде чем начать размножаться, снижают pH20 с величины [20-25] до [1-5], ограждая себя восстановительным барьером, другие — аэротолерантные — в процессе жизнедеятельности продуцируют перекись водорода, повышая pH20[5].
Некоторые засеянные культуры анаэробных микроорганизмов, прежде чем начать размножаться, снижают pH20 с величины [20-25] до [1-5], ограждая себя восстановительным барьером, другие — аэротолерантные — в процессе жизнедеятельности продуцируют перекись водорода, повышая pH20[5].
Дополнительная антиоксидантная защита может обеспечиваться синтезом или накоплением низкомолекулярных антиоксидантов: витамина С, А, E, лимонной и других кислот.
Получение энергии путём субстратного фосфорилирования. Брожение. ГниениеПравить
Схема гликолиза с образованием молочной кислоты
- Также анаэробные организмы могут получать энергию путём катаболизма аминокислот и их соединений (пептидов, белков). Такие процессы именуют гниением, а микрофлору в энергетическом обмене которой преобладают процессы катаболизма аминокислот называют гнилостной.
- Анаэробные микроорганизмы расщепляют гексозы (например, глюкозу) разными путями:
- Гликолиз (Путь Эмдена-Мейергофа) после которого продукт подвергается брожению
- окислительный пентозофосфатный путь (другие названия: Фосфогликонатный путь, иначе гексозомонофосфатный(ГКМ), иначе путь Варбурга — Диккенса — Хореккера)
- Путь Энтнера — Дудорова (особенно значимый, когда субстратами служат глюконовая, маннановая, гексуроновые кислоты или их производные)
В качестве примера организма, сбраживающего сахара по пути Энтнера — Дудорова, можно привести облигатно анаэробную бактерию Zymomonas mobilis.
Однако её изучение позволяет предполагать, что Z. mobilis — вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера — Дудорова обнаружен и у некоторых клостридиев, что ещё раз подчеркивает неоднородность эубактерий, объединённых в эту таксономическую группу[6].
При этом характерным только для анаэробов является гликолиз, который в зависимости от конечных продуктов реакции разделяют на несколько типов брожения:
В результате расщепления глюкозы расходуется 2 молекулы, а синтезируется 4 молекулы АТФ. Таким образом общий выход АТФ составляет 2 молекулы АТФ и 2 молекулы НАД·Н2. Полученный в ходе реакции пируват утилизируется клеткой по-разному в зависимости от того, какому типу брожения она следует.
Антагонизм брожения и гниенияПравить
В процессе эволюции сформировался и закрепился биологический антагонизм бродильной и гнилостной микрофлоры:
Расщепление микроорганизмами углеводов сопровождается значительным снижением pH среды, в то время как расщепление белков и аминокислот — повышением (защелачиванием). Приспособление каждого из организмов к определённой реакции среды играет важнейшую роль в природе и жизни человека, например, благодаря бродильным процессам предотвращается загнивание силоса, заквашенных овощей, молочных продуктов.
Приспособление каждого из организмов к определённой реакции среды играет важнейшую роль в природе и жизни человека, например, благодаря бродильным процессам предотвращается загнивание силоса, заквашенных овощей, молочных продуктов.
Культивирование анаэробных организмовПравить
Выделение чистой культуры анаэробов схематично
Культивирование анаэробных организмов в основном является задачей микробиологии.
Сложнее дело обстоит с культивированием анаэробных многоклеточных организмов, поскольку для их культивирования часто необходима специфическая микрофлора, а также определённые концентрации метаболитов. Применяется, например, при исследовании паразитов человеческого организма.
Для культивирования анаэробов применяют особые методы, сущность которых заключается в удалении воздуха или замены его специализированной газовой смесью (или инертными газами) в герметизированных термостатах — анаэростатах[7].
Другим способом выращивания анаэробов(чаще всего микроорганизмов) на питательных средах — добавление редуцирующих веществ (глюкозу, муравьинокислый натрий, казеин, сульфат натрия, тиосульфат, цистеин, тиогликолят натрия и др. ), связывающих токсичные для анаэробов перикисные соединения.
), связывающих токсичные для анаэробов перикисные соединения.
Общие питательные среды для анаэробных организмовПравить
Для общей среды Вильсона-Блера базой является агар-агар с добавлением глюкозы, сульфита натрия и двуххлористого железа. Клостридии образуют на этой среде колонии чёрного цвета за счёт восстановления сульфита до сульфид-аниона, который, соединяясь с катионами железа (II), даёт соль чёрного цвета. Как правило, чёрные на этой среде образования колонии появляются в глубине агарового столбика[8].
Среда Китта-Тароцци состоит из мясопептонного бульона, 0,5 % глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20—30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина или вазелинового масла для изоляции от доступа кислорода.
Общие методы культивирования для анаэробных организмовПравить
GasPak — система химическим путём обеспечивает постоянство газовой смеси, приемлемой для роста большинства анаэробных микроорганизмов. В герметичном контейнере, в результате реакции воды с таблетками боргидрида натрия и бикарбоната натрия образуется водород и диоксид углерода. Водород затем реагирует с кислородом газовой смеси на палладиевом катализаторе с образованием воды, уже вторично вступающей в реакцию гидролиза боргидрида.
В герметичном контейнере, в результате реакции воды с таблетками боргидрида натрия и бикарбоната натрия образуется водород и диоксид углерода. Водород затем реагирует с кислородом газовой смеси на палладиевом катализаторе с образованием воды, уже вторично вступающей в реакцию гидролиза боргидрида.
Данный метод был предложен Брюером и Олгаером в 1965 году. Разработчики представили одноразовый пакет, генерирующий водород, который был позднее усовершенствован ими до саше, генерирующих двуокись углерода и содержащих внутренний катализатор[9][10].
Метод Цейсслера применяется для выделения чистых культур спорообразующих анаэробов. Для этого производят посев на среду Китт-Тароцци, прогревают 20 мин при 80 °C (для уничтожения вегетативной формы), заливают среду вазелиновым маслом и инкубируют 24 ч в термостате. Затем производят посев на сахарно-кровяной агар для получения чистых культур. После 24-часового культивирования интересующие колонии изучаются — их пересеивают на среду Китт-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод Фортнера
Метод Фортнера — посевы производят на чашку Петри с утолщённым слоем среды, разделённым пополам узкой канавкой, вырезанной в агаре. Одну половину засевают культуру аэробных бактерий, на другую — анаэробных. Края чашки заливают парафином и инкубируют в термостате. Первоначально наблюдают рост аэробной микрофлоры, а затем (после поглощения кислорода) — рост аэробной резко прекращается и начинается рост анаэробной.
Метод Вейнберга используется для получения чистых культур облигатных анаэробов. Культуры, выращенные на среде Китта-Тароцци, переносят в сахарный бульон. Затем одноразовой пастеровской пипеткой материал переносят в узкие пробирки (трубки Виньяля) с сахарным мясо-пептонным агаром, погружая пипетку до дна пробирки. Засеянные пробирки быстро охлаждают, что позволяет фиксировать бактериальный материал в толще затвердевшего агара. Пробирки инкубируют в термостате, а затем изучают выросшие колонии. При обнаружении интересующей колонии на её месте делают распил, материал быстро отбирают и засеивают на среду Китта-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод Перетца
Метод Перетца — в расплавленный и охлаждённый сахарный агар-агар вносят культуру бактерий и заливают под стекло, помещённое на пробковых палочках(или фрагментах спичек) в чашку Петри. Метод наименее надежен из всех, но достаточно прост в применении.
Дифференциально — диагностические питательные средыПравить
- Среды Гисса («пестрый ряд»)
- Среда Ресселя (Рассела)
- Среда Эндо
- Среда Плоскирева или бактоагар «Ж»
- Висмут-сульфитный агар
Среды Гисса: К 1 % пептонной воде добавляют 0,5 % раствор определённого углевода (глюкоза, лактоза, мальтоза, маннит, сахароза и др.) и кислотно-щелочной индикатор Андреде, разливают по пробиркам, в которые помещают поплавок для улавливания газообразных продуктов, образующихся при разложении углеводородов.
Среда Ресселя (Рассела) применяется для изучения биохимических свойств энтеробактерий(шигелл, сальмонелл). Содержит питательный агар-агар, лактозу, глюкозу и индикатор (бромтимоловый синий).
Содержит питательный агар-агар, лактозу, глюкозу и индикатор (бромтимоловый синий).
Цвет среды травянисто-зелёный. Обычно готовят в пробирках по 5 мл со скошенной поверхностью. Посев осуществляют уколом в глубину столбика и штрихом по скошенной поверхности.
Среда Эндо
Среда Плоскирева (бактоагар Ж) — дифференциально-диагностическая и селективная среда, поскольку подавляет рост многих микроорганизмов, и способствует росту патогенных бактерий (возбудителей брюшного тифа, паратифов, дизентерии). Лактозоотрицательные бактерии образуют на этой среде бесцветные колонии, а лактозоположительные — красные. В составе среды — агар, лактоза, бриллиантовый зелёный, соли желчных кислот, минеральные соли, индикатор (нейтральный красный).
Висмут-сульфитный агар предназначен для выделения сальмонелл в чистом виде из инфицированного материала. Содержит триптический гидролизат, глюкозу, факторы роста сальмонелл, бриллиантовый зелёный и агар. Дифференциальные свойства среды основаны на способности сальмонелл продуцировать сероводород, на их устойчивости к присутствию сульфида, бриллиантового зелёного и лимоннокислого висмута.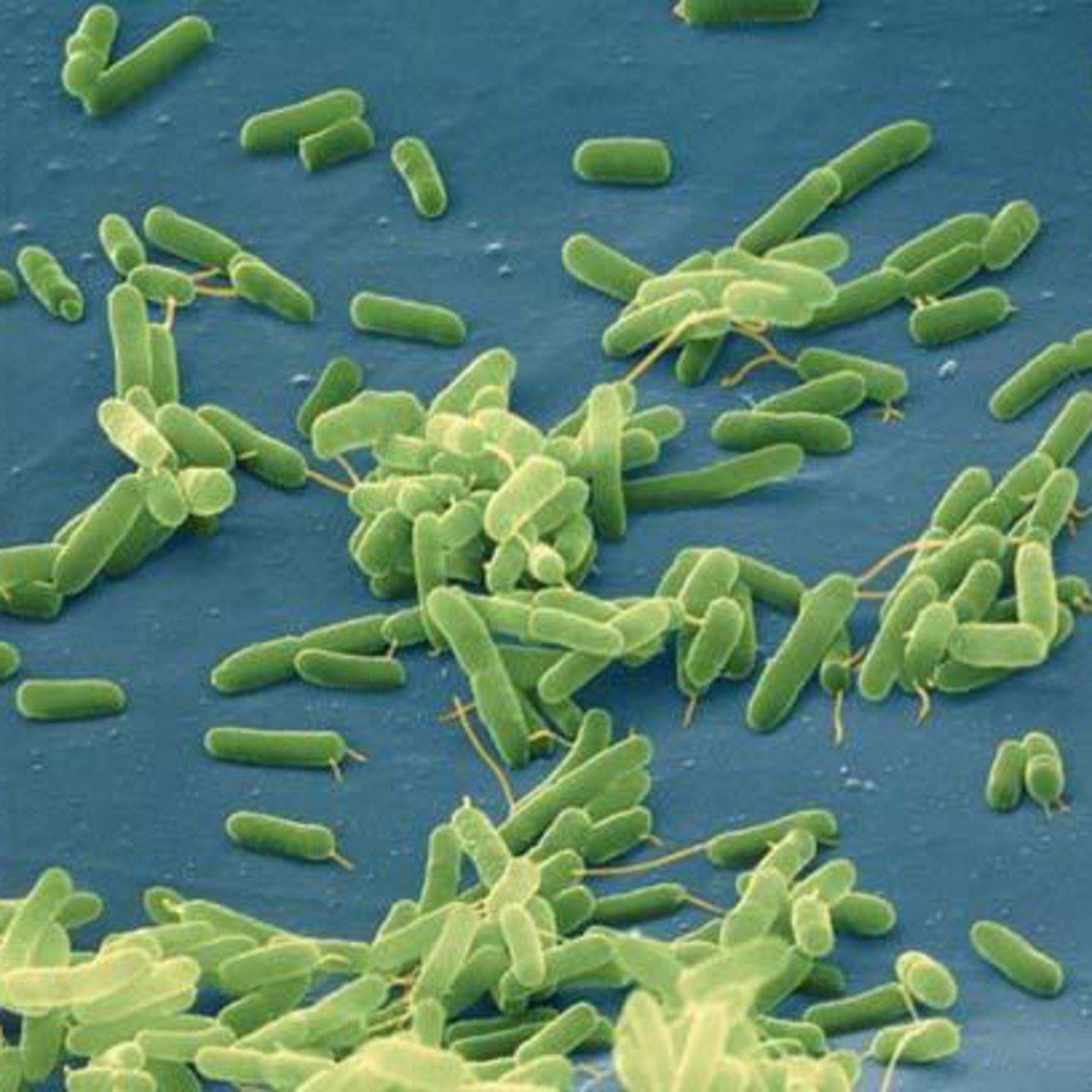 Маркируются колонии в чёрный цвет сернистого висмута (методика схожа со средой Вильсона-Блера).
Маркируются колонии в чёрный цвет сернистого висмута (методика схожа со средой Вильсона-Блера).
Метаболизм анаэробных организмовПравить
Метаболизм анаэробных организмов имеет несколько различных подгрупп:
Анаэробный энергетический обмен в тканях человека и животныхПравить
Основной источник: [12]
Анаэробное и аэробное энергообразование в тканях человека
Некоторые ткани животных и человека отличаются повышенной устойчивостью к гипоксии (особенно мышечная ткань).
В обычных условиях синтез АТФ идет аэробным путём, а при напряжённой мышечной деятельности, когда доставка кислорода к мышцам затруднена, в состоянии гипоксии, а также при воспалительных реакциях в тканях доминируют анаэробные механизмы регенерации АТФ. В скелетных мышцах выявлены 3 вида анаэробных и только один аэробный путь регенерации АТФ.
3 вида анаэробного пути синтеза АТФ
К анаэробным относятся:
- Креатинфосфатазный (фосфогеный или алактатный) механизм — перефосфорилирование между креатинфосфатом и АДФ
- Миокиназный — синтез (иначе ресинтез) АТФ при реакции трансфосфорилирования 2 молекул АДФ (аденилатциклаза)
- Гликолитический — анаэробное расщепление глюкозы крови или запаса гликогена, заканчивающийся образованием молочной кислоты (иначе именуется «лактатным»).

Необходимо отметить, что прямым следствием гликолиза является критическое снижение рН тканей — ацидоз. Это ведёт к снижению эффективного транспорта кислорода гемоглобином, и формирует положительную обратную связь.
Каждый механизм имеет своё время удержания максимальной мощности и оптимум энергообеспечения тканей.
Наибольшая мощность и наименьшее время удержания:
- ↑ Газогенерирующие контейнерные системы GasPak: Инструкция МК. — OOO «МК, официальный дистрибьютер Becton Dickinson International», 2010. — С. 7.
- ↑ 1 2 3 К. Д. Пяткин. Микробиология с вирусологией и иммунологией. — М:»Медицина», 1971. — С. 56.
- ↑ Л. Б. Борисов. Медицинская микробиология, вирусология и иммунология. — МИА, 2005. — С. 154—156. — ISBN 5-89481-278-X.
- ↑ Д. Г. Кнорре. Биологическая химия: Учеб. для хим., биол. и мед. спец. вузов. — 3. — М.: Высшая школа, 2000. — С.
 134. — ISBN 5-06-003720-7.
134. — ISBN 5-06-003720-7. - ↑ D. A. Eschenbach, P. R. Davick, B. L. Williams. Prevalence of hydrogen peroxide-producing Lactobacillus species in normal women and women with bacterial vaginosis. — J Clin Microbiol. 1989 February; 27(2): 251–256.
- ↑ М. В. Гусев, Л. А. Минеева. Микробиология. — М:МГУ, 1992. — С. 56.
- ↑ А. А. Воробьев. Атлас по медицинской микробиологии, вирусологии и иммунологии. — МИА, 2003. — С. 44. — ISBN 5-89481-136-8.
- ↑ Л. Б. Борисов. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии. — Медицина, 1992. — С. 31—44. — ISBN 5-2225-00897-6.
- ↑ J. H. Brewer, D. L. Allgeier. Disposable hydrogen generator. — Science 147:1033-1034. — 1966.
- ↑ J. H. Brewer, D. L. Allgeier. Safe self-contained carbon dioxide-hydrogen anaerobic system. — Appl. Microbiol.16:848-850. — 1966.
- ↑ G. F. Smirnova. Metabolism peculiarities of bacteria restoring chlorates and perchlorates.
 — Microbiol Z. 2010 Jul-Aug;72(4):22-8.
— Microbiol Z. 2010 Jul-Aug;72(4):22-8. - ↑ Филиппович Ю. Б., Коничев А. С., Севастьянова Г. А. Биохимические основы жизнедеятельности организма человека. — Владос, 2005. — С. 302. — ISBN 5-691-00505-7.
Анаэробные организмы — Википедия
Анаэробы (от греч. αν - нет, греч. αέρ - воздух и греч. βιοζ - жизнь) — организмы, получающие энергию при отсутствии доступа кислорода путём субстратного фосфорилирования, конечные продукты неполного окисления субстрата при этом могут быть окислены с получением большего количества энергии в виде АТФ.
Аэробные и анаэробные бактерии предварительно идентифицируются в жидкой питательной среде по градиенту концентрации O2:
1. Облигатные аэробные бактерии в основном собираются в верхней части пробирки, чтобы поглощать максимальное количество кислорода. (Исключение: микобактерии — рост плёнкой на поверхности из-за восколипидной мембраны).
2. Облигатные анаэробные бактерии собираются в нижней части, чтобы избежать кислорода (либо не дают роста).
3. Факультативные бактерии собираются в основном в верхнем (окислительное фосфорилирование является более выгодным, чем гликолиз), однако они могут быть найдены на всём протяжении среды, так как от O2 не зависят.
4. Микроаэрофилы собираются в верхней части пробирки, но их оптимум — малая концентрация кислорода.
5. Аэротолерантные анаэробы не реагируют на концентрации кислорода и равномерно распределяются по пробирке.
Анаэробы — обширная группа организмов, как микро-, так и макроуровня:
Помимо этого, анаэробное окисление глюкозы играет важную роль в работе поперечнополосатой мускулатуры животных и человека (особенно в состоянии тканевой гипоксии).
Термин «анаэробы» ввел Луи Пастер, открывший в 1861 году бактерии маслянокислого брожения.
Анаэробное дыхание — совокупность биохимических реакций, протекающих в клетках живых организмов при использовании в качестве конечного акцептора электронов не кислорода, а других веществ (например, нитратов) и относится к процессам энергетического обмена (катаболизм, диссимиляция), которые характеризуются окислением углеводов, липидов и аминокислот до низкомолекулярных соединений.
Степень аэробности средыПравить
Интерполяция руководства к системам BD Gaspak, описывающая условия среды генерируемые пакетом[1]
Для измерения потенциала среды М. Кларк предложил использовать величину pH20 — отрицательный логарифм парциального давления газообразного водорода. Диапазон [0-42,6] характеризует все степени насыщения водного раствора водородом и кислородом. Аэробы растут при более высоком потенциале [14-20], факультативные анаэробы [0-20], а облигатные — при наиболее низком [0-10][2].
Классификация анаэробовПравить
Согласно устоявшейся в микробиологии классификации, различают:
- Факультативные анаэробы
- Капнеистические анаэробы и микроаэрофилы
- Аэротолерантные анаэробы
- Умеренно-строгие анаэробы
- Облигатные анаэробы
Если организм способен переключаться с одного метаболического пути на другой (например, с анаэробного дыхания на аэробное и обратно), то его условно относят к факультативным анаэробам[3].
До 1991 года в микробиологии выделяли класс капнеистических анаэробов, требовавших пониженной концентрации кислорода и повышенной концентрации углекислоты (Бруцеллы бычьего типа — B. abortus)[2].
Умеренно-строгий анаэробный организм выживает в среде с молекулярным O2, однако не размножается. Микроаэрофилы способны выживать и размножаться в среде с низким парциальным давлением O2.
Если организм не способен «переключиться» с анаэробного типа дыхания на аэробный, но не гибнет в присутствии молекулярного кислорода, то он относится к группе аэротолерантных анаэробов. Например, молочнокислые и многие маслянокислые бактерии.
Облигатные анаэробы в присутствии молекулярного кислорода O2 гибнут — например,
представители рода бактерий и архей: Bacteroides,
Fusobacterium, Butyrivibrio, Methanobacterium). Такие анаэробы постоянно живут в лишённой кислорода среде. К облигатным анаэробам относятся некоторые бактерии, дрожжи, жгутиковые и инфузории.
Токсичность кислорода и его форм для анаэробных организмовПравить
Среда с содержанием кислорода является агрессивной по отношению к органическим формам жизни. Это связано с образованием активных форм кислорода в процессе жизнедеятельности или под действием различных форм ионизирующего излучения, значительно более токсичных, чем молекулярный кислород O2. Фактор, определяющий жизнеспособность организма в среде кислорода[4] — наличие у него функциональной антиоксидантной системы, способной к элиминации: супероксид-аниона(O2−), пероксида водорода(H2O2), синглетного кислорода(1O2), а также молекулярного кислорода (O2) из внутренней среды организма.
Наиболее часто подобная защита обеспечивается одним или несколькими ферментами:
Аэробные организмы содержат чаще всего три цитохрома, факультативные анаэробы — один или два, облигатные анаэробы не содержат цитохромов.
Анаэробные микроорганизмы могут активно воздействовать на среду[2]
, создавая подходящий окислительно-восстановительный потенциал среды (например, Clostridium perfringens). Некоторые засеянные культуры анаэробных микроорганизмов, прежде чем начать размножаться, снижают pH20 с величины [20-25] до [1-5], ограждая себя восстановительным барьером, другие — аэротолерантные — в процессе жизнедеятельности продуцируют перекись водорода, повышая pH20[5].
Некоторые засеянные культуры анаэробных микроорганизмов, прежде чем начать размножаться, снижают pH20 с величины [20-25] до [1-5], ограждая себя восстановительным барьером, другие — аэротолерантные — в процессе жизнедеятельности продуцируют перекись водорода, повышая pH20[5].
Дополнительная антиоксидантная защита может обеспечиваться синтезом или накоплением низкомолекулярных антиоксидантов: витамина С, А, E, лимонной и других кислот.
Получение энергии путём субстратного фосфорилирования. Брожение. ГниениеПравить
Схема гликолиза с образованием молочной кислоты
- Также анаэробные организмы могут получать энергию путём катаболизма аминокислот и их соединений (пептидов, белков). Такие процессы именуют гниением, а микрофлору в энергетическом обмене которой преобладают процессы катаболизма аминокислот называют гнилостной.
- Анаэробные микроорганизмы расщепляют гексозы (например, глюкозу) разными путями:
- Гликолиз (Путь Эмдена-Мейергофа) после которого продукт подвергается брожению
- окислительный пентозофосфатный путь (другие названия: Фосфогликонатный путь, иначе гексозомонофосфатный(ГКМ), иначе путь Варбурга — Диккенса — Хореккера)
- Путь Энтнера — Дудорова (особенно значимый, когда субстратами служат глюконовая, маннановая, гексуроновые кислоты или их производные)
В качестве примера организма, сбраживающего сахара по пути Энтнера — Дудорова, можно привести облигатно анаэробную бактерию Zymomonas mobilis.
Однако её изучение позволяет предполагать, что Z. mobilis — вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера — Дудорова обнаружен и у некоторых клостридиев, что ещё раз подчеркивает неоднородность эубактерий, объединённых в эту таксономическую группу[6].
При этом характерным только для анаэробов является гликолиз, который в зависимости от конечных продуктов реакции разделяют на несколько типов брожения:
В результате расщепления глюкозы расходуется 2 молекулы, а синтезируется 4 молекулы АТФ. Таким образом общий выход АТФ составляет 2 молекулы АТФ и 2 молекулы НАД·Н2. Полученный в ходе реакции пируват утилизируется клеткой по-разному в зависимости от того, какому типу брожения она следует.
Антагонизм брожения и гниенияПравить
В процессе эволюции сформировался и закрепился биологический антагонизм бродильной и гнилостной микрофлоры:
Расщепление микроорганизмами углеводов сопровождается значительным снижением pH среды, в то время как расщепление белков и аминокислот — повышением (защелачиванием). Приспособление каждого из организмов к определённой реакции среды играет важнейшую роль в природе и жизни человека, например, благодаря бродильным процессам предотвращается загнивание силоса, заквашенных овощей, молочных продуктов.
Приспособление каждого из организмов к определённой реакции среды играет важнейшую роль в природе и жизни человека, например, благодаря бродильным процессам предотвращается загнивание силоса, заквашенных овощей, молочных продуктов.
Культивирование анаэробных организмовПравить
Выделение чистой культуры анаэробов схематично
Культивирование анаэробных организмов в основном является задачей микробиологии.
Сложнее дело обстоит с культивированием анаэробных многоклеточных организмов, поскольку для их культивирования часто необходима специфическая микрофлора, а также определённые концентрации метаболитов. Применяется, например, при исследовании паразитов человеческого организма.
Для культивирования анаэробов применяют особые методы, сущность которых заключается в удалении воздуха или замены его специализированной газовой смесью (или инертными газами) в герметизированных термостатах — анаэростатах[7].
Другим способом выращивания анаэробов(чаще всего микроорганизмов) на питательных средах — добавление редуцирующих веществ (глюкозу, муравьинокислый натрий, казеин, сульфат натрия, тиосульфат, цистеин, тиогликолят натрия и др. ), связывающих токсичные для анаэробов перикисные соединения.
), связывающих токсичные для анаэробов перикисные соединения.
Общие питательные среды для анаэробных организмовПравить
Для общей среды Вильсона-Блера базой является агар-агар с добавлением глюкозы, сульфита натрия и двуххлористого железа. Клостридии образуют на этой среде колонии чёрного цвета за счёт восстановления сульфита до сульфид-аниона, который, соединяясь с катионами железа (II), даёт соль чёрного цвета. Как правило, чёрные на этой среде образования колонии появляются в глубине агарового столбика[8].
Среда Китта-Тароцци состоит из мясопептонного бульона, 0,5 % глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20—30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина или вазелинового масла для изоляции от доступа кислорода.
Общие методы культивирования для анаэробных организмовПравить
GasPak — система химическим путём обеспечивает постоянство газовой смеси, приемлемой для роста большинства анаэробных микроорганизмов. В герметичном контейнере, в результате реакции воды с таблетками боргидрида натрия и бикарбоната натрия образуется водород и диоксид углерода. Водород затем реагирует с кислородом газовой смеси на палладиевом катализаторе с образованием воды, уже вторично вступающей в реакцию гидролиза боргидрида.
В герметичном контейнере, в результате реакции воды с таблетками боргидрида натрия и бикарбоната натрия образуется водород и диоксид углерода. Водород затем реагирует с кислородом газовой смеси на палладиевом катализаторе с образованием воды, уже вторично вступающей в реакцию гидролиза боргидрида.
Данный метод был предложен Брюером и Олгаером в 1965 году. Разработчики представили одноразовый пакет, генерирующий водород, который был позднее усовершенствован ими до саше, генерирующих двуокись углерода и содержащих внутренний катализатор[9][10].
Метод Цейсслера применяется для выделения чистых культур спорообразующих анаэробов. Для этого производят посев на среду Китт-Тароцци, прогревают 20 мин при 80 °C (для уничтожения вегетативной формы), заливают среду вазелиновым маслом и инкубируют 24 ч в термостате. Затем производят посев на сахарно-кровяной агар для получения чистых культур. После 24-часового культивирования интересующие колонии изучаются — их пересеивают на среду Китт-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод Фортнера
Метод Фортнера — посевы производят на чашку Петри с утолщённым слоем среды, разделённым пополам узкой канавкой, вырезанной в агаре. Одну половину засевают культуру аэробных бактерий, на другую — анаэробных. Края чашки заливают парафином и инкубируют в термостате. Первоначально наблюдают рост аэробной микрофлоры, а затем (после поглощения кислорода) — рост аэробной резко прекращается и начинается рост анаэробной.
Метод Вейнберга используется для получения чистых культур облигатных анаэробов. Культуры, выращенные на среде Китта-Тароцци, переносят в сахарный бульон. Затем одноразовой пастеровской пипеткой материал переносят в узкие пробирки (трубки Виньяля) с сахарным мясо-пептонным агаром, погружая пипетку до дна пробирки. Засеянные пробирки быстро охлаждают, что позволяет фиксировать бактериальный материал в толще затвердевшего агара. Пробирки инкубируют в термостате, а затем изучают выросшие колонии. При обнаружении интересующей колонии на её месте делают распил, материал быстро отбирают и засеивают на среду Китта-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод Перетца
Метод Перетца — в расплавленный и охлаждённый сахарный агар-агар вносят культуру бактерий и заливают под стекло, помещённое на пробковых палочках(или фрагментах спичек) в чашку Петри. Метод наименее надежен из всех, но достаточно прост в применении.
Дифференциально — диагностические питательные средыПравить
- Среды Гисса («пестрый ряд»)
- Среда Ресселя (Рассела)
- Среда Эндо
- Среда Плоскирева или бактоагар «Ж»
- Висмут-сульфитный агар
Среды Гисса: К 1 % пептонной воде добавляют 0,5 % раствор определённого углевода (глюкоза, лактоза, мальтоза, маннит, сахароза и др.) и кислотно-щелочной индикатор Андреде, разливают по пробиркам, в которые помещают поплавок для улавливания газообразных продуктов, образующихся при разложении углеводородов.
Среда Ресселя (Рассела) применяется для изучения биохимических свойств энтеробактерий(шигелл, сальмонелл). Содержит питательный агар-агар, лактозу, глюкозу и индикатор (бромтимоловый синий).
Содержит питательный агар-агар, лактозу, глюкозу и индикатор (бромтимоловый синий).
Цвет среды травянисто-зелёный. Обычно готовят в пробирках по 5 мл со скошенной поверхностью. Посев осуществляют уколом в глубину столбика и штрихом по скошенной поверхности.
Среда Эндо
Среда Плоскирева (бактоагар Ж) — дифференциально-диагностическая и селективная среда, поскольку подавляет рост многих микроорганизмов, и способствует росту патогенных бактерий (возбудителей брюшного тифа, паратифов, дизентерии). Лактозоотрицательные бактерии образуют на этой среде бесцветные колонии, а лактозоположительные — красные. В составе среды — агар, лактоза, бриллиантовый зелёный, соли желчных кислот, минеральные соли, индикатор (нейтральный красный).
Висмут-сульфитный агар предназначен для выделения сальмонелл в чистом виде из инфицированного материала. Содержит триптический гидролизат, глюкозу, факторы роста сальмонелл, бриллиантовый зелёный и агар. Дифференциальные свойства среды основаны на способности сальмонелл продуцировать сероводород, на их устойчивости к присутствию сульфида, бриллиантового зелёного и лимоннокислого висмута. Маркируются колонии в чёрный цвет сернистого висмута (методика схожа со средой Вильсона-Блера).
Маркируются колонии в чёрный цвет сернистого висмута (методика схожа со средой Вильсона-Блера).
Метаболизм анаэробных организмовПравить
Метаболизм анаэробных организмов имеет несколько различных подгрупп:
Анаэробный энергетический обмен в тканях человека и животныхПравить
Основной источник: [12]
Анаэробное и аэробное энергообразование в тканях человека
Некоторые ткани животных и человека отличаются повышенной устойчивостью к гипоксии (особенно мышечная ткань).
В обычных условиях синтез АТФ идет аэробным путём, а при напряжённой мышечной деятельности, когда доставка кислорода к мышцам затруднена, в состоянии гипоксии, а также при воспалительных реакциях в тканях доминируют анаэробные механизмы регенерации АТФ. В скелетных мышцах выявлены 3 вида анаэробных и только один аэробный путь регенерации АТФ.
3 вида анаэробного пути синтеза АТФ
К анаэробным относятся:
- Креатинфосфатазный (фосфогеный или алактатный) механизм — перефосфорилирование между креатинфосфатом и АДФ
- Миокиназный — синтез (иначе ресинтез) АТФ при реакции трансфосфорилирования 2 молекул АДФ (аденилатциклаза)
- Гликолитический — анаэробное расщепление глюкозы крови или запаса гликогена, заканчивающийся образованием молочной кислоты (иначе именуется «лактатным»).

Необходимо отметить, что прямым следствием гликолиза является критическое снижение рН тканей — ацидоз. Это ведёт к снижению эффективного транспорта кислорода гемоглобином, и формирует положительную обратную связь.
Каждый механизм имеет своё время удержания максимальной мощности и оптимум энергообеспечения тканей.
Наибольшая мощность и наименьшее время удержания:
- ↑ Газогенерирующие контейнерные системы GasPak: Инструкция МК. — OOO «МК, официальный дистрибьютер Becton Dickinson International», 2010. — С. 7.
- ↑ 1 2 3 К. Д. Пяткин. Микробиология с вирусологией и иммунологией. — М:»Медицина», 1971. — С. 56.
- ↑ Л. Б. Борисов. Медицинская микробиология, вирусология и иммунология. — МИА, 2005. — С. 154—156. — ISBN 5-89481-278-X.
- ↑ Д. Г. Кнорре. Биологическая химия: Учеб. для хим., биол. и мед. спец. вузов. — 3. — М.: Высшая школа, 2000. — С.
 134. — ISBN 5-06-003720-7.
134. — ISBN 5-06-003720-7. - ↑ D. A. Eschenbach, P. R. Davick, B. L. Williams. Prevalence of hydrogen peroxide-producing Lactobacillus species in normal women and women with bacterial vaginosis. — J Clin Microbiol. 1989 February; 27(2): 251–256.
- ↑ М. В. Гусев, Л. А. Минеева. Микробиология. — М:МГУ, 1992. — С. 56.
- ↑ А. А. Воробьев. Атлас по медицинской микробиологии, вирусологии и иммунологии. — МИА, 2003. — С. 44. — ISBN 5-89481-136-8.
- ↑ Л. Б. Борисов. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии. — Медицина, 1992. — С. 31—44. — ISBN 5-2225-00897-6.
- ↑ J. H. Brewer, D. L. Allgeier. Disposable hydrogen generator. — Science 147:1033-1034. — 1966.
- ↑ J. H. Brewer, D. L. Allgeier. Safe self-contained carbon dioxide-hydrogen anaerobic system. — Appl. Microbiol.16:848-850. — 1966.
- ↑ G. F. Smirnova. Metabolism peculiarities of bacteria restoring chlorates and perchlorates.
 — Microbiol Z. 2010 Jul-Aug;72(4):22-8.
— Microbiol Z. 2010 Jul-Aug;72(4):22-8. - ↑ Филиппович Ю. Б., Коничев А. С., Севастьянова Г. А. Биохимические основы жизнедеятельности организма человека. — Владос, 2005. — С. 302. — ISBN 5-691-00505-7.
БАКТЕРОИДЫ — Большая Медицинская Энциклопедия
БАКТЕРОИДЫ (греческий bakterion палочка + eidos вид) облигатноанаэробные, не образующие спор, грамотрицательные бактерии палочковидной формы, относящиеся к роду Bacteroides семейства Bacteroidaceae. Бактероиды — одни из наиболее частых возбудителей неклостридиальных анаэробных и смешанных анаэробно-аэробных инфекций у человека.
Впервые грамотрицательные бесспоровые анаэробы были выделены Вейоном и Зюбером (A. Veillon, H. Zuber) в 1898 году у больного с абдоминальным абсцессом, о писаны как Bacillus fragilis; эти анаэробы вызывали абсцессы при экспериментальном заражении подопытных животных. В 1912 году Дистазо (A. Distaso) обнаружил подобные микробы в испражнениях здоровых людей. Кастеллани (A. Castellani) и Чалмерс (A. J. Chalmers) в 1919 году предложили для этих бактерий родовое название Bacteroides.
Castellani) и Чалмерс (A. J. Chalmers) в 1919 году предложили для этих бактерий родовое название Bacteroides.
Семейство Bacteroidaceae состоит из трех родов; Bacteroides, насчитывающий 22 вида, Fusobacterium, объединяющий 16 видов, и Leptotri-chia, включающий 5 видов. В 1979 году Колли (J. G. Collee) предложил разделить род Bacteroides на три группы на основе их устойчивости к 20% желчи в питательной среде, пигментообразовании и сахаролитической активности в отношении глюкозы, мальтозы, сахарозы, маннита, рамнозы, трегаллозы (табл. 1).
Бактероиды — палочки с биполярной окрашиваемостью, размером 0,5—0,8 X 1 —3 мкм, морфологически сходные или с выраженным полиморфизмом, неподвижные или движущиеся с помощью перитрихиально расположенных жгутиков, нередко имеют полисахаридную капсулу, являющуюся важным фактором вирулентности (см.). Различные виды варьируют по своей чувствительности к окислительно-восстановительному потенциалу. Окисленные среды тормозят рост бактероидов. В пределах вида рост бактероидов зависит также от величины посевной дозы.
При росте на кровяном агаре бактероиды образуют округлые, слабо выпуклые, полупрозрачные сероватые или черно-коричневые колонии, часто имеющие внутри включения в форме концентрических колец, диаметр колоний 1—3 мм, менее 1% штаммов бактероидов вызывают гемолиз. При росте бактероидов на жидкой питательной среде происходит равномерное помутнение бульона и образование осадка. Основными компонентами питательных сред для культивирования бактероидов являются пептон, мясной экстракт, дрожжевой экстракт, глюкоза и кровь. Стимулируют рост бактероидов гемин, витамин Кх (менадион), для некоторых видов — бычья желчь. Рост бактероидов улучшается также, если в окружающей анаэробной атмосфере содержится углекислый газ (5—10%). Бактероиды растут в значительном диапазоне температур (от 25 до 45°), оптимум роста при t 37°. Оптимальное значение pH питательных сред 7,0.
При росте на глюкозопеитонном бульоне бактероиды продуцируют в качестве конечного продукта метаболизма смесь жирных кислот: большое количество янтарной и небольшое количество уксусной, пропионовой, изовалериановой, изомасляной и масляной. Бактероиды образуют протеолитические ферменты, некоторые виды продуцируют нейраминидазу, действующую как фактор распространения бактерий. Устойчивые к Р-лактамным антибиотикам бактероиды продуцируют Р-лак-тамазы, разрушающие пенициллины и цефалоспорины.
Бактероиды образуют протеолитические ферменты, некоторые виды продуцируют нейраминидазу, действующую как фактор распространения бактерий. Устойчивые к Р-лактамным антибиотикам бактероиды продуцируют Р-лак-тамазы, разрушающие пенициллины и цефалоспорины.
Антигенные свойства бактероидов изучены недостаточно. Общий родовой антиген для бактероидов не описан. Bacteroides fragilis — пока единственный вид бактероидов, для которого доказано наличие видоспецифического антигена; в диагностических целях используют капсульный полисахаридный антиген.
Бактероиды —одни из основных представителей нормальной микрофлоры человека (см.) и животных. В наибольшем количестве бактероиды содержатся в толстой кишке (около 30% всех микробов), значительно преобладая над аэробной микрофлорой, в том числе в сотни раз превышая количество кишечных палочек. Среднее количество бактероидов в 1 г фекалий взрослого здорового человека составляет св. 10 млрд. и зависит от физиологического состояния организма и диеты. У лиц, находящихся на смешанной диете, обнаруживается больше бактероидов, чем у людей, в диете которых преобладают углеводы. Более интенсивному размножению и метаболизму бактероидов способствует диета, богатая животными продуктами. При стрессовых состояниях содержание В. thetaiotaomicron в толстой кишке может быть повышено и составлять 20—30% всей микрофлоры (при норме 2—4%). Наиболее часто в микрофлоре фекалий здорового взрослого человека встречаются В. vulgatus (12%), В. thetaiota-omicron (до 4,5%), В. fragilis (0,5%). Из бактероидов, являющихся условно-патогенными микробами (см.), наиболее частым возбудителем анаэробных и смешанных анаэробно-аэробных инфекций является В. fragilis.
У лиц, находящихся на смешанной диете, обнаруживается больше бактероидов, чем у людей, в диете которых преобладают углеводы. Более интенсивному размножению и метаболизму бактероидов способствует диета, богатая животными продуктами. При стрессовых состояниях содержание В. thetaiotaomicron в толстой кишке может быть повышено и составлять 20—30% всей микрофлоры (при норме 2—4%). Наиболее часто в микрофлоре фекалий здорового взрослого человека встречаются В. vulgatus (12%), В. thetaiota-omicron (до 4,5%), В. fragilis (0,5%). Из бактероидов, являющихся условно-патогенными микробами (см.), наиболее частым возбудителем анаэробных и смешанных анаэробно-аэробных инфекций является В. fragilis.
Физиологическое значение бактероидов во многом не ясно, однако известно, что они проявляют антагонистическую активность по отношению к шигеллам, сальмонеллам и некоторым эшерихиям.
Бактероиды проявляют патогенные свойства при изменении иммунитета. Они выступают в качестве инфекционных агентов при самых разнообразных заболеваниях гнойного и септического характера, могут поражать любые органы и ткани организма человека или животного, в очагах инфекции находятся в ассоциации с другими анаэробными и аэробными микробами. Бактероиды выделяют при гнойном перитоните, аппендиците, эндометрите, аднексите, кольпите, септическом аборте, абсцессе внутренних органов, плеврите, пневмонии, при поражениях костей и суставов, при пародонтозе и воспалительных заболеваниях ротовой полости, кожи, подкожной клетчатки. Бактероидный инфекционный процесс любой локализации может осложниться эндокардитом (см.) или сепсисом (см.).
Для эффективного лечения болезней, вызванных бактероидами, большое значение имеет микробиологическая диагностика. Успешное выделение бактероидов во многом зависит от правильного забора и доставки материала в лабораторию. Если есть возможность получить патологический материал с помощью пункции, его следует доставить в шприце, вытеснив из него воздух. Доставка материала на обычном тампоне малоэффективна. Тампоны лучше доставлять в транспортной среде либо забирать материал тампоном, имнрегнированным 10% раствором гемоглобина. Вместо гемоглобина можно использовать лизированную донорскую кровь (10% лизированной крови, 10% глицерина, 80% изотонического раствора хлорида натрия).
Посев материала производят на плотные и жидкие питательные среды. Плотные среды содержат лизированную кровь и при необходимости канамицин или неомицин — ингибиторы сопутствующей факультативно-анаэробной микрофлоры. Посевы инкубируют не менее 2 суток (из-за медленного роста бактероидов) в анаэробных условиях при t° 37°. Одновременно с посевом производят микроскопию окрашенного по Граму мазка из патологического материала.
Посевы просматривают с помощью лупы с 6—8-кратным увеличением или стереоскопического микроскопа (см.). Описывают морфологию каждого вида колоний, пересевают их на жидкую питательную среду и инкубируют в анаэробных условиях в течение 48—72 часов (для получения чистой культуры), а также пересевают на кровяной агар и инкубируют в аэробных условиях в течение 24—48 часов (для определения аэротолерантности). Из этих же колоний готовят мазки для окраски по Граму. Выросшие на кровяном агаре в аэробных условиях колонии расцениваются как факультативно анаэробные бактерии. Чистую культуру грамотрицательных анаэробных бактерий, полученную на жидкой питательной среде, исследуют на подвижность (с помощью фазовоконтрастного микроскопа) и на чувствительность к антимикробным препаратам.
До уровня семейства бактероиды можно идентифицировать на основании отрицательной окраски по Граму, отсутствия роста в аэробных условиях, отсутствия спорообразования, установления перитрихиально расположенных жгутиков, если бактерии подвижны. Способность к спорообразованию проверяют прогреванием пятисуточной культуры на жидкой питательной среде с крахмалом (1 г на 1 i среды) при t° 80° в течение 10 минут. Выжившие клетки свидетельствуют о их спорогенности. Тип жгутиков определяют соответствующим методом окраски (см. Леффлера методы).
До рода и вида бактероиды идентифицируют на основании определения продуктов метаболизма (состав жирных к-т Ci—Св, а также янтарной и молочной кислот) с помощью газожидкостной хроматографии (см.) и изучения ферментативной активности. В таблице 2 представлены данные Бартлетта (J. G. Bartlett) с сотр. (1975), позволяющие ориентировочно идентифицировать бактероиды группы В. fragilis.
Предпринимаются попытки ускоренной идентификации бактероидной группы
В. fragilis и В. melaninogenieus с помощью реакции иммунофлюоресценции (см.) в прямой и непрямой модификациях. Для обнаружения бактероидов непосредственно в патологическом материале необходимы соответствующие специфические диагностические сыворотки. Для подтверждения этиологической роли бактероидов при различных воспалительных заболеваниях (например, при поражениях тазовых органов у женщин) используют серологическую диагностику. При этом применяют радиоиммунологический метод (см.) и иммуно-ферментный метод выявления антител, а также определяют титры антител против В. fragilis в парных сыворотках.
Бактероиды наиболее чувствительны к метранидазолу, левомицетину, некоторым цефалоспоринам и др. Некоторые виды бактероидов, за исключением В. fragilis, могут быть чувствительны к пенициллину, но необходимо учитывать, что бактероиды могут продуцировать бета-лактамазы. Бактероиды устойчивы к стрептомицину, гентамицину, канамицину, мономицину. Для успешной антибактериальной терапии необходимо определение чувствительности выделенных бактерий к химиопрепаратам. При лечении инфекций, вызываемых бактероидами, также необходимо помнить, что эти инфекции носят смешанный характер: бактероиды чаще всего выделяются в ассоциации с другими микроорганизмами.
Специфическая профилактика бактероидных инфекций — вакцины и сыворотки — пока не разработана.
См. также Анаэробы, Бактерии, Фузобактерии.
Таблица 1. КЛАССИФИКАЦИЯ НЕКОТОРЫХ ВИДОВ БАКТЕРОИДОВ ПО ГРУППАМ В ЗАВИСИМОСТИ ОТ ИХ ОТНОШЕНИЯ К САХАРАМ, УСТОЙЧИВОСТИ К ЖЕЛЧИ И ОБРАЗОВАНИЮ ПИГМЕНТА (по Колли, 1979)
№ группы | Виды бактероидов | Признаки, отличающие различные виды бактероидов |
I | В. fragilis, В. thetaiotaomicron, В. ovatus, В. | Сахаролитические, не образуют пигмента, устойчивы к желчи |
II | В. melaninogenicus subsp. melaninogenicus, subsp. | Сахаролитические, образуют пигмент, чувствительны к желчи |
III | B. asaccharolyticus, B. putredinis, B. praeacutus, B. | H e с а х а р о литические |
* Новое название В. ureolyticus. | ||
Таблица 2. ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ НЕКОТОРЫХ ВИДОВ БАКТЕРОИДОВ, НАИБОЛЕЕ ЧАСТО ВЫДЕЛЯЕМЫХ ИЗ ПАТОЛОГИЧЕСКОГО МАТЕРИАЛА (по Бартлетту, 1975)
Виды бактероидов | Признаки | ||||||||
Морфология | Ингибиторы роста бактероидов | Биохимические свойства бактероидов | |||||||
Клеток | Колоний | Канамицин, | Пенициллин, 2 ЕД/мл | Желчь, 20% | Индол | Гидролиз эскулина | Рамноза | Трегаллоза | |
В. fragilis | Короткие, | Серые, | Устойчив | Устойчив | Устойчив | _ | + | _ | _ |
В. vulgatus | овоидные, | гладкие, | Устойчив | Устойчив | Устойчив | _ | 4- | + | _ |
В. thetaiota- | вакуоли- | края ров | Устойчив | Устойчив | Устойчив | 4- | “Г | + | |
omicron | зировзн- | ные, диа | Устойчив | Устойчив | Устойчив | 4- | ~г | ~г | в |
В. ovatus В. distasonis | ные палочки | метр 1 — 2 мм | Устойчив | Устойчив | Устойчив | + | в | + | |
В. oralis | Короткие, овоидные палочки | Серо-белые, гладкие | Чувстви телен | Чувствителен | Чувствителен | СП | СП | СП | |
В. melanino-genicus | Равномерно окрашенные, полиморфные кокко-бактерии | Черно-коричневые | Чувствителен | Чувстви телен | Устойчив | в | СП | ||
В. corrodens | Тонкие палочки с закругленными концами | Плоские, размазанные, разъедающие поверхность агара | Чувстви телен | Чувстви телен | Чувстви телен | ||||
Условные обозначения: + наличие признака, — отсутствие | |||||||||
Библиогр.: Балтрашевпч А. К. Микробы семейства Bacteroidaceae в патологии человека и животных, Журн, микр., эпид, и иммун., № 10, с. 14, 1979, библиогр.; Толстых П. И., Коган А. X. и Туман с кий А. В. Анаэробная газовая инфекция, Хирургия, № 5, с. 102, 1981, библиогр.; Bergey’s manual of determinative bacterilogy, ed. by R. E. Buchanan a. N. E. Gibbons, Baltimore, 1975; С о 1 1 e e J. G. Current classification of anaerobic bacteria, J. infect. Dis., v. 1, suppl. 1, p. 3, 1979; International symposium on anaerobic bacteria, laboratory aspects, pathogenicity, human immune response to infection and serology, ed. by D. W. Lambe a. o., N. Y., 1980; M а с y J. M. a. Probst I. Th,e biology of gastrointestinal bacteroides, Ann. Rev. Microbiol., v. 33, p. 561, 1979, bibliogr.
E. П. Пашков, A. А. Петраков.
Анаэробные микроорганизмы
1. Характеристика анаэробов
2. Диагностика ЭМКАРа
1. Распространение анаэробных микроорганизмов в природе.
Анаэробные микроорганизмы находятся повсеместно там, где происходит разложение органических веществ без доступа О2: в разных слоях почвы, в прибрежном иле, в кучах навоза, в созревающем сыре и т. д.
Встречаются анаэробы и в хорошо аэрируемой почве, если там есть аэробы, поглощающие О2.
В природе встречаются как полезные, так и вредные анаэробы. Например, в кишечнике животных и человека имеются анаэробы, приносящие пользу хозяину (B. bifidus), играющий роль антагониста к вредной микрофлоре. Этот микроб сбраживает глюкозу и лактозу и образует молочную кислоту.
Но в кишечнике есть гнилостные и патогенные анаэробы. Они расщепляют белки, вызывают гниение и различные виды брожения, выделяют токсины (B. Putrificus, B. Perfringens, B. tetani).
Расщепление клетчатки в животном организме осуществляется анаэробами и актиномицетами. В основном этот процесс пробегает в пищеварительном тракте. В основном анаэробы встречаются в преджелудках и толстом отделе кишечника.
Большое количество анаэробов находится в почве. Причем некоторые из них могут находится в почве в вегетативное форме и там же размножаться. Например, B. perfringens. Как правило, анаэробы являются спорообразующими микроорганизмами. Споровые формы обладают значительной устойчивостью к воздействию внешних факторов (химических веществ).
2. Анаэробиоз микроорганизмов.
Несмотря на разнообразие физиологических особенностей микроорганизмов – химический состав их, в принципе, одинаков: белки, жиры, углеводы, неорганические вещества.
Регулирование процессов обмена веществ осуществляется ферментативным аппаратом.
Термин анаэробиоз (an – отрицание, aer – воздух, bios — жизнь) ввел Пастер, который впервые обнаружил анаэробный спороносный микроб B. Buturis, способный развиваться в отсутствие свободного О2 и факультативных, развивающихся в среде, содержащей 0,5%О2 и могут связывать его (например, B. chauvoei).
Анаэробных процессах – при окислении происходит ряд дегидрогенераций, при которых «2Н» последовательно передаются с одной молекулы в другую (в конечном счете участвует О2).
На каждом этапе освобождается энергия, которую клетка использует для синтеза.
Пероксидаза и каталаза – ферменты, которые способствуют использованию или удалению Н2О2 образующийся при этой реакции.
Строгие анаэробы не имеют механизмов связывания с молекулами кислорода, по этому не разрушают Н2О2.Анаэробное действие каталазы и Н2О2 сводится к анаэробному восстановлению железа каталазы перекисью водорода и к аэробному окислению молекулой О2.
3. Роль анаэробов в патологии животных.
В настоящее время считается установленными такие заболевания вызываемые анаэробами:
-ЭМКАР – B. Chauvoei
-некробациллез – B. necrophorum
-возбудитель столбняка – B. Tetani.
По течению и клиническим признакам эти заболевания трудно дифферинцировать и только бактериологические исследования дают возможность выделить соответствующий возбудитель и установить причину заболевания.
Некоторые из анаэробов имеют несколько серотипов и каждый из них вызывает различные заболевания. Например, B. perfringens – 6 серогрупп: A, B, C, D, E, F – которые отличаются по биологическим свойствам и токсинообразованию и вызывают разные заболевания. Так
— B. perfringens тип А – газовую гангрену у людей.
— B. perfringens тип В – B. lamb – dysentery – анаэробною дизентерию у ягнят.
— B. perfringens тип С – (B. paludis) и тип D (B. ovitoxicus) – инфекционную энтэроксэмию овец.
— B. perfringens тип E – кишечную интоксикацию у телят.
Определенную роль анаэробы играют в происхождении осложнений при других заболеваниях. Например, при чуме свиней, паратифе, ящуре и др. в следствие чего процесс усложняется.
4. Способы создания анаэробных условий для выращивания анаэробов.
Различают: химический, физический, биологический и комбинированный.
Питательные среды и культивирование на них анаэробов.
1.Жидкие питательные среды.
А)Мясо пептонный печеночный бульон – Среда Китт-Тороццы-является основной жидкой питательной средой
Для его приготовления используется 1000 г. бычьей печени, которую заливают 1.л водопроводной воды и стерилизуют 40 мин. При t=110 С
— разводят 3-х кратным количеством МПБ
— устанавливаю рн=7,8-8,2
— + на 1 л. бульона 1,25 г. Nacle
— добавляют маленькие кусочки печени
— на поверхность среды наслаивают вазелиновое масло
— автоклавируют t=10-112 C – 30-45 мин.
Б) Мозговая среда
Состав – свежий мозг крс(не позже 18 часов),очищают от оболочек и измельчают на мясорубке
— смешивают с водой 2 : 1 и пропускают через сито
— смесь разливают по пробиркам и стерилизуют 2 часа при t=110
Плотные питательные среды
А)Кровяной сахарный агар цейсмера используют для выделения чистой культуры и определения характера роста.
Пропись агара Цейсслера
— 3% МПА разливают по 100мл. и стерилизуют
— к расплавленному агару добавляют стерильно! 10 мл. 20% глюкозы (т. с. 2%)и 15-20 мл. стерильной крови барана, крс, лошади
— Подсушивают
Б) желатина — столбиком
Для определения вида анаэробов необходимо изучать такие их признаки:
Морфологические ,культуральные, патологические и серологические с учетом их возможностей к изменчивости.
Морфологические и биохимические свойства анаэробов
Морфологические особенности – характеризуются выраженным многообразием. Формы микробов в мазках, приготовленных из органов, резко отличаются от форм микробов, полученных на искусственных питательных средах. Чаще им присуща форма палочек или нитей и реже кокков. Один и тот же возбудитель может быть и в виде палочек, так и сгруппированными нитями. В старых культурах можно обнаружить в форме кокков (например, B. Necrophorum).
Самыми крупными являются B. Gigas и B. Perfringens имеющие длину до 10 мкм. И ширину 1-1,5 мкм.
Неколько меньше B. Oedematiens 5-8 х 0,8 –1,1. Вместе с тем длина нитей Vibrion Septicum достигают 50-100 мкм.
Среди анаэробов большинство спорообразующих микроорганизмов. Споры располагаются по разному в этих микроорганизмов. Но чаще это Clostridium тип(closter — веретено)Споры могут иметь круглую овальную форму. Расположение спор характерно для определенных видов бактерий: в центре- палочки B. Perfringens, B. Oedematiens и т. д. или же субтерминально(несколько ближе к концу )- Vibrion Septicum, B.Histolyticus и др. а также терминальноB. Tetani
Споры образуются по одной в клетке. Споры, как правило, образуются после гибели животного. Эта особенность состоит с функциональным назаченим спор как сохранение вида в неблагоприятных условиях.
Некоторые анаэробы подвижные и жгутики расположены по перетрическому типу.
Капсула обладает защитной функцией и имеет запасные питательные вещества.
Основные биохимические свойства анаэробных микроорганизмов
По способности разлагать углеводы и белки анаэробов разделяют на сахаролитические и протеолитические.
Описание важнейших анаэробов.
Фезер — 1865 г. в докожной клетчатке коровы.
B. Schauvoei — является возбудителем острого неконтактного инфекционного заболевания, поражающего главным образом КРС и овец. Возбудитель открыт в1879-1884 гг. Арлуенком, Корневеном, Томасом.
Морфология и окраска: в мазках приготовленных из патологического материала (отечная жидкость, кровь, пораженые мышцы, серозные оболочки) B. Schauvoei имеет вид палочек с закругленными концами 2-6 мкм. х 0,5-0,7 мкм. Обычно палочки встречаются поодиночно, но иногда можно встретить короткие цепочки (2-4). Нитей не образует. По своей форме полиморфен и часто имеет формы вздутых бацилл, лимонов, шаров, дисков. Особенно четко полиморфизм наблюдается в мазках, приготовленных из ткани животного и сред, богатых белками и свежей кровью.
B. Schauvoei представляет собой подвижную палочку, имеющие жгутики по 4-6 с каждой стороны. Капсул не образует.
Споры большие, форма от круглой до продолговатой. Спора располагается центрально или субтерминально. Споры образуются как в тканях, так и вне организма. На искусственных питательных средах спора появляется через 24-48 часов.
B. Schauvoei окрашивается почти всеми красителями. В молодых культурах Г+,в старых –Г-.Палочки воспринимают окраску зернисто.
Заболевания ЭМКАР – носит септический характер и поэтому Сl. Schauvoei встречаются не только в органах с патологическими отклонениями, но также в эксудате перикарда, на плевре, в почках, печени, селезенке, в лимфатических узлах, костном мозге, в коже и эпителиальном слое, в крови.
В невскрытом трупе бациллы и другие микроорганизмы быстро размножаются, и поэтому выделяется смешанная культура.
Культуральные свойства. На МППБ Cl. Chauvoei дает обильный рост через 16- 20 часов. В первые часы равномерное помутнение, к 24 часам- постепенное просветление, а к 36 – 48 часам — столбик бульона совершенно прозрачный, а на дне пробирки осадок из микробных тел. При интенсивном встряхивании осадок разбивается в равномерную муть.
На бульоне Мартена – после 20-24 часов роста наблюдается помутнение и обильное выделение газа. Через 2-3 суток — на дне хлопья, просветление среды.
Cl. Chauvoei хорошо растет на мозговой среде, образуя небольшое количество газов. Почернение среды не наступает.
На агаре Цейсмера (кровяном) образует колонии похожие на перламутровую пуговицу или виноградный лист, плоские, в центре имеют возвышение питательной среды, цвет колоний — нежно-фиолетовый.
B. Schauvoei свертывает молоко на 3-6 сутки. Коагулированное молоко имеет вид мягкой, губчатой массы. Пептонизация молока не наступает. Желатину не разжижает. Свернутую сыворотку не разжижает. Индол не образует. Нитриты в нитраты не редуцирует.
Вирулентность на искусственных питательных средах быстро утрачивается. Для поддержания ее необходимо проводить пассаж через организм морских свинок. В кусочках высушенных мышц сохраняет свою вирулентность в течении многих лет.
B. Schauvoei разлагает углеводы:
— глюкозу
— галактозу
— левулезу
— сахарозу
— лактозу
— мальтозу
Не разлагает — маннит, дульцит, глицерин, инулин, салицин. Однако надо признать, что отношение Cl. Chauvoei к углеводам непостоянное.
На агаре по Вейону +2% глюкозы или сывороточном агаре образуются круглые или чечевицеподобные колонии с отростками.
Антигенная структура и токсинообразование
Cl. Chauvoei установлен О — антиген-соматический-термостабильный, несколько Н-антигенов-термолябильных, а также споровый S-антиген.
Cl. Chauvoei – вызывает образование агглютининов и комплемент связывающих антител. Образует ряд сильных гемолитических, некротизирующих и летально действующих токсинов белкового характера, которые обуславливают патогенность возбудителя.
Устойчивость обусловлена наличием споры. В гниющих трупах сохраняется до 3-х месяцев, в кучах навоза с остатками животной ткани — 6 мес. Споры сохраняются в почве до 20-25 лет.
Кипячение в зависимости от питательной среды 2-12 мин.(мозговая), бульонные культуры 30 мин. – t=100-1050С, в мышцах – 6 часов, в солонине – 2 года, прямые солнечные лучи – 24 часа, 3% раствор формалина – 15 мин., 3% раствор карболовой кислоты слабо действует на споры, 25% NaOH – 14 часов, 6% NaOH – 6-7 дней. Низкая температура не оказывает действие на споры.
Чувствительность животных.
В естественных условиях болеет КРС в возрасте от 3 мес. до 4 лет. Животные до 3 мес. не болеют (колостральный иммунитет), старше 4 лет – животные переболели в латентной форме. Не исключено заболевание до 3 мес. и старше 4 лет.
Болеют также овцы, буйволы, козы, олени, но редко.
Верблюды, лошади, свиньи невосприимчивы (отмечались случаи).
Человек, собаки, кошки, куры невосприимчивы.
Лабораторные животные – морские свинки.
Клиника
Инкубационный период 1-5 дней. Прохождение болезни острое. Заболевание начинается неожиданно повышается температура до 41-43 С. Сильное угнетение остановка жвачки. Часто симптомирует безпричинная хромота, которая сведетильствует о порожение глубоких слоев мускулатуры.
В отделе туловища, поясници, плеча, реже грудины, шее, подчелюстного пространства появляются восполительные опухоли — твердые, горячие, болезненые, а вскоре становятся холодные и бездолезненные.
Перкусия – темпанический звук
Пальпация – крупитацию.
Кожа преобретает темно – синий цвет. Овцы — шерсть на месте опухоли торчит.
Продолжительность болезни 12-48 часов, реже 4-6 дней.
Пат. анатомия: труп очень вздутый. Из носа выделяется кровянистая пена кисловатого запаха(прогорклое масло).Подкожная клетчатка в месте поражения мышц содержит инфильтраты, кровоизлияние, газ. Мышцы черно-красного цвета, покрыты кровоизлияниями, сухие, пористые, при надавливание хрусят. Оболочки с кровоизлияниями. Селезенка, печень увеличены.
что это, характеристика, свойства, патогенность
Бактероиды (Bacteroides) — микроорганизмы, входящие в состав условно-патогенной микрофлоры человека. Основными представителями многочисленного рода Bacteroides являются: В. fragilis, В. ureolyticum, В. thetaiotaomieron, B.melaninogenicus. Именно они чаще других вызывают анаэробные инфекции у человека.
Род Bacteroides представлен микробами двух групп:
- Аэробными бактериями B.urealyticus и B.gracilis, которые являются возбудителями инфекций органов дыхания, ЖКТ, мочевыделительной системы;
- Анаэробными бактериями B. fragilis и B. melaninogenicus, которые вызывают гнойно-воспалительные заболевания у лиц с иммунодефицитом.
Термин «бактероиды» в переводе с древнегреческого языка означает «палочка, вид». Микробы этого семейства впервые были выделены в 1898 году от больного с абдоминальным абсцессом. В 1912 году они были обнаружены в испражнениях здоровых людей. В 1919 году бактерии получили свое родовое название Bacteroides.
Бактероиды содержатся в большом количестве в толстой кишке. При этом они значительно преобладают над аэробной микрофлорой и в сотни раз превышают количество кишечных палочек. Их физиологическое значение связано с антагонистической активностью, которую микробы проявляют к шигеллам, сальмонеллам и энтеропатогенным эшерихиям.
Свойства бактериодов
Bacteroides fragilis
Морфология. Bacteroides spp. – палочковидные бактерии, имеющие средний размер и разнообразную форму: изогнутую, спиралевидную, овальную. Палочки не имеют жгутиков, спор и капсул, за исключением Bacteroides fragilis. Геномы изученных видов представлены кольцевыми двуцепочечными молекулами ДНК.
- Тинкториальные свойства. Бактероиды окрашиваются по Граму в красный цвет и располагаются в мазке одиночно или парами. Тонкие ветвящиеся палочки могут содержать большие вакуоли.
- Физиологические свойства. Большинство бактероидов — строгие анаэробы. Они растут в значительном диапазоне температур от 25 до 45 °С, оптимальное значение рН питательных сред 7—7,4. Микробы обладают малой устойчивостью во внешней среде. Они чувствительны к различным дезинфектантам. В качестве источника энергии бактерии используют химические соединения, а в качестве источника углерода – органические вещества.
- Культуральные свойства. Бактероиды требовательны к питательным средам. Им необходимы специальные условия для роста и размножения — двуокись углерода и менадион. Для выделения чистой культуры в лабораторных условиях используют специальные сложные среды, обогащенные гемином, пептоном, дрожжевым экстрактом, глюкозой, бычьей желчью. Микробы размножаются медленно: посевы выдерживают в термостате в течение пяти суток. На пластинчатых средах с кровью бактероиды растут в виде мелких округлых выпуклых колоний, лишенных пигмента или имеющих черную, серую или темно-коричневую окраску с включениями в форме концентрически расположенных колец. При росте в жидких средах образуют равномерную муть с осадком.
- Биохимические свойства. Большинство бактероидов не продуцируют каталазу, не ферментируют глюкозу, лактозу, мальтозу или расщепляют данные сахара с образованием кислот — янтарной, уксусной, пропионовой, изовалериановой, изомасляной и масляной. Они метаболизируют пептон и промежуточные продукты обмена. Бактероиды вовлечены в процессы утилизации белков и биотрансформации желчных кислот, восстановления холестерина, гидролиза мукополисахаридов.
- Факторы патогенности бактероидов: эндотоксин – липополисахарид наружной мембраны клеточной стенки; О – антиген, структура которого остается неизученной; капсула; пили. Фимбрии, белки-адгезины и белки-агглютинины обеспечивают адгезию – позволяют микробам хорошо связываться с тканями хозяина. Капсула B.fragilis выполняет защитную функцию – уклонение от иммунного ответа хозяина. Большинство бактероидов аэротолерантны – устойчивы к токсическому действию кислорода. Ферменты инвазии, разрушающие ткани хозяина – нейраминидаза, фибринолизин, гепариназа, ДНК-аза, гиалуронидаза, хондроитинсульфатаза, гемолизин.
Эпидемиология
Различные штаммы бактероидов появляются у человека спустя 10 дней после рождения. Естественным их ареалом является толстый кишечник, а также дыхательные пути, полость рта, половые органы и мочевыводящий тракт. Для бактероидов характерен вертикальный путь передачи — от матери ребенку. В процессе рождения эти микробы становятся частью нормальной микрофлоры и не вызывают патологии.
В норме количество бактероидов в кале у детей и взрослых составляет 107 — 108 КОЕ/г. Эти бактерии участвуют в процессе переваривания пищи – в переработке жиров в организме. Снижение бактероидов в кале обусловлено длительной антибиотикотерапией или кишечными инфекциями бактериальной или вирусной этиологии. Увеличение количества бактероидов связано с обилием в рационе жирных продуктов.
Под воздействием негативных эндогенных и экзогенных факторов они приобретают патогенные свойства и вызывают гнойно-воспалительные заболевания брюшины, червеобразного отростка, мочевого пузыря, клапанов сердца, легких, мозговых оболочек, кожи, среднего уха, пазух носа.
Бактероиды находятся в полостных органах, связанных с внешней средой. Они отсутствуют у здоровых людей в стерильных внутренних органах и брюшной полости. При микробном дисбалансе патогенные штаммы бактериодов становятся возбудителями воспаления шейки матки, эндометрия, яичников, простаты, уретры. Эти заболевания отличаются упорным течением и частым рецидивированием. Бактероиды могут вызывать ДВС-синдром, который приводит к тяжелому флебиту и тромбозу. В тяжелых случаях наблюдается эндокардит и бактериемия. Травмы и повреждения кишечной стенки становятся причинами образования абсцессов в разных частях тела: печени, малом тазу, легких, головном мозге. Бактероиды способны вызывать опасные для жизни патологии – внутрибрюшной сепсис, перфорированный и гангренозный аппендицит, септический артрит, неспецифический язвенный колит, болезнь Крона.
Бактероидозы являются осложнением оперативных вмешательств на толстом кишечнике, мочевых путях, матке. Обычно бактероиды обнаруживаются в ассоциациях с другими микробами.
Симптомы
Бактероиды являются представителями кишечного эубиоза — совокупности микробных популяций, населяющих толстый кишечник здорового человека. Они относятся к облигатной группе бактерий. Наряду с бифидобактериями, лактобактериями, кишечной палочкой и энтерококками бактероиды постоянно обитают в кишечнике. Резидентная микрофлора составляют около 90% от общего числа микроорганизмов.
Под воздействием неблагоприятных факторов внешней среды происходят изменения в составе нормальной кишечной микрофлоры, формируется дисбиоз, сопровождающийся рядом клинических симптомов. При снижении количества бактероидов нарушается их антагонистическая, иммунотренирующая и метаболическая функция. Причинами подобных расстройств являются: недоношенность, искусственное вскармливание, заболевания ЖКТ, длительное лечение антибиотиками, гормонами, цитостатиками, лучевая терапия.
Изменение количества представителей условно-патогенных кишечных микроорганизмов, в том числе и бактероидов соответствует 2, 3 и 4 степени дисбактериоза. При этом 3 и 4 степени характеризуются появлением тяжелых кишечных дисфункций. У больных возникает боль в животе, вздутие, урчание, тошнота и рвота, отрыжка, изжога, неустойчивый стул, при котором запоры сменяются поносами. Постепенно к данным признакам присоединяется симптомы стоматита, фарингита, холецистита, уретрита, пиелонефрита, пневмонии.
В мазке из влагалища здоровой женщины обнаруживают гарднереллы, бактероиды, фузобактерии, велионеллы, пептококки и другие. Эти микроорганизмы относятся к транзиторной микрофлоре — непостоянно присутствующей во влагалище. В норме их количество очень мало. Под воздействием ряда факторов молочнокислые бактерии уничтожаются, среда во влагалище становится щелочной, транзиторные микроорганизмы начинают активно размножаться, что приводит к развитию бактериального вагиноза. У женщины появляются выделения из половых путей с неприятным запахом пропавшей рыбы. Они жидкие, беловатые или сероватые. Больные жалуются на жжение, зуд, дизурические расстройства, боль или неприятные ощущения при половых контактах. Усиленное размножение бактероидов во влагалище может закончиться не только развитием бактериального вагинита. Они проникают в вышележащие отделы половой системы и вызывают цервицит, эндометрит, сальпингит, аднексит.
Мужчины также могут быть носителями транзиторных микробов. Обычно это лица, перенесшие венерические болезни, страдающие воспалением простаты или часто применяющие для профилактики антисептические средства. У мужчин воспалительный процесс не развивается, конкретные жалобы отсутствуют.
Диагностика
Основным методом диагностики заболеваний, вызванных бактероидами, является лабораторный. В микробиологический лаборатории исследуют кровь, гной, ликвор, мокроту, мочу, кал, отделяемое влагалища и другой биоматериал от больных, в зависимости от места локализации патологического процесса. Принцип взятия и транспортировки исследуемого материала – исключение контакта с атмосферным воздухом. Оптимальный вариант — доставка проб в шприцах с удаленным воздухом.
С помощью микроскопа и окраски мазка по Граму обнаруживают грамотрицательные биполярно окрашенные полиморфные палочки, располагающиеся по одиночке, парами или короткими цепочками.
Бактериологическое исследование заключается в посеве материала на плотные и жидкие питательные среды с целью выделения чистой культуры и определения ее культуральных, биохимических и физиологических свойств с применением тест-систем. Для этого используют кровяной или сывороточный агар, тиогликолевую среду, жидкие среды с гемином, мозговой тканью и витаминами. Плотные питательные среды содержат лизированную кровь, а также антибиотики «Канамицин» или «Неомицин» для подавления роста сопутствующей микрофлоры.
Посевы инкубируют в анаэробных или микроаэрофильных условиях в течение 5-7 дней. Даже при кратковременной экспозиции с кислородом рост бактероидов прекращается. Нередко обращает на себя внимание отвратительный запах при росте микробов на питательных средах. После выделения и накопления чистой культуры идентифицируют полученный микроорганизм и определяют его чувствительность к антибиотикам.
Характер роста:
- В. fragilis – мелкие, вогнутые, серовато-белые колонии без гемолиза.
- В. melaninogenicu — гладкие колонии черного цвета с зоной гемолиза вокруг.
Бактероидоз – классическая полиинфекция, при которой монокультуры практически не выделяются. Бактероиды обычно находятся в ассоциациях с клостридиями, фузобактериями, вейлонеллами, стрептококками.
Серологическое исследование проводят при септицемии и тяжелых воспалительно-гангренозных процессах. В крови больных быстро и в больших количествах вырабатываются антитела. Высокие титры антител определяют с помощью реакции агглютинации, преципитации в геле и непрямой гемагглютинации.
Ускоренная идентификации микробов бактероидной группы:
- Прямая и непрямая реакция иммунофлюоресценции,
- Радиоиммунологический метод,
- ИФА.
Лечение
Чтобы избавиться от бактероидов, оказывающих патогенное воздействие на организм, необходимо пройти курс противомикробной терапии. Больным назначают антибиотики широкого спектра действия из группы пенициллинов, цефалоспоринов, фторхинолонов. Бактероиды устойчивы к макролидам и аминогликозидам. Чтобы лечение антибиотиками было эффективным, необходимо назначать препараты по результатам антибиотикограммы. В микробиологической лаборатории после идентификации возбудителя определяют его чувствительность к противомикробным средствам.
После антибиотикотерапии необходим прием пре- и пробиотиков – «Колибактерина», «Бифиформа», «Аципола». Эти препараты восстанавливают нормальную кишечную микрофлору.
Симптоматическое лечение бактероидозов заключается в применении спазмолитиков при боли в животе «Но-шпы», «Дюспаталина». Если имеются нарушения процессов пищеварения, назначают ферменты «Креон», «Панкреатин», «Мезим», при наличии тошноты и рвоты – «Церукал», «Мотилиум». В тяжелых случаях показана дезинтоксикационная, десенсибилизирующая и стимулирующая терапия. Для укрепления иммунной системы больным показан прием иммуностимуляторов – «Иммунала», «Имудона», «Ликопида», витаминных и минеральных комплексов.
При наличии у женщины вагинита бактероидной этиологии применяют местные препараты в виде свечей, восстанавливающие нормальную микрофлору – «Фемилекс», «Вагинорм», «Вагилак». Местное воздействие и физиотерапевтические процедуры способствуют скорейшему выздоровлению больных.
Чтобы предупредить заболевания бактероидной этиологии, необходимо выполнять следующие врачебные рекомендации:
- Соблюдать правила личной гигиены,
- Полноценно питаться,
- Проводить общеукрепляющие мероприятия,
- Принимать антибиотики по строгим показаниям,
- Для восстановления микрофлоры и нормализации пищеварительных процессов периодически пить про- и пребиотики, витамины, ферменты.
Мнения, советы и обсуждение:
анаэробных бактерий | UF Health, Университет здравоохранения Флориды,
Академический медицинский центр Университета Флориды — самый обширный академический медицинский центр на юго-востоке — предназначен для высококачественных программ образования, исследований, ухода за пациентами и государственных услуг.
Стоматологический колледж UF является единственной стоматологической школой во Флориде, финансируемой государством, и признан одной из лучших стоматологических школ США за качество образовательных программ, исследовательскую деятельность в области гигиены полости рта и приверженность уходу за пациентами и обслуживанию.
Медицинский колледж, крупнейший из шести колледжей Академического медицинского центра Университета Флориды, открылся в 1956 году с миссией увеличения количества высококвалифицированных врачей во Флориде, предоставления передовых медицинских услуг жителям Флориды и содействия открытиям в области здравоохранения. исследование.
Колледж медсестер Университета Флориды, основанный в 1956 году, является ведущим учебным заведением для медсестер в штате Флорида и входит в 10% лучших медицинских программ для выпускников в стране.Колледж медсестер UF постоянно привлекает и сохраняет высочайший уровень студентов и преподавателей медсестер, увлеченных наукой и заботой.
Фармацевтический колледж, основанный в 1923 году, является старейшим колледжем Академического медицинского центра UF. Колледж, входящий в число лучших фармацевтических школ страны, поддерживает исследовательские, сервисные и образовательные программы, дополненные онлайн-технологиями.
Колледж общественного здравоохранения и медицинских профессий (PHHP) предназначен для предоставления отличных образовательных программ, которые готовят выпускников к удовлетворению многогранных медицинских потребностей населения, сообществ и отдельных лиц.
UF College of Veterinary Medicine — единственный ветеринарный колледж Флориды, предлагающий множество уникальных образовательных программ для студентов и услуг, направленных на помощь домашним животным, дикой природе и исчезающим видам. Мы предлагаем четырехлетние программы доктора ветеринарной медицины, а также M.S. и к.т.н. степени в области ветеринарной медицины.
Расположенный в одном месте с больницей Shands Jacksonville, Центр медицинских наук Джексонвилля выделяется в области образования, исследований и ухода за пациентами, что отражает наши неизменные ценности сострадания, совершенства, профессионализма и инноваций.Наш современный медицинский центр обслуживает 1 миллионное городское население от северной Флориды до южной Джорджии.
UFCOM-J предлагает аккредитованные программы ординатуры и стипендий для выпускников медицинских вузов в дополнение к нестандартным программам стипендий. Клинические ротации по всем основным дисциплинам предусмотрены для студентов-медиков UFCOM, а факультативные ротации — для студентов из других аккредитованных школ.
UFHSC-J — это клинический учебный центр для медсестринского колледжа в Гейнсвилле.Студенты сменяют друг друга в различных клинических учреждениях на территории кампуса, а также в центрах первичной медицинской помощи и специализированных медицинских центрах, расположенных по всему Джексонвиллю.
Фармацевтический колледж UF в Джексонвилле предлагает четырехлетнюю программу доктора фармацевтики (Pharm.D.), Полностью завершенную в Джексонвилле. Также на территории кампуса предлагается программа резидентуры в аптеке Shands Jacksonville, аккредитованная Американским обществом фармацевтов системы здравоохранения.
University of Florida Health знает, насколько важно постоянное медицинское обучение для поставщиков медицинских услуг и общества.Вот почему мы предлагаем онлайн-курсы непрерывного медицинского образования (CME), которые вы можете пройти для получения кредитов CME. Эти курсы делятся последними медицинскими знаниями, обучают новым навыкам взаимоотношений с пациентами и помогают поставщикам медицинских услуг решать актуальные текущие проблемы.
Porphyromonas gingivalis как модельный организм для оценки взаимодействия анаэробных бактерий с клетками-хозяевами
В следующих протоколах будут описаны методы культивирования и изучения инвазии анаэробных видов, P.gingivalis ; однако эти протоколы могут использоваться для ряда анаэробных патогенов. Хотя используются HUVEC, этот протокол можно использовать для других эукариотических клеток, как иммунных, так и неиммунных.
1. Использование и обслуживание анаэробной камеры
Примечание : P. gingivalis — анаэроб, чувствительный к нормальному уровню кислорода в окружающем воздухе. Контролируемая анаэробная среда жизненно важна для выращивания P. gingivalis .
- Здесь поддерживайте искусственную атмосферу, обозначенную как смешанный анаэробный газ (80% N 2 , 10% H 2 , 10% CO 2 ) в виниловой анаэробной камере ( Рисунок 1A ).Используйте воздушный шлюз (, рис. 1B, ) для переноса предметов из лабораторной среды в анаэробную камеру. Шлюз работает вручную, дважды продувая газом N 2 перед подачей смешанного анаэробного газа.
- Используйте колонну для удаления сероводорода (, рис. 1C, ) для удаления нежелательного сероводорода без обслуживания. Поместите осушитель в камеру, чтобы удалить H 2 O, образующийся катализатором, и избежать аэрозолей, которые способствуют распространению загрязнения.
Примечание. Сероводород является естественным побочным продуктом метаболизма многих анаэробных бактерий, и его накопление токсично для бактерий и может привести к повреждению электроники и сокращению срока службы катализатора. - Используйте коробку вентилятора для циркуляции атмосферы камеры через палладиевый катализатор, который удаляет кислород в присутствии водорода (, рис. 1D, ).
Примечание. Рециркуляционный атмосферный фильтр (HEPA) удаляет переносимые по воздуху загрязнители размером 0,22 мкм и более. - Выращивайте анаэробные бактерии в инкубаторе 37 ° C, который расположен внутри анаэробной камеры. При работе внутри анаэробной камеры используйте стандартные асептические методы.
Рис. 1. Анаэробная виниловая камера и ее компоненты. ( A ) Виниловая анаэробная камера, полностью закрытая от атмосферного кислорода, обеспечивает рабочее пространство для двух человек одновременно (32 x 78 дюймов). Он содержит инкубатор, установленный на 37 ° C (сзади посередине). ( B ) Воздушный шлюз используется для передачи предметов из лабораторной среды в анаэробную камеру.На фото показан автоматический воздушный шлюз, управляемый контроллером, который можно запрограммировать на автоматическое выполнение процедур вакуумирования и продувки, необходимых для создания анаэробной среды. ( C ) Колонна для удаления сероводорода обеспечивает необслуживаемую высокую производительность по удалению нежелательного сероводорода. ( D ) По всей анаэробной камере размещены две камеры вентилятора с катализатором, чтобы способствовать циркуляции атмосферы камеры через палладиевый катализатор, который в присутствии водорода удаляет кислород.Анаэробная камера настроена в соответствии с инструкциями производителя. Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Подготовка анаэробных бактерий
Примечание: P. gingivalis является аэротолерантным и может храниться в аэробных условиях, но не будет расти в присутствии кислорода на уровнях выше 6% 17,18 . Анаэробная камера необходима для правильного выращивания P. gingivalis и других анаэробных видов ( Рисунок 1 ).Перед началом работы с микроанаэробами требуется надлежащая подготовка и обучение использованию анаэробной камеры 19 .
- Уравновесьте все жидкие среды и планшеты в анаэробных условиях в течение не менее 12 часов перед экспериментом, чтобы удалить остаточный кислород.
- Перенести P. gingivalis из морозильной камеры -80 ° C в анаэробную камеру, дать оттаять.
- Streak P. gingivalis на чашках с триптиказо-соевым кровяным агаром (TSA II с 5% овечьей крови). Оберните планшеты парафильмом и храните при 37 ° C в анаэробном инкубаторе в течение 4-7 дней.
- Засейте P. gingivalis в 3 мл бульона для инфузии мозга и сердца (BHI), дополненного гемином и менадионом, обогащенной неселективной жидкой средой для выделения и культивирования анаэробных и требовательных микроорганизмов с использованием стерильных петель.
Примечание. Для длительного хранения смешайте бактериальные культуры, полученные в BHI, с глицерином или ДМСО (конечная концентрация 10-20%) и поместите в морозильную камеру -80 ° C. - Приготовьте закваску P. gingivalis , сделав разведение 1:10 и давая бактериям возможность расти до середины логарифмической фазы.
Примечание. Определяется оптическая плотность бактериальной суспензии и регулируется концентрация бактерий для каждого исследуемого штамма. Для P. gingivalis суспензия с OD 660 0,7 соответствует средней логарифмической фазе и ~ 7 x 10 8 клеток / мл. Условия роста, описанные в протоколе выше, специфичны для P. gingivalis и могут нуждаться в адаптации для других бактериальных штаммов.
3. Культура эндотелиальных клеток
Примечание. Приобретите объединенные первичные HUVEC и культуру в основной среде, содержащей факторы роста эндотелия сосудов (VEGF) при 37 ° C в 5% CO. 2 в соответствии с инструкциями производителя.
- Посев HUVEC в колбы Т-75 размером 2,5 x 10 5 клеток / колбу в 15 мл среды VEGF.
Примечание: проверьте жизнеспособность с помощью разведения 1: 1 4,0% трипановым синим. Клетки с поврежденной мембраной сохранят трипановый синий, а здоровые клетки с неповрежденными мембранами будут казаться белыми при просмотре в бинокулярный световой микроскоп. Подсчитайте 100 клеток, убедитесь, что более 80% клеток являются жизнеспособными 20 . - Заменяйте среду каждые 2 дня предварительно подогретой свежей средой VEGF, пока клетки не достигнут ~ 80% конфлюэнтности.
- Вымойте клетки один раз предварительно нагретым PBS. Освободите клетки из колбы Т75, инкубируя с 2 мл трипсин-ЭДТА (0,25%) в течение 5 мин, а затем 2 мл раствора для нейтрализации трипсина.
- Соберите суспендированные HUVEC в коническую пробирку на 50 мл. Вымойте лишние клетки из колб Т-75 с помощью PBS и перенесите в конические пробирки на 50 мл.
- Центрифугируйте клетки при 200 x g в течение 10 мин.
- Удалить супернатант, суспендировать клеточный осадок в 10 мл предварительно нагретой среды VEGF.
- Определите концентрацию клеток с помощью гемоцитометра или аналогичного устройства для подсчета клеток.
- Рассчитайте количество клеточной суспензии для добавления в 6-луночный планшет (400 000 / лунку) или 12-луночный планшет с покровными стеклами (50 000 / лунку). На следующий день HUVEC будут готовы к экспериментам.
4. Анализ выживаемости Вторжение / взаимодействие (покрытие)
Примечание. При проведении этого анализа приготовьте два 6-луночных планшета с эндотелиальными клетками, засеянными по 400 000 клеток / лунку. Один планшет будет использоваться для оценки бактерий, прикрепленных к клеткам-хозяевам и усвоенных ими. Другая пластина будет учитывать внутриклеточные бактерии.6-луночный планшет позволяет проводить три повторения двух образцов в одном эксперименте. Краткое описание этого протокола см. В блок-схеме анализа выживаемости (, рисунок 2, ).
- Подготовьте анаэробные бактерии, как описано выше (см. Раздел 1), пока они не достигнут середины логарифмического роста (OD 660 0,5-0,7).
- Центрифуга бактерий при 5000 x g в течение 10 мин.
Примечание. Если центрифуга находится вне анаэробной камеры, переносите образцы бактерий в плотно закрытой пробирке на 15 мл, оберните крышку парафильмом, чтобы предотвратить утечку кислорода. - Поместите осажденный P. gingivalis обратно в камеру, удалите супернатант. Промойте PBS, осадите бактерии еще раз перед ресуспендированием в среде VEGF. Подготовьте суспензии для всех бактериальных штаммов, подлежащих тестированию, при OD 660 0,7, что соответствует средней логарифмической фазе (~ 7 x 10 8 клеток / мл). Теперь бактерии готовы к заражению.
- Перенесите 6-луночные планшеты, содержащие HUVEC, из инкубатора тканевых культур в анаэробную камеру. Удалите среду и трижды промойте анаэробным PBS.Добавьте 2 мл анаэробной среды VEGF в каждую лунку и поместите планшеты при 37 ° C в анаэробный инкубатор на 20 минут, чтобы уравновесить температуру для инфекции.
Примечание. Поместите бактерии на чашки с кровяным агаром, чтобы убедиться, что те, которые используются для инфекции, являются однородными и не заражены при заражении. - Заразить клетки-хозяева бактериями при множественности инфекции (бактерии MOI: хозяин) 100: 1.
Примечание. Число клеток HUVEC определяется путем проведения теста исключения трипана на одной лунке перед заражением.Количество бактериальных клеток определяется с помощью оптической плотности (, например, OD 0,5 = 5 x 10 8 клеток / мл). Концентрация бактерий доводится до надлежащего MOI на основе концентрации HUVEC 21 . - Поместите 6-луночные планшеты с инфицированными HUVEC в анаэробный инкубатор и дайте бактериям взаимодействовать с клетками-хозяевами в течение 30 мин.
- Приготовьте сапонин в BHI (1,0% мас. / Об.) Внутри анаэробной камеры и профильтруйте через фильтр 0,2 мкм.
- Выживаемость прикрепленных и интернализованных бактерий.
- Удалите планшеты из инкубатора, аспирируйте среду, трижды промойте анаэробным PBS и добавьте 2 мл отфильтрованного 1,0% сапонина (приготовленного, как описано в шаге 4.8). Инкубируйте в течение 15 минут, чтобы позволить лизис клеток-хозяев.
- Очистите дно каждой лунки скребком для клеток. Соберите смесь клеток из каждой лунки и сделайте разведение 1: 1 в BHI.
- Выполните серийные разведения образца. В зависимости от вида и концентрации бактерий отрегулируйте серийные разведения. Начните с разведений 1: 100 или 1: 1000.
- Пластина 200 мкл желаемого разведения на пластинах с кровяным агаром. Оберните планшеты парафильмом и поместите в анаэробный инкубатор при 37 ° C.
- После семи дней инкубации при 37 ° C удалите чашки и подсчитайте колониеобразующие единицы (КОЕ) с помощью светового ящика для ручного подсчета колоний.
Примечание. Перечислены КОЕ. Для большего количества КОЕ можно делать изображения и использовать компьютерное программное обеспечение для облегчения подсчета КОЕ.
- Выживание интернализованных бактерий.
- Выньте чашки из инкубатора. Трижды промойте анаэробным PBS и добавьте 2 мл среды VEGF с добавлением антибиотика (300 мкг / мл гентамицина и 400 мкг / мл метронидазола).
- Инкубируйте 1 час. Обязательно проверьте антибиотики, чтобы они были на 100% эффективны при уничтожении желаемого бактериального штамма, и убедитесь, что они не проникают в клетки-хозяева 22,23 .
- Аспирируйте среду, добавьте 2 мл отфильтрованного 1,0% сапонина. Инкубируйте в течение 15 минут, чтобы позволить лизис клеток-хозяев.
- Очистите дно каждой лунки скребком для клеток. Соберите смесь клеток из каждой лунки и сделайте разведение 1: 1 в BHI.
- Приготовьте серийные разведения образца (1: 100, 1: 1000).
- Пластина 200 мкл желаемого разведения на пластинах с кровяным агаром. Оберните чашки парафильмом и поместите в анаэробный инкубатор.
- После семи дней инкубации при 37 ° C удалите чашки и подсчитайте КОЕ.
Рис. 2. Схематическое изображение протокола, используемого для выживания анаэробных бактерий с эукариотическими клетками. Оба теста на общую выживаемость бактерий и выживаемость интернализованных бактерий могут быть выполнены одновременно. Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Интернализация бактерий в клетки-хозяева (флуоресцентная микроскопия)
Примечание: P. gingivalis маркирован 2 ‘, 7’-бис- (2-карбоксиэтил) -5- (и-6) -карбоксифлуоресцеином, ацетоксиметиловым эфиром (BCECF-AM). BCECF-AM — нефлуоресцентный мембранопроницаемый краситель; его превращение во флуоресцеин BCECF под действием внутриклеточных эстераз может указывать на жизнеспособность клеток. P. gingivalis метят красителем BCECF-AM и затем используют для инфицирования эукариотических клеток. После инфицирования клетки фиксируют и метят DAPI и TRITC-фаллоидином. Окрашивание DAPI, используемое для окрашивания ядра эукариотической клетки, также будет метить ядро бактериальной клетки, что обеспечивает контрмеру для выявления нежизнеспособных бактерий, которые не могут метаболически расщеплять BCECF-AM. Клетки-хозяева выделены красным актиновым красителем TRITC-фаллоидином.
- Покровные стекла в автоклаве. С соблюдением правил асептики добавьте покровные стекла в 12-луночные планшеты перед посевом эндотелиальных клеток из расчета 5 x 10 4 клеток / лунку.(Подготовлено за день до эксперимента)
- Подготовьте эндотелиальные клетки на круглых покровных стеклах 18 мм (толщиной # 1,5) в 12-луночных планшетах, как описано выше.
- Подготовьте анаэробные бактерии, выращенные до средней логарифмической фазы (OD 660 = 0,5-0,7), как описано в разделе 1.
- Вымойте бактерии 2 раза анаэробным PBS путем центрифугирования при 5000 x g и суспендирования осадка в PBS при 5-7 x 10 8 клеток / мл.
- Добавьте 20 мкл 0,2 мМ BCECF-AM к 2 мл бактериальной суспензии (5-7 x 10 8 клеток / мл) до конечной концентрации BCECF-AM 2 мкМ.
- Инкубируйте при 37 ° C в течение 30 минут в темноте.
- Переносите планшеты с эндотелиальными клетками, засеянными на круглые покровные стекла толщиной 18 мм (# 1,5) из инкубатора для тканевых культур в анаэробную камеру. Промыть PBS и заменить анаэробной средой VEGF.
Примечание. Убедитесь, что HUVEC здоровы под световым микроскопом. HUVECS должен быть на ~ 80% сливным, морфология должна быть сопоставима с производителями. - Центрифугируйте меченые бактерии при 5000 x g в течение 10 мин для удаления остаточного красителя BCECF-AM.Суспендировать в 2 мл анаэробной среды VEGF.
- Заразить клетки-хозяева мечеными бактериями при MOI 100: 1 (бактерии: хозяин).
- Инкубируйте в анаэробной камере при 37 ° C в течение 30 мин.
- После заражения клетки промыть 3 раза PBS и зафиксировать в свежеприготовленном 4,0% параформальдегиде в течение 10 мин.
Примечание: после фиксации клеток эксперимент можно проводить вне анаэробной камеры. - Промыть покровные стекла PBS три раза.
- Добавьте 1 мл 0,2% Triton X-100 на 10 мин.
- Промыть покровные стекла PBS три раза.
- Добавьте 50 мкл фаллоидина TRITC (50 мкг / мл) в покровные стекла на 45 мин.
- Вымойте покровные стекла три раза, снимите с 12-луночного планшета и поместите на предметное стекло с мягким фиксирующим средством, содержащим DAPI. Боковые стороны обработайте лаком для ногтей.
Примечание: слайды можно хранить пару месяцев в темноте. Избегайте воздействия света, чтобы предотвратить фотообесцвечивание. - Просмотрите слайды с помощью конфокального микроскопа.
- Здесь используется 34-канальная спектральная система (32-канальный матричный детектор и два боковых детектора ФЭУ, плюс детектор проходящего света), сконфигурированная вокруг стенда AxioObserver (перевернутый) с моторизованным XY-столиком.Система имеет пять лазеров: синий диод (405 нм), многолинейный аргоновый (458, 488, 514 нм), зеленый диод (561 нм), красный HeNe (633 нм) и импульсный лазер 440 нм. Оборудуйте систему визуализации времени жизни флуоресценции двумя гибридными детекторами GaAsP (для FRET-FLIM).
- Обнаружение флуоресценции от DAPI и TRITC в одном канале с использованием двухдиапазонного фильтра с длинами волн возбуждения 340–380 нм и 540–560 нм и эмиссионного фильтра 435–485 нм и 570–590 нм соответственно. Обнаруживают флуоресценцию от BCECF-AM, используя фильтр с длиной волны возбуждения 440-500 нм и фильтр эмиссии 510-590 нм.
Примечание. Контроль BCECF-AM следует проводить на каждом изучаемом штамме бактерий, чтобы обеспечить надлежащую маркировку жизнеспособных бактерий. Сначала подтвердите, что нежизнеспособные бактерии являются DAPI-положительными и BCECF-n
Жизнь растений: анаэробный фотосинтез
Анаэробный фотосинтез, также известный как аноксигенный фотосинтез, — это процесс, при котором определенные бактерии используют световую энергию для создания органических соединений, но не производят кислород. Анаэробы — это бактерии, которые не могут использовать кислород для выработки энергии.
Процесс фотосинтеза у всех растений и водорослей, а также у определенных типов бактерий включает в себя восстановление углекислого газа до углеводов и удаление электронов из воды, что приводит к высвобождению кислорода.
Этот процесс известен как кислородный или аэробный фотосинтез. Вода окисляется многосубъединичным белком, расположенным в фотосинтетической мембране. Это свойство молекулярного белка, характерное для более чем 500 000 видов растений на Земле.
Хотя это общая черта почти для всех форм растительной жизни на Земле, некоторые фотосинтезирующие бактерии могут использовать световую энергию для извлечения электронов из молекул, отличных от воды.Эти бактерии имеют древнее происхождение и, как полагают, эволюционировали до аэробных фотосинтезирующих организмов.
Эти анаэробные фотосинтезирующие организмы встречаются в домене бактерий. Анаэробные фотосинтезирующие бактерии, также известные как аноксигенные фотосинтезирующие бактерии, отличаются от аэробных организмов тем, что каждый вид этих бактерий имеет только один тип реакционного центра.
У некоторых фотосинтезирующих бактерий реакционный центр включает окисление воды и восстановление ароматической молекулы пластохинона.У других видов он включает окисление пластоцианина и восстановление белка ферредоксина.
Фотосинтезирующие бактерии — это, как правило, водные микроорганизмы, населяющие морскую и пресноводную среду, включая влажные и илистые почвы, стоячие пруды, серные источники и тихие озера. Они подразделяются на пять групп в зависимости от состава пигментов, метаболических требований и структуры мембран: зеленые бактерии, пурпурные серные бактерии, пурпурные несерные бактерии, гелиобактерии и галофильные архебактерии.
Некоторые из этих организмов являются анаэробами; то есть они могут расти только при полном отсутствии кислорода. Они не могут использовать воду в качестве субстрата и не производят кислород во время фотосинтеза. С другой стороны, факультативные анаэробы могут расти как в присутствии, так и в отсутствие кислорода.
Зеленые бактерии включают два семейства: Chloroflexaceae и Chlorobiaceae. Chlorobiaceae — это строгие анаэробы, которые растут за счет использования сульфида, тиосульфата или органического водорода в качестве источника электронов.
| Процесс анаэробного фотосинтеза |
Chloroflexaceae — это факультативные аэробы, которые используют восстановленные соединения углерода в качестве доноров электронов. Пурпурные серные бактерии используют неорганическое соединение серы, такое как сероводород, в качестве фотосинтетического донора электронов.
Пурпурные несерные бактерии зависят от наличия простых органических соединений, таких как спирты и кислоты, в качестве доноров электронов, но они также могут использовать водород.Пурпурные серные бактерии должны связывать углекислый газ, чтобы жить, тогда как несерные бактерии могут расти в аэробных условиях в темноте путем дыхания на источнике органического углерода.
Гелиобактерии — анаэробные фотосинтезирующие бактерии, содержащие особый тип бактериохлорофилла, BChl g, который действует как пигмент антенны и реакционного центра. Галобактерии очень необычны. Они не могут расти при низких концентрациях соли (или их клеточные стенки разрушаются).
Обычно это гетеротрофы с аэробной цепью переноса электронов, но они также могут дышать анаэробно с нитратом или серой.В отсутствие подходящих акцепторов электронов они могут сбраживать углеводы.
Галобактерии при воздействии света в отсутствие кислорода могут синтезировать пурпурную мембрану, содержащую единственный фоточувствительный белок, называемый бактериородопсин, который при освещении начинает циклическое обесцвечивание и регенерацию, вытесняя протоны из клетки. Этот светостимулированный протонный насос работает без транспорта электронов.
Механизм преобразования света галобактериями принципиально отличается от механизма высших организмов, поскольку отсутствует химия окисления / восстановления, а галобактерии не могут использовать диоксид углерода в качестве источника углерода.В результате некоторые ученые не считают галобактерии фотосинтезирующими.
Процесс
Общие черты аэробного и анаэробного фотосинтеза известны с середины двадцатого века:
Зеленые растения:
CO2 + 2h3O + свет → (Ch3O) + O2 + h3O
Зеленые серные бактерии:
CO2 + 2S + h3O + свет → (Ch3O) + 2S + h3O
В каждом случае неорганический углерод (CO2) фиксируется в органическом углероде (Ch3O), источником восстановителя является водород либо в воде, либо в сероводороде, а химическая энергия, необходимая для этой активности, получается из энергии света.Сера, произведенная анаэробно, аналогична кислороду, произведенному кислородным фотосинтезом зеленых растений.
Фотохимические процессы в фотосинтезирующих бактериях требуют трех основных компонентов: антенны светособирающих пигментов, реакционного центра внутри внутрицитоплазматической мембраны, содержащей по крайней мере один бактериохлорофилл, и цепи переноса электронов.
Все фотосинтезирующие бактерии могут преобразовывать световую энергию в трансмембранный протонный градиент, используемый для генерации аденозинтрифосфата (АТФ) и производства оксидазы, но ни одна из анаэробных фотосинтезирующих бактерий не способна извлекать электроны из воды, поэтому они не эволюционируют кислород.
Многие виды могут выжить только в среде с низким содержанием кислорода. Чтобы обеспечить необходимые электроны для восстановления углекислого газа, аноксигенные фотосинтезирующие бактерии должны окислять неорганические или органические молекулы из своего непосредственного окружения.
Несмотря на принципиальные различия, принципы преобразования энергии одинаковы при анаэробном и аэробном фотосинтезе. Анаэробные фотосинтезирующие бактерии зависят от бактериохлорофилла, группы молекул, подобных хлорофиллу, которые поглощают в инфракрасном спектре от 700 до 1000 нанометров.Антенные системы этих бактерий состоят из бактериохлорофилла и каротиноидов и служат реакционным центром, где происходит разделение первичных зарядов.
Электронные носители включают комплекс хинона и цитохрома bc. Перенос электронов связан с генерацией электрохимического потенциала, который запускает фосфорилирование АТФ-синтазой, а энергия, необходимая для восстановления диоксида углерода, обеспечивается АТФ и дегидрогеназой.
анаэробных бактерий Википедия
Организм, способный выжить в отсутствие кислорода
Анаэробный организм или анаэроб — любой организм, которому для роста не требуется кислород.Он может отреагировать отрицательно или даже погибнуть, если присутствует свободный кислород. Напротив, аэробный организм (аэроб) — это организм, которому требуется насыщенная кислородом среда. Анаэробы могут быть одноклеточными (например, простейшие, [1] бактерии [2] ) или многоклеточными. [3]
Большинство грибов являются облигатными аэробами, которым для выживания необходим кислород, однако некоторые виды, такие как Chytridiomycota, обитающие в рубце крупного рогатого скота, являются облигатными анаэробами; для этих видов используется анаэробное дыхание, поскольку кислород нарушает их метаболизм или убивает их.
Первое наблюдение []
В своем письме Королевскому обществу от 14 июня 1680 года Антони ван Левенгук описал эксперимент, который он провел, наполнив две одинаковые стеклянные пробирки примерно наполовину измельченным перцовым порошком.
было добавлено немного чистой дождевой воды. Ван Левенгук запечатал одну из стеклянных трубок с помощью пламени, а другую оставил открытой. Через несколько дней он обнаружил в открытой стеклянной трубке
очень много очень маленьких анималкулов самых разных видов, имеющих свое собственное движение.«Не ожидая увидеть жизнь в запечатанной стеклянной трубке, Ван Левенгук, к своему удивлению, увидел« своего рода живые животные, которые были круглыми и крупнее, чем самые большие виды, которые, как я сказал, находились в другой воде ». Условия в запаянной пробирке стали достаточно анаэробными из-за потребления кислорода аэробными микроорганизмами. [4]
В 1913 году Мартинус Бейеринк повторил эксперимент Ван Левенгука и идентифицировал Clostridium butyricum как заметную анаэробную бактерию в герметичной перцовой трубке для инфузии.Бейеринк прокомментировал:
«Таким образом, мы приходим к замечательному выводу, что, вне всякого сомнения, Ван Левенгук в своем эксперименте с полностью закрытой пробиркой культивировал и наблюдал настоящие анаэробные бактерии, что повторилось бы только через 200 лет, а именно около 1862 г. Пастер. То, что Левенгук за сто лет до открытия кислорода и состава воздуха, не осознавал значения своих наблюдений, понятно. Но тот факт, что в закрытой пробирке он наблюдал повышенное давление газа, вызванное ферментативными бактериями, и, кроме того, видел бактерии, в любом случае доказывает, что он не только был хорошим наблюдателем, но и смог разработать эксперимент, из которого
вывод можно было сделать.’ [4]
Классификация []
Аэробные и анаэробные бактерии можно идентифицировать, выращивая их в пробирках с тиогликолатным бульоном:
1: Облигатным аэробам нужен кислород, потому что они не могут ферментировать или дышать анаэробно. Они собираются в верхней части трубки, где концентрация кислорода самая высокая.
2: Облигатные анаэробы отравлены кислородом, поэтому они собираются на дне трубки, где концентрация кислорода самая низкая.
3: Факультативные анаэробы могут расти с кислородом или без него, потому что они могут метаболизировать энергию аэробно или анаэробно.Они собираются в основном наверху, потому что при аэробном дыхании образуется больше аденозинтрифосфата (АТФ), чем при ферментации или анаэробном дыхании.
4: Микроаэрофилы нуждаются в кислороде, потому что они не могут ферментировать или дышать анаэробно. Однако они отравлены высокой концентрацией кислорода. Они собираются в верхней части пробирки, но не в самом верху.
5: Аэротолерантные организмы не нуждаются в кислороде, поскольку они анаэробно метаболизируют энергию. Однако, в отличие от облигатных анаэробов, они не отравляются кислородом.Их можно найти равномерно распределенными по всей пробирке.
Из практических соображений различают три категории анаэробов:
- Облигатные анаэробы , которым вредит присутствие кислорода. [5] [6] Двумя примерами облигатных анаэробов являются Clostridium botulinum и бактерии, обитающие возле гидротермальных жерл на глубоководном дне океана.
- Аэротолерантные организмы , которые не могут использовать кислород для роста, но переносят его присутствие. [7]
- Факультативные анаэробы , которые могут расти без кислорода, но используют кислород, если он присутствует. [7]
Однако эта классификация подверглась сомнению, поскольку недавние исследования показали, что человеческие «облигатные анаэробы» (такие как Fineglodia magna или метаногенные археи Methanobrevibacter smithii ) могут выращиваться в аэробной атмосфере. если питательная среда дополнена антиоксидантами, такими как аскорбиновая кислота, глутатион и мочевая кислота. [8] [9] [10] [11]
Энергетический обмен []
Некоторые облигатные анаэробы используют ферментацию, другие — анаэробное дыхание. [12] Аэротолерантные организмы строго ферментируют. [13] В присутствии кислорода факультативные анаэробы используют аэробное дыхание; без кислорода некоторые из них бродят; некоторые используют анаэробное дыхание. [7]
Ферментация []
Существует множество анаэробных ферментативных реакций.
Ферментативные анаэробные организмы в основном используют путь молочнокислого брожения:
- C 6 H 12 O 6 + 2 АДФ + 2 фосфат → 2 молочная кислота + 2 АТФ
Энергия, выделяемая в этом уравнении, составляет примерно 150 кДж на моль, что сохраняется при регенерации двух АТФ от АДФ на глюкозу. Это всего лишь 5% энергии, приходящейся на молекулу сахара, которую производит типичная аэробная реакция.
Растения и грибы (например, дрожжи) обычно используют спиртовую (этанольную) ферментацию, когда кислород становится ограниченным:
- C 6 H 12 O 6 (глюкоза) + 2 АДФ + 2 фосфата → 2 C 2 H 5 OH + 2 CO 2 ↑ + 2 ATP
Выделенная энергия составляет около 180 кДж на моль, что сохраняется при регенерации двух АТФ из АДФ на глюкозу.
Анаэробные бактерии и археи используют эти и многие другие пути ферментации, например, ферментацию пропионовой кислоты, ферментацию масляной кислоты, ферментацию растворителем, ферментацию смешанной кислоты, ферментацию бутандиола, ферментацию Stickland, ацетогенез или метаногенез.
Культивирование анаэробов []
Поскольку нормальное культивирование микробов происходит в атмосферном воздухе, который является аэробной средой, культивирование анаэробов представляет проблему. Поэтому микробиологи используют ряд методов при культивировании анаэробных организмов, например, обращение с бактериями в перчаточном ящике, заполненном азотом, или использование других специально герметичных контейнеров, или таких методов, как инъекция бактерий в двудольные растения, которые среда с ограниченным содержанием кислорода.Система GasPak представляет собой изолированный контейнер, в котором создается анаэробная среда за счет реакции воды с борогидридом натрия и таблетками бикарбоната натрия с образованием газообразного водорода и диоксида углерода. Затем водород реагирует с газообразным кислородом на палладиевом катализаторе с образованием большего количества воды, тем самым удаляя газообразный кислород. Проблема с методом Гаспака заключается в том, что может возникнуть побочная реакция, при которой бактерии могут погибнуть, поэтому следует использовать среду с тиогликолятом. Тиогликолят представляет собой среду, имитирующую среду двудольных растений, обеспечивая не только анаэробную среду, но и все питательные вещества, необходимые для размножения бактерий. [14]
Недавно французская группа ученых доказала связь между окислительно-восстановительными и кишечными анаэробами [15] на основе клинических исследований тяжелого острого недоедания. [16] Эти открытия привели к развитию аэробной культуры «анаэробов» путем добавления антиоксидантов в культуральную среду. [17]
Многоклеточность []
За исключением трех видов анаэробных лорицифер, вся известная сложная многоклеточная жизнь является аэробной, т.е. для выживания требуется кислород.В феврале 2020 года журнал PNAS опубликовал открытие нового 10-клеточного анаэробного организма: Henneguya salminicola Henneguya zschokkei . [18]
В 2010 году три вида анаэробных лорицифер были обнаружены в гиперсоленом бескислородном бассейне Л’Аталанте на дне Мерзлого моря. У них отсутствуют митохондрии, которые содержат путь окислительного фосфорилирования, который у всех других животных объединяет кислород с глюкозой для производства метаболической энергии, и поэтому они не потребляют кислород.

 Однако её изучение позволяет предполагать, что Z. mobilis — вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера — Дудорова обнаружен и у некоторых клостридиев, что ещё раз подчеркивает неоднородность эубактерий, объединённых в эту таксономическую группу[6].
Однако её изучение позволяет предполагать, что Z. mobilis — вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера — Дудорова обнаружен и у некоторых клостридиев, что ещё раз подчеркивает неоднородность эубактерий, объединённых в эту таксономическую группу[6].
 134. — ISBN 5-06-003720-7.
134. — ISBN 5-06-003720-7. — Microbiol Z. 2010 Jul-Aug;72(4):22-8.
— Microbiol Z. 2010 Jul-Aug;72(4):22-8.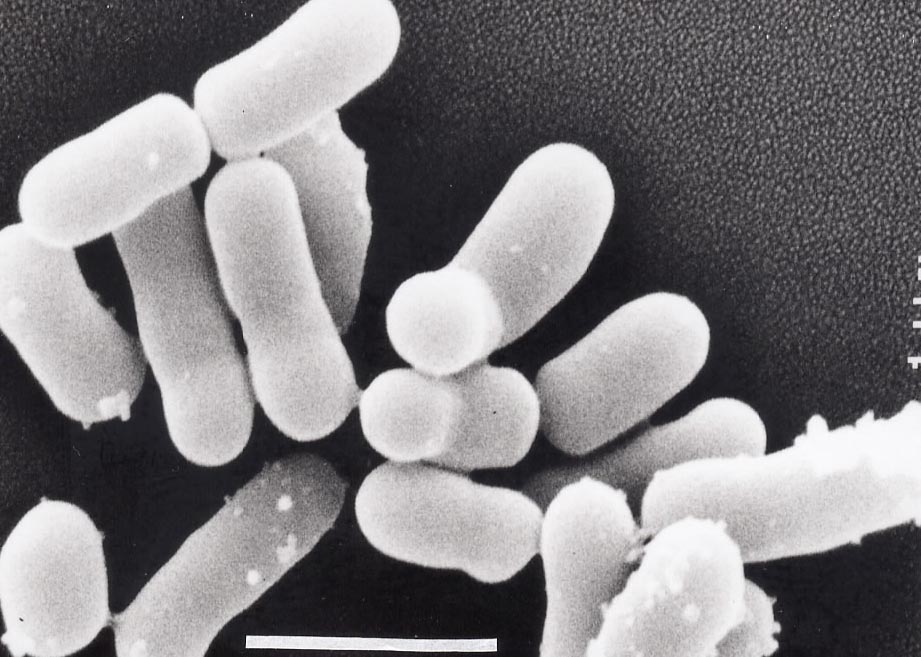 Однако её изучение позволяет предполагать, что Z. mobilis — вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера — Дудорова обнаружен и у некоторых клостридиев, что ещё раз подчеркивает неоднородность эубактерий, объединённых в эту таксономическую группу[6].
Однако её изучение позволяет предполагать, что Z. mobilis — вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера — Дудорова обнаружен и у некоторых клостридиев, что ещё раз подчеркивает неоднородность эубактерий, объединённых в эту таксономическую группу[6].
 134. — ISBN 5-06-003720-7.
134. — ISBN 5-06-003720-7. — Microbiol Z. 2010 Jul-Aug;72(4):22-8.
— Microbiol Z. 2010 Jul-Aug;72(4):22-8.