Гастроэнтероанастомоз — Med24info.com
Гастроэнтероанастомоз применяется для восстановления проходимости пищи из желудка в кишечник при непроходимости в области нижней половины желудка, привратника и двенадцатиперстной кишки.
Из различных методов гастроэнтероанастомоза наиболее применимы при неоперабельном раке желудка способ Вёльфлера с брау- новским энтеро-энтероанастомозом, обеспечивающий более длительную проходимость при росте опухоли, а при Рубцовых стенозах — методики Гаккера и Петерсена.
Гастроэнтероанастомоз по Вёльфлеру с энтеро-энтероанастомозом по Брауну. Доступ чаще срединный, реже параректальный или поперечный.
После вскрытия брюшной полости и ее ревизии сальник и поперечноободочную кишку поднимают кверху. Скользя вниз по брыжейке поперечноободочной кишки слева у позвоночника, находят верхнюю петлю тощей кишки и связку Трейца. Отступя от последней на 40—50 см, петлю тощей кишки перекидывают кверху над поперечной ободочной кишкой и сальником к передней поверхности желудка так, чтобы отводящий конец петли смотрел к привратнику. Параллельно продольной оси желудка поднимают складку на передней его стенке, которую и берут в кишечный зажим; другие же хирурги зажимы не накладывают, а отсасывают содержимое отсосами. Кишку и желудок сшивают узловатыми серо-серозными швами Ламберта на протяжении 8 см (рис. 390). Отступя 0,5 см от шва, вскрывают кишку и желудок на протяжении 7 см. Заднюю губу анастомоза сшивают через все слои стенки желудка и кишки непрерывными кетгуто- выми швами «взахлестку» (рис. 391), а переднюю вворачивающим швом скорняжным (рис.
Параллельно продольной оси желудка поднимают складку на передней его стенке, которую и берут в кишечный зажим; другие же хирурги зажимы не накладывают, а отсасывают содержимое отсосами. Кишку и желудок сшивают узловатыми серо-серозными швами Ламберта на протяжении 8 см (рис. 390). Отступя 0,5 см от шва, вскрывают кишку и желудок на протяжении 7 см. Заднюю губу анастомоза сшивают через все слои стенки желудка и кишки непрерывными кетгуто- выми швами «взахлестку» (рис. 391), а переднюю вворачивающим швом скорняжным (рис.
- или швом Коннеля. На переднюю губу накладывают второй ряд узловатых шелковых серо-серозных швов Ламберта (рис.
- . Анастомоз располагается изоперистальтически.
Для предотвращения образования порочного круга, когда отводящая петля или перегибается, или наложена неправильно, применяется энтеро-энтероанастомоз по Брауну. На 8—10 см ниже гастроэнтероанастомоза захватывают приводящую и отводящую петли кишки мягкими зажимами и накладывают между петлями серо-серозные узловатые шелковые швы на протяжении 8 см. Отступя 0,5 см от швов, вскрывают просветы петель кишок на протяжении 7 см. Задние губы кишечных петель через все слои стенок сшивают непрерывным кетгутовым швом «взахлестку», а передние — вворачивающим швом Коннеля или «скорняжным». На переднюю губу накладывают второй ряд узловатых шелковых серосерозных швов (рис. 394).
Отступя 0,5 см от швов, вскрывают просветы петель кишок на протяжении 7 см. Задние губы кишечных петель через все слои стенок сшивают непрерывным кетгутовым швом «взахлестку», а передние — вворачивающим швом Коннеля или «скорняжным». На переднюю губу накладывают второй ряд узловатых шелковых серосерозных швов (рис. 394).
Гастроэнтероанастомоз по Петерсену. Доступ чаще срединный, реже поперечный.
Поперечную ободочную кишку поднимают вместе с сальником кверху, отыскивают петлю тощей кишки у трейцевой связки. Вертикально в бессосудистой части рассекают брыжейку поперечной ободочной кишки (рис. 395), через окно брыжейки извлекают заднюю стенку желудка ближе к привратнику, большая кривизна которого смотрит вверх, малая — вниз. На складку стенки желудка накладывают мягкий зажим ручкой кверху. Отступя на 5—10 см от трейцевой связки, в зависимости от подвижности желудка (чем подвижнее, тем длиннее петля, но не длиннее 10 см), берут петлю тощей кишки в мягкий зажим ручкой к отводящей части кишки. Зажимы сводят ручками вверх, в результате чего отводящая часть петли находится у большой кривизны желудка, а малая — у малой. В последнее время большинство хирургов отказались от наложения жомов, а чтобы не истекало содержимое желудка, применяют отсос. Желудок и тощая кишка сшиваются серо-серозными шелковыми узловатыми швами на протяжении 8 см (рис. 396). Отступя 0,5 см от шва, вскрывают кишку и желудок на протяжении 7 см. Заднюю губу анастомоза сшивают через все слои стенки желудка и кишки непрерывным кетгутовым швом «взахлестку» (рис. 397), а переднюю — вворачивающим швом А. А. Шалимова (рис. 398) или Коннеля. На переднюю губу накладывают второй ряд узловатых шелковых серо-серозных швов.
Зажимы сводят ручками вверх, в результате чего отводящая часть петли находится у большой кривизны желудка, а малая — у малой. В последнее время большинство хирургов отказались от наложения жомов, а чтобы не истекало содержимое желудка, применяют отсос. Желудок и тощая кишка сшиваются серо-серозными шелковыми узловатыми швами на протяжении 8 см (рис. 396). Отступя 0,5 см от шва, вскрывают кишку и желудок на протяжении 7 см. Заднюю губу анастомоза сшивают через все слои стенки желудка и кишки непрерывным кетгутовым швом «взахлестку» (рис. 397), а переднюю — вворачивающим швом А. А. Шалимова (рис. 398) или Коннеля. На переднюю губу накладывают второй ряд узловатых шелковых серо-серозных швов.
- Передняя гастроэнтеростомия. Подшивание кишки к желудку.
- Передняя гастроэнтеростомия. Шов на заднюю губу.
- Передняя гастроэнтеростомия. Шов на переднюю губу.
- Передняя гастроэнтеростомия.
 Серо-серозные швы.
Серо-серозные швы.
395. Задняя гастроэнтеростомия. Рассечение брыжейки попе речной ободочной кишки.
- Задняя гастроэнтеростомия. Шов на заднюю губу.
- Задняя гастроэнтеростомия. Шов на переднюю губу.
- Задняя гастроэнтеростомия. Окончательный вид операции.
- Задняя гастроэнтеростомия с конечным расположением анастомоза.
- Варианты гастроэнтеростомии.
1—2 — по Бельфлеру; 3 — по Курвуазье; 4 — по Соуену — My азу; 5 — по Гаккеру; 6 — по Петерсену; 7 — по Брауну; 8 — по Бреннеру; 9 — по Шапю; 10 — по Ру; 11—по Шмилански; 12 — по Станишеву;’ 13- по Дельбе; 14 — по Леги.
Края разреза брыжейки поперечной ободочной кишки фиксируют к желудку серо-серозными швами вокруг анастомоза (рис. 399). Поперечная ободочная кишка опускается в брюшную полость, желудок занимает свое положение и петля тощей кишки оказывается подшитой отводящим концом вниз к большой кривизне, приводящим — вверх к малой.
Гастроэнтероанастомоз по Гаккеру. Доступ преимущественно срединный, реже поперечный. Поперечную ободочную кишку и малый сальник поднимают кверху. Горизонтально в бессосудистой части рассекают брыжейку поперечной ободочной кишки. Одни хирурги мягким зажимом берут складку задней стенки желудка, другие же им не пользуются. Отступя 5—10 см от трейцевой связки, захватывают петлю тощей кишки и укладывают отводящим концом к привратнику, приводящим — ко дну желудка. Петлю кишки подшивают к желудку на протяжении 8 см серо-серозными шелковыми швами. Отступя 0,5 см от швов, вскрывают просветы желудка и кишки на протяжении 7 см. Заднюю губу анастомоза сшивают кетгутовым непрерывным обвивным «взахле- стку» швом, а переднюю губу — погружным швом Коннеля или скорняжным. На переднюю губу накладывают второй ряд узловатых шелковых серо-серозных швов, край разреза брыжейки поперечной ободочной кишки подшивают серо-серозными узловатыми шелковыми швами к желудку вокруг анастомоза (рис. 400). Гастроэнтероанастомоз располагается изоперистальтически,
Различные виды гастроэнтероанастомозов представлены на рис.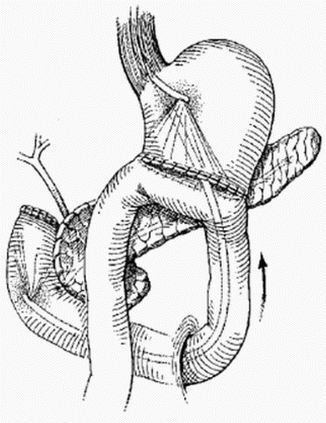 401.
401.
Болевой прием «узел» – виды и техника приема, узлы кимура и американа
Группа болевых приемов, направленных на выведение сустава согнутой конечности в неестественное положение, путем чрезмерного вращения.
«Кимура»
Прием «обратный узел плеча» назван в честь великого японского дзюдоиста, М. Кимура. Существует целый ряд разновидностей этого приема, суть которого заключается в захвате области предплечья соперника (наилучший вариант – захват у запястья), с последующим воздействием на плечо и излом локтевого сустава.
«Американа»
Прием «узел плеча» является разновидностью «кимуры». Выполняется из позиции бокового удержания (руки должны располагаться под предплечьями соперника) или из удержания поперек, и направлен на излом плечевого сустава. «Перекручивание» локтя противника начинается в момент, когда его рука находится в согнутом положении.
youtube.com/embed/FnpPiu_O1BA?feature=oembed&wmode=opaque» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
«Узел ноги»
Прием направлен на болевое воздействие на пятку соперника, поэтому имеет второе название – «скручивание пятки» (Heel Hook). В ММА был «внедрен» мастерами бразильского джиу-джитсу. Для проведения приема необходимо провести захват ступни соперника и вращениями создать давление на суставы и связки ноги, вынуждая сдаться.
Прием можно выполнять из нескольких позиций:
- лежа, захватив своими ногами ногу противника;
- захват ноги стоящего противника из «партера»;
- скручивание пятки лежащего противника из стойки.
Российские нейрохирурги прошли мастер-класс по микрососудистому анастомозу на базе ФЦН
Общество, 19:43 19 февраля 2018
Версия для печати
Международный образовательный курс по реваскуляризации головного мозга прошел 15-16 февраля на базе Федерального центра нейрохирургии в Тюмени. Под руководством главного врача центра, профессора Альберта Суфианова, а также приглашенных экспертов Кимуры Хидехито из Японии и Мартина Самеша из Чехии, участники прослушали лекции и отработали технологии наложения микрососудистых анастомозов на практике во время мастер-классов.
Под руководством главного врача центра, профессора Альберта Суфианова, а также приглашенных экспертов Кимуры Хидехито из Японии и Мартина Самеша из Чехии, участники прослушали лекции и отработали технологии наложения микрососудистых анастомозов на практике во время мастер-классов.
Организаторами образовательного курса выступили РОО «Ассоциация нейрохирургов Тюменской области» и кафедра нейрохирургии Первого МГМУ им. И. М. Сеченова.
«Программа мастер-класса была насыщенной, думаю, что участники узнали много нового. Нам было важно не только передать теоретические знания, но и проработать практический аспект. Мартин Самеш и Кимура Хидехито представляют разные школы микрососудистой техники, было интересно посмотреть, как они работают и чем отличаются. Я благодарен гостям за то, что они откликнулись и приняли участие в нашем образовательном курсе», — отметил Альберт Суфианов.
Обучение участников выстроено по ступенчатому принципу: от теории на лекциях специалисты переходили к практике на мастер-классах, сначала отрабатывая техники наложения швов на протезах, затем на препаратах в виде куриных бедер и крыльев. Также курс включал живую хирургию. Ход настоящих операций на пациентах транслировали на экране в конференц-зале.
Также курс включал живую хирургию. Ход настоящих операций на пациентах транслировали на экране в конференц-зале.
Врач-нейрохирург, доцент кафедры нейрохирургии медицинской аспирантуры университета г. Кобе (Япония) Кимура Хидехито посетил ФЦН в Тюмени четвертый раз. Он признался, что ему импонирует личность Альберта Суфианова, известного во всем мире нейрохирурга, и он всегда готов помочь в проведении совместных мероприятий.
«Бывать здесь – большая радость. Кроме того, мы легко находим язык с русскими врачами, которые приезжают на обучение, они прекрасные студенты», — отметил Кимура Хидехито.
Руководитель отделения нейрохирургии госпиталя Масарик (Чехия), профессор Мартин Самеш рад возможности поделиться чешским опытом по лечению ишемии и считает одной из самых важных тем, освещенных на курсе, COSS-исследования.
«Мне было интересно обменяться опытом с российскими и японскими специалистами.
Мы оказываем взаимное влияние на развитие нейрохирургии в целом. ФЦН в Тюмени я посещаю во второй раз и вижу прогресс, в том числе в оснащении лаборатории. Хорошо, что каждый микроскоп подсоединен к монитору и у всех обучающихся есть возможность посмотреть, что происходит во время операции», — рассказал Мартин Самеш.
Работа в лаборатории особенно впечатлила самих участников, которые приехали на образовательный курс в Тюмень из Москвы, Уфы, Нижнего Новгорода, Новосибирска, Ростова-на-Дону, Краснодарского края и других регионов.
«Наложение микроанастомозов – одна из сложнейших тем в нейрохирургии. Я пока не владею этой техникой, только учусь, и мне кажется, что необходимо тысячи раз отработать швы на тренажерах, чтобы суметь применить это в операционной. Здесь теория сочетается с практикой, причем мастер-классы максимально приближены к реальной хирургии», — поделился впечатлениями врач-нейрохирург городской клинической больницы №21 города Уфы Дмитрий Синило.
Врач-нейрохирург областной нижегородской больницы им.Н.А. Семашко Иван Козин добавил, что его в целом впечатлила организация работы Федерального центра нейрохирургии в Тюмени. И из числа других учреждений, на базе которых организуются курсы для нейрохирургов, он выбрал именно ФЦН Тюмени, потому что только здесь участникам предоставляют возможность отработать практические навыки на мастер-классах.
Анастомоз легочной артерии. Кавопульмональный анастомоз. Техника выполнения операции
Для обеспечения адекватного легочного кровотока применяют системно-легочный анастомоз. Основной задачей этого вмешательства является создание адекватного, но не избыточного легочного кровотока при условии исключения деформаций легочных артерий. Наиболее подходящим является модифицированный подключично-легочный анастомоз по Blalock-Taussig с применением сосудистого протеза из политетрафлюороэтилена диаметром 3,5-4 мм. Он может быть выполнен как через боковую торакотомию, так и через срединный доступ.
Он может быть выполнен как через боковую торакотомию, так и через срединный доступ.
Техника наложения модифицированного анастомоза по Blalock-Taussig через боковую торакотомию относительно проста. При выборе стороны торакотомии используют общее правило. Предпочтение отдают стороне, на которой расположена ВПВ. Однако если легочный кровоток у ребенка зависит от функции ОАП, то при выборе стороны торакотомии следует учитывать расположение ОАП. Проток не может быть закрыт до тех пор, пока не будет наложен анастомоз. Проток мешает наложить анастомоз более проксимально для удобства его устранения во время последующих хирургических вмешательств, поэтому подключично-легочное соустье лучше накладывать на стороне, противоположной расположению ОАП.
Некоторые хирурги предпочитают накладывать подключично-легочный анастомоз со срединного доступа. Формирование шунта через этот доступ позволяет легко подключить искусственное кровообращение, если возникает такая необходимость, а также исключает образование коллатерального кровообращения, которое развивается в результате спаечного процесса в плевральной полости. Образование коллатеральных сосудов ухудшает кровообращение Fontan. В случаях недоразвития легочных артерий более эффективен центральный аорто-легочный анастомоз. Он обеспечивает равномерный двусторонний поток крови в легочные артерии, что способствует увеличению их размеров.
Образование коллатеральных сосудов ухудшает кровообращение Fontan. В случаях недоразвития легочных артерий более эффективен центральный аорто-легочный анастомоз. Он обеспечивает равномерный двусторонний поток крови в легочные артерии, что способствует увеличению их размеров.
Хирургическое лечение пациентов с избыточным легочным кровотоком без обструкции выхода в системный круг кровообращения
Избыточный легочный кровоток приводит к повышению давления в легочной артерии и объемной перегрузке системного желудочка. В результате возникает застойная сердечная недостаточность и развивается обструктивная болезнь легочных артерий.
В целях уменьшения кровотока по легочным артериям производят суживание легочного ствола. Это вмешательство можно выполнять из левосторонней торакотомии и со срединного доступа. Из этого доступа удобнее суживать легочный ствол при ТМА.
Самым ответственным моментом операции является выбор целевого диаметра легочного ствола. Для пациентов с одножелудочковым сердцем длина суживающей тесьмы представляет собой сумму чисел: 24 и числа, соответствующего массе тела ребенка. Например, если масса больного 4 кг, то длина тесьмы должна составлять 28 мм. Эта длина обычно является начальной. Дополнительное суживание производят под контролем давления в легочной артерии дистальнее тесьмы. После суживания давление в легочной артерии должно составлять 1/3 системного, а артериальное насыщение кислородом — не ниже 75%. Необходимо учитывать, что эти измерения производят во время наркоза, искусственной вентиляции легких с открытой грудной клеткой.
Например, если масса больного 4 кг, то длина тесьмы должна составлять 28 мм. Эта длина обычно является начальной. Дополнительное суживание производят под контролем давления в легочной артерии дистальнее тесьмы. После суживания давление в легочной артерии должно составлять 1/3 системного, а артериальное насыщение кислородом — не ниже 75%. Необходимо учитывать, что эти измерения производят во время наркоза, искусственной вентиляции легких с открытой грудной клеткой.
Хирургическое лечение пациентов с избыточным легочным кровотоком и обструкцией выхода в системный круг кровообращения
Среди больных с избыточным легочным кровотоком часто встречаются случаи препятствия на пути выхода крови в системный круг кровообращения, поэтому помимо уменьшения поступления крови в легочные артерии необходимо обеспечить свободный путь крови в системный круг. Причиной обструкции выводного тракта желудочка могут быть подклапанное или клапанное сужение устья аорты, а также гипоплазия восходящей аорты и дуги.
Наиболее частой причиной подклапанного сужения является малый диаметр бульбовентрикулярного отверстия, через которое кровь из желудочка поступает в выпускную камеру и аорту.
Существуют два способа оперативного лечения этого варианта порока:
Первый из них заключается в том, что из желудочка формируют дополнительный выход в системный круг кровообращения через легочный ствол. Для этого последний рассекают поперек и его проксимальный конец подшивают к восходящей аорте. Отверстие дистального конца легочного ствола ушивают, а легочный кровоток обеспечивают за счет системно-легочного анастомоза.
Второй подход заключается в иссечении субаортального сужения с одновременным суживанием легочного ствола.
В ряде случаев наблюдаются явные признаки сужения выхода крови в системный круг кровообращения, в других случаях четкие физиологические данные, подтверждающие наличие сужения, отсутствуют. При эхокардиографическом исследовании можно обнаружить сужение субаортального пространства относительно диаметра клапанного кольца.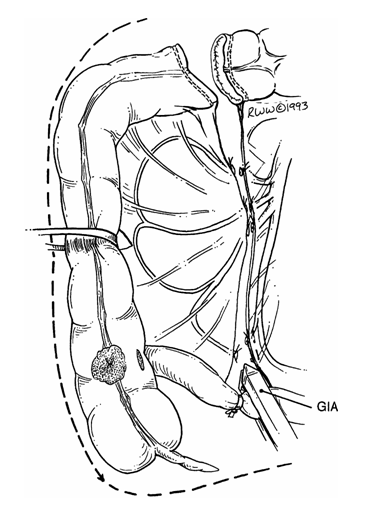
Matitiau изучил динамику изменения размеров бульбовентрикулярного отверстия в процессе развития ребенка. Он установил, что при увеличении поверхности тела ребенка индекс поперечного сечения бульбовентрикулярного отверстия прогрессивно уменьшается. В тех случаях, когда индекс поперечного сечения бульбовентрикулярного отверстия в неонатальном периоде был меньше чем 2 см2/м2, в последующем всегда развивалось субаортальное сужение, которое требовало его устранения. Эти данные были получены у больных с ЕЖС по левожелудочковому типу с выпускной камерой для аорты и, таким образом, неприменимы при других вариантах функционально единственного желудочка. Тем не менее, этот принцип может быть использован у больных, у которых основная аномалия сочетается с коарктацией аорты или гипоплазий восходящей аорты. В таких случаях наблюдается также некоторое сужение выводного отдела с последующим образованием субаортального стеноза в постнеонатальном периоде, поэтому считается целесообразным произвести устранение этих сужений.
Выбор методики устранения сужений на пути выхода крови в системный круг кровообращения зависит не только от его локализации, но и от расположения магистральных артерий, а также направленности дуги аорты.
У большинства новорожденных субаортальное сужение устраняют путем выполнения процедуры Damus-Kaye-Stansel или ее модификаций. У детей с нормальным расположением магистральных артерий такую операцию выполняют по методике, которая применяется при синдроме гипоплазии левых отделов сердца.
Операцию осуществляют в условиях глубокой гипотермии и полной остановки кровообращения. Канюлируют восходящую аорту и правое предсердие. Если имеется резкое сужение дуги аорты, используют две артериальные канюли. Отдельно канюлируют восходящую аорту и легочный ствол. Из легочного ствола через ОАП перфузируется бассейн нисходящей аорты, а из восходящей аорты — брахиоцефальные сосуды. При канюляции только восходящей аорты выделяют и перевязывают ОАП сразу после начала искусственного кровообращения, чтобы кровь из аорты не поступала в легкие. При использовании двух артериальных канюль под легочные артерии подводят лигатурные петли, которые затягивают в начале перфузии.
При использовании двух артериальных канюль под легочные артерии подводят лигатурные петли, которые затягивают в начале перфузии.
Для предотвращения попадания воздуха в сосуды головного мозга во время полной остановки кровообращения лигатурными петлями также пережимают плечеголовные артерии.
После введения кардиоплегического раствора и остановки кровообращения рассекают легочный ствол у самой бифуркации. Отверстие в дистальном конце ствола ушивают непрерывным швом или закрывают аутоперикардиальной заплатой. Использование заплаты позволяет избежать образования деформаций легочных артерий. В случаях, когда канюлируют только восходящую аорту, рассекают легочный ствол и закрывают отверстие в дистальном конце до остановки сердечной деятельности и кровообращения.
Продольным разрезом справа рассекают восходящую аорту в задней ее части. Начинают разрез ниже уровня рассечения легочного ствола. Его направляют вверх и заканчивают в месте отхождения безымянной артерии. Так же продольно рассекают проксимальный конец легочного ствола. Оба разреза анастомозируют между собой непрерывным швом. Оставшиеся свободными часть окружности легочного ствола и разреза аорты соединяют между собой с помощью гомографта. Заплата должна иметь форму полуконуса, длина основания которого должна соответствовать длине оставшейся свободной окружности проксимального конца легочного ствола, а стороны — длине разреза аорты.
Так же продольно рассекают проксимальный конец легочного ствола. Оба разреза анастомозируют между собой непрерывным швом. Оставшиеся свободными часть окружности легочного ствола и разреза аорты соединяют между собой с помощью гомографта. Заплата должна иметь форму полуконуса, длина основания которого должна соответствовать длине оставшейся свободной окружности проксимального конца легочного ствола, а стороны — длине разреза аорты.
При наличии сужения на уровне дуги аорты его расширяют путем вшивания отдельной заплаты. Для этого на боковой стенке восходящей аорты делают второй продольный разрез. Из восходящей аорты его направляют на дугу и дальше на нисходящую часть, ниже расположения ОАП. Очень важно, чтобы обе вшитые заплаты перекрывали друг друга. Это делают в целях предотвращения образования сужения сегмента аорты, расположенного между заплатами. В случаях, когда имеется стеноз или атрезия одного из AV-клапанов, проверяют величину межпредсердного дефекта. Если он небольшой, его расширяют.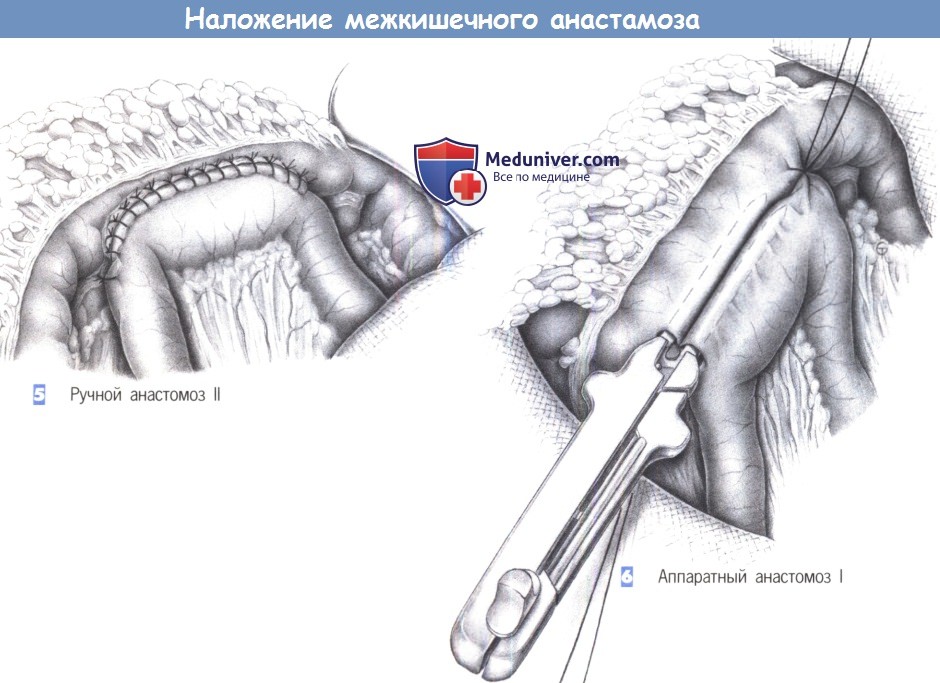 Операцию завершают наложением модифицированного анастомоза по Blelock-Taussig. Его накладывают после возобновления искусственного кровообращения и удаления воздуха из полостей сердца.
Операцию завершают наложением модифицированного анастомоза по Blelock-Taussig. Его накладывают после возобновления искусственного кровообращения и удаления воздуха из полостей сердца.
У больных с обструкцией выхода в большой круг кровообращения только на субаортальном уровне можно применить модификации, предусматривающие прямой анастомоз между легочным стволом и восходящей аортой.
Второй способ устранения субаортального сужения заключается в расширении межжелудочкового сообщения с одновременным суживанием легочного ствола. Данный метод более физиологичен. Различия между двумя способами заключаются в том, что после суживания легочного ствола кровь в легкие поступает только во время систолы желудочков, поэтому диастолическое давление остается высоким и коронарный кровоток не уменьшается. У больных с наличием системно-легочного шунтирования после процедуры Damus-Kay-Stansel кровь в легочные артерии поступает как в систолу, так и в диастолу. В результате из-за сниженного диастолического давления страдает коронарный кровоток.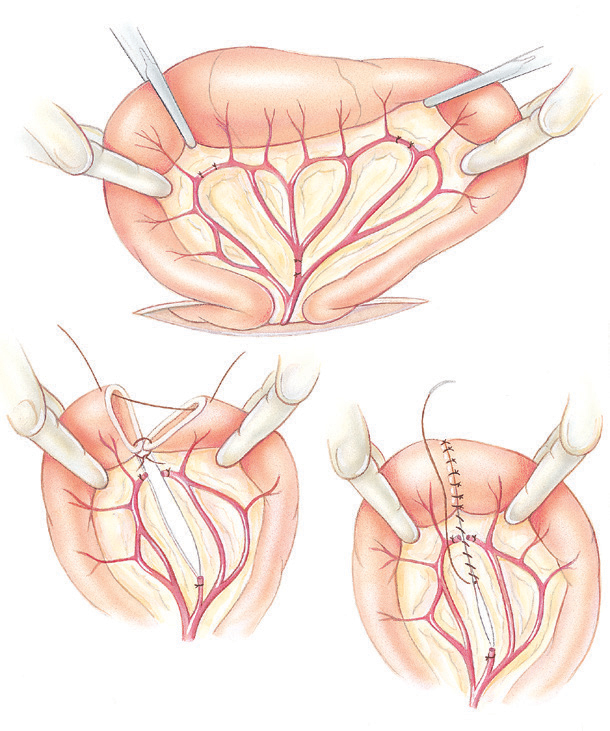
Техника расширения бульбовентрикулярного отверстия
Техника расширения бульбовентрикулярного отверстия описана Cheung и соавторами. Операцию выполняют в условиях искусственного кровообращения с применением глубокой гипотермии и кардиоплегии. Иногда бульбовентрикулярное отверстие можно расширить доступом через разрез аорты, но в грудном возрасте чаще всего приходится применять разрез инфундибулярной выпускной камеры. Очень важно во время расширения бульбовентрикулярного отверстия не повредить проводящие пути. Отверстие расширяют за счет иссечения перегородки в нижне-левом направлении. Разрез инфундибулярной части закрывают заплатой, которая также способствует расширению подаортального выводного тракта. Суживание легочного ствола выполняют во время согревания больного. Окончательное суживание и измерение давления в легочной артерии осуществляют после окончания искусственного кровообращения и стабилизации сердечной деятельности.
Особенности послеоперационного ведения
Ведение больных с функционально единственным желудочком сердца, перенесших паллиативное вмешательство, заключается в создании баланса между системным и легочным кровообращением.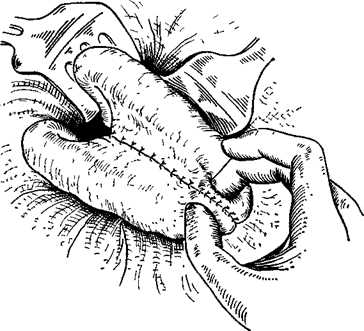 Если послеоперационное течение осложняется чрезмерным цианозом или неадекватным сердечным выбросом, требуется срочное проведение эхокардиографического или ангиографического исследования для выявления остаточных анатомических дефектов.
Если послеоперационное течение осложняется чрезмерным цианозом или неадекватным сердечным выбросом, требуется срочное проведение эхокардиографического или ангиографического исследования для выявления остаточных анатомических дефектов.
Хирургическая тактика в постнеонатальном периоде
Ведение больных с одножелудочковым сердцем в постнеонатальном периоде направлено на лечение застойной сердечной недостаточности и создание благоприятных условий для последующей коррекции гемодинамики по Fontan. При застойной сердечной недостаточности в дооперационном и послеоперационном периодах назначают дигоксин, диуретики и АПФ. Наиболее частыми проблемами в постнеонатальном периоде являются рестеноз дуги аорты, прогрессирование или развитие субаортальных сужений, ухудшение функции желудочка или АV-клапанов, а также повышение ЛСС. Устойчивость к медикаментозному лечению застойной сердечной недостаточности является одним из первых клинических сигналов развития сужения на уровне дуги аорты или субаортального стеноза.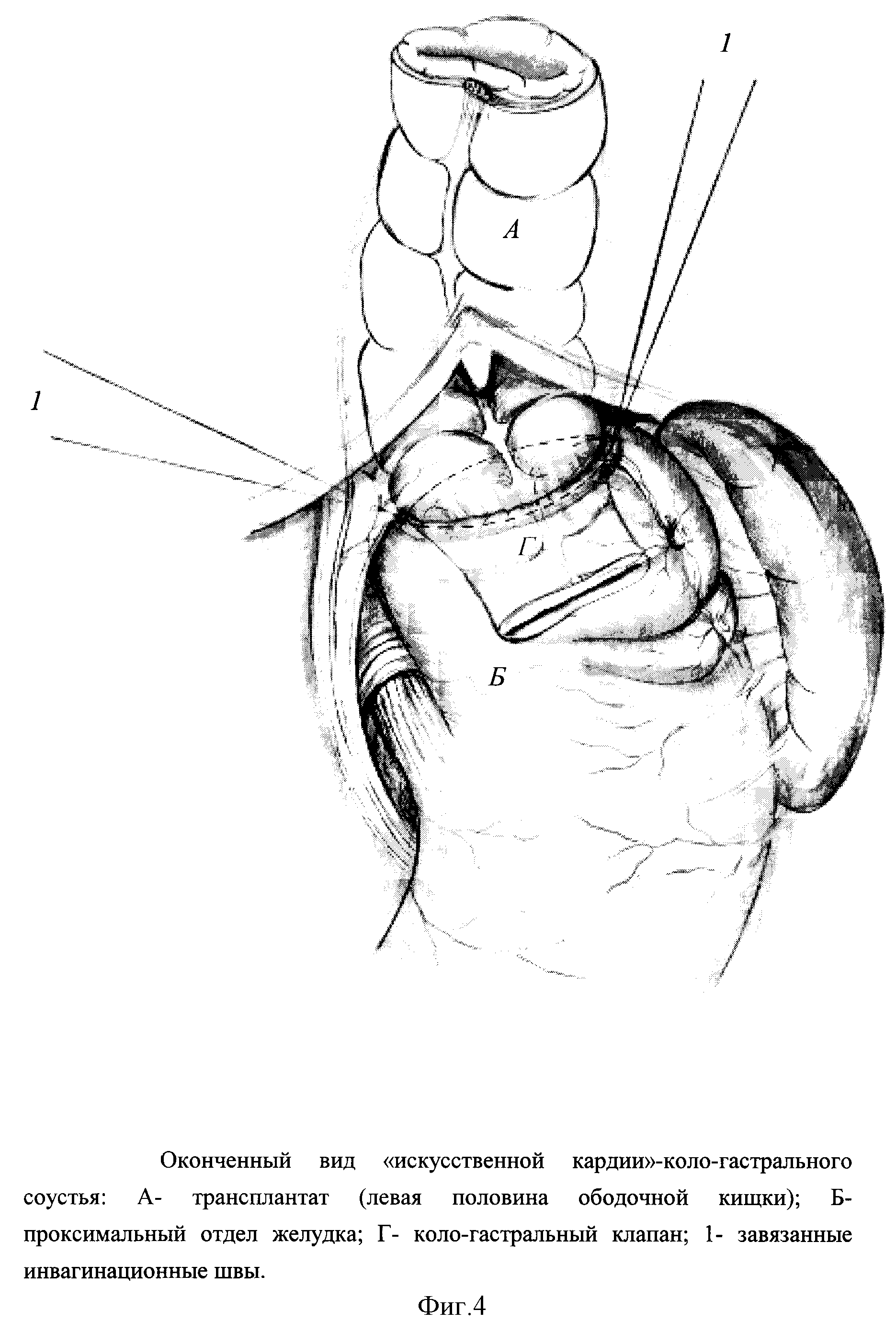 Несмотря на то, что с помощью ЭхоКГ большинство из этих сопутствующих пороков могут быть диагностированы, необходимо произвести катетеризацию полостей сердца на протяжении первых 6 мес. жизни ребенка. Это необходимо выполнить в целях измерения давления в легочной артерии и объемной перегрузки легких, вычисления ЛСС, выявления крупных коллатеральных артерий, которые являются причиной перегрузки легочного сосудистого русла. Во время зондирования полостей сердца необходимо попытаться перекрыть системно-легочные коллатеральные артерии с помощью катетерных технологий.
Несмотря на то, что с помощью ЭхоКГ большинство из этих сопутствующих пороков могут быть диагностированы, необходимо произвести катетеризацию полостей сердца на протяжении первых 6 мес. жизни ребенка. Это необходимо выполнить в целях измерения давления в легочной артерии и объемной перегрузки легких, вычисления ЛСС, выявления крупных коллатеральных артерий, которые являются причиной перегрузки легочного сосудистого русла. Во время зондирования полостей сердца необходимо попытаться перекрыть системно-легочные коллатеральные артерии с помощью катетерных технологий.
Хирургическая тактика постнеонатального периода предусматривает хирургические вмешательства, направленные на ограничение систолической и объемной нагрузки на единственный желудочек. Для устранения перегрузки желудочка давлением используют ранее описанные вмешательства. Объемную перегрузку желудочка устраняют путем закрытия системно-легочных шунтов и создания прямого сообщения между системными венами и легочными артериями. Это достигается путем создания двунаправленного кавопульмонального анастомоза или операции Fontan. Важно осознавать, что в результате гемодинамической коррекции по Fontan образуется физиологическое состояние, при котором вся энергия, потребляемая сердечно-сосудистой системой, обеспечивается единственным желудочком. Поэтому последовательное соединение системного и легочного кровообращения предпочтительнее параллельного.
Это достигается путем создания двунаправленного кавопульмонального анастомоза или операции Fontan. Важно осознавать, что в результате гемодинамической коррекции по Fontan образуется физиологическое состояние, при котором вся энергия, потребляемая сердечно-сосудистой системой, обеспечивается единственным желудочком. Поэтому последовательное соединение системного и легочного кровообращения предпочтительнее параллельного.
Таким образом, главной задачей хирургической стратегии при аномалиях сердца с функционально единственным желудочком является создание анатомо-физиологических условий для выполнения полной коррекции по Fontan в оптимальном возрасте. Ведение больных должно быть направлено на решение двух задач:
смягчение клинического синдрома;
устранение анатомических и функциональных факторов, препятствующих выполнению операции Fontan.
Роль кавопульмонального анастомоза в хирургическом лечении одножелудочкового сердца
Анастомоз между ВПВ и правой легочной артерией является частичной коррекцией гемодинамики в обход правого желудочка. На данном этапе развития кардиохирургии очень редко используется классический вариант этого вмешательства. Преимущество отдается более совершенной модификации в виде ДКПА. Кавопульмональный анастомоз может применяться в целях этапного лечения перед операцией Fontan и как окончательный вариант лечения у больных с одножелудочковым сердцем, сочетающимся с аномальным впадением НПВ в виде непарного или полунепарного ее продолжения в ВПВ. Этот метод играет важную роль в хирургическом лечении пациентов с наличием факторов риска для выполнения полной гемодинамической коррекции. К таким факторам относятся:
На данном этапе развития кардиохирургии очень редко используется классический вариант этого вмешательства. Преимущество отдается более совершенной модификации в виде ДКПА. Кавопульмональный анастомоз может применяться в целях этапного лечения перед операцией Fontan и как окончательный вариант лечения у больных с одножелудочковым сердцем, сочетающимся с аномальным впадением НПВ в виде непарного или полунепарного ее продолжения в ВПВ. Этот метод играет важную роль в хирургическом лечении пациентов с наличием факторов риска для выполнения полной гемодинамической коррекции. К таким факторам относятся:
наличие деформаций легочных артерий;
повышенное давление в легочной артерии;
повышенное ЛСС ;
наличие атрезии левого AV-клапана или общего AV-клапана;
наличие субаортального стеноза;
наличие недостаточности АV-клапанов;
сочетание ЕЖС с ТАДЛВ.
Особую роль играет ДКПА в лечении синдрома гипоплазии правого желудочка.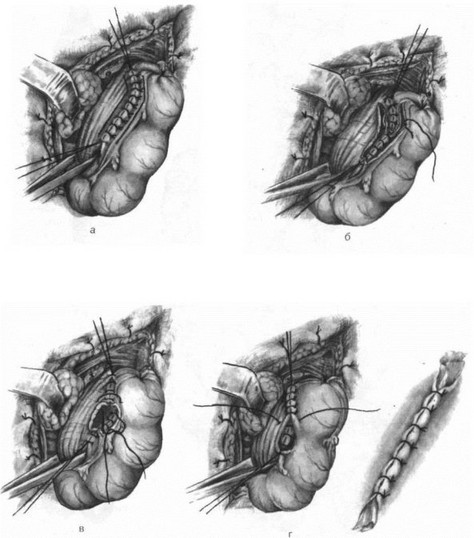 При этой патологии его применяют как окончательный вариант хирургического лечения в сочетании с корригирующими операциями, выполняемыми на внутрисердечном уровне. В данной ситуации гипоплазированный правый желудочек вовлекается в легочное кровообращение, создавая пульсирующий кровоток. Для предотвращения перегрузки недоразвитого желудочка венозный возврат из верхней половины туловища отводят через ДКПА непосредственно в легочную артерию.
При этой патологии его применяют как окончательный вариант хирургического лечения в сочетании с корригирующими операциями, выполняемыми на внутрисердечном уровне. В данной ситуации гипоплазированный правый желудочек вовлекается в легочное кровообращение, создавая пульсирующий кровоток. Для предотвращения перегрузки недоразвитого желудочка венозный возврат из верхней половины туловища отводят через ДКПА непосредственно в легочную артерию.
Двунаправленный кавопульмональный анастомоз имеет несколько преимуществ перед системно-легочными анастомозами. Он не увеличивает объемную нагрузку на желудочек, который, по определению, несет избыточную нагрузку по обеспечению системного и легочного кровотока, не способствует повышению ЛСС, несет в легочную артерию венозную кровь, а не артериально-венозную смесь, уменьшает объем крови, попадающей в правое предсердие. В отличие от классической операции, при ДКПА правая легочная артерия и легочный ствол не разобщены и кровь из ВПВ поступает в оба легких, сохраняется возможность попадания крови из бассейна НПВ в оба легких.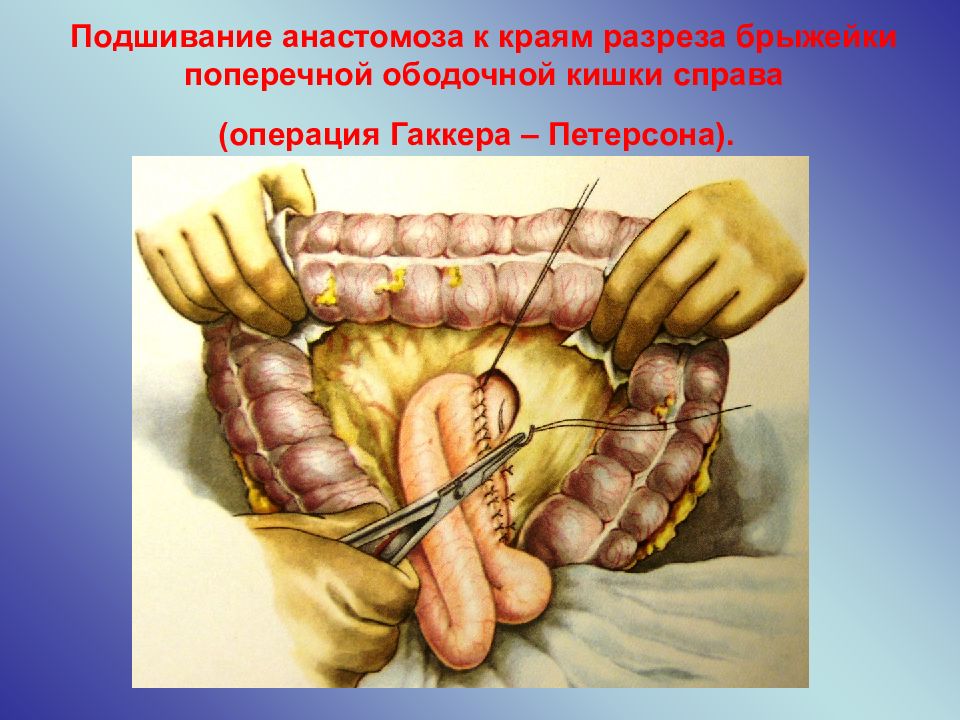
Степень повышения оксигенации артериальной крови после выполнения ДКПА зависит от возраста больного, дополнительных источников кровоснабжения легких и наличия непарного или полунепарного продолжения НПВ в ВПВ. В процессе роста ребенка количество крови, притекающей из системы ВПВ, меняется.
Так, у новорожденных оно составляет 49% объема циркулирующей крови, у детей в возрасте 2,5 года достигает 55%, а затем с развитием ребенка постепенно уменьшается и после 6 лет составляет 35%. Поэтому клинический эффект ДКПА значительно лучше у детей младшего возраста. У больных с наличием дополнительных источников кровоснабжения легких в виде системно-легочных коллатеральных артерий или сохраненного кровотока через стенозированное устье легочного ствола отмечается более высокий уровень насыщения артериальной крови кислородом. В случаях с непарным или полунепарным продолжением НПВ в ВПВ после выполнения ДКПА наблюдается значительное повышение артериальной сатурации кислородом. Это обусловлено тем, что в процессе оксигенации не участвует только кровь из коронарного синуса и печеночной вены.
В некоторых клиниках ДКПА формируют всем больным с функционально единственным желудочком, рассматривая его как подготовительную стадию лечения. ДКПА выполняют детям в возрасте 6-12 мес, а операцию Fontan — в возрасте 2 года. Применение такой схемы позволяет значительно раньше исключить источники объемной перегрузки желудочка и, таким образом, добиться лучшего окончательного результата. Этапное формирование кровообращения по Fontan способствует меньшему изменению геометрии желудочка по сравнению с одностадийным выполнением полной гемодинамической коррекции. Выраженные изменения геометрии желудочка после операции Fontan способствуют снижению сердечного выброса в раннем послеоперационном периоде.
Forbes и соавторы установили разницу влияния ДКПА на изменение массы желудочка у пациентов, которым кавопульмональный анастомоз был сформирован в раннем детстве и в старшем возрасте. Если у маленьких детей после выполнения ДКПА наблюдалась явная регрессия массы желудочка, то у подростков эти изменения были малоубедительными.
Одним из самых дискуссионных вопросов является выбор альтернативных решений: оставлять ли выход из правого желудочка через стенозированный клапан легочной артерии или полностью закрыть его? Некоторые авторы отмечают, что у больных с оставленным выходом в легочный ствол течение послеоперационного периода было более тяжелое, чем у тех, которым выход закрывали. При сохранении антеградного кровотока чаще отмечали транссудацию в плевральные полости и развитие хилоторакса в позднем послеоперационном периоде. Другие констатировали, что больных с дополнительным источником кровенаполнения легких через легочный ствол удавалось быстрее отлучить от механической вентиляции легких и укоротить сроки лечения в отделении интенсивной терапии. Эти авторы считают, что сохранение пульсирующего кровотока в легочных артериях предотвращает развитие артериовенозных фистул в легких и системно-легочных коллатералей. Также одной из положительных сторон этого подхода они считают сохранение возможности роста легочных артерий.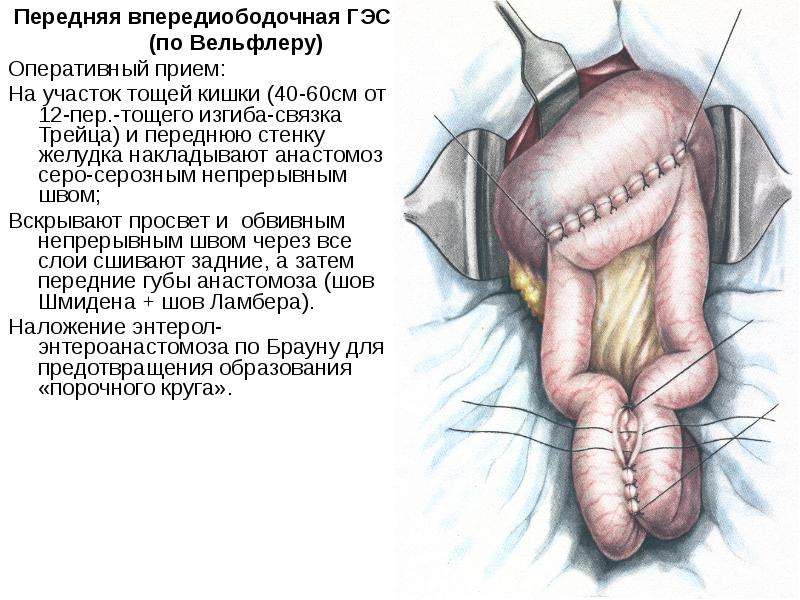
У пациентов с сохраненным кровотоком через легочный ствол наблюдается более высокое насыщение артериальной крови кислородом, однако это достигается ценой объемной перегрузки желудочка. Поэтому объем легочного кровотока в каждом случае следует подбирать таким образом, чтобы предотвратить объемную перегрузку желудочка и повышение давления в ВПВ.
На основании исследований можно отметить, что результаты выполнения ДКПА лучше в группе больных без дополнительного источника кровоснабжения легких через легочный ствол. У таких больных легче протекал ранний послеоперационный период, и в большинстве случаев отмечалось хорошее клиническое состояние на протяжении 1 года — 6 лет.
Aeba и соавторы считают необходимым оставлять частичный кровоток через легочный ствол у пациентов с низким давлением в ВПВ и недостаточным насыщением артериальной крови кислородом. Miyaji и соавторы установили, что после формирования ДКПА значительно уменьшается количество факторов риска для выполнения операции Fontan. У пациентов с пульсирующим кровотоком необходимость полной гемодинамической коррекции возникает значительно реже.
У пациентов с пульсирующим кровотоком необходимость полной гемодинамической коррекции возникает значительно реже.
Эта операция заключается в анастомозировании ВПВ с дистальным концом правой легочной артерии по типу «конец в бок». Ее выполняют через боковую торакотомию справа. Контроль давления в ВПВ осуществляют через катетер, поставленный в одну из центральных вен. Боковую торакотомию выполняют по IV межреберному промежутку справа. Правую легочную артерию и ее ветви, а также ВПВ тщательно освобождают от окружающих тканей, стараясь не повредить диафрагмальный нерв, проходящий рядом с этими сосудами. Под ветви правой легочной артерии подводят лигатурные петли, которые затягивают во время формирования анастомоза. Сосудистым зажимом пережимают проксимальный конец правой легочной артерии в месте, где она отходит от ствола, и пересекают ее поперечным разрезом. Проксимальный конец правой легочной артерии ушивают непрерывным швом. На некотором расстоянии от места впадения в полую вену перевязывают непарную вену. Заднебоковую поверхность ВПВ отжимают сосудистым зажимом. Непарную вену вскрывают поперек, вблизи от впадения ее в полую вену. Конец непарной вены, который остается со стороны полой вены, вскрывают продольным разрезом с переходом на полую вену. Затем разрез удлиняют на ВПВ в нижнем направлении. Проленовой нитью 6/0 дистальный конец правой легочной артерии анастомозируют с боковой стенкой ВПВ. Для предотвращения сужения соустья переднюю губу лучше сшивать отдельными швами. После окончательного формирования анастомоза ВПВ перевязывают толстой лавсановой нитью в месте соединения ее с правым предсердием.
Заднебоковую поверхность ВПВ отжимают сосудистым зажимом. Непарную вену вскрывают поперек, вблизи от впадения ее в полую вену. Конец непарной вены, который остается со стороны полой вены, вскрывают продольным разрезом с переходом на полую вену. Затем разрез удлиняют на ВПВ в нижнем направлении. Проленовой нитью 6/0 дистальный конец правой легочной артерии анастомозируют с боковой стенкой ВПВ. Для предотвращения сужения соустья переднюю губу лучше сшивать отдельными швами. После окончательного формирования анастомоза ВПВ перевязывают толстой лавсановой нитью в месте соединения ее с правым предсердием.
При выполнении классического кавопульмонального анастомоза важно знать, есть ли дополнительная левая верхняя полая вена. Если она имеется и отсутствует связь ЛВПВ с правой верхней полой веной посредством плечеголовной вены, выполнение классической модификации кавопульмонального анастомоза чревато возникновением осложнений со стороны головного мозга. Если же обе ВПВ соединены между собой крупной плечеголовной веной, можно выполнить анастомоз и перевязать ЛВПВ. Иногда перевязка ЛВПВ может привести к возникновению инфаркта миокарда. Это бывает в тех случаях, когда атрезировано устье коронарного синуса и кровь из вен сердца дренируется в ЛВПВ.
Иногда перевязка ЛВПВ может привести к возникновению инфаркта миокарда. Это бывает в тех случаях, когда атрезировано устье коронарного синуса и кровь из вен сердца дренируется в ЛВПВ.
Техника выполнения ДКПА
Эта операция может быть выполнена с использованием искусственного кровообращения или без него. Большинство хирургов предпочитает выполнять ее через срединный доступ в условиях искусственного кровообращения. Мобилизуют легочную артерию и ее долевые ветви с той стороны, где предполагают наложить соустье. Верхнюю полую вену освобождают от перикарда до места впадения в нее левой плечеголовной вены. Канюлируют аорту, ВПВ или плечеголовную вену, НПВ. Анастомоз формируют сразу же после начала искусственного кровообращения, на сокращающемся сердце. При наличии ранее выполненного системно-легочного анастомоза его пережимают и отсекают от легочной артерии. Перевязывают также непарную вену. ВПВ рассекают на 4-5 мм выше кавоатриального соединения. Головной конец вены анастомозируют с продольным разрезом верхнего края правой легочной артерии, а сердечный — ушивают непрерывным швом или закрывают заплатой из аутоперикарда. При наличии системно-легочного анастомоза ВПВ соединяют с легочной артерией в месте отсеченного системно-легочного анастомоза. Обычно не канюлируют ВПВ через ее стенку, так как это ограничивает ее подвижность. Перфузию начинают с одним венозным катетером в правом предсердии. По латеральным сторонам ВПВ накладывается два шва-держалки, которые позволяют избежать перекручивания вены при анастомозировании с легочной артерией. После пересечения ВПВ в ее зияющий просвет вводится венозный катетер и обжимается вокруг него полая вена турникетом. Швы-держалки позволяют приблизить вену к разрезу правой легочной артерии. Катетер не мешает выполнению анастомоза. После наложения основной части линии шва удаляется катетер и оставшаяся часть разрезов закрывается отдельными узловыми швами для исключения эффекта кисета и обеспечения возможности роста соустья.
При наличии системно-легочного анастомоза ВПВ соединяют с легочной артерией в месте отсеченного системно-легочного анастомоза. Обычно не канюлируют ВПВ через ее стенку, так как это ограничивает ее подвижность. Перфузию начинают с одним венозным катетером в правом предсердии. По латеральным сторонам ВПВ накладывается два шва-держалки, которые позволяют избежать перекручивания вены при анастомозировании с легочной артерией. После пересечения ВПВ в ее зияющий просвет вводится венозный катетер и обжимается вокруг него полая вена турникетом. Швы-держалки позволяют приблизить вену к разрезу правой легочной артерии. Катетер не мешает выполнению анастомоза. После наложения основной части линии шва удаляется катетер и оставшаяся часть разрезов закрывается отдельными узловыми швами для исключения эффекта кисета и обеспечения возможности роста соустья.
У больных с функционально единственным желудочком сердца, особенно сочетающимся с гетеротаксией и предсердным изомеризмом, часто имеют место аномалии системного и легочного венозного возврата. В этих случаях нередко бывают билатеральные ВПВ и обязательным условием является анастомозирование обеих вен с правой и левой ветвями легочной артерии во избежание перетока венозной крови из правой вены в левую. При наличии АЛА в неонатальном периоде необходимо наложить системно-легочный анастомоз. Если имеются СЛА и адекватный легочный кровоток, двусторонний кавопульмональный анастомоз может быть первым вмешательством, которое выполняют в условиях искусственного кровообращения.
В этих случаях нередко бывают билатеральные ВПВ и обязательным условием является анастомозирование обеих вен с правой и левой ветвями легочной артерии во избежание перетока венозной крови из правой вены в левую. При наличии АЛА в неонатальном периоде необходимо наложить системно-легочный анастомоз. Если имеются СЛА и адекватный легочный кровоток, двусторонний кавопульмональный анастомоз может быть первым вмешательством, которое выполняют в условиях искусственного кровообращения.
В ситуациях, когда ДКПА необходимо сочетать с расширением ДМПП или другими внутрисердечными вмешательствами, операцию выполняют в условиях умеренной гипотермии и кардиоплегии. Первый этап выполняют при сокращающемся сердце, а внутрисердечный — в условиях кардиоплегии.
5.2.2. Техника маммарокоронарного шунтирования в условиях искусственного кровообращения
Наряду с использованием аутовенозных трансплантатов при операциях АКШ широкое признание получил метод маммарокоронарного шунтирования (МКШ), имеющий как преимущества, так и недостатки. К преимуществам метода МКШ можно отнести использование артериального кондуита, однородного с КА, оптимальное соотношение диаметров ВГА и КА и высокую линейную скорость кровотока. Недостатками использования ВГА следует считать ее высокую склонность к спазмированию и тот факт, что в 25 % случаев отмечается ее малый диаметр и низкий объемный кровоток. В связи с этим перед тем как создать анастомоз между внутренней грудной и коронарной артериями, необходимо выполнить контрольное измерение объемной скорости кровотока по ВГА путем кровопускания в мерную емкость. Обычно объемная скорость кровотока по ВГА варьирует от 40 до 180 мл/мин при средних значениях артериального давления в ней 50—60 мм рт.ст. [Rankir J.S. et al., 1986]. Кровоток, превышающий 40 мл/мин, считается вполне приемлемым для использования ее при шунтировании коронарных артерий малых размеров. Однако для шунтирования коронарных артерий больших размеров и при выполнении последовательных маммарокоронарных анастомозов для достижения хороших результатов необходим кровоток, приближающийся к 100 мл/мин и более.
К преимуществам метода МКШ можно отнести использование артериального кондуита, однородного с КА, оптимальное соотношение диаметров ВГА и КА и высокую линейную скорость кровотока. Недостатками использования ВГА следует считать ее высокую склонность к спазмированию и тот факт, что в 25 % случаев отмечается ее малый диаметр и низкий объемный кровоток. В связи с этим перед тем как создать анастомоз между внутренней грудной и коронарной артериями, необходимо выполнить контрольное измерение объемной скорости кровотока по ВГА путем кровопускания в мерную емкость. Обычно объемная скорость кровотока по ВГА варьирует от 40 до 180 мл/мин при средних значениях артериального давления в ней 50—60 мм рт.ст. [Rankir J.S. et al., 1986]. Кровоток, превышающий 40 мл/мин, считается вполне приемлемым для использования ее при шунтировании коронарных артерий малых размеров. Однако для шунтирования коронарных артерий больших размеров и при выполнении последовательных маммарокоронарных анастомозов для достижения хороших результатов необходим кровоток, приближающийся к 100 мл/мин и более. При введении папаверина в просвет артерии диаметр ВГА колеблется от 1,5 до 3,5 мм, составляя в среднем 2 мм.
При введении папаверина в просвет артерии диаметр ВГА колеблется от 1,5 до 3,5 мм, составляя в среднем 2 мм.
Техника маммарокоронарного шунтирования (МКШ) состоит в следующем: после выполнения срединной стернотомии выделяют левую и правую ВГА на всем протяжении. Боковые ветви клипируют, лигируют или коагулируют. Предпочтительно анастомоз между ВГА и КА выполнять нитью 7/0 (рис. 5.3). Анализируя собственный опыт наложения дистальных анастомозов как с аутовеной, так и с внутренней грудной артерией, мы пришли к заключению, что предпочтительно накладывать первые швы не к «пятке» с последующим непрерывным швом с обеих сторон двумя иглами навстречу друг другу, а накладывать первый П-образный шов на боковую стенку ВГА или аутовены. Это позволяет раскрыть просвет шунтируемой коронарной артерии и под контролем зрения, с хорошей ее экспозицией выполнить непрерывный сосудистый шов. Такая техника почти в 100 % случаев гарантирует проходимость анастомоза (рис. 5.4).
При множественной реваскуляризации миокарда анастомоз между ВГА и КА выполняют в последнюю очередь, после наложения аутовенозных аортокоронарных шунтов.
Рис. 5.3. Маммарокоронарное шунтирование.
Это позволяет избежать дополнительной травмы ВГА. Для увеличения объема прямой реваскуляризации миокарда (т.е. числа шунтированных сосудов) с использованием ВГА применяют последовательное, или секвенциальное, МКШ (рис. 5.5). МКШ чаще всего производят для шунтирования ПМЖВ и ДВ. При использовании ВГА для последовательного шунтирования коронарных артерий in situ ее диаметр должен быть не менее 2—2,5 мм, кровоток — 100 мл/мин и более, она должна быть достаточной по длине, чтобы без натяжения достигнуть места дистальных анастомозов.
При последовательном шунтировании ПМЖВ и ДВ используют параллельную технику, однако при шунтировании комбинации ОВ и краевых ветвей, когда угол между проксимальным (первым) и дистальным (вторым) анастомозами составляет 90°, используют так называемый анастомоз диамонд. При этом следует учитывать, что слишком большая артериотомия приводит к характерному стенозу в виде крыльев чайки, описанному C. M.Grondin и др. Во избежание этого зоны коронарных артерий с выраженным кальцинозом нельзя шунтировать при помощи анастомоза бок в бок; нельзя также выполнять их при интрамиокардиаль-ном расположении коронарных артерий, так как ВГА может перегибаться при выходе из глубокой миокардиальной борозды.
M.Grondin и др. Во избежание этого зоны коронарных артерий с выраженным кальцинозом нельзя шунтировать при помощи анастомоза бок в бок; нельзя также выполнять их при интрамиокардиаль-ном расположении коронарных артерий, так как ВГА может перегибаться при выходе из глубокой миокардиальной борозды.
При ВГА для двух или трех анастомозов необходимо избегать ее сильных изгибов, которые значительно снижают кровоток в дистальные артериальные сегменты. Следует отметить, что увеличенные в объеме легкие во время операции могут сместить ВГА медиально и привести к ошибке при ориентировке ВГА.
Рис. 5.4. Наложение анастомоза с коронарной артерией (методика автора). а — начало наложения анастомоза; б, в — последующие этапы; г — окончательный вид анастомоза.
Рис. 5.5. Маммарокоронарный секвенциальный шунт к ПМЖВ и ДВ.
Непосредственные результаты аортокоронарного шунтирования.
Большой опыт, накопленный более чем за 30-летний период использования КШ в лечении ИБС, постоянное совершенствование хирургической техники, методик анестезиологического и реаниматологического пособия, а также перфузио-логии позволили существенно снизить риск операции и добиться положительных результатов хирургического лечения.
По данным разных авторов, в группе пациентов старше 65 лет без выраженных нарушений сократительной способности ЛЖ риск операции составляет не более 1 %, а для пациентов моложе 65 лет с ФВ менее 35 % — не превышает 5 %. Частота периоперационного инфаркта миокарда колеблется от 2,2 до 5,0 %, кровотечения в послеоперационном периоде возможны у 2,2 % больных, нарушения ритма сердца, в том числе фибрилляция желудочков (ФЖ), встречаются с различной частотой — от 3 до 31 % случаев, а необходимость в ино-тропной поддержке в послеоперационном периоде возникла у 34 % больных [CartierR., 1966, 1998].
Неврологические расстройства — наиболее часто встречающееся осложнение после операций с ИК: их частота составляет от 0,4 до 80 % [Mora C.T., 1995]. Тяжесть неврологических осложнений варьирует от легкого нарушения тонких психических функций до очаговых неврологических расстройств, ступора и комы. При этом летальность при первом виде мозговых осложнений достигает 10 %, а во втором — 21 %. Наиболее вероятной причиной развития неврологической симптоматики после операций, выполненных в условиях ИК, является микроэм-болизация. Частота развития послеоперационных осложнений напрямую зависит от длительности проведения ИК. Так, при продолжительности ИК более 180 мин, отек мозга возникает у 14,3 % больных, при ИК в пределах 150—180 мин — у 4 %, а при ИК менее 150 мин мозговых осложнений не наблюдалось. Согласно последним данным Дьюкского университета, около 50 % пациентов, перенесших операцию КШ в условиях ИК, впоследствии страдают слабоумием.
Наиболее вероятной причиной развития неврологической симптоматики после операций, выполненных в условиях ИК, является микроэм-болизация. Частота развития послеоперационных осложнений напрямую зависит от длительности проведения ИК. Так, при продолжительности ИК более 180 мин, отек мозга возникает у 14,3 % больных, при ИК в пределах 150—180 мин — у 4 %, а при ИК менее 150 мин мозговых осложнений не наблюдалось. Согласно последним данным Дьюкского университета, около 50 % пациентов, перенесших операцию КШ в условиях ИК, впоследствии страдают слабоумием.
Частым осложнением (1—4 %) после операций КШ является меди-астинит. В исследованиях, проведенных J.Braxton и соавт. (2000), были детально изучены причины и факторы риска медиастинита. По утверждению авторов, наибольшему риску развития этого осложнения подвержены пациенты, которым операция выполнялась в экстренном порядке, а также пациенты с различными сопутствующими заболеваниями, с выраженной сердечной недостаточностью и ФВ менее 40 %. Особое значение в развитии этого осложнения отводится ожирению, в зависимости от степени выраженности которого вдвое повышается риск медиастинита. Риск раннего закрытия шунтов при медиастините значительно выше: через 12 мес после перенесенного медиастинита закрытыми оказались 38 % шунтов по сравнению с 9 % у пациентов с неосложненным послеоперационным течением.
Особое значение в развитии этого осложнения отводится ожирению, в зависимости от степени выраженности которого вдвое повышается риск медиастинита. Риск раннего закрытия шунтов при медиастините значительно выше: через 12 мес после перенесенного медиастинита закрытыми оказались 38 % шунтов по сравнению с 9 % у пациентов с неосложненным послеоперационным течением.
Пережатие аорты, необходимое при выполнении операций в условиях ИК, приводит к ишемии миокарда во время наложения дистальных анастомозов. Напряженный поиск методов защиты миокарда, проводимый на протяжении почти 30 лет, способствовал созданию достаточно эффективных кардиопле-гических растворов, однако ни один из них не является идеальным [Lichtenstein S. et al., 1991]. Исследования, начатые в этом направлении W.Bigelow и соавт. (1950) и N.Shumway и соавт. (1959), продолженные D.Cooley и соавт. (1972), S.Lichtenstein и соавт. (1991), позволили создать теорию реперфузи-онного повреждения и возникновения феномена «оглушенного миокарда». Он заключается в резком уменьшении уровня энергетических фосфатов, внутриклеточной перегрузке кальцием, образовании су-пероксидных радикалов и нарушении микроциркуляторного русла. Вследствие этого возникают обратимые и необратимые повреждения митохондрий, актинмиозиновых связей, собственно миофибрилл [Benetti F. et al., 1986], что вызывает нарушение сократительной способности миокарда. Тяжесть «оглушения» зависит от длительности пережатия аорты и исходного состояния миокарда [Akins C.W. et al., 1984]. Таким образом, пациенты с исходно низкой фракцией выброса, с нестабильной стенокардией и острым ИМ, а также повторно оперируемые больные образуют группу повышенного риска при операциях с ИК и пережатием аорты.
Он заключается в резком уменьшении уровня энергетических фосфатов, внутриклеточной перегрузке кальцием, образовании су-пероксидных радикалов и нарушении микроциркуляторного русла. Вследствие этого возникают обратимые и необратимые повреждения митохондрий, актинмиозиновых связей, собственно миофибрилл [Benetti F. et al., 1986], что вызывает нарушение сократительной способности миокарда. Тяжесть «оглушения» зависит от длительности пережатия аорты и исходного состояния миокарда [Akins C.W. et al., 1984]. Таким образом, пациенты с исходно низкой фракцией выброса, с нестабильной стенокардией и острым ИМ, а также повторно оперируемые больные образуют группу повышенного риска при операциях с ИК и пережатием аорты.
Базовый курс микрохирургической техники | Центр микрохирургической подготовки
Курсы
Зачем идти на курс?
- 30 часов работы с микроскопом.

- Обучение «от сложного к простому»: отработка техники на хвостовой артерии крысы нитью 11/0.
- Разберем основные лоскуты, используемые для закрытия дефектов при реконструкции. Покажем их дизайн на анатомическом материале.
- Торжественно вручим сертификат участника и отпразднуем завершение курсов.
- 🔥 Получите в подарок набор микрохирургических инструментов.
После курса Вы сможете:
- Профессионально работать с операционным микроскопом.
- Выполнять основные микрососудистые анастомозы.
- Освоить технику свободной пересадки лоскутов.
- Накладывать анастомоз на сосуд любого диаметра.
- Освоить шов нерва.
Программа курса
09:30
Регистрация
10:00
Открытие курса
10:10
Лекция: История микрохирургии. Основы микрохирургической техники
Основы микрохирургической техники
10:30
Лекция: Физические основы микроскопии
10:40
Лекция: Шовный материал, используемый в микрохирургии
10:50
Лекция: Микрохирургический инструментарий
11:00
Лекция: Виды микрохирургических анастомозов
11:20
Лекция: Работа с лабораторным животным
11:40
Практическое занятие: Навыки работы с микроскопом
12:00
Практическое занятие
15:00
Практическое занятие
19:00
Окончание первого дня
10:00
Практическое занятие
15:00
Практическое занятие (Wet Lab)
17:00
Лекция: ультразвуковое высокочастотное исследование сосудов
17:30
Практическое занятие (Wet Lab)
19:00
Окончание второго дня
10:00
Практическое занятие (Wet Lab)
15:00
Практическое занятие (Wet Lab)
19:00
Окончание третьего дня
10:00
Практическое занятие (Wet Lab)
15:00
Практическое занятие (Wet Lab)
17:30
Практическое занятие (Wet Lab)
19:00
Окончание четвёртого дня
10:00
Лекция: Алгоритм реабилитации пациентов с обширными дефектами челюстно-лицевой области
10:30
Практическое занятие (Wet Lab)
12:00
Практическое занятие (Wet Lab)
14:00
Практическое занятие (Wet Lab)
Преподаватели
% PDF-1. 4
4
%
66 0 объект
>
endobj
xref
66 82
0000000016 00000 н.
0000002524 00000 н.
0000002745 00000 н.
0000002779 00000 н.
0000003149 00000 п.
0000003251 00000 н.
0000004191 00000 п.
0000005322 00000 п.
0000005714 00000 н.
0000005911 00000 н.
0000010523 00000 п.
0000010826 00000 п.
0000011209 00000 п.
0000012972 00000 п.
0000013382 00000 п.
0000013558 00000 п.
0000014126 00000 п.
0000014512 00000 п.
0000014740 00000 п.
0000020101 00000 п.
0000020447 00000 п.
0000020819 00000 п.
0000020983 00000 п.
0000024978 00000 п.
0000025252 00000 п.
0000025615 00000 п.
0000025919 00000 п.
0000034250 00000 п.
0000034692 00000 п.
0000035034 00000 п.
0000037420 00000 п.
0000039766 00000 п.
0000039866 00000 п.
0000039967 00000 н.
0000042144 00000 п.
0000042514 00000 п.
0000042668 00000 п.
0000045921 00000 п.
0000046168 00000 п.
0000046552 00000 п.
0000048546 00000 н.
0000050493 00000 п.
0000050553 00000 п.
0000050785 00000 п.
0000050985 00000 п.
0000051276 00000 п.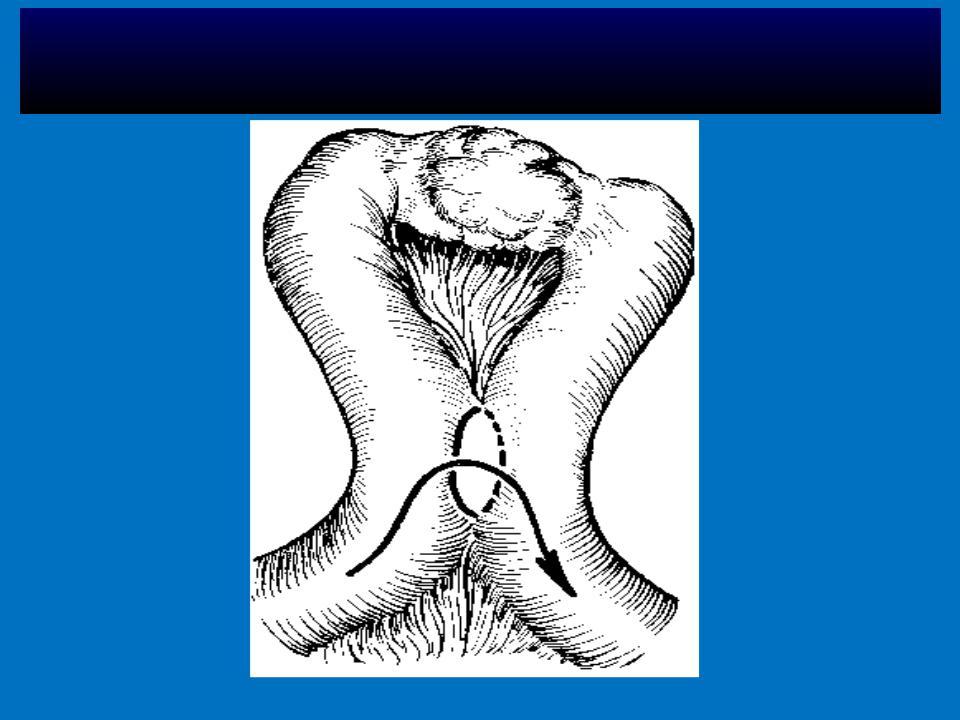
0000054182 00000 п.
0000054254 00000 п.
0000054394 00000 п.
0000054511 00000 п.
0000054555 00000 п.
0000054709 00000 п.
0000054750 00000 п.
0000054898 00000 п.
0000054939 00000 п.
0000055075 00000 п.
0000055119 00000 п.
0000055261 00000 п.
0000055305 00000 п.
0000055437 00000 п.
0000055481 00000 п.
0000055611 00000 п.
0000055655 00000 п.
0000055779 00000 п.
0000055823 00000 п.
0000055974 00000 п.
0000056018 00000 п.
0000056133 00000 п.
0000056258 00000 п.
0000056388 00000 п.
0000056432 00000 п.
0000056476 00000 п.
0000056520 00000 п.
0000056564 00000 п.
0000056681 00000 п.
0000056814 00000 п.
0000056859 00000 п.
0000056991 00000 п.
0000057036 00000 п.
0000057160 00000 п.
0000057205 00000 п.
0000001936 00000 н.
трейлер
] / Назад 949194 >>
startxref
0
%% EOF
147 0 объект
> поток
hb«b`e`c` + cf @
Техники лапароскопического анастомоза — Статья
A SAGES Wiki
Минимально инвазивная революция в общей хирургии началась с лапароскопической холецистэктомии. Желчный пузырь был идеальным органом для этой развивающейся технологии. Его необходимость в удалении была обычным явлением, практически все хирурги общего профиля были довольны открытой процедурой, и он находится на ножке, относительно легко удаляется и не требует реконструкции. Хотя в то время лапароскопическая холецистэктомия и аппендэктомия были продвинутыми, теперь они считаются основными лапароскопическими навыками, и ожидается, что хирургические ординаторы овладеют этими процедурами к завершению своего обучения. По мере развития лапароскопической техники и ловкости хирургов, использующих ее, ранее невообразимые лапароскопические операции стали обычным явлением.В частности, способность создавать интракорпоральный анастомоз ускорила распространение того, что сейчас называется продвинутой лапароскопией, и этот талант, возможно, является непременным условием минимально инвазивного хирурга.
Желчный пузырь был идеальным органом для этой развивающейся технологии. Его необходимость в удалении была обычным явлением, практически все хирурги общего профиля были довольны открытой процедурой, и он находится на ножке, относительно легко удаляется и не требует реконструкции. Хотя в то время лапароскопическая холецистэктомия и аппендэктомия были продвинутыми, теперь они считаются основными лапароскопическими навыками, и ожидается, что хирургические ординаторы овладеют этими процедурами к завершению своего обучения. По мере развития лапароскопической техники и ловкости хирургов, использующих ее, ранее невообразимые лапароскопические операции стали обычным явлением.В частности, способность создавать интракорпоральный анастомоз ускорила распространение того, что сейчас называется продвинутой лапароскопией, и этот талант, возможно, является непременным условием минимально инвазивного хирурга.
Общие положения
Основные принципы лапароскопического анастомоза ничем не отличаются от открытого анастомоза. Хирурги обычно используют различные модификации трех техник: сшивание вручную, сшивание линейных скоб или анастомоз с круговыми скобками (EEA).Для современного лапароскопического хирурга очень важны знания и умение выполнять каждую операцию. Техническая задача состоит в том, чтобы воссоздать угол наклона инструмента к органу, который достигается при открытой хирургии. Открытый живот, например, позволяет хирургу приближаться к органу для анастомоза под разными углами, но лапароскопия ограничивает это углом, образованным местом ввода троакара, и положением органа. Органы, которые обладают большой подвижностью, такие как тонкий кишечник, поэтому легче присоединиться, потому что им можно манипулировать в более благоприятное положение, чем двенадцатиперстная кишка или кардия желудка, которые в значительной степени фиксированы.Эффективное размещение троакара может не облегчить сложный анастомоз, но неправильное размещение троакара может сделать это практически невозможным.
Хирурги обычно используют различные модификации трех техник: сшивание вручную, сшивание линейных скоб или анастомоз с круговыми скобками (EEA).Для современного лапароскопического хирурга очень важны знания и умение выполнять каждую операцию. Техническая задача состоит в том, чтобы воссоздать угол наклона инструмента к органу, который достигается при открытой хирургии. Открытый живот, например, позволяет хирургу приближаться к органу для анастомоза под разными углами, но лапароскопия ограничивает это углом, образованным местом ввода троакара, и положением органа. Органы, которые обладают большой подвижностью, такие как тонкий кишечник, поэтому легче присоединиться, потому что им можно манипулировать в более благоприятное положение, чем двенадцатиперстная кишка или кардия желудка, которые в значительной степени фиксированы.Эффективное размещение троакара может не облегчить сложный анастомоз, но неправильное размещение троакара может сделать это практически невозможным.
Линейный сшиваемый анастомоз
Часто используется для анастомоза тонкой кишки из стороны в сторону, например, точеюно-анастомоза при обходном желудочном анастомозе, эта техника также хорошо работает для сквозных анастомозов (например, гастроеюностомия) или функциональных конфигураций конца в конец (например, резекция тонкой кишки с первичной анастомоз). Два сегмента кишечника соприкасаются, и между ними накладывается один шов.Ассистент поднимает этот шов правой рукой, подвешивая сегменты кишечника.
Два сегмента кишечника соприкасаются, и между ними накладывается один шов.Ассистент поднимает этот шов правой рукой, подвешивая сегменты кишечника.
Энтеротомии выполняются на антимезентериальной стороне двух сегментов в центре равносторонних треугольников, образованных поддерживающим швом (A) и левой рукой ассистента (B) и хирурга (C), втягивающих кишечник.
Хирург вставляет картридж и наковальню линейного степлера / резака в соответствующие энтеротомии, и две конечности кишечника продвигаются над устройством, как будто подтягивают пару штанов.
Анастомоз создается путем срабатывания устройства, оставляя единственную общую энтеротомию. Его можно закрыть ручным швом или другим применением линейного резака. Ручное ушивание обычно требуется для небольших анастомозов или менее подвижных тканей, таких как гастроеюностомия при обходном желудочном анастомозе. Независимо от техники, используемой для закрытия энтеротомии, необходимо соблюдать осторожность, чтобы избежать сужения просвета анастомоза.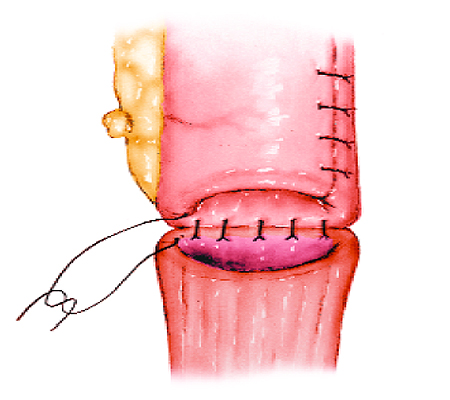 Чтобы закрыть дефект скобами, исходный тракционный шов находится на вершине общей энтеротомии (A), второй тракционный шов накладывается на противоположный конец энтеротомии (B), и ассистент удерживает оба шва.
Чтобы закрыть дефект скобами, исходный тракционный шов находится на вершине общей энтеротомии (A), второй тракционный шов накладывается на противоположный конец энтеротомии (B), и ассистент удерживает оба шва.
Хирург вводит линейный резак / степлер под швы и поперек энтеротомии. Два сегмента кишечника должны быть параллельны друг другу и оси сшивающего инструмента, чтобы предотвратить закупорку. Поскольку сшиватель закрывается по всей области энтеротомии, полезно представить процесс в два этапа. Во-первых, внимание обращается на ткань в промежности степлера. При правильной ориентации часто слишком много кишечника проникает в сшивающий аппарат около верхушки, что угрожает проходимости кишечника (стрелка).
Чтобы уменьшить количество кишечной ткани в степлере, он частично закрывается, чтобы удерживать ткани, и хирург переносит поддерживающий шов ближе к вершине (стрелка) от ассистента. Затем он или она протянет кишечник кзади через степлер и протолкнет его дальше по направлению к шарниру, так что на самом деле иссечена только небольшая полоска кишечника, но энтеростома полностью закрыта.
После срабатывания степлера иссеченная полоска кишки удаляется и проверяется линия скобки.Любые вызывающие беспокойство моменты перешиты, но это случается нечасто.
Дефекты брыжейки должны быть закрыты постоянным швом и могут выполняться непрерывным, прерывистым или кошельковым ушиванием. На этом этапе предпочтительнее наложение постоянного шва, поскольку во время лапароскопической операции образуется меньше спаек.
Анастомоз зашитый вручную
Техника сшивания вручную подходит практически для любого типа желудочно-кишечного анастомоза, будь то конец в конец, конец в бок или бок в бок.Обычно это занимает больше времени и требует большей ловкости, чем любой из методов с механической поддержкой. Ось линии шва по отношению к приводу иглы имеет первостепенное значение. Этот угол должен составлять от 0 o (т. Е. Параллельно) до ± 45 o . Кроме того, очень трудно наложить шов на обе стороны соединяемых тканей. Это ограничение несколько смягчается с помощью шарнирных инструментов, которые помещают дополнительный сустав внутри брюшной полости, чего нет у традиционных лапароскопических инструментов.Это было одним из ключевых преимуществ инструментов с роботизированным управлением, таких как система DaVinci®. Это позволяет больший диапазон движений. Однако с этими оговорками полностью ручная техника сшивания обеспечивает некоторую гибкость, недоступную для сшиваемых анастомозов. Поскольку каждый шов накладывается рядом с предыдущим, анастомоз строится постепенно, позволяя соединить несколько неконгруэнтных тканей. Напротив, сшивающие устройства создают весь анастомоз одновременно и, следовательно, требуют, чтобы ткани были точно сопоставлены до начала анастомоза.Сшитые вручную анастомозы могут быть выполнены в один или два слоя, с использованием узловых или непрерывных швов. Обычно выгодно накладывать тяговые швы на передний и задний углы сшитого вручную анастомоза, который ассистент может использовать для ориентации линии шва под наиболее выгодным углом.
Это ограничение несколько смягчается с помощью шарнирных инструментов, которые помещают дополнительный сустав внутри брюшной полости, чего нет у традиционных лапароскопических инструментов.Это было одним из ключевых преимуществ инструментов с роботизированным управлением, таких как система DaVinci®. Это позволяет больший диапазон движений. Однако с этими оговорками полностью ручная техника сшивания обеспечивает некоторую гибкость, недоступную для сшиваемых анастомозов. Поскольку каждый шов накладывается рядом с предыдущим, анастомоз строится постепенно, позволяя соединить несколько неконгруэнтных тканей. Напротив, сшивающие устройства создают весь анастомоз одновременно и, следовательно, требуют, чтобы ткани были точно сопоставлены до начала анастомоза.Сшитые вручную анастомозы могут быть выполнены в один или два слоя, с использованием узловых или непрерывных швов. Обычно выгодно накладывать тяговые швы на передний и задний углы сшитого вручную анастомоза, который ассистент может использовать для ориентации линии шва под наиболее выгодным углом.
Анастомоз конец в конец (EEA)
Степлер EEA — прекрасный инструмент для создания анастомозов на анатомических концах желудочно-кишечного тракта в брюшной полости. Это наиболее полезно, когда один из соединяемых концов имеет ограниченную подвижность или ее отсутствие, например.г., прямая кишка, пищевод и верхний отдел желудка. Это быстрое завершение анастомоза одним нажатием ручки и образование просвета одинакового размера. Ректальные анастомозы относительно прямые, поскольку наковальня вставляется в разрезанный конец проксимального отдела кишечника, который достаточно длинный и подвижный. Сравните это со стандартным желудочным мешком объемом 15–30 см3 у пациента с обходным желудочным анастомозом, и проблема установки наковальни очевидна. Стандартный метод размещения пациента с открытым обходным желудочным анастомозом заключался в создании гастротомии, введении наковальни и кошелька вокруг нее, почти так же, как при ректальном анастомозе.Однако, чтобы свести к минимуму наложение интракорпоральных швов, было разработано несколько методов введения наковальни в желудок.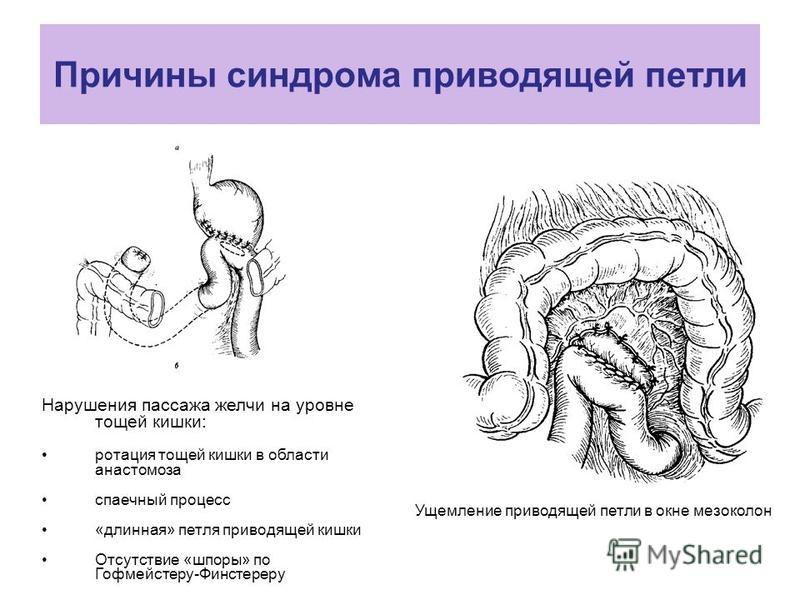 Доктор Виттгроув описывает использование эндоскопической петли для вытягивания чрескожно введенной трансжелудочной проволоки или шва изо рта, прикрепления ее к наковальне и втягивания обратно в желудок аналогично технике вытягивания для ПЭГ. (1) В другом методе наковальня прикрепляется к концу трубки NG, которая вводится трансорально, продвигается внутрь и через стенку желудочного мешка и извлекается, тем самым протягивая иглу наковальни через ту же гастротомию, что и трубка NG.(2) В дополнение к трансоральному введению наковальни было описано несколько методик, использующих гастротомию на будущей обходной части желудка для введения наковальни внутрибрюшно, что позволяет избежать любого потенциального повреждения пищевода. Наковальня направляется в верхнюю часть желудка, прежде чем она разделяется, где она проходит через переднюю стенку с помощью иглы. (3) (4) (5) После установки наковальни обычно вставляется степлер EEA. через один из участков троакара, который необходимо расширить для его размещения, и ввести в открытый конец разделенной тощей кишки.
Доктор Виттгроув описывает использование эндоскопической петли для вытягивания чрескожно введенной трансжелудочной проволоки или шва изо рта, прикрепления ее к наковальне и втягивания обратно в желудок аналогично технике вытягивания для ПЭГ. (1) В другом методе наковальня прикрепляется к концу трубки NG, которая вводится трансорально, продвигается внутрь и через стенку желудочного мешка и извлекается, тем самым протягивая иглу наковальни через ту же гастротомию, что и трубка NG.(2) В дополнение к трансоральному введению наковальни было описано несколько методик, использующих гастротомию на будущей обходной части желудка для введения наковальни внутрибрюшно, что позволяет избежать любого потенциального повреждения пищевода. Наковальня направляется в верхнюю часть желудка, прежде чем она разделяется, где она проходит через переднюю стенку с помощью иглы. (3) (4) (5) После установки наковальни обычно вставляется степлер EEA. через один из участков троакара, который необходимо расширить для его размещения, и ввести в открытый конец разделенной тощей кишки. Женский конец EEA проникает через антимезентерийную границу тощей кишки, присоединяется к мужскому концу наковальни, и устройство запускается, создавая анастомоз.
Женский конец EEA проникает через антимезентерийную границу тощей кишки, присоединяется к мужскому концу наковальни, и устройство запускается, создавая анастомоз.
Сравнение методов
В нескольких статьях сравниваются методы гастроеюнального анастомоза у пациентов с обходным желудочным анастомозом. Хотя некоторые из них продемонстрировали повышенную частоту стриктур с помощью EEA, это не было последовательным и может быть связано с диаметром выбранного степлера (21 против 25 мм), а не с техникой как таковой.(6) (7) (8) Более крупное и недавнее исследование Bendewald и др. Не показало различий в частоте стриктуры, подтекания или краевой язвы между тремя методами. (9) Однако в большинстве исследований сообщается об увеличении частоты инфицирования ран при использовании метода EEA, вероятно, из-за загрязнения подкожной ткани устройством после того, как оно попало в кишечник.
Выводы
Каждый из рассмотренных методов лапароскопического анастомоза имеет свои достоинства.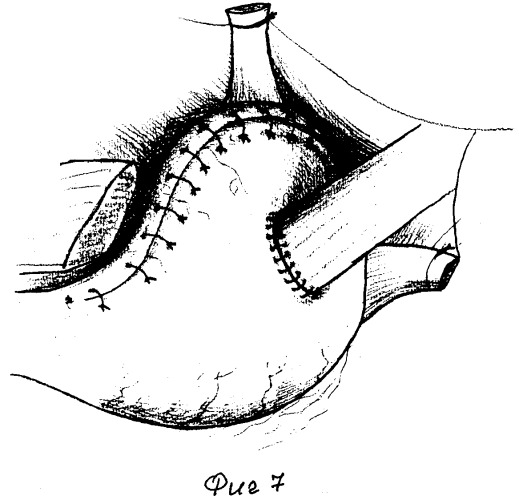 Большинство продвинутых лапароскопических хирургов перенимают один из методов, овладевают им и используют его в первую очередь.Но, как и ремесленник, хирург никогда не может иметь в своем распоряжении слишком много инструментов, и знание каждого из них имеет важное значение.
Большинство продвинутых лапароскопических хирургов перенимают один из методов, овладевают им и используют его в первую очередь.Но, как и ремесленник, хирург никогда не может иметь в своем распоряжении слишком много инструментов, и знание каждого из них имеет важное значение.
Ссылки
- Виттгроув, Алан. Лапароскопический обходной желудочный анастомоз: техника циркулярного степлера. [авт. книги] C Pitombo, et al. Хирургия ожирения: принципы и практика. s.l. : McGraw Hill, 2008.
- Tinoco, et al. Лапароскопический обходной желудочный анастомоз: трансоральное круговое сшивание. [авт. книги] C Pitombo, et al. Хирургия ожирения: принципы и практика.s.l. : McGraw Hill, 2008.
- де ла Торре, Роджер и Скотт, Дж. Стивен. Лапароскопический обходной желудочный анастомоз по Ру: методика полностью интраабдоминального доступа и предварительный отчет. Хирургия ожирения. 1999, т. 9.
- Борао, Фрэнк Дж., Томас, Териса А. и Стейхен, Фелисьен М.
 Альтернативные оперативные методы лапароскопического обходного желудочного анастомоза по Ру при патологическом ожирении. Журнал Общества лапароэндоскопических хирургов. 2001, Т. 5.
Альтернативные оперативные методы лапароскопического обходного желудочного анастомоза по Ру при патологическом ожирении. Журнал Общества лапароэндоскопических хирургов. 2001, Т. 5. - Мурр, Мишель М. и Галлахер, Скотт Ф.Технические аспекты трансабдоминальной нагрузки циркулярного степлера при лапароскопическом желудочном шунтировании по Ру. Американский журнал хирургии. 2003, т. 185.
- Rodrigo Gonzalez, MD, et al. Гастроеюностомия во время лапароскопического обходного желудочного анастомоза — анализ 3 методов. Архив хирургии. 2003, т. 138.
- Абдель-Галил, Эссам и Сабри, Алаа Аббас. Лапароскопический обходной желудочный анастомоз по Ру — оценка трех различных методов. Хирургия ожирения. 2002, т. 12.
- Bohdjalian, Arthur, et al.Циркулярная гастроеюностомия в сравнении с линейно-сшиваемой при лапароскопическом желудочном шунтировании по Ру. Хирургия ожирения. 2010, Т. 20.
- Bendewald, Frank P., et al. Сравнение гастроеюностомии с ручным, линейным и циркулярным сшиванием при лапароскопическом желудочном шунтировании по Ру.
 Хирургия ожирения. 2011.
Хирургия ожирения. 2011.
.
.
Что такое анастомоз? (с иллюстрациями)
Анастомоз — это хирургическая процедура, которая выполняется для соединения двух структур внутри тела. Анастомоз обычно используется для фиксации вместе верхнего и нижнего отделов толстой кишки после удаления среднего отдела.Хирурги также могут использовать эту процедуру после серьезной операции на тонком кишечнике, пищеводе, мочевом пузыре или желчном протоке. Специализированный тип проводится, когда необходимо обойти поврежденный участок артерии или вены или когда необходимо соединить кровеносные сосуды с пересаженным органом. Последние достижения в области инструментов и методов позволяют выполнять операцию минимально инвазивным способом с помощью эндоскопической камеры.
Анастомоз может быть выполнен после серьезной операции на мочевом пузыре.
В прошлом у пациентов, страдающих раком толстой кишки или тяжелым воспалительным заболеванием кишечника, было мало вариантов хирургического вмешательства. Когда нужно было удалить всю толстую кишку, нижний отдел тонкой кишки был соединен с хирургическим отверстием в брюшной полости. Мешок для колостомы вне тела использовался для сбора отходов, и у пациента вызвали недержание мочи. Процедуры илеоанального анастомоза устраняют необходимость во внешних мешках для колостомы и позволяют людям иметь нормальную контролируемую дефекацию.
Анастомоз может быть выполнен после обширной операции на пищеводе и желчном протоке.
Во время илеоанального анастомоза прямая кишка отделяется от анальной полости и толстая кишка отделяется от подвздошной кишки, основания тонкой кишки.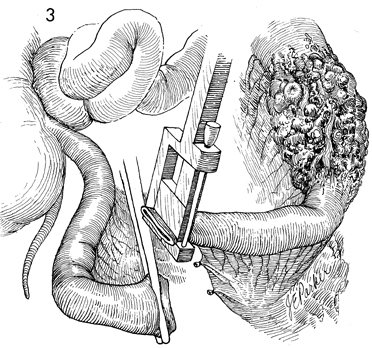 Затем хирург соединяет подвздошную кишку с анальной полостью с помощью швов и булавок. Процедура часто выполняется эндоскопически через несколько небольших разрезов в брюшной полости, а не через большой открытый разрез. Хирург использует эндоскоп для просмотра процедуры на мониторе и для наведения точных инструментов.
Затем хирург соединяет подвздошную кишку с анальной полостью с помощью швов и булавок. Процедура часто выполняется эндоскопически через несколько небольших разрезов в брюшной полости, а не через большой открытый разрез. Хирург использует эндоскоп для просмотра процедуры на мониторе и для наведения точных инструментов.
Если наложенный шов не закреплен должным образом, он может заразиться бактериями.
Подобные процедуры анастомоза можно использовать, когда необходимо удалить часть уретры, пищевода или тонкой кишки. Верхний и нижний отделы скрепляются скобами или сшиваются вместе, чтобы сохранить нормальное функционирование. Пациенты с сильно закупоренными артериями могут быть кандидатами на артериальный анастомоз, который включает рассечение поврежденного кровеносного сосуда у его основания и прикрепление его к донорскому сосуду для обхода закупорки. Большинство артериальных процедур проводится на груди и шее, хотя для устранения проблем с кровотоком в ногах, руках, паху или мозге можно использовать специальные операции.
Большинство артериальных процедур проводится на груди и шее, хотя для устранения проблем с кровотоком в ногах, руках, паху или мозге можно использовать специальные операции.
Все виды хирургического вмешательства сопряжены с риском, хотя квалифицированные хирурги могут минимизировать вероятность серьезных осложнений. Если наложенный шов не закреплен должным образом, он может заразиться бактериями.Еще одна распространенная проблема — чрезмерное кровотечение или утечка других биологических жидкостей. Хирурги обычно назначают частые осмотры после процедур, чтобы проверить наличие признаков осложнений.
Анастомоз обычно используется для фиксации вместе верхнего и нижнего отделов толстой кишки после удаления среднего отдела.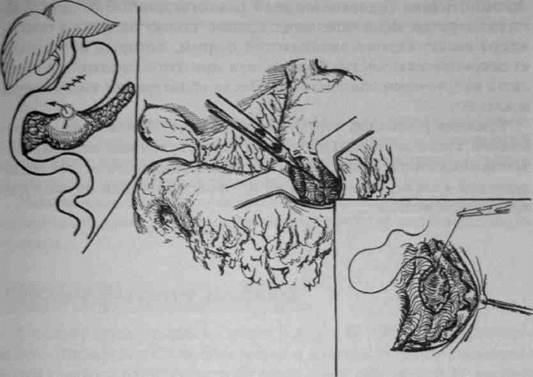

 Серо-серозные швы.
Серо-серозные швы.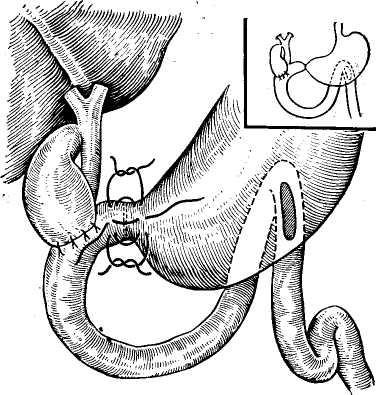 Мы оказываем взаимное влияние на развитие нейрохирургии в целом. ФЦН в Тюмени я посещаю во второй раз и вижу прогресс, в том числе в оснащении лаборатории. Хорошо, что каждый микроскоп подсоединен к монитору и у всех обучающихся есть возможность посмотреть, что происходит во время операции», — рассказал Мартин Самеш.
Мы оказываем взаимное влияние на развитие нейрохирургии в целом. ФЦН в Тюмени я посещаю во второй раз и вижу прогресс, в том числе в оснащении лаборатории. Хорошо, что каждый микроскоп подсоединен к монитору и у всех обучающихся есть возможность посмотреть, что происходит во время операции», — рассказал Мартин Самеш.

 Альтернативные оперативные методы лапароскопического обходного желудочного анастомоза по Ру при патологическом ожирении. Журнал Общества лапароэндоскопических хирургов. 2001, Т. 5.
Альтернативные оперативные методы лапароскопического обходного желудочного анастомоза по Ру при патологическом ожирении. Журнал Общества лапароэндоскопических хирургов. 2001, Т. 5. Хирургия ожирения. 2011.
Хирургия ожирения. 2011.