Анемия хронических заболеваний
Анемия хронических заболеваний (анемия воспаления) — анемия, возникающая у пациентов с инфекцией, воспалением, неоплазиями и продолжающаяся более 1-2 месяцев.
Необходимо отметить, что анемия хронических заболеваний обычно не бывает тяжелой. Ее степень коррелирует с тяжестью хронического заболевания, ее вызывающего. Характерной чертой этого типа анемии является сочетание пониженного уровня железа сыворотки (гипоферремия) с достаточными его запасами в ретикулоэндотелиальной системе.
Этиология анемии хронических заболеваний:
(1) инфекции (острые и хронические), вирусы, включая ВИЧ, бактериальные, паразитарные, грибковые;
(2) опухоли – гемобластозы, солидные опухоли;
(3) аутоиммунные заболевания – ревматоидный артрит, системная красная волчанка и другие заболевания соединительной ткани, васкулиты, саркоидоз, хронические воспалительные заболевания кишечника;
(4) хроническое отторжение трансплантата;
(5) хроническое заболевание почек.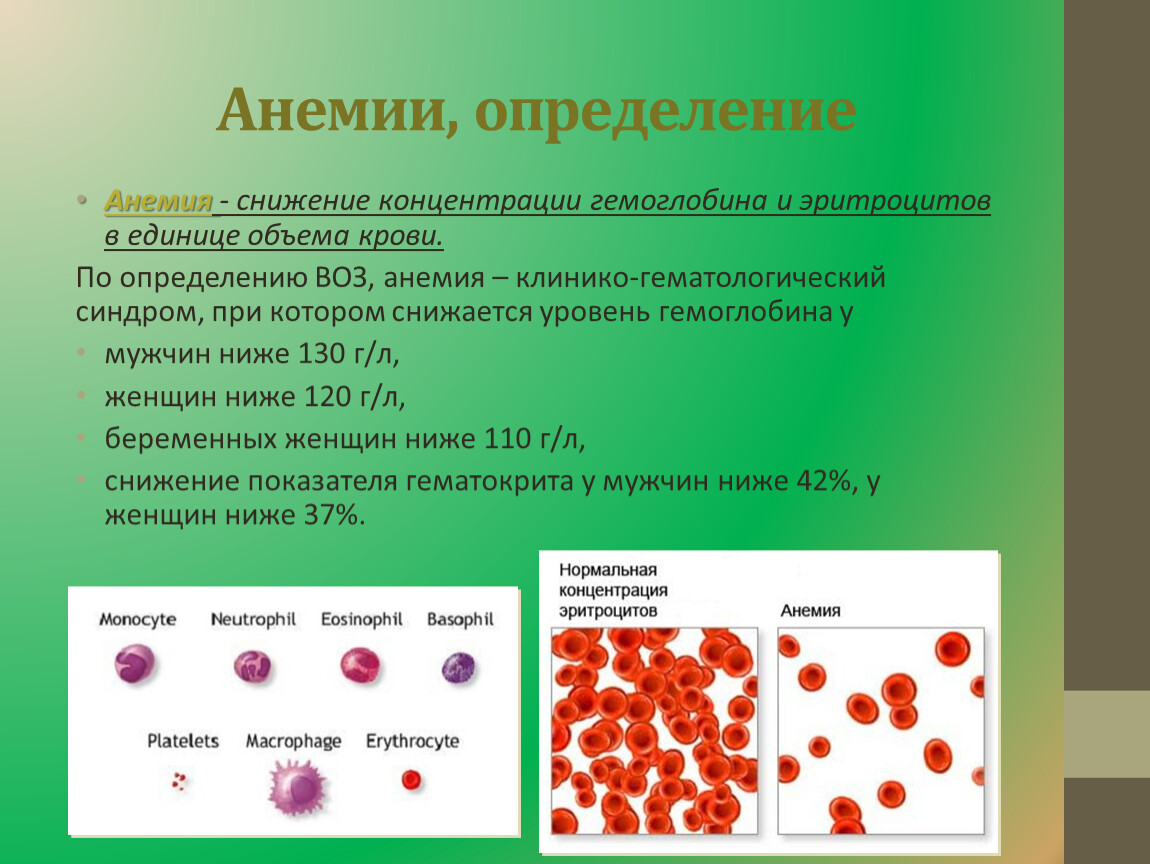
В патогенез анемии хронических заболеваний чаще всего имеет место сочетание нескольких факторов, ведущих к анемии:
(1) срок жизни эритроцитов слегка снижен;
(2) может быть заблокирован переход железа из ретикулоэндотелиальных клеток в эритробласты костного мозга;
(3) недостаточно высокий уровень эритропоэтина (угнетение эритропоэза) относительно степени анемии.
Клинические проявления анемий:
1) Общие симптомы. Обусловлены развивающейся гипоксией. Это бледность кожных покровов и слизистых оболочек, слабость, головные боли, головокружение, сердцебиение, одышка.
2) Симптомы, характерные для определенных групп анемий соответственно их патогенезу. При железодефицитных анемиях развивается сидеропенический синдром, обусловленный тканевым дефицитом железа-сухость во рту, выпадение волос, ломкость ногтей. При В12 — дефицитных анемиях — поражения желудочно-кишечного тракта, поражения нервной системы в виде фуникулярного миелоза(онемение, чувство покалывания, ползание мурашек в кончиках пальцев).
Пациентам с подозрением на анемию проводят лабораторные исследования:
1)Общий анализ крови с определением ретикулоцитов, подсчет сидероцитов.
2) Исследование пунктата костного мозга с подсчетом сидеробластов .
3)Биохимические исследования: определение общего белка и белковых фракций, мочевины, креатинина, сывороточного железа, общей железосвязывающей способности сыворотки, ферритина, трансферрина.
Периферическая кровь.
Чаще анемия хронических заболеваний носит нормохромный нормоцитарный, реже умеренно гипохромный характер. Количество ретикулоцитов нормальное или уменьшенное. Гематокрит колеблется от 25 до 40%. Эпизоды кровотечений, дефицит витаминов (цианкобаламина и фолиевой кислоты), аутоиммунный гемолиз, лучевая и химиотерапия могут служить дополнительными факторами, способствующими нарастанию анемии.
Изменения метаболизма железа характеризуются перераспределительным дефицитом железа (снижение сывороточного железа, общей железосвязывающей способности сыворотки, трансферрина, и повышение содержания сывороточного ферритина). Ферритин относится к острофазным белкам, поэтому повышенный уровень сывороточного ферритина при АХЗ может отражать не только запас железа в организме, но и явиться проявлением острофазного ответа, что ограничивает его использование в качестве показателя определения запасов железа.
Ферритин относится к острофазным белкам, поэтому повышенный уровень сывороточного ферритина при АХЗ может отражать не только запас железа в организме, но и явиться проявлением острофазного ответа, что ограничивает его использование в качестве показателя определения запасов железа.
В случае возникновения анемии необходимо обратиться к лечащему врачу или гематологу.
Лабораторные исследования можно провести в клинико-диагностической лаборатории Минского клинического консультативно-диагностического центра по направлению специалистов центра и прикрепленных учреждений здравоохранения бесплатно. Без направления — на платной основе.
Врач лабораторной диагностики Богачева Е.И.
Анемия хронических заболеваний и железодефицитная анемия: сравнительная характеристика показателей феррокинетики и их связь с воспалением у больных ХСН в пожилом и старческом возрасте | Соломахина
1. Лазарева Н. В., Ощепкова Е. В., Терещенко С. Н. Коморбидность у больных с хронической сердечной недостаточностью (по Данным Регистра ХСН). Кардиологический Вестник. 2016; XI (4):24-31.
Лазарева Н. В., Ощепкова Е. В., Терещенко С. Н. Коморбидность у больных с хронической сердечной недостаточностью (по Данным Регистра ХСН). Кардиологический Вестник. 2016; XI (4):24-31.
2. Tang Y-D. Anemia in Chronic Heart Failure: Prevalence, Etiology, Clinical Correlates, and Treatment Options. Circulation. 2006;113 (20):2454-61.DOI:10.1161/CIRCULATIONAHA. 105.583666
3. van Deursen VM, Urso R., Laroche C., Damman K., Dahlström U., Tavazzi L. et al. Co-morbidities in patients with heart failure: an analysis of the European Heart Failure Pilot Survey: Co-morbidities in heart failure. European Journal of Heart Failure. 2014;16 (1):103-11. DOI:10.1002/ejhf. 30
4. Groenveld HF, Januzzi JL, Damman K., van Wijngaarden J., Hillege HL, van Veldhuisen DJ et al. Anemia and Mortality in Heart Failure Patients. Journal of the American College of Cardiology. 2008;52 (10):818-27. DOI:10.1016/j. jacc. 2008.04.061
Anemia and Mortality in Heart Failure Patients. Journal of the American College of Cardiology. 2008;52 (10):818-27. DOI:10.1016/j. jacc. 2008.04.061
5. Anand I. Anemia and Its Relationship to Clinical Outcome in Heart Failure. Circulation. 2004;110 (2):149-54. DOI:10.1161/01. CIR. 0000134279.79571.73
6. Muzzarelli S., Pfisterer M. Anemia as independent predictor of major events in elderly patients with chronic angina. American Heart Journal. 2006;152 (5):991-6. DOI:10.1016/j. ahj. 2006.06.014
7. Anand I.S. Anemia and Chronic Heart Failure. Journal of the American College of Cardiology. 2008;52 (7):501-11. DOI:10.1016/j. jacc. 2008.04.044
8. Ezekowitz JA, McAlister FA, Armstrong P. W. Anemia is common in heart failure and is associated with poor outcomes: insights from a cohort of 12065 patients with new-onset heart failure. Circulation. 2003;107 (2):223-5.
W. Anemia is common in heart failure and is associated with poor outcomes: insights from a cohort of 12065 patients with new-onset heart failure. Circulation. 2003;107 (2):223-5.
9. Рудакова Л. Е., Беляева Ю. Б., Фаткабрарова А. М., Козина Л. Е. Анемия при хронической сердечной недостаточности (по данным кардиологического отделения). Теоретические и прикладные аспекты современной науки. 2014; (6-2):128-30.
10. Зубрихина Г. Н., Блиндарь В. Н., Матвеева И. И. Дифференциальная диагностика анемического синдрома при истинном железодефицитном состоянии и функциональном дефиците железа у больных с хроническими заболеваниями (злокачественными новообразованиями). Терапевтический архив. 2016;88 (4):61-7. DOI: 10.17116/terarkh301688461-67
11. Зубрихина Г. Н., Блиндарь В. Н., Матвеева И. И. Возможности современного автоматизированного клинического анализа крови в дифференциальной диагностике истинного и перераспределительного (функционального) дефицита железа при анемическом синдроме у онкологических больных. Клиническая лабораторная диагностика. 2014;59 (5):21-5.
Н., Матвеева И. И. Возможности современного автоматизированного клинического анализа крови в дифференциальной диагностике истинного и перераспределительного (функционального) дефицита железа при анемическом синдроме у онкологических больных. Клиническая лабораторная диагностика. 2014;59 (5):21-5.
12. Стуклов Н. И. Дефицит железа и анемия у больных ХСН. Рациональная фармакотерапия в кардиологии. 2017; 13 (5):651 60. DOI: 10.20996/1819-6446-2017-13-5-6 51-660
13. Koorts AM, Viljoen M. Ferritin and ferritin isoforms I: Structure — function relationships, synthesis, degradation and secretion. Archives of Physiology and Biochemistry. 2007;113 (1):30-54. DOI:10.1080/13813450701318583
14. Arezes J., Nemeth E. Hepcidin and iron disorders: new biology and clinical approaches. International Journal of Laboratory Hematology. 2015;37:92-8. DOI:10.1111/ijlh. 12358
International Journal of Laboratory Hematology. 2015;37:92-8. DOI:10.1111/ijlh. 12358
15. Camaschella C. Iron-Deficiency Anemia. Longo DL, editor. New England Journal of Medicine. 2015;372 (19):1832-43. DOI: 10.1056/NEJMra1401038
16. Nagai T., Nishimura K., Honma T., Higashiyama A., Sugano Y., Nakai M. et al. Prognostic significance of endogenous erythropoietin in long-term outcome of patients with acute decompensated heart failure: Endogenous erythropoietin in acute heart failure. European Journal of Heart Failure. 2016;18 (7):803-13. DOI:10.1002/ejhf. 537
17. van der Meer P., Lok DJ, Januzzi JL, de la Porte PWB-A, Lipsic E., van Wijngaarden J. et al. Adequacy of endogenous erythropoietin levels and mortality in anaemic heart failure patients. European Heart Journal. 2008;29 (12):1510-5. DOI:10.1093/eurheartj/ehn205
2008;29 (12):1510-5. DOI:10.1093/eurheartj/ehn205
18. Блиндарь В. Н., Зубрихина Г. Н., Матвеева И. И. Анемический синдром и основные метаболиты феррокинетики (ферритин, растворимый рецептор трансферрина, прогепсидин, гепсидин-25 и эндогенный эритропоэтин). Медицинский алфавит. 2015;2 (8):16-9.
19. Azerbaijan State Advance Training Institute for Doctors, Baku, Azerbaijan, Zakhidova K.K. Correlation Between Concentration of Pathological Cytokines and Erythropoietin in Patients with Chronic Heart Failure with Anemic Syndrome. Annals of the Russian academy of medical sciences. 2014;69 (1-2):32-7. DOI:10.15690/vramn. v69i1-2.939
20. Nairz M., Theurl I., Wolf D., Weiss G. Iron deficiency or anemia of inflammation? Differential diagnosis and mechanisms of anemia of inflammation. Wiener Medizinische Wochenschrift. 2016;166 (13-14):411-23. DOI: 10.1007/s10354-016-0505-7
Wiener Medizinische Wochenschrift. 2016;166 (13-14):411-23. DOI: 10.1007/s10354-016-0505-7
21. Drozd M., Jankowska EA, Banasiak W., Ponikowski P. Iron Therapy in Patients with Heart Failure and Iron Deficiency: Review of Iron Preparations for Practitioners. American Journal of Cardiovascular Drugs. 2017; 17 (3): 183-201. DOI: 10.1007/s40256-016-0211-2
22. Anand I.S. Heart failure and anemia: mechanisms and pathophysiology. Heart Failure Reviews. 2008;13 (4):379-86. DOI: 10.1007/s10741-008-9088-8
23. Caramelo C., Justo S., Gil P. Anemia in heart failure: pathophysiology, pathogenesis, treatment, and incognitae. Rev Esp Cardiol. 2007;60 (8):848-60. PMID:17688854
24. Diskin C. J. Erythropoietin, haemoglobin, heart failure, and mortality. European HeartJournal. 2008;29 (21):2695-2695. DOI:10.1093/eur-heartj/ehn399
J. Erythropoietin, haemoglobin, heart failure, and mortality. European HeartJournal. 2008;29 (21):2695-2695. DOI:10.1093/eur-heartj/ehn399
25. Cappellini MD, Comin-Colet J., de Francisco A., Dignass A., Doehner W., Lam CS et al. Iron deficiency across chronic inflammatory conditions: International expert opinion on definition, diagnosis, and management. AmericanJournal of Hematology. 2017;92 (10):1068-78. DOI:10.1002/ ajh.24820
Анемия хронических заболеваний — особенности патогенеза и попытка классификации | Сахин
1. Анемии / под. ред. О.А. Рукавицына. 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2016, 256 с.
2. Гематология: национальное руководство / под ред. О.А. Рукавицына. М.: ГЭОТАР-Медиа, 2015. С. 143-149.
М.: ГЭОТАР-Медиа, 2015. С. 143-149.
3. Сахин В.Т., Маджанова Е.Р, Крюков Е.В. [и др.]. Анемия хронических заболеваний: особенности патогенеза и возможности терапевтической коррекции (обзор литературы и результаты собственных исследований) // Онкогематология. 2018. Т. 13, № 1. С. 45-53.
4. Сахин В.Т., Маджанова Е.Р, Крюков Е.В. [и др.]. Патогенетические особенности анемии у больных с солидными опухолями // Клин. онкогематология. 2017. Т. 10, № 4. С. 514-519.
5. Стуклов Н.И., Козинец Г.И., Тюрина Н.Г. Учебник по гематологии. М.: Практическая медицина, 2018. 336 с.
6. De Lurdes Agostinho Cabrita A., Pinho A., Malho A. [et al.]. Risk factors for high erythropoiesis stimulating agent resistance index in pre-dialysis chronic kidney disease patients, stages 4 and 5 // International Urology and Nephrology. 2011. Vol. 43. P. 835-840.
2011. Vol. 43. P. 835-840.
7. Ganz T., Nemeth E. Hepcidin and iron homeostasis // Biochimica et Biophysica Acta. 2012. Vol. 1823. P 1434-1443.
8. Huang P, Wang J., Lin X. [et al.]. Effects of IL-10 on iron metabolism in LPS-induced inflammatory mice via modulating hepcidin expression // Eur. Rev. Med. Pharmacol. Sci. 2017. Vol. 21. P 3469-3475.
9. McCranor B., Kim M., Cruz N. [et al.]. Interleukin-6 directly impairs the erythroid development of human TF-1 erythroleukemic cells // Blood Cells Mol. Dis. 2014. Vol. 52. P. 126-133.
10. Park S. Iron deficient erythropoiesis might play key role in development of anemia in cancer patients // Oncotarget. 2015. Vol. 6. P. 42803-42812.
11. Poggiali E., Migone De Amicis M., Motta I. Anemia of chronic disease: a unique defect of iron recycling for many different chronic diseases // EJIM. 2014. Vol. 25. P 12-17.
12. Raj D. Role of interleukin-6 in the anemia of chronic disease // Seminars in Arthritis and Rheumatism. 2009. Vol. 38. P. 382-388.
13. Shanmugam N.K., Ellenbogen S., Trebicka E. [et al.]. Tumor necrosis factor a inhibits expression of the iron regulating hormone hepcidin in murine models of innate colitis // PLoS One. 2012 Vol. 7. e38136. doi: 10.1371/journal.pone.0038136.
14. Steinmetz T., Totzke U., Schweigert M. [et al.]. A prospective observational study of anaemia management in cancer patients -results from the German Cancer Anaemia Registry // European Journal of Cancer Care. 2011. Vol. 20, No. 4. P. 493-502.
2011. Vol. 20, No. 4. P. 493-502.
15. Weiss G. Iron metabolism in the anemia of chronic disease // Biochimica et Biophysica Acta. 2009. Vol. 1790, No. 7. P. 682-693.
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ И АНЕМИЯ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ: НЕКОТОРЫЕ АСПЕКТЫ ПАТОГЕНЕЗА И ПЕРСПЕКТИВЫ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ | Клочкова-Абельянц
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ И АНЕМИЯ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ: НЕКОТОРЫЕ АСПЕКТЫ ПАТОГЕНЕЗА И ПЕРСПЕКТИВЫ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ
Клочкова-Абельянц С.А., Суржикова Г.С.
Аннотация
Цель исследования – оценить информативность современных методов исследования обмена железа в алгоритме дифференциальной диагностики гипохромных анемий.
Материалы и методы исследования. Обследованы 296 женщин в возрасте от 16 до 60 лет с анемическим синдромом, из них у 103 женщин выявлена железодефицитная анемия (ЖДА), у 193 – анемия хронических заболеваний (АХЗ). Контрольную группу составили 79 практически здоровых женщин. Исследование гематологических показателей периферической крови проводили общепринятыми методами с оценкой морфофункциональных показателей эритроцитов. Растворимые трансферриновые рецепторы (рТФР) и содержание гепсидина-25 определяли иммуноферментным методом с использованием тест-систем АО «Вектор-Бест» и Peninsula Laboratories, LLS.
Основные результаты. Выявлено достоверное повышение уровня рТФР у лиц с ЖДА по сравнению с группой лиц, страдающих АХЗ (р = 0,000). Обнаружен крайне низкий уровень гепсидина при ЖДА – 0,46 ± 0,03 нг/мл, в то время как у лиц с АХЗ содержание гепсидина было повышено и в среднем составило 45,05 и 39,33 нг/мл при АХЗ на фоне РА и при инфекционно-воспалительных процессах, соответственно, против 8,7 ± 0,31 нг/мл у здоровых лиц (р = 0,000).
Выводы. Определение количества растворимых трансферриновых рецепторов в значительной степени повышает уровень дифференциальной диагностики ЖДА и функционального дефицита железа. Исследование уровня гепсидина является особенно ценным в случаях АХЗ, где оценка запасов железа по уровню ферритина сыворотки неинформативна по причине парадоксального повышения уровня ферритина, связанного с нарушением механизмов утилизации и хранения железа.
Ключевые слова
анемия железодефицитная; анемия хронических заболеваний; растворимые трансферриновые рецепторы; гепсидин
Литература
Kazyukova TV. Indicators of ferrokinetics in infectious and inflammatory diseases in young children. Pediatrics. 2004; (3): 42-48. Russian (Казюкова Т.В. Показатели феррокинетики при инфекционно-воспалительных заболеваниях у детей раннего возраста //Педиатрия. 2004. № 3. С. 42-48)
Vorobiev AP. Anemic syndrome in clinical practice. M.: Newdiamed, 2001. 165 p. Russian (Воробьев А.П. Анемический синдром в клинической практике. М.: Ньюдиамед, 2001. 165 с.)
Surzhikova GS, Klochkova-Abeliants SA. Soluble transferrin receptors in the differential diagnosis of hypochromic anemia. Polytrauma. 2013; (3): 62-65. Russian (Суржикова Г.С., Клочкова-Абельянц С.А. Растворимые трансферриновые рецепторы в дифференциальной диагностике гипохромных анемий //Политравма. 2013. № 3. С. 62-65)
Park CH, Valore EV, Waring AJ. Hepcidin: a urinary antibacterial peptide synthesized in the liver. J. Biol. Chem. 2001; 276: 7806-7810
Surzhikova GS, Klochkova-Abelyants SA. Method for differential diagnosis of iron deficiency anemia and anemia of chronic diseases. Patent for invention (N 2566282), 2015. Russian (Суржикова Г.С., Клочкова-Абельянц С.А. Способ дифференциальной диагностики железодефицитной анемии и анемии хронических заболеваний //Патент на изобретение № 2566282. 2015)
Страница статьи : Клиническая медицина
Чучалин А.Г., Авдеев С.Н., Айсанов З.Р., Белевский А.С., Лещенко И.В., Мещерякова Н.Н. и др. Российское респираторное общество. Федеральные клинические рекомендации по диагностике и лечению хронической обструктивной болезни легких. Пульмонология. 2014; (3): 15-54.
Белевский А.С. Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких (пересмотр 2011 г.). Пер. с англ. М.: Российское респираторное общество. 2012; 94.
Авдеев С.Н. Хроническая обструктивная болезнь легких: обострения. Пульмонология. 2013; (3): 5-19.
Barnes P.J., Celli B.R. Systemic manifestations and comorbidities of COPD. Eur. Respir. J. 2009; 33: 1165-85.
World Health Organization. Nutritional Anemias: Report of a WHO Scientific Group. WHO Techn. Rep. Ser. N 405. Geneva: World Health Organization; 1968.
Cote C., Zilberberg M.D., Mody S.H., Dordelly L.J., Celli B. Haemoglobin level and its clinical impact in a cohort of patients with COPD. Eur. Respir. J. 2007; 29: 923-9.
John M., Hoernig S., Doehner W., Okonko D.D., Witt C., Anker S.D. Anemia and inflammation in COPD. Chest. 2005; 127: 825-9.
Chambellan A., Chailleux E., Similowski T., ANTADIR Observatory Group. Prognostic value of hematocrit in patients with severe COPD receiving long-term oxygen therapy. Chest. 2005; 128: 1201-8.
John M., Lange A., Hoernig S., Witt C., Anker S.D. Prevalence of anemia in chronic obstructive pulmonary disease: comparison to other chronic diseases. Int. J. Cardiol. 2006; 111: 365-70.
Portillo K., Belda J., Antón P., Casan P. High frequency of anemia in COPD patients admitted in a tertiary hospital. Rev. Clin. Esp. 2007; 207: 383-7.
Halpern M.T., Zilberberg M.D., Schmier J.K., Lau E.C., Shorr A.F. Anemia, costs and mortality in chronic obstructive pulmonary disease. Cost Eff. Resour. Alloc. 2006; 16(4): 17.
Shorr A.F., Doyle J., Stern L., Dolgitser M., Zilberberg M.D. Anemia in chronic obstructive pulmonary disease: epidemiology and economic implications. Curr. Med. Res. Opin. 2008; 24(923): 1123-30.
Cartwright G.E. The anemia of chronic disorders. Semin. Hematol. 1966; 3: 351-75.
Nissenson A.R., Goodnough L.T., Dubois R.W. Anemia: not just an innocent bystander? Arch. Intern. Med. 2003; 163: 1400-4.
Melnikova I. Anaemia therapies. Nature Rev. Drug. Discov. 2006; 5: 627-8.
Будневский А.В., Овсянников Е.С., Чернов А.В., Дробышева Е.С. Диагностическое значение биомаркеров системного воспаления при хронической обструктивной болезни легких. Клин. мед. 2014; 92(9): 16-21.
Будневский А.В., Овсянников Е.С., Чернов А.В., Дробышева Е.С. Биомаркеры как предикторы исходов хронической обструктивной болезни легких (обзор литературы). Молодой ученый. 2014; 5(64): 125-8.
Провоторов В.М., Первеева И.М., Перфильева М.В., Овсянников Е.С. Качество жизни больных с хронической обструктивной болезнью легких и приобретенным андрогенодефицитом. Журнал теоретической и практической медицины. 2010; 8(3): 489.
Tassiopoulos S., Kontos A., Konstantopoulos K., Hadzistavrou C., Vaiopoulos G,. Aessopos A. et al. Erythropoietic response to hypoxaemia in diffuse idiopathic pulmonary fibrosis, as opposed to chronic obstructive pulmonary disease. Respir. Med. 2001; 95: 471-5.
Roy C.N. Anemia of inflammation. Hematology. Am. Soc. Hematol. Educ. Program. 2010; 2010: 276-80.
Nemeth E., Tuttle M.S., Powelson J., Vaughn M.B., Donovan A., Ward D.M. et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science. 2004; 306: 2090-3.
De Domenico I., Lo E., Ward D.M., Kaplan J. Hepcidin-induced internalization of ferroportin requires binding and cooperative interaction with Jak2. Proc. Natl. Acad. Sci. USA. 2009; 106: 3800-5.
Nemeth E., Valore E.V., Territo M., Schiller G., Lichtenstein A., Ganz T. Hepcidin, a putative mediator of anemia of inflammation, is a type II acute-phase protein. Blood. 2003; 101: 2461-3.
Nemeth E. Iron regulation and erythropoiesis. Curr. Opin. Hematol. 2008; 15: 169-75.
Babitt J.L., Huang F.W., Wrighting D.M., Xia Y., Sidis Y., Samad T.A. et al. Bone morphogenetic protein signaling by hemojuvelin regulates hepcidin expression. Nature Genet. 2006; 38: 531-9.
Du X., She E., Gelbart T., Truksa J., Lee P., Xia Y. et al. The serine protease TMPRSS6 is required to sense iron deficiency. Science. 2008; 320: 1088-92.
Truksa J., Lee P., Beutler E. Two BMP responsive elements, STAT, and bZIP/HNF4/COUP motifs of the hepcidin promoter are critical for BMP, SMAD1, and HJV responsiveness. Blood. 2009; 113: 688-95.
Kautz L., Jung G., Nemeth E., Ganz T. Erythroferrone contributes to recovery from anemia of inflammation. Blood. 2014; 124(16): 2569-74.
Kullich W., Niksic F., Burmucic K., Rheumatol Z. Effects of the chemokine MIP-1alpha on anemia and inflammation in rheumatoid arthritis. Z. Rheumatol. 2002; 61: 568-76.
Zhu Y., Ye D., Huang Z. The correlation of cytokines TNF alpha, IFN-gamma, Epo with anemia in rheumatoid arthritis. Zhonghua Xue. Ye. Xue. Za. Zhi. 2000; 21: 587-90.
Papadaki H.A., Kritikos H.D., Valatas V. Anemia of chronic disease in rheumatoid arthritis is associated with increased apoptosis of bone marrow erythroid cells: improvement following anti-tumor necrosis factor-alpha antibody therapy. Blood. 2002; 100: 474-82.
Casaburi R., Bhasin S., Cosentino L., Porszasz J., Somfay A., Lewis M.I. et al. Effects of testosterone and resistance training in men with chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2004; 170: 870-88.
Ferrucci L., Maggio M., Bandinelli S., Basaria S., Lauretani F., Ble A. et al. Low testosterone levels and the risk of anemia in older men and women. Arch. Intern. Med. 2006; 166: 1380-8.
Tsantes A.E., Tassiopoulos S.T., Papadhimitriou S.I., Bonovas S., Poulakis N., Vlachou A. et al. Theophylline treatment may adversely affect the anoxia-induced erythropoietic response without suppressing erythropoietin production. Eur. J. Clin. Pharmacol. 2003; 59: 379-83.
Goodnough L.T., Skikne B., Brugnara C. Erithropoietin, iron, and erythropoiesis. Blood. 2000; 96(3): 823-33.
Suominen P., Punnonen K., Rajamaki A., Irjala K. Serum transferrin receptor and transferrin receptor-ferritin index identify healthy subjects with sub clinical iron deficits. Blood. 1998; 92(8): 2934-9.
Mast A.E., Blinder M.A., Gronowski A.M., Chumley C., Scott M.G. Clinical utility of the soluble transferrin receptor and comparison with serum ferritin in several populations. Clin. Chem. 1998; 44(1): 45-51.
Sawhney M.S. Should patients with anemia and low normal or normal serum ferritin undergo colonoscopy? Am. J. Gastroenterol. 2007: 102(1): 82-8.
Punnonen K., Irjala K., Rajamaki A. Serum transferrin receptor and its ratio to serum ferritin in the diagnosis of iron deficiency. Blood. 1997; 89(3): 1052-7.
Beguin Y. The soluble transferring receptor: biological aspects and clinical usefulness as quantitative measure of erythropoiesis. Hematologica. 1992; 77: 1-10.
Shin Y.J., Baynes R.D., Hudson B.G. Serum transferrin receptor is a truncated form of tissue receptor. J. Biol. Chem. 1990; 265: 19077.
Baynes R.D., Shih Y.J., Cook J.D. Production of soluble transferrin receptor by K562 erythroleukemia cells. Proc. Soc. Exp. Biol. (N.Y.). 1993; 204: 65.
Beguin Y., Huebers H.A., Josephson В., Finch C. Transferrin receptors in rat plasma. Proc. Natl. Acad. Sci. USA 1988; 85: 637.
Cook J.D., Skikne B.S., Baynes R.D. Serum transferrin receptor. Ann. Rev. Med. 1993; (44): 63.
Ganz T., Olbina G., Girelli D., Nemet H.E., Westerman M. Immunoassay for human serum hepcidin. Blood. 2008; 112: 4292-7.
Theurl I., Aigner E., Theurl M., Nairz M., Seifert M., Schroll A. et al. Regulation of iron homeostasis in anemia of chronic disease and iron deficiency anemia: diagnostic and therapeutic implications. Blood. 2009; 113: 5277-86.
Celli B.R., Cote C.G., Marin J.M., Casanova C., Montes de Oca M., Méndez R.A. et al. The bodymass index, airflow obstruction, dyspnea, and exercise capacity index in chronic obstructive pulmonary disease. N. Engl. J. Med. 2004; 350: 1005-12.
Lima D.F., Dela Coleta K., Tanni S.E., Silveira L.V., Godoy I., Godoy I. Potentially modifiable predictors of mortality in patients treated with long-term oxygen therapy. Resp. Med. 2011; 105: 470-6.
Schonhofer B., Bohrer H., Kohler D. Importance of blood transfusion in anemic patients with COPD and unsuccessful weaning from respirator. Med. Klin. 1999; 1: 108-10.
Bhattacharya N. Placental umbilical cord whole blood transfusion to combat anemia in the background of advanced rheumatoid arthritis and emaciation and its potential role as immunoadjuvant therapy. Clin. Exp. Obstet. Gynecol. 2006; 33: 28-33.
Lowenthal R.M., Gill D.S. Twenty-year remission of rheumatoid arthritis in 2 patients after allogeneic bone marrow transplant. J. Rheumatol. 2006; 33: 812-3.
Анемия хронических заболеваний: отдельные аспекты патогенеза и пути коррекции | Рукавицын
1. Вуд М. Э., Банн П. А. Секреты гематологии и онкологии. М.: Бином, 1997. 560 с. [Vud M. E., Bann P. A. Secrets of hematology and oncology. Moscow: Binom, 1997. 560 p. (In Russ.)].
2. Руководство по гематологии. Под ред. А. И. Воробьева. Т. 3. М.: Ньюдиамед, 2005. 415 с. [Hematology guide. Ed. by A. I. Vorob’ev. Vol. 3. Moscow: Newdiamed, 2005. 415 p. (In Russ.)].
3. Новик А. А., Богданов А. Н. Анемия (от А до Я). Руководство для врачей. СПб.: Нева, 2004. 250 с. [Novik A. A., Bogdanov A. N. Anemia (A to Z). Medical guidelines. St. Petersburg: Neva, 2004. 250 p. (In Russ.)].
4. Болезни крови пожилых. Под ред. М. Дж. Дэнхэма, И. Чанарина. М.: Медицина, 1989. 480 с. [Blood disorders in the elderly. Ed. by M. J. Denhem, I. Chanarin. Moscow: Meditsina, 1989. 480 p. (In Russ.)].
5. Павлов А. Д., Морщакова Е. Ф., Румянцев А. Г. Эритропоэз, эритропоэтин, железо. М.: ГЭОТАР-медиа, 2011. 299 с. [Pavlov A. D., Morshchakova E. F., Rumyantsev A. G. Erythropoiesis, erythropoietin, iron. Moscow: GEOTAR-media, 2011. 299 p. (In Russ.)].
6. Шиффман Ф. Дж. Патофизиология крови. М.: Бином; СПб.: Невский диалект, 2000. 451 с. [Shiffman F. J. Blood pathophysiology. Moscow: Binom; St. Petersburg: Nevskiy dialekt, 2000. 451 p. (In Russ.)].
7. Cartwright G. E., Wintrobe M. M. The anemia of infection: a review. Adv Intern Med 1952;5:165–226.
8. Arezes J., Nemeth E. Hepsidin and iron disorders: new biology and clinical approaches. Int J Lab Hematol 2015;37 Suppl 1:92–8.
9. Jurado R. L. Iron, infections, and anemia of inflammation. Clin Infect Dis 1997;25(4):888–95.
10. Ganz T. Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation. Blood 2003;102(3):783–8.
11. Nicolas G., Bennoun M., Porteu A. et al. Severe iron deficiency anemia in transgenic mice expressing liver hepcidin. Proc Natl Acad Sci USA 2002;99(7):4596–601.
12. Andrews N. С. Anemia of inflammation: the cytokine-hepcidin link. J Clin Invest 2004;113(9):1251–3.
13. Park S., Jung C. W., Kim K. et al. Iron deficient erythropoiesis might play key role in development of anemia in cancer patients. 2015;6(40):42803–12.
14. Ludwig H., Fritz E., Leitgeb C. et al. Prediction of response to erythropoietin treatment in chronic anemia of cancer. Blood 1994;84(4):1056–63.
15. Schilling R. F. Anemia of chronic disease: a misnomer. Ann Intern Med 1991;115(7):572–3.
16. Weiss G., Goodnough L. T. Anemia of chronic disease. N Engl J Med 2005;352(10):1011–23.
17. Wilson A., Reyes E., Ofinan J. Prevalence and outcomes of anemia in inflammatory bowel disease: a systematic review of the literature. Am J Med 2004; 116 Suppl 7A:44S–9S.
18. Steinmets T., Tschechne B., Harlin O. et al. Clinical experience with ferric carboximaltose in treatment of cancer- and chemotherapy-associated anemia. Ann Oncol 2013;24(2):475–82.
19. Maury C. P., Liljestrom M., Laiho K. et al. Tumor necrosis factor alpha, its soluble receptor I, and -308 gene promoter polymorphism in patients with rheumatoid arthritis with or without amyloidosis: implications for the pathogenesis of nephropathy and anemia of chronic disease in reactive amyloidosis. Arthritis Rheum 2003;48(11):3068–70.
20. Brissot P., Ropert M., Lee L. C., Loreal O. Non-transferrin bound iron: a key role in iron overload and iron toxisity. Biochim Biophis Acta 2012;1820(3):403–10.
21. Tarantino G., Brilli E., Giordano G., Torelli A. Innovative oral iron supplement (sucrosomial iron) is able to downregulate hepsidin release during inflammation: in vitro study. Blood 2015;126:4563–5.
22. Rizzo J. D., Brouwers M., Hurley P. et al. American Society of Hematology/American Society of Clinical Oncology clinical practice guideline update on the use epoetin and darbepoetin in adult patients with cancer. Blood 2010;116(20):4045–59.
23. Stenvinkel P. The role of inflammation in the anaemia of end-stage renal disease. Nephrol Dial Transplant 2001;16 Suppl 7: 36–40.
24. Дрозд М. В., Ермолин В. В., Рукавицын О. А. и др. Болевой синдром (оссалгии) на фоне применения стимуляторов эритропоэза: случайность или побочный эффект? В сб.: Тезисы Всероссийской юбилейной конференции ГВКГ им. Н. Н. Бурденко. М., 2010. С. 207–8. [Drozd M. V., Ermolin V. V., Rukavitsyn O. A. et al. Pain (ossalgia) during treatment with erythropoiesis stimulants: a coincidence or a side effect? In: Abstract book of Russian Anniversary Conference f N. N. Burdenko Main Military Clinical Hospital. Moscow, 2010. Pp. 207–8. (In Russ.)].
25. Bohlius J., Schmidlin K., Brillant C. et al. Recombinant human erythropoiesisstimulating agents and mortality in patients with cancer: a meta-analysis of randomized trials. Lancet 2009;373(9674):1532–42.
26. Glaspy J., Crowford J., Vansteenkiste J. et al. Erythropoiesis-stimulating agents in oncology: a study-level meta-analysis of survival and other safety outcomes. Br J Cancer 2010;102(2):301–15.
27. Tsuboi M., Ezaki K., Tobinai K. et al. Weekly administration of epoetin beta for chemotherapy-induced anemia in cancer patients: results of multicenter, phase III, randomized, double-blind, placebo-controlled study. Jpn J Clin Oncol 2009;39(3):163–8.
28. Levine M. N., Lee A. Y., Kakkar A. K. Thrombosis and cancer. Am Soc Clin Oncol Ed Book. 2005. Pp. 748–57.
29. Дрозд М. В. Анемия у пациентов с лимфопролиферативными заболеваниями: патогенетические особенности и возможности терапии. Автореф. дис. … канд. мед. наук. М., 2007. [Drozd M. V. Anemia in patients with lymphoproliferative diseases: pathogenetic features and therapy options. Author’s abstract of thesis … of candidate of medicine. Moscow, 2007. (In Russ.)].
30. Aul C., Bowen D. T., Yoshida Y. Pathogenesis, ethiology and epidemiology of myelodysplastic syndromes. Hematologica 1998;83(1):71–86.
31. Geary C. C., Marsh J. C., Gordon-Smith E. C. Hypoplastic myelodysplasia (MDS). Br J Haematol 1996;94(3):579–84.
32. Rarcharidou A., Raza A., Economopoulos T. Extensive apoptosis of bone marrow cells as evaluated by the in situ end-labelling (ISEL) technique may be the basis for ineffective haematopoiesis in patients with myelodysplastic syndromes. Eur J Haematol 1999;62(1):19–26.
33. Ross S. D., Allen I. E., Probst C. A. et al. Efficacy and safety of erythropoiesisstimulating proteins in myelodysplastic syndrome: a systematic review and metaanalysis. Oncologist 2007;12(10):1264–73.
О взаимосвязи хронической обструктивной болезни легких и анемии | Жусина
1. Lozano R., Naghavi M., Foreman K. et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study. Lancet. 2012; 380 (9859): 2095–2128. DOI: 10.1016/S0140-6736(12)61728-0.
2. Стародубов В.И., Леонов С.А., Вайсман Д.Ш. Анализ основных тенденций изменения заболеваемости населения хроническими обструктивными болезнями легких и бронхоэктатической болезнью в Российской Федерации в 2005–2012 годах. Медицина. 2013; (4): 1–31.
3. Кокосов А.Н. Хронический бронхит и обструктивная болезнь легких. В кн.: Кокосов А.Н., ред. Эволюция представлений о хроническом поражении бронхов и классификация патологии. СПб: Лань; 2002: 11–19.
4. Barnes P.J., Celli B.R. Systemic manifestations and comorbidities of COPD. Eur. Respir. J. 2009; 33 (5): 1165–1185. DOI: 10.1183/09031936.00128008.
5. Прозорова Г.Г., Будневский А.В., Овсянников Е С. и др. К вопросу о системных проявлениях хронической обструктивной болезни легких. Молодой ученый. 2015; 13 (93): 308–310.
6. Чучалин А.Г. Хронические обструктивные болезни легких. М.: Атмосфера; 2008.
7. Vanfleteren L.E., Spruit M.A., Groenen M. Clusters of comorbidities based on validated objective measurements and systemic inflammation in patients with chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2013; 187 (7): 728–735. DOI: 10.1164/rccm.201209-1665OC.
8. Ноников В.Е. Хроническая обструктивная болезнь легких (ХОБЛ): диагностика и лечение. Consilium Medicum. 2004; 6 (5): 12–17.
9. Овчаренко С.И., Капустина В.А. Новые достижения в лечении хронической обструктивной болезни лёгких (результаты исследования UPLIFT). Фарматека. 2009; 5 (179): 33–38.
10. Anía B.J., Suman V.J., Fairbanks V.F. et al. Incidence of anemia in older people: an epidemiologic study in a well defined population. J. Am. Geriatr. Soc. 1997; 45 (7): 825–831. DOI: 10.1111/j.1532-5415.1997.tb01509.x.
11. Chambellan A., Chailleux E., Similowski T. Prognostic value of hematocrit in patients with severe COPD receiving long-term oxygen therapy. Chest. 2005; 128 (3): 1201–1208. DOI: 10.1378/chest.128.3.1201.
12. Дворецкий Л.И. Анемия у больных хронической обструктивной болезнью легких: коморбидность или системное проявление? Пульмонология. 2012; (2): 5–11. DOI: 10.18093/0869-0189-2012-0-2-5-11.
13. Guidi G.C., Lechi Santonastaso C. Advancements in anemias related to chronic conditions. Clin. Chem. Lab. Med. 2010; 48 (9): 1217–1226. DOI: 10.1515/CCLM.2010.264.
14. Будневский А.В., Есауленко И.Э., Овсянников Е.С., Жусина Ю.Г. Анемии при хронической обструктивной болезни легких. Терапевтический архив. 2016; 88 (3): 96–99. DOI: 10.17116/terarkh301688396-99.
15. Nissenson A.R., Goodnough L.T., Dubois R.W. Anemia: not just an innocent bystander? Arch. Intern. Med. 2003; 163 (12): 1400–1404. DOI: 10.1001/archinte.163.12.1400.
16. John M., Hoernig S., Doehner W. et al. Anemia and inflammation in COPD. Chest. 2005; 127 (3): 825–829. DOI: 10.1378/chest.127.3.825.
17. Halpern M.T., Zilberberg M.D., Schmier J.K. et al. Anemia, costs and mortality in chronic obstructive pulmonary disease. Cost Eff. Resour. Alloc. 2006; (4): 17. DOI: 10.1186/1478-7547-4-17.
18. Shorr A.F., Doyle J., Stern L. et al. Anemia in chronic obstructive pulmonary disease: epidemiology and economic implications. Curr. Med. Res. Opin. 2008; 24 (4): 1123–1130. DOI: 10.1185/030079908X280699.
19. Fidan A., Tokmak M., Kiral N. et al. Anemia in COPD and related factors. Chest. 2010; 138 (4, Suppl.): 457A. DOI: 10.1378/chest.10779.
20. Parveen S., Rangreze I., Ahmad S. N. et al. Prevalence of anemia in patients with COPD and its potential impact on morbidity of COPD patients. Int. J. Clin. Med. 2014; 5 (8): 452–458. DOI: 10.4236/ijcm.2014.58063.
21. Будневский А.В., Воронина Е.В., Овсянников Е.С. и др. Анемия хронических заболеваний как проявление хронической обструктивной болезни легких. Клиническая медицина. 2017; 95 (3): 201–206.
22. Wouters E. Local and systemic inflammation in chronic obstructive pulmonary disease. Proc. Am. Thorac. Soc. 2005; 2 (1): 26–33. DOI: 10.1513/pats.200408-039MS.
23. Weiss G., Goodnough L.T. Anemia of chronic disease. N. Engl. J. Med. 2005; 352 (10): 1011–1023. DOI: 10.1056/NEJMra041809.
24. Павлов А.Д., Морщакова Е.Ф., Румянцев А.Г. Эритропоэз, эритропоэтин, железо. М.: ГЭОТАР-медиа; 2011.
25. Шиффман Ф.Дж. Патофизиология крови. (Пер. с англ.). М.: Бином; СПб.: Невский диалект; 2000.
26. Kullich W., Niksic F., Burmucic K. et al. [Effects of the chemokine MIP-1alpha on anemia and inflammation in rheumatoid arthritis]. Z. Rheumatol. 2002; 61 (5): 568–576. DOI: 10.1007/s00393-002-0410-x (in German).
27. Zhu Y., Ye D., Huang Z. [The correlation of cytokines TNF alpha, IFN-gamma, Epo with anemia in rheumatoid arthritis]. Zhonghua Xue Ye Xue Za Zhi. 2000; 21 (11): 587–590 (in Chinese).
28. Hunt J.R., Roughead Z.K. Adaptation of iron absorption in men consuming diets with high or low iron bioavailability. Am. J. Clin. Nutr. 2000; 71 (1): 94–102. DOI: 10.1093/ajcn/71.1.94.
29. Eisenstein R.S., Bieming K.P. Iron regulatory proteins, iron responsive elements and iron homeostasis. J. Nutr. 1996; 128 (12): 2295–2298. DOI: 10.1093/jn/128.12.2295.
30. Park S., Jung C.W., Kim K. et al. Iron deficient erythropoiesis might play key role in development of anemia in cancer patients. Oncotarget. 2015; 6 (40): 42803–42812. DOI: 10.18632/oncotarget.5658.
31. Punnonen K., Irjala K., Rajamaki A. Serum transferrin receptor and its ratio to serum ferritin in the diagnosis of iron deficiency. Blood. 1997; 89 (3): 1052–1057.
32. Nemeth E., Ganz T. Anemia of inflammation. Hematol. Oncol. Clin. North. Am. 2014; 28 (4): 671–681. DOI: 10.1016/j.hoc.2014.04.005.
33. Casaburi R., Bhasin S., Cosentino L. et al. Effects of testosterone and resistance training in men with chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2004; 170 (8): 870–878. DOI: 10.1164/rccm.200305-617OC.
34. Tsantes A.E., Tassiopoulos S.T., Papadhimitriou S.I. et al. Theophylline treatment may adversely affect the anoxia-induced erythropoietic response without suppressing erythropoietin production. Eur. J. Clin. Pharmacol. 2003; 59 (5–6): 379–383. DOI: 10.1007/s00228-003-0640-0.
35. Marathias K.P., Agroyannis B., Mavromoustakos T. et al. Hematocrit-lowering effect following inactivation of renin- angiotensin system with angiotensin converting enzyme inhibitors and angiotensin receptor blockers. Curr. Top. Med. Chem. 2004; 4 (4): 483–486. DOI: 10.2174/1568026043451311.
36. Cote C., Zilberberg M.D., Mody S.H. et al. Haemoglobin level and its clinical impact in a cohort of patients with CODP. Eur. Respir. J. 2007; 29 (5): 923–929. DOI: 10.1183/09031936.00137106.
37. Agusti A.G., Noguera A, Sauleda J. et al. Systemic effects of chronic obstructive pulmonary disease. Eur. Respir. J. 2003; 21 (2): 347–360. DOI: 10.1183/09031936.03.00405703.
38. MacCallum P.K. Markers of hemostasis and systemic inflammation in heart disease and atherosclerosis in smoker. Proc. Am. Thorac. Soc. 2005. 2 (1): 34–43. DOI: 10.1513/pats.200406-036MS.
39. Kautz L., Jung G., Valore E.V. et al. Identification of erythroferrone as an erythroid regulator of iron metabolism. Nat. Genet. 2014; 46 (7): 678–684. DOI: 10.1038/ng.2996.
40. Tarantino G., Brilli E., Giordano G., Torelli A. Innovative oral iron supplement (sucrosomial iron) is able to downregulate hepsidin release during inflammation: in vitro study. Blood. 2015; 126 (23): 4563.
41. Theurl I., Schroll A., Sonnweber T. et al. Pharmacologic inhibition of hepcidin expression reverses anemia of chronic inflammation in rats. Blood. 2011; 118 (18): 4977–4984. DOI: 10.1182/blood-2011-03-345066.
42. Querbes W., Bogorad R.L., Moslehi J. et al. Treatment of erythropoietin deficiency in mice with systemically administered siRNA. Blood. 2012; 120 (9): 1916–1922. DOI: 10.1182/blood-2012-04-423715.
43. Schonhofer B., Wenze I.M., Geibe I.M., Kohler D. Blood transfusion and lung function in chronically anemic patients with severe chronic obstructive pulmonary disease. Crit. Care Med. 1998; 26 (11): 1824–1828. DOI: 10.1097/00003246-199811000-00022.
44. Будневский А.В., Цветикова Л.Н., Воронина Е.В. и др. Эритроферрон как эритроидный регулятор обмена железа. Гематология и трансфузиология. 2016; 61 (3): 161–163.
45. Будневский А.В., Провоторов В.М., Ульянова М.И. Хроническая обструктивная болезнь легких и анемия: клинические проявления и тактика лечения. Клиническая медицина. 2016; 94 (9): 677–683.
46. Федорова Т.А., Эккерт Н.В., Чернеховская Н.Е. и др. Возможности противовоспалительной терапии больных хронической обструктивной болезнью легких. Клиническая медицина. 2005. 83 (7): 24–29.
Анемия хронических заболеваний; Причины, симптомы, лечение, профилактика
Обзор
Что такое анемия при хроническом заболевании?
Анемия хронического заболевания означает низкий уровень эритроцитов в результате аутоиммунных заболеваний (заболеваний, при которых иммунная система организма атакует суставы и / или органы) или других хронических заболеваний.Хронические заболевания — это те, которые длятся более 3 месяцев. Это состояние также называется анемией воспаления или анемией воспаления и хронического заболевания (AI / ACD).
Насколько распространена анемия при хроническом заболевании?
Это второй по распространенности тип анемии после анемии, вызванной дефицитом железа.
Кто подвержен риску развития этого состояния?
Наиболее частыми заболеваниями, которые могут вызывать анемию, являются:
- Любая инфекция
- Рак
- Хроническая болезнь почек (Практически каждый пациент с этим типом заболевания заболеет анемией, потому что почки вырабатывают эритропоэтин (ЭПО), гормон, контролирующий выработку красных кровяных телец в костном мозге.)
- Аутоиммунные болезни
- Хроническое отторжение пересаженного органа
- Сердечная недостаточность
- Ожирение
Симптомы и причины
Что вызывает анемию при хроническом заболевании?
Хронические заболевания могут вызывать изменения в красных кровяных тельцах, переносящих кислород кровяных тельцах, вырабатываемых костным мозгом.Эти изменения могут привести к более ранней смерти красных кровяных телец и замедлению их производства.
При хронической анемии железо, которое обычно перерабатывается из старых красных кровяных телец для создания новых красных кровяных телец, сохраняется в системе клеток, называемых макрофагами. Это ограничивает количество железа, доступного для создания новых красных кровяных телец.
Кроме того, метаболизм железа в клетках нарушается. (Метаболизм — это серия организованных химических реакций, необходимых организму для выживания.)
Каковы симптомы анемии при хроническом заболевании?
Симптомы аналогичны симптомам, вызванным железодефицитной анемией, и включают:
- Чувство усталости или слабости
- С бледной кожей
- При одышке
- Потение
- Головокружение или слабость
- Учащенное сердцебиение
- Головная боль
У некоторых людей симптомы отсутствуют. У некоторых людей симптомы появляются только во время тренировок.
Диагностика и тесты
Как диагностируется анемия при хроническом заболевании?
Симптомы болезни, вызывающей анемию, могут маскировать симптомы самой анемии, поэтому врачи захотят провести анализ крови.
Тест ищет низкий уровень гемоглобина.Это вещество представляет собой красный пигмент крови, переносящий кислород. Нормальный уровень гемоглобина составляет 12,3-15,3 г / дл для взрослых женщин и 14-17,5 г / дл для взрослых мужчин. Для измерения гемоглобина можно использовать тест из пальца.
Самое главное, анализ крови покажет низкий уровень сывороточного железа у человека с анемией. Сыворотка — это жидкая часть крови.
Анализ крови также может выявить:
- Низкое количество ретикулоцитов (ретикулоциты — незрелые эритроциты)
- Низкая общая связывающая способность железа
- Высокий уровень ферритина в сыворотке
- Повышение скорости оседания из воспалительных белков, попадающих в кровь
Уровни эритропоэтина (ЭПО) можно измерить, если уровень гемоглобина ниже 10 г / дл.
Также может быть выполнена биопсия костного мозга. Биопсия костного мозга проводится в амбулаторных условиях либо под местной анестезией, либо под легким седативным действием и включает забор образца костного мозга путем введения иглы в таз. Повышенные запасы железа в костном мозге в дополнение к низкому уровню железа в сыворотке крови указывают на анемию хронического заболевания.
Ведение и лечение
Как лечится анемия, вызванная хроническим заболеванием?
Анемия, связанная с анемией при хроническом заболевании, обычно бывает легкой степени.Лечение основного заболевания, вызывающего анемию, является первым шагом к лечению большинства форм анемии хронического заболевания. Во многих случаях лечение этих заболеваний устраняет анемию и ее симптомы. Однако эта стратегия может не работать при анемии, вызванной раком или хроническим заболеванием почек. Могут потребоваться другие варианты лечения.
Переливания крови можно использовать при особенно тяжелой анемии (гемоглобин <8,0 г / дл). Переливания не используются в качестве долгосрочной терапии из-за рисков, таких как перегрузка железом и потенциальные побочные эффекты иммунной системы, которые могут увеличить риск заражения.
Синтетическая форма EPO может вводиться подкожно (под кожей), если уровни EPO снижены. Вы также можете получить дополнительную терапию железом, если в качестве лечения используется ЭПО. Если вы получаете терапию ЭПО, ваш уровень гемоглобина будет проверяться каждые несколько недель, чтобы узнать, помогает ли это. Обычно терапию корректируют таким образом, чтобы уровень гемоглобина находился в пределах 11–12 г / дл.
Также изучаются экспериментальные методы лечения.
Профилактика
Можно ли предотвратить хроническую анемию?
Возможно, невозможно предотвратить анемию при хроническом заболевании, но вы можете помочь себе, внеся некоторые изменения в свой рацион.Вы должны получать достаточно железа, фолиевой кислоты и витамина B-12 (также называемого кобаламином). Некоторые продукты, которые вы можете выбрать, включают курицу или индейку, бобы, шпинат, обогащенные хлопья для завтрака и обогащенный хлеб.
Перспективы / Прогноз
Каков прогноз для человека с анемией хронического заболевания?
Лечение болезни, вызывающей анемию, обычно означает, что анемия исчезнет.Вы всегда должны сообщать своему врачу, если симптомы, такие как усталость, возвращаются.
Анемия хронических заболеваний; Причины, симптомы, лечение, профилактика
Обзор
Что такое анемия при хроническом заболевании?
Анемия хронического заболевания означает низкий уровень эритроцитов в результате аутоиммунных заболеваний (заболеваний, при которых иммунная система организма атакует суставы и / или органы) или других хронических заболеваний.Хронические заболевания — это те, которые длятся более 3 месяцев. Это состояние также называется анемией воспаления или анемией воспаления и хронического заболевания (AI / ACD).
Насколько распространена анемия при хроническом заболевании?
Это второй по распространенности тип анемии после анемии, вызванной дефицитом железа.
Кто подвержен риску развития этого состояния?
Наиболее частыми заболеваниями, которые могут вызывать анемию, являются:
- Любая инфекция
- Рак
- Хроническая болезнь почек (Практически каждый пациент с этим типом заболевания заболеет анемией, потому что почки вырабатывают эритропоэтин (ЭПО), гормон, контролирующий выработку красных кровяных телец в костном мозге.)
- Аутоиммунные болезни
- Хроническое отторжение пересаженного органа
- Сердечная недостаточность
- Ожирение
Симптомы и причины
Что вызывает анемию при хроническом заболевании?
Хронические заболевания могут вызывать изменения в красных кровяных тельцах, переносящих кислород кровяных тельцах, вырабатываемых костным мозгом.Эти изменения могут привести к более ранней смерти красных кровяных телец и замедлению их производства.
При хронической анемии железо, которое обычно перерабатывается из старых красных кровяных телец для создания новых красных кровяных телец, сохраняется в системе клеток, называемых макрофагами. Это ограничивает количество железа, доступного для создания новых красных кровяных телец.
Кроме того, метаболизм железа в клетках нарушается. (Метаболизм — это серия организованных химических реакций, необходимых организму для выживания.)
Каковы симптомы анемии при хроническом заболевании?
Симптомы аналогичны симптомам, вызванным железодефицитной анемией, и включают:
- Чувство усталости или слабости
- С бледной кожей
- При одышке
- Потение
- Головокружение или слабость
- Учащенное сердцебиение
- Головная боль
У некоторых людей симптомы отсутствуют. У некоторых людей симптомы появляются только во время тренировок.
Диагностика и тесты
Как диагностируется анемия при хроническом заболевании?
Симптомы болезни, вызывающей анемию, могут маскировать симптомы самой анемии, поэтому врачи захотят провести анализ крови.
Тест ищет низкий уровень гемоглобина.Это вещество представляет собой красный пигмент крови, переносящий кислород. Нормальный уровень гемоглобина составляет 12,3-15,3 г / дл для взрослых женщин и 14-17,5 г / дл для взрослых мужчин. Для измерения гемоглобина можно использовать тест из пальца.
Самое главное, анализ крови покажет низкий уровень сывороточного железа у человека с анемией. Сыворотка — это жидкая часть крови.
Анализ крови также может выявить:
- Низкое количество ретикулоцитов (ретикулоциты — незрелые эритроциты)
- Низкая общая связывающая способность железа
- Высокий уровень ферритина в сыворотке
- Повышение скорости оседания из воспалительных белков, попадающих в кровь
Уровни эритропоэтина (ЭПО) можно измерить, если уровень гемоглобина ниже 10 г / дл.
Также может быть выполнена биопсия костного мозга. Биопсия костного мозга проводится в амбулаторных условиях либо под местной анестезией, либо под легким седативным действием и включает забор образца костного мозга путем введения иглы в таз. Повышенные запасы железа в костном мозге в дополнение к низкому уровню железа в сыворотке крови указывают на анемию хронического заболевания.
Ведение и лечение
Как лечится анемия, вызванная хроническим заболеванием?
Анемия, связанная с анемией при хроническом заболевании, обычно бывает легкой степени.Лечение основного заболевания, вызывающего анемию, является первым шагом к лечению большинства форм анемии хронического заболевания. Во многих случаях лечение этих заболеваний устраняет анемию и ее симптомы. Однако эта стратегия может не работать при анемии, вызванной раком или хроническим заболеванием почек. Могут потребоваться другие варианты лечения.
Переливания крови можно использовать при особенно тяжелой анемии (гемоглобин <8,0 г / дл). Переливания не используются в качестве долгосрочной терапии из-за рисков, таких как перегрузка железом и потенциальные побочные эффекты иммунной системы, которые могут увеличить риск заражения.
Синтетическая форма EPO может вводиться подкожно (под кожей), если уровни EPO снижены. Вы также можете получить дополнительную терапию железом, если в качестве лечения используется ЭПО. Если вы получаете терапию ЭПО, ваш уровень гемоглобина будет проверяться каждые несколько недель, чтобы узнать, помогает ли это. Обычно терапию корректируют таким образом, чтобы уровень гемоглобина находился в пределах 11–12 г / дл.
Также изучаются экспериментальные методы лечения.
Профилактика
Можно ли предотвратить хроническую анемию?
Возможно, невозможно предотвратить анемию при хроническом заболевании, но вы можете помочь себе, внеся некоторые изменения в свой рацион.Вы должны получать достаточно железа, фолиевой кислоты и витамина B-12 (также называемого кобаламином). Некоторые продукты, которые вы можете выбрать, включают курицу или индейку, бобы, шпинат, обогащенные хлопья для завтрака и обогащенный хлеб.
Перспективы / Прогноз
Каков прогноз для человека с анемией хронического заболевания?
Лечение болезни, вызывающей анемию, обычно означает, что анемия исчезнет.Вы всегда должны сообщать своему врачу, если симптомы, такие как усталость, возвращаются.
Анемия хронических заболеваний; Причины, симптомы, лечение, профилактика
Обзор
Что такое анемия при хроническом заболевании?
Анемия хронического заболевания означает низкий уровень эритроцитов в результате аутоиммунных заболеваний (заболеваний, при которых иммунная система организма атакует суставы и / или органы) или других хронических заболеваний.Хронические заболевания — это те, которые длятся более 3 месяцев. Это состояние также называется анемией воспаления или анемией воспаления и хронического заболевания (AI / ACD).
Насколько распространена анемия при хроническом заболевании?
Это второй по распространенности тип анемии после анемии, вызванной дефицитом железа.
Кто подвержен риску развития этого состояния?
Наиболее частыми заболеваниями, которые могут вызывать анемию, являются:
- Любая инфекция
- Рак
- Хроническая болезнь почек (Практически каждый пациент с этим типом заболевания заболеет анемией, потому что почки вырабатывают эритропоэтин (ЭПО), гормон, контролирующий выработку красных кровяных телец в костном мозге.)
- Аутоиммунные болезни
- Хроническое отторжение пересаженного органа
- Сердечная недостаточность
- Ожирение
Симптомы и причины
Что вызывает анемию при хроническом заболевании?
Хронические заболевания могут вызывать изменения в красных кровяных тельцах, переносящих кислород кровяных тельцах, вырабатываемых костным мозгом.Эти изменения могут привести к более ранней смерти красных кровяных телец и замедлению их производства.
При хронической анемии железо, которое обычно перерабатывается из старых красных кровяных телец для создания новых красных кровяных телец, сохраняется в системе клеток, называемых макрофагами. Это ограничивает количество железа, доступного для создания новых красных кровяных телец.
Кроме того, метаболизм железа в клетках нарушается. (Метаболизм — это серия организованных химических реакций, необходимых организму для выживания.)
Каковы симптомы анемии при хроническом заболевании?
Симптомы аналогичны симптомам, вызванным железодефицитной анемией, и включают:
- Чувство усталости или слабости
- С бледной кожей
- При одышке
- Потение
- Головокружение или слабость
- Учащенное сердцебиение
- Головная боль
У некоторых людей симптомы отсутствуют. У некоторых людей симптомы появляются только во время тренировок.
Диагностика и тесты
Как диагностируется анемия при хроническом заболевании?
Симптомы болезни, вызывающей анемию, могут маскировать симптомы самой анемии, поэтому врачи захотят провести анализ крови.
Тест ищет низкий уровень гемоглобина.Это вещество представляет собой красный пигмент крови, переносящий кислород. Нормальный уровень гемоглобина составляет 12,3-15,3 г / дл для взрослых женщин и 14-17,5 г / дл для взрослых мужчин. Для измерения гемоглобина можно использовать тест из пальца.
Самое главное, анализ крови покажет низкий уровень сывороточного железа у человека с анемией. Сыворотка — это жидкая часть крови.
Анализ крови также может выявить:
- Низкое количество ретикулоцитов (ретикулоциты — незрелые эритроциты)
- Низкая общая связывающая способность железа
- Высокий уровень ферритина в сыворотке
- Повышение скорости оседания из воспалительных белков, попадающих в кровь
Уровни эритропоэтина (ЭПО) можно измерить, если уровень гемоглобина ниже 10 г / дл.
Также может быть выполнена биопсия костного мозга. Биопсия костного мозга проводится в амбулаторных условиях либо под местной анестезией, либо под легким седативным действием и включает забор образца костного мозга путем введения иглы в таз. Повышенные запасы железа в костном мозге в дополнение к низкому уровню железа в сыворотке крови указывают на анемию хронического заболевания.
Ведение и лечение
Как лечится анемия, вызванная хроническим заболеванием?
Анемия, связанная с анемией при хроническом заболевании, обычно бывает легкой степени.Лечение основного заболевания, вызывающего анемию, является первым шагом к лечению большинства форм анемии хронического заболевания. Во многих случаях лечение этих заболеваний устраняет анемию и ее симптомы. Однако эта стратегия может не работать при анемии, вызванной раком или хроническим заболеванием почек. Могут потребоваться другие варианты лечения.
Переливания крови можно использовать при особенно тяжелой анемии (гемоглобин <8,0 г / дл). Переливания не используются в качестве долгосрочной терапии из-за рисков, таких как перегрузка железом и потенциальные побочные эффекты иммунной системы, которые могут увеличить риск заражения.
Синтетическая форма EPO может вводиться подкожно (под кожей), если уровни EPO снижены. Вы также можете получить дополнительную терапию железом, если в качестве лечения используется ЭПО. Если вы получаете терапию ЭПО, ваш уровень гемоглобина будет проверяться каждые несколько недель, чтобы узнать, помогает ли это. Обычно терапию корректируют таким образом, чтобы уровень гемоглобина находился в пределах 11–12 г / дл.
Также изучаются экспериментальные методы лечения.
Профилактика
Можно ли предотвратить хроническую анемию?
Возможно, невозможно предотвратить анемию при хроническом заболевании, но вы можете помочь себе, внеся некоторые изменения в свой рацион.Вы должны получать достаточно железа, фолиевой кислоты и витамина B-12 (также называемого кобаламином). Некоторые продукты, которые вы можете выбрать, включают курицу или индейку, бобы, шпинат, обогащенные хлопья для завтрака и обогащенный хлеб.
Перспективы / Прогноз
Каков прогноз для человека с анемией хронического заболевания?
Лечение болезни, вызывающей анемию, обычно означает, что анемия исчезнет.Вы всегда должны сообщать своему врачу, если симптомы, такие как усталость, возвращаются.
Анемия хронических заболеваний; Причины, симптомы, лечение, профилактика
Обзор
Что такое анемия при хроническом заболевании?
Анемия хронического заболевания означает низкий уровень эритроцитов в результате аутоиммунных заболеваний (заболеваний, при которых иммунная система организма атакует суставы и / или органы) или других хронических заболеваний.Хронические заболевания — это те, которые длятся более 3 месяцев. Это состояние также называется анемией воспаления или анемией воспаления и хронического заболевания (AI / ACD).
Насколько распространена анемия при хроническом заболевании?
Это второй по распространенности тип анемии после анемии, вызванной дефицитом железа.
Кто подвержен риску развития этого состояния?
Наиболее частыми заболеваниями, которые могут вызывать анемию, являются:
- Любая инфекция
- Рак
- Хроническая болезнь почек (Практически каждый пациент с этим типом заболевания заболеет анемией, потому что почки вырабатывают эритропоэтин (ЭПО), гормон, контролирующий выработку красных кровяных телец в костном мозге.)
- Аутоиммунные болезни
- Хроническое отторжение пересаженного органа
- Сердечная недостаточность
- Ожирение
Симптомы и причины
Что вызывает анемию при хроническом заболевании?
Хронические заболевания могут вызывать изменения в красных кровяных тельцах, переносящих кислород кровяных тельцах, вырабатываемых костным мозгом.Эти изменения могут привести к более ранней смерти красных кровяных телец и замедлению их производства.
При хронической анемии железо, которое обычно перерабатывается из старых красных кровяных телец для создания новых красных кровяных телец, сохраняется в системе клеток, называемых макрофагами. Это ограничивает количество железа, доступного для создания новых красных кровяных телец.
Кроме того, метаболизм железа в клетках нарушается. (Метаболизм — это серия организованных химических реакций, необходимых организму для выживания.)
Каковы симптомы анемии при хроническом заболевании?
Симптомы аналогичны симптомам, вызванным железодефицитной анемией, и включают:
- Чувство усталости или слабости
- С бледной кожей
- При одышке
- Потение
- Головокружение или слабость
- Учащенное сердцебиение
- Головная боль
У некоторых людей симптомы отсутствуют. У некоторых людей симптомы появляются только во время тренировок.
Диагностика и тесты
Как диагностируется анемия при хроническом заболевании?
Симптомы болезни, вызывающей анемию, могут маскировать симптомы самой анемии, поэтому врачи захотят провести анализ крови.
Тест ищет низкий уровень гемоглобина.Это вещество представляет собой красный пигмент крови, переносящий кислород. Нормальный уровень гемоглобина составляет 12,3-15,3 г / дл для взрослых женщин и 14-17,5 г / дл для взрослых мужчин. Для измерения гемоглобина можно использовать тест из пальца.
Самое главное, анализ крови покажет низкий уровень сывороточного железа у человека с анемией. Сыворотка — это жидкая часть крови.
Анализ крови также может выявить:
- Низкое количество ретикулоцитов (ретикулоциты — незрелые эритроциты)
- Низкая общая связывающая способность железа
- Высокий уровень ферритина в сыворотке
- Повышение скорости оседания из воспалительных белков, попадающих в кровь
Уровни эритропоэтина (ЭПО) можно измерить, если уровень гемоглобина ниже 10 г / дл.
Также может быть выполнена биопсия костного мозга. Биопсия костного мозга проводится в амбулаторных условиях либо под местной анестезией, либо под легким седативным действием и включает забор образца костного мозга путем введения иглы в таз. Повышенные запасы железа в костном мозге в дополнение к низкому уровню железа в сыворотке крови указывают на анемию хронического заболевания.
Ведение и лечение
Как лечится анемия, вызванная хроническим заболеванием?
Анемия, связанная с анемией при хроническом заболевании, обычно бывает легкой степени.Лечение основного заболевания, вызывающего анемию, является первым шагом к лечению большинства форм анемии хронического заболевания. Во многих случаях лечение этих заболеваний устраняет анемию и ее симптомы. Однако эта стратегия может не работать при анемии, вызванной раком или хроническим заболеванием почек. Могут потребоваться другие варианты лечения.
Переливания крови можно использовать при особенно тяжелой анемии (гемоглобин <8,0 г / дл). Переливания не используются в качестве долгосрочной терапии из-за рисков, таких как перегрузка железом и потенциальные побочные эффекты иммунной системы, которые могут увеличить риск заражения.
Синтетическая форма EPO может вводиться подкожно (под кожей), если уровни EPO снижены. Вы также можете получить дополнительную терапию железом, если в качестве лечения используется ЭПО. Если вы получаете терапию ЭПО, ваш уровень гемоглобина будет проверяться каждые несколько недель, чтобы узнать, помогает ли это. Обычно терапию корректируют таким образом, чтобы уровень гемоглобина находился в пределах 11–12 г / дл.
Также изучаются экспериментальные методы лечения.
Профилактика
Можно ли предотвратить хроническую анемию?
Возможно, невозможно предотвратить анемию при хроническом заболевании, но вы можете помочь себе, внеся некоторые изменения в свой рацион.Вы должны получать достаточно железа, фолиевой кислоты и витамина B-12 (также называемого кобаламином). Некоторые продукты, которые вы можете выбрать, включают курицу или индейку, бобы, шпинат, обогащенные хлопья для завтрака и обогащенный хлеб.
Перспективы / Прогноз
Каков прогноз для человека с анемией хронического заболевания?
Лечение болезни, вызывающей анемию, обычно означает, что анемия исчезнет.Вы всегда должны сообщать своему врачу, если симптомы, такие как усталость, возвращаются.
Анемия хронических заболеваний — NORD (Национальная организация по редким заболеваниям)
Точная причина анемии при хронических заболеваниях может варьироваться. Обычно одновременно происходит несколько процессов. Анемия может быть вызвана небольшим сокращением нормального выживания красных кровяных телец. Кроме того, может быть нарушена выработка красных кровяных телец (эритропоэз) или эритропоэтина (гормона, стимулирующего выработку красных кровяных телец).Красные кровяные тельца переносят кислород в организм. Точная причина анемии при хроническом заболевании может зависеть от основного состояния. Например, раковые клетки могут выделять определенные вещества, которые повреждают или разрушают незрелые эритроциты. В некоторых случаях раковые клетки или инфекционное заболевание могут проникать в костный мозг, мягкий губчатый материал, обнаруживаемый в длинных костях, где образуются клетки крови.
Исследователи также узнали, что люди с хронической анемией также имеют дисбаланс в распределении железа в организме и, как следствие, не могут эффективно использовать железо для создания новых клеток крови, несмотря на наличие достаточного или повышенного уровня железа, хранящегося в тканях. .Железо — это важный минерал, который содержится во всех клетках тела и необходим для правильного функционирования и роста организма. Железо содержится во многих продуктах питания, включая красное мясо, птицу, яйца и овощи. Уровни железа в организме должны оставаться в определенном диапазоне, иначе они могут вызвать анемию (из-за низкого функционального уровня железа) или повреждение пораженных органов (из-за аномально высокого уровня железа в определенных тканях).
Железо необходимо для производства гемоглобина, части красных кровяных телец, переносящих кислород.Ключевой находкой при анемии при хроническом заболевании является повышенное поглощение и удержание железа в определенных клетках, что приводит к снижению количества функционального железа, доступного для производства гемоглобина. Недостаток функционального железа препятствует развитию гемоглобина, что, в свою очередь, снижает количество кислорода, доставляемого по всему телу (анемия).
Исследователи считают, что иммунная система, которая остается постоянно активной у людей с хроническими заболеваниями, вырабатывает вещества, которые влияют на выработку, хранение и транспортировку железа в организме.Клетки иммунной системы производят цитокины, специализированные белки, которые стимулируют или подавляют функцию других клеток иммунной системы.
Гепсидин, гормон, вырабатываемый в печени, который помогает регулировать метаболизм и транспорт железа в организме, играет важную роль в развитии анемии при хронических заболеваниях. Исследователи полагают, что специфический цитокин, известный как интерлейкин-6 (ИЛ-6), в большинстве случаев стимулирует выработку гепсидина, хотя гепсидин также может вырабатываться в ответ на воспаление путями, не связанными с ИЛ-6.Избыток гепсидина приводит к тому, что в клетках задерживается слишком много железа, что снижает количество железа, доступного для производства гемоглобина, что приводит к анемии. Большинство исследователей считают, что гепсидин является ключевым фактором, влияющим на развитие анемии хронического заболевания.
Анемия воспаления или хронического заболевания
На этой странице:
Что такое воспалительная анемия?
Воспалительная анемия, также называемая анемией хронического заболевания или ACD, представляет собой тип анемии, которая поражает людей с состояниями, вызывающими воспаление, такими как инфекции, аутоиммунные заболевания, рак и хроническая болезнь почек (ХБП).
Анемия — это состояние, при котором в вашей крови содержится меньше эритроцитов, чем обычно. В ваших эритроцитах может быть меньше гемоглобина, чем обычно. Гемоглобин — это богатый железом белок, который позволяет эритроцитам переносить кислород из легких во все остальные части тела. Вашему организму нужен кислород для правильной работы. При меньшем количестве эритроцитов или гемоглобина ваше тело может не получать достаточно кислорода.
При воспалительной анемии у вас может быть нормальное, а иногда и повышенное количество железа в тканях вашего тела, но низкий уровень железа в крови.Воспаление может помешать вашему организму использовать запасенное железо для выработки достаточного количества здоровых эритроцитов, что приводит к анемии.
Анемия — это состояние, при котором в вашей крови содержится меньше эритроцитов или гемоглобина, чем обычно.
Почему анемию воспаления также называют анемией хронического заболевания?
Анемия воспаления также называется анемией хронического заболевания, потому что этот тип анемии обычно возникает у людей с хроническими состояниями, которые могут быть связаны с воспалением.
Есть ли другие виды анемии?
Есть много видов анемии. Общие типы включают
- железодефицитная анемия — состояние, при котором запасенное в организме железо расходуется, в результате чего организм вырабатывает меньше здоровых эритроцитов. У людей с железодефицитной анемией уровень железа низкий как в тканях тела, так и в крови. Это самый распространенный вид анемии.
- злокачественная анемия, вызванная недостатком витамина B12.
- апластическая анемия, состояние, при котором костный мозг не вырабатывает достаточно новых эритроцитов, лейкоцитов и тромбоцитов из-за повреждения стволовых клеток костного мозга.
- гемолитическая анемия, состояние, при котором эритроциты разрушаются раньше, чем обычно.
Насколько распространена анемия, вызванная воспалением?
Воспалительная анемия — второй по распространенности тип анемии после железодефицитной анемии. 1
Кто чаще болеет воспалительной анемией?
В то время как анемия воспаления может поражать людей любого возраста, пожилые люди с большей вероятностью болеют этим типом анемии, потому что у них больше вероятность хронических заболеваний, вызывающих воспаление.В Соединенных Штатах около 1 миллиона человек старше 65 лет страдают воспалительной анемией. 2
Приводит ли воспаленная анемия к другим проблемам со здоровьем?
Воспалительная анемия обычно бывает легкой или умеренной, что означает, что уровень гемоглобина в крови ниже нормы, но не сильно. Если анемия становится тяжелой, недостаток кислорода в крови может вызвать симптомы, например чувство усталости или одышку. Тяжелая анемия может стать опасной для жизни.
У людей с ХБП тяжелая анемия может увеличить вероятность развития проблем с сердцем.
Каковы симптомы воспалительной анемии?
Воспалительная анемия обычно развивается медленно и может вызывать незначительные симптомы или не вызывать их вовсе. Фактически, вы можете испытывать только симптомы болезни, вызывающей анемию, и не замечать дополнительных симптомов.
Симптомы воспалительной анемии такие же, как и при любом типе анемии, и включают
- учащенное сердцебиение
- Боль в теле
- обморок или головокружение
- чувство усталости или слабости
- Легкое утомление во время или после физической активности
- бледная кожа
- одышка
Что вызывает анемию воспаления?
Эксперты считают, что когда у вас есть инфекция или заболевание, вызывающее воспаление, ваша иммунная система вызывает изменения в работе вашего тела, что может привести к анемии или воспалению.
- Ваше тело может неправильно хранить и использовать утюг.
- Ваши почки могут вырабатывать меньше эритропоэтина (ЭПО), гормона, который сигнализирует вашему костному мозгу — губчатой ткани в большинстве ваших костей — вырабатывать красные кровяные тельца.
- Ваш костный мозг может не реагировать на ЭПО нормально, вырабатывая меньше эритроцитов, чем необходимо.
- Ваши эритроциты могут жить меньше, чем обычно, из-за чего они умирают быстрее, чем их можно заменить.
Хронические состояния, вызывающие воспалительную анемию
Воспаление, приводящее к анемии, может вызывать множество различных хронических состояний, в том числе
У людей с определенными хроническими состояниями анемия может иметь несколько причин.Например
- Причины анемии при ХБП могут включать воспаление, низкий уровень ЭПО из-за повреждения почек или низкий уровень питательных веществ, необходимых для образования красных кровяных телец. Гемодиализ для лечения ХБП также может привести к железодефицитной анемии.
- Люди с ВЗК могут иметь как железодефицитную анемию из-за кровопотери, так и анемию воспаления.
- У людей, больных раком, анемия может быть вызвана воспалением, кровопотерей или раком, который поражает костный мозг или распространяется на него.Лечение рака, такое как химиотерапия и лучевая терапия, также может вызвать или усугубить анемию.
Другие причины воспалений, которые могут привести к анемии
В то время как анемия воспаления обычно развивается медленно, анемия критического состояния — это тип анемии воспаления, который быстро развивается у пациентов, госпитализированных по поводу тяжелых острых инфекций, травм или других состояний, вызывающих воспаление.
В некоторых случаях у пожилых людей развивается воспалительная анемия, не связанная с основной инфекцией или хроническим заболеванием.Специалисты считают, что процесс старения может вызвать воспаление и анемию.
Как медицинские работники диагностируют воспалительную анемию?
Медицинские работники используют историю болезни и анализы крови для диагностики анемии или воспаления.
История болезни
Медицинский работник спросит вас об инфекциях или хронических заболеваниях, которые могут привести к анемии или воспалению.
Анализы крови
Медицинские работники используют анализы крови для выявления признаков анемии, воспаления, других типов анемии или других проблем со здоровьем.Медицинский работник возьмет у вас образец крови и отправит его в лабораторию для анализа.
Анализ крови
позволяет проверить многие части и особенности вашей крови, в том числе
.
- количество эритроцитов
- средний размер эритроцитов
- количество гемоглобина в крови и красных кровяных тельцах
- количество развивающихся красных кровяных телец, называемых ретикулоцитами, в вашей крови
Некоторые из этих и других анализов крови могут быть объединены в тест, который называется полным анализом крови.Мазок крови можно использовать для исследования размера, формы и количества эритроцитов в крови.
Медицинский работник может также использовать анализы крови, чтобы проверить количество железа в крови и накопленного в организме железа. Эти тесты могут измерить
- железо в твоей крови
- трансферрин, белок в крови, несущий железо
- ферритин, белок, который хранит железо в клетках вашего тела
Медицинский работник может диагностировать анемию воспаления, если результаты анализа крови показывают, что у вас анемия, низкий уровень железа в крови и нормальный уровень железа, хранящегося в тканях вашего тела.
Если результаты анализа крови показывают, что у вас воспаленная анемия, но причина неизвестна, врач может провести дополнительные тесты для поиска причины.
Для анализа крови медицинский работник возьмет у вас образец крови и отправит его в лабораторию.
Как медицинские работники лечат воспалительную анемию?
Медицинские работники лечат анемию, вызванную воспалением, путем лечения основного заболевания и лечения анемии лекарствами, а иногда и переливаниями крови.
Лечение основного состояния
Медицинские работники обычно лечат анемию, вызванную воспалением, путем лечения основного состояния, которое вызывает воспаление. Если доступны методы лечения, которые могут уменьшить воспаление, они могут вызвать улучшение или исчезновение анемии. Например, прием лекарств для лечения воспаления при ревматоидном артрите может улучшить анемию.
Лекарства
Медицинский работник может прописать стимулирующие эритропоэз агенты (ЭСС) эпоэтин альфа или дарбэпоэтин альфа для лечения анемии, связанной с ХБП, химиотерапевтического лечения рака или определенных методов лечения ВИЧ.ЭСС заставляют костный мозг производить больше красных кровяных телец. Медицинские работники обычно делают уколы ESA и могут научить вас делать эти уколы в домашних условиях. Медицинский работник может назначить добавки железа в виде таблеток или уколов, чтобы помочь ESAs работать.
Если вы находитесь на гемодиализе, вы можете получать внутривенные (в / в) ЭСС и добавки железа во время гемодиализа. Узнайте больше о лечении анемии при ХБП.
Переливания крови
В некоторых случаях медицинские работники могут использовать переливание крови для лечения тяжелой воспалительной анемии.Переливание крови может быстро увеличить количество гемоглобина в крови и повысить уровень кислорода.
Могу ли я предотвратить анемию воспаления?
Специалисты пока не нашли способа предотвратить анемию воспаления. Для некоторых хронических состояний, вызывающих воспаление, могут быть доступны методы лечения для уменьшения или предотвращения воспаления, которое может привести к анемии. Поговорите со своим врачом о лечении и следуйте плану лечения, который он рекомендует.
Как еда, диета и питание влияют на воспалительную анемию?
Если у вас хроническое заболевание, которое вызывает анемию или воспаление, следуйте советам врача или диетолога по вопросам здорового питания и питания.
Клинические испытания воспалительной анемии
Национальный институт диабета, болезней органов пищеварения и почек (NIDDK) и другие компоненты Национальных институтов здравоохранения (NIH) проводят и поддерживают исследования многих заболеваний и состояний, включая болезни крови.
Какие клинические испытания проводятся при воспалительной анемии?
Клинические испытания — и другие виды клинических исследований — являются частью медицинских исследований, в которых участвуют такие люди, как вы. Когда вы добровольно принимаете участие в клиническом исследовании, вы помогаете врачам и исследователям больше узнать о болезнях и улучшить медицинское обслуживание людей в будущем.
Исследователи изучают многие аспекты воспалительной анемии, включая новые методы лечения этого состояния.
Узнайте, подходят ли вам клинические исследования.
Какие клинические исследования воспалительной анемии ищут участники?
Вы можете найти клинические исследования по воспалительной анемии на сайте www.ClinicalTrials.gov. В дополнение к поиску исследований, финансируемых из федерального бюджета, вы можете расширить или сузить область поиска, включив в нее клинические исследования, проводимые отраслью, университетами и отдельными лицами; однако NIH не рассматривает эти исследования и не может гарантировать их безопасность.Прежде чем участвовать в клиническом исследовании, всегда консультируйтесь со своим врачом.
Список литературы
[1] Немет Э., Ганц Т. Воспалительная анемия. Гематологические / онкологические клиники Северной Америки. 2014; 28 (4): 671–681.
[2] Френкель П.Г. Анемия воспаления: обзор. Медицинские клиники Северной Америки. 2017; 101 (2): 285-296.
Анемия воспаления | Кровь
Несмотря на то, что сравнительные исследования не проводились, симптомы и признаки ЖДА и ИИ схожи и включают утомляемость, слабость, снижение сердечно-сосудистой деятельности и толерантности к физическим нагрузкам, а также нарушение способности к обучению и памяти. 49,50 Следует отметить, что неясно, в какой степени симптомы анемии вызваны гипоксией и пониженным напряжением кислорода в тканях, в отличие от дефицита железа, который ухудшает функцию митохондрий, клеточный метаболизм, активность ферментов и синтез нейротрансмиттеров. 11,51,52 Важные последствия дефицита клеточного железа подчеркиваются клиническими наблюдениями улучшения симптомов у женщин, получающих лечение от неанемического дефицита железа, 53 , а также интервенционными исследованиями у пациентов с застойной сердечной недостаточностью, которым вводили железо внутривенно. добавка обеспечивала сопоставимые преимущества у субъектов с ЖДА, даже без коррекции анемии. 7 Однако, в отличие от ЖДА, симптомы анемии при ИА часто связываются с основным заболеванием, что может быть одной из причин, по которой ИИ часто не лечится специально.
Анемия, определяемая концентрацией Hb <120 г / л для женщин и <130 г / л для мужчин, может быть диагностирована как AI или ACD на основании основных изменений гомеостаза железа, а также клинических или биохимических признаков воспаления; однако часто бывает необходимо исключить сопутствующие причины анемии, которые могут потребовать специальных вмешательств (таблица 2).Помимо оценки сопутствующего дефицита железа, как обсуждается ниже, лабораторные исследования могут включать функциональные тесты почек и печени, функциональные тесты щитовидной железы или маркеры гемолиза, а также определение концентраций фолиевой кислоты, кобаламина или витамина D. Витамин D является негативным регулятором экспрессии гепсидина. 54 Пожилые пациенты с различными причинами анемии часто страдают от дефицита витамина D, и анемию можно частично исправить с помощью добавок витамина D, который снижает уровень гепсидина. 54,55
Характерно, что AI представляет собой нормохромную и нормоцитарную анемию от легкой до умеренной, что четко отделяет его от гипохромной и микроцитарной ЖДА. 50 AI и IDA имеют общие пониженные концентрации циркулирующего железа и пониженный процент железа, связанного с трансферрином, известный как насыщение трансферрина, а также пониженное количество ретикулоцитов. Наиболее полезным дифференцирующим параметром является ферритин сыворотки.В то время как уровень ферритина <30 мкг / мл связан с абсолютным или истинным дефицитом железа, пациенты с AI имеют нормальный или повышенный уровень ферритина (> 100 мкг / л), в зависимости от основного состояния. 1 Ферритин сыворотки преимущественно секретируется макрофагами и гепатоцитами. 56,57 Высокие концентрации сывороточного ферритина в AI являются результатом повышенной секреции ферритина железо-удерживающими макрофагами, но также отражают, что ферритин является белком острой фазы, который индуцируется различными медиаторами воспаления. 5,56 Таким образом, при воспалительных заболеваниях ферритин в значительной степени теряет свою диагностическую ценность как индикатор запасов железа в организме. Циркулирующие концентрации трансферрина транспортного белка железа находятся на верхнем пределе нормы у субъектов с IDA, но снижаются у субъектов с AI, потому что на экспрессию трансферрина негативно влияют цитокины. 58 Таким образом, с этими параметрами можно диагностировать AI, 18 , как показано на рисунке 2.
Диагностическая задача при ИИ — это выявление пациентов с сопутствующим истинным дефицитом железа (пациенты с ИИ / ЖДА), поскольку им требуется специальная оценка источника кровопотери и стратегии лечения, нацеленные на железо. 1,59,60 Различный процент (20% -85%) пациентов с ИА также страдает истинным дефицитом железа, который в основном основан на сопутствующих или не связанных с заболеванием эпизодах желудочно-кишечного или урогенитального кровотечения, ятрогенном заборе крови или потери в связи с терапевтическими процедурами, такими как гемодиализ. 1,9,10,50,55,59,61-65 Дети с AI и хроническими воспалительными заболеваниями подвергаются особому риску сосуществования истинного дефицита железа, потому что их рост и увеличение массы эритроцитов требуют дополнительного железа.
Хотя можно было бы ожидать, что субъекты с ИИ / ЖДА могут стать микроцитарными и гипохромными, этот образец гораздо менее выражен в ИИ / ЖДА, чем в ЖДА, а значительное совпадение между ИИ и ИИ / ЖДА делает дифференциальный диагноз сложным и неточным. 18,66 Несколько альтернативных клеточных маркеров, включая процент гипохромных эритроцитов, содержание Hb в ретикулоцитах, содержание Hb в эритроцитах и ширину распределения эритроцитов, отдельно или в сочетании с параметрами метаболизма железа, были изучены на предмет их определения. потенциал для выявления дефицита железа при воспалении. 58,59,65,66 Хотя некоторые из этих тестов оказались многообещающими, анализы во многом зависят от наличия соответствующих лабораторных инструментов и стандартизированных преаналитических процедур. Более того, большинство этих тестов никогда не изучались проспективно, чтобы оценить их истинный диагностический потенциал для дифференциации ИИ от ИИ / ЖДА, для прогнозирования ответа на выбранную терапию или в качестве индикаторов потенциального вреда (например, избыточное количество железа). 65,67 Даже растворимый рецептор трансферрина (sTfR), важный показатель потребности в железе для эритропоэза, осложняется воспалением, потому что несколько цитокинов влияют на уровни sTfR независимо от статуса железа. 68 Индекс ферритина, который рассчитывается по значениям sTfR / log ферритина, обеспечил лучшее различение между субъектами AI (<1) и AI / IDA (> 2), по общему признанию, с некоторым перекрытием и клинически значимой зоной неопределенности. 58,64,69 Основываясь на наших расширяющихся знаниях о патофизиологии AI, измерение гепсидина может в конечном итоге сыграть роль в оценке и лечении AI (Таблица 3). 19,61,70,71 Потенциальная полезность измерений гепсидина в этом контексте была основана на наблюдениях, показывающих, что, хотя уровни гепсидина повышены при AI, они значительно снижаются при наличии сопутствующего дефицита железа.Механизм можно проследить до индукции ингибирующих белков SMAD из-за дефицита железа, который снижает экспрессию гепсидина, вызванную воспалением, что позволяет предположить, что подавляющие эритропоэтические сигналы преобладают над индукцией гепсидина, вызванной воспалением. 72,73 Хотя сывороточный гепсидин может помочь дифференцировать AI и AI / IDA субъектов, 19 анализ гепсидина сам по себе не является окончательным (Таблица 3). Тем не менее, определение гепсидина является многообещающим диагностическим инструментом при использовании в сочетании с другими признанными тестами 16,19,71,74 или новыми новыми маркерами, такими как эритроферрон.Следует отметить, что уровни гепсидина могут прогнозировать ответ на терапию пероральным железом, и если лечение пероральным железом не было эффективным через 2 недели, показан переход на внутривенное введение железа 75 (Таблица 3). Различие между AI и AI / IDA также является важным соображением при ведении диализных пациентов; тем не менее, уровни гепсидина повышены у этих субъектов в результате нарушения почечной экскреции гепсидина и имеют ограниченную диагностическую ценность. 67 Таким образом, все еще существует потребность в легкодоступных и интерпретируемых биомаркерах, которые четко разграничивают пациентов с ACD и ACD / AI, а также помогают определить лучшую терапию и предсказать терапевтический ответ.
