Синдром аспирации мекония — Симптомы, диагностика и лечение
Определяется как респираторный дистресс новорожденного по причине наличия мекония в трахее.
Младенцы, которые пребывали в зараженных меконием околоплодных водах, подвергаются риску развития синдрома аспирации мекония, особенно при наличии факторов риска со стороны матери и плода.
Вскоре после рождения младенцы проявляют признаки респираторного дистресса (тахипноэ, западание грудной клетки, гипоксия). Некоторые не проявляют никаких симптомов и при рождении энергичны, однако несколькими часами позже проявляют признаки тяжелого респираторного дистресса. Признаки переношенности, сильного фактора риска, включают кожные покровы зеленого или желтого цвета, длинные пятнистые ногти, сухую шелушащуюся кожу.
Диагноз подтверждают во время проведения рентгенографии органов грудной клетки.
Ведение таких пациентов в основном симптоматическое. За младенцами следует пристально наблюдать для обеспечения должных оксигенации и вентиляции.
При наличии хронической легочной гипертензии могут потребоваться ингаляции оксида азота и экстракорпоральная мембранная оксигенация.
Синдром аспирации мекония (САМ) определяется как респираторный дистресс новорожденного по причине наличия мекония в трахее. Он проявляется только в самом скором неонатальном периоде.[1]Rossi EM, Philipson EH, Williams TG, et al. Meconium aspiration syndrome: intrapartum and neonatal attributes. Am J Obstet Gynecol. 1989 Nov;161(5):1106-10.
http://www.ncbi.nlm.nih.gov/pubmed/2589429?tool=bestpractice.com
Это также касается респираторного дистресса у новорожденных, которые пребывали в зараженных меконием околоплодных водах, который нельзя объяснить другими факторами.[2]Fanaroff AA. Meconium aspiration syndrome: historical aspects. J Perinatol. 2008 Dec;28(suppl 3):S3-7.
https://www.nature.com/articles/jp2008162
http://www.ncbi.nlm.nih.gov/pubmed/19057607?tool=bestpractice.com
Аспирация околоплодными водами
АСПИРАЦИЯ ОКОЛОПЛОДНЫМИ ВОДАМИ
Н. Ю. Карпов
Ю. Карпов
Дискуссия по поводу аспирации околоплодными водами не первый раз возникает в различных профессиональных сообществах. То, что данный диагноз имеет право на существование, закреплено в МКБ-10: Р24.1 – неонатальная аспирация амниотической жидкости и слизи (аспирация околоплодных вод).
Однако публикаций по данной проблеме весьма немного в сравнении с аспирацией меконием либо с аспирацией окрашенных меконием околоплодных вод. При поиске в нескольких электронных базах медицинской литературы удалось обнаружить только лишь единичные публикации относительно аспирации околоплодными водами, причем в подавляющем большинстве публикации представляют собой описание наблюдений в сочетании с мини-обзором литературы. Не улучшилась ситуация при исследовании пристатейных списков литературы в отобранных публикациях, а также после просмотра тезисов конференций/конгрессов.
Ниже представлены небольшие выдержки из отобранных публикаций за последние 35 – 45 лет в мировой литературе.
В 1971 году в журнале J Clin Path вышла статья, представляющая собой описание методологии патоморфологического исследования плода в перинатальном периоде [1].
В данной, опубликованной более 45 лет назад статье указывается, что при микроскопическом исследовании легких можно обнаружить большое количество компонентов амниотической жидкости в просвете альвеол, что свидетельствует о перенесенной внутриматочной асфиксии.
Немногим более 30 лет назад в отечественном журнале «Архив патологии» также была опубликован обзор, посвященный асфиксии плода и новорожденного [2]. В случае асфиксии новорожденного рекомендуется обратить внимание на определенный анатомический субстрат, ответственный за нарушение дыхания у новорожденного. В большинстве случаев данный анатомический субстрат представлен пневмопатией – невоспалительными изменениями легких новорожденного. В свою очередь пневмопатия новорожденных представляет собой сочетание глубокой аспирации околоплодных вод, ателектазов, отека, кровоизлияний и гиалиновых мембран.
Без малого, почти 30 лет назад, американские специалисты из Филадельфии [3] представили описание наблюдения внезапной и непрогнозируемой смерти ребенка в возрасте 26 часов жизни. У доношенного новорожденного отсутствовали какие-либо факторы риска, как пренатальные, так и характерные для раннего неонатального периода. Специалисты обратили внимание, что наиболее выраженные посмертные изменения, обнаруженные при аутопсии, были ограничены поражением легких: в легких при микроскопии были обнаружены обширные альвеолярные поля, заполненные аспирированными околоплодными водами, а также обширные очаги бронхопневмонии. При посмертном бактериологическом исследовании был выделен Citrobacter freundii. Из особенностей течения родов следует отметить: продолжительность безводного промежутка около 1 часа, общая продолжительность родов — около 20 часов; роды завершены операцией кесарева сечения по поводу клинически узкого таза; оценка по Апгар – 8/9 баллов. В возрасте 24 часов жизни ребенок был накормлен, а через 2 часа после кормления ребенок был обнаружен с остановкой кровообращения.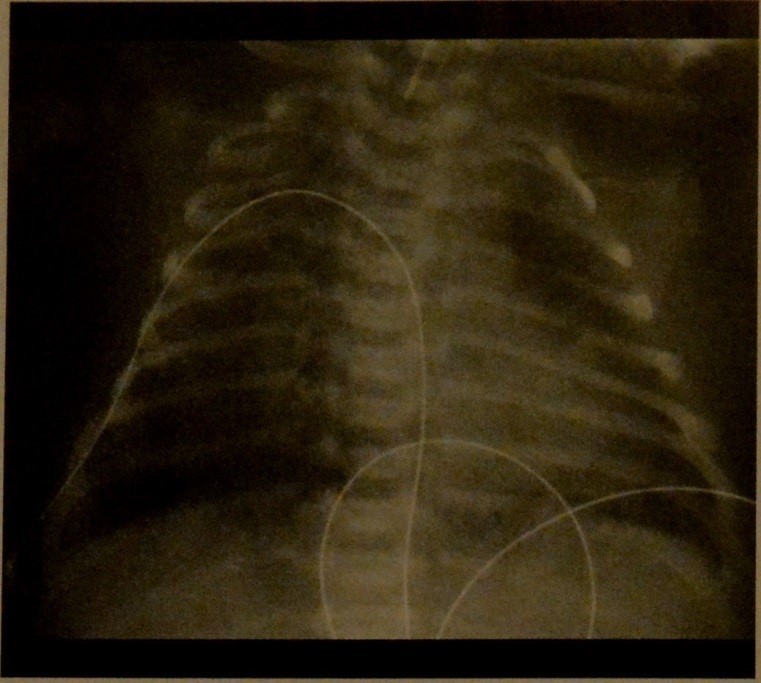 Реанимационные мероприятия оказались неэффективными. Авторы отмечают, что в подобных ситуациях у 25,9% при бактериологическом исследовании выявляется один либо два потенциальных возбудителя инфекционного процесса, а у 95% из них при гистологическом исследовании обнаруживаются проявления инфекционного процесса. Авторы отмечают, что к публикации данного клинического наблюдения их побудило выраженное несоответствие между практически полным отсутствием клинических симптомов и выраженностью поражения легочной ткани новорожденного. Тем не менее, основное внимание в публикации уделяется не аспирации околоплодных вод, а инфекционному процессу.
Реанимационные мероприятия оказались неэффективными. Авторы отмечают, что в подобных ситуациях у 25,9% при бактериологическом исследовании выявляется один либо два потенциальных возбудителя инфекционного процесса, а у 95% из них при гистологическом исследовании обнаруживаются проявления инфекционного процесса. Авторы отмечают, что к публикации данного клинического наблюдения их побудило выраженное несоответствие между практически полным отсутствием клинических симптомов и выраженностью поражения легочной ткани новорожденного. Тем не менее, основное внимание в публикации уделяется не аспирации околоплодных вод, а инфекционному процессу.
Более 20 лет назад японские специалисты опубликовали описание результатов аутопсии новорожденного с экстремально низкой массой тела, родившегося в плодных оболочках [4]. Плод женского пола, длиной 32 см, массой 662 грамма. Гибель плода произошла во время родов. Пуповина и плацента – без видимых повреждений. Не обнаружено также каких-либо очевидных признаков, свидетельствующих о наличии у плода заболеваний или врожденных аномалий развития. При проведении гидростатического теста ткани легкого тонули в воде. При гистологическом исследовании некоторая часть легочных альвеол была незначительно раскрыта, причем они были заполнены околоплодными водами. В результате иммуногистохимического исследования не обнаружено признаков продукции сурфактанта. Также не обнаружено признаков, свидетельствующих о живорождении.
При проведении гидростатического теста ткани легкого тонули в воде. При гистологическом исследовании некоторая часть легочных альвеол была незначительно раскрыта, причем они были заполнены околоплодными водами. В результате иммуногистохимического исследования не обнаружено признаков продукции сурфактанта. Также не обнаружено признаков, свидетельствующих о живорождении.
Описание наблюдения аспирации околоплодных вод более 15 лет назад было опубликовано специалистами из Австралии [5]. Авторы подчеркивают, что аспирация светлыми околоплодными водами с последующим развитием тяжелых дыхательных нарушений практически не описана должным образом. Далее в публикации приводится описание наблюдение развития тяжелых дыхательных нарушений непосредственно после рождения у доношенного новорожденного. Однако, диагноз аспирации околоплодными водами был подтвержден, к сожалению, на аутопсии.
В 2015 году специалисты из Чехии представили очередное наблюдение массивной аспирации околоплодными водами [6]. Под наблюдением специалистов находилась девочка в возрасте 15 дней жизни, страдающая врожденным буллезным эпидермолизом с вовлечением в патологический процесс 1/3 поверхности тела, умершая по причине неподдающегося терапии сепсиса, осложнившегося полиорганной недостаточностью. Специалисты решили опубликовать данное клиническое наблюдение по причине чрезвычайно необычных и выраженных изменений, обнаруженных в легких при аутопсии. При микроскопии было обнаружено огромное количество макрофагов с большим количеством внутрицитоплазматических вакуолей, присутствие которых объясняется массивной аспирацией околоплодных вод, с большим количеством слущенных клеток кожного эпителия. По мнению авторов, данное наблюдение заслуживает внимания по причине выраженного несоответствия между практически отсутствием специфичных клинических проявлений и массивным поражением легких, обнаруженных при гистологическом исследовании легких.
Под наблюдением специалистов находилась девочка в возрасте 15 дней жизни, страдающая врожденным буллезным эпидермолизом с вовлечением в патологический процесс 1/3 поверхности тела, умершая по причине неподдающегося терапии сепсиса, осложнившегося полиорганной недостаточностью. Специалисты решили опубликовать данное клиническое наблюдение по причине чрезвычайно необычных и выраженных изменений, обнаруженных в легких при аутопсии. При микроскопии было обнаружено огромное количество макрофагов с большим количеством внутрицитоплазматических вакуолей, присутствие которых объясняется массивной аспирацией околоплодных вод, с большим количеством слущенных клеток кожного эпителия. По мнению авторов, данное наблюдение заслуживает внимания по причине выраженного несоответствия между практически отсутствием специфичных клинических проявлений и массивным поражением легких, обнаруженных при гистологическом исследовании легких.
Таким образом, аспирация околоплодными водами, по-видимому, диагностируется существенно реже, чем встречается в действительности, что видно из представленных данных, где описаны единичные клинические наблюдения. В данной связи представляет интерес обобщенные данные китайских специалистов [7]. В течение 2004 – 2005 гг. проспективно собирались сведения о новорожденных с острыми дыхательными нарушениями в рамках Китайской неонатальной информационной сети. Наличие острых дыхательных нарушений устанавливалось на основании наличия клинических проявлений респираторного дистресса либо на основании наличия кислородной зависимости в течение первых трех дней жизни.
В данной связи представляет интерес обобщенные данные китайских специалистов [7]. В течение 2004 – 2005 гг. проспективно собирались сведения о новорожденных с острыми дыхательными нарушениями в рамках Китайской неонатальной информационной сети. Наличие острых дыхательных нарушений устанавливалось на основании наличия клинических проявлений респираторного дистресса либо на основании наличия кислородной зависимости в течение первых трех дней жизни.
Всего было зарегистрировано 2677 случаев острых дыхательных нарушений (20,5% от числа всех госпитализаций в отделение реанимации и интенсивной терапии новорожденных. В свою очередь из них респираторный дистресс-синдром зарегистрирован у 711 (5,44%) новорожденных, инфекции нижних дыхательных путей – 589 (4,51%), синдром мекониальной аспирации – 409 (3,13%), аспирация околоплодных вод — 658 (5,03%), транзиторное тахипноэ – 239 (1,83%). При этом частота применения искусственной вентиляции легких при данных нозологических формах составила, соответственно, 84,7%, 52,3%, 39,8%, 24,5% и 53,6%. Несмотря на то, что ИВЛ использовалась реже всего при аспирации околоплодными водами, она была применена у каждого четвертого ребенка с данной патологией. Смертность в зависимости от нозологических форм составила, соответственно, 31,4%, 13,6%, 17,8%, 4,1% и 5,0%. Таким образом, из числа новорожденных с аспирацией околоплодными водами погиб каждый 25-й ребенок или, в абсолютном количестве, 27 детей (!!!) в течение одного года, что достаточно значимо с клинической точки зрения. Тем не менее, в публикации не приводятся клинические, лабораторные и рентгенологические особенности аспирации околоплодными водами.
Несмотря на то, что ИВЛ использовалась реже всего при аспирации околоплодными водами, она была применена у каждого четвертого ребенка с данной патологией. Смертность в зависимости от нозологических форм составила, соответственно, 31,4%, 13,6%, 17,8%, 4,1% и 5,0%. Таким образом, из числа новорожденных с аспирацией околоплодными водами погиб каждый 25-й ребенок или, в абсолютном количестве, 27 детей (!!!) в течение одного года, что достаточно значимо с клинической точки зрения. Тем не менее, в публикации не приводятся клинические, лабораторные и рентгенологические особенности аспирации околоплодными водами.
Указанные выше наблюдения свидетельствуют о наличии несоответствия между тяжестью поражения, установленного при аутопсии, и клиническими проявлениями заболевания. В данной связи особого внимания заслуживает описание наблюдения, опубликованное итальянскими специалистами [8]. Под наблюдением специалистов находилась новорожденная девочка, с массой тела при рождении 3260 г, родившаяся через естественные родовые пути при сроке беременности 41 неделя. Беременность протекала без осложнений, роды также неосложненные. Признаков дистресса плода в родах не зарегистрировано. Плодные оболочки вскрылись за несколько минут до рождения плода. Околоплодные воды светлые, чистые. За 4 недели до родов выполнен бактериологический скрининг на предмет колонизации родовых путей стрептококками группы В. Результат скринингового обследования – отрицательный. Оценка по Апгар при рождении 9/10 баллов. В течение первого часа жизни ребенка отмечено развития выраженных дыхательных нарушений, проявляющихся цианозом, одышкой, появились хрипы и втяжение/западение грудины или межреберных промежутков, причем указанные симптомы быстро нарастали в течение последующих часов. Проводилась периодическая санация верхних дыхательных путей вследствие повышенной секреции. Дыхательная поддержка начата с назального СРАР’а и кислородотерапии. Поставлена венозная пупочная линия и начата инфузионная и антибактериальная терапия. При рентгенологическом исследовании выявлены неоднородные тени в проекции обоих легких, на основании чего был установлен диагноз аспирации околоплодными водами.
Беременность протекала без осложнений, роды также неосложненные. Признаков дистресса плода в родах не зарегистрировано. Плодные оболочки вскрылись за несколько минут до рождения плода. Околоплодные воды светлые, чистые. За 4 недели до родов выполнен бактериологический скрининг на предмет колонизации родовых путей стрептококками группы В. Результат скринингового обследования – отрицательный. Оценка по Апгар при рождении 9/10 баллов. В течение первого часа жизни ребенка отмечено развития выраженных дыхательных нарушений, проявляющихся цианозом, одышкой, появились хрипы и втяжение/западение грудины или межреберных промежутков, причем указанные симптомы быстро нарастали в течение последующих часов. Проводилась периодическая санация верхних дыхательных путей вследствие повышенной секреции. Дыхательная поддержка начата с назального СРАР’а и кислородотерапии. Поставлена венозная пупочная линия и начата инфузионная и антибактериальная терапия. При рентгенологическом исследовании выявлены неоднородные тени в проекции обоих легких, на основании чего был установлен диагноз аспирации околоплодными водами.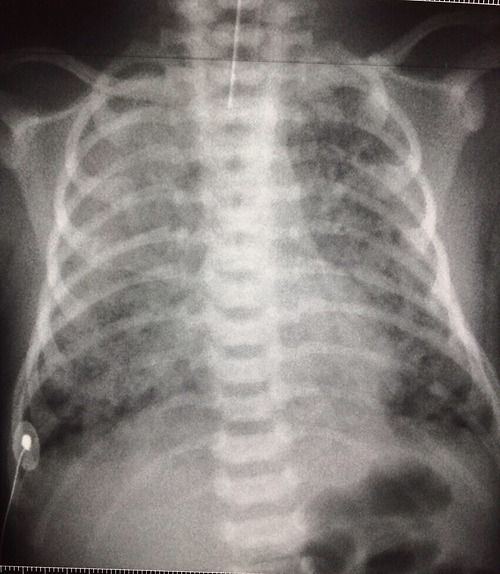 При исследовании газов крови выявлен ацидоз в сочетании с гиперкапнией. Несмотря на высокую потребность в кислороде изначально – до 50%, на фоне быстрого улучшения состояния в возрасте 30 часов жизни кислород был полностью заменен на атмосферный воздух. При повторном рентгенологическом исследовании через 48 часов изменений не обнаружено.
При исследовании газов крови выявлен ацидоз в сочетании с гиперкапнией. Несмотря на высокую потребность в кислороде изначально – до 50%, на фоне быстрого улучшения состояния в возрасте 30 часов жизни кислород был полностью заменен на атмосферный воздух. При повторном рентгенологическом исследовании через 48 часов изменений не обнаружено.
Авторы пришли к заключению, что аспирация светлых околоплодных вод, либо вод контаминированных чем-либо, кроме мекония, является причиной развития дыхательных нарушений. В описанном наблюдении на основании клинических и рентгенологических данных было исключено наличие врожденной пневмонии. Быстрое клиническое улучшение состояния, быстрая нормализация рентгенологической картины не характерны для врожденной/внутриутробной пневмонии. Кроме того, картина белой крови изначально была нормальной, а результат исследования крови на стерильность – отрицательный. Авторы подчеркивают, что аспирацию околоплодными водами чрезвычайно трудно изначально дифференцировать с пневмонией. Кроме того, околоплодные воды могут содержать микроорганизмы, что оправдывает назначение антибиотиков у детей с подозрением на аспирацию околоплодными водами.
Кроме того, околоплодные воды могут содержать микроорганизмы, что оправдывает назначение антибиотиков у детей с подозрением на аспирацию околоплодными водами.
Диагноз транзиторного тахипноэ обычно устанавливается ретроспективно. Как правило, такие дети рождены путем кесарева сечения. Из клинических симптомов не характерно наличие западения/втяжения грудины или межреберных промежутков. Концентрация кислорода при наличии потребности в нем не превышает 40%. Рентгенологическая картина характеризуется гипервентиляцией легких, за счет чего периферические сосуды выглядят более контрастированными, отмечается отек по ходу междолевых перегородок и скопление жидкости между листками междолевой плевры.
При синдроме мекониальной аспирации, как указывают авторы, рентгенологическая картина и ее динамика могут быть аналогичными таковым при аспирации околоплодными водами, однако, динамика клинических симптомов существенно различается. Причина аспирации – наличие выраженной асфиксии, в результате которой плод начинает совершать дыхательные движения.
Подводя некоторые итоги, аспирация околоплодными водами регистрируется сравнительно редко, что, возможно, связано с отсутствием каких-либо специфичных клинических проявлений данного состояния. Исключение составляют обобщенные сведения, опубликованные китайскими специалистами из различных медицинских центров [7]. Причиной возникновения аспирации околоплодными водами является гипоксия плода и/или новорожденного. Как правило, имеет место диссоциация между тяжестью поражения и выраженностью клинических и рентгенологических симптомов, однако, как следует из последней публикации [8], проявления аспирации околоплодными водами могут быть достаточно выраженными.
Так как диагноз аспирации околоплодными водами устанавливался, как правило, только на основании результатов аутопсии, резонно ожидать, что определенная информация по данной проблеме может содержаться в специальной в судебно-медицинской медицинской литературе. С учетом того, что при проведении судебно-медицинского исследования оцениваются обстоятельства смерти, то существует вероятность присутствия в таких публикациях описаний особенностей клинической картины.
1. Langley F.A. The perinatal postmortem examination. J Clin Path, 1971, 24:159-169.
2. Ивановская Т.Е. Асфиксия плода и новорожденного. Архив патологии. 1976, 38(6):3-10.
3. Imaizumi S.O., Balsara G.R. Sudden unexpected death in a neonate. Am J Perinatol, 1989, 6(3):281-283.
4. Zhu B.L., Nagai K., Imura M., Maeda H. An autopsy case of extremely immature newborn covered with fetal membrane. Nihon Hoigaku Zasshi, 1996, 50(4):272-275.
5. Bolisetty S., Patole S.K., McBride G.A., Whitehall J.S. Neonatal amniotic fluid aspiration syndrome underdiagnosed? Int J Clin Pract, 2001, 55(10): 727-728.
6. Farkaš D., Švajdler Ml.M., Frӧhlichová L., Šprláková J., Iannaccone S.F., Szép Z., Nyitrayová O. Neobvyklý pľúcny nález masívneho vyplnenia alveolov penovitými makrofágmi pri kongenitálnej epidermolysis bullosa po aspirácii súčastí plodovej vody u novorodenca prežívajúceho 15 dní bez akýchkoľvek príznakov poškodenia dýchacích funkcií. Čes-slov Patol, 2015, 51(2):89-93.
Čes-slov Patol, 2015, 51(2):89-93.
7. Qian L.L., Liu C.Q., Guo Y.X., Jiang Y.J., Ni L.M. et al. Current status of neonatal acute respiratory disorders: a one-year prospective survey from Chinese neonatal network. Clin Med J, 2010, 123(20):2769-2775.
8. De Cunto A., Paviotti G., Demarini S. Neonatal aspiration: Not just meconium. J Neonatal Perinatal Med, 2013, 6:355-357.
Вернуться к списку статей
Синдром аспирации мекония — Meconium aspiration syndrome
Состояние здоровья новорожденных
| Синдром аспирации мекония | |
|---|---|
| Другие названия | Неонатальная аспирация мекония |
| Рентгеновский снимок, показывающий степень повреждения эпителия легких в ответ на меконий у новорожденных с синдромом аспирации мекония. | |
| Специальность | Неонатология |
Синдром аспирации мекония ( MAS ), также известный как неонатальная аспирация мекония, представляет собой заболевание, поражающее новорожденных. Он описывает спектр заболеваний и патофизиологию новорожденных, рожденных в околоплодных водах, окрашенных меконием (MSAF) и имеющих меконий в легких. Таким образом, MAS имеет широкий диапазон степени тяжести в зависимости от того, какие состояния и осложнения развиваются после родов. Более того, патофизиология MAS многофакторна и чрезвычайно сложна, поэтому она является ведущей причиной заболеваемости и смертности доношенных детей.
Он описывает спектр заболеваний и патофизиологию новорожденных, рожденных в околоплодных водах, окрашенных меконием (MSAF) и имеющих меконий в легких. Таким образом, MAS имеет широкий диапазон степени тяжести в зависимости от того, какие состояния и осложнения развиваются после родов. Более того, патофизиология MAS многофакторна и чрезвычайно сложна, поэтому она является ведущей причиной заболеваемости и смертности доношенных детей.
Слово меконий происходит от греческого слова mēkōnion, означающего сок из опийного мака, поскольку успокаивающее действие, которое он оказывал на плод, наблюдал Аристотель .
Меконий представляет собой липкое темно-зеленое вещество, которое содержит желудочно-кишечные выделения, околоплодные воды , желчные кислоты , желчь , кровь, слизь , холестерин , выделения поджелудочной железы, лануго , верникса казеозу и клеточный мусор. Меконий накапливается в желудочно-кишечном тракте плода в течение третьего триместра беременности, и это первые выделения из кишечника в течение первых 48 часов после рождения. Примечательно, что поскольку меконий и все содержимое желудочно-кишечного тракта расположены «экстракорпорально», его составляющие скрыты и обычно не распознаются иммунной системой плода.
Примечательно, что поскольку меконий и все содержимое желудочно-кишечного тракта расположены «экстракорпорально», его составляющие скрыты и обычно не распознаются иммунной системой плода.
Чтобы меконий в околоплодных водах мог успешно вызвать МАС, он должен попасть в дыхательную систему в период, когда заполненные жидкостью легкие превращаются в наполненный воздухом орган, способный к газообмену .
Причины
Основные теории прохождения мекония в околоплодные воды вызваны зрелостью плода или стрессом плода в результате гипоксии или инфекции. К другим факторам, способствующим прохождению мекония в утробе матери, относятся плацентарная недостаточность, гипертония у матери, преэклампсия и употребление табака и кокаина матерью . Однако точный механизм перехода мекония в амниотическую жидкость до конца не изучен, и это может быть комбинация нескольких факторов.
Переход мекония в результате дистресса плода
Может быть важная связь между дистрессом плода и гипоксией с MSAF. Считается, что дистресс плода перерастает в гипоксию плода, заставляя плод испражняться меконием, что приводит к MSAF, а затем, возможно, к MAS. К другим факторам стресса, вызывающим дистресс плода и, следовательно, переход мекония, относятся случаи, когда насыщение кислородом пупочной вены ниже 30%.
Считается, что дистресс плода перерастает в гипоксию плода, заставляя плод испражняться меконием, что приводит к MSAF, а затем, возможно, к MAS. К другим факторам стресса, вызывающим дистресс плода и, следовательно, переход мекония, относятся случаи, когда насыщение кислородом пупочной вены ниже 30%.
Гипоксический стресс плода во время родов может стимулировать деятельность толстой кишки за счет усиления перистальтики кишечника и расслабления анального сфинктера, что приводит к прохождению мекония. Затем из-за внутриматочного вдоха или из-за первых нескольких вдохов после родов может развиться МАС. Кроме того, аспирация густого мекония приводит к обструкции дыхательных путей, что приводит к более тяжелой гипоксии .
Важно отметить, что связь между патологическим состоянием плода и пассажем мекония не является определенной причинно-следственной связью, поскольку более четверти детей с MSAF активны при рождении и не имеют дистресса или гипоксии. Кроме того, дистресс плода часто возникает без прохождения мекония.
Переход мекония в результате зрелости плода
Хотя меконий присутствует в желудочно-кишечном тракте на ранней стадии развития, MSAF редко возникает до 34 недель беременности .
Перистальтика кишечника плода присутствует уже на 8 неделе беременности, а анальный сфинктер развивается примерно на 20–22 неделе. Ранние механизмы контроля анального сфинктера изучены недостаточно, однако есть свидетельства того, что плод регулярно испражняется в амниотическую полость даже при отсутствии дистресса. Присутствие кишечных ферментов плода было обнаружено в околоплодных водах у женщин на сроке беременности 14–22 недели. Таким образом, предполагается, что кишечное содержимое свободно попадает в амниотическую жидкость.
Мотилин обнаруживается в более высоких концентрациях в желудочно-кишечном тракте плода после родов по сравнению с недоношенными. Точно так же кишечная парасимпатическая иннервация и миелинизация также усиливаются на более поздних сроках беременности. Следовательно, повышенная частота MAS при переношенных беременностях может отражать созревание и развитие перистальтики желудочно-кишечного тракта у новорожденного.
Следовательно, повышенная частота MAS при переношенных беременностях может отражать созревание и развитие перистальтики желудочно-кишечного тракта у новорожденного.
Патофизиология
Поскольку MAS описывает спектр заболеваний у новорожденных, рожденных через MSAF, без каких-либо врожденных респираторных нарушений или другой основной патологии, существует множество предполагаемых механизмов и причин возникновения этого синдрома. Эти расстройства могут иметь долгосрочные последствия, например, у младенцев, у которых развивается MAS, более высокая частота развития дефектов развития нервной системы из-за плохого дыхания.
Обструкция дыхательных путей
В первые 15 минут аспирации мекония наблюдается обструкция более крупных дыхательных путей, которая вызывает повышенное сопротивление легких, снижение эластичности легких , острую гипоксемию , гиперкапнию , ателектаз и респираторный ацидоз . После 60 минут воздействия меконий попадает в более мелкие дыхательные пути. Попадая в конечные бронхиолы и альвеолы, меконий вызывает воспаление, отек легких , вазоконстрикцию , бронхоспазм , коллапс дыхательных путей и инактивацию сурфактанта .
Попадая в конечные бронхиолы и альвеолы, меконий вызывает воспаление, отек легких , вазоконстрикцию , бронхоспазм , коллапс дыхательных путей и инактивацию сурфактанта .
Гипоксия плода
Области легких, которые не участвуют или участвуют лишь частично в вентиляции из-за обструкции и / или разрушения, станут гипоксичными, что может привести к воспалительной реакции. Частичная обструкция приведет к скоплению воздуха и гиперинфляции определенных участков легких, что может привести к пневмотораксу . Хроническая гипоксия приводит к повышению тонуса гладких мышц легочных сосудов и стойкой легочной гипертензии, вызывая нарушение дыхания и кровообращения.
Инфекционное заболевание
Микроорганизмы, чаще всего грамотрицательные палочки, и эндотоксины обнаруживаются в образцах MSAF чаще, чем в прозрачных околоплодных водах, например, у 46,9% пациентов с MSAF также присутствовали эндотоксины. Микробная инвазия в амниотическую полость (MIAC) чаще встречается у пациентов с MSAF, что в конечном итоге может привести к внутриамниотической воспалительной реакции. MIAC связан с высокими концентрациями цитокинов (таких как IL-6 ), хемокинов (таких как IL-8 и хемоаттрактантный белок-1 моноцитов ), комплемента , фосфолипазы A 2 и ферментов, разрушающих матрикс. Следовательно, эти вышеупомянутые медиаторы в околоплодных водах во время MIAC и внутриамниотической инфекции могут при аспирации в утробе матери вызвать воспаление легких у плода.
MIAC связан с высокими концентрациями цитокинов (таких как IL-6 ), хемокинов (таких как IL-8 и хемоаттрактантный белок-1 моноцитов ), комплемента , фосфолипазы A 2 и ферментов, разрушающих матрикс. Следовательно, эти вышеупомянутые медиаторы в околоплодных водах во время MIAC и внутриамниотической инфекции могут при аспирации в утробе матери вызвать воспаление легких у плода.
Легочное воспаление
Меконий имеет сложный химический состав, поэтому сложно выделить один агент, ответственный за несколько возникающих заболеваний. Поскольку меконий хранится внутри кишечника и частично не подвергается воздействию иммунной системы , при его аспирации врожденная иммунная система распознает чужеродное и опасное вещество. Иммунная система, которая присутствует при рождении, реагирует в течение нескольких минут с низкой специфичностью и без памяти, чтобы попытаться уничтожить микробы . Меконий, возможно, приводит к химическому пневмониту, поскольку он является мощным активатором медиаторов воспаления, которые включают цитокины , комплемент , простагландины и активные формы кислорода .
Меконий является источником провоспалительных цитокинов , в том числе фактора некроза опухоли (TNF) и интерлейкинов ( IL-1 , IL-6 , IL-8 ), а также медиаторов, продуцируемых нейтрофилами , макрофагами и эпителиальными клетками, которые могут напрямую поражать ткань легких. или косвенно. Например, протеолитические ферменты высвобождаются из нейтрофильных гранул, и они могут повредить легочную мембрану и сурфактантные белки. Кроме того, активированные лейкоциты и цитокины генерируют активные формы азота и кислорода, которые обладают цитотоксическим действием. Окислительный стресс приводит к сужению сосудов , бронхоспазму , агрегации тромбоцитов и ускоренному апоптозу клеток . Недавно была выдвинута гипотеза, что меконий является мощным активатором толл-подобных рецепторов (TLR) и комплемента , ключевых медиаторов воспаления, и, таким образом, может способствовать воспалительной реакции при MAS.
Меконий содержит большое количество фосфолипазы А 2 (PLA 2 ), мощного провоспалительного фермента, который может напрямую (или через стимуляцию арахидоновой кислоты ) приводить к дисфункции сурфактанта, разрушению эпителия легких, некрозу тканей и усилению апоптоза . Меконий также может активировать каскад коагуляции , выработку фактора активации тромбоцитов (PAF) и других вазоактивных веществ, что может привести к разрушению эндотелия капилляров и базальных мембран . Повреждение альвеолокапиллярной мембраны приводит к утечке жидкости, белков плазмы и клеток в интерстиций и альвеолярные пространства.
Меконий также может активировать каскад коагуляции , выработку фактора активации тромбоцитов (PAF) и других вазоактивных веществ, что может привести к разрушению эндотелия капилляров и базальных мембран . Повреждение альвеолокапиллярной мембраны приводит к утечке жидкости, белков плазмы и клеток в интерстиций и альвеолярные пространства.
Инактивация поверхностно-активного вещества
Поверхностно-активное вещество синтезируется альвеолярными клетками II типа и состоит из комплекса фосфолипидов , белков и сахаридов . Он действует для снижения поверхностного натяжения (для расширения легких во время вдоха ), стабилизации альвеол в конце выдоха (для предотвращения коллапса альвеол) и предотвращения отека легких . Поверхностно-активное вещество также способствует защите и защите легких, поскольку оно также является противовоспалительным агентом. Поверхностно-активное вещество способствует удалению вдыхаемых частиц и стареющих клеток из альвеолярной структуры.
Степень ингибирования поверхностно-активного вещества зависит как от концентрации поверхностно-активного вещества, так и от концентрации мекония. Если концентрация поверхностно-активного вещества низкая, даже очень сильно разбавленный меконий может ингибировать функцию поверхностно-активного вещества, тогда как при высоких концентрациях поверхностно-активного вещества действие мекония ограничено. Меконий может влиять на механизмы сурфактанта, предотвращая распространение сурфактанта по альвеолярной поверхности, уменьшая концентрацию сурфактантных белков ( SP-A и SP-B ), а также изменяя вязкость и структуру сурфактанта. После воздействия мекония происходит несколько морфологических изменений, наиболее заметными из которых являются отслоение эпителия дыхательных путей от стромы и выделение эпителиальных клеток в дыхательные пути. Это указывает на прямое пагубное воздействие на альвеолярные клетки легких из-за попадания мекония в легкие.
Стойкая легочная гипертензия
Стойкая легочная гипертензия (PPHN) — это неспособность кровообращения плода адаптироваться к внематочным условиям после рождения. PPHN ассоциируется с различными респираторными заболеваниями, включая MAS (поскольку у 15-20% младенцев с MAS развивается PPHN), а также с пневмонией и сепсисом . Сочетание гипоксии , легочной вазоконстрикции и несоответствия вентиляции / перфузии может вызвать PPHN в зависимости от концентрации мекония в дыхательных путях . PPHN у новорожденных является ведущей причиной смерти при МАС.
PPHN ассоциируется с различными респираторными заболеваниями, включая MAS (поскольку у 15-20% младенцев с MAS развивается PPHN), а также с пневмонией и сепсисом . Сочетание гипоксии , легочной вазоконстрикции и несоответствия вентиляции / перфузии может вызвать PPHN в зависимости от концентрации мекония в дыхательных путях . PPHN у новорожденных является ведущей причиной смерти при МАС.
Апоптоз
Апоптоз является важным механизмом очистки поврежденных клеток и восстановления тканей, однако слишком сильный апоптоз может нанести вред, например, острое повреждение легких. Меконий вызывает апоптоз и расщепление ДНК эпителиальных клеток дыхательных путей легких, что обнаруживается по присутствию фрагментированной ДНК в дыхательных путях и в ядрах альвеолярного эпителия. Меконий вызывает воспалительную реакцию в легких, поскольку после воздействия увеличивается количество аутофагоцитарных клеток и уровень каспазы 3 . После 8 часов воздействия мекония у плодов кроликов общее количество апоптотических клеток составляет 54%. Следовательно, большая часть повреждений легких, вызванных меконием, может быть вызвана апоптозом эпителия легких.
Следовательно, большая часть повреждений легких, вызванных меконием, может быть вызвана апоптозом эпителия легких.
Диагностика
Выброс мекония в амниотическую полость и затем внутриутробное дыхание у доношенных новорожденных может вызвать синдром аспирации мекония.
Дыхательной недостаточности у ребенка, родившегося в результате темного окраса MSAF, а также мекония, закупоривающего дыхательные пути, обычно достаточно для диагностики MAS. Кроме того, у новорожденных с МАС могут быть другие типы респираторного дистресса, такие как тахипноэ и гиперкапния . Иногда диагностировать МАС сложно, поскольку его можно спутать с другими заболеваниями, которые также вызывают респираторный дистресс, например, с пневмонией . Кроме того, рентген и УЗИ легких могут быть быстрыми, простыми и дешевыми методами визуализации для диагностики заболеваний легких, таких как MAS.
Профилактика
В целом, заболеваемость MAS значительно снизилась за последние два десятилетия, поскольку количество послеродовых родов сведено к минимуму. В настоящее время индуцируют роды у женщин, срок беременности которых превышает 41 неделю.
В настоящее время индуцируют роды у женщин, срок беременности которых превышает 41 неделю.
Профилактика при беременности
Профилактика во время беременности может включать амниоинфузию и антибиотики, но эффективность этих методов лечения сомнительна.
Профилактика во время родов
Как уже упоминалось ранее, отсасывание из ротоглотки и носоглотки не является идеальным профилактическим лечением как для энергичных, так и для детей с депрессией (не дышащих).
лечение
Большинство младенцев, рожденных в результате MSAF, не нуждаются в каком-либо лечении (кроме планового послеродового ухода), поскольку у них нет признаков респираторного дистресса, поскольку только примерно у 5% младенцев, рожденных в результате MSAF, развивается MAS. Тем не менее, младенцы, у которых действительно развивается МАС, должны быть помещены в неонатальное отделение, где за ними будут внимательно наблюдать и предоставлять любое необходимое лечение. Наблюдения включают мониторинг частоты сердечных сокращений , частоты дыхания , сатурации кислорода и уровня глюкозы в крови (для выявления ухудшения респираторного ацидоза или развития гипогликемии ). В целом, лечение МАС носит более поддерживающий характер.
Наблюдения включают мониторинг частоты сердечных сокращений , частоты дыхания , сатурации кислорода и уровня глюкозы в крови (для выявления ухудшения респираторного ацидоза или развития гипогликемии ). В целом, лечение МАС носит более поддерживающий характер.
Техники вспомогательной вентиляции легких
Чтобы очистить дыхательные пути от мекония, можно использовать аспирацию из трахеи, однако эффективность этого метода под вопросом, и он может нанести вред.
В случае MAS существует потребность в дополнительном кислороде в течение как минимум 12 часов, чтобы поддерживать кислородное насыщение гемоглобина на уровне 92% или более. Тяжесть респираторного дистресс-синдрома может значительно различаться у новорожденных с МАС, поскольку некоторым из них требуется минимальная потребность в дополнительном кислороде или вообще не требуется, а в тяжелых случаях может потребоваться искусственная вентиляция легких. Желаемое насыщение кислородом составляет от 90 до 95%, а PaO 2 может достигать 90 мм рт. В случаях, когда глубоко в легких находится густой меконий, может потребоваться искусственная вентиляция легких . В крайних случаях экстракорпоральная мембранная оксигенация (ЭКМО) может использоваться у младенцев, которые не реагируют на вентиляционную терапию. Находясь на ЭКМО, организм может успеть поглотить меконий и разрешить все связанные с этим расстройства. Это лечение было отличным ответом, поскольку выживаемость MAS при ЭКМО составляет более 94%.
В случаях, когда глубоко в легких находится густой меконий, может потребоваться искусственная вентиляция легких . В крайних случаях экстракорпоральная мембранная оксигенация (ЭКМО) может использоваться у младенцев, которые не реагируют на вентиляционную терапию. Находясь на ЭКМО, организм может успеть поглотить меконий и разрешить все связанные с этим расстройства. Это лечение было отличным ответом, поскольку выживаемость MAS при ЭКМО составляет более 94%.
Вентиляция младенцев с MAS может быть сложной задачей, и, поскольку MAS может влиять на каждого человека по-разному, может потребоваться индивидуальная процедура вентиляции. У некоторых новорожденных с MAS могут быть однородные изменения в легких, а у других — непостоянные и неоднородные изменения в легких. Обычно седативные препараты и миорелаксанты используются для оптимизации вентиляции и сведения к минимуму риска пневмоторакса, связанного с диссинхронным дыханием.
Вдыхаемый оксид азота
Вдыхаемый оксид азота (iNO) действует на гладкие мышцы сосудов, вызывая избирательное расширение сосудов легких . Это идеальный вариант для лечения ПРГН, поскольку вызывает расширение сосудов в вентилируемых областях легких, уменьшая несоответствие вентиляции и перфузии и тем самым улучшая оксигенацию. Лечение с использованием iNO снижает потребность в ЭКМО и снижает смертность новорожденных с гипоксической дыхательной недостаточностью и PPHN в результате MAS. Однако примерно 30-50% младенцев с PPHN не отвечают на терапию iNO.
Это идеальный вариант для лечения ПРГН, поскольку вызывает расширение сосудов в вентилируемых областях легких, уменьшая несоответствие вентиляции и перфузии и тем самым улучшая оксигенацию. Лечение с использованием iNO снижает потребность в ЭКМО и снижает смертность новорожденных с гипоксической дыхательной недостаточностью и PPHN в результате MAS. Однако примерно 30-50% младенцев с PPHN не отвечают на терапию iNO.
Противовоспалительные
Поскольку воспаление является такой серьезной проблемой при MAS, лечение состояло из противовоспалительных средств.
Глюкокортикоиды
Глюкокортикоиды (ГК) обладают сильной противовоспалительной активностью и снижают миграцию и активацию нейтрофилов , эозинофилов , мононуклеаров и других клеток. ГК уменьшают миграцию нейтрофилов в легкие ergo, уменьшая их прилипание к эндотелию . Таким образом, снижается действие медиаторов, высвобождаемых из этих клеток, и, следовательно, уменьшается воспалительная реакция.
ШС также обладают геномный механизм действия , в котором после того , как связанный с глюкокортикоидного рецептора , активированного комплекса перемещается в ядро и ингибирует транскрипцию в мРНК . В конечном итоге, влияет на то, будут ли производиться различные белки или нет. Подавление транскрипции ядерного фактора ( NF-κB ) и активатора белка ( AP-1 ) ослабляет экспрессию провоспалительных цитокинов ( IL-1 , IL-6 , IL-8 и TNF и т. Д.), Ферментов ( PLA 2 , ЦОГ-2 , iNOs и др.) И другие биологически активные вещества. Противовоспалительный эффект ГК также проявляется в усилении активности липокортинов, которые ингибируют активность PLA 2 и, следовательно, уменьшают продукцию арахидоновой кислоты и медиаторов липоксигеназного и циклооксигеназного путей.
Противовоспалительные средства необходимо вводить как можно быстрее, так как действие этих препаратов может ослабнуть даже через час после аспирации мекония. Например, раннее введение дексаметазона значительно усилило газообмен , снизило давление на дыхание, уменьшило количество нейтрофилов в бронхоальвеолярной области, уменьшило образование отека и окислительное повреждение легких. Однако ГК могут увеличивать риск инфекции, и этот риск увеличивается с увеличением дозы и продолжительность лечения глюкокортикоидами. Могут возникнуть и другие проблемы, такие как обострение сахарного диабета , остеопороз , атрофия кожи и задержка роста у детей.
Например, раннее введение дексаметазона значительно усилило газообмен , снизило давление на дыхание, уменьшило количество нейтрофилов в бронхоальвеолярной области, уменьшило образование отека и окислительное повреждение легких. Однако ГК могут увеличивать риск инфекции, и этот риск увеличивается с увеличением дозы и продолжительность лечения глюкокортикоидами. Могут возникнуть и другие проблемы, такие как обострение сахарного диабета , остеопороз , атрофия кожи и задержка роста у детей.
Ингибиторы фосфодиэстеразы
Фосфодиэстеразы (ФДЭ) расщепляют цАМФ и цГМФ, и в дыхательной системе новорожденного с МАС могут быть задействованы различные изоформы ФДЭ из-за их провоспалительной и сократительной активности гладких мышц . Следовательно, неселективные и селективные ингибиторы ФДЭ потенциально могут использоваться в терапии МАС. Однако использование ингибиторов ФДЭ может вызвать побочные эффекты со стороны сердечно-сосудистой системы . Неселективные ингибиторы ФДЭ, такие как метилксантины , увеличивают концентрацию цАМФ и цГМФ в клетках, что приводит к бронходилатации и расширению сосудов . Кроме того, метилксантины снижают концентрацию кальция, ацетилхолина и моноаминов , что контролирует высвобождение различных медиаторов воспаления и бронхоспазма , включая простагландины . Селективные ингибиторы PDE нацелены на один подтип фосфодиэстеразы, и в MAS активность PDE-3 , PDE-4 , PDE-5 и PDE-7 может усиливаться. Например, милринон (селективный ингибитор PDE3) улучшал оксигенацию и выживаемость новорожденных с MAS.
Неселективные ингибиторы ФДЭ, такие как метилксантины , увеличивают концентрацию цАМФ и цГМФ в клетках, что приводит к бронходилатации и расширению сосудов . Кроме того, метилксантины снижают концентрацию кальция, ацетилхолина и моноаминов , что контролирует высвобождение различных медиаторов воспаления и бронхоспазма , включая простагландины . Селективные ингибиторы PDE нацелены на один подтип фосфодиэстеразы, и в MAS активность PDE-3 , PDE-4 , PDE-5 и PDE-7 может усиливаться. Например, милринон (селективный ингибитор PDE3) улучшал оксигенацию и выживаемость новорожденных с MAS.
Ингибиторы циклооксигеназы
Арахидоновая кислота метаболизируется через циклооксигеназу (ЦОГ) и липоксигеназу до различных веществ, включая простагландины и лейкотриены , которые обладают сильным провоспалительным и вазоактивным действием. Путем ингибирования ЦОГ, а точнее ЦОГ-2 (с помощью селективных или неселективных лекарств) можно уменьшить воспаление и отек. Однако ингибиторы ЦОГ могут вызывать пептические язвы и вызывать гиперкалиемию и гипернатриемию . Кроме того, ингибиторы ЦОГ не показали значительного ответа при лечении МАС.
Однако ингибиторы ЦОГ могут вызывать пептические язвы и вызывать гиперкалиемию и гипернатриемию . Кроме того, ингибиторы ЦОГ не показали значительного ответа при лечении МАС.
Антибиотики
Меконий обычно стерилен, однако он может содержать различные культуры бактерий, поэтому может потребоваться назначение соответствующих антибиотиков.
Обработка поверхностно-активными веществами
Промывание легких разбавленным сурфактантом — это новое лечение, дающее потенциально положительные результаты в зависимости от того, как рано его вводить новорожденным с МАС. Это лечение является многообещающим, поскольку оно оказывает значительное влияние на утечки воздуха, пневмоторакс , необходимость в ЭКМО и смерть. Раннее вмешательство и его использование у новорожденных с легким MAS более эффективно. Однако есть риски, поскольку закапывание большого объема жидкости в легкие новорожденного может быть опасным (особенно в случаях тяжелого MAS с легочной гипертензией ), поскольку оно может усугубить гипоксию и привести к смерти.
Предыдущие процедуры
Первоначально считалось, что MAS возник в результате физической блокировки дыхательных путей меконием. Таким образом, для предотвращения развития МАС у новорожденных, рожденных с помощью MSAF, в течение 20 лет использовалось отсасывание ротоглотки и носоглотки перед родами с последующей аспирацией трахеи . Это лечение считалось эффективным, поскольку сообщалось, что оно значительно снижает частоту возникновения MAS по сравнению с новорожденными, рожденными через MSAF, которые не получали лечения. Позже это утверждение было опровергнуто, и будущие исследования пришли к выводу, что отсасывание через ротоглотку и носоглотку перед родоразрешением у младенцев, рожденных в результате MSAF, не предотвращает MAS или его осложнения. Фактически, это может вызвать больше проблем и повреждений (например, повреждение слизистой оболочки ), поэтому это не рекомендуемое профилактическое лечение. Отсасывание не может значительно снизить частоту возникновения MAS, поскольку пассаж мекония и аспирация могут происходить внутриутробно. Таким образом, отсасывание становится ненужным и бесполезным, поскольку меконий может находиться глубоко в легких во время рождения.
Таким образом, отсасывание становится ненужным и бесполезным, поскольку меконий может находиться глубоко в легких во время рождения.
Исторически сложился так , амниоинфузия была использована , когда MSAF присутствовал, которая включает в себя трансцервикальное вливание жидкости во время родов. Идея заключалась в том, чтобы разбавить густой меконий, чтобы уменьшить его потенциальную патофизиологию и уменьшить количество случаев MAS, поскольку MAS более распространен в случаях густого мекония. Однако существуют сопутствующие риски, такие как выпадение пуповины и удлинение родов. Руководящие принципы Национального института здоровья и клинической практики Великобритании (NICE) не рекомендуют использовать амниоинфузию у женщин с MSAF.
Распространенность
У 1 из каждых 7 беременностей есть MSAF, и из этих случаев примерно у 5% этих младенцев развивается MAS. MSAF наблюдается в 23-52% беременностей на сроке 42 недели, поэтому частота MAS увеличивается по мере увеличения срока беременности , так что распространенность наиболее высока при беременности после родов .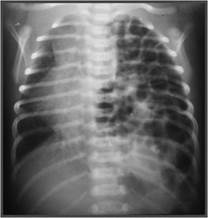 И наоборот, преждевременные роды не часто связаны с MSAF (только около 5% в общей сложности содержат MSAF). Частота MAS снижается в популяциях, в которых индуцируют роды у женщин, срок беременности которых превышает 41 неделю. Есть много предполагаемых факторов, предшествующих выбрасыванию, которые, как считается, увеличивают риск MAS. Например, риск MSAF выше у матерей афроамериканцев, африканцев и жителей островов Тихого океана по сравнению с матерями из других этнических групп.
И наоборот, преждевременные роды не часто связаны с MSAF (только около 5% в общей сложности содержат MSAF). Частота MAS снижается в популяциях, в которых индуцируют роды у женщин, срок беременности которых превышает 41 неделю. Есть много предполагаемых факторов, предшествующих выбрасыванию, которые, как считается, увеличивают риск MAS. Например, риск MSAF выше у матерей афроамериканцев, африканцев и жителей островов Тихого океана по сравнению с матерями из других этнических групп.
Будущие исследования
Исследования сосредоточены на разработке как успешного метода предотвращения MAS, так и эффективного лечения. Например, проводятся исследования эффективности противовоспалительных средств, заместительной терапии сурфактантами и терапии антибиотиками . Необходимо провести дополнительные исследования фармакологических свойств, например, глюкокортикоидов , включая дозировку, прием, время или любые взаимодействия с лекарствами. Кроме того, все еще проводятся исследования относительно того, является ли интубация и отсасывание мекония у новорожденных с MAS полезным, вредным или просто избыточным и устаревшим лечением. В целом до сих пор не существует общепринятого терапевтического протокола и эффективного плана лечения МАС.
В целом до сих пор не существует общепринятого терапевтического протокола и эффективного плана лечения МАС.
Смотрите также
Рекомендации
внешние ссылки
Аспирация мекония | Деткино
Вопрос неонатологу:Здравствуйте, я родила мальчика на 41 неделе. Во время беременности у нас было всё хорошо, результаты УЗИ отличные. На 39-ой неделе я легла в роддом, чтобы быть спокойной. Наступил срок 40 недель, начались схватки. 4 суток я проходила с ними, потом отошли воды. Но что-то пошло не так, воды стали зелеными и по данным КТГ стало видно, что малыш страдает. Мне сделали экстренное кесарево сечение, ребенок при рождении не закричал. Его доставили в реанимационное отделение, где он уже 6 дней лежит на искусственном дыхании с высокой концентрацией кислорода — позавчера 95%, вчера 60%, сегодня на 100%. Забито правое легкое, совсем не дышит. Насколько всё это серьёзно?? Есть ли какие шансы?!! (Ирина)
Ответ:
Уважаемая Ирина!
Все детки ещё в мамином животике делают дыхательные движения, но в норме голосовая щель закрыта, и околоплодные воды не попадают в лёгкие.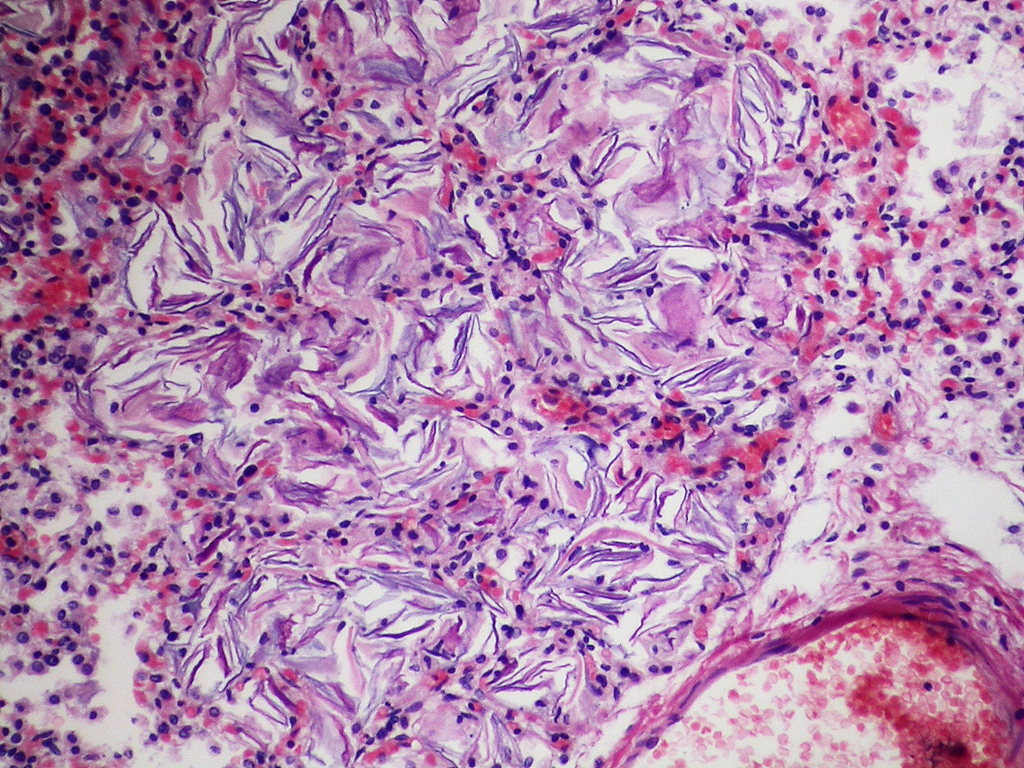 При развившейся и прогрессирующей гипоксии плода (гипоксия – кислородное голодание) голосовая щель открывается, вдохи становятся более глубокими, в результате чего околоплодные воды попадают в лёгкие. Это состояние называется «аспирация околоплодных вод», оно приводит к дыхательной недостаточности и требует лечения в виде респираторной поддержки (искусственная вентиляция лёгких). Если околоплодные воды были чистые, то стабилизация и улучшение состояния наступают довольно быстро. Однако в более тяжёлых случаях у ребёнка ещё внутриутробно отходит первородный кал (меконий), воды загрязняются (становятся зелёными, густыми) и при попадании в лёгкие развивается ещё более опасное состояние, называемое «синдром аспирации мекония».
При развившейся и прогрессирующей гипоксии плода (гипоксия – кислородное голодание) голосовая щель открывается, вдохи становятся более глубокими, в результате чего околоплодные воды попадают в лёгкие. Это состояние называется «аспирация околоплодных вод», оно приводит к дыхательной недостаточности и требует лечения в виде респираторной поддержки (искусственная вентиляция лёгких). Если околоплодные воды были чистые, то стабилизация и улучшение состояния наступают довольно быстро. Однако в более тяжёлых случаях у ребёнка ещё внутриутробно отходит первородный кал (меконий), воды загрязняются (становятся зелёными, густыми) и при попадании в лёгкие развивается ещё более опасное состояние, называемое «синдром аспирации мекония».
Аспирация околоплодных вод или мекония — опасное для жизни состояние, требующее интенсивного лечения, которое Ваш ребенок и получает в настоящее время в специализированном отделении, а именно в отделении реанимации новорожденных.
Несмотря на серьезность патологии, шансы на выздоровление, конечно же, есть. Вы не должны терять надежды, Ваша поддержка очень важна для малыша. Ежедневно посещайте своего ребеночка, беседуйте с лечащим врачом, будьте в курсе всех изменений в состоянии, надейтесь и верьте в положительный исход.
Вы не должны терять надежды, Ваша поддержка очень важна для малыша. Ежедневно посещайте своего ребеночка, беседуйте с лечащим врачом, будьте в курсе всех изменений в состоянии, надейтесь и верьте в положительный исход.
На фоне лечения в подавляющем большинстве случаев происходит стабилизация и улучшение состояния малыша. Дальнейший прогноз для жизни и развития малыша зависит от наличия сопутствующей патологии и степени перенесённого кислородного голодания.
Здоровья Вам и Вашему ребенку!
С уважением, неонатолог
Семёнова Екатерина Олеговна.
Синдром аспирации мекония
Синдром аспирации мекония (САМ) — тяжелое расстройство дыхания у детей вследствие попадания мекония в нижние дыхательные пути.
Меконий — первородный кал, темно-зеленоватая субстанция, заполняющая толстый кишечник. В состав мекония входят: гликопротеин, в частности сиаломукополисахарид, секрет желудочно-кишечного тракта, вода, билирубин, желчные пигменты, околоплодные воды и переваренный эпителий с волосами.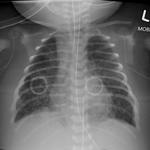
Частота встречаемости синдрома аспирации мекония варьируется в пределах 2–3 %, в то время как окрашивание меконием околоплодных вод наблюдается у 9–15 % рожениц. При переношенной беременности частота встречаемости мекония в околоплодных водах составляет 20–30 %. На долю обнаружения мекония в околоплодных водах при недоношенной беременности приходится всего 2–4 %.
Для оценки мекония используется специальная шкала: критериями является консистенция и цвет.
Оценка мекония по шкале в 2Б–3В является прогностически неблагоприятным исходом, поскольку повышается риск САМ и нарушения мозгового кровообращения вследствие гипоксии.
Пассаж мекония в околоплодные воды как правило происходит на 37 неделе, однако в литературе описаны случаи пассажа до 34 недели. Частота встречаемости напрямую коррелирует с гестационным возрастом, это обусловлено миелинизацией нервных волокон, повышением парасимпатического тонуса и увеличением концентрации мотилина, который напрямую влияет на перистальтику кишечника. Также на пассаж мекония оказывает влияние вес плода более 3500 г, при массе плода менее 2000 г выделение мекония не характерно.
Также на пассаж мекония оказывает влияние вес плода более 3500 г, при массе плода менее 2000 г выделение мекония не характерно.
Не существует единой патогенетической теории пассажа мекония, некоторые авторы, например J. Neu, придерживаются мнения, что отхождение мекония абсолютно физиологический процесс, который свидетельствует о зрелости желудочно-кишечного тракта. В исследованиях F. C. Miller был проведен анализ гипоксии при наличии светлых амниотических вод и отсутствия примесей мекония. Плод оказывает влияние на обмен околоплодных вод за счет мочевыделения, секреции дыхательной системы и заглатывания амниотической жидкости.
Некоторые авторы связывают пассаж мекония с активацией вагуса при периодическом давлении пуповины. Ряд исследователей придерживаются мнения о влиянии перерастяжения кишечника на отхождение мекония.
При асфиксии запускается следующий каскад реакций: в результате спазма сосудов брыжейки происходит усиление перистальтики кишечника, что в свою очередь ведет к расслаблению анального сфинктера и дальнейшему выделению мекония.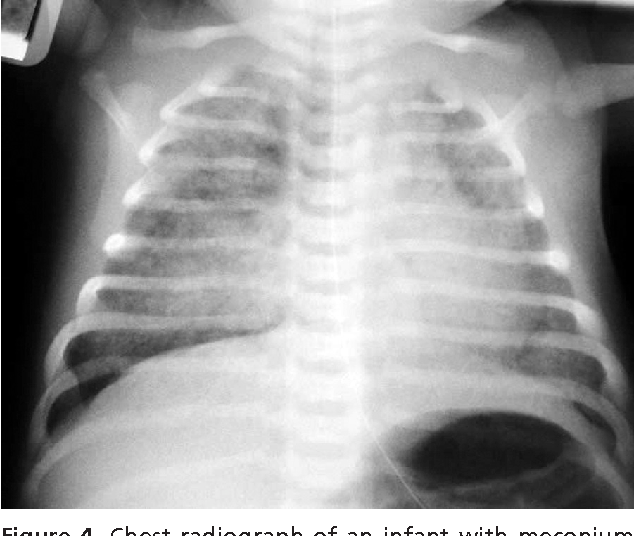 В то же время обвитие пуповины вокруг шеи приводит к активации вагуса и усилению пассажа мекония при отсутствии асфиксии.
В то же время обвитие пуповины вокруг шеи приводит к активации вагуса и усилению пассажа мекония при отсутствии асфиксии.
К факторам риска САМ относят: экстрагенитальная патология и осложнения гестационного периода, которые приводят к фетоплацентарной недостаточности, перенашивание беременности более 40 недель, запоздалые роды, аномалии родовой деятельности, длительное течение родов у женщин с хронической гипоксией плода, крупный плод, нерациональное применение утеротонических средств.
Основным инициирующим звеном патогенеза САМ является внутриутробное проникновение мекониальных вод в дыхательные пути ниже голосовой щели. Внутриутробно дыхательные пути плода заполнены жидкостью, которая участвует в образовании амниотической жидкости. При этом плод производит дыхательные движения ДД, при закрытой голосовой щели, которая препятствует попаданию амниотической жидкости в легкие. За счет открывающегося сфинктерного механизма, происходит заглатывание легочной жидкости.
Внутриутробное дыхание плода имеет ряд особенностей: во-первых, отсутствие силы поверхностного натяжения, во-вторых, отсутствие газообмена в легких, в-третьих, за счет горизонтального расположение ребер у плода грудная клетка постоянно находится в состоянии вдоха, а также высокое стояние диафрагмы ограничивает экскурсионные движения грудной клетки..jpg)
Изменение характера дыхательной деятельности плода является одним из ранних маркеров, свидетельствующих о нарушении состояния плода. Острая гипоксия сопровождается уменьшением глубины вдохов и возникновением одышки.
Повышение внутриматочного давления за счет усиления родовой деятельности провоцирует у плода рефлекс ныряния, как при погружении человека под воду, за счет перераспределения кровотока и замедления сердечных сокращений, проявляющееся децелерациями 1 типа. При этом рефлекторная деятельность ЦНС подавляется, в результате формируются децелерации 2 типа.
В результате выраженной хронической антенатальной гипоксии начало родовой деятельности ведет к повышению внутриматочного давления, что в совокупности с отрицательным давлением в плевральной полости при открытой голосовой щели формирует условия для проникновения мекониальных вод в дыхательные пути плода.
Одно из последствий синдрома аспирации мекония — ранняя механическая закупорка дыхательных путей, которая через 48 часов формирует химический пневмонит.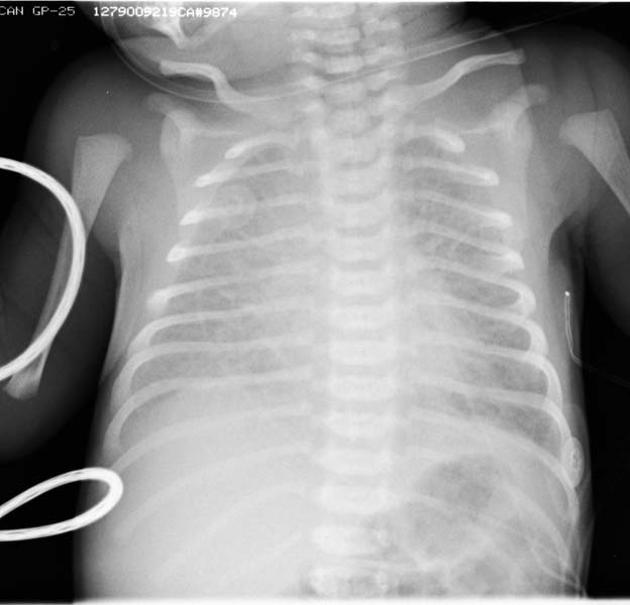 Более грозным осложнением является полная закупорка дыхательный путей, способствующее формированию субсегментарных ателектазов. Это приводит к снижению вентиляционно-перфузионных соотношений, в результате снижается диффузионная способность легких при нарастающем сопротивлении легочных путей. Результатом усиленного дыхания и неравномерной вентиляции служат разрывы альвеол, который будут дополнительно провоцировать утечку воздуха из легких.
Более грозным осложнением является полная закупорка дыхательный путей, способствующее формированию субсегментарных ателектазов. Это приводит к снижению вентиляционно-перфузионных соотношений, в результате снижается диффузионная способность легких при нарастающем сопротивлении легочных путей. Результатом усиленного дыхания и неравномерной вентиляции служат разрывы альвеол, который будут дополнительно провоцировать утечку воздуха из легких.
Профилактикой САМ является тщательный мониторинг женщин, входящих в группу риска, особенно в III семестре, в который входит функциональная оценка состояния плода, включающая в себя оценку реактивности сердечно-сосудистой системы, двигательной активности, частоты и типа ДД и оценку мышечного тонуса.
Источники:
- Yeh T. F. Meconium Aspiration Syndrome: The Core Concept of Pathophysiology during Resuscitation //Neonatal Medicine. – 2017. – Т. 24. – №. 2. – С. 53-61.
- Chettri S., Bhat B. V., Adhisivam B.
 Current concepts in the management of meconium aspiration syndrome //The Indian Journal of Pediatrics. – 2016. – Т. 83. – №. 10. – С. 1125-1130.
Current concepts in the management of meconium aspiration syndrome //The Indian Journal of Pediatrics. – 2016. – Т. 83. – №. 10. – С. 1125-1130. - Lee J. H. et al. Meconium aspiration syndrome: a role for fetal systemic inflammation //American journal of obstetrics and gynecology. – 2016. – Т. 214. – №. 3. – С. 366. e1-366. e9.
- Oliveira C. P. L. et al. Meconium aspiration syndrome: risk factors and predictors of severity //The Journal of Maternal-Fetal & Neonatal Medicine. – 2019. – Т. 32. – №. 9. – С. 1492-1498.
- Lindenskov P. H. H. et al. Meconium aspiration syndrome: possible pathophysiological mechanisms and future potential therapies //Neonatology. – 2015. – Т. 107. – №. 3. – С. 225-230.
Глава IX. Аспирация мекония, профилактика и лечение
Аспирация амниотической жидкости
Во время родов
возможна аспирация чистой и содержащей
микроорганизмы (даже гной) и кровь
амниотической жидкости. Если
Если
жидкость гнойная, то для предупреждения
пневмонии вводятся антибиотики.
Аспирация мекоиия
Отхождение мекония
при головных предлежаниях издавна
привлекало внимание акушеров. Однако
до настоящего времени
к
окончательно не установлена роль мекония
как признака страдания плода; полностью
не выяснены причины и
механизм
‘его отхождения, а также значение времени
отхождения меко-|s
ния
на исход родов.
Частота
отхождения мекония колеблется от 4,5 до
20% и в среднем составляет 10% родов с
головным предлежанием I
плода
даже при оптимальном ведении беременной.
Расхождения в частоте обнаружения
мекония объясняется различным контингентом
обследуемых беременных и рожениц.
Ряд
авторов указывают, что наличие мекония
в околоплодных водах не свидетельствует
о гипоксии как в момент исследования,
так и не устанавливает срока развития
ее, в связи с чем может служить абсолютным
критерием оценки состояния плода в
родах. реакцией кишечника плода
реакцией кишечника плода
на какие-то раздражения, которые Кмогли
иметь место задолго до исследования)
Гармашева Н. Л., | Константинова Н. Н.,
1978; Abramovich,
Gray, 1982).
Л. С.
Персианинов и соавт. (1973), А. С. Лявинец
(1982), |Е. Saling
(1965),
Miller,
Sacks (1975)
считают, что отхождение |мекония указывает
на угрожающее состояние плода.
Большинство
исследователей свидетельствуют, что
при наличии мекония в околоплодных
водах увеличивается частота I
гипоксии
плода, повышается перинатальная
смертность и забо-|леваемость новорожденных.
По данным М. В.
Федоровой (1982), в случаях, когда
околоплодная жидкость прозрачна в
момент начала родов, перинатальная
смертность низка, а при окрашенных
меконием показатель ее возрастает
до 6%.
При наличии мекония
в околоплодных водах тяжелым осложнением
периода новорожденности является
синдром аспирации мекония, ведущий
к высокой смертности новорожденных.
Однако
только у 50% новорожденных, у которых при
родах амниотическая жидкость была
окрашена меконием, он обнаруживался,
первичный кал содержался в трахее; в
последней группе, если принимались
меры, дыхательные нарушения (респираторный
дистресс) развились в 1/3 случаев. Таким
образом, Передняя частота симптоматического
синдрома аспирации меко-|ния составляет
1—2%. Аспирационный синдром наблюдается
§!у переношенных,, у родивших в срок, но
в состоянии гипоксии, f
и
у детей с задержкой роста во внутриутробном
периоде. Синдром аспирации мекония
редко возникает при нормальном развитии
плода, если роды происходят раньше 34-й
недели беременности.
Еще
Walker
в
1954 г. обнаружил, что внутриутробный плод
при наличии мекония в околоплодных
водах имеет низкое напряжение
кислорода в пупочной вене, чем со светлыми
водами.
Некоторые авторы
связывали отхождение мекония случайной
дефекацией нормального плода с
перерастянутым кишечником, иногда
связывали с действием различных
лекарственных средств.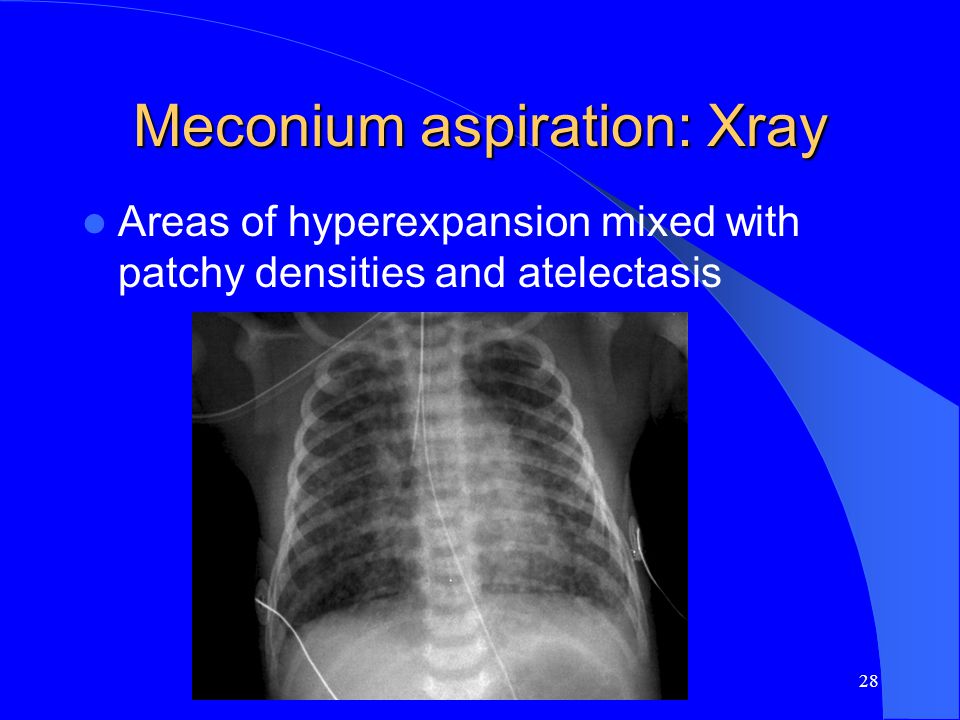
Однако во многих
случаях окраска околоплодных вод
меко-нием сигнализирует об угрожающем
состоянии плода, на что указывают данные
мониторного наблюдения и биохимические
изменения крови (Ильин И. В., Красин Б.
А., 1968; Персиани-нов Л. С. и др., 1973; Федорова
М. В., 1982; Лявинец А. С, 1982 и др.).
Поэтому в настоящее
время большинство авторов склонны
расценивать примесь мекония в околоплодных
водах как признак начавшейся гипоксии
плода.
Патофизиология
Гипоксия плода
может вызвать спазм сосудов брыжейки,
перистальтику кишечника, расслабление
анального сфинктера и пассаж мекония.
Сдавление пуповины стимулирует вагусную
реакцию, ведущую к пассажу мекония даже
при нормальном состоянии плода. Судорожные
дыхательные движения как внутриутробно
(в результате гипоксии плода), так и
сразу же после рождения способствуют
аспирации мекония в трахею. Перемещение
мекония в дыхательные пути малого
калибра происходит быстро, в течение
часа после рождения.
Последствием
аспирации мекония является ранняя
механическая закупорка дыхательных
путей с постепенным развитием химического
пневмонита через 48 ч. Полная закупорка
мелких дыхательных путей приводит к
субсегментарным ателектазам. К ним
примыкают зоны повышенной аэрации,
возникающие вследствие вентильного
эффекта («шаровой клапан») при частичной
закупорке и образовании «воздушных
ловушек». В результате снижаются
вентиляционно-перфузионное отношение,
растяжимость легких, уменьшается их
диффузионная способность, увеличивается
внутрилегочное шунтирование и
сопротивление дыхательных путей. На
фоне усиленного дыхания и неравномерной
вентиляции может произойти разрыв
альвеол, ведущий к утечке воздуха из
легких.
Спазм
сосудов и нарушенная микроциркуляция
в легких определяют длительную легочную
гипертензию и развитие экст-рапульмональных
шунтов (Ю Виктор В. X.,
1989
и др).
С помощью амниоскопии,
предложенной Е. Залингом в 1962 г. удается
удается
обнаружить примесь мекония в околоплодных
водах перед родами или в родах. Выявление
окрашивания ам-ниотической жидкости и
определение ее оптической плотности
может служить ценным методом для
диагностики нарушения состояния плода.
Имеются единичные сообщения о возможности
выявления примеси мекония в водах путем
эхографии.
Меконий представляет
собой зелено-черную вязкую субстан-
цию, заполняющую
толстый кишечник. Химический состав,
его морфологические и ультраструктурные
данные хорошо изучены.
Установлено, что
частицы мекония размером 5 — 30 м
представляют собой разновидность
глюкопротеина, содержащего
сиаломукополисахарид; при
спектрофотометрической оценке меконий
имеет наивысшую адсорбцию при 400 — 450
мкр.
Исследования А.
С. Лявинец (1982) показали, что повышение
уровня серотонина в водах более чем в
два раза приводит, очевидно, к усилению
перистальтики кишечника.
Предрасполагающими
факторами являются: гипертония, сахарный
диабет, изоиммунизация, поздний токсикоз
беременных, резус-конфликт, возраст
матери, количество родов и абортов,
мертворождаемость в анамнезе, коллизии
с пуповиной. При об-витии пуповины
При об-витии пуповины
отхождение мекония в родах отмечается
в 74%. Установлено более быстрое окончание
родов после разрыва плодного пузыря и
излития зеленых околоплодных вод, что
может быть связано с высоким содержанием
окситоцина в меконий. При слабости
родовой деятельности отхождение мекония
выявлено у каждой пятой роженицы.
Значение плодовых
факторов, влияющих на отхождение мекония
в околоплодные воды, изучено недостаточно.
К ним относятся: гиалиновые мембраны,
пневмония, хориоамниониты, эритробластозы.
Отхождение мекония чаще наблюдается
при массе плода более 3500 г, а у детей с
массой менее 2000 г меконий отходит
крайне редко, что может быть обусловлено
незначительным скоплением мекония
в кишечнике плода при преждевременных
родах или пониженной чувствительности
недоношенных детей к гипоксическому
состоянию.
Тактика ведения
беременности и родов при наличии мекония
в водах окончательно не решены.
Имеются единичные
сообщения о значении времени отхожде-ния
мекония и степени его окраски на исход
родов для плода и новорожденного.
Отмечено,
что окрашивание околоплодных вод после
отхож-дения мекония прежде всего
появляется в дне матки при головных
предлежаниях плода. Затем происходит
прокрашивание всей массы околоплодных
вод, в том числе и передних. Окрашивание
пигментами мекония ногтей и кожи плода,
а также хлопьев казеозной смазки
находится в прямой зависимости от
времени отхождения мекония: окрашивание
ногтей плода на-I:
ступает
через 4 — 6 ч, хлопьев смазки — через 12
— 15 ч. (Пер-сианинов Л. С. и др., 1973; Лампэ
Л. и др., 1979).
Высказывается
также предположение, что меконий может
появиться во втором триместре беременности
и находиться там до наступления срочных
родов, в процессе которых трактуется
как признак нарушения жизнедеятельности
плода. Имеются также данные о том,
что появление мекония в водах является
признаком гибели плода во втором
триместре беременности.
В родах
раннее появление мекония в околоплодных
водах по данным Meis
и
соавт. (1978, 1982) наблюдается в 78,8%, позднее
(1978, 1982) наблюдается в 78,8%, позднее
—в 21,2%. Раннее незначительное попадание
мекония в амниотическую жидкость,
наблюдавшееся у 50% беременных с
окрашенным меконием водами, не
сопровождалось уве:
личением
заболеваемости или смертности плодов
и новорожденных. Раннее массивное
попадание мекония сопровождалось
повышенной заболеваемостью и
смертностью новорожденных при осложненном
течении беременности.
По поводу
диагностического значения характера
мекония, обнаруживаемого в околоплодной
жидкости, имеются противоречивые
мнения. Одни авторы считают, что
равномерное окрашивание околоплодной
жидкости меконием говорит о длительном
страдании плода, взвешенные комочки и
хлопья — о кратковременной реакции
плода. Увеличение содержания мекония
является неблагоприятным прогностическим
признаком.
Некоторые
авторы светло-зеленый меконий характеризуют
как «старый, жидкий, слабый» и более
опасный в отношении плода, а темно-зеленый
—как «свежий, недавний, густой» и менее
опасный, так как не установлена его
связь с перинатальной смертностью.
В противоположность этому Fenton,
Steer (1962)
указывали, что при ЧСС плода в ПО уд/мин
и наличии густого мекония перинатальная
смертность составляла 21,4%, при слабом
окрашивании вод —3,5%, при светлых водах
— 1,2%. Установлено также, что при наличии
густого мекония в водах и открытии
маточного зева на 2 — 4 см имеет место
снижение рН крови плода (Hobel,
1971).
Более
того, установлена корреляция между
характером мекония, рН крови плода
и состоянием новорожденных по шкале
Апгар. Так, по Данным Starks
(1980),
при густом окрашивании вод меконием в
начале родов рН крови плода был ниже
7,25 в 64%, а оценка по шкале Апгар у всех
составила 6 баллов и ниже. В то же время
наличие мекония в околоплодной жидкости
без других симптомов (ацидоз, децелерации
ЧСС плода) нельзя расценивать как
свидетельство ухудшения состояния
плода и в связи с этим нет необходимости
форсировать родо-разрешение. В то же
время, когда бы ни появились нарушения
сердцебиения плода при наличии мекония
в водах риск для плода возрастает по
сравнению со светлыми водами (Kjebs
et al.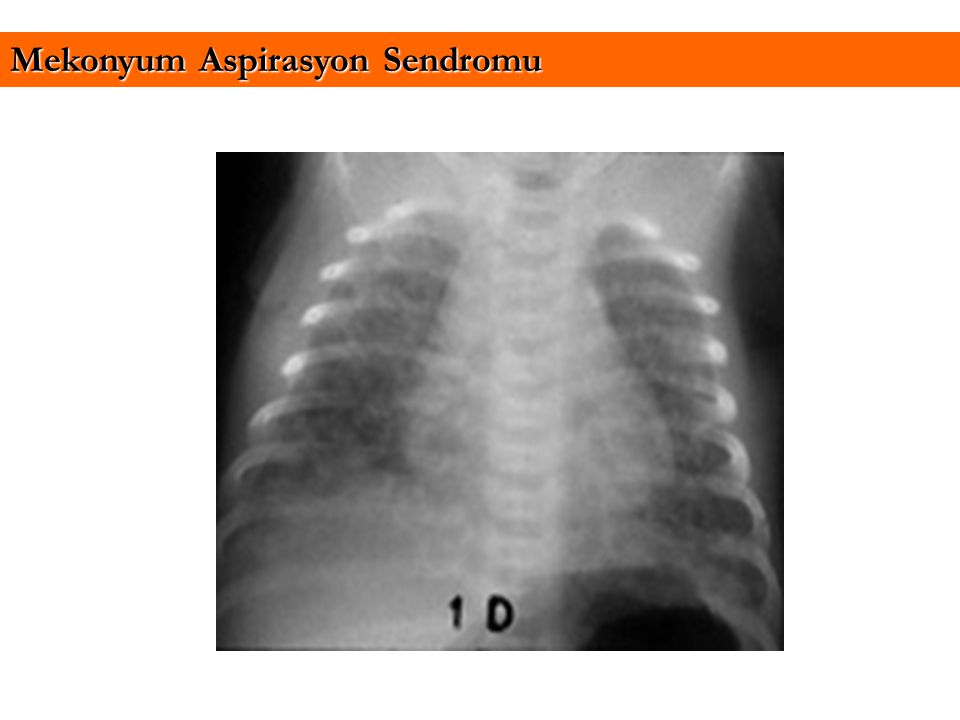 , 1980).
, 1980).
С целью уменьшения
опасности осложнений для плода и
новорожденного, связанных с асфиксией,
при наличии мекония в водах. Е. Залинг
рекомендует при рН 7,20 и ниже прибегать
к оперативному родоразрешению. Если же
имеются нарушения ЧСС плода по данным
кардиотокографии, то родоразрешение
показано при преацидозе (рН 7,24 — 7,20).
(Федорова М. В., 1982).
В связи с этим, в
родах при окрашивании вод меконием
большинство
исследователей указывают на целесообразность
I
мониторного
наблюдения за состоянием плода. При
проведении комплексной оценки состояния
плода в родах удается снизить перинатальную
смертность при наличии мекония в водах
до 0,46%. (Hoschel
et al., 1975).
Частота оперативных
вмешательств при (оперативных) при
наличии мекония в водах составляет
25,2% против 10,9% при светлых водах.
Существенно
отметить, что при кесаревом сечении
меконий может попасть в абдоминальную
полость, в результате чего может развиться
гранулематозная реакция на инородное
тело, последствием чего могут быть
спайки и абдоминальные боли (Freedman
et al. , 1982).
, 1982).
Одним из тяжелых
осложнений периода новорожденное™ при
наличии мекония в водах является синдром
аспирации мекония, частота которого
колеблется от 1 до 3%. Синдром аспирации
мекония чаще обнаруживается у плодов
при раннем и обильном его появлении,
чем при легком и позднем отхождении
мекония. При густом окрашивании
околоплодных вод меконием в начальном
периоде родов, аспирация мекония
встречается
Отмечено, что при
отхождении мекония в околоплодных
водах у 10 — 30% новорожденных развиваются
различные степени респираторных
нарушений.
Синдром аспирации
мекония чаще наблюдается у доношенных
и переношенных детей при острой гипоксии.
Гипоксический стресс приводит к
увеличению дыхательных движений плода,
и амниотическая жидкость, окрашенная
меконием, аспирирует-ся. Частицы мекония
проникают глубоко к альвеолам, вызывая
химические и морфологические изменения
легочной ткани. (Коронес Ш. Б., 1981 и др.).
В некоторых случаях аспирация мекония
может произойти в более хронической
форме, что дает возможность развития
острой внутриутробной пневмонии. .спирированный меконий следует отсасывать
.спирированный меконий следует отсасывать
катетером в терние 2 — 3 ч. Необходимость
осторожного ведения родов и не-гедленного
отсасывания мекония из верхних дыхательных
пу-гй
является
важной профилактикой неонатальной
смертности. Таким образом, имеющиеся в
литературе данные свидетель-
ствуют о том, что
диагностическое и прогностическое
значение; примеси мекония в околоплодных
водах окончательно не установлено.
Однако большиаство авторов расценивают
наличие мекония в околоплодных водах
как признак страдания плода.
Мониторное
наблюдение в родах с использованием
современных методов диагностики
(кардиотокография, амниоскопия,
определение кислотно-основного
состояния крови плода, рН-метрня
околоплодных вод) у рожениц с наличием
мекония в водах позволяет уточнить
состояние плода в родах и определить
даль-, нейшую тактику родов) Мухамадиева
С. М., Абрамченко В. В., 1986 и др).
В конце физиологической
беременности при отсутствии на-, рушений
в состоянии плода характерной
амниоскопической картиной является
умеренное количество прозрачных (реже’
«молочных») вод с наличием умеренно
большого содержания легкоподвижных
хлопьев казеозной смазки (Персианинов
Л. С. и др., 1973).
С. и др., 1973).
Обнаружение же
мекония в водах расценивается как
признак страдания плода. Пицменты
мекония окрашивают воды в зеленый цвет.
Эта окраска сохраняется длительное
время и может быть обнаружена через
несколько часов и дней. Расчеты Э.
Залинга (1967) показали, что при живом
плоде для элиминации мекония из
амниотической полости требуется по
крайней мере 4 — 6 дней. Следовательно,
при контроле через каждые два дня не
заметить меконий невозможно (Лампе Л.
и др., 1979).
Отмечено, что
асфиксия новорожденных наблюдается в
1,5—
2.4 раза чаще при
наличии мекония в водах, чем при светлых
водах.
С целью улучшения
диагностики состояния плода в родах
при наличии мекония в околоплодных
водах проводилась комплексная оценка
состояния плода, включающая
кардиотокогра-фию, амниоскопию,
определение кислотно-основного состояния
крови плода и роженицы, мониторную
рН-метрию околоплодных вод. (Абрамченко
В. В., Мухамадиева С. М.. 1983, 1984, 1986). Проведен
В., Мухамадиева С. М.. 1983, 1984, 1986). Проведен
клинический анализ течения родов у 700
рожениц, из них у 300 рожениц с наличием
мекония в околоплодных водах; у 400
рожениц (контрольная группа) было 150
рожениц со своевременным отхождением
вод и 250 рожениц с несвоевременным
отхождением вод. Клинико-физиологическое
исследование проведено у 236 рожениц.
Полученный
информационный массив 148 признаков
статистически обработан на ЭВМ
«ЕС-1060» с использованием аме-> риканского
пакета прикладных статистических
программ.
В результате
проведенных исследований установлено,
что количество абортов и выкидышей в
анамнезе было в 2 —*
2.5 раза больше в
группе с наличием мекония в водах. Среди
повторнородящих у 50% женщин предыдущие
роды имели ос-»
ложненное течение
(оперативные вмешательства, интранаталь-ная
гибель плода), что не наблюдалось в
контрольной группе рожениц.
Почти
у каждой второй роженицы основной группы
течение настоящей беременности было
осложненным. Следует подчеркнуть,
Следует подчеркнуть,
что нефропатией страдали только роженицы
основной группы. Отеки беременных и
анемия беременных встречалась в два
раза чаще у рожениц с наличием мекония
в водах. Полученные данные согласуются
с данными Iamberti
и
соавт. (1974), Miller,
Sacks (1975),
Fujukura,
Klionsky (1975).
придающих этим осложнениям большое
значение в отхождении мекония в
околоплодные воды перед родами или в
родах.
Первородящие
старшего возраста также преобладали в
основной группе, что подтверждает
мнение вышеуказанных авторов о
значении возраста роженицы в отхождении
мекония.
Очевидно, при
тяжелых сопутствующих заболеваниях
матери и осложнениях беременности
в первую очередь изменяются условия
питания и газообмена плода, обусловленные
нарушением маточно-плацентарного
кровообращения, что может привести
к отхождению мекония в околоплодные
воды (Кирющен-ков А. П., 1978; Лампэ Л., 1979).
Выявлена определенная
зависимость между клиническим течением
беременности и родов и состоянием плода
и новорожденного.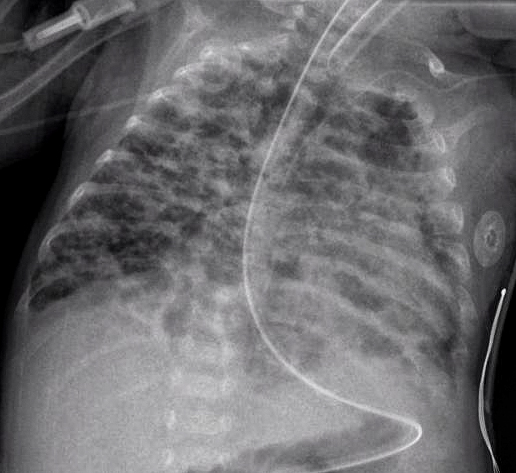 Так, выявлена
Так, выявлена
высокая зависимость между нефропатией
как при беременности, так и в родах,
слабостью родовой деятельности,
аномалиями вставления головки, обвитием
пуповины вокруг шеи плода и низкими
оценками новорожденных по шкале Апгар.
У каждой третьей
роженицы, страдающей нефропатией (35,3%)
и слабостью родовой деятельности
(36,1%), новорожденные имели оценку по
шкале Апгар 6 и ниже баллов. Л. С. Персианинов
и соавт. (1973) в своих исследованиях
показали, что при нефропатии плод
испытывает гипоксию только при отхождении
мекония; асфиксия новорожденных
возрастает в 2,5 раза по сравнению с
контрольной. Мы согласны с авторами,
что отхождение мекония зависит не
столько от степени токсикоза, сколько
от его длительности.
Отмечено
более длительное течение родового акта,
у рожениц с наличием мекония в
околоплодных водах (13,6 ±0,47 ч.) по сравнению
с контрольной (11,26 ±0,61 ч.) и расходятся
с мнением Seppala,
Aho (1975),
указывающих на быстрое окончание
родов при наличии мекония в водах,
связывая это с высоким содержанием
окситоцина в меконий.
У каждого второго
новорожденного, родившегося в асфиксии,
имело место обвитие пуповины вокруг
шеи плода (50%), у каждого пятого—(19,4%)—аномалии
вставления головки.
Осложнения родового
акта обусловили высокий процент
оперативного родоразрешения (14,33%),
в структуре которого
операция
кесарева сечения была у 7,66%, акушерские
щипцы и вакуум-экстракция плода —у
6,67%, что подтверждает данные Noschell
и
соавт. (1975).
Несмотря
на то, что в литературе имеются сообщения
о низкой корреляции (22,3%) оперативных
вмешательств и окраской околоплодных
вод меконием (Pfisterer,
1980),
нами выявлена высокая зависимость между
способом родоразрешения и низкими
оценками по шкале Апгар. Так, асфиксия
новорожденных при наложении полостных
акушерских щипцов наблюдалась в 83,3%,
при вакуум-экстракции плода —40%, операции
кесарева сечения — 34,7 % •
Мы
поддерживаем мнение большинства
исследователей (Ильин И. (1981), что синдром аспирации
(1981), что синдром аспирации
мекония является важной причиной
неонаталь-ной смертности. По нашим
наблюдениям синдром аспирации мекония
при асфиксии новорожденных привел к
летальному исходу в 5,5%, что согласуется
с данными литературы, указывающими
на увеличение перинатальной смертности
при этой патологии до 7,5% (Barham,
1969;
Pfisterer,
1980).
Таким образом,
данные клиники убедительно показывают,
что примесь мекония в водах следует
расценивать как признак страдания
плода.
Клинико-физиологическое
исследование показало, что при наличии
мекония в водах показатели КОС крови
плода достоверно различается с
контрольной группой.
Достоверное
снижение рН крови (7,26 ± 0,004) и дефицита
оснований (6,75 ± 0,46) уже в начале родовой
деятельности при наличии мекония в
водах указывает на напряжение
компенсаторных механизмов плода. Об
истощении резервных возможностей
плода при наличии мекония в водах
свидетельствует наши наблюдения,
позволившие обнаружить преацидоз в его
I
крови
(рН 7,24 — 7,21) в начале родовой деятельности
в 45,7%, в конце же периода раскрытия — в
два раза чаще (80%), что согласуется с
данными Starks
(1980),
в исследованиях которого у плодов,
имевших отхождение мекония, отмечался
значительный ацидоз в крови.
В
группе новорожденных с оценкой по шкале
Апгар 6 и ниже баллов показатели КОС
крови плода отражают патологический
ацидоз: в начале родовой деятельности
рН 7,25 ± 0,07, BE
—7,22
±0,88; в конце периода раскрытия рН 7,21 ±
0,006, BE
—11,26
± 1,52; увеличение же рСО2,
особенно во втором периоде родов (54,70 ±
1,60), указывает на наличие респираторного
ацидоза.
Наши
результаты подтверждают мнение Hobel
(1971),
Starks
(1980),
Krebs
и
соавт. (1980), выявивших зависимость между
показателями КОС крови плода и низкими
оценками новорожденных по шкале Апгар
при наличии мекония в околоплодных
водах.
Показатели
КОС крови роженицы при наличии мекония
в околоплодных водах не отличается от
однозначных в контрольной группе и
находятся в физиологических пределах.
По |i
нашим
данным дельта рН не несет дополнительной
диагностической информации, так как
данный показатель изменяется практически
только за счет плодового компонента.
Эти данные противоречат сообщениям
некоторых авторов (Персиани-нов Л. С. и
др., 1973; Huber
et al., 1983),
указывающих на изменение КОС крови
матери, связанных с внутриутробной
гипоксией плода. Мы поддерживаем
точку зрения большинства исследователей,
не придающим плодово-материнскому
градиенту существенного значения
(Венцковский Б. М., 1977; Фридман В. И.,
1981; Goeschek
et al., 1984).
Выявлена чбткая
корреляция между рН крови и рН околоплодных
вод.
Более низкие
показатели рН околоплодных вод,
окрашенных меконием (7,18 ± 0,08) в начале
родовой деятельности и 6,86 ± 0,04 в конце
периода раскрытия, укладываются в
«пре-патологическую зону» — зону
высокого риска для плода, и отражают
истощение компенсаторных ресурсов
внутриутробного плода, что подтверждается
исследованиями В. И. Фридмана (1981).
По данным П. А.
Клименко (1978), при гипоксии плода рН вод
снижается до 6,92, по М. В. Федоровой (1981)
при легкой асфиксии оно составляет
6,93, при тяжелой — 6,66.
При гипоксии плода
снижение рН вод и крови плода обусловлено
выделением в амниотическую жидкость
из организма плода большого количества
кислых продуктов обмена веществ. Снижение
рН околоплодных вод (6,67 ±0,11 в начале
родовой деятельности и 6,48 ± 0,14 в конце
второго периода родов) в группе
новорожденных с низкими оценками по
шкале Апгар
указывает
на выраженный ацидоз, особенно в периоде
изгнайия, что также согласуется с
наблюдением М. В. Федоровой (1981), отметившей,
что зависимость рН вод от крови плода
особенно выражена при гипоксии, когда
реакция околоплодных вод существенно
сдвигается в кислую сторону, и тем
значительнее, чем тяжелее состояние
плода. Мы поддерживаем мнение Sy-monds
и
соавт. (1971), отмечающего, что буферная
емкость околоплодных вод составляет
половину буферной емкости крови
плода, в связи с чем истощение ее ресурсов
идет быстрее и при гипоксии плода ацидоз
выражен в значительно большей степени.
Снижение буферной емкости вод проявляется
при гипоксии плода и наличия мекония
проявляется в виде повышения
внутричасовых колебаний рН вод до 0,04 ±
0,001 против 0,02 ± 0,0007 в контроле при наличии
светлых околоплодных вод. Кроме того,
Кроме того,
увеличение показателя внутричасовых
колебаний рН околоплодных вод может
произойти раньше, чем уменьшение
абсолютного значения их рН, что позволяет
своевременно выявить начальные
признаки страдания плода в процессе
родов.
Кардиотокография
при наличии мекония в водах приводит к
снижению амплитуды осцилляции (6,22 ±
0,27) и миокарди-ального рефлекса (10,52 ±
0,88), что указывает на снижение резервных
возможностей плода и согласуется с
результатами Krebs
и
соавт. (1980).
При наличии мекония
в водах патологические децелерации
зарегистрированы в четыре раза чаще
(35,4 ±4,69), чем при светлых водах (8,33 ±3,56),
указывая на нарушение жизнедеятельности
плода. Однако в наших наблюдениях
наблюдались ложно-положительные и
ложно-отрицательные результаты. Так,
при нормальных показателях КОС крови
плода патологические децелерации
зарегистрированы в 24% случаев, при
наличии же ацидоза в его крови
нормальные показатели кардиото-кографии
были в 60%.
Мы
полностью согласны с точкой зрения
Abramovici
и
соавт. (1974), считающих, что появление
мекония при нормальных показателях КТГ
и нормальной рН крови плода, может быть
временно компенсированной стадией
нарушения его жизнедеятельности;
однако, когда бы не появились нарушения
сердцебиения плода при наличии
мекония в водах, риск для плода возрастает,
чем при светлых водах.
Для определения
диагностической значимости различных
методов оценки состояния плода при
наличии мекония в водах, нами впервые
проведен корреляционный анализ,
позволяющий установить связь между
различными признаками. Корреляционные
матрицы составлялись на каждую группу
в отдельности и на каждый этап родового
акта.
При наличии мекония
в околоплодных водах рН крови плода
высоко коррелировало с рН вод и его
внутричасовыми колеба-
ниями, поздними
децелерациями; рН вод, окрашенных
мекони-ем, вступила в корреляционную
связь с миокардиальным рефлексом,
амплитудой осцилляции, децелерациями.
Средняя частота коррелировала с
децелерациями.
С
оценкой по шкале Апгар высокую
корреляционную связь имели рН крови
плода, рН вод, внутричасовые колебания
вод рН, поздние децелерации, рСО2
крови плода. Корреляционной связи между
рН крови плода и роженицы не выявлено.
Проведенное
исследование позволило нам разработать
комплексную оценку состояния плода в
родах при наличии мекония в околоплодных
водах:
1. У всех рожениц
в течение родов проводится кардиотокография
с определением средней ЧСС плода,
амплитуды осцилляции, величины
миокардиального рефлекса, патологических
децелерации. Независимо от показателей
КТГ производится амниоскопия.
2. При обнаружении
мекония в водах вскрывается плодный
пузырь и исследуется кислотно-основное
состояние крови плода по методу Залинга.
1
3.
Лри показателях КОС крови плода,
свидетельствующих о внутриутробном
страдании его, производится срочное
родо-разрешение.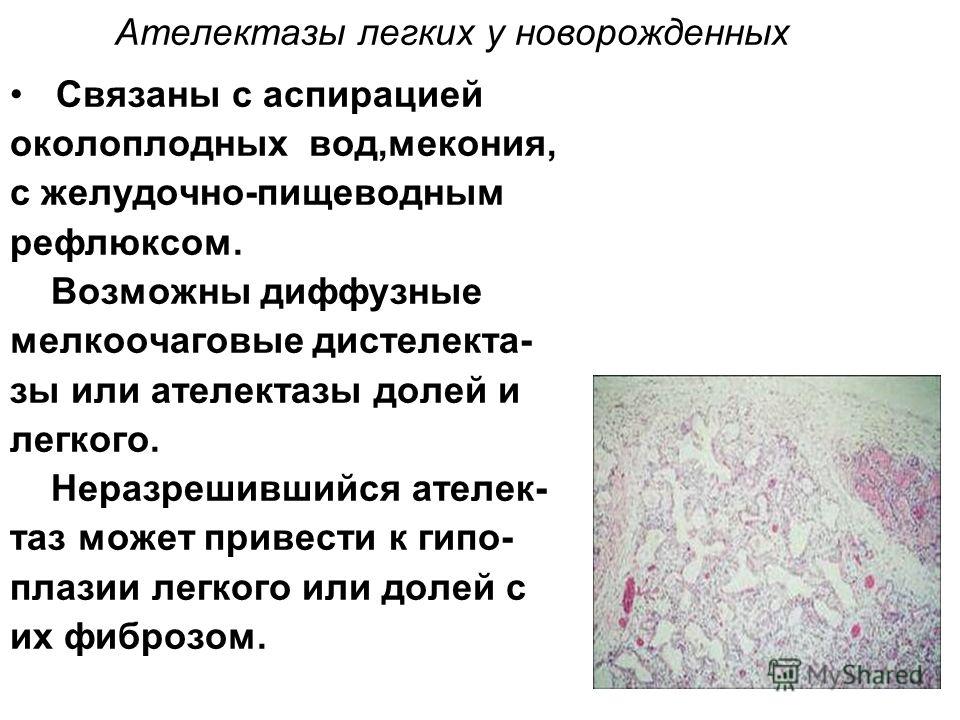
4. При стабильно
благополучных показателях рН вод
проводится дальнейшее наблюдение
за состоянием плода до конца родов;
при нарастании ацидоза в околоплодных
водах — повторная проба Залинга.
Нами была предпринята
попытка прогнозировать появление
мекония в водах, исхода родов для плода
и новорожденного при наличии данного
признака путем многофакторно
дискрими-нантного анализа.
В результате
проведенной работы созданы классификационные
таблицы, содержащие прогностические
факторы в порядке убывания их значимости.
Использование классификационных таблиц
позволяет прогнозировать появление
мекония в околоплодных водах в 70%,
оперативное родоразрешение в 84%, низкие
оценки новорожденных по шкале Апгар —
в 70%.
Наиболее
информативными показателями в оценке
состояния плода при наличии мекония
в околоплодных водах следует считать
рН крови плода и рН околоплодных вод.
При наличии мекония в околоплодных
водах происходит более раннее истощение
буферной емкости крови плода и околоплодных
вод.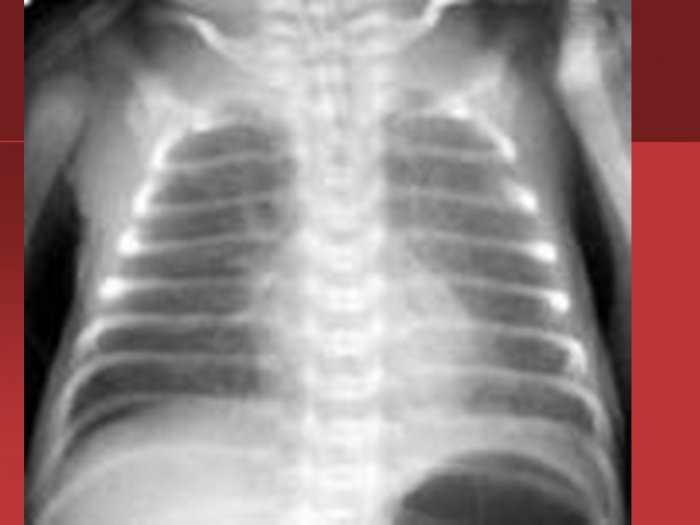
Основными
осложнениями беременности при наличии
мекония в водах являются поздние
токсикозы (28,9%) и анемия беременных
(12%), встречающиеся у них в два раза чаще,
чем в контрольной группе.
У рожениц с наличием
мекония в водах основными осложнениями
родового акта являются аномалии родовой
деятельности (31,3%), нефропатия (19,3%),
обвитие пуповины вокруг
шеи плода (21%),
аномалии вставления головки (4,6%), которые
наблюдаются в два раза чаще, чем в
контрольной группе.
При наличии мекония
в водах отмечается высокая частота
оперативных вмешательств (14,33%), в
структуре которых операция кесарева
сечения составляет 7%, операция наложения
акушерских щипцов — 2%, (полостных),
полостного вакуум-экстрактора — 1,67 %.
При наличии мекония
в водах асфиксия новорожденных встречается
в 6- раз чаще, чем в группе сравнения.
Тяжелое осложнение периода новорожденности
— синдром аспирации мекония* является
причиной летального исхода у 5,5%
новорожденных.
Многофакторный
дискриминантный анализ позволил
прогнозировать у рожениц с наличием
мекония в водах оперативное родоразрешение
в интересах плода в 84%, а состояние
новорожденного — в 76% •
Высокая частота
осложнений беременности, родового акта,
оперативных вмешательств, а также
комплексное мониторное наблюдение за
состоянием плода позволяет отнести
рожениц с наличием мекония в околоплодных
водах в группу высокого риска, нуждающихся
в интенсивном наблюдении в родах.
Лечение аспирационного синдромамеконием
и его профилактика
Ключ к лечению —
прогнозирование и предупреждение.
1.
Интранатальная амнионинфузия при
наличии мекония в водах. Эта процедура
наиболее показана при наличии густо
окрашенных меконием околоплодных вод.
Результаты четырех рандомизированных
исследований последних лет (Sadovsky
el al., 1989;
Adam
et al., 1989;
Wenstrom,
Parsons, 1989;
Ma
cri et al., 1991)
были исследованы путем мета-анализа
Hofmeyr
(1992).
В результате было установлено уменьшение
частоты кесарева сечения по показаниям
со стороны плода (дистресс плода),
отмечено значительное уменьшение
количества новорожденных, у которых
меконий располагался в дыхательных
путях не ниже голосовых связок и синдром
аспирации мекония был значительно
меньше по частоте. Не отмечено перинатальной
гибели детей ни в группе с амнионинфузией,
ни в контрольной группе.
Среди
осложнений амнионинфузии следует
отметить появление гипертонуса матки
(Posner
et al., 1990)
и, возможно, неона-тальной дыхательной
недостаточности) Dragich
et al., 1991).
Сомнения в отношении эффективности
амнионинфузии были высказаны в работах
Goodlin
(1989,
1991).
Как известно,
респираторный дистресс может развиваться
сразу же после рождения. Однако чаще
его симптомы появляются через 12 —
24 ч. в виде цианоза, тахипноэ, хриплого
дыхания, расширения или втяжения
межреберных промежутков
или перерастяжения
грудной клетки. При аускультации
При аускультации
выслушиваются грубые хрипы, нежная
крепитация, удлинение выдоха.
Рентгенологически видны участки крупных,
неправильной формы затемнений,
чередующихся с участками повышенной
прозрачности. Часто легкие выглядят
эмфизематозными, диафрагма уплощена,
основания легких отличаются повышенной
прозрачностью, преднезадний размер
грудной клетки увеличен. В 1/4 случаев в
плевре и междолевых пространствах
определяются жидкость и воздух.
Пневмоторакс обычно развивается в
течение первых 24 ч, часто спонтанно у
новорожденных, которым не проводилась
искусственная вентиляция. Для обильной
аспирации характерны рентгенологический
симптом «снежной бури» и кардиомегалия.
Нужно сказать, что рентгенологических
симптомов, патогномоничных для аспирации
мекония, нет, и иногда ее трудно отличить
от пневмонии и кровоизлияния в легкие.
Рентгенологическая картина обычно
нормализуется через 2 нед, однако
повышенная пневматизация легких и
обра-, зование пневматоцеле могут
наблюдаться несколько месяцев.
Метаболический
ацидоз в первые часы после рождения
свидетельствует о том, что у
новорожденного уже была асфиксия.
Поначалу минутная вентиляция нормальна
или даже несколько повышена, но в
более тяжелых случаях развитие
гиперкап-нии вынуждает прибегнуть к
искусственной вентиляции. Тяжесть
гипоксемии в значительной степени
зависит от степени поражения легкого,
а также персистирующей легочной
гипер-тензии.
В то
время как в легких случаях можно
ограничиться кисло-родотерапией в
течение нескольких часов или дней, в
тяжелых случаях может развиться
респираторный дистресс или возникает
необходимость в длительной (дни, недели)
искусственной | вентиляции. Такие
респираторные осложнения, как утечка
воздуха, вторичная инфекция и
бронхолегочная дисплазия, затягивают
процесс выздоровления. Сочетанные
осложнения, включающие
гипоксически-ишемическую энцефалопатию,
почечную недостаточность, коагулопатию
и некротический . энтероколит, I
обусловлены
перинатальной асфиксией, а не аспирацией
мекония. (Ю Виктор В. X.,
(Ю Виктор В. X.,
1989).
2.
Профилактика аспирационного синдрома
новорожденных I
с
помощью нового метода интраамниальной
перфузии вод | с
микрофильрацией.
|
Нами
(Моисеев В. Н., Петраш В. В., Абрамченко
В. В., I
1989)
с целью улучшения возможностей
профилактики аспира- | ционного синдрома
новорожденных был разработан и изучен
1 новый метод интраамниальной перфузии
околоплодных вод I
в
родах с их микрофильтрацией. При
мониторном наблюдении I
68
рожениц групп высокого риска, у 29 из них
в первом перио- | де родов была обнаружена
существенная примесь мекония 1
в
околоплодных водах.
1
i
Следует
подчеркнуть, что в современной литературе
большое внимание уделяется определению
концентрации мекония в околоплодных
водах, который позволяет дифференцировать
недавно отошедший меконий («свежий»)
или его повышение концентрации требует
быстрого родоразрешения в противоположность
«старому» меконию.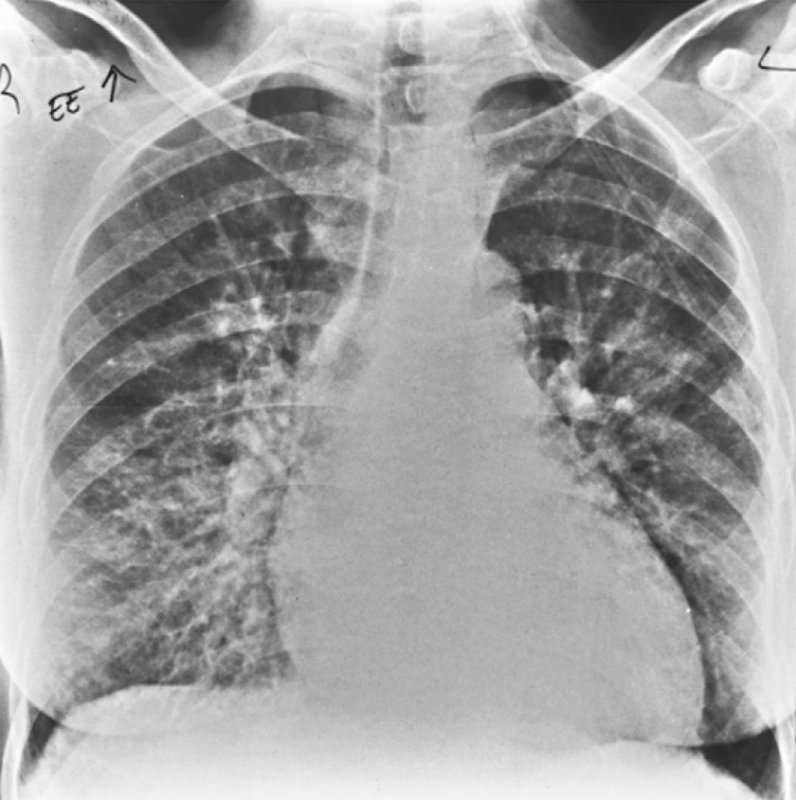 Так, Molcho
Так, Molcho
и
соавт. (1985) разработали метод
спектрофотометрического определения
концентрации мекония в водах, используя
принцип определения билирубина при
гемолитической болезни плода и
новорожденного (Liley,
1963).
Меконий определяется в спектре 410 нм
(405 — 415 нм) и может колебаться в
доверительных интервалах от 370 до 525 нм.
Weitzner
и
соавт. (1990) также разработали объективный
метод определения содержания мекония
в водах, ибо количество мекония обычно
определяется субъективно, визуально
и подразделяется на два вида: незначительная
примесь и значительная примесь мекония
в водах. Авторы разработали простой,
быстрый и недорогой метод определения
мекония в водах («Meconium
crit») и
его концентрация в водах. Методика
заключалась в следующем: брали 15 г
свежего неонатального мекония (не более
3 ч давности) и помещали в светлые
околоплодные воды и наблюдали в
течение 15 мин. Затем разводили 15 г мекония
на 100 мл амниотической жидкости и далее
разводили в концентрации 10 г, 7,5г, 5
г, 3 г и 1,5 г на 100 мл амниотической
жидкости..jpg) Далее 1 мл каждого образца
Далее 1 мл каждого образца
разводили добавочно чистой водой 0,5 мл,
1 мл, 2 мл, 4 мл и 9 мл, 10 мл смеси меконий и
вод помещали в стандартную тубу для
определения гематокрита, центрифугировали
и затем определяли количество мекония
как определяют гематокрит. Эти методики
важны, так как развитие аспирационного
синдрома (около 2%) может приводить к
неонатальной смертности более чем у
40% новорожденных (Falciglia,
1988).
При наличии так называемого «толстого»
мекония частота осложнений у новорожденных
повышается. Поэтому ряд авторов
проводят при наличии «толстого»
мекония амнионинфузию (Wenstrom,
Parsons, 1989).
В противоположность методики Molcho
и
соавт. (1985), где требуется очень сильно
разведение мекония ниже клинически
значимого (1 г.) 100 мл была максимальной
концентрацией), метод Weitzner
и
соавт. (1990) обычно использует те
концентрации мекония, которые
наблюдаются в клинической практике и
требуется наличие только центрифуги в
родильном зале. Ядерный магнитный
резонанс также используется для
определения мекония в амниотической
жидкости, но это требует наличие этого
аппарата (Вепе, 1980; Borcard,
Hiltbrand, Magnin et al. , 1982).
, 1982).
Bena-cerraf,
Gatter, Ginsburgh (1984)
в двух наблюдениях определили
эхографией наличие «толстого» мекония
в околоплодных водах. Ohi,
Kobayashi, Sugimura, Terao (1992)
разработали новый метод диагностики
определения мекония в околоплодных
водах моноклональными антителами с
определением компо-
нента
мекония — гликопротеина типа муцина.
Horiuchi
и
соавт. (1991) также изолировали и определили
корпорфирин цинка — как главный
флуоресцентный компонент мекония.
В
работе Davey
Becker, Davis (1993)
описаны новые данные синдрома аспирации
меконием: физиологические и воспалительные
изменения на модели новорожденных
поросят. Показано, что аспирационный
синдром меконием вызывает острое
снижение газообмена и динамической
пластичности легких, которые возвращаются
к исходному уровню через 48 ч. Эндогенная
сур-фактантная функция также значительно
заторможена меконием. Все изменения
легочной травмы были значительно выше
в группе животных с наличием мекония в
водах. По мнению Kariniemi,
По мнению Kariniemi,
Harrela (1990)
наличие мекония в водах больше связано
с плацентарной недостаточностью по
сравнению с пупочной недостаточностью
кровотока. Исходя из этих данных
амнионинфузия должна проводиться как
можно раньше в родах, ибо способствует
одновременно улучшению состояния плода
и профилактике дистресса плода (Wu
Bai-tao, Sun Li-jun, Tang Lo-yun, 1991).
Следует
подчеркнуть, что по мнению Parsons
(1989)
синдром аспирации мекония остается
постоянным в пределах 6,8 — — 7%- Другие
авторы определяют его частоту около
2%, несмотря на активное отсасывание
мекония из верхних дыхательных путей.
В то же время в работе Carson
и
соавт. (1976), где не проводилось отсасывания
слизи частота аспирационного синдрома
оставалась низкой. Поэтому Goodlin
(1989)
считает, что более эффективная методика
лечения аспирационного синдрома
заключается, особенно у плодов с
повышенной двигательной активностью
при наличии мекония в водах — есть
индукция апноэ у плода наркотиками,
так как в более ранней работе Goodlin
(1984)
было установлено, что аспирационный
синдром не проявляется у новорожденных,
матери которых получали седативные
и наркотические средства. Однако этот
Однако этот
вопрос нуждается в дальнейшем
изучении, ибо синдром- аспирации мекония
и до настоящего времени остается
высоким—до 7% (Hofmeyr,
1992).
Нами (Моисеев В.
Н., Петраш В. В., Абрамченко В. В., 1989)
разработана следующая методика
интраамниальной перфузии вод с
микрофильтрацией. Производится
катетеризация полости амниона
двухпросветным катетером, после чего
начинали перфузию собственными
околоплодными водами через внешнюю
систему, содержащую микрофильтры с
диаметром отверстий 4 мкм, со скоростью
10 — 50 мл/мин вплоть до рождения
ребенка. К предлежащей части плода
подводилась герметизирующая манжета,
позволявшая проводить длительную
перфузию без значительных потерь
околоплодных вод.
В 29 наблюдениях
при возникновении выраженной примеси
меконня в околоплодных водах в первом
периоде родов их пол-
ная
очистка происходила через 60 — 80 мин от
начала перфузии при отсутствии повторного
поступления мекония. У 14 рожениц (49) было
выявлено повторное поступление мекония.
В этих наблюдениях в течение 60 — 80 мин
происходило полное очищение
перфузионной системы. Параллельно с
микрофильтрацией вод, учитывая, что
наличие мекония может служить признаком
возможной начавшейся асфиксии плода,
проводился периодический контроль
состояния плода с помощью пробы Залинга.
Действительно, у 24 рожениц были выявлены
признаки гипоксии плода по данным
рН, рО2
и рСО2
крови плода. В этих случаях использовался
один из методов лечения гипоксии плода
с применением антигипоксантов,
антиоксидантов и других средств.
Продолжение перфузии осуществлялось
в случаях достаточной эффективности
противогипоксической терапии.
У 22 рожениц (76%) при
удовлетворительном состоянии плода в
родах метод интраамниальной перфузии
осуществлялся с момента обнаружения
мекония и до рождения ребенка, при этом
средняя продолжительность перфузии
составила 167 мин.
Состояние
новорожденных по шкале Апгар в 18 случаях
(82%) соответствовало 8—10 баллам, в 4
наблюдениях (18%) — 6 — 7 баллам. Случаев
Случаев
перинатальной смертности не было.
Синдром респираторных нарушений, а
также нарушения внешнего дыхания
детей при их комплексном обследовании
в ближайшие 10 суток не были выявлены.
Учитывая высокую
частоту возникновения респираторных
нарушений у новорожденных при наличии
мекония в околоплодных водах, метод
интраамниальной перфузии околоплодных
вод с их микрофильтрацией может стать
эффективным профилактическим методом
при обнаружении примеси мекония в водах
в первом периоде родов и при достаточной
терапии гипоксических состояний плода,
часто встречающихся в этих случаях.
Лечение
аспирационного синдрома у новорожденных
Ю.
Виктор В. X.
(1989),
Holtzman
и
соавт. (1989) полагают, что аспирацию
мекония почти всегда можно предотвратить,
если проводить соответствующий
контроль в антенатальном периоде,
способствовать ускорению течения родов,
сразу же очистить трахею у новорожденного.
С. М. Мухамадиева, В. В. Аб-рамченко (1986)
Аб-рамченко (1986)
провели изучение клинико-патологоанатоми-ческих
особенностей при синдроме аспирации
мекония на основании анализа 14 родов
с наличием мекония в водах, где синдром
аспирации мекония явился причиной
неонатальной смертности. В изучаемой
группе все роженицы были первородящими.
Интранатально погибли 6 (42,8%) плодов, во
всех этих случаях роды были закончены
наложением полостных акушерских щипцов
и вакуум-экстрактора. Остальные новорож-
денные при рождении
имели оценку по шкале Апгар 5 и ниже
баллов. Сразу после рождения у всех
детей производилось от-еасывание слизи
из верхних дыхательных путей, применялась
ИВЛ, в вену пуповины вводились растворы
соды, глюкозы, этимизола, сеанс
гипербарической оксигенации.
Несмотря на
проводимые реанимационные мероприятия
7 (50%) детей погибли
в первые сутки после родов от массивной
аспирации мекония, остальные — на 2 —
4 сутки от тяжелой аспирационной
пневмонии. Диагноз аспирации мекония
был подтвержден при аутопсии. Характерной
Характерной
патологоанатомичео кой картиной было
заполнение просвета бронхов большим
количеством слизи, элементами
околоплодных вод, мекония. Альвеолы
во всех случаях были расширены, в просвете
их определялось большое количество
околоплодных вод, частиц мекония.
8 трех случаях
имелся разрыв стенки альвеол, под плеврой
обнаружены обширные кровоизлияния.
Когда
меконий густой, в виде глыбок, следует
попытаться очистить от него нос и
ротоглотку еще до того, как грудная
клетка выйдет из родового канала. Сразу
же после рождения, если меконий густой
или показатель по шкале Апгар ниже 6,
нужно предпринять эндотрахеальную
интубацию, чтобы отсосать содержимое
трахеи до начала искусственного дыхания.
Если указанные мероприятия не проводятся
непосредственно после рождения, частота
аспирационного синдрома и летальность
возрастают. (Ting,
Brady, 1975).
Такая процедура показана даже в тех
случаях, когда мекония в ротоглотке нет
(как показано, у 17% новорожденных, имеющих
меконий в трахее, последний в ротоглотке
не обнаруживался) (Gregori
etal. , 1974).
, 1974).
Отсасывание содержимого из трахеи прн
повторной интубации или через катетер
следует повторять до полного очищения
трахеи. Дополнительная процедура в
родильном зале — удаление заглоченного
мекония из желудка — предупреждает
повторную аспирацию.
Новорожденного
следует поместить в блок интенсивного
наблюдения. Важен непрерывный мониторинг
частоты пульса и дыхания. Чтобы подтвердить
диагноз и исключить пневмоторакс,
проводят рентгенологическое исследование;
его повторяют, если клиническая
картина ухудшается. Всякому новорожденному,
которому необходима 30% воздушно-кислородная
смесь для сохранения розового цвета
кожи, целесообразно катетеризовать
какую-либо артерию, чтобы постоянно
следить за составом газов крови.
Рекомендуются
антибиотики широкого спектра действия,
поскольку причиной гипоксии плода и
выделения мекония в воды может быть
бактериальный сепсис. В ряде случаев
пневмонию нельзя отличить от синдрома
аспирации мекония, и даже если меконий
стерилен, он способствует росту бактерий.
Доказательств положительного действия
стероидов при данном синд-
роме нет. Для
удаления из легких остатков мекония
можно использовать физиотерапию и
постуральный дренаж.
Приблизительно
у 50% новорожденных с аспирацией мекония
развивается дыхательная недостаточность.
Искусственная вентиляция показана при
РаО2
ниже 80 мм рт. ст. на 100% кислороде, РаСо2
свыше 60 мм рт. ст. или апноэ. Рекомендуемые
параметры искусственной вентиляции:
частота дыханий 30 — 60 мин; давление на
вдохе 25 — 30 см вод. ст.; положительное
давление в конце выдоха (ПДКВ) 0 — 2 см
вод. ст.; соотношение между вдохом и
выдохом от 1 :2 до 1 :4.
При
высоком риске гипоксической легочной
вазоконстрикции и малой вероятности
ретинопатии у зрелого новорожденного
РаО2
следует поддерживать на верхнем пределе,
т. е. 80 — 100 мм рт. ст. Для снижения РаО2
учащение дыхания предпочтительнее
увеличения дыхательного объема путем
создания высокого пикового давления.
Высокий
уровень повышенного давления в конце
выхода (ПДКВ) увеличивает риск снижения
венозного возврата к сердцу и,
следовательно, сердечного выброса,
уменьшения растяжимости легких (что
может привести к ги-перкапнии) и
образования воздушных ловушек», (ведущего
к разрыву альвеол). Однако, если РаО2
остается ниже 60 мм рт. ст. несмотря на
искусственную вентиляцию легких чистым
кислородом, можно попытаться улучшить
оксигенацию крови, повысив ПДКВ до 6 см
вод. ст. Этот прием следует проводить
под тщательным контролем из-за возможных
осложнений. ПДКВ следует снизить, если
появляются системная гипотензия,
гиперкапния или утечка воздуха из
легких. Оксигенация улучшается, если
сочетать» искусственную вентиляцию
с мышечной релаксацией. Данный метод
особенно рекомендуется, если при
рентгенологическом исследовании
выявляется интерстициальная эмфизема
легких, ребенок «не синхронен» с аппаратом
и требуется повысить ПДКВ. Ухудшение
в процессе такого лечения возможно
вследствие развития пневмоторакса или
(возможно вследствие) закупорки
эндотрахеальной трубки меконием.
Наиболее вероятной причиной стойкой
или нарастающей ги-поксемии можно
считать персистирующую легочную
гипертен-зию (Ю. Виктор В. X.,
1989).
В заключение
необходимо отметить, что по литературным
и нашим данным летальность при синдроме
аспирации мекония составляет 24 —
28%; в тех случаях, когда требовалась
искусственная вентиляция легких,
летальность достигла 36 — 53%.
Если же сразу после
рождения, до первого вдоха, очищалась
носоглотка или отсасывалось содержимое
трахеи не зарегистрировано ни одного
летального исхода.
Окончательный
прогноз зависит не столько от развившегося
заболевания легких,
сколько от перинатальной асфиксии.
Каких-либо специфических хронических
нарушений функций легких не описано.
Прогнозирование мекониальной аспирации у плода в анте- и интранатальном периодах
На правах рукописи
КОЛГАНОВА АНАСТАСИЯ АЛЕКСАНДРОВНА
ПРОГНОЗИРОВАНИЕ МЕКОНИАЛЬНОЙ АСПИРАЦИИ У ПЛОДА В АНТЕ- И ИНТРАНАТАЛЬНОМ ПЕРИОДАХ
14. 01.01 —акушерство и гинекология
01.01 —акушерство и гинекология
АВТОРЕФЕРАТ диссертации на соискание ученой степени кандидата медицинских наук
— з ДЕК 2010
Ростов-на-Дону 2010
004616528
Работа выполнена в Федеральном государственном учреждении «Ростовский научно-исследовательский онкологический институт» Росмедтехнологий и Государственном образовательном учреждении высшего профессионального образования «Ростовский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель:
доктор медицинских наук, профессор Буштырева Ирина Олеговна Официальные оппоненты:
доктор медицинских наук, профессор Цаллагова Лариса Владимировна доктор медицинских наук, профессор Аксененко Виктор Алексеевич
Ведущая организация:
ФГУ Ростовский научно-исследовательский институт акушерства и педиатрии Федерального агентства по высокотехнологичной медицинской помощи
Защита состоится « » 2010 года в УЗ часов на заседании
диссертационного совета Д 208. 082.05 при ГОУ ВПО Ростовском государственном медицинском университете (344022, г. Ростов-на-Дону, пер. Нахичеванский, 29).
082.05 при ГОУ ВПО Ростовском государственном медицинском университете (344022, г. Ростов-на-Дону, пер. Нахичеванский, 29).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Ростовского государственного медицинского университета
Автореферат разослан « »-/V 2010 года.
Ученый секретарь диссертационного совета, доцент
Шовкун В.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ Актуальность проблемы
Повышение качества оказания акушерской помощи неразрывно связано с развитием перинатологии (González de Dios J., 2010). За последние годы в этой области знаний достигнуты значительные успехи по изучению физиологии и патологии внутриутробного плода, созданию новых методов диагностики и терапии нарушений в системе «мать-плацента-плод». Тем не менее, показатели перинатальной заболеваемости и смертности указывают на актуальность продолжения исследований (Н.В. Кузьмин, 2007). Один из путей снижения перинатальной патологии состоит в дальнейшей разработке и внедрении в практику современных высокоинформативных методов дородовой диагностики и прогноза осложнений беременности и родов, в том числе синдрома мекониальной аспирации (Е. В. Коханевич, 2006).
В. Коханевич, 2006).
Одно из самых грозных осложнений неонатального периода связано с аспирацией околоплодных вод, загрязненных меконием. Частота отхождения мекония колеблется от 4,5 до 20% и в среднем происходит в 10% родов при головном предлежании плода даже на фоне оптимальной акушерской тактики. Расхождения в частоте обнаружения мекония объясняются различным контингентом обследуемых беременных и рожениц (В.В. Абрамченко, 2004). Средняя частота аспирационного синдрома, по данным И.С. Сидоровой (2000), составляет 2,14 %. По данным Н.П. Шабалова (2004), частота синдрома аспирации мекония составляет примерно 1% всех новорожденных, родившихся через естественные родовые пути. По результатам многих исследований, при наличии мекония в околоплодных водах увеличивается частота гипоксии плода, повышается перинатальная смертность и заболеваемость новорожденных (В.Е. Радзинский, 2007).
Высокая частота осложнений беременности, родового акта, оперативных вмешательств у женщин с наличием мекония в околоплодных водах, а также затрудненная диагностика ухудшения внутриутробного состояния плода, высокий риск асфиксии новорожденных при мекониально окрашенных околоплодных водах, осложненное течение раннего неонатального периода и относительно частое развитие тяжелого осложнения периода новорожденное™ — синдрома аспирации мекония, который является причиной летального исхода у 5,5% новорожденных (В.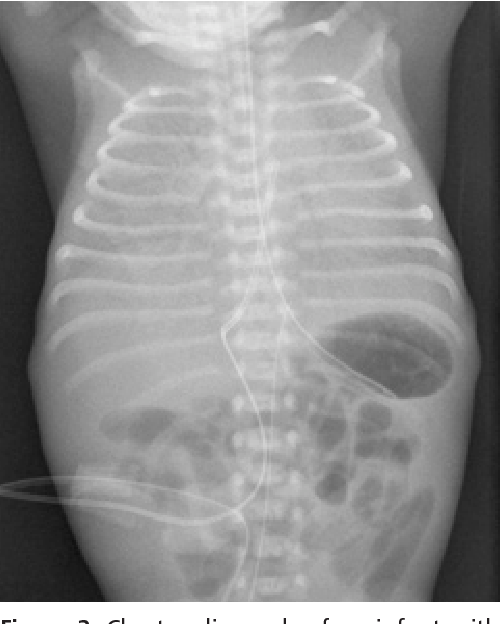 В. Абрамченко, 2004) — все это послужило основанием для поиска возможностей прогнозирования мекониальной аспирации. Однако, в доступной литературе мы не встретили однозначных, четко обозначенных представлений о методах прогноза аспирации первородного кала до и во время родов. Работ, посвященных поиску возможностей прогнозирования мекониальной аспирации в анте- и интранатальном периодах с помощью неинвазивного метода кардиоинтервалографии, в изученных литературных источниках нами не найдено, что и послужило основанием для проведения настоящего исследования.
В. Абрамченко, 2004) — все это послужило основанием для поиска возможностей прогнозирования мекониальной аспирации. Однако, в доступной литературе мы не встретили однозначных, четко обозначенных представлений о методах прогноза аспирации первородного кала до и во время родов. Работ, посвященных поиску возможностей прогнозирования мекониальной аспирации в анте- и интранатальном периодах с помощью неинвазивного метода кардиоинтервалографии, в изученных литературных источниках нами не найдено, что и послужило основанием для проведения настоящего исследования.
Целью настоящей работы явилось улучшение перинатальных исходов путем прогнозирования мекониальной аспирации у плода.
Для достижения указанной цели были поставлены следующие задачи:
1. Исследовать возможности кардиоинтервалографии в качестве метода, позволяющего прогнозировать мекониальную аспирацию в анте- и интранатальном периодах.
2. Выявить факторы риска пассажа мекония в анте- и интранатальном периодах.
3. Исследовать антенатальное состояние фето-плацентарного комплекса, а также дыхательную активность плода на фоне отхождения мекония.
4. Исследовать интранатальное состояние адаптационных систем плода, а также его дыхательную активность на фоне антенатального пассажа мекония.
5. Исследовать интранатальное состояние адаптационных систем, а также дыхательную активность у плодов с отхождением мекония во время родов.
Научная новизна работы
Впервые были проведены кардиоинтервалографические исследования активности дыхательного центра у плодов в анте- и интранатальном периодах для определения прогностически значимых показателей риска развития мекониальной аспирации в родах, что влияет на выбор акушерской тактики и, соответственно, исход для новорожденного.
Впервые было показано, что увеличение ширины ампулы прямой кишки плода при ультразвуковом исследовании до 15 мм и более в антенатальном периоде является фактором риска отхождения мекония в околоплодные воды.
Впервые было выявлено, что у плодов с различным временем отхождения мекония (анте- или интранатально) имели место разные механизмы адаптации к родовому стрессу.
Практическая значимость работы
Разработка прогностически значимых показателей риска развития мекониальной аспирации позволяет своевременно корректировать акушерскую тактику с целью предупреждения развития осложнений, связанных с попаданием мекония в дыхательные пути плода и новорожденного. По материалам проведённых исследований оформлена заявка на предполагаемое изобретение № 2010138408/14 (054866) «Способ выбора акушерской тактики», приоритет от 16.09.2010.
Положения, выносимые на защиту:
1. Включение кардиоинтервалографии в комплекс методов оценки внутриутробного состояния плода существенно повышает возможности прогноза мекониальной аспирации.
2. Для антенатального отхождения мекония в околоплодные воды необходимо сочетание предрасполагающих факторов (внутриматочные вмешательства в анамнезе, синдром задержки роста плода) с умеренным напряжением адаптационных систем плода и наличием «готовности» к пассажу мекония за пределы желудочно-кишечного
тракта (расширение ампулы прямой кишки плода более 15 мм, обвитие пуповины вокруг шеи).
3. Интранатальное отхождение мекония происходит при дезадаптации компенсаторно-приспособительных систем плода (наличие симпатикотонии на фоне истощения адаптационных механизмов) в сочетании с усугублением плацентарной недостаточности в виде ухудшения микроциркуляции в плодовой части плаценты; при этом дополнительными факторами риска являются срок беременности более 40 педель, нарушение сократительной деятельности матки (патологический прелиминарный период, первичная и вторичная слабость родовой деятельности, чрезмерная родовая деятельность) и воздействие инфекционного фактора в первой половине беременности.
4. Риск мекониальной аспирации является максимальным при интранатальном отхождении мекония в сочетании с дезадаптацией компенсаторно-приспособительных систем плода и появлением дыхательной активности по типу «gasps» («удушье»).
Апробация работы и реализация результатов исследования
Основные положения диссертационной работы использованы в лекционном материале тематических и сертификационных циклов, проводимых на кафедре акушерства и гинекологии № 3 ФПК и ППС Ростовского государственного медицинского университета.
Основные положения работы представлены на X — XI Российском форуме «Мать и дитя» (Москва, 2009-2010), на научно-практической конференции «Проблемы репродуктивного здоровья женщин» (Ростов-на-Дону, 2008), на научно-практической конференции «Здоровый образ жизни — основа репродуктивного благополучия» (Ростов-на-Дону, 2008), на междисциплинарной научно-практической конференции по акушерству, перинатологии и реанимации в неонатологии «Актуальные проблемы невынашивания беременности» (Владикавказ, 2009), на научно-практической конференции «Ранние сроки беременности. Профилактика репродуктивных потерь» (Ростов-на-Дону, 2009), на 64-ой Итоговой научной конференции студентов, молодых ученых и специалистов (Ростов-на-Дону, 2010).
Апробация работы проведена на конференции кафедры акушерства и гинекологии № 3 ГОУ ВПО Ростовского государственного медицинского университета и на конференции в Ростовском научно-исследовательском онкологическом институте.
Публикации
По теме диссертации опубликовано 9 печатных работ, из них 2 в журналах, рекомендованных ВАК.
Объем и структура работы
Диссертация состоит из введения, обзора литературы, общей характеристики материала и методов исследования, трех глав с результатами собственных исследований, обсуждения полученных результатов, выводов, практических рекомендаций и указателя литературы, включающего 139 работ на русском и 100 на
иностранных языках. Работа изложена на 181 странице машинописного текста, иллюстрирована 41 таблицей и 18 рисунками.
Материалы и методы исследования
Для реализации поставленных задач на первом этапе исследования с целью поиска наиболее значимых факторов риска нами был проведен ретроспективный анализ медицинской документации. Проанализировав 39 историй родов, пациентки были разделены на 2 группы: 1р (контрольная) — роженицы со светлыми околоплодными водами (п=20), Пр (основная) — роженицы, у которых роды закончились рождением детей с признаками мекониальной аспирации (МА) и последующим развитием синдрома аспирации мекония (САМ) (п=19). В последующем для достижения цели исследования и решения поставленных задач использовали клинические наблюдения, включая анализ данных обследования, зарегистрированных в амбулаторных и стационарных картах беременных, историях родов, изучение общего и акушерско-гинекологического анамнеза, динамическое наблюдение за состоянием плода.
Исследование проводилось на базе кафедры акушерства и гинекологии № 3 ФПК и ППС Ростовского государственного медицинского университета с 2007 по 2010 гг. в условиях акушерского отделения Областной больницы № 2 г. Ростова-на-Дону. Были обследованы беременные женщины со сроком 38-42 недели гестации. Большинство беременных проживали в г. Ростове-на-Дону и Ростовской области. Общий объем выборки составил 127 беременных.
В зависимости от характера околоплодных вод пациентки были подразделены на две группы. В I группу (контрольную) вошли женщины со светлыми околоплодными водами (п = 83). II группу составили пациентки, амниотическая жидкость у которых была окрашена меконием (п = 44). В свою очередь II группа была подразделена на две подгруппы: Па — роженицы с полностью прокрашенными меконием околоплодными водами (п = 30), т. е. с антенатальным отхождением мекония, Нб- женщины, у которых были окрашены только задние воды (п = 14), т. е. с интранатальным отхождением мекония.
Обследование пациенток проводили в условиях акушерского отделения Областной больницы № 2 г. Ростова на Дону в сроке доношенной беременности и в родах. Срок беременности определяли на основании анамнестических данных и результатов ультразвуковой биометрии. Всем женщинам проводили общеклиническое обследование, ультразвуковую диагностику, исследование плацентарного и плодового кровотока, кардиоинтервалографию (КИГ), кардиотокографическое исследование плода (КТГ), комплексную оценку состояния плода (биофизический профиль — БФП). С целью определения риска отхождения мекония измеряли диаметр ампулы прямой кишки плода. Определение размера ампулы прямой кишки, дыхательной и двигательной активности при помощи ультразвукового исследования, допплерометрическое исследование (ДПМ) плацентарного и плодового кровотока, а также КИГ и КТГ проводились также интранатально.критерия Стьюдента, критерия Вилкоксона, непараметрических методов — критерия Манна-Уитни. Для сравнения бинарных данных использовались точный критерий Фишера и у\
Результаты исследования
Средний возраст пациенток контрольной группы составил 27,31±5,13 лет, пациенток группы с антенатальным окрашиванием околоплодных вод меконием -27,17±4,85 лет, с интранатальным — 27,14±4,36 лет (р>0,05). Это позволяет сделать вывод о том, что все группы обследуемых женщин сопоставимы по возрастным характеристикам.
При клиническом обследовании выявлено отсутствие достоверных отличий между группами по количеству беременностей, паритету, наличию искусственных абортов, т.е. группы были сопоставимы между собой по данным показателям. Лишь в ретроспективной группе Нр (основной) имело место достоверно большая частота встречаемости искусственных абортов (63,2%) по сравнению с контролем (1р группа -25%) (р<0,05), что согласуется с данными исследования В.В.Абрамченко и соавторов (2004). Вероятно, большая частота абортов в группе женщин с мекониальным окрашиванием околоплодных вод демонстрирует роль повреждения внутреннего слоя матки в результате внутриматочных вмешательств, предшествовавших беременности, в развитии последующих нарушений имплантации и фетоплацентарной недостаточности (ФПН). Тот факт, что при детальном анализе количество искусственных прерываний беременности в группах с антенатальным и интранатальным отхождением мекония не отличалось, указывает на ФПН, развившуюся на фоне нарушений имплантации, как на универсальный фактор риска внутриутробного отхождения мекония.
В ходе нашего исследования мы подтвердили общепринятую точку зрения о том, что перенашивание беременности свыше 40 недель является фактором риска МА. Так, у пациенток в группе Нб срок беременности был достоверно больше (40,52±0,22 нед.) по сравнению с группой контроля. Однако, необходимо отметить, что в нашем исследовании тенденция к перенашиванию имела значение только для ишранатального отхождения мекония, тогда как в группе На (с антенатальным окрашиванием околоплодных вод меконием) средний срок беременности не отличался от группы контроля (39,42±0,22 нед.).
При изучении соматического анамнеза у пациенток исследованных групп было выявлено, что в группе с антенатальным отхождением мекония (Па) достоверно чаще (30%) по сравнению с контролем (8,4%) встречались заболевания сердечно-сосудистой системы (ССС) (миокардиодистрофия беременных, артериальная гипертензия, пролапс митрального клапана) (р<0,05). Полученные нами результаты согласуются с данными литературы о том, что заболевания беременных, в частности сердечно-сосудистые, являются предрасполагающими факторами к отхождению мекония в околоплодные воды и развитию аспирационного синдрома (И.С. Сидорова, 2000), что также было
подтверждено в нашей работе при изучении анамнеза в ретроспективной группе -патология ССС в основной группе встречалась достоверно чаще (28%), чем в группе контроля (2%) (р<0,05). По всей видимости, патология ССС приводит к значимым нарушениям плацентарной гемодинамики, что влечет за собой активацию адаптационных систем плода
В нашей работе мы получили статистически значимые отличия по такому фактору риска МА, как обвитие пуповины вокруг шеи плода: достоверно чаще указанная ультразвуковая находка встречалась в группах Ир (основная ретроспективная) — 57,8% и На (с антенатальным мекониальным окрашиванием околоплодных вод) — 63,3% (р<0,05).
В ходе исследования интересным оказался тот факт, что инфекционная патология (инфекции мочевыводящих путей, ЛОР-органов, ОРВИ, инфекции нижнего отдела генитального тракта), выявленная в течение первой половины беременности, достоверно чаще встречалась у пациенток с интранатальным окрашиванием амниотической жидкости меконием (85,7%) по сравнению с группой контроля (30,1%) (р<0,05).
Анализируя частоту встречаемости родоразрешения путем операции кесарева сечения, мы получили статистически значимые отличия при сравнении ее между группами I (40,9%) и Па (73,3%), а также На (73,3%) и Пб (21,4%) (р<0,05) — достоверно чаще кесарево сечение было выполнено пациенткам с антенатальным окрашиванием околоплодных вод. Указанное наблюдение, с большой долей вероятности, связано с настороженным отношением акушеров к родам на фоне мекониалыюго окрашивания околоплодных вод и желанием избежать риска МА. Более высокая (в 2 раза), по сравнению с данными И.С. Сидоровой и соавт., 2000 (36,3%), частота оперативного родоразрешения на фоне антенатального отхождения мекония в нашей работе связана, по-видимому, с внедрением в клиническую практику классификации мекониальных околоплодных вод и рекомендаций по акушерской тактике на фоне данного осложнения (Г.М. Савельева, М.А. Курцер и соавт., 2005).
В ходе нашего исследования также было установлено, что в обеих группах с мекониальным окрашиванием околоплодных вод (На и Пб) синдром задержки роста плода (СЗРП) встречался достоверно чаще (56,6% и 64,3% соответственно, р<0,05) по сравнению с контролем (28,9%). На наш взгляд, это связано с тем, что у пациенток обеих основных групп еще в антенатальном периоде имелись признаки ФПН той или иной степени тяжести. Это согласуется с данными, полученными в отношении искусственных абортов, учитывая роль внутриматочных вмешательств в генезе ФПН. По современным представлениям, асимметричная задержка роста сопровождается определенным напряжением компенсаторных систем плода и снижением адаптационных резервов (1ег1апс1 У. V., 2009). При воздействии дополнительных стрессорных факторов (антенатально или интранатально) возможно истощение адаптационных резервов и развитие декомпенсации регуляторных контуров, одним из проявлений которой может являться пассаж первородного кала в амниотическую жидкость.
В нашем исследовании данное утверждение нашло подтверждение в статистически значимом снижении средней балльной оценки КТГ (в рамках БФП) во На группе по сравнению с контролем, что указывает на развитие смешанного ацидоза у плодов в группе с антенатальным окрашиванием вод меконием.
При анализе показателей ДПМ было вьивлено, что у пациенток Нб группы в антенатальном периоде имели место наименьшие значения систоло-диастолического отношения (СДО) и индекса резистентности (ИР) в маточных артериях со стороны, противоположной плаценте. При этом статистической значимости отличия данных показателей достигали также между Па и Иб группами (р<0,05). Данный факт указывает на более интенсивный кровоток в микроциркуляторном русле матки у пациенток Нб группы. Возможно, это являлось следствием перераспределения кровотока между маточными артериями на фоне повышения сократительной активности матки перед родами.
С целью определения «готовности» к отхождению мекония мы проводили измерение диаметра ампулы прямой кишки плода в антенатальном периоде. Интересным оказался тот факт, что указанный показатель в сроке доношенной беременности у пациенток Па группы (с антенатальным отхождением мекония) был статистически значимо больше (16,3±0,93 мм), чем аналогичный показатель в контрольной группе (13,63±0,43 мм) (р <0,05). В группе Пб (в которой отхождение мекония было отмечено интранатально) средняя величина диаметра ампулы прямой кишки плода (15,0±2,64 мм) также превышала значения в контрольной группе, однако различия в данном случае не достигали статистической значимости. Выявленная закономерность позволяет предположить, что увеличение диаметра ампулы прямой кишки плода более 15 мм в антенатальном периоде свидетельствует о «готовности» к отхождению мекония под влиянием провоцирующих факторов.
С нашей точки зрения, механизмы опорожнения прямой кишки плода в анте- и интранатальном периодах изучены недостаточно. В связи с этим нам представлялось интересным исследовать механизмы адаптации у плодов с различным временем отхождения мекония.
Одним из немногих внутриутробных биофизических параметров, который в настоящее время может быть зарегистрирован стабильно, достоверно и без каких-либо инвазивных вмешательств, является ритм сердечной деятельности плода. А, как известно, его характеристики зависят от состояния собственных механизмов регуляции ССС и функций других систем организма, в том числе дыхательной, эндокринной и т.д.
В связи с вышеизложенным, для определения состояния регуляторных механизмов плода и оценки его компенсаторно-приспособительных реакций у обследуемых женщин проводилась КИГ в сроки доношенной беременности. С целью выяснения состояния регуляторных систем плода производили оценку данных статистического анализа антенатальных кардиоинтервалограмм, а также данные спектрального анализа. При этом были выявлены как медленноволновые, так и быстроволновые колебания сердечного ритма. Мы проанализировали суммарную спектральную плотность как медленных, так и быстрых волн, а также коэффициент
интенсивности быстрых (дыхательных) спектральных волн (Н.В. Рымашевский, А.Ф. Михельсон, 1988). Анализируя полученные результаты, было выявлено, что в антенатальном периоде в обеих группах с мекониальными околоплодными водами имела место активация адаптационно-приспособительных систем плодов. Однако, характер адаптации в группах На и Пб был различным.
В группе На (с антенатальным окрашиванием околоплодных вод меконием) адаптация выражалась в статистически значимом, по сравнению с группой контроля, уменьшении коэффициента вариации (СУ) и дисперсии (Б) в сочетании со снижением абсолютного дифференциального индекса (АБ1) и энтропии (Н). Уменьшение вариабельности в ряду кардиоинтервалов (по данным СУ и 8) указывает на более высокий тонус симпатического отдела вегетативной нервной системы (Р. М. Баевский и соавт., 1984). В то же время, статистически значимое по сравнению с контролем снижение (который определяет выраженность вариабельности последовательных интервалов вне зависимости от их направленности и отражает регуляторное влияние дыхательных движений на сердечный ритм) указывает на уменьшение активности дыхательного центра плода. Также у плодов данной группы отмечалось уменьшение Н, что указывает на снижение количества контуров регуляции ритмом сердца (таб. 1).
Таблица 1
Антенатальные показатели КИГ плодов: дифференциальный индекс (Б)), абсолютный дифференциальный индекс (А01),
энтропия(Н)
Показате I группа, п=83 На группа, п=30 Пб группа, п=14 Значимость различий, р
ль I-IIa I-II6 На-Нб
Di -0,001±0,020 -0,071±0,084 0,034±0,026 р>0,05 р>0,05 р>0,05
ADi 35,19±0,713 28,31±2,90 38,56±6,706 р <0,05 р>0,05 р>0,05
Н 2,303±0,027 2,081±0,096 2,487±0,198 р <0,05 р>0,05 р>0,05
В нашем исследовании при детальном анализе суммарного спектра быстрых дыхательных волн было обнаружено, что хотя у плодов с антенатальным отхождением мекония амплитуда дыхательных движений и была понижена (по данным ADi), однако активность дыхательного центра выражалась в появлении дыхательных волн I, II, III и IV типов. Это свидетельствует об активности дыхательных центров, эффекторным
звеном которых являются межреберные мышцы. Другими словами у плодов данной группы имела место комбинация низкоамплитудных дыхательных движений различной частоты.
Необходимо отметить, что по данным спектрального анализа в контрольной группе имела место наименьшая активность дыхательного центра — выделялись только дыхательные волны I типа (наиболее короткопериодические). Однако, амплитуда таких дыхательных движений была достаточно выражена (по данным АБ1).
Общим принципом строения волновой структуры сердечного ритма человека, по мнению Р.М. Баевского (1976, 1979), является увеличение длительности периода колебаний по мере роста уровня управления. Медленные волны сердечного ритма характеризуют регуляторное влияние гипоталамических структур и биологически активных жидкостей организма
При анализе графиков спектра медленных волн сердечного ритма, было выявлено, что в группе На медленные волны были более выражены, чем в группе контроля, что указывает на включение в процесс адаптации сосудодвигательного центра, центра терморегуляции, а также гуморального звена. Другими словами, в данной группе имела место активация подкорковых структур, участвующих в долговременной адаптации.
Таким образом, у плодов в группе Па антенатальное отхождение мекония происходило на фоне высокого тонуса симпатического отдела вегетативной нервной системы и признаков смешанного ацидоза в сочетании с низкоамплитудными дыхательными движениями различной частоты и активацией подкорковых структур, участвующих в долговременной адаптации. Указанные компенсаторные реакции, вероятнее всего, явились следствием ФПН (о чем свидетельствует повышенная частота асимметричной формы СЗРП, а также предшествующих внутриматочных вмешательств) и системных гемодинамических нарушений в организме матери (на фоне заболеваний ССС). Однако, для того, чтобы произошел антенатальный пассаж мекония, необходима определенная «готовность» в виде увеличения диаметра ампулы прямой кишки более 15 мм, а также провоцирующие факторы, одним из которых может служить стимуляция сино-каротидного рефлекса при обвитии пуповины.
По нашему мнению, сочетание пассажа мекония в околоплодные воды с ДА в данном случае незначительно повышает риск МА, так как дыхательные движения носят низкоамплитудный, поверхностный характер, но при этом являются регулярными, так как осуществляются за счет стимуляции межреберных мышц как инспираторным, так и экспираторным отделами дыхательного центра
В группе Нб (с интранатальной окраской околоплодных вод меконием) направленность плодовых адаптационных реакций в антенатальном периоде отличалась от группы На Здесь имели место статистически значимые, по сравнению с контролем, увеличение средней продолжительности кардиоинтервалов (М), моды (Мо) и уменьшение асимметрии (Аз) (таб. 2), а также меньшие значения индекса вегетативного равновесия (ИВР), индекса напряжения (ИН) и вегетативного показателя ритма (ВПР) (таб. 3).
Таблица 2
Антенатальные показатели КИТ плодов: среднее значение продолжительности сердечного цикла (М), асимметрия (Аэ), эксцесс
(Ех), мода (Мо)
I группа, п=83 Па группа, п=30 Пб группа, п=14 Значимость различий, р
Показатель 1-На 1-Иб На-Нб
М 0,44&Ш,004 0,443±0,006 0,468±0,006 р>0,05 р <0,05 р <0,05
Мо 0,427±0,004 0,429±0,008 0,463±0,008 р>0,05 р <0,05 р <0,05
Аэ 1,126±0,06 1,172±0,279 0,93 0±0,0,71 р>0,05 р <0,05 р>0,05
Ех 2,032±0,19 3,297±0,86 1,732±0,69 р>0,05 р>0,05 р>0,05
Математическое ожидание (М) отражает конечный результат всех регуляторных влияний на аппарат кровообращения, а Мо позволяет оценить наиболее вероятный уровень функционирования синусового узла. Увеличение этих показателей свидетельствует об урежении ритма сердцебиений плода и активации вагусных регуляторных влияний. Уменьшение Аэ, меньшие значения ИВР указывают на смещение вегетативного баланса в сторону преобладания активности парасимпатического отдела вегетативной нервной системы, более низкие значения ВПР — на повышение активности автономного контура регуляции сердечного ритма, более низкие значения ИН — на меньшую степень централизации управления сердечными сокращениями (Р. М. Баевский и соавт., 1984).
Таблица 3
Антенатальные показатели КИГ плодов: индекс вегетативного равновесия (ИВР), индекс напряжения регуляторных систем (ИН), вегетативный показатель ритма (ВПР), показатель адекватности процессов регуляции ___(ПАПР) _ _
Показатель I группа, п=83 Па группа, п=30 Пб группа, п=14 Значимость различий, р
1-Па Шб На-Нб
ИВР 1,254±0,054 1,732±0,334 0,857±0,190 р>0,05 р<0,05 р<0,05
ИН 149,53±6,89 202,95±39,83 93,003±22,45 р>0,05 р <0,05 р<0,05
ВПР 12,73±0,332 13,829±1,458 10,590±0,286 р>0,05 р <0,05 р<0,05
ПАПР 0,547±0,018 0,624±0,056 0,431±0,068 р>0,05 р>0,05 р<0,05
Во Иб группе в адаптационные реакции включалось наибольшее количество регуляторных контуров (о чем свидетельствуют наиболее высокие значения Н) и отмечалась наиболее выраженная дыхательная активность (по данным и АОГ). Хотя,
необходимо отметить, что отличия Н, Di и ADi от соответствующих показателей в группе контроля не достигали статистической значимости.
Спектральный анализ сердечного ритма плодов в данной группе выявил наименьшее значение коэффициента интенсивности быстрых (дыхательных) спектральных волн (Ки), при этом статистической значимости достигали различия между группами IIa и Иб.
Так же, как и в группе IIa, у плодов группы 116 при спектральном анализе отмечались выраженные волны I, II, III и IV типов, свидетельствующие о более выраженной, чем в группе контроля, активации дыхательного центра. Однако, в группе 116 появлялись еще и волны V типа («gasps»), что указывает на активацию дыхательного центра, эффекторным звеном которого является диафрагма. Именно за счет появления последнего типа волн имело место статистически значимое уменьшение в данной группе Ки.
При анализе графиков спектра медленных волн сердечного ритма во 116 группе очевидно, что медленные волны были более выражены, чем в группе IIa и в группе контроля. Это указывает на активное включение в процесс адаптации сосудодвигательного центра, центра терморегуляции, а также гуморального звена. При этом во 116 группе при спектральном анализе выделялись медленные волны с большим периодом, что свидетельствует о подключении более высоких уровней управления сердечным ритмом.
Отсутствие антенатального отхождения мекония, даже не смотря на появление активности дыхательного центра «gasps» (с преобладанием инспираторного компонента), позволяет сделать вывод о низком риске антенатальной МА у плодов данной группы.
При анализе данных интранатальной оценки состояния фетоплацентарного комплекса (ФПК), были получены данные об отличии его состояния на фоне родовой деятельности в группах с различным временем появления мекония в околоплодной жидкости.
В частности, в группе IIa (с антенатальным отхождением мекония) была выявлена наибольшая вариабельность сердечного ритма и наибольшая частота появления акцелераций (по данным КТГ-мониторинга), что сочеталось со статистически значимо повышенной (по сравнению с контролем) двигательной активностью плода. Мы полагаем, что это может быть проявлением начальных признаков гипоксии, проявление которых мы наблюдали у плодов данной группы в антенатальном периоде. Как известно, компенсаторной реакцией в начальных стадиях гипоксии является повышение сократительной активности произвольной мускулатуры с целью усиления притока крови и компенсации кислородной недостаточности.
Также в данной группе при проведении интранатальной ДПМ было выявлено ухудшение микроциркуляции (по данным СДО в маточной артерии со стороны плаценты) в материнской части плаценты, что, скорее всего, свидетельствует об усугублении плацентарной недостаточности на фоне родовой деятельности.
У плодов этой группы также были отмечены наименьшие показатели индексов сосудистого сопротивления в средних мозговых артериях (при измерении в период между маточными сокращениями), что указывает на централизацию фетальной гемодинамики и свидетельствует о напряжении адаптационных систем.
Для изучения регуляторных механизмов сердечно-сосудистой и дыхательной систем плода в родах был использован метод КИГ. Регистрацию кардиоинтервалограмм плода проводили в стандартных условиях в первом периоде родов.
В контрольной группе спектральный анализ сердечной деятельности плодов показал незначительную активность дыхательного центра — выявлялись только короткопериодические волны I и II типов. При этом имела место незначительная активация звеньев долговременной адаптации (по данным спектрального анализа медленных волн).
Отсутствие двигательной и ДА плода является одной из компенсаторно-приспособительных реакций на родовой стресс (П.С. Бабкин, И.П. Бабкина, 1987). Такое состояние плода в родах было охарактеризовано П.С. Бабкиным как физиологический гипобиоз. В то же время было установлено, что появление дыхательной активности в течение родов у плодов с хронической внутриутробной гипоксией может приводить к развитию аспирационного синдрома, особенно при наличии мекония в околоплодных водах (Л.Г. Сичинава, О.Г. Шраер, 1990).
В группе с антенатальным отхождением мекония (IIa) при спектральном анализе сердечного ритма плодов отмечена более выраженная активность дыхательного центра, о чем свидетельствовало появление в спектре сердечного ритма быстрых дыхательных волн I, II, III и IV типов. Также у плодов данной группы имело место включение долговременной адаптации, о чем свидетельствовало некоторое повышение мощности и выраженности медленных волн в спектре сердечного ритма. Повышение индекса активации подкорковых структур происходило за счет MaxSp (суммарная мощность медленных волн), что указывает на преимущественную роль в процессе интранатальной адаптации подкорковых центров, отвечающих за регуляцию внутрисосудистого давления, температуры, химического состава крови и т.п. При этом роль дыхательного центра была менее выраженной, о чем свидетельствует отсутствие отличий от контроля в величине суммарной мощности быстрых волн (MaxSpN).
Таким образом, выявленные особенности течения интранатального периода у плодов группы IIa (с антенатальным пассажем мекония) явились следствием процессов, начавшихся до начала родовой деятельности. Указанные механизмы адаптации носили компенсаторный характер, без признаков дезадаптации.
Интранатальное повышение активности дыхательного центра на фоне антенатального пассажа мекония в околоплодную жидкость, без сомнения, повышает риск МА. Однако, этот риск можно назвать умеренным, так как регулярные дыхательные движения (за счет межреберных мышц) в данном случае возникают в сочетании со сбалансированным включением адаптационных резервов.
В группе Иб (с интранатальным отхождением мекония) состояние ФПК на фоне родовой деятельности имело некоторые особенности.
В частности, в данной группе, также как и в группе IIa, были отмечены признаки интранатального усугубления плацентарной недостаточности. Однако, в данном случае наибольшие (по сравнению с остальными группами) величины индексов сосудистого сопротивления определялись в артериях пуповины, что свидетельствует о субкомпенсации микроциркуляции в плодовой части плаценты (в отличие от группы IIa, где происходило ухудшение кровотока в материнской части плаценты).
Также в группе 116 интранатально были получены наибольшие значения индексов сосудистого сопротивления в маточной артерии на контрлатеральной по отношению к плаценте стороне. Последнее наблюдение можно связать с нарушением сократительной деятельности матки вследствие длительной родостимуляции, которая в данной группе имела место в 35,7% случаев в связи с первичной слабостью родовой деятельности.
При статистическом анализе кардиоингервалограмм, записанных интранатально, имели место более высокие, чем в I группе, значения As и эксцесса (Ех), что свидетельствует о большей значимости нестационарных процессов и более высокой скорости (крутизне) изменений случайных нестационарных компонентов динамических рядов. Указанные отличия свидетельствуют о более выраженной симпатикотонии у плодов данной группы по сравнению с контролем (таб. 4).
Таблица 4
Интранатальные показатели КИТ плодов в группах: среднее значение продолжительности сердечного цикла (М), асимметрия (As), эксцесс (Ех), мода (Мо)
Показател ь I группа, п=83 IIa группа, п=30 116 группа, п=14 Значимость различий, р
I-IIa 1-Иб Па-Пб
М 0,445±0,005 0,423±0,015 0,446±0,017 р>0,05 р>0,05 р>0,05
Мо 0,425±0,006 0,410±0,015 0,432±0,023 р>0,05 р>0,05 р>0,05
As 1,174±0,068 1,012±0,196 1,724±0,476 р>0,05 р< 0,05 р>0,05
Ех 2,006±0,229 1,272±0,389 4,281±1,792 р>0,05 р< 0,05 р>0,05
Адекватно оценить активность дыхательных центров возможно с помощью спектрального анализа его сердечного ритма. В группе с интранатальным отхождением мекония (116) индекс активации подкорковых структур был достоверно ниже (0,72±0,13), чем в группе контроля (1,40±0,14) (р< 0,05). При этом уменьшение индекса происходило за счет снижения мощности как быстрых, так и медленных волн. Вероятно, это указывает на истощение адаптационных резервов на фоне интранатального стресса. Указанные особенности сопровождались появлением дыхательных волн V типа («gasps») и увеличением количества медленных волн при спектральном анализе сердечного ритма плода.
По нашему мнению, в данном случае риск мекониальной аспирации максимален, так как имеет место появление судорожных инспираторных дыхательных движений в сочетании с интранатальным пассажем мекония на фоне дезадапатции регуляторных систем.
При анализе частоты проведения утеротонической терапии было выявлено, что достоверно чаще она применялась в группе с интранатальным отхождением мекония (35,7%) (в контрольной группе — 4,8%, в группе с антенатальным мекониальным пассажем — 6,6% [р<0,05]). Также в нашей работе было отмечено, что часто а встречаемости аномалий родовой деятельности статистически значимо различалась между контрольной и основными группами: в группах с мекониальной окраской вод они встречались чаще. Полученные данные согласуются с данными литературы (В.В. Абрамченко и соавт., 2004) о том, что аномалии родовой деятельности являются основным осложнением родового акта у рожениц с наличием мекония в водах (31,1%).
При оценке состояния новорожденных по шкале Апгар были выявлены достоверные отличия между контрольной и основными группами как на 1, так и на 5 минутах (р<0,05) — в контрольной группе она была достоверно выше как по сравнению с группой с антенатальным окрашиванием околоплодных вод, что говорит о том, что плоды Па группы уже антенатально испытывали ацидоз и рождались с признаками асфиксии, и так и с группой, в которой отхождение мекония отмечалось в процессе родов (116), в которой новорожденные испытывали дистресс интранатально (рис.1).
Рис. 1. Различия показателей новорожденных по шкале APGAR
Нами были отслежены перинатальные исходы у новорожденных исследуемых групп. Было выявлено, что в группе с интранатальным окрашиванием околоплодных вод
1-я минута 5-я минута
Достоверность различий показателей групп: *-р,.„.< 0,05; **-р ,.„<(),05
Группы: ■ I И На Ш ||6
меконием (116) по сравнению с группой контроля аспирация, а также синдром аспирации мекония встречались достоверно чаще (35,7% и 14,3% соответственно). Также в этой группе статистической значимости достигали отличия в частоте встречаемости церебральных нарушений и признаков внутриутробного инфицирования (57,1% и 64,3% соответственно). Полученные данные согласуются с достоверным повышением частоты инфекционной патологии в первой половине беременности у пациенток Ii6 группы. На ИВЛ находились двое новорожденных из данной группы, которые впоследствие были переведены в отделения реанимации специализированных лечебных учреждений. Таким образом, частота перинатальной патологии в группе с интранатальным отхождением мекония указывает на высокий риск аспирационных осложнений.
В группе с антенатальным отхождением мекония (lia) также имел место один случай мекониальной аспирации (3,3%), однако, статистической значимости различия с группой контроля не достигали.
Таблица 5
Шкала балльной оценки риска мекониальной аспирации
Фактор риска Вероятность аспирации (в баллах)
Предшествующие внутриматочные вмешательства 2
СЗРП (асимметричная форма) 2
Заболевания ССС 1
Инфекционные осложнения в I половине беременности 1
Срок гестации более 40 недель 1
Патологический прелиминарный период 2
Аномалии родовой деятельности 1
Родостимуляция 2
Обвитие пуповины вокруг шеи плода 1
Расширение ампулы прямой кишки плода более 15 мм 1
Симпатикотония в сочетании с регулярной
низкоамплитудной дыхательной активностью и 1
увеличением спектральной мощности медленных волн в
антенатальном периоде
Регулярная дыхательная активность в интранатальном 1
периоде
ИАП менее 1 в сочетании с симпатикотонией в 9
интранатальном периоде
Активность дыхательного центра типа «gasps» в 2
интранатальном периоде
1 — 5 баллов — низкая степень риска (вероятность аспирации менее 30%) 6-15 баллов — средняя степень риска (вероятность аспирации от 30 до 70%) 16-20 баллов — высокая степень риска (вероятность аспирации более 70%)
Нами была разработана шкала балльной оценки риска мекониальной аспирации (таб.5). Эффективность приведенной шкалы была подтверждена настоящим клиническим исследованием: у новорожденных с мекониальной аспирацией средняя сумма баллов составила 18±1,5, ау новорожденных без аспирации-4,5±2,5 (р < 0,05).
Таким образом, результаты исследования сердечного ритма плода позволяют установить определенные закономерности его адаптационных механизмов. Выявление доклинических критериев неудовлетворительной адаптации плода к родовому стрессу значительно расширяет диагностические и тактические возможности акушеров-гинекологов как в анте-, так и в интранатальном периодах. Проведенные исследования показали, что метод компьютерной кардиоинтервалографии является специфическим в плане оценки и анализа регуляторных механизмов плода. Адекватное использование полученных новых знаний должно способствовать снижению перинатальной заболеваемости и смертности.
Выводы
1. Кардиоинтервалография — высокоинформативный метод, позволяющий оценить состояние адаптационных резервов и дыхательную активность плода в анте- и интранатальном периодах, а также построить прогноз в отношении риска мекониальной аспирации.
2. Предрасполагающими факторами к пассажу мекония в околоплодные воды при доношенной беременности являются предшествующие внутриматочные вмешательства, развитие патологического прелиминарного периода, асимметричная форма синдрома задержки развития плода; риск антенатального отхождения мекония повышается при наличии у беременной заболеваний сердечно-сосудистой системы, интранатального -при инфекционных осложнениях первой половины беременности, сроке гестации более 40 недель, аномалий родовой деятельности, применении родостимуляции.
3. Антенатальное отхождение мекония в околоплодные воды происходит на фоне активации компенсаторно-приспособительных реакций плода в виде повышения тонуса симпатического отдела вегетативной нервной системы в сочетании с регулярной низкоамплитудной дыхательной активностью и включением механизмов долговременной адаптации, а также расширения ампулы прямой кишки плода более 15 мм и бвития пуповины вокруг шеи; при этом риск мекониальной аспирации умеренный.
4. Интранатально у плодов с дородовым пассажем мекония отмечаются начальные признаки активация адаптационных механизмов и появление регулярной дыхательной активности, что умеренно повышает риск мекониальной аспирации.
5. Интранатальный пассаж мекония происходит на фоне дезадаптации регуляторных систем плода в сочетании с появлением дыхательной активности типа «gasps», что в наибольшей степени повышает риск мекониальной аспирации.
Практические рекомендации
1. В протокол ультразвукового исследования фето-плацентарного комплекса при доношенной беременности необходимо включать измерение диаметра ампулы прямой кишки плода; при увеличении данного показателя до 15 мм и более в сочетании с обвитием пуповины вокруг шеи у плода имеется «готовность» к антенатальному пассажу мекония в околоплодные воды.
2. В комплекс анте- и интранатальной оценки состояния плода необходимо включать исследование его дыхательной активности методом кардиоинтервалографии (спектральный анализ).
3. При наличии антенатального окрашивания околоплодной жидкости меконием необходимо включение в комплекс интранатальных диагностических мероприятий оценки адаптационных систем плода и его дыхательной активности с использованием кардиоинтервалографии; при появлении признаков активации дыхательной системы (дыхательные волны 1,11, III и IV типов) риск мекониальной аспирации существенно повышается, что требует исключения утеротонической терапии, а также своевременного пересмотра акушерской тактики в пользу отказа от консервативного лечения аномалий родовой деятельности.
4. При появлении дыхательной активности типа «gasps» (по данным спектрального анализа) в сочетании с интранатальным отхождением мекония и дезадаптацией регуляторных систем (симпатшсотония в сочетании с уменьшением ИАП менее 1) у плода существенно повышается риск мекониальной аспирации, что требует своевременной корректировки акушерской тактики.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Буштырева И.О., Чернавский В.В., Колганова A.A., Волокитина Е.И., Шумилина Е.В., Хаванская JI.C. Расширение ампулы прямой кишки плода как дополнительный фактор риска мекониальной аспирации//Материалы научно-практической конференции «Проблемы репродуктивного здоровья женщин», Ростов-на-Дону. -2008.-С. 15.
2. Буштырева И.О., Чернавский В.В., Колганова A.A., Шумилина Е.В., Волокитина Е.И., Тасина Е.И. Исследование факторов риска мекониальной аспирации // Материалы научно-практической конференции «Здоровый образ жизни — основа репродуктивного благополучия», Ростов-на-Дону.-2008. — С. 22-24.
3. Куиггырева И.О., Чернавский В.В., Колганова A.A., Волокитина Е.И., Шумилина Е.В., Порываева М.Ю. Факторы риска мекониальной аспирации — новые аспекты // Материалы научно-практической конференции «Проблемы репродуктивного здоровья женщин», Ростов-на-Дону. — 2008. — С. 13-14.
4. Буштырева И.О., Чернавский В.В., Колганова A.A., Хаванская Л.С., Порываева М.Ю. Адаптационные резервы плода и риск мекониальной аспирации // Материалы научно-практической конференции «Ранние сроки беременности. Профилактика репродуктивных потерь», Ростов-на-Дону — 2009. — С. 19-20.
5. Буштырева И.О., Чернавский В.В., Колганова A.A., Волокитина Е.И., Яковенко Е.П. Оценка влияния препаратов, используемых для лечения фетоплацентарной недостаточности, на характер околоплодных вод в родах // Материалы 10-го Всероссийского научного форума «Мать и дитя», М. — 2009. — С. 34
6. Буштырева И.О., Чернавский В.В., Колганова A.A., Волокитина Е.И., Пармон В.Я., Хаванская JI.C. Возможности прогноза мекониального окрашивания околоплодных вод // Материалы междисциплинарной научно-практической конференции по акушерству, перинатологии и реанимации в неонатологии «Актуальные проблемы невынашивания беременности», Владикавказ. — 2009. — С.14-15.
7. Чернавский В.В., Буштырева И.О., Колганова A.A., Лебеденко Е.Ю. Особенности гомеостатических механизмов у плода на фоне интранатального дистресса// Кубанский научный медицинский вестник. — Краснодар, 2010. -№3-4.-С. 202-205.
8. Буштырева И.О., Чернавский В.В., Колганова A.A., Хаванская Л.С., Богданова Т.В. Изучение дыхательной активности плода в родах с целью прогнозирования мекониальной аспирации // Материалы 11-го Всероссийского научного форума «Мать и дитя», М. — 2010. — С. 37
9. Буштырева И.О., Чернавский В.В., Колганова A.A. Синдром аспирации мекония// Саратовский научно-медицинский журнал. — Саратов, 2010. — Т.6, №2. -С. 378-383.
Формат 60×84’/16. Бумага офсетная. Тираж 100 экз. Зак. 45.
Отпечатано в учебной типографии ГОУ ВПО «РостГМУ Росздрава». 344022, г. Ростов-на-Дону, пер. Нахичеванский, 29
Синдром аспирации мекония | Johns Hopkins Medicine
Что такое синдром аспирации мекония?
Меконий — это первый кал или кал новорожденного. Синдром аспирации мекония возникает, когда новорожденный вдыхает смесь мекония и амниотической жидкости в легкие примерно во время родов. Синдром аспирации мекония, ведущая причина тяжелых заболеваний и смерти новорожденных, встречается примерно от 5 до 10 процентов рождений. Обычно это происходит, когда плод подвергается стрессу во время родов, особенно когда у ребенка истек срок родов.
Симптомы
- Голубоватый цвет кожи младенца
- Проблемы с дыханием
- Темное зеленоватое пятно или полосы околоплодных вод или явное присутствие мекония в околоплодных водах
- Вялость у новорожденного при рождении
Диагностика
- Перед родами монитор плода может показывать медленное сердцебиение.
- При рождении меконий можно увидеть в околоплодных водах. Самый точный тест для проверки возможной аспирации мекония заключается в поиске пятен мекония на голосовых связках с помощью ларингоскопа.
- Аномальные звуки дыхания, особенно грубые, потрескивающие, слышны через стетоскоп.
- Анализ газов крови показывает пониженную кислотность крови, пониженное содержание кислорода и повышенное содержание углекислого газа.
- Рентген грудной клетки может показать пятнистые или полосатые участки на легких.
Лечение
Рот новорожденного следует отсосать, как только во время родов станет видна голова. Дальнейшее лечение необходимо при сильном окрашивании мекония и дистрессе плода.Младенец может быть помещен в ясли особого ухода или отделение интенсивной терапии новорожденных. Другие методы лечения могут включать:
- Антибиотики для лечения инфекций
- Дыхательный аппарат для поддержания давления в легких
- Использование грелки для поддержания температуры тела
- Постукивание по груди для отделения секрета
Если во время беременности не было никаких признаков дистресс-синдрома плода, а ребенок — здоровый доношенный новорожденный, специалисты рекомендуют не проводить глубокое отсасывание дыхательного горла из опасения вызвать определенный тип пневмонии.
Прогноз
В большинстве случаев прогноз отличный и нет серьезных побочных эффектов. В более тяжелых случаях могут возникнуть проблемы с дыханием, хотя обычно они проходят через два-четыре дня. Однако учащенное дыхание может сохраняться в течение нескольких дней. Младенец с тяжелой аспирацией, которому требуется дыхательный аппарат, может иметь более осторожный исход. Недостаток кислорода в матке или осложнения аспирации мекония могут привести к повреждению головного мозга. Аспирация мекония редко приводит к необратимому повреждению легких.
Синдром аспирации мекония: причины, симптомы и диагностика
Что такое синдром аспирации мекония?
Меконий — это темно-зеленый фекальный материал, который образуется в кишечнике плода до рождения. После родов у вашего новорожденного в течение первых нескольких дней жизни будет выделяться мекониевый стул.
Стресс, который ваш ребенок испытывает до или во время родов, может привести к выделению мекония в стуле, пока он еще находится в матке. Стул мекония затем смешивается с околоплодными водами, окружающими плод.
Ваш ребенок может вдохнуть смесь мекония и околоплодных вод в легкие незадолго до, во время или сразу после рождения. Это явление известно как синдром аспирации мекония или синдром аспирации мекония (MAS).
Хотя MAS часто не опасен для жизни, он может вызвать серьезные осложнения для здоровья вашего новорожденного. И, если MAS тяжелый или не лечится, он может быть фатальным.
МАС может возникнуть, когда ваш ребенок испытывает стресс. Стресс часто возникает, когда количество кислорода, доступного для плода, уменьшается.К распространенным причинам стресса у плода относятся:
- беременность, которая превышает установленный срок (более 40 недель)
- трудные или продолжительные роды
- определенные проблемы со здоровьем, с которыми сталкивается мать, включая гипертонию (высокое кровяное давление) или диабет
- инфекция
Плод начинает вырабатывать меконий только на более поздних сроках беременности, поэтому, когда срок беременности истекает, плод может подвергаться воздействию мекония в течение более длительного периода времени.
По мере того, как беременность приближается к сроку и позже, количество околоплодных вод также уменьшается, в ней концентрируется меконий. В результате MAS чаще встречается у поздно родившихся новорожденных, чем у доношенных новорожденных. MAS редко встречается у недоношенных новорожденных.
Респираторный дистресс является наиболее заметным симптомом МАС. Ваш младенец может дышать учащенно или кряхтеть во время дыхания. Некоторые новорожденные могут перестать дышать, если их дыхательные пути заблокированы меконием. У вашего ребенка также могут быть следующие симптомы:
- синеватый цвет кожи, который называется цианозом
- вялость
- низкое артериальное давление
Диагноз ставится на основании симптомов вашего новорожденного и наличия мекония в околоплодных водах. .
Ваш врач послушает грудную клетку вашего младенца с помощью стетоскопа, чтобы обнаружить звуки ненормального дыхания. Для подтверждения диагноза обычно используются несколько методов:
- Анализ газов крови для оценки уровней кислорода и углекислого газа
- Рентген грудной клетки, чтобы определить, попал ли материал в легкие вашего новорожденного
Если произойдет MAS, ваш новорожденный будет требуется немедленное лечение для удаления мекония из верхних дыхательных путей. После родов ваш врач немедленно отсосит жидкость из носа, рта и горла.
Если ваш ребенок плохо дышит или плохо реагирует, в дыхательное горло (трахею) новорожденного можно ввести трубку для отсасывания жидкости, содержащей меконий, из трахеи. Затем отсасывание может продолжаться до тех пор, пока в удаленном материале не перестанет появляться меконий.
Если ваш новорожденный все еще не дышит или у него низкая частота пульса, врач воспользуется сумкой и маской, чтобы помочь ему дышать. Это доставит вашему ребенку кислород и поможет надуть его легкие.
Вашему врачу может потребоваться вставить трубку в дыхательное горло вашего новорожденного, чтобы помочь ему дышать, если ребенок очень болен или не дышит самостоятельно.
После оказания неотложной помощи ваш новорожденный может быть помещен в специальное отделение для наблюдения за его дыханием. Во избежание осложнений MAS может потребоваться дополнительное лечение. Пять распространенных методов лечения включают:
- кислородная терапия, чтобы убедиться, что в крови достаточно кислорода
- использование лучистого обогревателя, чтобы помочь вашему ребенку поддерживать температуру тела
- антибиотики, такие как ампициллин и гентамицин, для предотвращения или лечения инфекции
- использование аппарата искусственной вентиляции легких (дыхательный аппарат), чтобы помочь вашему младенцу дышать
- экстракорпоральная мембранная оксигенация (ЭКМО), если ваш ребенок не реагирует на другие виды лечения или имеет высокое кровяное давление в легких (для этого лечения используется помпа и машина, которая выполняет функцию легких, выполняет работу сердца и легких вашего новорожденного, чтобы эти органы могли зажить)
У большинства новорожденных с MAS не будет никаких долгосрочных осложнений для здоровья.Однако МАС — серьезная проблема, которая может немедленно сказаться на здоровье вашего новорожденного. Меконий в легких может вызвать воспаление и инфекцию.
Меконий также может блокировать дыхательные пути, что может вызвать чрезмерное расширение легких. Если легкое чрезмерно расширяется или надувается слишком сильно, оно может разорваться или разрушиться. Затем воздух из легкого может накапливаться в грудной полости и вокруг легкого. Это состояние, известное как пневмоторакс, затрудняет повторное наполнение легких.
MAS увеличивает риск развития стойкой легочной гипертензии новорожденного (PPHN) у вашего ребенка.Высокое кровяное давление в сосудах легких ограничивает кровоток и затрудняет правильное дыхание вашего ребенка. PPHN — редкое, но опасное для жизни заболевание.
В редких случаях тяжелая форма МАС может ограничивать поступление кислорода в мозг. Это может вызвать необратимое повреждение мозга.
Младенцы с легкими осложнениями MAS обычно хорошо выздоравливают. Младенцы, у которых в результате MAS развивается повреждение головного мозга или PPHN, могут на протяжении всей жизни сталкиваться с проблемами со здоровьем, требующими медицинской помощи.
Раннее обнаружение — лучшая защита от MAS.Мониторинг плода перед родами может определить, испытывает ли ваш ребенок стресс.
Ваш врач может принять меры для облегчения дистресса плода во время родов и снижения вероятности развития МАС. А если ваш ребенок испытывает стресс, ваш врач будет готов немедленно осмотреть и лечить вашего ребенка, если у него есть признаки MAS.
Синдром аспирации мекония: причины, симптомы и диагностика
Что такое синдром аспирации мекония?
Меконий — это темно-зеленый фекальный материал, который образуется в кишечнике плода до рождения.После родов у вашего новорожденного в течение первых нескольких дней жизни будет выделяться мекониевый стул.
Стресс, который ваш ребенок испытывает до или во время родов, может привести к выделению мекония в стуле, пока он еще находится в матке. Стул мекония затем смешивается с околоплодными водами, окружающими плод.
Ваш ребенок может вдохнуть смесь мекония и околоплодных вод в легкие незадолго до, во время или сразу после рождения. Это явление известно как синдром аспирации мекония или синдром аспирации мекония (MAS).
Хотя MAS часто не опасен для жизни, он может вызвать серьезные осложнения для здоровья вашего новорожденного. И, если MAS тяжелый или не лечится, он может быть фатальным.
МАС может возникнуть, когда ваш ребенок испытывает стресс. Стресс часто возникает, когда количество кислорода, доступного для плода, уменьшается. К распространенным причинам стресса у плода относятся:
- беременность, которая превышает установленный срок (более 40 недель)
- трудные или продолжительные роды
- определенные проблемы со здоровьем, с которыми сталкивается мать, включая гипертонию (высокое кровяное давление) или диабет
- инфекция
Плод начинает вырабатывать меконий только на более поздних сроках беременности, поэтому, когда срок беременности истекает, плод может подвергаться воздействию мекония в течение более длительного периода времени.
По мере того, как беременность приближается к сроку и позже, количество околоплодных вод также уменьшается, в ней концентрируется меконий. В результате MAS чаще встречается у поздно родившихся новорожденных, чем у доношенных новорожденных. MAS редко встречается у недоношенных новорожденных.
Респираторный дистресс является наиболее заметным симптомом МАС. Ваш младенец может дышать учащенно или кряхтеть во время дыхания. Некоторые новорожденные могут перестать дышать, если их дыхательные пути заблокированы меконием. У вашего ребенка также могут быть следующие симптомы:
- синеватый цвет кожи, который называется цианозом
- вялость
- низкое артериальное давление
Диагноз ставится на основании симптомов вашего новорожденного и наличия мекония в околоплодных водах. .
Ваш врач послушает грудную клетку вашего младенца с помощью стетоскопа, чтобы обнаружить звуки ненормального дыхания. Для подтверждения диагноза обычно используются несколько методов:
- Анализ газов крови для оценки уровней кислорода и углекислого газа
- Рентген грудной клетки, чтобы определить, попал ли материал в легкие вашего новорожденного
Если произойдет MAS, ваш новорожденный будет требуется немедленное лечение для удаления мекония из верхних дыхательных путей. После родов ваш врач немедленно отсосит жидкость из носа, рта и горла.
Если ваш ребенок плохо дышит или плохо реагирует, в дыхательное горло (трахею) новорожденного можно ввести трубку для отсасывания жидкости, содержащей меконий, из трахеи. Затем отсасывание может продолжаться до тех пор, пока в удаленном материале не перестанет появляться меконий.
Если ваш новорожденный все еще не дышит или у него низкая частота пульса, врач воспользуется сумкой и маской, чтобы помочь ему дышать. Это доставит вашему ребенку кислород и поможет надуть его легкие.
Вашему врачу может потребоваться вставить трубку в дыхательное горло вашего новорожденного, чтобы помочь ему дышать, если ребенок очень болен или не дышит самостоятельно.
После оказания неотложной помощи ваш новорожденный может быть помещен в специальное отделение для наблюдения за его дыханием. Во избежание осложнений MAS может потребоваться дополнительное лечение. Пять распространенных методов лечения включают:
- кислородная терапия, чтобы убедиться, что в крови достаточно кислорода
- использование лучистого обогревателя, чтобы помочь вашему ребенку поддерживать температуру тела
- антибиотики, такие как ампициллин и гентамицин, для предотвращения или лечения инфекции
- использование аппарата искусственной вентиляции легких (дыхательный аппарат), чтобы помочь вашему младенцу дышать
- экстракорпоральная мембранная оксигенация (ЭКМО), если ваш ребенок не реагирует на другие виды лечения или имеет высокое кровяное давление в легких (для этого лечения используется помпа и машина, которая выполняет функцию легких, выполняет работу сердца и легких вашего новорожденного, чтобы эти органы могли зажить)
У большинства новорожденных с MAS не будет никаких долгосрочных осложнений для здоровья.Однако МАС — серьезная проблема, которая может немедленно сказаться на здоровье вашего новорожденного. Меконий в легких может вызвать воспаление и инфекцию.
Меконий также может блокировать дыхательные пути, что может вызвать чрезмерное расширение легких. Если легкое чрезмерно расширяется или надувается слишком сильно, оно может разорваться или разрушиться. Затем воздух из легкого может накапливаться в грудной полости и вокруг легкого. Это состояние, известное как пневмоторакс, затрудняет повторное наполнение легких.
MAS увеличивает риск развития стойкой легочной гипертензии новорожденного (PPHN) у вашего ребенка.Высокое кровяное давление в сосудах легких ограничивает кровоток и затрудняет правильное дыхание вашего ребенка. PPHN — редкое, но опасное для жизни заболевание.
В редких случаях тяжелая форма МАС может ограничивать поступление кислорода в мозг. Это может вызвать необратимое повреждение мозга.
Младенцы с легкими осложнениями MAS обычно хорошо выздоравливают. Младенцы, у которых в результате MAS развивается повреждение головного мозга или PPHN, могут на протяжении всей жизни сталкиваться с проблемами со здоровьем, требующими медицинской помощи.
Раннее обнаружение — лучшая защита от MAS.Мониторинг плода перед родами может определить, испытывает ли ваш ребенок стресс.
Ваш врач может принять меры для облегчения дистресса плода во время родов и снижения вероятности развития МАС. А если ваш ребенок испытывает стресс, ваш врач будет готов немедленно осмотреть и лечить вашего ребенка, если у него есть признаки MAS.
Синдром аспирации мекония: причины, симптомы и диагностика
Что такое синдром аспирации мекония?
Меконий — это темно-зеленый фекальный материал, который образуется в кишечнике плода до рождения.После родов у вашего новорожденного в течение первых нескольких дней жизни будет выделяться мекониевый стул.
Стресс, который ваш ребенок испытывает до или во время родов, может привести к выделению мекония в стуле, пока он еще находится в матке. Стул мекония затем смешивается с околоплодными водами, окружающими плод.
Ваш ребенок может вдохнуть смесь мекония и околоплодных вод в легкие незадолго до, во время или сразу после рождения. Это явление известно как синдром аспирации мекония или синдром аспирации мекония (MAS).
Хотя MAS часто не опасен для жизни, он может вызвать серьезные осложнения для здоровья вашего новорожденного. И, если MAS тяжелый или не лечится, он может быть фатальным.
МАС может возникнуть, когда ваш ребенок испытывает стресс. Стресс часто возникает, когда количество кислорода, доступного для плода, уменьшается. К распространенным причинам стресса у плода относятся:
- беременность, которая превышает установленный срок (более 40 недель)
- трудные или продолжительные роды
- определенные проблемы со здоровьем, с которыми сталкивается мать, включая гипертонию (высокое кровяное давление) или диабет
- инфекция
Плод начинает вырабатывать меконий только на более поздних сроках беременности, поэтому, когда срок беременности истекает, плод может подвергаться воздействию мекония в течение более длительного периода времени.
По мере того, как беременность приближается к сроку и позже, количество околоплодных вод также уменьшается, в ней концентрируется меконий. В результате MAS чаще встречается у поздно родившихся новорожденных, чем у доношенных новорожденных. MAS редко встречается у недоношенных новорожденных.
Респираторный дистресс является наиболее заметным симптомом МАС. Ваш младенец может дышать учащенно или кряхтеть во время дыхания. Некоторые новорожденные могут перестать дышать, если их дыхательные пути заблокированы меконием. У вашего ребенка также могут быть следующие симптомы:
- синеватый цвет кожи, который называется цианозом
- вялость
- низкое артериальное давление
Диагноз ставится на основании симптомов вашего новорожденного и наличия мекония в околоплодных водах. .
Ваш врач послушает грудную клетку вашего младенца с помощью стетоскопа, чтобы обнаружить звуки ненормального дыхания. Для подтверждения диагноза обычно используются несколько методов:
- Анализ газов крови для оценки уровней кислорода и углекислого газа
- Рентген грудной клетки, чтобы определить, попал ли материал в легкие вашего новорожденного
Если произойдет MAS, ваш новорожденный будет требуется немедленное лечение для удаления мекония из верхних дыхательных путей. После родов ваш врач немедленно отсосит жидкость из носа, рта и горла.
Если ваш ребенок плохо дышит или плохо реагирует, в дыхательное горло (трахею) новорожденного можно ввести трубку для отсасывания жидкости, содержащей меконий, из трахеи. Затем отсасывание может продолжаться до тех пор, пока в удаленном материале не перестанет появляться меконий.
Если ваш новорожденный все еще не дышит или у него низкая частота пульса, врач воспользуется сумкой и маской, чтобы помочь ему дышать. Это доставит вашему ребенку кислород и поможет надуть его легкие.
Вашему врачу может потребоваться вставить трубку в дыхательное горло вашего новорожденного, чтобы помочь ему дышать, если ребенок очень болен или не дышит самостоятельно.
После оказания неотложной помощи ваш новорожденный может быть помещен в специальное отделение для наблюдения за его дыханием. Во избежание осложнений MAS может потребоваться дополнительное лечение. Пять распространенных методов лечения включают:
- кислородная терапия, чтобы убедиться, что в крови достаточно кислорода
- использование лучистого обогревателя, чтобы помочь вашему ребенку поддерживать температуру тела
- антибиотики, такие как ампициллин и гентамицин, для предотвращения или лечения инфекции
- использование аппарата искусственной вентиляции легких (дыхательный аппарат), чтобы помочь вашему младенцу дышать
- экстракорпоральная мембранная оксигенация (ЭКМО), если ваш ребенок не реагирует на другие виды лечения или имеет высокое кровяное давление в легких (для этого лечения используется помпа и машина, которая выполняет функцию легких, выполняет работу сердца и легких вашего новорожденного, чтобы эти органы могли зажить)
У большинства новорожденных с MAS не будет никаких долгосрочных осложнений для здоровья.Однако МАС — серьезная проблема, которая может немедленно сказаться на здоровье вашего новорожденного. Меконий в легких может вызвать воспаление и инфекцию.
Меконий также может блокировать дыхательные пути, что может вызвать чрезмерное расширение легких. Если легкое чрезмерно расширяется или надувается слишком сильно, оно может разорваться или разрушиться. Затем воздух из легкого может накапливаться в грудной полости и вокруг легкого. Это состояние, известное как пневмоторакс, затрудняет повторное наполнение легких.
MAS увеличивает риск развития стойкой легочной гипертензии новорожденного (PPHN) у вашего ребенка.Высокое кровяное давление в сосудах легких ограничивает кровоток и затрудняет правильное дыхание вашего ребенка. PPHN — редкое, но опасное для жизни заболевание.
В редких случаях тяжелая форма МАС может ограничивать поступление кислорода в мозг. Это может вызвать необратимое повреждение мозга.
Младенцы с легкими осложнениями MAS обычно хорошо выздоравливают. Младенцы, у которых в результате MAS развивается повреждение головного мозга или PPHN, могут на протяжении всей жизни сталкиваться с проблемами со здоровьем, требующими медицинской помощи.
Раннее обнаружение — лучшая защита от MAS.Мониторинг плода перед родами может определить, испытывает ли ваш ребенок стресс.
Ваш врач может принять меры для облегчения дистресса плода во время родов и снижения вероятности развития МАС. А если ваш ребенок испытывает стресс, ваш врач будет готов немедленно осмотреть и лечить вашего ребенка, если у него есть признаки MAS.
Синдром аспирации мекония: причины, симптомы и диагностика
Что такое синдром аспирации мекония?
Меконий — это темно-зеленый фекальный материал, который образуется в кишечнике плода до рождения.После родов у вашего новорожденного в течение первых нескольких дней жизни будет выделяться мекониевый стул.
Стресс, который ваш ребенок испытывает до или во время родов, может привести к выделению мекония в стуле, пока он еще находится в матке. Стул мекония затем смешивается с околоплодными водами, окружающими плод.
Ваш ребенок может вдохнуть смесь мекония и околоплодных вод в легкие незадолго до, во время или сразу после рождения. Это явление известно как синдром аспирации мекония или синдром аспирации мекония (MAS).
Хотя MAS часто не опасен для жизни, он может вызвать серьезные осложнения для здоровья вашего новорожденного. И, если MAS тяжелый или не лечится, он может быть фатальным.
МАС может возникнуть, когда ваш ребенок испытывает стресс. Стресс часто возникает, когда количество кислорода, доступного для плода, уменьшается. К распространенным причинам стресса у плода относятся:
- беременность, которая превышает установленный срок (более 40 недель)
- трудные или продолжительные роды
- определенные проблемы со здоровьем, с которыми сталкивается мать, включая гипертонию (высокое кровяное давление) или диабет
- инфекция
Плод начинает вырабатывать меконий только на более поздних сроках беременности, поэтому, когда срок беременности истекает, плод может подвергаться воздействию мекония в течение более длительного периода времени.
По мере того, как беременность приближается к сроку и позже, количество околоплодных вод также уменьшается, в ней концентрируется меконий. В результате MAS чаще встречается у поздно родившихся новорожденных, чем у доношенных новорожденных. MAS редко встречается у недоношенных новорожденных.
Респираторный дистресс является наиболее заметным симптомом МАС. Ваш младенец может дышать учащенно или кряхтеть во время дыхания. Некоторые новорожденные могут перестать дышать, если их дыхательные пути заблокированы меконием. У вашего ребенка также могут быть следующие симптомы:
- синеватый цвет кожи, который называется цианозом
- вялость
- низкое артериальное давление
Диагноз ставится на основании симптомов вашего новорожденного и наличия мекония в околоплодных водах. .
Ваш врач послушает грудную клетку вашего младенца с помощью стетоскопа, чтобы обнаружить звуки ненормального дыхания. Для подтверждения диагноза обычно используются несколько методов:
- Анализ газов крови для оценки уровней кислорода и углекислого газа
- Рентген грудной клетки, чтобы определить, попал ли материал в легкие вашего новорожденного
Если произойдет MAS, ваш новорожденный будет требуется немедленное лечение для удаления мекония из верхних дыхательных путей. После родов ваш врач немедленно отсосит жидкость из носа, рта и горла.
Если ваш ребенок плохо дышит или плохо реагирует, в дыхательное горло (трахею) новорожденного можно ввести трубку для отсасывания жидкости, содержащей меконий, из трахеи. Затем отсасывание может продолжаться до тех пор, пока в удаленном материале не перестанет появляться меконий.
Если ваш новорожденный все еще не дышит или у него низкая частота пульса, врач воспользуется сумкой и маской, чтобы помочь ему дышать. Это доставит вашему ребенку кислород и поможет надуть его легкие.
Вашему врачу может потребоваться вставить трубку в дыхательное горло вашего новорожденного, чтобы помочь ему дышать, если ребенок очень болен или не дышит самостоятельно.
После оказания неотложной помощи ваш новорожденный может быть помещен в специальное отделение для наблюдения за его дыханием. Во избежание осложнений MAS может потребоваться дополнительное лечение. Пять распространенных методов лечения включают:
- кислородная терапия, чтобы убедиться, что в крови достаточно кислорода
- использование лучистого обогревателя, чтобы помочь вашему ребенку поддерживать температуру тела
- антибиотики, такие как ампициллин и гентамицин, для предотвращения или лечения инфекции
- использование аппарата искусственной вентиляции легких (дыхательный аппарат), чтобы помочь вашему младенцу дышать
- экстракорпоральная мембранная оксигенация (ЭКМО), если ваш ребенок не реагирует на другие виды лечения или имеет высокое кровяное давление в легких (для этого лечения используется помпа и машина, которая выполняет функцию легких, выполняет работу сердца и легких вашего новорожденного, чтобы эти органы могли зажить)
У большинства новорожденных с MAS не будет никаких долгосрочных осложнений для здоровья.Однако МАС — серьезная проблема, которая может немедленно сказаться на здоровье вашего новорожденного. Меконий в легких может вызвать воспаление и инфекцию.
Меконий также может блокировать дыхательные пути, что может вызвать чрезмерное расширение легких. Если легкое чрезмерно расширяется или надувается слишком сильно, оно может разорваться или разрушиться. Затем воздух из легкого может накапливаться в грудной полости и вокруг легкого. Это состояние, известное как пневмоторакс, затрудняет повторное наполнение легких.
MAS увеличивает риск развития стойкой легочной гипертензии новорожденного (PPHN) у вашего ребенка.Высокое кровяное давление в сосудах легких ограничивает кровоток и затрудняет правильное дыхание вашего ребенка. PPHN — редкое, но опасное для жизни заболевание.
В редких случаях тяжелая форма МАС может ограничивать поступление кислорода в мозг. Это может вызвать необратимое повреждение мозга.
Младенцы с легкими осложнениями MAS обычно хорошо выздоравливают. Младенцы, у которых в результате MAS развивается повреждение головного мозга или PPHN, могут на протяжении всей жизни сталкиваться с проблемами со здоровьем, требующими медицинской помощи.
Раннее обнаружение — лучшая защита от MAS.Мониторинг плода перед родами может определить, испытывает ли ваш ребенок стресс.
Ваш врач может принять меры для облегчения дистресса плода во время родов и снижения вероятности развития МАС. А если ваш ребенок испытывает стресс, ваш врач будет готов немедленно осмотреть и лечить вашего ребенка, если у него есть признаки MAS.
Синдром аспирации мекония: общие сведения, патофизиология, этиология
Сингх Б.С., Кларк Р.Х., Пауэрс Р.Дж., Спитцер А.Р. Синдром аспирации мекония остается серьезной проблемой в отделении интенсивной терапии новорожденных: исходы и схемы лечения доношенных новорожденных, поступивших в реанимацию в течение десятилетнего периода. Дж Перинатол . 2009 июл.29 (7): 497-503. [Медлайн].
Янссен Д. Д., Карниелли В. П., Кого П. и др. Метаболизм сурфактанта фосфатидилхолина у новорожденных с синдромом аспирации мекония. Дж. Педиатр . 2006 ноябрь 149 (5): 634-9. [Медлайн].
Кларк Д.А., Ниман Г.Ф., Томпсон Дж. Э., Пасканик А. М., Рохар Дж. Э., Бреденберг CE. Замещение поверхностно-активного вещества жирными кислотами, свободными от мекония: альтернативное объяснение ателектаза при синдроме аспирации мекония. Дж. Педиатр . 1987 май. 110 (5): 765-70. [Медлайн].
Терасака Д., Кларк Д.А., Сингх Б.Н., Рокар Дж. Свободные жирные кислоты мекония человека. Биол Новорожденный . 1986. 50 (1): 16-20. [Медлайн].
Wiswell TE, Tuggle JM, Turner BS. Синдром аспирации мекония: что мы сделали? Педиатрия . 1990 Май. 85 (5): 715-21. [Медлайн].
Йодер Б.А., Кирш Е.А., Барт У.Х., Гордон М.С.Изменение акушерской практики, связанное с уменьшением заболеваемости синдромом аспирации мекония. Акушерский гинекол . 2002 Май. 99 (5 п.1): 731-9. [Медлайн].
Балчин I, Уиттакер Дж.С., Ламонт РФ, Стир П.Дж. Характеристики матери и плода, связанные с околоплодными водами, окрашенными меконием. Акушерский гинекол . 2011 Апрель 117 (4): 828-35. [Медлайн].
Macfarlane PI, Heaf DP. Легочная функция у детей после неонатального синдрома аспирации мекония. Детский Арк Дис . 1988 апр. 63 (4): 368-72. [Медлайн].
Ghidini A, Spong CY. Синдром тяжелой аспирации мекония не вызван аспирацией мекония. Am J Obstet Gynecol . 2001 Октябрь 185 (4): 931-8. [Медлайн].
[Рекомендации] Wyckoff MH, Aziz K, Escobedo MB, et al. Часть 13: Неонатальная реанимация: обновленные рекомендации Американской кардиологической ассоциации 2015 г. по сердечно-легочной реанимации и неотложной сердечно-сосудистой помощи. Тираж . 2015 г. 3 ноября. 132 (18 приложение 2): S543-60. [Медлайн].
Американский колледж акушеров и гинекологов. Заключение комитета ACOG № 689 Резюме: роды новорожденного с околоплодными водами, окрашенными меконием. Акушерский гинекол . 2017 Март 129 (3): 593-4. [Медлайн].
Nangia S, Pal MM, Saili A, Gupta U. Влияние внутриродовой ротоглоточной аспирации (IP-OP) на синдром аспирации мекония (MAS) в развивающихся странах: РКИ. Реанимация . 2015 Декабрь 97: 83-7. [Медлайн].
Boujenah J, Oliveira J, De La Hosseraye C, Benbara A, Tigaizin A, Bricou A, et al. Следует ли проводить забор крови на коже черепа плода в случае околоплодных вод, окрашенных меконием? J Matern Fetal Neonatal Med . 2016 29 декабря (23): 3875-8. [Медлайн].
Лю Дж., Цао Х.Й., Фу В. Ультрасонография легких для диагностики синдрома аспирации мекония у новорожденных. J Int Med Res .2016 г. 1 ноября. [Medline].
Американский колледж акушеров и гинекологов. Заключение комитета ACOG № 579: определение срока беременности. Акушерский гинекол . 2013 ноябрь 122 (5): 1139-40. [Медлайн].
Американский колледж акушеров и гинекологов. Заключение комитета ACOG № 561: ранние роды по немедицинским показаниям. Акушерский гинекол . 2013 Апрель 121 (4): 911-5. [Медлайн].
Акушерская практика комитета ACOG.Заключение комитета ACOG № 346, октябрь 2006 г .: инфузия амниона не предотвращает синдром аспирации мекония. Акушерский гинекол . 2006 Октябрь 108 (4): 1053. [Медлайн].
Велафи С., Видьясагар Д. Ведение младенцев, рожденных от матерей с околоплодными водами, окрашенными меконием, в период родов и после родов: рекомендации, основанные на фактических данных. Клин Перинатол . 2006 Mar.33 (1): 29-42, v-vi. [Медлайн].
Hofmeyr GJ, Xu H. Амниоинфузия ликвора, окрашенного меконием, в родах. Кокрановская база данных Syst Rev . 20 января 2010 г. CD000014. [Медлайн].
Fraser WD, Hofmeyr J, Lede R, et al, для группы испытаний амниоинфузии. Амниоинфузия для профилактики синдрома аспирации мекония. N Engl J Med . 2005 сентябрь 1. 353 (9): 909-17. [Медлайн].
Комитет по акушерской практике, Американский колледж акушеров и гинекологов. Заключение комитета ACOG № 379: ведение родов новорожденного с околоплодными водами, окрашенными меконием. Акушерский гинекол . 2007 Сентябрь 110 (3): 739. [Медлайн].
Vain NE, Szyld EG, Prudent LM, Wiswell TE, Aguilar AM, Vivas NI. Отсасывание из ротоглотки и носоглотки новорожденных, окрашенных меконием, перед родами на плечи: многоцентровое рандомизированное контролируемое исследование. Ланцет . 2004 14-20 августа. 364 (9434): 597-602. [Медлайн].
Четтри С., Бхат Б.В., Адхисивам Б. Современные концепции лечения синдрома аспирации мекония. Индийский Педиатр Дж. . 2016 Октябрь 83 (10): 1125-30. [Медлайн].
Wiswell TE, Knight GR, Finer NN и др. Многоцентровое рандомизированное контролируемое исследование, сравнивающее лаваж сурфаксина (луцинактанта) со стандартными методами лечения синдрома аспирации мекония. Педиатрия . 2002 июн.109 (6): 1081-7. [Медлайн].
Dargaville PA, Mills JF. Сурфактантная терапия синдрома аспирации мекония: текущее состояние. Наркотики .2005. 65 (18): 2569-91. [Медлайн].
Dargaville PA. Инновация в сурфактантной терапии I: лаваж сурфактанта и введение сурфактанта болюсом жидкости с использованием минимально инвазивных методов. Неонатология . 2012. 101 (4): 326-36. [Медлайн].
Эль-Шахед А.И., Даргавилль, Пенсильвания, Олссон А., Солл Р. Поверхностно-активное вещество при синдроме аспирации мекония у доношенных и поздних недоношенных детей. Кокрановская база данных Syst Rev . 2014 14 декабря. CD002054.[Медлайн].
Коллинз М. П., Лоренц Дж. М., Джеттон Дж. Р., Панет Н. Гипокапния и другие связанные с вентиляцией факторы риска развития церебрального паралича у младенцев с низкой массой тела при рождении. Педиатр Рес . 2001 декабрь 50 (6): 712-9. [Медлайн].
Abman SH, Kinsella JP. Ингаляционная терапия оксидом азота при заболеваниях легких в педиатрии. Curr Opin Pediatr . 1998 июн.10 (3): 236-42. [Медлайн].
Ward M, Sinn J.Стероидная терапия синдрома аспирации мекония у новорожденных. Кокрановская база данных Syst Rev . 2003. CD003485. [Медлайн].
Sarkar S, Hussain N, Herson V. Фибриновый клей для стойкого пневмоторакса у новорожденных. Дж Перинатол . 2003 23 января (1): 82-4. [Медлайн].
El Shahed AI, Dargaville P, Ohlsson A, Soll RF. Поверхностно-активное вещество при синдроме аспирации мекония у доношенных / недоношенных младенцев. Кокрановская база данных Syst Rev .18 июля 2007 г. 2: CD002054. [Медлайн]. [Полный текст].
[Рекомендации] Американская кардиологическая ассоциация, Американская академия педиатрии. Руководство Американской кардиологической ассоциации (AHA) 2005 г. по сердечно-легочной реанимации (CPR) и неотложной сердечно-сосудистой помощи (ECC) педиатрическим и неонатальным пациентам: рекомендации по реанимации новорожденных. Педиатрия . 2006 май. 117 (5): e1029-38. [Медлайн].
Cialone PR, Sherer DM, Ryan RM, Sinkin RA, Abramowicz JS.Амниоинфузия во время родов, осложненных околоплодными водами, окрашенными частицами мекония, снижает неонатальную заболеваемость. Am J Obstet Gynecol . 1994 Mar.170 (3): 842-9. [Медлайн].
Dargaville PA, Copnell B и Австралийская и Новозеландская сеть новорожденных. Эпидемиология синдрома аспирации мекония: заболеваемость, факторы риска, методы лечения и исходы. Педиатрия . 2006 май. 117 (5): 1712-21. [Медлайн].
Dargaville PA, South M, McDougall PN.Сурфактанты и ингибиторы сурфактантов при синдроме аспирации мекония. Дж. Педиатр . 2001, январь 138 (1): 113-5. [Медлайн].
Glantz JC, Woods JR. Значение мекония околоплодных вод. В: Creasy RK, Resnick R, eds. Медицина материнства и плода . 4-е изд. Филадельфия, Пенсильвания: У. Б. Сондерс; 1999. 393-403.
Kattwinkel J, Niermeyer S, Denson SE, ред. Учебник неонатальной реанимации . 4-е изд. Чикаго, штат Иллинойс: Американская академия педиатрии; 2000 г.
Кинселла JP. Синдром аспирации мекония: ответ на этот вопрос с помощью промывания сурфактантом ?. Am J Respir Crit Care Med . 15 августа 2003 г. 168 (4): 413-4. [Медлайн].
Korones SB, Bada-Ellzey HS. Аспирация мекония. Принятие решений в неонатальном периоде (принятие клинических решений) . Сент-Луис, Миссури: Ежегодник Мосби; 1993. 128-9.
Кугельман А., Гангитано Е., Тащук Р. и др. Экстракорпоральная мембранная оксигенация у младенцев с синдромом аспирации мекония: десятилетний опыт вено-венозной ЭКМО. J Педиатр Хирургия . 2005 июл. 40 (7): 1082-9. [Медлайн].
Lo KW, Rogers M. Контролируемое испытание амниоинфузии: предотвращение аспирации мекония во время родов. Aust N Z J Obstet Gynaecol . 1993 Февраль 33 (1): 51-4. [Медлайн].
Ранзини А.С., Чан Л. Меконий и компромисс между плодами и новорожденными. В: Spitzer AR, ed. Интенсивная терапия плода и новорожденного . Сент-Луис, Миссури: Мосби; 1996. 297-303.
Робертон NRC.Синдромы аспирации. В: Greenough A, Robertson NRC, Milner AD, eds. Неонатальные респираторные заболевания . Лондон, Великобритания: Публикация Арнольда; 1996. 313-33.
Soll RF, Dargaville P. Поверхностно-активное вещество при синдроме аспирации мекония у доношенных детей. Кокрановская база данных Syst Rev . 2000. CD002054. [Медлайн].
Уста И.М., Мерсер Б.М., Асвад Н.К., Сибай Б.М. Влияние политики амниоинфузии околоплодных вод, окрашенных меконием. Акушерский гинекол . 1995 Февраль 85 (2): 237-41. [Медлайн].
Whitsett JA, Pryhuber GS, Rice WR, Warner BB, Wert SE. Острые респираторные расстройства. В: Avery GB, Fletcher MA, MacDonald MG, eds. Неонатология: патофизиология и лечение новорожденных . 5-е изд. Филадельфия, Пенсильвания: Lippincott Williams & Wilkins; 1999. 494-508.
Wiswell TE, Gannon CM, Jacob J, et al. Ведение родильного отделения новорожденного с явно выраженным здоровьем, окрашенным меконием: результаты многоцентрового международного совместного исследования. Педиатрия . 2000 января 105 (1 п.1): 1-7. [Медлайн]. [Полный текст].
Yeh TF. Основные концепции: синдром аспирации мекония: патогенез и текущее лечение. NeoReviews . Сентябрь 2010. 11 (9): e503-12. [Полный текст].
Young TE, Mangum OB. Neofax: Руководство по лекарствам, используемым в неонатальной помощи . 11 изд. Bethesda, M: Американское общество фармацевтов систем здравоохранения; 1998.
Boet A, Brat R, Aguilera SS, Tissieres P, De Luca D.Поверхностно-активное вещество от новорожденных до педиатрических отделений интенсивной терапии: лабораторные и прикроватные доказательства. Минерва Анестезиол . 2014 декабрь 80 (12): 1345-56. [Медлайн].
Hermansen CL, Mahajan A. Дыхательная недостаточность новорожденного. Врач Фам . 2015 г. 1. 92 (11): 994-1002. [Медлайн].
von Bahr V, Hultman J, Eksborg S, et al. Долгосрочная выживаемость и причины поздней смерти детей, получавших экстракорпоральную мембранную оксигенацию. Pediatr Crit Care Med .2017 марта 18 (3): 272-80. [Медлайн].
Аспирация мекония. О синдроме аспирации мекония
Синдром аспирации мекония (MAS) возникает, когда новорожденный вдыхает густые частицы мекония. Обычно это вторично по отношению к гипоксии плода, которая вызывает усиление перистальтики, расслабление анальных сфинктеров и рефлекторное дыхание. Большинство родов мекония связано с некоторым окрашиванием жидкости меконием, но младенцы остаются энергичными и не нуждаются в дальнейшем вмешательстве.
Окрашенные меконием околоплодные воды можно аспирировать до или во время родов.Поскольку меконий редко обнаруживается в околоплодных водах до 34 недель беременности, аспирация мекония обычно поражает детей, рожденных в срок и после родов.
Есть несколько патомеханизмов, участвующих в MAS, в частности, обструкция дыхательных путей, дисфункция сурфактанта, воспаление, отек легких, сужение сосудов легких и бронхоспазм [1] .
Исследования аспирата трахеи подтверждают воспалительную реакцию с увеличением количества воспалительных клеток и уровня провоспалительных цитокинов с соответствующим снижением функции легких.В большинстве случаев эти изменения начинают исчезать после первых шести часов жизни с последующим улучшением функции легких.
Одно исследование предполагает, что пищеварительные ферменты поджелудочной железы плода могут играть определенную роль в повреждении легких, описанном в MAS [2] .
Эпидемиология
Цифра, указанная для младенцев, рожденных с ликвором, окрашенным меконием, в промышленно развитых странах составляет 8-25% рождений после 34 недель беременности. МАС встречается примерно у 1-3% живорожденных [3] .
Снижение заболеваемости MAS в течение десятилетия было связано с сокращением послеродовых родов, агрессивным контролем аномального мониторинга сердечного ритма и уменьшением числа младенцев с низким баллом по шкале Апгар [4] . Было показано, что плановая индукция родов при беременности на сроке 41 недели и более ассоциирована со значительным снижением частоты MAS и меньшим числом перинатальных смертей по сравнению с выжидательной тактикой [5] .
В развивающихся странах частота MAS выше, и это связано с более высоким уровнем смертности.
Этиология
[6]
Такие факторы, как плацентарная недостаточность, материнская гипертензия, преэклампсия, маловодие или злоупотребление материнскими наркотиками (табак, кокаин), увеличивают проникновение мекония внутрь матки.
Аспирация мекония может происходить в утробе матери при задыхании плода или после рождения при первых вдохах в жизни. МАС определяется как респираторный дистресс-синдром, развивающийся вскоре после рождения, с рентгенологическим подтверждением аспирационного пневмонита и наличием околоплодных вод, окрашенных меконием.
Дистресс плода и асфиксия связаны с тяжелой формой MAS [7] .
Презентация
- Явное присутствие мекония или темно-зеленого окрашивания околоплодных вод.
- Зеленое или синее окрашивание кожи при рождении.
- Ребенок выглядит вялым, с низкой оценкой по шкале Апгар.
- Дыхание частое, затрудненное или отсутствует.
- Признаки переношенности (например, шелушение кожи) присутствуют.
- Монитор плода может показать брадикардию.
Исследования
- Анализ газов крови показывает низкий pH крови, повышенное pCO 2 , пониженное pO 2 .
- Уровень электролитов в сыворотке крови следует измерять у младенцев с МАС, поскольку перинатальный стресс может привести к синдрому несоответствующей секреции антидиуретического гормона (АДГ) и острому повреждению почек.
- FBC может быть полезен для исключения инфекции или признаков, определяющих причину перинатального стресса (например, тромбофилию, указывающую на кровотечение, или полицитемию, связанную со снижением легочного кровотока).
- Рентгенография показывает пятнистые инфильтраты, грубые штрихи обоих легких, увеличенный диаметр АД и уплощение диафрагмы (из-за гиперинфляции).
- УЗИ легких — это быстрый, простой и дешевый метод визуализации, который все чаще используется в отделениях интенсивной терапии, в том числе для новорожденных [8] .
- Визуализация головного мозга может быть показана при наличии неврологических отклонений.
- ЭКГ следует выполнять для оценки структуры сердца и степени тяжести любой легочной гипертензии и шунтирования слева направо.
Ведение
Все младенцы из группы риска MAS, у которых наблюдаются признаки респираторного дистресса, должны быть помещены в отделения интенсивной терапии новорожденных.Тщательный контроль важен, поскольку они могут очень быстро испортиться. Поддержание адекватной оксигенации, оптимального артериального давления, коррекция ацидоза, гипогликемии и других метаболических нарушений — основа лечения [4] .
- Терапевтические вмешательства при тяжелом МАС включают отсасывание дыхательных путей, доставку кислорода или искусственную вентиляцию легких [9] .
- Отсасывание — Национальный институт здравоохранения и передового опыта (NICE) не рекомендует регулярно отсасывать носоглотку и ротоглотку до рождения плеча и туловища.Однако он рекомендует отсосать верхние дыхательные пути после родов из плеч, если в ротоглотке присутствует густой или вязкий меконий. Если после родов у ребенка ухудшились жизненно важные функции, ларингоскопию и аспирацию под контролем зрения должен проводить медицинский работник, обученный продвинутым методам жизнеобеспечения новорожденных [10] .
- Кислород необходимо подавать для поддержания насыщения кислородом 95-98%. Может потребоваться вентиляция. При пневмотораксе потребуется установка дренажа грудной клетки.
- В некоторых случаях может проводиться вентиляция с высокочастотными колебаниями [11] .
- Не было доказано, что профилактическое назначение антибиотиков новорожденным, рожденным через околоплодные воды, окрашенные меконием, снижает частоту MAS (или других осложнений) [12] .
- Поверхностно-активное вещество — меконий, попадающий в легкие, деактивирует активность сурфактанта, вызывает повышение поверхностного натяжения и предвещает начало респираторной недостаточности. Замещение сурфактанта может быть полезным для детей с МАС, поскольку оно может быстро улучшить оксигенацию [13] .
- Замещение поверхностно-активного вещества болюсным или медленным вливанием у младенцев с тяжелым MAS также снижает потребность в экстракорпоральной мембранной оксигенации [14] .
- Разработка активных синтетических поверхностно-активных веществ очень сложна [15] .
- Противовоспалительные препараты могут быть назначены для уменьшения побочного действия продуктов вызванного меконием воспаления как на эндогенное, так и на экзогенно доставленное сурфактант [16] .
- Вдыхаемый оксид азота может быть полезен при лечении легочной гипертензии, связанной с MAS [4] .Считается, что он действует путем расслабления гладких мышц легочных сосудов, вызывая расширение сосудов, а также способствуя бронходилатации.
- Энтеральный силденафил может использоваться для лечения стойкой легочной гипертензии, вызванной MAS [17] .
- Экстракорпоральная мембранная оксигенация (ЭКМО) может понадобиться тем младенцам, состояние которых ухудшается.
- Стероиды — ингаляционные или системные — были использованы с хорошим эффектом в некоторых исследованиях. Было показано, что будесонид улучшает эффекты экзогенного поверхностно-активного вещества в экспериментальном MAS [9] .
Осложнения и прогноз
В легких случаях респираторный дистресс обычно проходит через 2–4 дня, хотя тахипноэ может сохраняться дольше. В редких случаях может произойти более длительное поражение органов дыхания, которое может сохраняться в течение многих лет. Это более вероятно, если требовалась вентиляция.
Церебральная гипоксия может привести к длительному неврологическому повреждению.
Исследования показали широкий диапазон смертности младенцев с MAS от 5% до 40% [3] .Дисфункция миокарда, масса тела при рождении и исходная потребность в кислороде являются независимыми предикторами смертности.

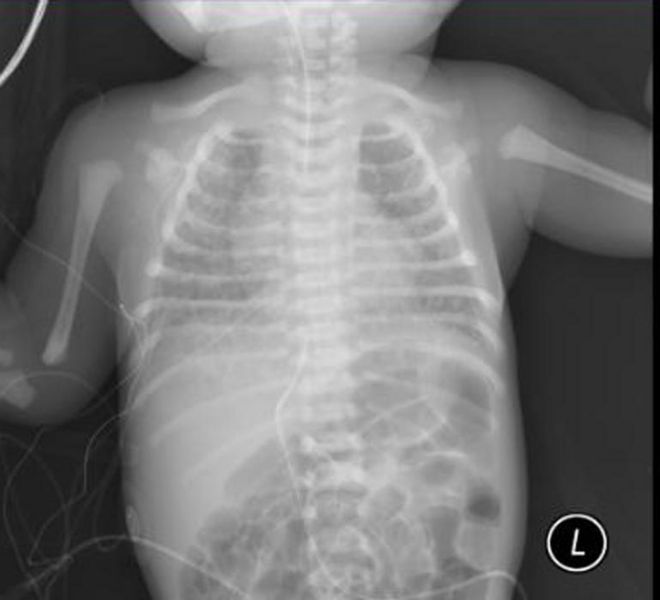 Current concepts in the management of meconium aspiration syndrome //The Indian Journal of Pediatrics. – 2016. – Т. 83. – №. 10. – С. 1125-1130.
Current concepts in the management of meconium aspiration syndrome //The Indian Journal of Pediatrics. – 2016. – Т. 83. – №. 10. – С. 1125-1130.