Аэробные и анаэробные бактерии — что это такое
Еще не так давно слово «бактерия» ассоциировалось у большинства людей с чем-то вредным и весьма опасным. Однако в последнее время эти микроорганизмы все чаще используются в качестве помощников в различных сферах жизни. Наиболее востребованными микробы являются в переработке отходов жизнедеятельности, избавляя от многих проблем и неприятностей, не нанося при этом вреда ни человеку, ни окружающей среде.
Аэробные бактерии — как работают?
Что это, и как оно работает? Купить биопрепарат, содержащий бактерии-помощники, можно в жидком, в сухом виде (в порошке или гранулах), а также в форме кассет или таблеток. В этих смесях бактерии находятся в «спячке» и активизируются, попав в питательную дружелюбную аэробную среду.
В состав подобных препаратов входят аэробные бактерии (нуждающиеся в кислороде для жизни и размножения), анаэробные также известные как бескислородные бактерии (вместо кислорода потребляют углерод, образующийся при разложении органики), ферменты (работают в качестве катализаторов) и энзимы.
Вносить биологические препараты необходимо в строго определенном количестве, в зависимости от объемов очищаемого резервуара, при этом колония полезных бактерий должна быть больше сообщества опасных.
Аэробным бактериям критически важен кислород, анаэробным — необязательно, а некоторым анаэробным микробам диоксид даже смертельно вреден, т.к. они питаются углекислым газом. Кстати, анаэробные бактерии бывают 2 видов:
- факультативные (условные) – могут жить без кислорода, но последний способствует ускоренному развитию анаэробов;
- облигатные (обязательные) – кислород губителен для таких бактерий.
Вот и все отличие.
Чтобы не было проблем с канализацией
Незаменимую помощь могут оказать аэробные или анаэробные бактерии на дачных участках и загородных домах без центральной канализации. Добавленные в выгребную яму бактерии уже через несколько дней полностью устраняют неприятный запах. Исчезнут и насекомые – постоянные спутники уличных туалетов. Кроме того, само содержимое ямы значительно уменьшится в объеме и превратиться из проблемы в пользу – станет удобрением.
Кроме того, само содержимое ямы значительно уменьшится в объеме и превратиться из проблемы в пользу – станет удобрением.
Раньше для устранения запаха некоторые использовали хлорную известь (хлорку). Однако эффект от ее применения был довольно сомнительным. Вместо одного запаха на участке появлялся другой, не менее неприятный – резкий, въедливый запах хлорки.
Кроме того, после использования этого препарата долгое время ничего на месте туалета и рядом с ним не растет, даже сорные травы. Да и естественный процесс разложения отходов жизнедеятельности значительно замедлялся или даже вовсе прекращался.
Видео о том, как работает автономная канализация с бактериями
youtube.com/embed/kgalVKOF1ok»/>
При добавлении же биологических препаратов всех этих неприятных последствий просто нет. Помимо этого, благодаря работе бактерий, реже возникает необходимость откачивать отходы, быстрее обеззараживают отходы, не разрушая при этом ни бетонные, ни пластиковые покрытия и стены, и не раздражая слизистые и кожные покровы человека. Эффективно применяется аэробная и анаэробная флора и при засорах в канализации, при необходимости быстрого начала очистительного процесса после долгого перерыва, при активном использовании канализационной системы, для очистки отстойника (септика) индивидуальной системы канализации и т.д.
Как сохранить бактерии от гибели?
Существуют правила, соблюдение которых позволит продлить жизнь бактерий в канализации:
- Регулярно пользоваться септиком (помните, микробы тоже нуждаются в пище).
- В случае длительного отсутствия требуется консервация автономной канализации (к примеру, на зиму).

- Избегать моющих средств, в составе которых есть щелочи, формальдегиды, фенол, кислоты и хлор.
- Бережно относиться к канализации: не засорять жесткой бумагой, мусором, очистками, прокладками и т.д. Что нельзя сбрасывать в автономную канализацию, читайте в нашей статье.
Ускоренное созревание компоста
О пользе хорошего компоста знают все дачники и садоводы. Однако для созревания хорошего удобрения в обычных условиях требуется несколько лет. И здесь снова приходят на помощь бактерии, значительно ускоряющие этот процесс.
При добавлении в компостную кучу биологических ускорителей, туда можно складывать практически любые отходы (органические), при этом не измельчая их. Главными аэробными условиями ускорения процесса является чередование садовых и кухонных отходов и постоянный доступ кислорода. Подобное компостирование помогает в несколько раз сократить время на подготовку удобрения и облегчить работу огороднику (нет необходимости мелко нарезать отходы и сооружать несколько компостных куч).
Уход за водоемами
Еще одним вариантом использования анаэробных или аэробных микробов является очистка водоемов, в частности садовых прудов. В отличие от больших естественных водоемов, где биологическое равновесие может восстанавливаться само собой, небольшие пруды на садовых участках требуют тщательного ухода. Переизбыток органических веществ в воде быстро приводит к ее помутнению и затхлости. И того, и другого можно избежать, если добавить в пруд препарат с микроорганизмами.
В результате, сначала специальный реагент собирает загрязняющие вещества хлопьями, которые оседают на дно. А здесь за них уже принимаются бактерии, содержащиеся все в том же препарате, которые разлагают органику. При этом на зиму бактерии-чистильщики «уходят в спячку», а весной вновь начинают свою работу.
Все эти препараты абсолютно безвредны для человека и всех обитателей пруда. Главное, о чем необходимо помнить, что наиболее эффективно микроорганизмы будут работать только в закрытых водоемах (нет поступлений и выхода воды).
Очистка колодцев и траншей для сточных вод
Рано или поздно, но любой колодец, в котором собираются сточные воды, загрязняется, покрывается илом. Очистить его также помогут микробиологические препараты (те же бактерии аэробы). Конечно совсем избежать заиливания не удастся, но срок службы колодца может увеличиться в разы.
Какие бактерии используются в наших канализациях
Во всех наших станциях используются только аэробные (живые и естественные природные бактерии). Точнеебудет сказать, что они сами появляются и размножаются в автономных системах канализаций, так как в них постоянно подаётся кислород.
Бактериологическая диагностика анаэробной инфекции
Анаэробные микроорганизмы, являясь представителями нормальной микрофлоры, в то же время они имеют потенциальные способности для развития инфекционного процесса практически в любом органе. Вследствие разных причин, например, при длительной терапии иммунодепрессантами, антибиотиками, а также в результате травмы, хирургического вмешательства, эти микроорганизмы попадают в кровяное русло, брюшную полость, различные органы и ткани и становятся причиной тяжелых гнойно-воспалительных процессов, сопровождающихся высокой смертностью, особенно при анаэробном сепсисе.
Важную роль анаэробы играют при развитии осложнений после хирургических вмешательств. В амбулаторной практике анаэробные инфекции с большой частотой встречаются у стоматологических, гинекологических больных, у женщин с отягощенным акушерским анамнезом.
Анаэробы являются участниками гнойно- воспалительных процессов, возникающих во всех отделах генитального тракта женщин. Их выделяют как единственного возбудителя или в составе ассоциации с аэробами при таких распространенных заболеваниях, как вагинит, вагиноз, послеродовый эндометрит. Установлена этиологическая роль анаэробов при возникновении воспалительных заболеваний придатков матки и околоматочного пространства, которые часто являются следствием абортов, инструментальных диагностических мероприятий, применения внутриматочных спиралей, хирургических вмешательств. Анаэробы также играют важную роль при возникновении пародонтоза — воспалительного процесса в тканях, прилегающих к зубам. По данным ВОЗ, около 95% взрослого населения планеты и 80% детей имеют признаки пародонтоза. Воспалительный процесс в тканях десны изначально возникает из-за массивных микробных скоплений и выделяемых ими ферментов и токсинов.
Воспалительный процесс в тканях десны изначально возникает из-за массивных микробных скоплений и выделяемых ими ферментов и токсинов.
Бактериологическая диагностика при подозрении на анаэробную инфекцию весьма актуальна поскольку позволяет назначить наиболее эффективное лечение.
Принципы забора материала на исследование.
Материал для исследования следует брать по возможности до начала химиотерапии и лучше во время вскрытия или дренирования гнойного очага.
Особенно актуально проведение бактериологического анализа при неэффективности антимикробной терапии и при неблагоприятном течении заболевания и возникновении осложнений.
Отбор проб клинического материала при подозрении на анаэробную инфекцию и транспортировка этих образцов в бактериологическую лабораторию имеет ряд трудностей, связанных с необходимостью избежать агрессивного действия кислорода воздуха на строгие анаэробы.
Так как анаэробы являются представителями нормальной микрофлоры человека, материал для исследования следует брать с соблюдением правил асептики и строго с места локализации очага, чтобы исключить загрязнение посторонней микрофлорой.
Оптимальным способом получения проб материала является его аспирация с помощью шприца. Материал, забранный в шприц, должен быть доставлен в лабораторию для исследования в максимально короткий срок. Транспортные среды позволяют сохранить жизнеспособность анаэробных бактерий в течение достаточно продолжительного срока, указанного в инструкции.
Методы исследования.
Исследование клинического материала на анаэробы включает в себя все этапы культурального исследования, принятого в бактериологии, в том числе: выделение анаэробных микроорганизмов на искусственных питательных средах, изучение их свойств и идентификацию. Однако, учитывая физиологические особенности этой обширной группы микроорганизмов и их высокие питательные потребности, культивирование этих микробных патогенов представляется сложным и недоступным для большинства бактериологических лабораторий.
В лаборатории клинической микробиологии ГБУЗ НО «КДЦ» проводятся исследования на анаэробную инфекцию с использованием специального оборудования , импортных питательных сред и тест-систем для идентификации изучаемых микроорганизмов до рода и вида.
Ленобласти в помощь – анаэробные бактерии-термофилы
Фото: Лина Зернова
Ох уж этот навоз…
Отходы от животноводческих комплексов и птицефабрик – одна из острейших проблем отечественного сельского хозяйства. Свежий навоз, в нарушение всех правил, нередко вывозят на поля, откуда он смывается в малые и большие реки. С птичьим пометом, который складируют рядом с птицефабриками, – та же история. В итоге водоемы от чрезмерной «удобренности» превращаются в сточные канавы, а земли теряют урожайность, а то и попросту «выгорают». Но даже если почвы визуально выглядят невредимыми, выращенный на таких полях урожай, скорее всего, окажется с избытком азота и фосфора. Отравленные биогенами вода и рыба также в итоге попадают на стол к человеку. Цепочка тут короткая.
Отравленные биогенами вода и рыба также в итоге попадают на стол к человеку. Цепочка тут короткая.
Случаются и курьезы: в один из летних сезонов середины 90-ых фонтаны Петергофа вдруг остро запахли свиными фекалиями. Что впоследствии стало одной из причин закрытия совхоза Петродворцовый. Его владельцы не справились с потоками отходов жизнедеятельности десятков тысяч свиней, в результате чего зловонные ручьи оказались в гидротехнической системе фонтанов… Вот уже действительно, экологические проблемы за забором не спрячешь.
Биогаз становится трендом
Наиболее эффективно с навозной проблемой справляются биогазовые установки. С помощью технологии сбраживания отходы «превращаются» в тепло и электроэнергию. В Европе они применяются уже не один десяток лет. А такие корпорации как «Сименс» производят даже биогазовые теплоэлектростанции. Одна из них действует и в России – в Белгородской области. «Лучки» – крупнейшая в стране биогазовая станция – была пущена в эксплуатацию в 2012 году. В феврале 2015 года ее мощность составила 3,6 МВт, чего хватило бы на суточные нужды 45-тысячного города. Ежегодно она потребляет до 15 млн тонн отходов сельского хозяйства, что для плодородного Черноземья – вариант оптимальный.
В феврале 2015 года ее мощность составила 3,6 МВт, чего хватило бы на суточные нужды 45-тысячного города. Ежегодно она потребляет до 15 млн тонн отходов сельского хозяйства, что для плодородного Черноземья – вариант оптимальный.
Фото: Лина Зернова
Биогаз становится трендом и в Ленобласти. Два года назад крупнейший в регионе биогазовый комплекс установила птицефабрика Синявинская. Ежесуточно он перерабатывает до 600 тонн птичьего помета, давая взамен электроэнергию и тепло. Ряд отечественных компаний также начал производство малых биогазовых установок. Фермеров, ориентирующихся на экологичность и высокие стандарты, в области уже десятки.
Однако биоустановка, начавшая свою работу на племенном заводе «Первомайский», – установка уникальная, не имеющая аналогов в мире.
Новое слово
– Биогаз для нас – побочный продукт. Но не цель! – рассказывает гендиректор «ЭВОБИОС» Даниил Абубикеров. – Наши бактерии перерабатывают органику без вредных выбросов – установка «ЭВОБИОС» не связана с атмосферой. Она выдает только высококачественные горючий газ и органические удобрения. Вырабатываемый нашим биореактором газ содержит 80 и более процентов метана, тогда как у лучших немецких установок потолок – 60-65%. Что касается второго продукта, в традиционных биогазовых установках органика уничтожается до такой степени, что получаемый на выходе материал для удобрений оказывается почти непригодным. Мы же даем потребителю полноценное органическое удобрение.
Она выдает только высококачественные горючий газ и органические удобрения. Вырабатываемый нашим биореактором газ содержит 80 и более процентов метана, тогда как у лучших немецких установок потолок – 60-65%. Что касается второго продукта, в традиционных биогазовых установках органика уничтожается до такой степени, что получаемый на выходе материал для удобрений оказывается почти непригодным. Мы же даем потребителю полноценное органическое удобрение.
Еще одно отличие новинки – компактность. Комплекс «ЭВОБИОС», перерабатывающий 100 тонн навоза в сутки – именно столько выдает на гора стадо крупного рогатого скота (КРС) завода «Первомайский», – занимает площадку в 50 квадратных метров. Что в 5-10 раз меньше по сравнению с традиционными аналогами. Компактность не требует строительства капитальных сооружений, а значит и дополнительных затрат.
– В течение шести лет мы занимались глубокой наукой, – рассказывает председатель совета директоров группы компаний «ЭВОБИОС» Александр Подсекин. – Не взяв за основу ни один из вариантов биогазовых технологий. В изобретении нашей установки принимали участие более 15 институтов как на территории РФ, так и за ее пределами. Сегодня можно сказать: мы решили вопрос переработки любых органических отходов.
– Не взяв за основу ни один из вариантов биогазовых технологий. В изобретении нашей установки принимали участие более 15 институтов как на территории РФ, так и за ее пределами. Сегодня можно сказать: мы решили вопрос переработки любых органических отходов.
Гендиректор Даниил Абубикеров.
Фото: Лина Зернова
Разгадка – в желудке коровы
Суть технологии проста. Навоз измельчается в пыль, сепарируется, нагревается и направляется в биореактор. Жидкость стекает по пористым стенкам реактора, буквально пропитанным анаэробными, термофильными бактериями. (Комфортнее всего они чувствуют себя при температуре 56 градусов при отсутствии кислорода). Прожорливые существа выедают органическую составляющую навоза, выделяя метан.
– Что это за хитрые бактерии? – задаю вопрос коммерческому директору компании «ЭВОБИОС» Сергею Закржевскому.
– Никаких хитростей, – поясняет он. – Источник – желудок коровы и, соответственно, навоз. На каждом квадратном сантиметре внутренней поверхности реактора мы сумели разместить на порядок больше бактерий, чем в традиционных метантенках. Отсюда и преимущества. Полученного на данной установке метана хватает для выработки 140 кВт товарной электроэнергии. Учитывая, что сам племенной завод потребляет до 180 кВт, причем, при пиковых нагрузках, ее хватает для покрытия почти 80% нужд, а в какие-то периоды – и 100% электроэнергии, необходимой сельхозпредприятию.
На каждом квадратном сантиметре внутренней поверхности реактора мы сумели разместить на порядок больше бактерий, чем в традиционных метантенках. Отсюда и преимущества. Полученного на данной установке метана хватает для выработки 140 кВт товарной электроэнергии. Учитывая, что сам племенной завод потребляет до 180 кВт, причем, при пиковых нагрузках, ее хватает для покрытия почти 80% нужд, а в какие-то периоды – и 100% электроэнергии, необходимой сельхозпредприятию.
Остается добавить, что система управления биогазовым комплексом состоит из вмонтированных в оборудование нескольких тысяч датчиков. Ею можно управлять дистанционно как с компьютера, так и с других гаджетов.
Термофилам по зубам все
Бактериям-термофилам «по зубам» любая органика.
– С помощью нашей технологии в перспективе планируем перерабатывать пищевые отходы кафе и ресторанов, продуктовых сетевых магазинов и плодовоовощных баз – всю органику, которая создает проблемы обращения с коммунальными отходами, – рассказывает корреспонденту «БЕЛЛОНЫ» Даниил Абубикеров. – Наша технология применима даже к переработке илового осадка сточных вод водоканалов. Процессы окисления, происходящие при анаэробном сбраживании, позволяют сильно снизить концентрации тяжелых металлов. А на выходе получить чистое органическое удобрение. Так в Липецке уже 2 года мы ведем подготовку к переработке иловых осадков. Там потребуется 2-3 биокомплекса, аналогичных тому, что мы установили в Приозерском районе.
– Наша технология применима даже к переработке илового осадка сточных вод водоканалов. Процессы окисления, происходящие при анаэробном сбраживании, позволяют сильно снизить концентрации тяжелых металлов. А на выходе получить чистое органическое удобрение. Так в Липецке уже 2 года мы ведем подготовку к переработке иловых осадков. Там потребуется 2-3 биокомплекса, аналогичных тому, что мы установили в Приозерском районе.
Если учесть, что Санкт-Петербурге иловые осадки сжигаются, что не есть хорошо, за экспериментом в Липецке стоит понаблюдать…
Председатель комитета по агропромышленному и рыбохозяйственному комплексу Олег Малащенко.
Фото: Лина Зернова
Цель – органическое земледелие
Директор АО «ПЗ «Первомайский» Алексей Павлов не скрывает от журналистов своих планов: «Наше хозяйство в 1100 голов крупного рогатого скота и 2300 гектаров сельхозугодий мы хотим сделать экологически чистым. И улучшение технологии производства экономически выгодно: во-первых, мы получаем новый источник электроэнергии, во-вторых, – качественные органические удобрения. А всем известно, что они по ряду показателей значительно лучше минеральных. Это значит, что мы улучшим в перспективе качество почв. Наконец, мы, надеюсь, привлечем потребителя своим «зеленым» подходом. Словом, мы переходим на рельсы органического земледелия».
А всем известно, что они по ряду показателей значительно лучше минеральных. Это значит, что мы улучшим в перспективе качество почв. Наконец, мы, надеюсь, привлечем потребителя своим «зеленым» подходом. Словом, мы переходим на рельсы органического земледелия».
– Экология для правительства Ленинградской области – вопрос номер один, – поддерживает директора председатель комитета по агропромышленному и рыбохозяйственному комплексу области Олег Малащенко. – Сельское хозяйство области на подъеме. Молочное поголовье в регионе составляет 180 тысяч голов, свиней – 175 тысяч, птицы – 130,5 млн. Нам просто не сохранить природу без современных технологий утилизации отходов. А с ними мы еще и повысим урожайность почв. Проекты мы намерены тиражировать на всю территорию области.
Биологи уличили анаэробные бактерии в клеточном дыхании с помощью Rnf-насоса
Kuhns, Martin et al.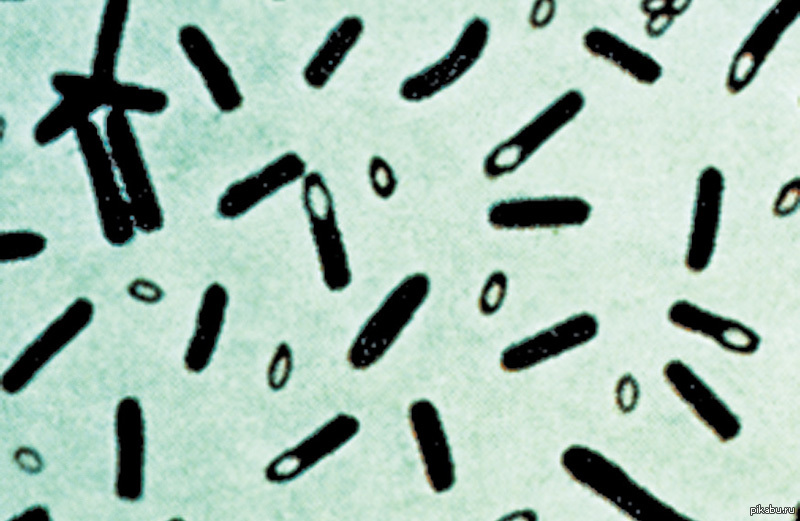 / Communication Biology, 2020
/ Communication Biology, 2020
Биологи доказали, что бактерии Thermotoga maritima используют мембранный белковый комплекс Rnf для клеточного дыхания — говорится в исследовании, опубликованном Communications Biology. Ученые выделили этот белок из бактериальных клеток и выяснили, что он работает как молекулярный насос — переносит через мембрану ионы Na+. Вместе с натриевой АТФ-синтазой комплекс Rnf формирует простую дыхательную цепь.
Клеточное дыхание — это последовательность химических превращений, в ходе которых клетка запасает энергию в виде молекул АТФ. В большинстве клеток эти превращения происходят при помощи ферментов дыхательной цепи.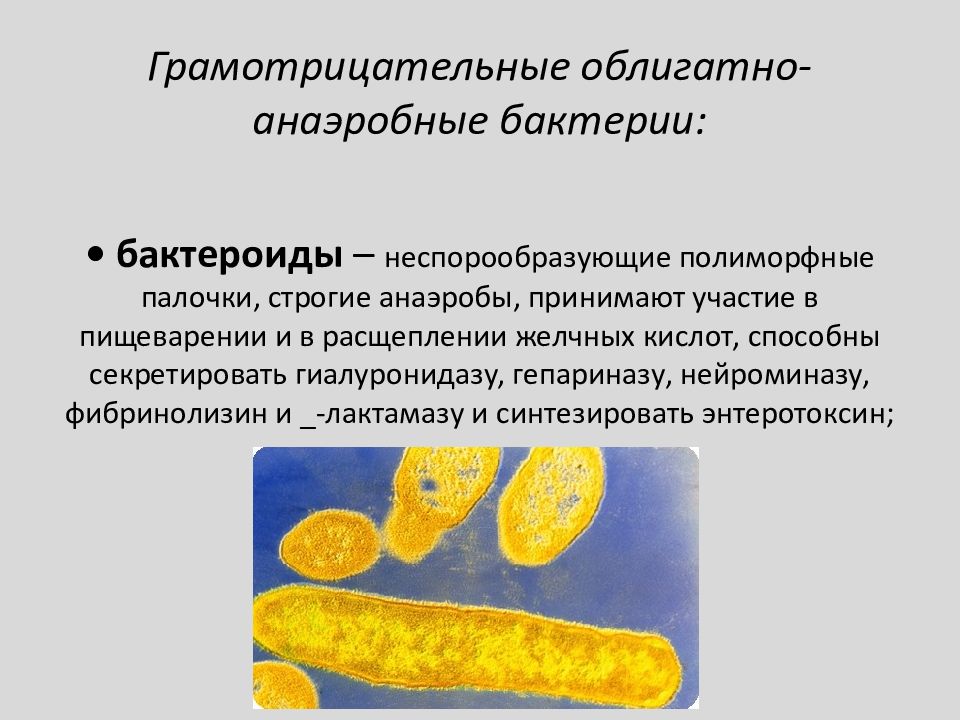 Они запасают энергию в два этапа: сначала молекулы-насосы перекачивают ионы через мембрану, создавая электрический потенциал, после чего заряды проходят обратно, сообщая энергию ферменту АТФ-синтазе, который и создает АТФ.
Они запасают энергию в два этапа: сначала молекулы-насосы перекачивают ионы через мембрану, создавая электрический потенциал, после чего заряды проходят обратно, сообщая энергию ферменту АТФ-синтазе, который и создает АТФ.
В эукариотических клетках дыхательная цепь расположена в мембране митохондрий и насчитывает пять комплексов. Но бактерии-анаэробы порой обходятся всего двумя: одной молекулой-насосом и АТФ-синтазой, которая тоже переносит ионы сквозь мембрану для запасания энергии. В дыхательной цепи бактерии часто используют NAD и ферредоксин — молекулы, которые переносят электроны между «звеньями». Сначала такая молекула восстанавливается, забирая электрон, а потом — окисляется, передавая его дальше в цепь.
Гены Rnf часто встречаются в геномах бактерий и их продукты до сих пор считались участниками клеточного дыхания у прокариот. На основе биохимических и генетических данных ученые выдвинули гипотезу о том, что эти белки закрепляются в мембране и участвуют в электронном транспорте. Однако выделить фермент и доказать его свойства не удавалось: белок неизбежно деградировал.
Однако выделить фермент и доказать его свойства не удавалось: белок неизбежно деградировал.
Мартин Кухнс (Martin Kuhns) и Драган Трифунович (Dragan Trifunović) из Франкфуртского института молекулярной биологии предположили, что тот же белок термофильных бактерий может оказаться стабильнее своих молекулярных родственников у других организмов. Для исследования ученые выбрали T. maritima — анаэробную бактерию, которая была впервые обнаружена в горячих водах вблизи итальянского города Вулкано. Идеальная температура для нее — около 80 градусов Цельсия.
В строго анаэробных условиях исследователям удалось выделить фермент со специфической оксидо-редуктазной активностью. В ходе изучения его свойств оказалось, что белок обладает сразу и АТФ-азной активностью, и способностью к окислению и восстановлению NAD. То есть выделенное вещество состояло из двух ферментов: оксидоредуктазы Rnf и АТФ-азы F1F0. Результаты анализа ученые оценили при помощи гель-электрофореза белков.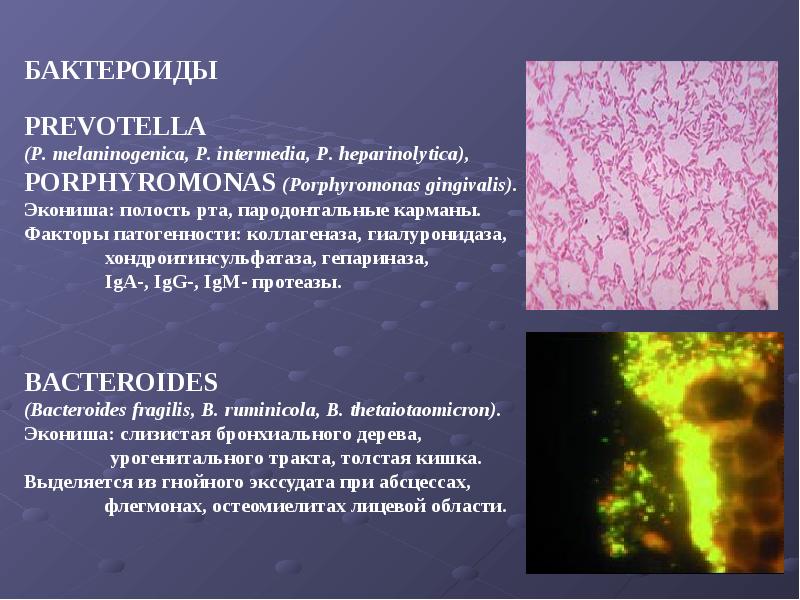
Разделение и идентификация белков Rnf и F1F0 на гель-электрофорезе
Kuhns, Martin et al./ Communication Biology, 2020
Предполагаемая масса белка Rnf — 160 килодальтон, то есть в выделенной смеси оказались и мономер белка, и его димер. Масса АТФ-азы F1F0 тоже совпала с теоретической — 550 килодальтон. После разделения соответствующие полоски белков выделили из геля. Чтобы установить, действительно ли суперкомплекс из двух белков участвует в дыхании, работу его компонентов оценили при разных концентрациях ионов. Оказалось, что активность F1F0 растет пропорционально концентрации натрия, а Rnf и вовсе не работает без этого иона.
Чтобы воссоздать работу суперкомплекса в мембране, ученые встроили его в липосому — специальный мембранный микрошарик. Это оказалось не так просто — ведь белки эффективно работают на высоких температурах, при которых липосомы теряли стабильность. Тогда решено было проводить эксперимент при температуре 45 градусов Цельсия, при которой активность АТФ-азы составляла 65% от оптимальной. В таких условиях липосома оставалась стабильной.
Это оказалось не так просто — ведь белки эффективно работают на высоких температурах, при которых липосомы теряли стабильность. Тогда решено было проводить эксперимент при температуре 45 градусов Цельсия, при которой активность АТФ-азы составляла 65% от оптимальной. В таких условиях липосома оставалась стабильной.
Транспорт натрия белками Rnf и АТФ-азой F1F0, встроенными в липосому, до и после добавления субстратов
Kuhns, Martin et al./ Communication Biology, 2020
Биологи хотели показать, что оба белка действительно транспортируют ионы сквозь мембрану. После их встройки исследователи поместили липосомы в раствор с ионами натрия. Затем они добавили субстрат: АТФ для АТФ-азы и NAD для Rnf. В обоих случаях произошел скачок концентрации натрия внутри липосомы. Биологи объясняют это транспортной натрий-зависимой активностью белков. Так Франкфуртские исследователи доказали давнюю гипотезу о функции гена Rnf у бактерий-анаэробов.
Биологи объясняют это транспортной натрий-зависимой активностью белков. Так Франкфуртские исследователи доказали давнюю гипотезу о функции гена Rnf у бактерий-анаэробов.
Эти организмы обычно используют в качестве окислителя не кислород, как аэробы, а серу, железо и азот. Но недавно были обнаружены хемосинтезирующие бактерии, которые способны фиксировать углерод за счет энергии окисления марганца. Ученые считают, что они могут замыкать природные циклы марганца и влиять на круговорот других элементов.
Анна Муравьева
Эффективное лечение пародонтита без боли и операций – ПЕРИОДЕНТ
“Заболевания пародонта, такие как пародонтит и гингивит, – самые распространённые заболевания в Мире” (Книга Рекордов Гиннеса).
Что такое пародонтит?
Современные представления о причинах и лечении пародонтита
Согласно официальной классификации и определению Всемирной Организации Здравоохранения, пародонтит – это инфекционное воспаление пародонта (совокупности тканей, удерживающих зуб). Были выявлены несколько семейств патогенных бактерий, вызывающих пародонтит в хронической или острой форме (т.н. “агрессивный пародонтит”). Большинство из этих семейств относятся к анаэробным бактериям.
☣ Анаэробная инфекция ☣
Общим свойством семейств патогенных анаэробных бактерий является также высокая устойчивость к антибиотикам и, в отличие от “нормальной” флоры, – эти бактерии питаются тканями пародонта. Некоторые из этих бактерий способны даже “обманывать” нашу иммунную систему и вызывать аутоиммунные реакции, заставляя организм “нападать” на здоровые клетки пародонта для того, чтобы самим питаться продуктами распада погибших тканей вокруг зуба.
Высокая, почти абсолютная устойчивость к лекарствам у патогенных бактерий, вызывающих пародонтит, объясняется их способностью выделять внешнюю биопленку (пресловутый зубной налёт), которая повышает устойчивость к средствам в тысячи раз (!). А также доказан обмен генами устойчивости между разными бактерия. Всё это делает пародонтальную инфекцию чуть ли неизлечимым заболеванием. Однако, это не так, современная пародонтология уже знает и успешно применяет эффективные методы лечения пародонтита.
☣ Пародонтит – опасное заболевание ☣
Выявлена и доказана прямое влияние пародонтита на весь организм в целом. В настоящее время доказано например, что риск инфаркта миокарда повышается в 7 раз, угроза выкидыша также резко возрастает. Несмотря на невероятность таких открытий, это доказано и совершенно логично, если понимать природу и причину возникновения пародонтита. Дело в том, что бактерии и их споры циркулируют с кровотоком по всему организму. В бляшках сосудов миокарда находят те же бактерии, которые вызвали пародонтит у данного пациента. Риск выкидыша объясняется способностью некоторых “пародонтитных” бактерий вызывать аутоиммунные реакции, перепрограммировать работу нашего клеточного иммунитета, провоцируя тем самым выкидыш!
☣ Причина пародонтита. Знать врага в лицо ☣
Ниже представлены несколько наиболее опасных и распространенных семейств бактерий, вызывающие острый (агрессивный) и хронический пародонтит.
Porphyromonas gingivalis (1 & 2) Actinobacillus actinomycetemcomitans (3)
P. intermedia (1), Bacteroides forsythus (2), Treponema denticola (3), T. socranskii
Современные методы эффективного лечения пародонтита.
Способность анаэробных бактерий жить и размножаться без доступа кислорода является также их главным слабым местом. Имея почти абсолютную устойчивость к антибиотикам (т.н. резистентность), данные бактерии абсолютно неустойчивы к такому сильному окислителю, как атомарный кислород. К счастью для нас, кислород не является токсичным для организма, не вызывает аллергии или побочных эффектов, однако атомарный кислород абсолютно губителен для клеточных клетов анаэробов, и самое главное, эти бактерии просто не в состоянии выработать устойчивость к атомарному кислороду.
Современные методы лечения пародонтита сводятся к разрушению защитной для бактерий биоплёнки и доставке атомарного кислорода непосредственно в контакт с анаэробными “пародонтитными” бактериями. Данный механизм показал абсолютную эффективность, достаточно мгновенного контакта для 100% дезинфекции.
На данный момент известно два основных эффективных метода дезинфекции пародонта:
озонирование поддесневого пространства
Озон это неустойчивое соединение, которое выделяет атомарный кислород, который нам нужен для дезинфекции пародонта. С помощью специального прибора озон доносится напрямую под десну, и происходит практически мгновенная гибель бактерий, грибков и вирусов. Процедура довольно быстрая, так требуется всего пара мгновений для контакта с инфекцией и абсолютно безболезненный. Метод получает всё более широкое распространение, существует несколько подобных аппаратов в том числе в России.
фотодинамическая терапия пародонтита
Данный метод основан на применении т.н. фотодинамического реагента, который избирательно прикрепляется к стенке патогенной бактерии, далее под воздействием света определенной длины волны этот реагент выделает атомарный кислород, который мгновнно убивает микроб.
Оба метода не являются инвазивными, могут осуществляться без операции, боли и разрезов десны!
Узнайте больше о наших услугах, задайте вопрос специалисту или запишитесь на бесплатную консультацию:
Страница не найдена |
Страница не найдена |
404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
14151617181920
21222324252627
282930
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Аэробно-анаэробное удаление азота: процессы нитри- и денитрификации
Процесс нитрификации протекает в две ступени, каждую из которых осуществляют специализированные бактерии — нитрификаторы первой и второй ступеней. Первую ступень неполной (частичной) нитрификации — окисление аммония до нитрита — осуществляют бактерии родов, названия которых начинаются с приставки Nitroso-: Nitrosomonas, Nitrosococcus, Nitrosolobus, Nitroosospira и Nitrosovibrio.
Окисление аммонийного азота до нитрита происходит через промежуточные стадии образования гидроксиламина (NH2OH), гипонитрита (NOH) по суммарной реакции:
NH4+ + 1,5 O2 = NO2– + 2H+ +H2O.
Электроны включаются в дыхательную цепь на уровне ФАД, и перенос их по цепи цитохромов сопряжен с двумя фосфорилированиями. Энергетическим субстратом, окисляемым в дыхательной цепи, служит гидроксиламин.
Вторую ступень — окисление нитрита до нитратов — осуществляют бактерии родов Nitribacter, Nitrospira, Nitrococcus по реакции:
NO2 + 0,5O2 = NO3–.
Преобладание в биореакторах процесса частичной нитрификации только до нитрита вследствие тех или иных причин может быть как негативным, так и позитивным. С одной стороны, нитрит является токсическим веществом, снижающим качество очищенной воды. С другой — наличие нитрита как субстрата стимулирует развитие анаэробных анаммокс-бактерий, которые имеют высокое сродство к азотным субстратам и обеспечивают более глубокую очистку воды от азотных загрязнений. Развитию этих бактерий способствует агрегирование активного ила и образование биопленок на материале-носителе.
Целью очистки сточных вод от загрязнений является образование молекулярного азота, который является инертным и основным компонентом приземного воздуха и атмосферы.
Образование молекулярного азота происходит в процессе денитрификации. Денитрифицирующие бактерии окисляют органические вещества нитритом или нитратом (анаэробное дыхание) с образованием молекулярного азота. В качестве источника углерода денитрифицирующие бактерии используют органические вещества. Способность к денитрификации обнаружена у бактерий, принадлежащим к разным физиологическим группам: фототрофам (Rhodopseudomonas sphaeroides), хемолитотрофам (Thiobacillus denitrificans, Paracoccus denitrificans), грамположительным и грамотрицательным факультативным анаэробам (виды родов Pseudomonas, Bacillus и др.). Наиболее часто способность к денитрификации распространена именно у этих родов, и большинство денитрификаторов являются хемоорганотрофами. Популяция гетеротрофных бактерий активного ила, осуществляющих процессы денитрификации, отличается большим разнообразием. В процессе денитрификации происходит цепь реакций:
NO3– à NO2– à NO à N2O à N2.
В зависимости от условий среды и состава динитрифицирующих бактерий промежуточные соединения могут выделяться во внешнюю среду.
Денитрифицирующие бактерии являются органотрофами, т.е. им необходимы органические субстраты. В процессе очистки сточных вод для доочистки воды от окисленных соединений азота используют два метода. Это рецикл очищенной в аэротенках воды, насыщенной окисленными соединениями азота, при котором вода возвращается в дениртификатор, расположенный в начале биологической очистки. Там эта вода перемешивается с поступающей на очистку водой, содержащей необходимые денитрификаторам органические вещества.
Вторым методом удаления азота в виде N2 является доочистка в анаэробном денитрификаторе на последнем этапе биологической очистки. Очищенная в аэротенках вода поступает в анаэробный денитрификатор, куда в качестве наиболее эффективного органического субстрата для денитрифицирующих бактерий добавляют метанол, этанол или уксусную кислоту. Обычно в таких денитрификаторах используют плавающую загрузку для иммобилизации денитрифицирующих бактерий и создания барьера на границе поверхности вода — воздух. Преимущественное развитие с метанолом в качестве субстрата получают бактерии, принадлежащие к гифомикробам, имеющим большое сродство к субстратам. Они практически полностью выедают метанол и образуют молекулярный азот. В России этот метод не используется.
За рубежом часто используют два денитирификатора — в начале и в конце процесса биологической очистки.
Анаэробные бактерии — обзор
Эпидемиология
Анаэробные бактерии — повсеместные представители нормальной флоры кожи и слизистых оболочек всех млекопитающих, 166,171,176 и основные роды, обнаруженные как нормальная флора лошадей, кажутся похожими на клинически значительные и нормальные анаэробы флоры человека и других млекопитающих. Может показаться несколько нелогичным, что облигатно-анаэробные бактерии в большом количестве обнаруживаются в местах, подверженных воздействию окружающего воздуха, таких как кожа или полость рта.Однако в дополнение к врожденной аэротолерантности, которой обладают некоторые облигатные анаэробы, в этих областях создается анаэробная микросреда за счет факультативно анаэробной бактериальной флоры (включая многие другие бактерии, знакомые врачам, такие как стафилококки, стрептококки, пастереллы, актинобациллы и т. и представители Enterobacteriaceae), потребляющие свободный кислород. 177 Анаэробы также являются частыми условно-патогенными микроорганизмами, вызывающими инфекции, когда эти бактерии получают доступ к анаэробным условиям в тканях, обычно возникающим в результате наличия некротической ткани и коинфекции с факультативно анаэробными бактериями.Хотя анаэробы могут вызывать инфекции сами по себе, в большинстве случаев анаэробные инфекции являются полимикробными, с множеством облигатно анаэробных бактерий, а также факультативно анаэробных бактерий.
Хотя большинство клинически значимых анаэробов можно найти на большинстве участков тела, определенные роды чаще встречаются на определенных участках. У людей роды, которые преимущественно колонизируют данный участок, также с наибольшей вероятностью могут быть обнаружены при инфекциях, связанных с этими анатомическими областями, и обнаружение определенных родов в крови может предсказать, в какой части тела возникает инфекция.Хотя эта связь не была хорошо продемонстрирована для лошадей, это, скорее всего, отражает отсутствие информации о нормальной анаэробной флоре лошадей и рутинном анаэробном культивировании крови, а не отсутствие такой корреляции.
Наиболее клинически значимыми инфекциями лошадей, вызываемыми облигатно анаэробными бактериями, являются пневмония и плевропневмония (см. Главу 1). Анаэробы, которые обнаруживаются из ротовой полости и дыхательных путей лошади, включают Bacteroides, Clostridium, Eubacterium, Fusobacterium, Peptostreptococcus, и Veillonella, , а также ряд других неопознанных анаэробных грамположительных палочек и кокков. 169 178 179 В одной серии исследований от 37% до 68% инфекций нижних дыхательных путей были связаны с анаэробами, обычно Bacteroides ; От 68% до 81% были смешаны с факультативными анаэробами, такими как стрептококки, пастереллы, актинобациллы и энтеробактерии; и 85% имели несколько анаэробов. 173 174 180 181 Наиболее часто встречающиеся анаэробы в случаях респираторных заболеваний лошадей включают Bacteroides , Clostridium , Eubacterium , Fusobacterium , Peptostreptococcus и Veillonella . 169 173 174 179-186 Клиническое значение анаэробного компонента этих инфекций подтверждается исследованиями, которые показали, что присутствие анаэробов было связано со снижением выживаемости, 173 173 174 181 185 и лошади, получавшие метронидазол, показали улучшенные клинические ответы и показатели выживаемости. 174 183 Анаэробные бактерии, вызывающие респираторные инфекции лошадей, скорее всего, возникают в результате аспирации нормальной флоры полости рта, поскольку большинство респираторных анаэробных патогенов также обнаруживаются на поверхности глоточных миндалин. 169 Анаэробы также часто связаны с различными параротовыми инфекциями, включая подчелюстные абсцессы, нижнечелюстной остеомиелит, инфекцию носовых пазух и зубные абсцессы. Преобладающие анаэробы, участвующие в этих инфекциях, очень похожи на анаэробы, обнаруживаемые при респираторных инфекциях, и как нормальная флора поверхности глоточных миндалин, 169 , и они, вероятно, возникают в результате условно-патогенных инфекций нормальной флоры.
Анаэробы также являются обычной флорой репродуктивного тракта лошадей (см. Главу 8).У нормальных жеребцов 96% проб, взятых из уретры, уретральной ямки, смегмы и предэякуляционной жидкости, содержали Bacteroides , Clostridium , Fusobacterium , Peptococcus и Peptostreptococcus . У нормальных кобыл 100% мазков из клитора, 24% мазков с эндометрия и 40% мазков с эндометрия содержали Bacteroides , Clostridium , Fusobacterium , Peptococcus и Peptostreptococcus spp. 187 Анаэробы, включая Bacteroides , Clostridium , Fusobacterium и Peptostreptococcus spp., Также могут быть выделены из образцов матки от кобыл с цитологическими признаками острого эндометрита. Предположительно, анаэробы могут вносить вклад в патологию матки во время активной инфекции, но возможность культивирования анаэробов от клинически здоровых кобыл иллюстрирует сложность интерпретации значения анаэробных бактерий, выявленных в образцах слизистой оболочки.
Анаэробные бактерии также часто связаны с внутрибрюшными инфекциями, такими как абсцессы и холангиогепатит. 188-190 Роды анаэробных бактерий, связанных с этими инфекциями, аналогичны родам, обнаруживаемым как нормальная флора в толстой кишке лошади, и включают Bacteroides , Bifidobacterium , Clostridium , Eubacterium , Lactobacillus и Пептострептококк. 191-194 Различные другие оппортунистические инфекции, включая ортопедические, 177 молочные, кожные и мышечные инфекции, 195 могут быть связаны с анаэробами.Как правило, любая рана или стерильный участок, особенно если инфекция вызвана заражением бактериями с кожи или слизистых оболочек, потенциально могут включать анаэробные бактерии.
Анаэробные инфекции — StatPearls — Книжная полка NCBI
Непрерывное обучение
Анаэробные бактерии являются частью нормальной флоры кожи и слизистых оболочек человека. Место анаэробной инфекции обычно является местом нормальной колонизации. Спектр инфекций варьируется от местных абсцессов до опасных для жизни инфекций.Анаэробные бактерии отличаются от аэробных бактерий потребностью в кислороде. Кислород токсичен для анаэробов, что можно объяснить отсутствием в анаэробах ферментов каталазы, супероксиддисмутазы и пероксидазы. Диагноз требует клинического подозрения и надлежащей микробиологической идентификации. Это упражнение исследует, когда это состояние следует учитывать при дифференциальной диагностике и как правильно его оценить. Это мероприятие подчеркивает роль межпрофессиональной команды в уходе за пациентами с этим заболеванием.
Цели:
Определить этиологию анаэробных инфекций.
Изучите различные клинические проявления анаэробных инфекций,
Опишите возможные варианты лечения анаэробных инфекций.
Объясните важность улучшения координации оказания помощи межпрофессиональной командой для достижения лучших клинических результатов у пациентов с анаэробными инфекциями.
Заработайте кредиты на непрерывное образование (CME / CE) по этой теме.
Введение
Анаэробные бактерии являются частью нормальной микрофлоры кожи и слизистых оболочек человека. Место анаэробной инфекции обычно является местом нормальной колонизации. Спектр инфекций варьируется от местных абсцессов до опасных для жизни инфекций. Анаэробные бактерии отличаются от аэробных бактерий потребностью в кислороде. Кислород токсичен для анаэробов, что можно объяснить отсутствием в анаэробах ферментов каталазы, супероксиддисмутазы и пероксидазы.Анаэробы являются привередливыми организмами, и их трудно выращивать, если не используются надлежащие методы сбора и культивирования. Диагноз требует клинического подозрения и надлежащей микробиологической идентификации. [1] [2]
В зависимости от потребности в кислороде бактерии можно разделить на следующие группы:
Облигатные аэробы нуждаются в кислороде в качестве конечного акцептора электронов и не имеют другого источника энергии, например ферментации.
Обязательные анаэробы получают энергию посредством ферментации и используют органические соединения в качестве концевых акцепторов электронов.
Факультативные анаэробы могут расти в присутствии или в отсутствие кислорода.
Облигатные анаэробы можно подразделить на 2 типа в зависимости от процентного содержания кислорода, который может оказаться токсичным. Строгие облигатные анаэробы не выживут, если в окружающей среде содержится более половины процента кислорода, в то время как умеренные облигатные анаэробы все еще могут расти в среде с 2-8% кислорода.
Этиология
Общие очаги анаэробных инфекций включают полости рта, брюшной полости и таза; однако анаэробы могут вызывать инфекции других областей, таких как голова, шея и кожа.Клинически значимые анаэробы, связанные с инфекциями человека, следующие:
грамположительные
грамположительные спорообразующие бациллы
Clostridium : это споровые анаэробы, ответственные за некоторые из более серьезных человеческих инфекции. На их долю приходится около 10% всех анаэробных инфекций. Значительными членами этого семейства являются Clostridium difficile, , вызывающие инфекцию C. difficile . Clostridium perfringens, , вызывающая газовую гангрену или инфекции мягких тканей. Clostridium septicum также вызывает газовую гангрену.
Грамположительные неспорообразующие бациллы
Actinomyces: Они колонизируют желудочно-кишечный тракт (ЖКТ) человека, а инфекции возникают в результате разрыва кожно-слизистого барьера. 3 наиболее распространенных анатомических участка, пораженных Actinomyces , — это шейно-лицевой, грудной и абдоминальный отделы.
Propionibacterium : Этот вид является частью нормальной флоры кожи и слизистых оболочек.Наиболее значительным членом этого семейства является Propionibacterium acne , который играет роль в патогенезе обыкновенных угрей.
Bifidobacterium : это нормальная флора кишечного тракта. Обычно он не патогенный; однако зарегистрированы педиатрические инфекции в виде хронического среднего отита, абсцессов брюшной полости и перитонита.
Lactobacillus: Эти организмы также обычно встречаются в желудочно-кишечном тракте и могут быть извлечены из многочисленных пищевых продуктов.Имеют низкий патогенный потенциал; однако описаны случаи абсцессов брюшной полости, аспирационной пневмонии и бактериемии, особенно у новорожденных.
Peptococcus и Peptostreptococcus : Эти анаэробы являются частью ротовой полости, желудочно-кишечного тракта, верхних дыхательных путей и мочеполовых путей, а также кожи. Они могут быть патогенными и вызывать многочисленные инфекции, такие как хронический средний отит, хронический синусит, аспирационная пневмония, воспалительные заболевания органов малого таза, включая абсцессы трубчатых яичников.
Другие члены включают Eubacterium, Bifidobacterium, Arcanobacterium, и микроаэрофильные Streptococcus ( Streptococcus anginosus, Streptococcus 9013atus , Streptococcus .
Грамотрицательные
Bacteroides: Это наиболее часто обнаруживаемые анаэробные патогены из клинических образцов. Они являются частью кишечной микрофлоры человека и нормальной микрофлоры женских половых органов.Эти организмы чаще всего являются причиной внутрибрюшных инфекций, особенно абсцессов. Большинство этих абсцессов представляют собой смешанные инфекции. Они также могут вызывать экстраабдоминальные инфекции, такие как аспирационная пневмония, абсцессы мозга и другие.
Fusobacterium : один из видов этой группы анаэробов, Fusobacterium necrophorum, является частой причиной перитонзиллярных абсцессов, связанных с осложнением тромбоза внутренней яремной вены, известного как синдром Лемьера.
Campylobacter: Это одна из наиболее частых причин острого бактериального гастроэнтерита.
Prevotella: Это нормальная флора ротовой полости и кишечного тракта человека. У детей они часто связаны с инфекциями головы и шеи, такими как перитонзиллярные абсцессы, заглоточные абсцессы, а также перинеальные или перианальные инфекции, такие как пилонидальные абсцессы.
Veillonella: Иногда ассоциируется с абсцессами брюшной полости и аспирационной пневмонией у детей.
Эпидемиология
Анаэробы являются частью местной или местной флоры, особенно ротовой полости, кишечника человека и женских половых путей. Колонизация анаэробами зависит от возраста, расположения органа и факторов окружающей среды. Например, у младенцев, находящихся на исключительно грудном вскармливании, кишечная флора преимущественно представлена Bifidobacterium , с небольшим количеством видов Bacteroides и Enterococcus . С другой стороны, младенцы, которых кормят коровьим молоком, имеют кишечную флору, аналогичную флоре кишечника взрослых, которая содержит грамотрицательные анаэробы и факультативные бациллы.[3] [4] [5]
Анаэробы являются частью местной флоры, которая сопротивляется колонизации и вторжению со стороны неместной флоры. Однако инфекции от анаэробов действительно возникают и обычно возникают в результате нарушения кожно-слизистого барьера или подавления иммунитета. Анаэробные инфекции органов включают, помимо прочего, абсцессы головного мозга, стоматологические инфекции, аспирационную пневмонию, абсцессы легких, инфекции укусов (животных / человека), абсцессы брюшной полости и некротические инфекции мягких тканей.
Патофизиология
Патогенез анаэробных инфекций включает нарушение слизистой оболочки и проникновение анаэробных бактерий в глубокие ткани.Механизмы проникновения включают местную травму, хирургическое вмешательство, перфорацию внутренних органов (например, аппендицит), некроз тканей и нарушение очистки стерильного участка (хронический синусит, пневмония). Место и степень заражения зависят от факторов вирулентности организма и иммунитета хозяина.
Факторами вирулентности, которые способствуют анаэробным инфекциям, являются факторы адгезии (фимбрии и лектин), факторы инвазии (фосфолипаза С, липополисахариды и протеазы), факторы, участвующие в деструкции тканей (фибринолиз, ацетилглюкозаминидаза и выработка коллагеназы), устойчивость капсулы к фагоцитозу. и другие.У хозяина с ослабленным иммунитетом наблюдаются серьезные инфекции.
При участии в абсцессе анаэробы обычно являются частью полимикробной инфекции. Экспериментальные модели крыс со смешанными инфекциями показали, что рост анаэробов, а также аэробов усиливается при полимикробных инфекциях.
История и физика
Большинство анаэробных инфекций у детей носят локальный характер, и инфекции кровотока составляют менее 2% случаев. Подход к анаэробным инфекциям включает выявление предрасполагающих факторов.К ним относятся:
Инфекция участка органа, заразная участку с местной колонизацией (ротовая полость, кишечник)
Обструкция: например, инородное тело в носу, непроходимость аппендикса, непроходимость кишечника
Перфорация: Полые внутренние органы, например, перфорация кишечника.
Неспособность хозяина выводить выделения, например, дети с церебральным параличом предрасположены к аспирационной пневмонии.
Укусы животных и людей, приведшие к проникающей травме от оральных анаэробов
Другие важные признаки анаэробной инфекции включают наличие состояния, предрасполагающего человека к анаэробной инфекции, например, некроз тканей, выделения с неприятным запахом , инфекция, приводящая к тромбофлебиту, при подозрении на анаэробную активность антибиотики не улучшают.
Клиницисты должны получить анаэробный посев при подозрении на анаэробную инфекцию.
Общие инфекции в области органов при анаэробных и аэробных инфекциях
Инфекция головы и шеи: Анаэробы обычно вызывают стоматологические инфекции, такие как зубные абсцессы, гингивит и пародонтит. Обычно присутствуют результаты осмотра: кариес или плохой прикус. Анаэробы также вовлечены вместе с другими аэробами в гнойные инфекции заглоточного абсцесса, перитонзиллярного абсцесса, шейного лимфаденита, глубоких абсцессов шеи и паротита.Анаэроб, связанный с Fusobacterium, связан с осложнением перитонзиллярного абсцесса, известным как синдром Лемьера. Синдром Лемьера вызывается септическим тромбофлебитом яремной вены и метастатическими эмболами в легкие и печень.
Анаэробы также вызываются хроническим средним отитом и хроническим синуситом, наряду с другими аэробами, такими как Staphylococcus aureus и Pseudomonas.
Инфекции центральной нервной системы (ЦНС): Анаэробы обычно выделяются в культурах из абсцессов головного мозга, которые возникают в результате осложнения синусита, среднего отита, стоматологических инфекций.Обычно выделяют 3 анаэроба: Fusobacterium , Prevotella и Bacteroides . Эти же микроорганизмы встречаются и при эпидуральных инфекциях.
Внутрибрюшные инфекции: Повреждение стенки кишечника, видимое на перфорированном отростке, дает кишечным анаэробам доступ к брюшной полости. В течение нескольких дней или недель это приводит к формированию абсцессов брюшной полости. Абдоминальные абсцессы почти всегда представляют собой смешанные инфекции, содержащие как аэробы, так и анаэробы.Наиболее частым анаэробом, вызывающим абдоминальные инфекции, является Bacteroides fragilis, за которым следуют виды Lactobacillus и Clostridium .
Анаэробы также являются частой причиной абсцессов печени. Общие ассоциированные анаэробы — это виды Bacteroides и Fusobacterium .
Воспалительные заболевания органов малого таза: Все анаэробы участвуют в воспалительных заболеваниях органов малого таза (ВЗОМТ). Сексуально активным женщинам с признаками и симптомами, совместимыми с воспалительными заболеваниями органов малого таза, показана эмпирическая антимикробная терапия против анаэробов и анаэробов.Обычными анаэробами, участвующими в ВЗОМТ, являются Prevotella , Porphyromonas , Clostridium .
Легочные инфекции наблюдаются у детей, которые не могут контролировать секрецию верхних дыхательных путей или не имеют нормального кашлевого рефлекса, например, у детей с церебральным параличом и трахеопищеводными мальформациями. Аспирация приводит к пневмонии, которая при отсутствии лечения может перерасти в абсцесс. Преобладающие возбудители аспирационной пневмонии являются частью ротоглоточной флоры и включают Peptostreptococcus, Prevotella, Bacteroides fragilis и Fusobacterium.
Инфекции кожи и мягких тканей: Анаэробы могут вызвать периректальный абсцесс или лицевой абсцесс у детей. Bacteroides fragilis и Clostridium видов обычно вовлечены в периректальные инфекции, а Prevotella , Porphyromonas и Fusobacterium вовлечены в инфекции полости рта.
Оценка
Выявление серьезных анаэробных инфекций
Своевременное выявление важно для начала эмпирической терапии.Опасные для жизни инфекции, такие как столбняк, газовая гангрена или детский ботулизм, вызываются спорообразующими анаэробами, Clostridium tetanus , Clostridium perfringens, или Clostridium botulism, соответственно [6] [7].
История травмы, например проникающая травма ногтя или наличие омертвевшей ткани, должна побуждать к обследованию на столбняк у иммунизированного ребенка.
Газовая гангрена вызывается Clostridium perfringens или Clostridium septicum .Это неотложная медицинская помощь, требующая хирургической обработки раны в дополнение к антибактериальной терапии пенициллин-содержащими антибиотиками в сочетании с клиндамицином.
Ботулизм проявляется как нисходящий паралич, особенно у младенцев. Часто встречаются случаи употребления поврежденных консервов, использования меда, проживания или путешествия в эндемичные регионы (высокое количество клостридиальных спор). Результаты физикального обследования относятся к младенцу без лихорадки с острым началом трудностей с кормлением и поражением бульбара (отсутствие рвотного рефлекса).В отношении подозреваемых случаев экспертиза предоставляется Министерством здравоохранения Калифорнии. Стул следует отправить на проверку на наличие спор Clostridium botulism . Основой лечения является поддерживающая терапия с применением иммуноглобулина против ботулизма (BabyBIG) или без него.
У подростка с болью в горле, болью в шее и тахикардией, непропорциональной лихорадке, следует учитывать синдром Лемьера. Для выявления тромбофлебита внутренних яремных вен необходимо провести ультразвуковое исследование шейки допплера, а для выявления септических эмболов — сделать рентген грудной клетки.
Местные инфекции, включая абсцессы
Абсцессы могут быть ограничены ЦНС, головой и областью шеи. Область живота можно диагностировать с помощью соответствующего анаэробного посева. Образец следует собирать в стерильном месте, желательно в обход нормальной микрофлоры и с помощью пункционной аспирации или хирургического исследования. Аспират ткани или жидкости предпочтительнее мазка. После сбора образец следует отправить в анаэробную транспортную среду и внести посев в бескислородную среду.
Лечение / ведение
Шаг 1
Лечение анаэробной инфекции зависит от места инфицирования, хозяина, а также наличия или отсутствия абсцесса. Как правило, абсцесс всегда должен быть дренирован , а культура отправлена на аэробную и анаэробную культуру. Кроме того, хирургическая обработка некротической ткани при клостридийно-некротическом фасциите имеет решающее значение в лечении. [8] [9] [10]
Step 2
После получения необходимых культур ребенку следует назначить эмпирические антибиотики с активностью против анаэробов.Возможны следующие варианты:
Метронидазол : Обладает отличной активностью против грамотрицательных препаратов, таких как Bacteroides fragilis . Его активность против грамположительных результатов хорошая, хотя и менее надежная. Метронидазол имеет отличную биодоступность (100%) и хорошо проникает в ткани, включая центральную нервную систему и брюшную полость. Метронидазол придает металлический привкус во рту, что часто называют причиной прекращения приема.
Клиндамицин активен против многих анаэробов.Устойчивость клиндамицина к Bacteroides fragilis возрастает, и он менее надежен по сравнению с метронидазолом, ингибитором пенициллина / бета-лактамазы или карбапенемом. Клиндамицин, вводимый внутривенно или перорально, хорошо проникает в ткани, включая абсцессы, кости и суставы. Клиндамицин, однако, не проникает в центральную нервную систему.
Комбинация ингибиторов пенициллина / бета-лактамазы : Пенициллин сам по себе активен против анаэробов, не продуцирующих бета-лактамазу, таких как Clostridium perfringens .Однако большинство грамотрицательных анаэробов продуцируют бета-лактамазу и комбинированные пенициллины, такие как пероральный амоксициллин / клавуланат или внутривенный (IV) / внутримышечный (IM) ампициллин / сульбактам, тикарциллин / клавуланат и пиперациллин / тазобактам.
Цефалоспорин второго поколения: Что касается цефалоспоринов, цефалоспорины второго поколения цефокситин, цефотетан и цефметазол более активны в отношении Bacteroides fragilis. Однако, учитывая возрастающую резистентность, они не рекомендуются в качестве эмпирического лечения.Обычно используется в хирургической профилактике.
Карбапенемы : Обладают отличной активностью против анаэробов, а также аэробов, вовлеченных в интраабдоминальные и другие органы, такие как ЦНС. Меропенем немного более активен, чем имипенем, в отношении грамотрицательных бактерий.
Хинолоны : хорошо всасываются и проникают в ткани. Однако резистентность растет, и их следует применять только детям с аллергией на бета-лактам. Хинолоны, обладающие активностью против анаэробов, включают левофлоксацин и моксифлоксацин.
Дифференциальный диагноз
Аэробные абсцессы от Escherichia coli , Pseudomonas, такие как абсцесс мозга, абсцессы головы и шеи, легочные инфекции и внутрибрюшные инфекции.
Жемчуг и другие проблемы
Рассмотрите возможность анаэробной инфекции, если место предполагаемой инфекции находится рядом с нормальной местной анаэробной флорой, такой как рот, кишечник или женские половые пути.
Выявление предрасположенности, такой как непроходимость, перфорация, травма, неспособность хозяина очищать секреты, снижение притока крови к ткани, например некроз ткани.
Следует предпринять попытку отправить анаэробные культуры, что предполагает надлежащий сбор, быструю транспортировку и надлежащие методы культивирования. Тканевый или гнойный материал предпочтительнее посылать мазки.
Метронидазол обладает анаэробной активностью широкого спектра с наименьшей резистентностью. Другие анаэробные антибиотики включают клиндамицин, комбинацию ингибиторов пенициллин-бета-лактамаз, цефалоспорины второго поколения, карбапенемы и хинолоны.
Улучшение результатов команды здравоохранения
Анаэробные инфекции распространены как у амбулаторных, так и у стационарных пациентов. Поскольку эти инфекции могут поражать различные органы и проявляться по-разному, с ними лучше всего справиться межпрофессиональная команда. Поставщикам первичной медико-санитарной помощи, практикующим медсестрам и другим медицинским работникам необходимо проконсультироваться со специалистом по инфекционным заболеваниям, когда они сталкиваются с инфекцией, которая не поддается лечению обычными антибиотиками или имеет странное проявление.По поводу дренирования часто обращаются к общим хирургам. Фармацевт должен пересмотреть выбор лекарств, взаимодействия с ними и соблюдение пациентом режима лечения, а также сообщить о проблемах команде. Медсестры должны помогать в координации ухода, способствовать общению между членами межпрофессиональной команды и помогать в обучении пациентов и их семей. При необходимости следует привлекать медсестер, прошедших специальную подготовку, в том числе медико-хирургических и инфекционных.
При неправильном диагнозе анаэробные инфекции приводят к высокой смертности.[11] [12] [13]
Прогноз зависит от типа анаэробной инфекции.
В нашу эпоху вакцинации против столбняка и доступности поддерживающей терапии столбняк не встречается в развитых странах мира. Любого ребенка с чистой проникающей ранкой следует вакцинировать от столбняка, а в случае зараженной раны следует рассмотреть возможность использования противостолбнячной вакцины и столбнячных иммуноглобулинов на основе последней вакцины против столбняка.
Любую загрязненную рану необходимо очистить и удалить инородное тело.
Хорошая гигиена полости рта и полости рта предотвращает анаэробные инфекции.
При операциях на брюшной полости, требующих проникновения полых внутренних органов, следует рассмотреть возможность применения антибиотиков с анаэробной активностью, таких как цефокситин.
Непрерывное образование / обзорные вопросы
Ссылки
- 1.
- Алаузет С., Лозневский А., Маршандин Х. Устойчивость к метронидазолу и гены ним у анаэробов: обзор. Анаэроб. 2019 Февраль; 55: 40-53.[PubMed: 30316817]
- 2.
- Bula-Rudas FJ, Olcott JL. Укусы человека и животных. Pediatr Rev.2018 Октябрь; 39 (10): 490-500. [PubMed: 30275032]
- 3.
- Ghoneim NH, Hamza DA. Эпидемиологические исследования пищевых отравлений Clostridium perfringens в пищевых продуктах розничной торговли. Rev Sci Tech. 2017 декабрь; 36 (3): 1025-1032. [PubMed: 30160688]
- 4.
- Шакья Н., Шарма Д., Ньюаскар В., Агравал Д., Шривастава С., Ядав Р. Эпидемиология, микробиология и чувствительность к антибиотикам одонтогенных космических инфекций в Центральной Индии.J Maxillofac Oral Surg. 2018 сентябрь; 17 (3): 324-331. [Бесплатная статья PMC: PMC6028331] [PubMed: 30034150]
- 5.
- Пиннола А., Куо Й.Х., Скиарретта Дж. Д., Макинтайр А., Мессье Р., Дэвис Дж. М.. Бактериология и сопутствующие заболевания у пациентов, которым требуется хирургическое лечение эмпиемы. Am Surg. 2018, 01 апреля; 84 (4): 599-603. [PubMed: 29712613]
- 6.
- Messbarger N, Neemann K. Роль анаэробных культур крови в неонатальной бактериемии. J Pediatric Infect Dis Soc. 2018 17 августа; 7 (3): e65-e69. [PubMed: 2
80]
- 7.
- Jacobs MR, Mazzulli T, Hazen KC, Good CE, Abdelhamed AM, Lo P, Shum B, Roman KP, Robinson DC. Многоцентровая клиническая оценка системы культуры крови BacT / Alert Virtuo. J Clin Microbiol. 2017 август; 55 (8): 2413-2421. [Бесплатная статья PMC: PMC5527419] [PubMed: 28539343]
- 8.
- Byun JH, Kim M, Lee Y, Lee K, Chong Y. Модели антимикробной чувствительности клинических изолятов анаэробных бактерий с 2014 по 2016 год, включая недавно названные или Переименованные виды. Ann Lab Med. 2019 Март; 39 (2): 190-199.[Бесплатная статья PMC: PMC6240532] [PubMed: 30430782]
- 9.
- Kheir MM, Tan TL, Ackerman CT, Modi R, Foltz C, Parvizi J. Культивирование перипротезной инфекции суставов: количество образцов, продолжительность роста и организмы . J Артропластика. 2018 ноя; 33 (11): 3531-3536.e1. [PubMed: 300]
- 10.
- Нич О., Крутова М. [Clostridium difficile остается проблемой со здоровьем]. Рожл Чир. Осень 2017; 96 (10): 411-414. [PubMed: 206]
- 11.
- Липски Б.А., Берендт А.Р., Корниа ПБ, Пайл Дж.С., Питерс Э.Дж., Армстронг Д.Г., Дери Х.Г., Эмбиль Дж.М., Джозеф В.С., Карчмер А.В., Пинзур М.С., Сенневиль Э.Руководство по клинической практике общества инфекционных болезней Америки 2012 г. по диагностике и лечению инфекций диабетической стопы. J Am Podiatr Med Assoc. 2013 январь-февраль; 103 (1): 2-7. [PubMed: 23328846]
- 12.
- Барсук В.О., Ледебур Н.А., Грэм МБ, Эдмистон CE. Clostridium difficile: эпидемиология, патогенез, лечение и профилактика стойкого патогена, связанного с оказанием медицинской помощи. JPEN J Parenter Enteral Nutr. 2012 ноябрь; 36 (6): 645-62. [PubMed: 22577120]
- 13.
- Рое З., Рое З., Матич Д., Либреняк Д., Докузович С., Варводич Я.Некротический фасциит: обзор литературы по современным стратегиям диагностики и лечения с тремя описаниями случаев: торс, брюшная стенка, верхние и нижние конечности. Мир J Emerg Surg. 23 декабря 2011 г .; 6 (1): 46. [Бесплатная статья PMC: PMC3310784] [PubMed: 22196774]
Анаэробные инфекции — StatPearls — Книжная полка NCBI
Непрерывное обучение
Анаэробные бактерии являются частью нормальной флоры кожи и слизистых оболочек человека. Место анаэробной инфекции обычно является местом нормальной колонизации.Спектр инфекций варьируется от местных абсцессов до опасных для жизни инфекций. Анаэробные бактерии отличаются от аэробных бактерий потребностью в кислороде. Кислород токсичен для анаэробов, что можно объяснить отсутствием в анаэробах ферментов каталазы, супероксиддисмутазы и пероксидазы. Диагноз требует клинического подозрения и надлежащей микробиологической идентификации. Это упражнение исследует, когда это состояние следует учитывать при дифференциальной диагностике и как правильно его оценить.Это мероприятие подчеркивает роль межпрофессиональной команды в уходе за пациентами с этим заболеванием.
Цели:
Определить этиологию анаэробных инфекций.
Изучите различные клинические проявления анаэробных инфекций,
Опишите возможные варианты лечения анаэробных инфекций.
Объясните важность улучшения координации оказания помощи межпрофессиональной командой для достижения лучших клинических результатов у пациентов с анаэробными инфекциями.
Заработайте кредиты на непрерывное образование (CME / CE) по этой теме.
Введение
Анаэробные бактерии являются частью нормальной микрофлоры кожи и слизистых оболочек человека. Место анаэробной инфекции обычно является местом нормальной колонизации. Спектр инфекций варьируется от местных абсцессов до опасных для жизни инфекций. Анаэробные бактерии отличаются от аэробных бактерий потребностью в кислороде. Кислород токсичен для анаэробов, что можно объяснить отсутствием в анаэробах ферментов каталазы, супероксиддисмутазы и пероксидазы.Анаэробы являются привередливыми организмами, и их трудно выращивать, если не используются надлежащие методы сбора и культивирования. Диагноз требует клинического подозрения и надлежащей микробиологической идентификации. [1] [2]
В зависимости от потребности в кислороде бактерии можно разделить на следующие группы:
Облигатные аэробы нуждаются в кислороде в качестве конечного акцептора электронов и не имеют другого источника энергии, например ферментации.
Обязательные анаэробы получают энергию посредством ферментации и используют органические соединения в качестве концевых акцепторов электронов.
Факультативные анаэробы могут расти в присутствии или в отсутствие кислорода.
Облигатные анаэробы можно подразделить на 2 типа в зависимости от процентного содержания кислорода, который может оказаться токсичным. Строгие облигатные анаэробы не выживут, если в окружающей среде содержится более половины процента кислорода, в то время как умеренные облигатные анаэробы все еще могут расти в среде с 2-8% кислорода.
Этиология
Общие очаги анаэробных инфекций включают полости рта, брюшной полости и таза; однако анаэробы могут вызывать инфекции других областей, таких как голова, шея и кожа.Клинически значимые анаэробы, связанные с инфекциями человека, следующие:
грамположительные
грамположительные спорообразующие бациллы
Clostridium : это споровые анаэробы, ответственные за некоторые из более серьезных человеческих инфекции. На их долю приходится около 10% всех анаэробных инфекций. Значительными членами этого семейства являются Clostridium difficile, , вызывающие инфекцию C. difficile . Clostridium perfringens, , вызывающая газовую гангрену или инфекции мягких тканей. Clostridium septicum также вызывает газовую гангрену.
Грамположительные неспорообразующие бациллы
Actinomyces: Они колонизируют желудочно-кишечный тракт (ЖКТ) человека, а инфекции возникают в результате разрыва кожно-слизистого барьера. 3 наиболее распространенных анатомических участка, пораженных Actinomyces , — это шейно-лицевой, грудной и абдоминальный отделы.
Propionibacterium : Этот вид является частью нормальной флоры кожи и слизистых оболочек.Наиболее значительным членом этого семейства является Propionibacterium acne , который играет роль в патогенезе обыкновенных угрей.
Bifidobacterium : это нормальная флора кишечного тракта. Обычно он не патогенный; однако зарегистрированы педиатрические инфекции в виде хронического среднего отита, абсцессов брюшной полости и перитонита.
Lactobacillus: Эти организмы также обычно встречаются в желудочно-кишечном тракте и могут быть извлечены из многочисленных пищевых продуктов.Имеют низкий патогенный потенциал; однако описаны случаи абсцессов брюшной полости, аспирационной пневмонии и бактериемии, особенно у новорожденных.
Peptococcus и Peptostreptococcus : Эти анаэробы являются частью ротовой полости, желудочно-кишечного тракта, верхних дыхательных путей и мочеполовых путей, а также кожи. Они могут быть патогенными и вызывать многочисленные инфекции, такие как хронический средний отит, хронический синусит, аспирационная пневмония, воспалительные заболевания органов малого таза, включая абсцессы трубчатых яичников.
Другие члены включают Eubacterium, Bifidobacterium, Arcanobacterium, и микроаэрофильные Streptococcus ( Streptococcus anginosus, Streptococcus 9013atus , Streptococcus .
Грамотрицательные
Bacteroides: Это наиболее часто обнаруживаемые анаэробные патогены из клинических образцов. Они являются частью кишечной микрофлоры человека и нормальной микрофлоры женских половых органов.Эти организмы чаще всего являются причиной внутрибрюшных инфекций, особенно абсцессов. Большинство этих абсцессов представляют собой смешанные инфекции. Они также могут вызывать экстраабдоминальные инфекции, такие как аспирационная пневмония, абсцессы мозга и другие.
Fusobacterium : один из видов этой группы анаэробов, Fusobacterium necrophorum, является частой причиной перитонзиллярных абсцессов, связанных с осложнением тромбоза внутренней яремной вены, известного как синдром Лемьера.
Campylobacter: Это одна из наиболее частых причин острого бактериального гастроэнтерита.
Prevotella: Это нормальная флора ротовой полости и кишечного тракта человека. У детей они часто связаны с инфекциями головы и шеи, такими как перитонзиллярные абсцессы, заглоточные абсцессы, а также перинеальные или перианальные инфекции, такие как пилонидальные абсцессы.
Veillonella: Иногда ассоциируется с абсцессами брюшной полости и аспирационной пневмонией у детей.
Эпидемиология
Анаэробы являются частью местной или местной флоры, особенно ротовой полости, кишечника человека и женских половых путей. Колонизация анаэробами зависит от возраста, расположения органа и факторов окружающей среды. Например, у младенцев, находящихся на исключительно грудном вскармливании, кишечная флора преимущественно представлена Bifidobacterium , с небольшим количеством видов Bacteroides и Enterococcus . С другой стороны, младенцы, которых кормят коровьим молоком, имеют кишечную флору, аналогичную флоре кишечника взрослых, которая содержит грамотрицательные анаэробы и факультативные бациллы.[3] [4] [5]
Анаэробы являются частью местной флоры, которая сопротивляется колонизации и вторжению со стороны неместной флоры. Однако инфекции от анаэробов действительно возникают и обычно возникают в результате нарушения кожно-слизистого барьера или подавления иммунитета. Анаэробные инфекции органов включают, помимо прочего, абсцессы головного мозга, стоматологические инфекции, аспирационную пневмонию, абсцессы легких, инфекции укусов (животных / человека), абсцессы брюшной полости и некротические инфекции мягких тканей.
Патофизиология
Патогенез анаэробных инфекций включает нарушение слизистой оболочки и проникновение анаэробных бактерий в глубокие ткани.Механизмы проникновения включают местную травму, хирургическое вмешательство, перфорацию внутренних органов (например, аппендицит), некроз тканей и нарушение очистки стерильного участка (хронический синусит, пневмония). Место и степень заражения зависят от факторов вирулентности организма и иммунитета хозяина.
Факторами вирулентности, которые способствуют анаэробным инфекциям, являются факторы адгезии (фимбрии и лектин), факторы инвазии (фосфолипаза С, липополисахариды и протеазы), факторы, участвующие в деструкции тканей (фибринолиз, ацетилглюкозаминидаза и выработка коллагеназы), устойчивость капсулы к фагоцитозу. и другие.У хозяина с ослабленным иммунитетом наблюдаются серьезные инфекции.
При участии в абсцессе анаэробы обычно являются частью полимикробной инфекции. Экспериментальные модели крыс со смешанными инфекциями показали, что рост анаэробов, а также аэробов усиливается при полимикробных инфекциях.
История и физика
Большинство анаэробных инфекций у детей носят локальный характер, и инфекции кровотока составляют менее 2% случаев. Подход к анаэробным инфекциям включает выявление предрасполагающих факторов.К ним относятся:
Инфекция участка органа, заразная участку с местной колонизацией (ротовая полость, кишечник)
Обструкция: например, инородное тело в носу, непроходимость аппендикса, непроходимость кишечника
Перфорация: Полые внутренние органы, например, перфорация кишечника.
Неспособность хозяина выводить выделения, например, дети с церебральным параличом предрасположены к аспирационной пневмонии.
Укусы животных и людей, приведшие к проникающей травме от оральных анаэробов
Другие важные признаки анаэробной инфекции включают наличие состояния, предрасполагающего человека к анаэробной инфекции, например, некроз тканей, выделения с неприятным запахом , инфекция, приводящая к тромбофлебиту, при подозрении на анаэробную активность антибиотики не улучшают.
Клиницисты должны получить анаэробный посев при подозрении на анаэробную инфекцию.
Общие инфекции в области органов при анаэробных и аэробных инфекциях
Инфекция головы и шеи: Анаэробы обычно вызывают стоматологические инфекции, такие как зубные абсцессы, гингивит и пародонтит. Обычно присутствуют результаты осмотра: кариес или плохой прикус. Анаэробы также вовлечены вместе с другими аэробами в гнойные инфекции заглоточного абсцесса, перитонзиллярного абсцесса, шейного лимфаденита, глубоких абсцессов шеи и паротита.Анаэроб, связанный с Fusobacterium, связан с осложнением перитонзиллярного абсцесса, известным как синдром Лемьера. Синдром Лемьера вызывается септическим тромбофлебитом яремной вены и метастатическими эмболами в легкие и печень.
Анаэробы также вызываются хроническим средним отитом и хроническим синуситом, наряду с другими аэробами, такими как Staphylococcus aureus и Pseudomonas.
Инфекции центральной нервной системы (ЦНС): Анаэробы обычно выделяются в культурах из абсцессов головного мозга, которые возникают в результате осложнения синусита, среднего отита, стоматологических инфекций.Обычно выделяют 3 анаэроба: Fusobacterium , Prevotella и Bacteroides . Эти же микроорганизмы встречаются и при эпидуральных инфекциях.
Внутрибрюшные инфекции: Повреждение стенки кишечника, видимое на перфорированном отростке, дает кишечным анаэробам доступ к брюшной полости. В течение нескольких дней или недель это приводит к формированию абсцессов брюшной полости. Абдоминальные абсцессы почти всегда представляют собой смешанные инфекции, содержащие как аэробы, так и анаэробы.Наиболее частым анаэробом, вызывающим абдоминальные инфекции, является Bacteroides fragilis, за которым следуют виды Lactobacillus и Clostridium .
Анаэробы также являются частой причиной абсцессов печени. Общие ассоциированные анаэробы — это виды Bacteroides и Fusobacterium .
Воспалительные заболевания органов малого таза: Все анаэробы участвуют в воспалительных заболеваниях органов малого таза (ВЗОМТ). Сексуально активным женщинам с признаками и симптомами, совместимыми с воспалительными заболеваниями органов малого таза, показана эмпирическая антимикробная терапия против анаэробов и анаэробов.Обычными анаэробами, участвующими в ВЗОМТ, являются Prevotella , Porphyromonas , Clostridium .
Легочные инфекции наблюдаются у детей, которые не могут контролировать секрецию верхних дыхательных путей или не имеют нормального кашлевого рефлекса, например, у детей с церебральным параличом и трахеопищеводными мальформациями. Аспирация приводит к пневмонии, которая при отсутствии лечения может перерасти в абсцесс. Преобладающие возбудители аспирационной пневмонии являются частью ротоглоточной флоры и включают Peptostreptococcus, Prevotella, Bacteroides fragilis и Fusobacterium.
Инфекции кожи и мягких тканей: Анаэробы могут вызвать периректальный абсцесс или лицевой абсцесс у детей. Bacteroides fragilis и Clostridium видов обычно вовлечены в периректальные инфекции, а Prevotella , Porphyromonas и Fusobacterium вовлечены в инфекции полости рта.
Оценка
Выявление серьезных анаэробных инфекций
Своевременное выявление важно для начала эмпирической терапии.Опасные для жизни инфекции, такие как столбняк, газовая гангрена или детский ботулизм, вызываются спорообразующими анаэробами, Clostridium tetanus , Clostridium perfringens, или Clostridium botulism, соответственно [6] [7].
История травмы, например проникающая травма ногтя или наличие омертвевшей ткани, должна побуждать к обследованию на столбняк у иммунизированного ребенка.
Газовая гангрена вызывается Clostridium perfringens или Clostridium septicum .Это неотложная медицинская помощь, требующая хирургической обработки раны в дополнение к антибактериальной терапии пенициллин-содержащими антибиотиками в сочетании с клиндамицином.
Ботулизм проявляется как нисходящий паралич, особенно у младенцев. Часто встречаются случаи употребления поврежденных консервов, использования меда, проживания или путешествия в эндемичные регионы (высокое количество клостридиальных спор). Результаты физикального обследования относятся к младенцу без лихорадки с острым началом трудностей с кормлением и поражением бульбара (отсутствие рвотного рефлекса).В отношении подозреваемых случаев экспертиза предоставляется Министерством здравоохранения Калифорнии. Стул следует отправить на проверку на наличие спор Clostridium botulism . Основой лечения является поддерживающая терапия с применением иммуноглобулина против ботулизма (BabyBIG) или без него.
У подростка с болью в горле, болью в шее и тахикардией, непропорциональной лихорадке, следует учитывать синдром Лемьера. Для выявления тромбофлебита внутренних яремных вен необходимо провести ультразвуковое исследование шейки допплера, а для выявления септических эмболов — сделать рентген грудной клетки.
Местные инфекции, включая абсцессы
Абсцессы могут быть ограничены ЦНС, головой и областью шеи. Область живота можно диагностировать с помощью соответствующего анаэробного посева. Образец следует собирать в стерильном месте, желательно в обход нормальной микрофлоры и с помощью пункционной аспирации или хирургического исследования. Аспират ткани или жидкости предпочтительнее мазка. После сбора образец следует отправить в анаэробную транспортную среду и внести посев в бескислородную среду.
Лечение / ведение
Шаг 1
Лечение анаэробной инфекции зависит от места инфицирования, хозяина, а также наличия или отсутствия абсцесса. Как правило, абсцесс всегда должен быть дренирован , а культура отправлена на аэробную и анаэробную культуру. Кроме того, хирургическая обработка некротической ткани при клостридийно-некротическом фасциите имеет решающее значение в лечении. [8] [9] [10]
Step 2
После получения необходимых культур ребенку следует назначить эмпирические антибиотики с активностью против анаэробов.Возможны следующие варианты:
Метронидазол : Обладает отличной активностью против грамотрицательных препаратов, таких как Bacteroides fragilis . Его активность против грамположительных результатов хорошая, хотя и менее надежная. Метронидазол имеет отличную биодоступность (100%) и хорошо проникает в ткани, включая центральную нервную систему и брюшную полость. Метронидазол придает металлический привкус во рту, что часто называют причиной прекращения приема.
Клиндамицин активен против многих анаэробов.Устойчивость клиндамицина к Bacteroides fragilis возрастает, и он менее надежен по сравнению с метронидазолом, ингибитором пенициллина / бета-лактамазы или карбапенемом. Клиндамицин, вводимый внутривенно или перорально, хорошо проникает в ткани, включая абсцессы, кости и суставы. Клиндамицин, однако, не проникает в центральную нервную систему.
Комбинация ингибиторов пенициллина / бета-лактамазы : Пенициллин сам по себе активен против анаэробов, не продуцирующих бета-лактамазу, таких как Clostridium perfringens .Однако большинство грамотрицательных анаэробов продуцируют бета-лактамазу и комбинированные пенициллины, такие как пероральный амоксициллин / клавуланат или внутривенный (IV) / внутримышечный (IM) ампициллин / сульбактам, тикарциллин / клавуланат и пиперациллин / тазобактам.
Цефалоспорин второго поколения: Что касается цефалоспоринов, цефалоспорины второго поколения цефокситин, цефотетан и цефметазол более активны в отношении Bacteroides fragilis. Однако, учитывая возрастающую резистентность, они не рекомендуются в качестве эмпирического лечения.Обычно используется в хирургической профилактике.
Карбапенемы : Обладают отличной активностью против анаэробов, а также аэробов, вовлеченных в интраабдоминальные и другие органы, такие как ЦНС. Меропенем немного более активен, чем имипенем, в отношении грамотрицательных бактерий.
Хинолоны : хорошо всасываются и проникают в ткани. Однако резистентность растет, и их следует применять только детям с аллергией на бета-лактам. Хинолоны, обладающие активностью против анаэробов, включают левофлоксацин и моксифлоксацин.
Дифференциальный диагноз
Аэробные абсцессы от Escherichia coli , Pseudomonas, такие как абсцесс мозга, абсцессы головы и шеи, легочные инфекции и внутрибрюшные инфекции.
Жемчуг и другие проблемы
Рассмотрите возможность анаэробной инфекции, если место предполагаемой инфекции находится рядом с нормальной местной анаэробной флорой, такой как рот, кишечник или женские половые пути.
Выявление предрасположенности, такой как непроходимость, перфорация, травма, неспособность хозяина очищать секреты, снижение притока крови к ткани, например некроз ткани.
Следует предпринять попытку отправить анаэробные культуры, что предполагает надлежащий сбор, быструю транспортировку и надлежащие методы культивирования. Тканевый или гнойный материал предпочтительнее посылать мазки.
Метронидазол обладает анаэробной активностью широкого спектра с наименьшей резистентностью. Другие анаэробные антибиотики включают клиндамицин, комбинацию ингибиторов пенициллин-бета-лактамаз, цефалоспорины второго поколения, карбапенемы и хинолоны.
Улучшение результатов команды здравоохранения
Анаэробные инфекции распространены как у амбулаторных, так и у стационарных пациентов. Поскольку эти инфекции могут поражать различные органы и проявляться по-разному, с ними лучше всего справиться межпрофессиональная команда. Поставщикам первичной медико-санитарной помощи, практикующим медсестрам и другим медицинским работникам необходимо проконсультироваться со специалистом по инфекционным заболеваниям, когда они сталкиваются с инфекцией, которая не поддается лечению обычными антибиотиками или имеет странное проявление.По поводу дренирования часто обращаются к общим хирургам. Фармацевт должен пересмотреть выбор лекарств, взаимодействия с ними и соблюдение пациентом режима лечения, а также сообщить о проблемах команде. Медсестры должны помогать в координации ухода, способствовать общению между членами межпрофессиональной команды и помогать в обучении пациентов и их семей. При необходимости следует привлекать медсестер, прошедших специальную подготовку, в том числе медико-хирургических и инфекционных.
При неправильном диагнозе анаэробные инфекции приводят к высокой смертности.[11] [12] [13]
Прогноз зависит от типа анаэробной инфекции.
В нашу эпоху вакцинации против столбняка и доступности поддерживающей терапии столбняк не встречается в развитых странах мира. Любого ребенка с чистой проникающей ранкой следует вакцинировать от столбняка, а в случае зараженной раны следует рассмотреть возможность использования противостолбнячной вакцины и столбнячных иммуноглобулинов на основе последней вакцины против столбняка.
Любую загрязненную рану необходимо очистить и удалить инородное тело.
Хорошая гигиена полости рта и полости рта предотвращает анаэробные инфекции.
При операциях на брюшной полости, требующих проникновения полых внутренних органов, следует рассмотреть возможность применения антибиотиков с анаэробной активностью, таких как цефокситин.
Непрерывное образование / обзорные вопросы
Ссылки
- 1.
- Алаузет С., Лозневский А., Маршандин Х. Устойчивость к метронидазолу и гены ним у анаэробов: обзор. Анаэроб. 2019 Февраль; 55: 40-53.[PubMed: 30316817]
- 2.
- Bula-Rudas FJ, Olcott JL. Укусы человека и животных. Pediatr Rev.2018 Октябрь; 39 (10): 490-500. [PubMed: 30275032]
- 3.
- Ghoneim NH, Hamza DA. Эпидемиологические исследования пищевых отравлений Clostridium perfringens в пищевых продуктах розничной торговли. Rev Sci Tech. 2017 декабрь; 36 (3): 1025-1032. [PubMed: 30160688]
- 4.
- Шакья Н., Шарма Д., Ньюаскар В., Агравал Д., Шривастава С., Ядав Р. Эпидемиология, микробиология и чувствительность к антибиотикам одонтогенных космических инфекций в Центральной Индии.J Maxillofac Oral Surg. 2018 сентябрь; 17 (3): 324-331. [Бесплатная статья PMC: PMC6028331] [PubMed: 30034150]
- 5.
- Пиннола А., Куо Й.Х., Скиарретта Дж. Д., Макинтайр А., Мессье Р., Дэвис Дж. М.. Бактериология и сопутствующие заболевания у пациентов, которым требуется хирургическое лечение эмпиемы. Am Surg. 2018, 01 апреля; 84 (4): 599-603. [PubMed: 29712613]
- 6.
- Messbarger N, Neemann K. Роль анаэробных культур крови в неонатальной бактериемии. J Pediatric Infect Dis Soc. 2018 17 августа; 7 (3): e65-e69. [PubMed: 2
80]
- 7.
- Jacobs MR, Mazzulli T, Hazen KC, Good CE, Abdelhamed AM, Lo P, Shum B, Roman KP, Robinson DC. Многоцентровая клиническая оценка системы культуры крови BacT / Alert Virtuo. J Clin Microbiol. 2017 август; 55 (8): 2413-2421. [Бесплатная статья PMC: PMC5527419] [PubMed: 28539343]
- 8.
- Byun JH, Kim M, Lee Y, Lee K, Chong Y. Модели антимикробной чувствительности клинических изолятов анаэробных бактерий с 2014 по 2016 год, включая недавно названные или Переименованные виды. Ann Lab Med. 2019 Март; 39 (2): 190-199.[Бесплатная статья PMC: PMC6240532] [PubMed: 30430782]
- 9.
- Kheir MM, Tan TL, Ackerman CT, Modi R, Foltz C, Parvizi J. Культивирование перипротезной инфекции суставов: количество образцов, продолжительность роста и организмы . J Артропластика. 2018 ноя; 33 (11): 3531-3536.e1. [PubMed: 300]
- 10.
- Нич О., Крутова М. [Clostridium difficile остается проблемой со здоровьем]. Рожл Чир. Осень 2017; 96 (10): 411-414. [PubMed: 206]
- 11.
- Липски Б.А., Берендт А.Р., Корниа ПБ, Пайл Дж.С., Питерс Э.Дж., Армстронг Д.Г., Дери Х.Г., Эмбиль Дж.М., Джозеф В.С., Карчмер А.В., Пинзур М.С., Сенневиль Э.Руководство по клинической практике общества инфекционных болезней Америки 2012 г. по диагностике и лечению инфекций диабетической стопы. J Am Podiatr Med Assoc. 2013 январь-февраль; 103 (1): 2-7. [PubMed: 23328846]
- 12.
- Барсук В.О., Ледебур Н.А., Грэм МБ, Эдмистон CE. Clostridium difficile: эпидемиология, патогенез, лечение и профилактика стойкого патогена, связанного с оказанием медицинской помощи. JPEN J Parenter Enteral Nutr. 2012 ноябрь; 36 (6): 645-62. [PubMed: 22577120]
- 13.
- Рое З., Рое З., Матич Д., Либреняк Д., Докузович С., Варводич Я.Некротический фасциит: обзор литературы по современным стратегиям диагностики и лечения с тремя описаниями случаев: торс, брюшная стенка, верхние и нижние конечности. Мир J Emerg Surg. 23 декабря 2011 г .; 6 (1): 46. [Бесплатная статья PMC: PMC3310784] [PubMed: 22196774]
Анаэробные инфекции — StatPearls — Книжная полка NCBI
Непрерывное обучение
Анаэробные бактерии являются частью нормальной флоры кожи и слизистых оболочек человека. Место анаэробной инфекции обычно является местом нормальной колонизации.Спектр инфекций варьируется от местных абсцессов до опасных для жизни инфекций. Анаэробные бактерии отличаются от аэробных бактерий потребностью в кислороде. Кислород токсичен для анаэробов, что можно объяснить отсутствием в анаэробах ферментов каталазы, супероксиддисмутазы и пероксидазы. Диагноз требует клинического подозрения и надлежащей микробиологической идентификации. Это упражнение исследует, когда это состояние следует учитывать при дифференциальной диагностике и как правильно его оценить.Это мероприятие подчеркивает роль межпрофессиональной команды в уходе за пациентами с этим заболеванием.
Цели:
Определить этиологию анаэробных инфекций.
Изучите различные клинические проявления анаэробных инфекций,
Опишите возможные варианты лечения анаэробных инфекций.
Объясните важность улучшения координации оказания помощи межпрофессиональной командой для достижения лучших клинических результатов у пациентов с анаэробными инфекциями.
Заработайте кредиты на непрерывное образование (CME / CE) по этой теме.
Введение
Анаэробные бактерии являются частью нормальной микрофлоры кожи и слизистых оболочек человека. Место анаэробной инфекции обычно является местом нормальной колонизации. Спектр инфекций варьируется от местных абсцессов до опасных для жизни инфекций. Анаэробные бактерии отличаются от аэробных бактерий потребностью в кислороде. Кислород токсичен для анаэробов, что можно объяснить отсутствием в анаэробах ферментов каталазы, супероксиддисмутазы и пероксидазы.Анаэробы являются привередливыми организмами, и их трудно выращивать, если не используются надлежащие методы сбора и культивирования. Диагноз требует клинического подозрения и надлежащей микробиологической идентификации. [1] [2]
В зависимости от потребности в кислороде бактерии можно разделить на следующие группы:
Облигатные аэробы нуждаются в кислороде в качестве конечного акцептора электронов и не имеют другого источника энергии, например ферментации.
Обязательные анаэробы получают энергию посредством ферментации и используют органические соединения в качестве концевых акцепторов электронов.
Факультативные анаэробы могут расти в присутствии или в отсутствие кислорода.
Облигатные анаэробы можно подразделить на 2 типа в зависимости от процентного содержания кислорода, который может оказаться токсичным. Строгие облигатные анаэробы не выживут, если в окружающей среде содержится более половины процента кислорода, в то время как умеренные облигатные анаэробы все еще могут расти в среде с 2-8% кислорода.
Этиология
Общие очаги анаэробных инфекций включают полости рта, брюшной полости и таза; однако анаэробы могут вызывать инфекции других областей, таких как голова, шея и кожа.Клинически значимые анаэробы, связанные с инфекциями человека, следующие:
грамположительные
грамположительные спорообразующие бациллы
Clostridium : это споровые анаэробы, ответственные за некоторые из более серьезных человеческих инфекции. На их долю приходится около 10% всех анаэробных инфекций. Значительными членами этого семейства являются Clostridium difficile, , вызывающие инфекцию C. difficile . Clostridium perfringens, , вызывающая газовую гангрену или инфекции мягких тканей. Clostridium septicum также вызывает газовую гангрену.
Грамположительные неспорообразующие бациллы
Actinomyces: Они колонизируют желудочно-кишечный тракт (ЖКТ) человека, а инфекции возникают в результате разрыва кожно-слизистого барьера. 3 наиболее распространенных анатомических участка, пораженных Actinomyces , — это шейно-лицевой, грудной и абдоминальный отделы.
Propionibacterium : Этот вид является частью нормальной флоры кожи и слизистых оболочек.Наиболее значительным членом этого семейства является Propionibacterium acne , который играет роль в патогенезе обыкновенных угрей.
Bifidobacterium : это нормальная флора кишечного тракта. Обычно он не патогенный; однако зарегистрированы педиатрические инфекции в виде хронического среднего отита, абсцессов брюшной полости и перитонита.
Lactobacillus: Эти организмы также обычно встречаются в желудочно-кишечном тракте и могут быть извлечены из многочисленных пищевых продуктов.Имеют низкий патогенный потенциал; однако описаны случаи абсцессов брюшной полости, аспирационной пневмонии и бактериемии, особенно у новорожденных.
Peptococcus и Peptostreptococcus : Эти анаэробы являются частью ротовой полости, желудочно-кишечного тракта, верхних дыхательных путей и мочеполовых путей, а также кожи. Они могут быть патогенными и вызывать многочисленные инфекции, такие как хронический средний отит, хронический синусит, аспирационная пневмония, воспалительные заболевания органов малого таза, включая абсцессы трубчатых яичников.
Другие члены включают Eubacterium, Bifidobacterium, Arcanobacterium, и микроаэрофильные Streptococcus ( Streptococcus anginosus, Streptococcus 9013atus , Streptococcus .
Грамотрицательные
Bacteroides: Это наиболее часто обнаруживаемые анаэробные патогены из клинических образцов. Они являются частью кишечной микрофлоры человека и нормальной микрофлоры женских половых органов.Эти организмы чаще всего являются причиной внутрибрюшных инфекций, особенно абсцессов. Большинство этих абсцессов представляют собой смешанные инфекции. Они также могут вызывать экстраабдоминальные инфекции, такие как аспирационная пневмония, абсцессы мозга и другие.
Fusobacterium : один из видов этой группы анаэробов, Fusobacterium necrophorum, является частой причиной перитонзиллярных абсцессов, связанных с осложнением тромбоза внутренней яремной вены, известного как синдром Лемьера.
Campylobacter: Это одна из наиболее частых причин острого бактериального гастроэнтерита.
Prevotella: Это нормальная флора ротовой полости и кишечного тракта человека. У детей они часто связаны с инфекциями головы и шеи, такими как перитонзиллярные абсцессы, заглоточные абсцессы, а также перинеальные или перианальные инфекции, такие как пилонидальные абсцессы.
Veillonella: Иногда ассоциируется с абсцессами брюшной полости и аспирационной пневмонией у детей.
Эпидемиология
Анаэробы являются частью местной или местной флоры, особенно ротовой полости, кишечника человека и женских половых путей. Колонизация анаэробами зависит от возраста, расположения органа и факторов окружающей среды. Например, у младенцев, находящихся на исключительно грудном вскармливании, кишечная флора преимущественно представлена Bifidobacterium , с небольшим количеством видов Bacteroides и Enterococcus . С другой стороны, младенцы, которых кормят коровьим молоком, имеют кишечную флору, аналогичную флоре кишечника взрослых, которая содержит грамотрицательные анаэробы и факультативные бациллы.[3] [4] [5]
Анаэробы являются частью местной флоры, которая сопротивляется колонизации и вторжению со стороны неместной флоры. Однако инфекции от анаэробов действительно возникают и обычно возникают в результате нарушения кожно-слизистого барьера или подавления иммунитета. Анаэробные инфекции органов включают, помимо прочего, абсцессы головного мозга, стоматологические инфекции, аспирационную пневмонию, абсцессы легких, инфекции укусов (животных / человека), абсцессы брюшной полости и некротические инфекции мягких тканей.
Патофизиология
Патогенез анаэробных инфекций включает нарушение слизистой оболочки и проникновение анаэробных бактерий в глубокие ткани.Механизмы проникновения включают местную травму, хирургическое вмешательство, перфорацию внутренних органов (например, аппендицит), некроз тканей и нарушение очистки стерильного участка (хронический синусит, пневмония). Место и степень заражения зависят от факторов вирулентности организма и иммунитета хозяина.
Факторами вирулентности, которые способствуют анаэробным инфекциям, являются факторы адгезии (фимбрии и лектин), факторы инвазии (фосфолипаза С, липополисахариды и протеазы), факторы, участвующие в деструкции тканей (фибринолиз, ацетилглюкозаминидаза и выработка коллагеназы), устойчивость капсулы к фагоцитозу. и другие.У хозяина с ослабленным иммунитетом наблюдаются серьезные инфекции.
При участии в абсцессе анаэробы обычно являются частью полимикробной инфекции. Экспериментальные модели крыс со смешанными инфекциями показали, что рост анаэробов, а также аэробов усиливается при полимикробных инфекциях.
История и физика
Большинство анаэробных инфекций у детей носят локальный характер, и инфекции кровотока составляют менее 2% случаев. Подход к анаэробным инфекциям включает выявление предрасполагающих факторов.К ним относятся:
Инфекция участка органа, заразная участку с местной колонизацией (ротовая полость, кишечник)
Обструкция: например, инородное тело в носу, непроходимость аппендикса, непроходимость кишечника
Перфорация: Полые внутренние органы, например, перфорация кишечника.
Неспособность хозяина выводить выделения, например, дети с церебральным параличом предрасположены к аспирационной пневмонии.
Укусы животных и людей, приведшие к проникающей травме от оральных анаэробов
Другие важные признаки анаэробной инфекции включают наличие состояния, предрасполагающего человека к анаэробной инфекции, например, некроз тканей, выделения с неприятным запахом , инфекция, приводящая к тромбофлебиту, при подозрении на анаэробную активность антибиотики не улучшают.
Клиницисты должны получить анаэробный посев при подозрении на анаэробную инфекцию.
Общие инфекции в области органов при анаэробных и аэробных инфекциях
Инфекция головы и шеи: Анаэробы обычно вызывают стоматологические инфекции, такие как зубные абсцессы, гингивит и пародонтит. Обычно присутствуют результаты осмотра: кариес или плохой прикус. Анаэробы также вовлечены вместе с другими аэробами в гнойные инфекции заглоточного абсцесса, перитонзиллярного абсцесса, шейного лимфаденита, глубоких абсцессов шеи и паротита.Анаэроб, связанный с Fusobacterium, связан с осложнением перитонзиллярного абсцесса, известным как синдром Лемьера. Синдром Лемьера вызывается септическим тромбофлебитом яремной вены и метастатическими эмболами в легкие и печень.
Анаэробы также вызываются хроническим средним отитом и хроническим синуситом, наряду с другими аэробами, такими как Staphylococcus aureus и Pseudomonas.
Инфекции центральной нервной системы (ЦНС): Анаэробы обычно выделяются в культурах из абсцессов головного мозга, которые возникают в результате осложнения синусита, среднего отита, стоматологических инфекций.Обычно выделяют 3 анаэроба: Fusobacterium , Prevotella и Bacteroides . Эти же микроорганизмы встречаются и при эпидуральных инфекциях.
Внутрибрюшные инфекции: Повреждение стенки кишечника, видимое на перфорированном отростке, дает кишечным анаэробам доступ к брюшной полости. В течение нескольких дней или недель это приводит к формированию абсцессов брюшной полости. Абдоминальные абсцессы почти всегда представляют собой смешанные инфекции, содержащие как аэробы, так и анаэробы.Наиболее частым анаэробом, вызывающим абдоминальные инфекции, является Bacteroides fragilis, за которым следуют виды Lactobacillus и Clostridium .
Анаэробы также являются частой причиной абсцессов печени. Общие ассоциированные анаэробы — это виды Bacteroides и Fusobacterium .
Воспалительные заболевания органов малого таза: Все анаэробы участвуют в воспалительных заболеваниях органов малого таза (ВЗОМТ). Сексуально активным женщинам с признаками и симптомами, совместимыми с воспалительными заболеваниями органов малого таза, показана эмпирическая антимикробная терапия против анаэробов и анаэробов.Обычными анаэробами, участвующими в ВЗОМТ, являются Prevotella , Porphyromonas , Clostridium .
Легочные инфекции наблюдаются у детей, которые не могут контролировать секрецию верхних дыхательных путей или не имеют нормального кашлевого рефлекса, например, у детей с церебральным параличом и трахеопищеводными мальформациями. Аспирация приводит к пневмонии, которая при отсутствии лечения может перерасти в абсцесс. Преобладающие возбудители аспирационной пневмонии являются частью ротоглоточной флоры и включают Peptostreptococcus, Prevotella, Bacteroides fragilis и Fusobacterium.
Инфекции кожи и мягких тканей: Анаэробы могут вызвать периректальный абсцесс или лицевой абсцесс у детей. Bacteroides fragilis и Clostridium видов обычно вовлечены в периректальные инфекции, а Prevotella , Porphyromonas и Fusobacterium вовлечены в инфекции полости рта.
Оценка
Выявление серьезных анаэробных инфекций
Своевременное выявление важно для начала эмпирической терапии.Опасные для жизни инфекции, такие как столбняк, газовая гангрена или детский ботулизм, вызываются спорообразующими анаэробами, Clostridium tetanus , Clostridium perfringens, или Clostridium botulism, соответственно [6] [7].
История травмы, например проникающая травма ногтя или наличие омертвевшей ткани, должна побуждать к обследованию на столбняк у иммунизированного ребенка.
Газовая гангрена вызывается Clostridium perfringens или Clostridium septicum .Это неотложная медицинская помощь, требующая хирургической обработки раны в дополнение к антибактериальной терапии пенициллин-содержащими антибиотиками в сочетании с клиндамицином.
Ботулизм проявляется как нисходящий паралич, особенно у младенцев. Часто встречаются случаи употребления поврежденных консервов, использования меда, проживания или путешествия в эндемичные регионы (высокое количество клостридиальных спор). Результаты физикального обследования относятся к младенцу без лихорадки с острым началом трудностей с кормлением и поражением бульбара (отсутствие рвотного рефлекса).В отношении подозреваемых случаев экспертиза предоставляется Министерством здравоохранения Калифорнии. Стул следует отправить на проверку на наличие спор Clostridium botulism . Основой лечения является поддерживающая терапия с применением иммуноглобулина против ботулизма (BabyBIG) или без него.
У подростка с болью в горле, болью в шее и тахикардией, непропорциональной лихорадке, следует учитывать синдром Лемьера. Для выявления тромбофлебита внутренних яремных вен необходимо провести ультразвуковое исследование шейки допплера, а для выявления септических эмболов — сделать рентген грудной клетки.
Местные инфекции, включая абсцессы
Абсцессы могут быть ограничены ЦНС, головой и областью шеи. Область живота можно диагностировать с помощью соответствующего анаэробного посева. Образец следует собирать в стерильном месте, желательно в обход нормальной микрофлоры и с помощью пункционной аспирации или хирургического исследования. Аспират ткани или жидкости предпочтительнее мазка. После сбора образец следует отправить в анаэробную транспортную среду и внести посев в бескислородную среду.
Лечение / ведение
Шаг 1
Лечение анаэробной инфекции зависит от места инфицирования, хозяина, а также наличия или отсутствия абсцесса. Как правило, абсцесс всегда должен быть дренирован , а культура отправлена на аэробную и анаэробную культуру. Кроме того, хирургическая обработка некротической ткани при клостридийно-некротическом фасциите имеет решающее значение в лечении. [8] [9] [10]
Step 2
После получения необходимых культур ребенку следует назначить эмпирические антибиотики с активностью против анаэробов.Возможны следующие варианты:
Метронидазол : Обладает отличной активностью против грамотрицательных препаратов, таких как Bacteroides fragilis . Его активность против грамположительных результатов хорошая, хотя и менее надежная. Метронидазол имеет отличную биодоступность (100%) и хорошо проникает в ткани, включая центральную нервную систему и брюшную полость. Метронидазол придает металлический привкус во рту, что часто называют причиной прекращения приема.
Клиндамицин активен против многих анаэробов.Устойчивость клиндамицина к Bacteroides fragilis возрастает, и он менее надежен по сравнению с метронидазолом, ингибитором пенициллина / бета-лактамазы или карбапенемом. Клиндамицин, вводимый внутривенно или перорально, хорошо проникает в ткани, включая абсцессы, кости и суставы. Клиндамицин, однако, не проникает в центральную нервную систему.
Комбинация ингибиторов пенициллина / бета-лактамазы : Пенициллин сам по себе активен против анаэробов, не продуцирующих бета-лактамазу, таких как Clostridium perfringens .Однако большинство грамотрицательных анаэробов продуцируют бета-лактамазу и комбинированные пенициллины, такие как пероральный амоксициллин / клавуланат или внутривенный (IV) / внутримышечный (IM) ампициллин / сульбактам, тикарциллин / клавуланат и пиперациллин / тазобактам.
Цефалоспорин второго поколения: Что касается цефалоспоринов, цефалоспорины второго поколения цефокситин, цефотетан и цефметазол более активны в отношении Bacteroides fragilis. Однако, учитывая возрастающую резистентность, они не рекомендуются в качестве эмпирического лечения.Обычно используется в хирургической профилактике.
Карбапенемы : Обладают отличной активностью против анаэробов, а также аэробов, вовлеченных в интраабдоминальные и другие органы, такие как ЦНС. Меропенем немного более активен, чем имипенем, в отношении грамотрицательных бактерий.
Хинолоны : хорошо всасываются и проникают в ткани. Однако резистентность растет, и их следует применять только детям с аллергией на бета-лактам. Хинолоны, обладающие активностью против анаэробов, включают левофлоксацин и моксифлоксацин.
Дифференциальный диагноз
Аэробные абсцессы от Escherichia coli , Pseudomonas, такие как абсцесс мозга, абсцессы головы и шеи, легочные инфекции и внутрибрюшные инфекции.
Жемчуг и другие проблемы
Рассмотрите возможность анаэробной инфекции, если место предполагаемой инфекции находится рядом с нормальной местной анаэробной флорой, такой как рот, кишечник или женские половые пути.
Выявление предрасположенности, такой как непроходимость, перфорация, травма, неспособность хозяина очищать секреты, снижение притока крови к ткани, например некроз ткани.
Следует предпринять попытку отправить анаэробные культуры, что предполагает надлежащий сбор, быструю транспортировку и надлежащие методы культивирования. Тканевый или гнойный материал предпочтительнее посылать мазки.
Метронидазол обладает анаэробной активностью широкого спектра с наименьшей резистентностью. Другие анаэробные антибиотики включают клиндамицин, комбинацию ингибиторов пенициллин-бета-лактамаз, цефалоспорины второго поколения, карбапенемы и хинолоны.
Улучшение результатов команды здравоохранения
Анаэробные инфекции распространены как у амбулаторных, так и у стационарных пациентов. Поскольку эти инфекции могут поражать различные органы и проявляться по-разному, с ними лучше всего справиться межпрофессиональная команда. Поставщикам первичной медико-санитарной помощи, практикующим медсестрам и другим медицинским работникам необходимо проконсультироваться со специалистом по инфекционным заболеваниям, когда они сталкиваются с инфекцией, которая не поддается лечению обычными антибиотиками или имеет странное проявление.По поводу дренирования часто обращаются к общим хирургам. Фармацевт должен пересмотреть выбор лекарств, взаимодействия с ними и соблюдение пациентом режима лечения, а также сообщить о проблемах команде. Медсестры должны помогать в координации ухода, способствовать общению между членами межпрофессиональной команды и помогать в обучении пациентов и их семей. При необходимости следует привлекать медсестер, прошедших специальную подготовку, в том числе медико-хирургических и инфекционных.
При неправильном диагнозе анаэробные инфекции приводят к высокой смертности.[11] [12] [13]
Прогноз зависит от типа анаэробной инфекции.
В нашу эпоху вакцинации против столбняка и доступности поддерживающей терапии столбняк не встречается в развитых странах мира. Любого ребенка с чистой проникающей ранкой следует вакцинировать от столбняка, а в случае зараженной раны следует рассмотреть возможность использования противостолбнячной вакцины и столбнячных иммуноглобулинов на основе последней вакцины против столбняка.
Любую загрязненную рану необходимо очистить и удалить инородное тело.
Хорошая гигиена полости рта и полости рта предотвращает анаэробные инфекции.
При операциях на брюшной полости, требующих проникновения полых внутренних органов, следует рассмотреть возможность применения антибиотиков с анаэробной активностью, таких как цефокситин.
Непрерывное образование / обзорные вопросы
Ссылки
- 1.
- Алаузет С., Лозневский А., Маршандин Х. Устойчивость к метронидазолу и гены ним у анаэробов: обзор. Анаэроб. 2019 Февраль; 55: 40-53.[PubMed: 30316817]
- 2.
- Bula-Rudas FJ, Olcott JL. Укусы человека и животных. Pediatr Rev.2018 Октябрь; 39 (10): 490-500. [PubMed: 30275032]
- 3.
- Ghoneim NH, Hamza DA. Эпидемиологические исследования пищевых отравлений Clostridium perfringens в пищевых продуктах розничной торговли. Rev Sci Tech. 2017 декабрь; 36 (3): 1025-1032. [PubMed: 30160688]
- 4.
- Шакья Н., Шарма Д., Ньюаскар В., Агравал Д., Шривастава С., Ядав Р. Эпидемиология, микробиология и чувствительность к антибиотикам одонтогенных космических инфекций в Центральной Индии.J Maxillofac Oral Surg. 2018 сентябрь; 17 (3): 324-331. [Бесплатная статья PMC: PMC6028331] [PubMed: 30034150]
- 5.
- Пиннола А., Куо Й.Х., Скиарретта Дж. Д., Макинтайр А., Мессье Р., Дэвис Дж. М.. Бактериология и сопутствующие заболевания у пациентов, которым требуется хирургическое лечение эмпиемы. Am Surg. 2018, 01 апреля; 84 (4): 599-603. [PubMed: 29712613]
- 6.
- Messbarger N, Neemann K. Роль анаэробных культур крови в неонатальной бактериемии. J Pediatric Infect Dis Soc. 2018 17 августа; 7 (3): e65-e69. [PubMed: 2
80]
- 7.
- Jacobs MR, Mazzulli T, Hazen KC, Good CE, Abdelhamed AM, Lo P, Shum B, Roman KP, Robinson DC. Многоцентровая клиническая оценка системы культуры крови BacT / Alert Virtuo. J Clin Microbiol. 2017 август; 55 (8): 2413-2421. [Бесплатная статья PMC: PMC5527419] [PubMed: 28539343]
- 8.
- Byun JH, Kim M, Lee Y, Lee K, Chong Y. Модели антимикробной чувствительности клинических изолятов анаэробных бактерий с 2014 по 2016 год, включая недавно названные или Переименованные виды. Ann Lab Med. 2019 Март; 39 (2): 190-199.[Бесплатная статья PMC: PMC6240532] [PubMed: 30430782]
- 9.
- Kheir MM, Tan TL, Ackerman CT, Modi R, Foltz C, Parvizi J. Культивирование перипротезной инфекции суставов: количество образцов, продолжительность роста и организмы . J Артропластика. 2018 ноя; 33 (11): 3531-3536.e1. [PubMed: 300]
- 10.
- Нич О., Крутова М. [Clostridium difficile остается проблемой со здоровьем]. Рожл Чир. Осень 2017; 96 (10): 411-414. [PubMed: 206]
- 11.
- Липски Б.А., Берендт А.Р., Корниа ПБ, Пайл Дж.С., Питерс Э.Дж., Армстронг Д.Г., Дери Х.Г., Эмбиль Дж.М., Джозеф В.С., Карчмер А.В., Пинзур М.С., Сенневиль Э.Руководство по клинической практике общества инфекционных болезней Америки 2012 г. по диагностике и лечению инфекций диабетической стопы. J Am Podiatr Med Assoc. 2013 январь-февраль; 103 (1): 2-7. [PubMed: 23328846]
- 12.
- Барсук В.О., Ледебур Н.А., Грэм МБ, Эдмистон CE. Clostridium difficile: эпидемиология, патогенез, лечение и профилактика стойкого патогена, связанного с оказанием медицинской помощи. JPEN J Parenter Enteral Nutr. 2012 ноябрь; 36 (6): 645-62. [PubMed: 22577120]
- 13.
- Рое З., Рое З., Матич Д., Либреняк Д., Докузович С., Варводич Я.Некротический фасциит: обзор литературы по современным стратегиям диагностики и лечения с тремя описаниями случаев: торс, брюшная стенка, верхние и нижние конечности. Мир J Emerg Surg. 23 декабря 2011 г .; 6 (1): 46. [Бесплатная статья PMC: PMC3310784] [PubMed: 22196774]
Рост анаэробных бактерий в присутствии кателицидина LL-37 и некоторых церагенинов, доставленных в виде груза магнитных наночастиц | BMC Microbiology
Секиров И., Рассел С.Л., Antunes LC, Финли ББ. Микробиота кишечника в здоровье и болезнях.Physiol Rev.2010; 90 (3): 859–904.
CAS
Статья
PubMed
Google Scholar
Пак Й., Чой Дж. Й., Йонг Д., Ли К., Ким Дж. М.. Клинические особенности и прогностические факторы анаэробных инфекций: 7-летнее ретроспективное исследование. Korean J Intern Med. 2009. 24 (1): 13–8.
Артикул
PubMed
PubMed Central
Google Scholar
Брук I. Роль анаэробных бактерий в бактериемии.Анаэроб. 2010. 16 (3): 183–9.
CAS
Статья
PubMed
Google Scholar
Lee DG. Клиническое значение анаэробных инфекций. Korean J Intern Med. 2009. 24 (1): 11–2.
Артикул
PubMed
PubMed Central
Google Scholar
Али Мохаммед М.М., Нерланд А.Х., Аль-Харони М., Баккен В. Характеристика внеклеточного полимерного матрикса и обработка биопленок Fusobacterium nucleatum и Porphyromonas gingivalis ДНКазой I и протеиназой K.J Oral Microbiol. 2013; 5
Мачадо Д., Кастро Дж., Палмейра-де-Оливейра А., Мартинес-де-Оливейра Дж., Серка Н. Биопленки бактериального вагиноза: проблемы современных методов лечения и новые решения. Front Microbiol. 2015; 6: 1528.
PubMed
Google Scholar
Вайшнави К. Клинический спектр и патогенез Clostridium Difficile ассоциированных заболеваний. Индийский J Med Res. 2010; 131: 487–99.
PubMed
Google Scholar
Nord CE, Oprica C. Устойчивость к антибиотикам у Propionibacterium acnes. Микробиологические и клинические аспекты. Анаэроб. 2006. 12 (5–6): 207–10.
CAS
Статья
PubMed
Google Scholar
Shindo Y, Dobashi Y, Sakai T., Monma C, Miyatani H, Yoshida Y. Эпидемиологические и патобиологические профили инфекций Clostridium Perfringens: обзор последовательной серии из 33 случаев за 13-летний период. Int J Clin Exp Pathol.2015; 8 (1): 569–77.
CAS
PubMed
PubMed Central
Google Scholar
Фелеке Г., Форленца С. Анаэробные инфекции. Основы для врачей первичного звена. Postgrad Med. 1991. 89 (8): 221–4. 227-230, 233-224
CAS
Статья
PubMed
Google Scholar
Akhi MT, Ghotaslou R, Beheshtirouy S, Asgharzadeh M, Pirzadeh T., Asghari B, Alizadeh N, Toloue Ostadgavahi A, Sorayaei Somesaraei V, Memar MY.Профиль чувствительности к антибиотикам аэробных и анаэробных бактерий, выделенных в результате инфекции места хирургического вмешательства у госпитализированных пациентов. Jundishapur J Microbiol. 2015; 8 (7): e20309.
PubMed
PubMed Central
Google Scholar
Durr UH, Sudheendra US, Ramamoorthy A. LL-37, единственный человеческий представитель семейства антимикробных пептидов кателицидина. Biochim Biophys Acta. 2006. 1758 (9): 1408–25.
Артикул
PubMed
Google Scholar
Epand RF, Pollard JE, Wright JO, Savage PB, Epand RM. Деполяризация, состав бактериальной мембраны и антимикробное действие церагенинов. Антимикробные агенты Chemother. 2010. 54 (9): 3708–13.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Поллард Дж., Райт Дж., Фенг Й., Дянлян Дж., Генберг К., Сэвидж ПБ. Активность церагенина CSA-13 против устоявшихся биопленок в модели деколонизации катетера in vitro.Антиинфекционные агенты Med Chem. 2009. 8 (4): 290–4.
CAS
Статья
Google Scholar
Вильчевска А.З., Ниемирович К., Маркевич К.Х., Кар Х. Наночастицы как системы доставки лекарств. Pharmacol Rep. 2012; 64 (5): 1020–37.
CAS
Статья
PubMed
Google Scholar
Niemirowicz K, Swiecicka I, Wilczewska AZ, Misztalewska I, Kalska-Szostko B, Bienias K, Bucki R, Car H.Магнитные наночастицы, функционализированные золотом, ограничивают рост Pseudomonas Aeruginosa. Int J Nanomedicine. 2014; 9: 2217–24.
Артикул
PubMed
PubMed Central
Google Scholar
Дин Б., Гуан К., Уолш Дж. П., Босвелл Дж. С., Винтер ТВ, Винтер ES, Бойд СС, Ли К., Сэвидж ПБ. Корреляция антибактериальной активности катионных пептидных антибиотиков и катионных стероидных антибиотиков. J Med Chem. 2002. 45 (3): 663–9.
CAS
Статья
PubMed
Google Scholar
Массарт Р. Приготовление водных магнитных жидкостей в щелочных и кислых средах. IEEE Trans Magn. 1981. 17 (2): 1247–8.
Артикул
Google Scholar
Niemirowicz K, Surel U, Wilczewska AZ, Mystkowska J, Piktel E, Gu X, Namiot Z, Kulakowska A, Savage PB, Bucki R. Бактерицидная активность и биосовместимость покрытых церагенином магнитных наночастиц. J Nanobiotechnol. 2015; 13:32.
Артикул
Google Scholar
CLSI. Методы определения антимикробной чувствительности анаэробных бактерий. В: Утвержденный стандарт, 8-е издание, документ CLSI M11-A8; 2012.
Google Scholar
Буки Р., Ниемирович К., Вноровска Ю., Ватек М., Байфилд Ф.Дж., Круз К., Вроблевска М., Янмей ПА. Увеличение массы биопленок за счет полиэлектролитов. BMC Microbiol. 2015; 15: 117.
Артикул
PubMed
PubMed Central
Google Scholar
Брук I. Противомикробное лечение анаэробных инфекций. Эксперт Opin Pharmacother. 2011; 12 (11): 1691–707.
CAS
Статья
PubMed
Google Scholar
Чин Дж. Н., Рыбак М. Дж., Чунг С. М., Сэвидж ПБ. Антимикробная активность церагенинов против клинических изолятов резистентного золотистого стафилококка. Антимикробные агенты Chemother. 2007. 51 (4): 1268–73.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Vila-Farres X, Callarisa AE, Gu X, Savage PB, Giralt E, Vila J. CSA-131, церагенин, активный против устойчивых к колистину клинических изолятов Acinetobacter Baumannii и Pseudomonas Aeruginosa. Int J Antimicrob Agents. 2015; 46 (5): 568–71.
CAS
Статья
PubMed
Google Scholar
Oh H, Hedberg M, Wade D, Edlund C. Активность синтетических гибридных пептидов против анаэробных бактерий: аспекты методологии и стабильности.Антимикробные агенты Chemother. 2000. 44 (1): 68–72.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Urban E, Nagy E, Pal T, Sonnevend A, Conlon JM. Активность четырех антимикробных пептидов, полученных из кожи лягушки (темпорин-1DRa, темпорин-1Va и связанные с мелиттином пептиды AR-23 и RV-23) против анаэробных бактерий. Int J Antimicrob Agents. 2007. 29 (3): 317–21.
CAS
Статья
PubMed
Google Scholar
Арзезе А., Скерлавай Б., Томасинсиг Л., Дженнаро Р., Занетти М. Антимикробная активность SMAP-29 против группы Bacteroides Fragilis и клостридий. J Antimicrob Chemother. 2003. 52 (3): 375–81.
CAS
Статья
PubMed
Google Scholar
Bachrach G, Altman H, Kolenbrander PE, Chalmers NI, Gabai-Gutner M, Mor A, Friedman M, Steinberg D. Устойчивость Porphyromonas gingivalis ATCC 33277 к прямому уничтожению антимикробными пептидами не зависит от протеазы.Антимикробные агенты Chemother. 2008. 52 (2): 638–42.
CAS
Статья
PubMed
Google Scholar
Ouhara K, Komatsuzawa H, Yamada S, Shiba H, Fujiwara T, Ohara M, Sayama K, Hashimoto K, Kurihara H, Sugai M. Чувствительность пародонтопатогенных и кариесогенных бактерий к антибактериальным пептидам, {бета} — дефенсины и LL37, продуцируемые эпителиальными клетками человека. J Antimicrob Chemother. 2005; 55 (6): 888–96.
CAS
Статья
PubMed
Google Scholar
Epand RF, Savage PB, Epand RM. Бактериальный липидный состав и антимикробная эффективность катионных стероидных соединений (церагенинов). Biochim Biophys Acta. 2007. 1768 (10): 2500–9.
CAS
Статья
PubMed
Google Scholar
Lofmark S, Edlund C, Nord CE. Метронидазол по-прежнему является препаратом выбора для лечения анаэробных инфекций. Clin Infect Dis. 2010; 50 (Приложение 1): S16–23.
Артикул
PubMed
Google Scholar
Винсент И., Манджи А., Грегори-Миллер К., Ли К. Обзор управления инфекцией Clostridium difficile: первичная и рецидивирующая. Антибиотики (Базель). 2015; 4 (4): 411–23.
CAS
Статья
Google Scholar
Rineh A, Kelso MJ, Vatansever F, Tegos GP, Hamblin MR. Clostridium Difficile: молекулярный патогенез и новые методы лечения. Expert Rev Anti-Infect Ther. 2014; 12 (1): 131–50.
CAS
Статья
PubMed
PubMed Central
Google Scholar
McQuade R, Roxas B, Viswanathan VK, Vedantam G. Клинические изоляты Clostridium Difficile проявляют переменную чувствительность и протеомные изменения при воздействии катионных антимикробных пептидов млекопитающих. Анаэроб. 2012; 18 (6): 614–20.
CAS
Статья
PubMed
Google Scholar
Hing TC, Ho S, Shih DQ, Ichikawa R, Cheng M, Chen J, Chen X, Law I, Najarian R., Kelly CP, et al. Антимикробный пептид кателицидин модулирует колит, связанный с Clostridium Difficile, и энтерит, опосредованный токсином А, у мышей.Кишечник. 2013. 62 (9): 1295–305.
CAS
Статья
PubMed
Google Scholar
Bucki R, Namiot DB, Namiot Z, Savage PB, Janmey PA. Муцины слюны подавляют антибактериальную активность пептида LL-37, производного кателицидина, но не катионного стероида CSA-13. J Antimicrob Chemother. 2008. 62 (2): 329–35.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Schmidt NW, Agak GW, Deshayes S, Yu Y, Blacker A, Champer J, Xian W., Kasko AM, Kim J, Wong GC. Pentobra: мощный антибиотик с несколькими слоями селективных антимикробных механизмов против Propionibacterium acnes. J Invest Dermatol. 2015; 135 (6): 1581–9.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Wang Y, Zhang Z, Chen L, Guang H, Li Z, Yang H, Li J, You D, Yu H, Lai R. Кателицидин-BF, антимикробный пептид, полученный из змеиного кателицидина, может быть отличное лечебное средство от вульгарных угрей.PLoS One. 2011; 6 (7): e22120.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Бэйстон Р., Нурадин Б., Ашраф В., Фриман Б.Дж. Антибиотики для уничтожения биопленок Propionibacterium acnes при хирургической инфекции. J Antimicrob Chemother. 2007. 60 (6): 1298–301.
CAS
Статья
PubMed
Google Scholar
Donelli G, Vuotto C, Cardines R, Mastrantonio P.Растущие на биопленке кишечные анаэробные бактерии. FEMS Immunol Med Microbiol. 2012. 65 (2): 318–25.
CAS
Статья
PubMed
Google Scholar
Wnorowska U, Niemirowicz K, Myint M, Diamond SL, Wroblewska M, Savage PB, Janmey PA, Bucki R. Бактерицидная активность кателицидина LL-37 и выбора катионных липидов против гипервирулентного штамма Pseudomonas Aeruginosa. Антимикробные агенты Chemother. 2015; 59 (7): 3808–15.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Durnas B, Wnorowska U, Pogoda K, Deptula P, Watek M, Piktel E, Gluszek S, Gu X, Savage PB, Niemirowicz K, et al. Кандидацидная активность выбранных церагенинов и человеческого кателицидина LL-37 в экспериментальных условиях, имитирующих места заражения. PLoS One. 2016; 11 (6): e0157242.
Артикул
PubMed
PubMed Central
Google Scholar
Lai XZ, Feng Y, Pollard J, Chin JN, Rybak MJ, Bucki R, Epand RF, Epand RM, Savage PB. Церагенины: имитаторы антимикробных пептидов на основе холевой кислоты. Acc Chem Res. 2008. 41 (10): 1233–40.
CAS
Статья
PubMed
Google Scholar
Niemirowicz K, Swiecicka I, Wilczewska AZ, Markiewicz KH, Surel U, Kulakowska A, Namiot Z, Szynaka B, Bucki R, Car H. Остановка роста и быстрое улавливание избранных патогенов после обработки магнитными наночастицами.Коллоиды Surf B Биоинтерфейсы. 2015; 131: 29–38.
CAS
Статья
PubMed
Google Scholar
Перенос электронов в синтрофных сообществах анаэробных бактерий и архей
Бриас, О., Гийу, К., Рениеро, Ф. и Вада, Э. Глобальный цикл метана: изотопы и соотношения смешивания, источники и поглотители. Isotop. Environ. Стад здоровья. 37 , 257–379 (2002).
Артикул
Google Scholar
Фальковски П.Г., Фенчел, Т. и деЛонг, Э. Ф. Микробные двигатели, управляющие биогеохимическими циклами Земли. Наука 280 , 1034–1039 (2008).
Артикул
CAS
Google Scholar
Тилче, А. и Галатола, М. Потенциал биометана в качестве биотоплива / биоэнергии для сокращения выбросов парниковых газов: качественная оценка для Европы с точки зрения жизненного цикла. Water Sci. Technol. 57 , 1683–1692 (2008).
CAS
Статья
PubMed
Google Scholar
Маккарти, П. Л. Развитие анаэробного лечения и его будущее. Water Sci. Technol. 44 , 149–156 (2001).
CAS
Статья
PubMed
Google Scholar
Whitman, W., Bowen, T. & Boone D. in Прокариоты: развивающийся электронный ресурс для микробиологического сообщества 3-е изд. Vol. 3 (ред. Дворкин, М., Фалькоу, С., Розенберг, Э., Шлейфер, К. Х. и Стакебрандт, Э.) 165–207 (Спрингер, Нью-Йорк, 2006).
Забронировать
Google Scholar
Stams, A. J. M. et al. Внеклеточный перенос электронов в анаэробных микробных сообществах. Environ. Microbiol. 8 , 371–382 (2006).
CAS
Статья
PubMed
Google Scholar
Шинк, Б.И Стамс, А. Дж. М. в Прокариоты: развивающийся электронный ресурс для микробиологического сообщества 3-е изд. Vol. 2 (ред. Дворкин, М., Фалькоу, С., Розенберг, Э., Шлейфер, К. Х. и Стакебрандт, Э.) 309–335 (Спрингер, Нью-Йорк, 2006).
Забронировать
Google Scholar
Reguera, G. et al. Внеклеточный перенос электронов через микробные нанопроволоки. Nature 435 , 1098–1101 (2005). В этой статье дается первое описание возможного переноса электронов через проводящие пили .
CAS
Статья
PubMed
PubMed Central
Google Scholar
Горби Ю.А. и др. Электропроводящие бактериальные нанопроволоки, продуцируемые штаммом MR-1 Shewanella oneidensis и другими микроорганизмами. Proc. Natl Acad. Sci. США 103 , 11358–11363 (2006).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Стамс, А.Дж. М. Метаболические взаимодействия между анаэробными бактериями в метаногенных средах. Антони ван Левенгук 66 , 271–294 (1994).
CAS
Статья
PubMed
Google Scholar
Нилсон, К. Х., Инагаки, Ф. и Такай, К. Подземные литоавтотрофные микробные экосистемы, управляемые водородом (SLiME): существуют ли они и почему мы должны заботиться о них? Trends Microbiol. 13 , 405–410 (2005). Дает описание развития всей пищевой цепи, подпитываемой биотрансформацией H 2 и CO 2 в отсутствие света.
CAS
Статья
PubMed
Google Scholar
Тиле, Дж. Х. и Зейкус, Дж. Г. Контроль межвидового электронного потока во время анаэробного сбраживания: значение переноса формиата по сравнению с переносом водорода во время синтрофного метаногенеза во флоках. Заявл. Environ. Microbiol. 54 , 20–29 (1988).
CAS
PubMed
PubMed Central
Google Scholar
Конрад, Р., Фелпс, Т. Дж. И Зейкус, Дж. Г. Доказательства газового метаболизма в поддержку сопоставления водородпроизводящих и метаногенных бактерий в иле сточных вод и озерных отложениях. Заявл. Environ. Microbiol. 50 , 595–601 (1985).
CAS
PubMed
PubMed Central
Google Scholar
Шинк, Б.И Тауер, Р. К. в Гранулированный анаэробный ил: микробиология и технология (ред. Леттинга, Г., Зендер, А. Дж. Б., Гротенхейс, Дж. Т. К. и Хулсхофф, Л. В.) 5–17 (Пудок, Вагенинген, Нидерланды, 1988).
Google Scholar
Исии, С., Косака, Т., Хори, К., Хотта, Ю. и Ватанабе, К. Коагрегация способствует межвидовому переносу водорода между Pelotomaculum thermopropionicum и Methanothermobacter thermautotrophicus . Заявл. Environ. Microbiol. 71 , 7838–7845 (2005).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Джексон, Б. Э. и МакИнерни, М. Дж. Анаэробный микробный метаболизм может протекать близко к термодинамическим пределам. Nature 415 , 454–456 (2002).
CAS
Статья
PubMed
Google Scholar
Макинерни, М.J. et al. Физиология, экология, филогения и геномика микроорганизмов, способных к синтрофическому метаболизму. Ann. NY Acad. Sci. 1125 , 58–72 (2008).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Мартин В. и Мюллер М. Гипотеза водорода для первого эукариота. Nature 392 , 37–41 (1998).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Бун Д.Р., Джонсон, Р. Л. и Лю, Й. Диффузия межвидовых переносчиков электронов h3 и формиата в метаногенных экосистемах, а также значение измерения KM для поглощения h3 или формиата. Заявл. Environ. Microbiol. 55 , 1735–1741 (1989).
CAS
PubMed
PubMed Central
Google Scholar
Конрад, Р., Шинк, Б. и Фелпс, Т. Дж. Термодинамика метаболических реакций, потребляющих и продуцирующих h3, в различных метаногенных средах в условиях in situ . FEMS Microbiol. Ecol. 38 , 353–360 (1986).
CAS
Статья
Google Scholar
Винье П. М. и Биллоуд Б. Возникновение, классификация и биологическая функция гидрогеназ: обзор. Chem. Ред. 107 , 4206–4272 (2007).
CAS
Статья
PubMed
Google Scholar
Хеддерих Р.И Форзи, Л. Энергопревращающие [NiFe] гидрогеназы: больше, чем просто активация h3. J. Mol. Microbiol. Biotechnol. 10 , 92–104 (2005). Показывает, что транслокация протонов с помощью мембраносвязанных гидрогеназ является методом сохранения энергии, который важен для анаэробных микробных сообществ .
CAS
Статья
PubMed
Google Scholar
Casalot, L. & Rousset, M. Созревание гидрогеназ [NiFe]. Trends Microbiol. 9 , 228–237 (2001).
CAS
Статья
PubMed
Google Scholar
Тауер, Р. К., Юнгерманн, К. и Декер, К. Сохранение энергии у хемотрофных анаэробных бактерий. Бактериол. Rev. 41 , 100–180 (1977).
CAS
PubMed
PubMed Central
Google Scholar
Thauer, R.К., Кастер, А. К., Зеедорф, Х., Бакель, В. и Хеддерих, Р. Метаногенные археи: экологически значимые различия в энергосбережении. Nature Rev. Microbiol. 6 , 579–591 (2008).
CAS
Статья
Google Scholar
Carepo, M. et al. Метаболизм водорода в штамме Desulfovibrio desulfuricans New Jersey (NCIMB 8313) — сравнительное исследование с D. vulgaris и D.гигас видов. Анаэроб 8 , 325–332 (2002).
CAS
Статья
PubMed
Google Scholar
Баграмян К. и Трчунян А. Структурные и функциональные особенности формиат-гидридлиазы, фермента смешанно-кислотной ферментации из Escherichia coli . Biochem. (Моск.) 68 . 1159–1170 (2003).
CAS
Статья
Google Scholar
Ботт, М.Анаэробный цитратный метаболизм и его регуляция у энтеробактерий. Arch. Microbiol. 167 , 78–88 (1997).
CAS
Статья
PubMed
Google Scholar
Meshulam-Simon, G., Behrens, S., Choo, A. D. & Spormann, A.M. Метаболизм водорода в Shewanella oneidensis MR-1. Заявл. Environ. Microbiol. 73 , 1153–1165 (2007).
CAS
Статья
PubMed
Google Scholar
Соерс, Р.G. Формиат и его роль в производстве водорода у Escherichia coli . Biochem. Soc. Пер. 33 , 42–46 (2005).
CAS
Статья
PubMed
Google Scholar
Hulshoff Pol, L. W., deCastro Lopes, S., I., Lettinga, G. & Lens, P. N. L. Анаэробное гранулирование ила. Water Res. 38 , 1376–1389 (2004).
CAS
Статья
PubMed
Google Scholar
Леттинга, Г.и другие. Использование концепции реактора с восходящим потоком для биологической очистки сточных вод, особенно для анаэробной очистки. Biotechnol. Bioeng. 22 , 699–734 (1980). Показывает, что спонтанная самоагрегация смешанных метаногенных сообществ в биореакторах с восходящим потоком в компактные и плотные агрегаты обеспечивает эффективную анаэробную очистку сточных вод. .
CAS
Статья
Google Scholar
Лю Ю., Сюй, Х. Л., Янг, С. Ф. и Тай, Дж. Х. Механизмы и модели анаэробной грануляции в реакторе с восходящим потоком анаэробного слоя ила. Water Res. 37 , 661–673 (2003).
CAS
Статья
PubMed
Google Scholar
Grotenhuis, J. T. et al. Бактериологический состав и структура гранулированного ила адаптированы к различным субстратам. Заявл. Environ. Microbiol. 57 , 1942–1949 (1991).
CAS
PubMed
PubMed Central
Google Scholar
Шмидт, Дж. Э. и Аринг, Б. К. Влияние водорода и формиата на разложение пропионата и бутирата в термофильных гранулах из реактора анаэробного бланкета с восходящим потоком. Заявл. Environ. Microbiol. 59 , 2546–2551 (1993).
CAS
PubMed
PubMed Central
Google Scholar
Стамс, А.Дж. М., Гролле, К. С., Фрайтерс, К. Т. и Ван Лиер, Дж. Б. Обогащение термофильных пропионат-окисляющих бактерий при синтрофии с помощью Methanobacterium thermoautotrophicum или Methanobacterium thermoformicum . Заявл. Environ. Microbiol. 58 , 346–352 (1992).
CAS
PubMed
PubMed Central
Google Scholar
Озтюрк, С. С., Палссон, Б. О. и Тиле, Дж. Х. Контроль межвидового потока переноса электронов во время анаэробного сбраживания: модели динамической диффузии для переноса газообразного водорода в микробных хлопьях. Biotechnol. Bioeng. 33 , 745–757 (1989).
CAS
Статья
PubMed
Google Scholar
Шмидт, Дж. Э. и Аринг, Б. К. Межвидовой перенос электронов при разложении пропионата и бутирата в мезофильном гранулированном иле. Заявл. Environ. Microbiol. 61 , 2765–2767 (1995).
CAS
PubMed
PubMed Central
Google Scholar
Крумхольц, Л.R. & Bryant, M. P. Syntrophococcus Sucromutans sp. ноя ген. ноя использует углеводы в качестве доноров электронов и формиат, метоксимонобензоиды или Methanobrevibacter в качестве систем акцепторов электронов. Arch. Microbiol. 143 , 313–318 (1986). Показывает, что субстраты, которые считаются легко ферментируемыми, могут разлагаться облигатно синтрофными сообществами бактерий и метаногенов .
CAS
Статья
Google Scholar
Мюллер, Н., Гриффин, Б. М., Стингл, У. и Шинк, Б. Преобладающие утилизаторы сахара в отложениях Боденского озера зависят от синтрофного взаимодействия с метаногенными организмами-партнерами. Environ. Microbiol. 10 , 1501–1511 (2008).
Артикул
CAS
PubMed
Google Scholar
Джексон, Б. Э., Бхупатираджу, В. К., Таннер, Р. С., Вёзе, К. Р. и Макинерни, М. Дж. Syntrophus aciditrophicus sp.nov., новая анаэробная бактерия, которая разлагает жирные кислоты и бензоат в синтрофической ассоциации с микроорганизмами, потребляющими водород. Arch. Microbiol. 171 , 107–114 (1999).
CAS
Статья
PubMed
Google Scholar
McInerney, M. J. et al. Геном Syntrophus aciditrophicus : жизнь на термодинамическом пределе роста микробов. Proc. Natl Acad. Sci. США 104 , 7600–7605 (2007).
Артикул
CAS
PubMed
Google Scholar
Imachi, H. et al. Pelotomaculum thermopropionicum gen. nov., sp. nov., анаэробная термофильная синтрофная пропионатокисляющая бактерия. Внутр. J. Syst. Evol. Microbiol. 52 , 1729–1735 (2002).
CAS
PubMed
Google Scholar
Kosaka, T. et al.Реконструкция и регуляция центрального катаболического пути в термофильном окисляющем пропионат синтрофе Pelotomaculum thermopropionicum . J. Bacteriol. 188 , 202–210 (2006).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Kosaka, T. et al. Геном Pelotomaculum thermopropionicum показывает эволюцию анаэробной микробиоты, связанную с нишами. Genome Res. 18 , 442–448 (2008).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Harmsen, H. J. M. et al. Syntrophobacter fumaroxidans sp. nov., синтрофная пропионат-деградирующая сульфатредуцирующая бактерия. Внутр. J. Syst. Бактериол. 48 , 1383–1387 (1998).
CAS
Статья
PubMed
Google Scholar
Наканиши-Мацуи, М.& Футаи, М. Стохастический вращательный катализ протонной накачки F-АТФазы. Philos. Пер. R. Soc. Лондон. B Biol. Sci. 363 , 2135–2142 (2008). Показывает, что стехиометрия транслокации протонов и гидролиза АТФ или синтеза АТФ может варьироваться.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Stams, A. J. M., Van Dijk, J. B., Dijkema, C. & Plugge, C. M. Рост синтрофических пропионат-окисляющих бактерий с фумаратом в отсутствие метаногенных бактерий. Заявл. Environ. Microbiol. 59 , 1114–1119 (1993).
CAS
PubMed
PubMed Central
Google Scholar
Kröger, A. et al. Фумаратное дыхание Wolinella succinogenes : энзимология, энергетика и механизм связывания. Biochim. Биофиз. Acta 1553 , 23–38 (2002).
Артикул
PubMed
Google Scholar
Ширавски, Дж.И Унден, Г. Менахинон-зависимая сукцинатдегидрогеназа бактерий катализирует обратный перенос электронов, управляемый протонным потенциалом. Eur. J. Biochem. 257 , 210–215 (1998).
CAS
Статья
PubMed
Google Scholar
Van Kuijk, B. L. M., Schlösser, E. & Stams, A. J. M. Исследование фумаратного метаболизма штамма синтрофных пропионатокисляющих бактерий MPOB. Arch.Microbiol. 169 , 346–352 (1998).
CAS
Статья
PubMed
Google Scholar
Wallrabenstein, C. & Schink, B. Доказательства обратного транспорта электронов при окислении синтрофного бутирата или бензоата с помощью Syntrophomonas wolfei и Syntrophus buswellii . Arch. Microbiol. 162 , 136–142 (1994).
CAS
Статья
Google Scholar
Шинк, Б.& Фридрих, М. Энергетика окисления синтрофных жирных кислот. FEMS Microbiol. Ред. 15 , 85–94 (1994).
CAS
Статья
Google Scholar
Herrmann, G., Jayamani, E., Mai, G. & Buckel, W. Сохранение энергии через переносящий электрон флавопротеин в анаэробных бактериях. J. Bacteriol. 190 , 784–791 (2008). Описание биохимического механизма сохранения энергии с участием медиаторов окислительно-восстановительного потенциала с высоким и низким потенциалом. .
CAS
Статья
Google Scholar
Li, F. et al. Связанное восстановление ферредоксина и кротонил-кофермента A (CoA) с помощью NADH, катализируемое комплексом бутирил-CoA дегидрогеназа / Etf из Clostridium kluyveri . J. Bacteriol. 190 , 843–850 (2008).
CAS
Статья
Google Scholar
Plugge, C. M., Dijkema, C.& Stams, A. J. M. Путь расщепления ацетил-КоА в синтрофной пропионатокисляющей бактерии, растущей на фумарате в отсутствие метаногенов. FEMS Microbiol. Lett. 110 , 71–76 (1993).
CAS
Статья
Google Scholar
Wofford, N.Q., Beaty, P. S. & McInerney, M.J. Получение бесклеточных экстрактов и ферментов, участвующих в метаболизме жирных кислот у Syntrophomonas wolfei . J. Bacteriol. 167 , 179–185 (1986).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Донг, X. и Стамс, А. Дж. М. Доказательства образования h3 и формиата во время разложения синтрофного бутирата и пропионата. Anaerobe 1 , 35–39 (1995).
CAS
Статья
PubMed
Google Scholar
Донг, Х., Plugge, C. M. и Stams, A. J. M. Анаэробное разложение пропионата мезофильной ацетогенной бактерией в сокультуре и трикультуре с различными метаногенами. Заявл. Environ. Microbiol. 60 , 2834–2838 (1994).
CAS
PubMed
PubMed Central
Google Scholar
Де Бок, Ф. А. М., Розе, Э. Х. и Стамс, А. Дж. М. Гидрогеназы и формиатдегидрогеназы Syntrophobacter fumaroxidans . Антони ван Левенгук 81 , 283–291 (2002).
CAS
Статья
PubMed
Google Scholar
Де Бок, Ф. А. М. и др. Две W-содержащие формиатдегидрогеназы (СО2-редуктазы) участвуют в синтрофическом окислении пропионата с помощью Syntrophobacter fumaroxidans . Eur. J. Biochem. 270 , 2476–2485 (2003).
CAS
Статья
PubMed
Google Scholar
Andreesen, J.Р. и Макдесси, К. Вольфрам, элемент хэви-метала, который на удивление положительно влияет на прокариот. Ann. NY Acad. Sci. 1125 , 215–229 (2008).
CAS
Статья
PubMed
Google Scholar
Plugge, C. M., Balk, M. & Stams, A. J. M. Desulfotomaculum thermobenzoicum subsp. thermosyntrophicum subsp. nov., термофильная, синтрофная, пропионатокисляющая, спорообразующая бактерия. Внутр. J. Syst. Evol. Microbiol. 52 , 391–399 (2002).
CAS
Статья
PubMed
Google Scholar
Sieber, J. et al. в Abstr. Генерал Знакомьтесь. Являюсь. Soc. Microbiol. I-002071 (2008).
Донг, X. и Стамс, А. Дж. М. Локализация ферментов, участвующих в метаболизме h3 и формиата в Syntrophospora bryantii . Антони ван Левенгук 67 , 345–350 (1995).
CAS
Статья
PubMed
Google Scholar
Брайант, М. П., Кэмпбелл, Л. Л., Редди, К. А. и Крабилл, М. Р. Выращивание Desulfovibrio в лактатной или этанольной среде с низким содержанием сульфата в сочетании с метаногенными бактериями, использующими h3. Заявл. Environ. Microbiol. 33 , 1162–1169 (1977).
CAS
PubMed
PubMed Central
Google Scholar
Шолтен, Дж.C. et al. Эволюция синтрофного взаимодействия между Desulfovibrio vulgaris и Methanosarcina barkeri : участие древнего горизонтального переноса генов. Biochem. Биофиз. Res. Commun. 352 , 48–54 (2007).
CAS
Статья
PubMed
Google Scholar
Winter, J. & Wolfe, R. S. Образование метана из фруктозы синтрофными ассоциациями Acetobacterium woodii и различных штаммов метаногенов. Arch. Microbiol. 124 , 73–79 (1980).
CAS
Статья
PubMed
Google Scholar
Корд-Рувиш, Р. и Олливье, Б. Межвидовой перенос водорода во время разложения метанола под действием Sporomusa acidovorans и гидрогенофильных анаэробов. Arch. Microbiol. 144 , 163–165 (1986).
CAS
Статья
Google Scholar
Фелпс Т.J., Conrad, R. & Zeikus, J. G. Сульфат-зависимый межвидовой перенос h3 между Methanosarcina barkeri и Desulfovibrio vulgaris во время совместного культивирования метаболизма ацетата или метанола. Заявл. Environ. Microbiol. 50 , 589–594 (1985).
CAS
PubMed
PubMed Central
Google Scholar
Валентайн Д. Л., Блэнтон Д. К. и Рибург В. С. Производство водорода метаногенами в условиях низкого содержания водорода. Arch. Microbiol. 174 , 415–421 (2000).
CAS
Статья
PubMed
Google Scholar
Calteau, A., Gouy, M. & Perrière, G. Горизонтальный перенос двух оперонов, кодирующих гидрогеназы, между бактериями и археями. J. Mol. Evol. 60 , 557–565 (2005).
CAS
Статья
PubMed
Google Scholar
Столяр, С.и другие. Метаболическое моделирование мутуалистического микробного сообщества. Мол. Syst. Биол. 3 , 92 (2007).
Reeburgh, W. S. Потребление метана в водах и отложениях желоба Кариако. Планета Земля. Sci. Lett. 28 , 337–344 (1976). В этой статье впервые предложено анаэробное окисление метана .
CAS
Статья
Google Scholar
Боэтиус, А.и другие. Консорциум морских микробов, по-видимому, опосредует анаэробное окисление метана. Nature 407 , 623–626 (2000). Описывает синтрофное сообщество архей и бактерий, участвующих в сульфат-зависимом анаэробном окислении метана .
CAS
Статья
PubMed
PubMed Central
Google Scholar
Raghoebarsing, A. A. et al. Консорциум микробов сочетает анаэробное окисление метана с денитрификацией. Nature 440 , 918–921 (2006). Описывает АОМ сообщества денитрифицирующих микробов .
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ettwig, K. F. et al. Денитрифицирующие бактерии анаэробно окисляют метан в отсутствие архей. Environ. Microbiol. 10 , 3164–3173 (2008).
CAS
Статья
PubMed
Google Scholar
Халлам, С.J. et. al . Обратный метаногенез: проверка гипотезы с помощью экологической геномики. Наука 305 , 1457–1462 (2004).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Krüger, M. et al. Заметный белок никель в микробных матах, которые анаэробно окисляют метан. Nature 426 , 878–881 (2003). Показывает очистку и описание ключевого фермента анаэробного окисления метана из отложений, в которых происходит анаэробное окисление метана. .
Артикул
CAS
PubMed
Google Scholar
Mayr, S. et al. Структура варианта F430 из архей, связанного с анаэробным окислением метана. J. Am. Chem. Soc. 130 , 10758–10767 (2008).
CAS
Статья
PubMed
Google Scholar
Фридрих, М. В. Гены метил-кофермента М редуктазы: уникальные функциональные маркеры метаногенных и анаэробных метанокисляющих архей. Methods Enzymol. 397 , 428–442 (2005).
CAS
Статья
PubMed
Google Scholar
Наухаус, К., Тройд, Т., Боэтиус, А. и Крюгер, М. Регулирование анаэробного окисления метана в окружающей среде: сравнение сообществ ANME-I и ANME-II. Environ. Microbiol. 1 , 98–106 (2005).
Артикул
CAS
Google Scholar
Treude, T.и другие. Потребление метана и CO2 метанотрофными микробными матами из газовых выходов бескислородного Черного моря. Заявл. Environ. Microbiol. 73 , 2271–2283 (2007).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Соренсен, К. Б., Финстер, К. и Рамзинг Н. Б. Термодинамические и кинетические требования в анаэробных консорциумах окислителей метана исключают водород, ацетат и метанол как возможные переносчики электронов. Microb. Ecol. 42 , 1–10 (2001).
PubMed
Google Scholar
Moran, J. J. et al. Метилсульфиды как промежуточные продукты анаэробного окисления метана. Environ. Microbiol. 10 , 162–173 (2007).
PubMed
Google Scholar
Тауэр, Р. К. и Шима, С. Метан как топливо для анаэробных организмов. Ann. NY Acad. Sci. 1125 , 158–170 (2008).
CAS
Статья
PubMed
Google Scholar
Оркатт Б., Самаркин В., Боэтиус А. и Джой С. О взаимосвязи между производством метана и окислением анаэробными метанотрофными сообществами из холодных выходов Мексиканского залива. Environ. Microbiol. 10 , 1108–1117 (2008).
CAS
Статья
PubMed
Google Scholar
Ниманн, Х.и другие. Новые микробные сообщества грязевого вулкана Хокон Мосби и их роль в качестве стока метана. Nature 443 , 854–858 (2006).
CAS
Статья
PubMed
Google Scholar
Lösekann, T. et al. Разнообразие и изобилие аэробных и анаэробных окислителей метана на грязевом вулкане Хокон Мосби в Баренцевом море. Заявл. Environ. Microbiol. 73 , 3348–3362 (2007).
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Наухаус, К., Альбрехт, М., Элверт, М., Боэтиус, А. и Виддел, Ф. Рост клеток морских архей и бактерий консорциумов морских архей и бактерий in vitro во время анаэробного окисления метана сульфатом. Environ. Microbiol. 9 , 187–196 (2007).
CAS
Статья
Google Scholar
Орфан, В. Дж., Хаус, К. Х., Хинрикс, К. У., МакКиган, К. Д. и ДеЛонг, Э. Ф. Множественные группы архей опосредуют окисление метана в бескислородных отложениях холодного просачивания. Proc. Natl Acad. Sci. США 99 , 7663–7668 (2002).
CAS
Статья
Google Scholar
Pernthaler, A. et al. Разнообразные синтрофические партнерства из глубоководных источников метана, выявленные прямым захватом клеток и метагеномикой. Proc. Natl Acad. Sci. США 105 , 7052–7057 (2008).
CAS
Статья
Google Scholar
Михаэлис, В.и другие. Микробные рифы в Черном море подпитываются анаэробным окислением метана. Наука 297 , 1013–1015 (2002).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Orphan, V.J. et al. Сравнительный анализ метанокисляющих архей и сульфатредуцирующих бактерий в бескислородных морских отложениях. Заявл. Environ. Microbiol. 67 , 1922–1934 (2001).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Финке, Н., Хёлер, Т. М. и Йоргенсен, Б. Б. «Утечка» водорода во время метаногенеза из метанола и метиламина: последствия для анаэробных путей разложения углерода в водных отложениях. Environ. Microbiol. 9 , 1060–1071 (2007).
CAS
Статья
PubMed
Google Scholar
Кельтьенс Дж. Т. и ван дер Дрифт К. Реакции переноса электрона в метаногенах. FEMS Microbiol. Rev. 39 , 259–303 (1986).
CAS
Статья
Google Scholar
Rother, M., Oelgeschläger, E. & Metcalf, W. M. Генетический и протеомный анализ утилизации CO Methanosarcina acetivorans . Arch. Microbiol. 188 , 463–472 (2007).
CAS
Статья
PubMed
Google Scholar
Хенстра, А. М., Дийкема, К. и Стамс, А.J. M. Archaeoglobus fulgidus сочетает окисление CO с восстановлением сульфата и ацетогенез с временным накоплением формиата. Environ. Microbiol. 9 , 1836–1841 (2007).
CAS
Статья
PubMed
Google Scholar
Guss, AM, Mukhopadhyay, B., Zhang, JK & Metcalf, WW Генетический анализ мутантов mch у двух видов Methanosarcina демонстрирует множественные роли метаноптерин-зависимого пути окисления / восстановления C-1 и различия в h3 метаболизм между близкородственными видами. Мол. Microbiol. 55 , 1671–1680 (2005). Показывает роль водородного метаболизма во время роста на различных субстратах с помощью анализа Methanosarcina мутантов .
CAS
Статья
PubMed
Google Scholar
Rabus, R., Hansen, T. A. & Widdel, F. in Прокариоты: развивающийся электронный ресурс для микробиологического сообщества 3-е изд. Vol. 2 (ред. Дворкин, М., Фалькоу, С., Розенберг, Э., Шлейфер, К. Х. и Стакебрандт, Э.) 659–768 (Спрингер, Нью-Йорк, 2006).
Забронировать
Google Scholar
Вегенер, Г., Ниманн, Х., Элверт, М., Хинрихс, К. У. и Боэтиус, А. Ассимиляция метана и неорганического углерода микробными сообществами, опосредующими анаэробное окисление метана. Environ. Microbiol. 10 , 2287–2298 (2008).
CAS
Статья
PubMed
Google Scholar
Лупа, Б., Хендриксон, Э. Л., Ли, Дж. А. и Уитман, У. Б. Формиат-зависимая продукция h3 мезофильным метаногеном Methanococcus maripaludis . Заявл. Environ. Microbiol. 74 , 6584–6590 (2008).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Sprenger, W.W., Hackstein, J. H. & Keltjens, J. T. Энергетический метаболизм Methanomicrococcus blatticola : физиологические и биохимические аспекты. Антони ван Левенгук 87 , 289–299 (2005).
CAS
Статья
PubMed
Google Scholar
Лопес-Гарсия, П. и Морейра, Д. Отслеживание микробного биоразнообразия с помощью молекулярной и геномной экологии. Res. Microbiol. 159 , 67–73 (2008).
Артикул
CAS
PubMed
Google Scholar
Пизани Д., Коттон Дж. А. и МакИнерни Дж. О. Супердеревья раскрывают химерическое происхождение геномов эукариот. Мол. Биол. Evol. 24 , 1752–1760 (2007).
CAS
Статья
Google Scholar
Сирси Д. Г. Метаболическая интеграция в процессе эволюционного происхождения митохондрий. Cell Res. 13 , 229–238 (2003).
CAS
Статья
Google Scholar
Баркер, Х.А. Исследования метанового брожения. IV: выделение и культивирование Methanobacterium omelianskii . Антони ван Левенгук 6 , 201–220 (1940).
Артикул
Google Scholar
Brill, W. J.& Wolfe, R. S. Окисление ацетальдегида Methanobacillus — новая ферредоксин-зависимая реакция. Nature 212 , 253–255 (1966).
CAS
Статья
PubMed
Google Scholar
Брайант, М. П., Волин, Э. А., Волин, М. Дж. И Вулф, Р. С. Methanobacillus omelianskii , симбиотическая ассоциация двух видов бактерий. Arch. Микробиол. 59 , 20–31 (1967).
CAS
Статья
Google Scholar
de Bruyn, J. C., Boogerd, F. C., Bos, P. & Kuenen, J. G. Плавающие фильтры, новый метод выделения и подсчета привередливых, ацидофильных, окисляющих железо автотрофных бактерий. Заявл. Environ. Microbiol. 56 , 2891–2894 (1990).
CAS
PubMed
PubMed Central
Google Scholar
Янотти, Э.Л., Кафкевиц, Д., Волин, М. Дж. И Брайант, М. П. Продукты ферментации глюкозы с помощью Ruminococcus albus , выращенного в непрерывной культуре с Vibrio succinogenes : изменения, вызванные межвидовым переносом h3. J. Bacteriol. 114 , 1231–1240 (1973).
Google Scholar
Чен М. и Волин М. Дж. Влияние продукции Ch5 Methanobacterium ruminantium на ферментацию глюкозы и лактата Selenomonas ruminantium . Заявл. Environ. Microbiol. 34 , 756–759 (1977).
CAS
PubMed
PubMed Central
Google Scholar
Латам, М. Дж. И Волин, М. Дж. Ферментация целлюлозы с помощью Ruminococcus flavefaciens в присутствии и в отсутствие Methanobacterium ruminantium . Заявл. Environ. Microbiol. 34 , 97–301 (1977).
Google Scholar
Цитозащитные металлоорганические каркасы для анаэробных бактерий
Значимость
Культивирование бактерий для производства нужных химикатов уже давно практикуется в истории человечества, и недавно было принято в качестве многообещающего подхода к устойчивой энергии, когда этот процесс осуществляется за счет солнечного света и подается CO 2 в качестве единственного источника углерода.К числу этих микробов, производящих химические вещества, относятся анаэробные бактерии, изначально чувствительные к O 2 и активные формы кислорода, которые неизбежно образуются на анодах. Здесь мы обеспечиваем цитозащиту против такого окислительного стресса, оборачивая бактерии искусственным материалом, металлоорганическими каркасами (MOF), что значительно увеличивает продолжительность жизни анаэробов в присутствии O 2 и поддерживает непрерывное производство уксусной кислоты из CO 2. Ультратонкий слой MOF позволяет воспроизводить клетки без потери этого цитопротекторного материала.
Abstract
Мы сообщаем о стратегии равномерного обертывания бактерий Morella thermoacetica монослоем металлоорганического каркаса (MOF) нанометровой толщины для цитозащиты при искусственном фотосинтезе. Каталитическая активность корпуса MOF по отношению к разложению активных форм кислорода (ROS) снижает гибель строго анаэробных бактерий в пять раз в присутствии 21% O 2 и позволяет бактериям с цитозащитой непрерывно производить ацетат из CO 2 фиксация при окислительном стрессе.Высокая четкость границы раздела MOF-бактерии, включающая прямую связь между фосфатными единицами на поверхности клетки и кластерами циркония на монослое MOF, обеспечивает увеличение продолжительности жизни на протяжении всего воспроизводства. Динамический характер оборачивания MOF обеспечивает удлинение и разделение клеток, включая спонтанное покрытие поверхности вновь выросших клеток. Открытые металлические участки на кластерах циркония приводят к более эффективному разложению АФК в 600 раз по сравнению с наночастицами диоксида циркония.
Анаэробные бактерии уже давно разводятся и используются для ферментации органических веществ в отсутствие O 2 для производства химических веществ с добавленной стоимостью (этанол, уксусная кислота, молочная кислота, ацетон и бутанол) (1).Недавняя работа по искусственному фотосинтезу использует преимущества автотропного метаболизма этих бактерий за счет использования CO 2 в качестве единственного источника углерода наряду с солнечной энергией для производства топлива и химикатов (2⇓⇓⇓⇓ – 7). Хотя эти исследования многообещающие, выделение O 2 и активных форм кислорода (ROS) на аноде вместе с образованием топлива пагубно сказывается на метаболизме анаэробных бактерий. Устранение этой врожденной уязвимости к окислительному стрессу расширит диапазон и условия для осуществления действительно продуктивного искусственного фотосинтеза.В этой статье мы показываем, что при обертывании сенсибилизированных полупроводниками анаэробных бактерий ( Moorella thermoacetica ) монослоем металлоорганического каркаса (MOF) CO 2 превращался в ацетат в два раза дольше, чем наблюдалось без него. упаковка. Мы обнаружили пятикратное снижение гибели завернутых бактерий при воздействии окружающей среды O 2 (21%), и что они также способны к размножению без потери MOF. Хорошо известно, что виды O 2 могут превращаться в H 2 O 2 на клеточной мембране (8).В нашей системе за этой конверсией O 2 -H 2 O 2 следует разложение H 2 O 2 на звеньях оксида циркония MOF. Эта последовательность реакций, опосредованная MOF, предотвращает образование и накопление ROS, которые, как известно, вредны для бактерий, и, следовательно, значительно продлевает время жизни в окислительной среде. Высокая четкость структуры монослоя MOF позволила нам подтвердить, что Zr 4+ MOF связан с фосфатными звеньями на клеточной стенке, и что динамический химический состав этой связи является ключом к наблюдаемому увеличению срока службы. бактерий, эффективности упаковки и возможности их размножения.
Известно, что бактерии могут быть покрыты полимерами, неорганическими наночастицами и MOF для повышения их жизнеспособности при радиационном, термическом и механическом воздействии (9⇓⇓⇓⇓⇓ – 15), но не для решения критической проблемы окислительный стресс при искусственном фотосинтезе. Эти покрытия страдают от сложной синтетической процедуры, которая дает либо плохое покрытие, либо жесткие оболочки толщиной в сотни нанометров, которые улавливают клетки в спящем состоянии. Таким образом, защита, обеспечиваемая этими материалами, носит временный характер, поскольку покрытие материала необходимо повторять каждый раз, когда вводится новая партия ячеек.Тот факт, что бактерии, о которых мы здесь сообщаем, были покрыты слоем MOF толщиной всего 1-2 нм, а связи на границе раздела бактерии и MOF являются динамическими, приводит к легкому размножению и поддерживает защиту от окислительного стресса. Стоит отметить, что избыток MOF в культуральной среде может охватывать поверхности вновь выросших клеток, передавая эту защиту поколениям анаэробов.
Результаты и обсуждение
В этом исследовании мы выбрали MOF [Zr 6 O 4 (OH) 4 (BTB) 2 (OH) 6 (H 2 O) 6 ; BTB = 1,3,5-бензолтрибензоат] (рис.1 A ) для упаковки клеток, поскольку составляющие кластеры циркония обладают низкой токсичностью и высокой стабильностью. Тот факт, что эти кластеры могут быть соединены линкерами BTB в самоподдерживающийся монослой (16), делает этот материал идеальным кандидатом. Для создания конструкции бактерии-MOF мы разработали стратегию путем добавления предварительно синтезированного монослоя MOF в культуральную среду бактерий (рис. 1 B ). Этот постсинтетический метод, в отличие от роста оболочек MOF на бактериях in situ (10), позволяет спонтанно оборачиваться вокруг вновь выросшей клеточной поверхности, чему способствует координационная связь между циркониевым кластером и тейхоевой кислотой на клеточной стенке (рис. .1 С ). Предполагается, что завершенная упаковка MOF будет служить цитопротекторным слоем из-за его каталитической активности по отношению к реакции разложения ROS (рис. 1 D ).
Рис. 1.
Разработка и синтез системы упаковки M. thermoacetica –MOF. ( A ) Монослой MOF состоит из 6-связанного кластера Zr 6 O 4 (OH) 4 (-CO 2 ) 6 и тригонального линкера BTB. ( B ) Монослой MOF спонтанно оборачивается вокруг M.thermoacetica , позволяя удлинение и разделение клеток, во время которого вновь образованная клеточная поверхность оборачивается in situ избытком MOF в культуральной среде. ( C ) Молекулярная структура на границе раздела иллюстрирует образование многовалентных координационных связей между неорганическими кластерами MOF и фосфатными фрагментами тейхоевой кислоты на клеточной стенке. ( D ) Разложение АФК монослойным покрытием MOF на поверхности клетки. В модели заполнения пространства атомы клеточной стенки и АФК представлены в голубых и зеленых сферах соответственно.Атомы водорода на кластерах циркония для ясности опущены. Цветовой код: синий, Zr; красный, О; серый, C; белый, H; yellow, P.
Монослой MOF получали по известной методике (16). Просвечивающая электронная микроскопия (ПЭМ) подтверждает образование самонесущего монослоя MOF с поперечными размерами микрометров (рис. 2 A ). Ранняя стационарная стадия M. thermoacetica , культивированная в гетеротрофной среде, была центрифугирована и повторно диспергирована вместе с монослоями MOF в автотрофной культуральной среде.После легкого встряхивания в течение 1 ч происходило самопроизвольное обертывание. Морфология полученных систем упаковки, M. thermoacetica –MOF, была исследована с помощью ПЭМ (рис. 2 B и SI Приложение , рис. S1 A — E ), сканирующей просвечивающей электронной микроскопии STEM) (Рис.2 C и SI Приложение , Рис. S1 F ) и сканирующая электронная микроскопия (SEM) (Рис.2 D и SI Приложение , Рис.S2), подтверждая, что бактерии были покрыты ультратонкими слоями, покрывающими и далее высовывающимися из всего тела клетки. Химический состав оберточной конструкции анализировали с использованием картирования энергодисперсионной рентгеновской спектроскопии (EDXS) (рис. 2 E — H ). Перекрывающаяся область распределения атомов между цирконием, углеродом, серой и фосфором указывает на присутствие MOF в теле клетки. Структурированная световая микроскопия была использована для оценки структуры гетерогенной системы упаковки.Для этого эксперимента мы пометили монослой MOF и бактерии флуоресцеином ( SI Приложение , рис. S3) и внутриклеточными нанокристаллами золота, испускающими зеленую и красную флуоресценцию соответственно. Восстановленные трехмерные изображения ( SI Приложение , рис. S4) демонстрируют структуру ядро-оболочка, дополнительно подтверждая, что бактерии были обернуты MOF.
Рис. 2.
Структурная характеристика M. thermoacetica –MOF. ( A ) ПЭМ-изображение монослоя MOF. ПЭМ-изображение ( B ), высокоугловое кольцевое темнопольное изображение STEM ( C ) и SEM-изображение ( D ) M.thermoacetica –MOF. Картирование EDS выбранной области, помеченной желтым квадратом в C , подтверждает присутствие углерода ( E ), серы ( F ), фосфора ( G ) и циркония ( H ) на краю M. thermoacetica –MOF. ( I ) PXRD-картина и положение Брэгга (красные линии) M. thermoacetica –MOF, MOF, пропитанный культуральной средой, MOF в момент синтеза и смоделированная структура. ( J ) FTIR-спектры M.thermoacetica , M. thermoacetica –MOF, M. thermoacetica –MOF, культивируемая в среде без фосфата (-NP), модельное соединение ZrDMPO, MOF, пропитанное культуральной средой, и MOF в исходном состоянии. Пики на 839 и 832 см -1 отмечены пунктирными линиями голубого и пурпурного цветов соответственно. ( K ) P 2p-спектры, полученные XPS ZrDMPO (синий), M. thermoacetica –MOF-NP (оранжевый) и M. thermoacetica (зеленый).
Кристалличность MOF и М.thermoacetica –MOF исследовали методом порошковой рентгеновской дифракции (PXRD). Было обнаружено, что полученные PXRD-рентгенограммы MOF, пропитанного культуральной средой, и конечной конструкции обертывания M. thermoacetica -MOF хорошо согласуются с таковой для синтезированной основы (рис. 2 I ), подтверждая, что MOF оставался неповрежденным во время процесса упаковки ячеек. Присутствие MOF было дополнительно подтверждено инфракрасными спектрами с преобразованием Фурье (FTIR), где M. thermoacetica –MOF имеет ароматические C = C (1,407 см -1 ) и участки CH (856 и 777 см -1 ). ) компоновщика BTB ( SI Приложение , рис.S5). Массовый процент монослоя MOF в полученной оберточной конструкции был определен с помощью атомно-эмиссионной спектроскопии с индуктивно связанной плазмой (ICP-AES) и составил 6,0 ± 0,9%.
Спонтанному обертыванию монослоя MOF на бактерии способствуют координационные центры на кластерах циркония, где гидроксильные и водные лиганды могут быть легко заменены фосфатными группами (17) тейхоевой кислоты на поверхности клетки (18, 19). Чтобы клеточная поверхность была единственным фосфатсодержащим лигандом, β-глицерофосфат, питательный компонент, был исключен из культуральной среды во время процесса упаковки для оценки структуры.Спектры FTIR полученной системы упаковки ( M. thermoacetica –MOF-NP) демонстрируют появление пика при 839 см -1 , который не принадлежит ни бактериям, ни только MOF (рис. 2 J ) . Для определения его химической природы был синтезирован и использован в качестве модельного соединения молекулярный аналог предложенного фрагмента M. thermoacetica –MOF — диметилфосфат циркония (ZrDMPO). Структура ZrDMPO была определена методом дифракции рентгеновских лучей на монокристаллах (SXRD) ( SI Приложение , рис.S6 и таблицы S1 и S2) и содержал два атома кислорода DMPO, координирующих бидентатно с соседними ионами циркония. Было обнаружено, что именно это связывание проявляет растяжение (Zr) -OP при 839 см -1 в FTIR-спектре (20), что согласуется с пиком, который возникает из пика M. thermoacetica -MOF-NP (рис. 2 J ). Координация β-глицерофосфата с циркониевым кластером происходит, когда MOF пропитывается культуральной средой и демонстрирует участок (Zr) -OP (832 см -1 ), который вносит вклад в широкий пик в том же положении в ИК-Фурье спектры M.thermoacetica –MOF. Этот результат указывает на присутствие как β-глицерофосфата, так и связывания клеточной поверхности с кластерами циркония, когда упаковка обрабатывается в полной культуральной среде, конкуренция между которыми может обеспечить динамическое обертывание, которое позволяет удлинить и разделить клеточную стенку. Наличие координационных связей между фосфатными фрагментами на поверхности клетки и кластерами циркония было подтверждено данными рентгеновской фотоэлектронной спектроскопии (XPS) (рис.2 K и SI Приложение , рис.S7). Спектр P 2p M. thermoacetica –MOF-NP демонстрирует сдвиг энергии связи от 132,8 до 133,1 эВ по сравнению с «голыми» бактериями, аналогичный спектру модельного соединения ZrDMPO с энергией связи P 2p 133,2 эВ.
Для анализа биосовместимости монослоя MOF гетеротрофный рост M. thermoacetica , культивированных в анаэробных условиях, был профилирован путем подсчета колониеобразующих единиц (КОЕ). M. thermoacetica -MOF показала кривую роста, совпадающую с кривой роста голых бактерий (рис.3 A ), который показывает, что упаковка MOF поддерживает жизнь клеток и их репродуктивную способность. Это открытие было подтверждено наблюдением, что монослой MOF позволяет транспортировать небольшие молекулы, необходимые для роста клеток ( SI Приложение , Рис. S8). Процесс размножения Escherichia. coli , обернутую монослоем MOF в микрофлюидной ячейке, записывали в режиме покадровой видеозаписи путем маркировки MOF зеленой флуоресценцией (фиг. 3 B и фильмы S1 и S2).Было отслежено движение корпуса MOF, и было обнаружено, что оно перемещается в соответствии с удлинением и разделением поверхности клетки и переносится бактериями следующих поколений. Когда в культуральной среде присутствуют избыточные монослои MOF, поверхность вновь выросших клеток может быть спонтанно покрыта. Таким образом, процесс обертывания in situ позволяет воспроизводить клетки и гарантирует сохранение цитопротекции в будущих поколениях.
Рис. 3. Монослойный корпус
MOF обеспечивает размножение бактерий и увеличивает их жизнеспособность в условиях окислительного стресса.( A ) Гетеротрофные кривые роста M. thermoacetica и M. thermoacetica –MOF в анаэробных условиях. ( B ) Снимки процесса деления E. coli –MOF, снятые в темном поле ( слева, ) и поле флуоресценции ( справа, ). (Масштаб: 1 мкм.) ( C ) Кривые распада клеточной популяции M. thermoacetica и M. thermoacetica –MOF на воздухе и голого M. thermoacetica в анаэробных условиях.Жизнеспособность M. thermoacetica и M. thermoacetica –MOF в средах, содержащих H 2 O 2 при концентрациях 1 мкМ ( D ), 5 мкМ ( E ) и 50 мкМ ( F ). Планки погрешностей представляют стандартное отклонение.
Классифицированные как строгие анаэробы, несколько ацетогенных бактерий, используемых в искусственном фотосинтезе, в том числе M. thermoacetica (6), как сообщается, переносят только низкие уровни O 2 (8, 21, 22). Чтобы исследовать цитопротективный эффект оболочки MOF на анаэробы при окислительном стрессе, M.thermoacetica после достижения стационарной фазы подверглись воздействию O 2 . Было обнаружено, что M. thermoacetica , снабженная оболочкой MOF, культивированная в среде 21% O 2 , проявляет высокую жизнеспособность 76 ± 8% через 2 дня, что сопоставимо с коэффициентом выживаемости 83 ± 7%, культивированным в анаэробной среде. условиях (рис.3 C ). Напротив, популяция голых бактерий без этого искусственного усиления распадалась до 50 ± 7% при воздействии того же уровня O 2 , что соответствовало пятикратному увеличению смертности.Кроме того, защита оболочки MOF от H 2 O 2 , преобладающей АФК, была проанализирована путем введения H 2 O 2 в культуральную среду в концентрациях 1, 5 и 50 мкМ. Было обнаружено, что цитопротекторный MOF приводит к значительному повышению жизнеспособности M. thermoacetica в этих средах H 2 O 2 (фиг. 3 D — F ).
Защита от окислительного стресса монослоем MOF может происходить из его каталитической активности в отношении разложения ROS из-за структурного сходства между кластерами циркония и активными центрами диоксида циркония (23).Механистические исследования этого процесса проводили путем измерения концентрации H 2 O 2 в среде MOF, определенной по трииодидному методу Гормли (24, 25), в различные промежутки времени. Наблюдалось начальное быстрое уменьшение концентрации H 2 O 2 , что приписывается физической адсорбции H 2 O 2 на поверхности MOF (рис. 4 A ). Когда физическая адсорбция достигает своего равновесия, каталитическое разложение H 2 O 2 становится доминирующим, что показывает зависимость скорости первого порядка от H 2 O 2 , аналогичную тому, что наблюдается для диоксида циркония (26 ).Каталитическая активность монослоя MOF дополнительно количественно определяется константой скорости второго порядка как k 2 = 3,26 ± 0,04 × 10 −9 · м · с −1 (рис. 4 B ) , число, которое в 28 раз выше, чем у наночастиц диоксида циркония, если нормировано на количество атомов циркония на поверхности, и в 600 раз больше, если нормировано по массе ( Материалы и методы, ). Чтобы дополнительно продемонстрировать преимущество обертывания бактерий монослоем MOF, мы сравниваем эффекты цитопротекции против окислительного стресса монослоем MOF и наночастицами диоксида циркония.При добавлении такого же количества наночастиц диоксида циркония (масса на основе Zr) в культуральную среду жизнеспособность M. thermoacetica оставалась такой же, и не наблюдалось эффекта цитопротекции ( SI Приложение , рис. S10). Такое сравнение дополнительно подчеркивает эффективные каталитические характеристики монослоя MOF и указывает на преимущество близости к активным каталитическим центрам в системе обертывания.
Рис. 4.
Механизм защиты от окислительного стресса с помощью корпуса MOF.Нормализованная концентрация H 2 O 2 как функция времени в реакции разложения при различных температурах ([MOF] = 45,08 мкг · мл -1 ) ( A ) и при различных концентрациях MOF (335 К) ( В ). Были определены энергия активации Аррениуса E a , частотный фактор A и константа скорости второго порядка k 2 (Материалы и методы и SI Приложение , рис.S9). Планки погрешностей представляют стандартное отклонение.
Каталитические свойства монослоя MOF имеют жизненно важное значение для повышенной устойчивости анаэробов к окислительному стрессу. Когда анаэробы, такие как M. thermoacetica , подвергаются воздействию O 2 , H 2 O 2 может генерироваться NADH-оксидазой (8) на клеточной мембране и диффундировать в клетку. Как только количество H 2 O 2 превышает буферную способность глутатиона, он представляет угрозу для выживания клеток из-за его превращения в токсичный гидроксильный радикал в результате реакции Фентона.В нашей системе мы демонстрируем, что за преобразованием O 2 -H 2 O 2 следует разложение H 2 O 2 на единицах оксида циркония MOF. Эта последовательность реакций, опосредованная MOF, предотвращает накопление ROS и, следовательно, значительно увеличивает время жизни в окислительной среде. Повышенная устойчивость M. thermoacetica к окислительному стрессу обещает облегчить всю реакцию фотосинтеза ацетата из CO 2 в сочетании с реакцией выделения кислорода.Чтобы продемонстрировать доказательство концепции, в нашу предыдущую фотосинтетическую биогибридную систему (PBS) (6) было введено 2% O 2 , чтобы имитировать атмосферу всей фотосинтетической реакции. Было обнаружено, что чистый PBS без цитопротекторной упаковки MOF может быть функциональным только для фиксации CO 2 в ацетат в течение первого дня ( SI, приложение , рис. S11). Короткое время жизни PBS связано с цитотоксичностью O 2 и АФК, образующихся при фотосинтезе. Напротив, упаковка MOF поддерживает фотосинтез PBS в течение 2.5 дней при тех же условиях, и увеличивает производительность ацетата до 200%.
Материалы и методы
Все исходные материалы и растворители, если не указано иное, были получены от Aldrich Chemical Co. и использовались без дополнительной очистки.
Синтез MOF монослоя Zr
6 O 4 (OH) 4 (BTB) 2 (OH) 6 (H 2 O) 6.
Синтетический протокол был модифицирован на основании опубликованной литературы (16).Полученную дисперсию MOF неоднократно промывали центрифугированием с использованием N, N -диметилформамида (ДМФ), а затем воды. Промытый монослой MOF в виде белого геля, находящегося на дне центрифужных пробирок, повторно диспергировали в 0,1 М HCl и нагревали при 90 ° C в течение ночи для удаления формиатных лигандов. Полученную суспензию фильтровали через мембранные фильтры из полиэфирсульфона (размер пор 0,2 мкм, STERLITECH) и промывали водой. Осадок на фильтре перед сушкой повторно диспергировали в воде и хранили для дальнейшего использования.Концентрацию полученной монослойной дисперсии MOF в воде определяли путем измерения УФ-видимой спектроскопии. Коэффициент поглощения при 280 нм составил 0,10 мг -1 · л · см -1 путем количественного определения количества циркония с использованием ICP-AES. Затем это значение было использовано для дальнейшего использования при количественной оценке этого материала.
Приготовление гетеротрофной среды.
Среду готовили в анаэробных условиях с деионизированной водой. Техника Hungate или анаэробная камера (Coy Laboratory Products, Inc.) использовался во всех операциях для предотвращения воздействия кислорода на анаэробные бактерии. Рецепт общего бульона такой же, как и раньше (6). Чтобы приготовить гетеротрофную среду, необходимо использовать 25 мл 1 М раствора глюкозы, 20 мл 5 мас.% Раствора Cys · HCl, 800 мг β-глицерофосфата · 2Na · xH 2 O, 500 мг дрожжевого экстракта (BD Biosciences), и 500 мг триптона (BD Biosciences) добавляли в 1 л общего бульона и перемешивали до полного растворения. Затем анаэробные среды распределяли в смешанной атмосфере (смесь N 2 : CO 2 в соотношении 80:20) в анаэробные культуральные пробирки типа Balch размером 16 × 125 мм (Chemglass Life Sciences) с бутилкаучуковыми пробками и завинчивающимися крышками. и 18 × 150-мм анаэробные культуральные пробирки типа Балча (Chemglass Life Sciences) с пробками из бутилкаучука и алюминиевыми обжимными уплотнениями.Затем среду перед использованием автоклавировали в течение 15 минут при 121 ° C.
Культивирование
M. thermoacetica .
Первоначальный посевной материал M. thermoacetica (Американская коллекция типовых культур, ATCC 39073) культивировали в гетеротрофной среде, а поздние логарифмические культуры криоконсервировали в морозильной камере -80 ° C с 10% диметилсульфоксидом в качестве криопротектора. Для приготовления культур M. thermoacetica 0,5 мл размороженного криоконсервированного исходного материала M. thermoacetica инокулировали в 10 мл анаэробной гетеротрофной среды и инкубировали при периодическом перемешивании при 52 ° C.В свободном пространстве каждой трубки повышалось давление до 150 кПа потоком смешанной атмосферы (смесь N 2 : CO 2 в соотношении 80:20). Через 2 дня роста (OD 600 = 0,16) культуру повторно инокулировали при 5 об.% В свежую гетеротрофную среду и инкубировали при 52 ° C. После других 2 дней роста (OD 600 = 0,38) бактерии центрифугировали при 860 × g в течение 10 минут, промывали и ресуспендировали в эквивалентном объеме гетеротрофной среды.
Однослойная упаковка MOF около
M.Ашхабад .
В культуру бактерий в гетеротрофной среде добавляли монослойную дисперсию MOF с конечной концентрацией 0,05 мг / мл. Пробирки возвращали в инкубатор при 52 ° C и помещали в мини-шейкер (VMR) со скоростью 100 об / мин на 1 час. час Полученная система обертывания непосредственно использовалась для тестирования жизнеспособности и фотосинтеза. Для структурной характеристики избыток MOF в среде удаляли центрифугированием при 140 × g в течение 30 мин. Супернатант собирали и центрифугирование повторяли три раза.Соли в полученном супернатанте удаляли дальнейшим центрифугированием при 2500 об / мин в течение 20 мин. Осадок собирали и центрифугирование повторяли трижды. Наконец, осадок повторно диспергировали в воде для определения структуры.
Флуоресцентная маркировка монослоя MOF.
Молекулы, содержащие карбоксилатные группы, могут связываться с монослоем MOF через координационную связь между карбоксилатными фрагментами и циркониевыми кластерами. С этой целью была синтезирована 2-FITC-бифенил-4,4′-дикарбоновая кислота (FITC-H 2 BPDC) согласно опубликованным данным (27).Для функционализации монослоя MOF с помощью FITC-H 2 BPDC, 20 мг FITC-H 2 BPDC добавляли в раствор MOF (5 мг) в DMF (5 мл). Смесь инкубировали при 85 ° C в течение 24 ч перед повторной промывкой путем центрифугирования в ДМФ и воде. Конечный монослой MOF, функционализированный FITC-BPDC, повторно диспергировали в воде для дальнейшего использования.
Синтез модельного соединения ZrDMPO.
Смесь ZrCl 4 (10 мг) и диметилфосфата (30 мг) в ДМФ (2 мл) инкубировали при 85 ° C в течение 2 дней, и были получены ромбоэдрические монокристаллы.Кристаллы промывали ДМФ и ацетоном перед сушкой в вакууме.
Структурные характеристики.
Образцы
ТЕМ были приготовлены путем капания суспензий на медные сетки с размером ячеек 400 меш с кружевной углеродной подложкой. Сетки сушили на воздухе в течение 1 сут. Получение изображений с помощью просвечивающего электронного микроскопа выполняли на анализирующем электронно-эмиссионном электронном микроскопе JEOL 2100-F на 200 кВ, оборудованном системой обнаружения рентгеновских лучей Oxford INCA EDS (Oxford Instruments) в Молекулярном литейном цехе Национальной лаборатории Лоуренса Беркли (Беркли, Калифорния).Электронно-микроскопические изображения с высокоугловым кольцевым сканированием в темном поле и элементарное рентгеновское картирование получали с помощью зонда с длиной волны 1 нм при 200 кВ. Образцы были наклонены на 10 ° к детектору рентгеновского излучения для оптимизации геометрии детектирования рентгеновского излучения. Время сбора было индивидуально оптимизировано для достижения наилучших результатов. Образцы SEM были приготовлены путем капания суспензии на кремниевую пластину и высушивания на воздухе в течение 1 дня. СЭМ-изображения регистрировали на аналитическом СЭМ Zeiss Gemini Ultra-55 с ускоряющим напряжением 5 кВ.
Визуализация с трехмерной структурированной подсветкой со сверхвысоким разрешением выполнялась на приборе Zeiss ELYRA PS.1 система (Carl Zeiss). Изображения получали с помощью масляного иммерсионного объектива Plan-Apochromat 100 × / 1.40 и камеры Andor iXon 885 EMCCD. Использовали полупроводниковый лазер с оптической накачкой и 486 нм мощностью 10 мВт (Coherent Inc.) и эмиссионный фильтр BP 510/620 нм (Optics Balzers AG). Было получено 30 изображений с 86 нм сечением z для создания изображений сверхвысокого разрешения. Необработанные изображения были реконструированы и обработаны для демонстрации структуры с большим разрешением с помощью программного обеспечения ZEN 2011 (Carl Zeiss), а программное обеспечение Imaris использовалось для анализа реконструированных изображений.
ICP-AES (Optima 7000 DV; Perkin-Elmer) использовали для определения количества Zr в материале. Образцы переваривали в смеси растворов азотной кислоты (0,5 мл) и плавиковой кислоты (0,1 мл). Полученный раствор фильтровали, затем разбавляли 2% водным раствором азота до 10 мл перед измерением. Все образцы для PXRD были высушены под вакуумом перед измерением. Диаграммы PXRD были записаны с использованием прибора Rigaku Miniflex 600 (геометрия Брэгга-Брентано, Cu Kα-излучение λ = 1,54056 Å).Спектры FTIR собирали на спектрометре Bruker ALPHA FTIR, оборудованном платиновым алмазным модулем ATR с единичным отражением с ослабленным полным отражением (НПВО) компании ALPHA, который может собирать ИК-спектры на чистых образцах. XPS был получен с использованием сверхвысоковакуумной системы PHI 5400 XPS с немонохроматическим источником рентгеновского излучения из алюминия (Kα = 1486,7 эВ), работающим при мощности 350 Вт. Обзорные XPS-спектры были получены при энергии прохода анализатора 178,5 эВ и шаге 1 эВ. Спектры высокого разрешения области P 2p были получены при энергии прохождения анализатора 35 эВ и 0.Шаг по энергии 05 эВ. Шкала энергии связи была скорректирована, установив пик C 1s (sp2) в 284 эВ ( SI Приложение , рис. S7). Подгонка пиков выполнялась с использованием программного обеспечения Casa XPS.
Для исследования SXRD бесцветный ромбоэдрический кристалл (0,200 мм) был установлен на дифрактометре Bruker D8 Venture, оснащенном тонкофокусной рентгеновской трубкой с мишенью из Мо, работающей при мощности 40 Вт (40 кВ, 1 мА) и PHOTON. 100 CMOS детектор. Образец охлаждали до 100 К с помощью криосистемы Oxford, охлаждаемой жидким азотом.Для сбора данных использовался программный пакет Bruker APEX2; Для обработки данных использовался программный пакет SAINT; Для коррекции поглощения использовалась программа SADABS; поправки на вымирание или распад не делались. Структура расшифрована прямыми методами в ромбоэдрической пространственной группе R-3 с помощью пакета программ SHELXTL и дополнительно уточнена методом наименьших квадратов. Все неводородные атомы уточнены анизотропно; весь водород был образован геометрически. Подробности кристаллографических данных приведены в SI Приложение , таблицы S1 и S2.
Жизнеспособность клеток при окислительном стрессе.
Объемное количество клеток определяли путем ручного подсчета с помощью счетной камеры Петрова-Хаузера. Параллельно с этим были выполнены анализы КОЕ путем отбора проб и инокуляции 0,1 мл суспензии M. thermoacetica и M. thermoacetica –MOF в 5 мл расплавленного (T> 50 ° C) агарового бульона с добавлением 40 мМ глюкозы и 0,1 мл. мас.% цистеина. В пробирках для анализа создавали давление 150 кПа со смесью 80:20 N 2 : CO 2 и инкубировали вертикально при 52 ° C.Через 3 дня роста подсчитывали видимые белые круглые колонии для определения КОЕ ( -1 мл) как меры количества и жизнеспособности клеток.
Жизнеспособность M. thermoacetica и M. thermoacetica –MOF при различных концентрациях O 2 и H 2 O 2 была проверена после перехода гетеротрофного роста в стационарную фазу. Стерильный O 2 вводили шприцем в среду для культивирования бактерий до достижения объемной концентрации 21% в свободном пространстве.H 2 O 2 вводили в культуральную среду путем инъекции шприцем до тех пор, пока концентрации не достигли 1, 5 и 50 мкМ. Для контрольного эксперимента в культуральную среду добавляли дисперсию наночастиц диоксида циркония (размер частиц <100 нм; Aldrich) в такой концентрации, чтобы количество Zr было сравнимым с количеством MOF.
E. coli –MOF получали так же, как M. thermoacetica –MOF. Инвертированный флуоресцентный микроскоп Zeiss Z1 AxioObserver использовался для измерения культур живых клеток в течение продолжительных периодов времени.Он оснащен функцией захвата цифровых изображений при слабом освещении как в цветных, так и в оттенках серого. Система полностью автоматизирована и может быть запрограммирована на длительные эксперименты на живых клетках. 100 мкл E. coli –MOF добавляли в планшет CellASIC ONIX B04X, который контролируется системой CellASIC Onix Microfluidics для перекачивания небольших бактерий в основную культуральную камеру в определенные моменты времени. Общие фильмы в светлом поле и возбужденном поле флуоресценции собирали с помощью камеры Hamamatsu 9100–13 EMCCD каждые 4 мин при определенном фокусе Zeiss.
Кинетическое исследование H
2 O 2 Разложение, катализируемое монослоем MOF.
Кинетику реакции разложения H 2 O 2 измеряли, загружая 100-мл колбу с различным количеством монослоя MOF и воды Milli-Q до конечного объема 78,4 мл. резиновую перегородку и нагревали на водяной бане с заданной температурой при перемешивании со скоростью 750 об / мин. После того, как дисперсия MOF достигнет заданной температуры, 1.6 мл H 2 O 2 (1 мМ) мгновенно вводили в раствор и начинали отсчет времени. Через разные интервалы времени шприцем отбирали 2 мл реакционной смеси и фильтровали через политетрафторэтиленовую мембрану (размер пор 200 нм; Whatman). Концентрацию H 2 O 2 в полученном растворе определяли методом трииодида Гормли (24, 25), в котором I — количественно окисляется H 2 O 2 до I 3 — .В частности, в раствор образца добавляли 100 мкл 1 M KI, 100 мкл смешанного раствора, содержащего 1 M ацетат натрия и 1 M уксусную кислоту, и доводили до конечного объема 2 мл. Раствор оставляли реагировать в течение 5 минут. перед измерением оптической плотности при 350 нм. Раствор, содержащий KI, ацетат натрия и уксусную кислоту той же концентрации, готовили параллельно в качестве холостого контроля для измерения фона. Молярный коэффициент экстинкции I 3 — на длине волны 350 нм был принят равным 25 500 M -1 · см -1 для расчета концентрации H 2 O 2 .
В литературе (23) сообщается, что каталитическое разложение H 2 O 2 на диоксиде циркония следует кинетике первого порядка по отношению к H 2 O 2 . Когда присутствует избыток диоксида циркония, кинетика реакции может быть приближена к псевдопервому порядку. Таким образом, концентрация H 2 O 2 как функция времени реакции следует ln ([h3O2] [h3O2] 0) = — k1t,
, где k 1 — псевдопервый порядок константа скорости, t — время реакции, [H 2 O 2 ] — концентрация H 2 O 2 во время реакции t , и [H 2 O 2 ] 0 — концентрация при t = 0.Было обнаружено, что после того, как адсорбция H 2 O 2 на поверхности MOF достигает равновесия, его концентрация как функция времени хорошо согласуется с этим кинетическим поведением первого порядка (рис. 4 A ). . Расчет наклонов такой линейной зависимости дает k 1 при различных температурах ( SI Приложение , рис. S9 A ), что следует уравнению Аррениуса ln (k1) = — EaR 1T + ln (A),
где E a — энергия активации Аррениуса, R — газовая постоянная, A — частотный коэффициент, а T — абсолютная температура.Из этой зависимости константы скорости от температуры извлекаются E a как 66,50 ± 0,07 кДж моль −1 и A как 2,8 ± 0,1 × 10 6 с −1 . Изменяя количество MOF, используемого в качестве катализатора, константа скорости второго порядка k 2 была получена путем изучения константы скорости псевдопервого порядка как функции отношения площади поверхности к объему раствора MOF согласно k1 = k2 (SAV),
, где S A — площадь поверхности MOF, а V — объем реакционной смеси.Используя удельную поверхность MOF, S MOF , это уравнение может быть выражено ask1 = k2 (SMOF [MOF] V),
, где [MOF] обозначает концентрацию MOF. Взяв S MOF = 883 м 2 g −1 (16), k 2 получено из наклона SI Приложение , Рис. S9 B для реакции на 335 K равно k 2 = 3,26 ± 0,04 × 10 −9 · м · с −1 .Это значение представляет собой внутреннюю каталитическую активность MOF в реакции разложения H 2 O 2. Для сравнения каталитической активности между MOF и диоксидом циркония мы берем k 2 диоксида циркония при той же температуре, что и 9,66 × 10 −10 мс −1 из литературы (23). Далее мы вычисляем атомную плотность циркония монослоя MOF как 0,91 нм -2 и грани (001) монолитного диоксида циркония как 7,5 нм -2 в соответствии с их кристаллической структурой.Используя эти значения, k 2 монослоя MOF, нормированного на числа атомов циркония, получают как 3,6 × 10 −27 · м 3 · с −1 , что в 28 раз выше, чем у оксида циркония ( 1,3 × 10 −28 · м 3 · с −1 ). При нормировании по массе, по сравнению с наночастицей диоксида циркония с площадью поверхности 5 м 2 г -1 (23), k 2 монослоя MOF в 600 раз больше.
Фотосинтез.
M. thermoacetica -CdS получали, как описано ранее (6). Обычно 1 мМ Cd (NO 3 ) 2 добавляли к M. thermoacetica , когда OD 600 достигала 0,42. Через 3 дня роста непрозрачная желтая суспензия выявила образование M. thermoacetica -CdS. ЗФР, защищенный цитопротезом MOF, получали таким же способом, как показано выше. Перед фотосинтезом в каждую пробирку добавляли 0,2 мас.% Цистеина. Стерилизованный O 2 вводили в каждую пробирку до 2% (об. / Об.), Чтобы имитировать состояние окислительного стресса во всей реакции.Каждую пробирку перемешивали со скоростью 150 об / мин и нагревали до измеренной температуры 55 ° C с помощью перемешивающей горячей плиты. Источником освещения, используемым для измерений моделированного солнечного света, была коллимированная ксеноновая лампа мощностью 75 Вт (Newport, Corp.) с фильтром AM 1,5 G. Все интенсивности света калибровались кремниевым фотодиодом (Hamamatsu S1787-04). Концентрации продуктов фотосинтеза измеряли с помощью 1 H-qNMR с 3- (триметилсилил) -2,2 ‘, 3,3’-тетрадейтеропропионатом натрия (TMSP-d 4 ; Cambridge Isotope Laboratories, Inc.) в качестве внутреннего стандарта в D 2 О. Спектры обрабатывали с использованием программного обеспечения MestReNova.
Статистический анализ.
Все данные выражены как среднее ± стандартное отклонение. Каждый эксперимент повторяли не менее трех раз.
Благодарности
Мы благодарим J. Baek и B. Rungtaweevoranit (OMY group) за получение данных XPS и изображений SEM, C. Zhao (OMY group) за помощь в механистических исследованиях разложения H 2 O 2 по MOF, CSДирксу (группа O.M.Y.) за обсуждения и К. Чену (группа P.Y.) за культивирование и подсчет клеток. SEM, XPS и STEM измерения были выполнены в Molecular Foundry Национальной лаборатории Лоуренса Беркли. Это исследование было поддержано BASF SE (Людвигсхафен, Германия) для синтеза и описания MOF, King Abdulaziz City for Science and Technology (Центр передового опыта в области наноматериалов и приложений чистой энергии) для механистических исследований и NASA, Центр использования биологической инженерии в космосе, получившей награду NNX17AJ31G за исследования бактерий.H.Z. признает стипендию промышленного парка Сучжоу.
Сноски
Вклад авторов: Z.J., H.Z., O.M.Y. и P.Y. спланированное исследование; З.Дж., Х.З. и Х.Л. проводили исследования; Z.J., H.Z. и H.L. предоставили новые реагенты / аналитические инструменты; Z.

