причины, симптомы и лечение болезни
Болезнь Кейра, или эритроплазия Кейра, — это заболевание, относящееся к группе карцином и определяющееся специалистами как внутриэпидермальный рак. Чаще локализуется на слизистых и полуслизистых оболочках: гениталиях и в анальной области. Реже патологические изменения затрагивают слизистую полости рта. Характерной чертой данного заболевания является способность опухоли к метастазированию.
Прогноз болезни Кейра
Прогноз болезни Кейра зависит от стадии клинического течения заболевания. Если болезнь выявлена своевременно, на ранних стадиях, то прогноз считается условно благоприятным. Период исцеления длится не более шести месяцев, однако реабилитация может продлиться до десяти месяцев.
Прогноз становится неблагоприятным при злокачественном перерождении болезни Кейра в плоскоклеточный рак.
Необходимо помнить о профилактических мерах, заключающихся в наиболее раннем выявлении заболевания и проведении активной терапии.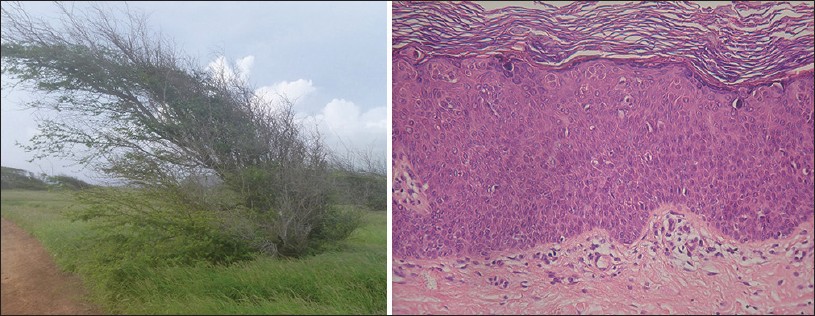
Причины возникновения болезни Кейра
Многие специалисты склонны считать, что болезнь Кейра часто возникает по причине несоблюдения пациентом элементарных правил личной гигиены. Ежедневный туалет головки полового члена и женских половых органов позволяет избежать возникновения факторов, предрасполагающих к возникновению данного заболевания. Некоторые ученые считают эритроплазию Кейра вариантом болезни Боуэна, так как для данного патологического состояния также характерно поражение эпидермиса без распространения патологических изменений на дерму. Более того, эритроплазия Кейра имеет способность к злокачественному перерождению в плоскоклеточный рак кожи.
В 70% клинических случаев болезнь Кейра развивается на фоне некоторых типов онкогенного вируса папилломы человека (ВПЧ). Кроме того, известна роль канцерогенных факторов в возникновении данного патологического состояния. Реже болеют мужчины, которым было произведено хирургическое вмешательство по поводу обрезания крайней плоти.
Симптомы болезни Кейра
Заболевание имеет длительное течение. Как уже было отмечено, мужчины страдают от этой болезни чаще, чем женщины. На головке полового члена или на крайней плоти возникает новообразование, имеющее насыщенный красный цвет, вплоть до темно- бордового. Оно имеет чётко очерченные границы, а поверхность новообразования может быть как бархатистой, так и гладкой, и блестящей. На головке полового члена часто появляются гнойное отделяемое или характерный белый налет, легко снимающийся.
В 30% случаев болезнь Кейра переходит в плоскоклеточный рак. В такой ситуации могут возникать очаги изъязвления, характерный мясистый узел. Возможно появление уплотнений или бородавчатых разрастаний. Если процесс имеет злокачественное течение, он часто характеризуется метастазированием.
Обнаружили симптомы данного заболевания?
Звоните
Наши специалисты проконсультируют Вас!
Диагностика эритроплазии Кейра
Диагностика данного заболевания заключается в следующих мероприятиях:
- первичном осмотре врача-дерматолога;
- сборе анамнеза;
- исследовании клинической картины;
- биопсии пораженного участка с последующим его гистологическим исследованием;
- применении методик дифференциальной диагностики.
При локализации очага поражения на головке полового члена проводятся пробы с окрашиванием раствором толуидинового синего. При болезни Кейра очаг поражения приобретает синюю окраску, а при наличии обычного воспаления с гиперемией этого не происходит.
Следует провести дифференциальную диагностику с такими заболеваниями, как: баланит, сифилис, фиксированная эритема, баланопостит, красный плоский лишай, ограниченный псориаз, крауроз и другими.
Лечение болезни Кейра
Консервативному лечению болезнь Кейра не поддается. Применяется один из радикальных методов, направленных на разрушение или иссечение пораженной ткани, а именно:
- хирургическое вмешательство;
- криодеструкция, или прижигание жидким азотом;
- электрокоагуляция и другие.
В случае если опухоль имеет тенденцию к инвазивному росту, применяют химиотерапию. В тех клинических случаях, когда болезнь Кейра перерождается в злокачественное образование и переходит в плоскоклеточный рак, проводят радикальное удаление опухоли и регионарных лимфатических узлов. После такой операции пациенту показана местная рентгенотерапия.
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом
или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу.
Рентгенотерапия в лечении распространённой формы эритроплазии Кейра | Джабаров
Введение
Эритроплазия Кейра (ЭК) (син.: папиллярная эпителиома Дарье, эпителиома бархатистая) плоскоклеточный рак in situ — достаточно редкое онкологическое заболевание, сопровождающиеся появлением поверхностной внутриэпителиальной опухоли на головке или внутреннем листке крайней плоти полового члена. Данная патология по своим симптомам и гистологическому строению во многом напоминает болезнь Боуэна (или Бовена), хотя имеет ряд характерных клинических признаков, что и даёт возможность рассматривать это заболевание как самостоятельное. Впервые заболевание было описано L. Queyrat в 1911 году как «erytthroplasie du gland»» [1][2]. По материалам Всемирной организации здравоохранения (1980), рекомендуется считать ЭК и болезнь Боуэна отдельными нозологическими единицами, так как при ЭК вероятность инфильтративного роста значительно выше: риск злокачественной трансформации чётко не определен, но, как сообщается, составляет до 30% в случае отсутствия специализированной терапии [3][4].
К факторам риска развития ЭК относятся необрезанная крайняя плоть, токсическое влияние смегмы на кожу головки полового члена и внутреннего листка крайней плоти при недостаточной гигиене, фимозе, хроническое механическое повреждение и травматизация кожи полового члена, рецидивирующий генитальный вирус простого герпеса, инфицирование вирусом папилломы человека 16-го и 18-го типов, хронические воспалительные процессы, частая смена сексуальных партнёров, иммуносупрессивные состояния (ВИЧ-инфекция), курение [5].
Инфицирование вирусом папилломы человека (ВПЧ) является одним из наиболее важных и широко изученных факторов риска развития рака полового члена, при этом ДНК ВПЧ обнаруживается примерно в 50% всех ЭК и плоскоклеточных карцином полового члена [6].
Предраковые поражения полового члена можно в общих чертах разделить на те, которые связаны с инфекцией ВПЧ, и те, которые не связаны с ВПЧ, но вызваны хроническим воспалением. Поражения, ассоциированные с ВПЧ, включают болезнь Боуэна, ЭК и бовеноидный папулёз, которые связаны с типами ВПЧ 16 и 18 «высокого риска». ВПЧ типов 6 и 11 низкого риска связаны с другими предраковыми поражениями, такими как гигантские остроконечные кондиломы или опухоли Бушке-Левенштейна. ЭК представляет собой ярко-красную бляшку с чёткими конурами, гладкую на ощупь, без уплотнения подлежащих тканей, бархатистую на вид, без глянцевого блеска. В редких случаях на поверхности бляшки могут иметься эрозированные участки. Поражения наиболее часто локализуются на слизистых поверхностях гениталий, таких как внутренняя крайняя плоть и головка полового члена, в большинстве случаев встречается у мужчин с фимозной крайней плотью.
Предраковые поражения составляют примерно 10% всех злокачественных новообразований полового члена при первичной диагностике, причём подавляющее большинство из них возникает на головке полового члена [7][8]. Неинвазивный характер предраковых поражений предопределяет лечение с сохранением полового члена. В зависимости от размера, локализации и типа поражения можно использовать ряд различных подходов.
Описание клинического случая
Пациент М. 1952 года рождения. Впервые диагноз плоскоклеточный рак in situ (эритроплазия Кейра) установлен в 2014 году. В течение двух лет до установления диагноза проходил лечение у дерматолога по месту жительства. Однако эффекта получено не было. Направлен на консультацию к онкологу. Взята биопсия — плоскоклеточный рак in situ. Проведена криотерапия жидким азотом. В течение года пациент не наблюдался. При явке отмечен рецидив на головке полового члена. В проекции изменённых после криотерапии тканей имеется ярко алое образование с чёткими ровными краями и бархатистой поверхностью (рис. 1). Общесоматическая патология не выявлена.
Рисунок 1. Внешний вид головки полового члена на момент консультации
Figure 1. The initial appearance of the glans penis
Рисунок 2. Внешний вид головки полового члена после окончания лечения
Figure 2. The appearance of the glans penis after the treatment course
Рисунок 3. Внешний вид головки полового члена спустя полгода после завершения лечения
Figure 3. The appearance of the glans penis six months after the treatment course
Учитывая рецидивирующее течение, после консультации радиотерапевта рекомендован курс рентгенотерапии. Учитывая собственный опыт о высоком лечебном эффекте и отсутствии постлучевых рубцовых изменений кожи после мультифракционного курса рентгенотерапии, проведён курс мультифракционной лучевой терапии — РОД 2,0 + 2,0 Гр до СОД = 60,0 Гр. Тубус — 3,5 см 1,8 Al. На момент окончания лечения отмечена выраженная гиперемия и радиоэпителиит второй степени выраженности. На фоне симптоматической терапии в течение 6 недель проявления острой лучевой реакции купированы.
Пациент наблюдался в течение 4-х лет после завершения курса лучевой терапии. Признаков рецидива не отмечено.
Обсуждение
Существуют различные варианты лечения плоскоклеточного рак in situ полового члена. Выбор метода лечения должен быть адаптирован к типу и месту поражения, принимая во внимание предпочтения пациента и вероятное соблюдение режимов лечения, а также необходимость тщательного наблюдения с использованием минимально инвазивных методов. Наиболее широко используются следующие методики: местная химиотерапия / иммунотерапия (5-фторурацил / имиквимод), лазеротерапия, криотерапия, фотодинамическая терапия, хирургическое удаление: шлифовка головки полового члена (частичная / полная), обрезание, микрографическая хирургия Мооса, близкофокусная рентгенотерапия.
Местная химиотерапия 5% 5-фторурацилом (5-ФУ) является одним из наиболее часто используемых методов лечением. Наиболее эффективен он у иммунокомпетентных пациентов с чётко выраженными одиночными поражениями небольшого размера, но имеет низкую эффективность у пациентов с ослабленным иммунитетом или пациентов с широко распространённым поражением. Протоколы применения 5-ФУ различаются. Обычно его используют местно на срок от 4 до 6 недель через день. Во всех исследованиях отмечают, что обработанный участок часто покрывается коркой и воспаляется в период лечения. Дополнительное применение стероидов снижает остроту местных реакций, но увеличивает длительность клинических проявлений. Для заживления реактивных изменений может потребоваться от 4 до 8 недель.
Лазеротерапия может использоваться для лечения более обширных очагов поражения. Лазер проникает в ткань на 3 — 5 мм, и вызывает коагуляцию ткани, препятствуя гистологической диагностике, и создаёт риск занижения стадии заболевания. Для заживления участков, подвергшихся абляции может потребоваться до 2 — 3 месяцев. Лечение лазером обычно хорошо переносится, но имеются и осложнения, включающие выраженный болевой синдром и кровоточивость в местах лечения [9]. Пациенты, подвергнутые лазеротерапии, имеет более высокую частоту развития рецидивов и риск прогрессирования по сравнению с другими методами лечения. В исследовании B.P. van Bezooijen et al. из 19 пациентов, получавших лазерную терапию, у 5 (26,3%) был верифицирован рецидив ЭК, им потребовалось повторное вмешательство. Средний период наблюдения составил 32 месяца, а у одного пациента (5,2%) при явке был диагностирован инвазивный плоскоклеточный рак головки полового члена [10]. В другом исследовании рецидив заболевания после лазеротерапии диагностирован в 23% случаев. [11].
При криотерапии используют жидкий азот для создания циклов быстрого замораживания и медленного опаивания для достижения температуры от -20 °с до -50 °C, чтобы вызвать повреждение тканей за счёт образования кристаллов льда, что приводит к разрушению клеточных мембран и гибели клеток. Обобщённые данные о применении криотерапии у пациентов с плоскоклеточным раком in situ, говорят о достаточном высоком проценте развития рецидивов заболевания (до 20%) [12].
Фотодинамическая терапия (ФДТ) предраковых поражений полового члена всё ещё находится в стадии изучения. Этот метод включает покрытие поражённой области фотосенсибилизирующим кремом для местного применения, содержащим химические вещества, такие как дельта-5-аминолевулиновая кислота, в течение примерно 3 часов, которые предпочтительно поглощаются и задерживаются злокачественными клетками. Затем зона поражение подвергается воздействию некогерентного света от лампы PDT, что приводит к фотоселективной гибели сенсибилизированных клеток. В исследовании j. Paoli et al. с участием 10 пациентов только 40% имели полный ответ при среднем периоде наблюдения в течение 35 месяцев, при этом было проведено в среднем четыре сеанса лечения [13]. Учитывая высокую эффективность данного метода при лечении аналогичных опухолей экстрагенитальной локализации, сохраняется перспектива более широкого применения фотодинамической терапии при ЭК.
Все предраковые поражения можно лечить хирургическим путём. Первичное хирургическое иссечение рекомендуется пациентам с обширным изменением головки полового члена, а также тем, кто не соблюдает строгие протоколы лечения и наблюдения. Хирургическое лечение является практически безальтернативным при рецидиве заболевания после других консервативных методов лечения, когда повторное местное лечение приводит к появлению грубых рубцов и обнажённой головки, что может затруднить клинический мониторинг.
Процедура тотальной шлифовки головки полового члена (TGR) обеспечивает наиболее эффективный хирургический подход к лечению: иссечение поражённого участка с адекватным краем с последующей пересадкой кожи. Методика была впервые описана A. Bracka для лечения тяжёлой формы лейкоплакии, но был адаптирована и для стадий Tis / T1 [14]. Частичная шлифовка головки полового члена (PGR) также используется в качестве основного хирургического подхода для лечения ЭК на головке. Этот метод основан на тех же принципах, что и TGR, но используется в случаях одиночных локализованных очагов, поражающих менее 50% головки.
Альтернативным подходом является иссечение с использованием микрографической хирургии Мооса, что включает удаление всего очага поражения тонкими срезами с одновременным гистологическим исследованием, чтобы под микроскопом убедиться в интактности краёв резекции. Хотя методика позволяет максимально сохранить нормальную ткань полового члена, она сложна и требует много времени, требуя обучения ей как хирурга, так и патологоанатома для обеспечения адекватной абластики. В обзоре этой методики сообщается о высокой (32%) частоте рецидивов [15], а распространение и использование её во всем мире весьма ограничено.
Близкофокусная рентгенотерапия (БФРГ) является наиболее широко распространённым методом лучевого лечения ЭК. С течением времени частота её применения несколько снизилась в связи расширением арсенала методик лечения, однако полностью отказываться от данной высокоэффективной методики, в настоящее время несколько преждевременно. По данным исследований, эффективность БФРТ составляет около 100% при длительности наблюдения до 60-ти месяцев. Также необходимо отметить, что БФРТ является чуть ли не единственным эффективным лечением рецидивов ЭК, возникших после использования других методов лечения [16][17]. Из недостатков — развитие склероза и рубцовой деформации головки полового члена.
Заключение
Данное клиническое наблюдение свидетельствует о излечивающем эффекте рентгенотерапии при рецидиве ЭК. Режим мультифракционирования суточной дозы позволяет минимизировать рубцовые изменения и косметические дефекты в проекции поля облучения. Гетерогенный характер популяции больных диктует необходимость определения персонализированного индивидуального подхода при проведении лечения в каждой конкретной клинической ситуации.
1. Schulze K, Schwartz RA, Lambert WC. Erythroplasia of Quey-rat. Am Fam Physician. 1984;29(4):185-6. PMID: 6720494
2. Kaye V, Zhang G, Dehner LP, Fraley EE. Carcinoma in situ of penis. Is distinction between erythroplasia of Queyrat and Bowen’s disease relevant? Urology. 1990;36(6):479-82. DOI: 10.1016/0090-4295(90)80181-l
3. Wieland U, Jurk S, Weissenborn S, Krieg T, Pfister H, Ritzkowsky A. Erythroplasia of queyrat: coinfection with cutaneous carcinogenic human papillomavirus type 8 and genital papillomaviruses in a carcinoma in situ. J Invest Dermatol. 2000;115(3):396-401. DOI: 10.1046/j.1523-1747.2000.00069.x
4. Mikhail GR. Cancers, precancers, and pseudocancers on the male genitalia. A review of clinical appearances, histopatholo-gy, and management. J DermatolSurg Oncol. 1980;6(12):1027-35. DOI: 10.1111/j.1524-4725.1980.tb01026.x
5. Gerber GS. Carcinoma in situ of the penis. J Urol. 1994;151(4):829-33. DOI: 10.1016/s0022-5347(17)35099-1
6. Backes DM, Kurman RJ, Pimenta JM, Smith JS. Systematic review of human papillomavirus prevalence in invasive penile cancer. Cancer Causes Control. 2009;20(4):449-57. DOI: 10.1007/s10552-008-9276-
7. Brown CT, Minhas S, Ralph DJ. Conservative surgery for penile cancer: subtotal glans excision without grafting. BJU Int. 2005;96(6):911-2. DOI: 10.1m/j.1464-410X.2005.05751.x
8. Trecedor J, Lopez Hernandez B. Human papillomavirus and mucocutaneous squamous cell carcinoma. Piel. 1991;6:470-471.
9. Tietjen DN, Malek RS. Laser therapy of squamous cell dysplasia and carcinoma of the penis. Urology. 1998;52(4):559-65. DOI: 10.1016/s0090-4295(98)00308-2
10. van Bezooijen BP, Horenblas S, Meinhardt W, Newling DW. Laser therapy for carcinoma in situ of the penis. J Urol. 2001;166(5):1670-1. DOI: 10.1097/00005392-200111000-00013
11. Windahl T, Andersson SO. Combined laser treatment for penile carcinoma: results after long-term followup. J Urol. 2003;169(6):2118-21. DOI: 10.1097/01. ju.0000067361.81295.a2
12. Hansen JP, Drake AL, Walling HW. Bowen’s Disease: a four-year retrospective review of epidemiology and treatment at a university center. Dermatol Surg. 2008;34(7):878-83. DOI: 10.1111/j.1524-4725.2008.34172.x
13. Paoli J, Ternesten Bratel A, Lowhagen GB, Stenquist B, Forslund O, Wennberg AM. Penile intraepithelial neoplasia: results of photodynamic therapy. Acta Derm Venereol. 2006;86(5):418-21. DOI: 10.2340/00015555-0130
14. Depasquale I, Park AJ, Bracka A. The treatment of balanitis xerotica obliterans. BJU Int. 2000;86(4):459-65. DOI: 10.1046/j.1464-410x.2000.00772.x
15. Shindel AW, Mann MW, Lev RY, Sengelmann R, Petersen J, Hruza GJ, Brandes SB. Mohs micrographic surgery for penile cancer: management and long-term followup. J Urol. 2007;178(5):1980-5. DOI: 10.1016/j.juro.2007.07.039
16. Бровкина А.Ф. Вайнштейн Е.С. Воробьев Ю.И. Клиническая рентгенрадиология. Москва: Издательство «Медицина»; 1985.
17. Агеева Н.А., Джабаров Ф.Р., Толмачев В.Г. Критерии эффективности режимов фракционирования близкофокусной рентгенотерапии базальноклеточного рака кожи лица. В сборнике: Наука сегодня: глобальные вызовы и механизмы развития Материалы международной научно-практической конференции: в 2 ч. Вологда: Научный центр «Диспут»; 2017.
Болезнь Кейра — причины, симптомы, диагностика и лечение
Болезнь Кейра – поверхностный внутриэпителиальный рак слизистых оболочек. В большинстве случаев опухолевое поражение затрагивает головку полового члена и внутренний листок крайней плоти, реже – вульву, шейку матки, перианальную область, полость рта. Представляет собой бляшку ярко-красного цвета с блестящей, слегка бархатистой, влажной поверхностью и четкими границами. С целью диагностики болезни Кейра используется биопсия новообразования, гистологическое и цитологическое исследование. В качестве методов лечения болезни Кейра предложено хирургическое иссечение, электрокоагуляция, криодестуркция, химиотерапия, рентгеновское облучение.
Общие сведения
Болезнь Кейра (эритроплазия Кейра) — это неинвазивный («рак на месте», рак in situ) рак, локализующийся на слизистой оболочке половых органов. Чаще всего в процесс вовлекается головка полового члена и крайняя плоть, но встречаются и поражения вульвы. Подобно болезни Боуэна, при болезни Кейра опухоль располагается внутри эпидермиса и не распространяется в дерму. Между тем, примерно в 30% случаев эритроплазия Кейра перерождается в плоскоклеточный рак кожи, имеющий злокачественное течение с метастазированием. Болезнь Кейра является преимущественно «мужским» заболеванием, поэтому, наряду с дерматологией, изучается андрологией.
Болезнь Кейра
Причины болезни Кейра
Заболевание встречается в основном среди мужчин пожилого или среднего возраста, которым не производили обрезание крайней плоти. В возникновении опухоли провоцирующую роль играют канцерогенные факторы, небрежное отношение к личной гигиене, онкогенные вирусы (например, ВПЧ — вирус папилломы человека, рецидивирующий генитальный герпес), постоянная травматизация половых органов, хронический баланопостит.
Симптомы болезни Кейра
Очаг поражения при болезни Кейра, как правило, одиночный и локализуется на внутренней части крайней плоти. Он имеет четко очерченные края, розово-красную или бордово-вишневую окраску, бархатистую или лоснящуюся блестящую поверхность. На половом члене может возникать налет белого цвета, который без затруднений снимается. Болевые ощущения обычно незначительные. Боль усиливается при травмировании пораженного опухолью участка. По этой же причине возможно возникновение кровотечения. Присоединение инфекции приводит к образованию желтого налета и появлению гнойного отделяемого.
При переходе опухоли Кейра в плоскоклеточный рак кожи в очаге поражения происходят изменения: могут появляться бородавчатые разрастания, уплотнения и покрытое кровянистыми корочками или белым налетом изъязвление.
Диагностика болезни Кейра
Диагностика проводится по клинической картине и результатам гистологического исследования образца ткани, взятого при биопсии пораженного участка. При гистологическом изучении препаратов выявляется гиперкератоз, неравномерный акантоз и инфильтрация дермы лимфоцитами, в эпидермисе обнаруживаются атипичные (опухолевые) клетки.
Для исключения воспалительных заболеваний полового члена проводится проба с красителем — 1% раствором толуидинового синего, который наносится на пораженный участок. При обычном покраснении воспалительного генеза окрашивание не происходит, при опухоли Кейра очаг приобретает синюю окраску. Дифференциальный диагноз болезни Кейра проводят с баланитом Зоона, твердым шанкром (сифилис), эрозивно-язвенной лейкоплакией, дрожжевым баланопоститом, ограниченным псориазом, красным плоским лишаем полового члена и др.
Лечение и прогноз болезни Кейра
Лечение опухоли Кейра осуществляют путем ее хирургического иссечения, криодеструкции жидким азотом или электрокоагуляции. Эффективно применение цитостатических мазей: фторурациловой, фторофуровой, проспидиновой. При выявлении инвазивного роста опухоли проводят химиотерапию внутримышечным или внутривенным введением блеомицина. При трансформации болезни Кейра в плоскоклеточный рак с вовлечением регионарных лимфатических узлов лечение включает удаление пораженных лимфоузлов (лимфаденэктомию) и близкофокусную рентгенотерапию опухоли.
Обычно заболевание имеет длительное и доброкачественное течение, без прорастания в подлежащие ткани и без вовлечения в процесс регионарных лимфоузлов. Прогноз становится неблагоприятным при трансформации опухоли Кейра в плоскоклеточный рак кожи.
Болезнь Кейра (эритроплазия)
Содержание статьи
Стадии
- инвазивная;
- неинвазивная.
Каждая из стадий имеет свои особенности.
Причины
Определить причины возникновения, способствующие развитию недуга не представляется возможным. Провоцирующими факторами являются:
- хронический баланопостит;
- неблагоприятные условия смегмы на слизистой головки полового члена;
- генитальный герпес;
- травмирование кожи на мужском половом органе.
- вирус папилломы;
Также к образованию патологии приводит несоблюдение правил гигиены.
Симптомы
Главным признак – появление единого очага, находящегося на слизистой. В большинстве случаев он располагается на головке органа, а у женщин – вокруг вульвы. При этом его границы выглядят равномерно и имеют круглую форму. В зоне поражения ощущается дискомфорт и небольшая инфильтрация. Очаг имеет ярок-красный или коричневый оттенок, его поверхность блестящая и гладкая. При прогрессировании происходит усиление инфильтрации, из-за этого возможно образование эрозий. Когда к заболеванию присоединяется инфекция, место очага становится желтым и появляется гной.
Обычно при эритроплазии очаг всего один, с фестончатыми краями. Через определенное время его поверхность покрывается корочками и начинает кровоточить. Рост эрозий свидетельствует о развитии инвазии патологических клеток.
Если болезнь перешла в ротовую полость, очаги локализуются на слизистой губ и языке. Поражающие элементы приобретают бархатную структуру с видимыми границами ярко-красного цвета. Структура новообразования обычно покрыта эрозиями. Пациенты с этой патологией нередко страдают от жжения в области опухоли.
Эритроплазия зачастую появляется после 50 лет, преимущественно у представителей сильного пола, не подвергшихся обрезанию. При несвоевременном лечении опухоль трансформируется в плоскоклеточный рак.
При появлении одного из перечисленных проявлений нужна консультация врача уролога-андролога.
Диагностика
Перед началом обследования полагается осмотр у уролога-андролога. На приеме доктор изучает историю болезни и выслушивает жалобы пациента, после этого назначает диагностику, основой которой является изучение клинических симптомов и проведение гистологического и цитологического анализа.
Для диагностирования заболевания используют тест, предусматривающий наложение на зону поражения компресса
с раствором толуидинового синего (1%), из-за этого область эритроплазии окрашивается в синий цвет.
Дифференциальный диагноз устанавливается исходя из результатов цитологического и гистологического анализа.
Данные процедуры помогают отличить недуг от других схожих по клиническим проявлениям заболеваний.
Лечение
При этом недуге применяется комплексная терапия. Как правило, применяется лучевая, химиотерапия и различные медикаменты. Выбор методики зависит о распространенности процесса. Если наблюдается инвазивная форма, назначается блеомицин. Лекарство вводится внутримышечно или внутривенно. Очень важно, чтобы оно не попало на кожу, поскольку это может привести к некрозу. Раствор блеомицина – 15 мг вводят через день. Если потребуется – курс повторяют.
Наружное лечение прописывается исходя из локализации новообразования. Если инфекция находится на головке органа, используют жидкий азот. Перед криолечением применяют обезболивающие. Процедуру проводят два раза в неделю, курс составляет от 4 до 5 процедур.
Также очень часто применяют фторофуровую мазь. Ее необходимо накладывать на поврежденное место на протяжении двадцати дней.
Если болезнь затронула лимфатические узлы, показано их хирургическое удаление.
Профилактика
Профилактические меры направлены на ранее выявление патологии и адекватное лечение. Также следует уделять внимание личной гигиене.
причины, симптомы, диагностика, лечение, профилактика
Представляет собой поверхностный внутриэпителиальный рак слизистых оболочек.
Причины
Развитию заболевания подвержены в основном мужчины пожилого или среднего возраста, которым не производили обрезание крайней плоти. Развитию новообразования способствуют такие канцерогенные факторы, как небрежное отношение к личной гигиене, наличие у больного онкогенных вирусов, таких как вирус папиломы человека или вирус герпеса. Довольно часто главной причиной развития заболевания является постоянная травматизация наружных половых органов. Помимо этого, очень часто заболевание может выявляться у лиц, которые страдают хронической формой баланопостита.
Симптомы
Очаг поражения при болезни Кейра, как правило, одиночный и локализуется на внутренней части крайней плоти. Он имеет четко очерченные края, розово-красную или бордово-вишневую окраску, бархатистую или лоснящуюся блестящую поверхность. На половом члене может возникать налет белого цвета, который без затруднений снимается.
Патологический процесс не сопровождается развитием выраженных болевых ощущений, в редких случаях пациенты могут жаловаться на появление в данной зоне незначительных болей или дискомфорта, которые не нарушают их привычный образ жизни. Однако может происходить значительное усиление болей в результате травмирования пораженного опухолью участка. По этой же причине возможно возникновение кровотечения. Присоединение инфекции приводит к образованию желтого налета и возникновению гнойного отделяемого.
При переходе опухоли Кейра в плоскоклеточный рак кожи в очаге поражения происходят изменения. В результате таких патологических изменений в этой зоне может отмечаться появление бородавчатых разрастаний, уплотнения и покрытого кровянистыми корочками или белым налетом и изъязвления.
Диагностика
Диагностика проводится по клинической картине и результатам гистологического исследования образца ткани, взятого при биопсии пораженного участка. При гистологическом изучении биоптата выявляется гиперкератоз, неравномерный акантоз и инфильтрация дермы лимфоцитами, в эпидермисе обнаруживается присутствие атипичных клеток.
Для исключения воспалительных заболеваний полового члена проводится проба с красителем — 1% раствором толуидинового синего, который наносится на пораженный участок. При обычном покраснении воспалительного генеза окрашивание не происходит, при опухоли Кейра очаг приобретает синюю окраску. Дифференциальный диагноз болезни Кейра проводят с баланитом Зоона, твердым шанкром, эрозивно-язвенной лейкоплакией, дрожжевым баланопоститом, ограниченным псориазом, красным плоским лишаем полового члена.
Лечение
Лечение опухоли Кейра осуществляют путем ее хирургического иссечения, криодеструкции жидким азотом или электрокоагуляции. Эффективно применение цитостатических мазей: фторурациловой, фторофуровой, проспидиновой. При выявлении инвазивного роста опухоли проводят химиотерапию внутримышечным или внутривенным введением блеомицина. При трансформации болезни Кейра в плоскоклеточный рак с вовлечением в патологический процесс регионарных лимфатических узлов лечение включает удаление пораженных лимфоузлов и близкофокусную рентгенотерапию опухоли.
Чаще всего заболевание имеет длительное и доброкачественное течение, без прорастания в подлежащие ткани и без вовлечения в процесс регионарных лимфоузлов. Прогноз становится неблагоприятным при трансформации опухоли Кейра в плоскоклеточный рак кожи.
Профилактика
Профилактика развития Болезни Кейра основана на своевременном лечении баланопостита, предупреждение развития постоянного травмирования крайней плоти и соблюдении правил личной гигиены. Также снизить вероятность развития патологии поможет предупреждение инфицирования вирусом папилломы человека либо герпесной инфекцией.
Болезнь Кейра, симптомы, диагностика и лечение болезни Кейра
Болезнь Кейра
– опухолевый процесс, локализующийся исключительно в эпидермальном слое. За пределы базальной мембраны, в слой дермы он не распространяется. Опасность заболевания заключается в том, что с течением времени происходит его трансформация в плоскоклеточный рак. Излюбленная локализация патологического процесса – головка полового члена. Значительно реже поражается вульва.
Симптомы
Патологический очаг представлен участком красно-вишневой окраски с четкими краями. Его пальпация сопровождается некоторой чувствительностью. Легкое травмирование приводит к кровоточивости, а в результате инфицирования появляется гнойное отделяемое. Однако клинические признаки неспецифичны. Специалисты вынуждены проводить дифференциальную диагностику с другими заболеваниями инфекционной, воспалительной природы, дерматозами.
Диагностика
Для того чтобы уточнить диагноз, методов визуального исследования недостаточно. Некоторую помощь в диагностике может оказать проведение пробы с раствором красителя, толуидиновым синим. При болезни Кейра очаг приобретает синюю окраску, что позволяет исключить воспалительные процессы.
Поскольку болезнь Кейра относится к предраковым заболеваниям, весьма важным является определить глубину поражения, выяснить, ограничено ли оно эпидермальным слоем, или проникает более глубоко. Основным методом диагностики является биопсия. Материал, изъятый из патологического очага, подвергается дальнейшему микроскопированию, в результате чего создается точная картина поражения, осуществляется 100% достоверная диагностика.
Лечение
Лечение болезни Кейра проводится хирургическим путем и с помощью консервативных методик. К радикальным методам относится
- иссечение патологического очага в пределах здоровых тканей;
- удаление с помощью радиоволновой методики;
- криодеструкция.
Среди органосохраняющих методик все большую популярность приобретает фотодинамическая терапия. Этот метод нехирургического лечения ряда онкологических заболеваний и предраковых состояний основан на применении фотосенсибилизаторов и определенного светового излучения. В результате запуска фотохимической реакции происходит гибель опухолевых клеток.
Среди преимуществ данной методики, по сравнению с оперативным вмешательством:
- максимальный косметический эффект;
- отсутствие повреждений окружающих тканей;
- безболезненность процедуры;
- короткий восстановительный период.
Лечение эритроплазии Кейра в Израиле
В клинике Топ Ихилов, которая входит в пятерку лучших медучреждений Израиля, лечение эритроплазии Кейра – опасного предракового состояния, представляющего собой поражение эпителиальных клеток слизистых оболочек и кожи, – почти в 100% случаев заканчивается полным излечением. Важную роль здесь играет качественная диагностика, позволяющая распознать патологию на раннем этапе и назначить грамотную терапию, которая надежно избавит от измененных клеток, предотвратит их злокачественное перерождение и сведет к минимуму риск рецидива.
Рассчитать стоимость лечения
Эффективное лечение эритроплазии Кейра в Израиле обусловлено высоким уровнем профессиональной подготовки и многолетним опытом здешних специалистов, применением передовых лечебно-диагностических методик, высокотехнологичного медицинского оборудования и инновационных лекарственных препаратов. Пациенты, прошедшие комплексную терапию в Топ Ихилов, даже те из них, у кого началось озлокачествление новообразования, полностью избавляются от недуга и возвращаются к полноценной жизни.
Методы лечения эритроплазии Кейра в Израиле
Лечение всегда подбирается в индивидуальном порядке на основании проведенной диагностики и во многом зависит от локализации участка поражения. В подавляющем большинстве случаев эритроплазию Кейра выявляют на слизистых оболочках и кожных покровах половых органов – головке полового члена у мужчин (в некоторых случаях также может быть поражена крайняя плоть) и вульве у женщин. Реже патологический процесс возникает на слизистой ротовой полости (языке и губах) и перианальной области. На выбор метода терапии также влияют характер новообразования, его форма, площадь изъязвления и длительность периода, в течение которого развивается заболевание.
Лечение эритроплазии Кейра без операции в Израиле является приоритетным. Если патология выявлена на начальных стадиях развития и носит неинвазивный характер, специалисты медицинского центра Топ Ихилов обращаются к консервативной терапии. Она заключается в первую очередь в обработке пораженного участка специальными мазями на основе цитостатиков – противоопухолевых препаратов, которые блокируют механизмы деления измененных клеток и тем самым способствуют сокращению их количества.
При небольшой площади поражения эффективным методом борьбы с эритроплазией Кейра является криодеструкция, при которой патологический очаг разрушается под воздействием экстремально низких температур. Чаще всего для этого используется жидкий азот, который применяется либо контактным (в виде аппликации), либо аэрозольным методом. Процедура выполняется с предварительным местным обезболиванием.
Деструкция углекислотным лазером – еще один действенный способ провести лечение эритроплазии Кейра без операции в Израиле. Разрушение патологически измененных клеток при этом происходит благодаря воздействию на них невидимого светового излучения с постоянной длиной волны, источником которого являются современные лазеры на углекислом газе. Это приводит к быстрому повышению температуры внутри пораженных тканей, их испарению и дальнейшей гибели.
Если же обследование показало распространение патологического очага в более глубокие слои тканей и тенденцию к злокачественному перерождению, пациенту назначают системную химиотерапию. В этом случае препараты, способные останавливать рост атипичных клеток и приводить к их гибели, вводят внутривенно или внутримышечно.
Методы лечения эритроплазии Кейра в Израиле могут включать в себя и хирургическое вмешательство, которое используется при небольших поражениях, склонных к озлокачествлению. Специалисты клиники Топ Ихилов, если и обращаются к такому методу, то предпочтение отдают минимально травматичным техникам. Это может быть:
- электрохирургическая эксцизия петлей – малоинвазивная операция, при которой иссечение новообразования происходит при помощи проволочной петли-электроножа, использующей ток высокой частоты. Она позволяет аккуратно срезать поврежденный слой слизистой или кожи, не травмируя окружающие ткани.
- операция по методу Моса – новейшая техника, обеспечивающая максимальный эффект при минимальном вмешательстве. Резекция опухоли происходит послойно под микроскопическим контролем – при этом каждый слой, срезанный хирургом, оперативно отправляется в лабораторию для гистологического исследования. Это позволяет завершить операцию именно тогда, когда в удаленных слоях больше не будут обнаруживаться измененные клетки, и сохранить таким образом максимальный объем здоровых тканей.
Получить цены
После хирургического вмешательства может понадобиться закрыть образовавшуюся рану, для того специалисты медцентра Топ Ихилов проводят восстановительную пластику с использованием собственных тканей пациента или донорского материала.
В случае поражения головки полового члена оперативное лечение эритроплазии Кейра в Израиле, отзывы о котором свидетельствуют о его надежности и безопасности, может сопровождаться циркумцизией, то есть обрезанием крайней плоти. Эта малоинвазивная манипуляция позволяет предотвратить дальнейшее распространение патологического процесса и способствует скорейшему заживлению пораженного участка слизистой.
В случаях, когда изъязвления приобретают злокачественный характер, также может использоваться близкофокусная рентгенотерапия, разновидность лучевого лечения, которую дополняют иссечением регионарных лимфатических узлов.
Диагностика эритроплазии Кейра в Израиле
Чтобы поставить точный диагноз и назначить адекватную терапию, необходимо провести тщательное обследование. В случае с эритроплазией важную роль играет в том числе дифференциальная диагностика: она нужна, чтобы исключить другие заболевания, имеющие схожую клиническую картину. Среди них эрозивная форма лейкоплакии, шанкриформная пиодермия, баланопостит, кандидоз, ограниченный псориаз, крауроз, экзема, красный плоский лишай и другие.
Ультрасовременное диагностическое оборудование, имеющееся в распоряжении клиники Топ Ихилов, а также профессионализм работающих здесь врачей и широкий арсенал используемых ими методик позволяет быстро и с высокой точностью определять эритроплазию Кейра. Весь процесс обычно занимает не больше 3–4 рабочих дней.
День 1. Осмотр специалистом
Приблизительная диагностическая программа разрабатывается еще до приезда иностранного пациента в Израиль, а потому сразу по прибытии в страну он в сопровождении персонального куратора-переводчика отправляется в больницу на консультацию с лечащим врачом. Доктор знакомится с историей болезни и проводит осмотр, в ходе которого изучает поврежденные участки слизистой оболочки или кожи. Уже на этом этапе он способен с большой достоверностью распознать эритроплазию по характерным признакам. Но чтобы подтвердить диагноз, врач назначает дополнительные обследования.
День 2–3. Тщательное обследование
В течение следующего дня или двух – в зависимости от объема необходимых диагностических процедур – пациент проходит обследование, которое включает в себя:
- аппликационный тест с использованием специального красителя – помогает дифференцировать эритроплазию от воспалительных заболеваний;
- гистологическое исследование образца пораженной ткани, взятого в ходе биопсии, – определяет природу и структуру патологических клеток;
- цитологическое исследование измененных клеточных элементов;
- сонографическое исследование регионарных лимфоузлов – при подозрении на метастазы.
День 4. Заключение специалиста
Диагностика эритроплазии Кейра в Израиле завершается консилиумом, на котором собираются ведущие специалисты Топ Ихилов – урологи, дерматологи, онкологи, хирурги, химиотерапевты, которые внимательно изучают результаты диагностики и на их основании коллегиально разрабатывают для пациента индивидуальную схему терапии.
Лечение эритроплазии Кейра в Израиле: стоимость
Обследование и лечение эритроплазии в Израиле обходится значительно дешевле аналогичных услуг в других зарубежных клиниках. Так, в медучреждениях Западной Европы оно при сопоставимом качестве и высокой эффективности будет стоить минимум на 30% дороже, в США – почти на 50%. Фиксированного тарифа нет, а итоговая стоимость терапии в каждом конкретном случае будет определяться индивидуально с учетом локализации поражения, его площади, стадии болезни, выбранных методов лечения, примененных лекарственных препаратов, общего состояния здоровья пациента и других факторов.
Иностранные граждане, которых интересует лечение эритроплазии Кейра в Израиле, цены на соответствующие процедуры могут узнать заблаговременно, обратившись за бесплатной консультацией к представителю Топ Ихилов. Он составит предварительную медицинскую программу и просчитает ориентировочную стоимость. Окончательная же цена станет известна уже на месте – после прохождения обследования и разработки лечебного плана.
Рассчитать стоимость лечения
Преимущества лечения эритроплазии Кейра в Топ Ихилов
- Высокопрофессиональные врачи, сочетающие богатый клинический опыт с научными исследованиями.
- Современная материально-техническая база.
- Новейшие методики диагностики и лечения.
- Индивидуальный подход.
- Доступные цены.
- Высокий уровень обслуживания, всесторонняя помощь и сопровождение пациентов из-за рубежа.
- 5
- 4
- 3
- 2
- 1
(5 голосов, в среднем: 5 из 5)
Ритуксимаб при тяжелой интерстициальной болезни легких, не поддающейся лечению
Предпосылки и цель:
У пациентов с тяжелым интерстициальным заболеванием легких (ILD), прогрессирующим, несмотря на обычную иммуносупрессию, ритуксимаб, моноклональное антитело, истощающее B-лимфоциты, может предложить эффективную терапию спасения.
Методы:
Ретроспективная оценка 50 пациентов с тяжелыми прогрессирующими ВЗЛ (различной этиологии, за исключением идиопатического фиброза легких (IPF)), получавших ритуксимаб в период с 2010 по 2012 год.Изменение показателей легочной функции по сравнению с уровнем пре-ритуксимаба оценивали через 6-12 месяцев после лечения.
Результаты:
ILD были связаны с заболеванием соединительной ткани у 33 пациентов, гиперчувствительным пневмонитом у 6 пациентов и различными состояниями у 11 пациентов. На момент введения ритуксимаба пациенты имели тяжелые физиологические нарушения со средней форсированной жизненной емкостью (ФЖЕЛ) 44.0% (24,0-99,0%) и рассеивающая способность по монооксиду углерода (DLCO) 24,5% (11,4-67,0%). В отличие от медианного снижения FVC на 14,3% и DLCO на 18,8% за 6-12 месяцев до приема ритуксимаба, анализ парных данных функции легких выявил медианное улучшение FVC на 6,7% (P <0,01) и стабильность DLCO. (Изменение 0%; P <0,01) в течение 6-12 месяцев после лечения ритуксимабом. У двух пациентов развилась серьезная инфекция (пневмония), потребовавшая госпитализации после приема ритуксимаба, и 10 пациентов умерли от прогрессирования основного заболевания, в среднем 5.Через 1 (1,2-24,5) месяца после лечения.
Выводы:
У пациентов с тяжелым прогрессирующим заболеванием, не связанным с IPF, и не реагирующим на обычную иммуносупрессию, ритуксимаб может предложить эффективное терапевтическое вмешательство. Необходимы будущие проспективные контролируемые испытания для подтверждения этих результатов и оценки результатов безопасности.
Ключевые слова:
интерстициальное заболевание легких; спасательная терапия; ритуксимаб; лечение.
Тяжелое интерстициальное заболевание легких при заболевании соединительной ткани: ритуксимаб как метод спасения
Реферат
При очень тяжелом интерстициальном заболевании легких, связанном с заболеванием соединительной ткани (CTD-ILD), прогрессирующем, несмотря на максимальную традиционную иммуносупрессию, не существует эффективной медицинской спасательной терапии.
Целью настоящего исследования было проверить, является ли ритуксимаб, моноклональное антитело, истощающее периферические В-лимфоциты, эффективным в качестве спасательной терапии при очень тяжелых CTD-ILD, невосприимчивых к традиционной иммуносупрессии.
Мы провели ретроспективную оценку восьми пациентов с тяжелой и прогрессирующей ЗСТ-ВЗЛ, получавших ритуксимаб. У шести пациентов изменение показателей легочной функции (PFT) по сравнению с уровнями преритуксимаба оценивалось через 9–12 месяцев после лечения. У двух пациентов, которым во время лечения была выполнена искусственная вентиляция легких, оценивались клинические изменения и изменения КТВ.
У семи из восьми пациентов был положительный ответ на лечение ритуксимабом, в то время как у одного пациента тяжесть заболевания не изменилась.В отличие от предыдущего прогрессирования, мы наблюдали в среднем значимое улучшение диффузионной способности по монооксиду углерода на 22% (по сравнению со средним исходным уровнем 25%; диапазон 16-32%; p = 0,04) и среднее значительное улучшение на 18% в форсированная жизненная емкость легких (медиана исходного уровня 45%; диапазон 37–59%; p = 0,03) в течение 9–12 месяцев после лечения ритуксимабом.
При очень тяжелых CTD-ILD, не реагирующих на обычную иммуносупрессию, ритуксимаб может представлять собой эффективное, потенциально спасающее жизнь терапевтическое вмешательство.
В контексте заболевания соединительной ткани (CTD) очень тяжелое интерстициальное заболевание легких (ILD), не поддающееся традиционному лечению, является слишком частым и удручающим явлением. В отсутствие трансплантации легких пациентам мало что можно предложить, кроме облегчения симптомов. Было замечено, что при идиопатической интерстициальной пневмонии уместен паллиативный подход, когда тяжесть заболевания достигает критической точки: несмотря на гораздо более низкую смертность при более раннем заболевании, идиопатическая фиброзная неспецифическая интерстициальная пневмония (NSIP) имеет такой же плохой результат лечения, как и идиопатический легочный фиброз (IPF) у пациентов с диффузионной способностью легких по монооксиду углерода ( D L, CO ) <35% от прогнозируемого [1].Клинический опыт показывает, что в подгруппе пациентов с очень тяжелой прогрессирующей ЗСТ-ВЗЛ прогноз столь же безрадостный.
Патогенез CTD-ILD сложен, и широко признано, что лежащая в основе дисфункция иммунной системы и иммуноопосредованное легочное воспаление имеют решающее значение для развития и прогрессирования CTD-ILD. Нарушения клеточной и гуморальной иммунной функции были описаны при ILD, связанном с системным склерозом (SSc) [2–4], идиопатической воспалительной миопатией [5, 6] и некоторыми другими CTD [7, 8].Успех противовоспалительной и иммуносупрессивной терапии в этих условиях подтверждает мнение о том, что иммунологическая сверхактивность является ключевым процессом в прогрессирующем фиброзе легких.
Ритуксимаб представляет собой химерное (человеческое / мышиное) моноклональное антитело с высоким сродством к поверхностному антигену CD20, экспрессируемому на пре-В- и В-лимфоцитах. Ритуксимаб приводит к быстрому истощению В-клеток из периферического кровообращения [9] до того, как восстановление В-клеток начинается через 6–9 месяцев [10]. Доказательства эффективности истощения В-клеток существуют при ряде иммуноопосредованных состояний, включая ревматоидный артрит [11-13], васкулит, связанный с антинейтрофильными цитоплазматическими антителами [14, 15], альвеолярный протеиноз легких [16] и иммунный тромбоцитопенический синдром. пурпура [17].Несколько серий случаев предполагают, что ритуксимаб может также быть эффективным при ILD, возникающем в контексте иммунологической сверхактивности, с благоприятными ответами, описанными при ILD, ассоциированном с антисинтетазой [18] и SSc-ILD [19]. Тем не менее, пациенты в этих группах имели интерстициальное поражение легких преимущественно от легкой до умеренной степени тяжести.
Доказательства эффективности ритуксимаба в качестве «спасательной» терапии у пациентов с тяжелыми, опасными для жизни ILD ограничены [20, 21]. Мы сообщаем об использовании ритуксимаба в качестве спасательной терапии у восьми пациентов с основными признаками ДСТ и чрезвычайно тяжелым фиброзным заболеванием легких, прогрессирующим, несмотря на сильную традиционную иммуносупрессию.
МЕТОДЫ
Группы пациентов
Обзор нашей медицинской документации и базы данных о назначениях в больничных аптеках выявил всех пациентов, получавших ритуксимаб в период с декабря 2007 года по декабрь 2010 года. В наш анализ были включены все последовательные пациенты с тяжелой прогрессирующей ЗСТ-ВЗЛ, всего восемь пациентов. Ни один пациент с CTD-ILD не был исключен из-за плохого исхода или ранней смерти. Всем пациентам было доступно минимум 9 месяцев после лечения.ILD возникла в сочетании с полимиозитом или дерматомиозитом (PM / DM) у пяти пациентов, у четырех из которых были антитела против синтетазы Jo-1. У двух пациентов ILD возникла в сочетании с недифференцированным CTD, а у одного — с SSc. Все пациенты не ответили на обычную иммуносупрессивную терапию с продолжающимся ухудшением показателей легочных функциональных тестов (PFT) и / или ухудшением дыхательной недостаточности. На момент направления два пациента прошли искусственную вентиляцию легких и были переведены непосредственно в отделение интенсивной терапии (ОИТ) нашей больницы.В таблице 1 приведены демографические данные и иммуносупрессивная терапия за 9–12 месяцев до терапии ритуксимабом.
Таблица 1-
Исходные характеристики пациентов, получавших ритуксимаб, включая иммуносупрессивную терапию, в предыдущие 12 месяцев
Статистический анализ
Все пациенты после приема ритуксимаба наблюдались в течение не менее 9 месяцев. У шести пациентов с данными PFT до лечения ритуксимабом значимость медианы D L, CO и процентного изменения форсированной жизненной емкости легких (FVC) до и после лечения оценивалась с помощью рангового критерия Вилкоксона.Для оценки статистической значимости ответа на лечение у всех пациентов были получены категориальные переменные изменения (хуже, стабильно, улучшилось) путем объединения значимых изменений в тестах функции легких (определяемых как изменение ФЖЕЛ на ≥10% и / или изменение в тестах функции легких). D L, CO ≥15%) и / или клинический статус (для двух пациентов, нуждающихся в ИВЛ, потребность в ИВЛ была классифицирована как значительное ухудшение). Изменения оценивались за 9–12 месяцев до и после ритуксимаба и анализировались с помощью знакового рангового критерия Вилкоксона.Статистически значимыми считались значения p — ≥0,05. Анализ данных последующего наблюдения через 9–12 месяцев был выбран на основании ранее описанных ответов CTD-ILD на ритуксимаб [18, 19] и ожидаемой продолжительности аблации В-клеток после ритуксимаба [10, 15].
Оценка пациента
Все пациенты были обсуждены на нашем междисциплинарном совещании по интерстициальным заболеваниям легких и прошли полную клиническую оценку, включая компьютерную томографию высокого разрешения (HRCT) и PFT.
Лечение ритуксимабом
Ритуксимаб применялся в соответствии с рекомендациями нашей больничной группы по новым лекарствам и клиническим рекомендациям. Протокол лечения состоит из 1000 мг ритуксимаба, вводимого в день 0 и день 14 (которому предшествует лечение гидрокортизоном и хлорфенамином внутривенно), режим дозирования, одобренный для лечения ревматоидного артрита [12]. Пациент 5 получал ритуксимаб 375 мг · м -2 еженедельно в течение 4 недель до того, как были окончательно утверждены наши больничные рекомендации.После введения ритуксимаба потребность в постоянной иммуносупрессии оценивалась индивидуально для каждого пациента.
РЕЗУЛЬТАТЫ
Во время лечения ритуксимабом все пациенты имели крайне тяжелые ВЗЛ со средним значением D, L, CO 25% (диапазон 16–32%) и FVC 45% (диапазон 37–59%), и ожидаемая выживаемость менее 6–12 месяцев (на основании клинического опыта и данных о выживаемости у пациентов с идиопатическими фиброзными ВЗЛ аналогичной степени тяжести) [1].После ритуксимаба мы наблюдали значительное категориальное улучшение клинического статуса и / или PFT ( D, , L, CO и / или FVC) у семи из восьми пациентов (p = 0,008) в соответствии с критериями, изложенными в разделе методов. . У одного пациента (пациент 8) серьезность заболевания не изменилась после лечения, за исключением легкого улучшения симптомов. У шести пациентов с серийными ПФП медиана улучшения D L, CO составила 22% (диапазон 0–119%; p = 0.04) и 18% ФЖЕЛ (диапазон 0–100%; p = 0,03) в течение 9–12 месяцев после приема ритуксимаба. Это улучшение произошло после медианного снижения D L, CO на 16% (диапазон 8–67%) и FVC на 29% (диапазон 3–45%) в течение 9–12 месяцев, предшествующих лечению ритуксимабом (рис. 1а и б). Улучшение PFT и / или клинического статуса, как правило, происходило быстро (в течение 2–3 месяцев у большинства пациентов), а также было статистически значимым (p <0,05) при анализе в более ранний момент времени - 6 ± 1 месяц после лечения ритуксимабом.
Фигура 1-
a) Изменение диффузионной способности легких по монооксиду углерода ( D L, CO )%, прогнозируемое в течение 9–12 месяцев до и после введения ритуксимаба. После ритуксимаба среднее улучшение для D L, CO % до 22% (диапазон 0–119%; p = 0,04), в отличие от среднего снижения на 16% (диапазон 8–67%). до ритуксимаба. б)% изменения форсированной жизненной емкости легких (ФЖЕЛ) в течение 9–12 месяцев до и после введения ритуксимаба.После приема ритуксимаба медиана улучшения FVC% до 18% (диапазон 0–100%; p = 0,03), в отличие от среднего снижения на 29% (диапазон 3–45%) до приема ритуксимаба.
У пяти пациентов был замечательный ответ на ритуксимаб с резким улучшением функции легких (пациенты 3, 4 и 5) и / или успешной экстубацией (пациенты 1 и 7). Изменения клинического статуса и PFT представлены в таблице 2. На дополнительном рисунке S1a-f показаны ответы функции легких на лечение у отдельных пациентов.Дополнительную клиническую информацию можно найти в дополнительных материалах онлайн, включая полное функциональное наблюдение.
Таблица 2-
Изменение показателей легочной функции и симптомов у отдельных пациентов за 9–12 месяцев до и после лечения ритуксимабом
ILD, ассоциированный с полимиозитом / дерматомиозитом
Пациент 1
Этот 45-летний мужчина был переведен в отделение интенсивной терапии в нашей больнице после неудачной экстубации после процедуры биопсии четырехглавой мышцы. Недавно диагностированный дерматомиозит с ассоциированной организующейся пневмонией ухудшился, несмотря на i.v. метилпреднизолон и при переносе КТВР продемонстрировали картину организации пневмонии с смешанным фиброзом и диффузным альвеолярным повреждением (рис. 2а). Сочетание опасной для жизни дыхательной недостаточности, результатов HRCT и лежащего в основе аутоиммунного процесса привело к решению лечить одновременно с i.v. циклофосфамид 750 мг и ритуксимаб. Резкое улучшение внешнего вида HRCT произошло в течение следующих шести недель (рис. 2a и b), и улучшения в PFT продолжались в течение периода наблюдения (с D L, CO на 50% и FVC 99%, прогнозируемыми на последний обзор).
Фигура 2-
Пациент 1. Мужчина 45 лет, дерматомиозит. a) КТ тонких срезов с контрастным усилением показывает пятнистую консолидацию и помутнение матового стекла в нижних долях, что соответствует организации пневмонии и диффузного альвеолярного повреждения. Пневмомедиастинум присутствует. б) через 7 недель после начала приема ритуксимаба. Консолидация нижней доли и изменения матового стекла почти полностью исчезли. Считалось, что некоторые ретикулярные изменения в переднем отделе независимого легкого могут быть связаны с повреждением, вызванным вентилятором.
Пациент 2
У этого 60-летнего мужчины с длительным фиброзным NSIP, ассоциированным с PM (Jo-1-антителами), наблюдалось постепенное ухудшение дыхания и сохраняющаяся активность миозита, несмотря на одновременное лечение микофенилатом, циклоспорином и преднизолоном. В течение 9 месяцев приема ритуксимаба креатинкиназа сыворотки снизилась с 4500 до 370 МЕ · л -1 , и наблюдалось значительное субъективное улучшение мышечной силы и одышки с улучшением на 19% для D L, CO . (Таблица 2).
Пациент 3
У этой 60-летней женщины с фиброзным NSIP, ассоциированным с антисинтетазными антителами (Jo-1), в течение 12 месяцев в анамнезе наблюдалось ухудшение симптомов и ухудшение PFT, несмотря на i.v. циклофосфамид. После приема ритуксимаба наблюдалось заметное улучшение респираторных и внелегочных симптомов в течение 3 месяцев, в сочетании с улучшением показателей PFT (таблица 2).
Пациент 4
Эта 29-летняя женщина была направлена с быстро прогрессирующим фиброзным NSIP, связанным с антисинтетазным синдромом (Jo-1), и ухудшением состояния, несмотря на преднизолон и микофенилат, за которым последовало i.v. циклофосфамид. Ритуксимаб привел к значительному улучшению симптомов и ПФП в течение 2–3 месяцев после приема, причем улучшения продолжались в течение последующих 12 месяцев наблюдения.
Пациент 5
Этот 51-летний мужчина был направлен с очень быстро прогрессирующим фиброзным NSIP, связанным с антисинтетазным синдромом (Jo-1), и ухудшением интерстициального поражения легких, несмотря на преднизолон, микофенилат и, в конечном итоге, i.v. циклофосфамид.Лечение ритуксимабом привело к быстрому и поразительному улучшению симптомов и ПФП (дополнительная цифра S1d), однако он умер в своей местной больнице через 18 месяцев после терапии ритуксимабом (причиной смерти была указана инфекция нижних дыхательных путей). Во время наблюдения в нашей больнице за 8 дней до смерти он оставался здоровым, сохранял стабильные показатели PFT ( D L, CO 38% и FVC 68%) и нормальные маркеры воспаления. Последний анализ субпопуляции лимфоцитов, проведенный через 12 месяцев после ритуксимаба (и за 6 месяцев до смерти), выявил стойкое истощение В-клеток, хотя за это время проблемы с инфекциями не возникали.Циклоспорин был недавно начат (в дополнение к длительному режиму приема микофенолатов и преднизолона) из-за сохраняющейся активности миозита и для дальнейшего снижения уровня стероидов.
Недифференцированный CTD
У двух пациентов в нашей когорте был подтвержденный CTD с положительной аутоиммунной серологией и системными симптомами (таблица 1), но они не соответствовали критериям классификации для определенного CTD. Их клиническая история такова.
Пациент 6
У этого 49-летнего мужчины был диагностирован недифференцированный CTD в 2006 году с появлением фиброзного NSIP на КТВР.Интерстициальное заболевание легких прогрессировало, несмотря на в / в. циклофосфамид, за которым следуют микофенолят и преднизолон. Ритуксимаб был введен в декабре 2007 года, что привело к заметному улучшению симптомов и функции легких (улучшение на 22% для D L, CO ) в течение следующих 9 месяцев, прежде чем ухудшение повторилось (несмотря на продолжающуюся пероральную иммуносупрессию). Ему отказали в трансплантации легких, и терапевтический подход в виде циклических инфузий ритуксимаба был связан со стабильностью его очень тяжелой ЗСТ, связанной с ИЛЗ, в течение последних 12 месяцев.
Пациент 7
Эта 37-летняя женщина обратилась с жалобой на обширную консолидацию на HRCT и первоначально лечилась как неизлечимая пневмония. Ухудшение дыхательной недостаточности привело к началу ИВЛ и лечению i.v. метилпреднизолон (один грамм в день в течение 3 дней; без клинических улучшений), и пациент был переведен в наш ITU. Положительные аутоиммунные серологические исследования (ревматоидный фактор 1: 1720, анти-Ro-антитела), появление HRCT с организацией пневмонии с диффузным альвеолярным повреждением и отрицательная микробиология (включая вирусологию) при бронхоальвеолярном лаваже (БАЛ) привели к решению лечить ритуксимабом и снизить доза я.v. циклофосфамид (750 мг).
После ритуксимаба эпизод с подозрением на ЦМВ-пневмонит был успешно вылечен ацикловиром (более подробную информацию можно найти в дополнительных материалах онлайн), и в последующие 4 недели показатели КТВР значительно улучшились. Пациент выписан домой через 9 недель. Через 8 месяцев после введения начальной дозы ритуксимаба на КТВР на фоне фиброзных изменений снова появилась обширная консолидация, и после БАЛ для исключения инфекции был назначен второй курс ритуксимаба.Одышка постепенно уменьшалась в течение последующих 3 месяцев, хотя значительная остаточная нетрудоспособность сохраняется.
SSc
Пациент 8
У этого 63-летнего мужчины был длительный НСВП, связанный с SSc, симптомы ухудшения и визуализация HRCT, несмотря на микофенилат и преднизолон. Значительная гематурия при применении циклофосфамида препятствовала дальнейшему применению этого препарата. Хотя наблюдалось улучшение симптомов и улучшение через 6 минут ходьбы после приема ритуксимаба (с 198 до 264 м), через 9 месяцев наблюдения не наблюдалось значительных изменений в PFT.
ОБСУЖДЕНИЕ
Наблюдение за тем, что ритуксимаб является эффективным средством спасения у некоторых пациентов с тяжелыми ЗСТ-ВЗЛ, имеет важное клиническое значение. Если эти данные будут подтверждены дальнейшим опытом, больше нельзя будет предполагать, что пациенты с тяжелым прогрессирующим CTD-ILD имеют такой же безрадостный исход лечения, как и пациенты с терминальной фиброзной идиопатической интерстициальной пневмонией. Мы сообщаем об объективном улучшении у семи из восьми пациентов (с очень поразительными улучшениями у пяти пациентов), у которых единственными реалистичными исходами были трансплантация легких или ранняя смерть.
Хотя это исследование можно критиковать как наблюдательное, маловероятно, что в этом контексте можно было бы провести плацебо-контролируемую оценку. В первую очередь, пациенты и многие клиницисты сочтут плацебо-контролируемое исследование неприемлемым в условиях опасного для жизни заболевания, для которого существует открытая терапия с хорошей концептуальной основой для ее использования. Избирательная предвзятость в отношении пациентов с более тяжелым заболеванием, когда доступно открытое лечение, была выделена как одно из ключевых препятствий на пути к очевидным преимуществам в плацебо-контролируемых исследованиях SSc-ILD [22] и при хроническом легочном саркоидозе [22]. 23].Во-вторых, тщательные клинические обсервационные исследования, основанные на лечении, основанном на подтверждении концепции, а не на доказательной базе, могут быть единственно возможным вариантом при редких и / или клинически гетерогенных ИЛЗ, как описано здесь. Наконец, тяжелая терминальная стадия заболевания менее привлекательна для фармацевтических и других финансирующих органов ввиду большего риска неэффективности и применимости только к небольшой подгруппе пациентов, что подчеркивается исключением пациентов с более тяжелым заболеванием в большинстве случаев. недавно завершенные крупные клинические испытания IPF [24–29].
Хотя наш отчет является наблюдательным (с присущими ему ограничениями), наш анализ был перекрестным, и, таким образом, лечебный эффект был по сути более убедительным, чем оценка терапии de novo без ссылки на предыдущие тенденции функции легких. В двух сериях исследований ранее сообщалось об эффективности ритуксимаба при CTD-ILD [18, 19]. Важно отметить, что обе серии включали пациентов с гораздо менее тяжелым интерстициальным поражением легких, чем наша собственная когорта. Сем и др. .[18] сообщили о положительном эффекте ритуксимаба у семи из 11 пациентов с антисинтетазным синдромом-ассоциированным заболеванием, у большинства из которых не удалось добиться традиционной иммуносупрессии [18]. Хотя полные данные о функции легких не приводятся, графическое представление доступных исходных измерений позволяет предположить, что D, , L, CO и FVC были только умеренно или умеренно нарушены ( D L, CO ≥60%, прогнозируемое в восьми из девяти). пациентов, ФЖЕЛ ≥50% у шести пациентов), в отличие от значительно более тяжелого заболевания легких в нашей когорте PM / DM (таблица 2).При SSc-ассоциированном ILD Daoussis et al. [19] и его коллеги сообщили о значительном улучшении PFT после лечения ритуксимабом (по сравнению со стандартной терапией). Опять же, пациенты этой группы, получавшие ритуксимаб, имели менее тяжелые ВЗЛ (средний% прогнозируемый D L, CO 52 ± 21% и FVC 68 ± 20%).
Несмотря на то, что существует мало прогностических данных для очень тяжелых и прогрессирующих CTD-ILD, клинический опыт предполагает ожидаемую выживаемость 6–12 месяцев у пациентов с такой же тяжестью заболевания, как те, которые описаны в нашей когорте.Наши результаты показывают, что в контексте основного аутоиммунитета даже пациенты с очень тяжелой формой ВЗЛ (для которых мы обычно планируем паллиативное лечение) могут быть спасены с помощью ритуксимаба, несмотря на болезнь, которая не поддается лечению всеми традиционными методами лечения. Иммунологическая сверхактивность, по-видимому, является ключевым процессом в прогрессирующем фиброзе легких, даже если фиброз тяжелый, а эффективность ритуксимаба предполагает, что B-лимфоциты являются ключевыми действующими лицами в прогрессировании заболевания.
В этом отчете следует выделить несколько важных моментов.Тяжесть опасного для жизни заболевания у пациентов 1 и 7 (оба из которых находились на ИВЛ на момент направления к специалисту) повлекла за собой решение о введении ритуксимаба и в / в. циклофосфамид одновременно. Это действительно затрудняет точную оценку отдельных эффектов ритуксимаба. Однако циклофосфамид вводился только дважды, в уменьшенной дозе (50–75% от обычно используемой дозы), тогда как стандартный режим для ILD-CTD включал бы шесть ежемесячных доз (по 600 мг · м -2 каждая). [30].Поэтому кажется маловероятным, что малая доза циклофосфамида была эффективна сама по себе в борьбе с разрушительными ILD, хотя нельзя исключить аддитивный эффект. У других пациентов эффект сопутствующей или предшествующей иммуносупрессии следует рассматривать как потенциальный мешающий фактор. Трое получили лечение в / в. циклофосфамид перед переходом на ритуксимаб. Хотя отсроченный эффект i.v. Циклофосфамид нельзя исключить с абсолютной уверенностью, стабилизация и / или улучшение функции легких наблюдались у респондентов в течение 6 месяцев после начала приема циклофосфамида в большой ретроспективной когорте пациентов с прогрессирующим фиброзным заболеванием легких [31].У остальных трех пациентов продолжалось прогрессирование при приеме микофенолата, и ответ на ритуксимаб кажется наиболее правдоподобным объяснением наблюдаемого улучшения.
Незначительный лечебный эффект наблюдался у одного пациента (пациент 8) после приема ритуксимаба. Как описано, у этого 60-летнего мужчины был фиброзный NSIP, связанный с SSc, в течение> 10 лет, и, хотя наблюдалось определенное улучшение симптомов и способности к физической нагрузке через 9 месяцев, значительных изменений в PFT не наблюдалось.
Повышенный риск инфицирования после ритуксимаба вызывает серьезную озабоченность.При злокачественных гематологических заболеваниях повторные дозы ритуксимаба, по-видимому, связаны с повышенным риском инфицирования [32, 33], хотя при ревматологическом заболевании это явно не проявляется. В недавнем метаанализе 745 пациентов с ревматоидным артритом (РА) частота серьезных инфекций существенно не различалась между ритуксимабом и пациентами, получавшими плацебо (2,3%, против , 1,5%) [34]. В долгосрочном анализе безопасности 2578 пациентов с РА, получавших хотя бы один курс ритуксимаба, частота тяжелых инфекций не увеличивалась при последующих дозах, несмотря на увеличение частоты гипогаммаглобулинемии [35].У пациентов, получавших ритуксимаб, описана прогрессирующая мультифокальная лейкоэнцефалопатия. Несмотря на то, что зарегистрированная заболеваемость чрезвычайно низка (менее 1:20 000 у пациентов с РА, принимающих ритуксимаб) [36], пациенты должны находиться под тщательным наблюдением на предмет развития новых или ухудшающихся неврологических симптомов. Сообщалось также о легочных реакциях, индуцированных ритуксимабом, при этом организующаяся пневмония, чувствительная к стероидам, была наиболее частым проявлением в одном систематическом обзоре [37].
У двух пациентов из нашей когорты после приема ритуксимаба развились серьезные инфекционные осложнения.Пациент 7 перенес рецидивирующие инфекции нижних дыхательных путей после приема ритуксимаба, а пациент 5 умер от инфекции дыхательных путей через 18 месяцев после приема ритуксимаба. Пациенту 5 за 4 месяца до смертельной респираторной инфекции начали принимать циклоспорин (в дополнение к давнему микофенолату), чтобы лучше контролировать свой миозит, и трудно установить влияние ритуксимаба на предрасположенность к инфекции. Ни у одного пациента не наблюдалось снижения уровня иммуноглобулина во время наблюдения. Возможность того, что серьезные легочные инфекции, вызванные ритуксимабом, чаще встречаются у пациентов с ILD по сравнению с аутоиммунными заболеваниями без значительного поражения легких, необходимо дополнительно изучить.
Заключение
В выбранной группе пациентов с тяжелыми, прогрессирующими ЗСТ-ассоциированными ИЛЗ, резистентными к традиционному иммуносупрессивному лечению, терапия ритуксимабом была связана со значительными клиническими и функциональными улучшениями. Необходима дальнейшая работа для подтверждения этих результатов, определения путей, посредством которых абляция В-клеток может подавлять фиброз легких, а также для оценки лучших схем повторного лечения и оценки долгосрочных результатов и проблем безопасности.
- Поступила 20.09.2011.
- Принято 2 января 2012 г.
Роль IL-22 в здоровье и болезнях кишечника | Журнал экспериментальной медицины
РТПХ остается основной причиной заболеваемости и смертности среди аллогенных
трансплантация гемопоэтических стволовых клеток (Blazar
и др., 2012). Перед трансплантацией пациентов кондиционируют:
облучение или химиотерапевтические препараты для уничтожения иммунных клеток хозяина, которые также могут
приводят к нарушению эпителиального барьера (Hill
и Феррара, 2000).Последующая утечка микробных продуктов в
системное кровообращение активирует реципиентный антиген, представляющий
клеток и увеличивают последующую экспансию донорских Т-клеток, в результате чего Т
клеточно-зависимое воспаление (рис. 2 А).
IL-22 регулирует патогенез GVHD во многих тканевых компартментах на разных участках.
этапы. В кишечнике IL-22 из кишечных клеток ILC3 поддерживает кишечные
регенерация эпителия и барьерная функция (Hanash et al., 2012; Lindemans et al.
др., 2015). При тестировании на доклинических моделях острой РТПХ
лечение рекомбинантным ИЛ-22 в целом улучшило течение болезни, увеличило
количество стволовых клеток Lgr5 + , повышенная экспрессия
антимикробные пептиды Reg3α и Reg3γ и улучшенные эпителиальные
целостность (Lindemans et al., 2015; Zhao et al., 2018). Благотворное
действие IL-22 не ограничивается кишечником, поскольку IL-22 также имеет решающее значение для
регенерация и выживание эпителиальных клеток тимуса (Дудаков и др., 2017; Pan et al., 2019). IL-22, полученный из резидента тимуса ILC3, поддерживает
регенерация тимуса при аллогенной трансплантации (Дудаков и др., 2012, 2017). Соответственно, недостаток реципиентного ИЛ-22 приводит к снижению
количество эпителиальных клеток тимуса и последующая экспрессия генов, связанных с
тимический отрицательный отбор (например, Foxn1 , Aire ).
Этот эффект IL-22 может усугублять РТПХ из-за неправильного отрицательного отбора
аутореактивные Т-клетки (Дудаков и др.,
2017; Pan et al., 2019).
Как обсуждалось выше, Reg3α и Reg3γ могут секретироваться IEC при
Стимуляция IL-22 (Zheng et al.,
2008 г.). Повышенный уровень Reg3α в сыворотке крови является прогностическим биомаркером тяжелого
кишечная РТПХ, которая встречается у 9–15% пациентов, получающих аллогенные
гемопоэтическая трансплантация (Ferrara et al.,
2011; Чжао и др., 2018).
Вероятно, повышенные уровни Reg3α в сыворотке отражают более серьезное повреждение
кишечный барьер, который предрасполагает пациентов к более тяжелым кишечным
РТПХ. В то время как уровень IL-22 и Reg3α повышается в воспаленных тканях кишечника,
как и ВЗК, неясно, играют ли они роль в развитии болезни,
или являются ли они частью недостаточной попытки устранить повреждение.в
В последнем случае введение супрафизиологического уровня IL-22 может, таким образом,
защитный эффект. Такой эффект также может зависеть от времени
лечение, как вмешательство до появления сильного аллогенного иммунитета
ответ может иметь больше шансов на успех. Тем не менее, как и в случае с ВЗК, существуют также
некоторые доклинические результаты, которые могут служить предостережением. В частности, одно исследование
продемонстрировали, что воспаление, толщина эпидермиса кожи и фиброз были
снижается при нейтрализации IL-22 в модели кожной GVHD (Gartlan et al., 2018), присвоив
роль IL-22 в развитии заболевания во время хронического воспаления. Такая роль могла бы
согласовываться с другими наблюдениями о роли IL-22 в развитии заболевания в
кожа. Например, лечение фезакинумабом привело к улучшению клинического состояния.
баллы у пациентов, страдающих атопическим дерматитом, в первую очередь
с повышенным уровнем сывороточного IL-22 (Brunner
и другие., 2019; Гутман-Ясский и др.
др., 2018). Уровни IL-22 также повышены при псориазе (Caproni et al., 2009), но с тех пор
фезакинумаб и ILV-095 были выведены из клинических исследований на раннем этапе
псориаз (NCT01010542 и NCT00563524 соответственно), и результатов не было.
опубликованы выводы о роли IL-22 в псориатическом воспалении кожи.
не может быть нарисован в это время. В свете разрозненных результатов исследования мышей
моделей, общий эффект агонизма IL-22 в контексте GVHD должен будет
определяться в клинике.В настоящее время слитый белок IL-22-IgG2 (F-652; Tang et al., 2019) находится в стадии разработки.
исследование для лечения острой GHVD нижних отделов желудочно-кишечного тракта
(NCT02406551). Отдельно эта молекула также оценивается у пациентов.
с алкогольным гепатитом (NCT02655510).
Genentech: Мэри Кейр | Главный научный сотрудник, Biomarker Discovery OMNI
Журнал экспериментальной медицины, ISSN: 15409538 00221007
Мэри Кейр; Таншэн И; Тимоти Т.Лу; Нико Гиларди
Роль интегринов в патогенезе воспалительного заболевания кишечника: одобренные и исследуемые методы антиинтегриновой терапии
Обзоры медицинских исследований, ISSN: 01986325
Ирис Дотан; Матье Аллез; Сильвио Данезе; Мэри Кейр; Свати Толе; Жаклин МакБрайд
Границы иммунологии, ISSN: 16643224
WeiYu Lin; Даци Сюй; Кэри Остин; Патрик Каплази; Кейт Сенгер; Юнлянь Сунь; Суриндер Джит; Джуди Янг; Донни Делароза; Эрик Суто; Чжию Хуан; Хуан Чжан; Дунхун Янь; Алекс Корсо; Кай Барк; Шармила Раджан; Майк Луни; Винила Гандхэм; Джастин Леш; Вэй-Чинг Лян; Элейн Май; Хай Нгу; Навнит Ратти; Юнмэй Чен; Миснер; Тори Линь; Дмитрий Даниленко; Паула Катаволос; Эстель Дудемон; Хирдеш Уппал; Джеффри Истхэм; Джуди Мак; Патрисия Э.де Алмейда; Кэтрин Бао; Азаде Хададианпур; Мэри Кейр; Рик Карано; Лаури Диль; Мин Сюй; Ян Ву; Робби М. Веймер; Джейсон ДеВосс; Вайн П. Ли; Мерседес Балаш; Кевин Уолш; Катила Алацис; Флавий Мартин; Али Заррин
Важность молекулярных иммунных исследований в терапевтических клинических разработках для оценки биомаркеров
Журнал Крона и колита,
Кристофер А.Ягненок; Джон К. Мэнсфилд; Джон А. Кирби; Мэри Кейр
Журнал Крона и колита, ISSN: 18764479
Райан Итикава; Кристофер А.Ягненок; Джефф Истхэм; Алексис Шерл; Лаура Раффалс; Уильям А. Фобион; Мириам Р. Беннетт; Анна К. Лонг; Джон К. Мэнсфилд; Джон А. Кирби; Мэри Кейр
Журнал Крона и колита, ISSN: 18764479 18739946
Кристофер А.Ягненок; Шэрон О’Бёрн; Мэри Кейр; Юджин С. Бутчер
Пищевая фармакология и терапия, ISSN: 13652036 02692813
Meina Tao Tang; Мэри Кейр; Рич Эриксон; Эрик Стефанич; Франклин Фух; Тереза Рамирес Монтэгут; Жаклин МакБрайд; Димитрий Даниленко
Nature Immunology, ISSN: 15292916 15292908
Мохаммад Сами; Чонхён Лим; Эрик Вершуерен; Джошуа Боуман; Иван Пэн; Аарон Вонг; Ёнсу Квон; Ясин Сенбабаоглу; Джейсон Хакни; Мэри Кейр; Брент Маккензи; Дон Киркпатрик; Менно ван Лукирен Кампань; Адитья Мурти
Журнал Крона и колита, ISSN: 18764479
Кристофер А.Ягненок; Джон А. Кирби; Мэри Кейр; Джон К. Мэнсфилд
Журнал Крона и колита, ISSN: 18764479
Кристофер А.Ягненок; Джон К. Мэнсфилд; Вэй Тью; Дон Л. Гиббонс; Анна К. Лонг; Питер М. Ирвинг; Лаури Диль; Джефф Истхэм Андерсон; Мария Б. Прайс; Грэм О’Бойл; Дэвид Э. Дж. Джонс; Шэрон О’Бёрн; Адриан К. Хейдей; Мэри Кейр; Джексон Эген; Джон А. Кирби
Кишечник, ISSN: 14683288
Жан-Фредерик Коломбель; Мэри Кейр; Алексис Шерл; Руи Чжао; Герт Де Хертог; Уильям А.Faubion Jr .; Тим Лу
Гастроэнтерология, ISSN: 15280012
Мэри Кейр; Вэй Тью; Джейсон Хакни
Гастроэнтерология, ISSN: 15280012
Wei Tew; Джейсон Хакни; Дина Гиббонс; Кристофер А.Ягненок; Диана Лука; Джексон Эген; Лаури Диль; Джефф Истхэм Андерсон; Северин Вермейр; Джон К. Мэнсфилд; Брайан Г. Фиган; Хулиан Панес; Дэниел К. Баумгарт; Стефан Шрайбер; Ирис Дотан; Уильям Дж. Сэндборн; Джон А. Кирби; Питер М. Ирвинг; Герт Де Хертог; Герт А. Ван Аше; Пол Рутгертс; Шэрон О’Бёрн; Адриан К. Хейдей; Мэри Кейр
Клиническая иммунология, ISSN: 15217035
Джо Аррон; Майкл Таунсенд; Мэри Кейр; Брайан Яспан; Эндрю С.Чан
Ланцет, ISSN: 1474547X
Séverine Vermeire; Шэрон О’Бёрн; Мэри Кейр; Марна Уильямс; Тим Лу; Джон К. Мэнсфилд; Кристофер А.Ягненок; Брайан Г. Фиган; Хулиан Панес; Азучена Салас; Дэниел К. Баумгарт; Стефан Шрайбер; Ирис Дотан; Уильям Дж. Сэндборн; Вэй Тью; Диана Лука; Meina Tang; Лаури Диль; Джефф Истхэм Андерсон; Герт Де Хертог; Клементина Перье; Джексон Эген; Джон А. Кирби; Герт Ван Аше; Пол Дж. Рутгертс
PLoS ONE, ISSN: 19326203
Стивен Каудер; Лидия Сантелл; Элейн Май; Лилиан Райт; Элизабет Луис; Эльза Ндиайе-Дюлак; Джефф Лутман; Навнит Ратти; Сьюзан Са; Генри Маун; Эрик Стефанич; Лино Гонсалес; Роб Грэм; Лаури Диль; Уильям А.Faubion Jr .; Мэри Кейр; Джуди Янг; Амитабха Чаудхури; Боб Лазарус; Джексон Эген
Американский журнал гастроэнтерологии, ISSN: 00029270
Уильям А.Faubion Jr .; Джоэл Дж. Флетчер; Шэрон О’Бёрн; Брайан Г. Фиган; Виллем Дж. де Вильерс; Брюс Зальцберг; Скотт Э. Плеви; Дебора Д. Проктор; Джон Ф. Валентайн; Хиггинс; Джефф Харрис; Лаури Диль; Лилиан Райт; Вэй Тью; Диана Лука; Карен Басу; Мэри Кейр
Кишечник, ISSN: 00175749
Пол Дж.Рутгертс; Ричард Н. Федорак; Даан В. Хоммес; Андреас Штурм; Дэниел К. Баумгарт; Брайан Бресслер; Стефан Шрайбер; Джон К. Мэнсфилд; Марна Уильямс; Meina Tang; Джен Висич; Сяохуэй Вэй; Мэри Кейр; Диана Лука; Дмитрий Даниленко; Джексон Эген; Шэрон О’Берн
PLoS ONE, ISSN: 19326203
Маниш Дж.Бьютт; Сун Чжон Ли; Джонатан Джеснек; Мэри Кейр; В. Николас Хейнинг; Арлин Х. Шарп
Журнал клинических исследований, ISSN: 00219738
Скотт Н.Мюллер; Виджай К. Вангури; Санг-Джун Ха; Эрин Э. Уэст; Мэри Кейр; Джонатан Н. Гликман; Арлин Х. Шарп; Рафи Ахмед
PLoS Pathogens, ISSN: 15537374
Шерил А.Стоддарт; Мэри Кейр; Джозеф М. МакКьюн
Волчанка, ISSN: 09612033
Wei Tew; Rabbee; Кристен Волслегель; Синь-Цзюй Се; Джон Монро; Тим Беренс; Поль Брунетта; Мэри Кейр
Иммунитет, ISSN: 10747613
Джон Монро; Мэри Кейр
Внеклеточные ловушки нейтрофилов, тяжесть заболевания и ответ на антибиотики при бронхоэктазах: международное, обсервационное, многоконтактное исследование
Резюме
Предпосылки
Бронхоэктазы — это преимущественно нейтрофильное воспалительное заболевание.Не существует установленных методов лечения, которые непосредственно нацелены на нейтрофильное воспаление, потому что мало изучены основные механизмы, ведущие к тяжелому заболеванию. Формирование внеклеточной ловушки нейтрофилов (NET) — это метод защиты хозяина, который вовлечен во множественные воспалительные заболевания. Мы стремились изучить роль НЭО в тяжести заболевания и реакции на лечение бронхоэктазов.
Методы
В этом наблюдательном исследовании мы провели серию британских и международных исследований, чтобы изучить роль NET в тяжести заболевания и реакции на лечение при бронхоэктазах.Во-первых, мы использовали жидкостную хроматографию-тандемную масс-спектрометрию для определения протеомных биомаркеров, связанных с серьезностью заболевания, определяемой с помощью индекса тяжести бронхоэктазов, у пациентов с бронхоэктазами (n = 40) в Данди, Великобритания. Во-вторых, мы проверили эти биомаркеры в двух когортах пациентов с бронхоэктазами, первая из которых включала 175 пациентов из исследования TAYBRIDGE в Великобритании, а вторая — 275 пациентов из когортного исследования BRIDGE из центров Италии, Испании и Великобритании, с использованием иммуноанализа. для измерения NET.В-третьих, мы исследовали, влияют ли патогенные бактерии на концентрацию NET у пациентов с тяжелыми бронхоэктазами. В отдельное исследование мы включили пациентов с обострениями бронхоэктазов (n = 20) в Данди, получавших внутривенные антибиотики в течение 14 дней, и протеомика использовалась для определения белков, связанных с ответом на лечение. Результаты этой когорты были подтверждены на независимой когорте пациентов, которые были госпитализированы в ту же больницу (n = 20). В-четвертых, чтобы оценить потенциальное использование макролидов для снижения NET у пациентов с бронхоэктазами, мы изучили два исследования долгосрочного лечения макролидами, одно — у пациентов с бронхоэктазами (n = 52 из Великобритании), в которых пациентам давали 250 мг азитромицина. три раза в неделю в течение года, а также ретроспективный анализ австралийского исследования AMAZES с участием пациентов с астмой (n = 47), которым давали 500 мг азитромицина 3 раза в неделю в течение года.
Результаты
Протеомика мокроты определила, что NET-ассоциированные белки были наиболее распространенными и были белками, наиболее тесно связанными с тяжестью заболевания. Этот результат был подтвержден в двух наблюдательных когортах, в которых НЭО мокроты были связаны с индексом тяжести бронхоэктазов, качеством жизни, будущим риском госпитализации и смертностью. В подгруппе из 20 пациентов с обострениями клинический ответ на внутривенное лечение антибиотиками был связан с успешным снижением NET в мокроте.Пациенты с инфекцией Pseudomonas aeruginosa имели меньший протеомный и клинический ответ на внутривенное лечение антибиотиками по сравнению с пациентами без инфекции Pseudomonas , но ответили на терапию макролидами. Лечение низкими дозами азитромицина было связано со значительным снижением NET в мокроте в течение 12 месяцев как при бронхоэктазах, так и при астме.
Интерпретация
Мы определили NET как ключевой маркер тяжести заболевания и ответа на лечение при бронхоэктазах.Эти данные подтверждают концепцию борьбы с нейтрофильным воспалением с помощью существующих и новых методов лечения.
Финансирование
Правительство Шотландии, Британский фонд легких и Европейское многоцентровое сотрудничество по аудиту и исследованиям бронхоэктазов (EMBARC).
Сэр Кейр Стармер: предвидение без видения
S Лейбористская партия ИР КЕЙРА СТАРМЕРА Лидерство Лейбористской партии произошло полностью в эпоху covid-19 — он был избран 4 апреля, но политика болезни полностью изменилась за это короткое время.В прошлый раз, когда Великобритания была заблокирована, лидер оппозиции ходил по яичной скорлупе. Критика стратегии правительства выглядела бы оппортунистической или непатриотичной. На этот раз он катается на серфинге. Серийная некомпетентность поставила правительство в честную игру. Чувство национального единства, которое начало распадаться, когда главный советник премьер-министра нарушил правила изоляции, полностью исчезло. Когда тори вцепились друг другу в глотку, никто не может возражать против жесткой критики со стороны лейбористов.
Послушайте эту историю
Ваш браузер не поддерживает элемент
Больше аудио и подкастов на iOS или Android.
Последний успех сэра Кейра — это сама изоляция. 13 октября он начал выступать за двух-трехнедельный «перерыв», чтобы он совпал с половиной срока. Его позиция перекликается с позицией SAGE , правительственной группы научных советников. Борис Джонсон категорически отверг его совет на том основании, что полная изоляция будет «национальной катастрофой».Затем премьер-министр провел три недели, пытаясь заставить свою многоуровневую систему работать, только чтобы изменить себя и ввести национальную изоляцию.
Это хорошо согласуется с основной линией атаки лейбористов: премьер-министр с самого начала медленно и неуклюже справлялся с вирусом. Повернувшееся лицо мистера Джонсона заставляет его выглядеть слабым и неуверенным, а сэра Кейра — дальновидным и решительным. Это также дает лидеру лейбористов лицензию одновременно выступать за и против изоляции: всякий раз, когда кто-либо упоминает о затратах на закрытие страны, он может утверждать, что они были бы ниже, если бы только премьер-министр действовал раньше.Консервативная партия посвятила много энергии тому, чтобы называть сэра Кейра «капитаном ретроспективным взглядом». Мистер Джонсон мгновенно превратил его в капитана Предвидения.
Хороший призыв сэра Кейра о карантине совпадает с одной удачей: резким отчетом Комиссии по вопросам равенства и прав человека об антисемитизме в партии под руководством его предшественника и пренебрежительной реакцией Джереми Корбина на него. Г-на Корбина быстро отстранили от вечеринки. Избавление от бывшего лидера — опасный маневр, особенно когда этот лидер является героем не только для грубых старых левых, но и для молодых идеалистов, хлынувших в партию, когда он пришел к власти в 2015 году.Более того, жесткие левые — опасные враги, учитывая их давние воспоминания и привычку прятаться в темных коридорах партийной техники с ледорубами в руках. Но до сих пор этот шаг окупился, заставив сэра Кейра выглядеть жестким, не вызвав восстания в парламентской партии. Наиболее активные сторонники Корбина состоят в основном из бывших и неудачников — действительно, Крис Уильямсон, один из самых громких из них, был исключен из партии из-за антисемитизма. Это больше похоже на предсмертный хрип умирающего режима, чем на живую угрозу в будущем.
Удача в политике распределяется не случайно: она достается хорошо подготовленным и смелым. Сэр Кейр проделал терпеливую работу, взяв на себя руководство партией. Вместо того, чтобы привлекать старых блейристов, таких как Хилари Бенн, в теневой кабинет, он назначил новое поколение сотрудников MP и привел в свой кабинет энергичных молодых советников. Парламентская партия стала более дисциплинированной, чем это было в течение многих лет. Джон МакТернан, бывший политический советник Тони Блэра, указывает, что разница между первоклассными барристерами и рангами заключается в их чувстве выбора времени: они знают не только, какая слабость в случае их оппонента является наиболее разрушительной, но и точно. когда выставлять.Во всем, начиная с увольнения своего левого соперника за лидерство, Ребекки Лонг-Бейли, из теневого кабинета — одного из его первых шагов в качестве лидера — до призыва ко второй изоляции, сэр Кейр использовал навыки, которые он отточил в своей работе. карьера.
Возможно, учитывая развалины правительства Джонсона, профессионализма, компетентности и нормальности сэра Кейра будет достаточно, чтобы победить на следующих выборах. Но из-за краха лейбористов в Шотландии избирательная гора, на которую он должен подняться, намного выше, чем та, с которой столкнулся Тони Блэр в 1997 году.А Консервативная партия имеет выдающийся послужной список избавления от неудачливых лидеров: примечательно, что Лейбористская партия теперь перекладывает огонь с г-на Джонсона, который начинает вести себя как вчерашний человек, на своего канцлера Риши Сунака, который такой же нормальный, профессиональный и компетентный, как сэр Кейр.
Лидеры лейбористов, нарушившие длительные периоды правления консерваторов, предложили нечто большее, чем компетентность: вдохновляющее видение будущего. Клемент Эттли предложил заменить старую лоскутную лоскутную одежду дьявола на задний план современным государством всеобщего благосостояния, а классовое общество — меритократией.Гарольд Уилсон говорил о «белом накале технологической революции». Тони Блэр выбрал третий путь между социализмом и капитализмом.
Основные инициативы сэра Кейра ориентированы на партии и ориентированы на прошлое: вернуть себе традиционных лейбористских избирателей в Мидлендсе и на севере, избавить партию от ее непатриотичного имиджа, изгнать антисемитов. Он ничего не сказал о великих проблемах, которые определят будущее: как Британия должна попытаться определить себя после Брексита, как помешать независимости Шотландии или даже — в конце концов, это лейбористская партия — как будет выглядеть работа, когда пандемия разразится. над.«Технократический, гнусный и скучный» — так ветеран лейбористской партии резюмирует свой стиль.
Это еще только начало эры Кейра, и в разгар пандемии, возможно, не самое подходящее время для того, чтобы открывать новые блестящие видения будущего. Но сэр Кейр не подал никаких признаков того, что он способен обеспечить то, что Джордж Буш-старший назвал «вещью видения», или продвигать других, которые могут сделать это за него. Эттли, Уилсон и Блэр окружили себя большими политическими зверями, которые прекрасно понимали не только, как получить власть, но и то, что они хотели с ней делать.Сегодня в топ-листе лейбористов полно технократов, но мало гуру. Сэр Кейр, возможно, сбросил ярлык капитана задним числом, когда дело доходит до пандемии, но если он хочет вдохновить избирателей, ему нужно будет убедить своих соотечественников, что он может выйти за рамки следующего карантина. ■
Эта статья появилась в Великобритании раздел печатного издания под заголовком «Капитан Предвидение»
Истории из жизни Пирса Моргана: Сэр Кейр Стармер плачет, когда делится последними воспоминаниями о матери перед ее смертью | Новости Великобритании
Сэр Кейр Стармер поделился некоторыми из своих последних воспоминаний о своей матери в эмоциональном телеинтервью.
Лидер лейбористов, 58 лет, со слезами на глазах говорил на Пирс Морган «Истории жизни», рассказывая о смерти своей матери за несколько недель до того, как он стал депутатом парламента в 2015 году.
Мать сэра Кейра , Жозефина, страдала редким заболеванием, называемым болезнью Стилла, которое вызывает болезненные опухоли в суставах.
Изображение:
Сэр Кейр сказал, что его отец так и не оправился от смерти матери. Рис: ITV
Оба родителя сэра Кейра были сторонниками лейбористов и назвали своего сына в честь Кейра Харди, первого лидера партии.
Сэр Кейр сказал: «Моя мама заболела болезнью Стилла — это болезнь, поражающая ваши суставы.
«Для некоторых людей это приходит и уходит, для мамы это приходило, и оно приходило, и оно приходило снова.
«Мой папа был полностью ей предан, и я помню, как был дома, и он позвонил.
» И он сказал: ‘Твоя мама не выживет, ты можешь сказать остальным?’ и это поразило меня. «
Сэр Кейр был вторым из четырех детей своего родителя.
Морган спросил, жестоко ли поступил отец политика, Родни.
Лидер лейбористов сказал: «Нет. Он не собирался оставлять ее, у него нет возможности выйти из больницы, даже чтобы рассказать своим детям.
Изображение:
Мать сэра Кейра умерла, когда он выступал за то, чтобы стать депутатом в 2015 году.
«Он собирался остаться там с ней, он всегда так делал — рядом с ней в отделении с высокой зависимостью — и если он не мог быть там, он спал на стульях снаружи.
» Не было никакого способа, которым он был возвращаясь домой, он не оставит ее.Так было каждый раз, когда она лежала в больнице, он не отходил от нее.
«И когда она умерла, это сломало его».
Родни Стармер умер в 2018 году, три года спустя.
Сэр Кейр сказал, что после смерти Жозефины его отец «выжил, но так и не выздоровел».
Морган продолжал спрашивать лидера лейбористов, удалось ли ему сказать все, что он хотел сказать своей матери, когда она умирала.
Сэр Кейр сказал: «Нет. И это трагедия, когда кто-то теряет способность говорить, потому что вы не знаете, прежде чем они потеряют способность говорить, что это произойдет, поэтому у вас никогда не будет такого разговора.
