(PDF) Инвазия опухолевых эпителиальных клеток: механизмы и проявления
30 | ACTA NATURAE | ТОМ 7 № 2 (25) 2015
ОБЗОРЫ
36. Gaggioli C., Hooper S., Hidalgo-Carcedo C., Grosse R.,
Marshall J.F., Harrington K., Sahai E. // Nat. Cell Biol. 2007.
V. 9. № 12. P. 1392–1400.
37. Friedl P., Wolf K. // Cancer Res. 2008. V. 68. № 18. P. 7247–7249.
38. Scott R.W., Hooper S., Crighton D., Li A., Konig I., Munro J.,
Trivier E., Wickman G., Morin P., Croft D.R., et al. // J. Cell
Biol. 2010. V. 191. № 1. P. 169–185.
39. Schoumacher M., Goldman R.D., Louvard D., Vignjevic D.M.
// J. Cell Biol. 2010. V. 189. № 3. P. 541–556.
40. Friedl P. // Curr. Opin. Cell Biol. 2004. V. 16. № 1. P. 14–23.
41. Madsen C.D., Sahai E. // Dev Cell. 2010. V. 19. № 1. P. 13–26.
42. Sanz-Moreno V., Gadea G., Ahn J., Paterson H., Marra P.,
Pinner S., Sahai E., Marshall C.J. // Cell. 2008. V. 135. № 3.
P. 510–523.
43. Carragher N.O., Walker S.M., Scott Carragher L.A., Harris
F., Sawyer T.K., Brunton V.G., Ozanne B.W., Frame M.C. //
Oncogene. 2006. V. 25. № 42. P. 5726–5740.
44. Yamazaki D., Kurisu S., Takenawa T. // Oncogene. 2009.
V. 28. № 13. P. 1570–1583.
45. Siletz A., Schnabel M., Kniazeva E., Schumacher A.J., Shin
S., Jeruss J.S., Shea L.D. // PLoS One. 2013. V. 8. № 4. e57180.
46. Friedl P., Wolf K., Lammerding J. // Curr. Opin. Cell Biol.
2011. V. 23. № 1. P. 55–64.
47. Чикина А.С., Александрова А.Ю. // Молекуляр. биология.
2014. Т. 48. № 2. С. 195–213.
48. Ehrbar M., Sala A., Lienemann P., Ranga A., Mosiewicz K.,
Bittermann A., Rizzi S.C., Weber F.E., Lutolf M.P. // Biophys. J.
2011. V. 100. № 2. P. 284–293.
49. Abreu-Blanco M.T., Verboon J.M., Parkhurst S.M. // Curr.
Biol. 2014. V. 24. № 2. P. 144–155.
50. Li H., Peyrollier K., Kilic G., Brakebusch C. // Biofactors.
2014. V. 40. № 2. P. 226–235.
40. № 2. P. 226–235.
51. Lash L.L., Wallar B.J., Turner J.D., Vroegop S.M., Kilkuskie
R.E., Kitchen-Goosen S.M., Xu H.E., Alberts A.S. // Cancer
Res. 2013. V. 73. № 22. P. 6793–6803.
52. Militello R., Colombo M.I. // Commun. Integr. Biol. 2013. V. 6.
№ 5. e25460.
53. Bloomfield G., Skelton J., Ivens A., Tanaka Y., Kay R.R. //
Science. 2010. V. 330. № 6010. P. 1533–1536.
54. Sabeh F., Shimizu-Hirota R., Weiss S.J. // J. Cell Biol. 2009.
V. 185. № 1. P. 11–19.
55. Gadea G., Sanz-Moreno V., Self A., Godi A., Marshall C.J. //
Curr. Biol. 2008. V. 18. № 19. P. 1456–1465.
56. Chaussepied M., Janski N., Baumgartner M., Lizundia R.,
Jensen K., Weir W., Shiels B.R., Weitzman J.B., Glass E.J.,
Werling D., et al. // PLoS Pathog. 2010. V. 6. № 11. e1001197.
57. Tozluoglu M., Tournier A.L., Jenkins R.P., Hooper S., Bates
P.A., Sahai E. // Nat. Cell. Biol. 2013. V. 15. № 7. P. 751–762.
58. Miyazawa Y., Uekita T., Ito Y., Seiki M., Yamaguchi H., Sakai
R. // Mol. Cancer Res. 2013. V. 11. № 6. P. 628–637.
59. Razidlo G.L., Schroeder B., Chen J., Billadeau D.D., McNiven
M.A. // Curr. Biol. 2014. V. 24. № 1. P. 86–93.
60. Bakal C. // J. Cell Biol. 2013. V. 203. № 3. P. 378–379.
61. Synek L., Sekeres J., Zarsky V. // Front. Plant Sci. 2014. V. 4.
P. 543.
62. Pinner S.E., Sahai E. // F1000 Biol. Rep. 2009. V. 1. P. 67.
63. Gerlitz G., Bustin M. // Trends Cell Biol. 2011. V. 21. № 1.
P. 6–11.
64. Condeelis J., Segall J.E. // Nat. Rev. Cancer. 2003. V. 3. № 12.
P. 921–930.
65. Ewald P.W., Swain Ewald H.A. // Evol. Appl. 2013. V. 6. № 1.
P. 70–81.
66. Berton S., Belletti B., Wolf K., Canzonieri V., Lovat F.,
Vecchione A., Colombatti A., Friedl P., Baldassarre G. // Mol.
Cell Biol. 2009. V. 29. № 18. P. 5031–5045.
67. Häger A., Alexander S., Friedl P. // Eur. J. Cancer Suppl.
2013. V. 11. № 2. P. 291–293.
68. Васильев Ю.М., Гельфанд И.М. // Биохимия. 2006. Т. 71.
№ 8. С. 1013–1020.
69. Micalizzi D.S., Farabaugh S.M., Ford H.L. // J. Mammary
Gland Biol. Neoplasia. 2010. V. 15. № 2. P. 117–134.
70. Said N.A., Williams E.D. // Cells Tissues Organs. 2011. V. 193.
№ 1–2. P. 85–97.
71. Kim S., Lee J.W. // Genomics Inform. 2014. V. 12. № 1.
P. 12–20.
72. Tsai J.H., Yang J. // Genes Dev. 2013. V. 27. № 20. P. 2192–
2206.
73. Gotte M., Kersting C., Radke I., Kiesel L., Wulfing P. //
Breast Cancer Res. 2007. V. 9. № 1. P. R8.
74. Savagner P. // Ann. Oncol. 2010. V. 21 Suppl 7. P. vii89–92.
75. Lu M., Jolly M.K., Levine H., Onuchic J.N., Ben-Jacob E. //
Proc. Natl. Acad. Sci. USA. 2013. V. 110. № 45. P. 18144–18149.
76. Tsai J.H., Donaher J.L., Murphy D.A., Chau S., Yang J. //
Cancer Cell. 2012. V. 22. № 6. P. 725–736.
77. Taddei M.L., Giannoni E., Morandi A., Ippolito L., Ramazzotti
M., Callari M., Gandellini P., Chiarugi P. // Cell Commun.
Signal. 2014. V. 12. P. 24.
78. Giannoni E., Parri M., Chiarugi P. // Antioxid. Redox Signal.
2012. V. 16. № 11. P. 1248–1263.
79. Ocana O.H., Corcoles R., Fabra A., Moreno-Bueno G.,
Acloque H., Vega S., Barrallo-Gimeno A., Cano A., Nieto M.A.
// Cancer Cell. 2012. V. 22. № 6. P. 709–724.
80. Bindels S., Mestdagt M., Vandewalle C., Jacobs N., Volders
L., Noel A., van Roy F., Berx G., Foidart J.M., Gilles C. //
Oncogene. 2006. V. 25. № 36. P. 4975–4985.
81. Vandewalle C., Van Roy F., Berx G. // Cell Mol. Life Sci. 2009.
V. 66. № 5. P. 773–787.
82. Samatov T.R., Tonevitsky A.G., Schumacher U. // Mol.
Cancer. 2013. V. 12. № 1. P. 107.
83. Sanchez-Tillo E., Liu Y., de Barrios O., Siles L., Fanlo L.,
Cuatrecasas M., Darling D.S., Dean D.C., Castells A., Postigo A.
// Cell Mol. Life Sci. 2012. V. 69. № 20. P. 3429–3456.
2012. V. 69. № 20. P. 3429–3456.
84. De Craene B., Berx G. // Nat. Rev. Cancer. 2013. V. 13. № 2.
P. 97–110.
85. Friedl P., Wolf K. // Nat. Rev. Cancer. 2003. V. 3. № 5.
P. 362–374.
86. Tsuji T., Ibaragi S., Hu G.F. // Cancer Res. 2009. V. 69. № 18.
P. 7135–7139.
87. Zavyalova M.V., Perelmuter V.M., Vtorushin S.V., Denisov
E.V., Litvyakov N.V., Slonimskaya E.M., Cherdyntseva N.V. //
Diagn. Cytopathol. 2013. V. 41. № 3. P. 279–282.
88. Геращенко Т.С., Денисов Е.В., Литвяков Н.В., Завьялова
М.В., Вторушин С.В., Цыганов М.М., Перельмутер В.М.,
Чердынцева Н.В. // Биохимия. 2013. Т. 78. № 11. С. 1531–1549.
89. Denisov E.V., Geraschenko T.S., Zavyalova M.V., Litviakov
N.V., Tsyganov M.M., Kaigorodova E.V., Slonimskaya E.M.,
Kzhyshkowska J., Cherdyntseva N.V., Perelmuter V.M. //
Neoplasma. 2015. doi: 10.4149/neo_2015_041 [Epub ahead of
print].
90. Alexander S., Friedl P. // Trends Mol. Med. 2012. V. 18. № 1.
P. 13–26.
91. Goswami S., Wang W., Wyckoff J.B., Condeelis J.S. // Cancer
Res. 2004. V. 64. № 21. P. 7664–7667.
92. Mallini P., Lennard T., Kirby J., Meeson A. // Cancer Treat.
Rev. 2014. V. 40. № 3. P. 341–348.
93. Chen W.J., Wang H., Tang Y., Liu C.L., Li H.L., Li W.T. //
Chin. J. Cancer. 2010. V. 29. № 2. P. 151–157.
94. Li Q.Q., Xu J.D., Wang W.J., Cao X.X., Chen Q., Tang F., Chen
Z.Q., Liu X.P., Xu Z.D. // Clin. Cancer Res. 2009. V. 15. № 8.
P. 2657–2665.
Особенности внутрикишечной опухолевой инвазии в проксимальном направлении при раке прямой кишки
Городская больница № 40
СПбГУ, медицинский факультет, кафедра хирургии
Аннотация. Представлены результаты гистологических исследований распространения «ракового поля» в проксимальном направлении при раке прямой кишки. Необходимость таких исследований обусловлена важностью сохранения дистальных отделов сигмовидной кишки, при выполнении передней резекции прямой кишки, с целью улучшения резервуарной и эвакуаторной функций.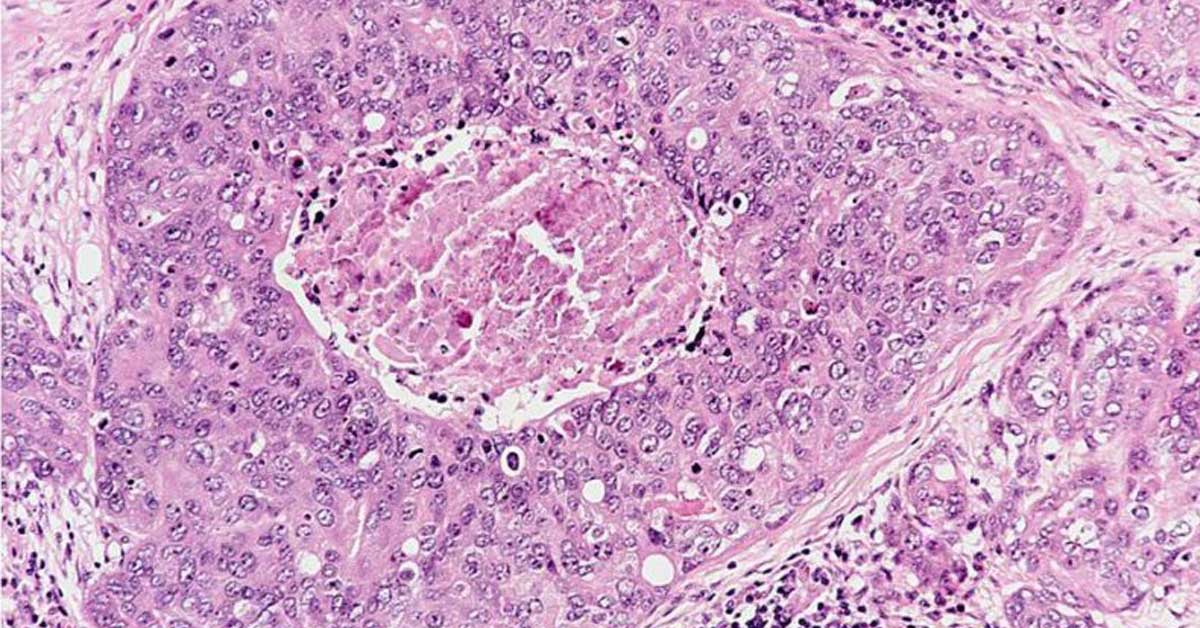 В результате определено минимальное расстояние от верхнего края опухоли, которое необходимо отступить при пересечении кишки, не нарушая онкологических принципов оперирования.
В результате определено минимальное расстояние от верхнего края опухоли, которое необходимо отступить при пересечении кишки, не нарушая онкологических принципов оперирования.
Клинические наблюдения о несомненной важности бережного отношения к дистальной части сигмовидной кишки при передних резекциях прямой кишки (ПК), побудили нас изучить распространенность ракового поля в проксимальном направлении от верхнего края раковой опухоли. Знания эти должны лечь в основу рекомендаций, насколько минимально допустимо отступать от верхнего края опухоли при резекции сигмовидной кишки, не нарушая онкологических принципов оперирования. Такая озабоченность связана с тем, что у больных, у которых при резекции ПК для анастомоза использовалась самая дистальная часть низводимой сигмовидной кишки, резервуарно-накопительная и эвакуаторная функции оказывались заметно лучше. Вместе с тем, заботясь об улучшении функциональных результатов операций, мы постоянно имели в виду важность соблюдения онкологических принципов оперирования, поскольку главным при лечении онкологических больных является, конечно, улучшение пятилетней выживаемости.
Распространение ракового процесса внутристеночно от края видимой опухоли ПК в дистальном направлении привлекало внимание ряда авторов. Такие исследования имеют чрезвычайно важное значение при оперативном лечении больных с низкой раковой опухолью ПК. При этой локализации злокачественной опухоли, с позиций функциональных результатов, важен каждый сантиметр сохраненной дистальной части кишки. Использование сшивающих аппаратов при резекции ПК позволяет в техническом плане проводить максимально низкие резекции кишки.
Распространенность инвазии в дистальном направлении при раке прямой кишки.
Распространенность раковой инвазии в дистальном направлении изучалась целенаправленными и тщательными морфологическими исследованиями. R.Willis приводит концепцию «опухолевого поля», в соответствии с которой новообразование развивается мультицентрически с формированием затем единого опухолевого узла. В.Ю.Клур с соавт. проводил серийные гистологические срезы не только в дистальном направлении, но и радиарно. Они установили, что контуры «опухолевого поля» имеют эксцентрическое распространение от основного узла с внутристеночной инвазией, которая в дистальном направлении составляет не менее 3,5-4,0 см при экзофитных опухолях, а при эндофитном росте увеличивается еще на 1,0-1,5 см. Г.И. Воробьев с соавт. исследовал 71 препарат прямой кишки, удаленный при брюшно-промежностной экстирпации. Они установили, что глубина опухолевой инвазии прогрессивно уменьшается в направлении от центра к периферии опухоли. Дистальный внутристеночный рост по подслизистому слою был зарегистрирован лишь в 2,2 % случаев и не превышал 15 мм. Глубина инвазии колоректального рака изучалась также с помощью компьютерного исследования, эндоректоэхографии. В результате была установлена незначительная по протяженности от опухолевого узла внутрикишечная инвазия опухолевого процесса в дистальном направлении. Практически это было претворено в жизнь, и на смену «правила 5 см» пришло «правило 2 см», т. е. достаточно отступить от нижнего края опухоли 2 см с тем, чтобы не нарушить основной онкологический принцип оперирования.
В.Ю.Клур с соавт. проводил серийные гистологические срезы не только в дистальном направлении, но и радиарно. Они установили, что контуры «опухолевого поля» имеют эксцентрическое распространение от основного узла с внутристеночной инвазией, которая в дистальном направлении составляет не менее 3,5-4,0 см при экзофитных опухолях, а при эндофитном росте увеличивается еще на 1,0-1,5 см. Г.И. Воробьев с соавт. исследовал 71 препарат прямой кишки, удаленный при брюшно-промежностной экстирпации. Они установили, что глубина опухолевой инвазии прогрессивно уменьшается в направлении от центра к периферии опухоли. Дистальный внутристеночный рост по подслизистому слою был зарегистрирован лишь в 2,2 % случаев и не превышал 15 мм. Глубина инвазии колоректального рака изучалась также с помощью компьютерного исследования, эндоректоэхографии. В результате была установлена незначительная по протяженности от опухолевого узла внутрикишечная инвазия опухолевого процесса в дистальном направлении. Практически это было претворено в жизнь, и на смену «правила 5 см» пришло «правило 2 см», т. е. достаточно отступить от нижнего края опухоли 2 см с тем, чтобы не нарушить основной онкологический принцип оперирования.
Распространенность опухолевой инвазии в проксимальном направлении в меньшей мере привлекала внимание специалистов. При пересечении кишки выше опухоли не возникает необходимости в строгой экономичности сохранения кишки, примыкающей к опухоли, так как всегда имеется достаточная часть остающегося участка левого фланга ободочной кишки. Вместе с тем наши специальные исследования с анализом длины сигмовидной кишки по дооперационным ирригограммам и размера резецированной части ее после передней резекции ПК показали несомненную важность максимально возможного сохранения для анастомоза дистальной части сигмовидной кишки. К подобному заключению нас подвело изучение функциональных результатов сфинктеросохраняющих резекций ПК. Все это побудило специально изучить распространенность ракового поля в проксимальном направлении от верхнего края видимой опухоли. Результаты таких исследований были нужны для определения минимального расстояния, которое необходимо отступать от верхнего края раковой опухоли при пересечении кишки для соблюдения онкологических принципов оперирования.
Результаты таких исследований были нужны для определения минимального расстояния, которое необходимо отступать от верхнего края раковой опухоли при пересечении кишки для соблюдения онкологических принципов оперирования.
Методы исследования. Исследовано 17 макропрепаратов ПК, удаленных при операциях, производившихся по поводу раковой опухоли. Макропрепараты фиксировались в 10%-ном растворе формалина и через 24 ч. проводилось микроскопическое исследование. Окраска препаратов — гематоксилин-эозин, увеличение 10 х 20.
В 15 случаях раковая опухоль располагалась в нижнеампулярном отделе ПК, в одном — в среднеампулярном и еще в одном — в верхнеампулярном отделе ПК. Раковые опухоли по наибольшему диаметру были различны: от 3 см в диаметре (3) до 5−6 см (7) и даже до 10 см (1). Резецированные участки кишки вместе с опухолью были различной длины: 20−30 см — 4, 30−40 см — 5, 40−50 см — 5, 50−60 см — 3.
При гистологическом исследовании в 12 случаях выявлена аденокарцинома разной степени дифференцирования, в двух — слизеобразующая аденокарцинома и в трех случаях — плоскоклеточный рак. В 15 из 17 препаратах установлено прорастание всех слоев стенки ПК. В шести случаях были выявлены метастазы опухоли в регионарных лимфатических узлах. Исследования проводились в Петроградском централизованном патологоанатомическом отделении городского патологоанатомического бюро, которым руководит Г.И. Суханкина.
После фиксации препарата в проксимальном направлении от видимого верхнего края опухоли последовательно проводились пересечения кишечной стенки с интервалом 5мм (рис. 1).
В первый препарат обязательно включалась видимая часть раковой опухоли. В каждом последующем препарате делались три ступенчатых среза на разных уровнях поперечного пересечения кишечной стенки (а, б, в), а далее — в зависимости от морфологических изменений слизистой оболочки и нижележащих слоев кишки. Когда в двух последовательных срезах морфологических изменений ни в одном слое не обнаруживалось, дальнейшее гистологическое исследование прекращалось. В общей сложности приготовлено и просмотрено с помощью световой микроскопии 180 микропрепаратов. В большей части случаев — 13 из 17 — внутристеночного распространения злокачественной инфильтрации в проксимальном направлении от видимого края опухоли не отмечено или оно ограничивалось несколькими миллиметрами. Причем это наблюдалось как при больших, так и при небольших размерах опухоли; как при наличии метастазов опухоли в регионарные лимфоузлы, так и при отсутствии метастазов; при прорастании опухоли в примыкающую жировую клетчатку, так и без такого прорастания, а также не зависит от степени прорастания всей толщи стенки кишки. Вот несколько иллюстраций к этому.
В общей сложности приготовлено и просмотрено с помощью световой микроскопии 180 микропрепаратов. В большей части случаев — 13 из 17 — внутристеночного распространения злокачественной инфильтрации в проксимальном направлении от видимого края опухоли не отмечено или оно ограничивалось несколькими миллиметрами. Причем это наблюдалось как при больших, так и при небольших размерах опухоли; как при наличии метастазов опухоли в регионарные лимфоузлы, так и при отсутствии метастазов; при прорастании опухоли в примыкающую жировую клетчатку, так и без такого прорастания, а также не зависит от степени прорастания всей толщи стенки кишки. Вот несколько иллюстраций к этому.
Результаты исследования. Представляем наблюдение, характеризующее отсутствие опухолевой инвазии по кишечной стенке.
Мужчина 54 года, рак анального канала и ПК, выполнена брюшнопромежностная экстирпация ПК. Гистологическое исследование 31261−31272.
Макропрепарат: блюдцеобразно возвышающееся над поверхностью кишки новообразование диаметром 6 см, прорастает все стенки кишки. От края опухоли в проксимальном направлении макроскопически определяется инфильтрация стенки на протяжении 3,5 см.
Микроскопическое исследование: высокодифференцированная слизеобразующая аденокарцинома ПК, прорастание всей толщи стенки кишки, врастание опухоли в жировую ткань. В опухоли очаги некроза, выраженная мононуклеарная реакция. От проксимального края видимой инвазии уже в 1 мм внутристеночного роста опухоли нет. (Рис. 2). Метастазов аденокарциномы в лимфатических узлах и жировой ткани не выявлено.
А | Б |
Рис. 2. Микропрепарат слизеобразующей аденокарциномы ПК
с прорастанием всей толщи стенки.
Окраска гематоксилин-эозин. Увеличение 10 х 20.
А. Первый срез — в препарате виден край аденокарциномы.
Б. Срез через 5мм — признаков опухолевого роста нет.
Такие данные были получены и при аденокарциноме, и при плоскоклеточном раке ПК. Приведем наблюдение, свидетельствующее о распространении опухолевого роста по кишке в проксимальном направлении. Мужчина 73 года, рак ПК, выполнена передняя резекция ПК. Гистологическое исследование № 869−870; 871−882. Макропрепарат: опухоль 5 см с кратером, циркулярно охватывающая просвет кишки, прорастание всех слоев кишки и прилежащей жировой ткани, участки абсцедирования.
Микроскопическое исследование: аденокарцинома разной степени дифференцировки. В 5 мм вне видимой опухоли − аденокарцинома в подслизистом, мышечных слоях, в клетчатке, с абсцедированием (рис 3). На срезах через 10 мм от видимого края новообразования опухолевого роста нет.
| А | Б |
Рис. 3. Микропрепарат аденокарциномы ПК разной степени дифференцировки
с прорастанием всех слоев кишки.
Окраска — гематоксилин-эозин. Увеличение 10 х 20.
А. Первый срез — в препарате виден край аденокарциномы.
Б. Срез через 5 мм — в слизистом слое видны признаки опухолевого роста.
Приведем еще одно наблюдение, свидетельствующее о несомненном распространении опухолевого роста по кишке в проксимальном направлении. Женщина 73 года, рак ПК, выполнена резекция ПК по Гартману. Макропрепарат: экзофитная опухоль 5 х 5 см, прорастание всех слоев кишки, регионарные лимфоузлы не определяются.
Микроскопическое исследование: аденокарцинома разной степени дифференцировки с очагами в слизистой оболочке, подслизистом слое, в жировой клетчатке, во внутриорганных лимфатических узлах, в сосудах определяются опухолевые эмболы. На срезах 5 и 15 мм — аденокарцинома на всех препаратах. На срезах в 20 мм от видимого края опухоли — одиночная структура аденокарциномы на границе мышечного слоя и клетчатки. На других двух ступенчатых срезах этого уровня опухолевого роста уже нет (рис. 4). На всех трех ступенчатых срезах в 25 мм от края ракового новообразования опухолевого роста нет.
Рис. 4. Микропрепарат аденокарциномы ПК разной степени дифференцировки
с прорастанием всей толщи стенки кишки.
А. Первый срез — в препарате виден край аденокарциномы.
Б. Срез через 20 мм — в слизистом слое видны признаки опухолевого роста.
В. Срез через 25 мм — признаков опухолевого роста нет.
Рак прямой кишки. Инвазия опухоли. Обсуждение результатов исследования.
Данные исследования убедительно свидетельствуют, что раковая инвазия в проксимальном направлении от верхнего видимого края раковой опухоли ПК не имеет тенденции к значительному распространению, а в основном ограничена контурами макроскопического «ракового узла» или инвазией по кишечной стенке не более чем на 5мм от него. Лишь в 23,5 % случаев было установлено распространение ракового поля в проксимальном направлении, причем максимально зарегистрированная инвазия была в 20мм от видимого края опухоли ПК.
Вопреки ожиданиям не выявилось повышенной тенденции к внутристеночному росту при низкодифференцированной аденокарциноме, слизистых и плоскоклеточных формах рака ПК. Следовательно, отступление от верхнего края опухоли на 4−5 см в проксимальном направлении с онкологических позиций вполне оправдано и нет необходимости удалять здоровую и функционально полноценную часть кишки. Однако нужно учитывать, что уровень пересечения кишки выше опухоли во многом определяется высотой перевязки основного кровеносного сосуда, которым для этой зоны является нижняя брыжеечная артерия, особенностями кровоснабжения конкретного участка кишки и вовлеченностью в онкопроцесс лимфатического аппарата. Намечая линию пересечения сигмовидной или нисходящей части ободочной кишки, нужно учитывать эти обстоятельства и по возможности бережно, экономно относиться к удалению этого отдела толстой кишки, помня, что инвазия опухоли по стенке кишки незначительна.
* * *
Таким образом, внутрикишечная инвазия злокачественного роста в проксимальном направлении от видимого края опухоли ПК наблюдается в 23,5 % случаев и не превышает по протяженности 20 мм. В остальных случаях «раковое поле» ограничивается контурами основного видимого новообразования или распространяется не более чем на 5 мм от него.
В остальных случаях «раковое поле» ограничивается контурами основного видимого новообразования или распространяется не более чем на 5 мм от него.
Уровень пересечения кишки на 4−5 см выше проксимального края видимой раковой опухоли ПК онкологически оправдан, если учесть распространение «ракового поля» по кишечной стенке. Однако объем операции, конечно, зависит от особенностей кровоснабжения конкретного участка кишки, вовлеченностью в онкопроцесс лимфатических узлов и некоторых других факторов.
ВОЗМОЖНОСТИ ОПРЕДЕЛЕНИЯ ОПУХОЛЕВОЙ СОСУДИСТОЙ ИНВАЗИИ И ЕЕ РОЛЬ В ПРОГНОЗЕ ОПЕРАБЕЛЬНОГО НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО | Зинькович
1. Чиссов В.И., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2008 году (заболеваемость и смертность). М.: ФГУ «МНИОИ им. П.А.Герцена» Росздрава; 2010. / Chissov V.I., Starinskiy V.V., Petrova G.V. Malignancies in Russia in 2008 (Morbidity and Mortality). [Zlokachestvennye novoobrazovaniya v Rossii v 2008 godu (zabolevaemost’ i smertnost’)]. Moscow: Moscow Scientific and Research Oncological P.A.Gertsen’s Institute; 2010 (in Russian).
2. Трахтенберг А.Х., Чиссов В.И. Рак легкого: руководство, атлас. М.: ГЭОТАР-Медиа; 2009. / Trakhtenberg A.Kh., Chissov V.I. Lung cancer: handbook, atlas. [Rak legkogo: rukovodstvo, atlas]. Moscow: GEOTAR-Media; 2009 (in Russian).
3. Лактионов К.К., Давыдов М.И., Полоцкий Б.Е. и др. Прогностические и предсказывающие факторы у больных немелкоклеточным раком легкого. Практическая онкология 2006; 7 (3): 145–153. / Laktionov K.K., Davydov M.I., Polotskiy B.E. et al. Prognostic and predictive factors in patients with non-small cell lung carcinoma. Prakticheskaya onkologiya 2006; 7 (3): 145–153 (in Russian).
4. Gabor S., Renner H., Popper H. et al. Invasion of blood vessels as significant prognostic factor in radically resected T1-3N0M0 non-small-cell lung cancer. Eur. J. Cardiothorac. Surg. 2004; 25 (3): 439–442.
Gabor S., Renner H., Popper H. et al. Invasion of blood vessels as significant prognostic factor in radically resected T1-3N0M0 non-small-cell lung cancer. Eur. J. Cardiothorac. Surg. 2004; 25 (3): 439–442.
5. Poncelet A.J., Cornet J., Coulon C. et al. Intra-tumoral vascular or perineural invasion as prognostic factors for longterm survival in early stage non-small cell lung carcinoma. Eur. J. Cardiothorac. Surg. 2008; 33 (5): 799–804.
6. Tsuchiya T., Akamine S., Muraoka M. et al. Stage IA nonsmall cell lung cancer: Vessel invasion is a poor prognostic factor and a new target of adjuvant chemotherapy. Lung Cancer 2007; 56 (3): 341–348.
7. Зинькович С.А., Непомнящая Е.М., Анистратов П.А. и др. Опухолевая сосудистая инвазия как прогностический фактор у больных операбельным немелкоклеточным раком легкого. В кн.: Материалы IV Всероссийского съезда патологоанатомов. Белгород; 2013: 24–244. / Zin’kovich S.A., Nepomnyashchaya E.M., Anistratov P.A. et al. Vascular invasion as a prognostic factor in patients with operable non-small cell lung carcinoma. In: Materials of the IV Russian meeting of pathologists. Belgorod; 2013: 242–244 (in Russian).
Онкология
Афанасьев Сергей Геннадьевич ― доктор медицинских наук, профессор, главный научный сотрудник торакоабдоминального отделения НИИ онкологии, Томский национальный исследовательский медицинский центр Российской академии наук
634009, г. Томск, пер. Кооперативный, д. 5, тел. (3822) 41-80-89, e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Реферат. Изучались параметры первичной опухоли, такие как глубина инвазии, степень дифференцировки, наличие метастатического поражения лимфатических узлов у больных раком прямой кишки. Был исследован, операционный материл от 149 пациентов, получивших комбинированное лечение в торакоабдоминальном отделении Томского НИИ онкологии. Средний возраст больных составил 57,6±9,3 лет. Мужчин было 95 (63,8%), женщин ― 54 (36,2%). Оценивалась связь между частой лимфогенных метастазов и наличием феномена ретракции вокруг разных типов опухолевых структур на разной глубине инвазии. В проведенном исследовании было показано, что наличие ретракционной щели по периферии опухолевых структур может быть связано с риском лимфогенного метастазирования при раке прямой кишки.
Был исследован, операционный материл от 149 пациентов, получивших комбинированное лечение в торакоабдоминальном отделении Томского НИИ онкологии. Средний возраст больных составил 57,6±9,3 лет. Мужчин было 95 (63,8%), женщин ― 54 (36,2%). Оценивалась связь между частой лимфогенных метастазов и наличием феномена ретракции вокруг разных типов опухолевых структур на разной глубине инвазии. В проведенном исследовании было показано, что наличие ретракционной щели по периферии опухолевых структур может быть связано с риском лимфогенного метастазирования при раке прямой кишки.
Ключевые слова: рак прямой кишки, лимфогенные метастазы, феномен ретракции.
Введение
В механизме развития метастазов злокачественных опухолей важную роль играют последовательные и взаимосвязанные процессы, ассоциированные с синтезом проангиогенных факторов, а также с экспрессией ряда ферментов, способствующих инвазии опухолевых клеток в окружающую строму и сосуды [11]. Наиболее ранним процессом прогрессирования опухоли является формирование регионарных лимфатических метастазов в перигастральных лимфоузлах, что диктует необходимость изучения факторов, способствующих развитию данного явления [7, 17, 18]. Особый интерес вызывает исследование механизмов инвазии злокачественных клеток в стенку лимфатических сосудов опухоли [9, 20]. Обнаружение опухолевых клеток в пределах эндотелиальной выстилки лимфатического сосуда именуется как лимфоваскулярная инвазия (ЛВИ), а в их просветах ― как опухолевая эмболия [12, 16, 19]. Мнения исследователей в отношении критериев микроскопической диагностики ЛВИ неоднозначны [12, 15]. Это связано, в том числе, с наличием перитуморальной ретракционной щели, отделяющей опухолевые структуры или группы опухолевых клеток от окружающей стромы.
Ретракционная щель проявляется в гистологических срезах опухолевой ткани как пустое пространство частично или полностью окружающее гнезда опухолевых клеток и в ряде случаев этот феномен может имитировать ЛВИ и наличие опухолевых эмболов в просвете лимфатических сосудов [8]. I. Yeh et al. связывали образование данной щели с артефициальными изменениями, возникающими в результате дефектов фиксации и изготовления гистологических срезов [22]. Позднее было установлено, что возникновение ретракционного пространства вокруг опухолевых структур может быть результатом взаимодействий атипичных клеток с элементами опухолевого микроокружения, в частности со стромальными компонентами, и связано с неблагоприятным прогнозом [4, 13]. Феномен ретракции наблюдается при опухолях различных локализаций: раке желудка, предстательной железы, молочной железы, яичников [1, 2, 5, 8]. При плоскоклеточной карциноме пищевода было показано, что наличие перитуморальной ретракционной щели коррелирует с глубиной инвазии опухоли и поражением регионарных лимфоузлов. Так, более выраженная ретракционная щель наблюдалась при Т3-стадии и метастатическом поражении регионарного лимфатического аппарата [8]. Степень выраженности феномена ретракции при микропапиллярной карциноме молочной железы коррелирует с размером и гистологическими параметрами опухоли, а также имеет связь с началом инвазии в лимфатические сосуды и метастазированием в лимфатические узлы [2, 4]. Дальнейшие результаты исследования в этом направлении продемонстрировали взаимосвязь феномена наличия перитуморальной ретракционной щели при инвазивной карциноме молочной железы с лимфангиогенезом и лимфогенной диссеминацией опухоли. Кроме того, имеются данные о возможной связи феномена ретракции с ранним этапом развития лимфоваскулярной инвазии, обусловленного синтезом опухолевыми клетками факторов роста и стимуляцией опухоль-ассоциированного лимфангиогенеза путем активации эндотелизации этих перитуморальных пространств [3, 5].
I. Yeh et al. связывали образование данной щели с артефициальными изменениями, возникающими в результате дефектов фиксации и изготовления гистологических срезов [22]. Позднее было установлено, что возникновение ретракционного пространства вокруг опухолевых структур может быть результатом взаимодействий атипичных клеток с элементами опухолевого микроокружения, в частности со стромальными компонентами, и связано с неблагоприятным прогнозом [4, 13]. Феномен ретракции наблюдается при опухолях различных локализаций: раке желудка, предстательной железы, молочной железы, яичников [1, 2, 5, 8]. При плоскоклеточной карциноме пищевода было показано, что наличие перитуморальной ретракционной щели коррелирует с глубиной инвазии опухоли и поражением регионарных лимфоузлов. Так, более выраженная ретракционная щель наблюдалась при Т3-стадии и метастатическом поражении регионарного лимфатического аппарата [8]. Степень выраженности феномена ретракции при микропапиллярной карциноме молочной железы коррелирует с размером и гистологическими параметрами опухоли, а также имеет связь с началом инвазии в лимфатические сосуды и метастазированием в лимфатические узлы [2, 4]. Дальнейшие результаты исследования в этом направлении продемонстрировали взаимосвязь феномена наличия перитуморальной ретракционной щели при инвазивной карциноме молочной железы с лимфангиогенезом и лимфогенной диссеминацией опухоли. Кроме того, имеются данные о возможной связи феномена ретракции с ранним этапом развития лимфоваскулярной инвазии, обусловленного синтезом опухолевыми клетками факторов роста и стимуляцией опухоль-ассоциированного лимфангиогенеза путем активации эндотелизации этих перитуморальных пространств [3, 5].
Имеются сведения о необходимости проведения дополнительного иммуногистохимического исследования (factor VIII related antigen, CD31, D2-40) для подтверждения ЛВИ с целью исключения артефициальных изменений и выбора дальнейшей тактики лечения на ранней стадии процесса [6, 15]. S.R. Jeon et al. высказались о необходимости проведения иммуногистохимического исследования для определения наличия опухолевых эмболов в лимфатических и кровеносных сосудах [14].
S.R. Jeon et al. высказались о необходимости проведения иммуногистохимического исследования для определения наличия опухолевых эмболов в лимфатических и кровеносных сосудах [14].
Опубликованы противоречивые результаты, касающиеся прогностической значимости наличия ретракционной щели, в отношении ЛВИ при ацинарной аденокарциноме предстательной железы. В одних исследованиях ее возникновение связывают с отсутствием базальных клеток в сочетании с рядом стромальных изменений вокруг ацинусов [21]. При этом оценка экспрессии мукопротеина D2-40 (Podoplanin), тропного к эндотелию лимфатических сосудов, выявила низкую плотность лимфатических сосудов в опухолевой ткани по сравнению с нормальной тканью предстательной железы. С другой стороны, отмечено, что количество истинных лимфатических сосудов в опухоли было выше, чем количество сосудов, имитирующих ретракционное пространство. В целом экспрессия мукопротеина D2-40 в перитуморальных щелях, имитирующих лимфатические сосуды, была достаточно низкой. В ряде других исследований обсуждается возникновение ретракционной щели при аденокарциноме предстательной железы в результате структурных изменений в строме, окружающей ацинарные структуры и отсутствие ее связи с инвазией в лимфатические сосуды [10].
Таким образом, приведенные данные о возможной роли феномена возникновения ретракционной щели как раннего маркера лимфогенного метастазирования противоречивы и неоднозначны. В настоящей работе будет подробно рассмотрена взаимосвязь наличия феномена ретракции с параметрами лимфогенного метастазирования.
Цель исследования ― исследовать частоту метастатического поражения регионарных лимфатических узлов с учетом наличия феномена ретракции в ткани опухоли при раке прямой кишки.
Материал и методы
Исследовался операционный материал от 149 больных раком прямой кишки T1-4N0-2M0 стадий, получавших лечение в торакоабдоминальном отделении НИИ онкологии Томского НИМЦ в период с 2000 по 2015 гг. Средний возраст составил 57,6±9,3 лет. Мужчин было 95 (63,8%), женщин ― 54 (36,2%). Оперативное лечение в объеме брюшно-промежностной экстирпации прямой кишки было выполнено 69 (46,3%) пациентам, передней резекции прямой кишки ― 68 (45,6%), трансанальной резекции прямой кишки ― 4 (2,7%), интерсфинктерной резекции прямой кишки ― 1 (0,7%), эвисцерации малого таза ― 3 (2,0%), операции по типу Гартмана ― 4 (2,7%) больным.
Средний возраст составил 57,6±9,3 лет. Мужчин было 95 (63,8%), женщин ― 54 (36,2%). Оперативное лечение в объеме брюшно-промежностной экстирпации прямой кишки было выполнено 69 (46,3%) пациентам, передней резекции прямой кишки ― 68 (45,6%), трансанальной резекции прямой кишки ― 4 (2,7%), интерсфинктерной резекции прямой кишки ― 1 (0,7%), эвисцерации малого таза ― 3 (2,0%), операции по типу Гартмана ― 4 (2,7%) больным.
Морфологическому исследованию подвергалась ткань первичной опухоли. Материал фиксировался в 10-12% растворе нейтрального формалина. Проводка материала и изготовление гистологических препаратов осуществлялись по стандартной методике. Препараты окрашивались гематоксилином и эозином. Исследование выполнялось с применением светового микроскопа Carl Zeiss Axio Lab.A1 (Германия). Гистологический тип рака прямой кишки устанавливался согласно рекомендациям ВОЗ (2010).
В исследование включались только случаи с аденокарциномой, при этом в 20 (13,4%) наблюдениях диагностирована аденокарцинома высокой степени дифференцировки, в 119 (79,9%) ― умеренной, в 10 (6,7%) ― низкой степени дифференцировки. В паренхиматозном компоненте опухоли отдельно в слизистой оболочке, подслизистой основе, мышечном и серозном/адвентициальном слоях выделяли железистоподобные, криброзные, солидные структуры и дискретные группы опухолевых клеток. В строме вокруг каждого из перечисленных типов паренхиматозных структур опухоли, располагающихся на разной глубине инвазии, определялось наличие ретракции. Ретракцией считали артефициальную «щель» между клетками структур паренхиматозного компонента и окружающей стромой (рис. 1). Для оценки метастатического поражения исследовались все удаленные лимфатические узлы.
Рис. 1. Микрофотографии: а ― феномен ретракции вокруг железистоподобных структур, окраска гематоксилином и эозином, ув. ×400; б ― феномен ретракции вокруг дискретных групп опухолевых клеток, окраска гематоксилином и эозином, ув.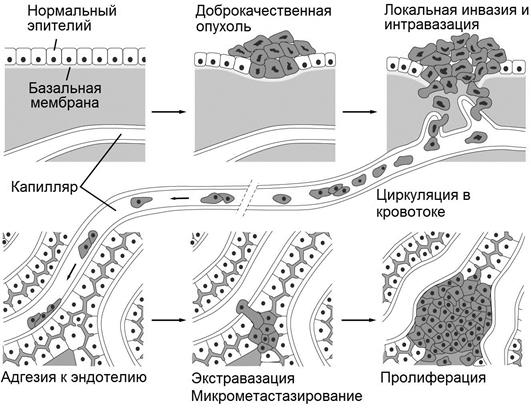 ×200; в ― феномен ретракции вокруг криброзных структур, окраска гематоксилином и эозином, ув. ×400; г ― феномен ретракции вокруг солидных структур, окраска гематоксилином и эозином, ув. ×400. Стрелками обозначены ретракционные щели вокруг опухолевых структур
×200; в ― феномен ретракции вокруг криброзных структур, окраска гематоксилином и эозином, ув. ×400; г ― феномен ретракции вокруг солидных структур, окраска гематоксилином и эозином, ув. ×400. Стрелками обозначены ретракционные щели вокруг опухолевых структур
Обработка полученных данных выполнялась с использованием пакета программ Statistica 10. Применялся критерий χ2. Обсуждались результаты с достоверностью различий при р<0,05.
Результаты
Исследование частоты лимфогенного метастазирования в зависимости от наличия ретракции вокруг разных структур паренхиматозного компонента опухоли, располагающихся на разной глубине инвазии показало, что в случаях обнаружения ретракционной щели вокруг железистоподобных структур метастатическое поражение регионарных лимфатических узлов наблюдается чаще (60%), в сравнении со случаями, когда подобный феномен отсутствует (27%; χ2=4,0; р=0,04). Наличие ретракции вокруг железистоподобных структур, располагающихся в слизистой оболочке, подслизистом слое и серозной оболочке или параректальной клетчатке не было связано с частотой лимфогенного метастазирования (табл. 1).
Таблица 1. Частота лимфогенного метастазирования в зависимости от наличия ретракции вокруг железистоподобных структур, располагающихся на разной глубине инвазии
|
|
| ||
|
|
| ||
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
| |
|
| |||
|
|
|
|
|
|
|
|
| |
Связи между наличием ретракционной щели вокруг криброзных структур, располагающихся в слизистой оболочке, подслизистом, мышечном слоях или серозной оболочке или параректальной клетчатке не определялось (табл. 2).
2).
Метастазы в лимфатических узлах обнаруживались чаще при наличии ретракции вокруг солидных структур, располагающихся в мышечном слое (60%), в сравнении со случаями, когда ретракции вокруг данных структур не наблюдалось (32%; χ2=4,8; р=0,02). Обнаружение ретракции вокруг солидных структур, находящихся в слизистой оболочке, подслизистом слое, серозной оболочке или параректальной клетчатке, не было связано с частотой лимфогенного метастазирования (табл. 2).
Таблица 2. Частота лимфогенного метастазирования рака прямой кишки в зависимости от наличия ретракции вокруг солидных структур, располагающихся на разной глубине инвазии
|
|
| ||
|
|
| ||
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
| |
|
| |||
|
|
|
|
|
|
|
|
| |
Кроме того, метастатическое поражение регионарных лимфатических узлов чаще обнаруживалось при наличии ретракционной щели вокруг групп опухолевых клеток, располагающихся в мышечном слое стенки кишки (55%), в сравнении со случаями, когда ретракция вокруг данных структур отсутствовала (29%; χ2=7,6; р=0,005). Присутствие ретракционной щели вокруг дискретных групп опухолевых клеток в слизистой оболочке, подслизистом слое и серозной оболочке или параректальной клетчатке не было связано с частотой лимфогенного метастазирования (табл. 3).
Присутствие ретракционной щели вокруг дискретных групп опухолевых клеток в слизистой оболочке, подслизистом слое и серозной оболочке или параректальной клетчатке не было связано с частотой лимфогенного метастазирования (табл. 3).
Таблица 3. Частота лимфогенного метастазирования в зависимости от наличия ретракции вокруг дискретных групп клеток, располагающихся на разной глубине инвазии
|
|
| ||
|
|
| ||
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
| |
|
| |||
|
|
|
|
|
|
|
|
| |
Заключение
Стромально-опухолевые взаимоотношения при раке прямой кишки влияют на инвазивные свойства опухоли и имеют большое значение для прогнозирования возникновения различных вариантов прогрессии злокачественного новообразования. Так, стромальные клеточные элементы принимают непосредственное участие в синтезе ряда регуляторных белков, ростовых факторов, регуляторов эпителиальной-мезенхимального перехода (ЭМП). Нарушение взаимосвязей между опухолевыми клетками и элементами опухолевого микроокружения приводит к появлению ретракционной щели, что может быть связано с изменением уровня экспрессии молекул межклеточной адгезии и факторов, инициирующих ЭМП. В результате клетки новообразования теряют контакты с окружающей стромой, приобретают подвижные свойства, что влечет за собой увеличение инвазивных свойств и увеличение частоты и распространенности метастатического поражения лимфатических узлов.
Так, стромальные клеточные элементы принимают непосредственное участие в синтезе ряда регуляторных белков, ростовых факторов, регуляторов эпителиальной-мезенхимального перехода (ЭМП). Нарушение взаимосвязей между опухолевыми клетками и элементами опухолевого микроокружения приводит к появлению ретракционной щели, что может быть связано с изменением уровня экспрессии молекул межклеточной адгезии и факторов, инициирующих ЭМП. В результате клетки новообразования теряют контакты с окружающей стромой, приобретают подвижные свойства, что влечет за собой увеличение инвазивных свойств и увеличение частоты и распространенности метастатического поражения лимфатических узлов.
Проведенное исследование показало, что наличие феномена ретракции вокруг опухолевых структур при раке прямой кишки может иметь прогностическое значение, поскольку ассоциировано с риском метастатического поражения регионарных лимфатических узлов. Необходимо отметить, что определение данного морфологического параметра необходимо проводить с учетом морфологической гетерогенности опухоли и глубины инвазии, поскольку обнаруженная закономерность прослеживается только в отношении железистоподобных, солидных структур и дискретных групп опухолевых клеток, располагающихся в мышечном слое стенки прямой кишки.
Литература
-
Завьялова М.В., Перельмутер В.М., Степанов И.В. и др. Роль инвазивных свойств опухоли в развитии лимфогенного метастазирования при кишечном и диффузном типах рака желудка // Сибирский онкологический журнал. ― 2011. ― №1. ― С. 16-20.
Ультразвуковая диагностика рака языка. Определение глубины инвазии опухоли | АЛЛАХВЕРДИЕВА
1. Hubert Low TH, Gao R, Elliot M, Clark JR. Tumor classification for early oral cancer: re-evaluate the current TNM classification. Head Neck. 2015 Feb; 37(2):233–8. doi: 10. 1002/hed.23581. Epub 2014 Mar.
1002/hed.23581. Epub 2014 Mar.
2. J. Shah, S.G Patel. Head and Neck surgery and oncology. Mosby, Edinburg, 2007, p.731.
3. Pinto FR, de Matos LL, Palermo FC, Kulsar MA, Cavalheiro BG, de Mello ES, Alves VA, Cernea CR, Brandao LG. Tumor thickness as an independent risk factor of early recurrence in oral cavity squamous cell carcinoma. Eur Arch Otorhinolaryngol. 2014 Jun; 271(6):1747–54. Doi: 10.1007/s00405–013–2704–9. Epub 2013 Sep 27.
4. Ariji Y, Goto M, Fukano H, Sugita Y, Izumi M, Ariji E. Role of intraoral Doppler sonograhpy in predicting delayed cervical lymph node metastasis in patients with early-stage tongue cancer: a pilot study. Oral Surg Oral Med Oral Pathol Oral Radiol. 2015 Fed;119(2):246–53. doi: 10.1016/j.oooo.2014,10.21. Epub 2014 Nov 11.
5. Joshi PS, Pol J, Sudesh AS. Ultasonography – A diagnostic modality foe oral and maxillofacial diseases. Conmet Clin Dent. 2014 Jul; 5(3):345–51. doi: 10.4103/0976–237X. 137942.
6. Trojanowska A., Grzycka-Kowalczyk L., Trojanowski P. et al. Computed tomography perfusion examination is helpful in evaluating the extent of oropharyngeal and oral cavity cancer. Pol J Radiol 2011;76(1):14–9.
7. Dogan E., Sarioglu S., Ada E. et al. Comparison of clinical and pathological staging in oral cavity cancers. Kulak Burun Bogaz Ihtis Derg 2012;22(6):305–10.
8. Rumboldt Z., Al-Okaili R., Deveikis J. P. Perfusion CT for head and neck tumors: pilot study. Am J Neuroradiol 2005;26(5):1178–85.
9. С. О. Степанов, Л. А. Митина, В. В. Ратушная, Д. В. Долгачева, В. А. Соловьев Ультрасонографическая диагностика рака языка, Head and Neck/Голова и шея. Российское издание № 3 / 2013: 5–7.
10. Lwin C. T., Hanlon R., Lowe D. et al. Accuracy of MRI in prediction of tumour thickness and nodal stage in oral squamous cell carcinoma. Oral Oncol 2012;48(2):149–54.
11. Keberle M., Jenett M., Hahn D. Clinical trial on the accuracy of a freehand and sensor-independent three-dimensional power Doppler ultrasound system measuring diameters, volumes and vascularity of malignant primaries of the neck. Ultraschall Med 2001; 22(2):91–95.
12. Kumar N, Patel MD. Pattern of lymphatic metastasis in relation to the depth of tumor in oral tongue cancers: a clinic pathological correlation. Indian J Otolaryngol Head Neck Surg.2013 Jul; 65(Suppl1): 59–63.doi: 10.1007/ы12070–012–0504-y. Epub 20.
Перспективы победы над раком — Новости — Кто есть Кто в медицине
Тема обсуждения ведущих мировых специалистов была самая позитивная и обнадеживающая: «Новые горизонты в лечении опухолей печени и поджелудочной железы». В приветственном слове участникам форума генеральный директор ГНЦ РФ ФГБУ ФМБЦ им. А.И. Бурназяна ФМБА России Константин Котенко поблагодарил президента IASGO Масатоши Макуучи и генерального секретаря IASGO Н. Дж. Ликидакиса за активное участие в подготовке конференции.
Более 200 ученых и практикующих хирургов аплодировали заместителю руководителя Федерального медико-биологического агентства России Елене Хавкиной и известному японскому хирургу, профессору Кокудо, которые в своих выступлениях подчеркнули, что только тесное общение в мировом медицинском сообществе дает конструктивное движение науке, работает на благо здоровья всех людей планеты.
Первым докладчиком стал руководитель центра хирургии и трансплантологии ГНЦ РФ ФМБЦ им. А.И. Бурназяна Сергей Восканян. Темой его исследований было значение периневральной инвазии в выборе объема оперативного вмешательства при раке поджелудочной железы. В настоящий момент не наблюдается снижения числа пациентов, страдающих этой болезнью, а смертность очень высока. После оперативного вмешательства развивается ряд осложнений, и наиболее часто встречается локо-регионарный рецидив. По словам профессора, проведено изучение большой группы больных. Целью исследования стал вопрос: какую роль периневральная инвазия играет в развитии локо-регионарного рецидива после операции. Показано существенное влияние на отдаленную выживаемость больных. Следовательно, в подобных случаях должна проводиться тотальная экстирпация нервных волокон в очаге поражения. А самый надежный метод оценки периневральной инвазии — компьютерная томография. Как заметил Сергей Восканян, при проведении расширенной панкреатодуоденальной резекции по технологиям ФМБЦ им. А.И. Бурназяна летальность практически отсутствует.
Темой выступления профессора Р.И. Расулова из Иркутска стала радикальная хирургия при раке поджелудочной железы с инвазией магистральных сосудов. Тщательно обследовано более 700 больных с таким диагнозом и только чуть более ста человек признаны резектабельными. Пятидесяти пациентам была проведена расширенная гастропанкреатодуоденальная резекция. Результат оказался самый обнадеживающий: летальность — 6,7%, осложнения — 34%. При артериальной реконструкции с 2010 г. в Иркутской клинике используются алломатериалы.
Профессор В.И. Егоров в исследовании по теме «Является ли артериальное Кт-усиление признаком артериальной инвазии при раке поджелудочной железы» подтвердил вышесказанное Восканяном, что компьютерная томография является золотым стандартом диагностики в данном случае. И дает в 70–80% верный результат. Точности же Кт-усилений недостает для безошибочного диагноза.
Выступление профессора И. Е. Хатькова было посвящено лапароскопии в диагностике и лечении опухолей поджелудочной железы. Он обобщил все перспективные направления в данной области отечественных и зарубежных коллег и провел мастер-класс для участников конференции.
Е. Хатькова было посвящено лапароскопии в диагностике и лечении опухолей поджелудочной железы. Он обобщил все перспективные направления в данной области отечественных и зарубежных коллег и провел мастер-класс для участников конференции.
Стоит отметить, что поднятые и изученные на конференции проблемы касались также лечения опухолей печени. Блестящее выступление профессора М. Миязаки было посвящено пользе неоадъювантной химиотерапии при нерезектабельных опухолях желчевыводящих путей. Его земляк, профессор Н. Кокудо рассказал, как в Японии делают венозную реконструкцию в хирургии печени и о текущих представлениях хирургического лечения колоректальных метастазов в печени. Но и наши соотечественники не понаслышке знакомы с этой проблемой. Профессор О.Г. Скипенко с коллегами провели глубокое исследование двухэтапных резекций печени при колоректальных метастазах. Профессор В.Е. Загайнов рассмотрел вопрос расширенных резекций при колоректальных метастазах печени. Профессор Г.Г. Ахаладзе рассказал о проведенной работе по изучению особенностей сложных резекций печени. Среди выступающих были звезды отечественной онкологии: В.А. Вишневский, Ю.И. Патютко, Д.Н. Панченков, М.О. Воздвиженский, М.Г. Ефанов и другие.
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: III РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
III РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ПРЕДЕЛЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ: ЕСТЬ ЛИ ОНИ?
С. Петров, Е. Велиев
ВМА, Санкт-Петербург
Рак предстательной железы (РП) является одним из распространенных онкологических заболеваний у мужчин. По предварительным оценкам в США частота заболеваемости РП колеблется от 182 до 249 случаев на 100000 населения.
Риск развития клинически проявляющегося РП в течение жизни у американских мужчин составляет приблизительно 10%, у 3% он является причиной смерти. Эти факты заставляют урологов и онкологов стремиться к выработке рационального подхода в ранней диагностике и эффективной лечебной тактике всех стадий заболевания. Несмотря на имеющиеся успехи в лечении данного заболевания, многие вопросы остаются нерешенными, а предлагаемые пути решения остаются спорными. Кого лечить? Как лечить? Когда лечить? Различные показания — социальные, биохимические, патоморфологические, терапевтические и многие другие учитываются перед выбором той или иной лечебной тактики.
Несмотря на имеющиеся успехи в лечении данного заболевания, многие вопросы остаются нерешенными, а предлагаемые пути решения остаются спорными. Кого лечить? Как лечить? Когда лечить? Различные показания — социальные, биохимические, патоморфологические, терапевтические и многие другие учитываются перед выбором той или иной лечебной тактики.
Радикальная простатэктомия (РПЭ) является одним из старейших и наиболее эффективных методов лечения локализованных форм РП. Немецкий хирург Billroth первый выполнил перинеальную простатэктомию в 1860 году. В начале этого века Young H.H. усовершенствовал технику операции при лечении больных РП.
Позадилонный подход для удаления предстательной железы был предложен Т. Мillin в 1947 году, однако операция сопровождалась большим количеством осложнений, таких как массивная кровопотеря, недержание мочи, импотенция. До внедрения анатомического подхода в технику операции почти 100 % больных после операции оставались импотентами.
В последние два десятилетия интерес специалистов к оперативному лечению рака предстательной железы значительно вырос.
Целесообразность применения агрессивной тактики в лечении больных РП основывается на следующих положениях.
- Клинически выявленный рак предстательной железы прогрессирует медленно, но неизбежно.
- Оперативное лечение может быть эффективным, а подчас и радикальным, если РП выявляется на ранних стадиях.
- Пациент, страдающий РП, который распространяется в перипростатические ткани, семенные пузырьки, или лимфоузлы не может быть радикально излечен, однако оперативное лечение способствует увеличению продолжительности жизни.
- Данный вид терапии в настоящее время является относительно безопасным.
- Только хирургическая тактика позволяет точно установить патоморфологический диагноз и более точно прогнозировать исход заболевания.
Выжидательная тактика в лечении определенных категорий больных РП применяется давно. Основными аргументами, которые приводятся специалистами в защиту этой лечебной тактики, являются: а) отсутствие каких-либо осложнений, снижающих качество жизни; б) низкая стоимость лечения; в) отсутствие потерь рабочего времени; г) достаточно высокие показатели выживаемости больных с клинически незначимыми, а также локализованными формами РП. Последний довод в пользу выжидательной тактики спорен, так как эти данные, представленные шведскими специалистами, не подтверждаются сообщениями из Англии и Дании. Так, по данным M. Borre с соавт. (1997), 5- летняя выживаемость у больных РП в стадии Т
Основными аргументами, которые приводятся специалистами в защиту этой лечебной тактики, являются: а) отсутствие каких-либо осложнений, снижающих качество жизни; б) низкая стоимость лечения; в) отсутствие потерь рабочего времени; г) достаточно высокие показатели выживаемости больных с клинически незначимыми, а также локализованными формами РП. Последний довод в пользу выжидательной тактики спорен, так как эти данные, представленные шведскими специалистами, не подтверждаются сообщениями из Англии и Дании. Так, по данным M. Borre с соавт. (1997), 5- летняя выживаемость у больных РП в стадии Т
1-2N
ХМ
0 составила 71%, а 10-летняя — 42%. Согласно данным W.V. Catalona с соавт. (1994), длительное наблюдение за больными с локализованными формами рака предстательной железы показало, что более 50% больных умирает от этого заболевания. Эти и другие наблюдения свидетельствуют о том, что рак предстательной железы даже в ранних стадиях не является «беззубым львом», т.е. он растет и становится инкурабельным, особенно у мужчин с ожидаемой продолжительностью жизни более 10 лет. Кроме того, постоянный стресс для мужчины жить с прогрессирующим РП снижает качество его жизни.
Интерес к хирургическому лечению рака предстательной железы в последние десятилетия значительно вырос. Это обусловлено лучшим знанием анатомии таза и совершенствованием техники оперативного вмешательства.
В 1979 году W. Reiner и P. Walsh описали технику позадилонной радикальной простатэктомии с учетом анатомии дорсального венозного комплекса и венозного сплетения Санторини. В 1982 году P. Walsh и P. Donher высказали положение о том, что импотенция, которая возникала после операции, была обусловлена повреждением боковых сосудисто-нервных пучков, обеспечивающих иннервацию кавернозных тел. На основании этих наблюдений они модифицировали технику позадилонной РПЭ, что позволило значительно облегчить ее выполнение, уменьшить объем кровопотери, увеличить число континентных больных, а также сохранить потенцию у большинства пациентов. Кроме этого, преимуществом анатомического подхода при выполнении РПЭ стала возможность тщательного гемостаза, что обеспечивало хорошую визуализацию места операции.
Кроме этого, преимуществом анатомического подхода при выполнении РПЭ стала возможность тщательного гемостаза, что обеспечивало хорошую визуализацию места операции.
Применение анатомического подхода к выполнению позадилонной РПЭ в условиях хорошей видимости позволяет хирургу принимать решения об объеме удаляемых тканей в зависимости от интраоперационных находок, т.е. сохранить или же широко иссечь сосудисто-нервный пучок. Сохранение одного пучка позволяет сохранить потенцию в послеоперационном периоде у большинства больных (P.Walsh — 1988). Билатеральное сохранение пучков увеличивает шансы пациента сохранить потенцию (71% против 48%), если он моложе 70 лет, и 48% против 40%, если он старше 70 лет. (Catalona W.J.с соавт., 1999). Таким образом, РПЭ стала более радикальной и сопровождается значительно меньшей частотой послеоперационных осложнений.
Данные различных авторов говорят о том, что смертность в результате РПЭ колеблется от 0,2 до 0,5 %. Частота послеоперационных осложнений по данным различных источников весьма варьирует, однако их процент существенно ниже в тех клиниках, где эта операция выполняется часто и одними и теми же специалистами. Так стрессовое недержание мочи после РПЭ составляет, по различным сообщениям, 10% и менее, а 92% больных полностью удерживают мочу. (Catalona W.J. с соавт., 1999). Сексуальная активность у мужчин с локализованными формами рака предстательной железы после операции составляет в возрасте менее 50 лет — 92%; от 50 — 60 лет — 75%, а свыше 60 лет — 58% и широко варьирует не только в зависимости от возраста, но и от вида оперативной техники, используемой при сохранении сосудисто-нервных пучков (Catalona W.J. с соавт., 1999; Igel T. с соавт., 1987). Частота других послеоперационных осложнений по данным B. Andriol с соавт. (1994 ) составляет 7,2%.
Выбор больных раком предстательной железы для операции, к сожалению, как шутят специалисты, считается скорее хирургическим искусством, чем хирургической наукой. Тем не менее, подавляющее большинство специалистов едины во мнении, что кандидатами на РПЭ, являются пациенты с ожидаемым сроком жизни не менее 10 лет. Не самыми удачными кандидатами являются больные, имеющие риск анестезии. Кроме того, пациенты, для которых риск потери сексуальной потенции крайне важен, иногда воздерживаются от выбора агрессивной лечебной тактики в пользу других видов терапии.
Тем не менее, подавляющее большинство специалистов едины во мнении, что кандидатами на РПЭ, являются пациенты с ожидаемым сроком жизни не менее 10 лет. Не самыми удачными кандидатами являются больные, имеющие риск анестезии. Кроме того, пациенты, для которых риск потери сексуальной потенции крайне важен, иногда воздерживаются от выбора агрессивной лечебной тактики в пользу других видов терапии.
Одним из наиболее спорных критериев выбора больных для хирургического лечения РП является стадия заболевания. Рассмотрим результаты лечения больных с различными стадиями.
Клиническая стадия Т
1а — Т
1с
Стадия Т
1аN
0M
0 встречается крайне редко, и как правило, это хорошо дифференцированные опухоли. Ранее считалось, что лечить пациентов в этой стадии нет необходимости, так как появление метастазов в течение 4 лет наблюдения отмечалось только у 2% больных (Cantrell B. с соавт., 1981). В то же время данные V. Epstain с соавт. (1986) свидетельствуют о прогрессии опухоли у 16 % больных в стадии Т
1а. Кроме того, клиническая практика говорит о том, что несовершенство методов диагностики часто приводит нас в этих случаях к занижению стадии заболевания. Так по данным D. Paulson с соавт. (1988), из 18 больных в стадии Т
1а 11 (61%) имели окончательный диагноз после выполненной РПЭ стадии Т
1b — Т
3.
Наиболее часто стадия Т
1аN
0M
0 заболевания выявляется после выполнения трансуретральной электрорезекции (ТУР) предстательной железы по поводу доброкачественной гиперплазии простаты. Однако вероятность полного удаления опухоли в ходе ТУР определить крайне тяжело. Об этом можно судить косвенно по уровню простатического специфического антигена (PSA) в сыворотке крови, либо по результатам шести точечной трансректальной биопсии под ультразвуковым наведением, выполненной позже. В то же время наличие высокой дифференциации опухоли в полученном материале (G3), отсутствие специфических маркеров наличия рака предстательной железы (20 % РП проходит на фоне PSA < 4 нг/мл) свидетельствует о целесообразности выполнения РПЭ как единственного радикального метода лечения этой локализованной стадии.
В то же время наличие высокой дифференциации опухоли в полученном материале (G3), отсутствие специфических маркеров наличия рака предстательной железы (20 % РП проходит на фоне PSA < 4 нг/мл) свидетельствует о целесообразности выполнения РПЭ как единственного радикального метода лечения этой локализованной стадии.
Клиническая стадия Т
1bN
0М
0. Данная стадия опухоли безусловно должна рассматриваться как новообразование с высоким риском прогрессии, т.к. у 20% больных после РПЭ выявляется Т
3 (Altwein V., 1999). Поэтому у данной группы пациентов предпочтителен выбор оперативного метода лечения — РПЭ. Ряд специалистов высказывают мнение о нецелесообразности РПЭ, если стадия Т
1b сочетается с низким показателем по шкале Глиссона, однако невозможность точного определения стадии процесса, а также высокий процент расхождений при определении степени дифференцировки опухолевых клеток в биопсийных столбиках и препарате заставляет большинство специалистов склоняться в пользу агрессивной лечебной тактики.
Клиническая стадия Т
1cN
0M
0. Это группа опухолей предстательной железы очень неоднородна. Epstain J. с соавт. (1994) предложили для более точного определения объема опухоли выделить три категории: ограниченный рак, очень ограниченный и незначимый рак. Он полагает, что на основании трактовки результатов секстантной биопсии, а также уровня PSA можно в 95% случаев определить локализованную форму рака предстательной железы с объемом <0,2 мл и суммой по шкале Глиссона <7. Однако выделение этих категорий в стадии Т
1c не дает возможности говорить о вероятной прогрессии этой опухоли при выборе выжидательной тактики или лучевой терапии. Клиническая практика свидетельствует о том, что стадия опухоли Т
1с часто является заниженной. Так, по данным Т. Donglas с соавт. (1995), у 44% больных в стадии Т
Так, по данным Т. Donglas с соавт. (1995), у 44% больных в стадии Т
1с после выполненной РПЭ выявлено распространение образования в перипростатическую жировую клетчатку, у 8% — в семенные пузырьки и только у 5% имел место незначимый рак в стадии Т
1сN
0М
0. Из 72 больных, прооперированных в период между 1987-1995 годами, средний балл по шкале Глиссона составлял 5,6, а у 25% больных он превышал 7, свидетельствуя о высоком риске рецидива. Данные, приведенные J. Epstein с соавт. (1994) показывают, что позитивный хирургический край имел место у 17%, а инвазия в семенные пузырьки у 6% прооперированных больных в стадии Т
1с.
Таким образом, отсутствие диагностических возможностей точно определить стадию опухоли и прогноз на будущее у пациентов с предполагаемой стадией Т
1N
0М
0 и высокая надежность радикального удаления локализованной формы рака предстательной железы позволяет говорить о целесообразности выполнения именно РПЭ.
Клиническая стадия Т
2а-bN
0М
0. Показания для выполнения РПЭ у больных в стадии Т
2 сходны с приведенными выше для стадии Т
1, однако не все специалисты согласны с этой точкой зрения, ссылаясь на тот факт, что у большого количества больных с ограниченной формой РП до операции окончательным диагнозом является стадия Т
3. Так по данным E. Mukamel с соавт. (1987), 66% больных, прооперированных в его институте с предполагаемой стадией Т
2, имели прорастание в капсулу предстательной железы или за ее пределы и инвазию в семенные пузырьки, либо экстракапсулярную экстензию. Сходные результаты сообщает V. Epstein с соавт. (1994).
Тем не менее, большинство институтов и клиник придерживаются мнения, что пациенты, имеющие стадию Т
2а, являются идеальными кандидатами для выполнения РПЭ, т. к. у них еще нет пенетрации капсулы и инвазии в семенные пузырьки. Если больных в стадии Т
к. у них еще нет пенетрации капсулы и инвазии в семенные пузырьки. Если больных в стадии Т
2а не лечить, то у 35-55% из них через 5 лет будут выявлены метастазы и 20% умрут от основного заболевания, что еще раз свидетельствует о неумолимом росте опухоли. Некоторые специалисты склоняются в пользу лучевой терапии при стадии Т
2а, апеллируя к хорошим результатам лечения, однако рост уровня PSA отмечается у многих больных, а частота положительных биопсий через 1 год после облучения колеблется от 39% до 62% по разным источникам. (Dudan, Kabalin).
Клиническая стадия Т
2b рака предстательной железы оценивается как более агрессивная. В течение 5 лет у 77% больных в стадии Т
2b отмечается дальнейший рост опухоли. Эффект от лучевой терапии не дает высоких показателей выживаемости. Общая выживаемость для пациентов, имеющих стадию Т
2 РП составляет: 81% — 5 лет; 60% — 10 лет и 34% — 15 лет.
Применение РПЭ в лечении больных в стадии Т
2 обеспечивает радикальность лечения в тех случаях, когда опухоль ограничена железой. Это является основной причиной хороших результатов лечения. Так по данным D. Paulson с соавт. (1994) 92% больных с локализованной формой рака предстательной железы были свободны от болезни в течение 5 лет наблюдений, 89% — в течение 10 лет. Пациенты с капсулярной инвазией без экстракапсулярного прорастания в 81% в течение 5 лет были свободны от заболевания и в 70% — к 10 годам. В тех случаях, когда была выявлена экстракапсулярная инвазия или инвазия в семенные пузырьки, эти показатели составили соответственно 57% и 40%.
Эффективность любого агрессивного метода лечения в онкологии оценивается по его радикальному удалению тканей опухоли, а также по предотвращению рецидива заболевания. Следовательно, успех того или иного метода лечения необходимо рассматривать с точки зрения продолжительности жизни без клинических и биохимических признаков заболевания.
Именно у больных раком предстательной железы в стадии Т
2 при локализованной форме частота локального рецидива очень мала. Так по данным E. Mukamel с соавт. (1987) из 103 больных с локализованной формой опухоли, либо имевших капсулярную инвазию, частота локального рецидива составила 1% в течение 48 месяцев наблюдения. Таким образом, правильно выполненная РПЭ является наиболее эффективным методом радикального удаления локализованных форм рака предстательной железы.
Клиническая стадия Т
3N
0М
0.
Частота выявления стадии Т
3 по данным различных источников колеблется от 12 до 18% (Schmidt V. с соавт., 1986). На сегодняшний день выбор лечебной тактики у больных с этой стадией заболевания остается спорным. Многие используют лучевую терапию, однако результаты свидетельствуют о невысокой ее эффективности при Т
3. Основной проблемой при выборе хирургического лечения является наличие экстракапсулярного прорастания, а также инвазии в семенные пузырьки, что, по мнению противников агрессивной терапии, не позволяет говорить о радикальности операции и лишает целесообразности ее применения. В то же время, данные многочисленных исследований говорят о том, что среди больных с предполагаемой стадией Т
3 от 9 до 22% пациентов имели окончательный патоморфологический диагноз Т
2 (Van den Ouden с соавт., 1998; M.Wolf с соавт., 1994). Кроме того, радикальность операции может быть достигнута широким иссечением окружающих тканей, включая боковые сосудисто-нервные пучки, что бесспорно увеличивает число отрицательных хирургических краев и улучшает результаты лечения.
В целях снижения частоты положительных краев при выполнении РПЭ у больных в стадии Т
3 (она достигает 66% — van den Ouden с соавт.,1998) была предложена неоадъювантная гормональная терапия. Ее применение позволило в несколько раз снизить частоту положительных краев после РПЭ (с 45% до 24% — Aus O. с соавт., 1998; с 33,8% до 7,8% — Labrie F. с соавт., 1994). Однако ряд последних исследований (включая и рандомизированные) показал, что в течение 3-4 лет наблюдения нет значительных различий в частоте биохимической прогрессии (PSA) между двумя группами (Witjes W. с соавт., 1998). В настоящее время установлено, что применение неоадъювантной терапии не увеличивает продолжительность жизни больных, однако никто не отрицает целесообразности проведения дальнейших рандомизированных исследований.
Ее применение позволило в несколько раз снизить частоту положительных краев после РПЭ (с 45% до 24% — Aus O. с соавт., 1998; с 33,8% до 7,8% — Labrie F. с соавт., 1994). Однако ряд последних исследований (включая и рандомизированные) показал, что в течение 3-4 лет наблюдения нет значительных различий в частоте биохимической прогрессии (PSA) между двумя группами (Witjes W. с соавт., 1998). В настоящее время установлено, что применение неоадъювантной терапии не увеличивает продолжительность жизни больных, однако никто не отрицает целесообразности проведения дальнейших рандомизированных исследований.
Помимо попыток снизить частоту положительных краев применением неоадъювантной терапии были предприняты усилия по улучшению технического выполнения операции по полному удалению опухолевой ткани. Применение панорамных увеличительных линз позволяет избежать повреждений капсулы, улучшить за счет хорошего гемостаза визуализацию операционного поля. Кроме того, широкое иссечение периуретральной и перипростатической фасций в области верхушки, включая несколько миллиметров проксимальной части мембранозной уретры, позволяет повысить радикальность оперативного вмешательства (Stamey T. с соавт., 1990).
Применение экспресс биопсии (frozen section) проксимального отдела уретры, а также краев резекции не получили широкого применения вследствие имевших место ложноположительных или ложноотрицательных ответов.
Некоторые авторы рекомендуют широкое иссечение сосудисто-нервных пучков, что, безусловно, снижает вероятность положительных краев. Ряд авторов предлагает выделять до выполнения РПЭ группу риска, у которой должны быть предприняты все меры по снижению прогнозируемой высокой вероятности положительных краев. Так высокий уровень PSA, большой объем, а также высокая степень дифференциации опухоли (G3) свидетельствуют о значительной вероятности положительных краев. (V. Epstein 1996 ; van den Ouden с соавт., 1994). Кроме этого показаниями для широкого иссечения краев могут служить более чем два положительных биопсийных столбика, либо один, но содержащий 100 % опухолевой ткани; локализация опухоли в верхушке железы (Watson R. с соавт., 1996). По данным R. Smith с соавт. (1996), широкое иссечение сосудисто-нервных пучков на стороне пальпируемой опухоли позволило получить отрицательный хирургический край у 58% больных по сравнению с 45%, у которых он сохранялся.
с соавт., 1996). По данным R. Smith с соавт. (1996), широкое иссечение сосудисто-нервных пучков на стороне пальпируемой опухоли позволило получить отрицательный хирургический край у 58% больных по сравнению с 45%, у которых он сохранялся.
Таким образом, широкое иссечение тканей способствует повышению степени радикальности операции и за счет явного циторедуктивного эффекта, который не может быть достигнут ни одним из других видов терапии, позволяет начать адъювантную терапию в более поздние сроки, что улучшает качество жизни больного и способствует увеличению продолжительности жизни. Примером этого могут быть данные, представленные van den Ouden с соавт. (1998), которые проследили 5-10 — летнюю выживаемость у 64 больных в стадии Т
3N
0М
0 после РПЭ как монотерапии. Так пациенты с низко дифференцированным раком предстательной железы в стадии Т
3N
0М
0 имели высокие показатели прогрессии (локальный рецидив на 5 и 10 год наблюдения составили 28% и 100%, а отдаленные метастазы — 64% и 100% соответственно), что говорит о необходимости немедленной адъювантной терапии. В то же время, пациенты, у которых опухоль была G
1-2 степени дифференциации имели результаты, сходные с показателями у больных со стадией Т
2 (локальный рецидив на 5 и 10 год наблюдений составили 13% и 30%, а отдаленные метастазы 16% и 31% соответственно). Эти данные убедительно свидетельствуют о том, что РПЭ должна рассматриваться как эффективный метод лечения у пациентов с высокой или средней степенью дифференцировки тканей опухоли в стадии Т
3N
0М
0.
Клинические стадии Т
1-3N
1М
0.
Вопрос о выборе оптимальной лечебной тактики у больных раком предстательной железы с положительными лимфоузлами вызывает большие споры. Дело в том, что наличие метастазов в лимфатических узлах расценивается как системное заболевание, и на этом основании многие специалисты считают бесполезной оперативную тактику. Выявление метастазов в лимфоузлах у пациентов, с прежде считавшимся локальным заболеванием понизилось с 20-40% в 1970 гг. до менее 10% в начале 1980 гг. В настоящее время в клинике Мейо это число составляет 5%. Однако оптимальные пути лечения для пациента с узловым метастазированием неясны. Не леченный л/у-позитивный рак предстательной железы ассоциируется с плохим прогнозом. У большинства пациентов симптоматическая локальная прогрессия происходит в сроки от 18 до 24 месяцев. Монотерапия в виде хирургии, гормональной терапии демонстрирует дальнейшую прогрессию заболевания. В то же время применение лучевой терапии, как на предстательную железу, так и лимфатические узлы не является методом лечения системного заболевания, о чем говорят и неудовлетворительные результаты ее применения в качестве монотерапии.
Другой проблемой является трудность выявления положительных лимфоузлов. Дело в том, что микрометастазы в лимфоузлы не выявляются ни КТ (компьютерной томографией), ни MЯТ (магнитно-ядерной томографией). В тех случаях, где увеличенный лимфоузел определяется с помощью КТ, в 90% случаев имеют место и отдаленные метастазы. На сегодняшний день мы можем лишь предполагать наличие опухолевых клеток в лимфоузлах на основании уровня PSA и степени дифференцировки. Наиболее часто специалисты прибегают к помощи экспресс биопсии лимфатических узлов у больных группы риска, и при получении положительного ответа решают вопрос о дальнейшей тактике — применении лучевой терапии в сочетании с андрогенной блокадой (Paulson D.F. с соавт., 1982; Seay T.M., Blute M.L. с соавт., 1998, Zincke N., 1989), либо РПЭ с последующей адъювантной терапией.
Данные, представленные в последние годы из клиники Mayo (Zincke H. 1997; Seay T. с соавт., 1998) и посвященные лечению больных с положительными лимфоузлами посредством РПЭ и адъювантной терапии, приобретают сторонников. Отмечено, что пациенты в стадии Т
3N
1-3М
0 и диплоидным типом опухоли, перенесшие РПЭ в сочетании с адъювантной гормональной терапией, имеют результаты лечения, сходные с результатами у пациентов со стадией Т
2 — 88% больных в течение 10 лет наблюдения не имели рецидива заболевания. Заслуживают внимания результаты R. Kalies с соавт., (1997): время до прогрессии заболевания у больных после РПЭ в сочетании с адъювантной эндокринной терапией было значительно больше, чем в группе после выполнения лимфаденэктомии в сочетании с эндокринной терапией. Все эти данные свидетельствуют о целесообразности применения комбинации РПЭ в сочетании с адъювантной терапией в лечении больных в стадиях Т
3N
1-3М
0. Результаты последнего исследования в клинике Мейо, опубликованных в 1999 г. в J. Urology, являются самым большим контролируемым ретроспективным анализом роли РПЭ в рТ
хN+ РП. У пациентов с рТ
хN+ была выполнена РПЭ с ранней орхэктомией (в течение 3-х месяцев после простатэктомии). Общая выживаемость в течение 10 лет в группе РПЭ + орхэктомия составила 66% в сравнении с 28%, если выполнялась только орхэктомия. Это наблюдение подтверждает тот факт, что РПЭ в сочетании с орхэктомией обеспечивает существенное улучшение общей и раково-специфической выживаемости (Ghavamian R. с соавт., 1999).
Радикальная простатэктомия для большинства больных раком предстательной железы, имеющих ожидаемую продолжительность жизни не менее 10 лет и локализованную форму
Т
1-2N
0М
0 — идеальный метод лечения, так как позволяет радикально удалить опухоль. Выживаемость больных после РПЭ зависит от многих факторов, но летальные исходы отмечаются крайне редко, а частота серьезных осложнений составляет не более 2%. Кроме того, частота послеоперационных осложнений уменьшается со временем, то есть в приводимых группах пациентов первые имели больше осложнений, чем оперированные в последние годы. Это обстоятельство может быть связано с улучшением хирургической техники, тщательным отбором больных и более совершенной диагностикой. Важность этих факторов и их позитивные изменения часто недооцениваются, однако, именно они являются направлением по улучшению результатов РПЭ (Catalona W.J. с соавт., 1999). Современная хирургическая техника операции дает возможность полностью удалять экстракапсулярные формы РП у пациентов в стадии Т
3N
0М
0, а также выделять пациентов группы риска (положительные хиpургические края, G>7), т.е. тех, которым при необходимости может назначаться адъювантная терапия. Пациенты с положительными лимфоузлами Т
1-3N
1М
0 могут рассчитывать на хороший эффект системной терапии после циторедуктивного эффекта РПЭ. Изучение рака груди подтверждает, что локо-региональная опухоль может быть потенциальным источником для будущей опухолевой диссеминации и присоединение локо-региональной терапии может предупредить вторичную диссеминацию из опухоли (Cadedu J.A. с соавт., 1997).
Хирургическая тактика, исповедуемая клиникой урологии ВМА, является активной как в отношении так называемых «традиционных» для оперативного лечения стадий РП — Т
1-Т
2, так и в отношении местно-распространенных процессов без вовлечения лимфоузлов (Т
3N
0M
0). В ситуациях с микрометастазированием в лимфоузлы, выявляемых после выполнения РПЭ, нам импонирует опыт клиники Мейо с использованием циторедуктивного эффекта в сочетании с антиандрогенной терапией или энуклеацией. Этот опыт особенно ценен и убедителен у молодых пациентов.
Кроме того, текущие исследования, возможно, позволят нам рационально использовать новые методы лечения, усиливающие циторедуктивный эффект, такие как использование аутовакцины и дендритных клеток.
Наши результаты подтверждают, что РПЭ является безопасной операцией у тщательно отобранных пациентов и в руках опытной хирургической команды.
Вторжение и метастазы | EdCaN
Ключевой особенностью, которая отличает раковые клетки от всех других клеток, является способность распространяться по телу с помощью двух взаимосвязанных механизмов: инвазии и метастазирования.
Вторжение
Инвазия относится к прямому распространению и проникновению раковых клеток в соседние ткани. Размножение трансформированных клеток и прогрессирующее увеличение размера опухоли в конечном итоге приводит к нарушению барьеров между тканями, что приводит к распространению опухоли в соседние ткани.Местная инвазия также является первым этапом процесса, который приводит к развитию вторичных опухолей или метастазов. 4, 7, 10
Метастазы
«Метастаз», от греческого «метистанай», что означает «переехать в другое место», описывает способность раковых клеток проникать в лимфатические и кровеносные сосуды, циркулировать по этим системам и вторгаться в нормальные ткани в других частях тела. Этот процесс протекает упорядоченно и предсказуемо, иногда его называют «метастатический каскад». 4, 7, 10
Способность раковых клеток мигрировать из первичного очага заболевания объясняется мутацией генов, регулирующих выработку белков, которые обычно связывают клетки с окружающими их тканями. Снижение синтеза раковыми клетками ряда веществ, которые связывают их с соседними клетками, вместе с аномальным синтезом ферментов, способных разрушать связи между клетками и тканями, позволяют раковым клеткам покинуть первичный очаг опухоли. 4, 7, 10
Ангиогенез
Ангиогенез играет роль в росте опухолей, инвазивности и метастазировании. 32, 33 Ангиогенез опухоли относится к росту новых сосудов, которые развиваются после стимуляции эндотелиальных клеток в существующих сосудистых сетях рядом с опухолью, обеспечивая кровоснабжение этой опухоли. 33 Баланс стимуляторов и ингибиторов строго контролирует ангиогенез в нормальных условиях. 2, 26 Одним специфическим и мощным промотором ангиогенеза является фактор роста эндотелия сосудов (VEGF). 26
Фактор роста эндотелия сосудов (VEGF)
VEGF — это цитокин, который оказывает свое действие на эндотелиальные клетки сосудов, способствуя образованию новых кровеносных сосудов, и имеет решающее значение как для нормального, так и для опухолевого ангиогенеза: 26, 34 VEGF чрезмерно экспрессируется в различных солидных опухолях и некоторых гематологических злокачественных новообразованиях. . Действие VEGF включает: 26
- связывание и активация двух структурно родственных мембранных рецепторных тирозинкиназ (TKs)
- включение нескольких сигнальных путей
- стимулирует рост, выживание и пролиферацию эндотелиальных клеток сосудов
- способствует росту опухоли и способствует инвазии и метастазированию опухоли.
Тирозинкиназы (TK)
Рост и прогрессирование опухоли также зависят от активности специфических рецепторов клеточной мембраны, которые контролируют сигнальные пути внутри клетки. Передача клеточных сигналов или «передача сигналов» включает в себя процесс коммуникации, когда сообщения или сигналы извне клетки передаются ядру внутри клетки. 26 Тирозинкиназы (ТК) представляют собой подгруппу рецепторов роста, участвующих в процессе передачи сигнала. 26 Поскольку TK являются регуляторами процесса передачи сигнала, они играют роль в клеточных процессах, таких как пролиферация, миграция, метаболизм, дифференцировка и выживание. 26 Было выявлено несколько важных факторов роста и других ТЗ: 26
- Семейство EGFR
- Рецептор фактора роста тромбоцитов (PDGF)
- BCR-ABL
- КОМПЛЕКТ
- Фактор роста эндотелия сосудов (VEGF)
- трансформирующий фактор роста (TGF)
- фактор роста фибробластов (FGF).
Учебная деятельность
Далее: Признаки и симптомы рака
Механизмы инвазии опухолевых клеток — Институт рака Хантсмана —
Распространение опухоли является наиболее важной причиной заболеваемости и смертности от рака. Это распространение представляет собой клеточный процесс, при котором раковые клетки мобилизуются и вторгаются из первичного очага опухоли. Местная инвазия вызывает разрушение тканей и органов при глиоме, базальноклеточном раке и опухолях головы, шеи и слюнных желез.Дальнейшее проникновение в лимфатические узлы и кровеносные сосуды вызывает метастатическое заболевание, которое остается неизлечимым при раке легких, груди и простаты. Во время лечения популяции устойчивых клеток увеличиваются и становятся более инвазивными, что еще больше ограничивает терапевтическую эффективность. Работа в лаборатории Мендосы дает механистическое понимание того, как онкогенная передача сигналов изменяет морфологию клеток и делает возможной инвазию через аберрантное микроокружение опухоли.
Движение клеток в 3D
Проникающие раковые клетки должны преодолеть структурные ограничения организации ткани и пройти через строму в сосудистую сеть.Инвазия может происходить в виде отдельных клеток, цепочек, кластеров или листов, которые ползут, разлагаются и сжимаются между фибриллами внеклеточного матрикса (ЕСМ). Механизмы инвазии раковых клеток варьируются от амебоидных до коллективных мезенхимальных или фибробластоподобных. Амебоидные клетки имеют эллипсовидную форму с быстро деформирующейся морфологией, небольшими выступами, слабыми адгезиями и низким уровнем продукции протеазы. Вместо того, чтобы разрушать ECM, амебоидные клетки ползают вокруг и деформируют матричные барьеры посредством опосредованного миозином II сокращения актиновых волокон, механически связанных с клеточной корой и клеточными адгезиями.Инвазия, подобная фибробластам, отличается морфологией веретена, заметным выступом, сильными адгезиями и продуцированием протеазы для разрушения барьеров межклеточного матрикса. Мы исследуем, как гиперактивация ERK и ее нижестоящая киназа RSK влияет на режимы и склонность к инвазии. Для этого мы разрабатываем новые анализы для мониторинга и количественной оценки инвазии через искусственные и естественные трехмерные микросреды. Эта работа финансируется Американским онкологическим обществом.
ERK / RSK при инвазии рака легкого
Во многих солидных опухолях, включая аденокарциному легких, драйверные мутации в RAS и RAF индуцируют гиперактивную передачу сигналов ERK для инициации, прогрессирования и поддержания опухоли.Прогрессирование опухоли включает распространение от первичного очага опухоли, что коррелирует с более низкой выживаемостью пациента. Лаборатория Мендосы использует клеточные линии рака легких человека и модели рака легких у мышей, чтобы исследовать, какие вторичные события дополнительно усиливают передачу сигналов ERK, способствуя прогрессированию аденокарциномы легких, и какие субстраты ERK участвуют в инвазии и метастазировании. Мы исследуем семейство p90RSK и субстраты, идентифицированные в нашей биохимической и механистической работе над актомиозиновым цитоскелетом.Эта работа финансируется Американским онкологическим обществом, Американской ассоциацией легких, V Foundation и NCI-NIH.
Признаков рака: активация, инвазия и метастаз
Раковые клетки проникают в локальную ткань и распространяются на отдаленные участки посредством двух различных, но похожих процессов, известных как инвазия и метастазирование.
Тканевая инвазия — это механизм распространения опухолевых клеток в близлежащую среду.Метастазирование относится к процессу отделения опухолевых клеток от первичной опухоли, миграции в новое место и образования новой или вторичной опухоли в новой среде. Оба этих сложных процесса задействуют существующие клеточные механизмы, такие как сигнальный путь Adherens Junction, чтобы обеспечить инвазию и миграцию опухолевых клеток.
Адгезивные соединения — это динамические структуры, которые формируются, укрепляются и распространяются, деградируют и затем реформируются, поскольку связанные с ними белки создают связи с аналогами из соседних клеток.Соединение Adherens выполняет множество функций, таких как инициация и стабилизация межклеточной адгезии, регуляция актинового цитоскелета, внутриклеточная передача сигналов и регуляция транскрипции. Они могут проявляться в виде полос, окружающих клетку (zonula adherens), или в виде пятен прикрепления к внеклеточному матриксу (адгезионные бляшки).
В нормальных условиях это помогает навести порядок между ячейками. Соединения клетка-клетка связывают клетки с соседними клетками в ткани. Они также регулируют тканевый гомеостаз в критических клеточных процессах, которые включают функцию тканевого барьера, пролиферацию и миграцию клеток.Дефекты межклеточных соединений вызывают широкий спектр тканевых аномалий, которые нарушают гомеостаз и являются обычными для генетических аномалий и рака.
Связь между клеточными соединениями и цитоскелетом все еще исследуется. Он может быть более динамичным, чем первоначально предполагалось, и может зависеть от множественных слабых ассоциаций между комплексом кадгерин-катенин и актиновым цитоскелетом или полагаться на др. Ассоциированные с мембраной белки.
Узнайте больше о передаче сигналов Adherens Junction и задействованных белках.
Ознакомьтесь с полным руководством по клеймам целей исследования рака. Загрузите электронную книгу сейчас.
Артикул:
1) Ханахан Д., Вайнберг Р.А. (январь 2000 г.). «Признаки рака». Клетка. 100 (1): 57–70. DOI: 10.1016 / S0092-8674 (00) 81683-9
2) Ханахан Д., Вайнберг Р.А. (март 2011 г.). «Признаки рака: следующее поколение». Клетка. 144 (5): 646-74. DOI: 10.1016 / j.cell.2011.02.013.
3) Гарсия, Мигель А. (апрель 2018 г.). «Межклеточные соединения организуют структурные и сигнальные сети для регулирования гомеостаза эпителиальной ткани».Cold Spring Harb Perspect Biol. 2; 10 (4): a029181.
4) Хартсток А., Нельсон В.Дж. (март 2008 г.). «Адгезии и плотные соединения: структура, функция и связи с актиновым цитоскелетом». Biochim Biophys Acta. 1778 (3): 660–669.
Вторжение и метастазы: неуловимый признак рака
В своем основополагающем обзоре, опубликованном почти два десятилетия назад, Ханахан и Вайнберг представили «признаки рака» и типизировали основные биологические способности, приобретаемые раком человека [1], включая устойчивую пролиферативную передачу сигналов, устойчивость к апоптозу, уклонение от подавителей роста, индукцию ангиогенеза, обеспечивая репликативное бессмертие, а также инвазию и метастазирование.Одиннадцать лет спустя, в 2011 году, авторы добавили еще два новых признака: перепрограммирование энергетического метаболизма и уклонение от иммунного разрушения [2]. В их обновленном обзоре геномная нестабильность и опухолевое воспаление также были добавлены как обеспечивающие характеристики онкогенеза. С тех пор несколько авторов пытались по-разному определить сложности биологии рака и оспаривали критерии включения конкретных признаков [3].
Метастатическое распространение злокачественных клеток — основная причина смертности от рака.Метастазирование — одна из самых загадочных особенностей биологии рака, сложный последовательный и взаимосвязанный процесс, ведущий к образованию отдаленных вторичных опухолей, совокупно называемых каскадом инвазии-метастазирования. Серия событий инициируется миграцией и локальным вторжением клеток в окружающий внеклеточный матрикс. Впоследствии клетки проникают в сосудистую сеть, выживают в суровых условиях кровотока, задерживаются на удаленных участках, экстравазируются в паренхиму органа, адаптируются к новой микросреде, образуя спящие клетки или многоклеточные микрометастазы, и, в конечном итоге, процветают в чужой среде для клинического установления обнаруживаемые макроскопические метастазы [2].
Растущее понимание основных принципов, ведущих к метастазированию, способствовало терапевтическому развитию, основанному на знаниях; однако, несмотря на быстро растущий арсенал целевых терапевтических средств (так называемые «волшебные пули»), стойкие безболезненные реакции на большинство форм рака встречаются редко, а излечения — еще реже [4]. Если не обнаружено на ранней стадии и не удалено хирургическим путем, нацеливание на определенные отличительные признаки эффективно только временно. В конце концов, сопротивление возникает из-за стратегий адаптивного и уклоняющегося сопротивления, разработанных раком, что позволяет опухоли прогрессировать, часто с новой силой.Успешное вторжение и метастазирование зависят от всех других приобретенных отличительных способностей [1], к которым были разработаны различные стратегические подходы [4].
Однако остается более серьезный вопрос: каков наиболее важный признак рака? В своем эссе [5] Лазебник указал, что, за исключением инвазии и метастазирования, все пять из шести исходных признаков являются общими как для доброкачественных, так и для злокачественных опухолей, и поэтому не отличаются от «рака». Эту концепцию можно аналогичным образом расширить до обновленных признаков — метаболического перепрограммирования, геномной нестабильности, опухолевого воспаления и уклонения от иммунитета, которые также преобладают в доброкачественных опухолях [6,7,8,9,10].Исключением является эндометриоз, распространенное доброкачественное заболевание среди женщин, при котором клетки эндометрия распространяются и проникают в отдаленные участки [3]. За исключением этого или, возможно, нескольких других исключений, инвазия и метастатическое распространение не характерны для доброкачественных состояний. Поэтому мы утверждаем, что важность признака инвазии и метастазирования проистекает из наиболее определяющей особенности злокачественности, которая влечет за собой способность вторгаться, распространяться и колонизировать отдаленные ткани.К сожалению, никаких одобренных лекарств не было специально разработано для блокирования инвазии или метастазирования, и вместо этого современные терапевтические подходы направлены на снижение жизнеспособности опухолевых клеток за счет воздействия на другие признаки.
В то время как модель отличительных признаков прекрасно описывает, что происходит с раковыми клетками, она не дает ответа на вопрос о том, какова иерархия отличительных признаков в более широкой перспективе терапевтических стратегий. Здесь мы предлагаем модифицированную модель клейм, в которой инвазия и метастазирование смещены в центр внимания (рис.1), тем самым подчеркивая его как потенциально лучшую терапевтическую мишень. Поскольку методы лечения, направленные на большинство других механизмов, специфичных для отличительных признаков, напрямую влияют на жизнеспособность клеток, популяция раковых клеток подвержена неизбежному отбору и дарвиновской эволюции. Напротив, блокирование инвазии не влияет напрямую на выживаемость клеток, и, таким образом, наложение селективного давления на новые устойчивые клоны менее вероятно [11]. Более того, блокирование метастатического каскада может предотвратить посев и последующий неограниченный экспоненциальный рост неограниченного числа отдаленных метастатических колоний; поэтому мы утверждаем, что противоинвазивную терапию можно рассматривать как эффективное подавляющее опухоль и «цитотоксическое» лечение, даже не убивая ни одной опухолевой клетки.
Рис. 1
Признаки рака, ориентированные на инвазию и метастазы. Иллюстрация отличительных признаков рака с признаком инвазии и метастазов вынесена в центр модели, чтобы подчеркнуть его ведущую роль в злокачественных новообразованиях
Метастатическое распространение является причиной большинства случаев смерти от рака, однако его профилактике как таковой уделяется очень мало внимания в литературе. в отличие от лечения первичных опухолей или вторичных поражений. Ранее мы упоминали, что большинство клинических исследований не сосредоточено на результатах, связанных с инвазией, а вместо этого медицинские исследования преимущественно сосредоточены на других целях, таких как прогрессирование заболевания и уменьшение опухоли [11].Действительно, поиск в литературе публикаций, связанных с профилактикой метастазов с помощью антиметастатических препаратов, из всех публикаций, связанных с терапией рака, показал, что только небольшая часть (<4%) публикаций связана с терапией профилактики метастазов, что указывает на то, что большинство публикаций по терапии рака сосредоточиться на других признаках рака (рис. 2).
Рис. 2
Ежегодные публикации, связанные с антиметастатическими препаратами. Общее количество годовых публикаций среди исследований, связанных с раком, за 1997-2017 годы, по данным поиска Pubmed.Для поиска публикаций, связанных с наркотиками, использовался поисковый запрос: «Наркотики» | «Наркотики» | «Лечение» | «Лечение» | «Терапия» | «Терапия». Поисковый запрос, использованный для поиска публикаций, связанных с антиметастазами, был: («Антиметастатический» | «Антиметастатический» | «Антиметастатический» | «Антиметастазовый» | «Антиинвазивный» | «Противодействующий инвазии» | «Противомиграционный» | | «Анти-деградация» | «Антипротеолитик» | «Антипротеолиз» | «Анти-ММП» | «Анти-матриксная металлопротеиназа» | «Предотвращение метастазов» | «Предотвращение метастазов» | «Анти-инвадоподия») ИЛИ («Инвазия» | «Инвадоподия» | «Миграция» | «Деградация» | «Протеолиз» | «Протеолитик» | «ММП» | «Матриксная металлопротеиназа») И («Ингибитор» | «Ингибиторы» | «Антагонист» | «Антагонисты»).Соотношение между запросами представлено пунктирной линией.
Несмотря на усилия, предпринимаемые различными группами [12,13,14,15,16,17,18], чрезвычайно малое значение, придаваемое противометастазирующей терапии, вызывает беспокойство. Эти наблюдения подтверждают необходимость расставлять приоритеты в отношении усилий, основанных на признаках, и терапевтических средств, нацеленных по-разному, как предлагается на рис. 1, сосредотачивая внимание на метастазах. В соответствии с этим, поскольку большинство успешных методов лечения основаны на раннем обнаружении и хирургическом удалении для предотвращения распространения опухоли в будущем, возможно, профилактическое лечение метастазов, при котором инвазивный фенотип полностью заблокирован, может быть столь же успешным.
Другие исследования ссылались на искажение инвазии и метастазирования [12, 19]; однако, насколько нам известно, мы первые, кто объективно оценил это в литературе. Таким образом, этот анализ подчеркивает диссоциацию между общепризнанной и беспрецедентной ролью инвазии и метастазов в смертности от рака и парадоксальной недостаточной представленностью исследований, посвященных его профилактике. Это очевидное противоречие можно объяснить хронологией метастатического каскада, согласно которому метастазы не могли бы развиться без первичной опухоли; интуитивная связь между ростом и распространением, которые не обязательно совпадают и приводят к совершенно различным клиническим последствиям; и заблуждение, что уничтожение раковых клеток и метастатических поражений синонимично предотвращению метастазирования [19, 20].Таким образом, предлагаемая иерархическая модель пытается продвинуться к разрешению этого противоречия.
Признаки рака были предложены в качестве генерального плана для руководства исследовательскими усилиями, направленными на понимание основных черт рака и разработку методов лечения этого исключительно сложного заболевания. Одна из наиболее серьезных проблем в лечении рака связана с появлением уравновешенных форм устойчивости, которые постепенно преодолевают существующие и новые методы лечения. Эту проблему можно обойти, сместив фокус исследования и парадигмы лечения в сторону блокирования признака инвазии и метастазирования, который служит естественным кандидатом на наиболее важный и определяющий признак злокачественного новообразования.Однако, несмотря на то, что мы безмерно вовлечены в использование постоянно растущего арсенала стратегий для подрыва жизнеспособности рака, мы легко можем упустить самое важное и неуловимое свойство из всех.
Ссылки
- 1.
Hanahan D, Weinberg RA. Признаки рака. Клетка. 2000; 100: 57–70.
CAS
СтатьяGoogle ученый
- 2.
Ханахан Д., Вайнберг, РА. Признаки рака: следующее поколение.Клетка. 2011; 144: 646–74.
CAS
СтатьяGoogle ученый
- 3.
Фуад Ю.А., Аанеи К. Возвращение к признакам рака. Am J Cancer Res. 2017; 7: 1016.
CAS
PubMed
PubMed CentralGoogle ученый
- 4.
Ханахан Д. Переосмысление войны с раком. Ланцет. 2014; 383: 558–63.
Артикул
Google ученый
- 5.
Лазебник Ю. Каковы признаки рака? Nat Rev Рак. 2010; 10: 232.
CAS
СтатьяGoogle ученый
- 6.
Чегини Н. Провоспалительные и профибротические медиаторы: основные эффекторы развития лейомиомы как фиброзного заболевания. Semin Reprod Med. 2010. 28: 180–203.
CAS
СтатьяGoogle ученый
- 7.
Marino-Enriquez A, Fletcher CD.Разве нам не нужно заботиться о биологии доброкачественных опухолей? Nat Rev Рак. 2014; 14: 701.
CAS
СтатьяGoogle ученый
- 8.
Монлеон Д., Моралес Дж. М., Гонсалес-Сегура А., Гонсалес-Дардер Дж. М., Хиль-Бенсо Р., Серда-Николас М. и др. Метаболическая агрессивность при доброкачественных менингиомах с хромосомной нестабильностью. Cancer Res. 2010; 70: 8426–34.
Артикул
Google ученый
- 9.
Reiman JM, Kmieciak M, Manjili MH, Knutson KL. Пути иммуноредактирования и иммуноскульптуры опухолей к прогрессированию рака. Semin Cancer Biol. 2007. 17: 275–87.
CAS
СтатьяGoogle ученый
- 10.
Yigit R, Massuger LF, Zusterzeel PL, Pots J, Figdor CG, Torensma R. Профили цитокинов в жидкостях кист от опухолей яичников отражают иммуносупрессивное состояние опухоли. Int J Gynecologic Cancer. 2011; 21: 1241–7.
Артикул
Google ученый
- 11.
Мейрсон Т., Гил-Хенн Х. Нацеливание на инвадоподии для блокирования метастазов рака груди. Обновления устойчивости к лекарствам. 2018; 39: 1–17.
Артикул
Google ученый
- 12.
Гандаловичова А., Розель Д., Фернандес М., Весели П., Хенеберг П., Чермак В. и др. Миграстатики — антиметастатические и противоинвазивные препараты: перспективы и проблемы. Тенденции рака. 2017; 3: 391–406.
Артикул
Google ученый
- 13.
Hayes KE, Walk EL, Ammer AG, Kelley LC, Martin KH, Weed SA. Киназы Ableson негативно регулируют функцию инвадоподий и инвазию в плоскоклеточный рак головы и шеи, ингибируя аутокринную петлю HB-EGF. Онкоген. 2013; 32: 4766.
CAS
СтатьяGoogle ученый
- 14.
Линде Н., Казанова-Асебес М., Соса М.С., Морта А., Рахман А., Фариас Е. и др. Макрофаги организуют раннее распространение и метастазирование рака груди.Nat Commun. 2018; 9: 21.
Артикул
Google ученый
- 15.
Меирсон Т., Генна А., Лукич Н., Махний Т., Альтер Дж., Шарма В.П. и др. Нацеливание на метастазирование рака молочной железы, опосредованное инвадоподиями, с помощью ингибиторов киназы ABL. Oncotarget. 2018; 9: 22158.
Артикул
Google ученый
- 16.
Паз Х, Патак Н., Янг Дж. Постепенное вторжение: роль инвадоподий в метастазировании опухоли.Онкоген. 2014; 33: 4193.
CAS
СтатьяGoogle ученый
- 17.
Revach O-Y, Sandler O, Samuels Y, Geiger B. Перекрестное взаимодействие между рецепторными тирозинкиназами AXL и ERBB3 регулирует образование инвадоподий в клетках меланомы. Cancer Res. 2019; 79: 2634–48.
CAS
СтатьяGoogle ученый
- 18.
Немлич Ю., Барух Э.Н., Бессер М.Дж., Шошан Э., Бар-Эли М., Анафи Л.ADAR1-опосредованная регуляция инвазии меланомы. Nat Commun. 2018; 9: 2154.
Артикул
Google ученый
- 19.
Слиман Дж., Стиг П.С. Метастазирование рака как терапевтическая мишень. Eur J Cancer. 2010; 46: 1177–80.
CAS
СтатьяGoogle ученый
- 20.
Карагианнис Г.С., Кондиелис Дж.С., Октай М.Х. Метастазирование, вызванное химиотерапией: механизмы и возможности трансляции.Clin Exp Metastasis. 2018; 35: 269–84.
CAS
СтатьяGoogle ученый
Ссылки для скачивания
Благодарности
Эта работа была поддержана Израильской онкологической ассоциацией и компаниями Estee Lauder (номер гранта 20180089), Израильским научным фондом (грант номер 1462/17) и Израильским фондом исследований рака (грант номер 17-902-AG) (в HG-H), а также Leir Foundation и Ginzburg Foundation (в AOS).TM поддерживается стипендией Фонда Фоулкса для студентов MD / PhD.
Информация об авторе
Принадлежность
Лаборатория миграции и инвазии клеток, Медицинский факультет Азриэли, Университет Бар-Илан, Цфат, Израиль
Томер Мейрсон и Хава Гил-Хенн
Лаборатория открытия лекарств, Азриэли Медицинский факультет Университета Бар-Илан, Цфат, Израиль
Томер Меирсон и Абрахам О. Самсон
Автор, ответственный за переписку
Для корреспонденции
Томер Меирсон.
Декларации этики
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Дополнительная информация
Примечание издателя Springer Nature сохраняет нейтралитет в отношении юрисдикционных претензий на опубликованных картах и сведений об учреждениях.
Об этой статье
Цитируйте эту статью
Meirson, T., Гил-Хенн, Х. и Самсон, А.О. Вторжение и метастазирование: неуловимый признак рака.
Онкоген 39, 2024–2026 (2020). https://doi.org/10.1038/s41388-019-1110-1
Скачать цитату
Дополнительная литература
Терапевтические препараты, направленные на TGFβ: 2020
Фармакология и терапия
(2021 год)Метаболический потенциал раковых клеток в контексте метастатического каскада
- Моханед Бензарти
- , Кэтрин Дельбрук
- , Лаура Нейзес
- , Николь Кивелер
- и Йоханнес Мейзер
Ячейки
(2020)Противоопухолевые препараты и их мишени
Молекулы
(2020)
Миграция, инвазия и метастазирование раковых клеток
Рак является основной причиной смерти в Соединенных Штатах и распространения раковых клеток из первичной опухоли в другие органы, т.е.е. метастазирование — это ключевая особенность, которая приводит к высокой смертности. Например, 5-летняя выживаемость женщин с локализованными опухолями груди составляет 98%. Однако метастазирование местных опухолей молочной железы в другие органы приводит к очень низкой выживаемости — 23%. Метастазирование включает отделение эпителиальных клеток от первичной опухоли, миграцию клеток в окружающую ткань, инвазию клеток в кровеносные / лимфатические сосуды и колонизацию дистальных органов. Один биологический механизм, ответственный за метастазирование, известен как переход от эпителия к мезенхиме (EMT).EMT — это форма клеточной пластичности (т.е. поведение, подобное стволовым клеткам), при которой неподвижные эпителиальные клетки превращаются в высоко мигрирующие / инвазивные мезенхимальные клетки. EMT — нормальное явление, которое оценивается путем измерения активности определенных генов, которые модулируются во время перехода. К сожалению, многие из этих генных маркеров неспецифичны и не претерпевают последовательных изменений во время метастазирования. Кроме того, эти маркеры не позволяют количественно определить степень EMT и / или метастатический потенциал у данного пациента.
Недавно наша лаборатория продемонстрировала, что раковые клетки претерпевают драматические биомеханические и структурные изменения во время EMT (см. Рисунок 1). Эти биомеханические изменения не только высокоспецифичны, поскольку характеристика механики клеток / тканей является клинически жизнеспособным диагностическим методом, эти изменения в механике клеток представляют собой новый способ количественной оценки степени ЭМП. Однако не совсем понятно, как изменения в механике клеток облегчают или изменяют процессы миграции и инвазии клеток, необходимые для метастазирования.Поэтому мы начали разрабатывать сложные многомасштабные вычислительные модели, чтобы исследовать, как изменения в различных биомеханических свойствах клеток влияют на миграцию и метастазирование раковых клеток (см. Рисунок 2). Эти модели могут моделировать как отделение раковых клеток от первичной опухоли, так и их миграцию / инвазию в окружающие ткани. В летних проектах студенты сначала познакомятся с вычислительными инструментами, используемыми для создания моделей миграции и инвазии раковых клеток (т.е. конечно-элементное моделирование). Затем студенческой группе будет предложено смоделировать очень конкретный и важный этап метастазирования, когда раковые клетки, отделившиеся от первичной опухоли, должны протиснуться через поры внеклеточного матрикса и проникнуть через тонкий слой эндотелиальных клеток, чтобы попасть в кровоток. Два аспиранта из лаборатории доктора Гадиали будут доступны, чтобы помочь студентам создать начальные модели и проанализировать результаты моделирования. Эти студенты также расскажут, как они используют вычислительные методы для продвижения своих программ PhD.
Частично спонсируется грантом NSF 1134201
Оценка стромальной инвазии для правильной гистологической диагностики ранней гепатоцеллюлярной карциномы
Стромальная инвазия (инвазивный рост опухолевой ткани в портальные тракты и фиброзные перегородки) в настоящее время признана наиболее важной находкой в диагностике высокодифференцированного типа раннего гепатоцеллюлярного карциномы (ГЦК). Для дифференциации инвазии в строму от псевдоинвазии (доброкачественная ткань печени в фиброзной строме) полезны следующие 5 пунктов: (1) макроскопические или панорамные изображения гистологического образца, (2) количество фиброзных компонентов стромы, (3) разрушение структура портальных трактов, (4) потеря ретикулиновых волокон вокруг раковых клеток и (5) иммуноокрашивание цитокератином 7 для пролиферации протоков.Информация о стромальной инвазии также полезна для лучшего понимания сосудистой сети (гиповаскулярные ГЦК) и гистологических особенностей (жировые изменения) ранних ГЦК. Инвазия ранее существовавших артерий и воротных вен вызывает гиповаскуляризацию ГЦК. Кроме того, гиповаскулярность вызывает жировые изменения как гипоксические изменения раковых тканей.
1. Введение
Недавно Международная консенсусная группа по гепатоцеллюлярной неоплазии (ICGHN) опубликовала международный консенсус в отношении гистологической диагностики гепатоцеллюлярной карциномы, особенно хорошо дифференцированного типа ранней стадии (ранняя ГЦК) [1].Это было эпохальное событие для ранней диагностики и лечения гепатоцеллюлярных карцином (ГЦК). В этом консенсусном документе инвазия стромы (инвазивный рост опухолевой ткани в портальные тракты и фиброзные перегородки) была признана наиболее важным открытием для диагностики ранних ГЦК. К сожалению, однако, об этом открытии мало кто знает, за исключением небольшого числа экспертов по патологии печени. Чтобы представить правильный гистологический диагноз ранних ГЦК, здесь объясняются гистологические особенности инвазии в строму с подробностями, показанными на многих рисунках.Также описано, как инвазия в строму тесно связана с характерными изображениями и гистологическими особенностями ранних ГЦК.
2. История исследований стромальной инвазии ГЦК
Стромальная инвазия, ранее называемая интерстициальной инвазией ГЦК, определяется как инвазивный рост опухолевой ткани в фиброзные перегородки, портальные тракты и / или кровеносные сосуды [2–7]. Инвазия стромы другими опухолями других органов является общепризнанной концепцией и долгое время служила важным доказательством для окончательного диагноза злокачественной опухоли [8, 9].Однако до недавнего времени инвазия ГЦК в строму не была широко известна. Об этом открытии впервые сообщили Kondo Y. et al. Как о «полосе» в фиброзных перегородках цирроза вокруг узла ГЦК. [2]. Kondo F. et al. затем сообщил, что это открытие часто обнаруживалось в уже существующих воротных трактах, а также в фиброзных перегородках [3], подчеркнув, что это открытие было очень полезным для диагностики хорошо дифференцированных ГЦК. Схема инвазии была разделена на 3 типа: перекрестный, продольный и нерегулярный.Также сообщалось, что инвазия в строму может быть обнаружена даже при макроскопическом обзоре и панорамном обзоре гистологического образца. В то время это открытие называли «интерстициальной инвазией» вместо «стромальной инвазии». Tomizawa et al. сообщили, что ростовая активность хорошо дифференцированного HCC была значительно подавлена инвазией в строму [4]. Накано и др. разделили стромальную инвазию на три типа: (1) инвазия стромы в фиброзную ткань и / или портальные тракты, (2) инвазию стенки кровеносных сосудов в воротные вены или печеночные вены и (3) опухолевый тромб [5].Miyao et al. описали, что ткань HCC в состоянии стромальной инвазии не сопровождается ретикулиновыми каркасами и коллагеном IV типа [6].
В 1995 г. Международная рабочая группа (IWP) Всемирного конгресса гастроэнтерологов опубликовала согласованную номенклатуру и диагностические критерии узловых гепатоцеллюлярных поражений [10]. В этой статье инвазия в строму была указана в качестве критерия гистологического диагноза хорошо и умеренно дифференцированного ГЦК. Однако даже после публикации этой статьи это открытие все еще не было хорошо известно, особенно среди патологов в западных странах, возможно, потому, что соответствующие статьи, касающиеся инвазии в строму, были написаны японскими патологами.Этот факт вызвал серьезные различия в критериях диагностики ранних ГЦК между восточными и западными патологами.
Для решения этой серьезной проблемы в апреле 2002 года в Куруме, Япония, была созвана Международная консенсусная группа по гепатоцеллюлярной неоплазии (ICGHN). Эта группа встречалась несколько раз и впоследствии, вплоть до июля 2007 г., обсуждала гистологические критерии диагностики ранних ГЦК [1]. На этих встречах подробно обсуждались результаты инвазии в строму.Наконец, все участники, включая западных патологов, великодушно признали важность и полезность этого открытия. Park et al. сообщили, что протоковая реакция, подтвержденная цитокератином 7 (CK7), полезна для определения ранней стромальной инвазии, небольших гепатоцеллюлярных карцином и диспластических узелков (DN) [7]. Это была первая статья о инвазии в строму, написанная патологом неяпонского происхождения. Все авторы этой статьи были членами ICGHN. В число авторов входили 1 корейский, 4 западных и 4 японских патологоанатома.
В 2009 году ICGHN опубликовала консенсусную статью [1], в которой описывается, что инвазия в строму является наиболее полезной для дифференциации ранней стадии HCC от DN высокой степени злокачественности. Однако этот вывод не получил достаточного распространения даже после публикации консенсусного документа. Чтобы добиться прогресса в ранней диагностике многих пациентов с ГЦК в мире, необходимо подробно объяснить это открытие.
3. Как правильно оценить стромальную инвазию: макроскопическая и гистологическая оценка стромальной инвазии
Стромальная инвазия — это инвазивный рост опухолевой ткани в строму (фиброзные перегородки, портальные тракты и / или кровеносные сосуды).Гистологически он подразделяется на 3 типа: перекрестный, продольный и неправильный (Рисунки 1 (A), 1 (B) и 1 (C) [4]).
При перекрестном типе ГЦК проникает через фиброзные перегородки. опухолевых узлов (Рисунок 1 (A)). В продольном типе опухолевые клетки растут продольно внутри фиброзных перегородок (Рисунок 1 (B)). В нерегулярном типе портальные области нерегулярно поражены опухолевыми клетками (Рисунок 1 (C) Тип скрещивания обычно наблюдается в умеренно или слабо дифференцированных ГЦК, тогда как продольный и нерегулярный типы обычно обнаруживаются в хорошо дифференцированных ГЦК, хотя иногда также и в умеренно или слабо дифференцированных ГЦК.При оценке стромальной инвазии очень полезно сравнение раковых областей с доброкачественными (рис. 1 (D)), и мы должны отличать «псевдо-инвазию» от истинной стромальной инвазии. Псевдоинвазия означает доброкачественную незлокачественную ткань в фиброзной строме (рис. 1 (E)), и это действительно похоже на стромальную инвазию.
Для дифференциации очень полезны следующие факторы: (1) Макроскопические и / или панорамные (с малым увеличением) изображения узелка. (2) Количество фиброзных компонентов стромы.(3) Продолжение инвазии сосудов и разрушение структуры портальных трактов. (4) Потеря ретикулиновых волокон вокруг опухолевых клеток. (5) Иммуноокрашивание цитокератина 7.
Стромальную инвазию можно идентифицировать даже с помощью макроскопического и / или панорамного обзора гистологических образцов. Как видно на рисунке 1 (F) (макроскопическое изображение ГЦК), в доброкачественной области без инвазии (область (а)) четко видны фиброзные перегородки. Однако в области распространения опухоли (область (b)) перегородки нечеткие.Точно так же на панорамном виде гистологического образца ГЦК (рис. 1 (G)) можно четко идентифицировать отчетливые фиброзные перегородки (область (a)) и нечеткие фиброзные перегородки (область (b)). В этих нечетких перегородках инвазия опухоли была затем обнаружена под микроскопом (Рисунки 1 (B) и 1 (C)). Количество фиброзного компонента сильно различается в инвазивной и неинвазивной областях, что является важным моментом для дифференциации от псевдоинвазии. Количество фиброзного компонента уменьшилось в результате инвазии опухоли, и это уменьшение вызвало нечеткость фиброзных перегородок.Псевдоинвазия обычно вызывается фиброзом доброкачественной доброкачественной ткани печени. Следовательно, он не показывает уменьшения волокнистого компонента. Когда стромальная инвазия очень легкая, а фиброзные компоненты минимально редуцированы, гистологическая и макроскопическая оценка стромальной инвазии затруднена. Однако стромальная инвазия достаточно серьезна, гистологическая и макроскопическая оценка проста (Рисунки 1 (F) и 1 (G)). Даже в случаях ГЦК с минимальной инвазией и DN доля фиброзной стромы или портальных трактов снижается до некоторой степени, как описано ниже.Таким образом, макроскопическое изображение полезно для распознавания eHCC и DN. Непрерывность сосудистой инвазии и разрушение структуры портальных трактов также являются важными выводами (рис. 1 (H)). Первое является решающим признаком злокачественности. Хотя это не обычная находка, ее можно обнаружить при некоторых ранних ГЦК. Ткань опухоли сначала проникает в фиброзные перегородки, затем в стенки сосудов и, наконец, в просвет сосудов. Связь между эндотелиальными клетками наверняка была разрушена механической силой, вызванной ростом опухоли.Инвазия воротной вены на рисунке 1 (H) происходит в сосудистом пространстве. Это означает, что опухолевые клетки распространяются в кровотоке. Однако распространение опухолевых клеток напрямую не вызывает метастазирования. Прежде чем образовывать метастатические очаги, опухолевые клетки должны выжить в кровотоке, достичь удаленных областей, проникнуть в стенки сосудов изнутри наружу и распространяться за пределы кровеносных сосудов. Интерпретация опухолевых клеток в субэндотелиальном пространстве противоречива. Это может быть истинная субэндотелиальная инвазия.Однако это можно интерпретировать как вторжение в кровяное пространство после повторного покрытия эндотелиальными клетками. Эндотелиальные клетки могут легко покрывать внутрисосудистые инородные вещества. Разрушение структуры портального тракта чаще встречается при инвазии в строму, тогда как эта особенность не наблюдается при псевдоинвазии (Рисунок 1 (E)).
Потеря ретикулиновых волокон вокруг опухолевых клеток — еще одно полезное открытие [7]. На рисунках 1 (I) и 1 (J) показано окрашивание трихромом по Массону и окрашивание серебром псевдоинвазии.На рисунках 1 (K) и 1 (L) показаны изображения истинного вторжения, соответственно. Увеличение на рисунках 1 (J) и 1 (L) немного больше, чем на рисунках 1 (I) и 1 (K). Паренхима печени явно окружена волокнами ретикулина в псевдоинвазии (рис. 1 (J)). Напротив, ткань печени истинной инвазии лишена таких окружающих ретикулиновых волокон (Рисунок 1 (L)). Опухолевые клетки встраиваются в перегородочные волокна, не покрываясь волокнами ретикулина.
Как описано выше, Park et al.сообщили, что иммуноокрашивание CK7 полезно для выявления инвазии в строму [7]. Проточная реакция, подтвержденная окрашиванием CK7, часто встречается при доброкачественных гепатоцеллюлярных узловых поражениях (рис. 1 (M)), тогда как она реже встречается при HCC с истинной стромальной инвазией (рис. 1 (N)). Протоки вокруг фиброзных перегородок не являются раковыми компонентами. В них должны были проникнуть хорошо дифференцированные клетки HCC вокруг фиброзных перегородок или клетки HCC из фиброзных перегородок.
Для правильной оценки истинной инвазии в строму полезны эти окрашивания серебром и СК7.Окрашивание трихромом Массона, краситель Азана-Мэллори и краситель Виктория синий также полезны для осветления волокнистых компонентов.
Затем необходимо показать некоторые гистологические особенности, которые затрудняют оценку инвазии в строму (рис. 2).
Рисунок 2 (а) показывает истинную стромальную инвазию очень легкой степени. Фиброзная перегородка практически не повреждена, за исключением небольшого участка (стрелка). Напротив, Рисунок 2 (b) показывает псевдоинвазию, состоящую из очень тонких фиброзных пучков внутри и вокруг толстых тяжей клеток печени.Этот образец не был сформирован за счет уменьшения фиброзного компонента, а скорее за счет рассечения паренхимы печени очень тонкой фиброзной тканью. Наблюдая за этими двумя фигурами, патологи могут усомниться в концепции инвазии в строму. Однако в таких случаях очень полезно окрашивание серебром. Волокна ретикулина теряются в случае истинной инвазии, но не в случае псевдо-инвазии. В случаях, подобных рис. 2 (а), я рекомендую патологоанатомам искать более серьезно пораженные портальные тракты, которые можно легко оценить как истинное вторжение.Даже очень хорошо дифференцированные ГЦК иногда включают сильно пораженные портальные тракты, а также минимально пораженные портальные тракты. На рис. 2 (с) показан образец с очень плохим окрашиванием серебром. Такой плохо окрашенный препарат затрудняет диагностику.
Рисунок 2 (d) показывает, что волокна ретикулина иногда ограничивают раковые ткани даже в области истинной инвазии (желтая стрелка). Однако в одной и той же фиброзной перегородке обычно видны необрезанные клетки (зеленые стрелки). Этот район является «фронтом» вторжения.Напротив, красные стрелки показывают обычную опухолевую ткань с волокнами ретикулина вне фиброзной ткани. Фактически, волокна ретикулина иногда наблюдаются внутри и вокруг истинно инвазивных областей. После завершения инвазивного процесса раковые клетки образуют обычные раковые участки. В такой фазе роста опухоли волокна ретикулина должны снова формироваться.
4. Влияние инвазии стромы на изображения и гистологические особенности ранних ГЦК
Инвазия стромы тесно связана с изображениями и гистологическими особенностями ранних ГЦК.На рисунке 3 показана взаимосвязь между развитием рака, васкуляризацией, гистологическими особенностями (жировые изменения) и инвазией в строму. Хотя прямых доказательств в строгом смысле слова не существует, возможность или гипотеза, показанная на Рисунке 3, хорошо объясняет механизм образования сосудов и жировых изменений ГЦК. По крайней мере, предыдущие исследования [12–18] могут быть хорошим косвенным доказательством описания на рисунке 3. Хорошо дифференцированные ГЦК возникают из незлокачественных тканей печени (нормальная печень, регенеративные узелки и DN), а затем переходят в умеренно выраженные формы. или плохо дифференцированные ГЦК.Васкулярность (обычно оцениваемая по изображениям, усиленным контрастным веществом) изменяется во время этого процесса. Хорошо дифференцированные ГЦК обычно представляют собой гиповаскулярные поражения [12–17]. Эта гиповаскуляризация означает уменьшение ранее существовавшего артериального и портального кровоснабжения, вызванное инвазией стромы. Во время процесса, при котором хорошо дифференцированный ГЦК прогрессирует в умеренно или слабо дифференцированный ГЦК, васкуляризация обычно изменяется и становится гиперваскулярной [12–17]. Это сосудистое изменение вызвано разрастанием аномальных артерий (неоваскуляризацией) [1, 17].
На самом деле аномальные артерии обнаруживаются в пределах DN [1, 17]. Однако увеличения артерий недостаточно, чтобы вызвать гиперваскуляризацию. В DNs иногда наблюдается гиповаскуляризация без инвазии в строму [17]. Эта гиповаскуляризация объясняется относительным уменьшением плотности ранее существовавших портальных трактов. Поскольку паренхимный компонент увеличивается в узелке DN, плотность ранее существовавших портальных трактов уменьшается. После того, как DNs трансформируются в ранние HCC, плотность может уменьшаться более серьезно из-за инвазии стромы.Этот процесс должен был вызвать гиповаскуляризацию ранних ГЦК.
Эта гиповаскуляризация также может объяснить механизм образования жировых изменений, хорошо известную особенность ранних ГЦК (рис. 3) [18]. Хотя жировые изменения могут быть приписаны метаболическим изменениям опухолевых клеток с развитием опухоли независимо от гипоксических изменений, гиповаскулярность может вызывать жировые изменения как гипоксические изменения.
Как упоминалось выше, знание инвазии в строму очень полезно для понимания васкуляризации и гистологических особенностей ранних ГЦК.
5. Ограничения оценки стромальной инвазии
Наконец, необходимо описать ограничения оценки стромальной инвазии. Стромальную инвазию не всегда можно оценить гистологически, и ее очень редко оценивают при исследовании образцов биопсии тонкой иглой [11]. Образцы биопсии слишком малы для исследования инвазии в строму. По этой причине очень хорошо дифференцированные ГЦК, не имеющие типичных признаков обычных хорошо дифференцированных ГЦК, не диагностируются при биопсии [11].В качестве гистологических критериев для биопсийной диагностики хорошо дифференцированных ГЦК до сих пор используются (1) скопление ядер (гиперцеллюлярность), (2) гиперкрашиваемость цитоплазмы (базофилия или эозинофилия) и (3) образование микроацинаров [19]. Эти критерии оказались полезными, поскольку обычные хорошо дифференцированные ГЦК имеют значительную паренхиматозную атипию. Однако некоторые очень хорошо дифференцированные ГЦК не диагностируются при биопсии и окончательно диагностируются после исследования инвазии стромы в резецированных образцах.
Чтобы добиться прогресса в ранней диагностике ГЦК, мы должны разработать новые паренхимные опухолевые маркеры, которые можно использовать для диагностики биопсии. Недавно были предприняты попытки использовать иммуногистохимические маркеры для диагностики высокодифференцированных ГЦК [20-25]. Белок теплового шока 70 (HSP70) [20, 21], глипикан 3 (GPC3) [20, 22, 23] и глутамин синтетаза (GS) [20, 24, 25] использовались независимо или в комбинации. В настоящее время эти маркеры используются как дополнение к морфологическим критериям.Были опробованы и более новые маркеры [26, 27]. Мы надеемся, что в будущем будут разработаны отличные маркеры с высокой чувствительностью и высокой специфичностью.
6. Выводы
(1) Инвазия в строму — очень важный результат для гистологической диагностики ранних ГЦК. (2) Для правильной оценки инвазии в строму полезны следующие 5 пунктов: (1) макроскопические или панорамные изображения гистологический образец, (2) количество фиброзных компонентов стромы, (3) разрушение структуры портальных трактов, (4) потеря ретикулиновых волокон вокруг раковых клеток и (5) иммуноокрашивание СК 7 для выявления пролиферации протоков.(3) Знание инвазии стромы очень полезно для понимания механизма формирования изображений (васкуляризация) и гистологических особенностей (жировые изменения) ранних ГЦК. (4) Инвазия стромы не может быть оценена в образцах биопсии тонкой иглой. Необходимо разработать паренхимные опухолевые маркеры, которые можно использовать для диагностики при биопсии.
Рак полости рта и глотки: стадии и степени
НА ЭТОЙ СТРАНИЦЕ: Вы узнаете, как врачи описывают рост или распространение рака. Это называется этапом.Используйте меню для просмотра других страниц.
Стадия — это способ описания того, где находится рак, распространился ли он и где он распространился, а также влияет ли он на другие части тела.
Врачи используют диагностические тесты, чтобы определить стадию рака, поэтому определение стадии может быть неполным, пока не будут завершены все тесты. Знание стадии помогает врачу решить, какой вид лечения лучше всего, и может помочь предсказать прогноз пациента, который является шансом на выздоровление. Существуют разные описания стадий для разных типов рака.
Промежуточная система TNM
Одним из инструментов, который врачи используют для описания стадии, является система TNM. Врачи используют результаты диагностических тестов и сканирования, чтобы ответить на следующие вопросы:
Опухоль (T): Насколько велика первичная опухоль? Где он расположен?
Узел (N): Распространилась ли опухоль на лимфатические узлы? Если да, то где и сколько?
Метастазы (M): Распространился ли рак на другие части тела? Если да, то где и сколько?
Система TNM различается в зависимости от диагноза: рак полости рта, рак ротоглотки или рак ротоглотки, связанный с ВПЧ.
Результаты системы TNM объединяются для определения стадии рака у каждого человека. В зависимости от диагноза бывает 4 или 5 стадий. Стадия 0 (нулевая) используется только для рака ротоглотки, не связанного с ВПЧ. Стадии с I по IV (с 1 по 4) используются для всех типов рака полости рта и ротоглотки. Этап представляет собой общий способ описания рака, поэтому врачи могут работать вместе, чтобы спланировать наилучшее лечение.
Вот более подробная информация о каждой части системы TNM для рака полости рта и ротоглотки.
Опухоль (T)
В системе TNM буква «Т» плюс буква или цифра (от 0 до 4) используется для описания размера и местоположения опухоли. Размер опухоли измеряется в миллиметрах (мм) и сантиметрах (см). Сантиметр примерно равен ширине стандартной ручки или карандаша. В 1 сантиметре 10 миллиметров.
Стадия также может быть разделена на более мелкие группы, которые помогают описать опухоль еще более подробно. Информация о конкретной стадии опухоли приведена ниже.
Полость рта
TX: Первичная опухоль не может быть оценена.
Tis: Описывает стадию, называемую карциномой (рак) in situ. Это очень ранний рак, при котором раковые клетки обнаруживаются только в 1 слое ткани.
T1: Опухоль составляет 2 см или меньше в максимальном размере. Опухоль проникла в близлежащие ткани на глубину 5 мм или меньше; это называется глубиной вторжения.
T2: Размер опухоли 2 см или меньше, глубина инвазии составляет от 5 до 10 мм. Или опухоль больше 2 см, но не больше 4 см, а глубина инвазии составляет 10 мм или меньше.
T3: Опухоль больше 4 см или любая опухоль с глубиной инвазии более 10 мм.
T4: Это местное заболевание средней или очень запущенной стадии.
T4a (губа): Опухоль началась на губе, но распространилась на кость или распространилась на нижний альвеолярный нерв во рту, дно рта или кожу лица.
T4a (полость рта): Опухоль проникла в близлежащие структуры во рту, такие как челюсть, пазухи или кожа лица.
T4b: Опухоль поразила мышцы и кости, образующие рот или основание черепа, и / или покрывает внутренние артерии.
Ротоглотка
TX: Первичная опухоль не может быть оценена.
Tis: Описывает стадию, называемую карциномой (рак) in situ. Это очень ранний рак, при котором раковые клетки обнаруживаются только в 1 слое ткани.
T1: Опухоль составляет 2 см или меньше в максимальном размере.
T2: Опухоль больше 2 см, но не больше 4 см.
T3: Опухоль больше 4 см или распространилась на надгортанник, который представляет собой хрящевой лоскут, отводящий пищу в пищевод.
T4a: Опухоль поразила гортань, мышцы языка, мышцы челюсти, нёба или челюстной кости.
T4b: Опухоль поразила мышцы и кости в области рта; носоглотка, воздуховод в верхней части глотки за носом; или основание черепа, или опухоль охватывает сонную артерию.
Рак ротоглотки, связанный с ВПЧ
T0 (Т плюс ноль): Опухоль не обнаружена.
T1: Опухоль составляет 2 см или меньше в максимальном размере.
T2: Опухоль больше 2 см, но не больше 4 см.
T3: Опухоль больше 4 см или распространилась на надгортанник, который представляет собой лоскут хряща, препятствующий попаданию пищи в дыхательные пути во время глотания.
T4: Опухоль поразила гортань, мышцы языка, мышцы челюсти, нёба или челюстной кости.
Узел (N)
Буква «N» в промежуточной системе TNM означает лимфатические узлы. Эти крошечные органы в форме бобов помогают бороться с инфекцией. Лимфатические узлы рядом с местом начала рака называются региональными лимфатическими узлами. Лимфатические узлы в других частях тела называются удаленными лимфатическими узлами. В области головы и шеи много лимфатических узлов. Тщательная оценка лимфатических узлов — важная часть определения стадии.
Когда рак распространился через лимфатический узел в ткани, непосредственно окружающие его, это называется экстранодальным распространением (ENE).Знание наличия ENE играет важную роль в оценке лимфатических узлов при раке полости рта и ротоглотки, не связанном с ВПЧ.
Существует 2 метода категоризации N в системе TNM: клинический и патологический. Клинический N используется для пациентов, которым не производилось расслоение шеи (см. «Хирургия» в разделе «Типы лечения»). Патологический N используется для тех, у кого была диссекция лимфатических узлов.
Полость рта и ротоглотка — клинический
NX: Невозможно оценить регионарные лимфатические узлы.
N0 (N плюс ноль): Нет свидетельств рака регионарных лимфатических узлов.
N1: Рак распространился на единственный лимфатический узел на той же стороне, что и первичная опухоль, и рак, обнаруженный в узле, имеет размер 3 см или меньше. Нет ENE.
N2a: Рак распространился на один лимфатический узел на той же стороне, что и первичная опухоль, и имеет размер более 3 см, но не более 6 см. Нет ENE.
N2b: Рак распространился на более чем 1 лимфатический узел на той же стороне, что и первичная опухоль, и ни один из них не превышает 6 см.Нет ENE.
N2c: Рак распространился на более чем 1 лимфатический узел с обеих сторон тела, и ни один из них не превышает 6 см. Нет ENE.
N3a: Рак обнаруживается в лимфатическом узле и имеет размер более 6 см. Нет ENE.
N3b: В любом лимфатическом узле есть ВНЭ.
Полость рта и ротоглотка — патология
NX: Невозможно оценить регионарные лимфатические узлы.
N0 (N плюс ноль): Нет свидетельств рака регионарных лимфатических узлов.
N1: Рак распространился на единственный лимфатический узел на той же стороне, что и первичная опухоль, и рак, обнаруженный в узле, имеет размер 3 см или меньше. Нет ENE.
N2a: Рак распространился на 1 лимфатический узел и имеет размер 3 см или меньше, но есть ENE. Или рак распространился на один лимфатический узел на той же стороне, что и первичная опухоль, и имеет размер более 3 см, но не более 6 см, и нет ENE.
N2b: Рак распространился на более чем 1 лимфатический узел на той же стороне, что и первичная опухоль, и ни один из них не превышает 6 см.Нет ENE.
N2c: Рак распространился на более чем 1 лимфатический узел с обеих сторон тела, и ни один из них не превышает 6 см. Нет ENE.
N3a: Рак обнаруживается в лимфатическом узле и имеет размер более 6 см. Нет ENE.
N3b: В одном лимфатическом узле на той же стороне, что и первичная опухоль, имеется ENE, размер которого превышает 3 см. Или рак распространился на многие лимфатические узлы, и по крайней мере один из них имеет ENE. Или, , есть ENE, в — единственный лимфатический узел на противоположной стороне первичной опухоли размером 3 см или меньше.
Рак ротоглотки, связанный с ВПЧ, клинический
NX: Невозможно оценить регионарные лимфатические узлы.
N0 (N плюс ноль): Нет свидетельств рака регионарных лимфатических узлов.
N1: Рак распространился на 1 или более лимфатических узлов на той же стороне, что и первичная опухоль, и рак, обнаруженный в узле, составляет 6 см или меньше.
N2: Рак распространился на 1 или более лимфатических узлов с обеих сторон тела, и ни один из них не превышает 6 см.
N3: Рак обнаруживается в лимфатическом узле и имеет размер более 6 см.
Рак ротоглотки, связанный с ВПЧ — патологический
NX: Невозможно оценить регионарные лимфатические узлы.
pN0 (N плюс ноль): Нет свидетельств рака регионарных лимфатических узлов.
pN1: Рак распространился на 1–4 лимфатических узла.
pN2: Рак распространился на более чем 4 лимфатических узла.
Метастазы (M)
Буква «M» в системе TNM описывает, распространился ли рак на другие части тела, что называется отдаленными метастазами.
M0 (M плюс ноль): Рак не распространился на другие части тела.
M1: Рак распространился на другие части тела.
Группа стадий рака
Врачи объединяют информацию о T, N и M, чтобы определить стадию рака.
Полость рта
Стадия I: Опухоль 2 см или меньше, глубина инвазии 5 мм или меньше. Рак не распространился на лимфатические узлы или другие части тела (T1, N0, M0).
Стадия II: Опухоль размером 2 см или меньше, глубина инвазии составляет от 5 до 10 мм. Или опухоль больше 2 см, но не больше 4 см, а глубина инвазии составляет 10 мм или меньше. Рак не распространился на лимфатические узлы или другие части тела (T2, N0, M0).
Стадия III: Применимо одно из следующих условий:
Опухоль больше 4 см или любая опухоль с глубиной инвазии более 10 мм. Рак не распространился на лимфатические узлы или другие части тела (T3, N0, M0).
Опухоль любого размера, но не вторглась в близлежащие структуры ротовой полости. Рак находится в одном лимфатическом узле на той же стороне, что и первичная опухоль, размер рака составляет 3 см или меньше. Нет ENE. Рак не распространился на другие части тела (от T1 до T3, N1, M0).
Stage IVA: Применимо одно из следующих условий:
Опухоль проникла в близлежащие структуры ротовой полости, такие как челюсть, носовые пазухи или кожа лица.Если рак распространился на лимфатический узел, то только на 1 узел на той же стороне, что и первичная опухоль, а размер рака составляет 3 см или меньше, без ENE. Рак не распространился на другие части тела (T4a, N0 или N1, M0).
Опухоль может быть небольшой или проникнуть в близлежащие структуры. Рак распространился на 1 или несколько лимфатических узлов, но ни один из них не превышает 6 см. Нет ENE. Рак не распространился на другие части тела (от T1 до T4a, N2, M0).
Stage IVB: Применяется одно из следующих условий:
Опухоль любого размера.Рак обнаруживается в лимфатическом узле и имеет размер более 6 см, но нет ENE; или есть ENE в любом лимфатическом узле. Рак не распространился на другие части тела (любые T, N3, M0).
Опухоль поразила мышцы и кости, образующие рот или основание черепа, и / или покрывает внутренние артерии. Рак может поражать лимфатические узлы, но он не распространился на другие части тела (T4b, любой N, M0).
Стадия IVC: Рак распространился на другие части тела (любой T, любой N, M1).
Ротоглотка
Стадия 0: Имеется карцинома in situ без распространения на лимфатические узлы или другие части тела (Tis, N0, M0).
Стадия I: Размер опухоли составляет 2 см или меньше, но рак не распространился на лимфатические узлы или другие части тела (T1, N0, M0).
Стадия II: Размер опухоли составляет от 2 до 4 см, но рак не распространился на лимфатические узлы или другие части тела (T2, N0, M0).
Стадия III: Применимо одно из следующих условий:
Опухоль больше 4 см или распространилась на надгортанник, но рак не распространился на лимфатические узлы или другие части тела (T3, N0, M0).
Опухоль не распространилась на близлежащие ткани, кроме надгортанника. Рак находится в 1 лимфатическом узле на той же стороне, что и первичная опухоль, размером 3 см или меньше, без ENE. Рак не распространился на другие части тела (от T1 до T3, N1, M0).
Stage IVA: Применимо одно из следующих условий:
Опухоль поразила гортань, мышцу языка, мышцы челюсти, нёба или челюстной кости. Рак мог распространиться на 1 лимфатический узел, но не распространился на другие части тела (T4a, N0 или N1, M0).
Опухоль может быть небольшой или может проникнуть в близлежащие структуры, такие как гортань, мышцы языка или челюсти, нёбо или челюсть. Рак распространился на 1 или несколько лимфатических узлов, но ни один из них не превышает 6 см. Нет ENE. Рак не распространился на другие части тела (от T1 до T4a, N2, M0).
Stage IVB: Применимо одно из следующих условий:
Опухоль любого размера. Рак обнаруживается в лимфатическом узле и имеет размер более 6 см, но нет ENE; или есть ENE в любом лимфатическом узле.Рак не распространился на другие части тела (любые T, N3, M0).
Опухоль поразила мышцы и кости в области рта; носоглотка, воздуховод в верхней части глотки за носом; или основание черепа, или опухоль охватывает сонную артерию. Лимфатические узлы могут быть вовлечены или нет. Рак не распространился на другие части тела (T4b, любой N, M0).
Стадия IVC: Рак распространился на другие части тела (любой T, любой N, M1).
Рак ротоглотки, связанный с ВПЧ
Группы стадий рака ротоглотки, связанного с ВПЧ, различаются в зависимости от того, были ли лимфатические узлы исследованы клинически или патологически.
Группы клинических стадий
Стадия I: Опухоль 4 см или меньше. Если рак распространился на лимфатические узлы, ни один из них не превышает 6 см, и он поражает только лимфатические узлы на той же стороне тела, что и первичная опухоль. Рак не распространился на другие части тела (от T0 до T2, N0 или N1, M0).
Стадия II: Применимо одно из следующих условий:
Опухоль 4 см или меньше. Рак распространился на 1 или более лимфатических узлов по обе стороны тела, и ни один из них не превышает 6 см. Рак не распространился на другие части тела (от T0 до T2, N2, M0).
Опухоль больше 4 см или распространилась на надгортанник. Если поражены лимфатические узлы, размер опухоли не превышает 6 см. Рак не распространился на другие части тела (T3, N0 до N2, M0).
Стадия III: Применимо одно из следующих условий:
Опухоль любого размера. Рак распространился на лимфатические узлы, и они больше 6 см. Нет распространения на другие части тела (любые T, N3, M0).
Опухоль поразила гортань, мышцу языка, мышцы челюсти, нёба или челюстной кости. Лимфатические узлы могут быть вовлечены или нет. Нет распространения на другие части тела (T4, любой N, M0).
Стадия IV: Рак распространился на другие части тела (любой T, любой N, M1).
Группы патологических стадий
Стадия I: Опухоль 4 см или меньше. Рак поражает 4 или меньше лимфатических узлов. Рак не распространился на другие части тела (от T0 до T2, pN0 или pN1, M0).
Стадия II: Применимо одно из следующих условий:
Опухоль 4 см или меньше. Рак распространился на более чем 4 лимфатических узла.Нет распространения на другие части тела (от T0 до T2, pN2, M0).
Опухоль больше 4 см или поражает близлежащие структуры. Рак поражает 4 или меньше лимфатических узлов. Рак не распространился на другие части тела (T3 или T4, pN0 или pN1, M0).
Стадия III: Опухоль больше 4 см или поражает близлежащие структуры. Рак распространился на более чем 4 лимфатических узла. Нет распространения на другие части тела (T3 или T4, pN2, M0).
Стадия IV: Рак распространился на другие части тела (любой T, любой pN, M1).
Рецидивирующий
Рецидивирующий рак — это рак, который вернулся после лечения. Если рак все же вернется, будет проведен еще один раунд тестов, чтобы узнать о степени рецидива. Эти тесты и сканирование часто аналогичны тем, которые проводились во время первоначального диагноза.
Марка (G)
Врачи также описывают рак полости рта и ротоглотки по его степени (G).Оценка описывает, насколько раковые клетки выглядят как здоровые при просмотре под микроскопом. Связанный с ВПЧ рак ротоглотки не имеет отдельной системы классификации.
Врач сравнивает злокачественную ткань со здоровой тканью. Здоровая ткань обычно содержит много разных типов клеток, сгруппированных вместе. Если рак похож на здоровую ткань и имеет разные группы клеток, его называют «дифференцированной» или «низкосортной опухолью». Если злокачественная ткань сильно отличается от здоровой ткани, ее называют «низкодифференцированной» или «высокодифференцированной опухолью».»Степень рака может помочь врачу предсказать, как быстро он будет распространяться. В целом, чем ниже степень опухоли, тем лучше прогноз.
GX: Оценка не может быть оценена.
G1: Клетки больше похожи на нормальную ткань и хорошо дифференцированы.
G2: Клетки умеренно дифференцированы.
G3 и G4: Клетки не похожи на нормальную ткань и плохо дифференцированы.
Используется с разрешения Американского колледжа хирургов, Чикаго, Иллинойс. Первоначальным и основным источником этой информации является Руководство по стадированию рака AJCC , восьмое издание (2017) , опубликованное Springer International Publishing.
Информация о стадии рака поможет врачу порекомендовать конкретный план лечения. Следующий раздел в этом руководстве — Типы лечения . Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
.
