Дезинфекция стирилизация (стр. 1 из 2)
ОБЩИЕ ПОЛОЖЕНИЯ
Дезинфекцию изделий проводят с целью уничтожения патогенных и условно-патогенных микроорганизмов — вирусов (в том числе возбудителей парентеральных вирусных гепатитов, ВИЧ-инфекции), бактерий (включая микобактерии туберкулеза), грибов на изделиях медицинского назначения, а также в их каналах и полостях.
Дезинфекции подлежат все изделия после применения их у пациента. После дезинфекции изделия применяют по назначению или (при наличии показаний) подвергают предстерилизационной очистке и стерилизации.
Стерилизацию изделий проводят с целью умерщвления на изделиях или в изделиях микроорганизмов всех видов, в том числе споровых форм микроорганизмов. Стерилизации подлежат все изделия, соприкасающиеся с раневой поверхностью, контактирующие с кровью в организме пациента или вводимой в него, инъекционными препаратами, а также изделия, которые в процессе эксплуатации контактируют со слизистой оболочкой и могут вызвать ее повреждение.
Изделия многократного применения, подлежащие стерилизации, перед стерилизацией подвергают предстерилизационной очистке.
Предстерилизационную очистку проводят с целью удаления с изделий белковых, жировых и механических загрязнений, а также остатков лекарственных препаратов.
Обработка изделий медицинского назначения многократного применения.
Нормативные документы:
-ОСТ 42-21-2-85 «стерилизация и дезинфекция изделий медицинского назначения. Методы, средства, режимы»;
-методические указания МУ-287-113 от 30.12.1998г. «дезинфекция, предстерилизационная очистка и стерилизации изделий медицинского назначения».
Медицинские инструменты, после их использования, по степени загрязнения делятся на 3 группы:
Iгруппа- критические инструменты- инструменты, соприкасающиеся, с раневой поверхностью, кровью, инъекционными препаратами (пинцеты, корнцанги, скальпели, шприцы, иглы.)
IIгруппа – условно-критические инструменты-инструменты, соприкасающиеся со слизистыми, которые могут быть ими ранены (нарушение целостности слизистых.)Это шпатели, глазные пипетки, зонты дуоденальные и назогастральные, мочевые катетеры, наконечники, эндоскопы.
IIIгруппа — некритические инструменты- инструменты, соприкасающиеся с неповрежденной кожей или слизистыми (термометры, манжетки от тонометров, грелки, пузыри для льда, судна, мочеприёмники, мензурки.)
Инструменты I и II групп должны быть стерильными, поэтому проходят три этапа обработки:
1-й этап – дезинфекция
2-й этап- предстерилизационная очистка
3-й этап- стерилизация
Инструменты IIIгруппы проходят один этап обработки – дезинфекция.
I этап обработки— дезинфекция.
Дезинфекция — это комплекс мероприятий, направленных на уничтожение возбудителей инфекционных заболеваний и разрушение токсинов на объектах внешней среды. Для её проведения обычно используются химические вещества, например, формальдегид или гипохлорит натрия. Дезинфекция уменьшает количество микроорганизмов до приемлемого уровня, но полностью может их и не уничтожить. Является одним из видов обеззараживания.
Методы дезинфекции:
1) Физический — обработка лампами, излучающими ультрафиолет, или источниками гамма-излучения, кипячение белья, посуды, уборочного материала, предметов ухода за больными и др. В основном применяется при кишечных инфекциях.
2) Химический — заключается в уничтожении болезнетворных микроорганизмов и разрушении токсинов дезинфицирующими веществами.
3) Комбинированный — основан на сочетании нескольких из перечисленных методов (например, влажная уборка с последующим ультрафиолетовым облучением).
Уровни дезинфекции
1) Низкий уровень.
К нему относятся: дезинфекция изделий растворами низкой концентрации.
2) Средний уровень.
Уничтожение возбудителей ВИЧ-инфекции, вирусных гепатитов, острых респираторных вирусных инфекций, сифилиса.
3) Высокий уровень.
Использование дезинфекционных растворов высокой концентрации,
способных уничтожить возбудителей туберкулёза, гнойных инфекций, кандидозов, анаэробной инфекции.
Режим дезинфекции
Режим дезинфекции – определённый уровень концентрации дезинфекционного раствора, температуры насыщенного пара или воздуха, экспозиции, способствующие уничтожению возбудителей.
Условия проведения дезинфекции.
1. Время кипячения отчитывается от момента закипания.
2. При химическом методе дезинфекции температура дезрастворов должна быть 180-200C.
3. Современные дезинфекционные растворы — бианол, лизафин и др. используются многократно до изменения окраски препарата.
4. Инструменты,замачиваемые в дезрастворах, должны быть сухими и в разобранном виде, с заполнением всех полостей и каналов; высота уровня над инструментами не менее 1 см.
5. Выдерживается определенная экспозиция (время дезинфекции).
6. После дезинфекции инструменты ополаскиваются в проточной воде до исчезновения запаха препарата (от 3 до 10 мин).
7. Перед проведением дезинфекции проводится контроль концентрации дезинфицирующего раствора химическим индикатором, предназначенным только для данного раствора.
Контроль качества дезинфекции
Контроль качества дезинфекции, предстерилизационной очистки, стерилизации изделий медицинского назначения осуществляется специалистами Роспотребнадзора.
II этап обработки – предстерилизационная очистка.
Цель – удаление балластных веществ с инструментария (крови, жира, белков, остатков лекарственных препаратов и моющих средств, ржавчина).
Этапы предстерилизационной очистки при дезинфекции инструментов медицинского назначения дезинфицирующими средствами не содержащие моющих веществ:
1. Ополаскивание в проточной воде 30 сек.
2. Замачивание в моющем растворе на 15 мин.
3. Мытьё каждого инструмента в моющем растворе ватно-марлевым тампоном в течение 1 минуты. Каналы изделий промывают с помощью ерша.
4. Ополаскивание в проточной воде 10 мин.
5. Ополаскивание (обессоливание) в дистиллированной воде 30 сек.
6. Высушивание в сухожаровом шкафу при температуре 80 – 850С или на чистых салфетках до полного исчезновения влаги.
Режим дезинфекции, совмещенный с предстерилизационной очисткой изделий медицинского назначения
Дезинфекцию изделий медицинского назначения, в том числе совмещенную с их предстерилизационной очисткой, осуществляют в пластмассовых или эмалированных (без повреждения эмали) емкостях с закрывающимися крышками.
Изделия медицинского назначения необходимо полностью погружать в рабочий раствор средства сразу же после их применения, обеспечивая незамедлительное удаление с изделий видимых загрязнений с поверхности с помощью тканевых салфеток. Использованные салфетки помещают в отдельную емкость, дезинфицируют, затем утилизируют.
Имеющиеся в изделиях каналы и полости заполняют раствором, избегая образования воздушных пробок. Через каналы поочередно прокачивают раствор средства и продувают воздухом с помощью шприца или иного приспособления. Процедуру повторяют несколько раз до полного удаления биогенных загрязнений.
Разъемные изделия погружают в раствор в разобранном виде. Изделия, имеющие замковые части, погружают раскрытыми, предварительно сделав ими несколько рабочих движений для лучшего проникновения раствора в труднодоступные участки изделий в области замковой части. Толщина слоя средства над изделиями должна быть не менее 1 см.
Классификация дезинфицирующих растворов по назначению
I группа. Дезинфицирующие растворы используются для обеззараживания:
II группа. Дезинфицирующие растворы используются для обеззараживания изделий медицинского назначения многократного применения, и совмещение дезинфекции и предстерилизационной очистки в один этап.
III группа. Дезинфицирующие растворы, используемые для дезинфекции высокого уровня и стерилизации – стериллянты.
Контроль качества предстерилизационной очистки
Качество предстерилизационной очистки оценивается по отсутствию положительных проб:
1. На кровь – азопирамовая проба
2. На моющие средства – фенолфталеиновая проба
3. На масляные препараты – проба с суданом. Эта проба ставится с изделиями, испачканными масляными препаратами.
Условия проведения контроля
1. Контролю подлежит 1% от обработанной партии, но не менее 3-5 шт.
2. Реакция читается в течение 1-ой мин.
3. Инструмент должен быть холодным и сухим
4. Рабочий раствор готовится перед применением.
При несоблюдении этих условий может быть ложноположительная реакция.
Азопирамовая проба
Маточным раствором является азопирам, которой который в холодильнике хранится 2 мес. И вне холодильника 1 мес. с момента изготовления азопирама.
Рабочий раствор азопирама готовится из равных объёмов азопирама и 3% р-ра перекиси водорода перед применением.
Рабочий раствор азопирама готовится из равных объёмов азопирама и 3% р-ра перекиси водорода перед применением.
Рабочий раствор азопирама проверяется на пригодность не реже одного раза в неделю: на предметное стекло с мазком крови капается 2-3 капли рабочего раствора азопирама, если в течение 1-ой минуты появилось сине-фиолетовое окрашивание, раствор годен к применению.
бурое – на хлор и ржавчину, розовое – на моющие средства.
Результаты азипирамовой пробы заносятся в журнал.
Фенолфталеиновая проба
Рабочий раствор – 1% спиртовой раствор фенолфталеина. В холодильнике хранится один месяц, вне холодильника – 15 дней.
Дезинфекция, предстерилизационная очистка, стерилизация изделий медицинского назначения
Г.А. КУШНАРЕВА, госпитальный эпидемиолог
Дезинфекция и стерилизация изделий медицинского назначения проводится для обезвреживания либо уничтожения различных микроорганизмов. Но некоторые руководители лечебных учреждений, стремясь сэкономить, относятся к этим мероприятиям недостаточно ответственно. В результате значительно возрастает риск развития различных инфекционных заболеваний, в том числе и гнойно-септических, как среди больных, так и сотрудников ЛПУ. Поэтому очень важно правильно обеззараживать медицинские изделия. Качество дезинфекции можно оценить с помощью смывов на определение золотистого стафилококка, синегнойной палочки и бактерий группы кишечной палочки. Контролируют 1 % одновременно обработанных изделий, но не менее трех инструментов. Дезинфекция считается эффективной при отсутствии роста микроорганизмов.
Обработка медицинских инструментов включает в себя дезинфекцию, предстерилизационную очистку и собственно стерилизацию. Общие правила организации указанных процессов установлены «Методическими указаниями по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения» (МУ-287-113). Их утвердил Департамент Госсанэпиднадзора Минздрава РФ 30.12.1998 г. Кроме того, применяются утвержденные НИИ дезинфектологии Роспотребнадзора методические пособия по применению конкретных дезинфицирующих средств.
Познакомимся сначала с дезинфекцией, которая является достаточно сложной, объемной и универсальной для различных ЛПУ.
Что такое дезинфекция
Этот термин обозначает уничтожение патогенных и условно-патогенных микроорганизмов на всех поверхностях в помещениях, в том числе на полу, стенах, ручках дверей, выключателях, подоконниках, а также на жесткой мебели, поверхностях врачебного оборудования, в воздухе помещений, на посуде, белье, изделиях медицинского назначения и предметах ухода за больными, санитарно-техническом оборудовании, биологических жидкостях. Словом, дезинфекцию должны проходить все инструменты и расходные материалы, которые используются в работе любого ЛПУ.
Задачей дезинфекции является предупреждение или ликвидация накопления, размножения и распространения возбудителей заболеваний. И в первую очередь, если мы говорим о больницах, внутрибольничных инфекций. Дезинфекция может быть профилактической и очаговой.
Профилактическая дезинфекция проводится для защиты людей от возможного заражения. В лечебных учреждениях она выполняется в виде текущей ежедневной влажной уборки и генеральной уборки эпидзначимых кабинетов (операционных, перевязочных) один раз в неделю. Очаговая дезинфекция проводится в случае возникновения или подозрения на возникновение инфекционного заболевания.
Препарат для проведения дезинфекции и его концентрация выбираются исходя из конкретного инфекционного заболевания. В зависимости от вида медицинского изделия проводят дезинфекцию высокого (ДВУ), промежуточного (ДПУ) и низкого уровней (ДНУ).
А теперь условно разделим обрабатываемые предметы на несколько видов. «Некритические» контактируют с неповрежденной кожей. «Полукритические» контактируют со слизистыми оболочками или поврежденной кожей. «Критические» проникают в стерильные ткани организма или сосуды, контактируют с кровью или инъекционными растворами.
ДВУ используется для обработки «критических» предметов. При этом методе обработки погибают все микроорганизмы, кроме спор бактерий. Для ДВУ применяют глутаровый альдегид, диоксид хлора, 6 % раствор перекиси водорода и средства на основе надуксусной кислоты. Эти химические средства можно использовать и для стерилизации. Однако при стерилизации данными веществами время обработки значительно увеличивается.
ДПУ используется для обработки «полукритических предметов. При проведении ДПУ погибают вегетативные формы бактерий, в том числе микобактерии, большинство вирусов и грибов. Однако споры бактерий в этих условиях выживают. Мелкие нелипидные вирусы, например энтеровирусы, риновирусы, более устойчивы к бактерицидным средствам. Крупные же липидные вирусы, такие как аденовирусы, вирус гепатита В и ВИЧ, обычно погибают при обработке дезинфектантами промежуточного уровня. К дезинфекционным средствам, используемым для ДПУ, относятся практически все препараты, концентрация которых готовится по режиму уничтожения бактерий и в соответствии с методическими указаниями к каждому используемому препарату.
ДНУ используется для обработки «некритических» и некоторых «полукритических» предметов. Например, для обработки ванн, которые применяют при гидротерапии пациентов с поврежденной кожей. После ДНУ погибают вегетативные формы большинства видов бактерий, вирусы и грибы. Не реагируют на этот метод обработки споры бактерий, микобактерии и мелкие нелипидные вирусы. К средствам ДНУ относятся соединения на основе 70 % и 90 % этилового или изопропилового спирта, хлорсодержащие препараты, некоторые фенолсодержащие средства и йодофоры. Среди дезинфектантов низкого уровня также можно назвать препараты на основе четвертичных аммониевых соединений.
Применяются 4 основных метода дезинфекции:
Механический метод – это проветривание, вентиляция помещений, стирка белья, обработка поверхностей пылесосом, протирание их влажной ветошью.
Физический метод заключается в высокотемпературной обработке Используются кипячение в дистиллированной воде или воде с добавлением натрия двууглекислого (питьевая сода), паровой метод в стерилизаторе (автоклаве), воздушный метод в суховоздушном шкафу. Этот метод надежен, экологически чист и безопасен для персонала.
Химический метод позволяет обрабатывать медицинские предметы различными химическими веществами в жидком, газообразном состоянии. Изделия погружают в дезраствор, налитый в пластмассовые, стеклянные или покрытые эмалью без повреждений емкости. Для проведения такой дезинфекции рекомендуется применять специальные контейнеры, в которых изделия размещаются на перфорированных решетках. Это снижает риск инфицирования и травматизации персонала. Емкости с растворами дезинфицирующих средств должны быть снабжены крышками, иметь надписи с указанием названия средства, его концентрации, срока приготовления и использования.
Биологический метод основан на использовании антагонизма различных видов микроорганизмов. Так, при использовании бактериофагов, то есть вирусов бактерий, уничтожаются стафилококки, синегнойная палочка, брюшнотифозные бактерии и т. д.
К сведению. Бактериофаги узко специфичны. Например, стафилококковый бактериофаг, проникая в микробную клетку стафилококка, уничтожает только ее. Для обработки медицинских изделий их не применяют, но зато их можно достаточно эффективно использовать для лечения людей и для обеззараживания поверхностей, особенно там, где сформировался госпитальный штамм (например, роддома). Также бактериофаги хорошо знакомы работникам предприятий коммунальной сферы. Их используют для обеззараживания сточных вод на полях фильтрации.
Средства химической дезинфекции
Средства химической дезинфекции наиболее часто используется в ЛПУ. Большинство таких средств по химическому составу можно разделить на 7 групп.
В состав галогенсодержащих веществ входят в качестве активного действующего вещества хлор, бром, йод. Препаратами из этой группы являются, в частности, Хлорамин Б, Хлорэффект, гипохлорид натрия, Де-хлор, нейтральный анолит, Сульфохлорантин, Пресепт, хлоргексидин глюконат и т.д.
В кислородсодержащей группе препаратов действующим веществом является кислород, выделяющийся из перекиси водорода, перекисных соединений, надкислот. Препаратами этой группы являются, например, перекись водорода, Оксидезин, Пероксимед, Окадез, Клиндезин Окси, Виркон.
Средства на основе катионных поверхностно-активных веществ (ПАВы) представляются весьма перспективными, так как позволют совмещать дезинфекцию и предстерилизационную обработку. ПАВы не вызывают коррозию медицинских инструментов. К препаратам из этой группы относятся АХД 2000 специаль, Аламинол и Аламинол плюс, Бриллиант, Велтолен, Ника-дез, Премьер, Самаровка, Септодор форте, Вегосепт.
Гуанидсодержащие средства созданы на основе сложных органических соединений. Они активны в отношении широкого спектра микроорганизмов. Препаратами этой группы являются Лизоформин специаль, Лизетол АФ (при его использовании металлические инструменты полностью очищаются, причем без коррозии), Пливасепт 5%, хлоргексидин биглюконат (Гибитан), Фогуцид, который на обработанной поверхности образует защитную пленку, действующую от 3 до 7 суток.
В состав альдегидсодержащих средств входят глутаровый или янтарный альдегид. Препараты этой группы обладают выраженным бактерицидным, вирулоцидным, фунгицидным, спороцидным действием. Вместе с тем они отрицательно действуют на макроорганизмы. Часть этих дезсредств может использоваться не только для дезинфекции, но и для стерилизации инструментария, а также для проведения дезинфекции эндоскопического оборудования по режиму ДВУ. Из этой группы чаще всего используются Гигасепт ФФ, Сайдекс, Лизоформин 3000, Секусепт Форте.
Спирты. Это группа препаратов на основе этанола, пропанола, изопропанола. Такие средства как Бациллол плюс, Деконекс Соларсепт используют для дезинфекции поверхностей и оборудования. 70 % этиловый спирт используется как кожный асептик.
Среди фенолсодержащих препаратов можно рекомендовать Амоцид и Амоцид 2000, которые эффективны для проведения текущей и заключительной дезинфекции в очагах туберкулеза для обеззараживания биоматериала от больных.
Как проводят дезинфекцию
Медицинские изделия погружают в дезраствор сразу же после их использования. При этом дезраствор должен полностью покрывать инструменты не менее 1 см над их поверхностью. Изделия сложной конфигурации дезинфицируют в разобранном виде. Каналы и полости изделий заполняют дезинфицирующим раствором так, чтобы в них не оставалось пузырьков воздуха. Сильно загрязненные инструменты нужно подвергать двукратной обработке.
Хлорсодержащие средства, например, Хлорамин Б, Клорсепт, применяют в основном для дезинфекции изделий медицинского назначения из стекла, пластмассы, резины, коррозионно-стойкого материала или отработанного перевязочного материала и одноразовых инструментов. Очистка с помощью ерша резиновых изделий не допускается!
Для дезинфекции многоразового металлического инструментария рекомендуется использовать препараты, которые не вызывают коррозии. Правда, эти дезсредства стоят дороже. Но экономить не стоит. Ведь стоимость металлических многоразовых инструментов намного выше.
По окончании дезинфекционной выдержки изделия промывают. Оставшиеся загрязнения оттирают с помощью ершей, щеток, салфеток под проточной питьевой водой либо в специальных моющих аппаратах.
Обратите внимание. Поскольку альдегидосодержащие дезсредства достаточно токсичны, при работе с ними персоналу следует соблюдать особые меры предосторожности:
* рабочие растворы из концентратов готовьте в отдельных хорошо вентилируемых помещениях с достаточной кубатурой;
* во время приготовления рабочих растворов и при работе с ними защищайте органы дыхания респираторами, кожу рук перчатками, а глаза очками;
* рабочие растворы должны находиться только в емкостях с плотно закрытыми крышками! Используйте специальные ванночки — стерилизаторы из полиэтилена. Емкость следует открывать только при необходимости, защищая органы дыхания;
* нельзя разводить исходный концентрат теплой и тем более горячей водой. Это усиливает вредные испарения с поверхности раствора;
* промывка изделий под проточной водой до дезинфекции не допускается. Ведь аэрозоль, образующийся в процессе мытья, может инфицировать персонал, проводящий обработку, а также поверхности помещений. Подчеркнем, однако, что при применении многих альдегидосодержащих дезинфектантов очистка медицинских изделий от загрязнения все же необходима. Дело в том, что такие дезинфектанты фиксируют белковые загрязнения. Это затрудняет процесс дезинфекции. Поэтому предварительная очистка в данном случае должна проводиться с соблюдением противоэпидемических принципов. Используются специальные емкости. Промывные воды, салфетки, использованные для очистки, обеззараживаются одним из хлорсодержащих дезинфектантов.
Практическими вопросами проведения дезинфекции в любом ЛПУ занимаются в основном медицинские сестры. А вот задача администрации медучреждения — обеспечить приобретение эффективных дезпрепаратов, замену их с периодичностью не реже 8-12 месяцев, чтобы предотвратить формирование антибиотикоустойчивых микроорганизмов. На сегодня поставщики предлагают ЛПУ десятки различных дезинфектантов. Реклама у продавцов напористая, сделать правильный выбор не так-то легко.
В письме от 25.01.2006 № 0100/626-06-32 Роспотребнадзор предписал при выборе реагентов для дезинфекции руководствоваться государственным реестром зарегистрированных дезсредств. Найти этот реестр можно, в частности, на информационных ресурсах Роспотребнадзора в сети Интернет.
Перечни некоторых зарегистрированных в нашей стране дезинфицирующих средств доводятся и специальными письмами Роспотребнадзора. Например, перечень дезсредств, обладающих вирулицидной активностью, отечественного и зарубежного производства приведен в письме Роспотребнадзора от 07.03.2006 № 0100/2490-06-32.
Предстерилизационная обработка
Для инструментария, который соприкасается со слизистыми оболочками и ранами, в том числе операционными, одной дезинфекции недостаточно. Требуется стерилизация. Но перед этим проводят предстерилизационную обработку. Цель — удаление всех мелких частиц, оставшихся после операции, различных белковых загрязнений.
При предстерилизационной обработке используют специально приготовленные растворы, в которые входят вода, перекись водорода и моющие средства «Астра», «Лотос», «Айна», «Прогресс». Можно также применять дезинфектанты, специально предусмотренные для совмещения дезинфекции с предстерилизационной обработкой. Такие препараты очень удобны в работе, позволяют экономить рабочее время персонала, тем самым сокращая затраты ЛПУ. В настоящее время выбор комбинированных препаратов достаточно широк.
При предстерилизационной очистке разъемные медицинские изделия замачиваются в разобранном виде. Все предметы полностью погружаются в раствор с заполнением всех полостей. О качестве же дезинфекции и предстерилизационной подготовки медицинского инструментария судят по результатам биологических и химических анализов.
Важно. Контроль качества предстерилизационной очистки проводят в ЛПУ ежедневно, под руководством старшей медицинской сестры. Проверке подлежит 1 % изделий от партии, но не менее трех единиц. Качество очистки оценивают путем постановки азопирамовой пробы на наличие остаточных количеств крови, а также путем постановки фенолфталеиновой пробы на наличие остаточных количеств щелочных компонентов моющих средств. При положительной азопирамовой пробе не позднее чем через 1 минуту после нанесения реактива появляется фиолетовое окрашивание, которое вскоре переходит в розово-сиреневое или буроватое.
При положительной фенолфталеиновой пробе о наличии на изделиях остаточных количеств щелочных компонентов моющего средства свидетельствует появление розового окрашивания реактива. Если пробы на кровь или на остатки щелочных компонентов моющих средств, оказываются положительными, всю партию изделий повторно очищают до получения отрицательных результатов.
Стерилизация
Как мы уже говорили, оборудование и инструменты, которые проникают в стерильные ткани организма или сосуды, контактируя с кровью или инъекционными растворами, относятся к «критическим» предметам. Они должны пройти стерилизацию, чтобы полностью удалились или уничтожились всех виды микроорганизмов, включая споры бактерий. Стерилизация не может быть относительной, она всегда абсолютна! В медицинской практике применяются в основном три вида стерилизации.
Таблица 1. Виды стериализации.
| Виды стерилизации | Методы стерилизации | Действующий агент |
| физический | паровой
воздушный
гласперленовый
инфракрасный | пар под избыточным давлением (120 °С, давление 1,1 атм) (132 °С, давление 2,0 атм)
сухой воздух при 180 °С
нагретые стеклянные шарики при 190–240 °С
инфракрасное излучение при 200+3 °С |
| химический | жидкостной
плазменный | растворы химических соединений (альдегид-, кислород-, хлорсодержащих) пары 20 % пероксида водорода |
| газовый | — | окись этилена в смеси с углекислым газом, бромистым метилом и др. |
Поясняем. При стерилизации горячим воздухом возбудители болезней уничтожаются высокой температурой 180°С в суховоздушном стерилизаторе. В случае подобной стерилизации в автоклаве эффект достигается уже при 120 °С. Инструменты в него укладывают так, чтобы они не касались друг друга. Для контроля стерилизации используют химические тесты, которые укладывают на каждую полку суховоздушного стерилизатора в виде конверта в 5 точках по четырем краям и в середине. Если хотя бы один химический тест не изменил цвет, стерилизацию всей партии инструментов проводят заново. Обратите внимание, что сроки хранения стерильного материала после этой процедуры незначительные – до 1 суток.
Об успешном проведении стерилизации можно говорить при соблюдении следующих параметров обработки: температурный режим, давление пара, время воздействия (экспозиция).
Таблица 2. Режимы стерилизации некоторых медицинских инструментов
| Способ стерилизации | Температура, °С | Давление, кгс/кв.см | Экспозиция, мин. | Материал обрабатываемых изделий |
| Сухим горячим воздухом (суховоздушный стерилизатор) | 180 | 60 | металл, стекло | |
| Водяным насыщенным паром под избыточным давлением (автоклав) | 132 | 2,0 | 20 | металл, стекло, текстильные материалы, резина |
| 120 | 1,1 | 45 | резина, латекс, отдельные полимерные материалы |
Стерилизация горячим паром широко распространена в ежедневной медицинской практике. Ее достоинства – это короткий полный производственный цикл и невысокие температуры. Автоклавная техника а последние годы усовершенствовалась и позволяет при доступном для ЛПУ уровне затрат обеспечивать жесткие требования клинических стандартов.
Одним из основных условий проведения качественной стерилизации является загрузка автоклава в точном соответствии с рекомендациями производителя. Это означает правильное расположение и количество загружаемых предметов. Водяной пар должен свободно циркулировать, а конденсат своевременно выводиться. При загрузке автоклава обратите внимание на то, чтобы тяжелые инструменты располагались на нижних поддонах, а легкие — на верхних.
Изделия загружают в таком количестве, которое допускает свободную подачу воздуха к стерилизуемым изделиям. Не допускается перекрывать продувочные окна и решетки вентиляции. Загрузку и выгрузку изделий проводят при температуре не выше 40-50°С.
Для контроля стерилизации в каждый бикс закладывают специальные термоиндикаторы. Они должны располагаться на трех разных уровнях — нижнем, среднем, верхнем — и позволяют осуществлять как внешний (в камере стерилизатора) и внутренний (в упаковке с изделиями) контроль. После окончания стерилизации и обязательно до использования стерильного материала проверяют тесты. Они должны изменить цвет. Если хотя бы одна полоска не изменила цвет, весь материал повторно стерилизуют.
Срок хранения простерилизованных изделий: в биксах без фильтра, в двойной мягкой упаковке – 3 суток; в пергаменте, бумаге мешочной непропитанной, мешочной влагопрочной, бумаге упаковочной высокопрочной, бумаге крепированной, стерилизационной коробке с фильтром – 20 суток.
Виды стерилизаторов. Плюсы и минусы
Существуют стерилизаторы, в которых используется метод, основанный на применении кратковременного импульсного инфракрасного излучения, создающего в рабочей камере температуру 200+3°С. Время инфракрасной стерилизации инструментария в неупакованном виде составляет от 10 до 25 минут, включая этапы выхода на режим и охлаждения. Однако недостатками такой стерилизации являются отсутствие упаковки инструментов, повреждающее воздействие на полимерные материалы и резину, наконец, отсутствие контролирующих индикаторов.
В настоящее время появляется различная аппаратура для стерилизации мелких инструментов. В качестве примера можно привести гласперленовый стерилизатор. Он представляет собой камеру, наполненную стеклянными шариками, которые нагреваются до температуры 190-240°С. Такой метод стерилизации используется в стоматологии. Однако и он имеет недостатки: можно применять лишь для мелких цельнометаллических инструментов без упаковки. Они стерилизуются в течение 5-15 секунд. У более крупных инструментов для такой обработки доступна только рабочая часть. А полная их стерилизация даже при увеличении экспозиции не удается. Проблемы возникают и со средствами контроля работы этих стерилизаторов.
Недостатком стерилизации жидкими химическими средствами является возможное наличие на очищенном инструментарии следов очистки — остатков токсичных бактерицидных средств. Кроме этого необходимо наличие стерильных емкостей, причем не менее двух, со стерильной дистиллированной водой для отмывания стерилизующего агента. При химической стерилизации может наступать загрязнение микроорганизмами простерилизованных инструментов.
Стерилизация газовым методом более надежна, но технически она весьма сложна. Для нее необходимы особые помещения, аппаратура, согласование с органами санитарного надзора. Тем не менее иногда этому методу нет альтернативы. Ведь не всякая медицинская техника выдержит температурную и жидкостную стерилизацию. К примеру, оптические инструменты, электрооборудование. Но стерилизация газовым методом с применением окиси этилена и формальдегида в России широко не применяется, так как пока разработки отечественной аппаратуры находятся на начальной стадии. В некоторых ЛПУ используют зарубежные газовые стерилизаторы. Заметим, что это оборудование достаточно дорогое. Плюсом стерилизации газовым методом является возможность использования упаковки материалов, которые могут храниться годами. Минусом, помимо его дороговизны, считается существенное время экспозиции (несколько часов), необходимость дегазации при помощи специальной аппаратуры, что дополнительно увеличивает длительность цикла стерилизации.
Существует современный, эффективный, но весьма дорогой метод стерилизации – плазменная очистка в низкотемпературных плазменных стерилизаторах SPS. Принцип работы этой аппаратуры основан на генерации плазмы непосредственно вокруг стерилизуемого материала. Стерилизующим агентом является 20 %-ный пероксид водорода. Процесс происходит в любой части камеры. Контроль температуры осуществляется инфракрасными датчиками. Стерилизация в этом случае представляет собой сухой процесс при температуре от +35 до +50 °С, что гарантирует сохранность инструментов и оборудования, чувствительного к повышенной температуре и влажности. Время стерилизации — от 90 до 120 минут.
Особенности очистки отдельных видов инструментов
Выше мы отнесли к «полукритическим» предметы, контактирующие со слизистыми оболочками или поврежденной кожей, например, ингаляторы и некоторые виды эндоскопов. «Полукритические» инструменты должны подвергаться ДВУ. Но некоторые эндоскопические инструменты относятся к «критическим» и подлежат стерилизации.
Обработка эндоскопов производится непосредственно после их использования и имеет свои особенности, отраженные в табл. 3.
Таблица 3. Порядок очистки эндоскопов
| Эндоскопы, используемые для нестерильных эндоскопических манипуляций (гастрофиброскопия, бронхоскопия) | Эндоскопы, используемые для стерильных эндоскопических манипуляциях
|
| 1) предварительная очистка 2) окончательная очистка по методике предстерилизационной очистки 3) ДВУ спороцидными средствами | 1) предварительная очистка 2) предстерилизационная очистка 3) стерилизация
|
Особенности очистки, дезинфекции, стерилизации эндоскопов и инструментов к ним содержатся в Методических указаниях МУ 3.5.1937-04, утвержденных Главным государственным санитарным врачом РФ 04.03.2004.
Особые хлопоты ЛПУ доставляет стерилизация термолабильных инструментов. К ним, в частности, относятся лапароскопы. Стерилизация газом окиси этилена или жидкими химическими средствами требует наличие специальной дорогостоящей техники (газовый метод), а также продолжительного времени. Поэтому чтобы не испортить инструмент, во многих стационарах используют дезинфекцию высокого уровня. Однако в отличие от стерилизации ДВУ не уничтожает полностью споры бактерий. Поэтому увеличивается риск инфицирования пациентов. И напомним, что эти изделия после очистки надо хранить в условиях, исключающих вторичное заражение микроорганизмами.
В заключение хочется подчеркнуть, что последовательное и четкое проведение в лечебных учреждениях всех мероприятий по проведению дезинфекции и стерилизации позволит значительно снизить уровень внутрибольничного инфицирования.
(«СанЭпидемКонтроль» №1 2009) #2467
Дезинфекция и предстерилизационная очистка медицинских инструментов
Содержание статьи:
Человек постоянно окружен микроорганизмами, способными доставить ему неприятности и даже лишить жизни. Как только люди уяснили вредность их влияния, то начали им противостоять. Для этой цели придумали высокоэффективные средства. В конечном счете выработаны действенные меры. Последние получили определения: «стерилизация» и «дезинфекция». Оба они направлены на истребление высокопатогенных организмов, но между ними есть разница.
Дезинфекция и стерилизация

Термины и определения
Дезинфекцией называют совокупность мероприятий, которые направлены на ликвидацию источников болезней, уничтожение токсических веществ на предметах наружной среды. Она выполняется разными химическими веществами (например, гипохлоритом натрия). В результате такого процесса численность микробов уменьшается до допустимого количества, но совсем они не уничтожаются.
Различают следующие виды дезинфекции:
- профилактическая — делается преждевременно, не зависит от наличия эпидемии: чистка расположенных вокруг объектов, мытье рук моющими и чистящими средствами с антибактериальными добавками;
- текущая — выполняется в условиях наличия источников инфекции (в больницах, изоляторах), чтобы уничтожить возбудители, которые выделяют их носители либо больные люди;
- заключительная — выполняется по прошествии госпитализации, изоляции или выздоровления больного, чтобы очистить очаги.
Стерилизацией называют полную ликвидацию микробов, бактерий (вместе со спорами), грибов на поверхности какого-либо предмета, в лекарственных препаратах, пищевых продуктах.
Различают следующие способы стерилизации:
- химическая — проводится смесями, газом;
- тепловая — выполняется паром или сухим воздухом;
- радиационная — используется промышленностью;
- метод фильтров (мембранных) — применяется для получения малого объема стерильных смесей, качество которых ухудшается под влиянием других способов стерилизации (бактериофаги, лекарства).
В результате стерилизации ликвидируются все микробы (включительно возбудители заболеваний со смертельным исходом), а также споры микробов. Такому процессу обязательно подвергаются: инструменты для хирургических вмешательств или прокалывания кожи.
Внимание! Дезинфекция применяется, если невозможно провести стерилизацию. Например, обеззараживание половых покрытий, стен, рук и т. д. К тому же, такая процедура выполняется незамедлительно после внедрения, чтобы избежать инфицирования работников при очистке инструмента. Большое преимущество стерилизационных работ, если не учитывать эффективность, в возможности их проведения в автоматических режимах.
Медицинские инструменты подлежащие дезинфекции и стерилизации
Впоследствии работы с пациентом все использованные инструменты непременно должны быть дезинфицированы. Отдельные из них, например, зеркала для стоматологии, после такого процесса уже готовы к следующему использованию. Иными словами, их не надо стерилизовать.
Стерилизации подлежат все медицинские изделия, которые соприкасались с поверхностями ран, контактировали с кровью, лекарствами.
Методы дезинфекции и стерилизации

Методы дезинфекции
Дезинфекция изделий медицинского назначения выполняется следующими методами:
- Физический. Кипячение на протяжении 30 минут (если с содой, на 1л — 20 г, то 15 минут).
- Химический. Полное погружение изделий в дезинфицирующую жидкость.
Процедура выполняется непременно после применения. Разборные инструменты обрабатываются в разобранном виде с обязательным заполнением жидкостью всех каналов. По окончанию дезинфекции весь инструментарий тщательно промывается в проточной воде.
Если в процессе применения медицинские изделия не прикасались к пациентам, то их можно просто протереть тампоном, предварительно смоченном в дезинфицирующей жидкости.
Обработка изделий, которые подлежат стерилизации, состоит из 3 этапов:
- Дезинфекция (описана выше).
- Предстерилизационная очистка. Представляет собой удаление остаточного количества лекарств, засорений разных видов. Очищать можно вручную либо механизированным методом (в специальном оборудовании) с применением допустимых моющих средств.
- Стерилизация.
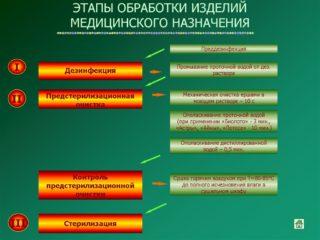
Этапы обработки изделий медицинского назначения
Самые распространенные методы стерилизации:
- Паровой. Обработка хирургического белья, инструментов, перевязочных материалов, посуды, элементов приборов из коррозиестойких материалов, резины, стекла выполняется в паровых стерилизаторах. Процедура проводится с помощью водяного пара под давлением. Продолжительность — до 10 минут, температурный режим —126-141 °С.
- Воздушный. Менее эффективный, чем паровой, поэтому требует более высоких температур. Выполняется в результате воздействия сухого горячего воздуха. Время воздушной стерилизации —0,5-2 часа, температура —160-200 °С. Метод применяется для гинекологических и хирургических инструментов, деталей аппаратов и приборов (включая коррозийно-неустойчивые), шприцов и иголок для инъекций.
- Газовый. Осуществляется при небольших температурах (от 18 до 80 °С). При этом используется оксид этилена, пары раствора формалина, смесь бромистого метила с оксидом этилена (2.5:1). Все стерилизуется в бумажной, пергаментной, полиэтиленовой упаковке. Такой метод практикуется для медицинских изделий из пластмассы, резины, с зеркальными поверхностями, эндоскопов, одноразовых предметов, кардиостимуляторов.
- Химический. Изделия из коррозиестойких материалов, пластмасс, металлов, стекла, резины обрабатываются химическими растворами: «Колдспор», анолит нейтральный, «Бианол», глутаровый альдегид, «Лизоформин 300» «Дюльбак растворимый», ” Первомур” (4,8 %), перекись водорода (6 %), «Сайдекс».
- Радиационный. Считается главным методом в промышленности. Используется на производстве одноразовых стерильных изделий для медицины. Радиационная стерилизация выполняется под влиянием бета- и гамма-излучений.
Внимание! Метод стерилизации назначается исходя из материалов обрабатываемых изделий, их конструкций, нужной продолжительности сохранения стерильности.
Растворы для дезинфекции
Так как перекись водорода может повредить инструменты из коррозионно-неустойчивых металлов, то в состав моющего раствора добавляется ингибитор коррозии (1,4 грамм на 1 литр).
Раствор «Биолот» для мытья инструментов — для однократного использования, а раствор перекиси водорода возможно применять многократно в течение суток.
В последнее время выполняется презентация многих средств, сочетающих моющие и дезинфицирующие качества. С их помощью проводится дезинфекция и предстерилизационная очистка медицинских инструментов одновременно («Гротанат», «Дюльбак», «Септодор-Форте»). Также возможно использовать нейтральные анолиты, получаемые из растворов поваренной соли. Католит имеют только моющие характеристики, их используют для предстерилизационной чистки изделий с любым составом.
Правила безопасности

Дезинфекция и стерилизация изделий медицинского назначения
При выполнении работ по дезинфекции, предстерилизационной очистке, стерилизации, которые регулируются приказом Министерства здравоохранения, необходимо соблюдать такие меры предосторожности:
- Работы могут выполнять лица, достигшие 18 лет, а также прошедшие инструктаж по технике безопасности, профилактике отравлений и имеющие понятия о сути процессов. За инструктаж несет ответственность главный врач мед. учреждения, а контроль выполняется ответственным лицом.
- К работе не допускаются лица с высокой чувствительностью к применяемым средствам.
- Замачивание изделий в дезинфицирующих растворах, предстерилизационная обработка, стерилизация медицинских изделий проводятся в помещениях с оборудованной вентиляцией.
- Растворы дезинфицирующих средств готовятся в помещениях, которые проветриваются. Хранение растворов выполняются в закрытых емкостях. Запасы препаратов содержатся в недоступных для всеобщего пользования местах. Емкости подписываются (указывается название, концентрация, срок годности, дата изготовления).
- При выполнении обеззараживания строго соблюдается правильная последовательность и этапы работ.
- Обеззараживание выполняется в специальной одежде, герметических очках, перчатках (резиновых), повязках (из марли) или респираторах.
- По завершению дезинфекционных процедур руки необходимо вымыть, смазать кремом.
Важно! Меры безопасности при работе с отдельными веществами прописаны в «Методических указаниях» по использованию препарата.
Дезинфекция и стерилизация важные этапы подготовки медицинских инструментов, одежды, постельного белья, помещений перед началом работы в любых медицинских учреждениях. Эти процессы нельзя игнорировать, ведь от них зависит здоровье человека. Перед тем, как приступить к обеззараживанию, необходимо обеспечить себя средствами личной защиты, а также ознакомиться с инструкцией.
Алгоритм «Этапы предстерилизационной очистки» — Студопедия
Цель: очистить поверхность медицинского инструментарий от любых загрязнений (остатков крови, дезинфицирующих веществ, лекарственных препаратов, белковых, жировых загрязнений и др.)
Оснащение: Маркированная емкость с моющим раствором, ватно-марлевые тампоны или щетки для мытья инструментов, ерши для мытья мединструментов, проточная водопроводная вода , вода дистиллированная, термометр, плитка электрическая , часы , спецодежда м\с
| Этапы | Обоснование |
| 1. Одеть спецодежду | Обеспечение безопасности на рабочем месте. |
| 2. Подготовить оснащение, проверить маркировку | для правильного проведения манипуляции |
| 3. Промывание проточной водой от дез. растворов в течение 1 мин | Удаление остатков дез. средств |
| 4. Подогреть моющий раствор до 50 град. | Повышение активности моющ раствора |
| 5. Поместить инструментарий в разобранном виде в моющий раствор на 15 мин | Соблюдение приказа МЗ № 408
|
| 6. Обработать ершом, ватно-марлевым тампоном в моющем растворе каждый предмет в течение 30 сек | Удаление остатков загрязнений |
| 7. Промыть под проточной водопроводной водой инструментарий в течение не менее 10 мин | Удаление остатков моющего раствора |
| 8. Ополоснуть инструментарий в дистиллированной воде в течение не менее 30 сек | Удаление солей содержащихся в водопроводной воде |
| 9. Просушить инструментарий в сухожаровом шкафу при температуре 85 град до полного удаления влаги | Удаление влаги для гарантированной стерилизации |
| 8. Снять спецодежду, вымыть руки, вытереть насухо. | Соблюдение личной гигиены м\с |
| 9. Сделать отметку о проведении ПСО | Обеспечение преемственности в работе |
Инструкция «Дезинфекция, предстерилизационная очистка и стерилизация изделий медицинского назначения»
1. Общие положения
1.1.
Дезинфекция, предстерилизационная
очистка и стерилизация изделий
медицинского назначения (далее изделия)
производятся с целью профилактики
внутрибольничных инфекций у пациентов
и персонала лечебно-профилактических
учреждений (ЛПУ).
1.2.
Дезинфекцию изделий (на поверхностях,
а также в их каналах и полостях) проводят
с целью уничтожения патогенных и
условно-патогенных микроорганизмов:
вирусов (в том числе возбудителей
парентеральных вирусных гепатитов,
ВИЧ-инфекции), вегетативных бактерий
(включая микобактерии туберкулеза),
грибов (включая грибы рода Кандида).
Дезинфекции
подлежат все изделия после применения
их у пациентов. После дезинфекции изделия
промывают водопроводной водой, высушивают
и применяют по назначению или (при
наличии показаний) подвергают
предстерилизационной очистке и
стерилизации.
1.3.
Стерилизацию изделий проводят с целью
уничтожения микроорганизмов всех видов,
в том числе споровых форм. Стерилизации
подлежат все изделия, соприкасающиеся
с раневой поверхностью, контактирующие
с кровью в организме пациента или
вводимой в него, инъекционными препаратами,
а также изделия, которые в процессе
эксплуатации контактируют со слизистой
оболочкой и могут вызвать ее повреждение.
1.4.
Изделия многократного применения,
подлежащие стерилизации, перед
стерилизацией подвергаются
предстерилизационной очистке (ПСО).
Предстерилизационную очистку проводят
с целью удаления с изделий белковых,
жировых и механических загрязнений, а
также остатков лекарственных препаратов.
1.5.
В качестве средств дезинфекции,
предстерилизационной очистки и
стерилизации в Республике Беларусь
используются только разрешенные в
установленном порядке физические и
химические средства.
1.6.
При выборе средств следует учитывать
рекомендации изготовителей изделий,
касающиеся воздействия конкретных
средств на материалы этих изделий (из
числа разрешенных в республике для
данной цели).
При
проведении дезинфекции, предстерилизационной
очистки и стерилизации допускается
использование оборудования (установки,
моечные машины, стерилизаторы и др.),
разрешенного в установленном порядке
к промышленному выпуску и применению
(в случае импортного оборудования —
разрешенного к применению) в Республике
Беларусь.
1.7.
Емкости с растворами дезинфицирующих,
моющих и стерилизующих средств должны
быть изготовлены из коррозионностойких
материалов, снабжены перфорированными
поддонами и плотно закрывающимися
крышками, иметь четкие надписи с указанием
названия средства, его концентрации,
даты приготовления (для готовых к
применению средств, разрешенных для
многократного использования, указывают
дату начала использования средства).
1.8.
Рекомендации по дезинфекции,
предстерилизационной очистке и
стерилизации сложных по конструкции
изделии (эндоскопы, медицинские
инструменты к гибким эндоскопам и др.),
а также дополнительные сведения,
касающиеся различных аспектов указанных
видов обработки изделий, более подробно
изложены в официальных инструктивно-методических
документах.
| 7.a. | Чтобы обнаружить поврежденные эндоскопы, проверяйте каждый гибкий эндоскоп на герметичность в рамках каждого цикла обработки. Исключите из клинического использования любой инструмент, не прошедший проверку на герметичность, и отремонтируйте этот инструмент. | II |
| 7.b. | Сразу после использования тщательно очистите эндоскоп ферментным очистителем, совместимым с эндоскопом.Очистка необходима как перед автоматической, так и перед ручной дезинфекцией. | IA |
| 7.c. | Отсоедините и разберите эндоскопические компоненты (например, всасывающие клапаны) как можно полнее и полностью погрузите все компоненты в ферментный очиститель. Стерилизуйте эти компоненты паром, если они термостойкие. | IB |
| 7.d. | Промойте и почистите все доступные каналы, чтобы удалить все органические вещества (например, кровь, ткани) и другие остатки.Очистите внешние поверхности и аксессуары устройств с помощью мягкой ткани, губки или щеток. Продолжайте чистить, пока на щетке не исчезнет мусор. | IA |
| 7.e. | Используйте чистящие щетки, соответствующие размеру канала или порта эндоскопа (например, щетина должна соприкасаться с поверхностями). Предметы для чистки (например, щетки, ткань) должны быть одноразовыми или, если они не одноразовые, их следует тщательно очищать и либо дезинфицировать, либо стерилизовать после каждого использования. | II |
| 7.f. | Выбрасывайте ферментные чистящие средства (или детергенты) после каждого использования, поскольку они не обладают микробицидным действием и, следовательно, не замедляют рост микробов. | IB |
| 7.г. | Технологические эндоскопы (например, артроскопы, цистоскопы, лапароскопы), которые проходят через обычно стерильные ткани с использованием процедуры стерилизации перед каждым использованием; если это невозможно, обеспечьте, по крайней мере, дезинфекцию высокого уровня. После тщательной дезинфекции артроскопов, лапароскопов и цистоскопов следует промыть их стерильной водой. | IB |
| 7.h. | Поэтапный отказ от эндоскопов, которые являются критически важными (например, артроскопы, лапароскопы), но не подлежат стерилизации паром. По возможности замените эти эндоскопы инструментами, стерилизуемыми паром. | II |
| 7.i. | Механически очищаемые многоразовые принадлежности, вставляемые в эндоскопы (например, щипцы для биопсии или другие режущие инструменты), которые разрушают слизистую оболочку (например, щипцы для биопсии, очищаемые ультразвуком), а затем стерилизуйте эти предметы между каждым пациентом. | IA |
| 7.j. | Используйте ультразвуковую очистку многоразовых эндоскопических принадлежностей для удаления почвы и органических материалов с труднодоступных для очистки участков. | II |
| 7.k. | Обрабатывайте эндоскопы и аксессуары, которые контактируют со слизистыми оболочками как полукритические предметы, и используйте, по крайней мере, дезинфекцию высокого уровня после использования для каждого пациента. | IA |
| 7.л. | Используйте стерилизующее средство, одобренное FDA, или дезинфицирующее средство высокого уровня для стерилизации или дезинфекции высокого уровня (Таблица 1). | IA |
| 7. м. | После очистки используйте составы, содержащие глутаральдегид, глутаральдегид с фенолом / фенатом, орто-фталевый альдегид, перекись водорода, а также перекись водорода и перуксусную кислоту для достижения дезинфекции высокого уровня с последующей промывкой и сушкой (рекомендуемые концентрации см. В таблице 1). | IB |
| 7. н. | Осторожно и консервативно увеличивайте время воздействия сверх минимального эффективного времени для дезинфекции полукритического оборудования для ухода за пациентами, поскольку продолжительное воздействие дезинфицирующего средства высокого уровня с большей вероятностью повредит тонкие и сложные инструменты, такие как гибкие эндоскопы.Время воздействия зависит от дезинфицирующих средств высокого уровня, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (таблица 2). | IB |
| 7.o. | Федеральные правила должны соответствовать утвержденным FDA этикеткам для дезинфицирующих средств высокого уровня. Этикетки, одобренные FDA для дезинфекции высокого уровня с> 2% глутарового альдегида при 25ºC, варьируются от 20 до 90 минут, в зависимости от продукта, на основе трехуровневого тестирования, которое включает спорицидные тесты AOAC, тестирование с моделированием использования с микобактериальными препаратами и тестирование в процессе использования. | IC |
| 7.п. | Несколько научных исследований и профессиональных организаций подтверждают эффективность> 2% глутарового альдегида в течение 20 минут при 20ºC; эта эффективность предполагает адекватную очистку перед дезинфекцией, тогда как утверждение на этикетке, одобренное Управлением по контролю за продуктами и лекарствами (FDA), включает дополнительный запас прочности, чтобы компенсировать возможные упущения в методах очистки. Учреждения, которые выбрали применение 20-минутной продолжительности при 20ºC, сделали это на основе рекомендации МА, содержащейся в документе с изложением позиции SHEA от июля 2003 г. «Многостороннее руководство по переработке гибких желудочно-кишечных эндоскопов».Обработка гибкого желудочно-кишечного эндоскопа [июнь 2011 г.] | |
| 7.кв. | При использовании дезинфицирующих средств высокого уровня, одобренных FDA, используйте рекомендуемые производителем условия воздействия. Для некоторых продуктов может потребоваться более короткое время воздействия (например, 0,55% ортофталевый альдегид в течение 12 минут при 20 ° C, 7,35% перекиси водорода плюс 0,23% перуксусная кислота в течение 15 минут при 20 ° C), чем глютаральдегид при комнатной температуре, из-за их быстрой инактивации микобактерий или сокращение времени воздействия из-за повышенной микобактерицидной активности при повышенной температуре (например, 2,5% глутарового альдегида на 5 минут при 35 ° C). | IB |
| 7.r. | Выберите дезинфицирующее или химическое стерилизующее средство, совместимое с обрабатываемым устройством. Избегайте использования химикатов для обработки эндоскопа, если производитель эндоскопа предостерегает от использования этих химикатов из-за функционального повреждения (с косметическим повреждением или без него). | IB |
| 7.s. | Полностью погрузите эндоскоп в дезинфицирующее средство высокого уровня и убедитесь, что все каналы перфузированы.По мере возможности откажитесь от использования непогружаемых эндоскопов. | IB |
| 7.т. | После дезинфекции высокого уровня промойте эндоскопы и промойте каналы стерильной водой, фильтрованной водой или водопроводной водой, чтобы предотвратить неблагоприятные воздействия на пациентов, связанные с дезинфицирующим средством, оставшимся в эндоскопе (например, колит, вызванный дезинфицирующим средством). Затем промойте водой с помощью 70-90% этилового или изопропилового спирта. | IB |
| 7.и. | После промывки всех каналов спиртом продуйте каналы принудительным воздухом, чтобы снизить вероятность заражения эндоскопа патогенами, передающимися через воду, и облегчить сушку. | IB |
| 7.v. | Повесьте эндоскопы в вертикальном положении для облегчения сушки. | II |
| 7.w. | Храните эндоскопы таким образом, чтобы защитить их от повреждений или загрязнения. | II |
| 7.Икс. | Стерилизуйте или дезинфицируйте на высоком уровне как бутылку с водой, используемую для подачи раствора для промывки внутри процедуры, так и ее соединительную трубку не реже одного раза в день. После стерилизации или глубокой дезинфекции бутылки с водой наполните ее стерильной водой. | IB |
| 7. г. | Вести журнал для каждой процедуры и записывать следующее: имя пациента и номер медицинской карты (если имеется), процедура, дата, эндоскопист, система, использованная для повторной обработки эндоскопа (если в зоне обработки может использоваться более одной системы), и серийный номер или другой идентификатор используемого эндоскопа. | II |
| 7.z. | Спроектируйте помещения, в которых используются и дезинфицируются эндоскопы, чтобы обеспечить безопасные условия для медицинских работников и пациентов. Использовать воздухообменное оборудование (например, вентиляция |
.
химических дезинфицирующих средств | Рекомендации по дезинфекции и стерилизации | Библиотека руководств | Инфекционный контроль
Спирт
Обзор.
В медицинских учреждениях «спирт» относится к двум водорастворимым химическим соединениям — этиловому спирту и изопропиловому спирту — которые, как правило, имеют заниженные бактерицидные свойства. 482 . FDA не одобряло жидкие химические стерилизаторы или дезинфицирующие средства высокого уровня со спиртом в качестве основного активного ингредиента.Эти спирты обладают быстрым бактерицидным, а не бактериостатическим действием в отношении вегетативных форм бактерий; они также обладают туберкулоцидным, фунгицидным и вирулицидным действием, но не уничтожают бактериальные споры. Их цидная активность резко падает при разбавлении до концентрации ниже 50%, а оптимальная бактерицидная концентрация составляет 60–90% растворы в воде (объем / объем) 483, 484 .
Начало страницы
Способ действия.
Наиболее вероятное объяснение антимикробного действия алкоголя — денатурация белков.Этот механизм подтверждается наблюдением, что абсолютный этиловый спирт, дегидратирующий агент, менее бактерициден, чем смеси спирта и воды, потому что белки денатурируются быстрее в присутствии воды 484, 485 . Денатурация белка также согласуется с наблюдениями, что алкоголь разрушает дегидрогеназы Escherichia coli 486 , и что этиловый спирт увеличивает лаг-фазу Enterobacter aerogenes 487 , и что эффект лаг-фазы может быть отменен добавлением определенных аминокислот. кислоты.Считалось, что бактериостатическое действие вызвано ингибированием продукции метаболитов, необходимых для быстрого деления клеток.
Начало страницы
Микробицидная активность.
Метиловый спирт (метанол) обладает самым слабым бактерицидным действием из спиртов и поэтому редко используется в здравоохранении. 488 . Бактерицидная активность различных концентраций этилового спирта (этанола) была исследована в отношении множества микроорганизмов в периоды воздействия от 10 секунд до 1 часа 483 . Pseudomonas aeruginosa были уничтожены за 10 секунд при всех концентрациях этанола от 30% до 100% (об. / Об.), А Serratia marcescens, E, coli и Salmonella typhosa были уничтожены за 10 секунд при всех концентрациях этанола. от 40% до 100%. Грамположительные организмы Staphylococcus aureus и Streptococcus pyogenes были немного более устойчивыми, погибая за 10 секунд при концентрации этилового спирта 60–95%. Изопропиловый спирт (изопропанол) был немного более бактерицидным, чем этиловый спирт для E.coli и S. aureus 489 .
Начало страницы
Этиловый спирт в концентрации 60–80% является сильнодействующим вирулицидным агентом, инактивирующим все липофильные вирусы (например, вирусы герпеса, осповакцины и гриппа) и многие гидрофильные вирусы (например, аденовирус, энтеровирус, риновирус и ротавирусы). но не вирус гепатита A (HAV) 58 или полиовирус) 49 . Изопропиловый спирт не активен против нелипидных энтеровирусов, но полностью активен против липидных вирусов 72 .Исследования также продемонстрировали способность этилового и изопропилового спирта инактивировать вирус гепатита B (HBV) 224, 225 и вирус герпеса 490 и этиловый спирт инактивировать вирус иммунодефицита человека (ВИЧ) 227 , ротавирус, эховирус и астровирус 491 .
Начало страницы
В испытаниях действия этилового спирта против M. tuberculosis 95% этанол убивал микобациллы туберкулеза в мокроте или водной суспензии в течение 15 секунд 492 .В 1964 году Сполдинг заявил, что спирты являются гермицидами выбора для туберкулоцидной активности, и они должны быть стандартом, по которому сравниваются все другие туберкулоциды. Например, он сравнил туберкулоцидную активность йодофора (450 частей на миллион), замещенного фенола (3%) и изопропанола (70% / объем), используя тест с муциновой петлей (10 6 M. tuberculosis на петлю). и определили, что время контакта, необходимое для полного разрушения, составило 120–180 минут, 45–60 минут и 5 минут соответственно.Тест с муциновой петлей — это серьезный тест, разработанный для увеличения времени выживания. Таким образом, эти цифры не следует экстраполировать на время воздействия, необходимое при использовании этих гермицидов на медицинских или хирургических материалах 482 .
Этиловый спирт (70%) был наиболее эффективной концентрацией для уничтожения тканевой фазы Cryptococcus neoformans , Blastomyces dermatitidis , Coccidioides immitis и Histoplasma capsulatum и фаз культивирования последних трех организмов, распыленных на различные поверхностей.Фаза культивирования была более устойчивой к действию этилового спирта и требовала около 20 минут для дезинфекции загрязненной поверхности по сравнению с <1 минутой для фазы ткани 493, 494 .
Изопропиловый спирт (20%) эффективен при уничтожении цист Acanthamoeba culbertsoni ( 560 ), а также хлоргексидина, перекиси водорода и тимеросала 496 .
Начало страницы
Использует.
Спирты не рекомендуются для стерилизации медицинских и хирургических материалов в основном потому, что они не обладают спороцидным действием и не проникают в богатые белком материалы.Смертельные послеоперационные раневые инфекции, вызванные Clostridium , произошли при использовании спиртов для стерилизации хирургических инструментов, загрязненных бактериальными спорами 497 . Спирты эффективно используются для дезинфекции оральных и ректальных термометров 498, 499 , больничных пейджеров 500 , ножниц 501 и стетоскопов 502 . Для дезинфекции оптоволоконных эндоскопов 503, 504 использовались спирты, но отказ этого дезинфицирующего средства привел к заражению 280, 505 .Спиртовые салфетки в течение многих лет использовались для дезинфекции небольших поверхностей, таких как резиновые пробки флаконов с множественными дозами лекарств или флаконов с вакцинами. Кроме того, спирт иногда используется для дезинфекции внешних поверхностей оборудования (например, стетоскопов, аппаратов ИВЛ, ручных вентиляционных мешков) 506 , манекенов для СЛР 507 , ультразвуковых инструментов 508 или зон приготовления лекарств. Два исследования продемонстрировали эффективность 70% -ного изопропилового спирта для дезинфекции многоразовых головок датчиков в контролируемой среде 509, 510 .Напротив, были описаны три вспышки инфекции кровотока, когда алкоголь использовался для дезинфекции головок датчиков в отделении интенсивной терапии 511 .
Начало страницы
Документально подтвержденные недостатки спиртов в оборудовании заключаются в том, что они повреждают крепления шеллака инструментов с линзами, имеют тенденцию к набуханию и затвердеванию резины и некоторых пластиковых трубок после длительного и многократного использования, отбеливают резину и пластмассовые плитки 482 и повреждают наконечники тонометров (из-за износа) клея) после эквивалента 1 рабочего года регулярного использования 512 .Бипризмы тонометра, пропитанные спиртом в течение 4 дней, образовали шероховатую переднюю поверхность, которая потенциально могла вызвать повреждение роговицы; это оказалось вызвано ослаблением вяжущих веществ, использованных для изготовления бипризмов 513 . Сообщалось о помутнении роговицы, когда кончики тонометров протирались спиртом непосредственно перед измерением внутриглазного давления 514 . Спирты легко воспламеняются, поэтому их следует хранить в прохладном, хорошо вентилируемом помещении. Они также быстро испаряются, что затрудняет достижение длительного воздействия, если предметы не погружены в воду.
Начало страницы
Хлор и соединения хлора
Обзор.
Гипохлориты, наиболее широко используемые из хлорсодержащих дезинфицирующих средств, бывают жидкими (например, гипохлорит натрия) или твердыми (например, гипохлорит кальция). Наиболее распространенными продуктами с содержанием хлора в США являются водные растворы гипохлорита натрия 5,25–6,15% (см. Глоссарий), обычно называемые бытовыми отбеливателями. Они обладают широким спектром антимикробной активности, не оставляют токсичных остатков, не подвержены влиянию жесткости воды, недороги и быстро действуют 328 , удаляют засохшие или фиксированные организмы и биопленки с поверхностей 465 и имеют низкую частоту серьезных серьезных заболеваний. токсичность 515-517 .Гипохлорит натрия в концентрации, используемой в бытовом отбеливателе (5,25-6,15%), может вызвать раздражение глаз или ожоги ротоглотки, пищевода и желудка 318, 518-522 . К другим недостаткам гипохлоритов относятся коррозионная активность металлов в высоких концентрациях (> 500 ppm), инактивация органическими веществами, обесцвечивание или «отбеливание» тканей, выделение токсичного газообразного хлора при смешивании с аммиаком или кислотой (например, бытовыми чистящими средствами) 523 -525 , и относительная стабильность 327 .Микробицидная активность хлора в основном связана с недиссоциированной хлорноватистой кислотой (HOCl). Диссоциация HOCI до менее микробицидной формы (гипохлорит-ион OCl — ) зависит от pH. Дезинфицирующая эффективность хлора снижается с увеличением pH, которое происходит параллельно с превращением недиссоциированного HOCI в OCl — 329, 526 . Потенциальная опасность представляет собой образование канцерогенного бис (хлорметилового) эфира при контакте растворов гипохлорита с формальдегидом 527 и образование канцерогенного вещества тригалогенметана при гиперхлорировании горячей воды 528 .После изучения экологической судьбы и экологических данных EPA определило, что зарегистрированные в настоящее время виды использования гипохлоритов не приведут к необоснованным неблагоприятным последствиям для окружающей среды 529 .
Начало страницы
Альтернативные соединения, выделяющие хлор и используемые в медицинских учреждениях, включают высвобождаемый по потребности диоксид хлора, дихлоризоцианурат натрия и хлорамин-Т. Преимущество этих соединений перед гипохлоритами состоит в том, что они дольше задерживают хлор и, таким образом, оказывают более продолжительное бактерицидное действие.Таблетки дихлоризоцианурата натрия стабильны, и по двум причинам микробицидная активность растворов, приготовленных из таблеток дихлоризоцианурата натрия, может быть выше, чем у растворов гипохлорита натрия, содержащих такое же общее количество доступного хлора. Во-первых, в случае дихлоризоцианурата натрия только 50% всего доступного хлора является свободным (HOCl и OCl — ), тогда как остальная часть объединяется (монохлоризоцианурат или дихлоризоцианурат), и по мере использования свободного доступного хлора последний выделяется в восстановить равновесие.Во-вторых, растворы дихлоризоцианурата натрия являются кислыми, тогда как растворы гипохлорита натрия являются щелочными, и считается, что более микробицидный тип хлора (HOCl) преобладает 530-533 . Дезинфицирующие средства на основе диоксида хлора готовятся в свежем виде по мере необходимости путем смешивания двух компонентов (основного раствора [лимонная кислота с консервантами и ингибиторами коррозии] и раствора активатора [хлорит натрия]). Тесты суспензий in vitro показали, что растворы, содержащие около 140 ppm диоксида хлора, достигают коэффициента восстановления, превышающего 10 6 из S.aureus за 1 минуту и спор Bacillus atrophaeus за 2,5 минуты в присутствии 3 г / л бычьего альбумина. Возможность повреждения оборудования требует рассмотрения, поскольку длительное использование может привести к повреждению внешнего пластикового покрытия вводной трубки 534 . В другом исследовании растворы диоксида хлора в концентрации 600 или 30 частей на миллион убили Mycobacterium avium-intracellulare в течение 60 секунд после контакта, но загрязнение органическим материалом значительно повлияло на микробицидные свойства 535 .
Начало страницы
Была исследована микробицидная активность нового дезинфицирующего средства, «сверхокисленной воды». Концепция электролиза физиологического раствора для создания дезинфицирующего или антисептического средства является привлекательной, поскольку основные материалы, такие как физиологический раствор и электричество, недороги, а конечный продукт (например, вода) — не наносить вред окружающей среде. Основными продуктами этой воды являются хлорноватистая кислота (например, с концентрацией около 144 мг / л) и хлор. Как и в случае любого гермицида, на антимикробную активность перекисленной воды сильно влияет концентрация активного ингредиента (доступный свободный хлор) 536 .Один производитель генерирует дезинфицирующее средство в месте использования, пропуская физиологический раствор через покрытые титановые электроды при 9 ампер. Образовавшийся продукт имеет pH 5,0–6,5 и окислительно-восстановительный потенциал (окислительно-восстановительный потенциал)> 950 мВ. Хотя сверхокисленная вода предназначена для создания свежей в месте использования, при тестировании в чистых условиях дезинфицирующее средство было эффективным в течение 5 минут при 48-часовой выдержке 537 . К сожалению, оборудование, необходимое для производства продукта, может быть дорогим, потому что необходимо тщательно контролировать такие параметры, как pH, ток и окислительно-восстановительный потенциал.Раствор нетоксичен для биологических тканей. Хотя производитель из Соединенного Королевства заявляет, что раствор не вызывает коррозии и не повреждает эндоскопы и технологическое оборудование, один производитель гибких эндоскопов (Olympus Key-Med, Великобритания) аннулировал гарантию на эндоскопы, если для их дезинфекции используется сверхокисленная вода 538 . Как и в случае с любым бактерицидным препаратом, пользователь должен уточнить у производителя устройства совместимость с бактерицидным препаратом. Необходимы дополнительные исследования, чтобы определить, можно ли использовать этот раствор в качестве альтернативы другим дезинфицирующим средствам или антисептикам для мытья рук, антисептики кожи, уборки помещений или дезинфекции оборудования (например,г., эндоскопы, диализаторы) 400, 539, 540 9000 8. В октябре 2002 г. FDA одобрило сверхокисленную воду как дезинфицирующее средство высокого уровня (FDA, личное сообщение, 18 сентября 2002 г.).
Начало страницы
Способ действия.
Точный механизм, с помощью которого свободный хлор уничтожает микроорганизмы, не выяснен. Инактивация хлором может быть результатом ряда факторов: окисления сульфгидрильных ферментов и аминокислот; кольцевое хлорирование аминокислот; потеря внутриклеточного содержимого; снижение усвоения питательных веществ; угнетение синтеза белка; пониженное потребление кислорода; окисление респираторных компонентов; снижение выработки аденозинтрифосфата; разрывы в ДНК; и подавленный синтез ДНК 329, 347 .Фактический микробицидный механизм хлора может включать комбинацию этих факторов или влияние хлора на критические участки 347 .
Начало страницы
Микробицидная активность.
Низкие концентрации свободного доступного хлора (например, HOCl, OCl — и элементарного хлора-Cl 2 ) оказывают биоцидное действие на микоплазму (25 частей на миллион) и вегетативные бактерии (<5 частей на миллион) за секунды в отсутствие органическая загрузка 329, 418 .Для уничтожения M. tuberculosis требуются более высокие концентрации (1000 ppm) хлора с использованием туберкулоцидного теста 73 , проведенного Ассоциацией официальных химиков-аналитиков (AOAC). Концентрация 100 ppm убьет ≥99,9% спор B. atrophaeus в течение 5 минут 541, 542 и уничтожит микотические агенты менее чем за 1 час 329 . Подкисленный отбеливатель и обычный отбеливатель (5000 ppm хлора) могут инактивировать 10 6 спор Clostridium difficile за ≤10 минут 262 .В одном исследовании сообщалось, что 25 различных вирусов были инактивированы за 10 минут с помощью 200 ppm доступного хлора 72 . Несколько исследований продемонстрировали эффективность разбавленного гипохлорита натрия и других дезинфицирующих средств для инактивации ВИЧ 61 . Хлор (500 частей на миллион) показал ингибирование Candida после 30 секунд воздействия 54 . В экспериментах с использованием метода разбавления AOAC 100 ppm свободного хлора уничтожили 10 6 –10 7 S.aureus , Salmonella choleraesuis и P. aeruginosa менее чем за 10 минут 327 . Поскольку бытовой отбеливатель содержит 5,25–6,15% гипохлорита натрия или 52 500–61 500 частей на миллион доступного хлора, разбавление 1: 1000 обеспечивает около 53–62 частей на миллион доступного хлора, а разбавление домашнего отбеливателя 1:10 дает около 5250–6150 частей на миллион.
Начало страницы
Имеются данные по диоксиду хлора, подтверждающие наличие бактерицидных, фунгицидных, спороцидных, туберкулоцидных и вирулицидных заявлений производителей 543-546 .Генератор диоксида хлора показал свою эффективность для обеззараживания гибких эндоскопов 534 , но в настоящее время он не одобрен FDA для использования в качестве дезинфицирующего средства высокого уровня 85 . Диоксид хлора можно получить путем смешивания растворов, таких как раствор хлора с раствором хлорита натрия 329 . В 1986 году продукт диоксид хлора был добровольно удален с рынка, когда его использование вызвало утечку мембран диализатора на основе целлюлозы, что позволило бактериям мигрировать со стороны диализирующего раствора диализатора на сторону крови 547 .
Дихлоризоцианурат натрия при 2500 ppm доступного хлора эффективен против бактерий в присутствии до 20% плазмы, по сравнению с 10% плазмой для гипохлорита натрия при 2500 ppm 548 .
Начало страницы
«Суперокисленная вода» была протестирована против бактерий, микобактерий, вирусов, грибов и спор 537, 539, 549 . Свежеобразованная перекисленная вода быстро (<2 минут) обеспечивает 5-log 10 снижения патогенных микроорганизмов (т.е.е., M. tuberculosis , M. chelonae , полиовирус, ВИЧ, множественная лекарственная устойчивость S. aureus , E. coli, Candida albicans , Enterococcus faecalis, P. aeruginosa ) в отсутствие органическая загрузка. Однако биоцидная активность этого дезинфицирующего средства существенно снижалась в присутствии органического материала (например, 5% лошадиной сыворотки) 537, 549, 550 . Бактерии или вирусы не были обнаружены на искусственно зараженных эндоскопах после 5-минутного воздействия сверхокисленной воды 551 , а ДНК HBV не была обнаружена ни на одном эндоскопе, экспериментально загрязненном HBV-положительной смешанной сывороткой после 7 минут воздействия дезинфицирующего средства 552 .
Начало страницы
Использует.
Гипохлориты широко используются в медицинских учреждениях в самых разных условиях. 328 Раствор неорганического хлора используется для дезинфекции головок тонометров 188 , а также для точечной дезинфекции столешниц и полов. Для обеззараживания пролитой крови рекомендуется разбавление 1: 10–1: 100 5,25–6,15% гипохлорита натрия (например, бытовой отбеливатель) 22, 228, 553, 554 или зарегистрированное Агентство по охране окружающей среды туберкулоцидное дезинфицирующее средство 17 .В случае небольших разливов крови (т. Е. Капель крови) на некритических поверхностях, область может быть продезинфицирована 1: 100 разведением 5,25-6,15% гипохлорита натрия или зарегистрированным EPA туберкулоцидным дезинфицирующим средством. Поскольку гипохлориты и другие гермициды практически инактивируются в присутствии крови 63, 548, 555, 556 , большие разливы крови требуют очистки поверхности перед использованием дезинфицирующего средства, зарегистрированного EPA, или раствора 1:10 (конечная концентрация) применяется бытовой отбеливатель 557 .Если возможно ранение острыми предметами, поверхность сначала следует обеззаразить 69, 318 , затем очистить и продезинфицировать (конечная концентрация 1:10) 63 . Всегда следует проявлять особую осторожность, чтобы не допустить чрескожных травм. Для обеззараживания учебных манекенов СЛР 558 рекомендуется не менее 500 частей на миллион доступного хлора в течение 10 минут. Полноценный отбеливатель рекомендован для самостоятельной дезинфекции игл и шприцев, используемых для инъекций запрещенных наркотиков, когда программы обмена игл недоступны.Разница в рекомендуемых концентрациях отбеливателя отражает сложность очистки внутренней части игл и шприцев и использования игл и шприцев для парентерального введения 559 . Клиницисты не должны изменять свое использование хлора на поверхностях из окружающей среды на основе методологий тестирования, которые не имитируют реальные методы дезинфекции 560, 561 . Другие применения в здравоохранении включают в себя ирригационное средство при эндодонтическом лечении 562 и в качестве дезинфицирующего средства для манекенов, стирки, стоматологического оборудования, резервуаров для гидротерапии 23, 41 , регулируемых медицинских отходов перед утилизацией 328 и системы распределения воды в центры гемодиализа и аппараты для гемодиализа 563 .
Начало страницы
Хлор давно используется как дезинфицирующее средство при очистке воды. Гиперхлорирование больничной системы водоснабжения Legionella 23 привело к резкому сокращению (с 30% до 1,5%) изоляции L. pneumophila из водостоков и прекращению заболеваний легионеров, связанных с оказанием медицинской помощи, в пострадавший блок 528, 564 . Обеззараживание воды монохлорамином на городских водоочистных сооружениях существенно снизило риск заболевания легионеров, связанного с оказанием медицинской помощи 565, 566 .Диоксид хлора также использовался для борьбы с Legionella в системе водоснабжения больниц. 567 Хлорамин Т 568 и гипохлориты 41 были использованы для дезинфекции оборудования для гидротерапии.
Растворы гипохлорита в водопроводной воде с pH> 8, хранящиеся при комнатной температуре (23 ° C) в закрытых непрозрачных пластиковых контейнерах, могут потерять до 40–50% свободного доступного хлора в течение 1 месяца. Таким образом, если пользователь хочет получить раствор, содержащий 500 ppm доступного хлора на 30-й день, он или она должен приготовить раствор, содержащий 1000 ppm хлора в момент 0.Раствор гипохлорита натрия не разлагается через 30 дней при хранении в закрытой коричневой бутылке 327 .
Использование порошков, состоящих из смеси высвобождающего хлор агента с сильно абсорбирующей смолой, для дезинфекции пролитых биологических жидкостей было оценено лабораторными испытаниями и испытаниями в больничных палатах. Включение частиц акриловой смолы в составы заметно увеличивает объем жидкости, которая может быть впитана, поскольку смола может поглощать жидкость в 200–300 раз больше собственного веса, в зависимости от консистенции жидкости.Когда экспериментальные составы, содержащие 1%, 5% и 10% доступного хлора, оценивали с помощью стандартизированного испытания поверхности, составы, содержащие 10%, демонстрировали бактерицидную активность. Одна проблема с гранулами, выделяющими хлор, заключается в том, что они могут выделять пары хлора при нанесении на мочу 569 .
Начало страницы
Формальдегид
Обзор.
Формальдегид используется как дезинфицирующее и стерилизующее средство как в жидком, так и в газообразном состоянии. Жидкий формальдегид будет кратко рассмотрен в этом разделе, а газообразная форма рассмотрена в другом месте 570 .Формальдегид продается и используется в основном в виде раствора на водной основе, называемого формалином, который содержит 37% формальдегида по весу. Водный раствор представляет собой бактерицид, туберкулоцид, фунгицид, вирулицид и спорицид 72, 82, 571-573 . OSHA указало, что формальдегид следует рассматривать на рабочем месте как потенциальный канцероген, и установил стандарт воздействия формальдегида на сотрудников, который ограничивает средневзвешенную по времени концентрацию воздействия за 8 часов 0,75 ppm 574, 575 . Стандарт включает второй допустимый предел воздействия в виде предела кратковременного воздействия (STEL) 2 ppm, что является максимальным воздействием, допустимым в течение 15-минутного периода 576 .Проглатывание формальдегида может быть смертельным, а длительное воздействие низких уровней в воздухе или на коже может вызвать астматические респираторные проблемы и раздражение кожи, например дерматит и зуд. По этим причинам сотрудники должны иметь ограниченный прямой контакт с формальдегидом, и эти соображения ограничивают его роль в процессах стерилизации и дезинфекции. Ключевые положения стандарта OSHA, защищающего рабочих от воздействия формальдегида, содержатся в Разделе 29 Свода федеральных правил (CFR), часть 1910.1048 (и аналогичные правила в штатах с государственными планами, утвержденными OSHA) 577 .
Начало страницы
Способ действия.
Формальдегид инактивирует микроорганизмы путем алкилирования амино- и сульфгидральных групп белков и кольцевых атомов азота пуриновых оснований 376 .
Начало страницы
Микробицидная активность.
Водные растворы формальдегида различной концентрации уничтожают широкий спектр микроорганизмов. Для инактивации полиовируса за 10 минут требовалась 8% концентрация формалина, но все другие протестированные вирусы были инактивированы 2% формалином 72 .Четыре
.
Рекомендации | Рекомендации по дезинфекции и стерилизации | Библиотека руководств | Инфекционный контроль
 Пояснение: CDC и HICPAC имеют рекомендации как в Руководстве 2003 по контролю за инфекциями окружающей среды в медицинских учреждениях , так и в Руководстве 2008 года по дезинфекции и стерилизации в медицинских учреждениях , в которых говорится, что CDC не поддерживать запотевание дезинфицирующим средством. В частности, в Руководящих принципах 2003 и 2008 гг .:
Пояснение: CDC и HICPAC имеют рекомендации как в Руководстве 2003 по контролю за инфекциями окружающей среды в медицинских учреждениях , так и в Руководстве 2008 года по дезинфекции и стерилизации в медицинских учреждениях , в которых говорится, что CDC не поддерживать запотевание дезинфицирующим средством. В частности, в Руководящих принципах 2003 и 2008 гг .:
- 2003: «Не выполняйте дезинфекцию туманом для обычных целей в зонах ухода за пациентами.Категория IB »
- 2008: «Не производите дезинфицирующее распыление в зонах ухода за пациентами. Категория II »
Эти рекомендации касаются распыления или туманообразования химических веществ (например, формальдегида, веществ на основе фенола или соединений четвертичного аммония) как способа обеззараживания поверхностей окружающей среды или дезинфекции воздуха в палатах. Рекомендация против запотевания была основана на исследованиях 1970-х годов, в которых сообщалось об отсутствии микробицидной эффективности (например, использование соединений четвертичного аммония при нанесении тумана), но также о неблагоприятном воздействии на медицинских работников и других лиц в учреждениях, где использовались эти методы.Более того, некоторые из этих химикатов не зарегистрированы Агентством по охране окружающей среды для использования в системах туманообразования.
Эти рекомендации не применяются к более новым технологиям, включающим туманообразование для дезактивации помещений (например, озоновый туман, испаренный перекись водорода), которые стали доступны после того, как были сделаны рекомендации 2003 и 2008 годов. Эти новые технологии были оценены CDC и HICPAC в Руководстве по профилактике и борьбе со вспышками норовирусного гастроэнтерита в медицинских учреждениях 2011 г., в котором содержится рекомендация:
«Требуются дополнительные исследования для выяснения эффективности и надежности туманообразования, УФ-излучения и озонового тумана для снижения загрязнения окружающей среды норовирусом.(Нет рекомендаций / нерешенный вопрос) »
Рекомендации 2003 и 2008 годов все еще применяются; однако CDC пока не дает рекомендаций относительно этих новых технологий. Этот вопрос будет рассмотрен еще раз, когда появятся дополнительные доказательства.
,
Промежуточных рекомендаций для общественных учреждений США с подозрением на / подтвержденное коронавирусное заболевание 2019
Изменения от 01.04.2020:
- Добавлено руководство по срокам дезинфекции после подозреваемого / подтвержденного случая COVID-19
Изменения от 26.03.2020:
- Обновленное руководство по очистке и дезинфекции мягких (пористых) поверхностей
- Обновлены ссылки на список дезинфицирующих средств, зарегистрированных EPA
- Добавлено руководство по дезинфекции электроники
- Обновленное руководство по дезинфекции / очистке ядра
Можно многое узнать о новом коронавирусе (SARS-CoV-2), вызывающем коронавирусную болезнь 2019 (COVID-19).Основываясь на том, что в настоящее время известно о вирусе и о похожих коронавирусах, вызывающих SARS и MERS, распространение от человека к человеку чаще всего происходит среди близких людей (в пределах примерно 6 футов). Этот тип передачи происходит воздушно-капельным путем, но передача болезни через инфекционные аэрозоли в настоящее время остается неопределенной. Передача SARS-CoV-2 людям с поверхностей, зараженных вирусом, не документирована. Передача коронавируса гораздо чаще происходит через респираторные капли, чем через предметы и поверхности, такие как дверные ручки, столешницы, клавиатуры, игрушки и т. Д.Текущие данные свидетельствуют о том, что SARS-CoV-2 может оставаться жизнеспособным в течение нескольких часов или дней на поверхностях, сделанных из различных материалов. Очистка заметно грязных поверхностей с последующей дезинфекцией — это лучшая практика для предотвращения COVID-19 и других респираторных вирусных заболеваний в общественных местах.
Неизвестно, как долго воздух в комнате, в которой находится кто-то с подтвержденным COVID-19, остается потенциально заразным. Помещения должны будут учитывать такие факторы, как размер помещения и дизайн системы вентиляции (включая скорость потока [воздухообмен в час] и расположение приточных и вытяжных вентиляционных отверстий) при принятии решения о том, как долго закрывать комнаты или зоны, используемые больными людьми, прежде чем начало дезинфекции.Принятие мер по улучшению вентиляции в помещении или помещении, где кто-то был болен или подозревался в заболевании COVID-19, поможет сократить время, необходимое для удаления капель из дыхательных путей из воздуха.
В этом руководстве представлены рекомендации по очистке и дезинфекции помещений или территорий, занятых лицами с подозрением на или подтвержденным COVID-19. Он направлен на ограничение выживания SARS-CoV-2 в ключевых средах. Эти рекомендации будут обновлены, если появится дополнительная информация.
Настоящее руководство ориентировано на общественные, немедицинские учреждения, такие как школы, высшие учебные заведения, офисы, детские сады, предприятия и общественные центры, в которых есть и не ночуют люди. Это руководство не предназначено для персонала, занимающегося уборкой в медицинских учреждениях или на местах репатриации, в домашних хозяйствах или для других лиц, для которых уже существуют специальные инструкции.
- Общественные учреждения , такие как школы, детские сады и предприятия, составляют большинство немедицинских учреждений, которые посещает широкая публика за пределами домашнего хозяйства.
- Очистка означает удаление грязи и загрязнений, в том числе микробов, с поверхностей. Сама по себе чистка не убивает микробы. Но, удаляя микробы, уменьшается их количество и, следовательно, риск распространения инфекции.
- Дезинфекция работает с использованием химикатов, например дезинфицирующих средств, зарегистрированных EPA, для уничтожения микробов на поверхностях. Этот процесс не обязательно очищает грязные поверхности или удаляет микробы. Но уничтожение микробов, оставшихся на поверхности после очистки, еще больше снижает риск распространения инфекции.
Сроки и место очистки и дезинфекции поверхностей
- В школе, детском саду, офисе или другом учреждении, где не принимает людей на ночь :
- Закрытие территорий, посещаемых больными. Откройте внешние двери и окна и используйте вентиляторы для увеличения циркуляции воздуха в помещении. Подождите 24 часа или столько, сколько возможно, прежде чем начинать чистку и дезинфекцию.
- Уборочный персонал должен убирать и дезинфицировать все помещения, такие как офисы, ванные комнаты, места общего пользования, общее электронное оборудование (например, планшеты, сенсорные экраны, клавиатуры, пульты дистанционного управления и банкоматы) , используемые больными , фокусируясь особенно на поверхностях, к которым часто прикасаются .
- На объекте ночуют люди :
- Следуйте временному руководству для высших учебных заведений США по работе с государственными и местными чиновниками здравоохранения для изоляции больных и предоставления временного жилья по мере необходимости.
- Закрытие территорий, посещаемых больными. Откройте внешние двери и окна и используйте вентиляторы для увеличения циркуляции воздуха в помещении. Подождите 24 часа или столько, сколько возможно, прежде чем начинать чистку и дезинфекцию.
- В районах, где больные содержатся изолированно, соблюдайте Временное руководство по очистке и дезинфекции окружающей среды для домохозяйств в США с подозрением или подтвержденным коронавирусным заболеванием 2019. Сюда входит , посвященное очистке и дезинфекции мест общего пользования, в которые могут войти сотрудники / другие лица, оказывающие услуги контактировать с больными, но сокращая уборку и дезинфекцию спален / ванных комнат, используемых больными, по мере необходимости.
- В районах, где больные посещали или использовали
.
