Диализный перитонит
Диализный перитонит – воспалительное заболевание брюшины у пациентов, получающих ПД, не обусловленное деструкцией органов брюшной полости и развивающееся вследствие микробной контаминации брюшной полости или воздействия других раздражающих факторов (РДО, 2016 г.)
- Рецидивирующий (relapsing) – в течение 4 недель от завершения лечения предыдущего эпизода, вызванный тем же микроорганизмом, а также если один из эпизодов – с отрицательными результатами посева.
Статистически считается одним эпизодом - Повторный (repeat) – более чем через 4 недели от завершения лечения предыдущего эпизода, вызванный тем же микроорганизмом.
Считается отдельным эпизодом. - Возвратный (recurrent) – в течение 4 недель от завершения лечения предыдущего эпизода, вызванный другим микроорганизмом.
- Рефрактерный (устойчивый, refractory) – сохраняется мутный диализат после 5 дней лечения.
- Связанный с катетерной инфекцией (catheter-related) – перитонит одновременно с инфекцией МВК или туннельной инфекцией.
 Высевается один и тот же микроорганизм или одна из проб стерильна.
Высевается один и тот же микроорганизм или одна из проб стерильна.
Диагностические критерии диализного перитонита
- Клиническая картина (мутный диализат, боли в животе, лихорадка)
- Лейкоциты в диализате > 100 в мкл; из них > 50% полиморфоядерных (проба взята после как минимум 2 часов от заливки)
- Положительный результат посева диализата
Причины помутнения диализата (помимо инфекционного перитонита)
- Menses (менструация)
- Кровотечение
- Диализат из «сухого» живота
- Химический перитонит
- Эозинофильный перитонит
- Хилезный диализат
- Блокаторы кальциевых каналов
- Злокачественная опухоль
Модифицируемые факторы риска диализного перитонита
- курение
- отдаленность проживания
- домашние животные
- ожирение
- депрессия
- запоры, кишечная инфекция
- прокалывание пакета с раствором
- гипокалиемия
- гипоальбуминемия
- гиповитаминоз D
- инвазивные обследования (колоноскопия, гистероскопия и т.
 п.)
п.)
- Связанные с диализом:
- начало ЗПТ с гемодиализа
- ПД помимо желания больного
- дефекты обучения
- использование Y-систем
- Связанные с инфекцией:
- носительство Staph. aureus в носоглотке;
- периодонтит
- инфекция МВК
Рекомендуем по теме:
Жизнь с хронической болезнью почек, стр. 76-80.
Презентация Диализные перитониты, профилактика и лечение (2016 г.)
Перитонеальный диализ (Тарту)
Лечение диализного перитонита у больных с поликистозом почек, находящихся на лечении постоянным амбулаторном перитонеальным диализом при подготовке к трансплантации почки Текст научной статьи по специальности «Клиническая медицина»
УДК 616.61-78:616.381-002-08
ЛЕЧЕНИЕ ДИАЛИЗНОГО ПЕРИТОНИТА У БОЛЬНЫХ С ПОЛИКИСТОЗОМ ПОЧЕРК, НАХОДЯЩИХСЯ НА ЛЕЧЕНИИ ПОСТОЯННЫМ АМБУЛАТОРНЫМ ПЕРИТОНЕАЛЬНЫМ ДИАЛИЗОМ ПРИ ПОДГОТОВКЕ К ТРАНСПЛАНТАЦИИ ПОЧКИ
В. В. Шувалова, А.В. Ватазин, А.Г. Янковой,
В. Шувалова, А.В. Ватазин, А.Г. Янковой,
А.А. Смоляков, И.В. Нестеренко, Р.В. Кошелев,
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Одной из наиболее серьезных проблем у пациентов, получающих постоянный амбулаторный перитонеальный диализ, является диализный перитонит. Среди больных поликистозом почек частота диализного перитонита составляет 1 случай на 36-38 диализо-месяиев, что превышает значения среди пациентов с хроническими нефрологическими заболеваниями (1 случай на 28±1,6 диализо-месяиев). Проанализированы результаты постоянного амбулаторного перитонеального диализа у 124 больных, среди которых 23 с поликистозом почек. Доказана эффективность лечения диализного перитонита у этих пациентов с применением экстракорпоральной гемокоррекиии и малоинвазивнои хирургической видеотехники, что позволяет успешно продолжать программу перитонеального диализа.
Ключевые слова: поликистоз почек, перитонеальный диализ, диализный перитонит.
One of the most serious problems of the patients, who get permanent out-patient peritoneal dialysis, is dialysis’ peritonitis. Among the patients with polycystic renal disease the frequency of dialysis’ peritonitis is 1 case out of 36-38 dialysis-months, which exceeds the same data for the patients with chronic nephrological diseases (1 case out of 28±1,6 dialysis-moths). The results of permanent out-patient peritoneal dialysis of 124 patients (23 out them with polycystic renal disease) have been analyzed. The efficiency of treatment of dialysis’ peritonitis of these patients with using extracorporeal hemocorrection and low-invasive surgical video equipment has been proved, that allows successfully continuing of peritoneal dialysis’ programme.
Key words: polycystic renal disease, peritoneal dialysis, dialysis’ peritonitis.
Проведение постоянного амбулаторного перитонеального диализа у больных с поликистозом почек, имеющих хронический очаг инфекции, сопряжено с более высоким риском возникновения инфекционных осложнений, среди которых особого внимания заслуживает диализный перитонит [1, 2].
Диализный перитонит — наиболее серьезная проблема у больных, получающих постоянный амбулаторный перитонеальный диализ. Частота диализных перитонитов в среднем колеблется в диапазоне 1 случай на 28±1,6 диализо-месяцев. В группе больных с поликистозом почек частота диализного перитонита составила 1 случай на 36-38 диализо-месяцев. Таким образом, у больных с поликистозом почек диализный перитонит представляет собой еще большую проблему по сравнению с больными, страдающими хроническими нефро-логическими заболеваниями. В этой связи особое значение приобретают своевременная диагностика перитонита, этио-тропная антибиотикотерапия и интенсификация программы перитонеального диализа [3].
Мы проанализировали результаты проведения постоянного амбулаторного перитонеального диализа у 124 больных, среди которых были 23 пациента с поликистозом почек. Этиология ХПН у больных, получавших постоянный амбулаторный перитонеальный диализ, была следующей: хронический диффузный гломерулонефрит — 62%, хронический пиелонефрит -12%, системные заболевания — 6,7%, сахарный диабет — 13%, поликистоз почек — 6,5%.
Достоверный диагноз диализного перитонита и выбор адекватной этиотропной антибиотикотерапии возможен
только после получения результатов посевов диализирую-щего раствора.
Мы изучили чувствительность микрофлоры диализирующе-го раствора к антибиотикам в двух группах больных, а именно, у больных с поликистозом почек — 1-я группа (23 больных) и у больных с ТХПН, обусловленную другими заболеваниями (101 больной) — 2-я группа. Выявлено, что возбудителями диализных перитонитов, в основном являются граммположитель-ные микроорганизмы, такие как Staph. epidermidis, Staph. aureus, Strept. viridans (60-67%), несколько реже возбудителями столь тяжелого осложнения постоянного амбулаторного перитонеального диализа (ПАПД) выступают граммотрицательные бактерии: Escherichia coli, Pseudomonas species, Enterobacter species, Klebsiella species (30-35%). К наиболее редким микробным агентам, вызывающим диализный перитонит, можно отнести анаэробные бактерии и грибы. У больных с поликистозом почек, даже при применении гликопептидов, а по данным литературы именно эта группа препаратов является наиболее эффективной, чаще встречаются резистентные штаммы.
Выявлено, что возбудителями диализных перитонитов, в основном являются граммположитель-ные микроорганизмы, такие как Staph. epidermidis, Staph. aureus, Strept. viridans (60-67%), несколько реже возбудителями столь тяжелого осложнения постоянного амбулаторного перитонеального диализа (ПАПД) выступают граммотрицательные бактерии: Escherichia coli, Pseudomonas species, Enterobacter species, Klebsiella species (30-35%). К наиболее редким микробным агентам, вызывающим диализный перитонит, можно отнести анаэробные бактерии и грибы. У больных с поликистозом почек, даже при применении гликопептидов, а по данным литературы именно эта группа препаратов является наиболее эффективной, чаще встречаются резистентные штаммы.
На наш взгляд, это обусловлено тем, что больные с полики-стозом почек, имеющие хронический очаг инфекции, еще в додиализной стадии, как правило, получали массивную анти-биотикотерапию. Именно поэтому лечение диализного перитонита у этой группы больных представляет значительные трудности, а комплекс лечебных мероприятий не может быть ограничен общепринятыми мероприятиями.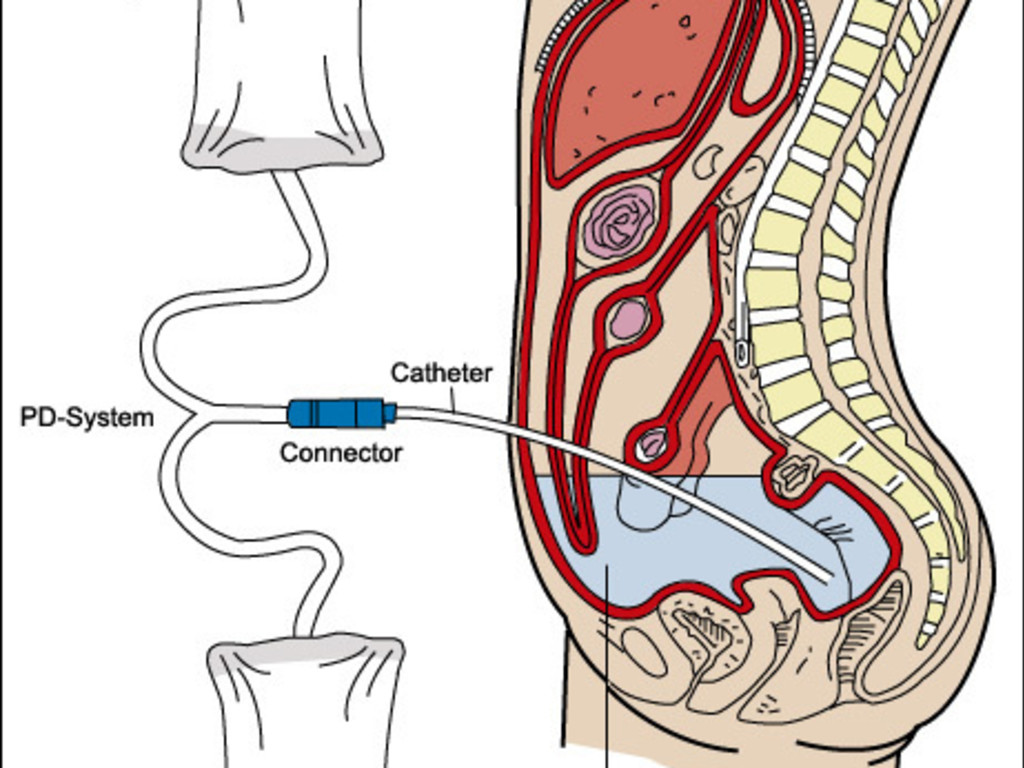
Во всех случаях развития диализного перитонита у больных с поликистозом почек, помимо общепринятых мероприятий май 2008 МЕДИЦИНСКИЙ АЛЬМАНАХ/СПЕЦВЫПУСК
(интраперитонеальное введение антибиотиков, гепарина), мы переходили на автоматизированный перитонеальный диализ в режиме PD Plus, проводили фильтрационный обменный плаз-маферез с экстракорпоральным лазерным облучением крови, а при неэффективности указанных методов осуществляли лапароскопическую санацию брюшной полости.
Для проведения автоматизированного перитонеального диализа использовали аппарат «Home Choice» компании «Baxter» и раствор «Экстранил» той же фирмы, не содержащий глюкозы.
Автоматизированный перитонеальный диализ, на наш взгляд, имеет существенные преимущества по сравнению с ручной методикой, а именно: 1. режим PD Plus позволяет непрерывно в течение суток осуществлять обмен перитонеального раствора, что фактически моделирует закрытый перитонеальный лаваж, применяемый при перитоните в общей хирургии; 2. раствор «Экстранил» не содержит питательного субстрата для микрофлоры; 3. интенсификация программы позволяет добиться адекватного клиренса уремических токсинов и достаточной ультрафильтрации; 4. аппарат «Home Choice» позволяет в режиме реального времени оценить адекватность заместительной почечной терапии и внести соответствующие коррективы в программу лечения; 5. использование постоянного замкнутого контура магистралей препятствует дополнительной контаминации брюшной полости; 6. применение аппарата «Home Choice» существенно снижает трудозатраты медперсонала.
режим PD Plus позволяет непрерывно в течение суток осуществлять обмен перитонеального раствора, что фактически моделирует закрытый перитонеальный лаваж, применяемый при перитоните в общей хирургии; 2. раствор «Экстранил» не содержит питательного субстрата для микрофлоры; 3. интенсификация программы позволяет добиться адекватного клиренса уремических токсинов и достаточной ультрафильтрации; 4. аппарат «Home Choice» позволяет в режиме реального времени оценить адекватность заместительной почечной терапии и внести соответствующие коррективы в программу лечения; 5. использование постоянного замкнутого контура магистралей препятствует дополнительной контаминации брюшной полости; 6. применение аппарата «Home Choice» существенно снижает трудозатраты медперсонала.
Поскольку большинство больных с поликистозом почек поступали в клинику уже с явлениями гипергидратации на фоне неадекватной программы перитонеального диализа, одной из основных задач являлась необходимость быстрой коррекции обьемов жидкостных сред организма.
При интенсификации диализной программы удается добиться нормализации распределения водных секторов организма (рис. 1).
До лечения Залив Экспозиция Слив Tidal Залив Tidal Слив НОРМА н ОЦК □ ОИЖ ОЦП
ОЦК- объём циркулирующей крови.
ОИЖ — объём интерстициальной жидкости.
ОЦП — объём циркулирующей плазмы.
Рис. 1. Динамика объёмов циркулирующей крови, плазмы и интерстициальной жидкости при автоматизированном перитонеальном диализе.
В процессе проведения полного суточного цикла автоматизированного перитонеального диализа объёмы циркулирующей крови, плазмы и интерстициальной жидкости приближаются к 100%, что убедительно доказывает эффективность
проводимого лечения в плане коррекции гиперволемии и гипергидратации.
Развитие перитонита у больных с поликистозом почек, получающих ПАПД, усугубляет тяжесть эндотоксикоза за счет присоединения к уремической еще и гнойной интоксикации. Все это обусловливает прогрессирование не только скрытой, но явной миокардиальной недостаточности. Следует также учесть, что у больных с поликистозом наличие хронического очага гнойной интоксикации существенно утяжеляет выраженность токсической миокардиопатии. При переводе больных на автоматизированный перитонеальный диализ в случаях развития тяжелого диализного перитонита после полного дренажа диализата из брюшной полости улучшение показателей центральной гемодинамики происходит в среднем в 1,18 раза (на 18,23% от исходного).
При неэффективности общепринятой консервативной терапии в комплекс лечебных мероприятий включали фильтрационный обменный плазмаферез (ФОП) в сочетании с экстракорпоральным лазерным облучением аутокрови (ЭКЛОК).
Исследования проведены у 18 больных, которым было выполнено 54 сеанса экстракорпорального лазерного облучения крови (ЭКЛОК). Группу сравнения составили 22 больных, получавших традиционное лечение (гипериммунная плазма направленого действия, тималин или тактивин, гамма-глобулин и др.). Динамическое наблюдение за состоянием иммунной системы показало, что проведение ФОП в сочетании с ЭКЛОК способствует более выраженному положительному эффекту по сравнению с больными, получавшими традиционное лечение.
При исследовании фагоцитарной активности нейтрофилов отмечена отчетливая положительная динамика в обеих группах больных, однако в период исследования этот показатель не достигал даже нижней границы физиологической нормы. Так, исходный фагоцитоз был одинаковым как в группе сравнения (13,1±1,%), так и у больных, которым в дальнейшем применили ЭКЛОК в сочетании с ФОП (13,1±1,5%). После первого сеанса ЭКЛОК в сочетании с ФОП фагоцитоз возрастал на 59,4±1,% и составлял 323,1 ±2,8%. После второго сеанса ЭКЛОК с ФОП фагоцитоз снизился до 21,8+2,2%, через 3-5 суток составлял 27,0+3,5%, а к 7-9-ым суткам — 28,9+2,9%. Аналогичная динамика фагоцитоза была отмечена и в группе сравнения, где этот показатель к 7-9-ым суткам составил 30,0+5,5%.
После первого сеанса ЭКЛОК в сочетании с ФОП фагоцитоз возрастал на 59,4±1,% и составлял 323,1 ±2,8%. После второго сеанса ЭКЛОК с ФОП фагоцитоз снизился до 21,8+2,2%, через 3-5 суток составлял 27,0+3,5%, а к 7-9-ым суткам — 28,9+2,9%. Аналогичная динамика фагоцитоза была отмечена и в группе сравнения, где этот показатель к 7-9-ым суткам составил 30,0+5,5%.
Нарушения в иммунной системе у урологических больных с диализным перитонитом диктуют целесообразность применения в комплексе лечебных мероприятий иммуностимулирующих воздействий, в частности, экстракорпорального лазерного облучения крови. Вместе с тем этому методу свойственен и ряд отрицательных эффектов. Так, после ЭКЛОК нами отмечено увеличение концентрации средних молекул (СМ) в крови больных. Именно поэтому мы считаем целесообразным обязательно сочетать экстракорпоральное лазерное облучение крови с экстракорпоральной детоксикацией, например, фильтрационным обменным плазмаферезом.
Таким образом, применение экстракорпорального лазерного облучения крови в сочетании с фильтрационным обменным май 2008 МЕДИЦИНСКИЙ АЛЬМАНАХ /СПЕЦВЫПУСК
плазмаферезом при диализном перитоните у больных с поли-кистозом почек позволяет добиться некоторой коррекции вторичного иммунодефицита, что, безусловно, целесообразно и патогенетически оправдано у этой категории больных.
При безуспешности консервативных мероприятий нами проводилась лапароскопическая санация брюшной полости. Применение этой методики позволило нам не только визуально оценивать тяжесть воспалительного процесса в брюшной полости, но и объективно судить об эффективности проводимого лечения, а также оценивать прогноз заболевания и возможность продолжения программы перитонеального диализа. Для этого при первичной лапароскопии мы, как правило, производили биопсию брюшины. < -■ —-
< -■ —-
Рис. 2. Гистологическая картина брюшины при фибринозном диализном перитоните (активный фибринозный процесс -неблагоприятный прогноз).
Приведенные примеры свидетельствуют, что информативность биопсии брюшины очевидна. Однако на этом ценность лапароскопии при диализном перитоните не исчерпывается. Лапароскопия позволяет также оценить распространенность процесса, определить наличие отграниченных спайками участков брюшной полости, где скапливается диализирующая жидкость, и оценить целесообразность продолжения программы перитонеального диализа еще до получения результатов биопсии брюшины. На рисунке 3 представлена еще одна лапароско-
пическая картина фибринозного перитонита с образованием мощных сращений между петлями тонкой кишки. Полностью освободить органы брюшной полости от сращений с помощью лапароскопической техники не удалось, и было принято решение о прекращении программы перитонеального диализа.
Рис. 3. Лапароскопическая картина фибринозного перитонита.
У 6 из 8 больных с поликистозом почек, которым произведена лапароскопическая санация брюшной полости, программа перитонеального диализа была успешно продолжена.
Таким образом, больные с поликистозом почек, страдающие терминальной стадией хронической почечной недостаточности, безусловно, представляют собой группу риска в плане развития гнойно-септических осложнений на стадии проведения перитонеального диализа. Это диктует необходимость применения особых методов лечения этих осложнений с использованием экстракорпоральной гемокоррекции и малоинвазивной хирургической видеотехники, что позволяет адекватно подготовить больных к трансплантации почки.
и
ЛИТЕРАТУРА
1. Celik F., Struijk D.G., Krediet R.T. //Analysis of factors that influence the recurrence of peritonitis in peritoneal dialysis patients. JASN., — USA. — San-Diego. — 2006.
Celik F., Struijk D.G., Krediet R.T. //Analysis of factors that influence the recurrence of peritonitis in peritoneal dialysis patients. JASN., — USA. — San-Diego. — 2006.
— P. 751.
2. Han D.S., Han S.H., Lee S.C. // Risk factors for peritoneal dialysis peritonitis in continuous ambulatory peritoneal dialysis patients. JASN. — USA. — San-Diego. -2006. — P. 752.
3. Казимиров В.Г., Бутрин С.В., Беков Р.Р., Сапожников А.Д. Перитонеальный диализ. — 2005. — Волгоград. — С. 96.
33 май 2008 МЕДИЦИНСКИЙ АЛЬМАНАХ/СПЕЦВЫПУСК
Наш опыт использования перитонеального диализа при острой почечной недостаточности у собак
Чубарова Е.А., Олишевко А. Клиника экспериментальной терапии НИИ клинической онкологии ФГБУ « РОНЦ им Н.Н.Блохина» РАМН, ветеринарная клиника «Биоконтроль»
Для лечения острой почечной недостаточности в гуманитарной и ветеринарной медицине используют перитонеальный диализ.
Перитонеальный диализ (от греч. dialisis – отделение, разложение) – это интракорпоральный метод детоксикации, основанный на свойствах париетальной и висцеральной брюшины выполнять функции диализной мембраны, через которую из микроциркуляторного русла брюшины в диализирующий раствор переходят токсичные метаболиты и вода, а из диализата в кровь – вещества, составляющие его основу.
Перитонеальный диализ стал впервые применяться около 80 лет назад при уремии (Ganter G., 1923), однако широко вошел в медицинскую практику лишь в последние годы. В 80-х годах этот метод, как дополнительный начали использовать и в ветеринарной медицине.
Показания:
- Острая почечная недостаточность
- Хроническая почечная недостаточность
- Отравления лекарственными препаратами, ядовитыми химическими веществами
Противопоказания:
- Постановка катетера противопоказана при воспалении брюшной стенки
- При установленных дренажах в брюшной полости
- Эффективность перитонеального диализа резко снижается при наличии опухолей или спаек брюшной полости, которые уменьшают объем брюшной полости.
Осложнения:
- Диализный перитонит
- Инфекции места выхода катетера
- Подтекание диализата из места выхода катетера
Самой важной и чувствительной составляющей перитонеального диализа является установка катетера. Идеально установленный катетер должен позволять свободно входить и выходить жидкости диализата, обладать высокой биосовместимостью. Должна обязательно соблюдаться асептика и антисептика.
При проведении диализа раньше использовали венозные катетеры, центральные венозные катетеры и дыхательные трубки. Они имеют преимущество перед остальными так, как их можно поставить без применения общей анестезии. Из-за риска заражения катетер не должен оставаться в брюшной полости больше, чем на 72 часа. (Parker, 1984).
C 2000 года стали доступны катетеры долговременного использования. В брюшную полость имплантируется тонкая силиконовая однопросветная трубка (катетер Тенкхоффа), которая имеет две манжеты Darcon, которые помещаются в подкожную клетчатку и в области прямой мышцы живота (M.rectus), где они срастается c тканями. Таким образом выстраивается определенный защитный барьер от внешней среды. После имплантации катетера, это место обрабатывают антибиотиками и накладывают стерильную повязку. (Garcia-Lacaze et al., 2002).
Как было замечено ранее, задачей диализата является собрать имеющиеся токсины и вывести их из организма. Идеальный диализат должен быть стерильным, без пирогенов и биологически совместимым с организмом пациента. Состав диализата должен собирать уремические токсины, и из-за большой вероятности обезвоживания организма, корректировать кислотно-щелочный и электролитный баланс. (Cowgill, 1995). Таким требованиям отвечают растворы для перитонеального диализа с содержанием в них глюкозы от 1,36%, 2,27%. 3,86%, до 4,5%.
В первые 48 часов проведения диализа или при наступлении перитонита к диализату добавляют 250-1000 МЕ/л гепарина (Cowgill, 1995; Labato, 2000). Никогда не стоит забывать о том, что возможность заражения присутствует в любых условиях, поэтому следует проводить данные процедуры в условиях строгой асептики.
В ветеринарии на сегодняшний день описано две техники проведения перитонеального диализа. При ручном контроле процесса диализа, диализат вводится в абдоминальную полость животным. Предварительно раствор выдерживается около 30-60 минут в специальном контейнере до достижения температуры 38-38,5º (Cowgill, 1995). Также перитонеальный диализ может проводится с помощью специальных приборов предназначенных для перитонеального диализа, диализат из резервуара инфундируется в брюшную полость и через определенное время попадает обратно в аппарат. Такая техника позволяет проводить наиболее эффективный диализ с минимальными потерями, так как диализат единовременно нагревается и обеспечивает ультрафильтрацию (Cowgill, 1995). Катетер, используемый для проведения диализа при использовании такой техники должен идеально функционировать (Cowgill, 1995). Чем меньше число циклов, тем ниже эффективность диализа. Вне зависимости от используемой системы, проведение каждой процедуры диализа нужно осуществлять в строго асептических условиях.
На начальном этапе проведения диализа, следует проводить непрерывные циклы диализа в течение 48 часов, каждый цикл должен длиться около 60 мин. Объем обмена для первых 10-12 циклов должен составлять 15-20 мл/кг. Однако если после первого цикла не происходит утечки диализата, объемы можно увеличить до 30-40 мл/кг.
Когда через 24-48 часов концентрация мочевины становится ниже, корректируется кислотно-щелочной баланс, баланс электролитов, а также баланс жидкости, рвота и понос находятся под контролем, циклы диализа можно уменьшить до 3-6 часов. Уровень электролитов, альбумина, мочевины, креатинина и кислотно-щелочного баланса на начальном этапе нужно проверять каждые 12 часов, на дальнейших этапах эти показатели контролируют ежедневно. Катетер должен проверяться ежедневно, на наличие всякого рода утечек. Также ежедневно стоит обновлять повязку на брюшной стенке животного. Диализат всегда должен проверятся на предмет мутности, инородных тел или крови. В таких случаях проводятся цитологические и микробиологические исследования. При стабилизации состояния животного катетер Тенкхоффа удаляется.
Цель исследовании: оценить эффективность перитонеального диализа у собак с острой почечной недостаточностью
Материалы и методы: перитонеальный диализ выполняли 5 собак с клиническими симптомами анурии или олигоурии. Все животные на момент постановки перитонеального катетера проходили терапию по поводу заражения бабезиозом (пироплазмозом). Масса тела животных составила 20-30кг, возраст пациентов варьировался от 3 до 6 лет, показатели мочевины в крови были более 20
ммоль/л; креатини более 600 мкмоль/л.
Все животные перед проведением перитонеального диализа прошли сонографию, лабораторные исследования (клинический анализ крови, мочи, биохимический анализ крови, анализ концентрации газов крови и электролитов).
Всем животным под общей анестезией была выполнена постановка катетера Тенкхоффа. У всех животных была выполнена оментэктомия. Диализ начинали через 4-6 часов после хирургического вмешательства.
Все собаки проходили интенсивную инфузионную терапию, антибиотикотерапию, получали парентеральное питание. У всех животных стоял уретральный катетер, для контроля над диурезом.
Объем диализного раствора варьировался от 15-30 мл/кг веса животного. Минимальная экспозиция раствора длилась 60 мин, максимально 240 минут. Количество циклов диализа составило от 12 до 6 за сутки. Для диализа использовали растворы фирмы Baxter или Fresenius c концентрацией глюкозы 1,36%, 2,27%. 3,86%, 4,5%. Ежедневно производился контроль диализного раствора.
Результаты:
Перитонеальный диализ у собак в 100% случаев (n=5) с острой почечной недостаточностью показан для восстановления функции почек.
У всех животных через 24 — 48 часов была зафиксировано регрессия показателей мочевины и креатинина в крови.
Максимальный срок эксплуатации перитонеального катетера составил 90 суток.
У всех животных до и во время перитонеального диализа наблюдалась гипоальбуминемия, гипокалиемия.
В 60% случаев (3 из 5) был выявлен диализный перитонит.
Отмечена 100% выживаемость животных после проведенного перитонеального диализа при острой почечной недостаточности.
Выводы:
- Перитонеальный диализ показан животным с острой почечной недостаточностью.
- Обязателен контроль электролитов, кислотно-щелочного баланса, показателей биохимического и клинического анализа крови и мочи
- Необходимо ежедневно оценивать диализный раствор на появление в нем инородных частиц, мутности, крови.
Non-infectious complications of peritoneal dialysis in children | Schebenkov
Введение
Проблема хронической почечной недостаточности (ХПН) остается актуальной в педиатрии в связи с высоким уровнем и ростом в последние годы встречаемости врожденных пороков развития мочевыводящей системы, прогрессирующих в почечную недостаточность в раннем детском возрасте. По данным общероссийского регистра детей с ХПН за 1998–2013 гг., доля пациентов, находящихся на перитонеальном диализе (ПД), среди всех на заместительной почечной терапии составляла всего 9,0 %, что представляется крайне низким, учитывая общепризнанные достоинства этого метода [1]. Перитонеальный диализ по праву можно считать методом выбора у больных с ХПН, так как его можно проводить в домашних условиях, его могут выполнять родители, он позволяет вести активный образ жизни, доступен у детей младенческого возраста, при нем лучше сохраняется остаточная функция почек, лучше результаты трансплантации почки [2–4].
Кроме того, ПД является методом выбора для лечения детей с острой почечной недостаточностью, наиболее частой причиной которой является гемолитико-уремический синдром [5–8].
Несмотря на широко применяемые меры по улучшению результатов ПД, осложнения при этой процедуре развиваются достаточно часто. Инфекционные проблемы по-прежнему остаются основной причиной заболеваемости детей на хроническом ПД, и частота перитонитов у детей превышает таковую у взрослых. Перитонит является наиболее распространенной причиной для перехода на гемодиализ. Неинфекционные осложнения включают механическую дисфункцию катетера, которая может быть вызвана закупоркой или перегибом трубки, или миграцию катетера. Утечки диализата, осложнения в виде кровотечения и грыж передней брюшной стенки менее распространены, а такие осложнения, как перфорация кишечника или повреждение внутрибрюшных структур, отличаются в единичных случаях.
По данным NARPTCS за 2011 г., ревизия катетера потребовалась в 19 % всех имплантаций. Причинами для ревизии послужили дисфункция катетера (40 %), диализные перитониты (16 %), инфекция места выхода катетера (14 %), утечка диализата (4 %) и другие (26 %) [9].
Несмотря на то что данных об инфекционных осложнениях (диализный перитонит, инфекции тоннеля и места выхода катетера) в литературе достаточно много, проблема неинфекционных осложнений освещена значительно меньше. Лечение неинфекционных осложнений зависит от опыта и квалификации лечащего врача. Ранняя диагностика и вмешательство играют важную роль в снижении частоты нарушений функционирования катетера и смертности пациентов на ПД. На сегодняшний день проведено лишь несколько исследований, посвященных неинфекционным осложнениям ПД у детей [10–14], а также опубликовано несколько отдельных статей с сообщениями о редких случаях подобных осложнений [15–17]. Стоит отметить, что первичная дисфункция катетера чаще возникает у маленьких детей до 6 месяцев (10 кг), которым диализ был начат в первые сутки после имплантации катетера. Таким образом, эта возрастная группа представляет собой группу риска по неинфекционным осложнениям в первый месяц [11].
Неинфекционные осложнения
К неинфекционным осложнениям ПД относятся нарушения оттока (5–24 %), утечки диализата (7–10 %), грыжи передней брюшной стенки (8 %), внутрибрюшное кровотечение (7 %), боли при заливе и сливе раствора (4 %), миграция катетера (3 %), повреждение катетера пациентом или медработником (3 %), увеличение размеров живота (1,5 %), эрозии над манжетой и экструзия манжеты, грануляции места выхода катетера [3, 14, 18, 19]. К редким осложнениям относятся склерозирующий инкапсулирующий перитонит, гидроторакс, гидроперикард, панкреатит, ишемический колит, некротический энтероколит, пневмоперитонеум [15, 20].
Отдельно стоит выделить такое осложнение, как прободение катетера в просвет кишечника. Описано два случая прободения катетера для перитонеального диализа в просвет тонкой кишки у детей. В обоих случаях клиника перитонита отсутствовала. Катетеры были удалены, перфорацию кишки лечили консервативно [21]. Также сообщается об 11-летнем мальчике с почечной дисплазией, который перенес трансплантацию почки спустя 23 месяца перитонеального диализа. Катетер не удаляли. Через 13 месяцев после трансплантации мальчик заметил закругленный катетер Тенкхоффа в области ануса во время дефекации. Клиника перитонита в данном случае также отсутствовала. Лапароскопически был удален катетер и ушита перфорация сигмовидной кишки без хирургических послеоперационных осложнений [22].
Утечки
Утечки диализата являются одним из наиболее частых неинфекционных осложнений ПД. Чаще всего встречаются перикатетерные подтекания диализата. Группу риска составляют дети младшей возрастной группы в связи со слабостью передней брюшной стенки.
Протечки диализата присутствуют, как правило, с первых недель диализа. В дополнение к явным протечкам через место выхода катетера это осложнение может манифестировать менее заметно в виде асимметричной отечности кожи, набора веса или уменьшения объема слива. Существует два мнения на корреляцию между ранним началом диализа и риском развития катетер-ассоциированных осложнений (утечки, грыжи). Традиционно считается, что риск подобных осложнений ниже при коротком вводном периоде (около 14 дней) [23]. Однако в последние годы появляется все больше публикаций, демонстрирующих отсутствие различий в частоте осложнений при раннем и отсроченном начале перитонеального диализа [14, 24–26]. В развитии перикатетерных протечек может играть роль и хирургическая техника установки катетера.
Диагноз протечки обычно ставят по промоканию диализатом повязки на месте выхода. Также следует предположить это осложнение при снижении объемов слива, наборе веса, увеличении объемов живота в отсутствие общих отеков. Перикатетерная протечка обычно возникает как послеоперационное осложнение при имплантации катетера. В данном случае бесполезно накладывать стягивающие швы, поскольку протечка диализата направится в окружающие ткани, а не в место выхода катетера. В таких случаях диализ следует приостановить на 24–48 часов. В большинстве случаев протечки затягиваются самостоятельно. Если они персистируют, катетер следует переустановить [19].
Утечки значительно реже встречаются после лапароскопической имплантации катетера из-за плотного прилегания катетера к брюшине и длинного мышечно-фасциального туннеля, даже в случае острого начала диализа. Причиной обильных утечек диализата может быть обширный дефект в брюшине, скорее всего вследствие использования троакара. Восстановление брюшины может выполняться без удаления катетера. Если разрыв брюшины близок к паховой области, может отмечаться отек гениталий. Предупредить утечки диализата в раннем послеоперационном периоде можно с помощью фибринового клея, который наносят на месте выхода, причем клей применяют как с профилактической, так и с лечебной целью [3, 27, 28].
Крайне редко обильные утечки диализата приводят к гидротораксу или перикардиальному выпоту. Это происходит в том случае, когда примерно на 8-й неделе гестации плевроперитонеальные каналы не закрываются, в результате чего возникает сообщение между грудной и брюшной полостями. Наиболее распространены левосторонние дефекты. Диализат выходит в плевральную полость, вызывая гидроторакс и респираторные нарушения. В литературе представлено сообщение о ребенке с гидротораксом и впервые диагностированной врожденной диафрагмальной грыжей [29]. В целом, если имеется значительная утечка диализата в любом месте, общим в лечении является использование более низких объемов диализата, выполнение ПД с помощью циклера, обеспечение покоя катетера или временное переключение на гемодиализ. При этом могут наблюдаться увеличение веса и снижение ультрафильтрации [3].
По сообщению NARPTCS, за последние 10 лет встречаемость гидроперикарда и гидроторакса у детей на ПД составила 0,66 % (10 случаев из 1506 пациентов) [9]. Возраст детей варьировал от четырех месяцев до 2,5 года. У 8 детей имелась диафрагмальная грыжа, у 7 — хирургическое внутрибрюшное вмешательство в анамнезе. Данное осложнение проявлялось респираторным дистрессом, сниженными показателями ультрафильтрации и тахикардией. Во всех случаях перитонеальный диализ был прекращен, у 7 детей потребовался торакоцентез. Лишь в трех случаях ПД был возобновлен, в двух случаях успешно. Таким образом проникновение диализата в полость перикарда или плевральную полость редко осложняет ПД у детей, однако оно достаточно серьезно, требует смены режима диализа во всех случаях. Факторами риска являются возраст до трех лет, наличие диафрагмальных грыж и хирургические вмешательства [15]. Тем не менее есть сообщения об успешном применении перитонеального диализа у новорожденного с острой почечной недостаточностью и врожденной диафрагмальной грыжей [30].
Грыжи брюшной стенки
Грыжи представляют собой распространенное заболевание у детей на хроническом ПД. Частота всех типов грыж может достигать 50 % и больше. Грыжи включают паховую, пупочную, эпигастральную и послеоперационные. Наибольшая заболеваемость наблюдается у младенцев и маленьких детей, что можно объяснить более слабой брюшной стенкой. В большинстве случаев грыжи проявляются в течение первых нескольких месяцев после начала диализа из-за повышения внутрибрюшного давления, которое складывается из объема диализного раствора и положения пациента во время обмена (наивысшее в положении сидя) [19]. В некоторых исследованиях не было выявлено корреляции между появлением грыж и ранним или отсроченным началом диализа [25].
У детей на перитонеальном диализе описаны различные типы грыж. Некоторые из них требуют прицельной дифференциальной диагностики. Перикатетерные грыжи следует дифференцировать с гематомой, серомой или абсцессом. В решении этого вопроса может оказать помощь УЗИ. Увеличение мошонки при паховой грыже следует отличать от гидроцеле и собственно от патологии мошонки и яичек. Также причиной отека гениталий может служить дефект брюшной стенки, связанный с катетером и распространением жидкости по брюшной стенке вниз до мошонки [19].
Имеются сообщения о сочетании двух осложнений у одного пациента. Так, катетер может мигрировать из полости малого таза в открытый влагалищный отросток и далее в мошонку [16]. Следует обратить внимание на невозможность такого осложнения в случае, если имплантация катетера выполняется лапароскопически.
После диагностирования грыжи рекомендуется ее лечение, для этого может потребоваться снижение объемов заливки или переход на альтернативные режимы ПД. Некоторые хирурги ушивают открытое внутреннее паховое кольцо (тем самым предотвращая грыжеобразование) во время лапароскопической имплантации катетера.
Распространение лапароскопического метода значительно снизило количество грыж передней брюшной стенки, диагностируемых после начала диализа [16, 23, 25, 26].
Миграция катетера
Миграция катетера и обструкция катетера составляют понятие дисфункции катетера вследствие механических причин. Дисфункцию дренажа обычно выявляют, когда объем сливаемого диализата существенно ниже, чем объем заливки, и нет данных о наличии перикатетерной протечки. Кончик диализного катетера может оказаться смещенным в околопеченочное или околоселезеночное пространство, а также в редких случаях — в мошонку [16]. В этой ситуации случается отказ работы дренажа. Причиной может быть неправильное положение катетера при имплантации или некорректно подобранная длина внутрибрюшной части. Для диагностики положения катетера достаточно бывает простой рентгенограммы. В таких случаях помогает усиление перистальтики кишечника с помощью слабительных или клизм. Стабильность положения катетера обеспечивает длинный экстраперитонеальный туннель, создаваемый во время имплантации катетера. Некоторые хирурги во время имплантации фиксируют катетер с помощью внутренних швов. Однако имеются данные о выраженных болях, связанных с фиксацией катетера к париетальной брюшине [16]. Если катетер все-таки мигрировал, его можно репозиционировать с помощью рентгеноскопического, лапароскопического или открытого методов.
На сегодняшний день большинство ревизий катетера (миграция, обструкция) с последующими манипуляциями в виде репозиции, фиксации, оментопексии или адгезиолизиса у взрослых пациентов производят лапароскопически [31]. В случае повторных миграций катетера показана его реимплантация [19].
Обструкция катетера
Обструкция катетера является основной причиной его дисфункции [11]. Причиной обструкции катетера может быть окутывание сальником, если он не резецирован во время имплантации, или реже яичником, фаллопиевой трубой, тонкой кишкой или у детей старшего возраста — жировым подвеском толстой кишки. Все авторы едины во мнении, что необходимо выполнять профилактическую оментэктомию во время имплантации катетера, поскольку в противном случае возникает высокий риск отказа катетера и повторной операции [3, 20, 23, 25]. Если обструкцию катетера вызвало окутывание сальником, то возможны освобождение катетера и резекция сальника (37,5 % всех ревизий по причине дисфункции катетера) [11]. Обструкция катетера сальником может произойти, если была выполнена оментопексия, а не оментэктомия. Другими причинами обструкции служат перекручивание катетера и окклюзия просвета катетера сгустком крови, с чем возможно справиться при помощи фибринолитиков [3].
Перегиб катетера с двумя муфтами в подкожном тоннеле может произойти, если две муфты установлены слишком близко друг к другу. Обструкция вследствие перегиба становится очевидной сразу после установки катетера. Функционально она проявляется как при заливе, так и при сливе раствора. Лечение состоит в замене катетера или в удалении поверхностной муфты. Частой причиной обструкции при сливе становятся запоры вследствие пониженной моторики кишечника. Разрешение запоров приводит к восстановлению дренажной функции в 50 % случаев [19]. Гепарин следует добавлять к диализному раствору всякий раз, когда в диализате видны сгустки или нити фибрина. Полезнее применять гепарин профилактически, чем с лечебной целью, до возникновения обструкции катетера. Если гепарин неэффективен, прибегают к использованию тромболитических препаратов. В диагностике и оценке результатов лечения большую вспомогательную роль может играть УЗИ при наличии опытного специалиста [32]. При неэффективности консервативных мероприятий может потребоваться ревизия.
Ревизия катетера (24,6 %) может быть выполнена и открытым традиционным способом, и лапароскопически. Это позволяет точно определить причину обструкции (окутывание сальником, миграция катетера) и в большинстве случаев решить проблему. В 48 % случаев удается избежать реимплантации катетера [11].
Кровотечение
Коагулопатии следует корректировать до операции, при наличии показаний во время вмешательства также вводят препараты крови. Незначительные кровотечения, окрашивание кровью диализного раствора случаются достаточно часто в случае раннего использования катетера, что происходит из-за разрыва небольших спаек. В последнее время серьезное внутрибрюшное кровотечение не частое явление, что связано с улучшением хирургических методов имплантации, редким использованием троакаров и производством более мягких катетеров. Обширные внутрибрюшные гематомы могут мешать диализному обмену и потребовать хирургической ревизии. Кровотечение может возникнуть из подкожного туннеля, если были повреждены нижние эпигастральные сосуды. Если не удается справиться с кровотечением путем прямого давления на туннель и место выхода, следует выполнить ревизию раны и замену катетера. При гематоме туннеля после имплантации назначают антибиотики, так как это снижает риск тоннельной инфекции и абсцесса [3].
Экструзия манжеты
Экструзия манжеты встречается редко и может быть следствием поверхностного проведения туннеля катетера под кожей, а не в подкожно-жировой клетчатке (или если подкожная клетчатка истощена, как у новорожденного, у ребенка с низкой массой тела или с синдромом «сливового живота»). Однако у пациентов с синдромом «сливового живота» превалируют инфекционные осложнения, грыжи и утечки диализата [18, 33]. Если внешняя манжета экструзируется, то это может привести к миграции катетера, особенно если это происходит на ранних сроках. Экструзия манжеты может наблюдаться при сочетании с инфекцией места выхода катетера или тоннельной инфекцией. В такой ситуации катетер удается сохранить с помощью шейвинга наружной манжеты или хирургических манипуляций по перемещению наружной части катетера с формированием нового подкожного туннеля [34]. Если эти мероприятия не дают эффекта или имеется повреждение катетера, требуются ревизия и удаление катетера.
Заключение
Перитонеальный диализ зарекомендовал себя как основной стартовый метод заместительной почечной терапии у детей с острой и хронической почечной недостаточностью. Вместе с ростом популярности методики, а также в связи с существенным ростом обеспеченности заместительной почечной терапией населения РФ (темпы прироста превышают таковую в развитых странах) увеличилось и число хирургических осложнений [1, 20].
Инфекционные осложнения (катетер-ассоциированные инфекции, перитониты) пока лидируют в списке причин смены режима диализа. Однако повышенное внимание к инфекционным осложнениям перитонеального диализа со стороны всемирного сообщества — мультицентровые исследования, формирование клинических рекомендаций, составление реестров — позволило значительно сократить число диализных перитонитов и тоннельных инфекций и обратиться к находящимся до последнего момента в тени неинфекционным осложнениям. Более детальное исследование проблемы неинфекционных хирургических осложнений перитонеального диализа позволит создать рекомендательную базу по имплантации и уходу за катетерами, по профилактике и лечению данных осложнений, что в конечном счете улучшит результаты лечения детей с острой и хронической почечной недостаточностью.
Малоинвазивная хирургия у больных терминальной стадией хронической почечной недостаточности, получающих перитонеальный диализ
МАЛОИНВАЗИВНАЯ ХИРУРГИЯ У БОЛЬНЫХ ТЕРМИНАЛЬНОЙ СТАДИЕЙ ХРОНИЧЕСКОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ, ПОЛУЧАЮЩИХ ПЕРИТОНЕАЛЬНЫЙ ДИАЛИЗ.
14.00.27-Хирургия
Автореферат _ диссертации на соискание учёной степени кандидата медицинских наук
Москва 2007
003061671
Работа выполнена в ГУ Московском областном научно-исследовательском клиническом институте им. М.Ф. Владимирского.
Научный руководитель:
доктор медицинских наук,
профессор Ватазан Андрей Владимирович
Официальные оппоненты:
доктор медицинских наук, профессор
ГУ МОНИКИ им.ШП года в 12.00 час на заседании Диссертационного Совета Д 208.049.01 при МОНИКИ им. М.Ф. Владимирского, по адресу: г. Москва, ул. Щепкина, д. 61/2, корп. 15, конференц-зал.
С диссертацией можно ознакомиться в научно-медицинской библиотеке МОНИКИ им. М.Ф. Владимирского.
Автореферат разослан «г2>(» г.
Ученый секретарь Диссертационного Совета д.м.н., профессор
Астахов П.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Не смотря на успехи, которые достигла современная медицина в лечении хронической почечной недостаточности (ХПН), число больных, страдающих этим тяжелым заболеванием и нуждающихся в постоянной заместительной почечной терапии, неуклонно растет Это связано с прогрессирующим старением населения, ухудшением экологической и эпидемиологической обстановки и др (Ва-тазин А В и соавт, 2002, Cala Z., 2002)
По сведениям Jakic М. и соавт в 2003 году частота хронической почечной недостаточности составила 162 больных на 1 млн населения, в то время как еще 5 лет назад число этих больных составляло 133 на 1 млн населения (Crabtree J Н и соавт, 1999) Ежегодно в мире регистрируется до 80 новых случаев хронической почечной недостаточности на 1 млн. населения (Ortiz А М и соавт, 2004).
Перитонеальный диализ (ПД) является одним из основных методов заместительной почечной терапии (ЗПТ) у больных с терминальной стадией хронической почечной недостаточностью наряду с трансплантацией почки и гемодиализом Из всех больных, поучающих заместительную почечную терапию, примерно 13% больных получает перитонеальный диализ (Keane W, 2000) Этот способ заместительной почечной терапии по праву можно считать методом выбора у больных с хронической почечной недостаточностью на ранних этапах развития ТХПН при сохранной остаточной функции почек Перитонеальный диализ, по мнению ряда авторов, можно считать более простым, доступным и физиологичным, чем гемодиализ (Зверев Д В и соавт, 1996, Ватазин А В и соавт, 2002, Казимиров В Г и соавт, 2005)
Перитонеальный диализ, как правило, проводится в домашних условиях, что уменьшает накладные расходы, а выживаемость больных, получающих заместительную почечную терапию перитонеальным диализом, в первые два года лечения превосходит выживаемость больных, находящихся на гемодиализе (ГД) (Fenton S и соавт , 1997, Foley R. и соавт, 1998, Ватазин А В и соавт, 2002, Казимиров В Г и соавт , 2005)
Однако ПД имеет целый ряд осложнений, что снижает его эффективность, а в ряде случаев является основанием для прекращения перитонеального диализа и перевода больного на гемодиализ Развитие таких осложнений перитонеального диализа, как диализный перитонит и дисфункция перитонеального катетера нередко вынуж-
дают отказаться от дальнейшего проведения программы перитонеального диализа (Зверев Д В и соавт, 1996, Астахов П В , 2001) Помимо этого, развитие острых хирургических заболеваний или прогрессирование хронических заболеваний органов брюшной полости и передней брюшной стенки (хронический холецистит, панкреатит, язвенная болезнь и др ) также приводят к завершению программы ПД (Magnuson Т Н и соавт, 1995, Willemsen Р, 1997, Ватазин А В и соавт, 2002, Казимиров И Г и соавт , 2005).
В настоящее время широкое применение в практической медицине получили малоинвазивные хирургические технологии Ведутся научные исследования в области обоснования и дальнейшего внедрения в работу хирургических стационаров новых, а также совершенствования уже существующих видеоэндоскопических оперативных вмешательств (Федоров И В и соавт, 1998; Коган М И, 2002, Jonler М и соавт , 2003, Booth С и соавт, 2004) Все большее распространение получает лапароскопическая хирургия в лечении хирургических заболеваний и их осложнений у больных, страдающих ТХПН (Ватазин А В и соавт, 2002, Wesselmg К М и соавт, 2003, Jwo S С и соавт, 2003)
Вместе с тем до настоящего времени не разработана единая стратегия применения малоинвазивной видеоэндоскопической хирургии у больных, получающих ПД, что и явилось основанием для выполнения настоящей работы Цель исследования
Разработать и внедрить в клиническую практику комплекс малоинвазивных видеоэндоскопических операций при осложнениях перитонеального диализа у больных с терминальной стадией хронической почечной недостаточности Задачи исследования
1 изучить частоту и структуру осложнений перитонеального диализа у больных терминальной стадией хронической почечной недостаточности,
2 разработать комплекс малоинвазивных хирургических вмешательств при дисфункции перитонеального катетера,
3 определить эффективность лапароскопической санации брюшной полости при рецидивирующем диализном перитоните,
4 оценить возможности лапароскопических вмешательств, при острых и хронических хирургических заболеваниях органов брюшной полости у больных, по-
лучающих перитонеальный диализ,
5 дать сравнительную оценку результатов хирургического лечения осложнений перитонеального диализа, а также острых и хронических заболеваний органов брюшной полости с использованием лапароскопической техники и открытой лапаротомии,
6. разработать алгоритм принятия решения о выборе способа оперативного лечения при сопутствующих хирургических заболеваниях и осложнениях перитонеального диализа
Научная новизна работы. В работе проведено изучение частоты и структуры осложнений перитонеального диализа у больных терминальной ХПН Для этого сформированы две группы больных, получающих перитонеальный диализ, которым лечение проводилось с использованием малоинвазивных хирургических вмешательств и открытой лапаротомии Разработан комплекс малоинвазивных хирургических вмешательств при дисфункции перитонеального катетера (преимущественно его дислокации в брюшной полости и «окутывании» катетера большим сальником) Помимо этого изучены возможности коррекции дислокации перитонеального катетера с использованием проводника-стилета под контролем электронного оптического преобразователя и частота последующей лапароскопической операции в случае неэффективности подобного низведения Разработана методика и определена эффективность лапароскопической санации брюшной полости при рецидивирующем диализном перитоните Дана сравнительная оценка результатов хирургического лечения осложнений перитонеального диализа и сопутствующих заболеваний органов брюшной полости с использованием лапароскопических операций и открытой лапаротомии Изучена частота конверсии больных на гемодиализ и послеоперационная летальность в сравниваемых группах больных Разработан алгоритм принятия решения о выборе способа оперативного лечения при осложнениях перитонеального диализа и сопутствующих хирургических заболеваниях у больных, получающих ПД.
Практическая ценность работы. На основе проведенных исследований доказана эффективность лапароскопических операций у больных с хирургическими осложнениями перитонеального диализа, а также острыми и хроническими заболеваниями органов брюшной полости Определена общая структура осложнений перитонеального диализа и выявлены наиболее часто встречающиеся хирургические ослож-
нения метода На основе проведенных исследований разработана последовательность лечебных мероприятий при дисфункции перитонеального катетера, определен оптимальный способ лапароскопической фиксации перитонеального катетера в полости малого при его дисфункции Показана эффективность лапароскопических операций при рецидивирующем диализном перитоните, что позволило пролонгировать программу ПД Внедрение лапароскопических методик при прогрессировании хронических и развитии острых хирургических заболеваний органов брюшной полости и передней брюшной стенки улучшило результаты лечения и снизило частоту конверсии на гемодиализ Проведенные исследования позволили разработать алгоритм хирургической тактики при осложнениях перитонеального Диализа, что привело к улучшению результатов применения ПД у этой категории больных В целом, летальность среди больных, которым были выполнены видеоэндоскопические операции, составила 11,1%, что на 6,9% ниже, чем в группе сравнения При этом конверсия больных на гемодиализ в основной группе была ниже на 10,6%
Внедрение результатов работы в практику. Результаты исследования внедрены в повседневную клиническую практику отделения хронического гемодиализа с пересадкой почки, кафедры «Эфферентной медицины, клинической и оперативной нефрологии» ФУВ МОНИКИ им М Ф Владимирского
Публикапии результатов исследования. Всего опубликовано 14 научных работ По материалам диссертации опубликовано 6 научных работ, из них 3 в центральной печати
Апробация работы. Основные положения диссертации доложены и обсуждены
1 на конференции «Актуальные вопросы трансплантологии и заместительной почечной терапии», посвященной 35-ю отделения хронического гемодиализа с пересадкой почки МОНИКИ, Москва, декабрь, 2005,
2 на XLIII Международном конгрессе ERA-EDTA, Глазго, июль, 2006,
3 на совместной научно-практической конференции сотрудников отделения хронического гемодиализа с пересадкой почки, отделения хирургической гемо-коррекции и детоксикации и кафедры Эфферентной медицины, клинической и оперативной нефрологии ФУВ МОНИКИ им М.Ф.Владимирского, Москва, 4 июня 2007
Объём и структура работы. Диссертационная работа изложена на 128 страницах машинописного текста и состоит из введения, 3 глав собственных наблюдений, заключения, выводов, практических рекомендаций и списка литературы Работа иллюстрирована 36 рисунками и 11 таблицами Указатель литературы включает 161 источников, в числе которых 28 работ отечественных и 133 зарубежных авторов
СОДЕРЖАНИЕ РАБОТЫ.
Клиническая характеристика больных и методы исследования.
Основу клинического материала составили больные, находившиеся на лечении в отделении гемодиализа с пересадкой точки МОНИКИ им М Ф Владимирского с 2001 по 2007 гг Анализу подвергнуты результаты лечения 86 больных, страдающих терминальной стадией ХПН различной этиологии, получавших программный перито-неальный диализ В связи с хирургическими осложнениями ПД у 36 больных основной группы были выполнены малоинвазивные хирургические операции У 50 больных группы сравнения была выполнена отбытая лапаротомия Распределение больных по полу и возрасту в указанных группах больных было следующим В исследовании преобладали лица зрелого возраста 40 — 59 лет (66,2% от общего числа больных) Средний возраст больных в основной группе составил 49,25±12,97 года
Средний возраст больных в группе сравнения составил 46,70± 14,28 лет Большинство пациентов в обеих группах составляли женщины — 59,35% Всем больным проводилось лечение программным перитонеальным диализом от 1 месяца до 7 лет (в среднем 29,55±26,81 диализо-месяцев) ‘
Таблица 1
Этиология хронической почечной недостаточности.
Этиология ХПН Основная группа Группа сравнения
Кол-во больных % Кол-во больных %
Хронический гломерулонефрит 25 69,4 31 62,0
Сахарный диабет 1 и 2 тип 7 19,5 12 24,0
МКБ Хронический пиелонефрит 3 8,3% 2 4,0
Поликистоз почек 1 2,8% 5 10,0
Всего 36 100% 50 100%
В структуре осложнений перитонеального диализа (таблица 2) в основной группе преобладали осложнения, связанные с послеоперационной дисфункцией перитонеального катетера — 18 больных (50%) из 36. В эту группу мы включили больных с такими осложнениями перитонеального диализа, как дислокация (миграция) перитонеального катетера в брюшной полости — 9 (25%) больных, «окутывание» перитонеального катетера большим сальником — 8 (22,2%) больных и блокирование дренажных отверстий перитонеального катетера фибрином («фибриновая пробка») у 1 больного — 3% У 2 больных (6%) дисфункция перитонеального катетера и его дислокация сопровождались перегибом силиконовой трубки перитонеального катетера Понятно, что у одного и того же больного последовательно могли развиться несколько из указанных осложнений
Рецидивирующий диализный перитонит, потребовавший лапароскопической санации, был у 6 (16,7%) пациентов основной группы Программа перитонеального диализа продолжена у 4 больных (11,1%), умерли 2 больных (5,5%) Это больные со склерозирующим рецидивирующим диализным перитонитом (в анамнезе более 10 эпизодов диализного перитонита) и тяжелой сопутствующей соматической патологией Длительность программы перитонеального диализа превышала у этих больных 4 года. Причинами смерти явились острая сердечно-сосудистая недостаточность и сепсис
Сопутствующие хирургические заболевания и их осложнения выявлены у 9 больных (25%) основной группы Из них в одном случае выявлено сочетание хронического калькулезного холецистита и грыжи передней брюшной стенки (таблица 2) У 2 больных выявлены заболевания матки (миома) и яичников (двусторонние кисты) в сочетании с хроническим калькулезным холециститом и острой кишечной непроходимостью Один больной основной группы был оперирован по поводу паховой грыжи и 4 пациента по поводу пупочной грыжи У 1 больного на фоне проводимого лечения выявлен острый панкреатит с исходом в панреанекроз, потребовавший проведения эндоскопической папиллосфинктеротомии и лапароскопической санации брюшной полости Осложнения перитонеального диализа в основной группе и в группе сравнения суммированы в таблице 2
Таблица 2
Осложнения перитонеального диализа
№п/и Осложнения перитонеального диализа Основная группа Группа сравнения
Кол-во больных % Кол-во больньо %
1 Дислокация (миграция) перитонеального катетера 9 25 12 24
2 Осложнения, обусловленные сопутствующими хирургическими заболеваниями 9 25 14 28
3 «Окутывание» большим сальником- 8 22 2 7 14
4 Диализный перитонит 6 16,7 15 30
5 «Фибриновая пробка» 1 2,8 2 4
6 Сочетание осложнений 3 8,3 . _
Всего 36 100 50 100%
Для установления диагноза, определения тактики лечения и выбора показаний к лапароскопической операции всем больным проводилось клиническое обследование, включающее комплекс рентгенологических исследований по стандартным методикам, ультрасонография в реальном масштабе времени, оценка лабораторных и функциональных показателей, выполнялись посевы диализной жидкости на бактериальную флору с идентификацией возбудителя и определением степени обсемененно-сти по стандартным методикам
Адекватность программы перитонеального диализа оценивалась с помощью формулы фракционного клиренса мочевины Kt/V (по Hume — Weyers)
(Uru*U24 + Urd *D24)*7 Kt/V = _
Urs* W*K
Где Urj—мочевина диализата, ммоль/л, Uru — мочевина мочи, ммоль/л, Urs-мочевина сыворотки, ммоль/л, U24 — суточный диурез, л, D¡4 — суточный объем диали-зирующего раствора, л, W— вес пациента, кг, К — коэффициент для женщин — 0,55, для мужчин — 0,6, V- общий объем воды организма
В качестве основного (базового) метода заместительной почечной терапии у больных в обеих группах применялся ручной перитонеальный диализ Вместе с тем в ряде случаев в зависимости от этиологии ХПН и тяжести состояния больного помимо перигонеального диализа использовались и другие методы экстракорпоральной деток-сикации (гемодиализ, гемодиафильтрация, плазмаферез и др ) Во всех случаях использовали двухманжеточный перитонеальный катетер типа Tenckhoff, который имплантировался в брюшную полость под местной анестезией по принятой методике
У всех больных использовали растворы для перигонеального диализа производства компании «Baxter» (США) В зависимости от веса пациента и транспортных свойств брюшины применялись сочетания диализирующих растворов различной ос-молярности, которая определяется концентрацией глюкозы в них Система предусматривает применение растворов с низкой, средней и высокой осмолярностью
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
По характеру оперативного вмешательства больные были разделены на 2 группы
1 пациенты, которым проводилось оперативное лечение, связанное с дисфункцией перигонеального катетера и диализным перитонитом,
2 пациенты, имеющие сопутствующие хирургические заболевания органов брюшной полости и передней брюшной стенки и их осложнения (калькулезный холецистит, панкреатит, грыжи различной локализации, кисты яичников и миома матки, спайки брюшной полости)
Малоинвазивные операции, выполненные по поводу дисфункции перито-неального катетера и диализного перитонита.
Всем больным с дисфункцией перитонеального катетера проводилось консервативное лечение заключающееся в промывание перитонеального катетера струей стерильной жидкости под давлением В случае диализного перитонита больные получали антибактериальные препараты широкого спектра действия с учетом микробиологического посева диализной жидкости на стерильность, после ее экспозиции в брюшной полости больного
При нарушении функции перитонеального катетера для определения причины его дисфункции больному выполнялся ряд диагностических и лечебных процедур, описанных ниже
При раннем выявлении дисфункции перитонеального катетера комплекс лечебных мероприятий начинали с попытки проведения «гидравлического удара» Суть манипуляции заключается в резком введении под давлением в брюшную полость стерильного физиологического раствора При этом рекомендуется использовать шприцы минимального диаметра, что обеспечивает максимальное давление на единицу площади поршня шприца
Если после проведения указанного.мероприятия улучшения функции ПК не наступило, больному выполнялся обзорный снимок брюшной полости с целью определения дальнейшей тактики лечения
Как правило, после проведения рентгеновского исследования выявляются две основные причины нарушения дренажной функции ПК — это классическая дислокация («всплытие») ПК и его визуализация в различных отделах брюшной полости, или нахождение ПК в обычном для проведения ПД месте (полость малого таза), но с отсутствием или крайним затруднении дренажной функции («окутывание» ПК большим сальником, «фибриновая пробка»)
Далее мы использовали разработанный в нашей клинике малоинвазивный метод низведения перитонеального в полость малого таза при помощи титанового проводника-стилета под контролем электронного оптического преобразователя (ЭОП) Манипуляция проводилась в условиях рентгеноперационной с соблюдениями всех правил асептики и антисептики Всего нами выполнено 18 подобных операций у 17 больных с дисфункцией перитонеального катетера
Положительный эффект этой малоинвазивной операции был достигнут у 8 больных, в 10 случаях попытка низведения катетера была безуспешной (в дальнейшем этим больным выполнялись лапароскопические операции) Следует помнить, что форсированное проведение процедуры низведения ПК на стилете может привести к перфорации силиконовой трубки и травме органов брюшной полости
В нашем исследовании лапароскопической коррекции дисфункции ПК подверглись 18 пациентов, из них мужчин 8 (44,5%) и 10 женщин (55,5%) Средний возраст составил мужчины — 46,5±7,6 лет, женщины — 49±9,2 лет Большинству пациентов
основной группы 17 (47,2%) лапароскопические операции выполнены по поводу дисфункции перитонеального катетера путем его низведения в малый таз с последующей фиксацией к париетальной брюшине, или без таковой Лапароскопическая фиксация модифицированного перитонеального катетера (патент на изобретение РФ № 2141850 бюллетень №33 от 27 11 1999 г.) к переходной складке брюшины титановыми клипсами выполнена у 3 больных (8,3%)
Лапароскопическая фиксация перитонеального катетера в складке париетальной брюшины выполнена 5 больным (13,9%) Лишь в одном случае потребовалась повторная операция фиксации (клиширования) перитонеального катетера
Операция без фиксации ПК произведена у 9 пациентов (25%) из 36-ти, однако послеоперационный рецидив был отмечен у 3 больных (33%) из 9 больных в течение первых 3-х месяцев наблюдения, что потребовало повторной лапароскопической операции для возобновления программы ПД
Одному больному проведена лапароскопическая операция по поводу «фибри-новой пробки», массивного сгустка фибрина нарушавшего дренажную функцию ПК
Наш опыт свидетельствует, что показаниями к лапароскопической коррекции дисфункции перитонеального катетера являются
— дислокация перитонеального катетера при неэффективности консервативными мероприятиями,
— «окутывание» катетера большим сальником,
— рецидивирующая дислокация перитонеального катетера,
— технические ошибки при установке перитонеального катетера (перегиб (слом) катетера,
— выпадение фибрина («фибриновая. пробка») в просвете перитонеального катетера при невозможности восстановления проходимости катетера промыванием
Лапароскопическая коррекция дисфункции перитонеального катетера выполняется под эндотрахеальным наркозом, поэтому основным противопоказания к выполнению оперативного вмешательства является невозможность проведения эндотрахе-ального наркоза С осторожностью следует использовать метод у больных с изменениями гемостаза и грубыми нарушениями сердечной деятельности
Основные причины дисфункции перитонеального катетера и результаты мало-инвазивных операций представлены в таблице 3
Таблица 3
Причины дисфункции перитонеального катетера и результаты мало-инвазивных вмешательств
Причина дисфунк- Способ коррек- Кол-во Кол-во Результат
ции перитонеального катетера ции больных операций Положительный Отрицательный
Дислокация перитонеального катетера «Гидравлический удар» 17 52 5 17
Низведение стилетом 17 37 12 5
Лапароскопическая коррекция с фиксацией катетера 8 . 9 13 4
Лапароскопическая коррекция без фиксации катетера 9 10 9 1
Окутывание сальником «Гидравлический удар» 6 18 8 2
Низведение стилетом 6 8 0 8
Лапароскопическая коррекция с резекцией сальника 2 2 2 0
Лапароскопическая коррекция без резекции сальника 4 4 4 0
«Фибриновая пробка» «Гидравлический удар» 1 7 0 7
Низведение стилетом 1 2 0 2
Лапароскопическая коррекция 1 1 1 0
Перегиб катетера Лапароскопическая коррекция 3 3 2 1
Комбинация причин Лапароскопическая коррекция 6 13 4 2
В группе сравнения осложнения перитонеального диализа, вызванные дисфункцией перитонеального катетера, имели место в 42% (21 больной) случаев, что сопоставимо с основной группой В 100% случаев больные группы сравнения были вынуждены приостановить программу ПД При этом только у 19 (38%) больных была выполнена открытая лапаротомия и имплантация ПК с контралатеральной стороны
Таким образом, лапароскопическая коррекция дисфункции ПК является эффективной и весьма доступной операцией, позволяющей восстановить дренажную функцию ПК и пролонгировать программу ПД При этом у 5 оперированных больных проводилась лапароскопическая фиксация ПК по модифицированной нами методике с использованием складки париетальной брюшины больного
Наш опыт применения лапароскопии при диализных перитонитах невелик В настоящей работе рассмотрены 6 пациентов (17%) основной 1руппы, у которых в период от 1 года до 4 лет с момента начала ПД имели место эпизоды диализных перитонитов, по поводу чего выполнялась лапароскопическая санация брюшной полости
Группу сравнения составили 50 пациентов с длительностью ПАПД от 1 месяца до 4,5 лет Средняя частота возникновения диализного перитонита в контрольной группе составила 1 случай на 29 диализо-месяца При этом из 50 пациентов группы сравнения диализный перитонит развился у 14 пациентов (28%), из которых у 8 (16%) диализный перитонит носил рецидивирующий характер, т е возникал 2 и более раз Известно, что течение рецидивирующих диализных перитонитов протекает тяжело и часто сопровождается летальным исходом — до 46% случаев ( Voinescu С G и соавт, 2002, Lee H.Y и соавт, 2003, Kawamshi H и соавт, 2004, Mitai S и соавт, 2004) При этом рецидивирующий диализный перитонит является одной из основных причин перевода больных на гемодиализ (рис 1)
транспортер ультрафильтрации £ 11 типа
ш Втечение первого года а За 10 лет!
Рис. 1 Основные причины перевода больных с перитонеального диализа на гемодиализ.
Наш опыт лечения диализных перитонитов позволил определить следующие
показания к лапароскопической операции
— невозможность формирования сосудистого доступа для перевода больного на гемодиализ,
— дисфункция перитонеального катетера на фоне диализного перитонита,
— необходимость визуализации брюшины и взятия биопсии для определения возможности пролонгирования перитонеального диализа при рецидивирующем перитоните и длительно существующей программе ПД,
— обострение хронических заболеваний органов брюшной полости, поддерживающих рецидивирующий диализный перитонит
Как уже сказано выше, лапароскопическая санация брюшной полости по поводу рецидивирующего диализного перитонита произведена у 6 (17%) больных основной группы (3 мужчин и 3 женщины) и заключалась в частичном или полном адгезио-лизисе, санации брюшной полости антисептическими растворами и антибиотиками, выявлении вероятного источника инфекции (хронические заболевания брюшной полости) и устранение причины (субстрата), поддерживающего воспалительный процесс (гематома, фибрин и т д )
У 4 больных из 6 больных программа перитонеального диализа была продолжена. Два пациента имели выраженный склероз париетальной брюшины и массивный спаечный процесс брюшной полости (умерли от присоединившейся острой сердечнососудистой недостаточности)
В группе сравнения у 15 больных (30%) с рецидивирующим диализным перитонитом применялся закрытый интенсивный лаваж брюшной полости путем более частых смен диализирующего раствора, содержащего антибиотики широкого спектра действия и гепарин У 8 больных (16%) с этой целью использовался автоматизированный перитонеальный диализ на аппарате «Ноте Choice» компании «Baxter» (США) Положительный эффект был достигнут только у 3 больных, 6 больных переведено на гемодиализ, 6 больных умерли от прогрессирования перитонита и генерализации инфекционного процесса
Таким образом лапароскопическая санация брюшной полости в сочетании с консервативным лечением является эффективным методом комплексного лечения рецидивирующего диализного перитонита
Применение лапароскопической санации брюшной полости позволило нам продолжить программу ПАПД у 4-х из 6-ти больных основной группы, в то время как в группе сравнения к программе ПД вернулись только 3 из 15 больных
Лапароскопические операции у больных с сопутствующими заболеваниями органов брюшной полости и их осложнениями.
Нами было оперировано 13 (36,1%) больных основной группы с хирургическими заболеваниями органов брюшной полости и передней брюшной стенки У 6 (16,7%) больных на момент операции проводилась программа перитонеального диализа, в 7 (19,4%) случаях осуществлялась эндоскопическая операция одномоментно с видеоассистированной имплантацией перитонеального катетера (таблица 4)
Таблица 4
Виды оперативных вмешательств, выполненных у больных с сопутствующими заболеваниями органов брюшной полости и их осложнениями.
№ п/п Диагноз Вид лапароскопической операции Кол-во больных Кол-во операций
1 Пупочные и паховая грыжи Лапароскопическое грыжесечение 5 5
2 Острый и хронический калькулезный холецистит Лапароскопическая холецистэктомия 4 4
3 Гинекологические заболевания Удаление кист яичников, миомы матки 2 2
4 Острый панкреатит Эндоскопическая вирслунгото-мия, санация брюшной полости 1 2
5 Острая кишечная непроходимость Лапароскопическое рассечение спаек 1 1
ВСЕГО 13 14
Видно, что лапароскопическая холецистэктомия (ЛХЭ) была выполнена 4 пациентам — 11,1% Средний возраст больных составил 54.2 года В 3-х случаях ЛХЭ выполнялась в плановом порядке Одна больная была оперирована по экстренным показаниям (2,8%)
Данные литературы свидетельствуют о высокой частоте встречаемости хронического калькулезного холецистита у пациентов, страдающих ТХПН, которая составляет около 16% на додиализной стадии и возрастает по мере длительности проведения заместительной почечной терапии (до 23% у больных на гемодиализе и до 18,5% при перитонеальном диализе) (Hojs R, 1995, Laie А М, 1996, Willemsen Р, 1997, Neugebauer Е, 1999, Cala Z , 2002, Ватазин А В и соавт, 2002, Казимиров В Г, 2005)
В исследованиях отечественных и зарубежных авторов в целом определена общая концепция лечения хронического калькулезного холецистита у больных ТХПН, получающих ПД В определенном смысле она схожа с таковой у обычных больных При неэффективности проводимого консервативного лечения большинство клиницистов рекомендуют оперативное лечение в течение первых 1-2 суток (Speck R, 1992, Magnuson Т Н, 1995, Ватазин А В и соавт, 2002)
У 3 (8,3%) пациентов имплантация ПК сочеталась с устранением грыжевого дефекта (пупочная грыжа), у 2 больных — с лапароскопической холецистэктомией (5,5%)
У 1 больного (2,8%) выполнено лапароскопическое ушивание дефекта пахового кольца В 1 случае лапароскопическая холецистэктомия сочеталась с грыжесечением и также у одного пациента симультанно выполнено 3 оперативных вмешательства на органах брюшной полости и малого таза — лапароскопическая холецистэктомия, удалением билатеральных кист яичников и видеоасситированная имплантация перитоне-ального катетера Во всех случаях программа ПД успешно продолжена
Наш опыт свидетельствует, что лапароскопическая холецистэктомия позволяет больным вернуться к программе ПД Так, у всех 4 больных программа ПД после лапароскопической холецитсэктомии была продолжена. В группе сравнения открытая холецистэктомия была выполнена у 6 больных, 2 умерли, остальные четверо больных переведены на гемодиализ
У 5 пациентов (19,2%) были грыжи передней брюшной стенки Из них женщин — 4, мужчин — 1 У 2-х больных ушивание пупочной грыжи выполнялось путем проведения эндоскопически ассистированных вмешательств Послеоперационных осложнений не отмечено
В 2 случаях при дефектах пупочного кольца небольших размеров мы применяли лапароскопическое ушивание пупочного кольца со стороны брюшной полости (метод Тейта)
У больного с паховой грыжей, также произведена видеоассистированная операция Известно, что хирургическое лечение грыж у больных ТХПН сопряжено с рядом сложностей Так, частота рецидивов может достигать 75% В этой связи важно определить срок возобновления ПД после грыжесечения
Наш опыт свидетельствует, что, если позволяет клиническая ситуация, целесообразно возобновлять программу ПД не ранее 7 суток после операции В наших наблюдениях срок возобновления ПД составил 6+2,7 дней Рецидивов не отмечено
В группе сравнения было 5 (10%) больных с пупочными и 3 (6%) больных с паховыми грыжами Грыжесечения выполнялись по общепринятым методикам Программа ПД была продолжена только у 3 пациентов, в остальных случаях больные были переведены на гемодиализ
Таким образом, лапароскопическое грыжесечение является операцией выбора у больных, получающих перитонеальный диализ Лапароскопическое грыжесечение показано на додиализной стадии ХПН уже на этапе подготовки больного к перитоне-альному диализу При формировании грыжи на фоне проведения ПД лапароскопическое грыжесечение позволяет продолжить программу перитонеального диализа уже на 5 — 7 сутки после операции
В одном случае мы применили эндоскопическое дренирование псевдокисты поджелудочной железы с рассечением вирслунгова протока (проведено 2 операции) Больной переведен на гемодиализ У одной больной с интервалов в 6 мес проведено лапароскопическое удаление миоматозного узла и эндоскопическое рассечение спаек брюшной полости (программа ПД успешно продолжена)
Таким образом, наш опыт свидетельствует, что при сопутствующих хирургических заболеваниях и их осложнениях у больных, получающих перитонеальный диализ, применение малоинвазивных видеоэндоскопических операций позволяет пролонгировать программу перитонеального диализа и улучшить результаты лечения
В заключении отметим, что всего в основной группе у 36 больных было выполнено 64 видеоэндоскопические операции При этом, если исключить низведение перитонеального катетера на стилете, как весьма паллиативный способ коррекции положения перитонеального катетера, осложнения в виде прогрессирования сопутствующих заболеваний, диализного перитонита, повторной дисфункции перитонеального катетера и др отмечены только в 7,8% случаев
Структура лапароскопических операций, выполненных в основной группе представлена в таблице 5
1В
Таблица 5
Структура лапароскопических операций у пациентов основной группы.
№ п/п Операции Число операций Осложнение (рецидив)
1. Коррекция дисфункции перитонеального катетера при помощи стилета под контролем ЭОП 18 10
2. Лапароскопическая коррекция положения перитонеального катетера в малом тазу (без клиширования) 10 3
3. Лапароскопическая коррекция положения перитонеального катетера в малом тазу (с кшлшрованием) 9 1
4. Видеоассистированная имплантация перитонеального катетера (из них реимплантаций) 7(3) -
5. Лапароскопическая санация брюшной полости при диализном перитоните 6 -
6. Лапароскопические грыжесечения 5 -
7. Лапароскопические холецистэктомии 4 -
8. Лапароскопические операции на органах малого таза 2 -
9. Видеоэндоскопическое рассечение спаек при острой кишечной непроходимости 1 -
10. Видеоэндоскопические вмешательства при пашфео-некрозе 2 1
Всего: 64 15
В целом, применение малоинвазивных оперативных вмешательств при хирургических осложнениях перитонеального диализа позволило нам улучшить результаты лечения больных и выживаемость метода
Так, из приведенной ниже диаграммы видно, что в группе сравнения летальность была выше на 7% Конверсия больных на гемодиализ была ниже в основной группе более, чем на 10% Число больных, продолживших программу перитонеально-
го диализа, в основной группе на 17% превышает аналогичный показатель в группе сравнения, что наглядно свидетельствует об эффективности лапароскопических операций у больных ТХПН, получающих перитонеальный диализ.
При этом снизился риск послеоперационной дислокации перитонеального катетера, который в основной группе составил при сроке наблюдения больных до 12 мес. около 3%, тогда как каждый третий (38%) больной группы сравнения столкнулся с подобной проблемой в течение аналогичного срока наблюдения (рис. 2).
Основная группа
Группа сравнения
; о Остались в программе ПД ш Переведены на ГД ■ Умерли
Put. 2. Сравнительная эффективность применения мялоннвазиваых вн-деоэндоскопическнх операций у бальных, получающих перитонеальный диализ.
Наш опыт применения видеоэндоскопическях операций при хирургических осложнениях перитонеального диализа позволил нам разработать и внедрить в практику отделения хронического гемодиализа с пересалкой почки МОНИКИ им. М.Ф.Владимирского алгоритм хирургической тактики у больных с терминальной стадией хронической почечной недостаточности, получающих перитонеальный диализ (Рис. 3).
Рис. 3. Алгоритм хирургической тактики больных с терминальной стадией хронической почечной недостаточности, получающих пернтонеальный диализ
21
Выводы.
1 Хирургические осложнения перитонеального диализа являются причиной перевода больных на гемодиализ в 44% случаев, в структуре этих осложнений преобладают дисфункция перитонеального катетера (50%), диализный перитонит (16,7%) сопутствующие хирургические заболевания и их осложнения (25%), а также сочетание указанных осложнений (8,3%)
2 Дисфункция перитонеального катетера является показанием к применению ма-лоивазивных способов оперативного лечения Методом выбора при дисфункции перитонеального катетера является лапароскопическое низведение катетера в малый таз с его фиксацией в складке париетальной брюшины
3 Лапароскопическая санация брюшной полости при рецидивирующем диализном перитоните позволяет пролонгировать программу перитонеального диализа и предупредить развитие склерозирующего диализного перитонита
4 Лапароскопические операции являются эффективным методом лечения хирургических заболеваний органов брюшной полости у больных, получающих пе-ритонеальный диализ
5 Применение малоинвазивных методов хирургического лечения осложнений перитонеального диализа позволяют снизить летальность с 18% до 11,1%, а также уменьшить конверсию на гемодиализ с 30% до 19,4%
6 Разработанный алгоритм хирургической тактики позволяет определить выбор способа хирургического лечения и улучшить результаты лечения хирургических осложнений перитонеального диализа
Практические рекомендации.
1 При дисфункции перитонеального катетера, обусловленной его дислокацией, комплекс лечебных мероприятий следует начинать с попытки низведения катетера на стилете под контролем электронно-оптического преобразователя. При неэффективности этой манипуляции операцией выбора следует считать лапароскопическое низведение катетера с его фиксацией в складке париетальной брюшины
2 Дисфункция перитонеального катетера, связанная с окутыванием катетера большим сальником, диктует необходимость незамедлительного выполнения лапароскопии При этом целесообразно устанавливать, как минимум, 3 порта,
поскольку в 43% случаев целесообразно выполнять резекцию большого сальника
3 Лапароскопическая санация брюшной полости должна выполняться при ре-цидивирущем диализном перитоните при исключении других хирургических причин, поддерживающих воспалительный процесс в брюшной полости, и невозможности перевода больного на гемодиализ Санацию брюшной полости следует выполнять 5 литрами физиологического раствора хлорида с натрия с антибиотиками широкого спектра действия
4 При подготовке больных к перигонеальному диализу на додиализной стадии необходимо лапароскопически ликвидировать хронические хирургические заболевания брюшной полости и грыжи передней брюшной стенки
5 Во всех случаях развития или прогрессирования хирургических заболеваний органов брюшной полости и передней брюшной стенки у больных, получающих перитонеальный диализ, следует стремиться к выполнению лапароскопической операции, что позволяет пролонгировать программу перитонеального диалиаза и уменьшить летальность
СПИСОК НАУЧНЫХ РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ.
1 Применение малоинвазивных хирургических вмешательств у больных терминальной ХПН, получающих перитональный диализ // Альманах клинической медицины Москва -2005 -Том VIII -Часть 4 — С 18-25 (А В Ватазин, Г Ю Лосев, В Н Фи-лижанко, В И Шумский, А Г Янковой, А А Смоляков, А П Мартынюк)
2 Особенности лечения диализного перитонита у больных с урологическими заболеваниями // Альманах клинической медицины Москва -2005 -Том VIII -Часть 4 -С 112-116 (А Г Янковой, А В Ватазин, А А Смоляков, А П Мартынюк, Г Ю. Лосев)
3 Peritoneal dialysis and polycystic kidney disease // XLIII ERA-EDTA Congress Glasgow United Kingdom 2006 Juli 15-18 № MP 582 (А В Ватазин, А Г Янковой, А А Смоляков, А П Мартынюк, Г Ю Лосев, В В Шувалова, С А Кулибаба)
4 Predictor abdominal complications m PD patients // 27th Annual Conferens on Peritoneal Diálisis Denver Colorado Febr 18-20, 2007 № 1522 (АГ Янковой, AB Ватазин, А А Смоляков, А П Мартынюк, Г Ю Лосев, В В Шувалова, С А Кулибаба)
5 A choice of specific factors leading to modality selection of chronic peritoneal dialysis or hemodialysis // World Congress of Nephrology, Rio de Janeiro, Brazil April 21-25, 2007 S-PO-0260 P -118 (А Г Янковой, AB Ватазин, А А Смоляков, ПВ Астахов, Г Ю Лосев, В В Шувалова, С А Кулибаба)
6 Лапароскопические операции у больных терминальной ХПН получающих перито-неальный диализ // Альманах клинической медицины Актуальные вопросы клинической хирургии Москва-2007,-Том XVI-Часть 4 — С 112-116. (AB Ватазин, В Н Филижанко, Г Ю Лосев, П В Астахов, А Г Янковой, А А Смоляков, С А Кулибаба, И С Пичугина)
Заказ № 344. Объем 1 п.л. Тираж 100 жз.
Отпечатано в ООО «Петроруш». г. Москва, ул. Палиха-2а, тел. 250-92-06 www.postator.ru
Способ оценки эффективности антибактериальной терапии при диализном перитоните
Изобретение относится к области медицины и может быть использовано при диализном перитоните у пациентов с почечной недостаточностью, получающих лечение перитонеальным диализом в стационарных условиях.
Известно, что развитие диализного перитонита у пациентов, получающих лечение перитонеальным диализом, достигает почти 70% случаев в течение первых 6 месяцев лечения и зачастую сопровождается снижением клиренса уремических сольвентов, развитием гипоальбуминемии и гипергидратации, в результате чего снижется качество жизни, а также выживаемость пациентов, получающих этот вид заместительной почечной терапии, а также выживаемость метода (Pulliam J1 et al., Am J Kidney Dis., 2014 Jun 11).
Известно, что основным способом купирования диализного перитонита является применение антибактериальной терапии с обязательным выполнением бактериологического исследования как для идентификации микрофлоры, так и с целью определения чувствительности к антимикробным препаратам, а также оценки эффективности антибактериальной терапии (Camargo CH. Clin J Am Soc Nephrol. 2014 Jun 6;9(6):1074-81).
Недостатком использования бактериологического исследования с целью оценки результатов антибактериальной терапии является длительность исследования, составляющая 3 и более суток. Следует подчеркнуть, что необоснованно длительная антибактериальная терапия способствует развитию микотического поражения. Это обусловливает прекращение заместительной почечной терапии перитонеальным диализом и перевода пациентов на лечение гемодиализом, что существенно удорожает лечение.
Наиболее близким способом определения эффективности антибактериальной терапии при диализном перитоните является способ, включающий введение антибактериальных препаратов в пакет с диализным раствором с последующим введением в брюшную полость, морфологическое исследование диализата (http://www.kazmed.ru/bolezni-mochepolovoy-sistemy/peritonealnyy-dializ).
К недостаткам описанного способа относится невысокая достоверность диагностики диализного перитонита и неспецифичность исследования на цитоз.
Задачей предлагаемого изобретения является устранение указанных недостатков, повышение точности определения эффективности проводимого лечения, уменьшение сроков проведения исследований, и, следовательно, исключение необоснованно длительной терапии антибиотиками за счет получения объективной информации при исследовании диализирующего раствора, возможность быстрого получения результата исследования — в течение до 18 часов; создание технически простого и экономичного исследования.
Для этого при оценке эффективности антибактериальной терапии при диализном перитоните, включающей введение антибактериальных препаратов в пакет с диализным раствором с последующим введением в брюшную полость, морфологическое исследование диализата, предложено после проведения цикла обмена диализирующего раствора проводить исследование диализата методом клиновидной дегидратации. При этом диализат центрифугируют при 1500 об/мин в течение 10-15 минут и отбирают 2 пробы — первую из верхней половины пробирки, вторую — из нижней, выявляют структуру кристаллов солей в диализате и при наличии линейных кристаллов в центральной зоне фаций обеих проб оценивают эффективность терапии как удовлетворительную и не требующую ее продолжения. При наличии линейных кристаллов только в первой пробе оценивают эффективность терапии как удовлетворительную и требующую ее продолжения. При отсутствии линейных кристаллов в центральной зоне фаций обеих проб оценивают проводимую антибактериальную терапию как неудовлетворительную.
В последнем случае требуется срочная конверсия на лечение гемодиализом с обязательным удалением перитонеального катетера, являющегося в таких случаях источником инфекции в результате образования на его поверхности биопленки из продуктов бактериального метаболизма.
Исследование картины структур диализирующего раствора, полученного непосредственно из брюшной полости через указанное время проведения заместительной почечной терапии, является интегральным показателем взаимодействия органической составляющей и минерального вещества — соли. При хронической почечной недостаточности органическая составляющая в таком диализирующем растворе представлена детритом, т.е. продуктами распада бактериальных белков. В процессе дегидратации диализирующего раствора действие органического детрита на кристаллизацию соли проявляется разрушением ее структуры в виде системной фрагментации. При этом чем выше концентрация детрита, тем сильнее выражена фрагментация структур соли и степень ее упорядоченности. То есть наибольшая степень фрагментации структур солей и хаотичность их расположения свидетельствует о выведении из организма значительной концентрации продуктов распада белковых фракций, на что, собственно, и направлена заместительная почечная терапия у пациентов с почечной недостаточностью.
На фиг. 1а, б представлена структура проб диализата из верхней части пробирки (1) и из нижней части пробирки (2) после центрифугирования при осуществленной адекватной и эффективной терапии и не требующей ее продолжения; на фиг. 2а, б — структура проб диализата из верхней части пробирки (1) и из нижней части пробирки (2) после центрифугирования при оценке терапии как эффективной, но требующей ее продолжения; на фиг. 3а, б — структура проб диализата из верхней части пробирки (1) и из нижней части пробирки (2) после центрифугирования при неудовлетворительной терапии.
Способ осуществляется следующим образом.
Пациенту с подтвержденным клиническими исследованиями диализным перитонитом через перитонеальный катетер вводили диализирующий раствор, осмолярность которого составила 7,5% — экстранил, в который предварительно помещали раствор антибактериального препарата, например, ванкомицина с концентрацией 500-1000 мг, затем через 1 час с помощью шприца проводили аспирацию 10-15,0 мл диализата из брюшной полости и помещали в пробирки, диализат центрифугировали при 1500 об/мин в течение 10-15 минут и отбирали 2 пробы — первую из верхней половины пробирки, вторую — из нижней.
Полученные пробы диализирующего раствора наносили на пластиковую поверхность тест-карты в количестве 0,02 мл в форме капли и оставляли в условиях рабочей комнаты для дегидратации в стандартных условиях (температура 20-25°C, относительная влажность 55-60%, минимальная подвижность воздуха). Через 3-18 часов оценивали морфологическую картину полученной фации из первой и второй проб (после центрифугирования первая проба забирается из области верхней ½ пробирки, вторая — из нижней) при обычной микроскопии (×10-40) и давали результат исследования в виде заключения.
Так, при эффективном применении антибактериальной терапии, оцененной путем анализа структуры диализата с использованием метода клиновидной дегидратации, была получена структура, характеризующаяся наличием перпендикулярно расположенных относительно друг друга линейных фрагментов кристаллов солей в обеих пробах (фиг. 1).
В подобных случаях прекращали интраперитонеальное введение антибактериальных препаратов с продолжением диализного лечения в необходимом объеме с последующим переводом пациентов на амбулаторное наблюдение.
Определение линейных кристаллов только в первой пробе и отсутствие их во второй оценивалось как правильное, т.е. адекватно выбранное антибактериальное лекарственное средство, с помощью которого необходимо продолжить антибактериальную терапию. Повторное исследованием диализирующего раствора предлагаемым способом рекомендуется проводить через 5-7 суток.
Отсутствие линейных кристаллов в обеих пробах диализирующего раствора свидетельствовало о неэффективности текущей антибактериальной терапии и, как первый этап — необходимости смены антибактериального препарата на таковой другой группы, а в последующем при неэффективности лечения пациента с диализным перитонитом перевод его на лечение гемодиализом.
Для подтверждения результатов исследования по предлагаемому способу сравнивали с результатами исследований у контрольной группы, пациентам которой определяли содержание лейкоцитов в диализирующей жидкости, результаты бактериологического исследования, окраска пробы диализирующего раствора по Граму. Сравнительный анализ результатов клинического и бактериологического лабораторных исследований с результатами анализа структур внеклеточной жидкости, полученными путем клиновидной дегидратации диализирующего раствора, позволило выявить корреляцию определяемых параметров.
Пример 1.
Пациент В., 53 года. Поступил на стационарное лечение с диагнозом: хронический гломерулонефрит. Хроническая почечная недостаточность, терминальная стадия. Постоянный амбулаторный перитонеальный диализ в объеме 8 л в сутки низкоосмолярным диализирующим раствором в течение 1 года. Диализный перитонит.
Клинические проявления диализного перитонита: боли в животе без четкой локализации, мутный дренируемый диализирующий раствор. Была назначена антибактериальная терапия цефазолином, который был введен в мешок с диализирующим раствором.
Для оценки эффективности антибактериальной терапии был выполнен забор пробы 7,5% диализирующего раствора из брюшной полости через 1 час после его инфузии с помощью шприца в объеме 15,0 мл и помещен в пробирки для исследования по предлагаемому способу.
После центрифугирования в течение 10 минут при скорости 1500 оборотов в минуту полученный диализирующий раствор был нанесен на пластиковую поверхность тест-карты в количестве 0,03 мл в форме капли и оставлен в термостате для дегидратации. Через 5 часов при микроскопии образца диализирующего раствора, обработанного с применением метода клиновидной дегидратации, была получена морфологическая картина линейных кристаллов солей только в первой пробе (фиг. 2). Выбранный препарат был признан эффективным, и антибактериальная терапия была продолжена.
Через 5 суток повторно выполнен забор пробы 7,5% диализирующего раствора из брюшной полости через 1,5 часа после его инфузии с помощью шприца в объеме 10,0 мл и помещен в пробирки для повторного исследования.
Была получена морфологическая картина линейных кристаллов солей в обеих пробах (фиг. 1). Антибактериальная терапия прекращена.
Пациент был выписан в удовлетворительном состоянии на амбулаторное лечение на следующие сутки.
Пример 2.
Больной О., 44 года. Обратился амбулаторно с жалобами на умеренно выраженные боли в нижней части живота, дренируемый диализирующий раствор прозрачный со 2-х суток антибактериальной терапии. Эмпирическая антибактериальная терапия в течение трех суток.
Диагноз: поликистоз почек. Хроническая почечная недостаточность, терминальная стадия. Постоянный амбулаторный перитонеальный диализ в объеме 10 л в сутки средне- и низкоосмолярными диализирующими растворами (1:1) в течение 6 месяцев. Диализный перитонит.
С целью купирования диализного перитонита было назначено интраперитонеальное введение ванкомицина в суточной дозе 2 г.
После проведения цикла обмена диализирующего раствора с целью оценки необходимости продолжения антибактериальной терапии был выполнен забор пробы 7,5% диализирующего раствора из брюшной полости через 1,5 часа после его инфузии с помощью шприца в объеме 15,0 мл и помещен в пробирки для исследования по вышеописанной предлагаемой методике.
После центрифугирования в течение 12 минут при скорости 1500 оборотов в минуту полученные пробы диализирующего раствора были нанесены на пластиковую поверхность тест-карты в количестве 0,04 мл в форме капли и оставлены в термостате для дегидратации. Через 3 часа при микроскопии образца диализирующего раствора получена морфологическая картина линейных кристаллов солей в обеих пробах (фиг. 1). Антибактериальная терапия прекращена. Пациент переведен на амбулаторне лечение на следующие сутки.
Пример 3.
Пациент М., 26 лет. Госпитализирован с диагнозом: аномалия развития мочевыводящих путей. Хронический пиелонефрит. Хроническая почечная недостаточность, терминальная стадия. Постоянный амбулаторный перитонеальный диализ в объеме 8 л в сутки низкоосмолярным диализирующим раствором в течение 3 лет. Диализный перитонит.
Клинические проявления диализного перитонита: боли в животе без четкой локализации, мутный дренируемый диализирующий раствор. Назначена антибактериальная терапия цефазолином в дозе 2 г в сутки.
После проведения цикла обмена диализирующего раствора при микроскопии образцов диализата, обработанного с применением метода клиновидной дегидратации, было выявлено отсутствие линейной структуры кристаллов солей (фиг. 3).
Проведена смена антибактериального препарата, назначен абактал в суточной дозе 800 мг интраперитонеально.
После проведения цикла обмена диализирующего раствора повторно проведено исследование методом клиновидной дегидратации диализата для оценки эффективности лечения пациента с диализным перитонитом.
При микроскопии образцов диализата по предлагаемому способу было выявлено отсутствие линейной структуры кристаллов солей, получена морфологическая картина линейных кристаллов солей только в первой пробе (фиг. 2). Продолжено интраперитонеальное введение раствора абактала в прежней дозе.
Через 4 суток после очередного исследования диализата по предложенному способу проведено очередное исследование. При микроскопии получена морфологическая картина линейных кристаллов солей в обеих пробах (фиг. 1).
Антибактериальная терапия прекращена. Пациент выписан на амбулаторное лечение.
Пример 4.
Пациент М., 37 лет. Госпитализирован с диагнозом: хронический гломерулонефрит. Хроническая почечная недостаточность, терминальная стадия. Постоянный амбулаторный перитонеальный диализ в объеме 10 л в сутки низкоосмолярным диализирующим раствором в течение 3 лет. Диализный перитонит (повторный эпизод).
Клинические проявления диализного перитонита: боли в животе без четкой локализации, снижение прозрачности дренируемого диализирующего раствора. Эмпирическая антибактериальная терапия абакталом в дозе 1200 мг в сутки.
С целью оценки эффективности лечения при микроскопии образцов диализирующего раствора, обработанных с применением метода клиновидной дегидратации, было выявлено отсутствие линейной структуры кристаллов солей (фиг. 3).
Проведена смена антибактериального препарата, назначен ванкомицин в суточной дозе 3000 мг интраперитонеально.
На вторые сутки после смены антимикробного препарата было повторно проведено исследование методом клиновидной дегидратации диализата для оценки эффективности лечения пациента с диализным перитонитом.
При микроскопии образцов диализата, обработанных с применением метода клиновидной дегидратации, было выявлено отсутствие линейной структуры кристаллов солей (фиг. 3).
В связи с неэффективностью проведения антибактериальной терапии лечение перитонеальным диализом было завершено, перитонеальный катетер удален, проведена конверсия на гемодиализ.
Назначена комбинированная антимикробная терапия с антимикотиками. Через 3 суток отмечена положительная динамика. Пациент был выписан на амбулаторное лечение программным гемодиализом через 7 суток в удовлетворительном состоянии.
При клиническом лабораторном исследовании выявлен выраженный лейкоцитоз, при бактериологическом исследовании (через 5 суток) — отрицательный результат посева образца диализата на флору.
Применение предлагаемого способа для оценки эффективности антибактериальной терапии было выполнено у 26 пациентов, страдавших диализным перитонитом. В 18 случаях была подтверждена эффективность антибактериальной терапии, в 8 случаях — отсутствие целесообразности продолжения антимикробной терапии и бесперспективность лечения перитонеальным диализом, последние были переведены на лечение гемодиализом. Это позволило повысить выживаемость и качество жизни пациентов (18), получавших лечение перитонеальным диализом, а также этого вида заместительной почечной терапии, сократить стоимость лечения за счет своевременно (8) выполненной конверсии на гемодиализ и прекращения безрезультатного применения антибактериальной терапии.
Применение способа в клинической практике позволяет оценить эффективность антибактериальной терапии при диализном перитоните в течение 1-3 суток, подтверждение которой ведет к сокращению сроков госпитализации, а выявление признаков отсутствия эффективности лечения позволяет в короткие срок осуществить обоснованное завершение лечения перитонеальным диализом с переводом на лечение гемодиализом, что ведет к повышению качества жизни и выживаемости пациентов, получающих этот вид заместительной почечной терапии, снижению затрат на лечение этой категории пациентов.
Способ оценки эффективности антибактериальной терапии при диализном перитоните, включающий введение антибактериальных препаратов в пакет с диализным раствором с последующим введением в брюшную полость, морфологическое исследование диализата, отличающийся тем, что после проведения цикла обмена диализирующего раствора проводят исследование диализата методом клиновидной дегидратации, при этом диализат центрифугируют при 1500 об/мин в течение 10-15 минут и отбирают 2 пробы — первую из верхней половины пробирки, вторую — из нижней, выявляют структуру кристаллов солей в диализате и при наличии линейных кристаллов в центральной зоне фаций обеих проб оценивают эффективность терапии как удовлетворительную и не требующую ее продолжения, при наличии линейных кристаллов только в первой пробе оценивают эффективность терапии как удовлетворительную и требующую ее продолжения, при их отсутствии — как неудовлетворительную.
Страница не найдена — Ассоциация нефрологов
Программа конференции
Информация по трансферам:
27 мая 2021: м. Пятницкое шоссе (выход №3)-Яхонты Авантель Истра. Время сбора отправляющихся – 07:45, отправление в 08:00
Обратный рейс: сбор отправляющихся – 18:00, отправление в 18:15
28 мая 2021: м.Пятницкое шоссе — Яхонты Авантель Истра. Время сбора отправляющихся – 07:45, отправление 08:00
Обратный рейс: сбор отправляющихся – 15:00, отправление в 15:15
Место отправления м. Пятницкое шоссе.
Последний вагон из центра. Выход №3 Выйти налево, затем прямо и направо. На улице окажетесь около магазина Авоська, он находится у ТЦ Мандарин.. Прямо возле выхода из метро Вас будет встречать представить оргкомитета с табличкой «Конференция нефрологов ЦФО». Телефон для связи +7 917 549-78-45
- Общественная организация «Ассоциация нефрологов»,
- Негосударственное образовательное учреждение Дополнительного профессионального образования «Учебный центр «ЭДИКОМ»
За дополнительной информацией просим обращаться в оргкомитет по адресу:
129119 Москва, ул.Щепкина, 61/2.
Сопредседатель оргкомитета — проф. Ватазин Андрей Владимирович Тел. 8-916-148-27-90 E-mail: [email protected];
администратор — Кузьмина Наталия Игоревна Тел. 8-916-521-84-01, E-mail: [email protected];
По вопросам регистрации на сайте и регистрации на конференцию — Зулькарнаев Алексей Батыргараевич, 8-916-705-98-99, E-mail: [email protected]
По вопросам размещения — Мелехова Оксана, 8-916-701-49-95, E-mail: [email protected]
Перитонит, связанный с перитонеальным диализом | Американское общество нефрологов
Перитонит — частое и серьезное осложнение перитонеального диализа (ПД). Перитонит, связанный с БП, является прямой или основной причиной смерти у> 15% пациентов на БП (1,2). Более того, единичный эпизод тяжелого перитонита или множественные эпизоды перитонита часто приводят к снижению способности перитонеальной ультрафильтрации и являются наиболее частой причиной перехода на длительный гемодиализ (3).
За последние 30 лет под эгидой Международного общества перитонеального диализа (ISPD) были опубликованы и регулярно пересматривались рекомендации по лечению и профилактике перитонита, связанного с БП. В версии 2010 г. было выпущено два набора рекомендаций: один по лечению перитонита, связанного с БП, и катетер-ассоциированных инфекций (4), а другой по их профилактике (5). Однако в последней версии 2016 г. и лечение, и профилактика перитонита, связанного с БП, были объединены в один набор рекомендаций (6), а в 2017 г. был опубликован отдельный набор рекомендаций по инфекциям, связанным с катетером (7).Поскольку их фокусы различны, их конкретные рекомендации не полностью идентичны. В этом обзоре мы сосредоточены на профилактике и лечении перитонита, связанного с БП.
Отчетность о частоте перитонита
В рекомендациях ISPD подчеркивается, что каждая программа PD должна контролировать частоту перитонита, связанного с PD, по крайней мере, на ежегодной основе (6). Частоту следует указывать как количество эпизодов на пациенто-год, а не количество пациенто-месяцев на один эпизод (6).В дополнение к общей частоте перитонита следует отслеживать частоту перитонита, вызванную конкретными микроорганизмами, процент пациентов без перитонита в год и спектр устойчивости к антибиотикам (6). При расчете частоты перитонита эпизоды рецидива следует подсчитывать только один раз, и следует учитывать все эпизоды, которые развиваются после начала (не завершения) тренировки на ПД (6). Хотя в рекомендациях указывается, что общая частота перитонита должна быть ниже 0,5 эпизода на пациенто-год, существует широкий разброс в показателях перитонита, о которых сообщают разные страны, а также разные центры в одной и той же стране (8).Недавнее исследование показывает, что показатели принятия рекомендаций ISPD в разных центрах сильно различаются, и такие различия, вероятно, объясняют разницу в риске инфицирования между центрами PD (9).
Профилактика перитонита, связанного с БП
Оборудование для ПД и обучение.
По крайней мере четыре рандомизированных контролируемых испытания поддерживают использование профилактических антибиотиков перед введением катетера для ПД (6,10). Были протестированы внутривенные ванкомицин, цефазолин, гентамицин и цефуроксим (10).Однако оптимальный выбор антибиотика не определен четко и должен определяться местным спектром устойчивости к антибиотикам. Помимо профилактических антибиотиков, другие аспекты практики введения катетера, включая метод размещения катетера (мини-лапаротомия, лапароскопия или перитонеоскопия), место разреза кожи (срединное или латеральное), дизайн катетера (, например, , удлиненный, предсердный или перитонеоскопический). верхний абдоминальный катетер), конфигурация (прямая или «лебединая шея», одинарная или двойная манжета) и направление выхода не оказывают существенного влияния на частоту перитонита (11,12).Тем не менее, крупное обсервационное исследование предполагает, что использование катетера с двойной манжетой связано с уменьшением перитонита, вызванного Staphylococcus aureus (13).
Системы Disconnect PD с конструкцией «промывка перед заполнением» неизменно ассоциируются с более низкой частотой перитонитов, чем традиционные спайк-системы, и в настоящее время являются стандартом непрерывного амбулаторного перитонеального диализа (CAPD) (11,14). Нет существенной разницы в частоте перитонита между различными системами отсоединения (Y-образная, двойная сумка или люэровский замок) (11,14), или между CAPD и автоматизированной системой PD (15,16).Неясно, приводит ли выбор диализного раствора (обычные растворы на основе глюкозы или биосовместимые растворы с нейтральным pH и низким содержанием продуктов разложения глюкозы) к каким-либо различиям в частоте возникновения перитонита (17).
Учебно-сестринская практика.
Хорошая программа тренировки PD логически минимизирует частоту перитонита. Принято считать, что обучение ПД должно проводиться медперсоналом с соответствующей квалификацией и опытом, а также следует следовать последним рекомендациям ISPD по обучению пациентов с ПД и их опекунов (18,19).Однако опубликованные данные ограничены, и критические элементы программы тренировок, которые определяют частоту перитонита, остаются неопределенными. Текущее испытание Целевого образовательного подхода для улучшения результатов перитонеального диализа, которое должно быть завершено в 2023 году (20), поможет прояснить преимущества комплексных программ обучения ПД.
После завершения обучения PD посещение врача медсестрой PD на дому имеет большое значение для выявления непредвиденных практических проблем с домашним диализом (6). Однако польза посещения на дому для риска перитонита официально не проверялась.В дополнение к первоначальному обучению следует рассмотреть возможность переподготовки после эпизодов перитонита или катетерной инфекции; любое изменение ловкости, зрения или остроты ума; смена поставщика или системы подключения; длительная госпитализация; или прерывание ПД по другим причинам (6). Ранние исследования показывают, что программа непрерывного улучшения качества (CQI) в центре PD может помочь снизить частоту перитонитов (6,21). Было обнаружено, что общенациональные программы CQI устойчиво снижают частоту перитонитов (22).Подробное описание организации программ CQI выходит за рамки этого обзора. Тем не менее, многопрофильная команда, которая запускает программы CQI, должна регулярно встречаться и пересматривать показатели производительности (6).
Инфекции места выхода и катетера.
Инфекции места выхода и катетерного канала являются важным фактором риска развития перитонита, связанного с БП (23). Их раннее выявление и своевременное лечение антибиотиками — логические шаги для минимизации риска последующего перитонита (6).Правильный уход за местом выхода катетера играет решающую роль в профилактике. Рекомендуется ежедневное местное нанесение крема или мази с антибиотиком на место выхода катетера (6), а крем или мазь с мупироцином должны быть средством выбора (24). Ежедневное нанесение крема или мази с мупироцином на кожу вокруг места выхода снижает частоту инфицирования S. aureus и, вероятно, снижает частоту перитонита (24,25). Мупироцин при интраназальном введении эффективен для снижения S.aureus , но не перитонит (26). Чрезмерное количество местного мупироцина, наносимое непосредственно на поверхность полиуретанового или силиконового катетера, может вызвать эрозию катетера (27). Пациенты должны быть осведомлены о правильном методе применения.
Гентамицин для местного применения является разумной альтернативой мупироцину для лечения места выхода (28), но доказательства кажутся менее надежными. Гентамицин имеет преимущество перед мупироцином в центрах с высокой частотой инфицирования места выхода грамотрицательными организмами, но возможность резистентности к гентамицину, которая влияет на выбор антибиотика для лечения перитонита, вызывает определенную озабоченность.Были протестированы другие альтернативные стратегии, такие как местный антибактериальный мед (29) или тройная мазь (полимиксин, бацитрацин и неомицин) (30), но ни один из них не превосходит местный мупироцин. В общем, регулярная системная антибиотикопрофилактика не рекомендуется. Хотя периодический пероральный прием рифампицина снижает частоту перитонита S. aureus (31), резистентность к рифампицину, побочные эффекты и лекарственные взаимодействия вызывают серьезную озабоченность.
Прочие изменяемые факторы риска.
Сообщалось о многих других модифицируемых факторах риска перитонита БП (8), но их абсолютный риск ( например, , цирроз, поликистоз почек, вспомогательное устройство левого желудочка, нейтропения во время химиотерапии) четко не определены, и вмешательства только очень немногие из них снижают риск перитонита. Перитонит часто возникает после инвазивных эндоскопических процедур (, например, , колоноскопия, гистероскопия) у пациентов на ПД (32). Следует рассмотреть возможность систематического приема антибиотиков с профилактической целью перед колоноскопией или инвазивными гинекологическими процедурами (6).Хотя оптимальная схема приема антибиотиков неизвестна, наиболее часто используется внутривенный ампициллин с аминогликозидами или метронидазолом или без них (10). Эффективность профилактического введения антибиотика внутрибрюшинно перед другими инвазивными процедурами не доказана. Профилактические антибиотики также следует рассматривать после влажного заражения или других нарушений техники (5), но общепринятой схемы не существует (6). Несмотря на то, что замена удлинительных трубок после контаминации является обычной практикой, опубликованные доказательства ограничены.Запор, энтерит и гипокалиемия связаны с повышенным риском перитонита, вызываемого кишечными микроорганизмами (6,8), и эти состояния заслуживают лечения сами по себе.
Вторичная профилактика.
Большинству эпизодов грибкового перитонита предшествует прием системных антибиотиков (6,33). Рандомизированные контролируемые испытания и систематический обзор показывают, что использование перорального нистатина или флуконазола во время антибактериальной терапии снижает риск вторичного грибкового (особенно Candida ) перитонита (6,10).В странах, где доступен нистатин, он должен быть предпочтительным выбором, поскольку он не имеет систематического эффекта или взаимодействия с лекарствами. Противогрибковая профилактика также может снизить риск грибкового перитонита, когда пациент на ПД получает системные антибиотики от инфекций, не связанных с перитонитом (10), но эта практика, похоже, не получила широкого распространения.
После каждого эпизода перитонита следует проводить анализ первопричин для определения этиологии и возможных вмешательств для предотвращения дальнейших эпизодов (6).Например, следует пересмотреть технику обмена после эпизодов перитонита, вызванного контактным заражением, и рассмотреть вопрос о замене катетера для ПД после рецидивов или повторных эпизодов перитонита (6). Ключевые меры профилактики перитонита, связанного с БП, приведены в таблице 1.
Таблица 1.
Ключевые меры профилактики перитонита, связанного с БП
Ведение перитонита, связанного с БП
Диагностика.
Для диагностики перитонита, связанного с БП, необходимы любые два из следующих признаков: ( 1 ) клинические признаки, соответствующие перитониту, i.е. , боль в животе или мутный диализный поток; ( 2 ) количество лейкоцитов в эффлюенте диализа> 100/ мкМ л (после времени выдержки не менее 2 часов), с> 50% нейтрофилов; и ( 3 ) положительная диализная эффлюентная культура (6). Однако своевременный клинический диагноз и раннее начало терапии антибиотиками являются ключом к успешному лечению. Следовательно, пациенты с мутными стоками должны считаться больными перитонитом и лечиться как таковые до подтверждения или исключения диагноза (6).При подозрении на перитонит следует проверить сток БП на подсчет клеток, дифференциал, окраску по Граму и бактериальный посев (6). Наборы бутылочек для посева крови являются предпочтительным методом для бактериального посева (6). Если немедленная доставка флаконов с засеянными культурами в лабораторию невозможна, их следует инкубировать при 37 ° C. Другие методы концентрирования сточных вод могут дополнительно увеличить выход, но они громоздки в использовании. Недостаточно доказательств для других новых лабораторных методов ( e.грамм. , полоска с реагентом или молекулярные тесты) (6).
Эмпирическая антибиотикотерапия.
После получения соответствующих микробиологических образцов следует начать эмпирическую антибактериальную терапию (6). Доказано, что ни одна из схем антибиотиков не превосходит другие, и выбор должен зависеть от конкретного центра (34). Основной принцип — обеспечить адекватный охват как грамположительных, так и грамотрицательных организмов, включая видов Pseudomonas . Текущие рекомендации: ванкомицин или цефалоспорин первого поколения для защиты от грамположительных организмов и цефалоспорин или аминогликозиды третьего поколения для защиты от грамотрицательных организмов (6).Выбор ванкомицина по сравнению с цефалоспорином первого поколения должен зависеть от распространенности метициллин-резистентных микроорганизмов в каждом центре.
Внутрибрюшинное введение антибиотиков является предпочтительным путем, если нет признаков системного сепсиса (6). Однако при предсказуемой задержке внутрибрюшинного введения антибиотиков следует использовать системный путь введения в качестве временной меры, чтобы обеспечить быстрое лечение (35). Ванкомицин, аминогликозиды и цефалоспорин можно смешивать в одном пакете с диализирующим раствором (36).Однако ванкомицин и цефтазидим несовместимы при использовании в одном шприце для инъекций (6). Рекомендуемые дозировки антибиотиков кратко изложены в последних рекомендациях ISPD (6), но многие из них основаны на клиническом опыте, а не на фармакокинетических исследованиях. Дозировку многих антибиотиков необходимо корректировать для пациентов со значительной остаточной функцией почек (4,6). Фиксированная общая доза для всех пациентов может объяснить наблюдение, что остаточная функция почек связана с неэффективностью лечения (37).
Антибиотики внутрибрюшинно можно вводить в виде непрерывного (при каждом обмене) или прерывистого приема (6). Прерывистое дозирование часто возможно, потому что многие антибиотики обладают значительной системной абсорбцией во время перитонита, что позволяет повторно попадать в брюшную полость в последующих циклах ПД. При периодическом введении раствор PD, содержащий антибиотик, должен оставаться в течение не менее 6 часов, чтобы обеспечить адекватное всасывание. Для β -лактамов разумными вариантами являются как непрерывное, так и периодическое внутрибрюшинное дозирование, но постоянное дозирование имеет теоретическое преимущество, поскольку бактерицидная активность зависит от времени ( i.е. , снижение плотности бактерий пропорционально времени превышения минимальной ингибирующей концентрации) и должно быть предпочтительным режимом (6). Тем не менее, прерывистое дозирование часто бывает эффективным и может быть единственно возможным режимом, когда пациенту требуются помощники или медицинские работники для введения антибиотиков, или у пациентов на автоматизированном БП, которые не могут быть временно переведены на ХАПД (6).
В отличие от β -лактамов, ванкомицин внутрибрюшинно вводят с перерывами каждые 4–5 дней.Для поддержания эффективности сывороточный уровень ванкомицина должен быть> 15 мкМ мкг / мл (38). Аминогликозид также предпочтительно вводить внутрибрюшинно в виде ежедневных прерывистых дозировок (6). Краткосрочная терапия аминогликозидами не ускоряет потерю остаточной функции почек (39), но длительное или повторяющееся воздействие связано с вестибулярной токсичностью (40), и этого следует избегать.
Пациенты на автоматизированной БП, у которых развивается перитонит, могут временно переключиться на КАПД, чтобы облегчить внутрибрюшинную терапию антибиотиками, но переход не всегда возможен по прагматическим причинам (6).Пациентам, которые остаются на автоматизированном ПД, периодическое внутрибрюшинное дозирование следует вводить в дневное время (6). К сожалению, существует значительный пробел в знаниях относительно дозирования антибиотиков для лечения перитонита при автоматизированном БП. Поскольку экстраполяция фармакокинетических данных из CAPD на автоматизированную PD может привести к значительной недостаточной дозировке у пациентов на автоматизированной PD (6), часто требуется более высокая суточная доза.
Дополнительные меры.
Большинство пациентов с перитонитом, связанным с БП, можно лечить амбулаторно.Решение о госпитализации зависит от тяжести заболевания, гемодинамического статуса и часто практических соображений относительно лечения. Противогрибковые препараты, предпочтительно пероральный нистатин, следует назначать одновременно с терапией антибиотиками (6). Гепарин для внутрибрюшинного введения обычно добавляют, когда сток ПД мутный, чтобы предотвратить закупорку катетера фибрином. Кроме того, у пациентов с диабетом рекомендуется тщательный мониторинг уровня глюкозы в крови, поскольку абсорбция глюкозы из раствора PD может увеличиваться во время перитонита.Потеря белка в брюшной полости также увеличивается во время перитонита, и может быстро развиться недоедание.
Последующее управление.
После того, как станут известны результаты окрашивания по Граму сточных вод БП или результаты посева, следует скорректировать антибактериальную терапию (6). В целом, если обнаружены грамположительные организмы, покрытие антибиотиками для грамотрицательных бактерий (, т.е. , аминогликозид или цефалоспорин третьего поколения) можно прекратить, а — наоборот, , как только станет известна чувствительность.Подсчет лейкоцитов в стоках БП и бактериальный посев следует повторить через 2–3 дня после антибактериальной терапии, особенно при отсутствии клинического улучшения. Количество лейкоцитов в стоках ПД> 1090/ мкл л на 3-й день может указывать на неэффективность лечения (41).
Текущие рекомендации ISPD содержат подробное описание лечения эпизодов перитонита, вызванных определенными микроорганизмами (6). По сути, если клинический ответ удовлетворительный, перитонит, вызванный коагулазонегативными стафилококками, стрептококками или эпизодами отрицательного посева, следует лечить в течение 2 недель (6).Что касается эпизодов с отрицательным посевом, остается спорным вопрос о том, следует ли прекратить прием грамотрицательных антибиотиков. В текущих рекомендациях говорится, что если аминогликозид используется в качестве эмпирического грамотрицательного покрытия, его следует прекратить, чтобы минимизировать риск ототоксичности от повторного воздействия (6), хотя небольшое исследование показало, что N-ацетилцистеин может предотвращать ототоксичность, связанную с аминогликозидами. (42).
Для лечения эпизодов перитонита, вызванного S.aureus , энтерококки, Corynebacterium видов, грамотрицательные палочки ( Pseudomonas или не Pseudomonas видов) и полимикробный перитонит, эффективные антибиотики следует продолжать в течение 3 недель. Поскольку энтерококки обладают внутренней устойчивостью к цефалоспорину, а ампициллин быстро инактивируется при внутрибрюшинном введении (43), энтерококковый перитонит следует лечить внутрибрюшинным ванкомицином, если нет устойчивости к ванкомицину (6). В отличие от других бактериальных причин, перитонит Pseudomonas следует лечить двумя эффективными антибиотиками с разными механизмами действия ( e.грамм. , гентамицин или пероральный ципрофлоксацин с цефтазидимом или цефепимом) (6,44,45). Если в стоках БП выявлено несколько кишечных микроорганизмов и нет быстрого клинического ответа на эмпирические антибиотики, следует немедленно провести хирургическое обследование и использовать метронидазол с ванкомицином и аминогликозидом или цефтазидимом (6). Напротив, если несколько грамположительных организмов идентифицируются из стока БП, лечение только антибиотиками обычно эффективно (46).Стандартная противотуберкулезная химиотерапия очень эффективна при перитоните, вызванном Mycobacterium tuberculosis . Схема лечения нетуберкулезного микобактериального перитонита четко не определена, но обычно требуется удаление катетера.
Тяжелые эпизоды.
Показания к удалению катетера PD приведены в таблице 2. В частности, эпизод рефрактерного перитонита теперь определяется как неспособность сточных вод отойти через 5 дней приема соответствующих антибиотиков (6), тогда как рецидивный перитонит относится к эпизоду, который возникает в течение 4 дней. недель после завершения терапии предыдущего эпизода с тем же организмом или с отрицательным посевом (6).Рецидивный перитонит относится к эпизоду, который возникает в течение 4 недель после завершения терапии предыдущего эпизода, но с другим организмом (6), тогда как повторный перитонит относится к эпизоду, который возникает> 4 недель после завершения терапии предыдущего эпизода с тот же организм (6).
Таблица 2.
Показания к удалению катетера
После удаления катетера при грибковом или рефрактерном перитоните прием эффективных антибиотиков следует продолжить еще в течение 2 недель (6,47). Иногда возможно введение нового катетера для ПД и возврат к ПД (47, 48), но его следует выполнять как минимум через 2 недели после удаления катетера и полного исчезновения перитонеальных симптомов (6).Катетер для ПД также следует удалить при резистентном участке выхода или туннельной инфекции (6). Если нет сопутствующего перитонита (или после того, как отток ПД очистился от сопутствующего эпизода), одновременно может быть вставлен новый катетер ПД и продолжить ПД (7).
Перитонит, связанный с перитонеальным диализом: проблемы и решения
Int J Nephrol Renovasc Dis. 2018; 11: 173–186.
Уильям Л. Зальцер
Медицинский факультет Университета Миссури, Колумбия, Миссури, США
Медицинский факультет Университета Миссури, Колумбия, Миссури, США
Для корреспонденции: Уильям Л. Зальцер, Департамент медицины, Отдел инфекционных болезней , University Hospital, University of Missouri, 5 Hospital Drive, Columbia, MO 65212, USA, тел. +1 573 882 3107, электронная почта ude.Авторские права © Salzer, 2018 г. Эта работа опубликована и лицензирована Dove Medical Press Limited. Полные условия этой лицензии доступны по адресу https://www.dovepress.com/terms.php и включают лицензию Creative Commons Attribution — Non Commercial (unported, v3.0) License ( http://creativecommons.org/licenses/by-nc/3.0/). Получая доступ к работе, вы тем самым принимаете Условия. Некоммерческое использование работы разрешено без какого-либо дополнительного разрешения Dove Medical Press Limited при условии надлежащей атрибуции работы.Эта статья цитировалась в других статьях в PMC.
Abstract
Перитонеальный диализ является эффективным методом лечения пациентов с терминальной стадией почечной недостаточности. Относительное использование перитонеального диализа по сравнению с гемодиализом широко варьируется в зависимости от страны. Данные исследования 2004 г. показывают, что процент пациентов с терминальной стадией почечной недостаточности, получавших перитонеальный диализ, составляет от 5% до 10% в экономически развитых регионах, таких как США и Западная Европа, до 75% в Мексике. Это несоответствие, вероятно, связано с доступностью гемодиализа или, в некоторых случаях, с предпочтением пациентом перитонеального диализа.Перитонит, связанный с перитонеальным диализом, остается основным осложнением и основной проблемой для долгосрочного успеха перитонеального диализа. Пятьдесят лет назад, с появлением катетера Тенкхоффа, пациенты на перитонеальном диализе в среднем регистрировали шесть эпизодов перитонита в год. В 2016 году Международное общество перитонеального диализа предложило контрольный показатель в 0,5 эпизода перитонита в год или один эпизод каждые 2 года. Несмотря на заметное снижение перитонита с течением времени, перитонит для отдельного пациента представляет собой проблему.Смертность от эпизода перитонита составляет 5% и является кофактором смертности еще у 16% больных. Профилактика перитонита и быстрое и надлежащее лечение перитонита имеет важное значение для долгосрочного успеха перитонеального диализа у всех пациентов. В этом обзоре рассматриваются проблемы и решения, касающиеся патогенеза, клинических характеристик, диагностики, лечения и профилактики перитонита, связанного с перитонеальным диализом, с точки зрения врача-инфекциониста.
Ключевые слова: перитонеальный диализ, связанный перитонит
Введение
Использование перитонеального диализа (ПД) для заместительной почечной терапии широко варьируется в разных регионах мира и в отдельных странах1. ПД по сравнению с гемодиализом иногда является вопросом предпочтений пациента, а иногда из-за отсутствия гемодиализного отделения, которое легко доступно на дому у пациента. В менее экономически привилегированных областях PD может быть первым выбором из-за более высоких затрат и трудностей доступа к отделению гемодиализа.В этой статье рассматриваются патогенез, клинические особенности, диагностика и терапия наиболее распространенных микроорганизмов, вызывающих перитонит при БП, а также меры по снижению частоты перитонита.
Перитонит, связанный с БП — патогенез
Катетер для ПД является источником инфекции в подавляющем большинстве случаев перитонита, связанного с БП. Катетер обеспечивает вход микроорганизмов в обычно стерильную брюшину. Большинство случаев перитонита, связанного с БП, являются результатом «контаминации прикосновением», когда пациент или его помощник случайно нарушает стерильный метод и загрязняет катетер или его соединения.Наиболее распространенными патогенами являются коагулазонегативные виды стафилококков (например, Staphylococcus epidermidis ), которые обычно колонизируют кожу и руки человека, и Staphylococcus aureus , которые вместе являются причиной 50% или более инфекций в большинстве серий2–4. Инфекции места выхода и туннельные инфекции также могут привести к перитониту. Реже источником может быть сам живот. Источником могут быть дивертикулит, аппендицит, холецистит или перфорация внутренних органов, а также интраабдоминальная хирургия, колоноскопия, гистероскопия и переселение кишечной флоры в результате запора.В случае интраабдоминального источника возбудителями инфекции обычно являются грамотрицательные кишечные бактерии, стрептококки и анаэробные бактерии. Бактериемия из другого источника также может заразить брюшину.
Попадая в брюшину, микроорганизмы находят очень гостеприимную среду. Он теплый, темный, и в нем много питательных веществ, таких как глюкоза. Кроме того, в неповрежденной брюшине имеется очень слабая защита хозяина, небольшое количество перитонеальных макрофагов и очень мало белков защиты хозяина, таких как иммуноглобулины или комплемент.В этой среде организмы могут быстро беспрепятственно размножаться. В течение нескольких часов бактериальные продукты, компоненты клеточной стенки для грамположительных и эндотоксин для грамотрицательных бактерий вызывают воспалительную реакцию. Полиморфноядерные лейкоциты (PMNL) и активированные макрофаги проникают в брюшину и вызывают воспаление, которое проявляется в виде боли в животе, лихорадки, лейкоцитоза периферической крови и мутного диализата из-за повышенного количества клеток в перитонеальной жидкости.
Инфекции места выхода и туннельные инфекции
Большинство случаев перитонита, связанного с БП, являются результатом контаминации путем прикосновения, когда инфекционный организм получает доступ к брюшине через просвет катетера.Небольшой процент является результатом инфекций в месте выхода или туннельных инфекций, при которых микроорганизмы распространяются по туннелю катетера за пределы просвета в брюшину.3 Инфекция в месте выхода представляет собой гнойный дренаж в месте выхода с эритемой или без нее. Сама по себе эритема не указывает на инфекцию в месте выхода. 5 Отек, уплотнение и / или эритема, которые простираются более чем на 2 см проксимальнее места выхода, указывают на туннельную инфекцию, которая представляет гораздо более высокий риск развития перитонита. Микроорганизмы, вызывающие инфекции места выхода с самым высоким риском последующего перитонита, составляют S.aureus , коагулазонегативные стафилококки, дифтероиды, виды стрептококков, Pseudomonas aeruginosa и Candida .6. Также сообщалось, что виды нетуберкулезных микобактерий (НТМ) вызывают инфекции в местах выхода и перитонит, особенно у пациентов, использующих крем с гентамицином для профилактика места выхода7
Гнойный дренаж из места выхода следует отправить на окрашивание по Граму; тем не менее, не следует получать культуры, если место выхода эритематозно без экссудата, потому что в культурах обычно растет организм, который только что колонизирует, и пациент часто будет без необходимости подвергаться воздействию антибиотиков, способствуя появлению устойчивых к лекарствам бактерий.Инфекции места выхода обычно можно лечить пероральными антибиотиками в течение 2–3 недель в зависимости от результатов определения лекарственной чувствительности. См. Рекомендуемые режимы дозирования для пациентов с БП. Инфекции места выхода, резистентные к антибиотикам, обычно требуют удаления катетера и замены катетера в другом месте.2
Таблица 1
Системные рекомендации по дозировке антибиотиков для лечения перитонита2
| Лекарство | Дозировка | |
|---|---|---|
| Антибактериальные препараты | ||
| Ципрофлоксацин (237) | перорально 250 мг BD a | |
| Колистин (288) | Внутривенно 300 мг нагрузки, затем 150–200 9019 мг b ежедневно b Эртапенем (289) | Внутривенно 500 мг в день |
| Левофлоксацин (239) | перорально 250 мг в день | |
| Линезолид (290–292) | Внутривенно или перорально 600 мг BD | |
| перорально 400 мг в день | ||
| Рифампицин (294 295) | 450 мг в день при МТ <50 кг; 600 мг в день при МТ ≥50 кг | |
| Триметоприм / сульфаметоксазол (252) | перорально 160 мг / 800 мг BD | |
| Противогрибковые средства | ||
| Доза амфотерицина | для внутривенного введения (296) начальная доза 0.1 мг / кг / день более 6 часов; увеличена до целевой дозы 0,75–1,0 мг / кг / день в течение 4 дней | |
| Каспофунгин (297,298) | Внутривенно 70 мг нагрузки, затем 50 мг ежедневно | |
| Флуконазол (299) | перорально 200 мг нагрузки, затем 50–100 мг в день | |
| Флуцитозин (296) | перорально 1 г / день | |
| Позаконазол (300) | Внутривенно 400 мг каждые 12 часов | |
| Вориконазол перорально (301–303) |
Туннельные инфекции более серьезны и представляют больший риск потери катетера и перитонита.Обычно наблюдается гнойный или серозно-кровянистый дренаж из места выхода, а также отек, эритема, уплотнение и боль вдоль канала катетера. Наиболее распространенными микроорганизмами, вызывающими туннельную инфекцию, являются S. aureus и P. aeruginosa , которым часто предшествует инфекция в месте выхода. Туннельные инфекции требуют лечения системными антибиотиками на основании отчетов о культуре и чувствительности. В большинстве случаев только антибактериальная терапия неэффективна, и потребуется удаление катетера с последующей заменой катетера.При туннельных инфекциях, которые переросли в перитонит, рекомендуется не менее 2 недель эффективной антибактериальной терапии после удаления катетера перед заменой катетера6. признаки и симптомы перитонита. Новое начало боли в животе, лихорадки или появление мутных выделений должно требовать немедленного уведомления поставщика диализа для срочного обследования. У пациентов, получающих автоматический диализ, первый дренаж, скорее всего, будет мутным и будет иметь повышенное количество лейкоцитов (WBC).Если у пациента сухой живот, необходимо ввести 1 л диализата и дать ему постоять в течение 2 часов перед взятием образца. В идеале перед введением антибиотиков следует получить образцы диализных стоков для определения количества лейкоцитов, дифференциала, окрашивания по Граму и посева. Если немедленный доступ в учреждение невозможен из-за поездки или расстояния, образец диализата должен быть получен в стерильных условиях и охлажден, если антибиотики будут введены до официального отбора образцов.Своевременный анализ жидкости и начало эмпирической антибактериальной терапии улучшают результаты. Подсчет лейкоцитов и дифференциал следует проводить в диализном эффлюенте. Наличие> 100 лейкоцитов / мкл с> 50% нейтрофилов в образце с двухчасовой выдержкой обычно указывает на перитонит.2
Культура с идентификацией инфекционного организма и определением его чувствительности к противомикробным препаратам имеет важное значение для целенаправленной антимикробной терапии. В идеале перитонеальная жидкость должна быть внесена в среду для культивирования крови у постели больного.Было показано, что прямой посев в культуральные флаконы BACTEC / Alert у постели больного увеличивает урожайность и снижает количество случаев отрицательного посева.8 Получение 50 мл пробы перитонеальной жидкости, центрифугирование при 3000 г в течение 15 минут и повторное суспендирование осадка в 3-5 мл буфера с последующим окрашиванием по Граму и культивированием ресуспендированного осадка могут увеличить выход культур и окрашивание по Граму. Положительное окрашивание по Граму будет способствовать более целенаправленной начальной антимикробной терапии, направленной на грамположительные или грамотрицательные бактерии или дрожжи.Однако в большинстве случаев окраска жидкости по Граму отрицательная. Бактериальным культурам обычно требуется 1–3 дня, чтобы вывести организм. Идентификация организма и тестирование на лекарственную чувствительность позволяет проводить целенаправленную антимикробную терапию.
Проблемы в диагностике
К сожалению, культуры PD-жидкости не всегда выявляют организм у пациентов с клиническими проявлениями перитонита. Руководства Международного общества перитонеального диализа (ISPD) рекомендуют эталонный уровень <20% случаев с отрицательным посевом.Наиболее частой причиной отрицательных посевов является назначение антибиотиков до получения посевов. Пациенты с клиническим перитонитом, с отрицательными перитонеальными культурами и улучшением результатов эмпирической терапии с уменьшением симптомов и падением количества лейкоцитов в брюшной полости обычно имеют инфекцию, вызванную чувствительными грамположительными бактериями, и их можно лечить в течение 2 недель.2 Случаи инфицирования привередливыми бактериальными организмами, кислотоустойчивыми бациллами (КУБ) или грибковыми организмами.В этих случаях, если клиническое улучшение симптомов и количество лейкоцитов в брюшной полости не произошло после 3 дней эмпирической антибактериальной терапии, а исходные культуры перитонеальной жидкости остаются отрицательными через 3 дня, исходные флаконы для культивирования перитонеальной жидкости следует пересеять на твердую среду и обогащенную жидкость. такие средства, как тиогликолят. Также необходимо получить жидкость и посеять ее на грибки и КУБ.
Будущие решения в диагностике
При первичной оценке перитонита окрашивание перитонеальной жидкости по Граму обычно отрицательное.Обычно требуется 1–3 дня, чтобы жидкие культуры стали положительными, и еще 2 дня для определения вида и результатов теста на чувствительность к противомикробным препаратам. В настоящее время существует ряд коммерчески доступных панелей мультиплексной полимеразной цепной реакции (ПЦР) для респираторных, желудочно-кишечных (ЖКТ) и патогенных микроорганизмов центральной нервной системы, которые дают результат идентификации вида за час на прямых клинических образцах. Кроме того, время пролета с помощью лазерной десорбции / ионизации с использованием матрицы (MALDITOF), выполненное на положительных культурах, может обеспечить идентификацию видов менее чем за час 9, а системы ПЦР в реальном времени могут предоставить идентификацию видов и общие данные о лекарственной устойчивости, такие как обнаружение метициллин-устойчивый S.aureus (MRSA) и устойчивый к ванкомицину Enterococcus (VRE) на положительных культурах.
Первоначальная эмпирическая антибактериальная терапия перитонита
После получения ПД жидкости для микробиологического исследования как можно скорее следует начать эмпирическую антибиотикотерапию. При отсутствии положительного окрашивания по Граму эмпирическая терапия должна включать антибиотики, которые действуют как на грамотрицательные, так и на грамположительные бактерии. Выбор антибиотиков должен определяться распространенностью и типами антибиотикоустойчивых бактериальных изолятов от пациентов с перитонитом в программе.В большинстве случаев антибиотики следует вводить внутрибрюшинно2. Для эмпирического исследования грамположительных бактерий рекомендуются цефазолин или ванкомицин. В программах с низкой заболеваемостью видами MRSA и энтерококками предпочтение отдается цефазолину. Во многих программах MR коагулазонегативные стафилококки и MRSA являются частыми патогенами у пациентов с перитонитом, и ванкомицин следует использовать изначально, до получения результатов посева. Для эмпирического охвата грамотрицательных бактерий начальная терапия должна включать цефалоспорин третьего поколения (цефтазидим или цефепим) или аминогликозиды (гентамицин, тобрамицин или амикацин).Опять же, выбор антибиотиков для эмпирического грамотрицательного покрытия зависит от вида бактерий, а также от распространенности и типов устойчивых к антибиотикам патогенов в программе.
Окончательная терапия перитонита, связанного с БП
В большинстве случаев результаты посева и чувствительности будут доступны через 3-5 дней, а терапия антибиотиками может быть сосредоточена на одном препарате. В случаях с отрицательным посевом, особенно в легких, наиболее вероятным возбудителем является грамположительный организм, чаще всего коагулазонегативный Staphylococcus sp., и грамотрицательное покрытие может быть прекращено. Если пациент не ответил клинически через 3-5 дней, как описано ранее, следует провести повторный посев образца перитонеальной жидкости на предмет необычных патогенов.
Введение антибиотиков при перитоните, связанном с БП
Предпочтительным методом введения антибиотиков при перитоните, связанном с БП, является внутрибрюшинное введение. Преимущества внутрибрюшинного введения антибиотиков включают доставку антибиотиков в высокой концентрации в очаг инфекции, антибиотики также всасываются в системный кровоток и диффундируют обратно в брюшину, что позволяет вводить их ежедневно или реже, а также внутривенный (IV) доступ, который потребуется в течение 2–4 недель, не требуется ().
Таблица 2
Рекомендации по дозировке антибиотиков IP для лечения перитонита2
| Прерывистая (одна замена в день) | Непрерывная (все замены) | ||
|---|---|---|---|
| Амикацин | 2 мг / кг в сутки (252) | ЛД 25 мг / л, ЛД 12 мг / л (253) | |
| Гентамицин | 0,6 мг / кг в сутки (254) | ЛД 8 мг / л , MD 4 мг / л (255,256) | |
| Нетилмицин | 0.6 мг / кг в день (233) | MD 10 мг / л (257) | |
| Тобрамицин | 0,6 мг / кг в день (253) | LD 3 мг / кг, MD 0,3 мг / кг (258,259) | |
| Цефалоспорины | |||
| Цефазолин | 15–20 мг / кг в день (260,261) | LD 500 мг / л, MD 125 мг / л (254) | Ce ежедневно (262 263) | LD 250–500 мг / л, MD 100–125 мг / л (262 263) |
| Цефоперазон | нет данных | LD 500 мг / л, MD 62.5-125 мг / л (264 265) | |
| Цефотаксим | 500–1000 мг в сутки (266) | нет данных | |
| Цефтазидим | 1000–1 500 мг в сутки (267 268) | ЛД , MD 125 мг / л (236) | |
| Цефтриаксон | 1000 мг в день (269) | нет данных | |
| Пенициллины | |||
| Пенициллин G | Ед. / Л, MD 25000 ед / л (270) | ||
| Амоксициллин | нет данных | MD 150 мг / л (271) | |
| Ампициллин | нет данных | MD 125 мг / л (272 273) | |
| Ампициллин / сульбактам | 2 г / 1 г каждые 12 часов (274) | LD 750–100 мг / л, MD 100 мг / л (253) | |
| Пиперациллин / тазобактам | нет данных | LD 4 г / 0.5 г, MD 1 г / 0,125 г (275) | |
| Прочие | |||
| Азтреонам | 2 г в день (242) | LD 1000 мг / л, MD 250 мг / л (243 244) | |
| Ципрофлоксацин | нет данных | MD 50 мг / л (276) | |
| Клиндамицин | нет данных | MD 600 мг / пакет (277) | |
| LD19 9019 Dapt 100 мг / л, MD 20 мг / л (278) | |||
| Имипенем / циластатин | 500 мг в альтернативной форме (244) | LD 250 мг / л, MD 50 мг / л (236) | |
| Офлоксацин | нет данных | LD 200 мг, MD 25 мг / л (279) | |
| Полимиксин B | нет данных | MD 300000 единиц (30 мг) / пакет (280) | |
| Quinuppristin / Dal | 25 мг / лин альтернативный обмен a (281) | нет данных | |
| Меропенем | 1 г в день (282) | нет данных | |
| Тейкопланин | 15 мг / кг каждые 5 дней (283) | LD 400 мг / мешок, MD 20 мг / мешок (229) | |
| Ванкомицин | 15–30 мг / кг каждые 5–7 дней b (284) | LD 30 мг / кг, MD 1.5 мг / кг / мешок (285) | |
| Противогрибковые | |||
| Флуконазол | IP 200 мг каждые 24–48 часов (286) | нет данных | |
| мг Вориконазол | мг Вориконазол / кг в день (287) | нет данных |
Проблемы
В рекомендациях ISPD от 2016 года выражается озабоченность по поводу эффективности однократного внутрибрюшинного дозирования цефалоспоринов у пациентов с APD и рекомендуется включать антибиотики в каждый пакет диализата для пациенты на автоматизированной ПД или, альтернативно, переходят на постоянную амбулаторную ПД на время лечения.Это было бы довольно обременительно для пациентов, находящихся на диализе дома. Тем не менее, были две опубликованные серии исследований, в которых изучались просто добавление антибиотиков к их «дневному пребыванию» у пациентов на автоматизированной БП, и были обнаружены сопоставимые показатели успеха по сравнению с пациентами, использующими антибиотики в каждом пакете циклера10,11
, связанных с ПД. перитонит: клиника, диагностика и лечение организмом
Коагулазонегативные стафилококки
S. epidermidis — наиболее часто определяемая причина перитонита, связанного с БП.Хотя S. epidermidis является наиболее распространенным из коагулазонегативных стафилококков, существует по крайней мере 40 других видов коагулазонегативных стафилококков Staphylococcus , которые считаются причиной инфекций у людей. Эти организмы являются преобладающей нормальной флорой на коже человека и, как правило, патогенами с низкой вирулентностью, но являются одной из наиболее распространенных причин инфекций, связанных с устройствами, из-за их способности прилипать к небиологическим поверхностям и производить биопленки.12 В биопленке микроорганизмы являются встроены в гликокаликс, аналогично коралловому рифу, в котором организмы на внешней поверхности метаболически активны и делятся, в то время как те, что глубоко в биопленке, по существу бездействуют.13 Антибиотики действуют только на активно делящиеся микроорганизмы, так что организмы, находящиеся глубоко в биопленке, не затрагиваются, что приводит к возникновению очага рецидива. Рецидивирующий или рецидивирующий перитонит часто наблюдается в случае коагулазонегативного перитонита Staphylococcus .14 Возвратный перитонит обычно требует удаления катетера с последующей заменой.
Иллюстративный случай
65-летний мужчина с болезнью Паркинсона имеет 6-часовую историю болей в животе, лихорадки и мутного диализата.Он рассказывает, что вчера мог прикоснуться к разъему без перчаток. Температура 38 ° C, боль в животе умеренная-умеренная. Анализ перитонеальной жидкости показывает 1400 лейкоцитов / мкл с 85% PMNL, а окраска жидкости по Граму показывает PMNL, но не микроорганизмы. Получают посевы, и его начинают эмпирически на внутрибрюшинном введении ванкомицина и цефтазидима. К 3-му дню состояние его симптоматики улучшилось, жидкости очистились. В жидких культурах растет коагулазонегативный стафилококк Staphylococcus , чувствительный к цефазолину и ванкомицину.Ванкомицин и цефтазидим отменены, и он лечится цефазолином внутрибрюшинно в течение 14 дней. Перитонит проходит без рецидива.
Клинически перитонит, вызванный коагулазонегативным стафилококком Staphylococcus , обычно проявляется относительно легкими признаками и симптомами по сравнению с более вирулентными микроорганизмами.15 Заболеваемость изолятов MR увеличивается, о чем сообщалось в 70% коагулазонегативных изолятов Staphylococcus в серия из Бразилии.16 При соответствующей внутрибрюшинной терапии антибиотиками клиническое улучшение обычно проявляется к 3-му дню.Рекомендуется лечение в течение 14 дней с коэффициентом излечения около 70% или более в большинстве серий.16 Замена или удаление катетера часто требуется в рецидивирующих или рецидивирующих случаях, что предположительно происходит из-за образования биопленки в катетере.
S. aureus перитонит
S. aureus обычно вызывает более клинически тяжелую форму перитонита у пациентов с БП из-за множества факторов вирулентности. S. aureus колонизирует многих пациентов в их ноздрях и на коже, а также поражает кожные покровы, например, места выхода.В одном исследовании было обнаружено, что 45% пациентов, начавших БП, являются носителями S. aureus и имели значительно более высокий риск развития инфекции в месте выхода.
S. aureus — частая причина инфекций места выхода и туннельных инфекций. Мупироцин для профилактики в месте выхода, по-видимому, уменьшает инфекции в месте выхода, перитонит и потерю катетера из-за S. aureus ,18
Показательный случай: туннельная инфекция MRSA, ведущая к перитониту
Мужчина 55 лет представляет с болью и припухлостью вдоль туннеля перитонеального катетера.У него нет лихорадки, и его эмпирически лечили ванкомицином внутривенно и пиперациллин-тазобактам. Ему делают разрез и дренируют катетерный туннель. Окрашивание туннельного экссудата по Граму выявляет множество PMNL и грамположительных кокков в скоплениях и растущий MRSA. Прием пиперациллина-тазобактама прекращается, и он лечится ванкомицином. Его переводят в операционную, где выводится наружная часть его катетера. После 5 дней терапии ванкомицином он выписан на пероральный клиндамицин.
Пять недель спустя он возвращается с лихорадкой, ознобом, диффузной болью в животе и гнойными выделениями из места выхода и заметил мутные кровянистые выделения.Его температура 38,1 ° C, кишечные шумы приглушены, наблюдается диффузная болезненность в животе с болезненностью отскока. Жидкость брюшины мутная и красноватого цвета, с 33 800 лейкоцитами и 92% PMNL. Посевы крови, перитонеальной жидкости и места выхода вырастают MRSA. Чреспищеводная эхокардиограмма на растительность отрицательна. Его перитонеальный катетер удален, он переводится на гемодиализ, и ему вводят ванкомицин внутривенно в течение 3 недель после удаления катетера.
Комментарий
Туннельная инфекция с болезненностью, припухлостью и покраснением, распространяющейся более чем на 2 см проксимальнее места выхода, очень трудно вылечить с помощью одной только антибактериальной терапии.В этом случае, ретроспективно, катетер должен был быть удален и заменен при первоначальном осмотре.
Как показывает этот случай, перитонит, вызванный S. aureus , обычно клинически тяжелый.19,20 Он может возникать после заражения прикосновением или через туннельную инфекцию или инфекцию в месте выхода. Лечение зависит от чувствительности возбудителя к противомикробным препаратам. Для чувствительного к метициллину S. aureus предпочтительным является цефазолин для внутрибрюшинного введения, а для лечения MRSA — ванкомицин, вводимый внутрибрюшинно.Если у пациента аллергия на ванкомицин или у него имеется штамм, устойчивый к ванкомицину (VR), можно использовать липопептид даптомицин. 21–23 Сообщалось о различных режимах дозирования даптомицина, но лучший режим, вероятно, составляет 200 мг внутрибрюшинно с 6-часовая выдержка один раз в день.23 Линезолид обладает хорошей активностью в отношении MRSA и успешно применяется для лечения перитонита, вызванного VRE. Используемая доза составляла 600 мг внутривенно дважды в день, 24 но пероральная биодоступность такова, что пероральное дозирование должно быть столь же эффективным.Однако прием 600 мг два раза в день был связан с гематологической токсичностью и лактоацидозом у пациентов с ТПН 25, а доза 400 мг два раза в день эффективна и безопаснее. Цефтаролин — это относительно новый цефалоспорин третьего поколения, который уникален среди β-лактамных антибиотиков тем, что очень активен в отношении MRSA. 26 Цефтаролин также имеет грамположительную активность, сравнимую с цефазолином, и грамотрицательный спектр, подобный цефотаксиму. Цефтаролин может быть эффективной альтернативой ванкомицину при перитоните, вызванном MRSA, но, насколько мне известно, не изучался.Есть некоторые свидетельства того, что добавление рифампицина в течение 5–7 дней к первичным антистафилококковым препаратам уменьшает рецидивы и рецидив перитонита.19 Однако рифампицин является мощным индуктором ферментов, метаболизирующих лекарственные средства, что может снизить концентрацию других препаратов.
Перитонит, вызванный S. aureus , следует лечить антибиотиками в течение 3 недель. Незамедлительное удаление катетера необходимо пациентам с рефрактерным или рецидивирующим перитонитом, а также при инфекциях в месте выхода и туннельных инфекциях, которые не поддаются лечению антибиотиками.Перитонит, вызванный S. aureus , имеет относительно плохие результаты: 20% рецидивов, 23% требуют удаления катетера, 18% переходят на гемодиализ и 2% смертности.20,21
Стрептококковый перитонит
Стрептококковый перитонит встречается реже, на них приходится 5–10% случаев в большинстве серий27,28. Перитонит, вызванный видами стрептококков, схож с перитонитом, вызванным стафилококками, в том смысле, что клинические признаки зависят от вида заражения. Перитонит, вызванный β-гемолитическими стрептококками групп A, B и др., Представлен как S.aureus , с более высокими параметрами воспалительной жидкости в брюшной полости, большей болью и часто с более септической картиной. Стрептококки Viridans представляют собой большую группу видов, определяемых α-гемолизом на культурах кровяного агара. Подобно коагулазонегативным стафилококкам, большинство изолятов стрептококков viridans не являются очень вирулентными организмами, являясь нормальными обитателями ротовой полости и желудочно-кишечного тракта. Сообщалось о случаях перитонита, вызванного вирусом стрептококка, после стоматологической работы. 28
β-Гемолитические стрептококки очень чувствительны к пенициллину и другим β-лактамным антибиотикам.Виды стрептококков Viridans обычно чувствительны к β-лактамам, но в некоторых областях наблюдается рост устойчивости к пенициллинам.29 Руководства ISPD рекомендуют внутрибрюшинный ампициллин для лечения стрептококкового перитонита.2 Ампициллин может быть проблематичным при амбулаторной терапии перитонита, потому что он начинает действовать. распадается в растворе через 6–8 часов.30 Лучшим выбором для пятен, чувствительных к пенициллину, может быть цефазолин, который стабилен в растворе в течение 9 дней при комнатной температуре и 3 недели в холодильнике.30 В отношении устойчивых к пенициллину стрептококков viridans лучшим препаратом будет ванкомицин. У большинства пациентов хорошие результаты после 2-недельной терапии антибиотиками, с показателем успеха до 90% .28,29,32 В некоторых исследованиях сообщалось о повышенном риске рецидива или рецидива перитонита, вызванного вирусом стрептококков viridans. 28,31
Энтерококковый перитонит
Enterococcus spp. являются нормальными обитателями желудочно-кишечного тракта и могут колонизировать или инфицировать мочеполовой тракт.Наиболее распространенными видами, изолированными от инфекций человека, являются Enterococcus faecalis и Enterococcus faecium . E. faecalis обычно чувствителен к ампициллину, пенициллину и ванкомицину, но может быть VR, если несет ген vanB . E. faecium всегда устойчив к пенициллину, ампициллину и карбапенемам и является наиболее распространенным видом энтерококков, который является VR, когда он обладает геном vanA . Все виды энтерококков по своей природе устойчивы ко всем цефалоспориновым антибиотикам.
Энтерококковый перитонит, вероятно, возникает в результате контактного заражения и, возможно, из источников ЖКТ. Энтерококковый перитонит, вызванный единичным организмом, обычно не является слишком тяжелым клинически и хорошо поддается соответствующей терапии, с успешным лечением до 90% случаев.33 Однако до 45% случаев, когда энтерококки изолированы, другие организмы выделяются как хорошо, 32,33 предполагая внутрибрюшной источник инфекции. Результаты значительно хуже при полимикробном энтерококковом перитоните, что приводит к более высокому уровню удаления катетера и постоянного перевода на гемодиализ.32
Варианты противомикробного лечения энтерококкового перитонита ограничены из-за присущей устойчивости ко всем β-лактамам, кроме ампициллина, пенициллина и пиперациллина, которые проблематичны для лечения перитонита. Руководства ISPD рекомендуют лечение ванкомицином внутрибрюшинно в течение 3 недель с добавлением гентамицина в тяжелых случаях2. В случаях полимикробного перитонита могут потребоваться дополнительные противомикробные препараты в зависимости от лекарственной чувствительности других инфекционных организмов.Лечение энтерококкового перитонита VR — непростая задача. VRE обычно устойчив ко всем обычно используемым антибиотикам. Меньшая часть инфекций VRE вызывается бактериями E. faecalis , которые обычно чувствительны к пенициллину и ампициллину. Большая часть VRE — это E. faecium , который по своей природе устойчив к ампициллину. Для перитонита VR E. faecium терапевтический выбор включает даптомицин, линезолид и хинупристин-далфопристин. Среди этих трех соединений наиболее опубликован опыт применения даптомицина, рекомендованного в рекомендациях ISPD.2 Наиболее часто описываемым режимом дозирования даптомицина была ударная доза 100 мг / л внутрибрюшинно, а затем 20 мг / л внутрибрюшинно для последующих доз. 34,35 Даптомицин также успешно применялся у пациентов на автоматическом перинеальном диализе, полученном 7. мг / кг внутрибрюшинно каждые 48 часов22 и пациенту, которому вводят 5 мг / кг внутривенно каждые 48 часов.21 Другой более простой режим — 200 мг внутрибрюшинно во время длительного пребывания у пациентов на автоматизированном ПД.23 Имеется меньше опубликованных опытов с линезолидом, с двумя сообщения об успешном лечении перитонита VRE, получавшего линезолид в дозе 600 мг внутривенно каждые 12 часов.24,36 В серии случаев сообщалось о гематологической токсичности с анемией, лейкопенией и тромбоцитопенией у пациентов, получавших линезолид в дозе 600 мг два раза в день в течение 14 дней или более, и в одном сообщении о фатальном лактоацидозе.25,37 Дозировка линезолида в дозе 400 мг два раза в день позволила достичь терапевтические концентрации и быть безопаснее. Кроме того, при пероральном приеме линезолид на 100% биодоступен, поэтому внутривенное или внутрибрюшинное введение, вероятно, не требуется.38
Corynebacterium peritonitis
Corynebacterium — это род с множеством видов маленьких грамположительных палочек.Часто называемые дифтероидами, они обычно колонизируют кожу и слизистые оболочки человека. Помимо Corynebacterium diphtheriae , они, как правило, являются патогенами с низкой вирулентностью, напоминающими инфекции, вызываемые коагулазонегативным стафилококком Staphylococcus . В большинстве больших серий коринебактерии составляют менее 5% случаев перитонита, связанного с БП. В двух крупнейших сериях коринебактериального перитонита в одной сообщалось в целом о хороших исходах и рекомендовалась терапия цефазолином 39, в то время как в другой сообщалось о частоте рецидивов 48% и были получены лучшие результаты с ванкомицином.40 Большинство видов коринебактерий восприимчивы к цефазолину, но некоторые виды — Corynebacterium jeikeium и Corynebacterium striatum — мультирезистентны и чувствительны только к ванкомицину (см. Случай). В рекомендациях ISPD рекомендуется лечение в течение 3 недель2.
Показательный случай.
У 57-летнего мужчины в анамнезе 2 дня боли в животе и мутные выделения. У него нет лихорадки, легкая болезненность в животе без отскока болезненности. Его жидкость PD содержит 2000 лейкоцитов с 83% PMNL и отрицательным окрашиванием по Граму.Он получает эмпирическую терапию ванкомицином и цефтазидимом внутрибрюшинно. В его культурах из перитонеальной жидкости вырастает C. jeikeium , но наша лаборатория не определяет лекарственную чувствительность к коринебактериям. Его терапия заменена только цефазолином. К сожалению, C. jeikeium всегда устойчив к цефазолину и большинству других антибиотиков, поэтому консультации по поводу инфекционных заболеваний не запрашивались. Три месяца спустя он возвращается с болью в животе, кровянистыми выделениями и плохо функционирующим катетером.Его перитонеальная жидкость содержит 1800 лейкоцитов с 93% PMNL, 8000 эритроцитов и отрицательное окрашивание по Граму. Он лечится эмпирически с применением ванкомицина и цефтазидима внутрибрюшинно. Культуры перитонеальной жидкости снова выращивают C. jeikeium . Предпринята попытка удаления перитонеального катетера, но безуспешно из-за обширных спаек, и пациента переводят на гемодиализ. Культуры крови отрицательны, но культуры перитонеальной жидкости снова вырастают. C. jeikeium . Его катетер, наконец, удален, и его кончик вырастает до C.Ашхабад . Компьютерная томография его брюшной полости выявила скопление жидкости в передней части брюшной полости размером 23 × 10 × 20 см, и ему поставлен диагноз — инкапсулирующий перитонит.
Комментарий
В этом неудачном случае не было обнаружено, что он был инфицирован устойчивым видом Corynebacterium , который не был должным образом обработан и привел к отказу методики.
Грамотрицательный кишечный перитонит
Грамотрицательные кишечные бактерии являются членами семейства Enterobacteriaceae и включают виды Escherichia coli и Klebsiella , Enterobacter , Citrobacter и Proteus spp.Эта группа организмов является частью нормальной флоры желудочно-кишечного тракта, может колонизировать верхний пищеварительный тракт и мочеполовой тракт и широко распространена в окружающей среде. Эти организмы имеют двухслойную клеточную мембрану, которая содержит липополисахарид (эндотоксин), который является важным фактором вирулентности.
В большинстве случаев перитонита грамотрицательные кишечные бактерии составляют 10–25% случаев, причем самые высокие показатели зарегистрированы в Азии и Австралии. В последние годы процент случаев, вызванных этими микроорганизмами, увеличился, возможно, из-за относительного снижения числа стафилококковых инфекций в результате широкого использования мупироцина для профилактики в месте выхода.41 Перитонит, вероятно, возникает в результате заражения прикосновением, но иногда в результате инфекции в месте выхода, туннельной инфекции или внутрибрюшного источника. Недавняя антибактериальная терапия перитонита или других показаний является фактором риска развития грамотрицательного кишечного перитонита.42
Клинические признаки и симптомы перитонита, вызванного грамотрицательными кишечными бактериями, имеют тенденцию быть более серьезными, с лихорадкой, более сильной болью в животе, тошнота, рвота и диарея.42 Недавний курс антибиотиков при перитоните, инфекции места выхода или по другим причинам присутствует примерно у трети пациентов.42,43
На долю E. coli приходится 30–50% случаев, за ней следуют Klebsiella и Enterobacter spp. Полимикробный грамотрицательный перитонит должен вызывать подозрение на наличие внутрибрюшного источника, такого как прободение внутренних органов или дивертикулит.
Большинство, если не все центры включают антибиотики с широкой грамотрицательной активностью, такие как цефтазидим или цефепим, или гентамицин или тобрамицин, в начальную эмпирическую терапию. Однако за последние 10–20 лет энтеробактерии стали все более устойчивыми ко многим антибиотикам.41,42,44,45 β-лактамазы расширенного спектра (БЛРС) — это плазмидные ферменты, расщепляющие цефалоспорины. 44 Штаммы грамотрицательных палочек, продуцирующие БЛРС, более распространены в Южной Азии, причем в двух сериях сообщается, что 12% и 35% из их перитонеальных изолятов E. coli продуцировали БЛРС.46,47. Пациенты, инфицированные штаммами E. coli , продуцирующими БЛРС, в три-четыре раза чаще не проходят лечение, чем пациенты без БЛРС Штаммы-продуценты.47 Как всегда, окончательная терапия должна основываться на тестах на лекарственную чувствительность, но в целом штаммы, продуцирующие БЛРС, обычно чувствительны к карбапенемам, таким как имипенем, меропенем и эртапенем, и обычно чувствительны к аминогликозидам, таким как гентамицин или тобрамицин.Кроме того, организмы SPICE ( Serratia , Pseudomonas , Proteus , Citrobacter и Enterobacter spp.) Обычно содержат ферменты β-лактамазы AmpC, которые расщепляют большинство цефалоспориновых антибиотиков и лучше всего лечятся карбапенемами. фторхинолоны или аминогликозиды, в зависимости от лекарственной чувствительности. 43 Еще большее беспокойство вызывает появление и распространение устойчивых к карбапенемам Enterobacteriaceae (CRE) или Klebsiella pneumoniae , продуцирующих карбапенемазу (KPC).48 Эта форма устойчивости к антибиотикам передается между бактериальными штаммами на мобильных генетических элементах и приводит к устойчивости ко всем β-лактамным антибиотикам, включая карбапенемы, и, как правило, к фторхинолонам и многим аминогликозидам. Варианты лечения в большинстве случаев ограничиваются полимиксином, колистином или тигециклином, в зависимости от исследований лекарственной чувствительности.48
Большинство эмпирических схем антибиотиков при перитоните, связанном с БП, включают довольно широкий охват грамотрицательных бактерий, включая цефалоспорины широкого спектра действия ( цефтазидим или цефепим) или аминогликозид.После получения результатов посева и определения чувствительности терапию можно сузить до одного эффективного антибиотика. Терапию следует продолжать в течение 3 недель2. Несмотря на оптимальную антибактериальную терапию, перитонит, вызванный грамотрицательными кишечными бактериями, приводит к относительно высокой частоте отказов, удалению катетера, постоянному переводу на гемодиализ и смерти.42,43
Перитонит, вызванный неферментирующим Грамом. -отрицательные палочки:
Pseudomonas , Acinetobacter и Stenotrophomonas
Pseudomonas , Acinetobacter и Stenotrophomonas являются строгими аэробами (неферментерами), которые в индивидуальном порядке составляют менее 5% случаев перитонита в программах .Важность этих организмов заключается в том, что они обычно устойчивы к большинству антибиотиков, что затрудняет их лечение, и имеют высокую частоту неудач, часто приводящую к удалению катетера.
Pseudomonas , перитонит
Pseudomonas aeruginosa — распространенный нозокомиальный патоген, который обычно обладает множественной лекарственной устойчивостью. Перитонит Pseudomonas часто возникает после недавнего курса антибиотиков по поводу перитонита или по другим показаниям.49 Рекомендуется лечение двумя антибиотиками в течение 3 недель2, а также рекомендуется удаление катетера, если присутствует туннельная инфекция или наблюдается неоптимальный ответ на терапию антибиотиками.49,50 Окончательная терапия основана на результатах теста на чувствительность к противомикробным препаратам. Комбинация β-лактамного агента широкого спектра действия и аминогликозида обычно дает синергетический эффект. β-лактамы с антипсевдомонадной активностью включают цефтазидим, цефепим, пиперациллин, имипенем, меропенем и азтреонам. Тобрамицин и амикацин являются наиболее активными аминогликозидами, а ципрофлоксацин имеет лучшую активность среди фторхинолонов. В случае полирезистентных штаммов может потребоваться полимиксин или колистин.Показатели неэффективности антибактериальной терапии, удаления катетера и постоянного перевода на гемодиализ выше, чем у большинства патогенов.49,50
Acinetobacter перитонит
Acinetobacter перитонит встречается нечасто, составляя 3–7% случаев в сообщенная серия.51,52 Подобно Pseudomonas , Acinetobacter по своей природе устойчив к большинству антибиотиков и легко вырабатывает устойчивость в результате мутаций и приобретения генетического материала от других организмов.53 Относительно высока частота терапевтических неудач, удаления катетера и летальности при перитоните Acinetobacter , особенно с лекарственно-устойчивыми штаммами.51,52 Как и Pseudomonas , терапия должна основываться на результатах тестирования на чувствительность, а терапия два активных препарата могут быть более эффективными. Большинство штаммов чувствительны к сульбактаму, который не доступен в виде единственного агента, но находится в виде ампициллина-сульбактама. Обычно активны карбапенемы и аминогликозиды.53 Для микроорганизмов с множественной лекарственной устойчивостью часто активны тигециклин и миноциклин, но имеется небольшой опыт использования этих препаратов при перитоните при БП. Наконец, обычно активны полимиксин B и колистин. Терапию следует продолжать в течение 3 недель.
Stenotrophomonas перитонит
Stenotrophomonas maltophilia — еще одна неферментирующая грамотрицательная палочка, которая обычно обладает множественной лекарственной устойчивостью. Согласно опубликованным сериям, на него обычно приходится менее 5% случаев перитонита.54,55 Недавний курс антибиотиков оказался фактором риска в одной серии исследований54.
Stenotrophomonas обладает высокой устойчивостью к большинству β-лактамных антибиотиков, особенно к карбапенемам и аминогликозидам. Имеет хромосомную карбапенемазу. Наиболее активными препаратами являются триметоприм-сульфаметоксазол, колистин, азтреонам, пиперациллин-тазобактам и моксифлоксацин. Исходя из ограниченного опыта, перитонит Stenotrophomonas следует лечить двумя эффективными препаратами в течение 3 недель. Несмотря на это, высока вероятность отказов и потери катетера.
Полимикробный перитонит
Полимикробный перитонит, выделение более чем одного микроорганизма в одном эпизоде перитонита, сообщается примерно в 10% случаев в большинстве серий.56,57 Полимикробный перитонит чаще встречается у пациентов с предшествующими эпизодами перитонита. Полимикробный перитонит, вызванный только грамположительными микроорганизмами, составляет около 20% случаев и имеет наилучший прогноз с точки зрения эффективности лечения и удержания катетера. Инфекции, которые включают грамотрицательные бактерии, анаэробы или грибки, имеют худшие результаты, с более высокой частотой неудач, удалением катетера и постоянным переводом на гемодиализ.56–58 Изоляция нескольких видов, особенно грамотрицательных кишечных бактерий и анаэробов, должна вызывать подозрение на внутрибрюшную инфекцию, которая присутствует менее чем в 10% случаев. Антимикробную терапию следует проводить в соответствии с результатами посева и чувствительностью и продолжать в течение 3 недель. Пациентам с плохим ответом на терапию следует как можно скорее удалить катетеры, чтобы сохранить перитонеальную мембрану.57
Перитонит с отрицательным посевом
Перитонит с отрицательным посевом, как следует из названия, является случаем с клиническими признаками перитонита: боль в животе, повышенные уровни лейкоцитов в перитонеальной жидкости и культуры перитонеальной жидкости, не являющиеся возбудителями.Возможными причинами отрицательных посевов являются введение антибиотиков перед посевом из перитонеальной жидкости, неоптимальное обращение или обработка культур или методы культивирования 59–61 или присутствие привередливых организмов, КУБ или нитчатых грибов. Руководящие принципы рекомендуют эталонный уровень менее 20% случаев с отрицательным посевом. Как правило, пациенты с перитонитом с отрицательной культурой чувствуют себя хорошо. Перитонеальная жидкость должна быть повторно оценена на 3-й день, чтобы оценить ответ на терапию. Тем, кто отвечает на начальную эмпирическую терапию, можно отменить прием грамотрицательных антибиотиков и лечить их 2-недельным ванкомицином или цефазолином.2,59 Пациенты, которые не реагируют на эмпирическую терапию уменьшением боли в животе и / или улучшением количества лейкоцитов в брюшной полости, должны быть повторно обследованы на предмет инфекции привередливыми бактериями, грибами или микобактериальной инфекцией с более вовлеченными бактериальными культурами и культурами для AFB и грибы. Отсутствие ответа также должно побуждать к рассмотрению вопроса об удалении катетера через 5-7 дней.
Грибковый перитонит
Заболеваемость грибковым перитонитом варьируется от центра к центру, от <5% до 15% случаев.62
Candida spp. составляют 90% и более эпизодов грибкового перитонита. В более ранних исследованиях большинство из случаев перитонита Candida было вызвано Candida albicans . В более поздних исследованиях сообщалось о Candida albicans менее чем в половине случаев с частым выделением Candida parapsilosis , Candida tropicalis и Candida krusei .62–65
Candida spp. являются частью нормальной флоры кожи и желудочно-кишечного тракта большинства людей, а терапия антибиотиками увеличивает плотность их колонизации.Таким образом, в большинстве случаев перитонит Candida происходит после недавнего курса антибиотиков по поводу перитонита или по другим показаниям. Заражение прикосновением — обычный путь заражения.
Клиническая картина перитонита Candida напоминает бактериальный перитонит с болью в животе и повышенным количеством лейкоцитов в перитонеальной жидкости с преобладанием нейтрофилов. Candida существует только в дрожжевой форме и легко растет на обычных средах для культивирования бактерий. Специфические грибковые культуры не нужны.Широко доступны тесты на чувствительность к противогрибковым препаратам, а также тесты на флуконазол, флуцитозин, амфотерицин B и каспофунгин. В случае перитонита Candida начальная эмпирическая терапия должна состоять из флуконазола, до определения вида и тестирования лекарственной чувствительности. Флуконазол вводят в дозе 200 мг внутрибрюшинно каждые 24–48 часов или перорально в нагрузочной дозе 200 мг с последующим приемом 50–100 мг в день. Должен быть проведен тест на лекарственную чувствительность, потому что C.krusei всегда устойчив к флуконазолу, а Candida glabrata часто устойчив. Кроме того, другие Candida spp. может стать резистентным.65 В случае резистентных к флуконазолу организмов успешно применялась терапия амфотерицином В 0,75–1 мг / кг / день внутривенно вместе с пероральным приемом флуцитозина 1 г в день. Амфотерицин для внутрибрюшинного введения вызывает сильное раздражение, и его трудно использовать. Если используется флуцитозин, следует измерять минимальные уровни в сыворотке с целевым уровнем 25–50 мкг / мл, чтобы избежать токсичности.66 Вориконазол — новый триазольный противогрибковый препарат, который активен в отношении многих устойчивых к флуконазолу штаммов.67 Имеется небольшой опыт использования вориконазола для лечения перитонита Candida , но он успешно применялся при лечении перитонита, вызванного мицелиальными грибами, в дозе 200 мг внутрибрюшинно один раз в день или 200 мг перорально два раза в день.68,69
Candida перитонит трудно лечить эффективно, и он приводит к высокому уровню потери катетера и необратимому переходу на гемодиализ.Руководства ISPD и ряд других источников рекомендуют немедленное удаление катетера при постановке диагноза перитонита Candida с последующим 2-недельным курсом противогрибковой терапии.2,62,64,65,70 Тем не менее, две опубликованные серии показали довольно хороший успех с другими методами лечения . Ван и др. Пролечили 13 пациентов с перитонитом Candida внутривенным введением амфотерицина B и перорального флуконазола, оставив катетер на месте до тех пор, пока сток не выйдет.66 Эти пациенты получали противогрибковые препараты в течение еще 1-2 недель с последующей заменой катетера примерно через 4 недели. начало лечения.Однако ни один из этих 13 пациентов не вернулся к ПД. Boer et al успешно пролечили восемь пациентов с Candida перитонитом с установленными катетерами.71 Пациенты получали флуконазол 150 мг внутрибрюшинно каждые 48 часов, флуцитозин перорально 500 мг два раза в день, а катетеры блокировали 10 мл амфотерицина B 0,1 мг / мл после каждого непрерывного приема. амбулаторный обмен ПД.
Большинство пациентов с перитонитом Candida получали недавно курс антибиотиков от перитонита или по другим показаниям до постановки диагноза перитонита Candida .72 Антибиотики широкого спектра действия уменьшают нормальную бактериальную флору кожи и желудочно-кишечного тракта и мочеиспускательного канала, а также способствуют чрезмерному росту с помощью Candida spp. Ранние исследования показали, что терапия пероральным нистатином, невсасывающимся противогрибковым средством, принимаемым во время антибиотикотерапии, может снизить частоту вторичного грибкового перитонита, но степень защиты была невысокой.73 Более недавнее рандомизированное контролируемое исследование, в котором пациенты получали антибиотики для лечения заболеваний. бактериальный перитонит, прием флуконазола 200 мг перорально каждые 48 часов снизил частоту вторичного грибкового перитонита более чем на 80%.74 В настоящее время это рекомендовано в рекомендациях ISPD.2
Перитонит, вызванный мицелиальными грибами или плесенью, встречается реже, чем Candida , составляя менее 10% случаев грибкового перитонита.72 Эти организмы повсеместно распространены в окружающей среде, и вероятно, вызывают перитонит из-за заражения прикосновением. Клинические проявления и исследования перитонеальной жидкости напоминают бактериальный перитонит. 75 Эти организмы плохо растут на стандартных средах для культивирования бактерий, поэтому в случаях с отрицательными посевами, которые не улучшаются к 3 дню эмпирической антибактериальной терапии, следует получить жидкость для грибковых культур.Эти культуры инокулируются на питательные среды для грибов, и организмы растут как плесень. Наиболее часто встречающиеся микроорганизмы — это Aspergillus , за которыми следует Mucor (мукормикоз), но, как сообщается, множество других видов вызывают грибковый перитонит.62,75 После постановки диагноза катетер следует немедленно удалить. Эти организмы почти всегда устойчивы к флуконазолу, но могут быть восприимчивы к вориконазолу или позаконазолу и обычно чувствительны к амфотерицину B.Имеется не так много публикаций об этих инфекциях, но большинство из них будет лечить с помощью эффективной противогрибковой терапии в течение 2–8 недель, прежде чем пытаться заменить катетер. Отчеты о случаях были успешными с применением внутрибрюшинного и перорального вориконазола при перитоните Aspergillus и липосомального амфотерицина B и перорального позаконазола при перитоните Mucor .68,69 Несмотря на оптимальное лечение, половина или более этих пациентов испытают неэффективность техники и будут переведены на гемодиализ.76,77
Микобактериальный перитонит
Микобактериальные инфекции человека делятся на две группы: инфекции, вызываемые Mycobacterium tuberculosis (MTB), и инфекции, вызываемые нетуберкулезными микобактериями (NTM). Инфекция MTB передается от одного человека к другому, обычно вызывая скрытую инфекцию, которая может возобновиться. НТМ — это организмы окружающей среды, которые не передаются от человека к человеку, и, хотя они являются редкими причинами перитонита при БП, частота их распространения увеличивается.
Туберкулезный перитонит
Туберкулезный перитонит обычно возникает при реактивации латентной туберкулезной инфекции. Хроническая почечная недостаточность является иммунодепрессивной и связана с 100-кратным увеличением частоты реактивации болезни.78 Скрининг пациентов на латентную туберкулезную инфекцию должен стать обычной практикой, когда они готовятся к диализу или входят в программу диализа, особенно если они живут в эмигрировали из региона, где высока заболеваемость латентной туберкулезной инфекцией (Азия, Африка, Южная или Центральная Америка).Это легко сделать с помощью туберкулиновой кожной пробы или анализа высвобождения IFNγ.79 Пациенты, у которых диагностирована латентная туберкулезная инфекция, должны получать профилактическую терапию изониазидом 300 мг в день или 900 мг три раза в неделю с пиридоксином 50 мг в день в течение 9 месяцев. . Это значительно снизит риск развития активного туберкулеза.
У пациентов с БП, у которых развивается активный туберкулез, перитонит является очагом инфекции (37%) почти так же часто, как туберкулез легких (40%) .80 Клинические проявления туберкулезного перитонита напоминают бактериальную инфекцию с лихорадкой, болями в животе и облачностью. диализат с повышенным содержанием лейкоцитов, которые обычно являются преимущественно PMNL.81,82 Основное различие состоит в том, что перитонит, как правило, имеет подострое начало признаков и симптомов. Обычные бактериальные культуры перитонеальной жидкости отрицательны, а мазки жидкости на КУБ редко бывают положительными. Во время презентации кожные пробы на туберкулез обычно отрицательны из-за анергии.83,84 В случае перитонита с отрицательным посевом следует рассмотреть вопрос о туберкулезе и направить жидкость на мазки и посевы на КУБ. Частота положительных мазков на КУБ перитонеальной жидкости в большинстве серий составляет менее 20%, а посевы КУБ с использованием системы BacT являются положительными в 70–90%, но для получения положительного результата требуется 10–14 дней.Биопсия брюшины обычно дает положительный результат при наличии гранулем и положительных посевов, но она инвазивна. Более быстрый способ диагностики — это прямая ПЦР жидкости PD. ПЦР на МТБ дает результаты в течение нескольких часов, она очень чувствительна и специфична для туберкулезного перитонита.81,83–85
При постановке диагноза туберкулезного перитонита следует начать четырехкомпонентную противотуберкулезную терапию. Руководства ISPD рекомендуют изониазид 300 мг один раз в день, рифампицин 600 мг один раз в день, пиразинамид 25–35 мг / кг три раза в неделю и офлоксацин перорально 200 мг один раз в день с пероральным пиридоксином 50 мг один раз в неделю.2 Этамбутол не рекомендуется из-за риска неврита зрительного нерва. Для чувствительных к лекарствам штаммов пиразинамид и офлоксацин можно прекратить через 2 месяца, а изониазид и рифампин продолжать в общей сложности 12–18 месяцев. В нескольких сериях лечение без удаления катетера приводило к хорошим результатам. 80,82–84 Несмотря на оптимальную диагностику и терапию, уровень смертности составляет 20–30%.
Нетуберкулезный микобактериальный перитонит
NTM — это группа из 150 или более видов, многие из которых были идентифицированы как патогены человека.Эти организмы существуют в окружающей среде в воде, почве, животных и птицах, обычно поступают из воды или других источников окружающей среды и не передаются от одного человека к другому.86 В большинстве центров США перитонит, вызванный НТМ, более выражен. чаще, чем МТБ. НТМ может также вызвать инфекции места выхода, что может привести к перитониту. Использование гентамицина для профилактики в месте выхода было связано с увеличением частоты инфицирования NTM в месте выхода. 6,87
Клинические проявления перитонита NTM напоминают бактериальный перитонит, с болью в животе и мутными выделениями с преобладанием нейтрофилов, но бактериального происхождения. посевы обычно отрицательны через 3 дня.Мазки жидкости на КУБ обычно отрицательны. Наиболее частыми возбудителями являются быстрорастущие Mycobacterium abscessus , Mycobacterium chelonae и Mycobacterium fortuitum .88–92 Эти организмы часто будут расти на обычных питательных средах для бактерий в течение 5 дней. Они представляют собой грамположительные палочки при окрашивании по Граму и могут быть ошибочно идентифицированы как дифтероиды. Если это произойдет, попросите лабораторию провести окрашивание изолята AFB. Идентификация видов и тестирование на чувствительность к противомикробным препаратам необходимы для эффективной терапии.Эти организмы обычно устойчивы к стандартным противотуберкулезным препаратам, таким как изониазид, рифампицин и пиразинамид. При лечении следует руководствоваться тестом на чувствительность к противомикробным препаратам и часто включать аминогликозиды, макролиды и фторхинолоны. Более 80% зарегистрированных случаев требуют удаления катетера с продолжением противомикробной терапии в течение не менее 6 недель после этого.
Профилактика перитонита
Частота перитонита, связанного с БП, за последние годы существенно снизилась за счет улучшения оборудования, техники и профилактических мер.В рекомендациях ISPD от 2016 г. рекомендовано 0,5 эпизода в год или один эпизод каждые 2 года2. Снижение числа случаев перитонита — многогранный процесс, начинающийся с обширного обучения пациентов с упором на правильную технику.93,94 Считается, что промывка перед заполнением с помощью Y-образных соединителей частично снижает частоту перитонита. Было показано, что профилактическое назначение антибиотиков с ванкомицином или цефалоспоринами первого или второго поколения до установки катетера снижает послеоперационные катетерные инфекции и рекомендуется в руководствах ISPD.2,95 Некоторые данные свидетельствуют о том, что скрининг пациентов на носительство S. aureus и лечение носителей интраназальным мупироцином снижает послеоперационные инфекции Staphylococcus 6,95. мало влияют на частоту перитонита, равно как и выбор диализных жидкостей.2
В случае нарушения техники, например, заражения прикосновением, пациента следует обучить, чтобы он немедленно уведомил своего поставщика.Если жидкость не вливалась, пациенту может потребоваться замена конца трубки. Если есть вероятность заражения и вливания жидкости, вероятно, показан короткий курс профилактического лечения антибиотиками, в зависимости от характера заражения. Обычно это однократная внутрибрюшинная доза цефазолина или 2-дневный курс перорального антибиотика, такого как цефалексин.95
Пациенты должны быть обучены правильному уходу на месте выхода. Перед любым уходом на месте выхода очень важно соблюдать правила гигиены рук.Место выхода следует очищать не реже двух раз в неделю и после душа с антибактериальным мылом и водой или хлоргексидиновым мылом.2,6 Доказано, что ежедневное нанесение противомикробных препаратов на место выхода снижает риск инфицирования места выхода и перитонита. Крем с мупироцином, наносимый ежедневно на место выхода, снижает количество инфекций места выхода S. aureus и перитонита на 73% .96
Мупироцин имеет активность только против Staphylococcus , Streptococcus и других грамположительных бактерий. .Крем с гентамицином также эффективен в снижении инфекций в месте выхода, вызванных S. aureus , Pseudomonas и другими грамотрицательными бактериями.97 Однако в некоторых исследованиях сообщается об увеличении частоты инфекций в месте выхода, вызванных S. aureus . , Грамотрицательные кишечные бактерии, Pseudomonas , 98 и NTM у пациентов, использующих гентамицин для профилактики в месте выхода. 6,87
Инвазивные диагностические и терапевтические процедуры, приводящие к транзиторной бактериемии, считаются причинами перитонита.Рекомендуется антибиотикопрофилактика однократной пероральной дозой 2 г амоксициллина за 2 часа до стоматологических процедур, вызывающих кровотечение десен.95 Перипроцедурная антибиотикопрофилактика парентеральным введением ампициллина и гентамицина также рекомендуется пациентам, подвергающимся колоноскопии, гистероскопии или другим инвазивным процедурам. разрушать колонизированные поверхности слизистой оболочки, чтобы предотвратить перитонит.2,95 Как упоминалось ранее, противогрибковая профилактика пероральным флуконазолом рекомендуется пациентам с БП, которые получают антибиотики от перитонита или других инфекций.2
Сноски
Раскрытие информации
Автор сообщает об отсутствии конфликта интересов в этой работе.
Ссылки
1. Grassmann A, Gioberges S, Moeller S, Brown G. Пациенты с ESRD в 2004 году: глобальный обзор количества пациентов, методов лечения и связанных тенденций. Пересадка нефрола Dial. 2005; 20: 2587–2593. [PubMed] [Google Scholar] 2. Ли П.К., Сзето С.К., Пираино Б. и др. Рекомендации ISPD по перитониту: обновленная информация о профилактике и лечении 2016 г. Perit Dial Int.2016; 36: 481–508. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Муджаис С. Микробиология и исходы перитонита в Северной Америке. Kidney Int. 2006; 70: S55 – S62. [PubMed] [Google Scholar] 4. Гали Дж. Р., Баннистер К. М., Браун Ф. Г. и др. Микробиология и исходы перитонита у австралийских пациентов на перитонеальном диализе. Perit Dial Int. 2011; 31: 651–662. [PubMed] [Google Scholar] 5. ван Дуэпен А.Т., Томлинсон Г.А., Джассал С.В. Связь между инфекцией места выхода и последующим перитонитом у пациентов на перитонеальном диализе.Clin J Am Soc Nephrol. 2012; 7: 1266–1271. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Сзето С.К., Ли П.К., Джонсон Д.В. и др. Рекомендации ISPD по инфекциям, связанным с катетером: обновление 2017 г. Perit Dial Int. 2017; 37: 141–154. [PubMed] [Google Scholar] 7. Burkhalter F, Clemenger M, Haddoub SS, McGrory J, Hisole N, Brown E. Pseudomonas Инфекция места выхода: результаты лечения гентамицином для местного применения в дополнение к системным антибиотикам. Clin Kidney J. 2015; 8: 781–784. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8.Альфа М.А., Дегань П., Олсон Н., Хардинг Г.К. Улучшенное обнаружение роста бактерий в стоках постоянного амбулаторного перитонеального диализа за счет использования бутылочек BacT / Alert FAN. J Clin Microbiol. 1997; 35: 862–866. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Бибер С.Д., Андерсон А.Е., Мехрота Р. Диагностическое тестирование перитонита у пациентов, находящихся на перитонеальном диализе. Semin Dial. 2014; 27: 602–606. [PubMed] [Google Scholar] 10. Ругер В., ван Иттерсум Ф.Дж., Комаззеттос С.Е., Хукс С.Е., тер Ви П.М. Сходные исходы перитонита у пациентов с CAPD и APD при продолжении диализа во время перитонита.Perit Dial Int. 2011; 31: 39–47. [PubMed] [Google Scholar] 11. de Moraes TP, Olandoski M, Caramori JC и др. Новые предикторы исходов, связанных с перитонитом, в когорте BRAZPD. Perit Dial Int. 2012; 34: 179–187. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. von Eiff C, Peters G, Heilmann C. Патогенез инфекций, вызванных коагулазонегативными стафилококками. Lancet Infect Dis. 2002; 2: 677–685. [PubMed] [Google Scholar] 13. Донлан РМ. Формирование биопленок: клинически значимый микробиологический процесс.Clin Infect Dis. 2001; 33: 1387–1392. [PubMed] [Google Scholar] 14. Берк М., Хоули С.М., Бадве С.В. и др. Рецидивирующий и рецидивирующий перитонит, связанный с перитонеальным диализом: многоцентровое регистрационное исследование. Am J Kidney Dis. 2011. 58: 429–436. [PubMed] [Google Scholar] 15. Фахим М., Хоули С.М., Макдональд С.П. и др. Коагулазонегативный стафилококковый перитонит у австралийских пациентов на перитонеальном диализе: предикторы, лечение и исход в 936 случаях. Пересадка нефрола Dial. 2010; 25: 3386–3392. [PubMed] [Google Scholar] 16.Camargo CH, da Cunha ML, Caramori JC, Mondelli AL, Montelli AC, Barretti P. Перитонит, связанный с перитонеальным диализом, вызванный коагулазонегативным стафилококком Staphylococcus : обзор 115 случаев в бразильском центре. Clin J Am Soc Nephrol. 2014; 9: 1074–1081. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Лузар М.А., Коулз Га, Фаллер Б. и др. Staphylococcus aureus Носительство через нос и инфекция у пациентов, находящихся на непрерывном амбулаторном перитонеальном диализе. N Engl J Med. 1990; 372: 505–509. [PubMed] [Google Scholar] 18.Ritzou J, Hoffmann RM, Tzamaloukas AH. Влияние предотвращения носительства Staphylococcus aureus на частоту возникновения стафилококковых инфекций, связанных с перитонеальным катетером. Perit Dial Int. 2001; 21: 471–479. [PubMed] [Google Scholar] 19. Szeto CC, Chow KM, Kwan BC, et al. Золотистый стафилококк осложняет перитонеальный диализ: обзор 245 последовательных случаев. Clin J Am Soc Nephrol. 2007; 2: 245–251. [PubMed] [Google Scholar] 20. Говиндараджулу С., Хоули С.М., Макдональд С.П. и др. Staphylococcus aureus Перитонит у австралийских пациентов на перитонеальном диализе: предикторы, лечение и исходы у 503 пациентов.Perit Dial Int. 2010. 30: 311–319. [PubMed] [Google Scholar] 21. Хаджинов Д., Джухадар С., Петерс Х. Уровни плазмы и перитонеального диализата во время терапии даптомицином при перитоните. Am J Kidney Dis. 2009; 53: 911–912. [PubMed] [Google Scholar] 22. Бахте С.К., Бертрам А., Буркхард О. и др. Терапевтические концентрации даптомицина в сыворотке крови после внутрибрюшинного введения у пациента с перитонитом, связанным с перитонеальным диализом. J Antimicrob Chemother. 2010; 65: 1312–1314. [PubMed] [Google Scholar] 23.Сен-Поль LP, Фишё М., Дебрюн Д. и др. Фармакокинетика внутрибрюшинного даптомицина у пациентов с перитонитом, связанным с перитонеальным диализом. Perit Dial Int. 2017; 37: 44–50. [PubMed] [Google Scholar] 24. Сон Ай Джей, Со Дж. У., Квон Й. Е. и др. Успешное лечение ванкомицин-резистентного энтерококкового перитонита с использованием линезолида без удаления катетера у пациента на перитонеальном диализе. Perit Dial Int. 2014; 34: 235–239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Gervasoni C, Bergia R, Cozzi V, Clementi E, Cattaneo D.Не пора ли пересмотреть дозы линезолида у пациентов на перитонеальном диализе? J Antimicrob Chemother. 2015; 70: 2918–2920. [PubMed] [Google Scholar] 26. Сараволац Л.Д., Штейн Г.Е., Джонсон Л.Б. Цефтаролин: новый цефалоспорин с активностью против метициллин-устойчивого Staphylococcus aureus . Clin Infect Dis. 2011; 52: 1156–1163. [PubMed] [Google Scholar] 27. О’Ши С., Хоули С.М., Макдональд С.П. и др. Стрептококковый перитонит у австралийских пациентов на перитонеальном диализе: предикторы, лечение и исходы в 287 случаях.BMC Nephrol. 2009; 10:19. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Шукла А., Абреу З., Баргман Дж. М.. Стрептококковый перитонит при БП: 10-летний обзор опыта одного центра. Пересадка нефрола Dial. 2006; 21: 3545–3549. [PubMed] [Google Scholar] 29. Hsu RB, Fang-Yue L. Влияние устойчивости к пенициллину на проявление и исход неэнтерококкового стрептококкового инфекционного эндокардита. Кардиология. 2006; 105: 234–239. [PubMed] [Google Scholar] 30. Робертс Д.М., Фернандо Дж., Певец Р.Ф., Кеннеди К.Дж., Лоуренс М., Талауликар Г.Стабильность антибиотиков в коммерческих растворах для перитонеального диализа: влияние состава, хранения и продолжительности. Пересадка нефрола Dial. 2011; 26: 3344–3349. [PubMed] [Google Scholar] 31. Чао С.Дж., Ли С.И., Ян В.С. и др. Стрептококки Viridans при перитоните перитонеального диализа: клиническое течение и отдаленные результаты. Perit Dial Int. 2015; 35: 333–341. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Эдей М., Хоули С.М., Макдональд С.П. и др. Энтерококковый перитонит у австралийских пациентов на перитонеальном диализе: предикторы, лечение и исходы в 116 случаях.Пересадка нефрола Dial. 2010; 25: 1272–1278. [PubMed] [Google Scholar] 33. Yip T, Tsa KC, Ng F, et al. Клиническое течение и исходы перитонита, вызванного энтерококками, у пациентов на перитонеальном диализе. Perit Dial Int. 2011; 31: 522–528. [PubMed] [Google Scholar] 34. Huen SC, Hall I, Topal J, Mahnensmith RL, Brewster UC, Abu-Alfa AK. Успешное применение даптомицина внутрибрюшинно при лечении ванкомицин-резистентного энтерококкового перитонита. Am J Kidney Dis. 2009; 54: 538–541. [PubMed] [Google Scholar] 35.Гилмор Дж. Ф., Кин М., Ла Сальвия М. Т., Махони М. В.. Лечение энтерококкового перитонита внутрибрюшинным даптомицином у пациентов с аллергией на ванкомицин и обзор литературы. Perit Dial Int. 2013; 33: 353–357. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Ян Дж.В., Ким Ю.С., Чхве СО, Хан Б.Г. Успешное применение линезолида для внутривенного введения у пациента с ХПНП с устойчивым к ванкомицину энтерококковым перитонитом. Perit Dial Int. 2011; 31: 209–210. [PubMed] [Google Scholar] 37. Wu VC, Wang YT, Wang CY и др. Высокая частота линезолид-ассоциированной тромбоцитопении и анемии среди пациентов с терминальной стадией почечной недостаточности.Clin Infect Dis. 2006; 42: 66–72. [PubMed] [Google Scholar] 38. Сон Ай Джей, Со Дж. У., Квон Й. Е. и др. Успешное лечение ванкомицин-резистентного энтерококкового перитонита с использованием линезолида без удаления катетера у пациента на перитонеальном диализе. Perit Dial Int. 2014; 34: 235–239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Барраклаф К., Хоули С.М., Макдональд С.П. и др. Corynebacterium перитонит у пациентов на перитонеальном диализе в Австралии: предикторы, лечение и исходы в 82 случаях.Пересадка нефрола Dial. 2009; 24: 3834–3839. [PubMed] [Google Scholar] 40. Szeto CC, Chow KM, Chung KY, Kwan BC, Leung CB, Li PK. Клиническое течение перитонита, связанного с перитонеальным диализом, вызванного видами Corynebacterium . Пересадка нефрола Dial. 2005. 20: 2793–2796. [PubMed] [Google Scholar] 41. Джейн А.К., Блейк П.Г. Не Pseudomonas грамотрицательный перитонит. Kidney Int. 2006; 69: 1107–1109. [PubMed] [Google Scholar] 42. Szeto CC, Chow VC, Chow KM, et al. Enterobacteriaceae перитонит, осложняющий перитонеальный диализ: обзор 210 последовательных случаев.Kidney Int. 2006; 69: 1245–1252. [PubMed] [Google Scholar] 43. Джарвис Э.М., Хоули С.М., Макдональд С.П. и др. Предикторы, лечение и исходы грамотрицательного перитонита, отличного от Pseudomonas . Kidney Int. 2010; 78: 408–414. [PubMed] [Google Scholar] 44. Брэдфорд PA. Β-лактамазы расширенного спектра в 21 веке: характеристика, эпидемиология и обнаружение этой важной угрозы устойчивости. Clin Microbiol Rev.2001; 14: 933–951. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Вонг СС, Хо П.Л., Юэнь К.Ю.Эволюция механизмов устойчивости к антибиотикам и их значение для инфекций, связанных с диализом. Perit Dial Int. 2007; 27: S272 – S280. [PubMed] [Google Scholar] 46. Ип Т., Це К.С., Лам М.Ф. и др. Факторы риска и исходы перитонита E. coli, продуцирующего β-лактамазу расширенного спектра действия, у пациентов с CAPD. Perit Dial Int. 2006; 26: 191–197. [PubMed] [Google Scholar] 47. Фэн X, Ян X, Yi C и др. Escherichia coli перитонит при перитонеальном диализе: распространенность, устойчивость к антибиотикам и клинические исходы в диализном центре Южного Китая.Perit Dial Int. 2014: 308–316. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Гупта Н., Лимбаго Б.М., Патель Дж. Б., Каллен А. Дж.. Карбапенем-устойчивые Enterobacteriaceae: эпидемиология и профилактика. Clin Infect Dis. 2011; 53: 60–67. [PubMed] [Google Scholar] 49. Szeto CC, Chow KM, Leung CB, et al. Клиническое течение перитонита, вызванного видами Pseudomonas , осложняющими перитонеальный диализ: обзор 104 случаев. Kidney Int. 2001; 59: 2309–2315. [PubMed] [Google Scholar] 50. Сива Б., Хоули С.М., Макдональд С.П. и др. Перитонит, вызванный Pseudomonas , в Австралии: предикторы, лечение и исходы в 191 случае. Clin J Am Soc Nephrol. 2009; 4: 957–964. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Ли PH, Cheng VC, Yip T, Yap DY, Lui SL, Lo WK. Эпидемиология и клинические характеристики Acinetobacter перитонита, связанного с перитонеальным диализом, в Гонконге: с точки зрения множественной лекарственной устойчивости и устойчивости к карбапенемам. Perit Dial Int. 2017; 37: 37: 177–182. [PubMed] [Google Scholar] 52. Чжан В., У Ю.Г., Ци ХМ, Дай Х., Лу В., Чжао М.Перитонит, связанный с перитонеальным диализом, вызванный Acinetobacter baumannii : обзор семи случаев. Perit Dial Int. 2012; 34: 317–321. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Муньос-Прайс Л.С., Вайнштейн Р.А. Инфекция, вызванная Acinetobacter . N Engl J Med. 2008; 558: 1271–1281. [PubMed] [Google Scholar] 54. Тейлор Г., Маккензи М., Бьюкенен-Челл М., Перри Д., Чуй Л., Дасгупта М. Перитонит, вызванный Stenotrophomonas maltophilia у пациентов, подвергающихся хромическому перитонеальному диализу.Perit Dial Int. 1999; 19: 259–262. [PubMed] [Google Scholar] 55. Сзето CC, Ли П.К., Люнг CB, Ю.А.В., Луи С.Ф., Лай К.Н. Xanthomonas maltophilia Перитонит у пациентов с уремией, получающих непрерывный амбулаторный перитонеальный диализ. Am J Kidney Dis. 1997. 29: 91–95. [PubMed] [Google Scholar] 56. Ким ГК, Корбет СМ. Полимикробный перитонит у пациентов с непрерывным амбулаторным перитонеальным диализом. Am J Kidney Dis. 2000; 36: 1000–1008. [PubMed] [Google Scholar] 57. Szeto CC, Chow KM, Wong TY и др. Консервативное лечение полимикробного перитонита, осложняющего перитонеальный диализ: серия из 140 последовательных случаев.Am J Med. 2002; 113: 728–733. [PubMed] [Google Scholar] 58. Барраклаф К., Хоули С.М., Макдональд С.П. и др. Полимикробный перитонит у пациентов на перитонеальном диализе в Австралии: предикторы, лечение и исходы. Am J Kidney Dis. 2010. 55: 121–131. [PubMed] [Google Scholar] 59. Фахим М., Хоули С.М., Макдональд С.П. и др. Культурально-отрицательный перитонит у пациентов на перитонеальном диализе в Австралии: предикторы, лечение и исходы у 435 пациентов. Am J Kidney Dis. 2010; 55: 690–697. [PubMed] [Google Scholar] 60.Szeto CC, Wong TY, Chow KM, Leung CB, Li PK. Клиническое течение перитонита без посева, осложняющего перитонеальный диализ. Am J Kidney Dis. 2003. 25: 207–222. [PubMed] [Google Scholar] 61. Одуду А., Тернер Дж., Кумер К., Салмон Л., Яздани Ф., Леунг Дж. Обзор практики отбора проб перитонита и диализа в Соединенном Королевстве. Perit Dial Int. 2016; 36: 101–104. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Прасад Н, Гупта А. Грибковый перитонит у пациентов на перитонеальном диализе. Perit Dial Int.2005. 25: 207–222. [PubMed] [Google Scholar] 63. Майлз Р., Хоули С.М., Макдональд С.П. и др. Предикторы и исходы грибкового перитонита у пациентов на перитонеальном диализе. Kidney Int. 2009. 76: 622–628. [PubMed] [Google Scholar] 64. Nadeau-Fredette AC, Bargman JM. Характеристики и исходы грибкового перитонита в современной когорте Северной Америки. Perit Dial Int. 2015; 35: 78–84. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Levallois J, Nadeau-Fredette AC, Labbé AC, Laverdière M, Ouimet D, Vallée M. Десятилетний опыт лечения грибкового перитонита у пациентов на перитонеальном диализе: модели восприимчивости к противогрибковым препаратам в североамериканском центре.Int J Infect Dis. 2012; 16: e41 – e43. [PubMed] [Google Scholar] 66. Ван П.Н., Ло К.Ю., Тонг Г.М. и др. Лечение грибкового перитонита комбинацией внутривенного амфотерицина B и перорального флуцитозина, а также отсроченная замена катетера при непрерывном амбулаторном перитонеальном диализе. Perit Dial Int. 2008. 28: 155–162. [PubMed] [Google Scholar] 67. Джонсон LB, Кауфман CA. Вориконазол: новое противогрибковое средство на основе триазола. Clin Infect Dis. 2003. 33: 92–99. [Google Scholar] 68. Робертс Д.М., Каутер Г., Рэй Дж. Э., Гиллин А.Г.Внутрибрюшинный вориконазол у пациента с перитонитом перитонеального диализа Aspergillus . Perit Dial Int. 2013; 33: 92–93. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Улусой С., Озкан Г., Тосун И. и др. Перитонит, вызванный Aspergillus nidulans и его эффективное лечение вориконазолом: сообщение о первом случае. Perit Dial Int. 2011; 31: 212–213. [PubMed] [Google Scholar] 70. Чанг Т.И., Ким Х.В., Пак Дж. Т. и др. Раннее удаление катетера улучшает выживаемость пациентов с грибковым перитонитом на перитонеальном диализе: результаты 94 эпизодов грибкового перитонита в одном центре.Perit Dial Int. 2011; 31: 60–66. [PubMed] [Google Scholar] 71. Boer WH, van Ampting JM, Vos P. Успешное лечение восьми эпизодов перитонита Candida без удаления катетера с использованием внутрикатетерного введения амфотерицина B. Perit Dial Int. 2007. 27: 208–210. [PubMed] [Google Scholar] 72. Matuszkiewicz-Rowinska J. Последние данные о грибковом перитоните и его лечении. Perit Dial Int. 2009; 29: S161 – S165. [PubMed] [Google Scholar] 73. Вонг П.Н., Ло К.Й., Тонг Г.М. и др. Профилактика грибкового перитонита с помощью профилактики нистатином у пациентов, получающих CAPD.Perit Dial Int. 2007. 27: 531–536. [PubMed] [Google Scholar] 74. Restrepo C, Chacon J, Manjarres G. Грибковый перитонит у пациентов на перитонеальном диализе: успешная профилактика флуконазолом, как продемонстрировано проспективным рандомизированным контрольным исследованием. Perit Dial Int. 2010. 30: 619–625. [PubMed] [Google Scholar] 75. Баер Р.А., Киллен Дж. П., Чо Й., Манта М. Некандидозный грибковый перитонит в далеком Северном Квинсленде: серия случаев. Perit Dial Int. 2013; 33: 559–564. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Седлачек М., Коттер Дж. Г., Суриавината А.А. и др.Мукормикозный перитонит: более 2 лет безрецидивного наблюдения после спасительной терапии позаконазолом после неэффективности липосомального амфотерицина B. Am J Kidney Dis. 2008. 51: 302–306. [PubMed] [Google Scholar] 77. Серна Дж. Х., Вангер А., Досекун А. К.. Успешное лечение мукормикозного перитонита липосомальным амфотерицином B у пациента, находящегося на длительном перитонеальном диализе. Am J Kidney Dis. 2003; 42: E14 – E17. [PubMed] [Google Scholar] 78. Мур Д.А., Лайтстоун Л., Джавид Б., Фридланд Дж. С.. Высокие показатели туберкулеза в терминальной стадии почечной недостаточности: влияние международной миграции.Emerg Infect Dis. 2002; 8: 77–78. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Левинсон Д.М., Леонард М.К., Лобуэ П.А. и др. Официальное руководство по клинической практике Американского торакального общества / Американского общества инфекционных заболеваний / Центров по контролю и профилактике заболеваний: диагностика туберкулеза у взрослых и детей. Clin Infect Dis. 2017; 64: e1 – e33. [PubMed] [Google Scholar] 80. Луи С.Л., Тан С., Фук Л. и др. Инфекция туберкулеза у китайских пациентов, находящихся на непрерывном перитонеальном диализе. Am J Kidney Dis.2001; 38: 1055–1060. [PubMed] [Google Scholar] 81. Чау Т.Н., Леунг В.К., Вонг С. и др. Проблемы диагностики туберкулеза у пациентов с терминальной стадией почечной недостаточности и без нее. Clin Infect Dis. 2007; 45: e141 – e146. [PubMed] [Google Scholar] 82. Талвани Р., Хорват Дж. А. Туберкулезный перитонит у пациентов, находящихся на постоянном перитонеальном диализе: история болезни и обзор. Clin Infect Dis. 2000; 31: 70–75. [PubMed] [Google Scholar] 83. Акполат Т. Туберкулезный перитонит. Perit Dial Int. 2009; 29: S166 – S169. [PubMed] [Google Scholar] 84.Abraham G, Matthews M, Sekar L, Srikanth A, Sekar U, Soundarajan P. Туберкулезный перитонит в когорте пациентов, постоянно находящихся на амбулаторном диализе. Perit Dial Int. 2001; 21: S202 – S204. [PubMed] [Google Scholar] 85. Эдвардс С., Глинн П., Дэвид М.Д., Камеш Л. Ранняя диагностика туберкулезного перитонита у пациентов, находящихся на перитонеальном диализе: использование анализа Xpert MTB / RIF. Perit Dial Int. 2016; 36: 481–483. [Бесплатная статья PMC] [PubMed] [Google Scholar] 86. Гриффит Д.Е., Аскамит Т., Браун-Эллиотт Б.А. и др. Официальное заявление ATS / IDSA: диагностика, лечение и симптомы нетуберкулезных микобактериальных заболеваний.Am J Respir Crit Care Med. 2007. 175: 367–416. [PubMed] [Google Scholar] 87. Це К.С., Луи С.Л., Ченг В.К. и др. Группа быстрорастущих микобактериальных инфекций в месте выхода катетера для перитонеального диализа. Am J Kidney Dis. 2007; 50: E1 – E5. [PubMed] [Google Scholar] 88. Ро М., Биа Ф., Брюстер, Калифорния. Нетуберкулезный микобактериальный перитонит у пациентов на перитонеальном диализе. Semin Dial. 2006. 20: 271–276. [PubMed] [Google Scholar] 89. Рено CJ, Subramanian S, Tambyah PA, Lee EJ. Клиническое течение быстрорастущих нетуберкулезных микобактериальных инфекций перитонеального диализа у азиатов: серия случаев и обзор литературы.Нефрология (Карлтон) 2011; 16: 174–179. [PubMed] [Google Scholar] 90. Song Y, Wu J, Yan H, Chen J. Перитонит, связанный с нетуберкулезными микобактериями, связанный с перитонеальным диализом: систематический обзор зарегистрированных случаев. Пересадка нефрола Dial. 2012; 27: 1639–1644. [PubMed] [Google Scholar] 91. Jiang SH, Roberts DM, Clayton PA, Jardine M. Нетуберкулезный микобактериальный перитонит PD в Австралии. Int Urol Nephrol. 2013; 45: 1423–1428. [PubMed] [Google Scholar] 92. Кунин М, Кнехт А, Хольцман Э. Mycobacterium chelonae перитонит при перитонеальном диализе: обзор литературы.Eur J Clin Microbiol Infect Dis. 2014; 33: 1267–1271. [PubMed] [Google Scholar] 93. Фигейредо А.Э., Бернардини Дж., Боуз Э. и др. Учебная программа для обучения пациентов, осуществляющих перитонеальный диализ, и лиц, осуществляющих уход. Perit Dial Int. 2016; 36: 592–605. [Бесплатная статья PMC] [PubMed] [Google Scholar] 94. Пираино Б., Бернардини Дж., Браун Э. и др. Заявление о позиции ISPD по снижению риска инфекций, связанных с перитонеальным диализом. Perit Dial Int. 2011; 31: 614–630. [PubMed] [Google Scholar] 95. Стрипполи Г.Ф., Тонг А, Джонсон Д., Шена Ф.П., Крейг Дж.Противомикробные препараты для профилактики перитонита при перитонеальном диализе: систематический обзор рандомизированных контролируемых исследований. Am J Kidney Dis. 2004; 44: 591–603. [PubMed] [Google Scholar] 96. Xu G, Tu W, Xu C. Мупироцин для предотвращения инфекции места выхода и перитонита у пациентов, проходящих перитонеальный диализ. Пересадка нефрола Dial. 2009. 25: 587–592. [PubMed] [Google Scholar] 97. Чен С.С., Шит Х., Пираино Б., Бендер Ф. Долгосрочная профилактика гентамицина в месте выхода и устойчивость к гентамицину в программе перитонеального диализа.Perit Dial Int. 2016; 36: 387–389. [Бесплатная статья PMC] [PubMed] [Google Scholar] 98. Пирс Д.А., Уильямсон Дж. К., Маук В. С., Рассел Г. Б., Палавесино Е., Буркарт Дж. М.. Влияние на возбудителей перитонеального диализа изменения местной антибиотикопрофилактики. Perit Dial Int. 2011; 32: 525–530. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Перитонит, связанный с перитонеальным диализом: проблемы и решения
Int J Nephrol Renovasc Dis. 2018; 11: 173–186.
Уильям Л. Зальцер
Медицинский факультет Университета Миссури, Колумбия, Миссури, США
Медицинский факультет Университета Миссури, Колумбия, Миссури, США
Для корреспонденции: Уильям Л. Зальцер, Департамент медицины, Отдел инфекционных болезней , University Hospital, University of Missouri, 5 Hospital Drive, Columbia, MO 65212, USA, тел. +1 573 882 3107, электронная почта ude.Авторские права © Salzer, 2018 г. Эта работа опубликована и лицензирована Dove Medical Press Limited. Полные условия этой лицензии доступны по адресу https://www.dovepress.com/terms.php и включают лицензию Creative Commons Attribution — Non Commercial (unported, v3.0) License ( http://creativecommons.org/licenses/by-nc/3.0/). Получая доступ к работе, вы тем самым принимаете Условия. Некоммерческое использование работы разрешено без какого-либо дополнительного разрешения Dove Medical Press Limited при условии надлежащей атрибуции работы.Эта статья цитировалась в других статьях в PMC.
Abstract
Перитонеальный диализ является эффективным методом лечения пациентов с терминальной стадией почечной недостаточности. Относительное использование перитонеального диализа по сравнению с гемодиализом широко варьируется в зависимости от страны. Данные исследования 2004 г. показывают, что процент пациентов с терминальной стадией почечной недостаточности, получавших перитонеальный диализ, составляет от 5% до 10% в экономически развитых регионах, таких как США и Западная Европа, до 75% в Мексике. Это несоответствие, вероятно, связано с доступностью гемодиализа или, в некоторых случаях, с предпочтением пациентом перитонеального диализа.Перитонит, связанный с перитонеальным диализом, остается основным осложнением и основной проблемой для долгосрочного успеха перитонеального диализа. Пятьдесят лет назад, с появлением катетера Тенкхоффа, пациенты на перитонеальном диализе в среднем регистрировали шесть эпизодов перитонита в год. В 2016 году Международное общество перитонеального диализа предложило контрольный показатель в 0,5 эпизода перитонита в год или один эпизод каждые 2 года. Несмотря на заметное снижение перитонита с течением времени, перитонит для отдельного пациента представляет собой проблему.Смертность от эпизода перитонита составляет 5% и является кофактором смертности еще у 16% больных. Профилактика перитонита и быстрое и надлежащее лечение перитонита имеет важное значение для долгосрочного успеха перитонеального диализа у всех пациентов. В этом обзоре рассматриваются проблемы и решения, касающиеся патогенеза, клинических характеристик, диагностики, лечения и профилактики перитонита, связанного с перитонеальным диализом, с точки зрения врача-инфекциониста.
Ключевые слова: перитонеальный диализ, связанный перитонит
Введение
Использование перитонеального диализа (ПД) для заместительной почечной терапии широко варьируется в разных регионах мира и в отдельных странах1. ПД по сравнению с гемодиализом иногда является вопросом предпочтений пациента, а иногда из-за отсутствия гемодиализного отделения, которое легко доступно на дому у пациента. В менее экономически привилегированных областях PD может быть первым выбором из-за более высоких затрат и трудностей доступа к отделению гемодиализа.В этой статье рассматриваются патогенез, клинические особенности, диагностика и терапия наиболее распространенных микроорганизмов, вызывающих перитонит при БП, а также меры по снижению частоты перитонита.
Перитонит, связанный с БП — патогенез
Катетер для ПД является источником инфекции в подавляющем большинстве случаев перитонита, связанного с БП. Катетер обеспечивает вход микроорганизмов в обычно стерильную брюшину. Большинство случаев перитонита, связанного с БП, являются результатом «контаминации прикосновением», когда пациент или его помощник случайно нарушает стерильный метод и загрязняет катетер или его соединения.Наиболее распространенными патогенами являются коагулазонегативные виды стафилококков (например, Staphylococcus epidermidis ), которые обычно колонизируют кожу и руки человека, и Staphylococcus aureus , которые вместе являются причиной 50% или более инфекций в большинстве серий2–4. Инфекции места выхода и туннельные инфекции также могут привести к перитониту. Реже источником может быть сам живот. Источником могут быть дивертикулит, аппендицит, холецистит или перфорация внутренних органов, а также интраабдоминальная хирургия, колоноскопия, гистероскопия и переселение кишечной флоры в результате запора.В случае интраабдоминального источника возбудителями инфекции обычно являются грамотрицательные кишечные бактерии, стрептококки и анаэробные бактерии. Бактериемия из другого источника также может заразить брюшину.
Попадая в брюшину, микроорганизмы находят очень гостеприимную среду. Он теплый, темный, и в нем много питательных веществ, таких как глюкоза. Кроме того, в неповрежденной брюшине имеется очень слабая защита хозяина, небольшое количество перитонеальных макрофагов и очень мало белков защиты хозяина, таких как иммуноглобулины или комплемент.В этой среде организмы могут быстро беспрепятственно размножаться. В течение нескольких часов бактериальные продукты, компоненты клеточной стенки для грамположительных и эндотоксин для грамотрицательных бактерий вызывают воспалительную реакцию. Полиморфноядерные лейкоциты (PMNL) и активированные макрофаги проникают в брюшину и вызывают воспаление, которое проявляется в виде боли в животе, лихорадки, лейкоцитоза периферической крови и мутного диализата из-за повышенного количества клеток в перитонеальной жидкости.
Инфекции места выхода и туннельные инфекции
Большинство случаев перитонита, связанного с БП, являются результатом контаминации путем прикосновения, когда инфекционный организм получает доступ к брюшине через просвет катетера.Небольшой процент является результатом инфекций в месте выхода или туннельных инфекций, при которых микроорганизмы распространяются по туннелю катетера за пределы просвета в брюшину.3 Инфекция в месте выхода представляет собой гнойный дренаж в месте выхода с эритемой или без нее. Сама по себе эритема не указывает на инфекцию в месте выхода. 5 Отек, уплотнение и / или эритема, которые простираются более чем на 2 см проксимальнее места выхода, указывают на туннельную инфекцию, которая представляет гораздо более высокий риск развития перитонита. Микроорганизмы, вызывающие инфекции места выхода с самым высоким риском последующего перитонита, составляют S.aureus , коагулазонегативные стафилококки, дифтероиды, виды стрептококков, Pseudomonas aeruginosa и Candida .6. Также сообщалось, что виды нетуберкулезных микобактерий (НТМ) вызывают инфекции в местах выхода и перитонит, особенно у пациентов, использующих крем с гентамицином для профилактика места выхода7
Гнойный дренаж из места выхода следует отправить на окрашивание по Граму; тем не менее, не следует получать культуры, если место выхода эритематозно без экссудата, потому что в культурах обычно растет организм, который только что колонизирует, и пациент часто будет без необходимости подвергаться воздействию антибиотиков, способствуя появлению устойчивых к лекарствам бактерий.Инфекции места выхода обычно можно лечить пероральными антибиотиками в течение 2–3 недель в зависимости от результатов определения лекарственной чувствительности. См. Рекомендуемые режимы дозирования для пациентов с БП. Инфекции места выхода, резистентные к антибиотикам, обычно требуют удаления катетера и замены катетера в другом месте.2
Таблица 1
Системные рекомендации по дозировке антибиотиков для лечения перитонита2
| Лекарство | Дозировка | |
|---|---|---|
| Антибактериальные препараты | ||
| Ципрофлоксацин (237) | перорально 250 мг BD a | |
| Колистин (288) | Внутривенно 300 мг нагрузки, затем 150–200 9019 мг b ежедневно b Эртапенем (289) | Внутривенно 500 мг в день |
| Левофлоксацин (239) | перорально 250 мг в день | |
| Линезолид (290–292) | Внутривенно или перорально 600 мг BD | |
| перорально 400 мг в день | ||
| Рифампицин (294 295) | 450 мг в день при МТ <50 кг; 600 мг в день при МТ ≥50 кг | |
| Триметоприм / сульфаметоксазол (252) | перорально 160 мг / 800 мг BD | |
| Противогрибковые средства | ||
| Доза амфотерицина | для внутривенного введения (296) начальная доза 0.1 мг / кг / день более 6 часов; увеличена до целевой дозы 0,75–1,0 мг / кг / день в течение 4 дней | |
| Каспофунгин (297,298) | Внутривенно 70 мг нагрузки, затем 50 мг ежедневно | |
| Флуконазол (299) | перорально 200 мг нагрузки, затем 50–100 мг в день | |
| Флуцитозин (296) | перорально 1 г / день | |
| Позаконазол (300) | Внутривенно 400 мг каждые 12 часов | |
| Вориконазол перорально (301–303) |
Туннельные инфекции более серьезны и представляют больший риск потери катетера и перитонита.Обычно наблюдается гнойный или серозно-кровянистый дренаж из места выхода, а также отек, эритема, уплотнение и боль вдоль канала катетера. Наиболее распространенными микроорганизмами, вызывающими туннельную инфекцию, являются S. aureus и P. aeruginosa , которым часто предшествует инфекция в месте выхода. Туннельные инфекции требуют лечения системными антибиотиками на основании отчетов о культуре и чувствительности. В большинстве случаев только антибактериальная терапия неэффективна, и потребуется удаление катетера с последующей заменой катетера.При туннельных инфекциях, которые переросли в перитонит, рекомендуется не менее 2 недель эффективной антибактериальной терапии после удаления катетера перед заменой катетера6. признаки и симптомы перитонита. Новое начало боли в животе, лихорадки или появление мутных выделений должно требовать немедленного уведомления поставщика диализа для срочного обследования. У пациентов, получающих автоматический диализ, первый дренаж, скорее всего, будет мутным и будет иметь повышенное количество лейкоцитов (WBC).Если у пациента сухой живот, необходимо ввести 1 л диализата и дать ему постоять в течение 2 часов перед взятием образца. В идеале перед введением антибиотиков следует получить образцы диализных стоков для определения количества лейкоцитов, дифференциала, окрашивания по Граму и посева. Если немедленный доступ в учреждение невозможен из-за поездки или расстояния, образец диализата должен быть получен в стерильных условиях и охлажден, если антибиотики будут введены до официального отбора образцов.Своевременный анализ жидкости и начало эмпирической антибактериальной терапии улучшают результаты. Подсчет лейкоцитов и дифференциал следует проводить в диализном эффлюенте. Наличие> 100 лейкоцитов / мкл с> 50% нейтрофилов в образце с двухчасовой выдержкой обычно указывает на перитонит.2
Культура с идентификацией инфекционного организма и определением его чувствительности к противомикробным препаратам имеет важное значение для целенаправленной антимикробной терапии. В идеале перитонеальная жидкость должна быть внесена в среду для культивирования крови у постели больного.Было показано, что прямой посев в культуральные флаконы BACTEC / Alert у постели больного увеличивает урожайность и снижает количество случаев отрицательного посева.8 Получение 50 мл пробы перитонеальной жидкости, центрифугирование при 3000 г в течение 15 минут и повторное суспендирование осадка в 3-5 мл буфера с последующим окрашиванием по Граму и культивированием ресуспендированного осадка могут увеличить выход культур и окрашивание по Граму. Положительное окрашивание по Граму будет способствовать более целенаправленной начальной антимикробной терапии, направленной на грамположительные или грамотрицательные бактерии или дрожжи.Однако в большинстве случаев окраска жидкости по Граму отрицательная. Бактериальным культурам обычно требуется 1–3 дня, чтобы вывести организм. Идентификация организма и тестирование на лекарственную чувствительность позволяет проводить целенаправленную антимикробную терапию.
Проблемы в диагностике
К сожалению, культуры PD-жидкости не всегда выявляют организм у пациентов с клиническими проявлениями перитонита. Руководства Международного общества перитонеального диализа (ISPD) рекомендуют эталонный уровень <20% случаев с отрицательным посевом.Наиболее частой причиной отрицательных посевов является назначение антибиотиков до получения посевов. Пациенты с клиническим перитонитом, с отрицательными перитонеальными культурами и улучшением результатов эмпирической терапии с уменьшением симптомов и падением количества лейкоцитов в брюшной полости обычно имеют инфекцию, вызванную чувствительными грамположительными бактериями, и их можно лечить в течение 2 недель.2 Случаи инфицирования привередливыми бактериальными организмами, кислотоустойчивыми бациллами (КУБ) или грибковыми организмами.В этих случаях, если клиническое улучшение симптомов и количество лейкоцитов в брюшной полости не произошло после 3 дней эмпирической антибактериальной терапии, а исходные культуры перитонеальной жидкости остаются отрицательными через 3 дня, исходные флаконы для культивирования перитонеальной жидкости следует пересеять на твердую среду и обогащенную жидкость. такие средства, как тиогликолят. Также необходимо получить жидкость и посеять ее на грибки и КУБ.
Будущие решения в диагностике
При первичной оценке перитонита окрашивание перитонеальной жидкости по Граму обычно отрицательное.Обычно требуется 1–3 дня, чтобы жидкие культуры стали положительными, и еще 2 дня для определения вида и результатов теста на чувствительность к противомикробным препаратам. В настоящее время существует ряд коммерчески доступных панелей мультиплексной полимеразной цепной реакции (ПЦР) для респираторных, желудочно-кишечных (ЖКТ) и патогенных микроорганизмов центральной нервной системы, которые дают результат идентификации вида за час на прямых клинических образцах. Кроме того, время пролета с помощью лазерной десорбции / ионизации с использованием матрицы (MALDITOF), выполненное на положительных культурах, может обеспечить идентификацию видов менее чем за час 9, а системы ПЦР в реальном времени могут предоставить идентификацию видов и общие данные о лекарственной устойчивости, такие как обнаружение метициллин-устойчивый S.aureus (MRSA) и устойчивый к ванкомицину Enterococcus (VRE) на положительных культурах.
Первоначальная эмпирическая антибактериальная терапия перитонита
После получения ПД жидкости для микробиологического исследования как можно скорее следует начать эмпирическую антибиотикотерапию. При отсутствии положительного окрашивания по Граму эмпирическая терапия должна включать антибиотики, которые действуют как на грамотрицательные, так и на грамположительные бактерии. Выбор антибиотиков должен определяться распространенностью и типами антибиотикоустойчивых бактериальных изолятов от пациентов с перитонитом в программе.В большинстве случаев антибиотики следует вводить внутрибрюшинно2. Для эмпирического исследования грамположительных бактерий рекомендуются цефазолин или ванкомицин. В программах с низкой заболеваемостью видами MRSA и энтерококками предпочтение отдается цефазолину. Во многих программах MR коагулазонегативные стафилококки и MRSA являются частыми патогенами у пациентов с перитонитом, и ванкомицин следует использовать изначально, до получения результатов посева. Для эмпирического охвата грамотрицательных бактерий начальная терапия должна включать цефалоспорин третьего поколения (цефтазидим или цефепим) или аминогликозиды (гентамицин, тобрамицин или амикацин).Опять же, выбор антибиотиков для эмпирического грамотрицательного покрытия зависит от вида бактерий, а также от распространенности и типов устойчивых к антибиотикам патогенов в программе.
Окончательная терапия перитонита, связанного с БП
В большинстве случаев результаты посева и чувствительности будут доступны через 3-5 дней, а терапия антибиотиками может быть сосредоточена на одном препарате. В случаях с отрицательным посевом, особенно в легких, наиболее вероятным возбудителем является грамположительный организм, чаще всего коагулазонегативный Staphylococcus sp., и грамотрицательное покрытие может быть прекращено. Если пациент не ответил клинически через 3-5 дней, как описано ранее, следует провести повторный посев образца перитонеальной жидкости на предмет необычных патогенов.
Введение антибиотиков при перитоните, связанном с БП
Предпочтительным методом введения антибиотиков при перитоните, связанном с БП, является внутрибрюшинное введение. Преимущества внутрибрюшинного введения антибиотиков включают доставку антибиотиков в высокой концентрации в очаг инфекции, антибиотики также всасываются в системный кровоток и диффундируют обратно в брюшину, что позволяет вводить их ежедневно или реже, а также внутривенный (IV) доступ, который потребуется в течение 2–4 недель, не требуется ().
Таблица 2
Рекомендации по дозировке антибиотиков IP для лечения перитонита2
| Прерывистая (одна замена в день) | Непрерывная (все замены) | ||
|---|---|---|---|
| Амикацин | 2 мг / кг в сутки (252) | ЛД 25 мг / л, ЛД 12 мг / л (253) | |
| Гентамицин | 0,6 мг / кг в сутки (254) | ЛД 8 мг / л , MD 4 мг / л (255,256) | |
| Нетилмицин | 0.6 мг / кг в день (233) | MD 10 мг / л (257) | |
| Тобрамицин | 0,6 мг / кг в день (253) | LD 3 мг / кг, MD 0,3 мг / кг (258,259) | |
| Цефалоспорины | |||
| Цефазолин | 15–20 мг / кг в день (260,261) | LD 500 мг / л, MD 125 мг / л (254) | Ce ежедневно (262 263) | LD 250–500 мг / л, MD 100–125 мг / л (262 263) |
| Цефоперазон | нет данных | LD 500 мг / л, MD 62.5-125 мг / л (264 265) | |
| Цефотаксим | 500–1000 мг в сутки (266) | нет данных | |
| Цефтазидим | 1000–1 500 мг в сутки (267 268) | ЛД , MD 125 мг / л (236) | |
| Цефтриаксон | 1000 мг в день (269) | нет данных | |
| Пенициллины | |||
| Пенициллин G | Ед. / Л, MD 25000 ед / л (270) | ||
| Амоксициллин | нет данных | MD 150 мг / л (271) | |
| Ампициллин | нет данных | MD 125 мг / л (272 273) | |
| Ампициллин / сульбактам | 2 г / 1 г каждые 12 часов (274) | LD 750–100 мг / л, MD 100 мг / л (253) | |
| Пиперациллин / тазобактам | нет данных | LD 4 г / 0.5 г, MD 1 г / 0,125 г (275) | |
| Прочие | |||
| Азтреонам | 2 г в день (242) | LD 1000 мг / л, MD 250 мг / л (243 244) | |
| Ципрофлоксацин | нет данных | MD 50 мг / л (276) | |
| Клиндамицин | нет данных | MD 600 мг / пакет (277) | |
| LD19 9019 Dapt 100 мг / л, MD 20 мг / л (278) | |||
| Имипенем / циластатин | 500 мг в альтернативной форме (244) | LD 250 мг / л, MD 50 мг / л (236) | |
| Офлоксацин | нет данных | LD 200 мг, MD 25 мг / л (279) | |
| Полимиксин B | нет данных | MD 300000 единиц (30 мг) / пакет (280) | |
| Quinuppristin / Dal | 25 мг / лин альтернативный обмен a (281) | нет данных | |
| Меропенем | 1 г в день (282) | нет данных | |
| Тейкопланин | 15 мг / кг каждые 5 дней (283) | LD 400 мг / мешок, MD 20 мг / мешок (229) | |
| Ванкомицин | 15–30 мг / кг каждые 5–7 дней b (284) | LD 30 мг / кг, MD 1.5 мг / кг / мешок (285) | |
| Противогрибковые | |||
| Флуконазол | IP 200 мг каждые 24–48 часов (286) | нет данных | |
| мг Вориконазол | мг Вориконазол / кг в день (287) | нет данных |
Проблемы
В рекомендациях ISPD от 2016 года выражается озабоченность по поводу эффективности однократного внутрибрюшинного дозирования цефалоспоринов у пациентов с APD и рекомендуется включать антибиотики в каждый пакет диализата для пациенты на автоматизированной ПД или, альтернативно, переходят на постоянную амбулаторную ПД на время лечения.Это было бы довольно обременительно для пациентов, находящихся на диализе дома. Тем не менее, были две опубликованные серии исследований, в которых изучались просто добавление антибиотиков к их «дневному пребыванию» у пациентов на автоматизированной БП, и были обнаружены сопоставимые показатели успеха по сравнению с пациентами, использующими антибиотики в каждом пакете циклера10,11
, связанных с ПД. перитонит: клиника, диагностика и лечение организмом
Коагулазонегативные стафилококки
S. epidermidis — наиболее часто определяемая причина перитонита, связанного с БП.Хотя S. epidermidis является наиболее распространенным из коагулазонегативных стафилококков, существует по крайней мере 40 других видов коагулазонегативных стафилококков Staphylococcus , которые считаются причиной инфекций у людей. Эти организмы являются преобладающей нормальной флорой на коже человека и, как правило, патогенами с низкой вирулентностью, но являются одной из наиболее распространенных причин инфекций, связанных с устройствами, из-за их способности прилипать к небиологическим поверхностям и производить биопленки.12 В биопленке микроорганизмы являются встроены в гликокаликс, аналогично коралловому рифу, в котором организмы на внешней поверхности метаболически активны и делятся, в то время как те, что глубоко в биопленке, по существу бездействуют.13 Антибиотики действуют только на активно делящиеся микроорганизмы, так что организмы, находящиеся глубоко в биопленке, не затрагиваются, что приводит к возникновению очага рецидива. Рецидивирующий или рецидивирующий перитонит часто наблюдается в случае коагулазонегативного перитонита Staphylococcus .14 Возвратный перитонит обычно требует удаления катетера с последующей заменой.
Иллюстративный случай
65-летний мужчина с болезнью Паркинсона имеет 6-часовую историю болей в животе, лихорадки и мутного диализата.Он рассказывает, что вчера мог прикоснуться к разъему без перчаток. Температура 38 ° C, боль в животе умеренная-умеренная. Анализ перитонеальной жидкости показывает 1400 лейкоцитов / мкл с 85% PMNL, а окраска жидкости по Граму показывает PMNL, но не микроорганизмы. Получают посевы, и его начинают эмпирически на внутрибрюшинном введении ванкомицина и цефтазидима. К 3-му дню состояние его симптоматики улучшилось, жидкости очистились. В жидких культурах растет коагулазонегативный стафилококк Staphylococcus , чувствительный к цефазолину и ванкомицину.Ванкомицин и цефтазидим отменены, и он лечится цефазолином внутрибрюшинно в течение 14 дней. Перитонит проходит без рецидива.
Клинически перитонит, вызванный коагулазонегативным стафилококком Staphylococcus , обычно проявляется относительно легкими признаками и симптомами по сравнению с более вирулентными микроорганизмами.15 Заболеваемость изолятов MR увеличивается, о чем сообщалось в 70% коагулазонегативных изолятов Staphylococcus в серия из Бразилии.16 При соответствующей внутрибрюшинной терапии антибиотиками клиническое улучшение обычно проявляется к 3-му дню.Рекомендуется лечение в течение 14 дней с коэффициентом излечения около 70% или более в большинстве серий.16 Замена или удаление катетера часто требуется в рецидивирующих или рецидивирующих случаях, что предположительно происходит из-за образования биопленки в катетере.
S. aureus перитонит
S. aureus обычно вызывает более клинически тяжелую форму перитонита у пациентов с БП из-за множества факторов вирулентности. S. aureus колонизирует многих пациентов в их ноздрях и на коже, а также поражает кожные покровы, например, места выхода.В одном исследовании было обнаружено, что 45% пациентов, начавших БП, являются носителями S. aureus и имели значительно более высокий риск развития инфекции в месте выхода.
S. aureus — частая причина инфекций места выхода и туннельных инфекций. Мупироцин для профилактики в месте выхода, по-видимому, уменьшает инфекции в месте выхода, перитонит и потерю катетера из-за S. aureus ,18
Показательный случай: туннельная инфекция MRSA, ведущая к перитониту
Мужчина 55 лет представляет с болью и припухлостью вдоль туннеля перитонеального катетера.У него нет лихорадки, и его эмпирически лечили ванкомицином внутривенно и пиперациллин-тазобактам. Ему делают разрез и дренируют катетерный туннель. Окрашивание туннельного экссудата по Граму выявляет множество PMNL и грамположительных кокков в скоплениях и растущий MRSA. Прием пиперациллина-тазобактама прекращается, и он лечится ванкомицином. Его переводят в операционную, где выводится наружная часть его катетера. После 5 дней терапии ванкомицином он выписан на пероральный клиндамицин.
Пять недель спустя он возвращается с лихорадкой, ознобом, диффузной болью в животе и гнойными выделениями из места выхода и заметил мутные кровянистые выделения.Его температура 38,1 ° C, кишечные шумы приглушены, наблюдается диффузная болезненность в животе с болезненностью отскока. Жидкость брюшины мутная и красноватого цвета, с 33 800 лейкоцитами и 92% PMNL. Посевы крови, перитонеальной жидкости и места выхода вырастают MRSA. Чреспищеводная эхокардиограмма на растительность отрицательна. Его перитонеальный катетер удален, он переводится на гемодиализ, и ему вводят ванкомицин внутривенно в течение 3 недель после удаления катетера.
Комментарий
Туннельная инфекция с болезненностью, припухлостью и покраснением, распространяющейся более чем на 2 см проксимальнее места выхода, очень трудно вылечить с помощью одной только антибактериальной терапии.В этом случае, ретроспективно, катетер должен был быть удален и заменен при первоначальном осмотре.
Как показывает этот случай, перитонит, вызванный S. aureus , обычно клинически тяжелый.19,20 Он может возникать после заражения прикосновением или через туннельную инфекцию или инфекцию в месте выхода. Лечение зависит от чувствительности возбудителя к противомикробным препаратам. Для чувствительного к метициллину S. aureus предпочтительным является цефазолин для внутрибрюшинного введения, а для лечения MRSA — ванкомицин, вводимый внутрибрюшинно.Если у пациента аллергия на ванкомицин или у него имеется штамм, устойчивый к ванкомицину (VR), можно использовать липопептид даптомицин. 21–23 Сообщалось о различных режимах дозирования даптомицина, но лучший режим, вероятно, составляет 200 мг внутрибрюшинно с 6-часовая выдержка один раз в день.23 Линезолид обладает хорошей активностью в отношении MRSA и успешно применяется для лечения перитонита, вызванного VRE. Используемая доза составляла 600 мг внутривенно дважды в день, 24 но пероральная биодоступность такова, что пероральное дозирование должно быть столь же эффективным.Однако прием 600 мг два раза в день был связан с гематологической токсичностью и лактоацидозом у пациентов с ТПН 25, а доза 400 мг два раза в день эффективна и безопаснее. Цефтаролин — это относительно новый цефалоспорин третьего поколения, который уникален среди β-лактамных антибиотиков тем, что очень активен в отношении MRSA. 26 Цефтаролин также имеет грамположительную активность, сравнимую с цефазолином, и грамотрицательный спектр, подобный цефотаксиму. Цефтаролин может быть эффективной альтернативой ванкомицину при перитоните, вызванном MRSA, но, насколько мне известно, не изучался.Есть некоторые свидетельства того, что добавление рифампицина в течение 5–7 дней к первичным антистафилококковым препаратам уменьшает рецидивы и рецидив перитонита.19 Однако рифампицин является мощным индуктором ферментов, метаболизирующих лекарственные средства, что может снизить концентрацию других препаратов.
Перитонит, вызванный S. aureus , следует лечить антибиотиками в течение 3 недель. Незамедлительное удаление катетера необходимо пациентам с рефрактерным или рецидивирующим перитонитом, а также при инфекциях в месте выхода и туннельных инфекциях, которые не поддаются лечению антибиотиками.Перитонит, вызванный S. aureus , имеет относительно плохие результаты: 20% рецидивов, 23% требуют удаления катетера, 18% переходят на гемодиализ и 2% смертности.20,21
Стрептококковый перитонит
Стрептококковый перитонит встречается реже, на них приходится 5–10% случаев в большинстве серий27,28. Перитонит, вызванный видами стрептококков, схож с перитонитом, вызванным стафилококками, в том смысле, что клинические признаки зависят от вида заражения. Перитонит, вызванный β-гемолитическими стрептококками групп A, B и др., Представлен как S.aureus , с более высокими параметрами воспалительной жидкости в брюшной полости, большей болью и часто с более септической картиной. Стрептококки Viridans представляют собой большую группу видов, определяемых α-гемолизом на культурах кровяного агара. Подобно коагулазонегативным стафилококкам, большинство изолятов стрептококков viridans не являются очень вирулентными организмами, являясь нормальными обитателями ротовой полости и желудочно-кишечного тракта. Сообщалось о случаях перитонита, вызванного вирусом стрептококка, после стоматологической работы. 28
β-Гемолитические стрептококки очень чувствительны к пенициллину и другим β-лактамным антибиотикам.Виды стрептококков Viridans обычно чувствительны к β-лактамам, но в некоторых областях наблюдается рост устойчивости к пенициллинам.29 Руководства ISPD рекомендуют внутрибрюшинный ампициллин для лечения стрептококкового перитонита.2 Ампициллин может быть проблематичным при амбулаторной терапии перитонита, потому что он начинает действовать. распадается в растворе через 6–8 часов.30 Лучшим выбором для пятен, чувствительных к пенициллину, может быть цефазолин, который стабилен в растворе в течение 9 дней при комнатной температуре и 3 недели в холодильнике.30 В отношении устойчивых к пенициллину стрептококков viridans лучшим препаратом будет ванкомицин. У большинства пациентов хорошие результаты после 2-недельной терапии антибиотиками, с показателем успеха до 90% .28,29,32 В некоторых исследованиях сообщалось о повышенном риске рецидива или рецидива перитонита, вызванного вирусом стрептококков viridans. 28,31
Энтерококковый перитонит
Enterococcus spp. являются нормальными обитателями желудочно-кишечного тракта и могут колонизировать или инфицировать мочеполовой тракт.Наиболее распространенными видами, изолированными от инфекций человека, являются Enterococcus faecalis и Enterococcus faecium . E. faecalis обычно чувствителен к ампициллину, пенициллину и ванкомицину, но может быть VR, если несет ген vanB . E. faecium всегда устойчив к пенициллину, ампициллину и карбапенемам и является наиболее распространенным видом энтерококков, который является VR, когда он обладает геном vanA . Все виды энтерококков по своей природе устойчивы ко всем цефалоспориновым антибиотикам.
Энтерококковый перитонит, вероятно, возникает в результате контактного заражения и, возможно, из источников ЖКТ. Энтерококковый перитонит, вызванный единичным организмом, обычно не является слишком тяжелым клинически и хорошо поддается соответствующей терапии, с успешным лечением до 90% случаев.33 Однако до 45% случаев, когда энтерококки изолированы, другие организмы выделяются как хорошо, 32,33 предполагая внутрибрюшной источник инфекции. Результаты значительно хуже при полимикробном энтерококковом перитоните, что приводит к более высокому уровню удаления катетера и постоянного перевода на гемодиализ.32
Варианты противомикробного лечения энтерококкового перитонита ограничены из-за присущей устойчивости ко всем β-лактамам, кроме ампициллина, пенициллина и пиперациллина, которые проблематичны для лечения перитонита. Руководства ISPD рекомендуют лечение ванкомицином внутрибрюшинно в течение 3 недель с добавлением гентамицина в тяжелых случаях2. В случаях полимикробного перитонита могут потребоваться дополнительные противомикробные препараты в зависимости от лекарственной чувствительности других инфекционных организмов.Лечение энтерококкового перитонита VR — непростая задача. VRE обычно устойчив ко всем обычно используемым антибиотикам. Меньшая часть инфекций VRE вызывается бактериями E. faecalis , которые обычно чувствительны к пенициллину и ампициллину. Большая часть VRE — это E. faecium , который по своей природе устойчив к ампициллину. Для перитонита VR E. faecium терапевтический выбор включает даптомицин, линезолид и хинупристин-далфопристин. Среди этих трех соединений наиболее опубликован опыт применения даптомицина, рекомендованного в рекомендациях ISPD.2 Наиболее часто описываемым режимом дозирования даптомицина была ударная доза 100 мг / л внутрибрюшинно, а затем 20 мг / л внутрибрюшинно для последующих доз. 34,35 Даптомицин также успешно применялся у пациентов на автоматическом перинеальном диализе, полученном 7. мг / кг внутрибрюшинно каждые 48 часов22 и пациенту, которому вводят 5 мг / кг внутривенно каждые 48 часов.21 Другой более простой режим — 200 мг внутрибрюшинно во время длительного пребывания у пациентов на автоматизированном ПД.23 Имеется меньше опубликованных опытов с линезолидом, с двумя сообщения об успешном лечении перитонита VRE, получавшего линезолид в дозе 600 мг внутривенно каждые 12 часов.24,36 В серии случаев сообщалось о гематологической токсичности с анемией, лейкопенией и тромбоцитопенией у пациентов, получавших линезолид в дозе 600 мг два раза в день в течение 14 дней или более, и в одном сообщении о фатальном лактоацидозе.25,37 Дозировка линезолида в дозе 400 мг два раза в день позволила достичь терапевтические концентрации и быть безопаснее. Кроме того, при пероральном приеме линезолид на 100% биодоступен, поэтому внутривенное или внутрибрюшинное введение, вероятно, не требуется.38
Corynebacterium peritonitis
Corynebacterium — это род с множеством видов маленьких грамположительных палочек.Часто называемые дифтероидами, они обычно колонизируют кожу и слизистые оболочки человека. Помимо Corynebacterium diphtheriae , они, как правило, являются патогенами с низкой вирулентностью, напоминающими инфекции, вызываемые коагулазонегативным стафилококком Staphylococcus . В большинстве больших серий коринебактерии составляют менее 5% случаев перитонита, связанного с БП. В двух крупнейших сериях коринебактериального перитонита в одной сообщалось в целом о хороших исходах и рекомендовалась терапия цефазолином 39, в то время как в другой сообщалось о частоте рецидивов 48% и были получены лучшие результаты с ванкомицином.40 Большинство видов коринебактерий восприимчивы к цефазолину, но некоторые виды — Corynebacterium jeikeium и Corynebacterium striatum — мультирезистентны и чувствительны только к ванкомицину (см. Случай). В рекомендациях ISPD рекомендуется лечение в течение 3 недель2.
Показательный случай.
У 57-летнего мужчины в анамнезе 2 дня боли в животе и мутные выделения. У него нет лихорадки, легкая болезненность в животе без отскока болезненности. Его жидкость PD содержит 2000 лейкоцитов с 83% PMNL и отрицательным окрашиванием по Граму.Он получает эмпирическую терапию ванкомицином и цефтазидимом внутрибрюшинно. В его культурах из перитонеальной жидкости вырастает C. jeikeium , но наша лаборатория не определяет лекарственную чувствительность к коринебактериям. Его терапия заменена только цефазолином. К сожалению, C. jeikeium всегда устойчив к цефазолину и большинству других антибиотиков, поэтому консультации по поводу инфекционных заболеваний не запрашивались. Три месяца спустя он возвращается с болью в животе, кровянистыми выделениями и плохо функционирующим катетером.Его перитонеальная жидкость содержит 1800 лейкоцитов с 93% PMNL, 8000 эритроцитов и отрицательное окрашивание по Граму. Он лечится эмпирически с применением ванкомицина и цефтазидима внутрибрюшинно. Культуры перитонеальной жидкости снова выращивают C. jeikeium . Предпринята попытка удаления перитонеального катетера, но безуспешно из-за обширных спаек, и пациента переводят на гемодиализ. Культуры крови отрицательны, но культуры перитонеальной жидкости снова вырастают. C. jeikeium . Его катетер, наконец, удален, и его кончик вырастает до C.Ашхабад . Компьютерная томография его брюшной полости выявила скопление жидкости в передней части брюшной полости размером 23 × 10 × 20 см, и ему поставлен диагноз — инкапсулирующий перитонит.
Комментарий
В этом неудачном случае не было обнаружено, что он был инфицирован устойчивым видом Corynebacterium , который не был должным образом обработан и привел к отказу методики.
Грамотрицательный кишечный перитонит
Грамотрицательные кишечные бактерии являются членами семейства Enterobacteriaceae и включают виды Escherichia coli и Klebsiella , Enterobacter , Citrobacter и Proteus spp.Эта группа организмов является частью нормальной флоры желудочно-кишечного тракта, может колонизировать верхний пищеварительный тракт и мочеполовой тракт и широко распространена в окружающей среде. Эти организмы имеют двухслойную клеточную мембрану, которая содержит липополисахарид (эндотоксин), который является важным фактором вирулентности.
В большинстве случаев перитонита грамотрицательные кишечные бактерии составляют 10–25% случаев, причем самые высокие показатели зарегистрированы в Азии и Австралии. В последние годы процент случаев, вызванных этими микроорганизмами, увеличился, возможно, из-за относительного снижения числа стафилококковых инфекций в результате широкого использования мупироцина для профилактики в месте выхода.41 Перитонит, вероятно, возникает в результате заражения прикосновением, но иногда в результате инфекции в месте выхода, туннельной инфекции или внутрибрюшного источника. Недавняя антибактериальная терапия перитонита или других показаний является фактором риска развития грамотрицательного кишечного перитонита.42
Клинические признаки и симптомы перитонита, вызванного грамотрицательными кишечными бактериями, имеют тенденцию быть более серьезными, с лихорадкой, более сильной болью в животе, тошнота, рвота и диарея.42 Недавний курс антибиотиков при перитоните, инфекции места выхода или по другим причинам присутствует примерно у трети пациентов.42,43
На долю E. coli приходится 30–50% случаев, за ней следуют Klebsiella и Enterobacter spp. Полимикробный грамотрицательный перитонит должен вызывать подозрение на наличие внутрибрюшного источника, такого как прободение внутренних органов или дивертикулит.
Большинство, если не все центры включают антибиотики с широкой грамотрицательной активностью, такие как цефтазидим или цефепим, или гентамицин или тобрамицин, в начальную эмпирическую терапию. Однако за последние 10–20 лет энтеробактерии стали все более устойчивыми ко многим антибиотикам.41,42,44,45 β-лактамазы расширенного спектра (БЛРС) — это плазмидные ферменты, расщепляющие цефалоспорины. 44 Штаммы грамотрицательных палочек, продуцирующие БЛРС, более распространены в Южной Азии, причем в двух сериях сообщается, что 12% и 35% из их перитонеальных изолятов E. coli продуцировали БЛРС.46,47. Пациенты, инфицированные штаммами E. coli , продуцирующими БЛРС, в три-четыре раза чаще не проходят лечение, чем пациенты без БЛРС Штаммы-продуценты.47 Как всегда, окончательная терапия должна основываться на тестах на лекарственную чувствительность, но в целом штаммы, продуцирующие БЛРС, обычно чувствительны к карбапенемам, таким как имипенем, меропенем и эртапенем, и обычно чувствительны к аминогликозидам, таким как гентамицин или тобрамицин.Кроме того, организмы SPICE ( Serratia , Pseudomonas , Proteus , Citrobacter и Enterobacter spp.) Обычно содержат ферменты β-лактамазы AmpC, которые расщепляют большинство цефалоспориновых антибиотиков и лучше всего лечятся карбапенемами. фторхинолоны или аминогликозиды, в зависимости от лекарственной чувствительности. 43 Еще большее беспокойство вызывает появление и распространение устойчивых к карбапенемам Enterobacteriaceae (CRE) или Klebsiella pneumoniae , продуцирующих карбапенемазу (KPC).48 Эта форма устойчивости к антибиотикам передается между бактериальными штаммами на мобильных генетических элементах и приводит к устойчивости ко всем β-лактамным антибиотикам, включая карбапенемы, и, как правило, к фторхинолонам и многим аминогликозидам. Варианты лечения в большинстве случаев ограничиваются полимиксином, колистином или тигециклином, в зависимости от исследований лекарственной чувствительности.48
Большинство эмпирических схем антибиотиков при перитоните, связанном с БП, включают довольно широкий охват грамотрицательных бактерий, включая цефалоспорины широкого спектра действия ( цефтазидим или цефепим) или аминогликозид.После получения результатов посева и определения чувствительности терапию можно сузить до одного эффективного антибиотика. Терапию следует продолжать в течение 3 недель2. Несмотря на оптимальную антибактериальную терапию, перитонит, вызванный грамотрицательными кишечными бактериями, приводит к относительно высокой частоте отказов, удалению катетера, постоянному переводу на гемодиализ и смерти.42,43
Перитонит, вызванный неферментирующим Грамом. -отрицательные палочки:
Pseudomonas , Acinetobacter и Stenotrophomonas
Pseudomonas , Acinetobacter и Stenotrophomonas являются строгими аэробами (неферментерами), которые в индивидуальном порядке составляют менее 5% случаев перитонита в программах .Важность этих организмов заключается в том, что они обычно устойчивы к большинству антибиотиков, что затрудняет их лечение, и имеют высокую частоту неудач, часто приводящую к удалению катетера.
Pseudomonas , перитонит
Pseudomonas aeruginosa — распространенный нозокомиальный патоген, который обычно обладает множественной лекарственной устойчивостью. Перитонит Pseudomonas часто возникает после недавнего курса антибиотиков по поводу перитонита или по другим показаниям.49 Рекомендуется лечение двумя антибиотиками в течение 3 недель2, а также рекомендуется удаление катетера, если присутствует туннельная инфекция или наблюдается неоптимальный ответ на терапию антибиотиками.49,50 Окончательная терапия основана на результатах теста на чувствительность к противомикробным препаратам. Комбинация β-лактамного агента широкого спектра действия и аминогликозида обычно дает синергетический эффект. β-лактамы с антипсевдомонадной активностью включают цефтазидим, цефепим, пиперациллин, имипенем, меропенем и азтреонам. Тобрамицин и амикацин являются наиболее активными аминогликозидами, а ципрофлоксацин имеет лучшую активность среди фторхинолонов. В случае полирезистентных штаммов может потребоваться полимиксин или колистин.Показатели неэффективности антибактериальной терапии, удаления катетера и постоянного перевода на гемодиализ выше, чем у большинства патогенов.49,50
Acinetobacter перитонит
Acinetobacter перитонит встречается нечасто, составляя 3–7% случаев в сообщенная серия.51,52 Подобно Pseudomonas , Acinetobacter по своей природе устойчив к большинству антибиотиков и легко вырабатывает устойчивость в результате мутаций и приобретения генетического материала от других организмов.53 Относительно высока частота терапевтических неудач, удаления катетера и летальности при перитоните Acinetobacter , особенно с лекарственно-устойчивыми штаммами.51,52 Как и Pseudomonas , терапия должна основываться на результатах тестирования на чувствительность, а терапия два активных препарата могут быть более эффективными. Большинство штаммов чувствительны к сульбактаму, который не доступен в виде единственного агента, но находится в виде ампициллина-сульбактама. Обычно активны карбапенемы и аминогликозиды.53 Для микроорганизмов с множественной лекарственной устойчивостью часто активны тигециклин и миноциклин, но имеется небольшой опыт использования этих препаратов при перитоните при БП. Наконец, обычно активны полимиксин B и колистин. Терапию следует продолжать в течение 3 недель.
Stenotrophomonas перитонит
Stenotrophomonas maltophilia — еще одна неферментирующая грамотрицательная палочка, которая обычно обладает множественной лекарственной устойчивостью. Согласно опубликованным сериям, на него обычно приходится менее 5% случаев перитонита.54,55 Недавний курс антибиотиков оказался фактором риска в одной серии исследований54.
Stenotrophomonas обладает высокой устойчивостью к большинству β-лактамных антибиотиков, особенно к карбапенемам и аминогликозидам. Имеет хромосомную карбапенемазу. Наиболее активными препаратами являются триметоприм-сульфаметоксазол, колистин, азтреонам, пиперациллин-тазобактам и моксифлоксацин. Исходя из ограниченного опыта, перитонит Stenotrophomonas следует лечить двумя эффективными препаратами в течение 3 недель. Несмотря на это, высока вероятность отказов и потери катетера.
Полимикробный перитонит
Полимикробный перитонит, выделение более чем одного микроорганизма в одном эпизоде перитонита, сообщается примерно в 10% случаев в большинстве серий.56,57 Полимикробный перитонит чаще встречается у пациентов с предшествующими эпизодами перитонита. Полимикробный перитонит, вызванный только грамположительными микроорганизмами, составляет около 20% случаев и имеет наилучший прогноз с точки зрения эффективности лечения и удержания катетера. Инфекции, которые включают грамотрицательные бактерии, анаэробы или грибки, имеют худшие результаты, с более высокой частотой неудач, удалением катетера и постоянным переводом на гемодиализ.56–58 Изоляция нескольких видов, особенно грамотрицательных кишечных бактерий и анаэробов, должна вызывать подозрение на внутрибрюшную инфекцию, которая присутствует менее чем в 10% случаев. Антимикробную терапию следует проводить в соответствии с результатами посева и чувствительностью и продолжать в течение 3 недель. Пациентам с плохим ответом на терапию следует как можно скорее удалить катетеры, чтобы сохранить перитонеальную мембрану.57
Перитонит с отрицательным посевом
Перитонит с отрицательным посевом, как следует из названия, является случаем с клиническими признаками перитонита: боль в животе, повышенные уровни лейкоцитов в перитонеальной жидкости и культуры перитонеальной жидкости, не являющиеся возбудителями.Возможными причинами отрицательных посевов являются введение антибиотиков перед посевом из перитонеальной жидкости, неоптимальное обращение или обработка культур или методы культивирования 59–61 или присутствие привередливых организмов, КУБ или нитчатых грибов. Руководящие принципы рекомендуют эталонный уровень менее 20% случаев с отрицательным посевом. Как правило, пациенты с перитонитом с отрицательной культурой чувствуют себя хорошо. Перитонеальная жидкость должна быть повторно оценена на 3-й день, чтобы оценить ответ на терапию. Тем, кто отвечает на начальную эмпирическую терапию, можно отменить прием грамотрицательных антибиотиков и лечить их 2-недельным ванкомицином или цефазолином.2,59 Пациенты, которые не реагируют на эмпирическую терапию уменьшением боли в животе и / или улучшением количества лейкоцитов в брюшной полости, должны быть повторно обследованы на предмет инфекции привередливыми бактериями, грибами или микобактериальной инфекцией с более вовлеченными бактериальными культурами и культурами для AFB и грибы. Отсутствие ответа также должно побуждать к рассмотрению вопроса об удалении катетера через 5-7 дней.
Грибковый перитонит
Заболеваемость грибковым перитонитом варьируется от центра к центру, от <5% до 15% случаев.62
Candida spp. составляют 90% и более эпизодов грибкового перитонита. В более ранних исследованиях большинство из случаев перитонита Candida было вызвано Candida albicans . В более поздних исследованиях сообщалось о Candida albicans менее чем в половине случаев с частым выделением Candida parapsilosis , Candida tropicalis и Candida krusei .62–65
Candida spp. являются частью нормальной флоры кожи и желудочно-кишечного тракта большинства людей, а терапия антибиотиками увеличивает плотность их колонизации.Таким образом, в большинстве случаев перитонит Candida происходит после недавнего курса антибиотиков по поводу перитонита или по другим показаниям. Заражение прикосновением — обычный путь заражения.
Клиническая картина перитонита Candida напоминает бактериальный перитонит с болью в животе и повышенным количеством лейкоцитов в перитонеальной жидкости с преобладанием нейтрофилов. Candida существует только в дрожжевой форме и легко растет на обычных средах для культивирования бактерий. Специфические грибковые культуры не нужны.Широко доступны тесты на чувствительность к противогрибковым препаратам, а также тесты на флуконазол, флуцитозин, амфотерицин B и каспофунгин. В случае перитонита Candida начальная эмпирическая терапия должна состоять из флуконазола, до определения вида и тестирования лекарственной чувствительности. Флуконазол вводят в дозе 200 мг внутрибрюшинно каждые 24–48 часов или перорально в нагрузочной дозе 200 мг с последующим приемом 50–100 мг в день. Должен быть проведен тест на лекарственную чувствительность, потому что C.krusei всегда устойчив к флуконазолу, а Candida glabrata часто устойчив. Кроме того, другие Candida spp. может стать резистентным.65 В случае резистентных к флуконазолу организмов успешно применялась терапия амфотерицином В 0,75–1 мг / кг / день внутривенно вместе с пероральным приемом флуцитозина 1 г в день. Амфотерицин для внутрибрюшинного введения вызывает сильное раздражение, и его трудно использовать. Если используется флуцитозин, следует измерять минимальные уровни в сыворотке с целевым уровнем 25–50 мкг / мл, чтобы избежать токсичности.66 Вориконазол — новый триазольный противогрибковый препарат, который активен в отношении многих устойчивых к флуконазолу штаммов.67 Имеется небольшой опыт использования вориконазола для лечения перитонита Candida , но он успешно применялся при лечении перитонита, вызванного мицелиальными грибами, в дозе 200 мг внутрибрюшинно один раз в день или 200 мг перорально два раза в день.68,69
Candida перитонит трудно лечить эффективно, и он приводит к высокому уровню потери катетера и необратимому переходу на гемодиализ.Руководства ISPD и ряд других источников рекомендуют немедленное удаление катетера при постановке диагноза перитонита Candida с последующим 2-недельным курсом противогрибковой терапии.2,62,64,65,70 Тем не менее, две опубликованные серии показали довольно хороший успех с другими методами лечения . Ван и др. Пролечили 13 пациентов с перитонитом Candida внутривенным введением амфотерицина B и перорального флуконазола, оставив катетер на месте до тех пор, пока сток не выйдет.66 Эти пациенты получали противогрибковые препараты в течение еще 1-2 недель с последующей заменой катетера примерно через 4 недели. начало лечения.Однако ни один из этих 13 пациентов не вернулся к ПД. Boer et al успешно пролечили восемь пациентов с Candida перитонитом с установленными катетерами.71 Пациенты получали флуконазол 150 мг внутрибрюшинно каждые 48 часов, флуцитозин перорально 500 мг два раза в день, а катетеры блокировали 10 мл амфотерицина B 0,1 мг / мл после каждого непрерывного приема. амбулаторный обмен ПД.
Большинство пациентов с перитонитом Candida получали недавно курс антибиотиков от перитонита или по другим показаниям до постановки диагноза перитонита Candida .72 Антибиотики широкого спектра действия уменьшают нормальную бактериальную флору кожи и желудочно-кишечного тракта и мочеиспускательного канала, а также способствуют чрезмерному росту с помощью Candida spp. Ранние исследования показали, что терапия пероральным нистатином, невсасывающимся противогрибковым средством, принимаемым во время антибиотикотерапии, может снизить частоту вторичного грибкового перитонита, но степень защиты была невысокой.73 Более недавнее рандомизированное контролируемое исследование, в котором пациенты получали антибиотики для лечения заболеваний. бактериальный перитонит, прием флуконазола 200 мг перорально каждые 48 часов снизил частоту вторичного грибкового перитонита более чем на 80%.74 В настоящее время это рекомендовано в рекомендациях ISPD.2
Перитонит, вызванный мицелиальными грибами или плесенью, встречается реже, чем Candida , составляя менее 10% случаев грибкового перитонита.72 Эти организмы повсеместно распространены в окружающей среде, и вероятно, вызывают перитонит из-за заражения прикосновением. Клинические проявления и исследования перитонеальной жидкости напоминают бактериальный перитонит. 75 Эти организмы плохо растут на стандартных средах для культивирования бактерий, поэтому в случаях с отрицательными посевами, которые не улучшаются к 3 дню эмпирической антибактериальной терапии, следует получить жидкость для грибковых культур.Эти культуры инокулируются на питательные среды для грибов, и организмы растут как плесень. Наиболее часто встречающиеся микроорганизмы — это Aspergillus , за которыми следует Mucor (мукормикоз), но, как сообщается, множество других видов вызывают грибковый перитонит.62,75 После постановки диагноза катетер следует немедленно удалить. Эти организмы почти всегда устойчивы к флуконазолу, но могут быть восприимчивы к вориконазолу или позаконазолу и обычно чувствительны к амфотерицину B.Имеется не так много публикаций об этих инфекциях, но большинство из них будет лечить с помощью эффективной противогрибковой терапии в течение 2–8 недель, прежде чем пытаться заменить катетер. Отчеты о случаях были успешными с применением внутрибрюшинного и перорального вориконазола при перитоните Aspergillus и липосомального амфотерицина B и перорального позаконазола при перитоните Mucor .68,69 Несмотря на оптимальное лечение, половина или более этих пациентов испытают неэффективность техники и будут переведены на гемодиализ.76,77
Микобактериальный перитонит
Микобактериальные инфекции человека делятся на две группы: инфекции, вызываемые Mycobacterium tuberculosis (MTB), и инфекции, вызываемые нетуберкулезными микобактериями (NTM). Инфекция MTB передается от одного человека к другому, обычно вызывая скрытую инфекцию, которая может возобновиться. НТМ — это организмы окружающей среды, которые не передаются от человека к человеку, и, хотя они являются редкими причинами перитонита при БП, частота их распространения увеличивается.
Туберкулезный перитонит
Туберкулезный перитонит обычно возникает при реактивации латентной туберкулезной инфекции. Хроническая почечная недостаточность является иммунодепрессивной и связана с 100-кратным увеличением частоты реактивации болезни.78 Скрининг пациентов на латентную туберкулезную инфекцию должен стать обычной практикой, когда они готовятся к диализу или входят в программу диализа, особенно если они живут в эмигрировали из региона, где высока заболеваемость латентной туберкулезной инфекцией (Азия, Африка, Южная или Центральная Америка).Это легко сделать с помощью туберкулиновой кожной пробы или анализа высвобождения IFNγ.79 Пациенты, у которых диагностирована латентная туберкулезная инфекция, должны получать профилактическую терапию изониазидом 300 мг в день или 900 мг три раза в неделю с пиридоксином 50 мг в день в течение 9 месяцев. . Это значительно снизит риск развития активного туберкулеза.
У пациентов с БП, у которых развивается активный туберкулез, перитонит является очагом инфекции (37%) почти так же часто, как туберкулез легких (40%) .80 Клинические проявления туберкулезного перитонита напоминают бактериальную инфекцию с лихорадкой, болями в животе и облачностью. диализат с повышенным содержанием лейкоцитов, которые обычно являются преимущественно PMNL.81,82 Основное различие состоит в том, что перитонит, как правило, имеет подострое начало признаков и симптомов. Обычные бактериальные культуры перитонеальной жидкости отрицательны, а мазки жидкости на КУБ редко бывают положительными. Во время презентации кожные пробы на туберкулез обычно отрицательны из-за анергии.83,84 В случае перитонита с отрицательным посевом следует рассмотреть вопрос о туберкулезе и направить жидкость на мазки и посевы на КУБ. Частота положительных мазков на КУБ перитонеальной жидкости в большинстве серий составляет менее 20%, а посевы КУБ с использованием системы BacT являются положительными в 70–90%, но для получения положительного результата требуется 10–14 дней.Биопсия брюшины обычно дает положительный результат при наличии гранулем и положительных посевов, но она инвазивна. Более быстрый способ диагностики — это прямая ПЦР жидкости PD. ПЦР на МТБ дает результаты в течение нескольких часов, она очень чувствительна и специфична для туберкулезного перитонита.81,83–85
При постановке диагноза туберкулезного перитонита следует начать четырехкомпонентную противотуберкулезную терапию. Руководства ISPD рекомендуют изониазид 300 мг один раз в день, рифампицин 600 мг один раз в день, пиразинамид 25–35 мг / кг три раза в неделю и офлоксацин перорально 200 мг один раз в день с пероральным пиридоксином 50 мг один раз в неделю.2 Этамбутол не рекомендуется из-за риска неврита зрительного нерва. Для чувствительных к лекарствам штаммов пиразинамид и офлоксацин можно прекратить через 2 месяца, а изониазид и рифампин продолжать в общей сложности 12–18 месяцев. В нескольких сериях лечение без удаления катетера приводило к хорошим результатам. 80,82–84 Несмотря на оптимальную диагностику и терапию, уровень смертности составляет 20–30%.
Нетуберкулезный микобактериальный перитонит
NTM — это группа из 150 или более видов, многие из которых были идентифицированы как патогены человека.Эти организмы существуют в окружающей среде в воде, почве, животных и птицах, обычно поступают из воды или других источников окружающей среды и не передаются от одного человека к другому.86 В большинстве центров США перитонит, вызванный НТМ, более выражен. чаще, чем МТБ. НТМ может также вызвать инфекции места выхода, что может привести к перитониту. Использование гентамицина для профилактики в месте выхода было связано с увеличением частоты инфицирования NTM в месте выхода. 6,87
Клинические проявления перитонита NTM напоминают бактериальный перитонит, с болью в животе и мутными выделениями с преобладанием нейтрофилов, но бактериального происхождения. посевы обычно отрицательны через 3 дня.Мазки жидкости на КУБ обычно отрицательны. Наиболее частыми возбудителями являются быстрорастущие Mycobacterium abscessus , Mycobacterium chelonae и Mycobacterium fortuitum .88–92 Эти организмы часто будут расти на обычных питательных средах для бактерий в течение 5 дней. Они представляют собой грамположительные палочки при окрашивании по Граму и могут быть ошибочно идентифицированы как дифтероиды. Если это произойдет, попросите лабораторию провести окрашивание изолята AFB. Идентификация видов и тестирование на чувствительность к противомикробным препаратам необходимы для эффективной терапии.Эти организмы обычно устойчивы к стандартным противотуберкулезным препаратам, таким как изониазид, рифампицин и пиразинамид. При лечении следует руководствоваться тестом на чувствительность к противомикробным препаратам и часто включать аминогликозиды, макролиды и фторхинолоны. Более 80% зарегистрированных случаев требуют удаления катетера с продолжением противомикробной терапии в течение не менее 6 недель после этого.
Профилактика перитонита
Частота перитонита, связанного с БП, за последние годы существенно снизилась за счет улучшения оборудования, техники и профилактических мер.В рекомендациях ISPD от 2016 г. рекомендовано 0,5 эпизода в год или один эпизод каждые 2 года2. Снижение числа случаев перитонита — многогранный процесс, начинающийся с обширного обучения пациентов с упором на правильную технику.93,94 Считается, что промывка перед заполнением с помощью Y-образных соединителей частично снижает частоту перитонита. Было показано, что профилактическое назначение антибиотиков с ванкомицином или цефалоспоринами первого или второго поколения до установки катетера снижает послеоперационные катетерные инфекции и рекомендуется в руководствах ISPD.2,95 Некоторые данные свидетельствуют о том, что скрининг пациентов на носительство S. aureus и лечение носителей интраназальным мупироцином снижает послеоперационные инфекции Staphylococcus 6,95. мало влияют на частоту перитонита, равно как и выбор диализных жидкостей.2
В случае нарушения техники, например, заражения прикосновением, пациента следует обучить, чтобы он немедленно уведомил своего поставщика.Если жидкость не вливалась, пациенту может потребоваться замена конца трубки. Если есть вероятность заражения и вливания жидкости, вероятно, показан короткий курс профилактического лечения антибиотиками, в зависимости от характера заражения. Обычно это однократная внутрибрюшинная доза цефазолина или 2-дневный курс перорального антибиотика, такого как цефалексин.95
Пациенты должны быть обучены правильному уходу на месте выхода. Перед любым уходом на месте выхода очень важно соблюдать правила гигиены рук.Место выхода следует очищать не реже двух раз в неделю и после душа с антибактериальным мылом и водой или хлоргексидиновым мылом.2,6 Доказано, что ежедневное нанесение противомикробных препаратов на место выхода снижает риск инфицирования места выхода и перитонита. Крем с мупироцином, наносимый ежедневно на место выхода, снижает количество инфекций места выхода S. aureus и перитонита на 73% .96
Мупироцин имеет активность только против Staphylococcus , Streptococcus и других грамположительных бактерий. .Крем с гентамицином также эффективен в снижении инфекций в месте выхода, вызванных S. aureus , Pseudomonas и другими грамотрицательными бактериями.97 Однако в некоторых исследованиях сообщается об увеличении частоты инфекций в месте выхода, вызванных S. aureus . , Грамотрицательные кишечные бактерии, Pseudomonas , 98 и NTM у пациентов, использующих гентамицин для профилактики в месте выхода. 6,87
Инвазивные диагностические и терапевтические процедуры, приводящие к транзиторной бактериемии, считаются причинами перитонита.Рекомендуется антибиотикопрофилактика однократной пероральной дозой 2 г амоксициллина за 2 часа до стоматологических процедур, вызывающих кровотечение десен.95 Перипроцедурная антибиотикопрофилактика парентеральным введением ампициллина и гентамицина также рекомендуется пациентам, подвергающимся колоноскопии, гистероскопии или другим инвазивным процедурам. разрушать колонизированные поверхности слизистой оболочки, чтобы предотвратить перитонит.2,95 Как упоминалось ранее, противогрибковая профилактика пероральным флуконазолом рекомендуется пациентам с БП, которые получают антибиотики от перитонита или других инфекций.2
Сноски
Раскрытие информации
Автор сообщает об отсутствии конфликта интересов в этой работе.
Ссылки
1. Grassmann A, Gioberges S, Moeller S, Brown G. Пациенты с ESRD в 2004 году: глобальный обзор количества пациентов, методов лечения и связанных тенденций. Пересадка нефрола Dial. 2005; 20: 2587–2593. [PubMed] [Google Scholar] 2. Ли П.К., Сзето С.К., Пираино Б. и др. Рекомендации ISPD по перитониту: обновленная информация о профилактике и лечении 2016 г. Perit Dial Int.2016; 36: 481–508. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Муджаис С. Микробиология и исходы перитонита в Северной Америке. Kidney Int. 2006; 70: S55 – S62. [PubMed] [Google Scholar] 4. Гали Дж. Р., Баннистер К. М., Браун Ф. Г. и др. Микробиология и исходы перитонита у австралийских пациентов на перитонеальном диализе. Perit Dial Int. 2011; 31: 651–662. [PubMed] [Google Scholar] 5. ван Дуэпен А.Т., Томлинсон Г.А., Джассал С.В. Связь между инфекцией места выхода и последующим перитонитом у пациентов на перитонеальном диализе.Clin J Am Soc Nephrol. 2012; 7: 1266–1271. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Сзето С.К., Ли П.К., Джонсон Д.В. и др. Рекомендации ISPD по инфекциям, связанным с катетером: обновление 2017 г. Perit Dial Int. 2017; 37: 141–154. [PubMed] [Google Scholar] 7. Burkhalter F, Clemenger M, Haddoub SS, McGrory J, Hisole N, Brown E. Pseudomonas Инфекция места выхода: результаты лечения гентамицином для местного применения в дополнение к системным антибиотикам. Clin Kidney J. 2015; 8: 781–784. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8.Альфа М.А., Дегань П., Олсон Н., Хардинг Г.К. Улучшенное обнаружение роста бактерий в стоках постоянного амбулаторного перитонеального диализа за счет использования бутылочек BacT / Alert FAN. J Clin Microbiol. 1997; 35: 862–866. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Бибер С.Д., Андерсон А.Е., Мехрота Р. Диагностическое тестирование перитонита у пациентов, находящихся на перитонеальном диализе. Semin Dial. 2014; 27: 602–606. [PubMed] [Google Scholar] 10. Ругер В., ван Иттерсум Ф.Дж., Комаззеттос С.Е., Хукс С.Е., тер Ви П.М. Сходные исходы перитонита у пациентов с CAPD и APD при продолжении диализа во время перитонита.Perit Dial Int. 2011; 31: 39–47. [PubMed] [Google Scholar] 11. de Moraes TP, Olandoski M, Caramori JC и др. Новые предикторы исходов, связанных с перитонитом, в когорте BRAZPD. Perit Dial Int. 2012; 34: 179–187. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. von Eiff C, Peters G, Heilmann C. Патогенез инфекций, вызванных коагулазонегативными стафилококками. Lancet Infect Dis. 2002; 2: 677–685. [PubMed] [Google Scholar] 13. Донлан РМ. Формирование биопленок: клинически значимый микробиологический процесс.Clin Infect Dis. 2001; 33: 1387–1392. [PubMed] [Google Scholar] 14. Берк М., Хоули С.М., Бадве С.В. и др. Рецидивирующий и рецидивирующий перитонит, связанный с перитонеальным диализом: многоцентровое регистрационное исследование. Am J Kidney Dis. 2011. 58: 429–436. [PubMed] [Google Scholar] 15. Фахим М., Хоули С.М., Макдональд С.П. и др. Коагулазонегативный стафилококковый перитонит у австралийских пациентов на перитонеальном диализе: предикторы, лечение и исход в 936 случаях. Пересадка нефрола Dial. 2010; 25: 3386–3392. [PubMed] [Google Scholar] 16.Camargo CH, da Cunha ML, Caramori JC, Mondelli AL, Montelli AC, Barretti P. Перитонит, связанный с перитонеальным диализом, вызванный коагулазонегативным стафилококком Staphylococcus : обзор 115 случаев в бразильском центре. Clin J Am Soc Nephrol. 2014; 9: 1074–1081. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Лузар М.А., Коулз Га, Фаллер Б. и др. Staphylococcus aureus Носительство через нос и инфекция у пациентов, находящихся на непрерывном амбулаторном перитонеальном диализе. N Engl J Med. 1990; 372: 505–509. [PubMed] [Google Scholar] 18.Ritzou J, Hoffmann RM, Tzamaloukas AH. Влияние предотвращения носительства Staphylococcus aureus на частоту возникновения стафилококковых инфекций, связанных с перитонеальным катетером. Perit Dial Int. 2001; 21: 471–479. [PubMed] [Google Scholar] 19. Szeto CC, Chow KM, Kwan BC, et al. Золотистый стафилококк осложняет перитонеальный диализ: обзор 245 последовательных случаев. Clin J Am Soc Nephrol. 2007; 2: 245–251. [PubMed] [Google Scholar] 20. Говиндараджулу С., Хоули С.М., Макдональд С.П. и др. Staphylococcus aureus Перитонит у австралийских пациентов на перитонеальном диализе: предикторы, лечение и исходы у 503 пациентов.Perit Dial Int. 2010. 30: 311–319. [PubMed] [Google Scholar] 21. Хаджинов Д., Джухадар С., Петерс Х. Уровни плазмы и перитонеального диализата во время терапии даптомицином при перитоните. Am J Kidney Dis. 2009; 53: 911–912. [PubMed] [Google Scholar] 22. Бахте С.К., Бертрам А., Буркхард О. и др. Терапевтические концентрации даптомицина в сыворотке крови после внутрибрюшинного введения у пациента с перитонитом, связанным с перитонеальным диализом. J Antimicrob Chemother. 2010; 65: 1312–1314. [PubMed] [Google Scholar] 23.Сен-Поль LP, Фишё М., Дебрюн Д. и др. Фармакокинетика внутрибрюшинного даптомицина у пациентов с перитонитом, связанным с перитонеальным диализом. Perit Dial Int. 2017; 37: 44–50. [PubMed] [Google Scholar] 24. Сон Ай Джей, Со Дж. У., Квон Й. Е. и др. Успешное лечение ванкомицин-резистентного энтерококкового перитонита с использованием линезолида без удаления катетера у пациента на перитонеальном диализе. Perit Dial Int. 2014; 34: 235–239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Gervasoni C, Bergia R, Cozzi V, Clementi E, Cattaneo D.Не пора ли пересмотреть дозы линезолида у пациентов на перитонеальном диализе? J Antimicrob Chemother. 2015; 70: 2918–2920. [PubMed] [Google Scholar] 26. Сараволац Л.Д., Штейн Г.Е., Джонсон Л.Б. Цефтаролин: новый цефалоспорин с активностью против метициллин-устойчивого Staphylococcus aureus . Clin Infect Dis. 2011; 52: 1156–1163. [PubMed] [Google Scholar] 27. О’Ши С., Хоули С.М., Макдональд С.П. и др. Стрептококковый перитонит у австралийских пациентов на перитонеальном диализе: предикторы, лечение и исходы в 287 случаях.BMC Nephrol. 2009; 10:19. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Шукла А., Абреу З., Баргман Дж. М.. Стрептококковый перитонит при БП: 10-летний обзор опыта одного центра. Пересадка нефрола Dial. 2006; 21: 3545–3549. [PubMed] [Google Scholar] 29. Hsu RB, Fang-Yue L. Влияние устойчивости к пенициллину на проявление и исход неэнтерококкового стрептококкового инфекционного эндокардита. Кардиология. 2006; 105: 234–239. [PubMed] [Google Scholar] 30. Робертс Д.М., Фернандо Дж., Певец Р.Ф., Кеннеди К.Дж., Лоуренс М., Талауликар Г.Стабильность антибиотиков в коммерческих растворах для перитонеального диализа: влияние состава, хранения и продолжительности. Пересадка нефрола Dial. 2011; 26: 3344–3349. [PubMed] [Google Scholar] 31. Чао С.Дж., Ли С.И., Ян В.С. и др. Стрептококки Viridans при перитоните перитонеального диализа: клиническое течение и отдаленные результаты. Perit Dial Int. 2015; 35: 333–341. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Эдей М., Хоули С.М., Макдональд С.П. и др. Энтерококковый перитонит у австралийских пациентов на перитонеальном диализе: предикторы, лечение и исходы в 116 случаях.Пересадка нефрола Dial. 2010; 25: 1272–1278. [PubMed] [Google Scholar] 33. Yip T, Tsa KC, Ng F, et al. Клиническое течение и исходы перитонита, вызванного энтерококками, у пациентов на перитонеальном диализе. Perit Dial Int. 2011; 31: 522–528. [PubMed] [Google Scholar] 34. Huen SC, Hall I, Topal J, Mahnensmith RL, Brewster UC, Abu-Alfa AK. Успешное применение даптомицина внутрибрюшинно при лечении ванкомицин-резистентного энтерококкового перитонита. Am J Kidney Dis. 2009; 54: 538–541. [PubMed] [Google Scholar] 35.Гилмор Дж. Ф., Кин М., Ла Сальвия М. Т., Махони М. В.. Лечение энтерококкового перитонита внутрибрюшинным даптомицином у пациентов с аллергией на ванкомицин и обзор литературы. Perit Dial Int. 2013; 33: 353–357. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Ян Дж.В., Ким Ю.С., Чхве СО, Хан Б.Г. Успешное применение линезолида для внутривенного введения у пациента с ХПНП с устойчивым к ванкомицину энтерококковым перитонитом. Perit Dial Int. 2011; 31: 209–210. [PubMed] [Google Scholar] 37. Wu VC, Wang YT, Wang CY и др. Высокая частота линезолид-ассоциированной тромбоцитопении и анемии среди пациентов с терминальной стадией почечной недостаточности.Clin Infect Dis. 2006; 42: 66–72. [PubMed] [Google Scholar] 38. Сон Ай Джей, Со Дж. У., Квон Й. Е. и др. Успешное лечение ванкомицин-резистентного энтерококкового перитонита с использованием линезолида без удаления катетера у пациента на перитонеальном диализе. Perit Dial Int. 2014; 34: 235–239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Барраклаф К., Хоули С.М., Макдональд С.П. и др. Corynebacterium перитонит у пациентов на перитонеальном диализе в Австралии: предикторы, лечение и исходы в 82 случаях.Пересадка нефрола Dial. 2009; 24: 3834–3839. [PubMed] [Google Scholar] 40. Szeto CC, Chow KM, Chung KY, Kwan BC, Leung CB, Li PK. Клиническое течение перитонита, связанного с перитонеальным диализом, вызванного видами Corynebacterium . Пересадка нефрола Dial. 2005. 20: 2793–2796. [PubMed] [Google Scholar] 41. Джейн А.К., Блейк П.Г. Не Pseudomonas грамотрицательный перитонит. Kidney Int. 2006; 69: 1107–1109. [PubMed] [Google Scholar] 42. Szeto CC, Chow VC, Chow KM, et al. Enterobacteriaceae перитонит, осложняющий перитонеальный диализ: обзор 210 последовательных случаев.Kidney Int. 2006; 69: 1245–1252. [PubMed] [Google Scholar] 43. Джарвис Э.М., Хоули С.М., Макдональд С.П. и др. Предикторы, лечение и исходы грамотрицательного перитонита, отличного от Pseudomonas . Kidney Int. 2010; 78: 408–414. [PubMed] [Google Scholar] 44. Брэдфорд PA. Β-лактамазы расширенного спектра в 21 веке: характеристика, эпидемиология и обнаружение этой важной угрозы устойчивости. Clin Microbiol Rev.2001; 14: 933–951. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Вонг СС, Хо П.Л., Юэнь К.Ю.Эволюция механизмов устойчивости к антибиотикам и их значение для инфекций, связанных с диализом. Perit Dial Int. 2007; 27: S272 – S280. [PubMed] [Google Scholar] 46. Ип Т., Це К.С., Лам М.Ф. и др. Факторы риска и исходы перитонита E. coli, продуцирующего β-лактамазу расширенного спектра действия, у пациентов с CAPD. Perit Dial Int. 2006; 26: 191–197. [PubMed] [Google Scholar] 47. Фэн X, Ян X, Yi C и др. Escherichia coli перитонит при перитонеальном диализе: распространенность, устойчивость к антибиотикам и клинические исходы в диализном центре Южного Китая.Perit Dial Int. 2014: 308–316. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Гупта Н., Лимбаго Б.М., Патель Дж. Б., Каллен А. Дж.. Карбапенем-устойчивые Enterobacteriaceae: эпидемиология и профилактика. Clin Infect Dis. 2011; 53: 60–67. [PubMed] [Google Scholar] 49. Szeto CC, Chow KM, Leung CB, et al. Клиническое течение перитонита, вызванного видами Pseudomonas , осложняющими перитонеальный диализ: обзор 104 случаев. Kidney Int. 2001; 59: 2309–2315. [PubMed] [Google Scholar] 50. Сива Б., Хоули С.М., Макдональд С.П. и др. Перитонит, вызванный Pseudomonas , в Австралии: предикторы, лечение и исходы в 191 случае. Clin J Am Soc Nephrol. 2009; 4: 957–964. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Ли PH, Cheng VC, Yip T, Yap DY, Lui SL, Lo WK. Эпидемиология и клинические характеристики Acinetobacter перитонита, связанного с перитонеальным диализом, в Гонконге: с точки зрения множественной лекарственной устойчивости и устойчивости к карбапенемам. Perit Dial Int. 2017; 37: 37: 177–182. [PubMed] [Google Scholar] 52. Чжан В., У Ю.Г., Ци ХМ, Дай Х., Лу В., Чжао М.Перитонит, связанный с перитонеальным диализом, вызванный Acinetobacter baumannii : обзор семи случаев. Perit Dial Int. 2012; 34: 317–321. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Муньос-Прайс Л.С., Вайнштейн Р.А. Инфекция, вызванная Acinetobacter . N Engl J Med. 2008; 558: 1271–1281. [PubMed] [Google Scholar] 54. Тейлор Г., Маккензи М., Бьюкенен-Челл М., Перри Д., Чуй Л., Дасгупта М. Перитонит, вызванный Stenotrophomonas maltophilia у пациентов, подвергающихся хромическому перитонеальному диализу.Perit Dial Int. 1999; 19: 259–262. [PubMed] [Google Scholar] 55. Сзето CC, Ли П.К., Люнг CB, Ю.А.В., Луи С.Ф., Лай К.Н. Xanthomonas maltophilia Перитонит у пациентов с уремией, получающих непрерывный амбулаторный перитонеальный диализ. Am J Kidney Dis. 1997. 29: 91–95. [PubMed] [Google Scholar] 56. Ким ГК, Корбет СМ. Полимикробный перитонит у пациентов с непрерывным амбулаторным перитонеальным диализом. Am J Kidney Dis. 2000; 36: 1000–1008. [PubMed] [Google Scholar] 57. Szeto CC, Chow KM, Wong TY и др. Консервативное лечение полимикробного перитонита, осложняющего перитонеальный диализ: серия из 140 последовательных случаев.Am J Med. 2002; 113: 728–733. [PubMed] [Google Scholar] 58. Барраклаф К., Хоули С.М., Макдональд С.П. и др. Полимикробный перитонит у пациентов на перитонеальном диализе в Австралии: предикторы, лечение и исходы. Am J Kidney Dis. 2010. 55: 121–131. [PubMed] [Google Scholar] 59. Фахим М., Хоули С.М., Макдональд С.П. и др. Культурально-отрицательный перитонит у пациентов на перитонеальном диализе в Австралии: предикторы, лечение и исходы у 435 пациентов. Am J Kidney Dis. 2010; 55: 690–697. [PubMed] [Google Scholar] 60.Szeto CC, Wong TY, Chow KM, Leung CB, Li PK. Клиническое течение перитонита без посева, осложняющего перитонеальный диализ. Am J Kidney Dis. 2003. 25: 207–222. [PubMed] [Google Scholar] 61. Одуду А., Тернер Дж., Кумер К., Салмон Л., Яздани Ф., Леунг Дж. Обзор практики отбора проб перитонита и диализа в Соединенном Королевстве. Perit Dial Int. 2016; 36: 101–104. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Прасад Н, Гупта А. Грибковый перитонит у пациентов на перитонеальном диализе. Perit Dial Int.2005. 25: 207–222. [PubMed] [Google Scholar] 63. Майлз Р., Хоули С.М., Макдональд С.П. и др. Предикторы и исходы грибкового перитонита у пациентов на перитонеальном диализе. Kidney Int. 2009. 76: 622–628. [PubMed] [Google Scholar] 64. Nadeau-Fredette AC, Bargman JM. Характеристики и исходы грибкового перитонита в современной когорте Северной Америки. Perit Dial Int. 2015; 35: 78–84. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Levallois J, Nadeau-Fredette AC, Labbé AC, Laverdière M, Ouimet D, Vallée M. Десятилетний опыт лечения грибкового перитонита у пациентов на перитонеальном диализе: модели восприимчивости к противогрибковым препаратам в североамериканском центре.Int J Infect Dis. 2012; 16: e41 – e43. [PubMed] [Google Scholar] 66. Ван П.Н., Ло К.Ю., Тонг Г.М. и др. Лечение грибкового перитонита комбинацией внутривенного амфотерицина B и перорального флуцитозина, а также отсроченная замена катетера при непрерывном амбулаторном перитонеальном диализе. Perit Dial Int. 2008. 28: 155–162. [PubMed] [Google Scholar] 67. Джонсон LB, Кауфман CA. Вориконазол: новое противогрибковое средство на основе триазола. Clin Infect Dis. 2003. 33: 92–99. [Google Scholar] 68. Робертс Д.М., Каутер Г., Рэй Дж. Э., Гиллин А.Г.Внутрибрюшинный вориконазол у пациента с перитонитом перитонеального диализа Aspergillus . Perit Dial Int. 2013; 33: 92–93. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Улусой С., Озкан Г., Тосун И. и др. Перитонит, вызванный Aspergillus nidulans и его эффективное лечение вориконазолом: сообщение о первом случае. Perit Dial Int. 2011; 31: 212–213. [PubMed] [Google Scholar] 70. Чанг Т.И., Ким Х.В., Пак Дж. Т. и др. Раннее удаление катетера улучшает выживаемость пациентов с грибковым перитонитом на перитонеальном диализе: результаты 94 эпизодов грибкового перитонита в одном центре.Perit Dial Int. 2011; 31: 60–66. [PubMed] [Google Scholar] 71. Boer WH, van Ampting JM, Vos P. Успешное лечение восьми эпизодов перитонита Candida без удаления катетера с использованием внутрикатетерного введения амфотерицина B. Perit Dial Int. 2007. 27: 208–210. [PubMed] [Google Scholar] 72. Matuszkiewicz-Rowinska J. Последние данные о грибковом перитоните и его лечении. Perit Dial Int. 2009; 29: S161 – S165. [PubMed] [Google Scholar] 73. Вонг П.Н., Ло К.Й., Тонг Г.М. и др. Профилактика грибкового перитонита с помощью профилактики нистатином у пациентов, получающих CAPD.Perit Dial Int. 2007. 27: 531–536. [PubMed] [Google Scholar] 74. Restrepo C, Chacon J, Manjarres G. Грибковый перитонит у пациентов на перитонеальном диализе: успешная профилактика флуконазолом, как продемонстрировано проспективным рандомизированным контрольным исследованием. Perit Dial Int. 2010. 30: 619–625. [PubMed] [Google Scholar] 75. Баер Р.А., Киллен Дж. П., Чо Й., Манта М. Некандидозный грибковый перитонит в далеком Северном Квинсленде: серия случаев. Perit Dial Int. 2013; 33: 559–564. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Седлачек М., Коттер Дж. Г., Суриавината А.А. и др.Мукормикозный перитонит: более 2 лет безрецидивного наблюдения после спасительной терапии позаконазолом после неэффективности липосомального амфотерицина B. Am J Kidney Dis. 2008. 51: 302–306. [PubMed] [Google Scholar] 77. Серна Дж. Х., Вангер А., Досекун А. К.. Успешное лечение мукормикозного перитонита липосомальным амфотерицином B у пациента, находящегося на длительном перитонеальном диализе. Am J Kidney Dis. 2003; 42: E14 – E17. [PubMed] [Google Scholar] 78. Мур Д.А., Лайтстоун Л., Джавид Б., Фридланд Дж. С.. Высокие показатели туберкулеза в терминальной стадии почечной недостаточности: влияние международной миграции.Emerg Infect Dis. 2002; 8: 77–78. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Левинсон Д.М., Леонард М.К., Лобуэ П.А. и др. Официальное руководство по клинической практике Американского торакального общества / Американского общества инфекционных заболеваний / Центров по контролю и профилактике заболеваний: диагностика туберкулеза у взрослых и детей. Clin Infect Dis. 2017; 64: e1 – e33. [PubMed] [Google Scholar] 80. Луи С.Л., Тан С., Фук Л. и др. Инфекция туберкулеза у китайских пациентов, находящихся на непрерывном перитонеальном диализе. Am J Kidney Dis.2001; 38: 1055–1060. [PubMed] [Google Scholar] 81. Чау Т.Н., Леунг В.К., Вонг С. и др. Проблемы диагностики туберкулеза у пациентов с терминальной стадией почечной недостаточности и без нее. Clin Infect Dis. 2007; 45: e141 – e146. [PubMed] [Google Scholar] 82. Талвани Р., Хорват Дж. А. Туберкулезный перитонит у пациентов, находящихся на постоянном перитонеальном диализе: история болезни и обзор. Clin Infect Dis. 2000; 31: 70–75. [PubMed] [Google Scholar] 83. Акполат Т. Туберкулезный перитонит. Perit Dial Int. 2009; 29: S166 – S169. [PubMed] [Google Scholar] 84.Abraham G, Matthews M, Sekar L, Srikanth A, Sekar U, Soundarajan P. Туберкулезный перитонит в когорте пациентов, постоянно находящихся на амбулаторном диализе. Perit Dial Int. 2001; 21: S202 – S204. [PubMed] [Google Scholar] 85. Эдвардс С., Глинн П., Дэвид М.Д., Камеш Л. Ранняя диагностика туберкулезного перитонита у пациентов, находящихся на перитонеальном диализе: использование анализа Xpert MTB / RIF. Perit Dial Int. 2016; 36: 481–483. [Бесплатная статья PMC] [PubMed] [Google Scholar] 86. Гриффит Д.Е., Аскамит Т., Браун-Эллиотт Б.А. и др. Официальное заявление ATS / IDSA: диагностика, лечение и симптомы нетуберкулезных микобактериальных заболеваний.Am J Respir Crit Care Med. 2007. 175: 367–416. [PubMed] [Google Scholar] 87. Це К.С., Луи С.Л., Ченг В.К. и др. Группа быстрорастущих микобактериальных инфекций в месте выхода катетера для перитонеального диализа. Am J Kidney Dis. 2007; 50: E1 – E5. [PubMed] [Google Scholar] 88. Ро М., Биа Ф., Брюстер, Калифорния. Нетуберкулезный микобактериальный перитонит у пациентов на перитонеальном диализе. Semin Dial. 2006. 20: 271–276. [PubMed] [Google Scholar] 89. Рено CJ, Subramanian S, Tambyah PA, Lee EJ. Клиническое течение быстрорастущих нетуберкулезных микобактериальных инфекций перитонеального диализа у азиатов: серия случаев и обзор литературы.Нефрология (Карлтон) 2011; 16: 174–179. [PubMed] [Google Scholar] 90. Song Y, Wu J, Yan H, Chen J. Перитонит, связанный с нетуберкулезными микобактериями, связанный с перитонеальным диализом: систематический обзор зарегистрированных случаев. Пересадка нефрола Dial. 2012; 27: 1639–1644. [PubMed] [Google Scholar] 91. Jiang SH, Roberts DM, Clayton PA, Jardine M. Нетуберкулезный микобактериальный перитонит PD в Австралии. Int Urol Nephrol. 2013; 45: 1423–1428. [PubMed] [Google Scholar] 92. Кунин М, Кнехт А, Хольцман Э. Mycobacterium chelonae перитонит при перитонеальном диализе: обзор литературы.Eur J Clin Microbiol Infect Dis. 2014; 33: 1267–1271. [PubMed] [Google Scholar] 93. Фигейредо А.Э., Бернардини Дж., Боуз Э. и др. Учебная программа для обучения пациентов, осуществляющих перитонеальный диализ, и лиц, осуществляющих уход. Perit Dial Int. 2016; 36: 592–605. [Бесплатная статья PMC] [PubMed] [Google Scholar] 94. Пираино Б., Бернардини Дж., Браун Э. и др. Заявление о позиции ISPD по снижению риска инфекций, связанных с перитонеальным диализом. Perit Dial Int. 2011; 31: 614–630. [PubMed] [Google Scholar] 95. Стрипполи Г.Ф., Тонг А, Джонсон Д., Шена Ф.П., Крейг Дж.Противомикробные препараты для профилактики перитонита при перитонеальном диализе: систематический обзор рандомизированных контролируемых исследований. Am J Kidney Dis. 2004; 44: 591–603. [PubMed] [Google Scholar] 96. Xu G, Tu W, Xu C. Мупироцин для предотвращения инфекции места выхода и перитонита у пациентов, проходящих перитонеальный диализ. Пересадка нефрола Dial. 2009. 25: 587–592. [PubMed] [Google Scholar] 97. Чен С.С., Шит Х., Пираино Б., Бендер Ф. Долгосрочная профилактика гентамицина в месте выхода и устойчивость к гентамицину в программе перитонеального диализа.Perit Dial Int. 2016; 36: 387–389. [Бесплатная статья PMC] [PubMed] [Google Scholar] 98. Пирс Д.А., Уильямсон Дж. К., Маук В. С., Рассел Г. Б., Палавесино Е., Буркарт Дж. М.. Влияние на возбудителей перитонеального диализа изменения местной антибиотикопрофилактики. Perit Dial Int. 2011; 32: 525–530. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Перитонит | Национальный фонд почек
Что такое перитонит?
Перитонит — это воспаление брюшины , внутренней оболочки вашего живота, которая действует как естественный фильтр.При перитонеальном диализе продукты жизнедеятельности удаляются через брюшину с помощью очищающей жидкости, называемой диализатом , которая циклически промывается в брюшной полости (животе) и из нее. Брюшина заполнена жидкостью и покрывает органы в области живота, защищая и поддерживая их.
Что вызывает перитонит?
Перитонит обычно возникает из-за бактериальной или грибковой инфекции. Инфекция может произойти из-за любого разрыва в области живота, например, лопнувшего аппендикса.Это также может произойти в результате любой травмы или травмы области живота или как осложнение других медицинских проблем.
Перитонит также может поражать людей, находящихся на перитонеальном диализе. Усовершенствованные технологии и методы самопомощи снизили риск перитонита для людей, находящихся на перитонеальном диализе, но риск инфицирования все еще сохраняется. Поэтому, если вы находитесь на перитонеальном диализе, важно соблюдать правила гигиены во время диализного лечения и обязательно принимать правильные меры, чтобы снизить риск заражения.К ним относятся мытье рук перед процедурой диализа, ношение маски во время лечения, нанесение крема с антибиотиком на место выхода катетера так часто, как предписано, и другие шаги, рекомендованные вашей медицинской бригадой.
Насколько серьезен перитонит?
Перитонит может быть опасным для жизни и вызывать серьезные осложнения в зависимости от причины и степени тяжести. Это также может привести к сепсису , опасному для жизни состоянию, вызванному реакцией организма на инфекцию.Общие симптомы перитонита могут включать:
- Боль в животе (в области живота)
- Болезненность в животе
- Вздутие живота или расширение живота наружу (также известное как растяжение )
- Тошнота и рвота
- Лихорадка
- Мутная перитонеальная жидкость во время процедуры перитонеального диализа
Перитонит может быть довольно серьезным, поэтому, если у вас есть какие-либо из этих симптомов, вам следует немедленно обратиться за медицинской помощью.
Как диагностируется перитонит?
Вы пройдете медицинский осмотр на предмет признаков и симптомов. Ваш живот проверит на предмет нежности или вздутия. Также могут быть сделаны анализы крови, рентген или компьютерная томография (КТ). Некоторое количество жидкости будет удалено для тестирования, чтобы подтвердить наличие инфекции.
Как лечится перитонит?
Людям с перитонитом, возможно, придется госпитализировать. Лечение бактериальной инфекции обычно включает введение антибиотиков в виде внутривенной (IV) инъекции в вену.Другие поддерживающие методы лечения, такие как внутривенное введение жидкостей и лекарства для поддержания артериального давления, назначаются, особенно если сепсис вызывает беспокойство. Симптомы сепсиса могут включать низкое кровяное давление, учащенное сердцебиение, лихорадку или затрудненное дыхание, поэтому могут потребоваться другие методы лечения.
Неотложная операция также может быть рассмотрена, особенно если произошел разрыв аппендикса или другое связанное состояние. Также может потребоваться операция по удалению поврежденных частей брюшины.
Если перитонит развился при перитонеальном диализе, антибиотики можно вводить с жидкостью для перитонеального диализа.Иногда может потребоваться другая форма диализа, пока организм излечивается от инфекции. Если перитонит продолжается или возвращается, может потребоваться прекратить перитонеальный диализ и потребоваться другой вид диализа.
Перитонит — симптомы и причины
Обзор
Перитонит — это воспаление брюшины — шелковой перепонки, которая выстилает внутреннюю брюшную стенку и покрывает внутренние органы брюшной полости — обычно вызванное бактериальной или грибковой инфекцией.Есть два типа перитонита:
- Спонтанный бактериальный перитонит. Иногда перитонит развивается как осложнение заболевания печени, например цирроза печени, или заболевания почек.
- Перитонит вторичный. Перитонит может возникнуть в результате разрыва (перфорации) брюшной полости или как осложнение других заболеваний.
Перитонит требует немедленной медицинской помощи для борьбы с инфекцией и, при необходимости, для лечения любых сопутствующих заболеваний.Лечение перитонита обычно включает антибиотики и, в некоторых случаях, хирургическое вмешательство. При отсутствии лечения перитонит может привести к серьезной, потенциально опасной для жизни инфекции по всему телу.
Частой причиной перитонита является перитонеальный диализ. Если вы получаете перитонеальный диализ, вы можете предотвратить перитонит, соблюдая правила гигиены до, во время и после диализа.
Продукты и услуги
Показать больше товаров от Mayo Clinic
Симптомы
Признаки и симптомы перитонита включают:
- Боль или болезненность в животе
- Вздутие живота или ощущение распирания в животе
- Лихорадка
- Тошнота и рвота
- Потеря аппетита
- Диарея
- Низкий диурез
- Жажда
- Невозможность отхождения стула или газов
- Усталость
- Путаница
Если вы получаете перитонеальный диализ, симптомы перитонита также могут включать:
- Мутный диализный раствор
- Белые пятна, нити или комки (фибрин) в диализирующем растворе
Когда обращаться к врачу
Перитонит может быть опасным для жизни, если его не лечить вовремя.Немедленно обратитесь к врачу, если у вас сильная боль или болезненность в животе, вздутие живота или чувство полноты, связанное с:
- Лихорадка
- Тошнота и рвота
- Низкий диурез
- Жажда
- Невозможность отхождения стула или газов
Если вы проходите перитонеальный диализ, немедленно обратитесь к врачу, если вам нужен диализный раствор:
- Облачно или необычного цвета
- С белыми пятнами
- Содержит нити или комки (фибрин)
- Имеет необычный запах, особенно если область вокруг трубки (катетера) красная или болезненная.
Перитонит может возникнуть в результате разрыва аппендикса или травмы брюшной полости.
- Немедленно обратитесь за медицинской помощью , если у вас возникла настолько сильная боль в животе, что вы не можете сидеть спокойно или найти удобное положение.
- Позвоните в службу 911 или обратитесь за неотложной медицинской помощью , если у вас возникла сильная боль в животе после несчастного случая или травмы.
Причины
Заражение брюшины может произойти по разным причинам.В большинстве случаев причиной является разрыв (перфорация) брюшной стенки. Хотя это случается редко, заболевание может развиться без разрыва брюшной полости.
Общие причины разрывов, которые приводят к перитониту, включают:
- Медицинские процедуры, например перитонеальный диализ. Перитонеальный диализ использует трубки (катетеры) для удаления продуктов жизнедеятельности из крови, когда ваши почки больше не могут это сделать. Инфекция может возникнуть во время перитонеального диализа из-за нечистоты окружающей среды, плохой гигиены или зараженного оборудования.Перитонит также может развиться как осложнение желудочно-кишечной хирургии, использования зондов для кормления или процедуры по отказу жидкости из брюшной полости, и редко как осложнение колоноскопии или эндоскопии.
- Разрыв аппендикса, язва желудка или перфорация толстой кишки. Любое из этих состояний может позволить бактериям попасть в брюшину через отверстие в желудочно-кишечном тракте.
- Панкреатит. Воспаление поджелудочной железы (панкреатит), осложненное инфекцией, может привести к перитониту, если бактерии распространяются за пределы поджелудочной железы.
- Дивертикулит. Инфекция небольших выпуклых мешочков в пищеварительном тракте (дивертикулез) может вызвать перитонит, если один из мешочков разорвется, и кишечные отходы попадут в брюшную полость.
- Травма. Травма или травма могут вызвать перитонит из-за попадания бактерий или химических веществ из других частей тела в брюшину.
Перитонит, развивающийся без разрыва брюшной полости (спонтанный бактериальный перитонит), обычно является осложнением заболевания печени, например цирроза.При запущенном циррозе в брюшной полости накапливается большое количество жидкости. Это скопление жидкости подвержено бактериальной инфекции.
Факторы риска
Факторы, повышающие риск перитонита, включают:
- Перитонеальный диализ. Перитонит может возникнуть у людей, проходящих терапию перитонеальным диализом.
- Прочие медицинские состояния. Следующие заболевания, среди прочего, повышают риск развития перитонита: цирроз печени, аппендицит, болезнь Крона, язва желудка, дивертикулит и панкреатит.
- Перитонит в анамнезе. После того, как вы переболели перитонитом, риск его повторного развития может быть выше, чем для человека, никогда не болевшего перитонитом.
Осложнения
При отсутствии лечения перитонит может распространяться за пределы брюшины и вызывать:
- Инфекция во всем теле (сепсис). Сепсис — это быстро прогрессирующее опасное для жизни состояние, которое может вызвать шок, отказ органов и смерть.
Профилактика
Часто перитонит, связанный с перитонеальным диализом, вызывается микробами вокруг трубки (катетера). Если вы получаете перитонеальный диализ, примите следующие меры для предотвращения перитонита:
- Вымойте руки, в том числе под ногтями и между пальцами, прежде чем прикасаться к катетеру.
- Ежедневно очищайте кожу вокруг катетера антисептиком.
- Храните все необходимое в санитарном помещении.
- Носите хирургическую маску во время замены диализирующего раствора.
- Поговорите со своей бригадой по диализу о правильном уходе за вашим катетером для перитонеального диализа.
Если у вас ранее был перитонит или у вас накопление жидкости в брюшной полости из-за такого заболевания, как цирроз печени, ваш врач может назначить антибиотики для предотвращения перитонита. Если вы принимаете ингибитор протонной помпы, ваш врач может попросить вас прекратить его прием.
Новое руководство ISPD по перитониту | Заместительная почечная терапия
Кин В.Ф., Эверетт Э.Д., Файн Р.Н., Голпер Т.А., Вас С., Петерсон П.К. Рекомендации по лечению перитонита, связанного с CAPD, и антибактериальной терапии: Консультативный комитет по лечению травенолового перитонита. Perit Dial Int. 1987. 7: 55–78.
Google Scholar
Кин В.Ф., Эверетт Э.Д., Файн Р.Н., Голпер Т.А., Вас С., Петерсон П.К., Гокал Р., Мацке Г.Р. Рекомендации по лечению перитонита на непрерывном амбулаторном перитонеальном диализе (CAPD): обновление 1989 г.Специальный консультативный комитет по ведению перитонита. Perit Dial Int. 1989; 9: 247–56.
Google Scholar
Кин В.Ф., Эверетт Э.Д., Голпер Т.А., Гокал Р., Холстенсон С., Кавагути Ю., Риелла М., Вас С., Вербру Г.А. Рекомендации по лечению перитонита, связанного с перитонеальным диализом. Обновление 1993 года. Специальный консультативный комитет по ведению перитонита. Международное общество перитонеального диализа. Perit Dial Int. 1993; 13: 14–28.
CAS
PubMed
Google Scholar
Keane WF, Alexander SR, Bailie GR, Boeschoten E, Gokal R, Golper TA, Holmes CJ, Huang CC, Kawaguchi Y, Piraino B, Riella M, Schaefer F, Vas S. Рекомендации по лечению перитонита, связанного с перитонеальным диализом: обновление 1996 г. . Perit Dial Int. 1996; 16: 557–73.
CAS
PubMed
Google Scholar
Keane WF, Bailie GR, Boeschoten E, Gokal R, Golper TA, Holmes CJ, Kawaguchi Y, Piraino B, Riella M, Vas S. Рекомендации по лечению перитонита, связанного с перитонеальным диализом, для взрослых: обновление 2000 года.Perit Dial Int. 2000. 20: 396–411.
CAS
PubMed
Google Scholar
Пираино Б., Бейли Г.Р., Бернардини Дж., Бошотен Э, Гупта А., Холмс С., Куиджпер Э.Дж., Ли П.К., Лай В.С., Муджайс С., Патерсон Д.Л., Фонтан М.П., Рамос А., Шефер Ф., Аттли Л. • Специальный консультативный комитет ISPD. Рекомендации по инфекциям, связанным с перитонеальным диализом: обновление 2005 г. Perit Dial Int 2005; 25: 107-131.
Li PK, Szeto CC, Piraino B, Bernardini J, Figuiredo AE, Gupta A, Johnson DW, Kuijper EJ, Lye WC, Salzer W., Schaefer F, Struijk DG.Рекомендации по инфекциям, связанным с перитонеальным диализом: обновление 2010 г. Perit Dial Int. 2010. 30: 393–423.
Артикул
PubMed
Google Scholar
Пираино Б., Бернардини Дж., Браун Э., Фигейредо А., Джонсон Д.В., Лай В.С., Прайс V, Рамаласми С., Сзето К.С. Заявление о позиции ISPD по снижению риска инфекций, связанных с перитонеальным диализом. Perit Dial Int. 2011; 31: 614–30.
CAS
Статья
PubMed
Google Scholar
Li PK, Szeto CC, Piraino B, de Arteaga J, Fan S, Figueiredo AE, Fish DN, Goffin E, Kim YL, Salzer W., Struijk DG, Teitelbaum I, Johnson DW. Рекомендации ISPD по перитониту: обновленная информация о профилактике и лечении 2016 г. Perit Dial Int. 2016; 36: 481–508.
Артикул
PubMed
Google Scholar
Сзето С.К., Ли П.К., Джонсон Д.В., Бернардини Дж., Донг Дж., Фигейредо А.Э., Ито Й., Казанчиоглу Р., Мораес Т., ван Эш С., Браун Э.А. Рекомендации ISPD по инфекциям, связанным с катетером: обновление 2017 г.Perit Dial Int. 2017; 37: 141–54.
Артикул
PubMed
Google Scholar
Генде Б.С., Саид Х., Гибб А.Г., Азиз Н.С., Конг Н., Захир З.М. Ототоксичность гентамицина при непрерывном амбулаторном перитонеальном диализе. J Laryngol Otol. 1993; 107: 681–5.
CAS
Статья
PubMed
Google Scholar
Бейли Г.Р., Кейн М.П. Стабильность лекарственных добавок к перитонеальному диализату.Perit Dial Int. 1995. 15: 328–35.
CAS
PubMed
Google Scholar
Пател Р.П., Шастри, доктор медицины, Баккари М., Вананди Т., Хосе, доктор медицины. Стабильность комбинации цефтазидима и цефазолина в икодекстрине или растворе для перитонеального диализа с нейтральным pH. Perit Dial Int. 2014; 34: 212–8.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Tobudic S, Poeppl W, Kratzer C, Vychytil A, Burgmann H.Сравнительная антимикробная активность ванкомицина, тейкопланина, даптомицина и цефтобипрола in vitro в четырех различных жидкостях для перитонеального диализа. Eur J Clin Microbiol Infect Dis. 2012; 31: 1327–34.
CAS
Статья
PubMed
Google Scholar
Kussmann M, Schuster L, Zeitlinger M, Pichler P, Reznicek G, Wiesholzer M, Burgmann H, Poeppl W. Влияние различных жидкостей для перитонеального диализа на активность in vitro ампициллина, даптомицина и линезолида против Enterococcus faecalis.Eur J Clin Microbiol Infect Dis. 2015; 34: 2257–63.
CAS
Статья
PubMed
Google Scholar
Szeto CC. Инфекция, связанная с перитонеальным диализом, у пожилых людей. Perit Dial Int. 2015; 35: 659–62.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Cho Y, Johnson DW. Перитонит, связанный с перитонеальным диализом: к улучшению доказательств, методов и результатов.Am J Kidney Dis. 2014; 64: 278–89.
Артикул
PubMed
Google Scholar
Strippoli GF, Tong A, Johnson D, Schena FP, Craig JC. Катетерные вмешательства для предотвращения перитонита при перитонеальном диализе: систематический обзор рандомизированных контролируемых исследований. J Am Soc Nephrol. 2004. 15: 2735–46.
Артикул
PubMed
Google Scholar
Hagen SM, Lafranca JA, IJzermans JN, Dor FJ.Систематический обзор и метаанализ влияния типа катетера для перитонеального диализа на частоту осложнений и выживаемость катетера. Kidney Int. 2014; 85: 920–32.
Артикул
PubMed
Google Scholar
Фигейредо А.Э., Бернардини Дж., Боуз Э., Хирамацу М., Прайс В., Су С., Уокер Р., Брунье Г. Программа обучения пациентов и лиц, осуществляющих уход за перитонеальным диализом. Perit Dial Int. 2016; 36: 592–605.
Артикул
PubMed
Google Scholar
Как диагностируется перитонит у пациентов, получающих непрерывный амбулаторный перитонеальный диализ (CAPD)?
Автор
Брайан Дж. Дейли, MD, MBA, FACS, FCCP, CNSC Профессор и программный директор, Департамент хирургии, руководитель, Отделение травм и критических состояний, Медицинский научный центр Университета Теннесси, Медицинский колледж
Брайан Дж. Дейли, доктор медицинских наук , MBA, FACS, FCCP, CNSC является членом следующих медицинских обществ: Американская ассоциация хирургии травм, Восточная ассоциация хирургии травм, Южная хирургическая ассоциация, Американский колледж грудных врачей, Американский колледж хирургов, American Medical Ассоциация, Ассоциация академической хирургии, Ассоциация хирургического образования, Шоковое общество, Общество реаниматологии, Юго-Восточный хирургический конгресс, Медицинская ассоциация Теннесси
Раскрытие: Ничего не раскрывать.
Специальная редакционная коллегия
BS Ананд, доктор медицины Профессор кафедры внутренней медицины, отделение гастроэнтерологии, Медицинский колледж Бейлора
BS Ананд, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени, Американского колледжа гастроэнтерологии , Американская гастроэнтерологическая ассоциация, Американское общество эндоскопии желудочно-кишечного тракта
Раскрытие: Ничего не говорится.
Главный редактор
Правин К. Рой, доктор медицины, AGAF Заведующий гастроэнтерологическим отделением пресвитерианской больницы; Медицинский директор эндоскопии пресвитерианской медицинской группы; Младший научный сотрудник Института респираторных исследований Лавлейс; Клинический доцент медицины, Медицинский факультет Университета Нью-Мексико
Правин К Рой, доктор медицины, AGAF является членом следующих медицинских обществ: Американская гастроэнтерологическая ассоциация, Американское общество эндоскопии желудочно-кишечного тракта
Раскрытие: Ничего не разглашать.
Благодарности
BS Ананд, MD Профессор кафедры внутренней медицины, отделение гастроэнтерологии, Медицинский колледж Бейлора
BS Ананд, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени, Американского колледжа гастроэнтерологии, Американской гастроэнтерологической ассоциации и Американского общества гастроэнтерологической эндоскопии
.
Раскрытие: Ничего не раскрывать.
Alex Jacocks, MD Программный директор, профессор кафедры хирургии Медицинской школы Университета Оклахомы
Раскрытие: Ничего не раскрывать.
Chandler Long, MD Врач-резидент, отделение хирургии, Медицинский центр Университета Теннесси, Ноксвилл
Раскрытие: Ничего не раскрывать.
Кетул Р. Патель, доктор медицины Резидент, отделение внутренней медицины, больница Провиденс
Кетул Р. Патель, доктор медицины, является членом следующих медицинских обществ: Американского колледжа гастроэнтерологии, Американского колледжа врачей и Американской медицинской ассоциации
.
Раскрытие: Ничего не раскрывать.
Майкл Х. Пайпер, доктор медицины, FACG, FACP Клинический доцент, кафедра внутренней медицины, отделение гастроэнтерологии, медицинский факультет государственного университета Уэйна; Персонал-консультант, Digestive Health Associates PLC
Майкл Х. Пайпер, доктор медицины, FACG, FACP является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж гастроэнтерологии, Американский колледж врачей и Медицинское общество штата Мичиган
Раскрытие: Ничего не раскрывать.
Kenneth L Reed, DO Научный сотрудник по гастроэнтерологии, Больница Провиденс, Мичиган
Кеннет Л. Рид, доктор медицинских наук, является членом следующих медицинских обществ: Американского колледжа гастроэнтерологии, Американского колледжа остеопатических терапевтов, Американской гастроэнтерологической ассоциации, Американской остеопатической ассоциации, Американского общества гастроинтестинальной эндоскопии и Американского общества по лечению заболеваний желудочно-кишечного тракта
Раскрытие: Ничего не раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Брэдли Дж. Уоррен, DO, FACG, FACOI Консультанты, Digestive Health Associates, PLC
Брэдли Дж. Уоррен, DO, FACG, FACOI является членом следующих медицинских обществ: Американского колледжа гастроэнтерологии, Американской остеопатической ассоциации и Американского общества гастроэнтерологической эндоскопии
Раскрытие: Ничего не раскрывать.
.

 Высевается один и тот же микроорганизм или одна из проб стерильна.
Высевается один и тот же микроорганизм или одна из проб стерильна. п.)
п.)