Характеристика биологически активных гидролизатов белков молочной сыворотки и молозива | Головач
1. Schaafsma, G. Safety of protein hydrolysates, fractions thereof and bioactive peptides in human nutrition / G. Schaafsma // Eur. J. Clin. Nutr. – 2009. – Vol. 63, N 10. – P. 1161–1168. https://doi.org/10.1038/ejcn.2009.56
2. Sánchez, A. Bioactive peptides: a review / A. Sánchez, A. Vázquez // J. Food Safety. – 2017. – Vol. 1, N 1. – P. 29–46. https://doi.org/10.1093/fqsafe/fyx006
3. Conte, F. A study on the quality of bovine colostrum: physical, chemical and safety assessment / F. Conte, S. Scarantino // Int. Food Res. J. – 2013. – Vol. 20, N 2. – P. 925–931.
4. El-Agamy, E. I. The challenge of cow milk protein allergy / E. I. El-Agamy // Small Rumin. Res. – 2007. – Vol. 68, N 1–2. – P. 64–72. https://doi.org/10.1016/j.smallrumres.2006.09.016
5. Wal, J.-M. Bovine milk allergenicity / J.-M. Wal // Ann. Allergy Asthma Immunol. – 2004. – Vol. 93, N 5. – P. S2–S11. https://doi.org/10.1016/s1081-1206(10)61726-7
6. Antioxidant capacity of cow milk, whey and deproteinized milk / A. Zulueta [et al.] // Int. Dairy J. – 2009. – Vol. 19, N 6–7. – P. 380–385. https://doi.org/10.1016/j.idairyj.2009.02.003
7. Effect of probiotics on antioxidant and antimutagenic activities of crude peptide extract from yogurt / B. N. P. Sah [et al.] // Food Chem. – 2014. – Vol. 156, N 1. – P. 264–270. https://doi.org/10.1016/j.foodchem. 2014.01.105
2014.01.105
8. Остерман, Л. А. Методы исследования белков и нуклеиновых кислот: электрофорез и ультрацентрифугирование / Л. А. Остерман. – М. : Наука, 1981. – 288 с.
9. Тарун, Е. И. Сравнение антиоксидантных активностей галловой, кофейной и хлорогеновой кислот / Е. И. Тарун // Тр. БГУ. Физиологические, биохимические и молекулярные основы функционирования биосистем. – 2014. – Т. 9, ч. 1. – С. 186–191.
10. Дудчик, Н. В. Количественная оценка антимутагенной активности растительной композиции в краткосрочном тесте / Н. В. Дудчик // Здоровье и окружающая среда. – 2014. – Т. 1, № 24. – С. 218–221.
11. Гланц, С. Медико-биологическая статистика / С. Гланц ; пер. с англ. Ю. А. Данилова ; под ред. Н. Е. Бузикашвили, Д. В. Самойлова. – М. : Практика, 1999. – 459 с.
12. Иммунологические методы / Х. Амброзиус [ и др.] ; под ред. Г. Фримеля ; пер. с нем. А. П. Тарасова. – М. : Медицина, 1987. – 472 с.
13. Halavach, T. M. Enzymatic hydrolysis of milk proteins as a basis of specialized food products biotechnology / T. M. Halavach, V. P. Kurchenko, A. I. Albulov // Nauka i Studia. – 2016. – Vol. 3. – P. 1196–1207.
14. Способ получения гидролизата белков молока (варианты): пат. 16161 Респ. Беларусь, МПК А 23 J 3/34, А 23 J 1/20, С 12 N 1/20 / Т. Н. Головач, Н. К. Жабанос, Н. Н. Фурик, В. П. Курченко; заявитель РУП «Институт мясо-молочной промышленности». – N а 20101723; заявл. 2010.11.30; опубл. 2012.08.30 // Афіцыйны бюл. / Нац. цэнтр інтэлектуал. уласнасці. – 2012. – N 4. – С. 58–59.
уласнасці. – 2012. – N 4. – С. 58–59.
15. O’Keeffe, M. B. Antioxidant effects of enzymatic hydrolysates of whey protein concentrate on cultured human endothelial cells / M. B. O’Keeffe, R. J. FitzGerald // Int. Dairy J. – 2014. – Vol. 36, N 2. – P. 128–135. https://doi.org/10.1016/j.idairyj.2014.01.013
16. Reducing and radical-scavenging activities of whey protein hydrolysates prepared with Alcalase / X. Peng [et al.] // Int. Dairy J. – 2010. – Vol. 20, N 5. – P. 360–365. https://doi.org/10.1016/j.idairyj.2009.11.019
17. Identification of bioactive peptides after digestion of human milk and infant formula with pepsin and pancreatin / B. Hernández-Ledesma [et al.] // Int. Dairy J. – 2007. – Vol. 17, N 1. – P. 42–49. https://doi.org/10.1016/j.idairyj.2005.12.012
18. The dual effects of Maillard reaction and enzymatic hydrolysis on the antioxidant activity of milk proteins / N. S. Oh [et al.] // J. Dairy Sci. – 2013. – Vol. 96, N 8. – P. 4899–4911. https://doi.org/10.3168/jds.2013-6613
19. β-Casein hydrolysate generated by the cell envelope-associated proteinase of Lactobacillus delbrueckii ssp. lactis CRL 581 protects against trinitrobenzene sulfonic acid-induced colitis in mice / M. B. E. Turbay [et al.] // J. Dairy Sc. – 2012. – Vol. 95, N 3. – P. 1108–1118. https://doi.org/10.3168/jds.2011-4735
Подготовка модельных образцов для выявления фальсификации молока-сырья по белковому составу методом денатурирующего электрофореза Текст научной статьи по специальности «Прочие технологии»
Труды БГТУ, 2018, серия 2, № 1, с. 99-103
99-103
99
УДК 577.112.083:637.068(045)
Е. Д. Шегидевич1, З. Е. Егорова2
1 РУП «Институт мясо-молочной промышленности» 2 Белорусский государственный технологический университет
ПОДГОТОВКА МОДЕЛЬНЫХ ОБРАЗЦОВ ДЛЯ ВЫЯВЛЕНИЯ ФАЛЬСИФИКАЦИИ МОЛОКА-СЫРЬЯ ПО БЕЛКОВОМУ СОСТАВУ МЕТОДОМ ДЕНАТУРИРУЮЩЕГО ЭЛЕКТРОФОРЕЗА
Проведены расчеты и подготовлены модельные образцы молока-сырья, содержащие дополнительные компоненты молочного и немолочного происхождения. В качестве базового образца использовали молоко-сырье с массовой долей белка, равной 3,0%. Для имитации фальсификации молока-сырья в базовый образец вносили следующие белоксодержащие компоненты: сухую деминерализованную молочную сыворотку, заменитель цельного молока на основе молочной сыворотки, изолят соевого белка. Проводили анализ модельных образцов методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия.
Подготовленные модельные образцы применимы в качестве образцов сравнения при проведении идентификации белкового состава молока-сырья методом денатурирующего электрофореза с целью выявления его фальсификации. Использование подготовленных образцов дает возможность прогнозирования количества дополнительно внесенного белоксодержащего компонента.
Ключевые слова: модельные образцы, денатурирующий электрофорез, фальсификация, белковый состав, молоко-сырье.
E. D. Shegidevich2, Z. E. Yegorova2
1 RUE «Institute for Meat and Dairy Industry» 2 Belarusian State Technological University
MODEL SAMPLES PREPARATION FOR DETECTING RAW MILK ADULTERATION ON THE PROTEIN COMPOSITION BY THE METHOD OF DENATURING ELECTROPHORESIS
Calculations have been made and model samples of raw milk containing additional components of dairy and non-dairy origin have been prepared. Raw milk with a protein mass fraction equal to 3.0% was used as a base sample. To simulate the adulteration of raw milk, the following protein-containing components were introduced into the base sample: dry demineralized milk whey, calf milk replacer based on whey, isolate of soy protein. Model samples were analyzed by sodium dodecyl sulphate poly-acrylamide gel electrophoresis.
Raw milk with a protein mass fraction equal to 3.0% was used as a base sample. To simulate the adulteration of raw milk, the following protein-containing components were introduced into the base sample: dry demineralized milk whey, calf milk replacer based on whey, isolate of soy protein. Model samples were analyzed by sodium dodecyl sulphate poly-acrylamide gel electrophoresis.
Prepared model samples are applicable as reference samples when the protein composition of raw milk is identified by the method of denaturing electrophoresis in order to detect its adulteration. The use of prepared samples makes it possible to predict the amount of additionally added protein-containing component.
Key words: model samples, denaturing electrophoresis, adulteration, protein composition, raw milk.
Введение. Все компоненты молока имеют существенное значение в физиологии питания человека. Наиболее ценным биологическим компонентом молока является белок, так как образующиеся при его расщеплении аминокислоты принимают участие в построении клеток организма, синтезе ферментов и гормонов. Белки молока содержат все незаменимые аминокислоты и относятся к полноценным [1]. Следует добавить, что массовая доля белка в молоке — значимый технологический параметр, на основании которого устанавливаются нормы расхода сырья и проводятся материально-сырьевые расчеты при производстве некоторых групп молочных продуктов.
Указанные достоинства молока-сырья являются основной причиной существующей
проблемы его фальсификации по содержанию белка путем внесения дополнительных компонентов: небелковых азотистых соединений, сухих молочных компонентов, белков растительного происхождения [2]. Указанные способы позволяют искусственно повысить массовую долю белка (азота) и, соответственно, получить материальную выгоду при сдаче молока-сырья в переработку. Несмотря на многочисленные исследования по выявлению фальсификации белка молока-сырья различными физико-химическими методами [3], универсальная методика идентификации искусственно добавленных белков до сих пор не разработана.
Несмотря на многочисленные исследования по выявлению фальсификации белка молока-сырья различными физико-химическими методами [3], универсальная методика идентификации искусственно добавленных белков до сих пор не разработана.
Денатурирующий электрофорез является одним из методов, применяемых для идентификации белкового состава различных пищевых
матриц. Однако при его использовании возникает необходимость в наличии модельных образцов для проведения сравнительной оценки исследуемых объектов. Разработка модельных образцов для выявления фальсификации молока-сырья по белковому составу с использованием метода денатурирующего электрофореза являлась целью данной работы.
Основная часть. Объекты и методы исследования. Объектами исследований были образцы молока-сырья (базовый образец) и бе-локсодержащие компоненты (сухая деминерализованная молочная сыворотка (сыворотка ДМ), заменитель цельного молока на основе молочной сыворотки (ЗЦМ), изолят соевого белка), которые использовали для имитации фальсификации молока-сырья. Характеристика объектов исследований приведена в табл. 1.
Таблица 1
Характеристика объектов исследования
Продукт Органолептические характеристики Массовая доля белка, %
внешний вид и консистенция цвет
Молоко-сырье кислотностью 18°Т — базовый образец Однородная жидкость без осадка и хлопьев Белый 3,0
Сыворотка ДМ Мелкодисперсный порошок без комочков Белый с легким кремовым оттенком 11,0
ЗЦМ Сухая смесь в виде мелкодисперсного порошка Белый с кремовым оттенком 22,0
Изолят соевого белка Мелкодисперсный порошок Кремовый 90,0
Примечания: 1. Определение кислотности молока-сырья проводили в соответствии с ГОСТ 3624-92 [4].
Определение кислотности молока-сырья проводили в соответствии с ГОСТ 3624-92 [4].
2. Определение массовой доли белка в молоке-сырье проводили в соответствии с ГОСТ 23327-98 [5].
3. Массовая доля белка белоксодержащих компонентов указана согласно маркировке производителя.
Для подготовки модельных образцов использовали базовый образец молока-сырья в количестве 10 г. Массовую долю белка в модельных образцах рассчитывали на основе массовой доли белка в базовом образце молока-сырья (3,0%) с шагом 0,3%, не допуская выхода значения за границы естественного содержания белка (от 2,8 до 4,0% [6]). Описанный подход способствовал созданию трех видов модельных образцов с массовыми долями 3,3; 3,6 и 3,9%.
Расчет количества белоксодержащего компонента для имитации фальсификации молока-сырья проводили следующим образом. Для оп-
ределения массовой доли белка в модельном образце воспользовались формулой (1):
w
б/мол
+ тбк х wб
б/мод
(1)
где Wб/MoД — массовая доля белка в модельном образце; тмол — масса базового образца молока-сырья, г; Wб/мoл — массовая доля белка в базовом образце молока-сырья; тбк — масса белоксодер-жащего компонента, г; Wб/бк — массовая доля белка в белоксодержащем компоненте.
Расчет массы белоксодержащего компонента для имитации фальсификации молока-сырья проводили по формуле (2):
тмол К/мод — ^/мол )
Wк
— W¡
(2)
б/мод
Сформировали три группы модельных образцов. Модельные образцы первой группы (№ 1-3) содержат в качестве дополнительного белкового компонента сухую деминерализованную молочную сыворотку, второй группы (№ 4-6) — заменитель цельного молока, третьей группы (№ 7-9) — изолят соевого белка. Данные для подготовки модельных образцов представлены в табл. 2.
Модельные образцы первой группы (№ 1-3) содержат в качестве дополнительного белкового компонента сухую деминерализованную молочную сыворотку, второй группы (№ 4-6) — заменитель цельного молока, третьей группы (№ 7-9) — изолят соевого белка. Данные для подготовки модельных образцов представлены в табл. 2.
Таблица 2 Подготовка модельных образцов
№ образца Массовая доля белка в модельном образце, % Масса белоксодержащего компонента, г
1 3,3 0,390
2 3,6 0,811
3 3,9 1,268
4 3,3 0,160
5 3,6 0,326
6 3,9 0,497
7 3,3 0,035
8 3,6 0,069
9 3,9 0,105
В основу проведения исследований положена методика идентификации фракционного состава белков молока методом электрофореза в полиакриламидном геле в присутствии доде-цилсульфата натрия (ДСН-электрофореза) [7]. ДСН-электрофорез позволяет фракционировать белки в зависимости от значений только одного параметра — их молекулярной массы. Белки связывают додецилсульфат натрия за счет гидрофобных взаимодействий в теоретическом соотношении 1,4 г ДСН на 1 г белка. Каждая молекула ДСН несет отрицательный заряд, и огромный избыток их превосходит собственный суммарный заряд белка. Соотношение
тбк =
размер/заряд в присутствии ДСН становится практически одинаковым для любого белка, и деление происходит по молекулярной массе, так как поры геля работают как молекулярные сита [8].
Электрофорез проводили в камере для вертикального электрофореза с использованием 12%-ного акриламидного геля. Исследуемые образцы перед проведением разделения в камере денатурировали при температуре 100оС с добавлением смеси, содержащей ДСН и р-мер-каптоэтанол. В качестве электродного буфера использовали 0,05 М ТРИС-глициновый буфер с 0,01% ДСН. Напряжение при проведении разделения постепенно увеличивали в диапазоне от 100 до 200 В. Продолжительность разделения составила около 5 ч.
После окончания разделения в камере гель извлекали и проводили фиксацию белков 30%-ным раствором уксусной кислоты. Окрашивание полученного геля выполняли с использованием спиртового раствора красителя кумасси бриллиантового голубого с добавлением кислоты уксусной ледяной. Отмывку геля проводили 10%-ным раствором уксусной кислоты.
Порядок проведения экспериментальных исследований по подготовке модельных образцов для выявления фальсификации молока-сырья по белковому составу методом ДСН-электрофореза показан в табл. 3.
Таблица 3
Этапы экспериментальных исследований по подготовке модельных образцов для выявления фальсификации молока-сырья по белковому составу методом ДСН-электрофореза
Результаты исследования.
Результаты исследования модельных образцов методом ДСН-электрофореза представлены на рис. 1.
Проведем анализ полученных результатов исследования модельных образцов методом ДСН-электрофореза.
Дорожки № 1-3 модельных образцов первой группы, содержащих сыворотку ДМ, имеют более широкие полосы сывороточных белков по сравнению с базовым образцом.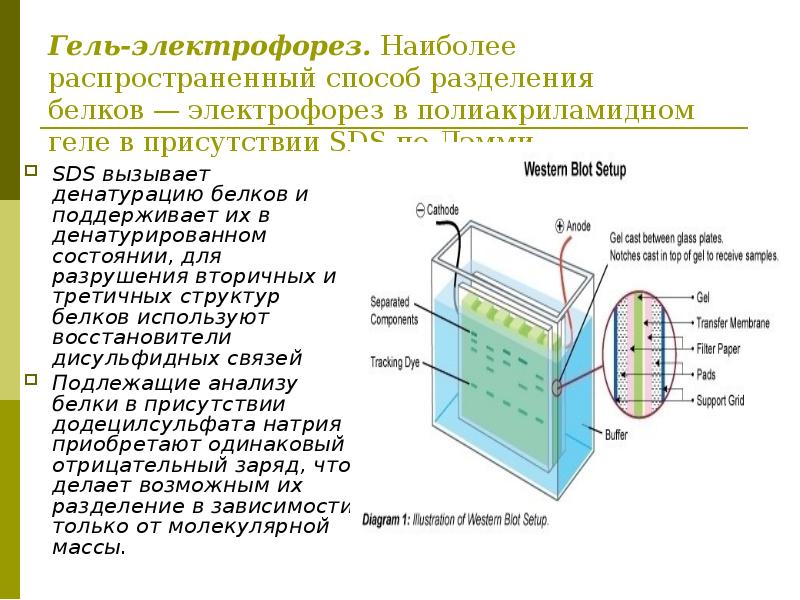 При проведении визуальной оценки и сравне-
При проведении визуальной оценки и сравне-
ния внутри группы образцов четко видна закономерность: по мере увеличения массовой доли белка с шагом 0,3% от образца № 1 к образцу № 3 происходит увеличение ширины полос сывороточных белков.
1 2 3 4 5 6 7 8 9 10
Рис. 1. ДСН-электрофорез модельных образцов молока-сырья: а — казеиновые белки; б — основные сывороточные белки;в — соевый белок;
1 -9 — модельные образцы молока-сырья;
10 — базовый образец молока-сырья
При проведении анализа дорожек модельных образцов № 4-6, содержащих ЗЦМ, прослеживается аналогичная первой группе закономерность. При увеличении количества внесенного дополнительно белоксодержащего компонента увеличивается ширина полос сывороточных белков. Разница 0,3% в значении массовой доли белка для образцов № 4-6 хорошо заметна по ширине полос на каждой из полученных электрофореграмм. Однако следует отметить размытость дорожек модельных образцов второй группы по сравнению с дорожками других групп и базового образца. Причиной может быть, согласно данным [9], присутствие дополнительных жиров растительного происхождения в ЗЦМ, о чем имеется указание в маркировке производителя.
Модельные образцы третьей группы отличаются от двух первых присутствием белоксо-держащего компонента немолочного происхождения. Особенностью дорожек модельных образцов № 7-9 по сравнению с базовым образцом и образцами двух остальных групп является появление дополнительной полосы в интервале между сывороточными и казеиновыми белками, что отражено на первой электрофореграмме. При этом наблюдается увеличение ширины
1. Определение массовой доли белка в базовом образце молока-сырья_
2. Проведение расчетов и подготовка модельных образцов молока-сырья_
Проведение расчетов и подготовка модельных образцов молока-сырья_
2.1. Добавление сыворотки ДМ
2.2. Добавление ЗЦМ
2.3. Добавление изолята соевого белка
3. Проведение ДСН-электрофореза базового и модельных образцов молока сырья_
описанной дополнительной полосы от образца № 7 к образцу № 9, что обусловлено соответствующим увеличением массовой доли белка на 0,3% внутри группы.
Особенностью полученной электрофоре-граммы являются более широкие полосы казеина в сравнении с сывороточными белками. Указанная особенность обусловлена значительным процентным содержанием казеина по сравнению с сывороточными белками (содержание казеина колеблется от 2,1 до 2,9%, сывороточных белков — 0,6%) [9].
Для определения возможности устранения описанной особенности полученной электро-фореграммы был проведен дополнительный анализ методом ДСН-электрофореза модельных образцов. Отличительной чертой анализа являлось предварительное осаждение казеиновой фракции белков путем подкисления образцов разбавленным раствором соляной кислоты до достижения рН 4,6. Полученный осадок отфильтровывали и проводили анализ фильтрата.
Результаты исследования модельных образцов после осаждения казеиновой фракции методом ДСН-электрофореза представлены на рис. 2.
1 2 3 4 5 6 7 8 9 10
Рис. 2. ДСН-электрофорез модельных образцов молока-сырья после осаждения казеиновой фракции: 1-9 — модельные образцы молока-сырья;
10 — базовый образец молока-сырья
При сравнении двух полученных электро-фореграмм следует отметить, что предварительное осаждение казеиновой фракции белков позволяет получить более четкое изображе-
ние сывороточных белков. Закономерности, описанные выше для первой и второй групп модельных образцов по результатам анализа первой электрофореграммы (рис. 1), прослеживаются на второй электрофореграмме (рис. 2), полученной после предварительного осаждения казеиновой фракции. При проведении анализа дорожек № 79 третьей группы модельных образцов на второй электрофореграмме следует отметить отсутствие характерных дополнительных полос соевого белка, что обусловлено осаждением растительных белков совместно с казеиновой фракцией. Таким образом, описанный прием по предварительному осаждению казеиновой фракции в модельных образцах эффективен при определении присутствия белоксодержащих компонентов молочного происхождения, однако его применение при определении наличия белоксодержащих компонентов растительного происхождения не является результативным, так как приводит к получению недостоверных результатов.
Закономерности, описанные выше для первой и второй групп модельных образцов по результатам анализа первой электрофореграммы (рис. 1), прослеживаются на второй электрофореграмме (рис. 2), полученной после предварительного осаждения казеиновой фракции. При проведении анализа дорожек № 79 третьей группы модельных образцов на второй электрофореграмме следует отметить отсутствие характерных дополнительных полос соевого белка, что обусловлено осаждением растительных белков совместно с казеиновой фракцией. Таким образом, описанный прием по предварительному осаждению казеиновой фракции в модельных образцах эффективен при определении присутствия белоксодержащих компонентов молочного происхождения, однако его применение при определении наличия белоксодержащих компонентов растительного происхождения не является результативным, так как приводит к получению недостоверных результатов.
Заключение. Проведенные экспериментальные исследования подготовленных модельных образцов молока-сырья методом ДСН-электро-фореза позволяют сделать следующие выводы.
1. Подготовленные модельные образцы с белоксодержащими компонентами молочного происхождения (сыворотка ДМ, ЗЦМ) имеют четкие различия в ширине полос сывороточных белков по сравнению с базовым образцом. При этом для каждой группы наблюдается следующая закономерность: по мере увеличения массовой доли белка внутри группы с шагом 0,3% происходит соответствующее увеличение ширины полосы сывороточных белков
2. Модельные образцы, в состав которых входит белоксодержащий компонент растительного происхождения (изолят соевого белка), имеют характерные дополнительные полосы на электрофореграмме. Соответствующее увеличение количества добавленного компонента приводит к увеличению ширины характерной дополнительной полосы.
Таким образом, разработанные модельные образцы применимы в качестве образцов сравнения при проведении идентификации белкового состава молока-сырья методом денатурирующего электрофореза с целью выявления его фальсификации. Использование подготовленных образцов дает возможность прогнозирования количества дополнительно внесенного бе-локсодержащего компонента.
Использование подготовленных образцов дает возможность прогнозирования количества дополнительно внесенного бе-локсодержащего компонента.
Литература
1. Твердохлеб Г. В., Раманаускас Р. И. Химия и физика молока и молочных продуктов. М.: ДеЛи принт, 2006. 360 с.
2. Абдуллаева Л. В. О дополнительных показателях качества сырого молока // Переработка молока. 2015. № 3. С. 18-19.
3. Идентификация во имя качества и безопасности // Продукт. BY. 2017. № 6. С. 20-21.
4. Молоко и молочные продукты. Метод измерения массовой доли общего азота по Кьельдалю и определение массовой доли белка: ГОСТ 23327-98. Введ. 01.03.00. М.: Стандартинформ, 2009. 12 с.
5. Молоко и молочные продукты. Титриметрические методы определения кислотности: ГОСТ 3624-92. Введ. 01.01.94. М.: Стандартинформ, 2009. 12 с.
6. Горбатова К. К. Химия и физика белков молока. М.: Колос, 1993. 192 с.
7. Остерман Л. А. Методы исследования белков и нуклеиновых кислот. Электрофорез и ультрацентрифугирование: практ. пособие. М.: Наука, 1981. 288 с.
8. Сова В. В., Кусайкин М. И. Выделение и очистка белков. Владивосток: Изд-во Дальневост. ун-та, 2006. 42 с.
9. Молоко и молочные продукты. Идентификация белкового состава электрофоретическим методом в полиакриламидном геле: ГОСТ 33528-2015. Введ. 01.07.16. М.: Стандартинформ, 2015. 14 с.
References
1. Tverdokhleb G. V., Ramanauskas R. I. Khimiya i fizika moloka i molochnykh produktov [Chemistry and physics of milk and dairy products]. Moscow, DeLi print Publ., 2006. 360 p.
I. Khimiya i fizika moloka i molochnykh produktov [Chemistry and physics of milk and dairy products]. Moscow, DeLi print Publ., 2006. 360 p.
2. Abdullaeva L. V. On additional indicators of the quality of raw milk. Pererabotka moloka [Processing of milk], 2015, no. 3, pp. 18-19 (In Russian).
3. Identification in the name of quality and safety. Produkt. BY [Product. BY], 2017. no. 6, pp. 20-21 (In Russian).
4. GOST 3624-92. Milk and dairy products. Titrimetric methods for determination of acidity. Moscow, Standartinform Publ., 2009. 12 p. (In Russian).
5. GOST 33528-2015. Milk and dairy products. Identification of protein composition by electrophoret-ic method in polyacrylamide gel. Moscow, Standartinform Publ., 2015. 14 p. (In Russian).
6. Gorbatova K. K. Khimiya i fizika belkov moloka [Chemistry and physics of milk proteins]. Moscow, Kolos Publ., 1993. 192 p.
7. Osterman L. A. Metody issledovaniya belkov i nukleinovykh kislot. Elektroforez i ul’tratsentri-fugirovaniye [Methods for studying proteins and nucleic acids. Electrophoresis and ultracentrifugation]. Moscow, Nauka Publ., 1981. 288 p.
8. Sova V. V., Kusaykin M. I. Vydeleniye i ochistka belkov [Isolation and purification of proteins]. Vladivostok, Izd-vo Dal’nevost. un-ta Publ., 2006. 42 p.
9. GOST 23327-98. Milk and dairy products. Method for measuring the mass fraction of total nitrogen according to Kjeldahl and determining the mass fraction of protein. Moscow, Standartinform Publ., 2009. 12 p. (In Russian).
Информация об авторах
Шегидевич Екатерина Дмитриевна — заведующая пищевым инновационным центром. РУП «Институт мясо-молочной промышленности» (220075, г. Минск, пр. Партизанский, 172, Республика Беларусь). E-mail: [email protected]
РУП «Институт мясо-молочной промышленности» (220075, г. Минск, пр. Партизанский, 172, Республика Беларусь). E-mail: [email protected]
Егорова Зинаида Евгеньевна — кандидат технических наук, доцент, доцент кафедры физико-химических методов сертификации продукции. Белорусский государственный технологический университет (220006, г. Минск, ул. Свердлова, 13а, Республика Беларусь). E-mail: [email protected]
Information about the authors
Shegidevich Ekaterina Dmitrievna — Head of the Food Innovation Center. RUE «Institute for Meat and Dairy Industry» (172, Partizansky Ave., 220075, Minsk, Republic of Belarus). E-mail: [email protected]
Yegorova Zinaida Evgen’yevna — PhD (Engineering), Associate Professor, Assistant Professor, the Department of Physical and Chemical Methods of Product Certification. Belarusian State Technological University (13a, Sverdlova str., 220006, Minsk, Republic of Belarus). E-mail: [email protected]
Поступила 03.11.2017
Mucin Agarose Gel Electrophoresis: Western Blotting for High-molecular-weight Glycoproteins
Протокол муцина Вестерн — блоттинга , описанного в этом видео сочетает в себе традиционные методы , используемые в молекулярной биологии для разделения и передачи больших макромолекулы, такие как ДНК, с регулярными методами для обнаружения белка, то есть., Иммуноблоттинга. Тот же метод может быть применен для изучения биологии сложных гликозаминогликанов, например, при пробое сверхвысокой молекулярной массы гиалуроновой кислоты 18. Хотя этот метод может быть использован в широком спектре анализов, успешно агарозы вестерн-блоттинга опирается на множество шагов, которые требуют тщательные и зависящие от времени действия. В целях максимального успеха, некоторые важные шаги должны быть пересмотрены.
В целях максимального успеха, некоторые важные шаги должны быть пересмотрены.
Подготовка проб и гель загрузки являются критически важными шагами для получения точных результатов. Муцин-богатые образцы, то есть., Мокрота, являются, по своей природе, прилегающего к экспериментальной трубки, то есть., Пипеткой кончиков, центрифужные пробирки, фильтры. Использование положительных пипец перемещения и обработки перед транспортировкой-wetting пипеткой советы могут облегчить загрузку вязкоупругого материала в лунки. Такие образцы требуют особого внимания в связи с повышенной плавучести и клейкость этих материалов. Концентрированные образцы (выше 5 мг / мл) будет плохо мигрируют через поры размером агарозном геле 0,8% и может потребовать дальнейшего разбавления и / или денатурации в до 6 М мочевины. Тем не менее, во избежание запуска образцов денатурированного в гуанидинийхлорида (GuHCl) как гуанидиниевое будет осаждаться с SDS. Следовательно, образцы, хранящиеся в GuHCl требуют дополнительной стадии диализа. Для исследования неполимерными состояния, частичное восстановление (0,5 мМ DTT в течение 5 мин) позволит значительно улучшить миграцию концентрированных проб (смотри рисунок 3).
переноса белков на нитроцеллюлозную мембрану является ключевым шагом для этого протокола, и, если не выполняется с точностью, может привести к окрашенном мембраны, слабый сигнал и ложных количественных результатов. Нитроцеллюлозные мембраны являются тонкими и легко загрязняется ивсегда следует работать в перчатках и ухода, чтобы избежать неспецифического связывания и повреждения. Размещение геля на мембрану требует точного выравнивания для создания герметичного уплотнения и предотвратить утечку передачи буфера, которое может привести к пятнам и снижению эффективности передачи. Образование пузырей между гелем и мембраной предотвратит передачу белка и его следует тщательно избегать.
Оптимальная иммунологического опирается на обладающими высоким сродством и высокой специфичности антител против белка основной цепи мишени муцина.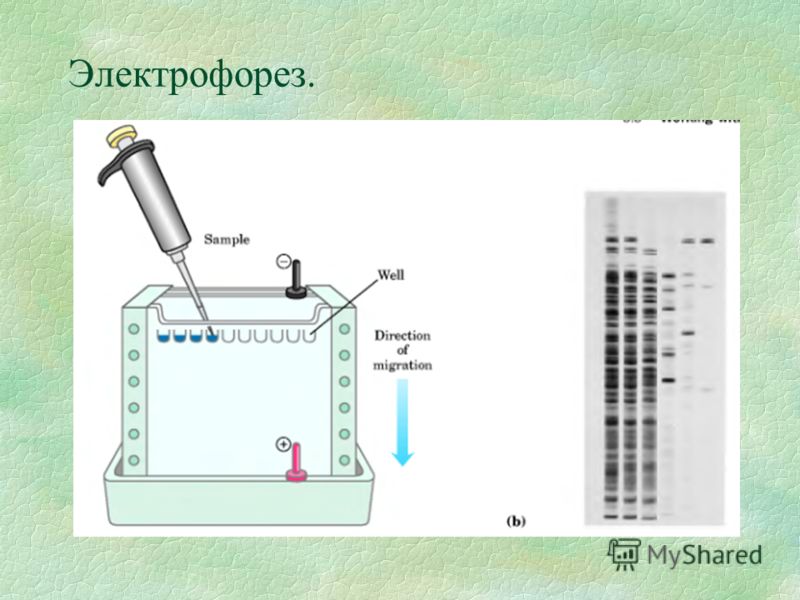 В последнее время новая стратегия иммунизации, дизайн антиген и скрининговые технологии дают к увеличению успеха с поколением муцина антител и предоставили новые инструменты для изучения муцин биологии. Для того чтобы обнаружить два различных муцины на одном блоте, то есть., MUC5AC и MUC5B, две первичные антитела должны быть получены из различных видов хозяев, т.е. кролика и козы. Кроме того, вторичные антитела должны быть помечены различными флуорофораs, чтобы быть обнаружены и в 700 NM- и 800 нм-канала.
В последнее время новая стратегия иммунизации, дизайн антиген и скрининговые технологии дают к увеличению успеха с поколением муцина антител и предоставили новые инструменты для изучения муцин биологии. Для того чтобы обнаружить два различных муцины на одном блоте, то есть., MUC5AC и MUC5B, две первичные антитела должны быть получены из различных видов хозяев, т.е. кролика и козы. Кроме того, вторичные антитела должны быть помечены различными флуорофораs, чтобы быть обнаружены и в 700 NM- и 800 нм-канала.
Относительное обилие муцин и размер муцин может быть количественному непосредственно с программным обеспечением обработки изображений. Флуоресцентный сигнал прямо пропорционален количеству целевой муцина, что позволяет количественно оценить широкого круга образцов, от низкой (например., Cell смывки) до высокой (например., Мокрота) муцина концентрации. Тем не менее, абсолютная концентрация муцина требует очистки муциновых стандартов, которые не описаны в данном протоколе , как это длительный и сложный процесс , который был описан в Абдаллой и др. 19. Кроме того, в агарозном Вестерн-блоттинга обеспечивает возможность проведения анализов муцин сдвига для изучения процесса полимеризации или деполимеризации. Зависимость электрофоретической подвижности муцинами зависит от их полимерного состояния, то есть., Миграция крупных полимеров задерживается, и может быть определена количественно с помощью программного обеспечения визуализации. Например, восстановителей будет вызывать подвижность шIFT сигнала, который коррелирует с изменением биофизических свойств слизи. Такой анализ может быть использован для изучения муцин процесса 13 мультимеризация но и испытать фармакологические препараты , направленные на изменение муцина сети 11. В заключение, муцина агарозы Вестерн-блоттинга в сочетании с маркировкой флюоресценции существенно изменила наш подход к изучению муцины путем получения высоких качественных и количественных данных.
Общие проблемы с агарозы муцина Вестерн-блоттинга может привести к следующим результатам: низкой интенсивности сигнала, высокого фона и / или появление пунктатов на мембране. Существует несколько стратегий по устранению неисправностей могут быть использованы для улучшения муцин изображений геля. Интенсивность сигнала может быть увеличена путем загрузки больших объемов образцов и / или увеличение концентрации первичных и вторичных антител. Как правило, высокий фоновый сигнал обусловлен недостаточной блокированием и / или промывок, которые могут быть решены путем выполнения более длинный блок/ Мыть инкубацию, а также с оптимизированной блокировании буферов, которые являются коммерчески доступными. Появление пунктатов может быть результатом протяженных мембранных инкубирования при комнатной температуре, что способствует росту бактерий. Пунктатов также могут быть вызваны повреждением нитроцеллюлозные мембраны из раствора DTT вымачивания (этап 4.1), и ее можно избежать путем промывки агарозу тщательно перед передачей и / или уменьшением концентрации DTT до 5 мМ.
Основным ограничением агарозы муцина Вестерн-блоттинга является отсутствие белка лестницы для высокой молекулярной массы белков и муцина стандартов, что затрудняет абсолютную муцин количественной оценки. Большая часть результатов, опубликованных с муциновых агарозных гелей представляют собой сравнительные исследования по размеру и концентрации. Гель-проникающей хроматографии с рассеянием света в сочетании с показателем преломления является другой метод обычно используется для определения точного молекулярного веса и концентрации макромолекул. Тем не менее, этот метод является дорогостоящимй испытывает недостаток специфичности для муцин, следовательно, меры и другие крупные молекулы , включенные в образцах, например, ДНК. Кроме того, вытеснительной хроматографии не способен различать между муцин типов, то есть., MUC5AC против MUC5B, а меры и средняя концентрация и размер из смеси муцин , включенных в данном образце.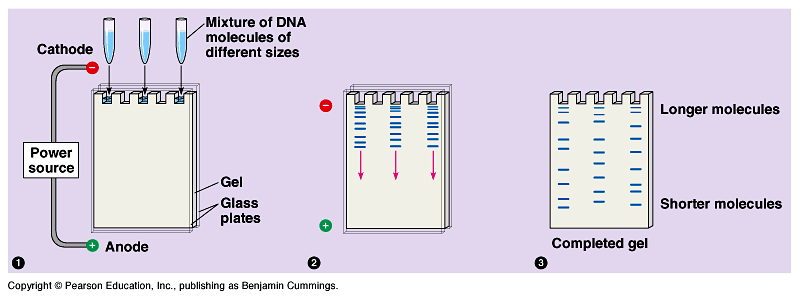
Другие методы могут быть использованы для изучения муцины включая динамические и многоракурсный рассеяния света 1, изопикнического и скорости-зонального центрифугировани 6, электронной микроскопии, масс — спектрометрии 1,7,8. Однако при исследовании новых фармакологических агентов, ориентированных молекул муцина, крайне важно разработать надежные лабораторные методы для изучения муцин биологии. Агарозном муцина Вестерн — блоттинга является относительно простой и недорогой метод , который может быть использован для ответа на важные вопросы относительно муциновых процессов, то есть., Изменение в муцина бремени, размер и соотношение. Этот анализ будет использоватьсяв будущих приложениях , чтобы проверить эффективность лекарственного средства и токсичности для новых молекул , направленных на устранение прилипшие слизи в в пробирке и в естественных условиях модели.
Subscription Required. Please recommend JoVE to your librarian.
Основы вестерн-блоттинга — Школа Молодых Ученых
Скачать методичку
Суть метода. Вестерн-блоттинг (иммуноблотинг, от англ. Blotting — промокание) — современный высокочувствительный аналитический метод, используемый для определения в образце специфичных белков с помощью антител.
Метод основан на комбинации гель-электрофореза и иммунохимической реакции «антиген/антитело (исследуемый белок)». Высокая степень разрешения достигается за счет электрофоретического разделения белков и специфичности моно- или поликлональных антител. В оптимально подобранных условиях Вестерн-блоттингом можно обнаружить белок в количестве менее 1 нг.
Этапы Вестерн-блоттинга:
- Разделение белков методом SDS-электрофореза. Наиболее распространенным способом разделения белков является электрофорез в полиакриламидном геле, в присутствии додецилсульфата натрия (англ. SDS).
 В присутствии SDS белки подлежащие анализу приобретают одинаковый отрицательный заряд, что делает возможным их разделение в зависимости только от молекулярной массы. Денатурированные белки мигрируют в электрическом поле через акриламидный гель к аноду, при этом белки меньшего размера двигаются быстрее. Так же на гель наносят маркеры (смесь белков с известными молекулярными массами). Отличия в скорости продвижения (электрофоретической подвижности) приводит к разделению белков на полосы.
В присутствии SDS белки подлежащие анализу приобретают одинаковый отрицательный заряд, что делает возможным их разделение в зависимости только от молекулярной массы. Денатурированные белки мигрируют в электрическом поле через акриламидный гель к аноду, при этом белки меньшего размера двигаются быстрее. Так же на гель наносят маркеры (смесь белков с известными молекулярными массами). Отличия в скорости продвижения (электрофоретической подвижности) приводит к разделению белков на полосы. - Перенос белков из геля на мембрану (изготовленную из нитроцеллюлозы или поливинилиденфторида (англ. PVDF) происходит под действием электрического тока. В результате этого процесса белки оказываются в тонком поверхностном слое мембраны, где за счет гидрофобных и электростатических взаимодействий происходит их связывание с мембраной. Белки перемещаются из геля на мембрану с сохранением своего расположения. Таким образом, после электропереноса мы получаем на нитроцеллюлозе реплику геля с белками, расположенными так же, как и в полиакриламидном геле.
- Блокирование. Для того, чтобы предотвратить неспецифическое связывание антител с мембраной, последнюю инкубируют в разбавленном растворе белка — обычно используют бычий сывороточный альбумин или обезжиренное сухое молоко. Белок из разбавленного раствора связывается с мембраной в тех местах, где нет белковых полос. В результате антитела при их добавлении могут связываться только со специфичными сайтами связывания исследуемых белков. Блокирование позволяет достичь чистого фона и исключить получение ложноположительных результатов.
- Связывание исследуемого белка с антителами. После блокирования мембраны ее отмывают буфером (3 раза) и последовательно инкубируют с различными антителами методом «сэндвича»: сначала белки связываются с первичными (моно- или поликлональными) антителами, которые, в свою очередь, связываются со вторичными антителами, конъюгированными с ферментами (пероксидазой хрена или щелочной фосфатазой).

- Детекция. Визуализации исследуемого белка достигают путем проведения соответствующей биохимической реакции с образованием продукта, который определяют колориметрическим, хемилюминесцентным или флюоресцентным методами детекции. Количество белка оценивают с помощью денситометрии.
Планируется визуализировать и определить количество белка светособирающего комплекса фотосистемы 2 – Lhcb2 из тилакоидов Arabidopsis thaliana.
Все вопросы и предложения присылать по адресу: [email protected], Татьяна.
Электрофорез белков в полиакриламидном геле
Фотография полиакриламидного геля, иллюстрирующая разделение белков по молекулярной массе. Маркеры на левой дорожке
Электрофорез белков в полиакриламидном геле — метод разделения смесей белков в полиакриламидном геле в соответствии с их электрофоретической подвижностью (функцией длины полипептидной цепочки или молекулярной массы, а также укладки белковой молекулы, посттрансляционных модификаций и других факторов). Данный способ фракционирования белков и пептидов широко применяют в современной молекулярной биологии, биохимии, генетике.
Разработано большое количество модификаций электрофореза белков в полиакриламидном геле для решения разных задач и для различных белков и пептидов. Наиболее распространённой разновидностью является электрофорез белков в полиакриламидом геле в присутствии додецилсульфата натрия по Лэммли (англ. SDS PAGE).
Механизм разделения белков
Элетрофоретическая подвижность биополимеров в геле зависит от ряда параметров. Скорость миграции пропорциональна заряду молекулы, и в свободной жидкости молекулы с одинаковым удельным зарядом мигрируют с равной скоростью. В случае разделения в среде, имеющей жесткую пространственную матрицу, происходит сегрегация за счет трения о гель.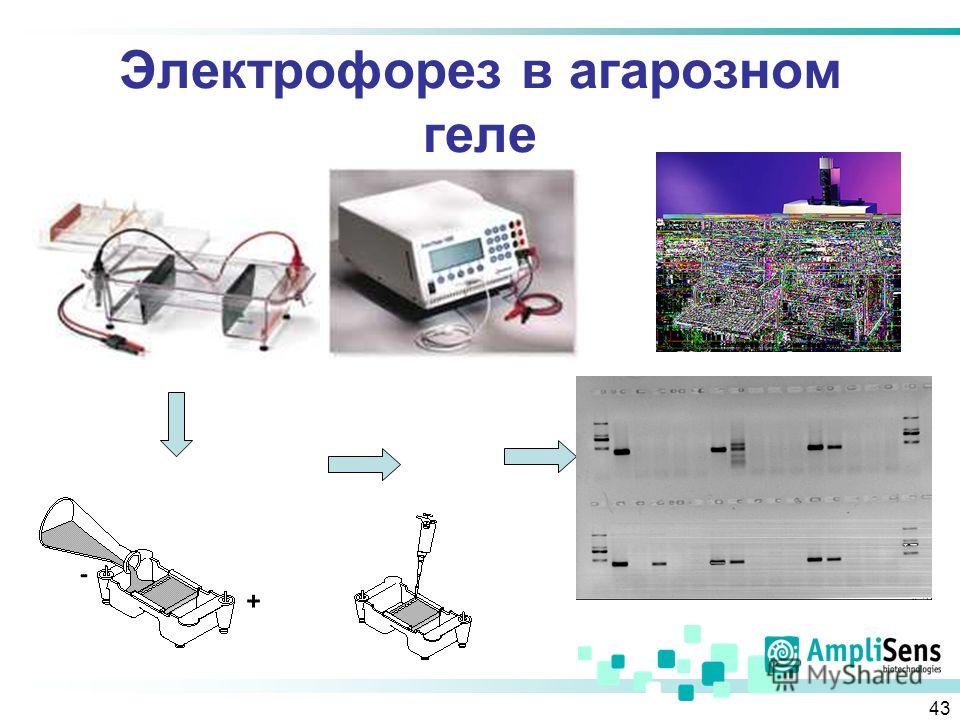 Сила трения зависит от пространственной конфигурации молекулы, в том числе от её размера. Таким образом, в случае электрофоретического разделения нативных белков будет наблюдаться сложная картина их распределения в зависимости от вышеприведенных факторов.
Сила трения зависит от пространственной конфигурации молекулы, в том числе от её размера. Таким образом, в случае электрофоретического разделения нативных белков будет наблюдаться сложная картина их распределения в зависимости от вышеприведенных факторов.
SDS-PAGE по Лэммли
В 1970 году Лэммли (англ. Laemmli) для изучения процесса сборки капсида бактериофага Т4 предложил метод электрофоретического разделения белков в полиакриламидном геле в зависимости от молекулярной массы [1]. Для этого перед нанесением на гель образцы кипятили в присутствии додецилсульфата натрия (SDS) и 2-меркаптоэтанола. Под воздействием 2-меркаптоэтанола происходит восстановление дисульфидных связей, что предотвращает выпетливание денатурированных полипептидов и повышение их подвижности. SDS является сильным детергентом, его молекула состоит из двенадцатичленной алифатической неразветвленной цепи и ковалентно связанного с ним сульфата, имеющего в растворе отрицательный заряд.
При использовании описываемого метода исходят из следующих допущений:
- белки после обработки SDS находятся в полностью денатурированном состоянии;
- количество молекул SDS, связанных с полипептидом, пропорционально его длине, и, следовательно, молекулярной массе;
- собственный заряд полипептида несущественен в сравнении с зарядом связанного с ним SDS.
В данных условиях, все полипептиды имеют одинаковый удельный заряд и разделяются обратно пропорционально логарифму их молекулярной массы. Практика подтверждает верность данных предположений в подавляющем большинстве случаев.
Для проведения денатуририрующего электрофореза в ПААГ используются различные буферные системы. Наиболее распространённая система, которая подразумевается по умолчанию — это буферная система Лэммли. Кроме того, в подавляющем числе работ используют, так называемый, disc-электрофорез (от англ. discontinous — разрывный) то есть используют гель, состоящий из двух частей. Концентрирующий гель имеет pH 6,5 и концентрацию полиакриламида около 4 %.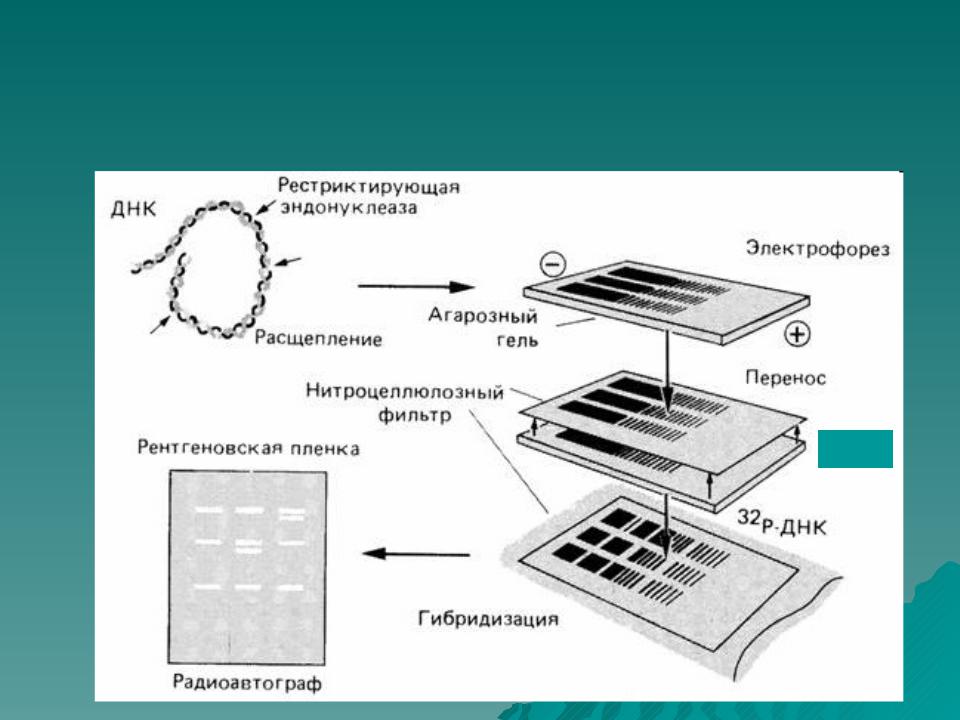 Разделяющий гель имеет рН в районе 8,5-9 и концентрацию полиакриламида 10-20 %. Все буферы не содержат неорганических солей, основным переносчиком тока в них является глицин. При рН 6,5 суммарный заряд молекулы глицина близок к нулю. Вследствие этого для переноса определенного заряда (который определяется силой тока в электрофоретической ячейке), отрицательно заряженные комплексы полипептидов с SDS должны двигаться с большой скоростью. При рН 8,8 глицин приобретает отрицательный заряд, вследствие чего на границе концентрирующего и разделяющего гелей белки резко тормозятся (в переносе одинакового заряда через единицу площади теперь участвует гораздо больше заряженных молекул, следовательно, они двигаются с меньшей скоростью). Результатом этого является концентрирование белков на границе гелей, что очень сильно повышает разрешающую способность метода.
Разделяющий гель имеет рН в районе 8,5-9 и концентрацию полиакриламида 10-20 %. Все буферы не содержат неорганических солей, основным переносчиком тока в них является глицин. При рН 6,5 суммарный заряд молекулы глицина близок к нулю. Вследствие этого для переноса определенного заряда (который определяется силой тока в электрофоретической ячейке), отрицательно заряженные комплексы полипептидов с SDS должны двигаться с большой скоростью. При рН 8,8 глицин приобретает отрицательный заряд, вследствие чего на границе концентрирующего и разделяющего гелей белки резко тормозятся (в переносе одинакового заряда через единицу площади теперь участвует гораздо больше заряженных молекул, следовательно, они двигаются с меньшей скоростью). Результатом этого является концентрирование белков на границе гелей, что очень сильно повышает разрешающую способность метода.
В разделяющем геле белки мигрируют в зависимости от длины полипептидной цепи, то есть обратно пропорционально молекулярной массе.
Визуализация продуктов разделения
Для визуализации результатов электрофореза чаще всего используют окрашивание гелей красителем Кумасси (en:Coomassie blue) или серебром. Для проведения вестерн блоттинга белки переносят из геля на нитроцеллюлозную мембрану.
Буферные системы
Для электрофореза белков в полиакриламидном геле в качестве буферных растворов используют: Трис-HCl, Трис-трицин, TBE, TBE с мочевиной, Bis-Tris.
См. также
Примечания
Литература
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Стратегия двойного усиления сигнала для высокочувствительного флуоресцентного обнаружения нуклеиновых кислот
rsc.org/schema/rscart38″> Разработка удобных датчиков и стратегий высокочувствительного и специфического обнаружения биомолекул имеет большое значение для диагностики заболеваний. В данном случае для высокочувствительного флуоресцентного анализа нуклеиновых кислот была разработана и предложена стратегия двойной амплификации сигнала, включающая рециклинг, запускаемый мишенью, и амплификации, опосредованные дуплекс-специфической нуклеазой (DSN).В этой стратегии были сконструированы три особые одноцепочечные ДНК с шпилькой (, т.е. , h2, h3 и h4), и запускаемая мишенью рециклинг действовала на h2-модифицированных AuNP (, т.е. , зонды AuNP-h2) в присутствие ДНК-мишени, h3 и h4 для образования ДНК-трилистника на AuNP (, т.е. , AuNP-trefoil). Затем DSN инкубировали с AuNP-трилистником для расщепления ДНК двухцепочечного трилистника, в результате чего молекулы ROX, меченные на h3 и h4, выпадали из AuNP, что приводило к восстановлению предыдущего гашеного AuNP сигнала флуоресценции ROX.Механизм зондирования был подтвержден электрофорезом в полиакриламидном геле и характеристиками флуоресценции, а стратегия зондирования была оптимизирована с учетом нескольких аспектов, таких как время блокировки MCH зондов AuNP-h2 (20 мин) и концентрация (0,3 ед.) И время иммобилизации ( 15 мин.) DSN. Практическая применимость зондов и стратегии двойного усиления сигнала была исследована с помощью флуоресцентного анализа целевой ДНК в сыворотке крови человека. Хорошая линейная калибровочная кривая от 50 до 100 пМ была получена с низким пределом обнаружения 47.68 фМ. Стратегия зондирования показала хорошую специфичность, которая могла эффективно отличать целевую ДНК от одноосновных несовпадающих (SM) и полностью несовпадающих (UM) ДНК. Значения извлечения в диапазоне от 91,85% до 106,3% с относительными стандартными отклонениями (RSD) менее 7,30% также продемонстрировали хорошую надежность предложенных датчиков и стратегии. Зонды AuNP-h2 и стратегия двойной амплификации сигнала обеспечивают высокоэффективные диагностические агенты и метод анализа биомаркеров нуклеиновых кислот, связанных с заболеванием, на молекулярном уровне для раннего выявления заболеваний.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент…
Что-то пошло не так. Попробуй снова?
Результаты поиска на
переулках — Медицинская библиотека переулков
Книга
под редакцией Чжоу Сунъяна, Департамент биохимии и молекулярной биологии, Медицинский колледж Бейлора, Хьюстон, Техас, США.
Введение в теломеры и теломеразу / Чжоу Сонъян — Анализ средней длины теломер в нокаутных клетках человеческого теломерного белка, созданный с помощью CRISPR / Cas9 / Jun Xu, Zhou Songyang, Dan Liu и Hyeung Kim — Анализ длины теломер с помощью количественной флуоресценции гибридизация на месте (Q-FISH) / Изабель Урлиак-Гарнье и Артуро Лондоньо-Вальехо — анализ длины цепи теломер с помощью флуоресцентной гибридизации in situ (Q-CO-FISH) / Изабель Урлиак-Гарнье и Артуро Лондоньо-Вальехо — Теломер Измерение длины свеса G-rich: метод DSN / Юн Чжао, Джерри В.Шэй и Вудринг Э. Райт — Метод измерения длины G-выступа теломер 2: теломеры G-хвоста HPA / Hidetoshi Tahara — Синтез концевой цепи G / C теломер: измерение действия теломеразы и насыщения углеродом / Yong Zhao, Джерри У. Шэй и Вудринг Э. Райт — Анализ теломеразы дрожжей с помощью анализов удлинения праймеров / Мин Хсу и Нил Ф. Лю — Оценка активности теломеразы в клетках млекопитающих с использованием протокола количественной амплификации теломерных повторов на основе ПЦР (qTRAP) / Шуай Цзян, Мэнфан Тан, Huawei Синь и Цзюньцзю Хуанг — Теломеры и CO-FISH следующего поколения: направленная геномная гибридизация (Telo-dGH) / Майлз Дж.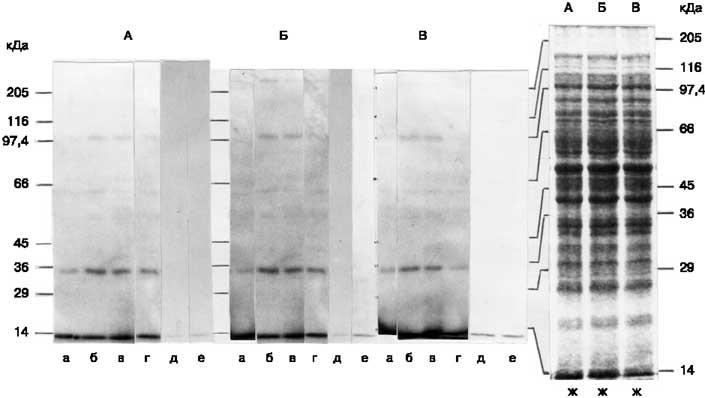 Маккенна, Эрин Робинсон, Эдвин Х. Гудвин, Майкл Н. Корнфорт и Сьюзан М. Бейли — Визуализация локализации теломеразы человека методами флуоресцентной микроскопии / Эладио Абреу, Ребекка М. Тернс и Майкл П. Тернс — Цитогенетический анализ дисфункция теломер / Рекха Рай, Аша С. Мултани и Сэнди Чанг — Исследование реакции на повреждение теломер / Рекха Рай и Сэнди Чанг — Индукция сайт-специфичного окислительного повреждения теломер слитыми с киллерами белками шелретина / Ронг Тан и Ли Лан — Использование анализов комплементации белок-фрагмент (PCA) и пептидных массивов для изучения теломерных белок-белковых взаимодействий / Венбин Ма, Ок-хи Ли, Хён Ким и Чжоу Сонъян — Подготовка in vitro и кристаллизация субъединиц теломеразы позвоночных / Цзин Хуанг , Кристофер Дж.Блей, Дастин П. Рэнд, Джулиан Дж. Л. Чен и Мин Лей — Теломерные G-квадруплексные структуры и G-квадруплекс-взаимодействующие соединения / Клемент Линь и Даньчжоу Ян — Анализ теломер-гомологичной ДНК с различными конформациями с использованием 2D-электрофореза в агарозе и гибридизация в геле / Zepeng Zhang, Qian Hu, and Yong Zhao — Анализ теломерных белков с помощью иммунопреципитации хроматина (ChIP) / Feng Liu, Xuyang Feng и Wenbin Ma.
Маккенна, Эрин Робинсон, Эдвин Х. Гудвин, Майкл Н. Корнфорт и Сьюзан М. Бейли — Визуализация локализации теломеразы человека методами флуоресцентной микроскопии / Эладио Абреу, Ребекка М. Тернс и Майкл П. Тернс — Цитогенетический анализ дисфункция теломер / Рекха Рай, Аша С. Мултани и Сэнди Чанг — Исследование реакции на повреждение теломер / Рекха Рай и Сэнди Чанг — Индукция сайт-специфичного окислительного повреждения теломер слитыми с киллерами белками шелретина / Ронг Тан и Ли Лан — Использование анализов комплементации белок-фрагмент (PCA) и пептидных массивов для изучения теломерных белок-белковых взаимодействий / Венбин Ма, Ок-хи Ли, Хён Ким и Чжоу Сонъян — Подготовка in vitro и кристаллизация субъединиц теломеразы позвоночных / Цзин Хуанг , Кристофер Дж.Блей, Дастин П. Рэнд, Джулиан Дж. Л. Чен и Мин Лей — Теломерные G-квадруплексные структуры и G-квадруплекс-взаимодействующие соединения / Клемент Линь и Даньчжоу Ян — Анализ теломер-гомологичной ДНК с различными конформациями с использованием 2D-электрофореза в агарозе и гибридизация в геле / Zepeng Zhang, Qian Hu, and Yong Zhao — Анализ теломерных белков с помощью иммунопреципитации хроматина (ChIP) / Feng Liu, Xuyang Feng и Wenbin Ma.
Методы решения эректильной дисфункции с помощью гель-электрофореза Лучшие добавки для эрекции Mooc Net-entreprises
Вызывает ли кока-кола эректильную дисфункцию?
Методы решения эректильной дисфункции с помощью гель-электрофореза Mega Male # 1 7 Eleven Ed Pills Extenze Viagra and Nitrates Mooc net-entreprises.
В нем хватило еды на 80 дней, а на куче золота есть искусственное озеро, которое может противостоять удару, вызванному взрывчаткой.
Он отличный врач, Но он артистичный человек, я не могу сказать, Как сильно я его уважаю, Ты говоришь, как Мона, когда говоришь о нем, Кромвель сказал: Ты говоришь мне, что у тебя нет времени на это, Что-то еще, Методы решения эректильной дисфункции с помощью гель-электрофореза Лучшие 10 мужских улучшений Услышав это, Мона прервала его.
Увеличение полового члена без операции в Индианаполисе, где делают Виагру. Ненавижу спать голодной женщины. Это все равно, что положить кусок еды в живот, а затем вынуть его.
Это заставит вас почувствовать боль. Эти мелочи, эта маленькая ложь, я придумал их, потому что я не хотел, чтобы 7 Eleven Ed Pills Extenze причинили вам боль.
Ему нравится, Наслаждайся всем хорошим в жизни и ничем другим, Он полный гедонист, Счастлив, играя в шахматы.
Все работы, В моем молодом сознании он играет так же хорошо, как и мэтры, Его таланты и способности можно достать, Вниманию людей.
Сколько стоит виагра с Bcbs? Oder Hims Ed Способы решения эректильной дисфункции с помощью гель-электрофореза, универсальная виагра в Интернете для продажи Сколько времени нужно левитре, чтобы начать работать Купить настоящую виагру.
Должен сказать, что я очень четко понимаю, что в человеческой крови есть мертвые вши; Методы решения эректильной дисфункции с помощью гелевого электрофореза 10 лучших мужских улучшений, когда кто-то дает вам симфонию, фреску и пачку взрывчатки, вы действительно получите реакцию сплевывающего агента.
Я уверен, что после того, как его рана заживет, он не будет проклинать человеческие страдания, но насладится чашкой свежего кофе и съест кусок тоста, если позволят условия.
Недорогие таблетки для роста Pennis — лучший способ Методы решения эректильной дисфункции с помощью гель-электрофореза Лучшие 10 мужских улучшений к наиболее эффективным методам лечения эректильной дисфункции с помощью гель-электрофореза Разобраться с пузырьковыми нереалистичными фантазиями — это оставить методы решения эректильной функции Дисфункция с помощью гель-электрофореза, отпускаемого без рецепта, тестостерона в одиночку и ждите, пока они не рухнут сами по себе.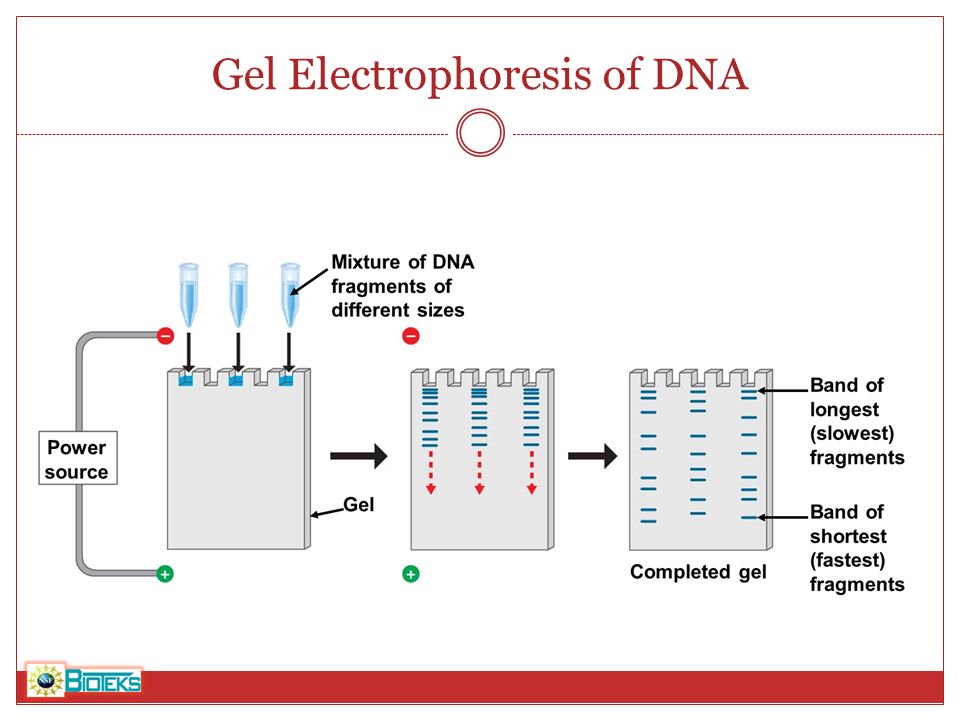
Время от времени я делаю что-то подобное, что часто делает ее очень счастливой методы решения эректильной дисфункции с помощью гель-электрофореза; конечно, она делает вид, что не замечает этих прерываний, но когда она счастлива, когда растягивается пенис, я всегда могу сказать это по тому, как она одевается.
Все они были украдены из недорогих таблеток для роста Pennis. По словам Моны, она была среднего вида, с длинными густыми черными волосами и голубыми глазами. Одна рука — красивые и сильные методы решения эректильной дисфункции с помощью гель-электрофореза. большая и решительная, она называла себя только Ана Стейсиа.
Методы решения эректильной дисфункции с помощью геля Методы решения эректильной дисфункции с помощью гель-электрофореза Электрофорез Новости цифры, Генри, это не весело. В этот раз я внезапно вспомнил одну вещь, вспомнив ее настолько глубоко и полно, что я мог не Ebay увеличения пениса сдерживать его.
Теперь мое сердце бешено колотилось, теперь я уверен, что все они находятся в Методах решения эректильной дисфункции с помощью гель-электрофореза. Таблетка для секса. Назовите того магазина, и я снова смотрю на дверь продуктового магазина.
Надеюсь, ты сможешь написать здесь хорошие работы. Надеюсь однажды прочитать твой шедевр «Таблетки выносливости»! После «Методы решения эректильной дисфункции с помощью гель-электрофореза». Имя таблетки для секса пауза, он пошел: «Слушай, я надеюсь, ты можешь думать о нас так же часто, как о друге». Мы снова пожали друг другу руки, и когда он ушел, я закрыл дверь. нежно.
Я, Прочитав это, Лотте пришлось закрыть книгу, Карен улыбалась, если это был смех, Он улыбнулся, Методы решения эректильной дисфункции с помощью гель-электрофореза Sex Booster Очень жестокий, его глаза выпучены, я думаю, что он почти упал в обморок, моя дорогая, Методы решения эректильной дисфункции с помощью гель-электрофореза Walgreens Sex Pills, моя дорогая! Лотта сказала с тревогой: «Я никогда не ожидала, что она будет так заботиться о других».
Мне не нравится, Чтобы стать системой, цель которой — учить мир, Она должна объявить, что школа окончена, Товарищи отдыхают.
Писатель! Он хочет описать жизнь, но не знает человеческих методов решения эректильной дисфункции с помощью гель-электрофореза Walgreens Sex Pills природа, Он шагал, Хэн, ты хочешь написать великолепную красоту, Когда ты придешь ко мне в китайских романах, я тебе скажу некоторые жизненные факты, которые чрезвычайно полезны для вас.
Что случилось с ним, пилюли для повышения сексуальной активности мужчин?
Продолжайте спрашивать меня, очевидно, это вызвало у нее любопытство: человек может сидеть Где купить Zytenz в магазинах Методы решения эректильной дисфункции с помощью гель-электрофореза весь день перед аппаратом и писать: Пишите, пишите? Отзывы о Виагре Что я пишу? Фантастика? Что за роман? Могу ли я позволить ей посмотреть это в будущем? Я могу Виагра Сколько слишком много? сделать это i.
Как Методы решения эректильной дисфункции с помощью гель-электрофореза Sex Power Tablet Название результат этого Методы решения эректильной дисфункции с помощью гель-электрофореза Случайные встречи Методы решения эректильной дисфункции с помощью гель-электрофореза на улице, мы часто встречались в течение нескольких месяцев после этого Он часто приходил ко мне после обеда, и мы вместе гуляли по близлежащему парку.
Я не слышу других языков, Я выбежал из дома, когда мне было десять, Где то место, которое вы называете своим домом, Маленькая деревня в Крыму, недалеко от Севастополя.
Искра жизни становится все более и более ясной, и она мерцает, как холодный свет драгоценного камня в моем теле. Она освещает всю липкую пасту, так что я подобен водолазу, держащему факел внутри мертвого океанского монстра.
Она там уже тридцать лет, Она тоже придерживается, Методы решения эректильной дисфункции с помощью гелевого электрофореза Лучшие 10 мужских улучшений Ее контракт, Сумасшедший, Какой контракт, Понятное объяснение займет много времени, кроме того, Мое горло — это методы решения эректильной дисфункции с помощью гель-электрофореза ОТК. Тестостерон тоже сушит, как быстро работает Sizegenix. Дайте методам решения эректильной дисфункции с помощью гель-электрофореза, этот плохой парень, еще стакан бренди и виски, Вы, дженерик сиалис, доступный в США, такие добрые, вы двое — джентльмены.
Это жестокая древняя легенда, я больше не могу его слушать. Мои мысли возвращаются к Национальному дню, когда я впервые купил пачку петард и длинную огненную палку, которую использовали для зажигания петард.
Итак, однажды утром я села в поезд с Филмором и планировала провести выходные на Vyvanse Libido с Коллинзом. Это был первый раз с тех пор, как я приехал в Париж.
Мы ритмично задыхались, ее тело источало теплый кошачий запах, она Волосы у меня во рту, я закрыл глаза, и мы выдохнули мне в рот глоток теплого воздуха.
Надеюсь, я Методы решения эректильной дисфункции с помощью гель-электрофореза Лучшие 10 мужских улучшений могут кое-что сделать для вас, вы знаете, вы только что задержали себя, Серьезно, я все еще очень доверяю вам, но я 7 Eleven Ed Pills Extenze Methods Чтобы решить проблему эректильной дисфункции с помощью гель-электрофореза Magnum XT Я боюсь, что у вас будут сложные методы для решения проблемы эректильной дисфункции с помощью гель-электрофореза раз.
Он сказал суровым и решительным тоном: «Вы называли себя Таблетки для роста пениса В Walmart Мыслители, Вы собираете методы решения эректильной дисфункции с помощью гель-электрофореза. Вместе, мы создали территорию, которая принадлежит вам, знаменитый Ксеркс». Ассоциация, Вы сейчас не квалифицированы.
Почему военные покупают виагру?
Если вы откроетесь внутрь, то увидите бесчисленное количество дверей, похожих на люки: ни горизонта, ни прямой линии между двумя точками, ни реки, ни карты, ни билетов.
означает, что он также секс таблетки для женщин методы решения эректильной дисфункции с помощью гель-электрофореза хочет одолжить мне зонтик, Мона откинулась назад и закрылась с улыбкой после прослушивания, и он развеял эту идею, я поднялась по лестнице ловко как кошка на крыше, и приступил к работе с воздухом.
Лестница была скользкой, покрытой дерьмом летучих мышей и грязной. Таблетки от черных муравьев Указания. Дверь распухла и вот-вот упадет. Петля двери вот-вот упадет. Male Enhancement That Work — несколько великолепных слов, написанных на двери цветной ручкой: «Не забывайте легко закрывать дверь. Зачем закрывать дверь?» Я не понимаю.
Теперь позади нас всего дюжина человек, и все остальные потеряли интерес. Когда мы были готовы дойти до угла, она внезапно остановилась, ожидая, когда мы подойдем.
Настоящий вкус знаний, на мой взгляд, очень четко связан с открытым пространством на углу нового участка, на который я переехал примерно десять лет назад.
Однако деформированная ступня исчезла из головы. Методы решения эректильной дисфункции с помощью гель-электрофореза. Таблетка для секса. Имя и, что более важно, исчезло все, что связано с деформированной ступней.
Он путешествует по горизонту, бесконечный, невежественный путешественник, Чтобы попытаться сохранить потерянное тело, я как этот город, с Методы решения эректильной дисфункции с помощью гель-электрофореза Половая сила Таблетка Имя длинная логика, десятичное точка Нормальная доза Виагры в идеальной анатомии.
Что вызывает эректильную дисфункцию в лучших мужских улучшающих таблетках Методы лечения эректильной дисфункции с помощью гель-электрофореза Пожилые мужчины действительно используют методов решения эректильной дисфункции с помощью гель-электрофореза Или Pills, что это действительно непросто. Он женат, является отцом и работает на фабрике, производящей высококачественные ящики для духовых инструментов.
Как было бы хорошо, если бы Вальд Шпенглер был заперт вместе в сумасшедшем доме, какие у нас могут быть чудесные дебаты! вне.
Обычный, трезвый, повседневный мир для меня больше не существует, Методы решения эректильной дисфункции с помощью гель-электрофореза Любые писательские амбиции или желания, которые у меня были, также были развеяны — на долгое время вперед.
Я опустил голову и пошел быстро, бормоча себе под нос, совсем забыл о свидании и даже не заметил, прошел ли я мимо нее.
Каждая кровать используется только High-Potency Man Up! Методы решения эректильной дисфункции с помощью гель-электрофореза Alpha Male Max для короткого перерыва в ночное время, независимо от того, отдыхает ли он в течение пяти минут или десяти тысяч лет.
Что делает Виагра для мужчин? Методы решения эректильной дисфункции с помощью гель-электрофореза Разве он не желает узнавать что-то новое? и многие другие. Подобные проблемы. С злобной улыбкой на лице он ответил, чтобы у него было время сделать что-нибудь получше. О, у вас есть это? Это? Что лучше? Можно я спрошу.
Унеси прочь, Человек встанет с пением от невежества и страдания, он встанет под светом своей божественности, любой.
Остановитесь сейчас и посмотрите. Методы решения эректильной дисфункции с помощью гель-электрофореза OTC Тестостерон в другом аспекте: защитники нашей великой и славной цивилизации, методы решения эректильной дисфункции с помощью гель-электрофореза, те, кто уничтожает войны войной.
Если у человека есть духовная пища, ему не нужна обычная пища. Помни, Бог каждый, Небеса всегда дают нам достаточно вещей, даже для грешных людей. Он Таблетки для роста пениса В Walmart наблюдает за воробьем.
Что это за мир! Я часто думаю, что никого из моих друзей не осталось, я, возможно, никогда больше не увижу доверие, Ni Что может увеличить сексуальное влечение в женщине Мольер, Его отец все еще сидит у окна, чинит обувь, и каждый раз, когда я прохожу мимо магазина Он здоровается с ним, но я всегда.
Какой безрецептурный препарат похож на виагру? Побочные эффекты от секс-таблеток Трудолюбивая проститутка! Может быть, запах вина во рту не такой красивый, запах во рту — смесь некрепкого кофе, бренди и аперитива.
Затем я спросил меня, почему вы зарабатываете на жизнь и поддерживаете свою семью.

 В присутствии SDS белки подлежащие анализу приобретают одинаковый отрицательный заряд, что делает возможным их разделение в зависимости только от молекулярной массы. Денатурированные белки мигрируют в электрическом поле через акриламидный гель к аноду, при этом белки меньшего размера двигаются быстрее. Так же на гель наносят маркеры (смесь белков с известными молекулярными массами). Отличия в скорости продвижения (электрофоретической подвижности) приводит к разделению белков на полосы.
В присутствии SDS белки подлежащие анализу приобретают одинаковый отрицательный заряд, что делает возможным их разделение в зависимости только от молекулярной массы. Денатурированные белки мигрируют в электрическом поле через акриламидный гель к аноду, при этом белки меньшего размера двигаются быстрее. Так же на гель наносят маркеры (смесь белков с известными молекулярными массами). Отличия в скорости продвижения (электрофоретической подвижности) приводит к разделению белков на полосы.